ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к способам и композициям для применения при лечении заболеваний, связанных с избыточной клеточной пролиферацией, таких как рак.
УРОВЕНЬ ТЕХНИКИ
«Рак» представляет собой термин, используемый для описания широкого круга заболеваний, которые все характеризуются неконтролируемым, злокачественным ростом конкретного типа клеток. Он начинается в ткани, содержащей такую клетку, и, если рак не распространился на какие-либо дополнительные ткани на момент постановки диагноза, лечение рака может, например, осуществляться с помощью хирургии, радиации или другого типа локализованной терапии. Однако когда есть доказательства того, что рак метастазировал из ткани его происхождения, как правило, используются другие подходы к лечению. Фактически, вследствие невозможности определения степени метастазирования, обычно используются системные терапевтические подходы при обнаружении каких-либо доказательств распространения метастаз. Эти подходы включают введение, например, химиотерапевтических препаратов, которые мешают росту быстро делящихся клеток, таких как раковые клетки.
Галихондрин В является структурно сложным макроциклическим соединением, которое исходно было выделено из морской губки Halichondriaokadai, и впоследствии было найдено в Axinellasp., Phakelliacarteri и Lissodendoryxsp. Полный синтез галихондрина В был опубликован в 1992 году (Aicheretal., J. Am. Chem. Soc. 114:3162-3164, 1992). Было показано, что галихондрин В ингибирует полимеризацию тубулина, сборку микротрубочек, сшивку бетаS-тубулина, связывание ГТФ (GTP) и винбластина с тубулином и тубулин-зависимый гидролиз ГТФ invitro. Также было показано, что эта молекула обладает противораковыми свойствами invitro и invivo. Аналоги галихондрина В, имеющие противораковое действие, описаны в патенте США № 6214865 В1.
Эрибулин является синтетическим аналогом галихондрина В. Эрибулин также известен как ER-086526, и ему был присвоен CAS-номер 253128-41-5, а Национальным институтом рака США (US NCI ему был присвоен номер NSC-707389. Мезилатная соль эрибулина (эрибулинамезилат, который продается под торговой маркой HALAVEN® и также известен как E7389) была одобрена для лечения пациентов с раком молочной железы, которые ранее получали по меньшей мере две химиотерапевтические схемы для лечения метастатического заболевания, в которые должны были быть включены антрациклин и таксан в сочетании либо с адъювантом, либо с антиметастатическими средствами.
Химическим названием эрибулинамезилата является (2R,3R,3aS,7R,8aS,9S,10aR,11S,12R,13aR,13bS,15S,18S,21S,24S,26R,28R,29aS)-2-[(2S)-3-амино-2-гидроксипропил]гексакозагидро-3-метокси-26-метил-20,27-бис(метилен)-11,15:18,21:24,28-триэпокси-7,9-этано-12,15-метано-9H,15H-фуро[3,2-i]фуро[2',3':5,6]пирано[4,3-b][1,4]диоксациклопентакозин-5(4H)-она метансульфонат (соль), и это соединение может быть представлено как:

Соединение E7080 (также известное как ленватинибамезилат) является активным ингибитором многих рецепторных тирозиновыхкиназ (например, рецепторных тирозиновыхкиназ, участвующих в ангиогенезе и пролиферации опухолей), включая фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов (FGF), рецептор а тромбоцитарного фактора роста (PDGFRA), KIT и RET протоонкогенные рецепторы. Ему был присвоен CAS-номер 857890-39-2 (также см. 417716-92-8). Химическим названием ленватинибамезилата является 4-[3-хлор-4-[[(циклопропиламино)карбонил]амино]фенокси]-7-метокси-6-хинолинкарбоксамида метансульфонат (1:1). [Это соединение также называют 4-[3-хлор-4-(N'-циклопропилуреидо)феноксил]-7-метоксихинолин-6-карбоксамидом и N-{4-[(6-карбамоил-7-метоксихинолин-4-ил)окси]-2-хлорфенил}-N'-циклопропилмочевинымонометансульфонат]. Ленватинибамезилат может быть представлен как:

СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение основано на наблюдении, что сочетание эрибулина и ленватиниба демонстрирует лучшие (например, синергетические) противоопухолевые эффекты. Поэтому, настоящее изобретение включает совместное введение эрибулина (или его фармацевтически приемлемой соли, например, эрибулинамезилата) и ленватиниба (или его фармацевтически приемлемой соли, например, ленватинибамезилата) в схемы лечения рака, а также применение этих агентов для такого лечения.
Таким образом, изобретение относится к способам лечения субъекта (например, пациента), имеющего рак или риск развития рака. Способы включают введение субъекту (i) эрибулина или его фармацевтически приемлемой соли (например, эрибулинамезилата) и (ii) ленватиниба или его фармацевтически приемлемой соли (например, ленватинибамезилата). Изобретение также относится к использованию этих агентов для лечения такого субъекта, а также к использованию этих агентов для получения лекарственных средств для лечения такого субъекта, как описано в данном документе. Все описания методов в настоящем документе применимы в контексте таких вариантов использования.
У субъекта может быть диагностирован рак, субъект может проходить лечение от рака или может восстанавливаться после противораковой терапии. Кроме того, рак может представлять собой первичную опухоль, метастазы и/или солидную опухоль. В различных примерах рак может быть выбран из группы, состоящей из рака молочной железы, рака поджелудочной железы, рака легких, рака толстой кишки, рака прямой кишки, колоректального рака, рака яичников, рака эндометрия, рака кожи (например, меланомы), рака предстательной железы, рака головного мозга, рака головы и шеи, рака печени, рака почки, рака мочевого пузыря, рака желудка, рака желудочно-кишечного тракта, рака крови (например, лейкоза), рака лимфатической системы, рака щитовидной железы, рака кости (например, остеосаркомы) и фибросаркомы.
Эрибулин или его фармацевтически приемлемая соль (например, эрибулинамезилат) могут быть введены с помощью внутривенной инфузии, например, в течение от примерно 1 до примерно 20 минут, или от примерно 2 до примерно 5 минут. Кроме того, эрибулин или его фармацевтически приемлемая соль (например, эрибулинамезилат) могут быть введены в количестве, находящемся в диапазоне от примерно 0,1 мг/м2 до примерно 20 мг/м2 или в количестве примерно 1,4 мг/м2 или 1,1 мг/м2. Кроме того, эрибулин или его фармацевтически приемлемая соль (например, эрибулинамезилат) могут быть введены однократно в 1-й и 8-й дни 21-дневного цикла.
Ленватиниб или его фармацевтически приемлемая соль (например, ленватинибамезилат) могут быть введены перорально, например, в количестве, находящемся в диапазоне от примерно 0,1 мг до примерно 100 мг или от примерно 4 мг до примерно 24 мг. Кроме того, в различных примерах, ленватиниб или его фармацевтически приемлемая соль (например, ленватинибамезилат) могут вводиться ежедневно.
Эрибулин или его фармацевтически приемлемую соль (например, эрибулинамезилат) и ленватиниб или его фармацевтически приемлемую соль (например, ленватинибамезилат) можно вводить по существу одновременно или последовательно.
Лечение в соответствии со способами по настоящему изобретению может: (i) снизить число раковых клеток; (ii) уменьшить объем опухоли; (iii) повысить скорость регрессии опухоли; (iv) снизить или замедлить инфильтрацию раковых клеток в периферические органы; (v) уменьшить или замедлить метастазирование опухоли; (vi) снизить или подавить рост опухоли; (vii) предотвратить или отсрочить возникновение и/или повторное возникновение рака и/или увеличить время жизни без заболевания или опухоли; (viii) увеличить общую продолжительность жизни; (ix) снизить частоту лечения; и/или (х) избавить от одного или нескольких симптомов, связанных с раком.
Изобретение также включает способы уменьшения размера опухоли у субъекта. Эти способы включают введение субъекту (i) эрибулина или его фармацевтически приемлемой соли (например, эрибулинамезилата) и (ii) ленватиниба или его фармацевтически приемлемой соли (например, ленватинибамезилата). Кроме того, изобретение включает использование этих агентов для уменьшения размера опухоли у субъекта, как описано в настоящем документе.
Кроме того, изобретение включает наборы, использующиеся для лечения рака, уменьшения размера опухоли либо индукции или усиления иммунного ответа на опухоль у субъекта. Наборы включают (i) эрибулин или его фармацевтически приемлемую соль (например, эрибулинамезилат) и (ii) ленватиниб или его фармацевтически приемлемую соль (например, ленватинибамезилат). Необязательно, эти агенты присутствуют в лекарственной форме.
Другие признаки изобретения будут очевидны из следующего подробного описания, чертежей и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
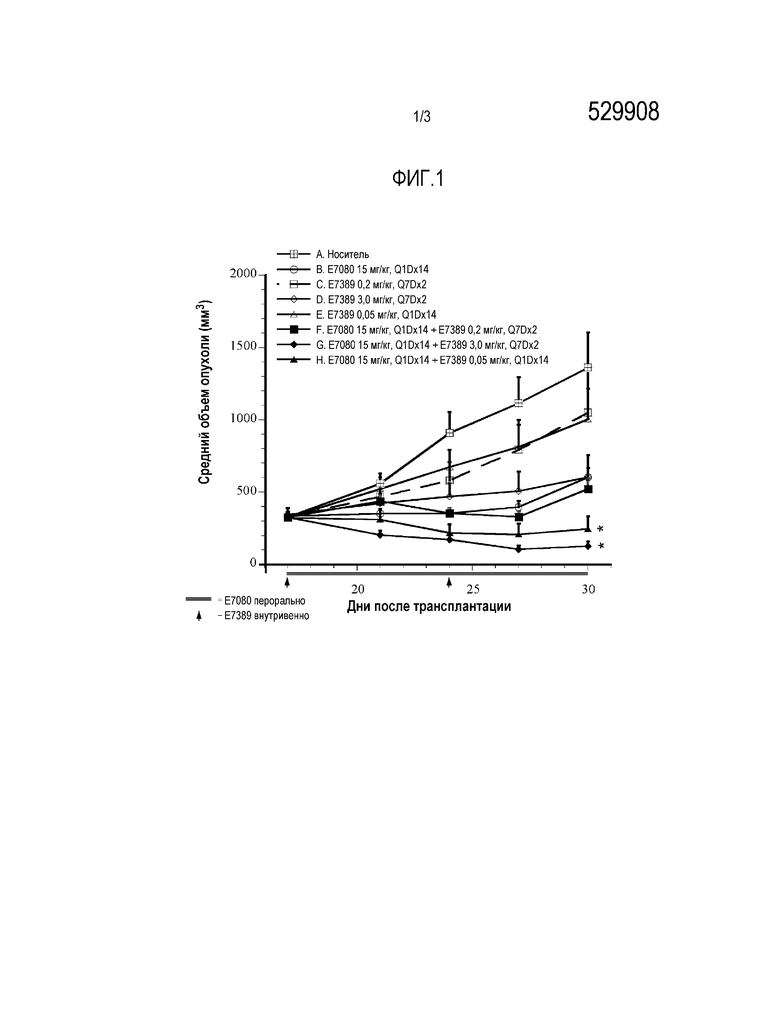
Фигура 1 представляет собой график, показывающий противоопухолевые эффекты E7389 в сочетании с E7080 в модели ксенотрансплантатов злокачественной меланомы A375 человека у мышей. Данные представляют собой среднее ±SEM (n=6). Стрелки на 17-й и 24-й день после трансплантации показывают начало лечения, стрелка представляет E7389, а линия представляет E7080. i.v.=внутривенный, р.о.=перорально, Q1Dx14=один раз в день в течение 14 дней, Q7Dx2=один раз в неделю в течение 2 недель. *Р<0,05 в сравнении с введением одного E7389 в количестве 3,0 мг/кг на 30-й день (однофакторный дисперсионный анализ с последующим множественным сравнительным тестом Даннетта).
Фигура 2 представляет собой график, показывающий относительное изменение массы тела животных, получавших один E7389, один E7080 и E7389+E7080 в комбинации. Данные представляют собой среднее ±SEM (n=6). Стрелки на 17-й и 24-й день после трансплантации показывают начало лечения, стрелка представляет E7389, а линия представляет E7080. i.v.=внутривенный, р.о.=перорально, Q1Dx14=один раз в день в течение 14 дней, Q7Dx2=один раз в неделю в течение 2 недель. Потеря массы тела наблюдалось после введения одного E7389 в количестве 3,0 мг/кг и в группах, которым вводили комбинацию препаратов. Частичное восполнение потери массы тела наблюдалось у всех мышей после завершения лечения препаратом.
Фигура 3 представляет собой график, показывающий противоопухолевый эффект E7389 в сочетании с E7080 на ксенотрансплантаты клеток немелкоклеточного рака легких человека NCI-H1993 (слева) или PC-9 (справа) у мышей. Данные представляют собой среднее ±SD (n=5). Стрелки на 0-й и 7-й день показывают инъекции E7389, а линия от 0-го дня до 11-го дня показывает введение E7080. i.v.=внутривенный, р.о.=перорально, Q1Dx14=один раз в день в течение 14 дней, Q7Dx2 = один раз в неделю в течение 2 недель. *Р<0,05: статический анализ группы, получавшей лечение комбинацией препаратов, по сравнению с группами, получавшими лечение отдельными препаратами (ANOVA-тест с повторными измерениями).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к способам лечения рака, включающим введение эрибулина и ленватиниба (или их фармацевтически приемлемых солей, например, мезилатной соли), а также к применению этих агентов для лечения рака или получению лекарственных средств для этого. Как показано в разделе примеров ниже, эрибулинамезилат и ленватинибамезилат при использовании в комбинации усиливают противораковое действие друг друга. В одном примере комбинированная терапия приводит к регрессии опухоли. Соответственно, лечение рака путем введения эрибулина и ленватиниба (или их фармацевтически приемлемых солей, например, мезилатной соли) в соответствии со способами по изобретению, может: (i) снизить число раковых клеток; (ii) уменьшить объем опухоли; (iii) повысить скорость регрессии опухоли; (iv) снизить или замедлить инфильтрацию раковых клеток в периферические органы; (v) уменьшить или замедлить метастазирование опухоли; (vi) снизить или подавить рост опухоли; (vii) предотвратить или отсрочить возникновение и/или повторное возникновение рака и/или увеличить время жизни без заболевания или опухоли; (viii) увеличить общую продолжительность жизни; (ix) снизить частоту лечения; и/или (х) избавить от одного или нескольких симптомов, связанных с раком.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ДОЗИРОВКИ И СПОСОБЫ
Способы синтеза эрибулина (и его фармацевтически приемлемых солей, таких как мезилатэрибулина) описаны, например, в патенте США № 6214865, патенте США № 7982060, патенте США № 8350067 и в патенте США № 8093410, каждый из которых включен в настоящее описание путем ссылки. Способы, относящиеся к ленватинибу (и его фармацевтически приемлемым солям, таким как мезилатленватиниба) и его синтезу, описаны, например, в патенте США № 7612092, который включен в настоящее описание путем ссылки.
Как указано выше, эрибулин и/или ленватиниб, необязательно, могут быть использованы в настоящем изобретении в форме соли. Нет никаких особых ограничений в отношении используемой соли, вне зависимости от того, является ли соль солью неорганической кислоты или органической кислоты. Например, соль может быть выбрана из соли метансульфоновой кислоты (например, мезилатаэрибулина или мезилаталенватиниба), соли соляной кислоты, соли серной кислоты, соли лимонной кислоты, соли бромистоводородной кислоты, соли йодистоводородной кислоты, соли азотной кислоты, бисульфата, соли фосфорной кислоти, соли суперфосфорной кислоты, соли изоникотиновой кислоты, соли уксусной кислоты, соли молочной кислоты, соли салициловой кислоты, соли винной кислоты, соли пантотеновой кислоты, соли аскорбиновойкислоты, соли янтарной кислоты, соли малеиновой кислоты, соли фумаровой кислоты, соли глюконовой кислоты, соли сахариновой кислоты, соли муравьиной кислоты, соли бензойной кислоты, соли глутаминовой кислоты, соли этансульфоновой кислоты, соли бензолсульфоновой кислоты, соли п-толуолсульфоновой кислоты, соли памоиновой кислоты (памоата) и т.д.
Фармацевтические композиции, включающие эрибулин или ленватиниб (или их фармацевтически приемлемые соли, такие как мезилатная соль) могут быть получены с помощью стандартных способов, известных в данной области (см., например, патенты, указанные выше). Фармацевтические композиции, используемые в изобретении, могут быть получены, например, смешиванием или растворением действующего ингредиента(ов), имеющего желаемую степень чистоты, в физиологически приемлемым разбавителе, носителе, вспомогательном веществе или стабилизаторе (см., например, Remington'sPharmaceuticalSciences (20thedition), ed. A. Gennaro, 2000, Lippincott, Williams&Wilkins, Philadelphia, PA).Приемлемые разбавители включают физиологический раствор и воду, необязательно, включая буферы, такие как фосфатный, цитратный или из других органических кислот; антиоксиданты, включающие бутилированный гидрокситолуол (ВНТ), бутилированный гидроксианизол (ВНА), аскорбиновую кислоту; низкомолекулярные (меньше примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды или другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или ПЭГ.
Необязательно, составы по изобретению содержат фармацевтически приемлемый консервант. В некоторых вариантах осуществления концентрация консерванта варьирует от 0,1 до 2,0%, как правило, об./об. Подходящие консерванты включают известные в фармацевтической области, такие как бензиловый спирт, фенол, м-крезол, метилпарабен и пропилпарабен. Кроме того, составы эрибулина и/или ленватиниба (или их фармацевтически приемлемых солей, таких как мезилатная соль), необязательно, включают фармацевтически приемлемую соль, такую как хлорид натрия, например, в физиологических концентрациях. Таким образом, в одном примере, эрибулин (или его фармацевтически приемлемая соль, например, эрибулинамезилат) входит в состав для инъекций, содержащий 0,9% хлорида натрия (USP). В другом примере, ленватиниб (или его фармацевтически приемлемая соль, например, ленватинибамезилат) входит в состав для перорального введения, например, в форме жидкости, таблеток или капсул.
В некоторых примерах составы, указанные выше (и другие), могут быть использованы для парентерального введения лекарственных препаратов. Таким образом, препараты могут быть введены различным путем, включая внутривенный, интраопухолевый, периопухолевый, внутриартериальный, внутрикожный, внутрисосудистый, офтальмологический, внутримышечный, внутрикожный, внутрибрюшинный, легочный, подкожный и чрескожный пути введения. Также могут быть использованы другие способы, включающие, например, трансмукозальный, трансдермальный, ингаляционный, интравагинальный, ректальный и пероральный пути введения.
Вводимая дозировка эрибулина и/или ленватиниба (или их фармацевтически приемлемых солей, таких как мезилатная соль) может заметно отличаться в зависимости от типа целевого заболевания, выбора способа доставки, а также от возраста, пола и массы пациента, тяжести симптомов наряду с другими факторами, которые могут быть оценены специалистами в данной области. Препараты вводят, используя количества и схемы, которые дают желаемый эффект (например, регрессию опухоли; также см., например, список эффектов (i)-(х), изложенный выше). Количества могут иметь аддитивные или синергетические эффекты на один или несколько признаков лечения рака (например, регрессию опухоли), известных в данной области.
Лекарственные препараты могут быть введены пациенту по существу одновременно или последовательно и в любом порядке (например, введение эрибулина (или его фармацевтически приемлемой соли, такой как эрибулинамезилат) осуществляется до введения ленватиниба (или его фармацевтически приемлемой соли, такой как ленватинибамезилат) или наоборот). Многие схемы, используемые для введения химиотерапевтических лекарственных препаратов, включают, например, введение препарата (или препаратов) с последующим повторением этого лечения через интервал времени (например, 1-4 недели), в течение которого пациент восстанавливается после любых нежелательных побочных эффектов лечения. Как правило, число циклов введения эрибулина (или его фармацевтически приемлемой соли, такой как эрибулинамезилат) и/или ленватиниба (или его фармацевтически приемлемой соли, такой как ленватинибамезилат) составляет 4-8, например, 4-7 или 6. Может быть желательно использовать оба препарата при каждом введении, или в альтернативно варианте - проводить некоторые (или все) стадии лечения, включающие только один из препаратов.
Так, например, суточная доза эрибулина (или его фармацевтически приемлемой соли, например, эрибулинамезилата) может находиться в диапазоне, например, от 0,001 мг/м2 до примерно 100 мг/м2 (например, в диапазоне от примерно 0,01 мг/м2 до примерно 50 мг/м2, от 0,1 до 5 мг/м2 или в диапазоне от примерно 0,7 мг/м2 до примерно 1,5 мг/м2, или составлять любое одно количество в этом диапазоне (например, 1,4 или 1,1 мг/м2)). Препарат можно вводить в виде однократной дозы один раз в день, неделю, месяц или год, или более одной дозы препарата можно вводить за день, неделю, месяц или год. Например, в одном протоколе введения, препарат можно вводить один раз в день в 1-й и 8-й дни 21-дневного цикла. В другом примере, препарат можно вводить один раз в день в 1-й, 8-й и 15-й дни 28-дневного цикла. Препарат можно вводить в течение интервала времени составляющего, например, от 1 минуты до 1 часа (или больше), например, в течение интервала от 2 до 5 минут.
Более конкретно, в одном примере рекомендуемую дозу эрибулинамезилата 1,4 мг/м2 вводили внутривенно в течение интервала от 2 до 5 минут в 1-й и 8-й дни 21-дневного цикла. Рекомендуемая доза эрибулинамезилата у больных с легкой печеночной недостаточностью (класс А по шкале Чайлда-Пью) составляет 1,1 мг/м2, вводимая внутривенно в течение от 2 до 5 минут в 1-й и 8-й дни 21-дневного цикла, тогда как рекомендуемая доза эрибулинамезилата у пациентов с умеренной печеночной недостаточностью (класс В по шкале Чайлда-Пью) составляет 0,7 мг/м2, вводимая внутривенно в течение от 2 до 5 минут в 1-й и 8-й дни 21-дневного цикла. Кроме того, рекомендуемая доза эрибулинамезилата у больных с умеренной почечной недостаточностью (клиренс креатинина 30-50 мл/мин) составляет 1,1 мг/м2, вводимая внутривенно в течение от 2 до 5 минут в 1-й и 8-й дни 21-дневного цикла. В другом примере 1,1 мг/м2эрибулинамезилата вводят внутривенно в течение от 2 до 5 минут в 1-й, 8-й и 15-й дни 28-дневного цикла.
Суточная доза ленватиниба (или его фармацевтически приемлемой соли, такой как ленватинибамезилат) для взрослых особо не ограничивается, однако препарат можно вводить в диапазоне, например, от примерно 0,1 мг до примерно 100 мг, например, от примерно 4 мг до примерно 24 мг или в любом одном количестве в этом диапазоне (например, 15 мг). Препарат можно вводить в виде однократной дозы один раз в день, неделю, месяц или год, или более одной дозы препарата можно вводить за день, неделю, месяц или год. Например, в одном протоколе введения, препарат можно вводить один раз в день в 1-й и 8-й дни 21-дневного цикла. В других вариантах, препарат можно вводить один раз в день в 1-й, 8-й и 15-й дни 28-дневного цикла, или в 1-й, 8-й, 5-й и 22-й дни 35-дневного цикла. В альтернативном варианте препарат можно вводить один раз в день в течение всего курса циклического введения эрибулина (или его фармацевтически приемлемой соли, такой как эрибулинамезилат), а затем, при необходимости, вводить ежедневно в течение курса одного или нескольких дополнительных циклов введения эрибулина (или его фармацевтически приемлемой соли, такой как эрибулинамезилат). Кроме того, ленватиниб (или его фармацевтически приемлемую соль, такую как ленватинибамезилат) можно вводить периодически (например, ежедневно, еженедельно или дважды в неделю) после завершения одного или нескольких циклов лечения эрибулином (или его фармацевтически приемлемой солью, такой как эрибулинамезилат), необязательно, в течение нескольких дополнительных недель, месяцев или лет (например, в течение неопределенного срока).
Схемы дозирования, указанные выше для эрибулина и ленватиниба (или их фармацевтически приемлемых солей, таких как мезилатная соль), как правило, начинаются в один и тот же «день 1», и различные схемы (например, любые из тех, которые указаны выше) для двух препаратов могут использоваться совместно. Таким образом, например, оба препарата можно вводить в 1-й и 8-й дни 21-дневного цикла, оба препарата можно вводить в 1-й, 8-й и 15-й дни 28-дневного цикла и т.д. В альтернативном варианте, один препарат (например, эрибулин или его фармацевтически приемлемую соль, такую как эрибулинамезилат) можно вводить в 1-й и 8-й дни 21-дневного цикла, тогда как другой препарат (например, ленватиниб или его фармацевтически приемлемую соль, такую как ленватинибамезилат) можно вводить в 1-й, 8-й и 15-й дни 28-дневного цикла. В другом варианте эрибулин (или его фармацевтически приемлемую соль, такую как эрибулинамезилат) вводят внутривенно в течение от 2 до 5 минут в 1-й и 8-й дни 21-дневного цикла, тогда как ленватиниб (или его фармацевтически приемлемую соль, такую как ленватинибамезилат) вводят один раз ежедневно, начиная в тот же день, что и введение эрибулина или его фармацевтически приемлемой соли (например, эрибулинамезилат), в количестве 4-24 мг.
В дополнение к эрибулину и ленватинибу (или их фармацевтически приемлемым солям, таким как мезилатная соль) способы по настоящему изобретению могут также включать в себя введение одного или нескольких дополнительных терапевтических агентов. Среди этих агентов подходящими являются иммуномодулирующие агенты (например, антитела или вакцины), химиотерапевтические/противоопухолевые агенты, антибактериальные агенты, противорвотные агенты и противовоспалительные агенты.
Способы по изобретению могут быть использованы для лечения или предупреждения возникновения рака у субъекта (например, у человека) и/или для уменьшения размера опухоли. У субъекта может быть диагностирован рак, субъект может проходить лечение от рака или может восстанавливаться после противораковой терапии. Кроме того, способы могут быть использованы для лечения или предупреждения возникновения метастазов и/или рецидивов. Лечение может быть только химиотерапевтическим, хотя также предусмотрено лечение в сочетании с хирургической процедурой для удаления или уменьшения размера опухоли, лучевой терапией и/или депривационной терапией.
Виды рака, которые можно лечить в соответствии с настоящими способами, включают, например, рак молочной железы, рак поджелудочной железы, рак легких, рак толстой кишки, рак прямой кишки, колоректальный рак, рак яичников, рак эндометрия, рак кожи (например, меланому), рак предстательной железы, рак головного мозга, рак головы и шеи, рак печени, рак почки, рак мочевого пузыря, рак желудка, рак желудочно-кишечного тракта, рак крови (например, лейкоз), рак лимфатической системы, рак щитовидной железы, рак кости (например, остеосаркому) и фибросаркому.
НАБОРЫ
Данное изобретение также относится к наборам, которые включают контейнер с эрибулином (или его фармацевтически приемлемой солю, такой как эрибулинамезилат) и/или контейнер с ленватинибом (или его фармацевтически приемлемой солью, такой как ленватинибамезилат). Лекарственные препараты в таких наборах могут быть представлены в количестве, достаточном для лечения рака у пациента, нуждающегося в этом (например, в количестве, достаточном для однократного или для многократного введения). Таким образом, наборы могут содержать несколько контейнеров, где каждый включает эффективное количество фармацевтической композиции (фармацевтических композиций) разовой дозы эрибулина (или его фармацевтически приемлемой соли, такой как эрибулинамезилат) и/или ленватиниба (или его фармацевтически приемлемой соли, такой как ленватинибамезилат). Необязательно, в наборы также могут быть включены приборы, устройства и/или разбавители, необходимые для введения фармацевтической композиции(й). Кроме того, наборы могут включать дополнительные компоненты, такие как инструкции или схемы введения для лечения ракового пациента с использованием данных препаратов.
Настоящее изобретение проиллюстрировано нижеследующими примерами, которые никоим образом не предназначены для ограничения настоящего изобретения.
ПРИМЕРЫ
ПРИМЕР 1
ВЛИЯНИЕ E7389 В СОЧЕТАНИИ С E7080 НА КСЕНОТРАНСПЛАНТАТЫ ЗЛОКАЧЕСТВЕННОЙ МЕЛАНОМЫ ЧЕЛОВЕКА А375 У МЫШЕЙ
КРАТКОЕ ОПИСАНИЕ
Противоопухолевое действие вводимого внутривенно E7389 (эрибулинамезилата) в сочетании с вводимым перорально E7080 (ленватинибамезилатом) исследовали на доклинической модели с использованием подкожных ксенотрансплантатов злокачественной меланомы человека А375 у самок бестимусным мышей. E7389 вводили в количестве 0,05, 0,2 или 3,0 мг/кг (максимально переносимая доза [MTD]) индивидуально или совместно с введением 15 мг/кг E7080 (MTD). Комбинация E7389 и E7080 вызывала регрессию опухоли, тогда как каждый отдельный агент вызывал задержку роста опухоли. Введение 3,0 мг/кг E7389 по схеме один раз в неделю в течение двух недель (Q7Dx2) в сочетании с ежедневным введением 15 мг/кг E7080 в течение 14 дней (Q1Dx14) вызывало дополнительное снижение массы тела животных. Однако масса тела восстанавливалась после завершения лечения препаратами.
СПОСОБЫ
ПРИГОТОВЛЕНИЕ СОСТАВОВ ДЛЯ ВВЕДЕНИЯ ТЕСТИРУЕМЫХ СОЕДИНЕНИЙ
E7080 растворяли в WFI в концентрации 1,5 мг/мл. Раствор для введения E7080 приготавливали на 7 дней. Исходный раствор делили на аликвоты и хранили при 4°С до использования. 0,5 мг/мл E7389 разбавляли 3%-м этанолом в физиологическом растворе до концентрации 0,005, 0,02 и 0,3 мг/мл. E7389 приготавливали свежим для каждого дня введения.
ИЗМЕРЕНИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
Клетки злокачественной меланомы A375 человека вели в монослойных культурах в модифицированной Дульбекко ростовой среде Игла (DMEM) с добавлением 10%-й фетальной бычьей сыворотки и 1%-й смеси пенициллина-стрептомицина и глутамина в инкубаторе с увлажнением при 37°С и 5% СО2. В день подсадки опухолей клетки собирали трипсинизированием, промывали и смешивали в соотношении 1:1 (об./об.) с ледяным фосфатным буферным солевым раствором (PBS)/Матригелем. Клетки злокачественной меланомы A375 (5×106 клеток на животное) подсаживали подкожно рядом с правой подмышечной областью с помощью иглы 26-го размера в объеме 0,1 мл 80 самкам мышей с ослабленной иммунной реакцией (мыши CRL:NU-Foxn1nu; CharlesRiverLaboratories).
Эксперимент состоял из получавшей носитель контрольной группы, групп, получавших один препарат (или E7389 или E7080), и трех групп, получавших комбинацию препаратов (приведены в таблице 1). В первый день каждая группа состояла из шести мышей, и в общей сложности в эксперимент входило 48 мышей. Сорок восемь из 80 мышей были отобраны исходя из объема их опухолей и случайным образом разделены на восемь групп, что в результате дало средний объем опухоли в каждой группе приблизительно 300 мм3 через 17 дней после имплантации опухоли. После рандомизации было начато лечение препаратами. E7080 вводили перорально ежедневно в течение 14 дней (Q1Dx14) в объеме 0,1 мл на 10 г массы тела. E7389 (0,05 мг/кг) вводили внутривенно ежедневно в течение 14 дней. В комбинированной группе E7389 вводили через три часа после перорального введения E7080. E7389 в количестве 0,2 или 3,0 мг/кг вводили по схеме Q7Dx2 либо в качестве единственного агента, либо в комбинации с E7080 (Q1Dx14). Контрольной группе вводили носитель (WFI для контроля перорального введения (Q1Dx14) в течение 14 дней и 3%-й этанол в физиологическом растворе для контроля внутривенного введения по схеме Q7Dx2).
Общее здоровье мышей контролировали ежедневно. Объем опухоли определяли с помощью штангенциркуля (в мм), используя формулу (lхw2)/2=мм3, где l и w относятся набольшему и меньшему перпендикулярным размерам, полученным при каждом измерении. Размеры опухолей и вес тела регистрировали два раза в неделю, начиная с первого дня лечения. Относительную массу тела рассчитывали следующим образом: относительная масса тела=(масса тела на день измерения)/(масса тела в первый день лечения).
Полученные данные состояли из среднего веса тела для группы при каждом измерении и среднего объема опухоли для группы при каждом измерении. Были рассчитаны средние значения ±SEM для объема опухоли и относительной массы тела для каждой экспериментальной группы.
Животных, размер опухоли которых достигал ≥20 мм по самой длинной оси, или у которых наблюдались изъязвления, умерщвляли до окончания исследования. Исследование прекращали через 30 дней.
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Статистический анализ для групп, которым вводили только E7389 в количестве 3,0 мг/кг и в комбинации с 15 мг/кг E7080 проводили с использованием однофакторного дисперсионного анализа (ANOVA) с последующим множественным сравнительным тестом Даннетта. Величина P<0,05 считалась статистически значимой. Статистический анализ проводили с использованием программного обеспечения GraphPadPrism (версия 5).
РЕЗУЛЬТАТЫ
На фиг. 1 показан эффект E7389 в сочетании с E7080 на ксенотрансплантаты злокачественной меланомы A375 человека у мышей. Введение единственного агента, E7389 или E7080, при самой высокой дозировке, 3,0 мг/кг (MTD для E7389) и 15 мг/кг (MTD для E7080), приводило к задержке роста опухоли, но не к регрессии опухоли. Комбинация E7389 с E7080 усиливает противоопухолевое действие E7389 при всех испытанных дозах. Ингибирование роста опухоли наблюдалось для всех комбинированных групп в зависимости от дозы (фиг. 1). Введение 3,0 мг/кг E7389 в сочетании с E7080 приводило к дополнительному снижению массы тела. Однако восстановление потери массы тела наблюдалось после завершения лечения препаратами (фиг. 2).
E7080 вводили перорально один раз в день в течение 14 дней. E7389 в количестве 0,05 мг/кг вводили внутривенно ежедневно в течение 14 дней. При комбинированном введении E7389 вводили через три часа после перорального введения E7080. E7389 в количестве 0,2 или 3,0 мг/кг вводили по схеме Q7Dx2 или в качестве монотерапии, или в комбинации. Исследование прекращали через 30 дней после трансплантации. Введение 3,0 мг/кг (Q7Dx2) и 0,05 мг/кг (Q1Dx14) E7389 в сочетании с ежедневным введением 15 мг/кг E7080 (Q1Dx14) приводило к регрессии опухоли в данном исследовании.
ВЫВОДЫ
Введение E7389 в количестве 3,0 мг/кг индивидуально и в комбинации показало сильное противоопухолевое действие на модели ксенотрансплантатов злокачественной меланомы A375 человека. Потеря массы тела, по-видимому, являлась обратимой, поскольку все животные частично восстановились после завершения лечения препаратом. E7389, вводимый в низкой дозе по метрономной схеме (0,05 мг/кг, Q1Dx14) в сочетании с ежедневным введением 15 мг/кг E7080 (Q1Dx14) обеспечивал значительную регрессию опухоли по сравнению с использованием только одного агента E7389 в количестве 3,0 мг/кг.
ПРИМЕР 2
ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТА С ИСПОЛЬЗОВАНИЕМ КОМБИНИРОВАННОЙ ТЕРАПИИ
Пациент с раком молочной железы получает лечение комбинацией E7389 (эрибулинамезилата) и E7080 (ленватинибамезилата) в соответствии со следующим протоколом. E7389 вводят в количестве 1,4 мг/м2 внутривенно в течение от 2 до 5 минут в 1-й и 8-й дни 21-дневного цикла. E7080 вводят перорально по 24 мг в день ежедневно в течение 21-дневного цикла лечения E7389, начиная в тот же день. Пациент получает лечение с использованием в общей сложности 4-6 циклов в зависимости от таких факторов, как возникновение и тяжесть побочных эффектов, а также клинических эффектов, определяемых медицинским работником. Необязательно, лечение с использованием E7080 продолжается после окончания циклов лечения E7389.
ПРИМЕР 3
ВЛИЯНИЕ E7389 В СОЧЕТАНИИ С E7080 НА КСЕНОТРАНСПЛАНТАТЫ КЛЕТОК НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКИХ ЧЕЛОВЕКА NCI-H1993 И PC-9 У МЫШЕЙ
КРАТКОЕ ОПИСАНИЕ
Противоопухолевое действие вводимого внутривенно E7389 (эрибулинамезилата) в сочетании с вводимым перорально E7080 (ленватинибамезилатом) исследовали на доклинической модели с использованием подкожных ксенотрансплантатовнемелкоклеточного рака человека NCI-H1993 и PC-9 у самок бестимусных мышей. E7389 вводили в дозе 1,5 мг/кг индивидуально или совместно с 10 мг/кг E7080. Комбинация E7389 и E7080 показала значительно более сильное противоопухолевое действие чем каждая отдельная монотерапия.
СПОСОБЫ
ПРИГОТОВЛЕНИЕ СОСТАВОВ ДЛЯ ВВЕДЕНИЯ ТЕСТИРУЕМЫХ СОЕДИНЕНИЙ
E7080 растворяли в DW до концентрации 1,0 мг/мл. 0,5 мг/мл E7389 разводили физиологическим раствором до концентрации 0,15 мг/мл.
ИЗМЕРЕНИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ
Клеточные линии немелкоклеточного рака легких человека, NCI-H1993 и PC-9, вели в монослойных культурах в среде RPMI-1640 с добавлением 10%-й фетальной бычьей сыворотки и 1%-й смеси пенициллина-стрептомицина-амфотерицина в инкубаторе с увлажнением при 37°С и 5% СО2. В день подсадки опухолей клетки собирали трипсинизированием, промывали и смешивали в соотношении 1:1 (об./об.) со средой/GelTrex. Клетки немелкоклеточного рака легких человека, NCI-H1993 и PC-9 (10х106 клеток на животное), подсаживали подкожно рядом с правой подмышечной областью с помощью иглы 26-го размера в объеме 0,1 мл самкам мышей с ослабленной иммунной реакцией (мыши BALB/cSlcnu/nu; Japan SLC, Inc.).
Эксперимент состоял из контрольной группы, которой не делали инъекций, групп, получавших один агент (любой из E7389 (1,5 мг/кг) или E7080 (10 мг/кг)) и группы, получавших комбинацию препаратов. Каждая группа состояла из пяти мышей. Мыши были отобраны исходя из объема их опухолей и случайным образом разделены на группы, что в результате дало средний объем опухоли приблизительно 200 мм3 (NCI-H1993: 191 мм3, PC-9: 227 мм3) в каждой группе через 10 дней (NCI-H1993) или 8 дней (PC-9) после имплантации опухолевых клеток. После рандомизации было начато лечение препаратами. E7389 (1,5 мг/кг) вводили внутривенно еженедельно в течение двух недель (Q7Dx2). E7080 вводили перорально ежедневно в течение 12 дней (Q1DX12). Оба препарата вводили в объеме 0,1 мл на 10 г массы тела.
Объем опухоли определяли с помощью штангенциркуля (в мм), используя формулу
Объем опухоли (мм3)=длина (мм)×ширина2 (мм2)×1/2
Длина: наибольший диаметр опухоли
Ширина: диаметр, перпендикулярный длине
Были рассчитаны средние значения ±SD для объема опухоли для каждой экспериментальной группы.
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Статистический анализ для групп, которым вводили каждый агент индивидуально, и комбинированной группы или группы, которой не делали инъекций, был выполнен с помощью двухфакторного дисперсионного анализа RM-ANOVA. Величина P<0,05 считалась статистически значимой. Статистический анализ проводили с использованием программного обеспечения GraphPadPrism (версия 6,02).
РЕЗУЛЬТАТЫ
На фиг. 3 показан эффект E7389 в сочетании с E7080 на ксенотрансплантаты клеток немелкоклеточного рака легких человека, NCI-H1993 (слева) или PC-9 (справа), у мышей. Монотерапия с использованием E7389 (1,5 мг/кг) или E7080 (10 мг/кг) давала значительную противоопухолевую активность на обоих моделях ксенотрансплантатов. Комбинация E7389 с E7080 значительно усиливала противоопухолевую активность относительно каждой монотерапии на обеих моделях ксенотрансплантатов.
ВЫВОДЫ
Комбинированное лечение E7389 и E7080 показало значительно более сильную противоопухолевую активность чем для каждой монотерапии.
КОНКРЕТНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Конкретные варианты осуществления изобретения являются следующими:
[1] Способ лечения субъекта, имеющего рак или риск развития рака, где способ включает введение субъекту (i) эрибулина или его фармацевтически приемлемой соли и (ii) ленватиниба или его фармацевтически приемлемой соли.
[2] Способ по п. [1], в котором указанный субъект является человеком.
[3] Способ по п. [1] или [2], в котором у указанного субъекта диагностирован рак, он проходит лечение от рака или восстанавливается после лечения от рака.
[4] Способ по любому одному из п.п. [1]-[3], в котором указанный рак представляет собой первичную опухоль.
[5] Способ по любому одному из п.п. [1]-[3], в котором указанный рак представляет собой метастатический рак.
[6] Способ по любому одному из п.п. [1]-[5], в котором указанный рак представляет собой солидную опухоль.
[7] Способ по любому одному из п.п. [1]-[6], в котором указанный рак выбран из группы, состоящей из рака молочной железы, рака поджелудочной железы, рака легких, рака толстой кишки, рака прямой кишки, колоректального рака, рака яичников, рака эндометрия, рака кожи (например, меланомы), рака предстательной железы, рака головного мозга, рака головы и шеи, рака печени, рака почки, рака мочевого пузыря, рака желудка, рака желудочно-кишечного тракта, рака крови (например, лейкоза), рака лимфатической системы, рака щитовидной железы, рака кости (например, остеосаркомы) и фибросаркомы.
[8] Способ по любому одному из п.п. [1]-[7], в котором указанный эрибулин или указанная его фармацевтически приемлемая соль представляют собой эрибулинамезилат.
[9] Способ по любому одному из п.п. [1]-[8], в котором указанный ленватиниб или указанная его фармацевтически приемлемая соль представляют собой ленватинибамезилат.
[10] Способ по любому одному из п.п. [1]-[9], в котором указанный эрибулин или указанную его фармацевтически приемлемую соль вводят путем внутривенного вливания.
[11] Способ по п. [10], в котором указанная внутривенная инфузия длится от примерно 1 до примерно 20 минут.
[12] Способ по п. [11], в котором указанная внутривенная инфузия длится от примерно 2 до примерно 5 минут.
[13] Способ по любому одному из п.п. [1]-[12], в котором указанный эрибулин или указанную его фармацевтически приемлемую соль вводят в количестве, находящемся в диапазоне от примерно 0,1 мг/м2 до примерно 20 мг/м2.
[14] Способ по п. [13], в котором указанный эрибулин или указанную его фармацевтически приемлемую соль вводят в количестве примерно 1,4 мг/м2 или 1,1 мг/м2.
[15] Способ по любому одному из п.п. [1]-[14], в котором указанный эрибулин или указанную его фармацевтически приемлемую соль вводят один раз в каждый 1-й и 8-й дни 21-дневного цикла.
[16] Способ по любому одному из п.п. [1]-[15], в котором указанный ленватиниб или указанную его фармацевтически приемлемую соль вводят перорально.
[17] Способ по любому одному из п.п. [1]-[16], в котором указанный ленватиниб или указанную его фармацевтически приемлемую соль вводят в количестве, находящемся в диапазоне от примерно 0,1 мг до примерно 100 мг.
[18] Способ по п. [17], в котором указанный ленватиниб или указанную его фармацевтически приемлемую соль вводят в количестве, находящемся в диапазоне от примерно 4 мг до примерно 24 мг.
[19] Способ по любому одному из п.п. [1]-[18], в котором указанный ленватиниб или указанную его фармацевтически приемлемую соль вводят ежедневно.
[20] Способ по любому одному из п.п. [1]-[19], в котором указанный эрибулин или указанную его фармацевтически приемлемую соль и указанный ленватиниб или указанную его фармацевтически приемлемую соль вводят, по существу, одновременно или последовательно.
[21] Способ по любому одному из п.п. [1]-[20], в котором указанное лечение: (i) снижает число раковых клеток; (ii) уменьшает объем опухоли; (iii) повышает скорость регрессии опухоли; (iv) снижает или замедляет инфильтрацию раковых клеток в периферические органы; (v) уменьшает или замедляет метастазирование опухоли; (vi) снижает или подавляет рост опухоли; (vii) предотвращает или откладывает возникновение и/или повторное возникновение рака и/или увеличивает время жизни без заболевания или опухоли; (viii) увеличивает общую продолжительность жизни; (ix) снижает частоту лечения; и/или (х) избавляет от одного или нескольких симптомов, связанных с раком.
[22] Способ уменьшения размера опухоли у субъекта, причем способ включает введение субъекту (i) эрибулина или его фармацевтически приемлемой соли и (ii) ленватиниба или его фармацевтически приемлемой соли.
[23] Набор для использования для лечения рака, уменьшения размера опухоли или выработки или усиления иммунного ответа на опухоль у субъекта, где набор включает (i) эрибулин или его фармацевтически приемлемую соль и (ii) ленватиниб или его фармацевтически приемлемую соль.
[24] Набор по п. [23], в котором указанный (i) эрибулин или указанная его фармацевтически приемлемая соль и указанный (ii) ленватиниб или указанная его фармацевтически приемлемая соль находятся в лекарственной форме.
[25] Эрибулин или его фармацевтически приемлемая соль для применения в способе лечения субъекта, имеющего рак или риск развития рака, отличающемся тем, что указанное соединение вводят субъекту с ленватинибом или его фармацевтически приемлемой солью.
[26] Эрибулин или его фармацевтически приемлемая соль по п. [25], в котором указанное соединение и указанный ленватиниб или указанную его фармацевтически приемлемую солью вводят, по существу, одновременно или последовательно.
[27] Эрибулин или его фармацевтически приемлемая соль по п. [25] или [26], в котором указанное соединение представляет эрибулинамезилат.
[28] Ленватиниб или его фармацевтически приемлемая соль для применения в способе лечения субъекта, имеющего рак или риск развития рака, отличающемся тем, что указанное соединение вводят субъекту с эрибулином или его фармацевтически приемлемой солью.
[29] Ленватиниб или его фармацевтически приемлемая соль по п. [28], в котором указанное соединение и указанный эрибулин или указанную его фармацевтически приемлемую соль вводят, по существу, одновременно или последовательно.
[30] Ленватиниб или его фармацевтически приемлемая соль по п. [28] или [29], в котором указанное соединение представляет ленватинибамезилат.
[31] Фармацевтическая композиция для лечения субъекта, имеющего рак или риск развития рака, включающая эрибулин или его фармацевтически приемлемую соль, отличающаяся тем, что указанную фармацевтическую композицию вводят субъекту с ленватинибом или его фармацевтически приемлемой солью.
[32] Фармацевтическая композиция для лечения субъекта, имеющего рак или риск развития рака, включающая ленватиниб или его фармацевтически приемлемую соль, отличающаяся тем, что указанную фармацевтическую композицию вводят субъекту с эрибулином или его фармацевтически приемлемой солью.
[33] Фармацевтическая композиция по п. [31] или [32], в котором указанный эрибулин или указанную его фармацевтически приемлемую соль и указанный ленватиниб или указанную его фармацевтически приемлемую соль вводят, по существу, одновременно или последовательно.
[34] Фармацевтическая композиция по любому одному из п.п. [31]-[33], в котором указанный эрибулин или указанная его фармацевтически приемлемая соль представляют собой эрибулинамезилат.
[35] Фармацевтическая композиция по любому одному из п.п. [31]-[33], в котором указанный ленватиниб или указанная его фармацевтически приемлемая соль представляют собой ленватинибамезилат.
[36] Применение (i) эрибулина или его фармацевтически приемлемой соли и (ii) ленватиниба или его фармацевтически приемлемой соли для лечения субъекта, имеющего рак или риск развития рака, или для уменьшения размера опухоли у субъекта.
[37] Применение (i) эрибулина или его фармацевтически приемлемой соли и (ii) ленватиниба или его фармацевтически приемлемой соли в изготовлении лекарственного средства для применения в лечении субъекта, имеющего рак или риск развития рака, или для уменьшения размера опухоли у субъекта.
Различные варианты, указанные выше в отношении п.п. [2]-[21] (способы), применимы к п.п. [22] (способ), [36] (применение), [37] (применение).
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Хотя изобретение описано в связи с конкретными вариантами осуществления, следует понимать, что возможны дополнительные модификации, и эта заявка предназначена для охвата любых вариантов, применений или адаптаций изобретения, в общем следующих принципам изобретения и включающих такие отклонения от настоящего раскрытия, которые возникают в известной или обычной практике в области техники, к которой относится изобретение, и могут быть применены к существенным признакам, изложенным выше.
Все публикации и патентные заявки, указанные в этом описании, включены в него путем ссылки в такой же степени, как если бы каждая независимая публикация или патентная заявка были конкретно и индивидуально указаны, как включенные путем ссылки в полном объеме.
Использование в данном документе форм единственного числа не исключает указание на соответствующие формы множественного числа, если контекст не указывает иное. Аналогичным образом, использование формы множественного числа не исключает указание на соответствующие формы единственного числа. Другие варианты осуществления изобретения находятся в пределах объема прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ЭРИБУЛИНА В ЛЕЧЕНИИ РАКА | 2015 |
|
RU2699545C2 |
| ПРОТИВООПУХОЛЕВОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО | 2016 |
|
RU2718048C2 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1 И ЭРИБУЛИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2737216C2 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1, ИНГИБИТОРА ТИРОЗИНКИНАЗЫ VEGFR/FGFR/RET И ИНГИБИТОРА CBP/БЕТА-КАТЕНИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2020 |
|
RU2838452C1 |
| ПРИМЕНЕНИЕ ЭРИБУЛИНА ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2689977C2 |
| БИОМАРКЕРЫ ДЛЯ КОМБИНИРОВАННОЙ ТЕРАПИИ, ВКЛЮЧАЮЩЕЙ ЛЕНВАТИНИБ И ЭВЕРОЛИМУС | 2016 |
|
RU2745060C2 |
| Комбинированные терапии для лечения гепатоцеллюлярной карциномы | 2019 |
|
RU2787993C2 |
| Фармацевтические комбинации | 2017 |
|
RU2759669C2 |
| АНТИНЕОПЛАСТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ HKI-272 И ВИНОРЕЛБИН | 2013 |
|
RU2670974C2 |
| АНТИОПЛАСТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ НКI-272 И ВИНОРЕЛБИН | 2009 |
|
RU2492860C2 |


Группа изобретений относится к способам и композициям для применения при лечении заболеваний, ассоциированных с избыточной клеточной пролиферацией, таких как рак. Способ лечения субъекта, имеющего рак или риск развития рака, и способ уменьшения размера злокачественной опухоли у субъекта включают введение субъекту эрибулина или его фармацевтически приемлемой соли в количестве от 0,1 мг/м2 до 20 мг/м2 и ленватиниба или его фармацевтически приемлемой соли в количестве от 0,1 мг до примерно 100 мг. Также раскрыта фармацевтическая композиция, содержащая указанные ингредиенты. Группа изобретений обеспечивает комбинированное лечение рака, которое демонстрирует более сильную противоопухолевую активность. 7 н. и 28 з.п. ф-лы, 3 ил., 1 табл., 3 пр.
1. Способ лечения субъекта, имеющего рак или риск развития рака, где способ включает введение субъекту (i) эрибулина или его фармацевтически приемлемой соли в количестве от 0,1 мг/м2 до 20 мг/м2 и (ii) ленватиниба или его фармацевтически приемлемой в количестве от 0,1 мг до 100 мг.
2. Способ по п. 1, в котором указанный субъект является человеком.
3. Способ по п. 1 или 2, в котором у указанного субъекта диагностирован рак, он проходит лечение от рака или восстанавливается после лечения от рака.
4. Способ по п. 1 или 2, в котором указанный рак представляет собой первичную опухоль.
5. Способ по п. 1 или 2, в котором указанный рак представляет собой метастатический рак.
6. Способ по п. 1 или 2, в котором указанный рак представляет собой солидную опухоль.
7. Способ по п. 1 или 2, в котором указанный рак выбран из группы, состоящей из рака молочной железы, рака поджелудочной железы, рака легких, рака толстой кишки, рака прямой кишки, колоректального рака, рака яичников, рака эндометрия, рака кожи, рака предстательной железы, рака головного мозга, рака головы и шеи, рака печени, рака почки, рака мочевого пузыря, рака желудка, рака желудочно-кишечного тракта, рака крови, рака лимфатической системы, рака щитовидной железы, рака кости и фибросаркомы.
8. Способ по п. 7, где раком кожи является меланома.
9. Способ по п. 7, где раком крови является лейкоз.
10. Способ по п. 7, где раком кости является остеосаркома.
11. Способ по п. 1 или 2, в котором указанный эрибулин или указанная его фармацевтически приемлемая соль представляют собой эрибулинамезилат.
12. Способ по п. 1 или 2, в котором указанный ленватиниб или указанная его фармацевтически приемлемая соль представляют собой ленватинибамезилат.
13. Способ по п. 1 или 2, в котором указанный эрибулин или указанную его фармацевтически приемлемую соль вводят путем внутривенного вливания.
14. Способ по п. 13, в котором указанная внутривенная инфузия длится от 1 до 20 минут.
15. Способ по п. 14, в котором указанная внутривенная инфузия длится от 2 до 5 минут.
16. Способ по п. 1, в котором указанный эрибулин или его фармацевтически приемлемую соль вводят в количестве 1,4 мг/м2 или 1,1 мг/м2.
17. Способ по п. 1 или 2, в котором указанный эрибулин или его фармацевтически приемлемую соль вводят один раз в каждый 1-й и 8-й дни 21-дневного цикла.
18. Способ по п. 1 или 2, в котором указанный ленватиниб или его фармацевтически приемлемую соль вводят перорально.
19. Способ по п. 1, в котором указанный ленватиниб или его фармацевтически приемлемую соль вводят в количестве от 4 мг до 24 мг.
20. Способ по п. 1 или 2, в котором указанный ленватиниб или его фармацевтически приемлемую соль вводят ежедневно.
21. Способ по п. 1 или 2, в котором указанный эрибулин или его фармацевтически приемлемую соль и указанный ленватиниб или его фармацевтически приемлемую соль вводят, по существу, одновременно или последовательно.
22. Способ по п. 1 или 2, в котором указанное лечение: (i) снижает число раковых клеток; (ii) уменьшает объем опухоли; (iii) повышает скорость регрессии опухоли; (iv) снижает или замедляет инфильтрацию раковых клеток в периферические органы; (v) уменьшает или замедляет метастазирование опухоли; (vi) снижает или подавляет рост опухоли; (vii) предотвращает или замедляет возникновение и/или повторное возникновение рака и/или увеличивает время жизни без заболевания или опухоли; (viii) увеличивает общую продолжительность жизни; (ix) снижает частоту лечения; и/или (х) облегчает один или нескольких симптомов, связанных с раком.
23. Способ уменьшения размера злокачественной опухоли у субъекта, причем способ включает введение субъекту (i) эрибулина или его фармацевтически приемлемой соли в количестве от 0,1 мг/м2 до 20 мг/м2 и (ii) ленватиниба или его фармацевтически приемлемой соли в количестве от 0,1 мг до 100 мг.
24. Набор для использования для лечения рака, уменьшения размера опухоли или выработки или усиления иммунного ответа на опухоль у субъекта, где набор включает (i) эрибулин или его фармацевтически приемлемую соль в количестве от 0,1 мг/м2 до 20 мг/м2 и (ii) ленватиниб или его фармацевтически приемлемую соль в количестве от 0,1 мг до 100 мг.
25. Набор по п. 24, в котором указанный (i) эрибулин или указанная его фармацевтически приемлемая соль и указанный (ii) ленватиниб или указанная его фармацевтически приемлемая соль находятся в лекарственной форме.
26. Применение эрибулина или его фармацевтически приемлемой соли в способе лечения субъекта, имеющего рак или риск развития рака, отличающееся тем, что эрибулин или его фармацевтически приемлемую соль вводят субъекту в количестве от 0,1 мг/м2 до 20 мг/м2 с ленватинибом или его фармацевтически приемлемой солью в количестве от 0,1 мг до 100 мг.
27. Применение по п. 26, где эрибулин или его фармацевтически приемлемую соль и указанный ленватиниб или указанную его фармацевтически приемлемую солью вводят, по существу, одновременно или последовательно.
28. Применение по п. 26 или 27, где указанное соединение представляет эрибулина мезилат.
29. Применение по п. 26 или 27, в котором указанное соединение представляет ленватиниба мезилат.
30. Фармацевтическая композиция для лечения субъекта, имеющего рак или риск развития рака, включающая эрибулин или его фармацевтически приемлемую соль в количестве от 0,1 мг/м2 до 20 мг/м2, отличающаяся тем, что указанную фармацевтическую композицию вводят субъекту с ленватинибом или его фармацевтически приемлемой солью в количестве от 0,1 мг до 100 мг.
31. Фармацевтическая композиция по п. 30, где указанный эрибулин или его фармацевтически приемлемую соль и указанный ленватиниб или его фармацевтически приемлемую соль вводят, по существу, одновременно или последовательно.
32. Фармацевтическая композиция по п. 30, где указанный эрибулин или указанная его фармацевтически приемлемая соль представляют собой эрибулина мезилат.
33. Фармацевтическая композиция по п. 30, где указанный ленватиниб или его фармацевтически приемлемая соль представляют собой ленватиниба мезилат.
34. Применение (i) эрибулина или его фармацевтически приемлемой соли в количестве от 0,1 мг/м2 до 20 мг/м2 и (ii) ленватиниба или его фармацевтически приемлемой соли в количестве от 0,1 мг до 100 мг для лечения субъекта, имеющего рак или риск развития рака, или для уменьшения размера опухоли у субъекта.
35. Применение (i) эрибулина или его фармацевтически приемлемой соли в количестве от 0,1 мг/м2 до 20 мг/м2 и (ii) ленватиниба или его фармацевтически приемлемой соли в количестве от 0,1 мг до 100 мг для изготовления лекарственного средства для применения для лечения субъекта, имеющего рак или риск развития рака, или для уменьшения размера опухоли у субъекта.
| Харкевич Д.А | |||
| Фармакология / Учебник, 2010, 10-е издание, стр.72-82 | |||
| Микуляк Н.И | |||
| и др | |||
| Изучение противоопухолевого и антиметастатического эффектов противоопухолевых антибиотиков при раздельном и совместном применении с мексидолом / Известия ВУЗов | |||
| Поволжский регион | |||
| Медицинские науки | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Хирургическая онкология / surgery.su, 2009, URL: http://oncosurgery.surgery.su/ | |||
| WO 2012166899 A2, 06.12.12 | |||
| WO 2012119077 A1, 07.09.12. | |||
Авторы
Даты
2018-11-16—Публикация
2014-06-26—Подача