Изобретение относится к ветеринаринарной медицине, в частности к созданию ветеринарных препаратов для иммунопрофилактики опасных антропозоонозов (трихинеллеза, эхинококкоза) домашних и сельскохозяйственных животных, а также может быть использовано в медицине при производстве противопаразитарных вакцин.
Введение
В настоящее время вакцинация зарекомендовала себя как наиболее перспективное средство в борьбе с тканевыми гельминтозами (ларвальными гидатидозами, трихинеллезом) животных, при этом главной целью иммунизации животных паразитарными антигенами является достижение сбалансированного иммунного ответа, сходного с тем, который индуцируется при естественном заражении (4-9).
Проведенные нами исследования по изучению протективных свойств иммунодоминантных антигенов тканевых гельминтов (Echinococcus granulosus, Echinococcus multilocularis и Trichinella spiralis) показали, что иммунизация только иммуногенными белками этих паразитов не создает достаточного иммунитета у вакцинируемых лабораторных животных. Полученные данные сопоставимы с многочисленными зарубежными публикациями, доказывающими, что оптимизировать иммунологические механизмы при вакцинации животных паразитарными антигенами возможно подбором соответствующих адъювантов. В качестве последних в настоящее время применяются различные соединения, которые действуют неспецифическим образом, усиливая иммунный ответ на специфический антиген (11).
Такие вакцинирующие комплексы позволяют вызывать наиболее ранние, выраженные и продолжительные иммунологические реакции, обеспечивающие высокий уровень защиты организма животного от инвазии тканевыми гельминтами.
Известно, что компоненты клеточных стенок некоторых микроорганизмов и их нуклеиновые кислоты обладают иммуноадъювантными свойствами, т.е. воспринимаются иммунной системой как неспецифический сигнал, усиливающий иммунный ответ. Наиболее известен полный адъювант Фрейнда (ПАФ), применяемый для иммунизации только лабораторных животных и представляющий собой масляную суспезию убитых клеток Mycobacterium tuberculosis с липофильным эмульсионным агентом (10% Арлацела А); перед введением животному этот препарат эмульгируют в водном растворе антигена (Фрейнд Л. и соавт., 1937). Воздействие адъюванта на иммунный ответ в основном обусловлено способностью удерживать и даже накапливать антиген в том месте, где он взаимодействует с лимфоцитами (эффект «депо»), и способностью убитых микобактерий вызывать синтез цитокинов, регулирующих лимфоцитарные функции. Показано, что цитокины действуют как эффективные адъюванты только в случае непосредственного связывания со специфическим антигеном. Однако существенным недостатком ПАФ является высокая вязкость препарата, его сильная реактогенность, выражающаяся в образовании абсцессов и обширных гранулем на месте введения, в связи с чем этот адъювант в практической ветеринарии не используется.
В настоящее время среди средств иммунокоррекции из числа природных препаратов ведущее место по широте спектра биологической активности занимают препараты нуклеиновых кислот и продукты их ферментативной деградации. Типичным представителем этой группы является натриевая соль РНК, выделяемой из простейших эукариотических организмов - Saccharomycis cerevisiae. Активным биологическим компонентом данной субстанции служат нуклеотиды. Являясь естественным компонентом организма животных, натриевая соль дрожжевой РНК не обладает видовой специфичностью, имеет широкий спектр биологической активности и лишена побочного действия. Клинические испытания показали, что этот препарат ускоряет процессы регенерации, стимулирует факторы естественной резистентности, миграцию и кооперацию Т- и В-лимфоцитов, фагоцитарную активность нейтрофилов. РНК стимулирует факторы как врожденного, так и приобретенного иммунитета, активируя пролиферацию Т- и В-лимфоцитов. Главным фармакологическим свойством нуклеиновых кислот является стимуляция лейкопоэза, процессов регенерации и репарации, функциональной активности практически всех клеток иммунной системы. Препараты этой группы стимулируют функциональную активность нейтрофилов и макрофагов, повышая их способность элиминировать чужеродные элементы (например, бактерий и паразитов), усиливают антиинфекционную устойчивость к заражению различными патогенами, вероятно, за счет стимуляции фагоцитоза, повышения функциональной активности Т-хелперов и Т-киллеров, пролиферации В-клеток и синтеза антител. Установлены иммуномодулирующие свойства РНК в связи с выраженной индукцией интерферона (ИФγ), способствующего нарастанию в процессе иммунного ответа субпопуляции высокоаффинных антител в сыворотке крови иммунизируемых животных. Известно, что под действием интерферона повышается способность макрофагов производить высокоактивные метаболиты кислорода и оксид азота.
Являясь важнейшей сигнальной молекулой и внутриклеточным медиатором, оксид азота путем простой диффузии моментально переходит в соседние и удаленные клетки, осуществляя межклеточную регуляцию практически во всех тканях организма.
Показано, что эндогенный синтез оксида азота макрофагами, нейтрофилами и сосудистым эндотелием является одним из механизмов защиты организма хозяина от тканевых гельминтов за счет повышения цитотоксических и цитостатических свойств клеточного звена иммунитета.
Собственно, оксид азота (NO) выполняет в макроорганизме многочисленные медиаторные и сигнальные функции, а токсическим действием на гельминтов и простейших обладают пероксинитриты, образующиеся в результате взаимодействия NO с продуктами восстановления кислорода в очагах воспаления и стимуляции фагоцитарной активности макрофагов.
Для стимуляции функциональной активности макрофагов, нейтрофилов, клеток сосудистого эндотелия при синтезе оксида азота необходимо присутствие достаточного количества в организме животного аминокислоты L-аргинина.
Целью изобретения являлось создание оптимального адъюванта, сочетание биологических и химических компонентов которого с иммунодоминантными антигенами тканевых гельминтов в ветеринарном препарате обеспечивало бы длительный напряженный иммунитет у вакцинируемых животных.
Сущность изобретения состоит в разработке технологии производства и применения многокомпонентой водно-масляной эмульсии, использование которой существенно повышает протективный эффект при иммунизации животных антигенами тканевых гельминтов.
Наиболее близким прототипом предложенной инновации можно считать адъюванты, примененные зарубежными исследователями (Lightowlers M.W., Rickard M.D., Heath D.D., Woollard D.J.) при испытании протективных свойств вакцин при тканевых гельминтозах (трихинеллезе, эхинококкозе): полный адъювант Фрейнда (ПАФ), неполный адъювант Фрейнда (без микобактерий) и глюкозид сапонин (Heath D.D., Lawrence S.B., 1996; Heath D.D., Lightowlers M.W., 1997; Woollard D.J., Heath D.D., Lightowlers M.W., 2000; Gamble H.K., 1985).
Высокими иммуностимулирующими свойствами обладает полный адъювант Фрейнда (ПАФ), основными компонентами которого являются минеральное масло, липофильный эмульгатор и убитые микобактерий. Недостатками прототипа - вакцинирующих комплексов с ПАФ - являются высокая вязкость препаратов, осложняющая их введение, и сильная местная реакция, выражающаяся в образовании абсцессов и гранулем. Высокая стоимость полного адъюванта Фрейнда (производство фирмы «Дифко») и вышеуказанные проблемы ограничивают применение данной субстанции в ветеринарии. Используемый зарубежными учеными в качестве адъюванта в сочетании с рекомбинантными антигенами эхинококка EG-95 глюкозид сапонин (8) в настящее время в РФ недоступен. В связи с этим представляется весьма актуальным поиск оптимального сочетания недорогих отечественных компонентов для адъювантной композиции при производстве вакцины против тканевых гельминтозов (трихинеллеза, ларвальных гидатидозов).
Наша работа отличается тем, что в составе представленной адъювантной композиции применено оригинальное сочетание нескольких иммуногенных агентов как биологической, так и химической природы.
Ценность изобретения состоит в том, что иммуногенное действие разработанной адьювантной композиции в сочетании с иммунодоминантными антигенами тканевых гельминтов проявляется в виде 3-х основных процессов:
1 - в изменении состояния вводимых паразитарных антигенов (их агрегирование с компонентами адъюванта), что способствует взаимодействию с чувствительными клетками иммунной системы животного, облегчая фагоцитоз.
2 - в депонировании антигенов гельминтов, их пролонгированной циркуляции в организме и в замедлении гидролиза антигенных молекул тканевыми ферментами за счет использования мелкодисперсной масляной основы и гидрофильного эмульгатора «Твин-80».
3 - в дополнительной стимуляции вспомогательных звеньев иммуногенеза, в том числе усилении макрофагальной реакции, синтезе оксида азота, стимуляции Т- и В-лимфоцитов, цитокинов, глобулинов, антител, связанных с введением в адъювантную композицию эукариотической рибонуклеиновой кислоты (РНК) и аминокислоты L-аргинина. Небольшие гранулемы у иммунизированных животных на месте апликации служат показателем адъювантного действия вакцинного препарата и его морфологической корреляции.
Многие иммуноадъюванты стимулируют образование антител, но лишь некоторые способны повысить их аффинность, а следовательно, и эффективность, а также активизировать клеточное звено иммунитета. Поскольку от этих свойств зависит напряженность гуморального и клеточного иммунитета, использование РНК, аминокислоты L-аргинина, гидрофильного эмульгатора и минерального масла в составе адъювантной композиции в сочетании с иммунодоминантными антигенами паразитов позволяет обеспечить пролонгированный протективный эффект вакцинного препарата против тканевых гельминтозов.
Способ получения адъювантной водно-масляной эмульсии состоит из следующих этапов:
1. Получение препаративных количеств РНК из культуры Saccharomycis cerevisiae и ее очистка.
2. Качественный и количественный анализ выделенной РНК.
3. Технология получения водно-масляной эмульсий для адъювантной композиции.
4. Технология использования представленного адъюванта для приготовления вакцинирующего комплекса с иммунодоминантными антигенами тканевых гельминтов (Echinococcus granulosus, Echinococcus multilocularis, Trichinella spiralis).
Ввиду трудностей в приобретении коммерческого препарата Na РНК надлежащего качества получение препаративных количеств РНК из культуры Saccharomycis cerevisiae и ее очистку проводили общепринятыми методами согласно рекомендациям Sambrook J., Fritch E.F., Maniatis Т., 1989.
Качественный и количественный анализ используемой в адъювантной композиции эукариотической РНК осуществляли по ранее разработанной авторами «Методике определения Na РНК в вакцинных и антгельминтных препаратах», утвержденной на секции «Инвазионные болезни животных» Отделения Ветеринарной медицины РАСХН 27 мая 2006 г.(2).
Технология получения водно-масляной эмульсии для адъювантной композиции включает несколько этапов.
1. Минеральное масло (марки Маркол - 52, в случае отсутствия допускается замена Oleum Vaselini) в количестве 50 мл (50% по объему) разливают в колбы Эрленмейера объемом не менее 250 мл и автоклавируют в течение 1 часа при давлении 0.5 атм.
2. В мерную колбу объемом 50 мл поместить 30-40 мл стерильного физиологического раствора и последовательно растворить в нем 5 граммов аминокислоты L-аргинина и 500 мг (0,0025%) лиофильно высушенной РНК. В полученную смесь биологических компонентов постепенно добавляют гидрофильный эмульгатор Твин-80 в количестве 2-х мл (2%) и осторожно перемешивают, не допуская вспенивания, после чего доводят объем до 50 мл раствором 0,9% NaCl. Затем полученную смесь реагентов в условиях стерильного бокса пропускают через бактериальную мембрану с диаметром пор в нитроцеллюлозном фильтре 200-240 мкм.
3. В колбу Эрленмейера с простерилизованным минеральным маслом добавляют 50 мл вышеуказанной смеси реагентов и помещают ее на шейкер магнитную мешалку (или лабораторную качалку) при температуре не выше 4-6°С и 120-150 об/мин в течение 2 часов для получения водно-масляной эмульсии.
4. Технология использования полученного адъюванта для приготовления вакцинирующего комплекса с иммунодоминантными антигенами тканевых гельминтов (Echinococcus granulosus, Echinococcus multilocularis, Trichinella spiralis).
Для приготовления иммунизирующего комплекса используются иммунодоминантные антигены тканевых гельминтов (патент РФ №2234539 от 20.08.04 и патент РФ №2287342 от 20.10.06), растворенные в стерильном физиологическом растворе. Концентрация белка предварительно измеряется по методу Лоури и должна составлять в конечном препарате не менее 350-500 мкг/мл.
Повторное эмульгирование проводят в течение 4-6 часов при температуре 2-4°С при интенсивном перемешивании, предварительно соединив 50 мл растворенного антигена и 150 мл адъювантной композиции.
Протективные свойства иммунопрепаратов изучали на нескольких видах лабораторных животных при двукратном подкожном введении с интервалом 21-30 дней и проверочным заражением иммунизированных и контрольных животных инвазионным материалом через 14 дней после последней иммунизации.
Полученные биологические препараты тестировали на предмет их иммуногенности, используя в качестве контроля традиционные коммерческие адъюванты: полный и неполный адъюванты Фрейнда и иммунофан, при этом количество вводимого специфического антигена животным каждой группы было строго одинаковым.
Примеры конкретного исполнения
Пример 1
Сравнительный анализ иммуногенных свойств вакцинирующего комплекса на основе иммунодоминантных антигенов трихинелл молекулярной массой 29-63 кДа в сочетании с различными адъювантами изучали на белых беспородных мышах весом 18-20 г. Животных в количестве 50 голов разделили на 5 групп, по 10 голов в каждой. Иммунизацию проводили дважды, подкожно, с интервалом в 21 день. Объем вводимого препарата составлял 0,25 мл, при этом суммарное количество вводимого антигена для животных всех групп составило 100 мкг.
Животных 1-й группы иммунизировали экскреторно-секреторными антигенами трихинелл, эмульгированными с равным объемом ПАФ (125 мкл антигена и 125 мкл полного адъюванта Фрейнда).
Животных 2-й группы иммунизировали только антигенами трихинелл, объем вводимого препарата восполнили стерильным физиологическим раствором.
Животных 3-й группы иммунизировали антигенами трихинелл, эмульгированными в равном объеме представленного в данной заявке адъюванта.
Животные 4-й группы были инъецированы антигенами трихинелл, смешанными с равным объемом 0,005%-ного иммунофана (коммерческого препарата, рекомендованного для увеличения титров и длительности циркуляции специфических антител при совместной вакцинации с антигенами).
Животные 5-й группы являлись контрольными и в установленные сроки были инъецированы стерильным физраствором.
Через 14 дней после последней иммунизации всех мышей заразили per.os инвазионными личинками трихинелл в количестве 100 личинок на мышь. Убой подопытных животных провели на 63 день после их заражения. Результаты опыта показали, что все животные контрольной (5-й) группы были интенсивно заражены трихинеллезом, количество гельминтов в средней пробе костно-мышечного фарша после переваривания в искусственном желудочном соке (ИЖС) составило 1785 личинок/г.
Количество личинок в средней пробе костно-мышечного фарша у животных 1-й и 3-й групп после переваривания в ИЖС было практически одинаковым и составило соответственно 26,4 и 28,2 личинок/г. Таким образом, эффект защиты составил 98,1%. Животные, иммунизированные только экскреторно-секреторными антигенами трихинелл (2-я группа) оказались заражены значительно интенсивнее (586 личинок/г, соответственно эффект защиты составил 60,5%), а у животных 4-й группы интенсивность инвазии составила 379 личинок/г (74,5%), что свидетельствует о недостаточном протективном эффекте при применении этих препаратов.
Пример 2
Изучение динамики антителогенеза при иммунизации кроликов рекомбинантными антигенами эхинококка EgFB с различными адъювантами.
Для определения оптимального сочетания в биологическом препарате EgFB адъювантных субстанций, взаимостимулирующих развитие гуморального и клеточного иммунитета, были сформированы 4 опытных группы животных. В начале опыта у каждого из 12 кроликов были отобраны пробы сыворотки крови. При проведении экспериментов титр специфических антител у иммунизированных животных в ИФР учитывался за вычетом показателей оптической плотности этих проб, служивших отрицательным контролем конкретно для каждого кролика. Животные всех групп были иммунизированы подкожно однократно в дозе 600 мкг антигенов EgFB, растворенных в 1 мл физиологического раствора с равным объемом одной из 4-х исследуемых адъювантных композиций.
1-й группе кроликов вводили антигены эхинококка EgFB с 1 мл 0,05%-ного раствора иммунофана (синтетического гексапептида C36H61O10N12), сочетанное применение которого с вакцинами резко увеличивает титры и длительность циркуляции специфических антител).
2-й группе кроликов в качестве адъювантной субстанции применили экскреторно-секреторный антиген T.spiralis в дозе 476 мкг по белку. Суммарный объем вакцинирующей композиции составил 2 мл.
3-й группе кроликов ввели вакцинирующую композицию с антигеном эхинококка EgFB в объеме 2 мл, в качестве адъюванта использовалась 4-х компонентная адъювантная эмульсия, представленная в настоящей заявке на изобретение.
4-й группе кроликов, являющейся базовым контролем, ввели то же количество антигена EgFB (600 мкг), эмульгированного с ПАФ. Объем вводимой вакцинной композиции составил 2 мл.
Динамику титра специфических антител определяли в ИФР на 7, 14, 21, 30, 90 и 120 день после завершения иммунизации.
Проведенные исследования показали, что у однократно иммунизированных животных специфические антитела против антигенов эхинококка EgFB начинают определяться с 7 дня после вакцинации, максимальных значений достигают к 21-30 дню, затем наступает период снижения их уровня, причем динамика и интенсивность этого процесса значительно различаются в зависимости от состава применяемого адъюванта.
Из испытанных композиций наилучшие показатели в ИФР были у антигена EgFB в сочетании с ПАФ (производства США). Высокие титры специфических антител регистрируются у иммунизированных животных длительное время, но высокая стоимость ПАФ, образование у животных обширных гранулем и абсцессов в местах введения препарата ограничивают применение этого адъюванта при производстве вакцины в ветеринарии.
Заменой ПАФ в составе биологического препарата EgFB может служить многокомпонентная водно-масляная эмульсия, рецептура и технология приготовления которой приводится в данной заявке на изобретение.
В местах введения этого препарата образуются лишь небольшие гранулемы, рассасывающиеся в течение нескольких недель.
Специфические антитела в сыворотке крови иммунизированных животных 3-й и 4-й групп регистрировались на протяжении всего срока наблюдения в диагностическом титре, что свидетельствует о наличии пролонгированного иммунитета против инвазии (чертеж а,б). Принимая во внимание иммунобиологические свойства представленного адъюванта и доступность всех его компонентов (отечественного производства), предлагаем использовать его в сочетании с различными паразитарными антигенами для профилактики гельминтозов.
Пример 3
Исследования проводили на 62 белых беспородных мышах весом 18-20 грамм, разделенных на 3 группы.
Первая группа была иммунизирована подкожно двукратно с интервалом 21 день препаратом, состоящем из экскреторно-секреторного антигена (50 мкг белка в 0,125 мл по объему) и равного количества представленного адъюванта (125 мл).
Вторая группа мышей была иммунизирована подкожно одной адъювантной композицией (без антигена) в той же дозе двукратно с интервалом в 21 день.
Третья группа была двукратно инъецирована стерильным физиологическим раствором по той же схеме.
По истечении 14 дней после последней иммунизации было проведено заражение всех трех групп мышей инвазионными личинками трихинелл в дозе 200 личинок на одно животное. Учет результатов опыта через 60 дней после заражения представлен в таблице 1.
Приведенные расчеты показывают, что уровень защиты при экспериментальном заражении T.spiralis мышей, вакцинированных препаратом, содержащим антиген и адъювант, составил 94,25%.
Пример 4
Исследования проводили на 16 молодых кроликах породы «Советская Шиншилла», разделенных на две равноценные группы - опытную и контрольную. Опытная группа животных была двукратно (с интервалом в 20 дней) подкожно иммунизирована препаратом, состоящим из равных объемов (по 0,25 мл) полного адъюванта Фрейнда и экскреторно-секреторного антигена Т.spiralis (доза по белку 250 мкг).
Контрольная группа кроликов была инъецирована в те же сроки стерильным физиологическим раствором. По истечении 14 дней после последней иммунизации обе группы заразили инвазионными личинками трихинелл в дозе 4 тысячи на одно животное.
Убой экспериментальных животных провели через 60 дней после заражения трихинеллами. С тушек кроликов отделили всю мышечную ткань и измельчили на электромясорубке (каждую по отдельности), тщательно перемешали и провели протеолиз трех аликвот фарша от каждой тушки в искусственном желудочном соке. Результаты опыта представлены в таблице 2.
Приведенные расчеты также показывают, что уровень защиты при экспериментальном заражении Т.spiralis кроликов, двукратно вакцинированных данным препаратом, составил 95,5%.
Проведенные опыты показали высокую иммуногенность препарата на основе экскреторно-секреторного антигена трихинелл с представленным адъювантом при двукратном подкожном введении лабораторным животным, эффект защиты составил от 94 до 98%.
Пример 5
Анализ протективных свойств адъювантной композиции при альвеолярном гидатидозе белых беспородных крыс.
Исследования проводили на 24 белых беспородных крысах массой 180-200 г, распределенных на 4 группы. Иммунизацию проводили дважды, подкожно, в объеме 0,5 мл, с интервалом 21 день.
Первая группа крыс была инъецирована рекомбинантным антигеном эхинококка EgF (240 мг по белку) в сочетании с представленным адъювантом.
Второй группе животных ввели один антиген EgF в той же дозе.
Третья группа крыс была иммунизирована одним адъювантом, а четвертой группе животных, являющихся контрольными, вводили стерильный физиологический раствор.
Через 21 день после последней иммунизации животных всех групп заразили протосколексами и ацефалоцистами Echinococcus multilocularis в количестве 600-800 экземпляров.
Убой животных и учет результатов опыта проводили через 6 месяцев после заражения. Результаты вскрытия показали, что все крысы 4-й группы были заражены альвеолярным гидатидозом, причем диаметр цист достигал 2-3 см, при микроскопии были обнаружены зрелые протосколексы, в то время как 5 животных 1-й группы были свободны от инвазии. У одной крысы в печени были обнаружены окруженные гнойной капсулой 2 ларвоцисты паразита диаметром около 1 мм. У 4-х животных 2-й и 3-й групп были обнаружены (по сравнению с имеющимися у крыс 1-й группы) мелкие ларвоцисты паразита, в основном без зародышевых элементов, что свидетельствует о недостаточном протективном эффекте при раздельном применении адъювантной композиции и антигена. Сочетанное же применение этих двух субстанций обеспечивает надежную защиту от заражения альвеолярным гидатидозом.
Пример 6
Иммуногенные свойства вакцинирующего комплекса, состоящего из рекомбинантного антигена EgF и представленного в заявке на изобретение адъюванта, изучали на 25 овцах грозненской породы в Джейрахском районе Республики Ингушетия. Животных поделили на две группы. Первую, в количестве 20 овец, двукратно, с интервалом в 30 дней, иммунизировали подкожно эмульсией, состоящей из равных объемов рекомбинантного антигена эхинококка EgF (в 2-х мл препарата содержалось 15 мг белка) и адъювантной композиции. Вторая группа, состоящая из 5 голов, оставалась интактной. Через две недели после второй иммунизации всех животных заразили активированными онкосферами E.granulosus, выделенными из кишечников зараженных эхинококкозом диких плотоядных лесов Северного Кавказа (шакала и 3-х лис), в количестве 1000 экземпляров на овцу. Пробы крови овец отбирали на 45 и 60 дни после заражения ларвальным гидатидозом. Уровень специфических антител оценивали иммуноферментным методом с использованием тест-системы «ИФА-эхинококк-IgG-стрип» (нами подана заявка на изобретение «Способ прижизненной диагностики ларвальных гидатидозов овец», №137821 от 26 октября 2006 г.). Статистическую обработку данных проводили по методу Фишера и Стьюдента, 1957; достоверность составила p<0,05. Титры специфических антител к антигенам эхинококка в среднем по группе через 45 и 60 дней после заражения составили: у иммунизированных овец 1:12800, у зараженных 1:100, 1:200, что свидетельствует о высоких иммуногенных свойствах испытанного вакцинирующего комплекса.
Источники информации
1. Одоевская И.М. Анализ титров специфических антител при иммунизации животных биологическим препаратом EgFB с различными адъювантами. // Ж. Медицинская паразитология и паразитарные болезни. - М.: - 2006. - №4. - С.- 13-16.
2. Одоевская И.М., Асеев В.В., Бенедиктов И.И. и др. «Методика определения Na РНК в вакцинных и антигельминтных препаратах». // М.: - Труды ВИГИС. - 2007. - Т.43 - С.286-297.
3. Одоевская И.М., Плиева A.M., Бенедиктов И.И. Лабораторный регламент на проведение ИФР при ларвальном гидатидозе овец. // Труды ВИГИС. - М. - 2007. - Т.43 - С.- 307-317.
4. Gamble H.R. Trichinella spiralis: Immunization of Mice Using Monoclonal Antibody Affinity-Isolated Antigens. Exp.Parasitology-1985. V.59. - P.398-404.
5. Heath D.D., Lawrence S.B. //Antigen polipeptides of Echinococcus granulosus oncospheres and definition of protective molecules. Parasite Immunol., 1996, V.18. - P.347-357.
6. Heath D.D., Lightowlers M.W.// Vaccination on Hydatidology-State of the Art. Arch. Int. Hidatid. - 1997. - V.32. - P.209-214.
7. Lightowlers M.W., Jensen O.E., Femandez J.A., Iriarte D.J., Woollard D.J., Jenkins D.J., Heath D.D. Vaccination trials in Australia fhd Argentina confirm the effectiveness of the EG95 hydatid vaccine in sheep // Int. J. Parasitol. - 1999. - V.29. - P.531-534.
8. Lightowlers M.W., A. Flisser, Gauci C.G., Heath D.D., Jensen O., Roife R. Vaccination against cysticercosis and hydatid disease // Parasitol. Today. - 2000. - V.16. - P.191-196.
9. Lightowlers M.W., Lawrence S.B., Gauci C.G., Young J., Ralston M.J., Maas D., Health D.D. Vaccination against hydatidosis using a defined recombinant antigen // Parasite Immunol. - 1996. - V.18. - P.457-462.
10. Sambrook J., Fritch E.F., Maniatis T. Extration and purification of RNA. // In: Molecular Cloning. A laboratory manual. Second edition. Cold Spring Harbor Laboratory Press. - 1989. - P. - 730-737.
11. Woollard D.J., Heaht D.D., Lightowlers M.W. Assessment of protective immune responses against hydatid disease in sheep by immunization with synthetic peptide antigens // Parasitology - 2000. - V.121. - N2. - P.145-153.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ИММУНОПРОФИЛАКТИКИ ТКАНЕВЫХ ГЕЛЬМИНТОЗОВ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ЧЕЛОВЕКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2830894C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОГО АНТИГЕНА Trichinella spiralis | 2005 |
|
RU2287342C1 |
| СПОСОБ ПРИЖИЗНЕННОЙ ДИАГНОСТИКИ ЛАРВАЛЬНОГО ГИДАТИДОЗА (ЭХИНОКОККОЗА) ОВЕЦ | 2006 |
|
RU2337647C2 |
| СПОСОБ ПРОФИЛАКТИКИ ВТОРИЧНОГО АЛЬВЕОЛЯРНОГО ЭХИНОКОККОЗА (ГИДАТИДОЗА) | 2004 |
|
RU2279274C2 |
| НОСИТЕЛЬ И АДЪЮВАНТ ДЛЯ АНТИГЕНОВ | 2006 |
|
RU2311926C2 |
| ВАКЦИНА ПРОТИВ ГЕЛЬМИНТОЗОВ | 1996 |
|
RU2095082C1 |
| СПОСОБ СТИМУЛИРОВАНИЯ ИММУННОГО ОТВЕТА ПРОТИВ ПАРАЗИТИЧЕСКИХ ГЕЛЬМИНТОВ ЖИВОТНЫХ | 1994 |
|
RU2145876C1 |
| Способ профилактики ларвальной стадии альвеолярного эхинококкоза | 2016 |
|
RU2609858C1 |
| СПОСОБ ПРОФИЛАКТИКИ МЫШЕЧНОЙ СТАДИИ ТРИХИНЕЛЛЁЗА | 2014 |
|
RU2562703C1 |
| ПРИМЕНЕНИЕ ПЕПТИДА, УСИЛИВАЮЩЕГО СЕКРЕЦИЮ СОМАТОТРОПНОГО ГОРМОНА, В КАЧЕСТВЕ АДЪЮВАНТА ВАКЦИНЫ | 2017 |
|
RU2768134C2 |
Изобретение относится к области биотехнологии. Композиция содержит минеральное масло, Твин-80, L-аргинин, РНК из культуры Saccharomyces cerevisiae и физиологический раствор в следующем соотношении компонентов: минеральное масло - 100 мл, Твин-80 - 2 мл, L-аргинин - 5 г, РНК из культуры Saccharomyces cerevisiae - 0,5 г, физиологический раствор - до конечного объема 150 мл. Сочетание биологических и химических компонентов композиции с иммунодоминантными антигенами тканевых гельминтов в ветеринарном препарате обеспечивает длительный напряженный иммунитет у вакцинируемых животных. 2 табл., 1 ил.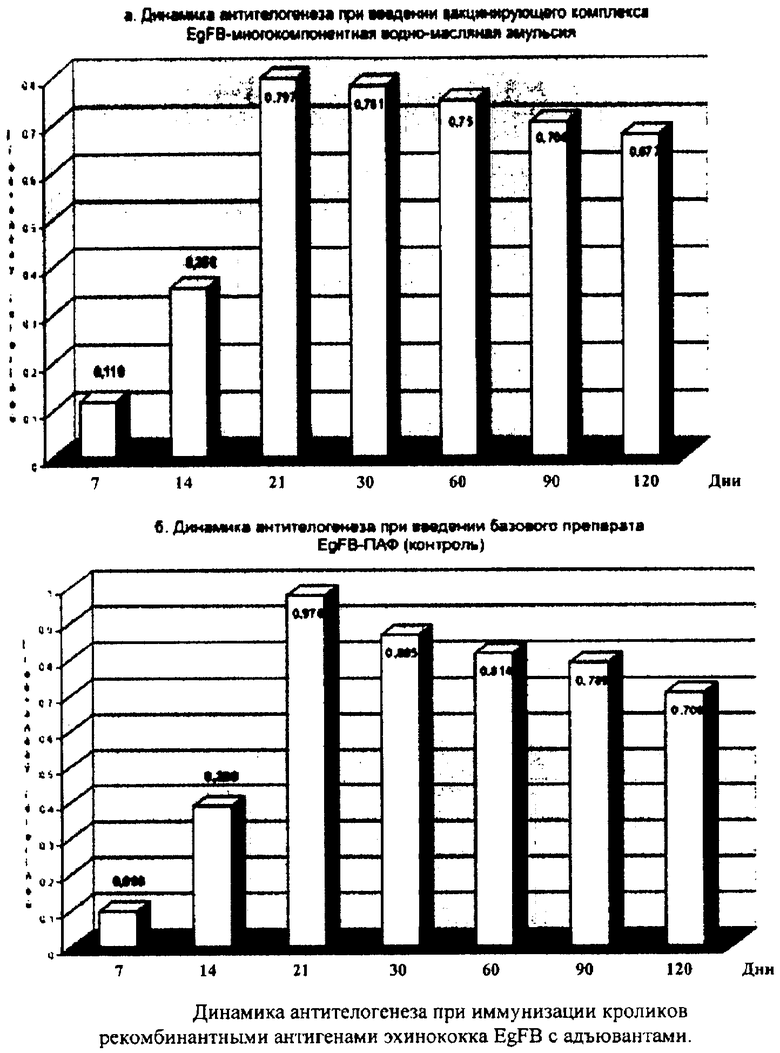
Адъювантная композиция для инъекционных вакцин против тканевых гельминтозов, состоящая из эмульгированной смеси биологических и химических компонентов, отличающаяся тем, что содержит минеральное масло, Твин-80, L-аргинин, РНК из культуры Saccharomyces cerevisiae и физиологический раствор в следующем соотношении компонентов:
| СПОСОБ СТИМУЛИРОВАНИЯ ИММУННОГО ОТВЕТА ПРОТИВ ПАРАЗИТИЧЕСКИХ ГЕЛЬМИНТОВ ЖИВОТНЫХ | 1994 |
|
RU2145876C1 |
| ВАКЦИНА ПРОТИВ ГЕЛЬМИНТОЗОВ | 1996 |
|
RU2095082C1 |
| WO 9323542 А, 25.11.1993 | |||
| WO 9402169 А, 03.02.1994 | |||
| WO 9008819 А, 09.08.1990. | |||
Авторы
Даты
2009-03-10—Публикация
2007-02-26—Подача