ОБЛАСТЬ ТЕХНИКИ
[0001] Идея настоящего изобретения относится к микроорганизму, обладающему способностью продуцировать О-сукцинилгомосерин или янтарную кислоту, и к способу продуцирования О-сукцинилгомосерина или янтарной кислоты посредством его применения.
УРОВЕНЬ ТЕХНИКИ
[0002] Для стимуляции продуцирования О-сукцинилгомосерина или янтарной кислоты в аэробных условиях необходим сукцинил-СоА в качестве предшественника. α-Кетоглутаратдегидрогеназный комплекс выступает в качестве катализатора для превращения α-кетоглутарата в янтарную кислоту путем дегидрогенизации в цикле трикарбоновых кислот (ТСА). Ген sucAB, кодирующий данный фермент, экспрессируется в виде кластера в хромосоме вместе с sdhCDAB, кодирующим сукцинатдегидрогеназу, и sucCD, кодирующим сукцинил-СоА-синтетазу, и известно, что эта экспрессия индуцируется двумя промоторами, включенными в кластер. Экспрессия генов в кластере индуцируется главным образом промотором sdhC. При этом sdhCDAB, sucAB и sucCD экспрессируются в указанном порядке. Цикл ТСА является преимущественным для экспрессии гена sdhCDAB, кодирующего сукцинатдегидрогеназу, и соответственно является преимущественным для быстрого разложения сукцинил-СоА по причине стимулируемой экспрессии сукцинатдегидрогеназы даже при том, что сукцинил-СоА продуцируется в результате экспрессии sucAB. Промотор sucA расположен между sdhCDAB и sucAB в центре кластера. Промотор sucA вызывает экспрессию sucAB, но более важным промотором в этом кластере является sdhC, который индуцирует экспрессию sdhCDAB. Промотор sucA является более слабым, чем промотор sdhC (SJ Park, G Chao and RP Gunsalus, J. Bacteriol. 1997; Cunningham, L. & Guest, J.R. (1998) Microbiology 144, 2113-2123). Имеется сообщение, в котором демонстрируется, что продуцирование янтарной кислоты увеличивалось при делеции sdhAB у штамма, продуцирующего янтарную кислоту, в аэробных условиях (A.Yu. Skorofkhodova, et al., Applied Biochemistry and Microbiology, December 2013, Vol. 49, Issue 7, pp. 629-637).
[0003] В ходе исследования стимуляции продуцирования янтарной кислоты или О-сукцинилгомосерина авторы настоящего изобретения создали микроорганизм, способный к стимуляции продуцирования О-сукцинилгомосерина или янтарной кислоты путем повышения активности α-кетоглутаратдегидрогеназного комплекса, что приводит к выполнению настоящего раскрытия.
ПОДРОБНОЕ ОПИСАНИЕ ИДЕИ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
[0004] Целью настоящего раскрытия является обеспечение микроорганизма, продуцирующего О-сукцинилгомосерин или янтарную кислоту.
[0005] Другой целью настоящего раскрытия является обеспечение способа продуцирования О-сукцинилгомосерина или янтарной кислоты, включающего стадию культивирования микроорганизма, обладающего способностью продуцировать О-сукцинилгомосерин или янтарную кислоту.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
[0006] В соответствии с одним аспектом идеи настоящего изобретения обеспечивается микроорганизм, обладающий способностью продуцировать О-сукцинилгомосерин или янтарную кислоту.
[0007] В варианте осуществления настоящего раскрытия микроорганизм, обладающий способностью продуцировать О-сукцинилгомосерин или янтарную кислоту, может представлять собой микроорганизм, у которого активность α-кетоглутаратдегидрогеназного комплекса повышена относительно уровня ее эндогенной активности, что, таким образом, стимулирует продуцирование О-сукцинилгомосерина или янтарной кислоты.
[0008] Термин "микроорганизм, обладающий способностью продуцировать О-сукцинилгомосерин или янтарную кислоту", используемый в данном документе, означает прокариотический или эукариотический микроорганизм, который продуцирует О-сукцинилгомосерин или янтарную кислоту в живом организме и может накапливать или секретировать О-сукцинилгомосерин или янтарную кислоту в нем. Например, микроорганизм, обладающий способностью продуцировать О-сукцинилгомосерин или янтарную кислоту, может представлять собой микроорганизм, принадлежащий к роду Escherichia, роду Erwinia, роду Serratia, роду Providencia, роду Corynebacterium, роду Pseudomonas, роду Leptospira, роду Salmonella, роду Brevibacterium, роду Hypomonas, роду Chromobacterium, роду Nocardia или грибам или дрожжам. В одном варианте осуществления микроорганизм в соответствии с настоящим раскрытием может представлять собой микроорганизм, принадлежащий к роду Escherichia. В одном варианте осуществления микроорганизм в соответствии с Настоящим раскрытием может представлять собой Е. coli.
[0009] Для стимуляции продуцирования янтарной кислоты и О-сукцинилгомосерина необходим сукцинил-СоА. Сукцинил-СоА образуется путем дегидрогенизации α-кетоглутарата в цикле ТСА.
[0010] α-Кетоглутаратдегидрогеназный комплекс представляет собой каталитический фермент, который катализирует продуцирование янтарной кислоты путем дегидрогенизации α-кетоглутарата в цикле ТСА. α-Кетоглутаратдегидрогеназный комплекс состоит из α-кетоглутаратдегидрогеназы и дигидролипоатсукцинилтрансферазы и кодируется геном sucAB (sucA, № доступа в GenBank ВАА35392.1, sucB, № доступа в GenBank ВАА35393.1). α-Кетоглутаратдегидрогеназа и дигидролипоатсукцинилтрансфераза могут иметь аминокислотные последовательности, приведенные соответственно под SEQ ID NO: 22 и SEQ ID NO: 24, или последовательности, по меньшей мере на 70%, 80%, 90% или 95% гомологичные последовательностям, кодируемым генами sucA и sucB. sucA и sucB могут иметь последовательности, приведенные соответственно под SEQ ID NO: 23 и SEQ ID NO: 25, или последовательности, по меньшей мере на 70%, 80%, 90% или 95% гомологичные данным последовательностям. sucAB экспрессируется в виде кластера с sdhCDAB и sucCD. sdhCDAB, кодирующий сукцинатдегидрогеназу, экспрессируется на высоком уровне благодаря сильному промотору для sdhCDAB, и поэтому янтарная кислота м сукцинил-СоА быстро разрушаются (Louise Cunningham et al., Microbiology (1998), 144, p. 211-2123). Таким образом, продуцирование янтарной кислоты и сукцинил-СоА можно стимулировать посредством увеличения продуцирования янтарной кислоты путем повышения активности фермента.
[0011] Термин "эндогенная активность", используемый в данном документе, означает активность в исходном микроорганизме или клетке в естественных условиях или до мутации.
[0012] В варианте осуществления настоящего раскрытия вышеупомянутый микроорганизм представляет собой микроорганизм, принадлежащий к роду Escherichia, у которого активность гомосерин-О-сукцинилтрансферазы повышена относительно уровня ее эндогенной активности.
[0013] Гомосерин-О-сукцинилтрансфераза представляет собой фермент, выступающий в качестве катализатора для продуцирования O-сукцинилгомосерина из сукцинил-СоА и гомосерина, который вовлечен в первую стадию пути биосинтеза метионина. Фермент может иметь аминокислотную последовательность, приведенную под SEQ ID NO: 26, или аминокислотную последовательность, по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности, и может кодироваться геном metA (№ доступа в GenBank ВАЕ78015.1). Ген metA может иметь последовательность, приведенную под SEQ ID NO: 27, или последовательность, по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности. Экспрессия этого гена ингибируется путем контроля метионином по принципу обратной связи. Таким образом, для стимуляции продуцирования метионина применялась мутантная форма, разработанная для увеличения экспрессии metA посредством устранения контроля метионином по принципу обратной связи. Гомосерин-О-сукцинилтрансфераза, не подвергаемая опосредованному метионином контролю по принципу обратной связи, может иметь аминокислотную последовательность, приведенную под SEQ ID NO: 32, или последовательность, по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности, и ее ген может кодироваться последовательностью, приведенной под SEQ ID NO: 33 (metA11: публикация корейского патента №2009-0106365), или последовательностью, по меньшей мере на 80%, 90% или 95% гомологичной данной последовательности.
[0014] Термин "гомология", используемый в отношении последовательности, используемой в данном документе, означает степень совпадения с указанной аминокислотной последовательностью или нуклеотидной последовательностью, которая может быть представлена в виде процентного значения (%). В настоящем раскрытии гомологичная последовательность, обладающая активностью, идентичной или подобной таковой у указанной аминокислотной последовательности или нуклеотидной последовательности, представлена как "% гомологии", который могут легко определить специалисты в данной области техники, способные использовать компьютерную программу BLAST 2.0, которая рассчитывает такие параметры, как вес выравнивания, идентичность и подобие.
[0015] Термины "повышать" или "усиливать", используемые в данном документе в отношении активности фермента, означают увеличение активности фермента до уровня, превышающего таковой для эндогенной активности, которое может быть обусловлено сверхэкспрессией гена, кодирующего фермент, или увеличение активности фермента до уровня, превышающего уровень эндогенной активности, посредством генной мутации. Например, число копий гена, кодирующего фермент, можно увеличить, или эндогенный промотор гена можно заместить более сильным промотором; в качестве альтернативы, всю последовательность или часть последовательности гена или всю последовательность, регулирующую экспрессию, или ее часть в хромосоме можно подвергнуть мутации путем делеции, замены или вставки или посредством их комбинации.
[0016] Термин "последовательность, регулирующая экспрессию", используемый в данном документе, означает нуклеотидную последовательность, регулирующую экспрессию гена, которая представляет собой сегмент, который может увеличивать или уменьшать экспрессию конкретного гена в организме, и включает в себя промотор, сайт связывания фактора транскрипции и т.п., но не ограничивается этим.
[0017] В варианте осуществления настоящего раскрытия промотор гена, кодирующего соответствующий фермент, можно заместить более сильным промотором, чем эндогенный промотор, или число копий гена можно увеличить с целью увеличения активности соответствующего фермента.
[0018] В варианте осуществления настоящего раскрытия промотор может представлять собой Ptac, Ptrc, Ppro, PR, PL, Prmf или PcysK, все из которых известны как промоторы с сильной активностью, но не ограничиваться ими.
[0019] В варианте осуществления настоящего раскрытия микроорганизм может представлять собой микроорганизм, принадлежащий к роду Escherichia, у которого активность одного или нескольких из ферментов цистатионин-гамма-синтазы и гомосеринкиназы ослаблена по сравнению с соответствующим уровнем эндогенной активности или устранена.
[0020] Цистатионин-гамма-синтаза катализирует превращение О-сукцинилгомосерина в цистатионин. Цистатионин-гамма-синтаза может иметь аминокислотную последовательность, приведенную под SEQ ID NO: 28, Или последовательность по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности, и может кодироваться геном metB (№ доступа в GenBank ВАЕ77371.1). Ген metB может иметь последовательность, приведенную под SEQ ID NO: 29, или последовательность, по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности. При ослаблении или устранении активности данного фермента О-сукцинилгомосерин не превращается в цистатионин или если и превращается, то скорость превращения является очень низкой.
[0021] Гомосеринкиназа выступает в качестве катализатора для синтеза О-фосфогомосерина из гомосерина и может иметь аминокислотную последовательность, приведенную под SEQ ID NO: 30, или последовательность, по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности, и она может кодироваться геном thrB (№ доступа в GenBank ВАВ96580.1). Ген thrB может иметь последовательность, приведенную под SEQ ID NO: 31, или последовательность, по меньшей мере на 70%, 80%, 90% или 95% гомологичную данной последовательности. При ослаблении или устранении активности данного фермента гомосерин не превращается в О-фосфогомосерин или если и превращается, то скорость превращения является очень низкой.
[0022] Термины "ослабленная" или "устраненная", используемые в данном документе в отношении активности фермента, означают соответственно уменьшение экспрессии гена, кодирующего его соответствующий фермент, до уровня, более низкого, чем эндогенный уровень, или полное прекращение активности фермента. Этого можно достичь с помощью мутации всей нуклеотидной последовательности или части нуклеотидной последовательности или всей или части последовательности, регулирующей экспрессию, путем делеции, замещения, вставки или посредством их комбинации.
[0023] В варианте осуществления настоящего раскрытия микроорганизм может представлять собой Е. coli. Микроорганизм можно сконструировать для увеличения активности α-кетоглутаратдегидрогеназного комплеса до уровня, превышающего эндогенный уровень, и дополнительно для повышения активности гомосерин-О-сукцинилтрансферазы до уровня, более высокого, чем ондогенный уровень; или активность одного или обоих из ферментов цистатионин-гамма-синтазы и гомосеринкиназы можно ослабить до уровня, более низкого, чем эндогенный уровень, или устранить.
[0024] В варианте осуществления настоящего раскрытия микроорганизм по настоящему раскрытию может иметь замещение гена metA в хромосоме Е. coli мутантным metA11 (SEQ ID NO: 33, WO2008-127240 A1), для которого регуляция по принципу обратной связи, опосредованная метионином, была устранена, может иметь делецию генов thrB и metB в хромосоме, и может быть трансформирован вектором, содержащим sucAB, который находится под контролем промотора, более сильного, чем его исходный промотор.
[0025] В аспекте настоящего раскрытия обеспечивается способ продуцирования О-сукцинилгомосерина или янтарной кислоты, при этом способ включает культивирование микроорганизма из рода Escherichia в культуральной среде, у которого активность α-кетоглутаратдегидрогеназного комплеса повышена по сравнению с уровнем его эндогенной активности, и извлечение О-сукцинилгомосерина или янтарной кислоты из культуральной среды или культивированного микроорганизма.
[0026] В варианте осуществления настоящего раскрытия в способе продуцирования О-сукцинилгомосерина или янтарной кислоты культивирование микроорганизма, обладающего способностью продуцировать О-сукцинилгомосерин или янтарную кислоту, можно осуществлять посредством применения подходящей среды и условий культивирования, хорошо известных специалистам в данной области техники. Этот процесс культивирования можно легко регулировать в зависимости от штамма, выбранного специалистами в данной области техники. В качестве примеров способа культивирования включены без ограничений все из периодического культивирования, непрерывного культивирования и культивирования с подпиткой. Различные способы культивирования, включающие вышеупомянутые, пояснены в литературном источнике ("Biochemical Engineering", James М. Lee, Prentice-Hall International Editions, pp 138-176.).
[0027] Культуральная среда в данном документе должна удовлетворять условия культивирования, необходимые для культивирования конкретного штамма в данном документе. Различные культуральные среды для микроорганизмов описаны в литературном источнике ("Manual of Methods for General Bacteriology", American Society for Bacteriology, Washington D.C., USA, 1981). Эти среды содержат различные источники углерода, источники азота и следовые элементы. Источники углерода включают углеводы, такие как глюкоза, лактоза, сахароза, фруктоза, мальтоза, крахмал и целлюлоза; жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; а также органические кислоты, такие как уксусная кислота. Источник углерода можно применять независимо или в виде комбинации по меньшей мере двух источников углерода. Источник азота включает органические источники азота, такие как пептон, дрожжевой экстракт, подлива, солодовый экстракт, жидкий кукурузный экстракт (CSL) и бобовая мука; а также неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота можно применять в отдельности или в комбинации. В дополнение, в вышеупомянутую культуральную среду может быть дополнительно включен источник фосфора, и его примеры включают дигидрофосфат калия, гидрофосфат дикалия и соответствующие натрийсодержащие соли. Культуральная среда в данном документе также может содержать металл, такой как сульфат магния или сульфат железа. Дополнительно, культуральная среда может включать аминокислоты, витамины и подходящие предшественники.
[0028] Для поддержания аэробных условий в культуральной жидкости в культуральную среду можно вводить кислород или кислородсодержащий газ (воздух). Температура культивирования в данном документе обычно составляет от 20 до 45°С и предпочтительно от 25 до 40°С. Культивирование можно продолжать до тех пор, пока продуцирование О-сукцинилгомосерина или янтарной кислоты не достигнет желаемого уровня, и предпочтительное время культивирования составляет от 10 ч. до 160 ч.
ПОЛЕЗНЫЕ ЭФФЕКТЫ
[0029] Штамм, продуцирующий О-сукцинилгомосерин или янтарную кислоту, в соответствии с настоящим раскрытием является эффективным в продуцировании О-сукцинилгомосерина или янтарной кислоты, и его можно применять в различных областях благодаря возможностям ферментативного или химического превращения.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0030] Фиг. 1 представляет собой схематическое изображение рекомбинантного вектора pCL_PsucA-sucAB.
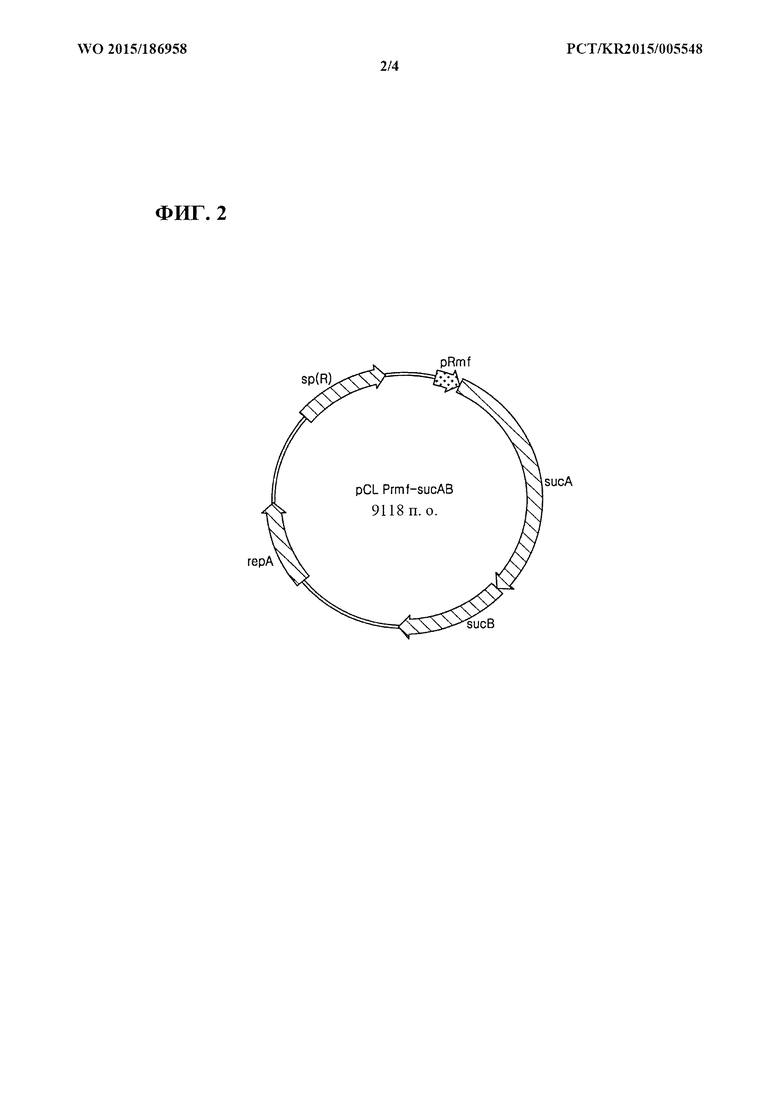
[0031] Фиг. 2 представляет собой схематическое изображение рекомбинантного вектора pCL_Prmf-sucAB.
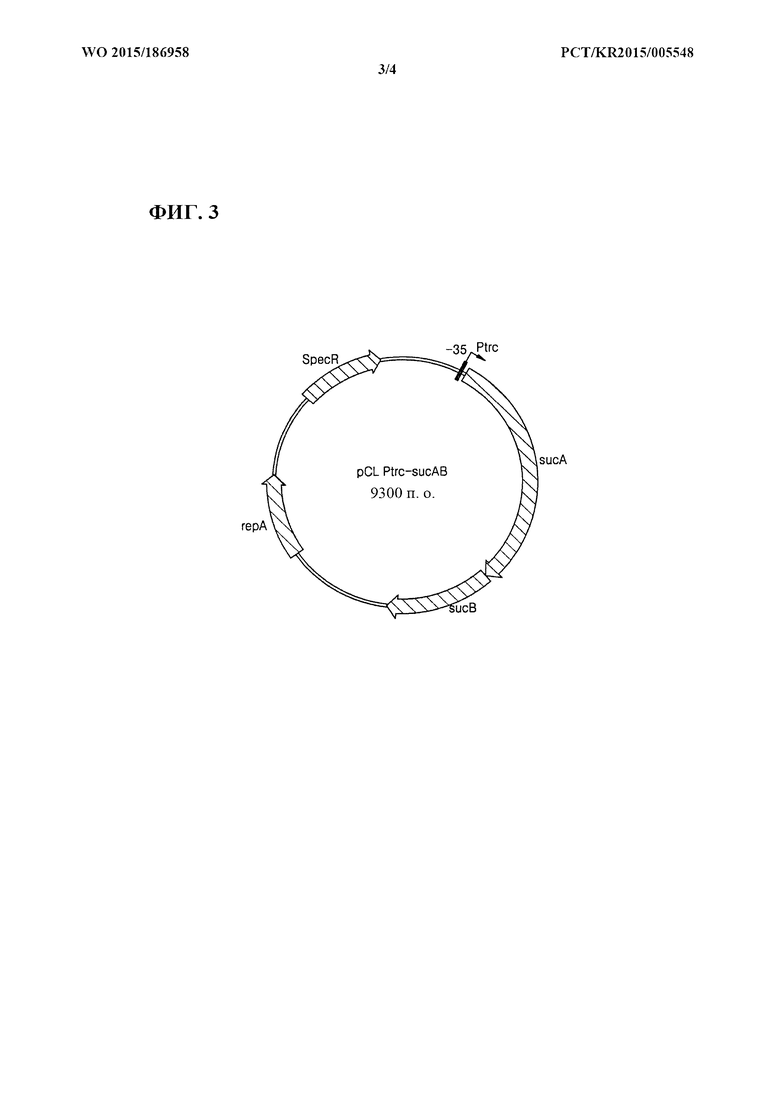
[0032] Фиг. 3 представляет собой схематическое изображение рекомбинантного вектора pCL_Ptrc-sucAB.
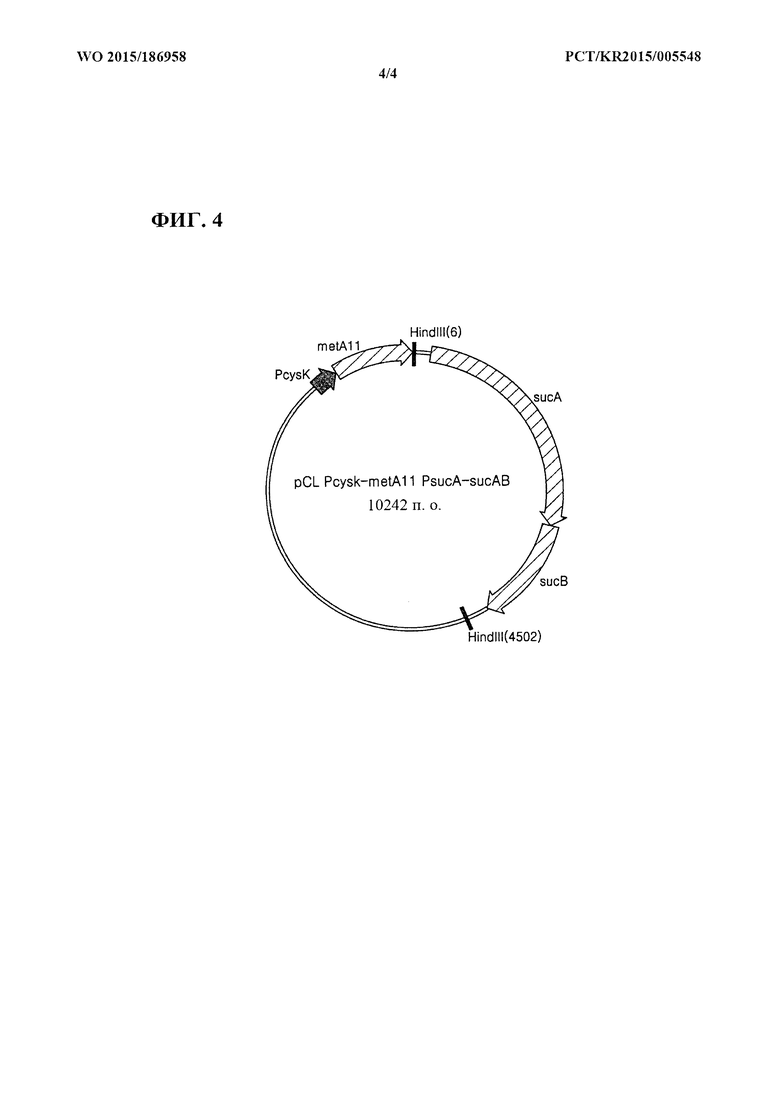
[0033] Фиг. 4 представляет собой схематическое изображение рекомбинантного вектора pCL_Pcysk-metA11_PsucA-sucAB.
ПРИНЦИП ИДЕИ ИЗОБРЕТЕНИЯ
[0034] Далее настоящее раскрытие будет описано более подробно со ссылками на примеры. Однако данные примеры приведены только в целях иллюстрации, и не подразумевается ограничение объема настоящего раскрытия данными примерами.
[0035]
[0036] Сравнительный пример. Конструирование штамма, продуцирующего О-сукцинилгомосерин или янтарную кислоту
[0037] 1) Делеция гена metB
[0038] Для увеличения накопления О-сукцинилгомосерина или янтарной кислоты конструировали штамм путем делеции гена metB, кодирующего цистатионин-гамма-синтазу, участвующую в распаде предшественника L-метионина.
[0039] Подвергали делеции ген metB, кодирующий цистатионин-гамма-синтазу у штамма W3110 Е. coli (K12) дикого типа. Известно, что цистатионин-гамма-синтаза связывается с различными предшественниками метионина и тем самым может обуславливать продуцирование различных побочных продуктов. Таким образом, сверхэкспрессия цистатионинсинтазы может приводить к увеличению частоты побочных реакций, снижая эффективность внутриклеточных реакций. Для делеции гена metB осуществляли одностадийный способ внесения делеции с использованием продуктов ПЦР и FRT (PNAS (2000), Vol. 197, р 6640-6645). Для делеции гена metB осуществляли ПЦР с праймерами, представленными под SEQ ID NO: 12 и SEQ ID NO: 13, с применением вектора pKD3 (PNAS (2000) Vol. 97, p 6640-6645) в качестве матрицы, в результате чего сконструировали делеционную кассету.
[0040] SEQ ID NO: 12:
[0041] 
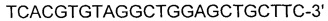
[0042] SEQ ID NO: 13:
[0043] 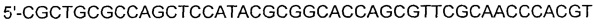
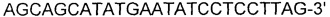
[0044] ПЦР осуществляли следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 1 минуты, осуществляя 30 циклов от денатурации до удлинения. Продукт ПЦР подвергали электрофорезу в 1,0% агарозном геле. Полосу размером 1,1 т.п.о. элюировали и очищали. Извлеченный фрагмент ДНК вводили путем электропорации в штамм W3110 Е. coli (K12), предварительно трансформированный вектором pKD46 (PNAS (2000) Vol. 97, р 6640-6645). Для электропорации штамм W3110, трансформированный с помощью pKD46, культивировали в среде LB, дополненной 200 мкг/л ампициллина и 5 мМ L-арабинозы, при 30°С до достижения OD600 0,5. Штамм промывали 10% глицерином три раза. Электропорацию осуществляли при 2500 В. Извлеченный штамм наносили на чашку со средой LB, содержащей 30 мкг/л хлорамфеникола, с последующим культивированием при 37°С в течение 1-2 дней. Затем отбирали устойчивый штамм.
[0045] Отобранный штамм затем применяли для ПЦР с применением праймеров, представленных под SEQ ID NO: 14 и SEQ ID NO: 15, в соответствии с условиями, упомянутыми выше.
В 1,0% агарозном геле наблюдали полосу размером 1,5 т.п.о., что позволяет предположить, что ген metB был подвергнут делеции.
[0046] SEQ ID NO: 14: 5'-TATTCGCCGCTCCATTCAGC-3'
[0047] SEQ ID NO: 15: 5'-TACCCCTTGTTTGCAGCCCG-3'
[0048] Штамм с делецией гена metB трансформировали вектором рСР20 (PNAS (2000) vol.97, р6640-6645), и его затем культивировали в среде LB, дополненной 100 мкг/л ампициллина. ПЦР осуществляли таким же образом, как описано выше, и отбирали конечный штамм с делецией гена metB, характеризующийся суженной полосой в 1,0% агарозном геле. Подтверждали делецию маркера устойчивости к хлорамфениколу. Полученный штамм, гуксотрофный по метионину, назвали СС03-0132.
[0049] 2) Делеция гена thrB
[0050] Для увеличения продуцирования О-сукцинилгомосерина из гомосерина ген thrB, кодирующий гомосеринкиназу, подвергали делеции. В частности, если применяют штамм, продуцирующий треонин, требуется делеция данного гена, поскольку активность утилизации гомосерина является очень сильной. Для делеции гена thrB у штамма СС03-0132, сконструированного в 1) выше, осуществляли одностадийный способ внесения делеций с использованием продуктов ПЦР и FRT (PNAS (2000) Vol. 97, р 6640-6645). Для делеции гена thrB осуществляли ПЦР с праймерами, представленными под SEQ ID NO: 16 и SEQ ID NO: 17, с применением вектора pKD3 (PNAS (2000) Vol. 97, p 6640-6645) в качестве матрицы, в результате чего сконструировали делеционную кассету.
[0051] SEQ ID NO: 16:
[0052] 
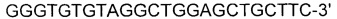
[0053] SEQ ID NO: 17:
[0054] 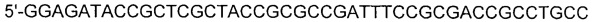

[0055] ПЦР осуществляли следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 1 минуты, осуществляя 30 циклов от денатурации до удлинения. Продукт ПЦР подвергали электрофорезу в 1,0% агарозном геле. Полосу размером 1,1 т.п.о. элюировали и очищали. Извлеченный фрагмент ДНК вводили путем электропорации в штамм СС03-0132, предварительно трансформированный вектором pKD46 (PNAS (2000) Vol.97, р6640-6645). Для электропорации штамм СС03-0132, трансформированный с помощью pKD46, культивировали в среде LB, дополненной 200 мкг/л ампициллина и 5 мМ L-арабинозы, при 30°С до достижения OD600 0,5. Штамм промывали 10% глицерином три раза. Электропорацию осуществляли при 2500 В. Извлеченный штамм наносили на чашку со средой LB, содержащей 30 мкг/л хлорамфеникола, с последующим культивированием при 37°С в течение 1-2 дней. Затем отбирали устойчивый штамм.
[0056] Отобранный штамм направляли на ПЦР с применением праймеров, представленных под SEQ ID NO: 18 и SEQ ID NO: 19, в соответствии с условиями, упомянутыми выше. В 1,0% агарозном геле наблюдали полосу размером 1,5 т.п.о., что позволяет предположить, что ген thrB был подвергнут делеции.
[0057] SEQ ID NO: 18: 5'-CTCGACGATCTCTTTGCC-3'
[0058] SEQ ID NO: 19: 5'-ACGCCGAGAGGATCTTCGCAG-3'
[0059] Подтвержденный штамм трансформировали вектором рСР20 (PNAS (2000) vol. 97, р6640-6645), и его затем культивировали в среде LB, Дополненной 100 мкг/л ампициллина. С ним осуществляли ПЦР таким же образом, как описано выше, и отбирали конечный штамм с делецией гена thrB, характеризующийся меньшей полосой, как подтверждалось посредством электрофореза в 1,0% агарозном геле. Подтверждали делецию маркера устойчивости к хлорамфениколу. Полученный штамм назвали СС03-0133.
[0060]
[0061] 3) Конструирование вектора pSG для вставки metA11
[0062] Гомосеринсукцинилтрансфераза находится под контролем следовых количеств метионина, добавляемого в среду, по принципу обратной связи, поэтому большая часть активности гомосеринсукцинилтрансферазы ингибируется. Для увеличения получения О-сукцинилгомосерина применяли предшественник L-метионина, мутантную форму, не подвергаемую контролю метионином по принципу обратной связи. Для замещения гена metA дикого типа (SEQ ID NO: 27), кодирующего гомосеринсукцинилтрансферазу, в хромосоме Е. coli мутантной формой metA11 (SEQ ID NO: 33), не подвергаемой контролю метионином по принципу обратной связи, конструировали инсерционный вектор pSG-metA11. В соответствии с инструкцией, приведенной в WO 2008/127240 А1, получали информацию о нуклеотидной последовательности гена metA11, и на основании данной информации синтезировали праймеры (SEQ ID NO: 20 и SEQ ID NO: 21), содержащие открытую рамку считывания (ORF), начиная со стартового кодона ATG гена metA11, и сайты распознавания для ферментов рестрикции EcoRI и Sacl. С данными праймерами, представленными следующими последовательностями, осуществляли ПЦР с применением штамма TF4076BJF metA#11, указанного в WO 2008/127240 А1, в качестве матрицы.
[0063] SEQ ID NO: 20: 5'-ggccgaattcatgccgattcgtgtgccgga-3'
[0064] SEQ ID NO: 21: 5'-ggccgagttcttaatccagcgttggattca-3'
[0065] ПЦР осуществляли с применением ДНК-полимеразы Pfu-X (Solgent, SPX16-R250) следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 2 минут с 30 циклами от денатурации до удлинения. В результате получали продукт ПЦР, в котором была амплифицирована ORF metA11, содержащая на обоих концах сайты распознавания для EcoRI и Sacl. Ген metA11, полученный посредством вышеописанной ПЦР, обрабатывали ферментами рестрикции EcoRI и Sacl с последующим лигированием с вектором pSG76-C (J Bacteriol. 1997 Jul; 179(13): 4426-8.), который также обрабатывали ферментами рестрикции EcoRI и Sacl. Наконец, конструировали рекомбинантный вектор pSG-metA11, содержащий клонированный ген metA11.
[0066] 4) Конструирование штамма со вставкой metA11
[0067] Инсерционный вектор pSG-metA11 metA11, сконструированный в сравнительном примере 3), вводили в штамм, полученный в сравнительном примере 2), с последующим культивированием в среде LB-Cm (дрожжевой экстракт - 10 г/л, NaCl - 5 г/л, триптон - 10 г/л, хлорамфеникол - 30 мкг/л). Затем отбирали колонии, устойчивые к хлорамфениколу. Отобранный трансформант представлял собой первичный штамм, в хромосому которого в положении metA был вставлен вектор pSG-metA11. Штамм, в который был введен ген metA11, трансформировали вектором pASceP (JOURNAL OF BACTERIOLOGY, July 1997, 4426-4428), экспрессирующим фермент рестрикции I-SceI для расщепления сайта I-SceI вектора pSG. Штамм отбирали после выращивания в среде LB-Amp (дрожжевой экстракт - 10 г/л, NaCl - 5 г/л, триптон - 10 г/л, хлорамфеникол - 100 мкг/л). В отобранном штамме metA дикого типа был замещен на metA11, и из него был удален вставленный вектор pSG76-C. Этот штамм назвали Е. coli СС03-0038.
[0068] 5) Конструирование штамма, продуцирующего О-сукцинилгомосерин, на основе штамма, продуцирующего треонин
[0069] Штамм, обладающий способностью продуцировать янтарную кислоту и О-сукцинилгомосерин, конструировали с помощью того же способа, который описан в 1)-4) выше, путем применения штамма KCCM 10541Р Е. соli, продуцирующего треонин, описанного в международной заявке на патент WO 2005/075625, вместо штамма W3110 дикого типа, и сконструированный штамм назвали CJM2-A11.
[0070] Пример 1. Конструирование плазмиды для повышенной экспрессии sucAB
[0071] 1-1. Конструирование плазмиды для повышенной экспрессии sucAB с промотором sucA
[0072] Информацию о нуклеотидной последовательности для с-кетоглутаратдегидрогеназного комплекса, кодируемого sucAB (sucA, № доступа в GenBank ВАА35392.1: SEQ ID NO: 23, sucB, № доступа в GenBank BAA35393.1: SEQ ID NO: 25), получали из базы данных Национального центра биотехнологической информации США, и на ее основании синтезировали праймеры, представленные под SEQ ID NO: 1 и SEQ ID NO: 2 и распознаваемые соответственно ферментами рестрикции HindIII и XbaI, содержащие последовательность в пределах до -188 от ATG, инициаторного кодона ORF sucAB, с целью получения гена sucAB под контролем промотора sucA.
[0073] SEQ ID NO: 1: 
[0074] SEQ ID NO: 2: 
[0075] Применяя хромосомную ДНК E. coli W3110 дикого типа в качестве матрицы, осуществляли клонирование гена sucAB, кодирующего α-кетоглутаратдегидрогеназный комплекс, с помощью ПЦР с праймерами, представленными под SEQ ID NO: 1 и SEQ ID NO: 2. ПЦР [Sambrook et al, Molecular Cloning, A Laboratory Manual (1989), Cold Spring Harbor Laboratories] осуществляли с применением ДНК-полимеразы Pfu-X (Solgent, SPX16-R250) следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 5 минут с 30 циклами от денатурации до удлинения. В результате получали продукт ПЦР размером примерно 4,5 т.п.о., содержащий промотор sucA, ген sucAB и сайты распознавания для HindIII и XbaI. Полученный продукт ПЦР обрабатывали ферментами рестрикции HindIII и XbaI. Путем применения ДНК-лигазы Т4 продукт ПЦР лигировали с вектором pCL1920 (Lerner, C.G. and Inouye, M., Nucl. Acids Res.(1990) 18:4631), который был предварительно обработан ферментами рестрикции HindIII и XbaI, в результате чего сконструировали рекомбинантный вектор pCL_PsucA-sucAB. Фиг. 1 представляет собой схематическое изображение, иллюстрирующее рекомбинантный вектор pCL_PsucA-sucAB.
[0076] 1-2. Конструирование плазмиды для повышенной экспрессии sucAB с промотором rmf или trc
[0077] Информацию о нуклеотидной последовательности (sucA, № доступа в GenBank ВАА35392.1: SEQ ID NO: 23, sucB, № доступа в GenBank BAA35393.1: SEQ ID NO: 25) гена sucAB (гена, кодирующего α-кетоглутаратдегидрогеназный комплекс) получали из базы данных Национального центра биотехнологической информации США, и на ее основании синтезировали праймеры, представленные под SEQ ID NO: 3 и SEQ ID NO: 4, имеющие сайты распознавания для EcoRV и HindIII, с целью получения гена sucAB.
[0078] SEQ ID NO: 3: 5'-ATCATGCAGAACAGCGCTTTGAA-3'
[0079] SEQ ID NO: 4: 5'-COCCAACCTTTGTCCATCCTTCACTAATCC-3'
[0080] Применяя хромосомную ДНК Е. coli W3110 дикого типа в качестве матрицы, осуществляли клонирование sucAB с помощью ПЦР с праймерами, представленными под SEQ ID NO: 3 и SEQ ID NO: 4. ПЦР [Sambrook et al, Molecular Cloning, A Laboratory Manual (1989), Cold Spring Harbor Laboratories] осуществляли с применением ДНК-полимеразы Pfu-X (Solgent, SPX16-R250) следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 5 минут с 30 циклами от денатурации до удлинения. В результате получали продукт ПЦР размером примерно 4,3 т.п.о., содержащий ген sucAB и сайт распознавания для фермента рестрикции HindIII. Полученный продукт ПЦР обрабатывали ферментом рестрикции HindIII. Для замещения промотора sucA, то есть нативного промотора гена sucAB, векторы pCL_Prmf-gfp (SEQ ID NO: 5) и pCL_Ptrc-gfp (SEQ ID NO: 6), содержащие соответственно промоторы rmf и trc, обрабатывали ферментами рестрикции EcoRV и HindIII с последующим лигированием с продуктом ПЦР с помощью ДНК-лигазы Т4 (Roche: 10481220001). В результате сконструировали рекомбинантные векторы pCL_Prmf-sucAB и pCL_Ptrc-sucAB. В векторы pCL_Prmf-gfp и pCL_Ptrc-gfp вводили ген зеленого флуоресцентного белка gfp с целью измерения силы промоторов rmf и trc. В это же время sucAB лигировали с промоторным участком вектора, в результате чего сконструировали вектор, содержащий sucAB, который может экспрессироваться под контролем промоторов rmf и trc. Фиг. 2 и фиг. 3 представляют собой схематические изображения, иллюстрирующие соответственно рекомбинантные векторы pCl__Prmf-sucAB и pCL_Ptrc-sucAB.
[0081] Пример 2. Конструирование плазмиды для одновременной повышенной экспрессии sucAB и metA11
[0082] Для синтезирования О-сукцинилгомосерина конструировали вектор экспрессии, одновременно экспрессирующий sucAB и metA11. Информацию о нуклеотидной последовательности гена metA11 получали на основании кодируемой аминокислотной последовательности мутантной О-сукцинилтрансферазы штамма TF4076BJF metA#11, описанного в публикации международной заявки на патент № WO 2008/127240 А1, и на основании информации о нуклеотидной последовательности синтезировали праймеры, представленные под SEQ ID NO: 7 и SEQ ID NO: 8, имеющие на обоих концах сайты распознавания для ферментов рестрикции EcoRV и HindIII, с целью амплификации ORF в пределах от ATG до ТАА гена metA11.
[0083] SEQ ID NO: 7: 5'-GAGTGCGATATC atgccgattcgtgtgccggac-3'
[0084] SEQ ID NO: 8: 5'-GCACTCAAGCTT ttaatccagcgttggatacatg-3'
[0085] Применяя TF4076BJF metA#11 в качестве матрицы, осуществляли ПЦР с праймерами, представленными под SEQ ID NO: 7 и SEQ ID NO: 8. ПЦР осуществляли с применением ДНК-полимеразы Pfu-X (Solgent, SPX16-R250) следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 1 минуты с 30 циклами от денатурации до удлинения. Полученный продукт ПЦР обрабатывали ферментами рестрикции EcoRV и HindIII. Вектор pCL_Pcysk-gfp (3EQ ID NO: 9) обрабатывали ферментами рестрикции EcoRV и HindIII с последующим лигированием с помощью ДНК-лигазы Т4 (Roche: 10481220001). В результате сконструировали рекомбинантный вектор pCL_Pcysk-metA11. Для вставки sucAB в вышеупомянутый сконструированный вектор синтезировали праймеры, представленные под SEQ ID NO: 10 и SEQ ID NO: 11, имеющие сайт распознавания для HindIII.
[0086] SEQ ID NO: 10: 
[0087] SEQ ID NO: 11: 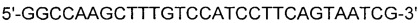
[0088] Для одновременной экспрессии metA11 и sucAB конструировали вектор pCL_Pcysk-metA11_PsucA-sucAB. Вначале, применяя хромосомную ДНК Е. coli W3110 дикого типа в качестве матрицы, осуществляли ПЦР с праймерами, представленными под SEQ ID NO: 10 и SEQ ID NO: 11. ПЦР [Sambrook et al, Molecular Cloning, A Laboratory Manual (1989), Cold Spring Harbor Laboratories] осуществляли с применением ДНК-полимеразы Pfu-X (Solgent, SPX16-R250) следующим образом: денатурация при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и удлинение при 72°С в течение 5 минут с 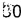 циклами от денатурации до удлинения. В результате получали продукт ПЦР размером примерно 4,5 т.п.о., имеющий PsucA-sucAB, включающий в себя сайт распознавания для HindIII. Полученный продукт ПЦР обрабатывали ферментом рестрикции HindIII с последующим лигированием с помощью ДНК-лигазы Т4 (Roche: 10481220001), с вектором pCL_Pcysk-metA11, который был предварительно обработан ферментом рестрикции HindIII. В результате сконструировали рекомбинантный вектор pCL_Pcysk-metA11_PsucA-sucAB. Фиг. 4 представляет собой схематическое изображение, иллюстрирующее рекомбинантный вектор pCL_Pcysk-metA11_PsucA-sucAB.
циклами от денатурации до удлинения. В результате получали продукт ПЦР размером примерно 4,5 т.п.о., имеющий PsucA-sucAB, включающий в себя сайт распознавания для HindIII. Полученный продукт ПЦР обрабатывали ферментом рестрикции HindIII с последующим лигированием с помощью ДНК-лигазы Т4 (Roche: 10481220001), с вектором pCL_Pcysk-metA11, который был предварительно обработан ферментом рестрикции HindIII. В результате сконструировали рекомбинантный вектор pCL_Pcysk-metA11_PsucA-sucAB. Фиг. 4 представляет собой схематическое изображение, иллюстрирующее рекомбинантный вектор pCL_Pcysk-metA11_PsucA-sucAB.
[0089] Пример 3. Брожение для продуцирования янтарной кислоты
[0090] Осуществляли культивирование в колбе для исследования продуцирования янтарной кислоты в случае, когда у штамма, продуцирующего О-сукцинилгомосерин, сконструированного в сравнительном примере, была повышена только активность sucAB. Штамм СС03-0038 из сравнительного примера 4) и штамм CJM2-A11 из сравнительного примера 5) трансформировали плазмидами pCL_PsucA-sucAB, pCL_Prmf-sucAB и pCL_Ptrc-sucAB, сконструированными в примере 1. Штаммы наносили на чашку со средой LB, содержащей спектиномицин, в результате чего получали штаммы со вставкой sucAB. В качестве контролей получали штаммы СС03-0038 и CJM2-A11, в которые был введен вектор рСL1920. Вектор pCC1BAC-scrO (SEQ ID NO: 34), имеющий последовательность scrO в плазмиде pUR 400, происходящей из штамма сальмонеллы, описанного в публикации международной заявки на патент № WO 10/101360, вводили в эти штаммы для обеспечения использования ими нерафинированного сахара в качестве источника углерода. Полученные в результате штаммы культивировали в среде, имеющей состав, указанный в таблице 2 ниже, для оценки продуцирования янтарной кислоты.
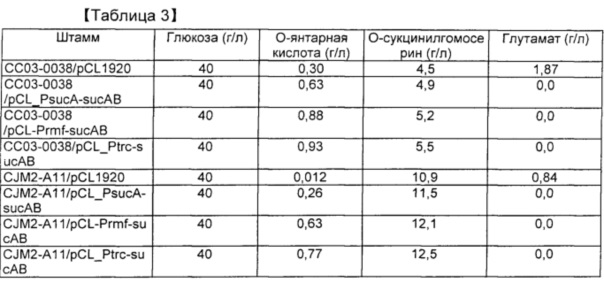
[0091] Каждый штамм инокулпровали в среду и культивировали при 33°С в течение ночи. Одну колонию инокулировали в 2 мл среды LB, содержащей спектиномицин, с последующим культивированием при 33°С в течение 2 часов. Штамм вновь инокулировали в колбу Эрленмейера на 250 мл, содержащую 25 мл среды в колбе, при плотности OD600=0,5 с последующим культивированием при 33°С при 200 об./мин. в течение 33 часов. Для исследования продуцирования янтарной кислоты осуществляли высокоэффективную жидкостную хроматографию (HPLC). Результаты указаны в таблице 3.
[0092] В результате по мере повышения экспрессии sucAB увеличивалось продуцирование янтарной кислоты. Этот результат означает, что повышенная экспрессия sucAB обладает эффектом снижения уровня глутамата, но увеличения потока продуцирования сукцинил-СоА с увеличением продуцирования янтарной кислоты. Если в качестве источника углерода применяют глюкозу, то продуцирование янтарной кислоты увеличивается максимум на 30%. Ожидалось, что продуцирование янтарной кислоты будет дополнительно увеличиваться по мере повышения синтеза янтарной кислоты у штамма в аэробных условиях. Если в качестве источника углерода применяют нерафинированный сахар, продуцирование янтарной кислоты увеличивается настолько же, как в случае применения глюкозы в качестве источника углерода. Результаты указаны в таблице 4.
[0093] Таблица 1. Состав среды с глюкозой в колбе
[0094]
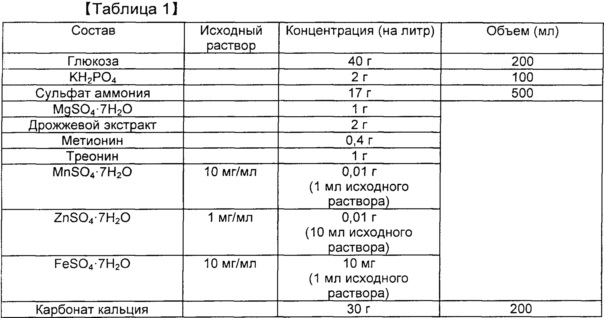
[0095]
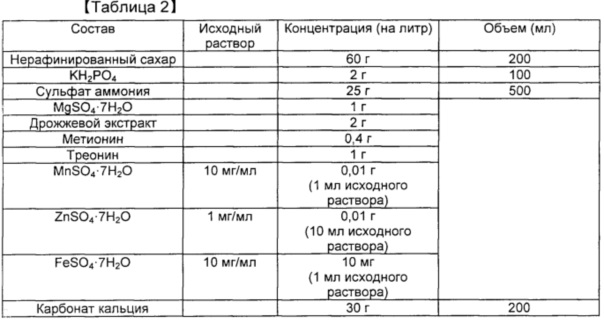
[0096] Таблица 2. Состав среды с нерафинированным сахаром в колбе
[0097]
[0098]
[0099] Таблица 3. Продуцирование янтарной кислоты посредством культивирования в колбе с применением глюкозы
[00100]
[00101]
[00102] Таблица 4. Продуцирование янтарной кислоты посредством культивирования в колбе с применением нерафинированного сахара
[00103]

[00104]
[00105] Пример 4. Брожение для продуцирования О-сукцинилгомосерина
[00106] Для повышения совместной экспрессии генов sucAB и metA у штаммов СС03-0038 и CJM2-A11 штаммы трансформировали плазмидой pCL_Pcysk-metA11_PsucA-sucAB, сконструированной в примере 2, с последующим культивированием в колбе Эрленмейера для исследования продуцирования О-сукцинилгомосерина. Состав среды в колбе соответствовал приведенному в таблице 1. Повышенная экспрессия гена metA11 в сравнительном примере 4) находилась под контролем исходного промотора. Поэтому с целью повышения экспрессии metA11 его клонировали в вектор, где он мог экспрессироваться под контролем промотора cysK, при этом одновременно индуцировали экспрессию sucAB.
[00107] СС03-0038 трансформировали плазмидой pCL_Pcysk-metA11_PsucA-sucAB, сконструированной в примере 2. Штамм наносили на чашку со средой LB, содержащей спектиномицин, в результате чего получали трансформированный штамм. Что касается контролей, штаммы СС03-0038 и CJM2-A11 трансформировали вектором рСL1920. Штамм, который может использовать нерафинированный сахар в качестве источника углерода, конструировали путем введения в штаммы вектора pCC1BAC-scrO, имеющего последовательность scrO в плазмиде pUR 400, происходящей из штамма сальмонеллы, описанного в заявке на корейский патент №2009-0018128. Штамм культивировали в среде с нерафинированным сахаром в колбе, имеющей состав, указанный в таблице 2, для оценки продуцирования О-сукцинилгомосерина. В целях оценки некоторые из штаммов, описанных выше, инокулировали в среду и культивировали при 33°С в течение ночи. Одну колонию инокулировали в 2 мл среды LB, содержащей спектиномицин, с последующим культивированием при 33°С в течение 2 часов. Штаммы вновь инокулировали в колбу Эрленмейера объемом 250 мл, содержащую 25 мл среды в колбе, при плотности OD600=0,5 с последующим культивированием при 33°С при 200 об./мин. в течение 33 часов. Для исследования продуцирования О-сукцинилгомосерина осуществляли HPLC. Результаты указаны в таблице 5.
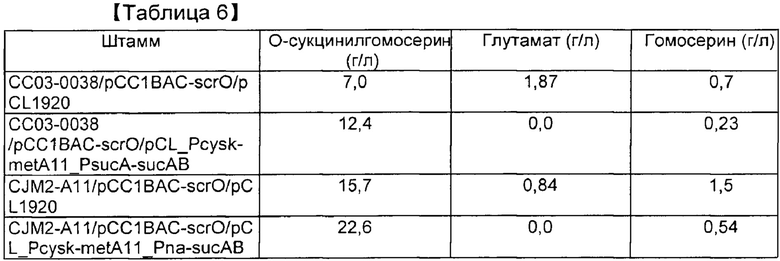
[00108] Результаты показали, что у штамма, в который была введена pCL_Pcysk-metA11_PsucA-sucAB, был повышен уровень О-сукцинилгомосерина. Выход продукта был повышен на приблизительно 40% по сравнению с контролем. По мере увеличения уровня О-сукцинилгомосерина происходило снижение уровней глутамата и гомосерина. Результаты означают, что повышенная экспрессия sucAB играет важную роль в выработке сукцинил-СоА. В случае, когда при применении сукцинил-СоА в качестве субстрата одновременно повышалась экспрессия metA, концентрация О-сукцинилгомосерина быстро возрастала.
[00109]
[00110] Таблица 5. Продуцирование О-сукцинилгомосерина посредством культивирования в колбе с применением глюкозы
[00111]

[00112]
[00113] Таблица 6. Продуцирование О-сукцинилгомосерина посредством культивирования в колбе с применением нерафинированного сахара
[00114]
[00115]
[00116] В случае, когда микроорганизм, принадлежащий к роду Escherichia, трансформировали вектором, содержащим sucAB, в соответствии с вариантом осуществления настоящего раскрытия для повышения экспрессии sucAB, продуцирование сукцинил-СоА и янтарной кислоты увеличивалось. Таким образом, повышение экспрессии sucAB можно применять к тем микроорганизмам, которые в том, что касается центрального метаболизма углерода, имеют такой же цикл ТСА, что и вышеупомянутые, например, к таким микроорганизмам, как дрожжи и актиномицеты и т.п.
[00117] Сконструированный штамм CC03-0038/pCL_Pcysk-metA11_PsucA-sucAB с подтвержденной способностью продуцировать О-сукцинилгомосерин назвали СС03-0157 и депонировали в Корейском центре культур микроорганизмов (KССМ) согласно Будапештскому договору 22 ноября 2013 г. (№ доступа: KССМ11488Р).
Свободный текст перечня последовательностей
[00118] Последовательности, представленные под SEQ ID NO: 1 - SEQ ID NO: 34, описанные в данном документе, указаны в прилагаемом перечне последовательностей.




































Группа изобретений относится к биотехнологии. Предложен микроорганизм из рода Escherichia, обладающий способностью продуцировать О-сукцинилгомосерин или янтарную кислоту, в котором активность α-кетоглутаратдегидрогеназного комплекса (KGDHC) повышена по сравнению с уровнем его эндогенной активности, активность гомосерин-О-сукцинилтрансферазы дополнительно повышена по сравнению с уровнем ее эндогенной активности и активность по меньшей мере одной из цистатионин-гамма-синтазы и гомосеринкиназы устранена. Предложены также способ продуцирования О-сукцинилгомосерина, способ продуцирования янтарной кислоты и применение микроорганизма из рода Escherichia для продуцирования О-сукцинилгомосерина. Группа изобретений обеспечивает получение увеличенного выхода О-сукцинилгомосерина или янтарной кислоты. 5 н. и 10 з.п. ф-лы, 4 ил., 6 табл., 4 пр.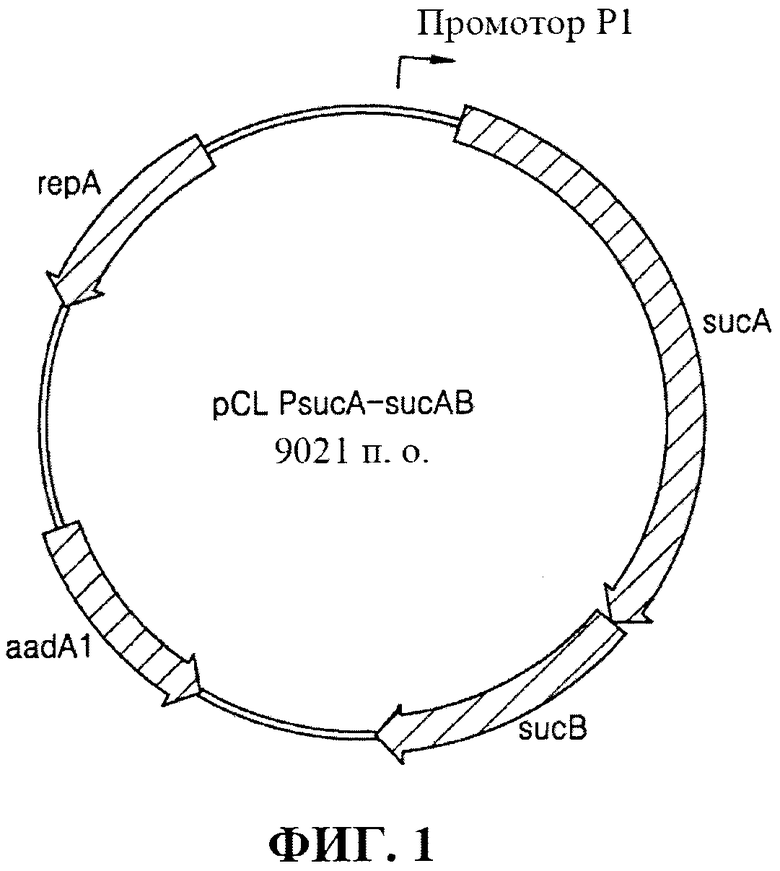
1. Микроорганизм из рода Escherichia, обладающий способностью продуцировать О-сукцинилгомосерин, где:
- активность α-кетоглутаратдегидрогеназного комплекса (KGDHC) повышена по сравнению с уровнем его эндогенной активности
посредством сверхэкспрессии гена, кодирующего α-кетоглутаратдегидрогеназный комплекс,
путем увеличения числа копий гена, кодирующего α-кетоглутаратдегидрогеназный комплекс, или
посредством замещения эндогенного промотора этого гена более сильным промотором,
по сравнению с его эндогенной активностью у микроорганизма дикого типа;
- активность гомосерин-О-сукцинилтрансферазы дополнительно повышена по сравнению с уровнем ее эндогенной активности
посредством замены гена, кодирующего гомосерин-О-сукцинилтрансферазу, геном, не имеющим контроля метионином по принципу обратной связи,
посредством сверхэкспрессии гена, кодирующего гомосерин-О-сукцинилтрансферазу,
путем увеличения числа копий гена, кодирующего гомосерин-О-сукцинилтрансферазу,
посредством замещения эндогенного промотора этого гена более сильным промотором, или
посредством их комбинации, по сравнению с эндогенной активностью микроорганизма дикого типа; и
- активность по меньшей мере одной из цистатионин-гамма-синтазы и гомосеринкиназы устранена путем делеции, замены или вставки всего или части гена, кодирующего одну или более из цистатионин-гамма-синтазы и гомосеринкиназы, или
путем делеции, замены или вставки всей или части последовательности, регулирующей экспрессию этого гена.
2. Микроорганизм по п.1, где α-кетоглутаратдегидрогеназный комплекс содержит аминокислотные последовательности, приведенные под SEQ ID NO: 22 и SEQ ID NO: 24.
3. Микроорганизм по п.1 или 2, который представляет собой Escherichia coli.
4. Способ продуцирования О-сукцинилгомосерина, включающий:
культивирование микроорганизма по п.1 в среде и
извлечение О-сукцинилгомосерина из культуральной среды или культивируемого микроорганизма.
5. Способ по п.4, где микроорганизм представляет собой Escherichia coli.
6. Микроорганизм по п.1, где более сильный промотор выбран из группы, состоящей из Ptac, Ptrc, Ppro, PR, PL, Prmf и PcysK.
7. Микроорганизм по п.1, где более сильный промотор представляет собой Ptrc или Prmf.
8. Микроорганизм по п.1, где ген, кодирующий α-кетоглутаратдегидрогеназный комплекс, представляет собой ген sucAB.
9. Микроорганизм по п.1, где более сильный промотор выбран из группы, состоящей из Ptac, Ptrc, Ppro, PR, PL, Prmf и PcysK.
10. Микроорганизм по п.1, где ген, не имеющий контроля метионином по принципу обратной связи, представляет собой ген metA11.
11. Микроорганизм по п.1, где ген, кодирующий цистатионин-гамма-синтазу, представляет собой ген metB и ген, кодирующий гомосеринкиназу, представляет собой ген thrB.
12. Микроорганизм из рода Escherichia, обладающий способностью продуцировать янтарную кислоту, где:
- активность α-кетоглутаратдегидрогеназного комплекса повышена по сравнению с уровнем его эндогенной активности
посредством сверхэкспрессии гена, кодирующего α-кетоглутаратдегидрогеназный комплекс,
путем увеличения числа копий гена, кодирующего α-кетоглутаратдегидрогеназный комплекс, или
посредством замещения эндогенного промотора этого гена более сильным промотором,
по сравнению с его эндогенной активностью у микроорганизма дикого типа; и
- активность гомосерин-О-сукцинилтрансферазы дополнительно повышена по сравнению с уровнем ее эндогенной активности
посредством замены гена, кодирующего гомосерин-О-сукцинилтрансферазу, геном, не имеющим контроля метионином по принципу обратной связи,
посредством сверхэкспрессии гена, кодирующего гомосерин-О-сукцинилтрансферазу,
путем увеличения числа копий гена, кодирующего гомосерин-О-сукцинилтрансферазу,
посредством замещения эндогенного промотора этого гена более сильным промотором, или
посредством их комбинации, по сравнению с ее эндогенной активностью у микроорганизма дикого типа; и
- активность по меньшей мере одной из цистатионин-гамма-синтазы и гомосеринкиназы устранена посредством делеции, замены или вставки всего или части гена, кодирующего одну или более из цистатионин-гамма-синтазы и гомосеринкиназы, или
путем делеции, замены или вставки всей или части последовательности, регулирующей экспрессию этого гена.
13. Микроорганизм по п.12, где более сильный промотор представляет собой Ptrc или PcysK.
14. Способ продуцирования янтарной кислоты, включающий:
культивирование микроорганизма по п.12 или 13 в среде и
извлечение янтарной кислоты из культуральной среды или культивируемого микроорганизма.
15. Применение микроорганизма из рода Escherichia для продуцирования О-сукцинилгомосерина, в котором:
- активность α-кетоглутаратдегидрогеназного комплекса повышена по сравнению с уровнем его эндогенной активности
посредством сверхэкспрессии гена, кодирующего α-кетоглутаратдегидрогеназный комплекс,
путем увеличения числа копий гена, кодирующего α-кетоглутаратдегидрогеназный комплекс, или
посредством замещения эндогенного промотора этого гена более сильным промотором,
по сравнению с его эндогенной активностью у микроорганизма дикого типа;
- активность гомосерин-О-сукцинилтрансферазы дополнительно повышена по сравнению с уровнем ее эндогенной активности
посредством замены гена, кодирующего гомосерин-О-сукцинилтрансферазу, геном, не имеющим контроля метионином по принципу обратной связи,
посредством сверхэкспрессии гена, кодирующего гомосерин-О-сукцинилтрансферазу,
путем увеличения числа копий гена, кодирующего гомосерин-О-сукцинилтрансферазу,
посредством замещения эндогенного промотора этого гена более сильным промотором, или
посредством их комбинации, по сравнению с эндогенной активностью микроорганизма дикого типа; и
- активность по меньшей мере одной из цистатионин-гамма-синтазы и гомосеринкиназы устранена посредством делеции, замены или вставки всего или части гена, кодирующего одну или более из цистатионин-гамма-синтазы и гомосеринкиназы, или
путем делеции, замены или вставки всей или части последовательности, регулирующей экспрессию этого гена.
| NING LI et al | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| HENRY LIN et al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| WO 2008013432 A1, 31.01.2008 | |||
| СКОРОХОДОВА А.Ю | |||
| Aнаэробный синтез янтарной кислоты рекомбинантными штаммами Escherichia coli с активированным НАД+-восстанавливающим пируватдегидрогеназным комплексом // Прикладная биохимия и микробиология, 2011, том 47, номер 4, с | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ АВТОМАТИЧЕСКОГО ТАРТАНИЯ | 1915 |
|
SU415A1 |
Авторы
Даты
2018-12-13—Публикация
2015-06-03—Подача