В данной заявке описан иммуноферментный анализ с подавлением интерференции для определения антител к лекарству (противолекарственных антител) в образцах сыворотки пациентов, получающих лечение антителами с противовоспалительным действием, и его применение.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Клиническая разработка новых терапевтически активных антител требует оценки их потенциальной иммуногенности соответствующими методами (Kaliyaperumal, A. and Jing, S., Curr. Pharm. Biotechnol. 10 (2009) 352-358). Исследование антител к лекарству (АЛ) обычно включает двухэтапный подход: (1) анализ, позволяющий детектировать АЛ, и (2) анализ, позволяющий охарактеризовать АЛ. Анализ для детекции АЛ включает скрининг и подтверждение специфичности (подтверждающий анализ). Твердофазный иммуноферментный анализ с использованием микропланшетов (твердофазный ИФА) благодаря своей высокой эффективности, относительной простоты и высокой чувствительности по прежнему является самым широко распространенным видом скринингового анализа на АЛ (Geng, D., et al., J. Pharm. Biomed. Anal. 39 (2005) 364-375). Твердофазный ИФА для определения АЛ чаще всего выполняют в модификации, где аналит играет роль мостика, что обеспечивает высокую селективность, возможность дететировать АЛ всех изотипов, независимо от видовой специфичности (Mire-Sluis, A.R., et al., J. Immunol. Methods 289 (2004) 1-16).
Модификацию ИФА, где аналит выполняет роль мостика, разработали и применяют в качестве скринингового и подтверждающего анализа на противолекарственные антитела к препарату тоцилизумаб, представляющего собой антитело к IL6R (Stubenrauch, К., et al., Clin. Ther. 32 (2010) 1597-1609).
Stubenrauch, К., et al. описали типовой толерантный к лекарству анализ для определения противолекарственных антител в сыворотке мышей, получавших антитела человека (Anal. Biochem. 430 (2012) 193-199). Bourdage, J.S., et al. описывает зависимость оптимальной концентрации иммобилизованного антигена от формата иммуноферментного анализа, в котором аналит выполняет роль мостика, и ее значение для разработки тестов на иммуногенность моноклональных антител (J. Pharm. Biomed. Anal. 39 (2005) 685-690). Mikulskis, A., et al. описывает жидкофазный ИФА как подходящую платформу для разработки робастного толерантного к лекарству теста на иммуногенность, исследование которой необходимо при разработке лекарственных средств (J. Immunol. Meth. 365 (2010) 38-49). Pan, J., et al. сравнивают экспресс-анализ NIDSA® с методами ИФА при исследовании иммуногенности двух биологических лекарственных средств (J. Pharm. Тох. Meth. 63 (2010) 150-159).
Документ WO 2009/077127 описывает дифференцирующий анализ.
Qiu, Z.J., et al. описывают новый гомогеный анализ с использованием биотина и дигоксигенина для детекции человеческих антител к лекарству в аутоиммунной сыворотке (J. Immunol. Meth. 362 (2010) 101-111).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данной заявке описан иммуноферментный анализ, в котором аналит выполняет роль мостика, для определения антител к лекарству (АЛ) в образцах, содержащих сыворотку пациентов, получающих терапевтически активное антитело, который может применяться в качестве анализа для скрининга, подтверждения и мониторинга. Описанный анализ особенно эффективен в случаях, когда образец, содержащий сыворотку, взят у пациента, страдающего аутоиммунным заболеванием, таким как ревматоидный артрит (РА).
Описанный в данном документе анализ обладает повышенной толерантностью к содержанию терапевтически активного антитела в образце, подлежащем анализу (ИФА на ЛА обладает повышенной толерантностью к лекарству), в то же время количество ложноположительных результатов анализа сокращается.
Обнаружено, что описанный в данной заявке анализ позволяет минимизировать интерференцию, обусловленную свободным лекарством или рефматоидным фактором (РФ).
Данный анализ особенно эффективен, если образец содержит антитела, отличные от указанных антител к лекарству, которые могут интерферировать в иммуноферментном анализе на определение антител к лекарству и, таким образом, являться причиной ложноположительных результатов иммуноферментного анализа.
В одном воплощении способы, описанные в данной заявке, применяют для определения антител к лекарству, представляющего собой антитело, которое используют при противовоспалительной терапии.
Упомянутая повышенная толерантность к лекарству достигается за счет взаимоусиливающего эффекта 1) повышения концентрации биотинилированного и дигоксигенированного захватывающего и детекторного реагентов; 2) одновременной, а не последовательной инкубации образцов сыворотки с захватывающим и детекторным реагентами; 3) пролонгированного времени инкубации; 4) использования меченых по одному специфическому остатку захватывающего и детекторного реагентов; и 5) повышения содержания такой матрицы, как сыворотка.
Интерференция с ревматоидным фактором может быть подавлена путем добавления олигомерных иммуноглобулинов G (IgG) человека в качестве добавки.
Толерантность к лекарству описанного в данном документе анализа на АЛ с подавлением интерференции по меньшей мере в 10 раз превышает известную на уровне техники.
Один аспект согласно данному описанию представляет собой твердофазный иммуноферментный анализ для определения в образце антител к лекарству, которое представляет собой терапевтически активное антитело, включающий захватывающее терапевтически активное антитело и детекторное терапевтически активное антитело, в котором
а) захватывающее терапевтически активное антитело и детекторное терапевтически активное антитело используют в концентрации, превышающей 0,5 мкг/мл,
б) образец инкубируют одновременно с захватывающим терапевтически активным антителом и детекторным терапевтически активным антителом от 4 до 24 часов,
в) захватывающее терапевтически активное антитело и детекторное терапевтически активное антитело модифицированы по одному остатку лизина,
г) образец содержит 7,5% сыворотки или более, и
д) перед инкубацией с захватывающим терапевтически активным антителом и детекторным терапевтически активным антителом в образец добавляют олигомерные IgG человека.
Один аспект согласно данному описанию представляет собой твердофазный иммуноферментный анализ для определения антител к лекарству, представляющему собой терапевтически активное антитело, в образце пациента с ревматоидным артритом, включающий захватывающее терапевтически активное антитело и детекторное терапевтически активное антитело, в котором
а) концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела в твердофазном иммуноферментном анализе составляет 0,5 мкг/мл или более,
б) образец инкубируют одновременно с захватывающим терапевтически активным антителом и детекторным терапевтически активным антителом от 0,5 до 24 часов,
в) захватывающее терапевтически активное антитело представляет собой конъюгат 1:1 захватывающего терапевтически активного антитела и первого компонента специфически связывающейся пары, а детекторное терапевтически активное антитело представляет собой конъюгат 1:1 детекторного терапевтически активного антитела и детектируемой метки,
г) образец содержит 1% сыворотки или более, и
д) перед инкубацией с захватывающим терапевтически активным антителом и детекторным терапевтически активным антителом в образец добавляют олигомерные IgG человека.
В одном воплощении образец содержит 5% сыворотки или более. В одном воплощении образец содержит 7,5% сыворотки или более.
В одном воплощении образец содержит антитела к лекарству и ревматоидный фактор.
В одном воплощении терапевтически активное антитело представляет собой антитело для лечения воспалительного заболевания. В одном воплощении антитело для лечения воспалительного заболевания представляет собой антитело для лечения аутоиммунного заболевания. В одном воплощении аутоиммунное заболевание представляет собой ревматоидный артрит или ювенильный артрит или остеоартрит или болезнь Кастлемана.
В одном воплощении терапевтически активное антитело представляет собой антитело для лечения онкологического заболевания. В одном воплощении антитело предназначено для лечения миеломы или плазмоцитомы.
В одном воплощении терапевтически активное антитело представляет собой антитело к рецептору IL-6 (анти-IGF1R), или к рецептору IGF-1 (анти-IGF1R), или к альфа 1 рецептору IL-13 (aнти-IL13R1a), или к Ox40L (анти-Ох40L), или к фактору некроза опухоли альфа (анти-TNFa). В одном воплощении терапевтически активное антитело представляет собой антитело к IL6R. В одном воплощении терапевтически активное антитело к IL6R представляет собой тоцилизумаб.
В одном воплощении захватывающее терапевтически активное антитело конъюгировано с твердой фазой. В одном воплощении конъюгирование захватывающего терапевтически активного антитела с твердой фазой осуществляют с использованием специфически связывающейся пары. В одном воплощении специфически связывающаяся пара (первый компонент/второй компонент) выбрана из стрептавидина или авидина/биотина или антитела/антигена (см., например, Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press, 1996) или лектина/полисахарида или стероида/стероид-связывающего белка или гормона/рецептора гормона или фермента/субстрата или IgG/белка А и/или G.
В одном воплощении захватывающее терапевтически активное антитело конъюгировано с биотином (как первым компонентом специфически связывающейся пары). В данном случае конъюгирование с твердой фазой осуществляют через иммобилизованный авидин или стрептавидин.
В одном воплощении детекторное терапевтически активное антитело конъюгировано с детектируемой меткой. В одном воплощении детекторное терапевтически активное антитело конъюгировано с детектируемой меткой с использованием специфически связывающейся пары. В одном воплощении специфически связывающаяся пара (первый компонент/второй компонент) выбрана из стрептавидина или авидина/биотина или антитела/антигена (см., например, Hermanson, G.T., et al., Bioconjugate Techniques, Academic Press, 1996) или лектина/полисахарида или стероида/стероид-связывающего белка или гормона/рецептора гормона или фермента/субстрата или IgG/белка А и/или G.
В одном воплощении детекторное терапевтически активное антитело конъюгировано с дигоксигенином (как детектируемой меткой). В данном случае для соединения с детектируемой меткой используют антитело к дигоксигенину.
В одном воплощении концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела в твердофазном иммуноферментном анализе (твердофазном ИФА) составляет приблизительно от 0,5 мкг/мл до 10 мкг/мл. В одном воплощении концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела составляет более чем 0,5 мкг/мл и менее чем 10 мкг/мл. В одном воплощении концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела составляет приблизительно от 1 мкг/мл до 5 мкг/мл. В одном воплощении концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела составляет приблизительно от 1,4 мкг/мл до 1,8 мкг/мл. В одном воплощении концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела составляет приблизительно от 1,45 мкг/мл до 1,6 мкг/мл. В одном воплощении концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела составляет приблизительно 1,5 мкг/мл.
В одном воплощении время инкубации составляет по меньшей мере 6 часов. В одном воплощении время инкубации составляет по меньшей мере 12 часов. В одном воплощении время инкубации составляет по меньшей мере 16 часов.
В одном воплощении время инкубации составляет самое большее 24 часа.
В одном воплощении время инкубации составляет от 4 часов и до 24 часов. В одном воплощении время инкубации составляет от 6 часов и до 24 часов. В одном воплощении время инкубации составляет от 12 часов и до 24 часов. В одном воплощении время инкубации составляет от 12 часов и до 20 часов. В одном воплощении время инкубации составляет от 14 часов и до 18 часов. В одном воплощении время инкубации составляет приблизительно 16 часов.
В одном воплощении образец содержит от 1% до 20% сыворотки. В одном воплощении образец содержит приблизительно 10% сыворотки.
В одном воплощении олигомерные IgG человека добавляют до конечной концентрации от 10 мкг/мл до 1000 мкг/мл. В одном воплощении олигомерные IgG человека добавляют до конечной концентрации от 15 мкг/мл до 500 мкг/мл. В одном воплощении олигомерные IgG человека добавляют до конечной концентрации от 20 мкг/мл до 250 мкг/мл. В одном воплощении олигомерные IgG человека добавляют до конечной концентрации от 25 мкг/мл до 100 мкг/мл. В одном воплощении олигомерные IgG человека добавляют до конечной концентрации приблизительно 50 мкг/мл.
Один аспект согласно данному описанию представляет собой твердофазный иммуноферментный анализ для определения антител к лекарству, представляющему собой терапевтически активное антитело, в образце пациента с ревматоидным артритом, включающий захватывающее терапевтически активное антитело и детекторное терапевтически активное антитело, в котором
а) концентрация захватывающего терапевтически активного антитела и детекторного терапевтически активного антитела в твердофазном иммуноферментном анализе составляет приблизительно 1,5 мкг/мл,
б) образец инкубируют одновременно с захватывающим терапевтически активным антителом и детекторным терапевтически активным антителом от 14 до 16 часов,
в) захватывающее терапевтически активное антитело представляет собой конъюгат 1:1 захватывающего терапевтически активного антитела и биотина, присоединенного к остатку лизина захватывающего терапевтически активного антитела, а детекторное терапевтически активное антитело представляет собой конъюгат 1:1 детекторного терапевтически активного антитела и дигоксигенина, присоединенного к остатку лизина детекторного терапевтически активного антитела,
г) образец содержит от 1% до 20% сыворотки, и
д) перед инкубацией с захватывающим терапевтически активным антителом и детекторным терапевтически активным антителом в образец добавляют олигомерные IgG человека в конечной концентрации от 25 мкг/мл до 100 мкг/мл.
Один аспект согласно данному описанию представляет собой применение олигомерных IgG человека для захвата ревматоидного фактора в твердофазном ИФА на антитела к лекарству.
Один аспект согласно данному описанию представляет собой способ лечения индивидуума, страдающего заболеванием, включающий введение индивидууму эффективного количества терапевтически активного антитела (лекарства) и определение наличия антител к лекарству в анализе согласно данному описанию.
Один аспект согласно данному описанию представляет собой способ лечения индивидуума, страдающего воспалительным заболеванием, включающий введение индивидууму эффективного количества анти-IL6R антитела (лекарства) и определение наличия антител к анти-IL6R антителу (антител к лекарству) в анализе согласно данному описанию.
В одном воплощении воспалительное заболевание представляет собой аутоиммунное заболевание. В одном воплощении аутоиммунное заболевание выбрано из ревматоидного артрита, ювенильного артрита, остеоартрита или болезни Кастлемана.
В одном воплощении воспалительное заболевание представляет собой мезангиальный пролиферативный гломерулонефрит.
Один аспект согласно данному описанию представляет собой способ лечения индивидуума, страдающего плазмоцитомой, включающий введение индивидууму эффективного количества анти-IL6R антитела (лекарства) и определение наличия антител к анти-IL6R антителу (антител к лекарству) в анализе согласно данному описанию.
Один аспект согласно данному описанию представляет собой способ лечения индивидуума, страдающего миеломой, включающий введение индивидууму эффективного количества анти-IL6R антитела (лекарства) и определение наличия антител к анти-IL6R антителу (антител к лекарству) в анализе согласно данному описанию.
Один аспект согласно данному описанию представляет собой способ ингибирования активности IL6R у индивидуума, включающий введение индивидууму эффективного количества анти-IL6R антитела для ингибирования активности IL6R и определение наличия антител к aнти-IL6R антителу (антител к лекарству) в анализе согласно данному описанию.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Принцип толерантного к лекарству метода определения антител к лекарству на примере анти-IL6R антитела тоцилизумаб.
Фиг. 2. Принцип метода определения антител к лекарству с подавлением интерференции на примере анти-IL6R антитела тоцилизумаб.
Фиг. 3. Калибровочная кривая, полученная для анализа на антитела к лекарству с подавлением интерференции для анти-IL6R антитела тоцилизумаб.
Фиг. 4. Сравнение толерантности к лекарству двухстадийного ИФА на антитела к лекарству и ИФА на антитела к лекарству с подавлением интерференции, описанного в данном документе для анти-IL6R антитела тоцилизумаб; показан сигнал, зарегистрированный для 300 нг/мл антитела к лекарству в присутствии повышающегося количества лекарства; пунктирная линия: Порог отсечения в стандартном анализе; сплошная линия: Порог отсечения в анализе с подавлением интерференции, описанном в данной заявке; пунктирная линия с кругами: стандартный анализ; сплошная линия с квадратами: анализ с подавлением интерференции, описанный в данной заявке.
Фиг. 5. Определение порога отсечения в твердофазном ИФА с подавлением интерференции на антитела к лекарству.
Фиг. 6. Определение порога отсечения в твердофазном ИФА с подавлением интерференции на антитела к лекарству с использованием ТЦЗ-Би (модифицированного по одному остатку) и ТЦЗ-Диг (модифицированного по одному остатку).
Фиг. 7. Вариабельность сигнала в 77 различных образцах сыворотки пациентов с РА, получавших ТЦЗ, при использовании стандартного твердофазного ИФА.
Фиг. 8. Вариабельность сигнала в 77 различных образцах сыворотки пациентов с РА, получавших ТЦЗ, при использовании твердофазного ИФА с подавлением интерференции, описанного в данном документе.
Определения
Термин «конъюгат 1:1» обозначает конъюгат, состоящий из двух одинаковых частей, соединенных/конъюгированных друг с другом при помощи одной ковалентной связи. Например, термин «конъюгат 1:1 захватывающего терапевтически активного антитела и первого компонента специфически связующейся пары» обозначает химический конъюгат, состоящий строго из одной молекулы захватывающего терапевтически активного антитела, ковалентно конъюгированного посредством одной химической связи со строго одной молекулой первого компонента специфически связующейся пары. Аналогично, термин «конъюгат 1:1 детекторного терапевтически активного антитела и детектируемой метки» обозначает химический конъюгат, состоящий строго из одной молекулы детекторного терапевтически активного антитела, ковалентно конъюгированного посредством одной химической связи со строго одной молекулой детектируемой метки.
Термин «терапевтически активное антитело» согласно изобретению обозначает антитело, которое можно вводить индивидууму, предполагают, что образец, взятый у указанного индивидуума после введения, содержит указанное терапевтически активное антитело. Терапевтически активное антитело представляет собой антитело, предназначенное для введения человеку в терапевтических целях. В одном анализе, описанном в данной заявке, терапевтически активное антитело, захватывающее терапевтически активное антитело и детекторное терапевтически активное антитело содержат «одинаковую» молекулу антитела, т.е. полученную рекомбинантным способом с использованием того же вектора экспрессии и содержащую одинаковую аминокислотную последовательность. Терапевтически активные антитела (используемые в терапевтических целях моноклональные антитела) широко применяются для лечения различных заболеваний, таких как онкологические заболевания (например, гемобластозы и солидные опухоли, включая неходжкинскую лимфому, рак молочной железы и колоректальный рак) или воспалительные заболевания. Такие антитела описаны, например, Levene, А.Р., et al., Journal of the Royal Society of Medicine 98 (2005) 145-152; Groner, В., et al., Curr. Mol. Meth. 4 (2004) 539-547; and Harris, M., Lancet Oncol. 5 (2004) 292-302).
В одном воплощении терапевтически активное антитело представляет собой антитело, которое может найти применение в лечении воспалительного заболевания, т.е. антитело оказывает противовоспалительное действие, например, как антитело к рецептору IL-6 или антитело к рецептору IGF-1 или антитело к альфа 1 рецептору IL-13.
Примером терапевтически активного антитела (предпочтительно, моноклонального) является антитело к рецептору IL-6 (анти-IL6R антитело). Такое антитело описано, например, Mihara, et al., Clin. Immunol. 98 (2001) 319-326; Nishimoto, N., et al., Blood 106 (2005) 2627-2632, в клиническом исследовании NCT00046774, или WO 2004/096274.
Примером терапевтически активного антитела (предпочтительно, моноклонального) является антитело к рецептору IGF-1 (анти-IGF1R антитело). Такое антитело описано, например, в WO 2004/087756 или WO 2005/005635.
Примером терапевтически активного антитела (предпочтительно, моноклонального) является антитело к альфа 1 рецептору IL-13 (анти-IL13R1a антитело). Антитела к IL-13R1a известны, например, из WO 96/29417, WO 97/15663, WO 03/080675, Graber, P., et al., Eur. J. Immunol. 28 (1998) 4286-4298; Poudrier, J., et al., J. Immunol. 163 (1999) 1153-1161; Poudrier, J., et al., J. Immunol. J. Immunol. 30 (2000) 3157-3164; Aikawa, M., et al., Cytokine 13 (2001) 75-84, и доступны для приобретения, например, в компании R&D Systems Inc, США. Другие приведенные в качестве примера антитела к IL-13R1 а описаны в WO 2006/072564.
Термин «терапевтически активное антитело, применяемое в противовоспалительной терапии», используемый в данном документе, обозначает терапевтически активное антитело, направленное против рецептора клеточной поверхности, опосредующего воспаление. Такими рецепторами являются, например, рецептор IL-6 или рецептор IGF-1 или альфа 1 рецептор IL-13. Если анализируют образец, взятый у пациента, получающего лечение таким противовоспалительным терапевтически активным антителом, необходимо определить, обусловлен ли полученный положительный результат истинными антителами к лекарству (истинный положительный результат) или присутствием в образце других антител, отличных от антител к лекарству (ложноположительный результат). Примером такого случая является образец, взятый у пациента, имеющего аутоиммунное заболевание, такое как ревматизм, соответственно, образец, полученный у данного пациента, содержит так называемые «ревматоидные факторы». Термин «ревматоидные факторы» в данном документе обозначает антитела, связывающиеся с IgG человека, более конкретно, с Fc-областью IgG человека. В большинстве случаев указанные «ревматоидные факторы» представляют собой олигомерные связывающиеся молекулы.
Термин «антитело к лекарству» в данном документе обозначает антитело, направленное против, т.е. связывающееся с антигенной областью терапевтически активного антитела. Указанная антигенная область может представлять собой вариабельную область, CDR, константную область или гликоструктуру терапевтически активного антитела. В одном воплощении антитело к лекарству направлено против CDR терапевтически активного антитела или вторичной модификации терапевтически активного антитела, являющейся результатом рекомбинантной продукции терапевтически активного антитела в рекомбинантных клетках, таких как клетки СНО, клетки НЕК, клетки Sp2/0 или клетки ВНК. Как правило, антитела к лекарству направлены против антигенной области терапевтически активного антитела, распознаваемого иммунной системой животного, которому вводят терапевтически активное антитело. Описанные выше антитела обозначают «специфическими антителами к лекарству».
Терапевтически активные антитела создают так, чтобы они содержали как можно меньше возможных антигенных областей. Например, терапевтически активные антитела предназначенные для применения у человека, гуманизируют перед введением пациентам-людям для минимизации развития иммунного ответа на терапевтически активное антитело. Данный иммунный ответ может быть в форме антител к лекарству (АЛ), направленных против участков таких гуманизированных антител, не являющихся человеческими, например, участков, определяющих комплементарность в составе вариабельных доменов (см., например, Pan, Y., et al., FASEB J. 9 (1995) 43-49).
Термин «гипервариабельный участок» или «HVR» (от англ. hypervariable region) в данном документе обозначает каждый из участков вариабельных доменов антитела, имеющих гипервариабельную последовательность (участков определяющих комплементарность, или CDR (от англ. complementarity determining regions)) и/или формирующих петли определенной структуры ("гипервариабельные петли») и/или содержащих остатки, участвующие в контакте с антигеном («контакты с антигеном»). Как правило, антитела содержат шесть HVR: три в составе VH (Н1, Н2, Н3) и три в оставе VL (L1, L2, L3). Примеры HVR включают:
(а) гипервариабельные петли, образованные аминокислотными остатками в положении 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) (Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987));
(б) CDR, образованные аминокислотными остатками в положении 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (Н1), 50-65 (Н2) и 95-102 (Н3) (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991));
(в) контакты с антигеном, образованные аминокислотными остатками в положении 27С-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (Н1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(г) комбинации (а), (б) и/или (в), включая аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (Н1), 26-35b (Н1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иначе, остатки HVR и другие остатки в составе вариабельного домена (например, остатки FR) пронумерованы в соответствии с нумерацией Кабат.
Антитела содержат ряд реакционно-способных групп, например, таких как аминогруппы (лизин, альфа-аминогруппы), тиоловые группы (цистин, цистеин и метионин), карбоксильные группы (аспарагиновая кислота, глутаминовая кислота) и спиртовые группы. Их можно использовать для присоединения связывающего партнера, такого как поверхность, белок, полимер (например, такой как ПЭГ, целлюлоза или полистирол), фермент, или члена связывающейся пары (см., например, Aslam М. and Dent, A., Bioconjuation MacMillan Ref. Ltd. (1999) 50-100).
Термин «анти-идиотипическое антитело» обозначает антитело, которое специфически связывается со связывающими детерминантами, например, такими как связывающий сайт, родительского антитела, т.е. анти-идиотипическое антитело направлено против антиген-связыващего сайта родительского антитела.
В одном воплощении анти-идиотипическое антитело специфически связывается с одним или несколькими CDR родительского антитела.
В одном воплощении родительское антитело представляет собой терапевтически активное антитело. В одном воплощении родительское антитело представляет собой мультиспецифическое антитело. В одном воплощении родительское антитело представляет собой биспецифическое антитело.
Одной из наиболее распространенных реакционно-способных групп белков является алифатическая е-аминогруппа аминокислоты лизина. Как правило, практически все антитела содержат большое количество остатков лизина. Аминогруппы лизина являются достаточно хорошими нуклеофилами при рН выше 8,0 (рKa=9,18) и, следовательно, легко и без остатка реагируют с большим количеством реагентов с образованием стабильных связей.
Другой распространенной реакционно-способной группой антител является тиоловый остаток серосодержащей аминокислоты цистина и продукта его восстановления цистеина (полуцистина). Цистеин содержит свободную тиоловую группу, которая является более сильным нуклеофилом по сравнению с аминогруппой, и как правило, является наиболее реакционно-способной функциональной группой белка. Тиолы обычно вступают в реакцию при нейтральном рН и, следовательно, могут избирательно присоединяться к другим молекулам в присутствии аминогрупп. Поскольку свободные сульфгидрильные группы являются относительно реакционно-способными, белки, содержащие эти группы, часто содержат их окисленную форму, например, дисульфидные группы или дисульфидные связи.
Помимо цистина и цистеина, некоторые белки также содержат аминокислоту метионин, которая содержит атом серы в составе тиоэфирной связи. В литературе описано применение нескольких тиолирующих реагентов, образующих поперечные сшивки, таких как реагент Трота (2-иминотиолан), сукцинимидил(ацетилтио)ацетат (САТА) или сульфосукцинимидил 6-[3-(2-пиридилдитио)пропионамидо]гексаноат (сульфо-LC-SPDP), которые обеспечивают эффективное внедрение множественных сульфгидрильных групп с использованием реакционно-способных аминогрупп.
Реакционно-способные сложные эфиры, в частности сложные эфиры N-гидроксисукцинимида (NHS) принадлежат к наиболее часто используемым реагентам для модификации аминогрупп. Оптимальные значения рН для проведения реакции в водной среде составляют от 8,0 до 9,0.
Изотиоцианаты представляют собой реагенты, модифицирующие аминогруппы и образующие тиокарбамидные связи с белками. Они вступают в реакцию с аминогруппами белков в водном растворе (оптимум рН 9,0-9,5).
Альдегиды вступают в реакцию в мягких условиях в водной среде с алифатическими и ароматическими аминами, гидразинами и гидразидами с образованием в качестве промежуточных продуктов иминов (Шиффовых оснований). Шиффово основание может быть избирательно восстановлено под воздействием слабых или сильных восстановителей (таких как борогидрид натрия или цианборогидрид натрия) с образованием стабильных алкиламинных связей.
Другими реагентами, используемыми для модификации аминов, являются ангидриды кислот. Например, ангидрид диэтилентриаминпентауксусной кислоты (DTPA) представляет собой бифункциональный хелатирующий агент, содержащий две ангидридные группы, способные вступать в реакцию с аминами. Они могут вступать в реакцию с N-концевыми и е-аминогруппами белков с образованием амидных связей. Раскрытие ангидридного кольца сопровождается образованием мультивалентных хелатирующих металлы клешней, способных прочно связывать металлы в координационные комплексы.
Термин «образец» включает любое количество вещества живого организма или бывшего живого организма, но не ограничивается этим. Указанные живые организмы включают человека, мышей, обезьян, крыс, кроликов и других животных. В одном воплощении образец забирают у обезьяны, в частности, яванского макака, или кролика, или мыши, или крысы. В одном воплощении такие вещества включают кровь, сыворотку или плазму индивидуума, представляющие собой наиболее распространенные источники образцов в клинической практике, но не ограничиваются ими.
Термин «твердая фаза» обозначает нетекучее вещество и включает частицы (включая микрочастицы и гранулы), сделанные из таких материалов, как полимер, металл (парамагнитные, ферромагнитные частицы), стекло и керамика; гелевые субстанции, такие как оксид кремния, оксид алюминия и полимерные гели; капилляры, которые могут быть сделаны из полимера, металла, стекла и/или керамики; цеолиты и другие пористые вещества; электроды; планшеты для микротитрования; твердые стрипы; кюветы, пробирки и другие контейнеры для спектрометрии образцов. Компонент твердая фаза отличается от инертной твердой поверхности тем, что «твердая фаза» содержит по меньшей мере одну группу на своей поверхности, которая предназначена для взаимодействия с субстратом в образце. Твердая фаза может быть неподвижным компонентом, таким как пробирка, стрип, кювета или планшет для микротитрования, или может быть подвижным компонентом, таким как гранулы или микрочастицы. Можно использовать разнообразные микрочастицы, обеспечивающие как ковалентное, так и нековалентное присоединение белков и других веществ. Такие частицы включают полимерные частицы, такие как полистироловые и поли(метакрилатные) частицы; частицы золота, такие как наночастицы золота и коллоидное золото, а также керамические частицы, такие как кремнийоксидные, стеклянные и металлооксидные частицы. См., например, Martin, C.R., et al., Analytical Chemistry-News & Features, 70 (1998) 322A-327A или Butler, J.E., Methods 22 (2000) 4-23.
В одном воплощении детектируемая метка выбрана из хромогенов (флуоресцентных или люминесцентных групп или красителей), ферментов, ЯМР-активных групп, металлических частиц или гаптенов, таких как дигоксигенин. В одном воплощении детектируемая метка представляет собой дигоксигенин. Детектируемая метка также может представлять собой фотоактивируемую образующую поперечные связи группу, например, азидную или азириновую группу. Хелаты металов, которые можно определять при помощи электрохемилюминесценции, также являются испускающими сигнал группами в одном воплощении, особенно предпочтительными являются хелаты рутения, например, хелаты (дипиридил)32+ рутений. Подходящие для мечения рутениевые группы описаны, например, в ЕР 0580979, WO 90/05301, WO 90/11511 и WO 92/14138.
Принцип различных модификаций иммуноферментного анализа описан, например, Hage, D.S. (Anal. Chem. 71 (1999) 294R-304R). Lu, В., et al. (Analyst 121 (1996) 29R-32R) описывает иммобилизацию антител в заданной ориентации для применения в иммуноферментном анализе. Иммуноферментный анализ с использованием авидина и биотина описан, например, Wilchek, М., and Bayer, Е.А., in Methods Enzymol. 184 (1990) 467-469).
СВЕДЕНИЯ. ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В данной заявке описан анализ с подавлением интерференции для определения антител к лекарству в образцах сыворотки, отличающийся повышенной толерантностью к свободному терапевтически активному антителу и повышенной устойчивостью к интерференции, обусловленной ревматоидным фактором.
Принцип анализа для определения антител к лекарству состоит в захвате антител к лекарству (АЛ) в комплекс с дигоксигенированным лекарством (лекарство-Диг) и биотинилированным лекарством (лекарство-Би) (например, тоцилизумабом (ТЦЗ-Диг и ТЦЗ-Би, соответственно)), последнее обеспечивает иммобилизацию на планшетах для микротитрования, покрытых стрептавидином (СА-ПМТ). Комплекс АЛ/лекарство-Диг, связанный с лекарством-Би на СА-МПТ определяют с использованием антитела к дигоксигенину, конъюгированного с ферментом пероксидазой хрена (анти-Диг-ПХ). Пероксидаза хрена (ПХ) катализирует цветную реакцию с участием субстрата ABTS. Интенсивность окраски пропорциональна концентрации аналита. Общий принцип анализа для определения антител к лекарству показан на Фиг. 1.
Обнаружено, что толерантность стандартного анализа на противолекарственные антитела к лекарству и ревматоидному фактору можно повысить без изменения общего принципа метода за счет
1) повышения концентрации биотинилированного и дигоксигенированного захватывающего и детекторного реагентов;
2) одновременной, вместо последовательной инкубации образца сыворотки с захватывающим и детекторным реагентами;
3) пролонгированной инкубации образца сыворотки с захватывающим и детекторным реагентами;
4) использования однородно модифицированных захватывающего и детекторного реагентов вместо смеси неоднородно модифицированных реагентов;
5) повышения содержания такой матрицы, как сыворотка;
6) включения олигомерных IgG в анализ в качестве добавки; и
7) применения монобиотинилированного захватывающего и монодигоксигенированного детекторного антител.
Указанные мероприятия обеспечили взаимоусиливающий эффект.
Благодаря перечисленным выше мероприятиям удалось разработать толерантный к лекарству анализ с подавлением интерференции для определения противолекарственных антител к терапевтически активным антителам.
Общий принцип описанного в данном документе толерантного к лекарству анализа с подавлением интерференции показан на Фиг. 2 на примере анти-IL6R антитела тоцилизумаб.
При выполнении анализа согласно данному описанию толерантность к лекарству анализа на АЛ в образцах сыворотки пациентов увеличилась по меньшей мере в 10 раз по сравнению со стандартным анализом на антитела к лекарству. В то же время уменьшилась подверженность влиянию ревматоидных факторов, приводящая к ложноположительным результатам.
Терапевтически активное антитело тоцилизумаб (ТЦЗ), обладающее противовоспалительным действием, представляет собой рекомбинантное гуманизированное моноклональное антитело, направленное против рецептора к интерлейкину-6. Показана его эффективность в клинических исследованиях ревматоидного артрита (Ohsugi, Y. and Kishimoto, Т., Expert Opin. Biol. Ther. 8 (2008) 669-681). Скрининговый и подтверждающий анализ на АЛ, проводившийся в данных исследованиях, показал достаточную толерантность к лекарству при обычных концентрациях ТЦЗ в сыворотке, которые устанавливаются при равновесном состоянии при внутривенном режиме введения.
Однако, при других способах введения, например, при подкожном введеним, при более частом введении и применении по новым показаниям у детей сывороточная концентрация при равновесном состоянии может быть более высокой.
Кроме того, например, у пациентов с аутоиммунными заболеваниями, например, такими как ревматоидный артрит, часто наблюдается значительное повышение ревматоидных факторов (РФ). РФ демонстрируют предпочтительное связывание с агрегированными глобулинами плазмы и задействованы в механизме клиренса иммунных комплексов in vivo (Tatarewicz, S., et al., J. Immunol. Methods. 357 (2010) 10-16). РФ преимущественно представлены пентамерными иммуноглобулинами изотипа М (IgM) (Artandi, S.E., et al., Proc. Natl. Acad. Sci. USA 89 (1991) 94-98) и способны к неспецифическому мультивалентному среднеаффинному связыванию с константной частью антитела, используемого в терапевтических целях, приводя к ложноположительным результатам в анализе на АЛ. Для преодоления интерференции, обусловленной перекрестно реагирующими антителами IgM в образцах пациентов с РА, в разбавитель для образцов, например, включают подвергнутое аффинной очистке антитело кролика к IgM человека (см., например, Araujo, J., et al., J. Pharm. Biomed. Anal., 55 (2011) 1041-1049).
Обнаружено, что неспецифическое связывание РФ, присутствующих в образцах сыворотки, с антителом, используемым в терапевтических целях, можно предотвращать за счет добавления в образец олигомерных IgG человека перед выполнением анализа на АЛ. Добавление олигомерных IgG обеспечивает дополнительные мишени для РФ и по большей части устраняет интерференцию, обусловленную РФ, в анализе на АЛ, согласно данному описанию.
Ниже приведен пример анализа на АЛ с подавлением интерференции, описанного в данной заявке, где исследуют образцы сыворотки пациентов, страдающих ревматоидным артритом, содержащей тоцилизумаб (ТЦЗ).
Мероприятия для повышения толерантности к лекарству стандартного анализа на антитела к лекарству для определения противолекарственных антител к анти-IL6R антителу тоцилизумаб заключались в:
1) повышении концентрации биотинилированного и дигоксигенированного ТЦЗ (например, от 0,5 мкг/мл до 1,5 мкг/мл);
2) одновременной инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг;
3) пролонгированной инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг (например, от 1 ч до 16 ч);
4) использовании только модифицированных по лизину реагентов ТЦЗ-Би и ТЦЗ-Диг вместо смеси реагентов, модифицированных по лизину и углеводам;
5) повышении содержания такой матрицы, как сыворотка; и
6) добавлении олигомерных IgG человека в образец перед инкубацией с ТЦЗ-Би и ТЦЗ-Диг.
Толерантность к лекарству
Концентрации анти-IL6R антитела тоцилизумаб, подлежащего определению в клинических образцах, составляли 0,5 мкг/мл или более, чаще находились в диапазоне от 1 мкг/мл до 10 мкг/мл.
Толерантность к лекарству стандартного анализа на антитела к лекарству оценивали путем определения наибольшей концентрации ТЦЗ, при которой положительные контрольные АЛ определялись выше порога отсечения. В Таблице 1 представлены обобщенные результаты.
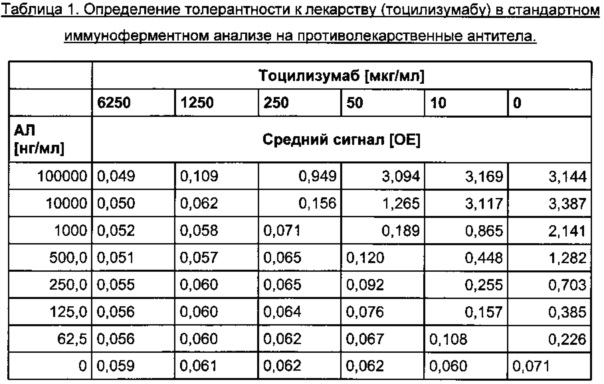
По левому краю выровнены значения сигналов ниже порога отсечения 0,136 отн. ед., рассчитанного для конкретного планшета.
В присутствии 10 мкг/мл ТЦЗ удалось зарегистрировать концентрацию АЛ 125 нг/мл, которую классифицировали как положительную.
Толерантность к лекарству описанного в данном документе толерантного к лекарству анализа с подавлением интерференции для определения противолекарственных антител оценивали путем определения наибольшей концентрации ТЦЗ, при которой положительные контрольные АЛ определялись выше порога отсечения. В Таблице 2 представлены обобщенные результаты.

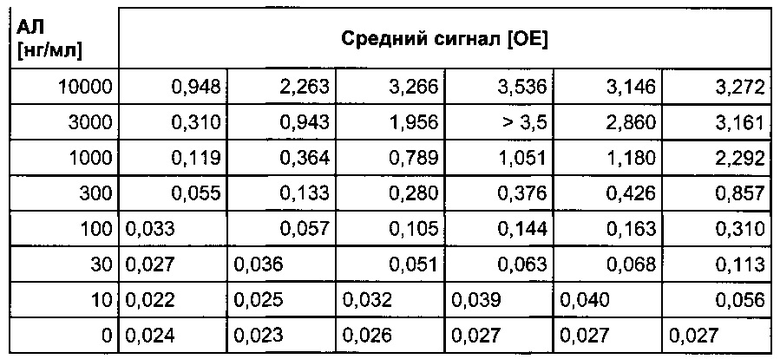
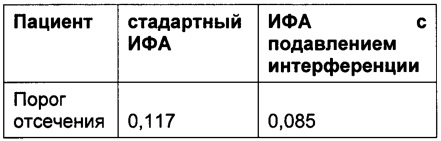
По левому краю выровнены значения сигналов ниже порога отсечения 0,045 отн. ед., рассчитанного для конкретного планшета.
В иммуноферментном анализе на противолекарственные антитела с подавлением интерференции, согласно данному описанию, в присутствии 10 мкг/мл ТЦЗ зарегистрировали очень низкую концентрацию АЛ 30 нг/мл, которую классифицировали как положительную. Кроме того, концентрации АЛ 100 нг/мл и 300 нг/мл указывают на толерантность к 30 мкг/мл и даже 100 мкг/мл терапевтически активного антитела, соответственно.
В анализе с подавлением интерференции установили по меньшей мере 10-кратное увеличение толерантности к лекарству по сравнению с аналогичным экспериментом, проведенным с известным на уровне техники стандартным двухстадийным твердофазным ИФА на противолекарственные антитела к тоцилизумабу (см. также Фиг. 4 для концентрации АЛ 300 нг/мл).
Толерантность к лекарству описанного в данном документе толерантного к лекарству анализа на противолекарственные антитела с подавлением интерференции, с использованием конъюгатов 1:1 биотина и дигоксигенина, присоединенных к одной валентности к захватывающего и детекторного антител, соответственно, оценивали путем определения наибольшей концентрации ТЦЗ, при которой положительные контрольные АЛ определялись выше порога отсечения. В Таблице 3 представлены обобщенные результаты.
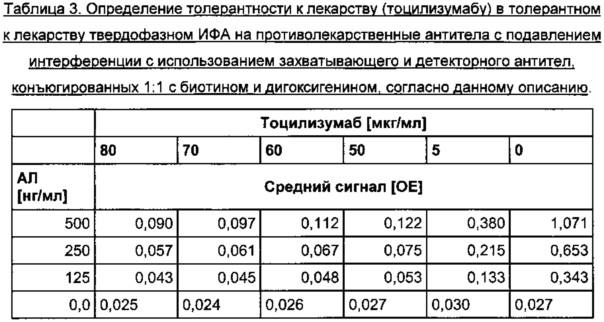
По левому краю выровнены значения сигналов ниже порога отсечения 0,037 отн. ед., рассчитанного для конкретного планшета.
В иммуноферментном анализе на противолекарственные антитела с подавлением интерференции, согласно данному описанию, в присутствии 80 мкг/мл ТЦЗ зарегистрировали концентрацию АЛ 250 нг/мл, которую классифицировали как положительную.
Подавление интерференции
16 клинических образцов плазмы исследовали при помощи стандартного анализа на антитела к лекарству, как описано Stubenrauch et al. (см. выше). Обобщенные результаты представлены в Таблице 4а.


Приняли ряд мер, не меняющих принцип метода, в результате чего был разработан толерантный к лекарству ИФА с подавлением интерференции для определения противолекарственных антител, описанный в данном документе.
Указанные меры состояли в:
1) повышении концентрации биотинилированного и дигоксигенированного ТЦЗ (например, от 0,5 мкг/мл до 1,5 мкг/мл);
2) одновременной инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг;
3) увеличении времени инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг (например, от 1 ч до 16 ч);
4) использовании только модифицированных по лизину реагентов ТЦЗ-Би и ТЦЗ-Диг вместо смеси реагентов, модифицированных по лизину и углеводам;
5) повышении содержания такой матрицы, как сыворотка; и
6) добавлении олигомерных IgG человека в образец перед инкубацией с ТЦЗ-Би и ТЦЗ-Диг.
Результаты, полученные в анализе с подавлением интерференции, описанном в данном документе, представлены в Таблице 4б.

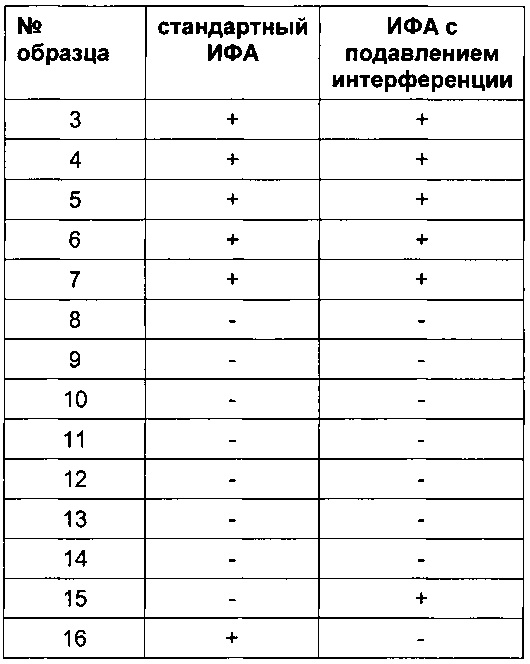
Установили, что если принимали только часть мер, описанных выше, подавление интерференции было недостаточным и по-прежнему наблюдалась интерференция, обусловленная присутствием ревматоидного фактора, приводящая к ложноположительным результатам анализа на АЛ.
Например, если принимали только такие меры, как:
1) повышение концентрации биотинилированного и дигоксигенированного ТЦЗ (например, от 0,5 мкг/мл до 1,5 мкг/мл);
2) одновременную инкубацию образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг;
3) увеличение времени инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг (например, от 1 ч до 16 ч);
4) использование только модифицированных по лизину ТЦЗ-Би и ТЦЗ-Диг реагентов вместо смеси модифицированных по лизину и углеводам реагентов; и
5) повышение содержания такой матрицы, как сыворотка,
предрасположенность к ложноположительным результатам полностью не устранялась. Сравнительные данные представлены в Таблице 4в.
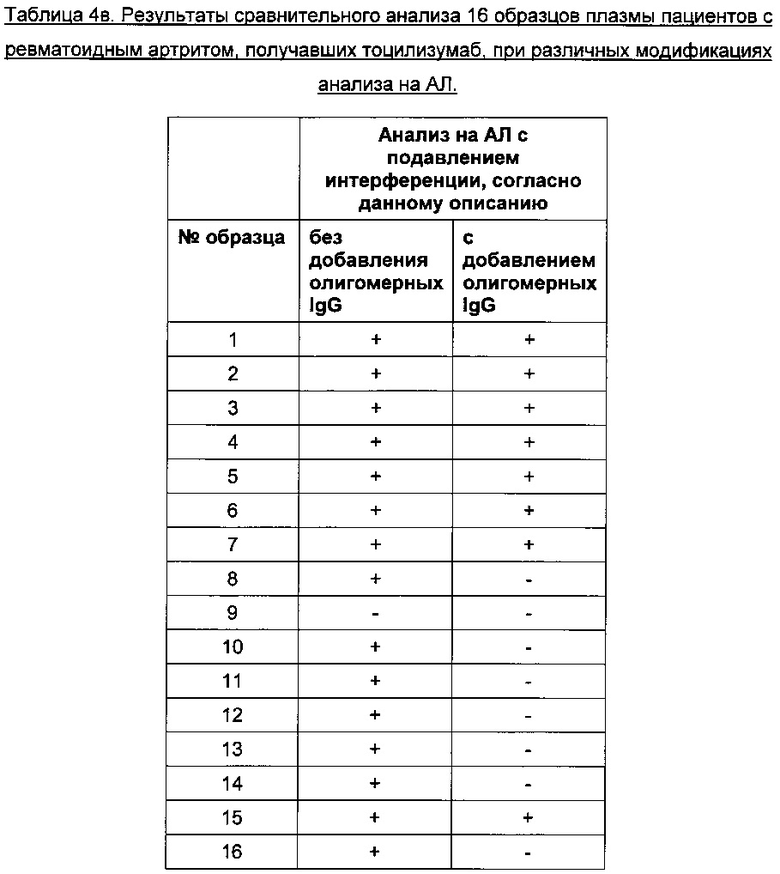
Сравнительная оценка 258 различных образцов сыворотки пациентов с РА, получавших ТЦЗ, с помощью стандартного анализа на АЛ и толерантного к лекарству анализа на АЛ с подавлением интерференции, описанного в данном документе, показала положительные результаты в тех же 12 образцах. Стандартный анализ показал положительные результаты у 27 пациентов, получавших плацебо, тогда как толерантный к лекарству анализ на АЛ с подавлением интерференции, описанный в данном документе, только у 4. В заключение, ряд мер, описанных в данном документе, а также добавление в анализ на АЛ олигомерных IgG человека в качестве дополнительного компонента обеспечили повышенную толерантность к лекарству и подавление интерференции, обусловленной РФ, по сравнению со стандартным анализом на АЛ.
Анализ данных, упомянутых выше, представлен в Таблице 7.
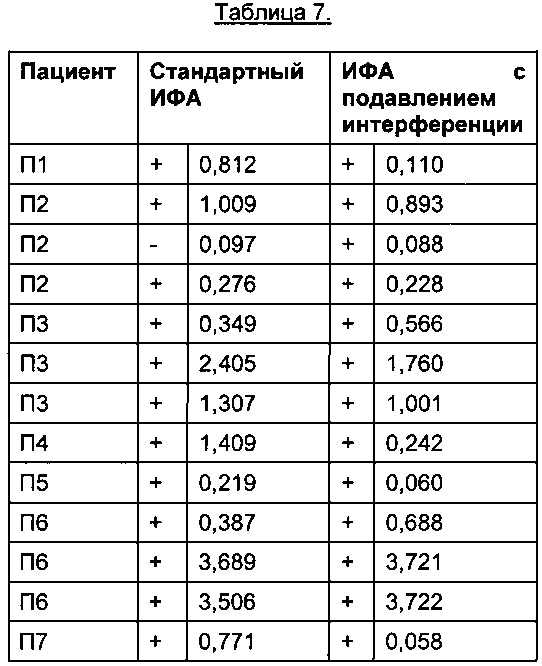
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
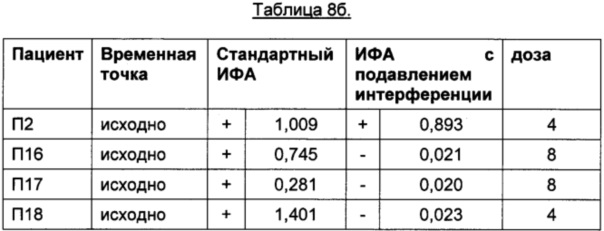
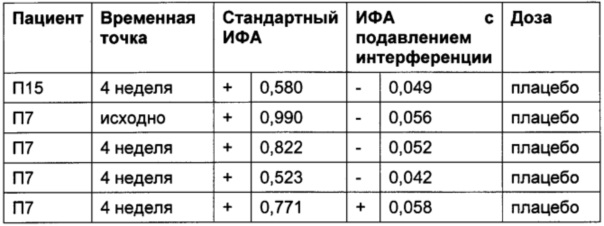
В Таблице 8а приведены результаты для 27 пациентов, получавших плацебо и не получавших ТЦЗ. Из-за отсутствия АЛ, возникающих на фоне лечения ТЦЗ, в этой группе высокий сигнал регистрироваться не должен и будет указывать на возможную интерференцию.
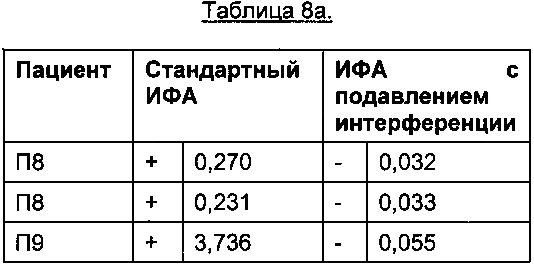
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
Профиль сигналов в двух анализах существенно различается: в стандартном ИФА положительными оказались все 27 образцов пациентов, получавших плацебо, тогда как в ИФА с подавлением интерференции, описанном в данном документе, положительными оказались результаты только в 4 образцах из 27.
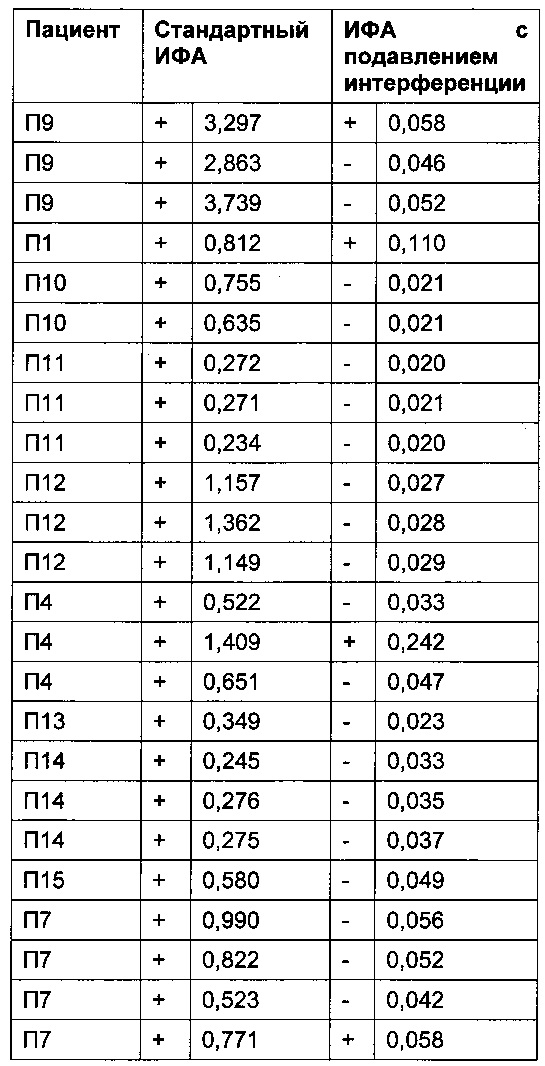
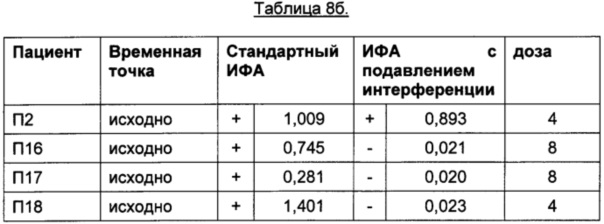
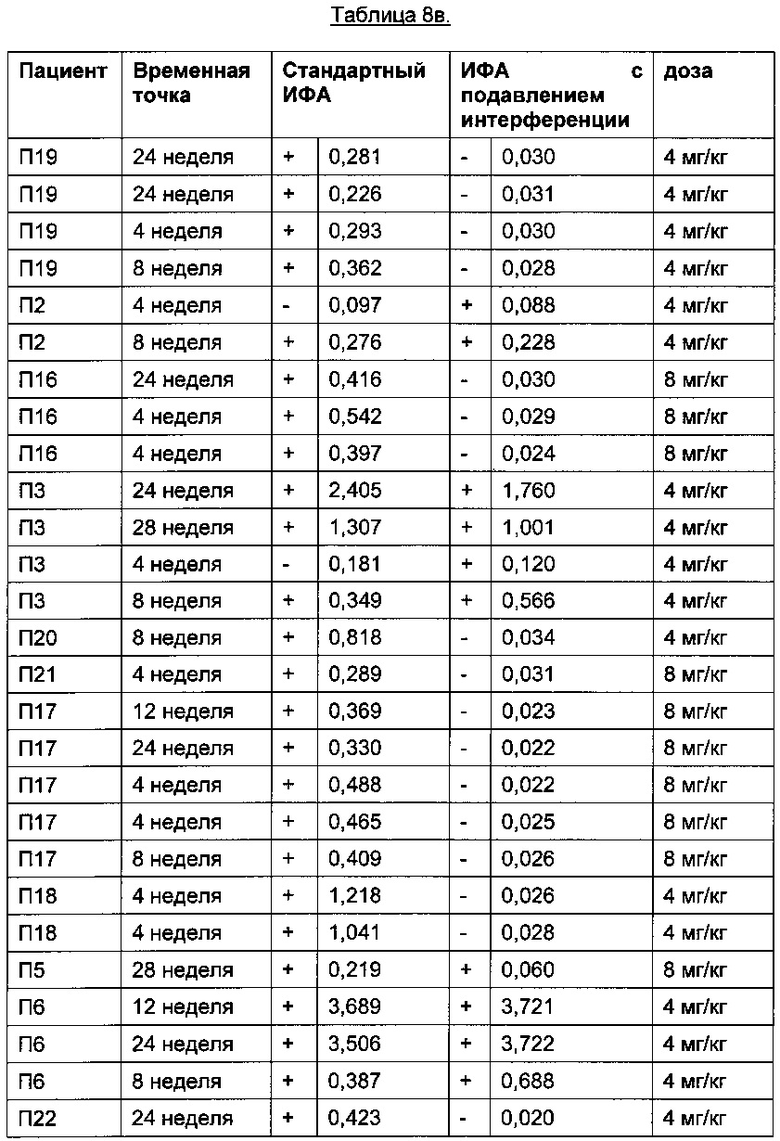
Помимо пациентов, получавших плацебо, провели анализ образцов пациентов, получавших ТЦЗ. В Таблице 8бgG приведены результаты пациентов до начала лечения ТЦЗ. В Таблице 8в приведены результаты пациентов, получавших ТЦЗ.
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
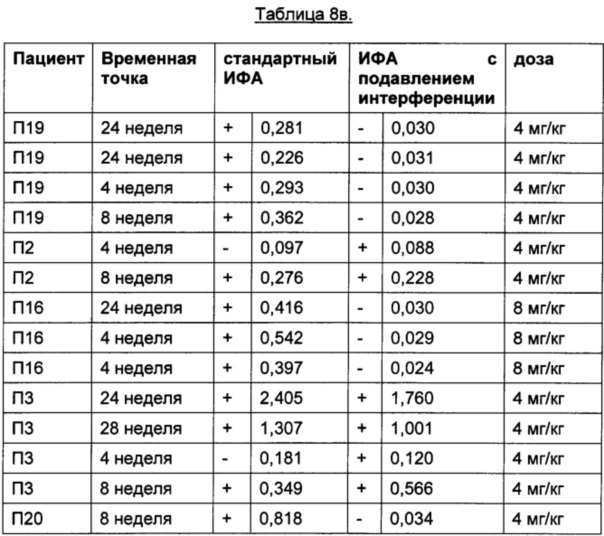
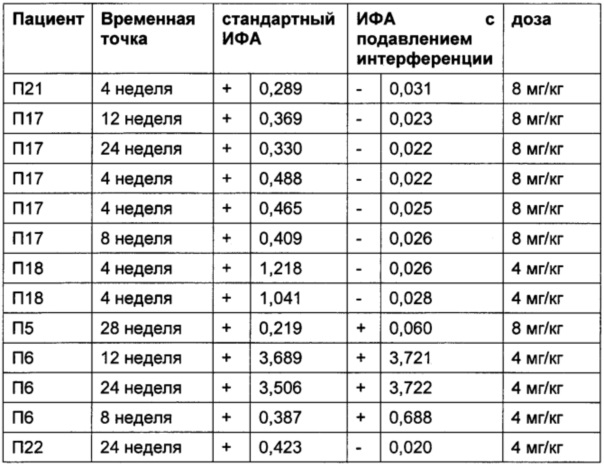
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
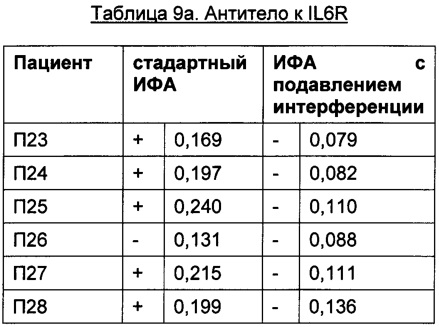
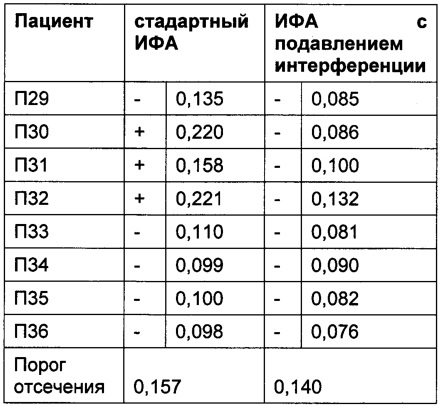
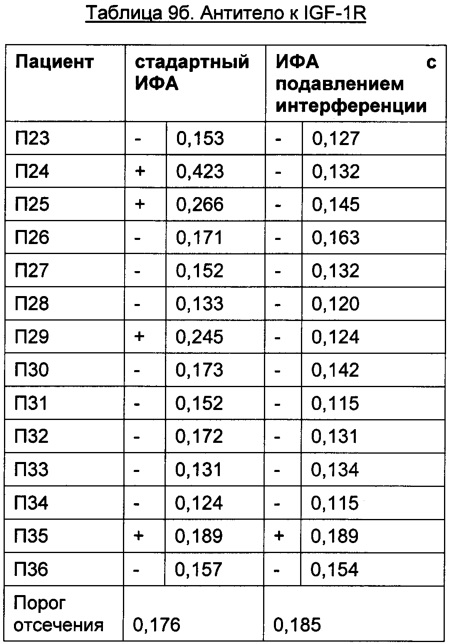
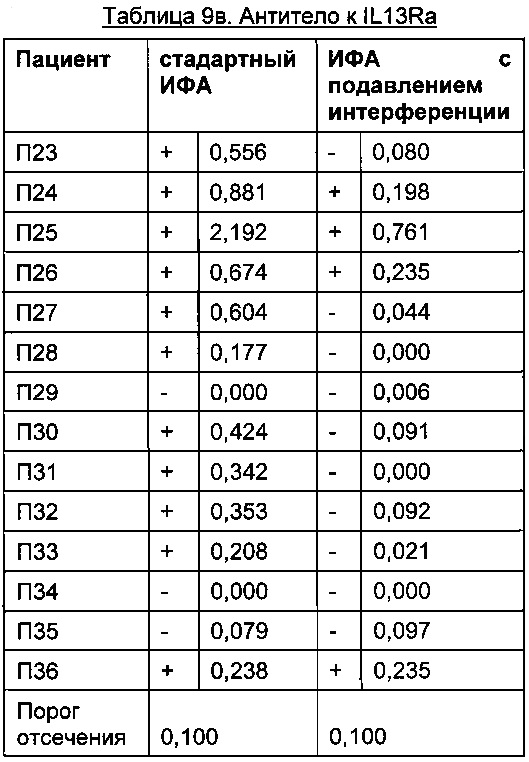
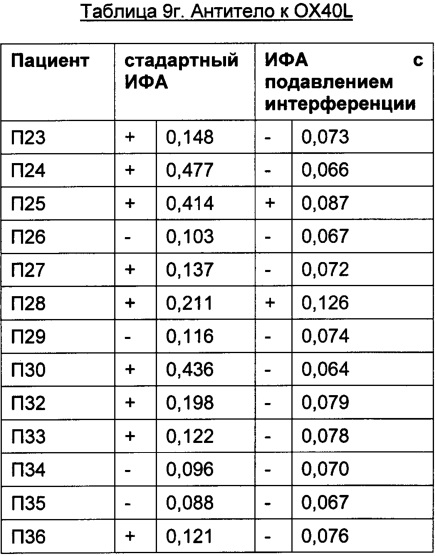
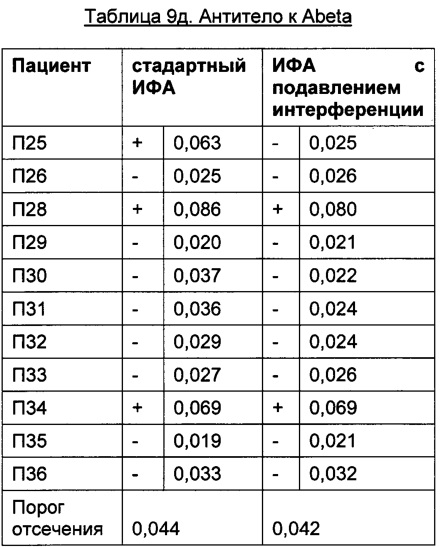
Преимуществом описанного в данной заявке анализа является отсутствие зависимости от используемых терапевтически активного антитела и мишени. Это продемонстрировано в следующих Таблицах для антитела к IL6R, антитела к IGF-1R, антитела к IL13Ra, антитела к OX40L и антитела к Abeta с использованием образцов пациентов, у которых был диагностирован ревматоидный артрит.
Ниже приведены примеры и графические материалы, которые дают возможность лучше понять настоящее изобретение, объем которого ограничен прилагаемой формулой. Следует понимать, что указанные методики могут быть модифицированы, но при этом суть изобретения сохранится.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Материалы и методы
Очищенный пулированный человеческий иммуноглобулин класса G (IgG) получали согласно описанию Stubenrauch et al. (Anal. Biochem. 390 (2009) 189-196). Вкратце, пулированную сыворотку человека, полученную от здоровых доноров, делипидировали с помощью реагента Aerosil (диоксид силикона, 1,5% (вес/об)) и преципитировали сульфатом аммония (до 2,0 М). Осадок гомогенизировали в фосфатном буфере и диализовали против фосфатного буфера, рН 7,0. Смесь разделяли путем ионообменной хроматографии на ДЭАЭ-целлюлозе при рН 7,0 и переходящие в фильтрат IgG концентрировали до 5,93 мг/мл и очищали путем гель-фильтрации.
Поликлональное антитело против дигоксигенина, конъюгированное с пероксидазой хрена (ПХ) (Fab-фрагменты), приобрели в компании Roche Diagnostics GmbH, Mannheim, Germany (кат. номер 11633716). Поликлональные антитела кролика к ТЦЗ (0,5 мг-эквивалентов/мл), которые использовали в качестве положительного контроля (K) и калибровочных стандартов (С), получали, как описано Stubenrauch et al. (см. выше).
Отдельные образцы сыворотки человека были получены из банка сывороток компании Roche Diagnostics GmbH, Penzberg, Германия. Пулированная сыворотка человека, служившая в качестве отрицательного контроля, была приобретена в компании TCS Biosciences Ltd., Buckingham, Великобритания.
Следующие реагенты приобрели в компании Roche Diagnostics GmbH, Mannheim, Германия: субстрат 2,2'-азино-бис(3-этилбензтиазолин-6-сульфоновая кислота (ABTS) (кат. номер 11684302-001), отмывочный буфер для ИФА: фосфатно-солевой буфер (ФСБ) (0,01 М KН2РO4, 0,1 М Na2НРO4, 1,37 М NaCl, 0,027 М KCl; рН 7,0) / 0,05% полисорбат 20 (Tween 20) (кат. номер 11332465-001) и готовый к употреблению универсальный буфер (кат. номер 4742672), который использовали в ИФА как разводящий буфер. Все химические реагенты были марки ч.д.а.
Покрытые стрептавидином планшеты для микротитрования (СА-ПМТ) приобрели в компании MicroCoat Biotechnologie GmbH, Bernried. Непокрытые 96-луночные планшеты для микротитрования Nunc приобрели в компании Fisher Scientific GmbH, Schwerte, Германия (кат. номер 442587) и использовали для предварительной инкубации.
Стандартный анализ на антитела к лекарству
Анализ проводили при комнатной температуре. На первом этапе ТЦЗ-Би в концентрации 0,5 мкг/мл иммобилизовали на СА-ПМТ по 100 мкл путем инкубации на шейкере при 400 об/мин в течение 1 часа. Перед добавлением в СА-ПМТ раствора, прошедшего предварительную инкубацию, избыток ТЦЗ-Би удаляли путем 3-кратной отмывки. Одновременно с процедурой иммобилизации проводили предварительную инкубацию стандартов и образцов в отдельных непокрытых 96-луночных плантешах, в дупликатах. Образцы и стандарты разводили (1:10) в лунках 10% сывороткой (матрица) до объема 75 мкл и смешивали с равным объемом ТЦЗ-Диг, начиная предварительную инкубацию в течение 1 часа. В покрытые ТЦЗ-Би СА-ПМТ загружали предварительно инкубированные растворы, перенося по 100 мкл из каждой лунки планшета для предварительной инкубации в покрытый ПМТ и инкубировали на шейкере при 400 об/мин в течение 1 часа. После отмывки в лунки добавляли поликлональное антитело к Диг, конъюгированное с пероксидазой хрена (ПХ), в объеме 100 мкл (100 мЕд/мл) и инкубировали на шейкере в течение 1 часа. После отмывки запускали цветную реакцию, катализируемую ПХ, путем добавления 100 мкл раствора ABTS. Когда максимальные значения оптической плотности (ОП) достигали приблизительно 2,0, что обычно занимало 20-30 минут, регистрировали сигнал на считывающем устройстве для ИФА при длине волны 405 нм (референтная длина волны 490 нм). Такой же анализ проводили в присутствии подтверждающих реагентов, с одновременным измерением без подтверждающих реагентов. Полученные значения ОП использовали для построения стандартной калибровочной кривой для расчета концентрации образца с помощью 4-параметрической нелинейной регрессионной аппроксимации по методу Вимера-Родбарда.
Порог отсечения для результатов измерений устанавливали на уровне 95% ДИ зарегистрированных сигналов (ОП) после многочисленых измерений холостых проб, содержащих образцы человеческой сыворотки, полученной от здоровых доноров и пациентов с РА. Результаты скринингового теста, превышающие указанный порог отсечения, считали положительными. Снижение показателя поглощения >20% относительно образца без добавления известного количества антитела указывало на положительный результат. Порог отсечения при скрининге установили на уровне 61,4 нг/мл референтного антитела. Внутрисерийная и межсерийная точность составляла от 84,8% до 93,1% и от 91,3% до 92,2%, соответственно. Соответствующие значения для внутрисерийной и межсерийной погрешности составляли от 1,8% до 2,0% и от 6,8% до 8,0%, соответственно. Точность ИФА определяли как степень близости результатов измерений к истинным значениям. Точность определяли путем сравнения найденных концентраций поликлонального антитела кролика к ТЦЗ, служившего положительным контролем, добавленным в сыворотку человека, с номинальными значениями концентрации антитела к ТЦЗ. Для определения внутрисерийной точности использовали по 6 аликвот каждого из контрольных образцов с высокой концентрацией (360 нг эквивалентов/мл) и низкой концентрацией (60 нг эквивалентов/мл), которые анализировали в дупликатах, а для определения межсерийной точности использовали по 3 аликвоты каждого из контрольных образцов, которые анализировали в дупликатах.
Пример 1. Биотинилирование анти-IL6R антитела тоцилизумаб
а) биотинилирование IgG стандартным способом
Анти-IL6R антитело тоцилизумаб диализовали против буфера (100 мМ калий-фосфатный буфер (далее обозначаемый K-РO4), рН 8,5). Затем концентрацию белка в растворе доводили до 5 мг/мл. N-гидроксисукцинимидный эфир D-биотиноил-аминокапроновой кислоты растворяли в диметилсульфоксиде (ДМСО) и добавляли к раствору антитела в молярном отношении 1:5. Через 60 мин реакцию останавливали добавлением L-лизина. Избыток метки удаляли путем диализа против 50 мМ K-РO4 с добавлением 150 мМ KCl, рН 7,5. Аликвоты ТЦЗ-Би хранили при -80°С с добавлением 6,5% сахарозы.
б) получение монобиотинилированного IgG
Антитело к IL6R тоцилизумаб диализовали против 100 мМ K-РO4, рН 8,5 и затем концентрацию белка в растворе доводили до 5 мг/мл. N-гидроксисукцинимидный эфир D-биотиноил-аминокапроновой кислоты растворяли в диметилсульфоксиде (ДМСО) и добавляли к раствору антитела в молярном отношении 1:1. Через 60 мин реакцию останавливали добавлением L-лизина. Избыток метки удаляли путем диализа против 25 мМ K-РO4 с добавлением 150 мМ KCl, рН 7,2. Смесь переносили в буферный раствор, содержащий 100 мМ K-РO4, 150 мМ KCl, рН 7,2, с добавлением 1 М сульфата аммония и наносили на колонку с сефарозой, конъюгированной с мутеином стрептавидина (мутантным стрептавидином). Небиотинилированный IgG переходил в фильтрат при промывании колонки, монобиотинилированный IgG элюировали 100 мМ K-РO4, 150 мМ KCl, 1,5% ДМСО, рН 7,2, а биотинилированный IgG, включающий популяции с более высоким уровнем биотинилирования, элюировали 100 мМ K-РO4, 150 мМ KCl, 2 мМ D-биотин, рН 7,2. Монобиотинилированное антитело диализовали против 50 мМ K-РO4 с добавлением 150 мМ KCl, рН 7,5. Аликвоты хранили при -80°С с добавлением 6,5% сахарозы.
Пример 2. Дигоксигенирование анти-IL6R антитела тоцилизумаб
а) дигоксигенирование IgG стандартным способом
Анти-IL6R антитело тоцилизумаб диализовали против буфера (100 мМ калий-фосфатный буфер (далее обозначаемый К-РО4), рН 8,5). Затем концентрацию белка в растворе доводили до 5 мг/мл. N-гидроксисукцинимидный эфир 3-O-метилкарбонил-ε-аминокапроновой кислоты растворяли в ДМСО и добавляли к раствору антитела в молярном отношении 1:4. Через 60 мин реакцию останавливали добавлением L-лизина. Избыток метки удаляли путем диализа против 50 мМ К-РO4 с добавлением 150 мМ NaCl, рН 7,5. Дигоксигенированный ТЦЗ (ТЦЗ-Диг) хранили при -80°С с добавлением 6,5% сахарозы.
б) получение монодигоксигенированного IgG
Антитело к IL6R тоцилизумаб диализовали против 100 мМ К-РO4, рН 8,5 и затем концентрацию белка в растворе доводили до 5 мг/мл. N-гидроксисукцинимидный эфир 3-O-метилкарбонил-ε-аминокапроновой кислоты растворяли в диметилсульфоксиде (ДМСО) и добавляли к раствору антитела в молярном отношении 1:1. Через 60 мин реакцию останавливали добавлением L-лизина. Избыток метки удаляли путем диализа против 50 мМ К-РO4 с добавлением 150 мМ KCl, рН 7,5. Смесь наносили на колонку с сефарозой с иммобилизованным моноклональным антителом к дигоксигенину. Недигоксигенированное антитело переходило в фильтрат при промывании колонки, монодигоксигенированный IgG элюировали мягким элюирующим буфером (Thermo Scientific, # 21013), а дигоксигенированное антитело, включающее популяции с более высоким уровнем дигоксигенирования, элюировали 1 М пропионовой кислотой. Фракцию монодигоксигенированного антитела диализовали первый раз против 20 мМ TRIS, 20 мМ NaCl, рН 7,5, и второй раз против 50 мМ K-РO4, 150 мМ KCl, рН 7,5. Аликвоты хранили при -80°С с добавлением 6,5% сахарозы.
Пример 3. Получение IgG человека в олигомерной форме
IgG человека, выделенные из человеческой сыворотки при помощи ионообменной хроматографии, диализовали против 150 мМ фосфатного буфера, содержащего 100 мМ NaCl, рН 8,4 и концентрировали раствор белка до концентрации белка 50 мг/мл. Дисукцинимидил суберат (DSS) растворяли в ДМСО и добавляли к раствору антитела в молярном отношении 1:6 (IgG : DSS). Смесь инкубировали при 25°С и рН 8,4 с перемешиванием и анализировали продукты реакции методом аналитической гель-фильтрации на колонке (например, используя колонку TSK 4000). Полимеризацию останавливали через 140 мин путем добавления лизина до конечной концентрации 20 мМ. Через 45 мин инкубации при 25°С олигомерные IgG человека разделяли при помощи гель-фильтрации (например, с использованием колонки Sephacryl S400) для удаления низкомолекулярной фракции. Состав олигомеров характеризовали при помощи УФ спектроскопии, эксклюзионной хроматографии и электрофореза в полиакриламидном геле с добавлением ДСН (ДСН-ПААГ). Олигомерные IgG человека (10,5 мг/мл) аликвотировали и хранили при -65°С до момента разведения универсальным буфером (кат. номер 4742672) до концентрации 55,6 мкг/мл для использования в иммуноферментном анализе на антитела к лекарству в качестве добавки (ААД).
Пример 4. Получение калибровочных стандартов и контрольных образцов
Отдельно готовили матричные растворы калибровочных стандартов (С) и образцов для контроля качества (K). Образцы С готовили в день исследования из матричного раствора ТЦЗ концентрацией 0,5 мг/мл. После предварительного разведения пулированной человеческой сывороткой (ПЧС) полученный рабочий раствор С последовательно разводили перед анализом 1:1 100% ПЧС с получением концентраций калибратора 1000, 500, 250, 125, 62,5, 31,3 и 15,6 нг/мл. Отрицательным контролем служила 100% ПЧС. Для этапа предварительной инкубации в ходе анализа образцы С разводили 1:10, чтобы концентрация сыворотки составляла 10%, а концентрация аналита находилась в диапазоне от 100 нг/мл до 1,56 нг/мл.
Матричные растворы контрольных образцов готовили на 100% пулированной человеческой сыворотке и хранили в аликвотах для однократного использования при -20°С. Готовили три разных контрольных образца с высокой (750 нг/мл), средней (400 нг/мл) и низкой (50 нг/мл) концентрациями, которые хранили в виде матричного раствора в неразведенной сыворотке. Для этапа предварительной инкубации в ходе анализа готовили свежие разведения образцов К 1:10 раствором для захвата/детекции, для достижения концентрации сыворотки 10%. Дополнительно в анализе использовали четвертый образец К с концентрацией 25 нг/мл, соответствующей типичному порогу отсечения.
Пример 5. Скрининговый и подтверждающий анализ на АЛ
Сэндвич-ИФА использовали как для скрининга, так и для подтверждения присутствия противолекарственных антител к тоцилизумабу (см. Stubenrauch, K., et al., Clin. Ther. 32 (2010) 1597-1609). Принцип метода заключается в захвате АЛ в комплекс с ТЦЗ-Диг и ТЦЗ-Би, последний обеспечивает иммобилизацию на планшетах, покрытых стрептавидином. Комплекс ТЦЗ-Би/АЛ/ТЦЗ-Диг, связанный с СА-ПМТ детектировали при помощи антитела к Диг, конъюгированного с ферментом ПХ. Принцип толерантного к лекарству анализа на противолекарственные антитела показан на Фиг.1. Включение олигомерных IgG в анализ на АЛ в качестве добавки приводит к подавлению интерференции в анализе на антитела к лекарству, как показано на Фиг. 2. Пероксидаза хрена (ПХ), конъюгированная с поликлональным антителом, катализирует цветную реакцию с участием субстрата ABTS. Интенсивность окраски пропорциональна концентрации аналита.
Скрининговый анализ проводили при комнатной температуре. Реагенты и образцы сыворотки разводили универсальным буфером (кат. номер 4742672), на всех этапах отмывки использовали отмывочный буфер (ФСБ, 0,05% полисорбат 20 ((Tween 20) (кат. номер 11332465-001), который трижды вносили по 300 мкл на лунку. Инкубацию проводили при перемешивании на встряхивателе для планшетов (шейкере) при 500 об/мин. Исследуемые образцы, образцы С и К инкубировали в течение ночи (до 16 часов) с захватывающим антителом ТЦЗ-Би и детекторным антителом ТЦЗ-Диг. В каждую лунку планшета для микротитрования (ПМТ) помещали по 225 мкл раствора для захвата/детекции, содержащего 1,667 мкг/мл ТЦЗ-Би и 1,667 мкг/мл ТЦЗ-Диг с олигомерными IgG человека, используемыми в анализе на антитела к лекарству в качестве добавки (ААД) и затем добавляли по 25 мкл соответствующего образца. Конечные концентрации ТЦЗ-Би и ТЦЗ-Диг составляли 1,5 мкг/мл каждая, а концентрация олигомерных IgG человека составляла 50 мкг/мл. Заполненный ПМТ накрывали во избежание испарения и инкубировали в течение ночи. Из каждой лунки планшета для предварительной инкубации переносили по 100 мкл в дупликатах в лунки покрытого стрептавидином планшета для микротитрования (СА-ПМТ), который накрывали и инкубировали в течение 1 ч.
После отмывки в каждую лунку добавляли по 100 мкл конъюгата поликлонального антитела к Диг (Fab-фрагмент) с ПХ в концентрации 25 мЕд/мл и инкубировали в течение 1 ч. После отмывки в каждую лунку добавляли аликвоты готового к применению раствора ABTS по 100 мкл и инкубировали приблизительно от 10 до 15 минут при встряхивании. После остановки цветной реакции регистрировали сигнал с помощью считывающего устройства для ИФА при длине волны 405 нм (референтная длина волны 490 нм). Значения показателя поглощения для каждого образца сыворотки определяли в трипликатах. Оптическая плотность (ОП) стандарта с самой высокой концентрацией должна была достигать 1,8-2,2 относительных единиц (ОЕ). Полученные значения ОП использовали для построения стандартной калибровочной кривой для расчета концентрации в образце с помощью 4-параметрической нелинейной регрессионной аппроксимации по методу Вимера-Родбарда. Образец считали положительным по АЛ, если найденная концентрация оказывалась ниже порога специфичности.
Для оценки порога специфичности анализировали 32 отдельных холостых пробы, содержащих сыворотку пациентов с ревматоидным артритом, внося их в один ПМТ в дупликатах. Порог отсечения указывает величину сигнала, выше которого образец считают потенциально положительным в отношении АЛ в скрининговом анализе на АЛ. Поскольку данные не подчинялись нормальному распределению, для определения порога отсечения применяли непараметрический подход и вычисляли 95% процентиль на основании среднего значения порогов отсечения, полученных для нескольких планшетов.
Для определения порога отсечения в анализе на АЛ, провели эксперимент с 32 отдельными холостыми пробами, содержащими образцы человеческой сыворотки пациентов с ревматоидным артритом, которые иследовали в дупликатах, при этом среднее значение для трех различных планшетов составило приблизительно 0,026 ОЕ, а стандартное отклонение приблизительно 0,009. Соответствующий коэффициент вариации составил 23,8%, 20,0% и 19,0%, соответственно. На основании полученных данных рассчитали нормализующий фактор НФ=1,6905, который использовали при выполнении анализа для определения порогов отсечения для конкретных планшетов (порог отсечения для конкретного планшета [ОЕ] = сигнал [ОЕ] (отрицательного контроля) × НФ).
Для оценки воспроизводимости скринингового анализа на АЛ строили пять отдельных калибровочных кривых, используя семь образцам калибраторов, концентрация которых варьировала от 1,56 нг/мл до 100 нг/мл, и холостую пробу, внося их в один планшет в дупликатах. Для оценки внутрисерийной воспроизводимости измерений каждый из четырех образцов К анализировали в пяти повторностях (пять отдельных пробирок), внося их в один планшет в дупликатах. Для оценки межсерийной воспроизводимости измерений по меньшей мере два оператора выполняли семь независимых серий в четыре разных дня, при этом все контрольные образцы исследовали в дупликатах.
Типичная калибровочная кривая ИФА с подавлением интерференции представлена на Фиг. 3. О воспроизводимости метода судили по величине погрешности результатов параллельных измерений, при этом коэффициент вариации не превышал 15%. Значения погрешности и точности результатов ИФА на АЛ с подавлением интерференции, полученных в одной и в разных сериях, обобщены в Таблице 5.
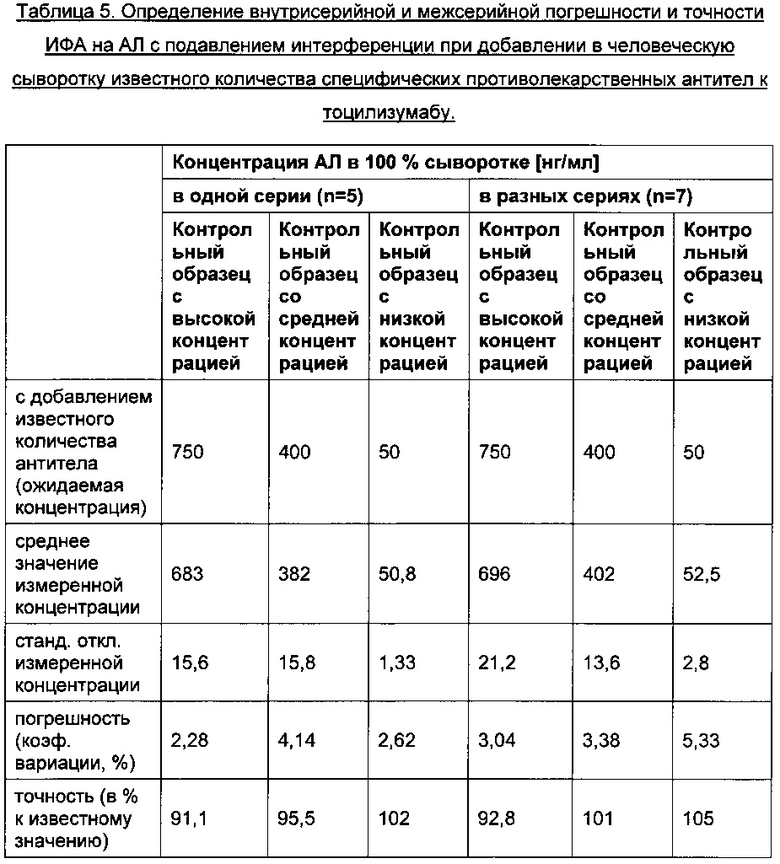
Внутрисерийная погрешность составила <5% для всех контрольных образцов, включая контрольный образец на уровне порога чувствительности 25 нг/мл. Внутрисерийная точность варьировала от 91,1% до 102%, а все контрольные образцы, в которых количество аналита соответствовало порогу чувствительности, были классифицированы как положительные. Межсерийная погрешность для всех контрольных образцов составила <6%. Межсерийная точность варьировала от 92,8% до 105% для контрольных образцов с высоким, средним и низким содержанием аналита. Все контрольные образцы, в которых количество аналита соответствовало порогу чувствительности, были классифицированы как положительные по АЛ.
Возможный эффект высокой дозы оценивали путем серийного разведения (1:2) положительного контрольного образца в диапазоне концентраций от 25000 нг/мл до 6,1 нг/мл. Найденные концентрации АЛ оказывались в интервале между 77,9% и 98,9% от известных значений. Для исследования потенциального влияния матрицы в 11 различных образцов нормальной человеческой сыворотки добавляли положительные контроли с высоким и низким уровнем АЛ, т.е. 50 и 750 нг/мл в 100% сыворотке, и проводили количественный анализ. Кроме того, в анализ на том же планшете включали контрольные образцы. Найденная концентрация АЛ для контролей с низким и высоким значениями составила 111% (диапазон 104-117%) и 111% (диапазон 107-117%), что указывало на отсутствие влияния матрицы на определение АЛ в ИФА с подавлением интерференции.
Толерантность к лекарству оценивали путем определения наибольшей концентрации ТЦЗ, при которой заданная концентрация АЛ в положительных контролях определялась выше порога отсечения. В Таблице 2 представлены обобщенные результаты.
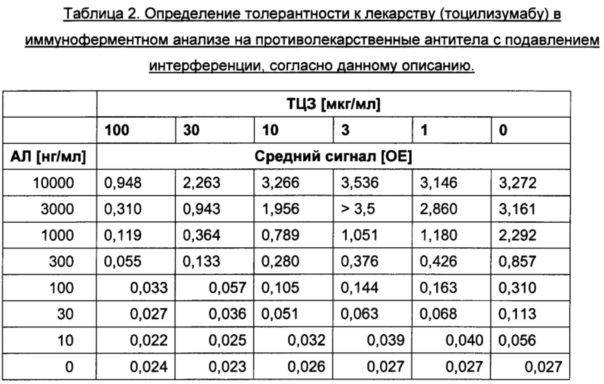
По левому краю выровнены значения сигналов выше порога отсечения 0,045 отн. ед., рассчитанного для конкретного планшета, по правому краю выровнены значения ниже порога отсечения.
Концентрации анти-IL6R антитела тоцилизумаб, подлежащего определению в клинических образцах, составляли 0,5 мкг/мл или более, чаще находились в диапазоне от 1 мкг/мл до 10 мкг/мл. Была зарегистрирована очень низкая концентрация АЛ 30 нг/мл, которую классифицировали как положительную в присутствии 10 мкг/мл ТЦЗ. Кроме того, концентрации АЛ 100 нг/мл и 300 нг/мл показали толерантность к 30 мкг/мл и даже 100 мкг/мл терапевтически активного антитела, соответственно. Аналогичные эксперименты, проведенные с известным на уровне техники стандартным двухстадийным твердофазным ИФА на противолекарственные антитела к тоцилизумабу, продемонстрировали по меньшей мере 10-кратное увеличение толерантности к лекарству в анализе с подавлением интерференции (см. также Фиг. 4 для концентрации АЛ 300 нг/мл).
Концентрацию ТЦЗ, которая бы соответствовала избытку свободного лекарства в подтверждающем анализе, определяли на основании данных, полученных в экспериментах с лекарственной интерференцией. Для определения концентрации ТЦЗ, способной блокировать АЛ, присутствующие в образцах в высокой концентрации, положительные контрольные образцы с четырьмя различными концентрациями (1000; 500; 250; 83,3 нг/мл в 100% сыворотке) инкубировали по отдельности с ТЦЗ в нарастающих концентрациях (0; 16; 31; 63; 125; 250 нг/мл в 100% сыворотке). Концентрации ТЦЗ, подавляющие по меньшей мере 95% регистрируемого сигнала для положительного контроля с высокой концентрацией АЛ (что соответствовало менее 5% известного значения), составили 25 мкг/мл ТЦЗ.
Для снижения вероятности получения ложноотрицательных результатов на следующей стадии исследования, обусловленных различной аффинностью АЛ в исследуемых образцах, далее провели анализ с избыточной концентрацией свободного лекарства, двукратно превышающей установленное значение, т.е. его конечная концентрация в анализе составляла 40 мкг/мл, что соответствовало концентрации 400 мкг/мл в 100% сыворотке.
Чтобы определить минимальное подавление сигнала, которое бы подтверждало присутствие специфических АЛ, проводили предварительную инкубацию 16 отдельных холостых проб, содержащих образцы сыворотки пациентов с ревматоидным артритом, с ТЦЗ и анализировали в дупликатах в одной серии. Анализ проводили в присутствии и в отсутствие 400 мкг/мл свободного ТЦЗ. Обнаружено, при добавлении свободного ТЦЗ уровень сигнала, регистрируемого в анализе, снижался в среднем на 14,1% (диапазон от -11,5% до 34,8%, стандартное отклонение 11,2%). При доверительном интервале 99,9% (среднее + 3,09 станд. откл.) минимальное снижение сигнала для холостых проб, содержащих сыворотку, составило 49%. Основываясь на данных расчетах, образец квалифицировали как положительный, если в присутствии избытка свободного лекарства сигнал снижался более чем на 49% по сравнению с сигналом в отсутствие свободного лекарства. В качестве референтных образцов использовали соответствующие образцы без избытка ТЦЗ. Чтобы продемонстрировать воспроизводимость подавления сигнала в подтверждающем анализе, трижды проанализировали образцы сыворотки с положительными контролями с высокой, средней и низкой концентрацией в присутствии избытка ТЦЗ в заданной концентрации и при его отсутствии.
В анализе с подавлением интерференции на противолекарственные антитела к ТЦЗ рабочий диапазон концентраций калибратора составлял от 1000 нг/мл до 15,6 нг/мл АЛ в 100% сыворотке. Внутрисерийная погрешность составляла менее 5% для контрольных образцов, а внутрисерийная точность составляла от 91,1 до 102%. Межсерийная погрешность и точность составляли менее 6% и от 92,8% до 105%, соответственно.
Апробация анализа показала отсутствие эффекта высокой дозы (hook effect) и влияния матрицы.
Можно отметить, что толерантность к лекарству анализа на АЛ с подавлением интерференции по меньшей мере в 10 раз превышала таковую известных модификаций.
Подтверждающий анализ проводили по существу, как описано выше для скринингового анализа, за исключением того, что образцы анализировали параллельно с добавлением избытка свободного лекарства, т.е. ТЦЗ, и без. Раствор для захвата/детекции, который использовали в подтверждающем анализе, содержал аналогичный объем раствора для захвата/детекции с добавлением избытка ТЦЗ (44,4 мкг/мл), с тем расчетом, чтобы после добавления образцов конечная концентрация ТЦЗ в анализе составляла 40 мкг/мл. Степень ингибирования сигнала в подтверджающем анализе с избытком лекарства рассчитывали по формуле:
степень ингибирования сигнала (%) = 100 × (1 - ([ОЕ] образца, инкубировавшегося с лекарством / [ОЕ] образца, не инкубировавшегося с лекарством)).
Пример 6. Апробация анализа на АЛ с подавленной интерференцией на клинических образцах
Меры, повышающие толерантность к лекарству, состоящие в 1) повышении концентрации биотинилированного и дигоксигенированного ТЦЗ (например, до 1,5 мкг/мл); 2) одновременной инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг; 3) пролонгированной инкубации образца сыворотки с ТЦЗ-Би и ТЦЗ-Диг (например, в течение ночи); 4) применении реагентов ТЦЗ-Би и ТЦЗ-Диг, модифицированных только по лизину, вместо смеси реагентов, модифицированных по лизину и углеводам; и повышении содержания такой матрицы, как сыворотка (например, 10% вместо 5%) привели к тому, что количество АЛ-положительных результатов увеличилось с 12 из 28 до 25 из 28.
Анализ 16 клинических образцов сыворотки проводили несколькими различными способами: с помощью стандартного анализа на АЛ, описанного в данном документе анализа на АЛ с подавлением интерференции без добавления IgG человека, а также описанного в данном документе анализа на АЛ с подавлением интерференции с добавлением олигомерных IgG человека. Обобщенные результаты представлены в Таблице 6. Из 16 образцов 15 оказались положительными в анализе на АЛ, в котором принимали меры 1-5, тогда как в стандартном анализе, а также в толерантном к лекарству анализе на АЛ с подавлением интерференции, согласно данному описанию, в котором принимали меры 1-6, положительными оказались только 8 образцов из 16, при этом у 7 из 8 образцов результаты оказались идентичными. Указанные 7 образцов с идентичными результатами отличались низкой концентрацией РФ в ходе исследования и/или до начала лечения. Все 7 образцов содержали АЛ изотипа IgG, которые связывались с Fab фрагментом тоцилизумаба, что свидетельствовало о подлинности специфичных к тоцилизумабу АЛ. Три из 7 образцов также имели АЛ изотипа IgM, которые также связывались с Fab фрагментом. Подавляющая часть остальных образцов, напротив, содержала АЛ преимущественно изотипа IgM, которые связывались с константным Fc фрагментом тоцилизумаба. Эти образцы также содержали РФ в высокой концентрации, т.е. >1000 Ед/мл.
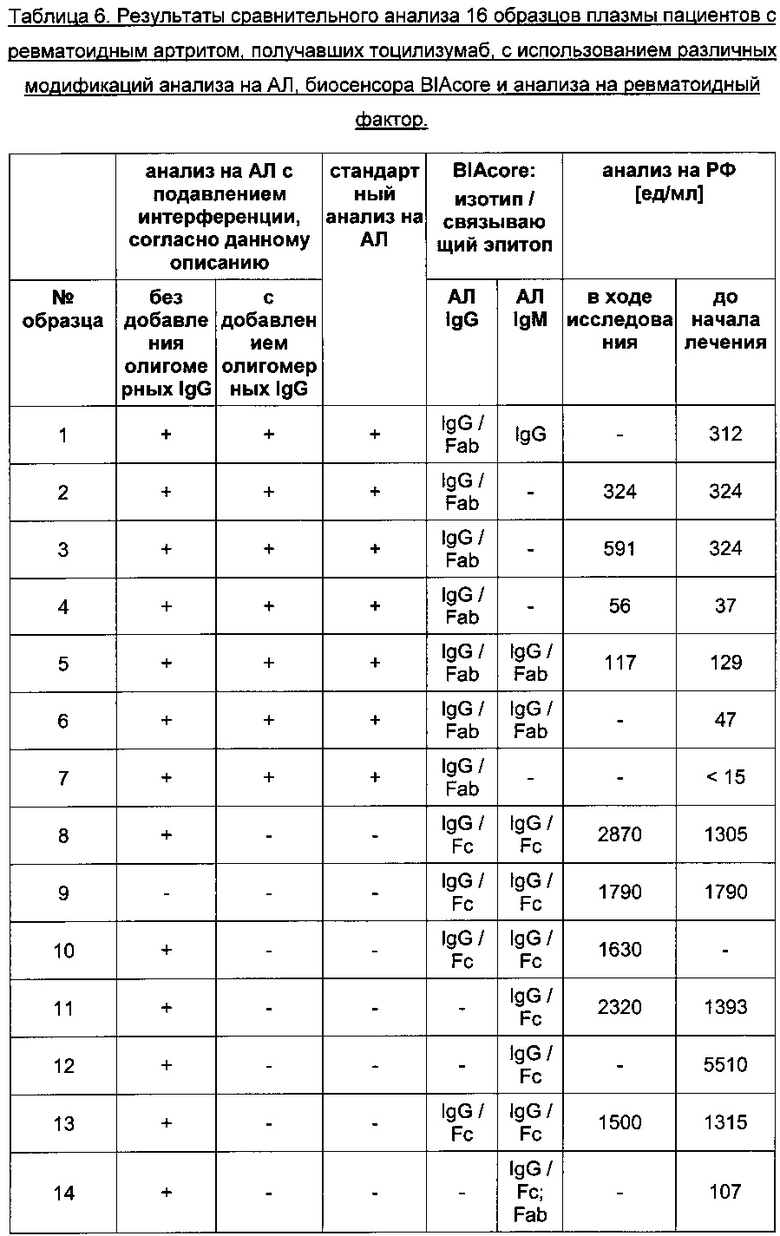
Иммуноферментный анализ на АЛ, описанный в Примере 5, использовали для анализа 148 различных образцов сыворотки пациентов с ревматоидным артритом, взятых до начала лечения и после введения тоцилизумаба. Результаты анализа на АЛ с подавлением интерференции сравнивали с результатами стандартного анализа на АЛ. Для более подробного анализа отобрали всего 92 образца сыворотки (из 148), взятые у 18 различных пациентов, для которых имелась дополнительная информация об изотипе АЛ, области связывания, а также клинических явлениях. Пациентов отбирали, если они удовлетворяли по меньшей мере одному из следующих критериев: 1) АЛ-положительный иммунный ответ в любой момент времени; 2) высокая концентрация ТЦЗ в сыворотке; 3) клинические проявления, такие как инфузионная реакция, гиперчувствительность или анафилактическая реакция. Исследования области связывания и изотипа АЛ выполняли с использованием биосенсоров, как описано ранее (Stubenrauch, K., et al., Anal. Biochem. 390 (2009) 189-196). Вкратце, в исследовании методом поверхностного плазмонного резонанса (ППР) паралельно использовали четыре проточные ячейки одного чипа биосенсора, иммобилизуя полноразмерное антитело и его константный (Fc) и антигенсвязывающий (Fab) фрагменты, для изучения различий в связывании АЛ. В качестве положительного контроля использовали стандартные конъюгаты, имитирующие человеческие поликлональные АЛ различных изотипов, которые получали путем конъюгирования поликлональных кроличьих антител к ТЦЗ с человеческими иммуноглобулинами (Ig) М, IgG или IgE (см. WO 2008/061684). Анализ на ревматоидный фактор (РФ) проводили с использованием нефелометра Siemens BN II и реагентов на РФ компании Siemens Healthcare Diagnostics (Newark, DE, США). Вкратце, полистироловые частицы, покрытые иммунными комплексами, состоящими из иммуноглобулинов человека и козьих антител к IgG человека, агрегировали при смешивании с образцами, содержащими РФ. Эти агрегаты вызывали рассеивание луча света, проходящего через образец. Интенсивность рассеянного света пропорциональна концентрации соответствующего белка в образце. Результаты оценивали путем сравнения со стандартом известной концентрации.
При сравнительном исследовании 258 различных образцов сыворотки пациентов с РА, получавших ТЦЗ, с помощью стандартного анализа на АЛ и толерантного к лекарству анализа на АЛ с подавлением интерференции, описанного в данном документе, положительные результаты совпали в 12 образцах. Стандартный анализ показал положительные результаты у 27 пациентов, получавших плацебо, тогда как толерантный к лекарству анализ на АЛ с подавлением интерференции, описанный в данном документе, только у 4. В заключение, ряд мер, описанных в данном документе, а также добавление в анализ на АЛ олигомерных IgG человека в качестве дополнительного компонента обеспечили повышенную толерантность к лекарству и подавление интерференции, обусловленной РФ, по сравнению со стандартным анализом на АЛ.
Анализ данных, упомянутых выше, представлен в Таблице 7.
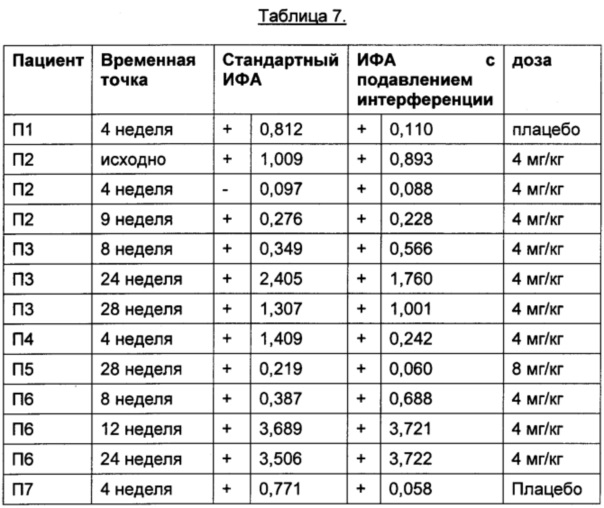
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
В Таблице 8а приведены качественные и количественные результаты для 27 пациентов, получавших плацебо и не получавших ТЦЗ. Из-за отсутствия АЛ, возникающих на фоне лечения ТЦЗ, в этой группе высокий сигнал регистрироваться не должен и будет указывать на возможную интерференцию.
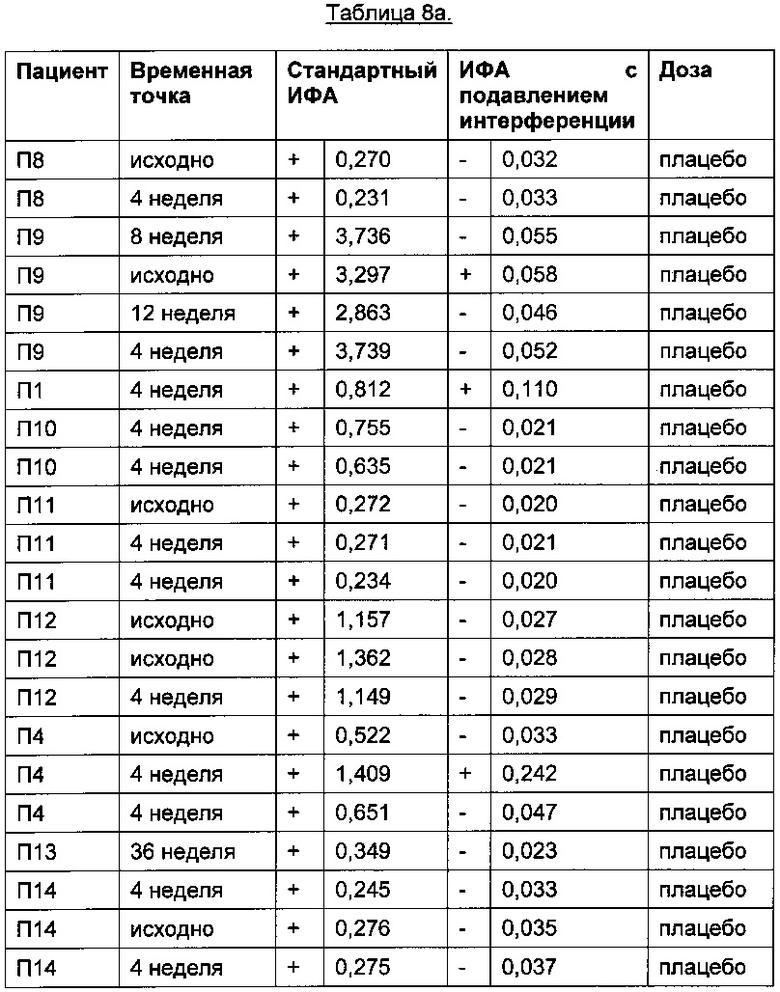
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
Профиль сигналов в двух анализах существенно различается: в стандартном ИФА положительными оказались все 27 образцов пациентов, получавших плацебо, тогда как в ИФА с подавлением интерференции, описанном в данной заявке, положительными оказались только 4 из 27 образцов.
Помимо пациентов, получавших плацебо, провели анализ образцов пациентов, получавших ТЦЗ. В Таблице 8б приведены результаты пациентов до начала лечения ТЦЗ. В Таблице 8в приведены результаты пациентов, получавших ТЦЗ.
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
Порог отсечения в исследовании: 0,215 (стандартный ИФА); 0,058 (ИФА с подавлением интерференции); +: положительные результаты ИФА; -: отрицательные результаты ИФА
Профиль сигналов в двух анализах различается: в стандартном ИФА положительными оказались результаты 25 пациентов, тогда как в ИФА с подавлением интерференции, описанном в данной заявке, положительными оказались результаты только 10 пациентов.
Пример 7. Влияние способа модификации захватывающего и детекторного реагентов
Мечение по одному и нескольким остаткам
Мероприятия для повышения толерантности к лекарству включали повышение концентрации биотинилированного и дигоксигенированного ТЦЗ (например, до 1,5 мкг/мл), что могло стать причиной повышения фоновых значений вследствие прилипания дигоксигенина; более высокий порог отсечения мог ухудшить толерантность к лекарству, а монобиотинилирование и монодигоксигенирование позволяют снизить фоновый сигнал при более высокой концентрации захватывающего и детекторного реагентов.
Сэндвич-ИФА использовали как для скрининга, так и для подтверждения присутствия противолекарственных антител к тоцилизумабу (см. Stubenrauch, К., et al., Clin. Ther. 32 (2010) 1597-1609). Принцип метода заключается в захвате АЛ в комплекс с ТЦЗ-Диг(моно) и ТЦЗ-Би(моно), последний обеспечивает иммобилизацию на планшетах, покрытых стрептавидином. Комплекс ТЦЗ-Би/АЛ/ТЦЗ-Диг (предварительную инкубацию проводили в течение ночи), связанный с СА-ПМТ, детектировали при помощи антитела к Диг, конъюгированного с ферментом ПХ. Принцип толерантного к лекарству анализа на противолекарственные антитела показан на Фиг. 1. Включение олигомерных IgG в анализ на АЛ в качестве добавки приводит к подавлению интерференции в анализе на антитела к лекарству, как показано на Фиг. 2. Пероксидаза хрена (ПХ), конъюгированная с поликлональным антителом, катализирует цветную реакцию с участием субстрата ABTS. Интенсивность окраски пропорциональна концентрации аналита.
Скрининговый анализ проводили при комнатной температуре. Реагенты и образцы сыворотки разводили универсальным буфером (кат. номер 4742672), на всех этапах отмывки использовали отмывочный буфер (ФСБ, 0,05% полисорбат 20 ((Tween 20) (кат. номер 11332465-001), который трижды вносили по 300 мкл на лунку. Инкубацию проводили при перемешивании на встряхивателе для планшетов (шейкере) при 500 об/мин. Исследуемые образцы, образцы С и К инкубировали в течение ночи (16 часов) с захватывающим антителом ТЦЗ-Би и детекторным антителом ТЦЗ-Диг. В каждую лунку планшета для микротитрования (ПМТ) помещали по 225 мкл раствора для захвата/детекции, содержащего 1,667 мкг/мл ТЦЗ-Би(моно) и 1,667 мкг/мл ТЦЗ-Диг(моно) с олигомерными IgG человека, используемыми в анализе на антитела к лекарству в качестве добавки (АЛД) и затем добавляли по 25 мкл соответствующего образца. Конечные концентрации ТЦЗ-Би(моно) и ТЦЗ-Диг(моно) составляли 1,5 мкг/мл каждая, а концентрация олигомерных IgG человека составляла 50 мкг/мл. Заполненный ПМТ накрывали во избежание испарения и инкубировали в течение ночи. Из каждой лунки планшета для предварительной инкубации переносили по 100 мкл в дупликатах в лунки покрытого стрептавидином планшета для микротитрования (СА-ПМТ), который накрывали и инкубировали в течение 1 ч.
После отмывки в каждую лунку добавляли по 100 мкл конъюгата поликлонального антитела к Диг (Fab-фрагмент) с ПХ в концентрации 25 мЕд/мл и инкубировали в течение 1 ч. После отмывки в каждую лунку добавляли аликвоты готового к применению раствора ABTS по 100 мкл и инкубировали приблизительно от 10 до 15 минут при встряхивании. После остановки цветной реакции регистрировали сигнал с помощью считывающего устройства для ИФА при длине волны 405 нм (референтная длина волны 490 нм). Значения показателя поглощения для каждого образца сыворотки определяли в трипликатах. Оптическая плотность (ОП) стандарта с самой высокой концентрацией должна была достигать 1,8-2,2 относительных единиц (ОЕ). Полученные значения ОП использовали для построения стандартной калибровочной кривой для расчета концентрации образца с помощью 4-параметрической нелинейной регрессионной аппроксимации по методу Вимера-Родбарда. Образец считали положительным по АЛ, если найденная коцентрация оказывалась ниже порога специфичности.
Для определения порога отсечения в обоих анализах исследовали 35 нативных образцов сыворотки пациентов с ревматической болезнью (РБ). Как показано на Фиг.5 и 6, в ИФА на АЛ с подавлением интерференции наблюдается большая вариабельность сигналов, регистрируемых для сыворотки, по сравнению с ИФА на антитела к лекарству с подавлением интерференции с использованием ТЦЗ-Би(моно) и ТЦЗ-Диг(моно).
Для дальнейшего исследования 77 различных образцов сыворотки пациентов с РА, получавших ТЦЗ, использовали оба варианта анализа на АЛ с подавлением интерференции. Поскольку все образцы были взяты до начала лечения ТЦЗ (исходно), противолекарственные антитела к ТЦЗ должны были отсутствовать. Сигнал, превышающий порог отсечения, может указывать на интерференцию (ложноположительные результаты), не связанную с противолекарственными антителами к лекарственному препарату (ТЦЗ).
Анализ с использованием меченного по нескольким остаткам ТЦЗ (Фиг. 7) показал большую вариабельность сигналов, чем анализ с использованием меченного по одному остатку ТЦЗ (Фиг. 8). Как можно заметить, данная вариабельность не связана с ошибкой в аналитической системе, иначе бы наблюдалось смещение относительно оси Y, а отражает большой разброс полученных сигналов. При заданном пороге отсечения почти все образцы в толерантном к лекарству анализе на АЛ с подавлением интерференции (мечение по одному остатку) находились ниже порога отсечения. По существу все образцы, которые исследовали при мечении по нескольким остаткам, оказывались выше порога отсечения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИПЛЕКСНЫЙ ИММУНОХРОМАТОГРАФИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ ЦИРКУЛИРУЮЩИХ ИММУНОКОМПЛЕКСОВ | 2013 |
|
RU2638812C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СВОБОДНОГО СВЯЗЫВАЮЩЕГО ПАРТНЕРА МУЛЬТИСПЕЦИФИЧНОГО СВЯЗУЮЩЕГО | 2012 |
|
RU2633488C2 |
| КОНЪЮГАТЫ АНТИТЕЛО-ФИНОМЕР | 2015 |
|
RU2732226C2 |
| СПОСОБЫ ВЫЯВЛЕНИЯ ПРЕПАРАТОВ И АУТОАНТИТЕЛ ПРОТИВ TNF | 2010 |
|
RU2571489C2 |
| АНТИТЕЛА ПРОТИВ IgG1 ЧЕЛОВЕКА | 2011 |
|
RU2603284C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ ПРОТИВ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНСУЛИНА В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА | 2016 |
|
RU2725142C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ЛЕКАРСТВАМ В ОТНОШЕНИИ ЧЕЛОВЕЧЕСКИХ ИЛИ ГУМАНИЗИРОВАННЫХ ЛЕКАРСТВЕННЫХ АНТИТЕЛ С ПОДАВЛЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ | 2015 |
|
RU2719642C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ВИРУСНОГО ЭНЦЕФАЛИТА | 2003 |
|
RU2235328C1 |
| АНАЛИЗ КОНКУРЕНТНОГО СВЯЗЫВАНИЯ С ЛИГАНДОМ ДЛЯ ОБНАРУЖЕНИЯ НЕЙТРАЛИЗИРУЮЩИХ АНТИТЕЛ | 2014 |
|
RU2701684C2 |
| СПОСОБ ДЕТЕКЦИИ ПАРТНЕРА ПО СВЯЗЫВАНИЮ МУЛЬТИСПЕЦИФИЧЕСКОГО СВЯЗЫВАЮЩЕГО АГЕНТА | 2013 |
|
RU2620563C2 |
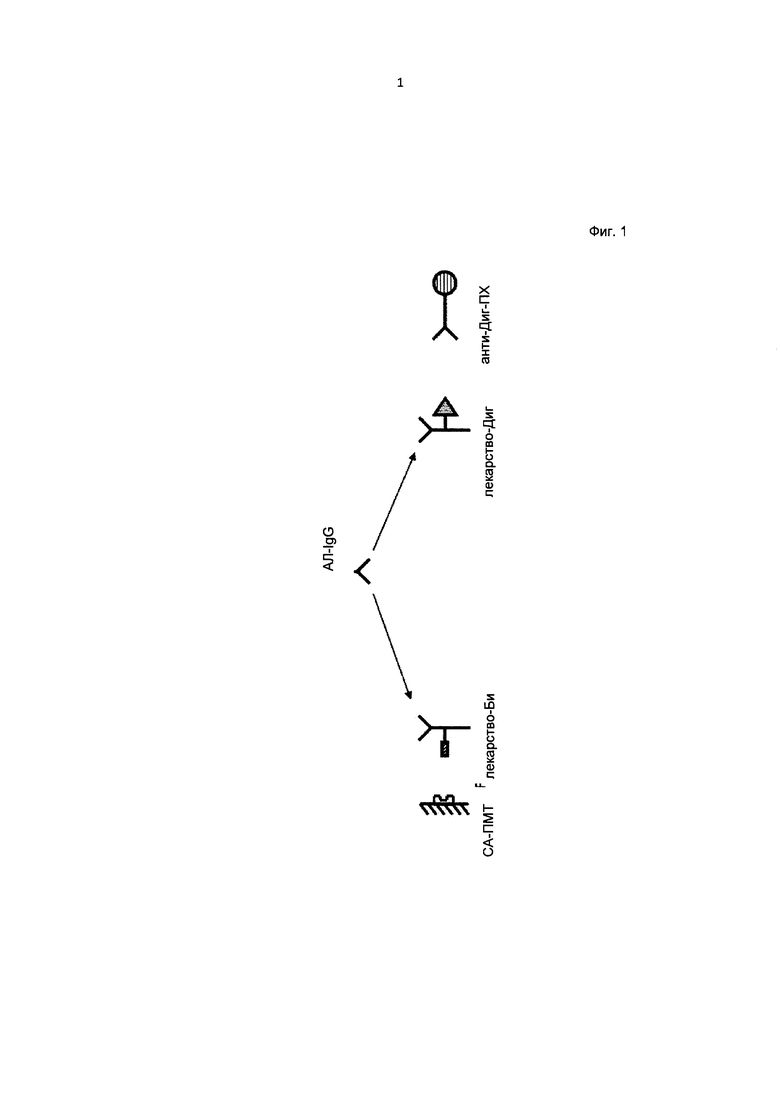
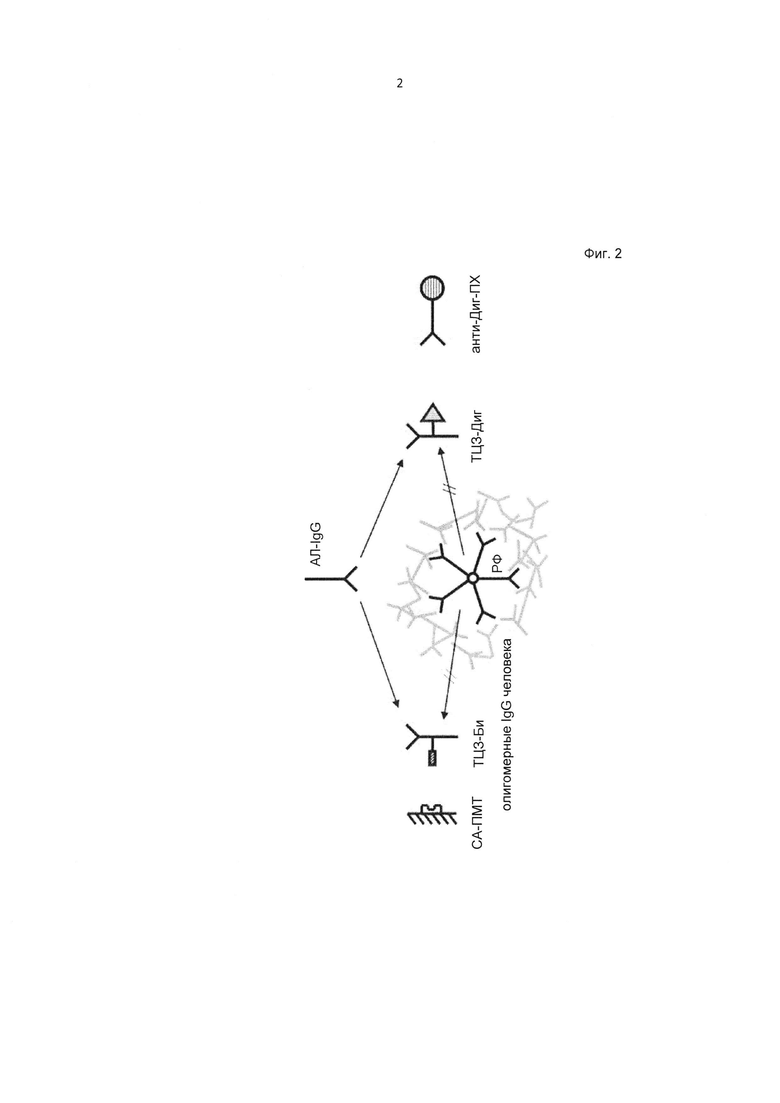
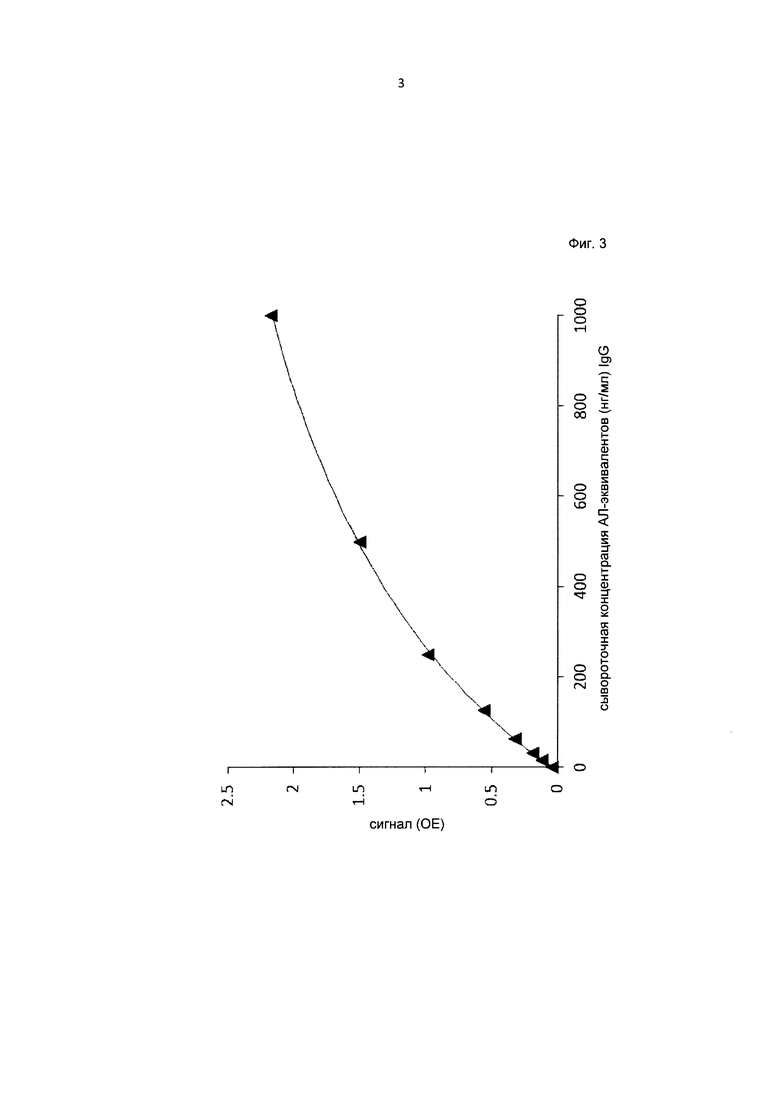
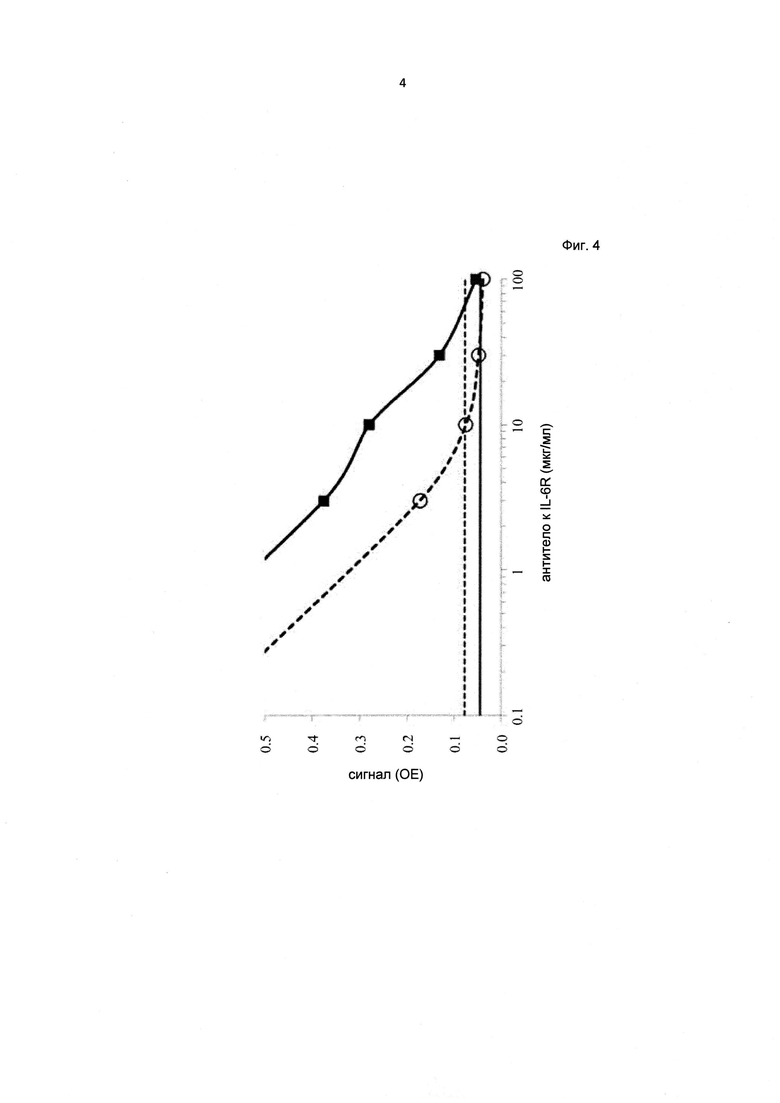
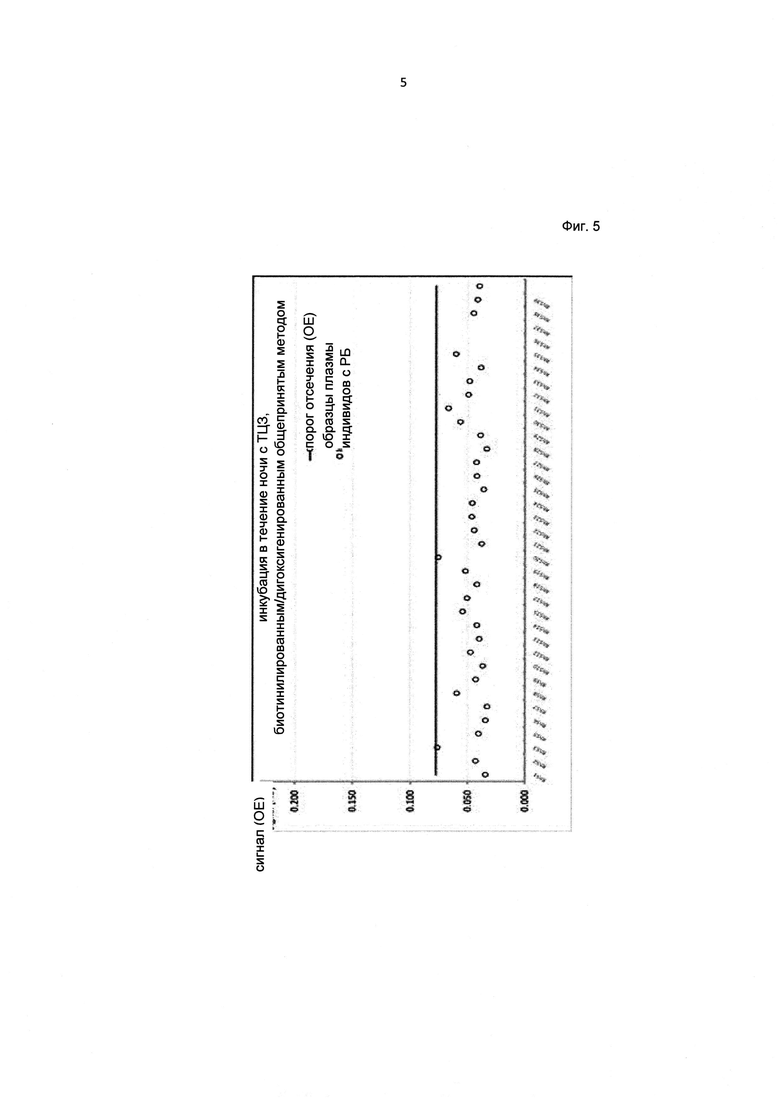

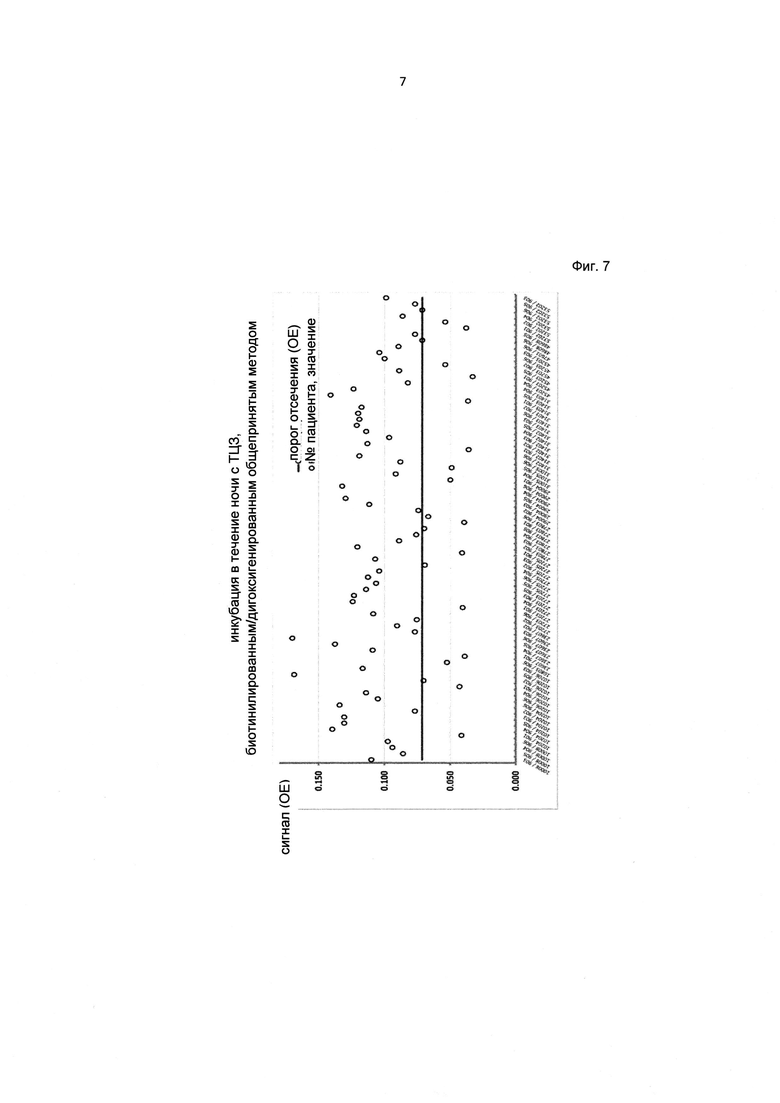

Изобретение относится к медицине и касается способа иммуноферментного анализа с подавлением интерференции для определения противолекарственных антител к терапевтически активному антителу для лечения артрита. Способ включает: (a) инкубацию образца, взятого у пациента с артритом, проходящего лечение указанным терапевтически активным антителом, со смесью, содержащей конъюгат указанного терапевтически активного антитела и первого компонента связывающейся пары в качестве захватывающего терапевтически активного антитела и конъюгат указанного терапевтически активного антитела и детектируемой метки в качестве детекторного терапевтически активного антитела, с образованием комплекса; (b) иммобилизацию образованного на стадии (а) комплекса на твердой фазе; (c) инкубацию иммобилизованного комплекса с антителом к детектируемой метке детекторного терапевтически активного антитела, конъюгированным со второй детектируемой меткой, и (d) определение противолекарственных антител. Изобретение обеспечивает сокращение количества ложноположительных результатов анализа противолекарственных антител к терапевтически активному антителу для лечения артрита. 6 з.п. ф-лы, 7 пр., 8 ил., 9 табл.
1. Способ иммуноферментного анализа с подавлением интерференции для определения противолекарственных антител к терапевтически активному антителу для лечения артрита, при этом указанный способ включает:
(a) инкубацию образца, взятого у пациента с артритом, проходящего лечение указанным терапевтически активным антителом, одновременно со смесью, содержащей от 1,5 до 10 мкг/мл конъюгата 1:1 указанного терапевтически активного антитела и первого компонента связывающейся пары через один остаток лизина в качестве захватывающего терапевтически активного антитела и от 1,5 до 10 мкг/мл конъюгата 1:1 указанного терапевтически активного антитела и детектируемой метки через один остаток лизина в качестве детекторного терапевтически активного антитела, в течение от 1 до 16 ч с образованием комплекса захватывающего терапевтически активного антитела, противолекарственного антитела и детекторного терапевтически активного антитела, где образец содержит 7,5% или более сыворотки, и перед инкубацией в образец добавляют олигомерный IgG человека до конечной концентрации от 10 до 1000 мкг/мл,
(b) иммобилизацию образованного на стадии (а) комплекса захватывающего терапевтически активного антитела, противолекарственного антитела и детекторного терапевтически активного антитела на твердой фазе с помощью ковалентного или нековалентного присоединения указанного первого компонента связывающейся пары ко второму компоненту связывающейся пары на твердой фазе,
(c) инкубацию иммобилизованного комплекса с антителом к детектируемой метке детекторного терапевтически активного антитела, конъюгированным со второй детектируемой меткой, и
(d) определение противолекарственных антител к указанному терапевтически активному антителу с помощью сигнала детектируемой метки антитела со стадии (с),
где терапевтически активное антитело представляет собой противовоспалительное антитело.
2. Способ по п. 1, в котором пациентом является пациент с ревматоидным артритом.
3. Способ по любому из пп. 1, 2, в котором первый компонент связывающейся пары в указанном захватывающем антителе представляет собой биотин, а детектируемой меткой в указанном детекторном антителе является дигоксигенин.
4. Способ по любому из пп. 1-3, в котором' вторым компонентом связывающейся пары на стадии (b) является стрептавидин.
5. Способ по любому из пп. 1-4, в котором образец содержит противолекарственные антитела и ревматоидные факторы.
6. Способ по любому из пп. 1-5, в котором терапевтически активное антитело представляет собой антитело к IL6R.
7. Способ по любому из пп. 1-6, в котором антитело к IL6R представляет собой тоцилизумаб.
| QIU Z.J., et al., A novel homogeneous Biotin-digoxigenin based assay for the detection of human anti-therapeutic antibodies in autoimmune serum.J Immunol Methods | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| MARAVEYAS A., et al., Improving tumour targeting and decreasing normal tissue uptake by optimizing the stoichiometry of a two-step biotinylated-antibody/streptavidin-based targeting strategy: studies in a nude mouse xenograft model.Int J Cancer | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| HOFFMANN E., et al., PK modulation of haptenylated peptides via non-covalent antibody complexation.J Control Release | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| WO 2012064627 A2, 18.05.2012. | |||
Авторы
Даты
2018-12-14—Публикация
2014-07-01—Подача