ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к методам анализа для обнаружения присутствия нейтрализирующих антител (Nab) против биотерапевтического биопрепарата.
УРОВЕНЬ ТЕХНИКИ
[0002] Обнаружение антител, таких как нейтрализирующие антитела (NAb), является частью исследования иммуногенности, которое выполняется для пациентов, которым назначено биотерапевтическое средство. Нейтрализирующие антитела нейтрализуют функцию лекарственного средства, тем самым отрицательно влияя на эффективность этого лекарственного средства. Наличие NAb у пациентов, которым назначено конкретное биотерапевтическое средство, может быть обнаружено с использованием нескольких способов иммунологического анализа, включая, например, колориметрический твердофазный иммуноферментный анализ (ELISA), анализ иммунофлюоресцентного связывания с рецептором, радиоиммуноанализы растворимой и твердой фазы, а также анализ на основе использования чувствительного элемента.
[0003] Нейтрализирующие антитела также могут быть обнаружены с использованием клеточных анализов. В этих клеточных анализах наличие нейтрализирующих антител может быть обнаружено по их способности ингибировать биологическое действие биотерапевтического средства, например, модуляцию биологического процесса в клетке-мишени. Эти анализы могут включать в себя, например, активацию гена-репортера, такого как люцифераза или бета-галактозидаза. Однако, эти текущие способы обнаружения страдают рядом недостатков, включая уровень чувствительности, уровень специфичности, проблемы матричной интерференции, вариабельность анализа, ограниченный динамический диапазон и большую продолжительность анализов.
[0004] Сарилумаб является первым полностью человеческим моноклональным антителом, нацеленным на рецептор интерлeйкин-6 (IL6), находящимся на стадии клинических испытаний. IL-6 является плеотропным цитокином, производимым иммуноцитами и неиммуноцитами, который играет важную роль в регуляции иммунного ответа, реакций острой фазы и гемопоэза. Он связывается с растворимым и связанным с клеточной мембраной IL-6R (α цепь), формируя двойной комплекс, и этот комплекс способен взаимодействовать со связанным с клеточной мембраной gp130 (β цепь), вызывая формирование сигнального комплекса, содержащего по два IL-6, IL-6R и gp130.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Существует установленная госорганами необходимость разработки чувствительных и воспроизводимых анализов, которые обнаруживали бы активность Nab в клинических пробах. В то время как в данной области техники известно применение клеточных проб для обнаружения нейтрализирующих антител, неклеточные анализы конкурентного связывания с лигандом (CLB) могут служить в качестве лучшей альтернативы, поскольку они обеспечивают превосходный динамический диапазон и чувствительность. Однако анализы CLB также могут сталкиваться с проблемами интерференции с различными компонентами пробы и матрицы. Заявители разработали чувствительный и достоверный анализ CLB, который может обнаруживать отклик нейтрализирующего антитела (NAb) на молекулу биотерапевтического лекарственного средства в пациенте.
[0006] В одном аспекте предлагается способ оценки нейтрализирующего антитела (NAb) к биотерапевтическому средству в пациенте, которому назначено биотерапевтическое средство. Этот способ охватывает оценку присутствия NAb во время и/или после лечения пациента, которому назначено биотерапевтическое средство.
[0007] В одном варианте осуществления предлагается способ для обнаружения присутствия нейтрализирующих антител к биотерапевтическому белку в пациенте, нуждающемся в биотерапевтическом белке и принимающем упомянутый белок, причем этот способ содержит стадии (a) комбинирования пробы пациента с реактивом захвата и (b) добавления реактива обнаружения, в котором уменьшенный сигнал относительно контрольного образца указывает наличие нейтрализирующего антитела к биотерапевтическому средству. В одном варианте осуществления биотерапевтический белок является моноклональным антителом (mAb), предпочтительно моноклональным антителом α рецептора анти-интерлейкина-6 (IL-6Rα). В одном варианте осуществления биотерапевтическим белком mAb является сарилумаб или тоцилизумаб; более конкретно биотерапевтическим белком mAb является сарилумаб.
[0008] Проба получается из пациента, получающего лечение от заболевания, зависимого от IL-6. Пробы, получаемые из пациента, включают в себя, например, ткань, слюну, молоко, кровь, плазму, сыворотку или любые другие биологические жидкости, в которых могут быть обнаружены антитела. В одном варианте осуществления проба представляет собой серологический образец, получаемый из такого пациента.
[0009] Примеры зависимых от IL-6 заболеваний включают в себя ревматоидный артрит, диабет, атеросклероз, болезнь Альцгеймера, системную эритематозную волчанку, множественную миеломную болезнь, все смешанные заболевания соединительных тканей, агрессивную ангиофолликулярную гиперплазию лимфоузлов и рак простаты. В одном конкретном варианте осуществления серологический образец получается из пациента, страдающего ревматоидным артритом.
[0010] В одном варианте осуществления этого способа реактив захвата содержит маркированный биотерапевтический белок. Когда пациент принимает сарилумаб, реактив захвата маркируется сарилумабом. В некоторых вариантах осуществления реактив захвата маркируется меткой для того, чтобы облегчить связывание с матрицей, поверхностью или молекулой, маркированной противометкой. Метки включают в себя, например, биотин, авидин, стрептавидин, полиаргинин, полигистидин, FLAG, c-myc, HAT (естественный признак сродства к гистидину), глютатионовую S-трансферазу, глютатион, S,S-фрагмент рибонуклеазы A, связывающий мальтозу белок, связывающий хитин домен, хитин, кальмодулин, связывающий кальмодулин пептид и т.п. См. публикацию Terpe, K., «Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems», Appl. Microbiol. Biotechnol. (2003) 60:523-533. В одном варианте осуществления способа по настоящему изобретению реактивом захвата является биотинилированный сарилумаб.
[0011] В одном варианте осуществления этого способа реактив обнаружения маркируется растворимым рецептором IL-6α. В другом варианте осуществления реактив обнаружения содержит метку для обеспечения обнаружения. Метки включают в себя, например, хелатированные металлы лантаноидного ряда, такие как европий, металлы платиновой группы, такие как рутений, флуорохромы, включая среди прочего производные ксантена, такие как флуоресцеин и родамин, флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP) и его производные, желтый флуоресцентный белок (YFP) и красный флуоресцентный белок (RFP), радиометки, такие как йод-125 и актиний-225, и другие сходные с ними поддающиеся обнаружению метки. В более конкретном варианте осуществления реактивом обнаружения является маркированный рутением растворимый рецептор IL-6α.
[0012] В одном варианте осуществления объединенные проба пациента и реактив захвата подвергаются обработке с низким (кислым) значением pH. В одном конкретном варианте осуществления такая обработка является обработкой уксусной кислотой, которая затем сопровождается стадией нейтрализации.
[0013] В одном варианте осуществления способ анализа по настоящему изобретению для обнаружения присутствия нейтрализирующих антител в пациенте, принимающем биотерапевтический белок, показывает чувствительность, равную приблизительно 150 нг/мл, пороговый предел лекарственного средства, равный приблизительно 500 нг/мл, и чувствительность к интерференции с мишенью, равную приблизительно 1 мкг/мл.
[0014] В другом аспекте предлагается комплект, содержащий описанные выше реактивы захвата и обнаружения, а также инструкции по их использованию.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
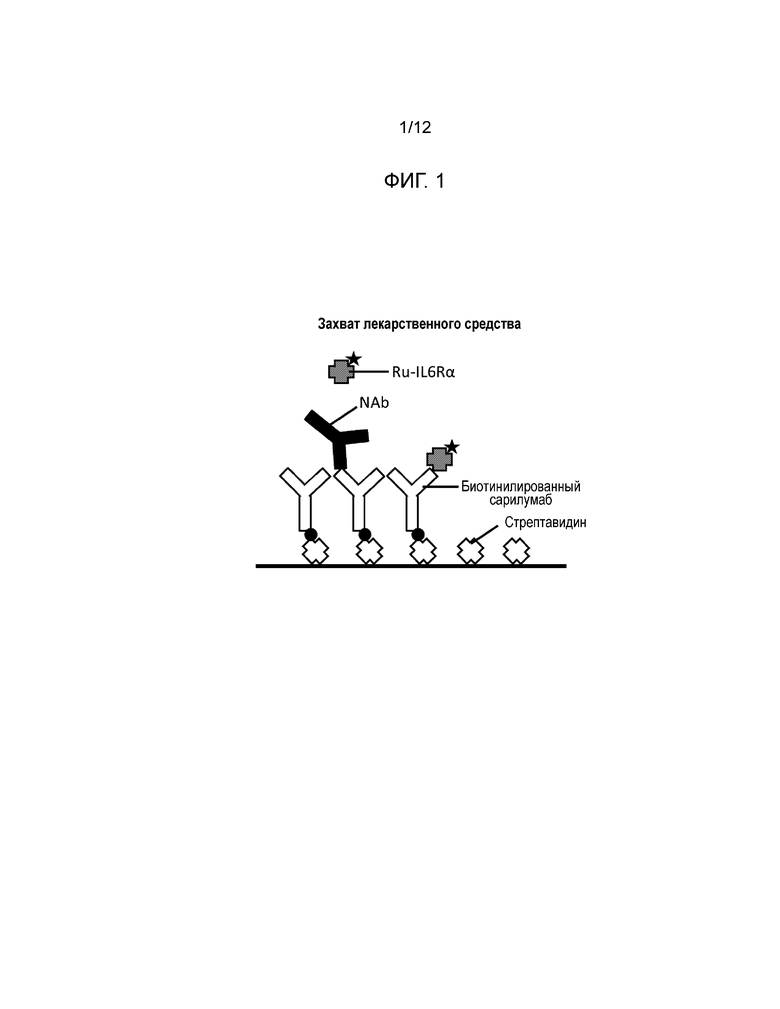
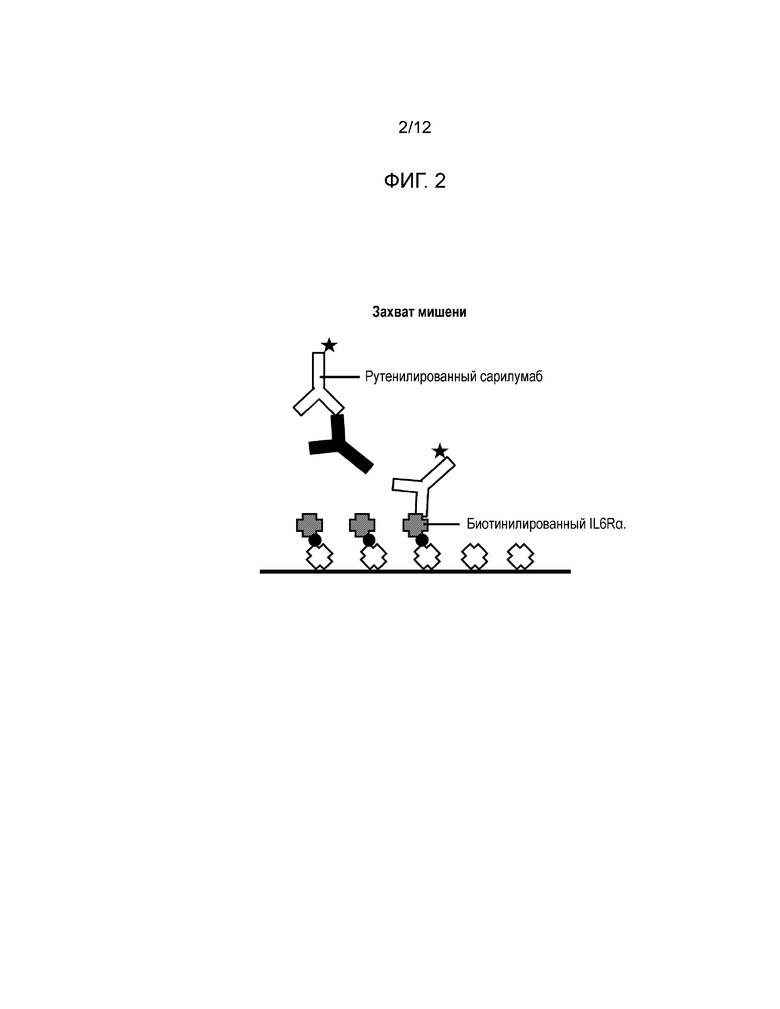
[0015] Фиг. 1 и Фиг. 2 иллюстрируют и сравнивают форматы анализов захвата лекарственного средства (Фиг. 1) и захвата мишени (Фиг. 2). В обоих форматах анализа сигнал генерируется в отсутствие нейтрализирующих антител, и ингибирование сигнала происходит в присутствии нейтрализирующих антител. % ингибирования=% снижения фонового сигнала (NQC), вызываемый присутствием нейтрализирующих антител.
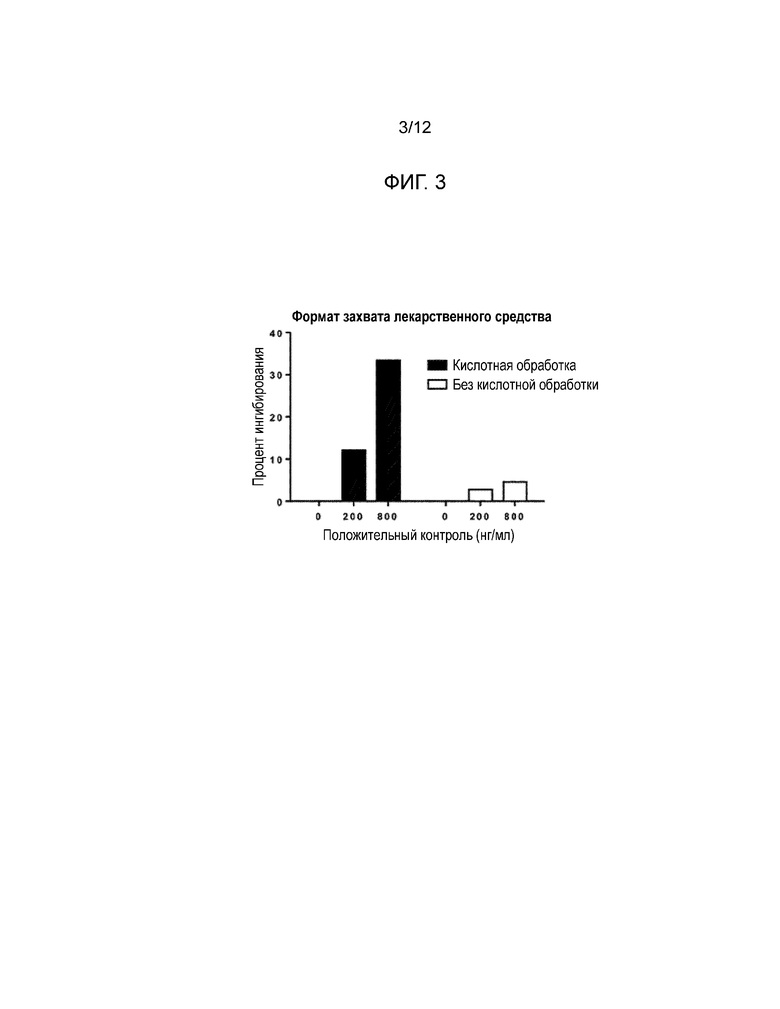
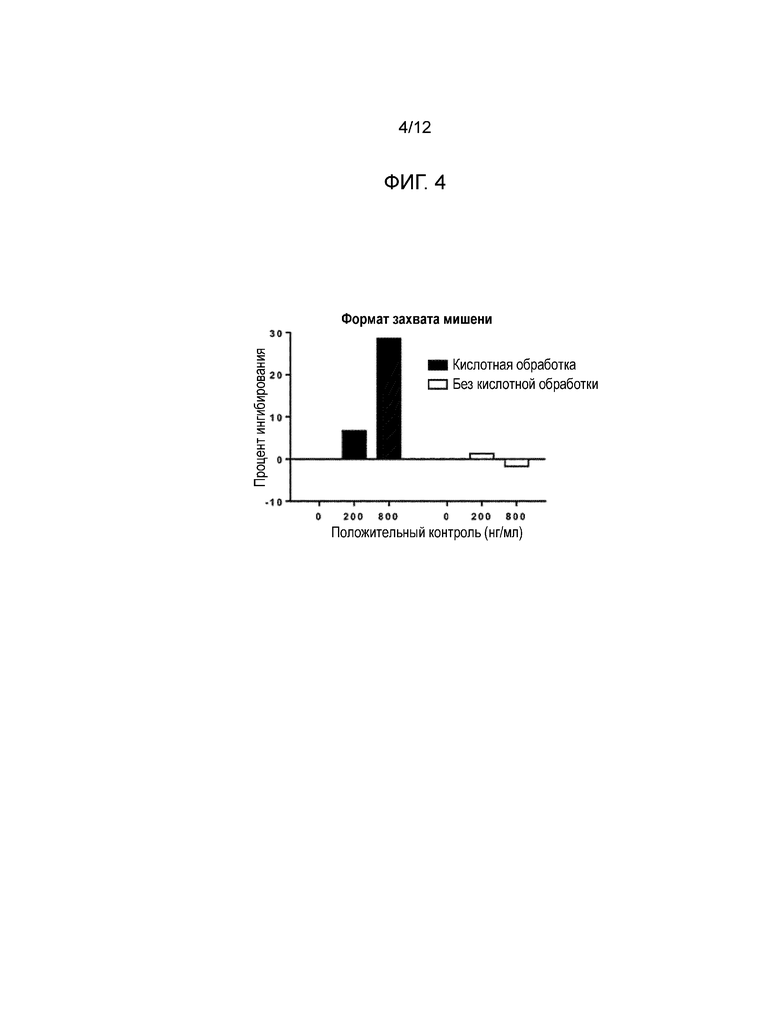
[0016] Фиг. 3 и Фиг. 4 представляют собой гистограммы, показывающие влияние обработки с низким значением pH на пороговый предел лекарственного средства для форматов анализа с захватом лекарственного средства (Фиг. 3) и с захватом мишени (Фиг. 4). Черным цветом изображены результаты для обработки с низким значением pH, белым - без обработки с низким значением pH.
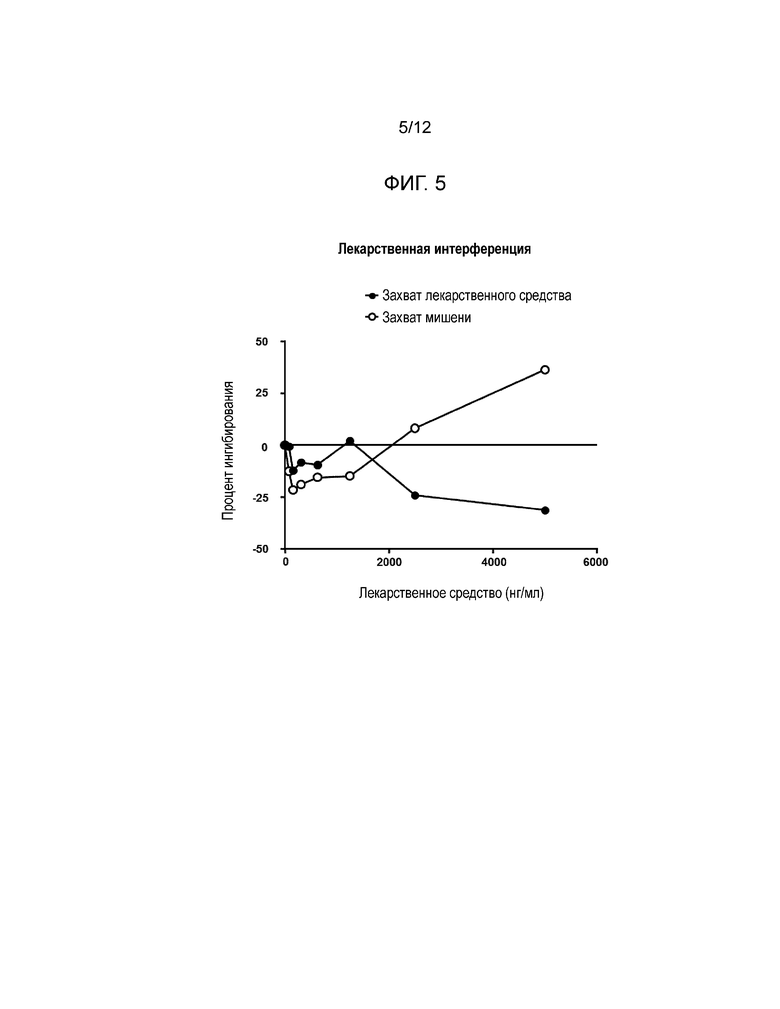
[0017] Фиг. 5 и Фиг. 6 показывают эффекты интерференции с лекарственным средством в форматах анализа с захватом лекарственного средства (Фиг. 5) и с захватом мишени (Фиг. 6).
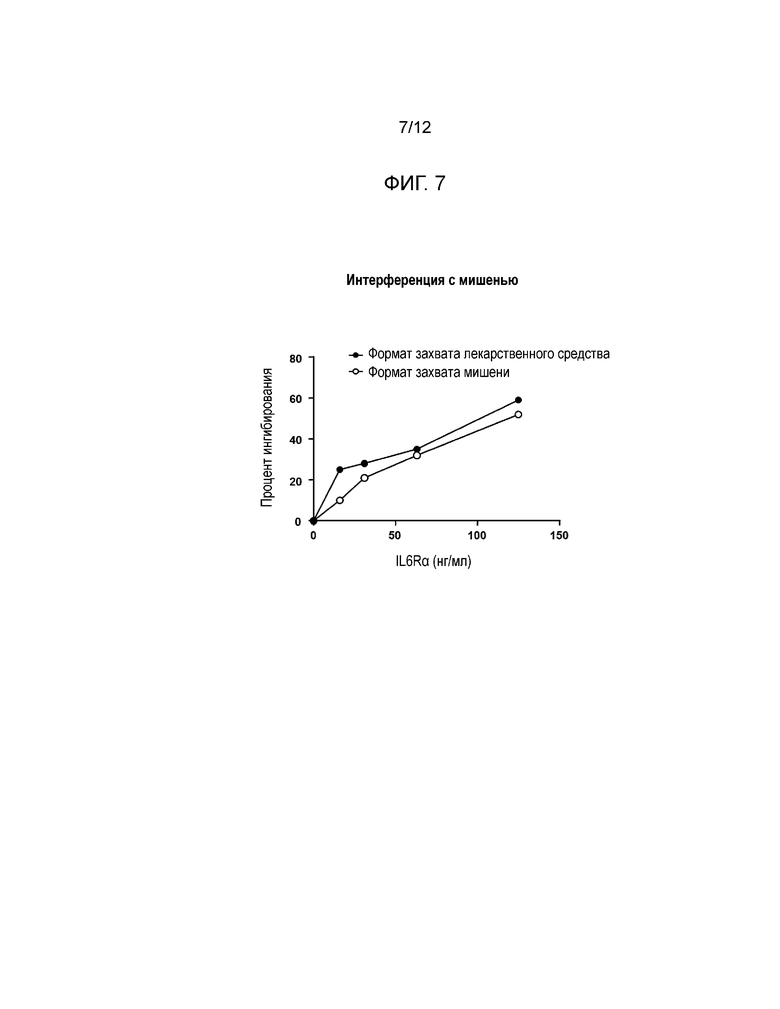
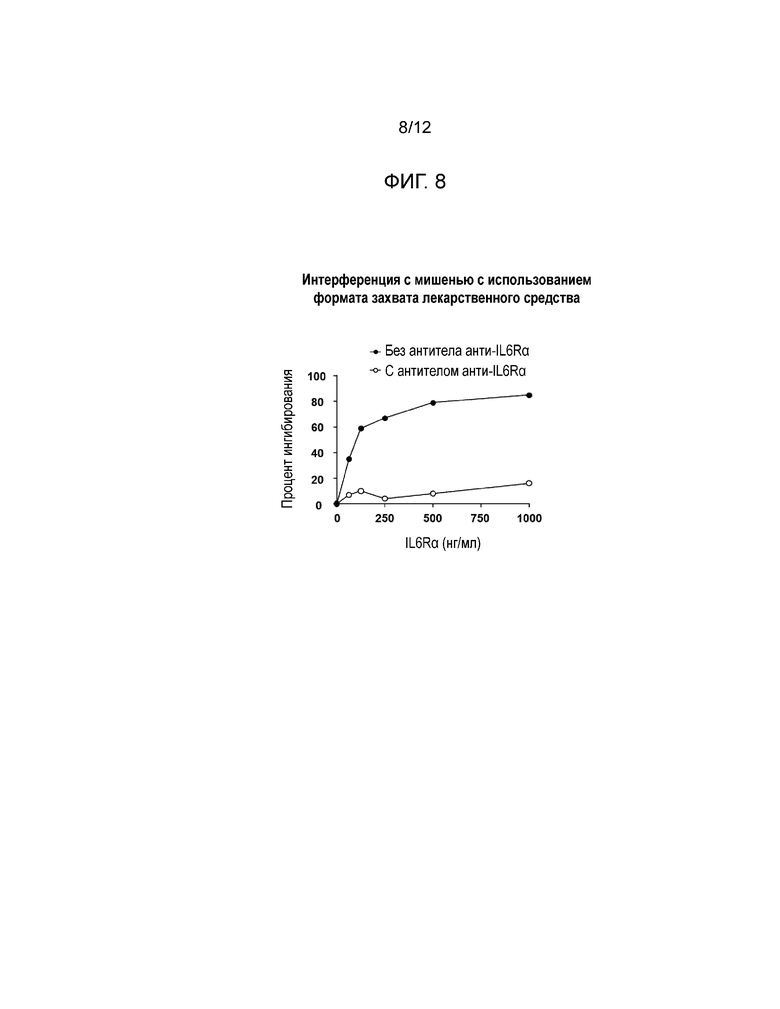
[0018] Фиг. 7 и Фиг. 8 представляют собой графики влияния интерференции с IL6Rα на генерирование ложных положительных результатов. Фиг. 7 показывает результаты для обоих форматов - захвата лекарственного средства и захвата мишени; Фиг. 8 показывает результаты интерференции с мишенью в присутствии антитела к анти-мишени при использовании формата захвата лекарственного средства.
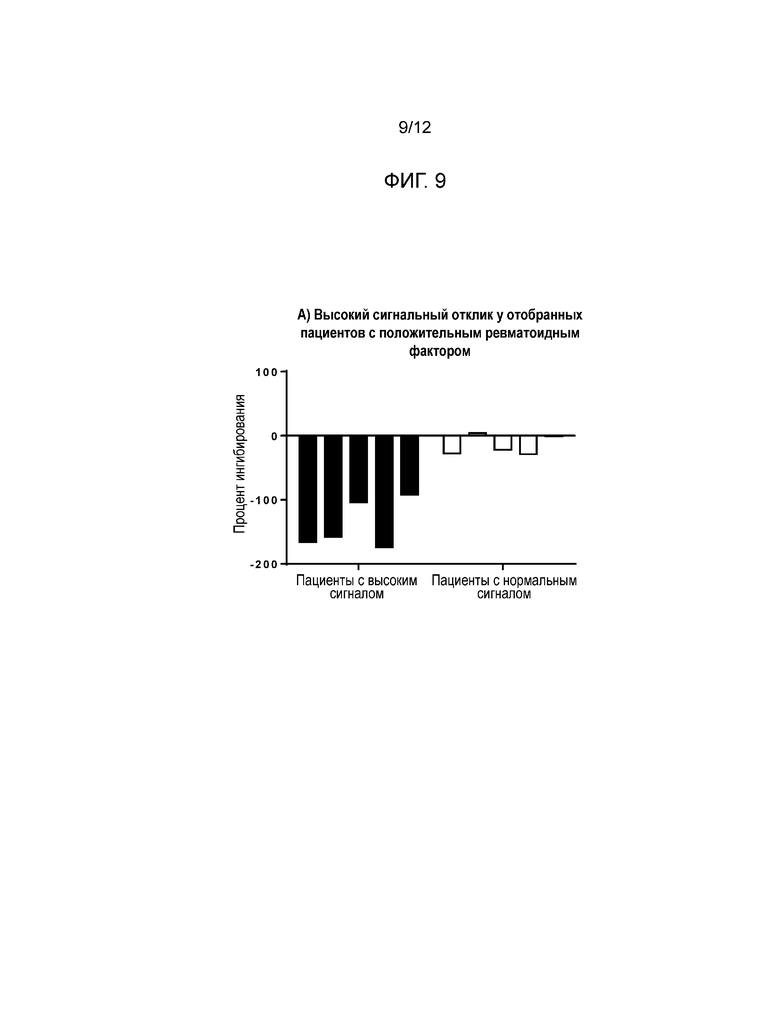
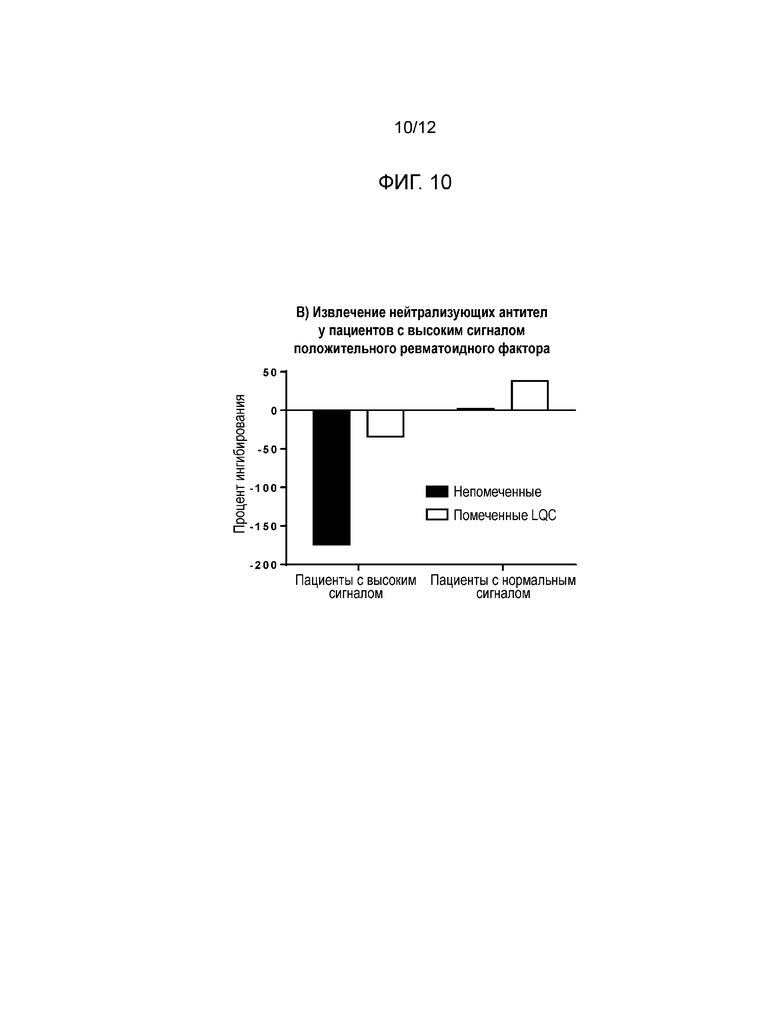
[0019] Фиг. 9 и Фиг. 10 показывают результаты в формате захвата лекарственного средства для исследования уменьшения высокого сигнального отклика человеческих проб, который интерферирует при обнаружении нейтрализирующих антител. Фиг. 9 показывает результаты высокого сигнального отклика у отобранных пациентов с положительным ревматоидным фактором (RF+); Фиг. 10 показывает результаты выделения нейтрализирующих антител в высоком сигнальном отклике у отобранных пациентов с положительным ревматоидным фактором.
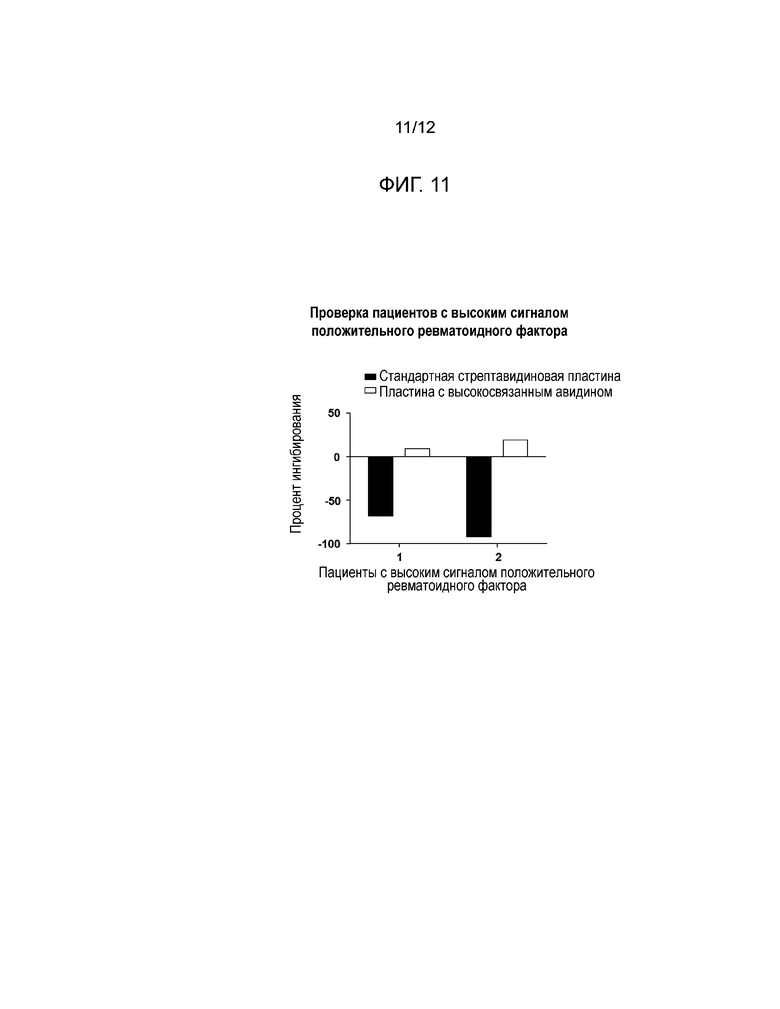
[0020] Фиг. 11 представляет собой гистограмму результатов, полученных из скрининга высокого сигнального отклика пациентов с положительным ревматоидным фактором в пластинах со стандартным стрептавидином (черные столбики) или высокосвязанным авидином (белые столбики).
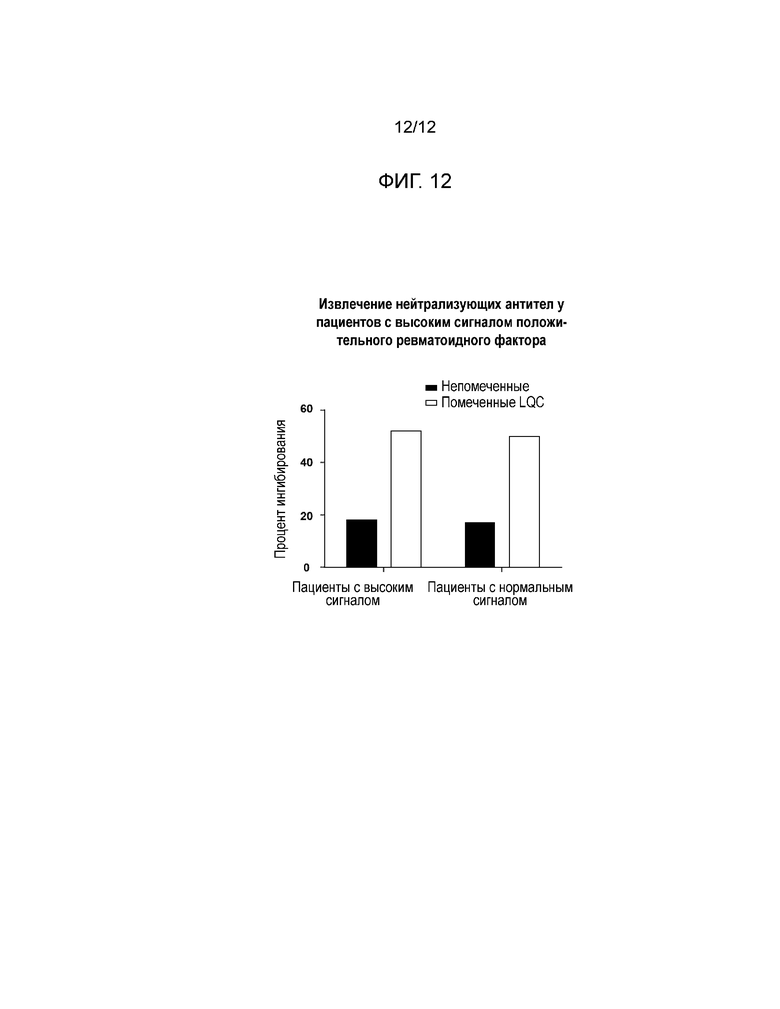
[0021] Фиг. 12 представляет собой гистограмму, показывающую результаты, полученные для отобранных пациентов с высоким сигналом RF+ или нормальным сигналом RF+; черные столбики=немеченная проба; белые столбики=проба, меченная контролем низкого качества.
ПОДРОБНОЕ ОПИСАНИЕ
[0022] Прежде, чем настоящее изобретение будет описано, следует понять, что это изобретение не ограничено описанными конкретными способами и экспериментальными условиями, и по сути способы и условия могут изменяться. Также следует учитывать, что используемая в настоящем документе терминология служит только для целей описания конкретных вариантов осуществления и не предназначена для ограничения области охвата настоящего изобретения, которая будет ограничена только приложенной формулой изобретения.
[0023] Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют то же самое значение, что и обычно понимаемое специалистами в области техники, к которой принадлежит настоящее изобретение. Используемый в настоящем документе термин «приблизительно» при его применении к конкретному численному значению означает, что это значение может изменяться относительно указанного значения на величину не более, чем 1%. Например, использующееся в настоящем документе выражение «приблизительно 100» включает в себя значения 99 и 101, а также все промежуточные значения (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
[0024] Хотя при реализации настоящего изобретения могут использоваться любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, далее описываются предпочтительные способы и материалы. Все публикации, упомянутые в настоящем документе, являются включенными в настоящий документ посредством ссылки во всей их полноте. Другие варианты осуществления станут очевидными из обзора следующего подробного описания.
[0025] Для того, чтобы описанное в настоящем документе изобретение могло быть полностью понято, приводится следующее подробное описание.
[0026] Разработанный здесь анализ CLB был основан на платформе Meso Scale Discovery (MSD). Фиг. 1 и Фиг. 2 иллюстрируют два исследованных формата анализа. Фиг. 1 иллюстрирует формат захвата лекарственного средства, в котором NAb в человеческом серологическом образце были культивированы с биотинилированным сарилумабом с последующим захватом на покрытой стрептавидином или авидином микропластине. Добавление рутенилированного IL6Rα затем приводило к сигналу в отсутствие нейтрализирующих антител и к ингибированию сигнала в присутствии нейтрализирующих антител. В формате захвата мишени принцип остается тем же самым, за исключением того, что рутенилированный сарилумаб теперь захватывается мишенью из биотинилированного IL6Rα на пластине. Разработка чувствительного и достоверного анализа включала в себя оптимизацию лекарственного средства, мишени, метки, значения pH и времени инкубации. Два формата анализа были сравнены, и лучший формат был затем оптимизирован и утвержден.
[0027] Первоначальная характеристика позволяла предполагать, что захват мишени является более восприимчивым к интерференции с лекарственным средством, в то время как формат захвата лекарственного средства приводит к более высоким неспецифичным сигналам. Было исследовано несколько стратегий оптимизации с последующей сравнительной оценкой для выбора наилучшего способа анализа для этой программы. Высокий фоновый сигнал, приводящий к ложным отрицательным результатам для сыворотки с положительным ревматоидным фактором (RF+), был эффективно устранен путем переключения на другую твердую подложку покрытых авидином микропластин. Обработка с низким значением pH улучшала пороговый предел лекарственного средства, в то время как интерференция с мишенью смягчалась антицелевым антителом, которое специфично блокирует взаимодействие между мишенью и лекарственным средством. Результаты показали, что формат захвата лекарственного средства обеспечивал чувствительный и надежный анализ с минимальной интерференцией с мишенью или с лекарственным средством. Утвержденный способ анализа продемонстрировал точность в пределах от 1 до 8% со следующими характеристиками: чувствительность=~150 нг/мл, пороговый предел лекарственного средства=~500 нг/мл, интерференция с мишенью=~1 мкг/мл.
[0028] Хотя оба формата - захвата мишени и захвата лекарственного средства - могут успешно использоваться для проведения CLB анализа нейтрализирующих антител, важно изучить конкретные характеристики связывания пары лекарственного средства и мишени для того, чтобы разработать успешные стратегии чувствительности, порогового предела лекарственного средства, и смягчения интерференции с мишенью. На основе полученных результатов формат захвата лекарственного средства был признан лучшим, и таким образом был утвержден и использован для биоанализа клинических образцов.
[0029] Настоящее изобретение предлагает анализ иммуногенности для обнаружения нейтрализирующих антител к биотерапевтическому белоку. В одном варианте осуществления биотерапевтический белок является моноклональным антителом (mAb); более конкретно биотерапевтический белок является mAb, которое специфично связывает альфа-рецептор интерлeйкина-6 (IL-6Rα); и более конкретно биотерапевтическим средством является сарилумаб. Сарилумаб (также называемый REGN88) был разработан для лечения ревматоидного артрита. Соответственно, в одном конкретном варианте осуществления настоящее изобретение представляет анализ иммуногенности для обнаружения нейтрализирующих антител у пациента, который получает лечение от ревматоидного артрита в виде сарилумаба. Предполагается, что в способе по настоящему изобретению могут использоваться другие анти-IL-6Rα моноклональные антитела, например, гуманизированный анти-IL-6Rα тоцелизумаб.
Определения
[0030] «Нейтрализирующее антитело (NAb)» является анти-лекарственным антителом, имеющим способность нейтрализовать биотерапевтическую молекулу. В одном варианте осуществления биотерапевтической молекулой является анти-IL6Rα антитело сарилумаб, и NAb связывает антитело IL6Rα и препятствует связыванию сарилумаба с IL6Rα.
[0031] Термин «аналит» используется для того, чтобы обозначить анализируемое вещество, то есть мышиное анти-REGN88 моноклональное антитело (REGN575), присутствующее в контроле качества, или человеческое анти-REGN88 NAb в человеческих серологических пробах.
[0032] «Точка отсечения» представляет собой термин, относящийся к пороговому значению (то есть, к проценту ингибирования), используемому для различения NAb-отрицательного и NAb-положительного отклика при анализе. Она представляет собой постоянное значение, определяемое статистически путем анализа откликов ряда человеческих проб, взятых у больных, не получавших медикаментозного лечения.
ПРИМЕРЫ
[0134] Следующие примеры приводятся для того, чтобы снабдить специалиста в данной области техники полным раскрытием и описанием того, как делать и использовать способы и композиции по настоящему изобретению, и не предназначены для того, чтобы ограничивать область охвата того, что авторы настоящего изобретения расценивают как их изобретение. Авторами были приложены все усилия для того, чтобы гарантировать точность использованных чисел (например, количества, температуры и т.д.), но некоторые экспериментальные погрешности и отклонения все-таки необходимо учитывать. Если не указано иное, части являются массовыми частями, молекулярная масса является средней молекулярной массой, температура определяется в градусах по Цельсию, а давление является атмосферным или близким к атмосферному.
Пример 1. Анализ конкурентного связывания с лигандом для обнаружения NAb к REGN88 (сарилумаб).
[0135] REGN88 представляет собой человеческое моноклональное антитело (подкласса IgG1), специфичное для α-рецептора человеческого интерлeйкина-6 (IL-6Rα). Способ для обнаружения анти-REGN88 нейтрализирующих антител (NAb) с использованием формата анализа конкурентного связывания с лигандом был разработан как описано ниже.
[0136] Процедура этого анализа использует мышиное анти-REGN88 моноклональное антитело (REGN575) в качестве положительного контроля, биотинилированный REGN88 в качестве реактива захвата, меченный рутением растворимый человеческий IL-6Rα (рутений-REGN78) в качестве реактива обнаружения, и REGN17 (анти-человеческое моноклональное антитело IL-6Rα) для смягчения интерференции с лигандом.
[0137] Вкратце, пробы и контрольные образцы разбавляются в условиях низких значений pH (уксусной кислотой), а затем нейтрализуются с использованием раствора трис-основания, содержащего биотинилированный-REGN88 и REGN17. Обработка с низкими значениями pH приводит к диссоциации комплексов NAb:лекарство и лекарство:мишень, присутствующих в серологических пробах, обеспечивая улучшенное обнаружение нейтрализирующих антител в присутствии избытка лекарственного средства в сыворотке. Для того, чтобы смягчить интерференцию с мишенью, используется REGN17 для связывания свободной мишени, высвобождаемой с помощью обработки с низкими значениями pH. Во время инкубации положительный контроль (REGN575) или любое NAb, присутствующее в пробе, связывается с биотинилированным REGN88. Обработанные с низкими значениями pH пробы добавлялись затем на предварительно покрытую авидином микропластину, где авидин захватывал биотинилированный-REGN88 вместе со связанным с ним NAb.
[0138] После инкубации и промывки рутений-REGN78 добавлялся на микропластину. В отсутствие NAb в пробе захваченный авидином биотинилированный-REGN88 связывается с рутений-REGN78, образуя на поверхности микропластины комплекс биотинилированный-REGN88:рутений-REGN78. Буфер считывания на основе трипропиламина (TPA) добавлялся на микропластину, которая считывалась электрохемилюминесцентным считывателем Meso Scale Discovery (MSD). В присутствии NAb оно будет связывать биотинилированный-REGN88, предотвращая формирование комплекса биотинилированный-REGN88:рутений-REGN78, который в свою очередь уменьшает электрохемилюминесцентный сигнал. Следовательно, измеренная электрохемилюминесценция (то есть число отсчетов) обратно пропорционально количеству нейтрализирующих антител в пробе.
[0033] Восемьдесят проб, взятых у не получавших медикаментозного лечения пациентов, были проанализированы для того, чтобы определить точку отсечения. Выбранный в качестве точки отсечения процент ингибирования составил 40, и был вычислен с использованием параметрического способа на основе доли ложноположительных результатов, равной 0,1%. Процент ингибирования (% ингибирования) был вычислен как уменьшение сигнала вследствие присутствия нейтрализирующих антител. Положительный контроль качества (PQC) представлял собой контрольные образцы с известным количеством REGN575, приготовленные в NQC, используемые для верификации качества пробы: HQC=контроль высокого качества; 20X HQC: 4 мкг/мл; MQC=контроль среднего качества; 20 MQC: 0,4 мкг/мл; LQC=контроль низкого качества; 20 LQC: 0,2 мкг/мл. Отрицательный контроль качества (NQC) представлял собой контрольные образцы без аналита (чистая человеческая сыворотка), используемые для вычисления процента ингибирования. Меченный отрицательный контроль качества (SNQC) представлял собой контрольные образцы с известным количеством REGN78, приготовленные в NQC, используемые для проверки эффективности REGN17. CV% - коэффициент вариации, выраженный в процентах. Пределом обнаружения (LOD) была самая низкая концентрация положительного контроля (REGN575) с процентом ингибирования большим, чем точка отсечения. LOD для анализа в чистой сыворотке составлял приблизительно 150 нг/мл мышиного анти-REGN88 моноклонального антитела (REGN575). Число отсчетов=количество сигналов электрохемилюминесценции.
[0034] Материалы и оборудование. Реактивы: Мышиное анти-REGN88 моноклональное антитело (регенерон, REGN575), также называемое как анти-REGN88 mAb; биотинилированный REGN88 (биотин-REGN88 или биотинилированный-REGN88); маркированный рутением человеческий IL-6Rα (Ru(bpy)3 REGN78 или рутений-REGN78); мышиное античеловеческое моноклональное антитело IL-6Rα (также называемое как анти-hIL-6Rα mAb); человеческий IL-6Rα (REGN78); 5%-ый BSA (бычий сывороточный альбумин) блокирующий буфер; забуференный фосфатом физиологический раствор со значением pH 7,2 (1X PBS); покрытая авидином микропластина - MULTI-ARRAY® 96-луночная авидиновая золотая пластина; уксусная кислота с концентрацией 300 мМ; раствор Trizma-основания с концентрацией 1,5 М (трис или трис-основание); буфер считывания - буфер считывания MSD T (4X), с поверхностно-активным веществом (4X буфер считывания); 1X промывочный буфер; очищенная вода; объединенная человеческая сыворотка.
[0035] Инструменты и лабораторное оборудование. 96-луночная полипропиленовая пластина (пластина или блок с глубокими лунками); Sector Imager 2400 (Meso Scale Discovery, Модель 1250) с соответствующим приложением MSD Discovery Workbench; Microsoft Excel; приложение SoftMax® Pro, версия 5,2 или выше (Molecular Devices).
[0036] Процедура. Встряхивание пластины выполнялось во время инкубационных стадий. Минимум 10 мкл использовалось для всех переносов объема. Предосторожности 2 уровня биологической безопасности применялись при обращении с человеческой сывороткой. Образцы для контроля качества (QC): Было показано, что QC являются устойчивыми для вплоть до 10 циклов замораживания/оттаивания, хранения при комнатной температуре в течение по меньшей мере 4 час (4 часа и 32 минуты), или хранения в холодильнике при температуре 4°C вплоть до 23 час (23 часа и 20 минут). Стабильность QC использовалась в качестве суррогата для стабильности исследуемых проб. Отрицательный контроль качества (NQC): коммерческий пул нормальной человеческой сыворотки был подготовлен для использования в качестве NQC. Аликвоты пула человеческой сыворотки (NQC) были приготовлены и хранились в морозильнике при температуре -80°C.
[0037] Приготовление PQC - (HQC, MQC, LQC). Образцы для положительного контроля качества считались пригодными, если они предназначались для использования в анализе образца на следующий день после приготовления. 20X PQC было приготовлено с концентрациями, указанными в таблице ниже, путем добавления мышиного анти-REGN88 моноклонального антитела (REGN575) в NQC. Следующее описание может использоваться в качестве примера для приготовления каждого образца PQC: Пример: 10 мкл REGN575 (0,88 мг/мл) добавлялось к 166 мкл NQC и смешивалось для получения раствора REGN575 с концентрацией 50 мкг/мл (QC прекурсор A). 10 мкл раствора REGN575 с концентрацией 50 мкг/мл добавлялось к 490 мкл NQC и смешивалось для получения раствора REGN575 с концентрацией 1 мкг/мл (QC прекурсор B). Образцы PQC могут использоваться в тот же день, или могут быть поделены на аликвоты и сохранены в морозильнике при температуре -80°C.
[0038] Меченный отрицательный контроль качества (SNQC). SNQC были пригодными для использования в анализе пробы на следующий день после приготовления. Раствор человеческого IL-6Rα (REGN78) с концентрацией 0,6 мкг/мл был приготовлен в NQC. Следующее описание может использоваться в качестве примера для приготовления SNQC: Пример: 10 мкл REGN78 (с концентрацией 2,3 мг/мл) добавлялось к 220 мкл NQC и смешивалось для получения раствора REGN78 с концентрацией 100 мкг/мл. 10 мкл раствора REGN78 с концентрацией 100 мкг/мл добавлялось к 90 мкл NQC и смешивалось для получения раствора REGN78 с концентрацией 10 мкг/мл. 30 мкл раствора REGN78 с концентрацией 10 мкг/мл добавлялось к 470 мкл NQC и смешивалось для получения раствора REGN78 с концентрацией 0,6 мкг/мл (SNQC). SNQC использовался в тот же день или делился на аликвоты и хранился в морозильнике при температуре -80°C.
[0039] Процедура анализа. QC доставались из холодильника и оттаивали, а изучаемые пробы хранились на льду или в холодильнике при температуре 4ºC. В полипропиленовой пластине с глубокими лунками (пластина для образцов), разбавление 1:10 каждого QC и изучаемой пробы подготавливалось в уксусной кислоте с концентрацией 300 мМ и перемешивалось. Пример: Пример: 10 мкл каждого QC/пробы добавлялось к 90 мкл уксусной кислоты с концентрацией 300 мМ и перемешивалось. Пластина для образцов была накрыта и инкубировалась в течение 45±15 мин при комнатной температуре. 1%-ый раствор BSA в 1X забуференном фосфатом физиологическом растворе (PBS) был приготовлен и перемешан. Пример: 8 мл 5%-го блокирующего буфера BSA было добавлено к 32 мл 1X PBS и перемешано. Раствор, содержащий 10 нг/мл биотинилированного REGN88, 50 мкг/мл REGN17 и 0,2 М трис в 1%-ом BSA, был приготовлен и перемешан. Пример: 10 мкл биотинилированного REGN88 (с концентрацией 3,8 мг/мл) добавлялось к 370 мкл 1%-го BSA и перемешивалось для получения раствора биотинилированного REGN88 с концентрацией 100 мкг/мл. 10 мкл биотинилированного REGN88 с концентрацией 100 мкг/мл добавлялось к 190 мкл 1%-го BSA и перемешивалось для получения раствора биотинилированного REGN88 с концентрацией 5 мкг/мл. 15 мкл раствора биотинилированного REGN88 с концентрацией 5 мкг/мл, 19,3 мкл раствора REGN17 с концентрацией 19,5 мг/мл и 1 мл основания Trizma с концентрацией 1,5 М добавлялось к 6,5 мл 1%-ого BSA и перемешивалось для получения биотинилированного REGN88 с концентрацией 10 нг/мл, REGN17 с концентрацией 50 мкг/мл, и трис с концентрацией 0,2 М в 1%-ом растворе BSA. В полипропиленовой пластине с глубокими лунками (пластина для образцов) окончательное разбавление 1:2 (полное разбавление 1:20) QC и изучаемых проб было подготовлено в биотинилированном REGN88 с концентрацией 10 нг/мл, REGN17 с концентрацией 50 мкг/мл, и трис с концентрацией 0,2 М в 1%-ом растворе BSA и перемешано. Пример: 100 мкл биотинилированного REGN88 с концентрацией 10 нг/мл, REGN17 с концентрацией 50 мкг/мл, и трис с концентрацией 0,2 М в 1%-ом растворе BSA добавлялось к 100 мкл подкисленных QC/проб и перемешивалось. Пластина для образцов была накрыта и инкубировалась в течение 60±15 мин при комнатной температуре при встряхивании со скоростью 400 об/мин во время инкубации. Пластина с пробами 3X промывалась с помощью 300 мкл на лунку 1X промывочного буфера с использованием промывочной программы MSD PLATE 3X. 50 мкл каждого QC и изучаемой пробы добавлялись с пластины для образцов на пластину для анализа в двойном экземпляре. Пластина для анализа была накрыта и инкубировалась в течение 60±15 мин при комнатной температуре при встряхивании со скоростью 400 об/мин во время инкубации. Раствор, содержащий 2 мкг/мл рутений-REGN78 в 1%-ом BSA, был приготовлен и перемешан. Пример: Добавить 10 мкл рутений-REGN78 (с концентрацией 2,9 мг/мл) к 280 мкл 1%-го BSA и перемешать для получения раствора рутений-REGN78 с концентрацией 100 мкг/мл. 140 мкл раствора рутений-REGN78 с концентрацией 100 мкг/мл перемещалось в 7 мл 1%-го BSA и перемешивалось для получения раствора рутений-REGN78 с концентрацией 2 мкг/мл в 1%-ом растворе BSA. Пластина для анализа 3X промывалась с помощью 300 мкл на лунку 1X промывочного буфера с использованием промывочной программы MSD_PLATE_3X. 50 мкл на лунку раствора рутений-REGN78 с концентрацией 2 мкг/мл в 1%-ом растворе BSA добавлялось на пластину для анализа. Пластина для анализа была накрыта и инкубировалась в течение 60±15 мин при комнатной температуре при встряхивании со скоростью 400 об/мин во время инкубации. Подготовка микропластины. 300 мкл на лунку 5%-го блокирующего буфера BSA добавлялось на покрытую авидином микропластину (пластину для анализа). Микропластина герметизировалась и инкубировалась в течение от 1 до 4 час при комнатной температуре. 2X раствор буфера считывания был приготовлен и перемешан. Пример: 10 мл 4X буфера считывания добавлялось к 10 мл очищенной воды и перемешивалось. Пластина для анализа 3X промывалась с помощью 300 мкл на лунку 1X промывочного буфера с использованием промывочной программы MSD_PLATE_3X. 150 мкл на лунку 2X раствора буфера считывания добавлялось на пластину для анализа. Пластина для анализа считывалась на приборе Sector Imager 2400 в течение 10 мин после добавления 2X буфера считывания.
[0040] Анализ данных. Данные, считанные с пластины, передавались в формате файла SoftMax Pro. Если было необходимо замаскировать некоторые лунки в файле данных SoftMax, лунки маскировались в секции преобразованных данных. Это позволяло видеть замаскированное значение, но не использовать его в вычислениях. Среднее число подсчетов, процент ингибирования и коэффициент вариации подсчетов затем вычислялись для каждого QC и изучаемой пробы.
[0041] Процент ингибирования=100 × [(Среднее число подсчетов NQC - Среднее число подсчетов PQC или пробы)/Среднее число подсчетов NQC].
[0042] Спецификации эффективности анализа: Процент ингибирования LQC должен быть > точки отсечения; процент ингибирования SNQC должен быть < точки отсечения; процент ингибирования HQC должен быть > процента ингибирования MQC; процент ингибирования MQC должен быть > процента ингибирования LQC; коэффициент вариации подсчетов для каждого из PQC и SNQC должен быть ≤20%; коэффициент вариации подсчетов NQC должен быть ≤15%.
[0043] Критерии допустимости изучаемой пробы. Эффективность анализа - Все спецификации эффективности анализа были соблюдены, в противном случае изучаемые пробы повторно документировались и повторно анализировались. Точность - коэффициент вариации подсчетов должен был составлять ≤20%, в противном случае изучаемые пробы повторно документировались и повторно анализировались. Любая изучаемая проба с процентом ингибирования большим, чем точка отсечения, считалась положительной. Любая изучаемая проба с процентом ингибирования меньшим или равным, чем точка отсечения, считалась отрицательной.
Пример 2. Влияние обработки с низким значением pH на пороговый предел лекарственного средства.
[0044] Для того, чтобы проверить влияние обработки с низким значением pH на пороговый предел лекарственного средства в обоих форматах - захвата лекарственного средства и захвата мишени, был проведен эксперимент. Человеческая сыворотка была мечена раствором сарилумаба с концентрацией 1 мкг/мл при указанных концентрациях положительного контроля. Эти пробы были проверены как с обработкой с низким значением pH, так и без нее в обоих форматах анализа. Образцы QC и пробы были разбавлены уксусной кислотой рабочей концентрации и инкубированы. Затем они были разбавлены в буфере нейтрализации трис, содержащем подходящий реактив обнаружения рутенилирования. Результаты показаны на Фиг. 3 и Фиг. 4.
[0045] Результаты: Обработка с низким значением pH эффективно смягчает интерференцию от избыточного лекарственного средства, улучшая обнаружение нейтрализирующих антител в обоих форматах анализа.
Пример 3. Лекарственная интерференция
[0046] Способность лекарственного средства генерировать ложноположительный отклик в отсутствие нейтрализирующих антител определяется как лекарственная интерференция. Для того, чтобы сравнить интерференцию лекарственного средства в отсутствие нейтрализирующих антител в обоих форматах пробы, было проведено исследование.
[0047] Метод: Нормальная человеческая сыворотка была мечена указанными концентрациями сарилумаба. Все образцы были обработаны с низким значением pH и проверены как в формате захвата лекарственного средства, так и в формате захвата мишени.
[0048] Результаты: Формат захвата мишени: Более высокие концентрации свободного сарилумаба вытесняют рутенилированный сарилумаб для связывания с биотинилированным IL6Rα, что приводит к ложноположительному отклику (см. Фиг. 5). Формат захвата лекарственного средства: Сарилумаб в отсутствие нейтрализирующих антител не может связываться с захваченным сарилумабом на пластине, и поэтому неспособен интерферировать при анализе (см. Фиг. 6).
[0049] Влияние конкретной мишени IL6Rα на смягчение ложноположительных результатов было изучено как описано выше. Нормальная человеческая сыворотка была мечена указанными концентрациями IL6Rα и проверена с обработкой при низких значениях pH в обоих форматах анализа (см. Фиг. 7). Подобные пробы были проверены с добавлением антитела антимишени (IL6Rα) или без него (см. Фиг. 8). Ложноположительные отклики от интерференции с мишенью наблюдались в обоих форматах анализа. Аналогичные результаты наблюдались, когда проверялись комплексы IL6Rα:сарилумаб. Добавление антитела антимишени смягчало интерференцию в формате захвата лекарственного средства. Однако антитело антимишени не может быть добавлено в формате захвата мишени, так как оно заблокировало бы захват. С этого момента был выбран и использовался формат захвата лекарственного средства.
[0050] Для того, чтобы смягчить ложноположительные результаты, вызываемые мишенью (IL6Rα), было проведено исследование. Нормальная человеческая сыворотка была мечена указанными концентрациями IL6Rα и проверена с обработкой при низких значениях pH в обоих форматах анализа. Подобные пробы были проверены с добавлением антитела антимишени (IL6Rα) или без него.
[0051] Ложноположительные отклики от интерференции с мишенью наблюдались в обоих форматах анализа (см. Фиг. 7). Аналогичные результаты наблюдались, когда проверялись комплексы IL6Rα:сарилумаб (см. Фиг. 8). Добавление антитела антимишени смягчало интерференцию в формате захвата лекарственного средства. Однако антитело антимишени не может быть добавлено в формате захвата мишени, так как оно заблокировало бы захват. С этого момента был выбран и использовался формат захвата лекарственного средства.
Пример 4. Смягчение интерференции с матрицей человеческой сыворотки
[0052] Затем сыворотки с положительным ревматоидным фактором (RF+) были обработаны с низким значением pH и проверены в формате захвата лекарственного средства. Сравнение было сделано между выбранными пациентами с высоким сигналом RF+ и пациентами с нормальным сигналом RF+. Положительный контроль на уровне LQC был добавлен в сыворотку, взятую у этих не получавших медикаментозного лечения пациентов, перед обработкой с низким значением pH, а затем был выполнен анализ.
[0053] Результаты: Сигнал, сгенерированный некоторыми RF+ пациентами, был больше, чем сигнал NQC, что привело к сильно отрицательным процентам ингибирования. Для этих пациентов мечание положительным контролем все равно приводило к ложноотрицательным результатам (см. Фиг. 9 и Фиг. 10).
[0054] Было проведено исследование, сравнивающее стандартные покрытые стрептавидином пластины с пластинами, покрытыми высокосвязанным авидином. Пробы, взятые у двух пациентов с высоким сигналом RF+, были обработаны при низком значении pH и проанализированы. Затем было проведено сравнение проб выбранных пациентов с высоким сигналом RF+ с пробами пациентов с нормальным сигналом RF+. Положительный контроль на уровне LQC был добавлен в сыворотку, взятую у этих не получавших медикаментозного лечения пациентов, перед обработкой с низким значением pH, а затем был выполнен анализ на пластине, покрытой высокосвязанным авидином.
[0055] Результаты: Пробы, взятые у пациентов с высоким сигналом RF+ смогли быть нормализованы путем замены на пластины, покрытые высокосвязанным авидином (см. Фиг. 11). За счет нормализации сигналов эти пластины позволили обнаружить NAb в этих пробах пациентов с высоким сигналом RF+ (см. Фиг. 12).
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ С ПОДАВЛЕНИЕМ ИНТЕРФЕРЕНЦИИ ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ЛЕКАРСТВАМ В ОБРАЗЦАХ СЫВОРОТКИ | 2014 |
|
RU2674996C2 |
| СОЕДИНЕНИЯ | 2007 |
|
RU2466139C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ ПРОТИВ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНСУЛИНА В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА | 2016 |
|
RU2725142C2 |
| Новая форма IL33, мутировавшие формы IL33, антитела, анализы и способы их применения | 2016 |
|
RU2736299C2 |
| АНТИТЕЛО К РЕЦЕПТОРУ IL-6 ДЛЯ ЛЕЧЕНИЯ ЮВЕНИЛЬНОГО ИДИОПАТИЧЕСКОГО АРТРИТА | 2020 |
|
RU2822089C2 |
| ПРИМЕНЕНИЕ ЧАСТИЦ НА ОСНОВЕ ЦИТОПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ, ЛИПОСОМ И ЭКЗОСОМ ДЛЯ АНАЛИЗА АКТИВНОСТИ ИММУННЫХ КЛЕТОК | 2020 |
|
RU2829443C2 |
| ПРИМЕНЕНИЕ СТИМУЛИРУЮЩЕГО СРЕДСТВА ДЛЯ АНАЛИЗА АКТИВНОСТИ ИММУННЫХ КЛЕТОК | 2020 |
|
RU2822517C2 |
| СИСТЕМА (ВАРИАНТЫ) И СПОСОБ ДЕТЕКТИРОВАНИЯ НАЛИЧИЯ АНАЛИТА В ЖИДКОМ ОБРАЗЦЕ | 2011 |
|
RU2653451C2 |
| СПОСОБ ДИАГНОСТИКИ ИНФЕКЦИОННОЙ ГУБЧАТОЙ ЭНЦЕФАЛОПАТИИ ЖИВОТНЫХ МЕТОДОМ ИММУНО-ПЦР | 2012 |
|
RU2486517C1 |
| УСОВЕРШЕНСТВОВАННЫЕ ФАРМАКОКИНЕТИЧЕСКИЕ АНАЛИЗЫ ДЛЯ ОДИНОЧНЫХ ВАРИАБЕЛЬНЫХ ДОМЕНОВ ИММУНОГЛОБУЛИНА | 2017 |
|
RU2765809C2 |

Изобретение относится к области биохимии, в частности к способу обнаружения присутствия нейтрализующих антител к биотерапевтическому белку. Также раскрыт набор для применения в заявленном способе. Изобретение обладает способностью к улученному обнаружению нейтрализующих антител путем осуществления простого способа. 3 н. и 27 з.п. ф-лы, 4 пр., 1 табл., 12 ил.
1. Способ обнаружения присутствия нейтрализирующих антител к биотерапевтическому белку, где биотерапевтическим белком является моноклональное антитело, которое вводили пациенту, нуждающемуся в нем, содержащий стадии:
(a) снижения рН пробы, взятой у пациента, до кислой рН;
(b) объединения пробы, взятой у пациента, с антителом, которое связывается с мишенью биотерапевтического белка и реактивом захвата, содержащим биотерапевтический белок, где биотерапевтический белок является меченым, и где метка облегчает связывание с поверхностью; и
(с) добавления реактива обнаружения, содержащего мишень биотерапевтического белка, и где мишень является меченой, и где уменьшенный сигнал относительно контрольного образца указывает на присутствие нейтрализирующего антитела к биотерапевтическому средству.
2. Способ по п. 1, где биотерапевтическим белком является моноклональное антитело против рецептора интерлeйкина-6 α (IL-6Rα).
3. Способ по любому из пп. 1 и 2, где биотерапевтическим белком является сарилумаб или тоцилизумаб.
4. Способ по п. 3, где биотерапевтическим белком является сарилумаб.
5. Способ по п. 4, в котором осуществляют лечение зависящего от IL-6 заболевания у пациента.
6. Способ по п. 5, где зависящим от IL-6 заболеванием является ревматоидный артрит, диабет, атеросклероз, болезнь Альцгеймера, эритематозная системная волчанка, множественная миеломная болезнь, заболевания соединительных тканей, болезнь Кэстлмена или рак простаты.
7. Способ по п. 6, где зависящим от IL-6 заболеванием является ревматоидный артрит.
8. Способ по любому из пп. 1-7, где реактивом захвата является меченый сарилумаб.
9. Способ по п. 8, где меченый сарилумаб представляет собой биотинилированный сарилумаб.
10. Способ по п. 9, где биотинилированный сарилумаб связан с покрытой авидином пластиной.
11. Способ по любому из пунктов 1-10, где мишенью является растворимый IL-6 рецептор α, и где мишень является меченой.
12. Способ по п. 11, где меченой мишенью является меченный рутением растворимый IL-6 рецептор α.
13. Способ по любому из пп. 1-12, где рН пробы, взятой у пациента, снижают до кислой рН путем обработки кислым раствором.
14. Способ по п. 13, где кислым раствором является уксусная кислота.
15. Способ по любому из пп. 1-14, где дополнительно включающий повышение рН пробы, взятой у пациента, до нейтральной рН после снижения рН пробы, взятой у пациента, до кислой рН.
16. Способ по п. 15, где рН повышают до нейтральной рН путем обработки основным раствором.
17. Способ по п.16, где основным раствором является трис-основание.
18. Способ по любому из пп. 1-17, где способ показывает чувствительность приблизительно 150 нг/мл, пороговый предел лекарственного средства приблизительно 500 нг/мл и чувствительность к интерференции с мишенью приблизительно 1 мкг/мл.
19. Способ по любому из пп. 1-18, где контрольным образцом является чистая человеческая сыворотка.
20. Способ по любому из пп. 1-19, где меткой меченного биотерапевтическим белком является биотин.
21. Способ по любому из пп. 1-20, где антитело, которое связывает свободную мишень биотерапевтического белка, высвобождают после снижения pH.
22. Способ по любому из пп. 1-21, где антитело, которое связывает свободную мишень биотерапевтического белка, смягчает интерференцию с мишенью.
23. Способ обнаружения присутствия нейтрализирующих антител к сарилумабу, где сарилумаб вводили пациенту, нуждающемуся в этом, включающий стадии:
(a) снижения рН образца сыворотки до кислой рН;
(b) объединения пробы сыворотки, взятой у пациента, с реактивом захвата, содержащим биотинилированный сарилумаб,
(c) повышения рН объединённой пробы сыворотки и реактива захвата до нейтральной pH; и
(d) добавления реактива обнаружения,
где реактив обнаружения включает меченый растворимый IL-6 рецептор α, и где уменьшенный сигнал относительно контрольного образца указывает на присутствие нейтрализирующего антитела к сарилумабу.
24. Способ по п. 23, где реактивом обнаружения является меченный рутением растворимый IL-6 рецептор α.
25. Способ по любому из пп. 23 и 24, где пациент страдает ревматоидным артритом.
26. Способ по любому из пп. 23-25, способ показывает чувствительность приблизительно 150 нг/мл, пороговый предел лекарственного средства приблизительно 500 нг/мл и чувствительность к интерференции с мишенью приблизительно 1 мкг/мл.
27. Способ по любому из пп. 23-26, где рН понижают с помощью уксусной кислоты.
28. Способ по любому из пп. 23-27, где рН повышают до нейтральной рН путем обработки основным раствором.
29. Способ по п.28, где основным раствором является трис-основание.
30. Набор для применения в способе по любому из пп. 23-29, содержащий:
(a) по меньшей мере 10 нг/мл биотинилированного сарилумаба;
(b) реактив обнаружения, содержащий по меньшей мере 2 мкг/мл меченого растворимого IL-6 рецептора α; и инструкции по применению.
| LOYET К.M | |||
| AND ET AL, Technology comparisons for anti-therapeutic antibody and neutralizing antibody assays in the context of an anti-TNF pharmacokinetic study, J | |||
| IMMUN | |||
| METH., v.345,2009, pp.17-28 | |||
| WO 2011022725 A2, 24.02.2011 | |||
| US 20100016228 A1, 21.01.2010 | |||
| АНАЛИЗ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ И ЕГО ПРИМЕНЕНИЕ | 2004 |
|
RU2370775C2 |
| WO 2011113013 A2, 15.09.2011. | |||
Авторы
Даты
2019-09-30—Публикация
2014-10-30—Подача