Изобретение относится к медицине, в частности к кардиологии и кардиохирургии, и может быть использовано для выявления больных с высоким риском возобновления клиники ишемической болезни сердца после коронарной ангиопластики со стентированием коронарных артерий у больных ишемической болезнью сердца.
Известен способ расчета риска возникновения отдаленных больших кардиальных и цереброваскулярных событий в группе пациентов, подвергшихся чрескожному коронарному вмешательству, с помощью калькулятора SYNTAX Score [Mohr FW, Morice MC, Kappetein AP, Feldman ТЕ,  E, Colombo A, Mack MJ, Holmes DR Jr, Morel MA, Van Dyck N, Houle VM, Dawkins KD, Serruys PW. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial. Lancet. 2013 Feb 23; 381(9867):629-38. doi: 10.1016/S0140-6736(13)60141-5.], при котором производится анализ анатомически сложных поражений коронарных артерий у больных со стенозом ствола левой коронарной артерии и 3-сосудистым поражения коронарных артерий. Известный способ позволяет выбрать оптимальный метод лечения путем выявления пациентов с высоким риском развития неблагоприятных событий после чрескожного коронарного вмешательства.
E, Colombo A, Mack MJ, Holmes DR Jr, Morel MA, Van Dyck N, Houle VM, Dawkins KD, Serruys PW. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial. Lancet. 2013 Feb 23; 381(9867):629-38. doi: 10.1016/S0140-6736(13)60141-5.], при котором производится анализ анатомически сложных поражений коронарных артерий у больных со стенозом ствола левой коронарной артерии и 3-сосудистым поражения коронарных артерий. Известный способ позволяет выбрать оптимальный метод лечения путем выявления пациентов с высоким риском развития неблагоприятных событий после чрескожного коронарного вмешательства.
Основным недостатком этого способа является использование для расчета риска возникновения таких осложнений после эндоваскулярных вмешательств как смерть, инфаркт миокарда, инсульт, повторная реваскуляризация, только лишь на основании анализа состояния коронарного русла (определение типа коронарного кровоснабжения, оценка сегментарного поражения коронарных артерий, диаметра стеноза, длины стеноза, кальцификации и наличия тромбоза в случае окклюзии, а также оценка три - и бифуркационных стенозов, наличие аорто-остиального поражения коронарных артерий и диффузно пораженных и суженных сегменты дистальнее стеноза). При этом неучтенными остаются факторы, влияние которых на возобновление клиники ишемической болезни сердца после эндоваскулярных вмешательств подтверждено результатами многоцентровых клинических исследований.
Однако выводы, сделанные на основе этих исследований, отражают лишь общие тенденции в популяции и носят рекомендательный характер. Соответственно, недостатками данных способов являются в первом случае одноплановая оценка факторов риска, а во втором случае отсутствие возможности персонального подхода в оценке риска развития осложнений после эндоваскулярных вмешательств.
Известен также способ расчета риска развития осложнений после аортокоронарного шунтирования с помощью математической модели нейронных сетей [Souza С., Pizzolato Е., Mendes R. Artificial neural networks prognostic evaluation of post-surgery complications in patients underwent to coronary artery bypass graft surgery. International Conference on Machine Learning and Applications, ICMLA 2009, Miami Beach, Florida, USA, December 13-15, 2009. DOI: 10.1109/ICMLA.2009.116], позволяющей произвести анализ известных факторов риска возникновения осложнений после коронарного шунтирования. Известный способ обеспечивает выявление пациентов с высоким риском развития осложнений, требующих применение экстракорпорального кровообращения, длительной механической вентиляции, реинтубации.
Однако недостатком известного способа является большой перечень разноплановой информации, которая не всегда может быть известна лечащему врачу.
Технический результат, достигаемый изобретением, заключается в повышении прогностической достоверности результатов теста генерации тромбина при прогнозировании возобновления клиники ишемической болезни сердца с помощью нейронных сетей у пациентов после эндоваскулярного вмешательства, в выявлении пациентов с высоким риском возобновления клинических проявлений ишемической болезни сердца после чрескожного коронарного вмешательства, и индивидуальном подходе к ведению пациентов с высоким риском, позволяющим повысить эффективность лечения.
Заявленный технический результат, достигается за счет того, что в способе прогнозирования возобновления клиники ишемической болезни сердца с помощью нейронных сетей у пациентов после эндоваскулярного вмешательства, у пациентов предварительно оценивают состояние системы гемостаза по тесту генерации тромбина (ТГТ) в двух параллельных постановках, одна из которых без добавления тромбомодулина (- rh-TM), а другая постановка с добавлением тромбомодулина (+ rh-TM), определяют в каждой постановке время инициации свертывания LT (Lag Time); пиковую концентрацию тромбина Peak (Peak thrombin), время достижения пиковых концентраций тромбина ttPeak (time to peak) и эндогенный тромбиновый потенциал ЕТР (Endogenous Thrombin Potential), а также рассчитывают скорость образования тромбина по формуле:
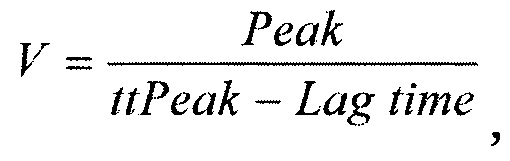
где Peak - пиковая концентрация тромбина, нМ;
ttPeak - время достижения пика, мин;
Lag Time - время инициации свертывания, мин; определяют % LT как процент изменения времени инициации образования тромбина после добавления тромбомодулина; после чего с помощью нейронных сетей анализируют ЕТР, Peak, VI_TM и % LT, программируемых в пакете Mathematica Wolfram, определяют персональный коэффициент каждого пациента:

по полученному коэффициенту судят о вероятности возобновления клиники ишемической болезни после эндоваскулярного вмешательства, а именно: в случае, если персональный коэффициент находится в пределах от 0,10 до 3,35, считают риск рецидива ишемической болезни минимальным, если персональный коэффициент находится в пределах от - 0,02 до - 4,58 риск рецидива ишемической болезни считают максимальным.
В отличие от известных аналогов, главной особенностью заявленного способа прогнозирования возобновления клиники ишемической болезни сердца с помощью нейронных сетей у пациентов после эндоваскулярного вмешательства является то, что он позволяет выявлять пациентов с высоким риском возобновления клинических проявлений ишемической болезни сердца после чрескожного коронарного вмешательства и обеспечивает индивидуальный подход к ведению пациентов с высоким риском, что приводит к повышению эффективности лечения таких пациентов.
Способ осуществляют следующим образом.
У пациентов предварительно оценивают состояние системы гемостаза с помощью теста генерации тромбина (ТГТ), согласно методике, предложенной Hemker H.et al. в 2003 г. Для этого используют плазму крови, бедную тромбоцитами, взятую для исследования перед чрескожным коронарным вмешательством. Для стандартизации ТГТ образцы крови отбирают в вакуумные пробирки VACUETT®, содержащие в качестве консерванта 3,2% (0,109 М) раствор цитрата натрия при соотношении антикоагулянта и крови 1:9. Бедная тромбоцитами плазма для исследования подготавливается путем последовательного двойного центрифугирования образцов крови: при 130g в течение 10 мин и 2500g в течение 30 мин. Для постановки ТГТ используют реагенты производства Thrombinoscope bv (Нидерланды). Триггерный реагент «РРР-Reagent 5рМ» представляет собой смесь рекомбинантного человеческого тканевого фактора (rh-TF) в конечной концентрации 5 пМоль и прокоагулянтных фосфолипидов. Смесь специфичного для тромбина флюорогенного субстрата и CaCl2 готовится перед каждой постановкой теста из реагентов «Fluo-Buffer» и «Fluo-Substrate».
Для оценки влияния системы активированного протеина С используется постановка ТГТ с добавлением в реакционную смесь человеческого рекомбинантного тромбомодулина (rh-TM) [Dargaud Y, Trzeciak MC, Bordet JC, Ninet J, Negrier C. Use of calibrated automated thrombinography +/- thrombomodulin to recognize the prothrombotic phenotype. Thromb. Haemost. 2006; 96(5)562-567; Tripodi A., Martinelli I., Chantarangkul V., Battaglioli Т., Clerici M., Mannucci P.M. The endogenous thrombin potential and the risk of venous thromboembolism. Thromb. Res. 2007; 121: 353-359; Liesel S., Sandset P.M., Mowinckel M.C, Wisloff F. Activated protein С resistance determined with a thrombin generation-based test is associated with thrombotic events in patients with lupus anticoagulants. J. Thromb. Haemost. 2007; 5(11): 2204-10]. Для этого ТГТ производят в двух параллельных постановках, одна из которых без добавления тромбомодулина (- rh-TM), а другая - с добавлением тромбомодулина (+ rh-TM) [Hemker Н.С., Giesen P., A1 Dieri R., Regnault V., de Smedt E., Wagenvoord R., et al. Calibrated automated thrombin generation measurement in clotting plasma. Pathophysiol Haemost Thromb 2003; 33:4-15.]. Калибровку осуществляют параллельно с генерацией тромбина в каждом исследуемом образце плазмы при помощи реагента «Thrombin Calibrator». Постановку ТГТ проводят в дублях на планшетном флюориметре Fluoroskan Ascent®, оборудованном диспенсером производства ThermoFisher SCIENTIFIC (Финляндия). Построение и расчет показателей тромбограмм генерации тромбина осуществляют при помощи программного обеспечения Thrombinoscope® версия 3.0.0.26.
Оценивают следующие показатели ТГТ: LT (Lag Time) - время инициации свертывания (мин); Peak (Peak thrombin) - пиковая концентрация тромбина, (нМ); ttPeak (time to peak) - время достижения пика (мин); ЕТР (Endogenous Thrombin Potential) - эндогенный тромбиновый потенциал (нМ⋅мин). V (Velocity Index) - скорость образования тромбина (нМ/мин), которую рассчитывали по формуле:
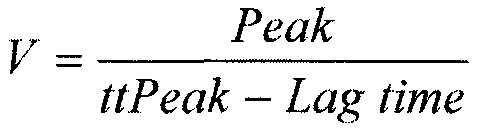
Далее проводят анализ показателей теста генерации тромбина (ЕТР, Peak, V в постановке с тромбомодулином и %LT) и клинических вариантов течения заболевания с помощью нейронных сетей, программируемых в пакете Mathematica Wolfram.
Математическое моделирование классификатора осложнений после операции на основе данных теста генерации тромбина, полученных непосредственно перед операцией, осуществляют с помощью аппарата нейронных сетей заданной архитектуры, который представляет собой модель, построенную на основе теории и алгоритмов, изложенных в книге (Васильев А.Н., Тархов Д.А. Нейросетевое моделирование: принципы. Алгоритмы. Приложения: монография. - Санкт-Петербург: Политехнический университет, 2009. - 528 с. - ISBN). Алгоритмы выбирают индивидуально для поставленной задачи в ходе вычислительных экспериментов, что в свою очередь является особенностью заявленного способа. Сама модель является оригинальной, так как ее параметры и архитектура подбирались в ходе обучения (машинного обучения) на конкретной базе данных. Модель имеет общий функциональный вид для всех пациентов, а различает их своим значением на выходе после введения входных данных по конкретному пациенту. В качестве входных данных по каждому пациенту используют оригинальные показатели, полученные на основе результатов ТГТ. Упомянутая задача при построении модели классификатора заключалась в поиске аппроксиматора некоторой неизвестной функции, зависящей от входных данных и отражающей в той или иной степени вероятность появления осложнений у объекта после оперативного вмешательства.
Результат моделирования представляет собой выход искусственной нейронной сети заданной архитектуры [Васильев А.Н., Тархов Д.А., 2009]
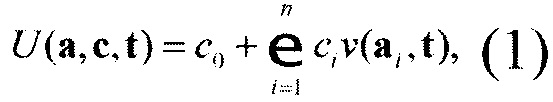
где n - число нейронов, скаляры с=(с0, …, cn) и векторы а=(а0, …, an) - входящие веса (параметры) модели; v - базисная функция выбранного типа (Васильев А.Н., Тархов Д.А., 2009), вектор t - используемые данные (результаты ТГТ). В частности, j-oe наблюдение обозначено как tj.
Значения весов нейросетевой модели подбирают в процессе минимизации так называемого функционала ошибки, дискретная форма которого имеет вид
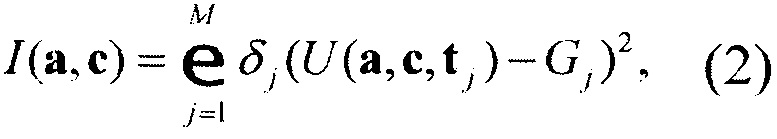
где М - число наблюдений, Gj - значения приближаемой функции в точках tj,δj - некоторые положительные штрафные множители.
В результате решения задачи глобальной нелинейной оптимизации получают итоговую нейросетевую модель U(a,c;t)=Ua,c(t) с фиксированными параметрами (весами). Данная функция принимает значения на вещественной прямой. Классификатор осложнений получен путем выбора порогового значения. В качестве базисных функций выбраны сигмоиды (гиперболические тангенсы), поведение которых лучше всего подходит для классификации данных [Bolgov I., Kaverzneva Т., 2016; Filkin V., Kaverzneva Т., 2016; Kaverzneva Т., Lazovskaya Т., 2016].
Во избежание излишней сложности модели, нейронную сеть строили в несколько этапов, на каждом из которых добавляли и обучали один дополнительный нейрон. Подразумевается, что процесс обучения сети идет до удовлетворительного результата. На первом этапе в функционале ошибки значения Gi закодированы в виде - 3 и 1 как наличие и отсутствие осложнений в первый год после операции. Построение бинарного классификатора обусловлено относительно небольшой рассматриваемой выборкой, а особенно общего числа наблюдений осложнений.
На последующих этапах производят аппроксимацию ошибки Gi предыдущего этапа с помощью выхода нейронной сети с одним нейроном. В результате выходы сетей суммируют, и число нейронов в текущей модели увеличивают на один. Общее число параметров модели равно 1+6 n, где n - число нейронов. На всех этапах обучения сети процесс минимизации функционала ошибки проводился с использованием таких алгоритмов оптимизации как RProp и Particle Swarm [Васильев А.Н., Тархов Д.А., 2009; Riedmiller М., Braim Н. А., 1993]. Начальные веса выбираются таким образом, чтобы уравновесить вклад каждого из факторов. Количество нейронов модели также является предметом исследования. Необходимо соблюдать баланс в меньшем числе нейронов и большем качестве построенного классификатора.
В результате проведенных расчетов с помощью искусственной нейронной сети заданной архитектуры для каждого больного определяют персональный коэффициент, по которому после выбора порогового значения, можно судить о вероятности возобновления клиники ИБС после эндоваскулярного вмешательства.
Способ иллюстрируется следующими клиническими примерами.
Было обследовано 66 больных ИБС в возрасте от 53 до 75 лет. Материалом для исследования являлась венозная кровь, полученная до первичного чрескожного коронарного вмешательства. Критериями исключения являлись: возраст >75 лет, аортокоронарное шунтирование и стентирование коронарных артерий в анамнезе, острая сердечная недостаточность и/или фракция выброса левого желудочка <40%, ХСН IIБ и III стадии, креатинин крови >180 ммоль/л, хроническая обструктивная болезнь легких, анемии средней и тяжелой степени, постоянная форма фибрилляции и трепетания предсердий, онкопатология. Все пациенты получали стандартную терапию, включающую препарат ацетилсалициловой кислоты (АСК) 300 мг и клопидогрель в дозе 600 мг за сутки до ЧКВ. В качестве клинических исходов рассматривались варианты возобновления клинических проявлений ИБС в течение года после вмешательства: нет событий (51 наблюдение); прогрессирование заболевания - возобновление клиники стабильной стенокардии напряжения II-III функционального класса (8 наблюдений); развитие острого коронарного синдрома (ОКС) (7 наблюдений)(Таблица 1). В контрольную группу вошли 35 сопоставимых по полу и возрасту практически здоровых людей без клинических проявлений ИБС и не принимающих антиагрегантные и антикоагулянтные препараты с какой-либо иной целью.

Анализ результатов ТГТ, выполненного в контрольной группе, а также у больных ИБС до ЧКВ показал, что значения большинства показателей не выходят за рамки референсных значений независимо от клинических исходов в течение первого года наблюдения.
В качестве клинических вариантов возобновления клиники ИБС в течение первого года после ЧКВ рассматривались случаи острого коронарного синдрома, а также возобновления стабильной стенокардии напряжения, подтвержденной результатами пробы с физической нагрузкой (стрессЭхоКГ).
Корреляции между рассматриваемыми факторами и категориальной переменной «осложнения» не выявлено, регрессионный анализ не дал значимых результатов. Для анализа данных с помощью нейронных сетей были выбраны показатели, характеризующие интенсивность образования тромбина (ЕТР, Peak), скорость образования тромбина при добавлении в реакционную смесь тромбомодулина (V_TM) и процент изменения времени инициации образования тромбина после добавления тромбомодулина (%LT).
Результатом нейросетевого моделирования является функция с полученными в ходе обучения сети 25 параметрами, принимающая значения на числовой прямой:

Установлено, что минимальный риск рецидива ИБС имеется при значениях данного коэффициента от 0,10 до 3,35 (у 51 больного). Напротив, максимальный риск - при значениях данного коэффициента от - 0,02 до - 4,58 (у 25 больных). Все пациенты, госпитализированные в экстренном порядке с острым коронарным синдромом имели значения данного коэффициента в этом диапазоне. И лишь 2 пациента, имеющие подтвержденный с помощью стрессЭхоКГ факт возобновления клиники ИБС, имели коэффициенты в диапазоне минимального риска: 0,34 и 0,46.
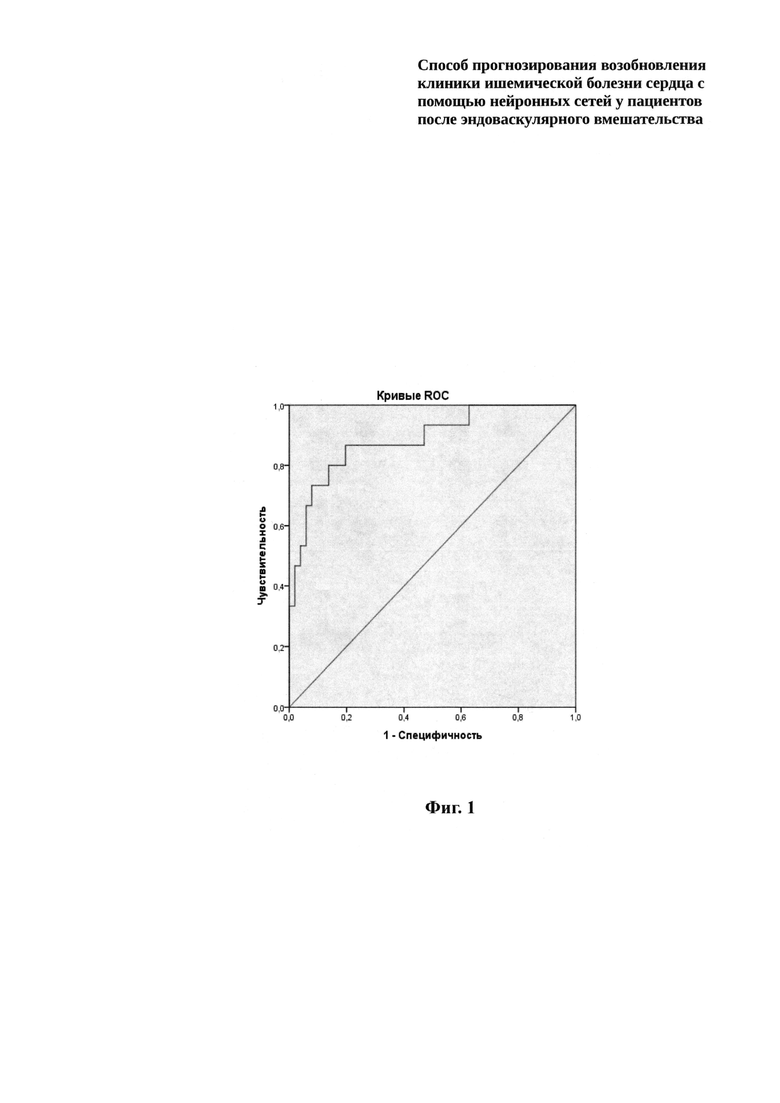
Качество построенных нейросетевых моделей было оценено с помощью ROC-анализа.
Изобретение иллюстрируется следующим графическим материалом, где:
на фиг. 1 представлено графическое изображение ROC-анализа.
Сравним результаты для нейросетевых моделей с возрастающим количеством нейронов на каждом из этапов моделирования.
Площадь под ROC-кривой AUC (Area Under Curve) является агрегированной характеристикой качества классификации, не зависящей от соотношения цен ошибок. Результаты ROC-анализа приведены в таблице 2.
Значения стандартной ошибки площади под кривой оценивались непараметрическим методом на уровне для доверительного интервала 95%. Можно говорить о том, что уже при использовании трех нейронов качество модели является хорошим, четырех нейронов - очень хорошим.
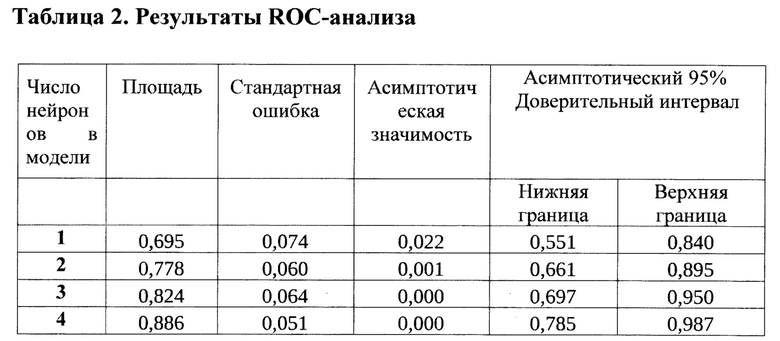
Таблица 3 иллюстрирует качество классификаторов после выбора наилучшего порогового значения (cut-off value). Учитывая особенности кодирования исходов (возобновления клиники ИБС) в наших случаях пороговое значение для всех моделей было близко или равно нулю.
Чувствительность (Sensitivity) - это и есть доля истинно положительных случаев; специфичность (Specificity) - доля истинно отрицательных случаев, которые были правильно идентифицированы моделью; доля истинно положительных примеров (True Positives Rate); доля ложно положительных примеров (False Positives Rate).
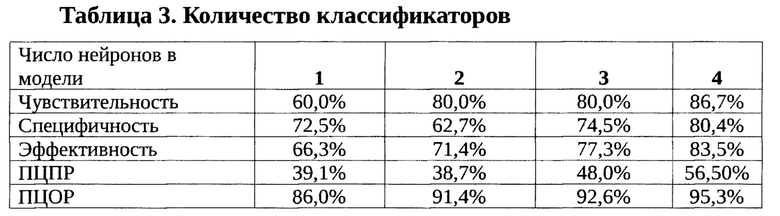
Модель с одним нейроном недостаточно чувствительна. Добавление второго нейрона значительно улучшает распознавание наблюдений, соответствующих осложнениям, но при этом резко падает специфичность. Начиная с трехнейронной модели, все показатели улучшаются.
Таким образом, заявленный способ обеспечивает получение технического эффекта, а именно повышает прогностическую достоверность результатов теста генерации тромбина при прогнозировании возобновления клиники ишемической болезни сердца с помощью нейронных сетей у пациентов после эндоваскулярного вмешательства, позволяет выявлять пациентов с высоким риском возобновления клинических проявлений ишемической болезни сердца после чрескожного коронарного вмешательства, и обеспечивает индивидуальный подход к ведению пациентов с высоким риском, позволяющим таким образом повысить эффективность лечения.
Заявитель просит рассмотреть представленные материалы заявки «Способ прогнозирования возобновления клиники ишемической болезни сердца с помощью нейронных сетей у пациентов после эндоваскулярного вмешательства» на предмет выдачи патента РФ на изобретение.
Изобретение относится к медицине, а именно к кардиологии и кардиохирургии, и может быть использовано для прогнозирования возобновления клиники ишемической болезни сердца после эндоваскулярного вмешательства. Определяют состояние системы гемостаза по тесту генерации тромбина (ТГТ) в двух параллельных постановках. Одна постановка без добавления тромбомодулина (- rh-TM), а другая постановка с добавлением тромбомодулина (+ rh-TM). Определяют в каждой постановке время инициации свертывания LT (Lag Time), пиковую концентрацию тромбина Peak (Peak thrombin), время достижения пиковых концентраций тромбина ttPeak (time to peak) и эндогенный тромбиновый потенциал ЕТР (Endogenous Thrombin Potential). Рассчитывают скорость образования тромбина по заявленной формуле. После чего с помощью нейронных сетей анализируют ЕТР, Peak, VI_TM и % LT, программируемых в пакете Mathematica Wolfram. Определяют персональный коэффициент каждого пациента. Если персональный коэффициент находится в пределах от 0,10 до 3,35, считают риск рецидива ишемической болезни минимальным. Если персональный коэффициент находится в пределах от - 0,02 до - 4,58, риск рецидива ишемической болезни считают максимальным. Способ позволяет повысить прогностическую достоверность результатов теста генерации тромбина при прогнозировании возобновления клиники ишемической болезни сердца у пациентов после эндоваскулярного вмешательства, выявлять пациентов с высоким риском и обеспечить индивидуальный подход к ведению пациентов с высоким риском, повысить эффективность лечения за счет использования нейронных сетей и оценки комплекса наиболее значимых показателей. 1 ил., 3 табл.
Способ прогнозирования возобновления клиники ишемической болезни сердца с помощью нейронных сетей у пациентов после эндоваскулярного вмешательства, характеризующийся тем, что у пациентов предварительно оценивают состояние системы гемостаза по тесту генерации тромбина (ТГТ) в двух параллельных постановках, одна из которых без добавления тромбомодулина (- rh-TM), а другая постановка с добавлением тромбомодулина (+ rh-TM), определяют в каждой постановке время инициации свертывания LT (Lag Time); пиковую концентрацию тромбина Peak (Peak thrombin), время достижения пиковых концентраций тромбина ttPeak (time to peak) и эндогенный тромбиновый потенциал ЕТР (Endogenous Thrombin Potential), а также рассчитывают скорость образования тромбина по формуле:
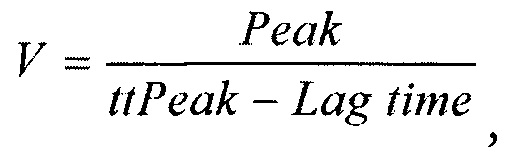
где Peak - пиковая концентрация тромбина, нМ;
ttPeak - время достижения пика, мин;
Lag Time - время инициации свертывания, мин; определяют % LT как процент изменения времени инициации образования тромбина после добавления тромбомодулина; после чего с помощью нейронных сетей анализируют ЕТР, Peak, VI_TM и % LT, программируемых в пакете Mathematica Wolfram, определяют персональный коэффициент каждого пациента:

по полученному коэффициенту судят о вероятности возобновления клиники ишемической болезни после эндоваскулярного вмешательства, а именно: в случае, если персональный коэффициент находится в пределах от 0,10 до 3,35, считают риск рецидива ишемической болезни минимальным, если персональный коэффициент находится в пределах от - 0,02 до - 4,58, риск рецидива ишемической болезни считают максимальным.
| CESAR SOUZA | |||
| Artificial Neural Networks Prognostic Evaluation of Post-Surgery Complications in Patients Underwent To Coronary Artery Bypass Graft Surgery | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Ртутный разрежающий насос | 1922 |
|
SU799A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ | 2014 |
|
RU2571715C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2011 |
|
RU2462722C1 |
| Приспособление для захвата стекла в машинах для вытягивания листового стекла | 1933 |
|
SU49085A1 |
| US 20130041683 A1, 14.02.2013 | |||
| БЕРЕЗОВСКАЯ Г.А | |||
| Коронарное кровообращение и возобновление клиники ишемической болезни сердца после интракоронарного стентирования | |||
| Регионарное кровообращение и микроциркуляция Т | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
Авторы
Даты
2018-12-14—Публикация
2017-09-18—Подача