ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет в соответствии с предварительной заявкой США № 61/886,717, зарегистрированной 4 октября 2013 года, которая включена во всей своей полноте в настоящий документ посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
(1) Область техники, к которой относится изобретение
Настоящее изобретение относится к конъюгатам инсулина, содержащим фукозу, которые характеризуются фармакокинетическим (PK) и/или фармакодинамическим (PD) профилем, который чувствителен к системным концентрациям сахарида, такого как глюкоза или α-метилманноза, даже при введении нуждающемуся в этом субъекту в отсутствие экзогенной мультивалентной сахарид-связывающей молекулы, такой как Con A. В частности, настоящее изобретение относится к конъюгатам инсулина, которые содержат молекулу инсулина, ковалентно присоединенную по меньшей мере к одному бидентатному линкеру, где каждое плечо линкера независимо присоединено к лиганду, содержащему сахарид, и где сахарид по меньшей мере для одного лиганда представляет собой фукозу.
(2) Описание предшествующего уровня техники
Большинство систем доставки лекарства с «контролируемым высвобождением», известных из уровня техники (например, патент США №4,145,410 на имя Sears, который описывает высвобождение лекарства из ферментативно лабильных капсул), не способны обеспечивать пациента лекарствами с интервалами и в концентрациях, которые прямо пропорциональны количеству молекулярного индикатора (например, метаболита), присутствующего в организме человека. Поэтому, лекарства в таких известных из уровня техники системах не являются в буквальном смысле «контролируемыми», а просто предоставляются в формате медленного высвобождения, который не зависит от внешних или внутренних факторов.
Лечение сахарного диабета с помощью инъецируемого инсулина представляет собой хорошо известный и изученный пример, при котором неконтролируемое медленное высвобождение инсулина нежелательно. На самом деле, очевидно, что простое замещение гормона недостаточно для предупреждения патологических осложнений, ассоциированных с этим заболеванием. Считается, что развитие таких осложнений отражает неспособность к обеспечению экзогенным инсулином пропорционально изменяющимся концентрациям глюкозы в крови, испытываемым пациентом. Для решения этой проблемы было предложено несколько биологических и биоинженерных подходов для развития более физиологичной системы доставки инсулина (например, см. патент США № 4,348,387 на имя Brownlee et al.; патент США № 5,830,506, 5,902,603 и 6410053 на имя Taylor et al., и опубликованную патентную заявку США № 2004-0202719 на имя Zion et al.).
Каждая из таких систем основана на сочетании мультивалентной молекулы, связывающей глюкозу (например, лектин Con A), и компонента на основе сахара, который обратимо связан с мультивалентной молекулой, связывающей глюкозу. К сожалению, Con A и многие из других легкодоступных лектинов обладают свойством стимулировать пролиферацию лимфоцитов. Посредством связывания с углеводными рецепторами на поверхностях конкретных типов лимфоцитов, так называемые «митогенные» лектины могут потенциально индуцировать митоз лимфоцитов и обуславливать тем самым их пролиферацию. Большинство митогенных лектинов, включая Con A, представляют собой селективные Т-клеточные митогены. Некоторые лектины менее селективны и стимулируют, как Т-клетки, так и В-клетки. Локальное или системное воздействие митогенными лектинами in vivo может приводить к воспалению, цитотоксичности, расщеплению макрофагами и аллергическим реакциям, включая анафилаксию. Кроме того известно, что растительные лектины особенно иммуногенны, способствуя продукции высоких титров специфических антилектиновых антител. Следует принимать во внимание, что митогенные лектины, следовательно, не могут быть использованы в их нативной форме для способов и устройств in vivo, пока не соблюдена предельная осторожность для предупреждения их высвобождения. Например, в патенте США № 5,830,506 на имя Taylor освещены токсические риски, к которым причастно использование Con A, и подчеркнута важность и сложность содержания Con A внутри системы доставки лекарства, которая также требует свободной диффузии молекул глюкозы и инсулина внутрь устройства и из него.
Упомянутые риски и сложности, к которым причастны те или иные способы применения лектинов in vivo, могут быть существенно снижены, если будет обеспечена альтернативная система доставки лекарства, которая не требует применения лектинов.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к конъюгатам инсулина, содержащим фукозу, которые характеризуются фармакокинетическим (PK) и/или фармакодинамическим (PD) профилем, который чувствителен к системным концентрациям сахарида, такого как глюкоза или α-метилманноза, при введении нуждающемуся в этом субъекту в отсутствие экзогенной мультивалентной сахарид-связывающей молекулы, такой как Con A. В общем, указанные конъюгаты содержат молекулу инсулина или аналога инсулина, присоединенную по меньшей мере к одному разветвленному линкеру, имеющему два плеча (бидентатный линкер), где каждое плечо независимо присоединено к лиганду, содержащему сахарид, где по меньшей мере один лиганд линкера представляет собой фукозу. Согласно конкретным вариантам осуществления, линкер является неполимерным. Согласно конкретным вариантам осуществления, конъюгат может характеризоваться коэффициентом полидисперсности, равным единице, и молекулярной массой приблизительно менее 20000 Да. Согласно конкретным вариантам осуществления, конъюгат представляет собой конъюгат пролонгированного действия (т.е., характеризуется PK профилем, который является более замедленным, чем у растворимого рекомбинантного инсулина человека (RHI)).
Конъюгаты, раскрытые в настоящем документе, характеризуются фармакодинамическим (PD) или фармакокинетическим (PK) профилем, который чувствителен к сывороточной концентрации сывороточного сахарида при введении нуждающемуся в этом субъекту в отсутствие экзогенной сахарид-связывающей молекулы. Согласно конкретным аспектам, сывороточный сахарид представляет собой глюкозу или α-метилманнозу. Согласно дополнительным аспектам, указанный конъюгат связывается с эндогенной сахарид-связывающей молекулой при концентрации глюкозы в сыворотке, равной 60 или 70 мг/дл или менее, при введении нуждающемуся в этом субъекту. Связывание конъюгата с эндогенной сахарид-связывающей молекулой чувствительно к сывороточной концентрации сывороточного сахарида. Согласно дополнительному аспекту, конъюгат способен связываться с инсулиновым рецептором при концентрации сывороточного сахарида более чем 60, 70, 80, 90 или 100 мг/дл. При концентрации сывороточного сахарида 60 или 70 мг/дл конъюгат предпочтительно связывается с эндогенной сахарид-связывающей молекулой, а не с инсулиновым рецептором, и как только сывороточная концентрация сывороточного сахарида возрастает выше 60 или 70 мг/дл, связывание конъюгата с эндогенной сахарид-связывающей молекулой снижается, а связывание конъюгата с инсулиновым рецептором увеличивается.
Поэтому, настоящее изобретение относится к конъюгату, содержащему молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему первое и второе плечо, причем первое плечо связано с первым лигандом, который включает в себя или состоит из первого сахарида, и второе плечо связано со вторым лигандом, который включает в себя или состоит из второго сахарида, где первый сахарид по меньшей мере для одного разветвленного линкера представляет собой фукозу. Также предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
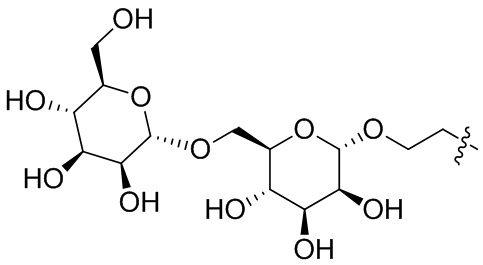
Согласно конкретным аспектам конъюгата, второй сахарид представляет собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, второй лиганд содержит бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, второй лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, и первый сахарид, и второй сахарид представляют собой фукозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой разветвленную триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой глюкозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой маннозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой биманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляет собой тетраманнозу.
Согласно конкретным аспектам по меньшей мере один разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина.
Согласно дополнительному аспекту конъюгата, инсулин или аналог инсулина дополнительно ковалентно связан с линейным или разветвленным линкером, содержащим лиганд, который включает в себя или состоит из сахарида. Согласно конкретным аспектам, сахарид представляет собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, лиганд содержит бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно дополнительному аспекту конъюгата, конъюгат характеризуется общей формулой (I):
 I,
I,
в которой:
(i) в каждом случае появления 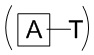 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
(ii) в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
(iii) в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
(iv) в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
(v) -B представляет собой -T-LB-X, где в каждом случае появления X независимо представляет собой лиганд, содержащий сахарид, и в каждом случае появления LB независимо представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
(vi) n равно 1, 2 или 3,
при условии, что инсулин или аналог инсулина конъюгирован по меньшей мере с одним линкером, в котором один из лигандов Х содержит сахарид, который представляет собой фукозу.
Согласно конкретным аспектам конъюгата по меньшей мере один сахарид по меньшей мере для одного линкера представляет собой фукозу, а другой сахарид или сахариды представляют собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам по меньшей мере один сахарид по меньшей мере для одного линкера представляет собой фукозу, а другой сахарид или сахариды представляют собой бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту по меньшей мере один сахарид по меньшей мере для одного линкера представляет собой фукозу, а другой сахарид или сахариды представляют собой биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно конкретному аспекту конъюгата, n равно 1, и сахарид в первом случае появления Х представляет собой фукозу, а сахарид во втором случае появления Х представляет собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, сахарид в первом случае появления Х представляет собой фукозу, а сахарид во втором случае появления Х представляет собой бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, сахарид в первом случае появления Х представляет собой фукозу, а сахарид во втором случае появления Х представляет собой биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно конкретному аспекту конъюгата, n равно 2, и сахарид в первом случае появления Х представляет собой фукозу, а сахарид во втором, третьем и четвертом случаях появления Х независимо представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно конкретному аспекту конъюгата, n равно 3, и сахарид в первом случае появления Х представляет собой фукозу, а сахарид во втором, третьем, четвертом, пятом и шестом случаях появления Х независимо представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно дополнительному аспекту конъюгата, конъюгат характеризуется общей формулой (II):
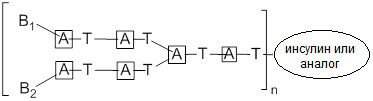 II
II
в которой:
(i) в каждом случае появления 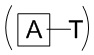 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
(ii) в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
(iii) в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
(iv) в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
(v) -B1 представляет собой -T-LB1-X1, где X1 представляет собой лиганд, содержащий фукозу, где LB1 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с X1;
(vi) -B2 представляет собой -T-LB2-X2, где X2 представляет собой лиганд, содержащий сахарид, который может представлять собой фукозу, маннозу или глюкозу; и LB2 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х2; и
(vii) n равно 1, 2 или 3.
Согласно конкретным аспектам конъюгата, Х2 представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно дополнительному аспекту конъюгата, бидентатный линкер характеризуется формулой





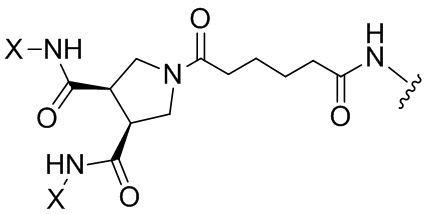
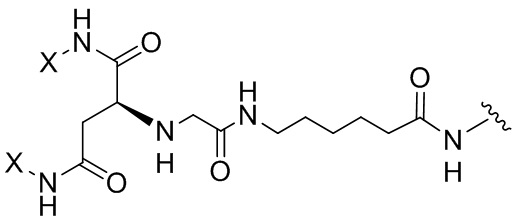
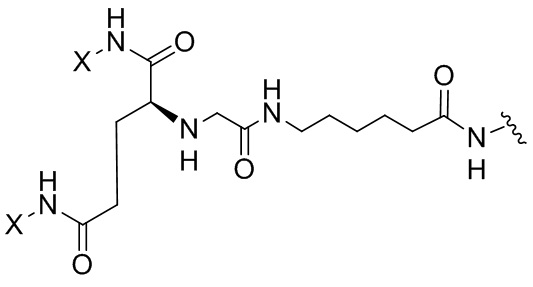


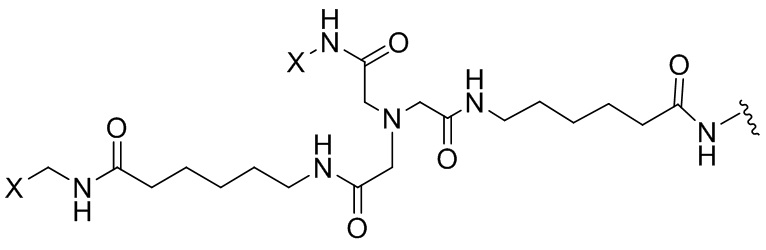
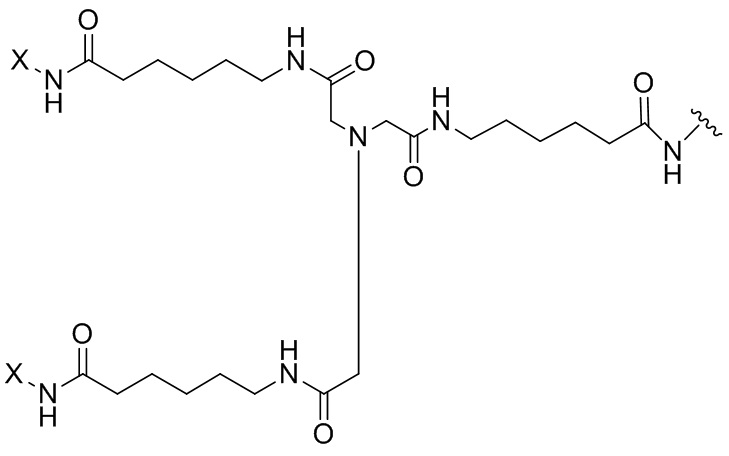


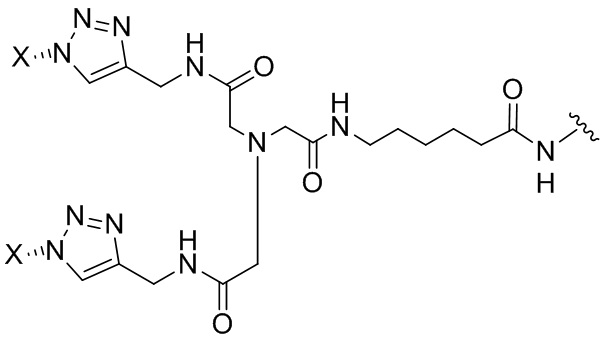









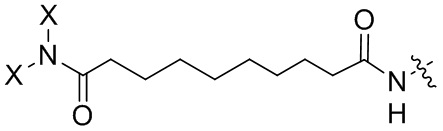







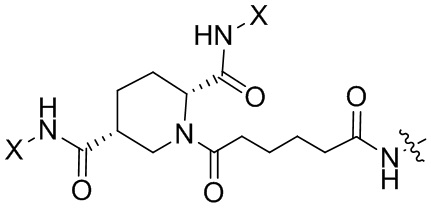




в которой каждый Х независимо представляет собой лиганд, содержащий сахарид, при условии, что по меньшей мере один бидентатный линкер, конъюгированный с инсулином или аналогом инсулина, содержит лиганд Х, содержащий фукозу по меньшей мере на одном плече бидентатного линкера. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат, имеющий упомянутый бидентатный линкер, и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно дополнительному аспекту конъюгата, каждый Х может независимо характеризоваться формулой

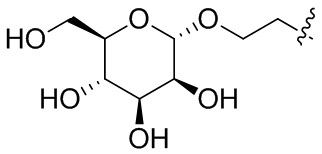






в которой волнистая линия указывает на связь с атомом бидентатного линкера, при условии, что по меньшей мере один бидентатный линкер, конъюгированный с инсулином или аналогом инсулина, содержит EDF по меньшей мере на одном плече бидентатного линкера. Дополнительно предусмотрена композиция, содержащая упомянутый конъюгат и фармацевтически приемлемый носитель, и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества.
Согласно дополнительному аспекту конъюгата, конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к двум разветвленным линкерам, причем каждый из которых имеет первое и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, где первый сахарид представляет собой фукозу. Согласно конкретным аспектам конъюгата, второй сахарид независимо представляет собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, второй сахарид независимо представляет собой бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, второй сахарид независимо представляет собой биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, как первый сахарид, так и второй сахарид представляют собой фукозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой разветвленную триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой глюкозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой маннозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой биманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой тетраманнозу.
Согласно дополнительному аспекту описанного выше конъюгата, два положения аминокислот, выбранные из A1, B1, B29, B28 и B3 молекулы инсулина или аналога инсулина, ковалентно связаны с двумя линкерами.
Согласно дополнительному аспекту конъюгата, конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к трем разветвленным линкерам, причем каждый из которых имеет первое и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, где первый сахарид представляет собой фукозу. Согласно конкретным аспектам конъюгата, второй сахарид независимо представляет собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, второй сахарид независимо представляет собой бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, второй сахарид независимо представляет собой биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, как первый сахарид, так и второй сахарид представляют собой фукозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой разветвленную триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой глюкозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой маннозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой биманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой триманнозу. Согласно конкретным аспектам, первый сахарид представляет собой фукозу, а второй сахарид представляют собой тетраманнозу.
Согласно дополнительному аспекту описанного выше конъюгата, три положения аминокислот, выбранные из A1, B1, B29, B28 и B3 молекулы инсулина или аналога инсулина, ковалентно связаны с тремя линкерами.
Согласно дополнительному аспекту конъюгата, конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к двум разветвленным линкерам, причем каждый из которых имеет первое и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, где первый сахарид одного из двух линкеров представляет собой фукозу.
Согласно конкретным аспектам конъюгата, оставшийся первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, оставшийся первый сахарид и второй сахарид независимо представляют собой бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, оставшийся первый сахарид и второй сахарид независимо представляют собой биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, как первый сахарид, так и второй сахарид для каждого из двух линкеров представляют собой фукозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой разветвленную триманнозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой триманнозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой глюкозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой маннозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой биманнозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой триманнозу. Согласно конкретным аспектам, для каждого из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляют собой тетраманнозу.
Согласно конкретным аспектам, как первый сахарид, так и второй сахарид для одного из двух линкеров представляют собой фукозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляет собой разветвленную триманнозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляет собой триманнозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляет собой глюкозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид для каждого из двух линкеров представляет собой фукозу, а второй сахарид представляет собой маннозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляет собой биманнозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид представляет собой фукозу, а второй сахарид представляет собой триманнозу, и для второго линкера первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу. Согласно конкретным аспектам, для одного из двух линкеров первый сахарид представляет собой фукозу и для второго линкера второй сахарид представляет собой тетраманнозу, и первый сахарид и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно дополнительному аспекту описанного выше конъюгата, два положения аминокислот, выбранные из A1, B1, B29, B28 и B3 молекулы инсулина или аналога инсулина, ковалентно связаны с двумя линкерами.
Согласно дополнительному аспекту конъюгата, конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к трем разветвленным линкерам, причем каждый из которых имеет первое и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, где первый сахарид по меньшей мере одного из трех линкеров представляет собой фукозу, а оставшиеся первые сахариды и второй сахарид независимо представляют собой фукозу, маннозу, глюкозамин или глюкозу. Согласно другим аспектам, оставшиеся первые сахариды и второй сахарид независимо представляют собой бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид. Согласно дополнительному аспекту, оставшиеся первые сахариды и второй сахарид представляют собой биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно дополнительному аспекту описанного выше конъюгата, три положения аминокислот, выбранные из A1, B1, B29, B28 и B3 молекулы инсулина или аналога инсулина, ковалентно связаны с тремя линкерами.
Дополнительно предусмотрен конъюгат или композиция, содержащая конъюгат, характеризующийся формулой, представленной для IOC-1, IOC-2, IOC-3, IOC-4, IOC-5, IOC-6, IOC-7, IOC-8, IOC-9, IOC-10, IOC-11, IOC-12, IOC-13, IOC-14, IOC-15, IOC-16, IOC-17, IOC-18, IOC-19, IOC-20, IOC-21, IOC-22, IOC-23, IOC-24, IOC-25, IOC-26, IOC-27, IOC-28, IOC-29, IOC-30, IOC-31, IOC-32, IOC-33, IOC-34, IOC-35, IOC-36, IOC-37, IOC-38, IOC-39, IOC-41, IOC-42, IOC-43, IOC-44, IOC-45, IOC-46, IOC-47, IOC-49, IOC-50, IOC-51, IOC-52, IOC-53, IOC-54, IOC-55, IOC-56, IOC-57, IOC-58, IOC-59, IOC-60, IOC-61, IOC-62, IOC-63, IOC-64, IOC-65, IOC-66, IOC-67, IOC-68, IOC-69, IOC-70, IOC-71, IOC-72, IOC-73, IOC-74, IOC-75, IOC-76, IOC-77, IOC-78, IOC-79, IOC-80, IOC-81, IOC-82, IOC-83, IOC-84, IOC-85, IOC-86, IOC-87, IOC-88, IOC-89, IOC-90, IOC-91, IOC-92, IOC-93, IOC-94, IOC-95, IOC-96, IOC-97, IOC-98, IOC-99 или IOC-100.
Дополнительно предусмотрен конъюгат или композиция, содержащая конъюгат, характеризующийся формулой, представленной для IOC-101, IOC-102, IOC-103, IOC-104, IOC-105, IOC-106, IOC-107, IOC-108, IOC-109, IOC-110, IOC-111, IOC-112, IOC-113, IOC-114, IOC-115, IOC-116, IOC-117, IOC-118, IOC-119, IOC-120, IOC-121, IOC-122, IOC-123, IOC-124, IOC-125, IOC-126, IOC-127, IOC-128, IOC-129, IOC-130, IOC-131, IOC-132, IOC-133, IOC-134, IOC-135, IOC-136, IOC-137, IOC-138, IOC-139, IOC-140, IOC-141, IOC-142, IOC-143, IOC-144, IOC-145, IOC-146, IOC-147, IOC-149, IOC-150, IOC-151, IOC-152, IOC-153, IOC-154, IOC-155, IOC-156, IOC-157, IOC-158, IOC-159, IOC-160, IOC-161, IOC-162, IOC-163, IOC-164, IOC-165, IOC-166, IOC-167, IOC-168, IOC-169, IOC-170, IOC-171, IOC-172, IOC-173, IOC-174, IOC-175, IOC-176, IOC-177, IOC-178, IOC-179, IOC-180, IOC-181, IOC-182, IOC-183, IOC-184, IOC-185, IOC-186, IOC-187, IOC-188, IOC-189, IOC-190, IOC-191 или IOC-192.
Дополнительно предусмотрен конъюгат или композиция, содержащая конъюгат, характеризующийся формулой, представленной для IOC-193, IOC-194, IOC-195, IOC-196, IOC-197, IOC-198, IOC-199, IOC-200, IOC-201, IOC-202, IOC-203, IOC-204, IOC-205, IOC-206, IOC-207, IOC-208, IOC-210, IOC-211, IOC-212, IOC-213, IOC-214, IOC-215, IOC-216, IOC-217, IOC-218, IOC-219, IOC-220, IOC-221, IOC-222, IOC-223, IOC-224, IOC-225, IOC-226, IOC-227, IOC-228, IOC-229, IOC-230, IOC-231, IOC-232, IOC-233, IOC-234, IOC-235, IOC-236, IOC-237, IOC-238, IOC-239, IOC-240, IOC-241, IOC-242, IOC-243, IOC-244, IOC-245, IOC-246, IOC-247, IOC-248, IOC-249, IOC-250, IOC-251, IOC-252, IOC-253, IOC-254, IOC-255, IOC-256, IOC-257, IOC-258, IOC-259, IOC-260, IOC-261, IOC-262, IOC-263, IOC-264, IOC-265, IOC-266, IOC-267, IOC-268, IOC-269, IOC-270, IOC-271 или IOC-272.
Описанные выше конъюгаты могут быть дополнительно предусмотрены в виде фармацевтической формулы, включающей в себя фармацевтически приемлемый носитель и необязательно один или несколько фармацевтически приемлемых наполнителей, консервантов и/или поверхностно-активных веществ. Согласно дополнительным аспектам, конъюгаты могут дополнительно включать в себя цинк и/или протамин. Конъюгаты могут быть предусмотрены в кристаллической форме.
Таким образом, настоящее изобретение дополнительно относится к композиции, содержащей один или несколько конъюгатов, которые в общем или более конкретно были раскрыты в настоящем документе, и фармацевтически приемлемый носитель и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка и/или поверхностно-активные вещества. Дополнительно предусмотрена композиция, содержащая один или несколько конъюгатов, которые в общем или более конкретно были раскрыты в настоящем документе, в кристаллической форме и фармацевтически приемлемый носитель и необязательно один или несколько фармацевтически приемлемых эксципиентов, консервантов, соль цинка, протамин и/или поверхностно-активные вещества.
Согласно дополнительным аспектам конъюгатов, молекула инсулина представляет собой инсулин млекопитающих, который, согласно конкретным вариантам осуществления, может представлять собой инсулин человека, бычий инсулин, инсулин собак, инсулин кошек, инсулин коз, инсулин лошадей, инсулин свиней или их аналог. Согласно конкретным вариантам осуществления, аналог инсулина представляет собой инсулин лизпро или инсулин глулизин. Согласно другим вариантам осуществления, инсулин или аналог инсулина модифицирован для включения в состав полиэтиленгликоля или жирной кислоты, ковалентно соединенных с аминокислотой инсулина или аналога инсулина. Согласно конкретным вариантам осуществления, аналог инсулина представляет собой инсулин лизпро, инсулин гларгин, инсулин аспарт, инсулин детемир или инсулин глулизин.
Настоящее изобретение дополнительно относится к способам лечения сахарного диабета, включающим в себя введение диабетическому субъекту раскрытых в настоящем документе конъюгатов или фармацевтического состава, содержащего раскрытые в настоящем документе конъюгаты. Настоящее изобретение дополнительно относится к использованию конъюгатов, раскрытых в настоящем документе, для производства лекарственного средства для лечения сахарного диабета.
Настоящее изобретение дополнительно относится к композиции или фармацевтической композиции, содержащей: молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему первое плечо и второе плечо, где первое плечо соединено с первым лигандом, включающим в себя первый сахарид, а второе плечо соединено со вторым лигандом, включающим в себя второй сахарид, и где первый сахарид представляет собой фукозу, с получением конъюгата, и фармацевтически приемлемый носитель.
Как правило, второй сахарид представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина.
Согласно другому варианту осуществления, инсулин или аналог инсулина ковалентно связан со вторым разветвленным линкером, имеющим первое плечо и второе плечо, где первое плечо соединено с третьим лигандом, которой включает в себя третий сахарид, а второе плечо соединено с четвертым лигандом, который включает в себя четвертый сахарид. Согласно конкретным аспектам, второй разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина, которое не занято первым разветвленным линкером.
Согласно другому варианту осуществления, инсулин или аналог инсулина ковалентно связан с третьим разветвленным линкером, имеющим первое плечо и второе плечо, где первое плечо соединено с пятым лигандом, которой включает в себя пятый сахарид, а второе плечо соединено с шестым лигандом, который включает в себя шестой сахарид. Согласно конкретным аспектам, третий разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина, которое не занято первым разветвленным линкером и вторым разветвленным линкером.
Согласно любому варианту осуществления описанного выше конъюгата, каждый из третьего, четвертого, пятого и шестого сахаридов независимо представляют собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно другому аспекту, молекула инсулина или аналога инсулина дополнительно ковалентно соединена с линейным линкером, содержащим лиганд, который включает в себя сахарид, и указанный сахарид может представлять собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, молекула аналога инсулина представляет собой инсулин лизпро, инсулин гларгин, инсулин аспарт, инсулин детемир или инсулин глулизин.
Согласно любому из описанных выше аспектов или вариантов осуществления, конъюгат характеризуется фармакодинамическим (PD) или фармакокинетическим (PK) профилем, который чувствителен к сывороточной концентрации сывороточного сахарида при введении нуждающемуся в этом субъекту в отсутствие экзогенной сахарид-связывающей молекулы. Согласно конкретным аспектам, сывороточный сахарид представляет собой глюкозу или α-метилманнозу. Согласно конкретным аспектам, указанный конъюгат связывается с эндогенной сахарид-связывающей молекулой при сывороточной концентрации глюкозы, равной 60 мг/дл или меньше, при введении нуждающемуся в этом субъекту. Эндогенная сахарид-связывающая молекула может представлять собой маннозный рецептор 1 человека.
Согласно конкретным аспектам композиции, конъюгат характеризуется общей формулой (I):
 I
I
в которой
(i) в каждом случае появления  представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
(ii) в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
(iii) в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
(iv) в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
(v) -B представляет собой -T-LB-X, где в каждом случае появления X независимо представляет собой лиганд, содержащий сахарид, и в каждом случае появления LB независимо представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
(vi) n равно 1, 2 или 3,
при условии, что по меньшей мере один Х представляет собой фукозу.
Согласно конкретным аспектам композиции, конъюгат характеризуется общей формулой (II):
 II
II
в которой:
(i) в каждом случае появления 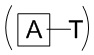 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
(ii) в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
(iii) в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
(iv) в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
(v) -B1 представляет собой -T-LB1-фукозу, где LB1 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с X;
(vi) -B2 представляет собой -T-LB2-X, где X представляет собой лиганд, содержащий сахарид, который может представлять собой фукозу, маннозу или глюкозу; и LB2 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
(vii) n равно 1, 2 или 3.
Согласно конкретным аспектам композиции, бидентатный линкер характеризуется формулой A, B, C, D, E, F, G, H, I, J, K, L, M, N, O, P, Q, R, S, T, U, V, W, X, Y, Z, AA, AB, AC, AD, AE, AF, AG, AH, AI, AJ или AK, представленной выше, где каждый Х независимо представляет собой лиганд, содержащий сахарид, при условии, что по меньшей мере один бидентатный линкер, конъюгированный с инсулином или аналогом инсулина, содержит фукозу по меньшей мере на одном плече бидентатного линкера. Согласно конкретным аспектам, каждый Х может независимо характеризоваться формулой EG, EM, EBM, EGA, EF, EFβ, EBM, ETM, EDG, EDF или EDM, представленной выше.
Дополнительно предусмотрены композиция, содержащая конъюгат, характеризующийся формулой, представленной для IOC-1, IOC-2, IOC-3, IOC-4, IOC-5, IOC-6, IOC-7, IOC-8, IOC-9, IOC-10, IOC-11, IOC-12, IOC-13, IOC-14, IOC-15, IOC-16, IOC-17, IOC-18, IOC-19, IOC-20, IOC-21, IOC-22, IOC-23, IOC-24, IOC-25, IOC-26, IOC-27, IOC-28, IOC-29, IOC-30, IOC-31, IOC-32, IOC-33, IOC-34, IOC-35, IOC-36, IOC-37, IOC-38, IOC-39, IOC-41, IOC-42, IOC-43, IOC-44, IOC-45, IOC-46, IOC-47, IOC-49, IOC-50, IOC-51, IOC-52, IOC-53, IOC-54, IOC-55, IOC-56, IOC-57, IOC-58, IOC-59, IOC-60, IOC-61, IOC-62, IOC-63, IOC-64, IOC-65, IOC-66, IOC-67, IOC-68, IOC-69, IOC-70, IOC-71, IOC-72, IOC-73, IOC-74, IOC-75, IOC-76, IOC-77, IOC-78, IOC-79, IOC-80, IOC-81, IOC-82, IOC-83, IOC-84, IOC-85, IOC-86, IOC-87, IOC-88, IOC-89, IOC-90, IOC-91, IOC-92, IOC-93, IOC-94, IOC-95, IOC-96, IOC-97, IOC-98, IOC-99 или IOC-100, и фармацевтически приемлемый носитель; композиция, содержащая конъюгат, характеризующийся формулой, представленной для IOC-101, IOC-102, IOC-103, IOC-104, IOC-105, IOC-106, IOC-107, IOC-108, IOC-109, IOC-110, IOC-111, IOC-112, IOC-113, IOC-114, IOC-115, IOC-116, IOC-117, IOC-118, IOC-119, IOC-120, IOC-121, IOC-122, IOC-123, IOC-124, IOC-125, IOC-126, IOC-127, IOC-128, IOC-129, IOC-130, IOC-131, IOC-132, IOC-133, IOC-134, IOC-135, IOC-136, IOC-137, IOC-138, IOC-139, IOC-140, IOC-141, IOC-142, IOC-143, IOC-144, IOC-145, IOC-146, IOC-147, IOC-149, IOC-150, IOC-151, IOC-152, IOC-153, IOC-154, IOC-155, IOC-156, IOC-157, IOC-158, IOC-159, IOC-160, IOC-161, IOC-162, IOC-163, IOC-164, IOC-165, IOC-166, IOC-167, IOC-168, IOC-169, IOC-170, IOC-171, IOC-172, IOC-173, IOC-174, IOC-175, IOC-176, IOC-177, IOC-178, IOC-179, IOC-180, IOC-181, IOC-182, IOC-183, IOC-184, IOC-185, IOC-186, IOC-187, IOC-188, IOC-189, IOC-190, IOC-191 или IOC-192, и фармацевтически приемлемый носитель; и композиция, содержащая конъюгат, характеризующийся формулой, представленной для IOC-193, IOC-194, IOC-195, IOC-196, IOC-197, IOC-198, IOC-199, IOC-200, IOC-201, IOC-202, IOC-203, IOC-204, IOC-205, IOC-206, IOC-207, IOC-208, IOC-210, IOC-211, IOC-212, IOC-213, IOC-214, IOC-215, IOC-216, IOC-217, IOC-218, IOC-219, IOC-220, IOC-221, IOC-222, IOC-223, IOC-224, IOC-225, IOC-226, IOC-227, IOC-228, IOC-229, IOC-230, IOC-231, IOC-232, IOC-233, IOC-234, IOC-235, IOC-236, IOC-237, IOC-238, IOC-239, IOC-240, IOC-241, IOC-242, IOC-243, IOC-244, IOC-245, IOC-246, IOC-247, IOC-248, IOC-249, IOC-250, IOC-251, IOC-252, IOC-253, IOC-254, IOC-255, IOC-256, IOC-257, IOC-258, IOC-259, IOC-260, IOC-261, IOC-262, IOC-263, IOC-264, IOC-265, IOC-266, IOC-267, IOC-268, IOC-269, IOC-270, IOC-271 или IOC-272, и фармацевтически приемлемый носитель.
Настоящее изобретение дополнительно относится к использованию композиций, раскрытых в настоящем документе, для лечения сахарного диабета. Согласно конкретным аспектам, сахарный диабет представляет собой сахарный диабет I типа, сахарный диабет II типа или гестационный сахарный диабет.
Настоящее изобретение дополнительно относится к способу лечения субъекта, страдающего сахарным диабетом, включающему в себя: введение субъекту некоторого количества композиции для лечения сахарного диабета, где упомянутая композиция содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему первое плечо и второе плечо, где первое плечо соединено с первым лигандом, включающим в себя первый сахарид, а второе плечо соединено со вторым лигандом, включающим в себя второй сахарид, и где первый сахарид представляет собой фукозу, с получением конъюгата, и фармацевтически приемлемый носитель, для лечения сахарного диабета; где упомянутое введение лечит сахарный диабет. Согласно конкретным аспектам, введенное количество композиции представляет собой эффективное количество или терапевтически эффективное количество.
Как правило, второй сахарид представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина.
Согласно дополнительному варианту осуществления, инсулин или аналог инсулина ковалентно связан со вторым разветвленным линкером, имеющим первое плечо и второе плечо, где первое плечо соединено с третьим лигандом, которой включает в себя третий сахарид, а второе плечо соединено с четвертым лигандом, который включает в себя четвертый сахарид. Согласно конкретным аспектам, второй разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина, которое не занято первым разветвленным линкером.
Согласно дополнительному варианту осуществления, инсулин или аналог инсулина ковалентно связан с третьим разветвленным линкером, имеющим первое плечо и второе плечо, где первое плечо соединено с пятым лигандом, которой включает в себя пятый сахарид, а второе плечо соединено с шестым лигандом, который включает в себя шестой сахарид. Согласно конкретным аспектам, третий разветвленный линкер ковалентно связан с аминокислотой в положении A1 молекулы инсулина или аналога инсулина; в положении B1 молекулы инсулина или аналога инсулина; в положении B29 инсулина или молекулы инсулина; в положении B28 молекулы аналога инсулина; или в положении B3 молекулы аналога инсулина, которое не занято первым разветвленным линкером и вторым разветвленным линкером.
Согласно любому варианту осуществления описанного выше конъюгата, каждый из третьего, четвертого, пятого и шестого сахаридов независимо представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно дополнительному аспекту, молекула инсулина или аналога инсулина дополнительно ковалентно соединена с линейным линкером, содержащим лиганд, который включает в себя сахарид, и указанный сахарид может представлять собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, молекула аналога инсулина представляет собой инсулин лизпро, инсулин гларгин, инсулин аспарт, инсулин детемир или инсулин глулизин.
Согласно любому из описанных выше аспектов или вариантов осуществления, конъюгат характеризуется фармакодинамическим (PD) или фармакокинетическим (PK) профилем, который чувствителен к сывороточной концентрации сывороточного сахарида при введении нуждающемуся в этом субъекту в отсутствие экзогенной сахарид-связывающей молекулы. Согласно конкретным аспектам, сывороточный сахарид представляет собой глюкозу или α-метилманнозу. Согласно конкретным аспектам, указанный конъюгат связывается с эндогенной сахарид-связывающей молекулой при сывороточной концентрации глюкозы, равной 60 мг/дл или меньше, при введении нуждающемуся в этом субъекту. Эндогенная сахарид-связывающая молекула может представлять собой маннозный рецептор 1 человека.
Согласно конкретным аспектам композиции, конъюгат характеризуется общей формулой (I):
 I
I
в которой:
(i) в каждом случае появления 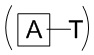 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
(ii) в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
(iii) в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
(iv) в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
(v) -B представляет собой -T-LB-X, где в каждом случае появления X независимо представляет собой лиганд, содержащий сахарид, и в каждом случае появления LB независимо представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
(vi) n равно 1, 2 или 3,
при условии, что по меньшей мере один Х представляет собой фукозу.
Согласно конкретным аспектам композиции, конъюгат характеризуется общей формулой (II):
 II
II
в которой:
(i) в каждом случае появления 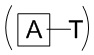 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
(ii) в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
(iii) в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
(iv) в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
(v) -B1 представляет собой -T-LB1-фукозу, где LB1 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с X;
(vi) -B2 представляет собой -T-LB2-X, где X представляет собой лиганд, содержащий сахарид, который может представлять собой фукозу, маннозу или глюкозу; и LB2 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
(vii) n равно 1, 2 или 3.
Согласно конкретным аспектам композиции, бидентатный линкер характеризуется формулой A, B, C, D, E, F, G, H, I, J, K, L, M, N, O, P, Q, R, S, T, U, V, W, X, Y, Z, AA, AB, AC, AD, AE, AF, AG, AH, AI, AJ или AK, представленной выше, где каждый Х независимо представляет собой лиганд, содержащий сахарид, при условии, что по меньшей мере один бидентатный линкер, конъюгированный с инсулином или аналогом инсулина, содержит фукозу по меньшей мере на одном плече бидентатного линкера. Согласно конкретным аспектам, каждый Х может независимо характеризоваться формулой EG, EM, EBM, EGA, EF, EFβ, EBM, ETM, EDG, EDF или EDM, представленной выше.
Настоящее изобретение дополнительно относится к способу лечения субъекта, страдающего сахарным диабетом, включающему в себя: введение субъекту композиции, содержащей конъюгат, характеризующийся формулой, представленной для IOC-1, IOC-2, IOC-3, IOC-4, IOC-5, IOC-6, IOC-7, IOC-8, IOC-9, IOC-10, IOC-11, IOC-12, IOC-13, IOC-14, IOC-15, IOC-16, IOC-17, IOC-18, IOC-19, IOC-20, IOC-21, IOC-22, IOC-23, IOC-24, IOC-25, IOC-26, IOC-27, IOC-28, IOC-29, IOC-30, IOC-31, IOC-32, IOC-33, IOC-34, IOC-35, IOC-36, IOC-37, IOC-38, IOC-39, IOC-41, IOC-42, IOC-43, IOC-44, IOC-45, IOC-46, IOC-47, IOC-49, IOC-50, IOC-51, IOC-52, IOC-53, IOC-54, IOC-55, IOC-56, IOC-57, IOC-58, IOC-59, IOC-60, IOC-61, IOC-62, IOC-63, IOC-64, IOC-65, IOC-66, IOC-67, IOC-68, IOC-69, IOC-70, IOC-71, IOC-72, IOC-73, IOC-74, IOC-75, IOC-76, IOC-77, IOC-78, IOC-79, IOC-80, IOC-81, IOC-82, IOC-83, IOC-84, IOC-85, IOC-86, IOC-87, IOC-88, IOC-89, IOC-90, IOC-91, IOC-92, IOC-93, IOC-94, IOC-95, IOC-96, IOC-97, IOC-98, IOC-99 или IOC-100, и фармацевтически приемлемый носитель, для лечения у субъекта сахарного диабета; к способу лечения субъекта, страдающего сахарным диабетом, включающему в себя: введение субъекту композиции, содержащей конъюгат, характеризующийся формулой, представленной для IOC-101, IOC-102, IOC-103, IOC-104, IOC-105, IOC-106, IOC-107, IOC-108, IOC-109, IOC-110, IOC-111, IOC-112, IOC-113, IOC-114, IOC-115, IOC-116, IOC-117, IOC-118, IOC-119, IOC-120, IOC-121, IOC-122, IOC-123, IOC-124, IOC-125, IOC-126, IOC-127, IOC-128, IOC-129, IOC-130, IOC-131, IOC-132, IOC-133, IOC-134, IOC-135, IOC-136, IOC-137, IOC-138, IOC-139, IOC-140, IOC-141, IOC-142, IOC-143, IOC-144, IOC-145, IOC-146, IOC-147, IOC-149, IOC-150, IOC-151, IOC-152, IOC-153, IOC-154, IOC-155, IOC-156, IOC-157, IOC-158, IOC-159, IOC-160, IOC-161, IOC-162, IOC-163, IOC-164, IOC-165, IOC-166, IOC-167, IOC-168, IOC-169, IOC-170, IOC-171, IOC-172, IOC-173, IOC-174, IOC-175, IOC-176, IOC-177, IOC-178, IOC-179, IOC-180, IOC-181, IOC-182, IOC-183, IOC-184, IOC-185, IOC-186, IOC-187, IOC-188, IOC-189, IOC-190, IOC-191 или IOC-192, и фармацевтически приемлемый носитель, для лечения у субъекта сахарного диабета; и к способу лечения субъекта, страдающего сахарным диабетом, включающему в себя: введение субъекту композиции, содержащей конъюгат, характеризующийся формулой, представленной для IOC-193, IOC-194, IOC-195, IOC-196, IOC-197, IOC-198, IOC-199, IOC-200, IOC-201, IOC-202, IOC-203, IOC-204, IOC-205, IOC-206, IOC-207, IOC-208, IOC-210, IOC-211, IOC-212, IOC-213, IOC-214, IOC-215, IOC-216, IOC-217, IOC-218, IOC-219, IOC-220, IOC-221, IOC-222, IOC-223, IOC-224, IOC-225, IOC-226, IOC-227, IOC-228, IOC-229, IOC-230, IOC-231, IOC-232, IOC-233, IOC-234, IOC-235, IOC-236, IOC-237, IOC-238, IOC-239, IOC-240, IOC-241, IOC-242, IOC-243, IOC-244, IOC-245, IOC-246, IOC-247, IOC-248, IOC-249, IOC-250, IOC-251, IOC-252, IOC-253, IOC-254, IOC-255, IOC-256, IOC-257, IOC-258, IOC-259, IOC-260, IOC-261, IOC-262, IOC-263, IOC-264, IOC-265, IOC-266, IOC-267, IOC-268, IOC-269, IOC-270, IOC-271 или IOC-272, и фармацевтически приемлемый носитель, для лечения у субъекта сахарного диабета.
Согласно любому из описанных выше аспектов или вариантов осуществления способа, сахарный диабет представляет собой сахарный диабет I типа, сахарный диабет II типа или гестационный сахарный диабет.
Настоящее изобретение дополнительно относится к композиции, содержащей конъюгат инсулина или аналога инсулина, где упомянутый конъюгат содержит по меньшей мере одну молекулу фукозы, и указанный конъюгат характеризуется соотношением значений EC50 или IP, определенных посредством анализа фосфорилирования функционального инсулинового рецептора, к значениям IC50 или IP, определенным посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, составляющим приблизительно от 0,5:1 приблизительно до 1:100; приблизительно от 1:1 приблизительно до 1:50; приблизительно от 1:1 приблизительно до 1:20; или приблизительно от 1:1 приблизительно до 1:10; и фармацевтически приемлемый носитель.
Согласно конкретным аспектам, конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему первое плечо и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, и где первый сахарид представляет собой фукозу. Согласно дополнительным аспектам, второй сахарид представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным вариантам осуществления, конъюгат может представлять собой конъюгат, раскрытый в настоящем документе.
Настоящее изобретение дополнительно относится к способу лечения субъекта, страдающего сахарным диабетом, включающему в себя введение субъекту композиции, содержащей конъюгат, включающий фукозу, и характеризующейся соотношением значений EC50 или IP, определенным посредством анализа фосфорилирования функционального инсулинового рецептора, к значениям IC50 или IP, определенным посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, составляющим приблизительно от 0,5:1 приблизительно до 1:100; приблизительно от 1:1 приблизительно до 1:50; приблизительно от 1:1 приблизительно до 1:20; или приблизительно от 1:1 приблизительно до 1:10; и фармацевтически приемлемый носитель, для лечения сахарного диабета.
Согласно конкретным вариантам осуществления, конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему первое плечо и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, и где первый сахарид представляет собой фукозу. Согласно дополнительным аспектам, второй сахарид представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным вариантам осуществления, конъюгат может представлять собой конъюгат, раскрытый в настоящем документе.
Согласно конкретным аспектам, сахарный диабет представляет собой сахарный диабет I типа, сахарный диабет II типа или гестационный сахарный диабет.
ОПРЕДЕЛЕНИЯ
Определения конкретных функциональных групп, химических терминов и общих терминов, используемых на всем протяжении описания, более детально описаны ниже. Применительно к настоящему изобретению, химические элементы определены в соответствии с Периодической Таблицей Элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed., внутренняя обложка, и конкретные функциональные группы, как правило определены, как описано в настоящем документе. Кроме того, общие принципы органической химии, а также конкретные функциональные фрагменты и химическая активность описаны в Organic Chemistry, Thomas Sorrell, University Science Books, Sausalito, 1999; Smith and March March's Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
Ацил - Используемый в настоящем документе термин «ацил» относится к группе, характеризующейся общей формулой -C(=O)RX1, -C(=O)ORX1, -C(=O)-O-C(=O)RX1, -C(=O)SRX1, -C(=O)N(RX1)2, -C(=S)RX1, -C(=S)N(RX1)2 и -C(=S)S(RX1), -C(=NRX1)RX1, -C(=NRX1)ORX1, -C(=NRX1)SRX1 и -C(=NRX1)N(RX1)2, где RX1 представляет собой водород; галоген; замещенный или незамещенный гидроксил; замещенный или незамещенный тиол; замещенный или незамещенный амино; замещенный или незамещенный ацил; циклическую или ациклическую, замещенную или незамещенную, разветвленную или неразветвленную алифатическую группу; циклическую или ациклическую, замещенную или незамещенную, разветвленную или неразветвленную гетероалифатическую группу; циклический или нециклический, замещенный или незамещенный, разветвленный или неразветвленный алкил; циклический или нециклический, замещенный или незамещенный, разветвленный или неразветвленный алкенил; замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, (алифатическая группа)окси, (гетероалифатическая группа)окси, алкилокси, гетероалкилокси, арилокси, гетероарилокси, (алифатическая группа)тиокси, (гетероалифатическая группа)тиокси, алкилтиокси, гетероалкилтиокси, арилтиокси, гетероарилтиокси, моно- или ди-алифатикамино, моно- или ди(гетероалифатическая группа)амино, моно- или диалкиламино, моно- или дигетероалкиламино, моно- или диариламино или моно- или дигетероариламино; или две группы RX1 формируют вместе 5- или 6-членное гетероциклическое кольцо. Иллюстративные ацильные группы включают в себя альдегиды (-CHO), карбоновые кислоты (-CO2H), кетоны, ацилгалогениды, сложные эфиры, амиды, имины, карбонаты, карбаматы и мочевины. Ацильные заместители включают в себя без ограничения любые из заместителей, описанных в настоящем документе, которые приводят к образованию стабильного фрагмента (например, алифатическая группа, алкил, алкенил, алкинил, гетероалифатическая группа, гетероциклическая группа, арил, гетероарил, ацил, оксо, имино, тиооксо, циано, изоциано, амино, азидо, нитро, гидроксил, тиол, галогенид, (алифатическая группа)амино, (гетероалифатическая группа)амино, алкиламино, гетероалкиламино, ариламино, гетероариламино, алкиларил, арилалкил, (алифатическая группа)окси, (гетероалифатическая группа)окси, алкилокси, гетероалкилокси, арилокси, гетероарилокси, (алифатическая группа)тиокси, (гетероалифатическая группа)тиокси, алкилтиокси, гетероалкилтиокси, арилтиокси, гетероарилтиокси, ацилокси и т.п., каждая из которых может быть дополнительно замещена или не замещена).
Алифатическая группа - Используемый в настоящем документе термин «алифатический» или «алифатическая группа» означает необязательно замещенный углеводородный фрагмент, который может быть линейным (т.е., неразветвленным), разветвленным или циклическим («карбоциклическим»), и может быть полностью насыщенным или может содержать одну или несколько единиц ненасыщенности, но не являться ароматическим соединением. Если иное не указано особо, то алифатические группы содержат 1-12 атомов углерода. Согласно некоторым вариантам осуществления, алифатические группы содержат 1-6 атомов углерода. Согласно некоторым вариантам осуществления, алифатические группы содержат 1-4 атома углерода, и согласно еще одним вариантам осуществления, алифатические группы содержат 1-3 атома углерода. Подходящие алифатические группы включают в себя без ограничения неразветвленные или разветвленные, алкильные, алкенильные и алкинильные группы и их гибриды, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
Алкенил - Используемый в настоящем документе термин «алкенил» означает необязательно замещенную моновалентную группу, полученную из неразветвленного или разветвленного алифатического фрагмента, содержащего по меньшей мере одну углерод-углеродную двойную связь, посредством удаления одного атома водорода. Согласно конкретным вариантам осуществления, используемая в настоящем изобретении алкенильная группа содержит 2-6 атомов углерода. Согласно конкретным вариантам осуществления, используемая в настоящем изобретении алкенильная группа содержит 2-5 атомов углерода. Согласно некоторым вариантам осуществления, используемая в настоящем изобретении алкенильная группа содержит 2-4 атома углерода. Согласно другому варианту осуществления, используемая алкенильная группа содержит 2-3 атома углерода. Алкенильные группы включают в себя, например, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил и т.п.
Алкил - Используемый в настоящем документе термин «алкил» относится к необязательно замещенным насыщенным неразветвленным или разветвленным углеводородным радикалам, полученным из алифатического фрагмента, содержащего 1-6 атомов углерода, посредством удаления одного атома водорода. Согласно некоторым вариантам осуществления, используемая в настоящем изобретении алкильная группа содержит 1-5 атомов углерода. Согласно другому варианту осуществления, используемая алкильная группа содержит 1-4 атома углерода. Согласно еще другим вариантам осуществления, алкильная группа содержит 1-3 атома углерода. Согласно еще одному варианту осуществления, алкильная группа содержит 1-2 атома углерода. Примеры алкильных радикалов включают в себя без ограничения метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, втор-пентил, изопентил, трет-бутил, н-пентил, неопентил, н-гексил, втор-гексил, н-гептил, н-октил, н-децил, н-ундецил, додецил и т.п.
Алкинил - Используемый в настоящем документе термин «алкинил» относится к необязательно замещенной моновалентной группе, полученной из неразветвленного или разветвленного алифатического фрагмента, содержащего по меньшей мере одну углерод-углеродную тройную связь, посредством удаления одного атома водорода. Согласно конкретным вариантам осуществления, используемая в настоящем изобретении алкинильная группа содержит 2-6 атомов углерода. Согласно конкретным вариантам осуществления, используемая в настоящем изобретении алкинильная группа содержит 2-5 атомов углерода. Согласно некоторым вариантам осуществления, используемая в настоящем изобретении алкинильная группа содержит 2-4 атома углерода. Согласно другому варианту осуществления, используемая алкинильная группа содержит 2-3 атома углерода. Иллюстративные алкинильные группы включают в себя без ограничения этинил, 2-пропинил (пропаргил), 1-пропинил и т.п.
Арил - Используемый в настоящем документе термин «арил», применяемый отдельно или как часть большего фрагмента, как в терминах «аралкил», «аралкокси» или «арилоксиалкил», относится к необязательно замещенным моноциклическим или бициклическим кольцевым системам, содержащим всего от 5 до 10 кольцевых атомов, где по меньшей мере одно кольцо в системе представляет собой ароматическую группу, и где каждое кольцо в системе содержит от 3 до 7 кольцевых атомов. Термин «арил» может использоваться взаимозаменяемо с термином «арильное кольцо». Согласно конкретным вариантам осуществления настоящего изобретения, термин «арил» относится к ароматической кольцевой системе, которая включает в себя без ограничения фенил, бифенил, нафтил, антрацил и т.п., которые могут содержать один или несколько заместителей.
Арилалкил - Используемый в настоящем документе термин «арилалкил» относится к алкильной группе, замещенной арильной группой (например, ароматической или гетероароматической группой).
Бидентат - молекула, образованная из двух или нескольких молекул, ковалентно связанных вместе в виде единой молекулы.
Двухвалентная углеводородная цепь - Используемый в настоящем документе термин «двухвалентная углеводородная цепь» (также называемая «двухвалентная алкиленовая группа») представляет собой полиметиленовую группу, т.е., -(CH2)z-, где z представляет собой положительное число от 1 до 30, от 1 до 20, от 1 до 12, от 1 до 8, от 1 до 6, от 1 до 4, от 1 до 3, от 1 до 2, от 2 до 30, от 2 до 20, от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 4, или от 2 до 3. Замещенная двухвалентная углеводородная цепь представляет собой полиметиленовую группу, в которой один или несколько атомов водорода метилена замещены заместителем. Подходящие заместители включают заместители, описанные ниже для замещенной алифатической группы.
Карбонил - Используемый в настоящем документе термин «карбонил» относится к моновалентному или двухвалентному фрагменту, содержащему углерод-кислородную двойную связь. Неограничивающие примеры карбонильных групп включают в себя альдегиды, кетоны, карбоновые кислоты, сложный эфир, амид, еноны, ацилгалогениды, ангидриды, мочевины, карбаматы, карбонаты, сложные тиоэфиры, лактоны, лактамы, гидроксаматы, изоцианаты и хлорформиаты.
Циклоалифатическая группа - Используемые в настоящем документе термины «циклоалифатический», «карбоцикл» или «карбоциклический», применяемые отдельно или как часть большего фрагмента, относятся к необязательно замещенным насыщенным или частично ненасыщенным циклическим алифатическим моноциклическим или бициклическим кольцевым системам, описанным в настоящем документе, содержащим от 3 до 10 атомов. Циклоалифатические группы включают в себя без ограничения циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклогептенил, циклооктил, циклооктенил или циклооктадиенил. Согласно некоторым вариантам осуществления, циклоалкил содержит 3-6 атомов углерода.
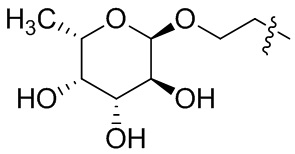
Фукоза - относится к D или L форме фукозы и может относиться к гликозиду, связанному с кислородом или углеродом.
Галоген - Используемые в настоящем документе термины «галогенид» и «галоген» относятся к атому, выбранному из фтора (фтор, -F), хлора (хлор, -Cl), брома (бром, -Br) и йода (йод, -I).
Гетероалифатическая группа - Используемые в настоящем документе термины «гетероалифатический» или «гетероалифатическая группа» означают необязательно замещенный углеводородный фрагмент, содержащий в дополнение к атомам углерода от 1 до 5 гетероатомов, который может быть линейным (т.е., неразветвленным), разветвленным или циклическим («гетероциклическим»), и может быть полностью насыщенным или может содержать одну или несколько единиц ненасыщения, но не является ароматическим соединением. Если иное не указано особо, то гетероалифатические группы содержат 1-6 атомов углерода, где 1-3 атома углерода необязательно и независимо заменены гетероатомами, выбранными из кислорода, азота и серы. Согласно некоторым вариантам осуществления, гетероалифатические группы содержат 1-4 атома углерода, где 1-2 атома углерода необязательно и независимо заменены гетероатомами, выбранными из кислорода, азота и серы. Согласно еще одним вариантам осуществления, гетероалифатические группы содержат 1-3 атома углерода, где 1 атом углерода необязательно и независимо заменен гетероатомом, выбранным из кислорода, азота и серы. Подходящие гетероалифатические группы включают в себя без ограничения неразветвленные или разветвленные, гетероалкильные, гетероалкенильные и гетероалкинильные группы.
Гетероаралкил - Используемый в настоящем документе термин «гетероаралкил» относится к алкильной группе, замещенной гетероарилом, в которой алкильная и гетероарильная части независимо и необязательно замещены.
Гетероарил - Используемый в настоящем документе термин «гетероарил», используемый отдельно или как часть большего фрагмента, например «гетероаралкил» или «гетероаралкокси», относится к необязательно замещенной группе, содержащей от 5 до 10 кольцевых атомов, предпочтительно 5, 6 или 9 кольцевых атомов; содержащей 6, 10 или 14 π электронов, принимающих участие в циклическом построении; и содержащей в дополнение к атомам углерода от 1 до 5 гетероатомов. Гетероарильные группы включают в себя без ограничения тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пуринил, нафтиридинил и птеридинил. Используемые в настоящем документе термины «гетероарил» и «гетероар-» также включают в себя группы, в которых гетероароматическое кольцо конденсировано с одним или несколькими арильными, карбоциклическими или гетероциклическими кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Неограничивающие примеры включают в себя индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4H-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил и тетрагидроизохинолинил. Гетероарильная группа может быть моно- или бициклической. Термин «гетероарил» может использоваться взаимозаменяемо с терминами «гетероарильное кольцо», «гетероарильная группа» или «гетероароматический», причем каждый из указанных терминов включает в себя кольца, которые необязательно замещены.
Гетероатом - Используемый в настоящем документе термин «гетероатом» относится к азоту, кислороду или сере, и включает в себя любую окисленную форму азота или серы и любую кватернизованную форму основного азота. Термин «азот» также включает в себя замещенный азот.
Гетероциклическая группа - Используемые в настоящем документе термины «гетероцикл», «гетероциклил», «гетероциклический радикал» и «гетероциклическое кольцо» используются взаимозаменяемо и относятся к стабильному необязательно замещенному 5-7-членному моноциклическому или 7-10-членному бициклическому гетероциклическому фрагменту, который может быть как насыщенным, так и частично ненасыщенным, и который содержит в дополнение к атомам углерода один или несколько гетероатомов, определенных выше. Гетероциклическое кольцо может быть присоединено к его боковой группе по любому гетероатому или атому углерода, что приводит к стабильной структуре, и любые из кольцевых атомов могут быть необязательно замещены. Примеры таких насыщенных или частично ненасыщенных гетероциклических радикалов включают в себя без ограничения тетрагидрофуранил, тетрагидротиенил, пирролидинил, пирролидонил, пиперидинил, пирролинил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, оксазолидинил, пиперазинил, диоксанил, диоксоланил, диазепинил, оксазепинил, тиазепинил, морфолинил и хинуклидинил. Термины «гетероцикл», «гетероциклил», «гетероциклическое кольцо», «гетероциклическая группа», «гетероциклический фрагмент» и «гетероциклический радикал» используются взаимозаменяемо в настоящем документе, и также включают в себя группы, в которых гетероциклильное кольцо конденсировано с одним или несколькими арильными, гетероарильными или карбоциклическими кольцами, такими как индолинил, 3H-индолил, хроманил, фенантридинил или тетрагидрохинолинил, где радикал или точка присоединения находится на гетероциклильном кольце. Гетероциклильная группа может быть моно- или бициклической. Термин «гетероциклилалкил» относится к алкильной группе, замещенной гетероциклилом, в которой алкильная и гетероциклильная части независимо и необязательно замещены.
Ненасыщенный - Используемый в настоящем документе термин «ненасыщенный» означает, что фрагмент содержит одну или несколько двойных или тройных связей.
Частично ненасыщенный - Используемый в настоящем документе термин «частично ненасыщенный» относится к кольцевому фрагменту, который содержит по меньшей мере одну двойную или тройную связь. Термин «частично ненасыщенный» предназначен для охвата колец, имеющих множество точек ненасыщения, но не предполагает включение арильных или гетероарильных фрагментов, определенных в настоящем документе.
Необязательно замещенный - Как описано в настоящем документе, соединения согласно настоящему изобретению могут содержать «необязательно замещенные» фрагменты. В общем, термин «замещенный», как с предшествующим термином «необязательно», так и без него, означает, что один или несколько атомов водорода обозначенного фрагмента заменены подходящим заместителем. Если иное не указано особо, то «необязательно замещенная» группа может содержать подходящий заместитель в каждом возможном для замещения положении группы, и если более чем одно положение в любой данной структуре может быть замещено более чем одним заместителем, выбранным из определенной группы, то в каждом положении заместитель может быть как тем же самым, так и другим. Сочетания заместителей, предусмотренные настоящим изобретением, предпочтительно представляют собой сочетания, которые приводят к образованию стабильных или химически возможных соединений. Используемый в настоящем документе термин «стабильный» относится к соединениям, которые по существу не изменяются, будучи подвергнутыми определенным условиям, делающим возможным их получение, определение и, согласно конкретным вариантам осуществления, их восстановление, очистку и применение для одной или нескольких целей, раскрытых в настоящем документе.
Подходящие моновалентные заместители на возможном для замещения атоме углерода «необязательно замещенной» группы независимо представляют собой галоген; -(CH2)0-4R°; -(CH2)0-4OR°; -O-(CH2)0-4C(O)OR°; -(CH2)0-4CH(OR°)2; -(CH2)0-4SR°; -(CH2)0-4Ph, который может быть замещен R°; -(CH2)0-4O(CH2)0-1Ph, который может быть замещен R°; -CH=CHPh, который может быть замещен R°; -NO2; -CN; -N3; -(CH2)0-4N(R°)2; -(CH2)0-4N(R°)C(O)R°; -N(R°)C(S)R°; -(CH2)0-4N(R°)C(O)NR°2; -N(R°)C(S)NR°2; -(CH2)0-4N(R°)C(O)OR°; -N(R°)N(R°)C(O)R°; -N(R°)N(R°)C(O)NR°2; -N(R°)N(R°)C(O)OR°; -(CH2)0-4C(O)R°; -C(S)R°; -(CH2)0-4C(O)OR°; -(CH2)0-4C(O)SR°; -(CH2)0-4C(O)OSiR°3; -(CH2)0-4OC(O)R°; -OC(O)(CH2)0-4SR-, SC(S)SR°; -(CH2)0-4SC(O)R°; -(CH2)0-4C(O)NR°2; -C(S)NR°2; -C(S)SR°; -SC(S)SR°, -(CH2)0-4OC(O)NR°2; -C(O)N(OR°)R°; -C(O)C(O)R°; -C(O)CH2C(O)R°; -C(NOR°)R°; -(CH2)0-4SSR°; -(CH2)0-4S(O)2R°; -(CH2)0-4S(O)2OR°; -(CH2)0-4OS(O)2R°; -S(O)2NR°2; -(CH2)0-4S(O)R°; -N(R°)S(O)2NR°2; -N(R°)S(O)2R°; -N(OR°)R°; -C(NH)NR°2; -P(O)2R°; -P(O)R°2; -OP(O)R°2; -OP(O)(OR°)2; SiR°3; -(C1-4 неразветвленный или разветвленный алкилен)O-N(R°)2; или -(C1-4-неразветвленный или разветвленный алкилен)C(O)O-N(R°)2, где каждый R° может быть замещен, как определено ниже, и независимо представляет собой водород, C1-6алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или безотносительно представленному вы определению, два независимых R° формируют вместе с их промежуточными атомами 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, которые могут быть замещены, как определено ниже.
Подходящие моновалентные заместители на R° (или кольце, образованном путем объединения двух независимых R° вместе с их промежуточными атомами) независимо представляют собой галоген, -(CH2)0-2R•, -(галогенR•), -(CH2)0-2OH, -(CH2)0-2OR•, -(CH2)0-2CH(OR•)2; -O(галогенR•), -CN, -N3, -(CH2)0-2C(O)R•, -(CH2)0-2C(O)OH, -(CH2)0-2C(O)OR•, -(CH2)0-2SR•, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHR•, -(CH2)0-2NR•2, -NO2, -SiR•3, -OSiR•3, -C(O)SR•, -(C1-4неразветвленный или разветвленный алкилен)C(O)OR• или -SSR•, где каждый R• не замещен, или, при наличии предшествующего термина «галоген», замещен только одним или несколькими галогенами, и независимо выбирают из C1-4алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители на насыщенном атоме углерода R° включают в себя =O и =S.
Подходящие двухвалентные заместители на насыщенном атоме углерода «необязательно замещенной» группы включают в себя следующие: =O, =S, =NNR*2, =NNHC(O)R*, =NNHC(O)OR*, =NNHS(O)2R*, =NR*, =NOR*, -O(C(R*2))2-3O- или -S(C(R*2))2-3S-, где каждый R* независимо выбирают из водорода, C1-6алифатической группы, которая может быть замещена, как определено ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители, которые связаны со смежными возможными для замещения углеродами «необязательно замещенной» группы включают в себя -O(CR*2)2-3O-, где каждый R* независимо выбирают из водорода, C1-6алифатической группы, которая может быть замещена, как определено ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на алифатической группе R* включают в себя галоген, -R•, -(галогенR•), -OH, -OR•, -O(галогенR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый R• не замещен, или, при наличии предшествующего термина «галоген», замещен только одним или несколькими галогенами, и независимо представляет собой C1-4алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на возможном для замещения азоте «необязательно замещенной» группы включают в себя -R†, -NR†2, -C(O)R†, -C(O)OR†, -C(O)C(O)R†, -C(O)CH2C(O)R†, -S(O)2R†, -S(O)2NR†2, -C(S)NR†2, -C(NH)NR†2 или -N(R†)S(O)2R†; где каждый R† независимо представляет собой водород, C1-6алифатическую группу, которая может быть замещена, как определено ниже, незамещенный -OPh или незамещенное 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или безотносительно представленному выше определению, два независимых R† формируют вместе с их промежуточными атомами незамещенное 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на алифатической группе R† независимо представляют собой галоген, -R•, -(галогенR•), -OH, -OR•, -O(галогенR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый R• не замещен, или, при наличии предшествующего термина «галоген», замещен только одним или несколькими галогенами, и независимо представляет собой C1-4алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящая защитная группа - Используемый в настоящем документе термин «подходящая защитная группа» относится к амино-защитным группам или гидрокси-защитным группам, в зависимости от их локализации в пределах соединения, и включает в себя группы, подробно описанные в Protecting Groups in Organic Synthesis, T. W. Greene and P. G. M. Wuts, 3rd edition, John Wiley & Sons, 1999.
Подходящие амино-защитные группы включают в себя метилкарбамат, этилкарбамат, 9-флуоренметилкарбамат (Fmoc), 9-(2-сульфо)флуоренметилкарбамат, 9-(2,7-дибром)флуоренметилкарбамат, 2,7-ди-трет-бутил-[9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)]метилкарбамат (DBD-Tmoc), 4-метоксифенацилкарбамат (Phenoc), 2,2,2-трихлорэтилкарбамат (Troc), 2-триметилсилилэтилкарбамат (Teoc), 2-фенилэтилкарбамат (hZ), 1-(1-адамантил)-1-метилэтилкарбамат (Adpoc), 1,1-диметил-2-галогенэтилкарбамат, 1,1-диметил-2,2-дибромэтилкарбамат (DB-t-BOC), 1,1-диметил-2,2,2-трихлорэтилкарбамат (TCBOC), 1-метил-1-(4-бифенилил)этилкарбамат (Bpoc), 1-(3,5-ди-трет-бутилфенил)-1-метилэтилкарбамат (t-Bumeoc), 2-(2'- и 4'-пиридил)этилкарбамат (Pyoc), 2-(N,N-дициклогексилкарбоксамидо) этилкарбамат, трет-бутилкарбамат (BOC), 1-адамантилкарбамат (Adoc), винилкарбамат (Voc), аллилкарбамат (Alloc), 1-изопропилаллилкарбамат (Ipaoc), циннамилкарбамат (Coc), 4-нитроциннамилкарбамат (Noc), 8-хинолилкарбамат, N-гидроксипиперидинилкарбамат, алкилдитиокарбамат, бензилкарбамат (Cbz), пара-метоксибензилкарбамат (Moz), пара-нитробензилкарбамат, пара-бромбензилкарбамат, пара-хлорбензилкарбамат, 2,4-дихлорбензилкарбамат, 4-метилсульфинилбензилкарбамат (Msz), 9-антрилметилкарбамат, дифенилметилкарбамат, 2-метилтиоэтилкарбамат, 2-метилсульфонилэтилкарбамат, 2-(пара-толуолсульфонил)этилкарбамат, [2-(1,3-дитианил)]метилкарбамат (Dmoc), 4-метилтиофенилкарбамат (Mtpc), 2,4-диметилтиофенилкарбамат (Bmpc), 2-фосфониоэтилкарбамат (Peoc), 2-трифенилфосфониоизопропилкарбамат (Ppoc), 1,1-диметил-2-цианоэтилкарбамат, мета-хлор-пара-ацилоксибензилкарбамат, пара-(дигидроксиборил)бензилкарбамат, 5-бензизоксазолилметилкарбамат, 2-(трифторметил)-6-хромонилметилкарбамат (Tcroc), мета-нитрофенилкарбамат, 3,5-диметоксибензилкарбамат, орто-нитробензилкарбамат, 3,4-диметокси-6-нитробензилкарбамат, фенил(орто-нитрофенил)метилкарбамат, фенотиазинил-(10)-карбонильное производное, N'-пара-толуолсульфониламинокарбонильное производное, N'-фениламинотиокарбонильное производное, трет-амилкарбамат, S-бензилтиокарбамат, пара-цианобензилкарбамат, циклобутилкарбамат, циклогексилкарбамат, циклопентилкарбамат, циклопропилметилкарбамат, пара-децилоксибензилкарбамат, 2,2-диметоксикарбонилвинилкарбамат, орто-(N,N-диметилкарбоксамидо)бензилкарбамат, 1,1-диметил-3-(N,N-диметилкарбоксамидо)пропилкарбамат, 1,1-диметилпропинилкарбамат, ди(2-пиридил)метилкарбамат, 2-фуранилметилкарбамат, 2-йодэтилкарбамат, изоборинилкарбамат, изобутилкарбамат, изоникотинилкарбамат, пара-(пара'-метоксифенилазо)бензилкарбамат, 1-метилциклобутилкарбамат, 1-метилциклогексилкарбамат, 1-метил-1-циклопропилметилкарбамат, 1-метил-1-(3,5-диметокифенил)этилкарбамат, 1-метил-1-(пара-фенилазофенил)этилкарбамат, 1-метил-1-фенилэтилкарбамат, 1-метил-1-(4-пиридил)этилкарбамат, фенилкарбамат, пара-(фенилазо)бензилкарбамат, 2,4,6-три-трет-бутилфенилкарбамат, 4-(триметиламмоний)бензилкарбамат, 2,4,6-триметилбензилкарбамат, формамид, ацетамид, хлорацетамид, трихлорацетамид, трифторацетамид, фенилацетамид, 3-фенилпропанамид, пиколинамид, 3-пиридилкарбоксамид, N-бензоилфенилаланильное производное, бензамид, пара-фенилбензамид, орто-нитрофенилацетамид, орто-нитрофеноксиацетамид, ацетоацетамид, (N'-дитиобензилоксикарбониламино)ацетамид, 3-(пара-гидроксифенил)пропанамид, 3-(орто-нитрофенил)пропанамид, 2-метил-2-(орто-нитрофенокси)пропанамид, 2 метил-2-(орто-фенилазофенокси)пропанамид, 4-хлорбутанамид, 3-метил-3-нитробутанамид, орто-нитроциннамид, производное N-ацетилметионина, орто-нитробензамид, орто-(бензоилоксиметил)бензамид, 4,5-дифенил-3-оксазолин-2-он, N-фталимид, N-дитиасукцинимид (Dts), N-2,3-дифенилмалеимид, N-2,5-диметилпиррол, N-1,1,4,4-тетраметилдисилилазациклопентановый аддукт (STABASE), 5-замещенный 1,3-диметил-1,3,5-триазациклогексан-2-он, 5-замещенный 1,3-дибензил-1,3,5-триазациклогексан-2-он, 1-замещенный 3,5-динитро-4-пиридон, N-метиламин, N-аллиламин, N-[2-(триметилсилил)этокси]метиламин (SEM), N-3-ацетоксипропиламин, N-(1-изопропил-4-нитро-2-оксо-3-пирролин-3-ил)амин, четвертичные соли аммония, N-бензиламин, N-ди(4-метоксифенил)метиламин, N-5-дибензосубериламин, N-трифенилметиламин (Tr), N-[(4-метоксифенил)дифенилметил]амин (MMTr), N-9-фенилфлуоренамин (PhF), N-2,7-дихлор-9-флуоренметиленамин, N-ферроценилметиламино (Fcm), N-2-пиколиламино-N'-оксид, N-1,1-диметилтиометиленамин, N-бензилиденамин, N-пара-метоксибензилиденамин, N-дифенилметиленамин, N-[(2-пиридил)меситил]метиленамин, N-(N',N'-диметиламинометилен)амин, N,N'-изопропилидендиамин, N-пара-нитробензилиденамин, N-салицилиденамин, N-5-хлорсалицилиденамин, N-(5-хлор-2-гидроксифенил)фенилметиленамин, N-циклогексилиденамин, N-(5,5-диметил-3-оксо-1-циклогексенил)амин, производное N-борана, производное N-дифенилбориновой кислоты, N-[фенил(пентакарбонилхром- или вольфрам)карбонил]амин, хелат N-меди, хелат N-цинка, N-нитроамин, N-нитрозоамин, амин-N-оксид, дифенилфосфинамид (Dpp), диметилтиофосфинамид (Mpt), дифенилтиофосфинамид (Ppt), диалкилфосфорамидаты, дибензилфосфорамидат, дифенилфосфорамидат, бензолсульфенамид, орто-нитробензолсульфенамид (Nps), 2,4-динитробензолсульфенамид, пентахлорбензолсульфенамид, 2-нитро-4-метоксибензолсульфенамид, трифенилметилсульфенамид, 3-нитропиридинсульфенамид (Npys), пара-толуолсульфонамид (Ts), бензолсульфонамид, 2,3,6,-триметил-4-метоксибензолсульфонамид (Mtr), 2,4,6-триметоксибензолсульфонамид (Mtb), 2,6-диметил-4-метоксибензолсульфонамид (Pme), 2,3,5,6-тетраметил-4-метоксибензолсульфонамид (Mte), 4-метоксибензолсульфонамид (Mbs), 2,4,6-триметилбензолсульфонамид (Mts), 2,6-диметокси-4-метилбензолсульфонамид (iMds), 2,2,5,7,8-пентаметилхроман-6-сульфонамид (Pmc), метансульфонамид (Ms), β-триметилсилилэтансульфонамид (SES), 9-антраценсульфонамид, 4-(4',8'-диметоксинафтилметил)бензолсульфонамид (DNMBS), бензилсульфонамид, трифторметилсульфонамид и фенацилсульфонамид.
Подходящие гидрокси-защитные группы включают в себя метил, метоксиметил (MOM), метилтиометил (MTM), трет-бутилтиометил, (фенилдиметилсилил)метоксиметил (SMOM), бензилоксиметил (BOM), пара-метоксибензилоксиметил (PMBM), (4-метоксифенокси)метил (пара-AOM), гваяколметил (GUM), трет-бутоксиметил, 4-пентенилоксиметил (POM), силоксиметил, 2-метоксиэтоксиметил (MEM), 2,2,2-трихлорэтоксиметил, бис(2-хлорэтокси)метил, 2-(триметилсилил)этоксиметил (SEMOR), тетрагидропиранил (THP), 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетрагидропиранил (MTHP), 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил S,S-диоксид, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил (CTMP), 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидрофуранил, 2,3,3a,4,5,6,7,7a-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил, 1-этоксиэтил, 1-(2-хлорэтокси)этил, 1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, пара-хлорфенил, пара-метоксифенил, 2,4-динитрофенил, бензил, пара-метоксибензил, 3,4-диметоксибензил, орто-нитробензил, пара-нитробензил, пара-галобензил, 2,6-дихлорбензил, пара-цианобензил, пара-фенилбензил, 2-пиколил, 4-пиколил, 3-метил-2-пиколил-N-оксидо, дифенилметил, p,p'-динитробензгидрил, 5-дибензосуберил, трифенилметил, α-нафтилдифенилметил, пара-метоксифенилдифенилметил, ди(пара-метоксифенил)фенилметил, три(пара-метоксифенил)метил, 4-(4'-бромфенацилоксифенил)дифенилметил, 4,4',4''-трис(4,5-дихлорфталимидофенил)метил, 4,4',4''-трис(левулиноилоксифенил)метил, 4,4',4''-трис(бензоилоксифенил)метил, 3-(имидазол-1-ил)бис(4',4''-диметоксифенил)метил, 1,1-бис(4-метоксифенил)-1'-пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил, бензизотиазолил S,S-диоксидо, триметилсилил (TMS), триэтилсилил (TES), триизопропилсилил (TIPS), диметилизопропилсилил (IPDMS), диэтилизопропилсилил (DEIPS), диметилтексилсилил, трет-бутилдиметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), трибензилсилил, три-пара-ксилилсилил, трифенилсилил, дифенилметилсилил (DPMS), трет-бутилметоксифенилсилил (TBMPS), формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, пара-хлорфеноксиацетат, 3-фенилпропионат, 4-оксопентаноат (левулинат), 4,4-(этилендитио)пентаноат (левулиноилдитиоацеталь), пивалоат, адамантоат, кротонат, 4-метоксикротонат, бензоат, пара-фенилбензоат, 2,4,6-триметилбензоат (мезитоат), алкилметилкарбонат, 9-флуоренметилкарбонат (Fmoc), алкилэтилкарбонат, алкил 2,2,2-трихлорэтилкарбонат (Troc), 2-(триметилсилил)этилкарбонат (TMSEC), 2-(фенилсульфонил)этилкарбонат (Psec), 2-(трифенилфосфонио)этилкарбонат (Peoc), алкилизобутилкарбонат, алкилвинилкарбонат, алкилаллилкарбонат, алкил-пара-нитрофенилкарбонат, алкилбензилкарбонат, алкил-пара-метоксибензилкарбонат, алкил-3,4-диметоксибензилкарбонат, алкил-орто-нитробензилкарбонат, алкил-пара-нитробензилкарбонат, алкил-S-бензилтиокарбонат, 4-этокси-1-нафтилкарбонат, метилдитиокарбонат, 2-йодбензоат, 4-азидобутират, 4-нитро-4-метилпентаноат, орто-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этил, 4-(метилтиометокси)бутират, 2-(метилтиометоксиметил)бензоат, 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (E)-2-метил-2-бутеноат, орто-(метоксикарбонил)бензоат, α-нафтоат, нитрат, алкил-N,N,N',N'-тетраметилфосфородиамидат, алкил-н-фенилкарбамат, борат, диметилфосфинотиоил, алкил-2,4-динитрофенилсульфонат, сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат (Ts). Защитные группы для защиты 1,2- или 1,3-диолов включают в себя метиленацеталь, этилиденацеталь, 1-трет-бутилэтилиденкеталь, 1-фенилэтилиденкеталь, (4-метоксифенил)этилиденацеталь, 2,2,2-трихлорэтилиденацеталь, ацетонид, циклопентилиденкеталь, циклогексилиденкеталь, циклогептилиденкеталь, бензилиденацеталь, пара-метоксибензилиденацеталь, 2,4-диметоксибензилиденкеталь, 3,4- диметоксибензилиденацеталь, 2-нитробензилиденацеталь, метоксиметиленацеталь, этоксиметиленацеталь, сложный диметоксиметиленортоэфир, сложный 1-метоксиэтилиденортоэфир, сложный 1-этоксиэтилиденортоэфир, сложный 1,2-диметоксиэтилиденортоэфир, сложный α-метоксибензилиденортоэфир, производное 1-(N,N-диметиламино)этилидена, производное α-(N,N'-диметиламино)бензилидена, сложный 2-оксациклопентилиденортоэфир, ди-трет-бутилсилиленовую группу (DTBS), производное 1,3-(1,1,3,3-тетраизопропилдисилоксанилидена) (TIPDS), производное тетра-трет-бутоксидисилоксан-1,3-диилидена (TBDS), циклические карбонаты, циклические боронаты, этилборонат и фенилборонат.
В любом случае, если показано, что химическая переменная (например, R группа) присоединена к связи, которая пересекает кольцевую связь, то это означает, что одна или несколько переменных необязательно присоединены к кольцу, имеющему перекрестную связь. Каждая R группа на таком кольце может быть присоединена по любому подходящему положению кольца, под этим, как правило, понимают, что группа присоединена вместо атома водорода на исходном кольце. Это также включает возможность того, что две R группы могут быть присоединены к одному и тому же кольцевому атому. Кроме того, если на кольце присутствует больше одной R группы, то каждая может быть такой же или отличной от других R групп, присоединенных к кольцу, и каждая группа определяется независимо от других групп, которые могут быть присоединены где-либо еще на той же молекуле, даже если они могут быть представлены одним и тем же условным обозначением.
Биоразлагаемый - Используемый в настоящем документе термин «биоразлагаемый» относится к молекулам, которые распадаются (т.е., теряют по меньшей мере какую-либо часть их ковалентной структуры) в физиологических или эндосомальных условиях. Биоразлагаемые молекулы не обязательно являются гидролитически разлагаемыми и могут нуждаться в ферментативном воздействии для распада.
Биомолекула - Используемый в настоящем документе термин «биомолекула» относится к молекулам (например, полипептидам, аминокислотам, полинуклеотидам, нуклеотидам, полисахаридам, сахарам, липидам, нуклеопротеинам, гликопротеинам, липопротеинам, стероидам, метаболитам и т.п.), как естественного происхождения, так и созданным искусственно (например, посредством синтетических или рекомбинантных способов), которые, как правило, обнаруживаются в клетках или тканях. Конкретные классы биомолекул включают в себя без ограничения ферменты, рецепторы, нейротрансмиттеры, гормоны, цитокины, модификаторы клеточного ответа, такие как факторы роста и хемотаксические факторы, антитела, вакцины, гаптены, токсины, интерфероны, рибозимы, антисмысловые вещества, плазмиды, ДНК и РНК.
Лекарство - Используемый в настоящем документе термин «лекарство» относится к малым молекулам или биомолекулам, которые изменяют, ингибируют, активируют или иным образом воздействуют на биологическое событие. Например, лекарства могут включать в себя без ограничения средства против СПИДа, противораковые средства, антибиотики, противодиабетические средства, иммуносупрессанты, противовирусные средства, ингибиторы ферментов, нейротоксины, опиоиды, снотворные средства, антигистаминные средства, смазки, транквилизаторы, антиконвульсанты, мышечные релаксанты и средства против болезни Паркинсона, противоспазматическе средства и мышечные контрактанты, включая блокаторы каналов, миотики и антихолинэргические средства, средства против глаукомы, противопаразитарные и/или антипротозойные соединения, модуляторы взаимодействия клетки и внеклеточного матрикса, включая ингибиторы роста клеток и антиадгезивные молекулы, вазодилятирующие средства, ингибиторы синтеза ДНК, РНК и белка, антигипертензивные средства, анальгетики, антипиретики, стероидные и нестероидные противовоспалительные средства, антиангиогенные факторы, противосекреторные факторы, антикоагулянты и/или противотромботические средства, местные анестетики, офтальмологические средства, простагландины, антидепрессанты, антипсихотические средства, противорвотные средства и радиофармацевтические препараты. Более полный перечень иллюстративных лекарств, подходящих для использования согласно настоящему изобретению, может быть найден в “Pharmaceutical Substances: Syntheses, Patents, Applications” by Axel Kleemann and Jurgen Engel, Thieme Medical Publishing, 1999; the “Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals”, edited by Susan Budavari et al., CRC Press, 1996 и the United States Pharmacopeia-25/National Formulary-20, published by the United States Pharmcopeial Convention, Inc., Rockville MD, 2001.
Экзогенный - Используемый в настоящем документе термин «экзогенная» молекула представляет собой молекулу, которая не присутствует в значимых количествах у пациента, не будучи введенной пациенту. Согласно конкретным вариантам осуществления, пациент представляет собой млекопитающее, например, человека, собаку, кошку, крысу, карликовую свинью и т.п. Согласно настоящему документу, молекула не присутствует в значимых количествах у пациента, если в нормальной сыворотке упомянутого типа пациента содержится менее 0,1 мМ молекул. Согласно конкретным вариантам осуществления, в нормальной сыворотке пациента может содержаться менее 0,08 мМ, менее 0,06 мМ или менее 0,04 мМ молекул.
Сверхразветвленный - Используемый в настоящем документе термин «сверхразветвленная» структура представляет собой ковалентную структуру, которая включает по меньшей мере одну разветвленную ветвь (например, дендримерную структуру). Сверхразветвленная структура может включать в себя полимерные и/или неполимерные вещества.
Нормальная сыворотка - Используемый в настоящем документе термин «нормальная сыворотка» представляет собой сыворотку, полученную посредством объединения приблизительно равных количеств жидкой части коагулированной цельной крови от пяти или более недиабетических пациентов. Недиабетический пациент-человек представляет собой случайно выбранного взрослого 18-30 лет, у которого отсутствуют симптомы диабета на момент взятия крови.
Полимер - Используемый в настоящем документе термин «полимер» или «полимерная структура» представляет собой структуру, которая включает цепь ковалентно связанных мономеров. Полимер может быть получен из мономеров одного типа или из мономеров нескольких типов. Поэтому, термин «полимер» охватывает сополимеры, включая блок-сополимеры, в которых в общем объеме полимера по отдельности сгруппированы различные типы мономеров. Полимер может быть линейным или разветвленным.
Полинуклеотид - Используемый в настоящем документе термин «полинуклеотид» представляет собой полимер из нуклеотидов. Термины «полинуклеотид», «нуклеиновая кислота» и «олигонуклеотид» могут использоваться взаимозаменяемо. Полимер может включать в себя природные нуклеозиды (т.е., аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин), аналоги нуклеозидов (например, 2-аминоаденозин, 2-тиотимидин, инозин, пирролопиримидин, 3-метиладенозин, 5-метилцитидин, C5-бромуридин, C5-фторуридин, C5-йодуридин, C5-пропинилуридин, C5-пропинилцитидин, C5-метилцитидин, 7-деазааденозин, 7-деазагуанозин, 8-оксоаденозин, 8-оксогуанозин, O(6)-метилгуанин, 4-ацетилцитидин, 5-(карбоксигидроксиметил)уридин, дигидроуридин, метилпсевдоуридин, 1-метиладенозин, 1-метилгуанозин, N6-метиладенозин и 2-тиоцитидин), химически модифицированные основания, биологически модифицированные основания (например, метилированные основания), интеркалированные основания, модифицированные сахара (например, 2'-фторрибоза, рибоза, 2'-деоксирибоза, 2'-O-метилцитидин, арабиноза и гексоза) или модифицированные фосфатные группы (например, фосфоротиоаты и 5'-N-фосфорамидитные сцепления).
Полипептид - Используемый в настоящем документе термин «полипептид» представляет собой полимер из аминокислот. Термины «полипептид», «протеин», «олигопептид» и «пептид» могут использоваться взаимозаменяемо. Полипептиды могут содержать натуральные аминокислоты, искусственные аминокислоты (т.е., соединения, которые не встречаются в природе, но которые могут быть включены в состав полипептидной цепи) и/или аналоги аминокислот, которые известны в данной области техники. Кроме того, один или несколько аминокислотных остатков в полипептиде могут быть модифицированы, например, посредством добавления химического структурного элемента, такого как углеводная группа, фосфатная группа, фарнезильная группа, изофарнезильная группа, группа жирной кислоты, линкер для конъюгации, функционализации или другой модификации и т.п. Упомянутые модификации могут включать в себя циклизацию пептида, включение в состав D-аминокислот и т.п.
Полисахарид - Используемый в настоящем документе термин «полисахарид» представляет собой полимер из сахаридов. Термины «полисахарид», «углевод» и «олигосахарид» могут использоваться взаимозаменяемо. Полимер может включать в себя природные сахариды (например, арабинозу, ликсозу, рибозу, ксилозу, рибулозу, ксилулозу, аллозу, алтрозу, галактозу, глюкозу, гулозу, идозу, маннозу, талозу, фруктозу, псикозу, сорбозу, тагатозу, манногептулозу, седогептулозу, октодозу и сиалозу) и/или модифицированные сахариды (например, 2'-фторрибозу, 2'-деоскидибозу и гексозу). Иллюстративные дисахариды включают в себя сахарозу, лактозу, мальтозу, трегалозу, гентиобиозу, изомальтозу, койибиозу, ламинарибиозу, маннобиозу, мелибиозу, нигерозу, рутинозу и ксилобиозу.
Малая молекула - Используемый в настоящем документе термин «малая молекула» относится к молекулам, как естественного происхождения, так и созданным искусственно (например, посредством химического синтеза), которые имеют сравнительно низкую молекулярную массу. Как правило, малые молекулы представляют собой мономеры и имеют молекулярную массу приблизительно менее 1500 Да. Предпочтительные малые молекулы являются биологически активными в том отношении, что они продуцируют локальный или системный эффект у животных, предпочтительно у млекопитающих, более предпочтительно у людей. Согласно конкретным предпочтительным вариантам осуществления, малая молекула представляет собой лекарство. Предпочтительно, хотя и необязательно, лекарство представляет собой лекарство, уже признанное безопасным и эффективным для применения соответствующим государственным агентством или органом. Например, лекарства для применения у людей, перечисленные FDA согласно статьи 21 C.F.R. §§ 330.5, 331-361 и 440-460; лекарства для ветеринарного применения перечисленные FDA согласно статьи 21 C.F.R. §§ 500-589, все рассматриваются как приемлемые для применения согласно настоящему изобретению.
Лечить - Используемый в настоящем документе термин «лечить» (или «проведение лечения», «получивший лечение», «лечение» и т.п.) относится к введению конъюгата согласно настоящему раскрытию нуждающемуся в этом субъекту с целью уменьшить, ослабить, изменить, уменьшить интенсивность, улучшить или воздействовать на состояние (например, сахарный диабет), симптом или симптомы состояния (например, гипергликемия) или предрасположенность к состоянию. Например, используемый в настоящем документе термин «лечение сахарного диабета» будет относиться, в общем, к сохранению уровней глюкозы крови около нормальных уровней и может включать в себя увеличение или снижение уровней глюкозы крови в зависимости от данной ситуации.
Фармацевтически приемлемый носитель - Используемый в настоящем документе термин включает в себя любой из стандартных фармацевтических носителей, таких как забуференный фосфатом солевой раствор, вода, эмульсии, такие как эмульсия типа «масло в воде» или «вода в масле» и различные типы увлажняющих средств. Термин также охватывает любые средства, одобренные регуляторным органом федерального правительства США или перечисленные в Фармакопее США для применения на животных, включая людей.
Фармацевтически приемлемая соль - Используемый в настоящем документе термин относится к солям соединения, которые сохраняют биологическую активность исходного соединения, и которые не являются нежелательными с биологической или какой-либо иной точки зрения. Многие из соединений, раскрытых в настоящем документе, способны образовывать соли с кислотами и/или основаниями вследствие присутствия аминогрупп и/или карбоксильных групп или групп, сходных с ними. Фармацевтически приемлемые основно-аддитивные соли могут быть получены из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают в себя, исключительно в качестве примера, натриевые, соли калия, литиевые, аммония, кальция и магния. Соли полученные из органических оснований включают в себя без ограничения соли первичных, вторичных и третичных аминов. Фармацевтически приемлемые кислотно-аддитивные соли могут быть получены из неорганических и органических кислот. Соли, полученные из неорганических кислот, включают в себя соли соляной кислоты, бромистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и т.п. Соли, полученные из органических кислот, включают в себя соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, паратолуолсульфоновой кислоты. салициловой кислоты и т.п.
Эффективное или терапевтически эффективное количество - Используемый в настоящем документе термин относится к нетоксичному количеству аналога инсулина, достаточному для получения желаемого эффекта. Например, одним желаемым эффектом могло бы быть предотвращение или лечение гипергликемии. Количество, которое является «эффективным», будет варьировать от субъекта к субъекту в зависимости от возраста и общего состояния здоровья индивидуума, способа введения и т.п. Поэтому, точное «эффективное количество» не всегда возможно определить. Однако, соответствующее «эффективное» количество в каждом конкретном случае может быть определено специалистом в данной области техники с использованием стандартного эксперимента.
Парентерально - Используемый в настоящем документе термин означает введение не через желудочно-кишечный тракт, а некоторым другим путем, таким как интраназальный, ингаляционный, подкожный, внутримышечный, интраспинальный или внутривенный.
Инсулин - Используемый в настоящем документе термин означает активный компонент поджелудочной железы, который воздействует на метаболизм углеводов в организме животного, и который представляет ценность для лечения сахарного диабета. Термин включает синтетические и биотехнологически полученные продукты, которые являются такими же или сходными с встречающимися в природе инсулинами по структуре, применению и предполагаемому эффекту, и которые представляют ценность для лечения сахарного диабета.
Инсулин или молекула инсулина - Термин представляет собой общее обозначение, которое означает состоящий из 51 аминокислот гетеродимер, содержащий пептид А-цепи, характеризующийся аминокислотной последовательностью, представленной в SEQ ID NO: 1, и пептид В-цепи, характеризующийся аминокислотной последовательностью, представленной в SEQ ID NO: 2, где остатки цистеина в положениях 6 и 11 А-цепи соединены дисульфидной связью, остатки цистеина в положении 7 А-цепи и положении 7 В-цепи соединены дисульфидной связью, и остатки цистеина в положении 20 А-цепи и положении 19 В-цепи соединены дисульфидной связью.
Вариант или аналог инсулина - Используемый в настоящем документе термин включает любой гетеродимерный аналог или одноцепочечный аналог, который содержит одну или несколько модификаций нативного пептида А-цепи и/или пептида В-цепи. Модификации включают в себя без ограничения замену нативной аминокислоты некоторой аминокислотой по положению, выбранному из A4, A5, A8, A9, A10, A12, A13, A14, A15, A16, A17, A18, A19, A21, B1, B2, B3, B4, B5, B9, B10, B13, B14, B15, B16, B17, B18, B20, B21, B22, B23, B26, B27, B28, B29 и B30; удаление любого или всех положений B1-4 и B26-30; или конъюгирование, прямое или с помощью полимерного или неполимерного линкера, одного или нескольких ацилов, полиэтилглицина (PEG) или сахаридного фрагмента (фрагментов); или любые их сочетания. Как представлено на примере N-связанных гликозилированных аналогов инсулина, раскрытых в настоящем документе, термин дополнительно включает в себя любой инсулиновый гетеродимер и одноцепочечный аналог, который был модифицирован так, чтобы содержать по меньшей мере один N-связанный сайт гликозилирования, и, в частности, варианты осуществления, где N-связанный сайт гликозилирования связан с N-гликаном или занят им. Примеры аналогов инсулина включают в себя без ограничения гетеродимер и одноцепочечные аналоги, раскрытые в опубликованных международных заявках WO2010/0080606, WO2009/099763 и WO2010/080609, раскрытия которых включены в настоящий документ посредством ссылки. Примеры одноцепочечных аналогов инсулина также включают в себя без ограничения аналоги, раскрытые в опубликованных международных заявках WO9634882, WO95516708, WO2005/054291, WO2006/097521, WO2007/104734, WO2007/104736, WO2007/104737, WO2007/104738, WO2007/096332, WO2009/132129; в патентах США №№ 5,304,473 и 6,630,348; и в Kristensen et al., Biochem. J. 305: 981-986 (1995), раскрытия которых включены в настоящий документ посредством ссылки.
Термин дополнительно включает в себя одноцепочечные и гетеродимерные полипептидные молекулы, которые характеризуются низкой или не обнаруживаемой активностью в отношении инсулинового рецептора, но которые были модифицированы с включением одной или нескольких аминокислотных модификаций или замен с получением активности в отношении инсулинового рецептора, которая соответствует по меньшей мере 1%, 10%, 50%, 75% или 90% по сравнению с активностью нативного инсулина в отношении инсулинового рецептора, и которые дополнительно включают в себя по меньшей мере один N-связанный сайт гликозилирования. Согласно конкретным аспектам, аналог инсулина представляет собой частичный агонист, который характеризуется 2-100-кратно меньшей активностью в отношении инсулинового рецептора по сравнению с нативным инсулином. Согласно другим аспектам, аналог инсулина характеризуется усиленной активностью в отношении инсулинового рецептора, например, пептидные производные IGFB16B17, раскрытые в опубликованной международной заявке WO2010/080607 (которая включена в настоящий документ посредством ссылки). Указанные аналоги инсулина, которые характеризуются сниженной активностью в отношении рецептора гормона роста и усиленную активность в отношении инсулиновом рецептора, включают в себя как гетеродимеры, так и одноцепочечные аналоги.
Одноцепочечный инсулин или одноцепочечный аналог инсулина - Используемый в настоящем документе термин включает в себя группу структурно-связанных белков, в которых пептид или функциональный аналог А-цепи и пептид или функциональный аналог В-цепи ковалентно связаны посредством пептида, или полипептида из 2-35 аминокислот, или непептидного полимера, или неполимерного линкера, и которые характеризуются по меньшей мере 1%, 10%, 50%, 75% или 90% активности инсулина в отношение инсулинового рецептора по сравнению с нативным инсулином. Одноцепочечный инсулин или аналог инсулина дополнительно содержит три дисульфидные связи: первая дисульфидная связь находится между остатками цистеина в положениях 6 и 11 А-цепи или ее функционального аналога, вторая дисульфидная связь находится между остатками цистеина в положении 7 А-цепи или ее функционального аналога и положении 7 В-цепи или ее функционального аналога, и третья дисульфидная связь находится между остатками цистеина в положении 20 А-цепи или ее функционального аналога и положении 19 В-цепи или ее функционального аналога.
Связывающий пептид или С-пептид - используемый в настоящем документе термин относится к связывающему фрагменту «С» полипептидной последовательности B-C-A одноцепочечной препроинсулин-подобной молекулы. Более конкретно, в натуральной цепи инсулина С-пептид соединяет аминокислоту в положении 30 В-цепи и аминокислоту в положении 1 А-цепи. Термин может относиться как к нативному С-пептиду инсулина (SEQ ID NO: 30), С-пептиду обезьяны, так и к любому другому пептиду из 3-35 аминокислот, который соединяет В-цепь с А-цепью, что подразумевает включение любого пептида, соединяющего пептид В-цепи с пептидом А-цепи в одноцепочечном инсулиновом аналоге (см., например, опубликованную заявку США № 2009/0170750 и 2008/0057004 и WO9634882) и в молекулах-предшественницах инсулина, раскрытых в WO9516708 и патенте США № 7,105,314.
Аминокислотная модификация - Используемый в настоящем документе термин относится к замещению аминокислоты или получению производного аминокислоты путем добавления и/или удаления химических групп к/от аминокислоты, и включает в себя замену любой из 20 аминокислот, обычно обнаруживаемых в белках человека, а также атипичными и не встречающимися в природе аминокислотами. Коммерческие источники атипичных аминокислот включают в себя Sigma-Aldrich (Milwaukee, WI), ChemPep Inc. (Miami, FL) и Genzyme Pharmaceuticals (Cambridge, MA). Атипичные аминокислоты могут быть приобретены от коммерческих поставщиков, синтезированы de novo или химически модифицированы или получены из натуральных аминокислот.
Аминокислотная замена - Используемый в настоящем документе термин относится к замене одного аминокислотного остатка другим аминокислотным остатком.
Консервативная аминокислотная замена - Используемый в настоящем документе термин определен согласно настоящему документу, как замены в пределах одной из следующих пяти групп:
I. Малые алифатические, неполярные или слабополярные остатки:
Ala, Ser, Thr, Pro, Gly;
II. Полярные, отрицательно заряженные остатки и их амиды:
Asp, Asn, Glu, Gln, цистеиновая кислота и гомоцистеиновая кислота;
III. Полярные, положительно заряженные остатки:
His, Arg, Lys; оринитин (Orn)
IV. Крупные алифатические неполярные остатки:
Met, Leu, Ile, Val, Cys, норлейцин (Nle), гомоцистеин
V. Крупные ароматические остатки:
Phe, Tyr, Trp, ацетилфенилаланин
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-2 в количестве 0,69 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 2: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-3 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 3: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-8 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 4: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-9 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 5: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-16 в количестве 0,35 нмоль/кг в условиях инфузии PBS или инфузии или в/в α-метилманнозы (αMM).
Фигура 6: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-22 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 7: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-23 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 8: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-46 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 9: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-48 в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 10: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-52 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 11: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-56 в количестве 0,69 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 12: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-60 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 13: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-75 в количестве 0,69 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 14: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-76 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 15: Графики сывороточных концентраций IOC-2 после внутривенной (в/в) инъекции 0,69 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 16: Графики сывороточных концентраций IOC-3 после внутривенной (в/в) инъекции 0,17 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 17: Графики сывороточных концентраций IOC-16 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 18: Графики сывороточных концентраций IOC-22 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 19: Графики сывороточных концентраций IOC-23 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили инфузию в/в раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 20: Графики сывороточных концентраций IOC-52 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 21: Графики сывороточных концентраций IOC-56 после внутривенной (в/в) инъекции 0,69 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 22: Графики сывороточных концентраций IOC-60 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам регулирования фармакокинетического (PK) и/или фармакодинамического (PD) профилей инсулина способом, чувствительным к системным концентрациям сахарида, такого как глюкоза. Способы частично основаны на открытии, раскрытом в опубликованной заявке США № 2011/0301083, что если конкретные конъюгаты инсулина модифицированы так, что включают в себя высокоаффинные лиганды сахаридов, такие как разветвленная триманноза, то они могут быть получены так, что характеризуются PK/PD профилями, чувствительными к изменениям концентрации сахаридов даже в отсутствие экзогенной мультивалентной сахарид-связывающей молекулы, такой как лектин конканавалин A (Con A).
В общем, конъюгаты инсулина согласно настоящему изобретению содержат молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему два плеча или состоящему из двух плечей, где каждое плечо независимо ковалентно связано с лигандом, содержащим сахарид или состоящим из сахарида, где по меньшей мере один лиганд линкера включает в себя сахарид фукозу. Согласно конкретным вариантам осуществления, лиганды способны конкурировать с сахаридом (например, глюкозой или α-метилманнозой) за связывание с эндогенной сахарид-связывающей молекулой. Согласно конкретным вариантам осуществления, лиганды способны конкурировать с глюкозой или α-метилманнозой за связывание с Con A. Согласно конкретным вариантам осуществления, линкер является неполимерным. Согласно конкретным вариантам осуществления, конъюгат может характеризоваться коэффициентом полидисперсности, равным единице и молекулярной массой приблизительно менее 20000 Да. Согласно конкретным вариантам осуществления, конъюгат характеризуется формулой (I) или (II), определенной и описанной в настоящем документе. Согласно конкретным вариантам осуществления, конъюгат характеризуется пролонгированным действием (т.е., характеризуется PK профилем, который является более замедленным, чем у растворимого рекомбинантного инсулина человека (RHI)).
Используемый в настоящем документе термин «конъюгат инсулина» включает в себя (i) конъюгаты инсулина, содержащие молекулу инсулина с аминокислотной последовательностью нативного инсулина или инсулина дикого типа, и (ii) конъюгаты инсулина, содержащие молекулу аналога инсулина, где аналог инсулина содержит аминокислотную последовательность, отличающуюся от аминокислотной последовательности нативного инсулина или инсулина дикого типа по меньшей мере на одну замену, делецию, перестановку или добавление аминокислоты. Термин дополнительно включает в себя молекулы инсулина или аналога инсулина, которые конъюгированы с молекулой полиэтиленгликоля или жирной кислоты. Молекула инсулина может представлять собой инсулин человека, инсулин свиньи, бычий инсулин, инсулин кролика, инсулин овцы и т.п. или его аналог. Целый ряд указанных молекул инсулина является коммерчески доступным, например, от Sigma-Aldrich (St. Louis, MO). Разнообразные модифицированные формы инсулина известны в данной области техники (например, см. Crotty and Reynolds, Pediatr. Emerg. Care. 23:903-905, 2007 и Gerich, Am. J. Med. 113:308-16, 2002, и процитированные в них ссылки). Модифицированные формы инсулина могут быть химически модифицированы (например, путем добавления химического фрагмента, такого как PEG-группа или цепь жирного ацила, как описано ниже) и/или подвергнуты мутации (т.е., путем добавления, делеции или замены одной или нескольких аминокислот).
Конъюгаты инсулина
Согласно одному аспекту, настоящее изобретение относится к конъюгатам инсулина, которые содержат молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему два плеча (бидентатный линкер), где одно плечо бидентатного линкера независимо ковалентно присоединено к лиганду, содержащему сахарид или состоящему из сахарида, и где первый лиганд бидентатного линкера содержит первый сахарид или состоит из первого сахарида, который представляет собой фукозу. Второй лиганд бидентатного линкера содержит второй сахарид или состоит из второго сахарида, который может представлять собой фукозу, маннозу, глюкозамин или глюкозу. Согласно конкретным аспектам, второй лиганд содержит бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид или состоит из него. Согласно конкретным аспектам, второй лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, молекула инсулина или аналога инсулина конъюгирована с одним, двумя, тремя или четырьмя бидентатными линкерами, где каждое плечо каждого бидентатного линкера независимо ковалентно соединено с лигандом, содержащим сахарид или состоящим из сахарида, и где первый лиганд бидентатного линкера содержит первый сахарид или состоит из первого сахарида, который представляет собой фукозу, а второй лиганд бидентатного линкера содержит второй сахарид или состоит из второго сахарида, который может представлять собой фукозу, маннозу или глюкозу. Согласно конкретным аспектам, второй лиганд содержит бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид или состоит из него. Согласно конкретным аспектам, второй лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу или состоит из нее.
Согласно конкретным аспектам, молекула инсулина или аналога инсулина конъюгирована с одним, двумя, тремя или четырьмя бидентатными линкерами, где каждое плечо каждого бидентатного линкера независимо ковалентно соединено с лигандом, содержащим сахарид или состоящим из сахарида, и где по меньшей мере для одного из бидентатных линкеров первый лиганд бидентатного линкера содержит первый сахарид или состоит из первого сахарида, который представляет собой фукозу, а второй лиганд бидентатного линкера содержит второй сахарид или состоит из второго сахарида, который может представлять собой фукозу, маннозу или глюкозу. Согласно конкретным аспектам, второй лиганд содержит бисахарид, трисахарид, тетрасахарид или разветвленный трисахарид или состоит из него. Согласно конкретным аспектам, второй лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу или состоит из нее. Для второго, третьего и четвертого бидентатных линкеров первые и вторые сахариды могут независимо представлять собой фукозу, маннозу, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, молекула инсулина или аналога инсулина конъюгирована (i) с одним бидентатным линкером, где каждое плечо каждого бидентатного линкера независимо ковалентно соединено с лигандом, содержащим сахарид или состоящим из сахарида, и где первый лиганд бидентатного линкера содержит первый сахарид или состоит из первого сахарида, который представляет собой фукозу, а второй лиганд бидентатного линкера содержит второй сахарид или состоит из второго сахарида, который может представлять собой фукозу, маннозу, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу.
Согласно конкретным аспектам, молекула инсулина или аналога инсулина конъюгата инсулина, раскрытого в настоящем документе, дополнительно ковалентно присоединена по меньшей мере к одному линейному линкеру, имеющему один лиганд, содержащий сахарид или состоящий из сахарида, который может представлять собой фукозу, маннозу, глюкозамин или глюкозу. Согласно конкретным аспектам, лиганд содержит бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид или состоит из него. Согласно конкретным аспектам, лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу или состоит из нее.
Согласно конкретным аспектам, молекула инсулина или аналога инсулина конъюгата, раскрытого в настоящем документе, дополнительно ковалентно присоединена по меньшей мере к одному тридентатному линкеру, где каждое плечо тридентатного линкера независимо ковалентно соединено с лигандом, содержащим сахарид или состоящим из сахарида, который может представлять собой фукозу, маннозу, глюкозамин или глюкозу. Согласно конкретным аспектам, лиганд содержит бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид или состоит из него. Согласно конкретным аспектам, лиганд содержит биманнозу, триманнозу, тетраманнозу или разветвленную триманнозу или состоит из нее.
Если конъюгат инсулина вводят млекопитающему, то по меньшей мере одно фармакокинетическое или фармакодинамическое свойство конъюгата чувствительно к сывороточной концентрации сахарида. Согласно конкретным вариантам осуществления, PK и/или PD свойства конъюгата чувствительны к сывороточной концентрации эндогенного сахарида, такого как глюкоза. Согласно конкретным вариантам осуществления, PK и/или PD свойства конъюгата чувствительны к сывороточной концентрации экзогенного сахарида, например, без ограничения, маннозы, L-фукозы, N-ацетилглюкозамина и/или α-метилманнозы.
PK и PD свойства
Согласно различным вариантам осуществления, фармакокинетическое и/или фармакодинамическое поведение конъюгата инсулина может быть модифицировано колебаниями сывороточной концентрации сахарида. Например, с точки зрения фармакокинетики, кривая сывороточной концентрации может смещаться вверх, если сывороточная концентрация сахарида (например, глюкозы) увеличивается или если сывороточная концентрация сахарида пересекает пороговое значение (например, выше, чем нормальные уровни глюкозы).
Согласно конкретным вариантам осуществления, кривая сывороточной концентрации конъюгата существенно отличается, если его вводят млекопитающим в условиях голодания и гипергликемии. Используемый в настоящем документе термин «существенно отличается» означает, что две кривые статистически различны, как определено посредством t-теста Стьюдента (p<0,05). Используемый в настоящем документе термин «условия голодания» означает, что кривую сывороточной концентрации получали путем объединения данных, полученных натощак от пяти или более недиабетических индивидуумов. Согласно конкретным вариантам осуществления, недиабетических индивидуумов в состоянии «натощак» случайно выбирали из людей возраста 18-30 лет, у которых на момент взятия крови не наблюдались симптомы диабета и которые голодали в течение 12 часов до взятия крови. Используемый в настоящем документе термин «гипергликемические условия» означает, что кривую сывороточной концентрации получали путем объединения данных, полученных натощак от пяти или более недиабетических индивидуумов, у которых гипергликемические состояния (Cmax глюкозы, по меньшей мере, на 100 мг/дл выше средней концентрации глюкозы, наблюдаемой в условиях голодания) индуцировали одновременным введением конъюгата и глюкозы. Одновременное введение конъюгата и глюкозы просто требует, чтобы в течение периода, когда конъюгат присутствует на обнаруживаемом уровне в сыворотке, наблюдалась Cmax глюкозы. Например, инъекция (или прием внутрь) глюкозы может быть приурочена к моменту непосредственно перед введением, во время введения или сразу после введения конъюгата. Согласно конкретным вариантам осуществления, конъюгат и глюкозу вводят различными путями или в различных местах. Например, согласно конкретным вариантам осуществления, конъюгат вводят подкожно, тогда как глюкозу вводят перорально или внутривенно.
Согласно конкретным вариантам осуществления, сывороточная Cmax конъюгата выше при гипергликемических условиях по сравнению с условиями голодания. В качестве дополнения или альтернативы, согласно конкретным вариантам осуществления, площадь под кривой (AUC) сывороточного уровня конъюгата выше при гипергликемических условиях по сравнению с условиями голодания. Согласно различным вариантам осуществления, скорость выведения конъюгата из сыворотки медленнее при гипергликемических условиях по сравнению с условиями голодания. Согласно конкретным вариантам осуществления, сывороточная концентрационная кривая конъюгатов может быть экстраполирована с использованием двухкомпонентной биэкспоненциальной модели с одним коротким и одним долгим временем полужизни. Долгое время полужизни, по-видимому, особенно чувствительно к концентрации глюкозы. Поэтому, согласно конкретным вариантам осуществления, долгое время полужизни дольше при гипергликемических условиях по сравнению с условиями голодания. Согласно конкретным вариантам осуществления, условия голодания подразумевают Cmax глюкозы менее 100 мг/дл (например, 80 мг/дл, 70 мг/дл, 60 мг/дл, 50 мг/дл, и т.п.). Согласно конкретным вариантам осуществления, гипергликемические состояния подразумевают Cmax глюкозы свыше 200 мг/дл (например, 300 мг/дл, 400 мг/дл, 500 мг/дл, 600 мг/дл, и т.п.). Следует понимать, что другие РК параметры, такие как среднее время удерживания в сыворотке (MRT), среднее время всасывания из сыворотки (MAT), и т.п. могут быть использованы вместо любых из описанных выше параметров или в сочетании с ними.
Нормальный диапазон концентраций глюкозы у людей, собак, кошек и крыс составляет от 60 до 200 мг/дл. Специалист в данной области техники сможет экстраполировать следующие значения для видов с другими нормальными диапазонами (например, нормальный диапазон концентраций глюкозы у карликовых свиней составляет от 40 до 150 мг/дл). Концентрации глюкозы ниже 60 мг/дл считаются гипогликемическими. Концентрации глюкозы свыше 200 мг/дл считаются гипергликемическими. Согласно конкретным вариантам осуществления, PK свойства конъюгата могут быть протестированы с использованием эугликемического гиперинсулинемического клэмп-теста (см. раздел «Примеры»), и сывороточная концентрационная кривая конъюгата может существенно отличаться при введении при концентрациях глюкозы 50 и 200 мг/дл, 50 и 300 мг/дл, 50 и 400 мг/дл, 50 и 500 мг/дл, 50 и 600 мг/дл, 100 и 200 мг/дл, 100 и 300 мг/дл, 100 и 400 мг/дл, 100 и 500 мг/дл, 100 и 600 мг/дл, 200 и 300 мг/дл, 200 и 400 мг/дл, 200 и 500 мг/дл, 200 и 600 мг/дл, и т.п. В качестве дополнения или альтернативы, сывороточное Tmax, сывороточная Cmax, среднее время удерживания в сыворотке (MRT), среднее время всасывания из сыворотки (MAT) и/или время полужизни в сыворотке могут существенно отличаться для двух концентраций глюкозы. Как обсуждается ниже, согласно конкретным вариантам осуществления, в качестве сравнительных концентраций глюкозы могут быть использованы 100 мг/дл и 300 мг/дл. Однако следует понимать, что настоящее раскрытие охватывает каждый из указанных вариантов осуществления с альтернативной парой сравнительных концентраций глюкозы, включая без ограничения любую из следующих пар: 50 и 200 мг/дл, 50 и 300 мг/дл, 50 и 400 мг/дл, 50 и 500 мг/дл, 50 и 600 мг/дл, 100 и 200 мг/дл, 100 и 400 мг/дл, 100 и 500 мг/дл, 100 и 600 мг/дл, 200 и 300 мг/дл, 200 и 400 мг/дл, 200 и 500 мг/дл, 200 и 600 мг/дл, и т.п.
Таким образом, согласно конкретным вариантам осуществления, Cmax конъюгата выше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы). Согласно конкретным вариантам осуществления, Cmax конъюгата, по меньшей мере, на 50% (например, по меньшей мере, на 100%, по меньшей мере, на 200% или, по меньшей мере, на 400%) выше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы).
Согласно конкретным вариантам осуществления, AUC конъюгата выше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы). Согласно конкретным вариантам осуществления, AUC конъюгата, по меньшей мере, на 50% (например, по меньшей мере, на 100%, по меньшей мере, на 200% или, по меньшей мере, на 400%) выше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы).
Согласно конкретным вариантам осуществления, скорость выведения конъюгата из сыворотки медленнее при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы). Согласно конкретным вариантам осуществления, скорость выведения конъюгата из сыворотки, по меньшей мере, на 25% (например, по меньшей мере, на 50%, по меньшей мере, на 100%, по меньшей мере, на 200% или, по меньшей мере, на 400%) быстрее при введении млекопитающему меньшей из двух концентраций глюкозы (например, 100 против 300 мг/дл глюкозы).
Согласно конкретным вариантам осуществления, сывороточная концентрационная кривая конъюгатов может быть экстраполирована с использованием двухкомпонентной биэкспоненциальной модели с одним коротким и одним долгим временем полужизни. Долгое время полужизни, по-видимому, особенно чувствительно к концентрации глюкозы. Поэтому, согласно конкретным вариантам осуществления, долгое время полужизни дольше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы). Согласно конкретным вариантам осуществления, долгое время полужизни, по меньшей мере, на 50% (например, по меньшей мере, на 100%, по меньшей мере, на 200% или, по меньшей мере, на 400%) дольше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы).
Согласно конкретным вариантам осуществления, настоящее раскрытие относится к способу, в котором при двух различных концентрациях глюкозы (например, 300 против 100 мг/дл глюкозы) получают сывороточную концентрационную кривую конъюгата; две кривые экстраполируют с использованием двухкомпонентной биэкспоненциальной модели с одним коротким и одним долгим временем полужизни; и сравнивают долгое время полужизни, полученное для двух концентраций глюкозы. Согласно конкретным вариантам осуществления, указанный способ может быть использован в качестве метода анализа для тестирования или сравнения чувствительности к глюкозе одного или нескольких конъюгатов.
Согласно конкретным вариантам осуществления, настоящее раскрытие относится к способу, в котором при одних и тех же условиях (например, в условиях голодания) получают сывороточные концентрационные кривые конъюгированного лекарства (например, конъюгат инсулина согласно настоящему раскрытию) и неконъюгированного варианта лекарства (например, RHI); две кривые экстраполируют с использованием двухкомпонентной биэкспоненциальной модели с одним коротким и одним долгим временем полужизни; и сравнивают долгое время полужизни, полученное для конъюгированного и неконъюгированного лекарства. Согласно конкретным вариантам осуществления, указанный способ может быть использован в качестве метода анализа для идентификации конъюгатов, которые выводятся более быстро, чем неконъюгированное лекарство.
Согласно конкретным вариантам осуществления, сывороточная концентрационная кривая конъюгата представляет собой по существу ту же концентрацию, что и сывороточная концентрационная кривая неконъюгированного варианта лекарства при введении млекопитающему в гипергликемических условиях. Используемый в настоящем документе термин «по существу тот же» означает, что между двумя кривыми отсутствует статистическое различие, как определено посредством t-теста Стьюдента (p>0.05). Согласно конкретным вариантам осуществления, сывороточная концентрационная кривая конъюгата существенно отличается от сывороточной концентрационной кривой неконъюгированного варианта лекарства при введении в условиях голодания. Согласно конкретным вариантам осуществления, сывороточная концентрационная кривая конъюгата представляет собой по существу ту же кривую, что и сывороточная концентрационная кривая неконъюгированного варианта лекарства при введении в гипергликемических условиях, и существенно отличается при введении в условиях голодания.
Согласно конкретным вариантам осуществления, гипергликемические условия подразумевают Cmax глюкозы более 200 мг/дл (например, 300 мг/дл, 400 мг/дл, 500 мг/дл, 600 мг/дл, и т.п.). Согласно конкретным вариантам осуществления, условия голодания подразумевают Cmax глюкозы менее 100 мг/дл (например, 80 мг/дл, 70 мг/дл, 60 мг/дл, 50 мг/дл, и т.п.). Следует понимать, что любые из описанных выше PK параметров, такие как сывороточное Tmax, сывороточная Cmax, AUC, среднее время удерживания в сыворотке (MRT), среднее время всасывания из сыворотки (MAT) и/или время полужизни в сыворотке, можно сравнивать.
С точки зрения фармакодинамики (PD), биоактивность конъюгата может увеличиваться, если увеличивается концентрация глюкозы, или если концентрация глюкозы пересекает пороговое значение, например, выше нормальных уровней глюкозы. Согласно конкретным вариантам осуществления, биоактивность конъюгата ниже при введении в условиях голодания по сравнению с гипергликемическими условиями. Согласно конкретным вариантам осуществления, условия голодания подразумевают Cmax глюкозы менее 100 мг/дл (например, 80 мг/дл, 70 мг/дл, 60 мг/дл, 50 мг/дл, и т.п.). Согласно конкретным вариантам осуществления, гипергликемические условия подразумевают Cmax глюкозы более 200 мг/дл (например, 300 мг/дл, 400 мг/дл, 500 мг/дл, 600 мг/дл, и т.п.).
Согласно конкретным вариантам осуществления, PD свойства конъюгата можно тестировать путем измерения скорости инфузии глюкозы (GIR), требуемой для поддержания равновесия концентрации глюкозы. Согласно таким вариантам осуществления, биоактивность конъюгата может существенно отличаться при введении концентраций глюкозы 50 и 200 мг/дл, 50 и 300 мг/дл, 50 и 400 мг/дл, 50 и 500 мг/дл, 50 и 600 мг/дл, 100 и 200 мг/дл, 100 и 300 мг/дл, 100 и 400 мг/дл, 100 и 500 мг/дл, 100 и 600 мг/дл, 200 и 300 мг/дл, 200 и 400 мг/дл, 200 и 500 мг/дл, 200 и 600 мг/дл, и т.п. поэтому, согласно конкретным вариантам осуществления, биоактивность конъюгата выше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы). Согласно конкретным вариантам осуществления, биоактивность конъюгата, по меньшей мере, на 25% (например, по меньшей мере, на 50% или, по меньшей мере, на 100%) выше при введении млекопитающему большей из двух концентраций глюкозы (например, 300 против 100 мг/дл глюкозы).
Согласно конкретным вариантам осуществления, в качестве лекарства конъюгат включает в себя молекулу инсулина. Согласно упомянутым вариантам осуществления, PD поведение инсулина можно наблюдать путем сравнения времени достижения минимальной концентрации глюкозы в крови (Tnadir), и продолжительности сохранения уровня глюкозы крови ниже конкретного процентного начального значения (например, 70% начального значения или T70% BGL), и т.п.
В целом, следует принимать во внимание, что любая из PK и PD характеристик, рассматриваемая в этом разделе, может быть определена в соответствии с любым из целого ряда опубликованных фармакокинетических и фармакодинамических способов (например, для способов, подходящих для подкожной доставки, см. Baudys et al., Bioconjugate Chem. 9:176-183, 1998). Также следует понимать, что PK и/или PD свойства могут быть измерены у любого млекопитающего (например, человека, крысы, кошки, карликовой свиньи, собаки и т.п.). Согласно конкретным вариантам осуществления, PK и/или PD свойства измеряют на крысах. Согласно конкретным вариантам осуществления, PK и/или PD свойства измеряют на карликовых свиньях. Согласно конкретным вариантам осуществления, PK и/или PD свойства измеряют на собаках.
Также следует принимать во внимание, что хотя вышеизложенное было описано в контексте чувствительных к глюкозе конъюгатов, те же самые свойства и методы анализа применимы к конъюгатам, которые чувствительны к другим сахаридам, включая экзогенные сахариды, например, маннозу, L-фукозу, N-ацетилглюкозамин, α-метилманнозу, и т.п. Как более подробно рассматривается ниже и в разделе «Примеры», вместо сравнения PK и/или PD свойств в условиях голодания и гипергликемии, можно сравнивать PK и/или PD свойства в условиях голодания с введением или без введения экзогенного сахарида. Следует понимать, что конъюгаты могут быть сконструированы так, чтобы быть чувствительными к различным значениям Cmax для данного экзогенного сахарида.
Лиганд(ы)
В общем, конъюгаты инсулина содержат молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному бидентатному линкеру, содержащему два лиганда, где по меньшей мере один из лигандов (первый лиганд) содержит сахарид или состоит из сахарида, который представляет собой фукозу, а другой лиганд (второй лиганд) содержит один или нескольких сахаридов или состоит из них. Согласно конкретным вариантам осуществления, конъюгаты инсулина могут дополнительно включать в себя один или несколько линейных линкеров, каждый из которых содержит единственный лиганд, который содержит один или нескольких сахаридов или состоит из них. Согласно конкретным вариантам осуществления, конъюгаты инсулина могут дополнительно включать в себя один или несколько разветвленных линкеров так, что каждый включает в себя по меньшей мере два, три, четыре, пять или более лигандов, где каждый лиганд независимо содержит один или нескольких сахаридов или состоит из них. При наличии более одного лиганда, лиганды могут иметь одинаковую или различную химическую структуру.
Согласно конкретным вариантам осуществления, лиганды способны конкурировать с сахаридом (например, с глюкозой, α-метилманнозой или маннозой) за связывание с эндогенной сахарид-связывающей молекулой (например, без ограничения поверхностно-активные белки А и D или представители семейства селектинов). Согласно конкретным вариантам осуществления, лиганды способны конкурировать с сахаридом (например, с глюкозой, α-метилманнозой или маннозой) за связывание с рецептором сахара на поверхности клетки (например, без ограничения, макрофагальный маннозный рецептор, лиганды-транспортеры глюкозы, рецепторы сахара на эндотелиальных клетках или рецепторы сахара гепатоцитов). Согласно конкретным вариантам осуществления, лиганды способны конкурировать с глюкозой за связывание с эндогенной сахарид-связывающей молекулой (например, без ограничения поверхностно-активные белки А и D или представители семейства селектинов). Согласно конкретным вариантам осуществления, лиганды способны конкурировать с глюкозой или α-метилманнозой за связывание с макрофагальным маннозным рецептором 1 (MRC1) человека. Согласно конкретным вариантам осуществления, лиганды способны конкурировать с сахаридом за связывание с лектином, отличным от человеческого (например, Con A). Согласно конкретным вариантам осуществления, лиганды способны конкурировать с глюкозой, α-метилманнозой или маннозой за связывание с лектином, отличным от человеческого (например, Con A). Иллюстративные связывающие глюкозу лектины включают в себя калнексин, калретикулин, N-ацетилглюкозаминовый рецептор, селектин, сиалогликопротеиновый рецептор, коллектин (связывающий маннозу лектин), рецептор маннозы, аггрекан, версикан, агглютинин зеленого горошка (PSA), лектин кормовых бобов, лектин чечевицы кулинарной, лектин соевых бобов, лектин арахиса, лектин чины желтой, лектин люцерны, лектин софоры японской, лектин Bowringia Milbraedii, конканавалин A (Con A) и митоген лаконоса.
Согласно конкретным вариантам осуществления, лиганд(ы) отличные от первого лиганда, содержащие сахарид фукозу или состоящие из него, могут иметь ту же химическую структуру, что и глюкоза, или могут быть химически близким видом глюкозы, например, глюкозамином. Согласно различным вариантам осуществления, для лиганда(ов) может быть благоприятно иметь химическую структуру, отличную от глюкозы, например, с целью улучшить ответ конъюгата на глюкозу. Например, согласно конкретным вариантам осуществления, можно использовать лиганд, включающий в себя глюкозу, маннозу, L-фукозу или их производные (например, α-L-фукопиранозид, маннозамин, связанный β-связью N-ацетилманнозамин, метилглюкоза, метилманноза, этилглюкоза, этилманноза, пропилглюкоза, пропилманноза, и т.п.) и/или их сочетания высшего порядка (например, биманнозу, неразветвленную и/или разветвленную триманнозу, и т.п.).
Согласно конкретным вариантам осуществления, лиганд(ы) включает(ют) в себя моносахарид. Согласно конкретным вариантам осуществления, лиганд(ы) включает(ют) в себя дисахарид. Согласно конкретным вариантам осуществления, лиганд(ы) включает(ют) в себя трисахарид. Согласно некоторым вариантам осуществления, лиганд(ы) содержит(ат) сахарид и одну или несколько аминогрупп. Согласно некоторым вариантам осуществления, лиганд(ы) содержит(ат) сахарид и этиловую группу. Согласно конкретным вариантам осуществления, сахарид и аминогруппа разделены C1-C6алкильной группой, например, C1-C3алкильной группой. Согласно некоторым вариантам осуществления, лиганд представляет собой аминоэтилглюкозу (AEG). Согласно некоторым вариантам осуществления, лиганд представляет собой аминоэтилманнозу (AEM). Согласно некоторым вариантам осуществления, лиганд представляет собой аминоэтилбиманнозу (AEBM). Согласно некоторым вариантам осуществления, лиганд представляет собой аминоэтилтриманнозу (AETM). Согласно некоторым вариантам осуществления, лиганд представляет собой β-аминоэтил-N-ацетилглюкозамин (AEGA). Согласно некоторым вариантам осуществления, лиганд представляет собой аминоэтилфукозу (AEF). Согласно конкретным вариантам осуществления, сахарид представляет собой «D» конфигурацию, и согласно другим вариантам осуществления, сахарид представляет собой «L» конфигурацию. Ниже представлены иллюстративные структуры сахаридов, содержащих аминогруппу, отделенную от сахарида C2этиловой группой, где R может представлять собой водород или карбонильную группу линкера. Другие иллюстративные лиганды будут известны специалистам в данной области техники.







Инсулин
Используемый в настоящем документе термин «инсулин» или «молекула инсулина» охватывает все солевые и несолевые формы молекулы инсулина. Следует принимать во внимание, что солевая форма может быть анионной или катионной, в зависимости от молекулы инсулина. Подразумевается, что терминами «инсулин» или «молекула инсулина» охватывают как инсулин дикого типа, так и модифицированные форм инсулина, при условии, что они биоактивны (т.е., способны индуцировать обнаруживаемое снижение глюкозы при введении in vivo). Инсулин дикого типа включает в себя инсулин любых видов как в очищенной, синтетической, так и в рекомбинантной форме (например, инсулин человека, инсулин свиней, бычий инсулин, инсулин кроликов, инсулин овец, и т.п.). Целый рад указанных инсулинов является коммерчески доступным, например, от Sigma-Aldrich (St. Louis, MO). Различные модифицированные формы инсулина известны в данной области техники (например, см. Crotty and Reynolds, Pediatr. Emerg. Care. 23:903-905, 2007 и Gerich, Am. J. Med. 113:308-16, 2002 и цитируемые в них ссылки). Модифицированные формы инсулина (аналоги инсулина) могут быть модифицированы химически (например, путем присоединения химического фрагмента, такого как группа PEG или цепь ацила жирной кислоты, как описано ниже) и/или путем мутации (т.е., посредством добавления, делеции или замены одной или нескольких аминокислот).
Согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию будет отличаться от инсулина дикого типа на 1-10 (например, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3, 1-2, 2-9, 2-8, 2-7, 2-6, 2-5, 2-4, 2-3, 3-9, 3-8, 3-7, 3-6, 3-5, 3-4, 4-9, 4-8, 4-7, 4-6, 4-5, 5-9, 5-8, 5-7, 5-6, 6-9, 6-8, 6-7, 7-9, 7-8, 8-9, 9, 8, 7, 6, 5, 4, 3, 2 и 1) замен, добавлений и/или делеций аминокислот. Согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию будет отличаться от инсулина дикого типа только заменами аминокислот. Согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию будет отличаться от инсулина дикого типа только добавлениями аминокислот. Согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию будет отличаться от инсулина дикого типа как заменами, так и добавлениями аминокислот. Согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию будет отличаться от инсулина дикого типа как заменами, так и делециями аминокислот.
Согласно конкретным вариантам осуществления, замены аминокислот могут быть выполнены на основании схожести в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природе вовлеченных остатков. Согласно конкретным вариантам осуществления, замена может быть консервативной, иными словами, одна аминокислота заменяется одной аминокислотой одинаковой формы и заряда. Консервативные замены хорошо известны в данной области техники и, как правило, включают в себя замены в рамках следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и тирозин, фенилаланин. Согласно конкретным вариантам осуществления, при выборе подходящих мутаций может рассматриваться индекс гидрофобности аминокислот. Важность индекса гидрофобности аминокислот для обеспечения интерактивной биологической функции полипептида, как правило, учитывается в данной области техники. В качестве альтернативы, замена подобных аминокислот может быть выполнена эффективно на основании гидрофильности. Важность гидрофильности для обеспечения интерактивной биологической функции полипептида, как правило, учитывается в данной области техники. Использование индекса гидрофобности или гидрофильности при конструировании полипептида дополнительно обсуждается в патенте США № 5,691,198.
Последовательность инсулина дикого типа (A-цепь и B-цепь) продемонстрирована ниже.
A-цепь (SEQ ID NO:1): GIVEQCCTSICSLYQLENYCN
B-цепь (SEQ ID NO:2): FVNQHLCGSHLVEALYLVCGERGFFYTPKT
Согласно различным вариантам осуществления, молекула инсулина согласно настоящему раскрытию мутирована по положениям B28 и/или B29 последовательности B-пептида. Например, инсулин лизпро (ХУМАЛОГ®) представляет собой быстро действующий мутант инсулина, в котором предпоследние лизиновые и пролиновые остатки на С-конце В-пептида были изменены (LysB28ProB29-человеческий инсулин) (SEQ ID NO:3). Указанная модификация блокирует образование мультимеров инсулина. Инсулин аспарт (НОВОЛОГ®) представляет собой другой быстро действующий мутант инсулина, в котором пролин в положении B28 был заменен на аспарагиновую кислоту (AspB28-человеческий инсулин) (SEQ ID NO:4). Указанный мутант также предотвращает образование мультимеров. Согласно некоторым вариантам осуществления, мутация по положениям B28 и/или B29 сопровождается одной или несколькими мутациями в другом месте инсулинового полипептида. Например, инсулин глулизин (АПИДРА®) представляет собой еще один быстро действующий мутант инсулина, в котором аспарагиновая кислота в положении B3 была заменена на остаток лизина, и лизин в положении B29 был заменен на остаток глутаминовой кислоты (LysB3GluB29-человеческий инсулин) (SEQ ID NO:5).
Согласно различным вариантам осуществления, молекула инсулина согласно настоящему раскрытию характеризуется изоэлектрической точкой, которая сдвинута относительно инсулина человека. Согласно некоторым вариантам осуществления, сдвиг изоэлектрической точки достигается путем добавления одного или нескольких остатков аргинина к N-концу А-пептида инсулина и/или С-концу В-пептида инсулина. Примеры таких инсулиновых полипетидов включают в себя ArgA0-инсулин человека, ArgB31ArgB32-инсулин человека, GlyA21ArgB31ArgB32-инсулин человека, ArgA0ArgB31ArgB32-инсулин человека и ArgA0GlyA21ArgB31ArgB32-инсулин человека. В качестве следующего примера, инсулин гларгин (ЛАНТУС®) представляет собой иллюстративный мутант инсулина пролонгированного действия, в котором AspA21 был заменен на глицин (SEQ ID NO:6), и два аргининовых остатка были добавлены к С-концу В-пептида (SEQ ID NO:7). Эффектом подобных изменений является сдвиг изоэлектрической точки с получением раствора, который полностью растворим при рН 4. Поэтому, согласно некоторым вариантам осуществления, молекула инсулина согласно настоящему раскрытию содержит последовательность А-пептида, в которой А21 представляет собой Gly, и последовательность В-пептида, в которой В31 и В32 представляют собой Arg-Arg. Следует понимать, что настоящее раскрытие охватывает все одиночные и множественные сочетания подобных мутаций и любые другие мутации, которые описаны в настоящем документе (например, GlyA21-инсулин человека, GlyA21ArgB31-инсулин человека, ArgB31ArgB32-инсулин человека, ArgB31-инсулин человека).
Согласно различным вариантам осуществления, молекула инсулина согласно настоящему раскрытию укорочена. Например, согласно конкретным вариантам осуществления, в последовательности В-пептида инсулинового полипептида согласно настоящему раскрытию отсутствуют B1, B2, B3, B26, B27, B28, B29 и/или B30. Согласно конкретным вариантам осуществления, в последовательности В-пептида инсулинового полипептида согласно настоящему раскрытию отсутствуют сочетания остатков. Например, в последовательности В-пептида могут отсутствовать остатки B(1-2), B(1-3), B(29-30), B(28-30), B(27-30) и/или B(26-30). Согласно некоторым вариантам осуществления, указанные делеции и/или укорочения распространяются на любые упомянутые выше молекулы инсулина (например, без ограничения, для получения дез(B30)-инсулин лизпро, дез(B30)-инсулин аспарт, дез(B30)-инсулин глулизин, дез(B30)-инсулин гларгин, и т.п.).
Согласно некоторым вариантам осуществления, молекула инсулина содержит дополнительные аминокислотные остатки на N- или C-концах последовательностей А- или В-пептида. Согласно некоторым вариантам осуществления, один или несколько аминокислотных остатков расположены в положениях A0, A21, B0 и/или B31. Согласно некоторым вариантам осуществления, один или несколько аминокислотных остатков расположены в положении A0. Согласно некоторым вариантам осуществления, один или несколько аминокислотных остатков расположены в положении A21. Согласно некоторым вариантам осуществления, один или несколько аминокислотных остатков расположены в положении B0. Согласно некоторым вариантам осуществления, один или несколько аминокислотных остатков расположены в положении B31. Согласно конкретным вариантам осуществления, молекула инсулина не включает в себя какие-либо дополнительные аминокислотные остатки в положениях A0, A21, B0 или B31.
Согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию мутирована так, что одна или несколько амидированных аминокислот заменены кислотными формами. Например, аспарагин может быть заменен аспарагиновой кислотой или глутаминовой кислотой. Аналогично, глутамин может быть заменен аспарагиновой кислотой или глутаминовой кислотой. В частности, AsnA18, AsnA21 или AsnB3, или любые сочетания указанных остатков, могут быть заменены аспарагиновой кислотой или глутаминовой кислотой. GlnA15 или GlnB4, или оба остатка, могут быть заменены аспарагиновой кислотой или глутаминовой кислотой. Согласно конкретным вариантам осуществления, молекула инсулина содержит аспарагиновую кислоту в положении A21 или аспарагиновую кислоту в положении B3, или в обоих положениях.
Специалист в данной области техники будет понятно, что возможно мутировать и другие аминокислоты в молекуле инсулина при сохранении биологической активности. Например, без ограничения, следующие модификации также широко применимы в данной области техники: замена гистидинового остатка в положении B10 аспарагиновой кислотой (HisB10→AspB10); замена фенилаланинового остатка в положении B1 аспарагиновой кислотой (PheB1→AspB1); замена треонинового остатка в положении B30 аланином (ThrB30→AlaB30); замена тирозинового остатка в положении B26 аланином (TyrB26→AlaB26); и замена серинового остатка в положении B9 аспарагиновой кислотой (SerB9→AspB9).
Согласно различным вариантам осуществления, молекула инсулина согласно настоящему раскрытию характеризуется длительным профилем действия. Так, согласно конкретным вариантам осуществления, молекула инсулина согласно настоящему раскрытию может быть ацилирована жирной кислотой. То есть, между аминогруппой на молекуле инсулина и группой карбоновой кислоты на жирной кислоте сформирована амидная связь. Аминогруппа может представлять собой α-аминогруппу на N-концевой аминокислоте молекулы инсулина или может представлять собой ε-аминогруппу остатка лизина молекулы инсулина. Молекула инсулина согласно настоящему раскрытию может быть ацилирована по одной или нескольким из трех аминогрупп, которые присутствуют в инсулине человека дикого типа, или может быть ацилирована по остатку лизина, который был введен в последовательность человеческого инсулина дикого типа. Согласно конкретным вариантам осуществления, молекула инсулина может быть ацилирована в положении B1. Согласно конкретным вариантам осуществления, молекула инсулина может быть ацилирована в положении B29. Согласно конкретным вариантам осуществления, жирную кислоту выбирают из миристиновой кислоты (C14), пентадекановой кислоты (C15), пальмитиновой кислоты (C16), маргариновой кислоты (C17) и стеариновой кислоты (C18). Например, инсулин детемир (ЛЕВЕМИР®) представляет собой мутант инсулина пролонгированного действия, в котором ThrB30 был делетирован, и C14-цепь жирной кислоты (миристиновая кислота) была присоединена к LysB29.
Согласно некоторым вариантам осуществления, N-конец А-пептида, N-конец В-пептида, ε-аминогруппа Lys в положении B29 или любая другая доступная аминогруппа в молекуле инсулина согласно настоящему раскрытию ковалентно присоединена к фрагменту жирной кислоты общей формулы:
 ,
,
в которой RF представляет собой водород или C1-30алкильную группу. Согласно некоторым вариантам осуществления, RF представляет собой C1-20алкильную группу, C3-19алкильную группу, C5-18алкильную группу, C6-17алкильную группу, C8-16алкильную группу, C10-15алкильную группу или C12-14алкильную группу. Согласно конкретным вариантам осуществления, полипептид инсулина конъюгирован с фрагментом по A1 положению. Согласно конкретным вариантам осуществления, полипептид инсулина конъюгирован с фрагментом по B1 положению. Согласно конкретным вариантам осуществления, полипептид инсулина конъюгирован с фрагментом на ε-аминогруппе Lys в положении B29. Согласно конкретным вариантам осуществления, положение В28 молекулы инсулина представляет собой Lys, и ε-аминогруппа LysB28 конъюгирована с фрагментом жирной кислоты. Согласно конкретным вариантам осуществления, положение В3 молекулы инсулина представляет собой Lys, и ε-аминогруппа LysB3 конъюгирована с фрагментом жирной кислоты. Согласно некоторым вариантам осуществления, цепь жирной кислоты имеет длину 8-20 углеродов. Согласно некоторым вариантам осуществления, жирная кислота представляет собой октановую кислоту (C8), нонановую кислоту (C9), декановую кислоту (C10), ундекановую кислоту (C11), додекановую кислоту (C12) или тридекановую кислоту (C13). Согласно конкретным вариантам осуществления, жирная кислота представляет собой миристиновую кислоту (C14), пентадекановую кислоту (C15), пальмитиновую кислоту (C16), гептадекановую кислоту (C17), стеариновую кислоту (C18), нонадекановую кислоту (C19) или арахидиновую кислоту (C20).
Согласно различным вариантам осуществления, молекула инсулина согласно настоящему раскрытию включает в себя три дисульфидных мостика дикого типа (т.е., один между положением 7 А-цепи и положением 7 В-цепи, второй между положением 20 А-цепи и положением 19 В-цепи, и третий между положениями 6 и 11 А-цепи). Согласно конкретным вариантам осуществления, молекула инсулина мутирована так, что сайт мутации используется в качестве точки конъюгации, и конъюгация в сайте мутации снижает связывание с инсулиновым рецептором (например, LysA3). Согласно другим конкретным вариантам осуществления, конъюгация по существующей аминокислоте дикого типа или концу снижает связывание с инсулиновым рецептором (например, GlyA1). Согласно некоторым вариантам осуществления, молекула инсулина конъюгирована в положении A4, A5, A8, A9 или B30. Согласно конкретным вариантам осуществления, конъюгация в положении A4, A5, A8, A9 или B30 происходит через боковую цепь аминокислоты дикого типа (например, GluA4). Согласно другим конкретным вариантам осуществления, молекула инсулина мутирована в положении A4, A5, A8, A9 или B30 для обеспечения сайта для конъюгации (например, LysA4, LysA5, LysA8, LysA9 или LysB30).
Способы конъюгирования молекул инсулина описаны ниже. Согласно конкретным вариантам осуществления, молекулу инсулина конъюгируют с линкером через аминокислотный остаток A1. Согласно конкретным вариантам осуществления, аминокислотный остаток A1 представляет собой глицин. Однако следует понимать, что настоящее раскрытие не ограничено N-концевой конъюгацией, и что согласно конкретным вариантам осуществления, молекула инсулина может быть конъюгирована через неконцевой аминокислотный остаток А-цепи. В частности, настоящее раскрытие охватывает конъюгацию через ε-аминогруппу лизинового остатка, присутствующего в любом положении А-цепи (дикий тип или введенный посредством сайт-специфического мутагенеза). Следует принимать во внимание, что различные положения конъюгации на А-цепи могут приводить к различным снижениям активности инсулина. Согласно конкретным вариантам осуществления, молекула инсулина конъюгирована с линкером через аминокислотный остаток B1. Согласно конкретным вариантам осуществления, аминокислотный остаток B1 представляет собой фенилаланин. Однако следует понимать, что настоящее раскрытие не ограничено N-концевой конъюгацией, и что согласно конкретным вариантам осуществления, молекула инсулина может быть конъюгирована через неконцевой аминокислотный остаток В-цепи. В частности, настоящее раскрытие охватывает конъюгацию через ε-аминогруппу лизинового остатка, присутствующего в любом положении В-цепи (дикий тип или введенный посредством сайт-специфического мутагенеза). Например, согласно конкретным вариантам осуществления, молекула инсулина может быть конъюгирована через лизиновый остаток B29. В случае инсулина глулизина, может быть использована конъюгация по меньшей мере с одним лигандом через лизиновый остаток В3. Следует принимать во внимание, что различные положения конъюгации на В-цепи могут вести к различным снижениям активности инсулина.
Согласно конкретным вариантам осуществления, лиганды конъюгированы по нескольким точкам конъюгации на молекуле инсулина. Например, молекула инсулина может быть конъюгирована как по A1 N-конца, так и по лизину В29. Согласно некоторым вариантам осуществления, в карбонатном буфере происходит амидная конъюгация с конъюгированием по положениям B29 и A1, но не в положении B1. Согласно другим вариантам осуществления, молекула инсулина может быть конъюгирована по A1 N-конца, по B1 N-конца и по В29 лизину. Согласно еще одним вариантам осуществления, защитные группы используются так, чтобы конъюгация происходила по положениям B1 и B29 или B1 и A1. Следует принимать во внимание, что может быть использовано любое сочетание точек конъюгации на молекуле инсулина. Согласно некоторым вариантам осуществления по меньшей мере одна из точек конъюгации представляет собой мутированный остаток лизина, например, LysA3.
Иллюстративные конъюгаты инсулина
Согласно различным вариантам осуществления, конъюгат инсулина согласно настоящему раскрытию содержит молекулу инсулина или аналога инсулина, конъюгированную по меньшей мере с одним бидентатным линкером, где по меньшей мере одно плечо бидентатного линкера присоединено к лиганду аминоэтилфукозе (AEF). Другое плечо бидентатного линкера может быть конъюгировано с лигандом AEF и/или с одним или несколькими лигандами, которые независимо выбирают из группы, состоящей из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF). Согласно конкретным вариантам осуществления, молекула инсулина конъюгирована через аминокислотный остаток A1. Согласно конкретным вариантам осуществления, молекула инсулина конъюгирована через аминокислотный остаток B1. Согласно конкретным вариантам осуществления, молекула инсулина конъюгирована через ε-аминогруппу LysB29. Согласно конкретным вариантам осуществления, молекула инсулина представляет собой аналог, который содержит лизин в положении B28 (LysB28), и молекула инсулина конъюгирована через ε-аминогруппу LysB28, например, инсулин лизпро конъюгирован через ε-аминогруппу LysB28. Согласно конкретным вариантам осуществления, молекула инсулина представляет собой аналог, который содержит лизин в положении B3 (LysB3), и молекула инсулина конъюгирована через ε-аминогруппу LysB3, например, инсулин глулизин конъюгирован через ε-аминогруппу LysB3.
Согласно конкретным вариантам осуществления, инсулин или молекула инсулина описанного выше конъюгата инсулина может быть конъюгирована с одним или несколькими дополнительными линкерами, присоединенными к одному или нескольким лигандам, где каждый лиганд независимо выбирают из лигандов аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF). Дополнительные линкеры могут быть линейными, бидентатными, тридентатными, квадридентатными и т.п., где каждое плечо линкера содержит лиганд, который может быть независимо выбирают из лигандов аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF).
Таким образом, согласно конкретным вариантам осуществления, конъюгат инсулина может содержать бидентатный линкер или состоять из бидентатного линкера, где по меньшей мере одно плечо бидентатного линкера присоединено к лиганду аминоэтилфукозе (AEF), конъюгированной с аминогруппой в положении A1 инсулина или аналога инсулина; или с аминогруппой в положении B1 инсулина или аналога инсулина; или с аминогруппой в положении B3 аналога инсулина; или с аминогруппой в положении B28 аналога инсулина; или с аминогруппой в положении B29 инсулина или аналога инсулина.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать два бидентатных линкера или состоять из двух бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении A1, а второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B1, B3, B28 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать два бидентатных линкера или состоять из двух бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении B1, а второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении A1, B3, B28 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать два бидентатных линкера или состоять из двух бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении B3, а второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B1, А3, B28 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать два бидентатных линкера или состоять из двух бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении B28, а второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B1, В3, A1 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать два бидентатных линкера или состоять из двух бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении B29, а второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B1, В3, В28 или A1.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать три бидентатных линкера или состоять из трех бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении A1; второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B1; а третий бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B3, В28 или В29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать четыре бидентатных линкера или состоять из четырех бидентатных линкеров, где первый бидентатный линкер, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгирован с аминогруппой в положении A1; второй бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B1; третий бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B3; а четвертый бидентатный линкер, присоединенный к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгирован с аминогруппой в положении B28 или В29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, в котором по меньшей мере одно плечо бидентатного линкера присоединено к лиганду аминоэтилфукозе (AEF), конъюгированного с аминогруппой в положении A1; или с аминогруппой в положении B1; или с аминогруппой в положении B3; или с аминогруппой в положении B28; или с аминогруппой в положении B29, и (b) линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгированного с аминогруппой в положении A1; или с аминогруппой в положении B1; или с аминогруппой в положении B3; или с аминогруппой в положении B28; или с аминогруппой в положении B29, если положение не занято бидентатным линкером.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгированного с аминогруппой в положении A1, и (b) линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгированного с аминогруппой в положении B1, B3, B28 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгированного с аминогруппой в положении B1, и (b) линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгированного с аминогруппой в положении A1, B3, B28 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгированного с аминогруппой в положении B3, и (b) линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгированного с аминогруппой в положении B1, A1, B28 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгированного с аминогруппой в положении B28, и (b) линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгированного с аминогруппой в положении B1, В3, A1 или B29.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера, конъюгированного с аминогруппой в положении B29, и (b) линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), конъюгированного с аминогруппой в положении B1, В3, В28 или A1.
Согласно конкретным вариантам осуществления, конъюгат инсулина может содержать или состоять из (а) бидентатного линкера, который содержит лиганд аминоэтилфукозу (AEF), присоединенную к одному плечу первого бидентатного линкера, и лиганд, выбранный из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), присоединенный к другому плечу бидентатного линкера; (b) первого линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF); и (с) второго линейного или тридентатного линкера, присоединенного к одному или нескольким лигандам, где каждый лиганд независимо выбирают из аминоэтилглюкозы (AEG), аминоэтилманнозы (AEM), аминоэтилбиманнозы (AEBM), аминоэтилтриманнозы (AETM), β-аминоэтил-N-ацетилглюкозамина (AEGA) и аминоэтилфукозы (AEF), где каждый линкер конъюгирован с аминогруппой в положении A1, B1, B3, B28 или B29, при условии, что каждый занимает отдельное положение, так что всего заняты три сайта.
Конъюгаты инсулина
В этом разделе описаны некоторые иллюстративные конъюгаты инсулина или аналогов инсулина.
Согласно конкретным вариантам осуществления, предусмотрены конъюгаты инсулина и аналогов инсулина, содержащие по меньшей мере одну фукозу, где конъюгат характеризуется соотношением значений EC50 или IP, определенных посредством анализа фосфорилирования функционального инсулинового рецептора, к значениям IC50 или IP, определенным посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, составляющим приблизительно от 0,5:1 приблизительно до 1:100; приблизительно от 1:1 приблизительно до 1:50; приблизительно от 1:1 приблизительно до 1:20; или приблизительно от 1:1 приблизительно до 1:10. Согласно дополнительным аспектам, указанный выше конъюгат содержит молекулу инсулина или аналога инсулина, ковалентно присоединенную по меньшей мере к одному разветвленному линкеру, имеющему первое плечо и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, и второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, и где первый сахарид представляет собой фукозу, и где конъюгат конъюгат характеризуется соотношением значений EC50 или IP, определенных посредством анализа фосфорилирования функционального инсулинового рецептора, к значениям IC50 или IP, определенным посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, составляющим приблизительно от 0,5:1 приблизительно до 1:100; приблизительно от 1:1 приблизительно до 1:50; приблизительно от 1:1 приблизительно до 1:20; или приблизительно от 1:1 приблизительно до 1:10. Согласно конкретным аспектам, второй сахарид представляет собой фукозу, маннозу, глюкозамин, глюкозу, бисахарид, трисахарид, тетрасахарид, разветвленный трисахарид, биманнозу, триманнозу, тетраманнозу, разветвленную триманнозу.
Термин «IP» относится к точке перегиба, которая представляет собой точку на кривой, в которой кривизна или вогнутость изменяет знак с плюса на минус или с минуса на плюс. В общем, IP обычно эквивалентна EC50 или IC50.
Согласно конкретным аспектам, значения IC50 или IP, определенные посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, могут составлять приблизительно менее 100 нМ и приблизительно более 0,5 нМ. Согласно конкретным аспектам, значения IC50 или IP составляют приблизительно менее 50 нМ и приблизительно более 1 нМ; приблизительно менее 25 нМ и приблизительно более 1 нМ; или приблизительно менее 20 нМ и приблизительно более 1 нМ. Согласно конкретным аспектам, значения EC50 или IP, определенные посредством анализа фосфорилирования функционального инсулинового рецептора, могут составлять приблизительно менее 100 нМ и приблизительно более 0,5 нМ. Согласно конкретным аспектам, значения IC50 или IP составляют приблизительно менее 50 нМ и приблизительно более 1 нМ; приблизительно менее 25 нМ и приблизительно более 1 нМ; или приблизительно менее 20 нМ и приблизительно более 1 нМ.
Согласно различным вариантам осуществления, конъюгаты могут характеризоваться общей формулой (I):
 I,
I,
в которой:
в каждом случае появления 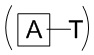 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, или ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
-B представляет собой -T-LB-X,
в каждом случае появления X независимо представляет собой лиганд;
в каждом случае появления LB независимо представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
где n равно 1, 2 или 3, при условии, что инсулин конъюгирован по меньшей мере с одним линкеров, где один из лигандов представляет собой фукозу.
Согласно конкретным аспектам, указанный выше конъюгат может характеризоваться соотношением значений EC50 или IP, определенных посредством анализа фосфорилирования функционального инсулинового рецептора, к значениям IC50 или IP, определенным посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, составляющим приблизительно от 0,5:1 приблизительно до 1:100; приблизительно от 1:1 приблизительно до 1:50; приблизительно от 1:1 приблизительно до 1:20; или приблизительно от 1:1 приблизительно до 1:10.
Согласно конкретным вариантам осуществления, конъюгат инсулина или аналога инсулина может характеризоваться общей формулой (II):
 II,
II,
в которой:
в каждом случае появления 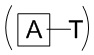 представляет собой потенциальный повтор в пределах ветви конъюгата;
представляет собой потенциальный повтор в пределах ветви конъюгата;
в каждом случае появления  независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
независимо представляет собой ковалентную связь, атом углерода, гетероатом или необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы;
в каждом случае появления T независимо представляет собой ковалентную связь или двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-30углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу;
в каждом случае появления R независимо представляет собой водород, подходящую защитную группу, или ацильный фрагмент, арилалкильный фрагмент, алифатический фрагмент, арильный фрагмент, гетероарильный фрагмент или гетероалифатический фрагмент;
-B1 представляет собой -T-LB1-фукозу,
где LB1 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с X;
-B2 представляет собой -T-LB2-X,
где X представляет собой лиганд, содержащий сахарид, который может представлять собой фукозу, маннозу или глюкозу; и LB2 представляет собой ковалентную связь или группу, полученную в результате ковалентной конъюгации T с Х; и
где n равно 1, 2 или 3.
Согласно конкретным аспектам, указанный выше конъюгат может характеризоваться соотношением значений EC50 или IP, определенных посредством анализа фосфорилирования функционального инсулинового рецептора, к значениям IC50 или IP, определенным посредством анализа конкурентного связывания на макрофагальном маннозном рецепторе, составляющим приблизительно от 0,5:1 приблизительно до 1:100; приблизительно от 1:1 приблизительно до 1:50; приблизительно от 1:1 приблизительно до 1:20; или приблизительно от 1:1 приблизительно до 1:10.
Описание иллюстративных групп
 (узел)
(узел)
Согласно конкретным вариантам осуществления, в каждом случае появления  независимо представляет собой необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы. Согласно некоторым вариантам осуществления, в каждом случае появления
независимо представляет собой необязательно замещенную группу, выбранную из группы, состоящей из ацила, алифатической группы, гетероалифатической группы, арила, гетероарила и гетероциклической группы. Согласно некоторым вариантам осуществления, в каждом случае появления  являются одинаковыми. Согласно некоторым вариантам осуществления, центральный узел
являются одинаковыми. Согласно некоторым вариантам осуществления, центральный узел  отличается от всех остальных случаев появления
отличается от всех остальных случаев появления  . Согласно конкретным вариантам осуществления, все случаи появления
. Согласно конкретным вариантам осуществления, все случаи появления  являются одинаковыми, за исключением центрального узла
являются одинаковыми, за исключением центрального узла  .
.
Согласно некоторым вариантам осуществления,  представляет собой необязательно замещенную арильную или гетероарильную группу. Согласно некоторым вариантам осуществления,
представляет собой необязательно замещенную арильную или гетероарильную группу. Согласно некоторым вариантам осуществления,  представляет собой 2-, 3-, 4-, 6- или 8-членную арильную или гетероарильную группу. Согласно некоторым вариантам осуществления,
представляет собой 2-, 3-, 4-, 6- или 8-членную арильную или гетероарильную группу. Согласно некоторым вариантам осуществления,  представляет собой 5- или 6-членную гетероциклическую группу. Согласно конкретным вариантам осуществления,
представляет собой 5- или 6-членную гетероциклическую группу. Согласно конкретным вариантам осуществления,  представляет собой гетероатом, выбранный из N, O или S. Согласно некоторым вариантам осуществления,
представляет собой гетероатом, выбранный из N, O или S. Согласно некоторым вариантам осуществления,  представляет собой атом азота. Согласно некоторым вариантам осуществления,
представляет собой атом азота. Согласно некоторым вариантам осуществления,  представляет собой атом кислорода. Согласно некоторым вариантам осуществления,
представляет собой атом кислорода. Согласно некоторым вариантам осуществления,  представляет собой атом серы. Согласно некоторым вариантам осуществления,
представляет собой атом серы. Согласно некоторым вариантам осуществления,  представляет собой атом углерода. Согласно некоторым вариантам осуществления,
представляет собой атом углерода. Согласно некоторым вариантам осуществления,  представляет собой структуру
представляет собой структуру  .
.
Т (спейсер)
Согласно конкретным вариантам осуществления, в каждом случае появления T независимо представляет собой двухвалентную, неразветвленную или разветвленную, насыщенную или ненасыщенную, необязательно замещенную C1-20углеводородную цепь, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу. Согласно конкретным вариантам осуществления, одна, две, три, четыре или пять метиленовых единиц T необязательно и независимо замещены. Согласно конкретным вариантам осуществления, T сконструирован из C1-10, C1-8, C1-6, C1-4, C2-12, C4-12, C6-12, C8-12 или C10-12углеводородной цепи, где одна или несколько метиленовых единиц в T необязательно и независимо заменены на -O-, -S-, -N(R)-, -C(O)-, C(O)O-, OC(O)-, -N(R)C(O)-, -C(O)N(R)-, -S(O)-, -S(O)2-, -N(R)SO2-, SO2N(R)-, гетероциклическую группу, арильную группу или гетероарильную группу. Согласно некоторым вариантам осуществления, одна или несколько метиленовых единиц в T заменены гетероциклической группой. Согласно некоторым вариантам осуществления, одна или несколько метиленовых единиц в T заменены триазольным фрагментом. Согласно конкретным вариантам осуществления, одна или несколько метиленовых единиц в T заменены -C(O)-. Согласно конкретным вариантам осуществления, одна или несколько метиленовых единиц в T заменены -C(O)N(R)-. Согласно конкретным вариантам осуществления, одна или несколько метиленовых единиц в T заменены -O-.
Согласно конкретным вариантам осуществления, T может характеризоваться структурой
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  .
.
Согласно конкретным вариантам осуществления, настоящее раскрытие предусматривает конъюгаты инсулина или аналога инсулина, содержащие 1, 2 или 3 бидентатных линкера, каждый независимо выбранный из группы, состоящей из





































в которых каждый Х независимо представляет собой лиганд, содержащий сахарид, при условии, что по меньшей мере один бидентатный линкер, конъюгированный с инсулином или аналогом инсулина, содержит фукозу, по меньшей мере, на одном плече бидентатного линкера. Согласно конкретным вариантам осуществления, каждый Х может независимо представлять собой











в которых волнистая линия указывает на связь с атомом бидентатного линкера. EG представляет собой этилглюкозу, EM представляет собой этилманнозу, EF представляет собой этилфукозу, ETM представляет собой этилтриманнозу, EBM представляет собой этилдиманнозу, EGA представляет собой этилглюкозамин, EDG представляет собой этилдезоксиглюкозу, EDF представляет собой этилдезоксифукозу, и EDM представляет собой этилдезоксиманнозу.
Специалисту в данной области техники следует принимать во внимание, что для ковалентной конъюгации Х с T и/или W с T (в общем, «компоненты») могут быть использованы различные подходы конъюгационной химии. Такие методики широко известны в данной области техники, а иллюстративные методики рассмотрены ниже. Компоненты могут быть связаны непосредственно (т.е., без каких-либо промежуточных химических групп) или связаны опосредованно через спейсер (например, агент сочетания или ковалентная цепь, которая обеспечивает некоторое физическое разделение между конъюгированным элементом и остальной частью линкера). Следует понимать, что компоненты могут быть ковалентно связаны с линкером посредством любого количества химических связей, включая без ограничения амидные, аминные, сложноэфирные, эфирные, тиоэфирные, изомочевинные, иминные и т.п. связи.
Согласно различным вариантам осуществления, компоненты могут быть ковалентно связаны с линкером, с использованием реакций «клик-химии», известных в данной области техники. Указанные реакции включают в себя, например, реакции циклоприсоединения, нуклеофильные реакции раскрытия кольца и присоединения к множественным углерод-углеродным связям (например, см. Kolb and Sharpless, Drug Discovery Today 8:1128-1137, 2003, и цитируемые в ней ссылки, а также Dondoni, Chem. Asian J. 2:700-708, 2007 и цитируемые в ней ссылки). Как рассматривалось выше, согласно различным вариантам осуществления, компоненты могут быть связаны с линкером посредством натуральных или химически добавленных боковых групп. В общем, следует принимать во внимание, что первый и второй представители пары реакционноспособных групп (например, карбоксильная группа и аминогруппа, которые взаимодействуют с получением амидной связи) могут присутствовать либо на одном из компонентов, либо на линкере (т.е., относительное положение двух членов не имеет большого значения, пока они взаимодействуют с образованием конъюгата). Иллюстративные связи обсуждаются более подробно ниже.
Конкретные компоненты могут то природы обладать двумя или более одинаковыми химически реакционноспособными фрагментами. Согласно некоторым примерам, можно выбирать тип химической реакции и условия для селективного взаимодействия компонента только на одном из указанных сайтов. Например, в случае, когда инсулин конъюгирован через реакционноспособные амины, согласно конкретным вариантам осуществления, N-концевой α-Phe-B1 может быть более желателен в качестве сайта присоединения, чем N-концевой α-Gly-A1 и ε-Lys-B29, для сохранения биоактивности инсулина (например, см. Mei et al., Pharm. Res. 16: 1680-1686, 1999 и цитируемые в ней ссылки, а также Tsai et al., J. Pharm. Sci. 86: 1264-1268, 1997). В иллюстративной реакции между инсулином с гексадеценалем (молекула с альдегидом на конце), исследователи обнаружили, что смешивание двух компонентов в течение ночи в 1,5 М водном растворе (рН 6,8) салицилата натрия, содержащем 54% изопропанола в молярном соотношении (инсулин/альдегид=1/6), в присутствии цианборгидрида натрия приводило к >80% конверсии до однозамещенного Phe-B1 конъюгированного со вторичным амином продукта (Mei et al., Pharm. Res. 16:1680-1686, 1999). Их исследования показали, что выбор растворителя, рН и соотношение инсулин/альдегид, все вместе влияли на селективность и выход реакции. Однако во многих случаях, достижение селективности посредством выбора условий химической реакции затруднено. В этой связи, согласно конкретным вариантам осуществления, может быть выигрышно селективно защищать компонент (например, инсулин) по всем сайтам, отличным от одного целевого для реакции, с последующей стадией снятия защиты после того, как вещество прореагировало и было очищено. Например, существует множество примеров селективной защиты аминогрупп инсулина, доступных в литературе, включая примеры, которые могут быть лишены защиты в кислых (BOC), слабокислых (цитраконовый ангидрид) и основных (MSC) условиях (например, см. Tsai et al., J. Pharm. Sci. 86: 1264-1268, 1997; Dixon et al., Biochem. J. 109: 312-314, 1968; и Schuettler et al., D. Brandenburg Hoppe Seyler's Z. Physiol. Chem. 360: 1721, 1979). Согласно одному примеру, амины Gly-A1 и Lys-B29 могут быть селективно защищены с помощью трет-бутоксикарбонильных (BOC) групп, которые после конъюгирования удаляют посредством инкубирования в течение 1 часа при температуре 4°C в смеси 90% трифторуксусной кислоты (TFA)/10% раствора анизола. Согласно одному варианту осуществления, сухой порошок инсулина растворяют в безводном DMSO, а затем добавляют избыток триэтиламина. К этому раствору медленно добавляют приблизительно 2 эквивалента раствора ди-трет-бутилдикарбоната в THF, и оставляют раствор перемешиваться в течение 30-60 минут. После взаимодействия, неочищенный раствор переливают в избыток ацетона, а затем по каплям добавляют разбавленный HCl для осаждения прореагировавшего инсулина. Осажденное вещество центрифугируют, промывают ацетоном и высушивают досуха в условиях вакуума.
Целевой ди-BOC-защищенный продукт может быть отделен от непрореагировавшего инсулина, нецелевых ди-BOC-изомеров и побочных моно-BOC- и три-BOC-продуктов методом препаративной HPLC с обращенной фазой или ионообменной хроматографии (например, см. Tsai et al., J. Pharm. Sci. 86: 1264-1268, 1997). В случае HPLC с обращенной фазой, раствор неочищенного продукта в смеси 70% воды/30% ацетонитрила, содержащей 0,1% TFA, наносят на колонку С8 и элюируют возрастающим градиентом ацетонитрила. Целевой ди-BOC-пик собирают, удаляют ацетонитрил и лиофилизируют с получением продукта.
Согласно конкретным вариантам осуществления, конъюгаты инсулин-олигосахарид могут содержать инсулин или аналог инсулина и по меньшей мере один бидентатный линкер, имеющий первое плечо и второе плечо, где первое плечо соединено с первым лигандом, который включает в себя первый сахарид, а второе плечо соединено со вторым лигандом, который включает в себя второй сахарид, и где по меньшей мере для одного бидентатного линкера первый сахарид представляет собой фукозу, и где по меньшей мере один бидентатный линкер конъюгирован с α-аминогруппой N-концевой аминокислоты А-цепи или В-цепи инсулина или аналога инсулина или с ε-аминогруппой остатка лизина А-цепи или В-цепи инсулина или аналога инсулина. Согласно конкретным вариантам осуществления, конъюгат может содержать по меньшей мере два линкера, из которых по меньшей мере один линкер представляет собой бидентатный линкер, содержащий фукозу. Согласно конкретным вариантам осуществления, конъюгат может содержать, по меньшей мере, три линкера, из которых по меньшей мере один линкер представляет собой бидентатный линкер, содержащий фукозу.
Согласно конкретным вариантам осуществления по меньшей мере один бидентатный линкер может характеризоваться формулой A, B, C, D, E, F, G, H, I, J, K, L, M, N, O, P, Q, R, S, T, U, V, W, X, Y, Z, AA, AB, AC, AD, AE, AF, AG, AH, AI, AJ или AK, представленной выше, где Х представляет собой сахарид; при условии, что по меньшей мере для одного бидентатного линкера Х по меньшей мере на одном плече по меньшей мере одного бидентатного линкера представляет собой фукозу. Согласно конкретным вариантам осуществления, Х характеризуется формулой EG, EM, EBM, EGA, EF, EFβ, EBM, ETM, EDG, EDF или EDM, представленной выше.
Согласно конкретным вариантам осуществления, аналог инсулина может содержать последовательность А-цепи, содержащую последовательность GIVEQCCX1SICSLYQLENYCX2 (SEQ ID NO: 8); и последовательность В-цепи, содержащую последовательность X3LCGX4X5LVEALYLVCGERGFF (SEQ ID NO: 9) или X8VNQX3LCGX4X5LVEALYLVCGERGFFYTX6X7 (SEQ ID NO: 10), в которых
X1 выбирают из группы, состоящей из треонина и гистидина;
X2 представляет собой аспарагин или глицин;
X3 выбирают из группы, состоящей из гистидина и треонина;
X4 выбирают из группы, состоящей из аланина, глицина и серина;
X5 выбирают из группы, состоящей из гистидина, аспарагиновой кислоты, глутаминовой кислоты, гомоцистеиновой кислоты и цистеиновой кислоты;
X6 представляет собой дипептид аспартат-лизин, дипептид лизин-пролин или дипептид пролин-лизин;
X7 представляет собой треонин, аланин или трипептид треонин-аргинин-аргинин; и
X8 выбирают из группы, состоящей из фенилаланина и дезаминофенилаланина.
Согласно конкретным вариантам осуществления, А-цепь может иметь аминокислотную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 6, и В-цепь может иметь аминокислотную последовательность, представленную в SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5. Согласно конкретным вариантам осуществления, аналог инсулина представляет собой desB30-аналог инсулина, desB29-B30-аналог инсулина, desB28-B30-аналог инсулина, desB27-B30-аналог инсулина или desB26-B30-аналог инсулина.
Иллюстративные конъюгаты инсулин человека/олигосахарид (IOC) согласно настоящему изобретению включают в себя IOC, характеризующиеся следующими структурами.




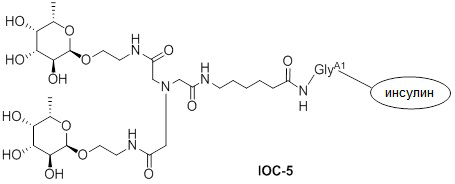





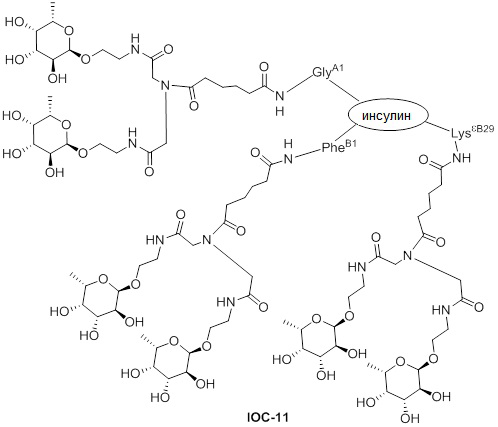






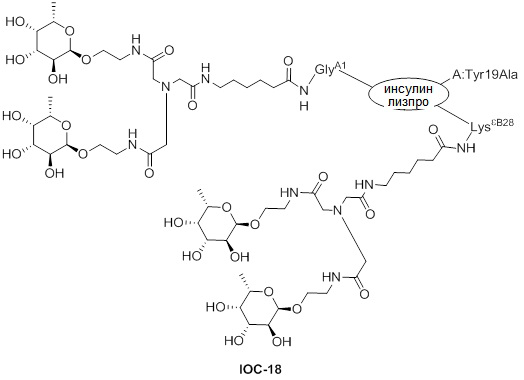
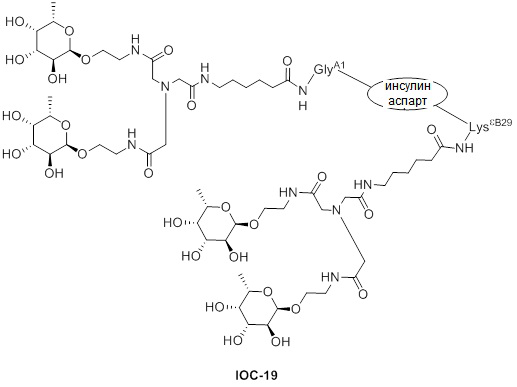



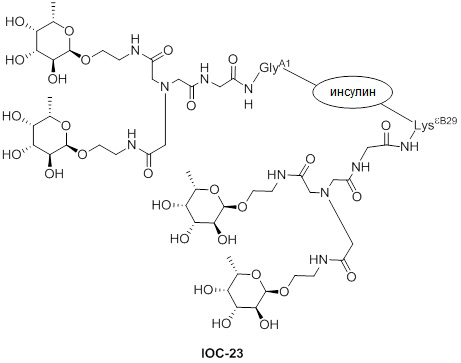
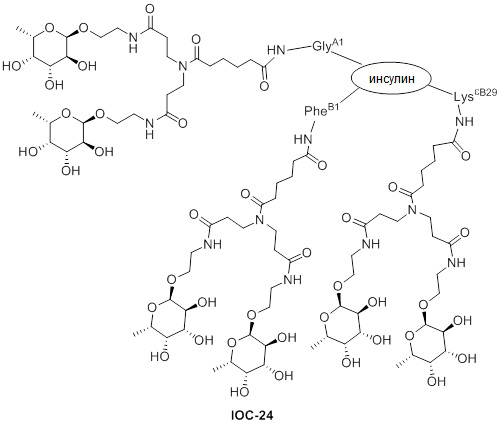











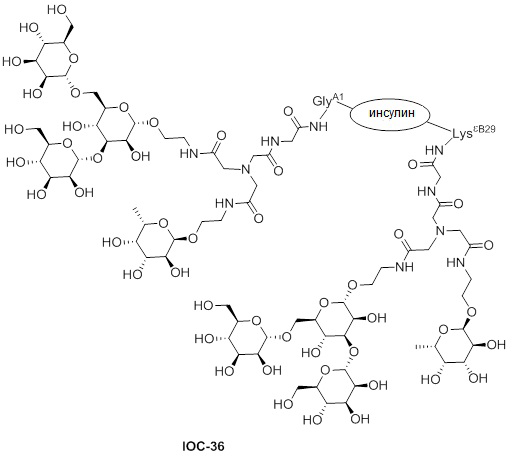


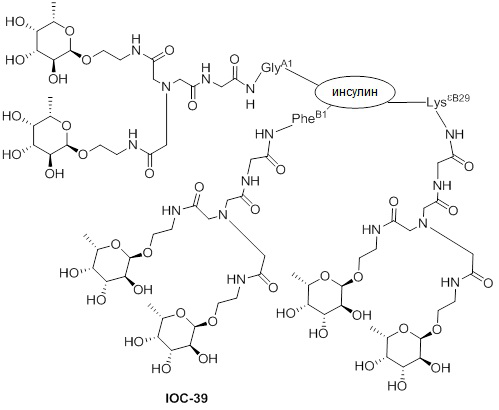





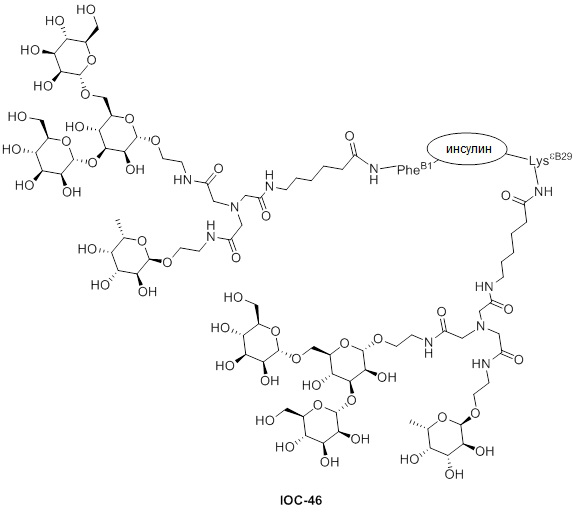

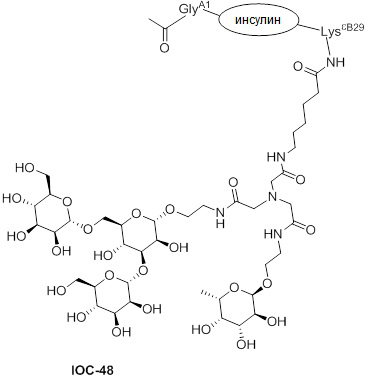
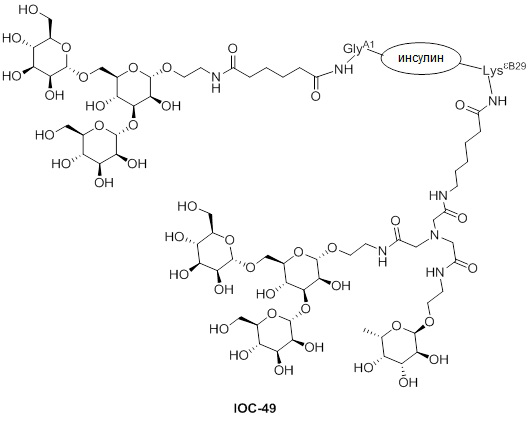

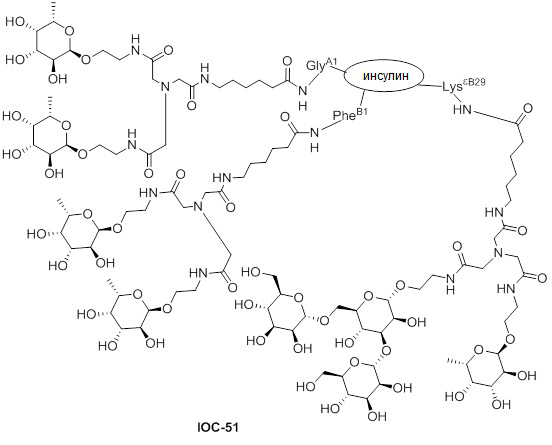




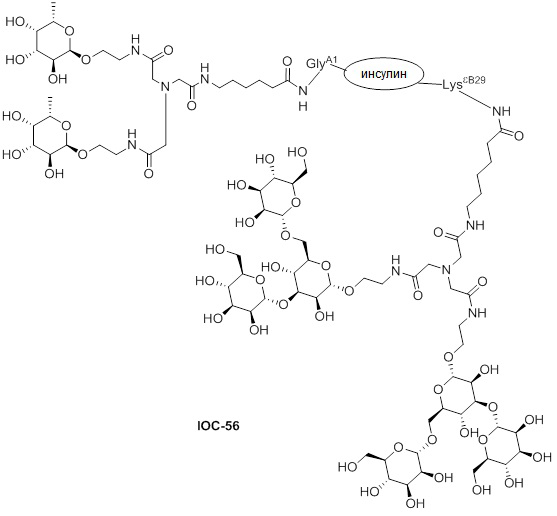


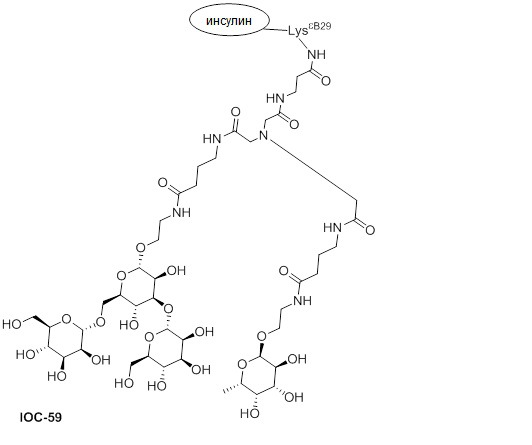





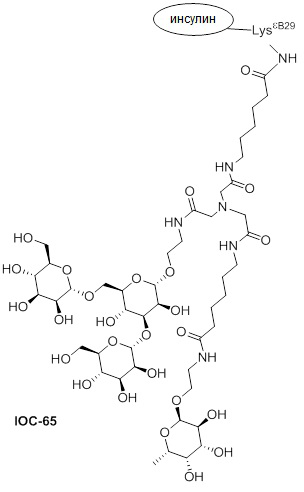







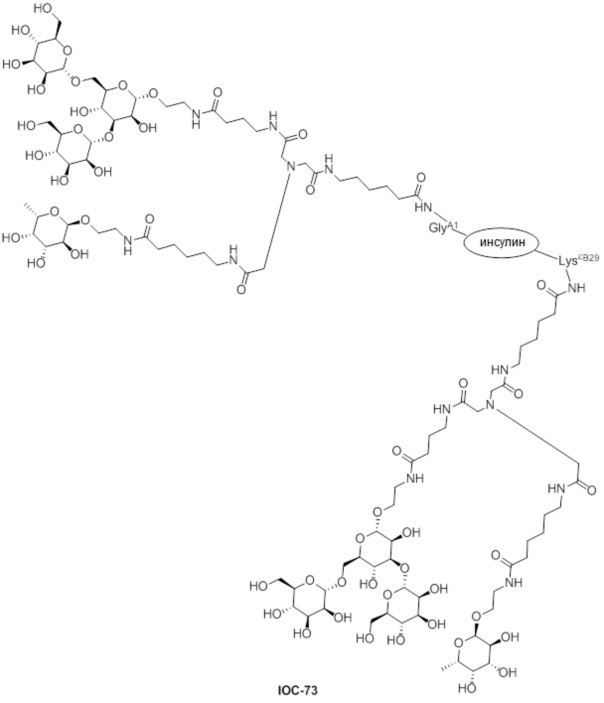

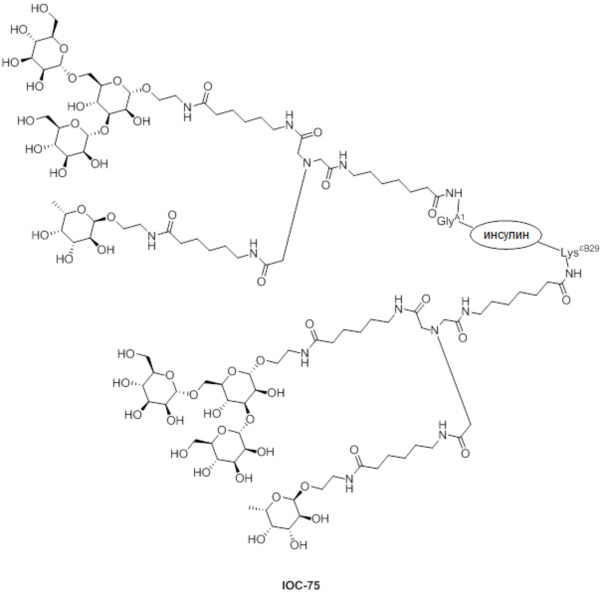

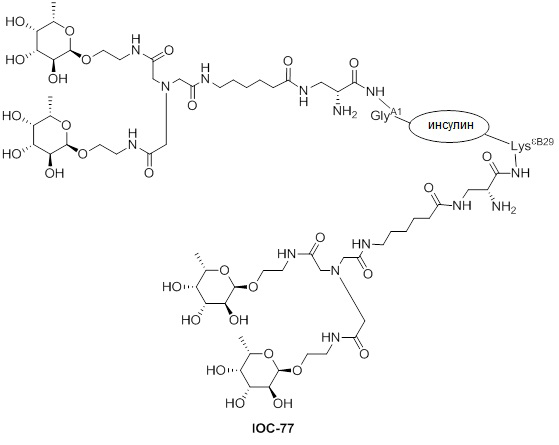
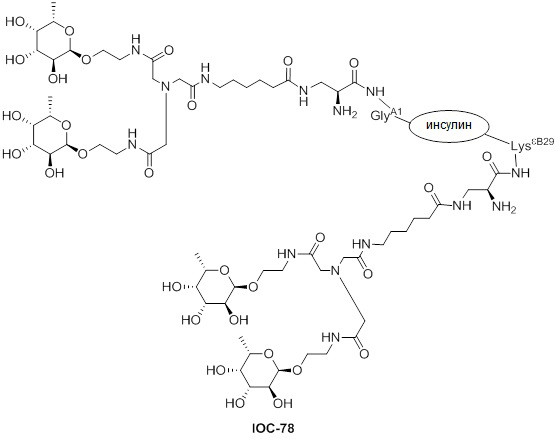



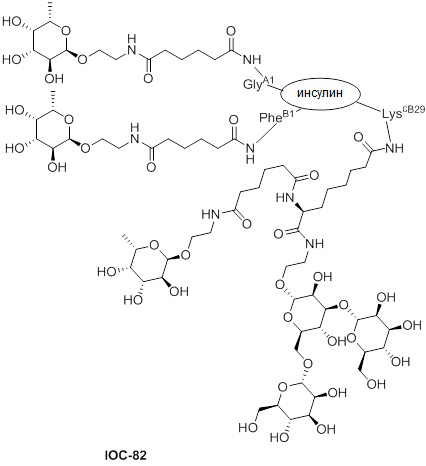


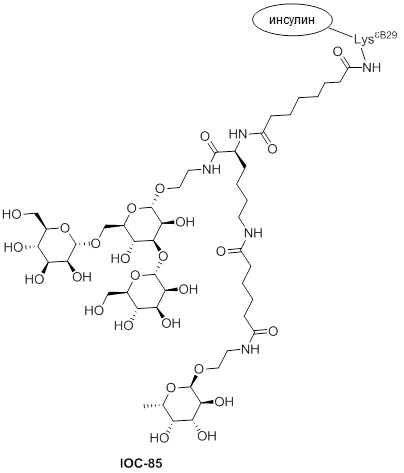





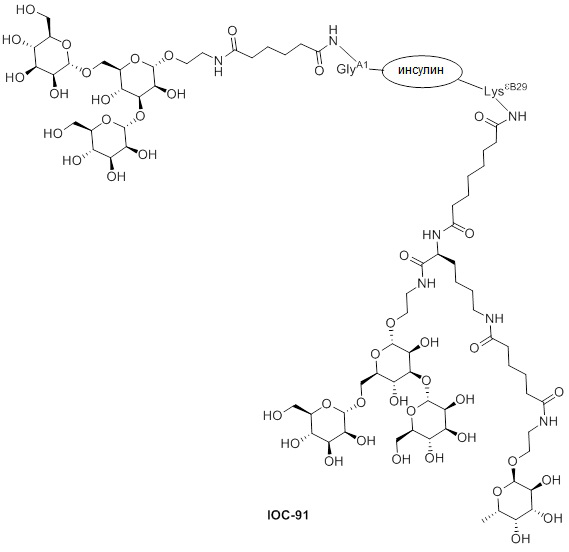

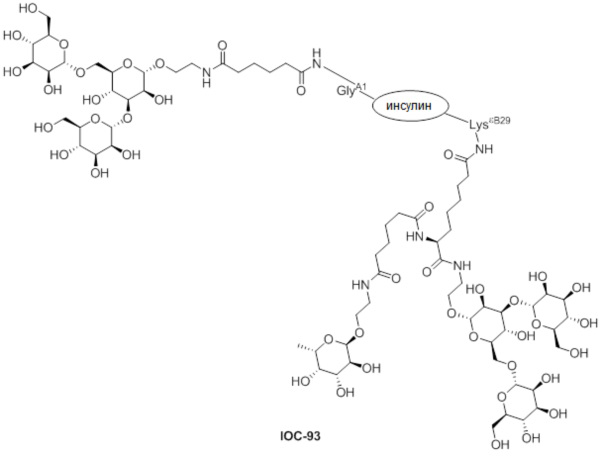




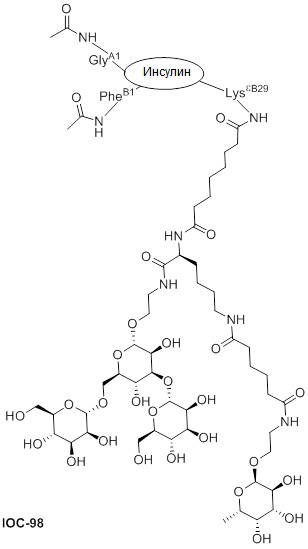








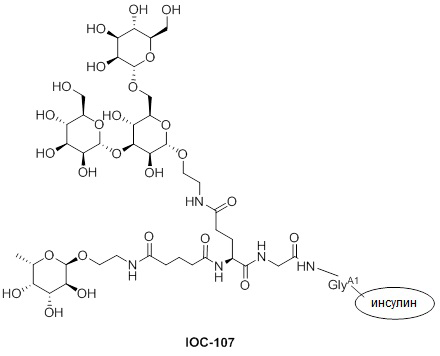
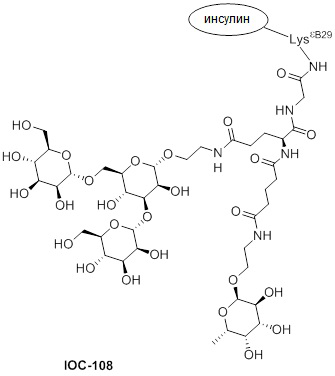

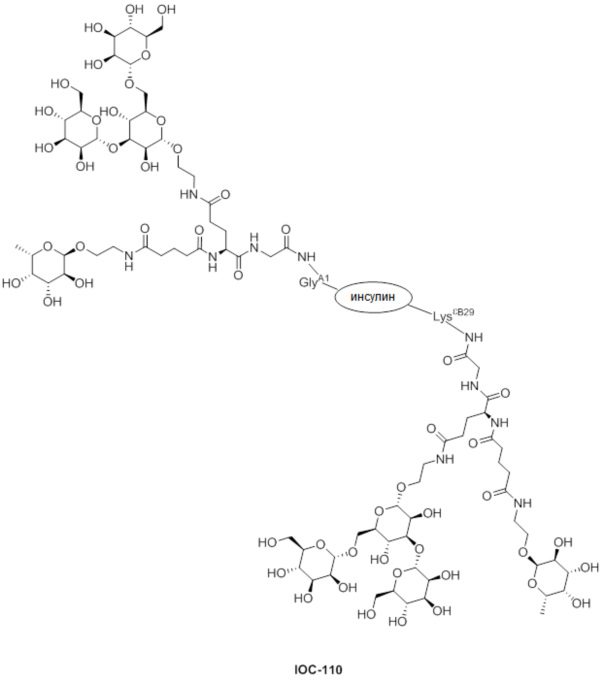

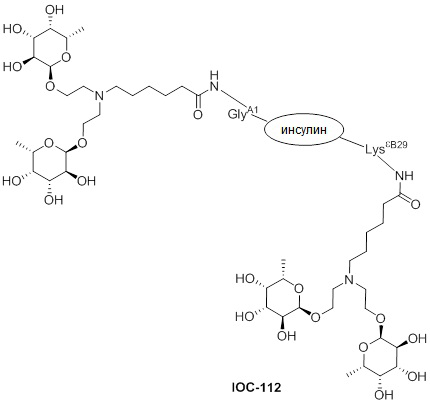

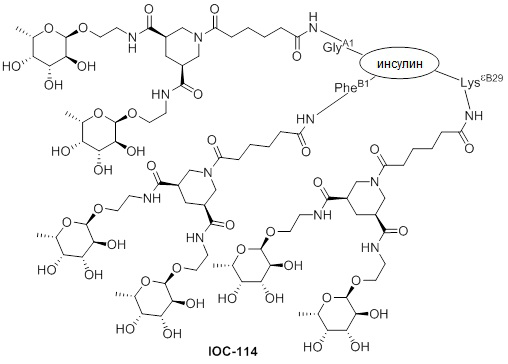



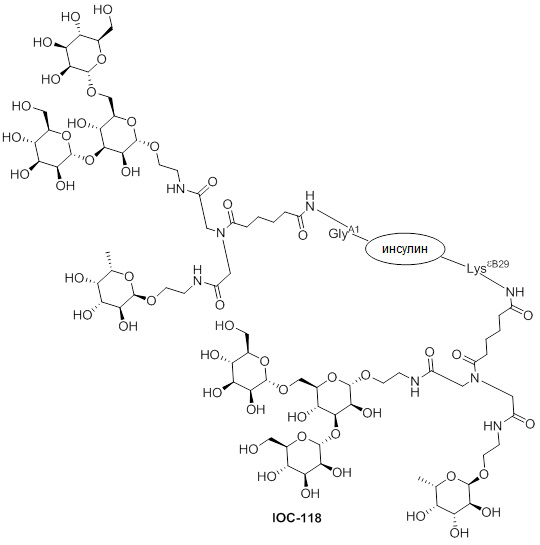
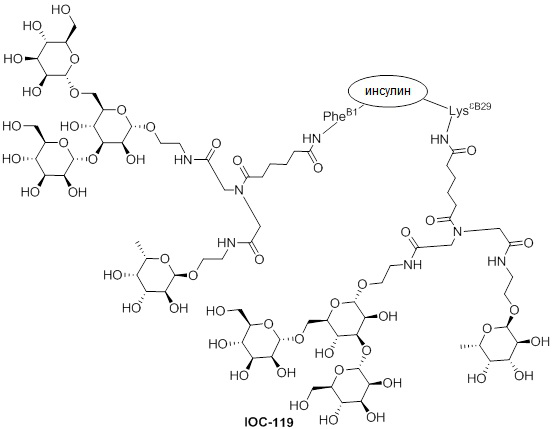


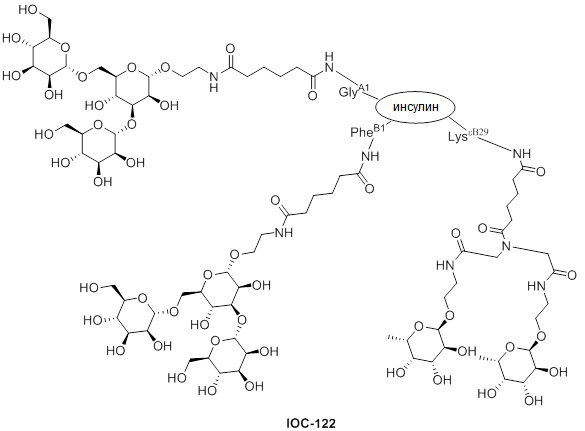

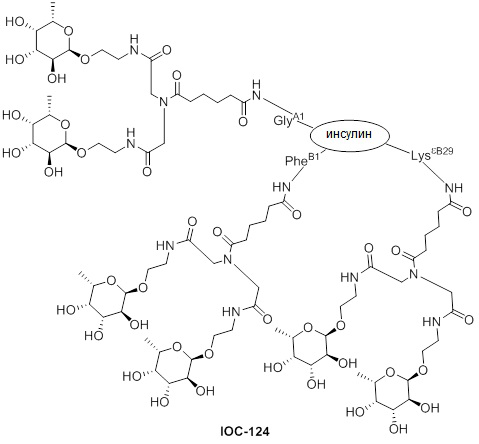
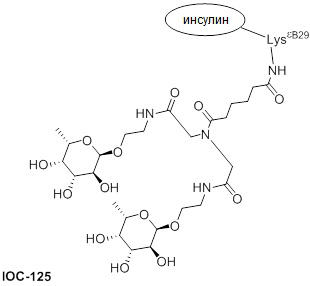

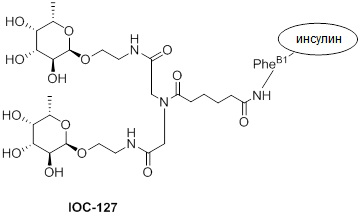





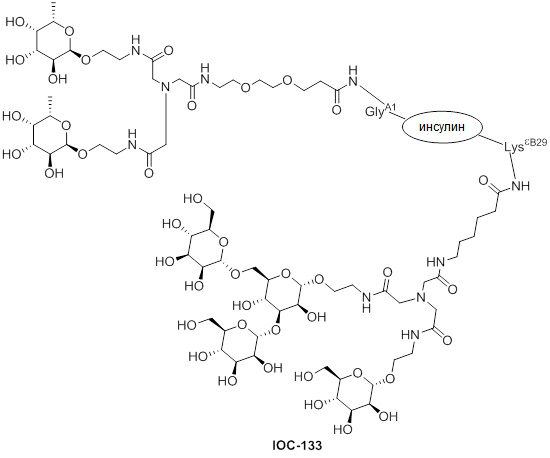


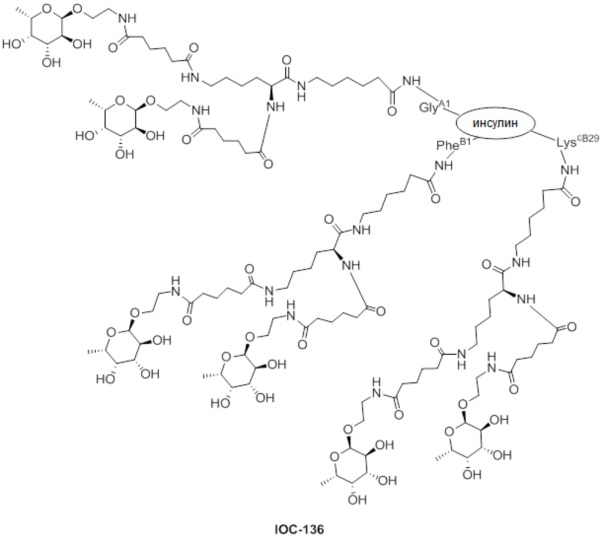
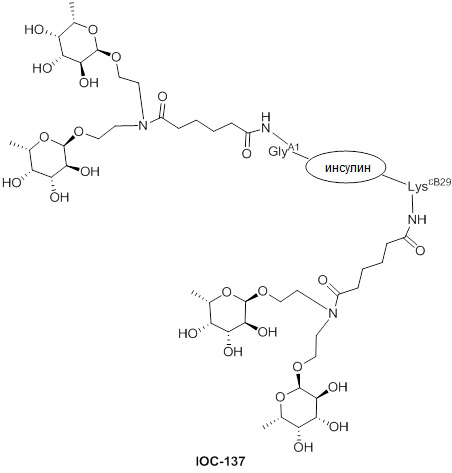

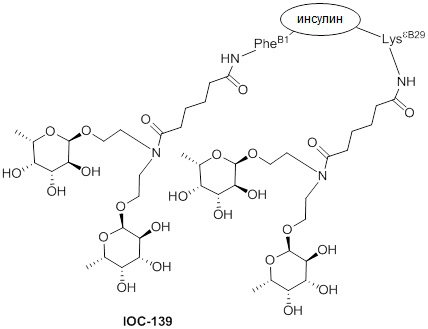
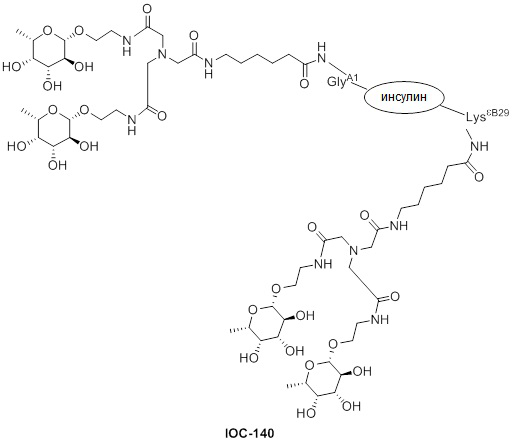

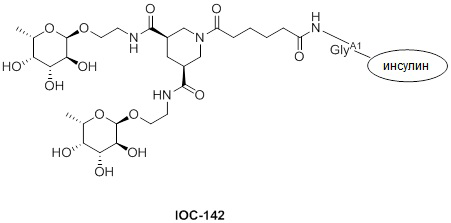









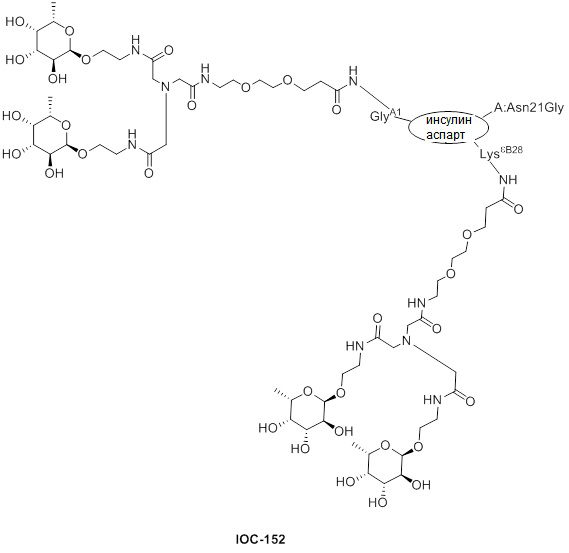









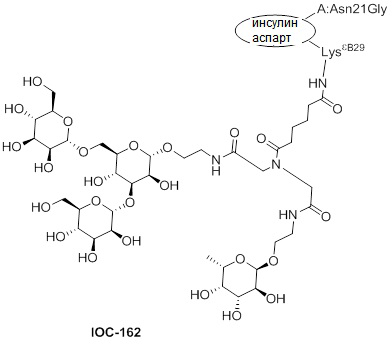



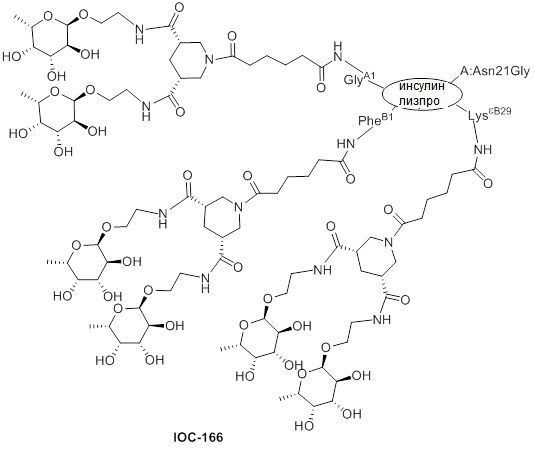



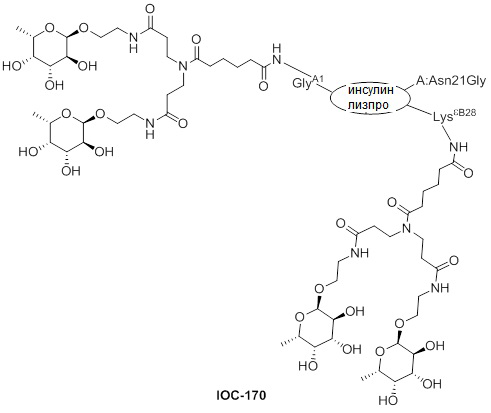


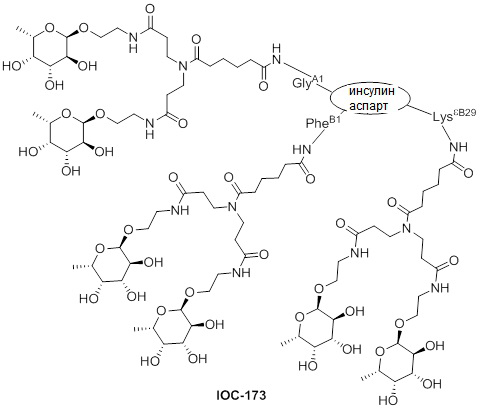

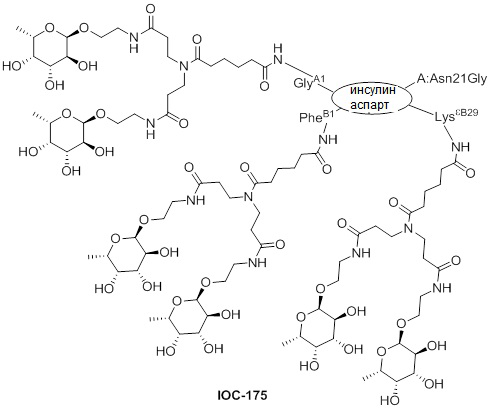













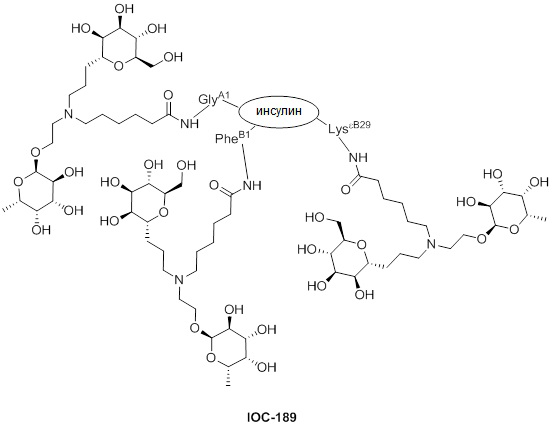



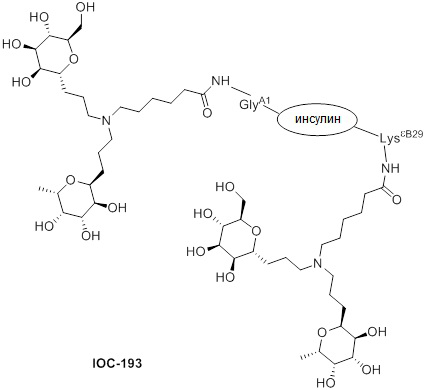


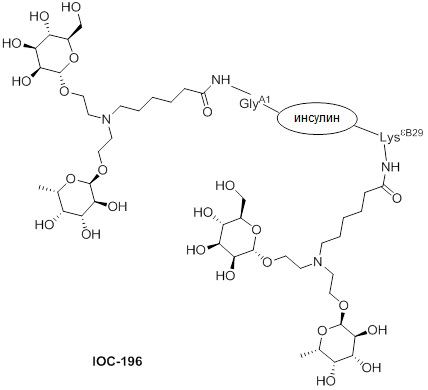


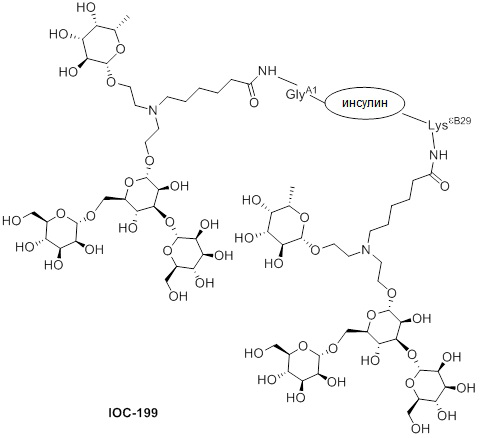

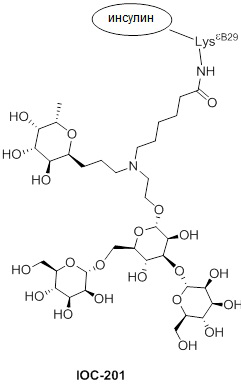

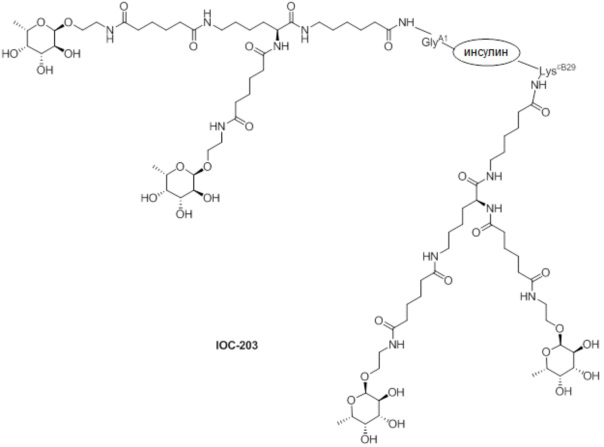



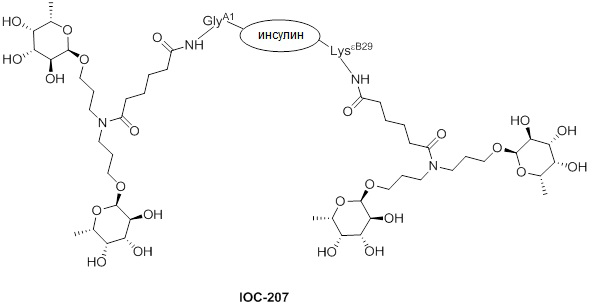









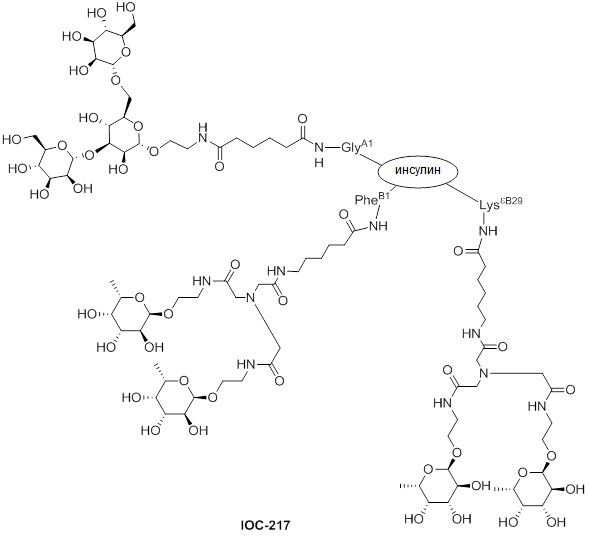
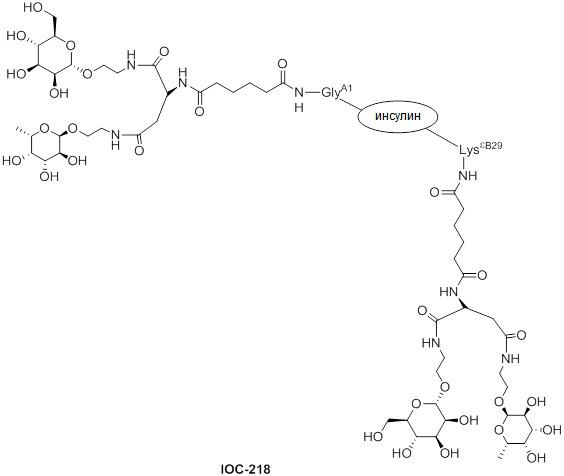


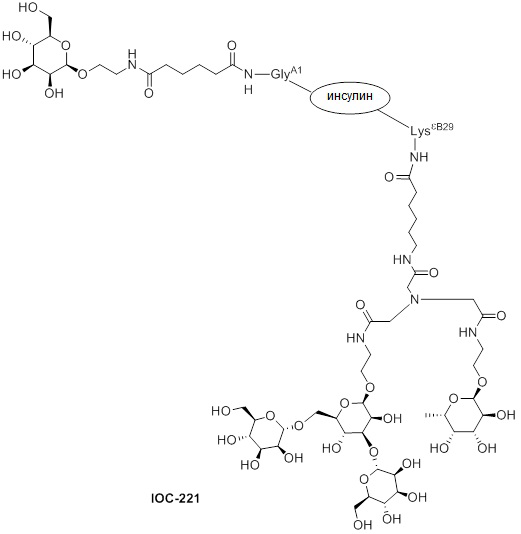

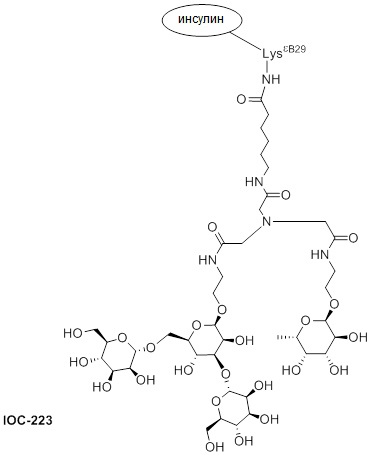





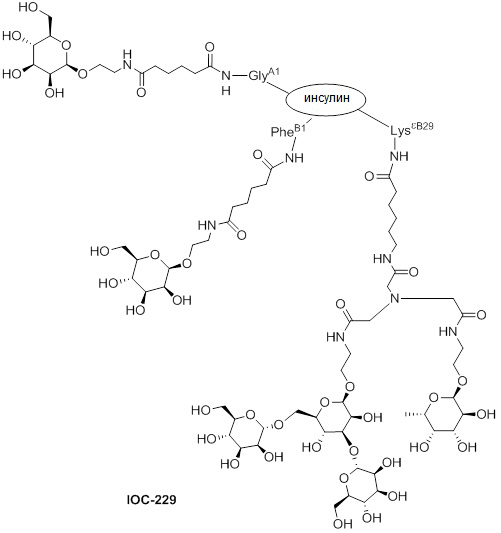

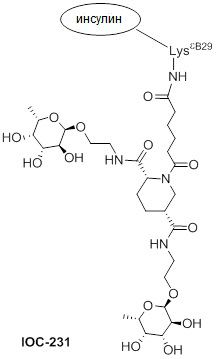










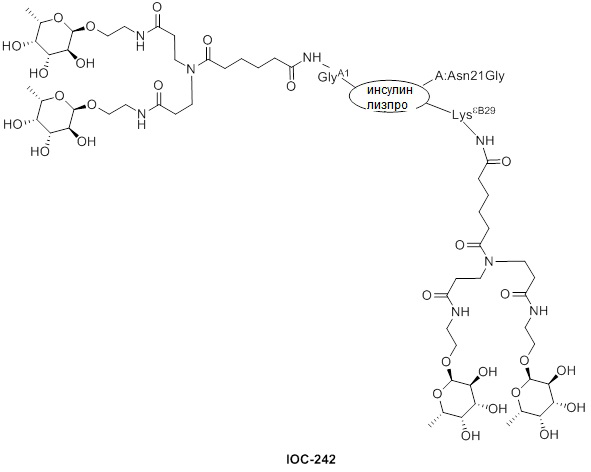







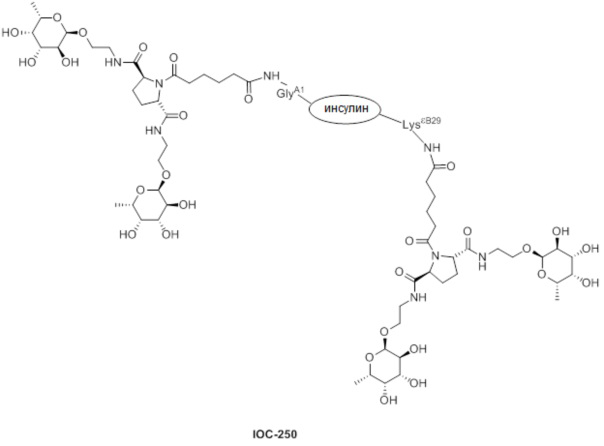



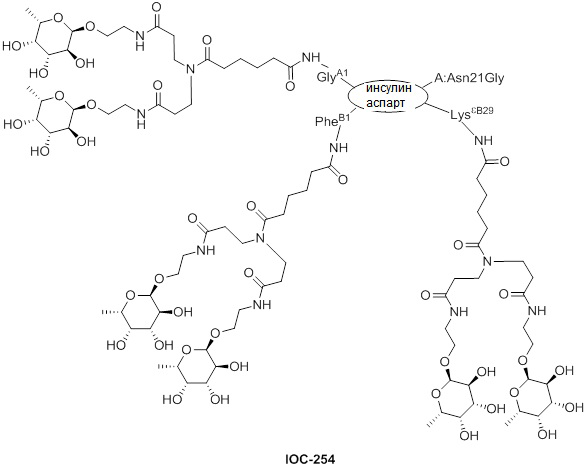


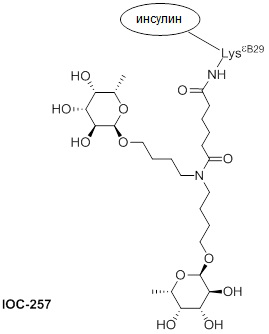
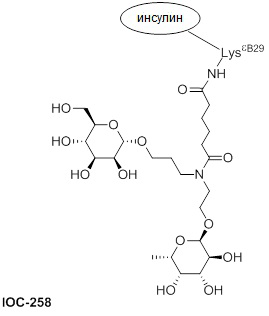
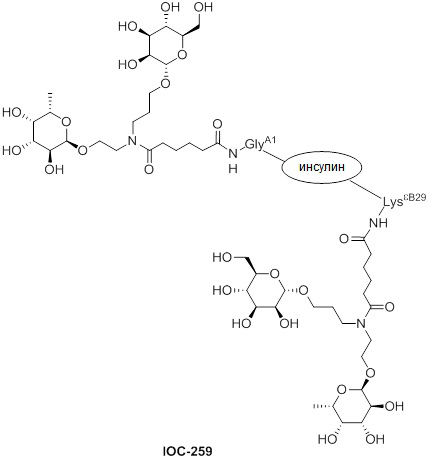

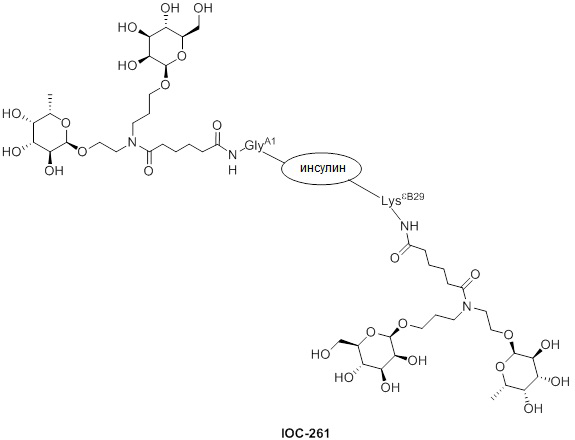
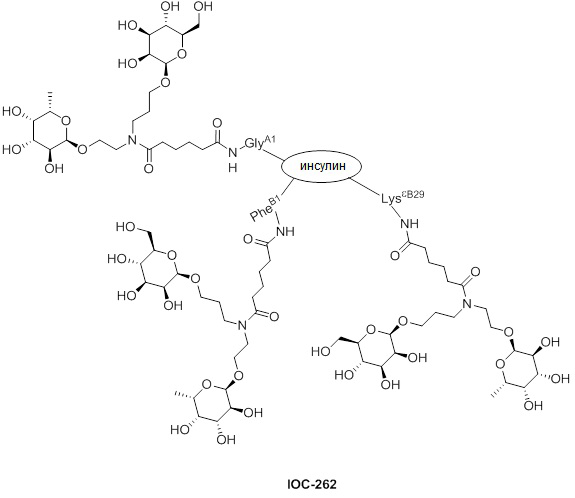


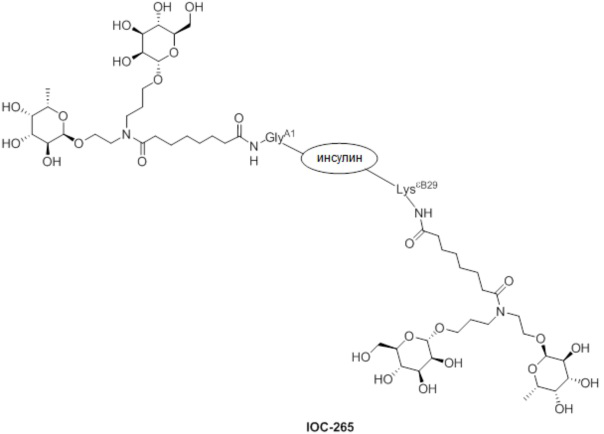




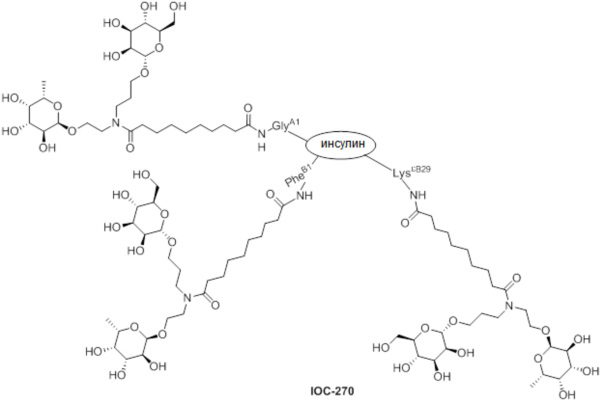
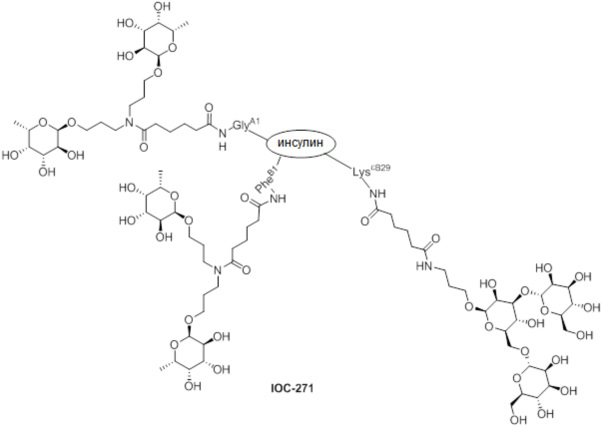
Составы с замедленным высвобождением
Согласно конкретным вариантам осуществления, может быть полезно замедленное введение инсулинового конъюгата (т.е. в форме, которая обладает профилем всасываемости более длительным, чем растворимый рекомбинантный инсулин человека). Это обеспечит непрерывно поддерживаемый уровень содержания конъюгата, который может отвечать на флуктуации глюкозы во времени, которое более близко к обычным флуктуациям глюкозы во времени (т.е. скорее часы, а не минуты). Согласно конкретным вариантам осуществления, состав с замедленным высвобождением может обладать равномерным высвобождением конъюгата при введении млекопитающему в негипергликемических условиях (т.е., в условиях голодания).
Следует понимать, что может быть использован любой состав, который обеспечивает профиль с замедленным всасыванием. Согласно конкретным вариантам осуществления, это может быть достигнуто путем сочетания конъюгата с другими ингредиентами, которые замедляют его способность к высвобождению в системный кровоток.
Например, для этой цели могут быть использованы PZI (протамин-цинк-инсулин) составы. Настоящее раскрытие охватывает аморфные и кристаллические формы указанных PZI составов.
Таким образом, согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию включает в себя приблизительно от 0,05 приблизительно до 10 мг протамина/мг конъюгата. Например, приблизительно от 0,2 приблизительно до 10 мг протамина/мг конъюгата, например, приблизительно от 1 приблизительно до 5 мг протамина/мг конъюгата.
Согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию включает в себя приблизительно от 0,006 приблизительно до 0,5 мг цинка/мг конъюгата. Например, приблизительно от 0,05 приблизительно до 0,5 мг цинка/мг конъюгата, например, приблизительно от 0,1 приблизительно до 0,25 мг цинка/мг конъюгата.
Согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию включает в себя протамин и цинк в соотношении (по массе) в диапазоне приблизительно от 100:1 приблизительно до 5:1, например, приблизительно от 50:1 приблизительно до 5:1, например, приблизительно от 40:1 приблизительно до 10:1. Согласно конкретным вариантам осуществления, PZI состав согласно настоящему раскрытию включает в себя протамин и цинк в соотношении (по массе) в диапазоне приблизительно от 20:1 приблизительно до 5:1, например, приблизительно от 20:1 приблизительно до 10:1, приблизительно от 20:1 приблизительно до 15:1, приблизительно от 15:1 приблизительно до 5:1, приблизительно от 10:1 приблизительно до 5:1, приблизительно от 10:1 приблизительно до 15:1.
Один или несколько из следующих компонентов могут быть включены в состав PZI состава: противомикробный консервант, изотоническое средство и/или молекула неконъюгированного инсулина.
Согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию включает в себя противомикробный консервант (например, мета-крезол, фенол, метилпарабен или пропилпарабен). Согласно конкретным вариантам осуществления, противомикробный консервант представляет собой мета-крезол. Например, согласно конкретным вариантам осуществления, состав может включать в себя приблизительно от 0,1 приблизительно до 1,0% (по объему) мета-крезола. Например, приблизительно от 0,1 приблизительно до 0,5% (по объему) мета-крезола, например приблизительно от 0,15 приблизительно до 0,35% (по объему) мета-крезола.
Согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию включает в себя полиол в качестве изотонического средства (например, маннит, пропиленгликоль или глицерин). Согласно конкретным вариантам осуществления, изотоническое средство представляет собой глицерин. Согласно конкретным вариантам осуществления, изотоническое средство представляет собой соль, например, NaCl. Например, состав может содержать приблизительно от 0,05 приблизительно до 0,5 M NaCl, например, приблизительно от 0,05 приблизительно до 0,25 M NaCl или приблизительно от 0,1 приблизительно до 0,2 M NaCl.
Согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию включает в себя некоторое количество молекул неконъюгированного инсулина. Согласно конкретным вариантам осуществления, молярное соотношение молекул конъюгированного инсулина к молекулам неконъюгированного инсулина в составе находится в диапазоне приблизительно от 100:1 до 1:1, например, приблизительно от 50:1 до 2:1, или приблизительно от 25:1 до 2:1.
Настоящее раскрытие также охватывает использование стандартных составов с замедленным (также называемым с пролонгированным) высвобождением, которые хорошо известны в области техники приготовления низкомолекулярных составов (например, см. Remington's Pharmaceutical Sciences, 19th ed., Mack Publishing Co., Easton, PA, 1995). Настоящее раскрытие также охватывает использование устройств, которые основаны на помпах или затрудненной диффузии для постепенной доставки конъюгата. Согласно конкретным вариантам осуществления, состав пролонгированного действия может быть предоставлен (дополнительно или альтернативно) посредством использования молекулы модифицированного инсулина. Например, вместо инсулина человека дикого типа при приготовлении конъюгата можно использовать инсулин гларгин (ЛАНТУС®) или инсулин детемир (ЛЕВЕМИР®). Инсулин гларгин представляет собой типовой аналог инсулина пролонгированного действия, в котором Asn в положении А21 А-цепи был замещен на глицин, и на С-конце В-цепи находятся два аргининовых остатка. Эффект этих изменений заключается в сдвиге изоэлектрической точки, что дает инсулин, который не растворим при физиологических значениях рН, но растворим при рН 4. Инсулин детемир представляет собой другой аналог инсулина пролонгированного действия, в котором Thr в положении В30 В-цепи был удален, и С14 цепь жирной кислоты была присоединена к Lys в положении В29.
Использование конъюгатов
Согласно другому аспекту, настоящее раскрытие относится к способам использования инсулиновых конъюгатов. В общем, инсулиновые конъюгаты могут быть использованы для регулируемого обеспечения инсулином индивидуума, нуждающегося в реакции на сахарид (например, глюкозу или экзогенный сахарид, такой как манноза, α-метилманноза, L-фукоза, и т.п.). Настоящее раскрытие включает в себя лечение сахарного диабета путем введения инсулинового конъюгата согласно настоящему раскрытию. Хотя и инсулиновые конъюгаты могут быть использованы для лечения любого пациента (например, собак, кошек, коров, лошадей, овец, свиней, мышей и т.п.), наиболее предпочтительно их использование для лечения людей. Инсулиновый конъюгат можно вводить пациенту любым путем. В общем, настоящее раскрытие включает в себя введение пероральным, внутривенным, внутримышечным, интраартериальным, подкожным, внутрижелудочковым, чрескожным, ректальным, интравагинальным, интраперитонеальным, местным (например, посредством порошков, мазей или капель), буккальным путем или в виде перорального или назального спрея или аэрозоля. Общие подходы для приготовления и производства фармацевтических композиций для упомянутых различных путей могут быть найдены, например, в Remington's Pharmaceutical Sciences, 19th ed., Mack Publishing Co., Easton, PA, 1995. Согласно различным вариантам осуществления, конъюгат можно вводить подкожно, например, посредством инъекции. Инсулиновый конъюгат может быть растворен в носителе для облегчения доставки. Например, носитель может представлять собой водный раствор, включая без ограничения стерильную воду, солевой раствор или забуференный солевой раствор.
В общем, будет вводиться терапевтически эффективное количество инсулинового конъюгата. Термин «терапевтически эффективное количество» означает количество инсулинового конъюгата, достаточное для лечения сахарного диабета с приемлемым соотношением пользы и риска, что подразумевает обеспечение баланса между эффективностью и токсичностью инсулинового конъюгата. Согласно различным вариантам осуществления, средняя суточная доза инсулина находится в диапазоне от 10 до 200 ед., например от 25 до 100 ед. (где 1 единица инсулина составляет ~0,04 мг). Согласно конкретным вариантам осуществления, количество конъюгата с указанными дозами инсулина вводят ежесуточно. Согласно конкретным вариантам осуществления, количество конъюгата с 5-ти до 10-ти кратной указанной дозой инсулина вводят еженедельно. Согласно конкретным вариантам осуществления, количество конъюгата с 10-ти до 20-ти кратной указанной дозой инсулина вводят один раз в две недели. Согласно конкретным вариантам осуществления, количество конъюгата с 20-ти до 40-ка кратной указанной дозой инсулина вводят ежемесячно.
Согласно конкретным вариантам осуществления, конъюгат согласно настоящему раскрытию может быть использован для лечения гипергликемии у пациента (например, у пациента-млекопитающего или пациента-человека). Согласно конкретным вариантам осуществления, пациент страдает сахарным диабетом. Однако настоящие способы не ограничиваются лечением пациентов с сахарным диабетом. Например, согласно конкретным вариантам осуществления, конъюгат может быть использован для лечения гипергликемии у пациента с инфекцией, ассоциированной с нарушенным гликемическим контролем. Согласно конкретным вариантам осуществления, конъюгат может быть использован для лечения сахарного диабета.
Согласно конкретным вариантам осуществления, если инсулиновый конъюгат или состав согласно настоящему раскрытию вводят пациенту (например, пациенту-млекопитающему), то он индуцирует меньшую гипогликемию, чем неконъюгированный вариант молекулы инсулина. Согласно конкретным вариантам осуществления, состав согласно настоящему раскрытию индуцирует более низкое значение HbA1c у пациента (например, пациента-млекопитающего или пациента-человека), чем состав, содержащий неконъюгированный вариант молекулы инсулина. Согласно конкретным вариантам осуществления, состав приводит к значению HbA1c, которое, по меньшей мере, на 10% меньше (например, по меньшей мере, на 20% меньше, по меньшей мере, на 30% меньше, по меньшей мере, на 40% меньше, по меньшей мере, на 50% меньше), чем состав, содержащий неконъюгированный вариант молекулы инсулина. Согласно конкретным вариантам осуществления, состав приводит к значению HbA1c меньшему чем 7%, например, в диапазоне приблизительно от 4 приблизительно до 6%. Согласно конкретным вариантам осуществления, состав, содержащий неконъюгированный вариант молекулы инсулина, приводит к значению HbA1c свыше 7%, например, приблизительно от 8 приблизительно до 12%.
Экзогенный триггер
Как упоминалось ранее, способы, конъюгаты и композиции, которые описаны в настоящем документе, не ограничиваются конъюгатами, чувствительными к глюкозе. Как продемонстрировано в разделе «Примеры», некоторые типовые инсулиновые конъюгаты были также чувствительны к экзогенным сахаридам, таким как α-метилманноза. Поэтому следует принимать во внимание, что согласно конкретным вариантам осуществления, инсулиновый конъюгат может быть активирован путем экзогенного введения отличного от глюкозы сахарида, такого как α-метилманноза, или любого другого сахарида, который может изменить PK или PD свойства конъюгата.
Если конъюгат вводят, как описано выше (например, в виде состава с замедленным высвобождением), то он может быть активирован путем введения подходящего экзогенного сахарида. Согласно конкретному варианту осуществления, вводят активирующее количество экзогенного сахарида. Используемый в настоящем документе термин «активирующее количество» экзогенного сахарида представляет собой количество, достаточное для индукции изменения по меньшей мере одного PK и/или PD свойства конъюгата (например, Cmax, AUC, времени полужизни, и т.п., обсуждавшихся выше). Следует понимать, что любой из вышеупомянутых для конъюгата способов введения в равной мере распространяется на экзогенный сахарид. Также следует понимать, что способы введения для конъюгата и экзогенного сахарида могут быть одинаковыми или различными. Согласно различным вариантам осуществления, способы введения отличаются (например, с целью иллюстрации, конъюгат может вводиться посредством подкожной инъекции еженедельно, тогда как экзогенный сахарид вводят перорально ежесуточно). Пероральное введение экзогенного сахарида представляет собой особую ценность, поскольку оно облегчает соблюдение пациентом режима и схемы лечения. В общем, следует принимать во внимание, что PK и PD свойства конъюгата могут быть адаптированы путем регулирования PK профиля экзогенного сахарида. Поэтому, PK и PD свойства конъюгата могут быть адаптированы путем контролирования PK профиля экзогенного сахарида. Как хорошо известно в данной области техники, PK профиль экзогенного сахарида может быть адаптирован на основании используемой дозы, пути, частоты введения и состава. Например, если желательна короткая и интенсивная активация конъюгата, то может быть использован пероральный состав с немедленным высвобождением. Напротив, если желательна длительная менее интенсивная активация конъюгата, то тогда может быть использован пероральный состав с пролонгированным высвобождением. Общие подходы для приготовления и производства состава с немедленным и пролонгированным высвобождением могут быть найдены, например, в Remington's Pharmaceutical Sciences, 19th ed., Mack Publishing Co., Easton, PA, 1995.
Также следует понимать, что относительная частота введения конъюгата согласно настоящему раскрытию и экзогенного сахарида может быть одинаковой или различной. Согласно конкретным вариантам осуществления, экзогенный сахарид вводят более часто, чем конъюгат. Например, согласно конкретным вариантам осуществления, конъюгат может вводиться ежесуточно, тогда как экзогенный сахарид вводят чаще, чем раз в сутки. Согласно конкретному варианту осуществления, конъюгат может вводиться дважды в неделю, еженедельно, раз в две недели или ежемесячно, тогда как экзогенный сахарид вводят ежесуточно. Согласно конкретным вариантам осуществления, конъюгат вводят ежемесячно, а экзогенный сахарид вводят дважды в неделю, еженедельно или раз в две недели. Другие варианты указанных схем будут учитываться специалистами в данной области техники, и будут варьировать в зависимости от природы конъюгата и используемого состава.
Последующие примеры предназначены для содействия лучшему пониманию настоящего изобретения.
ПРИМЕРЫ
Общие методики
Если не указано иное, то все химические реагенты приобретали из коммерчески доступных источников. Реакции, чувствительные к влажности или воздуху, проводили в атмосфере азота или аргона с использованием безводных растворителей или реагентов. Развитие реакции отслеживали методами аналитической тонкослойной хроматографии (TLC), высокоэффективной жидкостной хроматографии/масс-спектрометрии (HPLC-MS) или сверхэффективной жидкостной хроматографии/масс-спектрометрии (UPLC-MS). TLC проводили на TLC-пластинах E. Merck, предварительно покрытых силикагелем 60F-254 с толщиной слоя 0,25 мм. Пластины проявляли с использованием УФ-света (254 нм) и/или путем обработки проявляющими растворами молибдата аммония-церия (CAM) или пара-анисового альдегида с последующим обжигом. Высокоэффективную жидкостную хроматографию (HPLC) проводили на HPLC-системе Agilent 1100 series с использованием колонки Supelco Ascentis Express C18 (2,7 мкм, 3,0×100 мм) и градиента CH3CN/H2O+0,05% TFA=10/90-99/1 (об.) в течение 4,0 мин, затем удерживание при CH3CN/H2O+0,05% TFA=98/2 (об.) в течение 0,75 мин; скорость потока 1,0 мл/мин, диапазон УФ 200-400 нм (LC-MS способ A). Масс-спектрометрический анализ проводили на спектрометре Waters Micromass® ZQ™ с ионизацией электрораспылением в режиме детекции положительно заряженных ионов с диапазоном сканирования удельного заряда 170-900 или 500-1500. Сверхэффективную жидкостную хроматографию (UPLC) проводили на UPLC-системе Waters Acquity™ с использованием колонки Waters Acquity™ UPLC® BEH300 C4 (1,7 мкм, 2,1×100 мм) и градиента CH3CN/H2O+0,1% TFA=10/90-90/10 (об.) в течение 4,0 мин и CH3CN/H2O+0,1% TFA=90/10-95/5 (об.) в течение 0,5 мин; скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм (UPLC способ A). Альтернативные условия проведения UPLC обозначали как UPLC способ B (колонка Waters Acquity™ UPLC® BEH C18 (1,7 мкм, 2,1×100 мм), градиент CH3CN/H2O+0,1% TFA=10/90-70/30 (об.) в течение 4,0 мин и CH3CN/H2O+0,1% TFA=70/30-95/5 (об.) в течение 40 с, скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм); UPLC способ C (колонка Waters Acquity™ UPLC® BEH C18 (1,7 мкм, 2,1×100 мм), градиент CH3CN/H2O+0,1% TFA=60/40-100/0 (об.) в течение 4,0 мин и CH3CN/H2O+0,1% TFA=100/0-95/5 (об.) в течение 40 с, скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм); UPLC способ D (колонка Waters Acquity™ UPLC® BEH300 C4 (1,7 мкм, 2,1×100 мм), градиент CH3CN/H2O+0,1% TFA=10/90-50/50 (об.) в течение 4,3 мин и CH3CN/H2O+0,1% TFA=50/50-70/30 (об.) в течение 0,5 мин, скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм); UPLC способ E (колонка Waters Acquity™ UPLC® BEH C18 (1,7 мкм, 2,1×100 мм), градиент CH3CN/H2O+0,1% TFA=10/90-60/40 (об.) в течение 4,3 мин и CH3CN/H2O+0,1% TFA=60/40-90/10 (об.) в течение 0,5 мин, скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм); UPLC способ F (колонка Waters Acquity™ UPLC® BEH C18 (1,7 мкм, 2,1×100 мм), градиент CH3CN/H2O+0,1% TFA=60/40-100/0 (об.) в течение 4,0 мин и CH3CN/H2O+0,1% TFA/100/0-95/5 (об.) в течение 0,4 мин, скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм); и UPLC способ G (колонка Waters Acquity™ UPLC® BEH C8 (1,7 мкм, 2,1×100 мм), градиент 10/90-55/45 (об.) CH3CN/H2O+0,1% TFA в течение 4,2 мин и CH3CN/H2O+0,1% TFA=100/0-95/5 (об.) в течение 0,4 мин, скорость потока 0,3 мл/мин, длины волн УФ 200-300 нм). Масс-спектрометрический анализ проводили на спектрометре Waters Micromass® LCT Premier™ XE с ионизацией электрораспылением в режиме детекции положительно заряженных ионов с диапазоном сканирования удельного заряда 300-2000. Идентификацию полученных конъюгатов инсулина подтверждали путем сравнения теоретической молекулярной массы с экспериментально полученным значением, измеренным методом UPLC-MS. Для определения конкретного положения модификации(ий) сахаром, конъюгаты инсулина подвергали обработке DTT (для a/b цепи) или Glu-C расщеплению (с восстановлением и алкилированием), а затем анализировали полученные пептиды методом LC-MS. Исходя из измеренных масс, выясняли положения сахаров.
Флэш-хроматографию проводили с использованием либо аппарата Biotage Flash Chromatography (Dyax Corp.), либо аппарата CombiFlash®Rf (Teledyne Isco). Хроматографию с прямой фазой проводили на силикагеле (20-70 мкм, размер пор 60Å) в предварительно заполненных картриджах указанного размера. Хроматографию с обращенной фазой проводили на C18-связанном силикагеле (20-60 мкм, размер пор 60-100Å) в предварительно заполненных картриджах указанного размера. Препаративную HPLC проводили на бинарной системе Gilson 333-334 с использованием колонки Waters Delta Pak C4 (15 мкм, 300Å, 50×250 мм) или колонки Kromasil® C8 (10 мкм, 100Å, 50×250 мм), и скорости потока 85 мл/мин указанного градиента. Концентрирование растворов проводили на роторном испарителе в условиях пониженного давления или лиофилизировали на лиофилизаторе VirTis Freezemobile (SP Scientific).
Спектры 1H-ЯМР регистрировали на спектрометрах при 500 МГц (или других указанных) в указанных дейтерированных растворителях. Химические сдвиги приводили в миллионных долях in (м.д.). В качестве внутреннего стандарта использовали тетраметилсилан (TMS) или пик остаточных протонов дейтерированных растворителей. Константу взаимодействия (J) приводили в Герцах (Гц).
Сокращения: уксусная кислота (AcOH), ацетонитрил (AcCN), водный (водн.), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилурония) (HATU), этилацетат (EtOAc), диэтиловый эфир (эфир или Et2O), N,N-иззопропилэтиламин или основание Хунига (DIPEA), (4-диметиламино)пиридин (DMAP), N,N-диметилформамид (DMF), этилацетат (EtOAc), гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDC), грамм(ы) (г), 1- гидрат гидроксибензотриазола (HOBt), час(ы) (ч), масс-спектр (MS), микролитр(ы) ( мкл), миллиграмм(ы) (мг), миллилитр(ы) (мл), миллимоль (ммоль), минута(ы) (мин), гексафторфосфат пентафторфенолтетраметилурония (PFTU), петролейный эфир (PE), время удерживания (Rt), комнатная температура (к.т.), насыщенный (нас.), насыщенный водн. раствор хлорида натрия (солевой раствор), триэтиламин (TEA), трифторуксусная кислота (TFA), тетрагидрофуран (THF) и тетрафторборат N,N,N',N'-тетраметил-O-(N-сукцинимидил)урония (TSTU).
Пример 1
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-6-оксогексанамида (ML-1), характеризующегося следующей структурой.
 ML-1
ML-1
Стадия A: бензил-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноат
К раствору 6-(бензилокси)-6-оксогексановой кислоты (3,3 г, 13,97 ммоль) в DMF (50 мл) при 0°C добавляли TSTU (4,3 г, 14,28 ммоль) и DIPEA (2,5 мл, 14,31 ммоль). После перемешивания при 0°C в течение 1 часа, реакционную смесь распределяли между Et2O и водой. Органический слой разделяли, и водный слой дополнительно экстрагировали эфиром (2×150 мл). Объединенную органическую фазу промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C17H19NO6 333,12, обнаружено m/e: 334,10 [M+1]; Rt=3,75 мин. 1H-ЯМР (CDCl3) δ 7,40-7,30 (5H, м), 5,10 (2H, с), 2,80 (4H, с), 2,62-2,58 (2H, м), 2,41- 2,37 (2H, м), 1,80-1,72 (4H, м).
Стадия B: бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат
К раствору 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозида (1,23 г, 2,247 ммоль, WO 2010/088294 A1) в DMF (20 мл) при 0°C добавляли бензил-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноат (1,02 г, 3,06 ммоль) и TEA (0,5 мл, 3,59 ммоль). После перемешивания при 0°C в течение 1 часа, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на колонке с C18-связанным силикагелем (275 г), элюируя 0-40% AcCN в H2O, с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C33H51NO19 765,31, обнаружено m/e=766,26 [M+1]; Rt=4,04 мин. 1H-ЯМР (D2O) δ 7,43-7,37 (5H, м), 5,14 (2H, с), 5,07-5,06 (1H, м), 4,82-4,81 (1H, м), 4,77-4,76 (1H, м), 4,06-4,01 (2H, м), 3,96-3,92 (2H, м), 3,87-3,81 (5H, м), 3,79-3,77 (1H, м), 3,74-3,67 (5H, м), 3,65-3,60 (4H, м), 3,53-3,49 (1H, м), 3,37-3,35 (2H, м), 2,43-2,40 (2H, м), 2,22-2,19 (2H, м), 1,62-1,52 (4H, м).
Стадия C: 6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексановая кислота
Смесь бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноата (1,15 г, 1,502 ммоль) и Pd/C (80 мг, 0,075 ммоль) в воде (10 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при комнатной температуре в течение 16 ч. Катализатор отфильтровывали и промывали H2O (3×10 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C26H45NO19 675,26, обнаружено m/e: 676,21 [M+1]; Rt=3,50 мин.
Стадия D: 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-6-оксогексанамид
К раствору 6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексановой кислоты (1,55 г, 2,294 ммоль) в DMF (22 мл) при 0°C добавляли TSTU (760 мг, 2,52 ммоль) и DIPEA (0,52 мл, 2,98 ммоль). После перемешивания при 0°C в течение 1 ч, реакционную смесь гасили добавлением TFA (371 мкл, 4,82 ммоль) и концентрировали полученную смесь приблизительно до 3 мл. Остаток переносили по каплям автоматической пипеткой в пробирку с безводным ацетонитрилом (45 мл). Белый осадок собирали путем центрифугирования (3000 об/мин, 15 мин, при 4°C), промывали безводным AcCN (1 мл) и сушили с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C30H48N2O21 772,27, обнаружено m/e: 773,23 [M+1]; Rt=3,65 мин. 1H-ЯМР (D2O) δ 5,07-5,06 (1H, м), 4,84-4,83 (1H, м), 4,79-4,78 (1H, м), 4,06-4,01 (2H, м), 3,96-3,93 (2H, м), 3,87-3,83 (5H, м), 3,80-3,78 (1H, м), 3,75-3,69 (5H, м), 3,67-3,61 (4H, м), 3,57-3,52 (1H, м), 3,41-3,38 (2H, м), 2,91 (4H, с), 2,75-2,71 (2H, м), 2,29-2,25 (2H, м), 1,75-1,58 (4H, м).
Пример 2
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[3-O-(α-D-маннопиранозил)-α-D-маннопиранозил]окси}этил)-6-оксогексанамида (ML-2), характеризующегося следующей структурой.
 ML-2
ML-2
Стадия A: 2-азидоэтил-2,4-ди-O-бензоил-6-O-тритил-β-D-маннопиранозид
В круглодонной колбе емкостью 250 мл 2-азидоэтил-2,4-ди-O-бензоил-α-D-маннопиранозид (1,0 г, 2,186 ммоль; см. WO 2010/088294 A1, включенную в настоящий документ посредством ссылки) растворяли в пиридине (50 мл). К описанному выше раствору добавляли DMAP (13 мг, 0,109 ммоль) а затем тритилхлорид (762 мг, 2,73 ммоль). После перемешивания при 80°C в течение 18 ч, реакционную смесь концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (40 г), элюируя 0-50% EtOAc в гексанах, с получением указанного в заголовке соединения. UPLC способ C: m/e=722,2955, [M+Na]; Rt=4,50. 1H-ЯМР (CDCl3) δ 7,0-8,3 (м, 25H), 5,8 (т, 1H), 5,5(м, 1H), 5,2 (с, 1H), 4,3 (м, 1H), 4,1 (м, 2H), 4,0 (м, 1H), 3,5 (м, 1H), 3,4 (м, 2H), 3,2 (дд, 1H), 2,7 (д, 1H).
Стадия B: 2-азидоэтил-2,4-ди-O-бензоил-3-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-6-O-тритил-α-D-маннопиранозид
В круглодонную колбу емкостью 100 мл добавляли 2-азидоэтил-2,4-бис-O-бензоил-6-O-тритил-α-D-маннопиранозид (400 мг, 0,572 ммоль), 2,3,4,6-тетра-O-бензоил-1-O-(2,2,2-трихлорэтанимидоил)-α-D-маннопиранозу (508 мг, 0,686 ммоль) и 4Å молекулярные сита (300 мг). К описанной выше смеси добавляли CH2Cl2 (5 мл). Реакционную смесь охлаждали до -78°C, и добавляли TMSOTf (10,33 мкл, 0,057 ммоль). Смесь оставляли постепенно нагреваться до 0°C и перемешивали в течение 30 мин. Затем, реакционную смесь гасили добавлением нас. NaHCO3 и фильтровали через слой целита. Фильтрат разбавляли CH2Cl2 (20 мл), промывали солевым раствором и водой. Органическую фазу сушили над MgSO4 и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (80 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке продукта. LC-MS способ A: m/e=1278,80 [M+1]; Rt=3,14 мин. 1H-ЯМР (CDCl3) δ 7,1-8,3 (м, 30H), 6,0 (т, 1H), 5,8 (т, 1H), 5,7 (м, 2H), 5,4 (с, 1H), 5,38 (м, 1H), 5,2 (с, 1H), 4,7 (дд, 1H), 4,6 (дд, 1H), 4,45 (м, 1H), 4,35 (дд, 1H), 3,9-4,0 (м, 2H), 3,8 (м, 2H), 3,7 (м, 1H), 3,4 (м, 2H).
Стадия C: 2-азидоэтил-2,4-ди-O-бензоил-3-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-α-D-маннопиранозид
В круглодонную колбу емкостью 50 мл добавляли 2-азидоэтил-2,4-ди-O-бензоил-3-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-6-O-тритил-α-D-маннопиранозид (450 мг, 0,352 ммоль) и CH2Cl2 (3 мл). К описанному выше раствору добавляли TFA (3 мл, 38,9 ммоль). После перемешивания при 25°C в течение 1 ч, реакционную смесь разбавляли CH2Cl2 (10 мл), промывали водой (3×15 мл) и солевым раствором (10 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (40 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке продукта. LC-MS способ A: m/e=1053,57 [M+18]; Rt=2,73 мин. 1H-ЯМР (CDCl3) δ 7,0-8,5 (м, 45H), 6,1 (т, 1H), 6,0 (т, 1H), 5,7 (м, 2H), 5,4 (с, 1H), 5,3 (с, 1H), 5,25 (с, 1H), 4,6 (м, 2H), 4,5 (м, 1H), 4,3 (м, 1H), 4,0-4,2 (м, 3H), 3,8 (м, 1H), 3,3-3,5 (м, 3H).
Стадия D: 2-азидоэтил-3-O-α-D-маннопиранозил-α-D-маннопиранозид
В круглодонную колбу емкостью 50 мл добавляли 2-азидоэтил-2,4-ди-O-бензоил-3-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-α-D-маннопиранозид (350 мг, 0,338 ммоль) и CH3OH (5 мл). К описанному выше раствору по каплям добавляли NaOCH3 (конц.) до pH>10. Реакционную смесь оставляли перемешиваться при 25°C в течение 6 ч. К описанному выше раствору добавляли смолу Dowex H+ (50W × 8-200) до pH~7. Твердую смолу отфильтровывали, и концентрировали фильтрат с получением указанного в заголовке соединения. LC-MS способ A: m/e=434,00 [M+1]; Rt=0,44 мин.
Стадия E: 2-аминоэтил-3-O-α-D-маннопиранозил-α-D-маннопиранозид
В круглодонной колбе емкостью 50 мл 2-азидоэтил-3-O-α-D-маннопиранозил-α-D-маннопиранозид (139 мг, 0,338 ммоль) растворяли в воде/CH3OH (1/1 (об.), 5 мл). К описанному выше раствору добавляли Pd/C (10%, 36 мг, 0,034 ммоль). Реакционную смесь перемешивали при 25°C в условиях подаваемого из баллона H2 в течение 18 ч. Смесь фильтровали через слой целита, и концентрировали фильтрат с получением указанного в заголовке соединения. LC-MS способ A: m/e=386,08 [M+1]; Rt=0,24 мин.
Стадия F: 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[3-O-(α-D-маннопиранозил)-α-D-маннопиранозил]окси}этил)-6-оксогексанамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-3-O-α-D-маннопиранозил-α-D-маннопиранозидом на стадии B. UPLC способ B: m/e=611,201 [M+1]: Rt=1,82 мин.
Пример 3
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[6-O-(α-D-маннопиранозил)-α-D-маннопиранозил]окси}этил)-6-оксогексанамида (ML-3), характеризующегося следующей структурой.
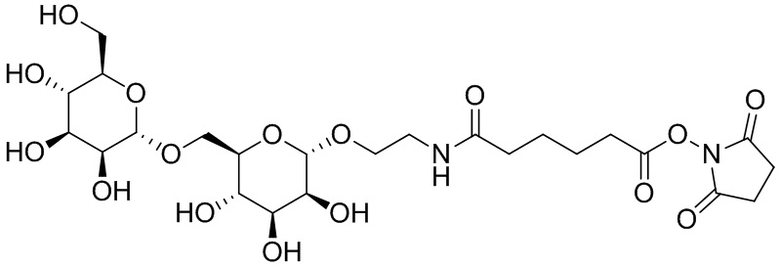 ML-3
ML-3
Стадия A: 2-азидоэтил-2,3,4-три-O-бензоил-6-тритил-α-D-маннопиранозид
В круглодонной колбе емкостью 250 мл 2-азидоэтил-2,4-ди-O-бензоил-α-D-маннопиранозид (1,0 г, 1,429 ммоль) растворяли в пиридине (20 мл). К описанному выше раствору при 0°C добавляли бензоилхлорид (166 мкл, 1,429 ммоль). После перемешивания при к.т. в течение 18 ч, смесь концентрировали, остаток растворяли в EtOAc (20 мл), промывали водой (10 мл) и солевым раствором (10 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (40 г), элюируя 0-50% EtOAc в гексане, с получением указанного в заголовке соединения. LC-MS способ A: m/e=804,44 [M+1]; Rt=2,88 мин. 1H-ЯМР (CDCl3) δ 7,0-8,2 (м, 30H), 6,1 (т, 1H), 5,8 (дд, 1H), 5,2 (д, 1H), 4,2-4,3 (м, 1H), 4,0-4,1 (м, 1H), 3,8 (м, 1H), 3,6 (м, 1H), 3,5 (м, 1H), 3,4 (дд, H), 3,3 (дд, 1H).
Стадия B: 2-азидоэтил-2,3,4-три-O-бензоил-α-D-маннопиранозид
В круглодонной колбе емкостью 100 мл 2-азидоэтил-2,3,4-три-O-бензоил-6-тритил-α-D-маннопиранозид (1,1 г, 1,368 ммоль) растворяли в CH2Cl2 (10 мл). К описанному выше раствору добавляли TFA (10 мл, 130 ммоль). После перемешивания при 25°C в течение 18 ч, смесь разбавляли CH2Cl2 (20 мл), промывали солевым раствором (10 мл) и нас. NaHCO3 до pH~7. Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (40 г), элюируя 0-100% EtOAc в гексане, с получением указанного в заголовке соединения. LC-MS способ A: m/e=579,12 [M+18] и 584,10 [M+Na]; Rt=2,22 мин. 1H-ЯМР (CDCl3) δ 7,2-8,2 (м, 15H), 6,0 (дд, 1H), 5,9 (т, 1H), 5,7 (м, 1H), 5,2 (ушир. с, 1H), 4,1-4,2 (м, 2H), 3,85 (м, 1H), 3,7-3,8 (м, 2H), 3,6 (м, 1H, 3,5 (м, 1H).
Стадия C: 2-азидоэтил-2,3,4-три-O-бензоил-6-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-α-D-маннопиранозид
В круглодонную колбу емкостью 100 мл добавляли 2-азидоэтил-2,3,4-три-O-бензоил-α-D-маннопиранозид (720 мг, 1,282 ммоль), 2,3,4,6-тетра-O-бензоил-1-O-(2,2,2-трихлорэтанимидоил)-α-D-маннопиранозу (1,14 г, 1,539 ммоль) и 4Å молекулярные сита (300 мг). К описанной выше смеси добавляли CH2Cl2 (10 мл). Реакционную смесь охлаждали до -78°C. К описанной выше смеси добавляли TMSOTf (23,2 мкл, 0,128 ммоль). Смесь оставляли постепенно нагреваться до 0°C и перемешивали в течение 30 мин. Затем, реакционную смесь гасили добавлением нас. NaHCO3, и фильтровали смесь через слой целита. Фильтрат разбавляли CH2Cl2 (20 мл), промывали солевым раствором и водой. Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (80 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке продукта. LC-MS способ A: m/e=1157,64 [M+18] и 1163,52 [M+Na]; Rt=3,01 мин. 1H-ЯМР (CDCl3) δ 7,2-8,3 (м, 25H), 6,0 (т, 1H), 5,8 (т, 1H), 5,7 (м, 2H), 5,4 (с, 1H), 5,38 (м, 1H), 5,2 (с, 1H), 4,7 (дд, 1H), 4,6 (дд, 1H), 4,45 (м, 1H), 4,35 (дд, 1H), 3,9-4,0 (м, 2H), 3,8 (м, 2H), 3,7 (м, 1H), 3,4 (м, 2H).
Стадия D: 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[6-O-(α-D-маннопиранозил)-α-D-маннопиранозил]окси}этил)-6-оксогексанамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-2, заменяя 2-азидоэтил-2,4-бис-O-бензоил-3-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-α-D-маннопиранозид 2-азидоэтил-2,3,4-три-O-бензоил-6-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-α-D-маннопиранозидом на стадии D. UPLC способ B: m/e=611,202 [M+1]; Rt=1,88 мин.
Пример 4
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-{2-[(α-L-фукопиранозил)окси]этил}-6-оксогексанамида (ML-4), характеризующегося следующей структурой.
 ML-4
ML-4
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-L-фукопиранозидом (Bilstein J. Org. Chem. 2010, 6, 699-703) на стадии B. UPLC способ B: m/e=433,14 [M+1]; Rt=2,14 мин.
Пример 5
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-[2-(α-D-маннопиранозилокси)этил]-6-оксогексанамида (ML-5), характеризующегося следующей структурой.
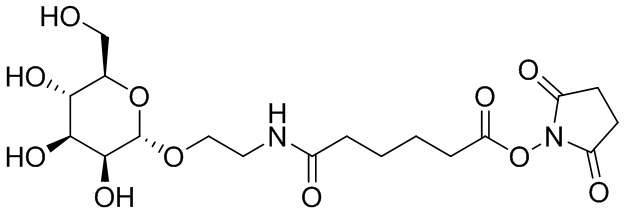 ML-5
ML-5
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозидом (Eur. J. Org. Chem. 2002, 79-86) на стадии B. UPLC способ B: m/e=449,14 [M+1], Rt=1,90 мин.
Пример 6
Описан синтез олигосахаридного линкера, N,N-бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексанамида (ML-6), характеризующегося следующей структурой.
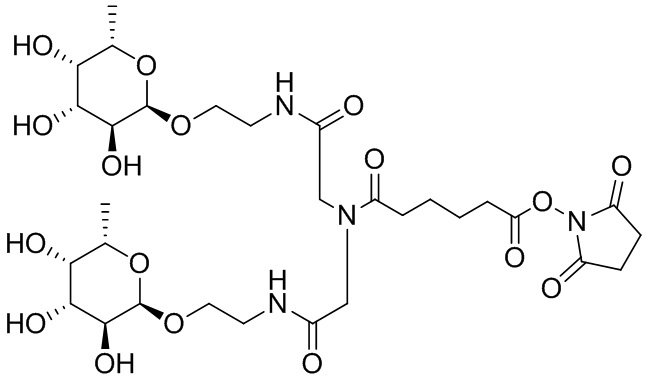 ML-6
ML-6
Стадия A: бензил-6-[бис(2-трет-бутокси-2-оксоэтил)амино]-6-оксогексаноат
К перемешанному раствору 6-(бензилокси)-6-оксогексановой кислоты (1,5 г, 6,35 ммоль) в DMF (50 мл) при комнатной температуре добавляли DIPEA (2,218 мл, 12,70 ммоль), HOBt (1,945 г, 12,7 ммоль), EDC (2,434 г, 12,7 ммоль) и ди-трет-бутил-2,2'-иминодиацетат (2,34 г, 9,52 ммоль). После перемешивания при комнатной температуре в течение 16 часов, реакционную смесь разбавляли H2O (30 мл) и экстрагировали CH2Cl2 (2×30 мл). Объединенную органическую фазу промывали солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (80 г), элюируя 0-40% EtOAc в гексане, с получением указанного в заголовке соединения. LC-MS способ A: m/e=464,04 [M+1]; Rt=2,47 мин. 1H-ЯМР (CDCl3) δ 7,32 (м, 5H), 5,07 (с, 2H), 4,02 (с, 2H), 3,96 (с, 2H), 2,35 (с, 2H), 2,26 (с, 2H), 1,66 (с, 4H), 1,42-1,44 (ушир. с, 18H).
Стадия B: 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусная кислота
К перемешанному раствору бензил-6-[бис(2-трет-бутокси-2-оксоэтил)амино]-6-оксогексаноата (5,9 г, 12,73 ммоль) в CH2Cl2 (30 мл) при комнатной температуре добавляли TFA (30 мл, 12,73 ммоль). После перемешивания при комнатной температуре в течение 16 часов, смесь концентрировали. Остаток очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле с получением указанного в заголовке соединения. LC-MS способ A: m/e=486 [M+1]; Rt=2,53 мин. 1H-ЯМР (CD3OD) δ 7,30 (м, 5H), 5,06 (с, 2H), 4,81 (с, 4H), 4,19 (с, 2H), 4,07 (с, 2H), 2,34 (кв, 4H, J=7,03).
Стадия C: бензил-6-{бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексаноат
К перемешанному раствору 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусной кислоты (800 мг, 2,277 ммоль) в DMF (12 мл) при комнатной температуре добавляли 2-аминоэтил-α-L-фукопиранозид (1,132 г, 5,46 ммоль), DMAP (834 мг, 6,83 ммоль) и EDC (1,528 г, 7,97 ммоль). После перемешивания при к.т. в течение 16 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (120 г), элюируя 0-40% AcCN в воде, с получением указанного в заголовке соединения. LC-MS способ A: m/e=730,26 [M+1]; Rt=1,42 мин.
Стадия D: 6-{бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексановая кислота
К перемешанному раствору бензил-6-{бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексаноата (900 мг, 1,233 ммоль) в H2O (5 мл) при к.т. добавляли дигидроксипалладий (866 мг, 1,233 ммоль). Смесь дегазировали, а затем перемешивали в атмосфере подаваемого из баллона H2. После перемешивания при к.т. в атмосфере H2 в течение 16 ч, реакционную смесь фильтровали через слой целита и промывали CH3OH (3×10 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. LC-MS способ A: m/e=640,17 [M+1]; Rt=0,98 мин.
Стадия E: N,N-бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексанамид
К перемешанному раствору 6-{бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексановой кислоты (160 мг, 0,250 ммоль) в DMF (3,0 мл) при 0°C добавляли раствор TSTU (94 мг, 0,313 ммоль) в DMF (2 мл) и, спустя 5 мин, DIPEA (53 мкл, 0,300 ммоль). После перемешивания в течение 1,5 ч при 0°C, смесь по каплям добавляли к Et2O (30 мл) в центрифужной пробирке. После центрифугирования в течение 30 мин при 3500 об/мин, надосадочную жидкость отбрасывали, твердый остаток растворяли в H2O и лиофилизировали с получением указанного в заголовке продукта. UPLC способ B: m/e=737 [M+1]; Rt=2,19 мин.
Пример 7
Описан синтез олигосахаридного линкера, 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис(N-{2-[(α-L-фукопиранозил)окси]этил}ацетамида) (ML-7), характеризующегося следующей структурой.
 ML-7
ML-7
Стадия A: 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)имино]диуксусная кислота
К раствору 4-метилбензолсульфоната 6-(бензилокси)-6-оксогексан-1-аминия (2,0 г, 5,08 ммоль) в DMF (10 мл) при 0°C добавляли K2CO3 (738 мг, 5,34 ммоль). После перемешивания при 0°C в течение 2 ч, надосадочную жидкость из реакционной смеси при 0°C добавляли к раствору 3-(2,6-диоксоморфолин-4-ил)пропановой кислоты (1,10 г, 6,35 ммоль) в DMF (10 мл). После перемешивания при 0°C в течение 30 мин, реакционную смесь оставляли перемешиваться при к.т. в течение 1 ч, а затем охлаждали до 0°C с последующим добавлением воды (10 мл). Полученную смесь концентрировали, и суспендировали остаток в воде (10 мл). После перемешивания при 0°C в течение 16 ч, твердое вещество собирали путем фильтрования и сушили с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 7,36-7,30 (м, 5H), 5,11 (с, 2H), 3,56 (с, 4H), 3,43 (с, 2H), 3,23 (т, J=6,7, 2H), 2,39 (т, J=7,3, 2H), 1,68-1,62 (м, 2H), 1,57-1,51 (м, 2H), 1,40-1,35 (м, 2H).
Стадия B: бензил-6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексаноат
К раствору 2-аминоэтил-α-L-фукопиранозида (7,88 г, 38,04 ммоль) и 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)имино]диуксуснйо кислоты (2,5 г, 19,02 ммоль) в DMF (10 мл) добавляли HOBt (2,43 г, 15,85 ммоль) и EDC (3,04 г, 15,85 ммоль). После перемешивания при к.т. в течение 16 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (120 г), элюируя 0-50% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=773,292 [M+1]; Rt=3,74 мин.
Стадия C: 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис(N-{2-[(α-L-фукопиранозил)окси]этил}ацетамид)
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6, заменяя бензил-6-{бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексаноат бензил-6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексаноатом на стадии D. UPLC способ B: m/e=780,265 [M+1]; Rt=2,39 мин.
Пример 8
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-N,N-бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]глицил-β-аланинат (ML-8), характеризующегося следующей структурой.
 ML-8
ML-8
Стадия A: 2,2'-[(2-{[3-(бензилокси)-3-оксопропил]амино}-2-оксоэтил)имино]диуксусная кислота
К охлажденному на бане со льдом раствору гидрохлорида бензил-3-аминопропаноата (4,49 г, 20,8 ммоль) в DMF (30 мл) добавляли K2CO3 (3,02 г, 21,84 ммоль), и перемешивали полученную смесь при 0°C в течение 2 ч. Затем, смесь фильтровали, и добавляли фильтрат к охлажденному на бане со льдом раствору 2-(2,6-диоксоморфолино)уксусной кислоты (4,47 г, 25,8 ммоль) в DMF (30 мл). Полученную смесь перемешивали при 0°C в течение 30 мин, а затем при к.т. в течение 2 ч. Реакционную смесь гасили добавлением воды (30 мл), и концентрировали полученную смесь. Остаток перемешивали с водой (40 мл), полученный осадок собирали путем фильтрования и сушили с получением указанного в заголовке соединения. 1H-ЯМР (DMSO-d6) δ 2,53 (т, J=6,8, 2H), 3,27 (с, 2H), 3,36 (кв, J=6,2, 2H), 3,42 (м, 2H), 3,49 (с, 2H), 5,09 (с, 2H), 7,28 (м, 4H), 8,16 (м, 1H), 12,45 (ушир. с, 2H).
Стадия B: 2,5-диоксопирролидин-1-ил-N,N-бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]глицил-β-аланинат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-7, заменяя 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)имино]диуксусную кислоту 2,2'-[(2-{[3-(бензилокси)-3-оксопропил]амино}-2-оксоэтил)имино]диуксусной кислотой на стадии B. UPLC способ E: m/e=738,2149 [M+1; Rt=1,77 мин.
Пример 9
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-N,N-бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]глицилглицината (ML-9), характеризующегося следующей структурой.
 ML-9
ML-9
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-7, заменяя 4-метилбензолсульфонат 6-(бензилокси)-6-оксогексан-1-аминия бензилглицинатом на стадии A. UPLC способ B: m/e=724,23 [M+1]; Rt=1,10 мин.
Пример 10
Описан синтез олигосахаридного линкера, 15-[(2,5-диоксопирролидин-1-ил)окси]-N-{2-[(α-L-фукопиранозил)окси]этил}-3-[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]-5,15-диоксо-9,12-диокса-3,6-диазапентадекан-1-амида (ML-10), характеризующегося следующей структурой.
 ML-10
ML-10
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-7, заменяя 4-метилбензолсульфонат 6-(бензилокси)-6-оксогексан-1-аминия бензил-3-[2-(2-аминоэтокси)этокси]пропаноатом на стадии A. UPLC способ B: m/e=825,812 [M+1]; Rt=2,17 мин.
Пример 11
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-{[бис({3-оксо-3-[(α-L-фукопиранозил)окси]-2-оксоэтил}амино)пропил]амино}-6-оксогексаноата (ML-11), характеризующегося следующей структурой.
 ML-11
ML-11
Стадия A: 3,3'-{[6-(бензилокси)-6-оксогексаноил]имино}дипропановая кислота
К раствору 3,3'-иминодипропионовой кислоты (2,59 г, 7,76 ммоль) в DMF (20 мл) при 0°C в течение 15 мин порциями добавляли бензил-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноат (2,59 г, 7,76 ммоль) в DMF (3 мл), а затем по каплям в течение 10 мин TEA (951 мкл, 6,83 ммоль). Полученную суспензию перемешивали при к.т. в течение 16 ч. Нерастворимое вещество удаляли путем фильтрования, и концентрировали фильтрат. Остаток очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (150 г), элюируя 5-50% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=380,177 [M+1]; Rt=3,46 мин.
Стадия B: 2,5-диоксопирролидин-1-ил-6-{[бис({3-оксо-3-[(α-L-фукопиранозил)окси]-2-оксоэтил}амино)пропил]амино}-6-оксогексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6, заменяя 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусную кислоту 3,3'-{[6-(бензилокси)-6-оксогексаноил]имино}дипропановой кислотой на стадии C. UPLC способ B: m/e=765,36 [M+1]; Rt=2,15 мин.
Пример 12
Описан синтез олигосахаридного линкера, 1-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-1-оксогексан-2-ил]-N-{2-[(α-L-фукопиранозил)окси]этил}-N'-[(2S)-6-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]амино}-гександиамида (ML-12), характеризующегося следующей структурой.
 ML-12
ML-12
Стадия A: N2-[(бензилокси)карбонил]-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин
В круглодонную колбу емкостью 250 мл добавляли N2-[(бензилокси)карбонил]-L-лизин (194 мг, 0,694 ммоль) и DMF (10 мл). К описанному выше раствору по каплям добавляли ML-4 (300 мг, 0,694 ммоль) в DMF (5 мл), а затем добавляли DIPEA (121 мкл, 0,694 ммоль). После перемешивания при к.т. в течение 18 ч, реакционную смесь концентрировали. Остаток очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле, элюируя 0-40% AcCN в воде, с получением указанного в заголовке продукта. UPLC способ B: m/e=598,2997 [M+1]; Rt=2,99 мин.
Стадия B: N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин
В колбе емкостью 100 мл N2-[(бензилокси)карбонил]-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин (200 мг, 0,335 ммоль) растворяли в воде (5 мл). Колбу дегазировали и заполняли N2. К описанной выше смеси добавляли Pd(OH)2 (48,7 мг, 0,069 ммоль. Смесь перемешивали в атмосфере подаваемого из баллона H2 в течение 2 ч. Смесь фильтровали через слой целита, и концентрировали фильтрат с получением указанного в заголовке соединения. UPLC способ B: m/e=464,2697 [M+1]; Rt=2,61 мин.
Стадия C: бензил-6-({N2,N6-бис[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизил}амино)гексаноат
Во флакон емкостью 40 мл добавляли N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин (150 мг, 0,324 ммоль) и DMF (5 мл). Раствор охлаждали до 0°C. К описанному выше раствору по каплям добавляли ML-4 (140 мг, 0,324 ммоль) в DMF (2 мл), а затем добавляли TEA (45 мкл, 0,324 ммоль). Реакционную смесь нагревали до к.т. и перемешивали в течение 1 ч. К полученной смеси добавляли TSTU (97 мг, 0,324 ммоль), а затем добавляли TEA (45 мкл, 0,324 ммоль). Смесь перемешивали при к.т. в течение 20 мин. К полученной смеси добавляли раствор 4-метилбензолсульфоната 6-(бензилокси)-6-оксогексан-1-аминия (127 мг, 0,324 ммоль) в DMF (1,0 мл). После перемешивания при к.т. в течение 18 ч, смесь концентрировали. Остаток очищали методом флэш-хроматографии с получением указанного в заголовке соединения. UPLC способ B: m/e=984,5469 [M+1]; Rt=3,37 мин.
Стадия D: 1-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-1-оксогексан-2-ил]-N-{2-[(α-L-фукопиранозил)окси]этил}-N'-[(2S)-6-{[6-({2-[(α-L-галактопиранозил)окси]этил}амино)-6-оксогексаноил]амино}гександиамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат бензил-6-({N2,N6-бис[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизил}амино)гексаноатом на стадии C. UPLC способ B: m/e=991,5182 [M+1]; Rt=2,41 мин.
Пример 13
Описан синтез олигосахаридного линкера, N-{2-[(α-L-фукопиранозил)окси]этил}-N'-[(5S)-6-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексил]амино}-5-({8-[(2,5-диоксопирролидин-1-ил)окси]-8-оксооктаноил}амино)-6-оксогексил]гександиамида (ML-13), характеризующегося следующей структурой.
 ML-13
ML-13
Стадия A: N2-{8-(бензилокси)-8-оксооктаноил}-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин
К раствору N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизина (310 мг, 0,669 ммоль) в DMF (20 мл) при 0°C добавляли бензил-8-[(2,5-диоксопирролидин-1-ил)окси]-8-оксооктаноат (242 мг, 0,669 ммоль), а затем добавляли DIPEA (0,117 мл, 0,669 ммоль). Реакционную смесь нагревали до 25°C и перемешивали при этой температуре в течение 18 ч. Реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле, элюируя 0-30% CAN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=710,423 [M+1]; Rt=4,59 мин.
Стадия B: бензил-8-({(12S)-1,26-бис[(α-L-фукопиранозил)окси]-4,11,18,23-тетраоксо-3,10,17,24-тетраазагексакозан-12-ил}амино)-8-оксооктаноат
Во флакон емкостью 40 мл добавляли N2-{8-(бензилокси)-8-оксооктаноил}-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин (100 мг, 0,141 ммоль) и DMF (5 мл). К описанному выше раствору при 0°C добавляли EDC (40,5 мг, 0,211 ммоль) и HOBt (23,7 мг, 0,155 ммоль). Реакционную смесь нагревали до к.т. и перемешивали при к.т. в течение 20 мин. К описанной выше смеси добавляли 6-амино-N-{2-[(α-L-фукопиранозил)окси]этил}гексанамид (45,1 мг, 0,141 ммоль). После перемешивания при к.т. в течение 18 ч, смесь концентрировали. Остаток очищали методом флэш-хроматографии, элюируя 0-40% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=1012,6348 [M+1]; Rt=3,28 мин.
Стадия C: N-{2-[(α-L-фукопиранозил)окси]этил}-N'-[(5S)-6-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексил]амино}-5-({8-[(2,5-диоксопирролидин-1-ил)окси]-8-оксооктаноил}амино)-6-оксогексил]гександиамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат бензил-8-({(12S)-1,26-бис[(α-L-фукопиранозил)окси]-4,11,18,23-тетраоксо-3,10,17,24-тетраазагексакозан-12-ил}амино)-8-оксооктаноатом на стадии C. UPLC способ B: m/e=1019,588 [M+1]; Rt=2,38 мин.
Пример 14
Описан синтез олигосахаридного линкера, N-{(5S)-5-({8-[(2,5-диоксопирролидин-1-ил)окси]-8-оксооктаноил}амино)-6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}-N'-{2-[(α-L-фукопиранозил)окси]этил}гександиамида (ML-14), характеризующегося следующей структурой.
 ML-14
ML-14
Стадия A: 2,5-диоксопирролидин-1-ил-N2-[(бензилокси)карбонил]-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизинат
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-1 на стадии A, заменяя 6-(бензилокси)-6-оксогексаноат N2-{8-(бензилокси)-8-оксооктаноил}-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизином. UPLC способ B: m/e=695,213 [M+1]; Rt=3,98 мин.
Стадия B: N2-[(бензилокси)карбонил]-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-L-лизинамид
Во флаконе емкостью 40 мл 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид (883 мг, 1,612 ммоль) растворяли в DMF (10 мл). К описанному выше раствору при 0°C по каплям добавляли раствор 2,5-диоксопирролидин-1-ил-N2-[(бензилокси)карбонил]-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизината (700 мг, 1,008 ммоль) в DMF (10 мл). После перемешивания при к.т. в течение 18 ч, смесь концентрировали. Остаток очищали методом HPLC (колонка Waters Delta Pak C4 300 A, 15 мкм, 50×250 мм, скорость потока 85 мл/мин, градиент 8-30% ACN в воде в течение 25 мин) с получением указанного в заголовке соединения. UPLC способ B: m/e=1127,335 [M+1]; Rt=2,83 мин.
Стадия C: N-{(5S)-5-амино-6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}-N'-{2-[(α-L-фукопиранозил)окси]этил}гександиамид
В колбе емкостью 100 мл N2-[(бензилокси)карбонил]-N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-L-лизинамид (950 мг, 0,843 ммоль) растворяли в воде (10 мл). Колбу дегазировали и заполняли N2. К полученной смеси добавляли Pd/C (10%, 179 мг, 0,169 ммоль). Смесь перемешивали в атмосфере подаваемого из баллона H2 в течение 18 ч. Смесь фильтровали через слой целита, и концентрировали фильтрат с получением указанного в заголовке соединения. UPLC способ B: m/e=993,326 [M+1]; Rt=1,37 мин.
Стадия D: N-{(5S)-5-({8-[(2,5-диоксопирролидин-1-ил)окси]-8-оксооктаноил}амино)-6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}-N'-{2-[(α-L-фукопиранозил)окси]этил}гександиамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-12, заменяя N6-[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]-L-лизин N-{(5S)-5-амино-6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}-N'-{2-[(α-L-фукопиранозил)окси]этил}гександиамидом на стадии C: UPLC способ B: m/e=1218,418 [M+1]; Rt=2,25 мин.
Пример 15
Описан синтез олигосахаридного линкера, 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис[N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)ацетамида] (ML-15), характеризующегося следующей структурой.
 ML-15
ML-15
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-7, заменяя 2-аминоэтил-α-L-фукопиранозид 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозидом на стадии B. UPLC способ B: m/e=1460,58 [M+1]; Rt=1,53 мин.
Пример 16
Описан синтез олигосахаридного линкера, N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}-1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}пирролидин-цис-3,4-дикарбоксамида (ML-16), характеризующегося следующей структурой.
 ML-16
ML-16
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6 заменяя пирролидин-цис-3,4-дикарбоновой кислотой 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусную кислоту на стадии C. UPLC способ B: m/e=763,38 [M+1]; Rt=2,12 мин.
Пример 17
Описан синтез олигосахаридного линкера, 1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиперидин-цис-3,5-дикарбоксамида (ML-17), характеризующегося следующей структурой.
 ML-17
ML-17
Стадия A: N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиридин-3,5-дикарбоксамид
К перемешанному раствору 3,5-пиридиндикарбоновой кислоты (311 мг, 1,861 ммоль) в DMF (30 мл) при комнатной температуре добавляли 2-аминоэтил-α-L-фукопиранозид (2,077 г, 9,30 ммоль), DMAP (568 мг, 4,65 ммоль) и EDC (1784 мг, 9,30 ммоль). После перемешивания при комнатной температуре в течение 16 часов, реакционную смесь концентрировали. Остаток очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (300 г), элюируя AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=578,31 [M+1]; Rt=0,25 мин.
Стадия B: N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиперидин-цис-3,5-дикарбоксамид
К перемешанному раствору N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиридин-3,5-дикарбоксамида (550 мг, 0,952 ммоль) в H2O (12 мл) при комнатной температуре добавляли PtO2 (64,9 мг, 0,286 ммоль). Смесь дегазировали, а затем перемешивали в атмосфере подаваемого из баллона H2 при к.т. в течение 4 ч. Реакционную смесь затем фильтровали через слой целита, фильтрат концентрировали, повторно растворяли в CH3OH и центрифугировали для осаждения твердого катализатора. Надосадочную жидкость концентрировали с получением указанного в заголовке соединения. UPLC способ B: m/e=584,27 [M+1]; Rt=1,14 мин.
Стадия C: бензил-6-[цис-3,5-бис({2-[(α-L-фукопиранозил)окси]этил}карбамоил)пиперидин-1-ил]-6-оксогексаноат
К перемешанному раствору 6-(бензилокси)-6-оксогексановой кислоты (125 мг, 0,529 ммоль) в DMF (3 мл) при комнатной температуре добавляли DMAP (64,6 мг, 0,529 ммоль), EDC (203 мг, 1,058 ммоль) и раствор N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиперидин-цис-3,5-дикарбоксамида (438 мг, 0,794 ммоль) в DMF (2 мл). После перемешивания при к.т. в течение ночи, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле, элюируя 0-50% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ F: m/e=770,48 [M+1]; Rt=1,38 мин.
Стадия D: 1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиперидин-цис-3,5-дикарбоксамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6, заменяя бензил-6-{бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексаноат бензил-6-[цис-3,5-бис({2-[(α-L-фукопиранозил)окси]этил}карбамоил)пиперидин-1-ил]-6-оксогексаноатом на стадии D. UPLC способ F: m/e=777,35 [M+1]; Rt=2,23 мин.
Пример 18
Описан синтез олигосахаридного линкера, N1,N5-бис{2-[(α-L-фукопиранозил)окси]этил}-N2-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-L-глутамамида (ML-18), характеризующегося следующей структурой.
 ML-18
ML-18
Стадия A: бензил[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)пентан-2-ил]карбамат
К раствору N-[(бензилокси)карбонил]-L-глутаминовой кислоты (1,1 г, 3,91 ммоль) и 2-аминоэтил-α-L-фукопиранозида (2,026 г, 9,78 ммоль) в DMF (10 мл) добавляли EDC (3,00 г, 15,64 ммоль) и DMAP (0,048 г, 0,391 ммоль). После перемешивания при к.т. в течение 24 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии на силикагеле (80 г), элюируя 100% EtOAc (5 объемов колонки), а затем изократически EtOAc/AcCN/MeOH (6/1/1), с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 7,38-7,29 (м, 5H), 5,13-5,05 (м, 2H), 4,76 (с, 2H), 4,09 (дд, J=5,3, 8,6, 1H), 3,95-3,91 (м, 2H), 3,74-3,65 (м, 6H), 3,53-3,25 (м, 8H), 2,30 (т, J=7,5, 2H), 2,06-2,04 (м, 1H), 1,92-1,89 (м, 1H), 1,19 (д, J=6,5, 6H).
Стадия B: 2-[(N-{2-[(α-L-фукопиранозил)окси]этил}-L-α-глутаминил)амино]этил-α-L-фукопиранозид
Суспензию бензил[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)пентан-2-ил]карбамата (940 мг, 1,425 ммоль) и катализатор Перлмана (20 мг, 0,028 ммоль) в CH3OH (20 мл) встряхивали при давлении H2 30 фунт/кв.дюйм при комнатной температуре. Спустя 16 часов, катализатор отфильтровывали, и концентрировали фильтрат до указанного в заголовке соединения.
Стадия C: бензил{[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)пентан-2-ил]амино}-6-оксогексаноат
К раствору 6-(бензилокси)-6-оксогексановой кислоты (260 мг, 1,1 ммоль) в DMF (10 мл) при 0°C добавляли TSTU (348 мг, 1,155 ммоль), а затем DIPEA (202 мкл, 1,155 ммоль). После перемешивания при 0°C в течение 1 ч, реакционную смесь распределяли между Et2O (100 мл) и солевым раствором (100 мл). Органическую фазу разделяли, дополнительно промывали солевым раствором (2×100 мл), сушили над MgSO4 и концентрировали. Остаток повторно растворяли в DMF (5 мл), при 0°C добавляли к раствору 2-[(N-{2-[(α-L-фукопиранозил)окси]этил}-L-α-глутаминил)амино]этил-α-L-фукопиранозида (368 мг, 1,103 ммоль) в DMF (10 мл), а затем добавляли Et3N (154 мкл, 1,103 ммоль). После перемешивания при 0°C в течение 30 мин, реакционную смесь оставляли постепенно нагреваться до к.т. и перемешиваться в течение 2 ч. Реакционную смесь разбавляли CH3OH (10 мл) и очищали методом HPLC (градиент 6-30% 0,1% TFA в воде в течение 34 мин, 50×250 мм C4 15 мкм, 300A, скорость потока 100 мл/мин). 1H-ЯМР (CD3OD) δ 8,18 (м, 1H), 7,35-7,30 (м, 5H), 5,11 (с, 2H), 4,76 (д, J=3,6, 2H), 4,30 (дд, J=5,5, 8,6, 1H), 3,93 (дд, J=6,5, 13,1, 2H), 3,74-3,71 (м, 4H), 3,65 (с, 2H), 3,54-3,25 (м, 6H), 2,40 (т, J=6,7, 2H), 2,29-2,26 (м, 4H), 2,07-2,03 (м, 2H), 1,93-1,88 (м, 2H), 1,65-1,64 (м, 4H), 1,19 (д, J=6,5, 6H).
Стадия D: {[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)пентан-2-ил]амино}-6-оксогексановая кислота
Суспензию бензил{[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)пентан-2-ил]амино}-6-оксогексаноата (380 мг, 0,511 ммоль) и катализатора Перлмана (50 мг, 0,071 ммоль) в метаноле (30 мл) перемешавали на шейкере Парра при давлении H2 50 фунт/кв.дюйм при комнатной температуре. Спустя 16 часов, катализатор отфильтровывали, и концентрировали фильтрат с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 4,76-4,75 (м, 2H), 4,32-4,29 (м, 1H), 3,96-3,91 (м, 2H), 3,76-3,66 (м, 5H), 3,55-3,27 (м, 9H), 2,34-2,27 (м, 6H), 2,09-2,04 (м, 1H), 1,99-1,88 (м, 1H), 1,67-1,61 (м, 4H), 1,20 (д, J=6,7, 6H).
Стадия E: N1,N5-бис{2-[(α-L-фукопиранозил)окси]этил}-N2-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-L-глутамамид
К суспензии {[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)пентан-2-ил]амино}-6-оксогексановой кислоты (289 мг, 0,422 ммоль) в DMF (5,0 мл) при 0°C добавляли TSTU (140 мг, 0,464 ммоль), а затем основание Хунига (810 мкл, 0,464 ммоль). После перемешивания в течение 1 часа, смесь концентрировали с получением указанного в заголовке продукта, который использовали без дополнительной очистки. UPLC способ B: m/e=[M+1]; Rt= 1,82 мин.
Пример 19
Описан синтез олигосахаридного линкера, N1,N4-бис{2-[(α-L-фукопиранозил)окси]этил}-N2-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-L-аспартамида (ML-19), характеризующегося следующей структурой.
 ML-19
ML-19
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-18, заменяя N-[(бензилокси)карбонил]-L-глутаминовую кислоту N-[(бензилокси)карбонил]-L-аспарагиновой кислотой на стадии A. UPLC способ B: m/e=737,3126 [M+1]; Rt=2,04 мин.
Пример 20
Описан синтез олигосахаридного линкера, N2-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-N5-{2-[(α-L-фукопиранозил)окси]этил}-N1-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамамида (ML-20), характеризующегося следующей структурой.
 ML-20
ML-20
Стадия A: бензил-N2-[(бензилокси)карбонил]-N-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутаминат
К раствору Z-Glu-γ-Bn (1,0 г, 2,69 ммоль) и 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозида (2,21 г, 4,04 ммоль) в DMF (10 мл) добавляли EDC (1,29 г, 6,73 ммоль), HOBt (41 мг, 0,269 ммоль) и Et3N (38 мкл, 0,269 ммоль). После перемешивания при комнатной температуре в течение 16 часов, смесь очищали методом HPLC (50×250 мм, C4, скорость потока 85 мл/мин, градиент 25-35% AcCN в H2O с 0,1% TFA в течение 30 мин) с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 8,12-8,10 (м, 1H), 7,38-7,26 (м, 10H), 5,50-5,04 (м, 5H), 4,81 (с, 1H), 4,73 (с, 1H), 4,16-4,13 (м, 1H), 4,06 (с, 1H), 3,99-3,3,97 (м, 1H), 3,93-3,37 (м, 20H), 2,48 (т, J=7,6, 2H), 2,15-2,10 (м, 1H), 1,97-1,90 (м, 1H).
Стадия B: N-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамин
Смесь бензил-N2-[(бензилокси)карбонил]-N-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамината (1,41 г, 1,57 ммоль) и катализатора Перлмана (110 мг, 0,157 ммоль) в H2O (30 мл) перемешавали на шейкере Парра при давлении H2 50 фунт/кв.дюйм при комнатной температуре. Спустя 16 часов, катализатор отфильтровывали, и лиофилизировали фильтрат с получением указанного в заголовке соединения. 1H-ЯМР (D2O) δ 5,07 (с, 1H), 4,87 (с, 1H), 4,81 (с, 1H), 4,08-3,55 (м, 22H), 3,41-3,36 (м, 1H), 2,32 (т, J=7,5, 2H), 2,10-2,06 (м, 2H).
Стадия C: N2-[6-(бензилокси)-6-оксогексаноил]-N-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамин
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-18, заменяя 2-[(N-{2-[(α-L-фукопиранозил)окси]этил}-L-α-глутаминил)амино]этил-α-L-фукопиранозид N-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамином на стадии C. 1H-ЯМР (CD3OD) δ 8,09-8,06 (м, 1H), 7,35-7,30 (м, 5H), 5,11 (с, 2H), 5,08 (с, 1H), 4,79 (м, 1H), 4,72 (с, 1H), 4,34-4,31 (м, 1H), 4,06-3,37 (м, 22H), 2,42-2,36 (м, 4H), 2,29-2,26 (м, 2H), 2,09-2,05 (м, 1H), 1,93-1,88 (м, 1H), 1,65-1,62 (м, 4H).
Стадия D: N2-[6-(бензилокси)-6-оксогексаноил]-N5-{2-[(α-L-фукопиранозил)окси]этил}-N1-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамамид
К раствору N2-[6-(бензилокси)-6-оксогексаноил]-N-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамина (500 мг, 0,559 ммоль) и 2-аминоэтил-α-L-фукопиранозида (116 мг, 0,559 ммоль) в DMF (10 мл) добавляли EDC (161 мг, 0,838 ммоль) и HOBt (8,56 мг, 0,056 ммоль). После перемешивания при комнатной температуре в течение 16 часов, смесь очищали методом HPLC (50×250 мм, C4, скорость потока 85 мл/мин, градиент 25-35% AcCN в H2O с 0,1% TFA в течение 30 мин) с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 8,12-8,08 (м, 1H), 7,35-7,29 (м, 5H), 5,11 (с, 2H), 5,08 (с, 1H), 4,80 (с, 1H), 4,77 (с, 1H), 4,72 (с, 1H), 4,32-4,29 (м, 1H), 4,12-3,26 (м, 30H), 2,42-2,39 (м, 2H), 2,30-2,26 (м, 4H), 2,09-2,04 (м, 1H), 1,93-1,88 (м, 1H), 1,65-1,64 (м, 4H), 1,19 (д, J=6,7, 3H).
Стадия E: N2-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-N5-{2-[(α-L-фукопиранозил)окси]этил}-N1-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-18, заменяя бензил{[(2S)-1,5-диоксо-1,5-бис({2-[(α-L-фукопиранозил)окси]этил}амино)-пентан-2-ил]амино}-6-оксогексаноат N2-[6-(бензилокси)-6-оксогексаноил]-N5-{2-[(α-L-фукопиранозил)окси]этил}-N1-{2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}-L-глутамамидом на стадии D. 1H-ЯМР (CD3OD) δ 5,08 (с, 1H), 4,80 (с, 1H), 4,77 (с, 1H), 4,72 (с, 1H), 4,33-4,30 (м, 1H), 4,06-3,33 (м, 30H), 2,84-2,82 (м, 4H), 2,69-2,66 (м, 2H), 2,34-2,27 (м, 4H), 2,10-2,02 (м, 1H), 1,94-1,89 (м, 1H), 1,76-1,74 (м, 4H), 1,20 (д, J=6,5, 3H).
Пример 21
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-N2-[5-({2-[(α-L-фукопиранозил)окси]этил}амино)-5-оксопентаноил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-L-глутаминилглицината (ML-21), характеризующегося следующей структурой.
 ML-21
ML-21
Стадия A: (S)-бензил-2-{[(бензилокси)карбонил]амино}-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксопентаноат
К раствору 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозида (2,6 г, 4,75 ммоль) и (S)-5-(бензилокси)-4-{[(бензилокси)карбонил]амино}-5-оксопентановой кислоты (2,0 г, 5,39 ммоль) в DMF (36 мл) при 0°C добавляли DMAP (580 мг, 4,75 ммоль) и EDC (3,64 г, 19,00 ммоль). Реакционную смесь оставляли постепенно нагреваться до к.т. После перемешивания в течение 16 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (275 г), элюируя 10-55% AcCN в H2O, с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C40H56N2O21 900,34, обнаружено m/e: 901,26 [M+1]; Rt=2,46 мин.
Стадия B: (S)-2-амино-5-((2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси)этил)амино)-5-оксопентановая кислота
Смесь (S)-бензил-2-{[(бензилокси)карбонил]амино}-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксопентаноата (1,0 г, 1,11 ммоль) и Pd/C (118 мг, 0,111 ммоль) в воде (10 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при комнатной температуре в течение 16 часов. Катализатор отфильтровывали и промывали H2O (3×10 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C25H44N2O19 676,25, обнаружено m/e: 677,21 [M+1]; Rt=0,86 мин.
Стадия C: 2,5-диоксопирролидин-1-ил-5-оксо-5-({2-[(α-L-фукопиранозил)окси]этил}амино)пентаноат
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-4, заменяя бензил-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноат бензил-5-[(2,5-диоксопирролидин-1-ил)окси]-5-оксопентаноатом. UPLC способ B: рассчитано для C17H26N2O10 418,16, обнаружено m/e: 419,11 [M+1]; Rt=2,00 мин.
Стадия D: (S)-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксо-2-[5-оксо-5-({2-[(α-L-фукопиранозил)окси]этил}амино)пентанамидо]пентановая кислота
К раствору (S)-2-амино-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксопентановой кислоты (350 мг, 4,75 ммоль) в DMF (5 мл) при 0°C добавляли 2,5-диоксопирролидин-1-ил-5-оксо-5-({2-[(α-L-фукопиранозил)окси]этил}амино)пентаноат (216 мг, 0,517 ммоль, получали в соответствии со стадией A примера 4 получения ML-4, заменяя 6-(бензилокси)-6-оксогексановую кислоту 5-(бензилокси)-5-оксопентановой кислотой) и TEA (0,2 мл, 1,435 ммоль). После перемешивания при 0°C в течение 2 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии на C18-связанном силикагеле (150 г), элюируя 5-40% AcCN в H2O, с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C38H65N3O26 979,39, обнаружено m/e: 980,31 [M+1]; Rt=0,92 мин.
Стадия E: (S)-2,5-диоксопирролидин-1-ил-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксо-2-[5-оксо-5-({2-[(α-L-фукопиранозил)окси]этил}амино)пентанамидо]пентаноат
К раствору (S)-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксо-2-[5-оксо-5-({2-[(α-L-фукопиранозил)окси]этил}амино)пентанамидо]пентановой кислоты (366 мг, 0,373 ммоль) в DMF (2 мл) при 0°C добавляли TSTU (115 мг, 0,381 ммоль) и DIPEA (0,1 мл, 0,573 ммоль). После перемешивания при 0°C в течение 1 часа, реакционную смесь гасили добавлением TFA (60 мкл, 0,784 ммоль). Реакционную смесь переносили по каплям автоматической пипеткой в пробирку с AcCN (45 мл). Полученную белую суспензию центрифугировали (3000 об/мин, 15 мин, при 4°C) с получением прозрачной надосадочной жидкости и белого осадка. Надосадочную жидкость отбрасывали, белый осадок промывали AcCN (1 мл) и сушили с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C42H68N4O28 1076,40, обнаружено m/e: 1077,28 [M+1]; Rt=0,90 мин.
Стадия F: бензил-N2-[5-({2-[(α-L-фукопиранозил)окси]этил}амино)-5-оксопентаноил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-L-глутаминилглицинат
К раствору (S)-2,5-диоксопирролидин-1-ил-5-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-5-оксо-2-[5-оксо-5-({2-[(α-L-фукопиранозил)окси]этил}амино)пентанамидо]пентаноата (0,35 г, 0,325 ммоль) в DMF (4 мл) при 0°C добавляли хлорид 2-(бензилокси)-2-оксоэтанаминия (77 мг, 0,382 ммоль) и TEA (0,15 мл, 1,076 ммоль). После перемешивания при к.т. в течение 24 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (150 г), элюируя 5-40% AcCN в H2O, с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C47H74N4O27 1126,45, обнаружено m/e: 1127,39 [M+1]; Rt=2,84 мин.
Стадия G: 2,5-диоксопирролидин-1-ил-N2-[5-({2-[(α-L-фукопиранозил)окси]этил}амино)-5-оксопентаноил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-L-глутаминилглицинат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат бензил-N2-[5-({2-[(α-L-фукопиранозил)окси]этил}амино)-5-оксопентаноил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-L-глутаминилглицинатом на стадии C. UPLC способ B: рассчитано для C44H71N5O29 1133,42, обнаружено m/e: 1134,34 [M+1]; Rt=2,17 мин.
Пример 22
Описан синтез олигосахаридного линкера, 2-{(2S)-8-[(2,5-диоксопирролидин-1-ил)окси]-1-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-1,8-диоксооктан-2-ил}-N'-{2-[(α-L-фукопиранозил)окси]этил}гександиамида (ML-22), характеризующегося следующей структурой.
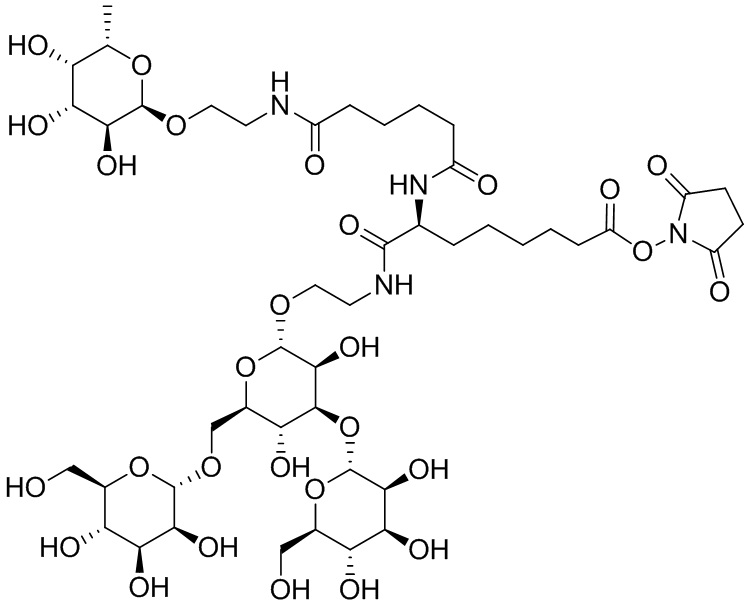 ML-22
ML-22
Стадия A: (2S)-8-(бензилокси)-2-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]амино}-8-оксооктановая кислота
К раствору ML-4 (300 мг, 0,694 ммоль) в DMF при 0°C добавляли (S)-2-амино-8-(бензилокси)-8-оксооктановую кислоту (194 мг, 0,694 ммоль), а затем DIPEA (121 мкл, 0,694 ммоль). Реакционную смесь оставляли перемешиваться при к.т. в течение 2 ч, а затем концентрировали. Остаток очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле, элюируя 5-28% AcCN в H2O, с получением указанного в заголовке соединения. UPLC способ B: m/e=597,226 [M+1]; Rt=3,45 мин.
Стадия B: N-{(2S)-8-[(2,5-диоксопирролидин-1-ил)окси]-1-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-1,8-диоксооктан-2-ил}-N'-{2-[(α-L-фукопиранозил)окси]этил}гександиамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя бензил-6-(бензилокси)-6-оксогексановую кислоту (2S)-8-(бензилокси)-2-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноил]амино}-8-оксооктановой кислотой на стадии A. UPLC способ B: m/e: 1133,312 [M+1]; Rt=2,23 мин.
Пример 23
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-1-[(α-L-фукопиранозил)окси]-13-{2-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-2-оксоэтил}-4,11,15-триоксо-3,10,13,16-тетраазадокозан-22-оата (ML-23), характеризующегося следующей структурой.
 ML-23
ML-23
Стадия A: бензил(6-{2-[(α-L-фукопиранозил)этил]амино}-6-оксогексил)карбамат
К раствору 2-аминоэтил-α-L-фукопиранозида (3,0 г, 14,48 ммоль) в DMF (80 мл) при к.т. добавляли 2,5-диоксопирролидин-1-ил-6-{[(бензилокси)карбонил]амино}гексаноат (6,3 г, 17,37 ммоль) с, спустя 1 ч, TEA (4,44 мл, 31,8 ммоль). После перемешивания в течение 16 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (230 г), элюируя 5-40% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=455,2568 [M+1]; Rt=2,86 мин.
Стадия B: 6-амино-N-{2-[(α-L-фукопиранозил)окси]этил}гексанамид
К раствору бензил(6-{2-[(α-L-фукопиранозил)этил]амино}-6-оксогексил)карбамата (1,72 г, 3,79 ммоль) в H2O (20 мл) добавляли Pd/C (23 мг, 0,217 ммоль). Смесь дегазировали и перемешивали в атмосфере подаваемого из баллона H2. Спустя 2 ч, реакционную смесь фильтровали через слой целита, и лиофилизировали фильтрат с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 1,21 (д, 3H), 1,40-1,38 (м, 2H), 1,62-1,60 (м, 4H), 2,23 (т, 2H), 2,76 (т, 2H), 3,28-3,27 (м, 1H), 3,44-3,43 (м, 1H), 3,54-3,52 (м, 1H), 3,66 (с, 1H), 3,75-3,74 (м, 2H), 3,94-3,93 (м, 1H), 4,76 (д, 1 H). UPLC способ B: m/e=321,2323 [M+1]; Rt =3,02 мин.
Стадия C: [(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)(2-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексил]амино}-2-оксоэтил)амино]уксусная кислота
К суспензии 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)азандиил]диуксусной кислоты (1,0 г, 2,54 ммоль) в CH2Cl2 (30 мл) при 0°C добавляли трифторуксусный ангидрид (448 мкл, 3,17 ммоль). После перемешивания при 0°C в течение 3 ч, смесь охлаждали до -30°C, и по каплям в течение 30 мин добавляли раствор Et3N (848 мкл, 6,08 ммоль) в DMF (20 мл). После перемешивания при -30°C в течение 30 мин, добавляли смесь 6-амино-N-{2-[(α-L-фукопиранозил)окси]этил}гексанамида, (812 мг, 2,54 ммоль) в DMF (30 мл) и оставляли полученную смесь перемешиваться при к.т. После перемешивания в течение 16 ч, смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (42 г), элюируя 0-40% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=697,3876 [M+1]; Rt=3,398 мин. 1H-ЯМР (CD3OD) δ 1,23 (3H, д, J=6,59), 1,39-1,36 (4H, м), 1,56 (6H, с), 1,67 (6H, д, J=10,32), 2,23 (2H, т, J=7,50), 2,41 (2H, т, J=7,37), 3,24 (6H, м), 3,42 (4H, с), 3,49 (2H, с), 3,57-3,52 (3H, м), 3,68 (1H, с), 3,77 (3H, т, J=1,65), 3,98-3,94 (1H, м), 4,77 (1H, с), 5,14 (2H, с), 7,38 (5H, д, J=4,43).
Стадия D: бензил-1-[(α-L-фукопиранозил)окси]-13-{2-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-2-оксоэтил}-4,11,15-триоксо-3,10,13,16-тетраазадокозан-22-оат
К раствору [(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)(2-{[6-({2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексил]амино}-2-оксоэтил)амино]уксусной кислоты (800 мг, 1,148 ммоль) в DMF (15 мл) добавляли 2-аминоэтил-α-D-маннопиранозил-(1→3)]-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид (1,89 г, 3,44 ммоль), HOBt (17,6 мг, 0,115 ммоль) и EDC (770 мг, 4,02 ммоль). После перемешивания в течение 16 ч при к.т., реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (50 г), элюируя 10-40% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=1226,5990 [M+1]; Rt=2,96 мин. 1H-ЯМР (CD3OD) δ 1,23 (3H, д, J=6,58), 1,38 (6H, с), 1,56 (6H, с), 1,69-1,65 (6H, м), 2,23 (2H, т, J=7,44), 2,41 (2H, т, J=7,35), 3,27-3,23 (6H, м), 3,37 (1H, с), 3,37 (1H, с), 3,38 (1H, с), 3,45 (1H, с), 3,47 (1H, с), 3,47 (1H, с), 3,54 (3H, с), 3,60 (1H, с), 3,62 (2H, с), 3,64 (1H, с), 3,65 (1H, с), 3,67 (2H, с), 3,68 (3H, с), 3,88-3,72 (20H, м), 4,07 (1H, с), 4,76 (1H, с), 4,78 (1H, с), 4,84 (1H, д, J=1,69), 5,10 (1H, с), 5,14 (2H, с), 7,38 (5H, д, J=4,37).
Стадия E: 2,5-диоксопирролидин-1-ил 13-(2-((2-(((([α-D-маннопиранозил-(1→3)]-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозилокси-(1-O→2))-этиламино)-2-оксоэтил)-4,11,15-триоксо-1-(((2-(α-L-фукопиранозилокси)-(1-O→2)))окси)-3,10,13,16-тетраазадокозан-22-оат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6, заменяя бензил-6-{бис[2α-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-6-оксогексаноат бензил-1-[(α-L-фукопиранозил)окси]-13-{2-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-2-оксоэтил}-4,11,15-триоксо-3,10,13,16-тетраазадокозан-22-оатом на стадии D. UPLC способ B: m/e=1233,6006 [M+1]; Rt=2,223 мин.
Пример 21
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-N-(2-{[6-({2-[(6-дезокси-α-L-галактопиранозил)окси]этил}амино)-6-оксогексил]амино}-2-оксоэтил)-N-[2-({6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}амино)-2-оксоэтил]глицил-β-аланината (ML-21), характеризующегося следующей структурой.
 ML-21
ML-21
Стадия A: бензил{6-[(2-{[α-D-маннопираноил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}карбамат
К перемешанному раствору 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозида (1,8 г, 3,29 ммоль) в DMF (50 мл) при 0°C добавляли бензил{6-[(2,5-диоксопирролидин-1-ил)окси]-6-гексил}карбамат (1,787 г, 4,93 ммоль) и, спустя 30 мин, Et3N (1,146 мл, 8,22 ммоль). После перемешивания в течение 16 ч, реакционную смесь концентрировали, и очищали полученный остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (240 г), элюируя 5-40% AcCN в воде, с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 1,35 (ушир. с, 2H), 1,52 (ушир. с, 2H), 1,63 (ушир. с, 2H), 2,21 (с, 2H), 3,12 (с, 2H), 3,37 (с, 1H), 3,51-3,37 (ушир. м, 5H), 3,81-3,69 (ушир. м, 14H), 3,98 (с, 1H), 4,06 (с, 1H), 4,72 (с, 1H), 4,81 (с, 2H), 5,07 (с, 2H), 7,35 (с, 5 H). UPLC способ B: m/e=795,303 [M+1]; Rt=2,49 мин.
Стадия B: 6-амино-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)гексанамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя бензил(6-{2-[(α-L-фукопиранозил)этил]амино}-6-оксогексил)карбамат бензил{6-[(2-{[α-D-маннопираноил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}карбаматом на стадии B. 1H-ЯМР (CD3OD) δ 1,40 (2H, д, J=7,97), 1,63 (4H, д, J=12,78), 2,23 (2H, т, J=7,37), 2,82 (2H, кв, J=8,46), 3,44-3,37 (2H, м), 3,53-3,46 (1H, м), 3,63-3,61 (4H, м), 3,72-3,70 (6H, м), 3,80 (5H, дд, J=9,96, 4,52), 3,83 (2H, с), 3,90 (1H, дд, J=11,05, 5,87), 3,97 (1H, с), 4,03 (1H, с), 4,72 (1H, с), 4,81 (1H, с), 5,06 (1H, с). UPLC способ B: m/e 661,3543 [M+1]; Rt=3,89 мин.
Стадия C: 2,5-диоксопирролидин-1-ил-N-(2-{[6-({2-[(6-дезокси-α-L-фукопиранозил)окси]этил}амино)-6-оксогексил]амино}-2-оксоэтил)-N-[2-({6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}амино)-2-оксоэтил]глицил-β-аланинат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 2-аминоэтил-α-L-фукопиранозид и 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)имино]диуксусную кислоту 6-амино-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)гексанамидом и бензил-N,N-бис(карбоксиметил)глицил-β-аланинатом, соответственно, на стадии C, и 6-амино-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)гексанамид 6-амино-N-{2-[(6-дезокси-α-L-галактопиранозил)окси]этил}гексанамидом на стадии D. UPLC способ E: m/e=1304,444 [M+1]; Rt=1,76 мин.
Пример 25
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-1-[(α-L-фукопиранозил)окси]-13-[2-({6-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-6-оксогексил}амино)-2-оксоэтил]-4,11,15-триоксо-3,10,13,16-тетраазадокозан-22-оата (ML-25), характеризующегося следующей структурой.
 ML-25
ML-25
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя бензил-N,N-бис(карбоксиметил)глицил-β-аланинат 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)имино]диуксусной кислотой. UPLC способ E: m/e=1346,5950 [M+1]; Rt=2,29 мин.
Пример 26
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-1-[(α-L-фукопиранозил)окси]-11-[2-({4-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-4-оксобутил}амино)-2-оксоэтил]-4,9,13-триоксо-3,8,11,14-тетраазаэйкозан-20-оата (ML-26), характеризующегося следующей структурой.
 ML-26
ML-26
Стадия A: бензил{4-[(2-{[α-D-маннопираноил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-4-оксобутил}карбамат
К смеси 2-аминоэтил-α-D-маннопиранозил-(1→3)]-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозида (790 мг, 1,44 ммоль) и 4-{[(бензилокси)карбонил]амино}бутановой кислоты (342 мг, 1,443 ммоль) в DMF (5 мл) добавляли EDC (553 мг, 2,89 ммоль) и DMAP (176 мг). После перемешивания при к.т. в течение ночи, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (43 г), элюируя 5-40% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=767,2084 [M+1]; Rt=2,56 мин.
Стадия B: 4-амино-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)бутанамид
К продутому азотом раствору бензил{4-[(2-{[α-D-маннопираноил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-4-оксобутил}карбамата (955 мг, 1,25 ммоль) в воде (6 мл) добавляли 10% палладированный уголь (133 мг), и перемешивали полученную смесь в атмосфере подаваемого из баллона H2 в течение 4 ч. Реакционную смесь фильтровали через слой целита, и лиофилизировали фильтрат с получением указанного в заголовке соединения. UPLC способ B: m/e=633,2224 [M+1]; Rt=0,78 мин.
Стадия C: 4-амино-N-{2-[(α-L-фукопиранозил)окси]этил}бутанамид
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-26, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)]-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-L-фукопиранозидом на стадии A. UPLC способ E: m/e= 1248,365 [M+1]; Rt=1,37 мин.
Стадия D: 11-[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-1-[(α-L-фукопиранозил)окси]-6-оксогексил}амино)-2-оксоэтил]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)-4,9,13-триоксо-3,8,11,14-тетраазаоктадекан-18-амид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 6-амино-N-{2-[(α-L-фукопиранозил)окси]этил}гексанамид 4-амино-N-{2-[(α-L-фукопиранозил)окси]этил}бутанамидом на стадии C, и 2-аминоэтил-α-D-маннопиранозил-(1→3)]-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 4-амино-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)бутанамидом на стадии D, соответственно. UPLC способ E: m/e=1290,4012 [M+1]; Rt=2,03 мин.
Пример 27
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-N-(2-{[4-({2-[(6-дезокси-α-L-галактопиранозил)окси]этил}амино)-4-оксобутил]амино}-2-оксоэтил)-N-[2-({4-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-4-оксобутил}амино)-2-оксоэтил]глицил-β-аланината (ML-27), характеризующегося следующей структурой.
 ML-27
ML-27
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя бензил{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}карбамат бензил{4-[(2,5-диоксопирролидин-1-ил)окси]-4-оксобутил}карбаматом на стадии B. UPLC способ E: m/e=1248,365 [M+1]; Rt=1,37 мин.
Пример 28
Описан синтез олигосахаридного линкера, N-{2-[(α-L-фукоопиранозил)окси]этил}-11-[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]-1-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}-4,9,13-триоксо-3,8,11,14-тетраазаэйкозан-20-амида (ML-28), характеризующегося следующей структурой.
 ML-28
ML-28
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)]-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 4-амино-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)бутанамидом на стадии D. UPLC способ E: m/e=1318,4270 [M+1]; Rt=2,19 мин.
Пример 29
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-({[(2-оксо-2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]-2-оксиэтил}амино)({2-оксо-2-[(α-L-фукопиранозил)окси]-2-оксоэтил}амино)этил]амино}ацетамидо)-6-оксогексаноата (ML-29), характеризующегося следующей структурой.
 ML-29
ML-29
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 6-амино-N-{2-[(α-L-фукопиранозил)окси]этил}гексанамид 2-аминоэтил-α-L-фукопиранозидом на стадии C. UPLC способ A: m/e=1120,30 [M+1]; Rt=1,90 мин.
Пример 30
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-2-({[(2-оксо-2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]-2-оксиэтил}амино)({2-оксо-2-[(α-L-фукопиранозил)окси]-2-оксоэтил}амино)этил]амино}ацетамидо)ацетата (ML-30), характеризующегося следующей структурой.
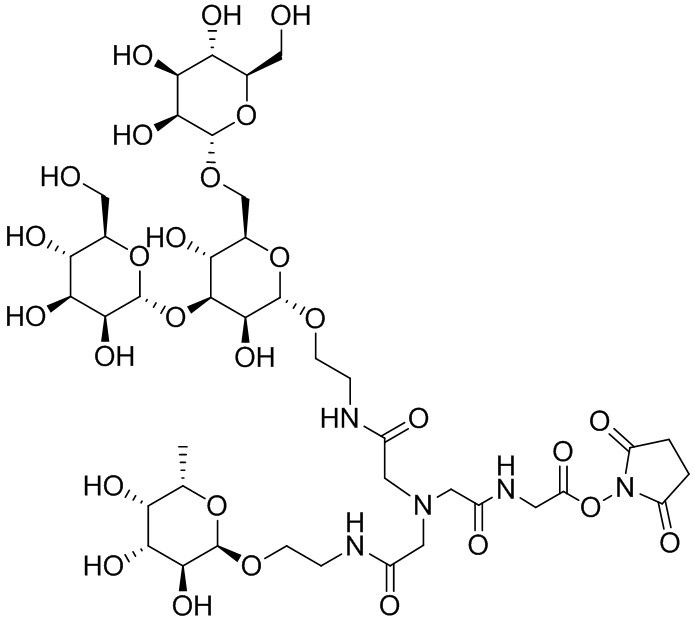 ML-30
ML-30
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 2,2'-((2-((6-(бензилокси)-6-оксогексил)амино)-2-оксоэтил)имино)диуксусную кислоту бензил-N,N-бис(карбоксиметил)глицилглицинатом, и 6-амино-N-(2-α-L-фукопиранозил)этил)гексанамид 2-аминоэтил-α-L-фукопиранозидом на стадии C, соответственно. UPLC способ B: m/e=1064,25 [M+1]; Rt=2,65 мин.
Пример 31
Описан синтез олигосахаридного линкера, 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-глюкопиранозил]окси}этил)ацетамида (ML-31), характеризующегося следующей структурой.
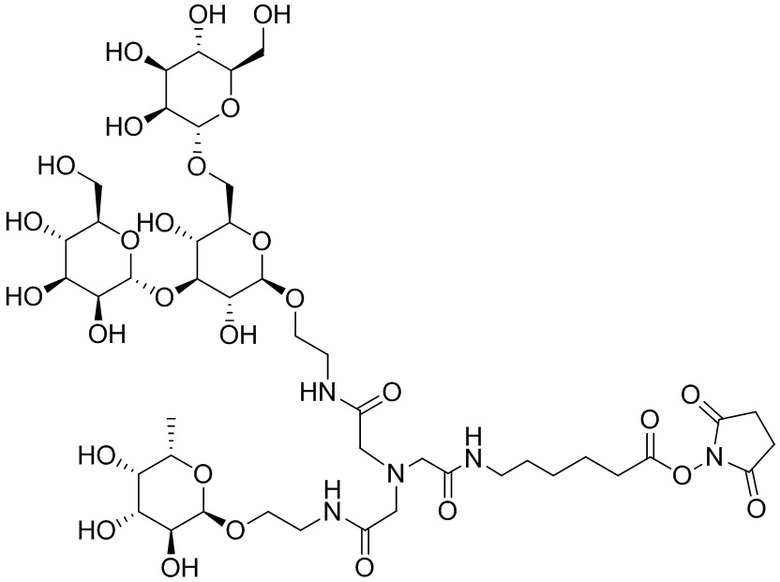 ML-31
ML-31
Стадия A: бензил{2-[(4,6-O-бензилиден-β-D-глюкопиранозил)окси]этил}карбамат
К раствору бензил[2-(β-D-глюкопиранозилокси)этил]карбамата (10 г, 28,0 ммоль, Beilstein J. Org. Chem. 2010, 6, 699) в AcCN (150 мл) добавляли бензальдегида диметилацеталь (5 мл, 31,6 ммоль) и моногидрат пара-толуолсульфоновой кислоты (60 мг, 0,315 ммоль). После перемешивания в течение 24 ч, реакционную смесь концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-20% CH3OH в CH2Cl2, с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C23H27NO8 445,17, обнаружено m/e: 446,06 [M+1]; Rt=3,21 мин. 1H-ЯМР (CDCl3) δ 7,50-7,45 (2H, м), 7,35-7,25 (8H, м), 5,50 (1H, с), 5,10 (2H, с), 4,40-4,36 (1H, м), 4,31-4,26 (1H, м), 3,95-3,85 (1H, м), 3,80-3,70 (2H, м), 3,55-3,40 (4H, м), 3,40-3,30 (2H, м).
Стадия B: бензил{2-[(2-O-бензоил-4,6-O-бензилиден-β-D-глюкопиранозил)окси]этил}карбамат
Перемешиваемую смесь бензил{2-[(4,6-O-бензилиден-β-D-глюкопиранозил)окси]этил}карбамата (4,5 г, 10,10 ммоль) и дибутилстаннанона (3 г, 12,05 ммоль) в толуоле (50 мл) оставляли нагреваться с обратным холодильником в течение 5 ч. Полученную смесь охлаждали до к.т. и обрабатывали бензоилхлоридом (1,3 мл, 11,19 ммоль). После перемешивания при к.т. в течение 1 ч, смесь концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (330 г, элюируя 0-10% ацетоном в CH2Cl2) с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C30H31NO9 549,20, обнаружено m/e: 572,09 [M+Na]; Rt=3,94 мин. 1H-ЯМР (CDCl3) δ 8,05-8,00 (2H, м), 7,55-7,45 (3H, м), 7,40-7,25 (10H, м), 5,55 (1H, с), 5,18-5,12 (1H, м), 5,04-5,00 (1H, м), 4,93-4,89 (1H, м), 4,66-4,63 (1H, м), 4,38-4,32 (1H, м), 4,05-4,00 (1H, м), 3,90-3,85 (1H, м), 3,82-3,77 (1H, м), 3,70-3,60 (2H, м), 3,55-3,45 (1H, м), 3,40-3,25 (2H, м). Региохимию подтверждали в эксперименте 1H-1H 2D COSY.
Стадия C: бензил{2-[(2-O-бензоил-4-O-бензил-β-D-глюкопиранозил)окси]этил}карбамат
К раствору бензил{2-[(2-O-бензоил-4,6-O-бензилиден-β-D-глюкопиранозил)окси]этил}карбамата (2,58 г, 4,69 ммоль) и комплекса боран/тетрагидрофуран (40 мл, 40,0 ммоль, 1,0 M в THF) при 0°C по каплям добавляли раствор дибутил(((трифторметил)-сульфонил)окси)борана (6 мл, 6,00 ммоль, 1,0 M в CH2Cl2). После перемешивания при 0°C в течение 2 ч, к реакционной смеси добавляли TEA (0,5 мл), а затем осторожно добавляли CH3OH до завершения выделения H2. Реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии на силикагеле (330 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке соединения. TLC: силикагель, гексаны/EtOAc=35/65, Rf=0,5. 1H-ЯМР (CDCl3) δ 8,05-8,00 (2H, м), 7,55-7,25 (13H, м), 5,05-4,98 (3H, м), 4,86-4,82 (1H, м), 4,78-4,74 (1H, м), 4,60-4,58 (1H, м), 3,95-3,90 (2H, м), 3,85-3,80 (1H, м), 3,75-3,65 (2H, м), 3,61-3,58 (1H, м), 3,45-3,40 (1H, м), 3,35-3,30 (2H, м). Региохимию подтверждали в экспериментах 1H-1H COSY 2D ЯМР-спектроскопии и 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC).
Стадия D: бензил(2-{[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→6)]-2-O-бензоил-4-O-бензил-β-D-глюкопиранозил]окси}этил)карбамат
К смеси бензил{2-[(2-O-бензоил-4-O-бензил-β-D-глюкопиранозил)окси]этил}карбамата (1,47 г, 2,67 ммоль), 2,3,4,6-тетра-O-бензоил-D-маннопиранозилтрихлорацетимидата (4,15 г, 5,60 ммоль, Organic Letters, 2003, 5, 4041) и 4Å молекулярных сит в CH2Cl2 (40 мл) и -30°C по каплям добавляли триметисилилтрифторметансульфонат (0,25 мл, 1,384 ммоль). Смесь оставляли постепенно нагреваться до к.т. После перемешивания в течение 6 ч, реакционную смесь гасили добавлением TEA (0,4 мл, 2,87 ммоль). Реакционную смесь фильтровали, и концентрировали фильтрат. Остаток очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-75% EtOAc в гексанах, с получением указанного в заголовке соединения. TLC: силикагель, гексаны/EtOAc=3/2, Rf=0,5. 1H-ЯМР (CDCl3) δ 8,20-7,95 (8H, м), 7,85-7,75 (8H, м), 7,65-7,60 (3H, м), 7,55-7,40 (8H, м), 7,38-7,18 (24H, м), 7,15-7,05 (4H, м), 6,00-5,95 (1H, м), 5,88-5,85 (1H, м), 5,75-5,65 (3H, м), 5,48-5,46 (1H, м), 5,35-5,25 (2H, м), 5,22-5,20 (1H, м), 5,07-5,05 (1H, м), 4,95-4,85 (2H, м), 4,78-4,75 (1H, м), 4,70-4,60 (1H, м), 4,60-4,55 (2H, м), 4,40-4,30 (2H, м), 4,27-4,23 (1H, м), 4,20-4,10 (2H, м), 3,95-3,90 (1H, м), 3,80-3,75 (1H, м), 3,75-3,70 (3H, м), 3,60-3,55 (1H, м), 3,51-3,48 (1H, м), 3,40-3,25 (2H, м).
Стадия E: бензил(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-4-O-бензил-β-D-глюкопиранозил]окси}этил)карбамат
К раствору бензил(2-{[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→6)]-2-O-бензоил-4-O-бензил-β-D-глюкопиранозил]окси}этил)карбамата (3,39 г, 1,984 ммоль) в CH3OH (30 мл) добавляли NaOCH3 (0,4 мл, 0,2 ммоль, 0,5 M в CH3OH). После перемешивания при к.т. в течение 24 ч, к реакционной смеси добавляли ионообменную смолу Amberlite IR 120 (H) (предварительно промытую CH3OH 3×30 мл). Полученную смесь оставляли дополнительно перемешиваться в течение 15 мин. Смолу отфильтровывали и промывали CH3OH (3×5 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C35H49NO18 771,29, обнаружено m/e: 772,42 [M+1]; Rt=2,51 мин.
Стадия F: 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-глюкопиранозид
Смесь бензил(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-4-O-бензил-β-D-глюкопиранозил]окси}этил)карбамата (0,96 г, 1,244 ммоль) и Pd/C (124 ммоль) в воде (20 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при к.т. в течение 16 ч. Катализатор отфильтровывали и промывали H2O (3×10 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C20H37NO16 547,21, обнаружено m/e: 548,29 [M+1]; Rt=0,87 мин. 1H-ЯМР (D2O) δ 5,20-5,19 (1H, м), 4,88-4,87 (1H, м), 4,51-4,49 (1H, м), 4,05 (1H, м), 4,00-3,90 (4H, м), 3,85-3,70 (9H, м), 3,70-3,60 (5H, м), 3,40-3,30 (1H, м), 3,05-3,00 (2H, м).
Стадия G: 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-глюкопиранозил]окси}этил)ацетамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-29, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-глюкопиранозидом. UPLC способ B: рассчитано для C44H71N5O29 1133,42, обнаружено m/e: 1134,34 [M+1]; Rt=2,17 мин.
Пример 32
Описан синтез олигосахаридного линкера, 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-2-дезокси-2-фтор-β-D-глюкопиранозил]окси}этил)ацетамида (ML-32), характеризующегося следующей структурой.
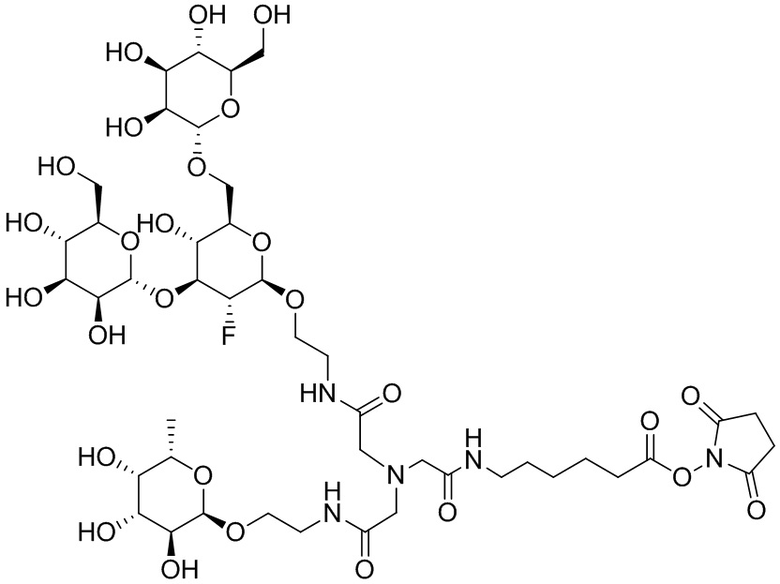 ML-32
ML-32
Стадия A: 2-хлорэтил-3,4,6-три-O-ацетил-2-дезокси-2-фтор-D-глюкопиранозид
К раствору 2-хлорэтанола (1,0 мл, 14,92 ммоль), 3,4,6-три-O-ацетил-2-дезокси-2-фтор-D-глюкопиранозилтрихлорацетимидата (1,4 г, 3,09 ммоль, Angew. Chem. Int. Ed. 2010, 49, 8724) и 4Å молекулярных сит в CH2Cl2 (50 мл) при -30°C по каплям добавляли триметисилилтрифторметансульфонат (0,25 мл, 1,384 ммоль). Смесь оставляли постепенно нагреваться до к.т. После перемешивания в течение 2 ч, реакционную смесь гасили добавлением TEA (0,13 мл, 0,933 ммоль). Полученную смесь фильтровали, и концентрировали фильтрат. Остаток очищали методом флэш-хроматографии на силикагеле (80 г), элюируя 0-60% EtOAc в гексанах, с получением указанного в заголовке соединения. Эту аномерную смесь использовали непосредственно на следующей стадии без дополнительной очистки. TLC: силикагель, гексан/EtOAc=3/1, Rf=0,35.
Стадия B: 2-хлорэтил-2-дезокси-2-фтор-D-глюкопиранозид
К раствору 2-хлорэтил-3,4,6-три-O-ацетил-2-дезокси-2-фтор-D-глюкопиранозида (0,85 г, 2,293 ммоль) в CH3OH (10 мл) добавляли NaOCH3 (0,46 мл, 0,230 ммоль, 0,5 M в CH3OH). Полученную смесь перемешивали при к.т. в течение 2 ч. К реакционной смеси добавляли ионообменную смолу Dowex 50wx2-200 (H) (предварительно промытую CH3OH 3×10 мл). После перемешивания в течение 15 мин, смолу отфильтровывали и концентрировали фильтрат с получением указанного в заголовке соединения. Эту аномерную смесь использовали непосредственно на следующей стадии без дополнительной очистки. TLC: силикагель, гексан/EtOAc=1/1, Rf=0,2.
Стадия C: 2-хлорэтил-4,6-O-бензилиден-2-дезокси-2-фтор-β-D-глюкопиранозид
К раствору 2-хлорэтил-2-дезокси-2-фтор-D-глюкопиранозида (0,55 г, 2,248 ммоль) в AcCN (10 мл) добавляли бензальдегида диметилацеталь (540 мкл, 3,6 ммоль) и моногидрат пара-толуолсульфоновой кислоты (6 мг, 0,032 ммоль). После перемешивания в течение 3 ч, реакционную смесь концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (80 г), элюируя 0-60% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 7,50-7,47 (2H, м), 7,35-7,32 (3H, м), 5,58 (1H, с), 4,76-4,72 (1H, м), 4,32-4,28 (1H, м), 4,16-4,02 (2H, м), 3,95-3,85 (2H, м), 3,80-3,74 (1H, м), 3,70-3,66 (2H, м), 3,52-3,48 (2H, м). β-аномерную стереохимию подтверждали в экспериментах 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC) и 1H-1H NOE (NOESY) 2D ЯМР-спектроскопии. TLC: силикагель, гексан/EtOAc=7/3, Rf=0,5.
Стадия D: 2-хлорэтил-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозид
К раствору 2-хлорэтил-4,6-O-бензилиден-2-дезокси-2-фтор-β-D-глюкопиранозида (422 мг, 1,268 ммоль) в комплексе боран/тетрагидрофуран (9 мл, 9,0 ммоль, 1,0 M в THF) при 0°C по каплям добавляли раствор дибутил{[(трифторметил)сульфонил]окси}-борана (1,27 мл, 1,270 ммоль, 1,0 M в CH2Cl2). После перемешивания при 0°C в течение 2 ч, к реакционной смеси добавляли TEA (0,5 мл), а затем осторожно добавляли CH3OH до завершения выделения H2. Реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии на силикагеле (40 г), элюируя 0-60% EtOAc в гексанах, с получением указанного в заголовке соединения. TLC: силикагель, гексан/EtOAc=1/1, Rf=0,6. 1H-ЯМР (CDCl3) δ 7,38-7,28 (5H, м), 4,84-4,71 (2H, м), 4,56-4,53 (1H, м), 4,22-4,04 (2H, м), 3,93-3,83 (3H, м), 3,77-3,71 (1H, м), 3,67-3,63 (2H, м), 3,55-3,50 (1H, м), 3,40-3,37 (1H, м). Региохимию подтверждали в экспериментах 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC); 1H-13C гетероядерной 2D ЯМР-спектроскопии с многоквантовым переносом когеренции (HMQC); и 1H-1H NOE (NOESY) 2D ЯМР-спектроскопии.
Стадия E: 2-азидоэтил-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозид
К раствору 2-хлорэтил-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозида (1,53 г, 4,57 ммоль) в DMF (45 мл) при к.т. добавляли азид натрия (360 мг, 5,54 ммоль). После перемешивания при 70°C в течение 16 ч, реакционную смесь охлаждали до к.т., выливали в воду со льдом (200 мл) и экстрагировали CH2Cl2 (3×100 мл). Органические слои объединяли и промывали солевым раствором (2×100 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (120 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке соединения. TLC: силикагель, гексан/EtOAc=1/1, Rf=0,55. 1H-ЯМР (CDCl3) δ 7,37-7,28 (5H, м), 4,84-4,71 (2H, м), 4,55-4,52 (1H, м), 4,22-4,07 (1H, м), 4,03-3,98 (1H, м), 3,94-3,86 (2H, м), 3,79-3,71 (2H, м), 3,56-3,51 (1H, м), 3,48-3,36 (3H, м).
Стадия F: 2-азидоэтил-2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→6)]-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозид
К раствору 2-азидоэтил-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозида (1,23 г, 3,6 ммоль), 2,3,4,6-тетра-O-бензоил-D-маннопиранозилтрихлорацетимидата (5,35 г, 7,22 ммоль, Organic Letters, 2003, 5, 4041) и 4Å молекулярных сит в CH2Cl2 (60 мл) при -30°C по каплям добавляли триметисилилтрифторметансульфонат (0,25 мл, 1,384 ммоль). Смесь оставляли постепенно нагреваться до к.т. После перемешивания в течение 6 ч, реакционную смесь гасили добавлением TEA (0,4 мл, 2,87 ммоль). Полученную смесь фильтровали, и концентрировали фильтрат. Остаток очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-75% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 8,20-7,70 (16H, м), 7,60-7,05 (29H, м), 6,14-5,98 (2H, м), 5,90-5,80 (2H, м), 5,79-5,77 (1H, м), 5,66-5,64 (1H, м), 5,42-5,41 (1H, м), 5,23-5,22 (1H, м), 5,03-5,02 (1H, м), 4,91-4,89 (1H, м), 4,70-4,60 (3H, м), 4,57-4,55 (1H, м), 4,50-4,48 (1H, м), 4,40-4,22 (3H, м), 4,10-4,00 (2H, м), 3,80-3,70 (3H, м), 3,55-3,45 (2H, м), 3,44-3,38 (1H, м), 3,36-3,30 (1H, м).
Стадия G: 2-азидоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозид
К раствору 2-азидоэтил-2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→6)]-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозида (5,0 г, 3,34 ммоль) в CH3OH (40 мл) добавляли NaOCH3 (1,0 мл, 0,5 ммоль, 0,5 M в CH3OH). После перемешивания при к.т. в течение 24 ч, к реакционной смеси добавляли ионообменную смолу Amberlite IR 120 (H) (предварительно промытую CH3OH 3×30 мл). Спустя 15 мин, смолу отфильтровывали и промывали CH3OH (3×5 мл). Фильтрат концентрировали, остаток переносили в EtOAc (50 мл) и перемешивали в течение 2 ч. Твердое вещество фильтровали, промывали EtOAc (3×15 мл) и сушили с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C27H40FN3O15 665,24, обнаружено m/e: 666,35 [M+1]; Rt=2,03 мин.
Стадия H: 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозид
Смесь 2-азидоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозида (1,77 г, 2,66 ммоль) и Pd/C (0,133 ммоль) в воде (30 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при к.т. в течение 16 ч. Катализатор отфильтровывали и промывали H2O (3×10 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C20H36FNO15 549,21, обнаружено m/e: 550,29 [M+1]; Rt=0,86 мин. 1H-ЯМР (D2O) δ 5,16-5,14 (1H, м), 4,88-4,86 (1H, м), 4,80-4,76 (1H, м), 4,30-4,16 (1H, м), 4,06-4,03 (1H, м), 3,98-3,88 (4H, м), 3,86-3,72 (9H, м), 3,70-3,62 (5H, м), 2,94-2,88 (2H, м).
Стадия I: 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-2-дезокси-2-фтор-β-D-глюкопиранозил]окси}этил)ацетамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-29, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-4-O-бензил-2-дезокси-2-фтор-β-D-глюкопиранозидом. UPLC способ B: рассчитано для C44H71N5O29 1133,42, обнаружено m/e: 1134,34 [M+1]; Rt=2,17 мин.
Пример 33
Описан синтез олигосахаридного линкера, 2-{[2-({2-[(α-L-фукоопиранозил)окси]этил}амино)-2-оксоэтил][2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]амино}-N-[2-(β-D-глюкопиранозилокси)этил]ацетамида (ML-33), характеризующегося следующей структурой.
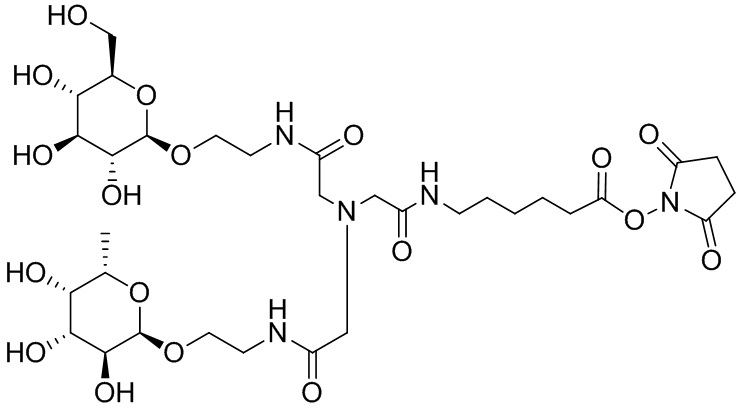 ML-33
ML-33
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 6-амино-N-(2-α-L-фукопиранозил)этил)гексанамид 2-аминоэтил-α-L-фукопиранозидом на стадии C и 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-глюкопиранозидом на стадии D, соответственно. UPLC способ B: m/e=796,38 [M+1]; Rt=1,87 мин.
Пример 34
Описан синтез олигосахаридного линкера, N,N-бис{2-[(α-L-фукопиранозил)окси]этил}-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексанамида (ML-34), характеризующегося следующей структурой.
 ML-34
ML-34
Стадия A: проп-2-ен-1-ил-2,3,4-три-O-бензоил-α-L-фукопиранозид
К перемешанному раствору 1,2,3,4-тетра-O-бензоил-L-фукопиранозида (70,34 г, 121 ммоль, Organic Letters 2007, 9, 1227-30) в CH2Cl2 (300 мл) при 0°C добавляли аллиловый спирт (12,36 мл, 182 ммоль), а затем по каплям в течение 1 ч добавляли диэтилэфират трифторида бора (44,9 мл, 363 ммоль), поддерживая внутреннюю температуру ниже 20°C. После перемешивания при к.т. в течение 16 ч, реакционную смесь охлаждали до 0°C, после чего к ней медленно добавляли нас. NaHCO3 (600 мл, 121 ммоль). После перемешивания в течение 16 ч, реакционную смесь экстрагировали CH2Cl2 (2×400 мл). Органическую фазу промывали водой (200 мл), нас. NaHCO3 (3×100 мл) и солевым раствором (200 мл). Органическую фазу разделяли, сушили над MgSO4 и фильтровали. Фильтрат концентрировали, остаток делили на пять равный порций, которые по отдельности очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-60% EtOAc в гексанах, с получением указанного в заголовке соединения. (α-изомер Rf=0,63 EtOAc/гексаны=30/70). 1H-ЯМР (CDCl3) δ 1,32 (3H, т, J=6,77), 2,09 (1H, с), 4,15-4,14 (1H, м), 4,33-4,31 (1H, м), 4,51-4,49 (1H, м), 5,22 (1H, д, J=10,52), 5,39-5,38 (2H, м), 5,73 (1H, дд, J=10,74, 3,67), 5,82 (1H, д, J=3,30), 5,92-5,91 (1H, м), 6,04 (1H, дд, J=10,75, 3,43), 7,44 (3H, дт, J=22,64, 7,61), 7,48-7,57 (5H, м), 7,65 (1H, д, J=7,49), 7,84 (2H, д, J=7,84), 8,04 (2H, д, J=7,84), 8,15 (2H, д, J=7,79).
Стадия B: 2-оксоэтил-2,3,4-три-O-бензоил-α-L-фукопиранозид
К раствору проп-2-ен-1-ил-2,3,4-три-O-бензоил-α-L-фукопиранозида (6,06 г, 11,73 ммоль) в ацетоне (94 мл) и воде (23,5 мл) добавляли 4-метилморфолин-4-оксид (2,75 г, 23,46 ммоль), а затем добавляли 2,5% OsO4 в воде (5,97 г, 0,587 ммоль). Смесь оставляли перемешиваться при к.т. в течение 16 ч. Затем, к полученной смеси добавляли раствор NaIO4 (5,40 г, 23,46 ммоль) в воде (100 мл). После перемешивания дополнительно в течение 6 ч, осадок фильтровали и промывали ацетоном (200 мл). Объем фильтрата сокращали приблизительно до 1/3 от начального объема, а затем экстрагировали EtOAc (200 мл). Органическую фазу разделяли, промывали нас. NaHCO3 (200 мл). Водную фазу экстрагировали EtOAc (3×100 мл). Органические фазы объединяли и промывали солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (220 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 1,33-1,29 (3H, м), 3,27 (1H, с), 3,41 (1H, с), 4,35-4,31 (1H, м), 5,51-5,45 (1H, м), 5,75-5,69 (1H, м), 5,81 (1H, дд, J=13,91, 3,57), 6,05-5,98 (1H, м), 7,42 (2H, д, J=7,76), 7,53 (5H, д, J=8,61), 7,67-7,63 (2H, м), 7,84-7,81 (2H, м), 8,01 (2H, т, J=8,82), 8,14-8,12 (2H, м), 9,77-9,77 (1H, м).
Стадия C: бензил{2-[(2,3,4-три-O-ацетил-α-L-фукопиранозил)окси]этил}карбамат
К перемешанному раствору 1,2,3,4-тетра-O-ацетил-L-фукопиранозы (200 г, 601,86 ммоль) в AcCN (100 мл) и бензил(2-гидроксиэтил)карбамата (140,96 г, 722,08 ммоль) при 0°C в течение 2 ч по каплям добавляли BF3∙Et2O (427,7 г, 3,01 моль). После перемешивания при к.т. в течение 16 ч, реакционную смесь охлаждали до 0°C, а затем добавляли Et3N (130 мл). Полученную смесь концентрировали, остаток растворяли в CH2Cl2 (2,0 л), а затем последовательно промывали нас. NaHCO3 (2×500 мл), водой (2×500 мл) и солевым раствором (500 мл). Органическую фазу разделяли, сушили над Na2SO4 и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле, элюируя EtOAc/петролейным эфиром (1/3), с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 7,33-7,37 (5H, м), 5,12-5,32 (5H, м), 4,99-5,04 (1H, м), 4,42-4,45 (1H, д), 3,87-3,94 (1H, м), 3,78-3,84 (1H, м), 3,66-3,70 (1H, м), 3,42-3,44 (2H, м), 2,19 (3H, с), 2,05-2,12 (6H, м), 1,25-1,30 (3H, д).
Стадия D: 2-аминоэтил-2,3,4-три-O-ацетил-α-L-фукопиранозид
К раствору бензил{2-[(2,3,4-три-O-ацетил-α-L-фукопиранозил)окси]этил}карбамата (1,0 г, 2,139 ммоль) в воде (10 мл) добавляли Pd/C (68 мг, 0,642 ммоль). Полученную суспензию дегазировали и перемешивали в атмосфере подаваемого из баллона H2 при к.т. Спустя 1 ч, реакционную смесь фильтровали через слой целита, и лиофилизировали фильтрат с получением указанного в заголовке соединения. UPLC способ B: m/e=334,1563 [M+1]; Rt=1,43 мин.
Стадия E: 2-(бензиламино)этил-2,3,4-три-O-ацетил-α-L-фукопиранозид
К раствору 2-аминоэтил-2,3,4-три-O-ацетил-α-L-фукопиранозида (8,56 г, 25,7 ммоль) в CH2Cl2 (100 мл) добавляли бензальдегид (2,197 мл, 21,67 ммоль), уксусную кислоту (372 мкл, 6,50 ммоль) и NaCNBH3 (3,40 г, 54,2 ммоль). После перемешивания при к.т. в течение 16 ч, реакционную смесь концентрировали, и распределяли остаток между EtOAc (50 мл) и нас. NaHCO3 (50 мл). Органическую фазу разделяли, промывали нас. NaHCO3 (2×100 мл), левым раствором (100 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (130 г), элюируя 0-100% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=424,2089 [M+1]; Rt =3,42 мин.
Стадия F: 2-(бензил{2-[(2,3,4-три-O-бензоил-α-L-фукопиранозил)окси]этил}амино)этил-2,3,4-три-O-ацетил-α-L-фукопиранозид
К раствору 2-(бензиламино)этил-2,3,4-три-O-ацетил-α-L-фукопиранозида (1,021 г, 2,411 ммоль) в CH2Cl2 (50 мл) добавляли 2-оксоэтил-2,3,4-три-O-бензоил-α-L-фукопиранозид (1,25 г, 2,411 ммоль), уксусную кислоту (41 мкл, 0,723 ммоль) и NaCNBH3 (227 мг, 3,62 ммоль). После перемешивания при к.т. в течение 16 ч, реакционную смесь концентрировали, и распределяли остаток между EtOAc (50 мл) и нас. NaHCO3 (50 мл). Органическую фазу разделяли, промывали насыщенным NaHCO3 (2×100 мл) и солевым раствором (100 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (120 г, элюируя 0-100 EtOAc в гексанах). Фракции, содержащие указанное в заголовке соединение, объединяли и концентрировали. Остаток дополнительно очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (130 г), элюируя 0-100% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: me/e=926,3234 [M+1]; Rt=1,947 мин. 1H-ЯМР (CDCl3) δ 1,12 (3H, д, J=6,54), 1,27 (3H, д, J=6,57), 2,00 (6H, д, J=5,40), 2,20 (3H, с), 2,78 (2H, кв, J=5,85), 2,85 (2H, т, J=5,72), 3,48-3,46 (1H, м), 3,77-3,59 (4H, м), 3,87-3,85 (1H, м), 4,09 (1H, д, J=6,63), 4,39 (1H, д, J=6,71), 5,02 (1H, д, J=3,71), 5,14 (1H, дд, J=10,82, 3,68), 5,30 (1H, д, J=3,36), 5,37-5,34 (2H, м), 5,65 (1H, дд, J=10,72, 3,66), 5,77 (1H, д, J=3,49), 5,98 (1H, дд, J=10,70, 3,47), 7,29 (6H, с), 7,36 (3H, т, J=7,74), 7,45 (1H, т, J=7,59), 7,52 (3H, т, J=7,73), 7,64 (1H, т, J=7,46), 7,81 (2H, дд, J=8,00, 1,41), 7,97 (2H, дд, J=8,07, 1,40), 8,14-8,12 (2H, м).
Стадия G: 2-(бензил{2-[(α-L-фукопиранозил)окси]этил}амино)этил-6-α-L-фукопиранозид
К раствору 2-(бензил{2-[(2,3,4-три-O-бензоил-α-L-фукопиранозил)окси]этил}амино)этил-2,3,4-три-O-ацетил-α-L-фукопиранозида (432,9 мг, 0,468 ммоль) в CH3OH (10 мл) добавляли NaOCH3 (0,087 мкл, 0,468 ммоль, 1,0 M). После перемешивания в течение 16 ч, реакционную смесь концентрировали с получением указанного в заголовке соединения. UPLC способ B: m/e=488,2324 [M+1]; Rt=2,106 мин.
Стадия H: 2-({2-[(α-L-фукопиранозил)окси]этил}амино)этил-α-L-фукопиранозид
К раствору 2-(бензил{2-[(α-L-фукопиранозил)окси]этил}амино)этил-6-α-L-фукопиранозида (220 мг, 0,451 ммоль) в воде (10 мл) добавляли Pd/C (14,41 мг, 0,135 ммоль). Смесь дегазировали и перемешивали в атмосфере подаваемого из баллона H2. Спустя 1 ч, реакционную смесь фильтровали через слой целита, и лиофилизировали фильтрат с получением указанного в заголовке соединения. UPLC способ: m/e=398,2161 [M+1]; Rt=1,119 мин. 1H-ЯМР (CD3OD) δ 1,24 (6H, д, J=6,58), 2,91-2,89 (4H, м), 3,56 (2H, ддд, J=10,66, 6,64, 4,66), 3,70-3,69 (2H, м), 3,80-3,75 (4H, м), 3,86 (2H, дт, J=10,61, 4,53), 3,98 (2H, кв, J=6,63), 4,80 (2H, д, J=3,45).
Стадия I: бензил-6-(бис{2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноат
К раствору 6-(бензилокси)-6-оксогексановой кислоты (40 мг, 0,169 ммоль), EDC (114 мг, 0,593 ммоль) и HOBt (2,59 мг, 0,017 ммоль) в DMF (5 мл) при к.т. добавляли 2-({2-[(α-L-фукопиранозил)окси]этил}амино)этил-α-L-фукопиранозид (190 мг, 0,478 ммоль). После перемешивания в течение 16 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (50 г), элюируя 5-40% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=616,2923 [M+1]; Rt=3,114 мин. 1H-ЯМР (CD3OD) δ 1,24 (6H, д, J=6,58), 1,72-1,64 (4H, м), 2,45 (2H, т, J=7,11), 2,53 (2H, т, J=7,32), 3,91-3,55 (17H, м), 4,78-4,75 (2H, м), 5,14 (2H, с), 7,38-7,37 (5H, м).
Стадия J: N,N-бис{2-[(α-L-фукопиранозил)окси]этил}-6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексанамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат бензил-6-(бис{2-[(α-L-фукопиранозил)окси]этил}амино)-6-оксогексаноатом на стадии C. UPLC способ B: m/e=623,2853 [M+1]; Rt=2,155 мин.
Пример 35
Описан синтез олигосахаридного линкера, 2-({2-[(α-L-фукоопиранозил)окси]этил}{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)этил-α-L-фукопиранозида (ML-35), характеризующегося следующей структурой.
 ML-35
ML-35
Стадия A: бензил-6-(бис{2-[(2,3,4-три-O-бензоил-α-L-фукопиранозил)окси]этил}амино)гексаноат
К раствору 2-оксоэтил-2,3,4-три-O-бензоил-α-L-фукопиранозида (1,25 г, 2,411 ммоль) в CH2Cl2 (50 мл) добавляли 6-(бензилокси)-6-оксогексан-1-аминия 4-метилбензолсульфонат, уксусную кислоту (17 мкл, 0,300 ммоль) и NaCNBH3 (189 мг, 3,00 ммоль). После перемешивания при к.т. в течение 16 ч, реакционную смесь концентрировали, и распределяли остаток между EtOAc (50 мл) и нас. NaHCO3 (50 мл). Органическую фазу разделяли, промывали нас. NaHCO3 (2×100 мл), солевым раствором (100 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (120г), элюируя 0-100% EtOAc в гексанах. Фракции, содержащие указанное в заголовке соединение, объединяли и концентрировали. Остаток дополнительно очищали методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (50 г), элюируя 0-100% AcCN в воде, с получением указанного в заголовке соединения. UPLC способ B: m/e=1226,4591 [M+1]; Rt=3,310 мин. 1H-ЯМР (CDCl3) δ 1,29 (5H, д, J=6,62), 2,36-2,31 (2H, м), 2,75 (3H, д, J=23,31), 3,53 (2H, д, J=9,26), 3,78-3,76 (1H, м), 4,45 (1H, д, J=6,66), 5,13 (2H, с), 5,35 (1H, д, J=3,64), 5,64 (2H, дд, J=10,69, 3,63), 5,79 (2H, д, J=3,48), 5,98 (1H, дд, J=10,71, 3,44), 7,26 (4H, т, J=7,64), 7,56-7,40 (14H, м), 7,64 (2H, т, J=7,72), 7,82-7,80 (5H, м), 7,99-7,97 (5H, м), 8,19-8,12 (5H, м).
Стадия B: метил-6-(бис{2-[(α-L-фукопиранозил)окси]этил}амино)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-34 на стадии G, заменяя 2-(бензил{2-[(2,3,4-три-O-бензоил-α-L-фукопиранозил)окси]этил}амино)этил-2,3,4-три-O-ацетил-α-L-фукопиранозид бензил-6-(бис{2-[(2,3,4-три-O-бензоил-α-L-фукопиранозил)окси]этил}амино)гексаноатом. UPLC способ B: m/e=526,2852 [M+1]; Rt=2,112 мин.
Стадия C: 6-(бис{2-[(α-L-фукопиранозил)окси]этил}амино)гексановая кислота
К раствору метил-6-(бис{2-[(α-L-фукопиранозил)окси]этил}амино)гексаноат (45 мг, 0,086 ммоль) в воде (10 мл) добавляли NaOH (0,086 мкл, 0,086 ммоль, 1,0 M). После перемешивания в течение 16 часов, реакционную смесь нейтрализовывали добавлением 0,01 M HCl, и лиофилизировали полученный раствор с получением указанного в заголовке соединения. UPLC способ B: m/e=512,2866 [M+1]; Rt=1,709 мин.
Стадия D: 2-({2-[(α-L-фукопиранозил)окси]этил}{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)этил-α-L-фукопиранозид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1 на стадии D, заменяя 6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексановую кислоту 6-(бис{2-[(α-L-фукопиранозил)окси]этил}амино)гексановой кислотой. UPLC способ B: m/e=609,2808 [M+1]; Rt=2,088 мин.
Пример 36
Описан синтез олигосахарида, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозида (ML-36), характеризующегося следующей структурой.
 ML-36
ML-36
Стадия A: 3-(2,3,4-три-O-ацетил-α-L-фукопиранозил)-1-пропен
К раствору 1,2,3,4-тетра-O-ацетил-α-L-фукопиранозы (12 г, 36,1 ммоль) и аллилтриметилсилана (11,48 мл, 72,2 ммоль) в AcCN (60 мл) при 0°C добавляли TMS-OTf (3,52 мл, 19,50 ммоль). Реакционную смесь перемешивали при 0°C в течение 18 ч, а затем при к.т. в течение 6 ч. Полученный красный раствор разбавляли CH2Cl2 (250 мл), и осторожно добавляли нас. NaHCO3 (150 мл). Водный слой разделяли и экстрагировали CH2Cl2 (2×50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (220 г), элюируя 15% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 1,16 (д, J=6,4, 3H), 2,04 (с, 3H), 2,08 (с, 3H), 2,18 (с, 3H), 2,34 (м, 1H), 2,57 (м, 1H), 4,00 (м, 1H), 4,29 (дт, J=10,4, 7,3, 1H), 5,13 (м, 2H), 5,23 (дд, J=10,0, 3,4, 1H), 5,30 (дд, J=3,4, 1,9, 1H), 5,35 (дд, J=10,0, 5,6, 1H), 5,77 (м, 1H).
Стадия B: 3-(α-L-фукопиранозил)-1-пропен
К перемешанному раствору 3-(2,3,4-три-O-ацетил-α-L-фукопиранозил)-1-пропена (10,65 г, 33,9 ммоль) в CH3OH (50 мл) добавляли NaOCH3 (183 мг, 3,4 ммоль). После перемешивания при к.т. в течение 2 ч, реакционную смесь нейтрализовывали добавлением смолы Amberlite IR120 (предварительно промытой метанолом 3×25 мл). Смолу отфильтровывали, и концентрировали фильтрат с получением белого твердого вещества, которое перекристаллизовывали из EtOAc (~200 мл) с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 1,22 (д, J=6,5, 3H), 2,41 (м, 1H), 2,47 (м, 1H), 3,73 (м, 2H), 3,85 (кв.д, J=6,5, 2,0, 1H), 3,90 (дд, J=8,9, 5,5, 1H), 3,99 (м, 1H), 5,07 (м, 1H), 5,15 (д.кв, J=17,2, 1,7, 1H), 5,85 (м, 1H).
Стадия C: 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)-1-пропен
К перемешанной суспензии NaH (3,91 г, 60% дисперсия в масле, 98 ммоль) в DMF (120 мл) при к.т. порциями добавляли 3-(α-L-фукопиранозил)-1-пропен (4,6 г, 24,44 ммоль). Спустя 2 ч, к полученной смеси добавляли тетрабутиламмония йодид (451 мг, 1,22 ммоль), а затем медленно добавляли бензилбромид (13,1 мл, 110 ммоль). После перемешивания при к.т. в течение 16 ч, реакционную смесь концентрировали, и распределяли остаток между водой (300 мл) и Et2O (150 мл). Водный слой экстрагировали Et2O (3×150 мл). Объединенные органические слои промывали солевым раствором (100 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (220 г), элюируя 0-40% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 1,34 (д, J=6,6, 3H), 2,33 (м, 1H), 2,42 (м, 1H), 3,82 (м, 3H), 3,99 (м, 1H), 4,12 (м, 1H), 4,58 (д, J=11,8, 1H), 4,64 (д, J=11,8, 2H), 4,69 (д, J=12,0, 1H), 4,76 (дд, J=12,0, 8,9, 2H), 5,05, 5,07 и 5,11 (м, 2H), 5,80 (м, 1H), 7,30-7,40 (м, 15H).
Стадия D: 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропанол
К раствору 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)-1-пропена (10,4 г, 22,68 ммоль) в THF (100 мл) при 0°C медленно добавляли 9-BBN (58,5 мл,, 29,3 ммоль, 0,5 M в THF). Смесь оставляли нагреваться до к.т., а затем нагревали с обратным холодильником в течение 3 ч. Реакционную смесь затем охлаждали до к.т., по каплям добавляли этанол (4,4 мл, 75 ммоль), а затем NaOH (11,51 мл, 46 ммоль, 4,0 M в воде). Полученную смесь охлаждали до 0°C, и добавляли 35% пероксид водорода (10 мл, 115 ммоль). Полученную суспензию перемешивали при к.т. в течение ночи. Реакционную смесь разбавляли солевым раствором (125 мл) и эфиром (200 мл). Органический слой промывали солевым раствором (2×125 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 1,33 (д, J=6,6, 3H), 1,67 (м, 3H), 1,70 (м, 1H), 3,65 (м, 2H), 3,80 (м, 3H), 3,98 (м, 1H), 4,02 (м, 1H), 4,56 (д, J=11,8, 1H), 4,63 (т, J=12,2, 2H), 4,69 (д, J=12,0, 1H), 4,78 (дд, J=12,1, 2,1, 2H), 7,27-7,40 (м, 15H).
Стадия E: 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропаналь
К раствору 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропанола (8,4 г, 17,62 ммоль) в CH2Cl2 (100 мл) при 0°C добавляли перйодинан Десс-Мартина (11,21 г, 26,4 ммоль). Полученную смесь оставляли перемешиваться при 0°C в течение 1 ч, а затем при к.т. в течение 2 ч. Методом TLC обнаруживали присутствие некоторого количества исходного спирта, поэтому дополнительно добавляли перйодинан Десс-Мартина (5 г, 11,8 ммоль), и дополнительно перемешивали смесь при к.т. в течение 2 ч. Полученную смесь промывали нас. NaHCO3 (3×150 мл), солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (220 г), элюируя 0-80% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 1,26 (д, J=6,6, 3H), 1,82 (м, 1H), 2,06 (м, 1H), 2,40-2,58 (м, 2H), 3,80 (м, 2H), 3,84 (м, 1H), 3,90 (м, 1H), 3,99 (дт, J=10,9, 3,8, 1H), 4,55 (д, J=11,8, 1H), 4,65 (д, J=11,8, 1H), 4,70 (т, J=12,0, 2H), 4,79 (дд, J=12,0, 9,2, 2H), 7,28-7,40 (м, 15H).
Стадия F: 2-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил]амино}этил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид
К смеси 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропаналя (800 мг, 1,69 ммоль) и 2-аминоэтил-3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозида (987 мг, 2,53 ммоль) в CH2Cl2 (15 мл) добавляли уксусную кислоту (29 мкл, 0,506 ммоль) и триацетоксиборгидрид натрия (893 мг, 4,21 ммоль). После перемешивания при к.т. в течение ночи, реакционную смесь концентрировали, остаток переносили в EtOAc (70 мл), промывали нас. NaHCO3 (2×100 мл), солевым раствором (30 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток переносили в CH3OH (8 мл), и добавляли NaOCH3 (27 мг, 0,506 ммоль). После перемешивания при к.т. в течение 2 ч, полученную смесь концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (120 г), элюируя 5-100% AcCN в воде, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 1,30 (д, J=6,6, 3H), 1,50 (м, 1H), 1,60 (м, 1H), 1,68 (м, 1H), 2,02 (с, 3H), 2,64 (м, 2H), 2,81 (м, 2H), 3,39 (м, 1H), 3,57 (м, 2H), 3,69 (м, 1H), 3,78-3,85 (м, 4H), 3,92 (м, 2H), 4,00 (м, 2H), 4,45 (д, J=7,7, 1H), 4,52 (д, J=11,9, 1H), 4,62 (д, J=11,8, 1H), 4,68 (д, J=12,1, 1H), 4,79 (д, J=12,0, 2H), 7,28-7,38 (м, 15H), 7,65 (с, 1H); [M+H/e]+=723,3925.
Стадия G: бензил-6-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил](2-{[2-(ацетиламино)-2-дезокси-β-D-глюкопиранозил]окси}этил)амино}гексаноат
К смеси бензил-6-оксогексаноата (170 мг, 0,77 ммоль) и 2-{[3-(2,3,4-три-O-бензилокси-α-L-фукопиранозил)пропил]амино}этил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозида (558 мг, 0,77 ммоль) в CH2Cl2 (8 мл) добавляли уксусную кислоту (13 мкл, 0,232 ммоль) и триацетоксиборгидрид натрия (327 мг, 1,54 ммоль), и перемешивали полученную смесь при комнатной температуре в течение 2 часов. Дополнительно добавляли бензил-6-оксогексаноат (170 мг, 0,77 ммоль), и продолжали перемешивание в течение ночи. Смесь упаривали, и распределяли остаток между EtOAc (40 мл) и нас. NaHCO3 (60 мл); водный слой промывали солевым раствором (30 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (40 г), элюируя 5-20% MeOH в CH2Cl2, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц): 1,27-1,38 (м, 5H), 1,48 (м, 1H), 1,62-1,75 (м, 4H), 1,80 (м, 1H), 2,09 (с, 3H); 2,37 (т, J=7,3, 2H), 2,90-3,02 (м, 4H), 3,04 (м, 1H), 3,13 (м, 1H), 3,42 (м, 1H), 3,59 (т, J=8,9, 1H), 3,65-3,75 (м, 3H), 3,78 (д, J=4,9, 2H), 3,86 (м, 1H), 3,87-4,05 (м, 4H), 4,15 (д, J=11,2, 1H), 4,49 (д, J=11,9, 1H), 4,62 (д, J=11,8, 1H), 4,66 (д, J=11,7, 1H), 4,69 (м, 2H), 4,74 (д, J=11,8, 1H), 4,78 (д, J=12,0, 1H), 5,12 (с, 2H), 7,25-7,38 (м, 15H), 8,36 (с, 1H); UPLC-MS [M+H/e]+=927,5049.
Стадия H: 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным в примере 1 для ML-1, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино-6-оксогексаноат бензил-6-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил](2-{[2-(ацетиламино)-2-дезокси-β-D-глюкопиранозил]окси}этил)амино}гексаноатом на стадии C. UPLC способ B: m/e=664,3474 [M+1]; Rt=1,08 мин.
Пример 37
Описан синтез олигосахаридного линкера, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-β-D-глюкопиранозида (ML-37), характеризующегося следующей структурой.
 ML-37
ML-37
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-36, заменяя 2-аминоэтил-3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид 2-аминоэтил-2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозидом на стадии F. UPLC способ B: m/e=623,3277 [M+1]; Rt=1,11 мин.
Пример 38
Описан синтез олигосахаридного линкера, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-α-D-глюкопиранозида (ML-38), характеризующегося следующей структурой.
 ML-38
ML-38
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-36, заменяя 2-аминоэтил-3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид 2-аминоэтил-2,3,4,6-тетра-O-ацетил-α-D-глюкопиранозидом на стадии F. UPLC способ B: m/e=623,3336 [M+1]; Rt=1,11 мин.
Пример 39
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-{[3-(α-L-фукопиранозил)пропил][2-(α-D-глюкопиранозил)пропил]амино}гексаноата (ML-39), характеризующегося следующей структурой.
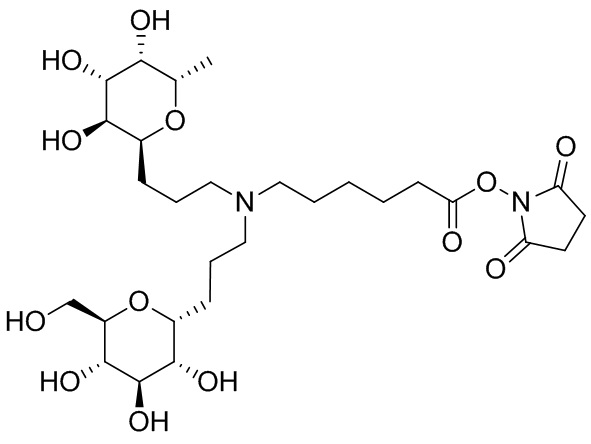 ML-39
ML-39
Стадия A: метил-2,3,4,6-тетра-O-бензил-α-D-глюкопиранозид
К суспензии NaH (5,19 г 60% дисперсии в масле, 130 ммоль) в DMF (150 мл) порциями добавляли метил-α-D-глюкопиранозид (4,2 г, 21,6 ммоль). Полученную смесь перемешивали при к.т. в течение 2 ч, добавляли к ней тетрабутиламмония бромид (800 мг, 2,16 ммоль), а затем по каплям добавляли бензилбромид (11,58 мл, 97 ммоль). После перемешивания при к.т. в течение ночи, смесь концентрировали, остаток суспендировали в воде и экстрагировали эфиром (3×150 мл). Объединенные эфирные слои промывали солевым раствором (200 мл), сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-30% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3, 400 МГц) δ 3,44 (с, 3H), 3,62 (дд, J=9,6, 3,5, 1H), 3,66-3,72 (м, 2H), 3,75-3,82 (м, 2H), 4,04 (т, J=9,3, 1H), 4,51-4,55 (м, 2H), 4,66 (д, J=12,1, 1H), 4,69 (д, J=3,5, 1H), 4,72 (д, J=12,1, 1H), 4,83-4,90 (м, 3H), 5,04 (д, J=11,0, 1H), 7,19 (м, 2H), 7,30-7,43 (м, 18H).
Стадия B: 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)-1-пропен
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-36 на стадии A, заменяя 1,2,3,4-тетра-O-ацетил-α-L-фукопиранозу метил-2,3,4,6-тетра-O-бензил-α-D-глюкопиранозидом. 1H-ЯМР (CDCl3) δ 2,48-2,60 (м, 2H), 3,64-3,70 (м, 3H), 3,76 (дд, J=10,5, 3,2, 1H), 3,80-3,88 (м, 2H), 4,18 (м, 1H), 4,52 (д, J=10,5, 2H), 4,68 (д, J=13,7, 2H), 4,74 (д, J=11,6, 1H), 4,86 (дд, J=10,6, 3,3, 2H), 4,98 (д, J=11,0, 1H), 5,11-5,18 (м, 2H), 5,84-5,90 (м, 1H), 7,18 (м, 2H), 7,29-7,41 (м, 18H).
Стадия C: 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропанол
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-36 на стадии D, заменяя 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)-1-пропен 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)-1-пропеном. 1H-ЯМР (CDCl3) δ 1,70 (м, 2H), 1,85 (м, 2H), 3,61 (м, 1H), 3,65 -3,76 (м, 2H), 3,76-3,86 (м, 2H), 4,91 (м, 1H), 4,52 (д, J=10,8, 1H), 4,55 (д, J=12,3, 1H), 4,65 (д, J=12,1, 1H), 4,67 (д, J=11,8, 1H), 4,75 (д, J=11,7, 1H), 4,86 (д, J=11,3, 2H), 4,98 (д, J=11,0, 1H), 7,18 (м, 2H), 7,29-7,40 (м, 18H).
Стадия D: 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропилметансульфонат
К раствору 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропанола (3,35 г, 5,75 ммоль) в CH2Cl2 (30 мл) при 0°C добавляли DIPEA (1,25 мл, 7,19 ммоль), а затем по каплям добавляли метансульфонилхлорид (538 мкл, 6,9 ммоль). После перемешивания при 0°C в течение 1 ч, реакционную смесь вливали в воду (50 мл). Органический слой разделяли и промывали нас. NaHCO3 (50 мл), солевым раствором (30 мл), сушили над MgSO4, фильтровали и концентрировали с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 1,76-1,90 (м, 3H), 1,90-1,99 (м, 2H), 3,00 (с, 3H), 3,58-3,66 (м, 2H), 3,68 -3,74 (м, 2H), 3,77-3,85 (м, 2H), 4,06 (м, 1H), 4,52 (д, J=10,7, 1H), 4,54 (д, J=12,1, 1H), 4,65 (д, J=12,1, 1H), 4,66 (д, J=11,6, 1H), 4,76 (д, J=11,6, 1H), 4,85 (д, J=10,9, 1H), 4,98 (д, J=10,9, 1H), 7,18 (м, 2H), 7,30-7,40 (м, 18H).
Стадия E: 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропилазид
К раствору 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропилметансульфоната (3,78 г, 5,72 ммоль) в AcCN (50 мл) добавляли тетрабутиламмония азид (1,66 г, 5,83 ммоль). Полученную смесь оставляли нагреваться с обратным холодильником в течение ночи. После охлаждения до к.т., реакционную смесь концентрировали. Остаток растворяли в эфире (50 мл), промывали водой (2×50 мл), солевым раствором (25 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом флэш-хроматографии на силикагеле (120 г), элюируя 0-30% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 1,58-1,68 (м, 2H), 1,74-1,86 (м, 2H), 3,32-3,41 (м, 2H), 3,58 -3,76 (м, 4H), 3,76-3,85 (м, 2H), 4,40 (м, 1H), 4,52 (т, J=10,4, 2H), 4,65 (дд, J=11,7, 2,5, 2H), 4,75 (д, J=11,7, 1H), 4,86 (м, 2H), 4,97 (д, J=10,8, 1H), 7,16 (м, 2H), 7,28-7,40 (м, 18H).
Стадия F: 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропиламин
К продутому азотом раствору 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропилазида (3 г, 4,94 ммоль) в CH3OH (100 мл) добавляли 10% Pd/C (525 мг). Полученную смесь оставляли перемешиваться в атмосфере подаваемого из баллона H2 в течение ночи. Реакционную смесь фильтровали через слой целита, и концентрировали фильтрат с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 1,48 (м, 1H), 1,59 (м, 1H), 2,23 (м, 1H), 2,30 (м, 2H), 3,66-3,76 (м, 5H), 4,00 (м, 1H), 4,09 (м, 1H), 4,38 (д, J=10,0, 1H), 4,50 (д, J=12,1, 1H), 4,61 (д, J=11,7, 1H), 4,68 (д, J=11,8, 1H), 4,70 (д, J=12,0, 1H), 4,79 (д, J=10,0, 1H), 4,86 (д, J=11,2, 1H), 5,02 (д, J=11,2, 1H), 7,00 (м, 2H), 7,25-7,40 (м, 18H), 8,06 (с, 2H).
Стадия G: 2,5-диоксопирролидин-1-ил-6-{[3-(α-L-фукопиранозил)пропил][2-(α-D-глюкопиранозил)пропил]амино}гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-36, заменяя 2-аминоэтил-3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропиламином на стадии F. UPLC способ B: m/e=621,3424 [M+1]; Rt=1,08 мин.
Пример 40
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-{[3-(α-L-фукопиранозил)пропил][2-(β-D-глюкопиранозил)пропил]амино}гексаноата (ML-40), характеризующегося следующей структурой.
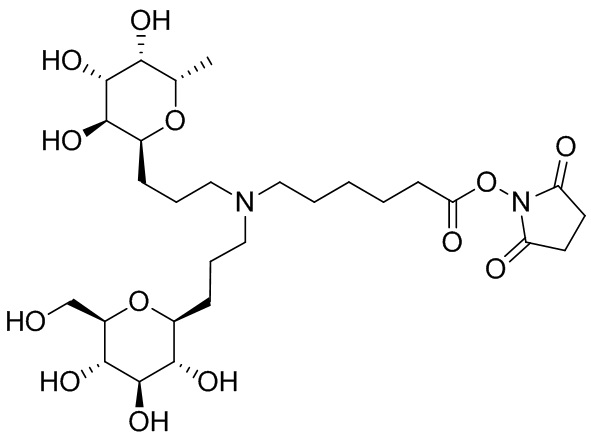 ML-40
ML-40
Стадия A: 2,3,4,6-тетра-O-ацетил-α-D-глюкопиранозилбромид
К пентаацетату β-D-глюкозы (5 г, 12,81 ммоль) при к.т. добавляли 33% HBr в уксусной кислоте (30 мл, 192 ммоль). После перемешивания в течение 40 мин, смесь разбавляли CH2Cl2 (150 мл) и промывали ледяной водой до получения смывов с нейтральным pH. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 2,06 (с, 3H), 2,08 (с, 3H), 2,12 (с, 3H), 2,13 (с, 3H), 4,15 (д, J=11,1, 1H), 4,31-4,37 (м, 2H), 4,86 (дд, J=9,9, 4,0, 1H), 5,19 (т, J=9,8, 1H), 5,58 (т, J=9,8, 1H), 6,63 (д, J=4,0, 1H).
Стадия B: 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозил)-1-пропен
К раствору аллилмагнийбромида (100 мл, 100 ммоль, 1,0 M в эфире,) при 0°C по каплям в течение 1 ч добавляли 2,3,4,6-тетра-O-ацетил-α-D-глюкопиранозилбромид (4,45 г, 10,82 ммоль) в эфире (60 мл). После завершения добавления, смесь оставляли нагреваться и перемешивали при к.т. в течение ночи. К полученной смеси осторожно добавляли воду (200 мл), а затем добавляли уксусную кислоту для растворения солей магния. Органический слой разделяли и концентрировали. Остаток обрабатывали уксусным ангидридом (70 мл, 740 ммоль) и пиридином (100 мл). После перемешивания при к.т. в течение ночи, смесь концентрировали, остаток переносили в EtOAc (200 мл) и промывали нас. NaHCO3 (5×300 мл), сушили над MgSO4, фильтровали и упаривали. Остаток очищали методом флэш-хроматографии на силикагеле (120 г), элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке соединения. 1H-ЯМР (CDCl3) δ 2,00 (с, 3H), 2,03 (с, 3H), 2,04 (с, 3H), 2,09 (с, 3H), 2,26-2,37 (м, 2H), 3,51 (м, 1H), 3,65 (м, 1H), 4,10 (дд, J=12,2, 2,2, 1H), 4,24 (дд, J=12,2, 5,0, 1H), 4,93 (т, J=9,4, 1H), 5,07 (м, 2H), 5,09 (с, 1H), 5,17 (т, J=9,4, 1H), 5,83 (м, 1H).
Стадия C: 3-(β-D-глюкопиранозил)-1-пропен
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозил)-1-пропена (4,15 г, 11,14 ммоль) в CH3OH (50 мл) добавляли NaOCH3 (0,56 мл, 2,2 ммоль, 4,0 M в CH3OH). После перемешивания при к.т. в течение 2 ч, реакционную смесь нейтрализовывали с использованием Dowex 50W (кислая форма). Смолу отфильтровывали, и концентрировали фильтрат с получением указанного в заголовке соединения. 1H-ЯМР (DMSO-d6) δ 2,09 (м, 1H), 2,49 (м, 1H), 2,88 (т, J=8,9, 1H), 2,98-3,07 (м, 3H), 3,11 (м, 1H), 3,39 (дд, J=11,4, 4,7, 1H), 3,60 (д, J=11,6, 1H), 4,99 (дд, J=10,3, 0,9, 1H), 5,06 (д, J=17,2, 1H), 5,90 (м, 1H).
Стадия D: 3-(2,3,4,6-тетра-O-бензил-β-D-глюкопиранозил)-1-пропен
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-36 на стадии C, заменяя 3-(α-L-фукопиранозил)-1-пропен 3-(β-D-глюкопиранозил)-1-пропеном. 1H-ЯМР (CDCl3) δ 2,39 (м, 1H), 2,65 (м, 1H), 3,41 (м, 2H), 3,49 (м, 1H), 3,68 (т, J=9,5, 1H), 3,72-3,82 (м, 3H), 4,72 (дд, J=10,8, 2,1, 1H), 4,89 (д, J=10,7, 1H), 4,94-500 (м, 3H), 5,16 (м, 2H), 6,03 (м, 1H), 7,25 (м, 2H), 7,32-7,44 (м, 18H).
Стадия E: 3-(2,3,4,6-тетра-O-бензил-β-D-глюкопиранозил)-1-пропанол
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-36 на стадии D, заменяя 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)-1-пропен 3-(2,3,4,6-тетра-O-бензил-β-D-глюкопиранозил)-1-пропеном. 1H-ЯМР (CDCl3) δ 1,60 (м, 1H), 1,76 (м, 2H), 2,04 (м, 1H), 2,36 (т, J=5,7, 1H), 3,35 (м, 2H), 3,49 (м, 1H), 3,62-3,72 (м, 4H), 3,72-3,77 (м, 2H), 4,58 (д, J=12,2, 1H), 4,60 (д, J=10,7, 1H), 4,65 (д, J=12,2, 1H), 4,70 (д, J=10,8, 1H), 4,86 (д, J=10,8, 1H), 4,95 (м, 3H), 7,21 (м, 2H), 7,31-7,41 (м, 18H).
Стадия F: 2,5-диоксопирролидин-1-ил-6-{[3-(α-L-фукопиранозил)пропил][2-(β-D-глюкопиранозил)пропил]амино}гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-39, заменяя 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропанол 3-(2,3,4,6-тетра-O-бензил-β-D-глюкопиранозил)-1-пропанолом на стадии D. UPLC способ B: m/e=621,3412 [M+1]; Rt=1,08 мин.
Пример 41
Описан синтез олигосахаридного линкера, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-D-маннопиранозил)пропил]амино)этил-α-L-фукопиранозида (ML-41), характеризующегося следующей структурой.
 ML-41
ML-41
Стадия A: 3-(2,3,4,6-тетра-O-бензил-α-D-маннопиранозил)-1-пропен
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-39 на стадии B, заменяя метил-2,3,4,6-тетра-O-бензил-α-D-глюкопиранозид метил-2,3,4,6-тетра-O-бензил-α-D-маннопиранозидом, в виде смеси α- и β-аномеров. Эти аномеры разделяли методом хиральной SFC (колонка: AD-H (50×250 см), элюируя 30% IPA (0,1% DEA)/CO2, 100 бар, 200 мл/мин, 220 нм; вводимый объем: 1,0 мл в концентрации 162 мг/мл в IPA/CH2Cl2=4/1 (об.)) с получением α-аномера в качестве основного продука. 1H-ЯМР (CDCl3) δ 2,38 (м, 2H), 3,68 (дд, J=4,6, 3,2, 1H), 3,76 (дд, J=10,4, 3,7, 1H), 3,83 (м, 2H), 3,90 (м, 2H), 4,10 (м, 1H), 4,55-4,62 (м, 4H), 4,62-4,65 (м, 3H), 4,75 (д, J=11,3, 1H), 5,06 (д, J=4,6, 1H), 5,08 (с, 1H), 5,80 (м, 1H), 7,25 (м, 2H), 7,30-7,42 (м, 18H).
Стадия B: 3-(2,3,4,6-тетра-O-бензил-α-D-маннопиранозил)-1-пропанол
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-39 на стадии C, заменяя 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)-1-пропен 3-(2,3,4,6-тетра-O-бензил-α-D-маннопиранозил)-1-пропеном. 1H-ЯМР (CDCl3) δ 1,85-2,00 (м, 2H), 2,53 (м, 1H), 2,60 (м, 1H), 3,62 (дд, J=6,0, 2,4, 1H), 3,73 (дд, J=10,2, 4,2, 1H), 3,78-3,87 (м, 3H), 3,90 (м, 1H), 3,98 (м, 1H), 4,54-4,62 (м, 7H), 4,67 (д, J=11,5, 1H), 7,25 (м, 2H), 7,28-7,40 (м, 18H), 9,79 (с, 1H).
Стадия C: 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-D-маннопиранозил)пропил]амино)этил-α-L-фукопиранозид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-36, заменяя 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропанол 3-(2,3,4,6-тетра-O-бензил-α-D-маннопиранозил)-1-пропанолом на стадии E и 2-аминоэтил-(3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид) 2-аминоэтил-(2,3,4-три-O-ацетил-α-L-фукопиранозидом) на стадии F. UPLC способ B: m/e=623,3235 [M+1]; Rt=1,13 мин.
Пример 42
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-{[3-(α-L-фукопиранозил)пропил][2-(α-D-маннопиранозил)пропил]амино}гексаноата (ML-42), характеризующегося следующей структурой.
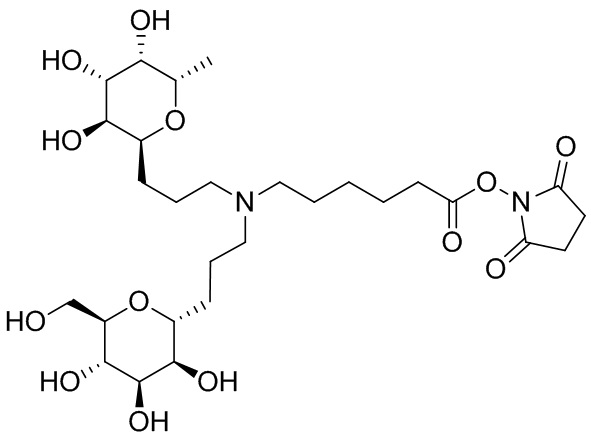 ML-42
ML-42
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-39, заменяя 3-(2,3,4,6-тетра-O-бензил-α-D-глюкопиранозил)пропанол 3-(2,3,4,6-тетра-O-бензил-α-D-маннопиранозил)-1-пропанолом на стадии D. UPLC способ B: m/e=621,3358 [M+1]; Rt=1,11 мин.
Пример 43
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-3-({6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]-гексил}амино)-N-[(9H-флуорен-9-илметокси)карбонил]-D-аланината (ML-43), характеризующегося следующей структурой.
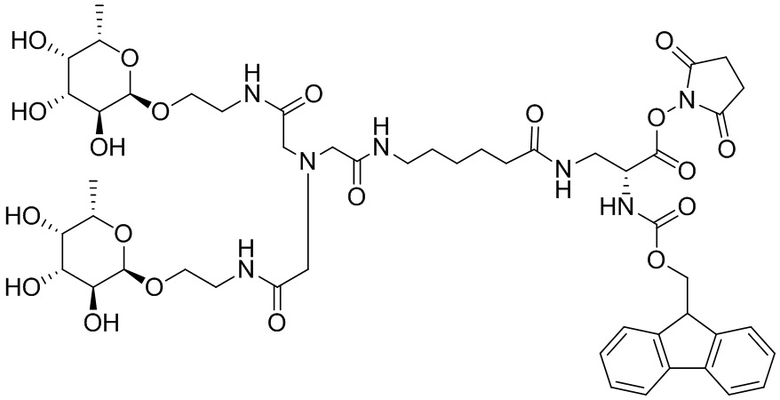 ML-43
ML-43
Стадия A: пентафторфенил-6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексаноат
К перемешанному раствору 6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексановой кислоты (1,0 г, 1,465 ммоль) в DMF (7,7 мл) при 0°C добавляли PFTU (627 мг, 1,465 ммоль) и, спустя 5 мин, DIPEA (256 мкл, 1,465 ммоль). Смесь оставляли постепенно нагреваться до комнатной температуры. После перемешивания в течение 16 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии на силикагеле (40 г), элюируя 300 мл EtOAc для отмывки от неполярных примесей, а затем а затем смесью растворителей (EtOAc/H2O/MeOH/AcCN=6/1/1/1 (об.)) с получением указанного в заголовке продукта. LC-MS способ A: m/e=849,50 [M+1]; Rt=1,94 мин.
Стадия B: гидрохлорид 3-амино-N-[(9H-флуорен-9-илметокси)карбонил]-L-аланина
К перемешанному раствору 3-[(трет-бутоксикарбонил)амино]-N-[(9H-флуорен-9-илметокси)карбонил]-D-аланина (1,0 г, 2,35 ммоль) в CH2Cl2 (11,72 мл) добавляли HCl (4,0 M в диоксане, 11,72 мл, 46,9 ммоль). После перемешивания в течение 16 часов, реакционную смесь концентрировали с получением указанного в заголовке продукта, который использовали без дополнительной очистки. LC-MS способ A: m/e=327,19 [M+1]; Rt=1,73 мин.
Стадия C: 3-({6-[({бис[2-оксо-2-({2-[(α-L-фукопиранозил)окси]этил}амино)этил]амино}ацетил)амино]гексаноил}амино)-N-[(9H-флуорен-9-илметокси)карбонил]-L-аланин
К перемешанному раствору пентафторфенил-6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексаноата (270 мг, 0,318 ммоль) в DMF при 0°C добавляли гидрохлорид 3-амино-N-[(9H-флуорен-9-илметокси)карбонил]-L-аланина (303 мг, 0,306 ммоль) и, спустя 5 мин, DIPEA (111 мкл, 0,636 ммоль). После перемешивания при 0°C в течение 2 ч, реакционную смесь концентрировали, и очищали остаток методом флэш-хроматографии на силикагеле (22 г), элюируя сначала 100 мл EtOAc, а затем 0-20% растворителя B в растворителе A (растворитель A: EtOAc/MeOH/AcCN/H2O=6/1/1/1 (об.); растворитель B: EtOAc/MeOH/AcCN/H2O=2/1/1/1 (об.)) с получением указанного в заголовке соединения. LC-MS способ A: m/e=991,66 [M+1]; Rt=1,84 мин.
Стадия D: 2,5-диоксопирролидин-1-ил-3-({6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексил}амино)-N-[(9H-флуорен-9-илметокси)карбонил]-D-аланинат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя 6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексановую кислоту 3-({6-[({бис[2-оксо-2-({2-[(α-L-фукопиранозил)окси]этил}амино)этил]-амино}ацетил)амино]гексаноил}амино)-N-[(9H-флуорен-9-илметокси)карбонил]-L-аланином на стадии D. LC-MS способ A: m/e=1088,9 [M+1]; Rt=1,96 мин.
Пример 44
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-3-({6-[({бис[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}ацетил)амино]гексил}амино)-N-[(9H-флуорен-9-илметокси)карбонил]-L-аланината (ML-44), характеризующегося следующей структурой.
 ML-44
ML-44
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-43 заменяя 3-[(трет-бутоксикарбонил)амино]-N-[(9H-флуорен-9-илметокси)карбонил]-D-аланин 3-[(трет-бутоксикарбонил)амино]-N-[(9H-флуорен-9-илметокси)карбонил]-L-аланином на стадии B. LC-MS способ A: m/e=1088,9 [M+1]; Rt=1,96 мин.
Пример 45
Описан синтез олигосахаридного линкера, 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис(N-{[1-(α-D-маннопиранозил)-1H-1,2,3-триазол-4-ил]метил}ацетамида) (ML-45), характеризующегося следующей структурой.
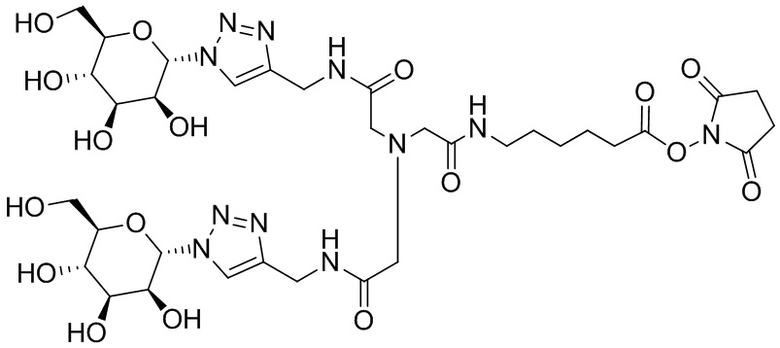 ML-45
ML-45
Стадия A: бензил-6-[({бис[2-оксо-2-(проп-2-ин-1-иламино)этил]амино}ацетил)амино]гексаноат
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-1 на стадии B, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид пропаргиламином. 1H-ЯМР (CDCl3, 400 МГц) δ 7,32 (м, 5H), 5,08 (с, 2H), 4,014 (с, 4H), 3,298 (м, 4H), 3,23 (м, 2H), 3,21 (м, 2H), 2,32 (м, 2H), 2,22 (с, 2H), 1,63 (м, 2H), 1,51 (м, 2H), 1,33 (м, 2H).
Стадия B: бензил-6-[({бис[2-оксо-2-({[1-(α-D-маннопиранозил)-1H-1,2,3-триазол-4-ил]метил}амино)этил]амино}ацетил)амино]гексаноат
К перемешанному раствору бензил-6-[({бис[2-оксо-2-(проп-2-ин-1-иламино)этил]амино}ацетил)амино]гексаноата (546 мг, 1,165 ммоль) и α-D-маннопиранозилазида (598 мг, 2,91 ммоль) в DMF (5,8 мл) добавляли DIPEA (1,0 мл, 5,83 ммоль) и йодид Cu(I) (222 мг, 1,165 ммоль). Реакционную смесь оставляли перемешиваться при 60°C в течение 30 мин до растворения всего CuI, а затем перемешивали при к.т. в течение 1 ч. Реакционную смесь разбавляли 10 объемами CH3OH. Выпавшие в осадок неорганические вещества отфильтровывали. Фильтрат концентрировали, и очищали остаток методом флэш-хроматографии на силикагеле (40 г), элюируя 0-60% растворителя B в растворителе A (растворитель A: EtOAc/MeOH/AcCN/H2O=6/1/1/1 (об.); растворитель B: EtOAc/MeOH/AcCN/H2O=2/1/1/1 (об.)), с получением указанного в заголовке соединения. LC-MS способ A: m/e=879,31 [M+1]; Rt=0,98 мин.
Стадия C: 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис(N-{[1-(α-D-маннопиранозил)-1H-1,2,3-триазол-4-ил]метил}ацетамид)
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат бензил-6-[({бис[2-оксо-2-({[1-(α-D-маннопиранозил)-1H-1,2,3-триазол-4-ил]метил}амино)этил]амино}ацетил)амино]гексаноатом на стадии C. UPLC способ A: m/e=886,2 [M+1]; Rt=2,02 мин.
Пример 46
Описан синтез олигосахаридного линкера, 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис(N-{2-[(β-L-фукопиранозил)окси]этил}ацетамида) (ML-46), характеризующегося следующей структурой.
 ML-46
ML-46
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-7, заменяя 2-аминоэтил-α-L-фукопиранозид 2-аминоэтил-β-L-фукопиранозидом на стадии B. UPLC способ B: m/e=780,361 [M+1]; Rt=2,09 мин.
Пример 47
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]-N-{2-[(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино]-2-оксоэтил}-6-оксогексанамида (ML-47), характеризующегося следующей структурой.
 ML-47
ML-47
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-29, заменяя 2,2'-[(2-{[6-(бензилокси)-6-оксогексил]амино}-2-оксоэтил)имино]диуксусная кислоту 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусной кислотой. UPLC способ B: m/e=1070,33 [M+1]; Rt=3,08 мин.
Пример 48
Описан синтез олигосахаридного линкера, 2-{[2-({2-[(α-L-фукоопиранозил)окси]этил}амино)-2-оксоэтил][2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]амино}-N-[2-(α-D-маннопиранозилокси)этил]ацетамида (ML-48), характеризующегося следующей структурой.
 ML-48
ML-48
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-23, заменяя 6-амино-N-(2-α-L-фукопиранозил)этил)гексанамид 2-аминоэтил-α-L-фукопиранозидом на стадии C и 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозидом на стадии D, соответственно. UPLC способ B m/e=796,37 [M+1]; Rt=1,87 мин.
Пример 49
Описан синтез олигосахаридного линкера, 2-{[2-({2-[(α-L-фукоопиранозил)окси]этил}амино)-2-оксоэтил][2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]амино}-N-[2-(β-D-маннопиранозилокси)этил]ацетамида (ML-49), характеризующегося следующей структурой.
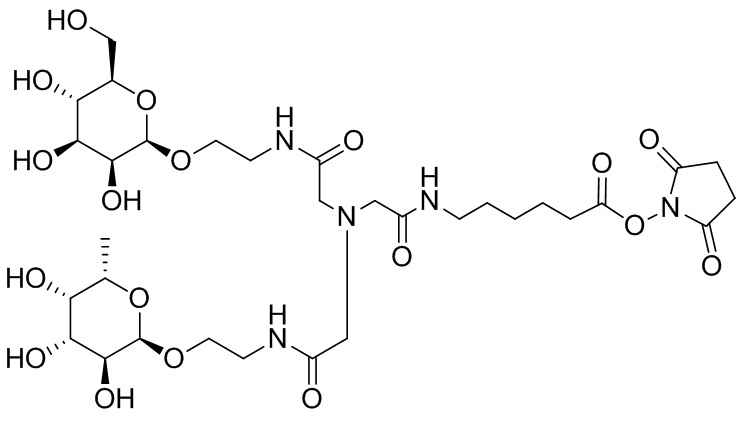 ML-49
ML-49
Стадия A: бензил{2-[(3,6-ди-O-бензоил-β-D-галактопиранозил)окси]этил}карбамат
К раствору бензил-2-({2-[(β-D-галактопиранозил)окси]этил}амино)карбамата (15,5 г, 43,4 ммоль, Beilstein J. Org. Chem. 2010, 6, 699) и 4Å молекулярных сит в толуоле (150 мл) добавляли дибутилстаннанон (23,4 г, 94 ммоль). После нагревания с обратным холодильником в течение 5 ч, реакционную смесь медленно охлаждали 0°C, и по каплям добавляли к ней бензоилхлорид (11 мл, 95 ммоль). Полученную смесь оставляли медленно нагреваться до. После перемешивания при к.т. в течение 24 ч, реакционную смесь фильтровали, и концентрировали фильтрат. Остаток очищали методом флэш-хроматографии на силикагеле (330 г), элюируя 0-75% EtOAc в гексанах, с получением указанного в заголовке соединения. TLC: силикагель, гексан/EtOAc=1/1, Rf=0,35. UPLC способ B: рассчитано для C30H31NO10 565,19 обнаружено m/e=566,21 [M+1]; Rt=1,87 мин. 1H-ЯМР (CDCl3) δ 8,05-7,95 (4H, м), 7,60-7,25 (11H, м), 5,10-5,05 (1H, м), 5,02 (2H, с), 4,60-4,55 (1H, м), 4,50-4,45 (1H, м), 4,40-4,35 (1H, м), 4,20-4,15 (1H, м), 4,05-4,00 (1H, м), 3,90-3,80 (2H, м), 3,75-3,70 (1H, м), 3,45-3,30 (1H, м), 3,35-3,25 (1H, м). Региохимию подтверждали в экспериментах 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC); 1H-13C гетероядерной 2D ЯМР-спектроскопии с многоквантовым переносом когеренции (HMBC); и 1H-1H NOE (NOESY) 2D ЯМР-спектроскопии.
Стадия B: бензил{2-[(3,6-ди-O-бензоил-β-D-маннопиранозил)окси]этил}карбамат
К перемешанному раствору бензил{2-[(3,6-ди-O-бензоил-β-D-галактопиранозил)окси]этил}карбамата (1,17 г, 2,069 ммоль) в CH2Cl2 (26 мл) при -20°C по каплям добавляли пиридин (2,4 мл, 29,7 ммоль) и, спустя 5 мин, трифторметансульфоновый ангидрид (1,1 мл, 6,51 ммоль). Смесь оставляли медленно нагреваться от -20°C до 0°C в течение 2 ч. Полученную смесь разбавляли CH2Cl2 (75 мл) и промывали холодным 1,0 M HCl (100 мл), холодным нас. NaHCO3 (100 мл), холодной водой (100 мл) и холодным солевым раствором (100 мл). Органическую фазу сушили над Na2SO4 и концентрировали при низкой температуре. Остаток растворяли в AcCN (20 мл), и добавляли к нему раствор нитрита тетрабутиламмония (3,0 г, 10,40 ммоль) в AcCN (6 мл). После перемешивания при 50°C в течение 6 ч, реакционную смесь концентрировали, и очищали остаток методом колоночной флэш-хроматографии на силикагеле (330 г), элюируя 0-75% EtOAc в гексанах, с получением указанного в заголовке соединения. TLC: силикагель, гексан/этилацетат=1/1, Rf=0,33. UPLC способ B: рассчитано для C30H31NO10 565,19 обнаружено m/e=566,22 [M+1]; Rt=1,84 мин. 1H-ЯМР (CDCl3) δ 8,10-8,00 (4H, м), 7,55-7,25 (11H, м), 5,05-5,00 (3H, м), 4,72-4,68 (1H, м), 4,64-4,58 (2H, м), 4,24-4,20 (1H, м), 4,17- 4,12 (1H, м), 3,93-3,87 (1H, м), 3,77-3,72 (1H, м), 3,65-3,60 (1H, м), 3,46-3,34 (2H, м). Стереохимию подтверждали в экспериментах 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC); 1H-13C гетероядерной 2D ЯМР-спектроскопии с многоквантовым переносом когеренции (HMBC); и 1H-1H NOE (NOESY) 2D ЯМР-спектроскопии.
Стадия C: бензил[2-(β-D-маннопиранозилокси)этил]карбамат
К перемешанному раствору бензил{2-[(3,6-ди-O-бензоил-β-D-фукопиранозил)окси]этил}карбамата (287 мг, 0,507 ммоль) в CH3OH (5 мл) добавляли NaOCH (0,1 мл, 0,05 ммоль, 0,5 M в CH3OH). Спустя 4 ч, к перемешанной реакционной смеси добавляли ионообменную смолу Amberlite IR 120 (H) (предварительно промытую CH3OH 3×5 мл). Спустя 15 мин, смолу отфильтровывали и промывали CH3OH (3×5 мл). Фильтрат концентрировали, и очищали остаток методом флэш-хроматографии с обращенной фазой на C18-связанном силикагеле (50 г), элюируя 5-60% AcCN в H2O, с получением указанного в заголовке соединения. UPLC способ B: рассчитано для C16H23NO8 357,14 обнаружено m/e=358,16 [M+1]; Rt=1,40 мин. 1H-ЯМР (CD3OD) δ 7,35-7,24 (5H, м), 5,04 (2H, с), 4,50-4,48 (1H, м), 3,90-3,82 (3H, м), 3,74-3,60 (2H, м), 3,55-3,50 (1H, м), 3,42-3,37 (1H, м), 3,36-3,30 (2H, м), 3,18-3,12 (1H, м).
Стадия D: 2-аминоэтил-β-D-маннопиранозид
Смесь бензил[2-(β-D-маннопиранозилокси)этил]карбамата (133 мг, 0,372 ммоль) и Pd/C (20 мг, 0,019 ммоль) в воде (5 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при к.т. в течение 4 ч. Катализатор отфильтровывали и промывали H2O (3×5 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. 1H-ЯМР (CD3OD) δ 4,53-4,52 (1H, м), 3,93-3,85 (3H, м), 3,72-3,64 (2H, м), 3,53-3,49 (1H, м), 3,44-3,42 (1H, м), 3,22-3,18 (1H, м), 2,92-2,85 (2H, м).
Стадия E: 2-{[2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил][2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]амино}-N-[2-(β-D-маннопиранозилокси)этил]ацетамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-48, заменяя 2-аминоэтил-α-D-маннопиранозид 2-аминоэтил-β-D-маннопиранозидом. UPLC способ B: m/e=796,37 [M+1]; Rt=2,19 мин.
Пример 50
Описан синтез олигосахаридного линкера, 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{1[α-D-маннопиранозил],4[α-D-маннопиранозил]окси}бутил)ацетамида (ML-50), характеризующегося следующей структурой.
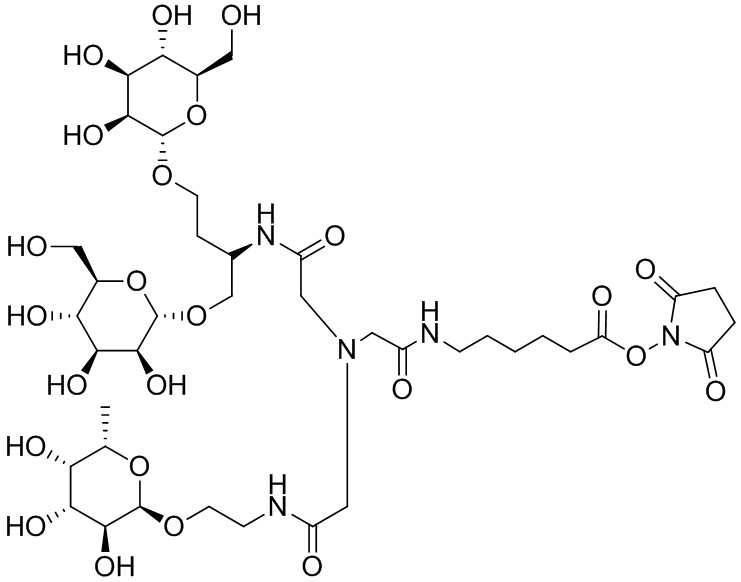 ML-50
ML-50
Стадия A: бензил(1[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил],4[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил]-дигидроксибутан-2-ил)карбамат
В круглодонную колбу емкостью 500 мл с 4Å молекулярными ситами добавляли раствор (S)-бензил(1,4-дигидроксибутан-2-ил)карбамата (2,7 г, 11,28 ммоль) и 2,3,4,6-тетра-O-бензоил-D-маннопиранозилтрихлорацетимидата (17,35 г, 23,42 ммоль, получен в соответствии с Organic Letters, 2003, vol.5, No.22, 4041) в безводном дихлорметане (200 мл). Смесь охлаждали до -30°C, и добавляли триметисилилтрифторметансульфонат (0,4 мл, 2,214 ммоль). После перемешивания при температуре от -30°C до температуры окружающей среды в течение 4 ч в атмосфере азота, реакционную смесь гасили добавлением TEA (3,15 мл, 22,57 ммоль), фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле (0-60% EtOAc в гексанах) с получением указанного в заголовке соединения. (TLC: силикагель, гексан/этилацетат=3/2, продукт с Rf=0,4). 1H-ЯМР (хлороформ-d, 500 МГц): δ 8,15-8,10 (4H, м), 8,10-8,05 (4H, м), 8,00-7,95 (4H, м), 7,80-7,75 (4H, м), 7,65-7,55 (4H, м), 7,45-7,20 (15H, м), 6,15-6,10 (2H, м), 5,95-5,85 (2H, м), 5,80-5,75 (2H, м), 5,15-5,10 (4H, м), 4,75-4,65 (2H, м), 4,55-4,40 (4H, м), 4,25-4,20 (1H, м), 4,10-4,00 (2H, м), 3,75-3,65 (2H, м), 2,15-2,05 (2H, м).
Стадия B: бензил(1[α-D-маннопиранозил],4[α-D-маннопиранозил]дигидроксибутан-2-ил)карбамат
К раствору бензил(1[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил],4[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил]-дигидроксибутан-2-ил)карбамата (9,72 г, 6,96 ммоль) в метаноле (30 мл) добавляли 0,5 M метоксид натрия (1,5 мл, 0,750 ммоль) в метаноле. После перемешивания при комнатной температуре в течение 48 часов, к реакционной смеси добавляли ионообменную смолу Amberlite IR 120 (H) (предварительно промытую метанолом 3×30 мл), и оставляли дополнительно перемешиваться в течение 15 минут. Ионообменную смолу отфильтровывали и промывали метанолом (2×5 мл). Фильтрат концентрировали и очищали остаток на колонке с обращенной фазой (86 г, C18), элюируя 5% CH3CN в воде (3 объема колонки), а затем 5-50% CH3CN в воде (20 объемов колонки) с получением указанного в заголовке соединения в виде белого твердого вещества. UPLC-MS: рассчитано для C24H37NO14 563,22 обнаружено m/e: 564,24 (M+H)+ (Rt: 2,31/5,00 мин).
Стадия C: 1(α-D-маннопиранозил),4(α-D-маннопиранозил)-дигидроксибутан-2-амин
Смесь бензил(1[α-D-маннопиранозил],4[α-D-маннопиранозил]-дигидроксибутан-2-ил)карбамата (3,73 г, 6,62 ммоль) и Pd/C (0,300 г, 0,282 ммоль) в воде (60 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при к.т. в течение 2 ч. Катализатор отфильтровывали и промывали H2O (3×10 мл). Фильтрат концентрировали с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C16H31NO12 429,18 обнаружено m/e: 430,21 (M+H)+ (Rt: 1,37/5,00 мин).
Стадия D: 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{1[α-D-маннопиранозил],4[α-D-маннопиранозил]окси}бутил)ацетамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-29, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 1(α-D-маннопиранозил),4(α-D-маннопиранозил)-дигидроксибутан-2-амином. UPLC способ B: рассчитано для C40H67N5O24 1001,42, обнаружено m/e: 1002,48 [M+1]; Rt=2,05min.
Пример 51
Описан синтез олигосахаридного линкера, 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-маннопиранозил]окси}этил)ацетамида (ML-51), характеризующегося следующей структурой.
 ML-51
ML-51
Стадия A: (2-((3,6-O-бензоил-β-D-галактопиранозил)окси)хлорэтил)
В круглодонную колбу емкостью 500 мл с 4Å молекулярными ситами добавляли 2-хлорэтил-β-D-галактопиранозид (6,58 г, 27,1 ммоль, получен в соответствии с Carbohydr. Res. 1992, 223, 303), дибутилстаннанон (14,5 г, 58,2 ммоль) и безводный толуол (150 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 3 ч. Спустя 3 ч, реакционную смесь охлаждали до комнатной температуры, а затем до 0°C. К холодному раствору неочищенной реакционной смеси при 0°C добавляли бензоилхлорид (6,7 мл, 57,7 ммоль), и перемешивали полученную смесь при температуре от 0°C до температуры окружающей среды. Спустя 24 часа, реакционную смесь отфильтровывали, и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле (0-75% EtOAc в гексанах) с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C22H23ClO8 450,11 обнаружено m/e: 473,11 (M+Na)+ (Rt: 1,82/5,00 мин),1H-ЯМР (хлороформ-d, 500 МГц): δ 8,10-8,05 (2H, м), 8,05-8,00 (2H, м), 7,60-7,55 (2H, м), 7,50-7,40 (4H, м), 5,20-5,10 (1H, м), 4,70-4,60 (1H, м), 4,55-4,50 (1H, м), 4,50-4,45 (1H, м), 4,25-4,20 (1H, м), 4,20-4,15 (1H, м), 4,12-4,08 (1H, м), 4,00-3,95 (1H, м), 3,90-3,85 (1H, м), 3,72-3,68 (2H, м). Региохимию подтверждали в экспериментах 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC); 1H-13C гетероядерной 2D ЯМР-спектроскопии с многоквантовым переносом когеренции (HMBC); и 1H-1H NOE (NOESY) 2D ЯМР-спектроскопии.
Стадия B: (2-((3,6-O-бензоил-β-D-маннопиранозил)окси)хлорэтил)
К раствору (2-((3,6-O-бензоил-β-D-галактопиранозил)окси)хлорэтила) (1 г, 2,218 ммоль) в DCM (28 мл) при -20°C добавляли пиридин (2,5 мл, 30,9 ммоль). После перемешивания 5 минут, по каплям добавляли трифторметансульфоновый ангидрид (1,2 мл, 7,10 ммоль), и перемешивали смесь в процессе нагревания от -20°C до 0°C в течение 2 часов. Полученную смесь разбавляли 75 мл DCM и промывали холодным 1 M HCl (1×100 мл); холодным водным NaHCO3 (1×100 мл); холодной водой (1×100 мл) и 100 мл холодного солевого раствора. Органическую фазу сушили над Na2SO4 и концентрировали в условиях вакуума при низкой температуре. Остаток использовали непосредственно на следующей стадии без дополнительной очистки. К раствору трифторметансульфонилированного промежуточного продукта в безводном ацетонитриле (22 мл) добавляли раствор нитрита тетрабутиламмония (3,3 г, 11,44 ммоль) в 5 мл безводного ацетонитрила, а затем оставляли реакционную смесь при 50°C на 5 часов. Полученную смесь концентрировали в условиях пониженного давления и немедленно очищали методом хроматографии на силикагеле (0-75% EtOAc в гексанах) с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C22H23ClO8 450,11 обнаружено m/e: 451,13 (M+H)+ (Rt: 1,80/5,00 мин). 1H-ЯМР (хлороформ-d, 500 МГц): δ 8,15-8,05 (4H, м), 7,65-7,60 (2H, м), 7,50-7,40 (4H, м), 5,12-5,08 (1H, м), 4,77-4,72 (2H, м), 4,68-4,65 (1H, м), 4,34-4,32 (1H, м), 4,24- 4,14 (2H, м), 3,90-3,84 (1H, м), 3,71-3,66 (3H, м), 2,98-2,96 (1H, b), 2,41-2,39 (1H, b). Стереохимию подтверждали в экспериментах 1H-13C гетероядерной 2D ЯМР-спектроскопии с одноквантовым переносом когеренции (HSQC); 1H-13C гетероядерной 2D ЯМР-спектроскопии с многоквантовым переносом когеренции (HMBC); и 1H-1H NOE (NOESY) 2D ЯМР-спектроскопии.
Стадия C: (2-((2,4-O-бензил,3,6-O-бензоил-β-D-маннопиранозил)окси)хлорэтил)
В круглодонную колбу емкостью 250 мл добавляли трифторметансульфонат 2-(бензилокси)-1-метилпиридин-1-ия (5 г, 14,31 ммоль), оксид магния (0,085 г, 2,118 ммоль), трифтортолуол (40 мл) и (2-((3,6-O-бензоил-β-D-маннопиранозил)окси)хлорэтил) (1,91 г, 4,24 ммоль). Гетерогенную реакционную смесь затем перемешивали при 82°C в течение 48 ч. После завершения реакции, реакционную смесь фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле (0-75% EtOAc в гексанах) с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C36H35ClO8 630,20 обнаружено m/e: 631,21 (M+H)+ (Rt: 3,97/5,00 мин).
Стадия D: (2-((2,4-O-бензил-β-D-маннопиранозил)окси)хлорэтил)
К раствору (2-((2,4-O-бензил,3,6-O-бензоил-β-D-маннопиранозил)окси)хлорэтила) (1,6 г, 2,54 ммоль) в метаноле (25 мл) и DCM (5 мл) добавляли 0,5 M метоксид натрия (0,5 мл, 0,25 ммоль) в метаноле. После перемешивания при комнатной температуре в течение 4 часов, к реакционной смеси добавляли ионообменную смолу Amberlite IR 120 (H) (предварительно промытую метанолом 3×5 мл), и оставляли дополнительно перемешиваться в течение 15 минут. Ионообменную смолу отфильтровывали и промывали метанолом (3×5 мл). Фильтрат концентрировали в условиях пониженного давления, и очищали остаток методом хроматографии на силикагеле (0-75% EtOAc в гексанах) с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C22H27ClO6 422,15 обнаружено m/e: 423,14 (M+H)+ (Rt: 1,90/5,00 мин).
Стадия E: (2-((2,4-O-бензил-β-D-маннопиранозил)окси)азидоэтил)
К раствору (2-((2,4-O-бензил-β-D-маннопиранозил)окси)хлорэтила) (800 мг, 1,892 ммоль) в безводном DMF (25 мл) при комнатной температуре добавляли азид натрия (140 мг, 2,154 ммоль). Реакционную смесь затем нагревали до 70°C и перемешивали в течение 16 ч в атмосфере азота. После завершения реакции, неочищенную реакционную смесь охлаждали до комнатной температуры, вливали в воду со льдом (200 мл) и экстрагировали эфиром (3×100 мл). Органические слои объединяли и промывали солевым раствором (2×100 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле (0-100% EtOAc в гексанах) с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C22H27N3O6 429,19 обнаружено m/e: 430,19 (M+H)+ (Rt: 1,87/5,00 мин).
Стадия F: (2-((2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→6)]-(2,4-O-бензил-β-D-маннопиранозил)окси)азидоэтил)
В круглодонную колбу емкостью 250 мл с 4Å молекулярными ситами добавляли раствор (2-((2,4-O-бензил-β-D-маннопиранозил)окси)азидоэтила) (710 мг, 1,653 ммоль) и 2,3,4,6-тетра-O-бензоил-D-маннопиранозилтрихлорацетимидата (2,6 г, 3,51 ммоль, получен в соответствии с Organic Letters, 2003, vol.5, No.22, 4041) в безводном дихлорметане (30 мл). Смесь охлаждали до -30°C, и добавляли триметисилилтрифторметансульфонат (0,03 мл, 0,166 ммоль). После перемешивания при температуре от -30°C до температуры окружающей среды в течение 4 ч в атмосфере азота, реакционную смесь гасили добавлением TEA (0,1 мл, 0,717 ммоль), фильтровали и концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле(0-75% EtOAc в гексанах) с получением указанного в заголовке соединения. (TLC: силикагель; гексан/этилацетат=3/2, продукт с Rf=0,6). 1H-ЯМР (хлороформ-d, 500 МГц): δ 8,15-7,80 (16H, м), 7,62-7,49 (8H, м), 7,47-7,32 (20H, м), 7,30-7,15 (6H, м), 6,13-6,05 (2H, м), 6,01-5,91 (2H, м), 5,87-5,85 (1H, м), 5,71-5,69 (1H, м), 5,43-5,42 (1H, м), 5,26-5,23 (1H, м), 5,13-5,12 (1H, м), 5,03-5,00 (1H, м), 4,84-4,81 (1H, м), 4,68-4,63 (2H, м), 4,60-4,55 (2H, м), 4,54-4,48 (2H, м), 4,31-4,25 (2H, м), 4,20-4,15 (1H, м), 4,08-4,07 (1H, м), 3,98-3,88 (3H, м), 3,84-3,80 (1H, м), 3,78-3,73 (1H, м), 3,62-3,54 (2H, м), 3,38-3,33 (1H, м).
Стадия G: (2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-(2,4-O-бензил,β-D-маннопиранозил)окси)азидоэтил)
К раствору 2-((2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил-(1→6)]-(2,4-O-бензил-β-D-маннопиранозил)окси)азидоэтил-(2,52 г, 1,588 ммоль) в метаноле (20 мл) и DCM (4 мл) добавляли 0,5 M метоксид натрия (0,32 мл, 0,16 ммоль) в метаноле. После перемешивания при комнатной температуре в течение 24 час, к реакционной смеси добавляли ионообменную смолу Amberlite IR 120 (H) (предварительно промытую метанолом 3×30 мл), и оставляли дополнительно перемешиваться в течение 15 минут. Ионообменную смолу отфильтровывали и промывали метанолом (3×5 мл). Фильтрат концентрировали в условиях пониженного давления, и очищали остаток методом хроматографии с обращенной фазой (C18 колонка) (ACN/H2O без модификатора) с получением указанного в заголовке продукта. UPLC-MS: рассчитано для C34H47N3O16 753,30 обнаружено m/e: 754,29 (M+H)+ (Rt: 2,93/5,00 мин).
Стадия H: 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-маннопиранозид
Смесь 2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-(2,4-O-бензил,β-D-маннопиранозил)окси)азидоэтила (1,05 г, 1,393 ммоль) и Pd/C (0,148 г, 0,139 ммоль) в воде (25 мл) оставляли перемешиваться в атмосфере подаваемого из баллона H2 при к.т. в течение 16 ч. Катализатор отфильтровывали и промывали H2O (3×5 мл). Фильтрат концентрировали в условиях пониженного давления с получением указанного в заголовке соединения. UPLC-MS: рассчитано для C20H37NO16 547,21 обнаружено m/e: 548,23 (M+H)+ (Rt: 1,07/5,00 мин). 1H-ЯМР (D2O, 500 МГц): δ 5,06-5,05 (1H, м), 4,86-4,85 (1H, м), 4,655-4,65 (1H, м), 4,13-4,12 (1H, м), 4,02-4,01 (1H, м), 3,95-3,82 (6H, м), 3,80-3,67 (8H, м), 3,66-3,57 (3H, м), 3,53-3,49 (1H, м), 2,90-2,85(2H, м).
Стадия I: 2-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил][2-({2-[(α-L-фукопиранозил)окси]этил}амино)-2-оксоэтил]амино}-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-маннопиранозил]окси}этил)ацетамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-29, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-маннопиранозидом. UPLC способ B: рассчитано для C44H73N5O28 1119,44, обнаружено m/e: 1120,46 [M+1]; Rt=2,09 мин.
Пример 52
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-{2-[(β-D-маннопиранозил)окси]этил}-6-оксогексанамида (ML-52), характеризующегося следующей структурой.
 ML-52
ML-52
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-β-D-маннопиранозидом на стадии B. UPLC-MS: рассчитано для C18H28N2O11 448,17 обнаружено m/e: 449,19 (M+H)+ (Rt: 1,96/5,00 мин).
Пример 53
Описан синтез олигосахаридного линкера, 4-[(2,5-диоксопирролидин-1-ил)окси]-N-{2-[(α-L-фукопиранозил)окси]этил}4-оксобутанамида (ML-53), характеризующегося следующей структурой.
 ML-53
ML-53
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-4, заменяя 6-(бензилокси)-6-оксогексановую кислоту 4-(бензилокси)-4-оксобутановой кислотой на стадии A. UPLC-MS: рассчитано для C16H24N2O10 404,14 обнаружено m/e: 405,14 (M+H)+ (Rt: 1,87/5,00 мин).
Пример 54
Описан синтез олигосахаридного линкера, 2,2'-{[2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)-2-оксоэтил]имино}бис[N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-глюкопиранозил]окси}этил)ацетамида] (ML-54), характеризующегося следующей структурой.
 ML-54
ML-54
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-15, заменяя 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-глюкопиранозидом на стадии B. UPLC способ B: рассчитано для C56H93N5O39 1459,54, обнаружено m/e: m/e=1460,62 [M+1]; Rt=0,92 мин.
Пример 55
Описан синтез олигосахаридного линкера, 2-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)этил-α-L-фукопиранозида (ML-55), характеризующегося следующей структурой.
 ML-55
ML-55
Стадия A: 2-аминоэтил-2,3,4,6-пентабензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пентабензоил-α-D-маннопиранозил-(1→6)]-2,4-дибензоил-α-D-маннопиранозид
К продутому азотом раствору 2-азидоэтил-2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-O-пентабензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозида (25 г, 15,5 ммоль, WO 2010/088294 A1) в EtOAc (300 мл) добавляли 10% палладированный уголь (1,65 г), и перемешивали полученную смесь при комнатной температуре в атмосфере подаваемого из баллона водорода в течение ночи. Смесь фильтровали через целит, фильтрат упаривали, и очищали остаток методом колоночной хроматографии на силикагеле (Teledyne Isco 330 г, элюент: градиент 2-5% MeOH в DCM, 8 объемов колонки) с получением указанного в заголовке соединения (18 г, 73%) в виде грязно-белой пены. UPLC способ C: рассчитано для C90H77NO26 1587,47, обнаружено m/e: 1588,6636 [M+1]; Rt=4,17 мин.
Стадия B: бензил-6-(2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил]-2-оксиэтил}амино)гексаноат.
К раствору 2-аминоэтил-2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозида (18 г, 11,35 ммоль) и бензил-6-оксогексаноата (1 г, 4,54 ммоль) в DCM (150 мл) добавляли уксусную кислоту (0,26 мл, 4,54 ммоль) и триацетоксиборгидрид натрия (2,41 г, 11,35 ммоль), и перемешиваил полученную смесь при комнатной температуре в течение ночи. Смесь упаривали, остаток растворяли в EtOAc (300 мл) и промывали нас. NaHCO3 (2×300 мл), нас. NaCl (200 мл), сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco: 2×330 г; элюент: градиент 2-5% MeOH в DCM, 8 объемов колонки) с получением указанного в заголовке соединения (4,8 г, 59%) в виде белой пены. 1H-ЯМР (CDCl3) δ 8,33 (2H, м), 8,18 (2H, м), 8,13 (2H, дд, J=8,0 и 1,4 Гц), 8,10 (2H, дд, J=8,0 и 1,4 Гц), 8,06 (2H, м), 8,05 (2H, дд, J 4,8 и 1,6 Гц), 7,84 (4H, м), 7,78 (2H, дд, J=8,0 и 1,4 Гц), 7,74 (2H, дд, J=8,0 и 1,4 Гц), 7,67-7,48 (8H, м), 7,47-7,30 (23H, м), 7,25 (2H, т, J=7,8Гц), 6,14 (1H, т, J=10,1 Гц), 6,10 (1H, т, J=10,0 Гц), 6,03 (1H, дд, J=10,1 и 3,3 Гц), 5,93 (1H, т, J=10,0 Гц), 5,80 (2H, м), 5,75 (1H, дд, J=10,1 и 3,3 Гц), 5,42 (1H, д, J=1,9 Гц), 5,38 (1H, дд, J=3,3 и 1,9 Гц), 5,20 (1H, с), 5,18 (1H, д, J=1,8 Гц), 5,11 (2H, с), 4,69 (1H, дд, J=9,7 и 3,5 Гц), 4,67 (1H, дд, J=12,4 и 2,6 Гц), 4,62 (1H, дд, J=12,2 и 2,4 Гц), 4,57 (1H, м), 4,48 (1H, дт, J=10,1 и 2,8 Гц), 4,42-4,31 (3H, м), 4,22 (1H, дд, J=10,8 и 6,3 Гц), 4,09 (1H, дт, J=10,0 и 5,4 Гц), 3,83 (1H, д, J=10,6 Гц), 3,78 (1H, м), 3,02 (2H, м), 2,73 (2H, т, J=7,3 Гц), 2,37 (2H, т, J=7,6 Гц), 1,71 (2H, м), 1,59 (2H, м), 1,40 (2H, м).
Стадия C: 2-оксоэтил-2,3,4-три-O-ацетил-α-L-фукопиранозид
К раствору проп-2-ен-1-ил-2,3,4-три-O-ацетил-α-L-фукопиранозида (1,34 г, 4,06 ммоль) в ацетоне (30 мл) и воде (7,5 мл) добавляли 4-метилморфолин-4-оксид (950 мг, 8,11 ммоль), а затем добавляли 2,5% OsO4 в трет-бутаноле (2,04 мл, 0,162 ммоль). Смесь оставляли перемешиваться при к.т. в течение 16 ч. К полученной смеси затем добавляли раствор NaIO4 (1,74 г, 8,11 ммоль) в воде (15 мл). После перемешивания еще в течение 4 ч, осадок фильтровали и промывали ацетоном (50 мл). Объем фильтрата сокращали приблизительно до 1/3 от начального объема, а затем разбавляли нас. NaHCO3 (100 мл). Смесь экстрагировали EtOAc (3×50 мл). Органические фазы объединяли и промывали солевым раствором, сушили над Na2SO4, и концентрировали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco: 120 г), элюируя 0-80% EtOAc в гексанах, с получением указанного в заголовке соединения (660 мг, 49%). 1H-ЯМР (CDCl3) δ 9,72 (1H, с), 5,44 (1H, дд, J=10,9 и 3,3 Гц), 5,35 (1H, дд, J=3,4 и 1,8 Гц), 5,19 (1H, дд, J=10,9 и 3,8 Гц), 5,13 (1H, д, J=3,8 Гц), 4,26 (3H, м), 2,19 (3H, с), 2,15 (3H, с), 2,02 (3H, с), 1,17 (3H, д, J=6,6 Гц).
Стадия D: бензил-6-{[{2-(2,3,4-три-O-ацетил-α-L-фукопиранозил)окси}этил](2-{(2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил]окси}этил)амино}гексаноат
К раствору бензил-6-(2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил]-2-оксиэтил}амино)гексаноата (1,3 г, 0,725 ммоль) и 2-оксоэтил-2,3,4-три-O-ацетил-α-L-фукопиранозида (651 мг, 1,96 ммоль) в DCM (20 мл) добавляли уксусную кислоту (0,042 мл, 0,725 ммоль) и триацетоксиборгидрид натрия (307 мг, 1,45 ммоль), и перемешивали полученную смесь при комнатной температуре в течение ночи. Смесь упаривали, и распределяли остаток между EtOAc (60 мл) и нас. NaHCO3 (80 мл); органический слой промывали дополнительной порцией нас. NaHCO3 (80 мл), нас. NaCl (50 мл), сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco: 80 г; элюент: градиент 20-100% EtOAc в гексанах, 10 объемов колонки) с получением указанного в заголовке соединения (1,5 г, 99%) в виде белой пены. 1H-ЯМР (CDCl3) δ 8,34 (2H, дд, J 6,7 и 3,2 Гц), 8,15 (2H, м), 8,10 (4H, м), 8,07 (2H, дд, J=8,0 и 1,4 Гц), 8,05 (2H, дд, J 8,1 и 1,5 Гц), 7,88 (4H, м), 7,78 (2H, дд, J=8,0 и 1,4 Гц), 7,72 (2H, дд, J=7,8 и 1,5 Гц), 7,62-7,55 (6H, м), 7,54-7,36 (14H, м), 7,34-7,29 (11H, м), 7,25 (2H, т, J=7,7Гц), 6,14 (1H, т, J=10,0 Гц), 6,07 (1H, м), 6,03 (2H, м), 5,83 (1H, дд, J=3,3 и 1,8 Гц), 5,75 (2H, м), 5,41 (1H, м), 5,39 (2H, м), 5,35 (1H, д, J=3,8 Гц), 5,33 (2H, м), 5,59 (1H, д, J=3,7 Гц), 5,18 (3H, м), 5,16 (1H, д, J=3,8 Гц), 5,13 (1H, т, J=4,2 Гц), 5,10 (1H, д, J=3,7 Гц), 5,06 (2H, с), 4,62 (2H, м), 4,54 (1H, м), 4,50 (2H, м), 4,57 (1H, м), 4,33 (3H, м), 4,25 (2H, м), 4,19 (2H, м), 3,80 (2H, м), 2,82 (2H, м), 2,60 (1H, т, J=7,3 Гц), 2,32 (2H, т, J=7,5 Гц), 2,20 (3H, с) 2,11 (3H, с) 2,02 (3H, с), 1,63 (2H, м), 1,51 (1H, м) 1,34 (1H, м) 1,18 (3H, д, J=6,6 Гц).
Стадия E: метил-6-{[{2-(-α-L-фукопиранозил)окси}этил](2-{(2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино}гексаноат
К раствору бензил-6-{[{2-(2,3,4-три-O-ацетил-α-L-фукопиранозил)окси}этил](2-{(2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил]окси}этил)амино}гексаноат (1,5 г, 0,71 ммоль) в смеси DCM (5 мл) и MeOH (15 мл) добавляли метоксид натрия (0,284 мл 0,5 M раствора в MeOH, 0,142 ммоль), и перемешивали смесь при комнатной температуре в течение 4 суток. Смесь упаривали до объема ~4 мл и по каплям добавляли при перемешивании к ацетонитрилу (80 мл) с получением белого осадка. Смесь центрифугировали при 3500 об/мин в течение 20 мин, надосадочную жидкость отбрасывали, твердые вещества повторно растворяли в ацетонитриле (80 мл) и центрифугировали при 3500 об/мин еще в течение 20 мин, надосадочную жидкость отбрасывали, и сушили твердые вещества под струей осушенного азота с получением указанного в заголовке соединения (580 мг, 94%) в виде белого твердого вещества. UPLC способ B: рассчитано для C35H63NO23 865,38, обнаружено m/e: 866,48 [M+1]; Rt=1,71 мин.
Стадия F: 6-{[{2-(-α-L-фукопиранозил)окси}этил](2-{(2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино}гексановая кислота
К раствору метил-6-{[{2-(-α-L-фукопиранозил)окси}этил](2-{(2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино}гексаноата (580 мг, 0,67 мл) в воде (3 мл) добавляли 5н NaOH (0,161 мл, 0,804 ммоль), и перемешивали полученную смесь при комнатной температуре в течение 6 часов. Добавляли уксусную кислоту (0,039 мл, 0,683 ммоль), и лиофилизировали смесь с получением указанного в заголовке соединения (620 мг, 100%). UPLC способ B: рассчитано для C34H61NO23 851,36, обнаружено m/e: 852,48 [M+1]; Rt=1,74 мин.
Стадия G: 2-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)этил-α-L-фукопиранозид
К суспензии 6-{[{2-(-α-L-фукопиранозил)окси}этил](2-{(2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси}этил)амино}гексановой кислоты (100 мг, 0,117 ммоль) в безводном DMF (2 мл) добавляли основание Хунига (0,082 мл, 0,47 ммоль) и гексафторфосфат (V) 1-(((2,5-диоксопирролидин-1-ил)окси)(пирролидин-1-ил)метилeне)пирролидин-1-ия (58 мг, 0,141 ммоль), и перемешивали полученную смесь при комнатной температуре в течение 30 мин. Добавляли TFA (0,036 мл, 0,47 ммоль), и добавляли полученную смесь по каплям к безводному ацетонитрилу (40 мл) с получением белого осадка. Смесь центрифугировали при 3500 об/мин в течение 20 мин, растворитель отбрасывали, твердое вещество повторно растворяли в ацетонитриле (40 мл) и центрифугировали при 3500 об/мин в течение 20 мин. Растворитель отбрасывали, и сушили твердое вещество под струей осушенного азота с получением указанного в заголовке соединения (84 мг, 75%). UPLC способ B: рассчитано для C38H64N2O25 948,38, обнаружено m/e: 949,48 [M+1]; Rt=3,64 мин.
Пример 56
Описан синтез олигосахаридного линкера, 2-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}амино)этил-β-L-фукопиранозида (ML-56), характеризующегося следующей структурой.
 ML-56
ML-56
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-55, заменяя проп-2-ен-1-ил-2,3,4-три-O-ацетил-α-L-фукопиранозид проп-2-ен-1-ил-2,3,4-три-O-ацетил-β-L-фукопиранозидом на стадии C. UPLC способ B: m/e=949,48 [M+1]; Rt=3,70 мин.
Пример 57
Описан синтез олигосахаридного линкера, 3-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-(2,5-диоксопирролидин-1-ил)-6-оксогексил}амино)пропил-α-L-фукопиранозида (ML-57), характеризующегося следующей структурой.
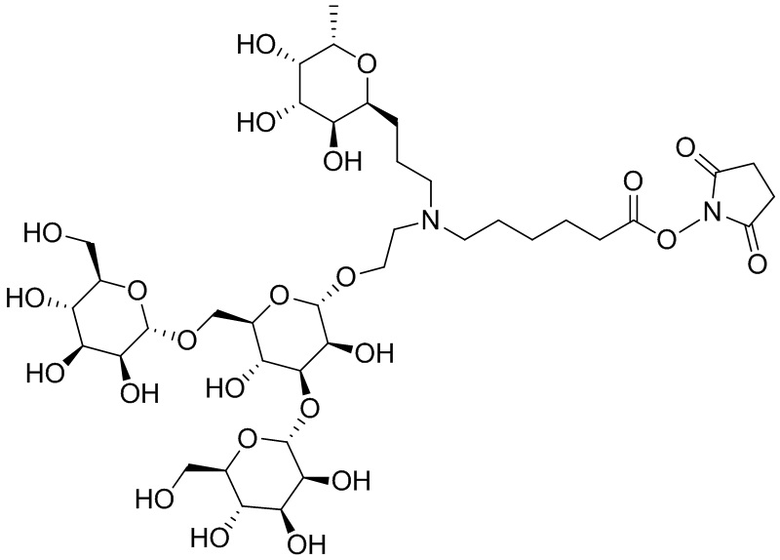 ML-57
ML-57
Стадия A: бензил-6-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил](2-[2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил}окси]этил)амино}гексаноат
Получали из бензил-6-(2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил]-2-оксиэтил}амино)гексаноата [ML-55, стадия B] и 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропаналя [ML-36, стадия E] в соответствии с методикой, изложенной для ML-55, стадия D. 1H-ЯМР (CDCl3) δ 8,35 (2H, дд, J=6,4 и 2,9 Гц), 8,17 (2H, д, J=7,7 Гц), 8,10 (4H, м), 8,06 (2H, дд, J=7,1 и 1,5 Гц), 8,04 (2H, дд, J=7,7 и 1,5 Гц), 7,89 (2H, м), 7,87 (2H, м), 7,80 (2H, дд, J=7,9 и 1,4 Гц), 7,74 (2H, м), 7,61 (2H, м), 7,59-7,55 (4H, м), 7,49 (2H, д, J=7,2 Гц), 7,45-7,35 (12H, м), 7,35-7,27 (26H, м), 7,23 (2H, м), 6,18 (1H, т, J=9,9 Гц), 6,11-6,02 (3H, м), 5,85 (1H, дд, J=3,3 и 1,8 Гц), 5,75 (2H, м), 5,37 (2H, м), 5,17 (2H, м), 5,06 (2H, с), 4,77 (1H, д, J=12,0 Гц), 4,70 (2H, д, J=8,3 Гц), 4,67-4,60 (5H, м), 4,56 (2H, д, J=8,6 Гц), 4,55-4,47 (4H, м), 4,33 (3H, м), 4,19 (1H, дд, J=11,0 и 4,8 Гц), 4,01 (1H, дд, J=10,5 и 4,7 Гц), 3,86 (1H, м), 3,79 (1H, д, J=11,2 Гц), 3,75 (2H, м), 3,62 (1H, м), 2,79 (2H, т, J=6,5 Гц), 2,52 (4H, м), 2,32 (2H, т, J=7,6 Гц), 1,65 (4H, м), 1,48 (2H, м), 1,30 (3H, м), 1,25 (3H, д, J=6,6Гц).
Стадия B: метил-6-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил](2-[2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил}окси]этил)амино}гексаноат
К раствору бензил-6-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил](2-[2-{2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→3)-[2,3,4,6-пента-O-бензоил-α-D-маннопиранозил-(1→6)]-2,4-ди-O-бензоил-α-D-маннопиранозил}окси]этил)амино}гексаноата (1,3 г, 0,577 ммоль) в смеси безводного DCM (5 мл) и безводного MeOH (15 мл) добавляли метоксид натрия (1,16 мл 0,5 M раствора в MeOH, 0,577 ммоль), и перемешивали полученную смесь при комнатной температуре в течение 3 суток. Смесь упаривали до объема ~5 мл и добавляли по каплям при перемешивании к безводному ацетонитрилу (80 мл). Смесь центрифугировали при 3500 об/мин в течение 30 мин, растворитель отбрасывали, и повторно растворяли твердое вещество в ацетонитриле (80 мл). Смесь центрифугировали при 3500 об/мин в течение 30 мин, растворитель сливли, и сушили твердое вещество на воздухе под струей осушенного азота с получением указанного в заголовке соединения (650 мг, 100%). UPLC способ B: рассчитано для C57H83NO22 1133,54, обнаружено m/e: 1134,64 [M+1]; Rt=2,08 мин.
Стадия C: метил-6-{[3-(-α-L-фукопиранозил)пропил](2-[2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил}окси]этил)амино}гексаноата гидрохлорид
К раствору метил-6-{[3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропил](2-[2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил}окси]этил)амино}гексаноата (650 мг, 0,577 ммоль) в метаноле (5 мл) добавляли конц. HCl (0,142 мл, 1,73 ммоль), продували азотом, добавляли 10% палладированный уголь (61 мг), и перемешивали в атмосфере подаваемого из баллона водорода в течение 3 часов. Фильтровали через 0,4 мкм фильтр-насадку на шприц, и упаривали фильтрат. Остаток растворяли в воде (4 мл) и лиофилизировали с получением указанного в заголовке соединения (531 мг, 100%). UPLC способ B: рассчитано для C39H66N2O24 863,40, обнаружено m/e: 864,43 [M+1]; Rt=1,64 мин.
Стадия D: 3-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-(2,5-диоксопирролидин-1-ил)-6-оксогексил}амино)пропил-α-L-фукопиранозид
Получали из метил-6-{[3-(-α-L-фукопиранозил)пропил](2-[2-{-α-D-маннопиранозил-(1→3)-[-α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил}окси]этил)амино}гексаноата гидрохлорид в соответствии с методиками, изложенными для ML-55, стадии F и G. UPLC способ B: рассчитано для C39H66N2O24 946,40, обнаружено m/e: 947,51 [M+1]; Rt=3,55 мин.
Пример 58
Описан синтез олигосахаридного линкера, 4-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-(2,5-диоксопирролидин-1-ил)-6-оксогексил}амино)бутил-α-L-фукопиранозида (ML-58), характеризующегося следующей структурой.
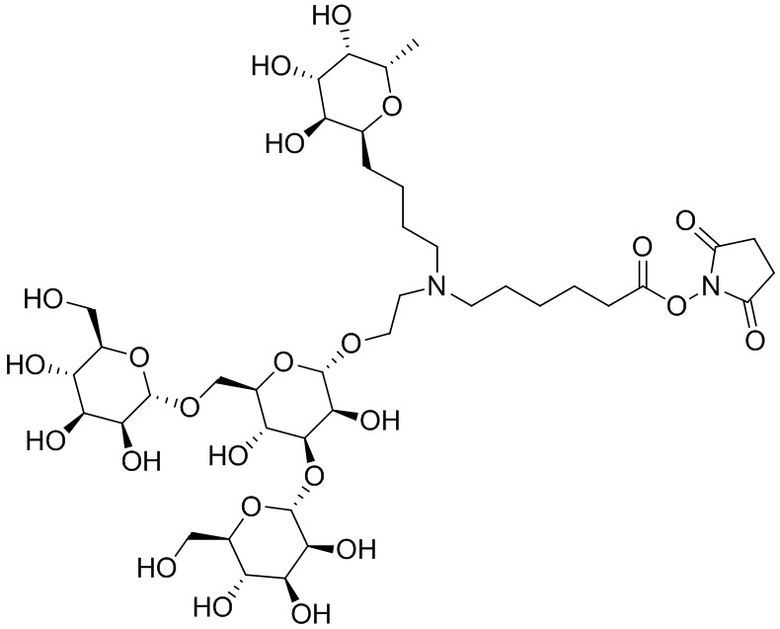 ML-58
ML-58
Стадия A: 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропилметансульфонат
К раствору 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропанола [ML-36, стадия D] (10,6 г, 22,2 ммоль) и основания Хунига (4,66 мл, 26,7 ммоль) в безводном DCM (100 мл), охлажденном на бане со льдом, по каплям добавляли метансульфонилхлорид (1,9 мл, 24,5 ммоль). После завершения добавления, смесь перемешивали при температуре бани со льдом в течение 1 часа. Смесь промывали водой (100 мл), нас. NaCl (50 мл); сушили над Na2SO4, фильтровали и упаривали с получением указанного в заголовке соединения (12,6 г, 100%). 1H-ЯМР (CDCl3) δ 7,37 (15H, м), 4,80 (2H, м), 4,68 (2H, м), 4,63 (1H, д, J=11,8 Гц), 4,53 (1H, J=11,8 Гц), 4,22 (2H, м), 4,00 (1H, д, J=9,8 Гц), 3,94 (1H, м), 2,99 (3H, с), 1,88 (1H, м), 1,75 (2H, м), 1,62 (1H, м), 1,31 (3H, д, J=6,6 Гц).
Стадия B: 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутаннитрил
К раствору 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)пропилметансульфоната (3 г, 5,4 ммоль) в безводном DMF (30 мл) добавляли азид натрия (422 мг, 6,49 ммоль), и нагревали полученную смесь при 60°C в течение ночи. Смесь охлаждали и разбавляли водой (100 мл) и экстрагировали Et2O (3×30 мл); объединенные Et2O слои промывали нас. NaCl (30 мл); сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco, 120 г; элюент: градиент 0-70% EtOAc в гексанах) с получением указанного в заголовке соединения (6 г, 76%). 1H-ЯМР (CDCl3) δ 7,29 (15H, м), 4,80 (2H, м), 4,71 (1H, д, J=11,8 Гц), 4,69 (1H, д, J=11,8 Гц), 4,65 (1H, д, J=11,8 Гц), 4,54 (1H, д, J=11,8 Гц), 3,95 (2H, м), 3,79 (3H, м), 2,37 (2H, м), 1,80 (2H, м), 1,62 (2H, м), 1,31 (3H, д, J=6,6 Гц).
Стадия C: 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутановая кислота
Смесь 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутаннитрила (6 г, 12,36 ммоль) в этаноле (100 мл) обрабатывали водой (100 мл) и 5н NaOH (25 мл, 124 ммоль), и нагревали полученную смесь с обратным холодильником в течение 3 суток. Смесь охлаждали, этанол удаляли путем выпаривания, оставшуюся водную фазу подкисляли добавлением конц. HCl и экстрагировали EtOAc (3×100 мл); объединенные EtOAc слои промывали нас. NaCl (100 мл), сушили над Na2SO4, фильтровали и упаривали с получением указанного в заголовке соединения (5,2 г, 83%) в виде светло-желтого масла. 1H-ЯМР (CDCl3) δ 7,40-7,30 (15H, м), 4,79 (2H, м), 4,71 (1H, д, J=12,0 Гц), 4,65 (2H, м), 4,53 (1H, д, J=11,8 Гц), 4,01 (1H, м), 3,92 (1H, м), 3,83 (1H, м), 3,78 (2H, м), 2,39 (2H, м), 1,75 (2H, м), 1,59 (2H, м), 1,30 (3H, д, J=6,6 Гц).
Стадия D: 4-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутан-1-ол
К охлажденному на бане со льдом раствору 3-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутановой кислоты (5,2 г, 10,3 ммоль) в безводном THF (100 мл) медленно добавляли комплекс боран-тетрагидрофуран (12,3 мл 1 M раствора в THF, 12,3 ммоль), и оставляли полученную смесь нагреваться до комнатной температуры и перемешивали в течение 3 суток. Смесь гасили добавлением метанола (5 мл), разбавляли нас. NaCl (200 мл) и экстрагировали EtOAc (2×150 мл); объединенные EtOAc слои сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco: 120 г; элюент: градиент 0-100% EtOAc в гексанах) с получением указанного в заголовке соединения (1,73 г, 34%) в виде прозрачного масла. 1H-ЯМР (CDCl3) δ 7,40-7,28 (15H, м), 4,79 (2H, м), 4,71 (1H, д, J=12,1 Гц), 4,66 (2H, м), 4,54 (1H, д, J=11,9 Гц), 3,99 (1H, м), 3,93 (1H, м), 3,80 (3H, м), 3,65 (2H, т, J=6,5 Гц), 1,67 (2H, м), 1,60-1,41 (4H, м), 1,30 (3H, д, J=6,6 Гц).
Стадия E: 4-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутаналь
К раствору 4-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутан-1-ола (1,73 г, 3,53 ммоль) в DCM (50 мл) добавляли реагент Десс-Мартина (2,24 г, 5,29 ммоль), и перемешивали полученную смесь при комнатной температуре в течение 3 часов. Смесь промывали нас. NaHCO3 (100 мл); сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco: 80 г; элюент: градиент 0-80% EtOAc в гексанах) с получением указанного в заголовке соединения (1,24 г, 72%). 1H-ЯМР (CDCl3) δ 9,77 (1H, с), 7,40-7,28 (15H, м), 4,80 (1H, д, J=12,0 Гц), 4,78 (1H, J=12,0 Гц), 4,71 (1H, д, J=12,0 Гц), 4,66 (2H, м), 4,54 (1H, д, J=11,8 Гц), 3,98 (1H, м), 3,92 (1H, м), 3,83-3,76 (3H, м), 2,43 (2H, м), 1,80-1,63 (2H, м), 1,62-1,48 (2H, м), 1,30 (3H, д, J=6,6 Гц).
Стадия F: 4-(2-{([α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил]окси)этил}{6-(2,5-диоксопирролидин-1-ил)-6-оксогексил}амино)бутил-α-L-фукопиранозид
Получали из 4-(2,3,4-три-O-бензил-α-L-фукопиранозил)бутаналя в соответствии с методиками, изложенными для ML-57. UPLC способ B: рассчитано для C40H68N2O24 960,42, обнаружено m/e: 961,48 [M+1]; Rt=3,46 мин.
Пример 59
Описан синтез олигосахаридного линкера, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-α-D-маннопиранозида (ML-59), характеризующегося следующей структурой.
 ML-59
ML-59
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-36, заменяя 2-аминоэтил-3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид 2-аминоэтил-2,3,4,6-тетра-O-ацетил-α-D-маннопиранозидом на стадии F. UPLC способ B: рассчитано для C27H46N2O14 622,29, обнаружено m/e=623,3231 [M+1]; Rt=1,16 мин.
Пример 60
Описан синтез олигосахаридного линкера, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-β-D-маннопиранозида (ML-60), характеризующегося следующей структурой.
 ML-60
ML-60
Стадия A: бензил(2-((4,6-ди-O-бензоил-β-D-галактопиранозил)окси)этил)карбамат
К бензил(2-((4,6-ди-O-бензоил-β-D-галактопиранозил)окси)-этил)карбамату (9,4 г, 26,3 ммоль) добавляли 3 г 4Å измельченных молекулярных сит, и суспендировали смесь в безводном толуоле (100 мл). К этой смеси добавляли оксид дибутилолова (IV) (14,21 г, 57,1 ммоль), и нагревали полученную смесь при 95°C в течение 5 часов. Смесь оставляли охлаждаться до комнатной температуры, затем охлаждали на бане со льдом, и по каплям добавляли бензоилхлорид (6,66 мл, 57,3 ммоль). Формировался мелкодисперсный белый осадок, добавляли безводный ацетонитрил (15 мл), и перемешивали при комнатной температуре в течение 48 ч. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле (Teledyne Isco: 330 г; элюент: 0-50% EtOAc в гексанах (8 объемов колонки); и 50% EtOAc в гексанах (10 объемов колонки)) с получением указанного в заголовке соединения (11,56 г, 78%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ 8,11 (2H, д, J=7,7 Гц), 8,04 (2H, дд, J=7,9 и 1,4 Гц), 7,58 (2H, м), 7,45 (4H, м), 7,36-7,29 (5H, м), 5,53 (1H, м), 5,14 (1H, дд, J=10,1 и 3,3 Гц), 5,06 (2H, с), 4,64 (1H, дд, J=11,5 и 6,3 Гц), 4,55 (1H, дд, J=11,5 и 6,6 Гц), 4,4 (1H, д, J=7,7 Гц), 4,24 (1H, т, J=4,2 Гц), 4,08 (1H, т, J=8,8 Гц), 3,93 (2H, м), 3,76 (1H, м), 3,48 (1H, м), 3,37 (1H, м), 3,28 (1H, д, J=3,3 Гц), 2,80 (1H, д, J=5,3 Гц).
Стадия B: бензил(2-((((3,5-бис(трифторметил)сульфонил)окси)-4,6-ди-O-бензоил-β-D-галактопиранозил)окси)этил)карбамат
К раствору бензил(2-((4,6-ди-O-бензоил-β-D-галактопиранозил)окси)этил)карбамата (11,56 г, 20,44 ммоль) в DCM (200 мл), охлажденному до -15°C, добавляли пиридин (21,5 мл, 266 ммоль), затем медленно добавляли трифторметансульфоновый ангидрид (10,36 мл, 61,3 ммоль), и оставляли полученную смесь нагреваться до 0°C в течение 3 часов. Смесь дополнительно разбавляли DCM (200 мл) и промывали ледяным 1н HCl (500 мл), ледяным нас. NaHCO3 (500 мл) и ледяным нас. NaCl (500 мл); сушили над Na2SO4, фильтровали и упаривали с получением указанного в заголовке соединения (16,9 г, 100%) в виде желтой пены. 1H-ЯМР (CDCl3) δ 8,16 (2H, дд, J=8,0 и 1,4 Гц), 8,04 (2H, дд, J=8,1 и 1,4 Гц), 7,65 (2H, м),7,52 (2H, м), 7,50 (2H, м), 7,39 (4H, м), 7,33 (1H, м), 5,55 (1H, дд, J=10,4 и 3,1 Гц), 5,50 (1H, д, J=3,1 Гц), 5,35 (1H, т, J=6,4 Гц), 5,14 (2H, с), 5,12 (1H, м), 4,77 (1H, д, J=7,9 Гц), 4,73 (1H, м), 4,28 (2H, м), 4,06 (1H, м), 3,80 (1H, м), 3,55 (1H, м), 3,47 (1H, м).
Стадия C: бензил(2-((3,5-ди-O-ацетил-4,6-ди-O-бензоил-β-D-маннопиранозил)окси)этил)карбамат
К раствору бензил(2-((((3,5-бис(трифторметил)сульфонил)-окси)-4,6-ди-O-бензоил-β-D-галактопиранозил)окси)этил)карбамата (16,9 г, 20,37 ммоль) в безводном толуоле (100 мл) добавляли раствор ацетата тетрабутиламмония (25 г, 82,9 ммоль) в смеси толуола (150 мл) и DMF (4 мл), и перемешивали полученную смесь при комнатной температуре в течение ночи. Разбавляли CH2Cl2 (30 мл) и промывали нас. NaCl (2×100 мл), сушили над MgSO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле (Teledyne Isco: 330 г; элюент: 0-50% EtOAc в гексане (10 объемов колонки), затем 50% EtOAc в гексане (5 объемов колонки)) с получением указанного в заголовке соединения (8 г, 60,5%). 1H-ЯМР (CDCl3) δ 8,10 (2H, м), 7,98 (2H, дд, J=8,1 и 1,4 Гц), 7,61 (2H, м), 7,48 (2H, т, J=7,8 Гц), 7,46 (2H, т, J=7,7 Гц), 7,37 (4H, м), 7,33 (1H, м), 5,70 (1H, д, J=3,3 Гц), 5,61 (1H, т, J=10,0 Гц), 5,29 (1H, дд, J=10,0 и 3,3 Гц), 5,26 (1H, м), 5,10 (2H, с), 4,79 (1H, с), 4,64 (1H, дд, J=12,1 и 2,7 Гц), 4,47 (1H, дд, J=12,1 и 5,8 Гц), 3,94 (2H, м), 3,74 (1H, м), 3,48 (1H, м), 3,37 (1H, м), 2,15 (3H, с), 2,00 (3H, с).
Стадия D: 2-аминоэтил-3,5-ди-O-ацетил-4,6-ди-O-бензоил-β-D-маннопиранозид
К продутому азотом раствору бензил(2-((3,5-ди-O-ацетил-4,6-ди-O-бензоил-b-D-маннопиранозил)окси)этил)карбамата (8 г, 12,31 ммоль) в EtOAc (100 мл) добавляли 10% палладированный уголь (1,31 г), и перемешивали полученную смесь в атмосфере подаваемого из баллона водорода в течение ночи. Смесь фильтровали через целит, и упаривали фильтрат с получением указанного в заголовке соединения (6,3 г, 99%) в виде светло-желтой пены. 1H-ЯМР (CDCl3) δ 8,11 (2H, м), 7,90 (2H, м), 7,60 (2H, м), 7,47 (4H, м), 5,72 (1H, ддд, J=9,2, 3,2 и 1,1 Гц), 5,59 (1H, т, J=9,7 Гц), 5,33 (1H, ддд, J=10,1, 4,8 и 3,3 Гц), 4,85 (1H, дд, J 16,0 и 1,1 Гц), 4,65 (1H, м), 4,45 (1H, ддд, J=12,1, 5,7 и 2,0 Гц), 3,95 (2H, м), 3,73 (1H, м), 3,09 (2H, ушир. с), 2,90 (1H, м), 2,15 (3H, с), 1,99 (3H, с).
Стадия E: 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}[3-(α-L-фукопиранозил)пропил]амино)этил-a-D-маннопиранозид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-36, заменяя 2-аминоэтил-3,4,6-три-O-ацетил-2-(ацетиламино)-2-дезокси-β-D-глюкопиранозид 2-аминоэтил-3,5-ди-O-ацетил-4,6-ди-O-бензоил-β-D-маннопиранозидом на стадии F. UPLC способ B: рассчитано для C27H46N2O14 622,29, обнаружено m/e=623,3536 [M+1]; Rt=1,13 мин.
Пример 61
Описан синтез олигосахаридного линкера, 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}-2-[(α-L-фукопиранозил)окси]этил)-α-D-маннопиранозида (ML-61), характеризующегося следующей структурой.
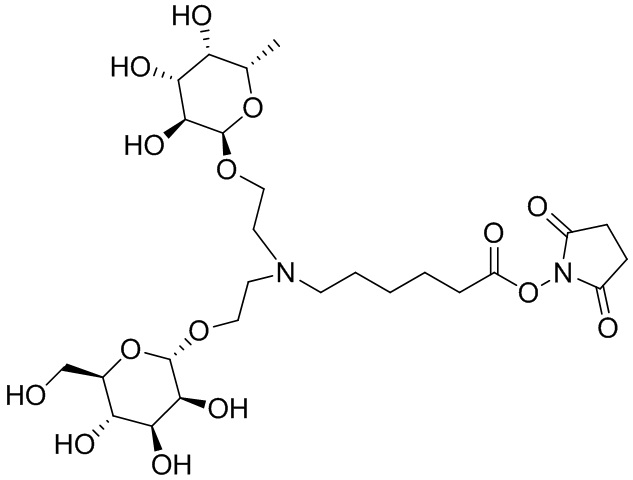 ML-61
ML-61
Стадия A: 2-{[2-(2,3,4-три-O-ацетил-α-L-фукопиранозил)этил]амино}этил-2,3,4,6-тетра-O-ацетил-α-D-маннопиранозид
К смеси 2-оксоэтил-2,3,4,6-тетра-O-ацетил-α-D-маннопиранозида (1,3 г, 3,33 ммоль) и 2-аминоэтил-2,3,4-три-O-ацетил-α-L-фукопиранозида (2,22 г, 6,7 ммоль) в безводном DCM (20 мл) добавляли TFA (0,257 мл, 3,3 ммоль), перемешивали смесь при комнатной температуре в течение 10 мин, затем добавляли триацетоксиборгидрид натрия (1,41 г, 6,66 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. Смесь упаривали, и распределяли остаток между EtOAc (50 мл) и нас. NaHCO3 (100 мл); органический слой промывали нас. NaCl (50 мл); сушили над Na2SO4; фильтровали и упаривали. Остаток очищали методом колоночной хроматографии с обращенной фазой на силикагеле (Teledyne Isco: C18, 275 г; элюент: градиент 10-100% CH3CN в воде) с получением указанного в заголовке соединения (667 мг, 28%). 1H-ЯМР (CDCl3) δ 5,37 (1H, дд, J=10,0 и 3,5 Гц), 5,32 (1H, д, J=9,8 Гц), 5,29 (1H, дд, J=3,4 и 1,9 Гц), 5,26 (1H, дд, J=3,5 и 1,1 Гц), 5,20 (1H, dd J=10,5 и 7,9 Гц), 5,04 (1H, дд, J 10,5 и 3,4 Гц), 4,87 (1H, д, J=1,8 Гц), 4,50 (1H, д, J=7,9 Гц), 4,32 (1H, дд, J=12,3 и 2,5 Гц), 4,13 (1H, дд, J=12,2 и 2,5 Гц), 4,04 (1H, м), 4,00 (1H, м), 3,86-3,79 (2H, м), 3,69 (1H, м), 3,59 (1H, м), 2,91-2,85 (4H, м), 2,19 (3H, с), 2,18 (3H, с), 2,13 (3H, с), 2,09 (3H, с), 2,07 (3H, с), 2,02 (3H, с), 2,01 (3H, с), 1,25 (3H, д, J=6,4 Гц).
Стадия B: бензил-6-{[2-(2,3,4-три-O-ацетил-α-L-фукопиранозил)этил](2-{[-2,3,4,6-тетра-O-ацетил-a-D-маннопиран]окси}этил)амино}гексаноат
К раствору 2-{[2-(2,3,4-три-O-ацетил-α-L-фукопиранозил)этил]амино}этил-2,3,4,6-тетра-O-ацетил-a-D-маннопиранозида (667 мг, 0,943 ммоль) и бензил-6-оксогексаноата (311 мг, 1,41 ммоль) в DCM (6 мл) добавляли уксусную кислоту (0,054 мл, 0,943 ммоль), перемешивали смесь при комнатной температуре в течение 10 мин, затем добавляли триацетоксиборгидрид натрия (400 мг, 1,89 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. Методом UPLC-MS обнаруживали завершение преобразования. Смесь упаривали, и распределяли остаток между EtOAc (30 мл) и нас. NaHCO3 (40 мл); органический слой промывали нас. NaCl (20 мл); сушили над Na2SO4, фильтровали и упаривали. Остаток очищали методом колоночной хроматографии с обращенной фазой на силикагеле (Teledyne Isco: C18, 40 г; элюент: градиент 5-100% CH3CN в воде) с получением указанного в заголовке соединения (434 мг, 50%). 1H-ЯМР (CDCl3) δ 7,37 (5H, м), 5,35 (1H, дд, J=9,9 и 3,1 Гц), 5,32 (1H, д, J=9,2 Гц), 5,25 (2H, дд, J=3,2 и 1,7 Гц), 5,19 (1H, дд, J=10,5 и 7,9 Гц), 5,14 (2H, с), 5,04 (1H, дд, J=10,4 и 3,5 Гц), 4,85 (1H, д, J=1,7 Гц), 4,51 (1H, д, J=7,9 Гц), 4,32 (1H, дд, J=12,2 и 5,1 Гц), 4,12 (1H, дд, J=12,2 и 2,5 Гц), 4,04 (1H, м), 3,93 (1H, дт, J=9,9 и 5,9Гц), 3,85 (1H, м), 3,72 (1H, дт, J=10,1 и 6,0 Гц), 3,59 (1H, дт, J=9,9 и 6,6 Гц), 3,51 (1H, м), 2,74-2,71 (4H, м), 2,50 (2H, т, J=7,4 Гц), 2,39 (2H, т, J=7,5 Гц), 2,19 (3H, с), 2,18 (3H, с), 2,13 (3H, с), 2,07 (3H, с), 2,06 (3H, с), 2,01 (3H, с), 2,00 (3H, с), 1,70-1,66 (4H, м), 1,44 (2H, м), 1,32 (2H, м), 1,24 (3H, д, J=6,4 Гц).
Стадия C: 2-({6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}-2-[(α-L-фукопиранозил)окси]этил)-α-D-маннопиранозид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-35 на стадии B, заменяя бензил-6-(бис{2-[(2,3,4-три-O-бензоил-α-L-фукопиранозил)окси]этил}амино)гексаноат бензил-6-{[2-(2,3,4-три-O-ацетил-α-L-фукопиранозил)этил](2-{[-2,3,4,6-тетра-O-ацетил-a-D-маннопиран]окси}этил)амино}гексаноатом. UPLC способ B: рассчитано для C26H44N2O15 624,27, обнаружено m/e=625,2990 [M+1]; Rt=1,12.
Пример 62
Описан синтез олигосахаридного линкера, N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}-1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}пирролидин-(2R,5R)--2,5-дикарбоксамида (ML-62), характеризующегося следующей структурой.
 ML-62
ML-62
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6, заменяя 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусную кислоту (2R,5R)-пирролидин-2,5-дикарбоновой кислотой на стадии C. UPLC способ B: m/e=736,36 [M+1]; Rt=2,22 мин.
Пример 63
Описан синтез олигосахаридного линкера, N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}-1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}(пиперидин-4,4-диил)диацетамида (ML-63), характеризующегося следующей структурой.
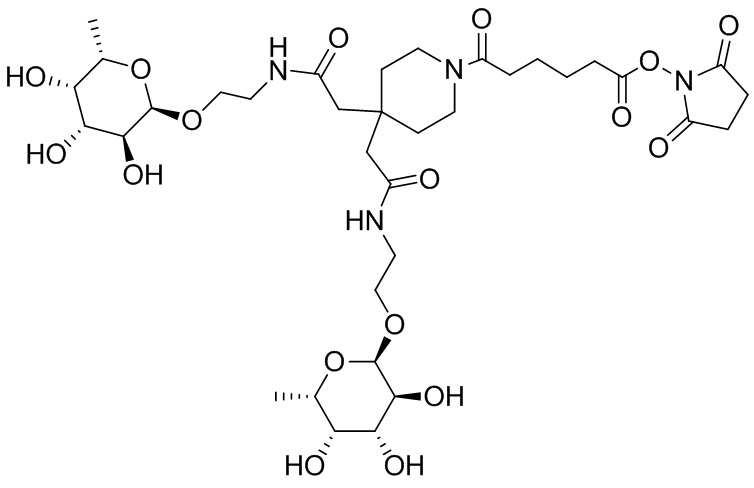 ML-63
ML-63
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-6, заменяя 2,2'-{[6-(бензилокси)-6-оксогексаноил]имино}диуксусную кислоту 2,2'-(пиперидин-4,4-диил)диуксусной кислотой на стадии C. UPLC способ B: m/e=805,38 [M+1]; Rt=2,35 мин.
Пример 64
Описан синтез олигосахаридного линкера, 1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексаноил}-N,N'-бис{2-[(α-L-фукопиранозил)окси]этил}пиперидин-цис-3,4-дикарбоксамида (ML-64), характеризующегося следующей структурой.
 ML-64
ML-64
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-17, заменяя 3,5-пиридиндикарбоновую кислоту в качестве исходного вещества 3,4-пиридиндикарбоновой кислотой на стадии A. UPLC способ F: m/e=777,3660 [M+1]; Rt=2,15 мин.
Пример 65
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-((3R,4R)-3,4-бис((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)карбамоил)пиперидин-1-ил)гексаноата (ML-65), характеризующегося следующей структурой.
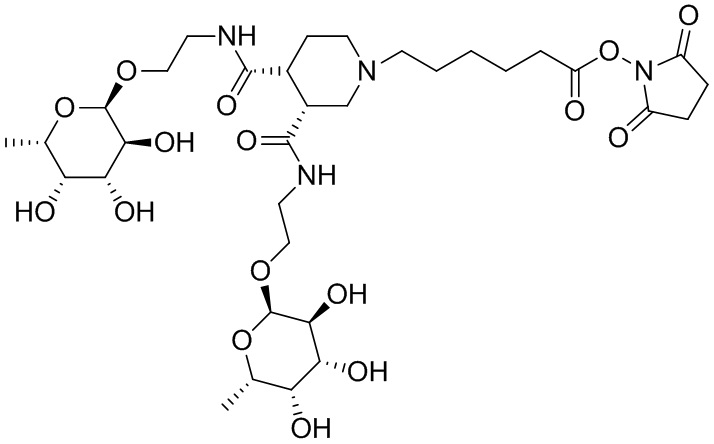 ML-65
ML-65
Стадия A: (3R,4R)-N3,N4-бис(2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)пиперидин-3,4-дикарбоксамид
Указанное в заголовке соединение получали с использованием методики, аналогичной описанной для ML-17 на стадиях A и B, заменяя 3,5-пиридиндикарбоновую кислоту в качестве исходного вещества 3,4-пиридиндикарбоновой кислотой на стадии A. UPLC способ F: m/e=552,2733 [M+1]; Rt=1,37 мин.
Стадия B: бензил-6-((3R,4R)-3,4-бис((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)карбамоил)пиперидин-1-ил)гексаноат
(3R,4R)-N3,N4-бис(2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)пиперидин-3,4-дикарбоксамид (118 мг, 0,214 ммоль) растворяли в THF (2 мл), добавляли к нему бензил-6-оксогексаноат (70,7 мг, 0,321 ммоль) в THF (0,5 мл), затем добавляли триацетоксиборгидрид натрия (136 мг, 0,642 ммоль) и уксусную кислоту (3,67 мкл, 0,064 ммоль), и перемешивали смесь при комнатной температуре в течение 3 ч. Продукт разделяли методом препаративной хроматографии с обращенной фазой на колонке C18 с использованием градиента 0-30% AcN в воде. UPLC способ F: m/e=756,4241 [M+1]; Rt=3,05 min
Стадия C: синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-((3R,4R)-3,4-бис((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)карбамоил)пиперидин-1-ил)гексаноата
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-1 на стадиях C и D, заменяя бензил-6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексаноат бензил-6-((3R,4R)-3,4-бис((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)карбамоил)пиперидин-1-ил)гексаноатом на стадии C и заменяя 6-({2-[(α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)окси]этил}амино)-6-оксогексановую кислоту 6-((3R,4R)-3,4-бис((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)карбамоил)пиперидин-1-ил)гексановой кислотой на стадии D: UPLC способ F: m/e=763,7796 [M+1]; Rt=2,15 мин.
Пример 66
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-((2R,5R)-2,5-бис((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)карбамоил)пиперидин-1-ил)-6-оксогексаноата (ML-66), характеризующегося следующей структурой.
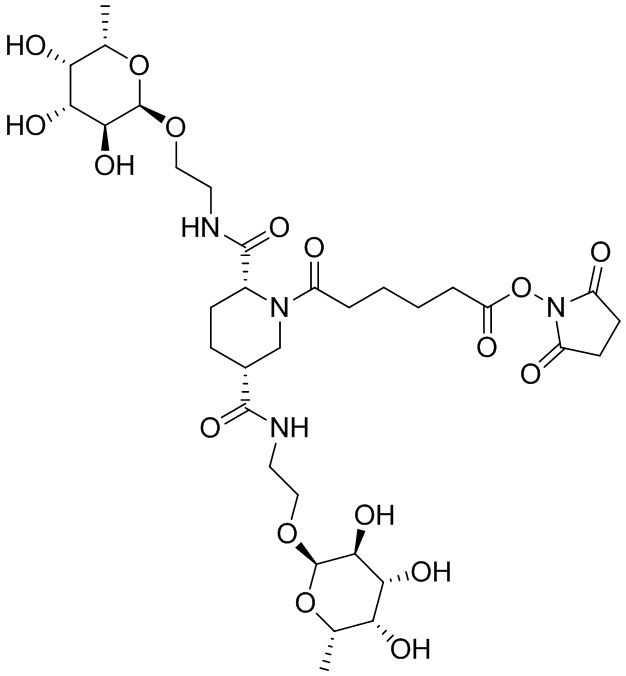 ML-66
ML-66
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-17, заменяя 3,5-пиридиндикарбоновую кислоту 2,5-пиридиндикарбоновой кислотой в качестве исходного вещества на стадии A. UPLC способ A: UPLC m/e=777,0 [M+1]; Rt=0,5 мин.
Пример 67
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-(((R)-1,4-диоксо-1-((2-(((2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)этил)амино)-4-((2-(((2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-метилтетрагидро-2H-пиран-2-ил)окси)этил)амино)бутан-2-ил)амино)-6-оксогексаноата (ML-67), характеризующегося следующей структурой.
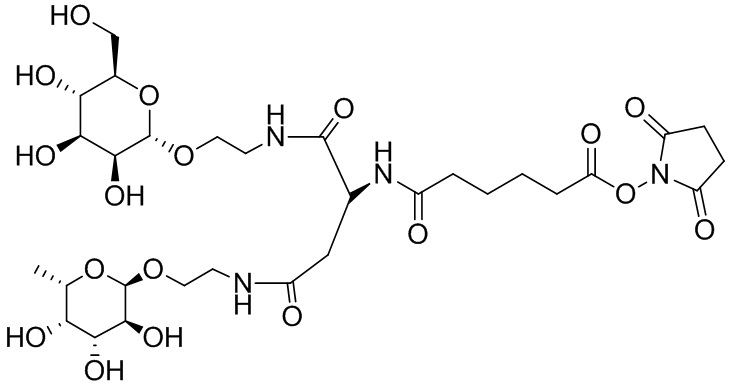 ML-67
ML-67
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-20, заменяя Z-ASP(OBZL)-OH на Z-Glu-γ-Bn и заменяя 2-аминоэтил-α-D-маннопиранозид 2-аминоэтил-α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозидом на стадии A. UPLC способ B: m/e=753,26 [M+1]; Rt=1,59 мин.
Пример 68
Описан синтез олигосахаридного линкера, (ML-68), характеризующегося следующей структурой.
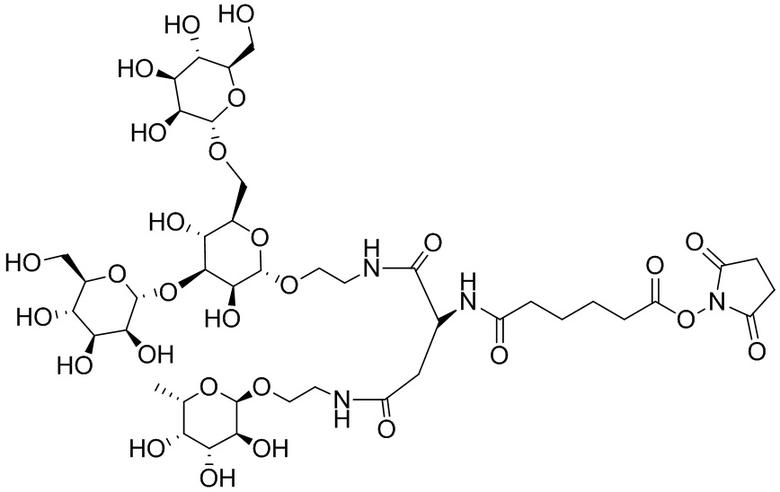 ML-68
ML-68
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-20, заменяя Z-ASP(OBZL)-OH на Z-Glu-γ-Bn на стадии A. UPLC способ B: m/e=1077,52 [M+1]; Rt=2,93 мин.
Пример 69
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-(2-(бис(-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноата (ML-69), характеризующегося следующей структурой.
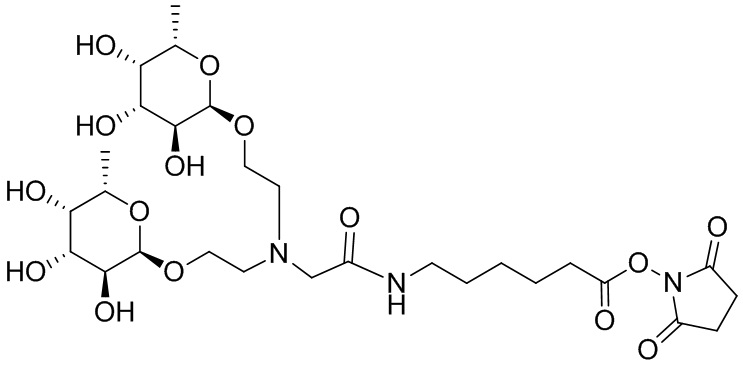 ML-69
ML-69
Стадия A: 1,2,3,4-тетракис(окси)тетракис(триметилсилан)-L-фукоза
К раствору L-фукозы (4,0 г, 24,37 ммоль, 1,0 экв.) в DMF (25 мл) при 0°C добавляли TEA (17,32 мл, 124 ммоль, 5,1 экв.). К описанной выше смеси по каплям добавляли TMS-Cl (15,88 мл, 125 ммоль, 5,1 экв.). Затем, реакционную смесь нагревали до к.т. и перемешивали при к.т. в течение 4 ч. Реакционную смесь вливали в смесь льда и гексанов (100 мл, 1/1). Смесь экстрагировали гексаном (3×100 мл). Органическую фазу промывали водой (3×10 мл), сушили над MgSO4, фильтровали. Фильтрат концентрировали и сушили в условиях высокого вакуума с получением указанного в заголовке соединения в виде бесцветного масла (8,7 г, 19,2 ммоль, 79%). 13C NMR (CDCl3, 125МГц) δ 94,5 (1C), 70,6 (1C), 69,6 (1C), 66,6 (1C), 39,6 (4C), 16,7 (Me), 0,67 (3Me), 0,43 (3Me), 0,29 (3Me), 0,16 (3Me); 1H-ЯМР (CDCl3, 500 МГц) δ 5,0 (с, 1H), 4,0 (м, 1H), 3,8 (1H), 3,6 (1H), 1,0 (д, 3H), 0-0,2 (м, 36H).
Стадия B: бензил-6-(2-(бис(2-гидроксиэтил)амино)ацетамидо)гексаноат
К раствору 2-(бис(2-гидроксиэтил)амино)уксусной кислоты (500 мг, 3,06 ммоль, 1,0 экв.) в DMF (10 мл) при 0°C добавляли TSTU (1107 мг, 3,68 ммоль, 1,2 экв.), а затем TEA (0,512 мл, 3,68 ммоль, 1,2 экв.). Реакционную смесь нагревали до к.т. и перемешивали при этой температуре в течение 2 ч. К описанной выше смеси добавляли материал, полученный на стадии А (L-000503048-001W001) (1447 мг, 3,68 ммоль, 1,2 экв.), предварительно смешанное с TEA (0,512 мл, 3,66 ммоль). Реакционную смесь перемешивали при к.т. в течение 18 ч. Методом UPLC обнаруживали формирование целевого продукта. В условиях пониженного давления удаляли DMF. Неочищенное вещество очищали методом хроматографии с обращенной фазой на C18 (элюировали 0-30% ACN в воде, 16 объемов колонки). Содержащие целевой продукт фракции объединяли, концентрировали и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного сиропа. UPLC способ B: m/e=367,2356 [M+1]; Rt=3,54 мин.
Стадия C: бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноат
К раствору бензил-6-(2-(бис(2-гидроксиэтил)амино)ацетамидо)гексаноата (210 мг, 0,573 ммоль, 1,0 экв.) в DCM (10 мл) при 0°C добавляли TBAI (1820 мг, 4,93 ммоль, 8,6 экв.) и DIPEA (0,500 мл, 2,87 ммоль, 5,0 экв.). Смесь нагревали до к.т. и перемешивали при к.т. в течение 30 мин. К описанному выше раствору по каплям добавляли 1,2,3,4-тетракис(окси)тетракис(триметилсилан)-L-фукозу (1557 мг, 3,44 ммоль, 6,0 экв.) с йодтриметилсиланом (0,390 мл, 2,87 ммоль, 5,0 экв.) в DCM (10 мл). Смесь перемешивали при к.т. в течение 18 ч. Методом UPLC обнаруживали формирование целевого продукта. Удаляли DCM и добавляли MeOH (10 мл) и смолу Dowex H+ до достижения pH~2. Перемешивали при к.т. в течение 1 ч, и фильтровали через слой целита. Фильтрат концентрировали и очищали методом хроматографии с обращенной фазой на C18 (элюировали 0-30% ACN в воде, 16 объемов колонки). Содержащие целевой продукт фракции объединяли, концентрировали и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного сиропа (40 мг, 0,061 ммоль, 10,6%). UPLC способ B: m/e=659,3745 [M+1]; Rt=3,36 мин.
Стадия D: 6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексановая кислота
К раствору бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноата (40 мг, 0,061 ммоль) в воде (5 мл), добавляли Pd/C (30,5 мг, 0,029 ммоль). Реакционную смесь перемешивали в атмосфере подаваемого из баллона H2 в течение 18 ч. Методом UPLC обнаруживали формирование целевого продукта. Описанный выше раствор разбавляли MeOH (5 мл), фильтровали через слой целита, концентрировали и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного сиропа (20 мг, 6,1%). UPLC способ B: m/e=569,3191 [M+1]; Rt=1,93 мин.
Стадия E: 2,5-диоксопирролидин-1-ил-6-(2-(бис(-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноат
К раствору 6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)-амино)ацетамидо)гексановой кислоты (20 мг, 0,037 ммоль, 1,0 экв.) в DMF (1 мл) добавляли TSTU (16,68 мг, 0,055 ммоль, 1,5 экв.), а затем основание Хунига (7,74 мкл, 0,044 ммоль, 1,2 экв.). Реакционную смесь перемешивали при к.т. в течение 1 ч. Методом TLC (EtOAc/MeOH/ACN/вода=4/1/1/1) обнаруживали отсутствие оставшего исходного вещества. Методом UPLC обнаруживали формирование продукта. Удаляли DMF в условиях пониженного давления. Неочищенный продукт использовали без очистки. UPLC способ B: m/e=666,3351 [M+1]; Rt=2,28 мин.
Пример 70
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-(2-(бис(-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексаноата (ML-70), характеризующегося следующей структурой.
 ML-70
ML-70
Стадия A: бензил-6-(бис(3-гидроксипропил)амино)-6-оксогексаноат
К раствору 3,3'-азандиилбис(пропан-1-ола) (1000 мг, 7,51 ммоль, 1,0 экв.) в DMF (10 мл) добавляли бензил(2,5-диоксопирролидин-1-ил)адипат (2503 мг, 7,51 ммоль, 1,0 экв.), а затем TEA (1,046 мл, 7,51 ммоль, 1,0 экв.). Реакционную смесь перемешивали при 25°C в течение 18 ч. Методом UPLC обнаруживали формирование целевого продукта. В условиях пониженного давления удаляли DMF. Неочищенное вещество очищали методом хроматографии с обращенной фазой на C18 (элюировали 0-40% ACN в воде, 16 объемов колонки). Содержащие целевой продукт фракции объединяли и концентрировали с получением указанного в заголовке соединения в виде бесцветного масла (1,55 г, 4,41 ммоль, 58,7%). UPLC способ B: m/e=352,2171 [M+1]; Rt=3,47 мин. 1H-ЯМР (CDCl3, 500 МГц) δ 7,3-7,5 (м, 5H), 5,15 (м, 2H), 3,65 (м, 2H), 3,40 (м, 5H), 2,66 (с, 3H), 2,45 (м, 3H), 2,29 (с, 1H), 1,84 (с, 1H), 1,70 (м, 7H).
Стадия B:: бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-гидроксиэтил)амино)ацетамидо)гексаноат бензил-6-(бис(3-гидроксипропил)амино)-6-оксогексаноатом на стадии C. UPLC способ B: m/e=644,3454 [M+1]; Rt=3,28 мин.
Стадия C: 6-(2-(бис(2-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексановая кислота
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноат бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексаноатом на стадии D. UPLC способ B: m/e=554,3076 [M+1]; Rt=2,13 мин.
Стадия E: 2,5-диоксопирролидин-1-ил-6-(2-(бис(-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя 6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексановую кислоту 6-(2-(бис(2-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексановой кислотой на стадии E. UPLC способ B: m/e=651,3166 [M+1]; Rt=2,41 мин.
Пример 71
Описан синтез олигосахаридного линкера, бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)бутил)амино)ацетамидо)гексаноата (ML-71), характеризующегося следующей структурой.
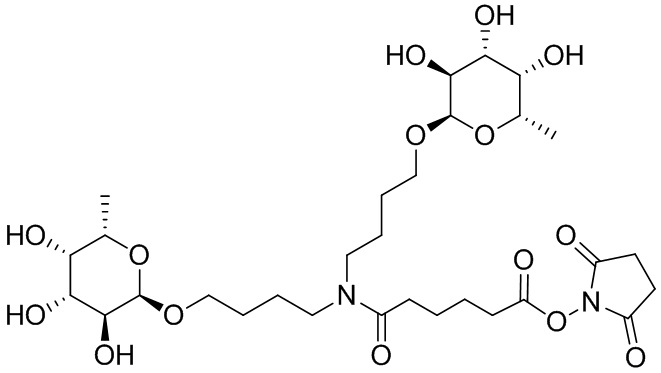 ML-71
ML-71
Стадия A: 4-(бензилокси)-N-(4-(бензилокси)бутил)бутанамид
К раствору 4-(бензилокси)бутановой кислоты (1 г, 5,15 ммоль, 1,0 экв.) в DMF (5 мл) при 0°C добавляли TSTU (1,627 г, 5,41 ммоль, 1,05 экв.), а затем TEA (0,718 мл, 5,15 ммоль, 1,0 экв.). Реакционную смесь нагревали до к.т. и перемешивали при к.т. в течение 2 ч. К описанной выше реакционной смеси добавляли 4-(бензилокси)бутан-1-амин (0,969 г, 5,41 ммоль, 1,05 экв.), а затем TEA (0,718 мл, 5,15 ммоль, 1,0 экв.). Реакционную смесь перемешивали при к.т. в течение 18 ч. Методом LC-MS обнаруживали формирование целевого продукта. В условиях пониженного давления удаляли DMF. Неочищенное вещество очищали на колонке с силикагелем (120 г, элюировали 0-15% MeOH в DCM, 16 объемов колонки). Содержащие целевой продукт фракции объединяли и концентрировали с получением указанного в заголовке соединения (1,65 г, 4,64 ммоль, выход 90%). LC-MS способ A: m/e=356,70 [M+1]; Rt=1,22 мин. 1H-ЯМР (CDCl3, 500 МГц) δ 7,2-7,4 (м, 10H), 5,98 (с, 1H), 4,51 (м, 4H), 3,53 (м, 4H), 3,24 (м, 2H), 2,28 (м, 2H), 1,96 (м, 2H), 1,5-1,7 (м, 4H).
Стадия B: бис(4-(бензилокси)бутил)амин
В круглодонной колбе емкостью 200 мл к раствору 4-(бензилокси)-N-(4-(бензилокси)бутил)бутанамида (1,65 г, 4,64 ммоль) в THF (5 мл) при 0°C по каплям добавляли BH3·THF (13,93 мл, 13,93 ммоль). Реакционную смесь нагревали до к.т. и перемешивали при к.т. в течение 18 ч. Методом TLC обнаруживали формирование продукта и исчезновение исходного вещества. Реакционную смесь гасили добавлением насыщенного водного NH4Cl. Смесь концентрировали, разбавляли EtOAc, встряхивали с 1н HCl, а также промывали бикарбонатом, солевым раствором и водой. Органический слой сушили над MgSO4, фильтровали и концентрировали. Неочищенное вещество использовали на следующей стадии без очистки. LC-MS способ A: m/e=341,00 [M+1]; Rt=1,06 мин.
Стадия C: 4,4'-азандиилбис(бутан-1-ол)
К раствору бис(4-(бензилокси)бутил)амина (300 мг, 0,879 ммоль) в смеси диоксан (5 мл)/вода (5 мл) добавляли Pd(OH)2 (30,8 мг, 0,044 ммоль). Реакционную смесь перемешивали в атмосфере H2 при давлении 40 фунт/кв.дюйм в течение 18 ч. Методом LC-MS обнаруживали отсутствие исходного вещества и формирование целевого продукта. Смесь фильтровали через слой целита и промывали диоксаном/водой (10 мл, 1/1). Фильтрат концентрировали и сушили в условиях высокого вакуума с получением указанного в заголовке соединения (130 мг, 0,806 ммоль, выход 92%). LC-MS способ A: m/e=162,01 [M+1]; Rt=0,18 мин.
Стадия D:: бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)бутил)амино)ацетамидо)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-гидроксиэтил)амино)ацетамидо)гексаноат бензил-6-(бис(3-гидроксибутил)амино)-6-оксогексаноатом на стадии C. UPLC способ B: m/e=644,3454 [M+1]; Rt=3,28 мин.
Стадия E: 6-(2-(бис(2-[(α-L-фукопиранозил)окси)пропил)амино)ацетамидо)гексановая кислота
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноат бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)бутил)амино)ацетамидо)гексаноатом на стадии D. UPLC способ B: m/e=554,3076 [M+1]; Rt=2,13 мин.
Стадия F: 2,5-диоксопирролидин-1-ил-6-(2-(бис(-[(α-L-фукопиранозил)окси)бутил)амино)ацетамидо)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя 6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексановую кислоту 6-(2-(бис(2-[(α-L-фукопиранозил)окси)бутил)амино)ацетамидо)гексановой кислотой на стадии E. UPLC способ B: m/e=651,3166 [M+1]; Rt=2,41 мин.
Стадия G: бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)бутил)амино)ацетамидо)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-гидроксиэтил)амино)ацетамидо)гексаноат бензил-6-(бис(3-гидроксибутил)амино)-6-оксогексаноатом на стадии C. UPLC способ B: m/e=644,3454 [M+1]; Rt=3,28 мин.
Пример 72
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-(2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)карбамоил)циклопропанкарбокси)амино)ацетамидо))гексаноата (ML-72), характеризующегося следующей структурой.
 ML-72
ML-72
Стадия A: 2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)карбамоил)циклопропанкарбоновая кислота
К раствору L-000719504-000X003 (353 мг, 2,027 ммоль) в DMF (10 мл) добавляли EDC (816 мг, 4,26 ммоль) и HOBT (93 мг, 0,608 ммоль). Смесь перемешивали при 25°C в течение 30 мин. К описанной выше смеси добавляли AEF (882 мг, 4,26 ммоль). Смесь перемешивали при 25 в течение 18 ч. Методом UPLC обнаруживали формирование целевого продукта. В условиях пониженного давления удаляли DMF. Неочищенное вещество очищали методом хроматографии с обращенной фазой на C18 (элюировали 0-30% ACN в воде с 0,05% TFA в течение 37 мин). Содержащие целевой продукт фракции объединяли и лиофилизировали с получением указанного в заголовке соединения (80 мг, 0,145 ммоль, выход 7,14%). UPLC способ B: m/e=553,2539 [M+1]; Rt=2,63 мин.
Стадия B:: бензил-6-(2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)карбамоил)циклопропанкарбокси)амино)ацетамидо)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя 2-(бис(2-гидроксиэтил)амино)уксусную кислоту 2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)карбамоил)циклопропанкарбоновой кислотой на стадии B. UPLC способ B: m/e=756,3689 [M+1]; Rt=3,15 мин.
Стадия C: 6-(2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)-карбамоил)циклопропанкарбокси)амино)ацетамидо)гексановая кислота
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноат бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноатом на стадии D. UPLC способ B: m/e=666,3151 [M+1]; Rt=1,23 мин.
Стадия D: 2,5-диоксопирролидин-1-ил-6-(2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)карбамоил)циклопропанкарбокси)амино)ацетамидо))гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя 6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексановую кислоту 6-(2,3-бис-2[2-(α-L-фукопиранозил)оксиэтил)карбамоил)-циклопропанкарбокси)амино)ацетамидо)гексановой кислотой на стадии E. UPLC способ B: m/e=763,3411 [M+1]; Rt=1,99 мин.
Пример 73
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексаноата (ML-73), характеризующегося следующей структурой.
 ML-73
ML-73
Стадия A: per-TMS-D-манноза
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя L-фукозу D-маннозой на стадии A. 1H-ЯМР (CDCl3, 500 МГц) δ 4,9 (с, 1H), 3,5-3,9 (м, 6H), 0-0,3 (м, 45H).
Стадия B: 2,3,4,6-тетра-O-триметилсилан-D-маннопиранозил
К раствору per-TMS-D-маннозы (5,4 г, 9,98 ммоль) в DCM (25 мл) при 0°C добавляли йодтриметилсилан (1,426 мл, 10,48 ммоль). Реакционную смесь нагревали до к.т. и перемешивали при к.т. в течение 1 ч. В условиях пониженного давления удаляли DCM. Промежуточный продукт использовали на следующей стадии без очистки.
Стадия C: 3-йодпропоксил-α-D-маннопиранозид и 3-йодпропоксил-β-D-маннопиранозид
К раствору 2,3,4,6-тетракис(триметилсилан) D-маннопиранозил (2,89 г, 4,99 ммоль) в DCM (10 мл) при 0°C добавляли оксетан (0,488 мл, 7,49 ммоль). Реакционную смесь нагревали до к.т. и перемешивали при к.т. в течение 5 ч. DCM удаляли на роторном испарителе. Смесь растворяли в MeOH (10 мл). К описанному выше раствору добавляли смолу Dowex H+ до достижения pH~2. Смесь перемешивали при к.т. в течение 1 ч. Методом LC-MS обнаруживали формирование целевого продукта. Смесь фильтровали через слой целита, концентрировали и очищали методом хроматографии с обращенной фазой на C8 (элюировали 5-25% ACN в воде с 0,05% TFA в течение 25 мин). Содержащие целевой продукт фракции собирали и лиофилизировали с получением 3-йодпроксил-α-D-маннопиранозида (710 мг, 2,04 ммоль, 40,8%) и 3-йодпропоксил-β-D-маннопиранозида (420 мг, 1,21 ммоль, 24,2%). LC-MS способ A: m/e=696,96 [M+1]; Rt=0,46 мин и Rt=0,53 мин. 1H-ЯМР (CD3OD, 500 МГц) 3-йодпропоксил-β-D-маннопиранозид: δ 4,54 (д, J=0,95 Гц, 1H), 3,95 (м, 1H), 3,88-3,92 (м, 2H), 3,75 (м, 1H), 3,65 (м, 1H), 3,50 (м, 1H), 3,45 (м, 1H), 3,3-3,4 (м, 2H), 3,23 (м, 1H), 2,1 (м, 2H). 1H-ЯМР (CD3OD, 500 МГц) 3-йодпропоксил-α-D-маннопиранозид: δ 4,81 (м, 1H), 3,8-3,9 (м, 3H), 3,6-3,8 (м, 3H), 3,5-3,6 (м, 2H), 3,3-3,4 (м, 2H), 2,1(м, 2H).
Стадия D: α-L-фукопиранозил)этил]амино}пропил-α-D-маннопиранозид
К раствору 3-йодпропоксил-α-D-маннопиранозид (220 мг, 0,632 ммоль) в DMF (5 мл), добавляли AEF (131 мг, 0,632 ммоль) и LiOH (15,13 мг, 0,632 ммоль). Смесь перемешивали при к.т. в течение 24 ч. Методом UPLC обнаруживали формирование продукта. В условиях пониженного давления удаляли DMF. Неочищенное вещество переносили на следующую стадию без очистки. UPLC способ B: m/e=428,2252 [M+1]; Rt=1,02 мин.
Стадия E: бензил-6-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя α-L-фукопиранозил)этил]амино}пропил-α-D-маннопиранозид α-L-фукопиранозил)этил]амино}пропил-α-D-маннопиранозидом на стадии A. UPLC способ B: m/e=646,3233 [M+1]; Rt=3,13 мин.
Стадия F: 6-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексановая кислота
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя бензил-6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексаноат бензил-6-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексаноатом на стадии D. UPLC способ B: m/e=556,2731 [M+1]; Rt=1,77 мин.
Стадия G: 2,5-диоксопирролидин-1-ил-6-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексаноат
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-69, заменяя 6-(2-(бис(2-[(α-L-фукопиранозил)окси)этил)амино)ацетамидо)гексановую кислоту 6-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексановой кислотой на стадии E. UPLC способ B: m/e=653,3008 [M+1]; Rt=2,09 мин.
Пример 74
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-6-оксо-(6-((3-β-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)гексаноат (ML-74), характеризующегося следующей структурой.
 ML-74
ML-74
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-73 заменяя α-D-маннозу β-D-маннопиранозой на стадиях A-F. UPLC способ B: m/e=653,3167 [M+1]; Rt=2,07 мин.
Пример 75
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-8-оксо-(6-((3-β-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)октандиоата (ML-75), характеризующегося следующей структурой.
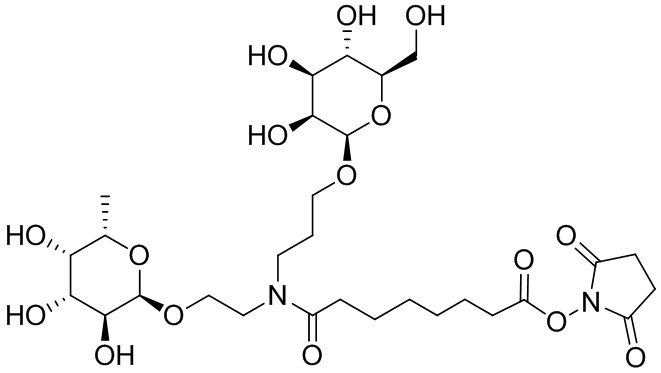 ML-75
ML-75
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-73, α-D-маннозу β-D-маннопиранозой на стадиях A-F и заменяя бензил(2,5-диоксопирролидин-1-ил)адипат бензил-8-(2,5-диоксопирролидин-1-ил)октандиоатом. UPLC способ B: m/e=681,3568 [M+1]; Rt=2,44 мин.
Пример 76
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-8-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)октандиоата (ML-76), характеризующегося следующей структурой.
 ML-76
ML-76
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-73, заменяя бензил(2,5-диоксопирролидин-1-ил)адипат бензил-8-(2,5-диоксопирролидин-1-ил)октандиоатом. UPLC способ B: m/e=681,3456 [M+1]; Rt=2,21 мин.
Пример 77
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-9-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)нонандиоата (ML-77), характеризующегося следующей структурой.
 ML-77
ML-77
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-73, заменяя бензил(2,5-диоксопирролидин-1-ил)адипат бензил-9-(2,5-диоксопирролидин-1-ил)нонандиоатом. UPLC способ B: m/e=695,3532 [M+1]; Rt=2,55 мин.
Пример 78
Описан синтез олигосахаридного линкера, 2,5-диоксопирролидин-1-ил-10-оксо-(6-((3-α-D-маннопиранозил)пропил-α-L-фукопиранозил)этил]амино)декандиоата (ML-78), характеризующегося следующей структурой.
 ML-78
ML-78
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-73, заменяя бензил(2,5-диоксопирролидин-1-ил)адипат бензил-10-(2,5-диоксопирролидин-1-ил)декандиоатом. UPLC способ B: m/e=709,3766 [M+1]; Rt=2,79 мин.
Пример 79
Описан синтез олигосахаридного линкера, 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-маннопиранозил]окси}пропил)-6-оксогексанамида (ML-79), характеризующегося следующей структурой.
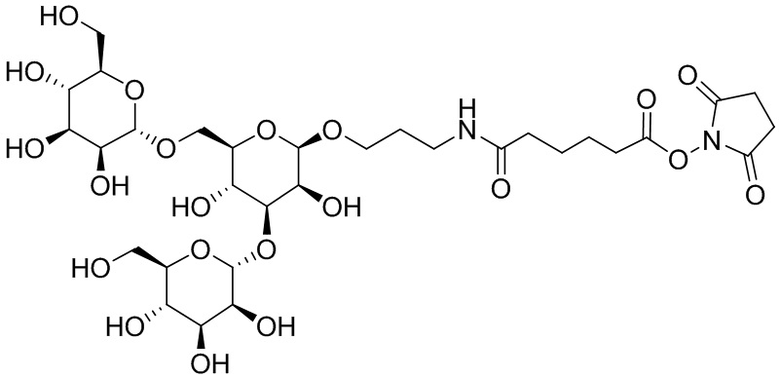 ML-79
ML-79
Стадия A: 3-азидопропоксил-β-D-маннопиранозид
К раствору 3-йодпропоксил-β-D-маннопиранозида (2,0 г, 5,74 ммоль) в DMF (10 мл) добавляли азид натрия (448 мг, 0,448 ммоль). Реакционную смесь нагревали до 60°C и перемешивали при этой температуре в течение 12 ч в атмосфере N2. Методом LC-MS обнаруживали формирование целевого продукта. В условиях пониженного давления удаляли DMF. Неочищенное вещество очищали методом хроматографии с обращенной фазой на C18 (элюировали 0-20% ACN в воде, 16 объемов колонки; затем 100% ACN, 2 объема колонки; 0% ACN, объема колонки). Содержащие целевой продукт фракции объединяли и лиофилизировали с получением указанного в заголовке соединения (1,27 г, 4,82 ммоль, выход 84%). LC-MS способ A: m/e=264,16 [M+1]; Rt=0,21. 1H-ЯМР (CD3OD, 500 МГц): δ 4,53 (м, 1H), 4,02 (м, 1H), 3,97 (м, 2H), 3,65 (м, 2H), 3,56 (м, 1H), 3,48 (м, 3H), 3,22 (м, 1H), 1,92 (м, 2H).
Стадия B: 2,4-бензоил-3-азидопропоксил-β-D-маннопиранозид
К раствору 3-азидопропоксил-β-D-маннопиранозида (1030 мг, 3,91 ммоль) в ацетонитриле (15 мл) добавляли триэтил-орто-бензоат (2,352 мл, 10,17 ммоль), а затем TFA (0,030 мл, 0,391 ммоль) и ACN (0,5 мл). Смесь оставляли перемешиваться при комнатной температуре в течение 1 часа. Удаляли ACN на роторном испарителе. Добавляли TFA (10% в воде) (4,28 мл, 5,55 ммоль). Смесь перемешивали при к.т. в течение 2 часов. Остаток очищали методом колоночной хроматографии на силикагеле, элюируя эфиром в CH2Cl2, с получением указанного выше продукта в виде белого твердого вещества. 1H-ЯМР (CDCl3, 500 МГц): δ 7,0-8,2 (м, 10H), 5,72 (дд, 1H, J=3,4 Гц, J=1,1 Гц), 5,44 (т, 1H, J=9,6 Гц), 4,79 (д, 1H, J=1,1 Гц), 4,16 (дд, 1H, J=3,4 Гц, J=1,1 Гц), 4,00 (м, 1H), 3,88 (м, 1H), 3,82 (м, 1H), 3,66 (м, 2H), 3,31 (м, 2H), 1,82 (м, 2H).
Стадия C: 2-азидопропоксил-2,4-ди-O-бензоил-3,6-O-(2,3,4,6-тетра-O-бензоил-α-D-маннопиранозил)-β-D-маннопиранозид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-2, заменяя 2-азидоэтил-2,4-бис-O-бензоил-6-O-тритил-α-D-маннопиранозид 2,4-бензоил-3-азидопропоксил-β-D-маннопиранозидом на стадии B. 1H-ЯМР (CDCl3, 500 МГц): δ 7,0- 8,3 (м, 50H), 6,2 (м, 2H), 5,95 (м, 2H), 5,85 (м, 2H), 5,70 (м, 1H), 5,35 (м, 2H), 5,22 (с, 1H), 3,0-5,0 (м, 15H), 1,90 (м, 2H).
Стадия D: 6-[(2,5-диоксопирролидин-1-ил)окси]-N-(2-{[α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-β-D-маннопиранозил]окси}пропил)-6-оксогексанамид
Указанное в заголовке соединение получали с использованием методик, аналогичных описанным для ML-2 на стадии D-F. UPLC способ B: m/e=787,3816 [M+1]; Rt=3,39 мин.
Пример 80
Описан синтез A1-защищенного инсулина.
В контейнере подходящего размера, инсулин суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения инсулина. К полученному раствору добавляют защитный реагент, например, этилтрифторацетат или 9-флуоренилметилпентафторфенилкарбонат, чистый или растворенный в органических растворителях, таких как DMSO или DMF. После того, как методом UPLC обнаруживают, что значительная часть реакционной смеси преобразовалась до A1-защищенного инсулина, реакционную смесь может быть непосредственно подвергнута HPLC-очистке с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN), или реакционная смесь может быть погашена путем осторожного разбавления холодной кислой H2O (20×, pH около 3,0) при 0°C, и ее pH корректируют до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор может быть сначала сконцентрирован путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Затем, концентрированный раствор подвергают HPLC-очистке с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением NA1-защищенного инсулина.
Пример 81
Описан синтез NA1-трифторацетилинсулина.
В круглодонную колбу емкостью 100 мл загружают инсулин (300 мг, 0,052 ммоль), к которому добавляют 8 мл DMSO, затем TEA (43,4 мг, 0,429 ммоль). Смесь осторожно перемешивают при к.т. приблизительно в течение 30 минут до получения прозрачного раствора. К полученному раствору добавляют этилтрифторацетат (35,2 мг, 0,248 мл). После перемешивания при к.т. в течение 4 ч, смесь осторожно разбавляют H2O (100 мл, pH=3,00). После сокращения объема смеси до 20 мл с использованием центрифужных фильтров 10 MWCO Amicon Ultra-15, полученный раствор очищают методом HPLC (колонка Kromasil® C8 10 мкм, 100Å, 50×250 мм, 210 нм, скорость потока 85 мл/мин, 0,05% TFA в AcCN/H2O, 26-37% AcCN в H2O, в течение 20 мин). Целевые фракции объединяли и лиофилизировали с получением NA1-трифторацетилинсулина. UPLC способ A: m/e=1476,55 [(M+4)/4]; Rt=3,62 мин.
Пример 82
В данном примере представлен синтез IOC-143.
К раствору NA1-трифторацетилинсулина человека (77,7 мг, 0,013 ммоль) в DMSO (1,2 мл) при к.т. добавляли TEA (18 мкл, 0,132 ммоль) и раствор ML-11 (30,2 мг, 0,039 ммоль) в DMSO (300 мкл). После перемешивания при к.т. в течение 4 часов, смесь добавляли к AcCN (40 мл). Осадок собирали путем центрифугирования. Собранное твердое вещество растворяли в воде (5 мл, pH=3,00), смесь охлаждали до 0°C, и добавляли к ней раствор NH4OH (5 мл, 28% в воде). Смесь перемешивали при 0°C в течение 2 ч, а затем разбавляли водой (20 мл, pH=3,00). Объем полученного раствора сокращали до 5 мл с использованием центрифужных фильтров 10K MWCO Amicon Ultra-15, и подвергают дополнительному диафильтрованию с водой (100 мл, pH=3,00) до конечного объема приблизительно 7,5 мл, который очищали методом HPLC с получением IOC-143. UPLC способ A: Rt=3,58 мин; m/e=1801,906.
Пример 83
Описан синтез NA1-[(9H-флуорен-9-илметокси)карбонил]инсулина человека (N1-Fmoc-инсулин).
Инсулин (1,5 г, 0,258 ммоль) растворяли в DMSO (6 мл) в сцинтилляционном флаконе емкостью 20 мл. К раствору инсулина добавляли 9-флуоренилметилпентафторфенилкарбонат (0,105 г, 0,258 ммоль) в DMSO (1 мл). Смесь перемешивали в течение 15 минут. Продукт очищали методом Gilson HPLC на колонке C4 с обращенной фазой. Целевые фракции (выходящий первым мономер) собирали и лиофилизировали с получением целевого продукта, NαA1-Fmoc-инсулина. UPLC MS (C4, 5 минут): 1508,37 (M+4/4) при 4,47 минут.
Пример 84
Описан синтез A1,B29-защищенного инсулина или A1,B28-защищенного инсулина лизпро.
В контейнере подходящего размера, инсулин суспендируют при к.т. в органическом растворителе или в смешанных водно-органических растворителях, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения инсулина. К полученному раствору добавляют защитный реагент, например, этилтрифторацетат или 9-флуоренилметилпентафторфенилкарбонат, чистый или растворенный в органических растворителях, таких как DMSO или DMF. После того, как методом UPLC обнаруживают, что значительная часть реакционной смеси преобразовалась до A1,B29-защищенного инсулина (A1,B28-защищенного инсулина лизпро), реакционная смесь может быть непосредственно подвергнута HPLC-очистке с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN), или реакционная смесь может быть погашена путем осторожного разбавления холодной кислой H2O (20×, pH~3,0) при 0°C, и ее pH корректируют до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор может быть сначала сконцентрирован путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Затем, концентрированный раствор подвергают HPLC-очистке с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 85
Описан синтез NA1, NεB29-бис(трифторацетил)инсулина человека.
В круглодонную колбу емкостью 100 мл загружали инсулин человека (300 мг, 0,052 ммоль), и добавляли к нему AcCN (6,0 мл), воду (6,0 мл) и DIPEA (1,5 мл, 8,59 ммоль). К полученной смеси при 0°C добавляли этилтрифторацетат (0,9 мл, 7,54 ммоль). После перемешивания при 0°C в течение 2 ч, смесь очищали методом HPLC (колонка Kromasil® C8 10 мкм, 100Å, 50×250 мм, 210 нм, скорость потока 85 мл/мин, 0,05% TFA в AcCN/H2O, 27-37% AcCN в H2O, в течение 20 мин). Целевые фракции объединяли и лиофилизировали с получением NA1,NεB29-бис(трифторацетил)инсулина человека. UPLC способ A: m/e=1500,677 [(M+4)/4]; Rt=3,87 мин.
Пример 86
Описан синтез NA1,NεB29-бис[(9H-флуорен-9-илметокси)карбонил]-инсулина человека.
В сцинтилляционном флаконе емкостью 20 мл, инсулин человека (1,19 г, 0,205 ммоль) и TEA (257 мкл, 1,844 ммоль) растворяли в DMSO (10 мл). К этому раствору инсулина добавляли 1-{[(9H-флуорен-9-илметокси)карбонил]окси}пирролидин-2,5-дион (207 мг, 0,615 ммоль) в DMSO (2 мл). После перемешивания при к.т. в течение 30 мин, реакционную смесь гасили добавлением HCl (1,84 мл, 1,844 ммоль, 1,0 M). Полученную смесь очищали методом HPLC с обращенной фазой. Целевые фракции собирали и лиофилизировали с получением NA1,NεB29-бис[(9H-флуорен-9-илметокси)карбонил]инсулина человека. UPLC способ A: m/e=1564,04 [(M+4/4)]; Rt=4,41 мин.
Пример 87
Синтез конъюгатов с одинаковыми линкер-олигосахаридами на NA1 и NεB29 инсулина.
В контейнере подходящего размера, инсулин суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт растворяют при к.т. в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что весь немодифицированный инсулин прореагировал, и что значительная часть реакционной смеси преобразовалась до A1,B29-конъюгированного инсулина. Реакционную смесь гасят добавлением амина-нуклеофила, например, 2-аминоэтанола. Реакционную смесь перемешивают при к.т. в течение 30 мин. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие A1,B29-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 88
Синтез конъюгатов с линкер-олигосахаридом на NA1 инсулина
В контейнере подходящего размера, инсулин суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт при к.т. растворяют в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что большая часть немодифицированного инсулина прореагировала, и что значительная часть реакционной смеси преобразовалась до A1-конъюгированного инсулина. Реакционную смесь гасят добавлением амина-нуклеофила, например, 2-аминоэтанола. Реакционную смесь перемешивают при к.т. в течение 30 мин. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие A1-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 89
Синтез конъюгатов с линкер-олигосахаридом на NB1 инсулина
Конъюгат с NB1 инсулина может быть получен в соответствии с примером 50, или он может быть получен с использованием защищенного инсулина в качестве субстрата:
В контейнере подходящего размера, защищенный инсулин, например, NA1,NεB29-бис[(9H-флуорен-9-илметокси)карбонил]инсулин или NA1,NεB29-бис(трифторацетил)инсулин человека суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения защищенного инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт при к.т. растворяют в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что весь немодифицированный инсулин прореагировал, и что значительная часть реакционной смеси преобразовалась до B1-конъюгированного защищенного инсулина. Реакционную смесь гасят при низкой температуре добавлением избытка амина-нуклеофила, например, 2-аминоэтанола или аммиака. Реакционную смесь перемешивают при низкой температуре до тех пор, пока методом UPLC не обнаруживают полное удаление защитной группы. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие B1-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 90
Синтез конъюгатов с линкер-олигосахаридом на NεB29 инсулина
В контейнере подходящего размера, инсулин растворяют при осторожном перемешивании при к.т. в смешанном растворителе: 0,1 M Na2CO3/AcCN=2/3 (об.). После того, как смесь становилась прозрачной, корректировали значение pH до 10,5-10,8 с использованием раствора щелочи, например, 0,1н NaOH. В отдельном флаконе, активированный сложноэфирный промежуточный продукт при к.т. растворяют в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что большая часть немодифицированного инсулина прореагировала, и что значительная часть реакционной смеси преобразовалась до B29-конъюгированного инсулина. Реакционную смесь гасят добавлением амина-нуклеофила, например, 2-аминоэтанола. Реакционную смесь перемешивают при к.т. в течение 30 мин. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие B29-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 91
Синтез конъюгатов с одинаковыми линкер-олигосахаридами на NB1 и NεB29 инсулина
В контейнере подходящего размера, защищенный инсулин, например, NA1-(9H-флуорен-9-илметокси)карбонилинсулин или NA1-(трифторацетил)инсулин человека суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения защищенного инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт при к.т. растворяют в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что весь немодифицированный защищенный инсулин прореагировал, и что значительная часть реакционной смеси преобразовалась до B1,B29-конъюгированного защищенного инсулина. Реакционную смесь гасят при низкой температуре добавлением избытка амина-нуклеофила, например, 2-аминоэтанола или аммиака. Реакционную смесь перемешивают при низкой температуре до тех пор, пока методом UPLC не обнаруживают полное удаление защитной группы. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие B1,B29-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 92
Синтез конъюгатов с одинаковыми линкер-олигосахаридами на NA1, NB1 и NεB29 инсулина
В контейнере подходящего размера, инсулин суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт растворяют при к.т. в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что весь немодифицированный инсулин прореагировал, и что значительная часть реакционной смеси преобразовалась до A1-, B1- и B29-конъюгированного инсулина. Реакционную смесь гасят добавлением амина-нуклеофила, например, 2-аминоэтанола. Реакционную смесь перемешивают при к.т. в течение 30 мин. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl).
Фракции, содержащие A1,B1,B29-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 93
Синтез конъюгатов с различными линкер-олигосахаридами на NA1 и NεB29 инсулина
В контейнере подходящего размера, NεB29-конъюгированный инсулин суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт растворяли при к.т. в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что весь немодифицированный инсулин прореагировал, и что значительная часть реакционной смеси преобразовалась до A1,B29-конъюгированного инсулина. Реакционную смесь гасят добавлением амина-нуклеофила, например, 2-аминоэтанола. Реакционную смесь перемешивают при к.т. в течение 30 мин. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор может быть сначала подвергнут ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие A1,B29-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 94
Синтез конъюгатов с одинаковыми линкер-олигосахаридами на NB1 и NεB29 инсулина
В контейнере подходящего размера, защищенный инсулин, например, NεB29-(9H-флуорен-9-илметокси)карбонилинсулин или NA1-(трифторацетил)инсулин человека суспендируют при к.т. в органическом растворителе, например, DMSO, в присутствии основания, например, TEA. Смесь оставляют осторожно перемешиваться до полного растворения защищенного инсулина. В отдельном флаконе, активированный сложноэфирный промежуточный продукт растворяют при к.т. в органическом растворителе, например, DMSO. К раствору, содержащему инсулин, в течение некоторого периода времени добавляют аликвоты раствора активированного сложного эфира до тех пор, пока методом UPLC не обнаруживают, что весь немодифицированный защищенный инсулин прореагировал, и что значительная часть реакционной смеси преобразовалась до A1,B1-конъюгированного защищенного инсулина. Реакционную смесь гасят при низкой температуре добавлением избытка амина-нуклеофила, например, 2-аминоэтанола или аммиака. Реакционную смесь перемешивают при низкой температуре до тех пор, пока методом UPLC не обнаруживают полное удаление защитной группы. Полученный раствор осторожно разбавляют холодной H2O (20×) при 0°C, и корректируют его pH до конечного значения pH=2,5 с использованием 1н HCl (и 0,1н NaOH при необходимости). Раствор сначала концентрируют путем ультрафильтрации, либо при помощи системы для тангенциального проточного фильтрования (TFF), либо с использованием центрифужных фильтров Amicon Ultra-15 с 1K, 3K или 10K MWCO-мембраной. Концентрированный раствор обычно сначала подвергают ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие B1,B29-конъюгат с целевой чистотой, объединяют и концентрируют с использованием TFF-системы или Amicon Ultra-15. Затем, полученный раствор дополнительно очищают методом HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие указанный в заголовке конъюгат, объединяют и лиофилизируют или удаляют буфер с использованием TFF-системы и/или Amicon Ultra-15 с получением указанного в заголовке продукта.
Пример 95
Описан синтез NεB29-(трифторацетил)инсулина человека.
В круглодонную колбу емкостью 100 мл загружают инсулин человека (200 мг, 0,034 ммоль), к которому добавляли AcCN (4,0 мл), воду (4,0 мл) и TEA (0,5 мл, 3,44 ммоль). К полученной смеси при 0°C добавляли этилтрифторацетат (0,41 мл, 3,44 ммоль). После перемешивания при 0°C в течение 30 мин, смесь разбавляли водой (20 мл, pH~3,0). После осторожного подкисления полученного раствора до pH~2,5, смесь очищали методом HPLC (колонка Delta Pak C4 15 мкм, 300Å, 50×250 мм, 210 нм, скорость потока 85 мл/мин, 0,05% TFA в AcCN/H2O, 27-37% AcCN в H2O, в течение 20 мин). Целевые фракции объединяли и лиофилизировали с получением указанного в заголовке соединения. UPLC способ A: m/e=1476,5012 [(M+4)/4]; Rt=3,71 мин.
Пример 96
Синтез IOC-3 - инсулина человека, конъюгированного по B1 и B29 с линкером ML-7.
NαA1-Tfa-инсулин (60 мг, 0,01 ммоль) растворяли в 1 мл DMSO при к.т., к этому раствору добавляли триэтиламин (10,3 мг, 0,102 ммоль), и добавляли к реакционной смеси ML-7 (18,2 мг, 0,023 ммоль), растворенный в 100 мкл DMSO. После перемешивания при к.т. в течение 4 часов, смесь добавляли к 40 мл AcCN. Формировался осадок, который собирали путем центрифугирования. Собранное твердое вещество растворяли в 5 мл деионизированной воды, доведенной до pH=3,00 и охлажденной до 0oC, затем к водному раствору добавляли 5 мл NH4OH (28% в воде), смесь перемешивали при 0°C в течение 2 часов, а затем разбавляли 20 мл деионизированной воды, доведенной до pH=3,00. Смеси концентрировали до 5 мл с использованием центрифужного фильтра Amicon с 10K-мембраной, дополнительно подвергали диафильтрации с 100 мл деионизированной воды, доведенной до pH=3,00, до конечного объема приблизительно 7,5 мл и очищали методом препаративной HPLC. Условия проведения HPLC были следующими: колонка Kromasil® C8 10 мкм, 100Å, 50×250 мм, 210 нм, скорость потока 85 мл/мин, 0,05% TFA в AcCN/H2O, 26-32% AcCN в H2O, в течение 25 мин; фракции собирали и лиофилизировали до получения порошка (38,8 мг, выход 52,4%) 1784,76[M+4]/4, tR=3,435
Пример 97
В этом примере представлено получение конъюгата инсулин-олигосахарид (IOC-123), в котором линкер-олигосахарид ML-11 связан с NH2-группой в положениях B1 и B29 инсулина человека.
NαA1-Fmoc-инсулин (80 мг, 0,014 ммоль) и линкер ML-11 (100 мг, 0,068 ммоль) нагревали до комнатной температуры в течение 30 минут. Во флаконе емкостью 20 мл к NαA1-Fmoc-инсулину (80 мг, 0,014 ммоль) в DMSO (1,00 мл) добавляли триэтиламин (18,95 мкл, 0,136 ммоль). В реакционный сосуд тремя равными порциями с интервалами в 50 минут добавляли ML-11 (100 мг, 0,068 ммоль) в DMSO (0,90 мл). Реакционную смесь гасили добавлением 2-аминоэтанола (103 мкл, 1,700 ммоль), и перемешивали смесь при комнатной температуре в течение 20 мин. Смесь разбавляли введением в H2O (10 мл) при 0°C. Значение pH реакционной смеси корректировали приблизительно до 2,5 с использованием 1н HCl. Неочищенный продукт сначала очищали методом ионообменной хроматографии. Целевые фракции концентрировали с использованием центрифужных фильтров Amicon Ultra или лиофилизировали в течение ночи, а затем дополнительно очищали методом препаративной HPLC с обращенной фазой (колонка Gilson C4). Объединенные целевые фракции лиофилизировали с получением твердого вещества. Затем, твердое вещество растворяли в воде, и корректировали значение pH до 7 с использованием 0,1н раствора NaOH с получением раствора IOC-123.
Пример 98
В этом примере проиллюстрирован синтез IOC-113 (NA1,NβB29-бис{6-[цис-3,5-бис({2-[(α-L-фукопиранозил)окси]этил}карбамоил)-пиперидин-1-ил]-6-оксогексаноил}инсулина человека), в котором A1 и B1 положения инсулина конъюгированы с ML-17.
В сцинтилляционный флакон емкостью 20 мл с инсулином человека (105 мг, 0,018 ммоль) при комнатной температуре добавляли DMSO (1 мл) и DIPEA (35,1 мг, 0,271 ммоль). Смесь оставляли осторожно перемешиваться до растворения инсулина. В отдельном флаконе, линкер ML-17 (35,1 мг, 0,045 ммоль) при комнатной температуре растворяли в DMSO (0,9 мл). К раствору, содержащему инсулин человека, тремя равными порциями с интервалами в 50 минут добавляли раствор ML-17. Реакционную смесь гасили добавлением 2-аминоэтанола (34 мкл, 0,42 ммоль). После перемешивания при комнатной температуре в течение 20 минут, полученную смесь осторожно разбавляли холодной H2O (4 мл) при 0°C. Значение pH полученной смеси корректировали до конечного значения pH=2,5 с использованием 1н HCl (или 0,1н NaOH). Смесь сначала подвергали ионообменной хроматографии (колонка PolySULFOETHYL A, PolyLC Inc., 250×21 мм, 5 мкм, 1000Å; буфер A: 0,1% (об.) H3PO4/25% AcCN; буфер B: 0,1% (об.) H3PO4/25% AcCN/0,5 M NaCl). Фракции, содержащие указанный в заголовке конъюгат в качестве основного продукта, объединяли и концентрировали с использованием центрифужных фильтров Amicon-15 MWCO 3K или 10K или лиофилизировали после нейтрализации до pH~7,0. Полученный раствор или повторный раствор конъюгата затем дополнительно очищали методом препаративной HPLC с обращенной фазой (колонка Waters C4 250×50 мм, 10 мкм, 1000Å, или колонка Kromasil C8 250×50 мм, 10 мкм, 100Å; буфер A: 0,05-0,1% TFA в деионизированной воде; буфер B: 0,05-0,1% TFA в AcCN). Фракции, содержащие >95% указанного в заголовке конъюгата, объединяли и лиофилизировали с получением указанного в заголовке продукта. UPLC-MS (C4, 5 минут): 1948,66 (M+4/4) при 3,48 мин.
Пример 99
В этом примере представлено конструирование IOC-52 (NA1-6-оксо-6-((2-(α-L-фукопиранозилокси)этил)амино)гексаноил-NεB29-6-((((2-оксо-2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)-2-оксиэтил)амино)(2-оксо-2-((α-L-фукопиранозилокси)-2-оксоэтил)амино)этил)амино)ацетамидо)-6-оксогексаноилинсулина человека), в котором A1 и B1 остатки инсулина человека конъюгированы с линкерами ML-4 и ML-29, соответственно.
Синтез NεB29-6-((((2-оксо-2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)-2-оксиэтил)амино)(2-оксо-2-((α-L-фукопиранозилокси)-2-оксоэтил)амино)этил)амино)-ацетамидо)-6-оксогексаноилинсулина человека (IOC-58)
Инсулин человека (1000 мг, 0,172 ммоль) растворяли в водном Na2CO3 (8,6 мл, 0,1 M) и AcCN (5,7 мл). Значение pH полученного раствора корректировали до 10,5, и одной порцией добавляли к нему раствор ML-29 (2,5-диоксопирролидин-1-ил-6-((((2-оксо-2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)-2-оксиэтил)амино)(2-оксо-2-((α-L-фукопиранозилокси)-2-оксоэтил)амино)этил)амино)ацетамидо)-6-оксогексаноат, 289 мг, 0,258 ммоль) в DMF (2,9 мл). Развитие реакции отслеживали методом UPLC-MS, и гасили реакционную смесь добавлением этаноламина (52,1 мкл, 0,861 ммоль). Реакционную смесь разбавляли H2O (15 мл) и корректировали значение pH приблизительно до 2,5 с использованием 1,0н раствора HCl. Полученную смесь очищали методом HPLC (ионообменная хроматография, колонка PolySULFOEthyl A, 9,4×250 мм, градиент 10-45%) (подвижная фаза A: 0,1% (об.) H3PO4/25% ацетонитрил в воде, подвижная фаза B: 0,1% (об.) H3PO4/25% ацетонитрил/0,5M NaCl в воде) в течение 30 минут, скорость потока 15 мл/мин). Целевые фракции объединяли, концентрировали с использованием шести центрифужных фильтров Amicon Ultra с мембраной Utracel 10K при 3500 об/мин при 4oC, и лиофилизировали с получением указанного в заголовке соединения (600 мг, выход 51%) в виде белого порошка. UPLC способ A: tR=3,58 мин. [M+4H/4]+=1703,99.
Синтез NA1-6-оксо-6-((2-(α-L-фукопиранозилокси)этил)амино)-гексаноил-NεB29-6-((((2-оксо-2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)-2-оксиэтил)амино)(2-оксо-2-((α-L-фукопиранозилокси)-2-оксоэтил)амино)этил)амино)-ацетамидо)-6-оксогексаноилинсулина человека
К раствору NεB29-6-((((2-оксо-2-((α-D-маннопиранозил-(1→3)-[α-D-маннопиранозил-(1→6)]-α-D-маннопиранозил)-2-оксиэтил)-амино)(2-оксо-2-((α-L-фукопиранозилокси)-2-оксоэтил)амино)этил)-амино)ацетамидо)-6-оксогексаноилинсулина человека (150 мг, 0,022 ммоль) и TEA (30,7 мкл, 0,22 ммоль) в DMSO (1,5 мл) при комнатной температуре одной порцией добавляли раствор 2,5-диоксопирролидин-1-ил-6-оксо-6-((2-(α-L-фукопиранозилокси)этил)-амино)гексаноата (17 мг, 0,040 ммоль) (ML-4) в DMSO (1,0 мл). Реакционную смесь гасили добавлением этаноламина (13,32 мкл, 0,22 ммоль). После перемешивания при комнатной температуре в течение 15 минут, реакционную смесь разбавляли H2O (15 мл), и корректировали значение pH приблизительно до 2,5 с использованием 1,0н раствора HCl. Полученную смесь очищали методом HPLC (ионообменная хроматография, колонка PolySULFOEthyl A, 9,4×250 мм, градиент 10-45%) (подвижная фаза A: 0,1% (об.) H3PO4/25% ацетонитрил в воде, подвижная фаза B: 0,1% (об.) H3PO4/25% ацетонитрил/0,5M NaCl в воде) в течение 30 минут, скорость потока 15 мл/мин). Целевые фракции объединяли, концентрировали с использованием двух центрифужных фильтров Amicon Ultra с мембраной Utracel 10K при 3500 об/мин при 4oC. Полученную смесь очищали методом HPLC (C4, 50×250 мм, градиент 25-30% AcCN в H2O с 0,1% TFA в течение 30 минут, скорость потока 85 мл/мин). Целевые фракции объединяли и лиофилизировали с получением указанного в заголовке соединения (31 мг, выход 19%) в виде белого порошка. UPLC способ A: tR=3,79 мин. [M+4H/4]+=1783,3.
Пример 100
Синтез IOC-10 - инсулина человека, конъюгированного по B1 и B29 с линкером ML-6.
A1-Fmoc-инсулин (80 мг, 0,014 ммоль) и линкер ML-6 (100 мг, 0,068 ммоль) нагревали до комнатной температуры в течение 30 минут. Во флаконе емкостью 20 мл к A1-Fmoc-инсулину (80 мг, 0,014 ммоль) в DMSO (1,00 мл) добавляли триэтиламин (18,95 мкл, 0,136 ммоль). В реакционный сосуд тремя равными порциями с интервалами в 50 минут добавляли линкер ML-6 (100 мг, 0,068 ммоль) в DMSO (0,90 мл). Реакционную смесь гасили добавлением 2-аминоэтанола (103 мкл, 1,700 ммоль), и перемешивали смесь при комнатной температуре в течение 20 минут. Смесь разбавляли введением в H2O (10 мл) при 0°C. Значение pH реакционной смеси корректировали приблизительно до 2,5 с использованием 1н HCl. Неочищенный продукт сначала очищали методом ионообменной хроматографии. Целевые фракции концентрировали с использованием центрифужных фильтров Amicon Ultra или лиофилизировали в течение ночи, а затем дополнительно очищали методом препаративной HPLC с обращенной фазой (колонка Gilson C4). Объединенные целевые фракции лиофилизировали. Затем, твердое вещество растворяли в воде, и корректировали значение pH до 7 с использованием 0,1н раствора NaOH. Концентрацию образца измеряли на спектрофотометре Lambda Bio+UV\Vis при •=276 нм. UPLC-MS (C4, 5 мин): 1763,3 (M+4/4) при 3,72 мин.
Пример 101
Синтез IOC-226 - инсулина человека, конъюгированного по B1 и B29 с линкерами ML-31 и ML-54, соответственно.
NαA1-Tfa-инсулин (40 мг, 0,0067 ммоль) растворяли при к.т. в 1 мл DMSO, к этому раствору добавляли DIPEA (0,038 мл, 0,215 ммоль); ML-54 (11,5 мг, 0,0078 ммоль) растворяли в 115 мкл DMSO и добавляли к реакционной смеси. Реакционную смесь перемешивали при к.т. в течение 2 ч или до тех пор, пока методом UPLC не обнаруживали, что значительная часть реакционной смеси преобразовывалась до B29-конъюгированного инсулина. Затем, второй активированный сложный эфир, ML-31 (16 мг, 0,014 ммоль), растворяли в 160 мкл DMSO и добавляли к реакционной смеси. Реакционную смесь перемешивали при к.т. в течение 16 ч или до тех пор, пока методом UPLC не обнаруживали, что значительная часть реакционной смеси преобразовывалась до B1,B29-конъюгированного инсулина. Смесь добавляли к 40 мл AcCN. Формирующийся осадок собирали путем центрифугирования. Собранное твердое вещество растворяли в 5 мл деионизированной воды, доведенной до pH=3,00 и охлажденной до 0oC, затем к водному раствору добавляли 5 мл NH4OH (28% в воде), смесь перемешивали при 0°C в течение 2 часов, а затем разбавляли 20 мл деионизированной воды, доведенной до pH=3,00. Смеси концентрировали до 3 мл на центрифужном фильтре Amicon с мембраной 10K, и дополнительно подвергали диафильтрации с 60 мл деионизированной воды, доведенной до pH=3,00, до конечного объема приблизительно 5 мл. Неочищенный продукт сначала очищали методом ионообменной хроматографии. Целевые фракции концентрировали с использованием центрифужных фильтров Amicon Ultra, а затем дополнительно очищали методом препаративной HPLC с обращенной фазой. Условия проведения HPLC были следующими: колонка Kromasil® C8 10 мкм, 100Å, 50×250 мм, 210 нм, скорость потока 85 мл/мин, 0,05% TFA в AcCN/H2O, 27-33% AcCN в H2O, в течение 25 мин; фракции собирали и лиофилизировали до получения порошка. Затем, твердое вещество растворяли в воде, и корректировали значение pH до 7 с использованием 0,1н раствора NaOH. Концентрацию образца измеряли на спектрофотометре Lambda Bio+UV\Vis при •=276 нм. (16,53 мг, выход 29,2%) 1632,54[M+5]/5, tR=3,35
Пример 102
Анализ связывания с инсулиновым рецептором проводили следующим образом.
Для определения аффинности IOC к инсулиновому рецептору типа B (IR(B)) человека относительно эндогенного лиганда, меченого 125[I] инсулина, использовали два метода анализа конкурентного связывания.
Способ E: анализ связывания с IR представлял собой анализ связывания в формате целой клетки с использованием клеток CHO, оверэкспрессирующих IR(B) человека. Клетки выращивали в среде F12, содержащей 10% FBS и антибиотики (G418, пенициллин/стрептавидин), помещали в количестве 40000 клеток на лунку в 96-луночный культуральный планшет, по меньшей мере, на 8 ч. Затем, клетки лишали сыворотки путем переноса на ночь в среду DMEM, содержащую 1% BSA (без инсулина). Клетки дважды промывали охлажденной средой DMEM, содержащей 1% BSA (без инсулина), а затем добавляли молекулы IOC в соответствующей концентрации в 90 мкл той же среды. Клетки инкубировали на льду в течение 60 минут. Добавляли 125[I]-инсулин (10 мкл) в конечной концентрации 0,015 нМ, и инкубировали на льду в течение 4 часов. Клетки осторожно трижды промывали охлажденной средой и лизировали добавлением 30 мкл лизирующего буфера Cell Signaling (кат.№ 9803) с перемешиванием встряхиванием в течение 10 минут при комнатной температуре. Лизат добавляли к сцинтилляционной жидкости, и проводили подсчет для определения связывания 125[I]-инсулина с IR и титрационных эффектов молекул IOC на это взаимодействие.
Способ D: анализ связывания с IR проводили посредством сцинтилляционного анализа сближения (SPA) в формате 384-луночного планшета с использованием мембран клеток, полученных от клеток CHO, оверэкспрессирующих IR(B), выращенных в среде F12, содержащей 10% FBS и антибиотики (G418, пенициллин/стрептавидин). Мембраны клеток получали в 50 мМ Трис-буфере, pH 7,8, содержащем 5 мМ MgCl2. Аналитический буфер содержал 50 мМ Трис-буфер, pH 7,5, 150 мМ NaCl, 1 мМ CaCl2, 5 мМ MgCl2, 0,1% BSA и ингибиторы протеаз (Complete-Mini-Roche). Мембраны клеток добавляли к WGA PVT PEI SPA гранулам (конечная концентрация 5 мг/мл), а затем добавляли молекулы IOC в соответствующих концентрациях. После инкубирования в течение 5-15 минут при комнатной температуре, добавляли 125[I]-инсулин в конечной концентрации 0,015 нМ в конечном общем объеме 50 мкл. Смесь инкубировали при перемешивании встряхиванием при комнатной температуре в течение 1-12 часов, а затем проводили подсчет сцинтилляций для определения связывания 125[I]-инсулина с IR и титрационных эффектов молекул IOC на это взаимодействие.
Пример 103
Анализ фосфорилирования инсулинового рецептора проводили следующим образом.
Анализ фосфорилирования инсулинового рецептора осуществляли с использованием коммерчески доступного метода анализа Meso Scale Discovery (MSD) pIR (см. Meso Scale Discovery, 9238 Gaithers Road, Gaitherburg, MD). Стабильно экспрессирующие IR(B) человека клетки CHO выращивали в клеточной среде F12, содержащей 10% FBS и антибиотики (G418, пенициллин/стрептавидин) в течение, по меньшей мере, 8 часов, а затем лишали сыворотки путем переноса на ночь для роста в среду F12, содержащую 0,5% BSA (без инсулина) вместо FBS. Клетки собирали и замораживали в аликвотах для использования в методе анализа MSD pIR. Вкратце, замороженные клетки помещали в 96-луночные (40000 клеток на лунку, способы A и B) или 384-луночные (10000 клеток на лунку, способ C) чистые культуральные планшеты и оставляли восстанавливаться. Добавляли молекулы IOC в соответствующих концентрациях, и инкубировали клетки в течение 8 минут при температуре 37°C. Среду удаляли путем аспирации, и добавляли охлажденный буфер, лизирующий клетки MSD, в соответствии с инструкциями набора MSD. Клетки лизировали на льду в течение 40 минут, а затем перемешивали лизат в течение 10 минут при комнатной температуре. Лизат переносили в планшеты для детекции pIR из набора для MSD. Оставшуюся часть метода анализа проводили в соответствии с рекомендованным протоколом из набора MSD.
Пример 104
Анализ связывания с макрофагальным маннозным рецептором (MRC1) человека проводили следующим образом.
При анализе конкурентного связывания с MRC1 использовали лиганд, маннозилированный-BSA, меченый реагентом DELFIA Eu-N1-ITC, о котором сообщалось в литературе. Анти-MRC1-антитело (25 мкл в концентрации 2 нг/мкл) добавляли в планшет с G-белком, который трижды промывали 100 мкл 50 мМ Трис-буфера, pH 7,5, содержащего 100 мМ NaCl, 5 мМ CaCl2, 1 мМ MgCl2 и 0,1% Tween-20 (промывочный буфер). Антитело инкубировали в планшете в течение 1 часа при комнатной температуре при перемешивании встряхиванием. Планшет 3-5 раз промывали промывочным буфером, а затем добавляли MRC1 (конечная концентрация 2 нг/мкл) в 25 мкл PBS, содержащего 1% стабилизатора BSA. Планшет инкубировали при комнатной температуре с осторожным перемешиванием в течение 1 часа. Планшет трижды промывали промывочным буфером. Добавляли молекулы IOC в соответствующих концентрациях в 12,5 мкл буфера, а затем добавляли 12,5 мкл Eu-маннозилированного-BSA (конечная концентрация 0,1 нМ) в 50 мМ Трис, pH 7,5, содержащем 100 мМ NaCl, 5 мМ CaCl2, 1 мМ MgCl2 и 0,2% стабилизатора BSA. Планшет инкубировали в течение 2 часов при комнатной температуре при перемешивании встряхиванием, а затем трижды промывали промывочным буфером. Добавляли Eu-индукторный реагент Perkin Elmer (25 мкл), и инкубировали в течение 30 минут при комнатной температуре, после чего определяли сигнал Eu (возбуждение=340 нм/испускание=615 нм). Анализ проводили в 96-луночном планшете с ручной раздачей жидкости (Способ F) или с использованием автоматизированной раздачи жидкости (Способ G), или в 384-луночном планшете с автоматизированной раздачей (Способ H).
Пример 105
В последующей таблице перечислены конъюгаты, которые были получены с использованием соответствующих промежуточных продуктов в соответствии с одним из общих способов, описанных выше. Упомянутые конъюгаты охарактеризовывали с использованием UPLC способа A или UPLC способа D, отмеченных звездочкой, или UPLC способа G, отмеченного #, отображая частицы исходного соединения либо с четырьмя зарядами, т.е. [(M+4)/4], (либо с пятью зарядами, т.е. [(M+5)/5]) с определенным временем удерживания (Rt). Значения их биологической активности in vitro в отношении инсулинового рецептора (IR) измеряли либо посредством анализа конкурентного связывания лиганда, либо посредством функционального анализа фосфорилирования, описанных выше, помеченных следующим образом: способ A: анализ фосфорилирования IR в формате 96-луночного планшета с ручной раздачей жидкости; способ B: анализ фосфорилирования IR в формате 96-луночного планшета с автоматизированной раздачей жидкости; способ C: анализ фосфорилирования IR в формате 96-луночного планшета с автоматизированной раздачей жидкости; способ D: анализ связывания с IR способом D; способ E: анализ связывания с IR способом E; способ F: MRC1-анализ проводили в 96-луночном планшете с ручной раздачей жидкости; способ G: MRC1-анализ проводили в 96-луночном планшете с автоматизированной раздачей жидкости; способ H: MRC1-анализ проводили в 384-луночном планшете с автоматизированной раздачей жидкости. Результаты представлены в таблице 1.
‡IP представляет собой точку перегиба кривой и соответствует IC50
Пример 106
Оценивали эффект метил-α-D-маннопиранозида (αMM) на PK и PD молекул IOC у недиабетических карликовых свиней.
Самцов недиабетических юкатанских карликовых свиней оснащали двумя портами сосудистого доступа (VAP) к яремной вене и использовали в исследованиях. Животные голодали в течение ночи перед исследованием. В сутки исследования, животных фиксировали в перевязи, и обеспечивали доступ к VAP для инфузии и взятия образцов. В момент времени t=-60 мин начинали постоянную инфузию PBS (n=3) или 21,2% α-метилманнозы (αMM) (n=3) со скоростью 2,67 мл/кг/час. Такую инфузию проводили в течение всего исследования. В момент времени t=0 мин и после отбора исходного образца крови для измерения глюкозы в плазме, животным вводили IOC в виде одного IV болюса. Взятие образцов продолжали в течение 90 минут с конечным считыванием уровней глюкозы в плазме и уровней соединения.
Молекулы IOC включали в концентрации 17-69 нмоль/мл в состав, содержащий хлорид натрия (87 мМ), фенол (21 мМ), гидрофосфат натрия (26,5 мМ); осмотическое давление=275 мОсм, pH=7,4; вода в количестве, достаточном для инъекций
Временные точки для отбора образцов: -60 мин, 0 мин, 1 мин, 2 мин, 4 мин, 6 мин, 8 мин, 10 мин, 15 мин, 20 мин, 25 мин, 30 мин, 35 мин, 45 мин, 60 мин и 90 мин.
Кровь отбирали в K3-EDTA пробирки с добавлением 10 мкг/мл апротинина и хранили на бане со льдом до обработки, в пределах 30 минут после отбора. После центрифугирования при 3000 об/мин и 4°C в течение 8 минут, плазму собирали и делили на аликвоты для измерения глюкозы с использованием химического анализатора Beckman Coulter AU480 и для измерения уровней соединения методом LC-MS.
Результаты по глюкозе выражали в виде изменений (%) по сравнению с исходными значениями при t=0 мин; результаты представлены для IOC-2, IOC-3, IOC-8, IOC-9, IOC-16, IOC-22, IOC-23, IOC-46, IOC-48, IOC-52, IOC-56, IOC-60, IOC-75, IOC-75 и IOC-76 на фигурах 1-14, соответственно.
Фигура 1: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-2 в количестве 0,69 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 2: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-3 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 3: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-8 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 4: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-9 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 5: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-16 в количестве 0,35 нмоль/кг в условиях инфузии PBS или инфузии или в/в α-метилманнозы (αMM).
Фигура 6: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-22 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 7: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-23 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 8: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-46 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 9: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-48 в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 10: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-52 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 11: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-56 в количестве 0,69 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 12: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-60 в количестве 0,35 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 13: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-75 в количестве 0,69 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 14: Кривые снижения уровня глюкозы в крови самцов недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), после в/в инъекции конъюгата IOC-76 в количестве 0,17 нмоль/кг в условиях инфузии PBS или в/в инфузии α-метилманнозы (αMM).
Фигура 15: Графики сывороточных концентраций IOC-2 после внутривенной (в/в) инъекции 0,69 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 16: Графики сывороточных концентраций IOC-3 после внутривенной (в/в) инъекции 0,17 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 17: Графики сывороточных концентраций IOC-16 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 18: Графики сывороточных концентраций IOC-22 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 19: Графики сывороточных концентраций IOC-23 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили инфузию в/в раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 20: Графики сывороточных концентраций IOC-52 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 21: Графики сывороточных концентраций IOC-56 после внутривенной (в/в) инъекции 0,69 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Фигура 22: Графики сывороточных концентраций IOC-60 после внутривенной (в/в) инъекции 0,35 нмоль/кг самцам недиабетических Юкатанских карликовых свиней, оснащенных двумя портами сосудистого доступа (n=3 на исследование), которым проводили в/в инфузию раствора α-метилманнозы (αMM) (21,2% масс./об. вводили инфузионно с постоянной скоростью 2,67 мл/кг/час) или PBS.
Хотя настоящее изобретение описано в настоящем документе со ссылкой на иллюстративные варианты осуществления, следует понимать, что изобретение ими не ограничивается. Средние специалисты в данной области техники и лица, имеющие доступ к представленным в настоящем документе основополагающим принципам изобретения, смогут определить дополнительные модификации и варианты осуществления, подпадающие под объем настоящего изобретения. Следовательно, настоящее изобретение ограничивается исключительно прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОНЪЮГАТ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА, И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840147C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2021 |
|
RU2841377C1 |
| Бифункциональные цитотоксические агенты, содержащие CTI фармакофор | 2016 |
|
RU2682645C1 |
| ПАРА-АМИНОБЕНЗИЛЬНЫЕ ЛИНКЕРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КОНЪЮГАТАХ | 2021 |
|
RU2839675C1 |
| КОНЪЮГАТ АНТИТЕЛО К B7H3-АНАЛОГ ЭКЗАТЕКАНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2019 |
|
RU2785664C2 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ | 2014 |
|
RU2694254C1 |
| БИАРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛОК-БЕЛКОВОГО ВЗАИМОДЕЙСТВИЯ YAP/TAZ-TEAD | 2021 |
|
RU2830596C1 |
| ПРОИЗВОДНОЕ ПИРАЗОЛО-ГЕТЕРОАРИЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2017 |
|
RU2748833C2 |
| УГЛЕВОДНО-ГЛИКОЛИПИДНЫЕ КОНЪЮГИРОВАННЫЕ ВАКЦИНЫ | 2013 |
|
RU2649009C2 |
| ФУНКЦИОНАЛИЗИРОВАННЫЕ ПРОИЗВОДНЫЕ МОРФОЛИНИЛАНТРАЦИКЛИНА | 2015 |
|
RU2715902C2 |









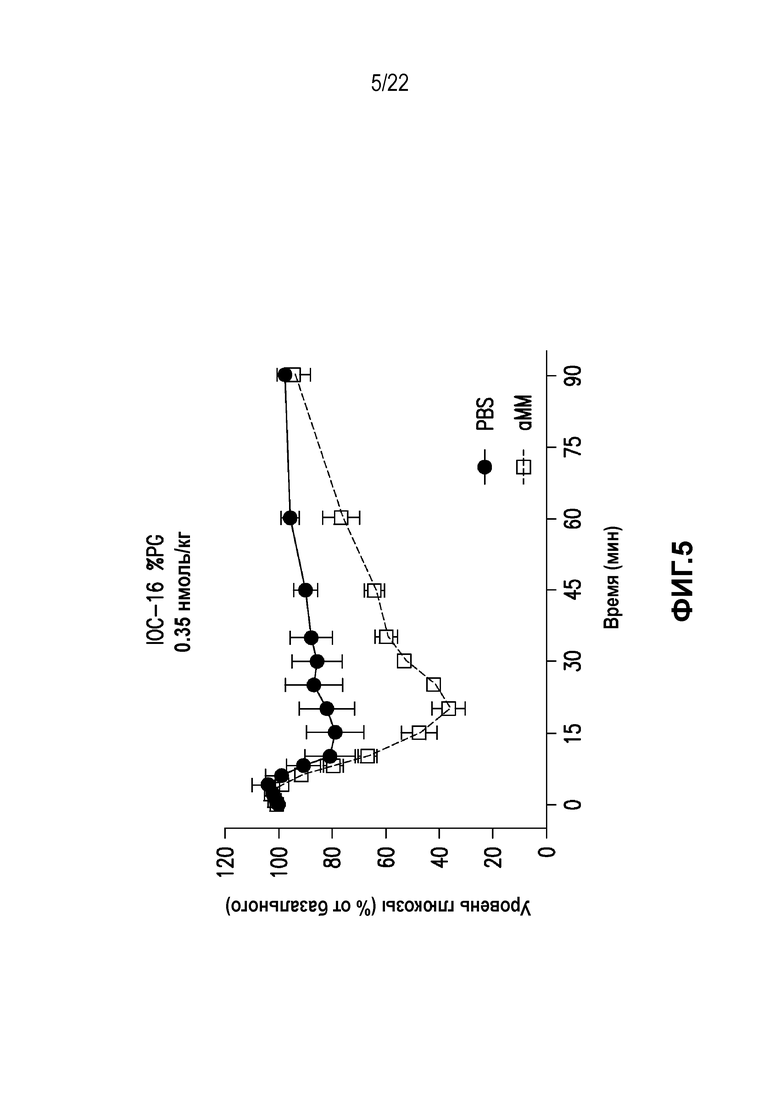

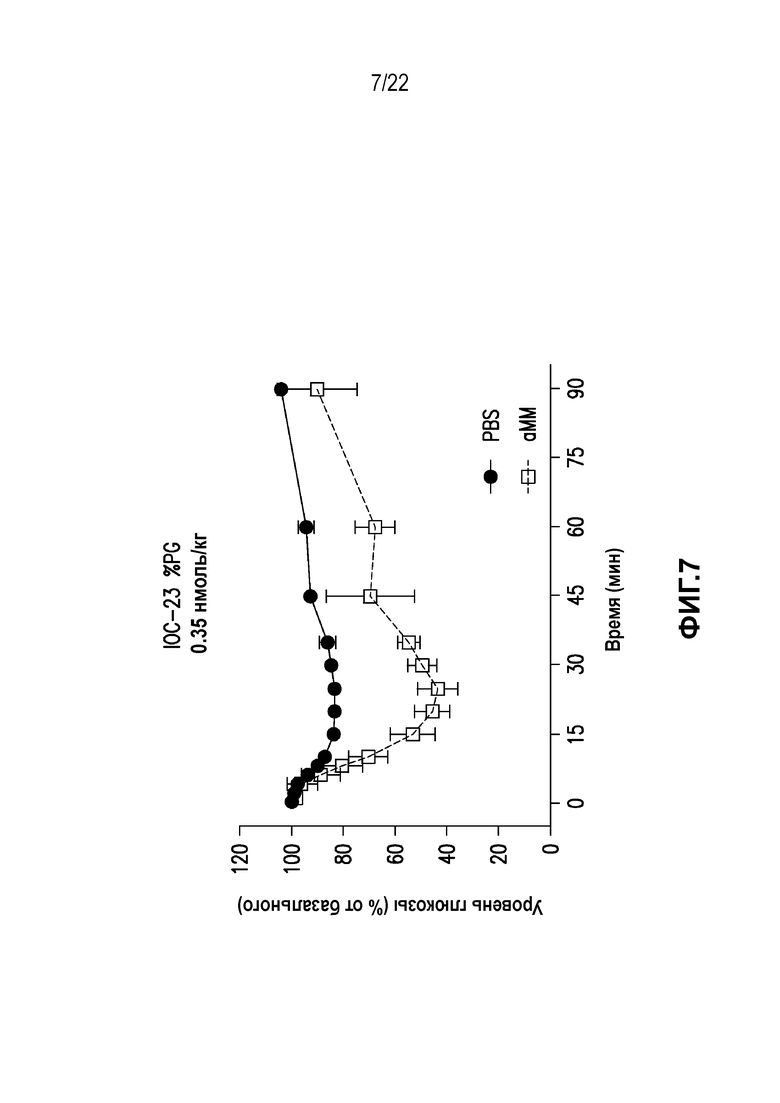
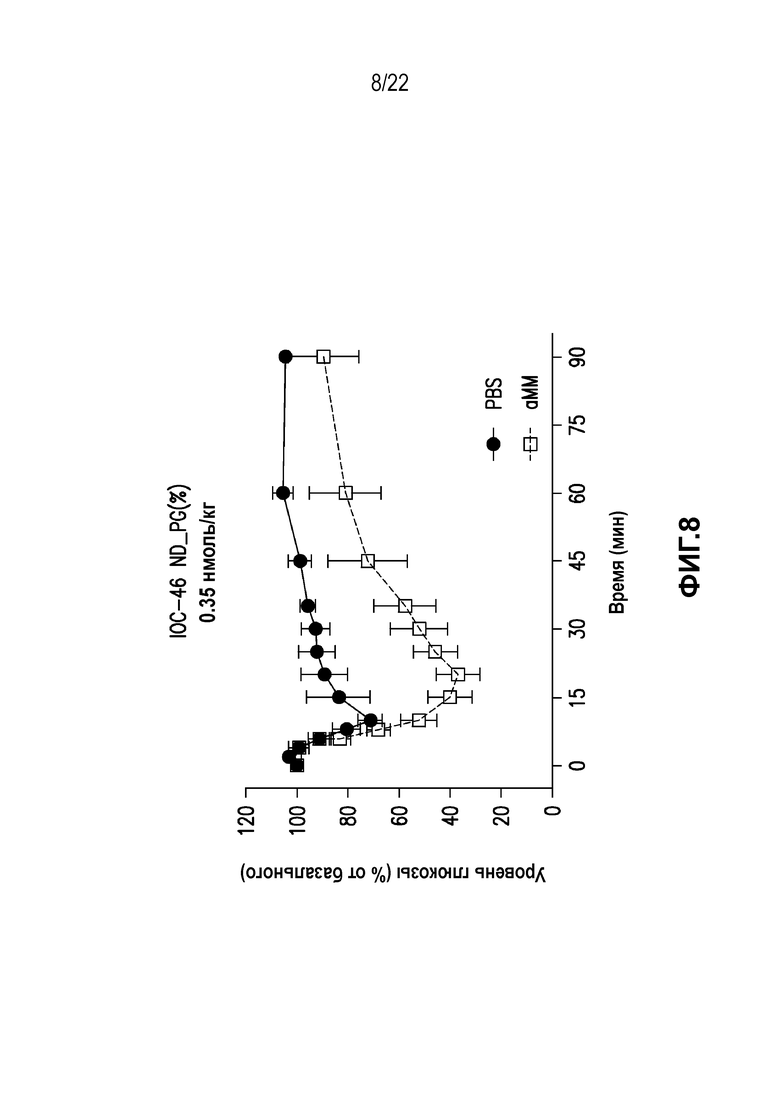
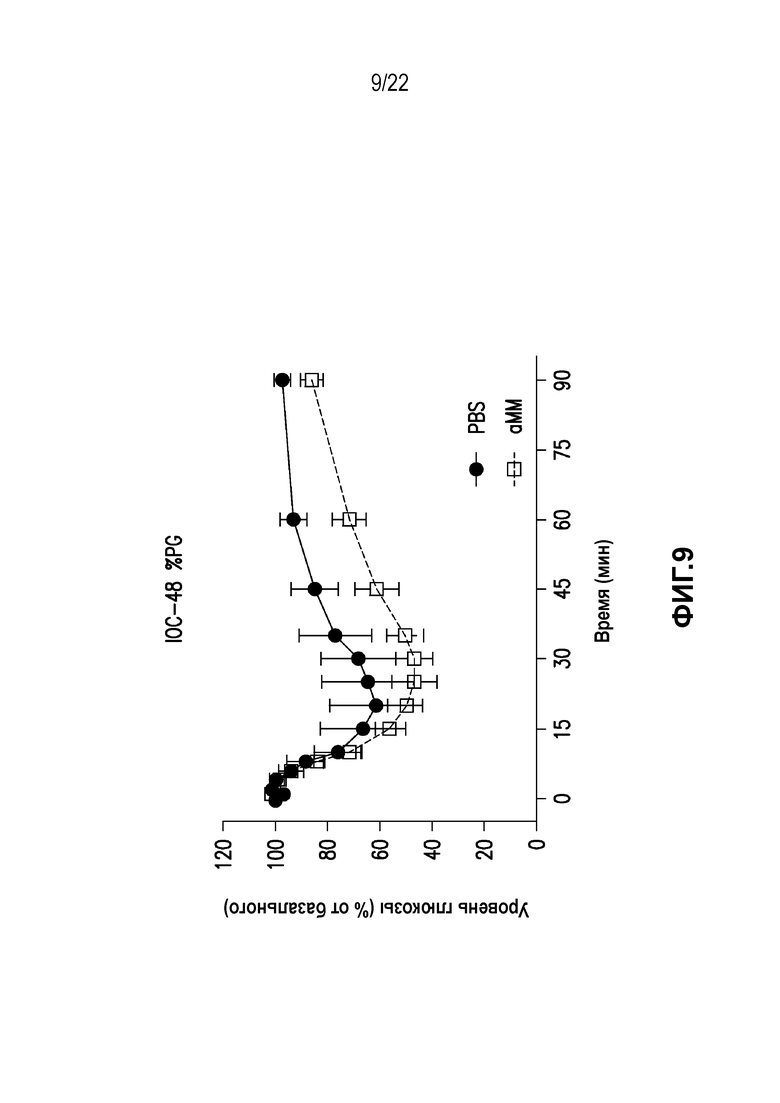

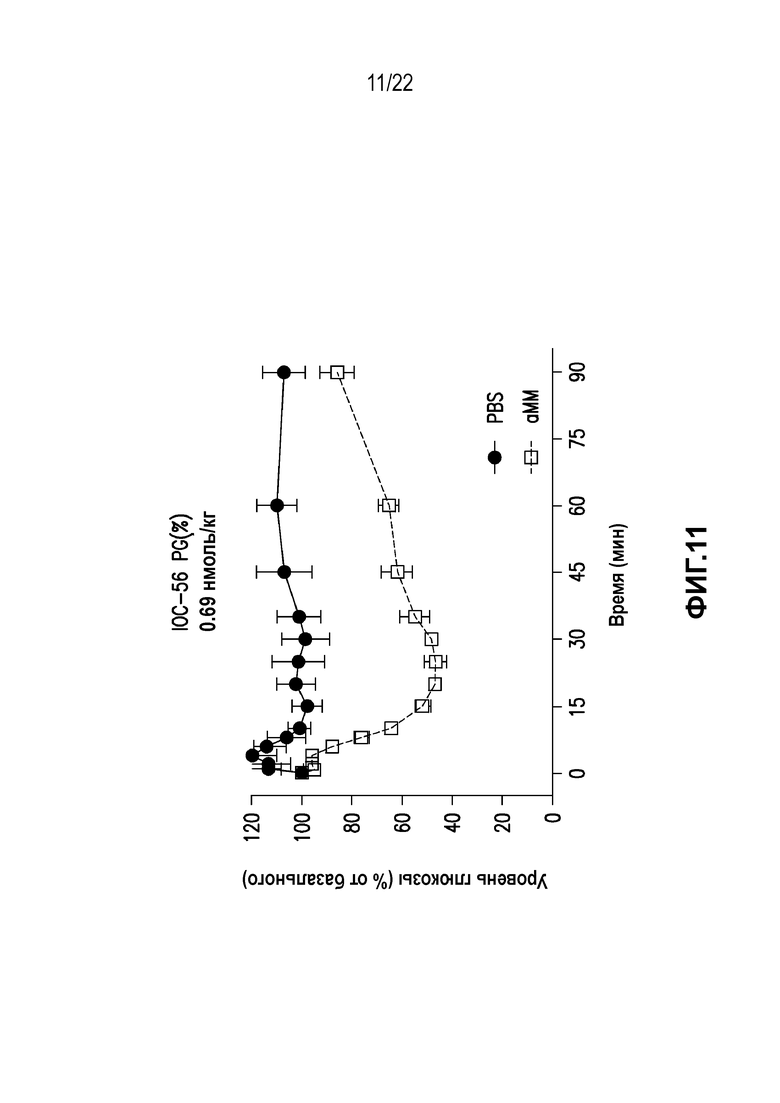

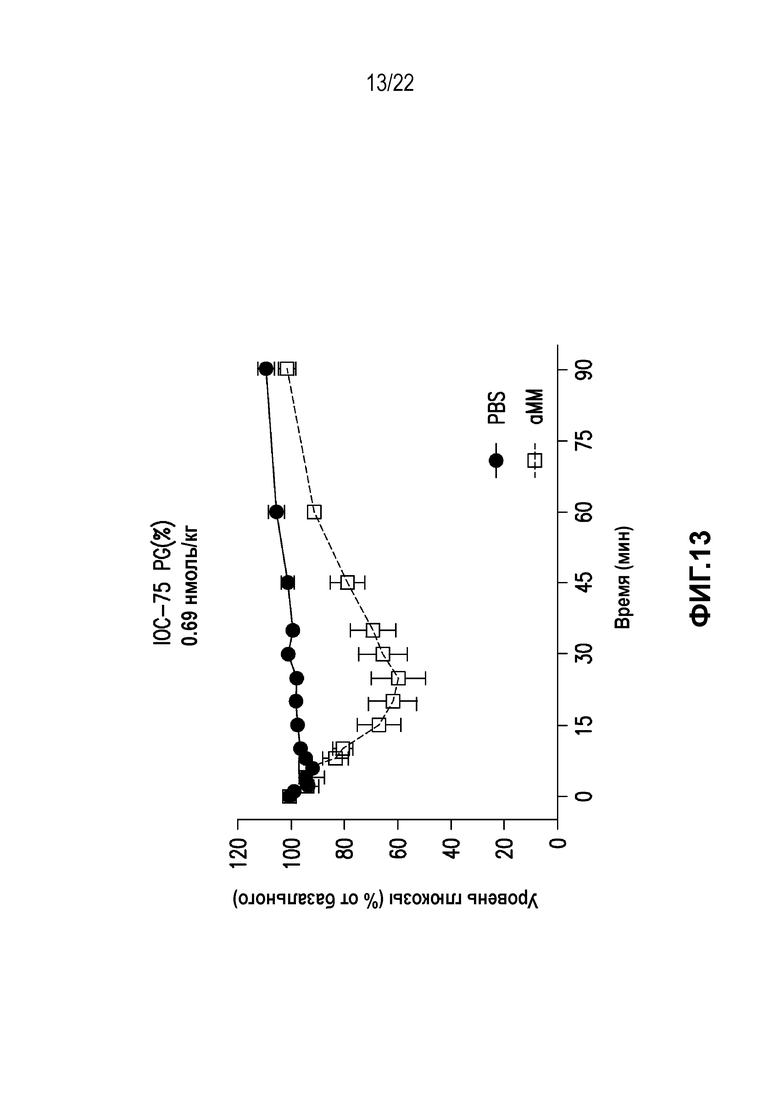
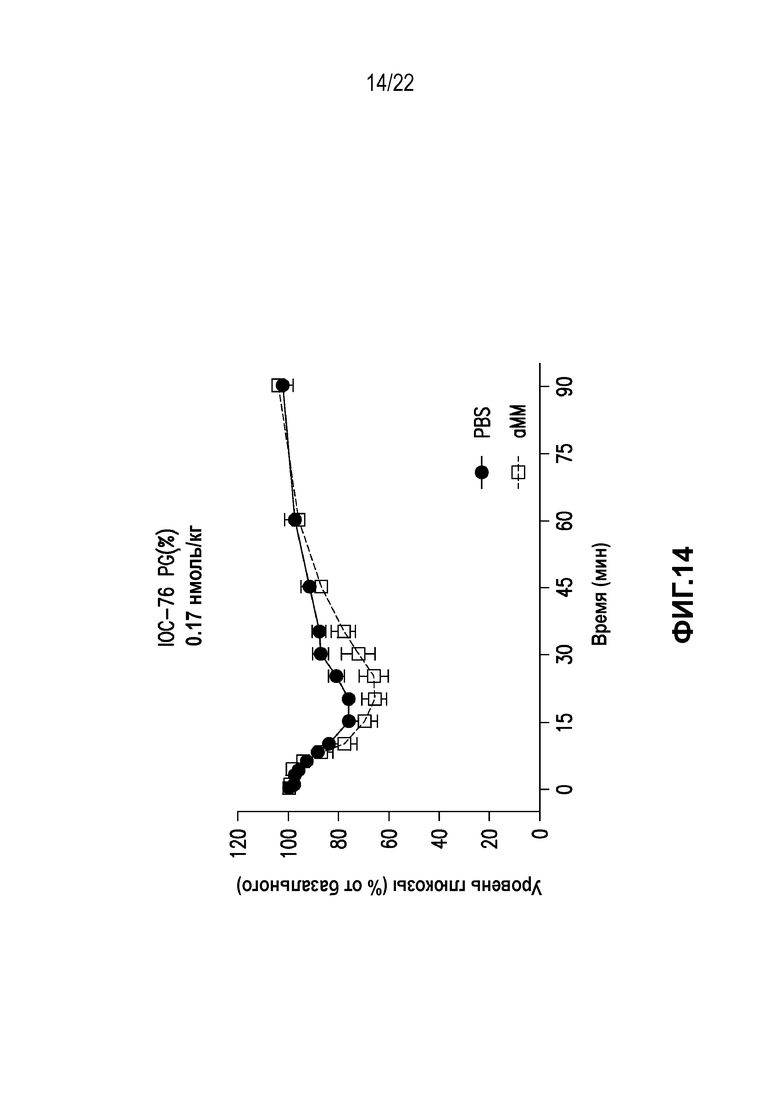
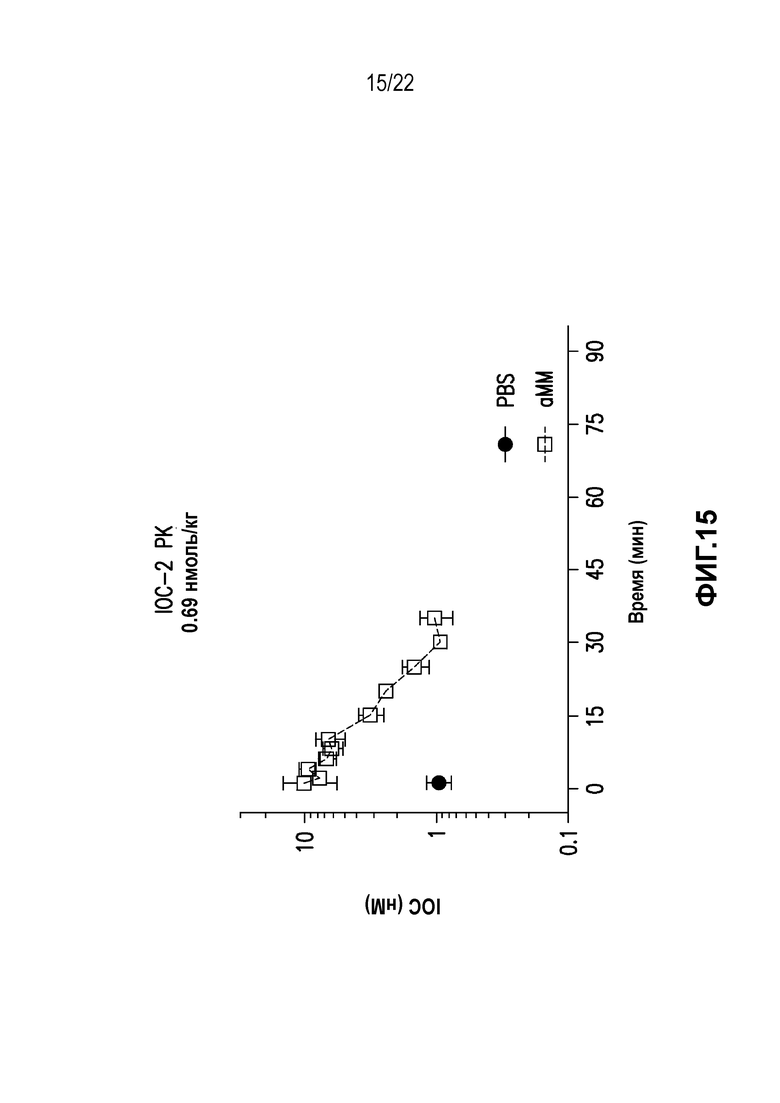
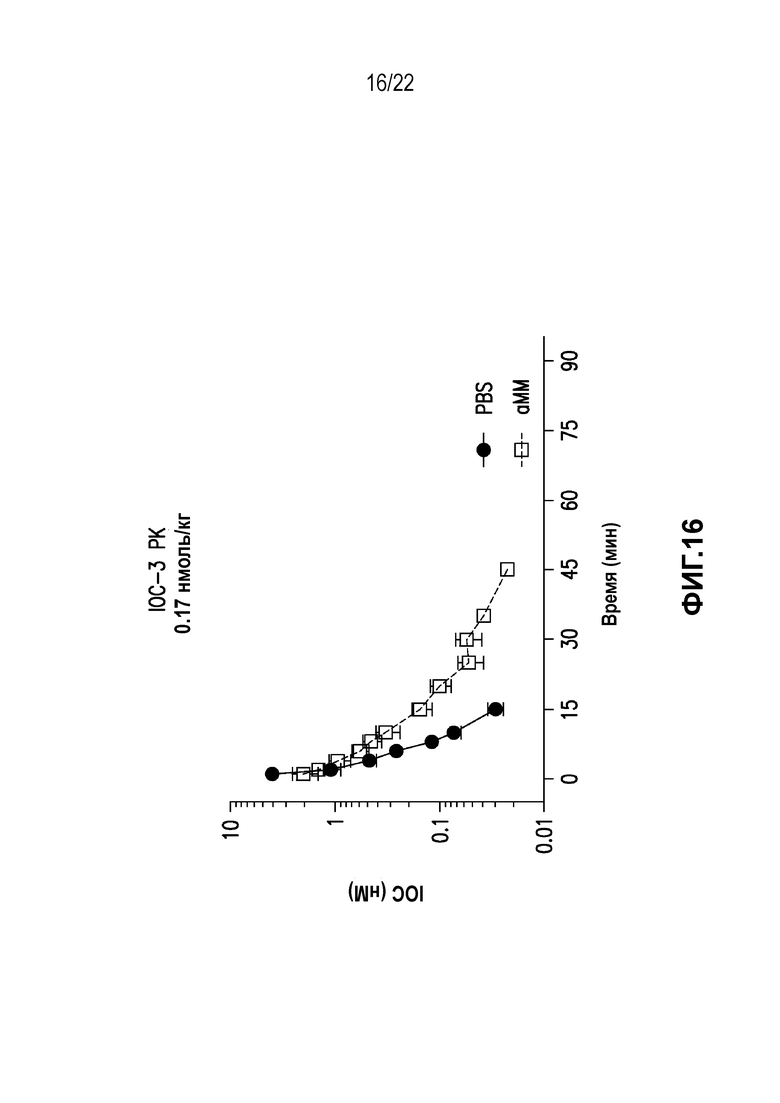





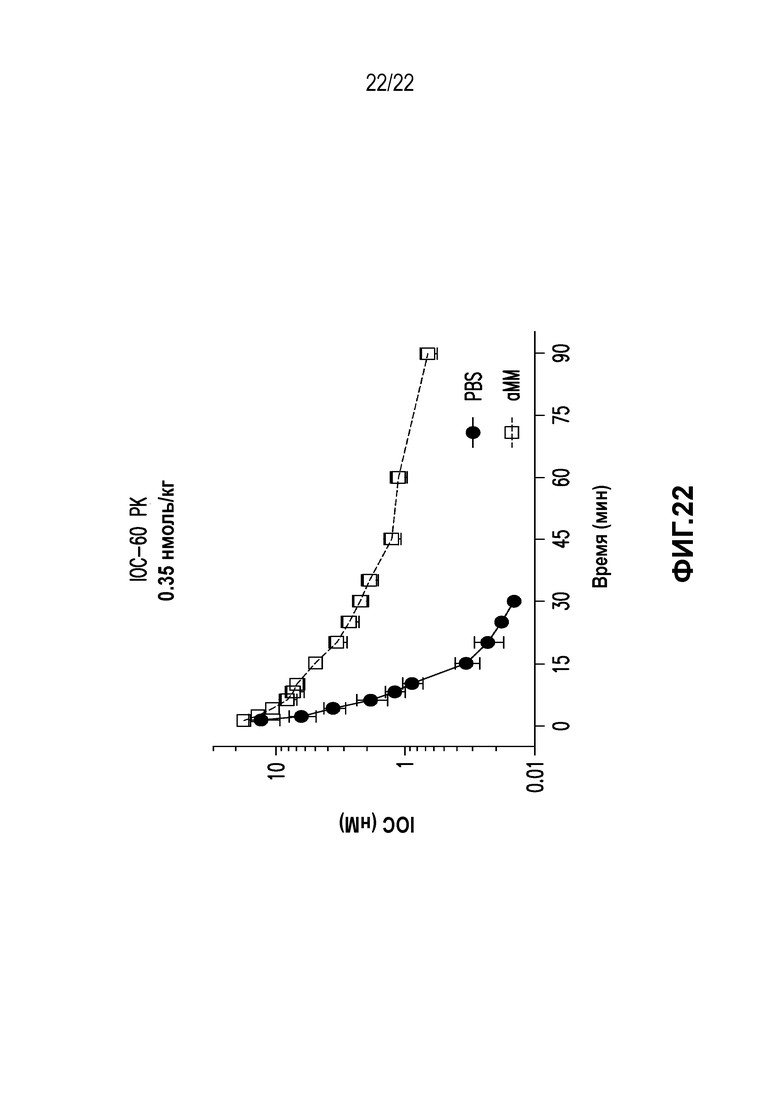
Изобретение относится к конъюгатам инсулина, которые содержат молекулу инсулина, ковалентно присоединенную по меньшей мере к одному бидентатному линкеру, содержащему два плеча, где каждое плечо, независимо присоединенное к лиганду, содержит сахарид и где сахарид представляет собой фукозу. Конъюгаты инсулина характеризуются фармакокинетическим (PK) и/или фармакодинамическим (PD) профилем, который чувствителен к системным концентрациям сахарида, такого как глюкоза или α-метилманноза, даже при введении нуждающемуся в этом субъекту в отсутствие экзогенной мультивалентной сахарид-связывающей молекулы, такой как Con A. 6 н. и 2 з.п. ф-лы, 22 ил., 1 табл., 106 пр.
1. Конъюгат для лечения сахарного диабета, характеризующийся формулой
 или
или
 .
.
2. Применение конъюгата по п. 1 для производства лекарственного средства для лечения сахарного диабета.
3. Применение конъюгата по п. 1 для производства лекарственного средства для лечения сахарного диабета I типа, сахарного диабета II типа, гестационного сахарного диабета, нарушенной толерантности к глюкозе или преддиабета.
4. Композиция для лечения сахарного диабета, содержащая конъюгат по п. 1 и фармацевтически приемлемый носитель.
5. Применение композиции по п. 4 для лечения сахарного диабета.
6. Применение по п. 5, где сахарный диабет представляет собой сахарный диабет I типа, сахарный диабет II типа или гестационный сахарный диабет.
7. Способ лечения субъекта, страдающего сахарным диабетом, включающий в себя
введение субъекту композиции по п. 4 для лечения у субъекта сахарного диабета.
8. Способ по п. 7, где сахарный диабет представляет собой сахарный диабет I типа, сахарный диабет II типа или гестационный сахарный диабет.
| WO 2010088294 A1, 05.08.2010 | |||
| RU 2011135730 A, 10.03.2013 | |||
| WO 2012050822 A1, 19.04.2012 | |||
| WO 2012015681 A2, 02.02.2012. |
Авторы
Даты
2018-12-27—Публикация
2014-10-02—Подача