Область изобретения
Настоящее изобретение относится к конъюгату антитело к В7Н3-аналог экзатекана, способу его получения, содержащей его фармацевтической композиции и его применению в приготовлении лекарственных средств для лечения В7Н3-опосредуемых заболеваний или расстройств, в особенности его применению в приготовлении противоракового лекарственного средства.
Предшествующий уровень техники
Т-клеточно-опосредуемый иммунный ответ играет чрезвычайно важную роль в противоопухолевых процессах в организме. Однако, для активации и пролиферации Т-клеток необходим не только сигнал от антигена, распознаваемый Т-клеточным рецептором (TCR, от англ. - Т cell receptor), но также второй сигнал, поступающий от костимуляторных молекул. Молекулы В7-семейства принадлежат к иммуноглобулиновому суперсемейству костимуляторных молекул. Все в большем и большем количестве исследований показано, что молекулы этого семейства играют важную регуляторную роль в нормальном функционировании иммунной системы и патологическом состоянии в организме.
B7H3 является членом В7-семейства и представляет собой трансмембранный белок I типа, который содержит сигнальный пептид на аминоконце, внеклеточную иммуноглобулин-подобную вариабельную область (IgV) и константную область (IgC), трансмембранную область и цитоплазматическую хвостовую область, имеющую 45 аминокислот (Tissue Antigens, 2007, August; 70(2): 96-104). B7H3 имеет сплайсинг-варианты двух видов, B7H3a и B7H3b. Внеклеточный домен B7H3a состоит из двух иммуноглобулиновых доменов IgV-IgC (также известен как 2IgB7H3), а внеклеточный домен B7H3b состоит из четырех иммуноглобулиновых доменов IgV-IgC-IgV-IgC (также известен как 4IgB7H3).
Белок B7H3 не экспрессируется или слабо экспрессируется в нормальных тканях и клетках, но экспрессируется в высокой степени в различных опухолевых тканях, и его экспрессия тесно коррелирует с прогрессированием опухолей, выживаемостью пациентов и прогнозом. Согласно отчетам о клинических испытаниях B7H3 сверхэкспрессируется при многих типах рака, особенно в случаях немелкоклеточного рака легкого, рака почки, рака эпителия мочевыводящих путей, колоректального рака, рака предстательной железы, мультиформной глиобластомы, рака яичников и рака поджелудочной железы (Lung Cancer, 2009, November, 66(2): 245-249; Clin. Cancer Res. 2008, Aug. 15, 14(16): 5150-5157). Кроме того, в литературе также сообщалось о том, что при раке предстательной железы уровень экспрессии B7H3 положительно коррелирует с параметрами клинической патологии процесса злокачественного новообразования (такими как объем опухоли, инвазия за пределы предстательной железы или индекс Глисона) и также ассоциируется с прогрессированием рака (Cancer Res., 2007, Aug. 15, 67(16): 7893-7900). Аналогичным образом, в случае мультиформной глиобластомы экспрессия B7H3 находится в обратной зависимости от бессобытийной выживаемости, а при раке поджелудочной железы экспрессия B7H3 ассоциируется с метастазированием в лимфатические узлы и патологическим прогрессированием. Ввиду этого B7H3 рассматривают в качестве нового опухолевого маркера и возможной терапевтической мишени.
В настоящее время при проведении доклинических исследований используют терапевтические стратегии со специфичностью к B7H3 как мишени. Например, антитела, направленно воздействующие на мышиный B7H3, будут усиливать инфильтрацию положительных Т-клеток в опухоли и подавлять рост опухоли (Mod. Pathol., 2010, August, 23(8): 1104-1112). Кроме того, в патентной заявке WO 2008/066691 показано, что антитела, распознающие вариант B7H3, В7-H3a, проявляли in vivo противоопухолевый эффект в отношении аденокарциномы. В клинических исследованиях показано, что лекарственное средство на основе антитела к B7H3 мыши, конъюгированного с радиоактивным I131, значительно подавляло рост нейробластомы у пациентов (J. Neurooncol., 97(3): 409-18 (2010)). Однако, изучаемыми в настоящее время проектами являются гуманизированные антитела, которые сконструированы путем гуманизации мышиных антител. Гуманизированные антитела после иммунизации имеют более высокий риск иммуногенности, что является неблагоприятным фактором в случае применения на людях.
Технология фагового дисплея относится к способу слияния экзогенного белка или полипептида с поверхностным фаговым белком с целью осуществления экспрессии экзогенного белка на поверхности фаговых частиц. Библиотека фаговых антител представляет собой библиотеку антител, созданную путем комбинирования технологии фагового дисплея, технологии амплификации с использованием ПЦР (полимеразная цепная реакция) и технологии экспрессии белков с применением комплексных технических средств.
Самое большое преимущество библиотеки фаговых антител заключается в получении полностью гуманизированного антитела путем имитации трех способов получения антител in vivo без иммунизации животных. Помимо этого, библиотека фаговых антител имеет следующие преимущества: 1) достигается унификация генотипа и фенотипа; кроме того, данный экспериментальный метод отличается простотой и быстротой исполнения; для традиционного способа получения антител с применением гибридомной технологии необходимо несколько месяцев, в то время как для технологии с применением библиотеки антител необходимо только несколько недель; 2) экспрессированный продукт представляет собой полностью гуманизированное антитело, и это антитело экспрессируется главным образом в форме активных фрагментов Fab и одноцепочечного вариабельного фрагмента (scFv). Благодаря низкой молекулярной массе экспрессированное антитело имеет очевидные преимущества в плане способности проникновения в ткани по сравнению с интактным антителом; 3) производительность скрининга велика: гибридомную технологию используют, чтобы провести скрининг среди нескольких тысяч клонов, в то время как технологию с применением библиотеки антител можно использовать для проведения отбора из миллионов или даже нескольких сотен миллионов молекул, поэтому будут получены более разнообразные антитела; 4) широкие возможности применения: используется система экспрессии прокариот, что дает более очевидное преимущество при крупномасштабном производстве (Curr. Opin. Biotechnol., 2002, December, 13(6): 598-602; Immunotechnology, 2013, 48(13): 63-73).
В конъюгатах антитело-лекарственное средство (ADC, от англ. antibody drug conjugate) можно комбинировать моноклональное антитело или фрагмент антитела с биологически активным цитотоксином через химически стабильный линкер, используя все преимущества специфичности связывания антитела с поверхностными антигенами нормальных клеток или опухолевых клеток и высокой эффективности цитотоксина при одновременном избегании низкой эффективности данного антитела и токсического побочного действия цитотоксина. Это означает, что по сравнению с традиционными химиотерапевтическими лекарственными средствами конъюгаты антитело-лекарственное средство могут с высокой степенью точности связываться с опухолевыми клетками при ослабленном воздействии на нормальные клетки.
В настоящее время, в клинике или клиническом исследовании использован ряд лекарственных средств ADC. Например, кадсила представляет собой лекарственное средство ADC, образованное с использованием трастузумаба, направленно воздействующего на рецептор эпидермального фактора роста 2 типа у человека (Her2), и N2'-дезацетил-N2'-(3-меркапто-1-оксопропил)майтанзина (DM1). В то же время также имеются патентные заявки, описывающие антитела и лекарственные средства ADC, направленно воздействующие на B7H3, такие как WO 2008100934, WO 2012147713, WO 2014061277, WO 2015184203 и WO 2016044383.
Имеется несколько типов цитотоксических малых молекул, используемых в конъюгате антитело-лекарственное средство, одной из которых являются производные камптотецина, демонстрирующие противоопухолевый эффект посредством ингибирования топоизомеразы I. Документы, описывающие применение производного камптотецина, экзатекана (химическое название: (1S,9S)-1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1Н,12Н-бензо[де]пирано[3',4':6,7]имидазо[1,2-b]хинолин-10,13(9Н,15Н)-дион), в конъюгате антитело-лекарственное средство (ADC), включают WO 2014057687, Clinical Cancer Research, (2016) 22(20): 5097-5108 и Cancer Sci., (2016) 107: 1039-1046. Однако, все еще остается потребность в дальнейшей разработке лекарственных средств ADC с улучшенной эффективностью.
Краткое описание сущности изобретения
Настоящее изобретение относится к ADC на основе антитела к B7H3 и его применению, и согласно настоящему изобретению предложено лекарственное средство ADC, образованное путем конъюгирования моноклонального антитела или антиген-связывающего фрагмента с цитотоксичными аналогами экзатекана, при этом моноклональное антитело или антиген-связывающий фрагмент связывается с аминокислотной последовательностью или пространственной структурой внеклеточной области B7H3.
Таким образом, целью настоящего изобретения является разработка конъюгата лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвата:
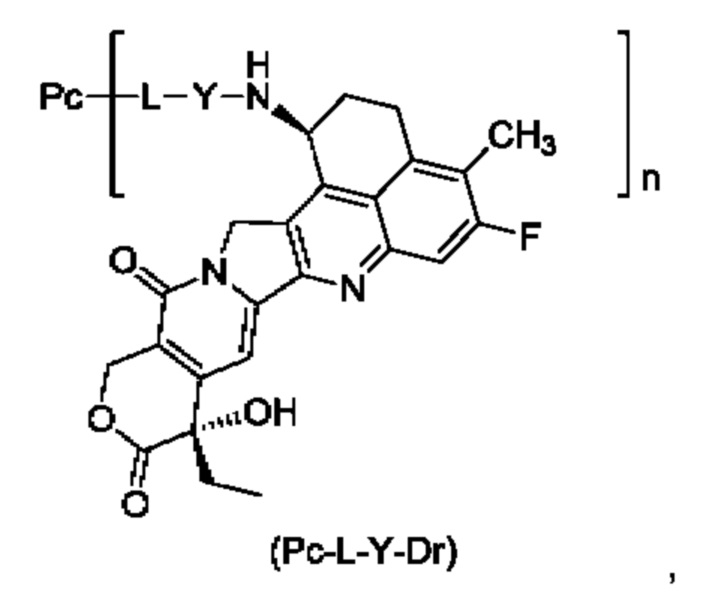
где:
Y выбран из группы, состоящей из -O-(CRaRb)m-CR1R2-C(O)-, -O-CR1R2-(CRaRb)m-, -O-CR1R2-, -NH-(CRaRb)m-CR1R2-C(O)- и -S-(CRaRb)m-CR1R2-C(O)-;
Ra и Rb являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода, атома дейтерия, галогена, алкила, галогеналкила, дейтерированного алкила, алкокси, гидрокси, амино, циано, нитро, гидроксиалкила, циклоалкила и гетеро циклила;
или Ra и Rb вместе с атомом углерода, к которому они присоединены, образуют циклоалкил или гетероциклил;
R1 выбран из группы, состоящей из галогена, галогеналкила, дейтерированного алкила, циклоалкила, циклоалкилалкила, алкоксиалкила, гетероциклила, арила и гетероарила;
R2 выбран из группы, состоящей из атома водорода, галогена, галогеналкила, дейтерированного алкила, циклоалкила, циклоалкилалкила, алкоксиалкила, гетероциклила, арила и гетероарила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил или гетероциклил;
или Ra и R2 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил или гетероциклил;
m представляет собой целое число от 0 до 4;
n равно 1-10, возможно выбрано из примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10;
n может представлять собой целое число или десятичную дробь;
L представляет собой линкерное звено;
Рс представляет собой антитело к B7H3 или его антиген-связывающий фрагмент.
В некоторых воплощениях настоящего изобретения, в предложенном конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, антитело к B7H3 или его антиген-связывающий фрагмент содержит:
определяющий комплементарность участок 1 тяжелой цепи (HCDR1), HCDR2 и HCDR3, представленные аминокислотными последовательностями SEQ ID NO: 8, 9 и 10, соответственно, или варианты HCDR, имеющие 3, 2 или 1 отличие(я) в аминокислотном составе от HCDR1, HCDR2 и HCDR3, представленных в SEQ ID NO: 8, 9 и 10, соответственно; и
CDR1 легкой цепи (LCDR1), LCDR2 и LCDR3, представленные аминокислотными последовательностями SEQ ID NO: 11, 12 и 13, соответственно, или варианты LCDR, имеющие 3, 2 или 1 отличие(я) в аминокислотном составе от LCDR1, LCDR2 и LCDR3, представленных в SEQ ID NO: 11, 12 и 13, соответственно.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, каркасная область (FR) легкой цепи в вариабельной области легкой цепи антитела к B7H3 или его антиген-связывающего фрагмента происходит из последовательности легкой цепи иммуноглобулина зародышевой линии человека или ее мутантной последовательности, и/или FR область тяжелой цепи в вариабельной области тяжелой цепи происходит из последовательности тяжелой цепи иммуноглобулина зародышевой линии человека или ее мутантной последовательности.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, антитело к B7H3 или его антиген-связывающий фрагмент содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, выбранные из следующих вариантов:
аминокислотной последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 6 или имеет по меньшей мере 95% идентичности последовательности с SEQ ID NO: 6, аминокислотной последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 7 или имеет по меньшей мере 95% идентичности последовательности c SEQ ID NO: 7.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, антитело к B7H3 или его антиген-связывающий фрагмент содержит константную область антитела; при этом константная область тяжелой цепи константной области антитела происходит из IgG1, IgG2, IgG3 или IgG4 человека или имеет по меньшей мере 95% идентичности последовательности с ними, константная область легкой цепи константной области антитела происходит из κ, λ цепей человеческого антитела или имеет по меньшей мере 95% идентичности последовательности с ними; и предпочтительно, аминокислотная последовательность константной области тяжелой цепи происходит из IgG1 человека или имеет по меньшей мере 95% идентичности последовательности с ним.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, Рс представляет собой полноразмерное антитело; при этом полноразмерное антитело выбрано из группы, состоящей из:
антитела h1702, состоящего из последовательности тяжелой цепи, представленной в SEQ ID NO: 14, и последовательности легкой цепи, представленной в SEQ ID NO: 15, и
антитела h1702DS, состоящего из последовательности тяжелой цепи, представленной в SEQ ID NO: 14, и последовательности легкой цепи, представленной в SEQ ID NO: 16.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, антиген-связывающий фрагмент выбран из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечных антител (scFv), димеризованных форм вариабельных (V, от англ. variable) областей (двойного антитела), стабилизированных дисульфидными связями V областей (dsFv) и антиген-связывающих фрагментов пептидов, содержащих определяющие комплементарность участки (CDR).
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, R1 представляет собой галогеналкил или С3-6циклоалкил.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, R2 представляет собой атом водорода.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, R1 представляет собой С3-6циклоалкил; и R2 представляет собой атом водорода.
В некоторых воплощениях настоящего изобретения предложены конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемые соль или сольват,
где:
Y представляет собой -O-(CRaRb)m-CR1R2-C(O)-;
Ra и Rb являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода, атома дейтерия, галогена и алкила;
R1 представляет собой галогеналкил или С3-6циклоалкил;
R2 выбран из группы, состоящей из атома водорода, галогеналкила или С3-6циклоалкила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкил;
m равно 0 или 1.
В некоторых воплощениях настоящего изобретения предложены конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемые соль или сольват,
где:
Y представляет собой -O-(CRaRb)m-CR1R2-C(O)-;
Ra и Rb являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода, атома дейтерия, галогена и алкила;
R1 представляет собой С3-6циклоалкил;
R2 представляет собой атом водорода;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкил;
m равно 0.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, Y выбран из группы, состоящей из:
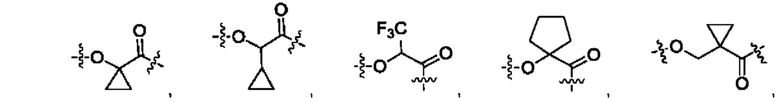
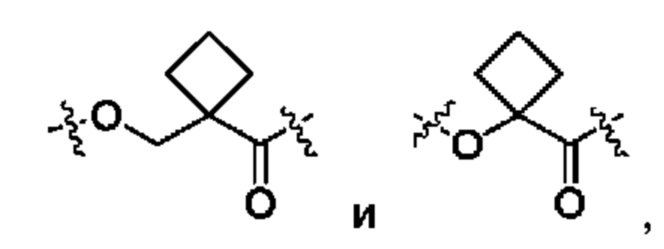 предпочтительно
предпочтительно 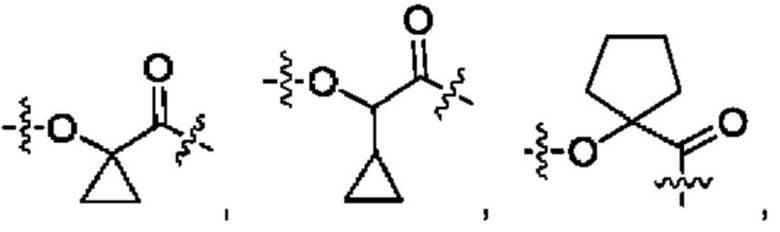
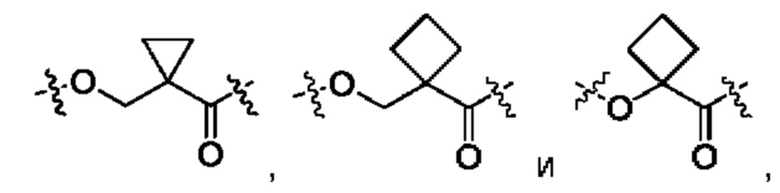 и наиболее предпочтительно
и наиболее предпочтительно 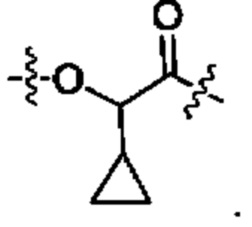
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, О-конец Y присоединен клинкерному звену L.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, n равно 2-8, предпочтительно 5-9 и наиболее предпочтительно 7,5; и неограничивающие примеры включают 3; 4; 5; 6; 7,2; 7,5; 8; 8,5; 9.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, линкерное звено -L- представляет собой -L1-L2-L3-L4-, где:
L1 представляет собой  и s1 представляет собой целое число от 2 до 8;
и s1 представляет собой целое число от 2 до 8;
L2 представляет собой химическую связь;
L3 представляет собой тетрапептидный остаток;
L4 представляет собой -NR5(CR6R7)t-, R5, R6 и R7 являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода и алкила, и t равно 1 или 2.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, конец L1 линкерного звена -L- присоединен к лиганду, а конец L4 линкерного звена -L- присоединен к Y.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, тетрапептидный остаток L3 представляет собой аминокислотный остаток, составленный из двух или более аминокислот, выбранных из группы, состоящей из фенилаланина (Е), глицина (G), валина (V), лизина (K), цитруллина, серина (S), глутаминовой кислоты (Е) и аспарагиновой кислоты (N), и предпочтительно тетрапептидный остаток GGFG (глицин-глицин-фенилаланин-глицин).
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, -L-Y- представляет собой структуру, которая приведена ниже:
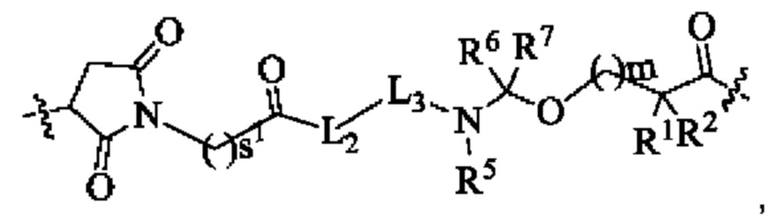
где:
L2 представляет собой химическую связь;
L3 представляет собой тетрапептидный остаток GGFG;
R1 представляет собой галогеналкил или С3-6циклоалкил;
R2 выбран из группы, состоящей из атома водорода, галогеналкила или С3-6циклоалкила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкил;
R5, R6 и R7 являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода и алкила;
s1 представляет собой целое число от 2 до 8;
m представляет собой целое число от 0 до 4.
В некоторых воплощениях настоящего изобретения, в конъюгате лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвате, -L-Y- выбран из группы, состоящей из:
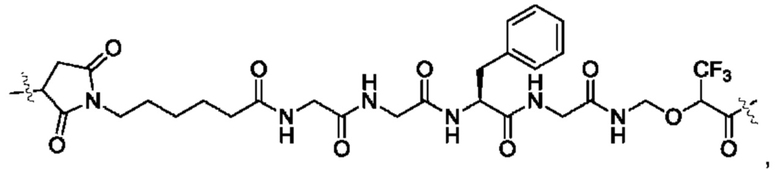
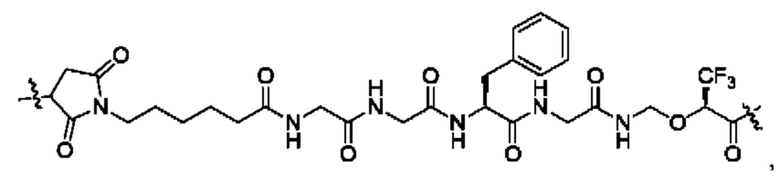
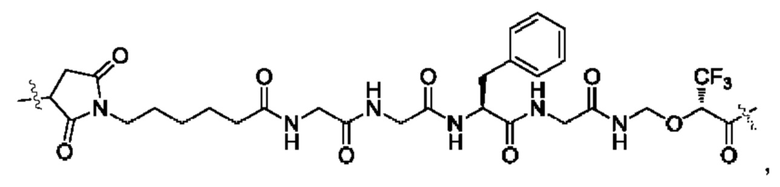
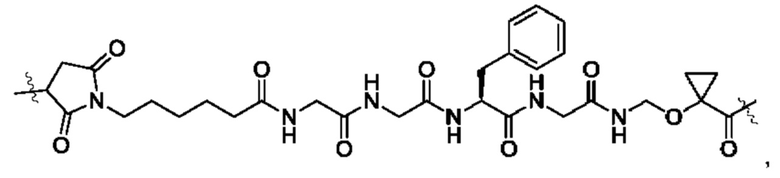
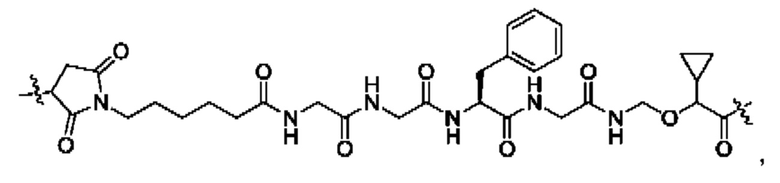
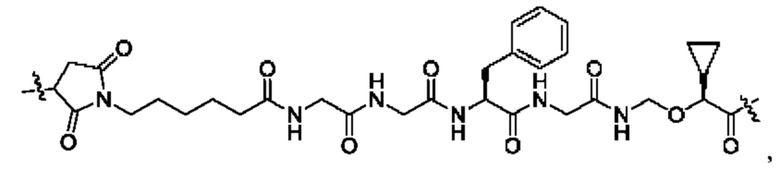
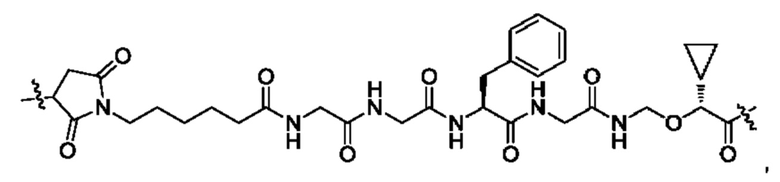
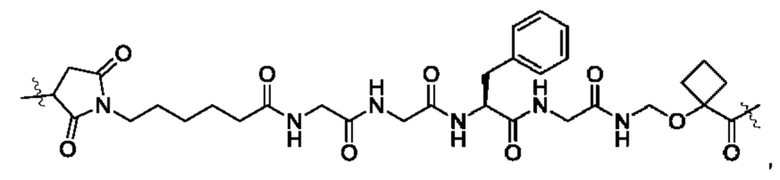
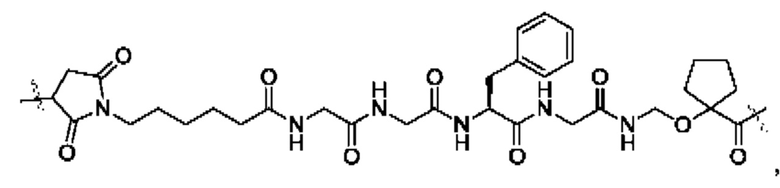
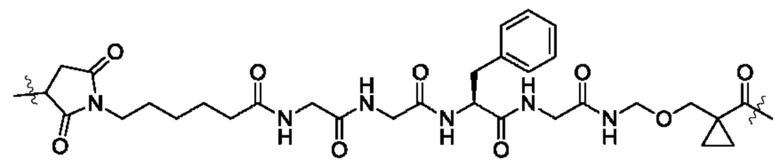 и
и
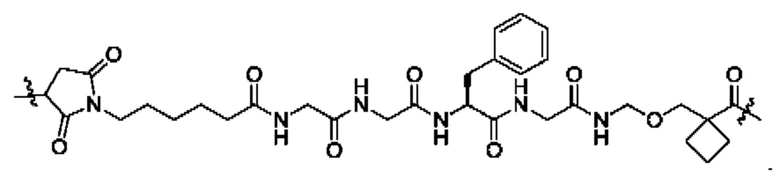
В некоторых воплощениях настоящего изобретения конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая(ый) соль или сольват представляет собой конъюгат лиганд-лекарственное средство формулы (Рс-La-Y-Dr) или фармацевтически приемлемые соль или сольват:
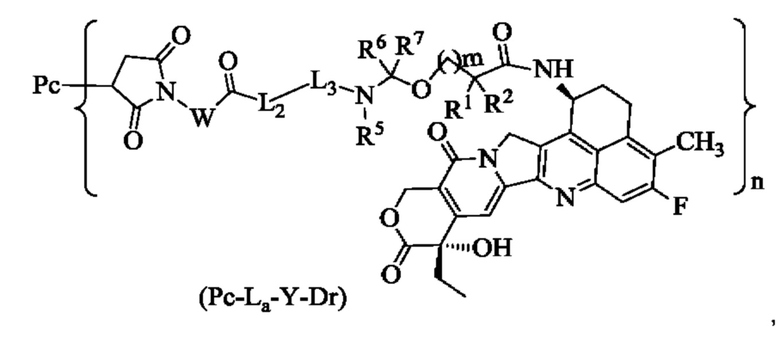
где:
W выбран из группы, состоящей из С1-8алкила, С1-8алкил-циклоалкила и линейного гетероалкила, содержащего от 1 атома до 8 атомов, причем гетероалкил содержит от 1 гетероатома до 3 гетероатомов, выбранных из группы, состоящей из N, О и S, при этом каждый указанный С1-8алкил, циклоалкил и линейный гетероалкил возможно независимо дополнительно замещен одним заместителем или несколькими заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, алкила, хлоралкила, дейтерированного алкила, алкокси и циклоалкила;
L2 выбран из группы, состоящей из -NR4(CH2CH2O)p1CH2CH2C(O)-, -NR4(CH2CH2O)p1CH2C(O)-, -S(CH2)p1C(O)- и химической связи, р1 представляет собой целое число от 1 до 20 и предпочтительно 1-6;
L3 представляет собой пептидный остаток, составленный из 2-7 аминокислот, причем аминокислота может быть замещенной или незамещенной, при наличии замещения замещаемая(ые) группа(ы) может/могут быть замещена(ы) по любому доступному месту присоединения, при этом замещающей(ими) группой(ами) являет(ют)ся одна или более групп, независимо выбранных из группы, состоящей из галогена, гидрокси, циано, амино, алкила, хлоралкила, дейтерированного алкила, алкокси и циклоалкила;
R1 выбран из группы, состоящей из галогена, галогеналкила, дейтерированного алкила, циклоалкила, гетеро цикл ила, арила и гетероарила;
R2 выбран из группы, состоящей из атома водорода, галогена, галогеналкила, дейтерированного алкила, циклоалкила, гетеро цикл ила, арила и гетероарила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклоалкил или гетероциклил;
R4 и R5 являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода, алкила, галогеналкила, дейтерированного алкила и гидроксиалкила;
R6 и R7 являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода, галогена, алкила, галогеналкила, дейтерированного алкила и гидроксиалкила;
m представляет собой целое число от 0 до 4;
n равно 1-10, что может означать целое число или десятичную дробь;
Рс представляет собой антитело к B7H3 или его антиген-связывающий фрагмент.
В некоторых воплощениях настоящего изобретения конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемые соль или сольват представляет собой конъюгат лиганд-лекарственное средство формулы (Pc-Lb-Y-Dr) или фармацевтически приемлемые соль или сольват:
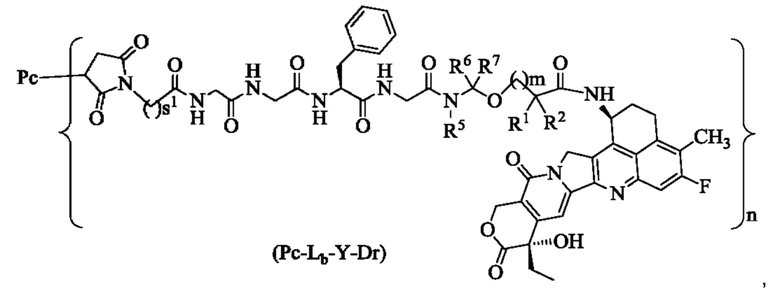
где:
s1 представляет собой целое число от 2 до 8 и предпочтительно 5;
R1, R2, R5 - R7, m и n являются такими, как определено в формуле (Pc-La-Y-Dr).
В некоторых воплощениях настоящего изобретения, в случае конъюгата лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемых соли или сольвата, конъюгат лиганд-лекарственное средство выбран из группы, состоящей из:
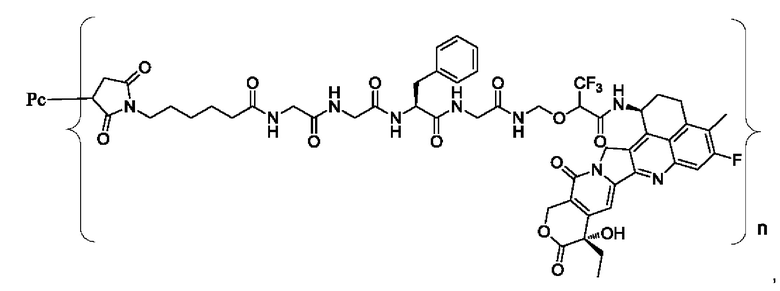
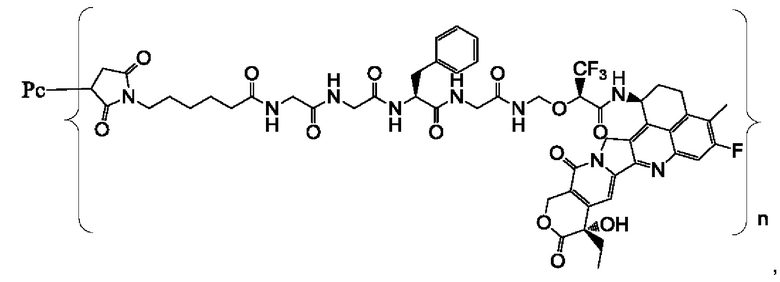
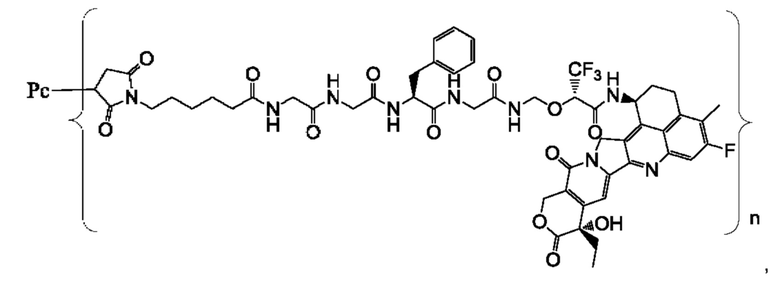
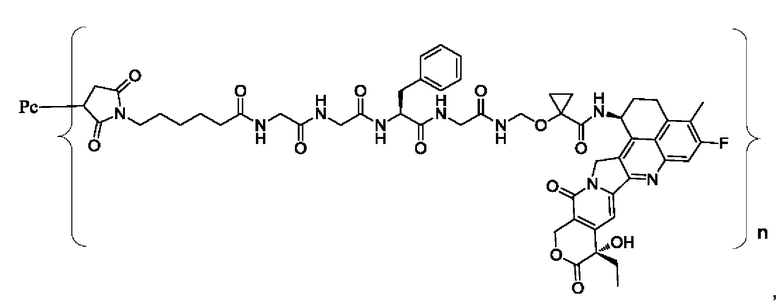
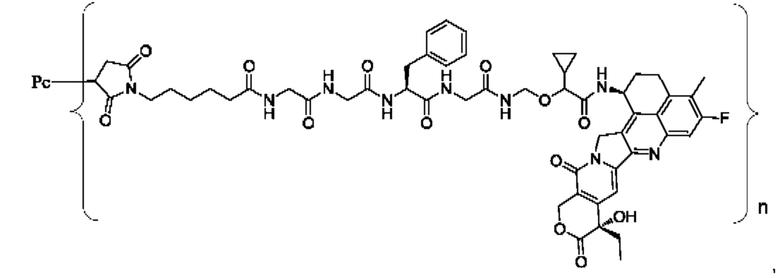
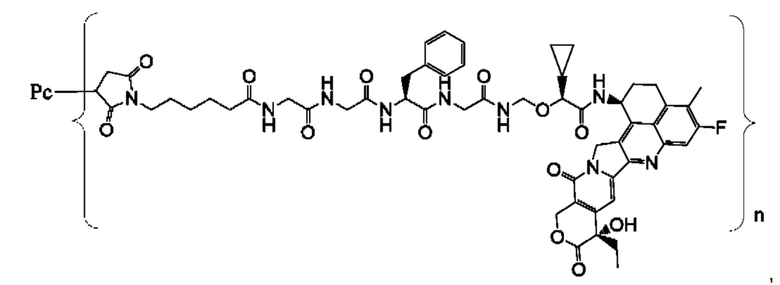
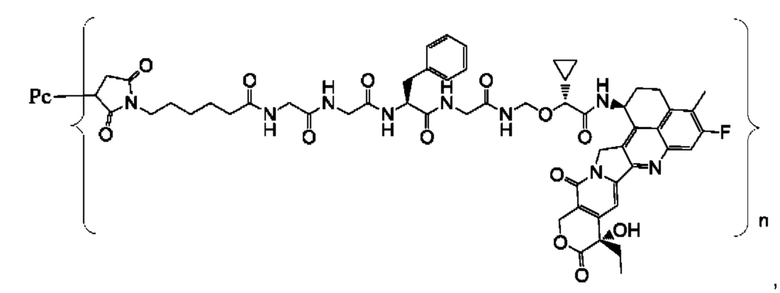
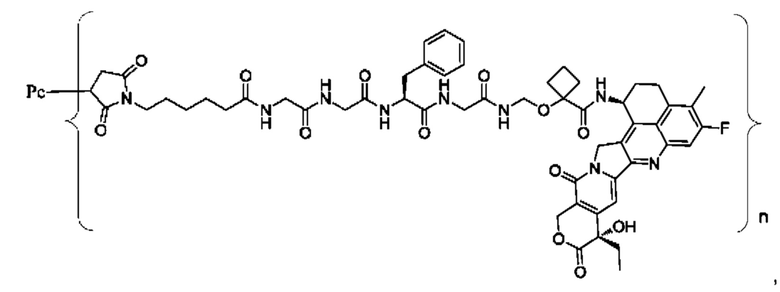
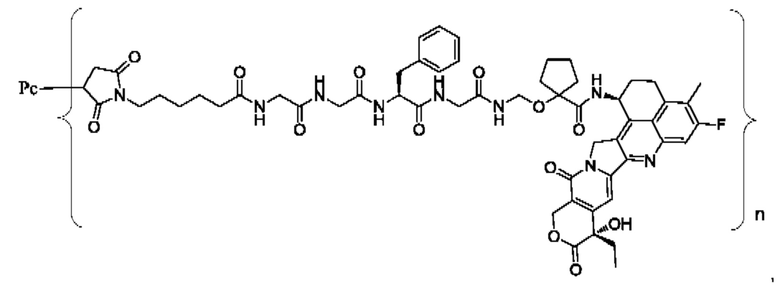
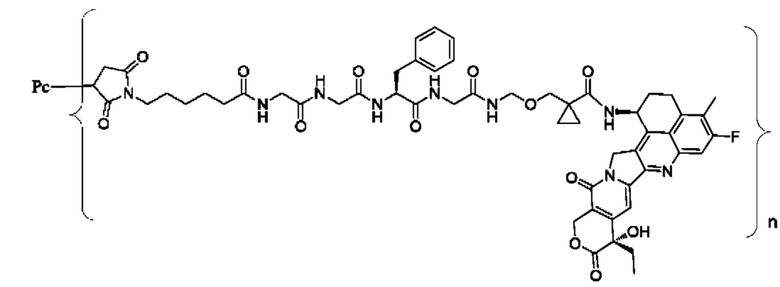
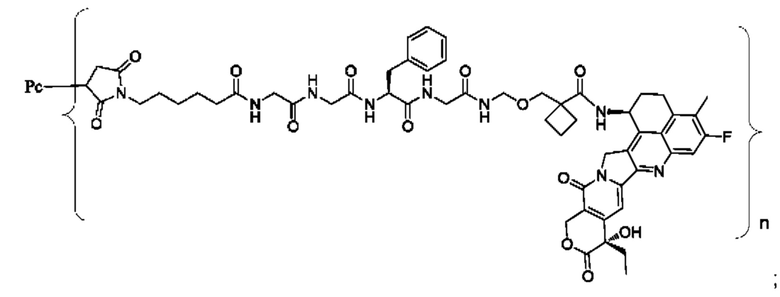
где Рс и n являются такими, как определено в формуле (Pc-L-Y-Dr).
Типичные конъюгаты лиганд-лекарственное средство формулы (Pc-L-Y-Dr) по настоящему изобретению включают, но не ограничиваются этим, следующие конъюгаты лиганд-лекарственное средство:

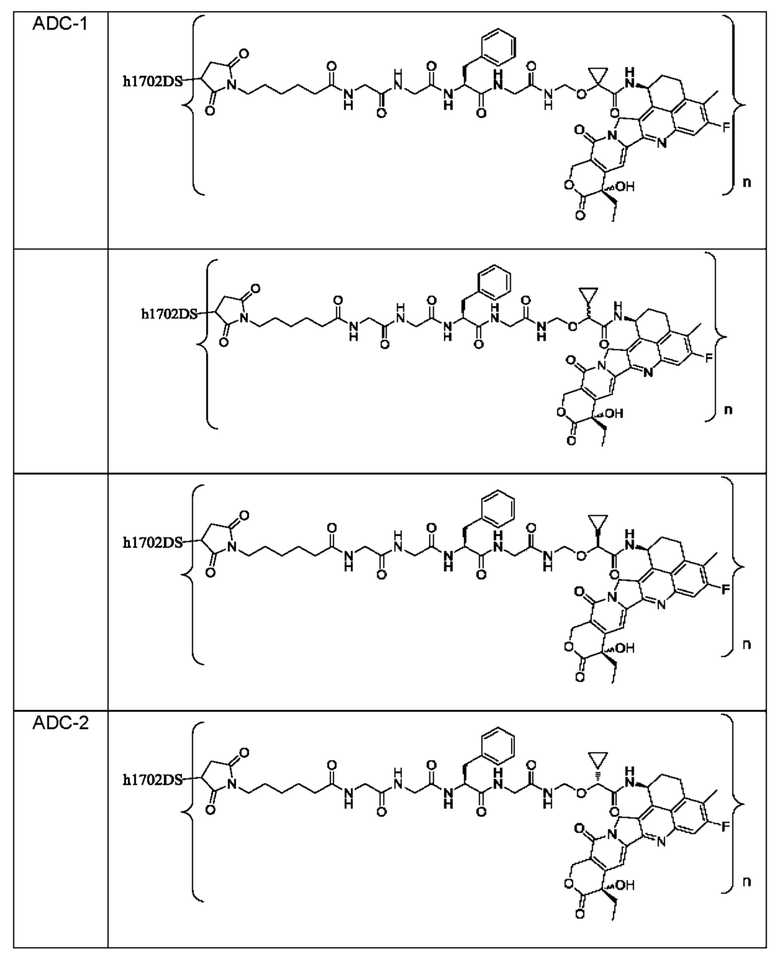
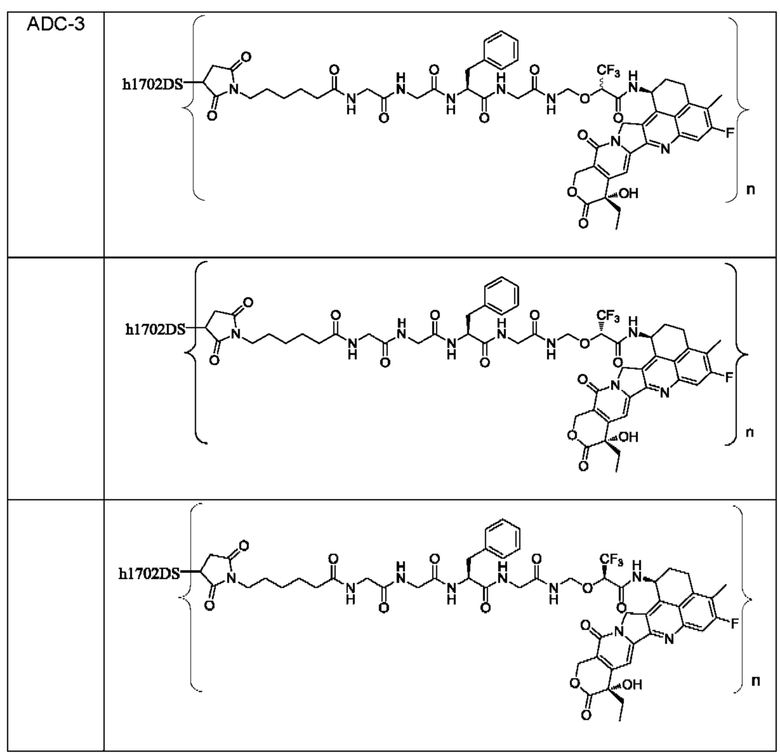
или их фармацевтически приемлемые соль или сольват;
где n может представлять собой целое число, не равное нулю, или десятичную дробь от 0 до 10, предпочтительно n представляет собой целое число или десятичную дробь от 1 до 10; более предпочтительно n равно 2-8, что может означать целое число или десятичную дробь; и наиболее предпочтительно n равно 3-8, что может означать целое число или десятичную дробь.
Кроме того, согласно настоящему изобретению предложен способ получения конъюгата лиганд-лекарственное средство формулы (Рс-La-Y-Dr) или его фармацевтически приемлемых соли или сольвата, включающий следующую стадию:
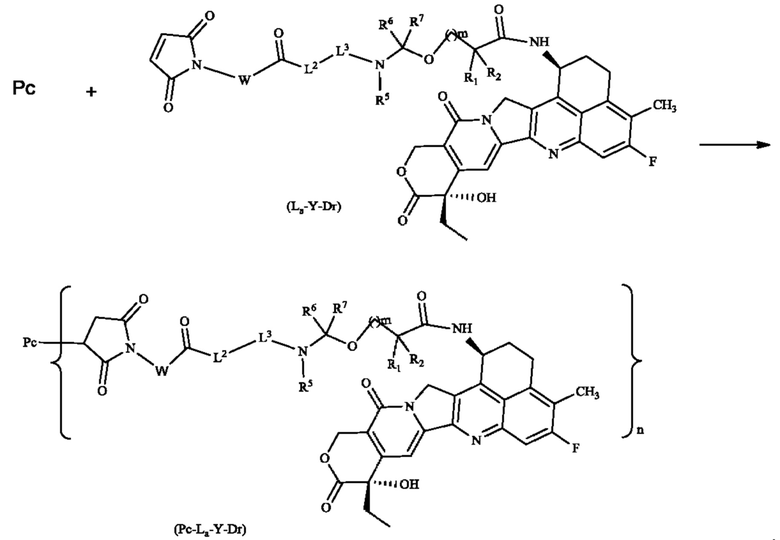
на которой
осуществляют реакцию сочетания Рс с соединением формулы (La-Y-Dr) после восстановления, получая соединение формулы (Рс-La-Y-Dr); восстанавливающий агент предпочтительно представляет собой ТСЕР (трис(2-карбоксиэтил)фосфин);
при этом:
Рс представляет собой антитело к B7H3 или его антиген-связывающий фрагмент;
W, L2, L3, R1, R2, R5 - R7, m и n являются такими, как определено в формуле (Рс-La-Y-Dr).
В другом воплощении предложен другой способ, где соединение формулы La-Y-Dr представляет собой соединение формулы La-Y-Dr:
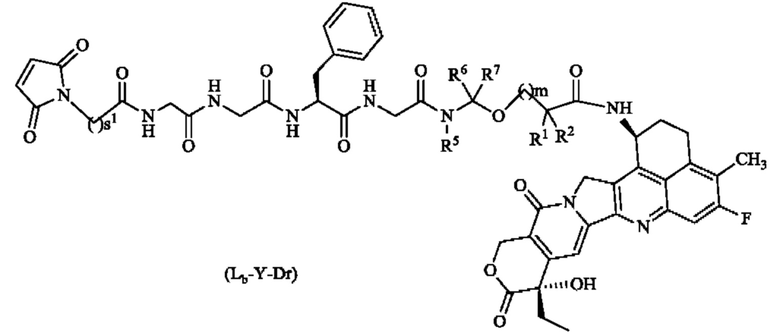
или его таутомер, мезомер, рацемат, энантиомер, диастереомер либо их смесь или их фармацевтически приемлемую соль,
где R1, R2, R5 - R7, s1 и m являются такими, как определено в формуле Рс-La-Y-Dr.
В предпочтительном воплощении по настоящему изобретению, в способе получения конъюгата лиганд-лекарственное средство формулы (Рс-La-Y-Dr) или (Рс-La-Y-Dr) или его фармацевтически приемлемых соли или сольвата, соединение формулы (La-Y-Dr) или соединение формулы (Lb-Y-Dr) выбрано из группы, состоящей из:
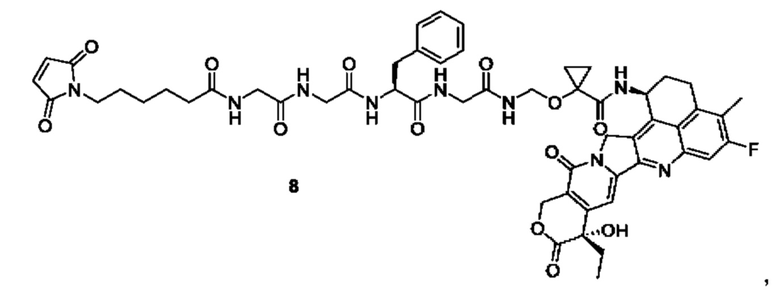
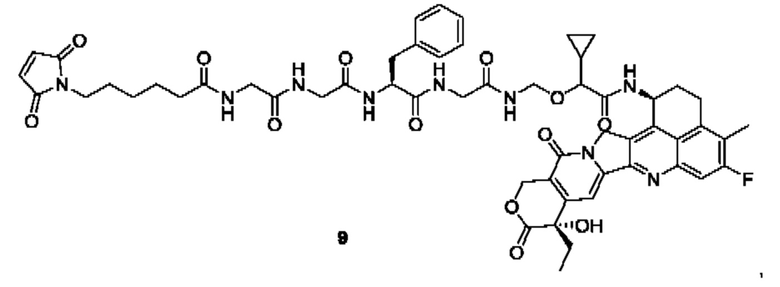
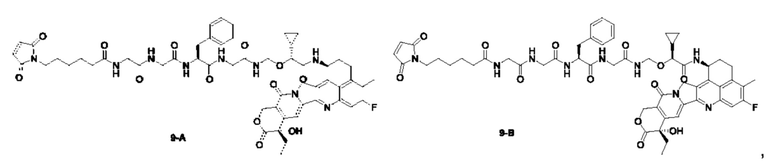
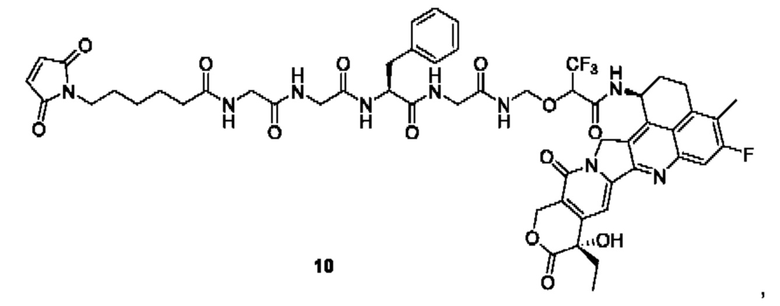
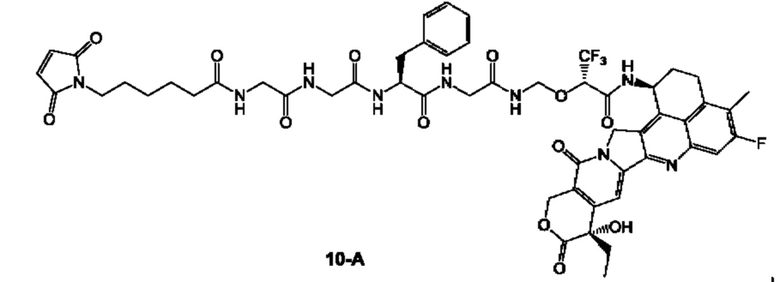
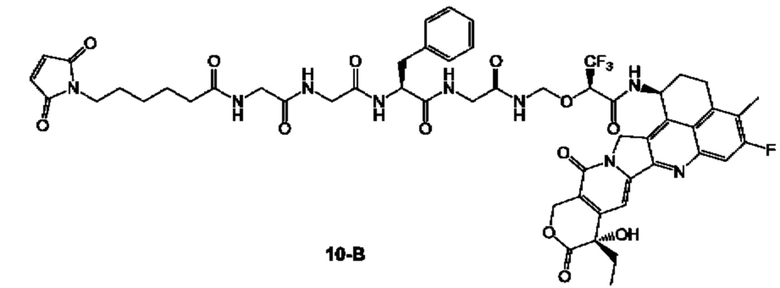 и
и
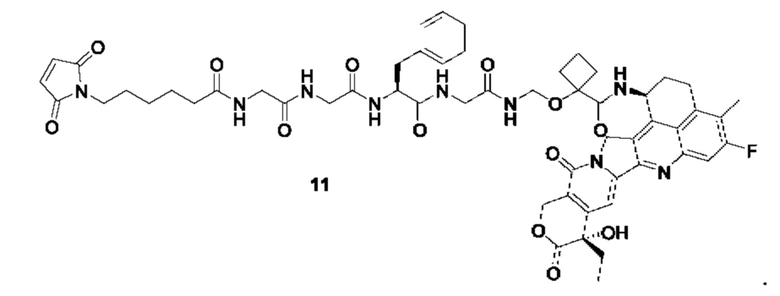
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая конъюгат лиганд-лекарственное средство или его фармацевтически приемлемые соль или сольват по настоящему изобретению и один или более чем один фармацевтически приемлемый эксципиент, разбавитель или носитель.
Согласно другому аспекту настоящего изобретения предложено применение конъюгата лиганд-лекарственное средство или его фармацевтически приемлемых соли либо сольвата или фармацевтической композиции, содержащей указанное выше, предложенное согласно настоящему изобретению, в приготовлении лекарственных средств для лечения В7Н3-опосредуемых заболеваний или расстройств; при этом В7Н3-опосредуемое заболевание или расстройство представляет собой раке высокой степенью экспрессии B7H3.
Согласно другому аспекту настоящего изобретения предложено применение конъюгата лиганд-лекарственное средство или его фармацевтически приемлемых соли либо сольвата или фармацевтической композиции, содержащей указанное выше, предложенное согласно настоящему изобретению, в приготовлении лекарственных средств для лечения или предупреждения возникновения опухоли, при этом рак предпочтительно выбран из группы, состоящей из рака молочной железы, рака яичников, рака шейки матки, рака легкого, рака матки, рака предстательной железы, рака почки, рака уретры, рака мочевого пузыря, рака печени, рака желудка, рака эндометрия, рака слюнных желез, рака пищевода, меланомы, глиомы, нейробластомы, саркомы, фарингеального рака, рака толстой кишки, рака прямой кишки, колоректального рака, лейкоза, рака кости, рака кожи, рака щитовидной железы, рака поджелудочной железы и лимфомы.
Согласно другому аспекту настоящее изобретение также относится к способу лечения и/или предупреждения возникновения опухоли, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества конъюгата лиганд-лекарственное средство или его фармацевтически приемлемых соли либо сольвата или фармацевтической композиции, содержащей указанное выше, предложенное согласно настоящему изобретению, при этом опухоль предпочтительно представляет собой рак, ассоциированный с высокой степенью экспрессии B7H3.
Согласно другому аспекту настоящее изобретение также относится к способу лечения или предупреждения рака, включающему введение пациенту, нуждающемуся в этом, терапевтически эффективного количества конъюгата лиганд-лекарственное средство или его фармацевтически приемлемых соли либо сольвата или фармацевтической композиции, содержащей указанное выше, предложенное согласно настоящему изобретению, при этом рак предпочтительно выбран из группы, состоящей из рака молочной железы, рака яичников, рака шейки матки, рака легкого, рака матки, рака предстательной железы, рака почки, рака уретры, рака мочевого пузыря, рака печени, рака желудка, рака эндометрия, рака слюнных желез, рака пищевода, меланомы, глиомы, нейробластомы, саркомы, фарингеального рака, рака толстой кишки, рака прямой кишки, колоректального рака, лейкоза, рака кости, рака кожи, рака щитовидной железы, рака поджелудочной железы и лимфомы.
На основе активного соединения может быть приготовлена композиция в форме, подходящей для введения любым подходящим путем, и активное соединение предпочтительно находится в форме стандартной дозы или в такой форме, что разовую дозу пациент может вводить самостоятельно. Формой стандартной дозы для соединения или композиции по настоящему изобретению может быть таблетка, капсула, облатка, ампула, порошок, гранула, пастилка, суппозиторий, порошок для повторного разведения или препарат в жидкой форме.
Дозировка соединения или композиции, используемая в способе терапии по настоящему изобретению, обычно будет варьировать в зависимости от тяжести заболевания, массы пациента и относительной эффективности соединения. Однако, как правило, подходящая стандартная доза может составлять от 0,1 до 1000 мг.
Помимо активного соединения фармацевтическая композиция по настоящему изобретению также может содержать одно или более чем одно вспомогательное вещество, включая наполнитель (разбавитель), связующее вещество, увлажняющий агент, разрыхлитель, эксципиент и тому подобное. В зависимости от способа введения композиция может содержать активное соединение в количестве от 0,1 до 99% по массе.
Описание графических материалов
Фиг. 1. Эффект эндоцитоза антитела к B7H3 в клетках U87MG.
Фиг. 2A-2F. Результаты ингибирующего действия ADC по настоящему изобретению на пролиферацию различных опухолевых клеток. На Фиг. 2А представлены результаты тестирования ингибирующего действия различных ADC на пролиферацию клеток А498; на Фиг. 2В представлены результаты тестирования ингибирующего действия различных ADC на пролиферацию клеток Calu-6; на Фиг. 2С представлены результаты тестирования ингибирующего действия различных ADC на пролиферацию клеток U87; на Фиг. 2D представлены результаты тестирования ингибирующего действия различных ADC на пролиферацию клеток А375; на Фиг. 2Е представлены результаты тестирования ингибирующего действия различных ADC на пролиферацию клеток Detroit562; и на Фиг. 2F представлены результаты тестирования ингибирующего действия различных ADC на пролиферацию клеток яичников китайского хомячка, субклона К1 (СНОК1).
Фиг. 3. Ингибирующее действие ADC-8 (1 мг/кг, 3 мг/кг) и ADC-5 (1 мг/кг, 3 мг/кг) по настоящему изобретению на ксенотрансплантат опухоли U87MG у бестимусных мышей после внутрибрюшинной инъекции в примере тестирования 7.
Фиг. 4. Ингибирующее действие ADC-2 (1 мг/кг, 3 мг/кг) и ADC-1 (1 мг/кг, 3 мг/кг) по настоящему изобретению на ксенотрансплантат опухоли Detroit 562 у бестимусных мышей после внутрибрюшинной инъекции в примере тестирования 8.
Фиг. 5А. Степень ингибирования пролиферации клеток Detroit562 под действием ADC-4, ADC-6 и ADC-7 по настоящему изобретению в примере тестирования 9.
Фиг. 5В. Степень ингибирования пролиферации клеток Calu-6 под действием ADC-4, ADC-6 и ADC-7 по настоящему изобретению в примере тестирования 9.
Фиг. 5С. Степень ингибирования пролиферации клеток СНОК1 под действием ADC-4, ADC-6 и ADC-7 по настоящему изобретению в примере тестирования 9.
Фиг. 6. Результаты тестирования ADC-4 по настоящему изобретению на предмет стабильности в плазме крови в примере тестирования 10.
Подробное описание изобретения
I. Термины
Если не указано иное, все технические и научные термины, использованные в данном описании, соответствуют их обычному пониманию специалистом средней квалификации в области техники, к которой относится настоящее изобретение. Хотя при практическом применении или тестировании настоящего изобретения можно использовать любые способы и материалы, аналогичные или эквивалентные описанным в данной заявке, в данном описании изложены предпочтительные способы и материалы. При описании и защите настоящего изобретения приведенные ниже термины используют в соответствии со следующими далее определениями.
Если в описании настоящего изобретения используется торговое наименование, то подразумевается, что под этим торговым наименованием заявитель включает препараты, воспроизведенное, аналогичное патентованному лекарственное средство и активные ингредиенты продукта.
Если не указано иное, термины, использованные в данном описании и формуле изобретения, имеют описанные ниже значения.
Термин "лекарственное средство" относится к цитотоксическому лекарственному средству, которое представлено сокращением Dr, обозначающему химическую молекулу, которая может вносить существенное нарушение в обычный рост опухолевых клеток. В принципе, все цитотоксические лекарственные средства могут уничтожать опухолевые клетки, будучи в достаточно высокой концентрации. Однако, это может быть причиной апоптоза нормальных клеток и серьезных побочных эффектов при одновременном уничтожении опухолевых клеток вследствие отсутствия специфичности. Этот термин включает в себя токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, радиоактивные изотопы (например, радиоактивные изотопы At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и Lu), токсические лекарственные средства, химиотерапевтические лекарственные средства, антибиотики и нуклеолитические ферменты и предпочтительно токсические лекарственные средства.
Термин "линкерное звено (или связывающий фрагмент)" относится к химическому структурному фрагменту или к химической связи, который соединен одним концом с лигандом, а другим концом соединен с лекарственным средством или соединен с лекарственным средством через другие линкеры. Предпочтительные воплощения по настоящему изобретению представлены обозначениями L и L1 - L4, при этом конец L1 присоединен к лиганду, а конец L4 присоединен к лекарственному средству (Dr) через структурное звено Y.
Линкер, включающий в себя удлиняющее звено, спейсерное звено и аминокислотное звено, может быть синтезирован способами, известными в данной области техники, такими как способы, описанные в US 2005-0238649А1. Линкер может представлять собой "расщепляемый линкер", который способствует высвобождению лекарственного средства в клетку. Например, можно использовать кислотолабильный линкер (например, на основе гидразона), чувствительный к протеазам (например, чувствительный к пептидазе) линкер, чувствительный к свету линкер, диметильный линкер или дисульфид-содержащий линкер (Chari et al., Cancer Research, 52: 127-131 (1992); патент США №5208020).
Термин "конъюгат лиганд-лекарственное средство" означает, что лиганд присоединен к биологически активному лекарственному средству через стабильное связывающее звено. В настоящем изобретении "конъюгат лиганд-лекарственное средство" предпочтительно представляет собой конъюгат антитело-лекарственное средство (ADC), и это означает, что моноклональное антитело или фрагмент антитела присоединен(о) к биологически активному токсическому лекарственному средству через стабильное связывающее звено.
Трехбуквенные коды и однобуквенные коды для аминокислот, использованные в описании настоящего изобретения, описаны в J. Biol. Chem., 243, p.3558 (1968).
Термин "антитело" относится к иммуноглобулину, структуре, состоящей из четырех полипептидных цепей, соединенных друг с другом межцепочечной дисульфидной связью между двумя идентичными тяжелыми цепями и двумя идентичными легкими цепями. Разные константные области тяжелой цепи иммуноглобулина имеют разные аминокислотные составы и последовательности, и вследствие этого проявляют разные антигенные свойства. Соответственно, иммуноглобулины могут быть подразделены на пять типов или называться изотипами иммуноглобулинов, а именно, IgM, IgD, IgG, IgA и IgE, с соответствующей тяжелой цепью μ, δ, γ, α и ε, соответственно. Сообразно аминокислотным составам шарнирной области и количеству и расположению дисульфидных связей в тяжелых цепях один и тот же тип Ig может быть дополнительно подразделен на разные подтипы, например, IgG может быть подразделен на IgG1, IgG2, IgG3 и IgG4. Легкая цепь может быть подразделена на цепь κ или λ на основании различия в константной области. Все пять типов Ig могут иметь цепь κ или λ.
Последовательность, состоящая примерно из 110 аминокислот, расположенных вблизи N-конца тяжелых цепей или легких цепей антитела, является высоко вариабельной, так называемой вариабельной областью (Fv областью). Остальная часть аминокислотной последовательности, расположенная вблизи С-конца, является относительно стабильной, так называемой константной областью. Вариабельная область включает три гипервариабельных участка (HVR) и четыре относительно консервативные каркасные области (FR). Эти три гипервариабельных участка, которые определяют специфичность антитела, также известны как определяющие комплементарность участки (CDR). Каждая вариабельная область легкой цепи (LCVR) или каждая вариабельная область тяжелой цепи (HCVR) состоит из трех CDR участков и четырех FR областей, с расположением от аминоконца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Эти три CDR участка легкой цепи обозначаются как LCDR1, LCDR2 и LCDR3; а три CDR участка тяжелой цепи обозначаются как HCDR1, HCDR2 и HCDR3. Количество и расположение аминокислотных остатков CDR в областях LCVR и HCVR антитела или связывающегося с антигеном фрагмента по настоящему изобретению соответствуют известным критериям нумерации по Kabat (LCDR1-3, HCDR2-3) или соответствуют критериям нумерации по Kabat и Chothia (HCDR1).
Термин "полностью гуманизированное антитело" также известен как "полностью гуманизированное моноклональное антитело", при этом и вариабельная область, и константная область антитела обе имеют человеческое происхождение, что исключает иммуногенность и побочные эффекты. Разработка моноклонального антитела проходила через четыре стадии, а именно: получение мышиного моноклонального антитела, химерного моноклонального антитела, гуманизированного моноклонального антитела и полностью гуманизированного моноклонального антитела. Родственные технологии получения полностью гуманизированных антител включают главным образом технологию с использованием гибридом человека, технологию с использованием трансфицированных вирусом Эпштейна-Барр (EBV) В-лимфоцитов, технологию фагового дисплея, технологию получения антител с использованием трансгенных мышей, технологию получения антител с использованием одиночных В-клеток и тому подобные. "Полностью гуманизированное антитело" по настоящему изобретению получают с использованием технологии фагового дисплея. Технология фагового дисплея включает конструирование библиотеки природных человеческих антител с использованием одноцепочечного фага путем выделения В-клеток из мононуклеарных клеток периферической крови (РВМС, от англ. peripheral blood mononuclear cells) человека, ткани селезенки, ткани лимфатических узлов или скрининг антител путем иммунизации трансгенных мышей, экспрессирующих легкую и тяжелую цепь человеческого антитела.
Термин "антигенсвязывающий фрагмент" относится к одному или более чем одному фрагменту антитела, сохраняющему способность специфически связываться с антигеном. Показано, что фрагменты полноразмерного антитела можно использовать для приобретения свойства связываться с антигеном. Примеры связывающих фрагментов, упомянутых в термине "антигенсвязывающий фрагмент", включают (1) Fab фрагмент, одновалентный фрагмент, составленный из VL, VH, CL и СН1 домена; (2) F(ab')2 фрагмент, бивалентный фрагмент, содержащий два Fab фрагмента, соединенных дисульфидной связью в шарнирной области; (3) Fd фрагмент, состоящий из VH и СН1 доменов; (4) Fv фрагмент, состоящий из VH и VL доменов антитела с одним плечом; (5) однодоменное антитело или фрагмент однодоменного антитела (dAb) (Ward et al. (1989) Nature, 341: 544-546), содержащего VH домен; и (6) выделенный определяющий комплементарность участок (CDR) или (7) комбинацию двух или более выделенных CDR, возможно соединенных посредством синтетического линкера. Помимо этого, несмотря на то, что VL домен и VH домен Fv фрагмента кодируются двумя отдельными генами, они могут быть соединены синтетическим линкером с использованием рекомбинантных методов, в результате чего образуется единая белковая цепь, одновалентная молекулярная структура которой образуется путем спаривания VL и VH доменов (называемая одноцепочечным Fv (scFv); см., например, Bird et al. (1988) Science, 242: 423-426 и Huston et al. (1988) Proc. Natl. Acad. Sci. USA, 85: 5879-5883). Также подразумевается, что это одно цепочечное антитело включено в объем термина "антигенсвязывающий фрагмент" антитела. Такие фрагменты антитела получают, используя традиционные методы, известные специалистам в данной области техники, и скрининг функциональных фрагментов проводят, используя тот же способ, что и для интактного антитела. Антигенсвязывающие сайты могут быть получены посредством технологии рекомбинантной ДНК или путем ферментативного или химического разрушения интактного иммуноглобулина. Антителами могут быть антитела разных изотипов, например, антитело IgG (например, подтипа IgG1, IgG2, IgG3 или IgG4), IgA1, IgA2, IgD, IgE или IgM.
Fab представляет собой фрагмент антитела, полученный путем обработки молекулы IgG антитела папаином (который расщепляет связь у аминокислотного остатка в положении 224 Н-цепи). Fab фрагмент имеет молекулярную массу примерно 50000 и обладает антигенсвязывающей активностью, в нем примерно половина N-концевой части Н-цепи и вся L-цепь связаны вместе через дисульфидную связь.
F(ab')2 представляет собой фрагмент антитела, полученный путем расщепления пепсином в части, расположенной ниже двух дисульфидных связей в шарнирной области IgG, который имеет молекулярную массу примерно 100000, обладает антигенсвязывающей активностью и содержит два Fab участка, которые связаны в конкретном положении шарнирной области.
Fab' представляет собой фрагмент антитела, полученный в результате расщепления дисульфидной связи в шарнирной области вышеуказанного F(ab')2, который имеет молекулярную массу примерно 50000 и обладает антигенсвязывающей активностью.
Кроме того, Fab' может быть получен путем вставки ДНК, кодирующей Fab' фрагмент антитела, в экспрессионный вектор прокариот или экспрессионный вектор эукариот, который затем вводят в клетку прокариот или эукариот для экспрессии Fab'.
Термин "одноцепочечное антитело", "одноцепочечный Fv" или "scFv" относится к молекуле, содержащей вариабельный домен (или вариабельную область) тяжелой цепи (VH) антитела и вариабельный домен (или вариабельную область) легкой цепи (VL) антитела, соединенные посредством линкера. Такие scFv молекулы могут иметь общую структуру вида NH2-VL-линкер-VH-СООН или NH2-VH-линкер-VL-СООН. Согласно предшествующему уровню техники подходящий линкер состоит из повторяющейся аминокислотной последовательности GGGGS или ее варианта, например, варианта с 1-4 повторами (Holliger et al. (1993), Proc. Natl. Acad. Sci. USA, 90: 6444-6448). Другие линкеры, которые можно использовать в настоящем изобретении, описаны в Alfthan et al. (1995), Protein Eng., 8: 725-731, Choi etal. (2001), Eur. J. Immunol., 31: 94-106, Hu et al. (1996), Cancer Res., 56: 3055-3061, Kipriyanov etal. (1999), J. Mol. Biol., 293: 41-56 и Roovers et al. (2001), Cancer Immunol.
Термин "CDR" относится к одному из шести гипервариабельных участков в пределах вариабельного домена антитела, который главным образом вносит вклад в связывание с антигеном. Одно из самых часто используемых определений для шести CDR приведено в Kabat Е.A. et al. (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242. Использованное в данном описании определение по Kabat для CDR применяется только к CDR1, CDR2 и CDR3 вариабельного домена легкой цепи (CDR L1, CDR L2, CDR L3 или L1, L2, L3), а также к CDR2 и CDR3 вариабельного домена тяжелой цепи (CDR Н2, CDR H3 или Н2, H3).
Термин "каркас антитела" относится к части вариабельного домена VL или VH, которая служит в качестве остова для антигенсвязывающей петли (CDR) вариабельного домена. По существу, это есть вариабельный домен без CDR.
Термин "эпитоп" или "антигенная детерминанта" относится к сайту антигена, с которым специфически связывается иммуноглобулин или антитело. Обычно эпитопы включают в себя по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 смежных или несмежных аминокислот в уникальной пространственной конформации. См., например, Epitope Mapping Protocols в Methods in Molecular Biology, Vol.66, G.E. Morris, Ed. (1996).
Термины "специфическое связывание", "селективное связывание", "селективно связываются" и "специфически связываются" относятся к связыванию антитела с эпитопом заранее определенного антигена. Обычно антитело связывается с аффинностью (с константой диссоциации (KD)), составляющей меньше приблизительно 10-7 М, например, меньше приблизительно 10-8 М, 10-9 М или 10-10 М или меньше.
Термин "молекула нуклеиновой кислоты" относится к молекуле ДНК и молекуле РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК. Нуклеиновая кислота "эффективно связана", если она находится в функциональной взаимосвязи с другой нуклеиновокислотной последовательностью. Например, если промотор или энхансер воздействуют на транскрипцию кодирующей последовательности, то промотор или энхансер эффективно связан с этой кодирующей последовательностью.
Термин "вектор" относится к молекуле нуклеиновой кислоты, обладающей способностью переносить другую молекулу нуклеиновой кислоты, с которой она связана. В одном из воплощений вектор представляет собой "плазмиду", означающую кольцевую двухцепочечную петлю ДНК, в которую может быть лигирован дополнительный сегмент ДНК. В другом воплощении вектор представляет собой вирусный вектор, при этом в вирусный геном может быть лигирован дополнительный сегмент ДНК. Векторы, описанные в данной заявке, способны самореплицироваться в клетке хозяина, в которую они введены (например, бактериальный вектор, имеющий бактериальный ориджин репликации, и эписомный вектор млекопитающих), или могут интегрироваться в геном клетки хозяина после введения в клетку хозяина, реплицируясь тем самым вместе с геномом хозяина (например, неэписомный вектор млекопитающих).
Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны в данной области техники, например, Cold Spring Harbor Antibody Technical Guide, разделы 5-8 и 15. Кроме того, антигенсвязывающий фрагмент может быть получен традиционными методами. Антитела или антигенсвязывающие фрагменты по изобретению генетически конструируют с целью добавления одной или нескольких FR областей иммуноглобулина человека к CDR участкам, не происходящим из иммуноглобулина человека. Последовательность(и) FR иммуноглобулина зародышевой линии человека может/могут быть получена(ы) путем сопоставления баз данных по иммуногенетике (IMGT) для генов вариабельных областей человеческого антитела зародышевых линий и использования программного обеспечения МОЕ (от англ. Molecular Operating Environment) с web-сайта ImMunoGeneTics (IMGT) по ссылке http://imgt.cines.fr или из Journal of Immunoglobulins, 20011SBN012441351.
Термин "клетка-хозяин" относится к клетке, в которую введен экспрессионный вектор. Клетки хозяина могут включать бактериальные, микробные, растительные клетки или клетки животных. Бактерии, восприимчивые к трансформации, включают членов семейства энтеробактерий, таких как штаммы Escherichia coli или Salmonella; семейства бацилл, таких как Bacillus subtilis; пневмококков; стрептококков и Haemophilus influenzae. Подходящие микроорганизмы включают Saccharomyces cerevisiae и Pichia pastoris. Подходящие линии клеток-хозяев, относящихся к животным, включают СНО (линия клеток яичников китайского хомячка) и NS0 клетки.
Сконструированные антитело или антигенсвязывающий фрагмент по настоящему изобретению могут быть получены и очищены традиционными методами. Например, последовательность(и) кДНК, кодирующая(ие) тяжелую цепь и легкую цепь, можно клонировать и вновь объединить в глутамат-синтетаза(GS)-экспрессионном векторе. Вектором, экспрессирующим рекомбинантный иммуноглобулин, могут быть стабильно трансфицированы СНО клетки. В качестве более рекомендуемой существующей технологии предложены экспрессионные системы млекопитающих, которые могут приводить к гликозилированию антител, в частности, в высоко консервативном N-концевом сайте Fc-области. Положительные клоны амплифицируют в бессывороточной среде в биореакторе для получения антител. Очистка содержащихся в культуральной среде секретированных антител может быть выполнена традиционным методом. Например, очистку осуществляют, используя колонку с сефарозой Fast Flow (FF) с иммобилизованным белком А или G, которая содержит соответствующий буфер. Неспецифично связанные компоненты удаляют путем элюирования. Связанное антитело элюируют методом с использованием градиента рН, фрагменты антитела детектируют с применением электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) и собирают. Фильтрование и концентрирование антител может быть выполнено традиционным методом. Растворимые агрегаты и мультимеры также могут быть удалены традиционными методами, такими как эксклюзионная или ионообменная хроматография. Полученный продукт необходимо незамедлительно подвергнуть заморозке, например при -70°С, или лиофилизации.
Термин "пептид" относится к фрагменту соединения размером от одной аминокислоты до белка, состоящего из двух или более молекул аминокислот, соединенных одна с другой пептидными связями. Пептиды представляют собой структурные и функциональные фрагменты белков. Гормоны, ферменты и тому подобное по существу являются пептидами.
Термин "сахарид" относится к биологической макромолекуле, составленной из трех элементов С, Н и О, с возможным подразделением на моносахариды, дисахариды и полисахариды.
Термин "флуоресцентный зонд" относится к виду флуоресцентных молекул с характерными сигналами флуоресценции в ультрафиолетовой, видимой и ближней инфракрасной областях спектра. Характеристики флуоресценции (длина волны возбуждения и испускания, интенсивность, время жизни и поляризация и т.д.) флуоресцентного зонда могут чувствительно варьировать в зависимости от свойств окружения, таких как полярность, рефрактивный индекс, вязкость и так далее. Нековалентное взаимодействие между флуоресцентным зондом и нуклеиновой кислотой (ДНК или РНК), белком или другой макромолекулярной структурой позволяет изменять одну или несколько характеристик флуоресценции, что можно использовать для исследования свойств и поведения макромолекулярного вещества.
Термин "токсическое лекарственное средство" относится к веществу, которое ингибирует или прекращает функционирование клеток и/или вызывает гибель или разрушение клеток. Токсические лекарственные средства включают токсины и другие соединения, которые можно использовать для лечения опухолей.
Термин "алкил" относится к насыщенной алифатической углеводородной группе, которая представляет собой группу с прямой или разветвленной цепью, содержащую 1-20 атомов углерода, предпочтительно алкил, имеющий 1-12 атомов углерода, более предпочтительно алкил, имеющий 1-10 атомов углерода, и наиболее предпочтительно алкил, имеющий 1-6 атомов углерода (имеющий 1, 2, 3, 4, 5 или 6 атомов углерода). Неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4-диметилпентил, 2,2-диметилпентил, 3,3-диметилпентил, 2-этилпентил, 3-этилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, н-нонил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2,2-диэтилпентил, н-децил, 3,3-диэтилгексил, 2,2-диэтилгексил и их различные разветвленные изомеры. Более предпочтительно, алкильная группа представляет собой низший алкил, имеющий 1-6 атомов углерода, и неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил и тому подобное. Алкил может быть замещенным или незамещенным. При наличии замещения замещаемая(ые) группа(ы) может/могут быть замещена(ы) по любому доступному месту присоединения. Замещающей(ими) группой(ами) предпочтительно являет(ют)ся одна или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио и оксо.
Термин "гетероалкил" относится к алкилу, содержащему один гетероатом или несколько гетероатомов, выбранных из группы, состоящей из N, О и S, при этом алкил является таким, как определено выше.
Термин "алкилен" относится к насыщенной линейной или разветвленной алифатической углеводородной группе, имеющей два остатка, образованных в результате удаления двух атомов водорода от одного и того же атома углерода или от двух разных атомов углерода исходного алкана. Алкилен представляет собой линейную или разветвленную группу, имеющую 1-20 атомов углерода, предпочтительно 1-12 атомов углерода и более предпочтительно 1-6 атомов углерода (имеющую 1, 2, 3, 4, 5 или 6 атомов углерода). Неограничивающие примеры алкилена включают, но не ограничиваются этим, метилен (-СН2-), 1,1-этилен (-СН(СН3)-), 1,2-этилен (-СН2СН2)-, 1,1-пропилен (-СН(СН2СН3)-), 1,2-пропилен (-СН2СН(СН3)-), 1,3-пропилен (-СН2СН2СН2-), 1,4-бутилен (-СН2СН2СН2СН2-), 1,5-пентилен (-СН2СН2СН2СН2СН2-) и тому подобное. Алкилен может быть замещенным или незамещенным. При наличии замещения замещаемая(ые) группа(ы) может/могут быть замещена(ы) по любому доступному месту присоединения. Замещающей (ими) группой(ами) предпочтительно являет(ют)ся одна или более групп, возможно независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио и оксо.
Термин "алкокси" относится к группе -О-(алкил) или -O-(незамещенный циклоалкил), где алкил и циклоалкил являются такими, как определено выше. Неограничивающие примеры алкокси включают метокси, этокси, пропокси, бутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси. Группа алкокси возможно может быть замещенной или незамещенной. При наличии замещения замещающей(ими) группой(ами) предпочтительно являет(ют)ся одна группа или несколько групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио и гетероциклилтио.
Термин "циклоалкил" относится к насыщенной или частично ненасыщенной моноциклической или полициклической углеводородной замещаемой группе, имеющей 3-20 атомов углерода, предпочтительно 3-12 атомов углерода, более предпочтительно 3-10 атомов углерода и наиболее предпочтительно 3-8 атомов углерода (имеющей 3, 4, 5, 6, 7 или 8 атомов углерода). Неограничивающие примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклогептатриенил, циклооктил и тому подобное. Полициклический циклоалкил включает циклоалкил, имеющий спиро-кольцо, конденсированное кольцо или мостиковое кольцо.
Термин "гетероциклил" относится к 3-20-членной насыщенной или частично ненасыщенной моноциклической либо полициклической углеводородной группе, при этом один или более атомов в кольце представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число 0, 1 или 2), но за исключением -О-О-, -O-S- или -S-S- в кольце, и при этом остальные атомы в кольце представляют собой атомы углерода. Предпочтительно, гетероциклил имеет 3-12 атомов в кольце, при этом 1-4 атома представляют собой гетероатомы (1, 2, 3 или 4 гетероатома); и более предпочтительно 3-10 атомов в кольце (имея 3, 4, 5, 6, 7, 8, 9 или 10 атомов в кольце). Неограничивающие примеры мо но циклического гетероциклила включают пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперазинил и тому подобное. Полициклический гетероциклил включает гетероциклил, имеющий спиро-кольцо, конденсированное кольцо или мостиковое кольцо.
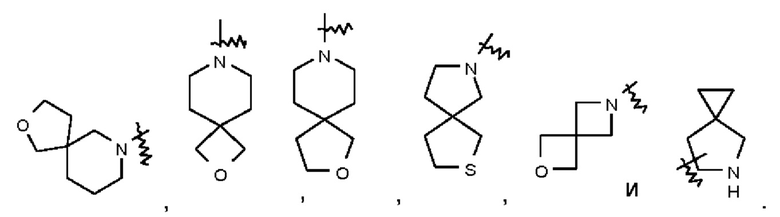
Термин "спиро-гетероциклил" относится к 5-20-членной полициклической гетероциклильной группе, содержащей отдельные кольца, соединенные через один общий атом (называемый спиро-атомом), при этом один атом или несколько атомов
в кольце представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число от 0 до 2), и при этом остальные атомы в кольце представляют собой атомы углерода, причем кольца могут содержать одну двойную связь или несколько двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы. Спиро-гетероциклил предпочтительно представляет собой 6-14-членный спиро-гетероциклил и более предпочтительно 7-10-членный спиро-гетероциклил. В зависимости от количества спиро-атомов, общих для этих колец, спиро-гетероциклилы можно подразделять на моно-спиро-гетероциклил, ди-спиро-гетероциклил или поли-спиро-гетероциклил, и спиро-гетероциклил предпочтительно представляет собой моно-спиро-гетероциклил или ди-спиро-гетероциклил и более предпочтительно 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моно-спиро-гетероциклил. Неограничивающие примеры спиро-гетероциклила включают:
Термин "конденсированный гетероциклил" относится к 5-20-членной поли циклической гетероциклильной группе, при этом каждое кольцо в такой системе имеет общую с другим кольцом соседнюю пару атомов, причем одно кольцо или несколько колец могут содержать одну или несколько двойных связей, но ни одно из этих колец не имеет полностью сопряженной π-электронной системы, и при этом один или более атомов в кольце представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число 0, 1 или 2), при этом остальные атомы в кольце представляют собой атомы углерода. Конденсированный гетероциклил предпочтительно представляет собой 6-14-членный конденсированный гетероциклил и более предпочтительно 7-10-членный (7-, 8-, 9- или 10-членный) конденсированный гетероциклил. В зависимости от количества имеющих члены колец конденсированные гетероциклилы можно подразделять на бициклический, трициклический, тетрациклический или полициклический конденсированный гетероциклил, и конденсированный гетероциклил предпочтительно представляет собой бициклический или трициклический конденсированный гетероциклил и более предпочтительно 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный гетероциклил. Неограничивающие примеры конденсированного гетероциклила включают:
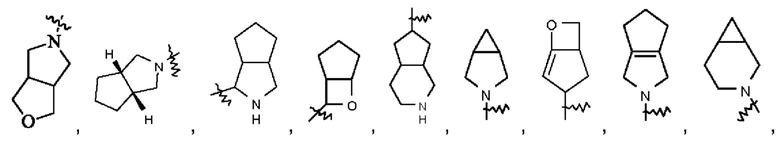
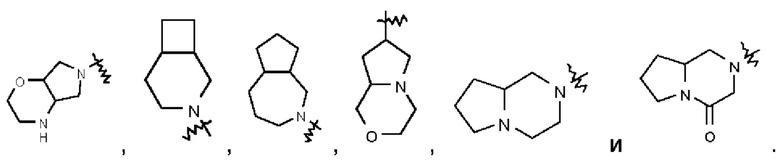
Термин "мостиковый гетероциклил" относится к 5-14-членной полициклической гетероциклильной группе, при этом каждые два кольца в этой системе имеют два общих несопряженных атома, причем данные кольца могут иметь одну двойную связь или несколько двойных связей, но ни одно из этих колец не имеет полностью сопряженной π-электронной системы, и при этом один атом или несколько атомов в кольце представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число 0, 1 или 2), причем остальные атомы в кольце представляют собой атомы углерода. Мостиковый гетероциклил предпочтительно представляет собой 6-14-членный мостиковый гетероциклил и более предпочтительно 7-10-членный (7-, 8-, 9- или 10-членный) мостиковый гетероциклил. В зависимости от количества указанных колец мостиковые гетероциклилы можно подразделять на бициклический, трициклический, тетрациклический или полициклический мостиковый гетероциклил, и мостиковый гетероциклил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый гетероциклил и более предпочтительно бициклический или трициклический мостиковый гетероциклил. Неограничивающие примеры мостикового гетероциклила включают:
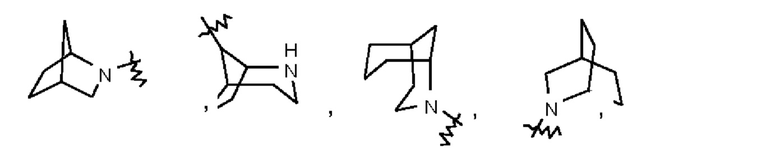
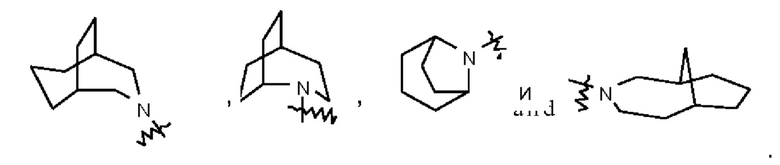
Такое гетерециклильное кольцо может быть конденсировано с кольцом арила, гетероарила или циклоалкила, при этом кольцом, связанным с исходной структурой, является гетероциклил. Их неограничивающие примеры включают:
 и тому подобное.
и тому подобное.
Гетероциклил возможно может быть замещенным или незамещенным. При наличии замещения замещающей(ими) группой(ами) предпочтительно являет(ют)ся одна группа или несколько групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, цикло алкилтио, гетероциклилтио и оксо.
Термин "арил" относится к 6-14-членному состоящему полностью из атомов углерода моноциклическому кольцу или полициклическому конденсированному кольцу (т.е. каждое кольцо в такой системе имеет общую с другим кольцом в данной системе соседнюю пару атомов углерода), имеющему сопряженную π-электронную систему, предпочтительно относится к 6-10-членному (6-, 7-, 8-, 9- или 10-членному) арилу, например, фенилу и нафтилу, и предпочтительно фенилу. Арильное кольцо может быть конденсировано с кольцом гетероарила, гетероциклила или циклоалкила, при этом кольцо, связанное с исходной структурой, представляет собой арильное кольцо. Их неограничивающие примеры включают:
Арил возможно может быть замещенным или незамещенным. При наличии замещения замещающей(ими) группой(ами) являет(ют)ся одна группа или несколько групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио и гетероциклилтио.
Термин "гетероарил" относится к 5-14-членной гетероароматической системе, имеющей 1-4 гетероатома (1, 2, 3 или 4 гетероатома), выбранных из группы, состоящей из О, S и N. Гетероарил предпочтительно представляет собой 5-10-членный (5-, 6-, 7-, 8-, 9- или 10-членный) гетероарил, более предпочтительно 5- или 6-членный гетероарил, например, фурил, тиенил, пиридил, пирролил, N-алкилпирролил, пиримидинил, пиразинил, имидазолил, тетразолил и тому подобное. Гетероарильное кольцо может быть конденсировано с кольцом арила, гетероциклила или циклоалкила, при этом кольцо, связанное с исходной структурой, представляет собой гетероарильное кольцо. Их неограничивающие примеры включают:
Гетероарил возможно может быть замещенным или незамещенным. При наличии замещения замещающей(ими) группой(ами) предпочтительно являет(ют)ся одна группа или несколько групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио и гетероциклилтио.
Термин "амино-защитная группа" относится к группе, которая предохраняет аминогруппу от взаимодействия, когда взаимодействию подвергаются другие части молекулы, и которая может быть легко удалена. Неограничивающие примеры включают 9-флуоренилметилоксикарбонил, трет-бутокси карбон ил, ацетил, бензил, аллил, пара-метоксибензил и тому подобное. Эти группы возможно могут быть замещены одним-тремя заместителями (одним заместителем, двумя или тремя заместителями), выбранными из группы, состоящей из галогена, алкокси и нитро. Амино-защитной группой предпочтительно является 9-флуоренилметилоксикарбонил.
Термин "галогеналкил" относится к алкильной группе, замещенной одним атомом или несколькими атомами галогена, при этом алкил является таким, как определено выше.
Термин "дейтерированный алкил" относится к алкильной группе, замещенной одним атомом или несколькими атомами дейтерия, при этом алкил является таким, как определено выше.
Термин "гидроксиалкил" относится к алкильной группе, замещенной одной группой или несколькими группами гидрокси, при этом алкил является таким, как определено выше.
Термин "гидрокси" относится к группе -ОН.
Термин "галоген" относится к фтору, хлору, брому или йоду.
Термин "амино" относится к группе -NH2.
Термин "нитро" относится к группе -NO2.
Термин "циано" относится к группе -CN.
Термин "амид" относится к группе -С(O)N(алкил) или -С(O)N(циклоалкил), где алкил и циклоалкил являются такими, как определено выше.
Термин "алкоксикарбонил" относится к группе -С(O)O(алкил) или -С(O)O(циклоалкил), где алкил и циклоалкил являются такими, как определено выше.
Настоящее изобретение также включает соединения формулы (I) в различных дейтерированных формах. Каждый из доступных атомов водорода, присоединенных к атому углерода, может быть независимо заменен на атом дейтерия. Специалисты в данной области техники могут синтезировать соединение формулы (I) в дейтерированной форме, руководствуясь релевантными литературными источниками. Соединение формулы (I) в дейтерированной форме может быть получено посредством применения имеющихся в продаже дейтерированных исходных веществ, или они могут быть синтезированы традиционными методами с использованием дейтерированных реагентов, включая, но не ограничиваясь этим, дейтерированный боргидрид, содержащий три атома дейтерия боргидрид в тетрагидрофуране, дейтерированный алюмогидрид лития, дейтерированный иодэтан, дейтерированный иодметан и тому подобное.
"Возможный" или "возможно" означает, что событие или обстоятельство, описываемое впоследствии, может произойти, но происходит не обязательно, и такое описание включает ситуацию, в которой данное событие или обстоятельство может или не может произойти. Например, "гетероциклил, возможно замещенный алкилом", означает, что алкильная группа может присутствовать, но присутствует не обязательно, и такое описание включает ситуацию замещения гетероциклила алкилом и ситуацию, когда гетероциклил не замещен алкилом.
Термин "замещенный" относится к ситуации, когда один или более атомов водорода в группе, предпочтительно до 5 включительно и более предпочтительно 1, 2 или 3 атома водорода, независимо замещены соответствующим количеством заместителей. Само собой разумеется, что заместители находятся только в своем возможном с точки зрения химии положении. Специалист в данной области техники способен определить, экспериментально или теоретически, возможно или не возможно такое замещение, без приложения чрезмерных усилий. Например, структура, в которой группа амино или гидрокси со свободным атомом водорода, связана с атомами углерода, имеющими ненасыщенные связи (такие как олефиновые), может оказаться нестабильной.
Термин "фармацевтическая композиция" относится к смеси одного или более чем одного из соединений, описанных в данной заявке, или их физиологически/фармацевтически приемлемых солей или пролекарств с другими химическими компонентами и другими компонентами, такими как физиологически/фармацевтически приемлемые носители и эксципиенты. Задачей фармацевтической композиции является облегчение введения соединения в организм, что способствует всасыванию активного ингредиента с целью проявления биологической активности.
Термин "фармацевтически приемлемая соль" или "фармацевтическая соль" относится к соли конъюгата лиганд-лекарственное средство по настоящему изобретению или соли соединения по настоящему изобретению, которая является безопасной и эффективной для млекопитающих и обладает желаемой биологической активностью. Конъюгат лиганд-лекарственное средство по настоящему изобретению содержит по меньшей мере одну аминогруппу, поэтому он может образовывать соль с кислотой. Неограничивающие примеры фармацевтически приемлемых солей включают гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, цитрат, ацетат, сукцинат, аскорбат, оксалат, нитрат, сорбат, гидрофосфат, дигидрофосфат, салицилат, гидроцитрат, тартрат, малеат, фумарат, формиат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, пара-толуолсульфонат.
Термин "сольват" относится к фармацевтически приемлемому сольвату, образуемому при взаимодействии конъюгата лиганд-лекарственное средство по настоящему изобретению с одной молекулой или несколькими молекулами растворителя. Неограничивающие примеры молекул растворителя включают воду, этанол, ацетонитрил, изопропанол, ДМСО (диметилсульфоксид), этилацетат.
Термин "нагрузка лекарственным средством" означает среднее число молекул цитотоксического лекарственного средства, нагруженных из расчета на каждую молекулу лиганда в соединении формулы (I), и он также может быть выражен в виде соотношения числа молекул лекарственного средства и числа молекул антитела (DAR, от англ. drug-antibody ratio). Значение нагрузки лекарственным средством может изменяться в диапазоне от 0 до 12, предпочтительно от 1 до 10 молекул цитотоксического лекарственного средства (D) на одну молекулу лиганда (Рс). В одном из воплощений по настоящему изобретению нагрузку лекарственным средством выражают в виде n, что также известно как значение DAR, и типичные значения могут составлять в среднем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10. Среднее число молекул цитотоксического лекарственного средства на одну молекулу ADC после проведения реакции сочетания может быть определено традиционными методами, такими как спектроскопия в ультрафиолетовой (УФ)/видимой области спектра, масс-спектрометрия, тестирование посредством ELISA (иммуноферментный твердофазный анализ) и определение характеристик методом высокоэффективной жидкостной хроматографии (HPLC).
В одном из воплощений по настоящему изобретению цитотоксическое лекарственное средство конъюгировано с N-концевой аминогруппой и/или ε-аминогруппой лизиновых остатков в лиганде через связывающее звено. Обычно число молекул лекарственного средства, конъюгированных с антителом в реакции сочетания, будет меньше теоретически максимального значения.
Для регулирования нагрузки в конъюгатах лиганд-цитотоксическое лекарственное средство можно использовать следующие неограничивающие способы:
(1) регулирование молярного соотношения связывающего реагента и моноклонального антитела,
(2) регулирование продолжительности и температуры реакции,
(3) выбор различных реагентов для этой реакции.
Приготовление традиционных фармацевтических композиций можно найти в Китайской фармакопее.
Термин "носитель", использованный в отношении композиции по настоящему изобретению, относится к системе, использование которой может изменять путь, каким лекарственное средство поступает в организм человека и распределяется в нем, может регулировать скорость высвобождения лекарственного средства и доставку лекарственного средства к органу-мишени. Использование носителя для высвобождения лекарственных средств и систем направленной доставки может уменьшить деградацию и утрату лекарственного средства, ослабить побочные эффекты и улучшить биодоступность. Например, полимерные поверхностно-активные вещества, которые могут быть использованы в качестве носителей, могут самоорганизовываться с образованием различных форм агрегатов вследствие своей уникальной амфифильной структуры. Предпочтительные примеры включают мицеллы, микроэмульсии, гели, жидкие кристаллы, везикулы и тому подобное. Такие агрегаты обладают способностью инкапсулировать молекулы лекарственных средств, одновременно характеризуясь хорошей проницаемостью мембраны, и их можно использовать в качестве превосходного носителя для лекарственных средств.
Термин "эксципиент" обозначает вспомогательное средство в фармацевтической композиции, отличающееся от основного лекарственного средства, которое также может называться адъювантом, таким как связующие вещества, наполнители, разрыхлители, смазывающие вещества в таблетках; вещества, составляющие основу в полутвердых препаратах типа мази и крема; консерванты, антиоксиданты, корригенты, ароматизаторы, сорастворители, эмульгаторы, солюбилизаторы, регуляторы осмотического давления, красители в препаратах в жидкой форме и тому подобное.
Термин "разбавитель", также известный как "наполнитель", предназначен главным образом для описания увеличения массы и объема таблетки. Добавление разбавителя обеспечивает достижение определенного объема, снижает величину разброса для дозы основных компонентов и улучшает связанные с прессованием характеристики лекарственного средства. Если таблетка содержит масляный компонент, то для абсорбирования масляного вещества добавляют абсорбент, тем самым сохраняя "сухое" состояние, чтобы способствовать приготовлению таблеток. Например, разбавитель включает крахмал, лактозу, неорганические соли кальция, микрокристаллическую целлюлозу и тому подобное.
Фармацевтическая композиция может быть в форме стерильного инъекционного водного раствора. Приемлемыми разбавителями или растворителями, которые могут быть использованы, являются вода, раствор Рингера или изотонический раствор хлорида натрия. Стерильный композиция для инъекций может представлять собой стерильную инъекционную микроэмульсию типа масло-в-воде, в которой активный ингредиент растворен в масляной фазе. Например, активный ингредиент растворяют в смеси соевого масла и лецитина. Затем этот раствор в масле добавляют к смеси воды и глицерина и обрабатывают для образования микроэмульсии. Раствор или микроэмульсия для инъекций могут быть введены в кровоток пациента посредством местной болюсной инъекции. Альтернативно, раствор и микроэмульсию предпочтительно вводят способом, при котором в циркулирующей крови поддерживается постоянная концентрация соединения по настоящему изобретению. Для поддержания этой постоянной концентрации можно использовать устройство для непрерывной внутривенной доставки. Примером такого устройства является насос для внутривенных инъекций Deltec CADD-PLUS™ 5400.
Фармацевтическая композиция может быть в форме стерильной инъекционной водной или масляной суспензии для внутримышечного и подкожного введения. Такая суспензия может быть приготовлена вместе с подходящими диспергирующими веществами или увлажняющими агентами и суспендирующими агентами, которые описаны выше, согласно известным методам. Стерильная композиция для инъекций также может представлять собой стерильный раствор или суспензию для инъекций, приготовленные в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор, приготовленный в 1,3-бутандиоле. Кроме того, в качестве растворителя или суспендирующей среды вполне могут быть использованы стерильные нелетучие масла. Для этой цели могут быть использованы любые смешивающиеся нелетучие масла, в том числе синтетический моно- или диглицерид. Кроме того, для приготовления инъекционной формы также можно использовать жирные кислоты, такие как олеиновая кислота.
Настоящее изобретение относится к расщепляемой линкерной ножке, имеющей специфическую структуру, и к активному веществу, имеющему специфическую структуру, и к конъюгату антитело-лекарственное средство (ADC), составленному из линкерной ножки, активного вещества и антитела. Такой ADC представляет собой комплекс, образованный путем присоединения токсического вещества к антителу через спейсер. Конъюгат антитело-лекарственное средство (ADC) расщепляется в организме с высвобождением молекул активных веществ, проявляя тем самым противоопухолевый эффект.
II. Способ синтеза
Чтобы выполнить задачу настоящего изобретения, в настоящем изобретении для синтеза применено упомянутое далее техническое решение.
Способ получения соединения формулы (Pc-La-Y-Dr) включает следующую стадию:
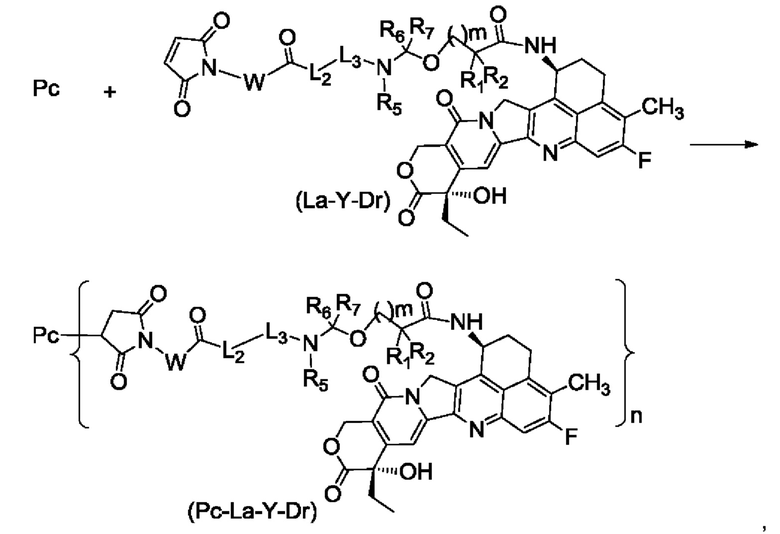
на которой
осуществляют реакцию сочетания Рс с соединением формулы (La-Y-Dr) после восстановления, получая соединение формулы (Pc-La-Y-Dr);
восстанавливающий агент предпочтительно представляет собой ТСЕР, в частности, предпочтительно для восстановления дисульфид но и связи в молекуле антитела;
где:
Рс, W, L2, L3, R1, R2, R5 - R7, m и n являются такими, как определено в формуле (Pc-La-Y-Dr).
Подробное изложение одного или более воплощений по настоящему изобретению приведено в показанной выше части описания. Хотя при практическом применении или тестировании настоящего изобретения можно использовать любые способы и материалы, аналогичные или эквивалентные описанным в данной заявке, ниже описаны предпочтительные способы и материалы. Другие признаки, цели и преимущества настоящего изобретения будут очевидны исходя из описания и формулы изобретения. В описании и формуле изобретения, если контекст явно не указывает иное, форма единственного числа включает ссылку на множественное число. Если не указано иное, все технические и научные термины, использованные в данном описании, соответствуют их обычному пониманию специалистом средней квалификации в области техники, к которой относится настоящее изобретение. Все патенты и публикации, процитированные в данном описании, включены в данное описание посредством ссылки. Следующие далее примеры приведены для более полной иллюстрации предпочтительных воплощений по настоящему изобретению. Эти воплощения не следует истолковывать как ограничивающие каким-либо образом объем настоящего изобретения, и объем настоящего изобретения определяется формулой изобретения.
Экспериментальные методы, приведенные в разделе Примеры описания настоящего изобретения, для которых не указаны конкретные условия, осуществляли в соответствии с традиционными условиями или условиями, рекомендованными производителями материалов или продуктов. Реагенты, для которых не указаны конкретные источники, представляют собой традиционные реагенты, приобретенные на рынке.
Структуры соединений устанавливают посредством ядерного магнитного резонанса (ЯМР) или масс-спектрометрии (MS). Спектры ЯМР определяют на приборе AVANCE-400 от Bruker. Для определения в качестве растворителей используют дейтерированный диметилсульфоксид (ДМСО-d6), дейтерированный хлороформ (CDCl3) и дейтерированный метанол (CD3OD), а в качестве внутреннего стандарта используют тетраметилсилан (TMS). Химические сдвиги приведены в 10-6 (млн-1).
MS-спектры определяют на масс-спектрометре FINNIGAN LCQAd (с электрораспылительной ионизацией (ESI)) (производитель: Thermo, тип: Finnigan LCQAd vantage MAX).
Сверхэффективную жидкостную хроматографию (UPLC) проводят на жидкостном хромато графе/масс-спектрометре Acquity UPLC SQD от Waters.
Высокоэффективную жидкостную хроматографию (HPLC) проводят на хроматографе для жидкостной хроматографии высокого давления Agilent 1200DAD (на хроматографической колонке Gunfire C18, 150×4,6 мм) и хроматографе для жидкостной хроматографии высокого давления Waters 2695-2996 (на хроматографической колонке Gemini C18, 150×4,6 мм).
Данные UV-HPLC (HPLC с детекцией в УФ диапазоне) определяют на УФ-спектрофотометре Thermo Nanodrop 2000.
Значения степени ингибирования пролиферации и значения вызывающей 50%-ное ингибирование концентрации (IC50) определяют, используя микропланшетный ридер PHERAstarFS (BMG Co., Germany).
В качестве пластинки для тонкослойной хроматографии (TLC) на силикагеле используют пластинку с силикагелем HSGF254 от Yantai Huanghai или GF254 от Qingdao. Размер слоя силикагеля на пластинке, использованной для TLC, составляет от 0,15 мм до 0,2 мм, а размер слоя силикагеля на пластинке, использованной для очистки продуктов, составляет от 0,4 мм до 0,5 мм.
В качестве носителя для колоночной хроматографии обычно используют силикагель от Yantai Huanghai с размером частиц 200-300 меш.
Известные исходные вещества для осуществления настоящего изобретения могут быть получены известными в данной области техники методами или могут быть приобретены у ABCR GmbH & Со. KG, Acros Organics, химической компании Aldrich, Accela ChemBio Inc., химической компании Dari и так далее.
Если не указано иное, реакции проводят в атмосфере аргона или азота.
"Атмосфера аргона" или "атмосфера азота" означает, что реакционная колба оснащена баллоном с аргоном или азотом (примерно 1 л).
"Атмосфера водорода" означает, что реакционная колба оснащена баллоном с водородом (примерно 1 л).
Реакцию гидрирования под давлением проводят на установке Парра для гидрирования 3916EKX и с использованием генератора водорода Qinglan QL-500 или на установке для гидрирования HC2-SS.
Для проведения реакций гидрирования реакционную систему обычно вакуумируют и заполняют водородом, и указанную выше операцию повторяют три раза.
Для проведения реакций в условиях облучения микроволнами используют микроволновой реактор СЕМ Discover-S 908860 типа.
Если не указано иное, реакционный раствор означает водный раствор.
Если не указано иное, температура реакции представляет собой комнатную температуру.
Комнатная температура от 20°С до 30°С является самой подходящей температурой реакции.
Приготовление буфера на основе PBS (забуференный фосфатом физиологический раствор) (рН 6,5) в примерах: к 8,5 г KH2PO4, 8,56 г K2HPO4.3H2O, 5,85 г NaCl и 1,5 г ЭДТА (этилендиаминтетрауксусная кислота) в колбе добавляют воду до 2 л, смесь подвергают ультразвуковой обработке для полного растворения и хорошо встряхивают, получая буфер.
Система элюентов для колоночной хроматографии и система растворителей для тонкослойной хроматографии, применяемые с целью очистки соединений, включают: А: систему дихлорметан/изопропанол, В: систему дихлорметан/метанол и С: систему петролейный эфир/этилацетат. Соотношение объемов растворителей корректируют в соответствии с полярностью соединений, и для корректировки также может быть добавлено небольшое количество кислотного реагента или щелочного реагента, такого как триэтиламин.
Некоторые из соединений по настоящему изобретению характеризуют посредством жидкостной хроматографии в сочетании с масс-спектрометрией на квадрупольном времяпролетном масс-спектрометре (Q-TOF LC/MS). Что касается Q-TOF LC/MS, то используют квадрупольный времяпролетный масс-спектрометр для точного определения масс Agilent 6530 и систему для сверхвысокоэффективной жидкостной хроматографии (UHPLC) Agilent 1290-lnfinity (с колонкой Agilent Poroshell 300SB-C8, 5 мкм, 2,1×75 мм).
Пример 1
N-((1S,9S)-9-Этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)-1-гидроксициклопропан-1-карбоксамид 1
1 мл N,N-диметилформамида добавляли к экзатекана метансульфонату 1b (2,0 мг; 3,76 мкмоль; полученному в соответствии со способом, описанным в патентной заявке "ЕР0737686А1") и раствор охлаждали до 0-5°С в бане с ледяной водой. Добавляли одну каплю триэтиламина и реакционный раствор перемешивали, пока не становился прозрачным. В реакционный раствор последовательно добавляли 1-гидроксициклопропилкарбоновую кислоту 1а (1,4 мг; 3,7 мкмоль; полученную в соответствии с известным способом, описанным в "Tetrahedron Letters, 25(12), 1269-72; 1984") и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (3,8 мг; 13,7 мкмоль). По завершении добавления реакционный раствор перемешивали при 0-5°С в течение 2 часов. В реакционный раствор добавляли 5 мл воды для гашения реакции и реакционный раствор экстрагировали этилацетатом (8 мл ×3). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия (5 мл ×2), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученные остатки очищали тонкослойной хроматографией в системе растворителей В, получая указанный в заголовке продукт 1 (1,6 мг; выход: 82,1%).
MS m/z (ESI): 520,2 [М+1].
1H ЯМР (400 МГц, CDCl3): δ 7.90-7.84 (m, 1H), 7.80-7.68 (m, 1H), 5.80-5.70 (m, 1H), 5.62-5.54 (m, 2H), 5.44-5.32 (m, 2H), 5.28-5.10 (m, 2H), 3.40-3.15 (m, 3H), 2.44 (s, 3Н), 2.23 (t, 1H), 2.06-1.75 (m, 2H), 1.68-1.56 (m, 1H), 1.22-1.18 (m, 2H), 1.04-0.98 (m, 2H), 0.89 (t, 3Н).
Пример 2
(S)-2-Циклопропил-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-1,2,3,9,10,12,13,15-октагидробензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)-2-гидроксиацетамид 2-А
(R)-2-Циклопропил-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-1,2,3,9,10,12,13,15-октагидробензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)-2-гидроксиацетамид 2-В
2 мл этанола и 0,4 мл N,N-диметилформамида добавляли к соединению 1b (4 мг; 7,53 мкмоль). Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. По каплям добавляли 0,3 мл N-метилморфолина и реакционный раствор перемешивали, пока не становился прозрачным. В реакционный раствор последовательно добавляли 2-циклопропил-2-гидрокси уксусную кислоту 2а (2,3 мг; 19,8 мкмоль; полученную в соответствии со способом, описанным в патентной заявке "WO2013106717"), 1-гидроксибензотриазол (3 мг; 22,4 мкмоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (4,3 мг; 22,4 мкмоль). По завершении добавления реакционный раствор перемешивали при 0-5°С в течение одного часа. Баню с ледяной водой удаляли, реакционный раствор нагревали до 30°С и перемешивали в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и полученное неочищенное соединение 2 очищали высокоэффективной жидкостной хроматографией (условия разделения: препаративная колонка: XBridge С18 OBD, 5 мкм, 19*250 мм; подвижная фаза: А - вода (NH4OAc, 10 ммоль), В - ацетонитрил; градиентное элюирование, скорость потока: 18 мл/мин). Соответствующие фракции собирали и концентрировали при пониженном давлении, получая указанные в заголовке продукты (1,5 мг; 1,5 мг).
MS m/z (ESI): 534,0 [М+1].
Соединение 2-В с индивидуальной конфигурацией (имеющее меньшее время удерживания)
UPLC анализ: время удерживания: 1,06 минуты; чистота: 88% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 8.37 (d, 1Н), 7.76 (d, 1H), 7.30 (s, 1H), 6.51 (s, 1H), 5.58-5.56 (m, 1H), 5.48 (d, 1H), 5.41 (s, 2H), 5.32-5.29 (m, 1H), 3.60 (t, 1H), 3.19-3.13 (m, 2H),2.38 (s, 3Н), 2.20-2.14 (m, 1H), 1.98 (q, 2H), 1.87-1.83 (m, 1H), 1.50-1.40 (m, 1H), 1.34-1.28 (m, 1H), 0.86 (t, 3Н), 0.50-0.39 (m, 4H).
Соединение 2-А с индивидуальной конфигурацией (имеющее большее время удерживания)
UPLC анализ: время удерживания: 1,10 минуты; чистота: 86% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 8.35 (d, 1Н), 7.78 (d, 1H), 7.31 (s, 1H), 6.52 (s, 1H), 5.58-5.53 (m, 1H), 5.42 (s, 2H), 5.37 (d, 1H), 5.32 (t, 1H), 3.62 (t, 1H), 3.20-3.15 (m, 2H), 2.40 (s, 3H), 2.25-2.16 (m, 1H), 1.98 (q, 2H), 1.87-1.82 (m, 1H), 1.50-1.40 (m, 1H), 1.21-1.14 (m, 1H), 0.87 (t, 3H), 0.47-0.35 (m, 4H).
Пример 3
(S)-N-((1S,9S)-9-Этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-1,2,3,9,10,12,13,15-октагидробензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)-3,3,3-трифтор-2-гидроксипропанамид 3-А
(R)-N-((1S,9S)-9-Этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-1,2,3,9,10,12,13,15-октагидробензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)-3,3,3-трифтор-2-гидроксипропанамид 3В
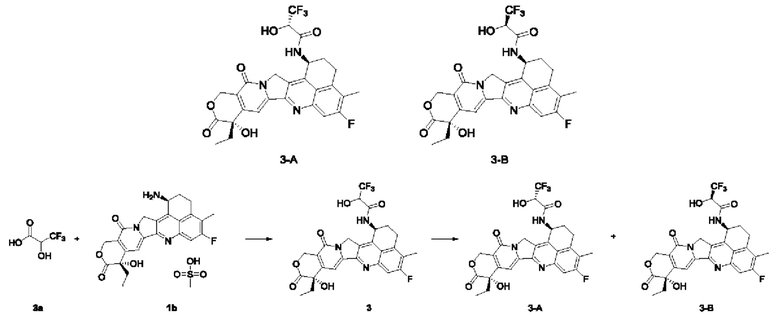
2 мл этанола и 0,4 мл N,N-диметилформамида добавляли к соединению 1b (5,0 мг; 9,41 мкмоль) и раствор охлаждали до 0-5°С в бане с ледяной водой. По каплям добавляли 0,3 мл N-метилморфолина и реакционный раствор перемешивали, пока не становился прозрачным. В реакционный раствор последовательно добавляли 3,3,3-трифтор-2-гидроксипропионовую кислоту 3а (4,1 мг; 28,4 мкмоль; поставщик: Alfa), 1-гидроксибензотриазол (3,8 мг; 28,1 мкмоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (5,4 мг; 28,2 мкмоль). По завершении добавления реакционный раствор перемешивали при 0-5°С в течение 10 минут. Баню с ледяной водой удаляли, реакционный раствор нагревали до 30°С и перемешивали в течение 8 часов. Реакционный раствор концентрировали при пониженном давлении и полученное неочищенное соединение 3 очищали высокоэффективной жидкостной хроматографией (условия разделения: препаративная колонка: XBridge C18 OBD, 5 мкм, 19*250 мм; подвижная фаза: А - вода (NH4OAc, 10 ммоль), В - ацетонитрил; градиентное элюирование, скорость потока: 18 мл/мин). Соответствующие фракции собирали и концентрировали при пониженном давлении, получая указанные в заголовке продукты (1,5 мг; 1,5 мг).
MS m/z (ESI): 561,9 [M+1].
Соединение с индивидуальной конфигурацией (имеющее меньшее время удерживания)
UPLC анализ: время удерживания: 1,11 минуты; чистота: 88% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1Н ЯМР (400 МГц, ДМСО-d6): δ 8.94 (d, 1Н), 7.80 (d, 1H), 7.32 (s, 1H), 7.20 (d, 1H), 6.53 (s, 1H), 5.61-5.55 (m, 1H), 5.45-5.23 (m, 3H), 5.15-5.06 (m, 1H), 4.66-4.57 (m, 1H), 3.18-3.12 (m, 1H), 2.40 (s, 3H), 2.26-2.20 (m, 1H), 2.16-2.08 (m, 1H), 2.02-1.94 (m, 1H), 1.89-1.82 (m, 1H), 1.50-1.40 (m, 1H), 0.87 (t, 3H).
Соединение с индивидуальной конфигурацией (имеющее большее время удерживания)
UPLC анализ: время удерживания: 1,19 минуты; чистота: 90% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 8.97 (d, 1H), 7.80 (d, 1H), 7.31 (s, 1H), 7.16 (d, 1H), 6.53 (s, 1H), 5.63-5.55 (m, 1H), 5.45-5.20 (m, 3H), 5.16-5.07 (m, 1H), 4.66-4.57 (m, 1H),3.18-3.12 (m, 1H), 2.40 (s, 3H), 2.22-2.14 (m, 1H), 2.04-1.95 (m, 2H), 1.89-1.82 (m, 1H), 1.50-1.40 (m, 1H), 0.87 (t, 3H).
Пример 4
1-(((S)-7-Бензил-20-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-3,6,9,12,15-пентаоксо-2,5,8,11,14-пентаазаикозил)окси)-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]-индолизино[1,2-b]хинолин-1-ил)циклопропан-1-карбоксамид 4
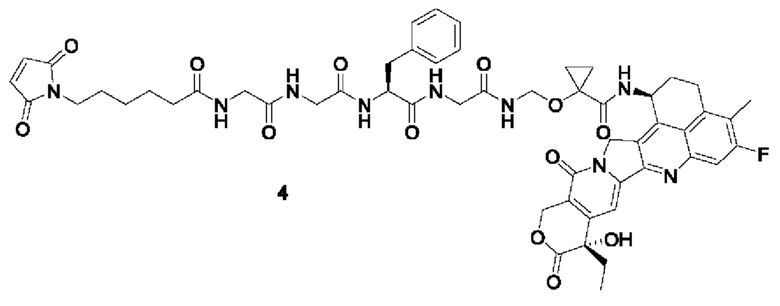
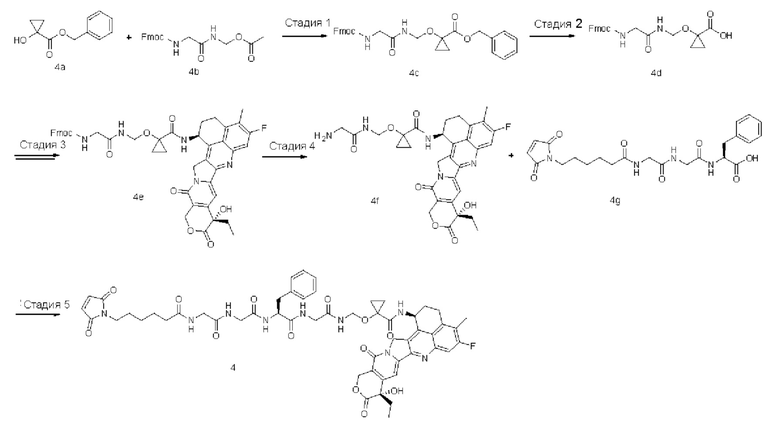
Стадия 1
Бензил-1-((2-((((9H-флуорен-9-ил)метокси)карбонил)амино)ацетамидо)метокси)-циклопропан-1-карбоксилат 4с
Бензил-1-гидроксициклопропан-1-карбоксилат 4а (104 мг; 0,54 ммоль; полученный в соответствии со способом, описанным в патентной заявке "US2005/20645") и (2-((((9Н-флуорен-9-ил)метокси)карбонил)амино)ацетамидо)-метилацетат 4b (100 мг; 0,27 ммоль; полученный в соответствии со способом, описанным в патентной заявке "CN105829346A") добавляли в реакционную колбу, после чего добавляли 5 мл тетрагидрофурана. Реакционный раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой, затем добавляли трет-бутилат калия (61 мг; 0,54 ммоль). Баню с ледяной водой удаляли, реакционный раствор нагревали до комнатной температуры и перемешивали в течение 10 минут. В реакционный раствор добавляли 20 мл ледяной воды, затем экстрагировали этилацетатом (5 мл ×2) и хлороформом (5 мл ×5). Органические фазы объединяли и концентрировали. Полученные остатки растворяли в 3 мл 1,4-диоксана, затем добавляли 0,6 мл воды, бикарбонат натрия (27 мг; 0,32 ммоль) и 9-флуоренметилхлорформиат (70 мг; 0,27 ммоль) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Добавляли 20 мл воды и реакционный раствор экстрагировали этилацетатом (8 мл ×3). Органическую фазу промывали насыщенным раствором хлорида натрия (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученные остатки очищали хроматографией на колонке с силикагелем с использованием системы растворителей В, получая указанный в заголовке продукт 4с (100 мг; выход: 73,6%).
MS m/z (ESI): 501,0 [M+1].
Стадия 2 1-((2-((((9H-Флуорен-9-ил)метокси)карбонил)амино)ацетамидо)метокси)-циклопропан-1-карбоновая кислота 4d
Соединение 4с (50 мг; 0,10 ммоль) растворяли в 3 мл смеси растворителей тетрагидрофурана и этилацетата (об.:об., 2:1), после чего добавляли палладий на угле (25 мг; содержание: 10%). Реакционный раствор три раза продували водородом и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через целит и осадок на фильтре промывали тетрагидрофураном. Фильтрат концентрировали, получая указанный в заголовке продукт 4d (41 мг; выход: 100%).
MS m/z (ESI): 411,0 [M+1].
Стадия 3
(9Н-Флуорен-9-ил)метил-(2-(((1-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)карбамоил)циклопропокси)метил)амино)-2-оксоэтил)карбамат 4е
В реакционную колбу добавляли соединение 1b (7 мг; 0,013 ммоль), после чего добавляли 1 мл N,N-диметилформамида. Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли одну каплю триэтиламина, соединение 4d (7 мг; 0,017 ммоль) в 0,5 мл N,N-диметилформамида и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (7 мг; 0,026 ммоль) и реакционный раствор перемешивали в ледяной бане в течение 35 минут. Добавляли 10 мл воды и реакционный раствор экстрагировали этилацетатом (5 мл ×3). Органическую фазу промывали насыщенным раствором хлорида натрия (10 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученные остатки очищали тонкослойной хроматографией с использованием системы растворителей В, получая указанный в заголовке продукт 4е (8,5 мг; выход: 78,0%).
MS m/z (ESI): 828,0 [М+1].
Стадия 4
1-((2-Аминоацетамидо)метокси)-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]-индолизино[1,2-b]хинолин-1-ил)циклопропан-1-карбоксамид 4f
Соединение 4е (4 мг; 4,84 мкмоль) растворяли в 0,2 мл дихлорметана, после чего добавляли 0,1 мл диэтиламина. Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Добавляли 2 мл толуола и раствор концентрировали при пониженном давлении, что повторяли дважды. К массе добавляли 3 мл н-гексана и верхний слой гексана сливали, что повторяли три раза. Смесь концентрировали при пониженном давлении, получая неочищенный указанный в заголовке продукт 4f (2,9 мг), который использовали непосредственно на следующей стадии без очистки.
MS m/z (ESI): 606,0 [М+1].
Стадия 5
1-(((S)-7-Бензил-20-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)-3,6,9,12,15-пентаоксо-2,5,8,11,14-пентаазаикозил)окси)-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]-индолизино[1,2-b]хинолин-1-ил)циклопропан-1-карбоксамид 4
Неочищенное соединение 4f (2,9 мг; 4,84 мкмоль) растворяли в 0,5 мл N,N-диметилформамида. Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли (S)-2(-2-(-2-(6-(2,5-диоксо-1H-пиррол-1-ил)гексанамидо)ацетамидо)ацетамидо)-3-фенилпропионовую кислоту 4g (2,7 мг; 5,80 мкмоль; полученную в соответствии со способом, описанным в патентной заявке "ЕР2907824") в 0,3 мл N,N-диметилформамида и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (2,7 мг; 9,67 мкмоль) и реакционный раствор перемешивали в ледяной бане в течение 30 минут. Ледяную баню удаляли, реакционный раствор нагревали до комнатной температуры и перемешивали в течение 15 минут. Реакционный раствор очищали высокоэффективной жидкостной хроматографией (условия разделения: препаративная колонка: XBridge C18 OBD, 5 мкм, 19*250 мм; подвижная фаза: А - вода (NH4OAc, 10 ммоль), В - ацетонитрил; градиентное элюирование, скорость потока: 18 мл/мин). Соответствующие фракции собирали и концентрировали при пониженном давлении, получая указанный в заголовке продукт 4 (2 мг; выход: 39,0%).
MS m/z (ESI): 1060,0 [М+1].
1H ЯМР (400 МГц, ДМСО-d6): δ 9.01 (d, 1H), 8.77 (t, 1H), 8.21 (t, 1H), 8.08-7.92 (m, 2H), 7.73 (d, 1H), 7.28 (s, 1H), 7.24-7.07 (m, 4H), 6.98 (s, 1H), 6.50 (s, 1H), 5.61 (q, 1H), 5.40 (s, 2H), 5.32 (t, 1H), 5.12 (q, 2H), 4.62 (t, 1H), 4.52 (t, 1H), 4.40-4.32 (m, 1H), 3.73-3.47 (m, 8H), 3.16-3.04 (m, 2H), 2.89 (dd, 1H), 2.69-2.55 (m, 2H), 2.37-2.23 (m, 4H), 2.12-1.93 (m, 4H), 1.90-1.74 (m, 2H), 1.52-1.38 (m, 4H), 1.33-1.11 (m, 5H), 0.91-0.81 (m, 4H).
Пример 5
N-((2R,10S)-10-Бензил-2-циклопропил-1-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)амино)-1,6,9,12,15-пентаоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамид 5-А
N-((2S,10S)-10-Бензил-2-циклопропил-1-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)амино)-1,6,9,12,15-пентаоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамид 5-В
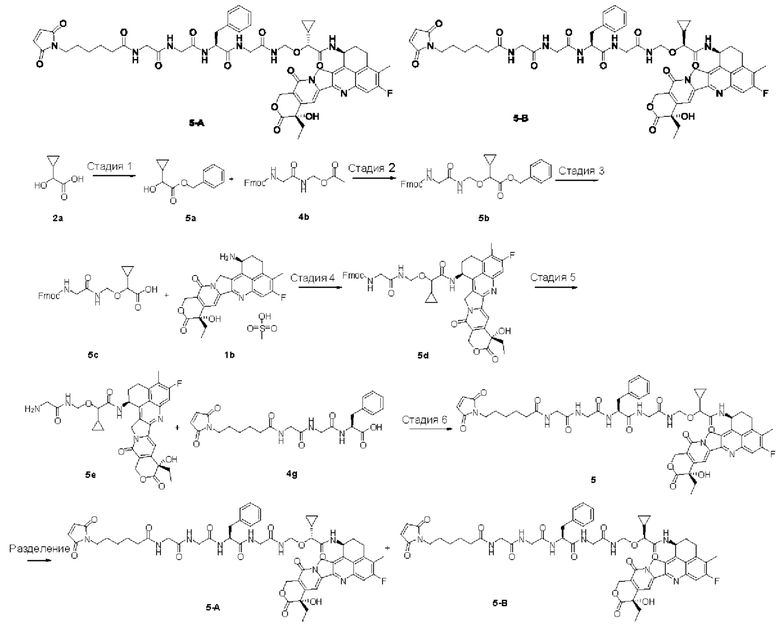
Стадия 1
Бензил-2-циклопропил-2-гидроксиацетат 5а
Соединение 2а (1,3 г; 11,2 ммоль; полученное в соответствии со способом, описанным в патентной заявке "WO2013/106717") растворяли в 50 мл ацетонитрила и затем последовательно добавляли карбонат калия (6,18 г; 44,8 ммоль), бензилбромид (1,33 мл; 11,2 ммоль) и тетрабутиламмония иодид (413 мг; 1,1 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 48 часов и фильтровали через целит. Осадок на фильтре промывали этилацетатом (10 мл) и фильтраты объединяли и концентрировали при пониженном давлении. Полученные остатки очищали хроматографией на колонке с силикагелем с использованием системы растворителей С, получая указанный в заголовке продукт 5а (2 г; выход: 86,9%).
Стадия 2
Бензил-10-циклопропил-1-(9Н-флуорен-9-ил)-3,6-диоксо-2,9-диокса-4,7-диазаундекан-11-оат 5b
В реакционную колбу добавляли соединение 5а (120,9 мг; 0,586 ммоль) и соединение 4b (180 мг; 0,489 ммоль), после чего добавляли 4 мл тетрагидрофурана. Реакционный раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли трет-бутилат калия (109 мг; 0,98 ммоль) и баню с ледяной водой удаляли. Реакционный раствор нагревали до комнатной температуры и перемешивали в течение 40 минут. В реакционный раствор добавляли 10 мл ледяной воды, затем экстрагировали этилацетатом (20 мл ×2) и хлороформом (10 мл ×5). Органические фазы объединяли и концентрировали. Полученные остатки растворяли в 4 мл диоксана, затем добавляли 2 мл воды, бикарбонат натрия (49,2 мг; 0,586 ммоль) и 9-флуорен-метилхлорформиат (126 мг; 0,49 ммоль) и реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Добавляли 20 мл воды и реакционный раствор экстрагировали этилацетатом (10 мл ×3). Органическую фазу промывали насыщенным раствором хлорида натрия (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученные остатки очищали хроматографией на колонке с силикагелем с использованием системы растворителей С, получая указанный в заголовке продукт 5b (48 мг; выход: 19%).
MS m/z (ESI): 515,0 [М+1].
Стадия 3
10-Циклопропил-1-(9H-флуорен-9-ил)-3,6-диоксо-2,9-диокса-4,7-диазаундекан-11-овая кислота 5с
Соединение 5b (20 мг; 0,038 ммоль) растворяли в 4,5 мл смеси растворителей тетрагидрофурана и этилацетата (об.:об., 2:1), после чего добавляли палладий на угле (12 мг; содержание: 10%, сухой). Реакционный раствор три раза продували водородом и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через целит и осадок на фильтре промывали этилацетатом. Фильтрат концентрировали, получая неочищенный указанный в заголовке продукт 5с (13 мг), который использовали непосредственно на следующей стадии без очистки.
MS m/z (ESI): 424,9 [М+1].
Стадия 4
(9H-Флуорен-9-ил)метил-(2-(((1-циклопропил-2-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)амино)-2-оксоэтокси)метил)амино)-2-оксоэтил)карбамат 5d
Соединение 1b (10 мг; 18,8 мкмоль) добавляй в реакционную колбу, после чего добавляли 1 мл N,N-диметилформамида. Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли одну каплю триэтиламина, неочищенное соединение 5 с (13 мг; 30,6 мкмоль) и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (16,9 мг; 61,2 мкмоль) и реакционный раствор перемешивали в ледяной бане в течение 40 минут. Добавляли 10 мл воды и реакционный раствор экстрагировали этилацетатом (10 мл ×3). Органические фазы объединяли. Органическую фазу промывали насыщенным раствором хлорида натрия (10 мл ×2), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученные остатки очищали тонкослойной хроматографией с использованием системы растворителей В, получая указанный в заголовке продукт 5d (19 мг; выход: 73,6%).
MS m/z (ESI): 842,1 [М+1].
Стадия 5
2-((2-Аминоацетамидо)метокси)-2-циклопропил-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1H,12H-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)ацетамид 5е
Соединение 5d (19 мг; 22,6 мкмоль) растворяли в 2 мл дихлорметан, после чего добавляли 1 мл диэтиламина. Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Добавляли 1 мл толуола и раствор концентрировали при пониженном давлении, что повторяли дважды. К остаткам массы добавляли 3 мл н-гексана и супернатант сливали после отстаивания. Оставляли твердое вещество. Твердые остатки концентрировали досуха при пониженном давлении с использованием масляного вакуумного насоса, получая неочищенный указанный в заголовке продукт 5е (17 мг), который использовали непосредственно на следующей стадии без очистки.
MS m/z (ESI): 638,0 [M+18].
Стадия 6
N-((2R,10S)-10-Бензил-2-циклопропил-1-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)амино)-1,6,9,12,15-пентаоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 5-А
N-((2S,10S)-10-Бензил-2-циклопропил-1-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)амино)-1,6,9,12,15-пентаоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 5-В
Неочищенное соединение 5е (13,9 мг; 22,4 мкмоль) растворяли в 0,6 мл N,N-диметилформамида. Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли соединение 4g (21,2 мг; 44,8 мкмоль) в 0,3 мл N,N-диметилформамида и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (18,5 мг; 67,3 мкмоль) и реакционный раствор перемешивали в ледяной бане в течение 10 минут. Ледяную баню удаляли, реакционный раствор нагревали до комнатной температуры и перемешивали в течение 1 часа, получая соединение 5. Реакционный раствор очищали высокоэффективной жидкостной хроматографией (условия разделения: препаративная колонка: XBridge C18 OBD, 5 мкм, 19*250 мм; подвижная фаза: А - вода (NH4OAc, 10 ммоль), В - ацетонитрил; градиентное элюирование, скорость потока: 18 мл/мин). Соответствующие фракции собирали и концентрировали при пониженном давлении, получая указанные в заголовке продукты (2,4 мг; 1,7 мг).
MS m/z (ESI): 1074,4 [М+1].
Соединение 5-А с индивидуальной конфигурацией (имеющее меньшее время удерживания)
UPLC анализ: время удерживания: 1,14 минуты; чистота: 85% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 8.60 (t, 1H), 8.51-8.49 (d, 1H), 8.32-8.24 (m, 1H), 8.13-8.02 (m, 2H), 8.02-7.96 (m, 1H), 7.82-7.75 (m, 1H), 7.31 (s, 1H), 7.26-7.15 (m, 4H), 6.99 (s, 1H), 6.55-6.48 (m, 1H), 5.65-5.54 (m, 1H), 5.41 (s, 2H), 5.35-5.15 (m, 3Н), 4.74-4.62 (m, 2H), 4.54-4.40 (m, 2H), 3.76-3.64 (m, 4H), 3.62-3.48 (m, 2H), 3.20-3.07 (m, 2H), 3.04-2.94 (m, 2H), 2.80-2.62 (m, 2H), 2.45-2.30 (m, 3Н), 2.25-2.15 (m, 2H), 2.15-2.04 (m, 2H), 1.93-1.78 (m, 2H), 1.52-1.39 (m, 3H), 1.34-1.12 (m, 5H), 0.87 (t, 3H), 0.64-0.38 (m, 4H).
Соединение 5-В с индивидуальной конфигурацией (имеющее большее время удерживания)
UPLC анализ: время удерживания: 1,16 минуты; чистота: 89% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 8.68-8.60 (m, 1H), 8.58-8.50 (m, 1H), 8.32-8.24 (m, 1H), 8.13-8.02 (m, 2H), 8.02-7.94 (m, 1H), 7.82-7.75 (m, 1H), 7.31 (s, 1H), 7.26-7.13 (m, 4H), 6.99 (s, 1H), 6.55-6.48 (m, 1H), 5.60-5.50 (m, 1H), 5.41 (s, 2H), 5.35-5.15 (m, 3H), 4.78-4.68 (m, 1H), 4.60-4.40 (m, 2H), 3.76-3.58 (m, 4H), 3.58-3.48 (m, 1H), 3.20-3.10 (m, 2H), 3.08-2.97 (m, 2H), 2.80-2.72 (m, 2H), 2.45-2.30 (m, 3H), 2.25-2.13 (m, 2H), 2.13-2.04 (m, 2H), 2.03-1.94 (m, 2H), 1.91-1.78 (m, 2H), 1.52-1.39 (m, 3H), 1.34-1.12 (m, 5H), 0.91-0.79 (m, 3H), 0.53-0.34 (m, 4H).
Пример 6
N-((2S,10S)-10-Бензил-2-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)карбамоил)-1,1,1-трифтор-6,9,12,15-тетраоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамид 6-А
N-((2R,10S)-10-Бензил-2-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)карбамоил)-1,1,1-трифтор-6,9,12,15-тетраоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексанамид 6-В
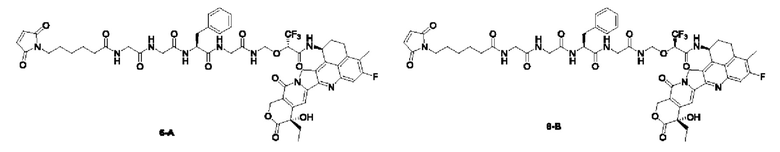
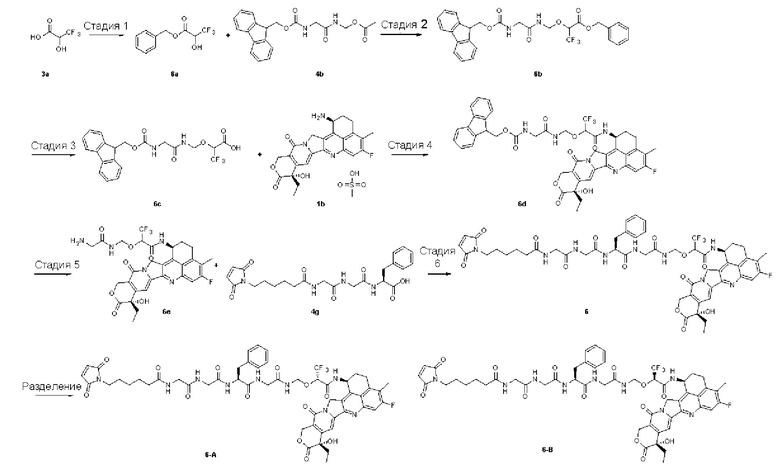
Стадия 1
Бензил-3,3,3-трифтор-2-гидроксипропаноат 6а
Соединение 3а (1,80 г; 12,5 ммоль) растворяли в 100 мл ацетонитрила и затем последовательно добавляли карбонат калия (5,17 г; 37,5 ммоль), бензилбромид (4,48 мл; 37,5 ммоль) и тетрабутиламмония иодид (231 мг; 0,63 ммоль). Реакционный раствор нагревали до 60°С и перемешивали в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали при пониженном давлении и полученные остатки очищали хроматографией на колонке с силикагелем с использованием системы растворителей С, получая указанный в заголовке продукт 6а (980 мг; выход: 33,5%).
1H ЯМР (400 МГц, CDCl3): δ 7.43-7.36 (m, 5Н), 5.34 (s, 2H), 4.53 (s, 1H), 3.44 (s, 1H).
Стадия 2 Бензил-1-(9H-флуорен-9-ил)-3,6-диоксо-10-(трифторметил)-2,9-диокса-4,7-диазаундекан-11-оат 6b
Соединение 4b (63 мг; 0,17 ммоль) и соединение 6а (80 мг; 0,34 ммоль) добавляли в реакционную колбу, после чего добавляли 3 мл тетрагидрофурана. Реакционный раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли трет-бутилат калия (38 мг; 0,34 ммоль) и баню с ледяной водой удаляли. Реакционный раствор нагревали до комнатной температуры и перемешивали в течение 20 минут. В реакционный раствор добавляли 10 мл ледяной воды, затем экстрагировали этилацетатом (20 мл ×2) и хлороформом (10 мл ×5). Органические фазы объединяли и концентрировали и полученные остатки растворяли в 2 мл диоксана. Добавляли 0,4 мл воды, бикарбонат натрия (19 мг; 0,23 ммоль) и 9-флуоренметилхлорформиат (49 мг; 0,19 ммоль) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Добавляли 20 мл воды и реакционный раствор экстрагировали этилацетатом (10 мл ×3). Органическую фазу промывали насыщенным раствором хлорида натрия (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученные остатки очищали хроматографией на колонке с силикагелем с использованием системы растворителей С, получая указанный в заголовке продукт 6b (51 мг; выход: 55,3%).
MS m/z (ESI): 559,9 [М+18].
Стадия 3
1-(9H-Флуорен-9-ил)-3,6-диоксо-10-(трифторметил)-2,9-диокса-4,7-диазаундекан-11-овая кислота 6с
Соединение 6b (15 мг; 0,28 ммоль) растворяли в 3 мл смеси растворителей тетрагидрофурана и этилацетата (об.:об., 2:1), после чего добавляли палладий на угле (15 мг; содержание: 10%). Реакционный раствор три раза продували водородом и перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор фильтровали через целит и осадок на фильтре промывали тетрагидрофураном. Фильтрат концентрировали, получая неочищенный указанный в заголовке продукт 6с (13 мг).
MS m/z (ESI): 452,9 [M+1].
Стадия 4
(9Н-Флуорен-9-ил)метил-(2-((((3-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)амино)-1,1,1-трифтор-3-оксопропан-2-ил)-окси)метил)амино)-2-оксоэтил)карбамат 6d
В реакционную колбу добавляли соединение 1b (10 мг; 18,8 мкмоль), после чего добавляли 1 мл N,N-диметилформамида. Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли одну каплю триэтиламина, соединение 6с (13 мг; 28,7 мкмоль) в 0,5 мл N,N-диметилформамида и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (11 мг; 39,7 мкмоль) и реакционный раствор перемешивали в ледяной бане в течение 30 минут. Добавляли 10 мл воды и реакционный раствор экстрагировали этилацетатом (10 мл ×3). Органические фазы объединяли, промывали насыщенным раствором хлорида натрия (10 мл ×2), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученные остатки очищали тонкослойной хроматографией с использованием системы растворителей В, получая указанный в заголовке продукт 6d (16 мг; выход: 97,8%).
MS m/z (ESI): 870,0 [М+1].
Стадия 5
2-((2-Аминоацетамидо)метокси)-N-((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)-3,3,3-трифторпропанамид 6е
Соединение 6d (16 мг; 18,4 мкмоль) растворяли в 0,6 мл дихлорметана, после чего добавляли 0,3 мл диэтиламина. Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Добавляли 2 мл толуола и раствор концентрировали при пониженном давлении, что повторяли дважды. К остаткам массы добавляли 3 мл н-гексана и супернатант сливали после отстаивания, в то время как твердое вещество оставляли, что повторяли три раза. Твердые остатки концентрировали при пониженном давлении досуха с использованием масляного вакуумного насоса, получая неочищенный указанный в заголовке продукт 6е (12 мг), который использовали непосредственно на следующей стадии без очистки.
MS m/z (ESI): 647,9 [М+1].
Стадия 6 N-((2S,10S)-10-Бензил-2-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)карбамоил)-1,1,1-трифтор-6,9,12,15-тетраоксо-3-окса-5,8,11,14 тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 6-А
N-((2R,10S)-10-Бензил-2-(((1S,9S)-9-этил-5-фтор-9-гидрокси-4-метил-10,13-диоксо-2,3,9,10,13,15-гексагидро-1Н,12Н-бензо[де]пирано[3',4':6,7]индолизино[1,2-b]хинолин-1-ил)карбамоил)-1,1,1-трифтор-6,9,12,15-тетраоксо-3-окса-5,8,11,14-тетраазагексадекан-16-ил)-6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамид 6-В
Неочищенное соединение 6е (12 мг; 18,5 мкмоль) растворяли в 1,0 мл N,N-диметилформамида. Раствор три раза продували аргоном и охлаждали до 0-5°С в бане с ледяной водой. Добавляли соединение 4g (14 мг; 29,6 мкмоль) в 0,3 мл N,N-диметилформамида и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид (15 мг; 54,2 мкмоль) и реакционный раствор перемешивали в ледяной бане в течение 30 минут. Ледяную баню удаляли, реакционный раствор нагревали до комнатной температуры и перемешивали в течение 1 часа, получая соединение 6. Реакционный раствор очищали высокоэффективной жидкостной хроматографией (условия разделения: препаративная колонка: XBridge C18 OBD, 5 мкм, 19*250 мм; подвижная фаза: А - вода (NH4OAc, 10 ммоль), В - ацетонитрил; градиентное элюирование, скорость потока: 18 мл/мин). Соответствующие фракции собирали и концентрировали при пониженном давлении, получая указанные в заголовке продукты (2,7 мг; 2,6 мг).
MS m/z (ESI): 1102,0 [М+1].
Соединение с индивидуальной конфигурацией (имеющее меньшее время удерживания)
UPLC анализ: время удерживания: 1,18 минуты; чистота: 91% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 8.97 (d, 1Н), 8.85-8.76 (m, 1H), 8.37-8.27 (m, 1H), 8.12-8.02 (m, 1H), 8.02-7.95 (m, 1Н), 7.80 (d, 1H), 7.31 (s, 1H), 7.26-7.10 (m, 4H), 6.99 (s, 1H), 6.66 (s, 1H), 6.52 (s, 1H), 5.65-5.54 (m, 1H), 5.41 (s, 1 Н), 5.37-5.25 (m, 3Н), 5.23-5.13 (m, 1H), 4.81-4.68 (m, 2H), 4.51-4.41 (m, 1H), 3.78-3.45 (m, 6H), 3.21-3.13 (m, 1Н), 3.02-2.93 (m, 1Н), 2.77-2.63 (m, 2H), 2.45-2.29 (m, 3Н), 2.24-2.05 (m, 3Н), 2.04-1.93 (m, 5H), 1.90-1.75 (m, 2H), 1.52-1.38 (m, 4H), 0.90-0.78 (m, 5H).
Соединение с индивидуальной конфигурацией (имеющее большее время удерживания)
UPLC анализ: время удерживания: 1,23 минуты; чистота: 90% (колонка: ACQUITY UPLC BEHC18, 1,7 мкм, 2,1*50 мм; подвижная фаза: А - вода (NH4OAc, 5 ммоль), В - ацетонитрил).
1H ЯМР (400 МГц, ДМСО-d6): δ 9.05 (d, 1Н), 8.97-8.88 (m, 1H), 8.35-8.27 (m, 1H), 8.11-8.03 (m, 1H), 8.02-7.95 (m, 1H), 7.80 (d, 1Н), 7.34 (s, 1H), 7.29-7.13 (m, 4H), 6.99 (s, 1H), 6.66 (s, 1H), 6.54 (s, 1H), 5.64-5.55 (m, 1H), 5.43 (s, 1Н), 5.36-5.20 (m, 3Н), 4.92-4.85 (m, 1H), 4.82-4.72 (m, 2H), 4.52-4.42 (m, 1H), 3.77-3.48 (m, 6H), 3.21-3.14 (m, 1Н), 3.03-2.95 (m, 1Н), 2.79-2.65 (m, 2H), 2.47-2.28 (m, 3Н), 2.25-2.05 (m, 3Н), 2.05-1.94 (m, 5H), 1.91 -1.76 (m, 2H), 1.52-1.37 (m, 4H), 0.92-0.77 (m, 5H).
Пример 7. Получение соответствующих антител и белков для их детектирования
Пример 7-1. Антиген В7Н3 и детектирующий белок
Последовательность В7Н3 человека, представленную в SEQ ID NO: 1, использовали в качестве матрицы для В7Н3 по настоящему изобретению и конструировали аминокислотную последовательность антигена и детектирующего белка, включенных в настоящее изобретение. Если не указано иное, приведенный далее антиген В7Н3 представляет собой В7Н3 человека.
1.1. Полноразмерная аминокислотная последовательность В7Н3 человека: В7Н3 (SEQ ID NO: 1):

Примечание: выделенная двойным подчеркиванием часть относится к сигнальному пептиду (сигнальному пептиду: 1-28);
выделенная подчеркиванием часть относится к внеклеточному домену В7Н3 (внеклеточному домену: 29-466), при этом аминокислоты 29-139 относятся к Ig-подобному 1-ому домену V-типа, а аминокислоты 145-238 относятся к Ig-подобному домену 1-ому домену С2-типа; аминокислоты 243-357 относятся к Ig-подобному 2-ому домену V-типа, а аминокислоты 363-456 относятся к Ig-подобному домену 2-ому домену С2-типа;
выделенная пунктирным подчеркиванием часть относится к трансмембранному домену (трансмембранному домену: 467-487);
выделенная курсивом часть относится к внутриклеточному домену (цитоплазматическому домену: 488-534).
1.2. Полноразмерная аминокислотная последовательность В7Н3 мыши (SEQ ID NO: 2)


Примечание: выделенная двойным подчеркиванием часть относится к сигнальному пептиду (сигнальному пептиду: 1-28);
выделенная подчеркиванием часть относится к внеклеточному домену В7Н3 (внеклеточному домену: 29-248), при этом аминокислоты 29-139 относятся к Ig-подобному домену V-типа, а аминокислоты 145-238 относятся к Ig-подобному домену С2-типа;
выделенная пунктирным подчеркиванием часть относится к трансмембранному домену (трансмембранному домену: 249-269);
выделенная курсивом часть относится к внутриклеточному домену (цитоплазматическому домену: 270-316).
1.3. Антиген В7Н3 человека для скрининга и детекции (SEQ ID NO: 3)
Это имеющийся в продаже продукт (R&D, № по каталогу 1949-B3-050/CF, сокращенно 2Ig-B7H3), и его последовательность приведена ниже:

Примечание: выделенная подчеркиванием часть относится к внеклеточному участку В7Н3;
выделенная курсивом часть относится к маркеру - His-метке.
1.4. Антиген В7Н3 человека для детекции (SEQ ID NO: 4)
Это имеющийся в продаже продукт (Sino Biological, № по каталогу 11188-Н08Н, сокращенно 4Ig-B7H3), и его последовательность приведена ниже:

Примечание: выделенная подчеркиванием часть относится к внеклеточному участку В7Н3;
выделенная курсивом часть относится к маркеру - His-метке.
1.5. Антиген В7Н3 мыши для скрининга и детекции (SEQ ID NO: 5)
Это имеющийся в продаже продукт (R&D, № по каталогу 1397-B3-050/CF), и его последовательность приведена ниже:

Примечание: выделенная подчеркиванием часть относится к внеклеточному участку В7Н3;
выделенная курсивом часть относится к маркеру - His-метке.
Пример 7-2. Получение полностью гуманизированного антитела
2.1. Скрининг положительной последовательности
Из РВМС, тканей селезенки и лимфатических узлов человека выделяли В-клетки и экстрагировали РНК для создания наивной фаговой библиотеки одноцепочечных антител (емкостью 3,2×1010). Созданную наивную фаговую библиотеку одноцепочечных антител упаковывали с образованием фаговых частиц и затем подвергали пэннингу методом с использованием жидкой фазы. Проводили связывание фага с биотинилированным В7Н3 в жидкой фазе и затем отделение с использованием магнитных гранул со стрептавидином. Чтобы получить положительные последовательности, которые могут перекрестно связываться с В7Н3 человека (R&D, № по каталогу 1949-B3-050/CF) и В7Н3 мыши (R&D, № по каталогу 1397-B3-050/CF), соответственно, для проведения пэннинга поочередно и по отдельности использовали биотинилированный В7Н3 человека и биотинилированный В7Н3 мыши. В первом раунде пэннинга использовали биотинилированный В7Н3 человека в концентрации 2 мкг/мл. Во втором раунде пэннинга использовали биотинилированный В7Н3 мыши в концентрации 2 мкг/мл. В третьем раунде пэннинга использовали биотинилированный В7Н3 человека в концентрации 0,5 мкг/мл. После трех раундов пэннинга были отобраны 500 моноклонов и упакованы в фаг для тестирования фагов посредством ELISA. Эффективность связывания моноклонального фага с В7Н3 человека (R&D, № по каталогу 1949-B3-050/CF) и В7Н3 мыши (R&D, № по каталогу 1397-B3-050/CF) тестировали по отдельности. В лунки планшета для ELISA вносили покрытие, используя В7Н3 человека или В7Н3 мыши в концентрации 1 мкг/мл, добавляли фаговый супернатант, разбавленный в отношении 1:1 блокирующим буфером, и затем проводили детектирование с использованием антител к М13, конъюгированных с пероксидазой хрена (HRP). Для секвенирования отбирали клоны со значением оптической плотности при длине волны 450 нм (OD450) в ELISA, превышающим 0,5, и с соотношениями значений OD450 в ELISA для связывания с В7Н3 человека или мыши к значениям OD450 в ELISA для связывания с 1%-ным BSA (бычий сывороточный альбумин), превышающими 2,0, и получали специфическую последовательность 1702 (также называемую в описании настоящего изобретения как h1702, при этом антитела h1702 и h1702DS, упоминаемые в описании настоящего изобретения, являются такими же, как и h1702 и h1702-1 в патентной заявке PCT/CN2018/081249; все содержимое патентной заявки PCT/CN2018/081249 включено в описание настоящего изобретения).
2.2. Конструирование интактного моноклонального антитела
Специфическую последовательность 1702 получали посредством скрининга фаговой библиотеки, и способ конструирования соответствующего ей интактного моноклонального антитела осуществляли так, как приведено ниже.
На основании последовательности одноцепочечного антитела, полученной путем секвенирования, конструировали праймеры для создания генного фрагмента VH/VK/VL для каждой последовательности одноцепочечного антитела посредством ПЦР Получали вариабельную область тяжелой цепи 1702.
> последовательность вариабельной области тяжелой цепи 1702

> последовательность вариабельной области легкой цепи 1702

Примечание: порядок таков: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. В последовательности выделенные курсивом части относятся к последовательностям FR, а выделенные подчеркиванием части относятся к последовательностям CDR.
Последовательности CDR в легкой цепи и тяжелой цепи каждого антитела показаны в Таблице 1.
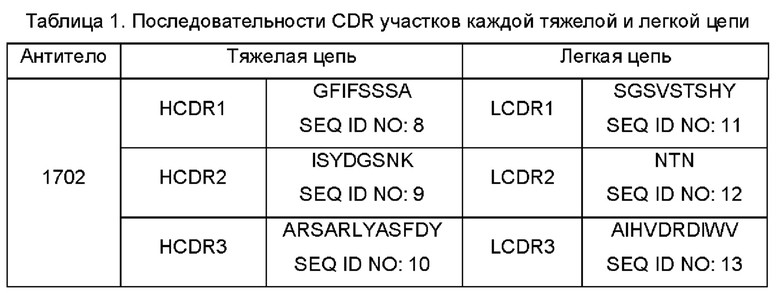
Затем, чтобы сконструировать интактное антитело VH-CH1-FC/VK-CL/VL-CL, проводили гомологическую рекомбинацию вариабельной области антитела с фрагментом гена константной области (CH1-FC/CL).
Сконструированная последовательность интактного полноразмерного антитела 1702 выглядит так, как приведено ниже.
Аминокислотная последовательность тяжелой цепи антитела 1702 (IgG1): (SEQ ID NO: 14)

Аминокислотная последовательность легкой цепи антитела 1702: цепи лямбда (SEQ ID NO: 15)

Для дальнейшего улучшения стабильности антитела аминокислоты в последовательности легкой цепи антитела 1702 подвергали мутациям. Специфическая мутация заключается в замене первого аминокислотного остатка Q на N-конце легкой цепи (SEQ ID NO: 15) на D, делетировании первого аминокислотного остатка S на С-конце, в результате чего получается более стабильное и универсальное моноклональное антитело 1702DS (также называемое
h1702DS в описании настоящего изобретения).
Последовательность тяжелой цепи антитела 1702DS после модификации посредством мутации представляет собой SEQ ID NO: 14, а аминокислотная последовательность легкой цепи выглядит так, как приведено ниже: (SEQ ID NO: 16).
DTVVTQEPSFSVSPGGTVTLTCGLSSGSVSTSHYPSWYQQTPGQAPRMLIYNTNTRSSGVPDRFSGSILGNKAALTITGAQADDESDYYCAIHVDRDIWVFGGGTKLTVLGQPKANPTVTLFPPSSEELQANKATLVCLISDFYPGAVTVAWKADGSPVKAGVETTKPSKQSNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTEC.
2.3. Экспрессия и очистка полностью гуманизированного антитела
Плазмидами, экспрессирующими легкую и тяжелую цепь антитела, соответственно, трансфицировали клетки HEK293E в соотношении 1,5:1. Через 6 суток отбирали супернатант, дебрис удаляли посредством высокоскоростного центрифугирования и проводили очистку на колонке с иммобилизованным белком А. Колонку промывали PBS до тех пор, пока показания поглощения при 280 нм (А280) не снижались до базовой линии. Целевой белок элюировали кислотным элюентом с рН 3,0-рН 3,5 и нейтрализовали с использованием 1 М раствора трис-HCl (рН 8,0-9,0). Элюированный образец соответствующим образом концентрировали и далее очищали гель-хроматографией на колонке с Superdex 200 (GE), которая была уравновешена PBS, для удаления агрегатов. Собирали соответствующий мономеру пики упаковывали для дальнейшего применения.
Примеры получения конъюгата антитело к В7Н3-лекарственное средство
Пример 8. ADC-1
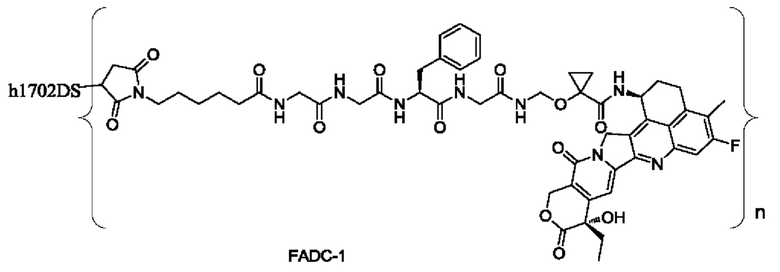
Приготовленный водный раствор трис(2-карбоксиэтил)фосфина (10 мМ; 0,347 мл; 3,47 мкмоль) добавляли в PBS-забуференный водный раствор антитела 1702DS (0,05 М PBS-забуференный водный раствор с рН 6,5; 7,3 мл; 13,8 мг/мл; 0,681 мкмоль) при 37°С. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 37°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор охлаждали до 25°С в водяной бане и разбавляли до объема 14,0 мл. Для проведения следующей реакции отбирали 3,3 мл этого раствора.
Соединение 4 (3,0 мг; 2,75 мкмоль) растворяли в 0,15 мл ДМСО и затем добавляли к 3,3 мл указанного выше раствора. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 25°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор обессоливали и очищали на колонке с гелем Сефадекс G25 (фаза для элюирования: 0,05 М PBS-забуференный водный раствор с рН 6,5, содержащий 0,001 М ЭДТА), получая PBS-забуференный раствор приводимого в качестве примера продукта ADC-1 формулы FADC-1 (1,35 мг/мл; 13 мл), который хранили при 4°С.
Среднее значение, рассчитанное по данным UV-HPLC: n=7,50.
Пример 9. ADC-2
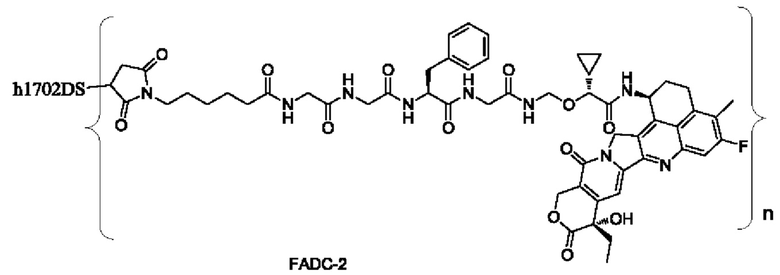
Приготовленный водный раствор трис(2-карбоксиэтил)фосфина (10 мМ; 0,050 мл; 0,50 мкмоль) добавляли в PBS-забуференный водный раствор антитела 1702DS (0,05 М PBS-забуференный водный раствор с рН 6,5; 1,0 мл; 13,8 мг/мл; 0,093 мкмоль) при 37°С. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 37°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор охлаждали до 25°С в водяной бане и разбавляли до объема 2,0 мл. Для проведения следующей реакции отбирали 1,15 мл этого раствора.
Соединение 5, имеющее меньшее время удерживания, а именно, соединение 5-А (1,29 мг; 1,02 мкмоль), растворяли в 0,10 мл ДМСО и затем добавляли к 1,15 мл указанного выше раствора. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 25°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор обессоливали и очищали на колонке с гелем Сефадекс G25 (фаза для элюирования: 0,05 М PBS-забуференный водный раствор с рН 6,5, содержащий 0,001 М ЭДТА), получая PBS-забуференный раствор приводимого в качестве примера продукта ADC-2 формулы FADC-2 (2,63 мг/мл; 2,4 мл), который хранили при 4°С.
Среднее значение, рассчитанное по данным UV-HPLC: n=7,24.
Пример 10. ADC-3
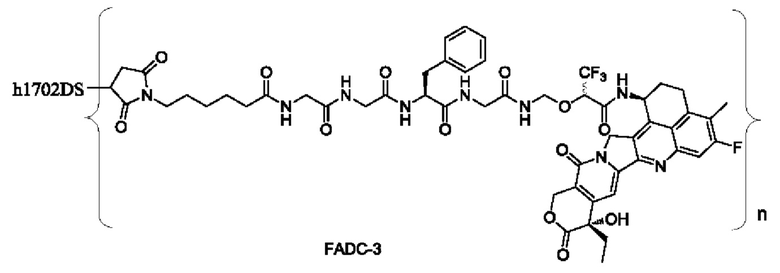
Приготовленный водный раствор трис(2-карбоксиэтил)фосфина (10 мМ; 0,347 мл; 3,47 мкмоль) добавляли в PBS-забуференный водный раствор антитела 1702DS (0,05 М PBS-забуференный водный раствор с рН 6,5; 7,3 мл; 13,8 мг/мл; 0,681 мкмоль) при 37°С. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 37°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор охлаждали до 25°С в водяной бане и разбавляли до объема 14,0 мл. Для проведения следующей реакции отбирали 3,3 мл этого раствора.
Соединение 6, соединение с большим временем удерживания (3,0 мг; 2,75 мкмоль), растворяли в 0,15 мл ДМСО и затем добавляли к 3,3 мл указанного выше раствора. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 25°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор обессоливали и очищали на колонке с гелем Сефадекс G25 (фаза для элюирования: 0,05 М PBS-забуференный водный раствор с рН 6,5, содержащий 0,001 М ЭДТА), получая PBS-забуференный раствор приводимого в качестве примера продукта ADC-3 формулы FADC-3 (1,28 мг/мл; 13 мл), который хранили при 4°С.
Среднее значение, рассчитанное по данным UV-HPLC: n=7,58.
Пример 11. ADC-4
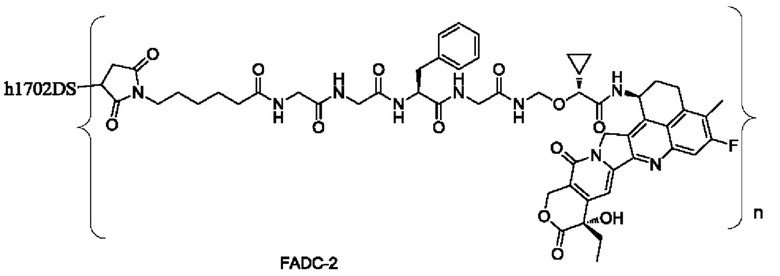
Приготовленный водный раствор трис(2-карбоксиэтил)фосфина (ТСЕР) (10 мМ; 73,7 мкл; 740 нмоль) добавляли в PBS-забуференный водный раствор антитела 1702DS (0,05 М PBS-забуференный водный раствор с рН 6,5; 10,0 мг/мл; 2,14 мл; 144,60 нмоль) при 37°С. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 37°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор охлаждали до 25°С в водяной бане.
Соединение 5, имеющее меньшее время удерживания, а именно, соединение 5-А (3,0 мг; 2793 нмоль), растворяли в 150 мкл ДМСО и затем добавляли к указанному выше раствору. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 25°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор обессоливали и очищали на колонке с гелем Сефадекс G25 (фаза для элюирования: 0,05 М PBS-забуференный водный раствор с рН 6,5, содержащий 0,001 М ЭДТА), получая PBS-забуференный раствор приводимого в качестве примера продукта ADC-4 формулы FADC-2 (1,28 мг/мл; 13,0 мл), который хранили при 4°С.
Среднее значение, рассчитанное по данным UV-HPLC: n=6,87.
Пример 12. ADC-5
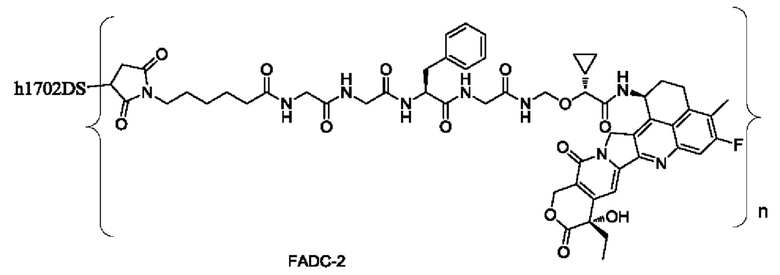
Приготовленный водный раствор трис(2-карбоксиэтил)фосфина (ТСЕР) (10 мМ; 30,1 мкл; 300 нмоль) добавляли в PBS-забуференный водный раствор антитела 1702DS (0,05 М PBS-забуференный водный раствор с рН 6,5; 10,0 мг/мл; 0,89 мл; 60,14 нмоль) при 37°С. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 37°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор охлаждали до 25°С в водяной бане.
Соединение 5, имеющее меньшее время удерживания, а именно, соединение 5-А (1,02 мг; 950 нмоль), растворяли в 100 мкл ДМСО и затем добавляли к указанному выше раствору. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 25°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор обессоливали и очищали на колонке с гелем Сефадекс G25 (фаза для элюирования: 0,05 М PBS-забуференный водный раствор с рН 6,5, содержащий 0,001 М ЭДТА), получая PBS-забуференный раствор приводимого в качестве примера продукта ADC-5 формулы FADC-2 (1,94 мг/мл; 3,5 мл), который хранили при 4°С.
Среднее значение, рассчитанное по данным UV-HPLC: n=6,11.
Условия реакций для получения приводимых в качестве примеров продуктов формулы FADC-2 со значениями n, равными 2,97 и 4,8, соответственно: ADC-6 (n=2,97); ADC-7 (n=4,8), корректировали в соответствии с описанными выше методиками реакций и традиционными в данной области техническими средствами.
Пример 13. ADC-8
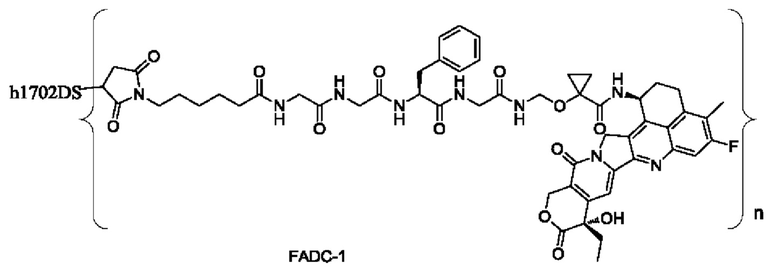
Приготовленный водный раствор трис(2-карбоксиэтил)фосфина (ТСЕР) (10 мМ; 30,1 мкл; 300 нмоль) добавляли в PBS-забуференный водный раствор антитела 1702DS (0,05 М PBS-забуференный водный раствор с рН 6,5; 10,0 мг/мл; 0,89 мл; 60,14 нмоль) при 37°С. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 37°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор охлаждали до 25°С в водяной бане.
Соединение 4 (1,0 мг; 943 нмоль) растворяли в 100 мкл ДМСО и затем добавляли к указанному выше раствору. Реакционный раствор помещали в шейкер с водяной баней и встряхивали при 25°С в течение 3 часов, после чего реакцию останавливали. Реакционный раствор обессоливали и очищали на колонке с гелем Сефадекс G25 (фаза для элюирования: 0,05 М PBS-забуференный водный раствор с рН 6,5, содержащий 0,001 М ЭДТА), получая PBS-забуференный раствор приводимого в качестве примера продукта ADC-8 формулы FADC-1 (1,47 мг/мл; 4,5 мл), который хранили при 4°С.
Среднее значение, рассчитанное по данным UV-HPLC: n=6,11.
Биологический анализ
Пример тестирования 1. Тестирование аффинности антител с использованием Biacore
Аффинность взаимодействия антитела к B7H3 и B7H3-ADC с антигеном 2Ig-B7H3 человека и антигеном 4Ig-B7H3 человека определяли, используя прибор Biacore (GE).
Для аффинного захвата определенных количеств антитела/ADC, подлежащих тестированию, использовали биосенсорный чип Protein A (№ по каталогу 29127556, GE). Над поверхностью этого чипа пропускали серию разбавленных растворов антигена 2Ig-B7H3 человека (№ по каталогу 1949-В3-050/CF, R&D) и антигена 4Ig-B7H3 человека (№ по каталогу 11188-Н08Н, Sino Biological). Детектирование сигнала взаимодействия осуществляли в режиме реального времени с использованием прибора (instrument) Biacore (Biacore T200, GE), получая кривые ассоциации и диссоциации. По завершении каждого цикла диссоциации биочип промывали и регенерировали раствором для регенерации глицин-соляная кислота (рН 1,5) (№по каталогу BR-1003-54, GE). В этом эксперименте в качестве буфера использовали буферный раствор HBS-EP (рН 7,4) (№ по каталогу BR-1001-88, GE).
Для получения значений аффинности экспериментальные данные аппроксимировали с использованием модели Ленгмюра (1:1) и программного обеспечения для нее BIAevaluation, версии 4.1 (GE). Результаты экспериментов показаны в Таблице 2.

Вывод: антитело h1702 обладает сильной аффинностью к антигенам. В то же время, при тестировании аффинности с использованием Biacore в случае 2Ig-B7H3 человека и 4Ig-B7H3 человека показано, что аффинность ADC аналогична таковой у неконъюгированного антитела.
Пример тестирования 2. Тестирование эндоцитоза in vitro
В этом эксперименте эффект эндоцитоза антитела оценивали на основании интенсивности сигнала флуоресценции от внутриклеточного антитела. Антитело к В7-Н3 и конъюгированное с аллофикоцианином (АРС) антитело к Fc области IgG человека (Biolegend, 409306) смешивали в молярном соотношении 1:2 и инкубировали на льду в течение 15 минут. Смесь этих антител инкубировали с клетками U87MG (астробластомы головного мозга человека, Банк клеток Китайской Академии наук, № по каталогу TCHu138) в количестве 2×105 на льду в течение 30 минут и избыток антител удаляли путем промывки. Клетки переносили в предварительно нагретую до 37°С среду и инкубировали при 37°С в течение 0, 15, 30, 60 и 120 минут, соответственно. Клетки центрифугировали и ресуспендировали в растворе для эпюирования антител (0,05 М глицине; 0,1 М NaCl; pH 2,45). После инкубирования в течение 7 минут при комнатной температуре раствор для элюирования антител удаляли путем промывки и сигнал внутриклеточной флуоресценции измеряли, используя прибор BD Verse (результаты показаны на Фиг. 1). Эти результаты демонстрируют, что h1702 подвергалось эффективному эндоцитозу клетками после связывания с клетками U87MG.
Пример тестирования 3. Оценка периода полувыведения (T1/2) на крысах SD (Sprague Dawley)
4-х SD крыс (приобретенных у Shanghai JieSiJie Laboratory Animal Co., Ltd., половина самцов и половина самок) содержали в соответствии с циклом свет/темнота, скорректированном для соотношения 12/12 часов, при постоянной температуре 24 плюс/минус 3°С, влажности 50-60% и со свободным доступом к корму и воде. В день эксперимента SD крысам вводили инъекцией тестируемый агент антитело к B7H3/ADC, соответственно, в хвостовую вену в дозе 3 мг/кг и с вводимым объемом 5 мл/кг.
Момент времени для отбора крови: в первые сутки введения кровь отбирали из вены глазного дна через 5 мин, 8 ч, 24 ч (на 2-е сутки), на 3-й сутки, на 5-е сутки, на 8-е сутки, на 11-е сутки и на 15-е сутки после введения, каждый раз по 200 мкл (что эквивалентно 100 мкл сыворотки). Отобранные образцы крови оставляли стоять при комнатной температуре в течение получаса до коагуляции и затем центрифугировали при 10000×g при 4°С в течение 10 минут. Супернатант собирали и незамедлительно помещали на -80°С для хранения.
Концентрацию антитела к B7H3 в сыворотке измеряли посредством ELISA и проводили фармакокинетический (ФК) анализ. Результаты показаны в Таблице 3.

Эти результаты показывают, что период полувыведения h1702 по настоящему изобретению у крыс составляет примерно 185 часов (7,7 суток).
Пример тестирования 4. Химическая стабильность антитела к B7H3 После получения антител одной из общих причин, приводящих к проблеме стабильности продукта является химическая модификация, в особенности модификация, обуславливающая высокую степень дезаминирования, окисления или изомеризации некоторых аминокислот в участке CDR. Следует избегать или сокращать число таких модификаций. В 500 мкл PBS (рН 7,4) растворяли 500 мг подлежащего тестированию антитела и помещали в водяную баню на 40°С. Образцы отбирали в 0-е, 10-е и 20-е сутки, соответственно, для экспериментов по ферментативному гидролизу. В разные моменты времени отбирали по 100 мкг образцов и растворяли в 100 мкл 0,2 М раствора His-HCl (буфера на основе гидрохлорида гистидина) и 8 М гуанидина гидрохлорида (Gua-HCl) (рН 6,0; буфер на основе гидрохлорида цитруллина). Добавляли 3 мкл раствора дитиотреита (DTT) в концентрации 0,1 г/мл и помещали в водяную баню при 50°С на 1 час. Образцы дважды подвергали ультра фильтрации с использованием 0,02 М раствора His-HCl (рН 6,0) и добавляли 3 мкл раствора трипсина в концентрации 0,25 мг/мл (Invitrogen; номер по каталогу 25200-072). Смесь подвергали ферментолизу в течение ночи при 37°С в водяной бане. Проводили LC-MS, используя Agilent 6530 Q-TOF, и сайты возможных модификаций анализировали с использованием масс-спекгрометрии (результаты показаны в Таблице 4). Эти результаты показывают, что антитело к B7H3 h1702 по настоящему изобретению не демонстрирует никакого значительного возрастания тенденции к дезамидированию, окислению или гетерогенности, и это указывает на то, что данное антитело характеризуется превосходной физической и химической стабильностью.
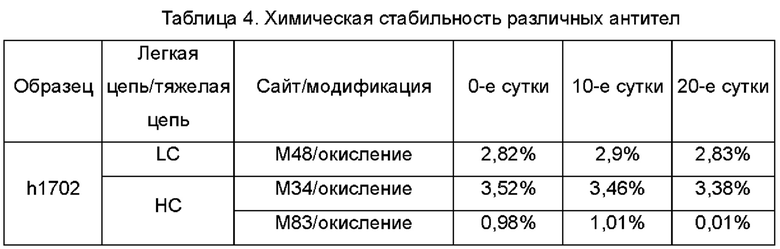
Пример тестирования 5. Стабильность антитела h1702DS
Стабильность h1702 и h1702DS тестировали посредством эксклюзионной хроматографии (SEC), метода тестирования с применением капиллярного электрофореза в присутствии SDS (CE-SDS) в невосстанавливающих условиях (NR) (рН 9,0) и метода тестирования с применением ионообменной (IEX) хроматографии.
Тестирование посредством SEC: использовали хроматограф Waters e2695 и колонку Xbridge ВЕН 200А для SEC. Загружали 50 мкг антитела и элюировали PBS в качестве подвижной фазы в изократическом режиме.
Метод с применением CE-SDS NR
Образцы обрабатывали, используя набор для анализа SDS-MW от Beckman. В буферный раствор добавляли 100 мкг белка и нагревали с целью денатурации. Данные собирали с применением аппарата для капиллярного электрофореза РА800.
Метод с применением IEX
Использовали хроматограф Acquity H-Class от Waters и колонку Thermo MAbPac SCX-10. Загружали 50 мкг антитела и применяли линейный градиент, используя в качестве подвижной фазы набор буферов для создания градиента рН СХ-1. Регистрировали сигнал в ультрафиолетовой области на длине волны 280 нм.
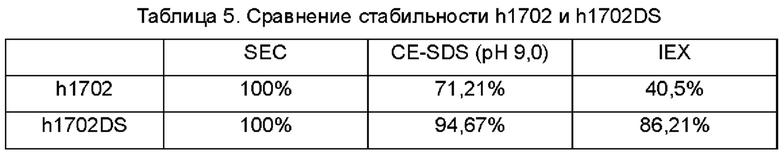
Пример тестирования 6. Тестирование пролиферации клеток in vitro В этом эксперименте ингибирующее влияние B7H3-ADC на пролиферацию клеток оценивали на основании значения IC50 путем детектирования содержания АТФ внутри клеток.
Клетки U87MG (астробластомы головного мозга человека, Банк клеток Китайской Академии наук, № по каталогу TCHu138), клетки Calu-6 (клетки рака легкого, АТСС (Американская коллекция типовых структур), № по каталогу АТСС® НТВ-56™), клетки Detroit562 (клетки фарингеальной карциномы человека, АТСС, № по каталогу АТСС® CCL-138™) и клетки А498 (клетки рака почки, АТСС, № по каталогу АТСС® НТВ-44™) культивировали в среде ЕМЕМ (минимальной поддерживающей среде Игла), содержащей 10% фетальной телячьей сыворотки (FBS), и пересевали 2-3 раза в неделю с соотношением при пересеве 1:3 или 1:6. Приготовление среды ЕМЕМ: среда MEM (минимальная поддерживающая среда) (GE, № по каталогу SH30024.01), раствор не являющихся незаменимыми аминокислот (NEAA) (Sigma, № по каталогу M7145-100ML) и раствор пирувата натрия (Sigma, № по каталогу S8636-100ML).
А-375 (клетки меланомы, АТСС, № по каталогу АТСС® CRL-1619™) культивировали в среде DMEM (модифицированной Дульбекко среде Игла) (GE, SH30243.01), содержащей 10% FBS, и пересевали 2-3 раза в неделю с соотношением при пересеве 1:3 или 1:6.
СНО-K1 (которые не экспрессируют B7H3 человека, АТСС, № по каталогу АТСС® CCL-61™) культивировали в среде F12 (Gibco, 11765-054), содержащей 10% FBS, и пересевали 2-3 раза в неделю с соотношением при пересеве 1:4 или 1:6.
Чтобы провести пересев, среду удаляли и спой клеток промывали 5 мл 0,25%-ного раствора трипсина, затем трипсин удаляли и отщепление клеток выполняли в течение 3-5 минут в инкубаторе. Далее клетки ресуспендировали, добавляя свежую порцию среды. Клетки подсчитывали и плотность клеток в суспензии подводили до соответствующего значения (для клеток U87MG: 500 клеток/лунка; для клеток А-498: 500 клеток/лунка; для клеток А-375: 300 клеток/лунка; для клеток Calu-6: 800 клеток/лунка; для клеток Detroit562: 2000 клеток/лунка; и для клеток СНО-K1: 500 клеток/лунка).
В лунки 96-луночного планшета добавляли по 180 мкл суспензии клеток, а в лунки, расположенные по периметру 96-луночного планшета, добавляли по 200 мкл среды. Планшет инкубировали в течение 24 часов в инкубаторе (37°С, 5% CO2).
Подлежащие тестированию образцы разбавляли PBS или ДМСО в 3-кратном соотношении, получая 9 концентраций (начальная концентрация каждого ADC составляла 500 нМ). Образцы добавляли в планшет, который инкубировали в течение 6 суток в инкубаторе (37°С, 5% CO2). В каждую лунку 96-луночного планшета добавляли по 90 мкл реагента CellTiter-Glo и планшет оставляли стоять в темном месте при комнатной температуре в течение 10 минут. Величину сигнала хемилюминесценции измеряли с использованием устройства Victor3 и данные обрабатывали, применяя программное обеспечение GraphPad. Измеренные значения IC50 показаны в Таблице 6 и на Фиг. 2A-2F.

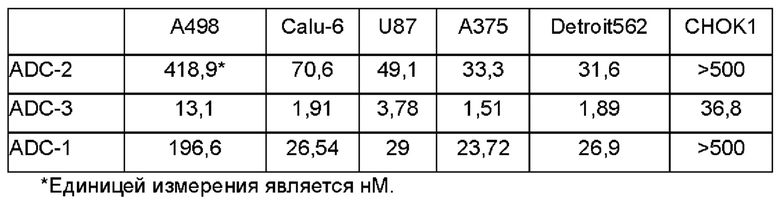
Пример тестирования 7. Оценка эффективности ADC по настоящему изобретению в отношении ксенотрансплантата астробластомы U87MG головного мозга человека у бестимусных мышей
I. Цель тестирования
Чтобы оценить эффективность соединения ADC по настоящему изобретению в отношении ксенотрансплантата астробластомы U87MG головного мозга человека в качестве тестируемых животных использовали бестимусных мышей BALB/c.
II. Тестируемые лекарственные средства и материалы
1. Тестируемые лекарственные средства
ADC-5 (1 мг/кг, 3 мг/кг).
ADC-8 (1 мг/кг, 3 мг/кг).
Холостая проба: буферный раствор на основе PBS (рН 7,4).
2. Метод приготовления: буферный раствор на основе PBS (рН 7,4).
3. Тестируемые животные
Бестимусные мыши BALB/c (беспатогенные (SPF), самки), приобретенные у Shanghai JieSiJie Laboratory Animal Co., Ltd.
III. Метод тестирования
Предназначенным для тестирования бестимусным мышам BALB/c (самкам в возрасте 6-7 недель) подкожно инокулировали клетки астробластомы головного мозга человека U87MG (как определено выше). На 10-е сутки после инокуляции животных случайным образом распределяли по группам из расчета по 8 животных на одну группу (в 0-е сут) и лекарственные средства вводили внутрибрюшинной инъекцией один раз в неделю, в целом 3 раза. Объем опухоли и массу тела измеряли 2-3 раза в неделю и данные регистрировали. Формула для расчета объема опухоли (V) приведена ниже:
V=1/2×a×b2,
где:
а и b представляют собой длину и ширину, соответственно.
Относительный объем опухоли (RTV)=VT/V0.
Степень ингибирования роста опухоли (%) = (CRTV - TRTV)/CRTV (%),
при этом V0 и vt представляют собой объем опухоли в начале тестирования и в конце тестирования, соответственно. CRTV и TRTV представляют собой относительный объем опухоли в контрольной группе (получающей холостую пробу) и тестируемой группе в конце тестирования, соответственно.
IV. Результаты тестирования
Введение путем внутрибрюшинной (в.б.) инъекции выполняли один раз в неделю, в целом 3 раза. На 18-е сутки наблюдения степень ингибирования роста опухоли в случае ADC-8 (1 мг/кг) достигала 39,22% (Р<0,01); степень ингибирования роста опухоли в случае ADC-8 (3 мг/кг) достигала 80,24% (Р<0,0001); степень ингибирования роста опухоли в случае ADC-5 (1 мг/кг) достигала 27,53% (Р<0,05); и степень ингибирования роста опухоли в случае ADC-5 (3 мг/кг) достигала 55,88% (Р<0,0001). На 22-е сутки (22-е сут) наблюдения степень ингибирования роста опухоли в каждой получающей лекарственное средство группе дополнительно улучшалась, при этом степень ингибирования роста опухоли в случае ADC-8 (1 мг/кг) достигала 47,7% (Р<0,0001); степень ингибирования роста опухоли в случае ADC-8 (3 мг/кг) достигала 89,8% (Р<0,0001); степень ингибирования роста опухоли в случае ADC-5 (1 мг/кг) достигала 40,6% (Р<0,0001); и степень ингибирования роста опухоли в случае ADC-5 (3 мг/кг) достигала 63,3% (Р<0,0001).
В ходе введения масса тела животных в каждой группе была обычной, и это позволяет предположить, что данный ADC не оказывает никаких явных побочных эффектов. Результаты тестирования показаны в Таблице 7 и на Фиг. 3. Протестированные антитела могут эффективно ингибировать рост ксенотрансплантата опухоли U87MG у опухоленесущих бестимусных мышей дозозависимым образом.
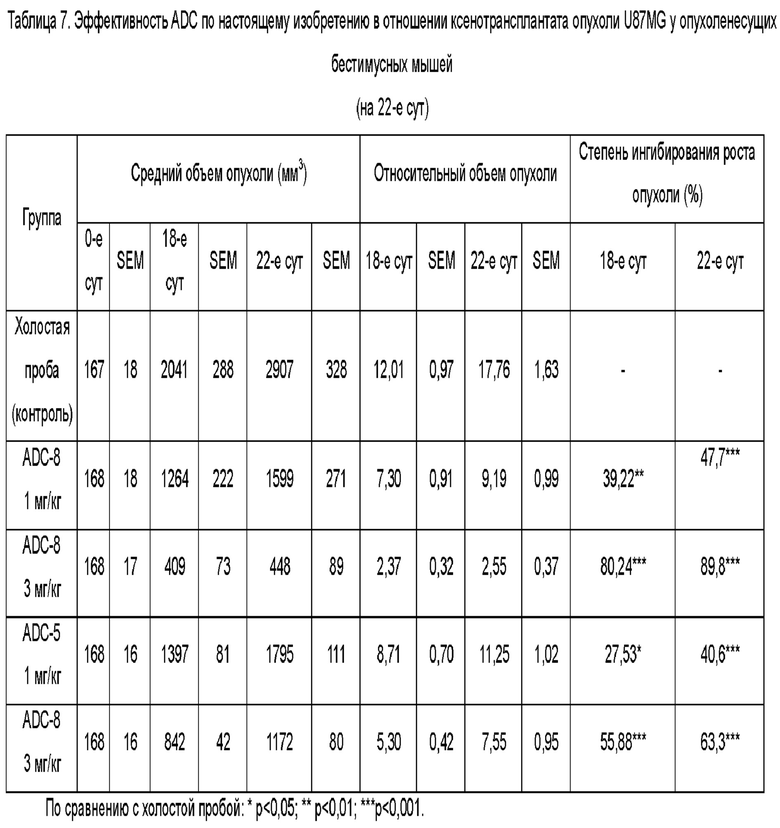
Пример тестирования 8. Оценка эффективности ADC по настоящему изобретению в отношении ксенотрансплантата метастазирующих в плевральную жидкость клеток фарингеальной карциномы человека Detroit 562 у бестимусных мышей
I. Цель тестирования
Чтобы оценить эффективность соединения ADC по настоящему изобретению в отношении ксенотрансплантата метастазирующих в плевральную жидкость клеток фарингеальной карциномы человека Detroit 562 в качестве тестируемых животных использовали бестимусных мышей BALB/c.
II. Тестируемые лекарственные средства и материалы
1. Тестируемые лекарственные средства
ADC-1 (1 мг/кг, 3 мг/кг).
ADC-2 (1 мг/кг, 3 мг/кг).
Отрицательный контроль для ADC (3 мг/кг): конъюгат лиганд-токсин, образованный в результате сочетания не являющейся B7H3 мишени с референсным соединением (из примера 58 в патентной заявке "CN104755494A").
2. Метод приготовления: при разбавлении и приготовлении растворов всех лекарственных средств использовали PBS.
3. Тестируемые животные
Бестимусные мыши BALB/c, приобретенные у Changzhou Cavens Laboratory Animal Co., Ltd.
III. Метод тестирования
Предназначенным для тестирования бестимусным мышам BALB/c (самкам в возрасте 6-7 недель) подкожно инокулировали метастазирующие в плевральную жидкость клетки фарингеальной карциномы человека Detroit 562. На 10-е сутки после инокуляции животных случайным образом распределяли по группам из расчета по 8 животных на одну группу (в 0-е сут) и лекарственные средства вводили внутрибрюшинной инъекцией один раз в неделю, в целом 3 раза. Объем опухоли и массу тела измеряли 2-3 раза в неделю и данные регистрировали. Формула для расчета объема опухоли (V) приведена ниже:
V=1/2×a×b2,
где:
а и b представляют собой длину и ширину, соответственно.
Относительный объем опухоли (RTV)=VT/V0.
Степень ингибирования роста опухоли (%) = (CRTV - TRTV)/CRTV (%),
где V0 и vt представляют собой объем опухоли в начале тестирования и в конце тестирования, соответственно. CRTV и TRTV представляют собой относительный объем опухоли в контрольной группе (получавшей холостую пробу) и тестируемой группе в конце тестирования, соответственно.
IV. Результаты тестирования
Введение путем внутрибрюшинной инъекции выполняли один раз в неделю, в целом 3 раза. На 28-е сутки наблюдения степень ингибирования роста опухоли в случае ADC-1 (1 мг/кг) достигала 40,85%; степень ингибирования роста опухоли в случае ADC-1 (3 мг/кг) достигала 62,55% (Р<0,05); степень ингибирования роста опухоли в случае ADC-2 (1 мг/кг) достигала 44,26%; и степень ингибирования роста опухоли в случае ADC-2 (3 мг/кг) достигала 72,27% (Р<0,01).
В ходе введения масса тела животных в каждой группе была обычной, и это позволяет предположить, что данный ADC не оказывает никаких явных побочных эффектов. Результаты тестирования показаны в Таблице 8 и на Фиг. 4. Протестированные антитела могут эффективно ингибировать рост ксенотрансплантата опухоли Detroit 562 у опухоленесущих бестимусных мышей дозозависимым образом.
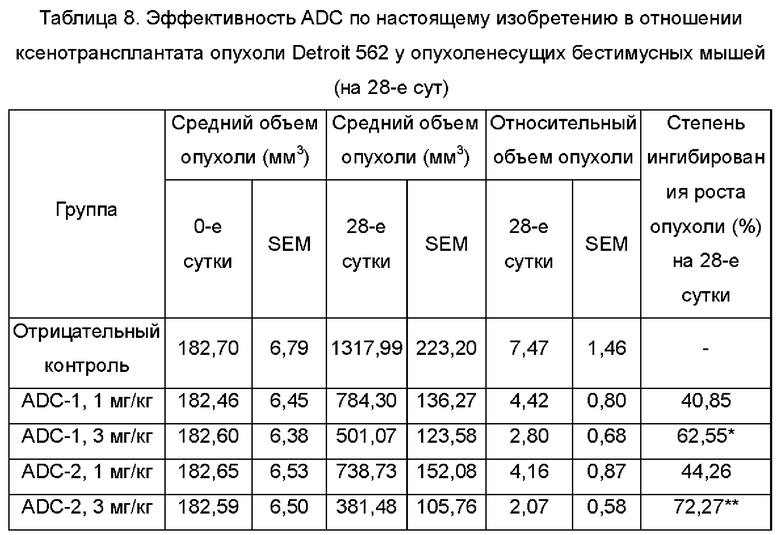
Пример тестирования 9. Пролиферация клеток in vitro в случае ADC с различными нагрузками лекарственным средством
Эффективность соединений ADC формулы FADC-2, ADC-4 (n=6,87), ADC-6 (n=2,97) и ADC-7 (n=4,8), определяли при тестировании пролиферации клеток in vitro в соответствии с экспериментальными методиками, аналогичными методикам из примера тестирования 6.
Измеренное значение IC50 и степень максимального ингибирования показаны в Таблице 9 и на Фиг. 5А, 5В и 5С. FADC-2 с различными значениями DAR демонстрируют эффект ингибирования пролиферации клеток, и этот эффект ингибирования положительно коррелирует со значением DAR, в то время как неконъюгированное антитело не демонстрирует никакого эффекта ингибирования пролиферации клеток.
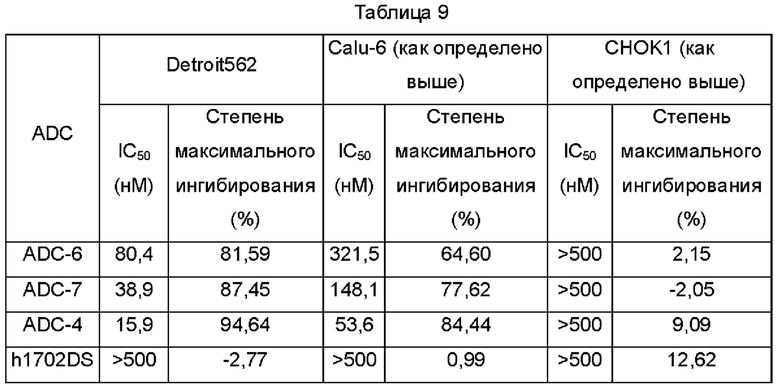
Пример тестирования 10. Стабильность в плазме крови
Образец ADC-4 тщательно смешивали с плазмой крови человека, плазмой крови обезьяны (Shanghai Medicilon Inc.) и 1%-ным раствором BSA (Sigma) в PBS (Sangon Biotech (Shanghai) Co., Ltd.), соответственно, в конечной концентрации 100 мкг/мл и фильтровали для стерилизации. Смесь инкубировали в водяной бане при 37°С и начальные сутки инкубирования обозначали как 0-е сутки. Образцы собирали на 7-е сутки, 14-е сутки и 21-е сутки для обнаружения свободного токсина.
Образцы, отобранные в разные моменты времени, охлаждали до комнатной температуры и хорошо перемешивали вихревым способом. В лунки 96-луночного планшета добавляли по 25 мкл образца. Добавляли 50 мкл рабочего раствора внутреннего стандарта (камптотецина в ацетонитриле в концентрации 100 нг/мл) и 150 мкл ацетонитрила. Раствор перемешивали вихревым способом в течение 5 минут и центрифугировали в течение 10 минут (4000 об./мин). Для анализа с применением жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (LC/MS/MS) (Applied Biosystems, Inc., USA) отбирали по 5 мкл раствора.
Результаты показаны на Фиг. 6. ADC-4 совершенно стабилен в плазме крови человека, плазме крови обезьяны и 1%-ном растворе BSA в PBS. Степень высвобождения свободного токсина не превышает 2% и не изменяется, начиная с 14-х суток.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЬ
<110> JIANGSU HENGRUI MEDICINE CO., LTD
SHANGHAI HENGRUI PHARMACEUTICAL CO., LTD.
<120> КОНЪЮГАТ АНТИТЕЛО К B7H3-АНАЛОГ ЭКЗАТЕКАНА И ЕГО ПРИМЕНЕНИЕ В
МЕДИЦИНЕ
<160> 16
<170> SIPOSequenceListing 1.0
<210> 1
<211> 534
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<223> Полноразмерная аминокислотная последоательность B7H3 человека
<400> 1
Met Leu Arg Arg Arg Gly Ser Pro Gly Met Gly Val His Val Gly Ala
1 5 10 15
Ala Leu Gly Ala Leu Trp Phe Cys Leu Thr Gly Ala Leu Glu Val Gln
20 25 30
Val Pro Glu Asp Pro Val Val Ala Leu Val Gly Thr Asp Ala Thr Leu
35 40 45
Cys Cys Ser Phe Ser Pro Glu Pro Gly Phe Ser Leu Ala Gln Leu Asn
50 55 60
Leu Ile Trp Gln Leu Thr Asp Thr Lys Gln Leu Val His Ser Phe Ala
65 70 75 80
Glu Gly Gln Asp Gln Gly Ser Ala Tyr Ala Asn Arg Thr Ala Leu Phe
85 90 95
Pro Asp Leu Leu Ala Gln Gly Asn Ala Ser Leu Arg Leu Gln Arg Val
100 105 110
Arg Val Ala Asp Glu Gly Ser Phe Thr Cys Phe Val Ser Ile Arg Asp
115 120 125
Phe Gly Ser Ala Ala Val Ser Leu Gln Val Ala Ala Pro Tyr Ser Lys
130 135 140
Pro Ser Met Thr Leu Glu Pro Asn Lys Asp Leu Arg Pro Gly Asp Thr
145 150 155 160
Val Thr Ile Thr Cys Ser Ser Tyr Gln Gly Tyr Pro Glu Ala Glu Val
165 170 175
Phe Trp Gln Asp Gly Gln Gly Val Pro Leu Thr Gly Asn Val Thr Thr
180 185 190
Ser Gln Met Ala Asn Glu Gln Gly Leu Phe Asp Val His Ser Ile Leu
195 200 205
Arg Val Val Leu Gly Ala Asn Gly Thr Tyr Ser Cys Leu Val Arg Asn
210 215 220
Pro Val Leu Gln Gln Asp Ala His Ser Ser Val Thr Ile Thr Pro Gln
225 230 235 240
Arg Ser Pro Thr Gly Ala Val Glu Val Gln Val Pro Glu Asp Pro Val
245 250 255
Val Ala Leu Val Gly Thr Asp Ala Thr Leu Arg Cys Ser Phe Ser Pro
260 265 270
Glu Pro Gly Phe Ser Leu Ala Gln Leu Asn Leu Ile Trp Gln Leu Thr
275 280 285
Asp Thr Lys Gln Leu Val His Ser Phe Thr Glu Gly Arg Asp Gln Gly
290 295 300
Ser Ala Tyr Ala Asn Arg Thr Ala Leu Phe Pro Asp Leu Leu Ala Gln
305 310 315 320
Gly Asn Ala Ser Leu Arg Leu Gln Arg Val Arg Val Ala Asp Glu Gly
325 330 335
Ser Phe Thr Cys Phe Val Ser Ile Arg Asp Phe Gly Ser Ala Ala Val
340 345 350
Ser Leu Gln Val Ala Ala Pro Tyr Ser Lys Pro Ser Met Thr Leu Glu
355 360 365
Pro Asn Lys Asp Leu Arg Pro Gly Asp Thr Val Thr Ile Thr Cys Ser
370 375 380
Ser Tyr Arg Gly Tyr Pro Glu Ala Glu Val Phe Trp Gln Asp Gly Gln
385 390 395 400
Gly Val Pro Leu Thr Gly Asn Val Thr Thr Ser Gln Met Ala Asn Glu
405 410 415
Gln Gly Leu Phe Asp Val His Ser Val Leu Arg Val Val Leu Gly Ala
420 425 430
Asn Gly Thr Tyr Ser Cys Leu Val Arg Asn Pro Val Leu Gln Gln Asp
435 440 445
Ala His Gly Ser Val Thr Ile Thr Gly Gln Pro Met Thr Phe Pro Pro
450 455 460
Glu Ala Leu Trp Val Thr Val Gly Leu Ser Val Cys Leu Ile Ala Leu
465 470 475 480
Leu Val Ala Leu Ala Phe Val Cys Trp Arg Lys Ile Lys Gln Ser Cys
485 490 495
Glu Glu Glu Asn Ala Gly Ala Glu Asp Gln Asp Gly Glu Gly Glu Gly
500 505 510
Ser Lys Thr Ala Leu Gln Pro Leu Lys His Ser Asp Ser Lys Glu Asp
515 520 525
Asp Gly Gln Glu Ile Ala
530
<210> 2
<211> 316
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<223> Полноразмерная аминокислотная последовательность B7H3 мыши
<400> 2
Met Leu Arg Gly Trp Gly Gly Pro Ser Val Gly Val Cys Val Arg Thr
1 5 10 15
Ala Leu Gly Val Leu Cys Leu Cys Leu Thr Gly Ala Val Glu Val Gln
20 25 30
Val Ser Glu Asp Pro Val Val Ala Leu Val Asp Thr Asp Ala Thr Leu
35 40 45
Arg Cys Ser Phe Ser Pro Glu Pro Gly Phe Ser Leu Ala Gln Leu Asn
50 55 60
Leu Ile Trp Gln Leu Thr Asp Thr Lys Gln Leu Val His Ser Phe Thr
65 70 75 80
Glu Gly Arg Asp Gln Gly Ser Ala Tyr Ser Asn Arg Thr Ala Leu Phe
85 90 95
Pro Asp Leu Leu Val Gln Gly Asn Ala Ser Leu Arg Leu Gln Arg Val
100 105 110
Arg Val Thr Asp Glu Gly Ser Tyr Thr Cys Phe Val Ser Ile Gln Asp
115 120 125
Phe Asp Ser Ala Ala Val Ser Leu Gln Val Ala Ala Pro Tyr Ser Lys
130 135 140
Pro Ser Met Thr Leu Glu Pro Asn Lys Asp Leu Arg Pro Gly Asn Met
145 150 155 160
Val Thr Ile Thr Cys Ser Ser Tyr Gln Gly Tyr Pro Glu Ala Glu Val
165 170 175
Phe Trp Lys Asp Gly Gln Gly Val Pro Leu Thr Gly Asn Val Thr Thr
180 185 190
Ser Gln Met Ala Asn Glu Arg Gly Leu Phe Asp Val His Ser Val Leu
195 200 205
Arg Val Val Leu Gly Ala Asn Gly Thr Tyr Ser Cys Leu Val Arg Asn
210 215 220
Pro Val Leu Gln Gln Asp Ala His Gly Ser Val Thr Ile Thr Gly Gln
225 230 235 240
Pro Leu Thr Phe Pro Pro Glu Ala Leu Trp Val Thr Val Gly Leu Ser
245 250 255
Val Cys Leu Val Val Leu Leu Val Ala Leu Ala Phe Val Cys Trp Arg
260 265 270
Lys Ile Lys Gln Ser Cys Glu Glu Glu Asn Ala Gly Ala Glu Asp Gln
275 280 285
Asp Gly Asp Gly Glu Gly Ser Lys Thr Ala Leu Arg Pro Leu Lys Pro
290 295 300
Ser Glu Asn Lys Glu Asp Asp Gly Gln Glu Ile Ala
305 310 315
<210> 3
<211> 223
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<223> 2Ig-B7H3
<400> 3
Leu Glu Val Gln Val Pro Glu Asp Pro Val Val Ala Leu Val Gly Thr
1 5 10 15
Asp Ala Thr Leu Cys Cys Ser Phe Ser Pro Glu Pro Gly Phe Ser Leu
20 25 30
Ala Gln Leu Asn Leu Ile Trp Gln Leu Thr Asp Thr Lys Gln Leu Val
35 40 45
His Ser Phe Ala Glu Gly Gln Asp Gln Gly Ser Ala Tyr Ala Asn Arg
50 55 60
Thr Ala Leu Phe Pro Asp Leu Leu Ala Gln Gly Asn Ala Ser Leu Arg
65 70 75 80
Leu Gln Arg Val Arg Val Ala Asp Glu Gly Ser Phe Thr Cys Phe Val
85 90 95
Ser Ile Arg Asp Phe Gly Ser Ala Ala Val Ser Leu Gln Val Ala Ala
100 105 110
Pro Tyr Ser Lys Pro Ser Met Thr Leu Glu Pro Asn Lys Asp Leu Arg
115 120 125
Pro Gly Asp Thr Val Thr Ile Thr Cys Ser Ser Tyr Gln Gly Tyr Pro
130 135 140
Glu Ala Glu Val Phe Trp Gln Asp Gly Gln Gly Val Pro Leu Thr Gly
145 150 155 160
Asn Val Thr Thr Ser Gln Met Ala Asn Glu Gln Gly Leu Phe Asp Val
165 170 175
His Ser Ile Leu Arg Val Val Leu Gly Ala Asn Gly Thr Tyr Ser Cys
180 185 190
Leu Val Arg Asn Pro Val Leu Gln Gln Asp Ala His Ser Ser Val Thr
195 200 205
Ile Thr Pro Gln Arg Ser Pro Thr Gly His His His His His His
210 215 220
<210> 4
<211> 439
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<223> 4Ig-B7H3
<400> 4
Leu Glu Val Gln Val Pro Glu Asp Pro Val Val Ala Leu Val Gly Thr
1 5 10 15
Asp Ala Thr Leu Cys Cys Ser Phe Ser Pro Glu Pro Gly Phe Ser Leu
20 25 30
Ala Gln Leu Asn Leu Ile Trp Gln Leu Thr Asp Thr Lys Gln Leu Val
35 40 45
His Ser Phe Ala Glu Gly Gln Asp Gln Gly Ser Ala Tyr Ala Asn Arg
50 55 60
Thr Ala Leu Phe Pro Asp Leu Leu Ala Gln Gly Asn Ala Ser Leu Arg
65 70 75 80
Leu Gln Arg Val Arg Val Ala Asp Glu Gly Ser Phe Thr Cys Phe Val
85 90 95
Ser Ile Arg Asp Phe Gly Ser Ala Ala Val Ser Leu Gln Val Ala Ala
100 105 110
Pro Tyr Ser Lys Pro Ser Met Thr Leu Glu Pro Asn Lys Asp Leu Arg
115 120 125
Pro Gly Asp Thr Val Thr Ile Thr Cys Ser Ser Tyr Gln Gly Tyr Pro
130 135 140
Glu Ala Glu Val Phe Trp Gln Asp Gly Gln Gly Val Pro Leu Thr Gly
145 150 155 160
Asn Val Thr Thr Ser Gln Met Ala Asn Glu Gln Gly Leu Phe Asp Val
165 170 175
His Ser Ile Leu Arg Val Val Leu Gly Ala Asn Gly Thr Tyr Ser Cys
180 185 190
Leu Val Arg Asn Pro Val Leu Gln Gln Asp Ala His Ser Ser Val Thr
195 200 205
Ile Thr Pro Gln Arg Ser Pro Thr Gly Ala Val Glu Val Gln Val Pro
210 215 220
Glu Asp Pro Val Val Ala Leu Val Gly Thr Asp Ala Thr Leu Arg Cys
225 230 235 240
Ser Phe Ser Pro Glu Pro Gly Phe Ser Leu Ala Gln Leu Asn Leu Ile
245 250 255
Trp Gln Leu Thr Asp Thr Lys Gln Leu Val His Ser Phe Thr Glu Gly
260 265 270
Arg Asp Gln Gly Ser Ala Tyr Ala Asn Arg Thr Ala Leu Phe Pro Asp
275 280 285
Leu Leu Ala Gln Gly Asn Ala Ser Leu Arg Leu Gln Arg Val Arg Val
290 295 300
Ala Asp Glu Gly Ser Phe Thr Cys Phe Val Ser Ile Arg Asp Phe Gly
305 310 315 320
Ser Ala Ala Val Ser Leu Gln Val Ala Ala Pro Tyr Ser Lys Pro Ser
325 330 335
Met Thr Leu Glu Pro Asn Lys Asp Leu Arg Pro Gly Asp Thr Val Thr
340 345 350
Ile Thr Cys Ser Ser Tyr Arg Gly Tyr Pro Glu Ala Glu Val Phe Trp
355 360 365
Gln Asp Gly Gln Gly Val Pro Leu Thr Gly Asn Val Thr Thr Ser Gln
370 375 380
Met Ala Asn Glu Gln Gly Leu Phe Asp Val His Ser Val Leu Arg Val
385 390 395 400
Val Leu Gly Ala Asn Gly Thr Tyr Ser Cys Leu Val Arg Asn Pro Val
405 410 415
Leu Gln Gln Asp Ala His Gly Ser Val Thr Ile Thr Gly Gln Pro Met
420 425 430
Thr His His His His His His
435
<210> 5
<211> 222
<212> Белок
<213> Искусственная последовательность
<220>
<221> Пептид
<223> Антиген B7H3 мыши для скрининга и детекции
<400> 5
Val Glu Val Gln Val Ser Glu Asp Pro Val Val Ala Leu Val Asp Thr
1 5 10 15
Asp Ala Thr Leu Arg Cys Ser Phe Ser Pro Glu Pro Gly Phe Ser Leu
20 25 30
Ala Gln Leu Asn Leu Ile Trp Gln Leu Thr Asp Thr Lys Gln Leu Val
35 40 45
His Ser Phe Thr Glu Gly Arg Asp Gln Gly Ser Ala Tyr Ser Asn Arg
50 55 60
Thr Ala Leu Phe Pro Asp Leu Leu Val Gln Gly Asn Ala Ser Leu Arg
65 70 75 80
Leu Gln Arg Val Arg Val Thr Asp Glu Gly Ser Tyr Thr Cys Phe Val
85 90 95
Ser Ile Gln Asp Phe Asp Ser Ala Ala Val Ser Leu Gln Val Ala Ala
100 105 110
Pro Tyr Ser Lys Pro Ser Met Thr Leu Glu Pro Asn Lys Asp Leu Arg
115 120 125
Pro Gly Asn Met Val Thr Ile Thr Cys Ser Ser Tyr Gln Gly Tyr Pro
130 135 140
Glu Ala Glu Val Phe Trp Lys Asp Gly Gln Gly Val Pro Leu Thr Gly
145 150 155 160
Asn Val Thr Thr Ser Gln Met Ala Asn Glu Arg Gly Leu Phe Asp Val
165 170 175
His Ser Val Leu Arg Val Val Leu Gly Ala Asn Gly Thr Tyr Ser Cys
180 185 190
Leu Val Arg Asn Pro Val Leu Gln Gln Asp Ala His Gly Ser Val Thr
195 200 205
Ile Thr Gly Gln Pro Leu Thr Phe His His His His His His
210 215 220
<210> 6
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> Последовательность вариабельной области тяжелой цепи 1702
<400> 6
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Thr
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Ser
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ala Arg Leu Tyr Ala Ser Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ala Leu Val Thr Val Ser Ser
115
<210> 7
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> Последовательность вариабельной области легкой цепи 1702
<400> 7
Gln Thr Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Leu Ser Ser Gly Ser Val Ser Thr Ser
20 25 30
His Tyr Pro Ser Trp Tyr Gln Gln Thr Pro Gly Gln Ala Pro Arg Met
35 40 45
Leu Ile Tyr Asn Thr Asn Thr Arg Ser Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Ile Leu Gly Asn Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Asp Tyr Tyr Cys Ala Ile His Val Asp Arg
85 90 95
Asp Ile Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 8
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> HCDR1 1702
<400> 8
Gly Phe Ile Phe Ser Ser Ser Ala
1 5
<210> 9
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> HCDR2 1702
<400> 9
Ile Ser Tyr Asp Gly Ser Asn Lys
1 5
<210> 10
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> HCDR3 1702
<400> 10
Ala Arg Ser Ala Arg Leu Tyr Ala Ser Phe Asp Tyr
1 5 10
<210> 11
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> LCDR1 1702
<400> 11
Ser Gly Ser Val Ser Thr Ser His Tyr
1 5
<210> 12
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> LCDR2 1702
<400> 12
Asn Thr Asn
1
<210> 13
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> Домен
<223> LCDR3 1702
<400> 13
Ala Ile His Val Asp Arg Asp Ile Trp Val
1 5 10
<210> 14
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<221> Цепь
<223> Аминокислотная последовательность тяжелой цепи антитела 1702 (lgG1)
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Thr
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Ser
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ala Arg Leu Tyr Ala Ser Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ala Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 15
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<221> Цепь
<223> Последовательность легкой цепи антитела 1702
<400> 15
Gln Thr Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Leu Ser Ser Gly Ser Val Ser Thr Ser
20 25 30
His Tyr Pro Ser Trp Tyr Gln Gln Thr Pro Gly Gln Ala Pro Arg Met
35 40 45
Leu Ile Tyr Asn Thr Asn Thr Arg Ser Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Ile Leu Gly Asn Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Asp Tyr Tyr Cys Ala Ile His Val Asp Arg
85 90 95
Asp Ile Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys Ser
210 215
<210> 16
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<221> Цепь
<223> Последовательность легкой цепи антитела 1702DS после модификации
посредством мутации
<400> 16
Asp Thr Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Leu Ser Ser Gly Ser Val Ser Thr Ser
20 25 30
His Tyr Pro Ser Trp Tyr Gln Gln Thr Pro Gly Gln Ala Pro Arg Met
35 40 45
Leu Ile Tyr Asn Thr Asn Thr Arg Ser Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Ile Leu Gly Asn Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Asp Tyr Tyr Cys Ala Ile His Val Asp Arg
85 90 95
Asp Ile Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
115 120 125
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
130 135 140
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys
145 150 155 160
Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr
165 170 175
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
180 185 190
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
195 200 205
Thr Val Ala Pro Thr Glu Cys
210 215
<---
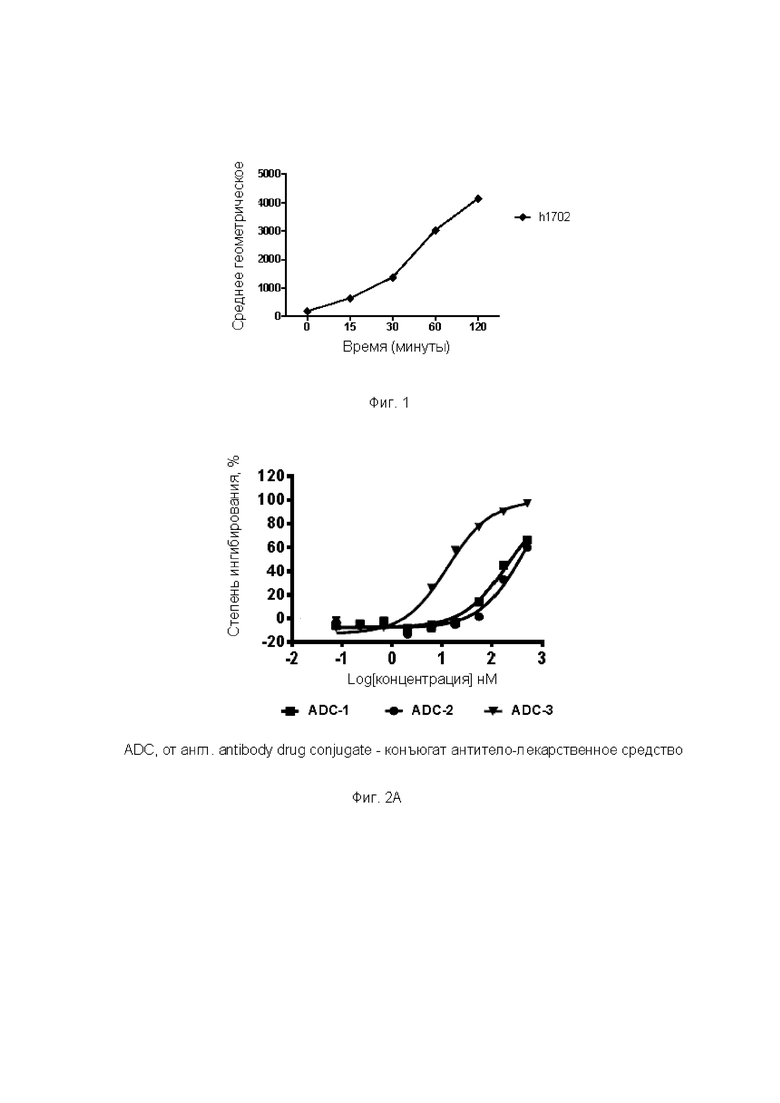
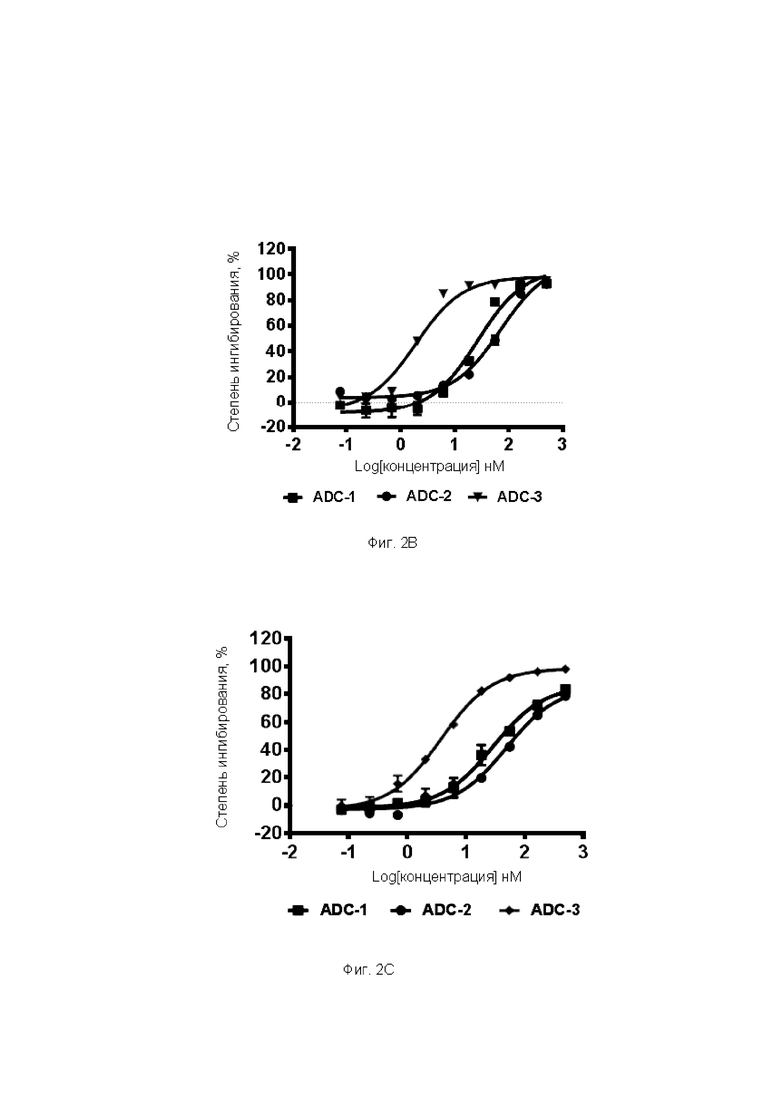
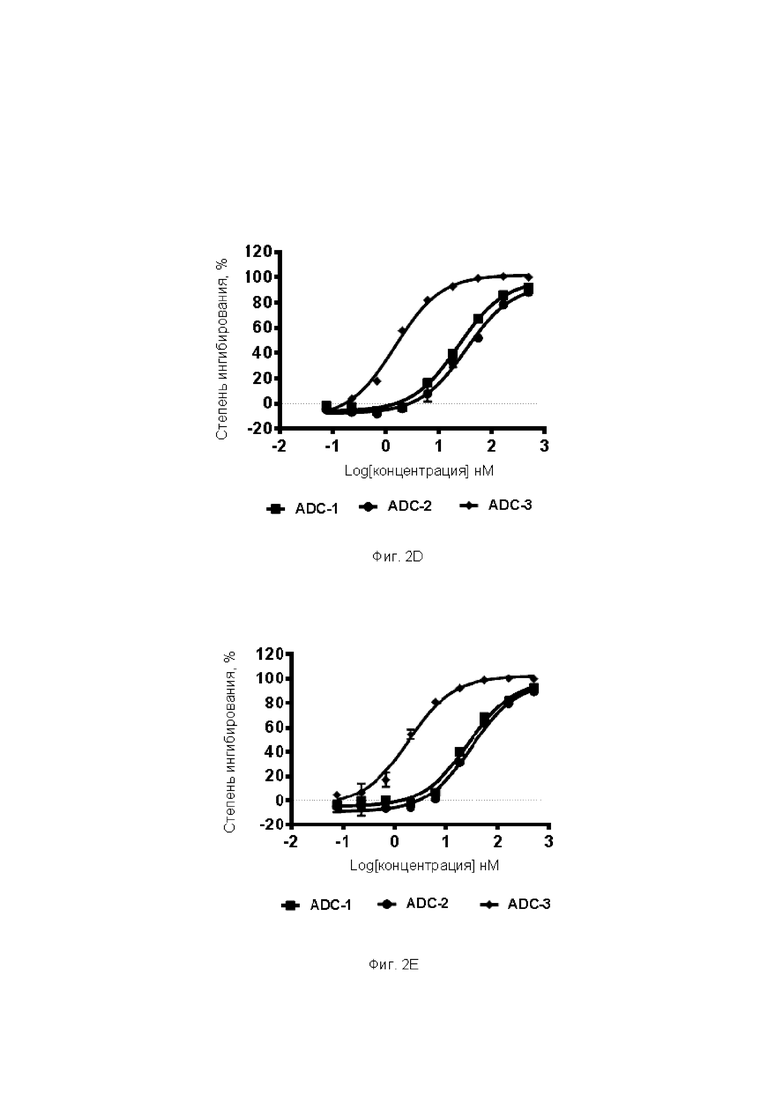
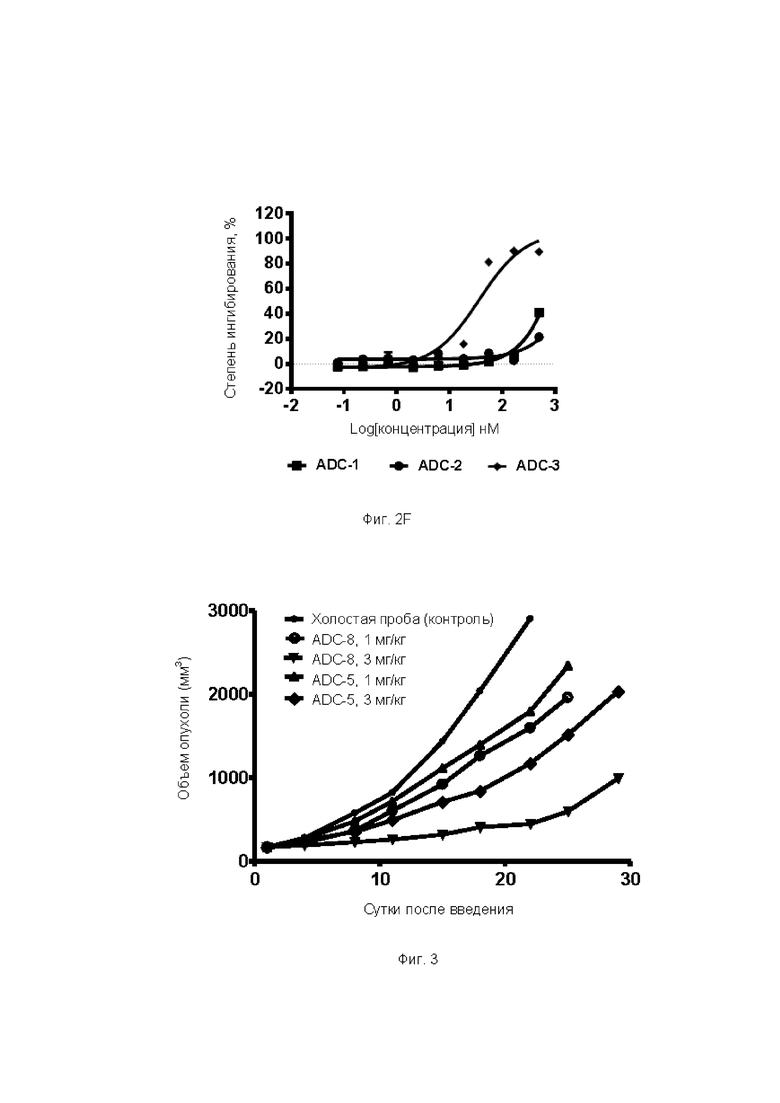
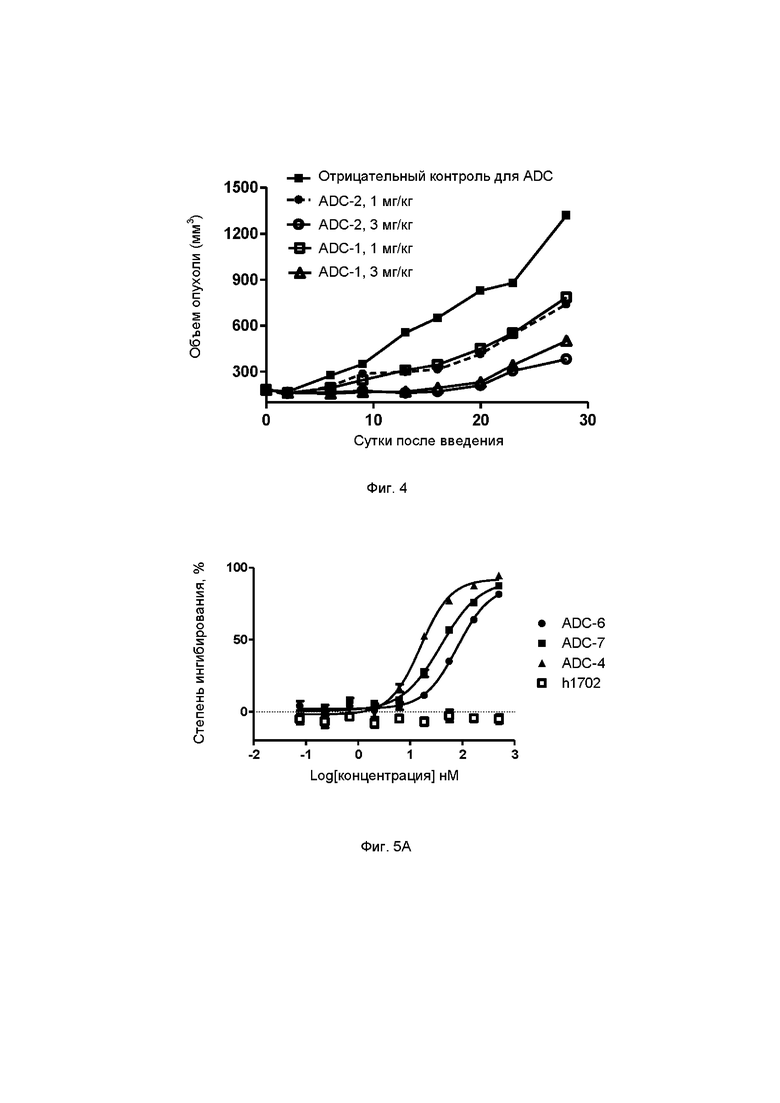
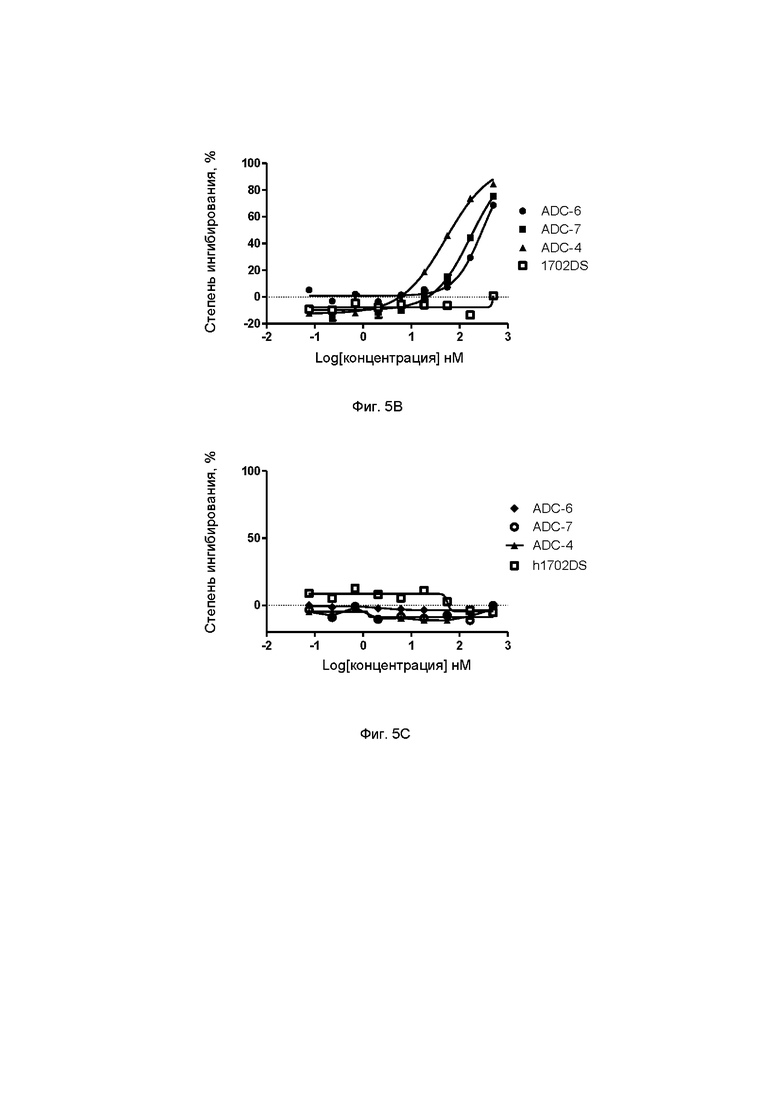
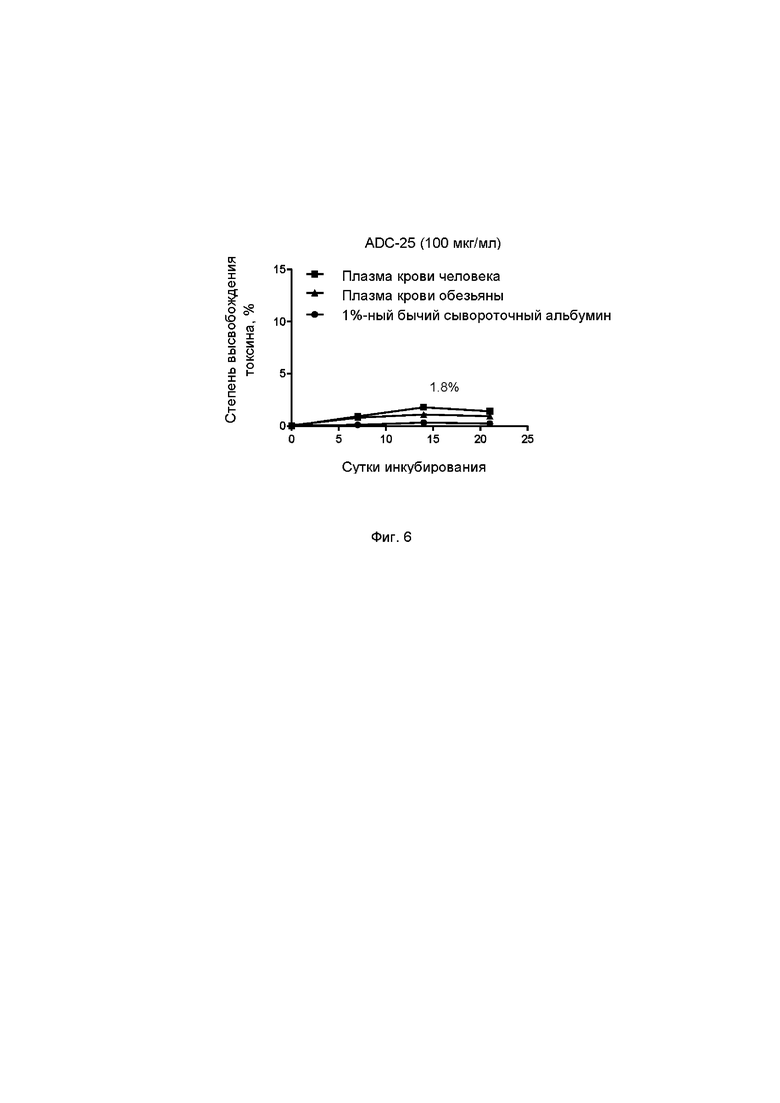
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая конъюгат лиганд-лекарственное средство против В7Н3 или его фармацевтически приемлемую соль, фармацевтическую композицию для лечения заболеваний или расстройств, опосредованных В7Н3, применение вышеуказанного конъюгата лиганд-лекарственное средство или его фармацевтически приемлемой соли или фармацевтической композиции в приготовлении лекарственных средств для лечения В7Н3-опосредуемых заболеваний или расстройств и применение вышеуказанного конъюгата лиганд-лекарственное средство или его фармацевтически приемлемой соли или фармацевтической композиции в приготовлении лекарственных средств для лечения и/или предупреждения рака, опосредованного В7Н3. Изобретение расширяет арсенал средств против В7Н3. 4 н. и 13 з.п. ф-лы, 13 ил., 9 табл., 24 пр.
1. Конъюгат против В7Н3, представляющий собой конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль:
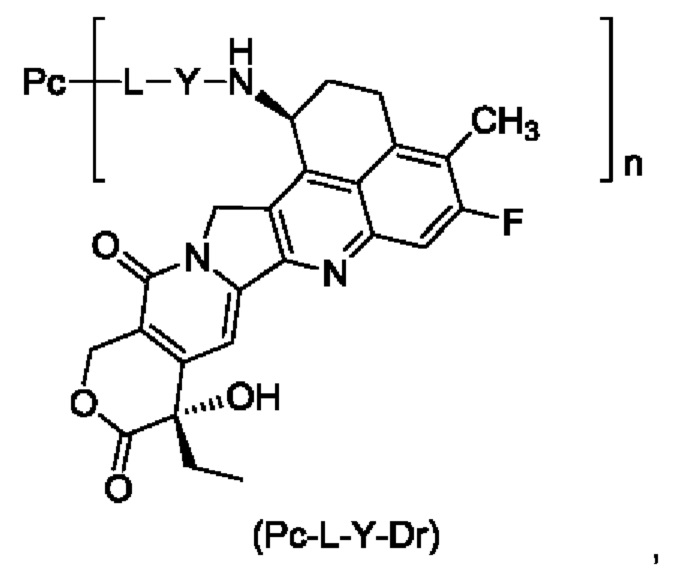
где:
Y представляет собой -O-(CRaRb)m-CR1R2-C(O)-;
Ra и Rb являются одинаковыми или разными и каждый независимо выбран из группы, состоящей из атома водорода, атома дейтерия, галогена, С1-6алкила;
R1 выбран из группы, состоящей из галогена, С1-6галогеналкила, дейтерированного С1-6алкила, С3-6циклоалкила;
R2 выбран из группы, состоящей из атома водорода, C1-6галогеналкила, С3-6циклоалкила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкил;
m представляет собой 0 или 4;
n равно 1-10, что означает десятичную дробь или целое число;
L представляет собой линкерное звено -L1-L2-L3-L4-;
L1 представляет собой 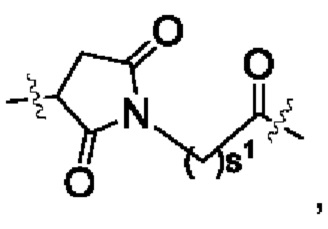 и s1 является целым числом от 2 до 8;
и s1 является целым числом от 2 до 8;
L2 представляет собой химическую связь;
L3 представляет собой тетрапептидный остаток;
L4 представляет собой -NR5(CR6R7)t-, R5, R6 и R7 являются одинаковыми или разными, и каждый независимо выбран из группы, состоящей из атома водорода и С1-6алкила, и t равно 1 или 2;
Рс представляет собой антитело к В7Н3 или его антигенсвязывающий фрагмент, которые содержат:
определяющий комплементарность участок 1 тяжелой цепи (HCDR1), HCDR2 и HCDR3, представленные аминокислотными последовательностями SEQ ID NO: 8, 9 и 10 соответственно; и
CDR1 легкой цепи (LCDR1), LCDR2 и LCDR3, представленные аминокислотными последовательностями SEQ ID NO: 11, 12 и 13 соответственно.
2. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по п. 1, где каркасная область (FR) легкой цепи в вариабельной области легкой цепи антитела к В7Н3 или его антигенсвязывающего фрагмента происходит из последовательности легкой цепи иммуноглобулина зародышевой линии человека или ее мутантной последовательности и/или FR область тяжелой цепи в вариабельной области тяжелой цепи происходит из последовательности тяжелой цепи иммуноглобулина зародышевой линии человека или ее мутантной последовательности.
3. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по п. 1 или 2, где антитело к В7Н3 или его антигенсвязывающий фрагмент содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи:
при этом аминокислотная последовательность вариабельной области тяжелой цепи представлена в SEQ ID NO: 6 или имеет по меньшей мере 95% идентичности последовательности с SEQ ID NO: 6, аминокислотная последовательность вариабельной области легкой цепи представлена в SEQ ID NO: 7 или имеет по меньшей мере 95% идентичности последовательности с SEQ ID NO: 7.
4. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-3, где антитело к В7Н3 или его антигенсвязывающий фрагмент содержит константную область антитела; при этом константная область тяжелой цепи константной области антитела происходит из IgG1, IgG2, IgG3 или IgG4 человека или имеет по меньшей мере 95% идентичности последовательности с ними, константная область легкой цепи константной области антитела происходит из κ, λ цепей человеческого антитела или имеет по меньшей мере 95% идентичности последовательности с ними; и предпочтительно аминокислотная последовательность константной области тяжелой цепи происходит из IgG1 человека или имеет по меньшей мере 95% идентичности последовательности с ним.
5. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-4, где Рс представляет собой полноразмерное антитело, при этом полноразмерное антитело выбрано из группы, состоящей из:
антитела, состоящего из последовательности тяжелой цепи, представленной в SEQ ID NO: 14, и последовательности легкой цепи, представленной в SEQ ID NO: 15, и
антитела, состоящего из последовательности тяжелой цепи, представленной в SEQ ID NO: 14, и последовательности легкой цепи, представленной в SEQ ID NO: 16.
6. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-5, где антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, Fab', F(ab')2, одноцепочечных антител (scFv), димеризованных форм вариабельных (V) областей (двойного антитела), стабилизированных дисульфидными связями V областей (dsFv) и антигенсвязывающих фрагментов пептидов, содержащих CDR.
7. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-6, где n равно 2-8, предпочтительно 5-9, и n представляет собой десятичную дробь или целое число.
8. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-7, где Y выбран из группы, состоящей из:
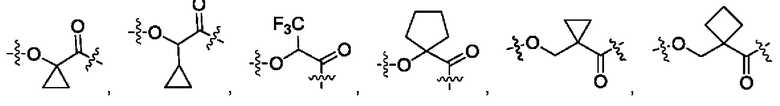 и
и 
9. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-8, где L3 представляет собой тетрапептидный остаток GGFG.
10. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по п. 1, где -L-Y- представляет собой структуру, которая приведена ниже:
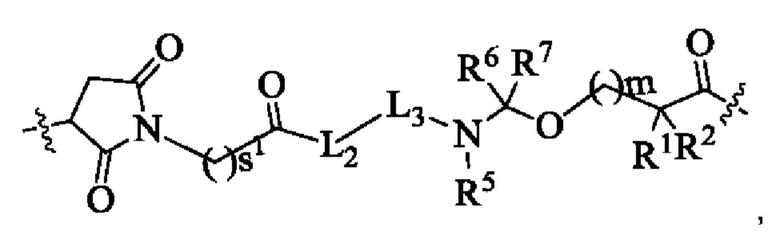
где:
L2 представляет собой химическую связь;
L3 представляет собой тетрапептидный остаток GGFG;
R1 представляет собой С1-6галогеналкил или С3-6циклоалкил;
R2 выбран из группы, состоящей из атома водорода, С1-6галогеналкила или С3-6циклоалкила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-6циклоалкил;
R5, R6 и R7 являются одинаковыми или разными и каждый независимо выбран из группы, состоящей из атома водорода и С1-6алкила;
s1 представляет собой целое число от 2 до 8;
m представляет собой целое число от 0 до 4.
11. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по п. 1, который представляет собой конъюгат лиганд-лекарственное средство формулы (Pc-Lb-Y-Dr) или фармацевтически приемлемую соль:
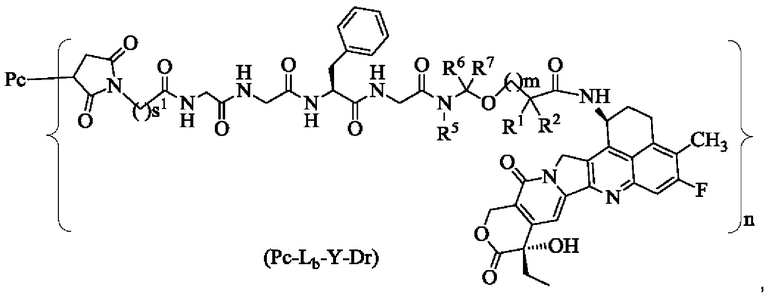
где:
s1 представляет собой целое число от 2 до 8;
R1 представляет собой С1-6 галогеналкил или С3-6 циклоалкил;
R2 выбран из группы, состоящей из атома водорода, С1-6 галогеналкила или С3-6 циклоалкила;
или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют С3-6 циклоалкил;
R5, R6 и R7 являются одинаковыми или разными и каждый из них независимо выбран из группы, состоящей из атома водорода и С1-6алкила;
m представляет собой целое число от 0 до 4;
n равно 1-10, что означает десятичную дробь или целое число;
Рс представляет собой антитело к В7Н3 или его антигенсвязывающий фрагмент, которые содержат:
определяющий комплементарность участок 1 тяжелой цепи (HCDR1), HCDR2 и HCDR3, представленные аминокислотными последовательностями SEQ ID NO: 8, 9 и 10 соответственно; и
CDR1 легкой цепи (LCDR1), LCDR2 и LCDR3, представленные аминокислотными последовательностями SEQ ID NO: 11, 12 и 13 соответственно.
12. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-11, выбранный из группы, состоящей из:
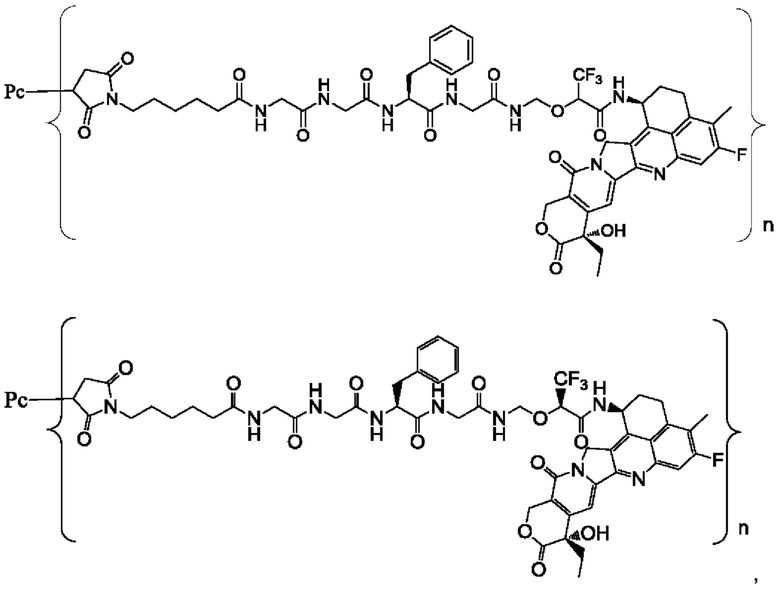
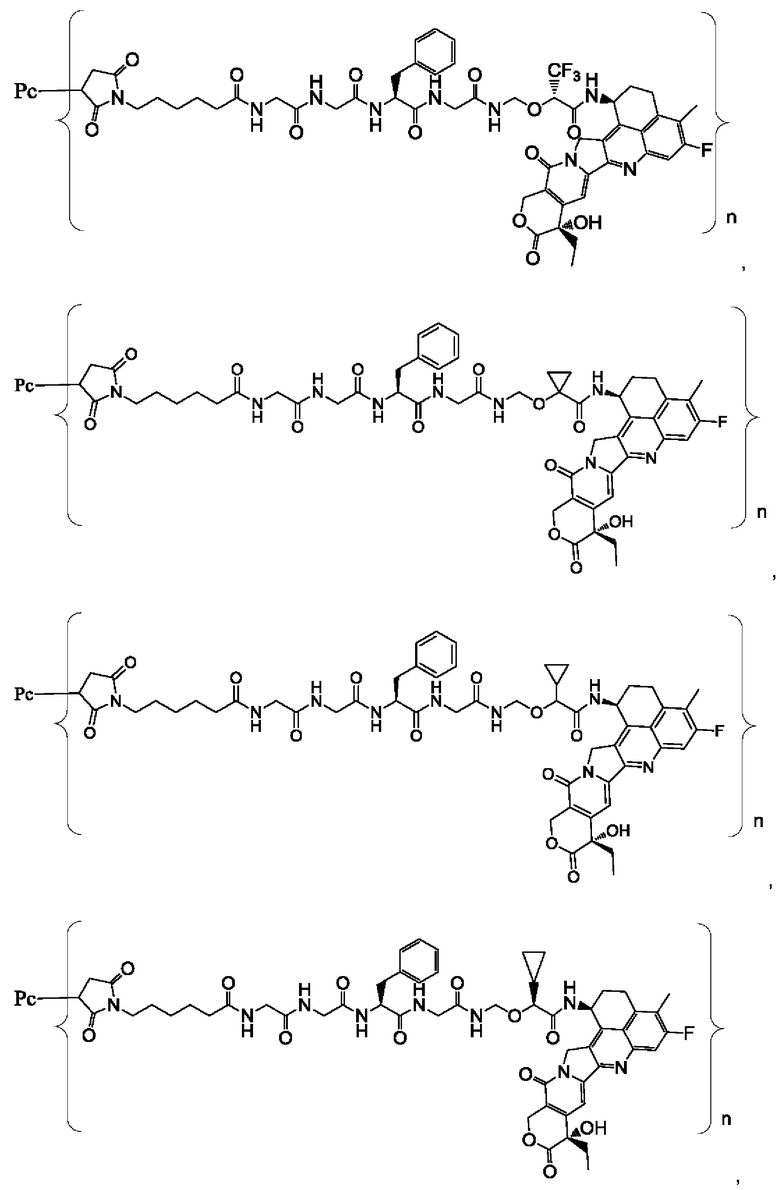
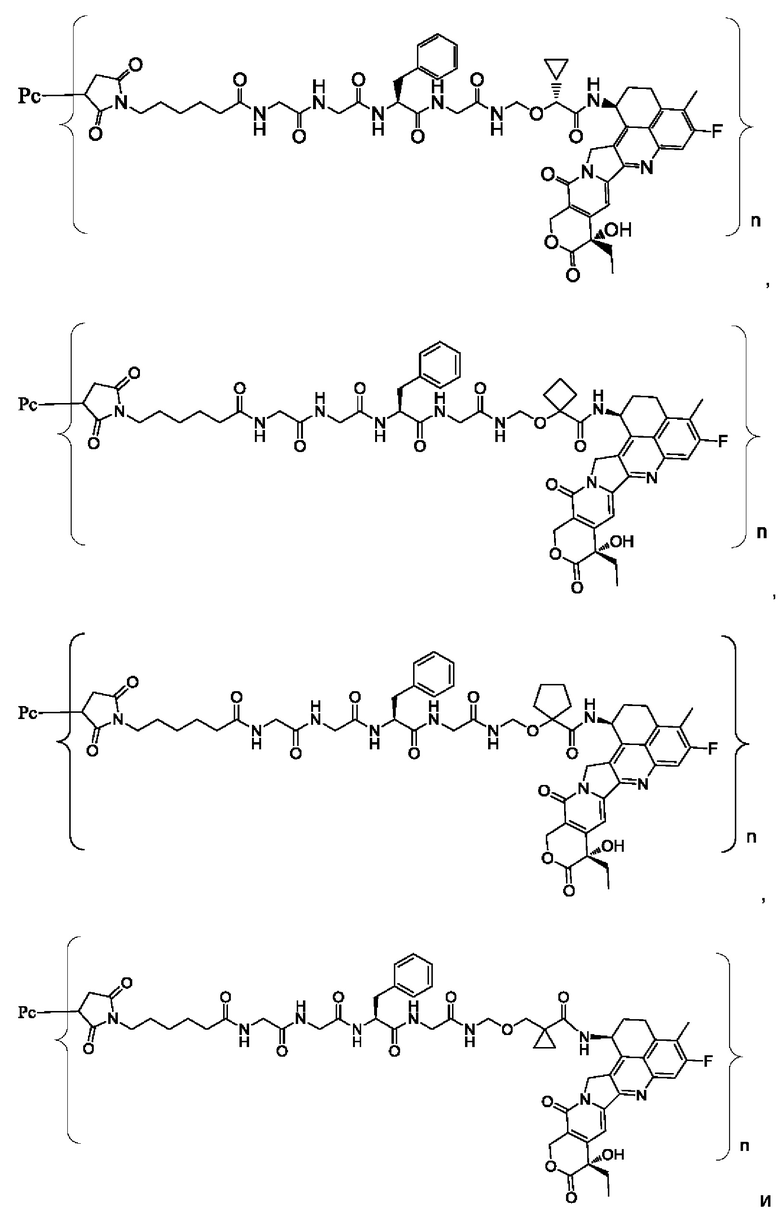
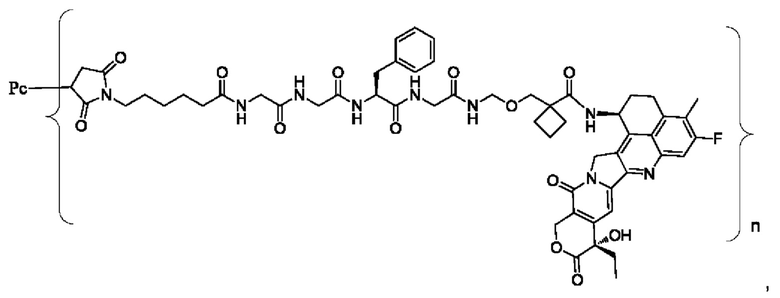
где n равно 1-10, что означает десятичную дробь или целое число;
Рс представляет собой антитело к В7Н3 или его антигенсвязывающий фрагмент, которые содержат:
определяющий комплементарность участок 1 тяжелой цепи (HCDR1), HCDR2 и HCDR3, представленные аминокислотными последовательностями SEQ ID NO: 8, 9 и 10 соответственно; и
CDR1 легкой цепи (LCDR1), LCDR2 и LCDR3, представленные аминокислотными последовательностями SEQ ID NO: 11, 12 и 13 соответственно.
13. Конъюгат лиганд-лекарственное средство формулы (Pc-L-Y-Dr) или его фармацевтически приемлемая соль по любому из пп. 1-12,
где Рс представляет собой антитело, состоящее из последовательности тяжелой цепи, представленной SEQ ID NO: 14, и последовательности легкой цепи, представленной SEQ ID NO: 16;
n равно 1-10, что означает десятичную дробь или целое число.
14. Фармацевтическая композиция для лечения заболеваний или расстройств, опосредованных В7Н3, содержащая конъюгат лиганд-лекарственное средство или его фармацевтически приемлемую соль по любому из пп. 1-13 и один или более чем один фармацевтически приемлемый эксципиент, разбавитель или носитель.
15. Применение конъюгата лиганд-лекарственное средство или его фармацевтически приемлемой соли по любому из пп. 1-13 или фармацевтической композиции по п. 14 в приготовлении лекарственных средств для лечения В7Н3-опосредуемых заболеваний или расстройств.
16. Применение по п. 15, где В7Н3-опосредуемое заболевание или расстройство представляет собой рак с высокой степенью экспрессии В7Н3.
17. Применение конъюгата лиганд-лекарственное средство или его фармацевтически приемлемой соли по любому из пп. 1-13 или фармацевтической композиции по п. 14 в приготовлении лекарственных средств для лечения и/или предупреждения рака, опосредованного В7Н3, выбранного из группы, состоящей из рака молочной железы, рака яичников, рака шейки матки, рака легкого, рака матки, рака предстательной железы, рака почки, рака уретры, рака мочевого пузыря, рака печени, рака желудка, рака эндометрия, рака слюнных желез, рака пищевода, меланомы, глиомы, нейробластомы, саркомы, фарингеального рака, рака толстой кишки, рака прямой кишки, колоректального рака, лейкоза, рака кости, рака кожи, рака щитовидной железы, рака поджелудочной железы и лимфомы.
| US 9808537 B2, 07.11.2017 | |||
| US 9453080 B2, 27.09.2016 | |||
| RU 2013152164 A, 27.05.2015. |
Авторы
Даты
2022-12-12—Публикация
2019-09-25—Подача