Изобретение относится к области биотехнологии, а именно к способам получения наночастиц благородных металлов с помощью методов биологического синтеза и может быть использовано в медицинской и косметической промышленности, в катализе химических реакций, для получения биомаркеров, антистатических и криогенных сверхпроводящих материалов, в производстве биосенсоров, а также в электронной промышленности.
Наночастицы находят самое разнообразное применение в различных областях науки и техники, и в последнее время область их использования расширяется все больше. Например, золотые наночастицы используются в оптико-электронике, катализе и биомедицине [Dreaden E.C. et al. The golden age: gold nanoparticles for biomedicine. Chem. Soc. Rev. 2012. 41: 2740–2779; Dykman L. and Khlebtsov N. Gold nanoparticles in biomedical applications: Recent advances and perspectives. Chem. Soc. Rev. 2012. 41: 2256–2282; Austin L.A. et al. The optical, photothermal, and facile surface chemical properties of gold and silver nanoparticles in biodiagnostics, therapy, and drug delivery. Arch. Toxicol. 2014. 88: 1391–1417]. Наночастицы серебра благодаря своим особым свойствам эффективны для применения в катализе химических реакций, в качестве биомаркеров, для получения антистатических, биосенсорных, криогенных сверхпроводящих материалов, косметической продукции, электроники [Sharma V.K. et al. Silver nanoparticles: Green synthesis and their antimicrobial activities. Adv. Colloid. Interface. Sci. 2009. 145: 83–96; Gade A. et al. Mycogenic metal nanoparticles: progress and applications. Biotechnol. Lett. 2010. 32: 593–600; Abbasi E. et al. Silver nanoparticles: Synthesis methods, bio-applications and properties. Crit. Rev. Microbiol. 2014. doi:10.3109/1040841X.2014.912200; Austin L.A. et al. The optical, photothermal, and facile surface chemical properties of gold and silver nanoparticles in biodiagnostics, therapy, and drug delivery. Arch. Toxicol. 2014. 88: 1391–1417]. Серебряные наночастицы обладают выраженным антимикробным действием по отношению к грамотрицательным и грамположительным бактериям, включая высоко мультирезистентные штаммы [Panáček A. et al. Silver Colloid Nanoparticles: Synthesis, Characterization, and Their Antibacterial Activity. J. Phys. Chem. B. 2006. 110: 16248–16253; Birla S.S. Fabrication of silver nanoparticles by Phoma glomerata and its combined effect against Escherichia coli, Pseudomonas aeruginosa and Staphylococcus aureus. Lett. Appl. Microbiol. 2009. 48: 173–179; Sharma V.K. et al. Silver nanoparticles: Green synthesis and their antimicrobial activities. Adv. Colloid. Interface. Sci. 2009. 145: 83–96].
Первоочередной задачей современной нанотехнологии является разработка надежных и эффективных методик получения монодисперсных наночастиц различного химического состава, размера и формы. Используемые в настоящее время физико-химические методы синтеза наночастиц, несмотря на их успешное применение, являются дорогостоящими, трудоемкими, экологически небезопасными, требуют использования высоких температур, рН и давления, вредных химических соединений [Dhillon G.S. et al. Green approach for nanoparticle biosynthesis by fungi: current trends and applications. Crit. Rev. Biotechnol. 2012. 32: 49–73; Yadav A. et al. Fungi as an efficient mycosystem for the synthesis of metal nanoparticles: progress and key aspects of research. Biotechnol. Lett. 2015. 37: 2099–2120].
В связи с этим все больше возрастает интерес к биологическому синтезу наночастиц, безопасному для окружающей среды и человека, с применением различных биологических объектов, включая живые культуры растений, водорослей, грибов, бактерий, актиномицетов [Vigneshwaran N. et al. Silver Protein (Core Shell) Nanoparticle Production Using Spent Mushroom Substrate. Langmuir. 2007. 23: 7113–7117; Philip D. Biosynthesis of Au, Ag and Au–Ag nanoparticles using edible mushroom extract. Spectrochim. Acta. A. Mol. Biomol. Spectrosc. 2009. 73: 374–381; Zhang Y.X. et al. Biosynthesis of gold nanoparticles using chloroplasts. Int. J. Nanomed. 2011. 6: 2899–2906; Narayanan K.B. and Sakthivel N. Green synthesis of biogenic metal nanoparticles by terrestrial and aquatic phototrophic and heterotrophic eukaryotes and biocompatible agents. Adv. Colloid Interface. Sci. 2011. 169: 9–79; Kharissova O.V. et al. The greener synthesis of nanoparticles. Trends. Biotechnol. 2013. 31: 240–248; Malik P. et al. Green Chemistry Based Benign Routes for Nanoparticle Synthesis. J. Nanopart. 2014. doi:10.1155/2014/302429; Mishra V. et al. A Review on Green Synthesis of Nanoparticles and Evaluation of Antimicrobial Activity. Int. J. Green Herbal. Chem. 2014. 3: 081–094; Singh P. et al. Biological Synthesis of Nanoparticles from Plants and Microorganisms. Trends. Biotechnol. 2016. DOI: 10.1016/j.tibtech.2016.02.006].
В большинстве исследований для получения наночастиц используются бактерии и микроскопические грибы, многие из которых являются патогенными. Более перспективным подходом представляется использование для биосинтеза наночастиц культивируемых съедобных и лекарственных базидиальных макромицетов, поскольку эти объекты введены в чистую культуру и широко используются для получения продуктов питания, пищевых добавок и лекарственных препаратов [Gade A. et al. Mycogenic metal nanoparticles: progress and applications. Biotechnol. Lett. 2010. 32: 593–600; Dhillon G.S. et al. Green approach for nanoparticle biosynthesis by fungi: current trends and applications. Crit. Rev. Biotechnol. 2012. 32: 49–73; Kitching M. et al. Fungal biosynthesis of gold nanoparticles: mechanism and scale up. Microb. Biotechnol. 2014. doi:10.1111/1751-7915.12151]. В частности, культура ксилотрофного базидиомицета Lentinus edodes отличается простотой и безопасностью выращивания, не является токсичной или патогенной, ценится как высококачественный съедобный гриб, а также как продуцент ферментов и уникального комплекса биологически активных и лекарственных веществ, нашедших широкое применение в пищевой и фармацевтической промышленности [Stamets P. Growing gourmet and medicinal mushrooms. Ten Speed Press, Berkeley. 1993. pp. 552; Wasser S.P. and Weis A.L. Medicinal Properties of Substances Occuring in Higher Basidiomycetes Mushrooms: Current Perspectives (Review). Int. J. Med. Mushr. 1999. 1: 31–62; Bender S. et al. The antibiotic activity of the edible and medicinal mushroom Lentinus edodes (Berk.) Sing. Int. J. Med. Mushr. 2001. 3: 118; Lobanok A.G. et al. Composition and biological activity of submerged mycelium of the xylotrophic basidiomycete Lentinus edodes. Appl. Biochem. Microbiol. 2003. 39: 60–64].
Известен способ получения наночастиц серебра при помощи культур микроскопических грибов рода Trichoderma, в частности, Trichoderma reesei (патент США №8394421 B2, опуб. 12.03.2013 г.). Способ состоит в инкубации биомассы триходермы с раствором AgNO3 (1 мМ) на ротационной мешалке в течение 120 ч, что приводит к внеклеточному образованию серебряных наночастиц неправильной формы размером 5–50 нм, имеющих тенденцию к агрегации.
Существенными недостатками данного метода являются длительное время реакции и необходимость отделять полученные наночастицы от грибных клеток. Кроме того, неправильная и неоднородная форма наночастиц, синтезированных при помощи Trichoderma, снижает их качество и потенциал дальнейшего применения.
Известен способ получения наночастиц золота с использованием аскомицета Botrylis cinerea – несовершенной стадии плесневого гриба, возбудителя серой гнили многих сельскохозяйственных растений (заявка на патент США №20150072392 A1, опуб. 12.03.2015 г.). В заявке предлагается использовать споры B. cinerea, гифы мицелия, склероции, внутри- и внеклеточные органические молекулы (белки, нуклеиновые кислоты, полисахариды, липиды, вторичные метаболиты). Культура гриба восстанавливала золотые наночастицы при росте на среде с 0.5–10 мМ HAuCl4×3H2O за 0.5–12 ч. Образовавшиеся частицы имели разнородную форму (наносферы с большим содержанием нанотреугольников и многоугольников) и сильно варьировали в размерах (10–300 нм).
К серьезным недостаткам данного метода относятся использование патогенной культуры, сильная неоднородность синтезируемых наночастиц, высокая концентрация золотохлористоводородной кислоты, используемой при синтезе.
Наиболее близким к заявленному является способ биосинтеза наночастиц серебра при помощи аскомицетов рода Alternaria – Alternaria pluriseptata и Alternaria alternata (патент США №9701552 B1, опуб. 11.07.2017 г.). Согласно данному способу, биомассу грибных клеток инкубируют в течение 24 ч при 35–60°С (оптимальная температура 45°С) с раствором AgNO3 для получения наночастиц диаметром от 1 до 300 нм, со средним диаметром 200 нм. При этом нанообразования имеют не только сферическую, но и удлиненно-сферическую, стержневидную или многогранную форму.
В качестве недостатка данного способа необходимо отметить, что микромицеты Alternaria не только являются патогенами растений, но также вызывают аллергические заболевания у человека, что делает их неблагоприятным объектом для проведения биотехнологических процессов. Другими недостатками этого метода являются большая неоднородность размера и формы наночастиц, длительность синтеза, необходимость отделять частицы от клеток микромицета и применение повышенной температуры.
Изобретение направлено на решение задачи сокращения продолжительности, снижения трудозатрат и удешевления биотехнологического процесса биологического синтеза мономорфных наночастиц серебра и золота, экологически безопасного для природной среды и человека, с помощью эффективного нетоксичного и непатогенного базидиомицета Lentinus edodes.
В данном изобретении авторами наряду с обнаружением способности к биологическому синтезу мономорфных наночастиц благородных металлов бесклеточными фильтратами культуральной жидкости, установлена возможность влиять на размер формирующихся наночастиц и их процентное соотношение в зависимости от возраста грибной культуры и времени инкубации.
Техническим результатом предлагаемого изобретения является получение однородных по размеру и форме наночастиц благородных металлов серебра или золота, с использованием нетоксичной и непатогенной культуры базидиального макромицета, при сокращении продолжительности и упрощении процесса биологического синтеза наночастиц.
Данный технический результат достигается реализацией заявляемого способа биосинтеза наночастиц, который включает культивирование базидиального макромицета Lentinus edodes в питательной среде не менее 7 суток, отбор культуральной жидкости, отделение мицелия базидиального макромицета с получением бесклеточного фильтрата культуральной жидкости, добавление к бесклеточному фильтрату водного раствора золотохлористоводородной кислоты, для получения наночастиц золота, или водного раствора нитрата серебра, для получения наночастиц серебра, инкубирование полученной смеси при температуре 23–26°C от 1 до 60 минут с последующим извлечением наночастиц из смеси.
В одном из вариантов реализации способа базидиальный макромицет Lentinus edodes культивируют в течение 7 или 14 суток при температуре 26°С.
Отделение мицелия базидиального макромицета может быть осуществлено посредством центрифугирования при 5000–10000 g в течение 10–30 мин с последующей фильтрацией.
Водный раствор золотохлористоводородной кислоты может быть использован в конечной концентрации 30–80 мкМ, а водный раствор нитрата серебра – в конечной концентрации 0.4–0.6 мМ.
В качестве питательной среды может быть использована среда с pH 5.8–6.1 на основе минеральных солей, содержащих ионы фосфора, серы, калия, натрия, магния, железа, с добавлением, в качестве источника азота и углерода, аспарагина и глюкозы. В частности, питательная среда может содержать (г/л): D-глюкоза – 1; L-аспарагин – 0.1; дигидрофосфат калия – 2; гидрофосфат калия – 3; сульфат магния семиводный – 2.5; сульфат железа семиводный – 0.03.
В одном из частных вариантов выполнения способа, для формирования сферических наночастиц золота или серебра размером от 1 до 20 нм, культивирование базидиального макромицета Lentinus edodes в питательной среде осуществляют в течение 7 суток, а инкубирование осуществляют в течение 1–30 мин. В другом частном варианте реализации способа, для формирования наночастиц золота или серебра размером от 20 до 40 нм, культивирование базидиального макромицета Lentinus edodes в питательной среде осуществляют в течение 14 суток, а инкубирование осуществляют в течение 10–30 мин.
Извлечение наночастиц из инкубационной смеси может быть осуществлено с помощью центрифугирования при 12000–15000 g в течение 15–20 мин.
Заявленный способ биологического синтеза наночастиц при помощи культивируемых съедобных и лекарственных базидиомицетов Lentinus edodes является доступным, простым, экологически безопасным и эффективным в отношении получения мономорфных наночастиц благородных металлов заданного размера. Образование металлических наночастиц золота и серебра при использовании предлагаемого способа наблюдается уже спустя 1 мин (Au0) и 5 мин (Ag0) инкубации. При этом размер формирующихся наночастиц и их процентное соотношение зависит от возраста грибной культуры и времени инкубации.
Изобретение поясняется следующими изображениями.
Фиг. 1. Просвечивающая электронная микроскопия наночастиц золота (Au0), полученных из золотохлористоводородной кислоты HAuCl4 с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры базидиомицета Lentinus edodes F-249 при разном времени инкубирования. 1 – 1 мин, 2 – 3 мин, 3 – 5 мин, 4 – 10 мин, 5 – 30 мин, 6 – 60 мин, 7 – 120 мин, 8 – 180 мин. Масштаб – 100 нм.
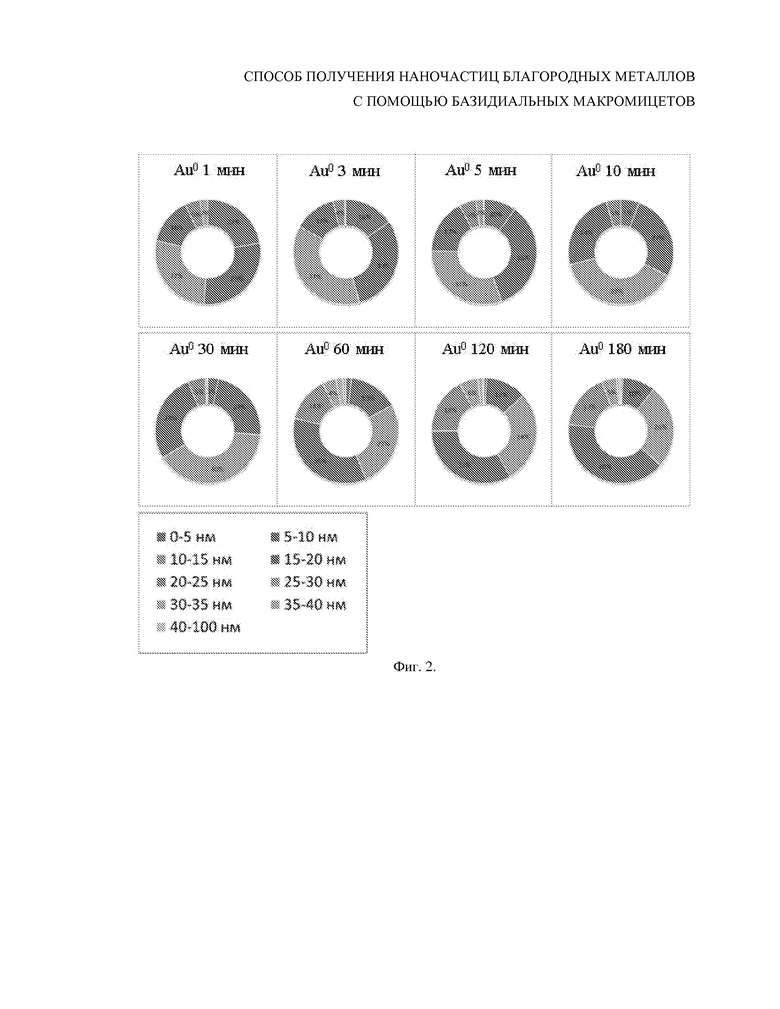
Фиг. 2. Распределение по размеру (в процентном соотношении) наночастиц золота, полученных из золотохлористоводородной кислоты с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры базидиомицета Lentinus edodes F-249 в зависимости от времени инкубирования.
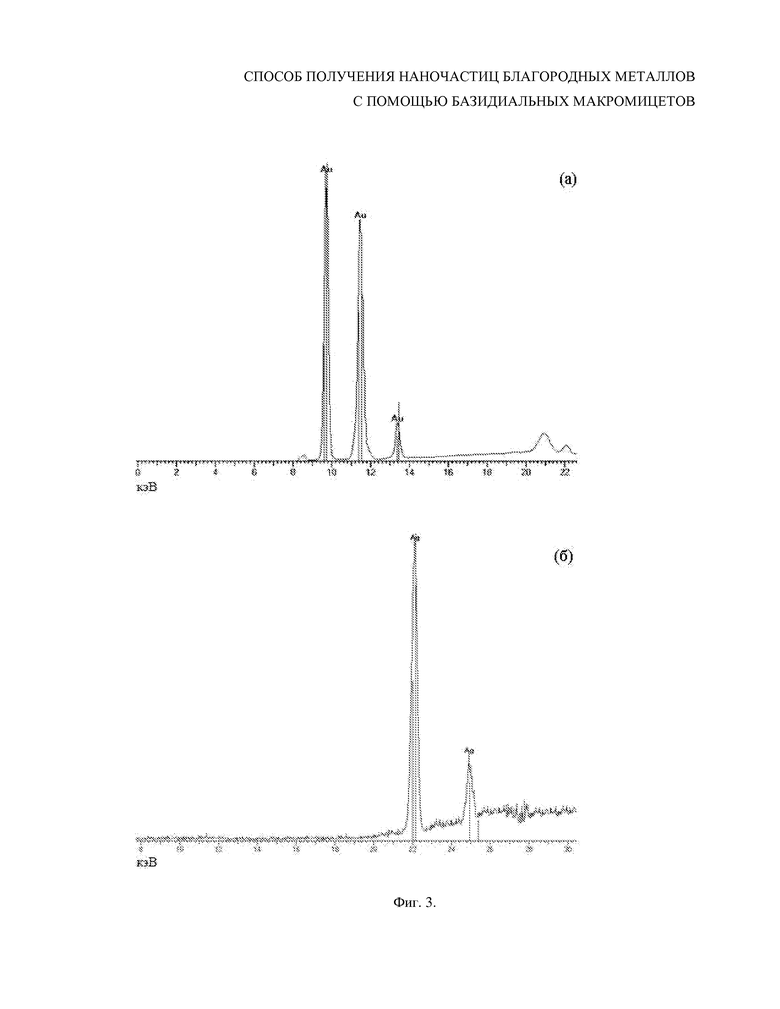
Фиг. 3. Рентгеновский флуоресцентный анализ суспензий наночастиц золота (а) и серебра (б), полученных из HAuCl4 и AgNO3 с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры базидиомицета Lentinus edodes F-249.
Фиг. 4. Рентгенофазовый анализ (определение степеней окисления элементов) в суспензиях наночастиц золота (а) и серебра (б), полученных из HAuCl4 и AgNO3 с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры базидиомицета Lentinus edodes F-249.
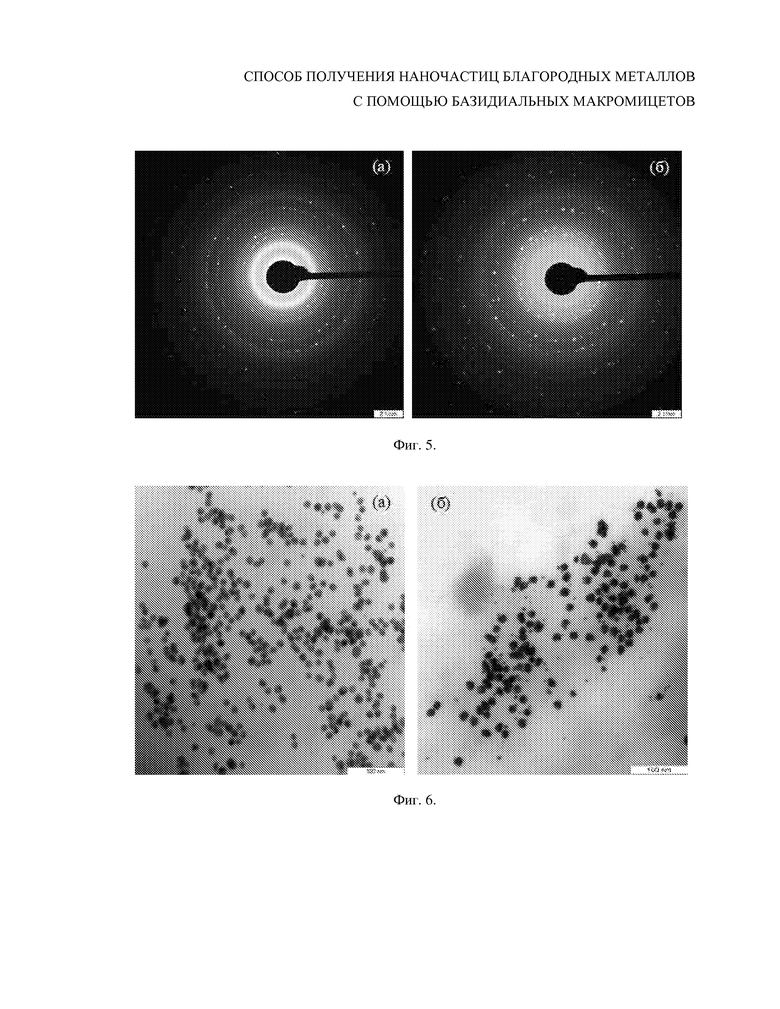
Фиг. 5. Электронная дифракция выбранной области с помощью просвечивающей электронной микроскопии с определением структуры наночастиц Au0 (а) и Ag0 (б).
Фиг. 6. Просвечивающая электронная микроскопия наночастиц золота (Au0), полученных из HAuCl4 с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры (а) и 14-суточной культуры (б) базидиомицета Lentinus edodes F-249 при 30 мин инкубирования. Масштаб – 100 нм.
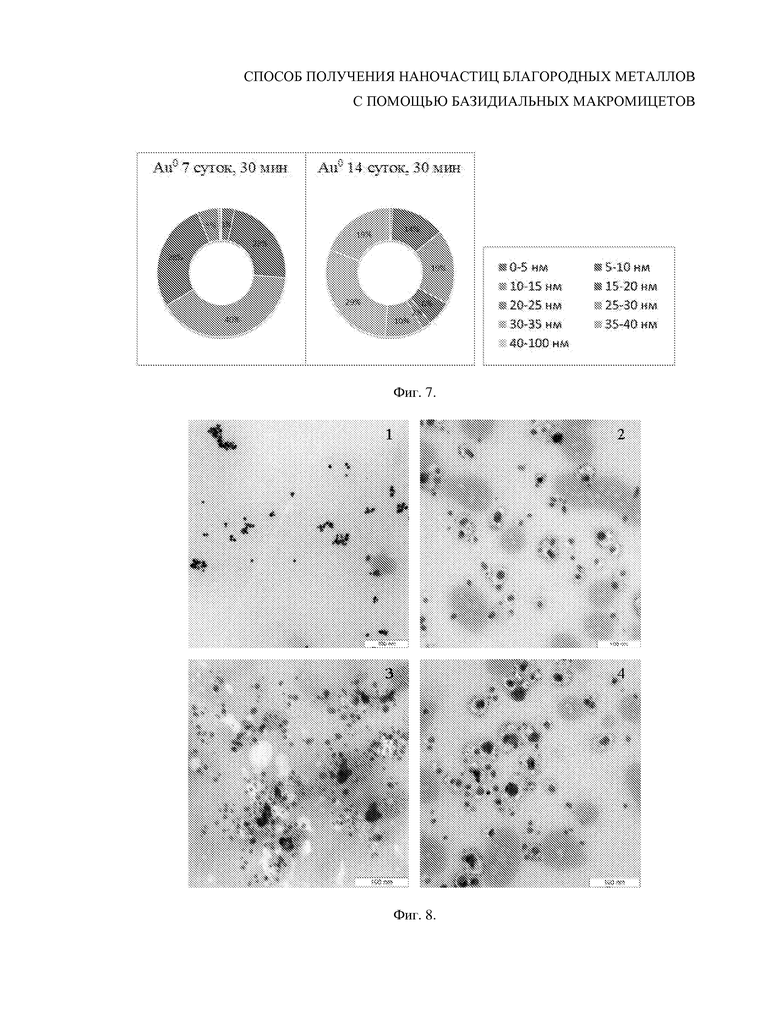
Фиг. 7. Распределение по размеру (в процентном соотношении) наночастиц золота, полученных из золотохлористоводородной кислоты с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры (а) и 14-суточной культуры (б) базидиомицета Lentinus edodes F-249 при 30 мин инкубирования.
Фиг. 8. Просвечивающая электронная микроскопия наночастиц серебра (Ag0), полученных из AgNO3 с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры базидиомицета Lentinus edodes F-249 при разном времени инкубирования. 1 – 5 мин, 2 – 10 мин, 3 – 30 мин, 4 – 60 мин. Масштаб – 100 нм.
Фиг. 9. Распределение по размеру (в процентном соотношении) серебряных наночастиц, полученных из нитрата серебра с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры базидиомицета Lentinus edodes F-249 в зависимости от времени инкубирования.
Фиг. 10. Просвечивающая электронная микроскопия наночастиц серебра (Ag0), полученных из AgNO3 с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры (а) и 14-суточной культуры (б) базидиомицета Lentinus edodes F-249 при 30 мин инкубирования. Масштаб – 200 нм.
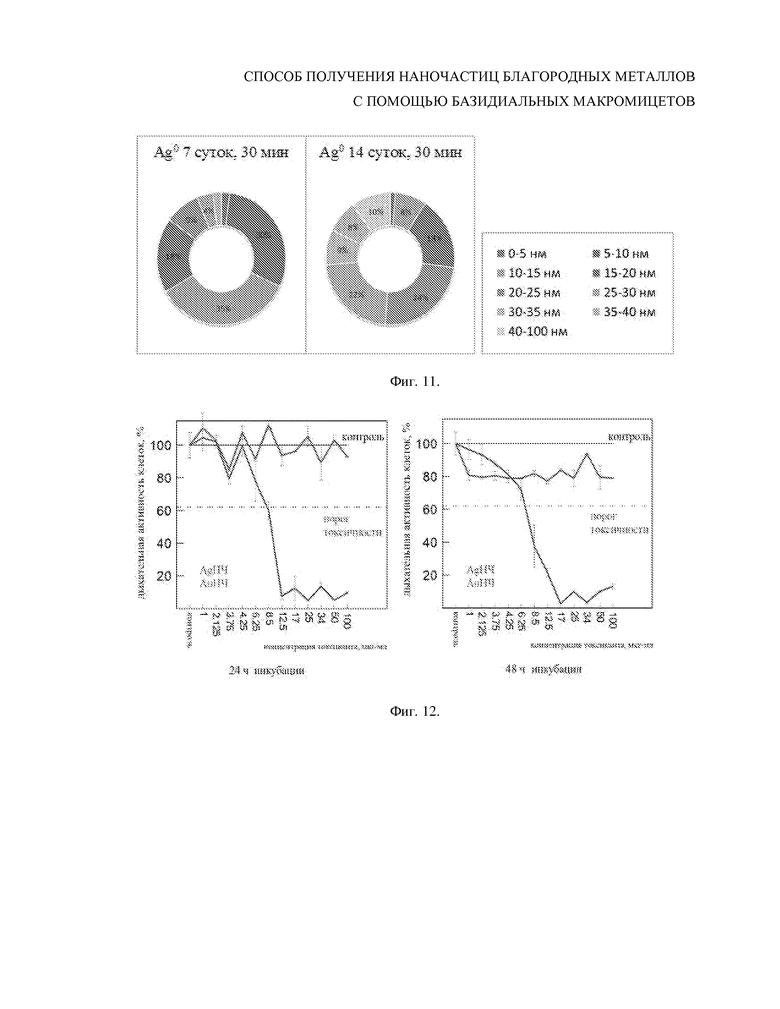
Фиг. 11. Распределение по размеру (в процентном соотношении) серебряных наночастиц, полученных из нитрата серебра с использованием бесклеточного фильтрата культуральной жидкости 7-суточной культуры (а) и 14-суточной культуры (б) базидиомицета Lentinus edodes F-249 при 30 мин инкубирования.
Фиг. 12. Определение цитотоксичности биологически синтезированных наночастиц серебра и золота с применением МТТ-теста.
Предлагаемый способ осуществляют следующим образом.
Ксилотрофный базидиальный макромицет Lentinus edodes выращивают не менее 7 суток в условиях глубинного культивирования на жидкой питательной среде с pH 5.8–6.1 на основе минеральных солей, содержащих ионы P, S, К, Na, Mg, Fe, с добавлением, в качестве источника азота и углерода, аспарагина и глюкозы. Культивирование проводят в колбах объемом 100 мл с 50 мл среды с периодическим перемешиванием при температуре 26°С, являющейся оптимальной температурой роста мицелия для данного вида гриба [Vetchinkina E.P. et al. Biological synthesis of gold nanoparticles by the xylotrophic basidiomycete Lentinula edodes. Appl. Biochem. Microbiol. 2013. 49: 406–411]. Далее отбирают полученную культуральную жидкость и отделяют от мицелия посредством центрифугирования при 5000–10000 g в течение 10–30 мин с последующей фильтрацией через бумажный фильтр, удерживающий грибные клетки. К полученному бесклеточному фильтрату культуральной жидкости добавляют 2–4% водный раствор золотохлористоводородной кислоты (HAuCl4) в конечной концентрации 30–80 мкМ или 1–3% водный раствор нитрата серебра (AgNO3) в конечной концентрации 0.3–0.6 мМ, перемешивают и инкубируют в темноте при комнатной температуре (23–26°С) во временном интервале от 1 до 60 минут до образования наночастиц золота или серебра заданного размера и формы. Наночастицы отделяют от инкубационной смеси центрифугированием при 12000–15000 g в течение 15–20 мин, надосадочную жидкость удаляют, осадок наночастиц отмывают от остатков инкубационной смеси дистиллированной водой и снова осаждают центрифугированием при 12000–15000 g в течение 15–20 мин. Затем наночастицы перерастворяют в буфере, необходимом для хранения или дальнейшего использования.
Предлагаемое изобретение позволяет получить наночастицы серебра и золота требуемого размера и формы в зависимости от возраста культуры и времени инкубации (от 1 до 60 мин). В частности, при использовании бесклеточного фильтрата 7-суточной культуры базидиомицета и времени инкубации от 1 до 30 мин, формируются сферические наночастицы диаметром преимущественно от 1 до 20 нм, а при использовании бесклеточного фильтрата 14-суточной культуры базидиомицета и времени инкубации от 10 до 30 мин, формируются сферические наночастицы большего диаметра с преимущественным содержанием наносфер размером от 20 до 40 нм.
При осуществлении способа могут быть использованы любые штаммы базидиального макромицета Lentinus edodes (Berk.) Singer [Lentinula edodes (Berk.) Pegler] (шиитаке), широко представленные в российских и зарубежных коллекциях микроорганизмов. В частности, могут быть использованы штаммы F-249, 2-T, М-370, 0779, 509, 363, 4080, представленные в следующих коллекциях: Коллекция штаммов базидиомицетов кафедры микологии и альгологии Московского государственного университета имени М.В. Ломоносова [Ветчинкина Е.П. и др. Морфологические особенности роста мицелия и плодоношения некоторых штаммов съедобного ксилотрофного базидиомицета Lentinus edodes. Изв. Самар. Н.Ц. РАН. 2007. 9: 1085–1090], Всероссийская коллекция микроорганизмов (ФАНО Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН), Коллекция культур базидиомицетов Ботанического института им. В.Л. Комарова, Белорусская коллекция непатогенных микроорганизмов (Институт микробиологии Национальной академии наук Беларуси), The culture collection of Zavod za naravoslovje (Ljubljana, Slovenia), Agricultural Culture Collection of China (The Institute of Agricultural Resources and Regional Planning). Базидиальный макромицет Lentinus edodes является популярной и легко доступной культурой.
Ниже приведены примеры, иллюстрирующие, но не ограничивающие применение способа получения наночастиц благородных металлов серебра и золота с помощью штамма Lentinus edodes F-249, поскольку штаммовые различия по биологическому синтезу наночастиц благородных металлов являются незначительными.
В качестве питательной среды для выращивания штамма использовали синтетическую среду следующего состава (г/л): D-глюкоза – 1; L-аспарагин – 0.1; KH2PO4 – 2; K2HPO4 – 3; MgSO4×7H2O – 2.5; FeSO4 ×7H2O – 0.03, при этом рН среды составляло 5.8. В качестве инокулята использовали 14-суточную грибную культуру, выращенную на агаризованной среде того же состава при 26°С. В качестве соединений, содержащих ионы благородных металлов, использовали 4-% водный раствор золотохлористоводородной кислоты (HAuCl4) и 1-% водный раствор нитрат серебра (AgNO3).
Пример 1. Культуру базидиомицета Lentinus edodes F-249 выращивали в течение 7 суток при температуре 26°С на синтетической среде в условиях глубинного культивирования. Культуральную жидкость отделяли от мицелия центрифугированием при 8000 g в течение 20 мин и фильтровали. Полученный бесклеточный фильтрат инкубировали в темноте при температуре 23–26°С с водным раствором HAuCl4 в конечной концентрации 50 мкМ. Биоредукцию золотосодержащего соединения с образованием наночастиц оценивали через 1, 3, 5, 10, 30, 60, 120 и 180 минут при помощи просвечивающей электронной микроскопии, используя метод негативного контрастирования (Фиг. 1). Оценку размера, формы и относительного количества электронно-плотных нанообразований проводили с помощью трансмиссионных электронно-микроскопических изображений (Фиг. 2). Содержание сверхмалых наночастиц (1–5 нм) при инкубировании от 1 до 30 мин уменьшается с 22 до 3% за счет увеличения количества наносфер диаметром 15–20 нм с 13 до 28%. При инкубировании более 30 мин (60–180 мин) сверхмалых частиц практически не наблюдалось, содержание наночастиц размером 5–10 нм уменьшалось с 35 до 10%, содержание наносфер размером 15–20 нм составляло 35–40%, содержание частиц диаметром 20–25 нм увеличивалось с 5 до 18%. Доля наночастиц диаметром 10–15 нм была достаточно стабильна и составляла от 27 до 40% на протяжении всего времени инкубирования. Средний размер наносфер с течением времени инкубации увеличивался с 10 до 20 нм, наночастицы были мономорфны (Фиг. 1 и 2).
Для подтверждения того, что данные наночастицы представляют собой восстановленное золото, они были исследованы методом рентгеновской флуоресценции. Наличие золота было определено по характерным для этого элемента эмиссионным линиям при Lα1 – 9.713; Lβ1 – 11.443; Lβ2 – 11.585; Ln – 10.308; Ly1 – 13.382 кэВ (Фиг. 3а).
Методом рентгенофазового анализа была определена степень окисления золота, которое восстанавливалось до нулевой степени окисления полностью, и сигналов от исходного HAuCl4 или промежуточных соединений, содержащих ионы золота, обнаружено не было. В образцах присутствовали 4 сигнала, относящихся к основному рефлексу Au0 (межплоскостное расстояние 1.230, 1.441, 2.030 и 2.350 Å [4-784]) (Фиг. 4а).
Дзета-потенциал коллоидного золота, синтезированного с помощью фильтрата культуральной жидкости макромицета в течение 30 мин инкубирования, измеряли с помощью метода динамического светорассеяния. Дзета-потенциал составил –25 мВ, что говорит об электростатической стабилизированности наночастиц и несклонности к коагуляции или флоккуляции.
Образцы наночастиц золота анализировали с помощью метода дифракции электронов выбранным участком. Дифракционная картина выбранной области наночастиц Au0 продемонстрировала их кристаллическую структуру (Фиг. 5а).
Пример 2. Культуру базидиомицета Lentinus edodes F-249 выращивали в течение 14 суток при температуре 26°С на синтетической среде в условиях глубинного культивирования. Культуральную жидкость отделяли от мицелия центрифугированием при 8000 g в течение 20 мин и фильтровали.
Полученный бесклеточный фильтрат инкубировали в темноте при температуре 23–26°С с водным раствором HAuCl4 в конечной концентрации 50 мкМ. Биоредукцию золотосодержащего соединения с образованием наночастиц оценивали аналогично примеру 1 (Фиг. 6). По сравнению с примером 1, где использовали фильтрат 7-суточной культуры, наблюдалось образование сферических наночастиц металлического золота большего размера, например, при инкубировании в течение 30 мин со средним диаметром 30 нм (Фиг. 7).
Пример 3. Культуру базидиомицета Lentinus edodes F-249 выращивали в течение 7 суток при температуре 26°С на синтетической среде в условиях глубинного культивирования. Культуральную жидкость отделяли от мицелия центрифугированием при 8000 g в течение 20 мин и фильтровали.
Полученный бесклеточный фильтрат инкубировали в темноте при температуре 23–26°С с водным раствором AgNO3 в конечной концентрации 0.5 мМ. Биоредукцию нитрата серебра с образованием металлических наночастиц оценивали через 5, 10, 30, 60 и 120 мин при помощи просвечивающей электронной микроскопии, используя метод негативного контрастирования (Фиг. 8). Оценку размера, формы и относительного количества электронно-плотных нанообразований проводили с помощью трансмиссионных электронно-микроскопических изображений (Фиг. 9). Наночастицы Ag0 начинали формироваться спустя 5 мин инкубирования бесклеточного фильтрата с нитратом серебра. При инкубировании в течение 5–10 мин формировались малые частицы металлического серебра, доля наночастиц диаметром 1–5 нм составляла 35%, 5–10 нм – 54%. При увеличении времени инкубирования сверхмалые наночастицы исчезали, доля наночастиц диаметром 5–10 нм уменьшалась до 24%, основное содержание было представлено наносферами 10–20 нм, спустя 60 мин появлялись наночастицы размером 25–30 нм. Все наночастицы были мономорфны и представлены сферами. Более длительное инкубирование (>60 мин) приводило к слипанию наночастиц и образованию конгломератов.
Методом рентгеновской флуоресценции серебро было определено по характерным для этого элемента эмиссионным линиям при Lα1 – 22 и Lβ1 – 25 кэВ (Фиг. 3б).
Методом рентгенофазового анализа была определена степень окисления серебра, которое восстанавливалось до нулевой степени окисления полностью, и сигналов от исходного или промежуточных соединений, содержащих ионы серебра, обнаружено не было. В образцах присутствовали 4 сигнала, относящихся к основному рефлексу Ag0 (межплоскостное расстояние 1.232, 1.446, 2.049 и 2.356 Å [4-783]) (Фиг. 4б).
Дзета-потенциал коллоидного серебра, синтезированного с помощью фильтрата культуральной жидкости макромицета в течение 30 мин инкубирования, измеряли с помощью метода динамического светорассеяния. Дзета-потенциал составил –18 мВ.
Образцы наночастиц серебра анализировали с помощью метода дифракции электронов с выбранным участком. Дифракционная картина выбранной области наночастиц Ag0 продемонстрировала их кристаллическую структуру (Фиг. 5б).
Пример 4. Культуру базидиомицета Lentinus edodes F-249 выращивали в течение 14 суток при температуре 26°С на синтетической среде в условиях глубинного культивирования. Культуральную жидкость отделяли от мицелия центрифугированием при 8000 g в течение 20 мин и фильтровали.
Полученный бесклеточный фильтрат инкубировали в темноте при температуре 23–26°С с водным раствором нитрата серебра AgNO3 в конечной концентрации 0.5 мМ. Биоредукцию нитрата серебра с образованием металлических наночастиц оценивали аналогично примеру 3 (Фиг. 10). Наблюдалось образование наночастиц металлического серебра неправильной сферической формы. При инкубировании в течение 30 мин диаметр наночастиц варьировал от 10 до 100 нм, со значительным содержанием наносфер 20–30 нм (Фиг. 11). По сравнению с примером 3, где использовали фильтрат 7-суточной культуры, образованные наночастицы были больше по размеру (средний диаметр 35 нм) и менее однородны по форме и размеру.
Полученные наночастицы исследовали на цитотоксичность с помощью МТТ-теста. При этом использовали наночастицы золота, образовавшиеся через 30 мин инкубирования бесклеточного фильтрата 14-суточной культуры Lentinus edodes F-249 с HAuCl4. Золь центрифугировали 15000 g, 15 мин при комнатной температуре с последующим повторным суспензированием в среде для выращивания тестируемой клеточной линии, финальная концентрация 100 мкг/мл. Использовали наночастицы серебра, образовавшиеся через 30 мин инкубирования бесклеточного фильтрата 14-суточной культуры Lentinus edodes F-249 с AgNO3. Золь центрифугировали 15000 g, 15 мин при комнатной температуре с последующим повторным суспензированием в культуральной среде, финальная концентрация 100 мкг/мл. В качестве живых объектов исследования были использованы животные клетки линий Vero (африканская зеленая мартышка, эпителий почки).
Биообразованные наночастицы золота обладали полным отсутствием токсичности по отношению к животной клеточной линии Vero. Для клеток, инкубированных 24 ч с наночастицами золота, снижение жизнеспособности по сравнению с контролем не наблюдалось. Среднее снижение дыхательной активности для диапазона концентраций от 1 до 100 мкг/мл при 48 ч инкубирования составило около 20%, что говорит о дозонезависимом характере проявленной токсичности в пределах исследуемых концентраций (Фиг. 12).
Выраженное токсическое действие биообразованных наночастиц серебра по отношению к клеточной линии Vero при инкубировании 24 ч и 48 ч начиналось с концентрации 8.5 мкг/мл (Фиг. 12).
Таким образом, предлагаемое изобретение обеспечивает экологически безопасный способ биосинтеза наночастиц благородных металлов с помощью бесклеточного фильтрата нетоксичного и непатогенного культивируемого съедобного и лекарственного базидиального макромицета, является простым, доступным, сокращает продолжительность, снижает трудозатраты и удешевляет биотехнологический процесс биологического синтеза наночастиц. Предлагаемое изобретение позволяет получить наночастицы серебра и золота требуемого размера и формы, изменяя возраст культуры и время инкубации. Получаемые в результате выполнения способа наночастицы золота и серебра являются мономорфными, не требуют дополнительной сортировки, легко отделяются от инкубационной смеси путем центрифугирования. Кроме того, в результате реализации способа обеспечивается полная деструкция используемых соединений благородных металлов, что исключает содержание промежуточных токсичных ионов. Образующиеся наночастицы элементного золота не обладают цитотоксичностью по отношению к животным клеткам в диапазоне концентраций от 1 до 100 мкг/мл, а наночастицы элементного серебра от 1 до 10 мкг/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ ЭКЗОЛЕКТИНОВ ИЗ ГРИБА-БАЗИДИОМИЦЕТА | 2006 |
|
RU2345132C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОЛИТИЧЕСКОГО ФЕРМЕНТА | 2020 |
|
RU2758788C1 |
| Питательная среда для глубинного культивирования мицелия базидиальных грибов | 2015 |
|
RU2621870C1 |
| ФЕРМЕНТНЫЙ ПРЕПАРАТ ТРОМБОЛИТИЧЕСКОГО И ФИБРИНОЛИТИЧЕСКОГО ДЕЙСТВИЯ ИЗ БАЗИДИАЛЬНОГО ГРИБА РОДА Coprinus | 2010 |
|
RU2435848C1 |
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРХОЛЕСТЕРИНЕМИИ | 2007 |
|
RU2358782C2 |
| Наноструктурированная композиция для пероральной доставки инсулина и способ ее получения | 2020 |
|
RU2753018C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОЛОКОСВЕРТЫВАЮЩЕГО ФЕРМЕНТА | 2006 |
|
RU2354698C2 |
| Способ получения продуктов с антибактериальной активностью из мицелия базидиомицетов | 2022 |
|
RU2800356C1 |
| ШТАММ МАКРОМИЦЕТА Trametes versicolor, ИСПОЛЬЗУЕМЫЙ В КАЧЕСТВЕ ПРОДУЦЕНТА ДЛЯ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ПРОТИВОПЛЕСНЕВЫХ ПРЕПАРАТОВ | 2013 |
|
RU2541770C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ, И СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2418062C1 |



Изобретение относится к области биотехнологии. Предложен способ получения наночастиц золота или серебра, включающий получение бесклеточного фильтрата культуральной жидкости при культивировании Lentinus edodes. К полученному фильтрату добавляют водный раствор золотохлористоводородной кислоты в концентрации 30-80 мкМ для получения наночастиц золота или водного раствора нитрата серебра в концентрации 0,4-0,6 мМ для получения наночастиц серебра. Полученную смесь инкубируют в темноте при температуре 23-26°С от 1 до 60 мин с последующим извлечением наночастиц. Изобретение обеспечивает получение однородных по размеру и форме наночастиц благородных металлов. 8 з.п. ф-лы, 12 ил., 4 пр.
1. Способ получения наночастиц золота или серебра, включающий культивирование базидиального макромицета Lentinus edodes в питательной среде от 7 до 14 сут, отбор культуральной жидкости, отделение мицелия базидиального макромицета с получением бесклеточного фильтрата культуральной жидкости, добавление к бесклеточному фильтрату водного раствора золотохлористоводородной кислоты в конечной концентрации 30-80 мкМ для получения наночастиц золота или водного раствора нитрата серебра в конечной концентрации 0.4-0.6 мМ для получения наночастиц серебра, инкубирование полученной смеси в темноте при температуре 23-26°С от 1 до 60 мин с последующим извлечением наночастиц из смеси.
2. Способ по п. 1, характеризующийся тем, что базидиальный макромицет Lentinus edodes культивируют в течение 7 или 14 сут.
3. Способ по п. 1, характеризующийся тем, что базидиальный макромицет Lentinus edodes культивируют при температуре 26°С.
4. Способ по п. 1, характеризующийся тем, что отделение мицелия базидиального макромицета осуществляют посредством центрифугирования при 5000-10000 g в течение 10-30 мин и последующей фильтрацией.
5. Способ по п. 1, характеризующийся тем, что в качестве питательной среды используют среду с рН 5.8-6.1 на основе минеральных солей, содержащих ионы фосфора, серы, калия, натрия, магния, железа с добавлением аспарагина и глюкозы в качестве источников азота и углерода.
6. Способ по п. 5, характеризующийся тем, что питательная среда содержит (г/л): D-глюкоза - 1; L-аспарагин - 0.1; дигидрофосфат калия - 2; гидрофосфат калия - 3; сульфат магния семиводный - 2.5; сульфат железа семиводный - 0.03.
7. Способ по п. 1, характеризующийся тем, что для формирования сферических наночастиц золота или серебра размером от 1 до 20 нм культивирование базидиального макромицета Lentinus edodes в питательной среде осуществляют в течение 7 суток, а инкубирование осуществляют в течение 1-30 мин.
8. Способ по п. 1, характеризующийся тем, что для формирования наночастиц золота или серебра размером от 20 до 40 нм, культивирование базидиального макромицета Lentinus edodes в питательной среде осуществляют в течение 14 суток, а инкубирование осуществляют в течение 10-30 мин.
9. Способ по п. 1, характеризующийся тем, что извлечение наночастиц из смеси осуществляют с помощью центрифугирования при 12000-15000 g в течение 15-20 мин.
| VETCHINKINA E.P | |||
| et al | |||
| "Biosynthesis of nanoparticles of metals and metalloids by basidiomycetes | |||
| Preparation of gold nanoparticles by using purified fungal phenol oxidases"//Appl | |||
| Microbiol | |||
| Biotechnol., 2017, v | |||
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| ВЕТЧИНКИНА Е.П | |||
| и др | |||
| "Биологический синтез золотых наночастиц ксилотрофным базидиомицетом Lentinula edodes"// (см | |||
| Прикладная биохимия и микробиология, 2013, т | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| ВНАТ RAVISHANKAR et al | |||
| "Photo-bio-syntesis of irregular shaped functionalized gold nanoparticles using edible mushroom Pleurotus florida and its anticancer evalution"// Journal of Photochemistry and Photobiology B: Biology, 2013, N 125, p.63-69 | |||
| КУПРЯШИНА М.А | |||
| и др | |||
| "Биологический синтез наночастиц почвенными микроорганизмами"// Тезисы ХI Молодежной школы-конференции с международным участием "Актуальные аспекты современной микробиологии", 1-2 ноября 2016, Москва, с.89-92. | |||
Авторы
Даты
2019-02-05—Публикация
2017-12-27—Подача