Изобретение относится к медико-биологической области биотехнологии и касается использования высших базидиальных грибов рода Coprinus, а именно использования макромицета Coprinus lagopides в качестве продуцента ферментов тромболитического и фибринолитического действия, подтвержденного в условиях экспериментального тромбоза.
Известно широкое медико-биологическое использование высших базидиальных грибов, обладающих противоопухолевыми, иммуностимулирующими, антивирусными, антибактериальными, антиоксидантными и другими ценными лечебными свойствами, S.P.Wasser, A.L.Weis. Medicinal properties of substances occurring in higher basidiomycetes mushrooms: current perspectives (review) // Int. Journal of Medicinal Mushrooms, 1999, Vol.1, pp.31-62; A.Karmali. The role of mushroom nutrition as a delivery agent for enzyme therapy in cancer care? - Chemical and biological properties in mushroom nutrition Mycology News, 2002, Vol.1(6), p.11-14; S-T. Chang. Development of the Culinary-Medicinal Mushrooms Industry in China: Past, Present, and Future, Int. Journal of Medicinal Mushrooms, 2006, Vol.8, pp.1-17; S-T Chang. Medicinal Mushrooms as a Good Source of Dietary Supplements for HIV/AIDS Patients, Int. Journal of Medicinal Mushrooms, 2007, Vol.9, pp.189-190; B.Štrukelj, J.Kac, D.Janeš, J.Kristl, A.Mlinarič et al. Medicinal Mushrooms and Drug Discovery: Identification of Potent Inhibitors of Thrombin, of Pancreatic Lipase, and Novel Antibiotic and Antigenotoxic Compounds, Int. Journal of Medicinal Mushrooms, 2007, Vol.9, p.195; S.M.Badalyan, K.W.Hughes and U.Kües. Biology, genetic variability and biotechnological application of several medicinal mushrooms. International Conference "Biotechnology and Health - 2", Yerevan, Armenia, April 21-25, 2008, p.21-27.
Известны медицинские грибы Ganoderma lucidum (Reishi), Grifola frondosa (Maitake), Lentinula edodes (Shiitake), которые широко используются в официальной и народной медицине стран Восточного региона при лечении различных заболеваний человека и считаются в восточной медицине панацеей, Terry Willard, Kenneth Jones, Reishi Mushroom, Herb of Spiritual Potency and Medical Wonder, Sylvan Press, 1990, 167 p.; Kenneth Jones, Shiitake, The Healing Mushroom, Healing Arts Press, Rochester, Vermont, 1995, 120 p.; Ch.Hobbs. Medicinal mushrooms. 3-rd ed., 1996, 252 p.; Н.П.Денисова. Лечебные свойства грибов, 1998, СПбГМУ, СПб, 59 с.; Alice W.Chen, John Seleen, Potential Benefits of Ling Zhi or Reishi Mushroom Ganoderma lucidum (W.Curt: Fr.) P.Karst. (Aphyllophoromycetideae) to Breast Cancer Patients, Int. Journal of Medicinal Mushrooms, 2007, Vol.9, p.29-38; Bojana Boh and Marin Berovic, Grifola frondosa (Dicks.: Fr.) S.F.Gray (Maitake Mushroom): Medicinal Properties, Active Compounds and Biotechnological Cultivation, Int. Journal of Medicinal Mushrooms, 2007, Vol.9, p.89-108.
Известные высшие базидиальные грибы находят широкое применение в медицине.
Известно наличие антитромбиновых соединений у видов Laetiporus sulphurous, Hypsizygus marmoreus, Inonotus obliquus (чага), T.Okamura, T.Takeno, M.Dohi et al., Development of mushrooms for thrombosis prevention by protoplast fusion, J. Biosci. Bioengineering, 2000, V.89, №5, p.474-478; K.Akahane, K.Satoh, O.Inoue, et al. Extracts of an edible mushroom with antithrombin III-independent anticoagulant activity. J. Thromb. Haemost. 2007, V.5, Suppl. 2: Abstracts XXI ISTH Congress, P-W-050.
Известно появление антикоагулянтных свойств у соевого соуса вследствие ферментации входящих в его состав соевых бобов мицелием зимнего опенка Flammulina velutipes, T.Okamura-Matsui, H.Izuta, T.Tomoda, et al., Fermented soybean with thrombosis preventing activity using mushroom mycelia as microbial source. Food Sci. Technol. Res., 2003, V.9 (3), p.227-230.
Известно наличие фибринолитических и тромболитических свойств в культурах различных базидиальных грибов, в том числе вида Flammulina velutipes, Н.П.Денисова, Н.Н.Фалина // Микол. и фитопатол, 1981, т.15, с.123-125; Н.П.Денисова, И.А.Алехина, ibid. 1987, т.21, с.471-477, Н.П.Денисова, Протеолитические ферменты базидиальных грибов, таксономические и экологические аспекты их изучения. Автореферат дисс. д.б.н., Ленинград, 1991, 31 с.; K.Takao, S.Kumiko. Thrombolytic enzyme activity in Grifola frondosa. Bioactive substances in Mushrooms. Part I. Jin'ai Joshi Tanki Daigaku Kenkyu Kiyo, V.32, 2000, P.65-71; J.H.Kim, Y.S.Kim. Characterization of a metalloenzyme from a wild mushroom Tricholoma saponaceum. Biosci. Biotechnol. Biochem. 2001, V.65, P.356-362.
Известна возможность использования с медицинской целью базидиальных грибов рода Panus, снижающих агрегацию тромбоцитов, Lorenzen K., Anke Т. et al., 1994 - Two inhibitors of platelet aggregation from a Panus species (Basidiomycetes). // Zeitschrift fur Naturforschung 49, с.132-138.
Известна тромболитическая активность грибных протеиназ из культур разных дереворазрушающих грибов, Nina P.Denisova, Vladimir N.Mikhailov, and Nickolay N.Petrishchev, Thrombolytic Activity of Proteineses from Coprinus domesticus, C.cinereus, and Cerrena unicolor. // Int. Journal of Medicinal Mushrooms, 1999, Vol.1, №2, pp.187-190.
Известные высшие базидиальные грибы обладают фибринолитическими и тромболитическими свойствами, однако вид Coprinus lagopides среди них не выявлен.
Известен способ получения молокосвертывающего фермента путем культивирования агарикового макромицета Coprinus lagopides на жидкой питательной среде, содержащей источники углерода, азота и минеральные соли, RU №2354698 С2, C12N 9/58, 10.05.2009.
Известный агариковый макромицет Coprinus lagopides используют в качестве продуцента молокосвертывающего фермента, технология получения этого фермента ограничена назначением и не предусматривает возможности использования его в ином качестве.
Известен штамм базидиального гриба Coprinus domesticus (Fr.) Gray BKM F 2459 D - продуцент фибринолитических и тромболитических ферментов, SU №1137762 A1, C12N 15/00, C12N 9/50, 07.08.1991.
Из известного гриба Coprinus domesticus путем глубинного культивирования продуцента получают ферментный препарат с тромболитической и фибринолитической активностью.
Для выделения известного ферментного препарата депигментацию и обессоливание нативного раствора проводят методом ионообменной хроматографии на смоле ФАФ двухэтапным дробным осаждением этанолом при -20°С в соотношении 1:1 с последующим центрифугированием, осаждением центрифугата при соотношении этанола 1:3 с последующим центрифугированием, растворением осадка, лиофильной сушкой.
Кроме того, в химический состав минерального фона питательной среды входит 8 минеральных солей и в составе использован солодово-ростковой экстракт, требующий трудоемкого приготовления.
Недостаточно эффективная технология культивирования продуцента и низко экономичный способ получения известного ферментного препарата (сложная схема выделения и состав питательной среды) не обеспечивают получение готового продукта с высоким уровнем тромболитической активности, что в условиях in vivo приводит к необходимости использования ферментного препарата в достаточно высоких концентрациях.
Тромболитическое действие известного ферментного препарата из агарикового маромицета Coprinus domesticus проявляется при концентрации 3.0 мг/кг.
Из известных базидиальных грибов рода Coprinus использование макромицета Coprinus lagopides в качестве продуцента ферментов тромболитического и фибринолитического действия не обнаружено.
В основу настоящего изобретения положено решение задачи, позволяющей выявить из базидиальных грибов рода Coprinus вид гриба, продуцирующий ферменты тромболитического и фибринолитического действия.
Технический результат - выявлен вид гриба Coprinus lagopides, обладающий высокой тромболитической и фибринолитической активностью и проявлением в условиях in vivo высокого уровня тромболитического и фибринолитического действия при разных концентрациях ферментного препарата, в том числе и при низких, характеризующийся технологическими приемами способа его получения.
Согласно изобретению эта задача решается за счет того, что ферментный препарат тромболитического и фибринолитического действия из базидиального гриба рода Coprinus характеризуется тем, что он получен путем глубинного культивирования макромицета Coprinus lagopides ТИ-12 или Coprinus lagopides ТИ-32, или Coprinus lagopides ТИ-33 на жидкой питательной среде, отделения мицелиальной биомассы от нативного раствора и концентрирования методом ультрафильтрации с последующим высушиванием ультрафильтрата.
Заявителями не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
За счет реализации отличительных признаков изобретения (в совокупности с признаками, указанными в ограничительной части формулы) достигаются важные новые свойства объекта.
Выявлен из базидиального гриба рода Coprinus макромицет Coprinus lagopides.
Макромицет Coprinus lagopides ТИ-12 или Coprinus lagopides ТИ-32, или Coprinus lagopides ТИ-33 - продуцент фермента с тромболитической и фибринолитической активностью характеризуется технологическими приемами способа его получения.
Заявителям не известны какие-либо публикации, которые содержали бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. В связи с этим, по мнению заявителей, можно сделать вывод о соответствии заявляемого технического решения критерию «изобретательский уровень».
Ферментный препарат тромболитического и фибринолитического действия получен при глубинном культивировании макромицета Coprinus lagopides на жидкой питательной среде.
Агариковый макромицет Coprinus lagopides является ксилотрофным базидиомицетом, растет на богатой лигнином почве, погребенной или обгорелой древесине, прелых опилках и т.п. Этот вид имеет свою экологическую особенность - в отличие от многих других видов рода Coprinus в природных условиях не встречается на субстратах навозного типа. Молодые плодовые тела съедобны.
Культура гриба Coprinus lagopides выделена из плодовых тел вида Coprinus lagopides, собранных в северо-восточной пригородной лесной зоне г.Санкт-Петербурга. Плодовые тела (базидиомы) собраны и индуцированы в чистую культуру на кафедре технологии микробиологического синтеза Санкт-Петербургского государственного технического университета.
Для получения ферментного препарата используют штаммы агарикового макромицета Coprinus lagopides ТИ-12, Coprinus lagopides ТИ-32 и Coprinus lagopides ТИ-33 из коллекции культур высших базидиомицетов кафедры технологии микробиологического синтеза Санкт-Петербургского государственного технического университета.
В коллекции указанные штаммы макромицета Coprinus lagopides ТИ-12, ТИ-32 и ТИ-33 хранятся в стеклянных пробирках на косяках сусло-агара (содержание сахаров 4° по Баллингу, агар 20%) в рефрижераторе при температуре 4-6°С±2°С.
Система вегетативного мицелия макромицета Coprinus lagopides мономитическая: гифы двух типов - недифференцированные генеративные 3-8 мкм в диаметре, длинноклетные, с регулярными небольшими пряжками, гиалиновые и мешковидные гифы, дифференцировавшиеся из них, и идентичные таковым поверхности кутикулы плодовых тел.
При хранении макромицета Coprinus lagopides в лабораторных условиях в пробирках могут появляться небольшие плодовые тела. Морфологические признаки образовавшихся базидиом подтверждают их принадлежность к виду Coprinus lagopides P.Karst. (Watling R. and Gregory N.M., 1987. In: British Fungus Flora. Agarics and Boleti: Part 5. Royal Botanic Garden, Edinburgh, 121 pp), что служит полной гарантией отнесения культур заявленного продуцента к указанному виду агарикового макромицета.
В глубинных условиях биотехнологического процесса макромицет Coprinus lagopides развивается, как и большинство культур базидиальных макромицетов, в виде пушистых пеллет (шариков), средний диаметр которых составляет 5-7 мм. Изменения цвета культуральной жидкости в процессе ферментации не происходит.
Глубинное культивирование агарикового макромицета Coprinus lagopides осуществляют следующим образом.
Культивирование проводят на жидкой полусинтетической глюкозопептонной среде.
В качестве питательной среды может быть использована и натуральная среда, содержащая пивное сусло (4° по Баллингу) и соевую муку (1%), pH среды 5.8-6.0.
В качестве питательной среды могут быть использованы и другие известные питательные среды.
В качестве источника углерода могут быть использованы - глюкоза, пивное сусло, мальтоза и другие ди- и олигосахариды.
В качестве источника азота предпочтение имеет использование пептона и азотнокислого калия, возможно использование аммонийных солей и соевой муки.
В качестве минеральных солей используют KH2PO4, ZnSO4, FeSO4, MgSO4*7H2O, CaCl2, NaCl.
Мицелиальную биомассу отделяют от нативного раствора методом фильтрации под вакуумом.
В нативном растворе определяют фибринолитическую активность.
Определение фибринолитической активности проводят методом количественной оценки содержания активатора плазминогена с помощью набора реагентов «ХромоТех-Плазминоген».
Проводят концентрирование нативного раствора.
Очистку концентрированного нативного раствора осуществляют методом ультрафильтрации.
Для ультрафильтрации используют полупроницаемую мембрану марки «МИФИЛ ПА-20» с величиной номинального молекулярно-массового предела задерживания до 20 kDa (молекулярная масса глобулярных белков, задерживаемых мембраной).
Ультрафильтрат лиофильно высушавают в режиме, предназначенном для белковых соединений.
Количественное содержание белка в сухом ультрафильтрате определяют стандартным методом Лоури.
Определяют фибринолитическую активность сухого ферментного препарата.
В качестве продуцентов ферментных препаратов используют штаммы агарикового макромицета Coprinus lagopides ТИ-12, Coprinus lagopides ТИ-32 и Coprinus lagopides ТИ-33 из коллекции культур высших базидиомицетов кафедры технологии микробиологического синтеза Санкт-Петербургского государственного технического университета.
Пример 1
Получение ферментного препарата культивированием агарикового макромицета Coprinus lagopides ТИ-12 на жидкой питательной среде.
Ферментый препарат получают из культуральной жидкости (нативного раствора) агарикового макромицета Coprinus lagopides ТИ-12, выращенного в условиях глубинного культивирования.
Глубинное культивирование проводят на роторной качалке при 28-30°С в колбах Эрленмейера (0.75 л), содержащих 250 мл питательной среды.
Используют полусинтетическую среду следующего состава (г/л): пептон - 2.5; глюкоза - 10; KH2PO4 - 1.0; MgSO4*7H2O - 0.5; FeSO4 - 0.005; ZnSO4 - 0.001; CaCl2 - 0.05; NaCl - 0.5; сухой дрожжевой экстракт - 2.0; pH среды до стерилизации 5.8-6.0.
Культивирование проводят в течение 4-9 дней.
Зависимость фибринолитической активности нативного раствора от продолжительности культивирования агарикового макромицета Coprinus lagopides ТИ-12 представлена в таблице 1.
Из таблицы 1 видно, что наиболее высокие значения фибринолитической активности нативного раствора наблюдаются на 7-е сутки культивирования.
Мицелиальную биомассу (после 7 суток культивирования) отделяют от нативного раствора методом фильтрации под вакуумом.
В нативном растворе определяют фибринолитическую активность.
Проводят концентрирование нативного раствора в 2 раза и концентрат очищают методом ультрафильтрации.
Ультрафильтрацию проводят на полупроницаемой мембране марки «МИФИЛ ПА-20» с величиной номинального молекулярно-массового предела задерживания 20 kDa.
Концентрированный ультрафильтрат лиофильно высушивают.
Лиофильную сушку проводят на установке "Hita" (США), температура замораживания материала составляла -40°С, температура конденсора -35°С.
Получают ферментный препарат в виде сухого порошка и проводят тестирование его фибринолитической и тромболитической активности.
Пример 2
Получение ферментного препарата культивированием агарикового макромицета Coprinus lagopides ТИ-32 на жидкой питательной среде.
Ферментый препарат получают из культуральной жидкости (нативного раствора) агарикового макромицета Coprinus lagopides ТИ-32, выращенного в условиях глубинного культивирования.
Глубинное культивирование проводят согласно примеру 1.
Зависимость фибринолитической активности нативного раствора от продолжительности культивирования агарикового макромицета Coprinus lagopides ТИ-32 представлена в таблице 2.
Из таблицы 2 видно, что наиболее высокие значения фибринолитической активности нативного раствора наблюдаются на 7-е сутки культивирования.
Мицелиальную биомассу (после 7 суток культивирования) отделяют от нативного раствора методом фильтрации под вакуумом.
В нативном растворе определяют фибринолитическую активность.
Концентрирование нативного раствора и очищение концентрата проводят согласно примеру 1.
Получают ферментный препарат в виде сухого порошка и проводят тестирование его фибринолитической и тромболитической активности.
Пример 3
Получение ферментного препарата культивированием агарикового макромицета Coprinus lagopides ТИ-33 на жидкой питательной среде.
Ферментый препарат получают из культуральной жидкости (нативного раствора) агарикового макромицета Coprinus lagopides ТИ-33, выращенного в условиях глубинного культивирования.
Глубинное культивирование проводят согласно примерам 1,2.
Зависимость фибринолитической активности нативного раствора от продолжительности культивирования агарикового макромицета Coprinus lagopides ТИ-33 представлена в таблице 3.
Из таблицы 3 видно, что наиболее высокие значения фибринолитической активности нативного раствора наблюдаются на 7-е сутки культивирования.
Мицелиальную биомассу (после 7 суток культивирования) отделяют от нативного раствора методом фильтрации под вакуумом.
В нативном растворе определяют фибринолитическую активность.
Концентрирование нативного раствора и очищение концентрата проводят согласно примерам 1, 2.
Получают ферментный препарат в виде сухого порошка и проводят тестирование его фибринолитической и тромболитической активности.
Примеры 1, 2, 3 показали, что максимальные значения фибринолитической активности в нативных растворах агариковых макромицетов Coprinus lagopides ТИ-12, ТИ-32, ТИ-33 достигаются всеми штаммами на 7-е сутки культивирования на глюкозопептонной среде.
Получение ферментного препарата культивированием агарикового макромицета Coprinus lagopides, согласно примерам 1, 2, 3, на жидкой питательной среде по сравнению с ближайшим аналогом обеспечивает:
- модифицирование состава питательной среды за счет сокращения видового состава минерального фона с 8 до 6 минеральных солей и замены солодово-росткового экстракта, требующего тродоемкого приготовления, на дрожжевой экстракт коммерческого производства;
- упрощение и усовершенствование схемы выделения ферментного препарата за счет замены многоступенчатой схемы (депигментация и обессоливание нативного раствора на колонке с анионообменной смолой ФАФ, двухэтапное дробное осаждение этанолом при -20°С в соотношении 1:1, центрифугирование, осаждение центрифугата при соотношении этанола 1:3, центрифугирование, растворение осадка, лиофильная сушка) на современную схему ультрафильтрации нативного раствора через полупроницаемую мембрану марки «МИФИЛ ПА-20», позволяющую удалять низкомолекулярные компоненты и концентрировать раствор, с последующей лиофильной сушкой.
Было проведено культивирование всех указанных штаммов агарикового макромицета Coprinus lagopides на различных питательных средах, при различных степенях концентрирования нативных растворов с целью дальнейшей очистки методом ультрафильтрации на мембране «МИФИЛ ПА-20». В результате штамм Coprinus lagopides ТИ-32, имеющий наиболее высокий уровень фибринолитической активности в исходном нативном растворе, был выбран в качестве продуцента фибринолитического фермента для дальнейшего тестирования активности препарата в условиях in vivo.
Тестирование тромболитической активности полученных ферментных препаратов проводилось в условиях in vivo на моделях венозного и артериального тромбозов у экспериментальных животных (крыс).
В качестве модели венозного тромбоза использована 24-часовая окклюзия задней полой вены.
В качестве модели артериального тромбоза использована модель фототромбоза (30-минутное облучение диодным лазером при длине волны 532 нм и мощности 60 мВт на фоне введения фотосенсибилизатора - бенгальского розового А из расчета 1.7 мг на 100 г веса).
В случае венозного тромбоза тромболитический эффект ферментных препаратов оценивали по влажной и сухой массе тромбов, образовавшихся в полой вене животных.
В случае артериального тромбоза тромболитический эффект оценивали по динамике линейной скорости кровотока (методом высокочастотной ультразвуковой допплерографии на приборе «Минимакс-Допплер-К»).
Исследования проводили на экспериментальных животных (крысы-самцы линии Вистар, возраст 18 недель, масса животных 270-300 г) из питомника лабораторных животных Института физиологии им. И.П.Павлова РАН, Колтуши, Санкт-Петербург.
Экспериментальных животных содержали на неограниченном потреблении корма и воды (стандартный рацион для лабораторных крыс К-120 фирмы «Информ-корм», Россия).
Экспериментальные животные были разделены на контрольную и опытную группы. Контрольная группа включала 6 животных, опытная группа - 9 животных.
Пример 4.
Тестирование фибринолитической активности в условиях экспериментального венозного тромбоза.
Техника тромбоза нижней полой вены.
Экспериментальным животным под наркозом (тиопентал натрия 50 мг/кг, внутрибрюшинно) проводят срединную лапаротомию (5 см). Освобождают от соединительной ткани участок нижней полой вены длиной 3 см в каудальном направлении от места впадения левой почечной вены, подводят под нижнюю полую вену лигатуру и завязывают ее, полностью перекрывая просвет сосуда [Henke PK et al, 2007]. Рану ушивают.
Непосредственно перед операцией животных опытной группы (т=9) предварительно взвешивают и вводят однократно внутривенно ферментный препарат из агарикового макромицета Coprinus lagopides ТИ-32 в дозе 12.5 мг/кг. Животным контрольной группы (n=6) вводят соответствующее количество стерильного 0.9% раствора NaCl.
В серии специально проведенных опытов было подтверждено, что образование тромба имеет место уже через 1 час после перевязки вены.
Период наблюдения составлял одни сутки.
По истечении суток после введения ферментного препарата оценивают степень тромболитического эффекта ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32 по изменению веса тромбов у контрольных и опытных животных.
Выжили все животные.
Через 24 часа после перевязки сосуда животных выводят из эксперимента (тиопентал натрия 150 мг/кг, внутрибрюшинно), после чего вскрывают брюшную полость животных, производят продольный разрез стенки вышеуказанного участка нижней полой вены и извлекают образовавшийся тромб.
Взвешивание проводят на аналитических весах ВЛР-200.
Массу влажного тромба определяют непосредственно после изъятия.
Массу сухого тромба - через 7 суток высушивания при 37°С.
Результаты исследования:
Через 24 часа после операции ниже места перевязки были обнаружены свободные тромбы у всех животных контрольной группы (n=6). У крыс опытной партии (n=9), получивших перед перевязкой вены инъекцию ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32, тромбы обнаружены только у 6 животных, у 3-х животных тромбы отсутствовали полностью.
У животных контрольной группы (n=6) средний вес влажного тромба составлял 30.4 мг, общий вес тромботической массы у животных контрольной группы составлял 182.4 мг.
У животных опытной группы, имевших тромбы (n=6), средний вес влажного тромба составлял 10.7 мг, и общий вес тромботической массы у животных опытной группы составлял 64.2 мг.
Данные исследований, представленные в примере 4, свидетельствуют, что ферментный препарат из агарикового макромицета Coprinus lagopides ТИ-32 обладает как выраженным тромболитическим действием, так и протекторным эффектом (тромбообразование снижается на 76% по сравнению с контролем).
Пример 5.
Тестирование фибринолитической активности в условиях экспериментального артериального тромбоза.
Динамику кровотока у экспериментальных животных определяют методом высокочастотной ультразвуковой допплерографии.
Стадии эксперимента, предшествующие непосредственному тестированию фибринолитической активности при артериальном тромбозе, включают:
Введение фотосенсибилизатора, для чего
- производят под наркозом (тиопентал натрия 50 мг/кг, внутрибрюшинно) разрез длиной около 2 см на внутренней поверхности левого бедра животного;
- освобождают участок бедренной вены от соединительной ткани;
- пунктируют и медленно вводят фотосенсибилизатор - бенгальский розовый А из расчета 1.7 мг на 100 г веса в 1 мл 0.9% раствора хлорида натрия (Boselli С. et al, 2006);
- накладывают на место прокола кусочек гемостатической губки для гемостаза;
- рану ушивают.
Лазерное облучение, для чего
- производят разрез длиной около 2 см на внутренней поверхности правого бедра животного сразу после введения фотосенсибилизатора;
- освобождают участок бедренной артерии длиной около 4 мм от соединительной ткани и выделяют из сосудисто-нервного пучка;
- подводят под данный участок артерии полоску непрозрачного черного пластика шириной 3 мм, изолируя тем самым вену и окружающие ткани от облучения;
- проводят облучение при помощи диодного лазера «DPSS-лазер» (Diode Pumpd Solid State Laser) (длина волны 532 нм, мощность 60 мВт) в течение 30 минут;
- убирают пластик после прекращения облучения;
- ушивают рану.
Контроль скорости кровотока в облучаемом сосуде:
Исследование кровотока в бедренной артерии животных проводят при помощи высокочастотной ультразвуковой допплерографии (прибор «Минимакс-Допплер-К», частота датчика 20 мГц).
Оценивают линейные скорости кровотока непосредственно перед облучением, каждые 5 минут после облучения и через 24 часа после прекращения облучения.
Результаты тестирования фибринолитической активности в условиях артериального тромбоза:
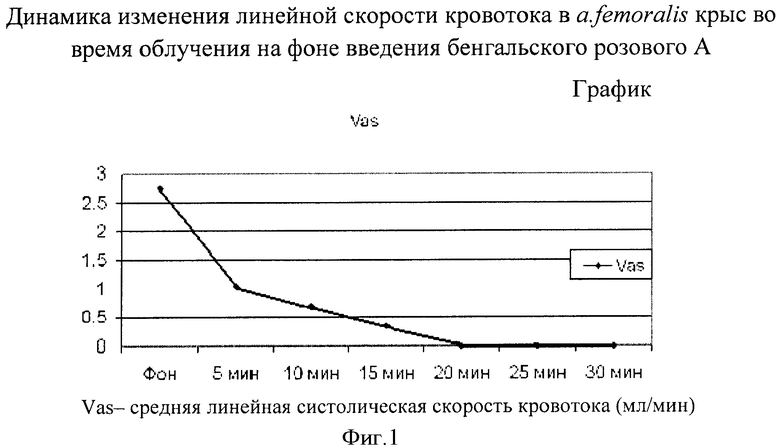
У всех экспериментальных животных (n=17) через 15-20 минут после начала облучения a. femoralis на фоне бенгальского розового А отмечалось снижение и последующее отсутствие кровотока, что свидетельствовало о тромбировании сосуда, как показано на графике (фиг.1).
Через 24 часа после образования тромба кровоток не восстанавливался.
Данная модель фотохимического тромбоза была использована для оценки фибринолитической активности ферментных препаратов, полученных из агарикового макромицета Coprinus lagopides ТИ-32.
Для приготовления раствора для инфузии 10 мг исследуемого ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32 растворяли в 10 мл стерильного 0.9% раствора NaCl.
Через 2 часа после прекращения облучения под наркозом (животные, как правило, не успевают выйти из наркоза, а при необходимости дополнительно вводят тиопентал натрия до 20 мг/кг внутрибрюшинно):
- производят разрез длиной около 2 см на передней поверхности шеи животного;
- освобождают участок яремной вены от соединительной ткани;
- пунктируют и медленно вводят исследуемый препарат в дозе 12.5 мг/кг веса животного, в контрольной группе - соответствующее количество стерильного 0.9% физиологического раствора (NaCl) (использование указанной дозы для начального тестирования активности ферментного препарата в условиях in vivo было обусловлено ориентированием на лечебную суточную дозу препарата стрептокиназы, используемого в медицинской практике при тромбозе человека);
- накладывают на место прокола кусочек гемостатической губки для гемостаза;
- рану ушивают.
Период наблюдения составлял одни сутки.
Через 24 часа после перевязки сосуда животных наркотизировали (тиопентал натрия 50 мг/кг, внутрибрюшинно), после чего вскрывали операционную рану на правом бедре (снимали швы) и проводили допплеровское исследование скорости кровотока на том же участке, как и в день облучения.
У всех экспериментальных животных (n=17) через 15-20 минут после облучения a. femoralis на фоне введения бенгальского розового А образовывался тромб и кровоток не регистрировался. У контрольных крыс (n=12), которым вводили 0.9% раствор NaCl, через 24 часа после образования тромба кровоток не восстанавливался.
В опытной группе животных, которым вводили ферментный препарат (n=5), кровоток восстановился у всех животных, как показано на чертеже (фиг.2).
Дополнительно было проведено следующее наблюдение.
Животных контрольной группы после повторного ушивания раны разделили на 2 группы. Первую группу (n=6) оставили для дальнейшего наблюдения. Крысам второй группы (n=6) ввели внутривенно, по вышеописанной методике исследуемый ферментный препарат из агарикового макромицета Coprinus lagopides ТИ-32. Через 24 часа (т.е. через 48 часов после окончания облучения) провели повторное допплеровское исследование скорости кровотока на том же участке, как и в день облучения. У контрольных животных первой группы (n=6) кровоток не восстанавливался, а у животных, получивших инъекцию ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32 (n=6), наблюдалось восстановление исходного кровотока. Эти данные также подтверждают, что исследуемый ферментный препарат из агарикового макромицета Coprinus lagopides ТИ-32 обладает выраженной тромболитической активностью.
Кроме того, дополнительно на модели артериального тромбоза было проведено тестирование фибринолитической активности исследуемого ферментного препарата при различных его концентрациях.
Тромболитический эффект различных доз ферментного препарата из Coprinus lagopides ТИ-32 представлен в таблице 4.
Результаты таблицы 4 показывают, что у всех животных опытной группы наблюдается практически полное восстановление кровотока, что свидетельствует о сохранении тромболитической активности ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32 даже при уменьшении его дозы до минимального количества 0.5 мг/кг.
Возможности применения ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32 подтверждены на двух разных моделях экспериментального тромбоза и на разных сроках его развития.
Установлено, что внутривенное введение предложенного ферментного препарата из агарикового макромицета Coprinus lagopides ТИ-32 может быть эффективным и безопасным способом лечения артериального и венозного тромбоза.
Тромболитическая и фибринолитическая активность ферментного препарата агарикового макромицета Coprinus lagopides ТИ-32, согласно примерам 4, 5, по сравнению с ближайшим аналогом проверена на современных моделях экспериментального венозного и артериального тромбоза и на разных сроках его развития, тромболитический эффект на этих моделях сохранялся при дозе препарата 0.5 мг/кг (в отличие от ближайшего аналога 3.0 мг/кг).
В ходе экспериментов тромболитические ферментные препараты из агарикового макромицета Coprinus lagopides вводились более чем 100 подопытным животным в дозах от 12.5 мг/кг до 0.5 мг/кг. При этом ни у одного из животных ни в ходе эксперимента, ни месяц спустя не было отмечено никаких изменений в общем состоянии.
Ферментный препарат из агарикового макромицета Coprinus lagopides оказывает профилактическое действие, значительно снижая тромбообразование в местах повреждения сосудистой стенки, и может быть перспективным для изучения возможности его применения для системной тромболитической терапии на поздних сроках.
Предложенный ферментный препарат выявлен при культивировании известного агарикового макромицета из рода Coprinus коллекции культур высших базидиомицетов кафедры технологии микробиологического синтеза Санкт-Петербургского государственного технического университета, а его тромболитическая и фибринолитическая активность подтверждена в эксперименте, проведенном в Санкт-Петербургском государственном медицинском университете им. акад. И.П.Павлова, что обусловливает, по мнению заявителей, соответствие его критерию «промышленная применимость».
Предложенный ферментный препарат характеризуется:
- высокой фибринолитической и тромболитической активностью при использовании в качестве продуцента агарикового макромицета Coprinus lagopides ТИ-12, Coprinus lagopides ТИ-32, Coprinus lagopides ТИ-33;
- проявлением тромболитического эффекта при низких концентрациях ферментного препарата (0.5 мг/кг);
- тестированием на современных моделях экспериментального венозного и артериального тромбоза;
- выделением по упрощенной технологии при модифицировании состава питательной среды за счет сокращения химического состава минерального фона;
- выделением по упрощенной технологии за счет ультрафильтрации через полупроницаемую мембрану, позволяющую одновременно удалять низкомолекулярные балластные компоненты и концентрировать раствор с последующей его лиофильной сушкой.
Ферментный препарат тромболитического и фибринолитического действия из базидиального гриба рода Coprinus
Зависимость фибринолитической активности нативного раствора от продолжительности культивирования агарикового макромицета Coprinus lagopides ТИ-12
Пример 1
Ферментный препарат тромболитического и фибринолитического действия из базидиального гриба рода Coprinus
Зависимость фибринолитической активности нативного раствора от продолжительности культивирования агарикового макромицета Coprinus lagopides ТИ-32
Пример 2
Ферментный препарат тромболитического и фибринолитического действия из базидиального гриба рода Coprinus
Зависимость фибринолитической активности нативного раствора от продолжительности культивирования агарикового макромицета Coprinus lagopides ТИ-33
Пример 3
Ферментный препарат тромболитического и фибринолитического действия из базидиального гриба рода Coprinus
Тромболитический эффект разных доз ферментного препарата из Coprinus lagopides ТИ-32
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРХОЛЕСТЕРИНЕМИИ | 2007 |
|
RU2358782C2 |
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРЛИПИДЕМИИ | 2007 |
|
RU2346699C1 |
| СПОСОБ НЕМЕДИКАМЕНТОЗНОГО СНИЖЕНИЯ ГИПЕРЛИПИДЕМИИ | 2007 |
|
RU2348422C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОЛОКОСВЕРТЫВАЮЩЕГО ФЕРМЕНТА | 2006 |
|
RU2354698C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОЛИТИЧЕСКОГО ФЕРМЕНТА | 2020 |
|
RU2758788C1 |
| Штамм базидиального гриба CopRINUS DомеSтIсUS (FR)GRaY ВКМ F 2459 Д - продуцент фибринолитических и тромболитических ферментов. | 1983 |
|
SU1137762A1 |
| Способ получения фибринолитического фермента | 1980 |
|
SU907070A1 |
| Способ получения молокосвертывающего фермента из биомассы плодовых тел высших грибов | 2022 |
|
RU2815049C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ БЛАГОРОДНЫХ МЕТАЛЛОВ С ПОМОЩЬЮ БАЗИДИАЛЬНЫХ МАКРОМИЦЕТОВ | 2017 |
|
RU2679065C1 |
| ШТАММ ARTHROBOTRYS LONGA MECHT - ПРОДУЦЕНТ ЛОНГОЛИТИНА - КОМПЛЕКСА ФИБРИНОЛИТИЧЕСКИХ И ТРОМБОЛИТИЧЕСКИХ ФЕРМЕНТОВ СО СПЕЦИФИЧЕСКОЙ СПОСОБНОСТЬЮ К АКТИВАЦИИ ПЛАЗМИНОГЕНА И НАРУЖНОЕ СРЕДСТВО ЛЕЧЕНИЯ ТРОМБОЗОВ | 2000 |
|
RU2182596C2 |

Изобретение относится к медико-биологической области биотехнологии. Препарат тромболитического и фибринолитического действия получен при глубинном культивировании на жидкой питательной среде штамма базидиального гриба Coprinus lagopides ТИ-12 или Coprinus lagopides ТИ-32, или Coprinus lagopides ТИ-33, хранящегося в коллекции культур высших базидиомицетов кафедры технологии микробиологического синтеза Санкт-Петербургского государственного технического университета, отделения мицелиальной биомассы от нативного раствора. Проводят концентрирование полученного раствора методом ультрафильтрации с использованием полупроницаемой мембраны с величиной номинального молекулярно-массового предела задерживания до 20 kDa и последующее лиофильное высушивание в режиме, предназначенном для белковых соединений. Изобретение позволило выявить из базидиальных грибов рода Coprinus вид гриба Coprinus lagopides, обладающий высокой тромболитической и фибринолитической активностью. Препарат проявляет в условиях in vivo высокий уровень тромболитической и фибринолитической активности при низких концентрациях. 2 ил., 4 табл.
Ферментный препарат тромболитического и фибринолитического действия из базидиального гриба рода Coprinus, характеризующийся тем, что он получен путем глубинного культивирования макромицета Coprinus lagopides ТИ-12, или Coprinus lagopides ТИ-32, или Coprinus lagopides ТИ-33 на жидкой питательной среде, отделения мицелиальной биомассы от нативного раствора, концентрирования нативного раствора в 2 раза, очистки его методом ультрафильтрации с использованием полупроницаемой мембраны с величиной номинального молекулярно-массового предела задерживания до 20 кДа и лиофильного высушивания в режиме, предназначенном для белковых соединений.
| Штамм базидиального гриба CopRINUS DомеSтIсUS (FR)GRaY ВКМ F 2459 Д - продуцент фибринолитических и тромболитических ферментов. | 1983 |
|
SU1137762A1 |
| ДЕНИСОВА Н.П | |||
| Тромболитические свойства ферментов базидиальных грибов | |||
| Проблемы медицинской микологии, 2009, т.11, №4, с.3-36 | |||
| ДЕНИСОВА Н.П., АЛЕХИНА И.А | |||
| Фибринолитическая активность культур базидиомицетов | |||
| Микология и фитопатология, 1987, т.21 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| BADALYAN S.M., HUGHES K.W., KILES U | |||
| Biology, | |||
Авторы
Даты
2011-12-10—Публикация
2010-05-31—Подача