Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, содержащей гидрогели из производных гиалуроновой кислоты, нагруженные, по меньшей мере, одним эндогенным ферментом, где указанный фермент выбран из группы, состоящей из пролил-эндопептидазы (ПЭП), эндопротеазы (ЭП), и их комбинаций; где указанная композиция предназначена для перорального лечения глютеновой энтеропатии.
Уровень техники
Глютеновая энтеропатия является патологией тонкой кишки, индуцированной глютеном у генетически восприимчивых индивидуумов, даже если факторы окружающей среды также вовлекаются в это комплексное воспалительное заболевание.
Глютен является смесью глиадинов и глютенинов, богатых пролином и глутамином, которые не являются предпочтительными субстратами для ферментов желудочно-кишечного тракта человека. В итоге, глютен не полностью разрушается у человека, с продукцией метастабильных иммуногенных пептидов из 30-40 аминокислот. В частности, последовательность альфа-2-глиадина, типичного белка глютена, расщепляется пепсином в желудке с образованием крупных пептидов, которые в полости тонкой кишки расщепляются панкреатическими протеазами и пептидазами мембраны щеточной каемки тонкой кишки до отдельных аминокислот, ди- и трипептидов для адсорбции. Однако последовательность из 33 аминокислот остается при пищеварении до пересечения эпителиального барьера, и дезаминируется трансглутаминазой-2 (ТГ-2) в избранных глутаминовых остатках. В подлежащей собственной пластинке слизистой оболочки эпитопы, полученные из дезаминированной последовательности из 33 аминокислот, демонстрируют высокую аффинность к человеческому лейкоцитарному антигену (HLA) DQ2. Комплексы дезаминированных глютеновых пептидов-DQ2 на поверхности антиген-презентирующих клеток (АПК) вызывают сильный воспалительный ответ глютен-специфических Т-клеток тонкой кишки, что вызывает разрушение интестинальной архитектуры, нарушение абсорбции нутриентов, диарею и анемию.
Полный рацион, не содержащий глютенов, обеспечивает купирование признаков и симптомов глютеновой энтеропатии у большинства пациентов, и на сегодняшний день является единственным лечением для данной патологии. Очевидно, что из-за повсеместного распространения глютена в рационе человека, это ограничение является трудновыполнимым, и часто связано со снижением качества жизни. Кроме того, безглютеновая диета является очень дорогостоящей; таким образом, помимо неоптимального вкуса, её применению у пациентов часто препятствуют экономические причины.
К сожалению, несоблюдение строгой безглютеновой диеты пациентом, добровольное или вынужденное, вызывает осложнения, такие как остеопороз, вторичные нарушения иммунитета, злокачественные новообразования и т.д., которые могут быть связаны с повышенной заболеваемостью и смертностью.
Таким образом, имеется высокая потребность в терапевтических альтернативах безглютеновой диете, включая, среди прочего, пероральное применение экзогенных пролил-эндопептидаз (ПЭП).
В отличие от ферментов желудочно-кишечного тракта человека, экзогенные ПЭП могут эффективно гидролизовать богатые пролином глютеновые пептиды, и таким образом, предотвращать иммунный ответ.
С этой целью предложены различные ПЭП, такие как ПЭП, полученные из Flavobacterium meninosepticum (FM), Myxococcus xanthus (MX), Sphingomonas capsulata (SC) и Aspergillus niger (AN), с различной последовательностью и длиной цепи, специфичностью и стабильностью в кислой среде или в присутствии протеаз желудочно-кишечного тракта (Bethune MT and Khosla C. «Oral enzyme therapy for celiac sprue». Methods Enzymol. 2012; 502:241-271 («Пероральная ферментная терапия спру-целиакии»)).
Однако для перорального применения этих ферментов необходимо выбрать подходящий состав, обеспечивающий как процесс получения без повреждения фермента, так и его высвобождение в желудке и/или тонкой кишке в активной форме и в эффективной дозе, предпочтительно постепенное и постоянное по времени.
На сегодняшний день нет коммерческих пероральных составов, содержащих ПЭП, но имеется лишь несколько примеров клинических испытаний, таких как с комбинацией, обозначенной как ALV003, из ПЭП SC и ЭП-B2 (эндопротеазы ячменя) (Tye-Din JA, Anderson RP, Ffrench RA, Brown GJ, Hodsman P, Siegel M, Botwick W, Shreeniwas R. «The effects of ALV003 pre-digestion of gluten on immune response and symptoms in celiac disease in vivo». Clin Immunol. 2010; 134:289–95 («Влияние предварительного расщепления глютена с ALV003 на иммунный ответ и симптомы глютеновой энтеропатии in vivo»)).
Однако, как кажется, пероральная ферментная терапия, как установлено к настоящему времени, неспособна к достаточному разрушению иммуногенных эпитопов при обычном ежедневном потреблении глютенов в количестве более 13 г, но скорее позволяет устранить вредное влияние от нескольких сотен миллиграмм до нескольких грамм глютена у пациентов с высокой чувствительностью к глютену или с рефрактерной целиакией 1 типа, или позволяет временно нарушать безглютеновую диету.
Наконец, пероральная терапия, предложенная к настоящему времени, вряд ли требует применения ПЭП с каждым приемом пищи, при котором намеренно или случайно употребляется пищевой глютен.
Таким образом, имеется потребность в данной области техники в улучшенном высвобождении экзогенных ПЭП для применения в пероральном лечении глютеновой энтеропатии, не имеющих недостатков предшествующего уровня техники.
Таким образом, настоящее изобретение нацелено на обеспечение новых составов для перорального применения экзогенного фермента, выбранного из группы, состоящей из пролил-эндопептидазы (ПЭП) и эндопротеазы (ЭП), способных к высвобождению фермента в активной дозировке в желудочно-кишечном тракте и постепенным образом, для обеспечения применения ПЭП и/или ЭП в дозировке один раз в сутки.
Определения и сокращения
ЭДА: этилендиамин
ЭП: эндопротеаза
ГК: гиалуроновая кислота
МА: метакриловый ангидрид
ГК-ЭДА-МА: гиалуроновая кислота, в которой, по меньшей мере, одна гидроксильная группа функционализирована посредством реакции с этилендиамином (ЭДА) и последующей реакции с метакриловым ангидридом (МА)
ПЭП: пролил-эндопептидаза
ПЭП FM: пролил-эндопептидаза, полученная из Flavobacterium meninosepticum
ПЭП МХ: пролил-эндопептидаза, полученная из Myxococcus Xanthus
ПЭП SC: пролил-эндопептидаза, полученная из Sphingomonas capsulate
ПЭП AN: пролил-эндопептидаза, полученная из Aspergillus niger
Раскрытие изобретения
Настоящее изобретение обеспечивает композицию, включающую, по меньшей мере, один экзогенный фермент, где указанный фермент выбран из группы, состоящей из пролил-эндопептидазы (ПЭП), эндопротеазы (ЭП) и их комбинации, где указанный фермент захвачен гидрогелем из фотосшитых метакриловых производных гиалуроновой кислоты (ГК-ЭДА-МА), где производные гиалуроновой кислоты содержат гиалуроновую кислоту (ГК) или её соль с молекулярной массой от 50000 до 1500000 Дальтон, где по меньшей мере одна гидроксильная группа, после активации карбонилирующим агентом, выбранным из фениловых эфиров карбоновых кислот или фениловых эфиров галогенмуравьиной кислоты, функционализирована посредством реакции с этилендиамином (ЭДА) и последующей реакции с метакриловым ангидридом (МА), предпочтительно с применением однореакторного синтеза.
Полученную композицию готовят в виде геля или лиофилизированного порошка.
Фермент, захваченный в гидрогеле, неожиданно оказывается защищенным от разрушения во время процесса лиофилизации, таким образом, обеспечивая получение и стабильность при продолжительном хранении композиции из настоящего изобретения в форме лиофилизированного порошка.
Композиция в соответствии с настоящим изобретением обеспечивает высвобождение экзогенного фермента в имитированных желудочно-кишечных соках длительным образом, и в виде активной формы для детоксикации глиадинового пептида. Таким образом, композиция в соответствии с настоящим изобретением пригодна для применения в лечении глютеновой энтеропатии, и может быть использована для приготовления обычных пероральных лекарственных форм, таких как гранулы, капсулы или таблетки, с кишечнорастворимой оболочкой или без неё, для перорального применения и пролонгированного высвобождения ферментов (ПЭП, ЭП или их комбинации) в активной форме, способной к детоксикации глиадинового пептида у пациентов с глютеновой энтеропатией. Таким образом, предметом обсуждения из настоящего изобретения является фармацевтический пероральный состав, включающий композицию в соответствии с изобретением и, по меньшей мере, другой фармацевтически пригодный ингредиент, где указанный состав предназначен для применения в лечении глютеновой энтеропатии.
Мукоадгезивные свойства исходного полимера, т.е. гиалуроновой кислоты, обеспечивают адгезию к слизистой оболочке желудочно-кишечного тракта и в результате более продолжительное время устойчивости состава, загруженного ферментами (ПЭП, ЭП или их комбинацией) в месте, где необходимо детоксицировать глиадиновый пептид.
Другой задачей настоящего изобретения является способ приготовления метакриловых производных гиалуроновой кислоты, где гидроксильные группы гиалуроновой кислоты функционализированы этилендиамином, а затем метакриловым ангидридом, где указанный способ является однореакторным способом.
Краткое описание фигур
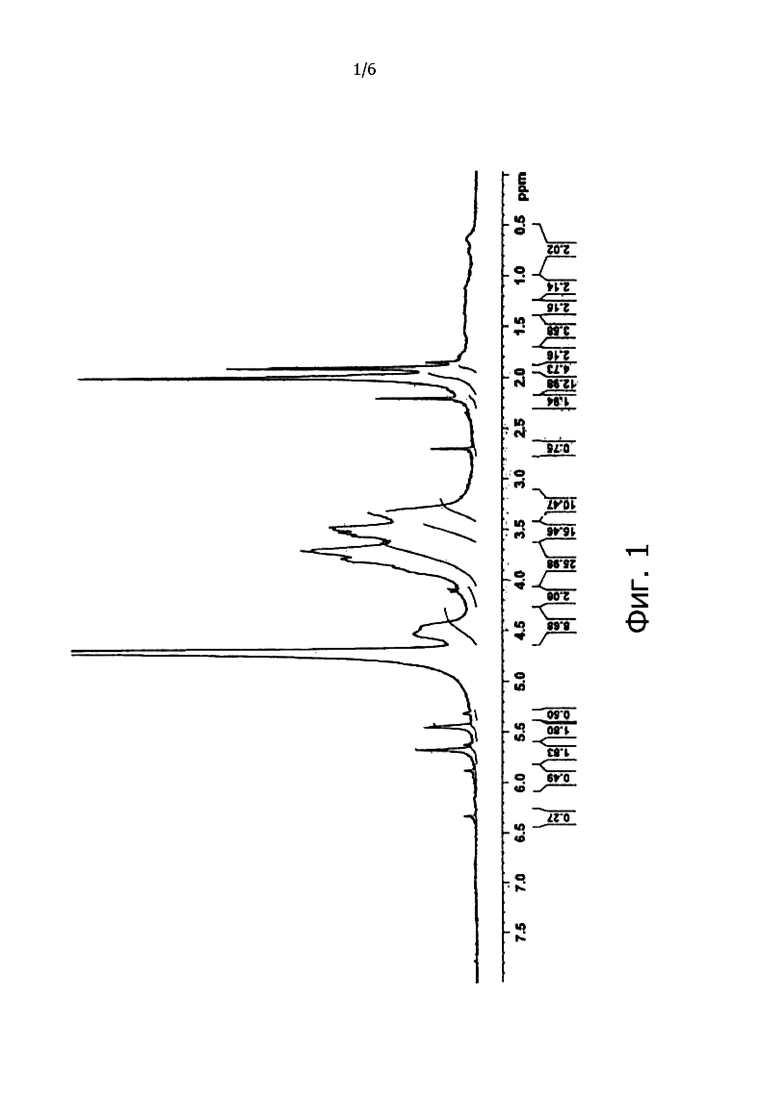
Фигура 1 демонстрирует 1Н-ЯМР спектр производного ГК-ЭДА-МА.
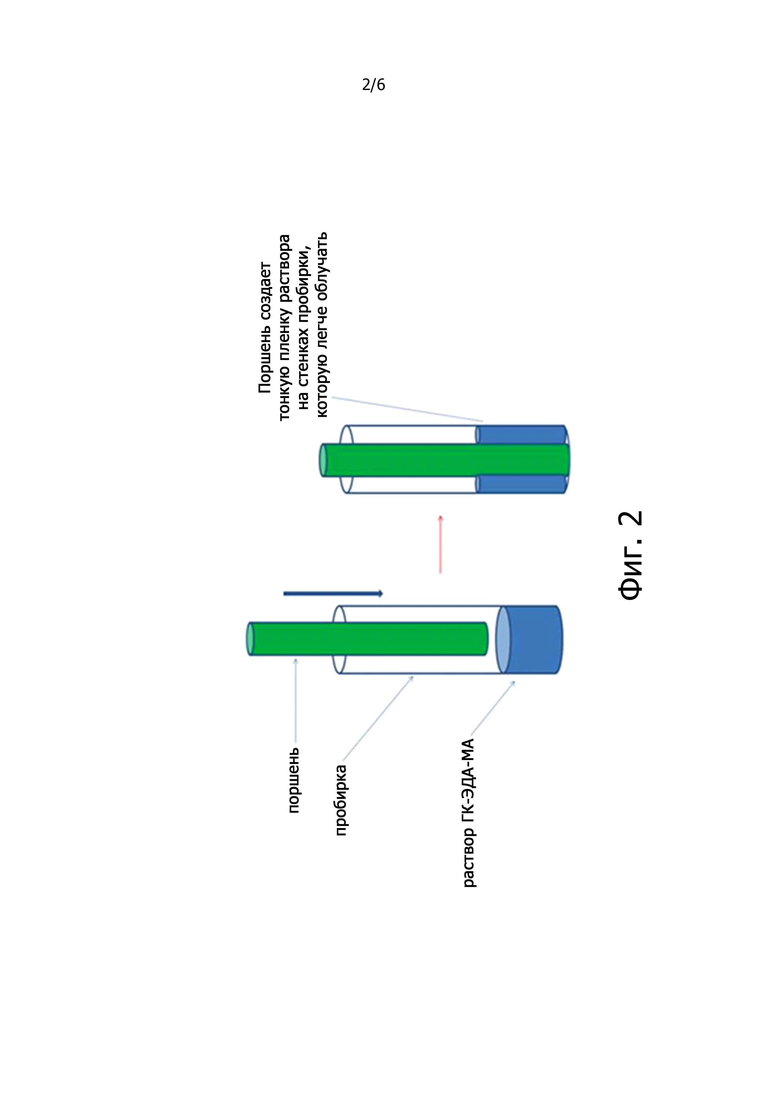
Фигура 2 показывает схему системы из пробирки и поршня Pyrex, используемую для фото-облучения растворов ГК-ЭДА-МА.
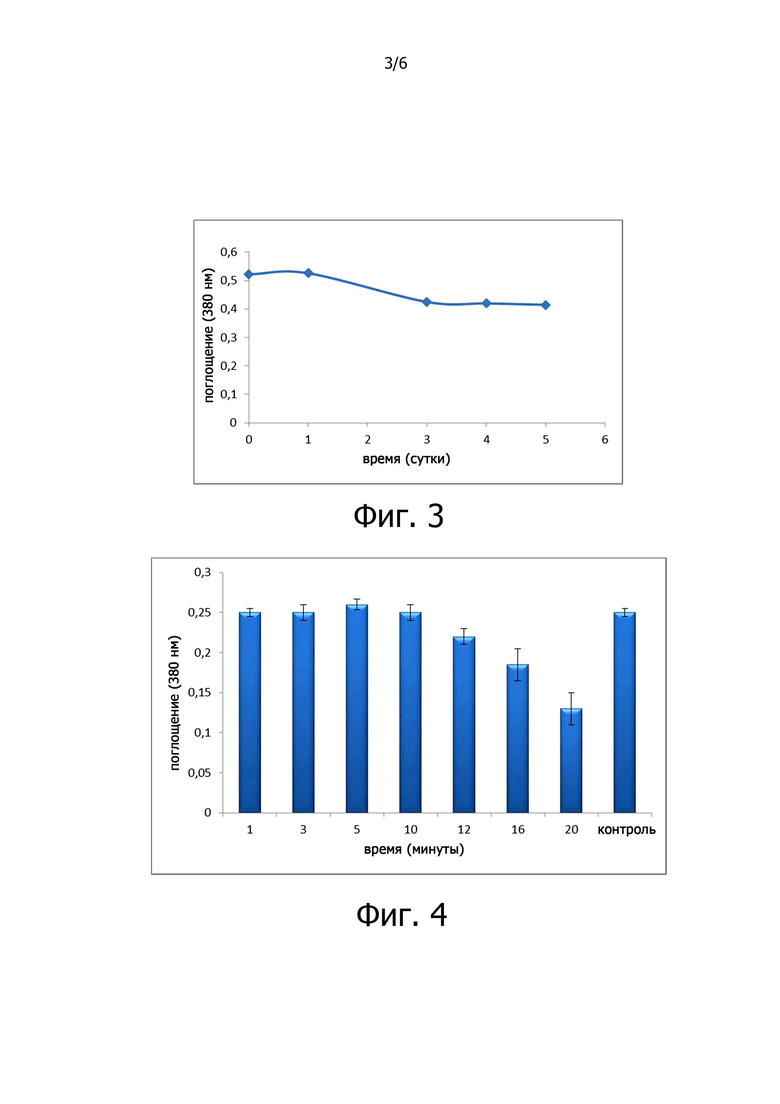
Фигура 3 показывает стабильность ПЭП FM в фосфатном буферном растворе с pH 7,2, выраженную в виде поглощения (ABS) при 380 нм для растворов субстрата (Z-Гли-Про-пНА), обработанных с ферментом при хранении при 4°C до 5 суток.
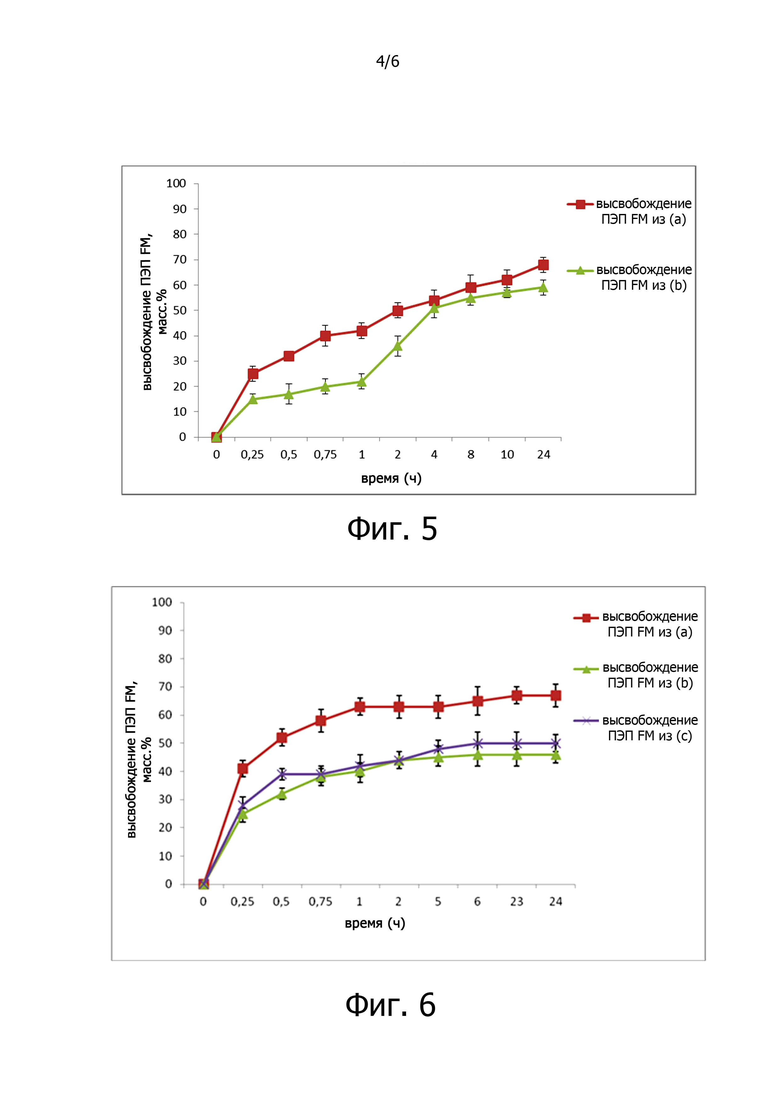
Фигура 4 показывает активность ПЭП FM, выраженную в виде поглощения (ABS) при 380 нм для растворов субстрата (Z-Гли-Про-пНА), обработанных с ферментом после его облучения при 366 нм в течение разного времени.
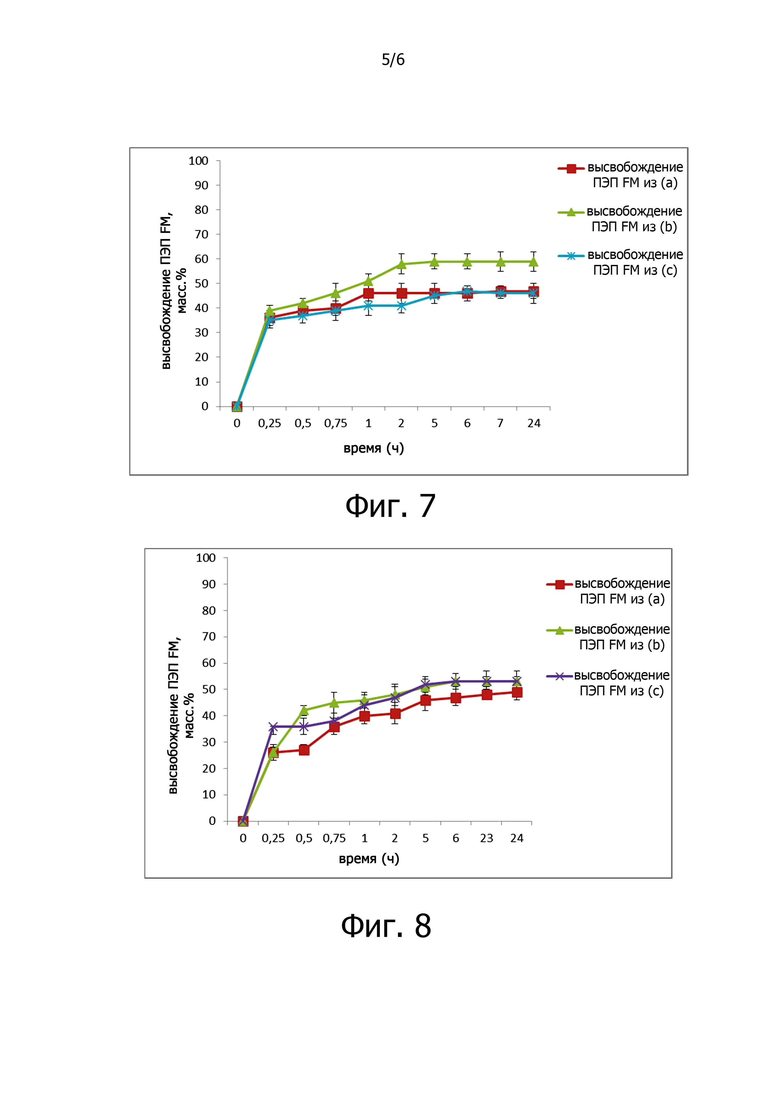
Фигура 5 показывает ПЭП FM, высвободившуюся из ГК-ЭДА-МА гелей, при анализе непосредственно после приготовления (а) и после хранения при 4°C в течение 10 суток (b). Изучение высвобождения проводили в имитированных кишечных соках, рН 7,2, от 0 до 24 часов.
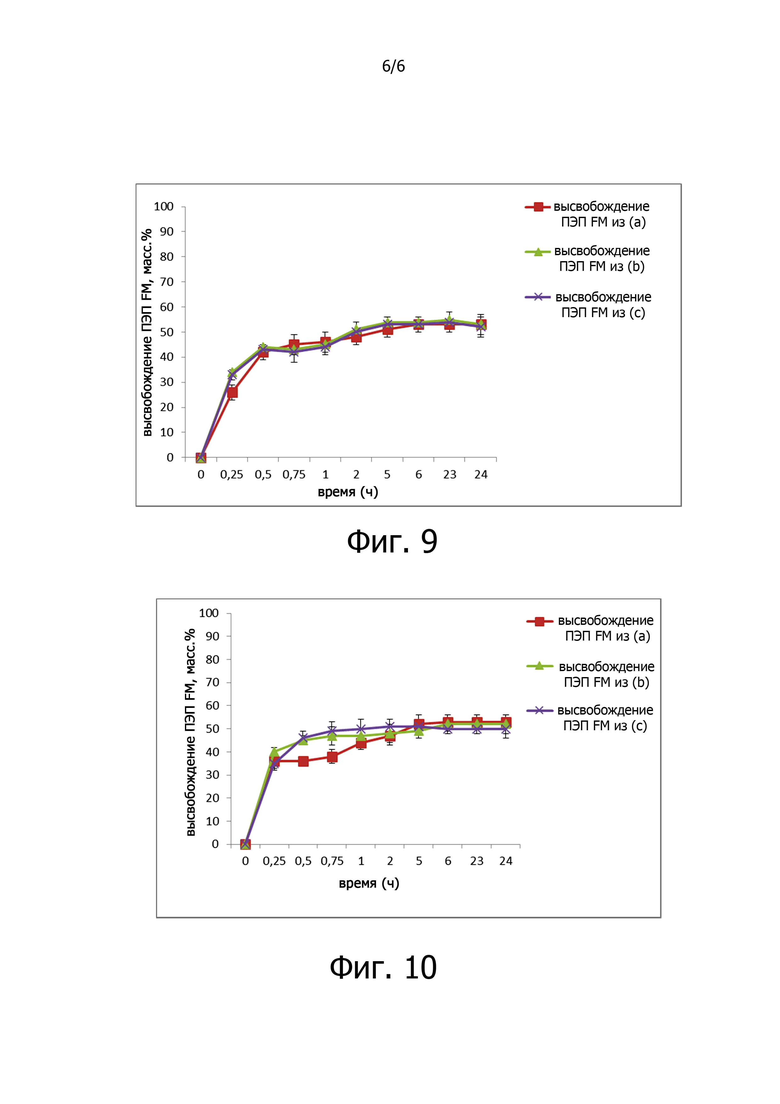
Фигура 6 показывает ПЭП FM, высвободившуюся из ГК-ЭДА-МА лиофилизированных порошков, при анализе непосредственно после приготовления (а), после хранения при 4°C в течение 10 суток (b), и после хранения при -20°С в течение 10 суток (с). Изучение высвобождения проводили в имитированных кишечных соках, рН 7,2, от 0 до 24 часов.
Фигура 7 показывает ПЭП FM, высвободившуюся из ГК-ЭДА-МА лиофилизированных порошков в присутствии 1,5 масс.% трегалозы, при анализе непосредственно после приготовления (а), после хранения при 4°C в течение 10 суток (b), и после хранения при -20°С в течение 10 суток (с). Изучение высвобождения проводили в имитированных кишечных соках, рН 7,2, от 0 до 24 часов.
Фигура 8 показывает ПЭП FM, высвободившуюся из ГК-ЭДА-МА лиофилизированных порошков в присутствии 3 масс.% трегалозы, при анализе непосредственно после приготовления (а), после хранения при 4°C в течение 10 суток (b), и после хранения при -20°С в течение 10 суток (с). Изучение высвобождения проводили в имитированных кишечных соках, рН 7,2, от 0 до 24 часов.
Фигура 9 показывает ПЭП FM, высвободившуюся из ГК-ЭДА-МА лиофилизированных порошков в присутствии 3 масс.% трегалозы, при анализе после хранения при 4°C в течение 10 суток (а), 1 месяца (b) и 2 месяцев (с). Изучение высвобождения проводили в имитированных кишечных соках, рН 7,2, от 0 до 24 часов.
Фигура 10 показывает ПЭП FM, высвободившуюся из ГК-ЭДА-МА лиофилизированных порошков в присутствии 3 масс.% трегалозы, при анализе после хранения при -20°C в течение 10 суток (а), 1 месяца (b) и 2 месяцев (с). Изучение высвобождения проводили в имитированных кишечных соках, рН 7,2, от 0 до 24 часов.
Осуществление изобретения
Производные ГК-ЭДА-МА в соответствии с изобретением показывают степень функционализации в ЭДА и МА, по меньшей мере, от одной гидроксильной группы до всех гидроксильных групп гиалуроновой кислоты.
Производные ГК-ЭДА-МА могут быть фотосшиты посредством фото-облучения при длине волны в диапазоне 180-800 нм, в водном растворе при концентрации от 1% м/о до 20 % м/о, и в присутствии по меньшей мере одного экзогенного фермента, предпочтительно ПЭП, в концентрации от 1 мЕд./мг до 100 Ед./мг полимера.
Производные ГК-ЭДА-МА могут быть фотосшиты посредством фото-облучения при длине волны в диапазоне 180-800 нм, в концентрации от 1% м/о до 20% м/о, а затем загружены посредством контакта полученных гидрогелей с раствором, по меньшей мере, одного экзогенного фермента, предпочтительно ПЭП, с концентрацией от 1 мЕд./мг до 100 Ед./мг полимера.
Производные ГК-ЭДА-МА могут быть фотосшиты в водной среде, предпочтительно посредством УФ облучения при длине волны 366 нм в присутствии экзогенного фермента, предпочтительно пролил-эндопептидазы (ПЭП).
В композиции в соответствии с настоящим изобретением ферментом может быть ПЭП или ЭП, полученная из одного микроорганизма, или фермент может быть комбинацией ПЭП и/или ЭП, полученных из различных микроорганизмов или произведенных посредством биотехнологического способа; любые ПЭП или ЭП, известные в данной области техники, и их комбинация, пригодны для захвата в гидрогеле, в соответствии с настоящим изобретением.
ПЭП можно также приготовить посредством рекомбинантной методики в Е.coli, как описано в Bethune et al., Methods Enzymol. 2012, 502, 241-271, и отмечено в настоящей заявке.
В соответствии с настоящим изобретением, ПЭП предпочтительно получают из микроорганизма, выбранного из группы, состоящей из Flavobacterium meningosepticum (FM), Myxococcus xanthus (MX), Sphingomonas capsulata (SC) или Aspergillus niger (AN).
В соответствии с настоящим изобретением, ЭП предпочтительно является ЭП ячменя, особо предпочтительно ЭП-В2.
Предпочтительно, в соответствии с настоящим изобретением, указанный фермент захватывается в гидрогеле, в гелевой форме, в концентрации от 1 мЕд./мг до 100 Ед./мг полимера.
ГК-ЭДА-МА гидрогели, загруженные ферментами, можно производить в виде гелей.
ГК-ЭДА-МА гидрогели, загруженные ферментами, можно производить в виде лиофилизированного порошка.
Лиофилизацию можно проводить как при отсутствии, так и в присутствии криопротекторов, в концентрации от 0,1 до 10 масс.% по массе полимера; где указанный криопротектор предпочтительно является трегалозой.
ГК-ЭДА-МА гидрогели, загруженные ПЭП (в частности, ПЭП FM), в соответствии с настоящим изобретением, тестировали в анализах высвобождения ПЭП в имитированных желудочно-кишечных соках, после их хранения в течение различного времени (до шести месяцев после приготовления) и при различных температурах (от -20°С до 37°С).
В предыдущем патенте (Giammona, G., Palumbo, F. S., Pitarresi. G., «Method to produce hyaluronic acid functionalized derivatives and formation of hydrogels thereof», WO 2010/061005 A1 («Способ получения функционализированных производных гиалуроновой кислоты, и получение гидрогелей из них»)), сообщалось о синтезе ГК-ЭДА-МА, но включено исходное получение производных ГК-ЭДА-МА, которые после выделения и очистки применяли для последующей реакции с МА; таким образом, сообщалось о двухреакторном синтезе.
Напротив, в настоящем изобретении заявлен однореакторный синтез, который обеспечивает непосредственное получение производных ГК-ЭДА-МА без выделения производных ГК-ЭДА.
Другим предметом обсуждения настоящего изобретения является процедура, предпочтительно однореакторная, для получения метакриловых производных гиалуроновой кислоты, включающая следующие этапы:
(а) обеспечение контакта соли гиалуроновой кислоты (ГК) в полярном апротонном растворителе с карбонилирующим агентом, выбранным из фениловых эфиров карбоновых кислот или фениловых эфиров галогенмуравьиной кислоты, для достижения активации, по меньшей мере, одной гидроксильной группы ГК, где указанная ГК находится в форме соли, растворимой в указанном полярном апротонном органическом растворителе;
(b) обеспечение контакта активированной соли ГК, полученной на этапе (а), с этилендиамином (NH2-CH2-CH2-NH2, указанным как ЭДА), для получения, посредством нуклеофильного замещения, ГК-ЭДА;
(с) обеспечения контакта ГК-ЭДА, полученного на этапе (b), с метакриловым ангидридом (указанным как МА), для получения, посредством нуклеофильного замещения, ГК-ЭДА-МА;
где предпочтительно все вышеуказанные этапы проводят в одном и том же реакторе.
Соль гиалуроновой кислоты, растворимую в органических растворителях, предпочтительно выбирают из тетрабутиламмонийной соли (указанной как ТБА) или цетилтриметиламмонийной соли (указанной как ЦТА).
Полярный апротонный органический растворитель, применяемый для реакций функционализации, предпочтительно выбирают из диметилсульфоксида, диметилформамида, диметилацетамида и их смесей.
Карбонилирующий агент, применяемый на этапе (а), может быть предпочтительно бис(4-нитрофенилкарбонатом) (фениловым эфиром карбоновой кислоты) и/или хлоронитрофенилкарбонатом.
Этап (с) предпочтительно проводят в присутствии катализатора, выбранного из диэтиламина, триэтиламина, диметиламинопиридина, и их смесей.
Все этапы предпочтительно проводят при температуре от 5 до 60°С.
Степень функционализации в ЭА и МА группах, связанных с ГК, может варьировать от лишь одной гидроксильной группы до всех гидроксильных групп ГК, и зависит (прямо пропорциональным образом) от количества карбонилирующего агента, используемого в вышеописанном процессе. Предпочтительно, степень функционализации варьирует от 5 до 95%, более предпочтительно от 20 до 80%.
В соответствии с другим аспектом, настоящее изобретение направлено на производные ГК-ЭДА-МА, имеющие молекулярную массу в диапазоне 50000-1500000 Дальтон, полученные способом, описанным выше.
Далее представлена структурная формула ГК-ЭДА-МА, которая просто представляет тип функционализации (ковалентное связывание), которое происходит, когда гидроксильная группа ГК подвергается вышеописанному процессу.
Отмечается, что указанная структура не предназначена для представления степени функционализации, которая, как установлено выше, вместо этого прямо пропорциональна количеству реактивного карбонилирующего агента, использованного в вышеуказанном способе.
В частности, тип функционализации производных ГК-ЭДА-МА может быть представлен следующей структурой, описывающей две последовательных дисахаридных единицы из исходной гиалуроновой кислоты, где, по меньшей мере, одна гидроксильная группа функционализирована.
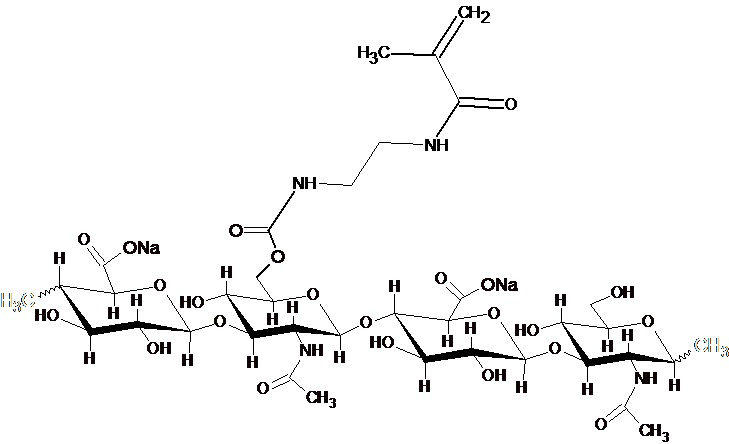 ГК-ЭДА-МА
ГК-ЭДА-МА
В соответствии с другим аспектом, настоящее изобретение направлено на поперечно-сшитые гидрогели, полученные из вышеописанных продуктов, т.е. производные ГК-ЭДА-МА, с применением процедуры фотосшивки, где концентрация вышеупомянутых функционализированных производных в водном или органическом растворе составляет от 1% м/о до 20% м/о. Предпочтительно, гидрогели получают путем облучения с длиной волны от 180 до 800 нм, с радикальным фотоинициатором или без него, со временем облучения от 5 минут до 10 часов.
Такие гидрогели могут быть получены путем гамма-облучения, микроволнового облучения, или путем другого вида ионизирующего облучения.
Такую фотосшивку можно осуществлять также в присутствии подходящих добавок, таких как акриловые и метакриловые мономеры, полиэтиленгликоля метакрилаты и акрилаты, как моно-, так и полифункциональных, или в присутствии других добавок, применяемых для изменения или улучшения пластичности, твердости, гидрофильного и липофильного характера.
В соответствии с другим аспектом, настоящее изобретение направлено на продукцию гидрогелей ГК-ЭДА-МА, полученных посредством фото-облучения и нагруженных экзогенными пролил-эндопептидазами (ПЭП) с концентрацией фермента от 1 мЕд./мг до 100 Ед./мг полимера, во время и/или после процесса облучения.
В соответствии со специфическим аспектом, настоящее изобретение направлено на получение производных ГК-ЭДА-МА, фотосшитых в водной среде, предпочтительно при 366 нм в течение 10 мин, в присутствии экзогенных пролил-эндопептидаз (ПЭП), предпочтительно ПЭП, полученных из Flavobacterium meningosepticum (FM), с концентрацией фермента от 1 мЕд/мг до 100 Ед./мг полимера.
ГК-ЭДА-МА гидрогели, загруженные ПЭП, получают как в виде гелей, так и в виде лиофилизированных порошков при отсутствии или в присутствии криопротекторов, с концентрацией от 0,1 до 10 масс.% по массе полимера.
Полученные гидрогели, нагруженные ПЭП, использовали для экспериментов по высвобождению в имитированных желудочно-кишечных соках непосредственно после получения и после хранения в течение разного времени (до шести месяцев после приготовления) и при различной температуре (от -20°С до 37°С).
Результаты экспериментов показали, что:
- ПЭП FM по отдельности, растворенная в фосфатном солевом растворе с рН 7,2, постепенно теряет свою активность со временем, даже при хранении при низкой температуре, например, 4°С.
- ПЭП FM по отдельности, растворенная в фосфатном солевом растворе с рН 7,2, полностью теряет свою активность после лиофилизации раствора, также в присутствии криопротекторов;
- ПЭП FM по отдельности, растворенная в фосфатном солевом растворе с рН 7,2 и подвергнутая фото-облучению при 366 нм в течение 10 минут, сохраняет свою активность при фото-облучении, но теряет активность полностью после лиофилизации раствора, также в присутствии криопротекторов;
- ПЭП FM, растворенная в фосфатном солевом растворе с рН 7,2 в присутствии производного ГК-ЭДА-МА и подвергнутая фото-облучению при 366 нм в течение 10 минут, сохраняет свою активность также после лиофилизации, как при отсутствии, так и в присутствии криопротекторов;
- Гидрогели ГК-ЭДФ-МА, загруженные ПЭП FM при фото-облучении и полученные в виде гелей, при анализе непосредственно после приготовления способны к высвобождению устойчивым образом примерно 70% фермента в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов. Количество ПЭП FM, остающейся в ГК-ЭДА-МА гелях, полностью сохраняет свою активность.
- Гидрогели ГК-ЭДФ-МА, загруженные ПЭП FM при фото-облучении и полученные в виде гелей, при анализе после хранения при 4°С в течение 10 суток, способны к высвобождению устойчивым образом примерно 60% фермента в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов, и только частично теряли активность (примерно 20%).
- Гидрогели ГК-ЭДФ-МА, загруженные ПЭП FM при фото-облучении при отсутствии криопротекторов и полученные в виде лиофилизированных порошков, при анализе непосредственно после приготовления способны к высвобождению устойчивым образом примерно 70% фермента в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов. Количество ПЭП FM, остающейся в ГК-ЭДА-МА гелях, полностью сохраняет свою активность.
- Гидрогели ГК-ЭДФ-МА, загруженные ПЭП FM при фото-облучении при отсутствии криопротекторов и полученные в виде лиофилизированных порошков, при анализе после хранения при 4°С или при -20°С в течение 10 суток способны к высвобождению устойчивым образом примерно 50% фермента в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов, и только частично теряют свою активность (примерно 30%). Это очень хороший результат, поскольку ПЭП FM по отдельности, т.е. при отсутствии ГК-ЭДА-МА гидрогеля, полностью теряет свою активность после лиофилизации.
- Гидрогели ГК-ЭДФ-МА, загруженные ПЭП FM при фото-облучении в присутствии трегалозы (в качестве примера криопротектора) в количестве 1,5 масс.% по массе полимера, и полученные в виде лиофилизированных порошков, при анализе непосредственно после приготовления способны к высвобождению устойчивым образом примерно 60% фермента в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов. Количество ПЭП FM, остающейся в ГК-ЭДА-МА гелях, полностью сохраняет свою активность.
Если образцы хранили при 4°С в течение 10 суток, они все еще были способными к высвобождению устойчивым образом примерно 50% ПЭП FM в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов, и только частично теряли свою активность (около 30%).
Если образцы хранили при -20°С в течение 10 суток, они все еще были способными к высвобождению устойчивым образом примерно 50% ПЭП FM в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов, и полностью сохраняли активность ПЭП FM.
- Гидрогели ГК-ЭДФ-МА, загруженные ПЭП FM при фото-облучении в присутствии трегалозы (в качестве примера криопротектора) в количестве 3 масс.% по массе полимера, и полученные в виде лиофилизированных порошков, при анализе непосредственно после приготовления способны к высвобождению устойчивым образом примерно 50% фермента в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов. Количество ПЭП FM, остающейся в ГК-ЭДА-МА гелях, полностью сохраняет свою активность.
Если образцы хранили при 4°С или -20°С в течение 1 и 2 месяцев, они все еще были способными к высвобождению устойчивым образом примерно 50% ПЭП FM в имитированном кишечном соке с рН 7,2, в активной форме до 24 часов, и полностью сохраняли активность ПЭП FM.
Таким образом, в соответствии с вышеуказанными результатами, композиция в соответствии с настоящим изобретением, приготовленная посредством фото-облучения ГК-ЭДА-МА гидрогелей в присутствии ПЭП FM и криопротектора в подходящей концентрации, способна к полной защите активности фермента во время процесса лиофилизации.
ПЭП FM, нагруженные на ГК-ЭДА-МА гидрогели, полученные в виде лиофилизированных порошков, полностью сохраняют свою активность при хранении в течение разного времени и при разной температуре, и высвобождаются в активной форме в имитированном кишечном соке с рН 7,2 до 24 часов из ГК-ЭДА-МА гидрогелей.
Следуя тому же самому подходу, который применялся для нагрузки ПЭП FM, настоящее изобретение направлено на ГК-ЭДА-МА гидрогели, нагруженные другими экзогенными ферментами, выбранными из группы, состоящей из пролил-эндопептидазы (ПЭП), такой как ПЭП из Myxococcus xanthus (MX), ПЭП из Sphingomonas capsulata (SC) или ПЭП из Aspergillus niger (AN), и эндопротеазы (ЭП), каждая из которых может применяться по отдельности или в комбинации с ПЭП FM, или с другими из них, или с другими ферментами.
В заключение, ГК-ЭДА-МА гидрогели способны:
- к защите нагруженных ферментов при процессе лиофилизации;
- к защите нагруженных ферментов от повреждения при хранении лиофилизированных порошков, в целом в присутствии криопротекторов;
- к обеспечению высвобождения ферментов в имитированном желудочном соке (для ферментов, активных в кислой среде) и в имитированном кишечном соке (для всех ферментов) в активной форме устойчивым образом;
- к применению для приготовления обычной пероральной лекарственной формы, такой как гранулы, капсулы и таблетки, с кишечнорастворимой оболочкой или без неё, для перорального применения и высвобождения ферментов в активной форме, способной к детоксикации глиадинового пептида у больных глютеновой энтеропатией.
Изобретение далее иллюстрировано с помощью следующих примеров, предназначенных для облегчения понимания изобретения, и не предназначенных для специального ограничения изобретения, как описано и заявлено в настоящей заявке.
Эксперименты
Пример 1
Приготовление производного ГК-ЭДА-МА путем синтеза в одном реакторе (однореакторного)
1 г тетрабутиламмонийной соли гиалуроновой кислоты (ГК-ТБА), приготовленной путем нейтрализации раствора гиалуроновой кислоты с применением раствора тетрабутиламмония гидроксида, растворяли в 90 мл безводного диметилсульфоксида (ДМСО) (средневесовая молекулярная масса гиалуроновой кислоты 260 кДа).
Подходящее количество бис(4-нитрофенил) карбоната (4-НФБК), выбранное для получения молярного отношения 4-НФБК/ повторяющиеся единицы ГК-ТБА, равного 0,5, растворяли в 10 мл безводного ДМСО; этот раствор добавляли по каплям в раствор ГК-ТБА при 40°С при перемешивании. Спустя 4 часа 175 мкл этилендиамина (ЭДА) добавляли по каплям, и раствор выдерживали при 40°С в течение еще 3 часов.
Добавляли подходящий объем (900 мкл) метакрилового ангидрида (МА) для получения восьмикратного молярного избытка, по сравнению с молями аминогрупп на ГК-ТБА-ЭДА, затем добавляли 105 мкл катализатора триэтиламина (ТЭА), и итоговый раствор выдерживали 24 часа при 40°С.
Проведение реакции осуществляли вначале добавлением 10 мл насыщенного раствора NaCl, и смесь оставляли на 30 минут при перемешивании при комнатной температуре. Затем реакционный раствор осаждали этанолом, и продукт промывали несколько раз раствором этанола/бидистиллированной воды (9:1) до получения продукта без промежуточных продуктов реакции и NaCl. Полученное твердое вещество обозначали как производное ГК-ЭДА-МА. На Схеме 1 показана однореакторная процедура, используемая для приготовления производного ГК-ЭДА-МА.
Схема 1. Реакция функционализации тетрабутиламмонийной соли гиалуроновой кислоты (ГК-ТБА) с этилендиамином (ЭДА) и метакриловым ангидридом (МА) для получения производного ГК-ЭДА-МА путем однореакторной процедуры.
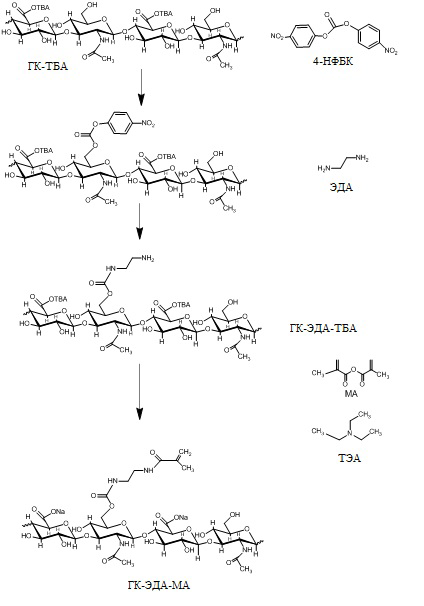
Производное ГК-ЭДА-МА при анализе посредством 1H-ЯМР (см. фигуру 1) показало следующие пики (D2O): δ 1,9 (s, -CO-CH=CH-CH3); δ 2,0 (s, -NH-CO-CH3); δ 5,5 и 5,7 (m, -CO-CH=CH-CH3).
Степень функционализации оценивали путем сравнения площадей пиков δ 5,5 и 5,7, связанных с виниловыми протонами метакриловой группы, с площадью пика δ 1,9, связанного с метиловой группой N-ацетилглюкозаминовой части повторяющихся единиц ГК. Степень функционализации метакриловых групп, связанных с повторяющимися единицами ГК-ЭДА, приводила к 50 моль%; пик, принадлежащий к свободным аминогруппам ЭДА, отсутствовал, т.е. при δ 3,1 (m, CO-NH-CH2-CH2-NH2) все аминогруппы были дериватизированы метакриловым ангидридом.
Пример 2
Фотосшивка производного ГК-ЭДА-МА
30 мг производного ГК-ЭДА-МА, полученного в примере 1, растворяли в 500 мкл 0,5 М фосфатного буферного раствора с рН 7,2 при комнатной температуре, до получения итоговой концентрации 6% м/о, и дегазировали под вакуумом. Затем раствор помещали в пробирку Pyrex и облучали с применением УФ фотореактора Rayonet при длине волны 366 нм в течение 10 минут (см. фигура 2). Спустя это время полученный гель извлекали в виде геля или лиофилизировали до получения порошка.
Пример 3
Оценка активности ПЭП FМ
Активность ПЭП, полученной из Flavobacterium meninosepticum (FM), определяли посредством колориметрического анализа, в котором фермент реагирует со своим специфическим субстратом, т.е. карбобензокси-Гли-Про-п-нитроанилидом (Z-Гли-Про-пНА).
В частности, 0,25 мл 2 мМ Z-Гли-Про-пНА в 40% диоксане смешивали с 1,0 мл 0,1 М фосфатного буферного раствора с рН 7,2, и раствор предварительно инкубировали в течение 5 минут при 30°С. Спустя это время, добавляли 0,1 мл фермента в 0,05 М фосфатном буферном растворе с рН 7,2 и инкубировали в течение 10 минут при 30°С; реакцию останавливали путем добавления 2,0 мл раствора Тритон-Х100 (10 г Тритон-Х100/95 мл 1М ацетатного буфера, рН 4,0).
Поглощение полученного продукта определяли при 380 нм.
Одна единица ферментативной активности определяется как активность фермента, производящая 1 мкмоль п-нитроанилина в минуту при 30°С, рН 7,2, из Z-Гли-Про-пНА.
Пример 4
Стабильность ПЭП FM в фосфатном буферном растворе с рН 7,2 в зависимости от времени
Готовили аликвоты (1,0 мл) 0,2 Ед./мл ПЭП FM в 0,05 М фосфатном буферном растворе с рН 7,2 и хранили в холодильнике при 4°С в течение 5 дней для оценки стабильности при хранении. Спустя 1, 2, 3, 4 и 5 суток оценивали активность фермента посредством колориметрического анализа, как показано в примере 3. Каждый пример проводили в трех повторностях. Результаты показаны на фигуре 3.
Пример 5
Лиофилизация ПЭП FM в фосфатном буферном растворе с рН 7,2 и оценка её активности
Лиофилизировали 1 мл 0,2 Ед./мл ПЭП FM в 0,05 М фосфатном буферном растворе с рН 7,2 при отсутствии или в присутствии трегалозы (7,5 мкг/мл или 15 мкг/мл). Затем оценивали активность фермента посредством колориметрического анализа, как описано в примере 3. Каждый эксперимент проводили в трех повторностях. Во всех случаях не отмечалось активности.
Пример 6
Фото-облучение ПЭП FM в фосфатном буферном растворе с рН 7,2, и оценка её активности
Проводили фото-облучение 1 мл 0,2 Ед./мл ПЭП FM в 0,05 М фосфатном буферном растворе с рН 7,2 при длине волны, равной 366 нм, в течение различного времени (от 1 до 20 минут).
После каждого времени облучения оценивали активность фермента посредством колориметрического анализа, как описано в примере 3.
Анализ активности также проводили с не облученными растворами ферментов, используемыми в качестве положительного контроля. Каждый пример проводили в трех повторностях. Результаты показаны на фигуре 4.
Пример 7
Лиофилизация ПЭП FM в фосфатном буферном растворе с рН 7,2 после её фото-облучения, и оценка её активности
1 мл 0,2 Ед./мл ПЭП FM в 0,05 М фосфатном буферном растворе (ФБР) с рН 7,2 подвергали фото-облучению при длине волны 366 нм в течение 10 минут.
Облученный раствор лиофилизировали, и оценивали активность фермента колориметрическим анализом, как описано в примере 3.
Эксперимент проводили в трех повторностях, и во всех случаях не было выявлено активности.
Пример 8
Лиофилизация ПЭП FM в фосфатном буферном растворе с рН 7,2 после её фото-облучения в присутствии трегалозы, и оценка её активности
200 мкл 0,2 Ед./мл ПЭП FM в 0,05 М фосфатном буферном растворе с рН 7,2 смешивали с 800 мкл трегалозы 15 мкг/мл в 0,05 М фосфатном буферном растворе с рН 7,2. Этот раствор подвергали фото-облучению при длине волны 366 нм в течение 10 минут.
Облученный раствор лиофилизировали, и оценивали активность фермента колориметрическим анализом, как описано в примере 3.
Эксперимент проводили в трех повторностях, и во всех случаях не было выявлено активности.
Пример 9
Приготовление ГК-ЭДА-МА геля, загруженного ПЭП FM
30 мг производного ГК-ЭДА-МА растворяли в 400 мкл 0,05 М фосфатного буферного раствора с рН 7,2. Этот раствор дегазировали под вакуумом, а затем добавляли 100 мкл 0,4 Ед./мг ПЭП FM в 0,05 М фосфатном буферном раствора с рН 7,2. Итоговая концентрация полимера составила 6% м/о. Раствор подвергали фото-облучению при длине волны 366 нм в течение 10 минут.
Полученный ГК-ЭДА-МА гель, нагруженный ПЭП FM, анализировали непосредственно после приготовления или после хранения при 4°С в течение 10 суток. Каждый эксперимент проводили в трех повторностях.
Пример 10
Приготовление ГК-ЭДА-МА гидрогеля в виде лиофилизированного порошка, загруженного ПЭП FM
Готовили ГК-ЭДА-МА гидрогель, загруженный ПЭП FM с 0,4 Ед./мг полимера, как описано в примере 9.
После фото-облучения полученный гидрогель лиофилизировали, затем анализировали непосредственно после приготовления или после хранения в течение 10 суток при 4°С или при -20°С. Каждый эксперимент проводили в трех повторностях.
Пример 11
Приготовление ГК-ЭДА-МА гидрогеля в виде лиофилизированного порошка, загруженного ПЭП FM, в присутствии 1,5 масс.% трегалозы
30 мг производного ГК-ЭДА-МА растворяли в смеси 350 мкл 0,05 М фосфатного буферного раствора с рН 7,2 и 100 мкл 4,5 мг/мл трегалозы в 0,05 М фосфатном буферном растворе с рН 7,2. Этот раствор дегазировали под вакуумом, а затем добавляли 50 мкл 0,4 Ед./мг ПЭП FM в 0,05 М фосфатном буферном раствора с рН 7,2. Итоговая концентрация полимера составила 6% м/о. Раствор подвергали фото-облучению при длине волны 366 нм в течение 10 минут.
После облучения полученный гидрогель лиофилизировали, затем анализировали непосредственно после приготовления или после хранения при 4°С или при -20°С в течение 10 суток. Каждый эксперимент проводили в трех повторностях.
Пример 12
Приготовление ГК-ЭДА-МА гидрогеля в виде лиофилизированного порошка, загруженного ПЭП FM, в присутствии 3 масс.% трегалозы
30 мг производного ГК-ЭДА-МА растворяли в смеси 350 мкл 0,05 М фосфатного буферного раствора с рН 7,2 и 100 мкл 9 мг/мл трегалозы в 0,05 М фосфатном буферном растворе с рН 7,2. Этот раствор дегазировали под вакуумом, а затем добавляли 50 мкл 0,4 Ед./мг ПЭП FM в 0,05 М фосфатном буферном раствора с рН 7,2. Раствор подвергали фото-облучению при длине волны 366 нм в течение 10 минут.
После облучения полученный гидрогель лиофилизировали, затем анализировали непосредственно после приготовления или после хранения в течение 10 суток, 1 или 2 месяцев при 4°С или при -20°С. Каждый эксперимент проводили в трех повторностях.
Пример 13
Изучение высвобождения в имитированном кишечном соке с рН 7,2 из образца из примера 9
Аликвоты (15 мг) загруженного ПЭП FM ГК-ЭДА-МА геля помещали в пробирки, содержащие 10 мл имитированного кишечного сока с рН 7,2 на 24 часа (100 об./мин, 37°С). С предварительно заданными интервалами времени отбирали 0,15 мл среды высвобождения, и анализировали путем определения ферментативной активности, как описано в примере 3. Добавляли равный объем свежей среды, и поддерживали условия достаточного разбавления во время эксперимента. Количество фермента определяли с применением калибровочной кривой (y = 1,5836 x + 0,0537, r2=0,9981). Каждый эксперимент проводили в трех повторностях.
Определение количества фермента, остающегося в ГК-ЭДА-МА геле спустя 24 часа, осуществляли путем применения анализа для определения ферментативной активности, но в этом случае субстрат Z-Гли-Про-пНА помещали непосредственно в контакт с гелем.
В частности, 15 мг геля, используемого для исследований высвобождения, добавляли к 0,5 мл имитированного кишечного сока с рН 7,2 и 4,0 мл 0,1 М фосфатного буферного раствора с рН 7,2, затем образец инкубировали при 100 об./мин, 37°С в течение 24 часов. Спустя это время, 1,25 мл 2 мМ Z-Гли-Про-пНА в 40% диоксане смешивали с 1,0 мл 0,1 М фосфатного буферного раствора с рН 7,2, и полученный раствор предварительно инкубировали в течение 5 минут при 30°С, затем его добавляли к гелю, и инкубировали в течение 10 минут при 30°С; реакцию останавливали путем добавления 20 мл раствора Тритон-Х100 (10 г Тритон-Х100/95 мл 1М ацетатного буфера, рН 4,0).
Поглощение полученного продукта измеряли в при 380 нм. Каждый эксперимент проводили в трех повторностях. Результаты экспериментов по высвобождению показаны на фигуре 5.
Пример 14
Исследования высвобождения в имитированном кишечном соке с рН 7,2 из образца из примера 10
Исследования высвобождения ПЭП FM из ГК-ЭДА-МА гидрогеля в виде лиофилизированного порошка, нагруженного ПЭП FM при отсутствии криопротектора (пример 10), проводили, как описано в примере 13. Результаты исследований высвобождения показаны на фигуре 6.
Пример 15
Исследования высвобождения в имитированном кишечном соке с рН 7,2 из образца из примера 11
Исследования высвобождения ПЭП FM из ГК-ЭДА-МА гидрогеля в виде лиофилизированного порошка, нагруженного ПЭП FM в присутствии трегалозы (1,5 масс.%) (пример 11), проводили, как описано в примере 13. Результаты исследований высвобождения показаны на фигуре 7.
Пример 16
Исследования высвобождения в имитированном кишечном соке с рН 7,2 из образца из примера 12
Исследования высвобождения ПЭП FM из ГК-ЭДА-МА гидрогеля в виде лиофилизированного порошка, нагруженного ПЭП FM в присутствии трегалозы (3 масс.%) (пример 12), проводили, как описано в примере 13. Результаты исследований высвобождения показаны на фигурах 8, 9 и 10.
Группа изобретений относится к области фармацевтики и раскрывает композицию и фармацевтический состав, а также способ приготовления указанной композиции. Композиция характеризуется тем, что содержит гидрогели из функционализированных производных гиалуроновой кислоты, загруженные экзогенными ферментами, выбранными из группы, состоящей из пролил-эндопептидазы (ПЭП) и эндопротеазы (ЭП). Способ приготовления композиции включает фотосшивку производных гиалуроновой кислоты посредством фото-облучения в водном растворе в присутствии или в отсутствие экзогенного фермента, выбранного из группы, состоящей из пролил-эндопептидазы (ПЭП), эндопротеазы (ЭП). Композиция обеспечивает защиту ферментов от повреждения в присутствии криопротекторов, высвобождение ферментов в активной форме в имитированных желудочно-кишечных соках и может быть использована для получения пероральных лекарственных форм для лечения глютеновой энтеропатии. 3 н. и 7 з.п. ф-лы, 10 ил., 16 пр.
1. Композиция для перорального лечения глютеновой энтеропатии, содержащая, по меньшей мере, один экзогенный фермент, выбранный из группы, состоящей из пролил-эндопептидазы (ПЭП), эндопротеазы (ЭП) и их комбинации, где указанный фермент захвачен в гидрогеле из фотосшитых метакриловых производных гиалуроновой кислоты (ГК-ЭДА-МА), где производные гиалуроновой кислоты содержат гиалуроновую кислоту (ГК) или её соль, с молекулярной массой от 50000 до 1500000 Да, где, по меньшей мере, одна гидроксильная группа после активации с карбонилирующим агентом, выбранным из фениловых эфиров карбоновых кислот или фениловых эфиров галогенмуравьиной кислоты, функционализирована посредством реакции с этилендиамином (ЭДА) и последующей реакции с метакриловым ангидридом (МА).
2. Композиция по п. 1, где указанный фермент захвачен в гидрогеле, в концентрации от 1 мЕд./мг до 100 Ед./мг полимера.
3. Композиция по любому из пп. 1, 2 в форме геля.
4. Композиция по любому из пп. 1, 2 в форме лиофилизированного порошка.
5. Композиция по п. 4, дополнительно содержащая по меньшей мере криопротектор в концентрации от 0,1 до 10 масс.% по массе полимера; где указанным криопротектором предпочтительно является трегалоза.
6. Композиция по 1, где экзогенный фермент представляет собой ПЭП, которая получена из микроорганизма, выбранного из группы, состоящей из Flavobacterium meningosepticum (FM), Myxococcus xanthus (MX), Sphingomonas capsulata (SC) или Aspergillus niger (AN) или их комбинации, где ЭП является эндопротеазой из ячменя.
7. Фармацевтический состав для перорального лечения глютеновой энтеропатии, включающий композицию по любому из пп. 1-6.
8. Способ приготовления композиции по п. 1, включающий фотосшивку производных ГК-ЭДА-МА посредством фотооблучения при длине волны в диапазоне 180-800 нм в водном растворе при концентрации от 1% м/о до 20% м/о,
- где указанную фотосшивку проводят в присутствии по меньшей мере одного экзогенного фермента в концентрации от 1 мЕд./мг до 100 Ед./мг полимера; или
- где указанную фотосшивку проводят при отсутствии экзогенного фермента, который затем нагружают путем контакта полученных гидрогелей с раствором экзогенного фермента в концентрации от 1 мЕд./мг до 100 Ед./мг полимера;
- где указанный фермент выбран из группы, состоящей из пролил-эндопептидазы (ПЭП), эндопротеазы (ЭП) и их комбинации;
- где производные ГК-ЭДА-МА содержат гиалуроновую кислоту (ГК) или её соль, с молекулярной массой от 50000 до 1500000 Да, где, по меньшей мере, одна гидроксильная группа функционализирована посредством реакции с этилендиамином (ЭДА) и последующей реакции с метакриловым ангидридом (МА).
9. Способ по п. 8, включающий приготовление производных ГК-ЭДА-МА в соответствии со следующими этапами:
(а) обеспечение контакта соли гиалуроновой кислоты (ГК) в полярном апротонном растворителе с карбонилирующим агентом, выбранным из фениловых эфиров карбоновых кислот или фениловых эфиров галогенмуравьиной кислоты, до достижения активации, по меньшей мере, одной гидроксильной группы ГК, где указанная ГК находится в форме соли, растворимой в указанном полярном апротонном органическом растворителе;
(b) обеспечение контакта активированной соли ГК, полученной на этапе (а), с этилендиамином (NH2-CH2-CH2-NH2 - ЭДА) для получения, посредством нуклеофильного замещения, ГК-ЭДА;
(с) обеспечение контакта ГК-ЭДА, полученного на этапе (b), с метакриловым ангидридом (МА) для получения, посредством нуклеофильного замещения, ГК-ЭДА-МА.
10. Способ по п. 9, где все этапы приготовления производных ГК-ЭДА-МА осуществляют последовательно в одном и том же реакторе.
| WO 2010061005 A1, 03.06.2010 | |||
| WO 2007044906 A2, 19.04.2007 | |||
| CALOGERO FIORICA et al | |||
| A new hyaluronic acid pH sensitive derivative obtained by ATRP forpotential oral administration of proteins | |||
| Internat.J.of Ph | |||
| Прибор для вычерчивания конических сечений | 1922 |
|
SU457A1 |
| SHAN L et al | |||
| Comparative biochemical analysis of three bacterial prolyl endopeptidases: implications for coeliac sprue | |||
| Biochem J | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| CHEN YS et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Appl Environ Microbiol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| STEPNIAK D et al | |||
| Highly efficient gluten degradation with a newly identified prolyl endoprotease: implications for celiac disease | |||
| Am J Physiol Gastrointest Liver Physiol | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2019-02-12—Публикация
2015-05-06—Подача