Перекрестная ссылка на родственные заявки
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/813563, поданной 18 апреля 2013 г., содержание которой полностью включено в настоящую заявку посредством ссылки.
Область техники
Настоящее изобретение относится к способам применения IL-10 и связанных с ним агентов при лечении или предотвращении разнообразных заболеваний и расстройств.
Введение
Цитокин интерлейкин-10 (IL-10) представляет собой плейотропный цитокин, который регулирует множественные иммунные ответы путем воздействия на Т-клетки, В-клетки, макрофаги и антиген-презентирующие клетки (АРС). IL-10 может подавлять иммунные ответы путем ингибирования экспрессии IL-1α, IL-1β, IL-6, IL-8, TNF-α, GM-CSF и G-CSF в активированных моноцитах и активированных макрофагах, и он также подавляет продукцию IFN-γ НК-клетками. Хотя IL-10 преимущественно экспрессируется в макрофагах, его экспрессию также обнаружили в активированных Т-клетках, В-клетках, тучных клетках и моноцитах. В дополнение к подавлению иммунных ответов, IL-10 проявляет иммуностимулирующие свойства, включая стимулирование пролиферации тимоцитов, обработанных IL-2 и IL-4, повышение жизнеспособности В-клеток, и стимулирование экспрессии МНС класса II.
Человеческий IL-10 представляет собой гомодимер, который становится биологически неактивным при разрушении нековалентных взаимодействий между двумя мономерными субъединицами. Данные, полученные из опубликованной кристаллической структуры IL-10, указывают, что функциональный димер имеет определенные общие черты с IFN-γ (Zdanov et al., (1995) Structure (Lond) 3: 591-601).
В результате его плейотропной активности, IL-10 связан с широким кругом заболеваний, расстройств и состояний, включая воспалительные состояния, иммуно-опосредованные расстройства, фиброзные расстройства и рак. Клинические и доклинические оценки IL-10 для ряда таких заболеваний, расстройств и состояний утвердили его терапевтический потенциал. Кроме того, было показано, что пегилированный IL-10 является более эффективным, чем непегилированный IL-10 при определенных планах лечения.
С учетом частоты случаев и тяжести IL-10-связанных заболеваний, расстройств и состояний, новые режимы дозирования и параметры, которые оптимизируют эффективность, переносимость пациентом и тому подобное, возможно будут иметь огромное значение в продвижении терапевтической пригодности IL-10 и пегилированного IL-10, и связанных с ними агентов.
Краткое описание изобретения
В настоящем описании рассмотрены способы применения IL-10, модифицированного (например, пегилированного) IL-10, и связанных с ним агентов, описанных в настоящем документе, и их композиций для лечения и/или предотвращения различных заболеваний, расстройств и состояний, и/или их симптомов. В частности, настоящее описание относится к оптимизированным параметрам дозирования для достижения и поддержания эффективности лечения и/или предотвращения различных заболеваний, расстройств и состояний у субъекта, при сведении к минимуму связанных с ними неблагоприятных эффектов. Как подробно указано ниже, такая оптимизация параметров дозирования включает, например, оценку фармакокинетических и фармакодинамических параметров, связанных с абсорбцией, распределением, метаболизмом и экскрецией («ADME»), с учетом пути введения и других факторов. Подразумевается что, если не указано иное, то термины, относящиеся к ADME и другим параметрам, предполагают их обычные значения, принятые в соответствующих областях науки. В качестве примера, термины «период полувыведения из сыворотки» или «t1/2» относятся к периоду полувыведения (т.е. времени, за которое концентрация агента в сыворотке достигает половину от своего первоначального или максимального значения).
В соответствии со способами, описанными в настоящем документе, заболевание, расстройство или состояние, и/или его симптомы, может представлять собой пролиферативное расстройство, такое как рак или связанное с раком расстройство, или фиброзное расстройство, такое как цирроз, НАСГ и НАЖБП. Тем не менее, не ограничиваясь конкретными видами рака, рак может представлять собой твердую опухоль, включая опухоли, ассоциированные с раком толстой кишки, меланомой, и плоскоклеточной карциномой, или он может представлять собой гематологическое расстройство.
В других вариантах реализации заболевание, расстройство или состояние представляет собой вирусное заболевание, включая, но не ограничиваясь ими, вирус иммунодефицита человека, вирусы гепатита В или С или цитомегаловирус. В еще других вариантах реализации заболевание, расстройство или состояние представляет собой иммунное или воспалительное расстройство, которое может быть острым или хроническим. Примеры иммунных и воспалительных расстройств включают воспалительное заболевание кишечника, псориаз, ревматоидный артрит, рассеянный склероз, и болезнь Альцгеймера.
В конкретных вариантах реализации настоящего описания заболевание, расстройство или состояние представляет собой сердечно-сосудистое расстройство, включая атеросклероз. Субъект, имеющий сердечно-сосудистое расстройство, может иметь повышенный уровень холестерина.
В еще других вариантах реализации заболевание, расстройство или состояние представляет собой тромбоз или тромботическое состояние.
Как будет рассмотрено далее, IL-10 человека представляет собой гомодимер, и каждый мономер содержит 178 аминокислот, первые 18 из которых содержат сигнальный пептид. Конкретные варианты реализации настоящего описания содержат зрелые полипептиды IL-10 человека, в которых отсутствует сигнальный пептид (см., например, патент США №6217857), или зрелый PEG-IL-10 человека. В других конкретных вариантах реализации IL-10 агент представляет собой вариант зрелого IL-10 человека. Вариант может проявлять активность меньше, сравнимую, или больше, чем активность зрелого IL-10 человека; в некоторых вариантах реализации активность сравнима или больше, чем активность зрелого IL-10 человека.
В некоторых вариантах реализации настоящего описания рассмотрены модификации IL-10 в целях повышения одного или несколько свойств (например, фармакокинетических параметров, эффективности, и т.д.). В конкретных вариантах реализации настоящего описания IL-10 модифицирован, например, посредством пегилирования, гликозилирования, конъюгации с альбумином (например, человеческим сывороточным альбумином (ЧСА)), и посредством обработки гидроксиэтилкрахмалом. В других вариантах реализации модификации IL-10 не приводят к терапевтически значимым, негативным воздействиям на иммуногенность, и в еще других вариантах реализации модифицированный IL-10 является менее иммуногенным, чем немодифицированный IL-10. Термины «IL-10», «IL-10 полипептид(ы)», «агент(ы)» и тому подобные следует толковать в широком смысле и они включают в себя, например, IL-10-родственные полипептиды человека и не относящиеся к человеку, включая гомологи, варианты (включая мутеины), и их фрагменты, а также IL-10 полипептиды, имеющие, например, лидерную последовательность (например, сигнальный пептид), и модифицированные версии вышеупомянутого. В других конкретных вариантах реализации термины «IL-10», «IL-10 полипептид(ы), «агент(ы)» являются агонистами. Конкретные варианты реализации относятся к пегилированному IL-10, который также упоминается в данном документе как «PEG-IL-10». В настоящем описании также рассмотрены молекулы нуклеиновых кислот, кодирующие упомянутое выше.
Конкретные варианты реализации настоящего описания относятся к способам лечения или предотвращения заболевания, расстройства или состояния у субъекта, включающие введение субъекту терапевтически эффективного количества IL-10 агента, при этом указанного количества достаточно для достижения средней остаточной концентрации IL-10 в сыворотке по меньшей мере 0,1 нг/мл. Способы лечения или предотвращения могут быть опосредованы CD8+ Т-клетками.
Другие варианты реализации относятся к способам лечения или предотвращения заболевания, расстройства или состояния у субъекта (например, человека), включающие введение субъекту терапевтически эффективного количества IL-10 агента, при этом указанного количества достаточно для поддержания средней остаточной концентрации IL-10 в сыворотке в течение некоторого периода времени, где средняя остаточная концентрация IL-10 в сыворотке составляет по меньшей мере 0,1 нг/мл, и где средняя остаточная концентрация IL-10 в сыворотке поддерживается в течение по меньшей мере 90% периода времени. В конкретных вариантах реализации настоящего описания, средняя остаточная концентрация IL-10 в сыворотке составляет по меньшей мере 0,2 нг/мл, по меньшей мере 0,3 нг/мл, и по меньшей мере 0,4 нг/мл, по меньшей мере 0,5 нг/мл, по меньшей мере 0,6 нг/мл, по меньшей мере 0,7 нг/мл, по меньшей мере 0,8 нг/мл, по меньшей мере 0,9 нг/мл, по меньшей мере 1 нг/мл, по меньшей мере 1,2 нг/мл, по меньшей мере 1,25 нг/мл, по меньшей мере 1,3 нг/мл, по меньшей мере 1,4 нг/мл, по меньшей мере 1,5 нг/мл, по меньшей мере 1,6 нг/мл, по меньшей мере 1,7 нг/мл, по меньшей мере 1,8 нг/мл, по меньшей мере 1,85 нг/мл, по меньшей мере 1,9 нг/мл, по меньшей мере 1,95 нг/мл, по меньшей мере 1,97 нг/мл, и по меньшей мере 1,98 нг/мл, по меньшей мере 1,99 нг/мл, по меньшей мере 2,0 нг/мл или более 2 нг/мл.
В других вариантах реализации период времени составляет по меньшей мере 12 часов, по меньшей мере 24 часа, по меньшей мере 48 часов, по меньшей мере 72 часа, по меньшей мере 1 неделю, по меньшей мере 2 недели, по меньшей мере 3 недели, по меньшей мере 1 месяц, по меньшей мере 6 недель, по меньшей мере 2 месяца, по меньшей мере 3 месяца, или более 3 месяцев.
В конкретных вариантах реализации настоящего описания средняя остаточная концентрация IL-10 в сыворотке поддерживается в течение по меньшей мере 85% периода времени, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%», по меньшей мере 99% или 100% периода времени.
Предполагается, что режим дозирования, достаточный для поддержания требуемой устойчивой остаточной концентрации в сыворотке (например, 0,1 нг/мл или 2 нг/мл), может приводить к начальной остаточной концентрации в сыворотке выше, чем требуемая устойчивая остаточная концентрация в сыворотке. Из-за фармакодинамических и фармакокинетических характеристик IL-10 у млекопитающих, начальная остаточная концентрация (достигаемая, например, путем введения одной или более насыщающих доз с последующей серией поддерживающих доз) постепенно, но непрерывно снижается в течение некоторого периода времени, даже если параметры дозирования (количество и частота) остаются постоянными. После данного периода времени постепенное, но постоянное снижение заканчивается и поддерживается устойчивая остаточная концентрация в сыворотке.
В качестве примера, парентеральное введение (например, п/к и в/в) ~0,1 мг/кг/сутки IL-10 агента (например, mIL-10) мышам (например, мышам C57BL/6) необходимо для поддержания устойчивой остаточной концентрации в сыворотке, например, 2,0 нг/мл. Однако данная устойчивая остаточная концентрация в сыворотке может не достигаться приблизительно в течение 30 дней после начала дозирования при 0,1 мг/кг/сутки (а также после любой(ых) насыщающей(их) дозы(доз)). Скорее всего, после достижения начальной остаточной концентрации в сыворотке (например, 2,5 нг/мл), данная концентрация постепенно, но непрерывно снижается на протяжении, например, приблизительно 30-дневного периода, после этого периода поддерживается требуемая устойчивая остаточная концентрация в сыворотке (например, 2,0 нг/мл). Специалист в данной области техники будет способен определить дозу, необходимую для поддержания требуемой устойчивой остаточной концентрации с помощью, например, ADME и индивидуальных параметров пациента.
В настоящем описании рассмотрены способы, где IL-10 агент может содержать по меньшей мере одну модификацию для образования модифицированного IL-10 агента, при этом модификация не изменяет последовательность аминокислот IL-10 агента. В некоторых вариантах реализации модифицированный IL-10 агент представляет собой PEG-IL-10 агент.PEG-IL-10 агент может содержать по меньшей мере одну молекулу ПЭГ, ковалентно присоединенную к по меньшей мере одному аминокислотному остатку по меньшей мере одной субъединицы IL-10, или содержать смесь монопегилированного и дипегилированного IL-10 в других вариантах реализации. ПЭГ компонент PEG-IL-10 агента может иметь молекулярную массу примерно более 5 кДа, примерно более 10 кДа, примерно более 15 кДа, примерно более 20 кДа, примерно более 30 кДа, примерно более 40 кДа, или примерно более 50 кДа. В некоторых вариантах реализации молекулярная масса составляет от примерно 5 кДа до примерно 10 кДа, от примерно 5 кДа до примерно 15 кДа, от примерно 5 кДа до примерно 20 кДа, от примерно 10 кДа до примерно 15 кДа, от примерно 10 кДа до примерно 20 кДа, от примерно 10 кДа до примерно 25 кДа, или от примерно 10 кДа до примерно 30 кДа.
В некоторых вариантах реализации модифицированный IL-10 агент содержит по меньшей мере одну Fc-гибридную молекулу, по меньшей мере один сывороточный альбумин (например, ЧСА или БСА), ЧСА-гибридную молекулу или конъюгат альбумина. В дополнительных вариантах реализации модифицированный IL-10 агент гликозилирован, обработан гидроксиэтилкрахмалом, или содержит по меньшей мере один альбумин-связывающий домен. Некоторые модифицированные IL-10 агенты могут содержать более одного типа модификации. В конкретных вариантах реализации настоящего описания модификация является сайт-специфичной. Некоторые варианты реализации включают линкер. Модифицированные IL-10 агенты более подробно обсуждаются ниже.
В настоящем описании также рассмотрено применение генной терапии в сочетании с излагаемыми здесь принципами. Для применения генной терапии и способов, клетки субъекта можно трансформировать in vivo нуклеиновой кислотой, которая кодирует IL-10-родственный полипептид, как изложено в настоящем документе. Альтернативно, клетки можно трансформировать in vitro с помощью трансгена или полинуклеотида, и затем трансплантировать в ткани субъекта для осуществления лечения. Кроме того, первичный изолят клеток или стабильную клеточную линию можно трансформировать с помощью трансгена или полинуклеотида, который кодирует IL-10-родственный полипептид, и затем необязательно трансплантировать в ткани субъекта.
В настоящем описании рассмотрены способы, в которых IL-10 агент вводят субъекту по меньшей мере два раза в сутки, по меньшей мере один раз в сутки, По меньшей мере один раз каждые 48 часов, по меньшей мере один раз каждые 72 часа, по меньшей мере один раз в неделю, по меньшей мере один раз каждые 2 недели, по меньшей мере один раз в месяц, по меньшей мере один раз каждые 2 месяца, или по меньшей мере один раз каждые 3 месяца. Некоторые варианты реализации также включают введение IL-10 агента с по меньшей мере одним дополнительным профилактическим или терапевтическим агентом, примеры которых приведены ниже.
IL-10 агент можно вводить любым эффективным путем. В некоторых вариантах реализации его вводят путем парентеральной инъекции, включая подкожную инъекцию.
Конкретные варианты реализации настоящего описания относятся к фармацевтическим композициям, содержащим количество IL-10 агента (например, терапевтически эффективное количество), включая данные агенты, описанные выше, вместе с одним или более фармацевтически приемлемым разбавителем, носителем или вспомогательным веществом (например, изотонический раствор для инъекций). Фармацевтическая композиция, как правило, является одной из тех, что пригодна для введения человеку. Более того, в некоторых вариантах реализации фармацевтическая композиция содержит по меньшей мере один дополнительный профилактический или терапевтический агент.
В некоторых вариантах реализации настоящего описания рассмотрена стерильная емкость, которая содержит одну из вышеуказанных фармацевтических композиций и необязательно один или более дополнительных компонентов. В качестве примера, но не ограничения, стерильная емкость может представлять собой шприц. В еще других вариантах реализации стерильная емкость представляет собой один компонент набора; набор может также содержать, например, вторую стерильную емкость, которая содержит по меньшей мере один профилактический или терапевтический агент.
Краткое описание чертежей
На фиг. 1 изображены аминокислотные последовательности IL-10 человека и мыши.
На фиг. 2А показана концентрация МСР-1 (пг/мл) в МКПК при увеличении концентраций IL-10. При концентрации 1 нг/мл и выше, IL-10 увеличивает секрецию МСР-1.
На фиг. 2В показана концентрация МСР-1 (пг/мл) в МКПК, простимулированных ЛПС, при увеличении концентраций IL-10. IL-10 является ингибитором ЛПС-опосредованной активации МКПК, и добавление IL-10 в концентрации 1 нг/мл и выше значительно ингибирует секрецию МСР-1.
Подробное описание изобретения
Перед дальнейшим изложением настоящего описания, следует понимать, что описание не ограничивается конкретными вариантами реализации, изложенными в настоящем документе, и также следует понимать, что терминология, используемая в настоящем документе, предназначена только для целей описания конкретных вариантов реализации, и не предназначена для ограничения.
В случае, когда предложен диапазон значений, понятно, что изобретение охватывает каждое промежуточное значение до десятых долей единицы нижнего предела, если из контекста явно не следует иное, между верхним и нижним пределом этого диапазона, и любое другое указанное или промежуточное значение в данном указанном диапазоне. Верхние и нижние пределы этих меньших диапазонов могут быть независимо включены в меньшие диапазоны, и также охватываются настоящим изобретением, с учетом любого специально исключенного предела в установленном диапазоне. Если установленный диапазон включает один или оба предела, диапазоны, исключающие любой или оба из этих включенных пределов, также включены в изобретение. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается обычным специалистом в данной области техники, к которой принадлежит настоящее изобретение.
Следует отметить, что используемые в настоящем описании и в прилагаемой формуле изобретения, формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иное. Также следует отметить, что формула изобретения может быть составлена так, что исключает любой необязательный элемент. Таким образом, данное заявление призвано служить предшествующей основой для применения таких исключающих терминов, как «единственно», «только» и тому подобное в связи с перечислением элементов формулы изобретения, или применения «отрицательного» ограничения.
Публикации, обсуждаемые в настоящем документе, предназначены исключительно для их раскрытия до даты подачи настоящей заявки. Кроме того, даты публикации могут отличаться от фактических дат публикации, которые, возможно, необходимо независимо подтвердить.
Обзор
В настоящем описании рассмотрено применение агентов, описанных в настоящем документе, и их композиций, для лечения и/или предотвращения различных заболеваний, расстройств и состояний, и/или их симптомов. В некоторых аспектах настоящего описания, такое лечение или предотвращение осуществляют с применением конкретных параметров дозирования. В некоторых вариантах реализации агенты вводят так, чтобы достичь остаточной концентрации в сыворотке, которая оптимизирована для лечения, например, расстройств, связанных с воспалением и иммунитетом, фиброзных расстройств, рака, и расстройств, связанных с раком, или сердечно-сосудистых расстройств (например, атеросклероза).
В некоторых вариантах реализации настоящего описания субъекту с наличием или риском наличия заболевания или расстройства, которого можно лечить IL-10 агентом (например, полипептидом IL-10), вводят IL-10 агент в количестве, достаточном для достижения остаточной концентрации в сыворотке примерно более 0,1 нг/мл, в некоторых вариантах реализации остаточная концентрация в сыворотке составляет примерно более 1 нг/мл, в то время как в других вариантах реализации остаточная концентрация в сыворотке составляет примерно более 2 нг/мл.
Следует отметить, что любая ссылка на «человеческий» в связи с полипептидами и молекулами нуклеиновых кислот настоящего описания не предназначена для ограничения того, каким образом получен полипептид или нуклеиновая кислота, или для ограничения источника, а только для ссылки на последовательность, которая может соответствовать последовательности полипептида человека, встречающейся в природе, или молекуле нуклеиновой кислоты. В дополнение к полипептидам человека и молекулам нуклеиновых кислот, которые их кодируют, в настоящем описании рассмотрены IL-10-родственные полипептиды и соответствующие молекулы нуклеиновых кислот других видов.
Определения
Если не указано иное, предполагается, что следующие термины имеют значение, указанное ниже. Другие термины определены в других местах по всему описанию.
Термины «пациент» или «субъект» используются как синонимы для обозначения человека или животного, не являющегося человеком (например, млекопитающего).
Термины «введение», «вводить» и тому подобное, если они применяются, например, к субъекту, клеткам, ткани, органу или биологической жидкости, указывают на контакт, например, IL-10 или PEG-IL-10, нуклеиновой кислоты (например, нуклеиновой кислоты, кодирующей природный IL-10 человека); фармацевтической композиции, содержащей вышеупомянутое, или диагностического агента с субъектом, клетками, тканью, органом или биологической жидкостью. Применительно к клеткам, введение включает контакт (например, in vitro или ex vivo) реагента с клетками, а также контакт реагента с жидкостью, если жидкость находится в контакте с клеткой.
Термины «лечить», «лечение», «обработка» и тому подобные относятся к способу действия (например, к введению IL-10 или фармацевтической композиции, содержащей IL-10) начатому после того, как заболевание, расстройство или состояние, или их симптомы, были диагностированы, проявились и тому подобное, для устранения, уменьшения, подавления, смягчения или ослабления, временно или постоянно, по меньшей мере одной из основных причин заболевания, расстройства или состояния, беспокоящих субъект, или по меньшей мере одного из симптомов, связанных с заболеванием, расстройством или состоянием, беспокоящих субъект. Таким образом, лечение включает ингибирование (например, ограничение развития или дальнейшего развития заболевания, расстройства или состояния или связанных с ними клинических симптомов) активного заболевания. Термины также могут применяться в других контекстах, например, в ситуации, когда IL-10 или PEG-IL-10 входит в контакт с рецептором IL-10, например, в жидкой фазе или коллоидной фазе.
Термин «нуждается в лечении», используемый в настоящем описании, относится к суждению, сделанному врачом или другим лицом, осуществляющим уход за субъектом, относительно того, что субъекту необходимо или будет польза от лечения. Данное решение принимается на основе целого ряда факторов, которые находятся в сфере компетенции врача или лица, осуществляющего уход.
Термины «предотвратить», «предотвращать», «предотвращение» и тому подобные относятся к способу действия (например, например, к введению IL-10 или фармацевтической композиции, содержащей IL-10), начатому таким образом (например, до начала заболевания, расстройства, состояния или их симптомов), чтобы предотвратить, подавить, ингибировать или уменьшить, временно или постоянно, риск развития у субъекта заболевания, расстройства, состояния и тому подобного (как определено, например, по отсутствию клинических симптомов) или для задержки их начала, обычно в контексте субъекта, предрасположенного к наличию конкретного заболевания, расстройства или состояния. В некоторых случаях термины также относятся к замедлению прогрессирования заболевания, расстройства или состояния, или ингибированию их прогрессирования до опасного или иного нежелательного состояния.
Термин «нуждается в предотвращении», используемый в настоящем описании, относится к суждению, сделанному врачом или другим лицом, осуществляющим уход за субъектом, относительно того, что субъекту необходимо или будет польза от превентивного лечения. Данное решение принимается на основе целого ряда факторов, которые находятся в сфере компетенции врача или лица, осуществляющего уход.
Термин «терапевтически эффективное количество» относится к введению агента субъекту, либо отдельно, либо как часть фармацевтической композиции, и либо в виде однократной дозы или как часть серии доз, в количестве, способном оказывать любой видимый, положительный эффект на любой симптом, аспект или характеристику заболевания, расстройства или состояния, при введению субъекту. Терапевтически эффективное количество может быть установлено путем измерения соответствующих физиологических эффектов, и его можно скорректировать в связи с режимом дозирования и диагностическим анализом состояния субъекта, и тому подобное. В качестве примера, измерение количества воспалительных цитокинов, выделившихся после введения, может свидетельствовать о том, было ли применено терапевтически эффективное количество.
Фраза «в количестве, достаточном для осуществления изменений» означает, что существует обнаруживаемая разница между уровнем показателя, измеренного до этого (например, базовый уровень), и после введения конкретного препарата. Показатели включают любой объективный параметр (например, концентрацию IL-10 в сыворотке) или субъективный параметр (например, хорошее самочувствие субъекта).
Термин «малые молекулы» относится к химическим соединениям, имеющим молекулярную массу, которая примерно менее 10 кДа, примерно менее 2 кДа, или примерно менее 1 кДа. Малые молекулы включают, но не ограничиваются, неорганические молекулы, органические молекулы, органические молекулы, содержащие неорганический компонент, молекулы, содержащие радиоактивный атом, и синтетические молекулы. Терапевтически, малая молекула может быть более проницаемой для клеток, менее подвержена деградации, и с меньшей вероятностью вызывает иммунный ответ, чем крупные молекулы.
Термин «лиганд» относится к, например, пептиду, полипептиду, молекуле, ассоциированной или связанной с мембраной, или их комплексам, которые могут действовать как агонисты или антагонисты рецептора. «Лиганд» включает природные и синтетические лиганды, например, цитокины, варианты цитокинов, аналоги, мутеины, и связывающие композиции, полученные из антител. Термин «лиганд» также охватывает малые молекулы, например, пептидные миметики цитокинов и пептидные миметики антител. Термин также охватывает агент, который не является ни агонистом, ни антагонистом, но который может связываться с рецептором без существенного влияния на его биологические свойства, например, передачу сигналов или адгезию. Кроме того, термин включает в себя лиганд, связанный с мембраной, который был изменен, например, химическими или рекомбинантными способами, с получением растворимой версии лиганда, связанного с мембраной. Лиганд или рецептор может быть полностью внутриклеточным, то есть, он может находиться в цитозоле, ядре, или каком-либо другом внутриклеточном компартменте. Комплекс лиганда и рецептора называется «лиганд-рецепторный комплекс».
Термины «ингибиторы» и «антагонисты», или «активаторы» и «агонисты» относятся к ингибирующим или активирующим молекулам, соответственно, например, для активации, например, лиганда, рецептора, кофактора, гена, клетки, ткани или органа. Ингибиторы представляют собой молекулы, которые уменьшают, блокируют, предотвращают, задерживают активацию, инактивируют, десенсибилизируют, или осуществляют понижающую регуляцию, например, гена, белка, лиганда, рецептора или клетки. Активаторы представляют собой молекулы, которые увеличивают, активируют, облегчают, усиливают активацию, сенсибилизируют, или осуществляют повышающую регуляцию, например, гена, белка, лиганда, рецептора или клетки. Ингибитор также можно охарактеризовать как молекулу, которая уменьшает, блокирует, или инактивирует конститутивную активность. «Агонист» представляет собой молекулу, которая взаимодействует с мишенью для того, чтобы вызвать или способствовать увеличению активации мишени. «Антагонист» представляет собой молекулу, которая имеет противоположное действие(я) как у агониста. Антагонист предотвращает, уменьшает, ингибирует или нейтрализует активность агониста, и антагонист может также предотвращать, ингибировать или уменьшить конститутивную активность мишени, например, мишени-рецептора, даже там, где нет четкого определения агониста.
Термины «модулировать», «модуляция» и тому подобные относятся к способности молекулы (например, активатора или ингибитора) увеличить или уменьшить функцию или активность IL-10 агента (или кодирующих их молекул нуклеиновых кислот) прямо или косвенно; или усиливать способность молекулы производить эффект, сопоставимый с IL-10 агентом. Термин «модулятор» в широком смысле относится к молекулам, которые могут повлиять на активность, описанную выше. В качестве примера, модулятор, например, гена, рецептора, лиганда или клетки, представляет собой молекулу, которая изменяет активность гена, рецептора, лиганда или клетки, при этом активность может активироваться, ингибироваться, или изменять свои регуляторные свойства. Модулятор может действовать по отдельности, или он может использовать кофактор, например, белок, ионы металлов, или малую молекулу. Термин «модулятор» включает в себя агенты, которые работают по тому же самому механизму действия, как IL-10 (т.е. агенты, которые модулируют тот же сигнальный путь, что IL-10, аналогичным ему способом) и способны вызывать биологический ответ сопоставимый (или более) с IL-10.
Примеры модуляторов включают малые молекулы и другие биоорганические молекулы. Многочисленные библиотеки малых молекул (например, комбинаторные библиотеки) коммерчески доступны и могут служить в качестве отправной точки для идентификации модулятора. Специалист в данной области способен разработать один или более тестов (например, на основе биохимических или клеточных анализов), в которых такие библиотеки соединений можно подвергать скринингу для выявления одного или более соединений, обладающих требуемыми свойствами; после этого специалист в области медицинской химии способен оптимизировать одно или более соединений, например, путем синтеза и оценки их аналогов и их производных. Для идентификации активатора также можно применять исследования с использованием синтетического и/или молекулярного моделирования.
«Активность» молекулы может описываться или относиться к связыванию молекулы с лигандом или с рецептором; к каталитической активности; к способности стимулировать экспрессию гена или клеточную сигнализацию, дифференцировку или созревание; к антигенной активности; к модуляции активности других молекул; и тому подобное. Термин может также относиться к активности при модуляции или поддержании взаимодействий клетки с клеткой (например, адгезии), или к активности в поддержании структуры клетки (например, клеточной мембраны). «Активность» также может означать удельную активность, например, [каталитическую активность]/[мг белка] или [иммунологическую активность]/[мг белка], концентрации в биологическом компартменте, или тому подобное. Термин «пролиферативная активность» включает в себя активность, которая способствует тому, для чего необходима, или тому, с чем специфически связана, например, с нормальным клеточным делением, а также раком, опухолями, дисплазией, трансформацией клеток, метастазами и ангиогенезом.
Используемые в настоящем описании выражения «сопоставимый», «сопоставимая активность», «активность, сравнимая с», «сопоставимый эффект», «эффект, сравнимый с», и тому подобные, представляют собой относительные понятия, которые можно рассматривать в количественном и/или качественном отношении. Смысл терминов часто зависит от контекста, в котором их применяют. В качестве примера, два агента, которые оба активируют рецептор, можно рассматривать как обладающие сравнимым эффектом с качественной точки зрения, но эти два агента можно рассматривать как не обладающие сравнимым эффектом с количественной точки зрения, если один агент в состоянии достигнуть только 20% активности другого агента, как определено посредством анализа, принятом в данной области (например, в анализе зависимости "доза-эффект"), или на принятой в данной области животной модели. При сравнении одного результата с другим результатом (например, одного результата с эталонным стандартом), «сопоставимый» часто означает, что один результат отличается от эталонного стандарта менее чем на 35%, менее чем на 30%, менее чем на 25%, менее чем на 20%, менее чем на 15%, менее чем на 10%, менее чем на 7%, менее чем на 5%, менее чем на 4%, менее чем на 3%, менее чем на 2%, или менее чем на 1%. В конкретных вариантах реализации настоящего описания один результат сопоставим с эталонным стандартом, если он отклоняется менее чем на 15%, менее чем на 10%, или менее чем на 5% от эталонного стандарта. В качестве примера, но не ограничения, активность или эффект может относиться к эффективности, стабильности, растворимости или иммуногенности.
Термин «ответ», например, клетки, ткани, органа или организма, включает в себя изменения в биохимических или физиологических характеристиках, например, концентрации, плотности, адгезии, или миграции в пределах биологического компартмента, скорости экспрессии генов или состояния дифференцировки, когда изменение коррелирует с активацией, стимуляцией, или обработкой, или с внутренними механизмами, такими как генетическое программирование. В некоторых контекстах термины «активация», «стимуляция» и тому подобные относятся к активации клеток как к регуляции посредством внутренних механизмов, а также внешних факторов или факторов окружающей среды; в то время как термины «ингибирование», «понижающая регуляция» и тому подобные, относятся к противоположным эффектам.
Термины «полипептид», «пептид», и «белок», применяемые взаимозаменяемо в настоящем документе, относятся к полимерной форме аминокислот любой длины, которая может содержать генетически закодированные и негенетически закодированные аминокислоты, химически или биохимически модифицированные аминокислоты или производные аминокислот, и полипептиды, имеющие модифицированный полипептидный остов. Термины включают гибридные белки, включая, но не ограничиваясь, гибридные белки с гетерологичной аминокислотной последовательностью; гибридные белки с гетерологичными и гомологичными лидерными последовательностями; гибридные белки с наличием или отсутствием N-концевых остатков метионина; гибридные белки с иммунологически мечеными белками; и тому подобное.
Следует отметить, что в данном раскрытии ссылки на аминокислоты сделаны в соответствии с однобуквенным или трехбуквенным кодом. Для удобства читателя, однобуквенные и трехбуквенные коды аминокислот приведены ниже:
Используемый в настоящем описании термин «вариант» включает встречающиеся в природе варианты и не встречающиеся в природе варианты. Встречающиеся в природе варианты включают гомологи (полипептиды и нуклеиновые кислоты, которые отличаются по аминокислотной или нуклеотидной последовательности, соответственно, от одного вида к другому), и аллельные варианты (полипептиды и нуклеиновые кислоты, которые отличаются по аминокислотной или нуклеотидной последовательности, соответственно, от одной особи к другой в пределах вида). Варианты, не встречающиеся в природе, включают полипептиды и нуклеиновые кислоты, которые содержат изменения в аминокислотной или нуклеотидной последовательности, соответственно, где изменение в последовательности введено искусственно (например, мутеины); например, изменение создается в лаборатории путем человеческого вмешательства («рука человека»). Таким образом, в настоящем документе термин «мутеин» в широком смысле относится к мутантным рекомбинантным белкам, в которых обычно есть одна или несколько аминокислотных замен, и которые часто получены из клонированных генов, подвергнутых сайт-направленному или случайному мутагенезу, или полностью из синтетических генов.
Термины «ДНК», «нуклеиновая кислота», «молекула нуклеиновой кислоты», «полинуклеотид» и тому подобные применяются в настоящем документе взаимозаменяемо для обозначения полимерной формы нуклеотидов любой длины, дезоксирибонуклеотидов или рибонуклеотидов, или их аналогов. Неограничивающие примеры полинуклеотидов включают линейные и кольцевые нуклеиновые кислоты, информационную РНК (мРНК), комплементарную ДНК (кДНК), рекомбинантные полинуклеотиды, векторы, зонды, праймеры и тому подобное.
Используемые в контексте структуры полипептида, термины «N-конец» (или «аминоконец) и «С-конец» (или «карбоксильный конец») относятся к крайним амино- и карбоксильному концам полипептида, соответственно, в то время как термины «N-концевой» и «С-концевой» относятся к относительным положениям в аминокислотной последовательности полипептида по отношению к N-концу и С-концу, соответственно, и могут включать остатки на N-конце и С-конце, соответственно. «Непосредственно N-концевой» или «непосредственно С-концевой» относится к положению первого аминокислотного остатка относительно второго аминокислотного остатка, где первый и второй аминокислотные остатки ковалентно связанны с получением непрерывной аминокислотной последовательности.
«Полученные из» в контексте аминокислотной последовательности или полинуклеотидной последовательности (например, аминокислотной последовательности, «полученной из» полипептида IL-10), предназначены для обозначения того, что полипептид или нуклеиновая кислота имеет последовательность, которая основана на эталонном полипептиде или нуклеиновой кислоте (например, встречающемся в природе полипептиде IL-10 или нуклеиновой кислоте, кодирующей IL-10), и не предназначены для ограничения в отношении источника или способа, которым получен белок или нуклеиновая кислота. В качестве примера, термин «полученный из» включает гомологи или варианты эталонной аминокислотной или ДНК-последовательности.
В контексте полипептида, термин «выделенный» относится к целевому полипептиду, который если встречается в природе, то находится в среде, отличной от той, в которой он может встречаться естественным образом. Термин «выделенный» включает полипептиды, которые находятся в образцах, которые по существу обогащенные целевым полипептидом и/или в котором целевой полипептид является частично или по существу очищенным. Если полипептид не встречается в природе, то «выделенный» означает, что полипептид был отделен от среды, в которой он был получен путем синтеза или рекомбинантным способом.
«Обогащенный» означает, что над образцом были произведены искусственные действия (например, ученым), таким образом, что целевой полипептид присутствует а) в большей концентрации (например, по меньшей мере в 3 раза больше, по меньшей мере 4 раза больше, по меньшей мере 8 раз больше, по меньшей мере 64 раза больше, или более), чем концентрация полипептида в исходном образце, например, в биологическом образце (например, образце, в котором полипептид встречается в природе, или в котором он присутствует после введения), или b) концентрация больше, чем в окружающей среде, в которой был получен полипептид (например, как в бактериальной клетке).
«По существу чистый» означает, что компонент (например, полипептид) составляет примерно более 50% от общего содержания композиции, и как правило, примерно более 60% от общего содержания полипептида. Более типично, «по существу чистый» относится к композициям, в которых по меньшей мере 75%, по меньшей мере 85%, по меньшей мере 90% или более от общей композиции является целевым компонентом. В некоторых случаях, полипептид будет составлять примерно более 90%, или примерно более 95% от общего содержания композиции.
Термины «специфически связывается» или «селективно связывается», когда речь идет о лиганде/рецепторе, антителе/антигене, или другой связанной паре, указывают на реакцию связывания, которая определяется присутствием белка в гетерогенной популяции белков и других биопрепаратах. Таким образом, при указанных условиях, специфический лиганд связывается с конкретным рецептором и не связывается в значимом количестве с другими белками, присутствующими в образце. Антитело, или связывающая композиция, полученная из антиген-связывающего сайта антитела из предполагаемого способа, связывается со своим антигеном, или его вариантом или мутеином, с аффинностью, которая по меньшей мере в два раза больше, по меньшей мере в десять раз больше, по меньшей мере в 20 раз больше, или по меньшей мере в 100 раз больше, чем аффинность с любым другим антителом или связывающей композицией, полученной из него. В конкретном варианте реализации антитело будет иметь аффинность, которая примерно более 109 литров/моль, как определено, например, посредством анализа Скэтчарда (Munsen, et al. 1980 Analyt. Biochem. 107: 220-239).
IL-10 и PEG-IL-10
Противовоспалительный цитокин IL-10, также известный как фактор, ингибирующий синтез цитокинов (CSIF) человека, классифицирован как 2 тип (класс) цитокинов, набор цитокинов, который включает IL-19, IL-20, IL-22, IL-24 (Mda-7), и IL-26, интерфероны (IFN-α, -β, -γ, -δ, -ε, -κ, -Ω, и -τ) и интерфероноподобные молекулы (лимитен, IL-28A, IL-28B, и IL-29).
IL-10 представляет собой цитокин с плейотропными эффектами в иммунорегуляции и воспалении. Он продуцируется тучными клетками, нейтрализуя воспалительное действие, которое данные клетки оказывают в месте аллергической реакции. В то время как он способен ингибировать синтез провоспалительных цитокинов, таких как IFN-γ, IL-2, IL-3, TNFα и GM-CSF, IL-10, он также стимулирует некоторые Т-клетки и тучные клетки и стимулирует созревание В-клеток, пролиферацию и продукцию антител. IL-10 может блокировать активность NF-κВ и участвует в регуляции сигнального пути JAK-STAT. Он также индуцирует цитотоксическую активность CD8+ Т-клеток и продукцию антител В-клетками, и он подавляет активность макрофагов и опухоль-промотирующее воспаление. Регулирование CD8+ Т-клеток является дозозависимым, причем более высокие дозы взывают более сильные цитотоксические ответы.
IL-10 человека представляет собой гомодимер с молекулярной массой 37 кДа, где каждый мономер по 18,5 кДа содержит 178 аминокислот, первые 18 из которых содержат сигнальный пептид, и две пары остатков цистеина, которые образуют две внутримолекулярные дисульфидные связи. Димер IL-10 становится биологически неактивным при нарушении нековалентных взаимодействий между двумя мономерными субъединицами.
В настоящем описании рассмотрены IL-10 человека и IL-10 мыши, которые демонстрируют 80% гомологичности, а также их применение. Кроме того, объем настоящего описания включает ортологи IL-10, и их модифицированные формы из других видов млекопитающих, включая крыс (учетный номер NP_036986.2; GI 148747382); коров (учетный номер NP_776513.1; GI 41386772); овец (учетный номер NP_001009327.1; GI 57164347); собак (учетный номер ABY86619.1; GI 166244598); и кроликов (учетный номер AAC23839.1; GI 3242896).
Как упоминалось выше, термины «IL-10», «полипептид(ы) IL-10», «агент(ы) IL-10» и тому подобные следует толковать в широком смысле и они включают в себя, например, IL-10-родственные полипептиды человека и не относящиеся к человеку, включая гомологи, варианты (включая мутеины), и их фрагменты, а также IL-10 полипептиды, имеющие, например, лидерную последовательность (например, сигнальный пептид), и модифицированные версии упомянутого выше. В других конкретных вариантах реализации IL-10, полипептид(ы) IL-10, и IL-10 агент(ы) являются агонистами.
Рецептор IL-10, представляет собой цитокиновый рецептор II типа, состоящий из альфа- и бета-субъединиц, которые также называют R1 и R2, соответственно. Активация рецептора требует связывания с обеими альфа и бета субъединицами. Один гомодимер полипептида IL-10 связывается с альфа, а другой гомодимер того же полипептида IL-10 связывается с бета.
Применение рекомбинантного IL-10 человека часто ограничено его сравнительно коротким периодом полувыведения из сыворотки, который может быть обусловлен, например, почечным клиренсом, протеолитическим распадом и мономеризацией в кровяном русле. Вследствие этого были изучены различные подходы для улучшения фармакокинетического профиля IL-10 без нарушения его димерной структуры и таким образом негативного влияния на его активность. Пегилирование IL-10 приводит к улучшению некоторых фармакокинетических параметров (например, периода полувыведения из сыворотки) и/или увеличению активности. Например, конкретные варианты реализации настоящего описания включают способы оптимизации лечения пролиферативных расстройств (например, рака) с помощью PEG-IL-10.
Как было указано ранее, в настоящем описании также рассмотрено применение генной терапии в сочетании с излагаемыми здесь принципами. Генную терапию осуществляют путем доставки генетического материала, обычно, упакованного в вектор, к эндогенным клеткам субъекта для введения новых генов, для введения дополнительных копий уже существующих генов, для ослабления функционирования существующих генов, или для восстановления существующих, но нефункционирующих генов. Оказавшись внутри клетки, нуклеиновая кислота экспрессируется при помощи клеточных механизмов, в результате чего образуется целевой белок. В контексте настоящего описания, генная терапия применяется в качестве терапии для доставки нуклеиновой кислоты, которая кодирует IL-10 агент, для применения для лечения или предотвращения заболевания, расстройства или состояния, описанного в настоящем документе.
Как упоминалось выше, для применения генной терапии и способов, клетки субъекта можно трансформировать in vivo нуклеиновой кислотой, которая кодирует IL-10-родственный полипептид, как изложено в настоящем документе. Альтернативно, клетки можно трансформировать in vitro с помощью трансгена или полинуклеотида, и затем трансплантировать в ткани субъекта для осуществления лечения. Кроме того, первичный изолят клеток или стабильную клеточную линию можно трансформировать с помощью трансгена или полинуклеотида, который кодирует IL-10-родственный полипептид, и затем необязательно трансплантировать в ткани субъекта.
Используемые в настоящем описании термины «пегилированный IL-10» и «PEG-IL-10», относятся к молекуле IL-10, имеющей одну или более молекул полиэтиленгликоля ковалентно присоединенных к по меньшей мере одному аминокислотному остатку в белке IL-10, как правило, через линкер, благодаря чему прикрепление является стабильным. Термины «монопегилированный IL-10» и «моно-PEG-IL-10» означают, что одна молекула полиэтиленгликоля ковалентно присоединена к одному аминокислотному остатку на одной субъединице димера IL-10, как правило, через линкер. В некоторых вариантах реализации PEG-IL-10, применяемый в настоящем описании, представляет собой моно-PEG-IL-10, в котором от одной до девяти молекул ПЭГ ковалентно присоединены через линкер к альфа-аминогруппе аминокислотного остатка на N-конце одной субъединицы димера IL-10. Монопегилирование на одной субъединице IL-10 обычно приводит к неоднородной смеси непегилированного, монопегилированного и дипегилированного IL-10 из-за перетасовки субъединиц. Более того, если позволить реакции пегилирования пройти до конца, то обычно это приводит к неспецифическому и мультипегилированному IL-10, таким образом снижая его биологическую активность. Таким образом, конкретные варианты реализации настоящего описания включают введение смеси моно- и дипегилированного IL-10, полученного при помощи способов, описанных в настоящем документе, (например, в Экспериментальной части).
В конкретных вариантах реализации настоящего описания средняя молекулярная масса фрагмента ПЭГ составляет от примерно 5 кДа и до примерно 50 кДа. Хотя способ или сайт прикрепления ПЭГ к IL-10 не является критическим, в некоторых вариантах реализации пегилирование не изменяет, или только минимально изменяет активность IL-10 агента. В некоторых вариантах реализации увеличение периода полувыведения составляет больше, чем любое снижение биологической активности. Биологическую активность PEG-IL-10 обычно измеряют путем оценки уровней воспалительных цитокинов (например, TNF-α или IFN-γ) в сыворотке субъектов, которым вводили бактериальный антиген (липополисахарид (ЛПС)) и обрабатывали PEG-IL-10, как описано в патенте США №7052686.
Варианты IL-10 могут быть приготовлены с учетом различных задач, включая увеличение периода полувыведения из сыворотки, уменьшение иммунного ответа к IL-10, облегчение очистки или подготовки, снижением преобразования IL-10 в его мономерные субъединицы, улучшение терапевтической эффективности, и уменьшение тяжести или возникновения побочных эффектов во время терапевтического применения. Варианты аминокислотных последовательностей обычно являются предварительно заданными вариантами, не встречающимися в природе, хотя некоторые могут представлять собой посттрансляционные варианты, например, гликозилированные варианты. Можно применять любой вариант IL-10 при условии сохранения надлежащего уровня активности IL-10. В контексте опухолей, подходящая активность IL-10 включает, например, CD8+ Т-клеточную инфильтрацию в участки опухоли, экспрессию воспалительных цитокинов, таких как IFN-γ, IL-4, IL-6, IL-10 и RANK-L, в этих клеточных инфильтратах, и повышенные уровни IFN-γ в биологических образцах.
Термин «консервативная аминокислотная замена» относится к заменам, при которых сохраняется активность белка путем замены аминокислот(ы) в белке на аминокислоту с боковой цепью с аналогичной кислотностью, основностью, зарядом, полярностью, или размером боковой цепи. Консервативные аминокислотные замены обычно включают замену аминокислотных остатков в пределах следующих групп: 1) L, I, М, V, F; 2) R, K; 3) F, Y, Н, W, R; 4) G, А, Т, S; 5) Q, N; и 6) D, Е. Рекомендации по заменам, вставкам или делециям могут быть основаны на выравнивании аминокислотных последовательностей различных вариантов белков или белков от различных видов. Таким образом, в дополнение к любому полипептиду IL-10, встречающемуся в природе, в настоящем описании рассмотрено наличие 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, обычно не более 20, 10 или 5 аминокислотных замен, при этом замены обычно представляет собой консервативные аминокислотные замены.
В настоящем описании также рассмотрены активные фрагменты (например, подпоследовательности) зрелого IL-10, содержащие непрерывные аминокислотные остатки, полученные из зрелого IL-10. Длина непрерывных аминокислотных остатков подпоследовательности пептида или полипептида варьирует в зависимости от конкретной аминокислотной последовательности, встречающейся в природе, из которой получена подпоследовательность. В целом, пептиды и полипептиды могут быть от примерно 20 аминокислот до примерно 40 аминокислот, от примерно 40 аминокислот до примерно 60 аминокислот, от примерно 60 аминокислот до примерно 80 аминокислот, от примерно 80 аминокислот до примерно 100 аминокислот, от примерно 100 аминокислот до примерно 120 аминокислот, от примерно 120 аминокислот до примерно 140 аминокислот, от примерно 140 аминокислот до примерно 150 аминокислот, от примерно 150 аминокислот до примерно 155 аминокислот, от примерно 155 аминокислот до полноразмерного пептида или полипептида.
Кроме того, полипептиды IL-10 могут иметь определенную идентичность последовательности по сравнению с эталонной последовательность на определенной длине непрерывных аминокислот (например, «окно сравнения»). Способы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения можно провести, например, с помощью алгоритма локальной гомологии по Smith & Waterman, Adv. Appl. Math. 2: 482 (1981), с помощью алгоритма локальной гомологии по Needleman & Wunsch, J. Mol. Biol. 48: 443 (1970), с помощью поиска для метода подобия по Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85: 2444 (1988), с помощью компьютерной реализации данных алгоритмов (GAP, BESTFIT, FASTA, и TFASTA в пакете программного обеспечения Wisconsin Genetics, Мэдисон, штат Висконсин), или с помощью ручного выравнивания и визуального контроля (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)).
Например, подходящий полипептид IL-10 может содержать аминокислотную последовательность, имеющую по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 98%, или по меньшей мере примерно 99%, идентичности аминокислотной последовательности с непрерывным участком от примерно 20 аминокислот до примерно 40 аминокислот, от примерно 40 аминокислот до примерно 60 аминокислот, от примерно 60 аминокислот до примерно 80 аминокислот, от примерно 80 аминокислот до примерно 100 аминокислот, от примерно 100 аминокислот до примерно 120 аминокислот, от примерно 120 аминокислот до примерно 140 аминокислот, от примерно 140 аминокислот до примерно 150 аминокислот, от примерно 150 аминокислот до примерно 155 аминокислот, от примерно 155 аминокислот до полноразмерного пептида или полипептида.
Как будет рассмотрено ниже, полипептиды IL-10 могут быть выделены из природного источника (например, среды, отличной от природной среды), а также могут быть получены рекомбинантным путем (например, в генетически модифицированных клетках-хозяевах, таких как бактерии, дрожжи, Pichia, клетки насекомых и тому подобное), при этом генетически модифицированные клетки-хозяева модифицированы нуклеиновой кислотой, содержащей нуклеотидную последовательность, кодирующую полипептид. Полипептиды IL-10 также могут быть получены синтетическим путем (например, посредством бесклеточного химического синтеза).
Молекулы нуклеиновых кислот, кодирующие IL-10 агенты, рассмотренные в настоящем описании, включая их встречающиеся в природе и не встречающиеся в природе изоформы, аллельные варианты и сплайс-варианты. Настоящее описание также охватывает последовательности нуклеиновых кислот, которые имеют изменения в одном или более оснований природной последовательности ДНК, но все еще транслируются в аминокислотную последовательность, которая соответствует полипептиду IL-10 из-за вырожденности генетического кода.
Концентрация IL-10 в сыворотке
Уровни IL-10 в плазме крови в способах, описанных в настоящем документе, можно охарактеризовать несколькими способами, включая: (1) среднюю остаточную концентрацию IL-10 в сыворотке выше некоторого заданного уровня или в диапазоне уровней; (2) среднюю остаточную концентрацию IL-10 в сыворотке выше некоторого заданного уровня в течение некоторого периода времени; (3) уровень устойчивой концентрации IL-10 в сыворотке выше или ниже некоторого заданного уровня или в диапазоне уровней; или (4) Cmax профиля концентрации выше или ниже некоторого заданного уровня или в некотором диапазоне уровней. Как указано в настоящем описании, установлено, что средние остаточные концентрации IL-10 в сыворотке имеют особенное значение для эффективности при некоторых показаниях.
В некоторых вариантах реализации настоящего описания, профили уровней концентрации в плазме крови, которые можно получить, включают: среднюю остаточную концентрацию IL-10 в сыворотке примерно более 0,1 нг/мл, примерно более 0,15 нг/мл, примерно более 0,2 нг/мл, примерно более 0,25 нг/мл, примерно более 0,3 нг/мл, примерно более 0,35 нг/мл, примерно более 0,4 нг/мл, примерно более 0,45 нг/мл, примерно более 0,5 нг/мл, примерно более 0,55 нг/мл, примерно более 0,6 нг/мл, примерно более 0,65 нг/мл, примерно более 0,7 нг/мл, примерно более 0,75 нг/мл, примерно более 0,8 нг/мл, примерно более 0,85 нг/мл, примерно более 0,9 нг/мл, примерно более 0,95 нг/мл, примерно более 1,0 нг/мл, примерно более 1,1 нг/мл, примерно более 1,2 нг/мл, примерно более 1,3 нг/мл, примерно более 1,4 нг/мл, примерно более 1,5 нг/мл, примерно более 1,6 нг/мл, примерно более 1,7 нг/мл, примерно более 1,8 нг/мл, примерно более 1,9 нг/мл, примерно более 2,0 нг/мл, примерно более 2,1 нг/мл, примерно более 2,2 нг/мл, примерно более 2,3 нг/мл, примерно более 2,4 нг/мл, примерно более 2,5 нг/мл, примерно более 2,75 нг/мл, или примерно более 3,0 нг/мл.
В конкретных вариантах реализации, направленных на лечение или предотвращение связанных с раком заболеваний, расстройств или состояний, терапия оптимизирована путем достижения средней остаточной концентрации IL-10 в сыворотке примерно более 0,5 нг/мл, примерно более 0,55 нг/мл, примерно более 0,6 нг/мл, примерно более 0,65 нг/мл, примерно более 0,7 нг/мл, примерно более 0,75 нг/мл, примерно более 0,8 нг/мл, примерно более 0,85 нг/мл, примерно более 0,9 нг/мл, примерно более 0,95 нг/мл, примерно более 1,0 нг/мл, примерно более 1,1 нг/мл, примерно более 1,2 нг/мл, примерно более 1,3 нг/мл, примерно более 1,4 нг/мл, примерно более 1,5 нг/мл, примерно более 1,6 нг/мл, примерно более 1,7 нг/мл, примерно более 1,8 нг/мл, примерно более 1,9 нг/мл, примерно более 2,0 нг/мл, примерно более 2,1 нг/мл, примерно более 2,2 нг/мл, примерно более 2,3 нг/мл, примерно более 2,4 нг/мл, примерно более 2,5 нг/мл, примерно более 2,75 нг/мл, или примерно более 3,0 нг/мл.
Конкретные варианты реализации настоящего описания включают среднюю остаточную концентрацию IL-10 в сыворотке в диапазоне от примерно 0,1 нг/мл до примерно 1,0 нг/мл, от примерно 0,1 нг/мл до примерно 0,9 нг/мл, от примерно 0,1 нг/мл до примерно 0,8 нг/мл, от примерно 0,1 нг/мл до примерно 0,7 нг/мл, от примерно 0,1 нг/мл до примерно 0,6 нг/мл, от примерно 0,1 нг/мл до примерно 0,5 нг/мл, от примерно 0,2 нг/мл до примерно 1,0 нг/мл, от примерно 0,2 нг/мл до примерно 0,9 нг/мл, от примерно 0,2 нг/мл до примерно 0,8 нг/мл, от примерно 0,2 нг/мл до примерно 0,7 нг/мл, от примерно 0,2 нг/мл до примерно 0,6 нг/мл, от примерно 0,2 нг/мл до примерно 0,5 нг/мл, от примерно 0,3 нг/мл до примерно 1,0 нг/мл, от примерно 0,3 нг/мл до примерно 0,9 нг/мл, от примерно 0,3 нг/мл до примерно 0,8 нг/мл, от примерно 0,3 нг/мл до примерно 0,7 нг/мл, от примерно 0,3 нг/мл до примерно 0,6 нг/мл, от примерно 0,3 нг/мл до примерно 0,5 нг/мл, от примерно 0,3 нг/мл до примерно 0,4 нг/мл, от примерно 0,4 нг/мл до примерно 1,0 нг/мл, от примерно 0,4 нг/мл до примерно 0,9 нг/мл, от примерно 0,4 нг/мл до примерно 0,8 нг/мл, от примерно 0,4 нг/мл до примерно 0,7 нг/мл, от примерно 0,4 нг/мл, до примерно 0,6 нг/мл, от примерно 0,4 нг/мл до примерно 0,5 нг/мл, от примерно 0,5 нг/мл до примерно 1,0 нг/мл, от примерно 0,5 нг/мл до примерно 0,9 нг/мл, от примерно 0,5 нг/мл до примерно 0,8 нг/мл, от примерно 0,5 нг/мл до примерно 0,7 нг/мл, от примерно 0,5 нг/мл до примерно 0,6 нг/мл, от примерно 0,7 нг/мл до примерно 2,3 нг/мл, от примерно 0,8 нг/мл до примерно 2,2 нг/мл, от примерно 0,9 нг/мл до примерно 2,1 нг/мл, от примерно 1,0 нг/мл до примерно 2,1 нг/мл, от примерно 1,0 нг/мл до примерно 2,0 нг/мл, от примерно 1,0 нг/мл до примерно 1,9 нг/мл, от примерно 1,0 нг/мл до примерно 1,8 нг/мл, от примерно 1,0 нг/мл до примерно 1,7 нг/мл, от примерно 1,0 нг/мл до примерно 1,6 нг/мл, от примерно 1,0 нг/мл до примерно 1,5 нг/мл, от примерно 1,9 нг/мл до примерно больше 2,5 нг/мл, от примерно 1,9 нг/мл до примерно 2,5 нг/мл, от примерно 1,9 нг/мл до примерно 2,4 нг/мл, от примерно 1,9 нг/мл до примерно 2,3 нг/мл, от примерно 1,9 нг/мл до примерно 2,2 нг/мл, или от примерно 1,9 нг/мл до примерно 2,1 нг/мл.
В конкретных вариантах реализации, направленных на лечение или предотвращение противовоспалительных заболеваний, расстройств или состояний, терапия оптимизирована путем достижения средней остаточной концентрации IL-10 в сыворотке от ОД нг/мл до 1,0 нг/мл, от 0,1 нг/мл до 0,9 нг/мл, от 0,1 нг/мл до 0,8 нг/мл, от 0,1 нг/мл до 0,7 нг/мл, от 0,1 нг/мл до 0,6 нг/мл, от 0,1 нг/мл до 0,5 нг/мл, от 0,2 нг/мл до 1,0 нг/мл, от 0,2 нг/мл до 0,9 нг/мл, от 0,2 нг/мл до 0,8 нг/мл, от 0,2 нг/мл до 0,7 нг/мл, от 0,2 нг/мл до 0,6 нг/мл, от 0,2 нг/мл до 0,5 нг/мл, от 0,3 нг/мл до 1,0 нг/мл, от 0,3 нг/мл до 0,9 нг/мл, от 0,3 нг/мл до 0,8 нг/мл, от 0,3 нг/мл до 0,7 нг/мл, от 0,3 нг/мл до 0,6 нг/мл, от 0,3 нг/мл до 0,5 нг/мл, от 0,3 нг/мл до 0,4 нг/мл, от 0,4 нг/мл до 1,0 нг/мл, от 0,4 нг/мл до 0,9 нг/мл, от 0,4 нг/мл до 0,8 нг/мл, от 0,4 нг/мл до 0,7 нг/мл, от 0,4 нг/мл до 0,6 нг/мл, от 0,4 нг/мл до 0,5 нг/мл, от 0,5 нг/мл до 1,0 нг/мл, от 0,5 нг/мл до 0,9 нг/мл, от 0,5 нг/мл до 0,8 нг/мл, от 0,5 нг/мл до 0,7 нг/мл, или от 0,5 нг/мл до 0,6 нг/мл.
В экспериментальной части описаны оценки терапевтической эффективности mIL-10 и PEG-mIL-10 в плоскоклеточной карциноме PDV6 и карциноме толстой кишки СТ-26, в которых параметры дозирования (количество и частота введения) mIL-10 и mPEG-IL-10 достаточны для достижения средней остаточной концентрации IL-10 в сыворотке 1-2 нг/мл. Как описано в экспериментальной части, обработка PEG-IL-10 давала полную ремиссию, в то время как обработка IL-10 демонстрировала противоопухолевое действие, но не полную ремиссию.
Также можно оценить эффект лечения IL-10 при гепатите С.Мышиную модель с функциональной иммунной системой, которая восприимчива к инфекции, вызываемой вирусом гепатита С (см., Dorner, М. (09 June 2011) Nature 474: 208-211), можно применять для оценки фармакокинетических и фармакодинамических эффектов mIL-10 и PEG-mIL-10. Используя принципы, изложенные в настоящем документе, и базу знаний в данной области, можно оценить эффект введения mIL-10 и PEG-mIL-10 для достижения средней остаточной концентрации IL-10 в сыворотке примерно 0,1 нг/мл, примерно 0,5 нг/мл, примерно 1,0 нг/мл, примерно 1,5 нг/мл и примерно 2 нг/мл.
Хотя это и не было широко распространено при терапевтических дозах для большинства групп пациентов, введение высоких доз IL-10 вызвало неблагоприятные эффекты (например, головную боль, анемию и воздействие на печень) у ограниченного числа субъектов. К счастью, такие неблагоприятные эффекты не являются широко распространенными, если поддерживать среднюю концентрацию IL-10 в сыворотке 0,1-2 нг/мл в течение всего периода лечения. Тем не менее в другом варианте реализации настоящего описания предложен способ мониторинга субъекта, получающего терапию IL-10, с целью предсказать, и, таким образом, потенциально избежать неблагоприятных эффектов, при этом способ включает: (1) измерение пиковой концентрации IL-10 у субъекта; (2) измерения остаточной концентрации IL-10 у субъекта; (3) вычисление колебаний между пиковой и остаточной концентрациями; и (4), применение рассчитанных колебаний между пиковой и остаточной концентрациями для предсказания потенциальных неблагоприятных эффектов у субъекта. Меньшие колебания между пиковой и остаточной концентрациями указывают на более низкую вероятность того, что субъект будет испытывать неблагоприятные эффекты, связанные с IL-10. В некоторых вариантах реализации конкретные колебания между пиковой и остаточной концентрациями определяют для лечения конкретных заболеваний, расстройств и состояний с применением конкретных параметров дозирования, и данные колебания применяют в качестве эталонных стандартов.
В дополнение к дозозависимым параметрам IL-10, описанным выше, также уместны рассуждения в отношении объема распределения. Для большинства лекарственных средств, концентрации лекарственных средств в плазе снижаются мультиэкспоненциальным образом. Сразу же после внутривенного введения лекарственное средство быстро распределяется во всем начальном пространстве (минимально определяется как объем плазмы), а затем происходит более медленное, равновесное распределение в экстраваскулярных пространствах (например, в определенных тканях). Внутривенное введение IL-10 связано с такой двухмерной кинетической моделью (см., Rachmawati, Н. et al. (2004) Pharm. Res. 21(11): 2072-78). Также была изучена фармакокинетика подкожного рекомбинантного hIL-10 (Radwanski, Е. et al. (1998) Pharm. Res. 15(12): 1895-1901). Более того, модификации IL-10 введены в попытке нацелить цитокин на конкретный тип клеток (см., Rachmawati, Н. (May 2007) Drug Met. Dist. 35(5):814-21).
Как описано далее, противоопухолевую эффективность IL-10 и PEG-IL-10 наблюдали у мышей в результате индукции цитотоксических ферментов в CD8+ Т-клетках, что приводило к уничтожению опухолевых клеток. Многие противораковые соединения, включая, но не ограничиваясь ими, апоптоз-индуцирующие агенты, вводят циклами. Часто, вводят однократную дозу или серию доз, приближающихся к максимально переносимой дозе (МПД), включая применение однократных или серии высоких доз, приближающихся к максимально переносимой дозе (МПД) с последующим прекращением дозирования («лекарственные каникулы») для восстановления нормальной физиологии пациента. В качестве примера, данная стратегия дозирования применяется к цитотоксическим химиотерапевтическим препаратам на основе антител, например, против фактора роста эндотелия сосудов VEGF (АВАСТИН), и короткоживущим биологическим реагентам, таким как ПРОЛЕЙКИН (IL-2).
Исследования на мышах проводили для получения данных, необходимых для понимания фармакокинетических параметров терапии IL-10 и для оптимизации режимов лечения опухолей у людей. Как описано в экспериментальной части, несмотря на то, что мыши, получавшие одинаковое количество лекарственного средства в течение недели, которое вводили в однократной или нескольких дозах, имели подобные общие экспозиции, мыши, получавшие ежедневные дозы, демонстрировали наибольшее уменьшение размера опухоли (таблица 15). Кроме того, режимы обработки, которые приводили к поддержанию остаточных концентраций в сыворотке примерно более 1 нг/мл (например, 1,1-2,1 нг/мл), показывали наибольшее снижение размера и массы опухоли (таблица 16).
В настоящем описании предусмотрено введение любых доз, которые приводят к поддержанию остаточных концентраций в сыворотке примерно более 0,1 нг/мл (например, 0,1-2 нг/мл, 0,1-1 нг/мл, 0,5-1,5 нг/мл или 1,1-2,1 нг/мл). Например, когда субъектом является человек, непегилированный hIL-10 можно вводить в дозе более 15 мкг/кг/сутки, более 18 мкг/кг/сутки, более 20 мкг/кг/сутки, более 21 мкг/кг/сутки, более 22 мкг/кг/сутки, более 23 мкг/кг/сутки, более 24 мкг/кг/сутки, или более 25 мкг/кг/сутки. Когда субъектом является человек, PEG-hIL-10, содержащий сравнительно небольшой ПЭГ (например, 5 кДа моно-ди PEG-hIL10) можно вводить в дозе более 2,0 мкг/кг/сутки, более 2,3 мкг/кг/сутки, более 2,5 мкг/кг/сутки, более 2,6 мкг/кг/сутки, более 2,7 мкг/кг/сутки, более 2,8 мкг/кг/сутки, более 2,9 мкг/кг/сутки, более 3,0 мкг/кг/сутки, более 3,1 мкг/кг/сутки, более 3,2 мкг/кг/сутки, более 3,3 мкг/кг/сутки, более 3,4 мкг/кг/сутки или более 3,5 мкг/кг/сутки.
Роль CD8+ Т-клеток в функции IL-10
CD8 (кластер дифференцировки 8) представляет собой трансмембранный гликопротеин, который служит в качестве корецептора для Т-клеточного рецептора (TCR). CD8 корецептор преимущественно экспрессируется на поверхности цитотоксических Т-лимфоцитов (ЦТЛ), но его также можно найти на других типах клеток, включая клетки натуральных киллеров (НК). Как и TCR, CD8 связывается с молекулой главного комплекса гистосовместимости (ГКГС), но является специфическим для белка ГКГС I класса.
CD8 функция требует формирование димера, содержащего пару цепей CD8. Существуют две изоформы CD8, альфа и бета, и наиболее распространенная форма CD8 содержит CD8-α и CD8-β цепь, которые обе являются членами надсемейства иммуноглобулинов. CD8-α взаимодействует с молекулой ГКГС I класса, и это взаимодействие удерживает Т-клеточный рецептор цитотоксической Т-клетки и клетку-мишень тесно связанными в процессе антиген-специфической активации. Цитотоксические Т-клетки с поверхностным белком CD8 называются «CD8+ Т-клетками». CD8+ Т-клетки (ЦТЛ и НК-клетки) распознают антигены (обычно пептиды или белки на поверхности клетки, образующиеся в результате инфекции внутриклеточными патогенами) специфических инфицированных клеток-мишеней, и если данные антигены отличаются от нормального профиля антигенов субъекта («иммунологически своих»), то активируются CD8+ Т-клетки и индуцируют апоптоз клеток-мишеней.
Существуют несколько сценариев, при которых отличаются профили антигенов. Например, когда возбудитель (например, вирус) проникает в клетку, клетка производит «чужие» антигены клеточной поверхности, и CD8+ Т-клетки инициируют иммунный ответ в попытке уничтожить инфицированные клетки. Другой сценарий реализуется тогда, когда модифицируется часть белков клетки из-за мутаций в нуклеиновой кислоте и/или на аминокислотном уровне. Раковые клетки обычно несут множество мутаций и распознаются CD8+ Т-клетками как «отличающиеся». Наличие CD8+ Т-клеток у людей с раком коррелирует с более долгой выживаемостью.
При обоих вышеупомянутых сценариях активированные CD8+ Т-клетки производят IFNγ, перфорин и гранзим В. IFNγ важен для дальнейшего повышающего регулирования «представления» антигенов на клетках-мишенях, которое происходит на белке ГКГС I класса. Перфорин и гранзим В опосредуют убийство клетки-мишени (например, вируса и рака).
Перфорин, цитолитический белок, обнаруженный в гранулах ЦТЛ и НК, встраивает себя в плазматическую мембрану клетки-мишени при дегрануляции. Перфорин имеет структурные и функциональные сходства с компонентом комплемента 9 (С9), и, как С9, перфорин создает трансмембранные канальцы и способен к неспецифическому лизису различных клеток-мишеней. Перфорин является ключевой эффекторной молекулой для Т-клеточного и НК-клеточного цитолиза.
Как упоминалось выше, гранзим В представляет собой сериновую протеазу, экспрессирующуюся цитотоксическими Т-лимфоцитами (ЦТЛ) и натуральными киллерами (НК). ЦТЛ и НК-клетки распознают специфические популяции зараженных клеток-мишеней и индуцируют апоптоз клеток, которые несут на своей поверхности «чужие» антигены, обычно пептиды или белки, образующиеся в результате заражения внутриклеточными патогенами. Гранзим В имеет решающее значение для быстрой индукции апоптоза клеток-мишеней с помощью ЦТЛ при клеточно-опосредованном иммунном ответе.
IL-10 играет различные роли в активации CD8+ Т-клеток. Например, IL-10 индуцирует эффекторные молекулы (IFNγ, перфорин и гранзим В) в памяти CD8+ Т-клеток, клеток, которые образовались во время предыдущей инфекции или вакцинации. Такие CD8+ Т-клетки памяти являются клетками, ответственными за обеспечение долгосрочной защиты субъекта от вирусов. Хотя образование и амплификация CD8+ Т-клеток памяти может происходить в отсутствие IL-10 (Vicari, A. and Trinchieri, G. (2004) Immuno. Rev. 202: 223-236), тот факт, что IL-10 непосредственно активизирует такие клетки, обеспечивает уникальный и альтернативный терапевтический подход. Несмотря на то что хроническая вирусная инфекция связана с CD8+ Т-клетками (Virgin, Н. et al. (2009) Cell 138, p. 30), не было описано лечения субъектов (например, мышей) при помощи непегированного IL-10 или легированного IL-10.
В свете вышеизложенного, один из вариантов настоящего описания основан на связи между CD8+ Т-клетками и раком и вирусными инфекциями. Таким образом, некоторые способы лечения и/или предотвращения связанных с раком заболеваний, расстройств и состояний, такие как поддержание средней концентрации IL-10 в сыворотке, например, ≥0,5 нг/мл, ≥1 нг/мл или ≥2 нг/мл, также следует применять при лечении связанных с вирусами заболеваний, расстройств и состояний.
В отличие от других цитокинов, IL-10 можно рассматривать и как мощный иммуностимулирующий и как иммуносупрессивный фактор. Роль CD8+ Т-клеток в хроническом воспалении полностью не выяснена. Однако, поскольку вовлечение IFNγ при раке и вирусных расстройствах опосредовано по меньшей мере частично CD8+ Т-клетками, и поскольку IL-10-Т-клеточный путь вовлечен в регуляцию расстройств, связанных воспалением (через понижающее регулирование воспалительных цитокинов), также включает IFNγ, CD8+ Т-клетки также могут играть ключевую роль в воспалении. Таким образом, IL-10 может оказаться важным терапевтическим средством среди современных стабильных противовоспалительных агентов.
Способы получения IL-10
Полипептид настоящего описания можно получить любым подходящим способом, включая нерекомбинантные (например, химический синтез) и рекомбинантные способы.
Химический синтез
Если полипептид синтезируют химически, синтез может протекать через жидкую фазу или твердую фазу. Твердофазный пептидный синтез (ТФПС) позволяет включение не встречающихся в природе аминокислот и/или модификацию пептидного/белкового скелета. Различные формы ТФПС, такие как 9-флуоренилметоксикарбонильные (Fmoc) и трет-бутилоксикарбонильные (Воc), доступны для синтеза полипептидов согласно настоящему описанию. Подробная информация о химических синтезах известна в данной области техники (например, Ganesan А. (2006) Mini Rev. Med. Chem. 6: 3-10; и Camarero J.A. et al., (2005) Protein Pept Lett. 12: 723-8).
Твердофазный пептидный синтез можно выполнять, как описано ниже. Альфа-группы (Nα) и любые реакционно-способные боковые цепи защищены кислотно-лабильными или основно-лабильными группами. Защитные группы стабильны в условиях получения амидных связей, но могут легко отщепляться без ущерба для образовавшейся пептидной цепи. Подходящие защитные группы для α-аминогрупп включают, но не ограничиваются, следующие: Boc, бензилоксикарбонил (Z), О-хлорбензилоксикарбонил, бифенилизопропилоксикарбонил, трет-амилоксикарбонил (Аmос), α,α-диметил-3,5-диметокси-бензилоксикарбонил, о-нитросульфенил, 2-циано-трет-бутоксикарбонил, Fmoc, 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde) и тому подобные.
Подходящие защитные группы для боковой цепи включают, но не ограничиваются: ацетил, аллил (All), аллилоксикарбонил (Alloc), бензил (Bzl), бензилоксикарбонил (Z), трет-бутилоксикарбонил (Boc), бензилоксиметил (Bom), о-бромбензилоксикарбонил, трет-бутил (tBu), трет-бутилдиметилсилил, 2-хлорбензил, 2-хлорбензилоксикарбонил, 2,6-дихлорбензил, циклогексил, циклопентил, 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde), изопропил, 4-метокси-2,3-6-триметилбензилсульфонил (Mtr), 2,3,5,7,8-пентаметилхроман-6-сульфонил (Pmc), пивалил (pivalyl), тетрагидропиран-2-ил, тозил (Tos), 2,4,6-триметоксибензил, триметилсилил и тритил (Trt).
В твердофазном синтезе С-концевая аминокислота соединена с подходящей подложкой. Применяют подходящие подложки, которые инертны по отношению к реагентам и условиям реакции ступенчатой конденсации и реакциям расщепления в процессе синтеза и которые не растворяются в реакционной среде. Примеры коммерчески доступных подложек включают сополимеры стирола/дивинилбензола, которые модифицированы реакционноспособными группами и/или полиэтиленгликолем; хлорметилированные сополимеры стирола/дивинилбензола; гидроксиметилированные или аминометилированные сополимеры стирола/дивинилбензола; и тому подобные. Когда желательно получение пептидной кислоты (peptidic acid), можно использовать полистирол(1%)-дивинилбензол или TentaGel®, дериватизированный 4-бензилоксибензиловым спиртом (смола Ванга) или 2-хлортритил хлоридом. В случае амида пептида, можно использовать полистирол(1%)-дивинилбензол или TentaGel®, дериватизированный 5-(4'-аминометил)-3',5'-диметоксифенокси)валериановой кислотой (PAL-смола) или п-(2,4-диметоксифенил-аминометил)-феноксигруппой (смола Ринка).
Связь с полимерным носителем можно достичь при помощи взаимодействия С-концевой Fmoc-защищенной аминокислоты с подложкой путем добавления активационного реагента в этаноле, ацетонитриле, N,N-диметилформамиде (ДМФА), дихлорметане, тетрагидрофуране, N-метилпирролидоне или подобных растворителях при комнатной температуре или повышенных температурах (например, от 40°С и 60°С) и с временем реакции, например, от 2 до 72 часов.
Присоединение Nα-защищенной аминокислоты (например, Fmoc-аминокислоты) к смоле PAL, Ванга или Ринка, например, можно осуществлять с помощью связывающих реагентов, таких как N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид (DIC) или других карбодиимидов, 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуроний тетрафторборат (TBTU) или других урониевых солей, О-ацил-мочевины, бензотриазол-1-ил-трис-пирролидино-фосфоний гексафторфосфат (PyBOP) или других солей фосфония, N-гидроксисукцинимиды, другие N-гидроксиимиды или оксимы, в присутствии или в отсутствии 1-гидроксибензотриазола или 1-гидрокси-7-азабензотриазола, например, с помощью TBTU с добавлением HOBt, с добавлением или без добавления основания, такого как, например, диизопропилэтиламин (ДИЭА), триэтиламин или N-метилморфолин, например, диизопропилэтиламин при времени реакции от 2 до 72 часов (например, 3 часа от 1,5 до 3-кратного избытка аминокислоты и связывающих реагентов, например, в 2-кратном избытке и при температуре от примерно 10°С до 50°С, например, 25°С, в растворителе, таком как диметилформамид, N-метилпирролидон или дихлорметан, например, диметилформамид).
Вместо связывающих реагентов также можно применять активные сложные эфиры (например, пентафторфенил, нитрофенил или тому подобные), симметричный ангидрид Nα-Fmoc-аминокислоты, ее хлорангидрид или фторангидрид при условиях, описанных выше.
Nα-защищенную аминокислоту (например, Fmoc-аминокислоту) можно присоединять к 2-хлортритиловой смоле в дихлорметане с добавлением ДИЭА и временем реакции от 10 до 120 минут, например, 20 минут, но не ограничиваясь применением данного растворителя и данного основания.
Последовательное присоединение защищенных аминокислот можно осуществлять в соответствии с обычными методами пептидного синтеза, обычно в автоматическом синтезаторе пептидов. После отщепления Nα-Fmoc-защитной группы от аминокислоты, присоединенной к твердой фазе, путем обработки, например, пиперидином (от 10% до 50%) в диметилформамиде в течение от 5 до 20 минут, например, 2×2 минуты 50% пиперидином в ДМФА и 1×15 минут 20% пиперидином в ДМФА, следующую защищенную аминокислоту от 3- до 10-кратного избытка, например, в 10-кратном избытке, соединяют с предыдущей аминокислотой в инертном, неводном, полярном растворителе, таком как дихлорметан, ДМФА или их смеси, и при температуре от примерно 10°С до 50°С, например, при 25°С. Указанные выше реагенты для присоединения первой Nα-Fmoc-аминокислоты к смоле PAL, Ванга или Ринка пригодны в качестве связывающих реагентов. В качестве альтернативы также можно применять активные сложные эфиры защищенной аминокислоты, или их хлориды или фториды или симметричные ангидриды.
В конце твердофазного синтеза пептид отщепляют от подложки одновременно с отщеплением защитных групп боковой цепи. Отщепление можно проводить при помощи трифторуксусной кислоты или другой сильнокислой среды с добавлением 5%-20% об./об. поглотителей, таких как диметилсульфид, этилметилсульфид, тиоанизол, тиокрезол, м-крезол, анизол этандитиол, фенол или вода, например, 15% об./об. диметилсульфид/этандитиол/м-крезол 1:1:1, в течение от 0,5 до 3 часов, например, 2 часа. Пептиды с полностью защищенными боковыми цепями получают путем расщепления 2-хлортритиловой смолы при помощи ледяной уксусной кислоты/трифторэтанола/дихлорметана 2:2:6. Защищенный пептид можно очищать при помощи хроматографии на силикагеле. Если пептид связан с твердой фазой через смолу Ванга, и если он предназначен для получения пептида с С-концевым алкиламидированием, расщепление можно осуществлять аминолизом с алкиламином или фторалкиламином. Аминолиз осуществляют при температуре от примерно -10°С до 50°С (например, примерно 25°С), и время реакции составляет от примерно 12 до 24 часов (например, примерно 18 часов). Кроме того, пептид можно отщеплять от носителя путем переэтерификации, например, с метанолом.
Полученный кислый раствор можно смешивать с 3- до 20-кратным количеством холодного эфира или н-гексана, например, с 10-кратным избытком диэтилового эфира, для осаждения пептида, и следовательно для разделения поглотителей и отщепленных защитных групп, которые остаются в эфире. Дальнейшую очистку можно осуществлять путем повторного осаждения пептида несколько раз из ледяной уксусной кислоты. Полученный осадок можно помещать в воду или трет-бутанол, или смесь двух растворителей, например, смесь 1:1 трет-бутанола/воды, и лиофилизировать.
Полученный пептид можно очищать при помощи различных хроматографических методов, включая ионный обмен на слабощелочной смоле в ацетатной форме; хроматографию с гидрофобной адсорбцией на недериватизированных сополимерах полистирола/дивинилбензола (например, Amberlite® XAD); адсорбционную хроматографию на силикагеле; ионообменную хроматографию, например, на карбоксиметилцеллюлозе; распределительную хроматографию, например, на Sephadex® G-25; противоточную распределительную хроматографию; или высокоэффективную жидкостную хроматографию (ВЭЖХ), например, обращенно-фазовую ВЭЖХ на октил или октадецилсиликагеле (ODS).
Рекомбинантное получение
Способы, описывающие получение IL-10 человека и мыши, можно найти, например, в патенте США №5231012, в котором изложены способы производства белков, обладающих активностью IL-10, включая рекомбинантные и другие способы синтеза. IL-10 может быть вирусного происхождения, клонирование и экспрессия вирусного IL-10 в вирусе Эпштейна-Барра (белок BCRF1) представлена в Moore et al., (1990) Science 248: 1230. L-10 можно получить несколькими способами с применением стандартных методов, известных в данной области техники, например, описанных в настоящем документе. Рекомбинантный IL-10 человека также коммерчески доступен, например, от PeproTech, Inc., Роки Хилл, Ньюджерси.
В случае, когда полипептид получают при помощи рекомбинантных методов, полипептид можно получить в виде внутриклеточного белка или в виде секретируемого белка с применением любой подходящей конструкции и любой подходящей клетки-хозяина, которая может быть прокариотической или эукариотической клеткой, такой как бактериальная (например, E.coli) или дрожжевая клетка-хозяин, соответственно; Другие примеры эукариотических клеток, которые можно применять в качестве клеток-хозяев, включают клетки насекомых, клетки млекопитающих и/или растительные клетки. Если применяются клетки млекопитающих, то они могут включать человеческие клетки (например, HeLa, 293, Н9 и клетки Jurkat); мышиные клетки (например, NIH3T3, L клетки, и С127 клетки); клетки приматов (например, Cos 1, Cos 7 и CV1); и клетки хомячка (например, клетки яичника китайского хомячка (СНО)).
Различные хост-векторные системы, пригодные для экспрессии полипептида, можно применять согласно стандартным процедурам, известным в данной области техники. См, например, Sambrook et al., 1989, Current Protocols in Molecular Biology Cold Spring Harbor Press, New York; и Ausubel et al., 1995, Current Protocols in Molecular Biology, Eds. Wiley and Sons. Методы введения генетического материала в клетки-хозяева включают, например, трансформацию, электропорацию, конъюгацию, кальций-фосфатные методы и тому подобные. Способ переноса можно выбрать так, чтобы обеспечить стабильную экспрессию введенной нуклеиновой кислоты, кодирующей полипептид. Нуклеиновая кислота, кодирующая полипептид, может быть предоставлена в виде наследуемого эписомального элемента (например, плазмиды) или может быть интегрирована в геном. Разнообразные подходящие векторы для применения в производстве целевого полипептида являются коммерчески доступными.
Векторы могут обеспечить внехромосомное поддержание в клетке-хозяине или могут обеспечить интеграцию в геном клетки-хозяина. Экспрессионный вектор содержит регуляторные последовательности транскрипции и трансляции, и может обеспечивать индуцируемую или конститутивную экспрессию, при этом кодирующая область функционально связана с транскрипционным контролем области инициации транскрипции, а также с областью терминации транскрипции и трансляции. В целом, регуляторные последовательности транскрипции и трансляции могут включать, но не ограничиваются, промоторные последовательности, сайты связывания рибосом, последовательности запуска и остановки транскрипции, последовательности запуска и остановки трансляции, и энхансерные или активаторные последовательности. Промоторы могут быть как конститутивными так и индуцируемыми, и могут являться сильными конститутивными промоторами (например, Т7).
Экспрессионные конструкции обычно имеют удобные сайты рестрикции, расположенные вблизи промоторной последовательности для обеспечения вставок последовательностей нуклеиновых кислот, кодирующих целевые белки. В экспрессирующем хозяине может присутствовать селективный маркер для облегчения селекции клеток, содержащих вектор. Кроме того, экспрессионная конструкция может содержать дополнительные элементы. Например, экспрессионный вектор может иметь одну или две системы репликации, что позволяет ему сохраняться в организмах, например, в клетках млекопитающих или насекомых для экспрессии, и в прокариотической клетке-хозяине для клонирования и амплификации. Кроме того, экспрессионная конструкция может содержать селективный маркерный ген, который позволяет отбирать трансформированные клетки-хозяев. Селективные гены хорошо известны в данной области техники и будут изменяться в зависимости от используемой клетки-хозяина.
Выделение и очистку белка можно осуществлять согласно способам, известными в данной области техники. Например, белок можно выделять из лизата клеток, генетически модифицированных для конститутивной экспрессии белка и/или экспрессии после индукции, или из синтетической реакционной смеси путем иммуноаффинной очистки, которая обычно включает контакт образца с антителом к белку, промывку для удаления неспецифически связанного материала, и элюирование специфически связанного белка. Выделенный белок можно дополнительно очищать при помощи диализа и других методов, обычно применяемых при очистке белков. В одном варианте реализации белок можно выделять при помощи методов металл-хелатной хроматографии. Белки могут содержать модификации для облегчения выделения.
Полипептиды могут быть получены по существу в чистом виде или в выделенном виде (например, свободном от других полипептидов). Полипептиды могут присутствовать в композиции, которая обогащена полипептидом по отношению к другим компонентам, которые могут присутствовать (например, к другим полипептидам или другим компонентам клетки-хозяина). Например, очищенный полипептид может быть предложен таким образом, что полипептид присутствует в композиции, которая по существу не содержит других экспрессированных белков, например, примерно менее 90%, примерно менее 60%, примерно менее 50%, примерно менее 40%, примерно менее 30%, примерно менее 20%, примерно менее 10%, примерно менее 5%, или примерно менее 1%.
Полипептид IL-10 может быть получен с использованием рекомбинантных методов для манипуляции с различными IL-10-родственными нуклеиновыми кислотами, известными в данной области техники, с получением конструкций, способных кодировать полипептид IL-10. Следует иметь в виду, что если предложена конкретная аминокислотная последовательность, то обычному специалисту в данной области техники будут понятны различные молекулы нуклеиновых кислот, кодирующие такую аминокислотную последовательность, с учетом его знаний и опыта, например, в молекулярной биологии.
Замены амидной связи
В некоторых случаях, IL-10 содержит одну или более связей, помимо пептидных связей, например, по меньшей мере две смежные аминокислоты соединены при помощи связи, отличной от амидной связи. Например, для уменьшения или устранения нежелательного протеолиза или других механизмов деградации, и/или для повышения стабильности в сыворотке, и/или для ограничения или увеличения конформационной гибкости может быть замещена одна или более амидных связей в основной цепи IL-10.
В другом примере одна или более амидных связей (-CO-NH-) в IL-10 может быть заменена связью, которая изостерна амидной связи, например, как -CH2NH-, -CH2S-, -СН2СН2-, -СН=СН-(цис и транс), -СОСН2-, -СН(ОН)СН2- или -CH2SO-. Одна или более амидных связей в IL-10 также может быть заменена, например, на восстановленную изостерную псевдопептидную связь. См., Couder et al. (1993) Int. J. Peptide Protein Res. 41: 181-184. Такие замены и способы их осуществления известны специалистам в данной области техники.
Аминокислотные замены
В полипептиде IL-10 может быть сделана одна или более аминокислотных замен. Ниже приведены не ограничивающие примеры:
a) замена алкилзамещенных гидрофобных аминокислот, включая аланин, лейцин, изолейцин, валин, норлейцин, (S)-2-аминомасляную кислоту, (S)-циклогексилаланин или другие простые альфа-аминокислоты, замещают на алифатическую боковую цепь C1-С10 атомов углерода, включая разветвленные, циклические и алкильные с прямой цепью, алкенильные или алкинильные замены;
b) замена арилзамещенных гидрофобных аминокислот, включая фенилаланин, триптофан, тирозин, сульфотирозин, бифенилаланин, 1-нафтилаланин, 2-нафтилаланин, 2-бензотиенилаланин, 3-бензотиенилаланин, гистидин, включая амино, алкиламино, диалкиламино, аза, галогенированные (фтор-, хлор-, бром- или йод-) или алкокси (от C1-С4)-замещенные формы указанных выше ароматических аминокислот, иллюстративные примеры которых представляют собой: 2-, 3- или 4-аминофенилаланин, 2-, 3- или 4-хлорфенилаланин, 2-, 3- или 4-метилфенилаланин, 2-, 3- или 4-метоксифенилаланин, 5-амино-, 5-хлор-, 5-метил- или 5-метокситриптофан, 2'-, 3'- или 4'-амино-, 2'-, 3'- или 4-хлор-, 2, 3 или 4-бифенилаланин, 2'-, 3'- или 4'-метил-, 2-, 3- или 4-бифенилаланин и 2- или 3-пиридил аланин;
c) замена аминокислот, содержащих основные боковые цепи, включая аргинин, лизин, гистидин, орнитин, 2,3-диаминопропионовую кислоту, гомоаргинин, включая алкил, алкенил или арил-замещенные (C1-С10 разветвленные, линейные или циклические) производные указанных ранее аминокислот, при этом заместитель представляет собой гетероатомы (например, альфа-азот, или дистальный азот или азоты, или альфа-углерод, например, в положении про-R. Соединения, которые служат в качестве иллюстративных примеров, включают N-эпсилон-изопропиллизин, 3-(4-тетрагидропиридил)-глицин, 3-(4-тетрагидропиридил)-аланин, N,N-гамма, гамма'-диэтил-гомоаргинин. Также включены соединения, такие как альфа-метил-аргинин, альфа-метил-2,3-диаминопропионовая кислота, альфа-метил-гистидин, альфа-метил-орнитин, где алкильная группа занимает положение при-R альфа-углерода. Также включены амиды, образованные из алкильной, ароматической, гетероароматической группы (где гетероароматическая группа содержит один или более атомов азота, кислорода или атомов серы по отдельности или в комбинации), карбоновые кислоты или любые из многочисленных известных активированных производных, таких как хлориды, активные сложные эфиры, активные азалиды и родственные производные, и лизин, орнитин или 2,3-диаминопропионовая кислота;
d) замена кислых аминокислот, включая аспарагиновую кислоту, глутаминовую кислоту, гомоглутаминовую кислоту, тирозин, алкил, арил, арилалкил, гетероарил и сульфонамиды 2,4-диаминоприопионовой (diaminopriopionic) кислоты, орнитин или лизин и тетразол-замещенные алкиламинокислоты;
e) замена амидных остатков боковой цепи, включая аспарагин, глутамин, и алкил или ароматические замещенные производные аспарагина или глутамина; и
f) замена гидроксил-содержащих аминокислот, включая серии, треонин, гомосерин, 2,3-диаминопропионовую кислоту и алкил- или ароматических замещенных производных серина или треонина.
В некоторых случаях, IL-10 содержит одну или более природных, не кодируемых генетически L-аминокислот, синтетические L-аминокислоты, или D-энантиомеры аминокислот. Например, IL-10 может содержать только D-аминокислоты. Например, полипептид IL-10 может содержать один или более следующих остатков: гидроксипролин, β-аланин, о-аминобензойную кислоту, м-аминобензойную кислоту, п-аминобензойную кислоту, м-аминобензойную кислоту, 2,3-диаминопропионовую кислоту, α-аминоизомасляную кислоту, N-метилглицин (саркозин), орнитин, цитруллин, трет-бутилаланин, трет-бутилглицин, N-метилизолейцин, фенилглицин, циклогексилаланин, норлейцин, нафтилаланин, пиридилаланин, 3-бензотиенилаланин, 4-хлорофенилаланин, 2-фторфенилаланин, 3-фторфенилаланин, 4-фторфенилаланин, пеницилламин, 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты, β-2-тиенилаланин, метионинсульфоксид, гомоаргинин, N-ацетиллизин, 2,4-диаминомасляную кислоту, п-аминофенилаланин, N-метилвалин, гомоцистеин, гомосерин, ε-аминокапроновую кислоту, ω-аминокапроновую кислоту, ω-аминогептановую кислоту, ω-аминооктановую кислоту, ω-аминодекановую кислоту, ω-аминотетрадекановую кислоту, циклогексилаланин, α,γ-диаминомасляную кислоту, α,β-диаминопропионовую кислоту, δ-аминовалериановую кислоту и 2,3-диаминомасляную кислоту.
Дополнительные модификации
Остаток цистеина или аналог цистеина может быть введен в полипептид IL-10 для обеспечения связи с другим пептидом через дисульфидную связь или для обеспечения циклизации полипептида IL-10. Способы введения цистеина или аналогов цистеина известны в данной области техники; см., например, патент США №8067532.
Полипептид IL-10 может быть циклизован. Один или более цистеинов или аналогов цистеина может быть введен в полипептид IL-10, при этом введенный цистеин или аналог цистеина может образовывать дисульфидную связь со вторым введенным цистеином или аналогом цистеина. Другие средства циклизации включают введение оксимного линкера или лантионинового линкера; см., например, патент США №8044175. Можно использовать и/или вводить любую комбинацию аминокислот (или неаминокислотных фрагментов), которые могут образовывать циклизующую связь. Циклизующую связь можно получить при помощи любой комбинации аминокислот (или с аминокислотой и -(СН2)n-СО- или -(СН2)n-C6H4-СО-) с функциональными группами, которые позволяют введение мостика. Некоторые примеры представляют собой дисульфиды, дисульфидные миметики, такие как -(СН2)n- карбамостики, тиоацетальные, тиоэфирные мостики (цистатионин или лантионин), и мостики, содержащие сложные и простые эфиры. В данных примерах, n может быть любым целым числом, но чаще менее десяти.
Другие модификации включают, например, N-алкильную (или арильную) замену (ψ[CONR]), или сшивку скелета для построения лактамных и других циклических структур. Другие производные включают С-концевые гидроксиметильные производные, о-модифицированные производные (например, С-концевой гидроксиметилбензиловый эфир), N-концевые модифицированные производные, включая замещенные амиды, такие как алкиламиды и гидразиды.
В некоторых случаях одна или более L-аминокислот в полипептиде IL-10 заменена на одну или более D-аминокислот.
В некоторых случаях полипептид IL-10 представляет собой ретро-инверсный аналог (см, например, Sela and Zisman (1997) FASEB J. 11: 449). Ретро-инверсные пептидные аналоги представляют собой изомеры линейных полипептидов, в которых направление аминокислотной последовательности является обратным (ретро) и хиральность, D- или L-, одной или более аминокислот в них инвертируется (инверсо), например, с применением D-аминокислот вместо L-аминокислот.[См., например, Jameson et al. (1994) Nature 368: 744; and Brady et al. (1994) Nature 368: 692].
Полипептид IL-10 может содержать «домен белковой трансдукции» (PTD), который относится к полипептидной, полинуклеотидной, углеводной, или органической или неорганической молекуле, которая способствует прохождению через липидный бислой мицеллы, клеточной мембраны, мембраны органелл, или мембраны везикулы. PTD, прикрепленный к другой молекуле, облегчает прохождение молекулы через мембрану, например прохождение от внеклеточного пространства в межклеточное пространство, или из цитозоля в органеллу. В некоторых вариантах реализации PTD ковалентно связан с аминоконцом полипептида IL-10, в то время как в других вариантах реализации PTD ковалентно связан с карбоксильным концом полипептида IL-10. Примеры доменов белковой трансдукции включают, но не ограничиваются, минимальный ундекапептид домена белковой трансдукции (соответствующий 47-57остаткам HIV-1 ТАТ, содержащий YGRKKRRQRRR; SEQ ID №://); полиаргининовую последовательность, содержащую несколько остатков аргинина, достаточных для непосредственного ввода в клетку (например, 3, 4, 5, 6, 7, 8, 9, 10, или 10-50 аргининов); домен VP22 (Zender et al. (2002) Cancer Gene Ther. 9(6): 489-96); домен белковой трансдукции Antennapedia дрозофилы (Noguchi et al. (2003) Diabetes 52(7): 1732-1737); усеченный пептид кальцитонина человека (Trehin et al. (2004) Pharm. Research 21: 1248-1256); полилизин (Wender et al. (2000) Proc. Natl. Acad. Sci. USA 97: 13003-13008); RRQRRTSKLMKR (SEQ ID №:/); транспортеры GWTLNSAGYLLGKINLKALAALAKKIL (SEQ ID №:/); KALAWEAKLAKALAKALAKHLAKALAKALKCEA (SEQ ID №:/); и RQIKIWFQNRRMKWKK (SEQ ID №:/). Примеры PTD включают, но не ограничиваются, YGRKKRRQRRR (SEQ ID №:/), RKKRRQRRR (SEQ ID №:/); гомополимер аргинина от 3 остатков аргинина до 50 остатков аргинина; примеры аминокислотных последовательностей PTD домена включают, но не ограничиваются, любые из следующих: YGRKKRRQRRR (SEQ ID №://); RKKRRQRR (SEQ ID №://); YARAAARQARA (SEQ ID №://); THRLPRRRRRR (SEQ ID №://); и GGRRARRRRRR (SEQ ID №://).
Карбоксильная группа COR3 аминокислоты на С-терминальном конце полипептида IL-10 может присутствовать в свободной форме (R3=ОН), или в форме физиологически переносимой соли щелочных или щелочноземельных металлов таких как, например, соли натрия, калия или кальция. Карбоксильная группа также может быть этерифицирована первичными, вторичными или третичными спиртами, такими как, например, метанол, разветвленные или неразветвленные C1-С6-алкильные спирты, например, этиловый спирт или трет-бутанол. Карбоксильная группа также может быть амидирована первичными или вторичными аминами, такими как аммиак, разветвленные или неразветвленные C1-C6-алкиламины или C1-С6-диалкиламины, например, метиламин или диметиламин.
Аминогруппа аминокислоты NR1R2 на N-конце полипептида IL-10, может присутствовать в свободной форме (R1=Н и R2=Н) или в форме физиологически переносимой соли, такой как, например, хлорид или ацетат. Аминогруппа также может быть ацетилирована кислотами, такими, что R1=Н и R2 = ацетил, трифторацетил или адамантил. Аминогруппа может присутствовать в форме, защищенной посредством аминозащитных групп, которые обычно применяют в химии пептидов, например, как те, которые предложены выше (например, Fmoc, бензилоксикарбонил (Z), Вос и Alloc). Аминогруппа может быть N-алкилирована, в которой R1 и/или R2=C1-С6-алкил или С2-С8 алкенил или С7-С9 аралкил. Алкильные остатки могут быть неразветвленными, разветвленными или циклическими (например, этил, изопропил и циклогексил, соответственно).
Конкретные модификации для усиления и/или имитирования функции IL-10
Это часто бывает полезно, а иногда и необходимо, для улучшения одного или более физических(свойств способов лечения, раскрытых в настоящем документе (например, IL-10), и/или способа, которым осуществляют их введение. Улучшения физических свойств включают, например, модуляцию иммуногенности; способы повышения растворимости в воде, биологическую доступность, период полувыведения из сыворотки, и/или терапевтический период полувыведения; и/или модуляцию биологической активности. Некоторые модификации также могут быть полезны, например, для индукции антител для применения в тестах обнаружения (например, эпитопные метки) и для обеспечения простоты очистки белков. Такие улучшения в целом должны быть сделаны без неблагоприятного воздействия на биологическую активность, способ лечения и/или увеличение иммуногенности.
Пегилирование IL-10 представляет собой одну из частных модификаций, рассмотренных в настоящем описании, в то время как другие модификации включают, но не ограничиваются, гликозилирование (N- и О-связанное); полисиалирование; гибридные молекулы с альбумином, содержащие сывороточный альбумин (например, человеческий сывороточный альбумин (ЧСА), сывороточный альбумин обезьян, или бычий сывороточный альбумин (БСА)); альбумин связывается, например, через жирную кислоту с сопряженными двойными связями (ацилирование); и Fc-гибридные белки.
Пегилирование: Клиническая эффективность терапевтических белков часто ограничена коротким периодом полувыведения из плазмы и восприимчивостью к разрушению протеазами. Исследования различных терапевтических белков (например, филграстима) показали, что такие трудности можно преодолеть с помощью различных модификаций, включая конъюгирование или пришивку полипептидной последовательности к любому из множества небелковых полимеров, например, к полиэтиленгликолю (ПЭГ), полипропиленгликолю или полиоксиалкиленам. Это часто осуществляют посредством линкерного остатка, ковалентно связанного как с белком, так и небелковым полимером, например, ПЭГ. Как было показано, такие ПЭГ-конъюгированные биологические молекулы обладают клинически выгодными свойствами, включая лучшую физическую и термическую стабильность, защищенность от восприимчивости к ферментативному разложению, повышенную растворимость, более длительный период полувыведения из крови in vivo и пониженный клиренс, сниженную иммуногенность и антигенность, и сниженную токсичность.
В дополнение к благоприятному действию пегилирования на фармакокинетические параметры, пегилирование само по себе может повышать активность. Например, было показано что, PEG-IL-10 был более эффективен против некоторых видов рака, чем непегилированный IL-10 (см., например, ЕР 206636 А2).
ПЭГи, пригодные для конъюгации с полипептидной последовательностью, как правило, растворимы в воде при комнатной температуре, и имеют общую формулу R(O-CH2-CH2)nO-R, где R представляет собой водород или защитную группу, такую как алкильная или алканольная группы, и где n является целым числом от 1 до 1000. Когда R обозначает защитную группу, он обычно содержит от 1 до 8 атомов углерода. ПЭГ, конъюгированный с полипептидной последовательностью, может быть линейным или разветвленным. Разветвленные производные ПЭГ, «звездчатые-ПЭГи» и многорукие ПЭГи рассмотренные в настоящем описании. Молекулярная масса ПЭГ, применяемого в настоящем описании, не ограничена каким-либо конкретным диапазоном, и примерами, приведенными других местах настоящего описания; в качестве примера, в некоторых вариантах реализации молекулярная масса составляет от 5 кДа до 20 кДа, в то время как в других вариантах реализации молекулярная масса составляет от 4 кДа до 10 кДа.
В настоящем описании также рассмотрены композиции конъюгатов, в которых ПЭГ имеет различные значения n, и, таким образом, множество различных ПЭГ присутствуют в определенных соотношениях. Например, некоторые композиции содержат смесь конъюгатов, где n=1, 2, 3 и 4. В некоторых композициях процент конъюгатов, где n=1, составляет 18-25%, процент конъюгатов, где n=2, составляет 50-66%, процент конъюгатов, где n=3, составляет 12-16%, и процент конъюгатов, где n=4, составляет до 5%. Такие композиции могут быть получены при условиях реакции и способах очистки, известных в данной области техники. Примеры условий реакции изложены во всем описании. Катионобменную хроматографию можно применять для разделения конъюгатов, и затем фракцию, в которой обнаружено наличие конъюгата, например, с желаемым количеством присоединенного ПЭГ, очищают от немодифицированных белковых последовательностей и от конъюгатов, имеющих другое количество присоединенного ПЭГ.
Пегилирование наиболее часто происходит на альфа-аминогруппе на N-конце полипептида, эпсилон-аминогруппе боковой цепи остатков лизина, и имидазольной группе боковой цепи гистидина. Поскольку большинство рекомбинантных полипептидов имеют одну альфа и ряд эпсилон амино- и имидазольных групп, то можно получить многочисленные изомеры по положению в зависимости от химии линкера. В настоящем документе могут применяться основные стратегии пегилирования, известные в данной области техники. ПЭГ может быть связан с полипептидом настоящего описания через концевую реактивную группу («спейсер»), которая опосредует связь между свободными аминогруппами или карбоксильными группами одной или более полипептидных последовательностей и полиэтиленгликолем. ПЭГ, имеющий спейсер, который может быть связан с свободной аминогруппой, включает N-гидроксисукцинимидполиэтиленгликоль, который можно получить путем активации сложного эфира янтарной кислоты и полиэтиленгликоля с N-гидроксисукцинимидом. Другой активированный полиэтиленгликоль, который может быть связан с свободной аминогруппой, представляет собой 2,4-бис(O-метоксиполиэтиленгликоль)-6-хлор-s-триазин, который можно получить при взаимодействии монометилового эфира полиэтиленгликоля с цианурхлоридом. Активированный полиэтиленгликоль, который связан со свободной карбоксильной группой, включает полиоксиэтилендиамин.
Конъюгацию одной или более полипептидных последовательностей настоящего описания с ПЭГ, имеющим спейсер, можно проводить посредством различных общепринятых методов. Например, реакцию конъюгации можно проводить в растворе с рН от 5 до 10, при температуре от 4°С до комнатной температуры, в течение 30 минут до 20 часов, используя молярное соотношение реагента и белка от 4:1 до 30:1. Условия реакции можно выбрать так, чтобы направить реакцию в сторону получения преимущественно требуемой степени замещения. В целом, низкая температура, низкий рН (например, рН=5) и небольшое время реакции обычно уменьшают количество присоединенного ПЭГ, в то время как высокая температура, рН от нейтрального до щелочного (например, рН≥7), и большее время реакции обычно увеличивают количество присоединенного ПЭГ. Для прекращения реакции можно применять различные способы, известные в данной области техники. В некоторых вариантах реализации реакцию останавливают подкислением реакционной смеси и замораживанием, например, при -20°С. Пегилирование различных молекул рассмотрено, например, в патентах США №5252714; 5643575; 5919455; 5932462; и 5985263. PEG-IL-10 описан, например, в патенте США №. 7052686. Конкретные условия реакции, предусмотренные для применения в настоящем документе, приведены в экспериментальной части.
В настоящем описании также рассмотрено применение миметиков ПЭГ. Разработаны рекомбинантные миметики ПЭГ, которые сохраняют атрибуты ПЭГ (например, повышенный период полувыведения из сыворотки), при этом придают несколько дополнительных выгодных свойств. В качестве примера, простые полипептидные цепи (содержащие, например, аланин, глутаминовую кислоту, глицин, пролин, серии и треонин), способные образовывать развернутую конформацию, аналогичную ПЭГ, можно получить рекомбинантно уже слитыми с целевым пептидным или белковым лекарственным средством (например, Amunix' XTEN technology; Маунтин-Вью, Калифорния). Это устраняет необходимость в дополнительных стадиях конъюгации в процессе производства. Кроме того, стандартные методы молекулярной биологии позволяют контролировать состав боковой цепи полипептидных цепей, что позволяет оптимизировать иммуногенность и производственные свойства.
Гликозилирование: Для задач настоящего описания, «гликозилирование» в широком смысле означает ферментативный процесс, при котором происходит прикрепление гликанов к белкам, липидам и другим органическим молекулам. Применение термина «гликозилирование» в сочетании с настоящим описанием, обычно означает добавление или удаление одного или более углеводных фрагментов (путем удаления лежащего в основе сайта гликозилирования или путем удаления гликозилирования химическими и/или ферментными средствами), и/или добавление одного или более сайтов гликозилирования, которые могут присутствовать или могут отсутствовать в нативной последовательности. Кроме того, фраза включает в себя качественные изменения при гликозилировании нативных белков, включая изменения природы и пропорций различных присутствующих углеводных остатков.
Гликозилирование может существенно повлиять на физические свойства (например, растворимость) полипептидов, таких как IL-10, а также может иметь важное значение в стабильности белка, секреции и субклеточной локализации. Гликозилированные полипептиды также могут проявлять повышенную устойчивость или могут улучшать одно или более фармакокинетических свойств, таких как период полувыведения. Кроме того, улучшения растворимости могут, например, способствовать получению составов, более подходящих для фармацевтического введения, чем составы, содержащие негликозилированный полипептид.
Правильное гликозилирование может иметь важное значение для биологической активности. Известно, что некоторые гены эукариотических организмов, при экспрессии в бактериях (например, E.coli), которые не имеют клеточных процессов для гликозилирования белков, образуют белки, которые при выделении имеют маленькую активность или совсем не имеют активности в силу отсутствия гликозилирования.
Добавление сайтов гликозилирования можно достичь путем изменения аминокислотной последовательности. Изменение полипептида можно провести, например, путем добавления или замены одного или более остатков серина или треонина (для О-связанных сайтов гликозилирования) или остатков аспарагина (для N-связанных сайтов гликозилирования). Структуры N-связанных и О-связанных олигосахаридов и остатков Сахаров, обнаруженные в каждом типе, могут быть различными. Один тип сахара, который обычно обнаруживается в обоих случаях, представляет собой N-ацетилнейраминовую кислоту (далее упоминаемую как сиаловая кислота). Сиаловая кислота обычно является концевым остатком обоих N-связанных и О-связанных олигосахаридов и, в силу своего отрицательного заряда, может придавать кислотные свойства гликопротеину. Конкретный вариант настоящего описания включает получение и применение N-гликозилированых вариантов.
Полипептидные последовательности настоящего описания могут быть необязательно изменены посредством изменения на уровне нуклеиновой кислоты, в частности, путем мутации нуклеиновой кислоты, кодирующей полипептид, в предварительно выбранных основаниях, таким образом, что полученные кодоны будут транслироваться в требуемые аминокислоты. Другим способом увеличения числа углеводных остатков в полипептиде является химическое или ферментативное сочетание гликозидов с полипептидом. Удаление углеводов можно выполнять химически или ферментативно, или путем замещения кодонов, кодирующих аминокислотные остатки, которые гликозилируются. Известны способы химического дегликозилирования, и ферментативное расщепление углеводных остатков в полипептидах можно достичь путем применения различных эндо- и экзогликозидаз.
Клетки яичника китайского хомячка (СНО) с дефицитом дигидрофолатредуктазы (ДГФР) являются широко используемыми клетками-хозяевами для получения рекомбинантных гликопротеинов. Данные клетки не экспрессируют фермент бета-галактозид-альфа-2,6-сиалилтрансферазу, и, следовательно, не добавляют сиаловую кислоту в альфа-2,6-связь в N-связанных олигосахаридах гликопротеинов, полученных в данных клетках.
Полисиалилирование: В настоящем описании также рассмотрено применение полисиалилирования, конъюгирование полипептидов с природной, биоразлагаемой с α-(2→8) связью полисиаловой кислотой («PSA») для улучшения стабильности полипептидов и фармакокинетики in vivo. PSA является биоразлагаемым, нетоксичным природным полимером, который является высоко гидрофильным, придавая ему высокую кажущуюся молекулярную массу в крови, что повышает его период полувыведения из сыворотки. Кроме того, полисиалилирование ряда пептидных и белковых терапевтических средств привело к значительному снижению протеолиза, сохранению активности in vivo, и уменьшению иммуногенности и антигенности (см., например, G. Gregoriadis et al., Int. J. Pharmaceutics 300(1-2): 125-30). Как и в случае с модификациями, с другими конъюгатами (например, ПЭГ) доступны различные способы сайт-специфического полисиалилирования (см., например, Т. Lindhout et al., (2011) PNAS 108(18) 7397-7402).
Гибридизация с альбумином: Дополнительные подходящие компоненты и молекулы для конъюгации включают альбумины, такие как человеческий сывороточный альбумин (ЧСА), сывороточный альбумин обезьян, и бычий сывороточный альбумин (БСА).
Зрелый ЧСА, 585 аминокислотый полипептид (~67 кДа), имеющий период полувыведения из сыворотки ~20 дней, в первую очередь отвечает за поддержание коллоидно-осмотического давления крови, рН крови, транспорта и распределения многочисленных эндогенных и экзогенных лигандов. Белок имеет три структурно гомологичных домена (домены I, II и III), практически полностью в альфа-спиральной конформации, и высоко стабилизирован 17 дисульфидными мостиками. Три первичные области связывания альбумина с лекарственным средством расположены на каждом из трех доменов в пределах субдоменов IB, IIA и IIIA.
Синтез альбумина происходит в печени, в которой происходит образование короткоживущего первичного продукта препроальбумина. Таким образом, полноразмерный ЧСА имеет сигнальный пептид из 18 аминокислот (MKWVTFISLLFLFSSAYS; SEQ ID №://), за которым следует про-домен из 6 аминокислот (RGVFRR; SEQ ID №://); данный пептид из 24 аминокислотных остатков может упоминаться как пре-про-домен. ЧСА может экспрессироваться и секретироваться с использованием эндогенного сигнального пептида как пре-про-домен. Альтернативно, ЧСА может экспрессироваться и секретироваться с использованием сигнального пептида IgK, слитого со зрелой конструкцией. Препроальбумин быстро расщепляется совместно с трансляцией в просвете эндоплазматического ретикулума на своем аминоконце с получением стабильного, 609-аминокислотного предшественника полипептида, проальбумина. Проальбумин затем переходит в аппарат Гольджи, где он преобразуется в 585 аминокислотный зрелый альбумин при помощи фурин-зависимого аминоконцевого расщепления.
Первичные аминокислотные последовательности, структура и функции альбуминов высококонсервативны у разных видов, так же, как и процессы синтеза и секреции альбумина. Альбуминовые сывороточные белки, сравнимые с ЧСА, найдены, например, у яванских макак, коров, собак, кроликов и крыс. У видов, не относящихся к человеку, бычий сывороточный альбумин (БСА) наиболее структурно похож на ЧСА (см., например, Kosa et al., Nov 2007 J Pharm Sci. 96(11): 3117-24). В настоящем описании рассмотрено применение альбумина от видов, не относящихся к человеку, включая, но не ограничиваясь, указанные выше, например, в процессе разработки лекарств.
В соответствии с настоящим описанием, альбумин может быть конъюгирован с молекулой лекарственного средства (например, полипептидом, описанном в настоящем документе) на карбоксильном конце, аминоконце, на обоих карбоксильном и аминоконцах, и внутри (см., например, патенты США №5876969 и USP 7056701).
В молекулах конъюгатов ЧСА с лекарственным средством, рассмотренных в настоящем описании, могут применяться различные формы альбумина, такие как секретируемые предварительные последовательности альбумина и их варианты, их фрагменты и варианты, и варианты ЧСА. Такие формы обычно обладают одним или более требуемыми видами активности альбумина. В другие варианты реализации настоящего описания включены гибридные белки, содержащие полипептидную молекулу лекарственного средства, слитую непосредственно или косвенно с альбумином, фрагментом альбумина, и вариантом альбумина, и т.д., при этом гибридный белок имеет более высокую стабильность в плазме, чем не гибридная молекула лекарственного средства, и/или гибридный белок сохраняет терапевтическую активность не гибридной молекулы лекарственного средства. В некоторых вариантах реализации непрямую гибридизацию осуществляют с помощью линкера, такого как пептидный линкер или его модифицированный вариант.
Внутриклеточное расщепление можно осуществлять ферментативно, например, при помощи фуриновой протеазы или каспазы. В клетках экспрессируется низкий уровень данных эндогенных ферментов, которые способны внутриклеточно расщеплять часть гибридных молекул; таким образом, некоторые из Полипептидов секретируются из клетки неконъюгированными с ЧСА, в то время как некоторые из полипептидов секретируются в виде гибридных молекул, которые содержат ЧСА. В вариантах реализации настоящего описания рассмотрено применение различных фурин-гибридных конструкций. Например, конструкции могут быть разработаны так, что будут содержать последовательности RGRR, RKRKKR, RKKR, или RRRKKR.
В настоящем описании также рассмотрено внеклеточное расщепление (т.е., расщепление ex-vivo), в результате чего гибридные молекулы выделяются из клетки, подвергаются очистке, а затем расщепляются. Понятно, что при расщеплении может быть отделен весь ЧСА-линкерный комплекс от зрелого IL-10, или менее чем весь ЧСА-линкерный комплекс.
Как упоминалось выше, гибридизацию альбумина с одним или более полипептидов настоящего описания, например, можно достичь путем генетических манипуляций, таких, что нуклеиновую кислоту, кодирующую ЧСА, или его фрагмент, присоединяют к нуклеиновой кислоте, кодирующей одну или более полипептидных последовательностей. Впоследствии можно осуществить трансформацию или трансфекцию подходящего хозяина посредством гибридных нуклеотидных последовательностей в виде, например, подходящей плазмиды, для экспрессии гибридного полипептида. Экспрессию можно осуществлять in vitro, например, при помощи прокариотических или эукариотических клеток, или in vivo, например, в трансгенном организме. В некоторых вариантах реализации настоящего описания экспрессию гибридного белка осуществляют в клеточных линиях млекопитающих, например, клеточных линиях СНО. Термин трансформация применяется здесь в широком смысле для обозначения генетического изменения клетки, происходящего в результате непосредственного поглощения через клеточную мембрану, встраивания и экспрессии экзогенного генетического материала (экзогенной нуклеиновой кислоты). Трансформация встречается в природе у некоторых видов бактерий, но ее также можно осуществлять искусственным путем и в других клетках.
Более того, альбумин сам по себе может быть модифицирован для увеличения периода полувыведения из крови. Гибридизацию модифицированного альбумина с IL-10 можно достичь при помощи методов генетической манипуляции, описанных выше, или при помощи химической конъюгации; в результате чего гибридная молекула имеет период полувыведения, который превышает период полувыведения гибридных молекул с немодифицированным альбумином (см., WO 2011/051489).
Альтернативные стратегии связывания альбумина: Было разработано несколько стратегий связывания альбумина в качестве альтернативы непосредственной гибридизации, включая связывание альбумина посредством конъюгации с цепями жирных кислот (ацилирование). Поскольку сывороточный альбумин является транспортным белком для жирных кислот, эти природные лиганды с альбумин-связывающей активностью использовали для увеличения периода полувыведения малых белковых терапевтических средств. Например, инсулин детемир (ЛЕВЕРМИР), представляет собой одобренный продукт для лечения диабета, содержащий миристиловую цепь, конъюгированную с генетически модифицированным инсулином, что привело к получению аналога инсулина пролонгированного действия.
В настоящем описании также рассмотрены гибридные белки, которые содержат полипептидную последовательность альбумин-связывающего домена (ABD) и одну или более последовательностей полипептидов, описанные в настоящем документе. Любая полипептидная последовательность ABD, описанная в литературе, может быть составной частью гибридных белков. Компоненты гибридных белков необязательно могут быть ковалентно связаны через линкер, например, через линкеры, описанные в настоящем документе. В некоторых вариантах реализации настоящего описания гибридные белки содержат полипептидную последовательность ABD как N-концевой остаток, и полипептиды, описанные в настоящем документе, как С-концевой остаток.
В настоящем описании также рассмотрены гибридные белки, содержащие фрагмент альбумин-связывающего полипептида, при этом фрагмент по существу сохраняет связывание с альбумином; или мультимер альбумин-связывающих полипептидов или их фрагментов, содержащих по меньшей мере два альбумин-связывающих полипептида, или их фрагменты в виде мономерных единиц. Общие сведения о ABD и связанных с ними технологий, см. WO 2012/050923, WO 2012/050930, WO 2012/004384 и WO 2009/016043.
Конъюгация с другими молекулами: Дополнительные подходящие компоненты и молекулы для конъюгации включают, например, тиреоглобулин; столбнячный анатоксин; дифтерийный анатоксин; полиаминокислоты, такие как поли(D-лизин:D-глутаминовая кислота); полипептиды VP6 ротавирусов; гемагглютинин вируса гриппа, нуклеопротеин вируса гриппа; гемоцианин фисуреллы (KLH); и белок ядра и поверхностный антиген вируса гепатита В; или любую комбинацию вышеупомянутого.
Таким образом, в настоящем описании рассмотрена конъюгация одного или более дополнительных компонентов или молекул с N- и/или С-концом полипептидной последовательности, например, с другим полипептидом (например, полипептидом, имеющим аминокислотную последовательность, гетерологичную к рассматриваемому полипептиду), или с молекулой-носителем. Таким образом, иллюстративная полипептидная последовательность может быть представлена в виде конъюгата с другим компонентом или молекулой.
Модификация конъюгированием может приводить к получению полипептидной последовательности, которая сохраняет активность с дополнительной или комплементарной функцией, или активностью, проистекающей из второй молекулы. Например, полипептидная последовательность может быть конъюгирована с молекулой, например, для улучшения растворимости, хранения, in vivo или срока хранения или стабильности, снижения иммуногенности, отсроченного или контролируемого высвобождения in vivo, и т.д. Другие функции и воздействия включают конъюгат, у которого снижена токсичность по отношению к неконъюгированной полипептидной последовательности, конъюгат, который более эффективно нацелен на тип клеток или орган, чем неконъюгированная полипептидная последовательность, или лекарственное средство для дальнейшего противодействия причинам или эффектам, связанным с заболеванием, расстройством или состоянием, как изложено в настоящем документе (например, раком).
Полипептид IL-10 также может быть конъюгирован с большими, медленно метаболизируемыми макромолекулами, такими как белки; полисахариды, такими как сефароза, агароза, целлюлоза, или целлюлозные шарики; полимерными аминокислотами, такими как полиглутаминовая кислота или полилизин; сополимерами аминокислот; инактивированными вирусными частицами; инактивированными бактериальными токсинами, такими как анотоксины дифтерии, столбняка, холеры, или молекул лейкотоксина; инактивированными бактериями; и дендритными клетками. Такие конъюгированные формы при необходимости можно применять для получения антител к полипептидам настоящего описания.
Дополнительные возможные компоненты и молекулы для конъюгации включают те, которые пригодны для выделения или очистки. Конкретные неограничивающие примеры включают связывающие молекулы, такие как биотин (пару специфического связывания биотин-авидин), антитело, рецептор, лиганд, лектин, или молекулы, которые содержат твердый носитель, включая, например, пластиковые или полистирольные шарики, пластины или шарики, магнитные шарики, тест-полоски и мембраны.
Методы очистки, такие как катионообменная хроматография, можно применять для разделения конъюгатов по разности заряда, которая эффективно разделяет конъюгаты по их различным молекулярным массам. Например, катионообменную колонку можно загрузить, а затем промыть ~20 мМ ацетатом натрия, рН ~4, и далее элюировать при линейном градиенте (от 0 М до 0,5 М) забуференным NaCl при рН от примерно 3 до 5,5, например, при рН ~4,5. Содержимое фракций, полученных при помощи катионообменной хроматографии, можно идентифицировать по молекулярной массе при помощи обычных методов, например, масс-спектроскопии, электрофореза в ДСН-ПААГ, или других известных способов разделения соединений по молекулярной массе.
Fc-гибридные молекулы: В некоторых вариантах реализации амино- или карбоксильные концы полипептидной последовательности согласно настоящему описанию могут быть слиты с Fc областью иммуноглобулина (например, Fc человека) с получением гибридного конъюгата (или гибридной молекулы). Было показано, что Fc гибридные конъюгаты увеличивают системный период полувыведения биофармацевтических препаратов, и, следовательно, может потребоваться менее частое введение биофармацевтического продукта. Fc связывается с неонатальным Fc-рецептором (FcRn) в эндотелиальных клетках, выстилающих кровеносные сосуды, и, при связывании, Fc-гибридная молекула защищена от деградации и повторно высвобождается в систему кровообращения, дольше сохраняя молекулу в системе кровообращения. Полагают, что Fc-связывание происходит по механизму, с помощью которого эндогенный IgG сохраняет свой более длительный период полувыведения из плазмы. В более поздней технологии Fc-гибридизации одна копия биофармацевтического препарата связывается с Fc-областью антитела для оптимизации фармакокинетических и фармакодинамических свойств биофармацевтического препарата по сравнению с традиционными Fc-гибридными конъюгатами. Примеры других Fc-связанных технологий, подходящих для применения с полипептидами, раскрытыми в настоящем документе, описаны в WO 2013/113008.
Другие модификации: В настоящем описании рассмотрено применение других модификаций IL-10, известных в настоящее время, или которые будут разработаны в будущем, для улучшения одного или более свойств. Один из таких способов для пролонгирования периода полувыведения из системы кровообращения, увеличения стабильности, уменьшения клиренса, или изменения иммуногенности или аллергенности полипептида согласно настоящему описанию, включает модификацию полипептидных последовательностей путем модифицикации гидроксиэтилкрахмалом (hesylation), в котором применяют гидроксиэтилпроизводные крахмала, связанные с другими молекулами, для того, чтобы изменить характеристики полипептидных последовательностей. Различных аспекты модифицикации гидроксиэтилкрахмалом описаны, например, в заявках на патент США №2007/0134197 и 2006/0258607.
В настоящем описании также рассмотрены гибридные молекулы, содержащие SUMO (малый убиквитин-подобный модификатор) в качестве гибридной метки (LifeSensors, Inc.; Малверн, Пенсильвания). Гибридизация полипептида, описанного в настоящем документе, с SUMO может иметь несколько ценных эффектов, включая усиление экспрессии, улучшение растворимости и/или помощь в разработке методов очистки. Протеазы SUMO распознают третичную структуру SUMO и расщепляют гибридный белок с С-конца SUMO, таким образом освобождая полипептид, описанный в настоящем документе, с требуемой N-концевой аминокислотой.
Линкеры: Линкеры и их применение описано выше. Любые из вышеупомянутых компонентов и молекул, применяемых для модификации полипептидных последовательностей настоящего описания, могут быть необязательно конъюгированы через линкер. Подходящие линкеры включают «гибкие линкеры», которые обычно имеют достаточную длину для обеспечения некоторой подвижности между модифицированными полипептидными последовательностями и связанными компонентами и молекулами. Линкерные молекулы обычно составляют примерно 6-50 атомов в длину. Линкерные молекулы могут представлять собой, например, олигомеры арилацетилена, этиленгликоля, содержащие 2-10 мономерных единиц, диамины, дикислоты, аминокислоты или их комбинации. Подходящие линкеры можно легко выбрать и они могут иметь любую подходящую длину, например, 1 аминокислоту (например, глицин), 2, 3, 4, 5, 6, 7, 8, 9, 10, 10-20, 20-30, 30-50 или более 50 аминокислот.
Примеры гибких линкеров включают полимеры глицина (G)n, глицин-сериновые полимеры (например, (GS)n, GSGGSn, GGGSn, (GmSo)n, (GmSoGm)n, (GmSoGmSoGm)n, (GSGGSm)n, (GSGSmG)n и (GGGSm)n, и их комбинации, где m, n и о каждый независимо выбраны из целого числа по меньшей мере единицы), глицин-аланиновые полимеры, аланин-сериновые полимеры, и другие гибкие линкеры. Глицин и глицин-сериновые полимеры относительно неструктурированны, и, следовательно, могут служить в качестве нейтральной нити между компонентами. Примеры гибких линкеров включают, но не ограничиваются, GGSG, GGSGG, GSGSG, GSGGG, GGGSG, и GSSSG.
Терапевтическое и профилактическое применение
В настоящем описании рассмотрено применение полипептидов IL-10, описанных в настоящем документе (например, PEG-IL-10), для лечения или предотвращения широкого спектра заболеваний, расстройств и/или состояний, и/или их симптомов. Более того, принципы настоящего описания предназначены для применения к любому заболеванию, расстройству или состоянию, для которого может быть полезно достижение или поддержание параметров средней остаточной концентрации в сыворотке IL-10, описанные выше. В то время как конкретное применение подробно описано далее, понятно, что настоящее описание этим не ограничено. Более того, хотя общие категории конкретных заболеваний, расстройств и состояний изложены ниже, некоторые заболевания, расстройства и состояния могут быть членами более одной категории (например, нарушения, связанные с раком и фиброзом), а другие могут не являться членами какой-либо из описанных категорий.
Фиброзные расстройства и рак. В соответствии с настоящим описанием, IL-10 (например, PEG-IL-10) можно применять для лечения или предотвращения пролиферативного состояния или расстройства, включая рак (например, рак матки, шейки матки, молочной железы, предстательной железы, семенников, желудочно-кишечного тракта (например, пищевода, ротоглотки, желудка, тонкого или толстого кишечника, толстой кишки или прямой кишки), почки, почечных клеток, мочевого пузыря, кости, костного мозга, кожи, головы или шеи, кожи, печени, желчного пузыря, сердца, легких, поджелудочной железы, слюнных желез, надпочечников, щитовидной железы, головного мозга (например, глиомы), ганглий, центральной нервной системы (ЦНС) и периферической нервной системы (ПНС), а также рак кроветворной системы и иммунной системы (например, селезенки или тимуса). В настоящем описании также предложены способы лечения или предотвращения других связанных с раком заболеваний, расстройств или состояний, включая, например, иммуногенные опухоли, неиммуногенные опухоли, латентные опухоли, вирус-индуцированные раки (например, рак эпителиальных клеток, рак эндотелиальньгх клеток, плоскоклеточные карциномы и папилломавирусные), аденокарциномы, лимфомы, карциномы, меланомы, лейкозы, миеломы, саркомы, тератокарциномы, химически индуцированные раки, метастазы и ангиогенез. Описание предусматривает снижение толерантности к антигенам опухолевых клеток или раковых клеток, например, путем модуляции активности регуляторных Т-клеток и/или CD8+ Т-клеток (см., например, Ramirez-Montagut, et al. (2003) Oncogene 22: 3180-3187; и Sawaya, et al. (2003) New Engl. J. Med. 349: 1501-1509). В конкретных вариантах реализации настоящего описания опухоль или рак представляет собой рак толстой кишки, рак яичников, рак молочной железы, меланому, рак легких, глиобластому или лейкоз. Применение термина(ов) связанные с раком заболевания, расстройства и состояния, предназначено для обозначения в широком смысле состояний, которые связаны, прямо или косвенно, с раком, и включает, например, ангиогенез и предраковые состояния, такие как дисплазия.
В некоторых вариантах реализации настоящего описания предложены способы лечения пролиферативного состояния, рака, опухоли, или предракового состояния при помощи полипептида IL-10 (например, PEG-IL-10) и по меньшей мере одного дополнительного терапевтического или диагностического агента, примеры которых приведены в данном описании.
В настоящем описании также предложены способы лечения или предотвращения фиброзных заболеваний, расстройств и состояний. Используемая в настоящем описании, фраза «фиброзные заболевания, расстройства и состояния» и подобные термины (например, «фиброзные расстройства») и фразы, следует понимать в широком смысле, таким образом, что они включают любые состояния, которые могут привести к образованию фиброзной ткани или рубцовой ткани (например, фиброз в одной или более ткани). В качестве примера, травмы (например, раны), которые могут привести к образованию рубцовой ткани, включают ранения кожи, глаз, легких, почек, печени, центральной нервной системы и сердечно-сосудистой системы. Фраза также охватывает формирование рубцовой ткани в результате инсульта, и сращивания ткани, например, в результате травмы или хирургического вмешательства.
Используемый в настоящем описании термин «фиброз» относится к образованию фиброзной ткани как восстановительного или реактивного процесса, а не как нормальной составляющей органа или ткани. Фиброз характеризуется накоплением фибробластов и отложением коллагена в избытке по отношению к нормальному отложению в каждой конкретной ткани.
Фиброзные расстройства включают, но не ограничиваются, фиброз, возникающий при заживлении ран, системной и местной склеродермии, атеросклерозе, рестенозе, воспалении легких и фиброзе, идиопатическом легочном фиброзе, интерстициальной болезни легких, циррозе печени, фиброз в результате хронической инфекции гепатитом В или С, заболевания почек (например, гломерулонефрит), заболевания сердца, происходящего в результате рубцовой ткани, келоидньгх рубцов и гипертрофических шрамов, и заболеваний глаз, таких как дегенерация желтого пятна, и ретинопатия сетчатки и витреальная ретинопатия. Другие фиброзные заболевания включают фиброз, вызванный химиотерапевтическими препаратами, лучевой фиброз, а также травмы и ожоги.
Фиброзные расстройства часто связаны с печенью, и часто существует связь между такими расстройствами и неадекватным накоплением холестерина в печени и триглицеридов в гепатоцитах. Данное накопление, по-видимому, приводит к провоспалительной реакции, которая приводит к фиброзу и циррозу печени. Расстройства печени, имеющие фиброзный компонент, включают неалкогольную жировую болезнь печени (НАЖБП) и неалкогольный стеатогепатит (НАСГ).
Сердечно-сосудистые заболевания. В настоящем описании также рассмотрено применение полипептидов IL-10 (например, PEG-IL-10), описанных в настоящем документе, для лечения и/или предотвращения некоторых сердечно-сосудистых и/или связанных с метаболизмом заболеваний, расстройств и состояний, а также расстройств, связанные с ними.
Используемые в настоящем описании, термины «сердечно-сосудистые заболевания», «заболевания сердца» и тому подобные, относятся к любой болезни, которая влияет на сердечно-сосудистую систему, в первую очередь к кардиологическому заболеванию, сосудистым заболеваниям головного мозга и почек, и заболеваниям периферических артерий. Сердечно-сосудистые заболевания представляют собой группу заболеваний, которые включают коронарную болезнь сердца (т.е. ишемическую болезнь сердца или коронарно-артериальное заболевание), атеросклероз, кардиомиопатию, артериальную гипертензию, гипертоническую болезнь сердца, легочное сердце, сердечные аритмии, эндокардит, цереброваскулярные заболевания, и заболевания периферических артерий. Сердечно-сосудистые заболевания являются главной причиной смерти во всем мире, и хотя обычно это влияет на пожилых людей, предпосылки сердечно-сосудистых заболеваний, в частности атеросклероза, начинаются в раннем возрасте.
Конкретные варианты реализации настоящего описания, направлены на применение полипептидов IL-10 для лечения и/или предотвращения атеросклероза, хронического состояния, при котором стенки артерии утолщаются, образуя бляшки в результате накопления жировых веществ, таких как холестерин и триглицериды. Атеросклероз часто включает в себя хронический воспалительный ответ в стенках артерий, в основном вызванный накоплением макрофагов и промотируемый липопротеинами низкой плотности (ЛПНП) без адекватного удаления жиров и холестерина из макрофагов функциональными липопротеинами высокой плотности. Хронически расширенные атеросклеротические поражения могут привести к полному закрытию просвета, который может проявиться только тогда, когда стеноз просвета настолько серьезен, что недостаточное кровоснабжение нижележащей ткани(ей) приводит к ишемии.
Полипептиды IL-10 могут быть особенно выгодными для лечения и/или предотвращения расстройств, связанных с холестерином, которые могут быть связаны, например, с сердечно-сосудистыми заболеваниями (например, атеросклерозом), цереброваскулярными заболеваниями (например, инсультом), и заболеваниями периферических сосудов. В качестве примера, а не ограничения, полипептиды IL-10 можно применять для снижения уровня холестерина в крови у субъекта. При определении наличия у субъекта гиперхолестеринемии, нет четкого разделения между нормальными и аномальными уровнями холестерина, и интерпретацию значений следует делать во взаимосвязи с другими заболеваниями и факторами риска. Тем не менее, следующие рекомендации обычно применяют в Соединенных Штатах: общий холестерин <200 мг/дл желателен, 200-239 мг/дл верхняя граница, и ≥240 мг/дл высокий. Высокие уровни общего холестерина увеличивают риск сердечно-сосудистых заболеваний, а уровни ЛПНП или не-ЛПВП холестерина предвещают коронарную болезнь сердца в будущем. При оценке гиперхолестеринемии, часто полезно измерение всех субфракций липопротеинов (ЛПОНП, ЛППП, ЛПНП и ЛПВП). Конкретный терапевтической целью является уменьшение ЛПНП при сохранении или увеличении ЛПВП.
Тромбоз и тромботические состояния
Тромбоз, образование тромба (сгустка крови) внутри кровеносного сосуда приводит к затруднению прохождения потока крови через кровеносную систему, и может быть вызван нарушениями одного или более из указанного ниже (триады Вирхова): гиперкоагуляции или повышенной свертываемости крови, повреждения эндотелиальных клеток, или нарушения кровотока (застой, турбулентность).
Тромбоз обычно классифицируют как артериальный или венозный, каждый из которых может быть представлен несколькими подтипами. Венозный тромбоз включает тромбоз глубоких вен (ТГВ), тромбоз воротной вены, тромбоз почечных вен, тромбоз яремной вены, синдром Бадда-Киари, синдром Педжета-Шреттера и тромбоз синусов твердой мозговой оболочки. Артериальный тромбоз включает инсульт и инфаркта миокарда.
Другие заболевания, расстройства и состояния, рассматриваемые в настоящем описании, включают тромбоз предсердий и истинную полицитемию (также известную как эритема, первичная полицитемия и болезнь Вакеза-Ослера), миелопролиферативное заболевание крови, при котором костный мозг производит слишком много эритроцитов, лейкоцитов и/или тромбоцитов.
Иммунные и воспалительные состояния. Используемые в настоящем описании термины, такие как «иммунное заболевание», «иммунное состояние», «иммунное расстройство», «воспалительное заболевание», «воспалительное состояние», «воспалительное расстройство» и тому подобные, широко охватывают любые состояния, связанные с иммунитетом или воспалением (например, патологическое воспаление и аутоиммунные заболевания). Такие состояния часто неразрывно связаны с другими заболеваниями, расстройствами и состояниями. В качестве примера, «иммунное состояние» может относиться к пролиферативным состояниям, таким как рак, опухоли и ангиогенез, включая инфекции (острые и хронические), опухоли и рак, которые оказывают сопротивление уничтожению иммунной системой.
Неограничивающий список иммунных и воспалительных заболеваний, расстройств и состояний, например, которые могут быть вызваны воспалительными цитокинами, включают артрит, почечную недостаточность, волчанку, астму, псориаз, колит, панкреатит, аллергии, фиброз, хирургические осложнения (например, когда воспалительные цитокины препятствуют заживлению), анемию и фибромиалгию. Другие заболевания и расстройства, которые могут быть связаны с хроническим воспалением, включают болезнь Альцгеймера, сердечную недостаточность с застойными явлениями, инсульт, стеноз аортального клапана, атеросклероз, остеопороз, болезнь Паркинсона, инфекции, воспалительное заболевание кишечника (например, болезнь Крона и язвенный колит), аллергический контактный дерматит и другие экземы, системный склероз, трансплантация и рассеянный склероз.
Некоторые из вышеупомянутых заболеваний, расстройств и состояний, для которых IL-10 (например, PEG-IL-10) может быть особенно эффективен (вследствие, например, ограничений современных способов терапии), более подробно описаны ниже.
Полипептиды IL-10 настоящего описания могут быть особенно эффективны при лечении и предотвращении воспалительных заболеваний кишечника (ВЗК). ВЗК включает болезнь Крона (БК) и язвенный колит (ЯК), которые оба представляют собой идиопатические хронические заболевания, которые могут поражать любую часть желудочно-кишечного тракта, и связаны со многими неблагоприятными эффектами, и пациенты с продолжительным ЯК подвергаются повышенному риску развития рака толстой кишки. Современные методы лечения ВЗК направлены на контроль воспалительных симптомов, и в то время некоторые агенты (например, кортикостероиды, аминосалицилаты и стандартные иммунодепрессанты (например, циклоспорин, азатиоприн и метотрексат)) имеют ограниченный успех, длительная терапия может вызвать повреждение печени (например, фиброз или цирроз) и супрессию костного мозга, и пациенты часто становятся невосприимчивыми к такому лечению.
Псориаз, представляет собой группу широко распространенных иммуноопосредованных хронических заболеваний кожи, поражающих более чем 4,5 миллиона человек в США, считается, что из них 1,5 миллиона имеют от умеренной до тяжелой формы заболевания. Кроме того, у более 10% пациентов с псориазом развивается псориатический артрит, который повреждает костную и соединительную ткань вокруг суставов. Лучшее понимание базовой физиологии псориаза привело к внедрению агентов, которые, например, направлены на активность Т-лимфоцитов и цитокины, ответственные за воспалительный характер заболевания. Такие агенты включают ингибиторы TNF-α (также применяемые при лечении ревматоидного артрита (РА)), включая ЭНБРЕЛ (этанерцепт), РЕМИКЕЙД (инфликсимаб) и ХУМИРА (адалимумаб)), и Т-клеточные ингибиторы, такие как АМЕВИВ (алефацепт) и РАПТИВА (эфализумаб). Хотя некоторые из данных агентов в некоторой степени являются эффективными для некоторых групп пациентов, ни один из них не показал эффективного лечения для всех пациентов.
Ревматоидный артрит (РА), который обычно характеризуется хроническим воспалением в мембране (синовиальной мембране), выстилающей суставы, поражает приблизительно 1% населения США, или 2,1 миллиона человек в США. Дальнейшее понимание роли цитокинов, включая TNF-α и IL-1, в воспалительном процессе позволило разработать и внедрить новой класс противоревматических препаратов, модифицирующих течение болезни (DMARD). Агенты (некоторые из которых пересекаются с методами лечения для РА) включают ЭНБРЕЛ (этанерцепт), РЕМИКЕЙД (инфликсимаб), ХУМИРА (адалимумаб) и КИНЕРЕТ (анакинра). Хотя некоторые из этих агентов облегчают симптомы, тормозят развитие структурных повреждений и улучшают физические функции у конкретных групп пациентов, по-прежнему существует необходимость в альтернативных агентах с улучшенной эффективностью, дополнительными механизмами действия, и небольшой/меньшей тяжестью неблагоприятных эффектов.
Субъектам, страдающим от рассеянного склероза (PC), серьезного изнурительного аутоиммунного заболевания, включающего несколько областей воспаления и рубцевания миелина в головном и спинном мозге, могу особенно помогать полипептиды IL-10, описанные в настоящем документе, а современные методы лечения могут только облегчать симптомы или задержать прогрессирование недееспособности.
Подобным образом, полипептиды IL-10 могут быть особенно выгодными для субъектов, страдающих нейродегенеративными расстройствами, такими как болезнь Альцгеймера (БА), мозговым нарушением, которое серьезно ухудшает мышление, память и речь пациента, и болезнь Паркинсона (БП), прогрессирующим заболеванием ЦНС, характеризующимся, например, ненормальным движением, ригидностью и дрожанием. Эти нарушения являются прогрессирующими и изнурительными, и для них не доступны средства лечения.
Вирусные заболевания. Существует повышенный интерес к роли IL-10 в вирусных заболеваниях. Было постулировано, что IL-10 оказывает как стимулирующие, так и ингибирующие действия в зависимости от его активности связывания с рецептором.
Например, был рассмотрен эффект ингибирования функции IL-10 для повышения противовирусного иммунитета и эффективности вакцины (см., Wilson, Е., (2011) Curr Тор Microbiol Immunol. 350: 39-65). Кроме того, была изучена роль IL-10 в функции вируса иммунодефицита человека (ВИЧ). В дополнение к ингибированию репликации вируса иммунодефицита человека 1 типа (ВИЧ-1), IL-10 также может способствовать вирусной персистенции путем инактивации эффекторных иммунных механизмов (Naicker, D., et al., (2009) J Infect Dis. 200 (3): 448-452). В другом исследовании установлено IL-10-продуцирующее подмножество В-клеток, способных регулировать Т-клеточный иммунитет при хронической инфекции вирусом гепатита В (ВГВ).
Хотя вышеупомянутые исследования показывают, что ингибирование IL-10 может быть выгодным, конкретные вирусные инфекции, которые включают компонент CD8+ Т-клеток, могут быть кандидатами для лечения и/или предотвращения путем введения IL-10. Это подтверждается положительной ролью, которую играет IL-10 при определенных видах рака путем модуляции регуляторных Т-клеток и/или CD8+ Т-клеток.
В настоящем описании рассмотрено применение полипептидов IL-10 для лечения и/или предотвращения любого вирусного заболевания, расстройства или состояния, для которого может быть выгодным лечение при помощи IL-10. Примеры предполагаемых вирусных заболеваний, расстройств и состояний, включают гепатит В, гепатит С, ВИЧ, вирус герпеса и цитомегаловирус (ЦМВ).
Фармацевтические композиции
Полипептиды IL-10 настоящего описания могут быть в форме композиций, пригодных для введения субъекту. В целом, такие композиции представляют собой «фармацевтические композиции», содержащие IL-10 и один или более фармацевтически приемлемых или физиологически приемлемых разбавителей, носителей или вспомогательных веществ. В некоторых вариантах реализации полипептиды IL-10 присутствуют в терапевтически приемлемом количестве. Фармацевтические композиции могут применяться в способах согласно настоящему описанию; таким образом, например, фармацевтические композиции могут быть введены ex vivo или in vivo субъекту для осуществления на практике терапевтических и профилактических способов и применений, описанных в настоящем документе.
Фармацевтические композиции настоящего описания можно изготовить таким образом, чтобы они были совместимым с предполагаемым способом или путем введения; примеры путей введения изложены в настоящем документе. Более того, фармацевтические композиции можно применять в сочетании с другими терапевтически активными агентами или соединениями, как описано в настоящем документе, с целью лечения или предотвращения заболеваний, расстройств и состояний, как рассмотрено в настоящем описании.
Фармацевтические композиции обычно содержат терапевтически эффективное количество полипептида IL-10, рассмотренного в настоящем описании, и один или более фармацевтически приемлемых и физиологически рецептурных агентов. Подходящие фармацевтически приемлемые или физиологически приемлемые разбавители, носители или вспомогательные вещества включают, но не ограничиваются, антиоксиданты (например, аскорбиновую кислоту и бисульфат натрия), консерванты (например, бензиловый спирт, метилпарабены, этил или н-пропил, п-гидроксибензоат), эмульгаторы, суспендирующие агенты, диспергирующие агенты, растворители, наполнители, объемообразующие агенты, детергенты, буферы, носители, разбавители и/или адъюванты. Например, подходящим носителем может быть физиологический раствор или забуференный цитратом физиологический раствор, возможно с добавлением других материалов, широко применяемых в фармацевтических композициях для парентерального введения. Нейтральный забуференный физиологический раствор или физиологический раствор, смешанный с сывороточным альбумином, является дополнительным примером носителей. Специалисты в данной области техники легко поймут, какие разнообразные буферы можно применять в фармацевтических композициях и дозированных формах, рассматриваемых в настоящем документе. Типичные буферы включают, но не ограничиваются, фармацевтически приемлемые слабые кислоты, слабые основания или их смеси. В качестве примера, компонентами буфера могут быть водорастворимые материалы, такие как фосфорная кислота, винные кислоты, молочная кислота, янтарная кислота, лимонная кислота, уксусная кислота, аскорбиновая кислота, аспарагиновая кислота, глутаминовая кислота и их соли. Приемлемые буферные агенты включают, например, трис буфер, N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновую кислоту) (HEPES), 2-(N-морфолино)этансульфоновую кислоту (MES), 2-(N-морфолино)этансульфоновой кислоты натриевую соль (MES), 3-(N-морфолино)пропансульфоновую кислоту (MOPS) и N-трис[гидроксиметил]метил-3-аминопропансульфоновую кислоту (TAPS).
После получения фармацевтической композиции ее можно хранить в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого вещества, или обезвоженного или лиофилизированного порошка. Такие составы можно хранить в виде готовой к применению формы, лиофилизированной формы, которую необходимо растворить перед применением, жидкой формы, которую необходимо разбавить перед применением, или в другом приемлемом виде. В некоторых вариантах реализации фармацевтическая композиция предложена в виде одноразовой емкости (например, в одноразовом флаконе, ампуле, шприце или автоинжекторе (аналогичном, например, EpiPen®)), в то время как емкость многоразового применения (например, флакон многоразового применения) предложена в других вариантах реализации. Любое устройство для доставки лекарственного средства можно применять для доставки IL-10, включая имплантаты (например, имплантируемые насосы) и катетерные системы, медленные инъекционные насосы и устройства, которые хорошо известны специалистам в данной области техники. Депо инъекции, которые обычно вводят подкожно или внутримышечно, также могут быть использованы для высвобождения полипептидов, описанных в настоящем документе, в течение определенного периода времени. Депо инъекции обычно на твердой или масляной основе и, как правило, содержат по меньшей мере один из компонентов состава, изложенных в настоящем документе. Специалисты в данной области техники знакомы с возможными составами и применением депо инъекций.
Фармацевтические композиции могут быть в форме стерильной инъецируемой водной или масляной суспензии. Данные суспензии могут быть получены в соответствии с известным уровнем техники с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, упомянутых в настоящем документе. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Приемлемые разбавители, растворители и дисперсионные среды, которые могут быть использованы, включают воду, раствор Рингера, изотонический раствор хлорида натрия, Cremophor EL™ (BASF, Парсиппани, Нью-Джерси) или фосфатно-солевой буфер (ФБС), этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), и их подходящие смеси. Кроме того, стерильные нелетучие масла традиционно применяют в качестве растворителя или суспендирующей среды. Для этого можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение в приготовлении инъекционных препаратов. Пролонгированную абсорбцию конкретных инъекционных составов можно достичь путем включения агента, который задерживает абсорбцию (например, моностеарата алюминия или желатина).
Фармацевтические композиции, содержащие активный ингредиент, могут быть в форме, подходящей для перорального применения, например, в виде таблеток, капсул, пастилок, леденцов, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов, растворов, микрошариков или эликсиров. Фармацевтические композиции, предназначенные для перорального введения, могут быть получены в соответствии с любым способом, известным в данной области техники для изготовления фармацевтических композиций, и такие композиции могут содержать один или более агентов, таких как, например, подсластители, ароматизаторы, красители и консерванты для получения фармацевтически привлекательных и приятных на вкус препаратов. Таблетки, капсулы и тому подобное содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, которые пригодны для изготовления таблеток. Данные вспомогательные вещества могут представлять собой, например, разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, кукурузный крахмал или альгиновая кислота; связующие агенты, например крахмал, желатин или гуммиарабик, и смазывающие агенты, например, стеарат магния, стеариновая кислота или тальк.
Таблетки, капсулы и тому подобное, пригодные для перорального введения, могут быть непокрытыми или покрытыми с применением известных способов для замедления дезинтеграции и абсорбции в желудочно-кишечном тракте, и тем самым обеспечивая пролонгированное действие. Например, можно применять замедляющий (time-delay) материал, такой как глицерилмоностеарат или глицерилдистеарат. Они также могут быть покрыты с помощью методов, известных в данной области техники, с получением осмотических терапевтических таблеток для контролируемого высвобождения. Дополнительные агенты включают биоразлагаемые или биосовместимые частицы или полимерные вещества, такие как полиэфиры, полиаминные кислоты, гидрогель, поливинилпирролидон, полиангидриды, полигликолевая кислота, этиленвинилацетат, метилцеллюлоза, карбоксиметилцеллюлоза, протаминсульфат, или сополимеры лактида и гликолида, сополимеры полилактида и гликолида, или сополимеры этиленвинилацетата, для контроля доставки вводимой композиции. Например, пероральный агент может быть заключен в микрокапсулы, полученные методами коацервации или полимеризации на границе фаз, путем использования гидроксиметилцеллюлозных или желатиновых микрокапсулы или поли(метилметакрилатных) микрокапсул, соответственно, или в коллоидной системе доставки лекарственного средства. Коллоидные дисперсные системы включают макромолекулярные комплексы, нанокапсулы, микросферы, микрошарики и системы на основе липидов, включая эмульсии масло в воде, мицеллы, смешанные мицеллы и липосомы. Способы получения вышеуказанных составов будут очевидны специалистам в данной области техники.
Составы для перорального применения могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция, каолином или микрокристаллической целлюлозой, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активные материалы в смеси со вспомогательными веществами, подходящими для их изготовления. Такие вспомогательные вещества могут представлять собой суспендирующие агенты, например, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие или смачивающие агенты, например, природные фосфатиды (например, лецитин), или продукты конденсации алкиленоксида с жирными кислотами (например, полиоксиэтиленстеарат), или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами (например, гептадекаэтиленоксицетанол), или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита (например, полиоксиэтиленсорбитмоноолеат), или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гексита (например, полиэтиленсорбитан моноолеат). Водные суспензии также могут содержать один или более консервантов.
Масляные суспензии могут быть получены суспендированием активного ингредиента в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как указанные выше, и ароматизаторы могут быть добавлены для обеспечения приятного вкуса перорального препарата.
Диспергируемые порошки и гранулы, подходящие для получения водной суспензии путем добавления воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантом. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты приведены в качестве примера в настоящем документе.
Фармацевтические композиции настоящего описания также могут быть представлены в виде эмульсий масло в воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или их смеси. Подходящие эмульгаторы могут представлять собой природные смолы, например, гуммиарабик или трагакантовую камедь; природные фосфатиды, например, лецитин соевых бобов, и сложные эфиры или неполные сложные эфиры, полученные из жирных кислот; ангидридов гексита, например, сорбйтана моноолеат; и продукты конденсации неполных эфиров с этиленоксидом, например, полиоксиэтиленсорбитана моноолеат.
Составы также могут содержать носители для защиты композиции от быстрой деградации или выведения из организма, например, составы с контролируемым высвобождением, включая имплантаты, липосомы, гидрогели, пролекарства и микроинкапсулированные системы доставки. Например, можно применять замедляющий (time-delay) материал, такой как глицерилмоностеарат или глицерилстеарат по отдельности или в сочетании с воском.
В настоящем описании рассмотрено введение полипептидов IL-10 в форме суппозиториев для ректального введения. Суппозитории могут быть приготовлены путем смешивания лекарственного средства с подходящим нераздражающими вспомогательным веществом, которое является твердым при обычных температурах, но становится жидким при ректальной температуре, и, следовательно, плавится в прямой кишке с высвобождением лекарственного средства. Такие материалы включают, но не ограничиваются, масло какао и полиэтиленгликоли.
Полипептиды IL-10, рассмотренные в настоящем описании, могут быть в форме любой другой подходящей фармацевтической композиции (например, в виде спреев для назального или ингаляционного применения) известной в настоящее время или которая будет разработана в будущем.
Концентрация полипептида или его фрагментов в составе может изменяться в широких пределах (например, от примерно менее 0,1%, обычно на уровне или по меньшей мере примерно 2%, вплоть до 20% - 50% или более по массе) и, обычно будет выбираться в первую очередь на основе объемов жидкости, вязкости и факторов, связанных с субъектом, в соответствии, например, с выбранным конкретным способом введения.
Пути введения
В настоящем описании рассмотрено введение IL-10, и его композиций, любым подходящим способом. Подходящие пути введения включают парентеральное введение (например, внутримышечно, внутривенно, подкожно (например, путем инъекции или имплантата), внутрибрюшинно, интрацистернально, внутрисуставно, внутрибрюшинно, интрацеребрально (интрапаренхимально) и интрацеребровентрикулярно), пероральное, назальное, вагинальное, сублингвальное, внутриглазное, ректальное, местное (например, трансдермально), сублингвальное введение и путем ингаляции. Депо инъекции, которые обычно вводят подкожно или внутримышечно, также можно применять для высвобождения полипептидов IL-10, описанных в настоящем документе, в течение определенного периода времени.
В конкретных вариантах реализации настоящего описания рассмотрено парентеральное введение, и в других конкретных вариантах реализации парентеральное введение представляет собой подкожное введение.
Комбинированная терапия
В настоящем описании рассмотрено применение IL-10 (например, PEG-IL-10) в сочетании с одним или более активными терапевтическими агентами (например, цитокинами) или другими профилактическими или терапевтическими средствами (например, облучением). В такой комбинированной терапии, различные активные агенты часто имеют разные механизмы действия. Такая комбинированная терапия может быть особенно выгодна, благодаря возможности уменьшения дозы одного или более агентов, тем самым уменьшая или устраняя неблагоприятные эффекты, связанные с одним или более агентов; более того, такая комбинированная терапия может иметь синергическое терапевтическое или профилактическое действие на причину заболевания, расстройства или состояния.
Используемый в настоящем описании, термин «комбинация» означает включение средств, которые могут вводиться раздельно, например, изготовленные раздельно для введения по отдельности (например, которые могут поставляться в виде набора), и средств, которые могут быть вводиться совместно в одном составе (т.е. «комбинированном составе»).
В некоторых вариантах реализации полипептиды IL-10 вводят или применяют последовательно, например, когда один агент вводят до одного или более других агентов. В других вариантах реализации полипептиды IL-10 вводят одновременно, например, когда два или более агентов вводят в одно или примерно в одно и то же время; два или более агентов могут присутствовать в двух или более отдельных составах или объединены в одном составе (т.е., в комбинированном составе). Независимо от того, вводят ли два или более агентов последовательно или одновременно, предполагается, что их можно вводить в комбинации для целей настоящего описания.
Полипептиды IL-10 настоящего описания можно применять в комбинации с одним или более другим (активным) агентом любым подходящим образом, в соответствии обстоятельствам. В одном варианте реализации лечение по меньшей мере одним активным агентом и по меньшей мере одним полипептидом IL-10 настоящего описания поддерживается в течение некоторого периода времени. В другом варианте реализации лечение по меньшей мере одним активным агентом снижают или прекращают (например, когда субъект стабилен), в то время как лечение при помощи IL-10 полипептида настоящего описания поддерживают в постоянном режиме дозирования. В другом варианте реализации лечение по меньшей мере одним активным агентом снижают или прекращают (например, когда субъект стабилен), в то время как лечение при помощи полипептида IL-10 настоящего описания снижают (например, посредством более низкой дозы, более редкого дозирования или более короткой схемы лечения). В другом варианте реализации лечение по меньшей мере одним активным агентом снижают или прекращают (например, когда субъект стабилен), и лечение при помощи полипептида IL-10 настоящего описания увеличивают (например, посредством более высокой дозы, более частого дозирования или более длинной схемы лечения). В другом варианте реализации поддерживают лечение по меньшей мере одним активным агентом и лечение при помощи полипептида IL-10 настоящего описания снижают или прекращают (например, посредством более низкой дозы, более редкого дозирования или более короткой схемы лечения). В другом варианте реализации лечение по меньшей мере одним активным агентом и лечение при помощи полипептида IL-10 настоящего описания снижают или прекращают (например, посредством более низкой дозы, более редкого дозирования или более короткой схемы лечения).
Фиброзные расстройства и рак. В настоящем описании предложены способы лечения и/или предотвращения пролиферативного состояния, рака, опухоли, или предракового заболевания, расстройства или состояния, при помощи полипептида IL-10 (например, PEG-IL-10) и по меньшей мере одного дополнительного терапевтического или диагностического агента.
Примеры химиотерапевтических средств включают, но не ограничиваются, алкилирующие агенты, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтаминоксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин (authramycin), азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин (caminomycin), карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идаруцибин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицин, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; ингибиторы функции коры надпочечников (anti-adrenals), такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквин; элформитин; элиптен ацетат; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (Ara-С); циклофосфамид; тиотепа; таксоиды, например, паклитаксел и доксетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; платина и координационные комплексы платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ11; ингибиторы топоизомеразы; дифторметилорнитин (DMFO); ретиноевая кислота; эсперамицины; капецитабин; и их фармацевтически приемлемые соли, кислоты или любые производные указанного выше.
Химиотерапевтические агенты также включают противогормональные средства, которые регулируют или ингибируют действие гормона на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокси тамоксифен, триоксифен, кеоксифен, онапристон и торемифен; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и их фармацевтически приемлемые соли, кислоты или любые производные указанного выше. В некоторых вариантах реализации комбинированная терапия включает введение гормона или связанного гормонального агента.
Дополнительные методы лечения, которые можно применять в комбинации с полипептидами IL-10, включают цитокин или антагонист цитокина, такой как IL-12, INFα или рецептор к эпидермальному фактору роста, радиотерапию, моноклональные антитела к другому опухолевому антигену, комплекс из моноклональных антител и токсина, Т-клеточный адъювант, трансплантацию костного мозга, или антиген-презентирующие клетки (например, терапия дендритными клетками). В настоящем документе также предложены вакцины (например, в виде растворимого белка или в виде нуклеиновой кислоты, кодирующей белок).
Сердечно-сосудистые заболевания. В настоящем описании предложены способы лечения и/или предотвращения сердечно-сосудистых и/или связанных с метаболизмом заболеваний, расстройств и состояний, а также связанных с ним расстройств, при помощи полипептида IL-10 (например, PEG-IL-10) и по меньшей мере одного дополнительного терапевтического или диагностического агента.
Примеры терапевтических агентов, пригодных для комбинированной терапии для лечения гиперхолестеринемии (и, следовательно, часто атеросклероза), включают статины (например, КРЕСТОР, ЛЕСКОЛ, ЛИПИТОР, МЕВАКОР, ПРАВАКОЛ, и ЗОКОР), которые ингибируют ферментативный синтез холестерина; секвестранты желчных кислот (например, ХОЛЕСТИД, LO-CHOLEST, PREVALITE, КВЕСТРАН, и ВЕЛХОЛ), которые связывают холестерин и предотвращают его поглощение; эзетимиб (ЗЕТИА), который блокирует поглощение холестерина; фиброевую кислоту (например, ТРАЙКОР), которая снижает триглицериды и может незначительно повышать ЛПВП; ниацин (например, НИАКОР), который незначительно снижает уровень холестерина ЛПНП и триглицеридов; и/или комбинацию вышеуказанного (например, ВИТОРИН (эзетимиб с симвастатином). Альтернативные методы лечения холестерина, которые возможно можно применять в сочетании с полипептидами IL-10, описанными в настоящем документе, включают различные добавки и травы (например чеснок, поликозанол и гуггул). Настоящее описание охватывает фармацевтически приемлемые соли, кислоты или любые производные указанного выше.
Иммунные и воспалительные состояния. В настоящем описании предложены способы лечения и/или предотвращения связанных с иммунитетом и/или воспалением заболеваний, расстройств и состояний, а также связанных с ним расстройств, при помощи полипептида IL-10 (например, PEG-IL-10) и по меньшей мере одного дополнительного терапевтического или диагностического агента.
Примеры терапевтических агентов, применяемых в комбинированной терапии, включают, но не ограничиваются, следующие: нестероидное противовоспалительное лекарственное средство (НПВС), такое как аспирин, ибупрофен и другие производные пропионовой кислоты (альминопрофен, беноксапрофен, буклоксовая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, индопрофен, кетопрофен, миропрофен, напроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (индометацин, ацеметацин, альклофенак, клиданак, диклофенак, фенклофенак, фенклозовая кислота (fenclozic acid), фентиазак, фуирофенак (fuirofenac), ибуфенак, изоксепак, окспинак (oxpinac), сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенамовой кислоты (флуфенамовая кислота, меклофенамовая кислота, мефенамовая кислота, нифлумовая кислота и толфенамовая кислота), производные бифенилкарбоновой кислоты (дифлунизал и флуфенизал), оксикамы (изоксикам, пироксикам, судоксикам и теноксикан (tenoxican)), салицилаты (ацетилсалициловая кислота, сульфасалазин) и пиразолоны (апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон, фенилбутазон). Другие комбинации включают ингибиторы циклооксигеназы-2 (СОХ-2).
Другие активные агенты для комбинирования включают стероиды, такие как преднизолон, преднизон, метилпреднизолон, бетаметазон, дексаметазон, или гидрокортизон. Такое сочетание может быть особенно выгодно, так как один или более побочных эффектов стероида можно уменьшить или даже устранить путем постепенного снижения дозы стероида, необходимой для лечения пациентов в комбинации с полипептидами IL-10 настоящего описания.
Дополнительные примеры активных агентов для комбинирования для лечения, например, ревматоидного артрита, включают противовоспалительное средство(а), подавляющее цитокины (CSAID); антитела или антагонисты к другим человеческим цитокинам или факторам роста, например, TNF, LT, IL-1β, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF, или PDGF.
Конкретные комбинации активных агентов могут создавать помехи в различных точках аутоиммунного и последующего воспалительного каскада, и включают антагонисты TNF, такие как химерные, гуманизированные или человеческие антитела к TNF, РЕМИКЕЙД, фрагменты антител к TNF (например, CDP870) и растворимые рецепторы р55 или р75 TNF, их производные, p75TNFRIJgG (ЭНБРЕЛ) или p55TNFR1gG (ЛЕНЕРЦЕПТ), растворимый IL-13-рецептор (sIL-13), а также ингибиторы TNFα-превращающего фермента (ТАСЕ); аналогичным образом могут быть эффективным ингибиторы IL-1 (например, ингибиторы интерлейкин-1-превращающего фермента). Другие комбинации включают интерлейкин 11, анти-P7s и гликопротеиновый лиганд р-селектина (PSGL). Другие примеры агентов, пригодных для комбинации с полипептидами IL-10, описанными в настоящем документе, включают интерферон-β1а (АВОНЕКС); интерферон-β1b (БЕТАЦЕРОН); копаксон; кислород под повышенным давлением; внутривенный иммуноглобулин; клабрибин (clabribine); и антитела или антагонисты к другим человеческим цитокинам или факторам роста (например, антитела к лигандам CD40 и CD80).
Настоящее описание охватывает фармацевтически приемлемые соли, кислоты или любые производные указанного выше.
Вирусные заболевания. В настоящем описании предложены способы лечения и/или предотвращения вирусных заболеваний, расстройств и состояний, а также связанных с ним расстройств, при помощи полипептида IL-10 (например, PEG-IL-10) и по меньшей мере одного дополнительного терапевтического или диагностического агента (например, при помощи одного или более других противовирусных агентов и/или одного или более других невирусных агентов).
Такая комбинированная терапия включает противовирусные агенты, направленные на различные стадии жизненного цикла вирусов и имеющие различные механизмы действия, включая, но не ограничиваясь, следующие: ингибиторы сбрасывания вирусной оболочки (например, амантадин и римантадин); ингибиторы обратной транскриптазы (например, ацикловир, зидовудин, и ламивудин); агенты, которые нацелены интегразу; агенты, которые блокируют прикрепление факторов транскрипций к вирусной ДНК; агенты (например, антисмысловые молекулы), которые негативно влияют на трансляцию (например, фомивирсен); агенты, которые модулируют трансляционную/рибозимную функцию; ингибиторы протеаз; модуляторы вирусной сборки (например, рифампицин); и агенты, которые предотвращают высвобождение вирусных частиц (например, занамивир и озельтамивир). Лечение и/или предотвращение определенных вирусных инфекций (например, ВИЧ), часто включает группу («коктейль») противовирусных средств.
Другие противовирусные агенты рассматриваемые для применения в комбинации с полипептидами IL-10, включают, но не ограничиваются, следующие: абакавир, адефовир, амантадин, ампренавир, амплиген, арбидол, атазанавир, атрипла, боцепревир (boceprevirertet), сидофовир, комбивир, дарунавир, делавирдин, диданозин, докозанол, эдоксудин, эфавиренц, эмтрицитабин, энфувиртид, энтекавир, фамцикловир, фосампренавир, фоскарнет, фосфонет, ганцикловир, ибацитабин, имуновир, идоксуридин, имиквимод, индинавир, инозин, различные интерфероны (например, пегинтерферон альфа-2а), лопинавир, ловирид, маравирок, мороксидин, метисазон, нелфинавир, невирапин, нексавир, пенцикловир, перамивир, плеконарил, подофиллотоксин, ралтегравир, рибавирин, ритонавир, пирамидин, саквинавир, ставудин, телапревир, тенофовир, типранавир, трифлуридин, тризивир, тромантадин, трувада, валацикловир, валганцикловир, викривирок, видарабин, вирамидин и зальцитабин.
Настоящее описание охватывает фармацевтически приемлемые соли, кислоты или любые производные указанного выше.
Дозирование
Полипептиды IL-10 настоящего описания, могут быть введены субъекту в количестве, которое зависит, например, от цели введения (например, требуемой степени регрессии); возраста, массы, пола, и здоровья и физического состояния субъекта, которому вводят состав; пути введения; и природы заболевания, расстройства, состояния или их симптомов. В режиме дозирования также можно принимать во внимание наличие, природу, и степень любых неблагоприятных эффектов, связанных с вводимым агентом(ми). Эффективные количества доз и режимы дозирования лекарственных средств могут быть легко определены, например, из испытаний на безопасность и повышение дозы, исследований in vivo (например, на моделях на животных) и других способов, известных специалистам в данной области техники.
В настоящем описании рассмотрено введение IL-10 для достижения определенных остаточных концентраций в сыворотке и/или поддержания определенных средних остаточных концентраций в сыворотке. Методики, специфичные для IL-10, описаны в других местах настоящего документа и данном разделе ниже.
В целом, параметры дозирования требуют того, чтобы количество дозы было меньше, чем количество, которое может быть необратимо токсичным для субъекта (т.е. максимально допустимой дозы, «МДД»), и не менее количества, необходимого для получения поддающегося измерению влияния на субъект. Такие количества определяют, например, в фармакокинетических и фармакодинамических параметрах, связанных с ADME, принимая во внимание путь введения и другие факторы.
Эффективная доза (ЭД) представляет собой дозу или количество агента, который взывает терапевтический ответ или требуемый эффект у некоторой части субъектов, которые его принимают. «Средняя эффективная доза» или ЭД50 агента представляет собой дозу или количество агента, который вызывает терапевтический ответ или требуемый эффект у 50% лиц, которым его вводят. Несмотря на то что ЭД50 обычно используют качестве меры разумно ожидаемого эффекта агента, она не обязательно является дозой, которую врач может счесть целесообразной, принимая во внимание все сопутствующие факторы. Таким образом, в некоторых случаях эффективное количество составляет больше, чем расчетная ЭД50, в других случаях эффективное количество составляет меньше, чем расчетная ЭД50, и в еще других случаях эффективное количество составляет столько же, сколько расчетная ЭД50.
Кроме того, эффективная доза полипептида IL-10 согласно настоящему описанию может составлять такое количество, которое при введении одной или более дозы субъекту, дает требуемый результат относительно здорового субъекта. Например, для субъекта, имеющего определенное расстройство, эффективная доза может быть такой, что улучшает диагностический параметр, меру, маркер и тому подобное этого расстройства по меньшей мере примерно на 5%, по меньшей мере примерно на 10%, по меньшей мере примерно на 20%, по меньшей мере примерно на 25%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80%, по меньшей мере примерно на 90%, или более 90%, где 100% определено как диагностический параметр, мера, маркер и тому подобное, которые проявляются у здорового субъекта.
Количество PEG-IL-10, необходимое для лечения заболевания, расстройства или состояния, описанного в настоящем документе, основано на активности IL-10 конъюгированного белка, которую можно определить при помощи анализов активности IL-10, известных в данной области техники. В качестве примера, в контексте опухоли, подходящая активность IL-10 включает, например, проникновение CD8+ Т-клеток в опухолевые сайты, экспрессию воспалительных цитокинов, таких как IFN-γ, IL-4, IL-6, IL-10, и RANK-L, этими клеточными инфильтратами, и повышенные уровни IFN-γ в биологических образцах.
Терапевтически эффективное количество IL-10 агента может варьировать от примерно 0,01 до примерно 100 мкг белка/кг массы тела/сутки, от примерно 0,1 до 20 мкг белка/кг массы тела/сутки, от примерно 0,5 до 10 мкг белка/кг массы тела/сутки, или от примерно 1 до 4 мкг белка/кг массы тела/сутки. В некоторых вариантах реализации IL-10 агент вводят путем непрерывной инфузии для доставки от примерно 50 до 800 мкг белка/кг массы тела/сутки (например, от примерно 1 до 16 мкг белка/кг массы тела/сутки IL-10 агента). Скорость инфузии можно изменять на основании оценки, например, неблагоприятных эффектов и клинического анализа крови.
Для введения перорального агента, композиции могут быть представлены в виде таблеток, капсул и тому подобного, содержащих от 1,0 до 1000 миллиграмм активного ингредиента, в частности 1,0, 3,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 и 1000,0 миллиграмм активного ингредиента.
Конкретные режимы дозирования (например, частота дозирования) полипептидов IL-10 описаны в другом месте настоящего описания.
В некоторых вариантах реализации доза раскрытого IL-10 полипептида содержится в «лекарственной форме с однократной дозировкой». Фраза «лекарственная форма с однократной дозировкой» относится к физически дискретным единицам, причем каждая единица содержит предварительно заданное количество IL-10 полипептида согласно настоящему описанию, либо отдельно, либо в комбинации с одним или более дополнительных агентов, достаточное для получения требуемого эффекта. Следует иметь в виду, что параметры лекарственной формы с однократной дозировкой будут зависеть от конкретного агента и эффекта, которой необходимо достичь.
Наборы
В настоящем описании также рассмотрены наборы, содержащие IL-10, и его фармацевтические композиции. Наборы обычно представлены в виде физической конструкции, удерживающей различные компоненты, как описано ниже, и их можно применять, например, в практическом осуществлении способов, описанных выше (например, для введения полипептида IL-10 субъекту, нуждающемуся в восстановлении гомеостаза холестерина).
Набор может содержать один или более полипептидов IL-10, описанных в настоящем документе (поставляемых, например, в стерильной емкости), которые могут быть в форме фармацевтической композиции, пригодной для введения субъекту. Полипептиды IL-10 могут быть предложены в форме, готовой к использованию, или в форме требующей, например, растворения или разбавления перед введением. Если полипептиды IL-10 находятся в форме, которую необходимо восстановить пользователю, набор также может содержать буферы, фармацевтически приемлемые вспомогательные вещества, и тому подобное, упакованные вместе или отдельно от полипептидов IL-10. Если предполагается комбинированная терапия, набор может содержать несколько агентов по отдельности, или они могут быть уже объединены в наборе. Каждый компонент набора может быть помещен в индивидуальную емкость, и все различные емкости могут быть в одной упаковке. Набор согласно настоящему описанию может быть разработан для условий, необходимых для надлежащего хранения компонентов, размещенных в нем (например, для охлаждения или замораживания).
Набор может содержать этикетку или упаковочный вкладыш, включая информацию для идентификации компонентов в нем и инструкции для их применения (например, параметры дозирования, клиническую фармакологию активного ингредиента(ов), включая механизм действия, фармакокинетику и фармакодинамику, неблагоприятные эффекты, противопоказания, и т.д.). Этикетки или вкладыши могут содержать информацию об изготовлении, такую как номер партии и дату истечения срока годности. Этикетка или упаковочный вкладыш может быть, например, встроен в физическую конструкцию, удерживающую компоненты, содержаться отдельно от физической конструкции, или быть прикрепленным к компоненту набора (например, ампуле, трубе или флакону).
Этикетки или вкладыши могут дополнительно содержать, или содержаться на компьютером носителе, таком как диск (например, жестком диске, карте, диске памяти), оптическом диске, таком как CD- или DVD-ROM/RAM, DVD, МР3, магнитной ленте, или электрическом носителе информации, таком как ОЗУ и ПЗУ или их гибридах, таких как магнитный/оптический носитель информации, флэш-носитель или карта памяти. В некоторых вариантах реализации действительные инструкции не присутствуют в наборе, но предложены средства для получения инструкций из удаленного источника, например, через Интернет.
Экспериментальная часть
Следующие примеры предложены для обеспечения специалистов в данной области техники полным раскрытием и описанием того, как реализовать и применять настоящее изобретение, и они не предназначены для ограничения объема того, что авторы изобретения считают своим изобретением, а также они не предназначены для указания на то, что эксперименты ниже были выполнены, и они являются всеми экспериментами, которые могут быть выполнены. Следует понимать, что описания экспериментов, написанные в настоящем времени, не обязательно были выполнены, а то, что описания экспериментов можно выполнить для получения данных, и тому подобного, описанного в настоящем документе. Были предприняты усилия в целях обеспечения точности в отношении используемых чисел (например, количеств, температуры и т.д.), но следует учитывать наличие некоторых экспериментальных ошибок и отклонений.
Если не указано иное, части представляют собой части по массе, молекулярная масса представляет собой среднюю молекулярную массу, температура выражена в градусах Цельсия (°С), и давление равно или близко к атмосферному. Применяются стандартные сокращения, включая следующие: п.о. = пара оснований; т.п.о. = тысяча пар оснований; пкл = пиколитр(ы); с или сек = секунда(ы); мин = минута(ы); ч = час(ы); ак = аминокислота(ы); т.п.о. = тысяча пар оснований; н. = нуклеотид(ы); нг = нанограммы; мкг = микрограммы; мг = миллиграммы; г = граммы; кг = килограммы; дл = децилитр; мкл = микролитр; мл = миллилитр; л = литр; мкМ = микромолярный; мМ = миллимолярный; М = молярный; кДа = килодальтон; в/м = внутримышечно(ный); в/б = внутрибрюшинно(ный); вв или в/в = внутривенно(ный); пк или п/к = подкожно(ный); QD = ежедневно; BID = два раза в сутки; QW = еженедельно; QM = ежемесячно; ВЭЖХ = высокоэффективная жидкостная хроматография; BW = масса тела; Ед. = единица; ns = статистически не значимый; ФСБ = фосфатно-солевой буфер; ПЦР = полимеразная цепная реакция; NHS = N-гидроксисукцинимид; DMEM = среда Игла в модификации Дульбекко; GC = копия генома; ЭДТА = этилендиаминтетрауксусная кислота.
Материалы и методы
Следующие основные материалы и методы могут быть использованы в примерах, приведенных ниже:
Стандартные методы молекулярной биологии описаны в литературе (см., например, Sambrook and Russell (2001) Molecular Cloning, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; и Ausubel, et al. (2001) Current Protocols in Molecular Biology, Vols. 1-4, John Wiley and Sons, Inc. New York, N.Y., в которых описано клонирование в бактериальных клетках и мутагенез ДНК (том 1), клонирование в клетках млекопитающих и дрожжах (том 2), гликоконъюгаты и экспрессия белков (том 3), и биоинформатические методы (том 4)).
В научной литературе описаны методы очистки белков, включая иммунопреципитацию, хроматографию, электрофорез, центрифугирование и кристаллизацию, а также методы химического анализа, химической модификации, посттрансляционной модификации, получения гибридных белков и гликозилирования белков (см., например, Coligan, et al. (2000) Current Protocols in Protein Science, Vols. 1-2, John Wiley and Sons, Inc., NY).
Получение, очистка и фрагментация поликлональных и моноклональных антител описаны в литературе (например, Harlow and Lane (1999) Using Antibodies, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY); стандартные методики для характеристики лиганд/рецепторных взаимодействий являются общедоступными (см., например, Coligan et al. (2001) Current Protocols in Immunology, Vol. 4, John Wiley, Inc., NY); методы проточной цитометрии, включая флуоресцентную сортировку клеток (FACS), являются общедоступными (см., например, Shapiro (2003) Practical Flow Cytometry, John Wiley and Sons, Hoboken, NJ); и флуоресцентные реагенты, пригодные для модификации нуклеиновых кислот, включая праймеры и зонды нуклеиновых кислот, полипептидов и антител, например, для применения их в качестве диагностических реагентов, являются коммерчески доступными (Molecular Probes (2003) Catalogue, Molecular Probes, Inc., Eugene, OR.; Sigma-Aldrich (2003) Catalogue, St. Louis, MO.).
Стандартные методы гистологии иммунной системы описаны в литературе (см., например, Louis et al. (2002) Basic Histology: Text and Atlas, McGraw-Hill, New York, NY).
Истощение клеток иммунной системы (CD4+ и CD8+ Т-клеток) может осуществляться путем антителоопосредованной элиминации. Например, можно еженедельно вводить 250 мкг CD4- или CD8-специфичных антител и подтверждать исчезновение клеток методами FACS и иммуногистохимического анализа.
Программные пакеты и базы данных для определения, например, антигенных фрагментов, лидерных последовательностей, пространственной укладки белка, функциональных доменов, участков гликозилирования и для выравнивания последовательностей, также являются доступными (см., например, GCG Wisconsin Package (Accelrys, Inc., Сан-Диего, Калифорния); и DeCypher™ (TimeLogic Corp., Кристал Бэй, Невада).
Иммунокомпетентных и иммунодефицитных по В-клеткам мышей линии Balb/C получали от The Jackson Lab., Бар-Харбор, Мэн, и использовали согласно стандартным процедурам (см., например, Martin et al. (2001) Infect. Immun., 69(11): 7067-73 и Compton et al. (2004) Comp. Med. 54(6): 681-89). Другие линии мышей, подходящие для экспериментальной работы, рассмотренные в настоящем описании, известны специалистам в данной области техники и обычно доступны в The Jackson Lab.
Если не указано иное, в экспериментах, описанных в настоящем документе, использовали плоскоклеточную карциному кожи PDV6 (см., например, Langowski et al. (2006) Nature 442: 461-465). Могут быть использованы и другие онкологические модельные системы и клеточные линии, такие как Ер2 карцинома молочной железы, СТ26 карцинома толстой кишки и 4Т1 карцинома молочной железы, (см., например, Langowski et al. (2006) Nature 442: 461-465), которые известны специалистам в данной области техники. Также могут быть использованы модельные системы и клеточные линии, не относящиеся к онкологии (например, модели воспаления), известные специалистам в данной области техники.
Уровни концентрации IL-10 в сыворотке и уровни экспозиции можно определять стандартными методами, применяемыми в данной области. Например, измерение уровня экспозиции в сыворотке можно выполнять путем сбора цельной крови (~50 мкл/мышь) из надреза на хвосте мыши в гладкие капиллярные трубки, разделения сыворотки и клеток крови посредством центрифугирования, и определения уровней экспозиции IL-10 с помощью стандартных наборов и техник ИФА. Дополнительные способы определения концентрации IL-10 в сыворотке описаны ниже.
Получение пегилированного IL-10
В настоящем описании предполагается синтез пегилированного IL-10 любыми способами, известными специалистам в данной области техники. Нижеприведенные описания нескольких альтернативных схем синтеза моно-PEG-IL-10 и смеси моно-/ди-PEG-IL10 имеют иллюстративных характер. Хотя свойства моно-PEG-IL-10 и смеси моно-/ди-PEG-IL-10 во многом сравнимы, смесь селективно пегилированных моно- и ди-PEG-IL-10 улучшает выход конечного пегилированного продукта (см., например, патент США №7052686 и публикацию патента США №2011/0250163).
В дополнение к применению собственных навыков получения и применения ПЭГ (и других методов доставки лекарственных средств), подходящих к практике настоящего описания, специалисту в данной области доступно много коммерческих поставщиков ПЭГ-технологий (и других методов доставки лекарственных средств). К примеру, NOF America Corp (Ирвин, Калифорния) поставляет монофункциональные линейные ПЭГи, бифункциональные ПЭГи, «многорукие» ПЭГи, разветвленные ПЭГи, гетерофункциональные ПЭГи, вилкообразные ПЭГи и высвобождаемые ПЭГи; и Parchem (Нью-Рошель, Нью-Йорк) является мировым дистрибутором продуктов на основе ПЭГ и другого специализированного сырья.
Пример схемы синтеза PEG-IL-10 №1. IL-10 можно диализировать против раствора 10 мМ фосфата натрия с рН 7,0 и 100 мМ NaCl. Диализированный IL-10 можно затем развести в 3,2 раза диализным буфером до концентрации 4 мг/мл. Перед добавлением ликера, SC-PEG-12K (Delmar Scientific Labs; Мейвуд, Иллинойс), можно добавить 1 объем 100 мМ раствора тетрабората натрия с рН 9,1 к 9 объемам разведенного IL-10, чтобы поднять рН раствора IL-10 до 8,6. Линкер SC-PEG-12K можно растворить в буфере для диализа и добавить необходимый объем раствора линкера (от 1,8 до 3,6 моль линкера на моль IL-10) к разбавленному раствору IL-10 для начала реакции пегилирования. Реакцию следует проводить при 5°С, чтобы иметь возможность контролировать скорость реакции. В ходе реакции пегилирования реакционную смесь можно слегка перемешивать. Когда выход моно-PEG-IL-10, определяемый при помощи эксклюзионной ВЭЖХ (ЭВЖХ), приближается к 40%, реакцию останавливают добавлением 1 М раствора глицина до конечной концентрации 30 мМ. рН реакционной смеси медленно доводят до 7,0 с помощью раствора НCl, затем фильтруют реакционную смесь через фильтр с диаметром пор 0,2 микрометра и хранят при-80°С.
Пример схемы синтеза PEG-IL-10 №2. Моно-PEG-IL-10 получают с использованием метокси-ПЭГ-альдегида (PALD-PEG) в качестве линкера (Inhale Therapeutic Systems Inc., Хантсвилл, Алабама; также доступен в NOF America Corp (Ирвин, Калифорния)). PALD-PEG может иметь молекулярную массу 5 кДа, 12 кДа или 20 кДа. IL-10 диализируют и разбавляют так, как описано выше, за исключением того, что рН реакционного буфера должен находиться между 6,3 и 7,5. Активированный линкер PALD-PEG добавляют к реакционному буферу в молярном соотношении 1:1. Затем к реакционной смеси добавляют водный раствор цианоборгидрида так до конечной концентрации от 0,5 до 0,75 мМ. Реакцию проводят при комнатной температуре (18-25°С) в течение 15-20 часов при умеренном перемешивании. Реакцию гасят добавлением 1 М раствора глицина. Выход анализируют методом ЭВЖХ. Моно-PEG-IL-10 отделяют от непрореагировавшего IL-10, ПЭГ линкер и ди-PEG-IL-10 при помощи гель-фильтрационной хроматографии и характеризуют методом ОФ-ВЭЖХ и биологическим тестированием (например, на стимуляцию IL-10-чувствительных клеток или клеточных линий).
Пример схемы синтеза PEG-IL-10 №3. IL-10 (например, из грызунов или приматов) диализируют против раствора, содержащего 50 мМ фосфата натрия, 100 мМ хлорида натрия с рН в диапазоне 5-7,4. 5K ПЭГ-пропилальдегид в молярном соотношении 1:1-1:7 вводят в реакцию с IL-10 с концентрацией 1-12 мг/мл в присутствии 0,75-30 мМ цианоборгидрида натрия. В качестве альтернативы, реакцию можно активировать аналогичным образом с помощью пиколинборана. Реакционную смесь инкубируют при 5-30°С в течение 3-24 часов.
рН реакции пегилирования доводят до 6,3, 7,5 мг/мл hIL-10 вводят в реакцию с ПЭГ так, чтобы соотношение IL-10 и ПЭГ-линкера составляло 1:3,5. Конечная концентрация цианоборгидрида составляет ~25 мМ, реакцию проводят при 15°С в течение 12-15 часов. Моно- и ди-PEG-IL-10 являются главными продуктами реакции, концентрация каждого из них составляет в момент ее прерывания ~45-50%. Реакцию можно остановить добавлением аминокислоты, такой как глицин или лизин, или, альтернативно, трис-буферов. Для выделения требуемых молекул пегилированного IL-10 можно применять множество способов очистки, таких как гель-фильтрация, анионо- и катионообменная хроматография и эксклюзионная ВЭЖХ (ЭВЖХ).
Пример схемы синтеза PEG-IL-10 №4. IL-10 диализируют против 10 мМ раствора фосфата натрия с рН 7,0, содержащего 100 мМ NaCl. Диализованный IL-10 разбавляют в 3,2 раза буфером для диализа до примерной концентрации от 0,5 до 12 мг/мл. Перед добавлением линкера, SC-PEG-12K (Delmar Scientific Laboratories, Мейвуд, Иллинойс), 1 объем 100 мМ раствора тетрабората натрия с рН 9,1 добавляют к 9 объемам разбавленного IL-10, чтобы поднять рН раствора IL-10 до 8,6. Линкер SC-PEG-12K растворяют в буфере для диализа и добавляют требуемый объем полученного раствора линкера (от 1,8 до 3,6 молей линкера на моль IL-10) к разбавленному раствору IL-10 для инициации реакции пегилирования. Реакцию проводят при 5°С, чтобы иметь возможность контролировать скорость реакции, и реакционный раствор умеренно перемешивают. Когда выход моно-PEG-IL-10, определяемый при помощи эксклюзионной ВЭЖХ (ЭВЖХ), приближается к 40%, реакцию останавливают добавлением 1 М раствора глицина до конечной концентрации 30 мМ. рН реакционной смеси медленно доводят до 7,0 с помощью раствора HCl, затем ее фильтруют через 0,2 микронный фильтр и хранят при -80°С.
Набор материалов, описанных ниже, вплоть до таблицы 15 включительно, и соответствующее описание были по существу взяты из публикации патента США №2011/00911419 (соизобретатель опубликованного патента США №2011/00911419 также является изобретателем данной заявки), и принципы данного изобретения и их вариации могут иметь широкое применение и могут быть использованы и/или модифицированы во многих различных ситуациях. Подобным образом, принципы других публикаций в смежных областях и/или технологических областях (см., например, патенты США №6387364 и 7052684, и публикацию РСТ № WO 2006/075138), наряду с общими знаниями специалиста в данной области, могут служить основой для дополнительной экспериментальной работы.
Модели опухолей и анализ опухолей
Любые из принятых в данной области моделей опухоли, тестов и т.п. могут быть использованы для оценки действия IL-10 и PEG-IL-10 на различные опухоли. Модели опухолей и анализы опухолей, описанные ниже, являются типичными примерами того, что можно применять, и их использовали для получения и оценки наборов данных, приведенных далее в таблицах 1-15.
Сингенные опухолевые клетки мыши вводят подкожно или внутрикожно в количестве 104, 105 или 106 клеток на одну инокуляцию опухоли. Можно использовать модели карциномы молочной железы Ер2, карциномы толстого кишечника СТ26, плоскоклеточной карциномы кожи PDV6 и карциномы молочной железы 4Т1 (см., например, Langowski et al. (2006) Nature 442: 461-465). Можно использовать иммунокомпетентных или иммунодефицитных по В-клеткам мышей линии Balb/C. PEG-mIL-10 можно вводить иммунокомпетентным мышам, тогда как лечение при помощи PEG-hIL-10 можно применять к мышам, иммунодефицитным по В-клеткам. До начала лечения, опухолям дают достигнуть размера 100-250 мм3. IL-10, PEG-mIL-10, PEG-hIL-10 или контрольный буфер вводят подкожно в место, удаленное от места имплантации опухоли. Рост опухоли обычно контролируют дважды в неделю с помощью электронных калиперометров.
Опухолевые ткани и лимфатические органы отбирают в различных контрольных точках для измерения экспрессии мРНК ряда маркеров воспаления и для иммуногистохимического определения ряда клеточных маркеров воспаления. Ткани подвергают мгновенной заморозке в жидком азоте и хранят при -80°С. Рост первичных опухолей обычно контролируют дважды в неделю с помощью электронных калиперометров. Объем опухоли может быть рассчитан по формуле (ширина2 × длина/2), где длиной является больший из размеров. До начала лечения опухолям дают достигнуть размера 90-250 мм3.
Введение IL-10 и/или PEG-IL-10
Описанные выше модели опухолей и методы анализа опухолей были использованы для получения наборов данных, представленных ниже. Однако, как упомянуто выше, эти же модели и методики могут быть использованы и в других экспериментальных схемах.
Мышиный IL-10 (mIL-10) или PEG-mIL-10 вводили иммунокомпетентным мышам, тогда как к лечение PEG-hIL-10 применяли к мышам, иммунодефицитным по В-клеткам. Мышиный IL-10, PEG-mIL-10, PEG-hIL-10, или применяемый в качестве контроля носитель, вводили подкожно в место, удаленное от имплантированной опухоли. Применяемый в данных опытах PEG-mIL-10, был получен при помощи ликера SC-PEG-12K. Биологическую активность mIL-10 и PEG-mIL-10 оценивали путем применения биологического теста на краткосрочную пролиферацию, в котором использовали линию мышиных тучных клеток МС/9, которые экспрессируют рецепторы эндогенного mIL-10 (R1 и R2). Клетки МС/9 пролиферировали в ответ на одновременную стимуляцию с помощью mIL-4 и mIL-10 (клетки МС/9 не пролиферировали в присутствии только mIL-4 или mIL-10). Пролиферацию измеряли колориметрическим способом с применением Alamar Blue, красителя-индикатора роста, реагирующего на метаболическую активность. Биологическую активность рекомбинантного или PEG-mIL-10 оценивали по величине ЕС50, то есть такой концентрации белка, при которой на кривой зависимости «доза-эффект» наблюдали стимуляцию, составляющую половину от максимальной (таблица 1).

Как показано в таблице 1, по результатам биологического теста МС/9 специфическая активность PEG-mIL-10, использованного в экспериментах, приблизительно в 7 раз ниже активности mIL-10.
PEG-mIL-10 также можно вводить раз в 2 дня мышам, несущим клетки рака молочной железы Ер2. Лечение было эффективным по критериям уменьшения размеров опухоли и индукции отторжения опухолей.
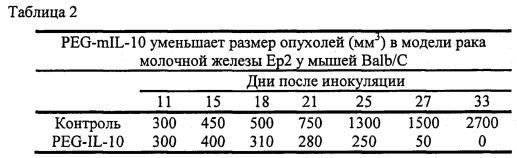
Лечение с помощью PEG-mIL-10 было эффективно по критерию уменьшения размеров опухоли в опухолевых моделях PDV6, СТ-26 и 4Т1 на сингенных иммунокомпетентных мышах (смотри таблицы 3,4 и 5).
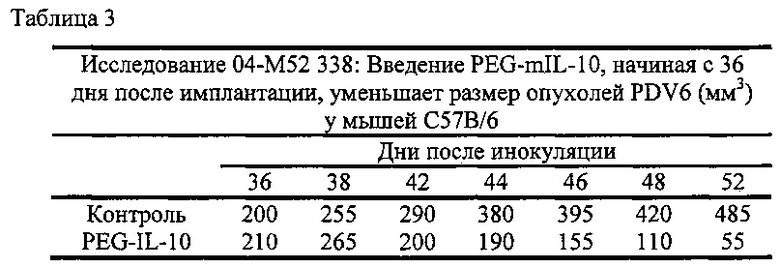


Исследования по подбору дозы
В исследованиях по подбору дозы образцы крови из хвостовой вены отбирали у представителей каждой группы мышей в моменты времени, соответствующие ожидаемому пику и остаточным уровням дозы. В собранной сыворотке определяли концентрацию mIL-10, используя систему Meso Scale Discovery, основанную на мультиматричной технологии, комбинации электрохемилюминесцентного обнаружения и структурированных матриц. Для сравнения средних объемов опухоли у мышей, получавших mIL-10 или PEG-mIL-10, сгруппированных по концентрации mIL-10 в сыворотке, со средним объемом опухоли в соответствующих группах, получавших контрольный носитель, использовали двусторонний t-критерий Стьюдента для независимых выборок. В тех случаях, где дисперсии для двух групп отличались (р<0,05 по результатам t-теста), применяли коррекцию Уэлча.
Результаты подбора доз PEG-mIL-10 и mIL-10, полученные на мышах с привитой карциномой молочной железы 4Т1, показали, что контроль над первичной опухолью и метастазами в легких является дозозависимым, как в случае mIL-10, так и PEG-mIL-10. Как показано далее в таблице 6, при любой дозе PEG-mIL-10 более эффективен, чем mIL-10. Обработку по схеме два раза в сутки начали на 17 день после имплантации, когда средние объемы опухолей составляли 84-90 мм3. Группы лечения состояли из 14 мышей каждая, тогда как в каждой из контрольных групп было по 8 мышей. В качестве контролей для mIL-10 и PEG-mIL-10 использовали буферные растворы Трис и Hepes, соответственно.
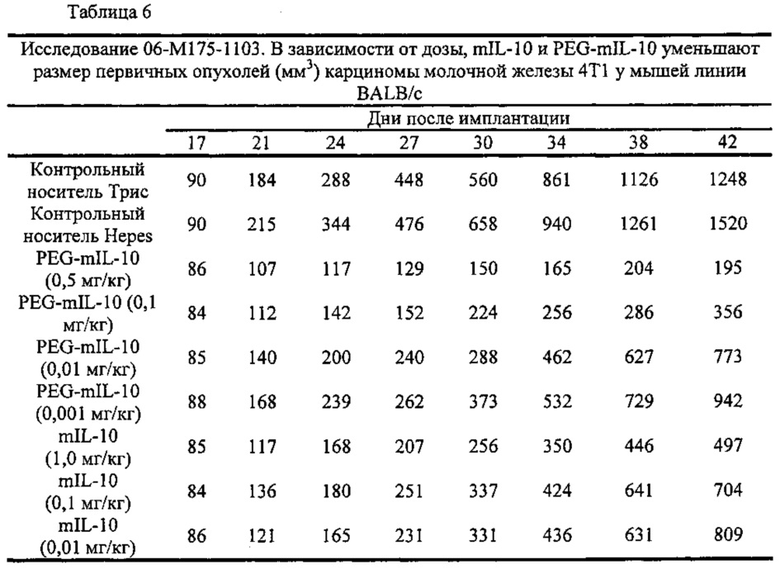
Результаты подбора доз PEG-mIL-10 и mIL-10, полученные на мышах с привитой плоскоклеточной карциномой PDV6, показали, что контроль над первичной опухолью является дозозависимым, как в случае mIL-10, так и PEG-mIL-10, хотя при любой дозе PEG-mIL-10 более эффективен, чем mIL-10 (таблица 7). Лечение высокими дозами PEG-mIL-10 приводило почти к 100% регрессии опухоли и дальнейшей устойчивости к повторной ее имплантации (таблица 8). Обработку по схеме два раза в сутки начали на 23 день после имплантации, когда средние объемы опухолей составляли 107-109 мм, и продолжали до 55 дня во всех группах, получавших mIL-10, и в группе, получавшей 0,01 мг/кг PEG-mIL-10. Лечение дозой 0,1 мг/кг PEG-mIL-10 прекратили на 48 день, когда была отмечена 100% регрессия опухолей, а оставшиеся группы получали лечение до 51 дня. Группы лечения состояли из 10 мышей, тогда как в каждой контрольной группе было по 6 мышей. В качестве контрольных носителей использовали буферные растворы Трис и Hepes для mIL-10 и PEG-mIL-10, соответственно. Повторную имплантацию производили спустя 85 дней после первичной имплантации и через 4 недели после окончания лечения PEG-mIL-10. В группах было по 10 мышей.
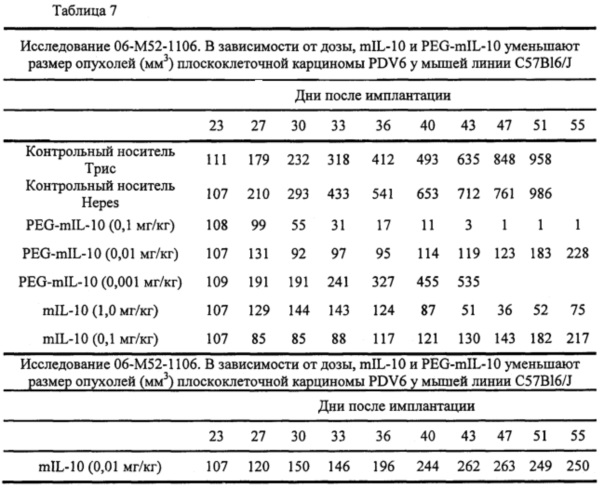
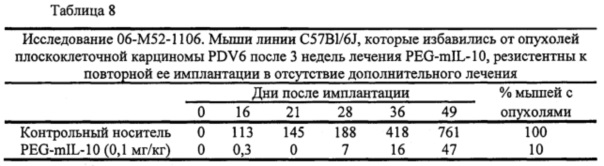
Исследование метастазирования в легких
Количественную оценку легочных метастаз модельной карциномы молочной железы 4Т1 проводили либо визуально после резекции легких (таблица 9), либо путем подсчета легочных метастатических колоний после культивирования (таблица 10), как это описано в Current Protocols in Immunology (Section 20.2.4) John Wiley and Sons, Inc., New York; Harlow and Lane (1999). Вкратце, легкие, взятые у мышей, несущих опухоли 4Т1, измельчали и обрабатывали коллагеназно/эластазным коктейлем, после чего проводили культивирование методом предельного разведения с применением среды, содержащей 6-тиогуанин. Только клетки 4Т1 являются устойчивыми к 6-тиогуанидину и могут быть количественно измерены путем подсчета числа колоний спустя 10-14 дней культивирования. Обработку по схеме два раза в сутки начинали на 17 день после имплантации, когда средние объемы опухолей составляли 84-90 мм3. В качестве контролей для mIL-10 и PEG-mIL-10 использовали буферные растворы Трис и Hepes, соответственно. В качестве меры метастазирования в легких использовали число метастатических колоний, полученных в культуре в расчете на одно легкое.

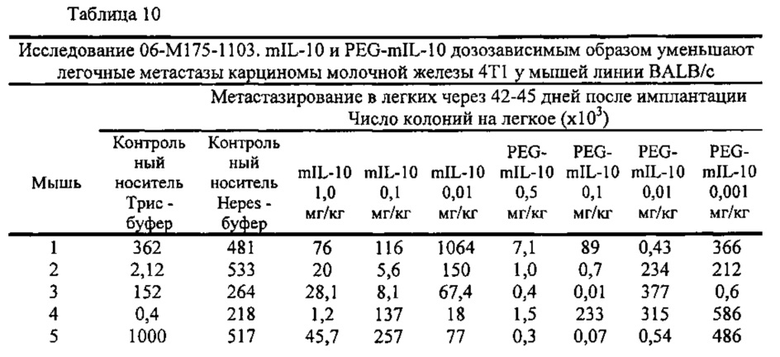
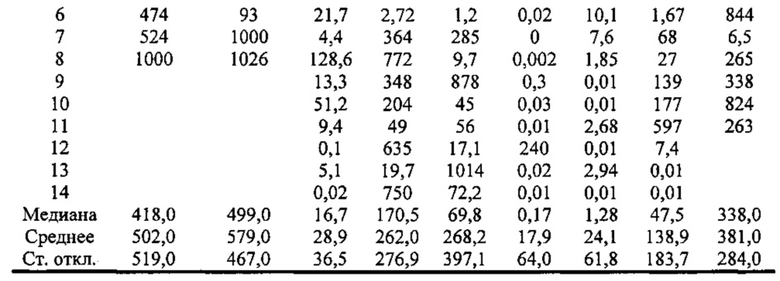
Введение PEG-mIL-10 или IL-10 мышам с привитой карциномой молочной железы 4Т1 уменьшает скорость метастазирования и увеличивает инфильтрацию CD8+ Т-клеток и экспрессию иммуностимулирующих цитокинов, измеренную количественным ОТ-ПЦР (таблицы 11 и 12). Число инфильтрирующих CD8+ Т-клеток было посчитано на репрезентативных срезах нескольких опухолей, иммунохимически окрашенных на присутствие поверхностного маркера CD8, и верифицировано окрашиванием с помощью антител к CD3 и к TCRαβ.

PEG-mIL-10 более эффективно индуцирует воспалительные цитокины, чем IL-10. Тотальную РНК из гомогенизированных образцов опухолей экстрагировали и подвергали обратной транскрипции так, как описано ранее (см., например, Homey, et al. (2000) J. Immunol. 164: 3465-3470). В комплементарной ДНК количественно проанализировали экспрессию цитокинов с помощью ПЦР-теста с флуорогенной 5-нуклеазой (см., например, Holland, et al. (1991) Proc. Natl. Acad. Sci. 88: 7276-7280). Специфические продукты ПЦР непрерывно измеряли на протяжении 40 циклов с помощью генетического анализатора ABI PRISM 7700 (Applied Biosystems). Полученные значения нормализовали по отношению к убиквитину. Логарифмически преобразованные данные подвергли статистическому анализу по Крускалу-Уоллису (метод медианы). Уровень экспрессии (логарифмические значения) соответствует количеству воспалительного цитокина, экспрессируемого в образце опухоли, таким образом, чем выше уровень экспрессии (логарифмические значения), тем больше количество воспалительного цитокина, экспрессируемого в образце опухоли.

Истощение популяции клеток иммунной системы
Популяции CD4+ и CD8+ Т-клеток истощали путем антителоопосредованной элиминации. Для этой цели 250 мкг CD4- или CDS-специфичных антител вводили еженедельно. Истощение популяции клеток верифицировали с помощью FACS и иммуногистохимического анализа.
Истощение популяции CD4+ Т-клеток у иммунодефицитных по В-клеткам мышей линии BALB/c (C.129-Igh-6tm1Cgn) с помощью антител к CD4 ингибирует действие PEG-hIL-10 на опухоли (таблица 13).

Истощение популяции CD8+ Т-клеток полностью ингибирует влияние PEG-mIL-10 нарост сингенных опухолей (таблица 14).

Частота дозирования IL-10 и остаточная концентрация в сыворотке
Исследования на мышах разработаны и проведены для улучшения понимания фармакокинетических параметров терапии IL-10 и на получение данных, полезных при оптимизации режимов лечения опухолей у людей с помощью рекомбинантного IL-10 (rhIL-10).
Мышам вводили опухолевые клетки PDV6, и позволяли опухолям расти в течение 2,5 недель до достижения объема 100 мм3. Затем группы мышей с опухолями (n=10/на группу) подвергали лечению идентичными еженедельными дозами (0,7 мг/кг/в неделю), путем введения 5 кДа моно-ди PEG-mIL-10 в виде а) одной болюсной подкожной инъекции раз в неделю, или b) нескольких подкожных инъекций в виде разделенных доз в течение недели, включая дважды в неделю (0,35 мг/кг), через день (~0,25 мг/кг, чтобы суммарная недельная доза составляла 0,7 мг/кг), и ежедневно (0,1 мг/кг/сутки). Поскольку все мыши в течение недели получали одинаковое количество лекарственного средства, то наблюдали схожие величины общей экспозиции (площади под кривой, ППК). Пиковая экспозиция была наибольшей у животных, получавших однократную дозу раз в неделю, тогда как минимальная экспозиция лекарственного средства (остаточная) была наибольшей у мышей, получавших меньшие, но ежедневные, дозы. К нашему удивлению, как отражено в таблице 15, у животных, получавших дозу ежедневно, наблюдался самый высокий противоопухолевый эффект, указывая на то, что остаточная экспозиция в плазме важна для противоопухолевого действия, тогда как влияние пиковой экспозиции на противоопухолевое действие не было определяющим.
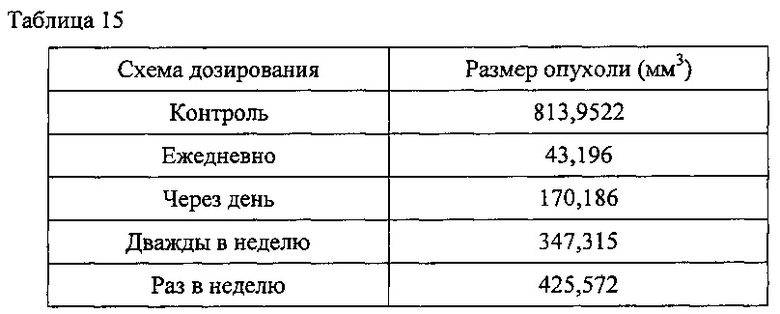
Требуемую остаточную концентрацию в сыворотке далее изучали на двух опухолевых моделях: опухолях PDV6 у мышей C57BL/6 и клетках СТ26 рака толстой кишки у мышей Balb/C. Применяя стандартные процедуры, опухолям у мышей давали вырасти до 100 мм3, после чего начинали лечение путем введения 5 кДа моно-ди PEG mIL-10 в течение 4 недель. После этого измеряли остаточную концентрацию IL-10 в сыворотке у мышей с опухолями, получавших лечение по различным схемам. Затем проводили корреляцию между остаточной концентрацией IL-10 в сыворотке и конечным размером опухоли. Как показано в таблице 16, у мышей с остаточной концентрацией IL-10 в сыворотке свыше 1 нг/мл опухоли были стабильно меньше и происходило их отторжение.
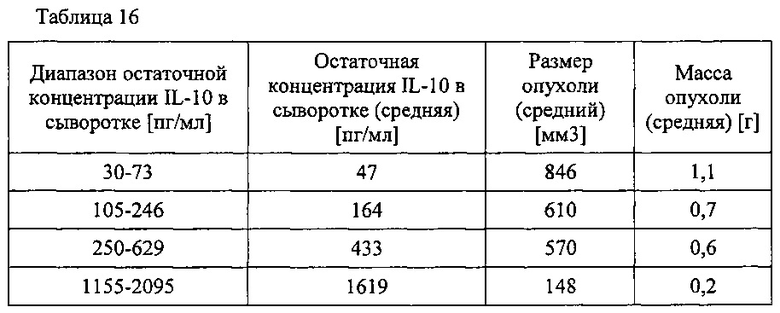
Для подтверждения критической величины остаточной концентрации для человеческих клеток, к культурам моноцитов периферической крови человека (МКПК) добавляли hIL-10 в постепенно возрастающей концентрации. При этом культуры МКПК либо ничем не обрабатывали, либо стимулировали с помощью липополисахарида (ЛПС). Известно, что IL-10 ингибирует ЛПС-опосредованную активацию МКПК. Активность оценивали по секреции хемокина МСР-1. И ЛПС и IL-10 вызывают секрецию МСР-1, но ингибируют стимулирующее действие друг друга на данный хемокин. При концентрациях от 1 нг/мл и выше, IL-10 увеличивал секрецию МСР-1 в отсутствие ЛПС (ФИГ. 2А). Напротив, в МКПК, простимулированных ЛПС, добавление IL-10 в концентрации 1 нг/мл значительно ингибировало секрецию МСР-1 (ФИГ. 2В). Это подтвердило биологическую активность IL-10 для индукции и ингибирования соответствующих биологических процессов.
Влияние IL-10 на цитокины и холестерин у человека
Определение концентрации IL-10 в сыворотке у людей. Необходимое количество rhIL-10 вводили добровольцам подкожно или внутривенно, и в требуемые моменты времени после введения у них отбирали образцы цельной крови в пробирки, содержащие антикоагулянт гепарин. Сывороточные концентрации rhIL-10 или PEG-rhIL-10 определяли с помощью стандартного набора для твердофазного иммуноферментного анализа (ИФА) сэндвич-типа. Обычно тест ИФА был селективным, линейным и воспроизводимым в диапазоне концентраций от 0,1 до 10 нг/мл, и предел количественного определения (ПКО) составлял 0,1 нг/мл. Образцы сыворотки также анализировали методом ИФА на присутствие антител, связывающих hIL-10. В дополнение этому, выбранные образцы сыворотки анализировали при помощи валидированного биологического теста, включающего применение линии тучных клеток МС9 мыши; клетки этой линии пролиферируют в ответ на действие IL-10. Данный биологический тест применяли для определения биологической активности rHuIL-10 и PEG-rHuIL-10, полученных в соответствии с протоколом GMP, и для определения биологической активности IL-10 в сыворотке больных. Как правило, определение концентрации и активности IL-10 методами ИФА и биологического тестирования давало согласующиеся значения.
Определение концентраций TNFα и IL-1β у людей. У больных, страдающих хроническими воспалительными заболеваниями, IL-10 выполняет противовоспалительную функцию, а TNFα и IL-1β являются ключевыми воспалительными цитокинами, высвобождаемыми при таких заболеваниях. Проводили определение концентраций TNFα и IL-1β в образцах крови, полученных от людей. Как правило, 3 мл венозной крови асептически отбирали непосредственно перед подкожным или внутривенным введением rhIL-10 (в 0 часов) и спустя 0,5, 2, 3,4, 6, 8, 12,16, 24, 48, 72 и 96 часов после введения дозы. Образцы анализировали при помощи теста высвобождения цитокинов в цельной крови в присутствии ЛПС и антикоагулянта, а также измеряли концентрации TNFα и IL-1β с помощью ИФА. ЛПС стимулировал высвобождение TNFα и IL-1β из клеток крови.
В образцах, собранных спустя 0,5-12 часов после введения индивидуумам внутривенной дозы rHuIL-10, высвобождение TNFα и IL-1β было подавлено. В образцах, собранных от индивидуумов, получивших подкожные дозы rHuIL-10, высвобождение TNFα и IL-1β было подавлено между 0,5 и 24 часами. Концентрации rHuIL-10 в сыворотке у данных людей определяли с помощью метода ИФА. Ингибирование TNFα и IL-1β коррелировало с концентрацией rHuIL-10 в сыворотке. Концентрация rhIL-10 в сыворотке повышалась после введения препарата и оставалась повышенной в течение 48 часов. Однако высвобождение TNFα и IL-1β ингибировалось только до тех пор, пока концентрация rHuIL-10 составляла 0,2 нг/мл и выше; высвобождение TNFα и IL-1β не ингибировалось, если концентрация составляла менее 0,1 нг/мл. Спустя 12 ч после внутривенного введения rHuIL-10 и спустя 24 ч после подкожного введения, концентрация в сыворотке падала ниже 0,2 нг/мл и наблюдалось высвобождение TNFα и IL-1β. Эти данные показывают, что для получения противовоспалительного эффекта у больных, страдающих хроническими воспалительными заболеваниями, необходимо достичь остаточной концентрации IL-10 в сыворотке 0,2 нг/мл или выше.
Обнаружение модуляции INFγ и холестерина под действием PEG-IL-10 у людей, больных раком. IL-10 индуцирует выработку IFNγ в CD8+ Т-клетках, и индукция IFNγ имеет важное значение для IL-10-опосредованного отторжения опухолей у мышей. Мыши, не имеющие IFNγ, были не способны отторгать опухоли при лечении с помощью PEG-rmIL-10 в концентрациях, вызывающих рассасывание опухолей у контрольных мышей (данные не приведены). Поэтому в сыворотке больных, получавших PEG-rhIL-10, производили измерение IFNγ.
После обучения, касающегося правильной техники введения, раковые больные ежедневно самостоятельно Подкожно вводили себе различные дозы PEG-rhIL-10. Концентрации IL-10 в сыворотке определяли с помощью ИФА сэндвич-типа так, как описано ранее. В образцах сыворотки, взятых до введения первой дозы, или после 28-дневного курса, измеряли IFNγ с применением теста Luminex на гранулах (Luminex Corp.; Остин, Техас).
Как показано в таблице 17, у больных, получавших 1 мкг/кг PEG-IL-10, остаточные уровни IL-10 в сыворотке составляли от ~0,4 до ~1,1 нг/мл, тогда как у больных, получавших дозу 2,5 мкг/кг PEG-IL-10, остаточные уровни IL-10 в сыворотке составляли от ~0,4 до ~2,6 нг/мл.
Сигнал IFNγ передается главным образом по Jak-Stat пути. Jak-Stat сигнализация включает последовательное рекрутирование рецепторов и активацию членов семейства киназ Janus (Jak : Jak 1-3 и Tyk2) и Stat (Stat 1-6, включая Stat5a и Stat5b), позволяющую контролировать транскрипцию целевых генов через специфические ответные элементы. Поскольку такой механизм передачи сигнала характерен для многих членов надсемейства цитокиновых рецепторов, вызываемая IFNγ сигнализация через Jak-Stat является современной парадигмой передачи сигнала цитокиновыми рецепторами II класса. Как показано в таблице 17, больные с остаточным уровнем в сыворотке 1 нг/мл или более, демонстрировали индукцию IFNγ в сыворотке, тогда как у больных с остаточными уровнями IL-10 в сыворотке ниже 1 нг/мл отсутствовала индукция IFNγ. В таблице 17, индукция IFNγ соответствует значениям, превышающим 1.

Эти данные указывают на то, что для получения терапевтического эффекта в ситуации рака/опухоли необходимо достижение остаточной концентрации IL-10 в сыворотке 1 нг/мл или выше. Важным является то, что именно остаточная концентрация в сыворотке, а не уровень дозы, является определяющим фактором индукции IFNγ.
В образцах сыворотки, взятых у раковых больных до начала введения, или спустя неделю ежедневного подкожного введения (1 мкг/кг; 2,5 мкг/кг; или 5 мкг/кг; n=3-4 больных на дозу), измеряли содержание холестерина. Согласно таблице 18, у больных, получавших 1 мкг/кг, средняя дневная концентрация холестерина в сыворотке достигала 0,4 нг/мл, что соответствует 7,8% снижению уровня холестерина; у больного, получавшего 2,5 мкг/кг, средняя дневная концентрация холестерина в сыворотке достигала 1 нг/мл, что соответствует 19% снижению уровня холестерина; у больного, получавшего 5 мкг/кг, средняя дневная концентрация холестерина в сыворотке достигала 2 нг/мл, что соответствует 38% снижению уровня холестерина. Таким образом, каждая из схем дозирования приводила к терапевтически значимому снижению уровня холестерина в сыворотке, что указывает на эффективность остаточных концентраций IL-10 в сыворотке приблизительно от 0,2 нг/мл до 0,4 нг/мл.

В настоящем документе описаны конкретные варианты реализации данного изобретения, включая наилучший из известных изобретателям способов реализации. При чтении вышеупомянутого описания лицам, работающим в данной области техники, могут стать очевидны вариации раскрытых способов реализации, и мы ожидаем, что данные квалифицированные специалисты смогут использовать такие вариации в случае необходимости. Соответственно, предполагается, что данное изобретение будет осуществляться иначе, чем описано в настоящем документе, и что оно включает все модификации и эквиваленты предмета изобретения, изложенного в прилагаемой формуле изобретения, в степени, допускаемой соответствующим законодательством. Сверх того, любая комбинация вышеописанных элементов во всех их возможных вариантах входит в настоящее изобретение, если иное не указано в данной заявке или это явным образом противоречит контексту.
Все публикации, патентные заявки, номера патентов и другие источники, использованные в настоящем описании, включены в настоящую заявку посредством ссылки, как если бы в отношении каждой отдельной публикации или патентной заявки было конкретно и индивидуально указано, что она включена посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ МОНО- И ДИ-ПЭГ IL-10 | 2009 |
|
RU2549702C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ЛИГАНДЫ, И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2699007C2 |
| СКОНСТРУИРОВАННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ МНОЖЕСТВЕННЫЕ ИММУНОМОДУЛЯТОРЫ, И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2573912C2 |
| РНК-ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ПОЛИСАРКОЗИН | 2019 |
|
RU2792644C2 |
| АНТИТЕЛА ПРОТИВ ВСПОМОГАТЕЛЬНОГО БЕЛКА РЕЦЕПТОРА ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-1 (IL1RAP) И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2710787C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ IL-31 И СПОСОБЫ ПРИМЕНЕНИЯ | 2006 |
|
RU2444528C2 |
| РЕЖИМЫ ДОЗИРОВАНИЯ АНТИТЕЛ АНТИ-LAG-3 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2801208C2 |
| НОВЫЙ ЛИГАНД РЕЦЕПТОРА ЦИТОКИНА ZCYTOR17 | 2003 |
|
RU2490276C2 |
| ОДНОЦЕПОЧЕЧНЫЕ БЕЛКИ-АГОНИСТЫ РЕЦЕПТОРА CD40 | 2016 |
|
RU2745801C2 |
| МОДУЛЯТОРЫ АКТИВНОСТИ КОМПЛЕМЕНТА | 2017 |
|
RU2778811C2 |


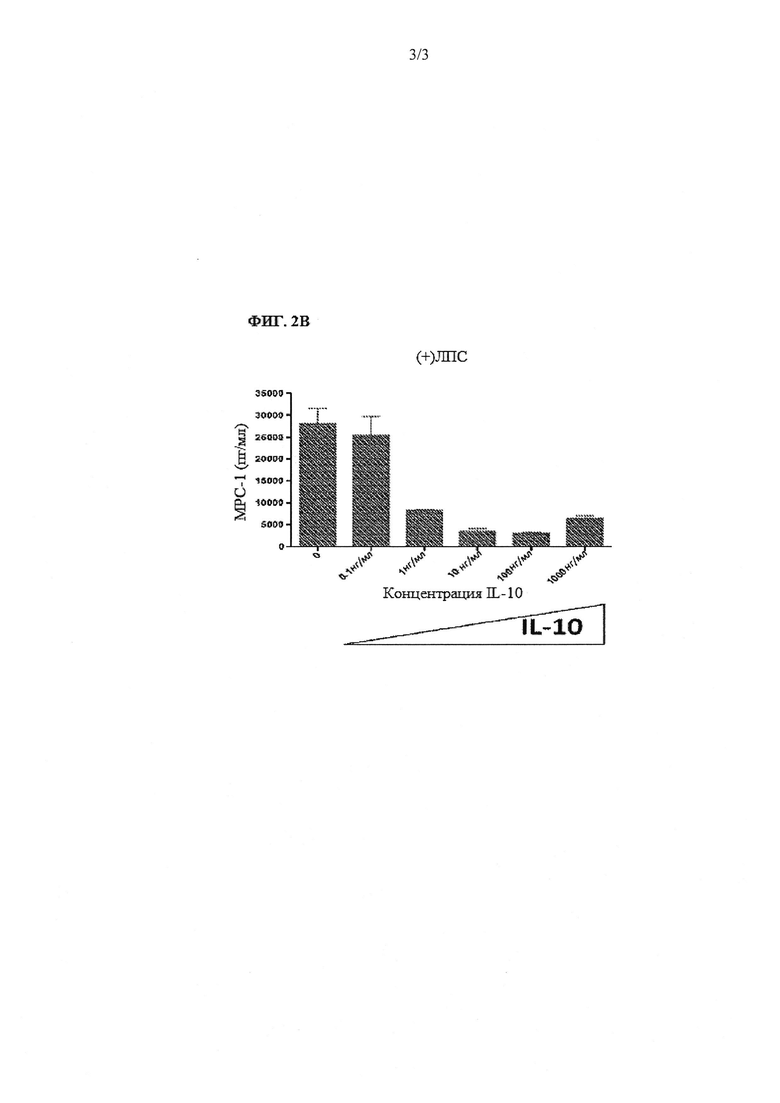
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака. Для этого человеку вводят терапевтически эффективное количество ПЭГ-IL-10 агента, в котором указанного количества достаточно для поддержания средней остаточной концентрации IL-10 в сыворотке, составляющей, по меньшей мере, 1,0 нг/мл, в течение некоторого периода времени, равного, по меньшей мере, 1 неделе, при этом средняя остаточная концентрация IL-10 в сыворотке поддерживается в течение по меньшей мере 90% указанного периода времени. Способ позволяет предотвратить и повысить эффективность лечения раковых заболеваний за счет достижения необходимой остаточной концентрации IL-10 в сыворотке. 14 з.п. ф-лы, 3 ил.,18 табл.
1. Способ лечения или предотвращения заболевания, расстройства или состояния у человеческого субъекта, включающий введение человеческому субъекту терапевтически эффективного количества ПЭГ-IL-10 агента, в котором указанного количества достаточно для поддержания средней остаточной концентрации IL-10 в сыворотке, составляющей, по меньшей мере, 1,0 нг/мл в течение некоторого периода времени, равного, по меньшей мере, 1 неделе,
при этом средняя остаточная концентрация IL-10 в сыворотке поддерживается в течение по меньшей мере 90% указанного периода времени,
где заболевание, расстройство или состояние представляет собой рак.
2. Способ по п. 1, отличающийся тем, что средняя остаточная концентрация IL-10 в сыворотке составляет по меньшей мере 1,5 нг/мл.
3. Способ по п. 1, отличающийся тем, что средняя остаточная концентрация IL-10 в сыворотке поддерживается в течение по меньшей мере 95% указанного периода времени.
4. Способ по п. 3, отличающийся тем, что средняя остаточная концентрация IL-10 в сыворотке поддерживается в течение по меньшей мере 98% указанного периода времени.
5. Способ по п. 1, отличающийся тем, что IL-10 агент представляет собой зрелый IL-10 человека.
6. Способ по п. 1, отличающийся тем, что IL-10 агент представляет собой вариант зрелого IL-10 человека, где вариант сохраняет приемлемый уровень активности IL-10.
7. Способ по п. 1, отличающийся тем, что ПЭГ-IL-10 агент содержит по меньшей мере одну молекулу ПЭГ, ковалентно присоединенную к по меньшей мере одному аминокислотному остатку по меньшей мере одной субъединицы IL-10.
8. Способ по п. 1, отличающийся тем, что ПЭГ-IL-10 агент содержит смесь монопегилированного и дипегилированного IL-10.
9. Способ по п. 1, отличающийся тем, что ПЭГ компонент ПЭГ-IL-10 агента имеет молекулярную массу от 5 кДа до 20 кДа.
10. Способ по п. 1, отличающийся тем, что ПЭГ компонент ПЭГ-IL-10 агента имеет молекулярную массу более 20 кДа.
11. Способ по п. 1, отличающийся тем, что модификация содержит линкер.
12. Способ по п. 1, отличающийся тем, что ПЭГ-IL-10 агент вводят субъекту по меньшей мере один раз в сутки.
13. Способ по п. 1, дополнительно включающий введение по меньшей мере одного дополнительного профилактического или терапевтического агента.
14. Способ по п. 1, отличающийся тем, что средняя остаточная концентрация IL-10 в сыворотке составляет по меньшей мере 1,25 нг/мл.
15. Способ по п. 1, отличающийся тем, что средняя остаточная концентрация IL-10 в сыворотке составляет по меньшей мере 1,75 нг/мл.
| US 20110250163 A1, 13.10.2011 | |||
| US 20080081031 A1, 03.04.2008 | |||
| US 20020044921 A1, 18.04.2002 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ТОРМОЖЕНИЯ ЗАВИСИМОЙ ОТ ИНТЕРЛЕЙКИНА-2 ПРОЛИФЕРАЦИИ ОПУХОЛЕВЫХ КЛЕТОК, УВЕЛИЧЕНИЯ СОДЕРЖАНИЯ ИНТЕРФЕРОНА, ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА, ПОТЕНЦИРОВАНИЯ ТОРМОЖЕНИЯ ПРОИЗВОДСТВА ЦИТОКИНА И ОГРАНИЧЕНИЯ ИЛИ ТОРМОЖЕНИЯ АЛЛЕРГИЧЕСКОЙ РЕАКЦИИ ЗАМЕДЛЕННОГО ТИПА | 1993 |
|
RU2120802C1 |
| НИКИТИН И.Г | |||
| и др | |||
| Пегилированные лекарственные препараты: современное состояние проблемы и перспективы// Вирусные гепатиты: достижения и перспективы | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| MATTOS A | |||
| et al | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2019-02-14—Публикация
2014-04-15—Подача