Изобретение относится к области подкрепления иммунной системы млекопитающих, включая человека, в частности к фармацевтической композиции, предназначенной для торможения зависимой от интерлейкина-2 пролиферации опухолевых клеток, увеличения содержания γ-интерферона, лечения воспалительных заболеваний кишечника, потенцирования торможения производства цитокина и ограничения или торможения аллергической реакции замедленного типа.
Предлагаемая фармацевтическая композиция содержит по меньшей мере один фармацевтически приемлемый носитель и активное вещество из группы, включающей интерлейкин-4, интерлейкин-10, комбинацию интерлейкина-4 и интерлейкина-10 и антитела против интерлейкина-4 и интерлейкина-10, в эффективном количестве.
Для торможения зависимой от интерлейкина-2 пролиферации опухолевых клеток и лечения воспалительных заболеваний кишечника используют композицию, в качестве активного вещества содержащую интерлейкин-10 в эффективном количестве.
Для увеличения содержания γ-интерферона используют композицию, в качестве активного вещества содержащую антитела против интерлейкина-4 и интерлейкина-10 в эффективном количестве.
Для потенцирования торможения производства цитокина используют композицию, в качестве активного вещества содержащую интерлейкин-4 и интерлейкин-10 в эффективном количестве.
Для ограничения или торможения аллергической реакции замедленного типа используют композицию, в качестве активного вещества содержащую интерлейкин-10 или комбинацию интерлейкина-4 и интерлейкина-10 в эффективном количестве.
Фармацевтическая композиция согласно изобретению может иметься в виде любого известного препарата, пригодного для любого способа дачи.
Как принято, все указанные последовательности нуклеиновых кислот определяют с 5'-конца до 3'-конца, то есть слева направо. В указанных последовательностях для нуклеотидных оснований использованы стандартные сокращения, каждое состоящее из одной буквы.
Под "интерлейкином-4" в рамках настоящего изобретения подразумевается протеин, а) имеющий аминокислотную последовательность, в основном идентичную последовательности зрелого человеческого интерлейкина-4, приведенного в фиг. 1C международной патентной заявки, опубликованной под N WO 87/02990, и б) обладающий биологической активностью природного интерлейкина-4. Выражение "в основном идентичная аминокислотная последовательность" следует понимать в том смысле, что последовательность другого интерлейкина-4 или идентична приведенной в указанной заявке последовательности, или отличается от нее лишь одним или больше изменениями аминокислот (делецией, добавлением, заменой), не в значительной степени влияющими на биологическую активность.
Интерлейкин-4 можно приобрести у разных фирм, например Genzyme Corporation, г. Cambridge, Массачусетс, США, или его можно получать известными методами, или с использованием естественных источников, или путем рекомбинации ДНК (см., например, Sheehan и др., J. Immunol. 142, с. 884, 1989, и Starnes и др., J. lmmunol. 145, с. 4185, 1990).
Альтернативно для обнаружения кодирующей интерлейкин-4 ДНК в геномных библиотеках или библиотеках кДНК можно использовать смешанные пробы олигонуклеотидов на основе известных нуклеотидных последовательностей интерлейкина-4. Обнаруженную таким образом ДНК можно вырезать из библиотеки путем расщепления эндонуклеазой рестрикции, или ее можно получать с использованием пригодных праймеров и путем метода цепной реакции с помощью полимеразы (см. Saiki и др., Science 239, с. 487, 1988), чередовать и экспримировать в эукариотной экспрессионной системе или, в случае необходимости после делеции интрона известным методом, в прокариотной или эвкариотной экспрессионной системе. Конечно, вместо использования олигонуклеотидных проб или осуществления цепной реакции с помощью полимеразы можно также экранировать библиотеки и кДНК, и геномной ДНК известными методами экспрессионного клонирования. Полученный таким образом интерлейкин-4 можно обнаруживать известным методом, например иммунохимическим способом или путем биоанализа.
В качестве интерлейкина-4 предпочтительно используют человеческий рекомбинантный интерлейкин-4. Можно использовать или гликозилированный интерлейкин-4, например рекомбинантный интерлейкин-4, полученный в эвкариотной экспрессионной системе, или негликозилированный интерлейкин-4, полученный, например, путем химического синтеза или в бактериальной экспрессионной системе.
В рамках настоящего изобретения под "интерлейкином-10" подразумевается протеин, а) имеющий аминокислотную последовательность, в основном идентичную с последовательностью зрелого интерлейкина-10 (то есть интерлейкина-10, не содержащего секреторной лидерной последовательности), приведенного в международной патентной заявке, опубликованной под N WO 91/00349, и б) обладающий биологической активностью природного интерлейкина-10. Можно использовать или гликозилированный интерлейкин-10, полученный, например, в эвкариотных клетках, как например клетках яичника китайского хомячка, или негликозилированный интерлейкин-10, полученный, например, известным методом путем химического синтеза или в E.coli. Охватываются также мутеины и другие аналоги, включая протеин BCRFI (вирусный интерлейкин-10 из вируса Eppstein Ваrr, далее: вирусный интерлейкин-10), обладающий биологической активностью интерлейкина-10. В международной патентной заявке, опубликованной под N WO 91/00349, описан ряд проведенных in vitro опытов, пригодных для определения активности интерлейкина-10. В рамках настоящей заявки описан ряд предпочтительных форм интерлейкина-10.
Пригодный в рамках настоящего изобретения интерлейкин-10 можно получать из разных источников. Например, его можно выделять из культуры активированных Т-клеток, способных к выделению протеина. Кроме того, интерлейкин-10 или его активные фрагменты можно получать известным методом путем химического синтеза (см., например, Merrifield, Science 233, с. 341 - 347, 1986, и Atherton и др., Solid Phase Peptide Synthesis, A Practical Approach, 1989, издательство I.R.L. Press, г. Oxford).
Рекомбинантный человеческий интерлейкин-10 можно также приобрести на рынке, например, у фирмы PeproTech, Inc., г. Rocky Hill, Нью-Джерси, США.
Альтернативно рекомбинантный интерлейкин-10 можно получать описанным выше для интерлейкина-4 способом с использованием известной информации о последовательностях человеческого или вирусного интерлейкина-10. Методы получения рекомбинантного человеческого интерлейкина-10 описаны, например, в международной патентной заявке, опубликованной под N WO 91/00349. Клоны, содержащие кодирующие человеческий интерлейкин-10 последовательности, были депонированы в Американской коллекции культур, г. Rockville, Мэриленд, США, 20-го декабря 1989 г. под N 68191 и 68192. Клонирование и экспрессия вирусного интерлейкина-10 (протеина BCRFI) из вируса Эпштейна и Барра описаны в источнике Moore и др., Science 248, с. 1230, 1990.
Для лечения человека предпочтительно используют человеческий интерлейкин-10, хотя можно использовать также вирусный интерлейкин-10 или интерлейкин-10, полученный из других млекопитающих. Наиболее предпочтительным является использование рекомбинантного человеческого интерлейкина-10.
Интерлейкин-4 и интерлейкин-10 любого происхождения можно очищать известными методами, например путем осаждения в виде кислоты или соли, ионообменной хроматографии, хроматографии на хелатном соединении металлов, гель-фильтрации, высокопроизводительной жидкостной хроматографии протеинов, жидкостной хроматографии высокого разрешения, гелевого препаративного диск-электрофореза или другого вида электрофореза, изоэлектрического фокусирования, фракционирования в органическом растворителе при низких температурах, противоточного распределения и иммуноаффинной хроматографии.
Антитела против интерлейкина-4 и интерлейкина-10 можно также получать путем известных методов. В данном контексте понятие "антитело" охватывает и поликлональные, и моноклональные антитела. Оно охватывает и целые иммуноглобулины, и их связывающие антигены фрагменты.
Поликлональные антитела можно получать путем иммунизации животного-хозяина, например зайца, крысы, козы, овцы, мыши и т.п. с использованием интерлейкина-4 или интерлейкина-10. Предпочтительно для повышения титра антител после первичной инъекции дают одну или больше повторных инъекций. После этого у животного берут кровь и получают сыворотку, которую экранируют известным методом, например путем твердофазного иммуноферментного анализа, в качестве антигена используя полипептид. Фракции иммуноглобулина можно получать известным способом.
Предпочтительно иммуногенность интерлейкина-4 или интерлейкина-10 повышается при их комбинации с одним из многочисленных известных стимуляторов, и/или путем превращения в большую форму перед иммунизацией, например путем известной поперечной сшивки.
Сыворотку, полученную из иммунизованных таким образом животных, можно использовать непосредственно без дальнейшей переработки. Альтернативно фракцию иммуноглобулина G можно отделять из сыворотки путем известных методов, например плазмафореза или адсорбционной хроматографии с использованием специфических в отношении иммуноглобулина G адсорбентов, например иммобилизованного протеина А.
Моноклональные антитела, предпочтительно используемые в рамках настоящего изобретения, можно получать известным методом (см., например, Kohler и др., Nature 256, с. 495, 1975, или Eur. J. Immunol. 6, с. 511, 1976). В основном для получения соматических клеток, выделяющих антитело, животное иммунизуют вышеописанным способом. Затем полученные клетки выделяют из иммунизованного животного для слияния с миеломными клетками.
Соматические клетки, способные к производству антител, в частности В-клетки, пригодны для слияния с миеломной клеточной линией. Данные соматические клетки можно получать из лимфатического узла, селезенки и периферической крови подверженных первичному воздействию антигена животных. Часто используют клетки из селезенки крысы, а именно отчасти по той причине, что этими клетками достигают сравнительно большого процента стабильных слияний с миеломными линиями мыши. Однако также было бы возможно использовать клетки человека, мыши, зайца, овцы, козы или других животных.
Получение из лимфоцитических опухолей специализированных миеломных клеточных линий, которые используют для слияния с получением гибридом, описано, например, Kohler и Milstein (Eur. J. Immunol. 6, с. 511, 1976; Shulman и др. , Nature 276, с. 269, 1978; Volk и др., J. Virol. 42, с. 220, 1982). Способы получения гибридов производящих антитела клеток селезенки или лимфатического узла и миеломных клеток обычно включают прием смешивания соматических клеток с миеломными клетками в соотношении 10 : 1 (при этом соотношение может колебаться примерно между 20 : 1 и 1 : 1) в присутствии химического, вирусного или электрического агента способствующего слиянию клеточных мембран. Способы слияния описаны, например, Kohler и Milstein (см. в вышеуказанном источнике), Gefter и др. (Somatic Cell Genet. 3, с. 231, 1977) и Volk и др. (J. Virol. 42, с. 220, 1982). В способах, описанных в данных источниках, в качестве способствующих слиянию агентов использованы вирус Сендай и полиэтиленгликоль.
Так как путем методов слияния получают жизнеспособные гибриды лишь с чрезвычайно низким выходом (например, при применении селезенки в качестве источника соматических клеток получают лишь один гибрид примерно на 1 • 105 клеток селезенки), требуется способ отделения полученных гибридов от остальных неслитых клеток, в частности неслитых миеломных клеток. Кроме того, требуется способ обнаружения желаемых производящих антитело гибридом среди других полученных клеточных гибридов.
В общем отделение слитых клеточных гибридов осуществляют путем выращивания клеток в среде, поощряющей рост гибридом, а тормозящей рост неслитых миеломных клеток, которые иначе продолжали бы беспредельно размножаться. Соматические клетки, используемые для слияния, недолго сохраняют жизнеспособность в культуре in vitro, почему и они не представляют собой проблему. Можно использовать, например, миеломные клетки, не содержащие гипоксантин-фосфорибозилтрансферазы (отрицательные относительно ГФРТ клетки). Отбор против этих клеток можно осуществлять в среде, содержащей гипоксантин, аминоптерин и тимидин, в которой слитые клеточные гибриды выживают благодаря положительному относительно ГФРТ генотипу клеток селезенки. Можно также использовать миеломные клетки, имеющие разные генетические недостатки, например проявляющие особую чувствительность к воздействию определенных лекарств, причем отбор тогда осуществляют в среде, поощряющей рост генотипически компетентных гибридов.
Для избирательной культивации слитых клеточных гибридов требуется несколько недель. В начале данного периода необходимо идентифицировать гибриды, производящие желаемое антитело с тем, чтобы их могли потом клонировать и размножать. В общем примерно 10% получаемых гибридов производят желаемое антитело, хотя данная величина может колебаться примерно между 1 и 30 %.
Производящие антитело гибриды можно обнаруживать путем любого известного метода, например иммуноферментного анализа или радиоиммуноанализа (см., например, Monoclonal Antibodies and Hybridomas: A New Dimension in Biological Analyses, под ред. Kennet и др., с. 376 - 384, издательство Plenum Press, Нью-Йорк, 1980).
После выделения желаемых слитых клеточных гибридов и их клонирования в отдельные производящие антитело клеточные линии каждую клеточную линию можно размножать путем одного из двух стандартных методов. Суспензию гибридомных клеток можно вводить в гистосовместимое животное путем инъекции. В животном затем возникают опухоли, выделяющие специфическое моноклональное антитело, производимое клеточным гибридом. Для получения моноклонального антитела в высокой концентрации можно использовать жидкости тела животного, например сыворотку или асцитную жидкость. Согласно альтернативному методу отдельные клеточные линии можно размножать in vitro в лабораторных сосудах. Культурную среду, содержащую отдельное специфическое моноклональное антитело в высокой концентрации, можно собирать путем декантирования, фильтрации или центрифугирования, после чего его очищают.
После получения гибридомы, производящей желаемое моноклональное антитело, путем пригодных методов можно получать межвидовые моноклональные антитела, в которых связывающая область одного вида комбинирована с несвязывающей областью антитела другого вида (см. Liu и др., Proc. Natl. Acad. Sci. USA 84, с. 3439, 1987). Например, участок CDR моноклонального антитела грызуна можно размещать на решетке человеческого антитела, при этом осуществляя "гуманизацию" антитела грызуна (см. Riechmann и др., Nature 332, с. 323, 1988). В частности, участки CDR можно размещать в вариабельной области человеческого антитела с человеческими константными областями или без них. Такой метод использовали, например, для гуманизации моноклонального антитела мыши против субъединицы р55 (Тас) рецептора человеческого интерлейкина-2 (см. Queen и др., Proc. Natl. Acad. Sci. USA 86, с. 10029, 1989).
Альтернативно человеческие моноклональные антитела можно получать с использованием интерлейкина-4 или интерлейкина-10 и по методу, описанному Banchereau и др. (см. Science 251, с. 70, 1991).
Настоящее изобретение также включает связывающие антитело фрагменты, например Fab-фрагменты, F(ab')2-фрагменты, Fc-фрагменты и т.п. Использование и получение фрагментов антител известны (см., например, относительно Fab-фрагментов: Tijssen, Practice and Theory of Enzyme Immunoassays, издательство Elsevier, г. Амстердам, 1985, относительно Fv-фрагментов - Hochmann и др., Biochemistry 12, с. 1130, 1973, Sharon и др., Biochemistry 15, с. 1591, 1976, Ehrlich и др., патент США N 4355023, а относительно полумолекул антител - Auditore-Нагgreaves, патент США N 4470925).
Предпочтительно антитела и их фрагменты, используемые в рамках настоящего изобретения, специфически связываются с интерлейкином-4 и интерлейкином-10, нейтрализуя их биологическую активность, для чего они и образованы.
Торможение зависимой от интерлейкина-2 пролиферации опухолевых клеток.
Как показано в нижеследующем примере, человеческий и вирусный интерлейкины-10 непосредственно влияют на человеческие Т-клетки. При использовании L-клеток, трансфецированных FcγRII (CD32), в комбинации или с моноклональными антителами против CD3, или с митогенной парой моноклональных антител против CD2, пролиферирующая реакция человеческих клеток, подобных Т-клеткам-помощникам 0, 1 и 2, тормозится интерлейкином-10. Кроме того, специфическая относительно антигена пролиферирующая реакция клонов человеческих Т-клеток тормозится интерлейкином-10, если в качестве антигенпредставляющих клеток используют L-клетки мыши, трансфецированные молекулами соответствующего главного комплекса гистосовместимости II-го класса. В данной системе интерлейкин-10 не влияет на экспрессию главного комплекса гистосовместимости II-го класса, так как конструктивная экспрессия трансфецированных генов главного комплекса гистосовместимости управляется промотором SV40.
Тормозящее действие интерлейкина-10 обусловлено прежде всего непосредственным влиянием интерлейкина-10 на клоны Т-клеток путем торможения производства интерлейкина-2 на уровне мРНК. Тормозящее действие является специфическим относительно интерлейкина-2, так как интерлейкин-10 не влияет на производство γ-интерферона, интерлейкина-4, интерлейкина-5 и GM-CSF (GM = гранулоциты и макрофаги, CSF = колониестимулирующий фактор). Очевидно взаимодействие интерлейкина-10 с рецептором интерлейкина-10 приводит к специфическому торможению синтеза интерлейкина-2.
Для подтверждения действия композиции согласно изобретению можно также использовать другие опыты. Например, можно использовать модели ксенотрансплантата мыши. Такие модели были использованы для исследования большого диапазона химикотерапевтических агентов (см. Howard и др., Cancer Res. 51, с. 3274, 1991 и McLemoer и др., Cancer Res. 47, с. 5132, 1987).
Такая пролиферация клеток может сопровождаться лейкемией, например хроническим лимфолейкозом В-клеток. Млекопитающие, которым дают композицию согласно изобретению, предпочтительно представляют собой люди, страдающие от зависящей от интерлейкина-2 пролиферации опухолевых клеток.
Фармацевтические композиции, содержащие интерлейкин-10, обычно дают внутривенно. Интерлейкин-10 может также иметься во включенном в липосомы виде.
В рамках настоящего изобретения под "зависящей от интрелейкина-2 пролиферации опухолевых клеток" понимается новый или отклоняющийся от нормы рост ткани, причем рост происходит неконтролируемым прогрессивным способом, а пролиферация зависит от интерлейкина-2. Рост может быть доброкачественным или злокачественным. Злокачественный рост обычно характеризуется большей степенью анаплазии (дедифференцировки) опухолевых клеток. Зависящие от интерлейкина-2 опухолевые клетки обычно получают из лимфоидных или миелоидных линий.
Интерлейкин-2 производится Т-клетками и многообразным образом влияет на разные виды клеток, включая Т-клетки, NK-клетки и В-клетки. Выявилось, что интерлейкин-2 действует в качестве фактора роста Т-клеток и поощряет производство цитокинов Т-клетками, когда последние стимулируют в присутствии интерлейкина-2. Интерлейкин-2 активирует NK-клетки к лизисе целевых клеток неспецифическим к главному комплексу гистосовместимости способом. Кроме того, интерлейкин-2 играет некоторую роль при экспансии коммитированных клеток, таким образом поощряя производство антител этими клетками.
Из-за описанных действий интерлейкина-2 торможение его производства интерлейкином-10 может представлять собой важный вклад при терапии разных болезней. Например, им можно воспользоваться для снижения поощряемой интерлейкином-2 пролиферации Т-клеток в ситуациях, в которых пролиферация и рост Т-клеток являются нежелательными, например при аутоиммунных болезнях, как например аутоиммунном тиреоидите, зависящем от инсулина диабете, ревматическом артрите, системном эритематозе и множественном склерозе.
Кроме того, способностью интерлейкина-10 к снижению поощряемой интерлейкином-2 экспансии Т-клеток можно было воспользоваться при терапии острых заболеваний, вызванных реакцией пациента против трансплантата, и хронических воспалительных болезней, как например воспалительного заболевания кишечника, саркоидного фиброза и фиброза легких. Далее, путем торможения поощряемой интерлейкином-2 пролиферации аллерген-специфических Т-клеток, являющихся сильными производителями интерлейкина-4 и интерлейкина-5, интерлейкин-10 можно использовать для лечения аллергических болезней, как например астмы или атопического дерматита.
К болезням, в которых некоторую роль играет рост опухолевых клеток и которые можно лечить с применением композиций согласно изобретению, относятся также зависящие от интерлейкина-2 лейкозы, как например хронический лимфолейкоз В-клеток или Т-клеточный лейкоз взрослых. Предлагаемые фармацевтические композиции пригодны для дачи в качестве разных препаратов. Разные формы дачи описаны, например, Langer (см. Science 249, с. 1527, 1990). Способы получения пригодных для дачи препаратов известны и более подробно описаны, например, в Remington's Pharmaceutical Science, 17-е издание, издательство Mack Publishing Company, г. Easton, Пенсильвания, США, 1985.
Интерлейкин-10, используемый в рамках настоящего изобретения, можно получать в качестве препарата в фармацевтически приемлемой среде, например солевом растворе, фосфатсодержащем солевом буфере, растворе Рингера, смеси декстрозы и солевого раствора, растворе Ханка или глюкозе. Композиция может содержать фармацевтически переносимые вспомогательные агенты, требуемые для их приближения к физиологическим условиям, например буферы, тонизирующие агенты, увлажнители, детергенты и т.п. Кроме того, композиция может содержать дальнейшие активные вещества, как например бактерицидные агенты или стабилизаторы. Доза может колебаться в зависимости от вида активного вещества, конкретного состава препарата, цели дачи (профилактика или лечение), состояния пациента, способа дачи и т.д.
Фармацевтические препараты обычно предназначены для трансдермальной или парентеральной дачи, например внутривенной, подкожной или внутримышечной дачи. Путем изменения препарата с тем, чтобы он не разлагался в желудке, его можно также приспосабливать к оральной даче. Как уже указывалось, композицию согласно изобретению можно применять в целях профилактики и/или лечения. Предпочтительно ее дают внутривенно. Так, например, изобретением охватываются композиции, содержащие полипептид интерлейкина-10 в растворенном или суспендированном в приемлемом носителе виде, причем предпочтительно использован водный носитель. Препараты можно стерилизовать известным методом или путем стерильной фильтрации.
Полученные водные растворы можно упаковать как таковые, или их можно подвергать лиофилизации, и полученный препарат перед дачей объединяют с стерильным водным носителем. Интерлейкин-10 можно также дать вместе с другим биологически активным агентом, например известным хемотерапевтическим веществом. К последним относятся, например, винкристин, даунорубицин, L-аспарагиназа, митоксантрон, амсакрин и другие.
В целях лечения фармацевтическую композицию дают пациенту в количестве, достаточном для торможения зависящей от интерлейкина-2 пролиферации опухолевых клеток. Количество, пригодное для достижения желаемого эффекта, называется "терапевтически эффективной дозой". Терапевтически эффективная доза интерлейкина-10 может колебаться в зависимости от того, для какой терапии предназначен конкретный препарат, от способа дачи, здоровья и состояния пациента и усмотрения врача. Например, при постоянной инфузии доза обычно составляет примерно от 500 нг до 800 мкг в сутки при весе тела пациента, составляющем 70 кг, предпочтительно примерно от 10 до 300 мкг. Типичная доза составляет от 700 нг до 16 мкг в сутки на кг веса тела.
Концентрация интерлейкина-10 в фармацевтических композициях может сильно колебаться и составлять примерно от 10 мкг до 5 мг на мл, предпочтительно примерно от 100 мкг до 2 мг на мл. Концентрацию обычно выбирают в соответствии с объемом среды, вязкости и т.д. в зависимости от конкретного способа дачи. Например, типичный препарат, предназначенный для внутривенной инфузии, может содержать 250 мл смеси декстрозы и солевого раствора и 2,5 мг интерлейкина-10.
В случае твердых препаратов можно использовать известные нетоксичные твердые носители, как например фармацевтические формы маннита, лактозы, крахмала, стеарата магния, натриевого сахарина, талька, целлюлозы, глюкозы, сукрозы, карбоната магния и т.п. Предназначенный для оральной дачи фармацевтически приемлемый нетоксичный препарат содержит известный разбавитель, например один из вышеуказанных носителей, и 10-95%, предпочтительно 25-75% активного вещества, то есть полипептида интерлейкина-10 согласно изобретению.
Для дачи в виде аэрозоля интерлейкин-10 предпочтительно имеется в тонкораспределенном виде в комбинации с поверхностно-активным веществом и носителем. В данном случае интерлейкин-10 обычно имеется в количестве 0,01 - 20, предпочтительно 1-10% от веса общего препарата. Конечно поверхностно-активное вещество должно быть нетоксичным и предпочтительно способным к растворению в носителе. В качестве таких веществ можно называть, например, сложные эфиры или неполные сложные эфиры жирных кислот, содержащих 6 - 22 атома углерода, например капроновой кислоты, каприловой кислоты, лауриновой кислоты, пальмитиновой кислоты, стеариновой кислоты, линолевой кислоты, линоленовой кислоты или олеиновой кислоты, с алифатическим полугидридным спиртом или его циклическим ангидридом, например этиленгликолем, глицерином, эритритолом, арбитом, маннитом или сорбитом, или гекситным ангидридом сорбита, и полиоксиэтиленовыми и полиоксипропиленовыми производными данных сложных эфиров. Можно также использовать смешанные сложные эфиры, как например смешанные или естественные глицериды.
Поверхностно-активное вещество может иметься в количестве от 0,1 до 20, предпочтительно 0,25-5% от веса препарата. Главным компонентом препарата обычно является носитель. В качестве последнего обычно используют вещество, в нормальных условиях имеющееся в газовом состоянии, в конденсированном под давлением виде. В качестве примеров ожиженных носителей можно называть, например, низшие алканы с числом атомов углерода до 5, как например бутан или пропан и предпочтительно фторированные алканы, или фторхлоралканы или их смеси. В случае аэрозоля резервуар, снабженный пригодным соплом, наполняют пригодным носителем, содержащим тонкораспределенный (тонкораспределенные) пептид(ы) и поверхностно-активное вещество. Таким образом компоненты находятся при повышенном давлении до их выпуска через сопло.
Для продления периода полураспада сыворотки интерлейкин-10 можно заключать в капсулах, вводить в полость липозом, приготовлять в виде коллоида, или можно использовать другие известные методы, продлевающие долговечность пептидов. Так, например, в некоторых случаях интерлейкин-10 можно заключать в липозомах. Известны разные методы получения липозом (см., например, Szoka и др. , Ann. Rev. Biophys. Bioeng. 9, с. 467, 1980, или патенты США N 4235871, 4501728 и 4837028).
После получения липозом их размер можно варьировать желаемым образом с получением липозом со сравнительно узким гранулометрическим составом.
Даже при применении самого эффективного метода заключения в капсулы первичная суспензия липозом может содержать 50% или больше активного вещества в свободном (незаключенном в капсулы) виде. Известны разные методы удаления незаключенного активного вещества из суспензии липозом. Например, согласно одному методу имеющиеся в суспензии липозомы переводят в гранулят путем высокоскоростного центрифугирования, после чего свободное активное вещество и очень мелкие липозомы содержатся в сверхосадочной жидкости. Согласно другому методу суспензию сгущают путем ультрафильтрации с последующим повторным суспендированием концентрированных липозом в замененной среде. Другая альтернатива заключается в гель-фильтрации, причем большие липозомы отделяются от растворенных молекул.
После вышеописанной переработки липозомсодержащую суспензию доводят до желаемой концентрации, пригодной для внутривенной дачи. Если липозомы имеются в концентрированном виде в результате центрифугирования или ультрафильтрации, то для получения пригодного для внутривенной дачи препарата липозомы можно повторно суспендировать в определенном количестве инъекционного раствора, а если объем суспензии большой, то ее можно сгущать. После этого полученную суспензию можно вышеописанным методом стерилизировать путем фильтрации. Липозомы, содержащие пептиды согласно изобретению, можно дать парентерально вышеописанным способом.
Повышение производства γ-интерферона.
Фармацевтические композиции, предназначенные для увеличения содержания γ-интерферона, особенно полезны в том случае, если пациент болен инфекционной болезнью, приводящей к торможению производства γ-интерферона иммунной системой пациента вследствие производства интерлейкина-4 и интерлейкина-10. В качестве таких болезней можно называть, например, индийский висцеральный лейшманиоз, лепроматозную лепру и мукозы, причем к последним относятся, например, кандидамикоз, паракокцидиоидомикоз, бластомикоз и криптоспироидиум.
Определенные инфекционные организмы или непосредственно, или косвенно извлекают пользу при низком содержании γ-интерферона. Такие инфекции часто являются хроническими, и их типическим признаком является неравновесие реакции Т-клеток-помощников 2 по сравнению с Т-клетками-помощниками 1 на инфекционный агент. В результате данного неравновесия производство γ-интерферона клетками Th1 тормозится вследствие производства интерлейкина-4 и интерлейкина-10 Т-клетками-помощниками 2.
Антитела, получаемые в рамках настоящего изобретения, предпочтительно являются аутологичными для пациента. Полезны также антитела, представляющие собой не собственные антитела, но получаемые из клеток того же вида. Можно также использовать антитела, полученные из другого вида, но при этом рекомендуется применение методов, снижающих вероятность отрицательной иммунной реакции. Иммунную реакцию человека можно сократить до минимума, например, при использовании гуманизованных антител крысы. Предпочтительно антитела имеют константы связывания, приближенные к сродству интерлейкина-4 и интерлейкина-10 к их естественным рецепторам, или превышающие данное сродство.
Предпочтительными являются антитела, константа связывания до 100 раз превышает константу связывания данных цитокинов к их соответствующим рецепторам. Сравнение связывания можно осуществлять путем известных методов равновесия. Основной подход описан в главе 25 в Immunochemistry, том 1, под ред. D. М. Weir, 4-е издание, 1986, издательство Blackwell Scientific Publ, пункты 25.1 - 25.30. Альтернативно можно исследовать молярный избыток антитела, нейтрализующий определенное количество интерлейкина-4 или интерлейкина-10 в стандартном биологическом опыте in vitro. Такие опыты описаны в Mosmann и др. (см. J. Immunol. Methods 116, с. 151, 1989) (для интерлейкина-4), и Fiorentino и др. (см. J. Exp. Med. 170, с. 2081, 1989). Возможное количество антител, нейтрализующее определенное количество интерлейкина-4 или интерлейкина-10, представляет собой 10 - 1000-кратный избыток.
В контексте настоящего изобретения под "совместной дачей" подразумевается дача антител против интерлейкина-4 и интерлейкина-10 в таком небольшом периоде, что они одновременно находятся в теле пациента. При этом конкретная последовательность дачи не играет никакой роли, антитела можно дать или одновременно, или отдельно, после предварительного смешивания или же путем отдельной дачи.
Антитела обычно дают парентерально, предпочтительно внутривенно. Их можно дать путем инфузии путем известных методов. Антитела сперва суспендируют в стерильной, физиологически приемлемой среде, например фосфатсодержащем солевом буфере, причем вместе с антителами можно также суспендировать фармацевтически приемлемые разбавители, как например лецитин, глюкозу, декстрозу или антибиотики.
При совместной даче антител доза каждого антитела составляет от 1 до 10 мг на кг веса тела. Желательно, чтобы антитела давали в количестве, обеспечивающем концентрацию каждого антитела в сыворотке примерно 1 - 150, предпочтительно 10 - 100 мкг на мл. Обычно период полураспада антител составляет 2 - 7 дней, и рекомендуется повторная дача при снижении содержания антитела под желаемый уровень. Содержание антител в пробах сыворотки можно определять путем известного иммунологического анализа, предпочтительно путем твердофазного иммуноферментного анализа.
Хотя согласно описанному здесь варианту изобретения используют моноклональные антитела против интерлейкина-4 и интерлейкина-10, можно также использовать другие антагонисты, например антитела, специфически связывающиеся с рецепторами интерлейкина-4 и интерлейкина-10, таким образом препятствуя связыванию цитокина. Кроме того, можно использовать способные к растворению формы рецепторов интерлейкина-4 и интерлейкина-10, не содержащие трансмембранный домен. Далее, пригодны также мутированные антагонистические формы интерлейкина-4 и интерлейкина-10, проявляющие сильное связывание с соответствующими рецепторами, но в основном не обладающие биологической активностью. Такой антагонист в виде мутированного интерлейкина-4, в котором тирозин в положении 124 дикого человеческого интерлейкина-4 заменен аспарагиновой кислотой, описан Kruse и др. (см. ЕМВО J. 11, с. 3237, 1992).
Совместную дачу антител предпочтительно осуществляют внутривенно с использованием стерильной водной смеси, которая может содержать любой фармацевтически приемлемый разбавитель, например стерильный буфер, солевой раствор, антибиотики и т.п.
Обычно дачу прекращают, когда инфекция является под контролем, судя по клинической реакции пациента. В сочетании с композицией согласно изобретению можно также применять известные антибиотические терапии.
Воспалительное заболевание кишечника.
Под термином "воспалительное заболевание кишечника" в рамках настоящего изобретения подразумевается язвенный колит или болезнь Крона. Для лечения воспалительного заболевания кишечника интерлейкин-10 предпочтительно дают парентерально, например внутрисосудисто, в частности внутривенно, причем лечимое млекопитающее представляет собой человек.
Интерлейкин обычно дают в количестве примерно 1 мкг - 100 мг на 1 кг веса тела. Часто доза будет находиться в пределах примерно от 10 мкг до 1000 мкг на 1 кг веса тела, а наиболее предпочтительно доза составляет примерно от 50 до 100 мкг на 1 кг веса тела.
Интерлейкин-10 можно дать или отдельно, или вместе с одним или некоторыми дополнительными терапевтическими агентами. В качестве примеров таких агентов, пригодных для контроля периодических воспалений кишечной ткани, можно называть кортикостероиды, сульфазалазины и их производные, иммуносупрессоры, как например циклоспорин А, меркаптопурин и азатиоприн, и другие цитокины. При этом совместную дачу можно осуществлять или последовательно, или одновременно. В общем под совместной дачей подразумевается наличие двух или больше активных веществ в теле пациента во время определенного периода. Обычно из совместной дачи исходят тогда, если второе активное вещество дают до истечения периода полураспада первого активного вещества.
Далее, настоящее изобретение позволяет предсказать предрасположение млекопитающего к развитию воспалительного состояния, характеризующегося содержанием интерлейкина-10 ниже оптимального уровня, путем исследования пробы, отобранной у млекопитающего в этих целях. При этом под содержанием ниже оптимального уровня подразумевают количество, которое уже не обнаруживается, так как способный к обнаружению уровень представляет собой нормальное содержание интерлейкина-10. Альтернативно в качестве посредников воспаления можно исследовать интерлейкин-1, интерлейкин-6, опухолево-некрозный фактор и γ-интерферон, используя для этого имеющуюся в торговле аппаратуру.
Перепроизводство одного из этих посредников может быть признаком того, что имеется в распоряжении недостаточное количество интерлейкина-10. Предпочтительно в качестве исследуемой пробы берут кровь. С помощью изобретения можно предсказать разные воспалительные состояния, например воспалительное заболевание кишечника, анемию, артрит, дерматит или другие синдромы, связанные с воспалительным заболеванием кишечника.
Млекопитающему, больному воспалительным заболеванием кишечника, например язвенным колитом или болезнью Крона, дают фармацевтическую композицию, содержащую интерлейкин-10 в количестве, способном к улучшению по меньшей мере одного симптома или признака воспалительного заболевания кишечника у млекопитающего.
В общем под понятием "симптом" подразумевается любое субъективное проявление болезни или состояние пациента, включая проявление болезни, ощущаемое пациентом. В качестве примеров симптомов воспалительного заболевания кишечника можно приводить понос, боль в животе, повышенную температуру, мелену, кровавый стул и снижение веса. Под "признаком" болезни в данном контексте подразумеваются все объективные проявления болезни или состояния, как их видит врач, или которые можно определять путем лабораторных исследований или другими средствами, например ультразвуком или радиографией. К "признакам" воспалительного заболевания кишечника относятся, например, глоссит, афтозная язва, трещины заднего прохода, перианальная фистула, анемия, малабсорбция и недостаток железа. Иногда признаки и симптомы частично совпадают, например пациент страдает от кровавых стулов (= симптом), и при лабораторном исследовании пробы стула обнаруживается кровь (= признак).
Фармацевтические композиции данной формы осуществления изобретения обычно имеются в виде препаратов, пригодных для парентеральной дачи. Предпочтительно эффективное количество активного вещества содержится в отдельной дозе, размещенной в ампуле. Альтернативно эффективное количество может содержаться во флаконе, в котором имеются некоторые дозы, или в другом виде. При этом активное вещество может иметься в сочетании с фармацевтически приемлемыми добавками, например носителями, как например водой, буфером, разбавителем, антимикробным агентом и консервантом.
Для оценки активности интерлейкина-10 пригодно также биологическое исследование самих цитокинов. Биологическое исследование человеческого лимфотоксина описано Aggarwal (см. Methods in Enzymology 116, с. 441, 1985) и Matthews и др. (Clemens и др.) (см. Cytokines and Interferons; A Practical Approach, с. 221 - 225, издательство IRL Press, г. Washington, D.C., 1987). Человеческий интерлейкин-2 и GM-CSF можно исследовать с помощью зависящих от факторов клеточных линий CTLL-2 и KG-1, депонированных в Американской коллекции культур под NN TIB 214 и CCL 246. Человеческий интерлейкин-3 можно оценивать через его способность к стимуляции образования большого числа колоний кроветворных клеток в культурах на мягком агаре (см., например, Metclaf, "The Hemopoietic Colony Stimulating Factors", издательство Elsevier, r. Amsterdam, 1984). Количество γ-интерферона можно определять с помощью антивирусных опытов (см., например, Meager, см. в указанном источнике, под ред. Clemens и др., с. 129 - 147). Путем перманентного контроля данных цитокинов можно получать полезные данные относительно того, когда дано эффективное количество интерлейкина-10. Также можно применять иммунохимические исследования, например твердофазный иммуноферментный анализ.
Интерлейкин-10 можно дать в среде водного носителя, например воды, солевого раствора или буфера, вместе с разными добавками и/или разбавителями, или без них. Альтернативно интерлейкин может иметься в суспензии, например суспензии цинка. Такую суспензию можно использовать, например, для подкожной или внутримышечной инъекции. Соотношение интерлейкина-10 и добавки может колебаться в широких пределах, причем, однако, должно обеспечиваться, что оба компонента имеются в эффективном количестве. Одна доза может содержать примерно 1 мкг - 100 мг интерлейкина-10.
Общая доза в сутки обычно составляет примерно от 1 мкг до 100 мг на 1 кг веса тела, предпочтительно примерно 10 мкг - 1000 мкг. Наиболее предпочтительно доза составляет примерно 50 - 100 мкг на 1 кг веса тела в сутки. Отдельные дозы дают по программе, обеспечивающей достижение желаемого терапевтического эффекта, при этом лекарство можно давать регулярно во время короткого или длительного периода или нерегулярно в соответствии с периодическим характером таких воспалительных заболеваний.
Композиции можно дать орально или путем инъекции в тело. Предназначенные для оральной дачи препараты содержат агенты, защищающие полипептиды от протеаз, имеющихся в желудочно-кишечной системе. Инъекции как правило дают внутримышечно, подкожно, внутрикожно или внутривенно. Альтернативно, в случае необходимости лекарство можно дать внутрисуставно или другим путем. Кроме того, содержащие интерлейкин-10 композиции можно депонировать в пациенте путем имплантации или инъекции с помощью выделяющей лекарство системы (см., например, Urquhart и др., Ann. Rev. Pharmacol. Toxicol. 24, с. 199, 1984; "Controlled release of Pesticides and Pharmaceuticals", под ред. Lewis, издательство Plenum Press, г. Нью-Йорк, США, 1981; патенты США N 3773919 и 3270960).
Предпочтительно пептид дают парентерально и предпочтительно в виде отдельных доз, предназначенных для инъекции. В качестве предназначенных для инъекции препаратов можно приводить, например, растворы, суспензии и эмульсии. Наиболее предпочтительно эффективное количество интерлейкина-10 дают внутривенно.
Под выражением "эффективное количество" в рамках настоящего изобретения понимают количество, достаточное для улучшения симптома или признака аутоиммунного состояния, или нежелаемого или несоответствующей воспалительной или иммунной реакции. Типичные хозяева среди млекопитающих включают мышей, крыс, кошек, собак и приматов, включая человека. Эффективное количество для конкретного пациента может колебаться в зависимости от состояния, общего здоровья пациента, способа дачи, дозы и серьезности побочных действий.
На основе известных параметров врач определяет размер подходящей дозы. Обычно вначале дают дозу, которая меньше, чем оптимальная доза, после чего дозы повышают постепенно до достижения желаемого или оптимального действия (для общих сведений см. The Merck Manual, ст. 269 "Pharmacokinetics and Drug Administration"). Содержание опухолево-некрозного фактора α, γ-интерферона, интерлейкина-1 и интерлейкина-6 представляет собой важный индикатор момента достижения эффективной дозы. Предпочтительно используют интерлейкин-10, полученный из того вида млекопитающего, которого лечат.
Обычно интерлейкин-10 инъецируют в сочетании с фармакологическим носителем, например обычным солевым раствором, раствором Рингера, раствором декстрозы или другим известным водным носителем. Можно также использовать неводные носители, например масла и этилолеат. Предпочтительным носителем является 5%-ный раствор декстрозы в солевом растворе. Часто является желательным наличие добавок, например буфера и консерванта или других веществ, способствующих изотонии и химической стабильности.
Общую суточную дозу можно дать или в качестве одной единственной инъекции, или же в качестве непрерывной инфузии. Альтернативно ее можно разделять на некоторые меньшие дозы для внутривенной дачи или дачи другим способом, например внутримышечной инъекции. Предпочтительно интерлейкин-10 дают внутривенно в качестве ударной дозы.
Интерлейкин-10 можно дать отдельно или в комбинации с другими активными агентами. В качестве примеров таких агентов, пригодных для применения при воспалении кишечника, можно называть кортикостероиды, сульфазалазины и их производные, и определенные цитотоксичные лекарства, как например циклоспорин А, меркаптопурин и азатиоприн. Предпочтительно при даче более одного активного вещества последние дают отдельно путем последовательных инфузии или инъекций. В определенных случаях лекарства можно смешивать друг с другом для одновременной инфузии или инъекции, например интерлейкин-10 с другими цитокинами, стероидами, или с другими активными веществами.
Необходимо указать на то, что симптомы воспалительного заболевания кишечника могут возникать периодически, так что эффективного лечения можно достичь путем дачи одной небольшой дозы в выгодный момент. Альтернативно путем постоянной дачи небольших доз можно обеспечить для лечимого животного длительный свободный от повторения болезни период.
Совместную дачу можно осуществлять или последовательно, или одновременно. В общем под "совместной дачей" подразумевается наличие обоих цитокинов в лечимом животном или человеке во время определенного периода. Обычно из совместной дачи исходят тогда, если второй цитокин дают до истечения периода полураспада первого цитокина. Предпочтительно дачу осуществляют парентерально, наиболее предпочтительно внутривенно. Эффективное количество составляет примерно 15 мкг -1500 мкг на кг веса тела млекопитающего.
Торможение аллергической реакции замедленного типа.
Фармацевтические композиции, предназначенные для ограничения или торможения аллергической реакции замедленного типа в млекопитающем, в частности в человеке, обычно дают парентерально, предпочтительно внутрисосудисто.
Кроме того, настоящее изобретение позволяет надежно предотвращать миграцию клеток к месту воспаления в теле млекопитающего. Миграция клеток относится к рекрутменту или привлечению иммунной реакции клеток млекопитающего, включающей миграцию лимфоцитов, моноцитов и макрофагов к месту воспаления. Далее, изобретение позволяет тормозить набухания в ткани млекопитающего.
Интерлейкин-4 и/или интерлейкин-10 дают парентерально, например внутрисосудисто, или вблизи местного воспаления. Эффективное количество интерлейкина-4 или интерлейкина-10 обычно составляет примерно 15 мкг - 1500 мкг на кг веса тела млекопитающего.
Фармацевтическая композиция, позволяющая потенцировать торможение производства цитокинов Т-клетками в млекопитающем предпочтительно представляет собой комплект, включающий одну ампулу, содержащую одну дозу смеси интерлейкина-4 и интерлейкина-10. Вместо ампулы можно использовать другой резервуар, например пластмассовый мешочек, стеклянную пробирку или т.п. Предпочтительно смесь интерлейкина-4 и интерлейкина-10 имеется в форме, пригодной для парентеральной дачи. Отдельная доза обычно составляет примерно 15 - 1500 мкг и интерлейкина-4, и интерлейкина-10 на кг веса тела млекопитающего.
Основную концепцию изобретения представляет собой дополняющее друг друга действие интерлейкина-4 и интерлейкина-10 на активность Т-клеток. В рамках настоящего изобретения впервые было обнаружено, что это совместное действие относится специфически к Т-клеткам. Известные данные показали действие на макрофаги или моноциты и роль макрофагов как эффекторов. Дополнительное действие интерлейкина-4 и интерлейкина-10 на активность Т-клеток является неожиданным и расширяет возможности их терапевтического применения, в частности в отношении опосредованного клетками иммунитета. Так как комбинация интерлейкина-4 и интерлейкина-10 приводит к потенцированию опосредованного интерлейкином-10 торможению производства цитокина Т-клетками, изобретение можно применять везде, где желательно ограничивать реакцию Т-клеток относительно производства цитокинов. Примерами такой реакции являются аллергическая реакция замедленного типа, опосредованное клетками воспаление и пролиферация и активация Т-клеток.
Например, аутоиммунная болезнь сахарный диабет типа I характеризуется инфильтрацией инсулярных клеток лимфоцитами, макрофагами и плазматическими клетками. Подавление производства цитокинов Т-клетками может улучшать симптомы и разрушение инсулярных клеток при диабете. Кроме того, изобретение может играть роль при терапии опосредованных клетками иммунных реакций при трансплантации органов.
Известно, что отторжение почки отчасти вызвано опосредованным клетками иммунитетом. Цитокины в области трансплантированной почки приводят к активации клеток, пролиферации, агрегации, фиброгенезу, торможению роста и цитотоксичности. Кроме того, изобретение может играть положительную роль при лечении GVHD. Кроме того, саркоидоз, представляющий собой нарушение лимфопролиферации, связан с умершими DTH и активированными Т-клетками или клетками-помощниками с последующим образованием грануломы.
В нижеследующем изобретение иллюстрируется с помощью примеров, однако оно не ограничивается данными примерами. Если ничего другого не указано, то в данных примерах количество твердого вещества в смеси твердых веществ указано в мас.%, количество жидкости в жидкостях - в об.%, а твердого вещества в жидкости - как % при соотношении массы к объему.
Торможение зависимой от интерлейкина-2 пролиферации опухолевых клеток.
Пример 1. Торможение пролиферации человеческих клонов, "подобных" Т-клеткам-помощникам 0, 1 и 2, интерлейкином-10, и последующая активация моноклональными антителами против клеточной линии CD3, поперечно связанными с L-клетками мыши, трансфецированными CD32.
Клетки и клеточные линии.
Использовали Т-клетки клеточных линий CD2+, CD3+, CD4+ и CD8-. Клоны HY-06, 827 и 837 описаны, например, Yssel и др. (см. Eur. J. Immunol. 16, с. 1187, 1986) и Haanen и др. (см. J. Exp. Med. 174, с. 538, 1991). Клон 827 Т-клеток узнает токсин столбняка в контексте HLA-DR3, а клон HY-06 Т-клеток узнает пептид 2-12 белка теплового шока Mycobacterium leprae, имеющего вес 65 кД. Специфичность антигена клона 837 Т-клеток неизвестна.
Клоны SP-В21 и SP-A3 Т-клеток получали от пациента, больного тяжелым комбинированным иммунодефицитом, которого успешно лечили с помощью плодного тимуса и трансплантации плодной печени (см. Roncarolo и др., J. Exp. Med. 168, с. 2139, 1988). Клоны NP 12, NP 14 и NP 44 получали из РВМС пациента, больного атопией, и они специфически размножаются в ответ на белок р89-117 молекулы Der p I, представляющей собой главный аллерген клеща, имеющегося в домашней пыли (см. Yssel и др., J. Immunol. 148, с. 738, 1992). Клоны CR253, CR378, CR380, AP74 и AP75 Т-клеток выделяли из РВМС пациентов, больных хроническим Лима, и они способны к реакции с гомологом белка теплового шока Borrelia burgdorferi, имеющего вес 60 кД (HSP60) (см. Shanafelt и др., J. Immunol. 146, с. 3985, 1991).
Из-за профиля этих клонов Т-клеток относительно производства лимфокина их рассматривают как субпопуляции Т-клеток-помощников (см. табл. 1). Клоны Т-клеток (2 • 105 клеток/мл) известным методом (см. Spits и др., J. Immunol. 128, с. 95, 1982) стимулировали в периодах до 2 недель с использованием смеси питающих клеток, состоящей из 106 облученных при 4000 rad аллогенных лейкоцитов из периферийной крови на мл, 105 облученных при 5000 rad клеток трансформированной линии В-клеток вируса Эпштейна и Барра (EBV-LCL) JY на мл и 0,1 мг/мл очищенного фитогемоагглютинина (фирмы Wellcome Diagnostics, г. Beckenham, Kent, Великобритания) в снабженных 24 углублениями пластинках Линбро (фирмы Flow, г. McLean, Виржиния, США). За три или четыре дня после каждой повторной стимуляции культуры разделяли и далее расширяли в среде, содержащей 20 ед./мл rIL-2. Все клонированные линии Т-клеток и EBV-LCL выращивали в среде Иссела (см. Yssel и др., J. Immunol. Methods 72, с. 219, 1984), к которой добавили 1% человеческой сыворотки AB+.
Трансфецированные CD32 (FcγRII) (16.2CG7) L-клетки мыши получали описанным Peltz образом (см. J.Immunol. 141, с. 1891, 1988). Согласно данному методу использовали клон 16.2 FcγRII кДНК, выделенный из мутанта человеческой моноцитарной клеточной линии U937 (см. Stuart и др., J. Exp. Med. 166, с. 1668, 1987). При помощи известного метода сайт-специфического мутагенеза путем введения мутаций, изменяющих кодоны лизина путем их терминации за первой аминокислотой (аргинином) предсказуемого цитоплазматического домена, получали мутант, не содержащий цитоплазматического домена. Временную трансфекцию L-клеток мыши осуществляли известным методом.
Реагенты.
Рекомбинантный интерлейкин-10 экспримировали в E.coli и очищали методом, описанным de Waal Malefyt и др. (см. J. Exp. Med. 174, стр. 915, 1991) (см. также вышеуказанную международную заявку, опубликованную под N WO/91/00349).
Опыты по пролиферации.
Клонированные Т-клетки использовали за 10-12 дней после стимуляции питающими клетками. На этой стадии клоны Т-клеток были маленькими и находились в состоянии "покоя". Клоны Т-клеток в количестве 2 • 104 клеток на углубление инкубировали вместе с трансфецированными CD32 L-клетками (2 • 104 клеток на углубление) в присутствии 1 мкг/мл моноклонального антитела против CD3 (SPV-Т3b) (см. Spits и др., Hybridoma 2, с. 423, 1983) в плоскодонных пластинках емкостью 200 мкл (фирмы Falcon, Becton Dickinson, г. Lincoln Park, Нью Джерси, США). L-клетки предварительно инкубировали в течение часа вместе с 1 мкг/мл моноклонального антитела в присутствии или отсутствие интерлейкина-10 (100 ед./мл), и лишь после этого добавляли Т-клетки, после чего выращивали в течение 72 часов. L-клетки обрабатывали при температуре 37oC в течение 45 минут 50 мг/мл митомицина C (фирмы Sigma Chemical Co., г. St. Louis, МО, США), а затем перед употреблением промывали четыре раза. Клетки инкубировали при температуре 37oC в течение 72 часов в присутствии 5% двуокиси углерода, обрабатывали [3H]-тимидином в течение 4 часов и собирали описанным Yssel и др. образом (см. Eur. J. Immunol. 16, с. 1187, 1986). Результаты выражали в числе импульсов в минуту включенного [3H]-тимидина и представляют собой среднюю величину, получаемую из трех культур.
Действие интерлейкина-10 на пролиферацию клонов Т-клеток не различалось при разных способах производства лимфокина Т-клетками. Клоны Т-клеток 837, SP-B21 и 827 при активации выделяли интерлейкин-2, интерлейкин-4 и γ-интерферон, почему и их рассматривают как клоны человеческих Т-клеток-помощников 0. HY-06, CR 253, CR 378, CR 380, AP 74 и AP 75 выделяли большое количеств γ-интерферона, но не способное к обнаружению или незначительное количество интерлейкина-4 и интерлейкина-5. Данные клоны рассматривают как клоны, подобные человеческим Т-клеткам-помощникам 1, в то время как NP 12 и NP 44 представляют собой клоны, подобные человеческим Т-клеткам помощникам 2, так как после активации их специфическим антигеном они выделяли большое количество интерлейкина-4 и интерлейкина-5, но не способное к обнаружению или незначительное количество γ-интерферона. Клон SP-A3 Т-клетки после активации выделял интерлейкин-2, интерлейкин-5, γ-интерферон и GM-CSF, а не интерлейкин-4.
Как видно в табл. 1, интерлейкин-10 тормозил пролиферацию клонов 837, SP-B21, SP-A3, 827, HY-06, CR 253, CR 378, CD 380, AP 74, AP 75, NP 12 и NP 44 Т-клеток после активации. Таким образом, интерлейкин-10 оказался способным к торможению пролиферации клонов Т-клеток, относящихся ко всем субпопуляциям Т-клеток-помощников. В общем в условиях опыта интерлейкин-10 тормозил пролиферацию клонов Т-клеток на 20-50%. Торможение зависело от дозы, и оно являлось специфическим, так как его можно было реверсировать с использованием нейтрализующего моноклонального антитела 19F1 против интерлейкина-10.
Интерлейкин-10 мыши, который является специфическим относительно вида, не проявлял никакого действия на эти клоны человеческих Т-клеток. Это показывает, что интерлейкин-10 действует непосредственно на клоны Т-клеток, а не через L-клетки мыши, трансфецированные CD32 и использованные для поперечной сшивки с моноклональными антителами против CD3. По результатам данного опыта видно, что интерлейкин-10 непосредственно тормозил пролиферацию клонов человеческих Т-клеток-помощников 0, 1 и 2 после активации комплексом TCR/CD3 моноклональными антителами против CD3, поперечно сшитыми на L-клетках, трансфецированных CD32.
Пример 2. Торможение пролиферации клонов CD4+ Т-клеток, независимое от состимулирующих сигналов от ICAM-1, LFA-3 или B7.
Активацию клонов человеческих Т-клеток можно модулировать путем взаимодействия прибавочных молекул на Т-клетках с их противоструктурой на антигенпредставляющих клетках. Взаимодействие между LFA-1 и ICAM1, CD2 и LFA3, CD28 и В7 или CTLA-4 и В7 создает состимулирующие сигналы, поощряющие пролиферирующее действие Т-клеток и их действие в качестве эффектора. Для определения возможного тормозящего пролиферацию Т-клеток действия интерлейкина-10 в результате влияния на состимулирующую функцию данных прибавочных молекул получали L-клетки, экспримирующие CD32 и ICAM-1, LFA-3 или В7.
Конструкция pCD-SP α-LFA-3 HYG, pCDM8-ICAM-1 HYG и pBJ-B7 HYG.
кДНК LFA-3 получали из библиотеки Raji кДНК путем амплификации PCR с использованием специфических в отношении LFA-3 праймеров. Библиотеку кДНК Raji получали в векторе pCD-SR путем метода, описанного Matsui и др. (см. Science 154, с. 1788, 1991). Для клонирования трансмембранной формы LFA-3 использовали следующие праймеры:
смысловой: 5'-GGCTGCAGCGACGAGCCATGGTTGCTGGGAGCGACGCG-3' (nt 1-30) и
антисмысловой: 5'-TTCATCTTCTGGTACCAATCAATTGGAGTTGGTTC-3' (nt 780 - 745).
Прямой праймер LFA-3 снабжали сайтом Pst-I, а обратный праймер LFA-3 - сайтом Kpn-1 для удобного субклонирования амплифицированных продуктов.
Амплификацию осуществляли в следующих условиях: 1 мкг перевариваемой Hind-III плазмидной ДНК библиотеки Raji амплифицировали в 50 мкл среды, содержащей по 25 нмоль каждого праймера, по 125 ммоль dGTP, dATP, dCTN и dTTP (фирмы Pharmacia, г. Uppsala, Швеция), 50 ммоль хлорида калия, 10 ммоль Tris-HCl, значение pH 8,3, 1,5 ммоль хлорида магния, 1 мг/мл желатины и 5 единиц полимеразы Taq (фирмы IBI, г. New Haven, Коннектикут, США).
Смеси инкубировали в термическом циклическом реакторе марки Perkin-Elmer/ Cetus DNA Thermal cycler в течение 20 циклов, причем в каждом цикле осуществляли денатурацию в течение 30 с при температуре 94oC, отжиг в течение 30 с при температуре 55oC и растяжение в течение 60 с при температуре 72oC. Взяли аликвотную пробу размером 5 мкл, которую подвергали второй стадии амплификации при таких же условиях. Затем реакционную смесь экстрагировали хлороформом и размещали на 1%-ном агарозном геле. Амплифицированный продукт, предположительно имеющий размер 785 п.о., вырезали из геля после разделения, выделяли путем абсорбции на силикагеле с использованием комплекта Genelean (фирмы Bio 101, г. La Jolla, Калифорния, США), разрезали с использованием Pst-1 и Kpn-1 и субклонировали в Bluescript II KS (+) (фирма Stratagene, г. La Jolla, Калифорния, США).
С помощью известных методов выделяли ряд клонов, содержащих LFA-3, и 4 клона секвенировали путем известного метода с использованием комплекта фирмы USB (г. Cleveland, Охайо, США). Фрагмент Pst-1-Кpn-1 одного из данных клонов выделяли и субклонировали в экспрессионный вектор pCD-SRa 296 (см. Matsui и др., в вышеуказанном источнике).
pCDM8-ICAM-1 (см. Blanchard и др., J. Immunol. 138, с. 2417, 1987) подарил Dr. Brian Seed (Massachusetts General Hospital, г. Boston, Массачусетс, США). Ген аминоциклитол-фосфотрансферазы, кодирующий устойчивость против гигромицина В, поставили под контроль промотора SV-40 и сигналов полиаденилирования, и путем известных методов его вставили в сайты Sfi-I pCD-SRα-LFA-3 и pCDM8-ICAM-1 с получением pCD-SRα-LFA-3 HYG и pCDM8-ICAM-1 HYG, соответственно. pB7-B7-HYG содержит человеческий B7 под контролем промотора SRα (см. Makgoba и др., Nature 331, с. 86, 1988), и его подарил Dr. L. Lanier (DNAX Research Institute).
L-клетки, экспримирующие HLA-DR3 или CD32, путем липофекции (фирма BRL, г. Gaithersburg, Мэриланд, США) по указаниям производителя трансфецировали с использованием pCD-SRα-LFA-3-HYG, pCDM8-ICAM-1-HYG или pBJ-B7-HYG. Клетки расщепляли за 48 часов после трансфекции, и добавили среду, содержащую 200 мкг/мл гигромицина-B (фирмы Lilly, г. Indianapolis, Индиана, США), которую заменяли через три дня.
По истечении 12 дней стали видны отдельные устойчивые к гигромицину-В колонии. Эти клетки собирали, окрашивали для экспрессии LFA-3, ICAMN-1 или B7 путем косвенной иммунофлуоресценции и очищали путем двух последовательных циклов позитивной сортировки с применением клеточного сортера с возбуждением флуоресценции марки FAGS-Star Plus. Сотрансфецированные клеточные линии держали в стандартной среде RPMI-1640, содержащей 200 мкг/мл гигромицина-В и 10% ТЭС.
Для анализа с применением указанного сортера клетки инкубировали в микротитровых пластинках с V-образным дном (фирма Flow Laboratories, г. McLean, Вирджиния, США) при температуре 4oC в течение 30 минут вместе в 10 мкг/мл очищенного моноклонального антитела. После двухразовой промывки фосфатсодержащим солевым буфером, содержащим еще 0,02 ммоль азида натрия и 1% альбумина сыворотки крупного рогатого скота (фирмы Sigma, г. St. Louis, Монтана, США), клетки инкубировали при температуре 4oC в течение 30 минут вместе с 2,5 %-ным раствором маркированных FITC фрагментов F(ab')2 антитела козы против мыши (фирмы TAGO, Inc., г. Burlingame, Калифорния, США). Еще трижды промывали, затем маркированные клеточные пробы подвергали анализу путем поточной микрофлуориметрии с помощью клеточного сортера с возбуждением флуоресценции марки FACScan (фирмы Becton Dickinson, г. Sunnyvale, Калифорния, США). Использовали моноклональное антитело TS 2/9 против LFA-3, описанный Krensky и др. (см. J. Immunol. 132, с. 2180, 1984), и моноклональные антитела LB2 против ICAM-1 и L307 против В7, описанные Azuma и др. (см. J. Exp. Med. 175, с. 353, 1992).
Клоны Т-клеток активировали с использованием моноклональных антител против CD3 или CD2, поперечно сшитых на L-клетках, соэкспримирующих CD32 и ICAM-1, LFA-3 или В7 в присутствии или отсутствие интерлейкина-10. Выявилось, что пролиферация клонов SP-В21 и NP12 Т-клеток повышалась, когда клоны стимулировали моноклональными антителами против CD3, представляемыми трансфецированными CD32 L-клетками, которые коэкспримировали ICAM-1 и LFA-3. При коэкспрессии LFA-3 пролиферация клонов Т-клеток более сильно повысилась по сравнению с ICAM-1 или В7, в общем наблюдалось 2 - 4-кратное повышение пролиферации. При коэкспрессии ICAM-1 наблюдалось лишь незначительное повышение пролиферации, а В7 вообще не влияло на пролиферацию клонов Т-клеток.
Даже в присутствии ICAM-1, LFA-3 и В7 интерлейкин-10 тормозил пролиферирующую реакцию клонов Т-клеток после их активации моноклональными антителами против CD3, поперечно сшитыми на трансфецированных CD32 L-клетках. Однако торможение интерлейкином-10 пролиферации клонов Т-клеток, активированных клетками L CD32, экспримирующих LFA-3, оказалось менее выраженным.
Пролиферацию клонов SP-В21 и NP12 Т-клеток можно было также поощрять путем митогенной комбинации моноклональных антител против CD2, поперечно сшитых на клетках L CD32. Клоны Т-клеток в количестве 2 • 104 на углубление подали в круглодонные пластинки емкостью 200 мкл (фирмы Linbro, Flow Laboratories, г. MeLean, Вирджиния, США) и стимулировали вышеописанным образом с применением 0,5 мг/мл моноклональных антител X11-1 против CD2 и 0,5 мг/мл D66. Получение указанных антител описано Brottier (см. J. Immunol. 135, с. 1624, 1985).
Коэкспрессия ICAM-1 или LFA-3 не влияла на пролиферацию Т-клеток. Однако некоторое повышение пролиферации наблюдалось при использовании L-клеток, коэкспримирующих CD32 и В7. В случае использования L-клеток, экспримирующих CD32 и ICAM-1, LFA-3 или В7, вызываемая моноклональным антителом против CD2 пролиферация клонов Т-клеток тормозилась на 30-50% в присутствии интерлейкина-10. Интерлейкин-10 не влиял на экспрессию LFA-1, CD2 или CD28 клонами Т-клеток. В общем описанные результаты показали, что непосредственное тормозящее действие интерлейкина-10 на пролиферацию Т-клеток не являлось результатом изменений состимулирующих сигналов от ICAM-1, LFA-3 или В7.
Пример 3. Обратимость торможения интерлейкином-10 пролиферации Т-клеток при использовании интерлейкина-2, а не интерлейкина-4.
Для выяснения вопроса о том, можно ли путем добавления интерлейкина-2 или интерлейкина-4 реверсировать торможение пролиферации Т-клеток, вызываемое интерлейкином-10, клоны Т-клеток активировали моноклональными антителами против Cd3 или CD2, поперечно сшитыми на L-клетках, экспримирующих CD32 и ICAM-1, LFA-3 или В7 в присутствии интерлейкина-2 или интерлейкина-4. Интерлейкин-2 добавили в количестве 20 ед./мл, а интерлейкни-4 - в количестве 200 ед./мл. Очищенный человеческий r-интерлейкин-4 (со специфической активностью 2 • 107 ед./мг) приобрели у фирмы Schering- Plough Research (г. Bloomfield, Нью Джерси, США).
Выявилось, что путем добавления интерлейкина-2 при низкой концентрации можно полностью реверсировать тормозящее действие интерлейкина-10 на пролиферацию клонов SP-В21 и NP-12 Т-клеток. Однако добавление интерлейкина-4 в концентрации 200 ед. /мл не привело к реверсированию тормозящего действия интерлейкина-10 на пролиферацию Т-клеток. Культивация клонов Т-клеток в течение до 72 часов в присутствии интерлейкина-10 не привела к понижающей регуляции рецептора интерлейкина-2 экспресии α- или β-нити. Кроме того, активация клонов Т-клеток с использованием фитогемоагглютинина в присутствии интерлейкина-10 не влияет на индукцию рецептора интерлейкина-2 экспресии α- или β-нити. Использовали моноклональное антитело ВВ10 против рецептора α интерлейкина-2, описанное Herve и др. (см. Blood 75, с. 1017, 1990). Кроме того, использовали моноклональное антитело Tu 27 против рецептора β интерлейкина-2, описанное Takeshita (см. J. Exp. Med. 169, с. 1323, 1998). Вместе эти результаты подтверждают, что торможение пролиферации Т-клеток интерлейкином-10 можно было реверсировать с применением интерлейкина-2, а не интерлейкина-4, и, вероятно, торможение пролиферации Т-клеток представляло собой последствие торможения производства интерлейкина-2.
Пример 4. Торможение интерлейкином-10 производства интерлейкина-2, а не интерлейкина-4, интерлейкина-5, γ-интерферона и GM-CSF клонами человеческих Т-клеток.
Для выяснения вопроса о том, явилось ли непосредственное тормозящее действие интерлейкина-10 на пролиферацию клонов Т-клеток последствием торможения производства интерлейкина-2, клоны 837, SP-B21, 827, HY-06, CR 253, NP 12 и NP 44 Т-клеток активировали в течение 24 часов с применением моноклональных антител против CD3, поперечно сшитых на L-клетках, трансфецированых CD32 и ICAM-1, LFA-3 или В7 в присутствии или отсутствие интерлейкина-10, и производство интерлейкина-2, -4 и -5, γ-интерферона и GM-CSF определяли путем специфического относительно цитокина твердофазного иммуноферментного анализа, причем анализ проводили со следующей точностью: интерлейкин-2 10 пг/мл, интерлейкин-4 50 пг/мл, интерлейкин-5 50 пг/мл, γ-интерферон 300 пг/мл и GM-CSF 50 пг/мл.
По истечении 10 - 12 дней после вышеописанной стимуляции питающими клетками клоны Т-клеток собирали для оценки производства лимфокина. Клетки инкубировали при температуре 37oC в течение 24 часов во влажной атмосфере, содержащей 5% двуокиси водорода, после чего надосадочную культуру собирали, центрифугировали при 250 х g и получали аликвотные пробы, которые хранили до исследования при температуре -20oC.
В результате активации клонов Т-клеток началось производство интерлейкина-2, интерлейкина-4, интерлейкина-5, GM-CSF и γ-интерферона в соответствии с их соответствующим профилем производства цитокина в зависимости от субпопуляции Т-клеток-помощников. В основном наивысший уровень производства цитокина измеряли в том случае, если клоны Т-клеток активировались L-клетками, экспримирующими CD32 и LFA-3 или В7. Производство интерлейкина-2 установили прежде всего в надосадочной жидкости клонов Т-клеток, активированных антителом против CD3 на трансфецированных CD32-LFA-3 или CD32-B7 L-клетках. Интерлейкин-10 сильно тормозил производство интерлейкина-2 клонами Т-клеток. Производство интерлейкина-4 не изменялось при воздействии интерлейкина-10, а производство интерлейкина-5, GM-CSF и γ-интерферона тормозилось интерфероном-10 лишь в незначительной степени. Таким образом, можно констатировать, что интерлейкин-10 специфически тормозил производство интерлейкина-2 активированными клонами человеческих Т-клеток.
Пример 5. Торможение интерлейкином-10 производства интерлейкина-2 клонами человеческих Т-клеток после поликлональной активации.
Для определения того, способен ли интерлейкин-10 к непосредственному воздействию на клоны человеческих Т-клеток в смысле торможения производства лимфокинов, клоны 827, SP-В21 и NP 44 активировали тетрадеканоилфорбол-ацетатом (фирмы Calbiochem), моноклональным антителом против CD3 и тетрадеканоилфорбол-ацетатом, фитогемоагглютинином и тетрадеканоилфорбол-ацетатом, или митогенной комбинацией моноклональных антител против CD2 в отсутствие A-клеток. Клоны Т-клеток стимулировали в концентрации 1 • 106 клеток на мл в присутствии 100 нг/мл фитогемоагглютинина, 1 мкг/мл моноклонального антитела SPV-Т3b против CD3 и 1 нг/мл тетрадеканоилфорбол-ацетата.
Как видно из табл. 2, поликлональная активация клонов 827, SP-В21 и NP 44 Т-клеток приводила к высокому уровню производства лимфокина в соответствии с их профилем производства лимфокина. Интерлейкин-10 сильно тормозил производство интерлейкина-2 данными клонами при всех исследуемых способах активации, причем не изменилось производство интерлейкина-4, интерлейкина-5, γ-интерферона и GM-CSF. Интерлейкин-10 был способным к торможению интерлейкина-2 этими клонами Т-клеток после активации антителом против CD3 и тетрадеканоилфорбол-ацетатом и после активации Ca++ ионофором и тетрадеканоилфорбол-ацетатом, что показывает, что механизм торможения не затрагивает трансдукции сигналов между рецептором Т-клеток и CD3, и что данный механизм действует за активацией протеин-киназы C.
Пример 6. Торможение интерлейкином-10 производства интерлейкина-2 клонами человеческих Т-клеток на уровне мРНК.
Для определения степени торможения интерлейкином-10 производства интерлейкина-2 анализировали экспрессию мРНК интерлейкина-2, интерлейкина-4, интерлейкина-5 и γ-интерферона путем нозерн-блоттинг клонов NP-12, HY-06, 827/ SP-A3, 837 и SP-В21 Т-клеток после активации моноклональными антителами против CD3 и тетрадеканоилфорбол-ацетатом в отсутствие или присутствии интерлейкина-10. Общую РНК выделяли по методу, описанному Chirgwin и др. (см. Biochem. 18, с. 5294, 1979). Нозерн-анализ осуществляли описанным de Waal Malefyt образом (см. J. Immunol. 142, с. 3634, 1989).
Для проведения нозерн-анализа использовали следующие пробы: фрагмент Pst-1-Xba-I (285 п. о., nt 1 - 285) pCD-hIL-2, описанный Yokota и др. (см. Lymphokines 13, 1987); фрагмент Nhe-III-EcoRI (318 п.о., nt 106 - 424) pCD-hIL-4, описанный Yokota и др. (см. Proc. Natl. Acad. Sci. USA 83, стр. 5894, 1986); фрагмент Pst-I- Hinc-II (1100 п.о., nt 5 - 1106) pCD-hIFN-γ, описанный Yokota (см. в вышеуказанном источнике); и фрагмент Pst-I (1200 п. о. ) pAL, описанный de Waal Malefyt и др. (см. J. Immunol. 145, с. 2297, 1990).
Интерлейкин-10 сильно тормозил уровень экспрессии мРНК интерлейкина-2 в данных клонах, но не влиял на экспрессию интерлейкина-4 и интерлейкина-5 подобными Т-клетке-помощнику 0 и Т-клетке-помощнику-2 клонами, или экспрессию γ-интерферона подобными Т-клетке-помощнику 0 и Т-клетке-помощнику 1 клонами. Это указывает на то, что интерлейкин-10 специфически тормозит производство интерлейкина-2 клонами человеческих Т-клеток на уровне мРНК.
Пример 7. Торможение интерлейкином-10 производства интерлейкина-2 Т-клетками, изолированными из клеток периферийной крови.
Исследовали, способен ли интерлейкин-10 к торможению пролиферации и производства интерлейкина-2 Т-клетками, находящимися в покое. Т-клетки изолировали из периферийной крови, и их активировали с применением моноклональных антител против CD3 или CD2, поперечно сшитых или лишь на трансфецированных CD32 L-клетках или на трансфецированных CD32 L-клетках, коэкспримирующих ICAM-1, LFA-3 или В7. Целые PBMNC путем центрифугирования над градиентами по плотности Ficoll Hypaque (фирмы Sigma Diagnostics, г. St. Louis, Монтана, США) изолировали из полученного из здоровых доноров материла (см. A. Boyum, Scan. J. Clin. Lab. Invest. 21 (дополнение 97), с. 77, 1968).
Т-клетки очищали от PBMNC после адгезии к пластмассе, пропускания через наполненные нейлоновой шерстью колонки и негативного отбора путем магнитного истощения. При этом 100 • 106 PBMNC выращивали в течение 30 минут при температуре 37oC в чашке для культивирования размером 100 мм (фирмы Becton Dickinson, г. Lincoln Park, Нью Джерси, США) в среде Yssel, содержащей еще 1% человеческой сыворотки AB. Не прилипшие клетки удаляли и пропускали через наполненную нейлоновой шерстью (фирмы Robbins Scientific, г. Sunnyvale, Калифорния, США) колонку (см. Julius и др., Eur. J. Immunol. 3, стр. 645, 1973 г. ). Клетки последовательно в течение 30 минут при температуре 4oC инкубировали вместе с насыщающей концентрацией моноклональных антител против CD14 (Leu M3), CD16 (Leu 11a), CD19 (Leu 12) и CD56 (Leu 19), затем промывали и инкубировали вместе с магнитными шариками, снабженными оболочкой из иммуноглобулина G козы против мыши (марки Dynabeads М450 фирмы Dynal A.S., г. Осло, Норвегия), при соотношении шариков и клеток, составляющем 40 : 1.
Полученную смесь инкубировали при осторожном встряхивании при температуре 4oC в течение 30 минут, после чего снабженные розеткой клетки удаляли с помощью концентратора магнитных частиц по указаниям производителя. Популяции Т-клеток были 97-99% CD2+, CD3+. Моноклональные антитела против CD14 (Leu M3), CD16 (Leu 11a), CD19 (Leu 12) и CD56 (Leu 19), а также контрольные моноклональные антитела соответствующих изотипов приобрели у фирмы Becton Dickinson, г. Mountain View, Калифорния, США.
Т-клетки PBMNC в количестве 2 • 105 клеток на углубление вышеописанным способом стимулировали с использованием моноклональных антител против CD3 или CD2, поперечно сшитых на трансфецированных клетках LFcγRII. Надосадочную жидкость культур собирали по истечении 24 часов инкубации при температуре 37oC.
Выявилось, что активация находящихся в покое Т-клеток полностью зависела от присутствия антигена В7 на трансфецированных CD32 L-клетках. Ни моноклональными антителами против CD3, ни моноклональными антителами против CD2, поперечно сшитыми на трансфецированных CD32 L-клетках, вызывались пролиферация Т-клеток и производство лимфокина. Кроме того, данные клетки оставались неэффективными также после котрансфекции ICAM-1 или LFA-3 в данные клетки. Однако моноклональные антитела против CD2 или CD3, поперечно сшитые на трансфецированных CD32 L-клетках, которые были котрансфецированы В7, вызывали сильную пролиферацию Т-клеток и высокий уровень производства интерлейкина-2, γ-интерферона и GM-CSF. В данных условиях интерлейкин-10 значительно не тормозил пролиферацию находящихся в покое Т-клеток. При этом интерлейкин-10 тормозил производство интерлейкина-2 данными клетками, но не производство γ-интерферона или GM-CSF этими клетками.
Однако уровень производства интерлейкина-2 в присутствии интерлейкина-10 в третий день был еще достаточным для индуцирования максимальной пролиферации. Все вместе взятые результаты показывают, что вклад CD28 или CTLA-4 на Т-клетках путем взаимодействия с В7 на A-клетке был неотъемлемым для индукции пролиферации и производства лимфокина находящимися в покое Т-клетками, и что интерлейкин-10 и в этих условиях был еще способным к торможению производства интерлейкина-2.
Пример 8. Торможение интерлейкином-10 специфической относительно антигена пролиферации Т-клеток при использовании трансфецированных человеческими молекулами HLA L-клеток мыши в качестве антигенпредставляющих клеток.
Действие интерлейкина-10 на специфическую относительно антигена пролиферацию специфического относительно токсина столбняка клона 827 Т-клеток и специфического относительно М. Leprar 65 кД hsp pt [2-12] клона HY-06 Т-клеток исследовали при использовании в качестве антигенпредставляющих клеток L-клеток мыши, трансфецированных вышеописанным образом HLa-DR3 или HLA-CD3 и ICAM-1, LFA3 или В7. Полученные с помощью клеточного сортера с возбуждением флуоресценции профили экспрессии HLA-DR, ICAM-1, LFA3 и В7 трансфецированными L-клетками показывали, что интерлейкин-10 не влиял на конструктивную экспрессию MHC II-то класса на этих клетках.
Токсин столбняка получали от Dr. В. Bizzini (Institute Pasteur, г. Париж, Франция), и его использовали при конечной концентрации, составляющей 1 мкг/мл. Hsp pt [2-12] получали путем метода твердофазного синтеза пептида и проверяли путем аналитической обратнофазной ЖХВД и анализа аминокислот. Пептиды использовали при конечной концентрации 0,5 мкг/мл.
Стимуляцию клонов 827 и HY-06 Т-клеток, исследования по пролиферции и измерения цитокинов осуществляли вышеописанным методом. Выявилось, что интерлейкин-10 в зависимости от дозы тормозил специфическую относительно антигена пролиферацию клонов HY-06 и 827 при использовании в качестве антигенпредставляющих клеток L-клеток, трансфецированных HLA-DR3. При добавлении интерлейкина-10 в количестве 10 ед./мл было установлено тормозящее действие, и при добавлении интерлейкина-10 в количестве 100 ед./мл и 500 ед./мл было достигнуто 30 - 50%-ное торможение пролиферации.
Данные результаты подтверждались при применении трансфецированных HLA-DR и ICAM-1, LFA3 или В7 L-клеток в качестве антигенпредставляющих клеток. Пролиферирующая реакция клонов 827 и HY-06 повышалась при использовании L-клеток, котрансфецированных LFA3, и тормозящее действие интерлейкина-10 было менее выраженным. Торможение пролиферирующей реакции клонов 827 и HY-06 интерлейкином-10 полностью реверсировалось с применением нейтрализующего моноклонального антитела 19F1 против интерлейкина-10, что показало специфичность торможения. Эти результаты показали, что интерлейкин тормозил специфическую относительно антигена пролиферирующую реакцию клонов 827 и HY-06 при использовании трансфецированных HLA-DR L-клеток мыши в качестве антигенпредставляющих клеток.
Оказалось, что торможение специфической относительно антигена пролиферации интерлейкином-10 осуществляется на уровне Т-клеток. Для проверки клоны 827 и HY-06 Т-клеток активировали токсином столбняка и pt [2-12] в присутствии человеческого интерлейкина-10 или интерлейкина-10 мыши для исследования того, действует ли интерлейкин-10 на антигенпредставляющие L-клетки или непосредственно на клоны Т-клеток. Как указывалось выше, человеческий интерлейкин-10 действует на человеческие клетки и клетки мыши, а интерлейкин-10 мыши действует лишь на клетки мыши.
Выявилось, что интерлейкин-10 мыши не был способным к торможению специфической относительно антигена пролиферации клонов 827 и HY-06, когда в качестве антигенпредставляющих клеток использовали L-клетки, трансфецированные или лишь HLA-DR, или котрансфецированные ICAM-1, LFA3 или В7. Эти результаты показали, что интерлейкин непосредственно действует на пролиферацию клонов человеческих Т-клеток.
Для исследования вопроса о том, можно ли путем добавления экзогенного интерлейкина реверсировать тормозящее действие интерлейкина-10, клоны 827 и HY-06 Т-клеток активировали с использованием токсина столбняка или pt [2-12] L-клетками, экспримирующими HLA-DR или отдельно, или в комбинации с ICAM-1, LFA3 или В7, в присутствии или отсутствие интерлейкина-10 и интерлейкина-2. Тормозящее действие интерлейкина-10 на специфическую относительно антигена пролиферацию клонов 827 и HY-06 Т-клеток реверсировалось интерлейкином-2 в низкой концентрации.
Клон HY-06 Т-клетки активировали с использованием pt [2-12] L-клетками, экспримирующими HLA-DR3 или отдельно, или в комбинации с ICAM-1, LFA3 или В7, в присутствии или отсутствие интерлейкина-10, и производство интерлейкина-2 и γ-интерферона определяли в надкультурных жидкостях, которые собирали по истечении 24 часов. Интерлейкин-10 тормозил производство интерлейкина-2, а не γ-интерферона клоном HY-06 Т-клетки после специфической относительно антигена активации. Все описанные результаты показали, что интерлейкин-10 тормозил специфическую относительно антигена пролиферацию Т-клеток путем специфического торможения производства интерлейкина-2.
Воспалительное заболевание кишечника.
Развита мышиная модель воспалительного заболевания кишечника, которая содействует разъяснению этиологии или механизма воспалительного заболевания кишечника. Кроме того, данная модель представляет возможность исследования разных активных веществ, предназначенных для лечения воспалительного заболевания кишечника. Для развития данной модели ген интерлейкина-10 или удаляют из экспериментального животного, или разрушают действие или способность к экспрессии данного гена. При этом говорят, что ген интерлейкина-10 этого животного - "нокаут", или само животное называют "нокаут-животным". Нокаут можно осуществлять разными известными методами.
Например, можно получать трансгенное животное, в котором разрушали действие гена интерлейкина-10 (см. C. Goodnow, "Transgenic Animals", с. 1502 -1504, в Encyclopedia of Immunology, под ред. Roitt, издательство Academic Press, г. San Diego, 1992). Данный метод заключается в том, что очищенную ДНК микроинъецируют в пронуклеусы фертилизованных ооцитов. После этого ооциты хирургическим методом имплантируют в яйцеводы кормящих матерей. Альтернативно для изоляции гомозиготной линии мутированных животных можно применять известные методы генетического выведения.
Кроме того, известны методы инактивации определенных генов линии зародыша мыши. В таком случае путем гомологической рекомбинации вводят мутированный трансген взамен гена дикого типа. Клеточные линии первичного стебелка зародыша "можно выделять из мышиных бластоцист и выращивать in vitro, а позже их можно реимплантировать в другую бластоцисту для частичной колонизации соматической ткани и ткани линии зародыша получаемой мыши" (см. Goodnow, в указанном источнике, с. 1503).
ДНК вводят в культуру клеток первичного стебелка зародыша, и бластоцисты хирургическим методом имплантируют в кормящую мать. Получают гетерозиготное мутированное потомство, которое спаривают друг с другом с тем, чтобы в конечном итоге получить потомство, имеющее две мутированные аллели, то есть гомозиготных мутантов. Эти мутанты не имеют действующих аллелей соответствующего гена, и они позволяют осуществлять "генетическую диссекцию" для удаления определенных генов. Анализ потомства позволяет оценивать роль целевого гена в нокаут-мышах при возникновении соответствующих фенотипов.
Дальнейшие методы получения экспериментального животного с делецией определенного гена описаны McMahon и др. (см. "The Midbrain-Hindbrain Phenotype of Wnt-1-/Wnt-1- Mice Results from Stepwise Depletion of engrailed-Expressing Cells by 9,5 Days Postcoitum" в Cell 69, с. 581, 1992) и Travis (см. "Scoring a Technical Knockout in Mice" в Science 256, с. 1392, 1992). К другим пригодным методам относятся мутагенез и антисенсную технологию (см. C. Goodnow, в вышеуказанном источнике, 1992).
Пример 9. Мышиная модель воспалительного заболевания кишечника.
Разводили мышей, лишенных геном интерлейкина-10. Общая технология и процедура лишения мышей определенного гена описаны, например, Kuhn и др., Science, 254, стр. 707, 1991 г.; Capecchi, Science 244, с. 1288, 1989; Teratocarcinovas and embryonic stem cells: A Practical Approach, под ред. Robertson, издательство I.R.L. Press, г. Oxford, 1987, и Zijestra и др., Nature 336, с. 348, 1989. В нижеследующем мышей, лишенных геном интерлейкина-10, называют мышами IL-10Т, или нокаут-мышами.
Первая группа.
Четырех мышей умерщвляли для проведения исследования их костного мозга. Часть их костного мозга анализировали для определения их способности к производству милеоидных и эритроидных предшественников (см. табл. 3) и оценки производства исходных клеток (см. табл. 4). Остаточную долю костного мозга получали для длительных культур костного мозга для исследования способности микроклеток окружающей среды к поддержке обычного кроветворения. Тимус и селезенка содержали нормальное количество Т-клеток и В-клеток. Кратковременные предшественники и результаты исследований исходных клеток приведены ниже в табл. 3 и 4. Клетки контрольных животных и нокаут-мышей собирали отдельно.
Мыши IL-10T не проявляли никакого очевидного дефекта относительно производства миелоидных, эритроидных и исходных клеток. Все долговременные культуры образовали слой поддерживающей стромы, включая культуры мышей IL-10T. Эти культуры создали в двух стадиях: сперва клетки подали в культуру для создания комплексных слоев стромы, необходимых для поддерживания постоянного кроветворения. После этого в культуры повторно посеяли дополнительные клетки костного мозга доноров соответствующих видов для получения действительных предшественников, связывающихся с клетками стромы. Данную вторую стадию осуществляли при наличии мышей второй и третьей групп.
Вторая и третья группы.
Клетки костного мозга этих животных требовались для завершения долговременных опытов на культурах костного мозга. Для этой цели использовали их костной мозг; кроме того, осуществляли еще другие процедуры (см. табл. 5 - 9). Животные IL-10T страдали от анемии, но казалось, что они имели нормальное содержание предшественников костного мозга. Поэтому оценивали их анемию и осуществляли гистологическое исследование их органов.
Морфология эритроцитов.
Эритроциты всех контрольных животных казались нормальными, причем у мышей IL-10Т морфорлогия была разная. Животное IL-10Т N 1 имело микроцитарные клетки, а животные N 2 и 3 наряду с микроцитарными клетками имели также макроцитарные, полихромные клетки и некоторые содержащие ядро эритроциты. Мазки красной крови окрашивали новым метиленовым синим, и считывали клетки, показывающие окрашивание рибозов. Позитивное окрашивание имеет место в очень молодых эритроцитах (ретикулоцитах) и указывает на выпуск из кроветворных органов до зрелости. Это подразумевают под считыванием ретикулоцитов.
Гистология органов мышей IL-10Т.
При исследовании резанных сердца, легких, почки и тимуса данные органы рассматривали как нормальные. Печень также казалась нормальной за исключением отдельных фокусов мононуклеарных и нейтрофильных гранулоцитов. Селезенки были сильно анормальными. Имелись фолликулы, но зона красной пульпы была наполнена кроветворными клетками, в основном содержащими ядро эритроцитами и незрелыми клетками. Имелось лишь небольшое количество зрелых эритроцитов, или вообще не имелось зрелых эритроцитов, и отсутствовало накопление железа на макрофагах.
В нижеследующем приведены результаты исследований образования колоний. Исследовали клетки селезенки, а также клетки костного мозга. Для стимуляции образующих колонии клеток вместо интерлейкина-6 лиганд комплекта c использовали наряду с интерлейкином-3. При использовании комбинации интерлейкина-3 и лиганда комплекта c достигается более эффективная стимуляция предшественников эритроцитов, что подтверждается при сравнении количества эритроидных кроветворных единиц, полученных в первом исследовании (см. выше), с количеством эритроидных кроветворных единиц, полученных в нижеследующих исследованиях.
Исследование фекалий.
При исследовании фекалий мышей IL-10Т не было обнаружено яиц, указывающих на заражение паразитами. Не было обнаружено также зрелых паразитов в верхнем или нижнем кишечнике.
Животные страдали от легкой до выраженной анемии, которую нельзя было объяснить недостаточной способностью к образованию эритроцитов. Мыши IL-10Т проявляли признаки попытки компенсации анемии. Во-первых, они производили в селезенке большее чем обычное количество предшественников эритроцитов. В мышах обычно селезенка стремится к компенсации нехватки эритроцитов. Мышиные селезенки имели примерно вдвое больший размер, чем у нормальных животных, и они проявляли повышенную активность при попытке создания эритроцитов.
У некоторых мышей попытки компенсации были успешны. Содержание эритроцитов в их крови находилось почти на нормальном уровне, и не выпускали в кровообращение многие незрелые клетки, так как у них количество ретикулоцитов было сравнительно нормальным. Однако другие мыши выпускали в кровообращение клетки перед достижением зрелости из-за наличия большого количества ретикулоцитов (17%). У них также наблюдались содержащие ядро эритроциты в кровообращении.
У этих мышей имелось также повышенное содержание тромбоциотов, и, кроме того, в их селезенке заметили повышенный уровень мегакариоцитов. Это указало на то, что, может быть, у них было кровотечение. Потеря крови может быть причиной хронической анемии и истощения запасов железа (нехватка железа была видна и в селезенке, и в костном мозге). При аутопсии выявилось, что не было внутреннего кровотечения. Однако у большинства мышей IL-10Т имелась кровь в фекалиях и наблюдалось выпадение прямой кишки. Мышей тщательно исследовали, и получали отрицательные результаты относительно наличия выемчатокрылой моли, ленточного червя или заражения другими паразитами. Имелась прямая взаимосвязь между наличием крови в их фекалиях и степенью анемии.
Кроме анемии и проблемы кровотечения, в крови мышей IL-10Т имелось больше нейтрофильных гранулоцитов, чем лимфоцитов. Это противоположно нормальному для мышей состоянию (см. табл. 6). Это наблюдение совпадает с чрезвычайно сильным повышением количества миелоидных предшественников, которое установили при исследовании образования колоний в селезенке (см. табл. 9). Таким образом, мыши страдали от синдрома "анемия вследствие хронического воспаления".
При аутопсии исследовали пробы тканей из мышей IL-10T и контрольных животных. Все пробы контрольных животных оказались нормальными. Что касается мышей IL-10Т, то тимус и спинальная ткань также оказались нормальными. Селезенка показала незначительное до выраженного повышение количества эритробластов, миелобластов и мегакариоцитов. Пулы эритроцитов имели небольшой размер, или они вообще отсутствовали. В результате окрашивания берлинской лазурью подтвердилось истощение запаса железа, и не было признаков, указывающих на внемедуллярное кроветворение.
Истощение запасов железа обусловлено потерей крови и приводит к анормальному эритропоэзу. При исследовании выяснилось, что размер селезенок составил от нормального размера до 1,5 - 3-кратного размера нормальной селезенки. Мезентериальные лимфатические узлы были очень большими по сравнению с нормальным размером, и они почти имели размер нормальной селезенки. Фолликулы В- и Т-клеток имели подобным образом увеличенный размер, как это и соответствует реакции на воспаление.
Слизистая оболочка и подслизистая оболочка тонкой кишки имели хорошую форму. На некоторых участках количество полиморфонуклеированных лейкоцитов и мононуклеарных клеток было слегка повышено. При исследовании толстой и прямой кишек обнаружили значительное воспаление прямой кишки, простирающееся проксимально и на нижнем участке ободочной кишки. Имелось значительное количество отеков и инфильтрирующихся клеток. Преобладали полиморфонуклеированные лейкоциты, но имелись также эозинофилы, лимфоциты, плазматические клетки и эпителевидные клетки (клетки, напоминающие эпителий). Воспаление охватило слизистую оболочку, крипту и подслизистую оболочку. Местами инфильтраты обнаружили в мышечном слое, в частности в области внутреннего сфинктера. Во многих зонах отсутствовал эпителий. Во многих местах имелись повреждения, где был виден волокнистый материал с агрегацией эритроцитов и полиморфонуклеированными лейкоцитами. Некоторые кровеносные сосуды были переполнены эритроцитами. Комки эпителевидных клеток указали на раннюю стадию образования гранулемы, но не было видно правильно оформленных гранулом. Также не имелось признаков паразитов, яиц или внутриклеточных бактерий, которые могли бы вызвать хроническое воспаление. Многочисленные повреждения и кровотечение совпадали с позитивным результатом проверки наличия крови в стуле. Целая картина соответствовала воспалительному заболеванию кишечника со вторичной анемией и истощением организма.
Пример 10. Реакция нокаут-мышей на лечение с использованием экзогенного интерлейкина-10.
Исследовались четыре мыши, лишенные гена интерлейкина-10 (нокаут-мыши) и три нормальные контрольные мыши. Контрольные мыши находились в нормальном состоянии. У всех контрольных мышей при исследовании проб стула относительно наличия крови получили отрицательный результат. Прямая кишка была здоровой. Некоторые из нокаут-мышей имели заметно меньший рост, чем контрольные животные, и по внешнему виду было заметно, что они не были здоровыми. Шерсть у них ерошилась, и у них было меньше энергии по сравнению с нормальными контрольными животными. Одна из четырех нокаут-мышей имела горб, и у нее походка была ненормальная. У всех нокаут-мышей прямая кишка опухла, и ткань прямой кишки была эритематической, или имелось заметное выпадение прямой кишки.
У двух из нокаут-мышей получили позитивный результат при двухразовом исследовании стула относительно наличия крови, у третей мыши раз получили негативный результат, а другой раз - неоднозначный результат. У всех четырех нокаут-мышей взяли ректальные мазки, причем у трех мышей обнаружили гнойные эксудаты с большим количеством нейтрофильных гранулоцитов. В отдельных мазках имелись также эритроциты, если из прямой кишки животного текла кровь во время взятия мазка. Так как нокаут-мыши показались истощенными со временем, также контролировали и записали вес и нокаут-мышей, и контрольных мышей.
Трем из нокаут-мышей в течение двух недель ежедневно давали инъекцию, содержащую 35 мкг интерлейкина-10. Эти мыши раньше постоянно страдали гнойными эксудатами, причем у двух из этих трех мышей наблюдали признаки кровотечения и одна из них имела горб и анормальныую походку. Одной из нокаут-мышей, показывающей негативный результат относительно кровотечения и гнойного эксудата, и трем нормальным контрольным мышам в течение двух недель ежедневно путем инъекции давали трометаминсодержащий буфер (TRIS-буфер). При этом контролировали общее состояние, внешний вид, ректальный эксудат, наличие крови в стуле и вес.
По истечении второй недели, когда путем инъекции давали интерлейкин-10, у всех трех нокаут-мышей повысилась энергия, шерсть разгладилась, и осанка и походка нормализовались. У всех животных также уменьшилось опухание прямого кишка, хотя еще имелись признаки воспаления, у всех результат исследования относительно наличия крови в стуле был негативным, и не имелось следов эритроцитов в их ректальных мазках. Однако в ректальных мазках все же наблюдали нейтрофильные гранулоциты. В мазке одного животного имелось больше эпителиальных и лимфатических клеток, чем нейтрофильных гранулоцитов. Вес одного животного, который составил 16 г, остался неизмененным, вес второго животного повысился с 16 до 17,8 г, а вес третьего животного - с 11,4 до 14 г.
У нокаут-мыши, которой дали TRIS-буфер, после истечения двух недель еще имелся негативный результат при исследовании стула относительно наличия крови. Наблюдался значительный эксудат, содержащий большое количество нейтрофильных гранулоцитов. Прямая кишка еще была опухшей и показала тенденцию к выпадению. Животное имело горб и ходило ненормальной походкой. Кроме того, оно теряло вес, то есть последний снизился с 16,6 до 14 г. Нормальные контрольные животные, которым также инъецировали TRIS-буфер, сохранили свое здоровье, включая нормальное состояние прямой кишки. Результат исследования проб их стула относительно наличия крови неизменно был негативным, и не было обнаружено ректальных эксудатов. Вес этих мышей повысился в пределах с 17,1 до 19 г - 17,4 до 18,7 г. Даже после нескольких недель вес животных продолжал повышаться.
Пример 11. Улучшение признаков или симптомов, приписываемых воспалительному заболеванию кишечника.
Человеку-пациенту, больному воспалительным заболеванием кишечника, согласно изобретению можно дать интерлейкин-10 нижеописанным методом. Обычно такой пациент проявляет такие симптомы, как например понос, боль в животе, повышенная температура, мелена, кровавый стул и снижение веса, и признаки, как например глоссит, афтозная язва, трещины заднего прохода, перианальная фистула, анемия, малабсорбция, и недостаток железа. В начале пациенту дают 5 мкг интерлейкина-10 на 1 кг веса тела в день. При весе пациента, составляющем 70 кг, начальная доза составляет 350 мкг интерлейкина-10 в сутки. Данную дозу дают одноразово внутривенно. Дозу повышают примерно на 50 - 150 мкг в день в зависимости от реакции пациента. Оптимальной дозы, составляющей примерно 700 мкг в сутки (10 мкг на 1 кг веса тела в сутки), достигают после нескольких дней.
Перед первой дачей, во время дачи и ежедневно в течение нескольких дней после прекращения дачи пациента подвергают перманентному клиническому контролю, включая проверки лабораторных параметров. К последним относятся счет кровяных телец, причем особое внимание уделяют общему счету лейкоцитов и его дифференциалу. Особый интерес представляет также вопрос о том, остается ли количество лейкоцитов нормальным или в основном неизменным по сравнению с количеством перед началом дачи. Что касается дифференциала лейкоцитов, то внимательно следят за тем, возникают ли незрелые формы в периферийной крови, и остается ли нормальное соотношение разных типов лейкоцитов неизменным или нет. При этом, в частности, представляет интерес соотношение лимфоцитов и моноцитов в периферийной крови.
В качестве дальнейших параметров можно контролировать скорость седиментации эритроцитов, химические профили, содержание интерлейкина-6, TNF и γ-интерферона в крови. И наконец, путем регулярного, например ежедневного, исследования стула пациента относительно наличия крови и гнойного эксудата можно оценивать реакцию пациента на терапию.
В результате терапии улучшается один или несколько симптомов или признаков воспаления кишечника.
Торможение аллергических реакций замедленного типа.
Пример 12. Сниженное действие на мышей.
Мыши BALB/c предварительно обрабатывали моноклональным антителом против CD4, и по истечении четырех недель их заражают Leishmania major. BALB/c представляет собой инбредную линию мышей, которую можно приобрести в торговле у фирмы Simonsen Laboratories (г. Gilroy, Калифорния, США). Возраст используемых мышей составил 8 - 12 недель. L. major (название согласно номенклатуры линий ВОЗ - WHOM/-/173) выращивают в промастиготной форме в среде М199 (фирмы GIBCO, г. Grand Island, Нью-Йорк, США), содержащей 30% ТЭС (фирмы J.R. Scientific, г. Woodland, Калифорния, США), 2 ммоль L-глутамина и по 100 ед./мл пенициллина и стрептомицина. Промастиготы собирали из стационарных культур и промывали фосфатсодержащим солевым раствором. Мыши заражали 1,5 • 107 жизнеспособных промастиготов, которых инъецировали подкожно в левую заднюю ногу. Антиген против L. major получали в четырех циклах замораживания и размораживания паразитов с последующим центрифугированием. Антиген добавляли в углубления в количестве 2 • 106 организмов/мл.
Для осуществления опытов in vitro в качестве антител использовали нейтрализующее моноклональное антитело против мышиного интерлейкина-4 (N НВ188 в Американской коллекции тканевых культур), нейтрализующее моноклональное антитело против мышиного интерлейкина-10, полученное по методу получения антитела против интерлейкина-4, описанному Chatelain и др. (см. J. Immunol 148, с. 1182, 1992) и антитело против мышиного CD4 (N ТIВ207 в Американской коллекции тканевых культур). Все антитела очищали от надкультурной ткани с помощью ионообменной хроматографии и гель-фильтрации, и полученные препараты антител согласно анализа агглютинации по Лимулус содержат менее 3 единиц эндотоксина на мг протеина.
Для очистки клеток использовали следующие очищенные моноклональные антитела: биотинилированные RM-4-5 и RM-4-4 против мышиного CD4 и AMS-32.1, против мышиного Mac-1 (N ТIВ128), RA3-6В2 и антитело против мышиного В220 (см. Coffman, Immunological Reviews 69, с. 5, 1982). Рекомбинантные мышиные интерлейкин-4 и интерлейкин-10 экспримировали в Е. coli и очищали вышеописанным способом.
Из мышей BALB/c, в том числе мышей BALB/c, предварительно обработанные антителом против CD4, за 4-6 недель после заражения удаляли подколенные лимфатические узлы, дренирующие место заражения L. major, которые перерабатывали с получением отдельных клеточных суспензий в фосфатсодержащем солевом буфере, содержащем 0,25% альбумина сыворотки крупного рогатого скота. Для очистки Т-клеток CD4+ все приемы осуществляли при температуре 4oC. Примерно 4 • 108 клеток лимфатических узлов в течение 30 минут маркировали с использованием 2 мл раствора фосфатсодержащего солевого буфера и альбумина сыворотки крупного рогатого скота, дополнительно содержащего по 12 мкг/мл антител против В220, Mac-1, CD8 и класса II 1-Ad. Маркированную антителами клеточную суспензию затем промывали в смеси фосфатсодержащего солевого буфера и альбумина сыворотки крупного рогатого скота, после чего инкубировали в течение 30 минут на вращающемся колесе вместе с Dynabeads овцы, снабженными оболочкой против крысы (Dynabeads можно приобрести у фирмы Robbins Scientific, г. Mountain View, Калифорния, США), используемыми в количестве 3 шариков на клетку. Негативные клетки выделяли путем магнитной сепарации.
Т-клетки CD4+ далее обогащали из получаемой клеточной суспензии, которая примерно на 85% состояла из CD4+, путем позитивной селекции с использованием клеточного сортера с магнитной активацией (марки MACS, фирма Miltenyi, г. Dusseldorf, Германия). Для этого клетки маркировали в течение 15 минут с использованием 12 мкг/мл биотинилированного антитела против CD4 в смеси фосфатсодержащего солевого буфера и альбумина сыворотки крупного рогатого скота, взятой в количестве примерно 50 мл на 108 клеток. Клетки промывали в фосфатсодержащем солевом буфере и инкубировали вместе с микрошариками Streptavidin Microbeads (фирмы Becton Dickinson, г. Sunnyvale, Калифорния, США) в количестве примерно 50 мкл на 108 клеток. По истечении 15 минут добавляли Streptavidin-РЕ (фирмы Becton Dickinson) с конечной концентрацией 1/50. Далее инкубировали в течение 5 минут, после чего клеточную суспензию промывали и по указаниям производителя пропускали через магнитную колонку (марки MACS, фирма Miltenyi, г. Dusseldorf, Германия). Оставшиеся на намагниченной колонке клетки элюировали путем удаления колонки от магнита и тщательной промывки смесью фосфатсодержащего солевого буфера и альбумина сыворотки крупного рогатого скота. Полученная клеточная популяция более чем на 96% содержала CD4+.
Лишенные Т-клеток спленоциты получали из селезенок нормальных доноров, из которых выделяли клетки, окрашивающие антитела против CD4 и CD8, путем негативной селекции с использованием шариков Dynabeads овцы против крысы, как выше описано для клеток лимфатических узлов. С помощью клеточного сортера с возбуждением флуоресценции установили, что полученные препараты были на 99% негативными относительно CD4 и CD8.
Неразделенные клетки лимфатических узлов или очищенные Т-клетки CD4+ в вышеуказанных количествах в качестве двойных культур подали в круглодонные, снабженные 96 углублениями пластинки емкостью 250 мкл в среду cRPMI, содержащей 5% ТЭС, в случае очищенных Т-клеток CD4+ вместе с 5 • 105 нормальных спленоцитов, лишенных клеток, в присутствии или отсутствие антигена против L. major. Под cRPMI подразумевается полная культурная среда, содержащая RPMI-1640 (фирмы J. R. Н. Biosciences, г. Lenexa, Кансас, США), 10% ТЭС, 2 ммоль L-глутамина, 0,05 ммоль 2-ME и по 100 ед./мл пенициллина и стрептомицина.
Антигенпредставляющие клеток пульсировали в течение 4 часов или в присутствии антигена L. major в количестве 2 • 106 организмов/мл, или лишь в среде. Затем лишенные Т-клеток спленоциты перед выращиванием обрабатывали γ-радиацией 1000 rad. В некоторых случаях в углубления подают 50 мкг/мл рекомбинантного интерлейкина-10, 100 нг/мл рекомбинантного интерлейкина-4 и/или нейтрализующие моноклональные антитела против этих цитокинов. Надосадочную жидкость собирали по истечении 72 часов и подвергали анализу для обнаружения синтеза цитокинов.
Содержание цитокинов в надосадочной жидкости определяли путем твердофазного иммуноферментного анализа методом, описанным выше для γ-интерферона (см. Chatelain и др., в указанном источнике, 1992), для интерлейкина-4 (см. Chatelain и др., в указанном источнике, 1992) и для интерлейкина-10 и интерлейкина-3. Пробы подвергали количественному анализу путем сравнения со стандартными кривыми, полученными при анализе очищенного рекомбинантного или природного цитокина.
Предварительная обработка моноклональным антителом против CD4 сначала уменьшила количество имеющихся в распоряжении Т-клеток животного, но в конечном итоге способствовала сопротивляемости животного нападению паразитов L. major. Это явление часто наблюдается, хотя оно является противоинтуитивным, и его механизм неясен. Имелась сильная корреляция между DTH и сопротивляемостью животного против заражения паразитами.
За 4 недели после заражения животных подвергали воздействию замороженным-размороженным антигеном Leishmania, который вводили в контралатеральную ногу. В течение последующих 48 часов набухание ноги контролировали с помощью мерной вилки. Каждому животному внутрибрюшинно дали пять доз цитокинов, причем одной группе дали пять доз интерлейкина-4, другой - интерлейкина-10, а третьей группе - комбинации интерлейкина-4 и интерлейкина-10. Все пять доз давали с интервалом 12 часов, причем первую дозу дали за 12 часов до обработки антителом.
В табл. 11 показан размер ноги в течение 24 часов после инъекции антигена Leishnania. Реакцию контрольных животных, которым инъецировали лишь фосфатсодержащий солевой буфер, сравнивают с реакцией животных, которым давали интерлейкин-4, интерлейкин-10 или их комбинацию в указанных дозах. Цитокины дали внутрибрюшинно каждые 12 часов в течение 48 часов, причем первую дозу дали за 12 часов перед обработкой антигеном. Каждая группа охватила 5 животных.
Полученные данные показывают, что мыши, которым давали лишь интерлейкин-4, страдали примерно в той же степени, как мыши, которым давали фосфатсодержащий солевой буфер. Набухание у тех животных, которым дали интерлейкин-10, ниже, чем у контрольных животных.
Наименьшее набухание показали мыши, которым дали комбинацию интерлейкина-4 и интерлейкина-10, в частности та группа, которую обрабатывали количеством по 20 мкг каждого цитокина.
В табл. 12 приведены результаты другого независимого опыта. Опыт осуществляли по вышеописанному методу с той разницей, что ноги измеряли по истечении 48 часов после инъекции антигена Leishmania.
Каждая группа состояла из пяти животных. Тормозящее действие интерлейкина-4 и интерлейкина-10 блокировали путем дачи 2 мг моноклонального антитела против интерлейкина-4 и 5 мг моноклонального антитела против интерлейкина-10. Антитела против интерлейкина-4 и интерлейкина-10, используемые в качестве положительного контроля, давали внутрибрюшинно за 12 часов до первой дачи цитокинов. 5 мг изотипного контрольного моноклонального антитела, добавленного в качестве отрицательного контроля, не влияло на торможение. Изотипное контрольное моноклональное антитело получали описанным Chatelain и др. образом (см. выше, 1992).
Антитела против интерлейкина-4 и интерлейкина-10 добавили с тем, чтобы показать, что конкуренция относительно интерлейкина-4 и интерлейкина-10 снизила действие цитокинов. Кроме того, эти антитела представляли собой дальнейший контроль полученных рекомбинантым образом цитокинов.
Данные указывают на то, что комбинация интерлейкина-4 и интерлейкина-10 имеет большее действие при торможении аллергической реакции замедленного типа, чем один из обоих цитокинов отдельно. Действие интерлейкина-10 больше, чем действие интерлейкина-4, но меньше, чем действие комбинации интерлейкина-4 и интерлейкина-10. Дача комбинации цитокинов вместе с моноклональными антителами против каждого цитокина привела к погашению действия цитокинов.
Приведенные в табл. 13 данные получали путем дачи цитокинов каждые 12 часов до 24 часов после дачи антигена, причем дачу начали за 12 часов до дачи антигена. Клетки лимфатических узлов, дренирующих место инъекции антигена Leishmania, взяли по истечении 5 дней после дачи животным цитокинов и антигена. В первой колонке табл. 13 указана доза, которую дали тому животному, у которого взяли клетки лимфатических узлов. In vitro лимфатические узлы стимулировани с использованием замороженного-размороженного антигена L. major. 72 часа позже определяли содержание γ-интерферона в надосадочной жидкости. Приведены данные, полученные у трех животных.
Данные показывают, что животные, которым дали цитокин, производили меньше γ-интерферона, чем контрольные животные, которым дали фосфатсодержащий солевой буфер.
Кроме того, в животных, которым дали комбинацию интерлейкина-4 и интерлейкина-10, имелось значительно меньше γ-интерферона чем в животных, которым дали лишь один цитокин.
Для получения данных по табл. 14 Т-клетки CD4+ выделяли из предварительно обработанных антителом против CD4 мышей, за 4 недели до этого зараженных L. major. Клетки в количестве 3,5 • 105 на углубление стимулировали in vitro с использованием замороженного-размороженного антигена L. major вместе с лишенными Т-клеток спленоцитами в количестве 5 • 105 на углубление и источником антигенпредставляющих клеток. Содержание γ-интерферона определяли по истечении 72 часов путем твердофазного иммуноферментного анализа. В первой колонке табл. 14 приведены вещества, добавленные к среде, в которой выращивали Т-клетки-помощники 1.
По приведенным в табл. 14 данным видно, что и интерлейкин-4, и интерлейкин-10 при отдельном применении значительно снижают содержание γ-интерферона, производимого Т-клетками-помощниками 1, по сравнению с контролем, в котором использовали фосфатсодержащий солевой буфер. Кроме того, добавление к среде комбинации интерлейкина-4 и интерлейкина-10 привело к снижению содержания γ-интерферона, на ~50% превышающему снижение содержания γ-интерферона при добавлении лишь одного цитокина.
Вышеприведенные данные показывают, что интерлейкин-10 значительно уменьшил аллергическую реакцию замедленного типа, например набухание и производство γ-интерферона лимфатическими узлами, в частности Т-клетками-помощниками 1, по сравнению с контролем. Кроме того, комбинацией интерлейнина-4 и интерлейкина-10 достигают большего эффекта, чем при отдельном применении или интерлейкина-4, или интерлейкина-10. Путем дачи каждого цитокина в количестве по 20 мкг получали больший эффект, чем путем дачи более чем двойной дозы или интерлейкина-4, или интерлейкина-10. Это означает, что по 20 мкг и интерлейкина-4, и интерлейкина-10 при использовании в комбинации имеют более сильно выраженный положительный эффект, чем 50 мкг или интерлейкина-4, или интерлейкина-10 в качестве отдельного активного вещества.
Пример 13. Терапия пациента, больного сахарным диабетом I-го типа.
Для терапии выбирают пациента, больного сахарным диабетом I-го типа, то есть зависимым от инсулина сахарным диабетом, причем для диагноза применены критерии, установленные организацией National Diabetes Data Group (США) или Всемирной организацией здоровья. Вначале пациенту давали по 20 мкг и интерлейкина-4, и интерлейкина-10 на кг веса тела в сутки. При весе пациента, составляющем 70 кг, начальная доза составляет по 1400 мкг каждого цитокина в сутки. Данную дозу дают в качестве внутривенной инъекции. Дозу повышают примерно на 250 - 1000 мкг в день в зависимости от реакции пациента. Оптимальной дозы, составляющей примерно 7000 мкг в сутки (100 мкг на кг веса тела в сутки), достигают после нескольких дней.
Перед первой дачей, во время дачи и ежедневно в течение нескольких дней после прекращения дачи пациента подвергают перманентному клиническому контролю, включая проверки лабораторных параметров. К последним относятся определение содержания глюкозы в крови и счет кровяных телец, причем особое внимание уделяют общему счету лейкоцитов и его дифференциалу. В рамках терапии диабета известен метод определения содержания глюкозы в крови. Дополнительный интерес представляет также вопрос о том, остается ли количество лейкоцитов нормальным или в основном неизменным по сравнению с количеством перед началом дачи. Что касается дифференциала лейкоцитов, то внимательно следят за тем, возникают ли незрелые формы в периферийной крови, и остается ли нормальное соотношение разных типов лейкоцитов неизменным или нет. При этом в частности представляет собой интерес соотношение лимфоцитов и моноцитов в периферийной крови.
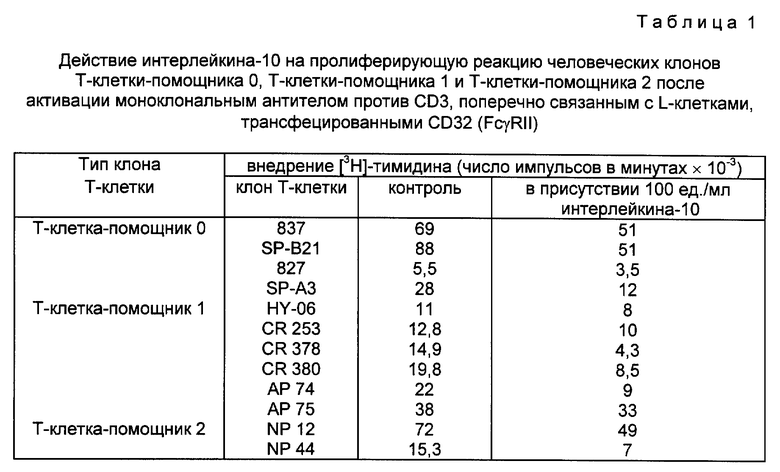
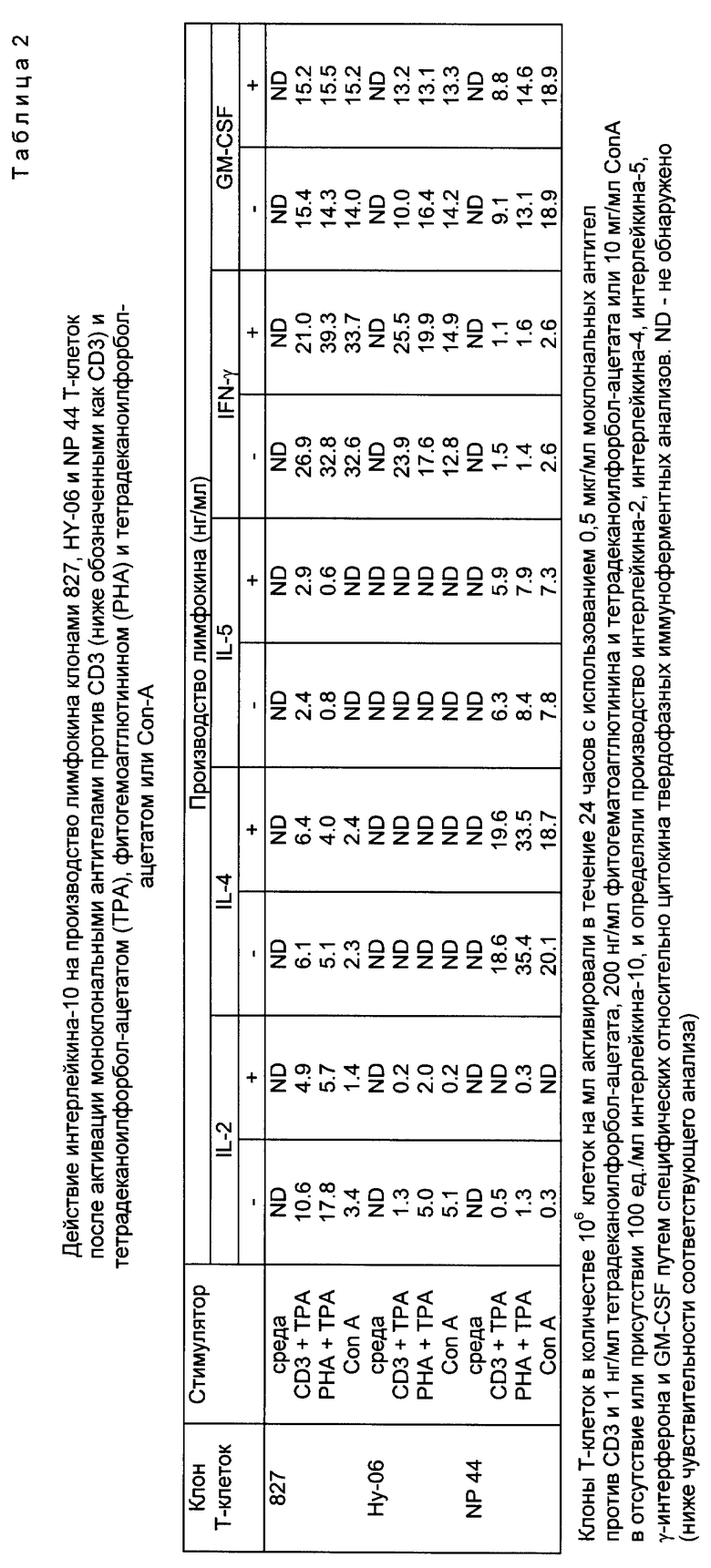

Изобретение относится к области медицины. Объектом изобретения является фармацевтическая композиция, предназначенная для торможения зависимой от интерлейкина-2 пролиферации опухолевых клеток, увеличения содержания γ-интерферона, лечения воспалительных заболеваний кишечника, потенцирования торможения производства цитокина и ограничения или торможения аллергической реакции замедленного типа, содержащая по меньшей мере один фармацевтически приемлемый носитель и активное вещество, выбранное из группы, включающей интерлейкин-4, интерлейкин-10, комбинацию интерлейкина-4 и интерлейкина-10 и антитела против интерлейкина-4 и интерлейкина-10, в эффективном количестве. 5 з.п.ф-лы, 14 табл.
Приоритет по признакам:
20.08.92 - по п. 1, 2 и 6 - в части композиции, касающейся интерлейкина-10 для лечения воспалительных заболеваний кишечника; по п. 1 - в части композиции, содержащей комбинацию интерлейкина-4 и интерлейкина-10 для потенцирования торможения производства цитокина и ограничения или торможения аллергической реакции замедленного типа и интерлейкин-10 для тех же целей, а также для торможения зависимой от интерлейкина-2 пролиферации опухолевых клеток, композиции, содержащей антитела и предназначенной для увеличения содержания γ-интерферона; по п. 2 - в части, касающейся торможения зависимой от интерлейкина-2 пролиферации опухолевых клеток; по п. 6 - в части композиции, содержащей интерлейкин-4;
21.08.92 - по пп. 3, 4 и 5.
| PCT, патент WO 91/00349, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1998-10-27—Публикация
1993-08-18—Подача