Область техники, к которой относится изобретение
В настоящем изобретении представлены специфические белки-агонисты рецептора CD40, содержащие три растворимых домена CD40L и один Fc-фрагмент, молекулы нуклеиновой кислоты, кодирующие белки-агонисты рецептора CD40, и их применение. Белки-агонисты рецептора CD40 практически не подвержены агрегации и пригодны для терапевтического, диагностического и/или исследовательского применения.
Уровень техники
Известно, что для эффективного связывания и активации рецептора требуется тримеризация цитокинов надсемейства TNF (TNFSF). Однако тримерные комплексы цитокинов надсемейства TNF трудно получить из рекомбинантных мономерных единиц.
В WO 01/49866 и WO 02/09055 раскрыты рекомбинантные слитые белки, содержащие цитокин TNF и мультимеризационный компонент, в частности, белок из семейства белков C1q или коллектин. Однако недостатком этих слитых белков является то, что тримеризационный домен обычно имеет большую молекулярную массу и/или что тримеризация не очень эффективна.
В Schneider et al. (J Exp Med 187 (1989), 1205-1213) описано, что тримеры цитокинов TNF стабилизируются расположенными с N-конца стабилизирующими мотивами. У CD95L стабилизация тримера рецептор-связывающего домена предположительно вызывается N-концевыми аминокислотными участками, которые располагаются возле цитоплазматической мембраны.
В Shiraishi et al. (Biochem Biophys Res Commun 322 (2004), 197-202) описано, что рецептор-связывающий домен CD95L может стабилизироваться с помощью N-концевых искусственных α-спиральных мотивов типа закрученной спирали (лейциновой молнии). Однако оказалось, что трудно предсказать ориентацию полипептидных цепей относительно друг друга, например, это параллельная или антипараллельная ориентация. К тому же трудно определить оптимальное количество гептадных повторов в мотиве молнии типа закрученной спирали. Кроме того, структуры типа закрученной спирали имеют тенденцию к образованию макромолекулярных агрегатов при изменении рН и/или ионной силы.
В WO 01/25277 описаны одноцепочечные олигомерные полипептиды, которые связываются с внеклеточным лиганд-связывающим доменом клеточного рецептора, причем такой полипептид содержит по меньшей мере три сайта связывания с рецептором, из которых по крайней мере один способен связываться с лиганд-связывающим доменом клеточного рецептора и по меньшей мере один не способен эффективно связываться с лиганд-связывающим доменом клеточного рецептора, поэтому одноцепочечные олигомерные полипептиды способны связываться с рецептором, но неспособны его активировать. К примеру, мономеры получают из цитокиновых лигандов семейства TNF, в частности, из TNF-α.
В WO 2005/103077 описаны одноцепочечные слитые полипептиды, содержащие по меньшей мере три мономера лиганда из семейства TNF и по меньшей мере два пептидных линкера, которые связывают мономеры лиганда из семейства TNF друг с другом. Однако недавние эксперименты показали, что эти одноцепочечные слитые полипептиды проявляют нежелательную агрегацию.
В WO 2010/010051 описаны одноцепочечные слитые полипептиды, содержащие три растворимых домена цитокинов семейства TNF и по меньшей мере два пептидных линкера. Описанные слитые полипептиды практически не подвержены агрегации.
Недавние исследования показали, что F(ab′)2-фрагменты mAb против CD40, которые в настоящее время изучаются в клинике, не являются агонистами без дальнейшего сшивания (см. Vonderheide R.H. and M.J. Glennie (2013). "Agonistic CD40 antibodies and cancer therapy". Clin Cancer Res. 19(5): 1035-1043.
В этой области существует потребность в новых агонистах рецептора CD40, проявляющих высокую биологическую активность независимо от перекрестной сшивки Fc-γ-R in vivo, высокую стабильность и позволяющих их эффективное получение рекомбинантными методами.
Сущность изобретения
Настоящим изобретением предусмотрены специфические белки-агонисты рецептора CD40, которые имитируют взаимодействие CD40:CD40L in vivo, проявляют слабое протеолитическое расщепление и продленный период полужизни in vivo.
Белки-агонисты рецептора CD40 по настоящему изобретению обычно включают: (i) первый растворимый домен цитокина CD40L; (ii) первый пептидный линкер; (iii) второй растворимый домен CD40L; (iv) второй пептидный линкер; (v) третий растворимый домен CD40L; (vi) третий пептидный линкер (например, шарнирный линкер) и (vii) Fc-фрагмент антитела.
В одном воплощении Fc-фрагмент (vi) антитела располагается N-терминально к первому домену CD40L (i) и/или C-терминально к третьему домену CD40L (v). В другом воплощении Fc-фрагмент антитела расположен C-терминально к третьему домену CD40L (v). В одном воплощении полипептид практически не подвержен агрегации. В другом воплощении второй и/или третий растворимый домен CD40L является N-терминально укороченным доменом, который необязательно содержит мутации в аминокислотной последовательности.
В одном воплощении по меньшей мере один из растворимых доменов CD40L, в частности, по меньшей мере один из растворимых доменов CD40L (iii) и (v), является растворимым доменом CD40L с N-концевой последовательностью, которая начинается с аминокислоты Gln121 или Ile122 CD40L человека и в которой Gln121 может быть заменен нейтральной аминокислотой, например, Ser или Gly. В другом воплощении по меньшей мере один из растворимых доменов CD40L, в частности, по меньшей мере один из растворимых доменов CD40L (iii) и (v), является растворимым доменом CD40L с N-концевой последовательностью, выбранной из (a) Gln121-Ile122 и (b) (Gly/Ser)121-Ile122. В одном воплощении растворимый домен CD40L заканчивается аминокислотой Leu261 в CD40L человека и/или необязательно содержит одну или несколько мутаций в положениях E129, A130, S132, K133, T134, E142, Y145, Y146, C178, C194, R200, F201, C218, Q220, N240. В одном воплощении растворимые домены CD40L (i), (iii) и (v) включают аминокислоты Gln121-Leu261 из CD40L человека в соответствии с SEQ ID NO: 1.
В одном воплощении первый и второй пептидный линкер (ii) и (iv) независимо имеют длину в 3-8 аминокислот, в частности, длину в 3, 4, 5, 6, 7 или 8 аминокислот и предпочтительно являются глицин/сериновыми линкерами, необязательно содержащими остаток аспарагина, который может быть гликозилирован. В одном воплощении первый и второй пептидный линкер (ii) и (iv) состоят из аминокислотной последовательности по SEQ ID NO: 2. В другом воплощении полипептид дополнительно содержит N-концевой домен сигнального пептида, например, по SEQ ID NO: 17, который может содержать сайт расщепления протеазой и/или дополнительно содержит С-концевой элемент, который может включать и/или соединяться с доменом распознавания/очистки, например, Strep-тегом, прикрепленным к сериновому линкеру по SEQ ID NO: 18.
В одном воплощении Fc-фрагмент (vii) антитела слит с растворимым доменом CD40L (i) и/или (v) через шарнирный линкер, предпочтительно по SEQ ID NO: 16. В другом воплощении Fc-фрагмент (vii) антитела состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 13 или 14.
В одном воплощении одноцепочечный слитый полипептид настоящего изобретения включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 15 и 25-35.
В одном воплощении настоящим изобретением предусмотрен белковый агонист рецептора CD40, содержащий два одноцепочечных слитых полипептида, каждый из которых имеет аминокислотную последовательность, приведенную в SEQ ID NO: 27. В одном воплощении эти два полипептида ковалентно связаны тремя межцепочечными дисульфидными связями, образующимися между остатками цистеина 453, 459 и 462 у каждого полипептида.
В одном воплощении один или несколько остатков аспарагина в положениях 147 и 296 зрелого полипептида по SEQ ID NO: 27, 28, 29, 30, 32 или 34 являются N-гликозилированными. В другом воплощении остатки аспарагина в обоих положениях 147 и 296 этих полипептидов являются N-гликозилированными.
В одном воплощении полипептид/полипептиды подвергаются дальнейшей посттрансляционной модификации. В другом воплощении посттрансляционная модификация включает превращение N-концевого глутамина в пироглутамат.
В другом аспекте настоящим изобретением предусмотрена фармацевтическая композиция, содержащая описанный здесь белок-агонист рецептора CD40 и один или несколько фармацевтически приемлемых носителей, разбавителей, наполнителей и/или адъювантов.
В другом аспекте настоящим изобретением предусмотрена молекула нуклеиновой кислоты, кодирующей белок-агонист рецептора CD40. В одном воплощении настоящим изобретением предусмотрен экспрессионный вектор, содержащий молекулу нуклеиновой кислоты. В другом воплощении настоящим изобретением предусмотрена клетка, содержащая молекулу нуклеиновой кислоты. В следующем воплощении клетка является эукариотической клеткой. В другом воплощении клетка является клеткой млекопитающих. В другом воплощении клетка представлена клеткой яичников китайского хомячка (CHO). В других воплощениях клетка выбрана из группы, состоящей из клеток CHO-DBX11, CHO-DG44, CHO-S и CHO-K1. В других воплощениях клетка выбрана из группы, состоящей из клеток Vero, BHK, HeLa, COS, MDCK, HEK-293, NIH-3T3, W138, BT483, Hs578T, HTB2, BT20, T47D, NS0, CRL7030, HsS78Bst, PER.C6, SP2/0-Agl4 и гибридомы.
В другом аспекте настоящим изобретением предусмотрен способ лечения лиц, страдающих связанными с CD40L заболеваниями, причем способ включает введение им эффективного количества белка-агониста рецептора CD40. В одном воплощении белок-агонист рецептора CD40 вводится сам по себе. В другом воплощении белок-агонист рецептора CD40 вводится до, одновременно или после введения второго средства. В другом воплощении заболевание входит в группу, содержащую: опухоли, инфекционные заболевания, воспалительные заболевания, метаболические заболевания, аутоиммунные заболевания, дегенеративные заболевания, заболевания, связанные с апоптозом, и отторжение трансплантатов. В одном воплощении опухоли представляют собой твердые опухоли. В одном воплощении опухоли входят в группу раковых заболеваний, состоящую из саркомы, рака пищевода и рака желудка. В другом воплощении опухоли возникают при саркоме Юинга или фибросаркоме. В другом воплощении опухоли входят в группу раковых заболеваний, состоящую из немелкоклеточной карциномы легких (NSCLC), рака поджелудочной железы, колоректального рака, рака молочной железы, рака яичников, рака головы и шеи и мелкоклеточного рака легких (SCLC). В другом воплощении опухоли представляют собой лимфатические опухоли. В одном воплощении опухоли представляют собой гематологические опухоли. В другом воплощении опухоли возникают при неходжкинской лимфоме, лейкемии, острой лимфобластной лейкемии (ALL), острой миелоидной лейкемии (AML), B-клеточной лимфоме, лимфоме Беркитта, хронической миелоцитарной лейкемии (CML), хронической лимфоцитарной лейкемии (CLL) или волосистоклеточной лейкемии. В другом воплощении аутоиммунные заболевания представлены ревматоидными заболеваниями, артритными заболеваниями либо ревматоидными и артритными заболеваниями. В следующем воплощении заболевание представлено ревматоидным артритом. В другом воплощении дегенеративные заболевания представлены нейродегенеративными заболеваниями. В следующем воплощении нейродегенеративное заболевание представлено рассеянным склерозом.
В одном воплощении второе средство представляет собой средство химиотерапии, радиотерапии или биологическое средство. В одном воплощении второе средство выбирают из группы, состоящей из дувелисиба, ибрутиниба, навитоклакса и венетоклакса. В другом воплощении второе средство представлено апоптотическим средством. В одном воплощении второе апоптотическое средство выбирают из группы, состоящей из бортезомиба, азацитидина, дазатиниба и гефитиниба. В одном предпочтительном воплощении раскрытые здесь фармацевтические композиции вводятся пациентам внутривенно или подкожно. В других воплощениях раскрытые здесь фармацевтические композиции вводятся пациентам перорально, парентерально, внутримышечно, внутрисуставно, интрабронхиально, интраабдоминально, интракапсулярно, интракартилагинально, внутриполостно, интрацелиально, интрацеребеллярно, интрацеребровентрикулярно, интраколикально, интрацервикально, внутрижелудочно, внутрипеченочно, интрамиокардиально, интраостеально, интрапельвикально, интраперикардиально, интраперитониально, интраплеврально, интрапростатически, внутрилегочно, интраректально, внутрипочечно, интраретинально, интраспинально, интрасиновиально, интраторакально, внутриматочно, внутрипузырно, болюсом, вагинально, ректально, буккально, подъязычно, интраназально или трансдермально.
В одном воплощении белок-агонист рецептора CD40 вводится в виде однократного болюса. В другом воплощении белок-агонист рецептора CD40 может вводиться в виде нескольких дробных доз. Белок-агонист рецептора CD40 можно вводить в дозе 0,1-100 мг/кг. В одном воплощении белок-агонист рецептора CD40 можно вводить в дозе, выбранной из группы, состоящей из: 0,1-0,5, 0,1-1, 0,1-10, 0,1-20, 0,1-50, 0,1-75, 1-10, 1-15, 1-7,5, 1,25-15, 1,25-7,5, 2,5-7,5, 2,5-15, 5-15, 5-7,5, 1-20, 1-50, 7-75, 1-100, 5-10, 5-15, 5-20, 5-25, 5-50, 5-75, 10-20, 10-50, 10-75 и 10-100 мг/кг. В других воплощениях белок-агонист рецептора CD40 присутствует в фармацевтических композициях в количестве 0,1-100 мг/мл. В одном воплощении белок-агонист рецептора CD40 присутствует в фармацевтических композициях в количестве, выбранном из группы, состоящей из: 0,1-0,5, 0,1-1, 0,1-10, 0,1-20, 0,1-50, 0,1-75, 1-10, 1-20, 1-50, 1-75, 1-100, 5-10, 5-15, 5-20, 5-25, 5-50, 5-75, 10-20, 10-50, 10-75 или 10-100 мг/мл. В других воплощениях субъектам вводится терапевтически эффективное количество белка-агониста рецептора CD40. В другом воплощении субъектам вводится профилактически эффективное количество белка-агониста рецептора CD40.
Краткое описание фигур
Фиг. 1. Доменная структура одноцепочечного слитого полипептида, содержащего три домена CD40L. I., II., III. - растворимые домены CD40L.
Фиг. 2. Схематическое представление общей структуры CD40L.
■ ■ ■ Клеточная мембрана, N-конец располагается внутри клетки,
1. антипараллельная β-складка рецептор-связывающего домена (RBD),
2. интерфейс между RBD и клеточной мембраной,
3. сайт расщепления протеазой.
Фиг. 3. Одноцепочечный слитый полипептид, содержащий дополнительный Fab-фрагмент антитела.
Фиг. 4. Димеризация двух слитых по С-концам полипептидов scFc через три дисульфидных мостика.
Фиг. 5. Хроматограммы при аналитической SEC гексавалентных слитых белков scCD40L-RBD-FC: белка A, белка B и белка C.
Фиг. 6. Гель-электрофорез в SDS-PAGE экспрессированных белков A, B и C в невосстановительных и восстановительных условиях. Дорожка 1: белок A, невосстановительный; 2: белок A, восстановительный; 3: маркеры молекулярного веса; 4: белок B, невосстановительный; 5: белок B, восстановительный; 6: холостая; 7, белок C, невосстановительный; 8: белок C, восстановительный.
Фиг. 7. Экспрессирующие CD40 клетки Ramos B инкубировали с белком X (c), белком A (d), белком B (e) или белком C (f), а активность связывания представлена в единицах флуоресценции. (a) только клетки; (b) только клетки, инкубированные с флуоресцентно меченым антителом.
Фиг. 8. Экспрессирующие CD40 клетки Ramos B инкубировали с белком X при 1 мкг/мл (b), белком X при 10 мкг/мл (c), белком A при 1 мкг/мл (d) или белком A при 10 мкг/мл (e), а активность связывания представлена по экспрессии CD86, нормированной по (а), который не инкубировался с агонистами рецептора CD40.
Фиг. 9. Инкубировали 2 мл крови с белком X при 1 мкг/мл (b), белком X при 50 мкг/мл (c), белком A при 1 мкг/мл (d) или белком A при 50 мкг/мл (e). Определяли содержание CD83-положительных клеток и нормировали по контрольному образцу (а), который не инкубировался с агонистами рецептора CD40.
Фиг. 10. Схематическое представление гексавалентного одноцепочечного слитого белка-агониста рецептора CD40 по изобретению. Углеводы (5), присутствующие на участках внутренней поверхности CH2, в норме стерически прикрывают субдомен СН2 (2) от протеаз при “переходе к открытой Fc-конформации”, при этом восстанавливаются шарнирные межцепочечные дисульфидные связи (4) и разрушается ковалентная связь между цепями. Это способствует диссоциации СН2 и открывает участки внутренней поверхности и верхний шарнирный лизин K223 (6) к воздействию протеаз. Ассоциация димеров на “открытой стадии” не нарушается из-за высокого сродства доменов CH3 (3) друг к другу. (1) scCD40L-RBD; (2) домен CH2; (3) домен CH3; (4) шарнирные цистеины (слева: окисленные в дисульфидные мостики; справа: восстановленные до свободных тиолов); (5) углеводы в CH2, присоединенные в положении N297 (нумерация EU); (6) верхний шарнирный лизин (K223).
Раскрытие сущности изобретения
Авторы изобретения обнаружили, что при слиянии одноцепочечного рецептор-связывающего домена CD40L с происходящим из антител димеризационным доменом получается гексавалентный агонист рецептора CD40, обладающий высокой биологической активностью в сочетании с хорошей стабильностью. Соответственно, предусмотрен одноцепочечный слитый полипептид, содержащий по меньшей мере три растворимых домена CD40L, соединенных двумя пептидными линкерами, и димеризационный домен антител в N-концевом и/или C-концевом положении.
Предпочтительно одноцепочечный слитый полипептид не подвержен агрегации. Термин “не подвержен агрегации” означает содержание мономера в препарате ≥ 50%, предпочтительно ≥ 70% и более предпочтительно ≥ 90%. Соотношение между содержанием мономера и содержанием агрегатов можно определить путем изучения степени образования агрегатов методом эксклюзионной хроматографии (SEC). Стабильность в отношении агрегации можно определить методом SEC после определенного периода времени, например, от нескольких дней до нескольких недель или месяцев при различных условиях хранения, например, при 4°C или 25°C. Для классификации слитого белка как практически не подверженного агрегации предпочтительно содержание “мономера” должно быть таким, как определено выше, по прошествии времени в несколько дней, например, 10 дней, более предпочтительно после нескольких недель, например, 2, 3 или 4 недель, и наиболее предпочтительно после нескольких месяцев, например, 2 или 3 месяцев хранения при 4°C или 25°C. Что касается определения “мономера” в случае Fc-слитых белков, то сборка двух полипептидных цепей управляется Fc-частью, а функциональная единица образовавшегося собранного белка состоит из двух цепей. Эта единица определяется как “мономер” в случае Fc-слитых белков независимо от того, что они представляет собой димеризованные одноцепочечные слитые полипептиды.
Одноцепочечный слитый полипептид может содержать дополнительные домены, которые могут располагаться на N- и/или C-концах. Примерами дополнительных слитых доменов являются, например, N-концевой домен сигнального пептида, который может содержать сайт расщепления протеазой, или C-концевой элемент, который может включать и/или соединяться с доменом распознавания/очистки. В соответствии с предпочтительным воплощением, слитый полипептид содержит Strep-тег на С-конце, который пришит через линкер. Типичный Strep-тег, включающий короткий сериновый линкер, представлен в SEQ ID NO: 18.
Белок-агонист рецептора CD40 по настоящему изобретению содержит три растворимых домена, происходящих из CD40L. Предпочтительно эти растворимые домены происходят из CD40L млекопитающих, в особенности человека, включая их аллельные варианты и/или производные. Растворимые домены включают внеклеточную часть CD40L, включая рецептор-связывающий домен без мембранных доменов. Как и другие белки из надсемейства TNF, CD40L прикрепляется к мембране через N-концевую часть из 15-30 аминокислот, так называемый стебелек. Стебелек способствует тримеризации и обеспечивает определенное расстояние до клеточной мембраны. Однако стебелек не входит в состав рецептор-связывающего домена (RBD).
Важно отметить, что RBD характеризуется определенной локализацией своих N- и C-концевых аминокислот. Данные аминокислоты являются непосредственно смежными и располагаются центрально к оси тримера. Первые N-концевые аминокислоты RBD образуют антипараллельную бета-цепь с С-концевыми аминокислотами RBD (фиг. 2).
Таким образом, антипараллельная бета-цепь RBD образует интерфейс с клеточной мембраной, который связан с ней и заякорен в клеточной мембране через аминокислоты стебелька. Очень предпочтительно, чтобы растворимые домены CD40L белка-агониста рецептора CD40 содержали рецептор-связывающий домен CD40L, лишенный каких-либо аминокислот из стебелька. В противном случае потребуется длинный линкер, соединяющий С-конец одного из растворимых доменов с N-концом следующего растворимого домена, чтобы компенсировать N-концевой стебелек следующего растворимого домена, что могло бы привести к неустойчивости и/или образованию агрегатов.
Дополнительным преимуществом таких растворимых доменов является то, что N- и C-концевые аминокислоты RBD недоступны для любых антител против лекарств. Предпочтительно одноцепочечный слитый полипептид способен образовывать упорядоченную тримерную структуру, содержащую по меньшей мере один функциональный сайт связывания соответствующего рецептора для CD40L.
Белок-агонист рецептора CD40 содержит три функциональных сайта связывания рецептора CD40, то есть аминокислотные последовательности, способные образовывать комплекс с рецептором CD40. Таким образом, растворимые домены способны связываться с соответствующим рецептором CD40. В одном воплощении по меньшей мере один из растворимых доменов способен активировать рецептор, что может повлиять на апоптотическую и/или пролиферативную активность. В другом воплощении один или несколько растворимых доменов не обладают способностью к активации рецептора.
Растворимые домены CD40L могут происходить из CD40L человека, как показано в SEQ ID NO: 1. Предпочтительно растворимые домены CD40L происходят из CD40L человека, в частности, начиная с аминокислоты 121 или 122, и предпочтительно включают в себя аминокислоты 121-261 или 122-261 по SEQ ID NO: 1. Необязательно аминокислота Gln121 по SEQ ID NO: 1 может быть заменена незаряженной аминокислотой, например, Ser или Gly.
Таблица 1. Последовательность белка CD40L дикого типа человека
Как указано выше, растворимые домены CD40L могут включать последовательности дикого типа, приведенные в SEQ ID NO: 1. Однако следует отметить, что в один или несколько из этих растворимых доменов можно вводить мутации, например, мутации, которые изменяют (например, повышают или уменьшают) связывающие свойства растворимых доменов. В одном воплощении выбирают такие растворимые домены, которые не могут связываться с соответствующим рецептором цитокинов.
В следующем воплощении изобретения растворимый домен CD40L (i) содержит мутантный CD40L или его рецептор-связывающий домен, что приводит к снижению сродства и/или уменьшению активации рецептора CD40.
Связывание и/или активность мутанта можно определить, к примеру, методами, описанными в An et al. (2011, J Biol Chem. 286(13): 11226-11235); Singh et al. (1998, Protein Sci. 7(5): 1124-1135); Kim et al., J Biol Chem. 286(13): 11226-11235; или Singh et al. (1998, Protein Sci. 7(5): 1124-1135).
Мутации можно получить любым способом, известным специалистам. Замены могут затрагивать по меньшей мере одну аминокислоту в CD40L, например, CD40L человека (например, SEQ ID NO: 1), или в его рецептор-связывающем домене, как описано здесь. При этом предпочтительные замены затрагивают по меньшей мере одну из следующих аминокислот в CD40L человека по SEQ ID NO: 1: E129, S132, T134, E142, Y145, Y146, R200, F201, Q220, как-то E129G, S132E, S132N, T134E, T134N, E142G, E142S, Y145S, Y146S, R200S, Q220E и Q220S; в особенности E129G и E142G.
Замены аминокислот могут повлиять на связывание и/или активность CD40L, например, CD40L человека, на связывание с CD40 либо на индуцированные CD40 сигналы. Связывание и/или активность CD40 могут подвергаться положительному влиянию, то есть в сторону усиления, большей избирательности или большей специфичности связывания и/или большей активации рецептора. С другой стороны, связывание и/или активность CD40 могут подвергаться отрицательному влиянию, то есть в сторону ослабления, меньшей избирательности или меньшей специфичности связывания и/или меньшей активации или отсутствия активации рецептора.
Примеры мутаций в CD40L с заменами аминокислот по изобретению, влияющими на связывание и/или активацию CD40, приведены, к примеру, на фиг. 1 в работе An et al. (см. выше).
Так, одно из воплощений составляет белок-агонист рецептора CD40, как описано здесь, у которого по меньшей мере один из растворимых доменов включает мутантный CD40L или его рецептор-связывающий домен, который связывает и/или активирует CD40 в меньшей степени, чем CD40L дикого типа.
Другие примеры мутаций CD40L, вызывающих снижение индуцированной CD40L агрегации рецепторов и/или снижение сигнализации, представлены S132E и T134E.
Одно из воплощений составляет белок-агонист рецептора CD40, как описано здесь, у которого в участок последовательности, определяемый E129-S136, введен по меньшей мере один искусственный консенсусный сайт N-гликозилирования, что ведет к снижению агрегации рецепторов и/или снижению сигнализации. Примеры мутаций CD40L, ведущих к появлению искусственного консенсусного сайта N-гликозилирования в этом участке, представлены E129N, A130N, S132N, K133N и T134N.
В другом воплощении изобретения один или несколько растворимых доменов (i), (iii) и (v) CD40L могут включать мутации CD40L или его рецептор-связывающего домена, ведущие к уменьшению аутоагрегации и/или продлению стабильности in vivo. При этом предпочтительные замены затрагивают по меньшей мере одну из следующих аминокислот CD40L человека по SEQ ID NO: 1: C178, C194, C218, N240; как-то C178(A,S,G), C194(A,S,G), F201(G,S,T,D), C218(A,S,G) и N240(E,S,D,T). Мутации у каждого домена CD40L могут быть одинаковыми или разными.
Одноцепочечная слитая молекула настоящего изобретения включает три растворимых домена CD40L, а именно компоненты (i), (iii) и (v). Устойчивость одноцепочечного слитого полипептида CD40L к агрегации повышается, если второй и/или третий растворимый домен CD40L будет укороченным с N-конца и необязательно содержит мутации аминокислотной последовательности. Так, предпочтительно и второй, и третий растворимый домен CD40L являются укороченными с N-конца и необязательно содержат мутации аминокислотной последовательности в N-концевых участках, предпочтительно в пределах первых пяти аминокислот с N-конца растворимого домена CD40L. Эти мутации могут включать замены основных аминокислот на нейтральные аминокислоты, в частности на серин или глицин.
В противоположность этому, выбор первого растворимого домена CD40L не столь важен. При этом можно использовать растворимый домен, имеющий полноразмерную N-концевую последовательность. Однако следует отметить, что и первый растворимый домен CD40L тоже может иметь укороченную с N-конца и необязательно мутантную последовательность.
В следующем предпочтительном воплощении настоящего изобретения растворимые домены (i), (iii) и (v) CD40L представлены растворимыми доменами CD40L человека. Первый растворимый домен (i) CD40L может быть выбран из нативных, укороченных и/или мутантных последовательностей. Так, первый растворимый домен (i) CD40L может иметь N-концевую последовательность, которая начинается с аминокислоты Gln121 или Ile122 в CD40L человека, при этом Gln121 может быть заменен на нейтральную аминокислоту, например, на Ser или Gly. Второй и третий растворимые домены (iii) и (v) CD40L имеют укороченную с N-конца последовательность, которая предпочтительно начинается с аминокислоты Gln120 или Ile122 в CD40L человека, при этом Gln121 может быть заменен на другую аминокислоту, например, Ser или Gly.
Предпочтительно N-концевая последовательность растворимых доменов (iii) и (v) CD40L выбирается из:
(a) Gln121 или Ile122,
(b) (Gly/Ser)121.
Растворимые домены CD40L предпочтительно заканчиваются аминокислотой Leu261 в CD40L человека. В некоторых воплощениях такие домены CD40L могут включать внутренние мутации, как описано выше.
Компоненты (ii) и (iv) белка-агониста рецептора CD40 представлены пептидными линкерами, которые располагаются между компонентами (i) и (iii) либо (iii) и (v), соответственно. Гибкие линкеры имеют длину в 3-8 аминокислот, в особенности 3, 4, 5, 6, 7 или 8 аминокислот. Линкерами предпочтительно являются глицин/сериновые линкеры, то есть пептидные линкеры, в основном состоящие из аминокислот глицина и серина. В тех случаях, когда растворимый домен цитокина начинается с S или G (N-конец), линкер заканчивается перед этим S или G.
Следует отметить, что линкер (ii) и линкер (iv) не обязательно должны иметь одинаковую длину. Для того, чтобы уменьшить потенциальную иммуногенность, предпочтительно можно использовать более короткие линкеры. Кроме того, оказалось, что более короткие линкеры приводят к получению одноцепочечных молекул с пониженной тенденцией к образованию агрегатов. В то же время линкеры, значительно более длинные, чем раскрытые здесь, могут проявлять неблагоприятные свойства агрегации.
Если потребуется, линкер может содержать остаток аспарагина, который может образовывать сайт гликозилирования Asn-Xaa-Ser. В некоторых воплощениях один из линкеров, например, линкер (ii) или линкер (iv), содержит сайт гликозилирования. В других воплощениях оба линкера (ii) и (iv) содержат сайты гликозилирования. Для того, чтобы повысить растворимость белков-агонистов CD40L и/или уменьшить потенциальную иммуногенность, предпочтительно линкер (ii) или линкер (iv) либо оба должны содержать сайт гликозилирования.
Предпочтительные последовательности линкеров представлены в таблице 2. Предпочтительным является линкер GSGSGNGS (SEQ ID NO: 2).
Таблица 2. Примеры последовательностей линкеров
Белок-агонист рецептора CD40 дополнительно содержит домен Fc-фрагмента антител, который может располагаться с N-конца к первому домену (i) CD40L и/или с С-конца к третьему домену (v) CD40L. Предпочтительно, домен Fc-фрагмента антител вызывает снижение способности к взаимодействию с рецепторами Fc-γ-R in vivo. Предпочтительно домен Fc-фрагмента антител содержит или состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 13 или 14. Примеры доменов Fc-фрагмента представлены в таблице 3.
Таблица 3. Примеры доменов Fc-фрагмента
Общее количество гликозидов и положения индивидуальных углеводов в трех измерениях влияют на стабильность белков-агонистов рецептора CD40 in vivo. Кроме того, распознавание углеводов зависит от локальной плотности концевых сахаридов, разветвленности углеводного древа и относительного положения самих углеводов.
Для того, чтобы избежать сшивки на основе Fc-рецептора in vivo и потенциальной токсичности при образовании суперкластера CD40L-рецептор, необходимо истощение углеводов домена CH2. Кроме того, при частичной деградации углеводов уменьшается период полужизни белков-агонистов рецептора CD40 in vivo через механизмы, связанные с лектинами. При уменьшении общего числа сайтов гликозилирования на молекуле получается соединение, менее доступное для этих механизмов, что повышает период полужизни. Соответственно, в одном воплощении уменьшали общее количество гликозидов у белков-агонистов рецептора CD40 по настоящему изобретению за счет истощения гликосайтов CH2, получая белки-агонисты рецептора CD40, содержащие эквивалентные N297S мутации SEQ ID NO: 15 (белки A) (по системе нумерации EU), создающие домены aglycosI-CH2.
Гликосайты CH2, присутствующие на участках внутренней поверхности, в норме прикрывают этот субдомен от протеаз при “переходе к открытой Fc-конформации”, когда восстанавливаются шарнирные межцепочечные дисульфидные связи и разрушается ковалентная связь между цепями (фиг. 10). Это способствует диссоциации СН2 и открывает участки внутренней поверхности к воздействию протеаз.
Следовательно, белки-агонисты рецептора CD40, содержащие эквивалентные N297S мутации SEQ ID NO: 15 (белки A) (по системе нумерации EU), создающие aglycosI-CH2, должны быть менее устойчивы к протеолизу, чем эквивалентные структуры с гликозилированием CH2 дикого типа. Это должно повлиять на стабильность соединения при USP/DSP/хранении, когда присутствуют протеазы клеток хозяина, которые имеют долгосрочный доступ к структуре. Соответственно, в некоторых воплощениях агонисты рецептора CD40 не содержат гликосайтов CH2, но содержат гликосайты в последовательностях линкеров у каждой полипептидной цепи (например, GSGSGNGS, SEQ ID NO: 2). В некоторых типичных воплощениях агонисты рецептора CD40 содержат пять гликосайтов на 1 полипептидную цепь, в общей сложности по 10 гликосайтов на димер.
В соответствии с одним предпочтительным воплощением изобретения, домен Fc-фрагмента антител пришивается через линкер шарнирного типа. Линкер шарнирного типа имеет длину в 10-30 аминокислот, предпочтительно в 15-25 аминокислот, например, в 22 аминокислоты. Линкер шарнирного типа предпочтительно включает последовательность шарнирного участка иммуноглобулина, который именуется здесь как “шарнирный участок Ig”. Термин “шарнирный участок Ig” обозначает любой полипептид, содержащий аминокислотную последовательность, которая идентична или аналогична по последовательности той части последовательности шарнирного участка натурального Ig, которая включает те остатки цистеина, по которым дисульфидные связи соединяют две тяжелые цепи иммуноглобулина.
Можно получить производные и аналоги шарнирного участка при помощи мутаций. В настоящем изобретении производное или аналог означает полипептид, включающий аминокислотную последовательность, которая идентична или аналогична полноразмерной последовательности дикого типа (или встречающегося в природе белка), за исключением того, что он имеет одно или несколько отличий по аминокислотной последовательности, обусловленных удалением, вставкой и/или заменой. Однако в соответствии с настоящим изобретением термин “шарнирный линкер” не ограничивается такими линкерами, которые содержат шарнирный участок Ig или его производное, но охватывает любые линкеры, достаточно длинные для того, чтобы домены, скрепленные линкером шарнирного типа, приобретали биологически активную конформацию.
Количество молекул с открытой Fc-конформацией у индивидуальных белков-агонистов рецептора CD40 зависит от числа межцепочечных дисульфидных связей, присутствующих в шарнирном участке. Соответственно, в одном воплощении в шарнирный участок белков-агонистов рецептора CD40 по настоящему изобретению вводили третий цистеин, чтобы улучшить эффект истощения гликосайтов CH2.
На связанность межцепочечных дисульфидов шарнирной области, стабилизирующих гомодимер гексавалентного белка-агониста рецептора CD40, также будут влиять свободные тиоловые группы субпоследовательностей CD40L (в целом шесть на 1 димер). Это также ведет к вышеупомянутой открытой Fc-конформации вследствие самовосстановления шарнирных дисульфидных мостиков этой структуры эндогенными свободными тиолами препарата. Поэтому следует ожидать, что одноцепочечные слитые белки CD40L-Fc, содержащие шесть свободных тиолов, будут менее стабильными при получении и хранении, когда имеет место длительное воздействие кислорода и протеаз.
Поэтому, чтобы обеспечить получение гексавалентного агониста рецептора CD40, остаток C194 предпочтительно подвергают мутации на другую аминокислоту, не влияющую на связывание с рецептором.
Кроме того, белки-агонисты рецептора CD40 по изобретению дополнительно содержат мутацию верхнего шарнирного лизина на глицин, чтобы уменьшить протеолитический процессинг в этом месте. Соответственно, в одном воплощении белки-агонисты рецептора CD40 по изобретению дополнительно содержат мутацию верхнего шарнирного лизина (K223 по системе нумерации EU) на глицин, чтобы уменьшить протеолитический процессинг в этом месте, тем самым повышая общую стабильность слитого белка. Сочетание вышеприведенного введения третьего цистеина (C225 по системе нумерации EU) с вышеупомянутой мутацией лизина на глицин (K223G по системе нумерации EU) в пределах шарнирной области приводит к общей стабилизации белка-агониста рецептора CD40 по изобретению.
Особенно предпочтительный линкер шарнирного типа содержит или состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 16 (таблица 4), которая включает вышеупомянутый цистеин С225 и мутацию лизина на глицин K223G.
Белок-агонист рецептора CD40 может дополнительно включать N-концевой домен сигнального пептида, который позволяет процессинг, например, внеклеточную секрецию, в подходящих клетках хозяина. Предпочтительно N-концевой домен сигнального пептида содержит сайт расщепления протеазой, например, сайт расщепления сигнальной пептидазой, поэтому он может быть удален после или во время экспрессии с получением зрелого белка. Особенно предпочтительный N-концевой домен сигнального пептида включает аминокислотную последовательность, приведенную в SEQ ID NO: 17 (таблица 4).
Кроме того, белок-агонист рецептора CD40 может дополнительно включать С-концевой элемент, имеющий длину, например, в 1-50, предпочтительно 10-30 аминокислот, которые могут включать в себя или соединяться с доменом распознавания/очистки, например, доменом FLAG, доменом Strep-тег или Strep-tag-II и/или доменом poly-His. В особенно предпочтительном воплощении слитый полипептид содержит Strep-тег, пришитый к С-концу через короткий сериновый линкер, как показано в SEQ ID NO: 18 (таблица 4).
Типичный линкер шарнирного типа (SEQ ID NO: 16, 19-24), N-концевой домен сигнального пептида (SEQ ID NO: 17) и сериновый линкер-Strep-тег (SEQ ID NO: 18) представлены в таблице 4.
Таблица 4. Типичные домены и линкеры
В одном воплощении изобретения слитый полипептид включает три растворимых домена CD40L, слитых пептидными линкерами по SEQ ID NO: 2. Первый растворимый домен CD40L (i) состоит из аминокислот 121-261 CD40L человека по SEQ ID NO: 1 и растворимые домены CD40L (iii) и (v) состоят из аминокислот 121-261 CD40L человека по SEQ ID NO: 1.
Кроме того, слитый полипептид содержит домен Fc-фрагмента антител по SEQ ID NO: 13, который пришит с C-конца к растворимому домену CD40L (v) через шарнирный линкер по SEQ ID NO: 16. Авторы изобретения неожиданно обнаружили, что именно этот слитый полипептид обеспечивает улучшение биологической активности и является особенно стабильным. Аминокислотная последовательность типичного воплощения белка-агониста рецептора CD40 по изобретению приведена в SEQ ID NO: 27.
Кроме того, слитый полипептид может содержать N-концевой домен сигнального пептида, например, по SEQ ID NO: 17. Конкретный пример белка-агониста рецептора CD40 по изобретению представлен в SEQ ID NO: 25.
В соответствии с другим предпочтительным воплощением, слитый полипептид может дополнительно содержать С-концевой Strep-тег, пришитый к полипептиду по изобретению через короткий сериновый линкер, как показано в SEQ ID NO: 18. В соответствии с этим аспектом изобретения, Fc-фрагмент предпочтительно состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 13 или 14. Кроме того, Fc-фрагмент может состоять из более короткого Fc-фрагмента, к примеру, включающего аминокислоты 1-217 по SEQ ID NO: 13. Особенно предпочтительные примеры слитых полипептидов, содержащих C-концевой Strep-тег, представлены в SEQ ID NO: 15 (БЕЛОК A).
Типичные белки-агонисты рецептора CD40, представленные в SEQ ID NO: 15, 25 и 26, содержат N-концевой домен сигнального пептида. Домен сигнального пептида включает аминокислоты 1-20. В каждом случае зрелый белок начинается с аминокислоты 21. Типичные зрелые белки-агонисты рецептора CD40 (без сигнального пептида) по настоящему изобретению представлены в SEQ ID NO: 27-30, 32 и 34. Типичные белки-агонисты рецептора CD40, описанные выше, показаны в таблице 5.
В одном воплощении изобретения одноцепочечный слитый полипептид CD40L включает три растворимых домена CD40L, сшитых пептидными линкерами SEQ ID NO: 2. Растворимые домены CD40L (i), (iii) и (v) состоят из аминокислот 121-261 CD40L человека SEQ ID NO: 1 с мутацией C194S. Этот одноцепочечный полипептид CD40L, содержащий вышеприведенные мутеины CD40L 121-261 C194S, представлен в SEQ ID: NO: 36 и хорошо подходит для получения слитых белков по N- или C-концу с повышенной стабильностью по сравнению с диким типом. В предпочтительном воплощении домен Fc-фрагмента антител по SEQ ID NO: 13 пришит с C-конца к растворимому домену CD40L (v) по SEQ ID: 36 через шарнирный линкер согласно SEQ ID NO: 16.
Агонист рецептора CD40, приведенный в SEQ ID NO: 27, имеет меньшее общее число сайтов гликозилирования (мутация N297S в области CH2, дающая агликозилированный домен CH2), большее число межцепочечных дисульфидных связей в шарнирной области и мутацию верхнего шарнирного лизина на глицин. Эти изменения приводят к снижению потенциальной деградации и суперкластеризации рецепторов CD40L (вместе с сопутствующей токсичностью). В некоторых воплощениях N-концевой глутамин подвергается модификации в пироглутамат (Liu et al., 2011, J. Biol. Chem., 286: 11211-11217).
Таблица 5. Типичные белки-агонисты рецептора CD40
БЕЛОК A
без Strep-тега
БЕЛОК A
CD40L дикого типа +SEQ14 (FC)
CD40L д.т. +SEQ13 (FC) без SP без Strep-тега
БЕЛОК B
БЕЛОК B без SP
БЕЛОК B без Strep-тега
БЕЛОК B без SP без Strep-тега
БЕЛОК C
Следующий аспект настоящего изобретения касается молекул нуклеиновой кислоты, кодирующих белок-агонист рецептора CD40, как описано здесь. Молекула нуклеиновой кислоты может представлять собой молекулу ДНК, например, молекулу двухцепочечной или одноцепочечной ДНК, либо молекулу РНК. Молекула нуклеиновой кислоты может кодировать белок-агонист рецептора CD40 или его предшественник, например, про- или препро-форму белка-агониста рецептора CD40, которая может содержать сигнальную последовательность или другие гетерологичные аминокислотные участки для секреции или очистки, которые предпочтительно располагаются на N- и/или С-конце белка-агониста рецептора CD40. Гетерологичные аминокислотные участки могут соединяться с первым и/или вторым доменом через сайт расщепления протеазой, например, сайт расщепления из фактора X3, тромбина или IgA. Конкретный пример последовательности нуклеиновой кислоты по изобретению представлен в таблице 6 в виде SEQ ID NO: 37. Эта молекула нуклеиновой кислоты кодирует слитый полипептид SEQ ID NO: 25.
Таблица 6. Нуклеотидная последовательность типичного белка-агониста рецептора CD40
Молекула нуклеиновой кислоты может быть функционально связана с контролирующей экспрессию последовательностью, например, такой контролирующей экспрессию последовательностью, которая позволяет экспрессию молекулы нуклеиновой кислоты в нужных клетках хозяина. Молекула нуклеиновой кислоты может находиться в векторе, например, в плазмиде, бактериофаге, вирусном векторе, встраивающемся в хромосомы векторе и т.д. Примеры подходящих контролирующих экспрессию последовательностей и векторов описаны, к примеру, в Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press; и Ausubel et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons; или более поздних изданиях таковых.
Для экспрессии последовательностей нуклеиновых кислот, кодирующих белки-агонисты рецептора CD40 по настоящему изобретению, можно использовать различные системы экспрессирующих векторов/клеток хозяина. Подходящими клетками хозяина являются, без ограничения, прокариотические клетки типа бактерий, например, E. coli, эукариотические клетки хозяина типа дрожжевых клеток, клеток насекомых, растительных клеток или клеток животных, предпочтительно клеток млекопитающих, более предпочтительно клеток человека. Кроме того, изобретение касается и других организмов, кроме человека, трансформированных или трансфецированных молекулами нуклеиновой кислоты, как описано выше. Такие трансгенные организмы могут быть получены известными методами генетического переноса, включая гомологическую рекомбинацию.
Следующий аспект настоящего изобретения касается фармацевтических или диагностических композиций, включающих в качестве активного средства по меньшей мере один белок-агонист рецептора CD40, соответствующую кодирующую его нуклеиновую кислоту либо трансформированные или трансфецированные клетки, как описано здесь.
Термин “связанное с CD40L заболевание или расстройство” в настоящем изобретении означает любое заболевание или расстройство, которое может быть улучшено добавлением агониста рецептора CD40. По меньшей мере один белок-агонист рецептора CD40, соответствующая кодирующая его нуклеиновая кислота или трансформированные либо трансфецированные клетки, все, как описано здесь, могут использоваться в терапии, например, при профилактике и/или лечении заболеваний, вызванных, связанных с и/или сопровождающихся дисфункцией CD40L, в особенности пролиферативных заболеваний, как-то опухолей, например, твердых или лимфатических опухолей; инфекционных заболеваний; воспалительных заболеваний; метаболических заболеваний; аутоиммунных заболеваний, например, ревматоидных и/или артритных заболеваний; дегенеративных заболеваний, например, нейродегенеративных заболеваний типа рассеянного склероза; связанных с апоптозом заболеваний или отторжения трансплантатов.
Термин “дисфункция CD40L” в настоящем изобретении понимается как такая функция или экспрессия CD40L, которая отличается от нормальной функции или экспрессии CD40L, например, гиперэкспрессия гена или белка CD40L, снижение или устранение экспрессии гена или белка CD40L по сравнению с нормальным физиологическим уровнем экспрессии CD40L, повышение активности CD40L, снижение или устранение активности CD40L, усиление связывания CD40L с какими-либо партнерами по связыванию, например, с рецептором, в частности, с рецептором CD40L или другой молекулы цитокина, снижение или устранение связывания с каким-либо партнером по связыванию, например, с рецептором, в частности, с рецептором CD40L или другой молекулы цитокина, по сравнению с нормальной физиологической активностью или связыванием CD40L.
В различных воплощениях предусмотрен способ диагностики и/или лечения лиц, страдающих заболеваниями, которые можно диагностировать и/или лечить путем воздействия на рецепторы CD40L, включающий введение им раскрытого здесь белка-агониста рецептора CD40 с тем, чтобы у них был агонистический эффект на активность мишени или мишеней, ослабление одного или нескольких симптомов и/или происходило лечение. Предусмотренные здесь белки-агонисты рецептора CD40 могут применяться для диагностики и/или лечения лиц, страдающих первичным или метастатическим раком, включая карциномы молочной железы, толстой кишки, прямой кишки, легких (например, мелкоклеточным раком легких “SCLC” и немелкоклеточным раком легких “NSCLC”), ротоглотки, подглоточника, пищевода, желудка, поджелудочной железы, печени, желчного пузыря и желчных протоков, тонкого кишечника, мочевыводящих путей (в том числе почек, мочевого пузыря и уротелия), женских половых путей (в том числе шейки матки, матки и яичников, а также хориокарциномы и гестационной трофобластической болезни), мужских половых путей (в том числе простаты, семенных пузырьков, семенников и опухолей зародышевых клеток), эндокринных желез (в том числе щитовидной железы, надпочечников и гипофиза) и кожи, а также гемангиомы, меланомы, саркомы (в том числе из костных и мягких тканей, а также саркомы Капоши), опухоли головного мозга, нервов, глаз и мозговых оболочек (включая астроцитомы, глиомы, глиобластомы, ретинобластомы, невромы, нейробластомы, шванномы и менингиомы), опухоли, возникающие при гемопоэтических раковых заболеваниях, острой лейкемии, острой лимфобластной лейкемии (ALL), острой миелоидной лейкемии (AML), B-клеточной лимфоме, лимфоме Беркитта, хронической миелоцитарной лейкемии (CML), хронической лимфоцитарной лейкемии (CLL), волосистоклеточной лейкемии, лимфоме Ходжкина и неходжкинской лимфоме, DLBCL, фолликулярной лимфоме, гемопоэтических раковых заболеваниях, саркоме Капоши, злокачественной лимфоме, злокачественном гистиоцитозе, злокачественной меланоме, множественной миеломе, паранеопластическом синдроме/злокачественной гиперкальциемии или солидные опухоли.
Предусмотрены фармацевтические композиции, включающие приведенные здесь белки-агонисты рецептора CD40 и фармацевтически приемлемые носители. В некоторых воплощениях фармацевтическая композиция содержит по меньшей мере одно дополнительное терапевтическое средство для лечения заболевания. Например, дополнительным средством может быть терапевтическое средство, химиотерапевтическое средство; средство визуализации, цитотоксическое средство, ингибитор ангиогенеза, ингибитор киназы (включая, без ограничения, ингибиторы KDR и TIE-2), модулятор костимулирующей молекулы или ингибитор контрольной точки иммунитета (включая, без ограничения, антитело против B7.1, против B7.2, против B7.3, против B7.4, против CD28, против B7RP1, Ig к CTLA4, антитело против CTLA-4, против PD-1, против PD-L1, против PD-L2, против ICOS, против LAG-3, против Tim3, против VISTA, против HVEM, против BTLA, слитый белок LIGHT, антитело против CD137, против CD137L, против OX40, OX40L, против CD70, против CD27, против GAL9, против A2AR, против KIR, против IDO-1, против CD20), модулятор дендритных клеток/антигенпрезентирующих клеток (включая, без ограничения, антитело против CD40, против CD40L, против DC-SIGN, против Dectin-1, против CD301, против CD303, против CD123, против CD207, против DNGR1, против CD205, против DCIR, против CD206, против ILT7), модулятор Toll-подобных рецепторов (включая, без ограничения, антитело против TLR-1, против TLR-2, против TLR-3, против TLR-4, против TLR-5, против TLR-6, против TLR-7, против TLR-8, против TLR-9), блокатор молекул адгезии (включая, без ограничения, антитело против LFA-1, антитело против селектина E/L, низкомолекулярные ингибиторы), антитело против цитокина или его функциональный фрагмент (включая, без ограничения, антитело против IL-18, антитело против TNF или антитело против рецептора IL-6/цитокинов), биспецифичное переадресуемое цитотоксическое средство для T-клеток или NK-клеток (включая, без ограничения, BiTE®), терапевтическое средство на основе химерного T-клеточного рецептора (CAR-T), средство на основе T-клеточного рецептора (TCR), терапевтическую противораковую вакцину, метотрексат, циклоспорин, рапамицин, FK506, детектируемую метку или репортер, антагонист TNF, противоревматическое средство, миорелаксант, наркотическое средство, нестероидный противовоспалительный препарат (NSAID), анальгетик, анестетик, седативное средство, местный анестетик, нервно-мышечный блокатор, противомикробное, антипсориатическое средство, кортикостероид, анаболический стероид, эритропоэтин, иммунизация, иммуноглобулин, иммунодепрессант, гормон роста, гормон-замещающий препарат, радиофармацевтический препарат, антидепрессант, нейролептик, стимулятор, лекарство от астмы, бета-агонист, ингаляционный стероид, адреналин или его аналог, цитокин или антагонист цитокина.
В одном воплощении при лечении рака или при профилактике или подавлении метастазов из описанных здесь опухолей, белки-агонисты рецептора CD40 могут применяться по отдельности или в сочетании с одним или несколькими дополнительными средствами, например, средствами химиотерапии, радиотерапии или биологическими средствами. В некоторых воплощениях к таким средствам могут относиться следующие: 13-цис-ретиноевая кислота; 2-CdA; 2-хлордезоксиаденозин; 5-азацитидин; 5-фторурацил; 5-ФУ; 6-меркаптопурин; 6-МП; 6-ТГ; 6-тиогуанин; абраксан; Accutane®; актиномицин D; Adriamycin®; Adrucil®; Afinitor®; Agrylin®; Ala-Cort®; алдеслейкин; алемтузумаб; Alimta; алитретиноин; Alkaban-AQ®; Alkeran®; полностью транс-ретиноевая кислота; альфа-интерферон; алтретамин; аметоптерин; амифостин; аминоглютетимид; анагрелид; Anandron®; анастрозол; арабинозилцистеин; Ara-C; Aranesp®; Aredia®; Arimidex®; Aromasin®; Arranon®; триоксид мышьяка; Arzerra™; аспарагиназа; ATRA; Avastin®; азацитидин; БЦЖ; BCNU; бендамустин; бевацизумаб; бексаротен; Bexxar®; бикалутамид; BiCNU; Blenoxane®; блеомицин; бортезомиб; бусульфан; Busulfex®; C225; лейковорин кальций; Campath®; Camptosar®; камптотецин-11; капецитабин Carac™; карбоплатин; кармустин; кармустин в облатках; Casodex®; CC-5013; CCI-779; CCNU; CDDP; CeeNU; Cerubidine®; цетуксимаб; хлорамбуцил; цисплатин; цитроворум-фактор; кладрибин; кортизон; Cosmegen®; CPT-11; циклофосфамид; Cytadren®; цитарабин; цитарабин в липосомах; Cytosar-U®; Cytoxan®; дакарбазин; дакоген; дактиномицин; дарбепоэтин-альфа; дасатиниб; дауномицин; даунорубицин; даунорубицин гидрохлорид; даунорубицин в липосомах; DaunoXome®; декадрон; децитабин; Delta-Cortef®; Deltasone®; денилейкин; дифтитокс; DepoCyt™; дексаметазон; дексаметазон ацетат; дексаметазон-фосфат натрия; дексазон; Dexrazoxane; DHAD; DIC; диодекс; доцетаксель; Doxil®; доксорубицин; доксорубицин в липосомах; Droxia™; DTIC; DTIC-Dome®; Duralone®; дувелисиб; Efudex®; Eligard™; Ellence™; Eloxatin™; Elspar®; Emcyt®; эпирубицин; эпоэтин-альфа; эрбитукс; эрлотиниб; L-аспарагиназа Erwinia; эстрамустин; этиол Etopophos®; этопозид; этопозид фосфат; Eulexin®; Everolimus; Evista®; эксеместан; Fareston®; Faslodex®; Femara®; филграстим; флоксуридин; Fludara®; флударабин; Fluoroplex®; фторурацил; фторурацил (крем); флуоксиместерон; флутамид; фолиновая кислота; FUDR®; фулвестрант; гефитиниб; гемцитабин; гемтузумаб озогамицин; Gemzar; Gleevec™; Gliadel® в облатках; GM-CSF; госерелин; колониестимулирующий фактор гранулоцитов (G-CSF); колониестимулирующий фактор гранулоцитов-макрофагов (G-MCSF); Halotestin®; Herceptin®; гексадрол; Hexalen®; гексаметилмеламин; НММ; Hycamtin®; Hydrea®; Hydrocort Acetate®; гидрокортизон; гидрокортизон-фосфат натрия; гидрокортизон-сукцинат натрия; гидрокортизон фосфат; гидроксикарбамид; ибрутиниб; ибритумомаб; ибритумомаб тиуксетан; Idamycin®; идарубицин Ifex®; альфа-интерферон; альфа-интерферон-2b (конъюгат с ПЭГ); ифосфамид; интерлейкин-11 (IL-11); интерлейкин-2 (IL-2); иматиниб мезилат; имидазол-карбоксамид; Intron A®; ипилимумаб, Iressa®; иринотекан; изотретиноин; иксабепилон; Ixempra™; Kadcycla®; Kidrolase™, Lanacort®; лапатиниб; L-аспарагиназа; LCR; леналидомид; летрозол; лейковорин; лейкеран; Leukine™; лейпролид; лейрокристин; Leustatin™; лирилумаб; липосомный Ara-C; Liquid Pred®; ломустин; L-РАМ; L-сарколизин; Lupron®; Lupron Depot®; Matulane®; максидекс; мехлорэтамин; мехлорэтамин гидрохлорид; Medralone®; Medrol®; Megace®; мегестрол; мегестрол ацетат; ингибиторы MEK; мелфалан; меркаптопурин; Mesna™; Mesnex™; метотрексат; метотрексат натрия; метилпреднизолон; Meticorten®; митомицин; митомицин С; митоксантрон; M-Prednisol®; MTC; MTX; Mustargen®; мустин; Mutamycin®; Myleran®; Mylocel™; Mylotarg®; Navitoclax®; Navelbine®; неларабин; Neosar®; Neulasta™; Neumega®; Neupogen®; Nexavar®; Nilandron®; нилотиниб; нилутамид; Nipent®; азотный иприт Novaldex®; ниволюмаб; Novantrone®; Nplate; октреотид; октреотид ацетат; офатумумаб; Oncospar®; Oncovin®; Ontak®; Onxal™; опрельвекин; Orapred®; Orasone®; оксалиплатин; паклитаксел; паклитаксел на белке; памидронат; панитумумаб; Panretin®; Paraplatin®; пазопаниб; Pediapred®; ПЭГ-интерферон; ПЭГ-аспаргаза; ПЭГ-филграстим; PEG-Intron™; ПЭГ-L-аспарагиназа; пеметрексед; пембролизумаб; пентостатин; пертузумаб; фенилаланиновый иприт; пидилизумаб; Platinol®; Platinol-AQ®; преднизолон; преднизон; Prelone®; прокарбазин; Procrit®; Proleukin®; Prolifeprospan 20 с имплантатом кармустина; Purinethol®; ингибиторы BRAF; ралоксифен; Revlimid®; Rheumatrex®; Rituxan®; ритуксимаб; Roferon-A®; ромиплостим; Rubex®; рубидомицин гидрохлорид; Sandostatin®; Sandostatin LAR®; сарграмостим; Solu-Cortef®; Solu-Medrol®; сорафениб; Sprycel™; STI-571; Stivagra™, стрептозоцин; SU11248; сунитиниб; Sutent®; тамоксифен Tarceva®; Targretin®; Tasigna®; Taxol®; Taxotere®; Temodar®; темозоломид темсиролимус; тенипозид; TESPA; талидомид; Thalomid®; TheraCys®; тиогуанин; тиогуанин Tabloid®; тиофосфамид; Thioplex®; тиотепа; TICE®; Toposar®; топотекан; торемифен; Torisel®; тоситумомаб; трастузумаб; Treanda®; тремелимумаб; третиноин; Trexall™, Trisenox®; TSPA; Tykerb®; урелумаб; VCR; Vectibix™; Velban®; Velcade®; Venetoclax®; VePesid®; Vesanoid®; Viadur™; Vidaza®; винбластин; винбластин сульфат; Vincasar Pfs®; винкристин; винорелбин; винорелбин тартрат; VLB; VM-26; вориностат; Votrient®; VP-16; Vumon®; Xeloda®; Zanosar®; Zevalin™; Zinecard®; Zoladex®; золедроновая кислота; Zolinza®; или Zometa® и/или любые другие средства, не представленные в этом списке, которые нацелены на такие же пути.
При использовании двух или нескольких веществ или начал в составе комбинированного режима лечения их можно вводить одним и тем же способом введения или разными способами введения, практически в одно и то же время или в различное время (например, практически одновременно, последовательно или по чередующейся схеме). При введении этих веществ или начал одновременно одним и тем же способом введения их можно вводить в виде различных фармацевтических форм или композиций или же в составе комбинированной фармацевтической формы или композиции, что должно быть ясно специалистам.
Также при использовании двух или нескольких активных веществ или начал в составе комбинированного режима лечения каждое из веществ или начал можно вводить в таком же количестве и по той же схеме, что и при использовании соединения или начала самого по себе, причем такое комбинированное применение может и не давать синергического эффекта. Однако, если комбинированное применение двух или нескольких активных веществ или начал дает синергический эффект, то можно и уменьшить количество одного, нескольких или всех веществ или начал, подлежащих введению, и в то же время получить требуемое терапевтическое действие. Это может быть полезным, например, для предотвращения, ограничения или уменьшения каких-либо нежелательных побочных эффектов, связанных с использованием одного или нескольких веществ или начал при их применении в обычном количестве, получая при этом требуемый фармацевтический или терапевтический эффект.
Эффективность используемой схемы лечения по изобретению можно определить и/или отследить любым способом, известным per se для данного заболевания или расстройства, как это должно быть ясно врачам. Врач также сможет, при необходимости и в каждом конкретном случае, изменить или модифицировать конкретный режим лечения с тем, чтобы получить требуемый терапевтический эффект, предотвратить, ограничить или уменьшить нежелательные побочные эффекты и/или добиться соответствующего баланса между получением требуемого терапевтического эффекта, с одной стороны, и предотвращением, ограничением или уменьшением нежелательных побочных эффектов, с другой стороны.
Как правило, режим лечения должен выполняться до получения требуемого терапевтического эффекта и/или пока нужно сохранить требуемый терапевтический эффект. Опять же, это определяется врачом.
В различных воплощениях предусмотрены фармацевтические композиции, содержащие один или несколько белков-агонистов рецептора CD40, самих по себе либо в комбинации с профилактическими средствами, терапевтическими средствами и/или фармацевтически приемлемыми носителями. В различных воплощениях неограничительные примеры применения приведенных здесь фармацевтических композиций включают диагностику, выявление и/или мониторинг заболеваний, предотвращение, лечение, ведение и/или облегчение заболеваний либо одного или нескольких симптомов таковых и/или в исследованиях. Составление фармацевтических композиций, самих по себе либо в комбинации с профилактическими средствами, терапевтическими средствами и/или фармацевтически приемлемыми носителями, известно специалистам в данной области (US Patent Publication No. 2009/0311253 A1).
В различных воплощениях лекарственная форма может содержать одну или несколько аминокислот, один или несколько полисахаридов и/или полисорбат и белок-агонист рецептора CD40, присутствующий в концентрации от 0,1 до 100 мг/мл, включая конечные точки (например, 0,1-10, 1-10, 0,01-50, 1-50, 1-100, 10-100, 25-100, 25-50 или 50-100 мг/мл), причем данная форма имеет значение рН от 5,0 до 7,0, включая конечные точки (например, рН 5,0-6,0, 5,5-6,0, 5,0-6,5, 5,5-6,5 или 6,0-7,0). В одном воплощении по меньшей мере одна аминокислота в рецептуре представлена гистидином и присутствует в концентрации 10-20 мМ, 10-15 мМ, 15-20 мМ или примерно 15 мМ. В одном воплощении по меньшей мере один полисахарид в рецептуре представлен сахарозой и присутствует в концентрации от 0 до 8,0% (масс./объем). В одном воплощении полисорбат в рецептуре представлен полисорбатом 80 и присутствует в концентрации 0-0,06% масс./об. В одном воплощении по меньшей мере одна аминокислота в рецептуре представлена аргинином и присутствует в концентрации 0-1,5% масс./об (например, 0,5-1,5, 1,0-1,5 или 0,5-1,0 масс./об.). В одном воплощении белок-агонист рецептора CD40 присутствует в рецептуре в концентрации 0,1-100 мг/мл (например, 1-100 мг/мл или 1-15 мг/мл или 1-7,5 мг/мл или 2,5-7,5 мг/мл или 5-7,5 мг/мл или 25-100 мг/мл или 20-60 мг/мл или 25-50 мг/мл или примерно 25 мг/мл или 50 мг/мл или же 0,1-60 мг/мл или 0,1-25 мг/мл или 1,0-60 мг/мл или 0,5-60 мг/мл или 0,1-2,0 мг/мл или 0,5-2,0 мг/мл или 1-5 мг/мл или 1-7,5 мг/мл или 1-15 мг/мл или примерно 0,5 мг/мл или 1,0 мг/мл).
В настоящем изобретении выражение “эффективное количество” означает такое количество белка-агониста CD40L, которое приводит к заметному улучшению (например, по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или больше от исходного уровня) одного или нескольких параметров, связанных с дисфункцией CD40L либо с заболеванием или расстройством, связанным с CD40L.
В различных воплощениях лекарственная форма представляет собой водный состав, лиофилизованный состав либо лиофилизованный и регидратируемый состав. В одном воплощении гидратирующий раствор представляет собой раствор декстрозы и/или физиологический раствор (например, декстроза в концентрации около 5% масс./об. и/или физиологический раствор в концентрации около 0,9% масс./об.). В одном воплощении лекарственная форма содержит около 15 мМ гистидина, 0,03% (масс./об.) полисорбата 80, 4% (масс./об.) сахарозы и 0,1-25 мг/мл белка-агониста рецептора CD40 либо 1-15 мг/мл белка-агониста рецептора CD40 и имеет значение рН около 6. В одном воплощении данная форма дополнительно содержит по меньшей мере еще одно средство.
В различных воплощениях применяется рецептура, содержащая 25 мг/мл белка-агониста рецептора CD40, 15 мМ гистидина, 0,03% полисорбата 80 (масс./об.) и 4,0% сахарозы (масс./об.) со значением рН около 6,0. В некоторых воплощениях рецептура не содержит аргинина. В некоторых воплощениях эта рецептура вне ожидания проявляет улучшение стабильности при замораживании-оттаивании, стабильности жидкого состава и/или стабильности лиофилизованного состава по сравнению с другими рецептурами, включающими другие компоненты или концентрации.
Способы введения представленных здесь терапевтических средств включают, без ограничения, пероральное введение, парентеральное введение (например, интрадермальное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, внутриопухолевое введение, мукозальное введение (например, интраназальным или пероральным способом) и внутрилегочное введение (например, введение соединений в виде аэрозоля с помощью ингалятора или распылителя). Составление фармацевтических композиций для конкретных способов введения, а также необходимые материалы и методы для различных способов введения доступны и известны специалистам в данной области (US Patent Publication No. 2009/0311253 A1).
В различных воплощениях схемы дозировки можно корректировать с тем, чтобы обеспечить оптимальную желательную реакцию (например, терапевтическую или профилактическую реакцию). Например, можно вводить одним болюсом, вводить несколько дробных доз по времени или же пропорционально уменьшать или повышать дозу в соответствии с требованиями терапевтической ситуации. В некоторых воплощениях парентеральные композиции составляют в стандартной дозовой форме для легкости введения и единообразия дозировки. Термин “стандартная дозовая форма” относится к физически дискретным единицам, подходящим в качестве унифицированной дозировки для подлежащих лечению субъектов-млекопитающих, причем каждая единица содержит предустановленное количество активного соединения, рассчитанное на получение требуемого терапевтического эффекта в сочетании с необходимым фармацевтическим носителем.
Типичный, без ограничения, диапазон для терапевтически или профилактически эффективного количества предусмотренного здесь белка-агониста рецептора CD40 составляет 0,1-100 мг/кг (например, 0,1-0,5, 0,1-1, 0,1-10, 0,1-20, 0,1-50, 0,1-75, 1-10, 1-15, 1-7,5, 1,25-15, 1,25-7,5, 2,5-7,5, 2,5-15, 5-15, 5-7,5, 1-20, 1-50, 7-75, 1-100, 5-10, 5-15, 5-20, 5-25, 5-50, 5-75, 10-20, 10-50, 10-75 или 10-100 мг/кг или любая концентрация между ними). В некоторых воплощениях белок-агонист рецептора CD40 в фармацевтической композиции присутствует в терапевтически эффективной концентрации, например, в концентрации 0,1-100 мг/мл (например, 0,1-0,5, 0,1-1, 0,1-10, 0,1-20, 0,1-50, 0,1-75, 1-10, 1-20, 1-50, 1-75, 1-100, 5-10, 5-15, 5-20, 5-25, 5-50, 5-75, 10-20, 10-50, 10-75 или 10-100 мг/мл или любой концентрации между ними). Отметим, что значения дозировки могут варьироваться в зависимости от типа и/или тяжести подлежащего лечению заболевания. Также следует иметь в виду, что для любого конкретного субъекта можно корректировать конкретные схемы дозировки по времени в соответствии с индивидуальными потребностями и/или профессиональным суждением лица, осуществляющего или контролирующего введение композиций, а приведенные здесь диапазоны доз служат только для примера и не должны ограничивать объем или практическое применение заявленной композиции.
Примеры
Пример 1. Получение белка-агониста рецептора CD40
1.1. Структура полипептида
A) Аминокислоты Met1-Gly20
Сигнальный пептид Ig-каппа, предполагаемый сайт отщепления сигнальной пептидазой после аминокислоты Gly20.
B) Аминокислоты Gln21-Leu161
Первый растворимый домен цитокинового лиганда CD40L человека (CD40L, аминокислоты 121-261 по SEQ ID NO: 1).
C) Аминокислоты Gly162-Ser169
Первый пептидный линкер по SEQ ID NO: 2.
D) Аминокислоты Gln170-Leu310
Второй растворимый домен цитокинового лиганда CD40L человека (CD40L, аминокислоты 121-261 по SEQ ID NO: 1).
E) Аминокислоты Gly311-Ser318
Второй пептидный линкер по SEQ ID NO: 2.
F) Аминокислоты Gln319-Leu459
Третий растворимый домен цитокинового лиганда CD40L человека (CD40L, аминокислоты 121-261 по SEQ ID NO: 1).
G) Аминокислоты Gly460-Cys482
Линкер шарнирного типа по SEQ ID NO: 16.
H) Аминокислоты Pro483-Lys700
Домен Fc-фрагмента антител по SEQ ID NO: 13.
Вышеуказанный белок-агонист рецептора CD40 представлен в SEQ ID NO: 25.
Указанные линкеры могут быть заменены другими предпочтительными линкерами, например, приведенными в SEQ ID NO: 3-12.
Указанный линкер шарнирного типа может быть заменен другими предпочтительными шарнирными линкерами, например, приведенными в SEQ ID NO: 19 и 20.
Следует отметить, что первый и второй пептидные линкеры не обязательно должны быть идентичными.
Последовательность сигнального пептида (А) может быть заменена любой другой подходящей, например, последовательностью сигнального пептида млекопитающих.
1.2. Генная кассета, кодирующая полипептид
Синтетический ген может быть оптимизирован с учетом его употребительности кодонов для экспрессии в подходящих клетках хозяина, например, в клетках насекомых или клетках млекопитающих. Предпочтительная нуклеотидная последовательность приведена в SEQ ID NO: 37.
Пример 2. Экспрессия и очистка
2.1. Клонирование, экспрессия и очистка слитых полипептидов
Вышеприведенные слитые белки экспрессировали рекомбинантно в двух разных эукариотических клетках хозяина.
Для первоначального анализа вышеприведенных слитых белков-агонистов рецептора CD40 клетки Hek293T, выращенные в DMEM + GlutaMAX (GibCo) с добавлением 10% FBS, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина, подвергали краткосрочной трансфекции плазмидой, содержащей экспрессионную кассету для слитого полипептида и соответствующий селектирующий маркер, например, функциональную экспрессионную кассету, содержащую ген резистентности к бластицидину, пуромицину или гигромицину. В тех случаях, когда для получения конечного продукта требуется несколько полипептидных цепей, экспрессионные кассеты либо объединяли в одной плазмиде, либо размещали в разных плазмидах во время трансфекции. Через три дня после трансфекции собирали супернатанты клеточных культур, содержащие рекомбинантные слитые полипептиды, и осветляли центрифугированием при 300×g с последующим фильтрованием через стерильный фильтр на 0,22 мкм.
Для крупномасштабной экспрессии слитых белков-агонистов рецептора CD40, предназначенных для использования in vivo, синтетические кассеты с ДНК, кодирующей вышеприведенные белки, вставляли в эукариотические экспрессионные векторы, содержащие соответствующие селектирующие маркеры (например, функциональную экспрессирующую кассету, содержащую ген резистентности к бластицидину, пуромицину или гигромицину) и генетические элементы, пригодные для повышения числа транскрипционно активных сайтов встраивания в геноме клеток хозяина. Проверенные по последовательности экспрессионные векторы вводили методом электропорации в адаптированные к суспензии клетки яичников китайского хомячка (CHO-S, Invitrogen). Через три дня после трансфекции к трансфецированным клеткам применяли соответствующее давление отбора. Выжившие клетки, несущие полученные из вектора гены резистентности, получали при последующем культивировании под давлением отбора. При стабильном росте отобранных клеточных пулов в химически определенной среде (PowerCHO2-CD, Lonza) при 37°C в атмосфере 7% CO2 в инкубаторе с круговой качалкой (100 об/мин, размах качания 50 мм) индивидуальные супернатанты анализировали методом ELISA для выявления вышеприведенных белков, а пулы клеток с максимальной удельной продуктивностью перед получением белка подвергали экспансии в качалочных колбах (круговая качалка, 100 об/мин, размах качания 50 мм).
Для получения белка в лабораторных масштабах индивидуальные клеточные пулы культивировали в течение 7-12 дней в химически определенной среде (PowerCHO2-CD, Lonza) при 37°C в атмосфере 7% CO2 в биореакторе 20/50 EHT типа Wave (GE Healthcare). Основная среда - PowerCHO2-CD с добавлением 4 мМ Glutamax. Культивирование типа Wave запускали при концентрации жизнеспособных клеток в 0,3-0,4×106 клеток/мл при следующих настройках (для мешка в 5 или 10 л): частота качания 18 об/мин, угол качания 7°, поток газа 0,2-0,3 л/мин, 7% CO2, 36,5°C. За один рабочий цикл Wave культуру клеток подпитывали дважды с помощью PowerFeed A (Lonza), обычно на 2-й день (подпитка 20%) и 5-й день (подпитка 30%). После второй подпитки повышали частоту качания до 22 об/мин, а угол качания до 8°.
Биореактор обычно убирали между 7-м и 12-м днем, когда жизнеспособность клеток падала ниже 80%. Сначала супернатант культуры осветляли с помощью ручной системы глубинной фильтрации (Millipore Millistak Pod, MC0HC 0,054 м2). Для белков со Strep-тегом добавляли авидин до конечной концентрации 0,5 мг/л. Наконец, супернатант культуры, содержащий слитый белок-агонист рецептора CD40, стерилизовали фильтрованием с помощью бутылочного фильтра (0,22 мкм, PES, Corning) и хранили при 2-8°C до дальнейшей обработки.
Для аффинной очистки набивали колонку сефарозой Streptactin (слой геля 1 мл), уравновешивали 15 мл буфера W (100 мМ трис-HCl, 150 мМ NaCl, pH 8,0) или PBS, pH 7,4 и наносили на колонку супернатант клеточной культуры со скоростью потока в 4 мл/мин. Затем промывали колонку 15 мл буфера W и элюировали связавшийся полипептид путем ступенчатого добавления 7×1 мл буфера E (100 мМ трис HCl, 150 мМ NaCl, 2,5 мМ детиобиотина, pH 8,0). С другой стороны, для этой операции можно использовать PBS pH 7,4, содержащий 2,5 мМ детиобиотина.
В качестве альтернативы методу на основе сефарозы Streptactin аффинную очистку проводили на колонке с иммобилизованным белком A в качестве аффинного лиганда на хроматографической установке Akta (GE Healthcare). В качестве твердой фазы был выбран материал с высоким сродством к Fc-домену слитого белка: MABSelect Sure™ (GE Healthcare). Вкратце, осветленный супернатант клеточной культуры наносили на колонку HiTrap MabSelectSure (CV = 5 мл), уравновешенную промывочным буфером-1 (20 мМ Pi, 95 мМ NaCl, pH 7,2), не превышая нагрузку в 10 мг слитого белка на 1 мл носителя. Колонку промывали 10 колоночными объемами (10CV) вышеприведенного уравновешивающего буфера, а затем 4 колоночными объемами (4CV) промывочного буфера-2 (20 мМ Pi, 95 мМ NaCl, pH 8,0), чтобы истощить белки и ДНК клеток хозяина. Затем колонку элюировали элюирующим буфером (20 мМ неорганического фосфата, 95 мМ NaCl, pH 3,5) и собирали элюат в виде десяти фракций, причем каждая фракция имела объем, равный объему носителя на колонке (5 мл). Каждую фракцию нейтрализовали равным объемом вышеприведенного промывочного буфера-2. При проведении аффинной хроматографии линейную скорость устанавливали равной 150 см/ч и поддерживали на этом уровне.
Во фракциях элюата определяли содержание белка, а пиковые фракции концентрировали ультрафильтрацией и подвергали дополнительной очистке методом эксклюзионной хроматографии (SEC).
SEC проводили на колонках Superdex 200 10/300 GL или HiLoad 26/60, используя хроматографическую установку Akta (GE Healthcare). Колонки уравновешивали фосфатно-солевым буфером и наносили на них концентрированный, прошедший аффинную очистку полипептид загружали в колонку SEC при объеме образца, не превышающем 2% (об/об) общего объема колонки. В случае колонок Superdex 200 10/300 GL (GE Healthcare) скорость потока составляла 0,5 мл/мин. В случае колонок HiLoad 26/60 Superdex 200 скорость потока составляла 2,5 мл в минуту. Профиль элюирования полипептида отслеживали по поглощению при 280 нм.
Хроматограммы при аналитической SEC гексавалентных слитых с scCD 40L-RBD-FC белков: БЕЛКА A, БЕЛКА B и БЕЛКА C представлены на фиг. 5.
Для определения кажущейся молекулярной массы очищенных слитых полипептидов в нативных условиях на колонку Superdex 200 наносили стандартные белки с известной молекулярной массой. Исходя из объема элюирования стандартных белков, строили калибровочную кривую и определяли кажущуюся молекулярную массу очищенных слитых полипептидов. Содержащие Fc-домен слитые белки-агонисты рецептора CD40 обычно элюируются из колонок Superdex200 с кажущейся молекулярной массой ок. 160-180 кДа, подтверждая гомодимеризацию зрелых слитых белков-агонистов рецептора CD40 под действием Fc-домена.
Пример 3. Результаты SDS-PAGE димерных белков, экспрессированных из белков A, B и C
Белки A, B и C экспрессировали и очищали в соответствии с примерами 1 и 2. Три очищенных белка либо не восстанавливали (дорожки 1, 4, и 7), либо восстанавливали дитиотреитолом (дорожки 2, 5, 8) и проводили гель-электрофорез SDS-PAGE в 4-12% бис-трис. Результаты представлены на фиг. 6. На дорожке 1 видно, что в невосстановительных условиях белок, экспрессированный из белка A, содержит полосы и мономера (85 кДа), и димера (170 кДа), что указывает на самовосстановление межцепочечных шарнирных дисульфидов эндогенными свободными тиолами, присутствующими в самом полипептиде. Напротив, на дорожках 4 и 7 видно, что в восстановительных условиях белки, экспрессированные из белка B и белка C, содержат только полосу димера (170 кДа), что означает отсутствие аутовосстановительных свойств у самих полипептидов, поэтому межцепочечные дисульфидные мостики в шарнирной области остаются невредимыми.
Пример 4. Тривалентный контрольный белок
Чтобы сравнить уровень связывания между гексавалентными слитыми белками-агонистами рецептора CD40 и тривалентным CD40, стабилизированным бактериофагом RB69-FOLDON, экспрессировали белок X (SEQ ID NO: 38) в клетках CHO-S и очищали, как описано в предыдущем разделе. Очищенный методом SEC белок служил в качестве контроля в следующих примерах. Последовательность белка X (SEQ ID NO: 38) представлена в таблице 7. Аминокислоты 1-20 белка X представляют сигнальный пептид, а зрелые белки начинаются с аминокислоты Gln21. Этот белок состоит из трех идентичных полипептидов, каждый из которых содержит один растворимый домен CD40L (Q121-L261 по SEQ ID NO: 1); эта сборка стабилизирована тримеризационным доменом фибритина бактериофага RB69, слитым через гибкий линкер с С-концом CD40L.
Таблица 7. Тривалентные контрольные белки, включая сигнальный пептид
БЕЛОК X
БЕЛОК X2
Пример 5. Клеточные анализы
5A. Анализ клеточного связывания для демонстрации связывания агонистов рецептора CD40 со своим нативным рецептором CD40 на поверхности B-клеток Ramos
Для того, чтобы дополнить наши данные по сродству агонистов рецептора CD40, полученные с помощью кварцевых микровесов (QCM), мы хотели исследовать, могут ли наши агонисты рецептора CD40 связываться со своим нативным рецептором на поверхности клеток. Поскольку B-клетки зависят от сигнализации CD40 для полной активации, для этого анализа использовали линию B-клеток Ramos человека. Известно, что клетки Ramos экспрессируют CD40 на своей поверхности, поэтому после инкубации с агонистами рецептора CD40 должен обнаруживаться C-концевой StrepTag II, связавшийся с нашими агонистами рецептора CD40, с помощью антитела. Затем это антитело, в свою очередь, можно детектировать с помощью флуоресцентного антитела и анализировать клетки на проточном цитометре.
B-клетки Ramos, экспрессирующие CD40 на своей поверхности, инкубировали с белком X (c), белком A (d), белком B (e) или белком C (f) на льду в течение 30 минут, чтобы прошло связывание рецептора с лигандами. Клетки промывали ледяным промывочным буфером, после чего инкубировали с поликлональным кроличьим антителом против StrepTagII на льду в течение 30 мин для выявления агонистов рецептора CD40, застрявших на поверхности клеток. Fc-рецепторы блокировали добавлением 1% IgG человека (Gamunex) в буферы для окрашивания и промывки. Клетки опять промывали ледяным промывочным буфером, а затем инкубировали с поликлональным помеченным Alexa488 козьим антителом против кролика на льду и в темноте в течение 20 мин. После этого клетки обрабатывали для проточной цитометрии путем промывки ледяным PBS. Клетки анализировали на проточном цитометре Guava Easycyte и регистрировали флуоресценцию на зеленом канале. В конечном счете, из первичных данных по проточной цитометрии получали средние значения флуоресценции с помощью программного обеспечения FlowJo путем настройки на живые клетки и анализа флуоресценции Alexa488 в пределах этого сектора (gate). В качестве контроля служили одни лишь клетки (a) и клетки, инкубированные только со вторичным козьим антителом против кролика (b).
Как видно из фиг. 7, все агонисты рецептора CD40 вызывают значительное повышение флуоресценции клеток по сравнению с одними лишь клетками или с клетками, инкубированными только со вторичным флуоресцентным антителом. При этом белок B давал самый большой сигнал флуоресценции (e), указывая на то, что белок B лучше связывается с клетками Ramos. По уровню сигнала за белком B следовал белок A (d) и белок X (c), а белок C (f) давал самый слабый сигнал. В целом из этих данных можно предположить, что все агонисты рецептора CD40 связываются со своим нативным рецептором в клеточном контексте in vitro, причем лучше всех связывается белок B.
5B. Повышающая регуляция CD86 на B-клетках как показатель запуска сигнализации CD40 агонистами рецептора CD40
CD86 является маркером активации на B-клетках человека и служит лигандом для CD28 и CTLA4 на T-клетках. Экспрессия CD86 на поверхности часто служит средством для описания активационного состояния B-клеток. Поскольку B-клетки нуждаются в нескольких сигналах для полной активации, включая B-клеточный рецептор и связывание лигандов CD40, мы задались вопросом, могут ли агонисты рецептора CD40 вызывать повышающую регуляцию поверхностной экспрессии CD86.
Для этого клетки B-клетки Ramos инкубировали с 1 мкг/мл белка X (b), 10 мкг/мл белка X (c), 1 мкг/мл белка A (d) или 10 мкг/мл белка A (e) в 24-луночных планшетах в течение ночи при 37°C и 5% CO2. Необработанные клетки служили контролем (a). На следующий день все образцы инкубировали с помеченным PE антителом против CD86 человека в течение 30 мин на льду и в темноте. Fc-рецепторы блокировали добавлением 1% IgG человека (Gamunex) в буферы для окрашивания и промывки. После этого образцы обрабатывали для проточной цитометрии на проточном цитометре Guava Easycyte. Из первичных данных по проточной цитометрии в конечном счете получали средние значения флуоресценции с помощью программного обеспечения FlowJo путем настройки на живые клетки и анализа флуоресценции PE в пределах этого сектора (gate). Средние значения флуоресценции использовали для выражения уровня CD86 на поверхности, причем эти значения нормировали по контрольному образцу, который не инкубировался с агонистами рецептора CD40 (а).
Как видно из фиг. 8, все агонисты рецептора CD40 вызывают повышение экспрессии CD86 на поверхности, указывая на то, что все соединения запускают сигнализацию CD40. Важно отметить, что это повышение было зависимым от дозы, если сравнить столбики b и c или d и e (1 мкг/мл против 10 мкг/мл того же соединения, соответственно). Кроме того, повышающая регуляция CD86 была сильнее у белка A, который является гексавалентным. Это означает четкий эффект авидности по сравнению с белком X, который является лишь тривалентным. Результаты показывают, что использовавшиеся при этом агонисты рецептора CD40 проявляют биологическую активность зависимым от дозы образом.
5C. Анализ цельной крови, показывающий стимуляцию иммунных клеток одновременно с повышающей регуляцией CD83 агонистами рецептора CD40
CD83 - поверхностная молекула, которая подвергается повышающей регуляции в процессе пролиферации и созревания иммунных клеток человека. CD83 встречается в основном на дендритных клетках и T-клетках и может использоваться в качестве маркера стимуляции иммунных клеток. Как показано в Chowdhury et al. (Cancer Immunology Research, 2013, doi: 10.1158/2326-6066.CIR-13-0070), повышающая регуляция CD83 может использоваться в качестве средства для изучения активации иммунных клеток после связывания CD40 антителами. Поэтому мы задались вопросом, могут ли наши агонисты рецептора CD40 также вызывать повышающую регуляцию CD83 при анализе на цельной крови.
Для этого отбирали цельную кровь у здоровых доноров в пробирки с ЭДТА. 2 мл крови инкубировали с 1 мкг/мл белка X (b), 50 мкг/мл белка X (c), 1 мкг/мл белка A (d) или 50 мкг/мл белка A (e) в 24-луночных планшетах в течение 4 часов при 37°C и 5% CO2. Необработанная кровь служила контролем (а). Через 4 часа все образцы инкубировали с помеченным PerCP/Cy5.5 антителом против CD83 человека в течение 20 мин при комнатной температуре и в темноте. После этого образцы обрабатывали для проточной цитометрии путем фиксации и лизиса эритроцитов с помощью лизирующего раствора BD FACS в соответствии с инструкциями производителя. Образцы анализировали на проточном цитометре Guava Easycyte и засекали популяции клеток (гранулоциты, лимфоциты и моноциты) по профилю светорассеяния. Для каждой популяции регистрировали флуореценцию в дальнем красном канале и анализировали с помощью программного обеспечения FlowJo. Определяли процент CD83-положительных клеток и нормировали по контрольному образцу, который не инкубировался с агонистами рецептора CD40.
Как видно из фиг. 9, как белок X, так и белок A вызывают появление новой CD83-положительной популяции по сравнению с необработанными клетками крови (a). Эта новая CD83-положительная популяция появилась у всех анализируемых клеточных популяций (лимфоциты, моноциты и гранулоциты) и была наиболее заметной в случае лимфоцитов. Важно отметить, что процентная доля CD83-положительных клеток была зависимой от дозы, если сравнить столбики b и c или d и e (1 мкг/мл по сравнению с 50 мкг/мл одного и того же соединения, соответственно). Кроме того, величина CD83-положительной популяции была больше у гексавалентного белка A по сравнению с белком X в тех же дозах. Результаты свидетельствуют о четком эффекте авидности у гексавалентного белка A по сравнению с тривалентным белком X. Результаты также свидетельствуют, что использовавшиеся при этом агонисты рецептора CD40 проявляют биологическую активность зависимым от дозы образом на свежей крови человека.
Пример 6. Анализ связывания in vitro с иммобилизованным рецептором CD40
Рассчитывали равновесные константы связывания (KD) тривалентных конструкций CD40L (например, белка X) и гексавалентных конструкций CD40L (например, белка A, белка B и белка C) с CD40 по кинетическим данным связывания (kon и koff), которые определяли с помощью автоматизированной биосенсорной системы (Attana A100). A100 позволяет исследовать молекулярные взаимодействия в реальном времени на основе метода кварцевых микровесов (QCM).
Для этого CD40-Fc человека, приобретенный у Enzo (кат. номер: ALX-522-016-C050), иммобилизировали на поверхности карбоксил-активированного чипа для QCM. В качестве растворимого аналита использовали тримерные и гексамерные конструкции CD40L в концентрациях 1, 5 и 10 мкг/мл. Анализировали константы связывания (kon) и диссоциация (koff). Измерения в реальном времени и рассчитанные из них значения KD показали сравнимую связывающую активность у всех гексавалентных белков A, B и C, но лучшее связывание гексавалентных белков в сравнении с тривалентным белком X.
Таблица 8. Показатели связывания
Пример 7. Определение времени полужизни
Молекулы белка A/белка B/белка C состоят из двух полипептидов, соединенных ковалентно тремя межцепочечными дисульфидными связями, и все они содержат мутацию N297S в положении 297 Fc-области (по системе EU), что приводит к агликозилированию домена CH2. Цистеины на внешней поверхности растворимых доменов CD40L заменяли на серин (эквивалентные C194 положения в CD40L, как показано в SEQ ID NO: 1), получая SEQ ID NO: 31 (белок B) с C94S, C243S, C392S по сравнению с SEQ ID NO: 15 (белок A). С другой стороны, цистеины на внешней поверхности растворимых доменов CD40L заменяли на аланин (эквивалентные C194 положения в CD40L, как показано в SEQ ID NO: 1), получая SEQ ID NO: 35 (белок C) с C94A, C243A, C392A, по сравнению с SEQ ID NO: 15 (белок A). Для оценки эффекта, вызванного этими изменениями, определяли время полужизни полученных слитых с Fc белков.
Самки мышей NMRI получали 1,0 мг/кг каждого соединения (белка A/белка B/белка C) в виде однократной внутривенной инъекции болюсом. Собирали цельную кровь перед введением (до препаратов) и вплоть до 312 часов после введения исследуемых препаратов. Готовили сыворотку и хранили образцы при -80°C до определения их концентрации в сыворотке.
Определение концентрации белка A/белка B/белка C в сыворотке мышей проводили методом ELISA, определяющим индивидуальные агонисты CD40, приведенные в таблице 7. Планшеты покрывали CD40-Fc. Затем детектировали конструкции CD40-лиганд, специфически связавшиеся со своим рецептором CD40 через их Strep-теги, с помощью StrepTactin-HRP. Проводили анализы методом ELISA, используя белок A или белок B или белок C в качестве калибровочных и контрольных образцов. Данные от измерений при стандартных концентрациях использовали для построения калибровочных кривых с подгонкой по 5 параметрам. Это позволяло определить неизвестные концентрации белка A или белка B или белка C в соответствующих образцах сыворотки мышей.
Фармакокинетические параметры рассчитывали, используя средние концентрации в сыворотке и программу фармакокинетической оценки PK Solutions версии 2.0 для некомпартментного анализа фармакокинетических данных (Summit Research Services, Montrose, CO). PK Solutions представляет собой автоматизированное приложение на основе Excel, которое вычисляет фармакокинетические параметры из данных типа концентрация-время, полученных при анализе, например, биологических образцов после внутривенного или внесосудистого введения. PK Solutions рассчитывает результаты без принятия какой-либо конкретной компартментной модели.
Результаты оценки фармакокинетики приведены в таблице 9.
Таблица 9. Результаты поискового исследования PK на мышах NMRI: однократная внутривенная доза 1 мг/кг белка A/белка B/белка C
Результаты показывают, что белок B, который содержит субпоследовательность Q121-L261 с мутацией C194S, проявляет более продолжительную стабильность in vivo по сравнению с диким типом (белок A) или белком C, содержащим мутацию C194A.
Пример 8. Испытание на стабильность/агрегацию (прогностический пример)
Определяли содержание мономеров и агрегатов аналитическим методом SEC, как описано в Примере 2. Для этой конкретной цели проводили анализ в буферах, содержащих физиологические концентрации солей при физиологическом рН (например, 0,9% NaCl, pH 7,4; PBS, pH 7,4). Типичный анализ агрегации проводили на колонке Superdex 200 (GE Healthcare). Эта колонка разделяет белки в диапазоне от 10 до 800 кДа.
Для определения кажущейся молекулярной массы очищенных слитых полипептидов в нативных условиях на колонку Superdex 200 наносили стандартные белки с известной молекулярной массой. Исходя из объема элюирования стандартных белков, строили калибровочную кривую и рассчитывали кажущуюся молекулярную массу очищенных слитых белков с неизвестной молекулярной массой на основе объема элюирования.
При анализе методом SEC растворимого, неагрегированного белка обычно проявляется отчетливый одиночный пик белка при определенном объеме элюирования (который измеряется по OD при 280 нм или OD при 214 нм). Этот объем элюирования соответствует кажущейся нативной молекулярной массе данного белка. Что касается определения “мономера” в случае слитых с Fc белков, то сборка из двух полипептидных цепей управляется Fc-частью белка, а функциональной единицей служит белок, состоящий из двух цепей. Эта единица, содержащая две соединенные с Fc полипептидные цепи, определяется как “мономер” в случае слитых с Fc белков независимо от того, что они представляют собой димеризованные одноцепочечные слитые полипептиды.
Если происходит агрегация белка, то при анализе методом SEC появляются дополнительные пики белка с меньшими объемами удерживания. В качестве зародышей агрегации могут служить белки-олигомеры, а высокое содержание олигомеров может приводить к агрегации белка. Олигомеры с большой молекулярной массой и агрегаты элюируются в пустом объеме колонки Superdex 200 и их невозможно анализировать методом SEC в отношении их нативной молекулярной массы.
Очищенные препараты слитых белков-агонистов рецептора CD40 предпочтительно должны содержать только заданный мономерный белок и лишь очень небольшое количество олигомерного белка. Степень агрегации/олигомеризации конкретного препарата слитого белка-агониста рецептора CD40 определяется на основании анализа SEC путем вычисления площади пиков на графике OD280 для данного мономера и фракции олигомеров/агрегатов, соответственно. Исходя из общей площади пиков, содержание мономера данного белка рассчитывается следующим образом:
содержание мономера [%] = [площадь пика мономерного белка]/[общая площадь пиков] ×100.
В настоящем изобретении под определение растворимого белка подходят белковые препараты очищенных белков-агонистов рецептора CD40 в буфере с физиологической концентрацией солей при физиологическом рН, которые имеют содержание заданного растворимого белка > 90% в типичном диапазоне концентрации белка от 0,2 до 10,0 мг/мл.
Пример 9. Запуск сигнализации CD40 агонистами рецептора CD40 повышает экспрессию маркеров активации на M2-поляризованных макрофагах
Макрофаги типа M2 характеризуются слабой экспрессией таких маркеров активации/молекул активации T-клеток, как CD83, CD86 и HLA, и сильной экспрессией таких иммунорегуляторных молекул, как IL-10. Поэтому макрофаги типа M2 часто называют проопухолевыми в отличие от “противоопухолевых” макрофагов типа M1. Мы решили проверить, может ли обработка белком B (SEQ ID NO: 31) усилить развитие макрофагов типа M1 в обычных условиях M2-поляризации. Для этого выделяли и очищали мононуклеарные клетки периферической крови человека (PBMCs) из лейкоцитной пленки, полученной от здоровых добровольцев, используя Ficoll-Hypaque (Sigma) в соответствии с инструкциями производителя. Выделяли моноциты при культивировании РВМСs в среде RPMI в 12-луночных планшетах в течение 2 ч при 37°C. Моноциты инкубировали в условиях M2-поляризации, в присутствии IL-4 (50 нг/мл) и IL-10 (50 нг/мл), или в одной лишь среде в течение 3 дней. При этой инкубации в половину лунок добавляли белок B (50 нг/мл) либо контрольную среду. На 3-й день суспензии клеток окрашивали с помощью коктейля из моноклональных антител, включающего CD206, CD163, CD86, CD83, HLA-DR и CD4 (BioLegend, eBioscience или BD Biosciences). Для устранения мертвых клеток из анализа использовали DAPI (4′,6-диамидино-2-фенилиндол, дигидрохлорид) (ThermoFisher) в соответствии с инструкциями производителя. Клетки анализировали на проточном цитометре Guava Easycyte 12 (Merck Millipore). Используя изотипичные контроли, проверяли качество антител и проводили стробирование (gating). Для анализа данных по проточной цитометрии использовали программное обеспечение Tree Star FlowJo и Guava InCyte. Экспрессию определяли количественно по секторам (gates) и средней интенсивности флуоресценции (MFI). Обработка IL-4 и IL-10 (M2-поляризация макрофагов) увеличивала экспрессию CD206 и CD163, классических маркеров макрофагов типа M2, на моноцитах (см. таблицу 10). Напротив, одновременная обработка белком B уменьшала экспрессию CD206 и CD163 с 37% до 22%. CD86 (B7.2) является классической костимулирующей T-клетки молекулой и партнером по связыванию CD28, тогда как CD83 является маркером созревания антиген-презентирующих клеток. Важно отметить, что обработка белком B повышала совместную экспрессию CD86 и CD83 с 5% до 20% по сравнению с одними лишь IL-4/IL-10. Кроме того, после обработки белком B повышалась экспрессия HLA-DR,DP с 94 до 162 MFI по сравнению с одними лишь IL-4/IL-10. Эти результаты показывают, что обработка белком B повышает уровень активации M2-поляризованных макрофагов и делает их более сильными антигенпрезентирующими клетками.
Таблица 10. Условия M2-поляризации: IL-4 (50 нг/мл) и IL-10 (50 нг/мл) в течение 3 дней
ные моноциты
ные моноциты с 50 нг/мл scCD40L-RBD-Fc
Пример 10. Обработанные агонистами рецептора CD40, M2-поляризованные макрофаги являются более сильными антигенпрезентирующими клетками для активации наивных T-клеток CD4+ в аллогенной системе совместного культивирования
Макрофаги типа М2 характеризуются слабой способностью к стимуляции T-клеточных реакций из-за низкой экспрессии HLA и костимулирующих молекул (например, CD86). Мы хотели проверить, может ли обработка белком B повысить эту способность у макрофагов типа M2. Для этого получали макрофаги типа M2, как описано выше, с помощью IL-10 и IL-4 (по 50 нг/мл). Выделяли наивные T-клетки CD4+ из РВМСs от второго (аллогенного) донора с помощью набора для выделения наивных T-клеток CD4+ Kit II (Miltenyi) в соответствии с инструкциями производителя. T-клетки метили с помощью набора CellTrace CFSE Cell Proliferation Kit (ThermoFisher) в соответствии с инструкциями производителя. К наивным T-клеткам CD4+ добавляли моноциты, прошедшие обработку в течение 3 дней, в соотношении 10 лимфоцитов на 1 моноцит. Через 3 дня измеряли пролиферацию и дробление (рост перед делением клеток) T-клеток, используя CFSE и прямое рассеяние света (FSC), соответственно. Лишь 2% T-клеток, инкубированных в одной лишь среде, проявляли признаки пролиферации (разбавление CFSE) или дробления (повышение FSC) (см. таблицу 11). Напротив, 23% T-клеток, инкубированных с нестимулированными аллогенными моноцитами, проявляли признаки активации. Инкубация T-клеток с M2-поляризованными макрофагами снижала T-клеточный ответ до 16%. Интересно, что добавление белка B в условиях M2-поляризации усиливала способность аллогенных макрофагов и ответ отмечался у 31% T-клеток. Эти данные свидетельствуют, что обработка моноцитов AGP1233 в обычных условиях M2-поляризации ведет к получению более сильных антиген-презентирующих клеток.
Таблица 11. Условия M2-поляризации: IL-4 (50 нг/мл) и IL-10 (50 нг/мл) в течение 3 дней
Пример 11. Запуск сигнализации CD40 гексавалентным агонистом рецептора CD40 наиболее эффективно повышает экспрессию маркеров активации и уменьшает развитие макрофагов типа M2 после культивирования с очищенными моноцитами человека
Для проверки эффективности кластеризации рецепторов и нисходящей сигнализации сравнивали гексавалентный агонист белок B по изобретению с двумя гомотримерными тривалентными агонистами рецептора CD40, представляющими распространенные инженерные концепции, известные в данной области. Белок X2 (SEQ ID NO: 39) представляет собой гомотримерный, нестабилизированный CD40L-RBD сам по себе, а белок X (SEQ ID NO: 38) - гомотримерный CD40L-RBD, стабилизированный C-концевым слитым тримеризационным каркасом, происходящим из бактериофага RB69. Поскольку мы показали, что продуктивная сигнализация рецептора CD40 вызывает повышающую регуляцию маркеров активации и усиление развития макрофагов типа M1, мы очищали моноциты человека из лейкоцитной пленки, как описано выше. Очищенные моноциты инкубировали в среде с добавлением трех различных конструкций (см. таблицу 12) при трех различных концентрациях (10, 100 и 1000 нг/мл) в течение 3 дней, а затем проводили анализ клеток методом проточной цитометрии на экспрессию маркеров активации и фенотипа. Обработка гексавалентным белком B при всех трех концентрациях вызывала зависимое от дозы повышение экспрессии CD86 (как по MFI, так и по содержанию положительных) по сравнению с контролем. Напротив, ни одна из концентраций тривалентного белка X2 не вызывала отличий от контроля. В случае стабилизированного каркасом RB69 тривалентного белка X только самая высокая концентрация вызывала небольшое повышение экспрессии CD86. Кроме того, такой же эффект соединения и дозы отмечался и с экспрессией HLA-DR,DP, что подтверждает, что даже небольшие дозы гексавалентной конструкции достаточны для кластеризации рецепторов и продуктивной сигнализации, тогда как тривалентные конструкции не проявляют или проявляют низкую активность при очень высоких концентрациях. Наконец, примерно у 20% моноцитов в среде обычно через 3 дня усиливается экспрессия CD206 и CD163, что указывает на появление макрофагов типа M2. При обработке гексавалентным белком B при всех трех концентрациях это снижалось до менее 3%. В соответствии с данными по маркерам активации, только при высокой концентрации тривалентного белка X проявлялось кое-какое снижение макрофагов типа M2. В совокупности эти данные свидетельствуют о превосходной биологической активности белка B по изобретению.
Таблица 12. Моноциты культивировали 3 дня в указанных условиях
и CD163+ (типа M2)
Изобретение также относится к следующим пунктам 1-22
1. Белок-агонист рецептора CD40, включающий полипептид с аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 15 и 25-35.
2. Белок-агонист рецептора CD40, включающий два полипептида, каждый из которых имеет аминокислотную последовательность, приведенную в SEQ ID NO: 27, 28, 29, 30, 32 или 34.
3. Белок-агонист рецептора CD40 по п. 2, при этом два полипептида соединяются ковалентно через три межцепочечные дисульфидные связи, образующиеся между остатками цистеина 453, 459 и 462 каждого полипептида.
4. Белок-агонист рецептора CD40 по п. 2 или 3, при этом один или несколько остатков аспарагина в положениях 147 и 296 полипептида/полипептидов являются N-гликозилированными.
5. Белок-агонист рецептора CD40 по п. 2 или 3, при этом остатки аспарагина в обоих положениях 147 и 296 полипептида/полипептидов являются N-гликозилированными.
6. Белок-агонист рецептора CD40 по п. 1-5, при этом полипептид/полипептиды подвергаются дальнейшей посттрансляционной модификации.
7. Белок-агонист рецептора CD40 по п. 6, при этом посттрансляционная модификация включает превращение N-концевого глутамина в пироглутамат.
8. Фармацевтическая композиция, содержащая белок-агонист рецептора CD40 по любому из п.п. 1-7 и один или несколько фармацевтически приемлемых носителей, разбавителей, наполнителей и/или адъювантов.
9. Молекула нуклеиновой кислоты, кодирующая белок-агонист рецептора CD40 по п. 1.
10. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п. 9.
11. Клетка, содержащая молекулу нуклеиновой кислоты по п. 9.
12. Клетка по п. 11, которая является эукариотической клеткой.
13. Клетка по п. 11, при этом клетка является клеткой млекопитающих.
14. Клетка по п. 11, при этом клетка является клеткой яичников китайского хомячка (CHO).
15. Способ лечения лица, страдающего заболеванием или расстройством, связанным с CD40L, причем способ включает введение ему эффективного количества белка-агониста рецептора CD40 по любому из п.п. 1-7.
16. Способ по п. 15, при этом заболевание или расстройство выбрано из группы, состоящей из: опухолей, инфекционных заболеваний, воспалительных заболеваний, метаболических заболеваний, аутоиммунных заболеваний, дегенеративных заболеваний, заболеваний, связанных с апоптозом, и отторжения трансплантатов.
17. Способ по п. 16, при этом опухоли представляют собой солидные опухоли.
18. Способ по п. 16, при этом опухоли представляют собой лимфатические опухоли.
19. Способ по п. 16, при этом аутоиммунные заболевания представлены ревматоидными заболеваниями или артритными заболеваниями либо ревматоидными и артритными заболеваниями.
20. Способ по п. 16, при этом заболевание представлено ревматоидным артритом.
21. Способ по п. 16, при этом дегенеративное заболевание представлено нейродегенеративным заболеванием.
22. Способ по п. 21, при этом нейродегенеративное заболевание представлено рассеянным склерозом.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОДНОЦЕПОЧЕЧНЫЕ БЕЛКИ-АГОНИСТЫ TRAIL-РЕЦЕПТОРА | 2015 |
|
RU2699285C2 |
| TRAIL R2-СПЕЦИФИЧЕСКИЕ МУЛЬТИМЕРНЫЕ СКАФФОЛДЫ | 2011 |
|
RU2628699C2 |
| БИОЛОГИЧЕСКИ АКТИВИРУЕМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ОСНОВЕ ЦИТОКИНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2819307C2 |
| CD40L-СПЕЦИФИЧНЫЕ КАРКАСНЫЕ СТРУКТУРЫ, ПРОИСХОДЯЩИЕ ИЗ Tn3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2704992C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗЫВАЕМОЙ ВИРУСОМ ГЕПАТИТА В | 2019 |
|
RU2777056C2 |
| НОВЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С CD40 И FAP | 2018 |
|
RU2766234C2 |
| ХИМЕРНЫЕ БЕЛКИ НА ОСНОВЕ CSF1R | 2018 |
|
RU2792239C2 |
| АНТАГОНИСТЫ АКТИВИНА-ActRIIa-Fc И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2473362C2 |
| АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2609647C2 |
| ОДНОВАЛЕНТНЫЕ МОДУЛИ-ПЕРЕНОСЧИКИ ЧЕРЕЗ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР | 2014 |
|
RU2694659C2 |
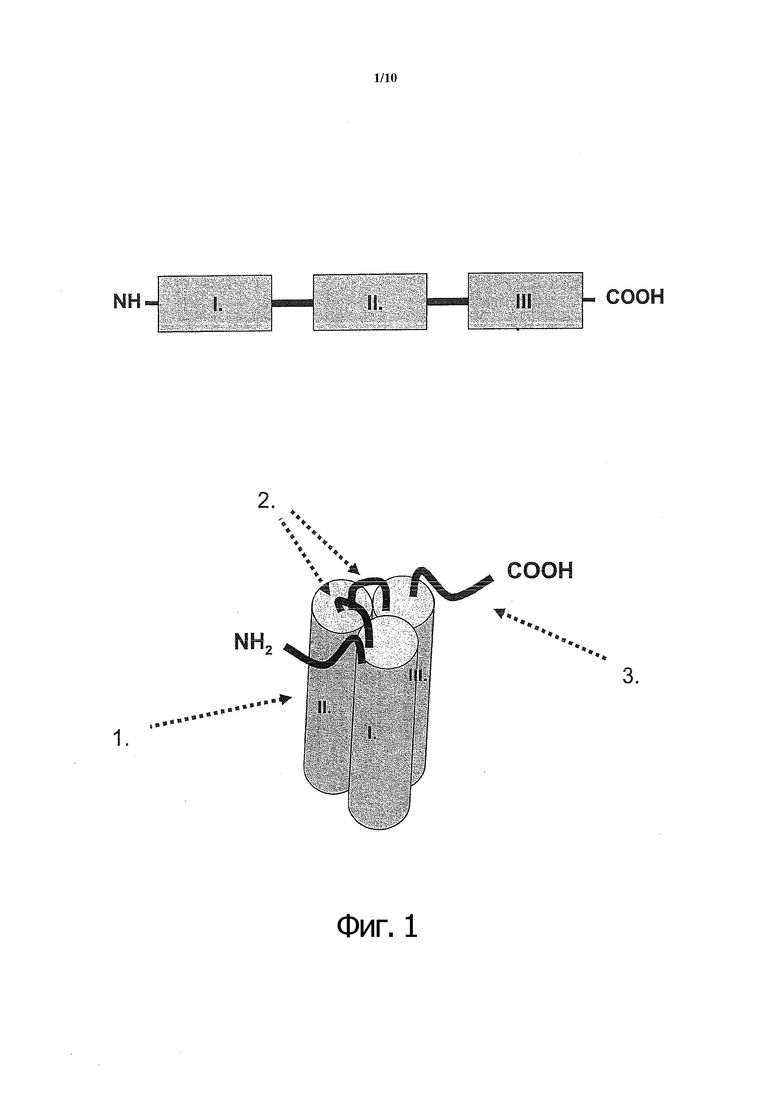
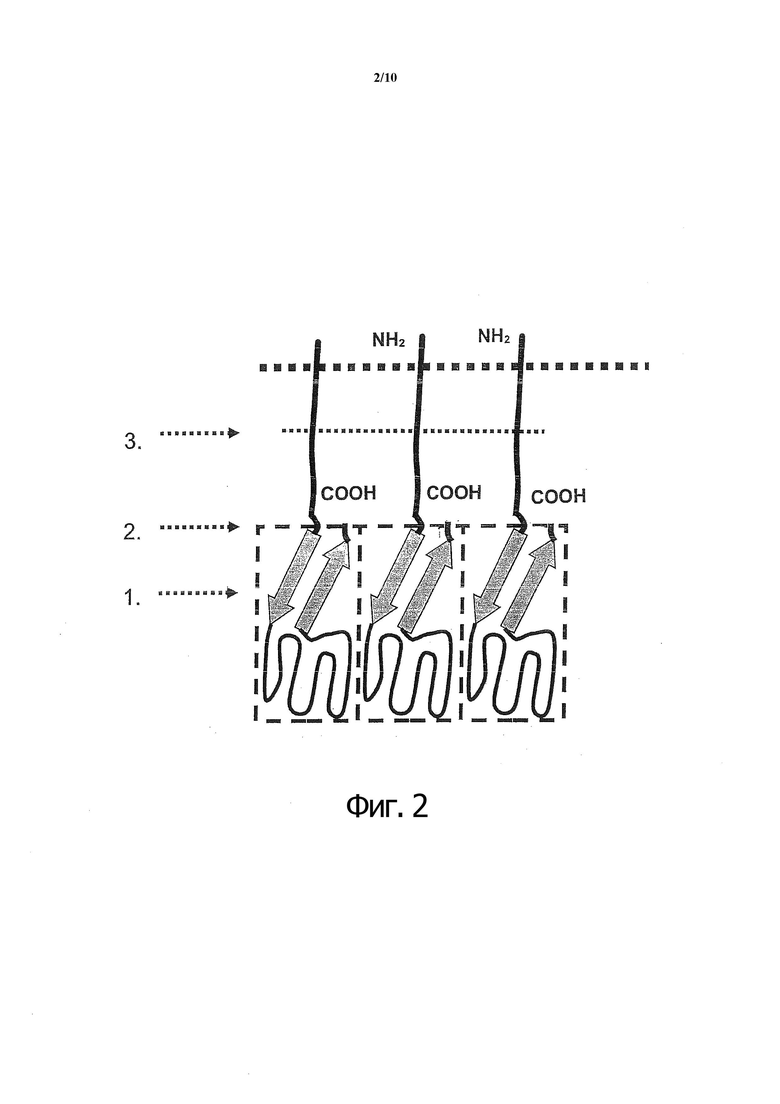
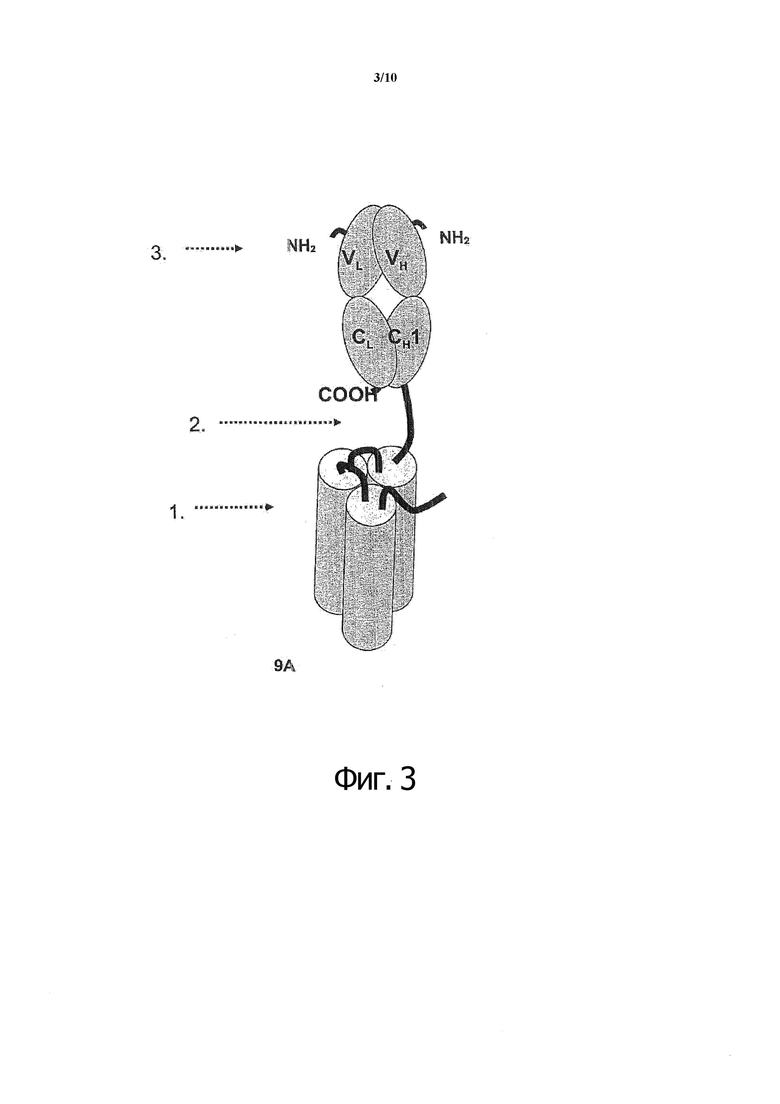
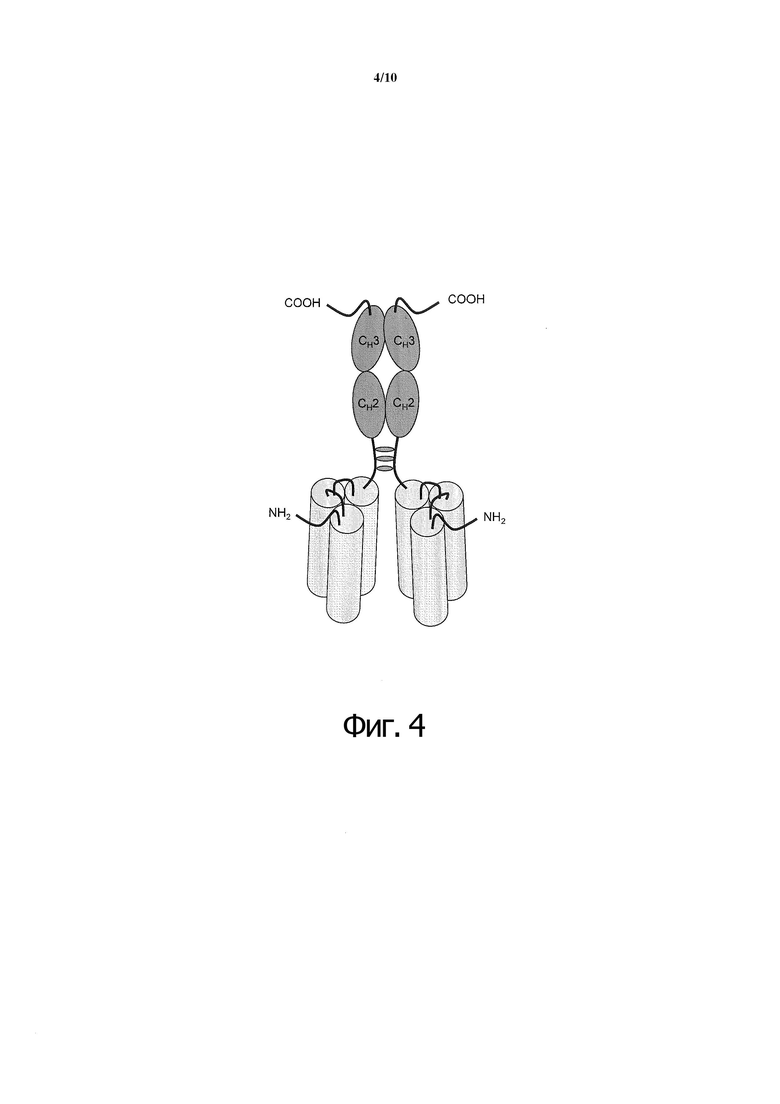
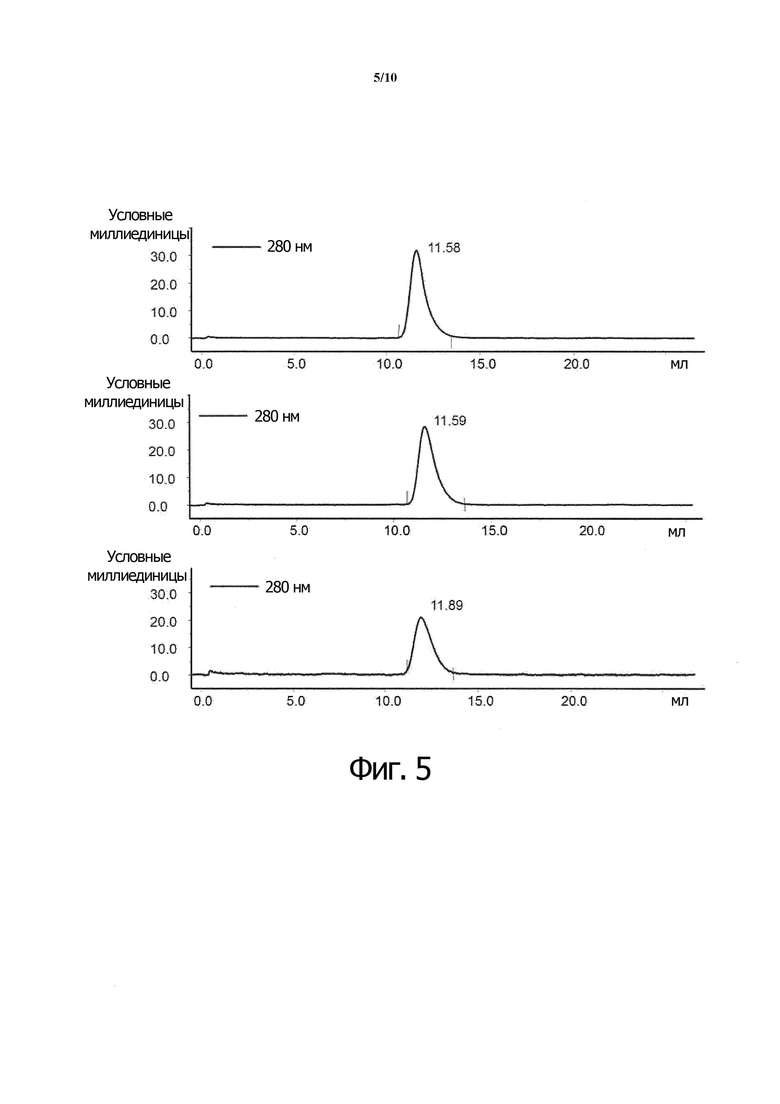
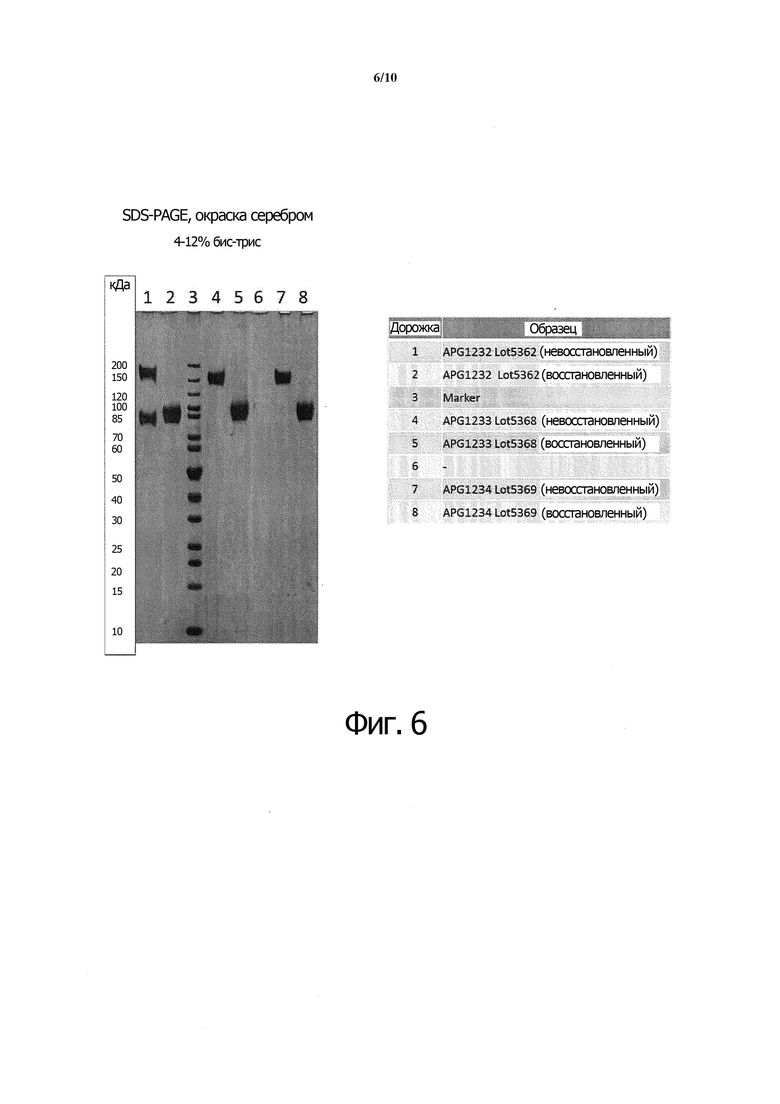
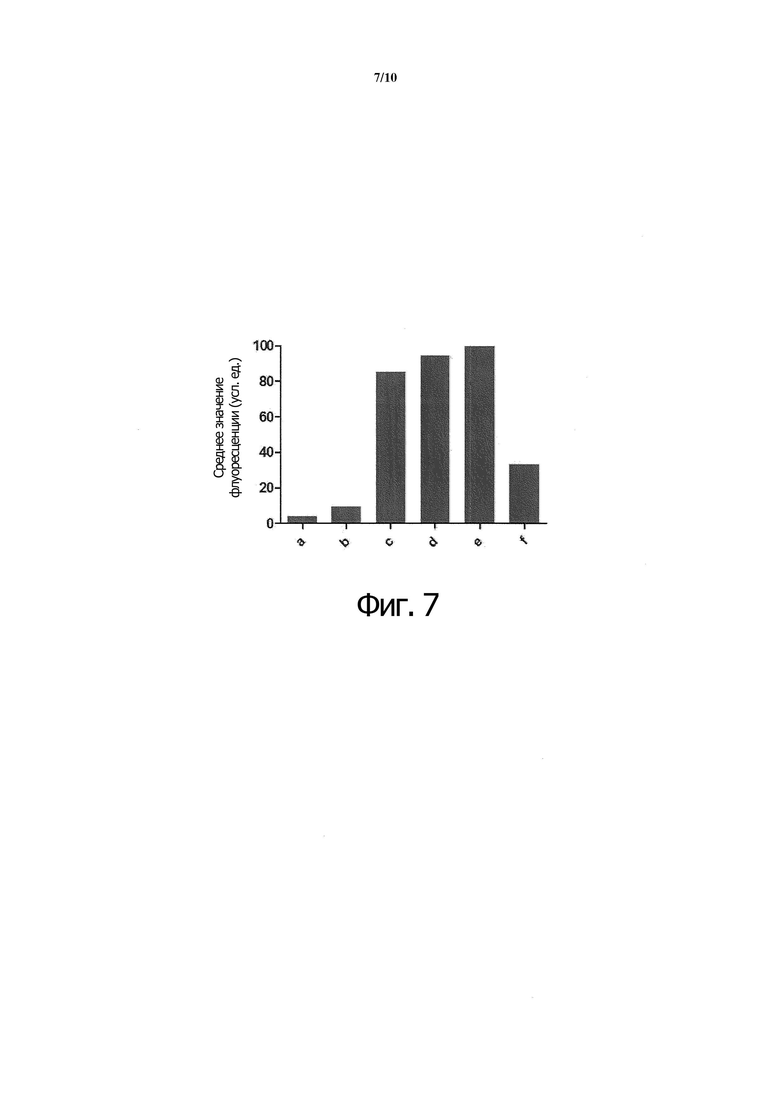
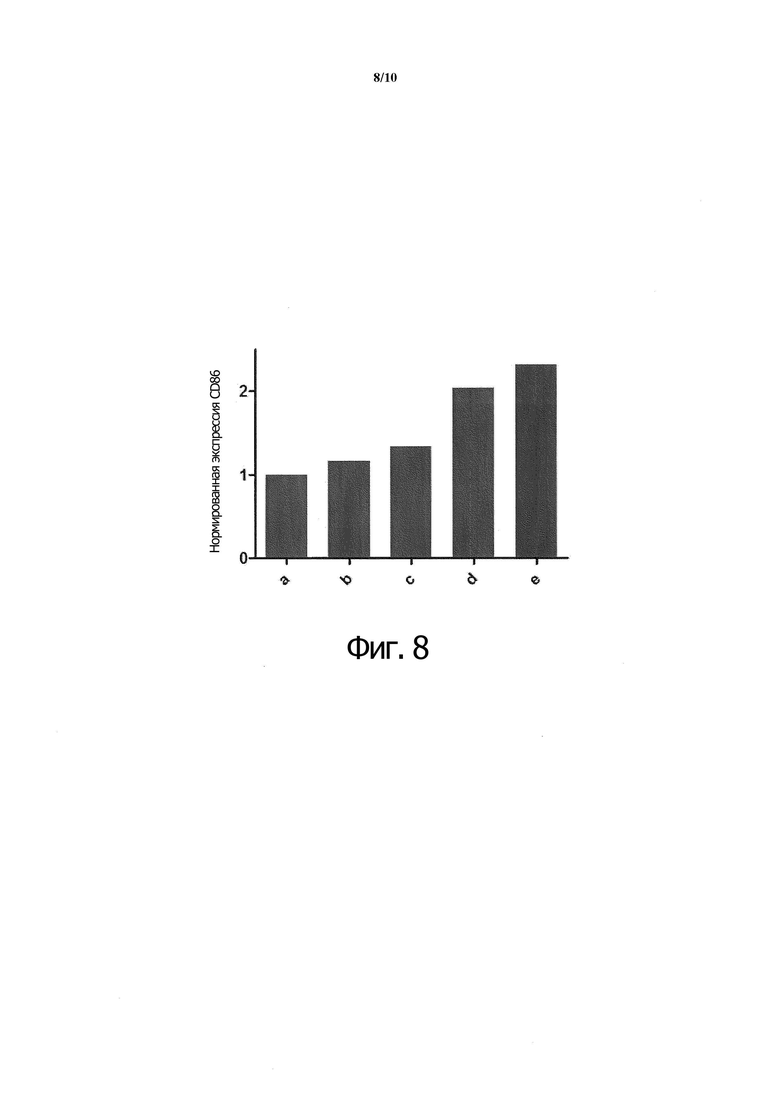
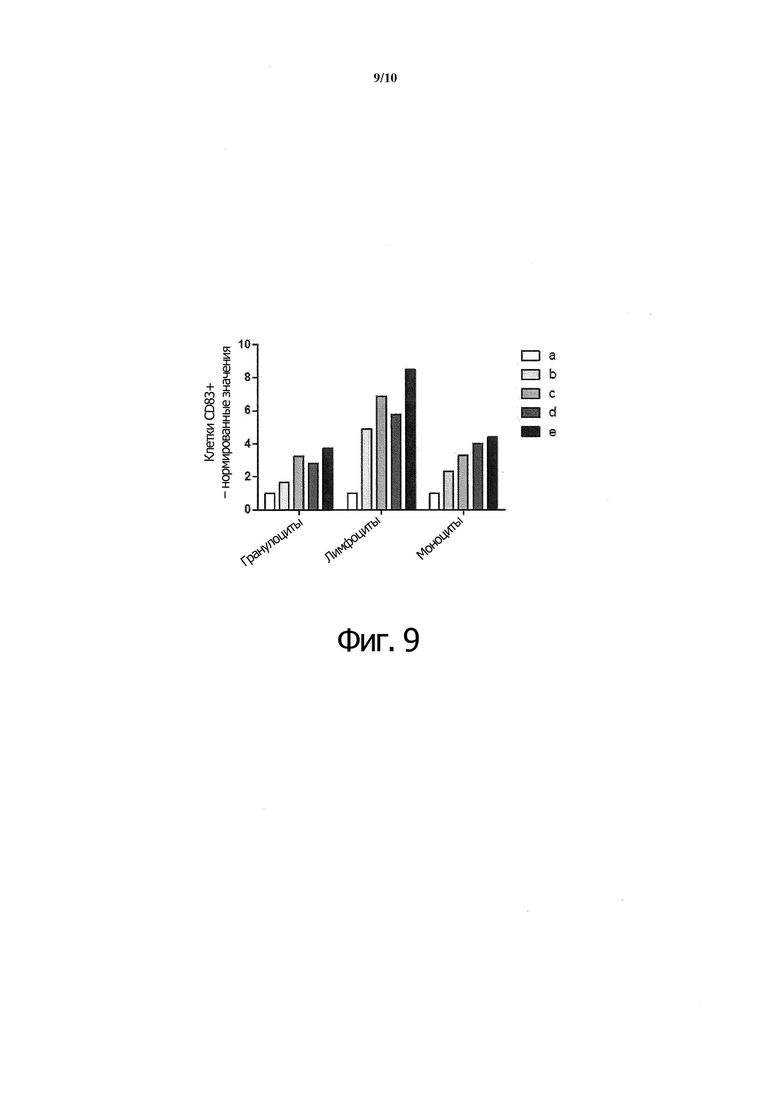
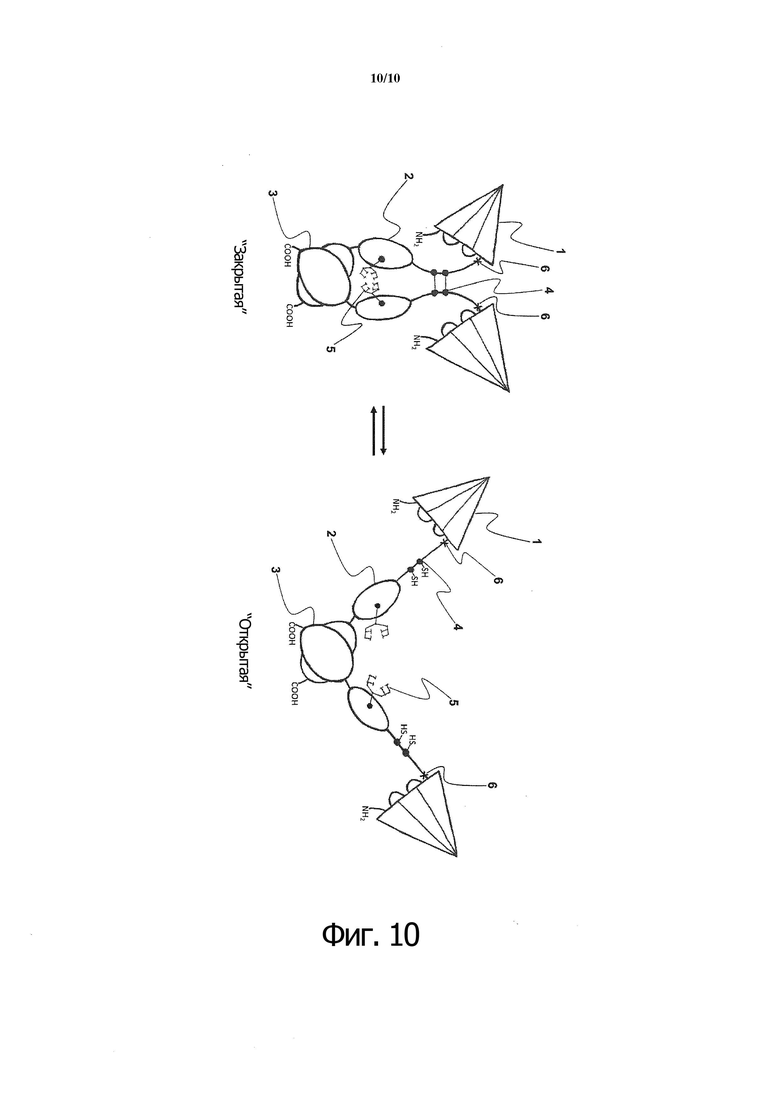
Изобретение относится к области биотехнологии, конкретно к белку-агонисту рецептора CD40, и может быть использовано в медицине. Полученный белок-агонист рецептора CD40, содержащий два одноцепочечных слитых полипептида, содержащих три растворимых домена CD40L слитых с Fc-фрагментом антитела, может быть использован для эффективного лечения или диагностики заболеваний, ассоциированных с CD40L. 6 н. и 8 з.п. ф-лы, 10 ил., 12 табл., 11 пр.
1. Белок-агонист рецептора CD40, содержащий два одноцепочечных слитых полипептида, соединенных дисульфидными связями, где полипептид включает следующие компоненты:
(i) первый растворимый домен CD40L,
(ii) первый пептидный линкер,
(iii) второй растворимый домен CD40L,
(iv) второй пептидный линкер, и
(v) третий растворимый домен CD40L, и
(vi) Fc-фрагмент антитела, причем Fc-фрагмент антитела (vi) состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 13,
причем первый и второй пептидные линкеры (ii) и (iv) состоят из аминокислотной последовательности по SEQ ID NO: 2, а Fc-фрагмент антитела (vi) слит с С-концом третьего растворимого домена CD40L (v) через шарнирный линкер с последовательностью SEQ ID NO: 16,
где каждый из растворимых доменов CD40L состоит из аминокислот 121-261 в CD40L человека по SEQ ID NO: 1, и где аминокислотная последовательность растворимого домена CD40L необязательно может содержать одну из мутаций C194S и C194A по сравнению с SEQ ID NO: 1,
где указанный белок-агонист рецептора CD40 необязательно может содержать N-концевой домен сигнального пептида,
где указанный белок-агонист рецептора CD40 необязательно может содержать C-концевой Strep-тег,
причем наиболее предпочтительно указанный белок-агонист рецептора CD40 имеет последовательность, выбранную из SEQ ID NO: 15, 27, 31, 35.
2. Белок-агонист рецептора CD40 по п. 1, который практически не подвержен агрегации.
3. Белок-агонист рецептора CD40 по любому из пп. 1, 2, в котором в первом и втором пептидных линкерах (ii) и (iv) остаток аспарагина может быть гликозилирован.
4. Белок-агонист рецептора CD40 по любому из пп. 1-3, в котором N-концевой домен сигнального пептида может иметь аминокислотную последовательность по SEQ ID NO: 17, который может содержать сайт расщепления протеазой, а Strep-тег может иметь аминокислотную последовательность SEQ ID NO: 18.
5. Белок-агонист рецептора CD40 по любому из пп. 1-4, включающий два полипептида, каждый из которых имеет аминокислотную последовательность, приведенную в SEQ ID NO: 27.
6. Белок-агонист рецептора CD40 по п.5, при этом два полипептида, каждый из которых включает аминокислотную последовательность, приведенную в SEQ ID NO: 27, ковалентно связаны тремя межцепочечными дисульфидными связями, образующимися между остатками цистеина 453, 459 и 462 каждого полипептида.
7. Белок-агонист рецептора CD40 по любому из пп. 1-6, в котором один или несколько остатков аспарагина в положениях 147 и 296 этих полипептидов являются N-гликозилированными.
8. Белок-агонист рецептора CD40 по любому из пп. 1-7, в котором полипептид/полипептиды подвергаются дальнейшей посттрансляционной модификации, где посттрансляционная модификация включает превращение N-концевого глутамина в пироглутамат.
9. Молекула нуклеиновой кислоты, кодирующая белок-агонист рецептора CD40 по любому из пп. 1-7.
10. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п. 9 в функциональной связи с контролирующей экспрессию последовательностью, причем этот вектор подходит для экспрессии в клетках млекопитающих.
11. Клетка для экспрессии белка-агониста рецептора CD40 по любому из пп.1-7, трансформированная или трансфицированная молекулой нуклеиновой кислоты по п. 9 в функциональной связи с контролирующей экспрессию последовательностью или экспрессионным вектором по п. 10, причем клетка представлена, например, прокариотической клеткой или эукариотической клеткой, предпочтительно клеткой млекопитающего или более предпочтительно клеткой человека либо клеткой яичников китайского хомячка (CHO), причем указанная клетка не является клеткой зародышевой линии клеток человека.
12. Фармацевтическая композиция для лечения и/или профилактики заболеваний, ассоциированных с CD40L, содержащая в качестве активного средства белок-агонист рецептора CD40 по любому из пп. 1-8 в терапевтически эффективном количестве, а также включающая один или несколько фармацевтически приемлемых носителей, разбавителей, наполнителей и/или адъювантов.
13. Фармацевтическая композиция по п. 12 для применения для лечения и/или профилактики пролиферативных заболеваний, инфекционных заболеваний, воспалительных заболеваний, метаболических заболеваний, аутоиммунных заболеваний или дегенеративных заболеваний.
14. Диагностическая композиция для диагностики заболеваний, ассоциированных с CD40L, содержащая в качестве активного средства белок-агонист рецептора CD40 по любому из пп. 1-8 в эффективном количестве, а также включающая один или несколько фармацевтически приемлемых носителей, разбавителей, наполнителей и/или адъювантов.
| WO 2010010051, 28.01.2010 | |||
| WO 2013136193, 19.09.2013 | |||
| US 2010303811, 02.12.2010 | |||
| SEYAMA K | |||
| et al., Mutations of the CD40 ligand gene and its effect on CD40 ligand expression in patients with X-linked hyper IgM syndrome, Blood, 1998, V | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| ALLEN R | |||
| C | |||
| et al., CD40 ligand gene defects responsible for X-linked hyper-IgM syndrome, | |||
Авторы
Даты
2021-04-01—Публикация
2016-05-04—Подача