Изобретение относится к химической промышленности, а именно к способу получения барбитуровой кислоты, которая широко применяется в тонком органическом синтезе и интересна тем, что может давать большое количество производных, применяемые в фармакологии. Также натриевые или калиевые соли барбитуровой кислоты используются как добавка в реактивное топливо для регулирования его скорости горения.
Перед авторами изобретения стояла задача разработать способ получения барбитуровой кислоты, который позволял бы простыми технологическими приемами быстро осуществлять реакцию и получать продукт с высоким выходом с минимальным количеством отходов.
Известен способ получения барбитуровой кислоты конденсацией малонового эфира с мочевиной в абсолютированном этаноле в присутствии этилата натрия («Синтезы органических препаратов» Сборник 2, перевод с англ. под ред. акад. Б.А. Казанского, 1949, 655 с). В реакторе растворяют натрий в абсолютированном этиловом спирте и последовательно добавляют диэтиловый эфир малоновой кислоты и предварительно приготовленный горячий раствор мочевины в этаноле. Реакция протекает 7 часов при атмосферном давлении и температуре 110°С. Выход барбитуровой кислоты составляет 72,0-78,0 мас. %.
В патенте Кореи 100387695, опубликованного 03.06.2003 г, заявлен способ получения барбитуровой кислоты конденсацией малонового эфира с мочевиной в присутствии метилата натрия в метаноле, в основу которого положен способ, описанный в Organic Synthesis Coll.,vol. II, p. 60, 1959, который полностью аналогичен вышеприведенному источнику. Растворяют натрий в метаноле, добавляют горячий раствор мочевины в метаноле и медленно прикапывают диэтиловый эфир малоновой кислоты. После протекания реакции выход барбитуровой кислоты составляет 72-78,0 мас. %. В патенте представлен усовершенствованный способ выделения барбитуровой кислоты, позволяющий получать продукт с высокой степенью чистоты.
Таким образом, основными недостатками известных способов получения барбитуровой кислоты при атмосферном давлении являются продолжительность синтеза и низкий выход барбитуровой кислоты.
Прототипом предлагаемого изобретения является способ получения барбитуровой кислоты путем конденсации диэтилового эфира малоновой кислоты с мочевиной в среде этиленгликоля в присутствии метилата натрия при температуре 110°С в течение 6 часов (патент США №20050027120, опубл. 03.02.2005). Данный способ обеспечивает получение барбитуровой кислоты с выходом 70 мас. %.
Недостатками заявленного в прототипе способа получения барбитуровой кислоты являются длительность реакции синтеза, низкий выход и образование большого количества отходов в виде загрязненного этиленгликоля.
В научно-технической литературе отмечается, что синтез барбитуровой кислоты осуществляется в абсолютированных спиртах, но не в одном из источников не указаны численные значения содержания влаги в них, тем более не приводятся численные значения содержания воды в других исходных веществах, участвующих в реакции.
Целью данного изобретения является упрощение способа получения барбитуровой кислоты, уменьшение продолжительности времени реакции конденсацией мочевины с диэтиловым эфиром малоновой кислоты при высоком выходе готового продукта.
Для достижения поставленной цели в способе получения барбитуровой кислоты, включающем конденсацию диэтилового эфира малоновой кислоты с карбамидом при температуре 85-95°С, фильтрацию реакционной массы, водно-метанольную промывку натриевой соли барбитуровой кислоты от примесей и выделение барбитуровой кислоты кислотной нейтрализацией ее натриевой соли, реакцию синтеза осуществляют в абсолютированной спиртовой среде (общее содержание влаги реакционной массы меньше 0,18 масс. %) в течение 30-90 минут в присутствии метилата натрия, в качестве катализатора, при мольном соотношении диэтилового эфира малоновой кислоты, мочевины, метилата натрия и спирта, равном 1:(1,1-1,2):(1,1-1,2):(17-22). В качестве катализатора можно использовать как метилат натрия, синтезированный непосредственно из металлического натрия и абсолютированного метанола, так и коммерческий метилат натрия с содержанием основного вещества не менее 94,5 масс. % и суммы карбоната и гидроокиси натрия не более 5,5 масс. %. Конденсацию диэтилового эфира малоновой кислоты с мочевиной в выше указанных условиях можно проводить в автоклаве, выдерживающем давление 3-4 атм. паров растворителя при заданной температуре.
В качестве спиртовой среды в реакции синтеза можно использовать абсолютированные метанол, смесь метанола с этанолом.
Сущность изобретения иллюстрируется нижеприведенными примерами.
Пример №1.
Синтез барбитуровой кислоты проводят в 1 л автоклаве, снабженном манометром, механическим перемешивающим устройством и термостати-рующим оборудованием. В реакционный сосуд при комнатной температуре одновременно загружают 100,0 г (0,63 моль) диэтилового эфира малоновой кислоты, 43,2 г (0,76 моль) карбамида, 39,1 г (0,72 моль) метилата натрия, 387,07 г (12,1 моль) метанола. Общее содержание влаги в реакционной массе 0,05 масс. %. Автоклав герметизируют, включают перемешивающее устройство, смесь нагревают до 90°С и перемешивают при указанной температуре 90 минут. За этот промежуток времени давление в реакционной массе поднимается до 3,5 атм. Затем реактор охлаждают до 15-35°С, полученную суспензию отфильтровывают от раствора метанола. Осадок промывают метанолом и водой и выделяют барбитуровую кислоту путем подкисления его водного раствора 10-36%-ной соляной кислотой до рН=2,0-2,5. Осадок барбитуровой кислоты отфильтровывают, промывают небольшим количеством воды и сушат под вакуумом при температуре 80-95°С.
Получают 65,6 г барбитуровой кислоты (белые кристаллы с температурой плавления 246-248°С). Выход 82,0% масс.
Примеры №№2-11.
Способ получения барбитуровой кислоты по примеру 1, только меняются условия осуществления реакции синтеза. Общее содержание воды в реакционной системе, концентрационные, температурно-временные параметры реакций конденсации диэтилового эфира малоновой кислоты с карбамидом и выходы барбитуровой кислоты представлены в таблице.
Пример №12 по прототипу.
Примеры №№13-22 для сравнения.
Способ получения барбитуровой кислоты по примеру 1, только меняются условия осуществления реакции конденсации за пределами заявляемых. Концентрационные и температурно-временные параметры реакции конденсации диэтилового эфира малоновой кислоты с карбамидом и выходы барбитуровой кислоты представлены в таблице.
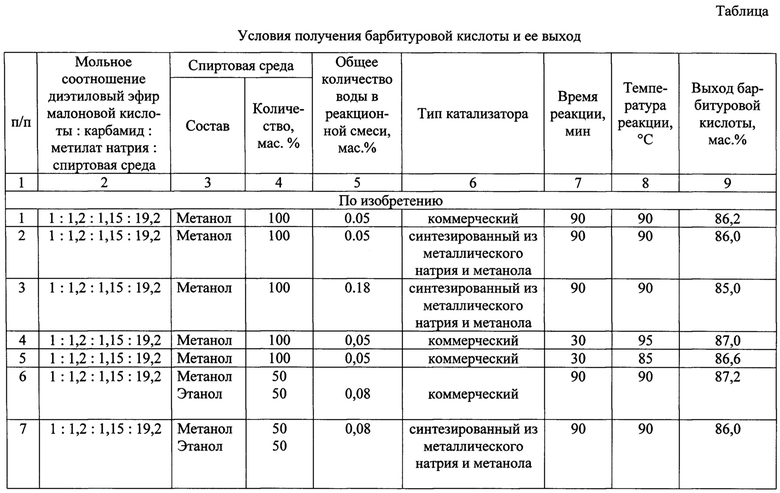
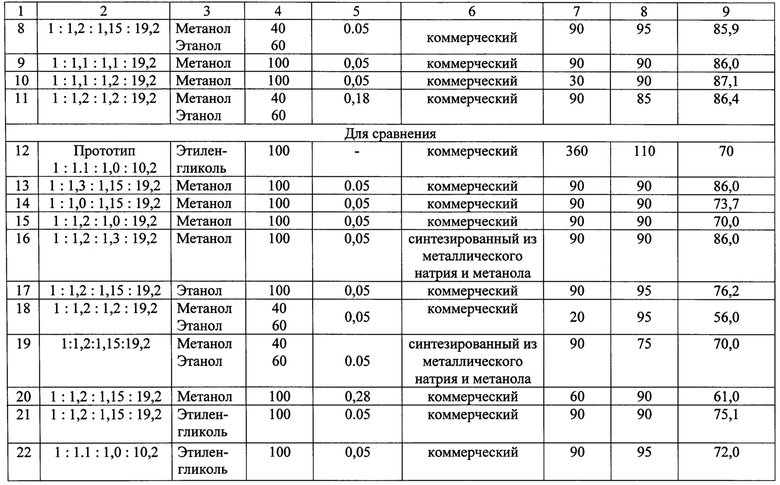
Способ получения барбитуровой кислоты конденсацией диэтилового эфира малоновой кислоты с карбамидом в спиртовой среде при найденном оптимальном мольном соотношении диэтилового эфира малоновой кислоты, карбамида, метилата натрия и спиртовой среды, равном 1:(1,1-1,2):(1,1-1,2):(17-22) осуществляется за 30-90 минут, что в 4-14 раза быстрее, чем при проведении синтеза по способу, заявленного в прототипе. Выход барбитуровой кислоты составляет 86,0-87,0 масс. % (см. примеры 1-11 в сравнении с 12).
Заявляемый способ получения барбитуровой кислоты осуществляется в абсолютированной спиртовой среде (метанол, смесь метанола с этанолом). Это значительно упрощает регенерацию растворителя. Спиртовой растворитель легче регенируется, чем этиленгликоль.
Проведение реакции при мольном соотношении диэтилового эфира малоновой кислота, карбамида, метилата натрия и спиртовой среды, равном 1:(1,1-1,2):(1,1-1,2):(17-22), в абсолютированной спиртовой среде обеспечивает высокий выход барбитуровой кислоты. Снижение мольного избытка мочевины (см. пример №14), метилата натрия (см. пример №15) и увеличение влаги в реакционной системе (см. пример №20) приводит к неполной конверсии диэтилового эфира малоновой кислоты и уменьшению выхода получаемого продукта. Увеличение избытка реагентов (см. примеры №№13, 16) по сравнению с оптимальным соотношением приводит к повышению расхода сырья, но не влияет на выход барбитуровой кислоты и является нецелесообразным. В случае замены метанола или смеси метанола с этанолом на этанол (см. пример №17) или этиленгликоль (см. пример №22) приводит к существенному снижению выхода барбитуровой кислоты. Также к уменьшению выхода готового продукта приводит понижение температуры (см. пример №19) и времени (см. пример №18) синтеза.
Предлагаемый способ получения барбитуровой кислоты за счет сокращения времени проведения реакции, загрузки реагентов без дозирования при комнатной температуре, возможность использования разных спиртов, в качестве спиртовой среды и управления общего содержания воды, позволяет повысить выход барбитуровой кислоты, уменьшить трудоемкость процесса и тем самым интенсифицировать процесс.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-(БЕНЗИЛТИО)ПИРИМИДИН-4,6(1Н,5Н)ДИОНА | 2009 |
|
RU2405775C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-МЕТИЛПИРИМИДИН-4,6-(3Н, 5Н)-ДИОНА | 2012 |
|
RU2503666C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА-4-АМИНО-3-ФЕНИЛБУТАНОВОЙ КИСЛОТЫ | 1993 |
|
RU2072984C1 |
| Способ получения с - с диалкиловых эфиров малоновой кислоты | 1976 |
|
SU614742A3 |
| СПОСОБ ПОЛУЧЕНИЯ N-МОРФОЛИНОЭТИЛМЕТАКРИЛАТА | 2019 |
|
RU2714132C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-МЕТОКСИИЗОМАСЛЯНОЙ КИСЛОТЫ | 1990 |
|
RU2026855C1 |
| 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИЕ 1,3-ДИКЕТОНЫ В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ ИХ ХЕЛАТНЫХ КОМПЛЕКСОВ С ИОНАМИ МЕДИ (II) И СПОСОБ ПОЛУЧЕНИЯ 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИХ 1,3-ДИКЕТОНОВ | 2012 |
|
RU2475473C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-МЕТИЛПИРИМИДИН-4,6-(3Н,5Н)-ДИОНА | 2012 |
|
RU2503665C1 |
| Способ получения металлсодержащих полимеров аллиловых производных барбитуровых кислот | 1990 |
|
SU1801964A1 |
| НОВЫЕ ПРОИЗВОДНЫЕ БАРБИТУРОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АКТИВНОСТЬЮ ИНГИБИРОВАНИЯ МЕТАЛЛОПРОТЕАЗ | 1996 |
|
RU2177475C2 |
Изобретение относится к способу получения барбитуровой кислоты путем конденсации диэтилового эфира малоновой кислоты с карбамидом в абсолютированной спиртовой среде (метанол, смесь метанола с этанолом) при температуре 85-95°С в течение 30-90 мин, с общим содержанием влаги в реакционной системе менее 0,18% масс, в присутствии метилата натрия (синтезированного из металлического натрия и абсолютированного метанола, или коммерческого метилата натрия с содержанием основного вещества не менее 94,5% и суммы карбоната и гидроокиси натрия не более 5,5%) в качестве катализатора при мольном соотношении диэтилового эфира малоновой кислоты, карбамида, метилата натрия и спиртовой среды, равном 1:(1,1-1,2):(1,1-1,2):(17-22), фильтрацию реакционной массы и выделение барбитуровой кислоты. Технический результат - упрощение способа получения барбитуровой кислоты, уменьшение продолжительности времени конденсации мочевины с диэтиловым эфиром малоновой кислоты при высоком выходе барбитуровой кислоты. 3 з.п. ф-лы, 1 табл., 22 пр.
1. Способ получения барбитуровой кислоты путем конденсации диэтилового эфира малоновой кислоты с карбамидом в присутствии метилата натрия при температуре 85-95°С с дальнейшей фильтрацией реакционной массы и выделением барбитуровой кислоты, отличающийся тем, что реакцию проводят в абсолютированной спиртовой среде (метанол, смесь метанола с этанолом) в течение 30-90 мин, при мольном соотношении диэтилового эфира малоновой кислоты, карбамида, метилата натрия и спиртовой среды, равном 1:(1,1-1,2):(1,1-1,2):(17-22).
2. Способ по п. 1, отличающийся тем, что реагенты и растворитель вводят без дозирования при комнатной температуре и после чего при включенной мешалке температуру поднимают до заданного значения.
3. Способ по п. 1, отличающийся тем, что общее содержание влаги в реакционной системе не должно превышать 0,18% масс.
4. Способ по п. 1, отличающийся тем, что в качестве катализатора может использоваться или метилат натрия, синтезированный из металлического натрия и абсолютированного метанола, или коммерческий метилат натрия с содержанием основного вещества не менее 94,5% и суммы карбоната и гидроокиси натрия не более 5,5%.
| US 20050027120 A1, 03.02.2005 | |||
| KR 100387695 B1, 03.06.2003 | |||
| Raimon Puig-de-la-Bellacasa et al | |||
| "Diverse combinatorial design, synthesis and in vitro evaluation of new HEPT analogues as potential non-nucleoside HIV-1 reverse transcription inhibitors", European Journal of Medicinal Chemistry, 2012, P | |||
| Катодное реле | 1918 |
|
SU159A1 |
Авторы
Даты
2019-02-22—Публикация
2018-08-02—Подача