Область техники, к которой относится изобретение
Настоящее изобретение относится к полинуклеотидам, содержащимся в генах T-клеточных рецепторов (TCR) хелперных T-клеток, специфичных к раковым антигенам. В частности, настоящее изобретение относится к полинуклеотидам, кодирующим определяющую комплементарность область 3 (CDR3) каждой α-цепи и β-цепи TCR CD4+ хелперных T-клеток, специфичных к хелперному пептиду WT1, имеющему аминокислотную последовательность SEQ ID NO:123. Настоящее изобретение также относится к полипептидам, кодируемым указанными полинуклеотидами. Кроме того, настоящее изобретение относится к CD4+ T-клеткам, в которые введены гены TCR, содержащие указанные полинуклеотиды, к индукции и стимуляции WT1-специфичных цитотоксических T-клеток (WT1-специфичных CTL) с их применением, а также к лечению злокачественных опухолей с их применением и так далее.
Уровень техники
Ген WT1 (ген 1 опухоли Вильмса) представляет собой ген, который был идентифицирован как ген, ответственный за развитие опухоли Вильмса, которая является раком почки у детей (непатентные документы 1 и 2). WT1 является фактором транскрипции, имеющим структуру цинковых пальцев. Первоначально ген WT1, как предполагали, был геном-супрессором опухоли. Однако последующие исследования (непатентные документы 3, 4, 5 и 6) показали, что ген WT1 скорее функционирует как онкоген в гемопоэтических опухолях и солидных злокачественных опухолях.
Было показано, что пептидспецифические цитотоксические T-клетки (CTL) были индуцированы при стимуляции периферических мононуклеарных клеток in vitro с использованием пептида WT1, и что эти CTL повреждают опухоль и злокачественные клетки в гемопоэтических опухолях и солидных злокачественных опухолях, которые экспрессируют WT1 эндогенно. Поскольку CTL распознают пептид WT1 в форме комплекса, в котором пептид WT1 связан с молекулой MHC класса I, такой пептид WT1 отличается в соответствии с подтипом MHC класса I (патентный документ 1, непатентный документ 7, патентные документы 2, 3 и 4).
Существование хелперных Т-клеток, специфичных к раковому антигену, важно для эффективной индукции CTL (непатентный документ 8). Хелперные Т-клетки индуцируются и активируются при распознавании комплекса молекулы MHC класса II и антигенного пептида на антигенпрезентирующих клетках. Активированные хелперные Т-клетки вырабатывают цитокины, такие как IL-2, IL-4, IL-5, IL-6, или интерфероны, и способствуют пролиферации, дифференцировке и созреванию B-клеток. Активированные хелперные Т-клетки также имеют функцию стимуляции пролиферации, дифференцировки и созревания другого подтипа T-клеток (таких как Tc-клетки). Таким образом, поскольку активированные хелперные Т-клетки имеют функцию активации иммунной системы посредством стимуляции пролиферации и активации B-клеток и T-клеток, предполагается, что усиление функции хелперных Т-клеток через MHC класса II-связывающий антигенный пептид (хелперный пептид) для усиления действия противораковой вакцины может применяться в иммунотерапии рака (непатентный документ 9).
Примерами хелперных пептидов, относящихся к WT1, которые известны на настоящий момент, являются пептид, связывающийся с молекулой HLA-DRB1*04:01 (непатентный документ 10), пептид, связывающийся с молекулой HLA-DRB1*04:05, пептид, связывающийся с молекулой HLA-DRB1*15:02 (патентный документ 5), пептид, связывающийся с молекулой HLA-DRB1*04:05, молекулой HLA-DRB1*15:02, молекулой HLA-DRB1*15:01, молекулой HLA-DPB1*09:01 и молекулой HLA-DPB1*05:01 (патентный документ 6).
Однако последовательности генов T-клеточных рецепторов (TCR) антигенспецифичных CD4+ хелперных T-клеток, которые распознают хелперный пептид, до настоящего времени не были известны.
Документы из уровня техники
Патентные документы
Патентный документ 1: WO2003/106682
Патентный документ 2: WO2005/095598
Патентный документ 3: WO2007/097358
Патентный документ 4: PCT/JP2007/074146
Патентный документ 5: WO2005/045027
Патентный документ 6: WO2008/105462
Непатентные документы
Непатентный документ 1: Daniel A. Haber et al., Cell. 1990 Jun 29; 61(7):1257-69.
Непатентный документ 2: Call KM et al., Cell. 1990 Feb 9; 60(3):509-20.
Непатентный документ 3: Обзор Menke AL et al., Int Rev Cytol. 1998; 181:151-212.
Непатентный документ 4: Yamagami T et al., Blood. 1996 Apr 1; 87 (7) :2878-84.
Непатентный документ 5: Inoue K et al., Blood. 1998 Apr 15; 91(8):2969-76.
Непатентный документ 6: Tsuboi A et al., Leuk Res. 1999 May; 23(5):499-505.
Непатентный документ 7: Oka Y et al., Immunogenetics. 2000 Feb; 51(2):99-107.
Непатентный документ 8: Gao FG et al., Cancer Res. 2002 Nov 15; 62(22):6438-41.
Непатентный документ 9: Zeng G, J Immunother. 2001 May; 24(3):195-204.
Непатентный документ 10: Knights AJ et al., Cancer Immunol Immunother. 2002 Jul; 51(5):271-81.
Сущность изобретения
Задача, решаемая изобретением
Задачи, решаемые изобретением, состояли в определении последовательностей TCR генов CD4+ хелперных T-клеток, специфичных к хелперному пептиду WT1, в получении CD4+ T-клеток, в которые эти гены TCR были введены, в усилении индукции WT1- специфичных CTL с применением таких клеток, а также в лечении или профилактики развития злокачественных опухолей, и так далее.
Способы решения задачи
Авторы изобретения усиленно трудились над решением вышеуказанных задач и успешно выделили гены α-цепи и гены β-цепи TCR CD4+ хелперных Т-клеток, специфичных к хелперному пептиду WT1, и определили каждую последовательность CDR3. Кроме того, авторы изобретения ввели TCR гены, содержащие определенные таким образом последовательности, в CD4+ T-клетки и успешно повысили индукцию WT1-специфичных CTL, и вызвали повреждение WT1-экспрессирующих злокачественных клеток при использовании CD4+ T-клеток. Таким образом, авторы изобретения осуществили настоящее изобретение.
Таким образом, в настоящем изобретении предложены:
(1) Полинуклеотид (обозначенный как "полинуклеотид αCDR3"), имеющий нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1, 3, 5, 8, 10, 11, 13, 14, 16, 18, 20, 22, 23, 25, 27, 28, 30, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 56 и 58, где указанный полинуклеотид кодирует CDR3 α-цепи TCR CD4+ хелперной T-клетки, специфичной к хелперному пептиду WT1 (пептид WT1332), имеющий аминокислотную последовательность SEQ ID NO:123, или вариант этой последовательности.
(2) Полинуклеотид (обозначенный как "полинуклеотид βCDR3"), имеющий нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, 4, 6, 7, 9, 12, 15, 17, 19, 21, 24, 26, 29, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 57 и 59, где указанный полинуклеотид кодирует CDR3 β-цепи TCR CD4+ хелперной T-клетки, специфичной к пептиду WT1332.
(3) Пара полинуклеотида αCDR3 и полинуклеотида βCDR3, где каждый полинуклеотид имеет следующую нуклеотидную последовательность:
при условии, что указанная последовательность может быть соответствующей комплементарной последовательностью или вырожденной последовательностью.
(4) Ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3 в любой из пар (3).
(5) Ген TCR (4), получаемый из CD4+ T-клетки, специфичной к пептиду WT1332.
(6) Способ получения CD4+ хелперной клетки, специфичной к пептиду WT1332, включающий введение гена TCR (4) в CD4+ T-клетку.
(7) CD4+ хелперная T-клетка, получаемая способом (5).
(8) Вектор, содержащий ген TCR, который содержит полинуклеотид αCDR3 и полинуклеотид βCDR3 в любой из пар (3).
(9) Способ (6), где указанное введение выполняют с применением вектора (8).
(10) Способ усиления индукции WT1-специфичных CTL, включающий совместное культивирование CD4+ хелперной T-клетки (7) и периферической мононуклеарной клетки.
(11) WT1-специфичный CTL, получаемый способом (10).
(12) Способ лечения или профилактики злокачественной опухоли у индивида, включающий введение CD4+ хелперной T-клетки (7) индивиду.
(13) Фармацевтическая композиция для лечения или профилактики злокачественной опухоли, содержащая CD4+ хелперную T-клетку (7).
(14) Применение CD4+ хелперной T-клетки (7) для получения лекарственного средства для лечения или профилактики злокачественной опухоли.
(15) ДНК-чип, содержащий полинуклеотид αCDR3 (1), полинуклеотид βCDR3 (2) или и полинуклеотид αCDR3 (1), и полинуклеотид βCDR3 (2).
(16) Способ измерения частоты CD4+ хелперной T-клетки, специфичной к пептиду WT1332, в образце, включающий применение ДНК-чипа (15).
(17) Пептид αCDR3, кодируемый любым из полинуклеотидов αCDR3 из (1).
(18) Пептид βCDR3, кодируемый любым из полинуклеотидов βCDR3 из (2).
(19) Пара пептидов, кодируемых любой из пар полинуклеотидов из (3).
(20) Чип, содержащий пептид (17) или (18), или пару пептидов (19).
(21) Антитело против любого из пептидов из любого из (17)-(19).
(22) Способ измерения частоты CD4+ хелперной T-клетки, специфичной к пептиду WT1332, в образце, включающий применение антитела (21).
Технический результат изобретения
Согласно настоящему изобретению получена CD4+ хелперная T-клетка, в которую был введен ген TCR, имеющий нуклеотидную последовательность CDR3, определенную согласно настоящему изобретению. WT1-специфичный CTL можно индуцировать с применением указанной CD4+ хелперной T-клетки, и злокачественную опухоль можно эффективно лечить или предотвращать. Кроме того, ДНК-чип получают, используя TCR последовательности, при этом может быть измерена частота WT1332-специфичных CD4+ хелперных Т-клеток в образце.
Краткое описание фигур
[Фигура 1A] На Фигуре 1A показаны нуклеотидные последовательности CDR3 α-цепей и β-цепей TCR CD4+ хелперных Т-клеток, полученных согласно настоящему изобретению, и кодируемые ими аминокислотные последовательности CDR3. Номер в круглых скобках, помещенный на правом конце каждой последовательности, представляет собой номер SEQ ID NO в Списке последовательностей. V-ген, J-ген и J-ген описывают V область, J область и D область в индивидуальных генах, соответственно.
[Фигура 1B] На Фигуре 1B показаны нуклеотидные последовательности CDR3 α-цепей и β-цепей TCR CD4+ хелперных Т-клеток, полученных согласно настоящему изобретению, и кодируемые ими аминокислотные последовательности CDR3. Номер в круглых скобках, помещенный на правом конце каждой последовательности, представляет собой номер SEQ ID NO в Списке последовательностей. V-ген, J-ген и J-ген описывают V область, J область и D область в индивидуальных генах, соответственно.
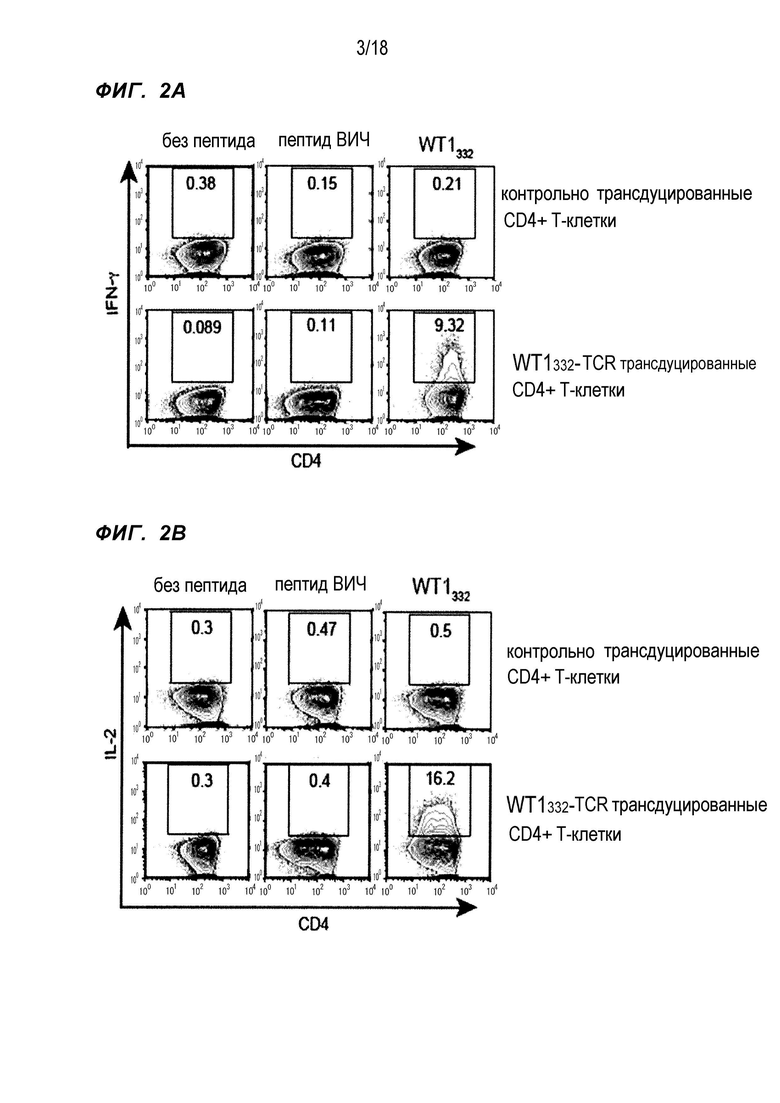
[Фигура 2A] На Фигуре 2A показана продукция интерферона-γ WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, показанные в Таблице 3.
[Фигура 2B] На Фигуре 2B показана продукция IL-2 WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, показанные в Таблице 3.
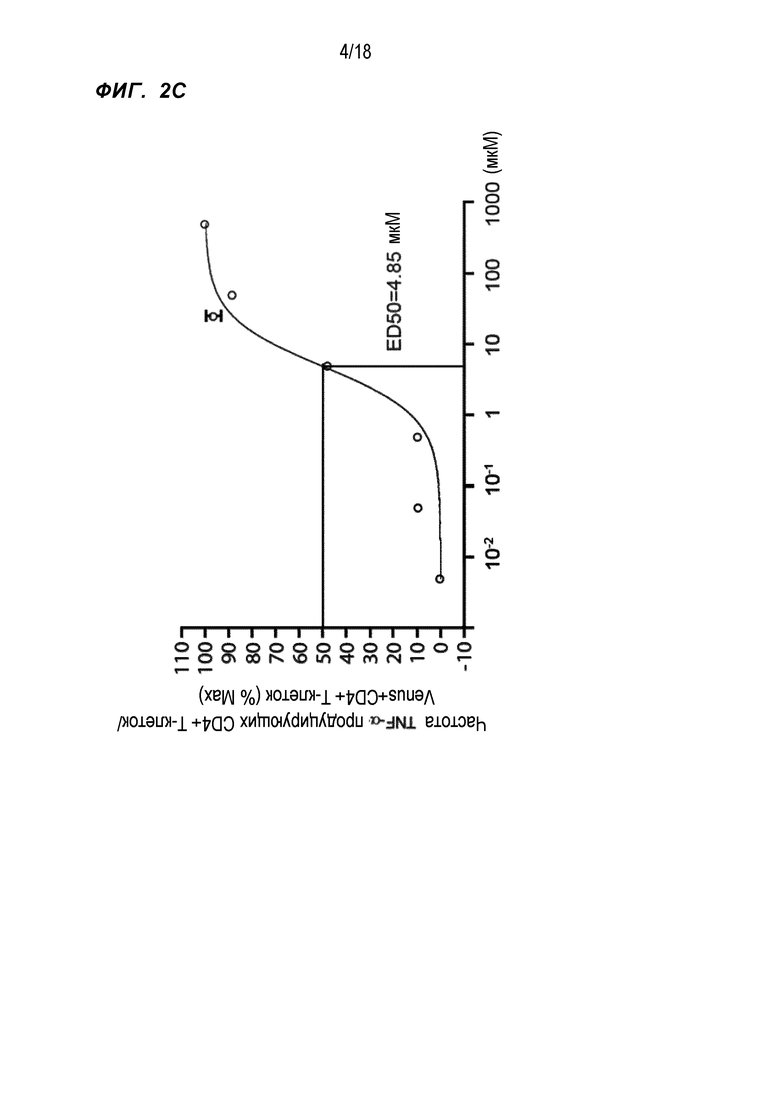
[Фигура 2C] На Фигуре 2C показан ответ с выработкой TNF-α WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, в зависимости от концентрации пептида WT1332.
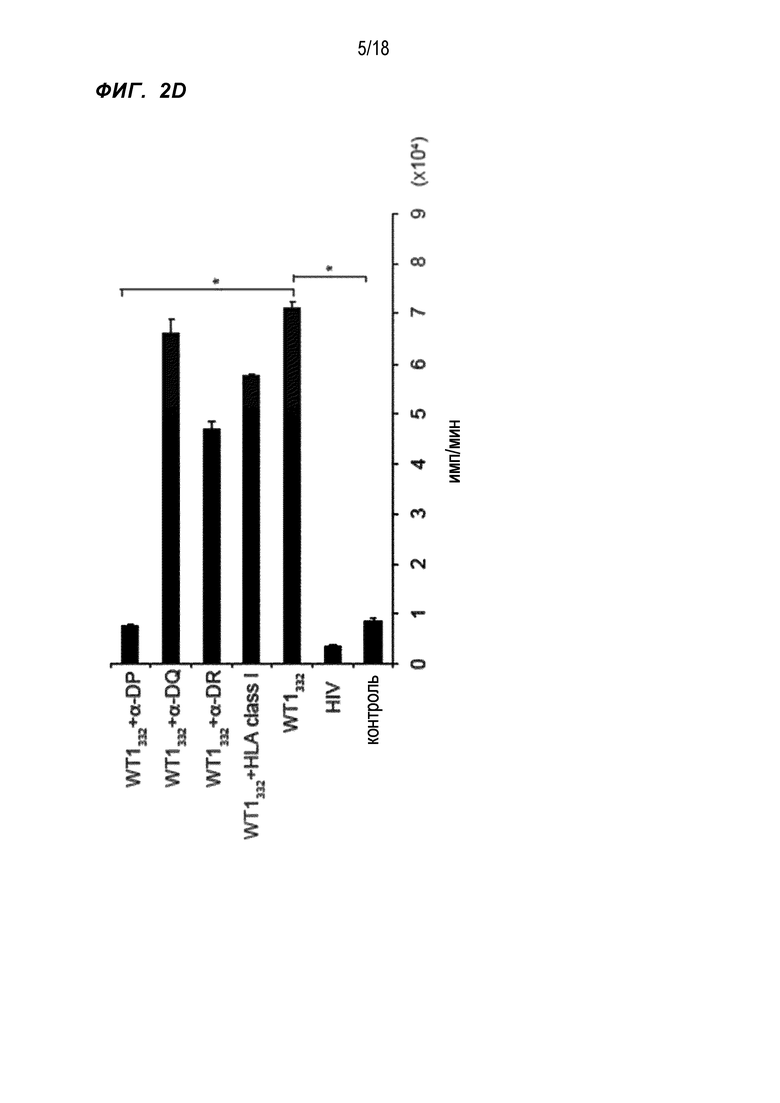
[Фигура 2D] На Фигуре 2D показана способность к пролиферации WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, в системах, в которые были добавлены несколько типов веществ. WT1332 обозначает культуру в присутствии пептида WT1332. α-DP обозначает культуру в присутствии антитела против HLA-DP. α-DQ обозначает культуру в присутствии антитела против HLA-DQ. α-DR обозначает культуру в присутствии антитела против HLA-DR. HLA класса I обозначает культуру в присутствии антитела против HLA класса I. HIV обозначает культуру в присутствии пептида ВИЧ (FRKQNPDIVIYQYMDDLYVG) (SEQ ID NO:124).
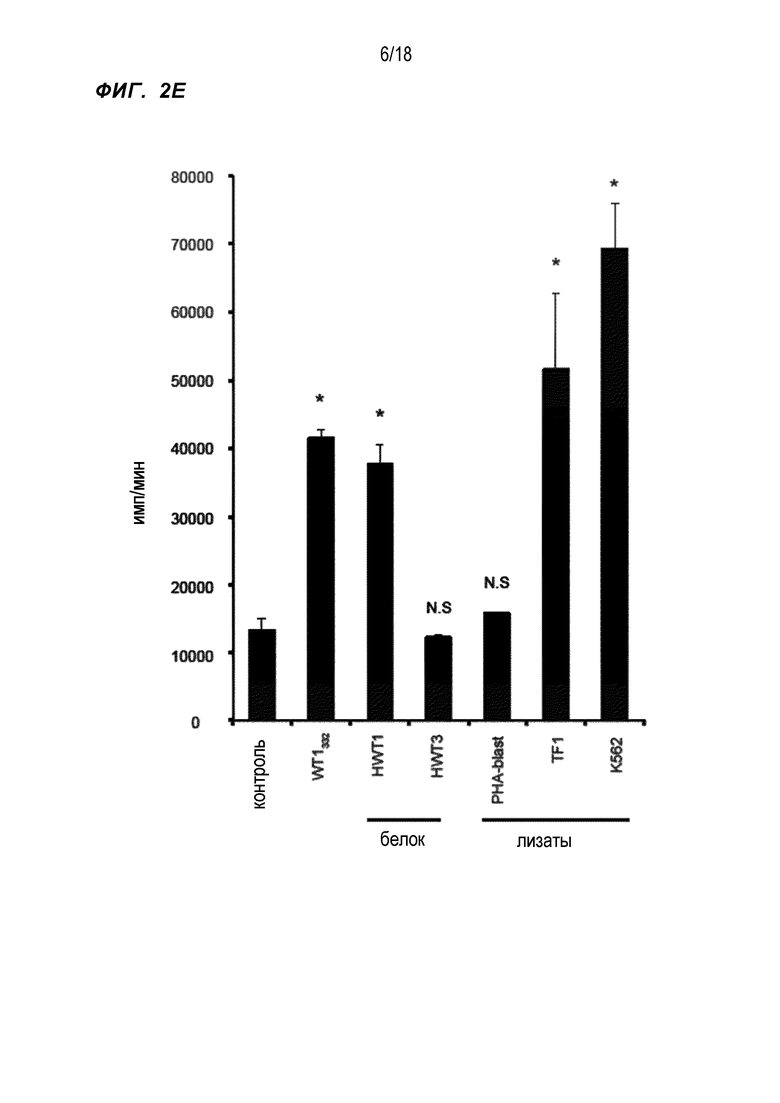
[Фигура 2E] На Фигуре 2E показана пролиферация WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, в присутствии PBMC с добавкой нескольких типов веществ. WT1332 обозначает стимуляцию аутологичной PBMC, активируемой пептидом WT1332. HWT1 обозначает стимуляцию аутологичных PBMC, активируемых полноразмерным белком WT1. HWT3 обозначает стимуляцию аутологичных PBMC, активируемых усеченным белком WT1 (не содержащим последовательности WT1332). PHA-blast обозначает стимуляцию PBMC, активируемых лизатом PHA-blast. TF1 обозначает стимуляцию PBMC, активируемых лизатом лейкозных клеток линии TF-1, экспрессирующих WT1. K562 обозначает стимуляцию PBMC, активируемых лизатом лейкозных клеток линии K562, экспрессирующих WT1.
[Фигура 2F] На Фигуре 2F показана продукция IFN-γ WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, в присутствии PBMC, активируемых несколькими типами веществ. WT1332 обозначает стимуляцию аутологичных PBMC, активируемых пептидом WT1332. HWT1 обозначает стимуляцию аутологичных PBMC, активируемых полноразмерным белком WT1. HWT3 обозначает стимуляцию аутологичных PBMC, активируемых усеченным белком WT1 (не содержащим последовательности WT1332). PHA-blast обозначает стимуляцию PBMC, активируемых лизатом PHA-blast. TF1 обозначает стимуляцию PBMC, активируемых лизатом лейкозных клеток линии TF-1, экспрессирующих WT1. K562 обозначает стимуляцию PBMC, активируемых лизатом лейкозных клеток линии K562, экспрессирующих WT1.
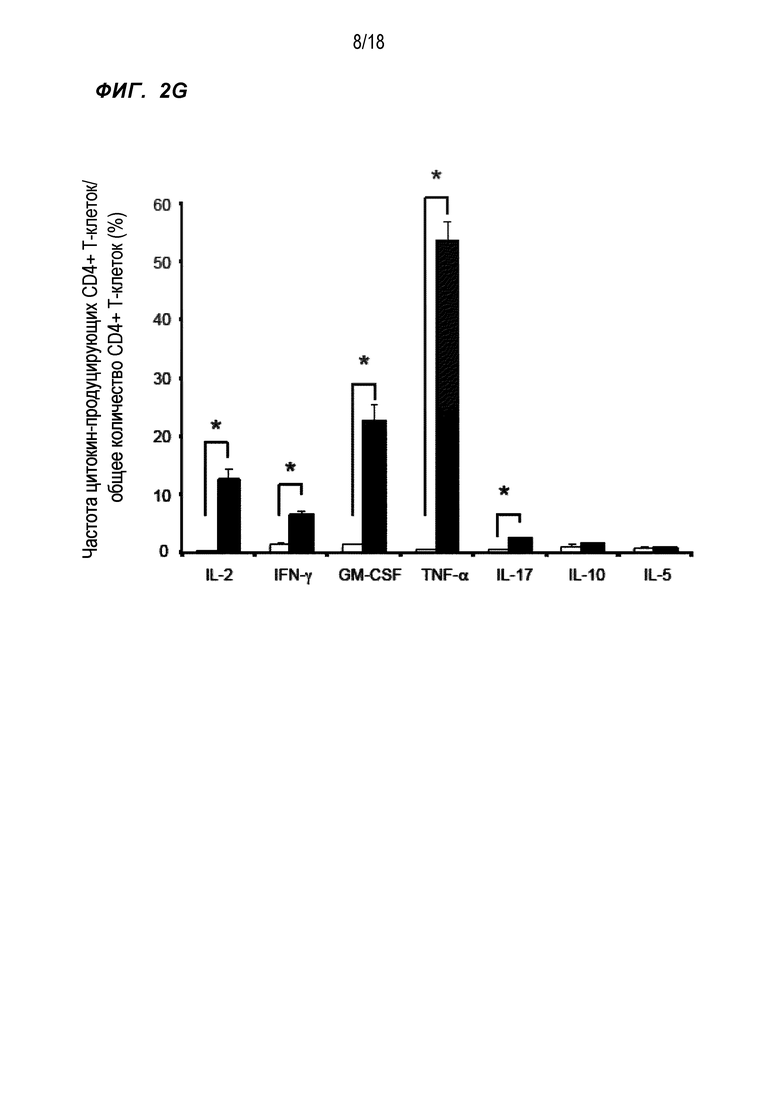
[Фигура 2G] На Фигуре 2G показан средний уровень продукции нескольких видов цитокинов в ответ на пептид WT1332 WT1332-специфичными линиями CD4+ хелперных Т-клеток трех здоровых индивидов (HLA-DPB1*05:01-положительных), в которые были введены гены TCR. Черные столбики обозначают стимуляцию пептидом WT1332. Белые столбики обозначают отсутствие стимуляции.
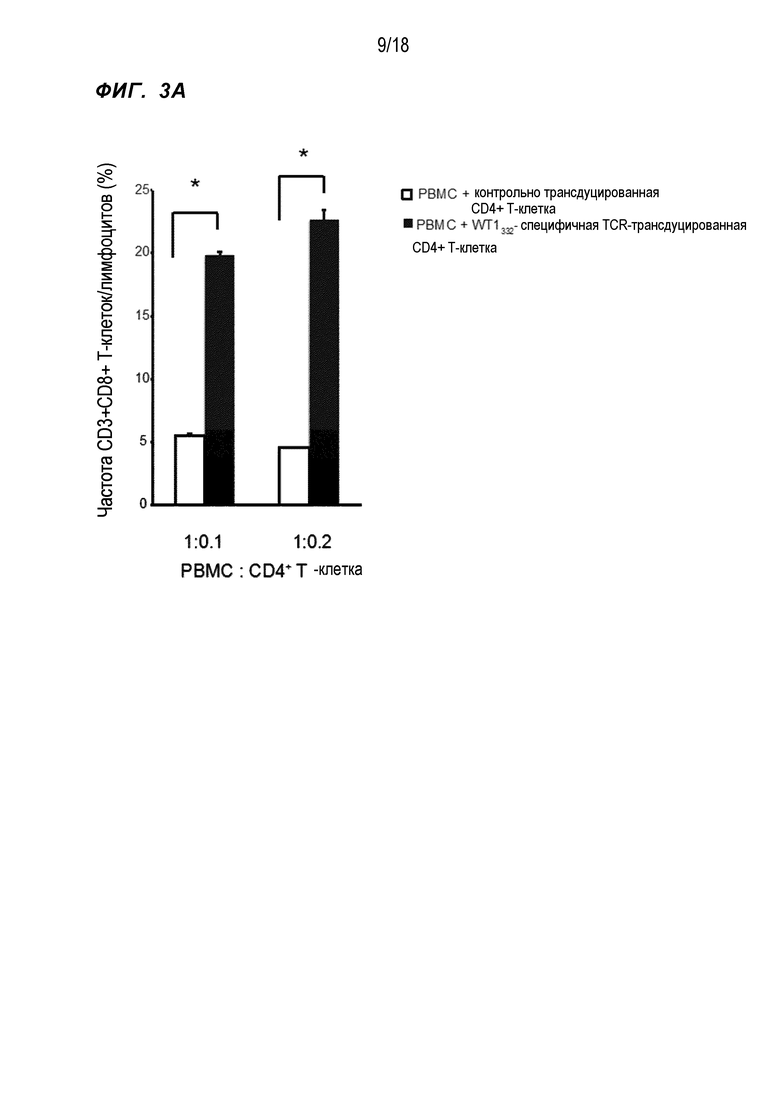
[Фигура 3A] На Фигуре 3A показана частота CD3+CD8+T-клеток в случае cокультивирования PBMC и WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, в отношении, показанном на фигуре.
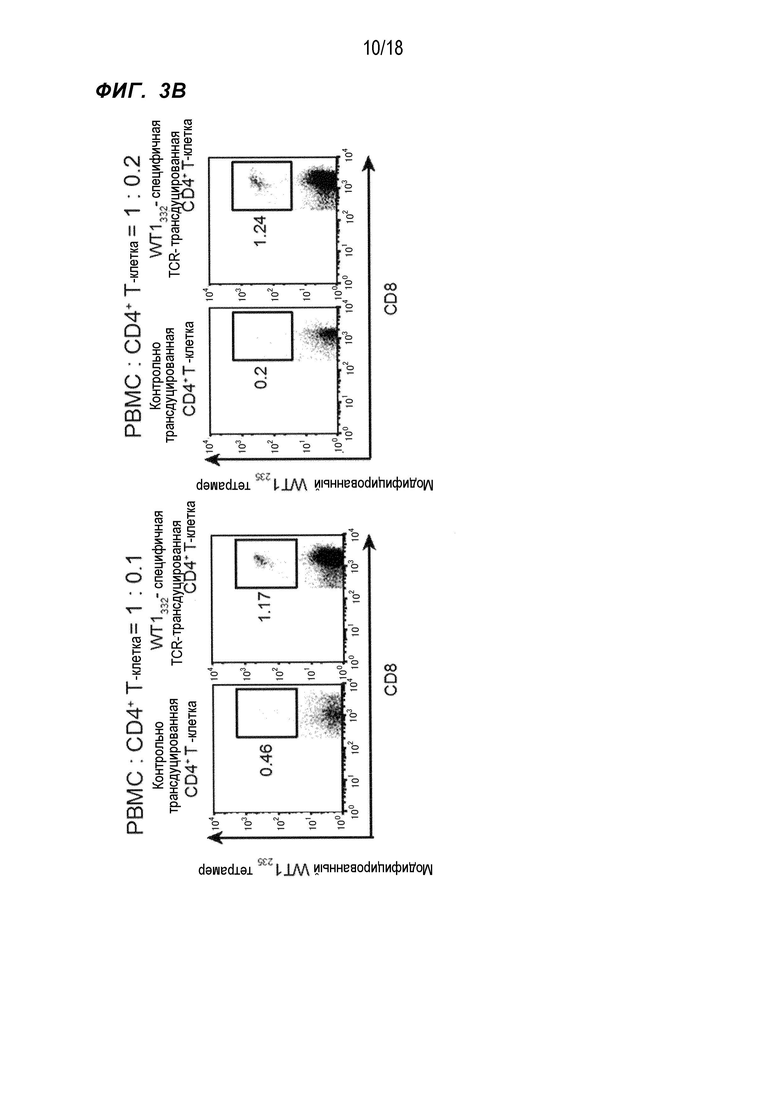
[Фигура 3B] На Фигуре 3B показана частота модифицированный WT1235/HLA-A*24:02 тетрамер-положительных CD8+T-клеток в случае cокультивирования PBMC и WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, в отношении, показанном на фигуре.
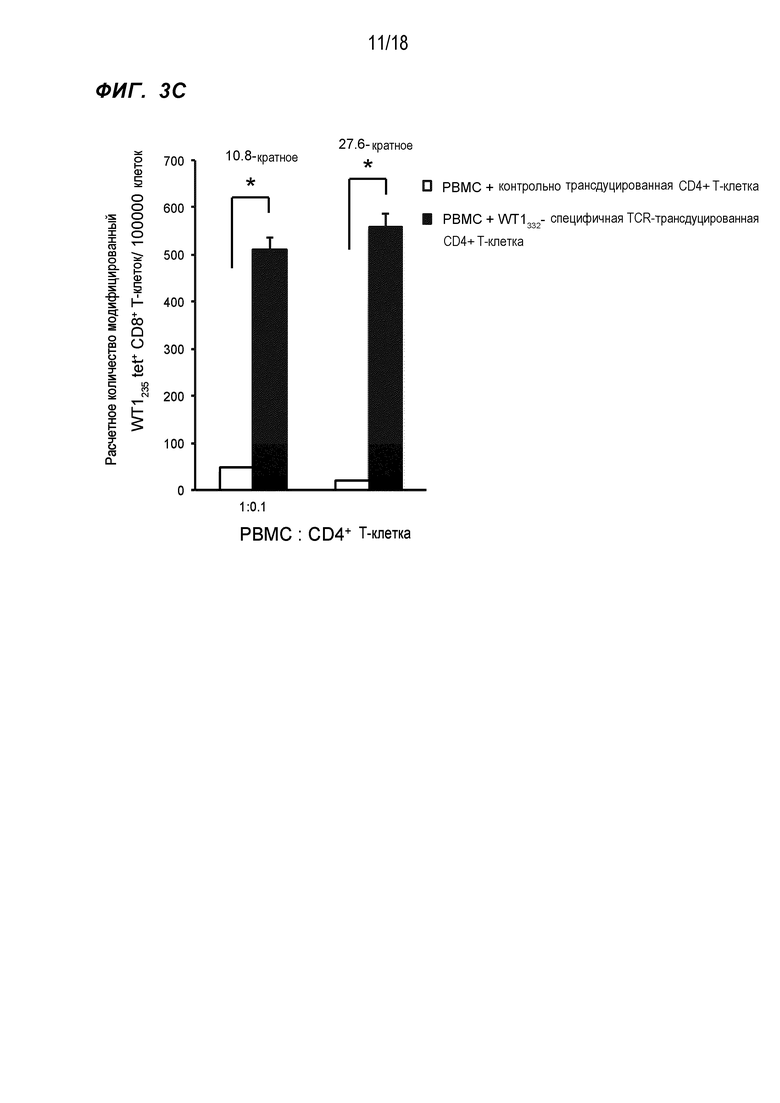
[Фигура 3C] На Фигуре 3C показано количество WT1-специфичных CTL в случае cокультивирования PBMC и WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, в отношении, показанном на фигуре.
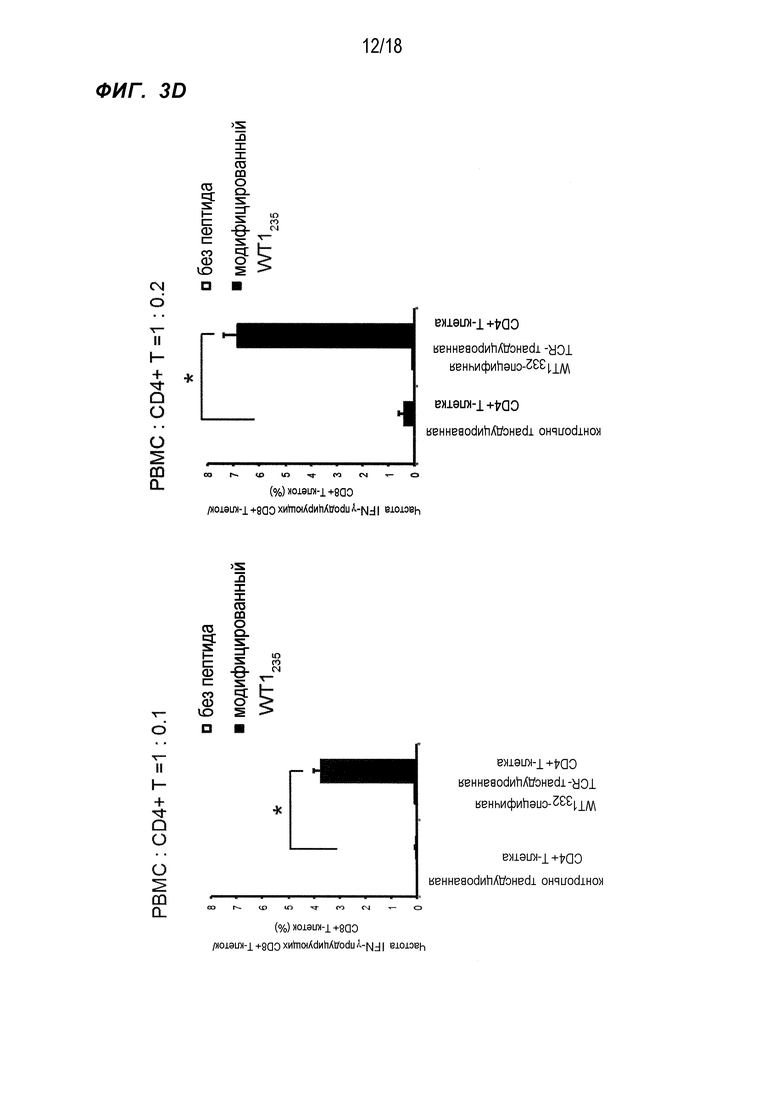
[Фигура 3D] На Фигуре 3D показана частота CD8+T-клеток, экспрессирующих интерферон-γ в ответ на стимуляцию модифицированным WT1235 в случае cокультивирования PBMC и WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, в отношении, показанном на фигуре.
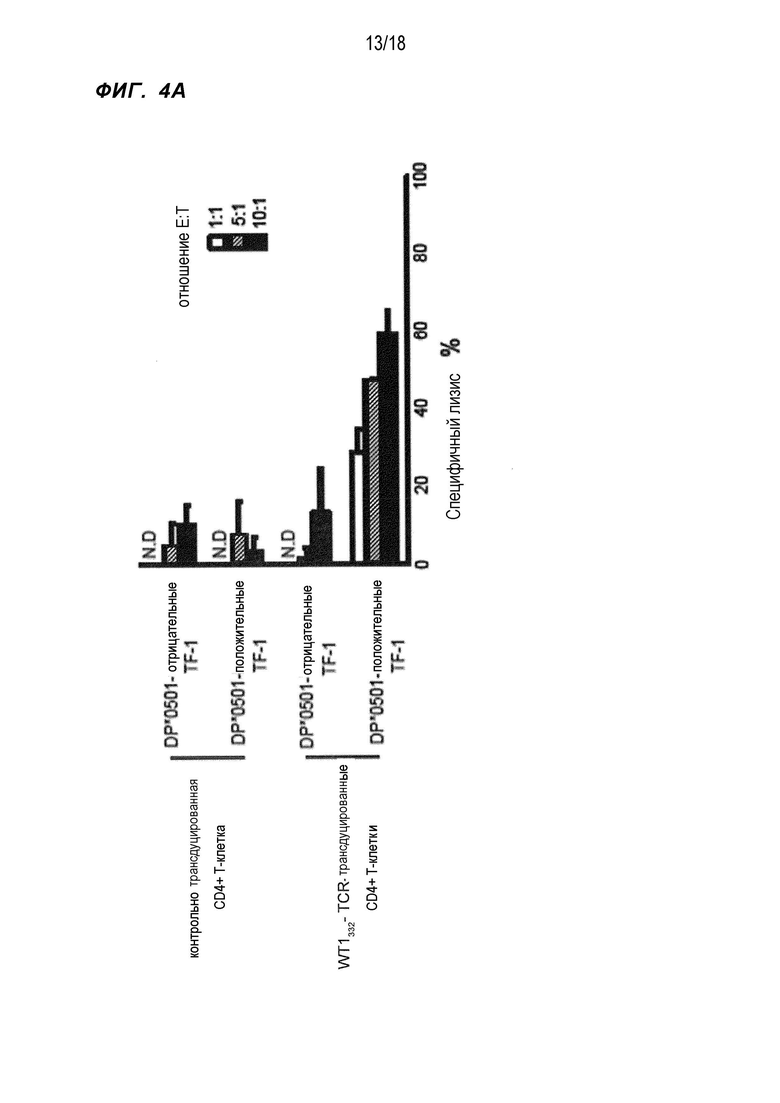
[Фигура 4A] На Фигуре 4A показано повреждение в форме лизиса (%) HLA-DPB1*05:01-положительных лейкозных клеток линии TF-1, экспрессирующих WT1, и HLA-DPB1*05:01-отрицательных лейкозных клеток линии TF-1, экспрессирующих WT1, WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, в отношении E:T, как показано на фигуре.
[Фигура 4B] На Фигуре 4B показано повреждение в форме лизиса (%) HLA-DPB1*05:01-положительных клеток B-LCL, которые были индуцированы для экспрессии WT1, и HLA-DPB1*05:01-положительных клеток B-LCL, которые не экспрессируют WT1, WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, в отношении E:T, как показано на фигуре.
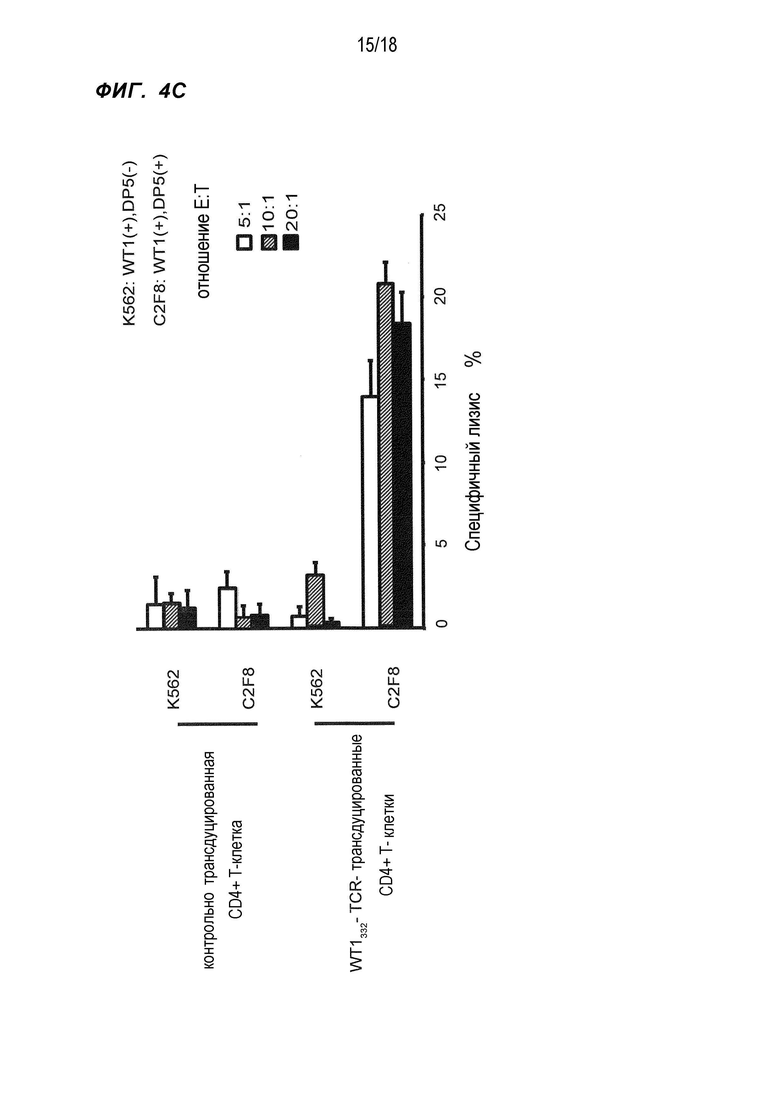
[Фигура 4C] На Фигуре 4C показано повреждение в форме лизиса (%) линии клеток K562 и HLA-DPB1*05:01-положительных лейкозных клеток линии C2F8, экспрессирующих WT1, WT1332-специфичными CD4+ хелперными Т-клетками, в которые были введены гены TCR, в отношении E:T, как показано на фигуре.
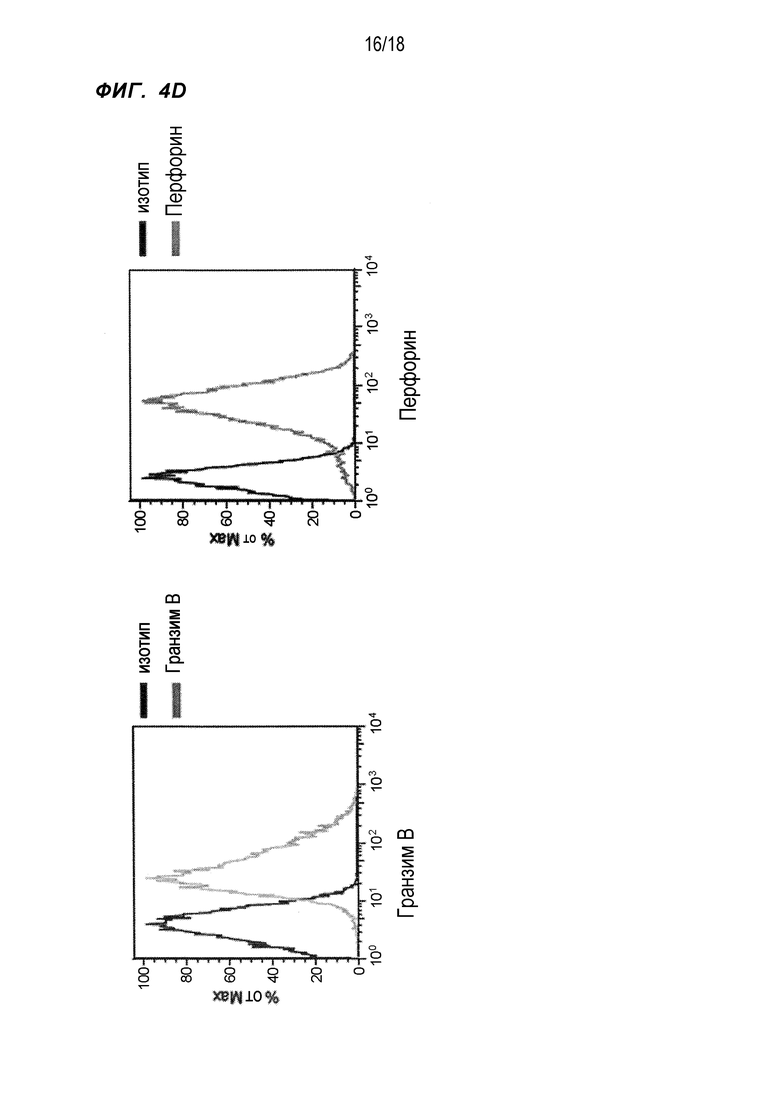
[Фигура 4D] На Фигуре 4D показаны результаты проточной цитометрии в отношении экспрессии гранзима B (слева) и перфорина (справа) в WT1332-специфичных CD4+ хелперных Т-клетках, в которые были введены гены TCR.
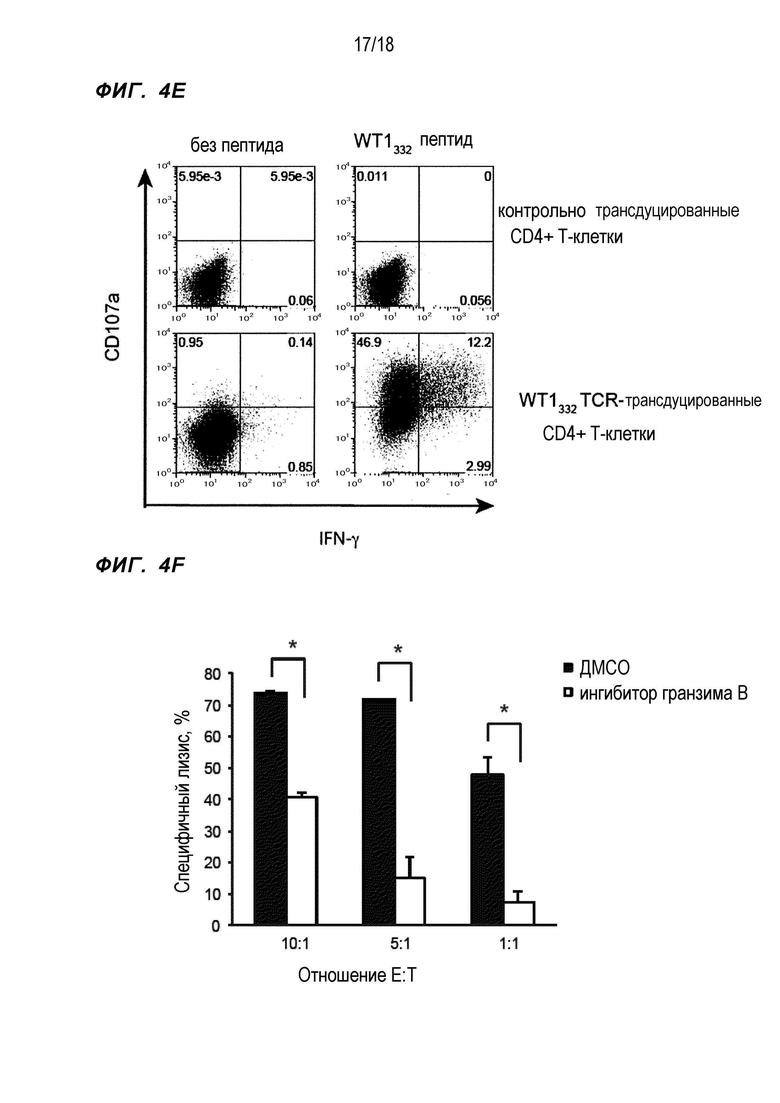
[Фигура 4E] На Фигуре 4E показаны результаты проточной цитометрии в отношении частоты CD107a продуцирующих клеток и IFN-γ продуцирующих клеток WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, культивируемых согласно способу, описанному в Примере 4.
[Фигура 4F] Фигура 4F является диаграммой, на которой показаны результаты для сравнения цитолитической активности WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, против HLA-CPB1*05:01-положительных клеток TF-1, предварительно обработанных Ac-IETD-Cho, с цитолитической активностью WT1332-специфичных CD4+ хелперных Т-клеток, в которые были введены гены TCR, против клеток TF-1, предварительно обработанных ДМСО. Высота столбиков соответствует среднему значению планками стандартного отклонения. Звездочка обозначает p<0,05.
[Фигура 5] На Фигуре 5 показаны кривые выживаемости, на которых показана противоопухолевая активность у мышей NOG (зарегистрированное торговое наименование) CD4+ T-клеток человека, в которые были введены гены TCR из WT1332-специфичных CD4+ T-клеток. Сплошная линия представляет собой кривую выживаемости мышей, которым перенесли CD4+ T-клетки человека, в которые были введены HLA-DPB1*05:01-рестриктированные WT1332-специфичные TCR. Прерывистая линия представляет собой кривую выживаемости мышей, которым перенесли CD4+ T-клетки человека, в которые был введен контрольный вектор.
Описание вариантов осуществления
Настоящее изобретение основано на определении полинуклеотидов, кодирующих α-цепь, содержащую CDR3 (в дальнейшем именуемую как "полинуклеотид αCDR3"), и полинуклеотидов, кодирующих β-цепь, содержащую CDR3 (в дальнейшем именуемую как "полинуклеотид βCDR3"), TCR клонов CD4+ хелперных T-клеток, специфичных к хелперному пептиду WT1. Таким образом, в одном аспекте настоящего изобретения предложены полинуклеотиды αCDR3, имеющие нуклеотидные последовательности, которые показаны на фигуре 1 (нуклеотидные последовательности, выбранные из группы, состоящей из SEQ ID NO:1, 3, 5, 8, 10, 11, 13, 14, 16, 18, 20, 22, 23, 25, 27, 28, 30, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 56, 58), и полинуклеотиды βCDR3, имеющие нуклеотидные последовательности, которые показаны на фигуре 1 (нуклеотидные последовательности, выбранные из группы, состоящей из SEQ ID NO:2, 4, 6, 7, 9, 12, 15, 17, 19, 21, 24, 26, 29, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 57, 59).
Предпочтительно, в отношении экспрессии функционального рецептора, полинуклеотид αCDR3 и полинуклеотид βCDR3, содержащиеся в каждом клоне, содержатся в одном TCR. Таким образом, предпочтительно, что полинуклеотид αCDR3 и полинуклеотид βCDR3, соответствующие каждому клону, формируют пару, как показано на фигуре 1. Таким образом, в другом аспекте настоящего изобретения предложена пара полинуклеотида αCDR3 и полинуклеотида βCDR3, где каждый полинуклеотид, составляющий пару, имеет нуклеотидную последовательность, которая показана на фигуре 1. Комбинация полинуклеотида αCDR3 и полинуклеотида βCDR3 отличается в зависимости от клона. Нуклеотидная последовательность пары полинуклеотида αCDR3 и полинуклеотида βCDR3 в каждом клоне является такой, как показано на фигуре 1.
Полинуклеотид, имеющий нуклеотидную последовательность, комплементарную полинуклеотиду αCDR3 или полинуклеотиду βCDR3, также включен в полинуклеотид αCDR3 или полинуклеотид βCDR3. Кроме того, вырожденная последовательность полинуклеотида αCDR3 или полинуклеотида βCDR3 также включена в полинуклеотид αCDR3 или полинуклеотид βCDR3 при условии, что она кодирует пептид, показанный на фигуре 1.
Полинуклеотид, обладающий идентичностью нуклеотидной последовательности 70% или больше, например, 75% или больше, 80% или больше, 85% или больше, или 90% или больше, например, 92% или больше, 94% или больше, 96% или больше, или 98% или больше, с последовательностью полинуклеотида αCDR3, также включен в полинуклеотид αCDR3. Полинуклеотид, обладающий идентичностью нуклеотидной последовательности 70% или больше, например, 75% или больше, 80% или больше, 85% или больше, или 90% или больше, например, 92% или больше, 94% или больше, 96% или больше, или 98% или больше, с последовательностью полинуклеотида βCDR3, также включен в полинуклеотид βCDR3.
Полинуклеотид, нуклеотидная последовательность которого гибридизуется с нуклеотидной последовательностью полинуклеотида αCDR3 в жестких условиях, также включен в полинуклеотид αCDR3. Полинуклеотид, нуклеотидная последовательность которого гибридизуется с нуклеотидной последовательностью полинуклеотида βCDR3 в жестких условиях, также включен в полинуклеотид βCDR3.
Примеры жестких условий гибридизации включают условия, при которых гибридизацию проводят в растворе, содержащем 5×SSC, 7% (в/об) ДСН, 100 мкг/мл денатурированной ДНК спермы лосося и 5× раствор Денхардта, при 48-52°C, и затем выполняют промывку в 0,1×SSC, 0,5×SSC, 1×SSC или 2×SSC; или условия, при которых гибридизацию проводят в растворе, содержащем 250 мМ NaCl, 25 мМ цитрата тринатрия, 1% ДСН, 50% формамида и 200 мкг/мл денатурированной ДНК спермы лосося, при 42°C, и затем выполняют промывку в растворе, содержащем 15 мМ NaCl, 1,5 мМ цитрата тринатрия и 0,1% ДСН.
В другом аспекте настоящего изобретения предложены пептиды, кодируемые полинуклеотидами αCDR3 и полинуклеотидами βCDR3 (называемые "пептид αCDR3" и "пептид βCDR3", соответственно). Эти пептиды имеют аминокислотные последовательности, показанные на фигуре 1. Предпочтительно, эти пептиды формируют пару пептида αCDR3 и пептида βCDR3, соответствующую каждому клону, как показано на фигуре 1.
В настоящем описании аминокислотная последовательность пептида представлена обычной однобуквенной системой или трехбуквенной системой.
Пептид, кодируемый вариантами полинуклеотида αCDR3 или полинуклеотида βCDR3, также включен в пептид αCDR3 или пептид βCDR3. Пептид, обладающий идентичностью аминокислотной последовательности 70% или больше, например, 75% или больше, 80% или больше, 85% или больше, или 90% или больше, например, 92% или больше, или 94% или больше, с последовательностью пептида αCDR3, также включен в пептид αCDR3. Пептид, обладающий идентичностью аминокислотной последовательности 70% или больше, например, 75% или больше, 80% или больше, 85% или больше, или 90% или больше, например, 92% или больше, или 94% или больше, с последовательностью пептида βCDR3, также включен в пептид βCDR3. Кроме того, пептид, имеющий аминокислотную последовательность пептида αCDR3, в которой от одной до нескольких (например, одна, две, три, четыре или пять) аминокислот заменены, удалены или добавлены, также включен в пептид αCDR3; и пептид, имеющий аминокислотную последовательность пептида βCDR3, в которой от одной до нескольких (например, одна, две, три, четыре или пять) аминокислот заменены, удалены или добавлены, также включен в пептид βCDR3. Следует отметить, что эти варианты пептидов обладают свойствами, аналогичными свойствам исходных пептидов αCDR3 или пептидов βCDR3.
Эти полинуклеотиды и полипептиды могут быть получены при использовании химических методов и/или биологических методов, известных в данной области.
В настоящем изобретении хелперный пептид WT1 представляет собой пептид, имеющий аминокислотную последовательность SEQ ID NO:123 (Lys Arg Tyr Phe Lys Leu Ser His Leu Gln Met His Ser Arg Lys His), или вариант этой аминокислотной последовательности. (Эти пептиды именуются "пептид WT1332"). Пептид WT1332 может иметь частичную последовательность или вариант последовательности полипептида WT1. Пептид, состоящий из аминокислотной последовательности, показанной в SEQ ID NO:123, или варианта этой последовательности, является примером такого пептида.
Известно, что пептид WT1332 обладает способностью связываться с молекулой HLA-DRB1*15:01, молекулой HLA-DPB1*09:01, молекулой HLA-DPB1*05:01, молекулой HLA-DRB1*04:05 или молекулой HLA-DRB1*15:02.
Вариант аминокислотной последовательности SEQ ID NO:123, как указано выше, относится к аминокислотной последовательности SEQ ID NO:123, в которой от одной до нескольких (например, одна, две, три, четыре или пять) аминокислот заменены, удалены или добавлены. Или же вариант аминокислотной последовательности SEQ ID NO:123, как указано выше, относится к аминокислотной последовательности, обладающей идентичностью 70% или больше, например, 75% или больше, 80% или больше, 85% или больше, или 90% или больше, с аминокислотной последовательностью SEQ ID NO:123. Предпочтительно пептид, имеющий аминокислотную последовательность SEQ ID NO:123, или вариант этой последовательности, имеет длину 25 аминокислот или меньше. Пептид, имеющий вариант аминокислотной последовательности SEQ ID NO:123, обладает свойствами, аналогичными свойствам пептида, имеющего аминокислотную последовательность SEQ ID NO:123.
В другом аспекте настоящее изобретение относится к гену TCR, содержащему полинуклеотид αCDR3 и полинуклеотид βCDR3, относящийся к любой паре, показанной на фигуре 1. Такой ген TCR может быть выделен из CD4+ T-клетки, специфичной к пептиду WT1332, или может быть получен известными методами генной инженерии.
В другом аспекте настоящее изобретение относится к CD4+ хелперной T-клетке (называемой "CD4+ хелперной T-клеткой с введенным геном TCR"), полученной при введении гена TCR, содержащего полинуклеотид αCDR3 и полинуклеотид βCDR3, относящиеся к любой паре, показанной на фигуре 1, в CD4+ T-клетку. CD4+ хелперная T-клетка с введенным геном TCR демонстрирует WT1332-специфичную и HLA класса II-рестриктированную пролиферацию и продукцию цитокинов.
Квалифицированный специалист в данной области сумеет легко ввести ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3, относящиеся к любой из пар, показанных на фигуре 1, в CD4+ T-клетку. Например, введение гена TCR может быть выполнено при использовании различных типов векторов, электропорации или генной пушки и т.д. Вводимый ген TCR может быть модифицирован с такой целью, как повышение эффективности экспрессии TCR.
Таким образом, в другом аспекте настоящего изобретения предложен вектор, содержащий ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3, относящиеся к любой паре, показанной на фигуре 1.
Введение гена TCR может быть выполнено посредством введения гена α-цепи, содержащего полинуклеотид αCDR3, и гена β-цепи, содержащего полинуклеотид βCDR3, в отдельные векторы, и введения указанных векторов в CD4+ T-клетку.
Примеры CD4+ T-клеток, в которые введен ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3, включают CD4+ T-клетки, полученные от HLA-DRB1*15:01-положительного индивида, HLA-DPB1*09:01-положительного индивида, HLA-DPB1*05:01-положительного индивида, HLA-DRBl*04:05-положительного индивида или HLA-DRB1*15:02-положительного индивида, но не ограничены ими. Кроме того, CD4+ T-клетки могут быть получены от индивида, имеющего злокачественную опухоль, могут быть получены от индивида, не имеющего злокачественную опухоль (здорового индивида), или могут быть получены от донора для пересадки костного мозга.
В другом аспекте настоящее изобретение также относится к WT1332-специфичной CD4+ хелперной T-клетке, содержащей ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3, относящиеся к любой паре, показанной на фигуре 1.
Индукция WT1-специфичных CTL может быть усилена при использовании CD4+ хелперной T-клетки с введенным геном TCR. В частности, индукция WT1-специфичных CTL может быть усилена путем сокультивирования CD4+ хелперной T-клетки с введенным геном TCR и периферической мононуклеарной клетки. Таким образом, в другом аспекте настоящего изобретения предложен способ усиления индукции WT1-специфичных CTL, включающий сокультивирование CD4+ хелперной T-клетки с введенным геном TCR и периферической мононуклеарной клетки. В другом аспекте настоящее изобретение относится к WT1-специфичным CTL, получаемым указанным способом.
Методы и условия сокультивирования CD4+ хелперной T-клетки с введенным геном TCR и периферической мононуклеарной клетки известны в уровне техники. Такие методы могут быть применяться in vivo или in vitro. Один тип CD4+ хелперной T-клетки с введенным геном TCR может применяться для усиления индукции WT1-специфичных CTL. Однако, предпочтительно, используют два или более типов CD4+ хелперных Т-клеток с введенным геном TCR.
Примеры периферических мононуклеарных клеток, используемых в способе усиления индукции WT1-специфичных CTL согласно настоящему изобретению, включают периферические мононуклеарные клетки, полученные от HLA-DRB1*15:01-положительного индивида, HLA-DPB1*09:01-положительного индивида, HLA-DPB1*05:01-положительного индивида, HLA-DRB1*04:05-положительного индивида или HLA-DRB1*15:02-положительного индивида, но не ограничены ими. Предпочтительно, периферические мононуклеарные клетки и CD4+ T-клетки являются клетками, которые были получены от индивида, который нуждается в лечении или профилактики злокачественной опухоли.
При сокультивировании пептид WT1332 и/или другие пептиды WT1, предпочтительно, существуют в комбинации. Примеры других пептидов WT1 включают пептиды, которые обладают способностью связываться с молекулой HLA-DRB1*15:01, молекулой HLA-DPB1*09:01, молекулой HLA-DPB1*05:01, молекулой HLA-DRB1*04:05 или молекулой HLA-DRB1*15:02, но не ограничиваются ими.
В случае необходимости WT1-специфичные CTL, полученные с помощью указанного выше способа, можно продолжить культивировать с целью увеличения количества клеток, а затем ввести их индивиду для лечения или профилактики злокачественной опухоли у индивида. При таком лечении или профилактике злокачественной опухоли пептид WT1332 и/или другие пептиды WT1 предпочтительно вводить совместно. Под действием WT1-специфичных CTL, также могут индуцироваться CTL, специфичные к другим раковым антигенам.
CD4+ хелперная T-клетка с введенным геном TCR может повреждать злокачественные клетки, экспрессирующие WT1. Таким образом, в другом аспекте настоящего изобретения предложен способ лечения или профилактики злокачественной опухоли у индивида, включающий введение индивиду CD4+ хелперной T-клетки с введенным геном TCR.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая CD4+ хелперную T-клетку с введенным геном TCR, для лечения или профилактики злокачественной опухоли, применение CD4+ хелперной T-клетки с введенным геном TCR для получения лекарственного средства для лечения или профилактики злокачественной опухоли и применение CD4+ хелперной T-клетки с введенным геном TCR для лечения или профилактики злокачественной опухоли.
Как используется в настоящем описании, "лечение" злокачественной опухоли относится не только к лечению злокачественной опухоли, например, замедлению прогрессирования злокачественной опухоли, уменьшению злокачественной опухоли и разрушению злокачественной опухоли, но также и к предотвращению рецидива злокачественной опухоли.
Примеры индивидов, у которых лечат или предотвращают злокачественную опухоль, включают HLA-DRB1*15:01-положительного индивида, HLA-DPB1*09:01-положительного индивида, HLA-DPB1*05:01-положительного индивида, HLA-DRB1*04:05-положительного индивида или HLA-DRB1*15:02-положительного индивида, но не ограничиваются ими. Вышеуказанный индивид не ограничен больным раком и может быть лицом, не имеющим рак (включая здоровое лицо), или может быть донором для пересадки костного мозга.
Варианты осуществления способа лечения или профидактики, фармацевтической композиции и применения, указанных выше, описаны ниже. Впрочем, варианты осуществления не ограничиваются ими. Сначала CD4+ T-клетки забирают из периферической крови больного раком, который нуждается в лечении, и вводят в CD4+ T-клетки ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3, с получением CD4+ хелперных Т-клеток с введенным геном TCR. CD4+ хелперные Т-клетки с введенным геном TCR, полученные таким образом, вводят больному раком. Перед введением CD4+ хелперные Т-клетки с введенным геном TCR можно культивировать и размножать в подходящих условиях для получения достаточного количества клеток, а затем их можно вводить больному раком.
Можно вводить один тип CD4+ хелперной T-клетки с введенным геном TCR, либо два или более типов CD4+ хелперных Т-клеток с введенным геном TCR. С позиции улучшения эффекта лечения или профилактики, предпочтительно, чтобы индивиду вводили два или более типов CD4+ хелперных Т-клеток с введенным геном TCR.
В случае, если такие CD4+ хелперные Т-клетки с введенным геном TCR вводят индивиду, врач может соответственно подобрать такие параметры, как количество вводимых клеток, частота введения, интервал введения. Например, CD4+ хелперные Т-клетки с введенным геном TCR можно вводить только один раз или вводить раздельно несколько раз. Как правило, в случае взрослого индивида, количество CD4+ хелперных Т-клеток с введенным геном TCR в дозе находится в пределах от приблизительно 109 до приблизительно 1011, но не ограничено указанными значениями.
В способе лечения или профилактики, фармацевтической композиции и применении, описанных выше, предпочтительно, чтобы пептид WT1332 и/или другие пептиды WT1 вводили совместно. Врач может соответственно подобрать количество и частоту введения пептида WT1332 и/или других пептидов WT1. Кроме того, другие способы противораковой терапии или профилактики можно комбинировать.
Способ лечения или профилактики, фармацевтическая композиция и применение, описанные выше, можно применять к различным видам злокачественных опухолей, не ограничивающимся, например, гематологическими злокачественными новообразованиями, такими как острый миелоцитарный лейкоз, острый лимфоцитарный лейкоз, злокачественная лимфома, множественная миелома, хронический миелоцитарный лейкоз, миелодиспластический синдром и рецидивы после пересадки гемопоэтических стволовых клеток такого же типа; солидные злокачественные опухоли, такие как рак языка, рак десен, рак дна полости рта, рак глотки, рак гортани, рак слюнной железы и рак щитовидной железы; торакальные раковые опухоли, такие как рак молочной железы, рак легкого и рак тимуса; желудочно-кишечные раковые опухоли, такие как рак толстой кишки, рак тонкой кишки, рак желудка, рак поджелудочной железы, рак печени, рак желчных протоков, желудочно-кишечная эндокринная опухоль и желудочно-кишечная нейроэндокринная опухоль; раковые опухоли мочевого и полового тракта, такие как рак почки, уротелиальный рак, герминома, опухоль Вильмса, рак предстательной железы, рак тела матки, рак шейки матки, саркома матки и злокачественное новообразование яичника; мышечно-скелетные злокачественные опухоли, такие как первичное злокачественное новообразование костной ткани (например, остеосаркома и саркома Юинга) и саркомы мягких тканей; и другие раковые опухоли, такие как рак кожи, нейробластома, злокачественная глиома (глиобластома), первичная злокачественная лимфома центральной нервной системы, медуллобластома и ПНЭО.
Области CDR3 являются наиболее разнообразными частями и наиболее важными частями, отвечающими за специфичность распознавания антигена. Таким образом, последовательности полинуклеотидов αCDR3, полинуклеотидов βCDR3, пептидов αCDR3 и пептидов βCDR3 настоящего изобретения считаются характерными для CD4+ хелперных Т-клеток, специфичных к пептиду WT1332. Таким образом, в том случае, если полинуклеотид, кодирующий CDR-область α-цепи и β-цепи, или пептид, соответствующий CDR-области, имеют последовательность полинуклеотида или пептида согласно настоящему изобретению, CD4+ хелперная T-клетка считается специфичной к пептиду WT1332.
Например, (i) ДНК-чип, содержащий один или более типов полинуклеотидов αCDR3, (ii) ДНК-чип, содержащий один или более типов полинуклеотидов βCDR3, или (iii) ДНК-чип, содержащий один или более типов полинуклеотидов αCDR3 и один или более типов полинуклеотидов βCDR3, могут применяться для измерения частоты CD4+ хелперных Т-клеток, специфичных к пептиду WT1332, в образце. В частности, образец получают, проводя лизис клеток в образце, полученном от индивида, и выделение нуклеиновых кислоты, после чего образец подвергают контакту с ДНК-чипом.
Например, в том случае, если образец подвергают контакту с чипом (i), и обнаруживают гибридизацию в каком-либо положении, тот же образец подвергают контакту с чипом (ii), чтобы подтвердить, обнаружена ли гибридизация, или нет. Затем, в том случае, если какая-либо гибридизация на чипе (i) и какая-либо гибридизация на чипе (ii) происходит с каким-либо полинуклеотидом αCDR3 и каким-либо полинуклеотидом βCDR3, которые составляют какую-либо пару, показанную на Фигуре 1, можно сделать вывод, что в образце существует CD4+ хелперная T-клетка, специфичная к пептиду WT1332, имеющая функциональный TCR. С применением чипа (III), вышеуказанный процесс можно выполнить в одну стадию.
ДНК-чип может находиться в любой форме, такой как микрочип и микроматрица. Указанные чипы могут быть получены известным методом. Например, полинуклеотиды αCDR3 и полинуклеотиды βCDR3 могут быть иммобилизованы на стеклянной подложке известным методом. Предпочтительно, к ДНК в образце или последовательностям ДНК на чипе присоединяют метку, которая может указывать наличие или отсутствие гибридизации и количество гибридизации.
Не только ДНК-чип, но также и такие методы, как Саузерн-блоттинг, Нозерн-блоттинг, гибридизазия колоний, могут использоваться для измерения частоты CD4+ хелперных Т-клеток, специфичных к пептиду WT1332, в образце.
Кроме того, пептид αCDR3 и пептид βCDR3 могут использоваться для получения антитела к CD4+ хелперной T-клетке, специфичной к пептиду WT1332. CD4+ хелперная T-клетка, специфичная к пептиду WT1332, может быть обнаружена при использовании такого антитела. Рецептор CD4+ хелперной T-клетки, специфичной к пептиду WT1332, можно также стимулировать при использовании такого антитела. Такая стимуляция может быть выполнена in vivo или in vitro.
Чип, содержащий пептиды αCDR3, чип, содержащий пептиды βCDR3, или чип, содержащий пептиды αCDR3 и пептиды βCDR3, также может применяться для обнаружения антитела к CD4+ хелперной T-клетке, специфичной к пептиду WT1332.
Чип, содержащий указанные пептиды, может быть получен при использовании известного метода. Предпочтительно добавить метку, которая может позволить определить присутствие или отсутствие специфичного связывания с пептидами в образце или с пептидами на чипе.
Чип, содержащий антитела к пептидам αCDR3 и/или пептидам βCDR3, также может применяться для определения типа и количества пептидов αCDR3 и/или пептидов βCDR3 в образце или для определения типа и количества CD4+ хелперных Т-клеток, специфичных к пептиду WT1332, в образце.
Чип, на котором иммобилизованы такие антитела, может быть получен с использованием известного метода. Предпочтительно добавить метку, которая может позволить определить присутствие или отсутствие специфичного связывания с пептидами в образце или с антителами на чипе.
Описание последовательностей
SEQ ID NO:1-59 - нуклеотидные последовательности, кодирующие CDR3, содержащийся в TCR клонов CD4+ хелперных Т-клеток.
SEQ ID NO:60-118 - аминокислотные последовательности CDR3, содержащегося в TCR клонов CD4+ хелперных Т-клеток.
SEQ ID NO:119 - обратный праймер для амплификации α-цепи TCR.
SEQ ID NO:120 - обратный праймер для амплификации β-цепи TCR.
SEQ ID NO:121 - обратный праймер для амплификации β-цепи TCR.
SEQ ID NO:122 - праймер для определения нуклеотидных последовательностей CDR3.
SEQ ID NO:123 - аминокислотная последовательность пептида WT1332.
SEQ ID NO:124 - аминокислотная последовательность пептида ВИЧ.
SEQ ID NO:125 - аминокислотная последовательность варианта природного пептида WT1.
Настоящее изобретение более подробно и более конкретно описано посредством примеров, представленных ниже. Однако не следует считать, что примеры ограничивают объем настоящего изобретения.
Пример 1
Пример 1 Получение WT1332-специфичных клонов CD4+ T-клеток и выделение и секвенирование генов T-клеточного рецептора (TCR)
Методика эксперимента являлась следующей.
(1) Способ получения WT1332-специфичных клонов CD4+ T-клеток
(i) Мононуклеарные клетки периферической крови (PBMC), полученные от здорового индивида, собирали и сеяли в 24-луночные планшеты в количестве 3×106 клеток/лунка. В качестве среды использовали среду X-VIVO 15 с добавкой 10% AB сыворотки и 40 МЕ/мл IL-2.
(ii) Пептид WT1332 добавляли в вышеуказанный i в конечной концентрации 20 мкг/мл и культивировали клетки в течение 7 дней.
(iii) Через 7 дней клетки собирали и подготавливали в среде X-VIVO 15 с добавкой 10% AB сыворотки так, чтобы плотность клеток составила 1×107 клеток/мл, а затем сеяли по 100 мкл в 96-луночный планшет с круглодонными лунками.
(iv) Пептид WT1332, BD GolgiStopTM (BD Bioscience) и костимулирующий реактив CD28/CD49d (BD Bioscience) добавляли в среду X-VIVO 15 с добавкой 10% AB сыворотки в конечных концентрациях 40 мкг/мл, 4 мкг/мл и 4 мкг/мл, соответственно.
(v) Вышеуказанный iv добавляли по 100 мкл в вышеуказанный iii.
(vi) Антитело против CD154 человека, меченное АФЦ (BD Bioscience), добавляли по 10 мкл в вышеуказанный v и инкубировали планшеты в инкубаторе с 5% CO2 в течение 6 часов при 37°C.
(vii) После инкубирования, клетки собирали и окрашивали антителом против CD4 человека, меченным АФЦ-H7 (BD Bioscience), и антителом против CD3 человека, меченным красителем Pacific Blue (BD Bioscience), а также 7-AAD (eBioscience) для удаления мертвых клеток.
(viii) PBMC забирали у 3 здоровых индивидов, смешивали, обрабатывали γ-излучением 30 Гр и подготавливали в среде X-VIVO 15 с добавкой 10% AB сыворотки в конечной концентрации 10%, IL-2 в конечной концентрации 100 МЕ/мл и ФГА в конечной концентрации 3 мкг/мл так, чтобы плотность клеток составила 1×106 клеток/мл. Эти полученные клетки сеяли по 100 мкл в 96-луночные планшеты с круглодонными лунками.
(ix) Фракцию клеток 7-ADD-CD3+CD4+CD154+, то есть фракцию, содержащую WT1332-специфичные CD4+ T-клетки, сортировали по одной клетке в каждую лунку вышеуказанного viii при использовании клеточного сортера FACSAria.
(x) После культивирования в течение 10-14 дней подросшие клетки в каждой лунке использовали в качестве независимых клонов CD4+ T-клеток.
(2) Скрининг WT1332-специфичных клонов CD4+ T-клеток
(i) Каждый клон CD4+ T-клеток из вышеуказанного (1)-x подготавливали в среде X-VIVO 15 с добавкой 1% AB сыворотки так, чтобы плотность клеток составила 3×105 клеток/мл.
(ii) Аутологичные PBMC, стимулированные WT1332 или не стимулированные никакими пептидами, обрабатывали γ-излучением 30 Гр и подготавливали в среде X-VIVO 15 с добавкой 1% AB сыворотки так, чтобы плотность клеток составила 1×106 клеток/мл.
(iii) Вышеуказанные (2)-i и ii сеяли по 100 мкл в 96-луночные планшеты с круглодонными лунками.
(iv) После культивирования в течение 2 дней в каждую лунку добавляли 3H-тимидин в количестве 1 мкКи/лунка.
(v) Через 18 часов 3H-тимидин, включенный в каждый клон CD4+ T-клеток, измеряли и отбирали клоны CD4+ T-клеток, демонстрировавшие WT1332-специфичный пролиферативный ответ. Эти отобранные клоны использовали в качестве WT1332-специфичных клонов CD4+ T-клеток.
(vi) Культуру WT1332-специфичных клонов CD4+ T-клеток подготавливали со стимуляцией WT1332-специфичных клонов CD4+ T-клеток путем сокультивирования с PBMC, которые были получены при облучении аутологичных PBMC, стимулированных WT1332, с частотой один раз за приблизительно 1-2 недели, γ-излучением 30 Гр.
(3) Выделение генов TCR с использованием метода 5'-RACE (Быстрой амплификации концов кДНК)
(i) WT1332-специфичные клоны CD4+ T-клеток культивировали в течение 10 дней или больше от последней стимуляции. Это было нужно для предотвращения контаминации T-клетками, содержащимися в аутологичных PBMC, которые использовали для стимуляции.
(ii) WT1332-специфичные клоны CD4+ T-клеток центрифугировали, добавляли к ним реактив TRIzol (Invitrogen) и выделяли РНК согласно инструкции.
(iii) кДНК синтезировали с РНК, выделенной в вышеуказанном (3)-ii с использованием набора SMARTerTM RACE cDNA Amplification Kit (Clontech).
(iv) гены α-цепи и β-цепи TCR амплифицировали при использовании кДНК, синтезированных в вышеуказанном (3)-iii, в качестве матриц. В отношении используемых праймеров, праймер UPM, входящий в набор SMARTerTM RACE cDNA Amplification Kit, использовали в качестве прямого праймера, а следующие TCR-специфичные праймеры использовали в качестве обратных праймеров:
праймер Cα3'UTR: 5'-CAC AGG CTG TCT TAC AAT CTT GCA GAT C-3' (SEQ ID NO:119)
праймер Cβ1-3'UTR: 5'-CTC CAC TTC CAG GGC TGC CTT CA-3' (SEQ ID NO:120)
праймер Cβ2-3'UTR: 5'-TGA CCT GGG ATG GTT TTG GAG CTA-3' (SEQ ID NO:121).
(v) Амплификацию генов TCR проводили с использованием KOD FX производства ToYoBo при следующих условиях: 94°C, 3 мин -> (98°C, 10 сек -> 68°C, 1 мин) ×35 циклов.
(vi) Размер ПЦР-продуктов подтверждали при использовании электрофореза в агарозном геле, и полосы размером приблизительно 1 тпн вырезали из геля и очищали.
(vii) После добавления аденинов к ПЦР-продуктам, очищенным в вышеуказанном (3)-vi, при использовании Taq-полимеразы, полученные фрагменты лигировали в вектор pCR 2.1.
(viii) Компетентные клетки HST02 трансформировали вышеуказанным (3)-vii, плазмиды выделяли из одиночных колоний и затем секвенировали.
(ix) Анализ последовательности проводили при использовании Международной информационной системы иммуногенетики (http://www.imgt.org/IMGT_vquest/vquest?livret=0&Option=humanTcR) и идентифицировали каждый ген TCR.
В отношении вышеуказанного (3) "Выделение генов TCR с использованием метода 5'-RACE (Быстрой амплификации концов кДНК)", подробная методика эксперимента приведена ниже.
(3-1) Выделение РНК
Выделение РНК из клонов T-клеток выполняли при использовании реактива TRIzol (Invitrogen). Что касается используемых клонов T-клеток, клоны, которые культивировали без стимуляции антигеном в присутствии IL-2 в течение 3 недель, получали с целью предотвращения контаминации питающими клетками.
(3-2) Клонирование полноразмерной кДНК TCR (T-клеточного рецептора) с использованием метода 5'-RACE (Быстрой амплификации концов кДНК)
Для клонирования TCR α/β использовали набор SMARTerTM RACE cDNA Amplification Kit (Clontech). Сначала проводили реакцию 5'-RACE согласно руководству и синтезировали таким образом 1-ю цепь кДНК. Затем для получения полноразмерных кДНК α-цепи и β-цепи TCR реакцию ПЦР проводили с использованием обратных праймеров, специфичных к каждой 3'UTR (нетранслируемой области), и универсального праймера (UPM), который входит в набор, и при использовании синтезированной 1-й цепи кДНК в качестве матрицы. Используемые праймеры являлись следующими.
праймер Cα 3'UTR-RACE: CACAGGCTGTCTTACAATCTTGCAGATC (SEQ ID NО:119)
праймер Cβ1 3'UTR-RACE: CTCCACTTCCAGGGCTGCCTTCA (SEQ ID NО:120)
праймер Cβ2 3'UTR-RACE: TGACCTGGGATGGTTTTGGAGCTA (SEQ ID NО:121)
Затем реакцию ПЦР проводили в реакционном растворе следующего состава, используя KOD FX (TOYOBO).
После реакции ПЦР проводили электрофорез в 1,0% агарозном геле, вырезали одиночные полосы размером приблизительно 900-1000 пн и очищали продукты ПЦР 50 мкл дистиллированной воды при использовании набора QIAquick Gel Extraction Kit (QIAGEN). Для TA-клонирования требовалось добавить аденин на оба конца продуктов ПЦР. Добавление аденина выполняли при использовании ДНК-полимеразы Taq Platinum (Invitrogen) следующим образом.
(1) Получали 2× реакционный раствор, показанный в Таблице ниже.
(2) 2× реакционный раствор инкубировали при 95°C в течение 5 минут.
(3) В раствор добавляли очищенные продукты ПЦР.
(4) Полученные смеси инкубировали при 72°C в течение 10 минут.
Продукты ПЦР с присоединенными аденинами очищали и концентрировали с помощью осаждения этанолом, а затем встраивали в векторы pCR 2.1 (Invitrogen), используя набор для лигирования ДНК Mighty Mix> (TaKaRa). Векторы pCR 2.1, содержащие продукты ПЦР, вводили в компетентные клетки HST02 с помощью трансформации и клонировали.
(3-3) Очистка плазмид, содержащих полноразмерные кДНК α-цепи и β-цепи TCR
Трансформированные компетентные клетки HST02 сеяли на чашки LB/ампициллин и инкубировали при 37°C. Затем одиночные колонии переносили в жидкую среду LB/ампициллин и инкубировали при 37°C с перемешиванием при 200 об/мин. Затем плазмиды выделяли из раствора Escherichia coli, используя автоматизированную систему для выделения ДНК PI-50 (KURABO).
(3-4) Определение CDR3 последовательности TCR при помощи секвенирования
Для секвенирования выделенных плазмид использовали набор BigDye® Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems). Кроме того, использовали обратный праймер M13: caggaaacagctatgac (SEQ ID NO:122). Для анализа TCR и CD3 использовали IMGT/V-QUEST (http://www.imgt.org/IMGT_ vquest/share/textes/).
Определенные нуклеотидные и аминокислотные последовательности CDR3 показаны на Фиг. 1. В некоторых клонах было 2 типа α-цепи и 2 типа последовательностей CDR 3.
Пример 2
Пример 2 Введение генов T-клеточного рецептора (TCR), полученных из WT1332-специфичных CD4+ T-клеток, в CD4+ T-клетки человека
Было подтверждено, что CD4+ T-клетка человека, в которую введены гены T-клеточного рецептора (TCR), полученные из WT1332-специфичной CD4+ T-клетки, показывала WT1332-специфичный и HLA класса II-рестриктированный пролиферативный ответ и продукцию цитокинов.
Гены TCR, показанные в Таблице 3, были выделены из клона 9, который является клоном CD4+ T-клетки, который специфично распознает WT1332 HLA-DPB1*05:01-рестриктированным образом. Эти гены TCR вводили в CD4+ T-клетки, полученные из периферической крови здоровых индивидов, при использовании лентивирусных векторов и исследовали ответ на WT1332 при использовании продукции цитокинов (интерферона-γ и IL-2) в качестве индикатора (фиг. 2A и B). Кроме того, CD4+ T-клетки, трансдуцированные лентивирусными векторами, не несущими гены TCR (обозначенные как пустые), использовали в качестве контроля. CD4+ T-клетки, трансдуцированные WT1332-специфичными генами TCR (обозначенные как "WT1332-TCR-трансдуцированные CD4+ T-клетки" в разделе Примеры), продуцировали IFN-γ и IL-2 только в ответ на WT1332, то есть WT1332-специфично. С другой стороны, контрольно трансдуцированные CD4+ T-клетки не показали WT1332-специфичной продукции цитокинов.
Исследовали влияние концентрации пептида WT1332 на экспрессию цитокина WT1332-TCR-трансдуцированными CD4+ T-клетками. WT1332-TCR-трансдуцированные CD4+ T-клетки в течение 4 часов стимулировали пептидом WT1332 при различных концентрациях и проводили анализ с внутриклеточным окрашиванием цитокинов с целью исследования отношения TNF-α-продуцирующих CD4+ T-клеток к CD4+ T-клеткам. Результаты представлены на фиг. 2C. Продукция цитокина зависела от концентрации пептида WT1332, причем ED50 составила 4,85 мкМ.
При проверке пролиферативной активности WT1332-TCR-трансдуцированных CD4+ T-клеток обнаружили сильную WT1332-специфичную пролиферативную активность, причем пролиферативный ответ был в заметной степени ингибирован антителом к HLA-DP (фиг. 2D).
Затем исследовали пролиферативный ответ и продукцию IFN-γ WT1332-TCR-трансдуцированных CD4+ T-клеток на аутологичные PBMC, стимулированные пептидом WT1332, аутологичные PBMC, стимулированные полноразмерным белком WT1, аутологичные PBMC, стимулированные усеченным белком WT1 (не содержащим последовательность WT1332), PBMC, стимулированные лизатом PHA-blast, PBMC, стимулированные лизатом линии лейкозных клеток TF-1, экспрессирующих WT1, и PBMC, стимулированные лизатом линии лейкозных клеток K562, экспрессирующих WT1. Пролиферацию клеток измеряли путем включения [3H]-тимидина, и IFN-γ измеряли с помощью ELISA. Результаты показаны на Фиг. 2E и Фиг. 2F, соответственно. Было обнаружено, что пролиферацию и продукцию IFN-γ WT1332-TCR-трансдуцированными CD4+ T-клетками существенно повышали PBMC, стимулированные лизатом линий лейкозных клеток (TF-1 и K562), экспрессирующих WT1, а также повышали аутологичные PBMC, стимулированные пептидом WT1332, и аутологичные PBMC, стимулированные полноразмерным белком WT1.
Кроме того, также исследовали продукцию различных цитокинов, которые отвечали на пептиды WT1332, в линиях WT1332-TCR-трансдуцированных CD4+ T-клеток, полученных аналогично линиям CD4+ T-клеток в Примере 2, которые были получены от 3 здоровых (HLA-DPB1*05:01 положительных) доноров (то есть три типа линий клеток). Средние значения цитокин-продуцирующей способности трех типов линий клеток показаны на Фиг. 2G. Цитокины Th1-типа, такие как IL-2, IFN-γ, TNF-α и GM-GSF, вырабатывались в большом количестве.
Гены TCR, выделенные из клона 9
Пример 3
Пример 3 Усиленная индукция WT1-специфичных CTL CD4+ T-клетками человека, трансдуцированными генами TCR, полученными из WT1332-специфичных CD4+ T-клеток
В общих чертах известно, что CD4+ T-клетка служит в качестве хелперной T-клетки и важна для задействования и поддержания CD8+ T-клеток (CTL), которые являются основными эффекторными клетками, атакующими злокачественные клетки. Таким образом, было исследовано, усиливают ли WT1332-TCR-трансдуцированные CD4+ T-клетки индукцию WT1-специфичных CTL.
PBMC HLA-A*24:02 и HLA-DPB1*05:01-положительных здоровых индивидов смешивали с WT1332-TCR-трансдуцированными CD4+ T-клетками, полученными от тех же здоровых индивидов, в отношении 10:1 и 5:1 (обозначены 1:0,1 и 1:0,2 на Фиг. 3) и инкубировали в течение 1 недели в присутствии измененного пептида WT1235 (в котором M, вторая аминокислота природного пептида WT1, связывающаяся с молекулой HLA-A*24:02, был изменена на Y (CYTWNQMNL) (SEQ ID NO:125)), который является эпитопом HLA-A*24:02-рестриктированных CTL, полученным из WT1 и WT1332. Затем полученные клетки снова стимулировали измененным пептидом WT1235 (с повышенной способностью связываться с молекулой HLA-A*24:02), после чего инкубировали в течение 1 недели. В ряд культур не добавляли IL-2, чтобы правильно оценить хелперную активность CD4+ T-клеток. После культивирования в общей сложности в течение 2 недель, проверяли, усиливалась ли индукция WT1-специфичных CTL WT1332-TCR-трансдуцированными CD4+ T-клетками, при использовании частот CD8+ T-клеток, модифицированных WT1235/HLA-A*24:02 тетрамер-положительных CD8+ T-клеток и модифицированных WT1235-специфичных, интерферон-γ (IFN-γ)-экспрессирующих CD8+ T-клеток в качестве индикаторов. В результате частота CD8+ T-клеток была значительно выше при совместном культивировании с WT1332-TCR-трансдуцированными CD4+ T-клетками по сравнению с культивированием с ложно трансдуцированными CD4+ T-клетками в качестве контроля (фиг.3A). Кроме того, в отношении модифицированных WT1235/HLA-A*24:02 тетрамер-положительных CD8+ T-клеток, которые являются WT1-специфичными CTL, четко положительную популяцию обнаружили при совместном культивировании с WT1332-TCR-трансдуцированными CD4+ T-клетками, однако это не обнаружили в контроле (фиг. 3B). При вычислении количества клеток WT1-специфичных CTL, присутствующих на 100000 лимфоцитов, на основе этих результатов, количество клетки было приблизительно в 28 раз выше при совместном культивировании с WT1332-TCR-трансдуцированными CD4+ T-клетками по сравнению с контролем (фиг. 3C). Аналогично, частота CD8+ T-клеток, экспрессирующих IFN-γ при стимуляции измененным WT1235, также была значительно выше при совместном культивировании с WT1332-TCR-трансдуцированными CD4+ T-клетками (фиг. 3D). На основе приведенного выше было показано, что WT1332-TCR-трансдуцированные CD4+ T-клетки усиливали индукцию WT1-специфичных CTL.
Пример 4
Пример 4 HLA-DPB1*05:01-рестриктированное повреждение WT1-экспрессирующих лейкозных клеток CD4+ T-клетками человека, трансдуцированными генами TCR, полученными из WT1332-специфичных CD4+ T-клеток.
Следующим шагом оценивали цитотоксическую активность, то есть киллерную активность, WT1332-TCR-трансдуцированных CD4+ T-клеток.
Во-первых, HLA-DPB1*05:01 ген выделили и трансфицировали в линию лейкозных клеток TF-1, экспрессирующих WT1, для получения HLA-DPB1*05:01-положительных клеток TF-1. Как показано на фиг.4A, WT1332-TCR-трансдуцированные CD4+ T-клетки сильно повреждали HLA-DPB1*05:01-положительные клетки TF-1, однако они не проявляли цитотоксическую активность в отношении HLA-DPB1*05:01-отрицательных клеток TF-1. Затем для подтверждения, является ли эта цитотоксическая активность WT1-специфичной, получали клетки B-LCL(+) путем сверхэкспрессии гена WT1 в HLA-DPB1*05:01-положительных клетках B-LCL, не экспрессирующих WT1 (обозначены как B-LCL(-)), и использовали эти клетки в качестве клеток-мишеней для оценки цитотоксической активности WT1332-TCR-трансдуцированных CD4+ T-клеток. Как показано на фиг. 4B, B-LCL(+) сильно повреждались WT1332-TCR-трансдуцированными CD4+ T-клетками, однако B-LCL(-) не были повреждены. На основе этих результатов было показано, что WT1332-TCR-трансдуцированные CD4+ T-клетки обладали HLA-DPB1*05:01-рестриктированной и WT1-специфичной цитотоксической активностью. Кроме того, цитотоксическая активность WT1332-TCR-трансдуцированных CD4+ T-клеток подтверждалась при использовании линии лейкозных клеток C2F8, которые были HLA-DPB1*05:01-положительными и экспрессировали WT1 (фиг. 4C).
Следующим шагом исследовали, проявляли ли WT1332-TCR-трансдуцированные CD4+ T-клетки цитотоксическую активность посредством гранзима B и перфорина. В WT1332-TCR-трансдуцированных CD4+ T-клетках были обнаружены высокие уровни экспрессии гранзима B и перфорина (фиг. 4D).
WT1332-TCR-трансдуцированные CD4+ T-клетки и CD4+ T-клетки, так же трансдуцированные пустым вектором (контрольно трансдуцированные CD4+ T-клетки), культивировали с HLA-DPB1*05:01-положительными клетками TF-1, стимулированными пептидом WT1332, или HLA-DPB1*05:01-положительными клетками TF-1, не стимулированными пептидом WT1332, в течение 5 часов в присутствии моноклонального антитела против CD107a, меченного АФЦ. Затем проводили IFN-γ окрашивание и подвергали окрашенные клетки проточной цитометрии. Коэкспрессию IFN-γ и CD107a обнаружили в WT1332-TCR-трансдуцированных CD4+ T-клетках только в том случае, когда WT1332-TCR-трансдуцированные CD4+ T-клетки инкубировали с HLA-DPB1*05:01-положительными клетками TF-1, стимулированными пептидом WT1332 (фиг. 4E). Это показывает, что в WT1332-TCR-трансдуцированных CD4+ T-клетках происходит дегрануляция.
Для подтверждения зависимости цитотоксической активности WT1332-TCR-трансдуцированных CD4+ T-клеток от пути гранзима B/перфорина, HLA-DPB1*05:01-положительные клетки TF-1, которые предварительно обрабатывали 100 мкМ ингибитора гранзима, Ac-IETD-Cho, использовали в качестве клеток-мишеней. HLA-DPB1*05:01-положительные клетки TF-1 предварительно обрабатывали 100 мкМ Ac-IETD-Cho или ДМСО (контроль) в течение 2 часов, затем метили 51Cr, инкубировали с WT1332-TCR-трансдуцированными CD4+ T-клетками и проводили анализ высвобождения 51Cr. Цитотоксическая активность WT1332-TCR-трансдуцированных CD4+ T-клеток в отношении HLA-DPB1*05:01-положительных клеток TF-1, которые предварительно обрабатывали Ac-IETD-Cho, была заметно ниже по сравнению с цитотоксической активностью в отношении клеток TF-1, которые предварительно обрабатывали ДМСО (Фиг. 4F).
При рассмотрении этих результатов в совокупности, было подтверждено, что WT1332-TCR-трансдуцированные CD4+ T-клетки, полученные согласно настоящему изобретению, непосредственно распознавали HLA-DPB1*05:01-положительные лейкозные клетки, экспрессирующие WT1, и повреждали их через путь гранзима B/перфорина.
Пример 5
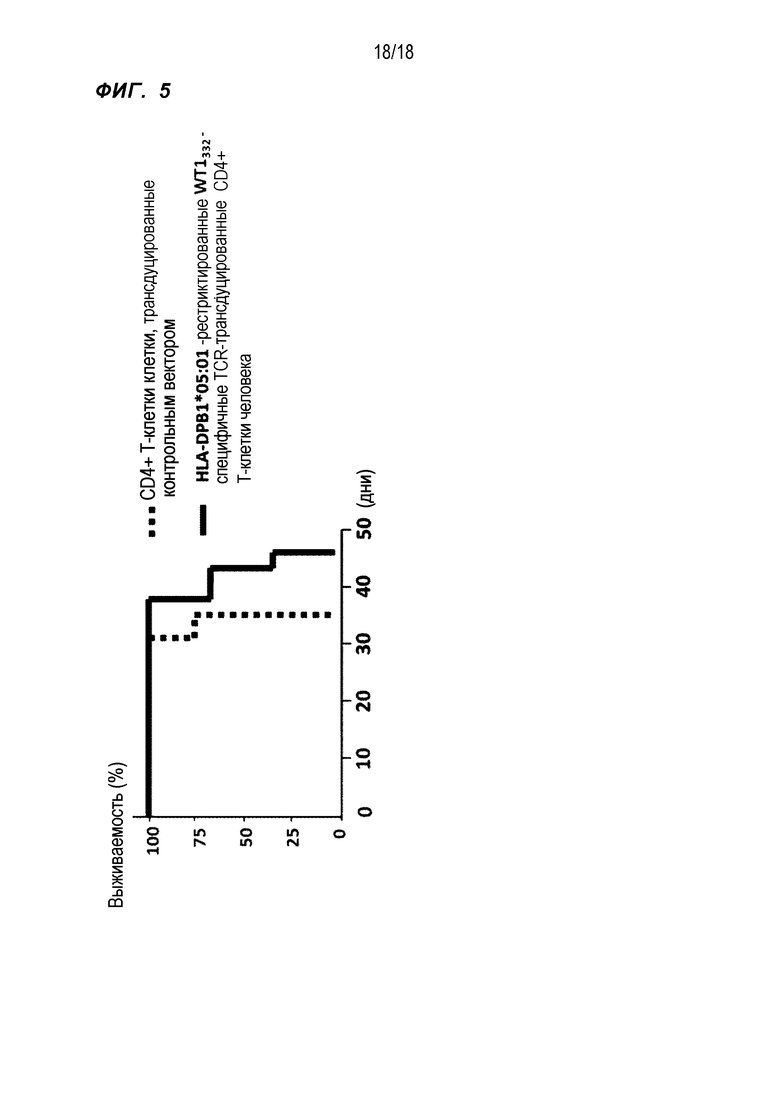
Пример 5 Противоопухолевое действие в мышах NOG® CD4+ T-клеток человека, трансдуцированных генами TCR, полученными из WT1332-специфичных CD4+ T-клеток
WT1-экспрессирующие человеческие HLA-DPB1*05:01-положительные лейкозные клетки C2F8 (5×104 клеток) вводили мышам NOG® (7 мышей) в хвостовую вену. На следующий день, в качестве экспериментальной группы, CD4+ T-клетки человека, трансдуцированные HLA-DPB1*05:01-рестриктированными WT1332-специфичными генами TCR (SEQ ID NO:14 и 15) (5×106 клеток) и человеческие мононуклеарные клетки периферической крови без T-клеток (2×106 клеток), полученные от того же индивида, в качестве антигенпрезентирующих клеток, вводили вышеуказанным мышам NOG® (3 мыши). В качестве контроля, CD4+ T-клетки человека, трансдуцированные контрольным вектором (5×106 клеток) и человеческие мононуклеарные клетки периферической крови без T-клеток (2×106 клеток), полученные от того же индивида, в качестве антигенпрезентирующих клеток, вводили вышеуказанным мышам NOG® (4 мыши).
Через 1 и 2 недели CD4+ T-клетки человека, трансдуцированные HLA-DPB1*05:01-рестриктированными WT1332-специфичными генами TCR (5×106 клеток), вводили мышам экспериментальной группы в хвостовую вену. CD4+ T-клетки человека, трансдуцированные контрольным вектором (5×106 клеток), вводили контрольным мышам в хвостовую вену. Затем исследовали выживаемость мышей.
Результаты показаны на фиг.5. Поскольку уровень выживаемости мышей экспериментальной группы превысил уровень выживаемости контрольных мышей, было показано, что HLA-DPB1*05:01-рестриктированные WT1332-специфичные TCR- трансдуцированные CD4+ T-клетки человека оказывали противоопухолевое действие in vivo.
Промышленная применимость
Настоящее изобретение может применяться в областях фармацевтических средств для лечения или профилактики злокачественной опухоли, реактивов для исследования злокачественной опухоли, а также тест-систем или наборов реактивов для анализа злокачественной опухоли и т.п.












































Настоящее изобретение относится к области биотехнологии, конкретно к полинуклеотидам, которые кодируют CDR3 в генах TCR-[альфа] и TCR-[бета] цепей CD4+ хелперных Т-клеток, которые специфичны к хелперному пептиду WT1322, и может быть использовано в медицине для индукции иммунного ответа против WT1322-экспрессирующей злокачественной опухоли. Гены TCR, содержащие полинуклеотид αCDR3 и полинуклеотид βCDR3, используют для получения CD4+ хелперной клетки, специфичной в отношении пептида WT1322, путем трансдукции CD4+ T-клетки вектором экспрессии, содержащим указанные гены TCR, выбранные из 33 комбинаций пар цепей αCDR3 и βCDR3. Изобретение позволяет эффективно индуцировать WT1322-специфичные противоопухолевые цитотоксические T-лимфоциты (CTL). 13 н. и 2 з.п. ф-лы, 5 ил., 3 табл., 5 пр.
1. Пара из полинуклеотида αCDR3 и полинуклеотида βCDR3 для получения антитела против CD4+ хелперной Т-клетки, специфичной в отношении пептида WT1322,
где пара выбрана из 33 комбинаций полинуклеотида αCDR3 и полинуклеотида βCDR3, как показано ниже:
при условии, что указанная последовательность может быть комплементарной последовательностью или вырожденной последовательностью.
2. Ген TCR, содержащий полинуклеотид αCDR3 и полинуклеотид βCDR3 любой пары по п.1.
3. Ген TCR по п.2, получаемый из CD4+ T-клетки, специфичной в отношении пептида WT1332.
4. Способ получения CD4+ хелперной клетки, специфичной в отношении пептида WT1332, включающий
трансдукцию CD4+ T-клетки вектором экспрессии, содержащим ген TCR по п.2, и
получение WT1332-специфичной TCR-трансдуцированной CD4+ T-клетки.
5. WT1332-специфичная TCR-трансдуцированная CD4+ хелперная T-клетка, получаемая способом по п.4.
6. Вектор экспрессии, содержащий ген TCR, который содержит полинуклеотид αCDR3 и полинуклеотид βCDR3 любой пары по п.1.
7. Способ по п.4, где указанную трансдукцию проводят с помощью вектора по п.6.
8. Способ усиления индукции WT1322-специфичных CTL, включающий совместное культивирование CD4+ хелперной T-клетки по п.5 и мононуклеарной клетки периферической крови.
9. Способ лечения или профилактики WT1322-экспрессирующей злокачественной опухоли у индивида, включающий введение CD4+ хелперной T-клетки, полученной способом по п.4, индивиду,
где индивид является HLA-DRB1*15:01-положительным, HLA-DRB1*09:01-положительным, HLA-DRB1*05:01-положительным, HLA-DRB1*04:05-положительным или HLA-DRB1*15:02-положительным,
где CD4+ хелперная Т-клетка получена из CD4+ Т-клеток индивида.
10. Фармацевтическая композиция для лечения или профилактики WT1322-экспрессирующей злокачественной опухоли, содержащая CD4+ хелперную T-клетку, полученную способом по п.4,
где индивид является HLA-DRB1*15:01-положительным, HLA-DRB1*09:01-положительным, HLA-DRB1*05:01-положительным, HLA-DRB1*04:05-положительным или HLA-DRB1*15:02-положительным,
где CD4+ хелперная Т-клетка получена из CD4+ Т-клетки индивида.
11. Применение CD4+ хелперной T-клетки, полученной способом по п.4, для производства лекарственного средства для лечения или профилактики WT1332-экспрессирующей злокачественной опухоли у индивида,
где индивид является HLA-DRB1*15:01-положительным, HLA-DRB1*09:01-положительным, HLA-DRB1*05:01-положительным, HLA-DRB1*04:05-положительным или HLA-DRB1*15:02-положительным,
где CD4+ хелперная Т-клетка получена из CD4+ Т-клетки индивида.
12. ДНК-чип для измерения количества CD4+ хелперной Т-клетки, специфичной в отношении пептида WT1332, содержащий по крайней мере одну пару олигонуклеотидов по п.1.
13. Применение ДНК-чипа по п.12 для измерения количества CD4+ хелперной Т-клетки, специфичной в отношении пептида WT1332, в образце.
14. Пара пептидов для получения антитела против CD4+ Т-хелперных клеток, специфичных в отношении пептида WT1332, где указанная пара кодируется любой парой полинуклеотидов по п.1.
15. Чип для детекции антитела против CD4+ Т-хелперных клеток, специфичных в отношении пептида WT1332, содержащий пару пептидов по п.14.
| СПОСОБ ПРОИЗВОДСТВА ПИВА "РОССИЯНИН" | 1993 |
|
RU2079253C1 |
| WO 2005056595 А2, 23.06.2005 | |||
| Винтовой пресс | 1938 |
|
SU55105A1 |
| WO 2012046730 A1, 12.04.2012 | |||
| WO 2008105462 A1, 04.09.2008 | |||
| RU 2010127298 A, 10.01.2012. | |||
Авторы
Даты
2019-02-22—Публикация
2013-09-12—Подача