Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к pH-чувствительному носителю и к способу его получения, а также к pH-чувствительному лекарственному средству и pH-чувствительной лекарственной композиции, где каждое из них содержит носитель, и к способу культивирования с их применением. Более конкретно изобретение относится к pH-чувствительному носителю, который является пригодным для DDS (системы доставки лекарственного средства) и способным проявлять эффект, способствующий функции разрушения мембраны, в ответ на слабокислую среду, и к способу его получения, а также к pH-чувствительному лекарственному средству и к pH-чувствительной лекарственной композиции, где каждое из них содержит носитель, и к способу культивирования с их применением.
Предшествующий уровень техники
[0002] В последние годы проводились обширные исследования в отношении носителей DDS (носителей) для доставки физиологически активного вещества в предопределенный участок в необходимом количестве. В настоящее время внимание уделяется реагирующему на стимул носителю с точки зрения улучшения накопления и избирательности участка доставки, и опубликовано много докладов об исследованиях, посвященных внешней стимуляции теплом, магнитным полем или т.п., и стимуляции in vivo, такой как молекулярное распознавание, изменение pH, ферментативная реакция или т.п. В их числе в течение длительного времени исследовали носитель, который является чувствительным к слабокислому pH.
[0003] Например, в качестве pH-чувствительного носителя, реагирующего на слабокислую среду, известны pH-чувствительные липосомы, где к липосомам, содержащим PE (фосфатидилэтаноламин), добавляют различные типы pH-чувствительных элементов, таких как PHC (пальмитоилгомоцистеин), олеиновая кислота, CHEMS (холестерилгемисукцинат) и т.п. (S. Simoes et al., Adv. Drug Deli. Rev., 2004 56 947-965, и т.п.). Недавно были опубликованы исследования с целью улучшения функции новых синтетических веществ, таких как PEAA (поли(2-этилакриловая кислота)), SucPG (сукцинилированный поли(глицидол)) и т.п., синтетических пептидов, таких как GALA, pHLIP (pH Low Insertion Peptide) и т.п., биоразлагаемых веществ, таких как PLGA (сополимер молочной и гликолевой кислот) и т.п., и VLP (вирусоподобной частицы) и виросомы с использованием pH-чувствительного вирусного компонента.
[0004] Предполагают, что pH-чувствительный носитель эффективно доставляет физиологически активное вещество к участку, такому как опухоль или воспаление, где в живом организме pH понижается (Reshetnyak et al., PNAC, 2007, vol. 104, 19, 7893-7898) или доставляет в цитозоль с использованием закисления везикул после захвата клетками.
[0005] В отношении доставки в цитозоль с использованием закисления везикул было выявлено, что миграция лекарственного средства в цитозоль облегчается в результате стимуляции слияния мембраны носителя после доставки в эндосомы, и были опубликованы носитель DDS пептидного производного, содержащего pH-чувствительный участок, структура которого изменяется в ответ на pH, участок слияния мембраны и трансмембранный участок (патент Японии, опубликованный с № 2006-34211).
[0006] Такая доставка физиологически активного вещества в цитозоль является пригодной в различных областях, и, таким образом, она представляет собой технику, осуществление которой является очень востребованным. Например, доставка РНК или ДНК в цитозоль обеспечивает генотерапию, и предполагали, что она индуцирует CTL (цитотоксический T-лимфоцит) доставкой антигена в цитозоль. Было опубликовано, что доставка в цитозоль низкомолекулярного противоракового средства оказывает улучшенное действие на активность, и рассматривалось ее применение к новому типу лекарственного средства для применения в качестве лекарственного средства с направленной внутриклеточной доставкой. Доставка в цитозоль физиологически активного вещества представляет собой серьезную проблему, которую необходимо решить в этих областях и, таким образом, является ключевой техникой для ее решения.
[0007] Принимая во внимание тот факт, что существует успешный случай доставки pHLIP с чувствительностью к pH не более 6 в участок ацидоза, как описано у Reshetnyak et al., PNAC 2007 vol. 104, 19, 7893-7898, или pH, наблюдаемый в эндосомах, составляет приблизительно 4, как описано у S. Simoes et al., Adv. Drug Deli. Rev., 2004, 56, 947-965, необходимо, чтобы pH-чувствительный носитель обладал высокой чувствительностью в диапазоне от нейтрального pH до pH 4. Это также, как указано во многих документах. С точки зрения практического применения важно, чтобы носитель состоял из безопасного вещества.
Сущность изобретения
[0008] Многие pH-чувствительные липосомы и часть биоразлагаемых веществ имеют проблему, которая заключается в том, что они обладают чувствительностью к слишком низкому pH или обладают только неподходящей функцией. Кроме того, по отношению к способу непосредственной модификации pH-чувствительного вещества существует проблема, которая заключается в том, что активность физиологически активного вещества может снижаться. Новый тип синтетического вещества или вирусного компонента вызывает опасение с точки зрения безопасности.
[0009] Таким образом, изобретение было выполнено при таких обстоятельствах, как указано выше, и целью изобретения является предоставление pH-чувствительного носителя, который может служить в качестве носителя для физиологически активного вещества и способен проявлять эффект, способствующий функции разрушения мембраны, в ответ на слабую кислую среду, и способа его получения, а также к предоставлению pH-чувствительного лекарственного средства и pH-чувствительной лекарственной композиции, где каждое содержит носитель, и к способу культивирования с их применением.
[0010] Для достижения указанной выше цели изобретение относится к (1) pH-чувствительному носителю, который содержит по меньшей мере одно pH-чувствительное соединение, выбранное из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей, и по меньшей мере одного амфипатического вещества, выбранного из группы, состоящей из фосфатидилхолина, содержащего от 10 до 12 атомов углерода, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола, и который способен проявлять эффект, способствующей функции разрушения мембраны.
[0011] Для достижения указанной выше цели изобретение также относится к (2) pH-чувствительному носителю, указанному в пункте (1) выше, где pH-чувствительное соединение и амфипатическое вещество образуют мицеллярные частицы.
[0012] Для достижения указанной выше цели изобретение относится к (3) pH-чувствительному носителю, указанному в пункте (2) выше, где размер частиц составляет от 10 до 200 нм.
[0013] Для достижения указанной выше цели изобретение относится к (4) pH-чувствительному носителю, указанному в любом из пунктов (1)-(3) выше, где pH-чувствительное соединение содержится в количестве не менее 10 моль на 100 моль амфипатического вещества.
[0014] Кроме того, для достижения указанной выше цели изобретение относится к (5) pH-чувствительному носителю, указанному в любом из пунктов (1)-(4) выше, где вымывание одного pH-чувствительного соединения в тесте на вымывание принимают как La, вымывание одного амфипатического вещества принимают как Lb, вымывание pH-чувствительного носителя принимают как Lc, вымывания при pH 7,4 соответственно принимают как Lc7,4, La7,4 и Lb7,4, и вымывания при pH 5,0 или 4,5 соответственно принимают как Lcx, Lax и Lbx, Δ, представленная следующим ниже уравнением (1), составляет не менее 5 и Δ', представленная следующим ниже уравнением (2), составляет не менее 5.
[0015] МАТЕМАТИКА 1
Уравнение(1) Δ=(Lcx-Lc7,4)-(Lax-La7,4)
Уравнение (2) Δ'=Lcx-(Lax+Lbx)
[0016] Для достижения указанной выше цели изобретение также относится к (6) pH-чувствительному лекарственному средству, где pH-чувствительный носитель, определяемый в любом из пунктов (1)-(5) выше, поддерживает физиологически активное вещество.
[0017] Кроме того, для достижения указанной выше цели изобретение относится к (7) pH-чувствительному лекарственному средству, указанному в пункте (6) выше, где физиологически активное вещество состоит из белка или пептида.
[0018] Для достижения указанной выше цели изобретение относится к (8) pH-чувствительной лекарственной композиции, содержащей pH-чувствительный носитель и физиологически активное вещество, определяемые в любом из пунктов (1)-(5) выше.
[0019] Кроме того, для достижения указанной выше цели изобретение относится к (9) pH-чувствительной лекарственной композиции, указанной в пункте (8) выше, где физиологически активное вещество представляет собой белок или пептид.
[0020] Для достижения указанной выше цели изобретение относится к (10) способу получения pH-чувствительного носителя, который способен проявлять эффект, способствующий функции разрушения мембраны, включающий стадию связывания по меньшей мере одного pH-чувствительного соединения, выбранного из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей, и по меньшей мере одного амфипатического вещества, выбранного из группы, состоящей из фосфатидилхолина, содержащего от 10 до 12 атомов углерода, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола.
[0021] Для достижения указанной выше цели изобретение относится к (11) способу культивирования, включающему стадию культивирования клеток в среде, содержащей pH-чувствительное лекарственное средство, указанное в пункте (6) или (7) выше, и/или pH-чувствительную лекарственную композицию, указанную в пункте (8) или (9) выше.
Краткое описание чертежей
[0022] Фиг. 1A
Фиг. 1A представляет собой схематическое изображение лекарственного средства, содержащего pH-чувствительный носитель по изобретению и физиологически активное вещество на подложке носителя.
Фиг. 1B
Фиг. 1B представляет собой схематическое изображение, демонстрирующее доставку физиологически активного вещества на подложке pH-чувствительного носителя в цитозоль, в результате проявления эффекта, способствующего функции разрушения мембраны pH-чувствительного носителя, в случае, когда используют pH-чувствительное лекарственное средство.
Фиг. 1C
Фиг. 1C представляет собой схематическое изображение, демонстрирующее доставку физиологически активного вещества смешанного с pH-чувствительным носителем, в цитозоль в результате проявления эффекта, способствующего функции разрушения мембраны pH-чувствительного носителя, в случае, когда используют pH-чувствительную лекарственную композицию.
Фиг. 2A
Фиг. 2A представляет собой фотографию дисперсий дезоксихолевой кислоты и EYPC (фосфатидилхолина яичного желтка), где дезоксихолевая кислота содержится в различных концентрациях.
Фиг. 2B
Фиг. 2B представляет собой фотографию дисперсий дезоксихолевой кислоты и DLPC (дилауроилфосфатидилхолина), где дезоксихолевая кислота содержится в различных концентрациях.
Фиг. 2C
Фиг. 2C представляет собой график, демонстрирующий прозрачность дисперсий, содержащих EYPC и дезоксихолевую кислоту.
Фиг. 2D
Фиг. 2D представляет собой график, демонстрирующий прозрачность дисперсий, содержащих DLPC и дезоксихолевую кислоту.
Фиг. 3
Фиг. 3 представляет собой график, демонстрирующий дзета-потенциал дисперсии, содержащей EYPC и дезоксихолевую кислоту, в зависимости от количества дезоксихолевой кислоты.
Фиг. 4
Фиг. 4 представляет собой график, демонстрирующий вымывания одного EYPC, одного DLPC, одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат при различных pH.
Фиг. 5
(A) фиг. 5 представляет собой график, демонстрирующий отношения интенсивности флуоресценции одного EYPC, одного DLPC, одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат при различных pH в случае инкубации с меченой двойной флуоресцентной меткой липосомой; и (B) фиг. 5 представляет собой график, демонстрирующий скорости слияния одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат.
Фиг. 6
Фиг. 6 представляет собой график, демонстрирующий вымывание в липосоме DOPE (диолеоилфосфатидилэтаноламина)-Chems, липосоме DOPE-олеиновой кислоты и комплекса DLPC-дезоксихолат в зависимости от pH.
Фиг. 7
(A) и (B) фиг. 7 представляют собой соответственно график, демонстрирующий скорости слияния одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат в зависимости от количества дезоксихолевой кислоты.
Фиг. 8
(A) фиг. 8 представляет собой график, демонстрирующий скорости слияния одной дезоксихолевой кислоты, одного комплекса DSPC (дистеароилфосфатидилхолин)-дезоксихолат, комплекса DPPC (дипальмитоилфосфатидилхолин)-дезоксихолат, комплекса DMPC (димиристоилфосфатидилхолин)-дезоксихолевая кислота, комплекса DLPC-дезоксихолат и комплекса DDPC (дидеканоилфосфатидилхолин)-дезоксихолат; и (B) фиг. 8 представляет собой график, демонстрирующий скорости слияния одной дезоксихолевой кислоты, комплекса HSPC (фосфатидилхолин гидрогенизированных соевых бобов)-дезоксихолат, комплекса DOPC (диолеоилфосфатидилхолин)-дезоксихолат и комплекса POPC (1-пальмитоил-2-олеоилфосфатидилхолин)-дезоксихолат.
Фиг. 9
(A) фиг. 9 представляет собой график, демонстрирующий вымывания одной дезоксихолевой кислоты, одного DLPE (дилауроилфосфатидилэтаноламина), одного DMPE (димиристоилфосфатидилэтаноламина), одного DSPE (дистеароилфосфатидилэтаноламина) и одного DOPE, и (B) фиг. 9 представляет собой график, демонстрирующий вымывания одной дезоксихолевой кислоты, комплекса DLPE-дезоксихолат, комплекса DMPE-дезоксихолат, комплекса DSPE-дезоксихолат и комплекса DOPE-дезоксихолат.
Фиг. 10
Фиг. 10 представляет собой график, демонстрирующий вымывания комплексов дезоксихолевой кислоты с макромолекулярными веществами при pH 5,0.
Фиг. 11
Фиг. 11 представляет собой набор графиков, демонстрирующих вымывания комплексов EYPC, дезоксихолевой кислоты и DLPC или SPAN 85 при pH 7,4 на (A) и pH 5,0 на (B).
Фиг. 12
Фиг. 12 представляет собой набор графиков, демонстрирующих вымывания комплексов DLPC и различных типов соединений-кандидатов при pH 7,4 на (A) и pH 5,0 на (B).
Фиг. 13
Фиг. 13 представляет собой набор графиков, демонстрирующих вымывания комплексов DLPC и различные типы соединений-кандидатов в зависимости от pH.
Фиг. 14
Фиг. 14 представляет собой набор графиков, демонстрирующих скорости слияния различных типов pH-чувствительных соединений, при их отдельном использовании на (A) и в комплексах DLPC и различных типов pH-чувствительных соединений на (B).
Фиг. 15
На фиг. 15 представлены микрофотографии, получаемые в случае, когда флуоресцентно-меченный комплекс DLPC-дезоксихолат и клетку HeLa инкубируют в среде с pH 7,4 на (A) и с pH 5,3 на (B), а также продемонстрирована интенсивность флуоресценции клеток, оцениваемая с использованием поточный цитометр на (C).
Фиг. 16
Фиг. 16 представляет собой набор графиков, демонстрирующих вымывания носителей, содержащих пептид на (A) и белок на (B) при pH 7,4 и 5,0 соответственно.
Фиг. 17
Фиг. 17 представляет собой набор графиков, демонстрирующих скорости слияния комплексов DLPC-дезоксихолат на (A) и комплексов DLPC-урсодезоксихолат на (B), содержащих пептид и белок, соответственно, при pH 7,4 и 5,0.
Фиг. 18
Фиг. 18 представляет собой фотографию (A) раствора одного флуоресцентно-меченого пептида, (B) раствора одного DLPC, содержащего флуоресцентно-меченый пептид, (C) раствора комплекса DLPC-дезоксихолат, содержащего флуоресцентно-меченый пептид, и (D) раствора комплекса DLPC-урсодезоксихолат, содержащего флуоресцентно-меченый пептид.
Фиг. 19
Фиг. 19 представляет собой набор микрофотографий флуоресценции клеток, обрабатываемых одним флуоресцентно-меченым пептидом на (A), одним DLPC, содержащим флуоресцентно-меченый пептид, на (B) и комплексом DLPC-дезоксихолат, содержащим флуоресцентно-меченый пептид на (C).
Фиг. 20
На фиг. 20 представлена микрофотография на (A) и микрофотография флуоресценции на (B) клеток, обрабатываемых комплексом DLPC-дезоксихолат, содержащим флуоресцентно-меченый пептид, и микрофотография на (C) и микрофотография флуоресценции на (D) клеток, обрабатываемых комплексом DLPC-урсодезоксихолат, содержащим флуоресцентно-меченый пептид, соответственно.
Фиг. 21
На фиг. 21 представлены результаты оценки доставки β-гал в цитозоль и, в частности, результаты оценки одного β-гал на (A), содержащего β-гал комплекса DLPC-дезоксихолат на (B) и содержащего β-гал комплекса DLPC-урсодезоксихолат на (C).
Фиг. 22A
На фиг. 22A представлены результаты теста проверки доставки в цитозоль, когда соответствующие pH-чувствительные носители и физиологически активные вещества используют независимо, и соответственно, представляют собой наложенные изображения микрофотографий и микрофотографий флуоресценции, получаемых с использованием в среде культуру клеток (A) одного флуоресцентно-меченого пептида-FITC, (B) одного флуоресцентно-меченого OVA-FITC, (C) комбинации флуоресцентно-меченого пептида-FITC и комплекса EYPC-дезоксихолат, (D) комбинации флуоресцентно-меченого OVA-FITC и комплекса EYPC-дезоксихолат, (E) комбинации флуоресцентно-меченого пептида-FITC и комплекса DLPC-дезоксихолат, (F) комбинации флуоресцентно-меченого OVA-FITC и комплекса DLPC-дезоксихолат, (G) комбинации флуоресцентно-меченого пептида-FITC и комплекса SPAN 80-дезоксихолат, (H) комбинации флуоресцентно-меченого OVA-FITC и комплекса SPAN 80-дезоксихолат, (I) комбинации флуоресцентно-меченого пептида-FITC и комплекса DDPC-дезоксихолат и (J) комбинации флуоресцентно-меченого OVA-FITC и комплекса DDPC-дезоксихолат.
Фиг. 22B
На фиг. 22B представлены результаты теста проверки доставки в цитозоль, когда соответствующие pH-чувствительные носители и физиологически активные вещества используют независимо, и соответственно представляют собой наложенные изображения микрофотографий и микрофотографий флуоресценции, получаемых с использованием в среде культуры клеток (K) комбинации флуоресцентно-меченого пептида-FITC и комплекса PEG-10 касторовое масло-дезоксихолат, (L) комбинации флуоресцентно-меченого OVA-FITC и комплекса PEG-10 касторовое масло-дезоксихолат, (M) комбинации флуоресцентно-меченого пептида-FITC и комплекса Tween 20-дезоксихолат, (N) комбинации флуоресцентно-меченого OVA-FITC и комплекса Tween 20-дезоксихолат, (O) комбинация флуоресцентно-меченого пептид-FITC и Tween 80-дезоксихолатного комплекса, (P) комбинация флуоресцентно-меченого OVA-FITC и комплекса Tween 80-дезоксихолатного комплекса, (Q) комбинации флуоресцентно-меченого пептида-FITC и комплекса α-токоферол-дезоксихолат, (R) комбинации флуоресцентно-меченого OVA-FITC и комплекса α-токоферол-дезоксихолат, (S) комбинации флуоресцентно-меченого пептида-FITC и комплекса DLPC-урсодезоксихолат и (T) комбинации флуоресцентно-меченого OVA-FITC и комплекса DLPC-урсодезоксихолат.
Фиг. 22C
На фиг. 22C представлены результаты теста проверки доставки в цитозоль, когда соответствующие pH-чувствительные носители и физиологически активные вещества используют независимо, и соответственно, представляют собой наложенные изображения микрофотографий и микрофотографии флуоресценции, получаемых с использованием в среде культуры клеток (U) комбинации флуоресцентно-меченого пептида-FITC и комплекса DLPC-глицирризиновая кислота, (V) комбинации флуоресцентно-меченого OVA-FITC и комплекса DLPC-глицирризиновая кислота, (W) комбинации флуоресцентно-меченого пептида-FITC и комплекса DLPC-хенодезоксихолат, (X) комбинации флуоресцентно-меченого OVA-FITC и комплекса DLPC-хенодезоксихолат, (Y) комбинации флуоресцентно-меченого пептида-FITC и комплекса DLPC-гиодезоксихолат, (Z) комбинации флуоресцентно-меченого OVA-FITC и комплекса DLPC-гиодезоксихолат, (AA) комбинации флуоресцентно-меченого пептида-FITC и комплекса DLPC-гликодезоксихолат и (AB) комбинации флуоресцентно-меченого OVA-FITC и комплекса DLPC-гликодезоксихолат.
Способы осуществления изобретения
[0023] Изобретение относится к pH-чувствительному носителю, который содержит по меньшей мере одно pH-чувствительное соединение, выбранное из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей, и по меньшей мере одного амфипатического вещества, выбранного из группы, состоящей из фосфатидилхолина, содержащего от 10 до 12 атомов углерода, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола, и способен проявлять эффект, стимулирующий функцию разрушения мембран. Далее в настоящем описании в некоторых случаях pH-чувствительный носитель может быть обозначен только как "носитель", "связанный продукт" или "комплекс". Следует отметить, что "число атомов углерода" амфипатического вещества в настоящем описании означает число атомов углерода молекулы жирной кислоты (ацильной группы), служащей в качестве гидрофобного участка амфипатического вещества.
[0024] По изобретению может быть предусмотрен pH-чувствительный носитель, который является лучше с точки зрения безопасности и обладает лучшей чувствительностью к изменению pH.
[0025] Как используют в практическом осуществлении изобретения термин "функция разрушения мембраны" означает функцию, вызывающую вымывание, в тесте на вымывание. Используемый в этом описании тест на вымывание представляет собой тест, где липосомы (дисперсия), содержащие водный раствор, содержащий гасящее вещество и флуоресцентное вещество, и pH-чувствительный носитель или дисперсию оцениваемого образца, такого как одно pH-чувствительное соединение или одно амфипатическое соединение, добавляют к водному раствору, pH которого доводят до заданного уровня, с последующей инкубацией водного раствора при 37°C в течение 90 минут или 30 минут и измерением флуоресценции водного раствора. В соответствии с этим способом можно измерять флуоресцентное вещество, растворенное и вымываемое из липосом, на основании чего можно подтверждать функцию разрушения мембраны липосомы pH-чувствительного носителя. Следует отметить, что тест на вымывание более подробно будет описан в примерах, приведенных далее в настоящем описании.
[0026] Предполагают, что термин "проявлять эффект, стимулирующий функцию разрушения мембран," соответствует обоим требованиям (1) и (2): (1) в тесте на вымывание, вымывание при данном pH, который является ниже физиологического pH, увеличивается по сравнению с вымыванием при физиологическом pH, и увеличение является больше чем увеличение, когда pH-чувствительное соединение отдельно подвергают тестированию; и (2) в тесте на вымывание при данном pH меньше физиологического pH вымывание в момент времени, когда pH-чувствительное соединение и амфипатическое вещество образуют комплекс (pH-чувствительный носитель), является больше, чем сумма вымывания одного pH-чувствительного соединения и вымывания одного амфипатического вещества. Более конкретно, проявлять эффект, стимулирующий функцию разрушения мембран, означает, что в тесте на вымывание при pH 7,4 и при pH 5,0 или 4,5 вымывание Lc pH-чувствительного носителя (комплекса pH-чувствительного соединения и амфипатического вещества) соответствует обоим следующим ниже отношениям с вымыванием одного La pH-чувствительного соединения и затем вымыванием Lb одного амфипатического вещества. Более конкретно, указанное выше (1) представлено следующей ниже формулой (1) и указанное выше (2) представлено следующей ниже формулой (2). Следует отметить, что в следующих ниже формулах вымывания при pH 7,4 соответственно обозначены как Lc7,4, La7,4 и Lb7,4, и вымывания при pH 5,0 или 4,5 соответственно обозначены как Lcx, Lax и Lbx.
[0027] МАТЕМАТИКА 2
Формула (1) Δ=(Lcx-Lc7,4)-(Lax-La7,4)>0
Формула (2) Δ'=Lcx-(Lax+Lbx)>0
[0028] В указанной выше формуле (1) Δ должно превышать 0 и предпочтительно равно не менее 5, более предпочтительно не менее 10 и наиболее предпочтительно не менее 30. В указанной выше формуле (2) Δ' должно превышать 0 и предпочтительно равно не менее 5, более предпочтительно не менее 10 и наиболее предпочтительно не менее 15.
[0029] Предпочтительный pH-чувствительный носитель представляет собой pH-чувствительный носитель, Δ и Δ' которого соответственно равны не менее 5 в указанных выше формулах (1) и (2), и который содержит желчную кислоту и липид. Еще один предпочтительный pH-чувствительный носитель представляет собой pH-чувствительный носитель, Δ и Δ' которого в формулах (1) и (2) соответственно равны не менее 5, и который содержит глицирризиновую кислоту или глицирретиновую кислоту и липид.
[0030] В настоящем описании термин "физиологический pH" означает pH в нормальной ткани или нормальной жидкости организма. Физиологический pH, как правило, равен 7,4 и может более или менее различаться (±0,10) в зависимости от нормальной ткани или нормальной жидкости организма. Термин "данный pH, меньший физиологического pH" означает pH менее 7,4, предпочтительно pH от не менее 3,0 до менее 7,4, более предпочтительно pH от не менее 4,0 до менее 7,3 и наиболее предпочтительно pH от не менее 4,5 до менее 7,0.
[0031] Несмотря на то, что не ясно как pH-чувствительный носитель по изобретению проявляет эффект, стимулирующий функцию разрушения мембран, предполагают, что этот эффект проявляется следующим образом. Следует отметить, что изобретение следует истолковывать как ограниченное следующим ниже предположением.
[0032] Полагают, что pH-чувствительный носитель по изобретению образован путем связывания pH-чувствительного соединения и амфипатического вещества в водном растворе при значении pH не ниже физиологического pH.
[0033] На фиг. 1A схематически представлен pH-чувствительный носитель и pH-чувствительное лекарственное средство по изобретению, где при этом pH-чувствительный носитель служит подложкой для физиологически активного вещества. Как продемонстрировано на фиг. 1A, полагают, что pH-чувствительный носитель образован путем связывания pH-чувствительного соединения с амфипатическим веществом в его гидрофобном участке. pH-чувствительный носитель по изобретению может содержать в себе физиологически активное вещество. Следует отметить, что форма пути связывания pH-чувствительного носителя основана на предположении, и, таким образом, pH-чувствительный носитель по изобретению не ограничен такой формой пути связывания. Форма подложки pH-чувствительного носителя основана на предположении, и, таким образом, не следует интерпретировать pH-чувствительный носитель по изобретению как ограниченный такой формой положки.
[0034] Предполагают, что pH-чувствительный носитель обладает эффектом, стимулирующим функцию разрушения мембран, вследствие того, что, если pH окружающей среды становится ниже физиологического pH, изменяется форма пути связывания pH-чувствительного носителя между pH-чувствительным соединением и амфипатическим веществом. Например, предполагают, что если в системе pH становится ниже физиологического pH, где присутствуют pH-чувствительный носитель и биологическая мембрана (например, клеточная мембрана, везикулярная мембрана или т.п.), изменяется путь связывания, образующий pH-чувствительный носитель. После контакта с биологической мембраной структурное изменение биологической мембраны обусловлено изменением формы пути связывания. Более конкретно, pH-чувствительный носитель вызывает структурное изменение биологической мембраны. Такое изменение предполагают следующим образом: когда pH изменяется в сторону слабой кислотности, pH-чувствительное соединение в pH-чувствительном носителе становится нестабилизированным в структуре носителя, что приводит к тому, что pH-чувствительный носитель претерпевает перегруппировку с биологической мембраной, существующей в системе, таким образом, проявляя эффект, способствующий функции разрушения мембраны. Другими словами, предполагают, что pH-чувствительное соединение представляет собой молекулу, которая действует, изменяя растворимость в сторону гидрофобного пути связывания через протонирование, когда pH становится слабокислым. Более конкретно, гидрофобный путь связывания, содержащий pH-чувствительное соединение, изменяется в ответ на слабую кислую среду и способен проявлять функцию. Как используют в настоящем описании, термин "разрушение мембраны" относится к изменению, в такой мембранной структуре и может не только включать разделение или разложение всех составляющих мембрану компонентов. Вследствие появления такого "разрушения мембраны" компоненты, содержащиеся внутри биологической мембраны (например, цитозоль) вымываются из биологической мембраны.
[0035] pH-чувствительный носитель по изобретению предпочтительно представляет собой pH-чувствительный носитель, вымывание которого, определяемое тестом на вымывание, составляет менее 20% при pH 7,4 и составляет более 20% при pH 4,0. Более предпочтительно вымывание в тесте на вымывание составляет менее 20% при pH 6,5 и более 20% при pH 4,0. Кроме того, вымывание при pH 7,4 или 6,5 составляет более предпочтительно не более 15% и наиболее предпочтительно не более 10%. Вымывание при pH 4,0 более предпочтительно составляет не менее 40% и наиболее предпочтительно не менее 50%. Когда вымывание pH-чувствительного носителя устанавливают, как определено выше, проявление эффекта, способствующего функции разрушения мембраны, можно лучше продемонстрировать при слабокислом pH.
[0036] Наряду с эффектом, способствующим функции разрушения мембраны, pH-чувствительный носитель по изобретению также может проявлять эффект, способствующий функции слияния мембран.
[0037] В практическом осуществлении изобретения термин "функция слияния мембран" означает функцию вызывания слияния мембран в тесте на слияние мембран. Тест на слияние мембран, используемый в настоящем описании, представляет собой тест, где липосома (дисперсия), содержащая два типа флуоресцентных веществ в бимолекулярной мембране, и pH-чувствительный носитель или оцениваемую дисперсию образца, такую как одного pH-чувствительного соединения, одного амфипатического вещества или т.п., добавляют в водный раствор, доведенный до данного pH, и получаемый водный раствор инкубируют при 37°C в течение 60 минут с последующим измерением флуоресценции водного раствора. Этим способом можно измерять изменения резонансного переноса энергии двух типов флуоресцентных веществ, содержащихся в липосоме, таким образом, подтверждая функцию слияния мембраны pH-чувствительного носителя. Следует отметить, что тест на слияние мембран подробно описан в примерах, следующих далее в настоящем описании.
[0038] Как используют в настоящем описании, предполагают, что термин "проявлять эффект, способствующий функции слияния мембран," соответствует тому, что в тесте на слияние мембран, скорости слияния при данном pH, меньшим физиологического pH, повышается по сравнению со скоростью слияния при физиологическом pH, и повышение является большим по сравнению с тем, когда в тесте используют одно pH-чувствительное соединение. Более конкретно, проявлять эффект, способствующий функции слияния мембран, означает, что в тесте на слияние мембран при pH 7,4 и 5,0 скорость слияния Rc (%) pH-чувствительного носителя (комплекса pH-чувствительного соединения и амфипатического вещества) и скорость слияния Ra (%) одного pH-чувствительного соединения соответствует отношению следующей ниже формулы (3). Следует отметить, что скорости слияния при pH 7,4 соответственно представлены Rc7,4 и Ra7,4, и скорости слияния при pH 5,0 соответственно представлены Rcx и Rax.
[0039] МАТЕМАТИКА 3
Формула (3) ΔR=(Rcx-Rc7,4)-(Rax-Ra7,4)>0
[0040] В формуле (3) ΔR должно быть больше 0 и предпочтительно равно не менее 2, более предпочтительно не менее 5 и наиболее предпочтительно не менее 10.
[0041] Предпочтительный pH-чувствительный носитель представляет собой pH-чувствительный носитель, ΔR которого в указанной выше формуле (3) равно не менее 2, и который содержит желчную кислоту и липид.
[0042] pH-чувствительный носитель по изобретению проявляет эффект, способствующий функции слияния мембраны при слабокислом pH (при данном pH ниже физиологического pH). Хотя этот механизм полностью непонятен, предполагают, что задействован такой механизм, как устанавливают в отношении эффекта, способствующего функции разрушения мембраны. Следует отметить, что изобретение не следует интерпретировать, как ограниченное этим предположением.
[0043] В частности, полагают, что форма пути связывания pH-чувствительного носителя по изобретению между pH-чувствительным соединением и амфипатическим веществом изменяется, если pH окружающей среды становится меньше физиологического, таким образом, что происходит слияние, вследствие перегруппировки с биологической мембраной, существующей в системе. В этом случае перегруппировка, приписываемая слиянию, возникает между самими аффинными компонентами с неаффинными компонентами биологической мембраны, или низкоаффинные компоненты (например, физиологически активное вещество) исключаются или выделяются из мембраны, претерпевшей перегруппировку.
[0044] Как правило, внеклеточная молекула окружена эндосомой, которая представляет собой вид биологической мембраны и поглощается клеткой. В дальнейшем pH внутри эндосомы понижается в результате действия протонного насоса. Кроме того, эндосома сливается с лизосомой, содержащей гидролазу, таким образом, что внеклеточная молекула разрушается. Таким образом, большинство внеклеточных молекул не доставляют в цитозоль.
[0045] В противоположность этому согласно изобретению pH-чувствительный носитель (pH-чувствительное лекарственное средство или pH-чувствительная лекарственная композиция) окружены эндосомой и поглощаются клеткой, как продемонстрировано на фиг. 1B и 1C, таким образом, приводя аналогично как в среде, где pH является ниже. В сочетании с понижением (закислением) pH pH-чувствительное соединение приводит к тому, что pH-чувствительный носитель является нестабильным, таким образом, что возникает перегруппировка мембраны между эндосомой и pH-чувствительным носителем, таким образом, обуславливая разрушающую мембрану функцию (иногда разрушающая мембрану функция возникает наряду с функцией слияния мембраны в некоторых случаях), обусловленную pH-чувствительным носителем.
[0046] Как проиллюстрировано на фиг. 1B и 1C, использование pH-чувствительного носителя по изобретению обеспечивает возможность доставки физиологически активного вещества и т.п. в цитозоль. Более конкретно, когда используют pH-чувствительное лекарственное средство, физиологически активное вещество (фиг. 1B), содержащееся в pH-чувствительном носителе, или физиологически активное вещество (фиг. 1C), используемое совместно с pH-чувствительным носителем, в случае использования pH-чувствительной лекарственной композиции окружено эндосомой совместно с pH-чувствительным носителем и поглощается в эндосоме. Когда pH внутри эндосомы понижается, pH-чувствительное соединение приводит к тому, что pH-чувствительный носитель является нестабильным, таким образом, что возникает перегруппировка мембраны между эндосомой и pH-чувствительным носителем. Как следствие, происходит разрушение мембраны эндосомы с pH-чувствительным носителем. Таким образом, физиологически активное вещество выделяется в цитозоль. Другими словами, доставку в цитозоль можно проводить, не вызывая разрушение физиологически активного вещества.
[0047] Предпочтительно pH-чувствительный носитель по изобретению образует комплекс, содержащий pH-чувствительное соединение и амфипатическое вещество в водной среде. Форма комплекса не является критичной, и pH-чувствительное соединение и амфипатическое вещество могут образовывать мембрану, или часть или все pH-чувствительное соединение может быть погружено в структуру, образованную амфипатическим веществом, посредством пути связывания. Хотя предпочтительно, чтобы pH-чувствительное соединение и амфипатическое вещество образовывали мицеллярные частицы, в pH-чувствительном носителе по изобретению может образовываться дисперсный носитель, такой как липосома. Когда принимают во внимание эффект EPR (повышенного проникновения и удержания) и эндоцитоз, размер мицеллярных частиц предпочтительно составляет от 10 до 200 нм. Более предпочтительно размер составляет от 10 до 100 нм. Следует отметить, что мицеллярная частица, используемая в настоящем описании, означает частицу, образованную в результате конкретного пути связывания pH-чувствительного соединения и амфипатического вещества в результате гидрофобного взаимодействия. Как правило, приводят частицы мономолекулярной мембранной структуры, но, не включая частицы, образующие бимолекулярную липидную мембранную структуру (например, липосому). Размер частиц pH-чувствительного носителя, указанного в этом описании, можно измерять способом динамического рассеяния света (Nano ZS 90, выпускаемого MALVERN Instruments Ltd).
[0048] Следует отметить, что в практическом осуществлении изобретения достаточным является, что pH-чувствительный носитель существует в водном растворе, содержащим pH-чувствительный носитель, даже если pH-чувствительное соединение или амфипатическое вещество существует в свободном состоянии без образования пути связывания.
[0049] Соответствующие компоненты pH-чувствительного носителя по изобретению описаны ниже.
[0050] СОСТАВЛЯЮЩИЕ КОМПОНЕНТЫ РН-ЧУВСТВИТЕЛЬНОГО НОСИТЕЛЯ
(pH-чувствительное соединение)
В качестве pH-чувствительного соединения, используемого в изобретении, можно упомянуть по меньшей мере pH-чувствительное соединение, выбранное из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей. Соли pH-чувствительного соединения не являются критичными, среды которых можно упомянуть соли щелочных металлов, таких как литий, натрий, калий и т.п., соли, таких как магний, кальций, барий и т.п., и аммонийные соли. Эти pH-чувствительные соединения можно использовать отдельно или в комбинации из двух или более.
[0051] Предпочтительные pH-чувствительные соединения включают дезоксихолевую кислоту, урсодезоксихолевую кислоту, хенодезоксихолевую кислоту, гиодезоксихолевую кислоту, глюкодезоксихолевую кислоту, глицирризиновую кислоту или их соли, из которых дезоксихолевая кислота, урсодезоксихолевая кислота, глицирризиновая кислота или их соли являются более предпочтительными.
[0052] Дезоксихолевая кислота, холевая кислота, урсодезоксихолевая кислота, хенодезоксихолевая кислота, гиодезоксихолевая кислота, C27-желчня кислота и глюкодезоксихолевая кислота, которые предпочтительно использовать в изобретении, как правило, называются "желчной кислотой". Еще до 1920 гг. желчная кислота была известна, как характерное стероидное производное, и ее использовали в области бактериологии. Желчная кислота образует комплексы с холестерином, липидами и жирорастворимыми витаминами в живом организме человека и играет роль дополнения их всасывания. Кроме того, вследствие способности образовывать комплексы с липидами, белками и гидрофобными веществами с точки зрения физико-химических свойств желчной кислоты в течение длительного времени ее использовали для выделения и очистки белков, а также в качестве солюбилизатора или эмульгатора. В последние годы внимание уделялось использованию в способах получения вакцин, а также в качестве усилителя всасывания лекарственного средства через переносчик желчных кислот. В частности, деоксихолат натрия (также известный, как дезоксихолат натрия) и урсодеоксихолевая кислота (также известная как урсодезоксихолевая кислота) были одобрены в качестве фармацевтической добавки, которую можно вводить людям, соответственно, и были признаны их превосходные показатели безопасности. Таким образом, в качестве pH-чувствительного соединения по изобретению более предпочтительно использовать дезоксихолевую кислоту, урсодезоксихолевую кислоту или их соли (например, натриевые соли).
[0053] Предпочтительно pH-чувствительное соединение содержится в количестве не менее 10 моль на 100 моль амфипатического вещества. Более предпочтительно оно содержится в количестве от 10 до 640 моль, более предпочтительно от 20 до 320 моль и наиболее предпочтительно от 20 до 160 моль на 100 моль амфипатического вещества.
[0054] (АМФИПАТИЧЕСКОЕ ВЕЩЕСТВО)
Используемое в изобретение амфипатическое вещество включает по меньшей мере амфипатическое вещество, выбранное из группы, состоящей из фосфатидилхолина, содержащего от 10 до 12 атомов углерода, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола. Эти амфипатические вещества можно использовать отдельно или в комбинации из двух или более. Как используют в настоящем описании, "число атомов углерода" амфипатического вещества в настоящем описании означает число атомов углерода молекулы жирной кислоты (ацильной группы), служащей в качестве гидрофобного участка амфипатического вещества.
[0055] В качестве фосфатидилхолина, содержащего от 10 до 12 атомов углерода, предпочтительным является диацилфосфатидилхолин, содержащий насыщенную ацильную группу, для которого следует упомянуть, например, дидеканоилфосфатидилхолин (DDPC:1,2-дидеканоил-sn-глицеро-3-фосфатидилхолин) и дилауроилфосфатидилхолин (DLPC:1,2-дилауроил-sn-глицеро-3-фосфатидилхолин). Фосфатидилхолин может представлять собой природный фосфатидилхолин или синтетический фосфатидилхолин, получаемый известными способами, или также можно использовать коммерчески доступные фосфатидилхолины.
[0056] Для сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, можно упомянуть сложный эфир полиоксиэтиленсорбитана и монолауриновой кислоты (монолаурат полиоксиэтиленсорбитана), сложный эфир полиоксиэтиленсорбитана и миристиновой кислоты (мономиристат полиоксиэтиленсорбитана), сложный эфир полиоксиэтиленсорбитана и монопальмитиновой кислоты (пальмитат полиоксиэтиленсорбитана), сложный эфир полиоксиэтиленсорбитана и моностеариновой кислоты (моностеарат полиоксиэтиленсорбитана), сложный эфир полиоксиэтиленсорбитана и моноолеиновой кислоты (моноолеат полиоксиэтиленсорбитана) и т.п. Хотя степень полимеризации полиоксиэтилена не является критичной, степень полимеризация всех цепей полиэтилена, добавляемых к сорбитану, предпочтительно составляет от 10 до 200, более предпочтительно от 15 до 100 и наиболее предпочтительно от 20 до 50. Сложный эфир полиоксиэтиленсорбитана и моножирной кислоты может представлять собой синтезированный сложный эфир полиоксиэтиленсорбитана и моножирной кислоты или коммерческий продукт. Коммерческие продукты сложного эфира полиоксиэтиленсорбитана и моножирной кислоты предпочтительно включают, например, продукты, коммерчески реализуемые под названиями Tween 20 (сложный эфир полиоксиэтиленсорбитана и монолауриновой кислоты), Tween 40 (сложный эфир полиоксиэтиленсорбитана и монопальмитиновой кислоты), Tween 60 (сложный эфир полиоксиэтиленсорбитана и моностеариновой кислоты) и Tween 80 (сложный эфир полиоксиэтиленсорбитана и моноолеиновой кислоты). Из них предпочтительными являются сложные эфиры полиоксиэтиленсорбитана и моножирной кислоты (Tween 40, Tween 60 и Tween 80), содержащие от 16 до 18 атомов углерода.
[0057] В качестве сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, можно упомянуть сложные эфиры сорбитана и моножирной кислоты, такие как сложный эфир сорбитана и монопальмитиновой кислоты (монопальмитат сорбитана), сложный эфир сорбитана и моностеариновой кислоты (моностеарат сорбитана), сложный эфир сорбитана и моноолеиновой кислоты (моноолеат сорбитана) и т.п., и сложные эфиры сорбитана и трижирной кислоты, такие как сложный эфир сорбитана и трипальмитиновой кислоты (трипальмитат сорбитана), сложный эфир сорбитана и тристеариновой кислоты (тристеарат сорбитана), сложный эфир сорбитана и триолеиновой кислоты (триолеат сорбитана) и т.п. Используемый сложный эфир сорбитана и жирной кислоты может представлять собой синтезированный сложный эфир сорбитана и жирной кислоты или коммерческий продукт. В качестве коммерческого продукта сложного эфира сорбитана и жирной кислоты предпочтительно можно использовать, например, продукты, поставляемые под названиями SPAN 40 (сложный эфир сорбитана и пальмитиновой кислоты), SPAN 60 (сложный эфир сорбитана и стеариновой кислоты), SPAN 80 (сложный эфир сорбитана и олеиновой кислоты), SPAN 65 (сложный эфир сорбитана и тристеариновой кислоты) и SPAN 85 (сложный эфир сорбитана и триолеиновой кислоты). Из них SPAN 80, SPAN 65 и SPAN 85 являются наиболее предпочтительными.
[0058] Моноолеат глицерина (глицерилмоноолеат), дилаурат глицерина (глицерилдилаурат), дистеарат глицерина (глицерилдистеарат) и диолеат глицерина (глицерилдиолеат), используемые в изобретении, представляют собой ацилглицерины, где одна или две молекулы жирной кислоты связаны сложноэфирной связью с глицерином при условии, что участки, с которыми жирная кислота связана, не являются критическими. Например, с моноолеатом глицерина, который представляет собой моноацилглицерин, жирная кислота может быть связана в положении C1 или положении C2 глицерина. С дилауратом глицерина, дистеаратом глицерина и диолеатом глицерина, где каждый представляет собой диацилглицерин, жирная кислота может быть связана сложноэфирной связью в положениях C1 и C2 или в положениях C1 и C3 глицерина. В качестве дилаурата глицерина, например, предпочтительным является α,α'-дилаурат, который является замещенным в положениях C1 и C3. Относительно дистеарата глицерина или диолеата глицерина, предпочтительным является диацилглицерин, который является замещенным в положениях C1 и C2. Эти производные глицерина могут представлять собой синтезированные производные глицерина или коммерческие продукты, соответственно.
[0059] Относительно полиоксиэтилен-касторового масла, можно упомянуть продукты присоединения полиоксиэтиленов с касторовым маслом. Степень полимеризации полиоксиэтилена не является критичной и предпочтительно составляет от 3 до 200, более предпочтительно от 5 до 100 и наиболее предпочтительно от 10 до 50. Полиоксиэтилен-касторовое масло может представлять собой синтезированное полиоксиэтилен-касторовое масло или коммерческий продукт.
[0060] Для α-токоферола можно использовать α-токоферолы природного происхождения или α-токоферолы, получаемые известными способами, а также можно использовать коммерческие продукты.
[0061] В качестве таких амфипатических веществ предпочтительными являются фосфатидилхолины, содержащие от 10 до 12 атомов углерода, из которых наиболее предпочтительным является дилауроилфосфатидилхолин (DLPC), содержащий 12 атомов углерода.
[0062] (КОМБИНАЦИЯ PH-ЧУВСТВИТЕЛЬНОГО СОЕДИНЕНИЯ И АМФИПАТИЧЕСКОГО ВЕЩЕСТВА)
pH-чувствительный носитель по изобретению способен проявлять эффект, стимулирующий функцию разрушения мембран, при желаемом pH в результате правильной комбинации pH-чувствительного соединения и амфипатического вещества. В этом случае pH, при котором pH-чувствительный носитель, начинает проявлять способствующий разрушению мембраны эффект, различается в зависимости от комбинации pH-чувствительного соединения и амфипатического вещества. Это предполагают по следующим причинам: pKa различается в зависимости от типа pH-чувствительного соединения, и способ образования пути связывания с амфипатическим веществом также различается в зависимости от комбинации pH-чувствительного соединения и амфипатического вещества. Таким образом, когда комбинацию pH-чувствительного соединения и амфипатического вещества соответствующим образом изменяют, возможным является правильный выбор pH, при котором может проявляться функция, таким образом, обеспечивая in vivo доставку, и можно детально проектировать внутриклеточную доставку.
[0063] В pH-чувствительном носителе по изобретению предпочтительные комбинации pH-чувствительных соединений и амфипатических веществ включают дезоксихолевую кислоту и DDPC, дезоксихолевую кислоту и DLPC, дезоксихолевую кислоту и Tween 20, дезоксихолевую кислоту и Tween 40, дезоксихолевую кислоту и Tween 60, дезоксихолевую кислоту и Tween 80, дезоксихолевую кислоту и SPAN 40, дезоксихолевую кислоту и SPAN 60, дезоксихолевую кислоту и SPAN 80, дезоксихолевую кислоту и SPAN 65, дезоксихолевую кислоту и SPAN 85, дезоксихолевую кислоту и α-токоферол, дезоксихолевую кислоту и моноолеат глицерина, дезоксихолевую кислоту и дистеарат глицерина, дезоксихолевую кислоту и диолеат глицерина, дезоксихолевую кислоту и дилаурат глицерина (α,α'-дилаурин), дезоксихолевую кислоту и полиоксиэтилен-касторовое масло, урсодезоксихолевую кислоту и DDPC, урсодезоксихолевую кислоту и DLPC, урсодезоксихолевую кислоту и Tween 20, урсодезоксихолевую кислоту и Tween 40, урсодезоксихолевую кислоту и Tween 60, урсодезоксихолевую кислоту и Tween 80, урсодезоксихолевую кислоту и SPAN 40, урсодезоксихолевую кислоту и SPAN 60, урсодезоксихолевую кислоту и SPAN 80, урсодезоксихолевую кислоту и SPAN 65, урсодезоксихолевую кислоту и SPAN 85, урсодезоксихолевую кислоту и α-токоферол, урсодезоксихолевую кислоту и моноолеат глицерина, урсодезоксихолевую кислоту и дистеарат глицерина, урсодезоксихолевую кислоту и диолеат глицерина, урсодезоксихолевую кислоту и дилаурат глицерина (α,α'-дилаурин), урсодезоксихолевую кислоту и полиоксиэтилен-касторовое масло, глицирризиновую кислоту и DDPC, глицирризиновую кислоту и DLPC, глицирризиновую кислоту и Tween 20, глицирризиновую кислоту и Tween 40, глицирризиновую кислоту и Tween 60, глицирризиновую кислоту и Tween 80, глицирризиновую кислоту и SPAN 40, глицирризиновую кислоту и SPAN 60, глицирризиновую кислоту и SPAN 80, глицирризиновую кислоту и SPAN 65, глицирризиновую кислоту и SPAN 85, глицирризиновую кислоту и α-токоферол, глицирризиновую кислоту и моноолеат глицерина, глицирризиновую кислоту и дистеарат глицерина, глицирризиновую кислоту и диолеат глицерина, глицирризиновую кислоту и дилаурат глицерина (α,α'-дилаурин) и глицирризиновую кислоту и полиоксиэтилен-касторовое масло.
[0064] Более предпочтительно, можно упомянуть дезоксихолевую кислоту и DDPC, дезоксихолевую кислоту и DLPC, дезоксихолевую кислоту и Tween 40, дезоксихолевую кислоту и Tween 60, дезоксихолевую кислоту и Tween 80, дезоксихолевую кислоту и SPAN 40, дезоксихолевую кислоту и SPAN 65, дезоксихолевую кислоту и SPAN 85, дезоксихолевую кислоту и α-токоферол, дезоксихолевую кислоту и моноолеин, дезоксихолевую кислоту и полиоксиэтилен-касторовое масло, урсодезоксихолевую кислоту и DDPC, урсодезоксихолевую кислоту и DLPC, урсодезоксихолевую кислоту и Tween 40, урсодезоксихолевую кислоту и Tween 60, урсодезоксихолевую кислоту и Tween 80, урсодезоксихолевую кислоту и SPAN 40, урсодезоксихолевую кислоту и SPAN 65, урсодезоксихолевую кислоту и SPAN 85, урсодезоксихолевую кислоту и α-токоферол, урсодезоксихолевую кислоту и моноолеин, урсодезоксихолевую кислоту и полиоксиэтилен-касторовое масло, глицирризиновую кислоту и DDPC, глицирризиновую кислоту и DLPC, глицирризиновую кислоту и Tween 40, глицирризиновую кислоту и Tween 60, глицирризиновую кислоту и Tween 80, глицирризиновую кислоту и SPAN 40, глицирризиновую кислоту и SPAN 65, глицирризиновую кислоту и SPAN 85, глицирризиновую кислоту и α-токоферол, глицирризиновую кислоту и моноолеин и глицирризиновую кислоту и полиоксиэтилен-касторовое масло.
[0065] (ВОДНЫЙ РАСТВОРИТЕЛЬ)
pH-чувствительный носитель по изобретению может содержаться в водном растворе. Следует отметить, что водный раствор, содержащий pH-чувствительный носитель, далее в настоящем описании также может быть обозначен как "дисперсия-носитель".
[0066] В качестве растворителя водного раствора, содержащего pH-чувствительный носитель по изобретению, предпочтительно упомянуть водный раствор, содержащий буфер, NaCl или сахар, такой как глюкоза, сахароза или т.п.
[0067] В качестве буфера, известные буферы можно подходящим способом использовать, т.к. они способны поддерживать pH водного раствора, содержащего pH-чувствительный носитель, на уровне не меньше физиологического pH, и не существует конкретных ограничений в их отношении. Буферы включают, например, фосфатный буфер, цитратный буфер, цитрат-фосфатный буфер, буфер трис-гидроксиметиламинометан-HCl (трис-гидрохлоридный буфер), буферы Good, такие как буфер MES (2-морфолиноэтансульфонатный буфер), буфер TES (N-трис(гидроксиметил)метил-2-аминоэтансульфонатный буфер), ацетатный буфер, буфер MOPS (3-морфолинопропансульфонатный буфер), буфер MOPS-NaOH, HEPES буфер (4-(2-гидроксиэтил)-1-пиперазинэтансульфонатный буфер), буфер HEPES-NaOH и т.п., аминокислотные буферы, такие как глицин-гидрохлоридный буфер, буфер глицин-NaOH, буфер глицилглицин-NaOH, буфер глицилглицин-KOH и т.п., буферы на основе бора, такие как Трис-боратный буфер, буфер борат-NaOH и боратный буфер или имидазольный буфер. Из них предпочтительными являются фосфатный буфер, цитратный буфер, цитрат-фосфатный буфер, Tрис-гидрохлоридный буфер, буфер MES, ацетатный буфер и буфер HEPES-NaOH. Концентрация буфера не является критичной и предпочтительно составляет от 0,1 до 200 мМ, более предпочтительно от 1 до 100 мМ. Следует отметить, что концентрация буфера, используемого в изобретении, означает концентрацию (мМ) буфера, содержащегося в водном растворе.
[0068] Концентрация NaCl или сахара, такого как глюкоза, сахароза или т.п., не является критичной и предпочтительно составляет от 0,1 до 200 мМ, более предпочтительно от 1 до 150 мМ.
[0069] Концентрация pH-чувствительного носителя в водном растворе не является критичной и является такой, что общая молярная концентрация pH-чувствительного соединения и амфипатического вещества предпочтительно составляет от 0,73 мкмоль/литр до 7,4 ммоль/литр, более предпочтительно от 7,3 мкмоль/литр до 6,5 ммоль/литр и наиболее предпочтительно от 8,0 мкмоль/литр до 4,2 ммоль/литр.
[0070] (ДРУГИЕ КОМПОНЕНТЫ)
pH-чувствительный носитель по изобретению может дополнительно содержать другие компоненты, такие как стабилизатор, в pH-чувствительном носителе или водном растворе, содержащем pH-чувствительный носитель. Содержание этих компонентов не является критичным кроме тех случаев, когда pH-чувствительный носитель разрушается, и предпочтительно составляет не более 150 моль, более предпочтительно не более 66,4 моль на 100 моль амфипатического вещества.
[0071] Тип стабилизатора не является критичным кроме тех случаев, когда pH-чувствительный носитель разрушается, и пригодными являются известные стабилизаторы, включая, например: насыщенные или ненасыщенные спирты, содержащие от 4 до 20 атомов углерода, такие как 1-октанол, 1-додеканол, 1-гексадодеканол, 1-эйкозанол и т.п.; насыщенные или ненасыщенные жирные кислоты, содержащие от 12 до 18 атомов углерода, такие как лауриновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота и т.п.; сложные эфиры алкила (алкила, содержащего от 1 до 3 атомов углерода) насыщенных или ненасыщенных жирных кислот, содержащих от 8 до 18 атомов углерода, таких как метилкаприлат (метилоктаноат), метилкаприлат (этилоктаноат), метиллаурат, этиллаурат, этилмиристат, этилпальмитат, этилстеарат, метилолеат, этилолеат и т.п.; D(L)-аминокислоты, такие как D(L)-аланин, альгинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глицин, гистидин, лейцин, изолейцин, лизин, метионин, пролин, серин, треонин, триптофан, тирозин, валин, фенилаланин и т.п.; триглицериды аминокислот, такие как трикапроин, трикаприлин и т.п.; сложные эфиры сорбитана полиоксиэтилена и трижирных кислот, содержащие от 12 до 18 атомов углерода (например, Tween 65, Tween 85), такие как сложный эфир полиоксиэтиленсорбитана и трипальмитиновой кислоты, сложный эфир полиоксиэтиленсорбитана и триолеиновой кислоты и т.п.; сложные эфиры полиоксиэтилена и алкила, содержащие от 12 до 18 атомов углерода (например, стеариловый простой эфир PEG-20, лауриловый простой эфир PEG-23), такие как сложный эфир полиоксиэтилена и лауриновой кислоты, сложный эфир полиоксиэтилена и миристиновой кислоты, сложный эфир полиоксиэтилена и пальмитиновой кислоты, сложный эфир полиоксиэтилена и стеариновой кислоты и т.п.; полиоксиалкилен-гидрогенизированные касторовые масла (например, PEG-10-гидрогенизированное касторовоемасло, PEG-40-гидрогенизированное касторовое масло и PEG-60-гидрогенизированное касторовое масло); сложные эфиры глицерина и насыщенных или ненасыщенных моножирных кислот, содержащих от 8 до 18 атомов углерода, такие как каприлин (октеноат глицерина), монокаприлат глицерина, монолаурат глицерина, мономиристат глицерина, монопальмитат глицерина, моностеарат глицерина, моноолеат глицерина и т.п.; сложные эфиры глицерина и дижирных кислот, содержащих от 8 до 16 атомов углерода, такие как диоктаноат глицерина, дикаприлат глицерина, дилаурат глицерина, димиристат глицерина, дипальмитат глицерина и т.п., и сложный эфир α-токоферола и уксусной кислоты, касторовое масло, соевое масло, холестерин, сквален, сквалан, лактоза, аскорбилпальмитат, бензилбензоат, метилпараоксибензоат, этилпараоксибензоат, пропилпараоксибензоат, бутилпараоксибензоат и т.п. Как используют в настоящем описании, "число атомов углерода" означает число атомов углерода фрагмента жирной кислоты (ацильной группы), служащей в качестве гидрофобного участка.
[0072] СПОСОБ ПОЛУЧЕНИЯ PH-ЧУВСТВИТЕЛЬНОГО НОСИТЕЛЯ
В соответствии с изобретением предоставлен способ получения pH-чувствительного носителя, способного проявлять эффект эффект, стимулирующий функцию разрушения мембран, который включает стадию связывания по меньшей мере одного pH-чувствительного соединения, выбранного из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей, и по меньшей мере одного амфипатического вещества, выбранного из группы, состоящей из фосфатидилхолина, содержащего от 10 до 12 атомов углерода, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола.
[0073] Для пути связывания pH-чувствительного соединения и амфипатического вещества достаточным является приведение pH-чувствительного соединения и амфипатического вещества в контакт друг с другом в водном растворе. Таким образом, pH-чувствительный носитель по изобретению можно получать приведением pH-чувствительного соединения и амфипатического вещества в контакт друг с другом в водном растворе. Более конкретно, получают водный раствор, содержащий pH-чувствительное соединение и амфипатическое вещество, а затем подвергают диспергированию при интенсивном перемешивании с использованием аппарата для эмульгирования, вихревой мешалки, ультразвуковых волн или т.п., посредством которых можно получать pH-чувствительный носитель в форме, в которой pH-чувствительное соединение и амфипатическое вещество образуют путь связывания.
[0074] Для получения водного раствора, содержащего pH-чувствительное соединение и амфипатическое вещество, не существует конкретных ограничений, при условии, что образуется ассоциированный продукт pH-чувствительного соединения и амфипатического вещества. Например, можно упомянуть: (1) способ, где водный раствор, содержащий pH-чувствительное соединение, и водный раствор, содержащий амфипатическое вещество, получают раздельно, и смешивают эти водные растворы с последующим диспергированием при интенсивном перемешивании с использованием аппарата для эмульгирования, вихревой мешалки, ультразвуковых волн или т.п. с получением pH-чувствительного носителя; и (2) способ получения с применением способа Бангама, известного как способ получения липосомы. Более конкретно, в соответствии со способом Бангама составляющие компоненты pH-чувствительного носителя, такие как pH-чувствительное соединение и амфипатическое вещество, растворяют в органическом растворителе (например, метаноле или хлороформе) в стеклянном контейнере и удаляют органический растворитель, таким образом, как с использованием роторного испарителя с получением тонкой пленки на стенках стеклянного контейнера. Затем добавляют водный раствор в стеклянный контейнер с образованной тонкой пленкой, с последующим набуханием тонкой пленки при нормальной температуре (от 5 до 35°C) и перемешиванием стеклянного контейнера при нормальной температуре (от 5 до 35°C). В этом случае при интенсивном перемешивании посредством аппарата для эмульгирования, вихревой мешалки или ультразвуковых волн, тонкую пленку можно хорошо диспергировать в водном растворе. В указанном выше способе получения (1) pH-чувствительное соединение можно смешивать в водном растворе, содержащем амфипатическое вещество. Следует отметить, что растворитель для водного раствора может представлять собой такой растворитель, как используют для водного раствора, указанного выше в настоящем описании.
[0075] Также следует отметить, что относительно подробного описания способа Бангама можно привести ссылку на известные способы получения липосом, как описано в "Liposomes" (под редакцией Shoushichi Nojima, Jyunzou Sunamoto and Keizou Inoue и опубликованной Nankoudou) и "Liposomes in Life Science" (под редакцией Hiroshi Terada and Tetsuro Yoshimura и опубликованной Springer-Verlag, Tokyo).
[0076] Способ добавления других компонентов, таких как стабилизатор, который может содержаться в pH-чувствительном носителе или в водном растворе, содержащим pH-чувствительный носитель, не является контрено ограниченным. Например, компоненты можно добавлять к водному раствору, содержащему pH-чувствительное соединение, или к водному раствору, содержащему амфипатическое вещество. Альтернативно, при получении тонкой пленки компоненты можно растворять совместно с составляющими компонентами pH-чувствительного носителя, после чего с использованием получаемой тонкой пленки, содержащей эти компоненты, можно получать водный раствор, содержащий pH-чувствительный носитель.
[0077] pH-чувствительный носитель, получаемый способом, как указано выше, способен проявлять такой эффект, стимулирующий функцию разрушения мембран, и его можно подходящим способом использовать для DDS.
[0078] PH-ЧУВСТВИТЕЛЬНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО И PH-ЧУВСТВИТЕЛЬНАЯ ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ
По одному из вариантов осуществления изобретение относится к pH-чувствительному лекарственному средству, где pH-чувствительный носитель служит подложкой по меньшей мере для одного физиологически активного вещества.
[0079] Как используют в настоящем описании, термин "подложка", используемый в изобретении, означает форму физиологически активного вещества, содержащегося в носителе, форму вещества, вводимого в носитель, или форму вещества, связанного непосредственно или посредством среды с поверхностью носителя. Как используют в настоящем описании, термин "связанный" означает химически связанный ковалентной связью или ионной связью или физически связанный связью Ван-дер-Ваальса или гидрофобной связью. Физиологически активное вещество может представлять собой гидрофильное вещество или гидрофобное вещество. Если физиологически активное вещество состоит из гидрофобного вещества, предпочтительно, чтобы активное вещество находилось на подложке в форме, содержащейся в pH-чувствительном носителе или вводимой в pH-чувствительный носитель. Когда физиологически активное вещество является гидрофильным по природе, вещество предпочтительно находится на подложке в форме, связанной непосредственно или посредством среды с поверхностью носителя.
[0080] pH-чувствительный носитель по изобретению может содержать физиологически активное вещество. Когда pH-чувствительный носитель проявляет эффект, способствующий функции разрушения мембраны, в среде с pH меньше физиологического, содержащееся физиологически активное вещество можно доставлять в желаемый участок. Хотя точно не известно, предполагают, что механизм этого является следующим (см. фиг. 1B). Следует отметить, что не следует интерпретировать изобретение как ограниченное следующим ниже предположением.
[0081] pH-чувствительное лекарственное средство, где pH-чувствительный носитель по изобретению служит подложкой для физиологически активного вещества, поглощается клетками посредством эндоцитоза, таким образом, образуя эндосому, содержащую pH-чувствительное лекарственное средство. В дальнейшем внутренняя часть эндосомы приводит к кислой среде. В этом случае, когда окружающая среда pH-чувствительного лекарственного средства по изобретению доходит до значения pH меньше физиологического (например, pH 6,5), проявляется эффект, способствующий функции разрушения мембраны pH-чувствительного носителя. Более конкретно, составляющие компоненты pH-чувствительного носителя и компоненты мембраны эндосомы подвергаются перегруппировке, таким образом, что физиологически активное вещество на подложке pH-чувствительного носителя, присутствующего в эндосоме, мигрирует в цитозоль. Это обеспечивает непосредственную доставку физиологического вещества в желаемый цитозоль, и, таким образом, предполагают, что, таким образом, проявляется высокий фармакологический эффект.
[0082] По другому варианту осуществления изобретение относится также к pH-чувствительной лекарственной композиции, содержащей pH-чувствительный носитель и по меньшей мере одно физиологически активное вещество. В этом случае физиологически активное вещество содержится на внешней стороне (раздельно) pH-чувствительного носителя в отличие от pH-чувствительного лекарственного средства по указанному выше варианту осуществления, и физиологически активное вещество и pH-чувствительный носитель не являются связанными непосредственно или посредством среды. Более конкретно, pH-чувствительная лекарственная композиция по этому варианту осуществления состоит из pH-чувствительного носителя и физиологически активного вещества, которые являются, соответственно, независимо смешанными.
[0083] pH-чувствительная лекарственная композиция по изобретению, где pH-чувствительный носитель и физиологически активное вещество соответственно смешивают независимо, может доставлять физиологически активное вещество в желаемый участок после того, как pH-чувствительный носитель проявляет эффект, способствующий функции разрушения мембраны, в среде, pH которой является меньше физиологического pH. Хотя точно не известно, предполагают, что механизм проявления является аналогичным случаю pH-чувствительного лекарственного средства, где pH-чувствительный носитель служит подложкой для физиологически активного вещества (см. фиг. 1C). Следует отметить, что изобретение не ограничено следующим ниже предположением.
[0084] Более конкретно, pH-чувствительная лекарственная композиция по этому варианту осуществления изобретения поглощается клеткой посредством эндоцитоза pH-чувствительного носителя клеткой. В тоже время, наряду с pH-чувствительным носителем, физиологически активное вещество также поглощается клеткой посредством эндоцитоза pH-чувствительного носителя клеткой. Как следствие, соответственно образуются эндосомы, независимо содержащие pH-чувствительный носитель и физиологически активное вещество. В дальнейшем, внутренняя часть эндосом подвергается действию кислой среды, и окружающая среда доходит до значения pH меньше физиологического (например, pH 6,5), вследствие чего проявляется эффект, способствующий функции разрушения мембраны pH-чувствительного носителя. При этом физиологически активное вещество, содержащееся во внутренней части эндосомы, мигрирует в цитозоль. Таким образом, физиологически активное вещество можно доставлять прямо в желаемый цитозоль.
[0085] pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция по изобретению способны эффективно доставлять физиологически активное вещество в отдел живого организма, pH которого становится пониженным, вследствие опухоли или воспаления. Более конкретно, pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция по изобретению могут проявлять эффект, стимулирующий функцию разрушения мембран, в отделе, где pH становится ниже, таким образом, что физиологически активное вещество может быть избирательно доставлено в область обработки, такую как воспаление.
[0086] Тип физиологически активного вещества, находящегося на подложке pH-чувствительного носителя, используемого в pH-чувствительном лекарственном средстве и pH-чувствительной лекарственной композиции, не является критическим. Например, в качестве физиологически активного вещества можно упомянуть нуклеиновую кислоту, низкомолекулярное соединение, белок и пептид.
[0087] Нуклеиновая кислота включает нуклеиновую кислоту, обладающую лечебным эффектом, такую как миРНК, ODN (олигодезоксинуклеотид), ДНК или т.п.
[0088] В качестве низкомолекулярного соединения можно упомянуть: противоопухолевые средства, такие как митомицин, доцетаксел, метотрексат и т.п.; пролекарства, такие как 5-аминолевулиновая кислота, протопорфирин IX и т.п.; противовоспалительные средства, так как ганцикловир, дексаметазон, рибавирин, видарабин и т.п.; контрастные вещества, такие как DOTA (1,4,7,10-тетраазациклотетрадекан-N,N',N'',N'''-тетрауксусная кислота), DTPA (1,4,7,10-тетраазациклодекан-N,N',N'',N'''-тетрауксусная кислота) и т.п., и нейропротекторы, такие как эдаравон и т.п.
[0089] В качестве белка можно упомянуть оксидоредуктазы, такие как SOD (супероксиддисмутаза), индофенолоксидаза и т.п.; цитокины, такие как IL-10 и т.п., факторы роста, такие как b-FGF и т.п., тромболитические средства, такие как t-PA и т.п., гормоны, такие как эритропоэтин и т.п., и препятствующие гибели клеток белки PSD (белок постсинаптической плотности), FNK (фактор против гибели клеток) и т.п., и антитела, такие как Fab (фрагмент), IgG, IgE и т.п.
[0090] В качестве пептида можно упомянуть: пептидные лекарственные средства, такие как циклоспорин A, JIP-1 (JNK-взаимодействующий белок 1) и т.п.
[0091] На такой уровень знаний можно соответствующим образом полагаться со ссылкой на уровень техники в данной области на момент подачи заявки.
[0092] Количество физиологически активного вещества не является критичным, и его можно соответствующим образом выбирать в зависимости от типа физиологически активного вещества.
[0093] Для способа поддержания физиологически активного вещества в pH-чувствительном носителе можно использовать любой из известных способов в зависимости от типа физиологически активного вещества. Такие способы не являются критичными. Для способа получения формы введения в носитель и формы встраивания в носитель, можно упомянуть способ, где после получения pH-чувствительного носителя указанным выше способом получения pH-чувствительного носителя, pH-чувствительный носитель погружают в раствор, содержащий физиологически активное вещество, для обеспечения возможности попадания физиологически активного вещества в pH-чувствительный носитель и способ, где раствор, содержащий физиологически активное вещество, вводят в контейнер, выполненный из тонкой пленки указанным выше способом получения pH-чувствительного носителя, таким образом, приводя к тому, что физиологически активное вещество вводится в носитель. Для способа получения формы связывания непосредственно или посредством среды с поверхностью носителя можно упомянуть способ, где в pH-чувствительное соединение или амфипатическое вещество, используемое в качестве составляющего компонента pH-чувствительного носителя, вводят функциональную группу, способную взаимодействовать с желаемым типом физиологически активного вещества, а затем подвергают взаимодействию с физиологически активным веществом с получением pH-чувствительного носителя, связанного с физиологически активным веществом. Следует отметить, что связывание с физиологически активным веществом можно проводить до получения pH-чувствительного носителя или после получения.
[0094] pH-чувствительный носитель и физиологически активное вещество можно смешивать любым из известных способов, определяемых в зависимости от типа физиологически активного вещества. Такие способы не являются критичными, из которых можно упомянуть, например, способ, где носитель и физиологически активное вещество смешивают со средой, такой как водный растворитель, разбавитель и т.п.
[0095] pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция по изобретению могут дополнительно содержать другие типы добавок к лекарственным средствам. Хотя pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция может находиться в форме твердых препаратов, включая таблетки, порошки, капсулы и т.п., жидкие препараты, такие как инъецируемые препараты являются предпочтительными. Жидкий препарат может находиться в форме сухого продукта, который можно восстанавливать с использованием воды или с использованием другого подходящего разбавителя.
[0096] Предпочтительно таблетку и капсулу следует покрывать растворяющимся в кишечнике покрытием общепринятым способом. Растворяющееся в кишечнике покрытие может представлять собой покрытие, как правило, применяемое в этой области. Внутри капсула может содержать твердое или жидкое вещество.
[0097] Когда pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция находятся в форме жидкого препарата, добавки к лекарственному средству могут включать растворитель (например, физиологический раствор, стерилизованную воду, буферный раствор или т.п.), стабилизатор мембран (например, холестерин или т.п.), средство придания тоничности (например, хлорид натрия, глюкоза, глицерин или т.п.), антиоксидант (например, токоферол, аскорбиновую кислоту, глутатион или т.п.), консервант (например, хлорбутанол, парабен или т.п.) и т.п. Растворитель может представлять собой растворитель, используемый для получения pH-чувствительного лекарственного средства и pH-чувствительной лекарственной композиции.
[0098] Когда pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция находятся в форме твердого препарата, добавки к лекарственному средству могут включать эксципиент (например, сахар, такой как лактоза, сахароза или т.п., крахмал, такой как кукурузный крахмал, целлюлозу, такую как кристаллическая целлюлоза, гуммиарабик, алюмометасиликат магния, фосфат кальция или т.п.), смазочное средство (например, стеарат магния, тальк, полиэтиленгликоль или т.п.), связывающее средство (например, маннит, сахар, такой как сахароза, кристаллическую целлюлозу, поливинилпирролидон, гидроксипропилметилцеллюлозу или т.п.), дезинтегрант (например, крахмал, такой как картофельный крахмал, целлюлозу, такую как карбоксиметилцеллюлоза, сшитый поливинилпирролидон или т.п.), краситель, ароматизатор и т.п.
[0099] pH-чувствительное лекарственное средство и pH-чувствительную лекарственную композицию можно получать смешиванием с указанными выше добавками к лекарственному средству в том виде, в котором они есть, или после лиофилизации. Когда pH-чувствительное лекарственное средство и pH-чувствительную лекарственную композицию подвергают лиофилизации, предпочтительно добавлять соответствующий тип разбавителя до лиофилизации.
[0100] Форма введения в случае, когда pH-чувствительное лекарственное средство и pH-чувствительную лекарственную композицию по изобретению используют для лечения индивидуума, не является критичной, из которого можно упомянуть, например, пероральное введение и парентеральное введение, такое как внутривенная инъекция, внутриартериальная инъекция, подкожная инъекция, внутрикожная инъекция, внутримышечная инъекция, интраспинальная инъекция, чрескожное введение или впитывание через кожу. Например, когда пептид или белок используют в качестве физиологически активного вещества, предпочтительным является введение парентеральными путями, такими как подкожная инъекция, внутрикожная инъекция, внутримышечная инъекция и внутривенная инъекция. Следует отметить, что в отношении pH-чувствительной лекарственной композиции, где pH-чувствительный носитель и физиологически активное вещество являются соответственно независимо смешанными, ее предпочтительно вводить в форме местного введения, в частности подкожной инъекции, внутрикожного введения или внутримышечного введения.
[0101] Когда внешняя среда pH-чувствительного лекарственного средства и pH-чувствительной лекарственной композиции по изобретению становится ниже физиологического pH (например, pH 6,5) после введения индивидууму, проявляются эффект, способствующий функции разрушения мембраны, или эффект, способствующий функции разрушения мембраны, и эффект, способствующий функции слияния мембраны, таким образом, обеспечивая возможность того, что физиологически активное вещество специфически выделяется эффективным образом.
[0102] Таким образом, изобретение относится к способу лечения или профилактики заболевания, включая прием внутрь или пероральное введение эффективного количества указанного выше pH-чувствительного лекарственного средства или pH-чувствительной лекарственной композиции индивидууму, нуждающемуся в лечении или профилактики.
[0103] Предпочтительно индивидуум представляет собой млекопитающее, более предпочтительно человека.
[0104] В качестве заболевания можно упомянуть, например, злокачественные опухоли, такие как рак предстательной железы, рак легких, рак толстого кишечника, рак печени, рак желудка, рак головного мозга, рак молочной железы и т.п., инфекционные заболевания, такие как ВИЧ (вирус иммунодефицита человека), гепатит C, гепатит B и т.п., и заболевания центральной нервной системы, такие как болезнь Альцгеймера, болезнь Паркинсона и т.п.
[0105] Более конкретно, по предпочтительному варианту осуществления изобретение относится к способу лечения или профилактики заболевания. Такой уровень знаний может соответствующим образом полагаться со ссылкой на уровень техники в данной области на момент подачи заявки.
[0106] В одном из вариантов осуществления изобретения pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция могут обеспечивать возможность транспортировки физиологически активного вещества непосредственно в клетки посредством культивирования. Другими словами, по этому варианту осуществления предоставлен способ культивирования для транспортировки физиологически активного вещества в клетки.
[0107] Способ культивирования включает стадию культивирования клеток в среде, содержащей pH-чувствительное лекарственное средство и/или pH-чувствительную лекарственную композицию.
[0108] pH-чувствительное лекарственное средство и pH-чувствительная лекарственная композиция соответственно являются такими, как указано выше. Более конкретно, можно упомянуть pH-чувствительное лекарственное средство, где pH-чувствительный носитель служит подложкой по меньшей мере для одного физиологически активного вещества и pH-чувствительной лекарственной композиции, которая независимо содержит pH-чувствительный носитель и по меньшей мере одно физиологически активное вещество. Их можно использовать отдельно или в комбинации.
[0109] Среда не является критической, и можно использовать известные в данной области среды. В частности, можно упомянуть MEM, DMEM, RPMI и т.п.
[0110] Количество pH-чувствительного лекарственного средства и/или pH-чувствительной лекарственной композиции в среде не является критическим, и общая молярная концентрация pH-чувствительной композиции и амфипатического вещества предпочтительно составляет от 0,73 мкмоль/литр до 7,4 ммоль/литр, более предпочтительно от 7,3 мкмоль/литр до 6,5 ммоль/литр и наиболее предпочтительно от 8,0 мкмоль/литр до 4,2 ммоль/литр.
[0111] pH среды предпочтительно составляет не менее 7,0, более предпочтительно от 7,2 до 7,8. Если pH среды составляет не менее 7,0, то можно благоприятным образом предотвращать переход pH-чувствительного соединения, используемого в качестве компонента pH-чувствительного носителя, в нестабильное состояние в среде.
[0112] Типы клеток не являются критическим, и можно упомянуть клетки, получаемые у индивидуума, установленные культивируемые клетки и т.п.
[0113] В этом случае конкретные примеры клеток, получаемых у индивидуума или установленных культивируемых клеток включают дендритные клетки, NK-клетки (естественные киллеры), клетки T-лимфоцитов, клетки B-лимфоцитов и клетки лимфоцитов.
[0114] Из указанных выше клеток предпочтительно использовать клетки, получаемые у индивидуума. Более предпочтительно используют дендритные клетки, NK-клетки, T-клетки и клетки лимфоцитов, получаемые у индивидуума.
[0115] Когда используют клетки, получаемые у индивидуума, можно получать клетки индивидуума путем взятия крови, биопсии или т.п. Таким образом, способ культивирования по этому варианту осуществления может дополнительно включать стадию сбора клеток у индивидуума.
[0116] Следует отметить, что культивируемые клетки можно вводить индивидууму. Таким путем можно лечить или проводить профилактику заболевания индивидуума. Таким образом, по этому варианту осуществления предоставлен способ лечения или профилактики заболевания.
[0117] В предпочтительном варианте осуществления способ лечения или профилактики включает стадии сбора клеток у индивидуума, культивирования собранных клеток в среде, содержащей pH-чувствительное лекарственное средство и/или pH-чувствительную лекарственную композицию, и введение культивируемых клеток индивидууму.
[0118] Таким образом, можно лечить или проводить профилактику заболевания. Заболевание представляет собой заболевание как указано выше.
ПРИМЕРЫ
[0119] Изобретение более подробно описано в виде примеров, которые не следует интерпретировать как ограничивающие изобретение.
[0120] ИСХОДНЫЕ ВЕЩЕСТВА
В примерах использовали следующие ниже соединения. В случае, когда название реагента и название продукта являются одинаковыми, название продукта опускают.
- EYPC (негидрогенизированный фосфатидилхолин яичного желтка: COATSOME NC-50, выпускаемый NOF Corporation)
- HSPC (фосфатидилхолин соевых бобов: COATSOME NC-21, выпускаемый NOF Corporation)
- DDPC (1,2-деканоил-sn-глицеро-3-фосфатидилхолин: COATSOME MC-1010, выпускаемый NOF Corporation)
- DLPC (1,2-дилауроил-sn-глицеро-3-фосфатидилхолин: COATSOME MC-1212, выпускаемый NOF Corporation)
- DMPC (1,2-димистироил-sn-глицеро-3-фосфатидилхолин: COATSOME MC-4040, выпускаемый NOF Corporation)
- DPPC (1,2-дипальмитоил-sn-глицеро-3-фосфатидилхолин: COATSOME MC-6060, выпускаемый NOF Corporation)
- DSPC (1,2-дистеароил-sn-глицеро-3-фосфатидилхолин: COATSOME MC-8080, выпускаемый NOF Corporation)
- DOPC (1,2-диолеоил-sn-глицеро-3-фосфатидилхолин: COATSOME MC 8181, выпускаемый NOF Corporation)
- POPC (1-пальмитоил-2-олеоил-sn-3-фосфатидилхолин: COATSOME MC 6081, выпускаемый NOF Corporation)
- DLPE (1,2-дилауроил-sn-глицеро-3-фосфоэтаноламин: COATSOME ME 2020, выпускаемый NOF Corporation)
- DMPE (1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин: COATSOME ME 4040, выпускаемый NOF Corporation)
- DSPE (1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин: COATSOME ME 8080, выпускаемый NOF Corporation)
- DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин: COATSOME ME 8181, выпускаемый NOF Corporation)
- Chems (холестерилгемисукцинат: выпускаемый Nacalai Tesque Co., Ltd.)
- NBD-PE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-(7-нитро-2-1,3-бензоксадиазол-4-ил)аммоний: выпускаемый Avanti Polar Lipids, Inc.
- Rh-PE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-(лиссамин-родамин B-сульфонил)аммоний: Avanti Polar Lipids, Inc.)
- Дезоксихолат натрия (Nacalai Tesque Co., Ltd.)
- Холат натрия (Nacalai Tesque Co., Ltd.)
- Урсодезоксихолат натрия (Tokyo Chemical Industry Co., Ltd.)
- Хенодезоксихолевая кислота (Tokyo Chemical Industry Co., Ltd.)
- Гиодезоксихолевая кислота (Tokyo Chemical Industry Co., Ltd.)
- Метилхолат (Tokyo Chemical Industry Co., Ltd.)
- Дегидрохолат натрия (Tokyo Chemical Industry Co., Ltd.)
- Литохолеая кислота (Nacalai Tesque Co., Ltd.)
- Гликохолат натрия (Tokyo Chemical Industry Co., Ltd.)
- Таурохолат натрия (Nacalai Tesque Co., Ltd.)
- Гликодезоксихолат натрия (Nacalai Tesque Co., Ltd.)
- Тауродезоксихолат натрия (Nacalai Tesque Co., Ltd.)
- Гликоурсодезоксихолат натрия (Nacalai Tesque Co., Ltd.)
- Тауроурсодезоксихолат натрия (Nacalai Tesque Co., Ltd.)
- C27-желчная кислота (3α,7α,12α-тригидроксихолестановая кислота: Avanti Polar Lipids, Inc.)
- 5β-холановая кислота (Sigma-Aldrich Co., LLC)
- Глицирризинат моноаммония (Tokyo Chemical Industry Co., Ltd.)
- Глицирризиновая кислота (Nagara Science Co., Ltd.)
- Сахарин натрия (Wako Pure Chemical Industries, Ltd.)
- Метанол (Nacalai Tesque Co., Ltd.)
- Хлороформ (Wako Pure Chemical Industries, Ltd.)
- Уксусная кислота (Wako Pure Chemical Industries, Ltd.)
- Ацетат натрия (Kanto Chemical Co., Inc.)
- MES-Na (Merck и Co., Inc.)
- Hepes-Na (Nacalai Tesque Co., Ltd.)
- Хлорид натрия (Kanto Chemical Co., Inc.)
- Пиранин (Tokyo Chemical Industry Co., Ltd.)
- DPX (пара-ксилол-бис-пиридинийбромид: Molecular Probes Inc.)
- PBS (фосфатные забуференные соли: таблетки PBS, выпускаемые Takara Bio Inc.)
- Сложные эфиры полиоксиэтиленсорбитана и моножирной кислоты (Tween 20, 40, 60, 80, 65, 85: выпускаемые Tokyo Chemical Industry Co., Ltd.)
- PEG-20-стеариловый простой эфир (полиоксиэтилен 20-стеариловый сложный эфир: выпускаемый Wako Pure Chemical Industries, Ltd.)
- PEG-23-лауриловый простой эфир (полиоксиэтилен 23-лауриловый сложный эфир: выпускаемый Wako Pure Chemical Industries, Ltd.)
- Сложные эфиры сорбитана и жирной кислоты (SPAN 20: монолаурат сорбитана, выпускаемый Nacalai Tesque Co., Ltd., SPAN 40, 60: выпускаемые Tokyo Chemical Industry Co., Ltd., SPAN 80: моноолеат сорбитана, выпускаемый Nacalai Tesque Co., Ltd., 65: тристеарат сорбитана, выпускаемый Wako Pure Chemical Industries, Ltd., SPAN 85: выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Монокапрат глицерина (монокаприн, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Монокаприлат глицерина (монокаприлин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Монолаурат глицерина (монолаурин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Мономиристат глицерина (мономиристин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Монопальмитат глицерина (монопальмитин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Моностеарат глицерина (моностеарин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Моноолеат глицерина (моноолеин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Дилаурат глицерина (α,α-дилаурин, выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Дистеарат глицерина (выпускаемый Wako Pure Chemical Industries, Ltd.)
- Диолеат глицерина (выпускаемый Wako Pure Chemical Industries, Ltd.)
- Полиоксиэтилен-касторовое масло (полиоксиэтилен 10-касторов масло, выпускаемое Wako Pure Chemical Industries, Ltd.)
- Полиоксиэтилен-гидрогенизированное касторовое масло (10:полиоксиэтилен 10-гидрогенизированное касторовое масло, выпускаемое Wako Pure Chemical Industries, Ltd., 40: Uniox HC-40, выпускаемый NOF Corporation, 60: Uniox HC-60, выпускаемый NOF Corporation)
- 1-бутанол (выпускаемый Nacalai Tesque Co., Ltd.)
- 1-октанол (выпускаемый Nacalai Tesque Co., Ltd.)
- 1-додеканол (выпускаемый Tokyo Chemical Industry Co., Ltd.)
- 1-гексадеканол (выпускаемый Nacalai Tesque Co., Ltd.)
- 1-эйкозанол (выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Лауриновая кислота (выпускаемая Nacalai Tesque Co., Ltd.)
- Олеат натрия (выпускаемый Nacalai Tesque Co., Ltd.)
- Этилоктеноат (выпускаемый Nacalai Tesque Co., Ltd.)
- Этиллаурат (выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Этилолеат (выпускаемый Nacalai Tesque Co., Ltd.)
- Лактоза (выпускаемая Nacalai Tesque Co., Ltd.)
- L-лейцин (выпускаемый Nacalai Tesque Co., Ltd.)
- L-гистидин (выпускаемый Nacalai Tesque Co., Ltd.)
- Соевое масло (соевое масло, выпускаемое Nacalai Tesque Co., Ltd.)
- Сквалан (выпускаемый Nacalai Tesque Co., Ltd.)
- Сквален (выпускаемый Nacalai Tesque Co., Ltd.)
- α-токоферол (DL-α-токоферол, выпускаемый Nacalai Tesque Co., Ltd.)
- Ацетат токоферола (ацетат DL-α-токоферола, выпускаемый Nacalai Tesque Co., Ltd.)
- Бензилбензоат (выпускаемый Nacalai Tesque Co., Ltd.)
- Бензил-пара-оксибензоат (выпускаемый Tokyo Chemical Industry Co., Ltd.)
- Аскорбилпальмитат (выпускаемый LKT Laboratories, Inc.)
- Гуммиарабик (порошок гуммиарабика, выпускаемый Nacalai Tesque Co., Ltd.)
- Желатин (очищенный порошок желатина, выпускаемый Nacalai Tesque Co., Ltd.)
- Циклодекстрин (выпускаемый Nacalai Tesque Co., Ltd.)
- Метилцеллюлоза (выпускаемая Nacalai Tesque Co., Ltd.)
- Минеральное масло (выпускаемое Nacalai Tesque Co., Ltd.)
- Парафин (выпускаемый Nacalai Tesque Co., Ltd.)
- Водный раствор гидроксида натрия (0,1 моль/литр: выпускаемый Nacalai Tesque Co., Ltd.)
- Соляная кислота (0,1 моль/литр, 1 моль/литр: выпускаемая Nacalai Tesque Co., Ltd.)
- Triton-X100 (Triton X100, выпускаемый Wako Pure Chemical Industries, Ltd.)
- Модельный пептид: OVA257-264 (SIINFEKL, получаемый комиссией для PH Japan Co., Ltd.)
- Флуоресцентно-меченый пептид: OVA257-264-Rh (получаемый комиссией для PH Japan Co., Ltd.)
- Модельный белок: OVA (Sigma-Aldrich Inc.)
- Трипсин (выпускаемый Life Technologies Inc.)
- EDTA (этилендиаминтетраацетат, выпускаемый Nacalai Tesque Co., Ltd.)
·β-гал (β-D-галактозидаза, выпускаемая Wako Pure Chemical Industries, Ltd.)
- FBS (эмбриональная телячья сыворотка: выпускаемая Kokusan Chemical Co., Ltd.)
- MEM (минимальная поддерживающая среда: MEM Игла и содержащий L-глутамин раствор, выпускаемые Nacalai Tesque Co., Ltd.)
- DMEM без фенолового красного (раствор 4,5 г/л модифицированной Дульбекко среда Игла (DMEM) без содержания глюкозы, L-глутамина, пировиноградной кислоты и фенолового красного)
- DMEN (модифицированная Дульбекко среда Игла, выпускаемая Nacalai Tesque Co., Ltd.)
- Дифосфат хлорохина (выпускаемый Nacalai Tesque Co., Ltd.)
- IsoFlow (выпускаемый Beckman Coulter Inc.)
ПОЛУЧЕНИЕ ОБРАЗЦОВ
(Получение pH-чувствительных носителей)
1000 нмоль амфипатического вещества, растворенного в метаноле (или хлороформе), и pH-чувствительного соединения или соединения-кандидата, растворенного в метаноле (или хлороформе), смешивали в 10 мл грушевидной колбе и преобразовывали в тонкую пленку посредством роторного испарителя (BuCHI). Следует отметить, что отношение амфипатического вещества к pH-чувствительному соединению или соединению-кандидату устанавливали таким, чтобы получать желаемые отношения (молярные отношения 100:10, 100:20, 100:640, и т.д.). Когда использовали ряд амфипатических веществ, контролировали общее количество амфипатических веществ таким образом, чтобы получать желаемое количество моль (1000 нмоль).
[0121] К получаемой тонкой пленке добавляли 1 мл буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4) с последующим диспергированием посредством облучения ультразвуковыми волнами в течение одной минуты при нормальной температуре с использованием ультразвукового облучателя (USC-J) с получением водного раствора предполагаемого pH-чувствительного носителя (дисперсии носителя).
[0122] (ПОЛУЧЕНИЕ НОСИТЕЛЕЙ ДЛЯ СРАВНЕНИЯ)
(Один EYPC и один DLPC)
1000 нмоль EYPC или DLPC, растворенного в хлороформе, помещали в 10 мл грушевидную колбу с последующим преобразованием в тонкую пленку посредством роторного испарителя (BuCHI).
[0123] К получаемой тонкой пленке добавляли 1 мл буфера MES (MWS: 25 мМ, NaCl: 125 мМ, pH 7,4) с последующим диспергированием посредством облучения ультразвуковыми волнами в течение одной минуты при нормальной температуре с использованием ультразвукового облучателя (USC-J) с получением дисперсии одного EYPC или одного DLPC.
[0124] (НОСИТЕЛИ, СОДЕРЖАЩИЕ МАКРОМОЛЕКУЛЯРНЫЕ ВЕЩЕСТВА)
Аналогичным путем, как в способе получения pH-чувствительного носителя, получали тонкую пленку pH-чувствительного соединения и макромолекулярного вещества для получения носителя. Макромолекулярное вещество, такое как гуммиарабик, желатин, метилцеллюлоза, минеральное масло или парафин, использовали в количествах 1/5 части, одной части и пяти частей от массы 1600 нмоль pH-чувствительного соединения.
[0125] (PH-ЧУВСТВИТЕЛЬНЫЕ ЛИПОСОМЫ)
Аналогичным путем, как в способе получения pH-чувствительного носителя, получали тонкую пленку DOPE и Chems или олеиновой кислоты для получения липосомы. Следует отметить, что DOPE-Chems (DOPE : Chems = 3:2 (по молярному отношению)) и DOPE-олеиновая кислота (DOPE : олеиновая кислота = 7:3 (по молярному отношению)), которые соответственно являлись pH-чувствительной липосомой, получали с использованием 1000 нмоль DOPE, данного количества Chems или олеиновой кислоты и 1 мл буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4).
[0126] (ПОЛУЧЕНИЕ СОДЕРЖАЩЕГО ПЕПТИД НОСИТЕЛЯ И СОДЕРЖАЩЕГО БЕЛОК НОСИТЕЛЯ)
Взвешивали от 0 до 1536 мкг модельного пептида OVA257-264 (SIINFEKL) или модельного белка OVA на 1000 нмоль амфипатического вещества и растворяли в 1 мл буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4). Эти растворы использовали для получения соответствующих носителей, из которых получали дисперсию, содержащую пептид или белок.
[0127] В случае использования флуоресцентно-меченого пептида OVA257-264-Rh получение проводили с использованием 140 мкг флуоресцентно-меченого пептида на 1000 нмоль амфипатического вещества, и в случае использования β-гал для получения использовали 1,4 мг β-гал на 1000 нмоль амфипатического вещества.
[0128] СПОСОБ ИЗМЕРЕНИЯ
(Измерение пропускания)
250 мкл дисперсии носителя добавляли к 250 мкл буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4) с получением раствора для измерения. Пропускание измеряли с использованием UV-2450 при 500 нм при нормальной температуре.
[0129] (Измерение дзета-потенциала и размера частиц)
Для измерения дзета-потенциала добавляли от 20 до 50 мкл дисперсии носителя к 1,0 мл буфера Hepes (Hepes: 1,0 мМ), pH которого доводили до 7,4, с получением раствора для измерения. Измерение проводили несколько раз с использованием Nano ZS 90 и получаемые значения дзета-потенциала усредняли с получением дзета-потенциала частиц носителя.
[0130] (Измерение размера частиц и индекса полидисперсности)
Для измерения размера частиц и индекса полидисперсности (PDI:индекс полидисперсности) соответствующее количество дисперсии носителя добавляли к буферу MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4) с получением раствора для измерения. Измерение проводили несколько раз с использованием Nano ZS 90 и значения Z-среднего (радиуса), получаемые измерением динамического рассеяния света, усредняли и получали двузначное значение в качестве диаметра (диаметра или размера частиц). Значение PDI определяли усреднением значений PDI, получаемых посредством нескольких измерений.
[0131] (ТЕСТ НА ВЫМЫВАНИЕ: ИЗМЕРЕНИЕ ВЫМЫВАНИЯ (СКОРОСТЬ ВЫМЫВАНИЯ))
Вымывание (скорость вымывания) определяли способом, описанным K. Kono et al., Bioconjugate Chem., 2008, 19, 1040-1048, и оценивали с использованием липосомы EYPC, содержащей пиранин, служащий в качестве флуоресцентного вещества, и DPX, служащий в качестве гасителя.
[0132] Измеряли 3000 нмоль EYPC, растворенного в хлороформе, и помещали в 10 мл грушевидную колбу и преобразовывали в тонкую пленку с использованием роторного испарителя (BuCHI). Добавляли 500 мкл раствора пиранина (пиранин: 35 мМ, DPX: 50 мМ, MES: 25 мМ, pH 7,4) с последующим диспергированием с использованием ультразвукового облучателя (USC-J) и пропусканием через поликарбонатную пленку с размером пор 100 нм с использованием экструдера с получением частиц одинакового размера. С использованием буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4) и колонки G100 заменяли внешний слой воды с получением дисперсии липосом EYPC, содержащих флуоресцентное вещество. Концентрацию холин группы фосфолипида определяли с использованием теста фосфолипида C от Wako и регулировали с использованием буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4), таким образом, чтобы получать 1,0 ммоль/л фосфолипида.
[0133] 20 мкл дисперсии липосомы EYPC, концентрацию которой регулировали, и 20 мкл дисперсии оцениваемого образца, такого как носитель или одно pH-чувствительное соединение, одно амфипатическое вещество или т.п., вводили в 2960 мкл соответствующих буферов MES (MES: 25 мМ, NaCl: 125 мМ), которые получали с различными pH. Для мониторинга вымывания после инкубации при 37°C в течение 30 минут или 90 минут (в примерах представлены результаты 90 минут, если не указано иначе) наблюдали флуоресценции при возбуждении 416 и испускании 512 нм с использованием спектрофотометра FP-6500. DOPE-Chems и DOPE-олеиновая кислота соответственно измеряли в буфере на основе уксусной кислоты (уксусная кислота: 25 мМ, NaCl: 125 мМ). В отношении других образцов измерение при pH от 4,0 до 3,0 проводили с использованием буфера на основе уксусной кислоты.
[0134] Следует отметить, что вымывание рассчитывали таким образом, что в случае, когда использовали одну дисперсию липосом EYPC, ее принимали за 0% и значение, получаемое в случае, когда добавляли 30 мкл разведенного в 10 раз Triton-X100, принимали за 100%.
[0135] Более конкретно, вымывание рассчитывали по следующему ниже уравнению. В следующем ниже уравнении измеряемая интенсивность флуоресценции представлена L, интенсивность флуоресценции одной дисперсии липосом EYPC, содержащих флуоресцентное вещество, представлена L0, и интенсивность флуоресценции в случае, когда добавляли Triton-X100 представлена L100.
[0136] МАТЕМАТИКА 4
Вымывание (%)=(L-L0)/(L100-L0)×100
[0137] (Тест на слияние: измерение слияния (слияния мембраны))
Слияние (слияние мембраны) проводили способом, описанным K. Kono et al., Biomaterials, 2008, 29, 4029-4036, и оценивали с использованием FRET (флуоресценции резонансного переноса энергии). Для флуоресцентного мечения использовали NBD-PE и Rh-PE.
[0138] Получали Тонкую пленку EYPC (1000 нмоль EYPC), содержащую 0,6% мол. NBD-PE и Rh-PR относительно EYPC и добавляли к 1 мл буфера MES (MES: 25 мМ, NaCl: 125 мМ, pH 7,4) с последующим диспергированием с использованием ультразвукового облучателя (USC-J) и пропускали через поликарбонатную пленку с размером пор 100 нм с использованием экструдера с получением двойной флуоресцентно-меченой дисперсии липосом EYPC. 20 мкл двойной флуоресцентно-меченой дисперсии липосом EYPC и 20 мкл дисперсии оцениваемого образца, такого как носитель или одно pH-чувствительное соединение, одно амфипатическое соединение или т.п., вводили в 2960 мкл буферов MES (MES: 25 мМ, NaCl: 125 мМ), которые доводили до различных значений pH, и инкубировали при 37°C в течение 60 минут с последующим измерением спектра флуоресценции при 500 нм - 620 нм посредством излучения возбуждения 450 нм с использованием спектрофотометра (EP-6500) с получением отношения интенсивности флуоресценции между 520 нм и 580 нм.
[0139] Скорость слияния рассчитывали таким образом, что отношение интенсивности флуоресценции в случае, когда инкубировали двойную флуоресцентно-меченую дисперсию липосом EYPC, получаемую выше, и амфипатическое вещество, принимали за 0% и отношение в случае, когда двойную флуоресцентно-меченую дисперсию липосом EYPC и дисперсию pH-чувствительного носителя или амфипатического вещества подвергали обработке метанолом, принимали за 100%. Обработку метанолом проводили таким образом, что двойную флуоресцентно-меченую дисперсию липосом EYPC и дисперсию оцениваемого образца, такого как pH-чувствительный носитель или одно pH-чувствительное соединение, одно амфипатическое соединение или т.п., растворяли в метаноле и преобразовывали в тонкую пленку с использованием роторного испарителя (BuCHI) с последующим диспергированием с использованием 3,0 мл буфера MES (MES: 25 мМ, NaCl: 125 мМ) и ультразвукового облучателя (USC-J).
[0140] Более конкретно, скорость слияния рассчитывали по следующему ниже уравнению. Следует отметить, что в следующем ниже уравнении отношение интенсивности флуоресценции, получаемое измерением, представлена R, отношение интенсивности флуоресценции, получаемое, когда двойную флуоресцентно-меченую дисперсию липосом EYPC и амфипатическое вещество инкубировали, представлено R0, и отношение интенсивности флуоресценции, получаемое, когда двойную флуоресцентно-меченую дисперсию липосом EYPC и дисперсию оцениваемого образца, такого как носитель, или одного pH-чувствительного соединения, одного амфипатического соединения или т.п., подвергали обработке метанолом, представлена R100.
[0141] МАТЕМАТИКА 5
Скорость слияния (%)=(R-R0)/(R100-R0)×100
[0142] (Подтверждение слияние мембраны с клеточной мембраной)
Использование клеток HeLa подтверждало, что pH-чувствительный носитель индуцировал слияние мембраны с фактической клеточной мембраной.
[0143] За сутки до введения pH-чувствительного носителя клетки HeLa рассеивали на планшет со стеклянным дном Matsunami и культивировали с DMEM, содержащей 10% FBS. В этом случае культивирование проводили с использованием инкубатора (MCO20AIC), установленного при 5% CO2 и 37°C. После инкубации клетки отмывали DMEM, содержащей 10% FBS. Затем к клеткам добавляли 2,0 мл DMEM, pH которой доводили до 7,4 с использованием водного раствора гидроксида натрия или соляной кислоты, и которая содержала 25 мМ Hepes и 50 мкМ дифосфата хлорохина с последующей предварительной инкубацией в течение одного часа.
[0144] Следует отметить, что в случае, когда тест проводили при pH 5,3, к клеткам добавляли 2,0 мл DMEM, pH которой доводили до 5,3 с использованием водного раствора гидроксида натрия или соляной кислоты, и которая содержала 25 мМ MES и 50 мкМ дифосфата хлорохина, с последующей предварительной инкубацией в течение одного часа.
[0145] После предварительной инкубации 100 мкл дисперсии 0,6% мол. относительно амфипатического вещества к среде с доведенным данным pH добавляли Rh-PE флуоресцентно-меченный pH-чувствительный носитель с последующей инкубацией в течение двух часов. Клетки промывали по меньшей мере три раза DMEM, не содержащей фенолового красного, и наблюдали посредством флуоресцентного микроскопа (Axiovert 200M, программное обеспечение: Axio vision 3.0, источник света: Fluo Arc). Следует отметить, что после того как промытые клетки собирали с использованием PBS, содержащего 0,025% масс. трипсина и 0,01% масс. EDTA, интенсивность флуоресценции клеток оценивали с использованием проточного цитометра (Cytomics FC500, программное обеспечение: CXP version 2).
[0146] (ОЦЕНКА ДОСТАВКИ В ЦИТОЗОЛЬ С ИСПОЛЬЗОВАНИЕМ ФЛУОРЕСЦЕНТНО-МЕЧЕНОГО ПЕПТИДА)
В качестве модельного пептида выбирали OVA-257-264-Rh. 140 мкг/мл раствора флуоресцентно-меченого пептида получали с использованием PBS, пропускаемого через 0,22 мкм фильтр, и использовали его для получения носителя. Используемые клетки представляли собой клетки RAW, и культивирование проводили с использованием инкубатора (MCO20AIC), установленного при 5% CO2 и 37°C. Клетки RAW рассеивали на планшет со стеклянным дном Matsunami за сутки до введения носителя и культивировали в среде MEM, содержащей 10% FBS. После промывания клеток PBS среду заменяли 1900 мкл свежей среды MEM, содержащей 10% FBS, в которую вводили 100 мкл соответствующих образцов. Инкубацию проводили в течение 16-20 часов и промывали клетки по меньшей мере три раза PBS. Затем добавляли 2 мл свежей среды MEM, содержащей 10% FBS, с последующей инкубацией в течение трех часов. Клетки промывали PBS с последующими заменой средой DMEM без фенолового красного и наблюдением клеток посредством флуоресцентного микроскопа (Axiovert 200M, программное обеспечение: Axio vision 3.0, источник света: Fluo Arc).
[0147] (ДОСТАВКА В ЦИТОЗОЛЬ β-ГАЛ)
С помощью PBS, пропускаемого через 0,22 мкм фильтр, получали 1,4 мг/мл раствор β-гал. Смешанную тонкую пленку, состоящую из 1000 нмоль DLPC и 1600 нмоль дезоксихолевой кислоты или урсодезоксихолевой кислоты, диспергировали в таком полученном растворе β-гал с получением содержащего β-гал носителя. За сутки до нагрузки клетки RAW рассеивали на планшет со стеклянным дном Matsunami и культивировали и промывали клетки PBS сразу же после нагрузки. Культивирование проводили с использованием инкубатора (MCO 20 AIC), установленного на 5% CO2 и 37°C, и среды MEM, содержащей 10% FBS. После замены 1900 мкл свежей средой MEM, содержащей 10% FBS, вносили 100 мкл соответствующих образцов с последующей инкубацией в течение от 16 до 20 часов. Клетки промывали по меньшей мере три раза PBS. Затем добавляли 2 мл свежей средой MEM, содержащей 10% FBS, с последующей дополнительной инкубацией в течение трех часов. Клетки промывали PBS с последующим окрашиванием клеток с использованием набора для окрашивания β-галактозидазы (приобретаемого у Takara Bio Inc.) и наблюдением клеток через микроскоп (Axiovert 200M, программное обеспечение: Axio vision 3.0). Окрашивание проводили в соответствии с рекомендациями к набору.
[0148] (Оценка доставки в цитозоль в случае, когда соответственно независимо использовали pH-чувствительный носитель и физиологически активное вещество)
За сутки клетки RAW рассеивали на планшет со стеклянным дном Matsunami и культивировали со средой MEM, содержащей 10% FBS. После промывания PBS, добавляли MEM с последующей инкубацией в течение одного часа. Получали 1900 мкл MEM, содержащей флуоресцентно-меченый пептид-FITC или флуоресцентно-меченный OVA-FITC в концентрации 30 мкг/мл, и заменяли среду для культивирования. Кроме того, добавляли раствор 100 мкл pH-чувствительного носителя с последующей инкубацией в течение от 16 до 20 часов в среде для культивирования в таком состоянии, что и были смешаны. Уже было подтверждено, что для каждого из флуоресцентно-меченого пептида-FITC и флуоресцентно-меченого OVA-FITC pH-чувствительный носитель не служил подложкой в смешанном состоянии с содержащим pH-чувствительный носитель раствором. После промывания PBS и трех часов последующей инкубации с 2 мл свежей MEM клетки промывали PBS с последующими заменой DMEM, не содержащей фенолового красного, и наблюдением через флуоресцентный микроскоп. Культивирование проводили с использованием инкубатора (MCO20AIC), установленного на 5% CO2 и 37°C, и наблюдали клетки через флуоресцентный микроскоп (Axiovert 200M, программное обеспечение: Axio vision 3.0, источник света: Fluo Arc).
[0149] (1) ОБРАЗОВАНИЕ КОМПЛЕКСОВ ДЕЗОКСИХОЛЕВОЙ КИСЛОТЫ
Сначала оценивали образование комплексов дезоксихолевой кислоты и амфипатических веществ.
[0150] В соответствии с получением указанного выше pH-чувствительного носителя получали смешанные тонкие пленки 1000 нмоль EYPC или DLPC и различных количеств (от 0 до 6400 нмоль) дезоксихолевой кислоты, к которым добавляли 1 мл буфера MES с pH 7,4, и облучали ультразвуковыми волнами, таким образом, получая дисперсии с образованными дезоксихолатными комплексами. Фотография дисперсий, содержащих EYPC и дезоксихолевую кислоту, где дезоксихолевая кислота содержалась в различных количествах, представлена на фиг. 2A, и фотография дисперсий, содержащих DLPC и дезоксихолевую кислоту, где дезоксихолевая кислота содержалась в различных количествах, представлена на фиг. 2B. Следует отметить, что на фиг. 2A и 2B, соответственно, продемонстрированы дисперсии 1000 нмоль липидов, содержащих, если смотреть с ее левой стороны, 0 нмоль, 50 нмоль, 100 нмоль, 200 нмоль, 400 нмоль, 800 нмоль, 1600 нмоль, 3200 нмоль и 6400 нмоль дезоксихолевой кислоты. В любом липиде EYPC или DLPC, дисперсия одного липида становилась мутной, при этом было выявлено, что растворы с образованными комплексами дезоксихолата становились прозрачными в зависимости от количества кислоты, образующей комплекс.
[0151] Измеряли пропускание соответствующих дисперсий при 500 нм, что приводило к тенденции, аналогичной той, которую наблюдали при визуальном обследовании. На фиг. 2C представлены результаты измерения пропускания дисперсий, содержащих EYPC и дезоксихолевую кислоту, и на фиг. 2D представлены результаты измерения пропускания дисперсий, содержащих DLPC и дезоксихолевую кислоту. Эти результаты подтверждают образование комплексов (образующих ассоциации продуктов) дезоксихолевой кислоты и липидов. В некоторых случаях комплекс дезоксихолевой кислоты и липида может далее в настоящем описании обозначаться как "комплекс липид-дезоксихолат".
[0152] Затем проверяли дзета-потенциал этих дисперсий. На фиг. 3 представлены результаты измерения дзета-потенциала дисперсии, содержащей EYP и дезоксихолевую кислоту, (т.е. комплекса EYPC-дезоксихолат на фигуре) и дисперсии, содержащей DLPC и дезоксихолевую кислоту (т.е. комплекс DLPC-дезоксихолат на фигуре), в зависимости от количества дезоксихолевой кислоты. Следует отметить, что результаты фиг. 3 представляют собой среднее значение пяти различных измерений и ± представляет собой SD.
[0153] Оба типа дисперсий имели значения отрицательно пониженные при образовании комплексов с дезоксихолевой кислотой. Это означает образование комплексов дезоксихолевой кислоты, имеющей отрицательный заряд, с липидом и свидетельствует об образовании смешанного комплекса дезоксихолевой кислоты и липида. В случае использования липидов для дзета-потенциала выявляли значение приблизительно -30 мВ в количестве 1600 нмоль дезоксихолевой кислоты, образующей комплекс, и значение дзета-потенциала значительно не снижалось в больших количествах, используемых для образования комплекса. Таким образом, считают, что дезоксихолевая кислота образует комплекс таким образом, что по существу покрывает поверхность получаемого с ней комплекса в количестве, указанном выше.
[0154] (2) СТРУКТУРА КОМПЛЕКСА
В соответствии с получением pH-чувствительного носителя проводили тест на удерживание флуоресцентного вещества (тест дисперсии тонкой пленки с использованием раствора пиранина) комплекса, получаемого из 1600 нмоль дезоксихолевой кислоты по отношению к 1000 нмоль DLPC, выявляя, что флуоресцентное вещество не удерживалось комплексом. Вследствие того, что комплекс не мог удерживать флуоресцентное вещество, подтверждали, что комплекс не имел полой структуры, а находился в мицеллярной форме (данные не показаны).
[0155] Затем измеряли размер частиц различных типов комплексов, получаемых в соответствии с получением pH-чувствительного носителя. Результаты измерения размера частиц способом динамического рассеяния света выявили, что размер частиц (диаметр) комплекса EYPC-дезоксихолат (EYPC : дезоксихолевая кислота = 1000 нмоль:1600 нмоль) составлял приблизительно 73 нм, и размер частиц (диаметр) комплекса DLPC-дезоксихолат (DLPC : дезоксихолевая кислота = 1000 нмоль:1600 нмоль) составлял приблизительно 43 нм (таблица 1). Индексы полидисперсности (PDI) этих комплексов соответственно представляли собой значения в пределах 0,26 и 0,07, демонстрируя, что комплексы дезоксихолевой кислоты и липидов находились в форме однородных частиц небольшого размера, соответственно.
[0156]
Размер частиц и PDI
Каждое из значений представляет собой среднее значение пяти различных измерений, и ± означает SD.
Только EYPC:один EYPC
Только DLPC:один DLPC
EYPC-дезоксихолат:комплекс EYPC-дезоксихолат
DLPC-дезоксихолевая кислота: комплекс DLPC-дезоксихолат
[0157] (3) Чувствительность к изменению pH
(Тест на вымывание)
Проверяли чувствительности к изменению pH одного EYPC, одного DLPC, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолевая кислота. Тест проводили таким образом, что комплекс получали указанным выше способом получения носителя с использованием 1000 нмоль липида (EYPC или DLPC) и 1600 нмоль дезоксихолевой кислоты с последующей инкубацией с липосомой EYPC, которая представляет собой модель биологической мембраны, в соответствии с указанным выше способом теста на вымывание (если не указано иначе, тест на вымывание являлся тестом, проводимым при инкубации в течение 90 минут, в настоящем описании и во всех случаях, когда он появляется далее в настоящем описании). На фиг. 4 представлены результаты измерения вымываний одного EYPC, одного DLPC, одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат при pH 7,4, 6,5, 6,0, 5,5, 5,0 и 4,5. Точки на фиг. 4 соответственно представляют собой среднее значение трех различных измерений, и ± представляет собой SD.
[0158] Один EYPC, один DLPC и комплекс EYPC-дезоксихолат не приводили к вымыванию флуоресцентного вещество при любых значениях pH от 7,4 до 4,5, и, таким образом, для них не выявляли чувствительности к изменению pH, тогда как комплекс DLPC-дезоксихолат приводил к большей степени вымывания по сравнению с одной дезоксихолевой кислотой при pH не более 6,5. Таким образом, выявляли, что комплекс DLPC-дезоксихолат проявляет pH-чувствительный эффект, способствующий функции разрушения мембраны.
[0159] Согласно этому тесту было выявлено, что можно получать комплексы из комбинаций дезоксихолевой кислоты и соответствующих типов амфипатических веществ, и они способны проявлять функцию в ответ на слабую кислую среду. pH для проявления эффекта являлся не более 6,5 и находился в диапазоне pH, достаточном для практического применения. Вследствие того, что вымывание при pH в физиологической среде не индуцировалось, чувствительность к изменению pH являлась такой, что функция являлась в хорошо контролируемом режиме включение-выключение.
[0160] (ТЕСТ СЛИЯНИЯ МЕМБРАНЫ)
Для доставки физиологически активного вещества в цитозоль желательно обладать функцией слияния мембраны в слабокислой среде. В соответствии со способом указанного выше теста слияния мембраны двойную флуоресцентно-меченную липосому EYPC и носитель (комплекс), получаемые с использованием 1000 нмоль липида (EYPC или DLPC) и 1600 нмоль дезоксихолевой кислоты, подвергали инкубации в течение 60 минут при 37°C при различных pH для проверки слияния обоих. (A) фиг. 5 представляет собой график, демонстрирующий отношения интенсивностей флуоресценции одного EYPC, одного DLPC, одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат при pH 7,4, 6,5, 6,0, 5,5, 5,0 и 4,5. (B) фиг. 5 представляет собой график, демонстрирующий при тех же значениях pH, как указано выше, скорости слияния одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат. Скорость слияния 0% представляет собой отношение интенсивности флуоресценции в случае, когда к двойной флуоресцентно-меченой липосоме добавляли один DLPC или один EYPC, и 100% указывает на значение, получаемое, когда соответствующие образцы подвергали обработке метанолом. Значение одной дезоксихолевой кислоты рассчитывали с использованием значения двойной флуоресцентно-меченой липосомы, принимаемого за 0%, и значения обработанного метанолом EYPC-дезоксихолевая кислота, принимаемого за 100%. Следует отметить, что каждая из точек (A) и (B) на фиг. 5 представляет собой среднее значение трех различных измерений, и ± представляет собой SD.
[0161] Из результатов (A) фиг. 5 можно видеть, что комплекс DLPC-дезоксихолат повышал отношение интенсивности флуоресценции при понижении pH и вызывал слияние двойной флуоресцентно-меченой липосомы EYPC. Оценка этих скоростей слияния выявляла, что комплекс DLPC-дезоксихолат проявляет эффект, способствующий функции слияния мембран, в слабокислой среде ((B) фиг. 5). Комплекс DLPC-дезоксихолат проявлял как эффект, способствующий функции разрушения мембраны, так и эффект, способствующий функции слияния мембраны. В связи с этим считают, что оба эффекта происходят в результате одного и того же явления, при возможности того, что носитель способен проявлять эффект, способствующий функции разрушения мембраны, а также проявлять эффект, способствующий функции слияния мембраны.
[0162] Следует отметить, что отношение интенсивности флуоресценции при pH 5,0 указывало на значение приблизительно 80% образца, подвергаемого обработке метанола ((A) фиг. 5). Обработанный метанолом образец находится в состоянии полного слияния двойной флуоресцентно-меченой липосомы и носителя, подтверждая, что липосома EYPC модели биологической мембраны и получаемый носитель сливаются с высокой эффективностью. Таким образом, ожидают высокоэффективную доставку физиологически активного вещества.
[0163] (4) СРАВНЕНИЕ С ОБЩЕПРИНЯТЫМИ PH-ЧУВСТВИТЕЛЬНЫМИ ЛИПОСОМАМИ
Для подтверждения степени чувствительности к изменению pH и интенсивности вымывания проводили сравнение с липосомой DOPE-Chems (DOPE : Chems = 3:2 (по молярному отношению)) и липосомой DOPE-олеиновая кислота (DOPE : олеиновая кислота = 7:3 (по молярному отношению)), которые хорошо известны как pH-чувствительная липосома, в соответствии с тестом на вымывание. Для измерения использовали дисперсию, содержащую липосому DOPE-Chems или липосому DOPE-олеиновая кислота в количестве, соответствующем 20 нмоль DOPE. Фиг. 6 представляет собой график, демонстрирующий вымывания липосомы DOPE-Chems, липосомы DOPE-олеиновая кислота и комплекса DLPC-дезоксихолат при различных pH. Каждая из точек на фиг. 6 представляет собой среднее значение трех измерений, и ± представляет собой SD.
[0164] В отношении липосомы DOPE-Chems и липосомы DOPE-олеиновой кислоты, вымывания начали происходить при pH не выше 6,0 и вымывание от 20 до 30%, значение максимума было указано при pH 3,5. С другой стороны, pH-чувствительный носитель (комплекс DLPC-дезоксихолат) начинал индуцировать вымывание при pH 6,5, и получали его вымывание более 60%.
[0165] Вымывание комплекса DLPC-дезоксихолат являлось больше, чем вымывание существующих pH-чувствительных липосом, выявляя, что pH-чувствительный носитель (комплекс DLPC-дезоксихолат) по изобретению обладает сильным эффектом дестабилизации и разрушения мембраны. Показано, что pH, при котором проявляется эффект, является более близким к нейтральному, и, таким образом, носитель является высоко чувствительным к слабокислой среде.
[0166] (5) ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩЕГО КОЛИЧЕСТВА ДЕЗОКСИХОЛЕВОЙ КИСЛОТЫ
Для проверки комплексообразующего количества дезоксихолевой кислоты, необходимой для проявления эффекта, использовали различные количества дезоксихолевой кислоты для получения pH-чувствительных носителей для оценки проявления эффекта, способствующего функции слияния мембраны, в соответствии с тестом на слияние мембран. Измерение повторяли три раза для вычисления среднего значения и SD. Значение одной дезоксихолевой кислоты рассчитывали с использованием значения обработанного метанолом комплекса EYPC-дезоксихолат.
[0167] На (A) и (B) фиг. 7, соответственно, продемонстрирована скорость слияния каждых из одной дезоксихолевой кислоты, комплекса EYPC-дезоксихолат и комплекса DLPC-дезоксихолат в зависимости от количества дезоксихолевой кислоты.
[0168] Из (A) и (B) фиг. 7, было выявлено, что для получаемых носителей демонстрируют большее значение, чем для одной дезоксихолевой кислоты комплексообразующего количества не менее 100 нмоль, и они могут проявлять эффект, способствующий функции слияния мембраны. Также было выявлено, что проявление эффекта, способствующего функции слияния мембраны, можно получать в результате образования комплексов от 100 до 6400 нмоль дезоксихолевой кислоты с 1000 нмоль липида.
[0169] Следует отметить, что скорость слияния комплекса EYPC-дезоксихолат представляет собой, по существу, аналогичное значение как с одной дезоксихолевой кислотой, таким образом, демонстрируя, что комплекс EPYC-дезоксихолат никогда не приобретал эффект, способствующий функции слияния мембраны, в результате образования комплекса с pH-чувствительным соединением.
[0170] (6) ВЛИЯНИЕ СТРУКТУРЫ ЛИПИДА
Из указанного выше исследования было выявлено, что когда объединяют дезоксихолевую кислоту и соответствующий тип липида (амфипатическое вещество), можно получать носитель, который способен проявлять эффект, способствующий функции разрушения мембраны, и эффект, способствующий функции слияния мембраны, в слабокислой среде. Для установления типа липида, способного обеспечивать такие свойства, получали ряд носителей с использованием липидов с различными структурами и подвергали тесту на вымывание или тесту на слияние мембраны.
[0171] В качестве структуры липида проверяли влияния (A) длины ацильной группы (от 10 до 18 атомов углерода) диацилфосфатидилхолинов и (B) ненасыщенной связи ацильной группы диацилфосфатидилхолинов. Получали соответствующие носители с использованием 1000 нмоль липидов и 1600 нмоль дезоксихолевой кислоты. Измерение повторяли три раза, из которых соответственно рассчитывали среднее значение и SD. Следует отметить, что "число атомов углерода" амфипатического вещества означает число атомов углерода фрагменты жирной кислоты (ацильной группы), служащей в качестве гидрофобного участка амфипатического вещества.
[0172] На (A) фиг. 8 представлена скорость слияния каждых из одной дезоксихолевой кислоты, комплекса DSPC-дезоксихолат, комплекса DPPC-дезоксихолат, комплекса DMPC-дезоксихолат, комплекса DLPC-дезоксихолат и комплекса DDPC-дезоксихолат. На (B) фиг. 8 представлена скорость слияния каждых из одной дезоксихолевой кислоты, комплекса HSPC-дезоксихолат, комплекса DOPC-дезоксихолат и комплекса POPC-дезоксихолат.
[0173] Из (A) фиг. 8 видно, что носители, в которых использовали DSPC, DPPC и DMPC, имели одинаковые значения по отношению к одной дезоксихолевой кислоте, и, таким образом, не обладали эффектом, тогда как DLPC и DDPC обладали эффектом. Считается, что длина углеродной цепи используемых липидов оказывает влияние, и проявление эффекта получают, когда используют липиды с короткой углеродной цепью. Липид с короткой углеродной цепью вероятнее всего вызывает "флип-флоп", который представляет собой инвертированное движение молекулы в мембране, и предполагают, что такой характер влияет на проявление.
[0174] В качестве влияния ненасыщенной связи носители, в которых использовали POPC с одной ненасыщенной связью и DOPC с двумя ненасыщенными связями в цепи с 18 атомами углерода, не проявляли какого-либо эффекта ((B) фиг. 8). Таким образом, показано, что ненасыщенная связь не оказывает заметного влияния на проявление эффекта.
[0175] Затем проверяли влияние структуры "головы" липида на проявление эффекта. Получали носители с использованием 1000 нмоль липидов и 1600 нмоль дезоксихолевой кислоты, соответственно. Измерение повторяли три раза, из которых рассчитывали среднее значение и SD, соответственно.
[0176] (A) фиг. 9 представляет собой график, демонстрирующий вымывание каждых из одной дезоксихолевой кислоты, одного DLPE, одного DMPE, одного DSPE и одного DOPE, и (B) фиг. 9 представляет собой график, демонстрирующий вымывание каждых из одной дезоксихолевой кислоты, комплекса DLPE-дезоксихолат, комплекса DMPE-дезоксихолат, комплекса DSPE-дезоксихолат и комплекса DOPE-дезоксихолат.
[0177] Ни один из липидов, содержащих PE, не приводит к проявлению эффекта, показывая, что холиновая группа является предпочтительной в качестве структуры "головы" ((A) и (B) фиг. 9).
[0178] Из указанных выше результатов было продемонстрировано, что для амфипатического вещества, которое может обеспечивать проявление эффекта, предпочтительно использовать ненасыщенные или насыщенные липиды, содержащие холиновую группу в качестве структуры "головы" и содержащие цепь от 10 до 12 атомов углерода.
[0179] (7) ИССЛЕДОВАНИЕ ДРУГИХ ТИПОВ АМФИПАТИЧЕСКИХ ВЕЩЕСТВ
Для доставки физиологически активного вещества использовали вещества, отличные от липида. Кроме того, известно, что дезоксихолевая кислота образует комплексы с гидрофобными веществами, отличными от липида, при условии, что можно получать носители, обладающие функциями при пути связывания с различными веществами. С этой целью ряд веществ и дезоксихолевую кислоту подвергали комплексообразованию с получением носителей, которые оценивали тестом на вымывание. Вследствие того, что одна дезоксихолевая кислота вызывает повышенное вымывание под действием ее поверхностной активности, проводили скрининг, таким образом устанавливали, что вещество, которое способно проявлять эффект, удовлетворяет обоим требованиям: (1) в тесте на вымывание, вымывание при данном pH, меньшим физиологического pH, увеличивается по сравнению с вымыванием при физиологическом pH, и его прирост увеличения является больше чем прирост увеличения, получаемый в случае, когда для теста используют одно pH-чувствительное соединение; и (2) в тесте на вымывание при данном pH, меньшим физиологического pH, вымывание в момент времени, когда образуется комплекс (pH-чувствительный носитель) из pH-чувствительного соединения и амфипатического вещества, является больше, чем сумма вымывания одного pH-чувствительного соединения и вымывания одного амфипатического вещества.
[0180] Следует отметить, что удовлетворять указанным выше пунктам (1) и (2) означает удовлетворять следующим ниже отношениям вымывания Lc pH-чувствительного носителя (комплекса pH-чувствительного соединения и амфипатического вещества), La одного pH-чувствительного соединения и Lb амфипатического вещества. Более конкретно, указанный выше пункт (1) представлен следующей ниже формулой (1), и указанный выше пункт (2) представлен следующей ниже формулой (2). В следующих ниже формулах вымывания при pH 7,4, соответственно, представлены Lc7,4, La7,4 и Lb7,4, и вымывания при pH 5,0 или 4,5, соответственно, представлены Lcx, Lax и Lbx.
[0181] МАТЕМАТИКА 6
Формула (1) Δ=(Lcx-Lc7,4)-(Lax-La7,4)>0
Формула (2) Δ'=Lcx-(Lax+Lbx)>0
[0182] Результаты представлены в таблицах 2-7. Следует отметить, что соответствующие значения, указанные в таблицах 2-7, представляют собой среднее значение трех измерений, и ± представляет собой SD.
[0183] Кроме того, для получения частиц использовали 1600 нмоль (663 мкг) дезоксихолевой кислоты и различных масс макромолекулярных веществ с последующей оценкой частоты вымывания при pH 5,0. На фиг. 10 представлены результаты вымывания комплексов дезоксихолевой кислоты и макромолекулярных веществ при pH 5,0. Следует отметить, что значения на фиг. 10 представляют собой значения одного измерения, соответственно.
[0184]
Функциональная оценка частиц, получаемых с использованием различных амфипатических веществ
только
pH 5,0
14,6±0,6
-
pH 5,0
80,2±3,4
61,9±0,5
pH 5,0
40,0±0,3
9,8±0,7
pH 5,0
29,6±0,5
6,3±0,2
pH 5,0
35,7±1,0
10,8±,4
pH 5,0
16,4±0,6
8,3±0,7
pH 5,0
15,1±0,6
6,3±0,2
стеариловый простой эфир
pH 5,0
78,3±0,7
72,0±3,1
лауриловый простой эфир
pH 5,0
13,3±0,4
4,7±0,6
Функциональная оценка частиц, получаемых с использованием различных амфипатических веществ
pH 5,0
14,5±0,2
7,3±0,3
касторовое масло
pH 5,0
26,0±0,4
3,4±0,6
гидрогенизированное касторовое масло
pH 5,0
14,6±1,1
2,9±0,2
гидрогенизированное касторовое масло
pH 5,0
6,0±0,5
3,1±0,5
гидрогенизированное касторовое масло
pH 5,0
5,3±0,8
2,5±0,6
pH 5,0
21,0±0,6
10,1±0,4
pH 5,0
50,4±3,7
20,8±1,4
pH 5,0
36,0±1,4
17,5±0,4
pH 5,0
27,8±0,7
10,0±0,7
[0185]
Функциональная оценка частиц, получаемых с использованием различных амфипатических веществ
pH 5,0
22,1±0,1
11,2±1,3
pH 5,0
19,3±1,2
11,1±1,1
pH 5,0
23,2±5,5
11,9±1,2
pH 5,0
18,8±1,0
10,7±0,4
pH 5,0
17,6±0,5
13,2±3,7
pH 5,0
15,2±0,9
8,9±0,5
pH 5,0
17,6±0,3
9,3±0,2
pH 5,0
17,6±3,4
8,4±0,9
pH 5,0
16,4±1,9
9,0±1,1
Функциональная оценка частиц, получаемых с использованием различных амфипатических веществ
pH 5,0
46,6±1,5
13,0±0,3
pH 5,0
78,7±,2
17,7±1,2
pH 5,0
18,6±0,7
11,1±0,5
pH 5,0
19,2±1,2
11,7±0,1
pH 5,0
14,1±0,6
9,1±0,8
pH 5,0
24,0±1,0
11,0±0,5
pH 5,0
20,8±2,1
8,6±0,5
pH 5,0
17,0±1,0
14,2±0,4
pH 5,0
87,2±5,9
76,0±2,3
[0186]
Функциональная оценка частиц, получаемых с использованием различных амфипатических веществ
pH 5,0
11,8±1,0
9,7±0,5
pH 5,0
14,0±0,4
7,9±0,1
pH 5,0
11,7±0,7
9,9±1,0
pH 5,0
16,4±0,9
9,0±0,7
pH 5,0
15,0±0,2
7,6±0,5
pH 5,0
18,3±0,4
8,9±0,2
pH 5,0
18,6±1,4
9,0±0,5
pH 5,0
20,9±0,7
9,4±0,5
pH 5,0
39,5±6,4
8,8±0,6
pH 5,0
18,0±1,0
7,0±2,1
Функциональная оценка частиц, получаемых с использованием различных амфипатических веществ
pH 5,0
13,9±0,8
8,1±0,2
pH 5,0
14,6±0,7
8,5±0,4
pH 5,0
14,3±0,6
5,6±0,4
pH 5,0
13,5±0,4
5,4±0,1
pH 5,0
19,3±0,4
8,1±0,7
pH 5,0
23,8±0,8
9,6±0,6
pH 5,0
71,3±2,1
8,3±0,4
pH 5,0
28,4±1,6
11,0±1,4
pH 5,0
24,1±0,7
7,4±0,6
pH 5,0
25,3±1,1
7,4±0,6
[0187] Из указанных выше исследований показано, что подходящие вещества представляют собой вещества, включая: Tween 20, Tween 40, Tween 60 и Tween 80, которые представляют собой сложные эфиры полиоксиэтиленсорбитана и моножирной кислоты, содержащие от 12 до 18 атомов углерода; SPAN 40, SPAN 60, SPAN 80, SPAN 65 и SPAN 85, которые представляют собой сложные эфиры сорбитана и жирной кислоты, содержащие от 16 до 18 атомов углерода; производные глицерина, такие как гликольмоноолеат (моноолеин в таблице), дистеарат глицерина, диолеат глицерина и дилаурат глицерина (α,α-дилаурин); PEG-10-касторовое масло, которое представляет собой полиоксиэтилен-касторовое масло, и α-токоферол. Следует отметить, что "число атомов углерода" амфипатического вещества означает число атомов углерода фрагмента жирной кислоты (ацильной группы), служащей в качестве гидрофобного участка амфипатического вещества.
[0188] (8) ИССЛЕДОВАНИЕ ОТНОШЕНИЯ АМФИПАТИЧЕСКОГО ВЕЩЕСТВА
Исследование указанного выше (7) выявило амфипатические вещества, которые способны обеспечивать проявление эффекта, и такие вещества, которые не способны к этому. Затем проверяли, какое отношение вещества, способного обеспечивать проявление эффекта, является необходимым для осуществления проявления эффекта. В качестве вещества, не обеспечивающего проявление эффекта, выбирали EYPC и DLPC или SPAN 85 смешивали с EYPC в различных отношениях, получая в целом 1000 нмоль, и получали носители, состоящие из нескольких амфипатических веществ.
[0189] DLPC или SPAN 85 смешивали с EYPC в различных отношениях с получением в целом 1000 нмоль с последующим образованием комплекса с 1600 нмоль дезоксихолевой кислоты с получением носителей. Соответствующие носители подвергали тесту на вымывание при pH 7,4 и 5,0 для проверки проявления эффекта.
[0190] На фиг. 11 представлено вымывание каждых из комплексов EYPC, дезоксихолевой кислоты и DLPC или SPAN 85 при pH 7,4 на (A) и при pH 5,0 на (B). Соответствующие значения на (A) и (B) фиг. 11 представляют собой среднее значение трех различных измерений, и ± представляет собой SD.
[0191] Когда отношение DLPC или SPAN 85 : EYPC (моль : моль) находится в диапазоне от 100:150 до 100:0, подтверждали вымывание чувствительное к изменению pH ((A) и (B) фиг. 11). Таким образом, выявляли, что для получения pH-чувствительного носителя, способного проявлять эффект в слабокислой среде в результате образования комплекса с дезоксихолевой кислотой, было необходимо, чтобы отношение соответствующего типа амфипатического вещества находилось в таком диапазоне, как указано выше.
[0192] (9) ИССЛЕДОВАНИЕ PH-ЧУВСТВИТЕЛЬНЫХ СОЕДИНЕНИЙ, ОТЛИЧНЫХ ОТ ДЕЗОКСИХОЛЕВОЙ КИСЛОТЫ
Из указанных выше результатов, выявлено, что дезоксихолевая кислота влияет на состоянии гидрофобного пути связывания в слабокислой среде. Таким образом, ожидают, что молекулы, обладающие структурами, аналогичными дезоксихолевой кислоте, аналогично, могут представлять собой pH-чувствительный носитель. Затем в качестве аналога молекулы дезоксихолевой кислоты выбирали ряд желчных кислот, глицирризиновую кислоту и глицирретиновую кислоту с последующим проведением теста на вымывание и теста на слияние мембраны комплексов указанных выше кислот и DLPC для проверки, могут ли они являться пригодными в качестве pH-чувствительного соединения.
[0193] Для получения носителей использовали 1000 нмоль DLPC и 1600 нмоль различных кислот (далее в настоящем описании, обозначаемых как соединения-кандидаты).
[0194] На фиг. 12 представлено вымывание комплексов DLPC и различных соединений-кандидатов при pH 7,4 на (A) и при pH 5,0 на (B). Соответствующие значения на фиг. 12 представляют собой среднее значение трех различных измерений, и ± представляет собой SD.
[0195] На фиг. 13 представлен график, демонстрирующий вымывания комплексов DLPC и различных соединений-кандидатов при различных pH. Соответствующие значения на фиг. 13 представляют собой среднее значение трех различных измерений, и ± представляет собой SD.
[0196] На фиг. 14 представлены скорости слияния (A) одних различных pH-чувствительных соединений и (B) комплексов DLPC и различных pH-чувствительных соединений при pH 7,4 и pH 5,0. Соответствующие значения представляют собой среднее значение трех различных измерений, и ± представляет собой SD.
[0197] Носители, получаемые из всех соединений-кандидатов не приводили к вымыванию при pH 7,4, при этом при pH 5,0 носители, получаемые с использованием дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты (тригидроксихолестановой кислоты), гликодезоксихолевой кислоты, глицирризиновой кислоты и глицирретиновой кислоты достоверно приводили к большему вымыванию по сравнению со случаями, когда добавляли одни соединения-кандидаты, таким образом, демонстрируя эффект, стимулирующий функцию разрушения мембран, ((A) и (B) фиг. 12). Подтверждали, что эти носители также обладали чувствительным к изменению pH эффектом, способствующим функции слияния мембраны ((A) и (B) фиг. 14). На сновании результатов на (A) и (B) фиг. 5, показано, что носители по изобретению проявляют эффект, способствующий функции слияния, совместно с эффектом, способствующий функции разрушения мембраны.
[0198] При проверке профиля pH этих носителей, было выявлено, что pH, при котором начинается вымывание, различается в зависимости от типа используемой молекулы (фиг. 13). Предложена теория о том, что pKa различается, и различается способ образования пути связывания с амфипатическим веществом, в обоих случаях в зависимости от типа молекулы. Эти результаты показывают, что можно точно выбирать pH, при котором проявляется эффект. Таким образом, можно ожидать обеспечение возможности точных установок доставки in vivo и внутриклеточной доставки. В соответствии с этим тестом было выявлено, что такие pH-чувствительные носители обладали эффектами при pH от 7 до 3.
[0199] (10) ИССЛЕДОВАНИЕ КОМБИНАЦИЙ PH-ЧУВСТВИТЕЛЬНЫХ СОЕДИНЕНИЙ И АМФИПАТИЧЕСКИХ ВЕЩЕСТВ
Подтверждали наличие или отсутствие проявления эффекта и проверяли многие комбинации соединений (pH-чувствительных соединений), обладающих структурами, аналогичными дезоксихолевой кислоте, и определяемыми на (A) и (B) фиг. 12, фиг. 13 и (A) и (B) фиг. 14, в отношении возможности обеспечивать проявление эффекта и амфипатические вещества, определяемые скринингом в таблицах 2-7 и на фиг. 10, в отношении обеспечения проявлению эффекта.
[0200] Носители получали с использованием 1000 нмоль амфипатического вещества и 100 нмоль pH-чувствительного соединения, или 1000 нмоль амфипатического вещества и 6400 нмоль pH-чувствительного соединения. В таблицах 8 и 9 представлены результаты теста на вымывание различных комплексов pH-чувствительных соединений и амфипатических веществ.
[0201]
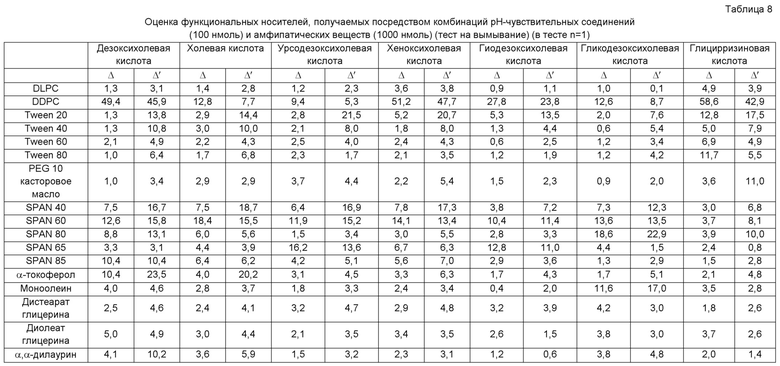
Δ=(Lc4,5-Lc7,4)-(La4,5-La7,4)
Δ'=Lc4,5-(La4,5+Lb4,5)
LcpH: вымывание комплекса pH-чувствительного соединения и амфипатического вещества при данном pH
LapH: вымывание одного pH-чувствительного соединения при данном pH
LbpH: вымывание амфипатического вещества при данном pH
[0202]
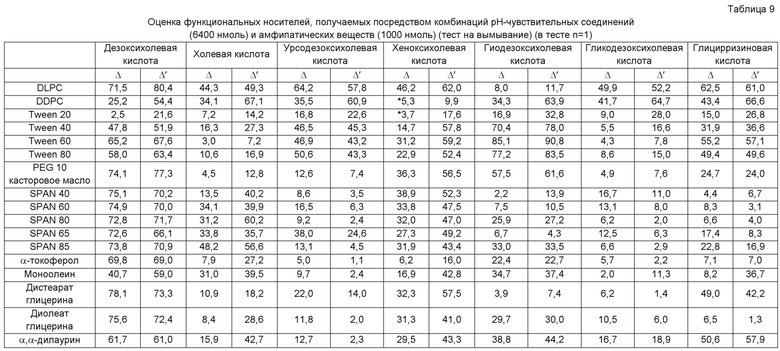
Δ=(Lc4,5-Lc7,4)-(La4,5-La7,4)
Δ'=Lc4,5-(La4,5+Lb4,5)
LcpH: вымывание комплекса pH-чувствительного соединения и амфипатического вещества при данном pH
LapH: вымывание одного pH-чувствительного соединения при данном pH
LbpH: вымывание амфипатического вещества при данном pH
Относительно комбинаций, обозначенных *, представлены результаты теста на основе инкубации течение 30 минут.
[0203] Из таблиц 8 и 9, выявлено, что для любой из комбинаций Δ и Δʹ, для которых указано, что они обладают достоверным эффектом, обеспечивают положительные значения, соответственно, носители, получаемые из комбинаций таблиц 8 и 9, обладали pH-чувствительной функцией.
[0204] (11) ПОДТВЕРЖДЕНИЕ СЛИЯНИЯ МЕМБРАНЫ С КЛЕТОЧНОЙ МЕМБРАНОЙ
Из результатов, указанных выше (3), (5), (6), (9) и т.п., было показано, что pH-чувствительный носитель по изобретению проявляет эффект, способствующий функции разрушения мембраны, и эффект, способствующий функции слияния мембраны, в слабокислой среде. Фактически подтверждали слияние pH-чувствительного носителя и клеточной мембраны. Более подробно, флуоресцентно-меченный pH-чувствительный носитель и клетки HeLa подвергали инкубации в течение короткого периода времени в среде с подведенными значениями pH 7,4 и 5,3, соответственно, и проверяли окрашивание поверхности клеточной мембраны, таким образом, подтверждая слияние pH-чувствительного носителя и клеточной мембраны.
[0205] В результате наблюдали флуоресценцию в виде очага или в области, близкой к ядру, при pH 7,4 ((A) фиг. 15). Это свидетельствует о том, что pH-чувствительный носитель поглощается клетками и присутствует в эндосоме и лизосоме. Следует отметить, что наблюдали аналогичное изображение, как в случае одного флуоресцентно-меченого амфипатического вещества (данные не показаны).
[0206] С другой стороны, наблюдали изображение, где формы флуоресценции и форма клеток совпадали друг с другом на всем поле зрения при pH 5,3 ((B) фиг. 15). Предложена теория о том, что флуоресцентно-меченный pH-чувствительный носитель претерпевает слияние мембраны с мембраной клетки на клеточной поверхности, в случае которого флуоресценция рассеивалась в форме клетки.
[0207] Из указанных выше результатов, было выявлено, что pH-чувствительный носитель проявляет эффект, способствующий функции слияния мембран, в слабокислой среде в среде и претерпевает слияние мембраны с мембраной клетки на клеточной поверхности.
[0208] Когда интенсивность флуоресценции клетки оценивали с использованием проточного цитометра, для инкубируемых клеток демонстрировали большую интенсивность флуоресценции при pH 5,3 ((C) фиг. 15). Считают, что результаты основаны на том, что флуоресцентно-меченный pH-чувствительный носитель претерпевает слияние мембраны в больших количествах. Таким образом, показано, что pH-чувствительный носитель способен эффективно претерпевать слияние мембраны с фактической клеточной мембраной.
[0209] (12) ВЛИЯНИЕ ВВЕДЕНИЯ ПЕПТИДА И БЕЛКА НА ЭФФЕКТИВНОСТЬ ПРОЯВЛЕНИЯ
Тщательно исследовали введение пептида или белка, обладающего физиологической активностью, посредством гидрофобного пути связывания для применения в качестве DDS. Предполагают, что это является перспективным способом настоящего носителя. Таким образом, проверяли влияние введения физиологически активного вещества на проявление эффекта носителя с использованием OVA 257-264 (SIINFEKL, приобретаемого от PH Japan) в качестве модельного пептида и OVA (приобретаемого от Sigma-Aldrich Co. LLC.) в качестве модельного белка.
[0210] Когда пептид или белок (192 мкг) вводили в комплекс DLPC-дезоксихолат (1000 нмоль:1600 нмоль), для оценки введения физиологически активного вещества сначала измеряли размер частиц и индекс полидисперсности (PDI) носителя, (таблица 10).
[0211] Затем определяли вымывания носителей, в которые вводили различные количества пептида (A) или белка (B) по отношению к 1000 нмоль DLPC и 1600 нмоль дезоксихолевой кислоты. На фиг. 16 представлены результаты вымываний содержащих (A) пептид и (B) белок носителей при pH 7,4 и 5,0. Каждое из значений на фиг. 16 представляет собой среднее значение трех различных измерений, и ± представляет собой SD.
[0212] Кроме того, проверяли скорость слияния каждых из носителей, в которые вводили 768 мкг пептида или белка, по отношению к 1000 нмоль DLPC и 1600 нмоль (A) дезоксихолевой кислоты или (B) урсодезоксихолевой кислоты. На фиг. 17 представлены результаты скоростей слияния (A) дезоксихолевой кислоты и (B) урсодезоксихолевой кислоты при pH 7,4 и 5,0. Каждое из значений на (A) и (B) фиг. 17 представляет собой среднее значение трех различных измерений, и ± представляет собой SD.
[0213]
Размер частиц и PDI
Значение представляет собой среднее значение в результате пяти измерений, и ± представляет собой SD.
Только мицелла: один комплекс DLPC-дезоксихолат
Пептид: содержащий пептид комплекс DLPC-дезоксихолат
OVA-белок: содержащий OVA комплекс DLPC-дезоксихолат
[0214] Введение пептида или белка в носитель, как правило, незначительно увеличивало размер частиц носителя (таблица 10). Таким образом, подтверждали, что эти вещества были введены в носитель. С другой стороны, относительно вызываемого вымывания значения являлись аналогичными значениям, получаемыми в случае отсутствия введения в любых количествах пептида или белка ((A) и (B) фиг. 16) и показано, что отсутствие снижение эффекта носителя не было обусловлено введением пептида или белка.
[0215] Относительно результатов теста слияния получали аналогичные результаты ((A) и (B) фиг. 17). Из этих результатов было выявлено, что введение физиологически активного вещества значительно не влияет на проявление эффекта носителя.
[0216] (13) ДОСТАВКА В ЦИТОЗОЛЬ 1
Опубликовано много сообщений относительно носителей, которые обладают такими свойствами, как способность содействовать слиянию мембраны и разрушению мембраны в слабокислой среде, и которые обеспечивают доставку вводимых или встраиваемых веществ посредством эндосомы в цитозоль. Была предпринята попытка доставки физиологически активного вещества в цитозоль с использованием формулируемого pH-чувствительного носителя.
[0217] Носитель получали с использованием 140 мкг/мл раствора флуоресцентно-меченого пептида по отношению к 1000 нмоль DLPC и 1600 нмоль дезоксихолевой кислоты или урсодезоксихолевой кислоты. Для контроля получали носитель с использованием 140 мкг/мл раствора флуоресцентно-меченого пептида по отношению к 1000 нмоль DLPC.
[0218] На фиг. 18 представлена фотография (A) раствора одного флуоресцентно-меченого пептида, (B) раствора одного содержащего флуоресцентно-меченый пептид DLPC, (C) раствора содержащего флуоресцентно-меченый пептид комплекса DLPC-дезоксихолат и (D) раствора содержащего флуоресцентно-меченый пептид комплекса DLPC-урсодезоксихолат.
[0219] Раствор (B), содержащий флуоресцентно-меченый пептид DLPC, раствор (C), содержащий флуоресцентно-меченый пептид комплекса DLPC-дезоксихолат, и раствор (D), содержащий флуоресцентно-меченый пептид комплекса DLPC-урсодезоксихолат, становились слабо флуоресцентными по сравнению с раствором (A) одного флуоресцентно-меченого пептида. Это обусловлено тем, что флуоресцентно-меченый пептид прикрепляется к гидрофобным доменам носителя, таким образом, подтверждая, что флуоресцентно-меченый пептид встраивается в носитель.
[0220] Затем предпринимали попытку доставки флуоресцентно-меченого пептида в цитозоль. Более конкретно, 100 мкл каждых из содержащих флуоресцентно-меченый пептид образцов (A)-(D), указанных выше, (14 мкг флуоресцентно-меченого пептида/лунку) вводили в клетки RAW, культивируемые в 1900 мкл среды MEM, содержащей 10% FBS, и они поглощались в течение ночи. Клетки промывали и подвергали последующей инкубации в течение трех часов с последующим наблюдением клеток через флуоресцентный микроскоп.
[0221] На фиг. 19 представлены микрофотографии флуоресценции (A) одного флуоресцентно-меченого пептида, (B) одного содержащего флуоресцентно-меченый пептид DLPC и (C) содержащего флуоресцентно-меченый пептид комплекса DLPC-дезоксихолат. На фиг. 20 представлены (A) микрофотография и (B) микрофотография флуоресценции содержащего флуоресцентно-меченый пептид комплекса DLPC-дезоксихолат и (C) микрофотография и (D) микрофотография флуоресценции содержащего флуоресцентно-меченый пептид комплекса DLPC-урсодезоксихолат.
[0222] В случае одного флуоресцентно-меченого пептида (A) или одного содержащего флуоресцентно-меченый пептид DLPC, наибольшую флуоресценцию наблюдали в виде очага, свидетельствующую о том, что флуоресцентно-меченый пептид оставался в эндосоме ((A) и (B) фиг. 19).
[0223] С другой стороны, в отношении комплекса DLPC-дезоксихолат (C), в который вводили флуоресцентно-меченый пептид, флуоресценцию подтверждали по существу во всех клетках во всем цитозоле, что свидетельствует о том, что флуоресцентно-меченый пептид покидал эндосому и мигрировал в цитозоль ((C) фиг. 19). Вследствие того, что носитель являлся отрицательно заряженным и последующую инкубацию проводили в течение трех часов, трудно предположить, что эта флуоресценция является изображением, получаемым в результате адсорбции носителя на всей поверхности клетки, и предполагают, что флуоресцентно-меченый пептид доставляется в цитозоль посредством эндосомы.
[0224] В качестве носителя, получаемого с использованием урсодезоксихолевой кислоты, флуоресценцию наблюдали во всем цитозоле, как в случае дезоксихолевой кислоты и подтверждали эффективную доставку в цитозоль ((C) и (D) фиг. 20).
[0225] На основании указанного выше, показано, что pH-чувствительные носители по изобретению обеспечивают эффективную доставку в цитозоль физиологически активного вещества.
[0226] (14) ДОСТАВКА В ЦИТОЗОЛЬ 2
Затем, предпринимали попытку доставки белка в цитозоль. В качестве модельного белка выбирали β-гал и вводили его в pH-чувствительный носитель. Доставку в цитозоль оценивали визуализацией ферментативной активности после применения к клеткам RAW и сравнения активностей.
[0227] Носители получали с использованием 1,4 мг/мл раствора β-гал по отношению к 1000 нмоль DLPC и 1600 нмоль дезоксихолевой кислоты или урсодезоксихолевой кислоты.
[0228] На фиг. 21 представлены микрофотографии (A) одного β-гал, (B) содержащего β-гал комплекса DLPC-дезоксихолат и (C) содержащего β-гал комплекса DLPC-урсодезоксихолат.
[0229] Клетки, к которым добавляли один β-гал не окрашивались ((A) фиг. 21). Это обусловлено тем, что β-гал разрушается в эндосоме, что указывает на отсутствие миграции в цитозоль. С другой стороны, в случае введения в pH-чувствительные носители, подтверждали появление синей окраски β-gal ((B) и (C) фиг. 21), что свидетельствует о том, что β-гал покидал эндосому и мигрировал в цитозоль, при этом сохраняя ферментативную активность. Согласно Vincent M. Rotello et al., J. Am. Chem. Soc., 2010, 132(8) 2642-2645 аналогичный эксперимент проводят для доставки в цитозоль β-gal и аналогичные результаты, как в указанной выше литературной ссылке, получают в настоящем описании, таким образом подтверждая указанное выше обсуждение.
[0230] (15) ДОСТАВКА В ЦИТОЗОЛЬ 3
В указанных выше пунктах (13) и (14) подтверждали доставку в цитозоль физиологически активного вещества, подложкой для которого служит pH-чувствительный носитель. Затем предпринимали попытку доставки в цитозоль, когда pH-чувствительный носитель и физиологически активное вещество использовали соответственно независимо друг от друга. Когда pH-чувствительный носитель и физиологически активное вещество поглощались одной и той же эндосомой, эндосома претерпевала разрушение мембраны в результате эффекта, способствующего функции разрушения мембраны, pH-чувствительного носителя. В этом случае, предполагают, что смешиваемое в эндосоме физиологически активное вещество вымывается из эндосомы и может быть доставлено в цитозоль.
[0231] В случае, когда флуоресцентно-меченый пептид-FITC добавляли к клеткам RAW, а также в случае, когда флуоресцентно-меченный OVA-FITC добавляли к клеткам RAW, в клетках подтверждали флуоресценцию в виде очага, что свидетельствует, что флуоресцентно-меченый пептид-FITC и флуоресцентно-меченный OVA-FITC, соответственно, оставались в эндосоме ((A) и (B) фиг. 22A).
[0232] Затем использовали комплекс EYPC-дезоксихолата, в котором наблюдали функцию, способствующую разрушению мембраны, и функцию, способствующую слиянию мембраны, в указанных выше пунктах (3) и (5), в комбинации с флуоресцентно-меченым пептидом-FITC или флуоресцентно-меченным OVA-FITC. Более конкретно, раствор комплекса EYPC-дезоксихолат дополнительно добавляли к культуральном раствору клеток RAW, содержащих флуоресцентно-меченый пептид-FITC. Отдельно раствор комплекса EYPC-дезоксихолат дополнительно добавляли к культуральному раствору клеток RAW, содержащих флуоресцентно-меченный OVA-FITC. В этих случаях подтверждали флуоресценцию в клетках в виде очага, как в указанном выше случае, что свидетельствует о том, что флуоресцентно-меченый пептид-FITC и флуоресцентно-меченный OVA-FITC, соответственно, оставались в эндосоме ((C) и (D) фиг. 22A).
[0233] Затем использовали pH-чувствительный носитель в комбинации с флуоресцентно-меченым пептидом-FITC или флуоресцентно-меченным OVA-FITC. Более конкретно, раствор pH-чувствительного носителя, обладающего эффектом, стимулирующим функцию разрушения мембран, дополнительно добавляли к культуральному раствору клеток RAW, содержащих флуоресцентно-меченый пептид-FITC. Кроме того, раствор pH-чувствительного носителя, обладающего эффектом, стимулирующим функцию разрушения мембран, дополнительно добавляли к культуральному раствору клеток RAW, содержащих флуоресцентно-меченный OVA-FITC. Для pH-чувствительного носителя использовали комплекс DLPC-дезоксихолат, комплекс SPAN 80-дезоксихолат, комплекс DDPC-дезоксихолат, комплекс полиоксиэтилен-касторовое масло (PEG-10-касторовое масло)-дезоксихолат, комплекс Tween 20-дезоксихолат, комплекса Tween 80-дезоксихолат, комплекс α-токоферол-дезоксихолат, комплекс DLPC-урсодезоксихолат, комплекс DLPC-глицирризиновая кислота, комплекс DLPC-хенодезоксихолат, комплекс DLPC-гиодезоксихолат и комплекс DLPC-гликодезоксихолат. Соответствующие pH-чувствительные носители получали с использованием 160 нмоль pH-чувствительного соединения и 100 нмоль амфипатического вещества. В этих случаях флуоресценцию выявляли во всем цитозоле ((E)-(J) фиг. 22A, (K)-(T) фиг. 22B и (U)-(AB) фиг. 22C). Таким образом, показано, что можно было осуществить доставку в цитозоль даже в случаях, когда физиологически активное вещество использовали независимо от pH-чувствительных носителей, обладающих эффектом, стимулирующим функцию разрушения мембран, (не служащих в качестве подложки).
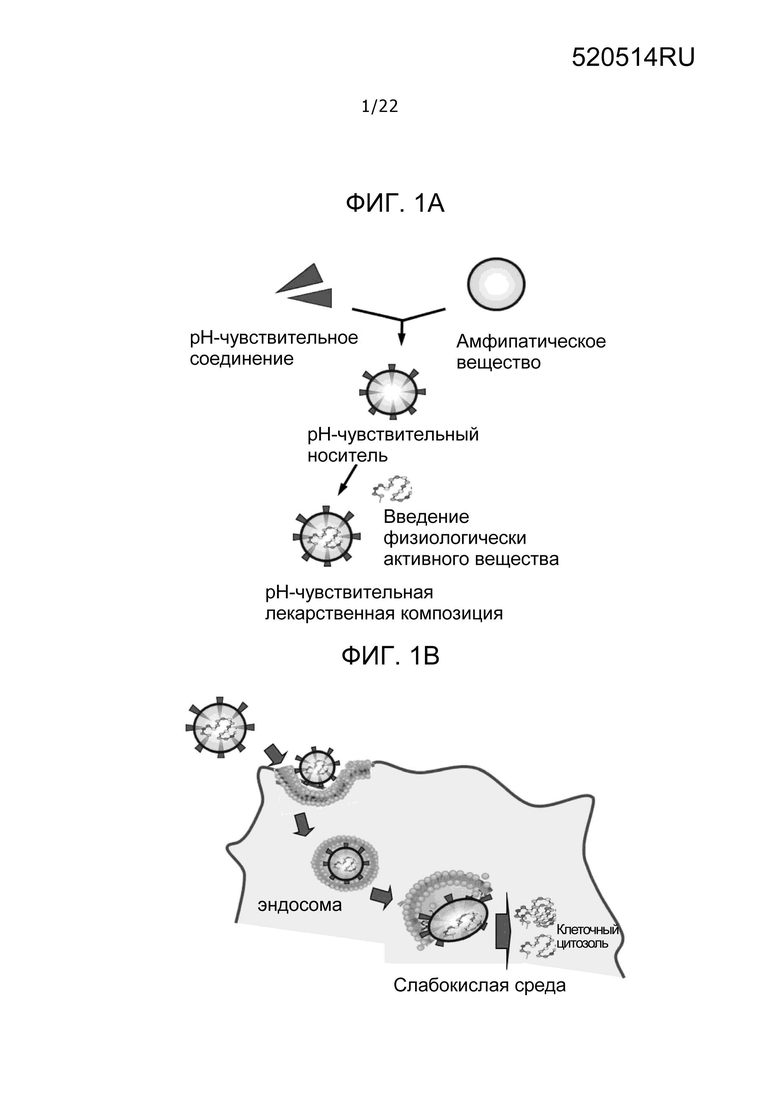
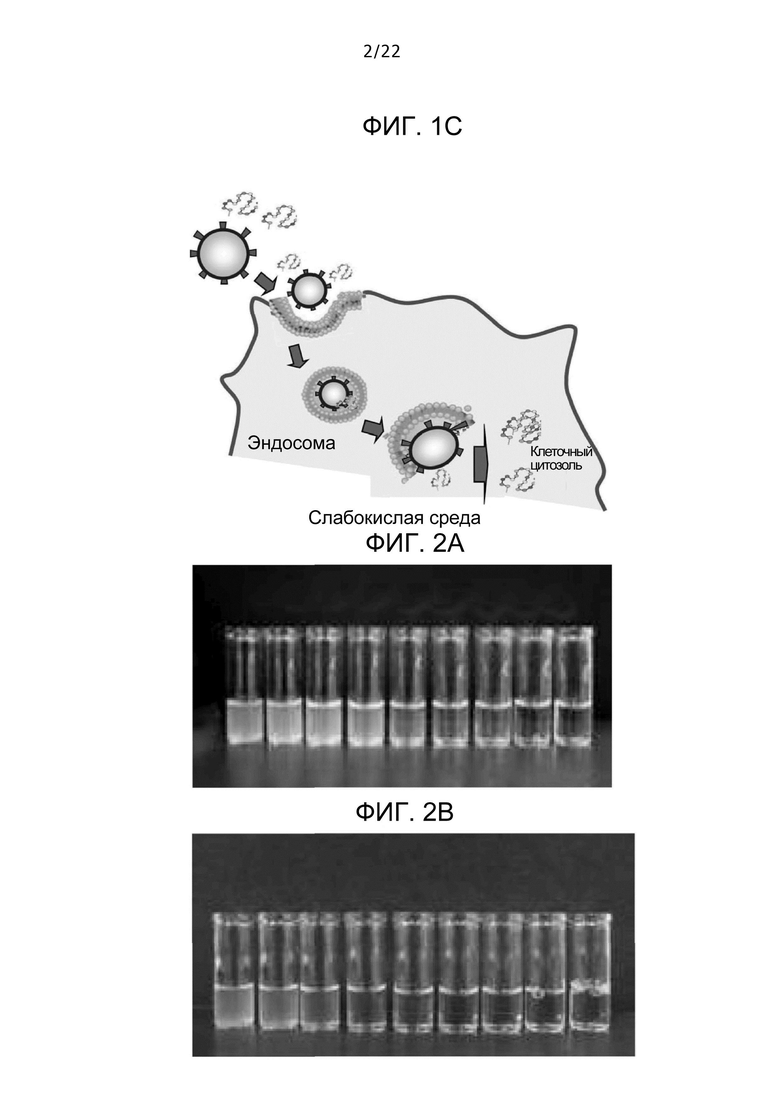
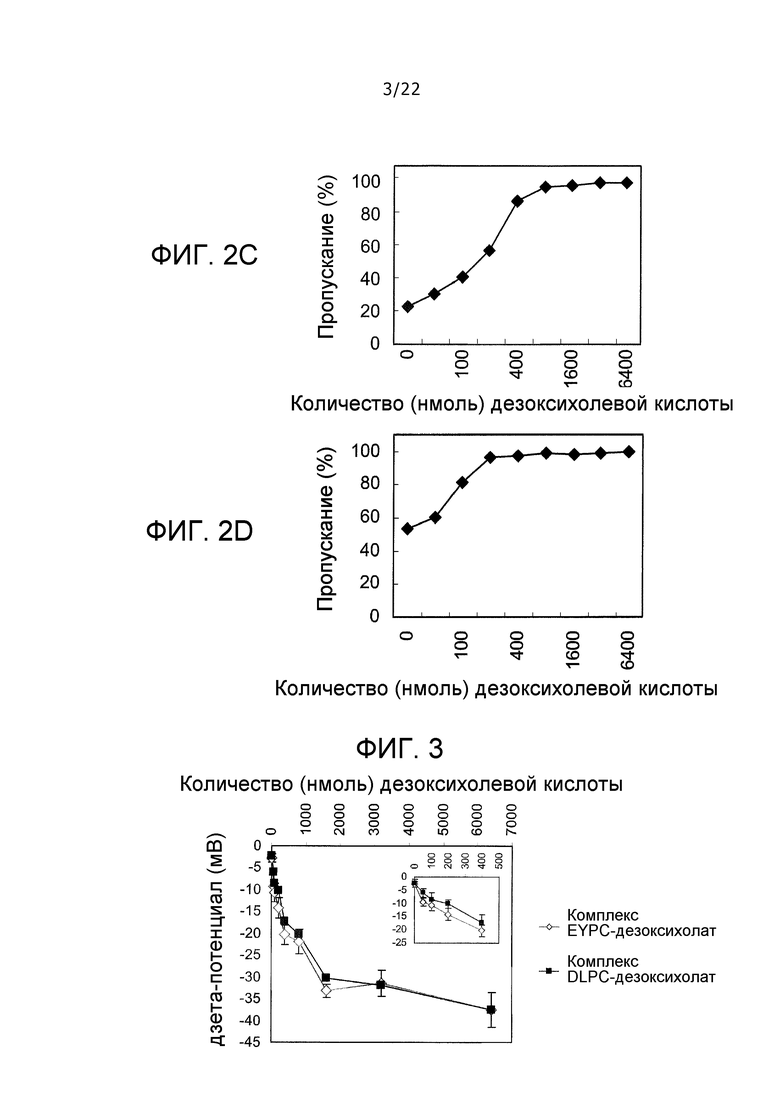
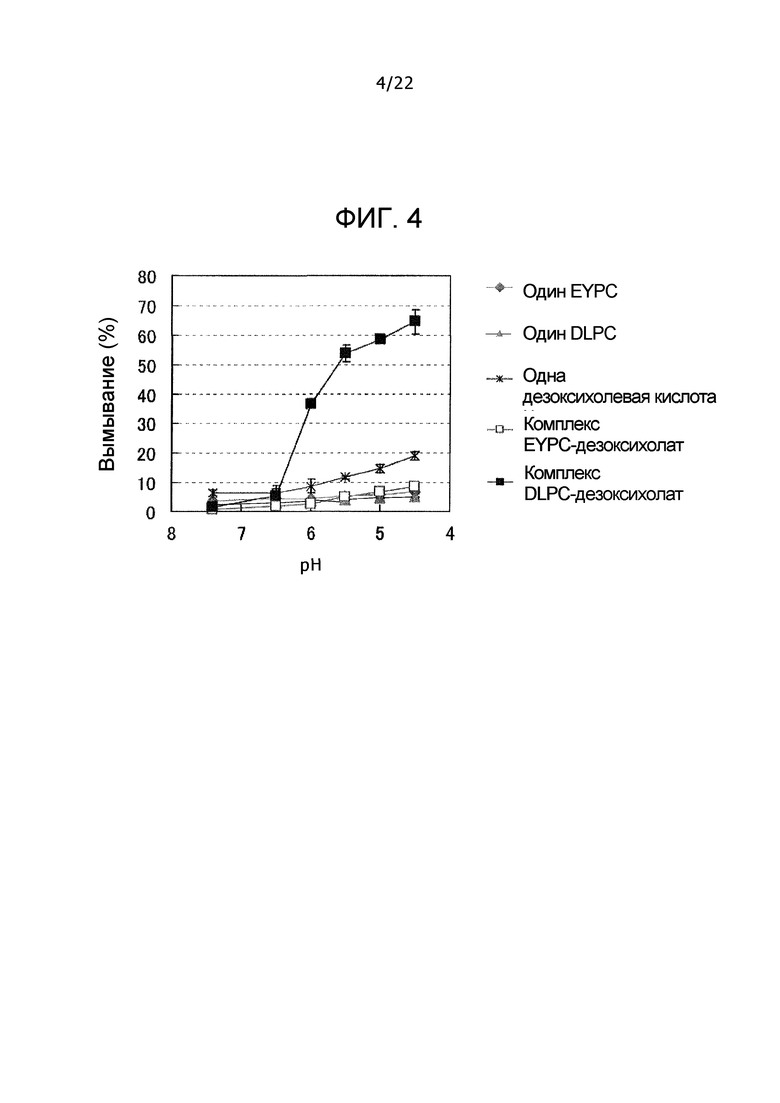
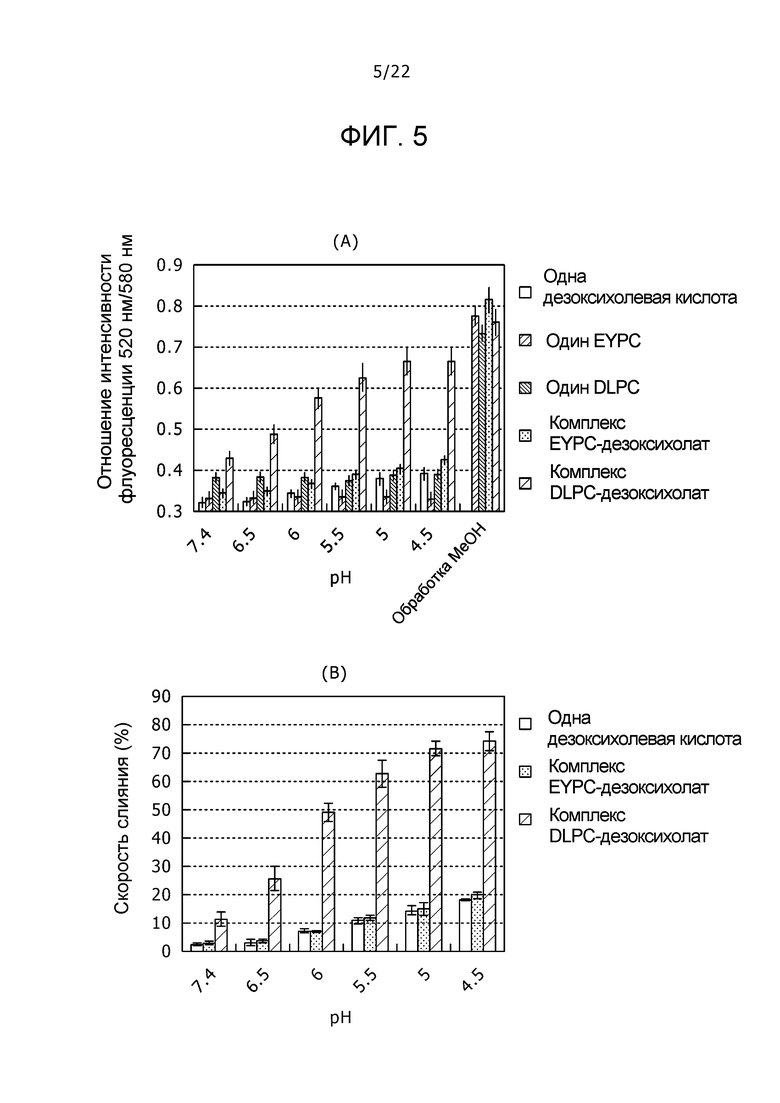
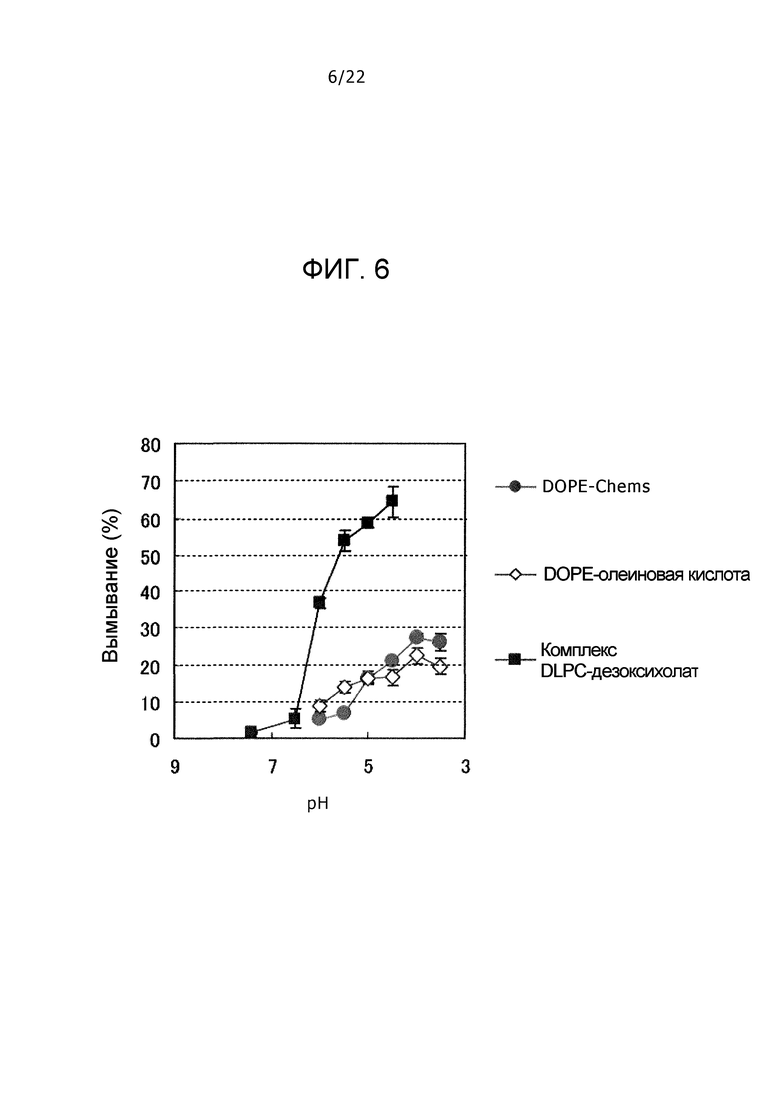
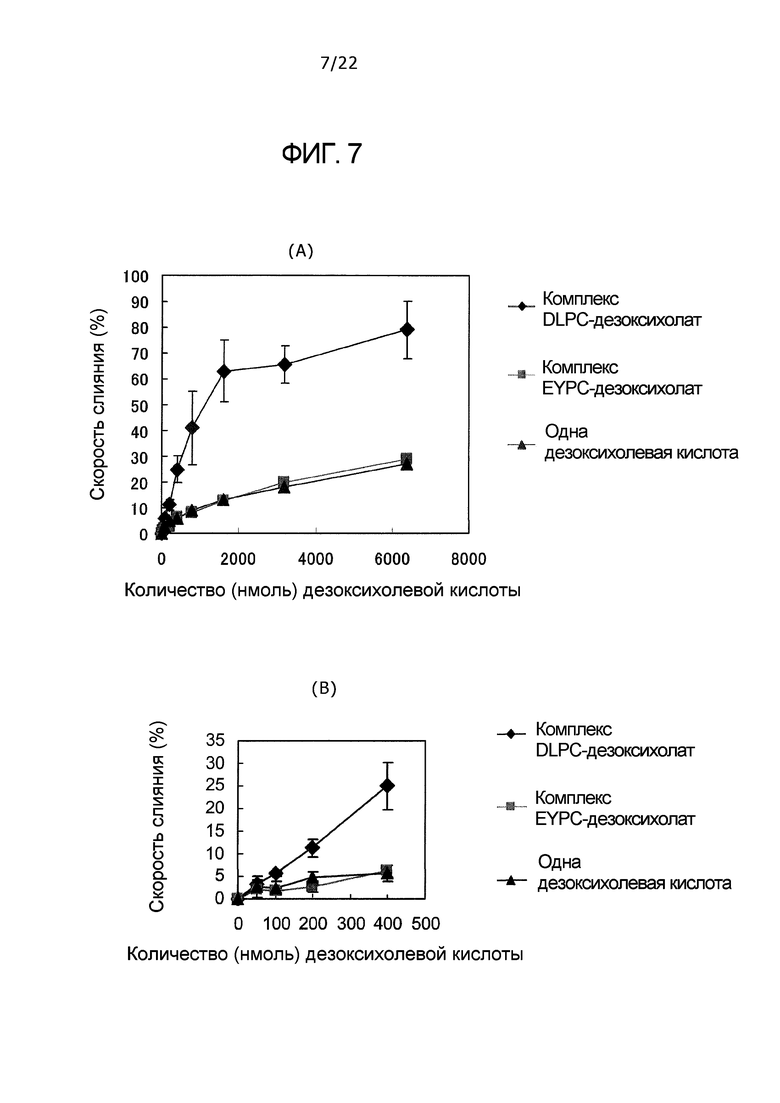
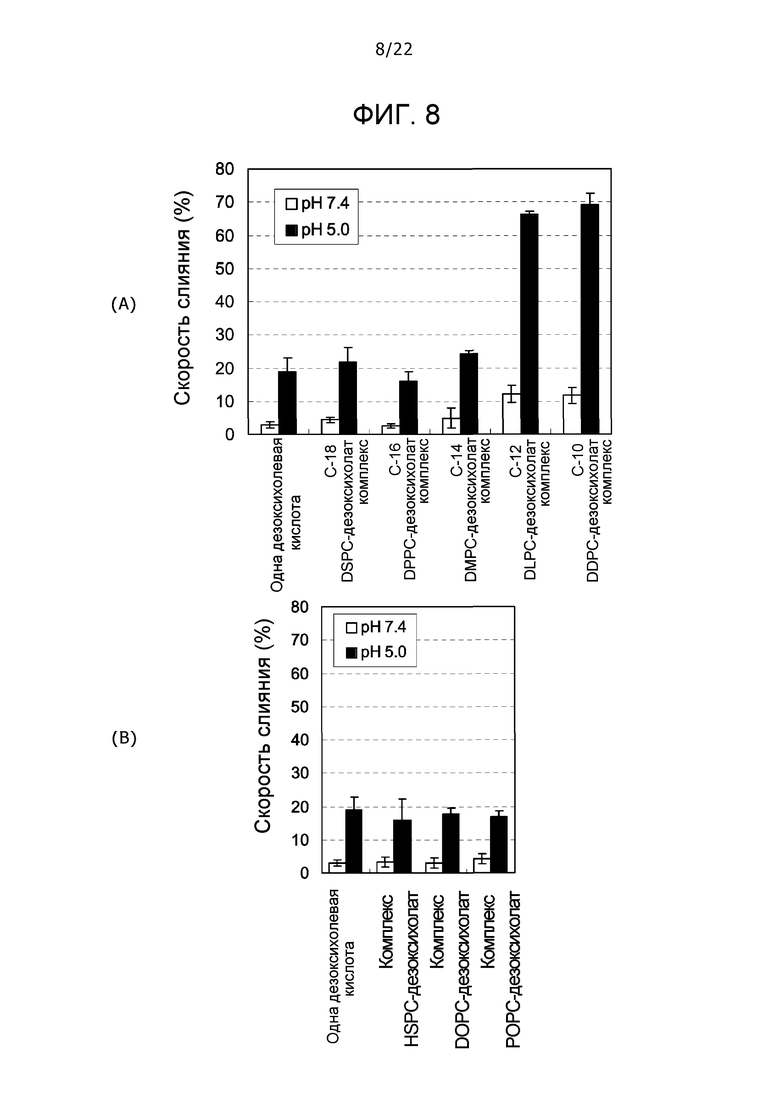
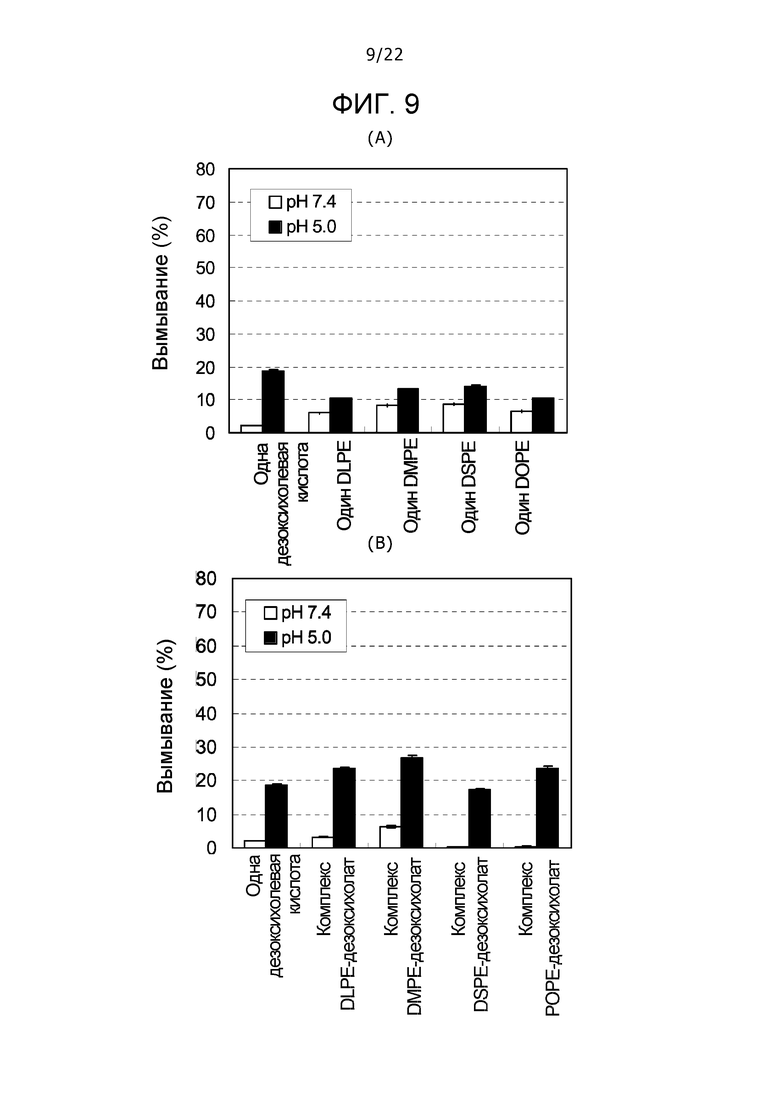
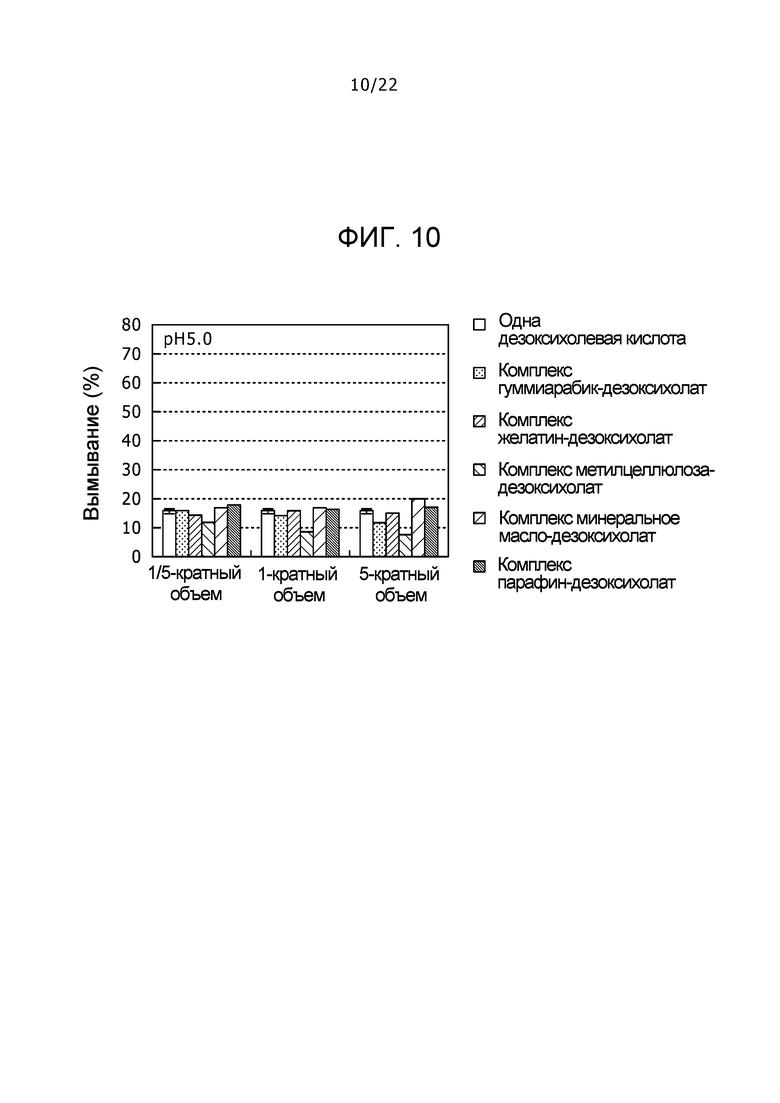
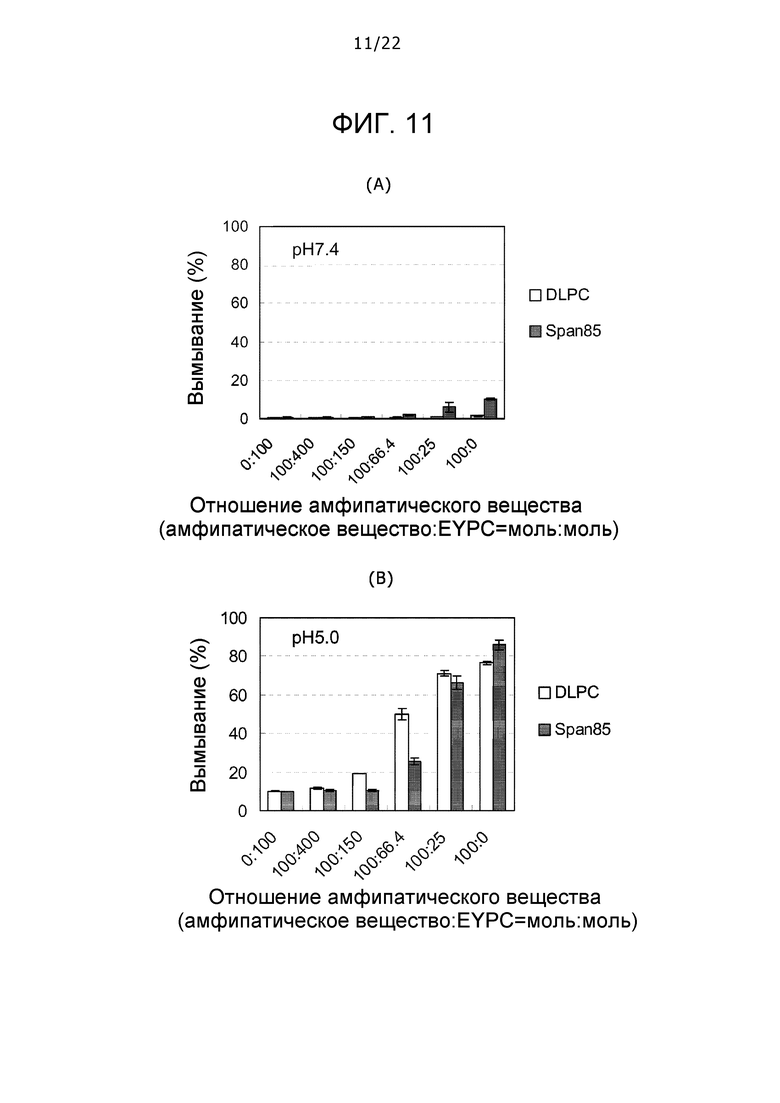
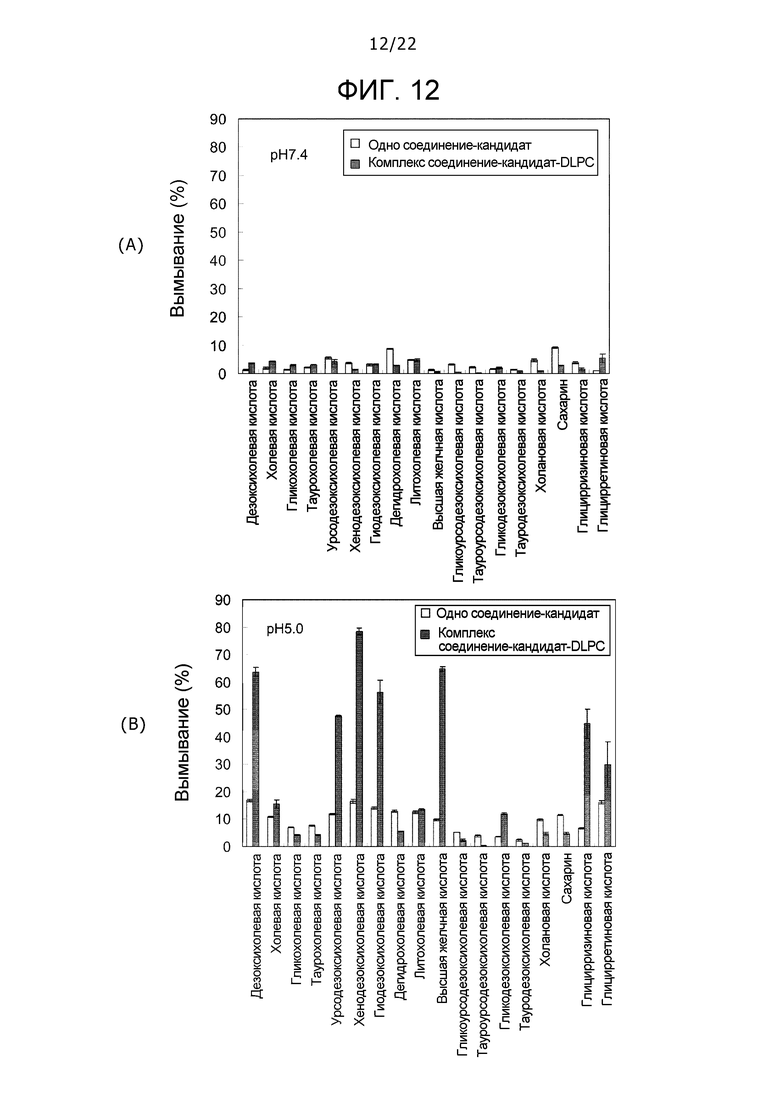
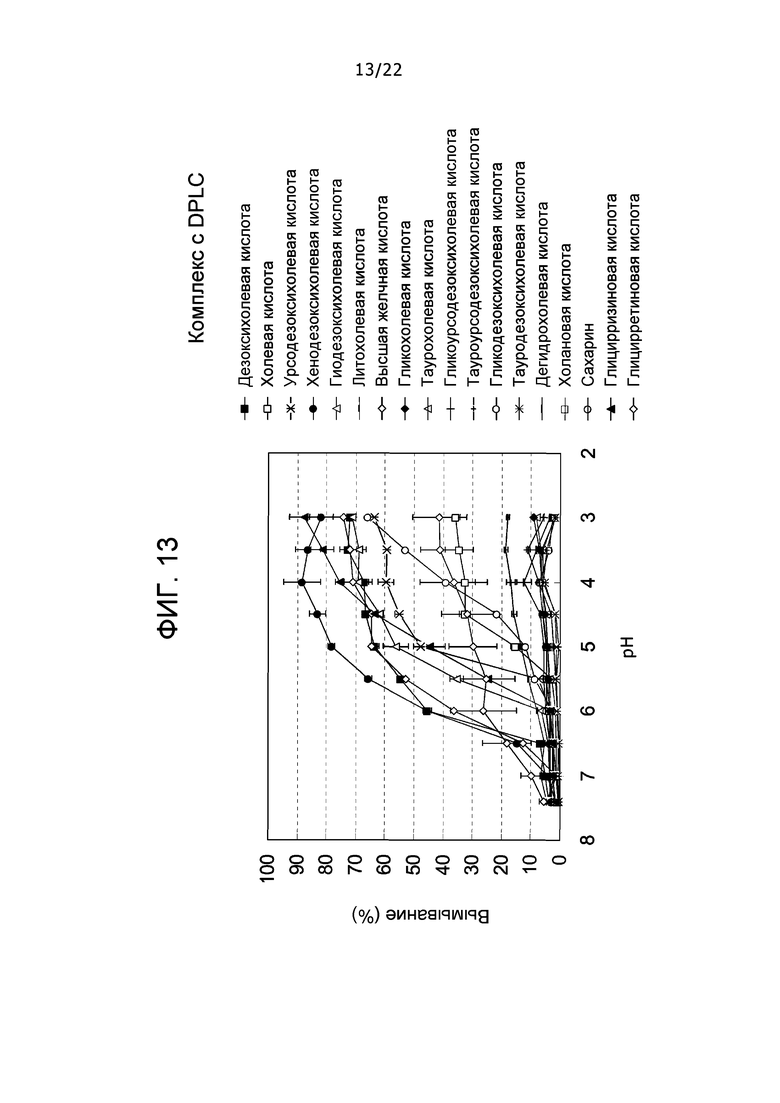
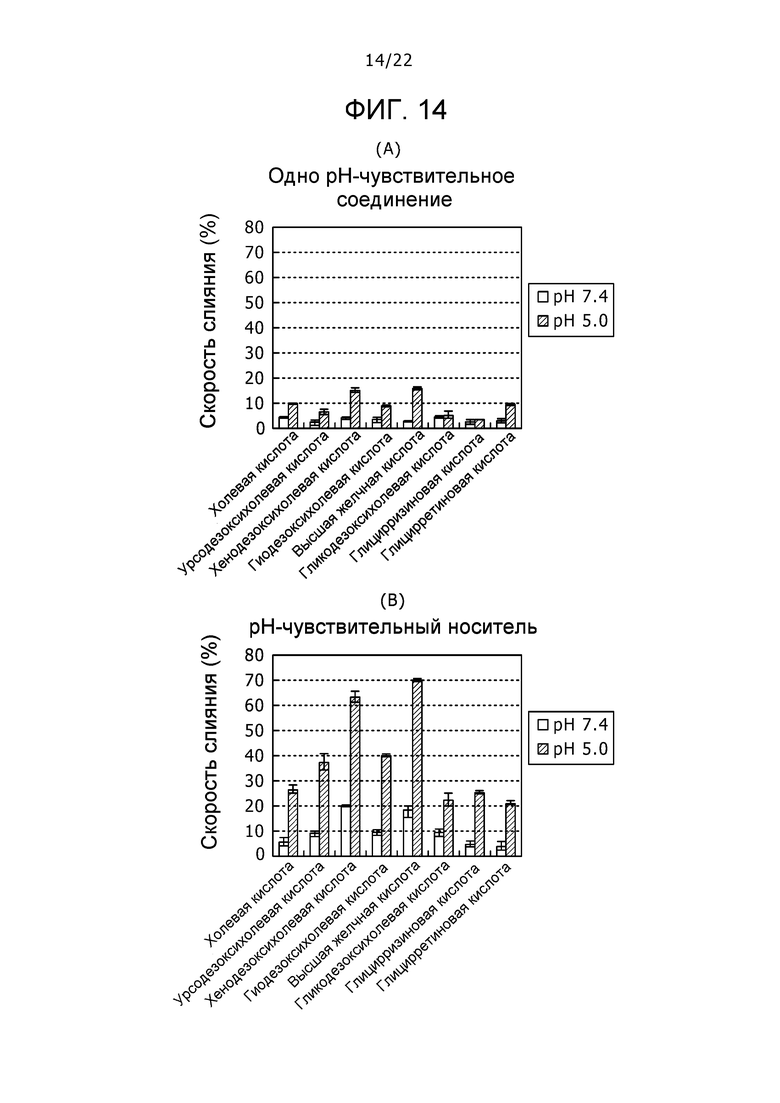
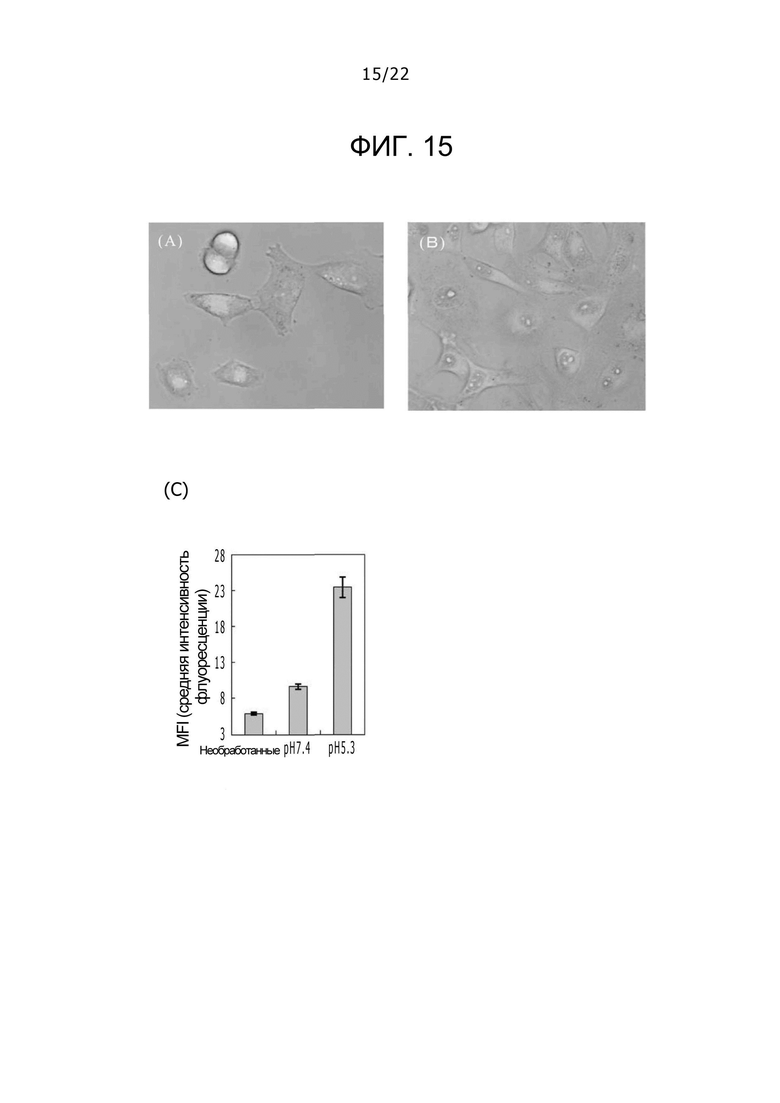
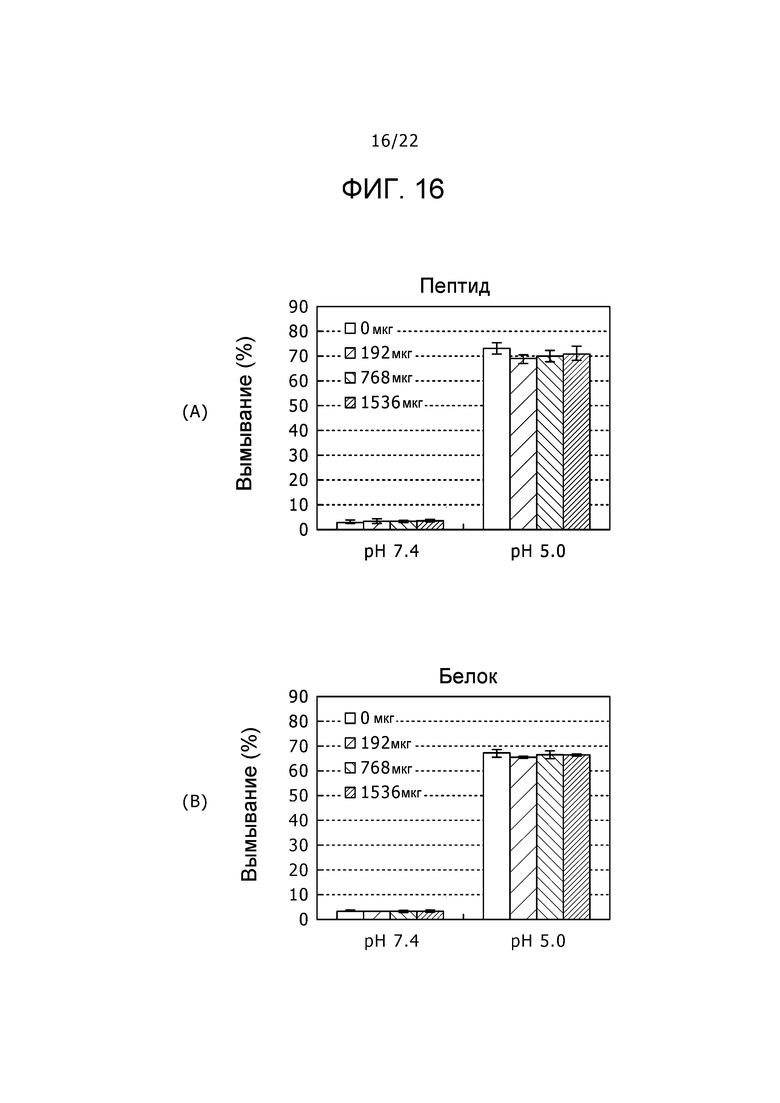
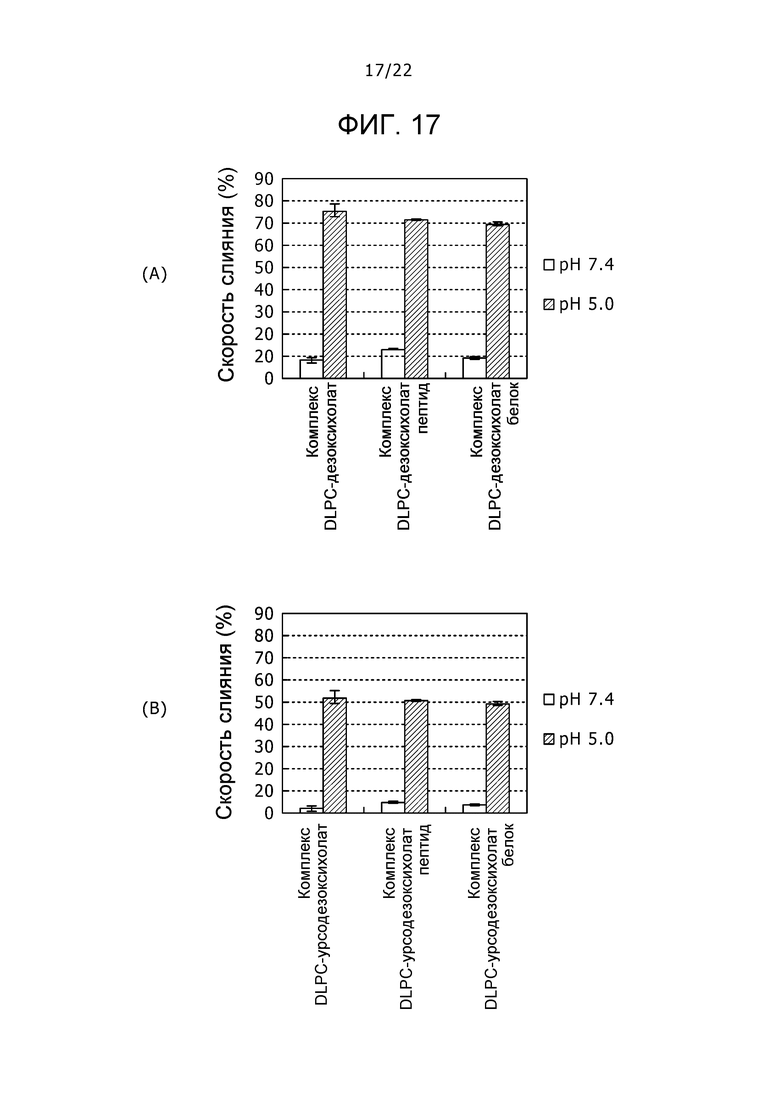
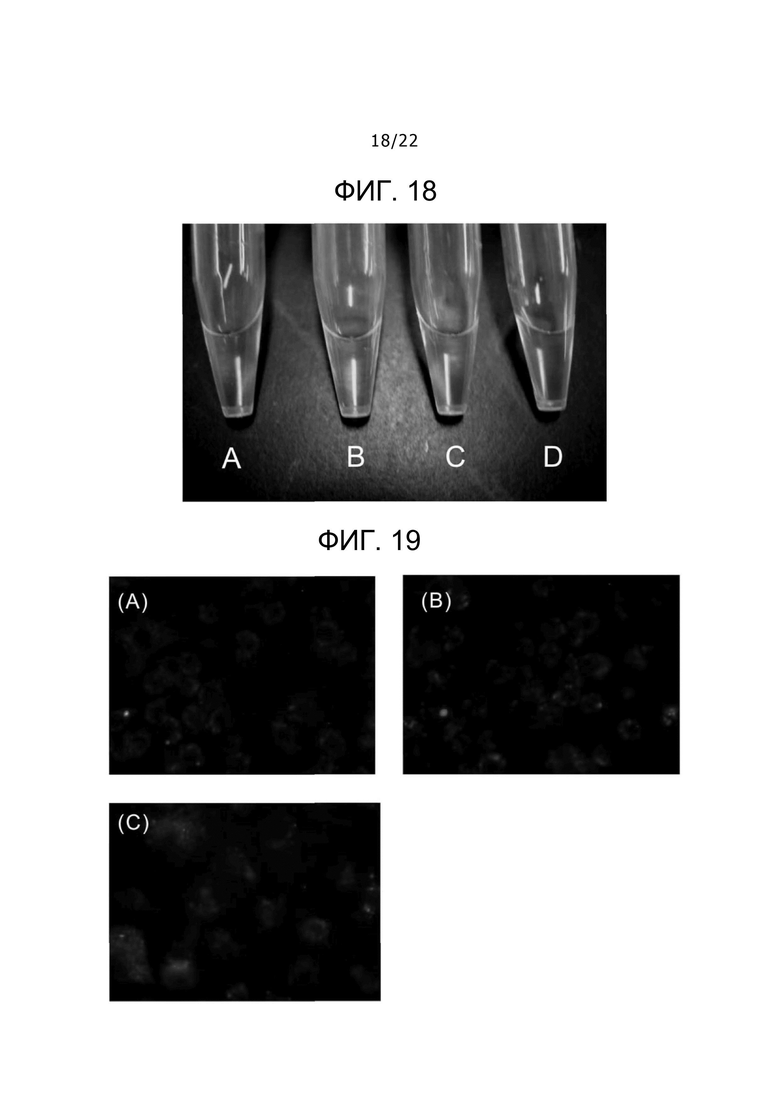



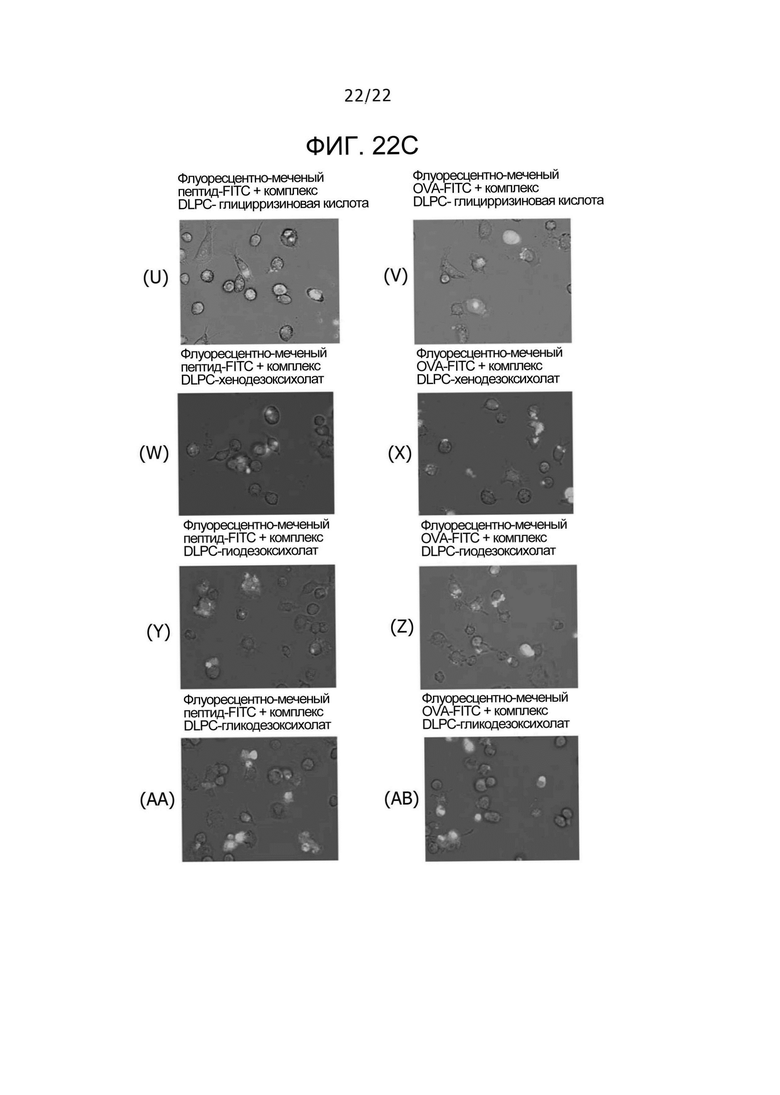
Изобретение относится к медицине, в частности к рН-чувствительному носителю для доставки лекарственного средства, способу получения рН-чувствительного носителя, рН-чувствительному лекарственному средству и композиции, и способу обработки клеток заявленным лекарственным средством и/или композицией. Заявленный pH-чувствительный носитель содержит по меньшей мере одно pH-чувствительное соединение, выбранное из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, C27-желчной кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей, и по меньшей мере одно амфипатическое вещество, выбранное из группы, состоящей из фосфатидилхолина, содержащего от 10 до 12 атомов углерода, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, содержащего от 12 до 18 атомов углерода, сложного эфира сорбитана и жирной кислоты, содержащего от 16 до 18 атомов углерода, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилена-касторового масла и α-токоферола, и способен проявлять эффект, стимулирующий функцию разрушения мембран. Осуществление изобретения позволяет реализовывать доставку физиологически активного вещества в цитозоль за счет разрушения клеточной мембраны. 5 н. и 4 з.п. ф-лы, 22 ил., 10 табл.
1. pH-чувствительный носитель для доставки физиологически активного вещества в цитозоль, содержащий по меньшей мере одно pH-чувствительное соединение, связанное с по меньшей мере одним амфипатическим веществом,
где по меньшей мере одно pH-чувствительное соединение выбирают из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, 3α,7α,12α-тригидроксихолестановой кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей; и
где по меньшей мере одно амфипатическое вещество выбирают из группы, состоящей из фосфатидилхолина, такого как дилауроилфосфатидилхолин (DLPC) или дидеканоилфосфатидилхолин (DDPC), сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, сложного эфира сорбитана и жирной кислоты, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола; и
который способен проявлять эффект, стимулирующий функцию разрушения клеточной мембраны.
2. pH-чувствительный носитель по п.1, где pH-чувствительное соединение и амфипатическое вещество образуют мицеллярные частицы.
3. pH-чувствительный носитель по п.2, где размер частиц составляет от 10 до 200 нм.
4. pH-чувствительный носитель по любому из пп.1-3, где pH-чувствительное соединение содержится в количестве не менее 10 моль на 100 моль амфипатического вещества.
5. pH-чувствительный носитель по п.1, где вымывание одного pH-чувствительного соединения в тесте на вымывание принимают за La, вымывание одного амфипатического вещества принимают за Lb, вымывание pH-чувствительного носителя принимают за Lc, вымывания при pH 7,4, соответственно, принимают за Lc7,4, La7,4 и Lb7,4, и вымывания при pH 5,0 или 4,5, соответственно, принимают за Lcx, Lax и Lbx, Δ, представленная следующей ниже формулой (1), является не меньше 5, и Δ', представленная следующей ниже формулой (2), является не меньше 5:
Расчет 1
Уравнение (1) Δ=(Lcx-Lc7,4)-(Lax-La7,4),
Уравнение (2) Δ'=Lcx-(Lax+Lbx).
6. pH-чувствительное лекарственное средство, физиологически активное вещество которого содержится в, вводится в, связано непосредственно или посредством среды с поверхностью pH-чувствительного носителя по любому из пп.1-5, где физиологически активное вещество состоит из белка или пептида.
7. pH-чувствительная лекарственная композиция, содержащая:
pH-чувствительный носитель по любому из пп.1-5; и
физиологически активное вещество, где указанное физиологически активное вещество состоит из белка или пептида.
8. Способ получения pH-чувствительного носителя по п.1, который способен проявлять эффект, стимулирующий функцию разрушения клеточной мембраны, включающий:
стадию связывания по меньшей мере одного pH-чувствительного соединения, выбранного из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, урсодезоксихолевой кислоты, хенодезоксихолевой кислоты, гиодезоксихолевой кислоты, 3α,7α,12α-тригидроксихолестановой кислоты, гликодезоксихолевой кислоты, глицирризиновой кислоты, глицирретиновой кислоты и их солей, и
по меньшей мере одного амфипатического вещества, выбранного из группы, состоящей из фосфатидилхолина, сложного эфира полиоксиэтиленсорбитана и моножирной кислоты, сложного эфира сорбитана и жирной кислоты, моноолеата глицерина, дилаурата глицерина, дистеарата глицерина, диолеата глицерина, полиоксиэтилен-касторового масла и α-токоферола.
9. Способ обработки клеток, включающий:
стадию, где клетки обрабатывают в среде, содержащей:
pH-чувствительное лекарственное средство по п.6 и/или
pH-чувствительную лекарственную композицию по п.7,
причем клетки выбраны из дендритных клеток, NK-клеток (естественных киллеров), клеток Т-лимфоцитов, клеток В-лимфоцитов, клеток лимфоцитов.
| US 4158707 A, 19.06.1979 | |||
| US 4158707 A, 19.06.1979 | |||
| US 5759445 A, 02.06.1998 | |||
| US 5759519 A, 02.06.1998 | |||
| СПОСОБ НАПРАВЛЕННОЙ ДОСТАВКИ ДНК В ОПУХОЛЕВЫЕ И СТВОЛОВЫЕ КЛЕТКИ | 2008 |
|
RU2408607C2 |
Авторы
Даты
2019-03-18—Публикация
2013-05-24—Подача