Настоящее изобретение относится к областям иммунологии и вакцинологии. В частности, настоящее изобретение относится к улучшенным способам получения (обеспечения) виросом, композициям, содержащим указанные виросомы, и их применению. Вакцины против мембрансодержащих (оболочечных) вирусов в основном состоят из инактивированных или живых ослабленных вирусов, или препарата их белков (например, вакцины на основе расщепленных вирусов или препараты субъединиц). Вакцинация инактивированными вирусами и белковыми препаратами более безопасна, чем вакцинация реплицирующимися живыми ослабленными (аттенуированными) или рекомбинантными вирусами, поскольку такие вирусы могут мутировать или снова стать вирусом дикого типа. Вакцины на основе субъединиц вызывают меньше местных и системных побочных эффектов, а также обладают тем очевидным преимуществом, что они могут быть получены из рекомбинантных вирусных белков, экспрессируемых клетками, а не из вируса, что делает получение более безопасным и исключает риск заражения препаратов, представляющих собой вакцину, живыми вирусами. Однако, тогда как инъекция живых вирусов обычно индуцирует сильный клеточный и гуморальный иммунные ответы, которые в будущем защищают от инфекций вирусом, нереплицирующиеся вакцины, такие как белковые препараты, в частности препараты мембранных белков, могут не вызывать указанный эффект и индуцировать преимущественно гуморальный иммунный ответ. Инфицированные клетки могут презентировать молекулы вызывающего инфекцию патогена на молекулах МНС-1 на своей поверхности, инициируя клеточный иммунный ответ, такой как ответ цитотоксических Т-клеток. Многие белковые препараты, не продуцируемые в клетке, не будут презентированы иммунной системе таким способом. Живые или инактивированные вирусы будут также предпочтительно поглощаться специализированными фагоцитарными клетками иммунной системы, такими как дендритные клетки, и будут презентированы другим клеткам иммунной системы с запуском иммунных ответов. Данные фагоцитарные клетки циркулируют в организме, поглощая частицы размера вирусов, но они не эффективно поглощают очищенные белки, такие как белки расщепленных вирусных или субъединичных вакцин. Особой проблемой в случае мембранных белков является то, что они не растворимы в воде. Поэтому для успешной презентации антигенпрезентирующими клеткам данные белки нуждаются в некоторой форме солюбилизации, позволяющей их применять в составе вакцины.
Было предпринято множество попыток усиления иммунного ответа на субъединичные или белковые препараты физическими или химическими способами. Самое важный принцип, который следует из данных экспериментов, состоит в том, что необходимо комбинировать множественные копии вирусных белков в частицах, которые будут эффективно поглощаться фагоцитарными клетками. Данные частицы могут представлять собой виросомоподобные частицы, виросомы, иммуностимулирующие комплексы (ISCOM), смешанные мицеллы, протеасомные препараты или белки на носителях, представляющих собой микрочастицы. Зачастую данные частицы также содержат химические вещества (называемые адъювантами), предназначенные для стимуляции иммунной системы, которые направлены на специфические рецепторы на фагоцитах или эффекторных клетках иммунной системы.
Виросомы представляют собой наиболее полезный вид композиции вакцины. Виросомы представляют собой восстановленные мембраны оболочечных вирусов. Их, как правило, получают путем экстракции мембранных белков и липидов из оболочечных вирусов с применением детергента или короткоцепочечного фосфолипида с последующим удалением данного детергента или короткоцепочечного фосфолипида из экстрагированных липидов и вирусных мембранных белков, фактически с восстановлением или преобразованием характерных липидных бислоев (оболочек), которые окружают вирусное ядро или нуклеокапсиды (WO 2004/071492, Stegmann Т. et al., 1987, EMBO J. 6, 2651-2659). Однако виросомы могут быть собраны по существу из каждого интегрального мембранного белка или периферического мембранного белка, или белков, конъюгированных с липидными якорями. Основным признаком виросом является то, что они представляют собой частицы такого размера, который эффективно поглощается фагоцитарными клетками иммунной системы, и они точно имитируют состав, структуру поверхности и функциональную активность, в частности способность к слиянию с мембраной, нативной вирусной оболочки. К солюбилизированному материалу мембраны можно добавлять другие молекулы, такие как липиды, адъюванты или белок,. Затем мембрану преобразуют путем удаления детергента или короткоцепочечного фосфолипида с получением виросом. Во время преобразования мембраны добавленные молекулы будут включены в виросомы или интегрированы в мембраны виросом. Виросомы можно применять в качестве вакцин или для доставки молекул в клетки.
Вирус гриппа и вирус леса Семлики (Semliki Forest Virus, SFV) представляют собой два классических примера оболочечных вирусов. Оболочечные вирусы, как правило, содержат специфические мембранные белки («шипы»), которые необходимы для связывания с клетками и проникновения в них. Данные белки присутствуют на поверхности зрелых вирионов в метастабильной конформации, известной как «предшествующая слиянию форма». После связывания вируса с клетками первый этап инфицирования клеток данными вирусами представляет собой поглощение интактных вирусных частиц путем опосредуемого рецепторами эндоцитоза. Затем эндосомный компартмент приобретает слабокислую реакцию вследствие активности АТФ-зависимого протонного насоса, присутствующего в мембране эндосомы. Эти кислые условия (pH 5-6) запускают конформационные изменения вирусных белков-шипов (с конформации, «предшествующей слиянию», на конформацию «после слияния»), которое приводит к слиянию вирусной мембраны с мембраной эндосомы. В результате такого слияния вирусный нуклеокапсид и генетический материал (ДНК или РНК) проникают в цитоплазму, и в результате репликации генома образуется потомство вируса.
Было обнаружено, что виросомы, которые наиболее активно индуцируют иммунный ответ, сохраняли надлежащие функции белков оболочки нативного вируса, такие как слияние с мембраной, связывание рецептора и другие виды активности. Сохранение способности к связыванию рецептора и слиянию с мембраной, указывающее на то, что вирусные белки-шипы на виросомальной мембране находятся в предшествующей слиянию форме, необходимо для проявления полных иммуногенных свойств указанных виросом. В результате доставки в цитоплазму, обусловленной способностью виросом сливаться с мембраной, было продемонстрировано МНС-1-презентация эпитопов из белков виросом, приводящая к индукции защитной активности цитотоксических Т-клеток (Bungener et al. Vaccine 23 (2005) 1232-1241, Bungener et al., Antiviral Therapy: 111 (6): 717-727). Таким образом, виросомы, обладающие способностью сливаться с мембраной, подходят для применения в качестве вакцин, обладают профилем безопасности инактивированных вакцин и при этом обеспечивают иммунную систему стимулами, характерными для живых вакцин.
В данной области техники известно включение амфифильных адъювантов в мембрану виросом для дополнительного повышения способности составов в виде виросомальной вакцины стимулировать иммунный ответ после инъекции или интраназального применения виросом. См., например, WO 2004/110486, где вирус солюбилизируют детергентом или короткоцепочечным фосфолипидом с последующим удалением вирусного нуклеокапсида. Затем адъювант, растворенный в том же детергенте или короткоцепочечном фосфолипиде, добавляют к солюбилизированным вирусным мембранам с включением указанного адъюванта в виросомы. Затем детергент или короткоцепочечный фосфолипид удаляют, что приводит к получению виросом, которые содержат по меньшей мере белки и липиды вирусной мембраны, и адъюванты. В доклинических исследованиях было показано, что амфифильные адъюванты, включенные в мембрану виросомы, таким образом, стабильно интегрированы в мембрану (Stegmann, Т et al. Vaccine 2010; 28(34): 5543-50; WO 2004/110486) и усиливают или изменяют иммунный ответ после вакцинации данными виросомами (Kamphuis, Т. et al. Plos One 2012; 7(5):e36812).
Однако соотношение между концентрацией белка и адъюванта в мембране фиксируется при образовании мембраны виросомы, поскольку они оба присутствуют в одной мембране. Кроме того, несмотря на то, что адъювант включен в оба слоя мембранного бислоя, только адъювант, присутствующий в наружном слое, доступен для взаимодействия с рецептором, присутствующим на клетках иммунной системы.
Соотношение антиген/адъювант сильно влияет на иммунный ответ после вакцинации. Например, было обнаружено, что для виросом респираторно-синцитиального вируса (РСВ), содержащих адъювант монофосфориллипид А, пороговая концентрация указанного адъюванта была способна смещать иммунный ответ от преобладающего ответа Th2 к более сбалансированному ответу Th1/Th2 (Kamphuis, Т. et al. Plos One 2012; 7(5):e36812).
Для получения разрешения на продажу вакцин, содержащих адъювант (ср. "ЕМА guidelines on adjuvants in vaccines for human use": EMEA/CHMP/VEG/134716/2004), требуется демонстрация достаточной и согласованной связи антигена с адъювантом с последующей оценкой безопасности вакцины-кандидата в доклинических, а затем в клинических исследованиях. Результаты экспериментов на животных зачастую не полностью позволяют предсказать действие вакцины на человека. В частности, трудно определить оптимальное соотношение антиген/адъювант. Тогда как желаемой является низкая концентрация адъюванта для минимизации побочных эффектов, адъювант должен усиливать или изменять иммунный ответ желаемым образом, а при высоких концентрациях адъюванта возможны другие эффекты, такие как возникновение толерантности или повышенная реактогенность (т.е. свойство вакцины быть способной вызывать общие «ожидаемые» нежелательные реакции, особенно чрезмерные иммунные ответы и связанные с ними признаки и симптомы). Следовательно, оптимальное соотношение антиген/адъювант может быть определено только путем проб и ошибок. Более того, возможно, что для разных групп пациентов, таких как пожилые люди или младенцы, могут являться оптимальными различные соотношения. Для вакцин, получаемых с классическим адъювантом, таких как антиген, абсорбированный на квасцах, антиген получают в соответствии с GMP (лекарственное вещество А), выпускают для клинического исследования, а затем он может быть смешан с квасцами GMP-класса (лекарственное вещество В) с получением лекарственного средства у постели пациента, что позволяет легко тестировать различные соотношения адъювант/антиген. Однако данный подход неприменим для виросом с включенным амфифильным адъювантом, поскольку соотношение антигена и адъюванта уже фиксировано при восстановлении мембраны.
Таким образом, единственный способ тестирования различных соотношений адъювант/антиген с использованием доступных в настоящее время способов получения адъювантных виросом заключается в получении широкого спектра виросом с различными комбинациями антиген/адъювант (каждый препарат представляет собой лекарственное вещество), проведении требуемого доклинического тестирования безопасности и иммуногенности для каждого препарата, выпуске каждого препарата для клинического исследования и тестировании каждого из различных препаратов отдельно. Очевидно, что это увеличивает стоимость таких исследований в значительное количество раз.
Для преодоления этих проблем авторы настоящего изобретения стремились облегчить клиническое тестирование адъювантных виросом. В частности, они стремились минимизировать число препаратов, требующих проведения отдельного тестирования для определения доклинической безопасности, иммуногенности, высвобождения, клинического исследования и т.д. Другая цель заключалась в минимизации количества применяемого адъюванта при сохранении иммуногенности.
Было обнаружено, что по меньшей мере некоторые из этих целей можно достичь путем адаптации традиционного способа получения адъювантных виросом. В частности, новый способ включает предварительное формирование виросом, содержащих антиген без адъюванта, и добавление амфифильных адъювантов, растворенных в подходящем растворителе. Растворенный адъювант смешивают с водной композицией, содержащей предварительно сформированные виросомы, в результате чего растворитель для адъюванта смешивается с водой, и адъювант интегрируется в виросомальную мембрану. Таким образом, амфифильный адъювант включают в виросомальные мембраны после, а не во время формирования виросом. Данный «двухэтапный» способ согласно настоящему изобретению облегчает получение вакцин на основе виросом с различными соотношениями адъювант/антиген и формирование виросом с адъювантом, включенным только в наружный слой мембраны. Неожиданно оказалось, что несмотря на воздействие растворителя для адъюванта на (вирусные) белки, виросомы, полученные в соответствии с данным новым протоколом последовательного встраивания, демонстрировали способность к слиянию, схожую с традиционным способом включения.
Соответственно, в одном из вариантов реализации настоящего изобретения предложен способ получения адъювантных виросом, включающий этапы:
(i) обеспечения водной композиции безадъювантных виросом, содержащих белок слияния мембран;
(ii) растворения амфифильного адъюванта в фармацевтически приемлемом неводном растворителе, который может образовывать гомогенную смесь с водой, и
(iii) разведения указанного раствора адъюванта в указанной водной композиции виросом с индукцией встраивания адъюванта в наружный слой мембраны виросомы при сохранении способности виросом к слиянию с мембраной.
Настоящее изобретение обладает важными преимуществами в отношении доклинического и клинического тестирования вакцин, содержащих адъювантные виросомы. Таким образом, композиция предварительно сформированных виросом будет представлять собой «лекарственное вещество A», в то время как адъювант в растворителе представляет собой «лекарственное вещество B». Для лекарственного вещества A и B требуется только проведение тестирования безопасности и клинического тестирования. Объединение вещества A и B с получением лекарственных средств с различными соотношениями адъювант/антиген можно осуществлять непосредственно у постели пациента.
Более того, известно, что адъюванты вызывают различные побочные эффекты от боли в месте инъекции, до воспалений, паралича Белла (Lewis, D.JH. et al., PLoSOne 2009 4(9):e6999) и нарколепсии (О Flanagan D. et al. PLoSOne 2014, 19(17)pii20789). Следовательно, важное значение имеет включение самой низкой эффективной концентрации адъюванта. Путем интеграции адъюванта в виросомальную мембрану в ходе традиционного одноэтапного способа формирования мембраны виросомы, адъювант будет включен в оба слоя бислоя. Однако только половина адъюванта, присутствующая в наружном слое мембраны, может вступать в контакт с клетками иммунной системы, таким образом, концентрация, которая может вносить вклад в нежелательные побочные эффекты, в два раза выше эффективной концентрации. В отличие от этого, в способе согласно настоящему изобретению с применением предварительно сформированных виросомальных мембран адъювант встраивают только в наружный слой мембраны, так что он весь будет доступен для взаимодействия с иммунной системой. Это позволяет снизить эффективную концентрацию адъюванта в два раза по сравнению с традиционными виросомами с адъювантом в обоих слоях и таким образом потенциально ограничить побочные эффекты.
Последующее встраивание амфифильного адъюванта непосредственно в наружный слой виросомального бислоя не было описано или предложено в данной области техники. Например, тогда как в WO 2007/099387 указано, что иммуностимулирующее действие виросомоподобных везикул может быть дополнительно усилено путем связывания указанных везикул по меньшей мере с одним адъювантом, только в общем указано, что адъювант может быть инкапсулирован внутри и/или включен в липидный бислой, и/или свободно комбинирован с указанной везикулой. Нет никаких упоминаний или предложений по последующему встраиванию адъюванта в наружный слой бислоя.
В соответствии с первым аспектом настоящего изобретения предложен способ введения амфифильных адъювантов в мембрану предварительно сформированных виросом. В соответствии со вторым аспектом настоящего изобретения предложены виросомы с адъювантом, присутствующим только в наружном слое виросомальной мембраны.
Термин «виросома» относится к липосоме, содержащей белки вирусной оболочки, встроенные в липидную мембрану. Виросомы получают in vitro, и они не содержат белков вирусного ядра. Как правило, виросомы представляют собой сферические моноламеллярные везикулы со средним диаметром примерно 150 нм. В отличие от липосом, виросомы обычно содержат функциональные гликопротеины вирусной оболочки, такие как гемагглютинин (HA) вируса гриппа, нейраминидаза (NA) или матричный белок 2 (M2), интеркалированные в фосфолипидную двухслойную мембрану. Для получения данных виросом может быть сначала получена водная суспензия обычных виросом без адъюванта в соответствии со способами, известными в данной области техники. Протоколы получения хорошо известны специалисту в данной области техники. Подходящие протоколы для настоящего изобретения описаны, например, в WO 2004/045582 или EP 0538437. Согласно одному из вариантов реализации виросома может быть получена либо из виросомной везикулы как таковой, либо из везикулы, полученной в результате слияния виросомной везикулы с липосомной везикулой.
Получение виросомных везикул можно осуществлять любым способом, известным специалисту в данной области техники, таким как описан Bron et al., Methods Enzymol. 220: 313-331 (1993). В одном из вариантов реализации, этап получения виросом включает функциональное восстановление оболочечного вируса, предпочтительно вируса, выбранного из группы, состоящей из Retroviridae; rubellavirus; paramyxoviridae; Flaviviridae; Herpesviridae; Bunyaviridae; Arenaviridae; Hantaviridae; Baculoviridae; Coronaviridae; Papovaviridae; Rhabdoviridae; Alphaviridae, Arteriviridae, Filoviridae и Poxviridae. Как правило, функциональное восстановление оболочечного вируса с получением виросом включает приведение оболочечного вируса в контакт с раствором, содержащим короткоцепочечный фосфолипид или детергент, обеспечивающее солюбилизацию вирусной оболочки указанного вируса, также включает удаление короткоцепочечного фосфолипида или детергента из указанного раствора, обеспечивающее образование функционально восстановленной вирусной оболочки. Предпочтительно, указанный фосфолипид или детергент удаляют путем диализа, фильтрации или абсорбции на гидрофобных гранулах. Предпочтительные гидрофобные гранулы включают гранулы, которые состоят из полистирол-дивинилбензола. Подходящие липиды для получения виросом представляют собой короткоцепочечный фосфолипид с критической концентрацией мицеллообразования (cmc) более 0,1 мМ, предпочтительно более 0,3 мМ, более предпочтительно более 1 мМ. Например, очень хорошие результаты получают, когда фосфолипид представляет собой фосфатидилхолин, предпочтительно 1,2-дигептаноил-sn-фосфатидилхолин или 1,2-дикапроил-sn-фосфатидилхолин. См. также WO 2004/071492. Подходящие детергенты также известны в данной области техники. Предпочтительно, детергент представляет собой неионный детергент, такой как октаэтиленгликоля моно-(n-додециловый)эфир.
В конкретном варианте реализации настоящего изобретения, виросома может быть восстановлена из исходных липидов вирусной мембраны и гликопротеинов шипов после солюбилизации, например, интактного вируса гриппа, октаэтиленгликоля моно-(n-додециловым)эфиром (С12Е8), седиментации нуклеокапсида (вирусные гликопротеины и липиды останутся в надосадочной жидкости) и удаления детергента в надосадочной жидкости с помощью гидрофобной смолы (Bio-Beads SM2) (Stegmann et al., Traffic 1: 598-604, 1987). Получение виросом, содержащих НА разных штаммов вирусов, можно осуществлять с равными количествами белков данных вирусов, солюбилизированных неионогенным детергентом - октаэтиленгликоля монододециловым эфиром.
После удаления детергента с помощью Bio-Beads SM2 могут быть получены виросомы, содержащие различные типы белков слияния. В соответствии с одним из вариантов реализации виросомоподобная везикула согласно настоящему изобретению может быть получена в результате слияния виросомной везикулы с липосомной везикулой.
Следовательно, в соответствии с одним из вариантов реализации настоящего изобретения, виросомоподобная везикула согласно настоящему изобретению может содержать виросомальные и липосомальные липиды.
Виросомальная мембрана предпочтительно содержит: (а) липидный бислой; (b) мембранный белок; и (с) возможно дополнительные антигены. Предпочтительно, указанный мембранный белок представляет собой белок слияния вирусной мембраны. Предпочтительно, липидный бислой содержит композицию липидов, совместимую со слиянием, индуцируемым белком слияния, вирусной мембраны с клеткой-хозяином природного хозяина вируса. Предпочтительно, композиция липидов совместима со слиянием при оптимальном для слияния значении pH. Для получения виросом в способе, предложенном согласно настоящему изобретению, возможно применение любого из различных оболочечных вирусов, таких как Retroviridae, например, вируса иммунодефицита человека (ВИЧ); rubellavirus; paramyxoviridae, например, вирусов парагриппа, кори, эпидемического паротита, респираторно-синцитиального вируса, метапневмовируса человека; Flaviviridae, например, вируса желтой лихорадки, вируса денге, вируса гепатита C (HCV), вируса японского энцефалита (JEV), клещевого энцефалита, энцефалита Сент-Луис или вируса Западного Нила; Herpesviridae, например, вируса простого герпеса, цитомегаловируса, вируса Эпштейна-Барра; Bunyaviridae; Arenaviridae; Hantaviridae, например, вируса Хантаан; Coronaviridae; Papovaviridae, например, вируса папилломы человека; Rhabdoviridae, например, вируса бешенства; Coronaviridae, например, коронавируса человека; Alphaviridae, Arteriviridae, filoviridae, например, вируса Эбола, Arenaviridae, poxviridae, например, вируса натуральной оспы или вируса африканской лихорадки свиней.
В настоящем описании термин «белок слияния вируса» означает интегральный мембранный белок вируса, обычно оболочечного вируса, который при экспрессии на поверхности подходящей клетки может индуцировать слияние указанной клетки при соответствующем pH с клетками, которые являются природными хозяевами указанного вируса. Примеры вирусных белков слияния для включения в восстановленную вирусную мембрану включают белок E1 вируса леса Семлики, белок гемагглютинин (НА) вируса гриппа, белки gp120/gp41 ВИЧ, F-белки парамиксовирусов. Также включены (генетически модифицированные) варианты белка слияния, которые могут опосредовать слияние с целевой клеткой. Можно выделить два типа слияния, индуцируемого вирусными белками слияния. Первый тип слияния, например, индуцируемый белками gp120/gp41 ВИЧ или F-белками парамиксовируса, происходит при нейтральном pH, обычно на поверхности целевой клетки-хозяина. Второй тип слияния, например, индуцируемый белком гемагглютинином (HA) вируса гриппа, происходит после интернализации при более низком pH (5,0-6,5) из эндосомального компартмента клетки-хозяина. Настоявшее изобретение специально включает оба типа слияния.
Способность виросом согласно настоящему изобретению к слиянию с клеткой-хозяином, таким образом, зависит от присутствия соответствующего вирусного белка слияния. Однако данная способность также зависит от композиции липидов в бислое восстановленной вирусной мембраны, поскольку в данной области техники описаны виросомы, состоящие из определенных синтетических липидов и вирусных белков слияния, которые не способны к слиянию. Таким образом, композицию липидов виросом предпочтительно выбирают таким образом, чтобы мембраны были способны к слиянию с соответствующими клетками-хозяевами при соответствующем pH. Одна из предпочтительных композиций липидов, обеспечивающих виросомы способностью к слиянию, представляет собой композицию липидов, содержащую природные липиды вируса. В настоящем описании термин «природные липиды вируса» означает те липиды, которые присутствуют в мембране вируса, выращенного на клетках, предпочтительно клетках млекопитающего, насекомого или растения, или выращенного на яйцах с развивающимся эмбрионом. Таким образом, природные липиды вируса предпочтительно получают или выделяют из вирусных частиц, выращенных таким образом, в отличие от синтетических липидов.
Однако функционально восстановленные вирусные мембраны согласно настоящему изобретению в дополнение к вирусным липидам могут содержать очищенные липиды из других источников, например, очищенные или синтетические липиды. Указанные другие липиды могут быть добавлены в виросомальные мембраны во время получения. Как правило, оптимальную активность виросом по слиянию поддерживают, когда добавляют липиды, схожие с липидами вирусного происхождения, или смеси липидов, которые очень схожи с композицией липидов вирусной оболочки. Таким образом, в соответствии с настоящим изобретением в указанную виросомальную мембрану может быть включен широкий спектр липидов. Группа липидов включает нейтральные и заряженные фосфолипиды, полученные из стероидов липиды, нейтральные и заряженные синтетические липиды. Таким образом, композиция липидов для получения виросом с активностью слияния предпочтительно представляет собой композицию, которую получают или которую можно получить из природных вирусных мембран. Таким образом, композиции липидов для применения в настоящем изобретении включают композиции, состоящие исключительно из природных липидов вируса, композиции, состоящие из природных липидов вируса с добавлением липидов из других источников, а также композиции, состоящие из липидов из различных источников, которые имитируют композицию липидов природной вирусной мембраны.
Данные липиды могут включать холестерин и фосфолипиды, такие как фосфатидилхолин (ФХ), сфингомиелин (СМ), фосфатидилэтаноламин (ФЭ) и фосфатидилсерин (ФС). Однако могут быть также добавлены другие фосфолипиды. Они включают, но не ограничиваются ими, фосфатидилглицерин (ФГ), фосфатидную кислоту (ФК), кардиолипин (КЛ) и фосфатидилинозит (ФИ) с различными композициями остатков жирных кислот и природного и/или (полу)синтетического происхождения, и дицетилфосфат. Также могут быть добавлены церамид и различные гликолипиды, такие как цереброзиды или ганглиозиды.
Виросома согласно настоящему изобретению предпочтительно содержит липиды, выбранные из группы, состоящей из катионных липидов, синтетических липидов, гликолипидов, фосфолипидов, стеролов и их производных. Фосфолипиды предпочтительно включают фосфатидилхолин, сфингомиелин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерин, фосфатидную кислоту, кардиолипин и фосфатидилинозит с различными композициями остатков жирных кислот. Катионные липиды предпочтительно выбраны из группы, состоящей из N-[(1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония хлорида (DOTMA), N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония хлорида (DOTAP), N,N-диолеил-N,N,-диметиламмония хлорида) (DODAC), дидодецилдиметиламмония бромида (DDAB), холестерил-N-(триметиламмониоэтил)карбаматхлорида (TC-Chol), холестерил-N-(диметиламмониоэтил)карбаматхлорида (DC-Chol) или других катионных производных холестерина и стеариламина или других алифатических аминов, дипальмитоилфосфатидилэтаноламинов (DPPE), диолеоилглицеросукцината (DOGS), 2,3-диолеоилокси-N-[2(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанаминия трифторацетата (DOSPA), 1,3-диолеоилокси-2-(6-карбоксиспермил)пропиламида (DOSPER), N,N,N',N'-тетраметил-N,N'-бис(2-гидроксиэтил)-2,3-диолеоилокси-1,4-бутандиаммония иодида (THDOB), диолеоил-sn-глицерофосфата (DOPA), диоктилтерефталата (DOTP), диолеоилсукцинилглицерина (DOSC), диолеоил-е-(4'-триметиламмонио)-бутаноил-sn-глицерина (DOTB), диолеоил-sn-глицерофосфатидилхолина (DOPC), диолеоил-sn-глицерофосфатидилэтаноламина (DOPE) и т.п. Наиболее предпочтительный катионный липид выбран из катионных производных холестерина, таких как TC-Chol (холестерил-N-(триметиламмониоэтил)карбамат) или DC-Chol (холестерил-N-(диметиламмониоэтил)карбамат). Они могут быть представлены в виде малых моноламеллярных липосом в смеси с ФХ (фосфатидилхолином). Виросомы согласно настоящему изобретению могут предпочтительно содержать полученный из яиц ФХ и, более предпочтительно, DOPC (диолеоил-sn-глицерофосфатидилхолин), DOPE (диолеоил-sn-глицерофосфатидилэтаноламин). Примеры производных холестерина или стерола, которые могут быть включены в виросомы согласно настоящему изобретению, включают: холестерина гемисукцинат, фитостеролы, такие как ланостерол, эргостерол, и витамин D и родственные витамину D соединения.
Для введения адъюванта в наружный слой предварительно сформированных не содержащих адъювант виросом, указанный адъювант растворяют в неводном растворителе, который может быть смешан с водой. Затем раствор добавляют к водной суспензии виросом без адъюванта. Разведение растворителя делает адъювант нерастворимым и осуществляется спонтанная интеграция в виросомальную мембрану.
Специалист сможет выбрать фармацевтически приемлемый неводный растворитель, способный образовывать гомогенную смесь с водой, которая может быть описана как раствор только одной фазы. Например, его выбирают из группы растворителей, известных в данной области техники как «остаточные растворители в фармацевтических препаратах». Их определяют как органические летучие химические вещества, которые применяют или получают для изготовления лекарственных веществ или вспомогательных веществ, или для получения лекарственных средств. Выражение «способный образовывать гомогенную смесь с водой» означает, что в конкретных используемых условиях растворитель для адъюванта смешивается с водной фазой композиции виросом в степени, достаточной для обеспечения контакта адъюванта, растворенного в нем, с виросомами, и индуцирования встраивания адъюванта в наружный слой виросомальной мембраны. Подходящие растворители эффективно растворяют адъювант и смешиваются с водой. Предпочтительно, они не повреждают виросомы, особенно присутствующие в них белки слияния мембран. Более предпочтительно, растворители являются фармацевтически приемлемыми и нетоксичными. Предпочтительные растворители представляют собой азеотропные растворители, спирты и сложные эфиры.
Объем растворенного адъюванта, как правило, мал по сравнению с объемом водной композиции виросом, в которой его разводят. Например, раствор адъюванта разводят по меньшей мере 5-кратно, предпочтительно по меньшей мере 10-кратно, более предпочтительно по меньшей мере 20-кратно.
Следовательно, растворимость растворителя для адъюванта в воде может быть относительно низкой. В одном из вариантов реализации настоящего изобретения, неводный растворитель для адъюванта демонстрирует растворимость в воде, составляющую по меньшей мере 5 г/100 мл при 20°C. Предпочтительно, растворимость в воде при 20°C составляет по меньшей мере 10 г/100 мл, более предпочтительно по меньшей мере 20 г/100 мл. В предпочтительном варианте реализации растворитель для адъюванта представляет собой смешивающийся с водой растворитель, т.е. растворитель, который смешивается с водой во всех пропорциях с образованием гомогенного раствора.
В одном из вариантов реализации растворитель для адъюванта выбран из группы, состоящей из ацетонитрила, 2-бутанола, метилацетата, этилацетата, уксусной кислоты, муравьиной кислоты, метанола, этанола, ДМСО, ДМФА, н-пропанола, изопропанола, 2-метил-1-пропанола и ТГФ или любой смеси указанных веществ. Для обеспечения сохранения фузогенной активности (активности слияния) виросом выбранный растворитель для адъюванта должен сохранять по меньшей мере частично функцию белков слияния мембран. Чувствительность белка слияния к неблагоприятным воздействиям растворителя будет зависеть от конкретного типа белков слияния. В общем, белки слияния, которые индуцируют слияние при низком pH, не очень чувствительны к растворителям, таким как ДМСО или ДМФА, но очень чувствительны к кислым растворителям, тогда как белки слияния, которые функционируют при нейтральном pH, такие как F-белок парамиксовируса, гораздо менее чувствительны к pH растворителей. Специалист в данной области техники сможет исследовать и оценить влияние конкретного неводного растворителя на белок слияния с применением способов, известных в данной области техники. Например, может быть проведен скрининг ряда потенциальных растворителей на предмет влияния на фузогенную активность конкретного препарата виросом в анализах слияния в бесклеточной системе с использованием липосомальных мишеней. Слияние можно контролировать путем измерений слияния in vitro, например, методом резонансного переноса энергии флуоресценции (FRET) (Struck et al. (1981) Biochemistry 20:4093). Хорошие результаты могут быть получены, когда растворитель для адъюванта представляет собой ДМСО, этанол или ДМФА.
В настоящем описании термин «адъювант» относится к любому веществу, которое при инъекции совместно с одним или более антигенами неспецифически усиливает иммунный ответ на данный антиген (антигены). В зависимости от природы адъюванта он может способствовать клеточноопосредованному иммунному ответу, гуморальному иммунному ответу или смеси указанных двух ответов. Поскольку усиление иммунного ответа является неспецифическим, в данной области понятно, что один и тот же адъювант можно применять совместно с различными антигенами для стимуляции ответов на различные мишени, например, с антигеном М. tuberculosis для стимуляции иммунитета к М. tuberculosis или с антигеном, полученным из опухоли, для стимуляции иммунитета к опухолям данного конкретного вида. Согласно настоящему изобретению адъюванты включают любое вещество или соединение, которое при применении в комбинации с антигеном для иммунизации человека или животного, стимулирует иммунную систему, тем самым влияя, вызывая, усиливая или облегчая иммунный ответ на указанный антиген, предпочтительно без вызова специфического иммунного ответа на сам адъювант. Термин «амфифильный адъювант» включает любой адъювант, в том числе соединения, подобные липопептидам, монофосфориллипиду А и его производным и аналогам, и гликолипидам, содержащие гидрофобные встраиваемые в мембрану и ориентированные в окружающую среду полярные (головная группа) группы, и которые могут связываться с или более предпочтительно интегрироваться в везикулы липидного бислоя или мицеллы в воде. Предпочтительно, белок слияния, амфифильный адъювант и предпочтительно также возможный дополнительный антиген взаимодействуют с гидрофобной внутренней частью липидного бислоя, т.е. связаны, интегрированы и/или встроены в бислой вирусной мембраны за счет гидрофобных взаимодействий с липидами бислоя и/или друг с другом.
Виросомальные мембраны согласно настоящему изобретению предпочтительно представляют собой функциональные виросомы, содержащие липиды, амфифильный адъювант, вирусный белок слияния и один или более антигенов, при этом указанный амфифильный адъювант, липиды, вирусные белки слияния и антигены взаимодействуют главным образом через гидрофобные взаимодействия, при этом гидрофобная часть амфифильного адъюванта предпочтительно образует составную часть двухслойной липидной мембраны, при этом указанный бислой дополнительно содержит белок слияния, антиген (антигены) и липиды. Термин «функциональное восстановление» означает, что восстановленная мембрана обладает способностью к слиянию с мембраной. Предпочтительная восстановленная вирусная мембрана имеет форму везикулы.
Данный термин также охватывает любой амфифильный адъювант, стабильно включенный в липидные бислой (содержащие природные липиды вируса), при этом его гидрофобная группа контактирует с внутренней гидрофобной областью двухслойной мембраны, и его полярная головная группа ориентирована во внешнюю полярную поверхность мембраны. Однако настоящее изобретение, в частности, не исключает более гидрофобные адъюванты, обладающие менее выраженной амфифильностью, т.е. не содержащие или содержащие только слабо полярные головные группы, но которые могут связываться с везикулами липидного бислоя или интегрироваться в них.
Согласно настоящему изобретению адъюванты включают любое вещество или соединение, которое при применении в комбинации с антигеном для иммунизации человека или животного, стимулирует иммунную систему, тем самым вызывая, усиливая или облегчая иммунный ответ на указанный антиген, предпочтительно без вызова специфического иммунного ответа на сам адъювант. Предпочтительные адъюванты смещают иммунный ответ от ответа Th2-типа к ответу Th1-типа. Другие предпочтительные адъюванты усиливают иммунный ответ на конкретный антиген по меньшей мере в 1,5, 2, 2,5, 5, 10 или 20 раз по сравнению с иммунным ответом, вырабатываемым на указанный антиген в тех же условиях, но в отсутствии адъюванта. Другие предпочтительные адъюванты увеличивают продолжительность иммунного ответа. В данной области техники доступны тесты для определения статистического среднего значения усиления иммунного ответа на конкретный антиген, обеспечиваемого адъювантом, в группе животных или людей по сравнению с соответствующей контрольной группой. Предпочтительно, адъювант способен влиять на иммунный ответ или усиливать иммунный ответ по меньшей мере на два различных антигена. Адъюванты для включения в функциональные виросомы согласно настоящему изобретению предпочтительно представляют собой амфифильные адъюванты.
В предпочтительном варианте реализации настоящего изобретения, амфифильный адъювант, присутствующий в виросоме, является фармацевтически приемлемым для применения у людей. Амфифильные адъюванты согласно настоящему изобретению предпочтительно нековалентным образом связаны с антигенами, но вместе присутствуют в липидном бислое восстановленной мембраны. Отсутствие ковалентной связи антигена и адъюванта обеспечивает процессинг антигена и представление его эпитопов иммунной системе, которое по существу идентично таковому у природного белка одного, что обеспечивает хорошее узнавание белка, присутствующего на природном патогене. С другой стороны, гидрофобное взаимодействие антигена и адъюванта с липидным бислоем (и друг с другом) обеспечивает распределение адъюванта и антигена в виросомах в препарате, благодаря чему большинство мембранных везикул в препарате содержат как антиген, так и адъювант в одной везикуле, более предпочтительно по меньшей мере 60, 70, 80, 90 или 95% везикул содержат как антиген, так и адъювант. Комбинация антигена и адъюванта в одной мембране или везикуле обеспечивает доставку антигена в антигенпрезентирующую клетку, активируемую адъювантом, что тем самым повышает терапевтическую и/или профилактическую эффективность виросом.
В предпочтительном варианте реализации настоящего изобретения указанный амфифильный адъювант узнается Toll-подобным рецептором (TLR), присутствующим на антигенпрезентирующих клетках. В качестве альтернативы, амфифильные адъюванты могут быть направлены на другие рецепторы. В данной области техники известны различные соединения, узнаваемые TLR, и они включают, например, липопептиды, монофосфориллипид A и производные или синтетические или полусинтетические аналоги монофосфориллипида A, липополисахариды, пептидогликаны, липотейхоевые кислоты, липопротеины (из микоплазмы, микобактерий или спирохет), двухцепочечную РНК (поли I:C), неметилированную ДНК, липоарабиноманнан, флагеллин, CpG-содержащую ДНК и имидазохинолины. Такие TLR-узнаваемые адъюванты сами по себе могут представлять собой амфифильные адъюванты или, в качестве альтернативы, они могут быть модифицированы с получением амфифильного адъюванта, например, путем конъюгации гидрофобных соединений (см. ниже) с полярным лигандом TLR. Предпочтительные амфифильные адъюванты включают монофосфориллипид A и его производные, и липопептид.
В одном из вариантов реализации виросома согласно настоящему изобретению характеризуется присутствием синтетического адъюванта, выбранного из фосфорилированного гексаацилдисахарида (PHAD) и его 3-O-дезацильного производного, 3-D-PHAD. Оба известны в данной области техники как синтетические агонисты TLR-4. PHAD также называется в данной области техники гликопиранозид-липидом A или GLA. См. Lousada-Dietrich et al.,, Vaccine. 2011 Apr 12; 29(17):3284-92. В одном из вариантов реализации виросома содержит PHAD, имеющий следующую структуру (обозначения 14 показывают общее число атомов углерода в каждой ацильной цепи):

В другом предпочтительном варианте реализации виросома содержит 3-D-PHAD, имеющий следующую структуру:
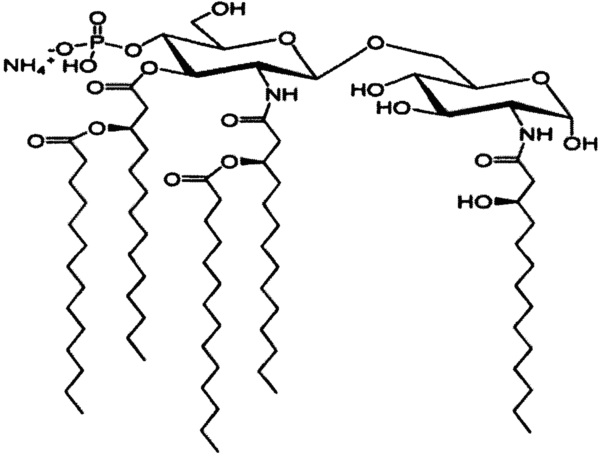
В другом варианте реализации настоящего изобретения, указанный амфифильный адъювант представляет собой гликолипид. Предпочтительный гликолипид для применения в качестве амфифильного адъюванта обладает активностью адъюванта и является фармацевтически приемлемым для применения у людей. Гликолипиды представляют собой липиды (или другие гидрофобные соединения), ковалентно связанные с одним или более сахарами. Типичные адъюванты, представляющие собой гликолипиды, включают α-галактозилцерамид, фосфатидилинозитолманнозид, производные эндотоксичных липополисахаридов и производные указанных соединений. В наиболее предпочтительном варианте реализации настоящего изобретения предложены виросомы согласно настоящему изобретению, в которых гликолипид представляет собой α-галактозилцерамид или фосфатидилинозитолманнозид. Термины «α-галактозилцерамид» и «фосфатидилинозитолманнозид» включают любое производное обоих этих соединений. Производные данных молекул, которые обладают активностью адъюванта и подходят согласно настоящему изобретению, например, описаны в US 5936076 и в US 4542212 соответственно. Другие подходящие адъюванты, представляющие собой гликолипиды, для применения в настоящем изобретении включают модифицированные формы эндотоксичных липополисахаридов (LPS) грамотрицательных бактерий, демонстрирующие пониженную токсичность липид A-части LPS, но сохраняющие (частично) активность адъюванта, которые могут быть получены из генетически модифицированных грамотрицательных патогенов и которые описаны в WO 02/09746.
Модифицированный LPS для применения в качестве амфифильного адъюванта в настоящем изобретении предпочтительно содержит модифицированную липид A-группу с пониженной токсичностью. Токсичность модифицированного LPS предпочтительно ниже токсичности соответствующего LPS дикого типа, более предпочтительно токсичность модифицированного LPS ниже 90, 80, 60, 40, 20, 10, 5, 2, 1, 0,5 или 0,2% токсичности LPS дикого типа. Токсичность LPS дикого типа и различных модифицированных LPS с пониженной токсичностью может быть определена в любом подходящем анализе, известном в данной области техники. С другой стороны, модифицированный LPS с пониженной токсичностью должен по-прежнему обладать достаточной иммуностимулирующей активностью, т.е. активностью адъюванта. Модифицированный LPS с пониженной токсичностью предпочтительно демонстрирует по меньшей мере 10, 20, 40, 80, 90 или 100% иммуностимулирующей активности соответствующего LPS дикого типа. Иммуностимулирующая активность может быть определена in vivo у лабораторных животных, как описано выше, или in vitro, например, путем определения созревания дендритных клеток, стимулируемых путем инкубации совместно с тестируемым LPS, путем измерения выработки по меньшей мере одного цитокина (например, одного из IL-12, IL-10, TNF-альфа, IL-6 и IL-1-бета) LPS-стимулируемыми дендритными клетками, или путем измерения экспрессии по меньшей мере одной костимулирующей молекулы (например, CD40 или CD86) на LPS-стимулируемых дендритных клетках.
В соответствии с другим аспектом настоящего изобретения амфифильный адъювант, присутствующий в виросоме согласно настоящему изобретению, представляет собой пептид, предпочтительно амфифильный пептид. Предпочтительный пептид для применения в качестве амфифильного адъюванта обладает активностью адъюванта и является фармацевтически приемлемым для применения у людей. Пептиды, в частности полярные пептиды, с активностью адъюванта могут быть превращены в амфифильные адъюванты путем (ковалентного) связывания их с подходящим гидрофобным соединением (см. выше). В качестве альтернативы, амфифильные пептиды могут содержать гидрофобный участок аминокислот, такой как трансмембранная последовательность, описанная ниже. Предпочтительный пептид содержит последовательность Jagged-1-лиганда Notch (см. Weijzen et al., 2002; номер доступа Genbank AAC 52020) или последовательность белка A Staphylococcus aureus. Пептиды, содержащие последовательности Jagged-1 или белка A, предпочтительно ковалентно связаны с подходящим гидрофобным соединением (см. выше) и/или содержат трансмембранную последовательность (см. ниже). (Полярная) часть пептидов, полученных из Jagged-1 или белка A, которая выступает из липидного бислоя, предпочтительно содержит не более 3, 4, 5, 6, 7 или 8 аминокислот.
Виросомы согласно настоящему изобретению содержат белок слияния и возможно дополнительные антигены. Таким образом, следует понимать, что виросомы, содержащие только вирусный белок слияния и не содержащие дополнительных антигенов, являются частью настоящего изобретения, и в этом случае указанный вирусный белок слияния также обладает функцией антигена в дополнение к своей функции белка слияния. С другой стороны, виросомы могут таким образом содержать один или более дополнительных антигенов в дополнение к вирусному белку слияния. Соответственно, в одном из вариантов реализации виросома содержит по меньшей мере один дополнительный антиген, предпочтительно опухолевый антиген или антиген, происходящий из вируса, паразита, гриба или бактерии.
Антигены, которые являются частью восстановленной вирусной мембраны согласно настоящему изобретению, предпочтительно содержат гидрофобную часть, которая способна встраиваться в двухслойную липидную мембрану восстановленной вирусной мембранной везикулы. Многие патогены, такие как вирусы, бактерии, дрожжи и паразиты, содержат в капсиде, клеточной стенке или мембране белки, которые вызывают иммунный ответ у хозяина. Примерами антигенов, содержащих гидрофобные элементы, такие как, например, трансмембранные сегменты, и подходящих для применения в качестве части восстановленной вирусной мембраны согласно настоящему изобретению, являются белки, присутствующие в мембране (также называемой оболочкой в случае вирусов) патогена. Следовательно, предпочтительно антиген, присутствующий в восстановленной вирусной мембране согласно настоящему изобретению, представляет собой интегральный мембранный белок. Антигенные белки в виросомах согласно настоящему изобретению ориентированы так же как и на вирусной или клеточной мембране, но могут представлять эпитопы, которые обычно частично или по меньшей мере временно скрыты, когда присутствуют в липидном бислое мембраны. Стимуляция иммунной системы данными антигенпрезентирующими виросомами может быть обусловлена комбинацией их специфичного узнавания клетками иммунной системы, их конкретными свойствами, презентацией белка и раскрытием скрытых эпитопов. Предпочтительно, антигенные белки, применяемые в виросомах согласно настоящему изобретению, содержат один или более протективных эпитопов, т.е. эпитопов, способных вызывать иммунный ответ у млекопитающего, который обеспечивает защиту от инфицирования патогеном, из которого получен антиген, или который обеспечивает защиту от опухоли, экспрессирующей антиген.
В предпочтительных вариантах реализации указанные антигены получают из вируса, паразита, гриба или бактерии. Антигены, которые можно применять для образования виросом согласно настоящему изобретению, могут быть получены из всех видов вирусов, не ограничивающими примерами таких вирусов являются: Retroviridae, например, вирус иммунодефицита человека (ВИЧ); rubellavirus; paramyxoviridae, например, вирусы парагриппа, корь, эпидемический паротит, респираторно-синцитиальный вирус (РСВ), метапневмовирус человека; flaviviridae, например, вирус желтой лихорадки, вирус денге, вирус гепатита C (HCV), вирус японского энцефалита (JEV), клещевой энцефалит, энцефалит Сент-Луис или вирус Западного Нила; Herpesviridae, например, вирус простого герпеса, цитомегаловирус, вирус Эпштейна-Барр; Bunyaviridae; Arenaviridae; Hantaviridae, например, вирус Хантаан; Coronaviridae; Papovaviridae, например, вирус папилломы человека; Rhabdoviridae, например, вирус бешенства; Coronaviridae, например, коронавирус человека; Alphaviridae, Arteriviridae, filoviridae, например, вирус Эбола, Arenaviridae, poxviridae, например, вирус натуральной оспы и вирус африканской лихорадки свиней. Особенно предпочтительными являются виросомы, в которых указанный антиген получен из вируса гриппа или РСВ. Белки вируса гриппа, которые можно применять в виросомах согласно настоящему изобретению, предпочтительно представляют собой белок гемагглютинин (НА), белок нейраминидазу (NA) и/или белок М2 отдельно или в комбинации. Белки РСВ, которые можно применять в виросомах согласно настоящему изобретению, представляют собой белок слияния (F), гликопротеин (G) и/или матричный (М) белок.
Такие антигены также могут быть получены из патогенных бактерий, грибов (включая дрожжи) или паразитов. Такие антигены включают бактериальные антигены, например, Helicobacter, например, Н. pylori; Neisseria, например, N. mengitidis; Haemophilus, например, Н. Influenza, Bordetella, например, В. pertussis, Chlamydia, Streptococcus, например, Streptococcus sp. серотип A; Vibrio, например, V. cholera; грамотрицательные кишечные патогены, включая, например, Salmonella, Shigella, Campylobacter и Escherichia, а также антиген бактерий, вызывающих сибирскую язву, проказу, туберкулез, дифтерию, болезнь Лайма, сифилис, брюшной тиф и гонорею. Антигены паразитов, например, включают антигены простейших, таких как Babeosis bovis, Plasmodium, Leishmania spp. Toxoplasma gondii и Trypanosoma, например, T. cruzi. Грибковые антигены могут включать антигены грибов, таких как Aspergillus sp., Candida albicans, Cryptococcus, например, С. neoformans и Histoplasma capsulatum.
Хотя вакцинацию, как правило, применяют для профилактической защиты от патогенов или для лечения заболеваний, вызванных патогенной инфекцией, специалисту в данной области техники известно применение вакцин для лечения опухолей. Более того, обнаруживают все большее количество опухолеспецифических белков, которые являются подходящими объектами, на которые можно прицельно воздействовать антителами человека или гуманизированными антителами. Такие опухолеспецифические белки также включены в объем настоящего изобретения. В данной области техники известно множество опухолеспецифических антигенов. Таким образом, в одном из предпочтительных вариантов реализации настоящего изобретения предложены виросомы, содержащие опухолеспецифический антиген. Подходящие опухолевые антигены включают, например, карциноэмбриональный антиген, простат-специфический мембранный антиген, укороченный рецептор эпидермального фактора роста (EGRF), антиген Томсена-Фриденрайха (Т), ганглиозиды GM-2 и GD-2, Ер-САМ, муцин-1, эпителиальный гликопротеин-2 и специфический антиген рака толстой кишки.
Предпочтительными антигенами данных патогенов являются интегральные мембранные белки. Однако немембранные белковые антигены или их части, содержащие протективные эпитопы, могут быть также модифицированы для применения в настоящем изобретении путем слияния их с трансмембранной последовательностью. Следовательно, в одном из вариантов реализации настоящего изобретения антиген представляет собой интегральный мембранный белок или антиген, присоединенный к группе, обеспечивающей заякоривание в мембране. Например, антиген может быть присоединен к трансмембранному домену или аминокислотной последовательности, обеспечивающей заякоривание в мембране. Трансмембранные последовательности или последовательности, обеспечивающие заякоривание в мембране, хорошо известны в данной области техники и основаны на генетической геометрии трансмембранных молекул млекопитающего. Трансмембранная последовательность, как правило, состоит из участка из примерно 10-30, обычно примерно 20 аминокислот, большинство из которых содержат гидрофобные боковые цепи. Трансмембранные последовательности известны для широкого спектра белков и можно применять любые из них. Примеры последовательностей, обеспечивающих заякоривание в мембране, для применения в настоящем изобретении включают, например, последовательности, полученные из CD8, ICAM-2, IL-8R, CD4 и LFA-1. Предпочтительно, трансмембранную последовательность получают из вирусного интегрального мембранного белка, который естественным образом присутствует в вирусной мембране. Примеры такой последовательности включают трансмембранную область гликопротеина G респираторно-синцитиального вируса (РСВ) человека (например, аминокислоты с 38 по 63) или трансмембранную область нейраминидазы вируса гриппа (например, аминокислоты с 7 по 27). Гидрофобные взаимодействия обусловлены нековалентными неэлектростатическими силами притяжения между гидрофобными веществами, присутствующими в водной среде. В одном из вариантов реализации группа, обеспечивающая заякоривание в мембране, представляет собой липидную группу, предпочтительно фосфолипид или ацильную цепь. Соответственно, дополнительные предпочтительные антигены представляют собой растворимые белки или пептиды, ковалентно связанные с гидрофобными веществами, такими как фосфолипиды или ацильные цепи, обеспечивающими их включение в виросомальную мембрану.
В соответствии с настоящим изобретением также предложена адъювантная виросома, получаемая новым способом «последующего встраивания» согласно настоящему изобретению. Такая адъювантная виросома среди прочего характеризуется тем, что адъювант представляет собой амфифильный адъювант, который по существу локализован в наружном слое виросомальной мембраны. Предпочтительно, адъювантная виросома содержит один или более амфифильных адъювантов, описанных выше в настоящем документе. Наиболее предпочтительные виросомы представляют собой те, которые получены из оболочечного вируса, предпочтительно вируса, выбранного из группы, состоящей из Retroviridae; rubellavirus; paramyxoviridae; Flaviviridae; Herpesviridae; Bunyaviridae; Arenaviridae; Hantaviridae; Baculoviridae; Coronaviridae; Papovaviridae; Rhabdoviridae; Alphaviridae, Arteriviridae, Filoviridae и Poxviridae.
Адъювантная виросома может содержать по меньшей мере один дополнительный антиген, предпочтительно опухолевый антиген или антиген, происходящий из вируса, паразита, гриба или бактерии. В конкретном варианте реализации указанный антиген представляет собой вирусный антиген, предпочтительно полученный из вируса гриппа или РСВ.
Как описано выше в настоящем документе, антиген может представлять собой интегральный мембранный белок или антиген, присоединенный к группе, обеспечивающей заякоривание в мембране, при этом предпочтительно указанная группа, обеспечивающая заякоривание в мембране, представляет собой трансмембранный домен, аминокислотную последовательность, обеспечивающую заякоривание в мембране, или липидную группу.
Другие особенно предпочтительные виросомы представляют собой те, которые содержат антигены метапневмовируса человека, F-белки парамиксовируса, белки gD и gB вируса простого герпеса, виросомы гриппа, дополнительно содержащие белки или пептиды, полученные из белка gp41 ВИЧ, виросомы гриппа, содержащие белки и пептиды из белков малярии, например, CS и AMA, или виросомы гриппа, дополнительно содержащие антиген, подходящий для применения в вакцинах против рака молочной железы.
Виросомы согласно настоящему изобретению можно применять для доставки вещества (например, иммуногенной молекулы, лекарственного средства и/или гена) в целевую клетку. В отличие от липосом виросомы обладают преимуществом, заключающимся в эффективном проникновении в клетки, запускаемом белком оболочки вируса, с последующим высвобождением содержимого виросом внутри клеток. Более того, если некоторые активные белки оболочки вируса включают в мембраны, указанные виросомы могут высвобождать содержимое в цитоплазму сразу после слияния с клеточной мембраной, что таким образом, например, предотвращает распад лекарственного вещества в кислой среде эндосомы.
Виросомы согласно настоящему изобретению особенно подходят для применения в области вакцинации, когда необходима стимуляция иммунного ответа на антиген, ассоциированный с конкретным заболеванием или нарушением. В таких случаях антиген, как правило, инкапсулируют в виросоме или связывают с виросомой, которая затем доставляет данный антиген иммунной системе хозяина, которого вакцинируют. Благодаря конкретному доставляемому антигену полученное профилактическое и/или терапевтическое средство обязательно является специфичным в отношении заболевания или нарушения, с которым ассоциирован указанный антиген.
Таким образом, в соответствии с другим аспектом настоящего изобретения предложен фармацевтический препарат, содержащий в качестве активного ингредиента виросомы согласно настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. В фармацевтические композиции могут быть также включены фармацевтически приемлемые стабилизаторы, осмотические агенты, буферные агенты, диспергирующие агенты и т.п. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Фармацевтический носитель может представлять собой любое совместимое нетоксичное вещество, подходящее для доставки виросом пациенту.
Примерами фармацевтически приемлемых носителей для интраназальной доставки являются вода, забуференные физиологические растворы, глицерин, полисорбат 20, кремофор EL и водная смесь каприлового/капринового глицерида, и они могут быть забуферены для обеспечения нейтрального pH среды. Примерами фармацевтически приемлемых носителей для парентеральной доставки является стерильный буферный 0,9% (масс./об.) NaCl или 5% (масс./об.) глюкоза, возможно с добавлением 20% альбумина. Препараты для парентерального введения должны быть стерильными. Парентеральный путь введения полипептида или антитела соответствует известным способам, например, инъекции или инфузии внутривенным, интраперитонеальным, внутримышечным, внутриартериальным или внутриочаговым путем.
Типичная фармацевтическая композиция для внутримышечной инъекции будет содержать, например, 1-10 мл фосфатного буферного раствора и от 1 до 100 мкг, предпочтительно 15-50 мкг (антигенного белка) виросом согласно настоящему изобретению.
Для перорального введения активный ингредиент можно вводить в жидких лекарственных формах, таких как эликсиры, сиропы и суспензии. Жидкие лекарственные формы для перорального введения могут содержать краситель и ароматизатор для улучшения приема пациентом. Способы получения композиций, вводимых парентерально, перорально или интраназально, хорошо известны в данной области техники и более подробно описаны в различных источниках, включая, например, Remington's Pharmaceutical Science (15th ed., Mack Publishing, Easton, PA, 1980) (полное содержание которого включено посредством ссылки для всех целей).
В одном из вариантов реализации виросомы согласно настоящему изобретению включены в иммуногенную композицию или вакцину. Термин «вакцина» относится к препарату, который можно вводить хозяину для индукции клеточного и/или гуморального иммунного ответа. Вакцины могут содержать дополнительные адъюванты, фармацевтически приемлемые носители, разбавители или вспомогательные вещества. Типичные дополнительные адъюванты включают полный адъювант Фрейнда, неполный адъювант Фрейнда, адъювант Gerbu (GMDP; С.С. Biotech Corp.), адъювант RIBI для домашней птицы (MPL; RIBI Immunochemical Research, Inc.), алюмокалиевые квасцы, фосфат алюминия, гидроксид алюминия, QS21 (Cambridge Biotech), адъювант Titer Max (CytRx) и адъювант Quil А. Другие соединения, которые могут обладать свойствами адъюванта, включают связующие агенты, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза или желатин; вспомогательные вещества, такие как крахмал, лактоза или декстрины, разрыхлители, такие как альгиновая кислота, альгинат натрия, Примогель, кукурузный крахмал и т.п.; смазывающие вещества, такие как стеарат магния или Стеротекс; вещества, способствующие скольжению, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин, ароматизатор, такой как перечная мята, метилсалицилат или ароматизатор апельсин, и краситель.
В одном из вариантов реализации виросомы согласно настоящему изобретению могут быть лиофилизированы или регидратированы после лиофилизации. Лиофилизированные виросомы можно применять в качестве вакцин в виде сухого порошка или после регидратации.
Также предложена адъювантная виросома согласно настоящему изобретению для применения в качестве лекарственного средства. Например, согласно настоящему изобретению предложена адъювантная виросома для применения в способе профилактики или лечения рака или инфекционного заболевания. В одном из вариантов реализации указанная адъювантная виросома является иммуногенной. Термин «иммуногенный» относится к молекуле, которая способна вызывать иммунный ответ у животного-хозяина, включая выработку гуморального иммунного ответа и/или клеточноопосредованного иммунного ответа (например, в который вовлечены цитотоксические Т-лимфоциты (CTL)).
Доза адъювантной виросомы или вакцины может быть определена, например, путем первоначального определения доз, эффективных для вызова профилактического и/или терапевтического иммунного ответа. Это можно осуществлять путем измерения сывороточного титра вирусоспецифических иммуноглобулинов и/или путем измерения ингибирующего соотношения антител в образцах сыворотки, образцах мочи и/или секретах слизистой. Дозы могут быть определены в результате проведения исследований у животных, включая животных, которые не являются природными хозяевами для РСВ. Например, животным может быть введена доза вакцины-кандидата для того, чтобы частично характеризовать индуцируемый иммунный ответ и/или для определения того, были ли выработаны какие-либо нейтрализующие антитела. Кроме того, могут быть проведены рутинные клинические исследования у людей для определения эффективной дозы для людей. Эффективные дозы могут быть экстраполированы из кривых доза-ответ, полученных в моделях у животных in vitro и/или in vivo.
В одном из вариантов реализации суточная доза лекарственного средства, полученного согласно настоящему изобретению, варьируется в диапазоне от 10 нг/кг до примерно 10 г/кг виросом для взрослого в сутки. Для перорального введения лекарственное средство предпочтительно получают в форме таблеток, содержащих от 0,001 до 1000 мг, предпочтительно от 0,01 до 100 мг, более предпочтительно от 0,05 до 50 мг и наиболее предпочтительно от 0,1 до 20 мг виросомы для симптоматической коррекции дозы в соответствии с признаками и симптомами пациента во время лечения. Таблетки могут, например, содержать 0,001, 0,01, 0,05, 0,1, 0,5, 1, 2,5, 10, 20, 50 или 100 миллиграмм виросомы. Эффективное количество виросомы в лекарственном средстве, полученном согласно настоящему изобретению, обычно обеспечивают на уровне доз от примерно 0,0001 мг/кг до примерно 50 мг/кг массы тела на единицу дозы. В частности, диапазон составляет от примерно 0,0001 мг/кг до 7 мг/кг массы тела в сутки. При введении детям доза может быть снижена соответствующим образом.
В одном из вариантов реализации вакцины могут быть получены с применением разбавителя. Типичные «разбавители» включают воду, физиологический солевой раствор, сывороточный альбумин человека, масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители, антибактериальные агенты, такие как бензиловый спирт, антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия, хелатирующие агенты, такие как этилендиаминтетрауксусная кислота, буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования осмолярности, такие как хлорид натрия или декстроза. Типичные «носители» включают жидкие носители (такие как вода, физиологический раствор, культуральная среда, физиологический раствор, водный раствор декстрозы и гликоли) и твердые носители (такие как углеводы, примером которых является крахмал, глюкоза, лактоза, сахароза и декстраны, антиоксиданты, примером которых является аскорбиновая кислота и глутатион, и гидролизованные белки.
В одном из вариантов реализации вакцины могут содержать вспомогательное вещество. В настоящем описании термин «вспомогательное вещество» относится к любому инертному веществу (например, аравийская камедь, сироп, ланолин, крахмал и т.д.), которое формирует носитель для доставки антигена. Термин «вспомогательное вещество» включает вещества, которые в присутствии достаточного количества жидкости придают композиции адгезионную способность, необходимую для получения пилюль или таблеток.
В одном из вариантов реализации иммунный ответ включает выработку антитела, которое специфично связывается с представляющим интерес белком, содержащимся в виросоме. Термины «специфическое связывание» или «специфично связывающийся» при употреблении в отношении взаимодействия антитела или клетки (такой как клетка, представляющая собой лимфоцит) с другой молекулой (такой как белок или пептид), означают, что данное взаимодействие зависит от присутствия конкретной структуры (т.е. антигенной детерминанты или эпитопа) в указанное молекуле.
В другом варианте реализации иммунный ответ включает увеличение числа Т-лимфоцитов, которые специфично связываются с представляющим интерес белком. Термин «Т-лимфоциты» включает, но не ограничивается ими, одну или более из: цитотоксических Т-клеток (CTL), Т-клеток-хелперов и Т-клеток-супрессоров. Т-лимфоциты экспрессируют рецепторы, которые распознают антиген в форме пептидных фрагментов в комплексе с молекулами МНС.
Таким образом, в одном из вариантов реализации виросомы согласно настоящему изобретению могут быть включены в вакцины, и иммунологически эффективное количество вакцины может быть введено животному для выработки иммунного ответа. В настоящем описании термины «иммуногенно эффективное количество» и «иммунологически эффективное количество» относятся к тому количеству молекулы, которое вызывает и/или усиливает выработку иммунного ответа (включая выработку специфических антител и/или индукцию ответа TCL) у хозяина после вакцинации. Предпочтительно, хотя и не обязательно, иммунологически эффективное (т.е. иммуногенно эффективное) количество представляет собой «защитное» количество. Термины «защитное» и «терапевтическое» количество композиции относятся к количеству композиции, которое отсрочивает, уменьшает, облегчает, ослабляет, стабилизирует и/или способствует устранению одного или более симптомов заболевания.
В одном из вариантов реализации виросомы или вакцины согласно настоящему изобретению могут быть введены профилактически (т.е. до инфицирования инфекционным агентом и/или наблюдения симптомов заболевания) и/или терапевтически (т.е. после инфицирования инфекционным агентом и/или наблюдения симптомов заболевания). Введение также можно осуществлять одновременно (т.е. в то же время или во время) с проявлением одного или более симптомов заболевания. Кроме того, виросомы или вакцины согласно настоящему изобретению могут быть введены до, одновременно и/или после введения другого типа лекарственного средства или проведения терапевтической процедуры (например, оперативного вмешательства, химиотерапии, лучевой терапии и т.д.). Способы введения соединений согласно настоящему изобретению включают, без ограничения, введение в парентеральной, пероральной, интраперитонеальной, интраназальной, топической (например, ректальной и вагинальной) и сублингвальной формах. Парентеральные пути введения включают, например, подкожный, внутривенный, внутримышечный, интрастернальный инъекционный и инфузионный пути. Другой аспект настоящего изобретения относится к способу вакцинации против или профилактики, или терапии инфекционного заболевания или опухоли путем введения терапевтически или профилактически эффективного количества (фармацевтической композиции, содержащей) виросом согласно настоящему изобретению субъекту, нуждающемуся в профилактике или терапии. Настоящее изобретение также относится к виросомам согласно настоящему изобретению для применения в качестве лекарственного средства, предпочтительно лекарственного средства для вакцинации против или профилактики, или терапии инфекционного заболевания или опухоли. Настоящее изобретение также относится к применению виросом согласно настоящему изобретению для получения лекарственного средства для вакцинации против или профилактики, или терапии инфекционного заболевания или опухоли. В одном из вариантов реализации настоящего изобретения предложен способ иммунизации субъекта от рака или вирусного заболевания, включающий введение указанному субъекту иммунологически эффективного количества иммуногенной композиции согласно настоящему изобретению для выработки иммунного ответа. Например, указанное вирусное заболевание вызывается РСВ, вирусом гриппа, вирусом герпеса или цитомегаловирусом.
Другой аспект относится к области разработки лекарственных средств, в частности оптимизации вакцин. Предложен способ оптимизации соотношения адъювант/антиген в вакцине на основе виросом, включающий получение по меньшей мере двух препаратов, содержащих адъювантные виросомы согласно настоящему изобретению, и/или применение способа «последующего встраивания» согласно настоящему изобретению, при этом каждый препарат содержит различное соотношение адъювант/антиген, и оценку каждого препарата у тестируемого субъекта на предмет его эффективности индуцирования иммунного ответа. Как объяснено выше в настоящем документе, данный способ обладает важными преимуществами в отношении доклинического и клинического тестирования вакцин, содержащих адъювантные виросомы. Поскольку композиция предварительно сформированных виросом формирует «лекарственное вещество А», в то время как адъювант в растворителе представляет собой «лекарственное вещество В», для лекарственного вещества А и В требуется только проведение тестирования безопасности и клинического тестирования. Комбинацию веществ А и В с получением по меньшей мере двух препаратов лекарственных средств с различными соотношениями адъювант/антиген можно осуществлять у постели пациента, что таким образом позволяет избежать дорогостоящих оценок безопасности каждого индивидуального соотношения адъювант/антиген в доклинических, а затем в клинических исследованиях. Более того, данный способ позволяет тестировать различные адъюванты с любой виросомой или экономично тестировать любой адъювант с различными виросомами.
ОПИСАНИЕ ФИГУР
Фиг. 1: анализ методом равновесного центрифугирования в градиенте плотности для подвергнутого последующему встраиванию адъюванта 3-D-PHAD в виросомах РСВ. На графике А показан белок, фосфат (как из фосфолипидов, так и из 3-D-PHAD) и плотность во фракциях, пронумерованных 1.1, 1.2 последовательно до 1.11 снизу вверх; на графике В показан аналогичный градиент только 3-D-PHAD, растворенного в ДМСО.
Фиг. 2: анализ планшетов методом тонкослойной хроматографии (ТСХ) для образцов из градиента на фиг. 1А. Полоса 1: экстракт вирусных липидов РСВ; полоса 2: применяемые ФХ и ФЭ; полоса 3: адъювант 3D-PHAD; полосы 4-8: фракции 1.5-1.9 градиента. Пятна обводили кружком после окрашивания этанолом, и планшет проявляли с помощью реагента фосфомолибдата.
Фиг. 3: анализ методом равновесного центрифугирования в градиенте плотности для последующего встраивания адъюванта 3-D-PHAD в виросомах РСВ из раствора в ДМФА. Фракции пронумерованы снизу вверх. Анализ, как на фиг. 1.
Фиг. 4: анализ методом равновесного центрифугирования в градиенте плотности для последующего встраивания адъюванта монофосфориллипида A (MPLA) в виросомах РСВ из раствора в ДМСО. Фракции пронумерованы снизу вверх. Анализ, как на фиг. 1.
Фиг. 5: анализ методом равновесного центрифугирования в градиенте плотности для последующего встраивания липопептидного адъюванта в виросомах РСВ из раствора в ДМСО. Фракции пронумерованы снизу вверх. Анализ, как на фиг. 1.
Фиг. 6: окрашенный серебром гель SDS-ПААГ для образцов из фракций градиента на фиг. 5. Показаны белки F (субъединица F1) и G вирусной мембраны. Липопептид отмечен стрелкой.
Фиг. 7: IgG анти-РСВ, определенный путем ELISA. Логарифмическое (основание 10) представление среднего геометрического титра; линия показывает среднее значение.
Фиг. 8: нейтрализующие антитела ex-vivo. Логарифмическое (основание 2) представление титра; линия показывает среднее значение.
ПРИМЕРЫ
Пример 1: включение адъюванта MPL путем последующего встраивания в виросомы РСВ
Виросомы получали из очищенного респираторно-синцитиального вируса (РСВ), штамма А2, как описано в данной области техники. Вкратце, вирус солюбилизировали в 50 мМ дикапроилфосфатидилхолине (DCPC) в течение 30 минут на льду и вирусные нуклеокапсиды удаляли путем центрифугирования при 120000 g в течение 30 минут. Надосадочную жидкость собирали и фильтровали через 0,1 мкм фильтр. Тонкую липидную пленку получали из смеси фосфатидилхолина (ФХ) и фосфатидилэтаноламина (ФЭ) (источник: куриное яйцо, соответственно трансфосфатидилированный из куриного яйца) в молярном соотношении 2:1 путем выпаривания растворителя (хлороформ/метанол 2:1 об./об.). Надосадочную жидкость вирусной мембраны (2,35 мл) добавляли к тонкой липидной пленке в соотношении 1 мг белка на 850 нмоль фосфолипида. Смесь фильтровали через 0,2 мкм фильтр и подвергали диализу в кассете для диализа slide-a-lyzer, стерилизованной гамма-облучением, с размером пор, обеспечивающим пропускание молекул с молекулярной массой до 10 кДа, в течение 48 часов против 7 замен 2 литров буфера HNE при 4°C. Виросомы собирали и измеряли концентрацию фосфолипидов в виросомах.
Готовили исходные растворы синтетического аналога монофосфориллипида A 3-D-PHAD (описанного в WO 2013/155448), амфифильного адъюванта, в ДМСО. К 975 мкл виросом, содержащим 850 нмоль фосфолипидов, быстро добавляли 25 мкл раствора ДМСО, содержащего 153 нмоль 3-D-PHAD, при перемешивании образца на вихревом смесителе. После хранения в течение ночи при 4°C анализировали плотность виросом путем равновесного центрифугирования в градиенте плотности на 10-60% градиентах сахарозы, которые центрифугировали в течение 66 часов в роторе Sorvall АН 650 при 50 тыс. об/мин. В качестве контроля также анализировали 153 нмоль одного 3 D-P-HAD на аналогичном градиенте. Образцы из градиента анализировали на предмет концентрации сахарозы путем рефрактометрии с измерением плотности, фосфата (как липида, так и 3-D-PHAD) и белка. Как показано на фиг. 1, виросомы формировали одну зону около 1,054-1,0759 г/мл, включающую весь фосфат, тогда как свободный 3-D-PHAD собирался в зоне около 1,12 г/мл. Следовательно, большая часть 3 D PHAD, добавленного к виросомам из раствора ДМСО, была включена в виросомы.
Фракции градиента экстрагировали хлороформом/метанолом в соответствии с методом Фолша и анализировали путем тонкослойной хроматографии на планшете Merck HP TLC 60. Планшеты анализировали в смеси хлороформ:метанол:вода 100:75:15 (об./об.). Липиды и 3 DPHAD визуализировали путем последовательного окрашивания этанолом, йодом, нингидрином и фосфомолибдатом. В качестве контроля экстракт Фолша вирусных липидов РСВ, ФХ и ФЭ, применяемые для получения виросом, и свободный 3 DPHAD также анализировали на этом же планшете. Как показано на фиг. 2, обнаруживали, что 3-D-PHAD присутствовал во фракциях, содержащих виросомы.
Пример 2: последующее встраивание нескольких адъювантов в виросомы РСВ с применением нескольких растворителей
Виросомы получали из очищенного вируса РСВ, штамма А2, как описано в примере 1. Виросомы собирали и измеряли концентрацию фосфолипидов в виросомах.
Готовили исходные растворы нескольких адъювантов в нескольких растворителях:
1) 100 нмоль 3-D-PHAD в 50 мкл ДМФА
2) 100 нмоль монофосфориллипида A (MPLA) в 50 мкл ДМСО
3) 0,3 мг N-пальмитоил-S-2,3(биспальмитоилокси)-пропилцистеинилсерил-(лизил)3-лизина (липопептид) в 50 мкл ДМСО
Вышеуказанные растворы адъювантов добавляли в четыре пробирки с 950 мкл виросом каждая, содержащими 850 нмоль фосфолипидов, с быстрым перемешиванием на вортексе. После хранения в течение ночи при 4°C анализировали плотность виросом путем равновесного центрифугирования в градиенте плотности на 10-60% градиентах сахарозы, которые центрифугировали в течение 66 часов в роторе Sorvall АН 650 при 120000 g. Образцы градиента анализировали на предмет плотности, фосфата (как липида, так и 3DPHAD) и белка. Как показано на фиг. 3-5, во всех градиентах был только один пик фосфата (из фосфолипидов, 3-D-PHAD или MPLA), также содержащий белок, тогда как обнаруживали, что липопептид присутствовал во фракции 4-7 с пиком в случае фракции 6 (содержащей самую высокую концентрацию виросом) по данным электрофореза в SDS-ПААГ (фиг. 7). Это показывает, что адъювант был включен в виросомы во всех случаях. В то время как липопептидсодержащие виросомы демонстрировали пиковую плотность около 1,1 г/мл, другие виросомы собирались в зоне около 1,04-1,06 г/мл. Таким образом, различные адъюванты, добавляемые к виросомам, по-разному влияли на плотность виросом, что дополнительно подтверждает их включение.
Пример 3: Иммунизация мышей виросомами РСВ, содержащими 3-D-PHAD, включенный либо во время формирования виросом, либо после него
Получали два разных препарата виросом из очищенного респираторно-синцитиального вируса (РСВ), штамма А2. Вкратце, вирус солюбилизировали в 50 мМ дикапроилфосфатидилхолине (DCPC) в течение 30 минут на льду и вирусные нуклеокапсиды удаляли путем центрифугирования при 120000 g в течение 30 минут. Надосадочную жидкость собирали и фильтровали через 0,1 мкм фильтр. Получали две тонкие липидные пленки: одну (тестируемый образец) из смеси фосфатидилхолина и фосфатидилэтаноламина в соотношении 2:1 путем выпаривания растворителя (хлороформ/метанол 2:1 (об./об.)); другая (сравнительный пример) дополнительно содержала 3-D-PHAD.
Надосадочную жидкость вирусной мембраны добавляли к тонкой липидной пленке в соотношении 1 мг белка на 850 нмоль фосфолипида (тестируемый образец) или 850 фосфолипида плюс 200 нмоль 3-D-DPHAD (сравнительный пример). Смесь фильтровали через 0,2 мкм фильтр и подвергали диализу в кассете для диализа slide-a-lyzer, стерилизованной гамма-облучением, с размером пор, обеспечивающим пропускание молекул с молекулярной массой до 10 кДа, в течение 48 часов против 7 замен 2 литров буфера HNE, при 4°C. Виросомы собирали и измеряли концентрацию фосфолипидов в виросомах. К 975 мкл водной композиции виросом, содержащей 850 нмоль фосфолипидов и не содержащей 3-D-PHAD, быстро добавляли 25 мкл раствора ДМСО, содержащего 153 нмоль 3-D-PHAD, при перемешивании образца на вихревом смесителе. Таким образом, сравнительный препарат виросом содержал 200 нмоль 3-D-PHAD, включенного во время формирования виросом («включение»), тогда как тестируемый препарат виросом содержал 100 нмоль 3-D-PHAD, добавленного из растворителя после формирования виросом («последующее встраивание»).
Три группы по десять мышей Balb/C каждая иммунизировали в 1 и 15 день либо контролем-носителем (буфер HNE, 145 мМ NaCl, 5 мМ HEPES, 1 мМ EDTA, pH 7,4), либо препаратом виросом «включения» на уровне 5 мкг вирусного белка и 1 мкг 3-D-PHAD на мышь на инъекцию, либо препаратом виросом «последующего встраивания» на уровне 5 мкг вирусного белка и 0,5 мкг 3-D-PHAD на мышь на инъекцию.
Титры IgG к вирусным белкам определяли в 28 день, как описано ранее (Kamphuis, Т. et al. Plos One 2012; 7(5):e36812). Как показано на фиг. 7, титры IgG, индуцированные виросомами последующего встраивания 3-D-PHAD, были эквивалентны титрам в случае виросом включения 3-D-PHAD, тогда как последние виросомы содержали в два раза большее количество адъюванта.
Нейтрализующие титры антител к живому вирусу определяли ex-vivo в 28 день, как описано ранее (Kamphuis, Т. et al. Plos One 2012; 7(5):e36812). Как показано на фиг. 8, титры IgG, индуцированные виросомами последующего встраивания 3-D-PHAD, были по меньшей мере эквивалентны титрам в случае виросом включения 3-D-PHAD, тогда как последние виросомы содержали в два раза большее количество 3-D-PHAD.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФУНКЦИОНАЛЬНО РЕКОНСТРУИРОВАННЫЕ ВИРУСНЫЕ МЕМБРАНЫ, СОДЕРЖАЩИЕ АДЪЮВАНТ | 2004 |
|
RU2348428C2 |
| ВИРОСОМЫ, ВКЛЮЧАЮЩИЕ ГЕМАГГЛЮТИНИН, ВЫДЕЛЕННЫЙ ИЗ ВИРУСА ГРИППА, ПОЛУЧЕННОГО В ЛИНИИ КЛЕТОК, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ ВИРОСОМЫ, СПОСОБЫ ИЗГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ | 2008 |
|
RU2441647C2 |
| УКОРОЧЕННАЯ СЕКРЕТИРУЕМАЯ АСПАРТИЛ-ПРОТЕИНАЗА 2 | 2008 |
|
RU2493255C2 |
| ПЕРОРАЛЬНО ДИСПЕРГИРУЕМАЯ ВАКЦИНА, СОДЕРЖАЩАЯ ВИРОСОМЫ | 2019 |
|
RU2808276C2 |
| НОВЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2009 |
|
RU2510280C2 |
| МУТАНТНЫЕ АНТИГЕНЫ GAS57 И АНТИТЕЛА ПРОТИВ GAS57 | 2008 |
|
RU2471497C2 |
| ЛИПОСОМАЛЬНЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2016 |
|
RU2736642C2 |
| АДЪЮВАНТНАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АЛЮМИНИЙ, И СОДЕРЖАЩАЯ ЕЕ ВАКЦИННАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2721417C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ И СПОСОБ РАЗРАБОТКИ ВАКЦИНЫ, ОСНОВАННОЙ НА СЛИТОМ БЕЛКЕ | 2004 |
|
RU2407749C2 |
| ПРИМЕНЕНИЕ МОНОМИКОЛИЛГЛИЦЕРИНА (MMG) В КАЧЕСТВЕ АДЪЮВАНТА | 2008 |
|
RU2479317C2 |

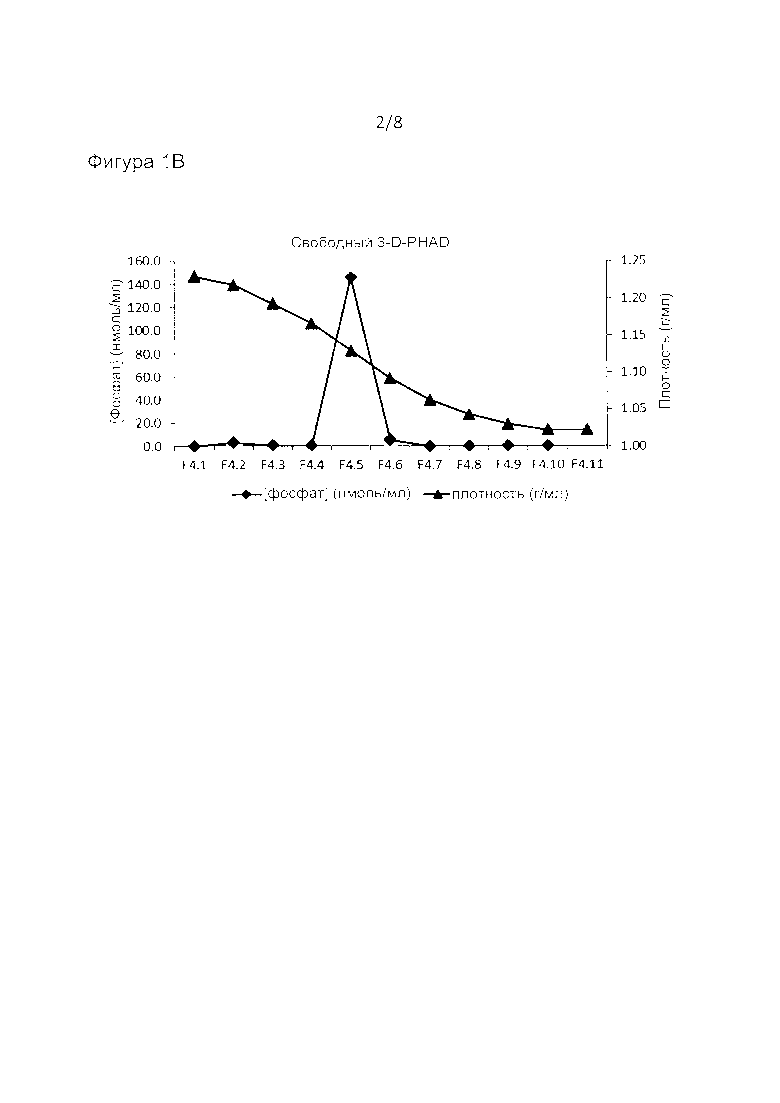
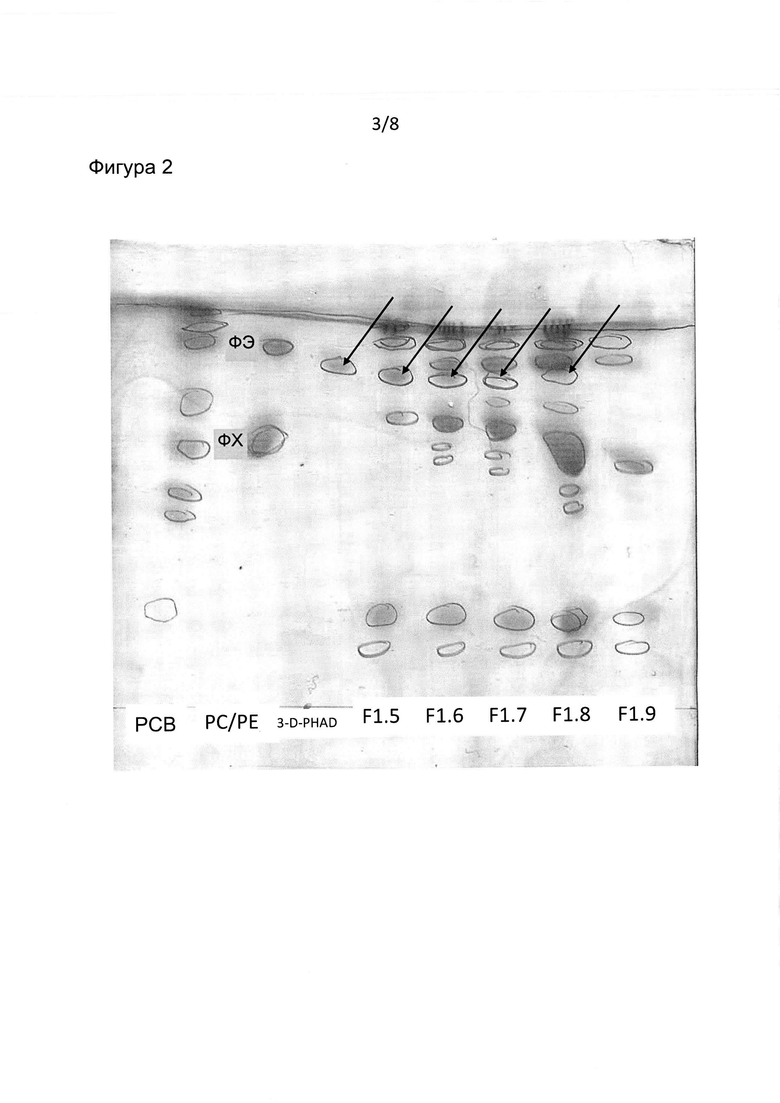
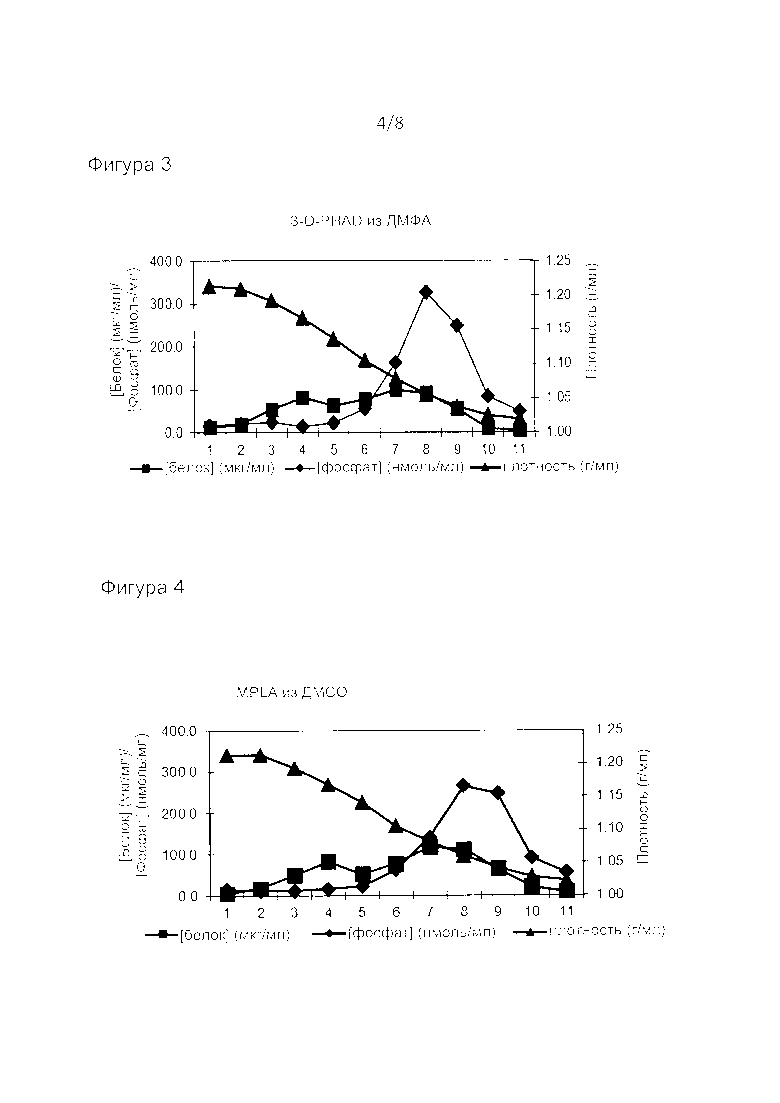
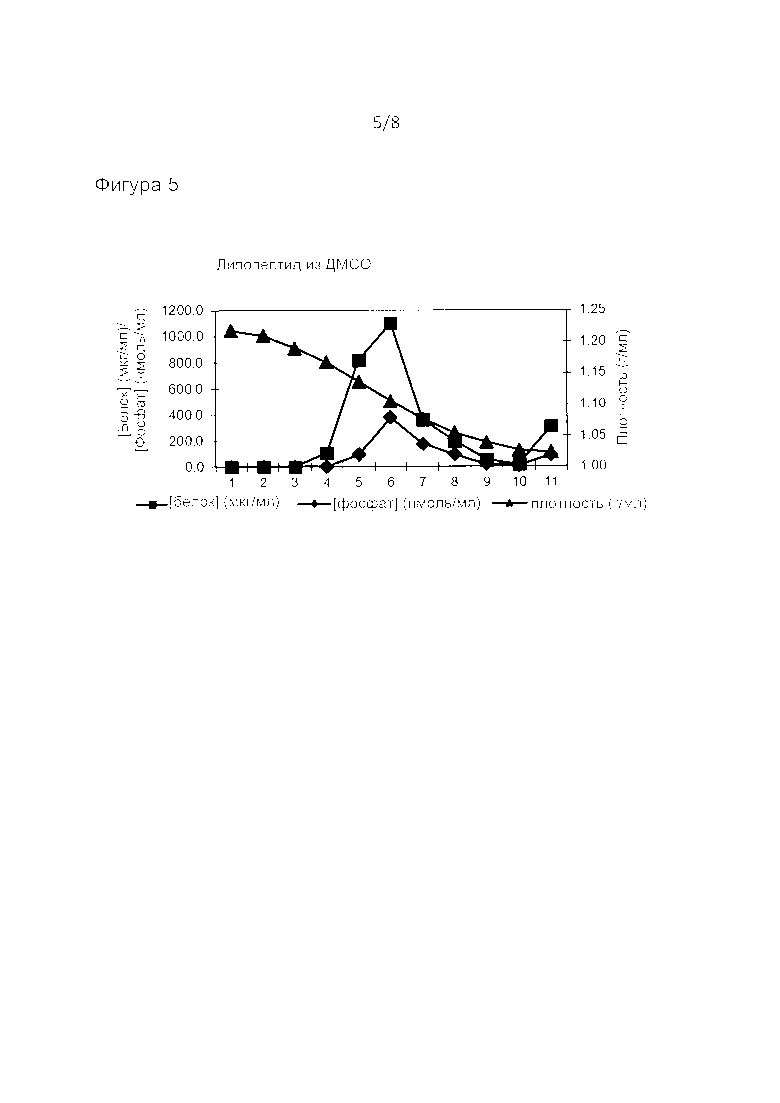
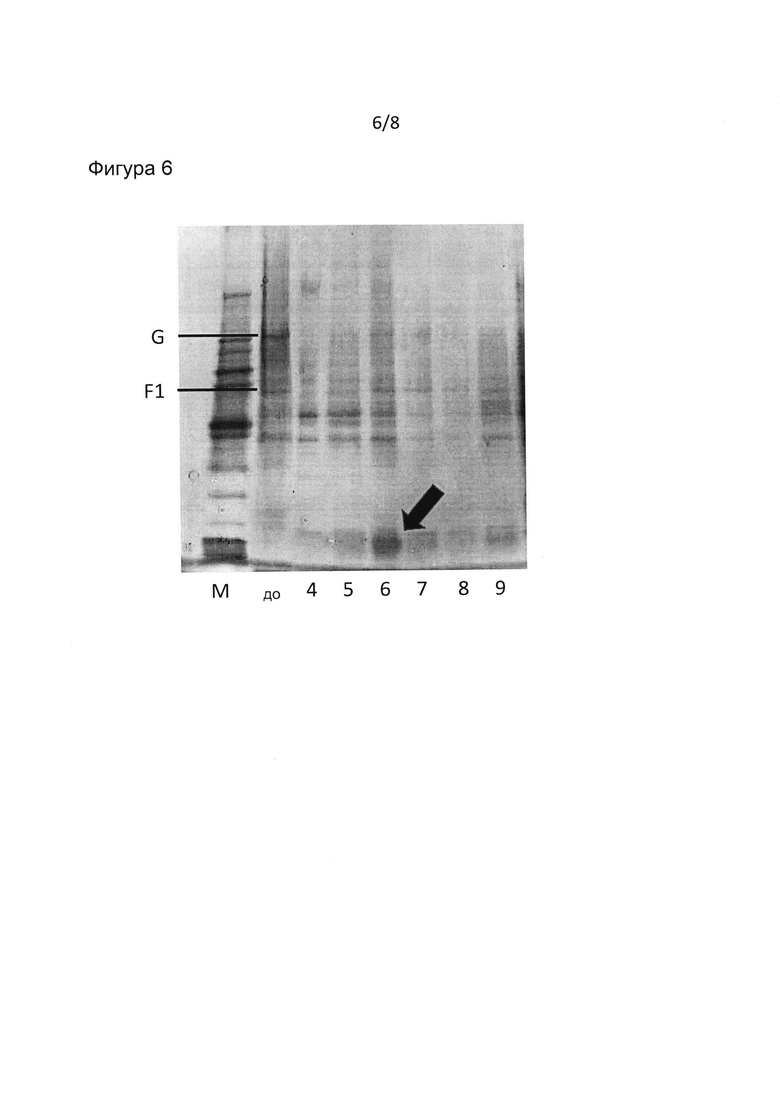

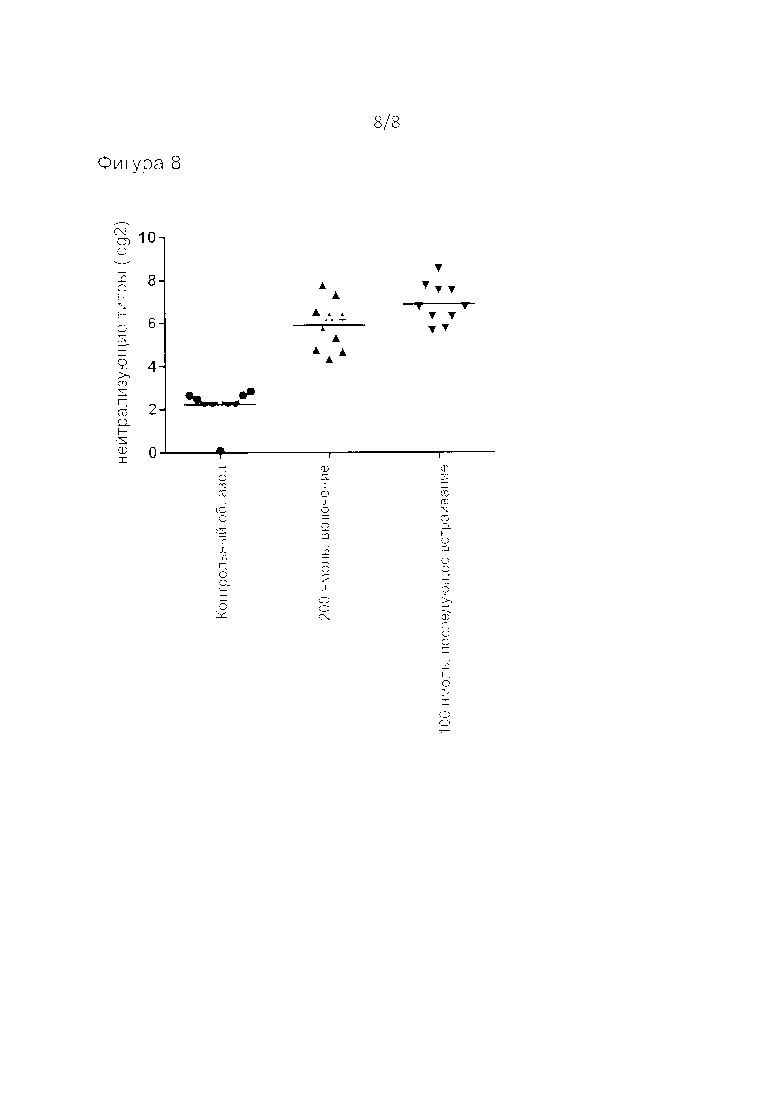
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для получения адъювантных виросом. Способ получения адъювантных виросом включает этапы: (i) обеспечения водной композиции безадъювантных виросом, содержащих белок слияния мембран; (ii) растворения амфифильного адъюванта в фармацевтически приемлемом неводном растворителе, который может образовывать гомогенную смесь с водой; и (iii) разведения указанного раствора адъюванта в указанной водной композиции виросом с индуцированием встраивания адъюванта в наружный слой виросомальной мембраны при сохранении способности указанных виросом к слиянию с мембраной. Группа изобретений относится к фармацевтической и иммуногенной композициям, содержащим адъювантную виросому, полученную указанным способом, а также к способам иммунизации субъекта от рака или вирусного заболевания. 8 н. и 26 з.п. ф-лы, 3 пр., 8 ил.
1. Способ получения адъювантных виросом, включающий этапы:
(i) обеспечения водной композиции безадъювантных виросом, содержащих белок слияния мембран;
(ii) растворения амфифильного адъюванта в фармацевтически приемлемом
неводном растворителе, который может образовывать гомогенную смесь с водой; и
(iii) разведения указанного раствора адъюванта в указанной водной композиции виросом для индуцирования встраивания адъюванта в наружный слой мембраны виросомы с сохранением способности виросом сливаться с мембраной.
2. Способ по п. 1, отличающийся тем, что указанный неводный растворитель для адъюванта имеет растворимость в воде, составляющую по меньшей мере 5 г/100 мл при 20ºC, предпочтительно по меньшей мере 10 г/100 мл, более предпочтительно по меньшей мере 20 г/100 мл.
3. Способ по п. 1 или 2, отличающийся тем, что указанный растворитель для адъюванта представляет собой смешивающийся с водой растворитель.
4. Способ по любому из пп. 1-3, отличающийся тем, что указанный растворитель для адъюванта выбран из группы, состоящей из ацетонитрила, 2-бутанола, метилацетата,
этилацетата, уксусной кислоты, муравьиной кислоты, метанола, этанола, ДМСО, ДМФА, н-пропанола, изопропанола, 2-метил-1-пропанола и ТГФ или любой смеси указанных веществ.
5. Способ по п. 4, отличающийся тем, что указанный растворитель для адъюванта представляет собой ДМСО или ДМФА.
6. Способ по любому из пп. 1-5, отличающийся тем, что указанный белок слияния мембран представляет собой вирусный белок слияния, предпочтительно выбранный из группы, состоящей из белков gp120/gp41 ВИЧ, F-белков парамиксовирусов и белка гемагглютинина (HA) вируса гриппа, белка gp64 бакуловируса, Е-белков вируса леса Семлики и их вариантов, сохраняющих способность к слиянию.
7. Способ по п. 6, отличающийся тем, что указанный белок слияния мембран представляет собой F-белок респираторно-синцитиального вируса (РСВ) или вариант, сохраняющий способность к слиянию.
8. Способ по любому из пп. 1-7, включающий обеспечение виросом путем функционального восстановления оболочечного вируса, предпочтительно вируса, выбранного из группы, состоящей из Retroviridae; rubellavirus; paramyxoviridae; Flaviviridae; Herpesviridae; Bunyaviridae; Arenaviridae; Hantaviridae; Baculoviridae; Coronaviridae; Papovaviridae; Rhabdoviridae; Alphaviridae, Arteriviridae, Filoviridae и Poxviridae.
9. Способ по п. 8, отличающийся тем, что указанное функциональное восстановление включает приведение оболочечного вируса в контакт с раствором, содержащим короткоцепочечный фосфолипид или детергент, что обеспечивает солюбилизацию вирусной оболочки указанного вируса, и также включает удаление короткоцепочечного фосфолипида или детергента из указанного раствора, что обеспечивает образование функционально восстановленной оболочки вируса, при этом предпочтительно указанный фосфолипид или детергент удаляют путем диализа, фильтрации или абсорбции на гидрофобных гранулах.
10. Способ по п. 9, отличающийся тем, что указанный короткоцепочечный фосфолипид имеет критическую концентрацию мицеллообразования (cmc) более 0,1 мМ, предпочтительно более 0,3 мМ, более предпочтительно более 1 мМ.
11. Способ по п. 10, отличающийся тем, что указанный фосфолипид представляет собой фосфатидилхолин, предпочтительно 1,2-дигептаноил-sn-фосфатидилхолин или 1,2- дикапроил-sn-фосфатидилхолин.
12. Способ по п. 9, отличающийся тем, что указанный детергент представляет собой октаэтиленгликоля моно-N-додециловый эфир.
13. Способ по п. 9, отличающийся тем, что указанные гидрофобные гранулы состоят из полистирол-дивинилбензола.
14. Способ по любому из пп. 1-13, отличающийся тем, что указанный амфифильный адъювант представляет собой соединение, узнаваемое Toll-подобным рецептором (TLR), предпочтительно выбранное из группы, состоящей из монофосфориллипида А и его производных, и липопептида.
15. Способ по любому из пп. 1-13, отличающийся тем, что указанный амфифильный адъювант представляет собой гликолипид, предпочтительно выбранный из группы, состоящей из α-галактозилцерамида, фосфатидилинозитолманнозида, производных эндотоксичных липополисахаридов и производных указанных соединений.
16. Способ по любому из пп. 1-13, отличающийся тем, что указанный амфифильный адъювант представляет собой амфифильный пептид, предпочтительно содержащий аминокислотную последовательность, полученную из Jagged-1 или белка А S. Aureus, обладающий активностью адъюванта.
17. Способ по любому из пп. 1-16, отличающийся тем, что указанная виросома содержит по меньшей мере один дополнительный антиген, предпочтительно антиген опухоли или антиген, происходящий из вируса, паразита, гриба или бактерии.
18. Способ по п. 17, отличающийся тем, что указанный антиген представляет собой вирусный антиген, предпочтительно полученный из вируса гриппа или РСВ.
19. Способ по п. 17 или 18, отличающийся тем, что указанный антиген представляет собой
интегральный мембранный белок или антиген, присоединенный к группе, обеспечивающей заякоривание в мембране.
20. Способ по п. 19, отличающийся тем, что указанная группа, обеспечивающая заякоривание в мембране, представляет собой трансмембранный домен или аминокислотную последовательность, обеспечивающую заякоривание в мембране.
21. Способ по п. 19, отличающийся тем, что указанная группа, обеспечивающая заякоривание в мембране, представляет собой липидную группу, предпочтительно фосфолипид или ацильную цепь.
22. Адъювантная виросома, полученная способом по любому из пп. 1-21.
23. Адъювантная виросома, характеризующаяся тем, что адъювант представляет собой амфифильный адъювант, который, по существу, локализован в наружном слое мембраны указанной виросомы.
24. Адъювантная виросома по п. 23, отличающаяся тем, что указанный амфифильный адъювант представляет собой соединение, указанное в любом из пп. 14-16.
25. Адъювантная виросома по п. 23 или 24, содержащая по меньшей мере один дополнительный антиген, предпочтительно антиген опухоли или антиген, происходящий из вируса, паразита, гриба или бактерии.
26. Адъювантная виросома по п. 25, отличающаяся тем, что указанный антиген представляет собой вирусный антиген, предпочтительно полученный из вируса гриппа или РСВ.
27. Адъювантная виросома по п. 25 или 26, отличающаяся тем, что указанный антиген представляет собой интегральный мембранный белок или антиген, присоединенный к группе, обеспечивающей заякоривание в мембране, при этом предпочтительно указанная группа, обеспечивающая заякоривание в мембране, представляет собой трансмембранный домен, аминокислотную последовательность, обеспечивающую заякоривание в мембране, или липидную группу.
28. Адъювантная виросома по любому из пп. 22-27 для применения в качестве лекарственного средства.
29. Адъювантная виросома по любому из пп. 22-27 для применения в способе профилактики или лечения рака или инфекционного заболевания.
30. Фармацевтическая композиция, содержащая адъювантную виросому по любому из пп. 22-27 и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
31. Иммуногенная композиция, содержащая адъювантную виросому по любому из пп. 22-27.
32. Композиция по п. 28 или 29, представленная в форме для интраназальной доставки, парентеральной доставки или перорального введения.
33. Способ оптимизации соотношения адъювант/антиген в вакцине на основе виросомы, включающий обеспечение по меньшей мере двух препаратов, содержащих адъювантные виросомы по любому из пп. 22-27, при этом каждый препарат содержит различное соотношение адъювант/антиген, и оценку каждого препарата у отдельного тестируемого субъекта на предмет его эффективности при индуцировании иммунного ответа.
34. Способ иммунизации субъекта от рака, включающий введение указанному субъекту
иммунологически эффективного количества иммуногенной композиции по п. 31 для выработки иммунного ответа.
35. Способ иммунизации субъекта от вирусного заболевания, включающий введение
указанному субъекту иммунологически эффективного количества иммуногенной композиции по п. 31 для выработки иммунного ответа.
36. Способ по п. 35, отличающийся тем, что указанное вирусное заболевание вызывается
РСВ, вирусом гриппа, вирусом герпеса или цитомегаловирусом.
| WO 2004045582 A1, 03.06.2004 | |||
| WO 2013155448 A1, 17.10.2013 | |||
| WO 2004110486 A1, 23.12.2004 | |||
| STEGMANN T | |||
| ET AL | |||
| Lipopeptide-adjuvanted respiratory syncytial virus virosomes: A safe and immunogenic non-replicating vaccine formulation // Vaccine | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2019-07-12—Публикация
2014-09-12—Подача