Настоящее изобретение относится к антителу, обладающему антиангиогенной активностью. Более конкретно, настоящее изобретение относится к антителу против ROBO4 и фармацевтической композиции, содержащей антитело.
Известный уровень техники
Гомолог 4 белка Roundabout (ROBO4), белок с молекулярной массой 110 кДа, имеет однократно пересекающую липидный бислой трансмембранную структуру (ссылка 1 списка непатентной литературы) и, как известно, подавляет ангиогенез посредством связывания с известным супрессором ангиогенеза гомологом 2 Slit (Slit2) (ссылка 1 списка патентной литературы и ссылка 2 списка непатентной литературы). Установлено, что Slit2 подавляет миграцию HUVEC, стимулируемую сосудистым эндотелиальным фактором роста (VEGF), кроме того, установлено, что он подавляет активацию клеточной миграции VEGF или bFGF в случае трансфектированных геном ROBO4 сосудистых эндотелиальных клеток (далее в контексте настоящего описания сосудистые эндотелиальные клетки обозначают также как «ЕС») по сравнению с клетками, трансфектированными «пустым» вектором ЕС (ссылка 1 списка патентной литературы и ссылки 2-4 списка непатентной литературы).
Кроме того, описано, что подавляющее действие Slit2 на стимуляцию клеточной миграции, стимуляцию образования полости или повышение проницаемости с помощью VEGF обнаружено в ЕС, полученных из мышей дикого типа, или ЕС, трансфектированных контрольной siPHK, но не обнаружено в ЕС, полученных из мышей с «выключенным» геном ROBO4, или в ЕС, трансфектированных siPHK, предназначенной для «выключения» гена ROBO4 (ссылка 2 списка патентной литературы и ссылки 4-6 списка непатентной литературы). Кроме того, установлено, что Slit2 через ROBO4 подавляет ангиогенез или повышает сосудистую проницаемость на мышиных моделях с индуцированной лазером хороидальной неоваскуляризацией или индуцированной кислородом ретинопатией, которые представляют собой созданные на животных модели таких заболеваний, как экссудативная возрастная дегенерация желтого пятна или диабетическая ретинопатия (ссылка 2 списка патентной литературы и ссылка 4 списка непатентной литературы).
Несмотря на эти сведения, опубликованы также данные, демонстрирующие, что ROBO4 не связывается с Slit2 (ссылка 9 списка непатентной литературы и ссылка 5 списка патентной литературы). Опубликованы также полученные при изучении функций ROBO4 данные о том, что он скорее стимулирует, чем подавляет ангиогенез, поскольку миграция или образование полости ингибируется в ЕС с «выключенным» геном ROBO4 (ссылки 10 и 11 списка непатентной литературы).
В клинической практике установлено, что высокий уровень экспрессии ROBO4 имеет место в сосудах внутри опухоли при метастазах в печень рака ободочной кишки, ганглиоглиоме, раке мочевого пузыря, раке молочной железы, метастатической меланоме, раке почки, раке легкого, раке печени или раке ободочной кишки (ссылка 3 списка патентной литературы и ссылки 1, 3 и 7 списка непатентной литературы). Кроме того, экспрессия ROBO4 обнаружена также в кровеносных сосудах в фиброваскулярных мембранах у пациентов с пролиферативной диабетической ретинопатией (ссылка 8 списка непатентной литературы). Так, ROBO4 экспрессируется в сосудистых эндотелиальных клетках, прежде всего эндотелиальных клетках в новых кровеносных сосудах, формирующихся при патологическом состоянии. Это позволяет предположить, что патологический ангиогенез является результатом высокого уровня экспрессии ROBO4, но также можно предположить наличие компенсаторной экспрессии ROBO4 для подавления патологического ангиогенеза.
Как описано выше, ROBO4 участвует в антиангиогенном действии. Таким образом, антитело против ROBO4 и его функциональный фрагмент, по-видимому, можно применять для лечения заболевания, в котором участвует ангиогенез. Однако остается неясным вопрос о том, какое антитело против ROBO4, агонистическое или антагонистическое, подавляет или стимулирует ангиогенез.
Антитела, описанные в патенте ЕР 1565491 (ссылка 4 списка патентной литературы) и WO 2008/100805 (ссылка 5 списка патентной литературы), известны как антитела против ROBO4 (далее в контексте настоящего описания обозначено как «антитело к ROBO4»). Однако ни для одного из указанных антител не выявлено подавляющее или ингибирующее действие на ангиогенез in vivo.
Перечень процитированных ссылок Список патентной литературы
[Ссылка 1 списка патентной литературы] WO 2004/003163.
[Ссылка 2 списка патентной литературы] WO 2008/073441.
[Ссылка 3 списка патентной литературы] WO 2002/036771.
[Ссылка 4 списка патентной литературы] европейский патент №1565491.
[Ссылка 5 списка патентной литературы] WO 2008/100805.
Список непатентной литературы
[Ссылка 1 списка непатентной литературы] Genomics, т. 79, 2002, сс. 547-552.
[Ссылка 2 списка непатентной литературы] Developmental Biology, т. 261, 2003, сс. 251-267.
[Ссылка 3 списка непатентной литературы] Biochemical and Biophysical Research Communications, т. 332, 2005, сс. 533-541.
[Ссылка 4 списка непатентной литературы] Nature Medicine, №14, 2008, сс. 448-453.
[Ссылка 5 списка непатентной литературы] Science Translational Medicine, т. 2, 2010, с 23ral9.
[Ссылка 6 списка непатентной литературы] Proceedings of the National Academy of Sciences, т. 107, 2010, cc. 10520-10525.
[Ссылка 7 списка непатентной литературы] Oncology Reports, т. 15, 2006, cc. 1437-1443.
[Ссылка 8 списка непатентной литературы] Molecular Vision, т. 15, 2009, сс. 1057-1069.
[Ссылка 9 списка непатентной литературы] The FASEB Journal, т. 19, 2005, сс. 121-123.
[Ссылка 10 списка непатентной литературы] ВМС Cell Biology, т. 9, 2008, сс. 61-72.
[Ссылка 11 списка непатентной литературы] The FASEB Journal, т. 23, 2009, сс. 513-522.
Краткое изложение сущности изобретения
Задачи, положенные в основу настоящего изобретения
В основу настоящего изобретения была положена задача разработать антитело против ROBO4.
Следующая задача настоящего изобретения заключалась в том, чтобы разработать фармацевтическую композицию, содержащую антитело к ROBO4, обладающую антиангиогенным действием, и т.д.
Следующая задача настоящего изобретения заключалась в том, чтобы разработать способ получения антитела.
Еще одна задача настоящего изобретения заключалась в том, чтобы разработать способ подавления ангиогенеза с использованием антитела и т.д.
Пути решения поставленных задач
При создании настоящего изобретения выполнены требуемые исследования для решения задач и, как следствие, позволившие успешно создать систему скрининга для обнаружения активации действующего в прямом направлении сигнала ROBO4. Кроме того, при создании настоящего изобретения использовали систему скрининга для успешного получения нового моноклонального антитела к ROBO4, которое активирует действующий в прямом направлении сигнал ROBO4, обладает подавляющим действием на клеточную миграцию экспрессирующих ROBO4 ЕС, индуцируемую различными ангиогенными факторами, такими как VEGF, bFGF, HGF, PDGF-BB и SDF-1, и обладает антиангиогенным действием даже на моделях in vivo. Таким путем решаются задачи, положенные в основу настоящего изобретения. В частности, настоящее изобретение относится к:
(1) антителу, обладающему свойствами, которые указаны ниже в подпунктах (I)-(III), или его функциональному фрагменту:
(I) обладает способностью связываться с белком ROBO4, которая предпочтительно характеризуется величиной KD, составляющей 1×10-8 или менее, особенно предпочтительно 5×10-9 или менее;
(II) подавляет или ингибирует миграцию сосудистых эндотелиальных клеток в отсутствии перекрестносшивающего антитела in vitro; и
(III) подавляет или ингибирует ангиогенез in vivo;
(2) антителу или его функциональному фрагменту по п. (1), где белок ROBO4 представляет собой человеческий белок ROBO4;
(3) антителу или его функциональному фрагменту по п. (1), где белок ROBO4 представляет собой белок, который имеет аминокислотную последовательность, состоящую из аминокислот №№1-1007 SEQ ID NO: 2;
(4) антителу или его функциональному фрагменту по п. (1), где белок ROBO4 представляет собой белок, который имеет аминокислотную последовательность, состоящую из аминокислот №№46-1007 SEQ ID NO: 2;
(5) антителу или его функциональному фрагменту по п. (3) или п. (4), где антитело или его функциональный фрагмент связывается с сайтом, который имеет аминокислотную последовательность, состоящую из аминокислот №№132-209 SEQ ID NO: 2;
(6) антителу или его функциональному фрагменту по п. (1), где антитело или его функциональный фрагмент представляет собой моноклональное антитело или его функциональный фрагмент;
(7) антителу или его функциональному фрагменту по одному из п.п. (1)-(6), где антитело состоит из тяжелой цепи, которая содержит CDRH1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 44 (фиг. 25), CDRH2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 46 (фиг. 26), или аминокислотной последовательности, выведенной из аминокислотной последовательности SEQ ID NO: 46 путем замены одной аминокислоты, и CDRH3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 48 (фиг. 27), и легкой цепи, которая содержит CDRL1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 50 (фиг. 28), или аминокислотной последовательности, выведенной из аминокислотной последовательности SEQ ID NO: 50 путем замены одной-трех аминокислоты(т), CDRL2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 52 (фиг. 29), и CDRL3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 54 (фиг. 30);
(8) антителу или его функциональному фрагменту по одному из п.п. (1)-(7), где антитело состоит из тяжелой цепи, которая содержит CDRH1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 44 (фиг. 25), CDRH2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 46 (фиг. 26), или аминокислотной последовательности, представленной в SEQ ID NO: 68 (фиг. 44), и CDRH3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 48 (фиг. 27), и легкой цепи, которая содержит CDRL1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 50 (фиг. 28), или аминокислотной последовательности, представленной в SEQ ID NO: 70 (фиг. 46), CDRL2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 52 (фиг. 29), и CDRL3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 54 (фиг. 30);
(9) антителу или его функциональному фрагменту по одному из п.п. (1)-(7), где антитело содержит вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной в SEQ ID NO: 31 (фиг. 16), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной в SEQ ID NO: 33 (фиг. 18);
(10) антителу или его функциональному фрагменту по одному из п.п. (1)-(8), где антитело содержит одну из вариабельных областей тяжелой цепи, выбранную из указанных ниже в подпунктах а)-г), и вариабельную область легкой цепи, выбранную из указанных в подпунктах д) и е):
а) вариабельная область тяжелой цепи (hMAb1-H1-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 56 (фиг. 32),
б) вариабельная область тяжелой цепи (hMAb1-Н2-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34),
в) вариабельная область тяжелой цепи (hMAb1-Н3-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 60 (фиг. 36), и
г) вариабельная область тяжелой цепи (hMAb1-Н4-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38); и
д) вариабельная область легкой цепи (hMAb1-L1-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40), и
е) вариабельная область легкой цепи (hMAb1-L2-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42);
(11) антителу или его функциональному фрагменту по одному из п.п. (1)-(8), где антитело содержит одну из следующих комбинаций 1)-6) вариабельной области тяжелой цепи и вариабельной области легкой цепи:
1) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40),
2) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42),
3) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42),
4) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40),
5) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 56 (фиг. 32), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40), и
6) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 60 (фиг. 36), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40);
(12) антителу или его функциональному фрагменту по одному из п.п. (1)-(11), где антитело или его функциональный фрагмент представляет собой химерное антитело или его функциональный фрагмент;
(13) антителу или его функциональному фрагменту по одному из п.п. (1)-(11), где антитело или его функциональный фрагмент представляет собой гуманизированное антитело или его функциональный фрагмент;
(14) антителу или его функциональному фрагменту по одному из п.п. (1)-(13), где антитело содержит константную область тяжелой цепи человеческого IgG1 или человеческого IgG2;
(15) антителу или его функциональному фрагменту по одному из п.п. (1)-(6), где антитело или его функциональный фрагмент связывается с сайтом на антигене, распознаваемым одним из антител по п.п. (7)-(14);
(16) антителу или его функциональному фрагменту по одному из п.п. (1)-(6), где антитело или его функциональный фрагмент конкурирует с одним из антител по п.п. (7)-(14) за связывание с белком ROBO4;
(17) антителу по одному из п.п. (1)-(8), где антитело содержит одну из следующих комбинаций 1)-6) тяжелой цепи и легкой цепи:
1) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 58 (фиг. 34), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-1140),
2) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 58 (фиг. 34), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 66 (фиг. 42) (Н-1143),
3) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 62 (фиг. 38), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 66 (фиг. 42) (Н-2143);
4) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 62 (фиг. 38), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-2140),
5) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 56 (фиг. 32), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-1040), и
6) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 60 (фиг. 36), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-2040);
(18) антителу, которое содержит модифицированную форму тяжелой цепи одного из антител по п. (17), где в указанной модифицированной форме отсутствует от одной до нескольких карбоксиконцевых аминокислот указанной тяжелой цепи, предпочтительно 1-8 карбоксиконцевая(ых) аминокислота(т) указанной тяжелой цепи, более предпочтительно 1-2 карбоксиконцевая(ых) аминокислота(т) указанной тяжелой цепи;
(19) антителу по одному из п.п. (1)-(6), где аминокислотная последовательность антитела идентична на 95% или более аминокислотной последовательности одного из антител по п. (17); имеет величину KD в отношении человеческого ROBO4, составляющую 1×10-8 или менее; подавляет или ингибирует миграцию сосудистых эндотелиальных клеток в отсутствии перекрестносшивающего антитела in vitro; и подавляет или ингибирует ангиогенез in vivo;
(20) антителу или его функциональному фрагменту по п. (15), где антитело или его функциональный представляет собой человеческое антитело или его функциональный фрагмент;
(21) нуклеотидной последовательности, выбранной из группы, представленной ниже в подпунктах (I)-(III):
(I) нуклеотидная последовательность, которая содержит нуклеотидную последовательность, кодирующую частичную или полную аминокислотную последовательность тяжелой цепи или легкой цепи антитела по одному из п.п. (1)-(20);
(II) нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, содержащей нуклеотидную последовательность, кодирующую частичную или полную аминокислотную последовательность тяжелой цепи или легкой цепи антитела по одному из п.п. (1)-(20), и
(III) нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, кодирующей частичную или полную аминокислотную последовательность тяжелой цепи или легкой цепи антитела по одному из п.п. (1)-(20);
(22) рекомбинантному вектору, содержащему встроенную в него нуклеотидную последовательность по п. (21);
(23) рекомбинантной клетке, содержащей нуклеотид по п. (21) или рекомбинантный вектор по п. (22), который интродуцирован в нее;
(24) клетке, продуцирующей антитело по одному из п.п. (1)-(20), где клетка предпочтительно представляет собой клетку млекопитающего, более предпочтительно СНО-клетку и еще более предпочтительно CHOK1SV;
(25) способу получения антитела или его функционального фрагмента по одному из п.п. (1)-(20), заключающемуся в том, что осуществляют стадии (I) и (II), на которых:
(I) культивируют клетку по п. (23) или п. (24); и
(II) собирают антитело или его функциональный фрагмент по одному из п.п. (1)-(20) из культуры, полученной на стадии (I);
(26) антителу или его функциональному фрагменту, полученному с помощью способа получения по п. (25);
(27) модифицированной форме антитела или его функционального фрагмента по одному из п.п. (1)-(20) и (26);
(28) фармацевтической композиции, содержащей антитело или его функциональный фрагмент по одному из п.п. (1)-(20) и (26) или его модифицированную форму по п. (27) в качестве действующего вещества;
(29) фармацевтической композиции по п. (28), где фармацевтическая композиция представляет собой средство для лечения или предупреждения ангиогенного заболевания;
(30) фармацевтической композиции по п. (28), где ангиогенное заболевание представляет собой экссудативную возрастную дегенерацию желтого пятна, диабетическую ретинопатию, макулярный отек, доброкачественную или злокачественную опухоль, атеросклероз, ретролентальную фиброплазию, ангиому, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативную ретинопатию, неоваскулярную глаукому, иммунное отторжение трансплантата ткани роговицы или других трансплантатов тканей, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение;
(31) фармацевтической композиции по п. (28), где ангиогенное заболевание представляет собой экссудативная возрастную дегенерацию желтого пятна, диабетическую ретинопатию, макулярный отек, ретролентальную фиброплазию, неоваскулярное заболевание глаза, пролиферативную ретинопатию, неоваскулярную глаукому или иммунное отторжение трансплантата ткани роговицы;
(32) ингибитору ангиогенеза, содержащему антитело или его функциональный фрагмент по одному из п.п. (1)-(20) и (26) или модифицированную форму по п. (27) в качестве действующего вещества;
(33) способу лечения или предупреждения ангиогенного заболевания, заключающемуся в том, что вводят индивидууму, который нуждается в этом, в эффективном количестве антитело или его функциональный фрагмент по одному из п.п. (1)-(20) и (26) или модифицированную форму по п. (27), или композицию по одному из п.п. (28)-(31), предпочтительно, если ангиогенное заболевание представляет собой ангиогенное заболевание у индивидуума, у которого имеет место экспрессия белка ROBO4; и
(34) фармацевтической композиции по одному из п.п. (28)-(31), где указанную композицию применяют в сочетании с другим терапевтическим или профилактическим средством, предпочтительно, если указанное средство представляет собой антиангиогенное лекарственное средство, противовоспалительное лекарственное средство и/или противораковое лекарственное средство.
Преимущества изобретения
Согласно настоящему изобретению можно получать терапевтическое средство или т.п. для лечения ангиогенного заболевания, содержащее антитело, которое связывается с ROBO4 и обладает антиангиогенным действием.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - диаграмма, демонстрирующая наличие или отсутствие изменения в репортерной активности в отношении NF-кВ, GAS, ISRE, промотора IL-8 или TCF как реагирующих элементов при кратковременной экспрессии человеческого ROBO4 в HEK293-клетках. «Усами» на диаграмме обозначено стандартное отклонение (n=3);
на фиг. 2 - диаграмма, демонстрирующая наличие или отсутствие изменения в активности промотора IL-8 при кратковременной экспрессии в HEK293-клетках полноразмерного белка ROBO4 или варианта человеческого ROBO4 с делецией внутриклеточной области. «Усами» на диаграмме обозначено стандартное отклонение (n=5 или 10);
на фиг. 3 - диаграмма, демонстрирующая изменение активности промотора IL-8 в трансфектированных человеческим ROBO4 HEK293-клетках, вызываемое антителом к ROBO4 MAb1. «Усами» на диаграмме обозначено стандартное отклонение (n=3);
на фиг. 4 - диаграмма, демонстрирующая изменение активности промотора IL-8 в трансфектированных человеческим ROBO4 HEK293-клетках, вызываемое антителом к ROBO4 MAb2, MAb3 или MAb4. «Усами» на диаграмме обозначено стандартное отклонение (n=3);
на фиг. 5 - диаграмма, демонстрирующая изменение способности к миграции HUVEC в присутствии VEGF или bFGF, вызываемое антителом к ROBO4 MAb1. «Усами» на диаграмме обозначено стандартное отклонение (n=3 или 4);
на фиг. 6 - диаграмма, демонстрирующая изменение способности к миграции HUVEC в присутствии bFGF, вызываемое антителом к ROBO4 MAb2, MAb3 или MAb4. «Усами» на диаграмме обозначено стандартное отклонение (n=4);
на фиг. 7 - диаграмма, демонстрирующая наличие или отсутствие связывающей активности антитела к ROBO4 MAb1 с человеческим ROBO4, мышиным ROBO4, крысиным ROBO4 или ROBO4 обезьян циномолгус;
на фиг. 8 - диаграмма, демонстрирующая наличие или отсутствие связывающей активности антитела к ROBO4 MAb1 с человеческим ROBO1, человеческим ROBO2 или человеческим ROBO3. В верхних прямоугольниках представлены результаты, касающиеся MAb1, а в нижних прямоугольниках представлены результаты, касающиеся применяемого в качестве положительного контроля антитела, с помощью которого подтверждали экспрессию указанных белков на клеточной поверхности;
на фиг. 9 - диаграмма, демонстрирующая наличие или отсутствие связывающей активности антитела к ROBO4 MAb1 в отношении варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен. В верхних прямоугольниках представлены результаты, касающиеся MAb1, а в нижних прямоугольниках представлены результаты, касающиеся антитела к FLAG, с помощью которого подтверждали экспрессию указанных белков на клеточной поверхности;
на фиг. 10 - диаграмма, демонстрирующая изменение в ангиогенезе на моделях индуцированной лазером хороидальной неоваскуляризации, вызываемое антителом к ROBO4 MAb1. «Усами» на диаграмме обозначено стандартное отклонение (n=4 глаза), и символом ■ или □ обозначены результаты для каждого глаза.
на фиг. 11 - диаграмма, демонстрирующая изменение в активности промотора IL-8 в трансфектированных человеческим ROBO4 HEK293-клетках, вызываемое химерным антителом к ROBO4 cMAb1-1 или cMAb1-2. «Усами» на диаграмме обозначено стандартное отклонение (n=3);
на фиг. 12 - диаграмма, демонстрирующая изменение способности к миграции HUVEC в присутствии bFGF, вызываемое химерным антителом к ROBO4 cMAb1-1 или cMAb1-2. «Усами» на диаграмме обозначено стандартное отклонение (n=4);
на фиг. 13 - кДНК, кодирующая полноразмерный человеческий ROBO4 (SEQ ID NO: 1);
на фиг. 14 - полноразмерная аминокислотная последовательность человеческого ROBO4 (SEQ ID NO: 2);
на фиг. 15 - нуклеотидная последовательность кДНК, кодирующей вариабельную область тяжелой цепи MAb1 (SEQ ID NO: 30);
на фиг. 16 - аминокислотная последовательность вариабельной области тяжелой цепи MAb1 (SEQ ID NO: 31);
на фиг. 17 - нуклеотидная последовательность кДНК, кодирующей вариабельную область легкой цепи MAb1 (SEQ ID NO: 32);
на фиг. 18 - аминокислотная последовательность вариабельной области легкой цепи MAb1 (SEQ ID NO: 33);
на фиг. 19 - нуклеотидная последовательность кДНК, кодирующей легкую цепь cMAb1 (SEQ ID NO: 37);
на фиг. 20 - аминокислотная последовательность легкой цепи cMAb1 (SEQ ID NO: 38);
на фиг. 21 - нуклеотидная последовательность кДНК, кодирующей тяжелую цепь cMAb1-1 (SEQ ID NO: 39);
на фиг. 22 - аминокислотная последовательность тяжелой цепи cMAb1-1 (SEQ ID NO: 40);
на фиг. 23 - нуклеотидная последовательность кДНК, кодирующей тяжелую цепь cMAb1-2 (SEQ ID NO: 41);
на фиг. 24 - аминокислотная последовательность тяжелой цепи cMAb1-2 (SEQ ID NO: 42);
на фиг. 25 - аминокислотная последовательность CDRH1 тяжелой цепи MAb1 (SEQ ID NO: 44);
на фиг. 26 - аминокислотная последовательность CDRH2 тяжелой цепи MAb1 (SEQ ID NO: 46);
на фиг. 27 - аминокислотная последовательность CDRH3 тяжелой цепи MAb1 (SEQ ID NO: 48);
на фиг. 28 - аминокислотная последовательность CDRL1 легкой цепи MAb1 (SEQ ID NO: 50);
на фиг. 29 - аминокислотная последовательность CDRL2 легкой цепи MAb1 (SEQ ID NO: 52);
на фиг. 30 - аминокислотная последовательность CDRL3 легкой цепи MAb1 (SEQ ID NO: 54);
на фиг. 31- нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-H1-типа (SEQ ID NO: 55);
на фиг. 32 - аминокислотная последовательность тяжелой цепи hMAb1-H1-типа (SEQ ID NO: 56);
на фиг. 33 - нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-Н2-типа (SEQ ID NO: 57);
на фиг. 34 - аминокислотная последовательность тяжелой цепи hMAb1-H2-типа (SEQ ID NO: 58);
на фиг. 35 - нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-Н3-типа (SEQ ID NO: 59);
на фиг. 36 - аминокислотная последовательность тяжелой цепи hMAb1-Н3-типа (SEQ ID NO: 60);
на фиг. 37 - нуклеотидная последовательность к ДНК, кодирующей тяжелую цепь hMAb1-Н4-типа (SEQ ID NO: 61);
на фиг. 38 - аминокислотная последовательность тяжелой цепи hMAb1-H4-типа (SEQ ID NO: 62);
на фиг. 39 - нуклеотидная последовательность к ДНК, кодирующей легкую цепь hMAb1-L1-типа (SEQ ID NO: 63);
на фиг. 40 - аминокислотная последовательность легкой цепи hMAb1-L1-типа (SEQ ID NO: 64);
на фиг. 41 - нуклеотидная последовательность кДНК, кодирующей легкую цепь hMAb1-L2-типа (SEQ ID NO: 65);
на фиг. 42 - аминокислотная последовательность легкой цепи hMAb1-L2-типа (SEQ ID NO: 66);
на фиг. 43 - аминокислотная последовательность CDRH1 тяжелой цепи hMAb1-H2- или hMAb1-Н4-типа (SEQ ID NO: 67);
на фиг. 44 - аминокислотная последовательность CDRH2 тяжелой цепи hMAb1-H2- или hMAb1-Н4-типа (SEQ ID NO: 68);
на фиг. 45 - аминокислотная последовательность CDRH3 тяжелой цепи hMAb1-H2- или hMAb1-Н4-типа (SEQ ID NO: 69);
на фиг. 46 - аминокислотная последовательность CDRL1 легкой цепи hMAb1-L2-типа (SEQ ID NO: 70);
на фиг. 47 - аминокислотная последовательность CDRL2 легкой цепи hMAb1-L2-типа (SEQ ID NO: 71);
на фиг. 48 - аминокислотная последовательность CDRL3 легкой цепи hMAb1-L2-типа (SEQ ID NO: 72);
на фиг. 49 - диаграмма, демонстрирующая изменение активности промотора IL-8 в трансфектированных человеческим ROBO4 HEK293-клетках, вызываемое Н-1040, Н-1 143, Н-1 140, Н-2040, Н- 2143 или Н-2140;
на фиг. 50 - диаграмма, демонстрирующая изменение способности к миграции HUVEC в присутствии bFGF, вызываемое Н-1143, Н-2140 или Н-2143. «Усами» на диаграмме обозначено стандартное отклонение (n=4);
на фиг. 51 - диаграмма, демонстрирующая межвидовую реактивность Н-1143;
на фиг. 52 - диаграмма, демонстрирующая межвидовую реактивность Н-2140.
на фиг. 53 - диаграмма, демонстрирующая межвидовую реактивность Н-2143;
на фиг. 54 - диаграмма, демонстрирующая специфичность связывания Н-1143, Н-2140 или Н-2143;
на фиг. 55 - диаграмма, демонстрирующая изменение ангиогенеза, выявленное на моделях индуцированной лазером хороидальной неоваскуляризации, вызываемое Н-2143. «Усами» на диаграмме обозначено стандартное отклонение (n=3-4 глаза).
Варианты осуществления изобретения
1. Определения
В настоящем изобретении «ген» означает нуклеотид(ы) или нуклеотидную последовательность, представляющую собой нуклеотидную последовательность, которая кодирует аминокислоты белка или комплементарную ей цепь. Подразумевается, что под понятие «ген» подпадают, например, полинуклеотид, олигонуклеотид, ДНК, мРНК, кДНК и кРНК в качестве нуклеотидной последовательности, содержащей нуклеотидную последовательность, которая кодирует аминокислоты белка или комплементарную ей цепь. Указанный ген является одноцепочечным, двухцепочечным, трехцепочечным или состоит из нуклеотидной последовательности с большим количеством цепей, при этом подразумевается, что под понятие «ген» подпадает также ассоциация цепей ДНК и РНК, смесь рибонуклеотидов (РНК) и дезоксирибонуклеотидов (ДНК) на одной нуклеотидной цепи и двухцепочечная или трехцепочечная, или состоящая из большего количества цепей нуклеотидная последовательность, содержащая указанную нуклеотидную цепь. Примеры «гена ROBO4», предлагаемого в настоящем изобретении, могут включать ДНК, мРНК, кДНК и кРНК, которые содержат нуклеотидную последовательность, кодирующую аминокислотную последовательность белка ROBO4. В настоящем изобретении понятие «нуклеотид(ы)» или «нуклеотидная последовательность» имеют такое же значение, что и понятие «нуклеиновая кислота», при этом подразумевается, что под него подпадают, например, ДНК, РНК, зонд, олигонуклеотид, полинуклеотид и праймер. Указанная нуклеотидная последовательность является одноцепочечной, двухцепочечной, трехцепочечной или представляет собой нуклеотид с большим количеством цепей, и под понятие «нуклеотидная» последовательность подпадает также ассоциация цепей ДНК и РНК, смесь рибонуклеотидов (РНК) и дезоксирибонуклеотидов (ДНК) на одной нуклеотидной цепи и ассоциация двух цепей или трех цепей или большего количества цепей, содержащая указанную нуклеотидную цепь.
В настоящем изобретении понятия «полипептид», «пептид» и «белок» имеют одинаковое значение.
В настоящем изобретении понятие «антиген» применяют также в значении «иммуноген».
В настоящем изобретении понятие «клетка» включает также различные клетки, выведенные из организма отдельных животных, клетки в субкультурах, первичные культивируемые клетки, клеточные линии, рекомбинантные клетки и т.п.
В настоящем изобретении антитело, распознающее белок ROBO4, обозначают также как «антитело к ROBO4». Понятие «антитело к ROBO4» включает химерное антитело к ROBO4, гуманизированное антитело к ROBO4, человеческое антитело к ROBO4 и т.п.
В настоящем изобретении понятие «функциональный фрагмент антитела» означает фрагмент антитела, который обладает по меньшей мере одной из функций, например, аффинностью связывания (величина KD) исходного антитела. Примерами «функционального фрагмента антитела» могут служить (но, не ограничиваясь только ими) Fab, F(ab')2, scFv, Fab', одноцепочечный иммуноглобулин и т.п. Указанный функциональный фрагмент антитела можно получать обработкой полноразмерной молекулы белка антитела ферментом, таким как папаин или пепсин, или он может представлять собой рекомбинантный белок, продуцируемый в соответствующей клетке-хозяине с помощью рекомбинантного гена. Предпочтительные «функциональные фрагменты» также обладают по меньшей мере одним видом биологической активности исходного антитела.
Кроме того, в контексте настоящего изобретения нуклеотидная последовательность, кодирующая «частичную аминокислотную последовательность» тяжелой или легкой цепи, представляет собой или включает нуклеотидную последовательность, которая кодирует «функциональный фрагмент антитела», как он описан выше.
В настоящем изобретении «сайт», с которым связывается антитело, т.е. «сайт», распознаваемый антителом, означает частичный пептид или частичную конформацию на антигене, который/которая связывается с антителом или распознается им. В настоящем изобретении указанный сайт обозначают также как эпитоп или антителосвязывающий сайт. Примерами сайтов на белке ROBO4, которые связываются или распознаются антителом к ROBO4, предлагаемом в настоящем изобретении, могут служить частичный пептид или частичная конформация на белке ROBO4.
Как известно, каждая из тяжелых и легких цепей молекулы антитела имеет три определяющих комплементарность области (CDR). Определяющие комплементарность области называют также гипервариабельными участками (доменами). Они локализованы в вариабельных областях тяжелых и легких цепей антител. Эти сайты имеют наиболее высоковариабельную первичную структуру и, как правило, находятся в трех различных положениях на соответствующих первичных структурах полипептидных цепей тяжелых и легких цепей. В настоящем изобретении гипервариабельные участки антитела обозначают как CDRH1, CDRH2 и CDRH3, начиная с аминоконца аминокислотной последовательности тяжелой цепи в случае гипервариабельных участков тяжелой цепи, и как CDRL1, CDRL2 и CDRL3, начиная с аминоконца аминокислотной последовательности легкой цепи в случае гипервариабельных участков легкой цепи. Эти сайты находятся в тесной близости друг с другом на трехмерной структуре и определяют специфичность в отношении антигена, с которым они должны связываться.
В настоящем изобретении «мутант антитела» означает полипептид, который имеет аминокислотную последовательность, выведенную из аминокислотной последовательности исходного антитела путем замены, делеции, добавления и/или инсерции (которые далее в контексте настоящего описания обозначают в целом как «мутация») аминокислоты(т), и который связывается с белком ROBO4, предлагаемым в настоящем изобретении. Количество мутантных аминокислот в указанном мутанте антитела составляет от 1 до 2, от 1 до 3, от 1 до 4, от 1 до 5, от 1 до 6, от 1 до 7, от 1 до 8, от 1 до 9, от 1 до 10, от 1 до 12, от 1 до 15, от 1 до 20, от 1 до 25, от 1 до 30, от 1 до 40 или от 1 до 50. В настоящем изобретении указанный мутант антитела также подпадает под понятие «антитело».
В настоящем изобретении понятие «несколько» в выражении «1 или несколько» означает 2-10, предпочтительно 2-8, более предпочтительно 2.
Примерами видов активности или свойств, характерных для антитела, предлагаемого в настоящем изобретении, могут являться виды биологический активности или физико-химические свойства и их конкретными примерами могут служить различные виды биологической активности, активность связывания с антигеном или эпитопом, стабильность в процессе производства или хранения и термостабильность.
В настоящем изобретении понятие «гибридизация в строгих условиях» означает гибридизацию в условиях, включающих гибридизацию при 65°С в растворе, содержащем 5×SSC, с последующей отмывкой при 65°С в течение 20 мин в водном растворе, содержащем 2×SSC-0,1% ДСН, при 65°С в течение 20 мин в водном растворе, содержащем 0,5×SSC-0,1% ДСН, и при 65°С в течение 20 мин в водном растворе, содержащем 0,2×SSC-0,1% ДСН, или гибридизацию в условиях, эквивалентных указанным. SSC означает водный раствор, содержащий 150 мМ NaCl-15MM цитрат натрия, a n×SSC означает SSC в n-кратной концентрации.
2. Белок ROBO4
В контексте настоящего описания понятия «ROBO4» и «белок ROBO4» используют взаимозаменяемо.
(2-1) Свойства
Белок ROBO4, предлагаемый в настоящем изобретении, обладает следующими свойствами:
(I) ROBO4 имеет молекулярную массу примерно 110 кДа и однократно пересекающую липидный бислой трансмембранную структуру, и он является рецепторным белком белка SLIT2, участвующего в ангиогенезе. Любой белок ROBO4, предлагаемый в настоящем изобретении, может присутствовать в высвободившейся из мембраны форме, например, из клеточной мембраны, и может находиться в связанной с мембраной форме, например, с клеточной мембраной. В этом контексте молекулярная масса означает кажущуюся молекулярную массу, определенную с помощью ДСН-ПААГ в невосстанавливающих условиях. N-концевая внеклеточная область ROBO4 содержит два иммуноглобулинподобных домена (далее в контексте настоящего описания обозначены как «Ig-подобные домены») и два домена фибронектина типа III, а его С-концевая внутриклеточная область содержит богатую белком область. В контексте настоящего описания указанных два иммуноглобулинподобных домена обозначают как Ig-подобный домен 1 и Ig-подобный домен 2 соответственно, начиная с аминоконца. Человеческий белок ROBO4 состоит из аминокислотной последовательности, состоящей из аминокислот №№28-1007 SEQ ID NO: 2. Аминокислоты №№1-27 SEQ ID NO: 2 соответствуют секреторному сигналу; аминокислоты №№28-467 указанной последовательности соответствуют внеклеточной области; аминокислоты №№46-131 соответствуют Ig-подобному домену 1; аминокислоты №№137-224 соответствуют Ig-подобному домену 2; аминокислоты №№252 -340 соответствуют домену 1 фибронектина типа III; аминокислоты №№347-438 соответствуют домену 2 фибронектина типа III; аминокислоты №№468-490 соответствуют области в клеточной мембране; и аминокислоты №№491-1007 соответствуют внутриклеточной области.
(II) ROBO4 обладает антиангиогенным действием. В настоящем изобретении понятие «антиангиогенез» означает, что молекула непосредственно или косвенно подавляет и/или ингибирует ангиогенез сама по себе, вместе с другим фактором, или в ассоциации с другим фактором. Антиангиогенное действие можно оценивать, используя, например, в качестве критерия подавляющее действие в отношении повышения проницаемости сосудов, активности, стимулирующей клеточную миграцию, или активности в отношении образовании полости в присутствии VEGF.
(III) ROBO4 содержит аминокислотную последовательность, указанную в одном из представленных ниже подпунктов (а) - (д) (далее в контексте настоящего описания обозначена как «аминокислотная последовательность ROBO4»), состоит из аминокислотной последовательности, которая содержит аминокислотную последовательность ROBO4, или состоит из аминокислотной последовательности ROBO4:
(а) аминокислотная последовательность, представленная в SEQ ID NO: 2 (фиг. 14);
(б) аминокислотная последовательность полипептида, последовательность которого на 80% или более, на 82% или более, на 84% или более, на 86% или более, на 88% или более, на 90% или более, на 92% или более, на 94% или более, на 96% или более, на 98% или более, или на 99% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 2 (фиг. 14), и обладает антиангиогенным действием;
(в) аминокислотная последовательность полипептида, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 2 (фиг. 14), которая имеет замену, делецию, добавление или инсерцию 1-50, 1-45, 1-40, 1-5, 1-30, 1-25, 1-20, 1-15, 1-10, 1-8, 1-6, 1-5, 1-4, 1-3, 1-2 или 1 аминокислоты(т), и подавляет ангиогенез;
(г) аминокислотная последовательность полипептида, который содержит аминокислотную последовательность SEQ ID NO: 2, имеющую делецию аминокислот №№1-45 или 1-131, и подавляет ангиогенез; и
(д) аминокислотная последовательность полипептида, который кодируется нуклеотидной последовательностью нуклеотида, гибридизующегося в строгих условиях с нуклеотидом, который имеет нуклеотидную последовательность, комплементарную нуклеотидной последовательности, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO: 2 (фиг. 14), и подавляет ангиогенез.
Белок ROBO4 может присутствовать в виде полного белка или в виде части ассоциации гомо- или гетероолигомера, состоящей из двух или большего количества субъединиц.
Аминокислотная последовательность и/или другие свойства белка ROBO4 могут не являться ни одинаковыми, ни гомогенными в организме индивидуума, ткани, общей воде организма, клетке, содержащей белок ROBO4 фракции, препарате очищенного или частично очищенного белка ROBO4 или т.п. или среди множества индивидуумов, тканей, клеток, содержащих белок ROBO4 фракций или препаратов белка ROBO4. Один/одна индивидуум, ткань, общая вода организма, клетка, содержащая белок ROBO4 фракция, препарат очищенного или частично очищенного белка ROBO4 или т.п. может содержать множество типов белков ROBO4, отличающихся по аминокислотной последовательности и/или свойству. Альтернативно этому, множество индивидуумов, тканей, клеток, содержащих белок ROBO4 фракций или препаратов белка ROBO4 могут отличаться по аминокислотной последовательности и/или другим свойствам белка ROBO4. Даже такие белки, которые отличаются друг от друга по аминокислотной последовательности и/или свойствам, все подпадают под понятие «белок ROBO4», предлагаемый в настоящем изобретении, если они обладают особенностями, указанными выше в подпунктах (I)-(III).
(IV) Белок ROBO4, предлагаемый в настоящем изобретении, можно получать из ткани позвоночного животного, предпочтительно млекопитающего, более предпочтительно грызуна, такого как мышь или крыса, или человека, еще более предпочтительно из тканей человека или мыши, клеток, выведенных из указанной ткани, культур указанных клеток и т.п. Изобретение не ограничено конкретной тканью или клеткой, если они содержат белок ROBO4. Их примерами являются ткани суставов, кровь, лимфа, вилочковая железа, селезенка, и клетки, выведенные из любой из них. Предпочтительными тканями и клетками являются ткани и клетки, выведенные из животных или пациентов, у которых имеет место ангиогенез. Однако происхождение белка ROBO4, предлагаемого в настоящем изобретении, не ограничено указанными выше, и согласно настоящего изобретению белок ROBO4 включает также даже белки ROBO4, выведенные из других видов животных, других тканей, других клеток или т.п., если они обладают особенностями, указанными выше в подпунктах (I)-(III).
Белок ROBO4, предлагаемый в настоящем изобретении, может представлять собой любой из нативных и рекомбинантных белков. Подразумевается также, что белок ROBO4 включает слитые продукты с другим пептидом или белком, таким как носитель или метка. Подразумевается также, что белок ROBO4 включает формы, полученные с помощью химической модификации, включающей добавление полимера, такого как ПЭГ, и/или биологической модификации, включающей модификацию сахарной цепи. Кроме того, подразумевается, что белок ROBO4, предлагаемый в настоящем изобретении, включает фрагмент белка ROBO4. Фрагмент белка ROBO4, обладающий особенностью, указанной выше в подпункте (II), обозначают как функциональный фрагмент белка ROBO4.
(2-2) Ген ROBO4
Ген ROBO4, предлагаемый в настоящем изобретении, содержит нуклеотидную последовательность, указанную в одном из представленных ниже подпунктов (а)-(в) (далее в контексте настоящего описания обозначена как «генная последовательность ROBO4»), состоит из нуклеотидной последовательности, которая содержит генную последовательность ROBO4, или состоит из следующей генной последовательности ROBO4:
(а) нуклеотидная последовательность, представленная в SEQ ID NO: 1 (фиг. 13);
(б) нуклеотидная последовательность, которая гибридизуется в строгих условиях с нуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, представленной в SEQ ID NO: 1 (фиг. 13), кодирует аминокислотную последовательность полипептида, подавляющего ангиогенез; и
(в) нуклеотидная последовательность, которая содержит нуклеотидную последовательность, представленную в SEQ ID NO: 1 (фиг. 13), имеющую замену, делецию, добавление или инсерцию 1-150, 1-140, 1-130, 1-120, 1-110, 1-100, 1-90, 1-80, 1-70, 1-60, 1-50, 1-45, 1-40, 1-30, 1-25, 1-20, 1-15, 1-10, 1-8, 1-6, 1-5, 1-4, 1-3, 1 или 2 или 1 основания(ий), и кодирует аминокислотную последовательность полипептида, подавляющего ангиогенез.
Для гена ROBO4 характерная сверхэкспрессия в кровеносных сосудах в фиброваскулярных мембранах или сосудах внутри опухоли пациентов, которые страдают сопровождающимся ангиогенезом заболеванием, например, пролиферативной диабетической ретинопатией. Кроме того, ген ROBO4, вероятно, сверхэкспрессируется во фракциях тканей или крови, полученных из организма пациентов, пораженных заболеванием, которое может включать ангиогенез, таким как экссудативная возрастная дегенерация желтого пятна, макулярный отек, атеросклероз, ретролентальная фиброплазия, ангиома, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативная ретинопатия, неоваскулярная глаукома, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение, или из животных, на которых моделируют указанные заболевания.
Экспрессию и уровень экспрессии гена ROBO4 можно оценивать с использованием в качестве критерия любого продукта транскрипции гена ROBO4 и белка ROBO4 и можно определять с помощью ОТ-ПЦР, гибридизации методом Нозерн-блоттинга или п.т. в качестве начального показателя и с помощью иммуноанализа (например, твердофазного иммуноферментного анализа; далее в контексте настоящего описания обозначен как «ELISA») или т.п. в качестве окончательного показателя.
(2-3) Получение белка
Белок ROBO4, предлагаемый в настоящем изобретении, можно очищать или выделять из тканей животных (включая общую воду организма), клеток, выведенных из тканей, или культур клеток и получать с помощью генетической рекомбинации, трансляции in vitro, химического синтеза и т.д.
(2-3-1) Очистка или выделение нативного ROBO4
Нативный белок ROBO4 можно очищать или выделять, например, из тканей (включая общую воду организма, клетки и т.д.), выведенных из организма пациентов или животных кроме человека, пораженных ангиогенным заболеванием, таким как экссудативная возрастная дегенерация желтого пятна, диабетическая ретинопатия, макулярный отек, доброкачественная или злокачественная опухоль, атеросклероз, ретролентальная фиброплазия, ангиома, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативная ретинопатия, неоваскулярная глаукома, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение, клеток, выведенных из указанных тканей, или культур клеток. Указанные животные кроме человека представляют собой также животных, на которых моделируют указанные заболевания. Животные, применяемые для создания модели, не ограничены конкретным видом, если они принадлежат к позвоночным. Животные предпочтительно представляют собой млекопитающих, более предпочтительно грызунов, таких как мыши или крысы, еще более предпочтительно мышей или крыс. Ткани и клетки указанных пациентов или животных моделей не ограничены конкретными типами, если они содержат белок ROBO4. Их примерами могут служить ткани суставов, кровь, лимфа, вилочковая железа, селезенка и клетки, выведенные из любой указанной ткани. Предпочтительные ткани и клетки выводят из пациентов или животных моделей, которые имеют ангиогенез или которые обладают сходными симптомами. Однако исходный белок ROBO4, предлагаемый в настоящем изобретении, не ограничен указанными выше, и белок ROBO4, предлагаемый в настоящем изобретении, можно выводить из других видов животных, других тканей, других клеток или т.п.
Очистку или выделение из указанных тканей, клеток, культур клеток или т.п. можно осуществлять с использованием комбинации подходов, хорошо известных специалистам в данной области, таких как фракционирование и хроматография. Указанные подходы включают (но, не ограничиваясь только ими) обессоливание, гель-фильтрацию, ионообменную хроматографию, аффинную хроматографию, гидрофобную хроматографию, хроматографию с нормальной фазой или обращенной фазой и т.п. Можно приготавливать и вносить в колонку аффинный гель, перекрестно сшитый с моноклональным антителом к ROBO4, получая тем самым колонку для аффинной хроматографии. Неочищенную или частично очищенную фракцию, содержащую белок ROBO4, добавляют в такую колонку. Затем неспецифическую адсорбированную субстанцию удаляют с помощью стерилизованного забуференного фосфатом физиологического раствора (ЗФР) и затем можно добавлять буферный раствор для элюции и тем самым осуществлять избирательный сбор белка ROBO4. Раствор, содержащий белок ROBO4, можно подвергать гель-фильтрации или осуществлять замену буфера и/или концентрирование с использованием концентратора, такого как Centriprep.
(2-3-2) Получение рекомбинантного белка ROBO4
Белок ROBO4, предлагаемый в настоящем изобретении, можно получать также в рекомбинантной форме. В частности, клетки-хозяева трансфектируют геном, кодирующим аминокислотную последовательность белка ROBO4 или фрагмента белка ROBO4, и белок ROBO4 можно собирать из культур клеток. Например, ген ROBO4 или его фрагмент встраивают в экспрессионный вектор. Затем прокариотические или эукариотические клетки трансфектируют полученным рекомбинантным вектором и полученные рекомбинантные клетки можно инкубировать для экспрессии белка ROBO4. Можно применять схему экспрессии, известную в данной области, такую как секреторная экспрессия, внутриклеточная экспрессия растворимых форм, или метод на основе телец включения. Кроме того, белок ROBO4 можно экспрессировать не только в виде молекулы, имеющей такой же аминоконец (N-конец) и/или карбоксиконец (С-конец), что и в нативной форме, но также и в виде слитого белка с сигналом секреции, сигналом внутриклеточной локализации, меткой для аффинной очистки или пептидом-партнером. Белок ROBO4 можно очищать или выделять из рекомбинантных клеточных культур с использованием соответствующей комбинации операций, таких как фракционирование и хроматография, которые описаны в разделе (2-3-1) «Очистка или выделение нативного ROBO4».
Ген ROBO4 или его фрагмент можно получать с помощью метода, хорошо известного специалистам в данной области.
Их примеры включают полимеразную цепную реакцию (далее в контексте настоящего описания обозначена как «ПЦР»; Saiki R.K. и др., Science, 239, 1988, сс. 487-489) с использованием экспрессионной библиотеки кДНК ROBO4 в качестве матрицы с применением одного набора праймеров, обеспечивающих специфичность амплификации последовательности; ПЦР с обратной транскрипцией (далее в контексте настоящего описания обозначена как ОТ-ПЦР) с использованием фракции мРНК для экспрессии ROBO4 в качестве матрицы с применением праймера, обеспечивающего обратную транскрипцию последовательности и одного набора праймеров, обеспечивающих специфичность амплификации последовательности; экспрессионное клонирование с использованием иммуноанализа; и клонирование кДНК с использованием частичной аминокислотной последовательности очищенного белка ROBO4.
(2-3-3) Трансляция in vitro
Белок ROBO4, предлагаемый в настоящем изобретении, можно получать также с помощью трансляции in vitro. Указанный метод трансляции не ограничен каким-либо конкретным методом, если его можно применять для бесклеточной системы трансляции, которая включает ферменты, необходимые для транскрипции и трансляции, субстраты и энергетические субстанции. Примеры могут включать метод с использованием быстрой системы трансляции (RTS), изготовленной фирмой Roche Diagnostics.
(2-3-4) Химический синтез
Белок ROBO4, предлагаемый в настоящем изобретении, можно получать также с помощью химического синтеза. Примеры методов химического синтеза могут включать методы твердофазного пептидного синтеза, такие как методы синтеза с использованием Fmoc и Boc.
3. Антитело к ROBO4
(3-1) Тип антитела к ROBO4
Антитело, предлагаемое в настоящем изобретении, может представлять собой любое из моноклональных и поликлональных антител. Примерами моноклональных антител, предлагаемых в настоящем изобретении, могут служить антитело, выведенное из организма животного кроме человека (антитело животного кроме человека), антитело, выведенное из организма человека (человеческое антитело), химерное антитело и гуманизированное антитело, предпочтительно химерное антитело, гуманизированное антитело и выведенное из организма человека антитело (человеческое антитело), более предпочтительно гуманизированное антитело и выведенное из организма человека антитело (человеческое антитело).
Примерами антител, выведенных из организма животного кроме человека, могут служить антитела из позвоночных животных, таких как млекопитающие и птицы. Примерами антител, выведенных из организма млекопитающих, могут служить антитела, выведенные из организма грызунов, такие как мышиные антитела и крысиные антитела. Примерами антител, выведенных из организма птиц, могут служить куриные антитела.
Примерами химерного антитела могут служить (но, не ограничиваясь только ими) антитело, которое содержит вариабельные области антитела, выведенного из организма животного кроме человека, связанные с константными областями человеческого антитела (человеческий иммуноглобулин). Примерами вариабельных областей антитела, выведенного из организма животного кроме человека, могут служить вариабельные области тяжелых и легких цепей из описанного ниже MAb1.
Примерами гуманизированного антитела могут служить (но, не ограничиваясь только ими) человеческое антитело (вариабельные области человеческого иммуноглобулина) с трансплантированными в вариабельные области CDR антитела животного кроме человека, человеческое антитело с трансплантированными CDR, а также с частичными последовательностями каркасных участков из антитела животного кроме человека, и антитело, имеющее аминокислоту(ы) человеческого антитела, замененную(ые) на одну или две, или большее количество аминокислоту(т) из антитела животного кроме человека, в любом из указанных гуманизированных антител. Примерами CDR в вариабельных областях антитела животного кроме человека могут служить CDRH1-3 в вариабельной области тяжелой цепи и CDRL1-3 в вариабельной области легкой цепи, выведенные из описанного ниже MAb1.
Человеческое антитело не ограничено каким-либо конкретным антителом, если оно представляет собой антитело, которое распознает антиген, предлагаемый в настоящем изобретении. Их примерами могут служить человеческое антитело, связывающееся в тем же сайтом, с которым связывается антитело, имеющее CDR, предлагаемые в настоящем изобретении, и человеческое антитело, связывающееся с тем же сайтом на ROBO4, с которым связывается описанное выше MAb1.
Антитело, предлагаемое в настоящем изобретении, может представлять собой антитело, состоящее из сайтов, выведенных из множества различных антител. Его примерами могут служить антитело, содержащее тяжелые и/или легкие цепи, обмененные на цепи множества различных антител, антитело, содержащее полноразмерные тяжелые и/или легкие цепи, обмененные друг на друга, антитело, содержащее вариабельные или константные области, обмененные друг на друга, и антитело, содержащее все или некоторые CDR, обмененные друг на друга. Вариабельные области тяжелых и легких цепей можно выводить из различных антител, предлагаемых в настоящем изобретении. CDRH1-3 и CDRL1-3 в вариабельных областях тяжелых и легких цепей гуманизированного антитела можно выводить из двух или большего количества различных антител, предлагаемых в настоящем изобретении. CDRH1-3 и CDRL1-3 в вариабельных областях тяжелых и легких цепей человеческого антитела могут представлять собой комбинацию CDR, входящих в два или большее количество различных антител, предлагаемых в настоящем изобретении.
Изотип моноклонального антитела, предлагаемого в настоящем изобретении, не ограничен конкретным изотипом, и их примеры включают IgG, такой как IgG1, IgG2, IgG3 и IgG4, IgM, IgA, такой как IgA1 и IgA2, IgD и IgE и могут предпочтительно включать IgG и IgM, более предпочтительно IgG2. Изотип и подкласс моноклонального антитела можно определять, например, с помощью теста Оухтерлони, ELISA, радиоиммуноанализа (далее в контексте настоящего описания обозначен как «РИА»). Можно применять поступающие в продажу наборы для идентификации (набор Mouse Typer производства фирмы Bio-Rad Laboratories, Inc., набор RAT MONOCLONAL ANTIBODY ISOTYPING TEST производства фирмы AbD Serotec, и т.д.)
(3-2) Специфичность связывания антитела к ROBO4
Антитело, предлагаемое в настоящем изобретении, распознает белок ROBO4. Другими словами, антитело, предлагаемое в настоящем изобретении, связывается с белком ROBO4. Такое антитело обозначают как «антитело к ROBO4». Более того, предпочтительное антитело, предлагаемое в настоящем изобретении, специфически распознает белок ROBO4. Другими словами, предпочтительное антитело, предлагаемое в настоящем изобретении, специфически связывается с белком ROBO4. Кроме того, более предпочтительное антитело, предлагаемое в настоящем изобретении, специфически связывается с Ig-подобным доменом, имеющимся в белке ROBO4. Примерами указанного Ig-подобного домена могут служить Ig-подобный домен 1 и Ig-подобный домен 2. Более предпочтительное антитело, предлагаемое в настоящем изобретении, распознает область, которая имеет аминокислотную последовательность, состоящую из аминокислот №№132-209 SEQ ID NO: 2. Антитело, предлагаемое в настоящем изобретении, связывается с человеческим белком ROBO4, обезьяньим (предпочтительно обезьян циномолгус) белком ROBO4 и кроличьим белком ROBO4, но не связывается с мышиным и крысиным белками ROBO4 (данные о межвидовой реактивности см. в примере 4)-3 и примере 11)-4).
В настоящем изобретении «специфически распознает», т.е. «специфически связывается» означает связывание, которое не является неспецифической адсорбцией. Примером критериев определения того, является ли связывание специфическим или нет, может служить константа диссоциации (далее обозначена как «KD»). Предпочтительное антитело, предлагаемое в настоящем изобретении, имеет величину KD, составляющую 1×10-5 или менее, 5×10-6 или менее, 2×10-6 или менее или 1×10-6 или менее, более предпочтительно 5×10-7 или менее, 2×10-7 или менее или 1×10-7 или менее, еще более предпочтительно 5×10-8 или менее, 2×10-8 или менее, или 1×10-8 или менее, еще более предпочтительно 5×10-9 или менее, 2×10-9 или менее или 1×10-9 или менее, наиболее предпочтительно 5×10-10 или менее, 2×10-10 или менее или 1×10-10 или менее, в отношении белка ROBO4. Более конкретно предпочтительное антитело, предлагаемое в настоящем изобретении, имеет величину KD, составляющую 2×10-8 или менее, более предпочтительно 1×10-8 или менее, еще более предпочтительно 5×10-9 или менее, в отношении белка ROBO4.
В настоящем изобретении связывание антитела с антигеном можно оценивать или определять с помощью анализов ELISA, РИА, поверхностного плазменного резонанса (далее в контексте настоящего описания обозначен как «ППР») или т.п. Примерами оборудования, применяемого для ППР-анализа, могут служить BIAcore™ (производства фирмы GE Healthcare Bio-Sciences Crop.), ProteOn™ (производства фирмы Bio-Rad Laboratories, Inc.), SPR-Navi™ (производства фирмы BioNavis Oy Ltd.), Spreeta™ (производства фирмы Texas Instruments Inc.), SPRi-PlexII™ (производства фирмы Horiba, Ltd.) и Autolab SPR™ (производства фирмы Metrohm). Связывание антитела с антигеном, экспрессируемым на клеточной поверхности, можно оценивать с помощью проточной цитометрии или т.п.
(3-3) Антиангиогенная активность in vitro антитела к ROBO4
Антитело, предлагаемое в настоящем изобретении, обладает антиангиогенной активностью в отсутствии перекрестносшивающего антитела in vitro. Известно, что некоторые антитела не обладают фармакологической активностью в отсутствии перекрестносшивающего антитела in vitro, но проявляют фармакологическую активность в отсутствии перекрестносшивающего антитела in vivo (Cancer Cell, 19, 2011, сс. 101-113). Это, вероятно, происходит вследствие того, что лейкоциты, как известно, экспрессируют in vivo Fcγ-рецептор, имеющий такие же функции, что и перекрестносшивающее антитело (Nature, 8, 2008, сс. 34-47); в результате антитела проявляют фармакологическую активность посредством перекрестного связывания в присутствии лейкоцитов даже без перекрестносшивающего антитела. Однако фактически в организмах количество лейкоцитов в повреждениях различается между индивидуумами (Cancer Res, 71, 2011, сс. 5670-5677), что, вероятно, приводит к тому, что среди индивидуумов различные действия антител, обладающих фармакологической активностью, зависят перекрестной связи, индуцируемой лейкоцитами. Антитело, предлагаемое в настоящем изобретении, обладает очень высокой антиангиогенной активностью in vitro даже в отсутствии перекрестносшивающего антитела. Таким образом, антитело, предлагаемое в настоящем изобретении, может обладать антиангиогенным действии вне зависимости от количества лейкоцитов in vivo и в результате является фармацевтически приемлемым.
Антиангиогенная активность обозначает активность, подавляющую рост, миграцию сосудистых эндотелиальных клеток, образование полости и т.д. Антиангиогенную активность in vitro можно оценивать с помощью анализа проницаемости сосудов, миграции сосудистых эндотелиальных клеток или образования полости.
Например, анализ проницаемости сосудов, применяемый для указанной оценки, может включать инокуляцию здоровых эндотелиальных клеток пупочной вены человека (HUVEC) в верхний слой камеры Бойдена, имеющей размер пор 1 мкм, с формированием одного слоя и последующее измерение количества меченного с помощью ФИТЦ декстрана или т.п., проникающего через клеточный слой. Количество меченного с помощью ФИТЦ декстрана, проникающего через клеточный слой, можно измерять, используя, например, анализ проницаемости сосудов in vitro (In Vitro Vascular Permeability Assay) (каталожный № ECM640, производство фирмы Millipore Corp.). Когда антитело, добавленное в концентрации 5 мкг/мл или ниже, оказывает действие, проявляющееся в снижении количества меченного с помощью ФИТЦ декстрана, проникающего через клеточный слой, то указанное антитело рассматривают как обладающее подавляющим действием на проницаемость сосудов и имеющее антиангиогенную активность. Антитело, предлагаемое в настоящем изобретении, обладает подавляющей активностью в отношении проницаемости сосудов в концентрации предпочтительно 5 мкг/мл или менее, более предпочтительно 1 мкг/мл или менее, наиболее предпочтительно 0,5 мкг/мл или менее в описанных выше условиях измерения.
Анализ клеточной миграции для такой оценки может включать инокуляцию HUVEC в верхний слой камеры Бойдена, имеющей размер пор от 3 до 8 мкм, добавление среды, содержащей усилитель миграции эндотелиальных клеток, такой как VEGF, в нижний слой и измерение количества клеток, мигрирующих в нижний слой. Когда антитело обладает способностью снижать количество мигрирующих клеток HUVEC, то это антитело можно рассматривать как обладающее подавляющим действием на миграцию сосудистых эндотелиальных клеток и обладающее антиангиогенной активностью. Количество мигрирующих клеток можно измерять, используя, например, систему для анализа миграции сосудистых эндотелиальных клеток (каталожный №354143, производство фирмы BD Biosciences). Антитело, предлагаемое в настоящем изобретении, обладает подавляющей активностью в отношении клеточной миграции в концентрации предпочтительно 5 мкг/мл или менее, более предпочтительно 1 мкг/мл или менее, наиболее предпочтительно 0,5 мкг/мл или менее в описанных выше условиях измерения.
Анализ образования полости при такой оценке может включать инокуляцию HUVEC в контейнер для клеточной культуры, покрытый Матригелем, и измерение количества точек ответвления, длины трубки или т.п. структуры полости, сформированной HUVEC на Матригеле.
Когда антитело обладает способностью снижать количество точек ответвления или длину трубки структуры полости, то это антитело можно рассматривать как обладающее подавляющим действием в отношении образования полости и обладающее антиангиогенной активностью. Количество точек ответвления или длину трубки структуры полости можно измерять, например, с помощью системы анализа образования трубки из сосудистых эндотелиальных клеток (каталожный №354149, производство фирмы BD Biosciences). Антитело, предлагаемое в настоящем изобретении, обладает подавляющей активностью в отношении образования полости в концентрации предпочтительно 5 мкг/мл или менее, более предпочтительно 1 мкг/мл или менее, наиболее предпочтительно 0,5 мкг/мл или менее в описанных выше условиях измерения.
Указанные тесты не ограничены указанными системами анализов, если они позволяют оценивать ангиогенез и его подавление, индуцированное белком ROBO4.
Под перекрестносшивающим антителом подразумевают антитело, которое связывается с Fc-областью антитела, предлагаемого в настоящем изобретении, и обладает способностью перекрестно связывать две или большее количество молекул антител, предлагаемых в настоящем изобретении. Например, когда Fc-область антитела, предлагаемого в настоящем изобретении, выводят из антитела мышей, то перекрестносшивающее антитело означает антитело, которое связывается с мышиной Fc-областью и ассоциирует две или большее количество молекул антител, предлагаемых в настоящем изобретении, посредством связывания указанных двух молекул антител, предлагаемых в настоящем изобретении, в двух сайтах связывания соответственно перекрестносшивающего антитела.
Фраза «обладает антиангиогенной активностью в отсутствии перекрестносшивающего антитела» означает, что антитело обладает антиангиогенным действием при использовании системы оценки, которая позволяет определять подавление ангиогенеза, например, системы оценки, описанной выше, даже без одновременного присутствия перекрестносшивающего антитела.
Фраза «обладает антиангиогенной активностью в присутствии перекрестносшивающего антитела» означает, что антитело не обладает антиангиогенной активностью в отсутствии перекрестносшивающего антитела при использовании системы оценки, которая позволяет оценивать ангиогенез, например, описанной выше системы оценки антиангиогенной активности, но обладает антиангиогенной активностью при одновременном присутствии одной или нескольких молекулы(л) перекрестносшивающих антител, предпочтительно двух или большего количества молекул перекрестносшивающего антитела, и одной молекулы антитела, предлагаемого в настоящем изобретении.
(3-4) Подавляющая или ингибирующая активность антитела к ROBO4 in vivo в отношении ангиогенеза
Антитело, предлагаемое в настоящем изобретении, подавляет или ингибирует ангиогенез in vivo. Подавляющую или ингибирующую активность in vivo в отношении ангиогенеза можно оценивать с использованием животных моделей заболеваний согласно стандартному методу. Например, модели индуцированной лазером хороидальной неоваскуляризации, описанные ниже в примерее 4)-6, широко используют в качестве моделей связанных с ангиогенезом заболеваний и их можно применять для оценки с использованием в качестве балла количества вновь образовавшихся кровеносных сосудов. Кроме того, в случае оценки на пациентах собирают образцы опухолей с помощью биопсии у страдающих опухолями пациентов до и после введения антитела, предлагаемого в настоящем изобретении, и сосудистую плотность их сосудов, расположенных внутри опухоли, можно измерять с помощью иммуногистохимического анализа (ИГХ) для балльной оценки количества вновь образовавшихся кровеносных сосудов.
(3-5) Активация передаваемого в прямом направлении сигнала антителом к ROBO4
Антитело к ROBO4, предлагаемое в настоящем изобретении, можно изучать с помощью системы оценки, в которой используют клеточную линию или первично культивируемые клетки, для которых характерен некоторый индуцированный ответ на белок ROBO4. Примером такой клеточной линии может служить линия мышиных сосудистых эндотелиальных клеток (АТСС NO. CRL-2779). Примерами указанных первичных культивируемых клеток могут служить мышиные сосудистые эндотелиальные клетки и человеческие сосудистые эндотелиальные клетки.
Антитело, предлагаемое в настоящем изобретении, представляет собой агонистическое антитело к ROBO4. В частности, антитело, предлагаемое в настоящем изобретении, связывается с ROBO4 и активирует передаваемый в прямом направлении сигнал ROBO4. Таким образом, антиангиогенное действие антитела, предлагаемого в настоящем изобретении, можно оценивать по активации передачи в прямом направлении сигнала ROBO4, используемой в качестве критерия. Примером передаваемого в прямом направлении сигнала ROBO4 может служить активность промотора IL-8. Активность промотора IL-8 резко возрастала в клетках, экспрессирующих полноразмерный человеческий ROBO4, по сравнению с клетками, в которых не происходила экспрессия человеческого ROBO4, и ее с трудом удавалось обнаружить в клетках, экспрессирующих человеческий ROBO4 с делецией внутриклеточного домена. Таким образом, изучение активности промотора IL-8 продемонстрировало, что обнаружена активация сигнала ROBO4 (пример 3). Активность промотора IL-8 можно оценивать, например, путем добавления антитела к ROBO4 или совместного добавления антитела к ROBO4 и перекрестносшивающего антитела к клеткам, трансфектированным репортерным вектором, несущим в качестве вставки последовательность промотора (гена) IL-8, и экспрессионной плазмидой, несущей человеческий ROBO4, с последующим определением репортерной активности.
(3-6) Мышиное моноклональное антитело и химерное антитело к ROBO4
MAb1 представляет собой мышиное моноклональное антитело к ROBO4, полученное согласно методу, описанному в примере 2.
Нуклеотидная последовательность кДНК, кодирующая вариабельную область тяжелой цепи MAb1, представлена в SEQ ID NO: 30 (фиг. 15), а ее аминокислотная последовательность представлена в SEQ ID NO: 31 (фиг. 16). Аминокислотная последовательность CDRH1 представлена в SEQ ID NO: 44 (фиг. 25); аминокислотная последовательность CDRH2 представлена в SEQ ID NO: 46 (фиг. 26) и аминокислотная последовательность CDRH3 представлена в SEQ ID NO: 48 (фиг. 27). Нуклеотидная последовательность кДНК, кодирующей вариабельную область легкой цепи MAb1, представлена в SEQ ID NO: 32 (фиг. 17), а ее аминокислотная последовательность представлена в SEQ ID NO: 33 (фиг. 18). Аминокислотная последовательность CDRL1 представлена в SEQ ID NO: 50 (фиг. 28); аминокислотная последовательность CDRL2 представлена в SEQ ID NO: 52 (фиг. 29) и аминокислотная последовательность CDRL3 представлена в SEQ ID NO: 54 (фиг. 30).
Мутантное антитело, предлагаемое в настоящем изобретении, предпочтительно характеризуется пониженной чувствительностью к расщеплению или окислению белка, повышенной биологической активностью, повышенной способностью связываться с антигеном или физико-химическими или функциональными свойствами, связанными с ним, или т.п. Примеры указанных мутантов антител могут включать антитело, которое имеет аминокислотную последовательность, полученную из аминокислотной последовательности исходного антитела с помощью консервативной аминокислотной замены. Консервативная аминокислотная замена представляет собой замену, которая имеет место в группе аминокислот с родственными боковыми аминокислотными цепями.
Предпочтительными группами аминокислот являются следующие: кислотная группа, включая аспарагиновую кислоту и глутаминовую аминокислот; основная группа, включающая лизин, аргинин и гистидин; неполярная группа, включающая аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан; и семейство незаряженных полярных аминокислот, включающее глицин, аспарагин, глутамин, цистеин, серии, треонин и тирозин. Другими предпочтительными группами аминокислот являются следующие: аминокислоты с алифатической гидрокигруппой, включая серии и треонин; с содержащей амин группой, включая аспарагин и глутамин; с алифатической группой, включая аланин, валин, лейцин и изолейцин; и с ароматической группой, включая фенилаланин, триптофан и тирозин. Указанную аминокислотную замену в мутанте антитела предпочтительно осуществляют без снижения антигенсвязывающей активности исходного антитела.
Под объем настоящего изобретения подпадает также мутант антитела, имеющий аминокислотную последовательность, полученную из аминокислотной последовательности MAb1, предлагаемого в настоящем изобретении, путем консервативной аминокислотной замены, а также мышиное антитело, крысиное антитело, химерное антитело, гуманизированное антитело, человеческое антитело или т.п., содержащее аминокислотную последовательность CDR, полученную из аминокислотной последовательности любого из CDRH1-3 и CDRL1-3, полученных из MAb1 путем консервативной аминокислотной мутации.
Константные области антитела, предлагаемого в настоящем изобретении, не ограничены конкретными областями. Предпочтительно для лечения или предупреждения заболевания у человека в антителе, предлагаемом в настоящем изобретении, используют указанные области, выведенные из человеческого антитела.
Примеры константной области тяжелой цепи человеческого антитела могут включать Cγ1, Сγ2, Сγ3, Сγ4, Сμ, Cβ, Cα1, Cα2 и Сε. Примеры константной области тяжелой цепи человеческого антитела могут включать Сκ и Сλ.
Нуклеотидная последовательность, кодирующая содержащую секреторный сигнал легкую цепь cMAb1-1, например, в виде мышиного-человеческого химерного антитела IgG1-типа, предлагаемого в настоящем изобретении, и его аминокислотная последовательность, а также нуклеотидная последовательность, которая кодирует его тяжелую цепь, и его аминокислотная последовательность представлены в SEQ ID NO: 37, 38, 39 и 40 (фиг. 19, 20, 21 и 22) соответственно. Аналогично этому нуклеотидная последовательность, кодирующая содержащую секреторный сигнал легкую цепь cMAb1-2, например, в виде мышиного-человеческого химерного антитела IgG2-типа, предлагаемого в настоящем изобретении, и его аминокислотная последовательность, а также нуклеотидная последовательность, которая кодирует его тяжелую цепь, и его аминокислотная последовательность представлены в SEQ ID NO: 37, 38, 41 и 42 (фиг. 19, 20, 23 и 24) соответственно.
(3-7) Функциональный фрагмент антитела к ROBO4
Одним из объектов настоящего изобретения является функциональный фрагмент антитела к ROBO4, предлагаемого в настоящем изобретении. Под функциональным фрагментом антитела подразумевают фрагмент, который сохраняет по меньшей мере часть функций антитела или его модифицированной формы, описанной ниже в разделе (3-10). Примеры указанных функций антитела, как правило, могут включать антигенсвязывающую активность, активность, регулирующую активность антигена, антигензависимую цитотоксическую активность и комплементзависимую цитоксическую активность. Примеры функций антитела к ROBO4, предлагаемого в настоящем изобретении, могут включать активность связывания белка ROBO4, антиангиогенную активность, и действие, активирующее распространяемый в прямом направлении сигнал ROBO4. Более конкретно, любой функциональный фрагмент, обладающей всеми или некоторыми из указанных выше видов активности (3-3)-(3-5), характерными для антитела к ROBO4, предлагаемого в настоящем изобретении, относится к функциональному фрагменту антитела, предлагаемого в настоящем изобретении.
Функциональный фрагмент антитела не ограничен каким-либо конкретным фрагментом, если он представляет собой фрагмент антитела, который сохраняет по меньшей мере часть видов активности антитела или его модифицированной формы. Их примерами могут служить (но, не ограничиваясь только ими) Fab, F(ab')2, Fv, одноцепочечный Fv (scFv), содержащий Fv легкой и тяжелой цепи, связанные с помощью приемлемого линкера, димерные антитела (диабоди), линейные антитела, полиспецифические антитела, полученные из фрагментов антител, и Fab', который представляет собой одновалентный фрагмент вариабельных областей антитела, полученный обработкой F(ab')2 в восстанавливающих условиях. Молекула, содержащая остаток, отличный от фрагмента антитела, предлагаемого в настоящем изобретении, как, например, в scFv, несущем линкерный остаток, подпадает также под понятие функциональный фрагмент антитела, предлагаемого в настоящем изобретении.
Молекула, полученная из белка антитела путем делеции от одной до нескольких или большого количества аминокислоты(т) на аминоконце и/или карбоксиконце, и сохраняющая по меньшей мере часть функций антитела, также подпадает под понятие функциональный фрагмент антитела, предлагаемого в настоящем изобретении.
Антитело, предлагаемое в настоящем изобретении, или его функциональный фрагмент может представлять собой полиспецифическое антитело, обладающее специфичностью в отношении по меньшей мере двух типов различных антигенов. Полиспецифическое антитело не ограничено биспецифическим антителом, которое связывается с двумя типами различных антигенов, и антитело, имеющее специфичность в отношении трех или большего количества различных антигенов, также подпадает под определение «полиспецифическое антитело», предлагаемое в настоящем изобретении.
Полиспецифическое антитело, предлагаемое в настоящем изобретении, может представлять собой полноразмерное антитело или его функциональный фрагмент (например, биспецифическое антитело F(ab')2). Биспецифическое антитело можно получать также путем связывания тяжелой и легкой цепей (HL-пары) двух типов антител. Биспецифическое антитело можно получать также путем слияния двух или большего количества типов продуцирующих моноклональные антитела гибридом с получением продуцирующих биспецифическое антитело слитых клеток (Millstein и др., Nature, 305, 1983, сс. 537-539). Полиспецифическое антитело можно получать также с помощью описанных выше путей.
Согласно одному из объектов изобретения антитело, предлагаемое в настоящем изобретении, представляет собой одноцепочечное антитело (одноцепочечный Fv; обозначенный далее в контексте настоящего описания как «scFv»). scFv получают путем связывания вариабельных областей тяжелых и легкий цепей антитела с помощью полипептидного линкера (Pluckthun, The Pharmacology of Monoclonal Antibodies, 113, под ред. Rosenburg и Moore, изд-во Springer Verlag, New York, 1994, cc. 269-315, Nature Biotechnology, 23, 2005, cc. 1126-1136). Кроме того, в качестве биспецифического антитела можно применять би-scFv, содержащий два scFv, связанных через полипептидный линкер. Кроме того, в качестве полиспецифического антитела можно применять мульти-scFv, содержащие три или большее количество scFv.
Настоящее изобретение относится к одноцепочечному иммуноглобулину, содержащему полноразмерные последовательности тяжелых и легких цепей антитела, связанные приемлемым линкером (Lee H-S и др., Molecular Immunology, 36, 1999, сс. 61-71; Shirrmann Т. и др., mAbs, 2, (1), 2010, сс. 1-4). Указанный одноцепочечный иммуноглобулин может быть димеризован для поддержания структуры и видов активности, таких же, как и у антитела, которое в исходном состоянии представляет собой тетрамер. Кроме того, антитело, предлагаемое в настоящем изобретении, может представлять собой антитело, которое имеет только вариабельную область тяжелой цепи и не имеет последовательности легкой цепи. Указанное антитело называют однодоменным антителом (sdAb) или наноантителом, и как описано, оно сохраняет способность связываться с антигеном (Muyldemans S. и др., Protein Eng., 7 (9), 1994, сс. 1129-1135, Hamers-Casterman С.и др., Nature, 363 (6428), 1993, сс. 446-448). Эти антитела также подпадают под понятие функциональный фрагмент антитела, предлагаемого в настоящем изобретении.
(3-8) Гуманизированное антитело к человеческому ROBO4 (обозначенное далее в контексте настоящего описания как «гуманизированное антитело к ROBO4»)
Одним из объектов настоящего изобретения является гуманизированное антитело или его функциональный фрагмент. Гуманизированное антитело к ROBO4, предлагаемое в настоящем изобретении, или его функциональный фрагмент обладает антиангиогенной активностью и предпочтительно обладает антиангиогенной активностью in vivo. Предпочтительно гуманизированное антитело или его функциональный фрагмент специфически связывается с белком ROBO4. Кроме того, гуманизированное антитело или его функциональный фрагмент представляет собой агонистическое антитело к ROBO4 и активирует его сигналы, передаваемые в прямом направлении. Кроме того, гуманизированное антитело или его функциональный фрагмент подавляет или ингибирует миграцию сосудистых эндотелиальных клеток в отсутствии перекрестносшивающего антитела in vitro.
Примерами гуманизированного антитела, предлагаемого в настоящем изобретении, могут служить антитело человеческого происхождения, имеющее гипервариабельные участки (CDR) MAb1, замененные на CDR антитела животного кроме человека (см., Nature, 321, 1986, сс. 522-525), и человеческое антитело с трансплантированными CDR-последовательностями и с некоторыми аминокислотными остатками каркасных участков, полученное с использованием метода трансплантации CDR (публикация международной заявки WO 90/07861). Кроме того, вариант, выведенный из гуманизированного антитела путем замены 1-3 аминокислотных остатков в каждом CDR на другие аминокислотные остатки, также относится к антителу, предлагаемому в настоящем изобретении, если вариант обладает всеми или некоторыми из видов активности, указанных в подпунктах (3-3)-(3-5). Предпочтительные примеры гуманизированного антитела к ROBO4, предлагаемого в настоящем изобретении, или его функционального фрагмента могут включать антитело, которое состоит из тяжелой цепи, имеющей вариабельную область, которая содержит CDRH1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 44 (фиг. 25), CDRH2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 46 (фиг. 26), или аминокислотной последовательности, выведенной из аминокислотной последовательности SEQ ID NO: 46 путем замены одной аминокислоты, и CDRH3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 48 (фиг. 27), и легкой цепи, имеющей вариабельную область, которая содержит CDRL1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 50 (фиг. 28), или аминокислотной последовательности, выведенной из аминокислотной последовательности SEQ ID NO: 50 путем замены 1-3 аминокислоты(т), CDRL2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 52 (фиг. 29), и CDRL3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 54 (фиг. 30), и распознает белок ROBO4, предлагаемый в настоящем изобретении, и фракции антитела, сохраняющие активность связывания антитела с белком ROBO4.
Примером аминокислотной замены в CDRH2 может служить замена аминокислоты, представленную в CDRH2 аминокислотой №4 SEQ ID NO: 46. В частности, аспарагин, аминокислоту №4 SEQ ID NO: 46, можно заменять на глутамин. Подлежащая замене аминокислота не ограничена конкретной аминокислотой, если образовавшееся антитело обладает всеми или некоторыми из видов активности, указанных в подпунктах (3-3)-(3-5), характерными для антитела к ROBO4, предлагаемого в настоящем изобретении.
Примером аминокислотной замены в CDRL1 может служить замена любых 1-3, предпочтительно 3, аминокислот, представленных в CDRL1 аминокислотами №№9, 11 и 13 SEQ ID NO: 50. В частности серии (аминокислота №9), глицин (аминокислота №11) и треонин (аминокислота №13) SEQ ID NO: 50 можно заменять на аминокислоту, выбранную из глутаминовой кислоты, лизина и лейцина, предпочтительно на глутаминовую кислоту, лизин и лейцин соответственно. Подлежащая(ие) замене аминокислота(ы) не ограничена(ы) конкретной(ыми) аминокислотой(амии), если образовавшееся антитело обладает всеми или некоторыми из видов активности, указанных в подпунктах (3-3)-(3-5), характерными для антитела к ROBO4, предлагаемого в настоящем изобретении.
Известно, что аспарагиновый остаток в пептидах или белке легко поддается деамидированию в некоторых условиях (Gerger и др., The Journal of Biological Chemistry, т. 262, №2, 1987, cc. 785-794), по этой причине аминокислотная замена в CDR, описанная выше, может повышать стабильность гуманизированных антител, предлагаемых в настоящем изобретении.
Примерами вариабельной области тяжелой цепи более предпочтительного гуманизированного антитела, которое имеет указанные CDRH, могут служить аминокислотная последовательность, представленная аминокислотами №№20-137 SEQ ID NO: 56 (фиг. 32), в которой CDRH1, CDRH2 и CDRH3 представлены аминокислотами №№50-54, 69-85 и 118-126 SEQ ID NO: 56 (фиг. 32) соответственно, аминокислотная последовательность, представленная аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), в которой CDRH1, CDRH2 и CDRH3 представлены аминокислотами №№50-54, 69-85 и 118-126 SEQ ID NO: 58 (фиг. 34) соответственно, аминокислотная последовательность, представленная аминокислотами №№20-137 SEQ ID NO: 60 (фиг. 36), в которой CDRH1, CDRH2 и CDRH3 представлены аминокислотами №№50-54, 69-85 и 118-126 SEQ ID NO: 60 (фиг. 36) соответственно, и аминокислотная последовательность, представленная аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), в которой CDRH1, CDRH2 и CDRH3 представлены аминокислотами №№50-54, 69-85 и 118-126 SEQ ID NO: 60 (фиг. 38). Примерами вариабельной области легкой цепи более предпочтительного гуманизированного антитела, которое имеет указанные CDRL, могут служить аминокислотная последовательность, представленная аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40), в которой CDRL1, CDRL2 и CDRL3 представлены аминокислотами №№44-59, 75-81 и 114-122 SEQ ID NO: 64 (фиг. 40) соответственно, аминокислотная последовательность, представленная аминокислотами №№21-134 of SEQ ID NO: 66 (фиг. 42), в которой CDRL1, CDRL2 и CDRL3 представлены аминокислотами №№44-59, 75-81 и 114-122 SEQ ID NO: 66 (фиг. 42) соответственно.
Примеры более предпочтительных комбинаций вариабельной области тяжелой цепи и вариабельной области легкой цепи более предпочтительных гуманизированных антител могут включать: гуманизированное антитело, содержащее вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40); гуманизированное антитело, содержащее вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42); гуманизированное антитело, содержащее вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42); гуманизированное антитело, содержащее вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40); гуманизированное антитело, содержащее вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 56 (фиг. 32), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40); и гуманизированное антитело, содержащее вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 60 (фиг. 36), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40). Еще более предпочтительные примеры полноразмерного гуманизированного антитела, содержащего более предпочтительную комбинацию вариабельной области тяжелой цепи и вариабельной области легкой цепи, могут включать: гуманизированное антитело (Н-1140), содержащее тяжелую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№. 20-463 SEQ ID NO: 58 (фиг. 34), и легкую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40); гуманизированное антитело (Н-1143), содержащее тяжелую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 58 (фиг. 34), и легкую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 66 (фиг. 42); гуманизированное антитело (Н-2143), содержащее тяжелую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 62 (фиг. 38), и легкую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 66 (фиг. 42); гуманизированное антитело (Н-2140), содержащее тяжелую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 62 (фиг. 38), и легкую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40); гуманизированное антитело (Н-1040), содержащее тяжелую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 56 (фиг. 32), и легкую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40); и гуманизированное антитело (Н-2040), содержащее тяжелую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 60 (фиг. 36), и легкую цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40).
Наиболее предпочтительными антителами, предлагаемыми в настоящем изобретении, являются Н-1140, Н-1143, Н-2140 и Н-2143.
Н-1140 обладает следующими свойствами: 1) специфически связывается с человеческим ROBO4 и не связывается с ROBO1, ROBO2 и ROBO3, 2) имеет величину KD, составляющую 3,9 нМ, в отношении человеческого ROBO4, 3) сохраняет аффинность к человеческому ROBO4 при 40°С в течение 4 недель, 4) ингибирует миграцию HUVEC, индуцированную одним или несколькими ангиогенными факторами, выбранными из VEGF, bFGF, HGF, PDGF-BB и SDF-1, прежде всего VEGF или bFGF, 5) ингибирует ангиогенез in vivo и 6) обладает низкой иммуногенностью при скрининге иммуногенности на основе ISPRI Web (фирма EpiVax, Inc).
Н-1143 обладает следующими свойствами: 1) специфически связывается с человеческим ROBO4 и не связывается с ROBO1, ROBO2 и ROBO3, 2) имеет величину KD, составляющую 3,5 нМ, в отношении человеческого ROBO4, 3) сохраняет аффинность к человеческому ROBO4 при 40°С в течение 4 недель, 4) ингибирует миграцию HUVEC, индуцированную одним или несколькими ангиогенными факторами, выбранными из VEGF, bFGF, HGF, PDGF-BB и SDF-1, прежде всего VEGF или bFGF, 5) ингибирует ангиогенез in vivo и 6) обладает низкой иммуногенностью при тестировании иммуногенности с помощью системы EpiScreen™ (фирма Antitope Ltd.)
Н-2140 обладает следующими свойствами: 1) специфически связывается с человеческим ROBO4 и не связывается с ROBO1, ROBO2 и ROBO3, 2) имеет величину KD, составляющую 1,8 нМ, в отношении человеческого ROBO4, 3) сохраняет аффинность к человеческому ROBO4 при 40°С в течение 4 недель, 4) ингибирует миграцию HUVEC, индуцированную одним или несколькими ангиогенными факторами, выбранными из VEGF, bFGF, HGF, PDGF-BB и SDF-1, прежде всего VEGF или bFGF, 5) ингибирует ангиогенез in vivo и 6) обладает низкой иммуногенностью при тестировании иммуногенности с помощью системы EpiScreen™ (фирма Antitope Ltd.).
Н-2143 обладает следующими свойствами: 1) специфически связывается с человеческим ROBO4 и не связывается с ROBO1, ROBO2 и ROBO3, 2) имеет величину Ко, составляющую 1,7 нМ, в отношении человеческого ROBO4, 3) сохраняет аффинность к человеческому ROBO4 при 40°С в течение 4 недель, 4) ингибирует миграцию HUVEC, индуцированную одним или несколькими ангиогенными факторами, выбранными из VEGF, bFGF, HGF, PDGF-BB и SDF-1, прежде всего VEGF или bFGF, 5) ингибирует ангиогенез in vivo, 6) обладает низкой иммуногенностью при тестировании иммуногенности с помощью системы EpiScreen™ (фирма Antitope Ltd.) и 7) не приводит к серьезным изменениям клинического признака, веса тела, потребления пищи, гематологии, химии крови, патологии, электроретинографии после однократной инъекции в стекловидное тело (2,75 мг/глаз) обезьянам циномолгус.
Антитело, содержащее аминокислотную последовательность, которая на 95% или более, предпочтительно на 97% или более, более предпочтительно 99% или более идентична аминокислотной последовательности антитела, такого как Н-1140, Н-1143, Н-2143, Н-2140, Н-1040 и Н-2040, также относится к антителу, предлагаемому в настоящем изобретении, если антитело обладает всеми или некоторыми из видов активности, указанных в подпунктах (3-3)-(3-5). Кроме того, антитело, которое имеет CDR, аминокислотная последовательность которых идентична CDR антитела, содержащего комбинацию вариабельной области тяжелой цепи и вариабельной области легкой цепи, или антитело, которое содержит комбинацию тяжелой цепи и легкой цепи и имеет аминокислотную последовательность, отличную от аминокислотной последовательности CDR, идентичную ей на 95% или более, предпочтительно 97% или более, более предпочтительно 99% или более, также относится к антителу, предлагаемому в настоящем изобретении, если антитело обладает всеми или некоторыми из видов активности, указанных в подпунктах (3-3)-(3-5).
(3-9) Антитело, связывающееся с тем же сайтом
«Антитело, связывающееся с тем же сайтом», с которым связывается антитело, предлагаемое в настоящем изобретении, также относится к антителу, предлагаемому в настоящем изобретении. «Антитело, связывающееся с тем же сайтом», с которым связывается определенное антитело, означает другое антитело, которое связывается с сайтом на молекуле антигена, распознаваемым антителом. Если второе антитело связывается с частью пептида или частью трехмерной структурой на молекуле антигена, с которой связывается первое антитело, то можно считать, что первое и второе антитела связываются с тем же сайтом. Кроме того, первое и второе антитела можно относить к связывающимся с одним и тем же сайтом путем подтверждения того, что второе антитело конкурирует с первым антителом за связыванием с антигеном, т.е. второе антитела оказывает интерферирующее воздействие на связывание первого антитела с антигеном, даже, если пептидная последовательность или трехмерная структура специфического сайта не определена. Кроме того, когда первое и второе антитела связываются с одним и тем же сайтом и первое антитело обладает действием, характерным для антитела, являющегося одним из объектов изобретения, таким как антиангиогенная активность, то второе антитело также должно с высокой вероятностью обладать такой же активностью. Так, если второе антитело к ROBO4 связывается с тем же сайтом, с которым связывается первое антитело к ROBO4, то первое и второе антитела можно относить к связывающимся с одним и тем же сайтом на белке ROBO4. Кроме того, первое и второе антитела можно рассматривать как антитела, связывающиеся с тем же сайтом на белке ROBO4, на основе подтверждения того, что второе антитело к ROBO4 конкурирует с первым антителом к ROBO4 за связыванием с белком ROBO4.
Под объем настоящего изобретения подпадает также антитело, связывающееся с сайтом на белке ROBO4, распознаваемым MAb1, предлагаемым в настоящем изобретении.
Сайт, с которым связывается антитело, можно определять методом, хорошо известным специалистам в данной области, таким как иммуноанализ. Например, получают серии пептидов путем соответствующего С-концевого или N-концевого укорочения аминокислотной последовательности антигена и изучают реактивность антитела в отношении них с целью грубого определения распознаваемого сайта. Затем синтезируют более короткие пептиды и реактивность антитела в отношении этих пептидов можно исследовать для определения сайта связывания. Пептиды фрагмента антигена можно получать с помощью такой методики, как рекомбинация генов или пептидный синтез.
Когда антитело связывается с частичной конформацией антигена или распознает ее, то связывающий сайт антитела можно определять путем идентификации аминокислотных остатков на антигене, примыкающих к антителу, с помощью рентгенографического структурного анализа.
(3-10) Модифицированная форма антитела к ROBO4 или его функционального фрагмента
В настоящем изобретении предложена модифицированная форма антитела или его функционального фрагмента. Модифицированная форма антитела, предлагаемого в настоящем изобретении, или его функционального фрагмента означает антитело, предлагаемое в настоящем изобретении, или его функциональный фрагмент имеет химическую или биологическую модификацию. Химически модифицированная форма включает форму, имеющую аминокислотный скелет, конъюгированный с химическим остатком, форму, имеющую химически модифицированную N-связанную или О-связанную углеводную цепь и т.п. Указанный химический остаток или форма могут обладать токсичностью или цитотоксичностью. Биологически модифицированная форма включает форму, подвергнутую пост-трансляционной модификации (например, N-связанное или О-связанное гликозилирование, N-концевой или С-концевой процессинг, деамидирование, изомеризация аспарагиновой кислоты или окисление метионина), форму, содержащую остаток метионина, добавленный к N-концу в результате экспрессии в прокариотических клетках-хозяевах и т.п. Подразумевается также, что указанная модифицированная форма включает форму, которую метят для обеспечения обнаружения или выделения антитела или антигена, предлагаемого в настоящем изобретении, например, меченную ферментом форму, флуоресцентно меченую форму или форму с аффинной меткой. Указанную модифицированную форму антитела, предлагаемого в настоящем изобретении, или его функционального фрагмента можно применять для повышения стабильности или удерживания в крови исходного антитела, предлагаемого в настоящем изобретении, или его функционального фрагмента, снижения антигенности, обнаружения или выделения антитела или антигена и т.д.
Примерами химического остатка, входящего в химически модифицированную форму, могут служить водорастворимые полимеры, такие как полиэтиленгликоль, сополимеры этиленголиколя/пропиленгликоля, карбоксиметилцеллюлозу, декстран и поливиниловый спирт.
Примерами биологически модифицированной формы могут служить форма, модифицированная ферментативной обработкой, клеточной обработкой или т.п., форма, слитая с другим пептидом, таким как метка, добавленная в результате генной рекомбинации, и форма, полученная из клеток-хозяев, экспрессирующих эндогенный или экзогенный фермент, модифицирующий сахарную цепь.
Указанную модификацию можно осуществлять в произвольном положении или требуемом положении в антителе или его функциональном фрагменте. Альтернативно этому, одну и ту же или две или большее количество различных модификаций можно осуществлять в одном или двух, или большем количестве положений.
В настоящем изобретении подразумевается также, что «модифицированная форма фрагмента антитела» включает даже «фрагмент модифицированной формы антитела».
Например, известно, что иногда в антителе, полученном путем культивирования клеток млекопитающего, отсутствует карбоксконцевой остаток лизина в тяжелой цепи (Journal of Chromatography А, 705, 1995, сс. 129-134). Известно также, что иногда отсутствуют 2 карбоксиконцевых аминокислотных остатка (т.е. глицин и лизин) тяжелой цепи и что остаток пролина, располагающийся в результате этого на карбоксильном конце, амидируется (Analytical Biochemistry, 360, 2007, сс. 75-83). Однако указанное отсутствие остатков или модификация в последовательностях этих тяжелых цепей не влияет ни на способность антитела связываться с его антигеном, ни на эффекторные функции (активация комплемента, антителозависимая цитотоксичность и т.д.) антитела. Таким образом, антитело, имеющее модификацию, и функциональный фрагмент антитела также относятся к антителу, предлагаемому в настоящем изобретении. Примерами такого антитела могут служить делеционный мутант, полученный из антитела, предлагаемого в настоящем изобретении, путем делеции или в результате отсутствия 1 или 2 аминокислоты(т) на карбоксильном конце тяжелой цепи, и делеционный мутант, имеющий амидированный остаток (например, амидированный остаток пролина в карбоксконцевом сайте тяжелой цепи). Однако делеционный мутант антитела, предлагаемого в настоящем изобретении, не ограничен описанными выше типами, если делеционный мутант сохраняет способность связываться с антигеном, и обладает всеми или некоторыми из видов активности, указанных в подпунктах (3-3)-(3-5). Две тяжелые цепи, входящие в состав антитела, предлагаемого в настоящем изобретении, могут состоять из одного типа тяжелой цепи, выбранного из группы, включающей полноразмерные тяжелые цепи и тяжелые цепи делеционного мутанта, или могут состоять из комбинации двух любых выбранных типов. Количественное соотношение делеционного варианта тяжелой(ых) цепи(ей) определяется, например, типом культивируемых клеток млекопитающего, продуцирующих антитело, предлагаемое в настоящем изобретении, и условиями культивирования клеток. Примеры указанного делеционного варианта тяжелых цепей в качестве основных компонентов антитела, предлагаемого в настоящем изобретении, могут включать две тяжелые цепи, в которых обеих отсутствует карбоксиконцевой аминокислотный остаток. Все указанные делеционные варианты подпадают под определение варианта антитела функционального фрагмента антитела или их модифицированной формы, предлагаемой в настоящем изобретении.
4. Метод получения антитела
(4-1) Метод с использованием гибридомы
Для получения антитела к ROBO4, предлагаемого в настоящем изобретении, продуцирующие антитело к ROBO4 клетки выделяют из селезенки животных, иммунизированных белком ROBO4, согласно методу Kohler и Milstein (Kohler и Milstein, Nature, 256, 1975, сс. 495-497, Kennet R. и др., Monoclonal Antibody, изд-во Prenum Press, N. Y. 1980, cc. 365-367). Клетки сливают с клетками миеломы, создавая тем самым гибридомы, и из культур этих гибридом можно получать моноклональные антитела.
(4-1-1) Получение антигена
Антиген, требуемый для получения антитела к ROBO4, можно создавать, например, согласно методу получения нативного или рекомбинантного белка ROBO4, представленного в других разделах настоящего описания. Примерами антигена, который можно получать таким образом, могут служить белок ROBO4 или фрагмент белка ROBO4, содержащий его частичную последовательность по меньшей мере с 6 последовательно расположенными аминокислотами, и его производные, дополнительно содержащие добавленные произвольную аминокислотную последовательность или носитель (далее в контексте настоящего описания обозначены в целом как «антиген ROBO4»).
Рекомбинантный антиген ROBO4 можно получать путем трансфекции клеток-хозяев геном, который содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность антигена ROBO4, и сбора антигена из культур клеток. Нативный антиген ROBO4 можно очищать или выделять, например, из тканей человека или грызунов, клеток, выведенных из тканей, или культур клеток, для которых характерен ангиогенез. Антиген ROBO4, полученный в бесклеточной системе трансляции in vitro из гена, который содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность антигена ROBO4, также подпадает под понятие «антиген ROBO4», предлагаемый в настоящем изобретении.
(4-1-2) Получение моноклонального антитела к ROBO4
Моноклональное антитело, как правило, получают с помощью следующих стадий, на которых:
(а) получают антиген,
(б) получают антителопродуцирующие клетки,
(в) получают клетки миеломы (далее в контексте настоящего описания обозначены как «миеломы»),
(г) сливают антителопродуцирующие клетки с миеломами,
(д) осуществляют скрининг группы гибридом, продуцирующих представляющее интерес антитело, и
(е) получают клоны единичных клеток (осуществляют клонирование). Указанный способ получения при необходимости дополнительно включает
(ж) стадию, на которой культивируют гибридомы, стадию, на которой получают животных с трансплантированными гибридомами и т.д., (з) стадию, на которой осуществляют оценку или определение биологической активности моноклонального антитела и т.д.
Далее способ получения моноклонального антитела будет описан подробно со ссылкой на указанные стадии. Однако способ получения антитела не ограничен указанным, и можно использовать, например, антителопродуцирующие клетки, отличные от клеток селезенки и миелом.
(а) Стадия получения антигена
Антиген можно получать с использованием метода получения белка ROBO4, описанного выше в разделе (2-3).
(б) Стадия получения антителопродуцирующих клеток
Антиген, полученный на стадии (а), смешивают с адъювантом, таким как полный или неполный адъювант Фрейнда или алюмосульфат калия, и лабораторных животных иммунизируют полученным иммуногеном. Можно применять без ограничения любое лабораторное животное, которое применяют в методе получения гибридом, известном в данной области.
В частности, например, можно использовать мышей, крыс, коз, овец, коров или лошадей. С позиций легко доступных клеток миелом, которые подлежат слиянию с выделенными антителопродуцирующими клетками и т.д., в качестве подлежащих иммунизации животных предпочтительно используют мышей или крыс.
Изобретение не ограничено конкретными фактически применяемыми линиями мышей или крыс.Например, в случае мышей, можно применять линии A, AKR, BALB/c, BALB/cAnNCrj, BDP, ВА, СЕ, С3Н, 57BL, C57BL, C57L, DBA, FL, HTH, HT1, LP, NZB, NZW, RF, R III, SJL, SWR, WB, 129. Например, в случае крыс можно применять линии Wistar, Low, Lewis, Sprague-Dawley, ACI, BN или Fischer.
Указанных мышей и крыс можно получать от фирм, занимающихся разведением/поставкой лабораторных животных, например, от фирмы CLEA Japan, Inc. или Charles River Laboratories Japan Inc.
Наиболее предпочтительными в качестве животных, подлежащих иммунизации, с учетом совместимости слияния с описанными ниже клетками миеломы являются мыши линии BALB/c или крысы линий Wistar и Low.
Кроме того, с учетом гомологии между человеческими и мышиными антигенами, предпочтительно применять также мышей, у которых снижен биологический механизм удаления аутоантител, т.е. мышей с аутоиммунным заболеванием.
При этом предпочтительный возраст мышей или крыс в момент иммунизации составляет 5-12 недель, более предпочтительно 6-8 недель.
Животных можно иммунизировать белком ROBO4, применяя, например, метод, описанный у Weir D.М., Handbook of Experimental Immunology, т.I, II, III, изд-во Blackwell Scientific Publications, Oxford, 1987; Kabat E.А. и Mayer M.M., Experimental Immunochemistry, изд-во Charles С Thomas Publisher Spigfield, Illinois, 1964.
Примерами методов определения титров антител могут служить (но, не ограничиваясь только ими) иммуноанализы, такие как РИА и ELISA.
Антителопродуцирующие клетки, выведенные из клеток селезенки или лимфоцитов, выделенных из иммунизированных животных, можно получать согласно методу, известному в данной области, например, методу Kohler и др., Nature, 256, 1975, с. 495; Kohler и др., Eur. J. Immnol. 6, 1977, с. 511; Milstein и др., Nature, 266, 1977, с. 550; Walsh, Nature, 266, 1977, с. 495).
В случае клеток селезенки можно адоптировать общий метод, который включает измельчение селезенки, фильтрацию клеток через сито из нержавеющей стали, а затем внесение полученных клеток в минимальную эссенциальную среду Игла (MEM) или т.п. для разделения антителопродуцирующих клеток.
(в) Стадия получения миелом
Клетки миеломы, применяемые для клеточного слияния, не ограничены конкретными клетками и их можно соответственно выбирать для применения из клеточных линий, известных в данной области. С учетом удобства селекции гибридом из слитых клеток предпочтительно применяют линию с дефицитом HGPRT (гипоксантингуанинфосфорибозилтрансфераза), т.е. полученную из мышей линию X63-Ag8 (Х63), NS1-ANS/1 (NS1), P3X63-Ag8.U1 (P3U1), Х63-Ag8.653 (Х63.653), SP2/0-Ag14 (SP2/0), MPC1 1-45.6TG1.7 (45.6TG), FO, S149/5XXO, BU.1 или т.п., полученную из крыс линию 210.RSY3.Ag.1.2.3 (Y3) или т.п. или полученную из человека линию U266AR (SKO-007), GM1500-GTG-А12 (GM1500), UC729-6, LICR-LOW-HMy2 (HMy2), 8226AR/NIP4-1 (NP41) или т.п., процедуры скрининга которых уже разработаны. Указанные линии с дефицитом HGPRT можно получать, например, из Американской коллекции типовых культур (АТСС).
Указанные клеточные линии субкультивируют в соответствующей среде, например, в содержащей 8-азагуанин среде [среда RPMI-1640, дополненная глутамином, 2-меркаптоэтанолом, гентамицином и фетальной телячьей сывороткой (далее в контексте настоящего описания обозначена как «FCS») и кроме того дополненной 8-азагуанином], среде Дульбекко, модифицированной по методу Исков (далее в контексте настоящего описания обозначена как «IMDM») или среде Игла, модифицированной по методу Дульбекко (далее в контексте настоящего описания она обозначена как «DMEM»), и пересевают в течение 3-4 дней перед осуществлением клеточного слияния в нормальной среде [например, среде ASF104 (производства фирмы Ajinomoto Co., Inc.), содержащей 10% FCS] для сохранения в день осуществления клеточного слияния количества клеток, равного или превышающего 2×107 клеток.
(г) Стадия слияния антителопродуцирующих клеток с клетками миеломы
Антителопродуцирующие клетки можно сливать с клетками миеломы в условиях, которые предупреждают резкое снижение жизнеспособности клеток, согласно методу, известному в данной области (Weir D.М., Handbook of Experimental Immunology, т. I, II, III, изд-во Blackwell Scientific Publications, Oxford, 1987, Kabat E.А. и Mayer M.M., Experimental Immunochemistry, изд-во Charles С Thomas Publisher Spigfield, Illinois, 1964 и т.д.). Например, можно применять химический метод, который включает смешение антителопродуцирующих клеток с клетками миеломы в высококонцентрированном растворе полимера, такого как полиэтиленгликоль, или физический метод с использованием электрической стимуляции.
(д) Стадия скрининга группы гибридом, продуцирующих представляющее интерес антитело
Метод селекции гибридом, полученных в результате клеточного слияния, не ограничен конкретным методом, и, как правило, применяют метод селекции с использованием среды HAT (гипоксантин-аминоптерин-тимидин) (Kohler и др., Nature, 256, 1975, с. 495; Milstein и др., Nature, 266, 1977, с. 550). Указанный метод является эффективным для получения гибридом с использованием клеточных линий миелом с дефицитом HGPRT, которые не могут выживать в присутствии аминоптерина. В частности, неслитые клетки и гибридомы можно культивировать в НАТ-среде, что избирательно позволяет сохраняться и расти только клеткам гибридом, устойчивым к аминоптерину.
(е) Стадия получения клонов единичных клеток (клонирование)
Гибридомы можно клонировать с помощью метода, известного в данной области, например, с использованием метилцеллюлозы, мягкой агарозы или метода серийных разведений (см., например, Barbara В.М. и Stanley М.S., Selected Methods in Cellular Immunology, изд-во W.H. Freeman and Company, San Francisco, 1980). Предпочтительным является метод серийных разведений.
(ж) Стадия культивирования гибридом и стадия получения животных с трансплантированными гибридомами
Отобранные гибридомы можно культивировать с получением моноклональных антител. Предпочтительно требуемые гибридомы клонируют и затем обеспечивают производство ими антител. Моноклональное антитело, продуцируемое указанной гибоидомой, можно собирать из культур гибридомы. Кроме того, рекомбинантное антитело можно собирать также из культур клеток, трансфектированных геном моноклонального антитела. Кроме того, гибридомы можно инъецировать внутрибрюшинно мышам той же линии (например, описанной выше линии BALB/cAnNCrj) или мышам линии Nu/Nu и давать расти. Затем моноклональное антитело можно собирать из их асцитов.
(з) Стадия оценки или определения биологической активности моноклонального антитела
Можно выбирать различные биологические тесты и применять их в зависимости от поставленной цели.
(4-2) Метод клеточной иммунизации
Клетки, экспрессирующие нативный белок ROBO4, клетки, экспрессирующие рекомбинантный белок ROBO4 или его фрагмент, или т.п. можно применять в качестве иммуногенов с получением антитела к ROBO4 с помощью описанного выше метода гибридом.
Примерами клеток, экспрессирующих нативный белок ROBO4, могут служить клетки, полученные из организма пациентов, пораженных ангиогенным заболеванием, таким как пролифкеративная диабетическая ретинопатия или опухоль, и клетки, полученные из тканей указанных пациентов. Такие клетки предпочтительно представляют собой (но, не ограничиваясь только ими) сосудистые эндотелиальные клетки. Такие экспрессирующие белок ROBO4 клетки применяют в количестве от 1×105 до 1×109 клеток, предпочтительно от 1×106 до 1×108 клеток, более предпочтительно от 0,5 до 2×107, еще более предпочтительно 1×107 клеток, на одну иммунизацию. Количество клеток, применяемых для иммунизации, можно изменять в зависимости от уровня экспрессии белка ROBO4. Иммуногены, как правило, вводят внутрибрюшинно, но можно использовать для введения внутрикожный путь или т.п. Метод, описанный в разделе (4-1-2), можно применять в подходе получения гибридом.
(4-3) Рекомбинация генов и клетки-хозяева
Для получения антитела, предлагаемого в настоящем изобретении, клетки-хозяева трансфектируют нуклеотидом, содержащим нуклеотидную последовательность, которая кодирует аминокислотную последовательность его тяжелой цепи (нуклеотид тяжелой цепи), и нуклеотидом, содержащим нуклеотидную последовательность, которая кодирует аминокислотную последовательность его легкой цепи (нуклеотид легкой цепи), или вектором, содержащим в виде вставки нуклеотид тяжелой цепи, или вектором, содержащим в виде вставки нуклеотид легкой цепи, и затем культивируют, и из этих культур можно собирать антитело. Нуклеотиды тяжелой и легкой цепи можно встраивать в один вектор.
В качестве клеток-хозяев можно применять прокариотические или эукариотические клетки. Когда в качестве хозяев применяют эукариотические клетки, то можно использовать клетки животных, клетки растений или эукариотические микроорганизмы.
Примеры клеток животных могут включать полученные из млекопитающих клетки, т.е. полученные из обезьян COS-клетки (Gluzman Y. Cell, 23, 1981, сс. 175-182, АТСС CRL-1650), мышиные фибробластиы NIH3T3 (АТСС № CRL-1658), мышиные линии клеток NS0 (ЕСАСС), клетки яичника китайского хомячка (СНО-клетки, АТСС CCL-61), их линии с дефицитом дигидрофолатредуктазы (CHOdhfr-; Urlaub G. и Chasin, L.A., Proc. Natl. Acad. Sci. U.S.A., 77, 1980, cc. 4126-4220), CHOKI SV, разработанные фирмой Lonza Biologies, клетки, полученные из птиц, таких как куры, и клетки, полученные из насекомых.
Кроме того, клетки-хозяева, предлагаемые в настоящем изобретении, включают клетки, которые могут продуцировать белок антитела, в котором структура сахарной цепи, присоединенной к белку антитела, модифицирована, при этом биологическая активность антитела с модификацией предпочтительно повышена по сравнению с антителом без модификации. Примеры указанных клеток-хозяев, предлагаемых в настоящем изобретении, включают СНО-клетки, которые могут продуцировать белок антитела, имеющий комплекс сцепленных N-гликозидом сахарных цепей, связанных с Fc-областью антитела, при этом, среди всех комплексов сцепленных N-гликозидом сахарных цепей, связанных с Fc-областью антитела, содержание сахарных цепей, в которых фукоза не связана с N-ацетилглюкозамином на восстанавливающем конце в сахарной цепи, составляет 20% или более (WO 2000/61739, WO 2002/31140). Примерами эукариотических микроорганизмов могут служить дрожжи. Примерами прокариотических клеток могут служить Е.coli и Bacillus subtilis.
Предпочтительно применяют полученные из млекопитающих клетки, наиболее предпочтительно применяют СНО-клетки и еще более предпочтительно CHOK1SV-клетки применяют в качестве клеток-хозяев для получения антител к ROBO4, предлагаемых в настоящем изобретении.
Сигнальный пептид для секреции антитела, предлагаемого в настоящем изобретении (моноклональные антитела из различных видов животных, крысиное антитело, мышиное антитело, химерное антитело, гуманизированное антитело, человеческое антитело и т.д.), не ограничено секреторным сигналом антитела из этих же видов, такого же типа и такого же подтипа, что и антитело, или секреторным сигналом самого антитела. Можно отбирать и применять любой секреторный сигнал антитела другого типа или подтипа или любой секреторный сигнал белка, полученного из других эукариотических видов или прокариотических видов.
(4-4) Методы конструирования и получения гуманизированного антитела
Примерами гуманизированного антитела могут служить (но, не ограничиваясь только ими) полученное из организма человека антитело, в котором CDR заменены CDR антитела животного кроме человека (см. Nature, 321, 1986, сс. 522-525), человеческое антитело с трансплантированными с использованием метода трансплантации CDR (см. WO 90/07861 и US 6972323) CDR-последовательностями и некоторыми аминокислотными остатками каркасных участков, и антитело, в которых аминокислота(ы) человеческого антитела заменена(ы) одной или двумя, или большим количеством аминокислот из антитела, полученного из животного кроме человека, в любом из указанных гуманизированных антител.
(4-5) Метод получения человеческого антитела
Другие примеры антитела, предлагаемого в настоящем изобретении, могут включать человеческое антитело. Под человеческим антителом к ROBO4 подразумевают антитело к ROBO4, состоящее из аминокислотной последовательности полученного из организма человека антитела. Человеческое антитело к ROBO4 можно получать с помощью метода, основанного на использовании продуцирующих человеческое антитело мышей, несущих фрагмент человеческой геномной ДНК, который содержит гены, кодирующие тяжелую цепь и легкую цепь человеческого антитела (см. Tomizuka K. и др., Nature Genetics, 16, 1997, сс. 33-143; Kuroiwa Y. и др., Nuc. Acids Res., 26, 1998, cc. 3447-3448; Yoshida H. и др., Animal Cell Technology: Basic and Applied Aspects, под ред. Kitagawa Y., Matuda Т. и Iijima S., Kluwer, изд-во Academic Publishers, т. 10, 1999, cc. 69-73; Tomizuka K. и др., Proc. Natl. Acad. Sci. USA, 97, 2000, cc. 722-727 и др.).
В частности, указанных продуцирующих человеческое антитело животных можно получать путем разрушения эндогенных генных локусов тяжелых и легких цепей иммуноглобулинов у млекопитающих кроме человека и интродукции вместо них генных локусов тяжелых и легких цепей человеческих иммуноглобулинов с помощью вектора типа искусственной хромосомы (YAC) или т.п.
Альтернативно этому, эукариотические клетки трансформируют кДНК, кодирующими тяжелую цепь и легкую цепь указанного человеческого антитела, предпочтительно векторами, содержащими каждую из кДНК, с использованием технологии рекомбинации генов, и культивируют трансформированные клетки, продуцирующие рекомбинантное человеческое моноклональное антитело. Это антитело можно получать из супернатанта культуры.
При этом в качестве хозяев можно использовать, например, эукариотические клетки, предпочтительно клетки млекопитающих, такие как СНО-клетки, лимфоциты или миеломы.
Кроме того, известен метод получения человеческого антитела из фаговых дисплейных библиотек, отобранных из библиотеки человеческих антител (см. Wormstone I.М. и др., Investigative Ophthalmology & Visual Science, 43 (7), 2002, сс. 2301-2308; Carmen S. и др., Briefings in Functional Genomics and Proteomics, 1 (2), 2002, cc. 189-203; Siriwardena D. и др., Opthalmology, 109 (3), 2002, сс. 427-431 и др.).
Например, можно применять метод фагового дисплея (Nature Biotechnology, 23, (9), 2005, cc.l 105-1116), который включает обеспечение экспрессии вариабельных областей человеческого антитела в виде одноцепочечного антитела (scFv) на поверхности фага и отбор фага, связывающегося с антигеном. Фаг, выбранный на основе его связывания с антигеном, можно подвергать генному анализу, определяя тем самым ДНК-последовательности, которые кодируют вариабельные области человеческого антитела, связывающиеся с антигеном.
Если ДНК-последовательность scFv, связывающаяся с антигеном, определена, то получают экспрессионный вектор, который несет указанную последовательность, и соответствующих хозяев можно трансфектировать экспрессионным вектором и давать экспрессироваться человеческому антителу (WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438, WO 95/15388, Annu. Rev. Immunol, 12, 1994, cc. 433-455, Nature Biotechnology, 23 (9), 2005, cc. 1105-1116).
(4-6) Метод получения функциональных фрагментов антитела
Метод получения одноцепочечного антитела хорошо известен в данной области (см., например, US №№4946778, 5260203, 5091513 и 5455030). В указанном scFv вариабельная область тяжелой цепи и вариабельная область легкой цепи сцеплены через линкер, препятствующий формированию ими конъюгата, предпочтительно через полипептидный линкер (Huston J.S. и др., Proc. Natl. Acad. Sci. U.S.A., 85, 1988, cc. 5879-5883). Вариабельную область тяжелой цепи и вариабельную область легкой цепи в scFv можно выводить из одного и того же антитела или можно выводить из различных антител.
Например, произвольный одноцпочечный пептид, состоящий из 12-19 остатков, применяют в качестве полипептидного линкера, который соединяет эти вариабельные области.
Для получения кодирующей scFv ДНК, т.е. последовательностей ДНК, которые кодируют тяжелую цепь или вариабельную область тяжелой цепи антитела, и ДНК, которые кодируют легкую цепь или вариабельную область его легкой цепи, каждый ДНК-сегмент, кодирующий всю или требуемую аминокислотную последовательность применяют в качестве матрицы и амплифицируют с помощью ПЦР с использованием пары праймеров, фланкирующих оба конца матрицы. Затем ДНК, кодирующую полипептидный линкерный фрагмент, амплифицируют также в сочетании с парой праймеров, фланкирующих оба его конца, для соединения их с тяжелой и легкой цепями соответственно. Таким образом, кодирующую scFv ДНК можно применять для получения с помощью общепринятого метода экспрессионного вектора, содержащего ДНК, и трансформировать клетки-хозяева экспрессионным вектором. Далее клетки-хозяева культивируют, после чего scFv можно собирать из культур с помощью общепринятого метода.
Кроме того, для получения других функциональных фрагментов антитела ген, кодирующий каждый функциональный фрагмент, получают с помощью описанного выше метода и клетки трансфектируют геном. Представляющий интерес функциональный фрагмент можно собирать из культур клеток.
Антитело, предлагаемое в настоящем изобретении, можно мультимеризировать, повышая тем самым его аффинность к антигену. Антитела, которые можно мультимеризировать, могут представлять собой антитела одного типа или могут представлять собой несколько антител, которые распознают несколько эпитопов соответственно на одном и том же антигене. Примеры методов мультимеризации антител могут включать связывание двух scFv с СН3-доменом IgG, связывание его со стрептавидином и интродукцию мотива спираль-поворот-спираль.
Антитело, предлагаемое в настоящем изобретении, может представлять собой смесь нескольких типов антител к ROBO4, отличающихся по аминокислотной последовательности, т.е. поликлональное антитело.
Примером поликлонального антитела может служить смесь множества типов антител, отличающихся частично или полностью по набору CDR. Указанное поликлональное антитело можно собирать из культур смешанных культур различных продуцирующих антитела клеток (WO 2004/061 104). Кроме того, можно смешивать полученные по отдельности антитела.
Кроме того, антисыворотку, которая является одним из источников поликлональных антител, можно получать путем иммунизации животных требуемым антигеном и сбора сыворотки из животных стандартным методом.
Антитела, конъюгированные с различными молекулами, такими как полиэтиленгликоль (ПЭГ), можно применять в качестве модифицированных форм антитела.
Антитело, предлагаемое в настоящем изобретении, может входить также в любой из конъюгатов, образованных этими антителами с другими лекарственными средствами (иммуноконъюгаты). Примеры такого антитела могут включать антитело, конъюгированное с радиоактивным материалом или соединением, обладающим фармакологическим действием (Nature Biotechnology, 23, 2005, cc. 1137-1146).
(4-7) Очистка антитела
Полученное антитело можно очищать до гомогенного уровня. Для разделения и очистки антитела можно применять общепринятые методы выделения и очистки белков.
Антитело можно выделять и очищать с помощью соответствующим образом подобранного подхода или комбинированных подходов, например (но, не ограничиваясь только ими), с помощью хроматографии на колонках, фильтрации, ультрафильтрации, обессоливания, диализа, препаративного электрофореза в полиакриламидных гелях и/или изоэлектрического фокусирования (Strategies for Protein Purification and Charcterization: A Laboratoy Course Manual, под ред. Daniel R. Marshak и др., изд-во Cold Spring Harbor Laboratory Press, 1996; Antibodies: A Laboratory Manual, под ред. Harlow и David Lane, изд-во Cold Spring Harbor Laboratory).
Примерами хроматографических методов являются аффинная хроматография, ионообменная хроматография, гидрофобная хроматография, гель-фильтрация, хроматография с обращенной фазой и адсорбционная хроматография.
Указанные хроматографические подходы можно осуществлять, используя жидкостную хроматографию, такую как ЖХВР, ЖХВД.
Примерами колонок, применяемых для аффинной хроматографии, могут служить колонки с белком А, белком G и антигеном.
Примерами колонок с белком А являются Hyper D (производства фирмы Pall Corp.), POROS (производства фирмы Applied Biosystems, Inc.) и Sepharose F.F. (производства фирмы GE Healthcare Bio-Sciences Crop.).
Кроме того, антитело можно очищать на основе его активности связывания с антигеном, используя носитель с иммобилизованном антигеном.
В настоящем изобретении предложены также ген, кодирующий антитело, предлагаемое в настоящем изобретении или его функциональный фрагмент, или его модифицированную форму, рекомбинантный вектор, содержащий вставку гена, клетка-хозяин, трансфектированная геном или вектором, и клетка, продуцирующая антитело, предлагаемое в настоящем изобретении.
Настоящее изобретение относится также к антителу или его фрагменту, которое/который получают с помощью любого из методов, указанных в разделах (4-1)-(4-6).
5. Фармацевтическая композиция
Настоящее изобретение относится к фармацевтической композиции, содержащей антитело к ROBO4 или его функциональный фрагмент, или его модифицированную форму.
Фармацевтическую композицию, предлагаемую в настоящем изобретении, можно применять для лечения или предупреждения заболевания, для которого характерен ангиогенез в качестве одного из патологических признаков во время возникновения, развития и/или обострения, и которое можно лечить путем подавления указанного ангиогенеза или проницаемости сосудов (далее в контексте настоящего описания указанное заболевание для удобства обозначено как «ангиогенное заболевание»).
Примеры ангиогенных заболеваний могут включать экссудативную возрастную дегенерацию желтого пятна, диабетическую ретинопатию, макулярный отек, доброкачественную или злокачественную опухоль, атеросклероз, ретролентальную фиброплазию, ангиому, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативную ретинопатию, неоваскулярную глаукому, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис и ожирение. Фармацевтическую композицию, предлагаемую в настоящем изобретении, можно применять в качестве средства для лечения или предупреждения ангиогенного заболевания, предпочтительно можно применять для лечения или предупреждения экссудативной возрастной дегенерации желтого пятна, диабетической ретинопатии, макулярного отека, доброкачественной или злокачественной опухоли, ретролентальной фиброплазии, неоваскулярного заболевания глаза, пролиферативной ретинопатии, неоваскулярной глаукомы и иммунного отторжения трансплантата ткани роговицы, более предпочтительно можно применять для лечения или предупреждения экссудативной возрастной дегенерации желтого пятна, диабетической ретинопатии, макулярного отека, доброкачественной или злокачественной опухоли, ретролентальной фиброплазии, неоваскулярного заболевания глаза, пролиферативной ретинопатии и неоваскулярной глаукомы.
В настоящем изобретении понятие лечение и/или лечение заболевания включает (но, не ограничиваясь только ими) предупреждение возникновения заболевания, предпочтительно заболевания у индивидуума, у которого присутствует экспрессированный белок ROBO4, подавление или ингибирование обострения заболевания или его развития, облегчение одного или двух, или большего количества симптомов, проявляющихся у индивидуума, пораженного заболеванием, подавление или ремиссию обострения заболевания или его развития, лечение или предупреждение вторичного заболевания и т.п.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, может содержать в терапевтически или профилактически эффективном количестве антитело к ROBO4 или функциональный фрагмент антитела и фармацевтически приемлемый разбавитель, наполнитель, солюбилизатор, эмульгатор, консервант и/или добавку.
«Терапевтически или профилактически эффективное количество» означает количество, которое обладает терапевтическим или профилактическим действием в отношении конкретного заболевания при использовании конкретной лекарственной формы и пути введения.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, может содержать материалы, предназначенные для изменения, поддерживания или сохранения рН, осмотического давления, вязкости, прозрачности, окраски, тоничности, стерильности или стабильности, растворимости, длительности высвобождения, способности к абсорбции, способности к проникновению, лекарственной формы, концентрации, свойств, формы и т.д. композиции или антитела, входящего в ее состав (далее в контексте настоящего описания обозначены как «фармацевтические материалы). Фармацевтические материалы не ограничены конкретными веществами, если они представляют собой фармакологически приемлемые материалы. Например, предпочтительным свойством указанных фармацевтических материалов является их низкая токсичность или отсутствие токсичности.
Примеры фармацевтических материалов могут включать (но, не ограничиваясь только ими) следующие вещества: аминокислоты, такие как глицин, аланин, глутамин, аспарагин, гистидин, аргинин и лизин; противомикробные средства; антиоксиданты, такие как аскорбиновая кислота, сульфат натрия и бисульфит натрия; буферы, такие как фосфатный, цитратный или боратный буферы, бикарбонат натрия и растворы Трис-HCl; наполнители, такие как маннит и глицин; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТК); комплексообразующие агенты, такие как кофеин, поливинилприрролидин, β-циклодекстрин и гидроксипропил-β-циклодекстрин; наполнители, такие как глюкоза, манноза и декстрин; другие углеводы, такие как моносахариды, дисахариды, глюкоза, манноза и декстрин; красители; корригенты; разбавители; эмульгаторы; гидрофильные полимеры, такие как поливинилпирролидин; низкомолекулярные полипептиды; солеобразующие противоионы; антисептики, такие как бензалконийхлорид, бенозойная кислота, салициловая кислота, тимеросал, фенилэтиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновая кислота и пероксид водорода; растворители, такие как глицерин, пропиленгликоль и полиэтиленгликоль; сахарные спирты, такие как манит и сорбит; суспендирующие агенты; поверхностно-активные вещества, такие как ПЭГ, сложный эфир сорбитана, полисорбаты, такие как полисорбат 20 и полисорбат 80, тритон, трометамин, лецитин и холестерин; усилители стабильности, такие как сахароза и сорбит; усилители эластичности, такие как хлорид натрия, хлорид калия, маннит и сорбит; транспортирующие агенты; разбавители; эксципиенты и/или фармацевтические добавки.
Указанные фармацевтические материалы добавляют в количестве, составляющем от 0,001 до 1000, предпочтительно от 0,01 до 100, более предпочтительно от 0,1 до 10 в пересчете на массу антитела к ROBO4 или его функционального фрагмента, или его модифицированной формы.
К фармацевтической композиции, предлагаемой в настоящем изобретении, относится также фармацевтическая композиция, содержащая иммунолипосому, которая содержит антитело к ROBO4 или его функциональный фрагмент, или его модифицированную форму, капсулированное/капсулированную в липосому, или модифицированную форму антитела, которая содержит антитело, конъюгированное с липосомой (US №6214388 и т.д.).
Для эксципиентов или наполнителей не имеется специальных ограничений, если они представляют собой жидкие или твердые продукты, которые обычно применяют в предназначенной для инъекции воде, физиологическом растворе, искусственных спинно-мозговых жидкостях и других препаратах для орального или парентерального введения. Примерами физиологического раствора могут служить нейтральный физиологический раствор и содержащий сывороточный альбумин физиологический раствор.
Примерами буферов могут служить Трис-буферы, которые обеспечивают конечное значение рН фармацевтической композиции, составляющее от 7,0 до 8,5, ацетатные буферы, которые обеспечивают конечное значение рН, составляющее от 4,0 до 5,5, цитратные буферы, которые обеспечивают конечное значение рН, составляющее от 5,0 до 8,0, и гистидиновые буферы, которые обеспечивают конечное значение рН, составляющее от 5,0 до 8,0.
Фармацевтическая композиция, предлагаемая в настоящем изобретении, является твердой, жидкой, суспензией или т.п. Другой пример фармацевтической композиции, предлагаемой в настоящем изобретении, может включать высушенные вымораживанием препараты. Высушенные вымораживанием препараты можно получать, используя в качестве эксципиента сахарозу.
Путь введения фармацевтической композиции, предлагаемой в настоящем изобретении, может представлять собой любой из таких путей введения как энтеральное введение, местное применение и парентеральное введение, и его можно выбирать предпочтительно в зависимости от целевого заболевания.
Конкретные примеры могут включать внутривенное введение, внутриартериальное введение, внутримышечное введение, внутрикожное введение, подкожное введение, внутрибрюшинное введение, чрескожное введение, внутрикостное введение, и внутрисуставное введение. Кроме того, можно применять введение в глаз предпочтительно при офтальмическом ангиогенном заболевании, таком как экссудативная возрастная дегенерация желтого пятна, диабетическая ретинопатия, макулярный отек, ретролентальная фиброплазия, неоваскулярное заболевание глаза, пролиферативная ретинопатия, неоваскулярная глаукома или иммунное отторжение трансплантата ткани роговицы.
Рецептуру фармацевтической композиции может определять в зависимости от метода введения, аффинности связывания антитела с белком ROBO4 и т.д. Антитело к ROBO4, предлагаемое в настоящем изобретении, или его функциональный фрагмент, или его модифицированная форма, обладающие более высокой аффинностью (более низкая величина KD) к белку ROBO4, могут обладать эффективностью в качестве лекарственного средства в более низкой дозе. Дозу антитела к ROBO4, предлагаемого в настоящем изобретении, можно определять в зависимости от вида индивидуума, типа заболевания, симптомов, пола, возраста, предшествующих обстоятельств, аффинности связывания к белку ROBO4 или его биологической активности и других факторов. Как правило, дозу от 0,01 до 1000 мг/кг, предпочтительно от 0,1 до 100 мг/кг можно вводить один раз в день в течение вплоть до 180 дней или два, или три, или большее количество раз в день.
Примерами форм фармацевтической композиции могут служить инъецируемые формы (включая высушенные вымораживанием препараты и капли), суппозитории, препараты для трансназальной абсорбции, препараты для чрескожной абсорбции, подъязычные препаративные формы, капсулы, таблетки, мази, гранулы, аэрозоли, пилюли, порошки, суспензии, эмульсии, глазные капли и препаративные формы биологических имплантатов.
Фармацевтическую композицию, которая содержит в качестве действующего вещества антитело к ROBO4, предлагаемое в настоящем изобретении, или его функциональный фрагмент, или его модифицированную форму, можно применять в комбинации с дополнительным терапевтическим или профилактическим средством. Примерами указанных средств являются антиангиогенное лекарственное средство, противовоспалительное лекарственное средство и/или противораковое лекарственное средство, Например, антиангиогенное лекарственное средство, противовоспалительное лекарственное средство и/или противораковое лекарственное средство вводят индивидууму, а затем ему вводят фармацевтическую композицию, которая содержит в качестве действующего вещества антитело к ROBO4 или функциональный фрагмент антитела. Альтернативно этому, индивидууму вводят фармацевтическую композицию, а затем ему вводят антиангиогенное лекарственное средство, противовоспалительное лекарственное средство и/или противораковое лекарственное средство. Альтернативно этому, фармацевтическую композицию можно вводить индивидууму одновременно с антиангиогенным лекарственным средством, противовоспалительным лекарственным средством и/или противораковым лекарственным средством. Примеры антиангиогенного лекарственного средства могут включать ранибизумаб.
В настоящем изобретении предложен также способ лечения или предупреждения ангиогенного заболевания, включающего экссудативную возрастную дегенерацию желтого пятна, диабетическую ретинопатию, макулярный отек, доброкачественную или злокачественную опухоль, атеросклероз, ретролентальную фиброплазию, ангиому, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативную ретинопатию, неоваскулярную глаукому, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение, применение антитела, предлагаемого в настоящем изобретении, для приготовления фармацевтической композиции, предназначенной для лечения или предупреждения ангиогенного заболевания, и применение антитела, предлагаемого в настоящем изобретении, для лечения или предупреждения ангиогенного заболевания. В настоящем изобретении предложен также набор, предназначенный для лечения или предупреждения, который содержит антитело, предлагаемое в настоящем изобретении.
6. Композиция для диагностирования
В настоящем изобретении предложена композиция для оценки или диагностирования, содержащая антитело к ROBO4, предлагаемое в настоящем изобретении, или его функциональный фрагмент, или его модифицированную форму (далее в контексте настоящего описания обозначена как «композиция для диагностирования»).
Композицию для диагностирования, предлагаемую в настоящем изобретении, можно применять для оценки или диагностирования ангиогенного заболевания, такого как экссудативная возрастная дегенерация желтого пятна, диабетическая ретинопатия, макулярный отек, доброкачественная или злокачественная опухоль, атеросклероз, ретролентальная фиброплазия, ангиома, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативная ретинопатия, неоваскулярная глаукома, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение. Композицию для диагностирования, предлагаемую в настоящем изобретении, можно применять также для оценки или диагностирования раннего ангиогенеза или преангиогенезных симптомов, которые не удовлетворяют общепринятым диагностическим критериям, недиагностируемых симптомов, которые приводят к ангиогенезу, и т.д. В настоящем изобретении оценка или диагностирование включают, например, определение или тестирование риска приобретения заболевания, определение присутствия или отсутствия заболевания, тестирование степени прогрессирования или обострения заболевания, тестирование или определение воздействия лекарственной терапии с использованием фармацевтической композиции, которая содержит антитело к ROBO4 или т.п., тестирование или определение воздействия терапии, отличной от лекарственной терапии, тестирование риска рецидива и определение присутствия или отсутствия рецидива. Однако оценка или диагностирование, предлагаемые в настоящем изобретении, не ограничены указанными процедурами, если они представляют собой общепринятые оценку или диагностирование.
Когда белок ROBO4 обнаружен в 2-, 3-, 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11-, 12-, 13-, 14-, 15-, 16-, 17-, 18-, 19- или 20-кратном количестве или более, предпочтительно в 10-кратном количестве или более, в образце, полученном из тестируемого индивидуума, по сравнению с образом, полученным из здорового индивидуума, то тестируемого индивидуума можно диагностировать как имеющего ангиогенное заболевание или как имеющего высокий риск его возникновения. Кроме того, когда концентрация в сыворотке белка ROBO4 превышает определенное референс-значение, то тестируемого индивидуума можно диагностировать как имеющего ангиогенное заболевание или как имеющего высокий риск его возникновения. Референс-значение, как правило, составляет от 0,01 до 10 нг/мл, предпочтительно от 0,1 до 1 нг/мл, более предпочтительно от 0,1 до 0,3 нг/мл.
Указанная композиция для диагностирования может содержать рН-буфер, осмморегулятор, соли, стабилизатор, антисептик, проявитель цвета, активатор, ингибитор агрегации и т.п.
В настоящем изобретении предложен также способ оценки или диагностирования ангиогенного заболевания, такого как экссудативная возрастная дегенерация желтого пятна, диабетическая ретинопатия, макулярный отек, доброкачественная или злокачественная опухоль, атеросклероз, ретролентальная фиброплазия, ангиома, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативная ретинопатия, неоваскулярная глаукома, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение, применение антитела, предлагаемого в настоящем изобретении, для приготовления композиции, предназначенной для диагностики ангиогенного заболевания, и применение антитела, предлагаемого в настоящем изобретении, для оценки или диагностирования ангиогенного заболевания. В настоящем изобретении предложен также набор, предназначенный для оценки или диагностирования, который содержит антитело, предлагаемое в настоящем изобретении.
Метод оценки или диагностирования, включающий антитело, предлагаемое в настоящем изобретении, предпочтительно представляет собой сэндвич-ELISA. Можно применять общепринятый метод обнаружения с использованием антител, такой как ELISA, РИА, ELISPOT (метод иммуноферментных пятен), дот-блоттинг, тест Оухтерлони или CIE (противоточный иммуноэлектрофорез). Антитела, применяемые в системе анализа сэндвич-ELISA, могут представлять собой любую комбинацию двух антител, которые распознают ROBO4, но не конкурируют друг с другом. Помимо биотина, метод с использованием метки, которую можно использовать в биохимическом анализе, такой как HRP, щелочная фосфатаза или ФИТЦ, можно применять в методе мечения для антител. Хромогенный субстрат, такой как ТМВ (3,3',5,5'-тетраметилбензидин), BCIP (5-бром-4-хлор-3-индолилфосфат), н-NPP (н-нитрофенилфосфат), OPD (о-фенилендиамин), ABTS (3-этилбензотиазолин-6-сульфоновая кислота), хемилюминисцентный субстрат SuperSignal ELISA Pico (фирма Thermo Fisher Scientific Inc.), флуоресцентный субстрат, такой как флуорогенный субстрат для пероксидазы QuantaBlu™ (фирма Thermo Fisher Scientific Inc.) и хемилюминисцентный субстрат можно применять для обнаружения с использованием ферментной метки. Такому анализу можно подвергать образцы, полученные из организма человека или животных кроме человека, а также искусственно обработанные образцы, такие как рекомбинантные белки. Примеры тестируемых образцов, полученных из организма индивидуумов, могут включать (но, не ограничиваясь только ими) кровь, синовиальную жидкость, асциты, лимфу, спинномозговую жидкость и супернатанты тканевых гомогенатов.
Набор для осуществления сэндвич-ELISA для оценки или диагностирования, содержащий антитело, предлагаемое в настоящем изобретении, может включать раствор стандартов белка ROBO4, окрашивающий реагент, буферный раствор для разведения, антитело для твердой фазы, антитела для идентификации и отмывочный раствор и т.п. Количество антитела, связанного с антигеном, можно измерять предпочтительно с использованием такого метода, как метод, основанный на оценке абсорбции, флуоресценции, люминисценции или РИ (радиоизотопов). Для измерения предпочтительно применяют планшет-ридер абсорбции, планшет-ридер флуоресценции, планшет-ридер люминисценции, жидкостной сцинтилляционный счетчик для РИ или т.п.
Примеры
Ниже настоящее изобретение описано более подробно со ссылкой на примеры. Однако они не должны рассматриваться в качестве ограничивающих настоящее изобретение.
Ниже в примерах каждую из процедур генной инженерии осуществляли согласно методам, описанным в «Molecular Cloning» (Sambrook J., Fritsch E.F. и Maniatis Т., изд-во Cold Spring Harbor Laboratory Press, 1989), или методам, описанным в других руководствах по проведению экспериментальных исследований, применяемым специалистами в данной области, или их осуществляли согласно инструкциям к применяемым поступающим в продажу реагентам или наборам, если специально не указано иное.
Пример 1. Получение экспрессионного вектора
1)-1 Получение экспрессионного вектора человеческого ROBO4
1)-1-1 Получение экспрессионного вектора полноразмерного человеческого ROBO4
Человеческую кДНК ROBO4 отщепляли с помощью EcoRV и Notl от плазмиды (производства фирмы Open Biosystems), содержащей человеческую кДНК ROBO4 (регистрационный № ВС039602), и встраивали между EcoRV и Notl в pCI-вектор (производства фирмы Promega Corp.), получая экспрессионный вектор полноразмерного человеческого ROBO4 (обозначен далее в настоящем описании как «pCI-hROBO4»). Последовательность человеческого гена ROBO4, клонированного в этом векторе, представлена в SEQ ID NO: 1. Кроме того, аминокислотная последовательность человеческого ROBO4 представлена в SEQ ID NO: 2.
1)-1-2 Получение экспрессионного вектора внеклеточной области человеческого ROBO4
кДНК, кодирующую полипептид внеклеточной области человеческого ROBO4 (состоящий из аминокислотной последовательности, представленной аминокислотами №№1-461 SEQ ID NO: 2; обозначена далее в настоящем описании как «человеческий ROBO4-ECD»), амплифицировали с помощью ПЦР-реакции с использованием набора праймеров:
праймер 1F: 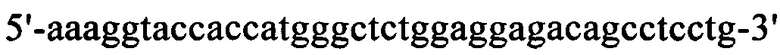 и
и
праймер 1R: 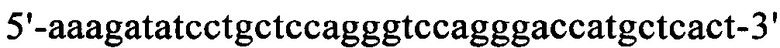 .
.
Полученный ПЦР-продукт клонировали в векторе pEF6/V 5-His-TOPO (производства фирмы Life Technologies Corp.) (далее в настоящем описании образовавшийся вектор сокращенно обозначали как «pEF6-ROBO4-ECD»; далее в настоящем описании рекомбинантный белок, экспрессируемый «pEF6-ROBO4-ECD» обозначали как «rROBO4-ECD»).
1)-1-3 Получение экспрессионных векторов полноразмерного человеческого ROBO4, меченного на N-конце FLAG, и вариантов человеческого ROBO4 с делецией. затрагивающей внеклеточную область/внеклеточный домен
Для конструирования векторов для экспрессии белка, содержащего область, состоящую из аминокислотной последовательности, представленной аминокислотами №№28-1007 SEQ ID NO: 2, человеческого ROBO4 (на диаграмме эта область обозначена как «hROBO4-28»), его область, состоящую из аминокислотной последовательности, представленной аминокислотами №№46-1007 (на диаграмме эта область обозначена как «hROBO4-46»), его область, состоящую из аминокислотной последовательности, представленной аминокислотами №№132-1007 (на диаграмме эта область обозначена как «hROBO4-132»), его область, состоящую из аминокислотной последовательности, представленной аминокислотами №№210-007 (на диаграмме эта область обозначена как «hROBO4-210»), его область, состоящую из аминокислотной последовательности, представленной аминокислотами №№225-1007 (на диаграмме эта область обозначена как «hROBO4-225»), или его область, состоящую из аминокислотной последовательности, представленной аминокислотами №№341-1007 (на диаграмме эта область обозначена как «hROBO4-341»), меченную на N-конце с помощью FLAG, осуществляли ПЦР-реакцию с использованием pCI-hROBO4 в качестве матрицы с применением каждого набора праймеров:
набор праймеров для амплификации hROBO4-28:
праймер 2F: 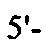
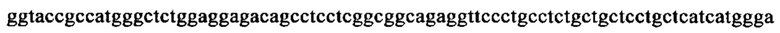
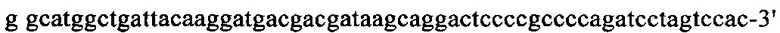 и
и
праймер 2R: 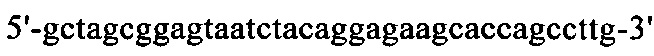 ,
,
набор праймеров для амплификации hROBO4-46:
праймер 3F: 
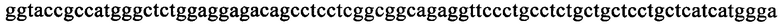
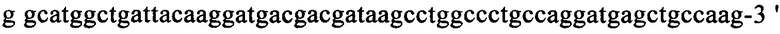 и праймер 2R,
и праймер 2R,
набор праймеров для амплификации hROBO4-132:
праймер 4F: 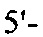
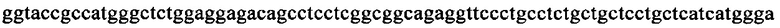
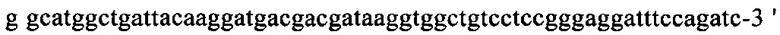 и праймер 2R,
и праймер 2R,
набор праймеров для амплификации hROBO4-210:
праймер 5F: 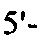
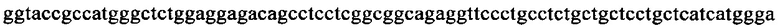
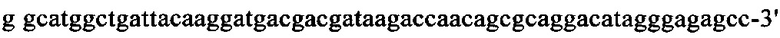 и праймер 2R,
и праймер 2R,
набор праймеров для амплификации hROBO4-225:
праймер 6F: 
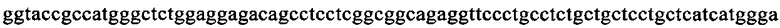
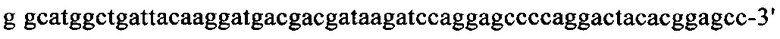 и праймер 2R,
и праймер 2R,
набор праймеров для амплификаци hROBO4-341:
праймер 7F: 
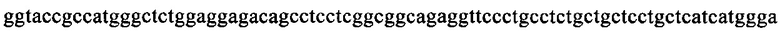
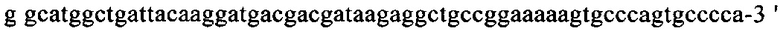 и праймер 2R.
и праймер 2R.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO (производства фирмы Life Technologies Corp.), создавая клонирующий вектор. Из каждого клонирующего вектора соответствующую кДНК отщепляли с помощью Kpnl и Nhel и встраивали между Kpnl и Nhel в pCI-вектор с получением экспрессионного вектора меченного на N-конце с помощью FLAG полноразмерного человеческого ROBO4 и четырех экспрессионных векторов вариантов человеческого ROBO4 с делециями, затрагивающими внеклеточную область/внеклеточные домены. Вектор меченного на N-конце с помощью FLAG полноразмерного человеческого ROBO4 состоит из нуклеотида, кодирующего сигнальную последовательность ROBO4 (аминокислоты №№1-27 SEQ ID NO: 2) + FLAG-последовательность (DYKDDDDK) + ROBO4 (аминокислоты №№28-1007 SEQ ID NO: 2), начиная с N-конца. Далее в контексте настоящего описания вектор для экспрессии меченного на N-конце с помощью FLAG полноразмерного человеческого ROBO4 обозначали как «pCI-FLAG-hROBO4-28». Экспрессионный вектор для вариантов человеческого ROBO4 с делециями, затрагивающими внеклеточную область/внеклеточные домены, например, вектор для экспрессии ROBO4, состоящего из аминокислот №№46-1007 SEQ ID NO: 2, состоит из нуклеотида, кодирующего сигнальную последовательность ROBO4 (аминокислоты №№1-27 SEQ ID NO: 2) + FLAG-последовательность (DYKDDDDK) + ROBO4 с делецией внеклеточной области (аминокислоты №№46-1007 SEQ ID NO: 2). Указанный вектор обозначен как «pCI-hROBO4-46». Аналогично этому, векторы, кодирующие ROBO4, который имеет частичную делецию внеклеточной области ROBO4, обозначают как «pCI-hROBO4-132», «pCI-hROBO4-210», «pCI-hROBO4-225» и «pCI-hROBO4-341» соответственно.
Нуклеотидная последовательность, которая кодирует аминокислотную последовательность меченного на N-конце с помощью FLAG полноразмерного человеческого ROBO4 или каждого варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточные домены, клонированная в векторе, представлена в SEQ ID NO: 3, 5, 7, 9, 11 или 13. Кроме того, аминокислотная последовательность соответствующего меченного на N-конце с помощью FLAG полноразмерного человеческого ROBO4 или каждого варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточные домены, представлена в SEQ ID NO: 4, 6, 8, 10, 12 или 14.
1)-1-4 Получение экспрессионного вектора для варианта человеческого ROBO4 с делецией. затрагивающей внутриклеточную область
Для конструирования вектора, предназначенного для экспрессии белка, который содержит область, состоящую из аминокислотной последовательности, представленной аминокислотами №№1-511 SEQ ID NO: 2 человеческого ROBO4 (далее в контексте настоящего описания эта область обозначена как «hROBO4-АС»), встраивали стоп-кодон непосредственно после кодона, кодирующего 511-ую аминокислоту человеческого ROBO4, с использованием pCI-hROBO4 в качестве матрицы с помощью набора праймеров hROBO4-AC:
праймер 8F: 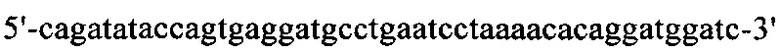 и
и
праймер 8R: 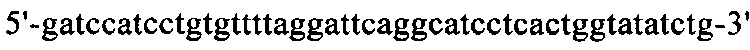 ,
,
и набора для сайтнаправленного мутагенеза QuikChange XL (производства фирмы Agilent Technologies, Inc.) для получения экспрессионного вектора hROBO4-AC (далее обозначен в настоящем описании как «pCI-hROBO4-ΔC»).
1)-2 Получение экспрессионного вектора мышиного ROBO4
ПЦР-реакцию осуществляли с использованием в качестве матрицы к ДНК QUICK-клона мышиного сердца (производства фирмы Takara Bio Inc.) с применением набора праймеров:
праймер 9F: 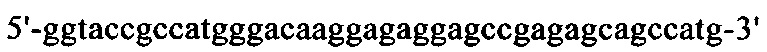 и
и
праймер 9R: 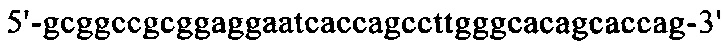 .
.
Полученный ПЦР-продукт встраивали в вектор pCR-Blunt II-ТОРО (производства фирмы Life Technologies Corp.) с получением клонирующего вектора, содержащего кДНК мышиного ROBO4. Из клонирующего вектора кДНК мышиного ROBO4 отщепляли с помощью Kpnl и Notl и встраивали между Kpnl и Notl в pCI-вектор с получением экспрессионного вектора мышиного ROBO4 (далее в контексте настоящего описания обозначен как «pCI-mROBO4»). Последовательность сайта ОРС в мышином гене ROBO4, клонированном в указанном векторе, представлена в виде нуклеотидов №№7-3051 SEQ ID NO: 15. Кроме того, аминокислотная последовательность мышиного ROBO4 представлена в SEQ ID NO: 16.
1)-3 Получение экспрессионного вектора крысиного ROBO4
ПЦР-реакцию осуществляли с использованием в качестве матрицы кДНК QUICK-клона крысиной селезенки (производства фирмы Takara Bio Inc.) с применением набора праймеров:
праймер 10F: 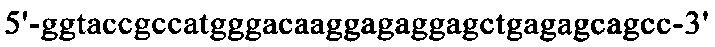 и
и
праймер 10R: 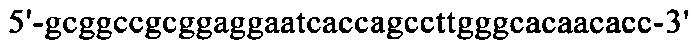 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением клонирующего вектора, содержащего кДНК крысиного ROBO4. Из клонирующего вектора кДНК крысиного ROBO4 отщепляли с помощью Kpnl и Notl и встраивали между Kpnl и Notl в pCI-вектор с получением экспрессионного вектора крысиного ROBO4 (далее в контексте настоящего описания обозначен как «pCI-raROBO4»). Нуклеотидная последовательность крысиной кДНК ROBO4 представлена в SEQ ID NO: 17. Аминокислотная последовательность, кодируемая указанной нуклеотидной последовательностью, представлена в SEQ ID NO: 18.
1)-4 Получение экспрессионного вектора ROBO4 обезьян циномогус с N-концевой FLAG-меткой
ПЦР-реакцию осуществляли с использованием в качестве матрицы кДНК, синтезированной из общей РНК почки обезьян циномолгус, и с применением набора праймеров:
праймер 11F: 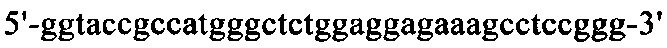 и
и
праймер 11R: 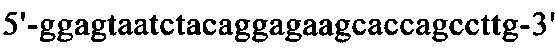 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением двух типов клонирующих векторов, каждый из которых содержал кДНК ROBO4 обезьян циномолгус (далее в настоящем описании обозначены как cynoROBO4-1 или cynoROBO4-2) (далее в настоящем описании эти векторы обозначены как pCR-cynoROBO4-1 и pCR-cynoROBO4-2 соответственно).
Затем осуществляли ПЦР-реакцию с использованием в качестве матрицы pCR-cynoROBO4-1 или pCR- cynoROBO4-2 с применением набора праймеров:
праймер 12F: 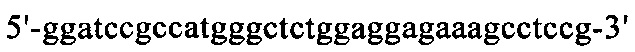 и
и
праймер 12R: 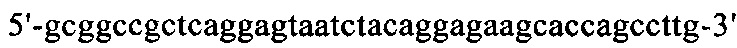 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением клонирующего вектора, содержащего каждую из кДНК ROBO4 обезьян циномолгус. Из клонирующего вектора соответствующую кДНК ROBO4 обезьян циномолгус отщепляли с помощью BamHI и Notl и встраивали между BamHI и Notl в pCI-вектор с получением двух типов экспрессионных векторов ROBO4 обезьян циномолгус (далее в контексте настоящего описания обозначены как pCI-cynoROBO4-1 и pCI-cynoROBO4-2 соответственно).
Затем осуществляли ПЦР-реакцию с использованием в качестве матрицы pCI-cynoROBO4-1 или pCI-cynoROBO4-2 с применением набора праймеров:
праймер 13F: 
и праймер 12R.
Полученный ПЦР-продукт встраивали с вектор pCR-TOPO (производства фирмы Life Technologies Corp.) с получением каждого клонирующего вектора, содержащего кДНК несущего N-концевую FLAG-метку ROBO4 обезьян циномолгус. Из клонирующего вектора отщепляли с помощью Kpnl и Notl соответствующую кДНК ROBO4 обезьян циномолгус и встраивали между Kpnl и Notl в pCI-вектор с получением экспрессионных векторов несущего N-концевую FLAG-метку ROBO4 обезьян циномолгус (далее в настоящем описании обозначены как «pCI-FLAG-cynoROBO4-1» и «pCI-FLAG-cynoROBO4-2» соответственно). Нуклеотидная последовательность кДНК ROBO4 обезьян циномолгус, клонированная в каждом из pCI-FLAG-cynoROBO4-1 и pCI-FLAG-cynoROBO4-2, представлена в SEQ ID NO: 19 и 21 соответственно. Аминокислотная последовательность, кодируемая каждой из нуклеотидных последовательностей, представлена в SEQ ID NO: 20 и 22 соответственно.
1)-5 Получение экспрессионного вектора человеческого ROBO1 с N-концевой FLAG-меткой
ПЦР-реакцию осуществляли с использованием в качестве матрицы кДНК QUICK-клона человеческого сердца (производства фирмы Takara Bio Inc.) с применением набора праймеров:
праймер 13F: 
 и
и
праймер 13R: 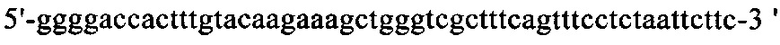 .
.
Полученный ПЦР-продукт и вектор pDONR221 (производства фирмы Life Technologies Corp.) подвергали ВР-реакции с получением донорского вектора, содержащего кДНК человеческого ROBO1.
Затем, используя в качестве матрицы донорский вектор, осуществляли ПЦР-реакцию с применением набора праймеров:
праймер 14F: 
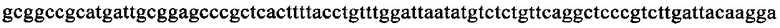
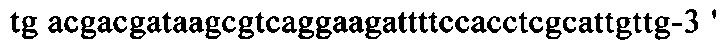 и
и
праймер 14R: 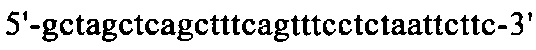 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением клонирующего вектора, содержащего кДНК человеческого ROBO1 с N-концевой FLAG-меткой. Из клонирующего вектора отщепляли с помощью Nhel и NotI кДНК человеческого ROBO1 с N-концевой FLAG-меткой и встраивали между Nhel и NotI в pCI-вектор с получением экспрессионного вектора (далее в настоящем описании обозначен как «pCI-FLAG-hROBO1»). Нуклеотидная последовательность кДНК человеческого ROBO1 с N-концевой FLAG-меткой представлена в SEQ ID NO: 23. Аминокислотная последовательность, кодируемая указанной нуклеотидной последовательностью, представлена в SEQ ID NO: 24.
1)-6 Получение экспрессионного вектора человеческого ROBO2
ПЦР-реакцию осуществляли с использованием в качестве матрицы кДНК QUICK-клона человеческого легкого (производства фирмы Takara Bio Inc.) с применением набора праймеров:
праймер 15F: 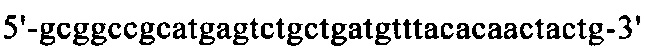 и
и
праймер 15R: 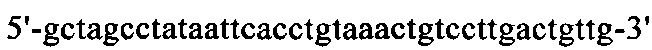 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением клонирующего вектора, содержащего кДНК человеческого ROBO2. Из клонирующего вектора кДНК человеческого ROBO2 отщепляли с помощью NotI и Nhel и встраивали между NotI и Nhel в pCI-вектор с получением экспрессионного вектора (далее в настоящем описании обозначен как «pCI-hROBO2»). Нуклеотидная последовательность кДНК человеческого ROBO2 представлена в SEQ ID NO: 25. Аминокислотная последовательность, кодируемая указанной нуклеотидной последовательностью, представлена в SEQ ID NO: 26.
1)-7 Получение экспрессионного вектора человеческого ROBO3
ПЦР-реакцию осуществляли с использованием в качестве матрицы человеческого ROBO3/pENTR223.1 (производства фирмы Open Biosystems) с применением набора праймеров:
праймер 16F: 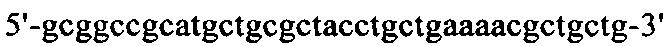 и
и
праймер 16R: 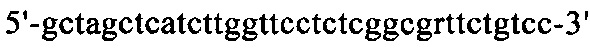 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением клонирующего вектора, содержащего кДНК человеческого ROBO3. Из клонирующего вектора кДНК человеческого ROBO3 отщепляли с помощью NotI и Nhel и встраивали между NotI и Nhel в pCI-вектора с получением экспрессионного вектора (далее в контексте настоящего описании обозначен как «pCI-hROBO3»). Последовательность сайта ОРС в человеческом гене ROBO3, клонированном в этом векторе, представлена нуклеотидами №№35-4192 SEQ ID NO: 27. Кроме того, аминокислотная последовательность человеческого ROBO3 представлена в SEQ ID NO: 28.
Пример 2. Получение моноклонального антитела
2)-1 Получение антигенного белка
Для экспрессии rROBO4-ECD трансфектировали клетки линии FreeStyle 293-F (производства фирмы Life Technologies Corp.) с помощью pEF6-ROBO4-ECD, используя 293fectin (производства фирмы Life Technologies Corp.), и культивировали при 37°С в течение 6 дней в атмосфере, содержащей 8% СО2. После завершения культивирования культуральный раствор собирали центрифугированием и применяли в качестве маточного раствора для очистки rR0BC4-ECD. Полученный супернатант культуры подвергали диализу в противотоке 20 мМ Трис-HCl, рН 7,5, используя диализационную трубку с номинальной отсекающей молекулярной массой 15000, фильтровали через фильтр (0,45 мкм), а затем добавляли на колонку HiTrap 16/10 Q XL (производства фирмы GE Healthcare Bio-Sciences Crop.), уравновешенную 20 мМ Трис-HCl, рН 7,5. Элюцию осуществляли с использованием градиента NaCl (20 мМ Трис-HCl, рН 7,5/0,2М NaCl, 20 мМ Трис-HCl, рН 7,5/1 М NaCl). Часть элюированной фракции разделяли с помощью электрофореза в полиакриламидном геле в присутствии ДСН (далее в контексте настоящего описания сокращенно обозначен как «ДСН-ПААГ»). Затем гель окрашивали кумасси бриллиантовым голубым (далее в контексте настоящего описания сокращенно обозначено как «КБГ-окрашивание) и осуществляли детекцию с помощью Вестерн-блоттинга для подтверждения того, что фракция содержит rROBO4-ECD. Затем фракцию, содержащую rROBO4-ECD, собирали и вносили на колонку HiLoad 16/60 Superdex 75 пг (производства фирмы GE Healthcare Bio-Sciences Crop.), уравновешенную ЗФР. После элюции с помощью ЗФР часть элюированной фракции подвергали ДСН-ПААГ. Затем гель подвергали КБГ-окрашиванию и осуществляли детекцию с помощью Вестерн-блоттинга для подтверждения того, что фракция содержит rROBO4-ECD. Фракцию, содержащую rROBO4-ECD, собирали и применяли в качестве антигена для иммунизации и в качестве антигена при осуществлении анализа аффинности связывания. Концентрацию белка определяли с помощью реагента для ВСА-анализа белков (производства фирмы Pierce Biotechnology, Inc.).
2)-2 Иммунизация
Применяли шестинедельных самок мышей линии BALB/c. В день 0 каждой мыши вводили подкожно или внутрикожно по 50 мкг смеси rROBO4-ECD и полного адъюванта Фрейнда. В дни 7, 14 и 21 каждой мыши вводили подкожно или внутрикожно по 50 мкг смеси rROBO4-ECD и неполного адъюванта Фрейнда. В день 38 мышам вводили внутрибрюшинно по 50 мкг rROBO4-ECD. В день 42 у мышей изымали лимфатические узлы или селезенку и применяли для получения гибридом.
2)-3 Получение гибридом
Клетки лимфатических узлов или клетки селезенки и клетки мышиной миеломы линии SP2/0-agl4 сливали с помощью электрических импульсов, используя систему для получения гибридом Hybrimune (производства фирмы Cyto Pulse Sciences, Inc.), разводили селективной средой D ClonaCell-HY (производства фирмы StemCell Technologies Inc.) и культивировали. Появившиеся клоны гибридом собирали для получения моноклональных гибридом. Каждую собранную колонию гибридом культивировали и полученный супернатант культур гибридом подвергали скринингу в отношении продуцирующих антитело к ROBO4 гибридом.
2)-4 Скрининг антител
2)-4-1 Получение клетки, экспрессирующей ген антигена, для применения в клеточном ELISA
Плотность клеток линии HEK293 доводили до 7,5×105 клеток/мл в среде DMEM, содержащей 10% FBS. Клетки трансфектировали вектором pCI-hROBO4 или применяемым в качестве отрицательного контроля pCI-имитатором с использованием липофектамина 2000 (производства фирмы Life Technologies Corp.), распределяли в концентрации 50 мкл/лунку в 96-луночный планшет половинной площади (производства фирмы Corning Inc.) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°С в атмосфере, содержащей 5% СО2. Полученные трансфектированные клетки применяли для клеточного ELISA в прикрепленном друг к другу виде.
2)-4-2 Получение клетки, экспрессирующей ген антигена, для применения в анализе методом проточной цитометрии
Клетки линии HEK293T инокулировали в концентрации 1,125×107 клеток/колбу в 225-сантиметровой колбе (производства фирмы Sumitomo Bakelite Co., Ltd.) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°С в среде с 5% СО2. На следующий день HEK293T-клетки трансфектировали pCI-ROBO4 или применяемым в качестве отрицательного контроля pCI-имитатором с использованием липофектамина 2000 и дополнительно культивировали в течение ночи при 37°С в атмосфере, содержащей 5% СО2. На следующий день трансфектированные экспрессионным вектором HEK293T-клетки обрабатывали TrypLE Express (производства фирмы Life Technologies Corp.), отмывали DMEM, содержащей 10% FBS, а затем суспендировали в ЗФР, содержащем 5% FBS. Полученную клеточную суспензию применяли для анализа методом проточной цитометрии.
2)-5 Клеточный ELISA
После удаления супернатанта из трансфектированных экспрессионным вектором HEK293-клеток, полученных согласно методу, описанному в разделе 2)-4-1, супернатант культуры гибридомы добавляли к каждой из трансфектированных pCI-hROBO4 и pCI-имитатором HEK293-клеток и клеткам давали выстояться при 4°С в течение 1 ч. Клетки в каждой лунке отмывали однократно ЗФР, содержащем 5% FBS. Затем добавляли к ним полученное в козах антитело к мышиному IgG, конъюгированное с пероксидазой (производства фирмы Sigma-Aldrich Corp.), разведенное в 500 раз ЗФР, содержащим 5% FBS, и клеткам давали выстояться при 4°С в течение 1 ч. Клетки в каждой лунке отмывали пятикратно ЗФР, содержащим 5% FBS. Затем к ним добавляли окрашивающий раствор OPD (дихлорид о-фенилендиамина (производства фирмы Wako Pure Chemical Industries, Ltd.) и H2O2, растворенные в концентрациях 0,4 мг/мл и 0,6 об.% соответственно в растворе для растворения OPD (0,05М тринатрийцитрат, 0,1М додекагидрат вторичного кислого фосфата натрия, рН 4,5)) из расчета 25 мкл/лунку. Осуществляли цветную реакцию с периодическим перемешиванием и реакцию прекращали, добавляя 1М HCl в концентрации 25 мкл/лунку. Затем оценивали абсорбцию при 490 нм с помощью планшет-ридера (ENVISION; производства фирмы Perkin Elmer, Inc.). Для отбора гибридом, продуцирующих антитело, специфически связывающееся с ROBO4, который экспресируется на поверхности клеточных мембран, гибридомы в супернатантах культур, которые характеризовались более высокой абсорбцией в трансфектированных pCI-hROBO4 HEK293-клетках по сравнению с HEK293-клетками, трансфектированными применяемым в качестве отрицательного контроля pCI-имитатором, отбирали в качестве гибридом, позитивных в отношении производства антител к ROBO4.
2)-6 Анализ методом проточной цитометрии
Для антитела, продуцируемого каждой гибридомой, выявленной в качестве позитивной согласно методу, описанному в разделе 2)-5 с помощью клеточного ELISA, дополнительно подтверждали способность связываться с ROBO4 с помощью проточной цитометрии. Суспензию HEK293T-клеток, полученную согласно методу, описанному в разделе 2)-4-2, центрифугировали. После удаления супернатанта супернатант культуры гибридом добавляли как к трансфектированным pCI-hROBO4 клеткам, так и к трансфектированным pCI-имитатором клеткам, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки отмывали дважды ЗФР, содержащим 5% FBS. Затем к ним добавляли антитело к мышиному IgG, конъюгированное с ФИТЦ (производства фирмы Sigma-Aldrich Corp.), разведенное в 1000 раз ЗФР, содержащим 5% FBS, или антитело к крысиному IgG, конъюгированное с ФИТЦ (производства фирмы Sigma-Aldrich Corp.), разведенное в 320 раз ЗФР, содержащим 5% FBS, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки отмывали трижды ЗФР, содержащим 5% FBS, затем ресуспендировали в ЗФР, содержащем 5% FBS и 2 мкг/мл 7-аминоактиномицина D (производства фирмы Molecular Probes), и подвергали детекции с помощью проточного цитометра (FC500; производства фирмы Beckman Coulter, Inc.). Данные анализировали с помощью Flowjo (производства фирмы TreeStar Inc.). Исключали позитивные по 7-аминоактиномицину D мертвые клетки путем установки дискриминационного окна, и затем для живых клеток получали гистограмму интенсивности флуоресценции ФИТЦ. Гибридомы, продуцирующие образец, в котором гистограмма для трансфектированных pCI-ROBO4 HEK293T-клеток смещалась в сторону области с более сильной интенсивностью флуоресценции по сравнению с гистограммой для трансфектированных применяемым в качестве отрицательного контроля pCI-имитатором 293Т-клеток, получали в качестве продуцирующих антитела к ROBO4 гибридом. Антитела к ROBO4, продуцируемые полученными гибридомами, обозначали как MAb1, MAb2, MAb3 и MAb4 соответственно.
2)-7 Изотипирование моноклонального антитела
Изотип каждого моноклонального антитела определяли с помощью набора для изотипирования мышиных мноклональных антител (Mouse monoclonal isotyping) или набора для изотипирования крысиных моноклональных антител (Rat monoclonal isotyping) (производства фирмы AbD Serotec). Установлено, что антитела принадлежат к IgG1 (MAb1 и MAb2) и IgG2b (MAb3 и MAb4).
2)-8 Получение моноклонального антитела
Каждое моноклональное антитело очищали из супернатанта культуры гибридомы (далее в настоящем описании обозначена как «биомасса для очистки антитела»). Биомассу для очистки антитела получали следующим образом: 8-9×107 гибридом вносили в 1272 см2 - колбу (производства фирмы Corning Inc.) и культивировали в среде для гибридом SFM (производства фирмы Life Technologies Corp.), содержащей 20% фетальной бычьей сыворотки с ультра низким содержанием IgG, при 37°С в течение 4 дней в атмосфере, содержащей 5% СО2, и затем собирали супернатант.
Антитело очищали, используя систему Hitrap Protein G HP или Hitrap MabSelect SuRe (производства фирмы GE Healthcare Bio-Sciences Crop.). При использовании Hitrap Protein G HP биомассу для очистки антитела добавляли на колонку и отмывали буфером для связывания (0,02М фосфат натрия рН 7,0), после чего элюировали с помощью 0,1М глицина, рН 2,7. В противоположность этому, при использовании Hitrap MabSelect SuRe биомассу для очистки антитела добавляли на колонку и отмывали ЗФР, после чего элюировали с помощью 2М аргинин-HCl, рН 4,0.
Раствор элюированного антитела нейтрализовали и затем буфер заменяли на ЗФР. Концентрацию антитела, очищенного с помощью Hitrap Protein G HP, оценивали с использованием реагента для ВСА-анализа белков. Мышиный IgG2a (производства фирмы R&D systems, Inc.) применяли в качестве стандарта для калибровочной кривой. Альтернативно этому, концентрацию антитела, очищенного с использованием Hitrap MabSelect SuRe, определяли путем измерения абсорбции (ОП при 280 нм) в элюате антитела, связанного с колонкой, заполненной POROS G 20 мкм РЕЕК, 4,6 мм × 50 мм, 0,83 мл (производства фирмы Applied Biosystems, Inc.). В частности, образец антитела, разведенный в ЗФР, добавляли на колонку, заполненную POROS G 20 мкм, уравновешенную буфером для уравновешивания (30,6 мМ додекагидрат вторичного кислого фосфата, 19,5 мМ первичный кислый фосфат калия, 0,15М NaCl, рН 7,0). Колонку промывали уравновешивающим буфером и затем антитело, связанное с колонкой, элюировали с использованием элюента (0,1 об.% НСl, 0,15М NaCl). Измеряли площадь пика абсорбции (ОП при 280 нм) в элюате и концентрацию рассчитывали с помощью следующего уравнения: концентрация антитела в образце (мг/мл) = (площадь пика образца антитела) / (площадь пика стандарта (человеческий IgG1)) × концентрация стандарта (мг/мл) × степень разведения образца.
Пример 3. Выявление активации действующего в прямом направлении сигнала ROBO4
3)-1 Получение репортерного вектора, содержащего промоторную область интерлейкина-8 (IL-8) в качестве реагирующего элемента
ПЦР-реакцию осуществляли с использованием в качестве матрицы ДНК промоторной области IL-8, применяя набор праймеров:
праймер 17F: 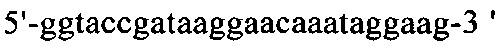 и
и
праймер 17R: 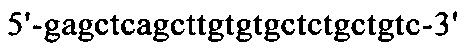 .
.
Полученный ПЦР-продукт встраивали в вектор pCR4Blunt-TOPO с получением клонирующего вектора, содержащего ДНК промоторной области IL-8 (от -253 до -59). Из клонирующего вектора отщепляли ДНК промоторной области IL-8 (от -253 до -59) с помощью Kpnl и Sacl и встраивали между Kpnl и Sacl в pGL4.15-вектора (производства фирмы Promega Corp.) с получением репортерного вектора, содержащего промоторную область IL-8 в качестве реагирующего элемента. Нуклеотидная последовательность ДНК промоторной области IL-8 (от -253 до -59) представлена в SEQ ID NO: 29.
3)-2 Репортерный вектор, содержащий ядерный фактор-кВ (NF-kB). активирующую последовательность интерферона гамма (GAS), интерферон-стимулируемый реагирующий элемент (ISRE), имеющий пригодную для трансфекции чистоту Т-клеточный фактор (TCF) в качестве реагирующего элемента
Вектор pGL4.32[luc2P NF-B-RE/Hygro] (производства фирмы Promega Corp.), вектор pGAS-TA-Luc (производства фирмы Takara Bio Inc.), вектор pISRE-TA-Luc (производства фирмы Takara Bio Inc.) и TOPflash (производства фирмы Millipore Corp.) применяли в качестве репортерного вектора, содержащего NF-кВ, GAS, ISRE или TCF в качестве реагирующего элемента соответственно. Альтернативно этому, вектор без реагирующей последовательности pTA-Luc (производства фирмы Takara Bio Inc.) применяли в качестве отрицательного контроля. Вектор pRL-TK (производства фирмы Takara Bio Inc.) применяли в качестве внутреннего контроля.
3)-3 Анализ изменения сигнала в клетке, кратковременно экспрессирующей человеческий ROBO4
HEK293-клетки вносили в концентрации 2×104 клеток/лунку в 96-луночный планшет (сенсибилизированный коллагеном I; производства фирмы Asahi Glass Co., Ltd.) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°С в атмосфере, содержащей 5% СО2. На следующий день HEK293-клетки трансфектировали pCI-ROBO4, pCI-ROBO4-AC или применяемым в качестве отрицательного контроля pCI-имитатором и каждым из репортерных векторов, указанных в разделах 3)-1 и 3)-2, используя реагент для трансфекции FuGene6, и дополнительно культивировали в течение ночи при 37°С в атмосфере, содержащей 5% СО2. На следующий день определяли в каждой лунке активность люциферазы светляка и люциферазы Renilla по интенсивности люминисценции с использованием планшет-ридера (Mithras; производства фирмы Berthold Technologies GmbH & Со, KG), применяя систему для анализа люциферазы Dual-Glo (производства фирмы Promega Corp.), и активность репортера в каждой лунке рассчитывали согласно следующему уравнению: активность репортера = интенсивность люминисценции люциферазы, полученной из светляков / интенсивность люминисценции люциферазы, полученной из Renilla. В результате установлено, что только активность промотора IL-8 возрастала в клетках, трансфектированных pCI-hROBO4, по сравнению с клетками, трансфектированными применяемым в качестве отрицательного контроля pCI-имитатором (фиг. 1). Кроме того, указанное повышение активности промотора IL-8, обнаруженное в трансфектированных pCI-hROBO4 клетках, резко снижалось в клетках, трансфектированных pCI-hROBO4-AC (мутант hROBO4 с делецией внутриклеточной области), демонстрируя, что для повышения активности промотора IL-8, обнаруженного в клетках, трансфектированных pCI-hROBO4, требуется внутриклеточная область ROBO4 (фиг. 2).
Таким образом, повышение активности промотора IL-8 в клетках, трансфектированных pCI-hROBO4, свидетельствует о наличии активации действующего в прямом направлении сигнала ROBO4.
Пример 4. Свойства MAb1
4)-1 Активация с помощью MAb1 действующего в прямом направлении сигнала ROBO4
Трансфектированные pCI-hROBO4 клетки или трансфектированные pCI-имитатором клетки, полученные согласно методу, описанному в разделе 3)-3, культивировали в течение ночи. На следующий день к ним добавляли каждое из антител к ROBO4 (MAb1, MAb2, MAb3 или MAb4) или применяемый в качестве отрицательного контроля мышиный IgG1 (производства фирмы R&D systems, Inc.) в концентрациях 0, 0,3125, 1,25, 5 и 20 мкг/мл или 0, 0,25, 1, 4 и 16 мкг/мл и клетки культивировали при 37°С в течение 5 ч в атмосфере, содержащей 5% СО2. Затем в каждой лунке определяли активность люциферазы светляка и люциферазы Renilla по интенсивности люминисценции с использованием планшет-ридера (Mithras), применяя систему для анализа люциферазы Dual-Glo (производства фирмы Promega Corp.), и активность репортера в каждой лунке рассчитывали согласно следующему уравнению: активность репортера = интенсивность люминисценции люциферазы, полученной из светляков / интенсивность люминисценции люциферазы, полученной из Renilla. В результате установлено, что применяемый в качестве отрицательного контроля мышиный IgG не влиял на активность промотора IL-8 в клетках, кратковременно экспрессирующих человеческий ROBO4, в то время как MAb1 повышало активность промотора IL-8 (фиг. 3). Аналогично MAb1, MAb2 также повышало активность промотора IL-8, в то время как MAb3 или MAb4 не повышали активность промотора IL-8 (фиг. 4). В клетках, трансфектированных pCI-имитатором MAb1 или MAb2 не повышали активность промотора IL-8. Эти результаты продемонстрировали, что MAb1 активировало действующий в прямом направлении сигнал ROBO4, и что не все антитела к ROBO4 активировали действующий в прямом направлении сигнал ROBO4.
MAb3 и MAb4, для которых подтверждено отсутствие способности повышать активность действующего в прямом направлении сигнала ROBO4, оценивали в отношении воздействия на активность промотора в присутствии перекрестносшивающих антител (AffiPure козье антитело к мышиному IgG, Fc-фрагмент специфическое, каталожный №115-005-071, фирма Jackson humunoResearch) (две молекулы перекрестносшивающего антитела на одну молекулу MAb3 или MAb4). В результате установлено повышение активности промотора в присутствии обоих антител.
4)-2 Оценка миграции HUVEC
HUVEC (производства фирмы KURABO INDUSTRIES LTD.) культивировали в течение ночи в среде HuMedia-EB2 (производства фирмы KURABO INDUSTRIES LTD.) содержащей 0,1% БСА, при 37°С в атмосфере, содержащей 5% СО2, а затем доводили плотность клеток до 4×105 клеток/мл с помощью среды HuMedia-EB2, содержащей 0,1% БСА. 0,25 мл клеточной суспензии с концентрацией 4×105 клеток/мл вносили в верхний слой камеры системы BD Falcon FluoroBlok с многолуночной (24-луночной) вставкой (размер пор: 8 мкм), имеющей покрытую желатином мембрану. Затем в нижний слой камеры добавляли среду HuMedia-EB2, содержащую 0,1% БСА и 10 нг/мл человеческого VEGF 165 (производства фирмы PeproTech Inc.) или человеческого bFGF (фирма BD Biosciences) и 2 мкг/мл мышиного IgG2a или каждого из антител к ROBO4 (MAb1, MAb2, MAb3 или MAb4). После инкубации при 37°С в течение 2-3 ч в атмосфере, содержащей 5% СО2, HUVEC, которые мигрировали в нижний слой, окрашивали средой HuMedia-EB2, содержащей 4 мкг/мл кальцеина-АМ (производства фирмы Life Technologies Corp.), в течение 15 мин. Затем интенсивность флуоресценции (длина волны возбуждения /длина волны флуоресценции: 485 нм/538 нм) каждой лунки измеряли с помощью планшет-ридера (FlexStation; фирма Molecular Devices, LLC), и количество мигрирующих клеток в каждой лунке рассчитывали с помощью следующего уравнения: количество мигрирующих клеток = интенсивность флуоресценции лунки с добавленными HUVEC - интенсивность флуоресценции в лунке без HUVEC. В результате установлено, что MAb1 подавляло миграцию HUVEC, индуцированную VEGF или bFGF (фиг. 5). Аналогично MAb1, MAb2 также подавляло миграцию HUVEC, индуцированную bFGF, в то время как MAb3 или MAb4 не подавляли клеточную миграцию (фиг. 6). Эти результаты продемонстрировали, что повышение активности промотора IL-8 с помощью антитела к ROBO4 коррелировало с подавляющей активностью в отношении миграции HUVEC.
4)-3 Межвидовая реактивность
4)-3-1 Получение клетки, экспрессирующей ген антигена HEK293-клетки вносили в концентрации 1,5×106 клеток/чашку в 60-миллиметровую чашку (производства фирмы Corning Inc.) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°С в атмосфере, содержащей 5% СО2. На следующий день HEK293-клетки трансфектировали вектором pCI-hROBO4, pCI-mROBO4, pCI-raROBO4, pCI-FLAG-cynoROBO4-1, pCI-FLAG-cynoROBO4-2, pCI-hROBO1, pCI-hROBO2 или pCI-hROBO3, используя реагент для трансфекции FuGENE6, и дополнительно культивировали в течение ночи при 37°С в атмосфере, содержащей 5% СО2. На следующий день клетки, трансфектированные экспрессионными векторами, обрабатывали TrypLE Express (производства фирмы Life Technologies Corp.), отмывали ЗФР, содержащим 5% FBS, а затем суспендировали в ЗФР, содержащим 5% FBS. Полученную клеточную суспензию применяли для анализа методом проточной цитометрии.
4)-3-2 Анализ методом проточной цитометрии
Каждую клеточную суспензию, полученную методом, описанным в разделе 4)-3-1, центрифугировали и удаляли супернатант. Затем MAb1 или применяемый в качестве отрицательного контроля мышиный IgG2a добавляли в концентрации 10 мкг/мл к 2×105 клеток, трансфектированных экспрессионным вектором, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки однократно отмывали ЗФР, содержащим 5% FBS. Затем к ним добавляли антитело к мышиному IgG, конъюгированное с ФИТЦ, которое разводили в 1000 раз ЗФР, содержащим 5% FBS, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки отмывали трижды ЗФР, содержащим 5% FBS, затем ресуспендировали в ЗФР, содержащем 5% FBS, и осуществляли обнаружение с помощью проточного цитометра (BD FACSCalibur). Данные анализировали с помощью программы Flowjo. Получали гистограмму интенсивности флуоресценции ФИТЦ. Считалось, что антитело обладает способностью к межвидовому связыванию, если гистограмма для MAb1 смещалась в сторону области с более сильной интенсивностью флуоресценции по сравнению с гистограммой для применяемого в качестве отрицательного контроля мышиного IgG2a. Результаты опыта по оценке межвидовой реактивности продемонстрировали, что MAb1 не связывалось с мышиным ROBO4 или крысиным ROBO4, но связывалось с человеческим ROBO4 и ROBO4 обезьян циномолгус (фиг. 7).
4)-4 Специфичность связывания
41-4-1 Получение клетки, экспрессирующей ген антигена HEK293-клетки вносили в концентрации 1,2×106 клеток/чашку или 1,5×106 клеток/чашку в 60-миллиметровую чашку (производства фирмы Corning Inc.) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°С в атмосфере, содержащей 5% СО2. На следующий день HEK293-клетки трансфектировали вектором pCI-hROBO4, pCI-FLAG-hROBO1, pCI-hROBO2 или pCI-hROBO3, используя реагент для трансфекции FuGENE6, и дополнительно культивировали в течение ночи при 37°С в атмосфере, содержащей 5% СО2. На следующий день клетки, трансфектированные экспрессионными векторами, обрабатывали TrypLE Express (производства фирмы Life Technologies Corp.), отмывали ЗФР, содержащим 5% FBS, а затем суспендировали в ЗФР, содержащим 5% FBS. Полученную клеточную суспензию применяли для анализа методом проточной цитометрии.
4)-4-2 Анализ методом проточной цитометрии
Каждую клеточную суспензию, полученную методом, описанным в разделе 4)-4-1, центрифугировали и супернатант удаляли. Затем добавляли в концентрации 10 мкг/мл Mab1, применяемое в качестве положительного контроля антитело к человеческому ROBO4 (производства фирмы R&D systems, Inc.), моноклональное антитело к FLAG М2, полученное в мышах (производства фирмы Sigma- Aldrich Corp.), антитело к человеческому ROBO2 (производства фирмы R&D systems, Inc.) или моноклональное антитело к человеческому ROBO3 (производства фирмы R&D systems, Inc.), или применяемый в качестве отрицательного контроля мышиный IgG1 или мышиный IgG2a к 2×105 клеток, трансфектированных экспрессионным вектором, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки однократно отмывали ЗФР, содержащим 5% FBS. Затем к ним добавляли антитело к мышиному IgG, конъюгированное с ФИТЦ, которое разводили в 1000 раз ЗФР, содержащим 5% FBS, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки отмывали трижды ЗФР, содержащим 5% FBS, затем ресуспендировали в ЗФР, содержащем 5% FBS, и осуществляли обнаружение с помощью проточного цитометра (BD FACSCalibur). Данные анализировали с помощью программы Flowjo. Получали гистограмму интенсивности флуоресценции ФИТЦ. Считалось, что антитело обладает способностью связываться с клеткой, если гистограмма для MAb1 смещалась в сторону области с более сильной интенсивностью флуоресценции по сравнению с гистограммой для применяемого в качестве отрицательного контроля мышиного IgG1 или мышиного IgG2a. Результаты продемонстрировали, что MAb1 не связывалось с hROBO1, hROBO2 или hROBO3 и специфически связывалось с hROBO4 (фиг. 8). В этом эксперименте с помощью применяемого в качестве положительного контроля антитела было подтверждено, что каждый из hROBO4, hROBO1, hROBO2 и hR0B03 экспрессировался на клеточной мембране (фиг. 8).
4)-5 Определение эпитопа
4)-5-1 Получение клетки, экспрессирующей ген антигена HEK293-клетки вносили в концентрации 1,5×106 клеток/чашку в 60-миллиметровую чашку (производства фирмы Corning Inc.) и культивировали в течение ночи в среде DMEM, содержащей 10% FBS, при 37°С в атмосфере, содержащей 5% СО2. На следующий день HEK293-клетки трансфектировали вектором pCI-FLAG-hROBO4-28, pCI-FLAG-hROBO4-46, pCI-FLAG-hROBO4-132, pCI-FLAG-hROBO4-210, pCI-FLAG-hROBO4-225 или pCI-FLAG-hROBO4-341, используя реагент для трансфекции FuGENE6, и дополнительно культивировали в течение ночи при 37°С в атмосфере, содержащей 5% СО2. На следующий день клетки, трансфектированные экспрессионными векторами, обрабатывали TrypLE Express (производства фирмы Life Technologies Corp.), отмывали ЗФР, содержащим 5% FBS, а затем суспендировали в ЗФР, содержащем 5% FBS. Полученную клеточную суспензию применяли для анализа методом проточной цитометрии.
4)-5-2 Анализ методом проточной цитометрии
Каждую клеточную суспензию, полученную методом, описанным в разделе 4)-5-1, центрифугировали и супернатант удаляли. Затем добавляли в концентрации 10 мкг/мл Mab1, применяемое в качестве положительного контроля моноклональное антитело к FLAG М2, полученное в мышах (производства фирмы Sigma-Aldrich Corp.), или применяемый в качестве отрицательного контроля IgG2a к 2×105 клеток, трансфектированных экспрессионным вектором, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки однократно отмывали ЗФР, содержащим 5% FBS. Затем к ним добавляли антитело к мышиному IgG, конъюгированное с ФИТЦ, которое разводили в 1000 раз ЗФР, содержащим 5% FBS, и образовавшейся суспензии давали выстояться при 4°С в течение 1 ч. Клетки отмывали трижды ЗФР, содержащим 5% FBS, затем ресуспендировали в ЗФР, содержащем 5% FBS, и осуществляли обнаружение с помощью проточного цитометра (BD FACSCalibur). Данные анализировали с помощью программы Flowjo. Получали гистограмму интенсивности флуоресценции ФИТЦ. Считалось, что антитело обладает способностью связываться с клеткой, если гистограмма для MAb1 смещалась в сторону области с более сильной интенсивностью флуоресценции по сравнению с гистограммой для применяемого в качестве отрицательного контроля мышиного IgG2a. Результаты продемонстрировали, что MAb1 связывалось с клеткой, трансфектированной pCI-FLAG-hROBO4-28, pCI-FLAG-hROBO4-46 или pCI-FLAG-hROBO4-132, и не связывалось с клеткой, трансфектированной pCI-FLAG-hROBO4-210, pCI-FLAG-hROBO4-225 или pCI-FLAG-hROBO4-341. Таким образом, продемонстрировано, что MAb1 распознает аминокислотную последовательность аминокислот №№132-209 в человеческом ROBO4, которая представлена на SEQ ID NO: 2 (фиг. 9). В этом эксперименте с помощью применяемого в качестве положительного контроля антитела к FLAG, было продемонстрировано, что каждый из вариантов с делецией внутриклеточной области/внеклеточного домена экспрессировался на клеточной мембране (фиг. 9).
4)-6 Оценка эффективности лекарственного средства на созданной на обезьянах модели индуцированной лазером хороидальной неоваскуляризации
4)-6-1 Анестезия
Медетомидина гидрохлорид (производства фирмы Nippon Zenyaku Kogyo Co., Ltd.) инъецировали внутримышечно в дозе 0,04 мг/кг каждой обезьяне циномолгус. Через 15 мин им инъецировали внутримышечно кетамина гидрохлорид (производства фирмы Daiichi Sankyo Co., Ltd.) в дозе 15 мг/кг.
4)-6-2 Создание модели
Каждую из обезьян циномолгус, анестезированных согласно методу, описанному в разделе 4)-6-1, содержали в клетке для обезьян. В оба глаза для анестезирующей/обезболивающей обработки поверхности глаза закапывали 4% ксилокаина (производства фирмы AstraZeneca pic). Для расширения зрачка в глаза закапывали смесь, содержащую 5 мг/мл тропикамида - 5 мг/мл фенилэфира гидрохлорида (производства фирмы Santen Pharmaceutical Co., Ltd.). Область желтого пятна сетчатки повреждали путем термической обработки с помощью лазерного излучения (количество теплового излучения: 350-500 мВт, продолжительность облучения: 0,1 с, размер пятна: 50 мкм; количество пятен: 6 или 9 пятен), используя зеленый лазерный фотокоагулятор OcuLight GLx (производства фирмы Iridex Corp.).
4)-6-3 Введение тестируемой субстанции
Через 7 дней после создания модели вводили иглу 33G Nanopass в стекловидное тело через конъюнктиву и инъецировали 50 мкл наполнителя или 13,2 мг/мл MAb1 в течение 2 мин через трубку из полиэтилена РЕ20, используя 100-микролитровый шприц Гамильтона. Опыт проводили на 4 глазах в каждой группе. После завершения введения в глаза вносили глазные капли, содержащие 0,5% гидрата левофлоксацина (производства фирмы Santen Pharmaceutical Co., Ltd.).
4)-6-4 Оценка эффективности лекарственного средства В дни 7, 14 и 21 после создания модели под анестезией фотографировали глазное дно общепринятым методом с использованием гибридной камеры для глазного дна СХ-1 (производства фирмы Canon Inc.). Затем внутривенно инъецировали 10% флуоресцеина в дозе 0,1 мл/кг. После завершения внутривенной инъекции флуоресцеина в течение периода времени вплоть до 6 мин каждую 1 мин осуществляли флуоресцентную ангиографию. Результаты визуализации сохраняли и рассчитывали площадь области, в которой накапливался флуоресцеин, с помощью анализатора изображения (WinRoof, производства фирмы Mitani Corp.). Количество вновь образовавшихся кровеносных сосудов рассчитывали согласно следующему уравнению: количество вновь образовавшихся кровеносных сосудов = площадь области, в которой происходило накопление флуоресцеина в день 21 после создания модели - площадь области, в которой происходило накопление флуоресцеина в день 7 после создания модели. В результате сравнения количества вновь образовавшихся кровеносных сосудов в обработанной наполнителем группе и обработанной MAb1 группе, для трех из четырех глаз в обработанной MAb1 группе, было подтверждено снижение количества вновь образовавшихся кровеносных сосудов, при этом для оставшегося одного глаза и группы, обработанной наполнителем никакого различия в количестве вновь образовавшихся сосудов не обнаружено. Это свидетельствует о том, что введение MAb1 подавляло индуцированную лазером хороидальную неоваскуляризацию (фиг. 10).
Пример 5. Клонирование и секвенирование кДНК MAb1
5)-1 Определение N-концевых аминокислотных последовательностей тяжелой и легкой цепей Mab1
Для определения N-концевых аминокислотных последовательностей тяжелой и легкой цепей MAb1 осуществляли разделение очищенного согласно методу, приведенному в примере 2)-8, MAb1 с помощью ДСН-ПААГ. Белки, разделенные с помощью указанного метода на геле, переносили из геля на ПВДФ-мембрану Sequi-Blot (фирма Bio-Rad Laboratories, Inc.), которую в свою очередь промывали буфером для отмывки (25 мМ NaCl, 10 мМ натрий-боратный буфер, рН 8.0), затем окрашивали, погружая на 5 мин в окрашивающий раствор (50% метанола, 20% уксусной кислоты, 0,05% кумасси бриллиантового голубого), а затем обесцвечивали с помощью 90% метанола. Участки с полосами, соответствующие тяжелой цепи (полоса с меньшей подвижностью) и легкой цепи (полоса с большой подвижностью), визуализированные на ПВДФ-мембране, вырезали. Соответствующие им N-концевые аминокислотные последовательности идентифицировали с помощью автоматизированного метода Эдмана (см. Edman и др., Eur. J. Biochem. 1, 1967, с. 80), используя секвенатор белков Procise cLC, модель 492cLC (фирма Applied Biosystems, Inc.). В результате установлено, что N-концевая аминокислотная последовательность полосы, соответствующей тяжелой цепи MAb1, представляла собой
EVQLVESGGGLVKPGGSLKL, а
N-концевая аминокислотная последовательность полосы, соответствующей легкой цепи MAb1, представляла собой DAVMTQTPLSLPVSL.
5)-2 Получение мРНК из продуцирующей MAb1 гибридомы Для клонирования кДНК, кодирующих тяжелую цепь и легкую цепь MAb1, получали мРНК из продуцирующей MAb1 гибридомы, используя набор для выделения мРНК (фирма Roche Applied Science).
5)-3 Клонирование и секвенирование кДНК MAb1 Синтезировали несколько олигонуклеотидных праймеров, гибридизующихся с 5'-концевой последовательностью кодирующей области гена антитела, и содержей стоп-кодон 3'-концевой последовательностью соответственно, с учетом N-концевых аминокислотных последовательностей тяжелой и легкой цепей, определенных на основе γ1- и κ-изотипов тяжелой и легкой цепей MAb1 соответственно (пример 2)-7) и 5-1), базы данных аминокислотных последовательностей антител, созданной согласно методу Кэбота с соавторами (см. Strausberg R.L. и др., Proc. Natl. Acad. Sci. U.S.A. 99, 2002, cc. 16899-16903 и Kabat E.А. и др., в: Sequences of Proteins of Immunological Interest, т. I и т. II, изд-во U.S. Department of Health and Human Services). кДНК, кодирующие тяжелую цепь и легкую цепь, амплифицировали с использованием мРНК, полученной согласно методу, описанному в разделе 5)-2, набора для ПЦР РНК TaKaRa One Step (AMV) (фирма Takara Bio Inc.). В результате кДНК, кодирующие тяжелую цепь и легкую цепь антитела, успешно амплифицировали с помощью следующего набора праймеров:
набор праймеров для тяжелой цепи LYHF6: 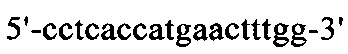
G1EVR1: 
набор праймеров для легкой цепи M19EIF1: 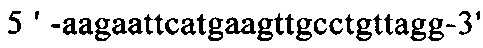 ,
,
KEVR1: 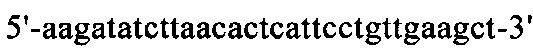 .
.
кДНК тяжелой и легкой цепей, амплифицированные с помощью ПЦР, клонировали раздельно, используя набор для экспрессии pEF6/V 5-His ТОРО ТА (фирма Invitrogen Corp.). Нуклеотидные последовательности клонированных кДНК, кодирующих соответственные вариабельные области тяжелой и легкой цепей, определяли, используя секвенатор генов («АВ1 PRISM 3700 DNA Analyzer; Applied Biosystems» или «Applied Biosystems 3730x1 Analyzer; Applied Biosystems»). Реакцию секвенирования осуществляли с использованием GeneAmp 9700 (фирма Applied Biosystems, Inc.).
Установленная нуклеотидная последовательность кДНК, кодирующей вариабельную область тяжелой цепи Mab1, представлена в SEQ ID NO: 30, а аминокислотная последовательность указанной области представлена в SEQ ID NO: 31. Нуклеотидная последовательность кДНК, кодирующей вариабельную область мышиного антитела Mab1, представлена в SEQ ID NO: 32, а аминокислотная последовательность указанной области представлена в SEQ ID NO: 33.
Пример 6. Получение химерного MAb1 (cMAb1)
6)-1 Получение экспрессионных векторов pCMA-LK, pCMA-G1 и pCMA-G2
6)-1-1 Конструирование экспрессионного вектора pCMA-LK химерной и гуманизированной легкой цепи
Плазмиду pcDNA3.3-TOPO/LacZ (фирма Invitrogen Corp.) расщепляли с помощью рестриктаз Xbal и Pmel и полученный фрагмент размером примерно 5,4 т.п.н. лигировали с ДНК-фрагментом, содержащим ДНК-последовательность (SEQ ID NO: 34), кодирующую секреторный сигнал человеческой κ-цепи и константную область человеческой κ-цепи, используя набор для клонирования In-Fusion Advantage PCR (фирма Clontech Laboratories, Inc.), с получением pcDNA3.3/LK. Осуществляли ПЦР с использованием в качестве матрицы pcDNA3.3/LK, применяя указанный ниже набор праймеров. Полученный фрагмент размером примерно 3,8 т.п.н. фосфорилировали и затем происходило его самолигирование с образованием из pcDNA3.3/LK экспрессионного вектора химерной и гуманизированной легкой цепи pCMA-LK, имеющего последовательность, кодирующую сигнальную последовательность, сайт клонирования и последовательность, кодирующую константную область человеческой κ-цепи по ходу транскрипции относительно промотора CMV.
Набор праймеров:
3.3-F1: 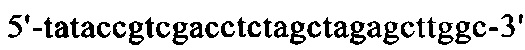 ,
,
3.3-R1: 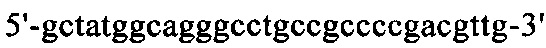 .
.
6)-1-2 Конструирование экспрессионного вектора химерной и гуманизированной тяжелой цепи IgG1-типа pCMA-G1
Плазмиду pCMA-LK расщепляли с помощью Xbal и Pmel для удаления последовательности, кодирующей секреторный сигнал κ-цепи и константную область человеческой κ-цепи. Образовавшийся ДНК-фрагмент лигировали с ДНК-фрагментом, содержащим ДНК-последовательность (SEQ ID NO: 35), которая кодирует аминокислоты сигнальной последовательности человеческой тяжелой цепи и константную область человеческого IgG1, используя набор для клонирования In-Fusion Advantage PCR (фирма Clontech Laboratories, Inc.), с получением конструкции экспрессионного вектора химерной и гуманизированной тяжелой цепи IgG1-типа pCMA-G1, имеющего последовательность, кодирующую сигнальную последовательность, сайт клонирования и последовательность, кодирующую константную область человеческой тяжелой цепи IgG1 по ходу транскрипции относительно промотора CMV.
6)-1-3 Конструирование экспрессионного вектора химерной и гуманизированной тяжелой цепи IeG2-типа pCMA-G2
Плазмиду pCMA-LK расщепляли с помощью Xbal и Pmel для удаления последовательности, кодирующей секреторный сигнал κ-цепи и константную область человеческой κ-цепи. Образовавшийся ДНК-фрагмент лигировали с ДНК-фрагментом, содержащим ДНК-последовательность (SEQ ID NO: 36), которая кодирует аминокислоты сигнальной последовательности человеческой тяжелой цепи и константную область человеческого IgG2, используя набор для клонирования In-Fusion Advantage PCR (фирма Clontech Laboratories, Inc.), с получением конструкции экспрессионного вектора химерной и гуманизированной тяжелой цепи IgG2-типа pCMA-G2, имеющего последовательность, кодирующую сигнальную последовательность, сайт клонирования и последовательность, кодирующую константную область человеческой тяжелой цепи IgG2 по ходу транскрипции относительно промотора CMV.
6)-2 Конструирование экспрессионного вектора легкой цепи химерного MAb1
Сайт, содержащий кДНК, которая кодирует вариабельную область легкой цепи, амплифицировали, используя кДНК, кодирующую вариабельную область легкой цепи MAb1 в качестве матрицы, применяя набор KOD-Plus- (фирма TOYOBO CO., LTD.) и указанный ниже набор праймеров, и встраивали в расщепленный с помощью рестриктазы BsiWI сайт имеющего общее назначение вектор pCMA-L для экспрессии легкой цепи химерного и гуманизированного антитела, используя набор для клонирования In-Fusion Advantage PCR (фирма Clontech Laboratories, Inc.) для создания экспрессионного вектора легкой цепи химерного MAb1. Полученный экспрессионный вектор обозначали как «рСМА-LK/MAb1 L». Нуклеотидная последовательность, кодирующая легкую цепь химерного MAb1, представлена в SEQ ID NO: 37, а ее аминокислотная последовательность представлена в SEQ ID NO: 38. Нуклеотиды №№1-60 SEQ ID NO: 37 представляют собой нуклеотидную последовательность, кодирующую сигнальную последовательность. Нуклеотиды №№61-402 представляют собой нуклеотидную последовательность, кодирующую вариабельную область. Нуклеотиды №№403-717 представляют собой нуклеотидную последовательность, кодирующую константную область. Аминокислоты №№1-20 SEQ ID NO: 38 представляют собой аминокислоты сигнальной последовательности. Аминокислоты №№21-134 представляют собой аминокислоты вариабельной области. Аминокислоты №№135-239 обозначают аминокислоты константной области.
Набор праймеров для легкой цепи
MAb1 LF: 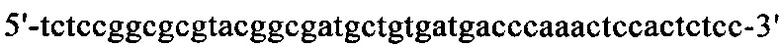 ,
,
MAb1 LR: 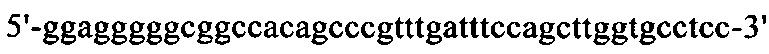 .
.
6)-3 Конструирование экспрессионного вектора тяжелой цепи химерного MAb1 IgG1-типа
Сайт, содержащий кДНК, которая кодирует вариабельную область тяжелой цепи, амплифицировали, используя кДНК, кодирующую вариабельную область тяжелой цепи MAb1 в качестве матрицы, с применением набора KOD-Plus-(фирма TOYOBO CO., LTD.) и представленный ниже набор праймеров, и встраивали в расщепленный с помощью рестриктазы BsiWI сайт экспрессионного вектора pCMA-Gl для тяжелой цепи химерного и гуманизированного MAb1 IgG1-типа, применяя набор для клонирования In-Fusion Advantage PCR (фирма Clontech Laboratories, Inc.), для конструирования экспрессионного вектора тяжелой цепи химерного MAb1 IgG1-типа. Полученный экспрессионный вектор обозначали как «рСМА-G1/MAb1 Н». Нуклеотидная последовательность, кодирующая тяжелую цепь химерного MAb1 IgG1-типа, представлена в SEQ ID NO: 39, а ее аминокислотная последовательность представлена в SEQ ID NO: 40. Нуклеотиды №№1-57 SEQ ID NO: 39 представляют собой нуклеотидную последовательность, кодирующую сигнальную последовательность. Нуклеотиды №№58-411 представляют собой нуклеотидную последовательность, кодирующую вариабельную область. Нуклеотиды №№412-1401 представляют собой нуклеотидную последовательность, кодирующую константную область. Аминокислоты №№1-19 SEQ ID NO: 40 представляют собой аминокислоты сигнальной последовательности. Аминокислоты №№20-137 представляют собой аминокислоты вариабельной области. Аминокислоты №№138-467 представляют собой аминокислоты константной области.
Набор праймеров для тяжелой цепи IgG1-типа:
MAb1 HF: 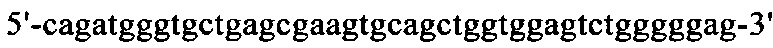 ,
,
MAb1 HIR: 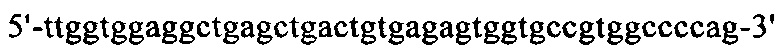 .
.
6)-4 Конструирование экспрессионного вектора тяжелой цепи химерного MAb1 IgG2-типа
Сайт, содержащий кДНК, которая кодирует вариабельную область тяжелой цепи, амплифицировали, используя кДНК, кодирующую вариабельную область тяжелой цепи MAb1 в качестве матрицы, применяя набор KOD-Plus- (фирма TOYOBO CO., LTD.) и представленный ниже набор праймеров, и встраивали в расщепленный с помощью рестриктазы BsiWI сайт экспрессионного вектора тяжелой цепи химерного и гуманизированного IgG2-типа pCMA-G2, применяя набор для клонирования In-Fusion Advantage PCR (фирма Clontech Laboratories, Inc.), для конструирования экспрессионного вектора тяжелой цепи химерного MAb1 IgG2-типа. Полученный экспрессионный вектор обозначали как «рСМА-G2/ MAb1 Н». Нуклеотидная последовательность, кодирующая тяжелую цепь химерного MAb1 IgG2-типа, представлена в SEQ ID NO: 41, а ее аминокислотная последовательность представлена в SEQ ID NO: 42.
Набор праймеров для тяжелой цепи IgG2-типа
MAb1 HF: 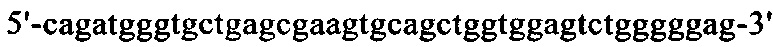 ,
,
MAb1 2R: 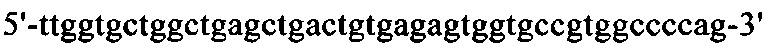 .
.
Пример 7. Получение химерного антитела MAb1 IgG1-типа и химерного антитела MAb1 IgG2-типа
7)-1 Создание химерного антитела MAb1 IgG1-типа и химерного антитела MAb1 IgG2-типа
Клетки линии FreeStyle 293-F (фирма Invitrogen Corp.) пересевали и культивировали согласно руководству. 1,2×109 клеток FreeStyle 293-F (фирма Invitrogen Corp.) на логарифмической фазе роста вносили в 3-литровую колбу Фернбаха, Эрленмейера (фирма Corning Inc.), разводили средой для экспрессии FreeStyle 293 (фирма Invitrogen Corp.) до концентрации 1,0×106 клеток/мл, а затем культивировали при встряхивании в инкубаторе с 8% СО2 при 90 об/мин при 37°С в течение 1 ч. Растворяли 3,6 мг полиэтиленимина (фирма Polysciences, Inc., №24765) в 20 мл среды Opti-Pro SFM (фирма Invitrogen Corp.). Затем экспрессионный вектор Н-цепи (0,4 мг) и экспрессионный вектор L-цепи (0,8 мг), которые получали, используя набор плазмид PureLink HiPure (фирма Invitrogen Corp.), суспендировали в 20 мл среды Opti-Pro SFM (фирма Invitrogen Corp.). 20 мл раствора смеси экспрессионный вектор/Opti-Pro SFM добавляли к 20 мл раствора смеси полиэтиленимин/Opti-Pro SFM и смесь постепенно перемешивали, дополнительно выстаивали в течение 5 мин, а затем добавляли к клеткам FreeStyle 293-F. Клетки культивировали при встряхивании в инкубаторе с 8% СО2 при 90 об/мин при 37°С в течение 7 дней и полученный супернатант культуры фильтровали через одноразовый капсульный фильтр (фирма Advantec, № CCS-045-E1H).
Химерные антитела MAb1 IgG1-типа и IgG2-типа, полученные путем комбинаций между pCMA-G1/MAb1 Н и pCMA-LK/MAb1 L, а также между pCMA-G2/MAb1 Н и pCMA-LK/MAb1 L, сокращенного обозначали как «cMAb1-1» и «cMAb1-2» соответственно. Понятие «cMAb1» означает химерные антитела MAb1 как IgG1-типа, так и IgG2-типа.
7)-2 Очистка cMAb1-1 и cMAb1-2
Супернатант культуры, полученный согласно методу, описанному в разделе 7-1), очищали с помощью аффинной хроматографии на рекомбинантном белке А (при 4-6°С). Стадию замены буфера после очистки с помощью аффинной хроматографии на рекомбинантном белке А осуществляли при комнатной температуре. Сначала вносили 1100-1200 мл супернатанта культуры на колонку, заполненную MabSelect SuRe (производства фирмы GE Healthcare Bio-Sciences Crop., колонка HiTrap; объем 1 мл, объединение 2 колонок), уравновешенную ЗФР. На колонку вносили весь раствор культуры и затем колонку промывали ЗФР. Затем осуществляли элюцию 2М раствором гидрохлорида аргинина (рН 4,0) для сбора содержащей антитело фракции. Буфер в указанной фракции заменяли на ЗФР, используя колонку для обессоливания (производства фирмы GE Healthcare Bio-Sciences Corp., обессоливающая колонка HiTrap; объем 5 мл, объединение двух колонок). И, наконец, фракцию концентрировали с помощью устройства Centrifugal UF Filter Device VIVASPIN20 (с номинальной отсекающей молекулярной массой 30 кДа, фирма Sartorius, при 4°С) с получением IgG в концентрации 20,0 мг/мл или выше и использовали его в качестве очищенного образца.
7)-3 Свойства cMAb1-1 и cMAb1-2
7)-3-1 Активация действующего в прямом направлении сигнала ROBO4 Указанное исследование осуществляли согласно методу, описанному в разделе 4)-1, со следующими исключениями: человеческий IgG (производства фирмы Sigma-Aldrich Corp.) применяли в качестве отрицательного контроля; и человеческий IgG, cMAb1-1 или cMAb1-2 добавляли в среду в конечной концентрации 0,313 мкг/мл. В результате установлено, что применяемый в качестве отрицательного контроля человеческий IgG не оказывал влияния на активность промотора IL-8 в клетках, кратковременно экспрессирующих человеческий ROBO4, в то время как cMAb1-1 и cMAb1-2 повышали активность промотора IL-8 (фиг. 11). Эти результаты продемонстрировали, что cMAb1-1 или cMAb1-2 активировали действующий в прямом направлении сигнал ROBO4, также как и MAb1.
7)-3-2 Оценка миграции HUVEC
Это исследование осуществляли согласно методу, описанному в разделе 4)-2, со следующими исключениями: человеческий IgG применяли в качестве отрицательного контроля; и человеческий IgG, cMAb1-1 или cMAb1-2 добавляли в среду в конечной концентрации 0,5 мкг/мл. В результате установлено, что cMAb1-1 или cMAb1-2 подавляли миграцию HUVEC, индуцированную bFGF (фиг. 12). Эти результаты продемонстрировали, что cMAb1-1 или cMAb1-2 подавляли миграцию HUVEC, также как и MAb1.
Пример 8. Создание моноклонального антитела MAb1 в виде гуманизированного мышиного антитела к человеческому ROBO4 8)-1 Создание гуманизированной версии MAb1 8)-1-1 Молекулярное моделирование вариабельной области MAb1 Молекулярное моделирование вариабельной области MAb1 осуществляли в целом согласно известному методу гомологичного моделирования (Methods in Enzymology, 203, 1991, сс. 121-153). Первичные последовательности (доступные в виде трехмерных структур, полученных из исследованных с помощью рентгеновских лучей кристаллических структур) вариабельных областей человеческого иммуноглобулина, зарегистрированные с банке данных белков (Nuc. Acid Res. 35, 2007, D301-D303), сравнивали с определенными таким же образом последовательностями вариабельных областей MAb1. В результате выбирали 3FFD на основе наиболее самой высокой гомологии последовательностей с вариабельными областями тяжелых цепей MAb1 среди антител с дефицитом в каркасном участке. Кроме того, отбирали 1Т66 на основе самой высокой гомологии последовательностей с вариабельными областями легких цепей MAb1. Трехмерные структуры каркасных областей получали путем создания «модели каркасных областей» на основе комбинации координат 3FFD и 1Т66, соответствующих тяжелым и легким цепям MAb1. Касательно CDR MAb1, то CDRL1, CDRL2, CDRL3, CDRH1 и CDRH2, были отнесены к кластерам 16А, 7А, 9А, 10А и 10В, соответственно согласно классификации Thornton и др., J. Mol. Biol., 263, 1996, сс. 800-815). CDRH3 классифицировали в к(7)В с использованием Н3-правила (FEBS letter 399, 1996, сс. 1-8). Таким образом, модель каркасных областей вносили в типичную конформацию каждого CDR.
И, наконец, расчет энергии для исключения неблагоприятного межатомного контакта осуществляли для получения молекулярной модели, которая, по-видимому, являлась характерной для вариабельных областей MAb1 с позиции энергии. Эти процедуры осуществляли, используя поступающую в продажу программу прогнозирования трехмерной структуры белков Prime и программу поиска координат MacroModel (фирма Schrodinger, LLC).
8)-1-2 Создание аминокислотной последовательности гуманизированного MAb1
Каждое гуманизированное антитело MAb1 (hMAb1) конструировали с помощью хорошо известного метода трансплантации CDR (Proc. Natl. Acad. Sci. USA 86, 1989, cc. 10029-10033). Два различных акцепторных антитела отбирали на основе гомологии аминокислот в каркасных областях. Последовательности каркасных областей MAb1 сравнивали со всеми человеческими каркасными областями в базе данных аминокислотных последовательностей антитела Кэбота (Nuc. Acid Res. 29, 2001, сс. 205-206). В результате отбирали антитело В3 в качестве акцепторного благодаря 83%-ной гомологии его последовательности с каркасными областями. Аминокислотные остатки каркасных областей В3 выравнивали с аминокислотными остатками каркасных областей MAb1 для идентификации положений различных применяемых аминокислот. Эти положения остатков анализировали с использованием сконструированной согласно описанному выше методу трехмерной модели MAb1. Затем донорские остатки, подлежащие трансплантации в акцепторное антитело, отбирали согласно критериям, представленным у Queen и др., Proc. Natl. Acad. Sci. USA 86, 1989, сс. 10029-10033). Некоторые отобранные донорские остатки интегрировали в акцепторное антитело, создавая последовательность гуманизированного MAb1, описанного ниже в примерах. Кроме того, конструировали варианты hMAb1 с заменой 1 -3 аминокислотного(ых) остатка(ов) в каждом CDR hMAb1 на другие аминокислотные остатки, описанные ниже в примерах.
8)-2 Гуманизация тяжелой цепи cMAb1
8)-2-1 Тяжелая цепь hMAb1-Hl-типа:
Гуманизированную тяжелую цепь MAb1, созданную путем замены аминокислоты №32 (лизин) на глутамин, аминокислоты №38 (лизин) на аргинин, аминокислоты №59 (треонин) на аланин, аминокислоты №61 (глутаминовая кислота) на глицин, аминокислоты №63 (аргинин) на глицин, аминокислоты №. 95 (глутаминовая кислота) на лизин, аминокислоты №103 (серии) на аспарагин, аминокислоты №107 (серии) на аланин, аминокислоты №112 (метионин) на валин, аминокислоты №114 (фенилаланин) на тирозин, аминокислоты №129 (гистидин) на глутамин, аминокислоты №132 (треонин) на лейцин и аминокислоты №133 (лейцин) на валин, в тяжелой цепи cMAb1-2, представленной SEQ ID NO: 42, обозначали как «тяжелая цепь hMAb1-H1-типа».
Аминокислотная последовательность тяжелой цепи hMAb1-H1-типа представлена в SEQ ID NO: 56. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-137, и последовательность, состоящая из аминокислотных остатков 138-463, в аминокислотной последовательности SEQ ID NO: 56 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи соответственно. Последовательность, состоящая из аминокислотных остатков 50-54, последовательность, состоящая из аминокислотных остатков 69-85, и последовательность, состоящая из аминокислотных остатков 118-126, в аминокислотной последовательности SEQ ID NO: 56 соответствуют последовательности CDRH1, последовательности CDRH2 и последовательности GDRH3 соответственно. Нуклеотидная последовательность, которая кодирует аминокислотную последовательность SEQ ID NO: 56, представлена в SEQ ID NO: 55. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58-411 и последовательность, состоящая из нуклеотидов 412-1389, в нуклеотидной последовательности SEQ ID NO: 55 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи соответственно. Нуклеотидная последовательность SEQ ID NO: 55 и аминокислотная последовательность SEQ ID NO: 56 представлены также на фиг. 31 и 32 соответственно.
8)-2-2 Тяжелая цепь hMAb1-Н2-типа:
Гуманизированную тяжелую цепь MAb1, созданную путем замены аминокислоты №32 (лизин) на глутамин, аминокислоты №38 (лизин) на аргинин, аминокислоты №59 (треонин) на аланин, аминокислоты №61 (глутаминовая кислота) на глицин, аминокислоты №63 (аргинин) на глицин, а аминокислоты №72 (аспарагин) на глутамин, аминокислоты №95 (глутаминовая кислота) на лизин, аминокислоты №103 (серии) на аспарагин, аминокислоты №107 (серии) на аланин, аминокислоты №112 (метионин) на валин, аминокислоты №114 (фенилаланин) на тирозин, аминокислоты №129 (гистидин) на глутамин, аминокислоты №132 (треонин) на лейцин и аминокислоты №133 (лейцин) на валин в тяжелой цепи cMAb1-2, представленной SEQ ID NO: 42, обозначали «тяжелая цепь hMAb1-Н2-типа».
Аминокислотная последовательность тяжелой цепи hMAb1-Н2-типа представлена в SEQ ID NO: 58. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-137 и последовательность, состоящая из аминокислотных остатков 138-463 в аминокислотной последовательности SEQ ID NO: 58 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи соответственно. Последовательность, состоящая из аминокислотных остатков 50-54, последовательность, состоящая из аминокислотных остатков 69-85 и последовательность, состоящая из аминокислотных остатков 118-126 в аминокислотной последовательности SEQ ID NO: 58 соответствуют последовательности CDRH1, последовательности CDRH2 и последовательности CDRH3 соответственно. Нуклеотидная последовательность, которая кодирует аминокислотную последовательность SEQ ID NO: 58, представлена в SEQ ID NO: 57. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58- 411, и последовательность, состоящая из нуклеотидов 412-1389, в нуклеотидной последовательности SEQ ID NO: 57 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи соответственно. Нуклеотидная последовательность SEQ ID NO: 57 и аминокислотная последовательность SEQ ID NO: 58 представлены также на фиг. 33 и 34 соответственно.
8)-2-3 Тяжелая цепь hMAb1-Н3-типа:
Гуманизированную тяжелую цепь MAb1, созданную путем замены аминокислоты №32 (лизин) на глутамин, аминокислоты №38 (лизин) на аргинин, аминокислоты №59 (треонин) на аланин, аминокислоты №61 (глутаминовая кислота) на глицин, аминокислоты №95 (глутаминовая кислота) на лизин, аминокислоты №103 (серии) на аспарагин, аминокислоты №107 (серии) на аланин, аминокислоты №112 (метионин) на валин, аминокислоты №114 (фенилаланин) на тирозин, аминокислоты №129 (гистидин) на глутамин, аминокислоты №132 (треонин) на лейцин и аминокислоты №133 (лейцин) на валин, в тяжелой цепи cMAb1-2, представленной SEQ ID NO: 42, обозначали «тяжелая цепь hMAb1-Н3-типа».
Аминокислотная последовательность тяжелой цепи hMAb1-Н3-типа представлена в SEQ ID NO: 60. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-137, и последовательность, состоящая из аминокислотных остатков 138-463 в аминокислотной последовательности SEQ ID NO: 60 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи соответственно. Последовательность, состоящая из аминокислотных остатков 50-54, последовательность, состоящая из аминокислотных остатков 69-85, и последовательность, состоящая из аминокислотных остатков 118-126, в аминокислотной последовательности SEQ ID NO: 60 соответствуют последовательности CDRH1, последовательности CDRH2 и последовательности CDRH3 соответственно. Нуклеотидная последовательность, которая кодирует аминокислотную последовательность SEQ ID NO: 60, представлена в SEQ ID NO: 59. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58-411, и последовательность, состоящая из нуклеотидов 412-1389, в нуклеотидной последовательности SEQ ID NO: 59 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи соответственно. Нуклеотидная последовательность SEQ ID NO: 59 и аминокислотная последовательность SEQ ID NO: 60 представлены также на фиг. 35 и 36 соответственно.
8)-2-4 Тяжелая цепь hMAb1-Н4-типа:
Гуманизированную тяжелую цепь MAb1, созданную путем замены аминокислоты №32 (лизин) на глутамин, аминокислоты №38 (лизин) на аргинин, аминокислоты №59 (треонин) на аланин, аминокислоты №61 (глутаминовая кислота) на глицин, аминокислоты №72 (аспарагин) на глутамин, аминокислоты №95 (глутаминовая кислота) на лизин, аминокислоты №103 (серии) на аспарагин, аминокислоты №107 (серии) на аланин, аминокислоты №112 (метионин) на валин, аминокислоты №114 (фенилаланин) на тирозин, аминокислоты №129 (гистидин) на глутамин, аминокислоты №132 (треонин) на лейцин и аминокислоты №133 (лейцин) на валин, в тяжелой цепи cMAb1-2, представленной SEQ ID NO: 42, обозначали «тяжелая цепь hMAb1-Н4-типа».
Аминокислотная последовательность тяжелой цепи hMAb1-Н3-типа представлена в SEQ ID NO: 62. Последовательность, состоящая из аминокислотных остатков 1-19, последовательность, состоящая из аминокислотных остатков 20-137, и последовательность, состоящая из аминокислотных остатков 138-463 в аминокислотной последовательности SEQ ID NO: 62 соответствуют сигнальной последовательности, вариабельной области тяжелой цепи и константной области тяжелой цепи соответственно. Последовательность, состоящая из аминокислотных остатков 50-54, последовательность, состоящая из аминокислотных остатков 69-85, и последовательность, состоящая из аминокислотных остатков 118-126, в аминокислотной последовательности SEQ ID NO: 62 соответствуют последовательности CDRH1, последовательности CDRH2 и последовательности CDRH3 соответственно. Нуклеотидная последовательность, которая кодирует аминокислотную последовательность SEQ ID NO: 62, представлена в SEQ ID NO: 61. Последовательность, состоящая из нуклеотидов 1-57, последовательность, состоящая из нуклеотидов 58-411, и последовательность, состоящая из нуклеотидов 412-1389, в нуклеотидной последовательности SEQ ID NO: 61 кодируют сигнальную последовательность, последовательность вариабельной области тяжелой цепи и последовательность константной области тяжелой цепи соответственно. Нуклеотидная последовательность SEQ ID NO: 61 и аминокислотная последовательность SEQ ID NO: 62 представлены также на фиг. 37 и 38 соответственно.
8)-3 Гуманизация легкой цепи MAb1
8)-3-1 Легкая цепь hMAb1-L1-типа:
Гуманизированную легкую цепь MAb1, созданную путем замены аминокислоты №22 (аланин) на изолейцин, аминокислоты №27 (треонин) на серии, аминокислоты №34 (серии) на треонин, аминокислоты №37 (аспарагиновая кислота) на глутаминовую кислоту, аминокислоты №38 (глутамин) на пролин, аминокислоты №62 (фенилаланин) на лейцин, аминокислоты №84 (лейцин) на пролин, аминокислоты №108 (фенилаланин) на валин, аминокислоты №112 (фенилаланин) на тирозин, аминокислоты №125 (глицин) на пролин, аминокислоты №129 (лейцин) на валин, аминокислоты №130 (глутаминовая кислота) на аспарагиновую кислоту и аминокислоты №134 (аланин) на треонин, в легкой цепи cMAb1, представленной в SEQ ID NO: 38, обозначали как «легкая цепь hMAb1-L1-типа».
Аминокислотная последовательность легкой цепи hMAb1-L1-типа представлена в SEQ ID NO: 64. Последовательность, состоящая из аминокислотных остатков 1-20, последовательность, состоящая из аминокислотных остатков 21-134, и последовательность, состоящая из аминокислотных остатков 135-239, в аминокислотной последовательности SEQ ID NO: 64 соответствуют сигнальной последовательности, вариабельной области легкой цепи и константной области легкой цепи соответственно. Последовательность, состоящая из аминокислотных остатков 44-59, последовательность, состоящая из аминокислотных остатков 75-81, и последовательность, состоящая из аминокислотных остатков 114-122, в аминокислотной последовательности SEQ ID NO: 64 соответствуют последовательности CDRL1, последовательности CDRL2 и последовательности CDRL3 соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 64, представлена в SEQ ID NO: 63. Последовательность, состоящая из нуклеотидов 1-60, последовательность, состоящая из нуклеотидов 61-402, и последовательность, состоящая из нуклеотидов 403-717, в нуклеотидной последовательности SEQ ID NO: 63 кодирует сигнальную последовательность, последовательность вариабельной области легкой цепи и последовательность константной области легкой цепи соответственно. Нуклеотидная последовательность SEQ ID NO: 63 и аминокислотная последовательность SEQ ID NO: 64 представлены на фиг. 39 и 40 соответственно.
8)-3-2 Легкая цепь hMAb1-L2-типа:
Гуманизированную легкую цепь MAb1, созданную путем замены аминокислоты №22 (аланин) на изолейцин, аминокислоты №27 (треонин) на серии, аминокислоты №34 (серии) на треонин, аминокислоты №37 (аспарагиновая кислота) на глутаминовую кислоту, аминокислоты №38 (глутамин) на пролин, аминокислоты №52 (серии) на глутаминовую кислоту, аминокислоты №54 (глицин) на лизин, аминокислоты №56 (треонин) на лейцин, аминокислоты №62 (фенилаланин) на лейцин, аминокислоты №84 (лейцин) на пролин, аминокислоты №108 (фенилаланин) на валин, аминокислоты №112 (фенилаланин) на тирозин, аминокислоты №125 (глицин) на пролин, аминокислоты №129 (лейцин) на валин, аминокислоты №130 (глутаминовая кислота) на аспарагиновую кислоту и аминокислоты №134 (аланин) на треонин, в легкой цепи cMAb1, представленной в SEQ ID NO: 38, обозначали как «легкая цепь hMAb1-L2-типа».
Аминокислотная последовательность легкой цепи hMAb1-L2-типа представлена в SEQ ID NO: 66. Последовательность, состоящая из аминокислотных остатков 1-20, последовательность, состоящая из аминокислотных остатков 21-134, и последовательность, состоящая из аминокислотных остатков 135-239, в аминокислотной последовательности SEQ ID NO: 66 соответствуют сигнальной последовательности, вариабельной области легкой цепи и константной области легкой цепи соответственно. Последовательность, состоящая из аминокислотных остатков 44-59, последовательность, состоящая из аминокислотных остатков 75-81, и последовательность, состоящая из аминокислотных остатков 114-122, в аминокислотной последовательности SEQ ID NO: 66 соответствуют последовательности CDRL1, последовательности CDRL2 и последовательности CDRL3 соответственно. Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 66, представлена в SEQ ID NO: 65. Последовательность, состоящая из нуклеотидов 1-60, последовательность, состоящая из нуклеотидов 61-402, и последовательность, состоящая из нуклеотидов 403-717, в нуклеотидной последовательности SEQ ID NO: 65 кодирует сигнальную последовательность, последовательность вариабельной области легкой цепи и последовательность константной области легкой цепи соответственно. Нуклеотидная последовательность SEQ ID NO: 65 и аминокислотная последовательность SEQ ID NO: 66 представлены на фиг. 41 и 42 соответственно.
Пример 9. Получение гуманизированного MAb1 9)-1 Конструирование экспрессионного вектора тяжелой цепи гуманизированного MAb1
9)-1-1 Конструирование экспрессионного вектора тяжелой цепи hMAb1-Hl-типа
ДНК, содержащую ген, который кодирует вариабельную область тяжелой цепи hMAb1-Hl-типа, представленную аминокислотами №№20-137 SEQ ID NO: 56, синтезировали (служба синтеза искусственных генов GeneArt) и расщепляли рестриктазой Blpl. Полученный ДНК-фрагмент встраивали в расщепленный рестриктазой Blpl сайт экспрессионного вектора химерной и гуманизированной тяжелой цепи IgG2-типа (pCMA-G2) с получением экспрессионного вектора тяжелой цепи hMAb1-H1-типа. Полученный экспрессионный вектор обозначали как «pCMA-G2/hMAb1-H1». Нуклеотидная последовательность тяжелой цепи hMAb1-H1-типа представлена в SEQ ID NO: 55.
9)-1-2 Конструирование экспрессионного вектора тяжелой цепи hMAb1-H2-типа
Экспрессионный вектор тяжелой цепи hMAb1-Н2-типа создавали с использованием в качестве матрицы вектора pCMA-G2/hMAb1-H1, созданного согласно методу, описанному в разделе 9)-1-1, с применением набора праймеров, указанных ниже, и набора для сайтнаправленного мутагенеза QuikChange XL (фирма Agilent Technologies, Inc.). Полученный экспрессионный вектор обозначали как «pCMA-G1/hMAb1-H2». Нуклеотидная последовательность тяжелой цепи hMAb1-Н2-типа представлена в SEQ ID NO: 57, а ее аминокислотная последовательность представлена в SEQ ID NO: 58.
Набор праймеров:
H-N53Q-F: 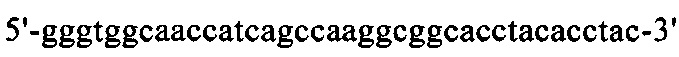 ,
,
H-N53Q-R: 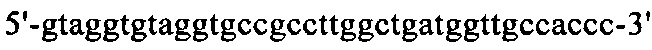 .
.
9)-1-3 Конструирование экспрессионного вектора тяжелой цепи hMAb1-H3-типа
Синтезировали (служба синтеза искусственных генов GeneArt) ДНК, содержащую ген, который кодирует вариабельную область тяжелой цепи hMAb1-Н3-типа, представленную аминокислотами №№20-137 SEQ ID NO: 60, и расщепляли рестриктазой Blpl. Полученный ДНК-фрагмент встраивали в расщепленный рестриктазой Blpl сайт экспрессионного вектора химерной и гуманизированной тяжелой цепи IgG2-типа (pCMA-G2) с получением экспрессионного вектора тяжелой цепи hMAb1-Н3-типа. Полученный экспрессионный вектор обозначали как «pCMA-G2/hMAb1-H3». Нуклеотидная последовательность тяжелой цепи hMAb1-Н3-типа представлена в SEQ ID NO: 59.
9)-1-4 Конструирование экспрессионного вектора тяжелой цепи hMAb1-H4-типа
Экспрессионный вектор тяжелой цепи hMAb1-Н4-типа создавали с использованием в качестве матрицы вектора pCMA-G2/hMAb1-H3, созданного согласно методу, описанному в разделе 9)-1-3, с применением набора праймеров, указанных ниже, и набора для сайтнаправленного мутагенеза QuikChange XL (фирма Agilent Technologies, Inc.). Полученный экспрессионный вектор обозначали как «pCMA-Gl/hMAb1-H4». Нуклеотидная последовательность тяжелой цепи hMAb1-Н4-типа представлена в SEQ ID NO: 61, а ее аминокислотная последовательность представлена в SEQ ID NO: 62.
Набор праймеров:
H-N53Q-F: 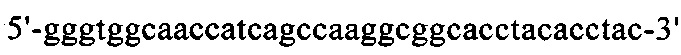 ,
,
H-N53Q-R: 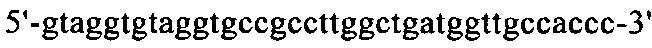 .
.
9)-2 Конструирование экспрессионного вектора легкой цепи гуманизированного MAb1
9)-2-1 Конструирование экспрессионного вектора легкой цепи hMAb1-L1-типа
ДНК, содержащую ген, который кодирует вариабельную область легкой цепи hMAb1-L1-типа, представленную аминокислотами №№21-134 SEQ ID NO: 64, синтезировали (служба синтеза искусственных генов GeneArt) и расщепляли рестриктазой BsiWI. Полученный ДНК-фрагмент встраивали в расщепленный рестриктазой BsiWI сайт вектора общего назначения (pCMA-LK) для экспрессии легкой цепи химерного и гуманизированного антитела, получая экспрессионный вектор легкой цепи hMAb1-L1-типа. Полученный экспрессионный вектор обозначали как «рСМА-LK/hMAb1-L1». Нуклеотидная последовательность легкой цепи hMAb1-L1-типа представлена в SEQ ID NO: 63.
9)-2-2 Конструирование экспрессионного вектора легкой цепи hMAb1-L2-типа
ДНК-фрагменты получали с помощью ПЦР с использованием в качестве матрицы pCMA-LK/hMAb1-L1, созданного согласно методу, описанному в разделе 9)-2-1, применяя набор KOD-Plus- (фирма TOYOBO CO., LTD.) и каждый из наборов праймеров А и Б, и сцепленные с использованием ПЦР с перекрывающимися расширениями с применением набора праймеров В для получения ДНК, содержащей ген, который кодирует легкую цепь hMAb1-L2-типа. Эту ДНК расщепляли рестриктазами Xbal и Pmel с получением ДНК-фрагмента, который затем встраивали в расщепленный рестриктазами Xbal/Pmel сайт вектора общего назначения (pCMA-LK) для экспрессии легкой цепи химерного и гуманизированного антитела, получая экспрессионный вектор легкой цепи hMAb1-L2-типа. Полученный экспрессионный вектор обозначали как «pCMA-LK/hMAb1-L2». Нуклеотидная последовательность легкой цепи hMAb1-L1-типа представлена в SEQ ID NO: 65, а ее аминокислотная последовательность представлена в SEQ ID NO: 66.
Набор праймеров А:
L inf-F: 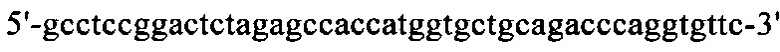 ,
,
L-EKL-R: 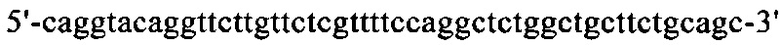 .
.
Набор праймеров Б:
L-EKL-F: 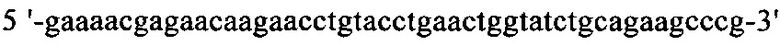 ,
,
L inf-R: 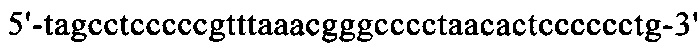 .
.
Набор праймеров В:
L inf-F: 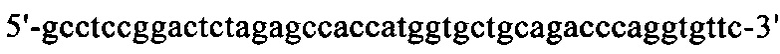 ,
,
L inf-R: 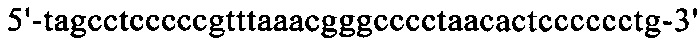 .
.
Пример 10. Получение гуманизированного MAb1 10-1-1) Создание гуманизированного MAb1
Клетки линии FreeStyle 293-F (фирма Invitrogen Corp.) пересевали и культивировали согласно руководству.
1,2×109 клеток FreeStyle 293-F (фирма Invitrogen Corp.) на логарифмической фазе роста вносили в 3-литровую колбу Фернбаха, Эрленмейера (фирма Corning Inc.), разводили средой для экспрессии FreeStyle 293 (фирма Invitrogen Corp.) до концентрации 1,0×106 клеток/мл, а затем культивировали при встряхивании в инкубаторе с 8% СО2 при 90 об/мин при 37°С в течение 1 ч. Растворяли 3,6 мг полиэтиленимина (фирма Polysciences, Inc., №24765) в 20 мл среды Opti-Pro SFM (фирма Invitrogen Corp.). Затем экспрессионный вектор Н-цепи (0,4 мг) и экспрессионный вектор L-цепи (0,8 мг), которые получали, используя набор плазмид PureLink HiPure (фирма Invitrogen Corp.), суспендировали в 20 мл среды Opti-Pro SFM (фирма Invitrogen Corp.). 20 мл раствора смеси экспрессионный вектор /Opti-Pro SFM добавляли к 20 мл раствора смеси полиэтиленимин/Opti-Pro SFM и смесь постепенно перемешивали, дополнительно выстаивали в течение 5 мин, а затем добавляли к клеткам FreeStyle 293-F. Клетки культивировали при встряхивании в инкубаторе в атмосфере, содержащей 8% СО2, при 90 об/мин при 37°С в течение 7 дней и полученный супернатант культуры фильтровали через одноразовый капсульный фильтр (фирма Advantec, № CCS-045-E1H) и очищали аналогично методу, описанному в разделе 7)-2.
Гуманизированное антитело MAb1, полученное путем комбинации рСМА-G2/hMAb1-Hl и pCMA-LK hMAb1-L1, обозначали как «Н-1040».
Гуманизированное антитело MAb1, полученное путем комбинации рСМА-G2/hMAb1-H2 и pCMA-LK/hMAb1-L1, обозначали как «H-1140». Гуманизированное антитело MAb1, полученное путем комбинации рСМА-G2/hMAb1-H2 и рСМА-LK/hMAb1-L2, обозначали как «Н-1143». Гуманизированное антитело MAb1, полученное путем комбинации рСМА-G2/hMAb1-H3 и pCMA-LK/hMAb1-L1, обозначали как «Н-2040». Гуманизированное антитело MAb1, полученное путем комбинации рСМА-G2/hMAb1-H4 и pCMA-LK/hMAb1-L1, обозначали как «И-2140». Гуманизированное антитело MAb1, полученное путем комбинации рСМА-G2/hMAb1-H4 и pCMA-LK/hMAb 1-L2, обозначали как «Н-2143».
Пример 11. Свойства гуманизированного антитела к ROBO4
11)-1 Аффинность связывания
Константу диссоциации между антителом и rROBO4-ECD определяли с использованием иммобилизованного антитела в качестве лиганда и антигена в качестве аналита, используя Biacore 3000 (производства фирмы GE Healthcare Bio-Sciences Corp.).
Примерно 80 RU антитела связывали через антитело к человеческому IgG (производства фирмы GE Healthcare Bio-Sciences Corp.), иммобилизованное на сенсорном чипе СМ5 (производства фирмы GE Healthcare Bio-Sciences Corp.) с использованием метода аминного сочетания. В качестве подвижного буфера применяли ЗФР, содержащий 0,05% сурфактанта Р20.
Полученные серийным разведением растворы (0,1-200нМ) антигена добавляли со скоростью потока 30 мкл/мин в течение 300 с на связанный с антителом чип. Затем осуществляли мониторинг фазы диссоциации в течение 300 с.Добавляли 3М MgCl2 в качестве регенерирующего раствора со скоростью потока 10 мкл/мин в течение 30 с. Данные анализировали, используя программу для анализа модели связывания 1:1 (программа BIAevaluation, версия 4.1), для расчета константы скорости ассоциации (kon), константы скорости диссоциации (koff) и константы диссоциации (KD=koff/kon). В результате установлено, что величина KD составляла 0,41 нМ для Н-1040, 3,5 нМ для Н-1143, 3,9 нМ для Н-1140, 0,40 нМ для Н-2040, 1,7 нМ для Н-2143 и 1,8 нМ для Н-2140.
11)-2 Активация действующего в прямом направлении сигнала ROBO4
Указанное исследование осуществляли согласно методу, описанному в разделе 4)-1, со следующими исключениями: в качестве отрицательного контроля применяли человеческий IgG; и человеческий IgG, Н-1040, Н-1140, Н-1143, Н-2040, Н-2140, Н-2143 или cMAb1-2 добавляли в среду в конечной концентрации 0,63 мкг/мл. В результате установлено, что применяемый в качестве отрицательного контроля человеческий IgG не влиял на активность промотора IL-8 в клетках, кратковременно экспрессирующих человеческий ROBO4, в то время как все гуманизированные антитела к ROBO4 повышали активность промотора IL-8 до уровня, эквивалентного активности cMAb1-2 (фиг. 49). Эти результаты продемонстрировали, что все гуманизированные антитела к ROBO4 активировали действующий в прямом направлении сигнал ROBO4, аналогично MAb1.
11)-3 Оценка миграции HUVEC
Указанное исследование осуществляли согласно методу, описанному в примере 4)-2, со следующими исключениями: в качестве отрицательного контроля применяли человеческий IgG; и человеческий Н-1143, Н-2140 или Н-2143 добавляли в среду в конечной концентрации 0,5 мкг/мл; и измеряли интенсивность флуоресценции (длина волны возбуждения/длина волны флуоресценции: 485 нм/538 нм) в каждой лунке с помощью планшет-ридера (EnVision: фирма Perkin Elmer, Inc.). В результате установлено, что Н-1143, Н-2140 или Н-2143 подавляли миграцию HUVEC, индуцированную bFGF (фиг. 50). Кроме того, у Н-1140 обнаружена подавляющая активность в отношении миграции HUVEC. Указанные результаты продемонстрировали, что Н-1140, Н-1143, Н-2140 или Н-2143 подавляли миграцию HUVEC.
11)-4 Межвидовая реактивность
11)-4-1 Получение клетки, экспрессирующей ген антигена
Клетки получали согласно методу, описанному в разделе 4)-3-1.
11)-4-2 Анализ методом проточной цитометрии
Указанное исследование осуществляли согласно методу, описанному в примере 4)-3-2, со следующими исключениями: в качестве отрицательного контроля применяли человеческий IgG; в качестве вторичного антитела использовали конъюгированное с ФИТЦ AffiniPure козье антитело к человеческому IgG, Fcγ-фрагмент-специфическое (производства фирмы Jackson ImmunoResearch Laboratories, Inc.); и применяли проточный цитометр (FC500; производства фирмы Beckman Coulter, Inc.) в качестве детектора. В результате установлено, что Н-1143, Н-2140 или Н-2143 не связывались с мышиным ROBO4 или крысиным ROBO4, но установлено их связывание с человеческим ROBO4 и ROBO4 обезьян циномолгус такое же, как у родительского антитела MAb1 (фиг. 51, 52 и 53). Кроме того, для Н-1140 обнаружены такие же результаты, что и для Н-1143, Н-2140 и Н-2143.
11)-5 Специфичность связывания Н-1140, Н-1143, Н-2140 или Н-2143
11)-5-1 Получение клетки, экспрессирующей ген антигена Клетки получали согласно методу, описанному в примере 4)-4-1 за исключением того, что в качестве экспрессионного вектора для человеческого ROBO4 применяли pCI-FLAG-hROBO4-28.
11)-5-2 Анализ методом проточной цитометрии
Указанное исследование осуществляли согласно методу, описанному в разделе 4)-4-2, со следующими исключениями: в качестве отрицательного контроля применяли человеческий IgG или мышиный IgG2A; в качестве вторичного антитела применяли конъюгированную с флуоресцеином козью IgG-фракцию к мышиному IgG (производства фирмы Cappel Laboratories, Inc.) или конъюгированное с ФИТЦ AffiniPure козье антитело к человеческому IgG, Fcγ-фрагмент-специфическое; и применяли проточный цитометр (FC500; производства фирмы Beckman Coulter, Inc.) в качестве детектора. В результате установлено, что Н-1143, Н-2140 или Н-2143 не связывались с hROBO1, hROBO2 или hROBO3, но установлено, что они специфически связывались с hROBO4, аналогичному родительскому антителу MAb1 (фиг. 54). Кроме того, для Н-1140 обнаружены такие же результаты, что и для Н-1143, Н-2140 и Н-2143. В этом эксперименте с помощью применяемого в качестве положительного контроля антитела было подтверждено, что каждый из hROBO4, hROBO1, hROBO2 и hROBO3 экспрессировался на клеточной мембране (фиг. 54).
11)-6 Оценка эффективности лекарственного средства на созданной на обезьянах модели индуцированной лазером хороидальной неоваскуляризации
11)-6-1 Анестезия
Медетомидина гидрохлорид инъецировали внутримышечно в дозе 0,08 мг/кг каждой обезьяне циномолгус. Через 15 мин им инъецировали внутримышечно кетамина гидрохлорид в дозе 15 мг/кг.
11)-6-2 Создание модели
Каждую из обезьян циномолгус, анестезированную согласно методу, описанному в разделе 11)-6-1, помещали на операционный стол из нержавеющей стали в положении лежа на спине. Для расширения зрачка в глаза закапывали смесь, содержащую 5 мг/мл тропикамида - 5 мг/мл фенилэфрина гидрохлорида. Область желтого пятна сетчатки повреждали путем термической обработки с помощью лазерного излучения (количество теплового излучения: 500 мВт, продолжительность облучения: 0,1 с, размер пятна: 50 мкм; количество пятен: 9 пятен), используя лазерный фотокоагулятор с зеленым спектром OcuLight GLx. После операции в подвергнутые оперативному вмешательству глаза закапывали глазные капли Cravit.
11)-6-3 Введение тестируемой субстанции
Через 7 дней после создания модели каждую из обезьян циномолгус анестезировали и затем вновь помещали на операционный стол из нержавеющей стали в положении лежа на спине. Затем вносили в глаза для дезинфекции наружной поверхности глаз промывочный офтальмический и глазной йодный раствор (PA IODO Ophthalmic and Eye) (фирма Nitten Pharmaceutical Co., Ltd.), разведенный в 4 раза стерильной очищенной водой. Иглу 33G вводили в стекловидное тело через конъюнктиву и с помощью 1-миллилитрового шприца инъецировали физиологический раствор или 0,05 мл Н-2143, концентрацию которого доводили до 1,1 мг/0,05 мл. После завершения введения на конъюнктиву с помощью тампона наносили мазь для глаз и ушей Rinderon-A и распространяли ее по поверхности глаз путем открывания и закрывания глаз.
11)-6-4 Оценка эффективности лекарственного средства
В дни 7, 14 и 21 после создания модели под анестезией фотографировали глазное дно общепринятым методом с использованием гибридной камеры для глазного дна СХ-1 (производства фирмы Canon Inc.). Затем внутривенно инъецировали флуоресцеин в дозе 0,05 мл/кг. После завершения внутривенной инъекции флуоресцеина осуществляли флуоресцентную ангиографию каждую 1 мин в течение вплоть до 10 мин, данные визуализации сохраняли. С учетом полученных при визуализации данных серьезность для каждой облученной лазером области, в которой происходило накапливание флуоресцеина, классифицировали с использованием балльной шкалы от 1 до 5, на основе интенсивности флуоресценции, согласно методу, описанному Zahn G. с соавторами (Zahn G. и др. Arch. Ophthalmol. 127, 2009, сс. 1329-1335).
Затем рассчитывали в виде процента соотношение областей, соответствующих баллам 4 и 5 по шкале классификации серьезности, среди всех облученных лазером сайтов, для оценки хороидальной неоваскуляризации. В результате сравнения хороидальной неоваскуляризация между группой, обработанной физиологическим раствором, и группой, обработанной Н-2143, установлено, что соотношение областей, оцененных баллами 4 и 5, увеличивалось после создания модели с течением времени в группе, обработанной физиологическим раствором, в то время указанное увеличение не было обнаружено в группе, обработанной Н-2143. Это свидетельствует о том, что введение Н-2143 подавляло индуцированную лазером хороидальную неоваскуляризацию (фиг. 55).
Промышленная применимость
Применение антитела, предлагаемого в настоящем изобретении, включает лечение или предупреждение ангиогенного заболевания, такого как экссудативная возрастная дегенерация желтого пятна, диабетическая ретинопатия, макулярный отек, доброкачественная или злокачественная опухоль, атеросклероз, ретролентальная фиброплазия, ангиома, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативная ретинопатия, неоваскулярная глаукома, иммунное отторжение трансплантата ткани роговицы или других трансплантатов ткани, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение, и оценку или диагностирование ангиогенного заболевания.
Перечень последовательностей
SEQ ID NO: 1: Нуклеотид последовательность кДНК полноразмерного человеческого ROBO4 (фиг. 13).
SEQ ID NO: 2: Аминокислотная последовательность человеческого ROBO4 (фиг. 14).
SEQ ID NO: 3: Нуклеотидная последовательность, кодирующая аминокислотную последовательность полноразмерного человеческого ROBO4, меченного на N-конце с помощью FLAG.
SEQ ID NO: 4: Аминокислотная последовательность полноразмерного человеческого ROBO4, меченного на N-конце с помощью FLAG.
SEQ ID NO: 5: Нуклеотидная последовательность, кодирующая аминокислотную последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящую из аминокислотной последовательности, которая включает аминокислоты №№46-1007 SEQ ID NO: 2.
SEQ ID NO: 6: Аминокислотная последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящая из аминокислотной последовательности, которая включает аминокислоты №№46-1007 SEQ ID NO: 2.
SEQ ID NO: 7: Нуклеотидная последовательность, кодирующая аминокислотную последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящую из аминокислотной последовательности, которая включает аминокислоты №№132-1007 SEQ ID NO: 2.
SEQ ID NO: 8: Аминокислотная последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящая из аминокислотной последовательности, которая включает аминокислоты №№132-1007 SEQ ID NO: 2.
SEQ ID NO: 9: Нуклеотидная последовательность, кодирующая аминокислотную последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящую из аминокислотной последовательности, которая включает аминокислоты №№210-1007 SEQ ID NO: 2.
SEQ ID NO: 10: Аминокислотная последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящая из аминокислотной последовательности, которая включает аминокислоты №№210-1007 SEQ ID NO: 2.
SEQ ID NO: 11: Нуклеотидная последовательность, кодирующая аминокислотную последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящую из аминокислотной последовательности, которая включает аминокислоты №№225-1007 SEQ ID NO: 2.
SEQ ID NO: 12: Аминокислотная последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящая из аминокислотной последовательности, которая включает аминокислоты №№225-1007 SEQ ID NO: 2.
SEQ ID NO: 13: Нуклеотидная последовательность, кодирующая аминокислотную последовательность меченного на N-конце с помощью FLAG варианта человеческого ROBO4 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящую из аминокислотной последовательности, которая включает аминокислоты №№341-1007 SEQ ID NO: 2.
SEQ ID NO: 14: Аминокислотная последовательность меченного на N-конце с помощью FLAG варианта человеческого ROB 04 с делецией, затрагивающей внеклеточную область/внеклеточный домен, состоящая из аминокислотной последовательности, которая включает аминокислоты №№341-1007 SEQ ID NO: 2.
SEQ ID NO: 15: Нуклеотидная последовательность кДНК мышиного ROBO4.
SEQ ID NO: 16: Аминокислотная последовательность мышиного ROBO4.
SEQ ID NO: 17: Нуклеотидная последовательность кДНК крысиного ROBO4.
SEQ ID NO: 18: Аминокислотная последовательность крысиного ROBO4. SEQ ID NO: 19: Нуклеотидная последовательность кДНК1 обезьяньего ROBO4.
SEQ ID NO: 20: Аминокислотная последовательность 1 обезьяньего ROBO4.
SEQ ID NO: 21: Нуклеотидная последовательность кДНК2 обезьяньего ROBO4.
SEQ ID NO: 22: Аминокислотная последовательность 2 обезьяньего ROBO4.
SEQ ID NO: 23: Нуклеотидная последовательность кДНК человеческого ROBO1.
SEQ ID NO: 24: Аминокислотная последовательность человеческого ROBO1.
SEQ ID NO: 25: Нуклеотидная последовательность кДНК человеческого ROBO2.
SEQ ID NO: 26: Аминокислотная последовательность человеческого ROBO2.
SEQ ID NO: 27: Нуклеотидная последовательность кДНК человеческого ROBO3.
SEQ ID NO: 28: Аминокислотная последовательность человеческого ROBO4.
SEQ ID NO: 29: Нуклеотидная последовательность промоторной области IL-8.
SEQ ID NO: 30: Нуклеотидная последовательность кДНК, кодирующей вариабельную область тяжелой цепи MAb1 (фиг. 15).
SEQ ID NO: 31: Аминокислотная последовательность вариабельной области тяжелой цепи MAb1 (фиг. 16).
SEQ ID NO: 32: Нуклеотидная последовательность кДНК, кодирующей вариабельную область легкой цепи MAb1 (фиг. 17).
SEQ ID NO: 33: Аминокислотная последовательность вариабельной области легкой цепи MAb1 (фиг. 18).
SEQ ID NO: 34: Нуклеотидная последовательность, содержащая кДНК, которая кодирует аминокислоты секреторного сигнала человеческой κ-цепи и константной области человеческой κ-цепи.
SEQ ID NO: 35: Нуклеотидная последовательность, содержащая кДНК, которая кодирует аминокислоты сигнальной последовательности человеческой тяжелой цепи и константную область человеческого IgG1.
SEQ ID NO: 36: Нуклеотидная последовательность, содержащая кДНК, которая кодирует аминокислоты сигнальной последовательности человеческой тяжелой цепи и константную область человеческого IgG2.
SEQ ID NO: 37: Нуклеотидная последовательность кДНК, кодирующей легкую цепь cMAb1 (фиг. 19).
SEQ ID NO: 38: Аминокислотная последовательность легкой цепи cMAb1 (фиг. 20).
SEQ ID NO: 39: Нуклеотидная последовательность кДНК, кодирующей тяжелую цепь cMAb1-1 (фиг. 21).
SEQ ID NO: 40: Аминокислотная последовательность тяжелой цепи cMAb1-1 (фиг. 22).
SEQ ID NO: 41: Нуклеотидная последовательность кДНК, кодирующей тяжелую цепь cMAb1-2 (фиг. 23).
SEQ ID NO: 42: Аминокислотная последовательность тяжелой цепи cMAb1-2 (фиг. 24).
SEQ ID NO: 43: Нуклеотидная последовательность, кодирующая аминокислотную последовательность CDRH1 тяжелой цепи MAb1.
SEQ ID NO: 44: Аминокислотная последовательность CDRH1 тяжелой цепи MAb1 (фиг. 25).
SEQ ID NO: 45: Нуклеотидная последовательность, кодирующая аминокислотную последовательность CDRH2 тяжелой цепи MAb1.
SEQ ID NO: 46: Аминокислотная последовательность CDRH2 тяжелой цепи MAb1 (фиг. 26).
SEQ ID NO: 47: Нуклеотидная последовательность, кодирующая аминокислотную последовательность CDRH3 тяжелой цепи MAb1.
SEQ ID NO: 48: Аминокислотная последовательность CDRH3 тяжелой цепи MAb1 (фиг. 27).
SEQ ID NO: 49: Нуклеотидная последовательность, кодирующая аминокислотную последовательность CDRL1 легкой цепи MAb1.
SEQ ID NO: 50: Аминокислотная последовательность CDRL1 легкой цепи MAb1 (фиг. 28).
SEQ ID NO: 51: Нуклеотидная последовательность, кодирующая аминокислотную последовательность CDRL2 легкой цепи MAb1.
SEQ ID NO: 52: Аминокислотная последовательность CDRL2 легкой цепи MAb1 (фиг. 29).
SEQ ID NO: 53: Нуклеотидная последовательность, кодирующая аминокислотную последовательность CDRL3 легкой цепи MAb1.
SEQ ID NO: 54: Аминокислотная последовательность CDRL3 легкой цепи MAb1 (фиг. 30).
SEQ ID NO: 55: Нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-Hl-типа (фиг. 31).
SEQ ID NO: 56: Аминокислотная последовательность тяжелой цепи hMAb1-Hl-типа (фиг. 32).
SEQ ID NO: 57: Нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-H2-типа (фиг. 33).
SEQ ID NO: 58: Аминокислотная последовательность тяжелой цепи hMAb1-Н2-типа (фиг. 34).
SEQ ID NO: 59: Нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-Н3-типа (фиг. 35).
SEQ ID NO: 60: Аминокислотная последовательность тяжелой цепи hMAb1-Н3-типа (фиг. 36).
SEQ ID NO: 61: Нуклеотидная последовательность кДНК, кодирующей тяжелую цепь hMAb1-Н4-типа (фиг. 37).
SEQ ID NO: 62: Аминокислотная последовательность тяжелой цепи hMAb1-Н4-типа (фиг. 38).
SEQ ID NO: 63: Нуклеотидная последовательность кДНК, кодирующей легкую цепь hMAb1-L1-типа (фиг. 39).
SEQ ID NO: 64: Аминокислотная последовательность легкой цепи hMAb1-L1-типа (фиг. 40).
SEQ ID NO: 65: Нуклеотидная последовательность кДНК, кодирующей легкую цепь hMAb1-L2-типа (фиг. 41).
SEQ ID NO: 66: Аминокислотная последовательность легкой цепи hMAb1-L2-типа (фиг. 42).
SEQ ID NO: 67: CDRH1 тяжелой цепи hMAb1-H2- или hMAb1-Н4-типа (фиг. 43).
SEQ ID NO: 68: CDRH2 тяжелой цепи hMAb1-H2- или hMAb1-Н4-типа (фиг. 44).
SEQ ID NO: 69: CDRH3 тяжелой цепи hMAb1-H2 или hMAb1-Н4-типа (фиг. 45).
SEQ ID NO: 70: CDRL1 легкой цепи hMAb1-L2-типа (фиг. 46).
SEQ ID NO: 71: CDRL2 легкой цепи hMAb1-L2-типа (фиг. 47).
SEQ ID NO: 72: CDRL3 легкой цепи hMAb1-L2-типа (фиг. 48).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ TFR И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ И ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2016 |
|
RU2737637C2 |
| НОВОЕ АНТИТЕЛО К TSLP-РЕЦЕПТОРУ ЧЕЛОВЕКА | 2014 |
|
RU2689528C2 |
| АНТИ-СD3-АНТИТЕЛО И МОЛЕКУЛА, СОДЕРЖАЩАЯ ЭТО АНТИТЕЛО | 2017 |
|
RU2790326C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2663123C2 |
| БЫСТРЫЙ СПОСОБ КЛОНИРОВАНИЯ И ЭКСПРЕССИИ СЕГМЕНТОВ ГЕНА РОДСТВЕННОЙ ВАРИАБЕЛЬНОЙ ОБЛАСТИ АНТИТЕЛА | 2012 |
|
RU2612910C2 |
| АНТАГОНИСТИЧЕСКИЕ АНТИТЕЛА К IL-17 | 2005 |
|
RU2426741C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ РАКА | 2009 |
|
RU2533460C2 |
| НОВЫЕ ПОЛНОСТЬЮ ЧЕЛОВЕЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ VAP-1 | 2008 |
|
RU2459832C2 |
| ТЕРАПЕВТИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2002 |
|
RU2328506C2 |















































































































































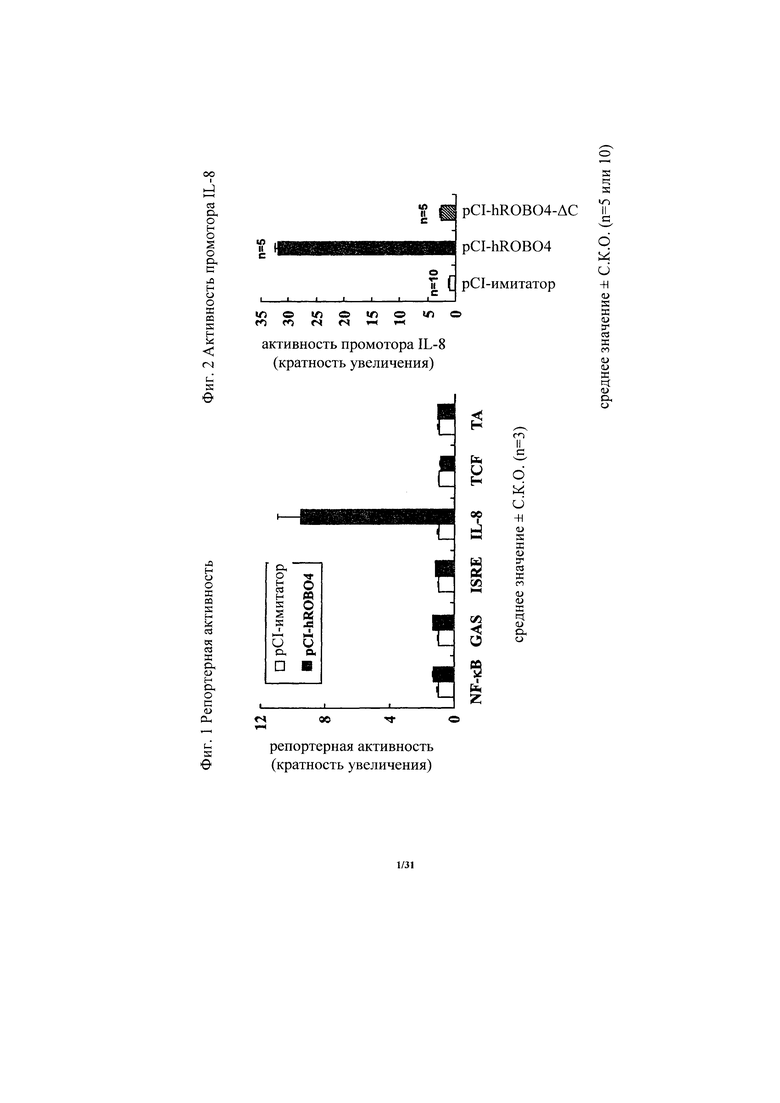
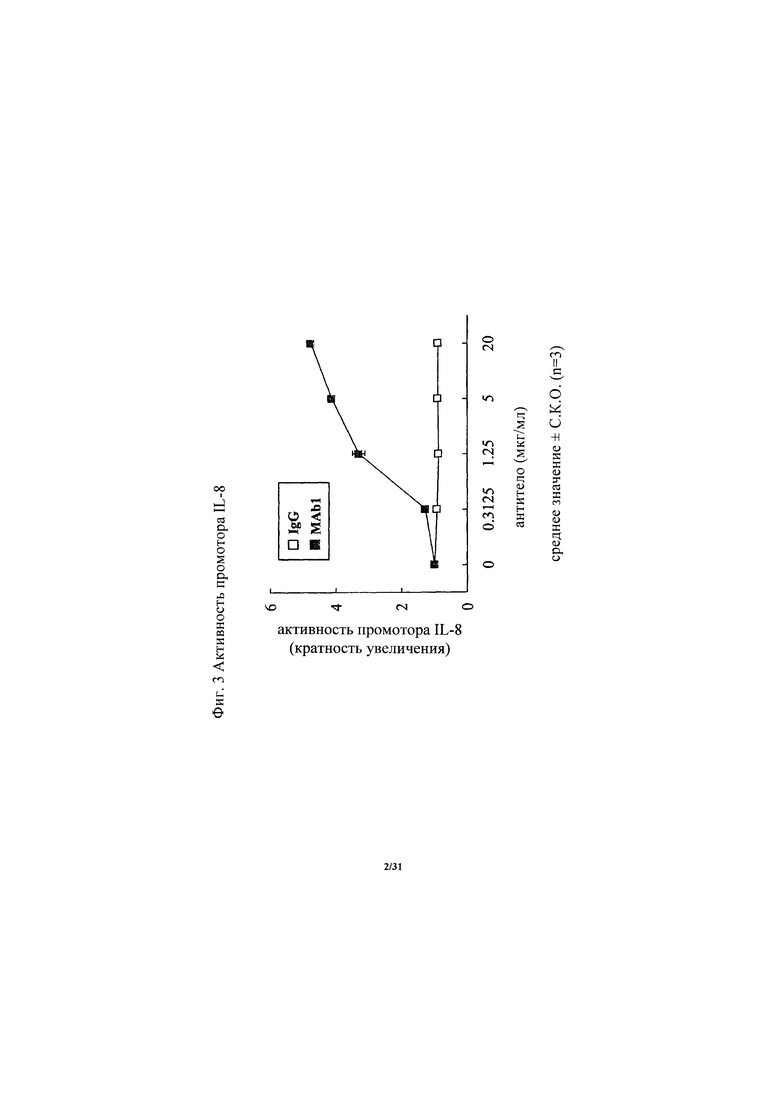
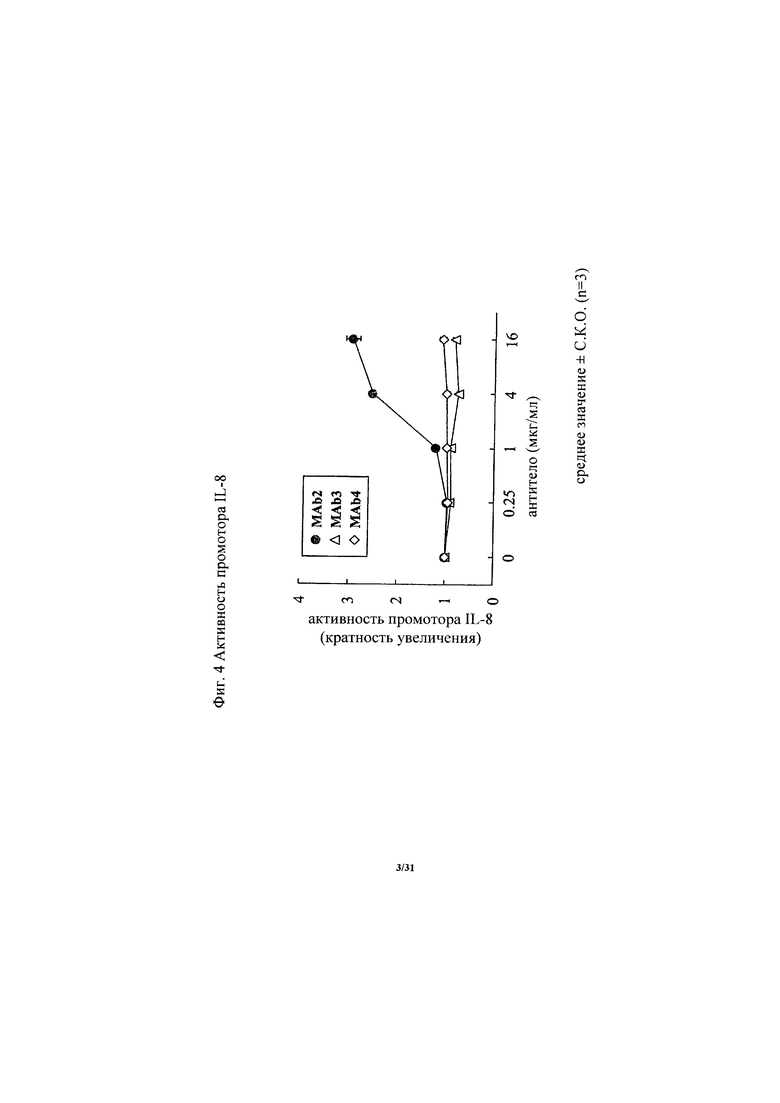

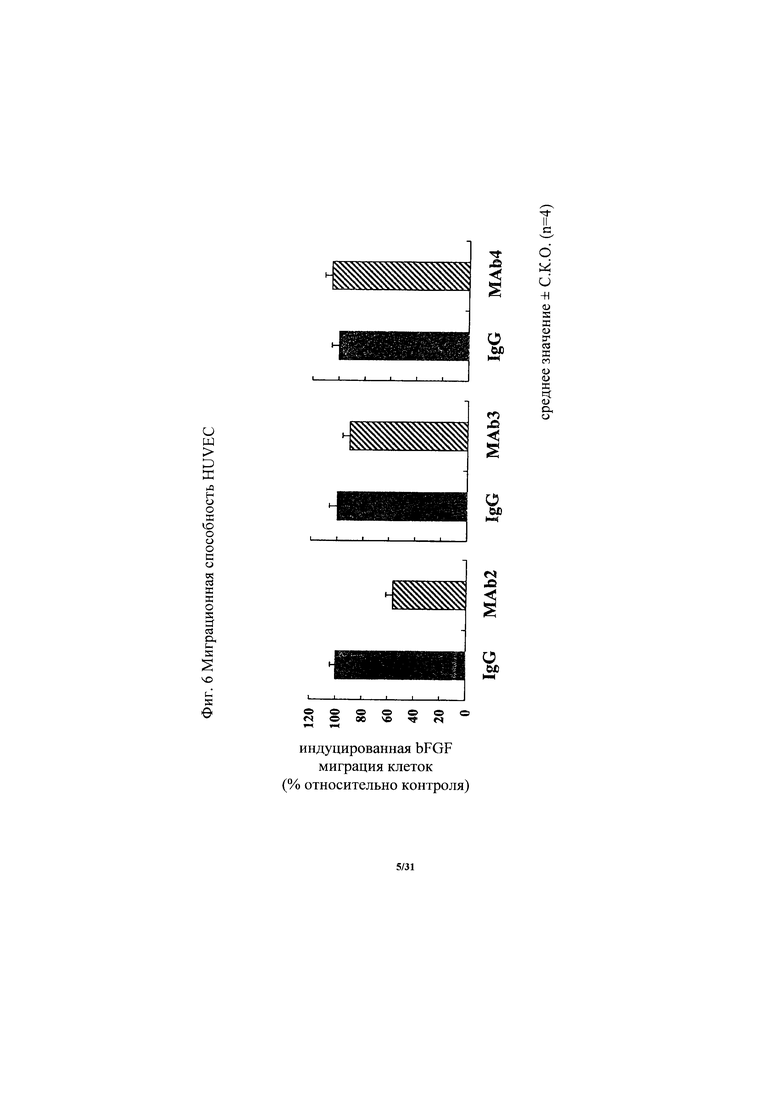
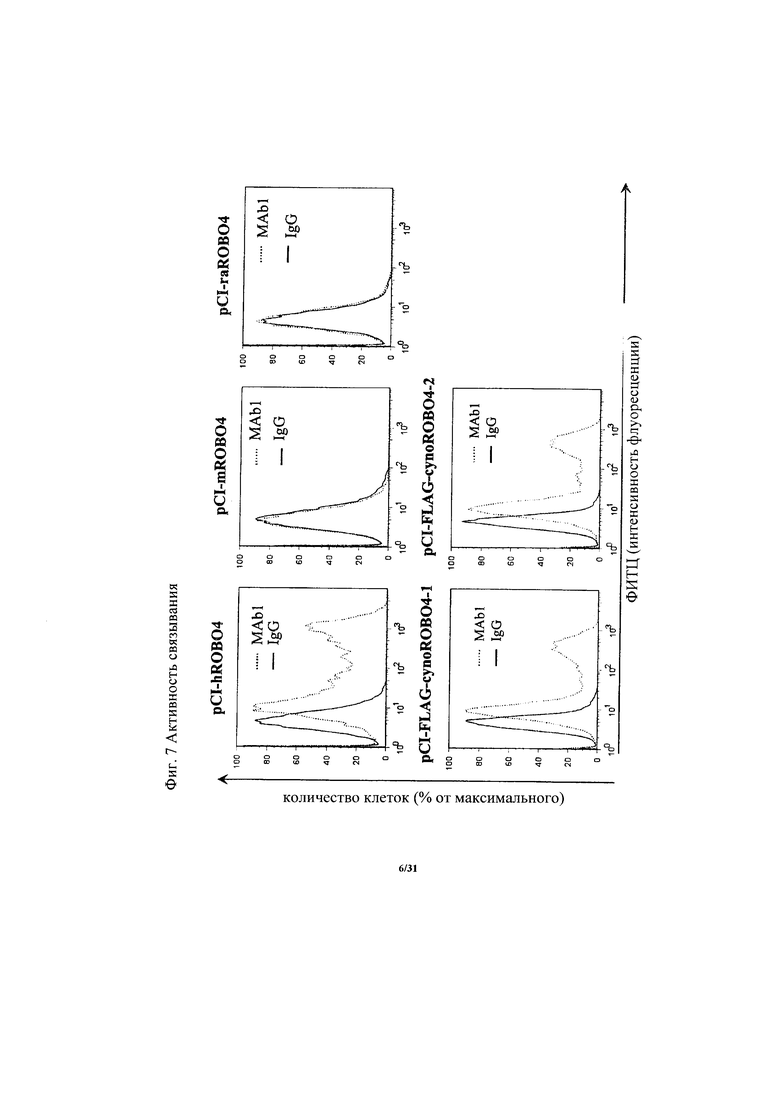
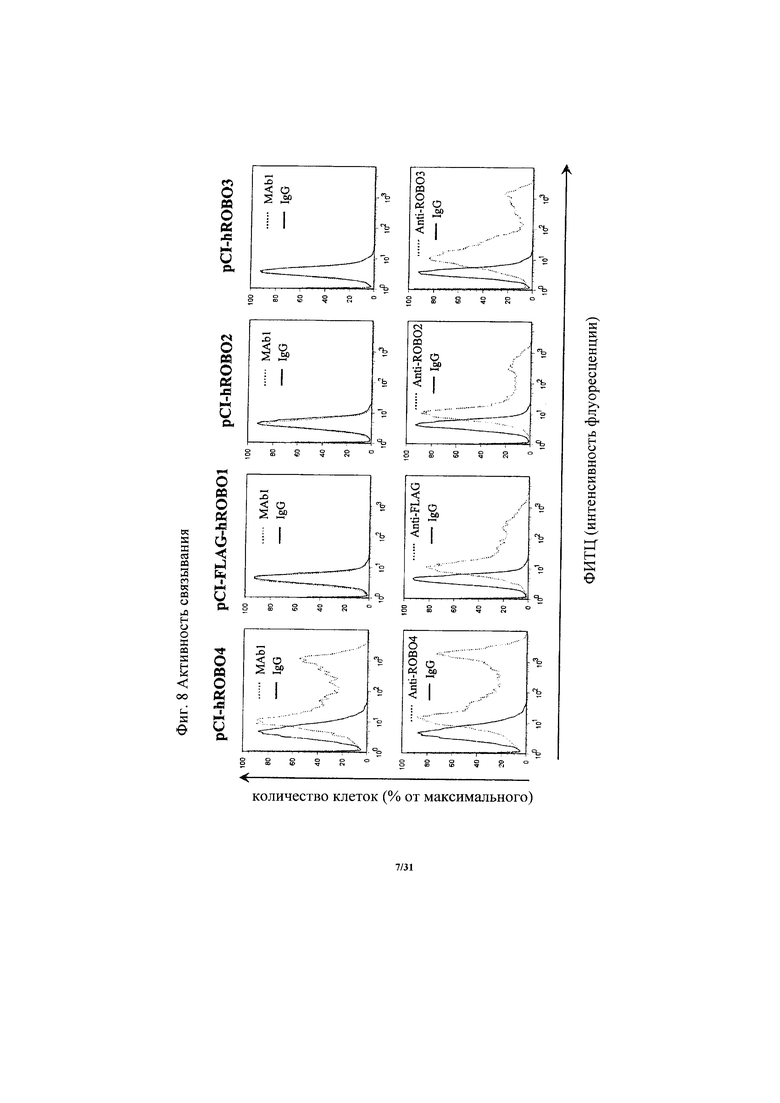

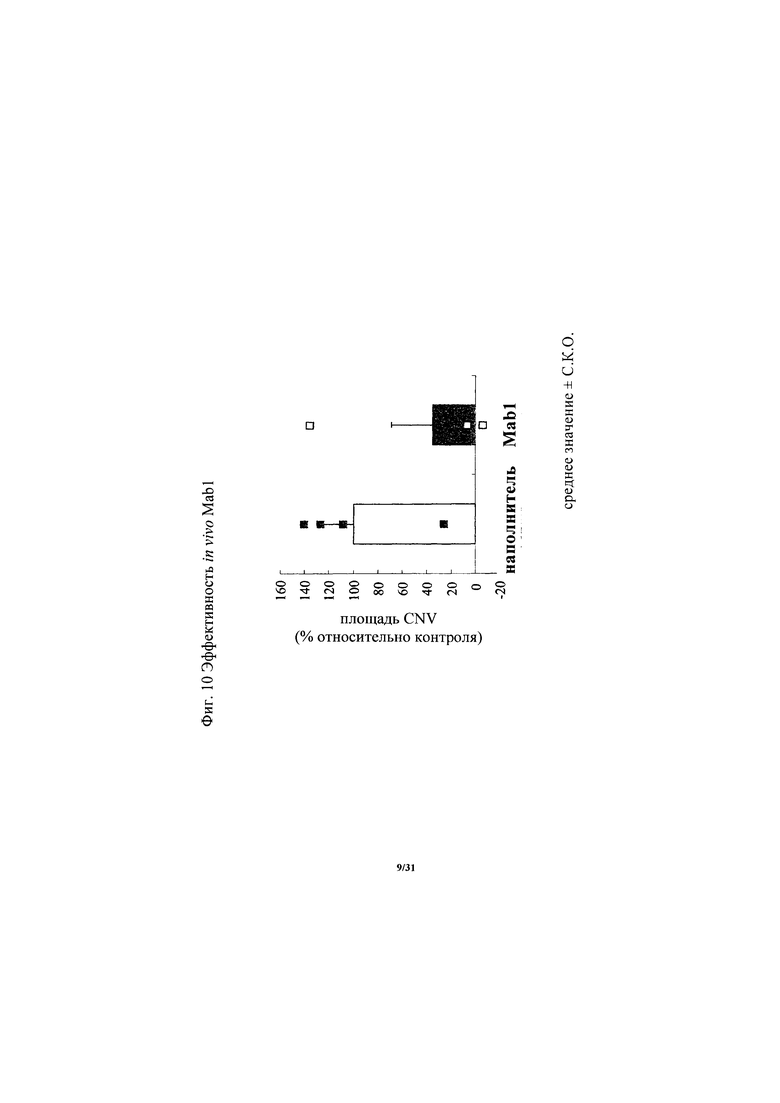

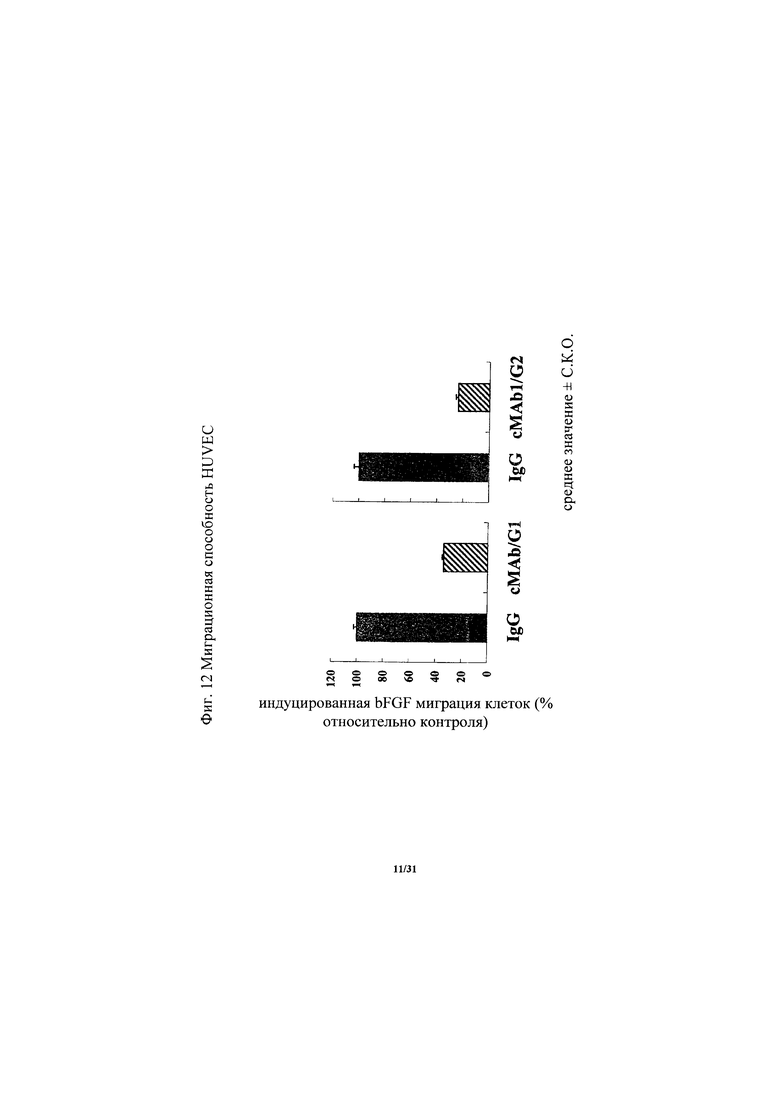














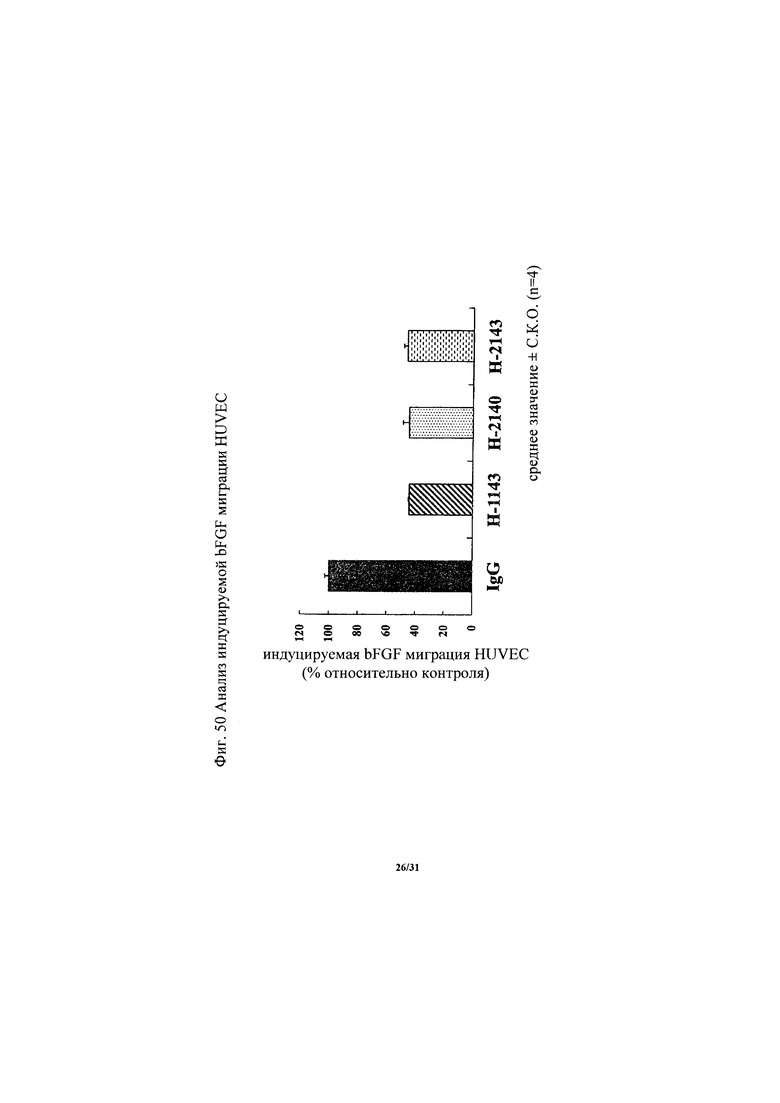
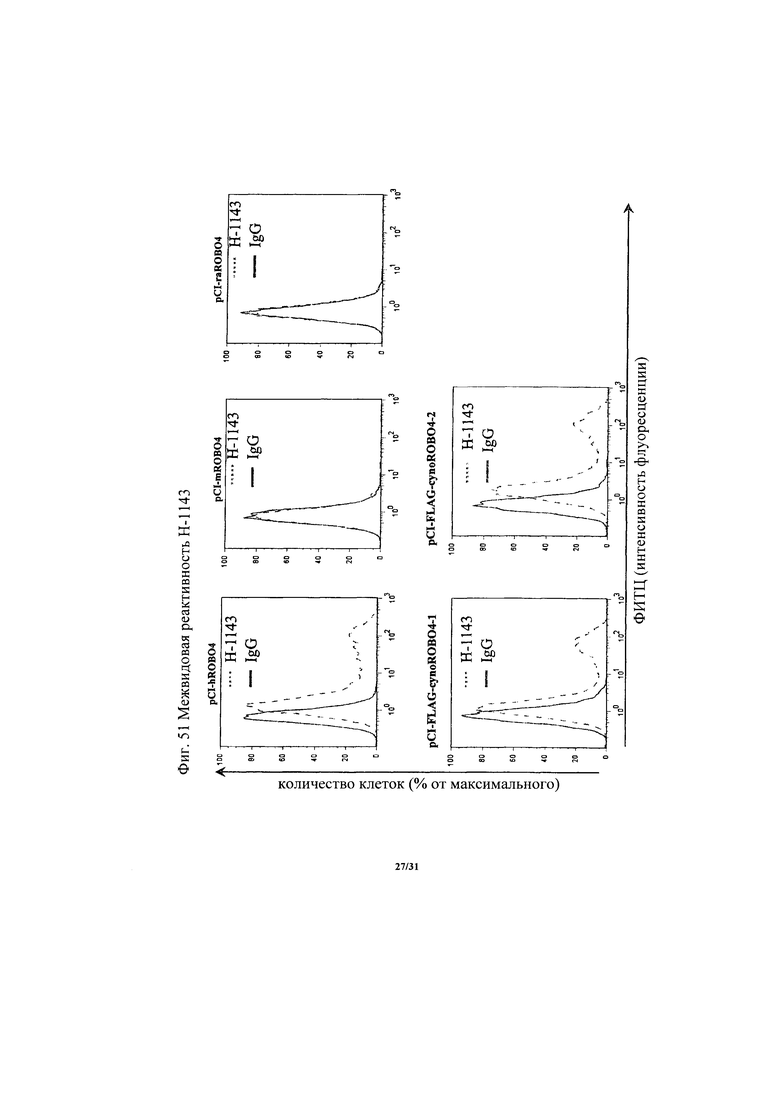
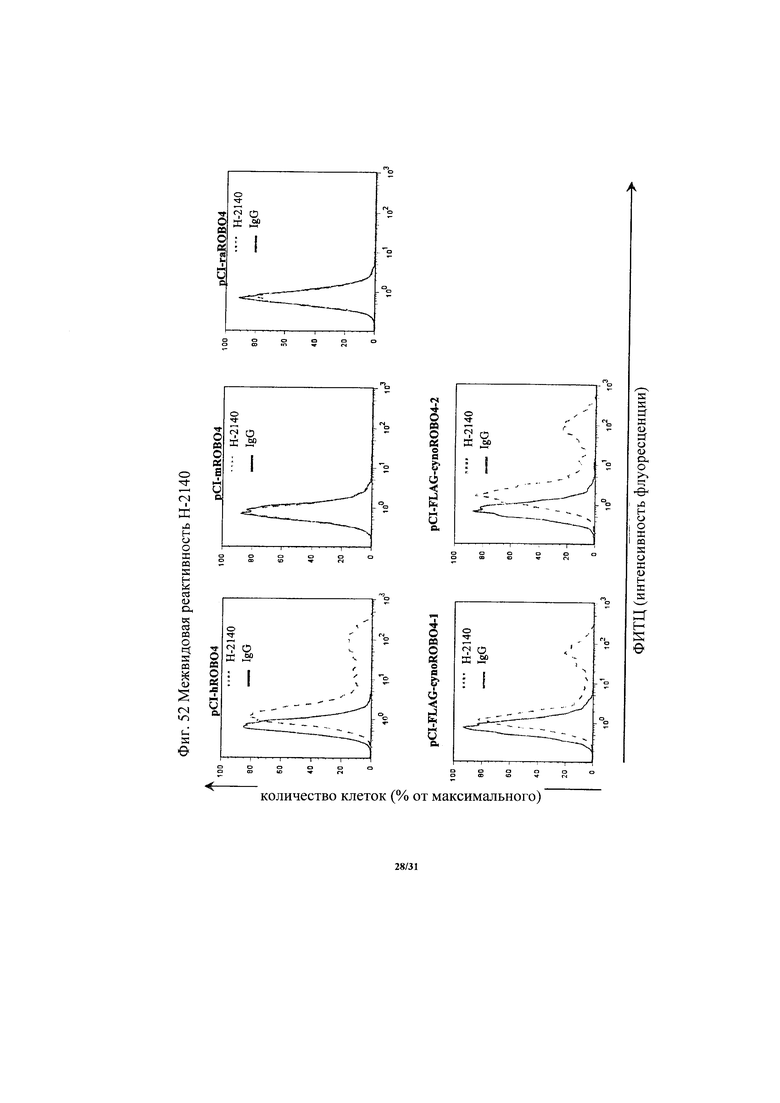
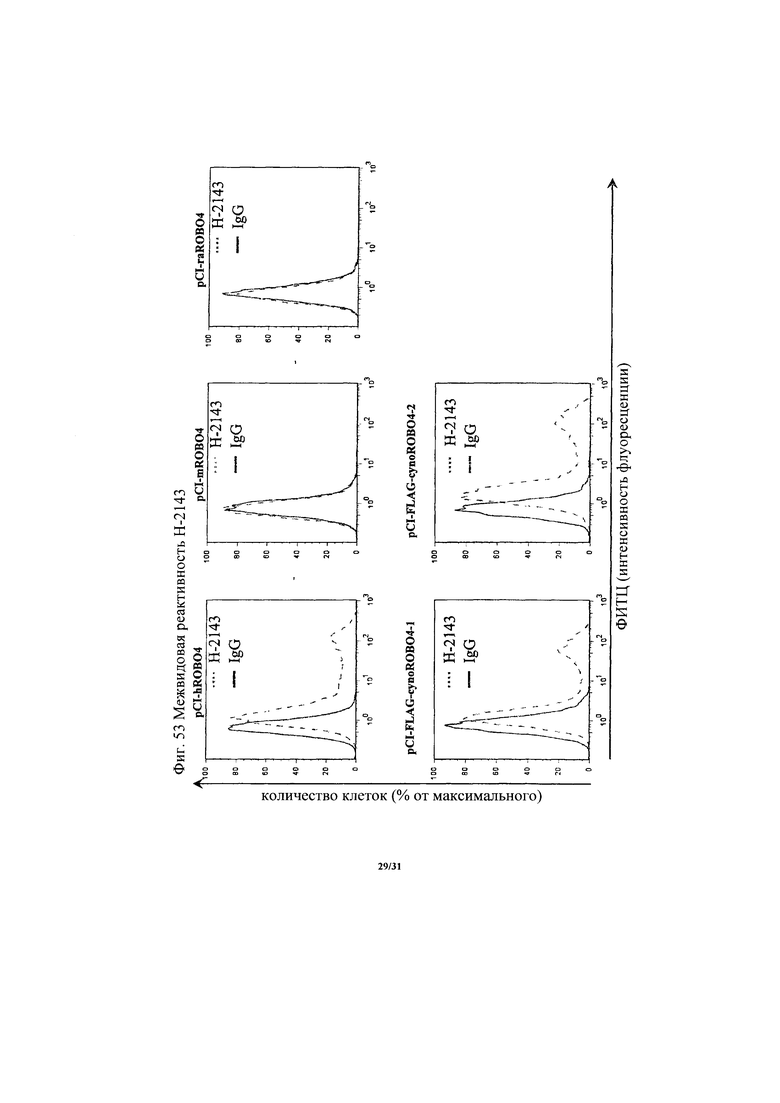
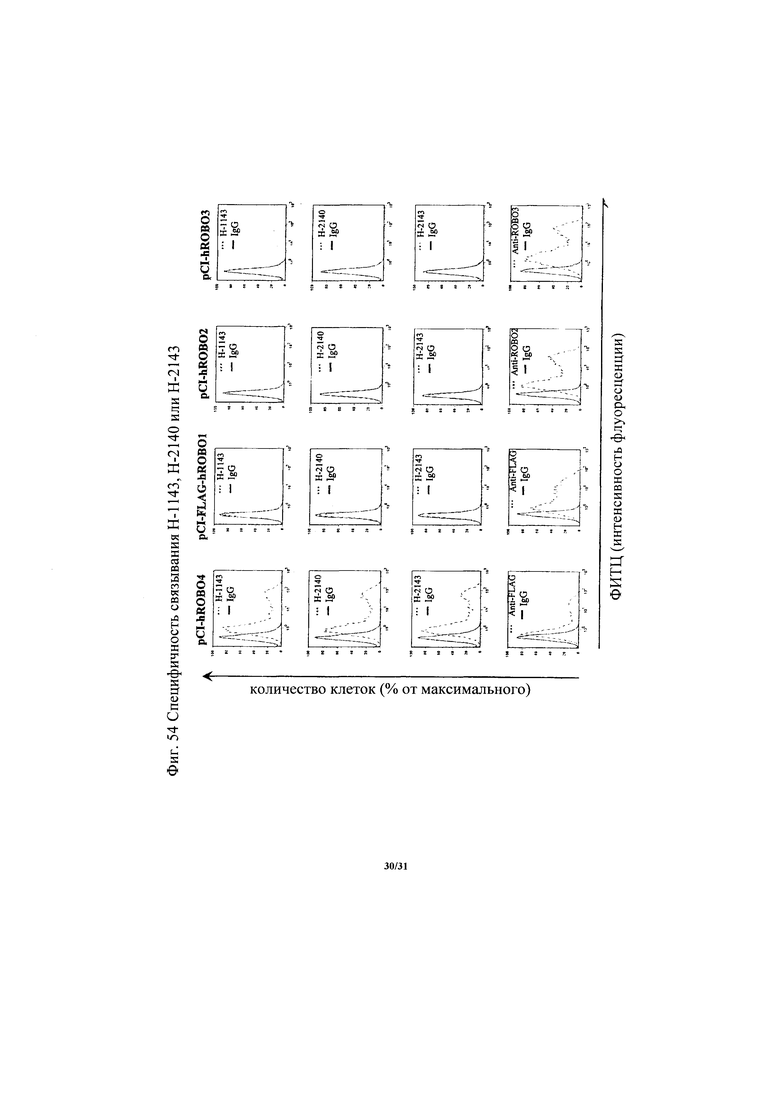
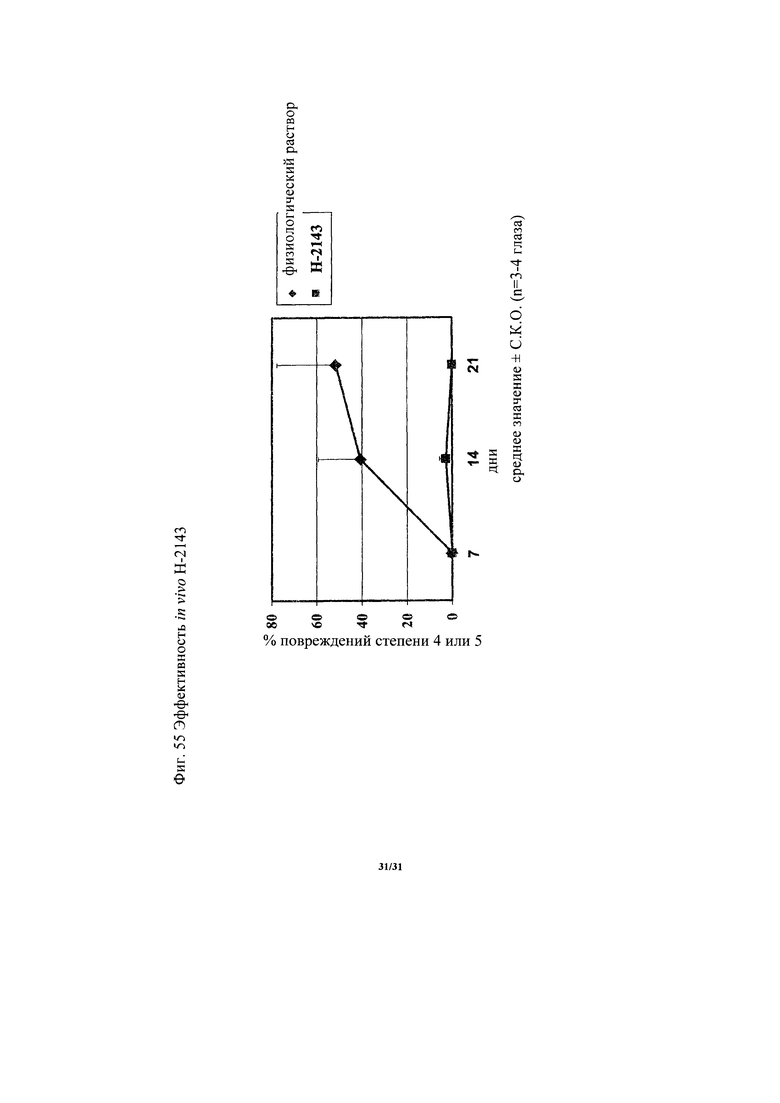
Настоящее изобретение относится к иммунологии. Предложено антитело к ROBO4 и его антигенсвязывающий фрагмент. Также представлены: кодирующий упомянутое антитело полинуклеотид, вектор, клетка и способ получения антитела или его антигенсвязывающего фрагмента. Кроме того, рассмотрены: фармацевтическая композиция, способ и применение антитела или его антигенсвязывающего фрагмента для предупреждения или лечения ангиогенного заболевания. Упомянутое антитело активирует действующий в прямом направлении сигнал ROBO4 и обладает подавляющим действием в отношении миграции, индуцированной VEGF или bFGF, а также антиангиогенным действием на моделях in vivo. 9 н. и 21 з.п. ф-лы, 55 ил., 11 пр.
1. Антитело или его антигенсвязывающий фрагмент, состоящее/состоящий из тяжелой цепи, которая содержит CDRH1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 44 (фиг. 25), CDRH2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 46 (фиг. 26), или аминокислотной последовательности, представленной в SEQ ID NO: 68 (фиг. 44), и CDRH3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 48 (фиг. 27), и легкой цепи, которая содержит CDRL1, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 50 (фиг. 28), или аминокислотной последовательности, представленной в SEQ ID NO: 70 (фиг. 46), CDRL2, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 52 (фиг. 29), и CDRL3, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 54 (фиг. 30), обладающее/обладающий свойствами, которые указаны ниже в подпунктах (I)-(III):
(I) способность связываться с белком ROBO4, что характеризуется величиной KD, составляющей 1×10-8 или ниже,
(II) способность подавлять или ингибировать миграцию сосудистых эндотелиальных клеток в отсутствии перекрестносшивающего антитела in vitro и
(III) способность подавлять или ингибировать ангиогенез in vivo.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где белок ROBO4 представляет собой человеческий белок ROBO4.
3. Антитело или его антигенсвязывающий фрагмент по п. 1, где белок ROBO4 представляет собой белок, состоящий из аминокислот №№1-1007 SEQ ID NO: 2.
4. Антитело или его антигенсвязывающий фрагмент по п. 1, где белок ROBO4 представляет собой белок, состоящий из аминокислот №№46-1007 SEQ ID NO: 2.
5. Антитело или его антигенсвязывающий фрагмент по п. 3 или 4, где антитело или его антигенсвязывающий фрагмент связывается с сайтом, состоящим из аминокислотной последовательности аминокислот №№132-209 SEQ ID NO: 2.
6. Антитело или его антигенсвязывающий фрагмент по п. 1, где антитело или его антигенсвязывающий фрагмент представляет собой моноклональное антитело или его антигенсвязывающий фрагмент.
7. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело содержит вариабельную область тяжелой цепи, которая состоит из аминокислотной последовательности, представленной в SEQ ID NO: 31 (фиг. 16), и вариабельную область легкой цепи, которая состоит из аминокислотной последовательности, представленной в SEQ ID NO: 33 (фиг. 18).
8. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело содержит одну из вариабельных областей тяжелой цепи, выбранную из указанных ниже в подпунктах а)-г), вариабельную область легкой цепи, выбранную из указанных в подпунктах д) и е):
а) вариабельная область тяжелой цепи (hMAb1-H1-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 56 (фиг. 32),
б) вариабельная область тяжелой цепи (hMAb1-Н2-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34),
в) вариабельная область тяжелой цепи (hMAb1-Н3-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 60 (фиг. 36), и
г) вариабельная область тяжелой цепи (hMAb1-Н4-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и
д) вариабельная область легкой цепи (hMAb1-L1-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40), и
е) вариабельная область легкой цепи (hMAb1-L2-типа), состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42).
9. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело содержит одну из следующих комбинаций 1)-6) вариабельной области тяжелой цепи и вариабельной области легкой цепи:
1) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40),
2) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 58 (фиг. 34), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42),
3) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 66 (фиг. 42),
4) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 62 (фиг. 38), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40),
5) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 56 (фиг. 32), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40), и
6) вариабельная область тяжелой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№20-137 SEQ ID NO: 60 (фиг. 36), и вариабельная область легкой цепи, состоящая из аминокислотной последовательности, представленной аминокислотами №№21-134 SEQ ID NO: 64 (фиг. 40).
10. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело или его антигенсвязывающий фрагмент представляет собой химерное антитело или его антигенсвязывающий фрагмент.
11. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело или его антигенсвязывающий фрагмент представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент.
12. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело содержит константную область тяжелой цепи человеческого IgG1 или человеческого IgG2.
13. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело или его антигенсвязывающий фрагмент связывается с сайтом на антигене, распознаваемым антителом по пп. 8-12.
14. Антитело или его антигенсвязывающий фрагмент по одному из пп. 1-4, 6, где антитело или его антигенсвязывающий фрагмент конкурирует с одним из антител по пп. 8-12 за связывание с белком ROBO4.
15. Антитело по одному из пп. 1-4, 6, где антитело содержит одну из следующих комбинаций 1)-6) тяжелой цепи и легкой цепи:
1) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 58 (фиг. 34), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-1140),
2) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 58 (фиг. 34), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 66 (фиг. 42) (Н-1143),
3) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 62 (фиг. 38), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 66 (фиг. 42) (Н-2143),
4) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 62 (фиг. 38), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-2140),
5) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 56 (фиг. 32), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-1040), и
6) тяжелая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№20-463 SEQ ID NO: 60 (фиг. 36), и легкая цепь, которая состоит из аминокислотной последовательности, представленной аминокислотами №№21-239 SEQ ID NO: 64 (фиг. 40) (Н-2040).
16. Антитело или его антигенсвязывающий фрагмент, связывающийся с белком ROBO4, по п. 15, где в указанной модифицированной форме отсутствует от одной до десяти карбоксиконцевых аминокислот указанной тяжелой цепи.
17. Антитело по одному из пп. 1-4, 6, где аминокислотная последовательность антитела идентична на 95% или более аминокислотной последовательности антитела по п. 15, имеет величину KD, составляющую 1×10-8 или менее, в отношении человеческого ROBO4, подавляет или ингибирует миграцию сосудистых эндотелиальных клеток в отсутствии перекрестносшивающего антитела in vitro и подавляет или ингибирует ангиогенез in vivo.
18. Антитело или его антигенсвязывающий фрагмент по п. 13, где антитело или его антигенсвязывающий фрагмент представляет собой человеческое антитело или его антигенсвязывающий фрагмент.
19. Полинуклеотид, имеющий нуклеотидную последовательность, выбранную из группы, состоящей из следующих подпунктов (I)-(III):
(I) нуклеотидная последовательность, которая содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность тяжелой цепи и легкой цепи или вариабельных областей тяжелой и легкой цепей антитела по одному из пп. 1-18,
(II) нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, содержащей нуклеотидную последовательность, которая кодирует аминокислотную последовательность тяжелой цепи и легкой цепи антитела или вариабельных областей тяжелой и легкой цепей антитела по одному из пп. 1-18, и
(III) нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, кодирующей аминокислотную последовательность тяжелой цепи и легкой цепи антитела или вариабельных областей тяжелой и легкой цепей антитела по одному из пп. 1-18.
20. Рекомбинантный вектор для получения антитела или его антигенсвязывающего фрагмента по пп. 1-18, содержащий встроенную нуклеотидную последовательность по п. 19.
21. Рекомбинантная клетка для получения антитела или его антигенсвязывающего фрагмента по пп. 1-18, содержащая нуклеотид по п. 19 или рекомбинантный вектор по п. 20, который интродуцирован в нее.
22. Способ получения антитела или его антигенсвязывающего фрагмента по одному из пп. 1-18, включающий следующие стадии (I) и (II), на которых:
(I) культивируют клетку по п. 21 и
(II) собирают антитело или его антигенсвязывающий фрагмент по одному из пп. 1-18 из культуры, полученной на стадии (I).
23. Антитело или его антигенсвязывающий фрагмент, связывающийся с белком ROBO4, полученное/полученный с помощью способа получения по п. 22.
24. Антитело или его антигенсвязывающий фрагмент, связывающееся/связывающийся с белком ROBO4, по одному из пп. 1-18 и 23, которое/который включает одну или более модификаций, выбранных из группы, состоящей из N-связанного гликозилирования, О-связанного гликозилирования, N-концевого процессинга, С-концевого процессинга, деамидирования, изомеризации аспарагиновой кислоты, окисление метионина, амидирования остатка пролина и отсутствия 1 или 2 аминокислоты(т) на карбоксильном конце тяжелой цепи.
25. Фармацевтическая композиция для предупреждения и лечения ангиогенного заболевания, содержащая антитело или его антигенсвязывающий фрагмент по одному из пп. 1-18 и 23 или его модифицированную форму по п. 24 в качестве действующего вещества в терапевтически или профилактически эффективном количестве, где модифицированная форма включает одну или более модификаций, выбранных из группы, состоящей из N-связанного гликозилирования, О-связанного гликозилирования, N-концевого процессинга, С-концевого процессинга, деамидирования, изомеризации аспарагиновой кислоты, окисления метионина, амидирования остатка пролина и отсутствия 1 или 2 аминокислоты(т) на карбоксильном конце тяжелой цепи.
26. Фармацевтическая композиция по п. 25, где ангиогенное заболевание представляет собой экссудативную возрастную дегенерацию желтого пятна, диабетическую ретинопатию, макулярный отек, доброкачественную или злокачественную опухоль, атеросклероз, ретролентальную фиброплазию, ангиому, хроническое воспаление, неоваскулярное заболевание глаза, пролиферативную ретинопатию, неоваскулярную глаукому, иммунное отторжение трансплантата ткани роговицы или других трансплантатов тканей, ревматоидный артрит, псориаз, острое воспаление, сепсис или ожирение.
27. Фармацевтическая композиция по п. 26, где ангиогенное заболевание представляет собой экссудативную возрастную дегенерацию желтого пятна, диабетическую ретинопатию, макулярный отек, ретролентальную фиброплазию, неоваскулярное заболевание глаза, пролиферативную ретинопатию, неоваскулярную глаукому или иммунное отторжение трансплантата ткани роговицы.
28. Применение антитела или его антигенсвязывающего фрагмента по одному из пп. 1-18 и 23 для предупреждения и лечения ангиогенного заболевания.
29. Способ лечения или предупреждения ангиогенного заболевания, включающий введение индивидууму, который нуждается в этом, эффективного количества антитела или его антигенсвязывающего фрагмента по одному из пп. 1-18 и 23, или модифицированной формы по п. 24, или композиции по одному из пп. 25-27.
30. Фармацевтическая композиция по одному из пп. 25-27, где указанную композицию применяют в сочетании с другим терапевтическим или профилактическим средством.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| EP 1790728 A2, 30.05.2007 | |||
| PARK K.W | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2019-03-19—Публикация
2013-04-26—Подача