ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании заявки на патент Китая №20121015155.7, поданной 16 мая 2012, содержание которой включено в настоящую заявку во всей полноте посредством ссылки, как если бы она была полностью изложена в настоящей заявке.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к области фармацевтических композиций, способных преодолевать один или более биологических барьеров, и к способам применения фармацевтических композиций для предотвращения и/или лечения состояний легких (например, астмы, инфекций нижних и верхних дыхательных путей), у человека и животных. Настоящее изобретение также относится к способам применения фармацевтических композиций для скрининга новых лекарственных средств.
УРОВЕНЬ ТЕХНИКИ
[0003] Состояния легких, могут быть вызваны аллергией, воспалением, бактериальными инфекциями или их комбинациями. Например, астма представляет собой хроническое воспалительное заболевание дыхательного тракта (дыхательных путей), характеризующееся обструкцией дыхательных путей и бронхоспазмом. Астма может быть классифицирована как изменяющаяся и частично обратимая обструкция дыхательных путей, включающая гиперсекрецию слизистой железы, утолщение стенок дыхательных путей в результате рубцевания и воспаления и сужение бронхов. Сужение бронхов вызывается отеком и набуханием, которые могут быть вызваны иммунным ответом на аллергены. Бактериальные инфекции верхних дыхательных путей также могут ухудшать симптомы астмы.
[0004] Стенки дыхательных путей у астматиков или субъектов, которые страдают от хронического состояния легких (например, эмфиземы и хронического бронхита), могут быть утолщены в результате рубцевания и воспаления. Таким образом, в данной области существует потребность в новых композициях, которые могут быть эффективно и продуктивно доставлены к месту развития состояния легких (например, астмы, инфекций нижних и верхних дыхательных путей), у субъекта для предотвращения, облегчения или лечения состояния, а также для минимизации нежелательных побочных эффектов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Структуры пролекарства с высокой проницаемостью (НРР) или композиции с высокой проницаемостью (НРС).
[0005] Один из аспектов настоящего изобретения относится к пролекарству с высокой проницаемостью (НРР) или композиции с высокой проницаемостью (НРС). Термины, «пролекарство с высокой проницаемостью» или «НРР», «композиция с высокой проницаемостью» или «НРС», применяемые в настоящей заявке, относятся к композиции, содержащей функциональный фрагмент, ковалентно связанный с транспортным фрагментом посредством линкерной группы.
[0006] Функциональный фрагмент
[0007] Функциональный фрагмент в составе НРР или НРС, которое содержит фрагмент исходного лекарственного средства, характеризуется тем, что: 1) для него желательна возможность доставки исходного лекарственного средства или НРР/НРС биологическому субъекту и/или доставки исходного лекарственного средства через один или более биологических барьеров, 2) НРР/НРС способны проникать через или преодолевать один или более биологические барьеры, и 3) НРР/НРС способны расщепляться с превращением фрагмента исходного лекарственного средства в исходное лекарственное средство или метаболит исходного лекарственного средства.
[0008] В конкретных вариантах реализации функционый фрагмент может быть гидрофильным, липофильным или амфифильным (гидрофильным и липофильным). Липофильный фрагмент функционального фрагмента может присутствовать изначально или может быть получен путем превращения одного или более гидрофильных фрагментов функционального фрагмента в липофильные фрагменты. Например, липофильный фрагмент функционального фрагмента получают путем превращения одной или более гидрофильных групп функционального фрагмента в липофильные группы при помощи органического синтеза. Примеры гидрофильных групп включают, без ограничений, карбоксильную, гидроксильную, тиольную, аминную, фосфатную/фосфонатную, гуанидиновую и карбонильную группы. Липофильные фрагменты, полученные путем превращения указанных гидрофильных групп, включают, без ограничений, простые эфиры, простые тиоэфиры, сложные эфиры, сложные тиоэфиры, карбонаты, карбаматы, амиды, фосфаты и оксимы. В некоторых вариантах реализации функциональный фрагмент превращают в более липофильный фрагмент путем ацетилирования или ацилирования(алканоилирования).
[0009] В некоторых вариантах реализации исходное лекарственное средство в составе НРР или НРС представляет собой лекарственное средство, которое может быть использовано индивидуально или в комбинации с другим(и) лекарственным(и) средством(ами) для лечения состояний легких (например, астмы, инфекций нижних и верхних дыхательных путей, хронического бронхита, хронического обструктивного заболевания легких, эмфиземы, кистозного фиброза, пневмонии, саркоидоза и фиброза легких), или родственное соединение. Родственное соединение исходного лекарственного средства представляет собой соединение, содержащее структуру исходного лекарственного средства, метаболит исходного лекарственного средства или агент, который может быть превращен в исходное лекарственное средство или метаболит исходного лекарственного средства после прохождения НРР или НРС через один или более биологических барьеров. Родственное соединение исходного лекарственного средства дополнительно содержит соединение, которое является аналогом или имитатором исходного лекарственного средства или метаболита исходного лекарственного средства, или агент, который может быть превращен в аналог или имитатор исходного лекарственного средства или метаболита исходного лекарственного средства после прохождения НРР или НРС через один или более биологических барьеров.
[0010] Как описано выше, фрагмент исходного лекарственного средства или его родственного соединения может быть дополнительно превращен в липофильный фрагмент. Основные классы лекарственных средств, которые могут быть применены для лечения состояний легких (например, астмы, инфекций нижних и верхних дыхательных путей, хронического бронхита, хронического обструктивного заболевания легких, эмфиземы, кистозного фиброза, пневмонии, саркоидоза и фиброза легких), включают, например, антигистаминные средства, агонисты β2-адренергических рецепторов, ингибиторы белка, активирующего 5-липоксигеназу (FLAP), ингибиторы 5-липоксигеназы, антагонисты рецепторов лейкотриена, противовоспалительные лекарственные средства, средства от кашля, противоотечные средства и антибиотики.
[0011] Примеры ингибиторов белка, активирующего 5-липоксигеназу (FLAP), включают, без ограничений, MK-886 [3-(1-(4-хлорбензил)-3-трет-бутилтио-5-изопропилиндол-2-ил)-2,2-диметилпропановую кислоту], MK-0591 [3-(1-(4-хлорбензил-3-(трет-бутилтио)-5-(хинолин-2-илметокси)индол-2-ил))-2,2-диметилпропановую кислоту], 2-циклопентил-2-[4-(хинолин-2-илметокси)фенил]уксусную кислоту и 3-[[1-(4-хлорбензил)-4-метил-6-(3-фенилпиридин-2-ил)метокси]-4,5-дигидро-1H-тиопирано[2,3,4-c,d]индол-2-ил]-2,2-диметилпропановую кислоту.
[0012] Примеры ингибиторов 5-липоксигеназы включают, без ограничений, зилеутон [(RS)-N-[1-(1-бензотиен-2-ил)этил]-N-гидроксимочевину], теофиллин [1,3-диметил-7H-пурин-2,6-дион], 2,6-диметил-4-[2-(4-фторфенил)этенил]фенол, 2,6-диметил-4-[2-(3-пиридил)этенил]фенол и 2,6-диметил-4-[2-(2-тиенил)этенил]фенол.
[0013] Примеры антагонисты рецепторов лейкотриена включают, без ограничений, монтелукаст {R-(E)-1-[[[-1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропануксусную кислоту}, 7-[3-(4-ацетил-3-гидрокси-2-пропилфенокси)-2-гидроксипропокси]-4-оксо-8-пропил-4H-1-бензопиран-2-карбоновую кислоту, натриевую соль (Е)-3-[[[3-[2-(7-хлор-2-хинолинил)этенил]фенил][[3-диметиламино]-3-оксопропил]тио]метил]тио]пропановой кислоты, 2(S)-гидроксил-3(R)-карбоксиэтилтио)-3-[2-(8-фенилоктил)фенил]пропановую кислоту, 4-[4-[3-(4-ацетил-3-гидрокси-2-пропилфенокси)пропилсульфонил]фенил]-4-оксобутановую кислоту и 3-(3-(2-(7-хлор-2-хинолинил)этенил)фенил)((3-диметиламино-3-оксопропил)тио)метил)тиопропановую кислоту.
[0014] Примеры антигистаминных средств включают, без ограничений, фексофенадин ((RS)-2-[4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидил]бутил]фенил]-2-метилпропановую кислоту), клемастин ((2R)-2-{2-[(1R)-1-(4-хлорфенил)-1-фенилэтокси]этил}-1-метилпирролидин), дифенгидрамин (2-(дифенилметокси)-N,N-диметилэтанамин), доксиламин [(RS)-N,N-диметил-2-(1-фенил-1-пиридин-2-илэтокси)этанамин], дезлоратадин [8-хлор-6,11-дигидро-11-(4-пиперидинилиден)-5H-бензо[5,6]циклогепта[1,2-b]пиридин], бромфенирамин (3-(4-бромфенил)-N,N-диметил-3-пиридин-2-илпропан-1-амин), хлорфенамин [3-(4-хлорфенил)-N,N-диметил-3-пиридин-2-илпропан-1-амин], фенирамин, фторфенирамин, дексхлорфенирамин (поларамин), десхлорфенирамин, дифенирамин, йодфенирамин, кромоглициевую кислоту (5,5'-(2-гидроксипропан-1,3-диил)бис(окси)бис(4-оксо-4H-хромен-2-карбоновую кислоту), лоратадин [этил-4-(8-хлор-5,6-дигидро-11H-бензо[5,6]циклогепта[1,2-b]пиридин-11-илиден)-1-пиперидинкарбоксилат], акривастин [(E)-3-(6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноевую кислоту], эбастин [4-(4-бензгидрилокси-1-пиперидил)-1-(4-трет-бутилфенил)бутан-1-он], каребастин, прометазин [(RS)-N,N-диметил-1-(10H-фенотиазин-10-ил)пропан-2-амин] и олопатадин [{(11Z)-11-[3-(диметиламино)пропилиден]-6,11-дигидродибензо[b,e]оксепин-2-ил} уксусную кислоту].
[0015] Примеры агонистов β2-адренергических рецепторов включают, без ограничений, альбутерол [(RS)-4-[2-(трет-бутиламино)-1-гидроксиэтил]-2-(гидроксиметил)фенол], левосальбутамол [4-[(1R)-2-(трет-бутиламино)-1-гидроксиэтил]-2-(гидроксиметил)фенол], тербуталин [(RS)-5-[2-(трет-бутиламино)-1-гидроксиэтил]бензол-1,3-диол], пирбутерол [(RS)-6-[2-(трет-бутиламино)-1-гидроксиэтил]-2-(гидроксиметил)пиридин-3-ол], прокатерол [(±)-(1R,2S)-rel-8-гидрокси-5-[1-гидрокси-2-(изопропиламино)бутил]хинолин-2(1H)-он], метапротеренол [(RS)-5-[1-гидрокси-2-(изопропиламино)этил]бензол-1,3-диол], фенотерол [(RR,SS)-5-(1-гидрокси-2-{[2-(4-гидроксифенил)-1-метилэтил]амино}этил)бензол-1,3-диол], битолтерол мезилат [(RS)-[4-(1-гидрокси-2-трет-бутиламиноэтил)-2-(4-метилбензоил)оксифенил]-4-метилбензоат], ритодрин [4-((1R,2S)-1-гидрокси-2-{[2-(4-гидроксифенил)этил]амино}пропил)фенол], салметерол [(RS)-2-(гидроксиметил)-4-{1-гидрокси-2-[6-(4-фетилбутокси)гексиламино]этил} фенол], формотерол [(RS,SR)-N-[2-гидрокси-5-[1-гидрокси-2-[1-(4-метоксифенил)пропан-2-иламино]этил]фенил]формамид], бамбутерол [(RS)-5-[2-(трет-бутиламино)-1-гидроксиэтил]бензол-1,3-диилбис(диметилкарбамат)], кленбутерол [(RS)-1-(4-амино-3,5-дихлорфенил)-2-(трет-бутиламино)этанол] и индакатерол [(R)-5-[2-[(5,6-диэтил-2,3-дигидро-1H-инден-2-ил)амино]-1-гидроксиэтил]-8-гидроксихинолин-2(1H)-он].
[0016] Примеры противовоспалительных лекарственные средств включают, без ограничений, нестероидные противовоспалительные агенты («НПВП», например, аспирин, ибупрофен, дифлунизал и диклофенак).
[0017] Примеры средств от кашля включают, без ограничений, декстрометорфан ((+)-3-метокси-17-метил-(9α,13α,14α)морфинан), типепидин (3-(ди-2-тиенилметилен)-1-метилпиперидин), клоперастин (1-[2-[(4-хлорфенил)фенилметокси]этил]пиперидин), бенпроперин (1-[2-(2-бензилфенокси)-1-метилэтил]пиперидин), диоксопрометазин (9,9-диоксопрометазин), промолат (2-морфолиноэтил-2-фенокси-2-метилпропионат), фоминобен (N-2-хлор-6-бензоиламинобензилметиламиноацетилморфолин) и пентоксиверин (2-[2-(диэтиламино)этокси]этил-1-фенилциклопентанкарбоксилат).
[0018] Примеры противоотечных средств включают, без ограничений, эфедрин [(R,S)-2-(метиламино)-1-фенилпропан-1-ол], левометамфетамин [(R)-N-метил-1-фенилпропан-2-амин], фенилэфрин [(R)-3-[1-гидрокси-2-(метиламино)этил]фенол], пропилгекседрин [(RS)-N,α-диметилциклогексилэтиламин], псевдоэфедрин [(R*,R*)-2-метиламино-1-фенилпропан-1-ол], синефрин [4-[1-гидрокси-2-(метиламино)этил]фенол] и тетрагидрозолин [(RS)-2-(1,2,3,4-тетрагидронафтален-1-ил)-4,5-дигидро-1H-имидазол].
[0019] Примеры антибиотиков включают, без ограничений, бета-лактамные антибиотики, сульфонамиды и хинолоны. Примеры бета-лактамных антибиотиков включают, но не ограничиваются ими, производные пенициллина, цефалоспорины, пенемы, монобактамы, карбапенемы, ингибиторы бета-лактамаз и комбинации указанных соединений. Примеры производных пенициллина включают, но не ограничиваются ими, аминопенициллины (например, амоксициллин, ампициллин и эпициллин); карбоксипенициллины (например, карбенициллин, тикарциллин и темоциллин); уреидопенициллины (например, азлоциллин, пиперациллин и мезлоциллин); мециллинам, сульбенициллин, бензатин пенициллин, пенициллин G (бензилпенициллин), пенициллин V (феноксиметилпенициллин), пенициллин О (аллилмеркаптометилпенициллин), прокаин пенициллин, оксациллин, метициллин, нафциллин, клоксациллин, диклоксациллин, флуклоксациллин, пивампициллин, гетациллин, бекампициллин, метампициллин, талампициллин, коамоксиклав (амоксициллин и клавулановая кислота) и пиперациллин. Примеры цефалоспоринов включают, но не ограничиваются ими, цефалексин, цефалотин, цефазолин, цефаклор, цефуроксим, цефамандол, цефотетан, цефокситин, цефоранид, цефтриаксон, цефотаксим, цефподоксим проксетил, цефтазидим, цефепим, цефоперазон, цефтизоксим, цефиксим и цефпиром. Примеры пенемов включают, без ограничений, фаропенем. Примеры монобактамов включают, без ограничений, атреонам и тигемонам. Примеры карбопенемов включают, но не ограничиваются ими, биапенем, ⋅дорипенем, эртапенем, ⋅имипенем, ⋅меропенем и панипенем. Примеры ингибиторов бета-лактамаз включают, но не ограничиваются ими, тазобактам (натриевую соль 4,4-диоксида [2S-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1H-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты), сульбактам (натриевую соль 4,4-диоксида (2S,5R)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты) и клавулановую кислоту ((2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-азабицикло[3.2.0]гептан-2-карбоновую кислоту). Другие примеры антибиотиков включают, без ограничений, натриевую соль сложного моно-4-нитрофенилового эфира [(N-бензилоксикарбониламино)метил]фосфоновой кислоты, натриевую соль сложного моно-3-пиридинилового эфира [(N-бензилоксикарбониламино)метил]фосфоновой кислоты, сульфаниламид (4-аминобензолсульфонамид), сульфасалазин (6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновую кислоту), 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновую кислоту и налидиксовую кислоту (1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновую кислоту).
[0020] Примеры сульфонамидов включают, без ограничений, сульфаизодимидин, сульфаниламид, сульфадиазин, сульфизоксазол, сульфаметоксазол, сульфадиметоксин, сульфаметоксипиридазин, сульфацетамид, сульфадоксин, ацетазоламид, буметанид, хлорталидон, клопамид, фуросемид, гидрохлортиазид, индапамид, мефрузид, метолазон, ксипамид, дихлорфенамид, дорзоламид, ацетазоламид, этоксзоламид, сультиам, зонисамид, мафенид, целекоксиб, дарунавир, пробенецид, сульфасалазин и суматриптан.
[0021] Примеры хинолонов включают, без ограничений, циноксацин, флумехин, налидиксовую кислоту, оксолиновую кислоту, пиромидовую кислоту, пипемидовую кислоту, росоксацин, ципрофлоксацин, эноксацин, флероксацин, ломефлоксацин, надифлоксацин, норфлоксацин, офлоксацин, пефлоксацин, руфлоксацин, балофлоксацин, гатифлоксацин, грепафлоксацин, левофлоксацин, моксифлоксацин, пазуфлоксацин, спарфлоксацин, темафлоксацин, тосуфлоксацин, клинафлоксацин, гемифлоксацин, ситафлоксацин, тровафлоксацин, прулифлоксацин, гареноксацин, эцинофлоксацин, делафлоксацин и налидиксовую кислоту.
[0022] Транспортный фрагмент
[0023] Транспортный фрагмент в составе НРР содержит протонируемую аминогруппу, которая способна облегчать прохождение НРР через один или более биологических барьеров (например, по сравнению с исходным лекарственным средством быстрей > примерно в 20 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 300 раз, > примерно в 500 раз, > примерно в 1000 раз или более). В некоторых вариантах реализации протонируемая аминогруппа протонируется по существу при физиологическом значении pH. В некоторых вариантах реализации аминогруппа может являться обратимно протонируемой. В некоторых вариантах реализации звено-носитель может отщепляться или не отщепляться от функционального звена после того, как НРР проходит через один или более биологических барьеров.
[0024] В некоторых вариантах реализации функциональный фрагмент также может содержать один или более транспортных фрагментов, особенно в случае исходных лекарственных средств, содержащих по меньшей мере свободную аминогруппу. В некоторых вариантах реализации, если функциональный фрагмент содержит один или более транспортный фрагмент, функциональный фрагмент модифицируют таким образом, чтобы только одна или две группы являлись протонируемыми. В некоторых вариантах реализации функциональный фрагмент содержит одну или две аминогруппы. Указанные функциональные фрагменты могут быть модифицированы или могут быть применены в качестве НРС без дополнительных превращений. Примеры соединений, содержащих одну или две аминогруппы, включают, без ограничений, фенирамин, фторфенирамин, хлорфенирамин, дексхлорфенирамин (поларамин), десхлорфенирамин, дифенирамин, йодфенирамин, альбутерол, левосальбутамол, пирбутерол, прокатерол, битолтерол мезилат, ритодрин, салметерол, формотерол, бамбутерол, кленбутерол и индакатерол.
[0025] В некоторых вариантах реализации протонируемая аминогруппа выбрана из группы, состоящей из фармацевтически приемлемых замещенных и незамещенных аминогрупп, структуры W-1, структуры W-2, структуры W-3, структуры W-4, структуры W-5, структуры W-6, структуры W-7, структуры W-8, структуры W-9, структуры W-10, структуры W-11, структуры W-12, структуры W-13, структуры W-14, структуры W-15, структуры W-16, структуры W-17 и структуры W-18:
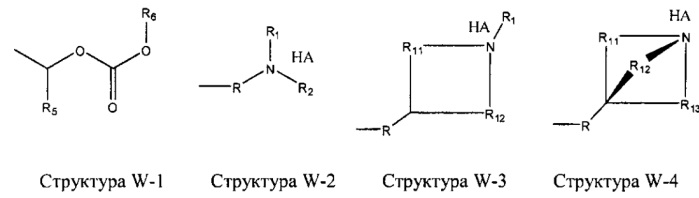
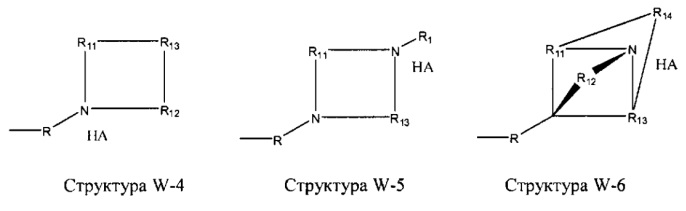
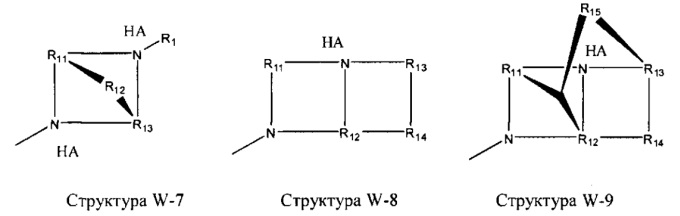
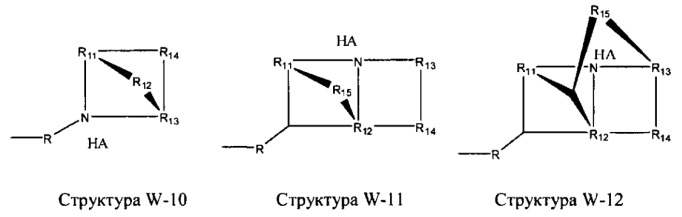

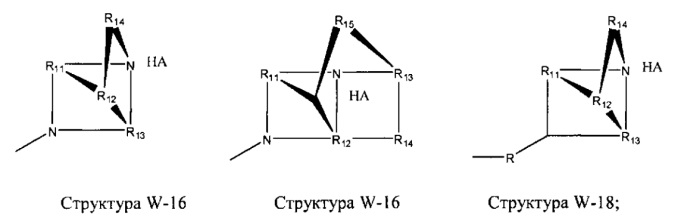
включая стереоизомеры и фармацевтически приемлемые соли указанных структур.
[0026] Если не указано иное, HA отсутствует или выбран из группы, состоящей из фармацевтически приемлемых кислот, например, соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, азотной кислоты, сульфокислоты, дисульфокислоты, фосфорной кислоты, фосфористой кислоты, фосфоновой кислоты, изоникотиновой кислоты, уксусной кислоты, молочной кислоты, салициловой кислоты, лимонной кислоты, винной кислоты, пантотеновой кислоты, дивинной кислоты, аскорбиновой кислоты, янтарной кислоты, малеиновой кислоты, гентизиновой кислоты, фумаровой кислоты, глюконовой кислоты, глюкароновой кислоты, сахаристой кислоты, муравьиной кислоты, бензойной кислоты, глутаминовой кислоты, метансульфоновой кислоты, этансульфоновой кислоты, бензолсульфоновой кислоты, н-толуолсульфоновой кислоты и памовой кислоты;
R отсутствует или выбран из группы, состоящей из CH2C(=O)OR6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила, где любой СН2 в R может быть дополнительно заменен на О, S, Р, NR6 или любую другую фармацевтически приемлемую группу;
R6 независимо выбран из группы, состоящей из Н, F, Cl, Br, I, Na+, K+, C(=O)R5, 2-оксо-1-имидазолидинила, фенила, 5-инданила, 2,3-дигидро-1H-инден-5-ила, 4-гидрокси-1,5-нафтиридин-3-ила, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного алкилоксила, замещенного и незамещенного циклоалкилоксила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила, -C(=O)-W, -L1-L4-L2-W и W;
R5 независимо выбран из группы, состоящей из Н, C(=O)NH2, CH2CH2OR6, CH2CH2N(CH3)2, CH2CH2N(CH2CH3)2, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного циклоалкилоксила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкилкарбонила, замещенного и незамещенного алкиламино, -C(=O)-W, L1-L4-L2-W и W;
L1 отсутствует или выбран из группы, состоящей из О, S, -O-L3-, -S-L3-, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -О-СН2-О-, -O-CH(L3)-O и -S-CH(L3)-O-;
L2 отсутствует или выбран из группы, состоящей из О, S, -O-L3-, -S-L3-, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -О-СН2-O-, -O-CH(L3)-O, -S-CH(L3)-O-, -O-L3-, -N-L3-, -S-L3-, -N(L3)-L5- и L3;
L4 отсутствует или выбран из группы, состоящей из C=O, C=S,
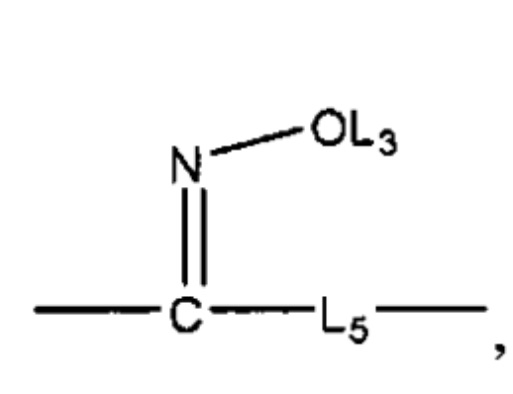
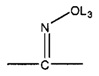 и
и 
для каждого из L1, L2 и L4 каждый из L3 и L5 независимо отсутствует или выбран из группы, состоящей из Н, CH2C(=O)OL6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой из атомов углерода или водорода может быть дополнительно заменен на О, S, Р, NL3 или любую другую фармацевтически приемлемую группу;
каждый из L6 и каждый из L7 независимо выбран из группы, состоящей из Н, OH, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой из атомов углерода или водорода может быть дополнительно заменен на О, S, N, P(O)OL6, CH=СН, С=С, CHL6, CL6L7, арил, гетероарил или циклическую группу;
W выбран из группы, состоящей из Н, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилокси, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, протонируемой аминогруппы, фармацевтически приемлемых замещенных и незамещенных аминогрупп, структуры Wa, структуры W-1, структуры W-2, структуры W-3, структуры W-4, структуры W-5, структуры W-6, структуры W-7, структуры W-8, структуры W-9, структуры W-10, структуры W-11, структуры W-12, структуры W-13, структуры W-14, структуры W-15, структуры W-16, структуры W-17 и структуры W-18;
R1 и R2 независимо выбраны из группы, состоящей из Н, фрагментов замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила;
R11-R15 независимо отсутствуют или выбраны из группы, состоящей из Н, CH2C(=O)OR11, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила; и
любая из групп CH2 может быть заменена на О, S или NH.
[0027] Линкерная группа
[0028] В некоторых вариантах реализации, линкерная группа ковалентно связывающая функциональный фрагмент с транспортным фрагментом в НРР, содержит связь, способную расщепляться после того, как НРР проходит через один или более биологических барьеров. Расщепляемая связь включает, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложную эфирную, сложную тиоэфирную, карбонатную, карбаматную, фосфатную или оксимную связи.
[0029] Структуры HPP
[0030] НРР исходного лекарственного средства или родственного соединения исходного лекарственного средства имеет следующую структуру L-1:
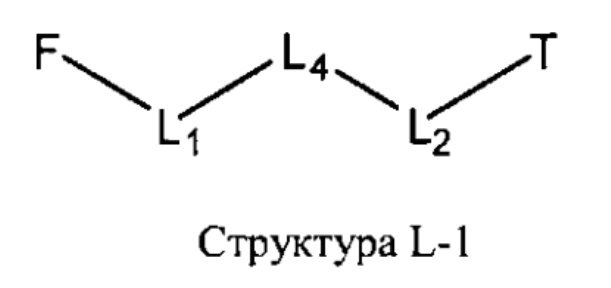
включая стереоизомеры и фармацевтически приемлемые соли указанной структуры;
F представляет собой функциональный фрагмент, например, выбранный из группы, состоящей из антигистаминных средств, агонистов β2-адренергических рецепторов, ингибиторов белка, активирующего 5-липоксигеназу (FLAP), ингибиторов 5-липоксигеназы, антагонистов рецепторов лейкотриена, противовоспалительных лекарственных средств, средств от кашля, противоотечных средств и антибиотиков;
Т представляет собой транспортный фрагмент, например, выбранный из группы, состоящей из протонируемых аминогрупп, фармацевтически приемлемых замещенных и незамещенных первичных аминогрупп, фармацевтически приемлемых замещенных и незамещенных вторичных аминогрупп и фармацевтически приемлемых замещенных и незамещенных третичных аминогрупп, структуры W-1, структуры W-2, структуры W-3, структуры W-4, структуры W-5, структуры W-6, структуры W-7, структуры W-8, структуры W-9, структуры W-10, структуры W-11, структуры W-12, структуры W-13, структуры W-14, структуры W-15, структуры W-16, структуры W-17 и структуры W-18, определенных выше;
L1, L2 и L4 являются такими, как определено выше, в некоторых вариантах реализации -L1-L4-L2- отсутствует или выбран из группы, состоящей из -O-, -X-, -O-X-, -N-X-, -S-X-, -Х5-, -O-X5-, -N-X5-, -S-X5-, -О-Х7-, -O-С(=O)-, -NH-C(=O)-, -С(=O)-, -С(=O)-O-, -C(=O)-N- и C(=O)-Х-;
X отсутствует или выбран из группы, состоящей из C(=O), OC(=O), СН2, СН, S, NH, NR6 и О;
Х5 отсутствует или выбран из группы, состоящей из С(=O), C(=S), ОС(=O), СН2, СН, S, О и NR5; и
Х7 отсутствует или выбран из группы, состоящей из С(=O), C(=S), OC(=O), CH2, СН, S, О и NR5.
[0031] НРР исходного лекарственного средства, которое может быть применено для лечения состояний легких (например, астмы, инфекций нижних и верхних дыхательных путей, хронического бронхита, хронического обструктивного заболевания легких, эмфиземы, кистозного фиброза, пневмонии, саркоидоза и фиброза легких), или его родственного соединения содержит, например, структуру, выбранную из группы, состоящей из структуры FLAP-1, структуры FLAP-2, структуры FLAP-3, структуры FLAP-4, структуры FLAP-5, структуры FLAP-6, структуры 5-LI-1-, структуры 5-LI-2, структуры 5-LI-3, структуры 5-LI-4, структуры 5-LI-5, структуры 5-LI-6, структуры 5-LI-7, структуры 5-LI-8, структуры LRA-1, структуры LRA-2, структуры LRA-3, структуры LRA-4, структуры LRA-5, структуры LRA-6, структуры ARA-1, структуры ARA-2, структуры ARA-3, структуры ARA-4, структуры ARA-5, структуры ARA-6, структуры ARA-7, структуры ARA-8, структуры ARA-9, структуры ARA-10, структуры ARA-11, структуры ARA-12, структуры ARA-13, структуры ARA-14, структуры АН-1, структуры АН-2, структуры АН-3, структуры АН-4, структуры АН-5, структуры АН-6, структуры АН-7, структуры АН-8, структуры АН-9, структуры АН-10, структуры АН-11, структуры АН-12, структуры АН-13, структуры АН-14, структуры АН-15, структуры АН-16, структуры АН-17, структуры АН-18, структуры АН-19, структуры АН-20, структуры CS-1, структуры CS-2, структуры CS-3, структуры CS-4, структуры CS-5, структуры CS-6, структуры CS-7, структуры CS-8, структуры DEC-1, структуры DEC-2, структуры DEC-3, структуры DEC-4, структуры DEC-5, структуры DEC-6, структуры NSAID-1, структуры NSAID-2, структуры NSAID-3, структуры NSAID-4, структуры NSAID-5, структуры NSAID-6, структуры NSAID-7, структуры NSAID-8, структуры NSAID-9, структуры NSAID-10, структуры NSAID-11, структуры NSAID-12, структуры NSAID-13 и структуры АВ-1:
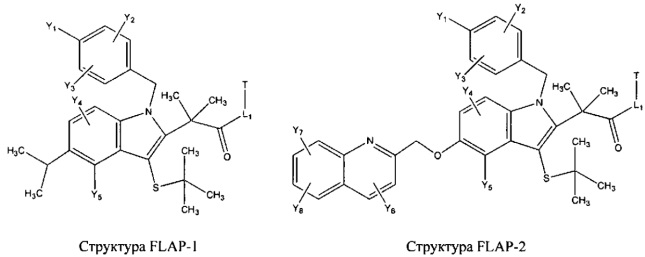
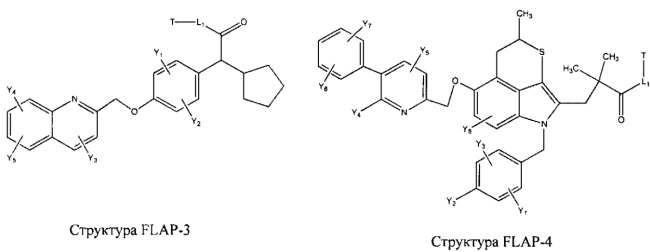
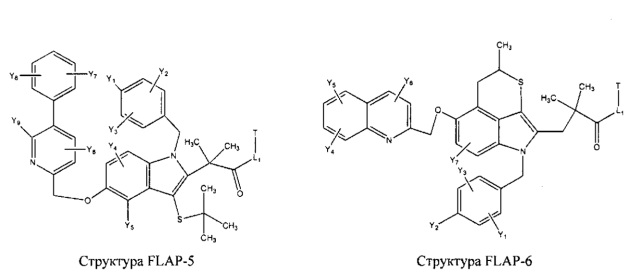
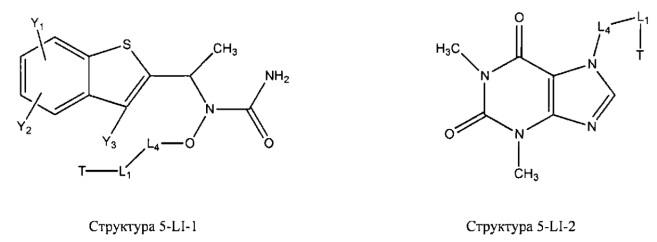
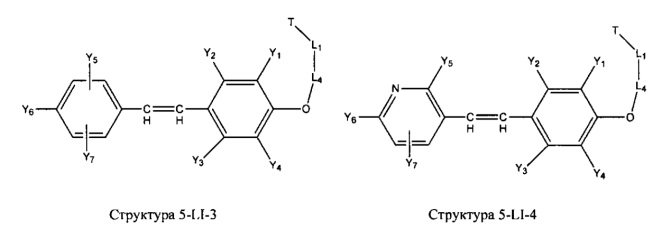
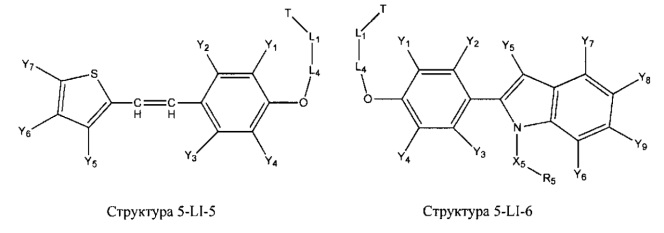
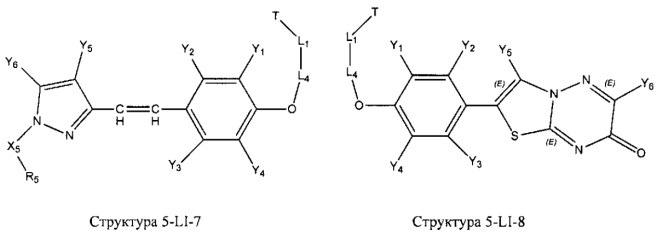
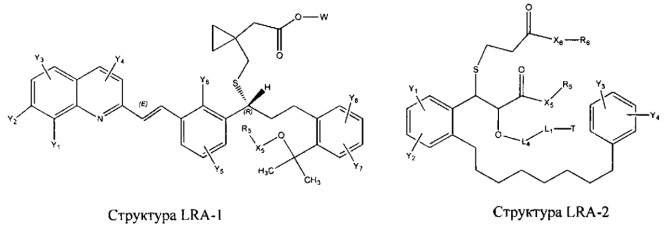
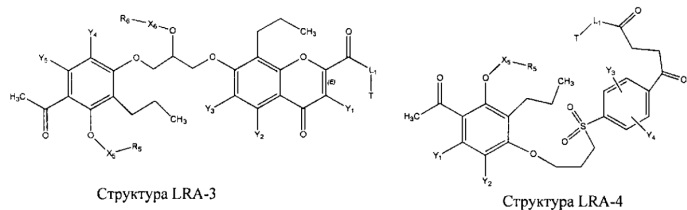
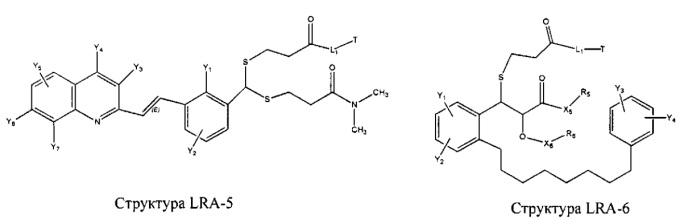
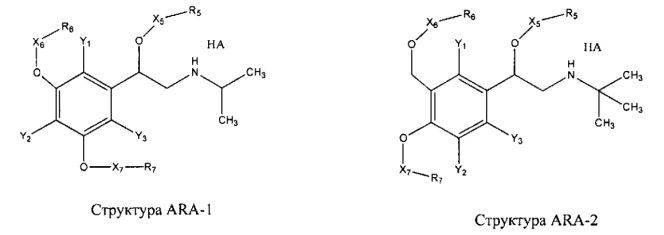
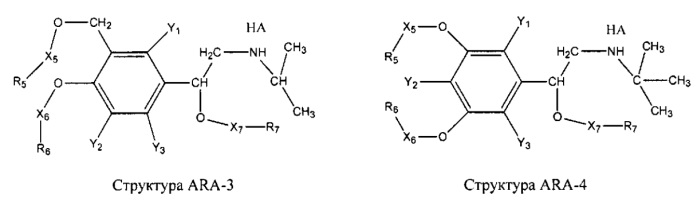
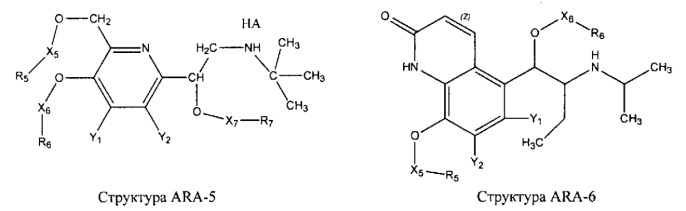
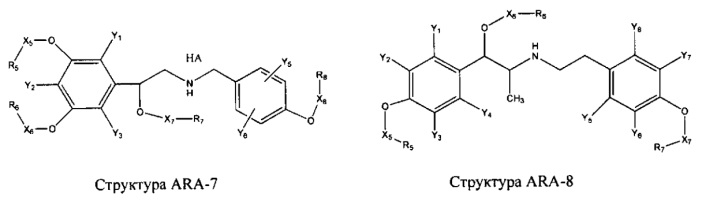
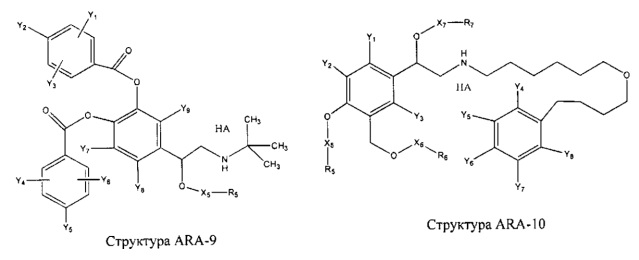
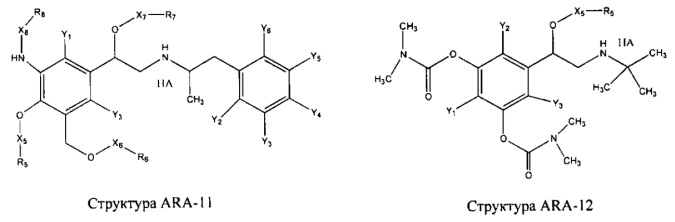
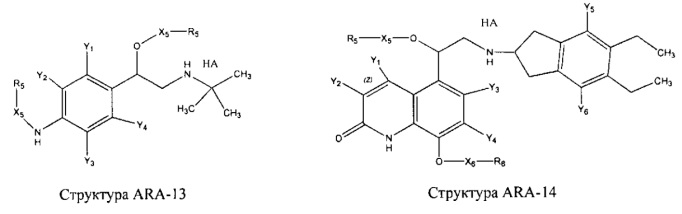
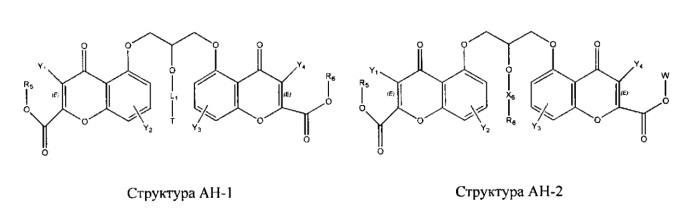
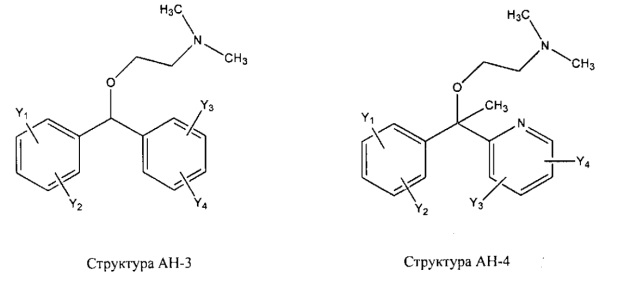
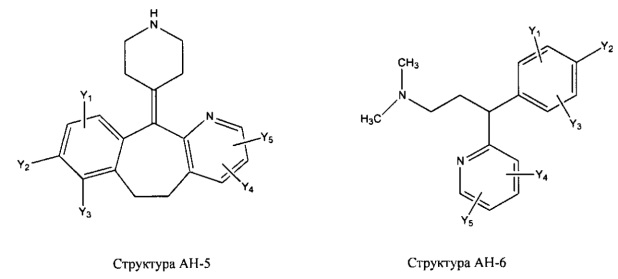
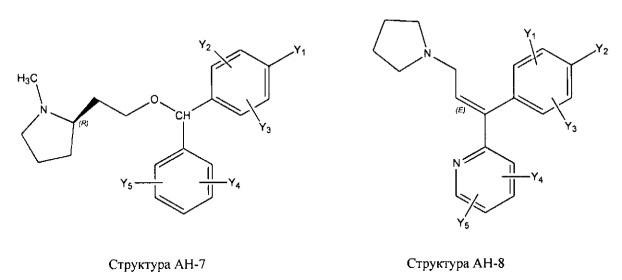
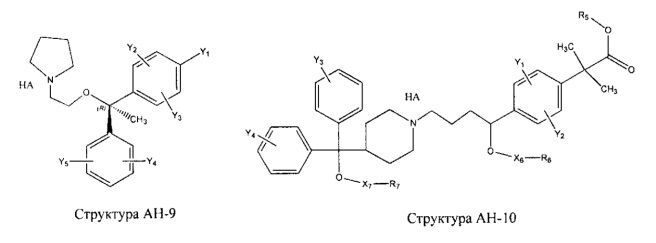
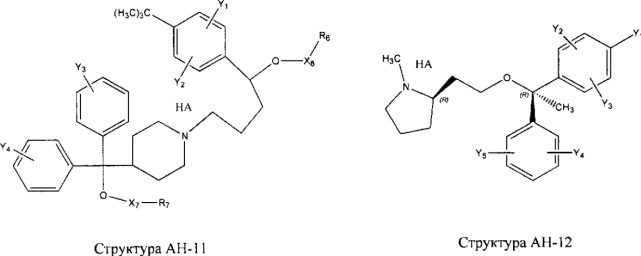
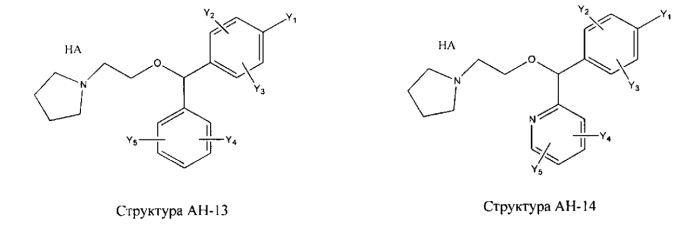
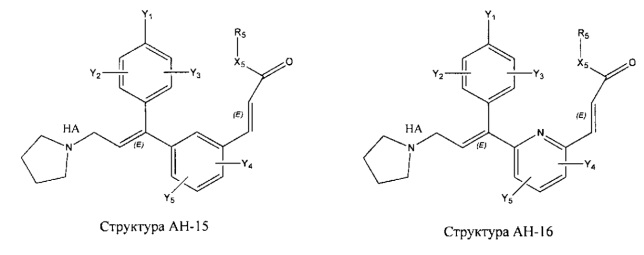
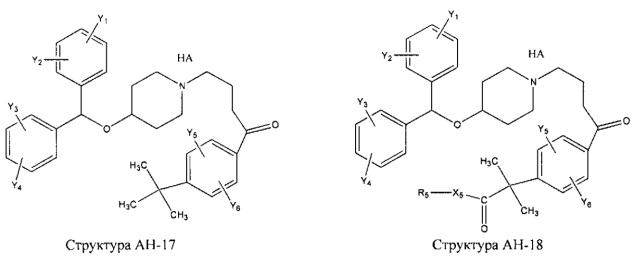
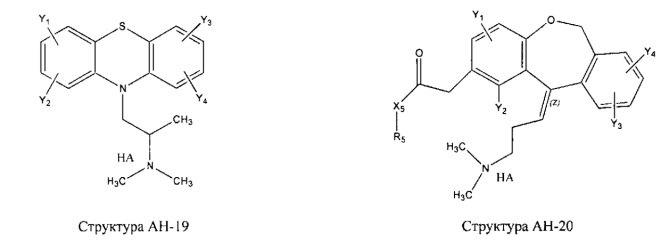
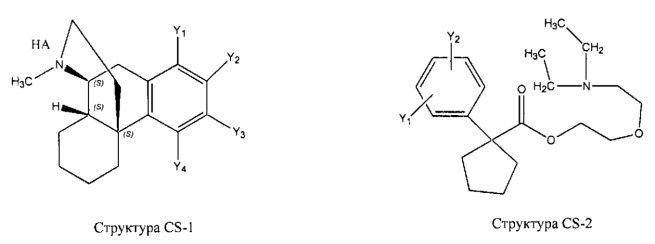
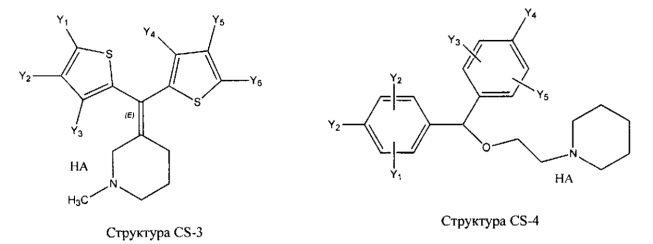
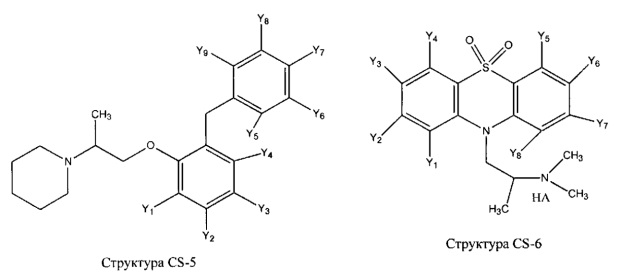
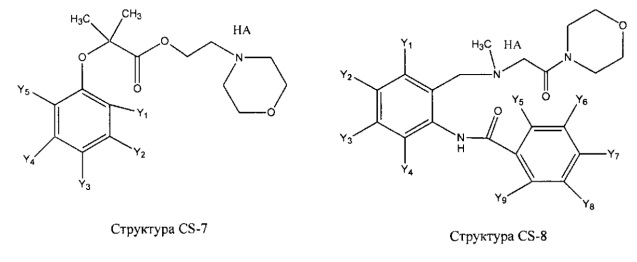
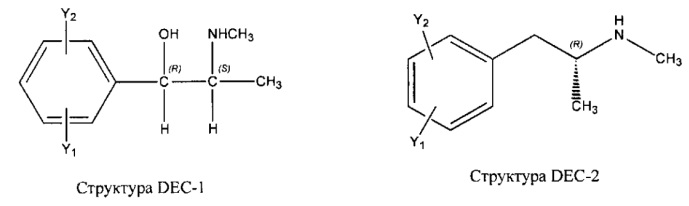
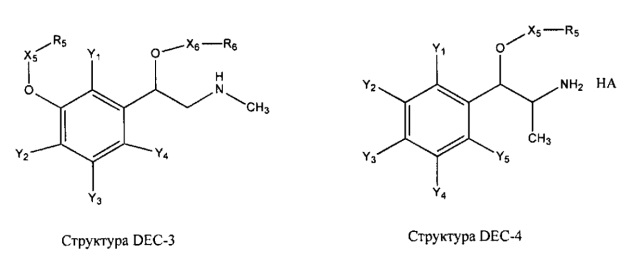
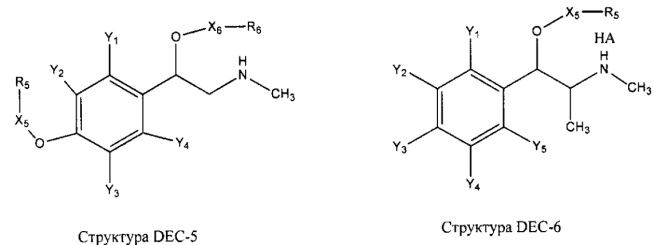
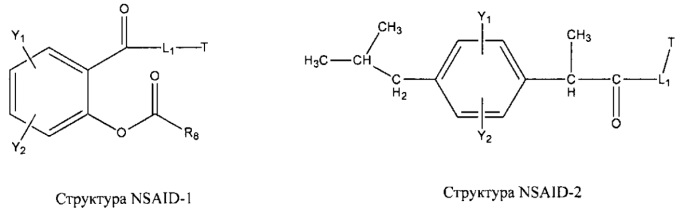
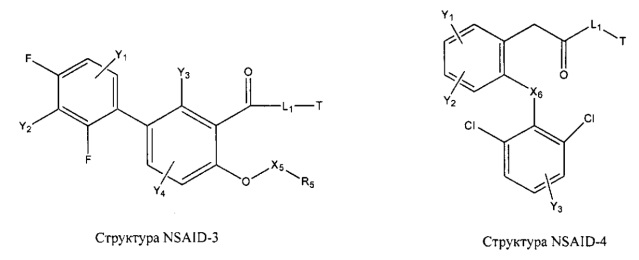
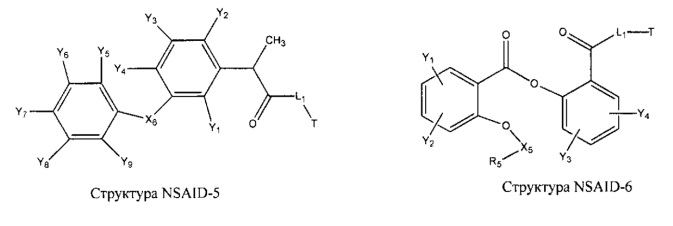
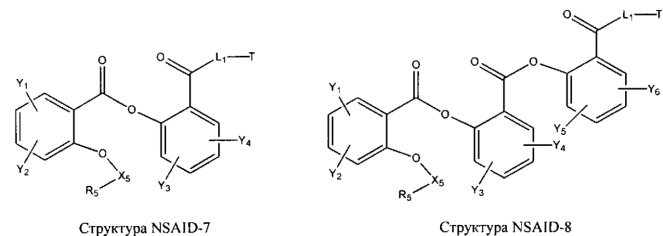
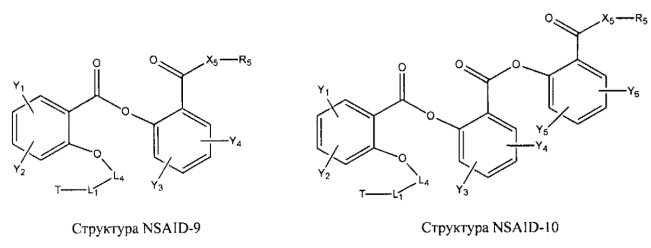
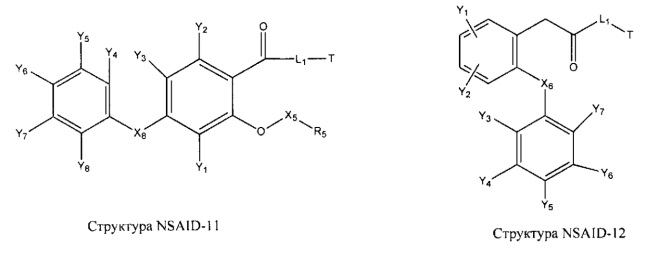

включая стереоизомеры и фармацевтически приемлемые соли указанных структур;
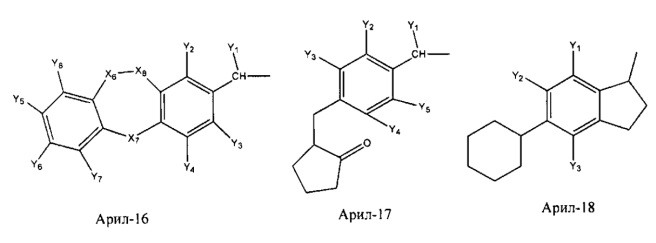
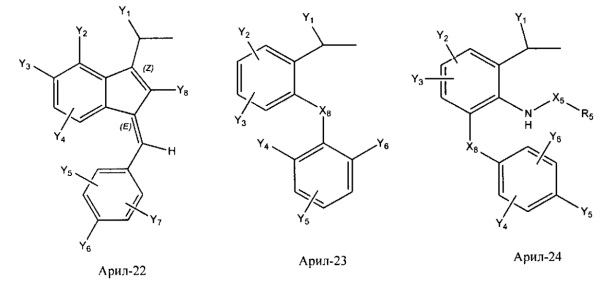
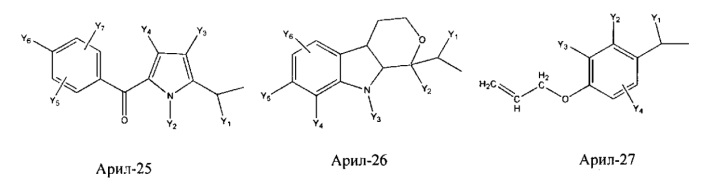
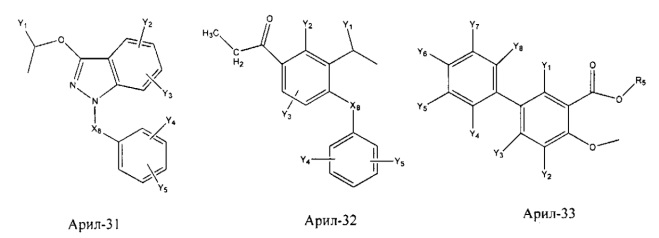
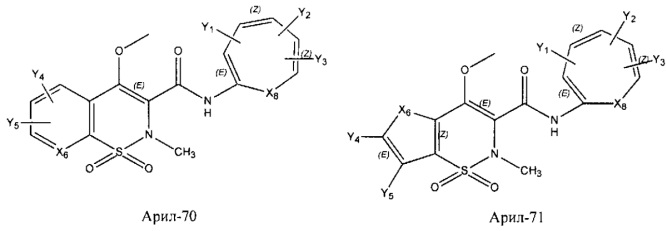
Арил- представляет собой функциональное звено в НРР противовоспалительного лекарственного средства или родственного соединения противовоспалительного лекарственного средства, и примеры арила- включают, без ограничений, арил-1, арил-2, арил-3, арил-4, арил-5, арил-6, арил-7, арил-8, арил-9, арил-10, арил-11, арил-12, арил-13, арил-14, арил-15, арил-16, арил-17, арил-18, арил-19, арил-20, арил-21, арил-22, арил-23, арил-24, арил-25, арил-26, арил-27, арил-28, арил-29, арил-30, арил-31, арил-32, арил-33, арил-34, арил-35, арил-36, арил-37, арил-38, арил-39, арил-40, арил-41, арил-42, арил-43, арил-44, арил-45, арил-46, арил-47, арил-48, арил-49, арил-50, арил-51, арил-52, арил-53, арил-54, арил-55, арил-56, арил-57, арил-58, арил-59, арил-60, арил-61, арил-62, арил-63, арил-64, арил-65, арил-66, арил-67, арил-68, арил-69, арил-70 и арил-71:

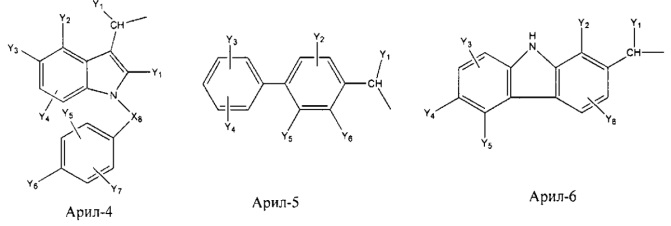
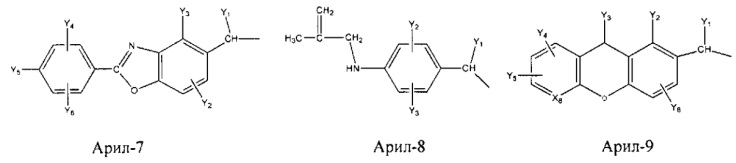
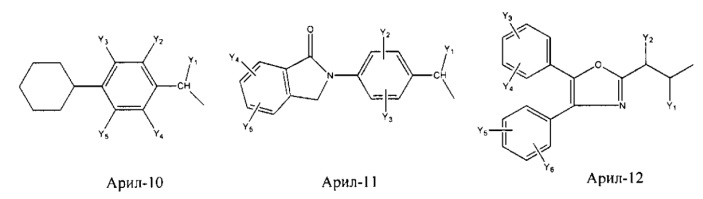
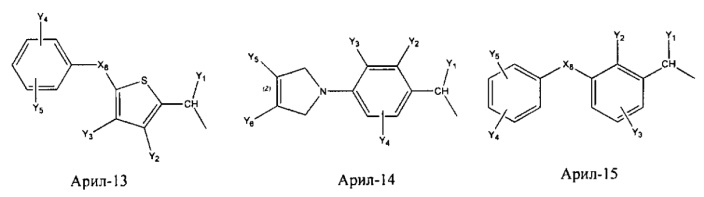


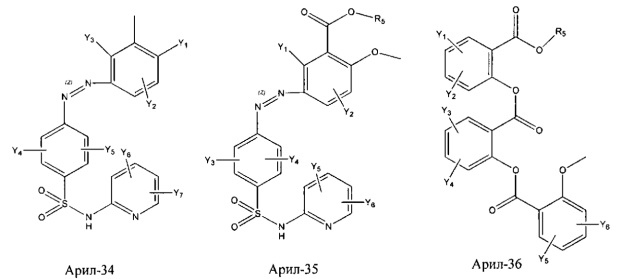
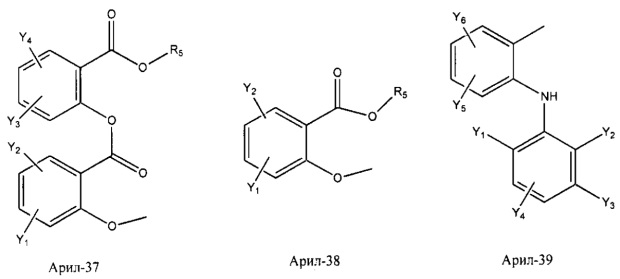
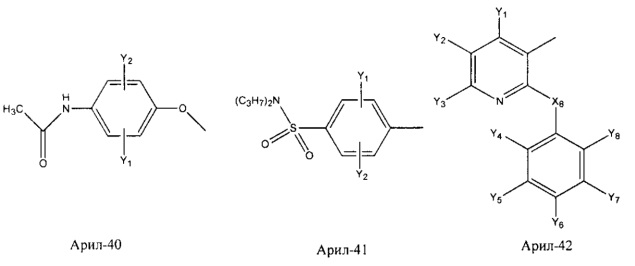
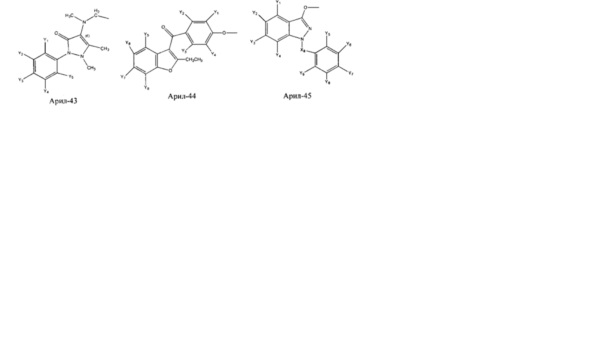
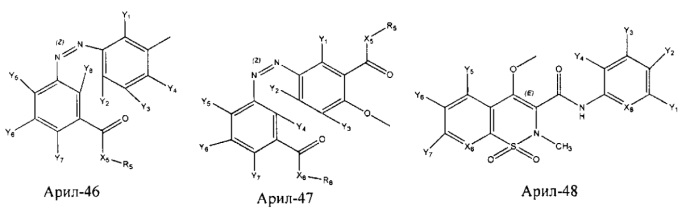
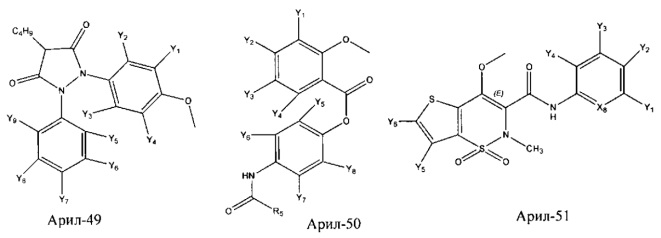
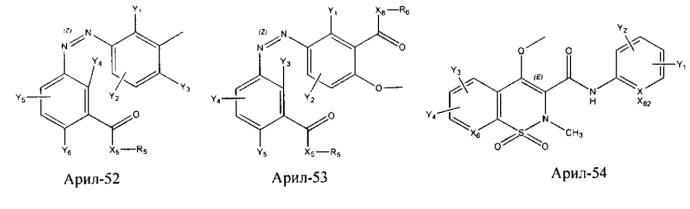
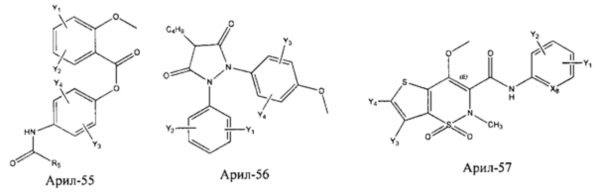
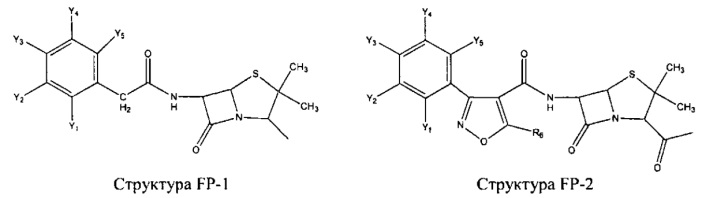
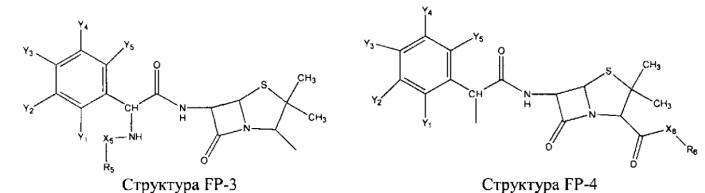
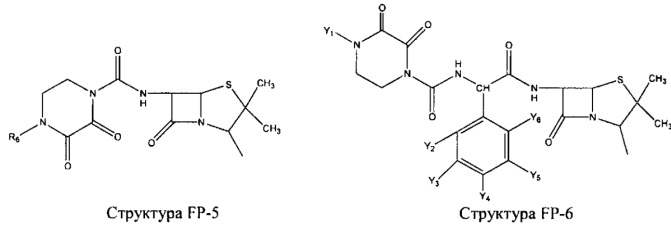
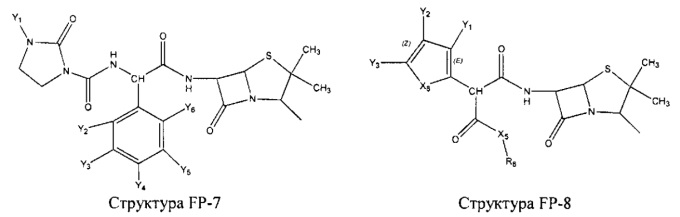
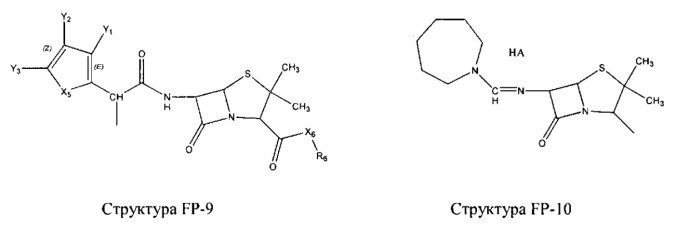
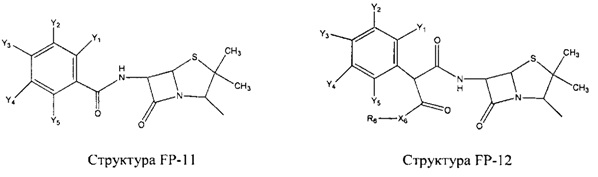
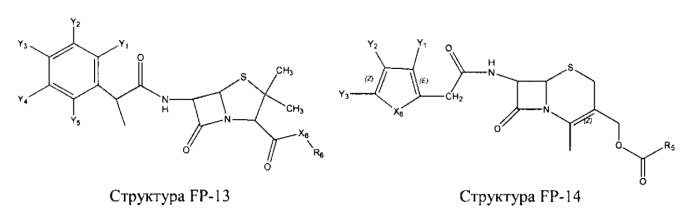
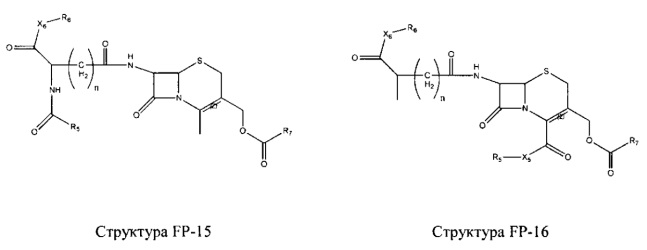
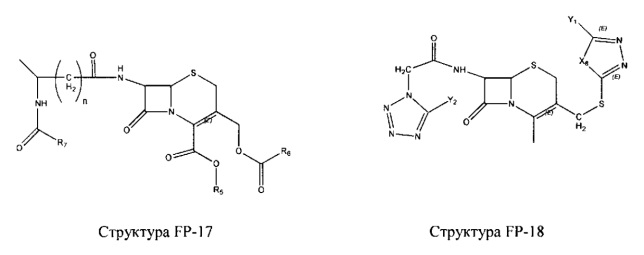
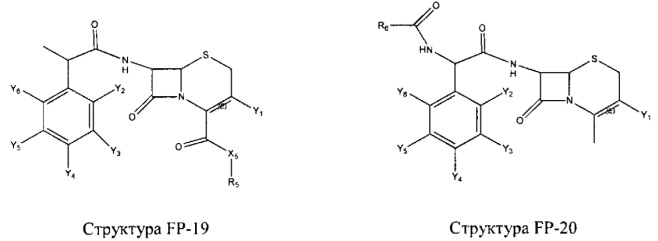
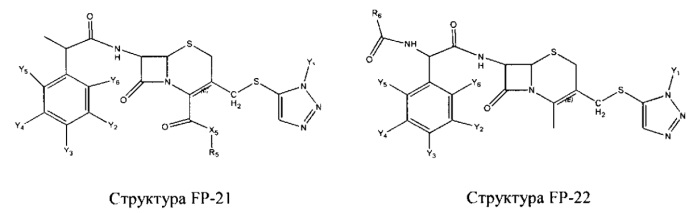
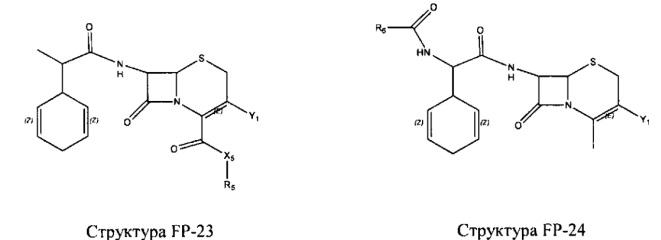
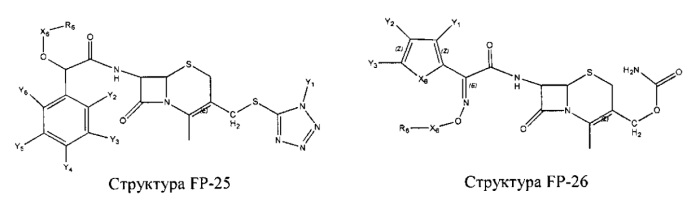
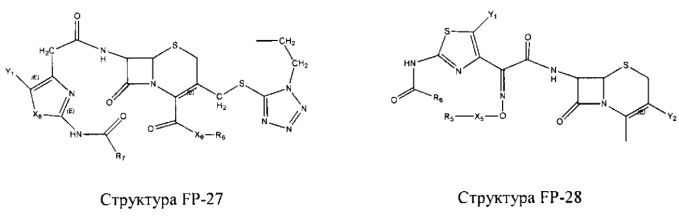
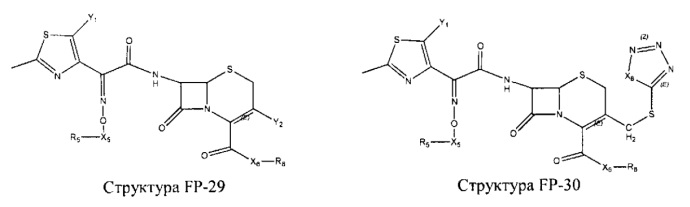
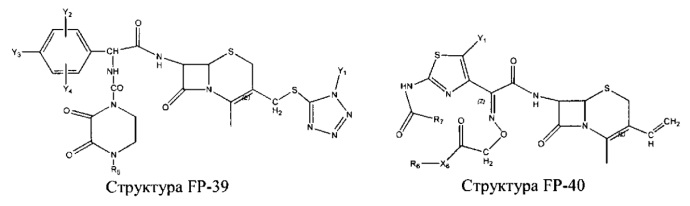
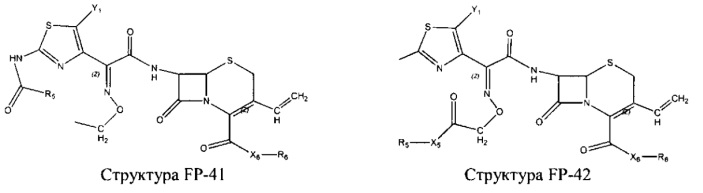
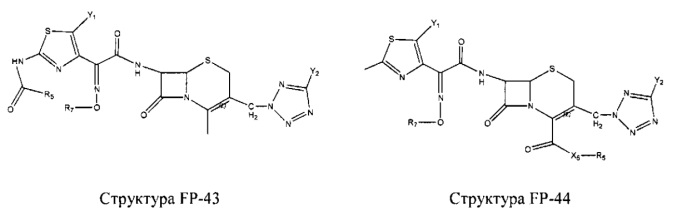
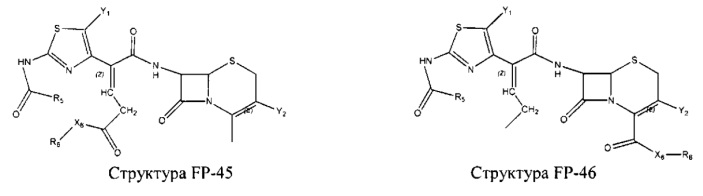
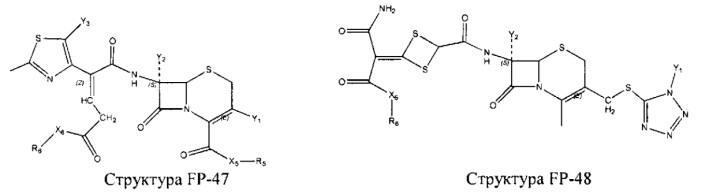
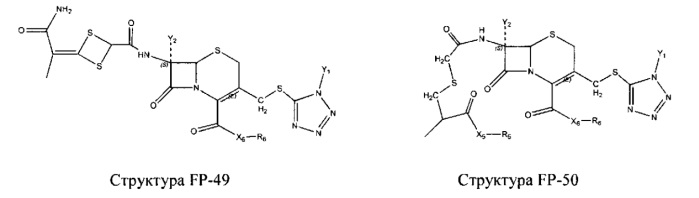
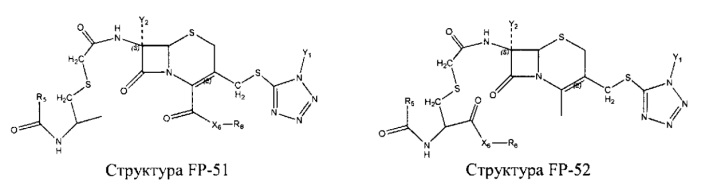
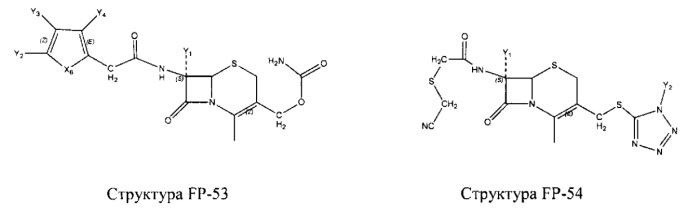
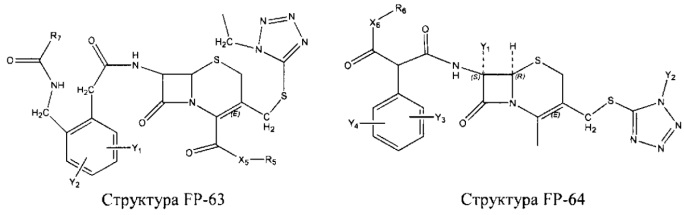
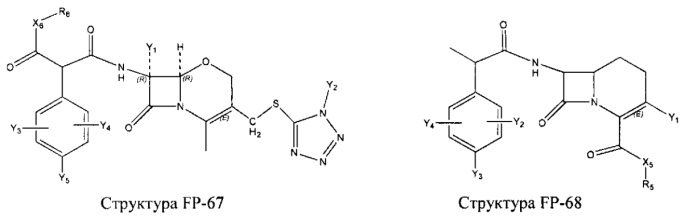
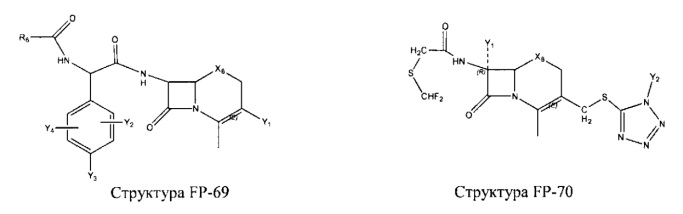
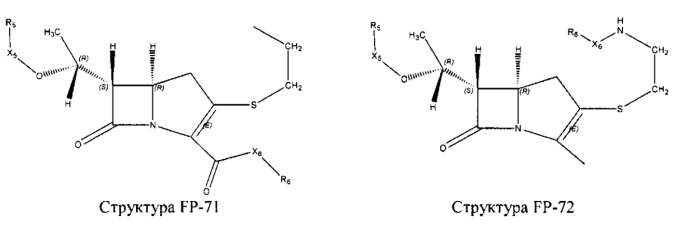
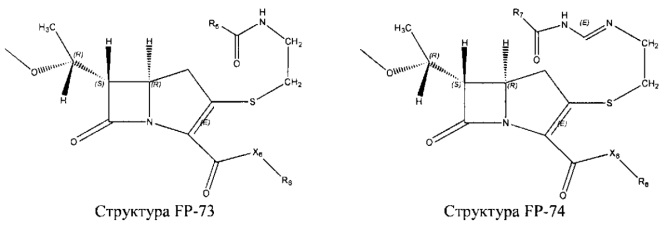
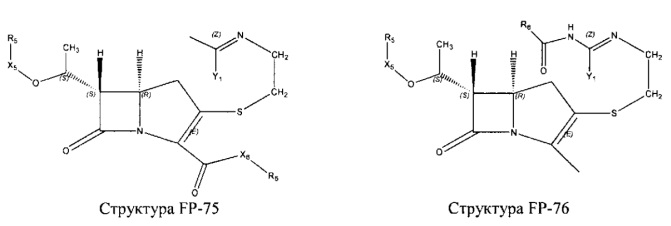
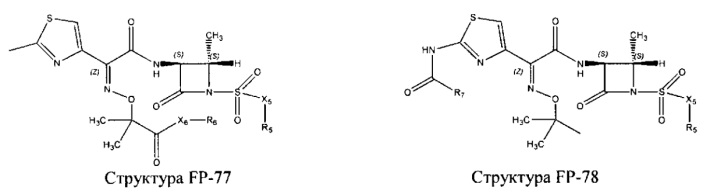
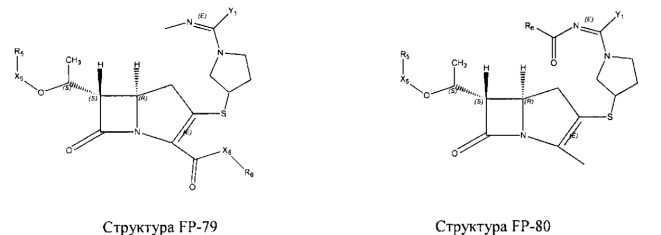
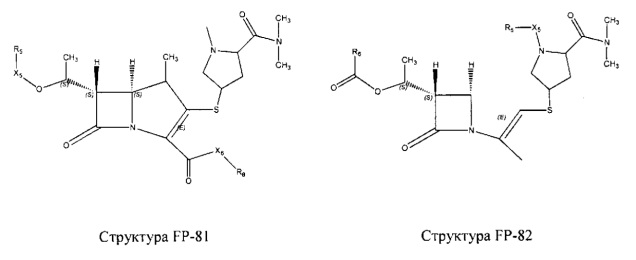
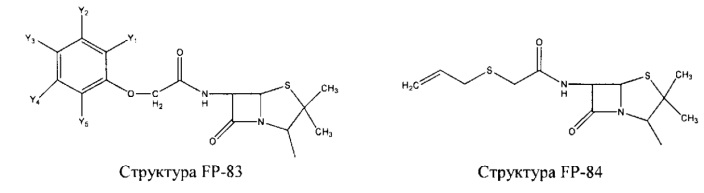
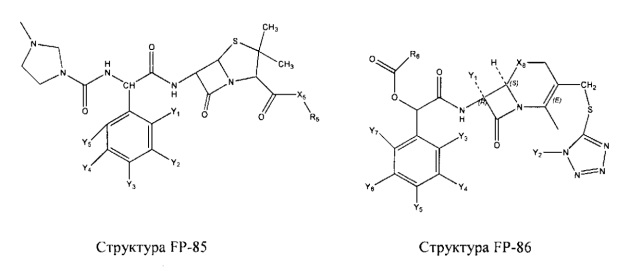
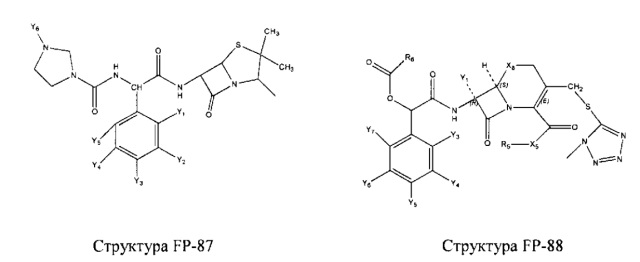
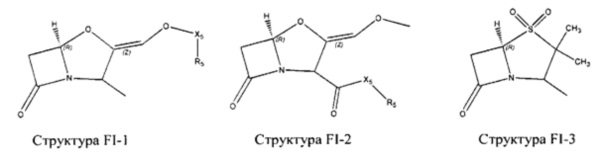
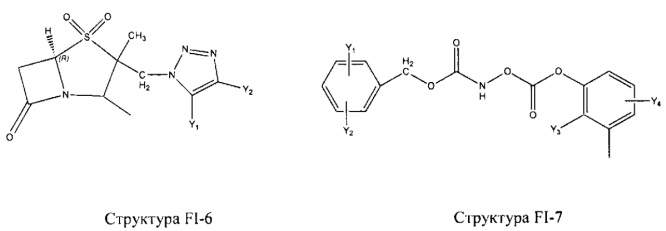
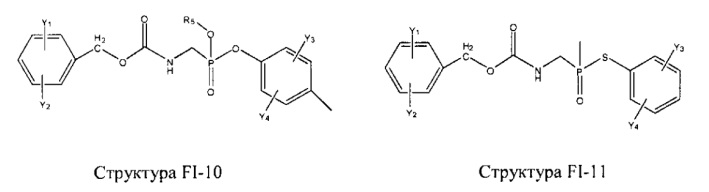
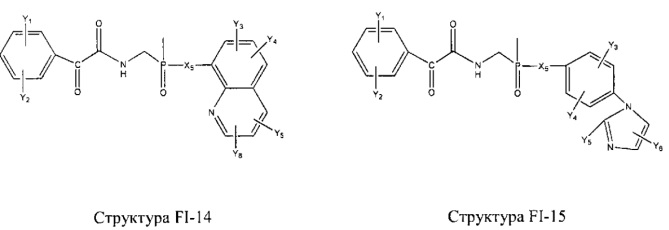
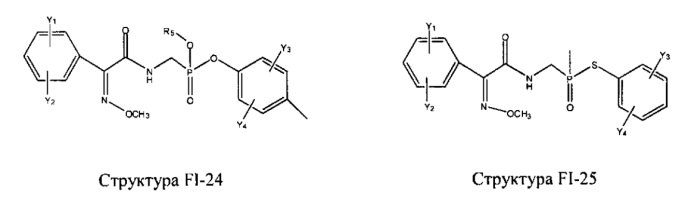
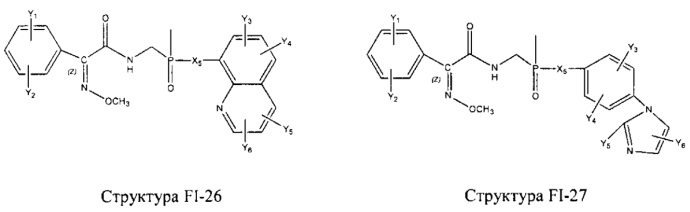
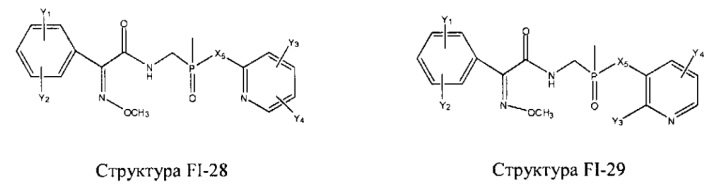
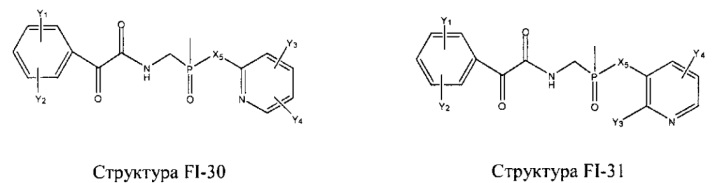
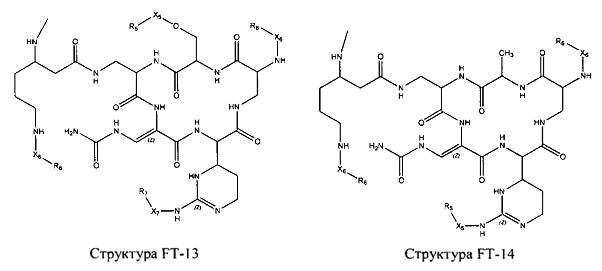
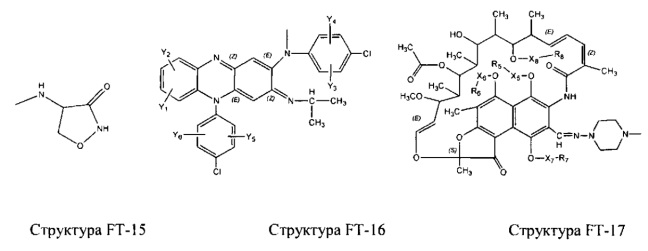
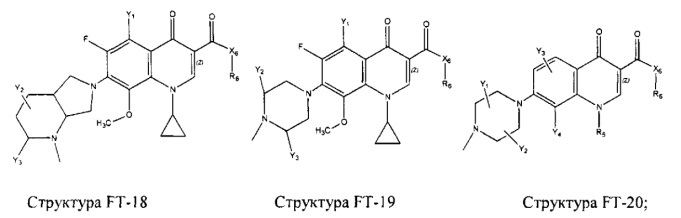
Fab представляет собой функциональное звено в НРР противомикробного лекарственного средства или родственного соединения противомикробного лекарственного средства, и примеры Fab включают, без ограничений, структуру FP-1, структуру FP-2, структуру FP-3, структуру FP-4, структуру FP-5, структуру FP-6, структуру FP-7, структуру FP-8, структуру FP-9, структуру FP-10, структуру FP-11, структуру FP-12, структуру FP-13, структуру FP-14, структуру FP-15, структуру FP-16, структуру FP-17, структуру FP-18, структуру FP-19, структуру FP-20, структуру FP-21, структуру FP-22, структуру FP-23, структуру FP-24, структуру FP-25, структуру FP-26, структуру FP-27, структуру FP-28, структуру FP-29, структуру FP-30, структуру FP-31, структуру FP-32, структуру FP-33, структуру FP-34, структуру FP-35, структуру FP-36, структуру FP-37, структуру FP-38, структуру FP-39, структуру FP-40, структуру FP-41, структуру FP-42, структуру FP-43, структуру FP-44, структуру FP-45, структуру FP-46, структуру FP-47, структуру FP-48, структуру FP-49, структуру FP-50, структуру FP-51, структуру FP-52, структуру FP-53, структуру FP-54, структуру FP-55, структуру FP-56, структуру FP-57, структуру FP-58, структуру FP-59, структуру FP-60, структуру FP-61, структуру FP-62, структуру FP-63, структуру FP-64, структуру FP-65, структуру FP-66, структуру FP-67, структуру FP-68, структуру FP-69, структуру FP-70, структуру FP-71, структуру FP-72, структуру FP-73, структуру FP-74, структуру FP-75, структуру FP-76, структуру FP-77, структуру FP-78, структуру FP-79, структуру FP-80, структуру FP-81, структуру FP-82, структуру FP-83, структуру FP-84, структуру FP-85, структуру FP-86, структуру FP-87, структуру FP-88, структуру FI-1, структуру FI-2, структуру FI-3, структуру FI-4, структуру FI-5, структуру FI-6, структуру FI-7, структуру FI-8, структуру FI-9, структуру FI-10, структуру FI-11, структуру FI-12, структуру FI-13, структуру FI-14, структуру FI-5, структуру FI-16, структуру FI-17, структуру FI-18, структуру FI-19, структуру FI-20, структуру FI-21, структуру FI-22, структуру FI-23, структуру FI-24, структуру FI-25, структуру FI-26, структуру FI-27, структуру FI-28, структуру FI-29, структуру FI-30, структуру FI-31, структуру FI-32, структуру FI-33, структуру FS-1, структуру FS-2, структуру FS-3, структуру FS-4, структуру FS-5, структуру FS-6, структуру FS-7, структуру FS-8, структуру FS-9, структуру FS-10, структуру FS-11, структуру FS-12, структуру FS-13, структуру FS-14, структуру FS-15, структуру FS-16, структуру FS-17, структуру FS-18, структуру FS-19, структуру FS-20, структуру FT-1, структуру FT-2, структуру FT-3, структуру FT-4, структуру FT-5, структуру FT-6, структуру FT-7, структуру FT-8, структуру FT-9, структуру FT-10, структуру FT-11, структуру FT-12, структуру FT-13, структуру FT-14, структуру FT-15, структуру FT-16, структуру FT-17, структуру FT-18, структуру FT-19 и структуру FT-20:
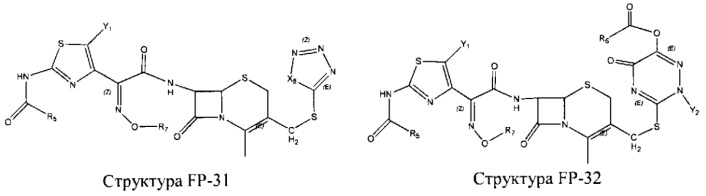
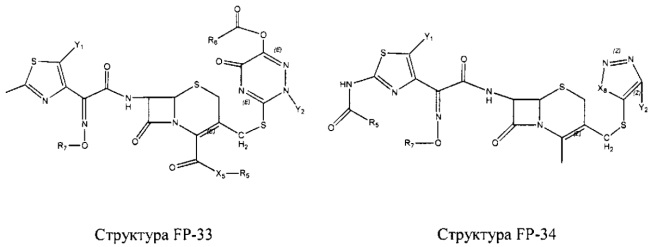
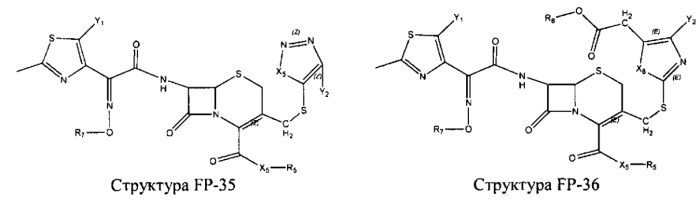
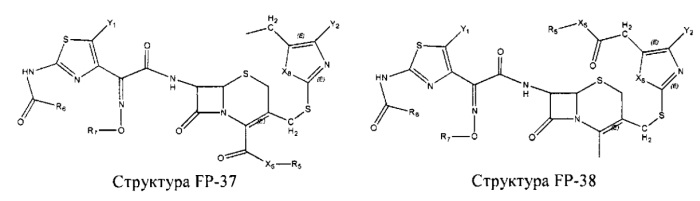
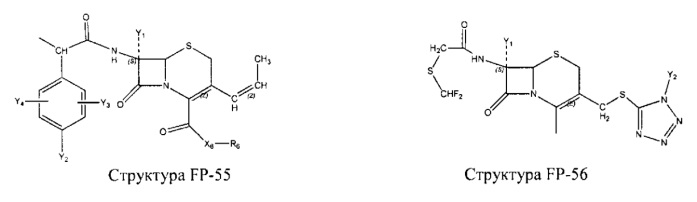
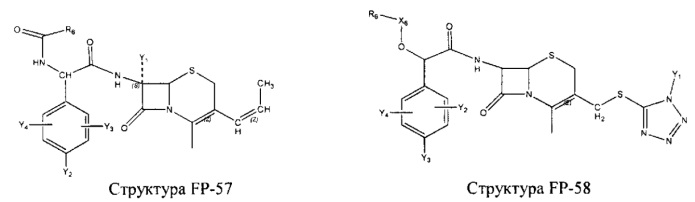
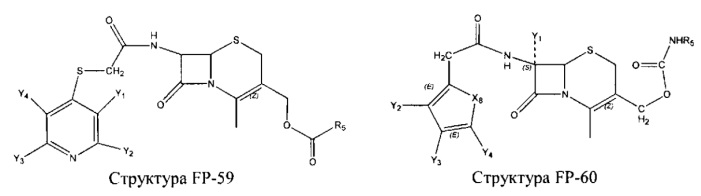
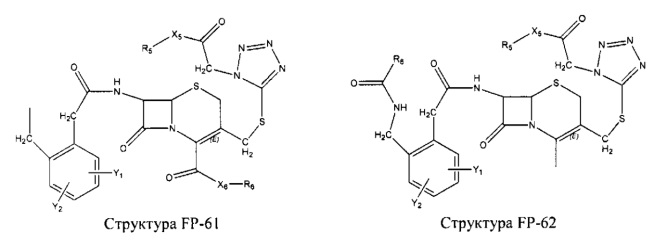




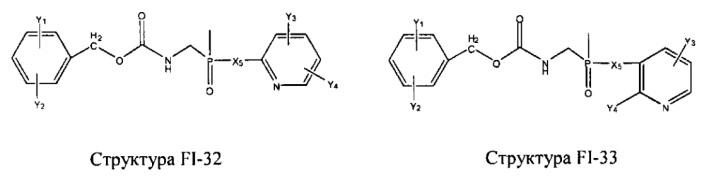
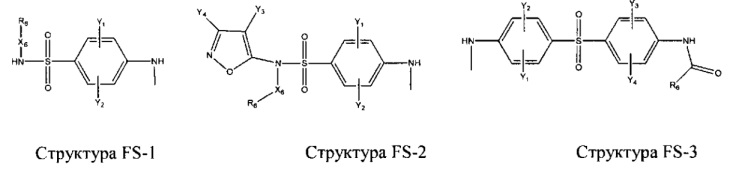
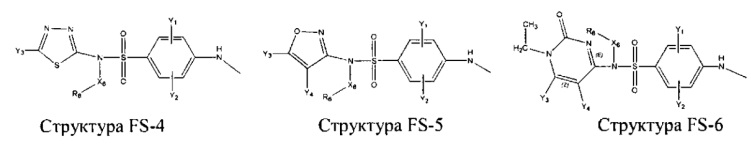
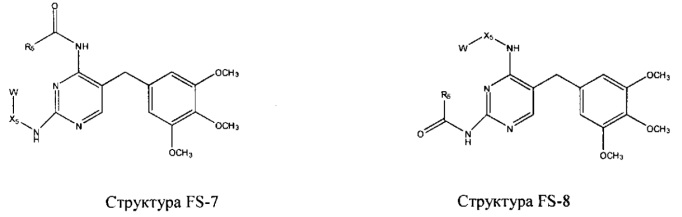

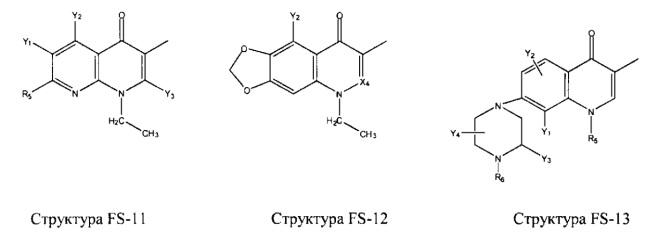

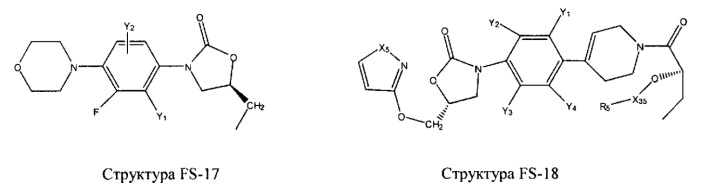
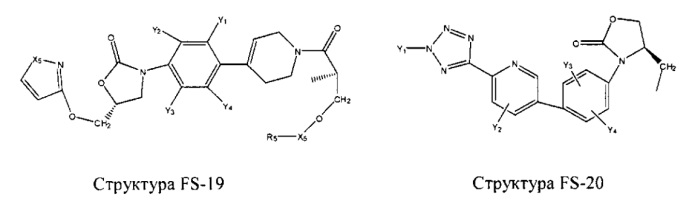
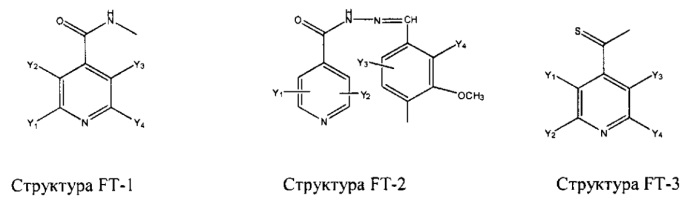
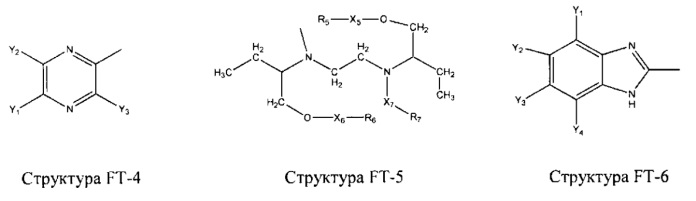
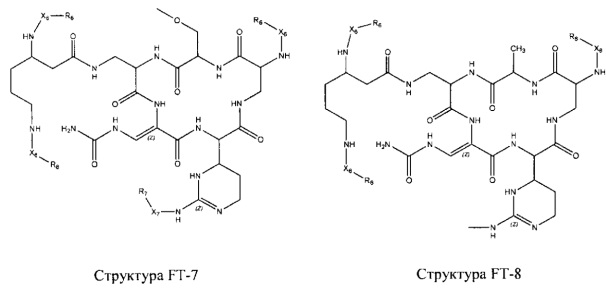
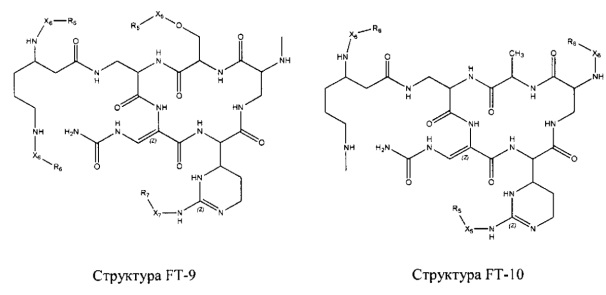
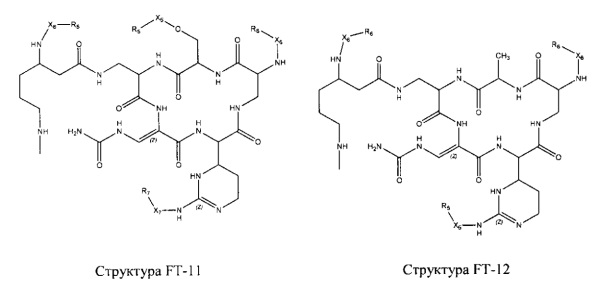
HA, W, Т, L1, L2, L4, R5, R6, Х5 и Х7 являются такими, как определено выше;
L1 отсутствует или выбран из группы, состоящей из О, S, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -О-CH2-О-, -O-CH(L3)-O и -S-CH(L3)-O-;
L2 отсутствует или выбран из группы, состоящей из О, S, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L3)-, -О-CH2-О-, -O-CH(L3)-O, -S-CH(L3)-O-, -O-L3-, -N-L3-, -S-L3-, -N(L3)-L5- и L3;
L4 выбран из группы, состоящей из C=O, C=S, 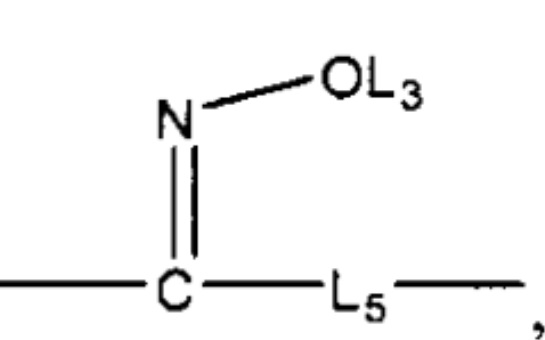
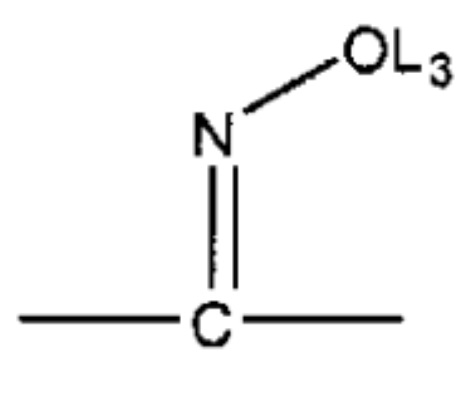 и
и 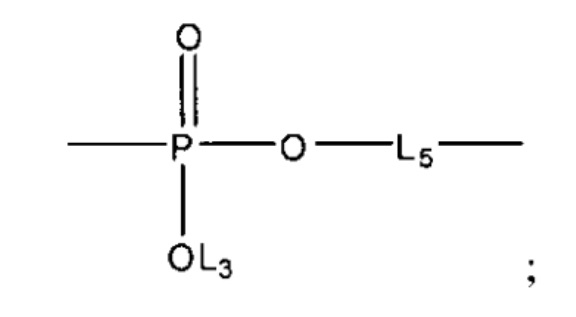
для каждого из L1, L2 и L4, L3 и L5 независимо отсутствуют или выбраны из группы, состоящей из Н, CH2C(=O)OL6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, любой из атомов углерода или водорода независимо может быть дополнительно заменен на О, S, Р, NL3 или любую другую фармацевтически приемлемую группу;
L6 независимо выбран из группы, состоящей из Н, ОН, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой из атомов углерода или водорода независимо может быть дополнительно заменен на О, S, N, P(O)OL6, CH=СН, С≡C, CHL6, CL6L7, арил, гетероарил или циклическую группу;
L7 независимо выбран из группы, состоящей из Н, ОН, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного алкилгалогенида, где любой из атомов углерода или водорода независимо может быть дополнительно заменен на О, S, N, Р(O)OL6, СН=СН, С≡С, CHL6, CL6L7, арил, гетероарил или циклическую группу; и где любая из групп СН2 может быть заменена на О, S или NH;
X6 и Х8 независимо отсутствуют или выбраны из группы, состоящей из С(=O), C(=S), ОС(=O), OC(=S), СН2, СН, S, О и NR5;
Y1, Y2, Y3, Y4, Y5, Y6, Y7, Y8 и Y9 независимо выбраны из группы, состоящей из Н, ОН, OW, OC(=O)W, L1-L4-L2-W, ОС(=O)CH3, CH3, С2Н5, С3Н7, С4Н9, R6, SO3R6, CH2OR6, CH2OC(=O)R6, CH2C(=O)OR8, OCH3, OC2H5, OR6, CH3SO2, R6SO2, CH3SO3, R6SO3, NO2, CN, CF3, OCF3, CH2(CH2)nNR5R6, CH2(CH2)nOR6, CH(C(=O)NH2)NHR6, CH2C(=O)NH2, F, Br, I, Cl, CH=CHC(=O)NHCH2C(=O)OW, CH=CHC(=O)NHCH2L1-L4-L2-W, NR8C(=O)R5, SO2NR5R8, C(=O)R5, SR5, R6OOCCH(NHR7)(CH2)nC(=O)NH-, R6OOCCH(NHR7)(CH2)nSC(=O)NH-, CF3SCH2C(=O)NH-, CF3CH2C(=O)NH-, CHF2SCH2C(=O)NH-, CH2FSCH2C(=O)NH-, NH2C(=O)CHFS-CH2C(=O)NH-, R7NHCH(C(=O)OW)CH2SCH2C(=O)NH-, R7NHCH(L1-L4-L2-W)CH2SCH2C(=O)NH-, CNCH2SCH2C(=O)NH-, CH3(CH2)nC(=O)NH-, R7N=CHNR7CH2CH2S-, R7N=C(NHR7)NHC(=O)-, R7N=C(NHR7)NHC(=O)CH2, CH3C(Cl)=CHCH2SCH2C(=O)NH-, (CH3)2C(OR6)-, CNCH2C(=O)NH-, CNCH2CH2S-, R7HN=CH(NR7)CH2CH2S-, CH2=CHCH2SCH2C(=O)NH-, CH3CH(ОН)-, CH3CH(OR8)-, CH3CH(Y1)-, (CH3)2CH-, CH3CH2-, CH3(CH2)nCH=CH(CH2)mC(=O)NH-, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида и замещенного и незамещенного алкилкарбонила;
R7 независимо выбран из группы, состоящей из Н, F, Cl, Br, I, CH3NHC(=O)CH2CH(NHR8)C(=O), R5N=C(NHR6)NHC(=O)-, С(=O)CH3, C(=O)R6, PO(OR5)OR6, sub замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкилкарбонила, замещенного и незамещенного алкиламино, L1-L4-L2-W и C-(=O)-W;
R8 независимо выбран из группы, состоящей из Н, F, Cl, Br, I, CH3, С2Н5, CF3, CH2CH2F, CH2CH2Cl, CH2CH2Br, CH2CH2I, CH2CHF2, CH2CF3, CH2F, CH2Cl, CH2Br, CH2I, CH2NR6R7, CH(NHR7)CH2C(=O)NH2, С3Н7, С4Н9, C5H11, R6, C(=O)R6, C(=O)NH2, CH2C(=O)NH2, CH2OC(=O)NH2, PO(OR5)OR6, C(CH3)2C(=O)OR6, CH(CH3)C(=O)OR6, CH2C(=O)OR6, C(=O)-W, L1-L4-L2-W, W, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила, замещенного и незамещенного алкилгалогенида и замещенного и незамещенного алкилкарбонила.
[0032] Термин «фармацевтически приемлемая соль», применяемый в настоящей заявке, означает соли соединений согласно настоящему изобретению, которые являются безопасными для применения на субъекте. Фармацевтически приемлемые соли включают соли кислотных и основных групп, присутствующих в соединениях согласно настоящему изобретению. Фармацевтически приемлемые соли присоединения кислоты включают, но не ограничиваются ими, гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (т.е., 1,11-метиленбис(2-гидрокси-3-нафтоат)). Некоторые соединения согласно настоящему изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Подходящие соли присоединения основания включают, но не ограничиваются ими, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Обзор фармацевтически приемлемых солей см. в BERGE ЕТ AL., 66 J. PHARM. SCI. 1-19 (1977), включенный в настоящую заявку посредством ссылки.
[0033] Если не указано иное, термин «алкил», применяемый в настоящей заявке, означает разветвленную или неразветвленную, насыщенную или ненасыщенную, одновалентную или поливалентную углеводородную группу, в том числе насыщенные алкильные группы, алкенильные группы и алкинильные группы. Примеры алкилов включают, но не ограничиваются ими, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, этенил, пропенил, бутенил, изобутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил, ундеценил, додеценил, этинил, пропинил, бутинил, изобутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил, ундецинил, додецинил, метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, трет-бутилен, пентилен, гексилен, гептилен, октилен, нонилен, децилен, ундецилен и додецилен. В некоторых вариантах реализации углеводородная группа содержит от 1 до 30 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 20 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 12 атомов углерода.
[0034] Если не указано иное, термин «циклоалкил», применяемый в настоящей заявке, означает алкил, содержащий по меньшей мере одно кольцо и не содержащий ароматических колец. Примеры циклоалкилов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. В некоторых вариантах реализации углеводородная цепь содержит от 1 до 30 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 20 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 12 атомов углерода.
[0035] Если не указано иное, термин «гетероциклоалкил», применяемый в настоящей заявке, означает циклоалкил, в котором по меньшей мере один кольцевой атом представляет собой атом, отличный от углерода. Примеры кольцевых атомов, отличных от углерода, включают, но не ограничиваются ими, S, О и N.
[0036] Если не указано иное, термин «алкоксил», применяемый в настоящей заявке, означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов кислорода. Примеры алкоксилов включают, но не ограничиваются ими, -CH2-OH, -ОСН3, -O-Re, -Re-OH, -Re1-O-Re2-, где Re, Re1 и Re2 могут представлять собой одинаковые или различные алкилы, циклоалкилы или гетероциклоалкилы.
[0037] Если не указано иное, термин «алкилгалогенид», применяемый в настоящей заявке, означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов галогенов, где атомы галогенов могут быть одинаковыми или могут различаться. Термин «галоген» означает фтор, хлор, бром или йод. Примеры алкилгалогенидов включают, но не ограничиваются ими, -Re-F, -Re-Cl, -Re-Br, -Re-I, -Re(F)-, -Re(Cl)-, -Re(Br)- и -Re(I)-, где Re представляет собой алкил, циклоалкил или гетероциклоалкил.
[0038] Если не указано иное, термин «алкилтио», применяемый в настоящей заявке, означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов серы. Примеры алкилтио включают, но не ограничиваются ими, -CH2-SH, -SCH3, -S-Re, -Re-SH, -Re1-S-Re2-, где Re, Re1 и Re2 представляют собой одинаковые или различные алкилы, циклоалкилы или гетероциклоалкилы.
[0039] Если не указано иное, термин «алкиламино», применяемый в настоящей заявке, означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов азота. Примеры алкиламино включают, но не ограничиваются ими, -СН2-NH, -NCH3, -N(Re1)-Re2, -N-Re, -Re-NH2, -Re1-N-Re2 и -Re-N(Re1)-Re2, где Re, Re1 и Re2 представляют собой одинаковые или различные алкилы, циклоалкилы или гетероциклоалкилы.
[0040] Если не указано иное, термин «алкилкарбонил», применяемый в настоящей заявке, означает алкил, циклоалкил или гетероциклоалкил, который содержит одну или более карбонильных групп. Примеры алкилкарбонильных групп включают, но не ограничиваются ими, альдегидную группу (-Re-C(O)-H), кетонную группу (-Re-C(O)-Re1), карбоксильную группу (Re-C(=O)OH), сложноэфирную группу (-Re-C(=O)O-Re1), карбоксамидную группу (-Re-C(=O)O-N(Re1)Re2), еноновую группу (-Re-C(O)-C(Re1)=C(Re2)Re3), ацилгалогенидную группу (-Re-C(O)-Xh) и ангидридную группу (-Re-C(O)-O-C(O)-Re1), где Re, Re1, Re2 и Re3 представляют собой одинаковые или различные алкилы, циклоалкилы или гетероциклоалкилы; и Xh представляет собой галоген.
[0041] Если не указано иное, термин «перфторалкил», применяемый в настоящей заявке, означает алкил, циклоалкил или гетероциклоалкил, который содержит один или более атомов фтора, включая, без ограничений, перфторметил, перфторэтил, перфторпропил.
[0042] Если не указано иное, термин «арил», применяемый в настоящей заявке, означает химическую структуру, содержащую одно или более ароматических колец. В некоторых вариантах реализации все кольцевые атомы представляют собой атомы углерода. В некоторых вариантах реализации один или более кольцевых атомов представляют собой атомы, отличные от углерода, например, атомы кислорода, азота или серы («гетероарил»). Примеры арилов включают, без ограничений, фенил, бензил, нафталинил, антраценил, пиридил, хиноил, изохиноил, пиразинил, хиноксалинил, акридинил, пиримидинил, хиназолинил, пиридазинил, циннолинил, имидазолил, бензимидазолил, пуринил, индолил, фуранил, бензофуранил, изобензофуранил, пирролил, индолил, изоиндолил, тиофенил, бензотиофенил, пиразолил, индазолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, тиаксолил, гуанидино и бензотиазолил.
II. Фармацевтические композиции, содержащие НРР
[0043] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей по меньшей мере один НРР исходного лекарственного средства, которое может быть использовано для лечения состояний легких (например, астмы, инфекций нижних и верхних дыхательных путей, хронического бронхита, хронического обструктивного заболевания легких, эмфиземы, кистозного фиброза, пневмонии, саркоидоза и фиброза легких), или родственного соединения и фармацевтически приемлемый носитель.
[0044] Фармацевтическая композиция может содержать более чем одно НРР различное исходное лекарственное средство. Различные исходные лекарственные средства могут относиться к одной или различным категориям лекарственных средств, которые могут быть использованы для лечения состояний легких (например, астмы, инфекций нижних и верхних дыхательных путей, хронического бронхита, хронического обструктивного заболевания легких, эмфиземы, кистозного фиброза, пневмонии, саркоидоза и фиброза легких). Например, фармацевтическая композиция может содержать НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства выбраны из группы, состоящей из антигистаминных средств, агонистов β2-адренергических рецепторов, противовоспалительных лекарственных средств, средств от кашля, противоотечных средств, антибиотиков и любых комбинаций указанных соединений.
[0045] Фармацевтическая композиция может содержать НРР исходных лекарственных средств того же класса, что и лекарственные средства, которые могут быть применены для лечения состояний легких. Например, фармацевтическая композиция может содержать НРР более одного из антигистаминных средств, агонистов β2-адренергических рецепторов, противовоспалительных лекарственных средств, средств от кашля, противоотечных средств и/или антибиотиков.
[0046] Фармацевтическая композиция может содержать более одного пролекарства с высокой проницаемостью, где первое исходное лекарственное средство выбрано из группы, состоящей из антигистаминных средств, агонистов β2-адренергических рецепторов, противовоспалительных лекарственных средств, средств от кашля, противоотечных средств, антибиотиков и любых комбинаций указанных соединений. Фармацевтическая композиция может дополнительно содержать по меньшей мере второе исходное лекарственное средство, выбранное из группы, состоящей из антигистаминных средств, агонистов β2-адренергических рецепторов, ингибиторов белка, активирующего 5-липоксигеназу (FLAP), ингибиторов 5-липоксигеназы, антагонистов рецепторов лейкотриена, противовоспалительных лекарственных средств, средств от кашля, противоотечных средств, антибиотиков и любых комбинаций указанных соединений. Второе исходное лекарственное средство также может быть выбрано из группы, состоящей из декстрометорфана, пентоксиверина, клемастина, дифенгидрамина, доксиламина, дезлоратадина, хлорфенамина, эфедрина и левометамфетамина.
[0047] Фармацевтическая композиция может дополнительно содержать лекарственное средство, способное эффективно преодолевать биологические барьеры (например, проникать под кожу со скоростью >0,01 мг/см2/ч). Примеры таких лекарственных средств включают, без ограничений, декстрометорфан, пентоксиверин, клемастин, дифенгидрамин, доксиламин, дезлоратадин, хлорфенамин, эфедрин и левометамфетамин.
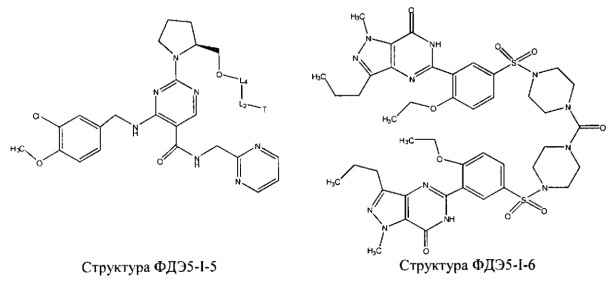
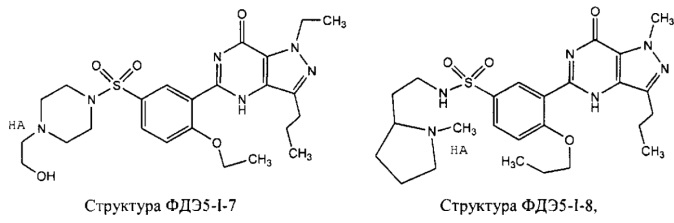
[0048] Фармацевтическая композиция может дополнительно содержать один или более ингибиторов цГМФ-специфической (циклический гуанозинмонофосфат) фосфодиэстеразы 5 типа (ФДЭ5), силденафил, варденафил, тадалафил, ацетилденафил, аванафил, лоденафил, мироденафил, уденафил, и их производных и солей. Примеры ингибиторов цГМФ-специфической фосфодиэстеразы 5 типа (ФДЭ5) и их производных и солей включают, без ограничений, структуру ФДЭ5-I-1, структуру ФДЭ5-I-2, структуру ФДЭ5-I-3, структуру ФДЭ5-I-4, структуру ФДЭ3-I-5, структуру ФДЭ5-I-6, структуру ФДЭ5-I-7 и структуру ФДЭ5-I-8, представленные ниже. В частности, структура ФДЭ5-I-1 представляет собой соль силденафила, структура ФДЭ5-I-2 представляет собой соль варденафила, структура ФДЭ5-I-3 представляет собой соль тадалафила, структура ФДЭ5-I-4 представляет собой соль ацетилденафила, структура ФДЭ5-I-5 представляет собой производное аванафила, структура ФДЭ5-I-6 представляет собой лоденафил, структура ФДЭ5-I-7 представляет собой соль мироденафила, и структура ФДЭ5-I-8 представляет собой соль уденафила.
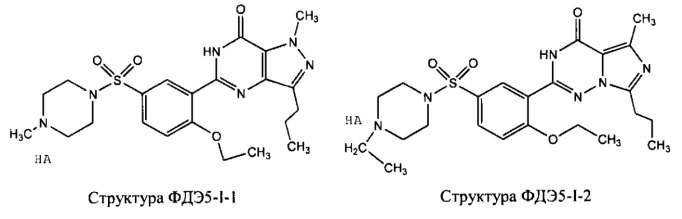
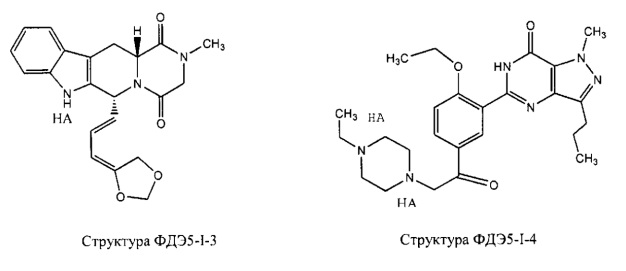
НА, Т, L2 и L4 являются такими, как определено выше.
[0049] Фармацевтическая композиция может дополнительно содержать воду.
[0050] Фармацевтическая композиция может дополнительно содержать спирты (например, этанол, глицерин, изопропанол, октанол и т.п.).
[0051] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой пенициллин V и/или другие антибиотики, например, соединение, содержащее структуру АВ-1; аспирин и/или другие противовоспалительные лекарственные средства, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры NSAID-1, структуры NSAID-2, структуры NSAID-3, структуры NSAID-4, структуры NSAID-5, структуры NSAID-6, структуры NSAID-7, структуры NSAID-8, структуры NSAID-9, структуры NSAID-10, структуры NSAID-11, структуры NSAID-12 и структуры NSAID-13; зилеутон и/или другие ингибиторы 5-липоксигеназы, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры 5-LI-1, структуры 5-LI-2, структуры 5-LI-3, структуры 5-LI-4, структуры 5-LI-5 и структуры 5-LI-6; метапротеренол и/или другие антагонисты рецепторов лейкотриена, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры LRA-1, структуры LRA-2, структуры LRA-3, структуры LRA-4, структуры LRA-5 и структуры LRA-6; и фексофенадин и/или другие антигистаминные средства, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры АН-1, структуры АН-2, структуры АН-3, структуры АН-4, структуры АН-5, структуры АН-6, структуры АН-7, структуры АН-8, структуры АН-9, структуры АН-10, структуры АН-11, структуры АН-12, структуры АН-13, структуры АН-14, структуры АН-15, структуры АН-16, структуры АН-17, структуры АН-18, структуры АН-19 и структуры АН-20; MK-886 [3-(1-(4-хлорбензил)-3-трет-бутилтио-5-изопропилидон-2-ил)-2,2-диметилпропановую кислоту] и/или другие ингибиторы белка, активирующего 5-липоксигеназу (FLAP), например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры FLAP-1, структуры FLAP-2, структуры FLAP-3, структуры FLAP-4, структуры FLAP-5 и структуры FLAP-6; альбутерол и/или другие агонисты (52-адренергических рецепторов, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры ARA-1, структуры ARA-2, структуры ARA-3, структуры ARA-4, структуры ARA-5, структуры ARA-6, структуры ARA-7, структуры ARA-8, структуры ARA-9, структуры ARA-10, структуры ARA-11, структуры ARA-12, структуры ARA-13 и структуры ARA-14; декстрометорфан и/или другие средства от кашля, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры CS-1, структуры CS-2, структуры CS-3, структуры CS-4, структуры CS-5, структуры CS-6, структуры CS-7, структуры CS-8; и/или эфедрин и/или другие противоотечные средства, например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры DEC-1, структуры DEC-2, структуры DEC-3, структуры DEC-4, структуры DEC-5 и структуры DEC-6; и/или силденафил и/или другие ингибиторы цГМФ-специфической фосфодиэстеразы 5 типа (ФДЭ5), например, соединение, содержащее структуру, выбранную из группы, состоящей из структуры PDE5-I-1, структуры PDE5-I-2, структуры PDE5-I-3, структуры PDE5-I-4, структуры PDE5-I-5, структуры PDE5-I-6, структуры PDE5-I-7 и структуры PDE5-I-8.
[0052] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (НРР пинициллина V), гидрохлорид диэтиламиноэтилацетилсалицата (НРР аспирина), гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (НРР зилеутона), гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (НРР метапротеренола) и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (НРР фексофенадина).
[0053] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой аспирин и зилеутон.
[0054] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид диэтиламиноэтилацетилсалицата и гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины.
[0055] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой цефокситин, аспирин, монтелукаст, метапротеренол и фексофенадин.
[0056] В некоторых вариантах реализации фармацевтическая композиция содержит клемастин и НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой цефокситин, аспирин, монтелукаст, метапротеренол и фексофенадин.
[0057] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой акривастин, цефокситин, аспирин, монтелукаст и альбутерол.
[0058] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (НРР цефокситина), гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, гидрохлорид (RS)-5-[2-(трет-бутиламино)-1-гидроксиэтил]бензол-1,3-диолдиацетата (HPP тербуталина) и изопропил-(Е)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат (НРР акривастина).
[0059] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой цефокситин, ибупрофен, монтелукаст, альбутерол и акривастин.
[0060] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой акривастин, цефокситин, ибупрофен, монтелукаст и альбутерол.
[0061] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, гидрохлорид диэтиламиноэтил-2-(n-изобутилфенил)пропионата, гидрохлорид диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, гидрохлорид (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата, (НРР тербуталина) и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат.
[0062] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой ибупрофен, монтелукаст и гидрохлорид диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, гидрохлорид (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата, (НРР тербуталина) и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат.
[0063] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой акривастин, цефокситин, ибупрофен и монтелукаст. В некоторых вариантах реализации фармацевтическая композиция содержит уденафил и HPPs акривастина, цефокситина, ибупрофена и монтелукаста.
[0064] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид диэтиламиноэтил-2-(n-изобутилфенил)пропионата, гидрохлорид диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат.
[0065] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой диклофенак, монтелукаст, пирбутерол и акривастин.
[0066] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой акривастин, диклофенак, монтелукаст и пирбутерол.
[0067] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетат, гидрохлорид (RS)-6-[2-(трет-бутиламино)-1-ацетилоксиэтил]-2-(ацетилоксиметил)-3-ацетилоксипиридина и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат.
[0068] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой дифлунизал, зилеутон, тербуталин и доксиламин.
[0069] В некоторых вариантах реализации фармацевтическая композиция содержит доксиламин и НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой дифлунизал, зилеутон и тербуталин.
[0070] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид диэтиламиноэтил-5-(2,4-дифторфенил)салицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, гидрохлорид-ацетат (±)-α-[(трет-бутиламино)метил]-3,5-диацетилоксибензилового спирта и доксиламин.
[0071] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой азлоциллин, дифлунизал, монтелукаст и эфедрин.
[0072] В некоторых вариантах реализации фармацевтическая композиция содержит эфедрин и НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой азлоциллин, дифлунизал и монтелукаст.
[0073] В некоторых вариантах реализации фармацевтическая композиция содержит (2S,5R,6R)-3,3-диметил-7-оксо-6-{[(2R)-2-{[(2-оксоимидазолидин-1-ил)карбонил]амино}-2-фенилацетил]амино}-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновую кислоту, гидрохлорид диэтиламиноэтил-5-(2,4-дифторфенил)салицилата, гидрохлорид диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-]-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и эфедрин.
[0074] В некоторых вариантах реализации фармацевтическая композиция содержит НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой пиперациллин, аспирин, зилеутон, метапротеренол и левометамфетамин.
[0075] В некоторых вариантах реализации фармацевтическая композиция содержит левометамфетамин и НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой пиперациллин, аспирин, зилеутон и метапротеренол.
[0076] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты, гидрохлорид 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата и левометамфетамин.
[0077] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, цитрат силденафила (структура ФДЭ5-I-1) и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата.
[0078] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, цитрат силденафила и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата.
[0079] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетат, варденафил •HCl, гидрохлорид (R,S)α6-{[(1,1-диметилэтил)амино]метил}-3-ацетилокси-2,6-пиридиндиметанолдиацетата и дифенгидрамин [2-(дифенилметокси)-N,N-диметилэтанамин].
[0080] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, тадалафил и клемастин [(2R)-2-{2-[(1R)-1-(4-хлорфенил)-1-фенилэтокси]этил}-1-метилпирролидин].
[0081] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, гидрохлорид диэтиламиноэтил-2-(n-изобутилфенил)пропионата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, уденафил и клемастин.
[0082] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, цитрат силденафила и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата. В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, ацетилденафил и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат.
[0083] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, цитрат силденафила и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата.
[0084] В некоторых вариантах реализации фармацевтическая композиция содержит левометамфетамин и НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой пиперациллин, диклофенак, зилеутон и метапротеренол.
[0085] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты, гидрохлорид 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, гидрохлорид 1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, ацетилденафил и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат.
[0086] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицилата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, цитрат силденафила и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата.
[0087] В некоторых вариантах реализации фармацевтическая композиция содержит левометамфетамин и НРР исходных лекарственных средств или родственных соединений, где исходные лекарственные средства представляют собой пиперациллин, диклофенак, зилеутон, метапротеренол, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины и гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата.
[0088] В некоторых вариантах реализации фармацевтическая композиция содержит НРР пенициллина V, аспирина, зилеутона, метапротеренола и фексофенадина.
[0089] В некоторых вариантах реализации фармацевтическая композиция содержит клемастин и НРР цефокситина, аспирина, монтелукаста и тербуталина.
[0090] В некоторых вариантах реализации фармацевтическая композиция содержит клемастин и НРР цефокситина, ибупрофена, монтелукаста и тербуталина.
[0091] В некоторых вариантах реализации фармацевтическая композиция содержит дифенгидрамин и НРР диклофенака, монтелукаста и пирбутерола.
[0092] В некоторых вариантах реализации фармацевтическая композиция содержит доксиламин и НРР дифлунизала, зилеутона и тербуталина.
[0093] В некоторых вариантах реализации фармацевтическая композиция содержит эфедрин и НРР пенициллина V, дифлунизала и монтелукаста.
[0094] В некоторых вариантах реализации фармацевтическая композиция содержит левометамфетамин и НРР пиперациллина, диклофенака, зилеутона и метапротеренола.
[0095] В некоторых вариантах реализации фармацевтическая композиция содержит НРР пиперациллина, аспирина, зилеутона, метапротеренола и акривастина.
[0096] В некоторых вариантах реализации фармацевтическая композиция содержит цитрат силденафила и НРР пенициллина V, аспирина, зилеутона и фексофенадина.
[0097] В некоторых вариантах реализации фармацевтическая композиция содержит варденафил •HCl и НРР пенициллина V, аспирина, зилеутона и фексофенадина.
[0098] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид тадалафила и НРР цефокситина, аспирина, монтелукаста и акривастина.
[0099] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид уденафила и НРР цефокситина, ибупрофена, монтелукаста и акривастина.
[00100] В некоторых вариантах реализации фармацевтическая композиция содержит цитрат силденафила и НРР пенициллина V, ибупрофена, зилеутона и фексофенадина.
[00101] В некоторых вариантах реализации фармацевтическая композиция содержит гидрохлорид варденафила и НРР пенициллина V, ибупрофена, зилеутона и фексофенадина.
[00102] Термин «фармацевтически приемлемый носитель», применяемый в настоящей заявке, означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество или материал для инкапсулирования, участвующие в переносе или доставке НРР от одного участка, биологической жидкости, ткани, органа (внутреннего или внешнего) или части тела к другому участку, биологической жидкости, ткани, органу или части тела.
[00103] Каждый из носителей является «фармацевтически приемлемым» в смысле совместимости с другими ингредиентами, например, НРР, состава и пригодности для применения в контакте с тканью или органом биологического субъекта при отсутствии избыточной токсичности, раздражения, аллергической реакции, иммуногенности или других проблем или осложнений и адекватном соотношении польза/риск.
[00104] Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные вещества, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) аспирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) спирты, такие как этиловый спирт и пропиловый спирт; (20) фосфатно-буферные растворы; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах, такие как ацетон.
[00105] Фармацевтические композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для симуляции физиологический условий, такие как агенты, регулирующие рН, буферные агенты, агенты, регулирующие токсичность, и т.п., например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п.
[00106] В одном из вариантов реализации фармацевтически приемлемый носитель представляет собой водный носитель, например, забуференный солевой раствор и т.п. В некоторых вариантах реализации фармацевтически приемлемый носитель представляет собой полярный растворитель, например, ацетон или спирт.
[00107] Концентрация НРР в таких составах может изменяться в широком диапазоне и выбирается, в первую очередь, на основе объемов жидкостей, вязкостей, массы тела и т.п. параметров в соответствии с конкретным выбранным способом введения и биологических потребностей субъекта. Например, концентрация может составлять от 0,0001% до 100%, от 0,001% до 50%, от 0,01% до 30%, от 0,1% до 20%, от 1% до 10% по массе.
[00108] Композиции согласно настоящему изобретению можно вводить в профилактических, терапевтических и/или гигиенических целях. Такое введение может являться местным, мукозальным, например, пероральным, назальным, вагинальным, ректальным, парентеральным, трансдермальным, подкожным, внутримышечным, внутривенным, ингаляционным, офтальмологическим или другим подходящим введением. В зависимости от способа введения фармацевтические композиции могут быть введены в различных стандартных лекарственных формах. Например, стандартные лекарственные формы, подходящие для перорального введения, включают порошок, таблетки, пилюли, капсулы и пастилки, и стандартные лекарственные формы, подходящие для трансдермального введения, включают раствор, суспензию и гель.
[00109] Таким образом, типичную фармацевтическую композицию для трансдермального, перорального и внутривенного введения вводят субъекту в количестве от примерно 10-8 г до примерно 100 г, от примерно 10-8 г до примерно 10-5 г, от примерно 10-6 г до примерно 1 г, от примерно 10-6 г до примерно 100 г, от примерно 0,001 г до примерно 100 г, от примерно 0,01 г до примерно 10 г или от примерно 0,1 г до примерно 1 г за сутки. Могут быть применены дозировки субъекту от примерно 0,001 мг до примерно 100 г за сутки. Фактические способы получения композиций, подходящих для парентерального введения, известны или очевидны специалистам в данной области и более подробно описаны в таких публикациях, как Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, (2005).
III. Применения НРР
i) Способы проникновения через биологические барьеры
[00110] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению при проникновении через один или более биологических барьеров у биологического субъекта. Способ включает стадию введения биологическому субъекту НРР или его фармацевтически приемлемой композиции. В некоторых вариантах реализации НРР продемонстрировал скорость проникновения через один или более биологических барьеров, превышающую примерно в 20 раз или более, 50 раз или более, примерно в 100 раз или более, примерно в 200 раз или более, примерно в 300 раз или более, примерно в 500 раз или более, примерно в 1000 раз или более, скорость проникновения исходного лекарственного средства.
[00111] Термин «биологический барьер», применяемый в настоящей заявке, относится к биологическому слою, который разделяет среду на различные пространственные области или отсеки и обеспечивает возможность модулирования (например, прекращения, ограничения, усиления или невмешательства) прохождения, проникновения или перемещения вещества или материи из одного отсека/области в другой. Различные пространственные области или отсеки, описываемые в настоящей заявке, могут содержать одинаковую(ые) или различную(ые) химическую(ие) или биологическую(ие) среду(ы). Биологический слой, описываемый в настоящей заявке, включает, но не ограничивается ими, биологическую мембрану, клеточный слой, биологическую структуру, внутренние поверхности полостей в субъектах, организмах, органах или теле, внешние поверхности полостей в субъектах, организмах, органах или теле и их любые комбинации или совокупности.
[00112] Примеры биологических мембран включают липидный бислой, мембрану эукариотической клетки, мембрану прокариотической клетки и внутриклеточную мембрану (например, ядерную мембрану или мембранную органеллу, такую как мембрана или оболочка аппарата Гольджи, гранулярный или гладкий эндоплазматический ретикулум (ЭР), рибосомы, вакуоли, везикулы, липосомы, митохондрия, лизосома, ядро, хлоропласт, пластиды, пероксисомы или микротельца).
[00113] Липидный бислой, описываемый в настоящей заявке, представляет собой двойной слой липидных молекул, включая, но, не ограничиваясь ими, фосфолипиды и холестерин. В конкретном варианте реализации липиды бислоя представляют собой амфифильные молекулы, состоящие из полярных головных групп и неполярных хвостов, состоящих из остатков жирных кислот. Бислой состоит из двух слоев липидов, расположенных таким образом, что их углеводородные хвосты обращены друг к другу с образованием маслянистого ядра, удерживаемого за счет гидрофобного эффекта, тогда как их заряженные головные группы обращены в сторону водных растворов по обе стороны мембраны. В другом варианте реализации липидный бислой может содержать одну или более молекул белка и/или сахара.
[00114] Примеры клеточных слоев включают оболочки из эукариотических клеток (например, эпителий, собственную пластинку слизистой оболочки и гладкую мускулатуру или мышечную пластинку слизистой оболочки (в желудочно-кишечном тракте)), оболочки из прокариотических клеток (например, поверхностный слой или S-слой, который относится к двумерной структуре мономолекулярного слоя, состоящего из одинаковых белков или гликопротеинов, в частности, S-слой относится к части клеточной оболочки, обычно встречающейся у бактерий и архей), биопленку (структурированную группы микроорганизмов, инкапсулированных в самоорганизующейся полимерной матрице и прилегающих к живой или инертной поверхности) и слой растительных клеток (например, эпидермис). Клетки могут представлять собой нормальные клетки или патологические клетки (например, клетки, пораженные заболеванием, раковые клетки).
[00115] Примеры биологических структур включают структуры, закрытые плотными или преграждающими перегородками, образующими барьер для прохождения токсинов, бактерий и вирусов, например, гематомолочный барьер и гематоэнцефалический барьер (ГЭБ). В частности. ГЭБ состоит из непроницаемого эпителия, который является, как физическим барьером благодаря наличию плотных перегородок, прилегающих к соседним эндотелиальным клеткам, так и транспортным барьером, состоящим из эффлюксных переносчиков. Биологическая структура также может включать смесь клеток, белков и Сахаров (например, сгустки крови).
[00116] Примеры внутренних поверхностей полостей в субъектах, организмах, органах или теле включают слизистую оболочку щеки, слизистую оболочку пищевода, слизистую оболочку желудка, слизистую оболочку кишечника, слизистую оболочку обонятельной области, слизистую оболочку полости рта, слизистую оболочку бронхов, слизистую оболочку матки и эндометрий (слизистую оболочку матки, внутренний слой стенки пыльцевого зерна или внутренний слой стенки споры) и их комбинации или совокупности.
[00117] Примеры внешних поверхностей полостей в субъектах, организмах, органах или теле включают капилляры (например, капилляры в сердечной ткани), мембраны слизистых оболочек, непосредственно переходящих в кожу (например, ноздрей, ушей, области гениталий и ануса), наружную поверхность органов (например, печени, легких, желудка, мозга, почек, сердца, ушей, глаз, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, прямой кишки, ободочной кишки, кишечника, вен, дыхательной системы, сосудистой системы, аноректальной области и трещин при анальном зуде), кожу, кутикулы (например, слои омертвевших клеток эпидермиса или кератиноцитов или поверхностный слой перекрывающихся клеток, покрывающий волосяные стержни у животных, многослойную структуру вне эпидермиса у многих беспозвоночных, кутикулы растений или полимеры кутина и/или кутана), внешний слой стенки пыльцевого зерна или внешний слой стенки споры и их комбинации или совокупности.
[00118] Кроме того, биологический барьер дополнительно включает слой сахара, слой белка или любой другой биологический барьер и их комбинации или совокупности. Например, кожа представляет собой биологический барьер, состоящий из совокупности биологических барьеров. Кожа состоит из эпидермиса (наружный слой), дермы и подкожного слоя. Эпидермис состоит из нескольких слоев, включая базальный слой, шиповатый слой, зернистый слой и роговой слой. Клетки в эпидермисе называются кератиноцитами. Роговой слой является первым внешним слоем эпидермиса, клетки которого являются плоскими и имеют форму чешуек («чешуевидную»). Указанные клетки содержат много кератина и расположены в виде перекрывающихся слоев, которые придают поверхности кожи жесткость, маслонепроницаемость и водонепроницаемость.
ii) Способы отбора вещества по требуемым характеристикам
[00119] Другой аспект настоящего изобретения относится к способу отбора НРР по требуемым характеристикам.
[00120] В некоторых вариантах реализации способ включает:
1) ковалентное связывание исследуемого функционального фрагмента с транспортным фрагментом посредством линкерной группы с образованием исследуемой композиции (или ковалентное связывание функционального фрагмента с исследуемым транспортным фрагментом посредством линкерной группы или ковалентное связывание функционального фрагмента с транспортным фрагментом посредством исследуемой линкерной группы);
2) введение исследуемой композиции биологическому субъекту; и
3) определение того, имеет ли исследуемая композиция требуемую природу или характер.
[00121] В одном из вариантов реализации требуемый характер может включать, например, 1) способность исследуемого функционального фрагмента образовывать композицию с высокой проницаемостью или превращаться обратно в исходное лекарственное средство, 2) способность к проникновению и/или скорость проникновения исследуемой композиции, 3) эффективность и/или активность исследуемой композиции, 4) способность транспортного фрагмента к транспортированию и 5) расщепляемость линкерной группы.
iii) Способы лечения состояний легких у биологического субъекта
[00122] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению или ее фармацевтической композиции при лечении состояния у биологического субъекта. Способ включает введение фармацевтической композиции биологическому субъекту.
[00123] Термин «излечение», применяемый в настоящей заявке, означает исцеление, облегчение, ингибирование или предотвращение. Термин «лечить», применяемый в настоящей заявке, означает исцелять, облегчать, ингибировать или предотвращать. Термин «лечение», применяемый в настоящей заявке, означает исцеление, облегчение, ингибирование или предотвращение.
[00124] Термин «биологический субъект» или «субъект», применяемый в настоящей заявке, означает орган, группу органов, работающих совместно над выполнением определенной задачи, организм или группу организмов. Термин «организм», применяемый в настоящей заявке, означает совокупность молекул, функционирующую более или менее стабильно и имеющую признаки жизнедеятельности, такую как животное, растение, гриб или микроорганизм.
[00125] Термин «животное», применяемый в настоящей заявке, означает эукариотический организм, характеризующийся произвольным движением. Примеры животных включают, без ограничений, позвоночных (например, человека, млекопитающих, птиц, рептилий, замноводных, рыб, marsipobranchiata и leptocardia), оболочников (например, thaliacea, appendicularia, sorberacea и ascidioidea), членистых (например, насекомых, мириаподов, malacapoda, паукообразных, пикногонид, меростомовых, ракообразных и аннелид), гекконовые (anarthropoda) и гельминтов (например, коловраток).
[00126] Термин «растение», применяемый в настоящей заявке, означает организмы, относящиеся к царству растений. Примеры растений включают, без ограничений, семенные растения, моховидные, настоящие папоротники и папоротниковидные. Примеры семенных растений включают, без ограничений, цикады, гинкго, хвойные, гнетофиты, покрытосеменные. Примеры моховидных включают, без ограничений, печеночные мхи, антоцеровые и мхи. Примеры настоящих папоротников включают, без ограничений, ужовниковидные (например, ужовники обыкновенные, лунники и гроздовники), марратиевые и тонкоспорангиатные настоящие папоротники. Примеры папоротниковидных включают, без ограничений, lycopsida (например, плауновидные, селагинеллы и полушники), псилотовые (например, ликоподы и псилоты) и хвощовые (например, хвощи).
[00127] Термин «гриб», применяемый в настоящей заявке, означает эукариотический организм, являющийся членом царства грибов. Примеры грибов включают, без ограничений, хитридиомицеты, бластокладиомицеты, неокаллимастигомицеты, зигомицеты, гломеромицеты, аскомицеты и базидиомицеты.
[00128] Термин «микроорганизм», применяемый в настоящей заявке, означает организм, являющийся микроскопическим (например, микрометровой длины). Примеры микроорганизмов включают, без ограничений, бактерии, грибки, археи, простейшие, микроскопические растения (например, зеленые водоросли) и микроскопических животных (например, планктон, планарий и амеб).
[00129] Некоторые примеры состояний, которые можно лечить при помощи способа, включают состояния, которые могут быть излечены при помощи исходного лекарственного средства в НРР. Например, без ограничений, астму, инфекции нижних и верхних дыхательных путей, аллергический ринит, аллергический конъюнктивит, зуд и ринит).
v) Способы применения HPP и их фармацевтических композиций при лечении состояний легких
[00130] Другой аспект настоящего изобретения относится к способу применения НРР или их фармацевтических композиций при лечении состояния легких, у биологического субъекта или субъекта путем введения НРР или его фармацевтической композиции биологическому субъекту или субъекту.
[00131] Такие состояния легких включают, но не ограничиваются ими, астму, инфекции нижних и верхних дыхательных путей, хронический бронхит, хроническое обструктивное заболевание легких, эмфизему, кистозный фиброз, пневмонию, саркоидозу, фиброз легких, аллергический ринит, аллергический конъюнктивит, зуд и ринорею.
[00132] В некоторых вариантах реализации способ лечения состояния легких, у субъекта включает введение субъекту терапевтически эффективного количества одного или более НРР или их фармацевтической композиции.
[00133] В некоторых вариантах реализации фармацевтическая композиция, как описано выше, содержит первую группу НРР и фармацевтически приемлемый носитель, где исходное(ые) лекарственное(ые) средство(а) первой группы НРР представляет(ют) собой первую группу исходных лекарственных средств, содержащую по меньшей мере одно исходное лекарственное средство, выбранное из группы, состоящей из антигистаминных средств, агонистов β2-адренергических рецепторов, ингибиторов белка, активирующего 5-липоксигеназу (FLAP), ингибиторов 5-липоксигеназы, антагонистов рецепторов лейкотриена, противовоспалительных лекарственных средств, средств от кашля и противоотечных средств. Исходные лекарственные средства первой группы исходных лекарственных средств могут быть одинаковыми или могут различаться и могут принадлежать к одному и тому же или к разным видам исходных лекарственных средств. Указанная фармацевтическая композиция может дополнительно содержать вторую группу НРР, где исходное(ые) лекарственное(ые) средство(а) второй группы НРР представляет(ют) собой вторую группу исходных лекарственных средств, и по меньшей мере одно исходное лекарственное средство второй группы исходных лекарственных средств выбрано из группы, состоящей из антибиотиков и противовоспалительных лекарственных средств. Исходные лекарственные средства второй группы исходных лекарственных средств могут быть одинаковыми или могут различаться и могут принадлежать к одному и тому же или к разным видам исходных лекарственных средств. Указанная фармацевтическая композиция может дополнительно содержать третью группу лекарственных средств, выбранных из группы, состоящей из силденафила, варденафила, тадалафила, ацетилденафила, аванафила, лоденафила, мироденафила, метапротеренола, клемастина, уденафила и солей указанных соединений, а также любых комбинаций указанных соединений.
[00134] В некоторых вариантах реализации первая фармацевтическая композиция содержит первую группу, вторую группу и/или третью группу НРР и фармацевтически приемлемый носитель, и сперва первую фармацевтическую композицию наносят субъекту, а затем после улучшения состояния вторую фармацевтическую композицию, содержащую вторую группу НРР (например, НРР аспирина), и фармацевтически приемлемый носитель, вводят субъекту для предотвращения повторного развития состояния легких.
[00135] Один или более НРР или их фармацевтическая композиция может быть введена биологическому субъекту при помощи любого способа введения, известного в данной области, включая, без ограничений, пероральное, энтеральное, трансбуккальное, назальное, местное, ректальное, вагинальное, аэрозольное, трансмукозальное, эпидермальное, трансдермальное, дермальное, офтальмологическое, легочное, подкожное и/или парентеральное введение. Фармацевтические композиции могут быть введены в различных стандартных лекарственных формах в зависимости от способа введения.
[00136] Парентеральное введение относится к способу введения, обычно относящемуся к инъекции, включающей, но, не ограничивающейся ими, внутривенную, внутримышечную, внутриартериальную, внутриоболочечную, внутрикапсулярную, внутриглазничную, внутрисердцечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, подпаутинную, интраспинальную и/или внутригрудинную инъекцию и/или инфузию.
[00137] Один или более НРР или их фармацевтическая композиция может быть введена биологическому субъекту в виде составов или препаратов, подходящих для каждого из способов введения. Составы, подходящие для применения в способах согласно настоящему изобретению, содержат один или более НРР, один или более фармацевтически приемлемых носителей для них и возможно другие терапевтические ингредиенты. Составы могут быть представлены в стандартной лекарственной форме и могут быть получены при помощи любых способов, хорошо известных в области фармации. Количество активного ингредиента, которое может быть объединено с носителем для получения единичной лекарственной формы, изменяется в зависимости от субъекта, подвергающегося лечению, и конкретного способа введения. Количество НРР, которое может быть объединено с носителем для получения фармацевтически эффективной дозы, обычно представляет собой количество НРР, которое обеспечивает терапевтический эффект. Как правило, в расчете на сто процентов указанное количество находится в диапазоне от примерно 0,01 процента до примерно девяносто девяти процентов НРР, предпочтительно от примерно 0,1 процента до примерно 20 процентов.
[00138] Способы получения таких составов или композиций включают стадию смешивания НРР с одним или более фармацевтически приемлемыми носителями и возможно одним или более вспомогательными ингредиентами. В целом, составы получают путем равномерного и тщательного смешивания НРР с жидкими носителями, тонкоизмельченными твердыми носителями или и теми и другими и, в случае необходимости, с последующим формованием продукта.
[00139] Составы, подходящие для перорального введения, могут быть представлены в виде капсул, облаток, пилюль, таблеток, леденцов (с применением ароматизированной основы, обычно сахарозы и гуммиарабика или трагаканта), порошков, гранул, в виде раствора или суспензии в водной или неводной жидкости, в виде жидкой эмульсии вида масло-в-воде или вода-в-масле, в виде эликсира или сиропа, пастилок (с применением инертного основания, такого как желатин и глицерин или сахароза и гуммиарабик) и/или в виде жидкости для полоскания рта и т.п., где каждая из форм содержит заранее определенное количество НРР в качестве активного ингредиента. Соединение также может быть введено в виде болюса, электуария или пасты.
[00140] В твердых лекарственных формах для перорального введения (например, капсулах, таблетках, пилюлях, драже, порошках, гранулах и т.п.) НРР смешивают с одним или более фармацевтически приемлемыми носителями, такими как цитрат натрия или фосфат дикальция, и/или с любым из следующих: (1) наполнители или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие агенты, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или гуммиарабик; (3) увлажнители, такие как глицерин; (4) разрыхлители, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) агенты, замедляющие растворение, такие как парафин; (6) ускорители абсорбции, такие как четвертичные аммониевые соединения; (7) смачивающие агенты, такие как, например, цетиловый спирт и глицеринмоностеарат; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и смеси указанных соединений; и (10) красители. В случае капсул, таблеток и пилюль фармацевтические композиции также могут содержать буферные агенты. Твердые композиции подобного вида также можно применять в качестве наполнителей мягких и жестких желатиновых капсул, в которых используют такие вспомогательные вещества, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и т.п.
[00141] Таблетка может быть получена путем прессования или формования возможно с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены с применением связующего агент (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, натриевая соль гликолята крахмала или сшитая натриевая соль карбоксиметилцеллюлозы), поверхностно-активного вещества или диспергатора. Формованные таблетки могут быть получены путем формования в подходящем устройстве смеси порошкообразных НРР или композиций НРР, смоченных инертным жидким разбавителем. На таблетки и другие твердые лекарственные формы, такие как драже, капсулы, пилюли и гранулы, можно наносить насечки или покрытия и оболочки, такие как кишечнорастворимые покрытия и другие покрытия, хорошо известные в области получения фармацевтических препаратов. Они также могут быть получены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение НРР, с применением, например, гидроксипропилметилцеллюлозы в различных пропорциях для обеспечения желаемого профиля высвобождения, других полимерных матриц, липосом и/или микросфер. Они могут быть стерилизованы, например, путем фильтрования через фильтр, удерживающий бактерии, или путем включения стерилизующих агентов в форме твердых стерильных композиций, которые могут быть растворены в стерильной воде, или других стерильных сред для инъекций непосредственно перед применением. Указанные композиции также могут содержать замутняющие агенты и могут представлять собой композицию, которая высвобождает только или предпочтительно НРР в конкретном участке желудочно-кишечного тракта, возможно замедленным образом. Примеры композиций, которые могут быть применены, включают полимерные вещества и воски. НРР также может находиться в форме микрокапсул, при необходимости, с одним или более вспомогательными веществами, описанными выше.
[00142] Жидкие лекарственные формы для перорального, трансдермального или местного введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к НРР жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области, такие как, например, вода или другие растворителя, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло ростков пшеницы, оликовое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли, сложные эфиры жирных кислот и сорбитана и смеси указанных соединений. Помимо инертных разбавителей пероральные композиции также могут содержать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы, красители, отдушки и консерванты.
[00143] В дополнение к НРР суспензии могут содержать суспендирующие агенты, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагакант и смеси указанных соединений.
[00144] Составы для ректального или вагинального введения могут быть представлены в виде суппозиториев, которые могут быть получены путем смешивания одного или более НРР с одним или более подходящими нераздражающими вспомогательными веществами или носителями, содержащими, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, которые являются твердыми при комнатной температуре и жидкостями при температуре тела и, следовательно, растапливаются в прямой кишке или вагинальной полости и высвобождают активный агент. Составы, которые подходят для вагинального введения, также включают составы в виде пессариев, тампонов, кремов, гелей, паст, пен и спреев, содержащие носители, которые, как известно в данной области, являются подходящими.
[00145] Составы для местного, трансдермального, эпидермального или дермального введения композиции НРР включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляторы. Активный компонент может быть смешан в стерильных условиях с фармацевтически приемлемым носителем и с любыми требуемыми консервантами, буферами или пропеллентами. В дополнение к композиции НРР мази, пасты, кремы и гели могут содержать вспомогательные вещества, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк, оксид цинка или смеси указанных веществ. В дополнение к композиции НРР порошки и спреи могут содержать вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция, полиамидный порошок или смеси указанных веществ. Спреи могут дополнительно содержать традиционные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Наилучшими составами для местного или трансдермального введения являются чистая вода, раствор, водный раствор, смесь этанола и воды, смесь изопропанола и воды.
[00146] Альтернативно НРР или его фармацевтическая композиция могут быть введены в виде аэрозоля. Это может быть достигнуто путем получения водного аэрозоля, липосомного препарата или твердых частиц, содержащих НРР. Может быть использована неводная суспензия (например, фторуглеродный пропеллент). Также могут быть использованы ультразвуковые небулайзеры. Водный аэрозоль получают путем приготовления водного раствора или суспензии агента вместе с обычными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы могут меняться в зависимости от конкретного соединения и обычно включают неионогенные поверхностно-активные вещества (Tween, плюроники или полиэтиленгликоль), нетоксичные белки, такие как сывороточный альбумин, сложные эфиры сорбитана, олеиновая кислота, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахарные спирты. Аэрозоли обычно получают из изотонических растворов.
[00147] Трансдермальные пластыри также могут быть использованы для доставки композиций НРР к целевому участку. Такие составы могут быть получены путем растворения или диспергирования агента в соответствующей среде. Усилители абсорбции также могут быть использованы для увеличения потока композиций НРР, проходящего через кожу. Скорость такого потока можно контролировать путем включения мембраны, контролирующей скорость, или диспергирования композиций НРР в полимерной матрице или геле.
[00148] Офтальмологические составы, глазные мази, порошки, растворы и т.п., также входят в объем настоящего изобретения.
[00149] Составы, подходящие для парентерального введения, содержат НРР в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые непосредственно перед применением могут быть восстановлены с получением стерильных растворов или дисперсий для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты, растворенные вещества, которые делают состав изотоническим с кровью предполагаемого реципиента, суспендирующие агенты или загустители.
[00150] Примеры подходящих водных и неводных носителей, которые могут быть применены в составах, подходящих для парентерального введения, включают воду, этанол, многоатомные спирты (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и подходящие смеси указанных соединений, растительные масла, например, оливковое масло, и инъекционные сложные органические эфиры, такие как этилолеат. Подходящую текучесть можно поддерживать, например, путем применения покрывающих материалов, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ.
[00151] Составы, подходящие для парентерального введения, также могут содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Предотвращение роста микроорганизмов может быть обеспечено путем добавления различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Также может быть желательным добавление в композиции изотонических агентов, таких как сахара, хлорид натрия и т.п. Кроме того, путем добавления агентов, способных замедлять абсорбцию, таких как моностеарат алюминия и желатин, может быть обеспечена пролонгированная абсорбция инъецируемой фармацевтической формы.
[00152] Инъецируемые депо-формы могут быть изготовлены путем получения микроинкапсулированных матриц из НРР или в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения НРР к полимеру и природы конкретного используемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые депо-составы также получают путем включения НРР в липосомы или микроэмульсии, которые совместимы с тканями организма.
[00153] В некоторых вариантах реализации один или более НРР или их фармацевтическую композицию доставляют к участку с активным проявлением состояния в терапевтически эффективной дозе. Как известно в области фармакологии, точное значение фармацевтически эффективной дозы НРР, которое приводит к наиболее эффективным результатам с точки зрения эффективности лечения конкретного пациента, зависит, например, от активности, природы, фармакокинетики, фармакодинамики и биодоступности конкретного НРР, физиологического состояния субъекта (включая, расу, возраст, пол, вес, диету, тип и стадию заболевания, общее физическое состояние, восприимчивость к получаемым типам и дозировкам лекарственных средств), природы фармацевтически приемлемых носителей, входящих в состав, способа и частоты введения и тяжести или предрасположенности к развитию состояния, подвергающегося лечению. Тем не менее, приведенные выше рекомендации можно применять в качестве основы для регулирования лечения, например, определения оптимальной вводимой дозы, для которого достаточно стандартных экспериментальных процедур, включающих мониторинг субъекта и регулировку дозировок. Remington: The Science and Practice of Pharmacy (Gennaro ed. 20.sup.th edition, Williams & Wilkins PA, USA) (2000).
[00154] В некоторых вариантах реализации комбинацию одного или более НРР и/или других лекарственных средств применяют на субъекте для достижения желаемой цели (например, лечения, скрининга и т.п.).
[00155] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
IV. ПРЕИМУЩЕСТВА
[00156] В некоторых вариантах реализации, поскольку НРР или НРС согласно настоящему изобретению способны преодолевать один или боле биологических барьеров, НРР или НРС можно вводить локально (например, местно или трансдермально) для достижения участка с развитием состояния без необходимости системного введения (например, перорального или парентерального введения). Локальное введение и проникновение НРР или НРС позволяет НРР или НРС достигать аналогичного значения локальной концентрации агента или лекарственного средства при значительно меньшей дозировке НРР или НРС по сравнению с системным введением исходного агента или лекарственного средства; альтернативно, более высокого значения локальной концентрации, которое не может быть достигнуто при системном введении, или, в случае возможности достижения, требует значительно больших дозировок агента при системном введении. Более высокое значение локальной концентрации НРР/НРС или их исходных агентов, в случае расщепления, позволяет лечить состояние более эффективно или гораздо быстрей по сравнению с системной доставкой исходного агента и лечить новые состояния, которые ранее не поддавались лечению или не наблюдались. Локальное введение НРР или НРС способно снижать неудобства, испытываемые биологическим субъектом при системном введении, например, побочные реакции, связанные с системным воздействием агента, воздействие на желудочно-кишечный тракт/почки. Кроме того, локальное введение позволяет НРР или НРС преодолевать множество биологических барьеров и системно попадать, например, в общий кровоток, и тем самым устранять необходимость системного введения (например, путем инъекции) и боль, связанную с парентеральной инъекцией.
[00157] В некоторых вариантах реализации НРР/НРС или фармацевтическую композицию согласно настоящему изобретению можно вводить системно (например, перорально, трансдермально или парентерально). НРР/НРС или активный агент (например, лекарственное средство или метаболит) в составе НРР/НРС или может попадать в общий кровоток быстрей, чем исходный агент, и обеспечивать более быстрый доступ к участку с активным развитием состояния. Кроме того, НРР/НРС может преодолевать биологический барьер (например, гематоэнцефалический барьер и гематомолочный барьер), который является непреодолимым для исходного агента, вводимого индивидуально, и, следовательно, обеспечивает новые возможности лечения состояний, которые ранее не поддавались лечению или не наблюдались.
V. ПРИМЕРЫ
[00158] Следующие примеры представлены для лучшей иллюстрации заявленного изобретения и не должны считаться в качестве ограничивающих объем настоящего изобретения в какой-либо степени. Все конкретные композиции, материалы и способы, описанные ниже, в целом или по отдельности, входят в объем настоящего изобретения. Указанные конкретные композиции, материалы и способы не ограничивают настоящее изобретение и представлены исключительно для иллюстрации конкретных вариантов реализации, входящих в объем настоящего изобретения. Специалист в данной области может разработать эквивалентные композиции, материалы и способы без отступления от сущности и объема настоящего изобретения. Следует иметь в виду, что в процедуры, описанные в настоящей заявке, можно вносить множество изменений, оставаясь в рамках настоящего изобретения. Согласно авторам настоящего изобретения такие изменения включены в объем настоящего изобретения. Кроме того, все ссылки, приведенные в настоящей заявке, включены во всей полноте посредством ссылки, как если бы они были полностью изложены в настоящей заявке.
Пример 1. Получение HPP из исходного лекарственного средства
[00159] В некоторых вариантах реализации исходное соединение, имеющее следующую структуру F-C:
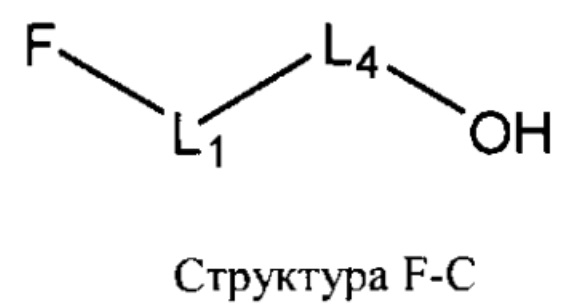
превращали в НРР со структурой L-1:
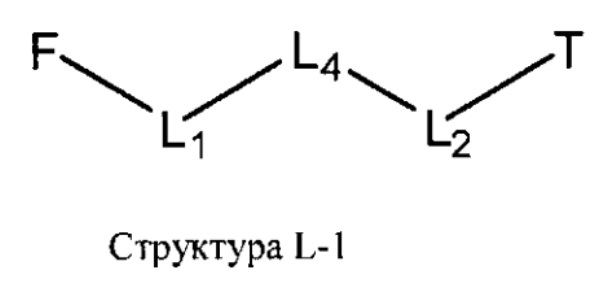
включая стереоизомеры и фармацевтически приемлемые соли указанной структуры, где:
F, L1, L2 и L4 являются такими, как определено выше;
Т представляет собой транспортный фрагмент НРР. Например, Т выбран из группы, состоящей из W и R6, как определено выше.
[00160] В некоторых вариантах реализации настоящего изобретения НРР со структурой L-1 получали при помощи органического синтеза путем взаимодействия исходных соединений или производных исходных соединений, имеющих структуру D (например, галогенангидридов кислот, смешанных ангидридов исходных соединений и т.п.):
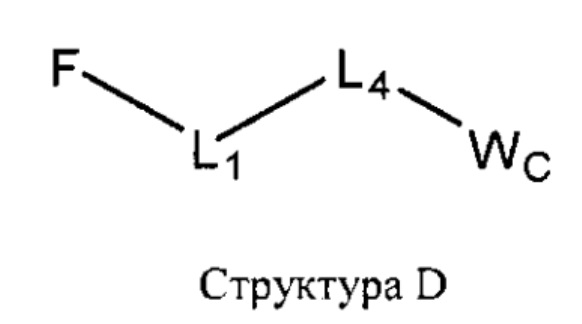
с соединениями со структурой Е (схема 1):
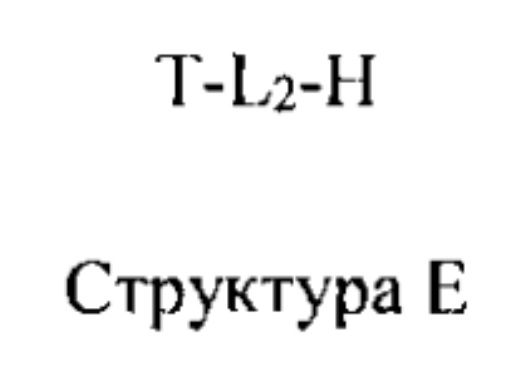
где WC выбран из группы, состоящей из ОН, галогена, алкоксикарбонила и замещенного арилоксикарбонилокси; и
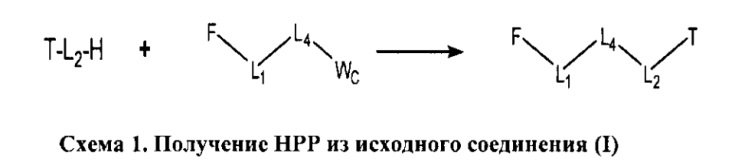
F, L1, L2 и L4 и Т являются такими, как определено выше.
[00161] В некоторых вариантах реализации НРР со структурой L-1 получали в соответствии со схемой 1, как описано выше, где L4 представляет собой С=O.
[00162] В некоторых вариантах реализации исходное соединение, имеющее следующую структуру F-N:

взаимодействовало с соединением, имеющим следующую структуру G:

с получением НРР со структурой L-1:
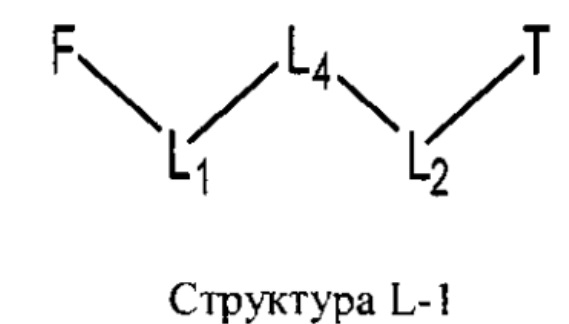
включая стереоизомеры и фармацевтически приемлемые соли указанной структуры, где:
F, L1, L2 и L4 являются такими, как определено выше;
Т представляет собой транспортный фрагмент НРР. Например, Т выбран из группы, состоящей из W и R6, как определено выше; и
М выбран из группы, состоящей из Na, K или другого металл. WN выбран из группы, состоящей из ОН, галогена, алкоксикарбонила и замещенного арилоксикарбонилокси. (Схема 2)
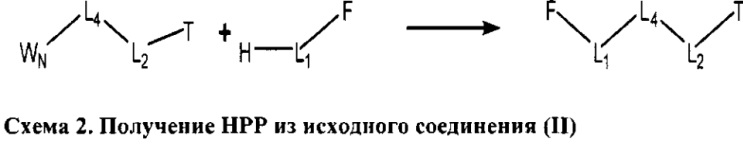
[00163] В некоторых вариантах реализации НРР со структурой L-1 получали при помощи органического синтеза, в котором нежелательные для превращения реакционноспособные фрагменты, такие как -С(=O)ОН, -NH2, -ОН или -SH, защищали перед связыванием транспортного фрагмента с функциональным фрагментом в соответствии с одним из способов синтеза, описанных выше. В некоторых вариантах реализации с полученного защищенного НРР дополнительно может быть частично или полностью снята защита с получением частично защищенного НРР или незащищенного НРР, соответственно.
Пример 2. Лечение астмы и/или других состояний легких
[00164] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, 50 мг гидрохлорида диэтиламиноэтилацетилсалицата, 30 мг гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (примера НРР зилеутона), 3 мг гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (или гидрохлорида метапротеренолтриацетата, примера НРР метапротеренола) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (примера НРР фексофенадина) в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 50 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 3. Лечение астмы и/или других состояний легких
[00165] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, 30 мг гидрохлорида диэтиламиноэтилацетилсалицата, 3 мг гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (примера НРР монтелукаста), 3 мг гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (или гидрохлорида метапротеренолтриацетата, примера НРР метапротеренола) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (примера НРР фексофенадина) в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 4. Лечение астмы и/или других состояний легких
[00166] Гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, 30 мг гидрохлорида диэтиламиноэтилацетилсалицата, 3 мг гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (примера НРР монтелукаста), 3 мг гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (или гидрохлорида метапротеренолтриацетата, примера НРР метапротеренола) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (примера НРР фексофенадина) в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата и 3 мг клемастина [(2R)-2-{2-[(1R)-1-(4-хлорфенил)-1-фенилэтокси]этил}-1-метилпирролидина] в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 5. Лечение астмы и/или других состояний легких
[00167] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (НРР цефокситина), 15 мг гидрохлорида диэтиламиноэтил-2-(п-изобутилфенил)пропионата, 3 мг гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (пример НРР монтелукаста), 2 мг гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата [НРР тербуталина] и 5 мг изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата и 3 мг гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 6. Лечение аллергического ринита, аллергического конъюнктивита, зуда и ринореи
[00168] 10 мг гидрохлорида диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, 3 мг диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, 0,5 мг гидрохлорида (RS)-6-[2-(трет-бутиламино)-1-ацетилоксиэтил]-2-(ацетилоксиметил)-3-ацетилоксипиридина (или гидрохлорида пирбутеролтриацетата, НРР пирбутерола) и 10 мг дифенгидрамина [2-(дифенилметокси)-N,N-диметилэтанамина] в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата и 3 мг гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 7. Лечение аллергического ринита, аллергического конъюнктивита, зуда и ринореи
[00169] 20 мг гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата, 3 мг диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и 5 мг изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 8. Лечение инфекции нижних дыхательных путей
[00170] 30 мг гидрохлорида сложного 2-пирролидинметилового эфира D-α-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллиновой кислоты (НРР азлоциллина), 30 мг гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата, 3 мг гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и 5 мг изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата в 0,5 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) в течение 2 недель или до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 9. Лечение инфекции верхних дыхательных путем
[00171] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-]-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (НРР пиперациллина), 10 мг гидрохлорида 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, 30 мг гидрохлорида диэтиламиноэтилацетилсалицата, 30 мг гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, 3 мг гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата и 5 мг изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) в течение 2 недель или до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 10. Лечение астмы и/или других состояний легких
[00172] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, 30 мг гидрохлорида диэтиламиноэтилацетилсалицата, 30 мг гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (примера НРР зилеутона), 15 мг цитрата силденафила (примера соединения, имеющего структуру ФДЭ5-I-1, где НА представляет собой лимонную кислоту) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (примера НРР фексофенадина) в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 11. Лечение астмы и/или других состояний легких
[00173] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, 30 мг гидрохлорида диэтиламиноэтилацетилсалицата, 30 мг гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, 5 мг варденафил •HCl (примера соединения, имеющего структуру ФДЭ5-I-2, где НА представляет собой HCl) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 12. Лечение астмы и/или других состояний легких
[00174] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, 30 мг гидрохлорида диэтиламиноэтилацетилсалицата, 3 мг гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (примера НРР монтелукаста), 5 мг тадалафил •HCl (примера соединения, имеющего структуру ФДЭ5-I-3, где НА представляет собой HCl) и 5 мг изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 13. Лечение астмы и/или других состояний легких
[00175] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, 15 мг гидрохлорида диэтиламиноэтил-2-(п-изобутилфенил)пропионата, 3 мг гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, 10 мг гидрохлорида уденафила (примера соединения, имеющего структуру ФДЭ5-I-8, где НА представляет собой HCl) и 3 мг клемастина в 1 мл воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) в течение 1-2 месяцев; затем 30 мг гидрохлорида диэтиламиноэтил-2-(п-изобутилфенил)пропионата, 3 мг диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и 5 мг изопропил-(Е)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 14. Лечение астмы и/или других состоянии легких
[00176] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты,, 15 мг гидрохлорида диэтиламиноэтил-2-(п-изобутилфенил)пропионата, 30 мг гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (примера НРР зилеутона), 10 мг цитрата силденафила (примера соединения, имеющего структуру ФДЭ5-I-1, где НА представляет собой лимонную кислоту) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (примера НРР фексофенадина) в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 15. Лечение астмы и/или других состояний легких
[00177] 30 мг гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты,, 15 мг гидрохлорида диэтиламиноэтил-2-(п-изобутилфенил)пропионата, 30 мг гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, 10 мг варденафил •HCl (примера соединения, имеющего структуру ФДЭ5-I-2, где НА представляет собой HCl) и 30 мг гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата в 0,5 мл 25% раствора этанола наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) до облегчения состояния. Затем 30 мг гидрохлорида диэтиламиноэтилацетилсалицата в 0,5 воды наносили на кожу грудной клетки субъекта каждое утро и вечер (дважды в день) для предотвращения повторного возникновения состояния.
Пример 16. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00178] 48 самкам мышей линии BALB/c в возрасте от 4 до 6 недель вводили внутрибрюшинную инъекцию 0,4 мл фосфатного буферного солевого раствора, содержащего 50 мкг яичного альбумина и 2,0 мг гидроксида алюминии, в 1 и 8 дни. Иммунизированных мышей подвергали воздействию аэрозоля 2,5% яичного альбумина в фосфатном буферном солевом растворе в течение 30 минут в день на 15 и 22 день. 12 мышам проводили симуляцию иммунизации, подвергали воздействию фосфатным буферным солевым раствором и определяли как контрольную группу (группа 1).
[00179] 48 исследуемых мышей случайным образом разделяли на 5 групп: группа симулируемого контроля (группа 1, n=6), группа отрицательного контроля (группа 2, n=6), группа с низкой дозировкой (группа 3, n=12), группа с умеренной дозировкой (группа 4, n=12) и группа с высокой дозировкой (группа 5, n=12). В период с 15 по 22 день мышам группы 1 (группы симулируемого контроля) и группы 2 (группы отрицательного контроля) один раз в сутки вводили носитель (25% смесь этанол/вода, вводимые объемы были такими же, как объемы лекарственных средств для группы с высокой дозировкой).
[00180] В период с 14 по 22 день в группе 3 (группе с низкой дозировкой) каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 3-пиперидинметилового эфира 6-феноксиацетацетамидопенициллановой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода, НРР пенициллина V), гидрохлорида дибутиламиноэтилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода, НРР аспирина), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (НРР зилеутона, структура AS-2) (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (или гидрохлорида метапротеренолтриацетата, НРР метапротеренола, структура AS-4) (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода), гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (НРР фексофенадина, структура AS-3) (10 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00181] В период с 15 по 22 день в группе 4 (группе с умеренной дозировкой) каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 3-пиперидинметилового эфира 6-феноксиацетацетамидопенициллановой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида дибутиламиноэтилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (20 мг/кг, 4% раствор в 25% смеси этанол/вода).
[00182] В период с 15 по 22 день в группе 5 (группе с высокой дозировкой) каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 3-пиперидинметилового эфира 6-феноксиацетацетамидопенициллановой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида дибутиламиноэтилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (30 мг/кг, 6% раствор в 25% смеси этанол/вода).
[00183] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
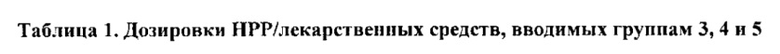
[00184] Чувствительность дыхательных путей (транспульмональную резистентность (RL) и динамическую податливость (Cdyn)) к ингалируемому β-метахолину определяли у мышей на день 2) через 3 часа после последнего введения исследуемых веществ и носителя (введение начинали после последней провокации метахолином). Животных анестезировали смесью кетамина и ксилазина, подвергали трахеостомии и проводили искусственную вентиляцию при помощи плетизмографической камеры. Изменения объема при расширении грудной клетки и изменения давления в трахее измеряли в ответ на обработку солевым раствором с последующим увеличением концентраций β-метахолина (6,25, 12,5, 25 и 50 мг/мл). Пиковые значения считали максимальным ответом на исследуемую концентрацию метахолина и выражали в виде процентного изменения относительно контроля с использованием солевого раствора. Результаты приведены в таблице 1.1.
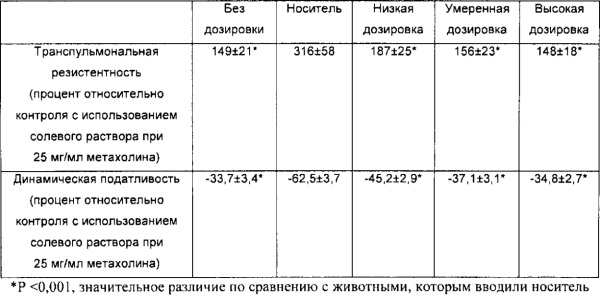
[00185] В день 22 мышей умерщвляли при помощи пентобарбитала натрия. Полость грудной клетки каждого из животных осторожно вскрывали, после чего трахею раскрывали и катетеризировали. Закрепляли катетер и в трех аликвотах (0,3, 0,3 и 0,4 мл, соответственно) общим объемом 1 мл вводили фосфатно-солевой буфер (ФСБ), содержащий 0,5% раствор цитрата натрия. Жидкость бронхоальвеолярного лаважа (BALF) извлекали и помещали в лед. Сразу же проводили подсчет общего количества клеток в камере с сеткой Нейбауэра. Дифференциальный подсчет клеток проводили с применением центрифужных препаратов, окрашенных по методу Розенфельда. После центрифугирования (405 × g в течение 5 мин при 4°C) надосадочные BALF собирали и хранили при -70°C для последующего определения содержаний цитокинов. Результаты приведены в таблице 1.2.
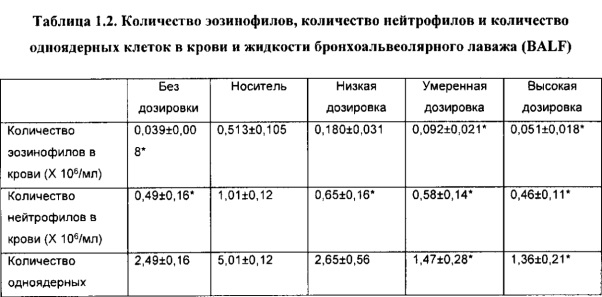
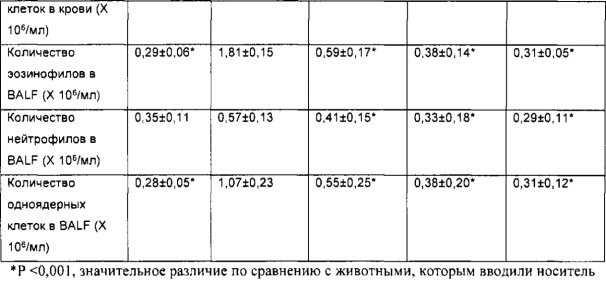
[00186] Легкие мышей удаляли, взвешивали, гомогенизировали в 1,0 мл ФСБ и центрифугировали (405 × g в течение 5 мин при 4°C). Надосадочные жидкости собирали и хранили при -70°C для последующего определения содержаний цитокинов. Определяли содержание цитокинов на мг ткани. Коммерчески доступные антитела для фермент-связанного иммуносорбентного исследования применяли для измерения IL-5 в гомогенатах легких. Значения чувствительности составляли >10 пк/мл. Результаты приведены в таблице 1.3.

[00187] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 17. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00188] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16.48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Применяли аналогичные дозировки и НРР исходного лекарственного средства и возможно другие звенья-носители, как показано в таблице 2.
[00189] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
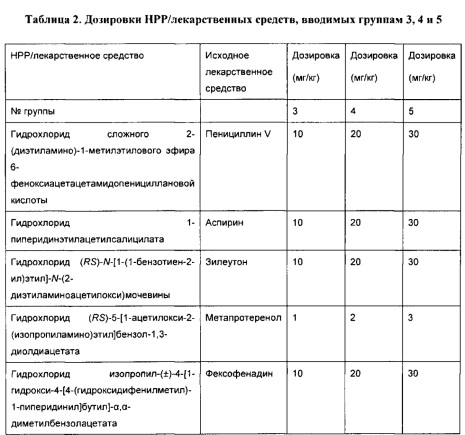
[00190] В частности, в период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)-1-метилэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 1-пиперидинэтилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил] -α,α-диметилбензолацетата (НРР фексофенадина, структура AS-3) (10 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00191] В период с 15 по 22 день в группе 4 (группе с умеренной дозировкой) каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 1-пиперидинэтилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (20 мг/кг, 4% раствор в 25% смеси этанол/вода).
[00192] В период с 15 по 22 день в группе 5 (группе с высокой дозировкой) каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 1-пиперидинэтилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (30 мг/кг, 6% раствор в 25% смеси этанол/вода).
[00193] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 2.1.
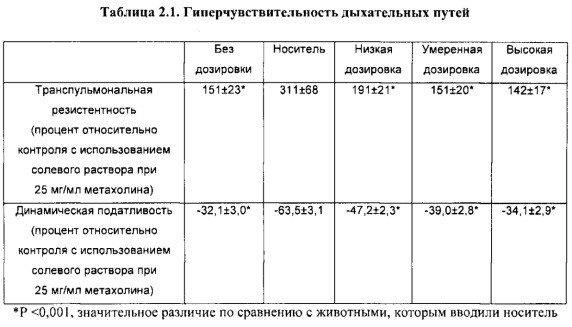
[00194] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 2.2.
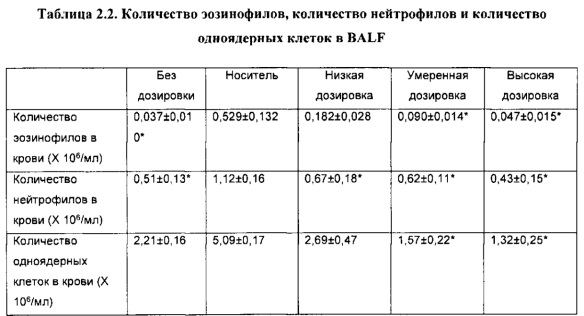
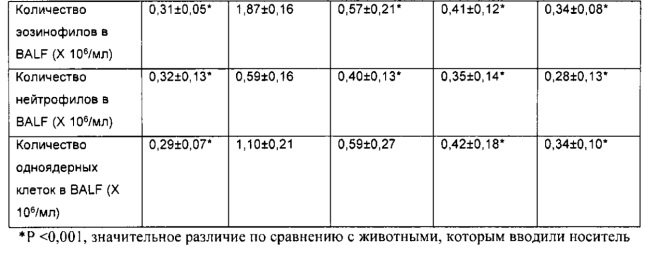
[00195] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 2.3.

[00196] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 18. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00197] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00198] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 4-пиперидинметилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 3-пиперидинметилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (1 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата (0,6 мг/кг, 0,2% раствор в 25% смеси этанол/вода) и клемастина [(2R)-2-{2-[(1R)-1-(4-хлорфенил)-1-фенилэтокси]этил}-1-метилпирролидина] (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода).
[00199] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 4-пиперидинметилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 3-пиперидинметилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (2 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата (1,2 мг/кг, 0,4% раствор в 25% смеси этанол/вода) и клемастина [(2R)-2-{2-[(1R)-1-(4-хлорфенил)-1-фенилэтокси]этил}-1-метилпирролидина] (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода).
[00200] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 4-пиперидинметилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 3-пиперидинметилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (3 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата (1,8 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и клемастина [(2R)-2-{2-[(1R)-1-(4-хлорфенил)-1-фенилэтокси]этил}-1-метилпирролидина] (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода).
[00201] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 3.
[00202] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
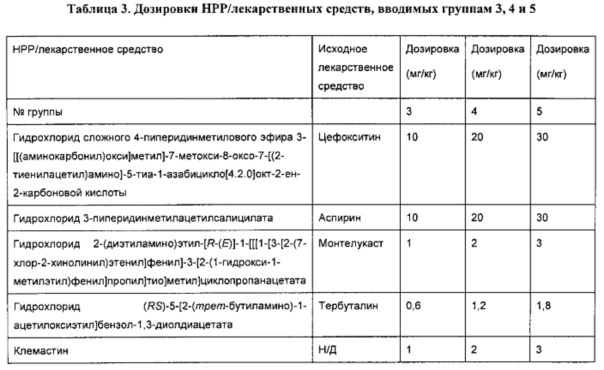
[00203] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 3.1.
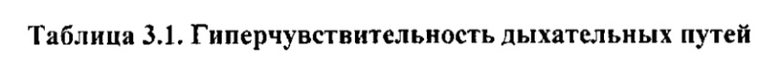
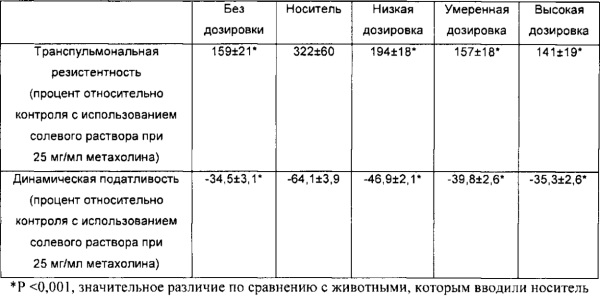
[00204] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 3.2.
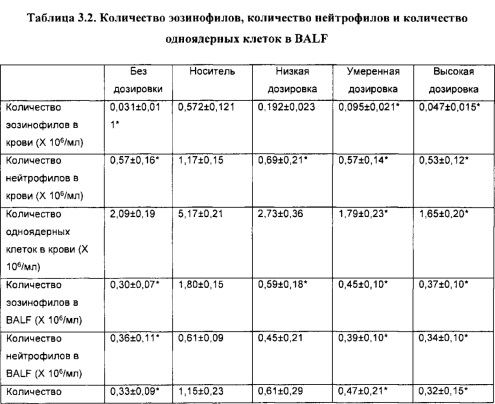

[00205] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 3.3.

[00206] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 19. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00207] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00208] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 4-пиперидинметилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 3-пиперидинметил-2-(п-изобутилфенил)пропионата (5 мг/кг, 1% раствор в 25% смеси этанол/вода), гидрохлорида 2-пирролидинметил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетата (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата (0,6 мг/кг, 0,2% раствор в 25% смеси этанол/вода) и клемастина (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода).
[00209] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 4-пиперидинметилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 3-пиперидинметил-2-(п-изобутилфенил)пропионата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-пирролидинметил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетата (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата (1,2 мг/кг, 0,4% раствор в 25% смеси этанол/вода) и клемастина (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода).
[00210] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 4-пиперидинметилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 3-пиперидинметил-2-(п-изобутилфенил)пропионата (15 мг/кг, 3% раствор в 25% смеси этанол/вода), гидрохлорида 2-пирролидинметил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетата (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата (1,8 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и клемастина (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода).
[00211] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 4.
[00212] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
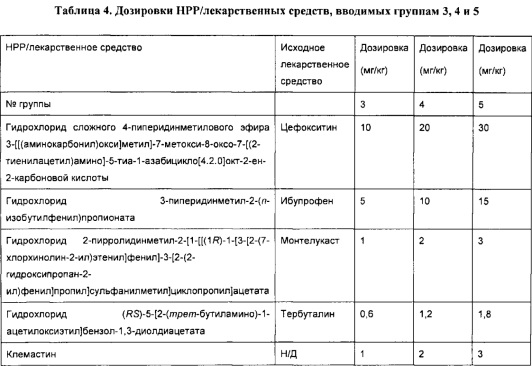
[00213] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 4.).
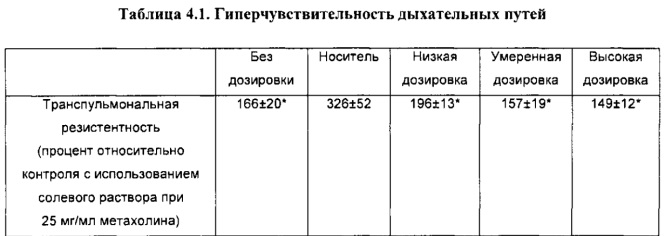

[00214] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 4.2.
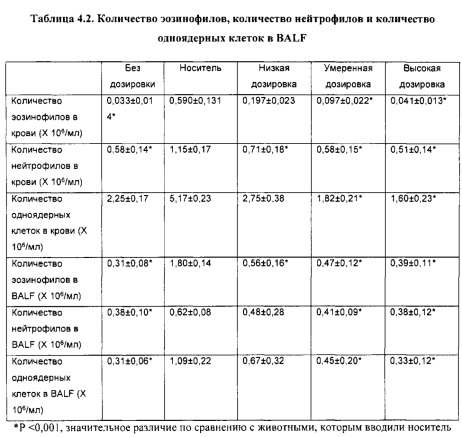
[00215] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 4.3.

[00216] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 20. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00217] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00218] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида 2-пирролидинметил-2-[(2,6-дихлорфенил)амино]бензолацетата (3 мг/кг, 1% раствор в 25% смеси этанол/вода), диэтиламиноэтил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетата (НРР монтелукаста, 1 мг/кг, 0,3% раствор в 25% смеси этанол/вода), гидрохлорида (R,S)α6-{[(1,1-диметилэтил)амино]метил}-3-ацетилокси-2,6-пиридиндиметанолдиацетата (0,2 мг/кг, 0,1% раствор в 25% смеси этанол/вода) и дифенгидрамина (3 мг/кг, 1% раствор в 25% смеси этанол/вода).
[00219] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида 2-пирролидинметил-2-[(2,6-дихлорфенил)амино]бензолацетата (6 мг/кг, 2% раствор в 25% смеси этанол/вода), диэтиламиноэтил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетата (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода), гидрохлорида (R,S)α6-{[(1,1-диметилэтил)амино]метил}-3-ацетилокси-2,6-пиридиндиметанолдиацетата (0,4 мг/кг, 0,2% раствор в 25% смеси этанол/вода) и дифенгидрамина (6 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00220] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида 2-пирролидинметил-2-[(2,6-дихлорфенил)амино]бензолацетата (9 мг/кг, 3% раствор в 25% смеси этанол/вода), диэтиламиноэтил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетата (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода), гидрохлорида (R,S)α6-{[(1,1-диметилэтил)амино]метил}-3-ацетилокси-2,6-пиридиндиметанолдиацетата (0,5 мг/кг, 0,3% раствор в 25% смеси этанол/вода) и дифенгидрамина (9 мг/кг, 3% раствор в 25% смеси этанол/вода).
[00221] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 5.
[00222] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
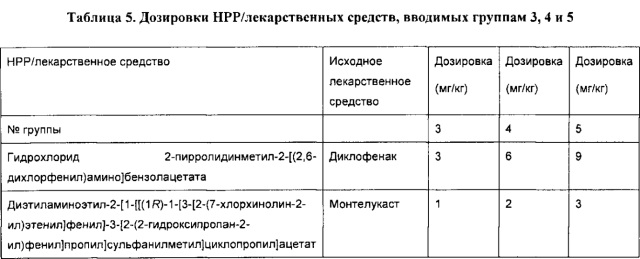
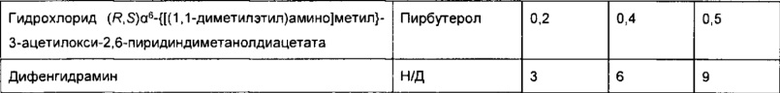
[00223] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены 5 в таблице 5.1.
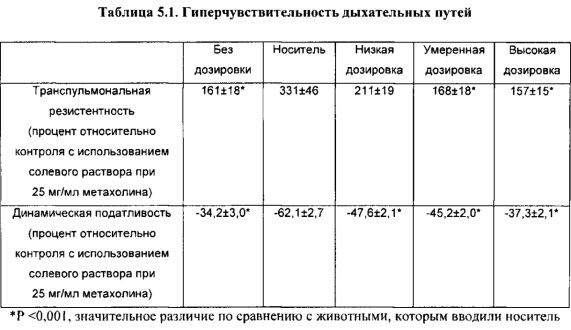
[00224] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 5.2.
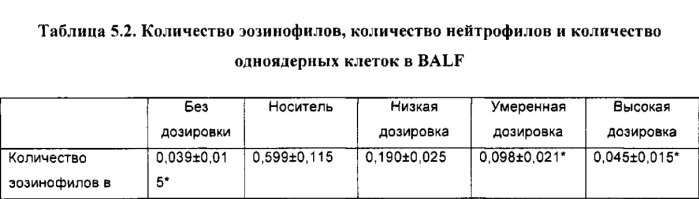
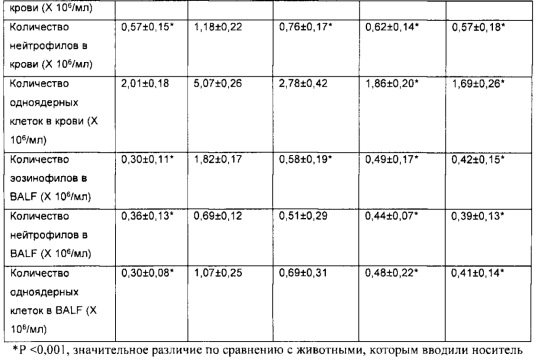
[00225] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 5.3.

[00226] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 21. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00227] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00228] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата (7 мг/кг, 1,5% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорид-ацетата (±)-α-[(трет-бутиламино)метил]-3,5-диацетилоксибензилового спирта (0,07 мг/кг, 0,05% раствор в 25% смеси этанол/вода) и доксиламина [(RS)-N,N-диметил-2-(1-фенил-1-пиридин-2-илэтокси)этанамина] (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода).
[00229] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата (14 мг/кг, 3% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорид-ацетата (±)-α-[(трет-бутиламино)метил]-3,5-диацетилоксибензилового спирта (0,14 мг/кг, 0,1% раствор в 25% смеси этанол/вода) и доксиламина (6 мг/кг, 1,2% раствор в 25% смеси этанол/вода).
[00230] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата (20 мг/кг, 4,5% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорид-ацетата (±)-α-[(трет-бутиламино)метил]-3,5-диацетилоксибензилового спирта (0,2 мг/кг, 0,15% раствор в 25% смеси этанол/вода) и доксиламина (9 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00231] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 6.
[00232] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
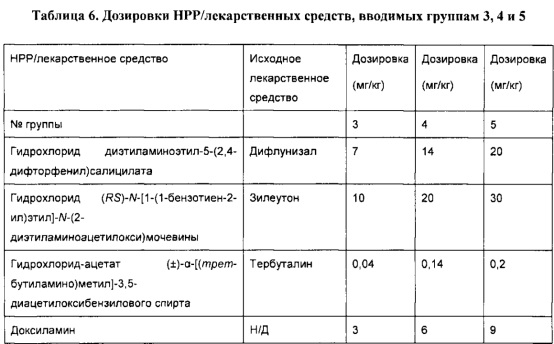
[00233] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 6.1.
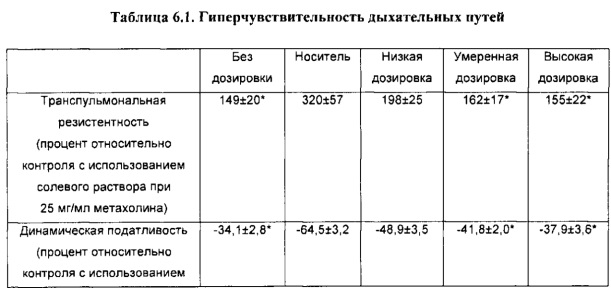

[00234] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 6.2.
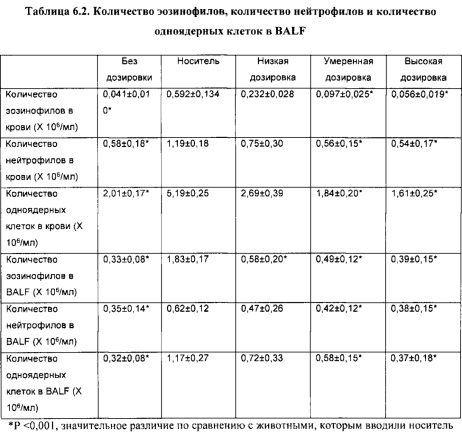
[00235] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 6.3.

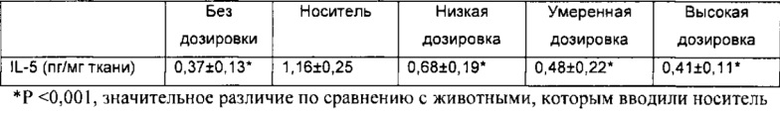
[00236] Результаты данного исследования показали, что исследуемые комбинации обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 22. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00237] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00238] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-пирролидинметилового эфира D-α-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллиновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода) и эфедрина (3 мг/кг, 1% раствор в 25% смеси этанол/вода).
[00239] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-пирролидинметилового эфира D-α-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллиновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и эфедрина (6 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00240] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-пирролидинметилового эфира D-α-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллиновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-5-(2,4-дифторфенил)салицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода) и эфедрина (9 мг/кг, 3% раствор в 25% смеси этанол/вода).
[00241] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 7.
[00242] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
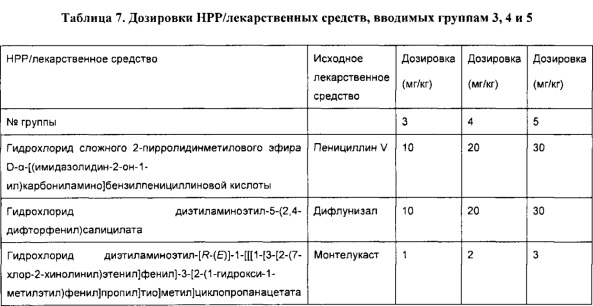

[00243] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 7.1.
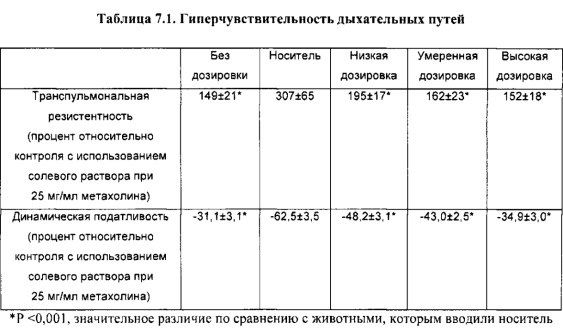
[00244] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 7.2.
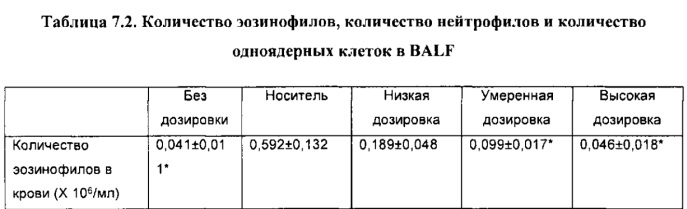
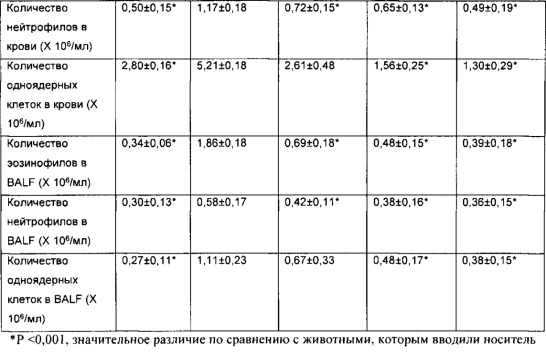
[00245] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 7.3.

[00246] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 23. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00247] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00248] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (НРР зилеутона, 10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (1 мг/кг, 0,2% раствор в 25% смеси этанол/вода) и левометамфетамина (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода).
[00249] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата (6 мг/кг, 1,2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (2 мг/кг, 0,4% раствор в 25% смеси этанол/вода) и левометамфетамина (6 мг/кг, 1,2% раствор в 25% смеси этанол/вода).
[00250] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата (9 мг/кг, 1,8% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и левометамфетамина (9 мг/кг, 1,8% раствор в 25% смеси этанол/вода) (6 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00251] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 8.
[00252] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.

[00253] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 8.1.
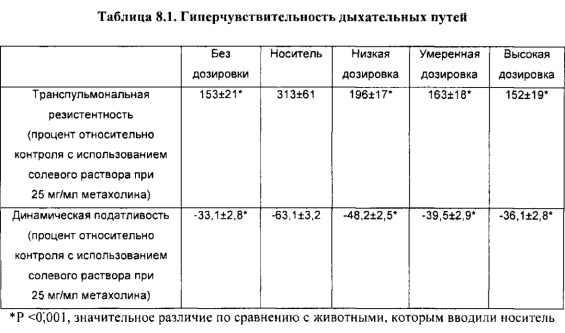
[00254] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 8.2.
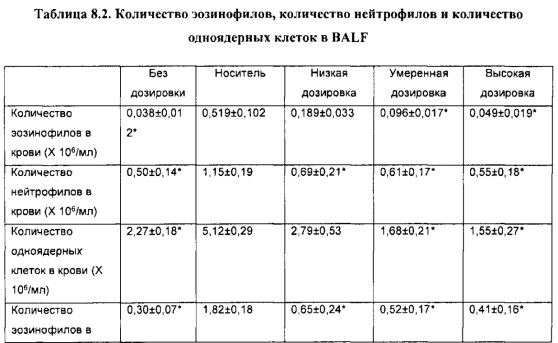
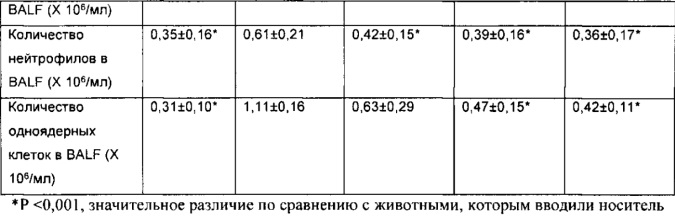
[00255] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 8.3.

[00256] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 24. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00257] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00258] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (НРР зилеутона, 10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (1 мг/кг, 0,2% раствор в 25% смеси этанол/вода) и изопропил-(E)-3-(6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (1,5 мг/кг, 0,1% раствор в 25% смеси этанол/вода).
[00259] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (2 мг/кг, 0,4% раствор в 25% смеси этанол/вода) и изопропил-(E)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (3 мг/кг, 0,2% раствор в 25% смеси этанол/вода).
[00260] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (4,5 мг/кг, 0,3% раствор в 25% смеси этанол/вода).
[00261] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 9.
[00262] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.

[00263] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 9.1.

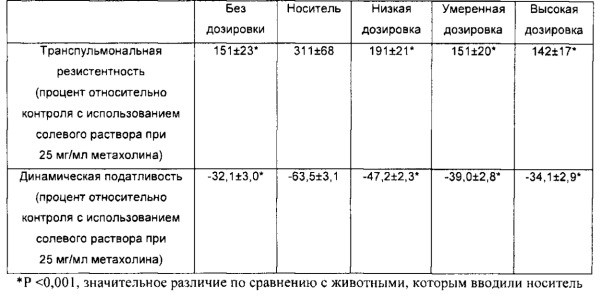
[00264] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 9.2.
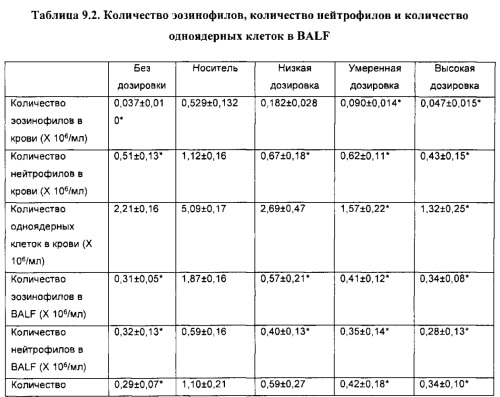

[00265] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 9.3.

[00266] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 25. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00267] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00268] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-феноксиацетацетамидопенициллановой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (НРР зилеутона, 10 мг/кг, 2% раствор в 25% смеси этанол/вода), цитрата силденафила (5 мг/кг, 2% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (10 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00269] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-феноксиацетацетамидопенициллановой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 4% раствор в 25% смеси этанол/вода), цитрата силденафила (10 мг/кг, 4% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (20 мг/кг, 4% раствор в 25% смеси этанол/вода).
[00270] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-феноксиацетацетамидопенициллановой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), цитрата силденафила (15 мг/кг, 6% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (30 мг/кг, 6% раствор в 25% смеси этанол/вода).
[00271] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 10.
[00272] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.

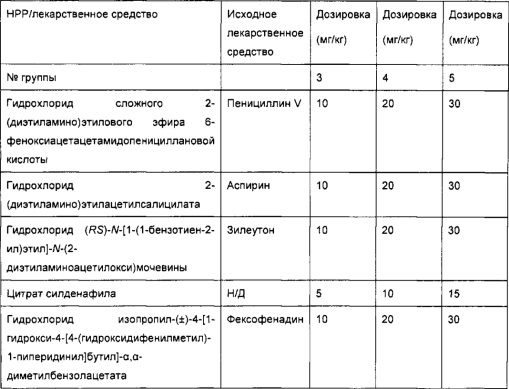
[00273] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 10.1.
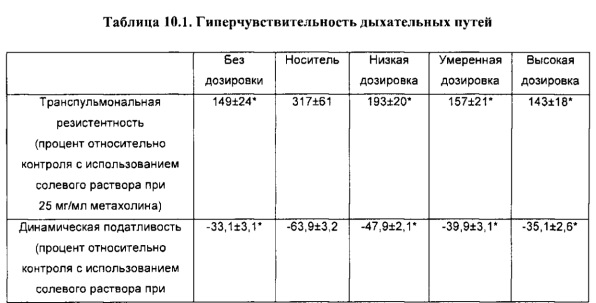

[00274] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 10.2.
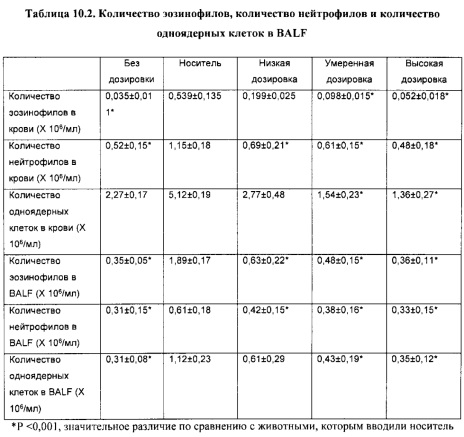
[00275] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 10.3.


[00276] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 26. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00277] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00278] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-феноксиацетацетамидопенициллановой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (10 мг/кг, 2% раствор в 25% смеси этанол/вода), варденафил •HCl (1,5 мг/кг, 0,5% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (10 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00279] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-феноксиацетацетамидопенициллановой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 4% раствор в 25% смеси этанол/вода), варденафил •HCl (3 мг/кг, 1% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (20 мг/кг, 4% раствор в 25% смеси этанол/вода).
[00280] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 6-феноксиацетацетамидопенициллановой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), варденафил •HCl (4,5 мг/кг, 1,5% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (30 мг/кг, 6% раствор в 25% смеси этанол/вода).
[00281] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 11.
[00282] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
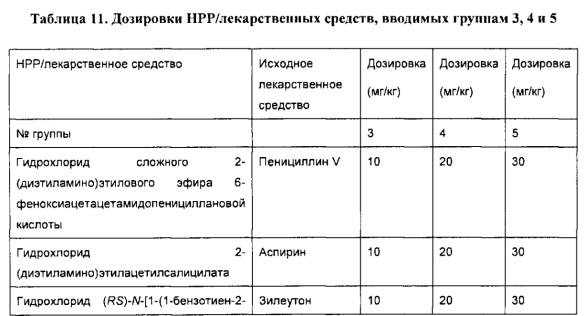

[00283] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 11.1.
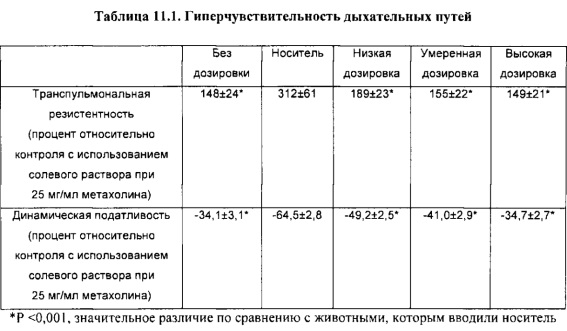
[00284] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 11.2.

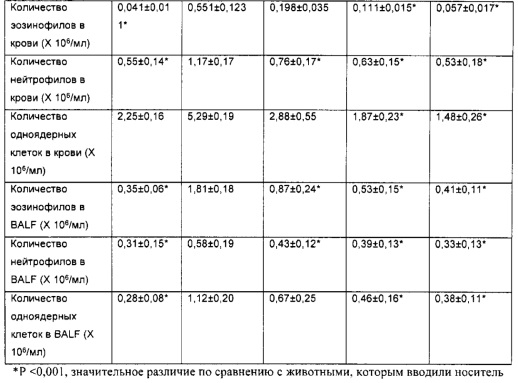
[00285] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 11.3.

[00286] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 27. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00287] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00288] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида тадалафила (1,5 мг/кг, 0,5% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (1,5 мг/кг, 0,5% раствор в 25% смеси этанол/вода) и изопропил-(Е)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (1,5 мг/кг, 0,3% раствор в 25% смеси этанол/вода).
[00289] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида тадалафила (3 мг/кг, 1% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (3 мг/кг, 1% раствор в 25% смеси этанол/вода) и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода).
[00290] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этилацетилсалицилата (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида тадалафила (145 мг/кг, 1,5% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (4,5 мг/кг, 1,5% раствор в 25% смеси этанол/вода) и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (4,5 мг/кг, 0,9% раствор в 25% смеси этанол/вода).
[00291] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 12.
[00292] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
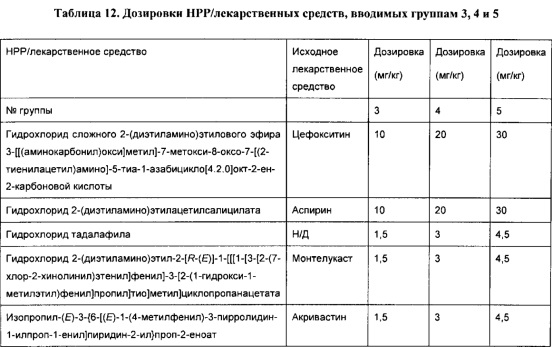
[00293] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 12.1.
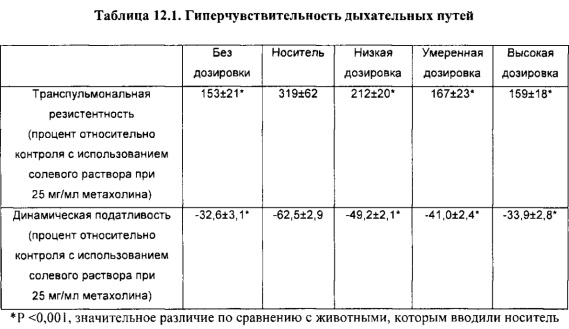
[00294] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 12.2.


[00295] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 12.3.

[00296] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 28. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00297] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00298] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (5 мг/кг, 1% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (1 мг/кг, 0,3% раствор в 25% смеси этанол/вода), гидрохлорида уденафила (3 мг/кг, 1% раствор в 25% смеси этанол/вода) и изопропил-(E)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (1,5 мг/кг, 0,3% раствор в 25% смеси этанол/вода).
[00299] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (2 мг/кг, 0,6% раствор в 25% смеси этанол/вода), гидрохлорида уденафила (6 мг/кг, 2% раствор в 25% смеси этанол/вода) и изопропил-(Е)-3-{6-[(Е)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода).
[00300] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-(диэтиламино)этилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (15 мг/кг, 3% раствор в 25% смеси этанол/вода), гидрохлорида диэтиламиноэтил-[R-(Е)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (3 мг/кг, 0,9% раствор в 25% смеси этанол/вода), гидрохлорида уденафила (9 мг/кг, 3% раствор в 25% смеси этанол/вода) и изопропил-(Е)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата (4,5 мг/кг, 0,9% раствор в 25% смеси этанол/вода).
[00301] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 13.
[00302] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
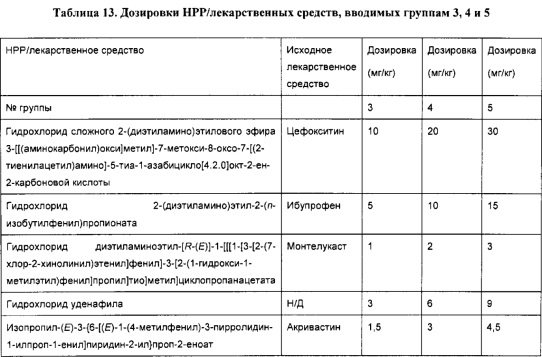
[00303] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 13.1.
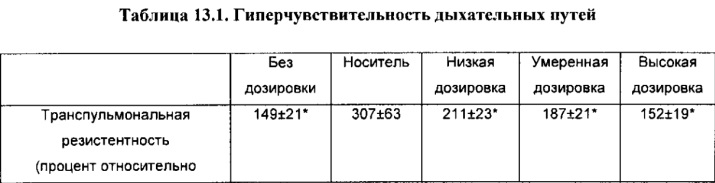

[00304] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 13.2.
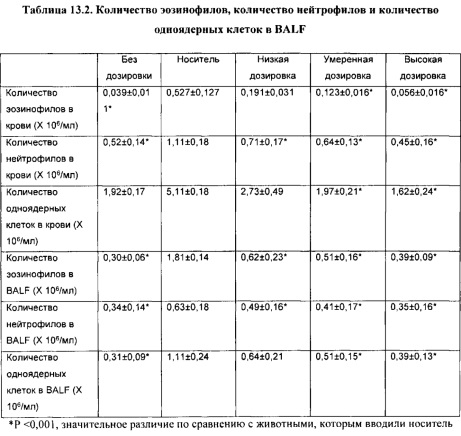
[00305] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 13.3.

[00306] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 29. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00307] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00308] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (5 мг/кг, 1% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (10 мг/кг, 2% раствор в 25% смеси этанол/вода), цитрата силденафила (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (10 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00309] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 4% раствор в 25% смеси этанол/вода), цитрата силденафила (6 мг/кг, 1,2% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (20 мг/кг, 4% раствор в 25% смеси этанол/вода).
[00310] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (15 мг/кг, 3% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), цитрата силденафила (9 мг/кг, 1,8% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (30 мг/кг, 6% раствор в 25% смеси этанол/вода).
[00311] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 14.
[00312] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
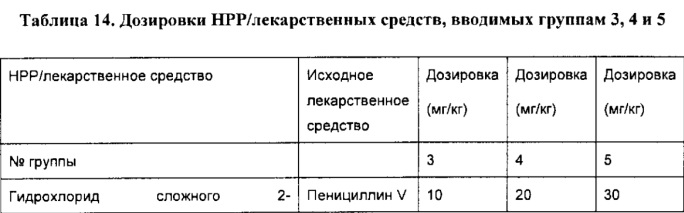
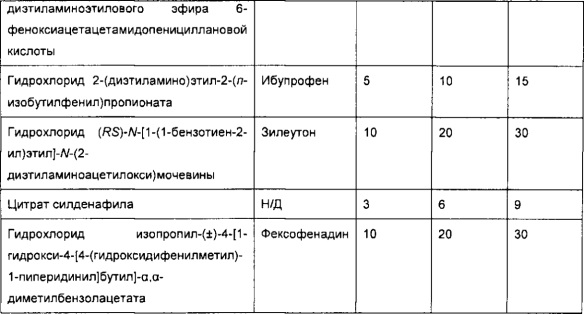
[00313] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 14.1.
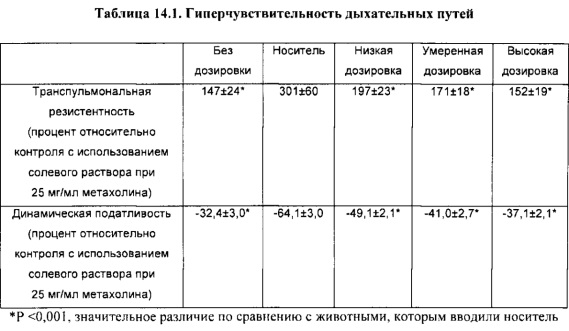
[00314] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 14.2.
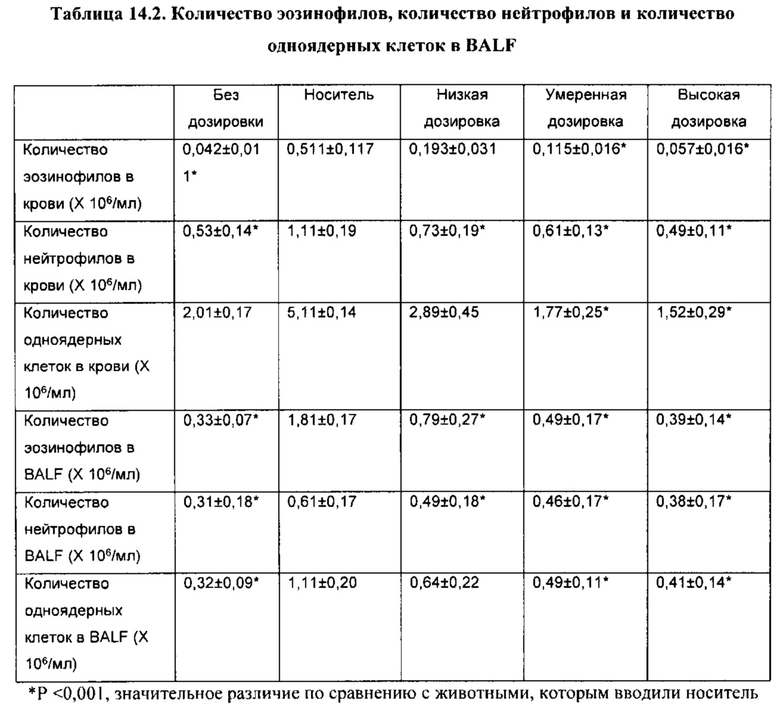
[00315] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 14.3.

[00316] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Пример 30. Испытание комбинаций лекарственных средств, представленных в настоящей заявке, на животных
[00317] Проводили эксперименты, аналогичные экспериментам, описанным в примере 16. 48 самок мышей линии BALB/c в возрасте от 4 до 6 подготавливали и распределяли по группам, как описано в примере 16. Группы 1 и 2 лечили, как описано в примере 16.
[00318] В период с 14 по 22 день в группе 3 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (5 мг/кг, 1% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида варденафила (3 мг/кг, 0,6% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (10 мг/кг, 2% раствор в 25% смеси этанол/вода).
[00319] В период с 15 по 22 день в группе 4 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (10 мг/кг, 2% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (20 мг/кг, 4% раствор в 25% смеси этанол/вода), гидрохлорида варденафила (6 мг/кг, 1,2% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (20 мг/кг, 4% раствор в 25% смеси этанол/вода).
[00320] В период с 15 по 22 день в группе 5 каждой мыши на выбритый участок кожи на шее один раз в сутки наносили комбинацию гидрохлорида сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида 2-(диэтиламино)этил-2-(п-изобутилфенил)пропионата (15 мг/кг, 3% раствор в 25% смеси этанол/вода), гидрохлорида (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (30 мг/кг, 6% раствор в 25% смеси этанол/вода), гидрохлорида варденафила (9 мг/кг, 2% раствор в 25% смеси этанол/вода) и гидрохлорида изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (30 мг/кг, 6% раствор в 25% смеси этанол/вода).
[00321] Дозировки НРР и лекарственных средств, вводимых группам 3, 4 и 5, приведены в таблице 15.
[00322] В случае введения субъекту комбинации нескольких лекарственных средств (например, одного или более НРР и/или других лекарственных средств) каждое из лекарственных средств можно применять отдельно, или одно или более лекарственных средств можно вводить одновременно в виде отдельных лекарственных средств (например, путем распыления двух или более лекарственных средств, по существу, одновременно без смешивания лекарственных средств перед распылением), или одно или более лекарственных средств можно смешивать перед введением субъекту, или можно применять любую комбинацию способов нанесения, описанных выше. Лекарственные средства можно применять в любом возможном порядке.
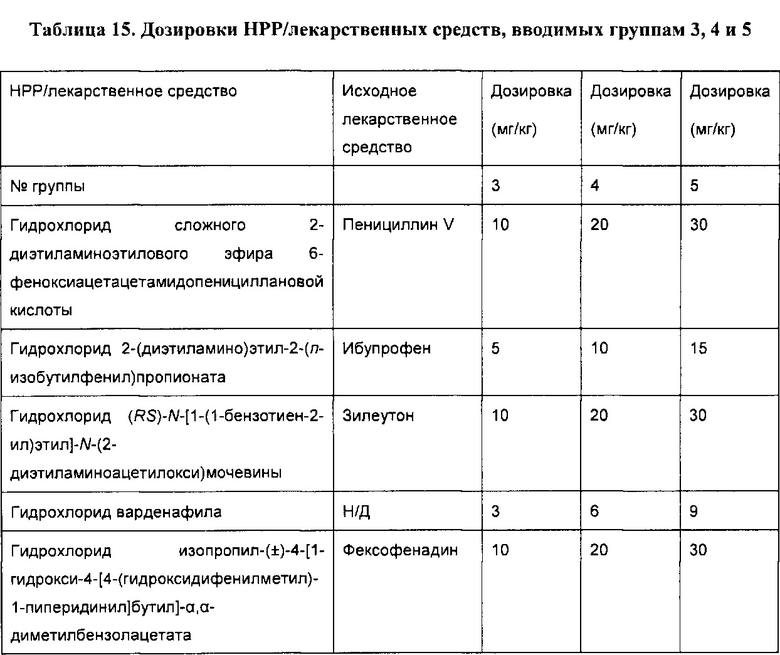
[00323] Чувствительность дыхательных путей [транспульмональную резистентность (RL) и динамическую податливость (Cdyn)] к ингалируемому β-метахолину определяли в соответствии с протоколом, описанным в примере)6. Результаты приведены в таблице 15.1.
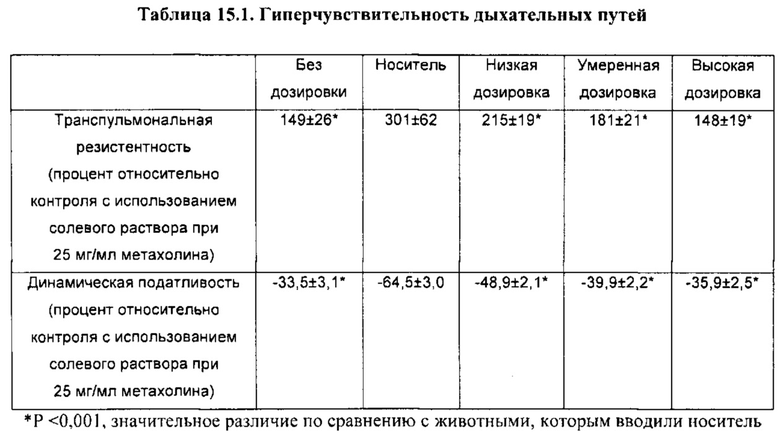
[00324] Количество эозинофилов, количество нейтрофилов и количество одноядерных клеток в BALF определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 15.2.
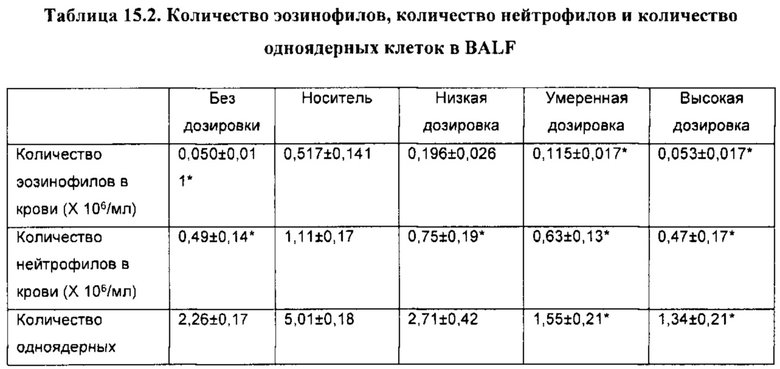
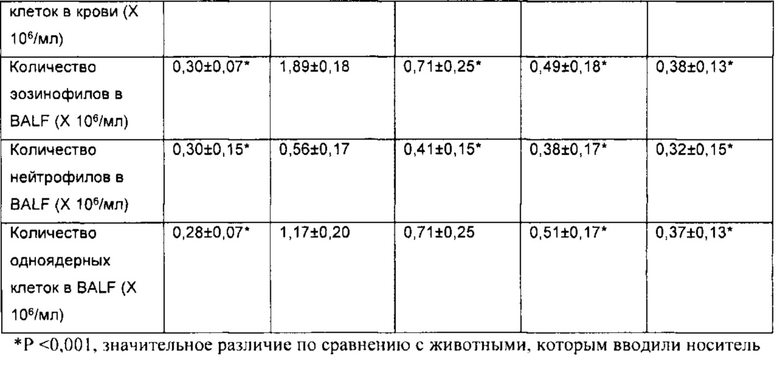
[00325] IL-5 в гомогенатах легких животных определяли в соответствии с протоколом, описанным в примере 16. Результаты приведены в таблице 15.3.

[00326] Результаты данного исследования показали, что исследуемые комбинации лекарственных средств обладают сильной противовоспалительной активностью и активностью против астмы.
Группа изобретений относится к области фармацевтических композиций, способных преодолевать один или более биологических барьеров. Фармацевтическая композиция для лечения состояния легких, где состояние легких выбрано из астмы, инфекций нижних и верхних дыхательных путей, аллергического ринита, аллергического конъюнктивита, зуда и ринореи, содержит сочетание терапевтически эффективных количеств пролекарств с высокой проницаемостью и лекарств с высокой проницаемостью, и фармацевтически приемлемый носитель, где указанным сочетанием, например, является: гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата. Также раскрыт способ лечения состояния легких у биологического субъекта, включающий введение композиции. Группа изобретений обеспечивает композиции, которые могут быть эффективно доставлены к легким для их лечения. 2 н. и 1 з.п. ф-лы, 60 табл., 30 пр.
1. Фармацевтическая композиция для лечения состояния легких, где состояние легких выбрано из астмы, инфекций нижних и верхних дыхательных путей, аллергического ринита, аллергического конъюнктивита, зуда и ринореи, содержащая сочетание терапевтически эффективных количеств пролекарств с высокой проницаемостью (HPP) и лекарств с высокой проницаемостью, и фармацевтически приемлемый носитель,
где указанное сочетание выбрано из следующих:
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (HPP зилеутона), гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (HPP метапротеренола) и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (HPP фексофенадина);
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорида диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (HPP монтелукаста), гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (HPP метапротеренола) и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (HPP фексофенадина);
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (HPP монтелукаста), гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата (HPP метапротеренола) и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (HPP фексофенадина);
- гидрохлорид 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты (HPP цефокситина), гидрохлорид диэтиламиноэтил-2-(п-изобутилфенил)пропионата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (HPP монтелукаста), гидрохлорид (RS)-5-[2-(трет-бутиламино)-1-ацетилоксиэтил]бензол-1,3-диолдиацетата [HPP тербуталина] и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата;
- гидрохлорид диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, гидрохлорид (RS)-6-[2-(трет-бутиламино)-1-ацетилоксиэтил]-2-(ацетилоксиметил)-3-ацетилоксипиридина (HPP пирбутерола) и дифенгидрамина [2-(дифенилметокси)-N,N-диметилэтанамина];
- гидрохлорид диэтиламиноэтил-5-(2,4-дифторфенил)салицилата, диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата;
- гидрохлорид сложного 2-пирролидинметилового эфира D-α-[(имидазолидин-2-он-1-ил)карбониламино]бензилпенициллиновой кислоты (HPP азлоциллина), гидрохлорид диэтиламиноэтил-5-(2,4-дифторфенил)салицилата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата;
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-D(-)-α-(4-этил-2,3-диоксо-1-пиперазинилкарбониламино)-α-фенилацетамидопенициллиновой кислоты (HPP пиперациллина), гидрохлорид 2-диэтиламиноэтил-2-[(2,6-дихлорфенил)амино]бензолацетата, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, гидрохлорид (RS)-5-[1-ацетилокси-2-(изопропиламино)этил]бензол-1,3-диолдиацетата и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноата;
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (HPP зилеутона), цитрат силденафила и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (HPP фексофенадина);
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, варденафил HCl и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата;
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, гидрохлорид диэтиламиноэтилацетилсалицата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата (HPP монтелукаста), тадалафил HCl и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат;
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 3-[[(аминокарбонил)окси]метил]-7-метокси-8-оксо-7-[(2-тиенилацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты, гидрохлорид диэтиламиноэтил-2-(п-изобутилфенил)пропионата, гидрохлорид диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетата, гидрохлорид уденафила и клемастин;
- гидрохлорид диэтиламиноэтил-2-(п-изобутилфенил)пропионата, диэтиламиноэтил-[R-(E)]-1-[[[1-[3-[2-(7-хлор-2-хинолинил)этенил]фенил]-3-[2-(1-гидрокси-1-метилэтил)фенил]пропил]тио]метил]циклопропанацетат и изопропил-(E)-3-{6-[(E)-1-(4-метилфенил)-3-пирролидин-1-илпроп-1-енил]пиридин-2-ил}проп-2-еноат;
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтил-2-(п-изобутилфенил)пропионата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины (HPP зилеутона), цитрат силденафила и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата (HPP фексофенадина); и
- гидрохлорид сложного 2-диэтиламиноэтилового эфира 6-феноксиацетацетамидопенициллановой кислоты, гидрохлорид диэтиламиноэтил-2-(п-изобутилфенил)пропионата, гидрохлорид (RS)-N-[1-(1-бензотиен-2-ил)этил]-N-(2-диэтиламиноацетилокси)мочевины, варденафил HCl и гидрохлорид изопропил-(±)-4-[1-гидрокси-4-[4-(гидроксидифенилметил)-1-пиперидинил]бутил]-α,α-диметилбензолацетата.
2. Фармацевтическая композиция по п. 1, отличающийся тем, что фармацевтически приемлемый носитель выбран из спирта, ацетона, сложного эфира, воды и водного раствора.
3. Способ лечения состояния легких у биологического субъекта, где состояние легких выбрано из астмы, инфекций нижних и верхних дыхательных путей, аллергического ринита, аллергического конъюнктивита, зуда и ринореи, включающий введение биологическому субъекту фармацевтической композиции по п.1 или 2.
| WO 2007089745 A2, 09.08.2007 | |||
| WO 2010142241 A1, 16.12.2010 | |||
| WO 2008029199 A1, 13.03.2008 | |||
| US 2002127198 A1, 12.09.2002 | |||
| WO 2010065936 A1, 10.06.2010 | |||
| ПОЛИМЕРЫ НА ОСНОВЕ ЦИКЛОДЕКСТРИНА ДЛЯ ДОСТАВКИ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2332425C2 |
Авторы
Даты
2019-04-03—Публикация
2013-03-15—Подача