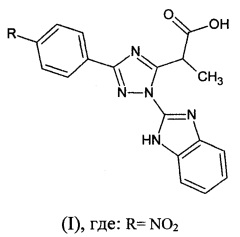
Изобретение относится к медицине и фармации и касается нового анальгезирующего средства, в том числе анальгезирующего средства, дополнительно обладающего противовирусной активностью, на основе замещенной 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил]пропановой кислоты формулы I.
Замещенные соединения 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановой кислоты, их строение, физико-химические свойства и способ получения предложены [Особенности реакций 2,5-замещенных 4-гидрокси-6Н-1,3-оксазин-6-онов с бензимидазол-2-илгидразином. (статья). / Л.Н Овсянникова; Б.Ю. Лалаев; И.П Яковлев; Т.Л. Семакова. // ЖОРХ - 2016. Т. 52. - Вып 4. - с. 617-618.]. Однако не изучена была токсичность этих соединений, анальгезирующая и противовирусная активности не были известны, что не позволяло говорить о лекарственных средствах на их основе.
Наиболее близким по назначению к заявляемому средству является соединение XII - 2,4-диоксо-5-(2-гидрокси-3,5-дихлорбензилиден)имино-1,3-пиримидин, обладающий анальгезирующей и противовирусной активностью [WO 0034250 (А1) 15/06/2000. 2,4-DIOXO-5-ARYLIDENIMINO-1,3-PYRIMIDINES]. Остальные 24 соединения заявленной общей формулы на анальгезирующую активность не проверялись. Широта действия биологически активных веществ, являвшаяся задачей приведенного изобретения, может быть как сильной, так и слабой стороной средства. Так, не всегда может быть желательно присущее соединению XII психодепрессивное действие.
Задачей предполагаемого изобретения является расширение арсенала анальгезирующих и противовирусных средств, поиск нового на основе замещенной 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановой кислоты средства, имеющего низкую токсичность; средства, обладающего анальгезирующей и противовирусной активностью, превышающих указанные активности применяющихся в медицинской практике раздельно препаратов.
Указанная задача достигается созданием анальгезирующего и противовирусного средства на основе замещенной 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановой кислоты формулы (I), где: R=NO2 - 2-[1-(1H-бензимидазол-2-ил)-3-(4-нитрофенил)-1H-1,2,4-триазол-5-ил]пропановой кислоты.
Изобретение иллюстрируется способом получения и примерами исследования фармакологических свойств.
Замещенные соединения 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановой кислоты получали путем взаимодействия 2,5-замещенного-4-гидрокси-6H-1,3-оксазин-6-она с бензимидазол-2-илгидразином в среде безводного полярного органического растворителя (метанол), причем смесь перемешивали в течение 41-48 часов при комнатной температуре, полученный осадок отфильтровывали и промывали небольшими порциями этилацетата.
Способ получения замещенных 2-[1-(1H-бензимидазол-2-ил)-3-(4-нирофенил)-1H-1,2,4-триазол-5-ил]пропановой кислоты (I) осуществлен в лабораторных условиях на стандартном товарном сырье.
В плоскодонную колбу емкостью 100 мл загружают 5,0 г (0,02 моль) 4-гидрокси-5-метил-2-(4-нитрофенил)-6H-1,3-оксазин-6-она и 25 мл абсолютного метанола в качестве среды, а затем к суспензии добавляют 2,96 г (0,02 моль) 2-гидразинил-1Н-бензимидазола.
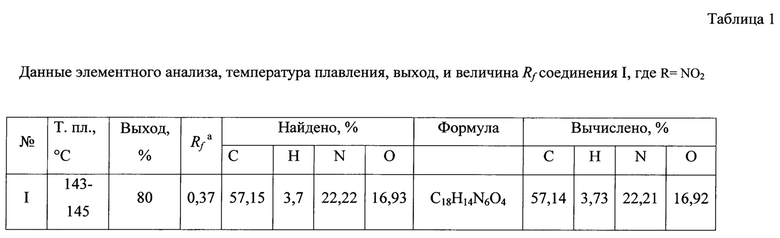
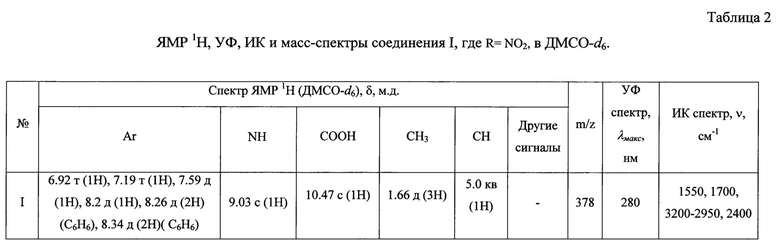
Данные элементного анализа, выход продукта реакции, температура плавления и величина Rƒ приведены в табл. 1, спектральные характеристики - в табл. 2.
Пример 1. Определение острой токсичности.
Острую токсичность синтезируемых соединений определяли на нелинейных белых мышах самцах массой тела 18-20 г. Животных распределяли на равные по численности и массе тела группы, по 10 животных в каждой. Суспензии соединения в воде, стабилизированные твином-80, вводили однократно внутрибрюшинно в интервале доз 50 мг/кг-2000 мг/кг. Выживаемость животных определяли, наблюдая через 24 часа и через 48 часов от момента введения исследуемого соединения. Наблюдение за животными осуществляли в течение 72 часов. Регистрировали развитие основных симптомов и время гибели животных.
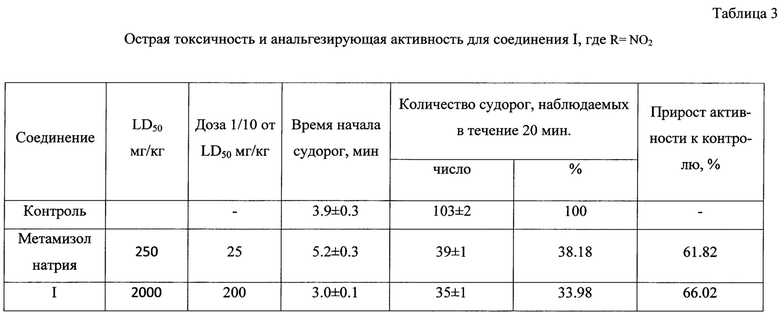
Расчет среднесмертельной дозы (LD50) проводили с помощью экспресс-метода В.Б. Прозоровского [Прозоровский В.Б. Статистическая обработка результатов фармакологических исследований // Псохофармакол. биол. наркол. - 2007. Т. 7, №3-4 - С. 2090-2120] и пробит-анализа по методу Миллера-Тейнтера [М.Л. Беленький. Элементы количественной оценки фармакологического эффекта (2-е изд, перераб. и доп.). - Л.,: Гос. изд-во мед. лит., 1963. С. 412]. Токсичность заявляемых субстанций составляет 2000 мг/кг (табл 3). Согласно классификации токсичности препаратов, соединение I относятся к классу малотоксичных веществ [Измеров И.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов. - М.: Медицина, 1977. С. 196-197]. Оно более чем в 8 раз менее токсично метамизола натрия - препарата сравнения по анальгезирующей активности (табл. 3).
Пример 2. Определение анальгезирующей активности.
Для экспериментальной оценки анальгезирующей активности использовали модель генерации уксуснокислых «корчей» у мышей-самцов. Судороги у животных вызывали при помощи внутрибрюшинного введения 3% раствора уксусной кислоты. Эксперимент проводили на белых нелинейных мышах-самцах массой тела 15-22 г. Для эксперимента использовали 3 группы животных по 7 особей в каждой. Суспензии замещенных соединений 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановой кислоты (I) в смеси ДМСО с водой (1:5) (стабилизатор твин-80) вводили однократно, внутрибрюшинно в дозах 1/10 LD50 за 40 минут до внутрибрюшинного введения 3% раствора уксусной кислоты. Животным контрольной группы вводили смесь ДМСО: вода (1:5). В качестве препарата сравнения использовали метамизол натрия в дозе 25 мг/мл. Регистрировали время начала судорог и их количество в течение 20 минут [Харкевич Д.А. Фармакология: Учебник. - 10-е изд. - М.: ГЭОТАР-Медиа, 2009. - С. 628-640]. Анальгетическая активность заявляемого средства выше препарата сравнения метамизола натрия, исследуемая субстанция в 8 раз менее токсична (табл 3).
Пример 3. Изучение токсичности в отношении линии нормальных эпителиальных клеток почек собак (MDCK, Sigma-Aldrich, USI).
Клетки MDCK сеяли в 96-луночные планшеты и культивировали при 36°С на минимальной поддерживающей среде (MEM) с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 (в газопроточном инкубаторе Sanyo-175) до состояния монослоя. Из исследуемого соединения (I) готовили маточный раствор концентрации 10 мг/мл в диметилсульфоксиде, после чего готовили серию трехкратных разведений препаратов в среде MEM от 300 до 3 μg/ml. Растворенные препараты вносили в лунки планшетов и инкубировали 2 суток при 36°С. По истечении этого срока клетки промывали 2 раза по 5 минут фосфатно-солевым буфером, и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 36°С в атмосфере 5% CO2 в течение 2 часов и промывали 5 минут фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли концентрацию соединения, вызывающую гибель 50% клеток в культуре - 50% цитотоксическую дозу (СС50). Для соединения I она составила 2552 мкг/мл, что лучше, чем у препарата сравнения рибавирина - 2130 мкг/мл.
Пример 4. Определение противовирусной активности.
Определение противовирусной активности соединения (I) проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединение растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 часа при 36°С в атмосфере 5% CO2.
Из вируссодержащей жидкости (штамм A/Puerto Rico/8/34 (H1N1) готовили серию десятикратных разведении от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°С в течение 48 часов в атмосфере 5% CO2. По окончании срока инкубации 100 мкл культуральной жидкости переносили в отдельные планшеты с круглым дном и смешивали с равным объемом 1% куриных эритроцитов. Учет результатов проводили через 60 минут инкубации при 20°С. За титр вируса принимали величину, обратную наибольшему разведению исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке, и выражали титр в количестве 50% инфекционных доз (ID50). Вирусингибирующее действие исследуемого соединения оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали концентрацию препарата, снижающую титр вируса вдвое - 50% ингибирующую концентрацию IC50, для соединения (I) она составила - 88,9 мкг/мл. Химиотерапевтический индекс, или индекс селективности (SI), представляющий собой отношение СС50 к IC50, для соединения (I) составил 15, что сопоставимо с препаратом сравнения рибавирином - 67.
Таким образом, заявляемое средство (I) являются малотоксичным, обладает значительно большей анальгезирующей активностью и низкой токсичностью по сравнению с широко известным и применяемым в медицине препаратом сравнения метамизол натрия. Кроме того средство на основе замещенной 2-[1-(1H-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановой кислоты формулы (I), где: R=NO2 - 2-[1-(1H-бензимидазол-2-ил)-3-(4-нитрофенил)-1H-1,2,4-триазол-5-ил]пропановой кислоты обладает противовирусной активностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| Анальгезирующее средство на основе замещённой 2-[1-(1Н-бензимидазол-2-ил)-3-фенил-1Н-1,2,4-триазол-5-ил]пропановой кислоты | 2017 |
|
RU2661603C1 |
| Анальгезирующее средство на основе замещённой 2,2'-[(6-метилпиримидин-2,4-диил)бис(3-фенил-1Н-1,2,4-триазол-1,5-диил)]дипропановой кислоты | 2017 |
|
RU2676092C1 |
| Анальгезирующее и противовирусное средство на основе 2,2'-[(6-метилпиримидин-2,4-диил)бис(3-(4-нитрофенил)-1H-1,2,4-триазол-1,5-диил)]дипропановой кислоты | 2017 |
|
RU2672878C1 |
| ЗАМЕЩЁННЫЕ 2-(1,3-БЕНЗОТИАЗОЛ-2-ИЛ)-3-ФЕНИЛ-1Н-1,2,4-ТРИАЗОЛ-5-ИЛ) ПРОПАНОВЫЕ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2603958C1 |
| Замещённые 2-(1-(3-оксо-3,4-дигидрохиноксалин-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил)пропановые кислоты и способ их получения | 2017 |
|
RU2645683C1 |
| 6-(2'-АМИНО-2'-КАРБОКСИЭТИЛТИО)-2-МЕТИЛТИО-4-ПИВАЛОИЛОКСИМЕТИЛ-1,2,4-ТРИАЗОЛО[5,1-c]1,2,4-ТРИАЗИН-7(4Н)-ОН | 2011 |
|
RU2455304C1 |
| Способ получения N-(нафталин-2-ил)бензамидина | 2018 |
|
RU2684117C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА И ВИРУСНЫХ ЗАБОЛЕВАНИЙ, СПОСОБ ЛЕЧЕНИЯ РАКА, СПОСОБ ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ НА ЕЕ ОСНОВЕ | 1996 |
|
RU2177316C2 |
| МЕТИЛ, ХЛОР И НИТРОПРОИЗВОДНЫЕ N-{3, 5-ДИОКСО-4-АЗАТЕТРАЦИКЛО[5.3.2.0.0]ДОДЕЦ-11-ЕН-4-ИЛ}-2-ГИДРОКСИБЕНЗАМИДА-ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ, ИНГИБИРУЮЩИЕ РЕПЛИКАЦИЮ РАЗЛИЧНЫХ ВИДОВ ОРТОПОКСВИРУСОВ | 2010 |
|
RU2440983C1 |
| 4-((2-АРИЛ-2,4-ДИГИДРОКСИ-5-ОКСО-3-(3-ОКСО-3,4-ДИГИДРОХИНОКСАЛИН-2-ИЛ)-2,5-ДИГИДРО-1Н-ПИРРОЛ-1-ИЛ)АМИНО)БЕНЗОЙНЫЕ КИСЛОТЫ, ОБЛАДАЮЩИЕ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2731215C1 |
Изобретение относится к медицине и фармации. Предложено анальгезирующее и противовирусное средство, включающее замещенную 2-[1-(1Н-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановую кислоту формулы (I) в качестве активного вещества. Технический результат: заявленное средство значительно менее токсично, его анальгезирующая и противовирусная активности выше, чем препарата сравнения метамизола натрия. 3 табл., 4 пр.
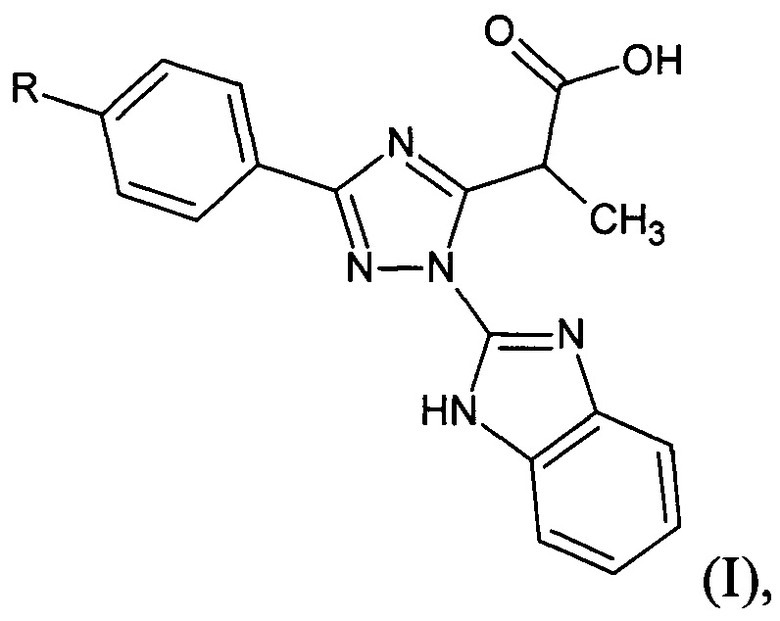
где R =NO2.
Анальгезирующее и противовирусное средство, включающее замещенную 2-[1-(1Н-бензимидазол-2-ил)-3-фенил-1H-1,2,4-триазол-5-ил]пропановую кислоту формулы (I) в качестве активного вещества
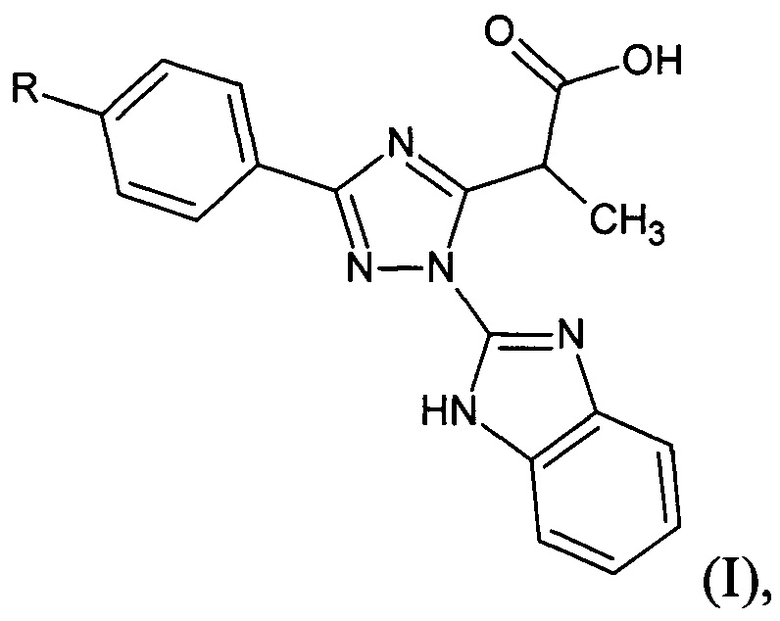 где: R=NO2.
где: R=NO2.
| WO 00/34250 A1, 15.06.2000 | |||
| CN 101897680 A, 01.06.2009 | |||
| ИНГИБИТОРЫ АРГИНАЗЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2011 |
|
RU2586219C2 |
| ОВСЯННИКОВА Л.Н | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
Авторы
Даты
2019-04-15—Публикация
2018-03-21—Подача