[0001] Настоящая заявка испрашивает приоритет на основании предварительных заявок на патент США №61/326892, поданной 22 апреля 2010 года, и №61/413202, поданной 12 ноября 2010 года, содержание которых включено в настоящую заявку посредством ссылки в том же объеме, как и в случае, если бы эти заявки были полностью приведены в настоящей заявке.
УРОВЕНЬ ТЕХНИКИ
[0002] Настоящее изобретение в целом относится к ингибиторам аргиназы и их применению для лечения патологических состояний. К настоящему времени идентифицированы две изоформы аргиназы: аргиназа I (ARG I), которая экспрессируется в цитозоле, и аргиназа II (ARG II), которая экспрессируется в митохондриях. Ферменты аргиназы совместно с ферментами синтазами оксида азота (NOS) играют важную роль в регуляции содержания оксида азота в клетках и в развитии патофизиологических болезненных состояний.
[0003] Аргиназы вовлечены в целый ряд патологических состояний. Такие состояния включают, без ограничения, эректильную дисфункцию, легочную гипертензию, гипертензию, атеросклероз, заболевания почек, астму, Т-клеточную дисфункцию, ишемическое реперфузионное повреждение, нейродегенеративные заболевания, заживление ран и фибротические заболевания. Несмотря на то, что механизм действия ферментов аргиназ в этих болезненных состояниях в настоящее время до конца не изучен, результаты некоторых исследований дают основания полагать, что при патологических болезненных состояниях зачастую имеет место повышающая регуляция ферментов аргиназ.
[0004] Например, полагают, что повышающая регуляция активности аргиназы приводит к снижению уровней аргинина, что в свою очередь снижает уровень оксида азота (NO) - физиологически важной сигнальной молекулы, которая необходима для деления клетки, вазодилатации артерий, регуляции кровотока и управления сигнальной трансдукцией в мышечной и нервной системах.
[0005] Помимо регуляции уровней оксида азота (NO) аргиназа также влияет на продуцирование жизненно важных полиаминов, таких как путресцин, спермидин и спермин. При катаболизме L-аргинина аргиназой образуется орнитин. Орнитин затем превращается в путресцин, спермидин и спермин под действием орнитиндекарбоксилазы, спермидинсинтазы и сперминсинтазы, соответственно. Таким образом, ферменты аргиназы регулируют физиологическую передачу сигнала посредством регуляции уровней переносчиков сигнала полиаминов внутри клетки. См. Wang, J-Y; and Casero, Jr., R.A., Ed; Humana Press, Totowa, NJ, 2006. Орнитин также обеспечивает альтернативный биосинтетический путь образования пролина и, таким образом, способствует выработке коллагена (Smith, R.J.; Phang, J.M., The importance of ornithine as a precursor for proline in mammalian cells. J. Cell. Physiol. 1979, 98, 475-482. Albina, J.E.; Abate, J.A.; Mastrofrancesco, B. Role of ornithine as a proline precursor in healing wounds. J. Surg. Res. 1993, 55, 97-102).
[0006] С учетом роли аргиназы в различных патологических состояниях в настоящем изобретении предложены соединения Формулы I и Формулы II, применяемые в качестве ингибиторов активности аргиназы, а также способы применения соединений согласно настоящему изобретению в качестве терапевтических средств.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] В настоящем изобретении предложены конкретные борсодержащие соединения Формул I и II, описанные в настоящей заявке, которые являются ингибиторами активности аргиназы. В изобретении также предложены способы применения соединений согласно настоящему изобретению для лечения. В одном из вариантов реализации, таким образом, предложены соединения согласно настоящему изобретению и содержащие их фармацевтически приемлемые составы, применяемые в качестве терапевтических агентов, которые способны ингибировать активность аргиназы. Соединения и фармацевтические составы согласно настоящему изобретению подходят для лечения ряда заболеваний и состояний, включая, но не ограничиваясь ими, легочную гипертензию, эректильную дисфункцию (ЭД), гипертензию, атеросклероз, заболевания почек, астму, Т-клеточную дисфункцию, ишемическое реперфузионное повреждение, нейродегенеративные заболевания, заживление ран и фибротические заболевания.
[0008] В одном из вариантов реализации в настоящем изобретении предложены соединения, которые соответствуют Формуле I, а также их стереоизомеры, таутомеры, пролекарства и фармацевтически приемлемые соли или сложные эфиры:
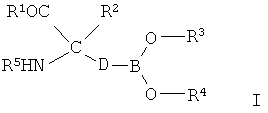
[0009] В Формуле I R1 выбран из группы, состоящей из -ОН, ORa и NRbRc. Заместитель Ra выбран из группы, состоящей из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С14)арила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, (С3-С14)гетероарил-(С1-С6)алкилена- и (С3-С14)арил(С1-С6)алкилена-. Каждый заместитель Rb и Rc независимо выбран из группы, состоящей из Н, -ОН, линейного или разветвленного (С1-С6)алкила, -S(O)2-(С1-С6)алкила, (С3-С14)арил-S(O)2-, (С3-С14)гетероциклоалкил-(С1-С6)алкилена- и (С3-С14)гетероарил-(С1-С6)алкилена-.
[0010] Заместитель R2 в Формуле I выбран из группы, состоящей из линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (С1-С6)алкенила, линейного или разветвленного (С2-С6)алкинила, (С3-С14)арила, (С3-С14)циклоалкила, (С3-С14)арил-(С1-С6)алкилена-, (С3-С14)гетероарил-(С1-С6)алкилена-, (С3-С14)гетероарила, (С3-С14)гетероциклоалкила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, (С3-С14)гетероарил-(С3-С6)гетероциклоалкилена-, (С3-С14)арил-(С3-С14)гетероциклоалкилена-, (С3-С14)арил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена-, (С3-С14)гетероарил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена-, (С3-С14)гетероциклоалкил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена- и -(СН2)m-(Х)u-(СН2)n-(Y)v-Rf.
[0011] Если R2 представляет собой -(CH2)m-(X)u-(CH2)n-(Y)v-Rf, то каждый u и v независимо равен 0 или 1, при этом u+v≥1. Каждый индекс m и n независимо равен 0, 1, 2, 3, 4, 5 или 6, где m+n≥1.
[0012] Переменные Х и Y независимо выбраны из группы, состоящей из -NH-, -О- и -S-.
[0013] Заместитель Rf выбран из группы, состоящей из Н, гидроксила, линейного или разветвленного (С1-С6)алкила и (С3-С14)арила.
[0014] Каждый заместитель R3 и R4 независимо представляет собой водород или линейный или разветвленный (С1-С6)алкил.
[0015] В качестве альтернативы R3 и R4 совместно с атомом бора, с которым они связаны, образуют 5- или 6-членное кольцо, которое является полностью или частично насыщенным и которое возможно содержит 1-3 дополнительных гетероатома в кольце, выбранных из О, S и N.
[0016] Также изобретение включает соединения, где фрагмент бороновой кислоты в Формуле I этерифицирован с сахаром. Соединения этого класса являются подходящими пролекарствами.
[0017] Заместитель R5 выбран из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила и (С1-С6)алкил-С(O)-.
[0018] В Формуле I D выбран из группы, состоящей из линейного или разветвленного (С1-С6)алкилена, линейного или разветвленного (С2-С8)алкенилена, (С3-С14)арилена, линейного или разветвленного (С2-С8)алкинилена и (С3-С14)циклоалкилена. В некоторых вариантах реализации одна или более -CH2- групп в D возможно и независимо заменены на фрагмент, выбранный из группы, состоящей из -O-, -NR′-, -S-, -SO-, -SO2- и -CR′R′′-, где каждый R′ и R′′ независимо выбран из группы, состоящей из Н, (С1-С8)алкила и (С3-С6)арила. В других вариантах реализации любые две соседние группы -СН2- возможно являются двумя членами (С3-С14)-циклоалкиленильной группы.
[0019] Любой алкил, алкилен, алкенил, алкенилен, алкинил или алкинилен в Формуле I возможно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, оксо, -СООН, -CN, -NO2, -ОН, -NRdRe, -NRgS(O)2Rh, (С1-С6)алкокси и (С3-С14)арилокси.
[0020] Заместители Rd, Re, Rg и Rh независимо выбраны из группы, состоящей из Н, линейного или разветвленного (C1-С6) алкила, возможно замещенного (С3-С14)арил-(С1-С6)алкилена-, (С1-С6)алкокси, возможно замещенного (С3-С14)арила, (С1-С6)гидроксиалкила, (С1-С6)аминоалкила, H2N(С1-С6)алкилена-, возможно замещенного (С3-С6)циклоалкила, возможно замещенного (С3-С14)гетероциклоалкила, возможно замещенного (С3-С14)гетероарила, возможно замещенного (С3-С14)арил-(С1-С6)алкилена-, NR′R′′C(O)- и (С3-С6)арил-(С3-С14)-циклоалкилена-, а каждый R′ и R′′ может быть независимо выбран из группы, состоящей из Н, (С1-С8)алкила и (С3-С6)арила.
[0021] Любой арил, гетероарил, циклоалкил или гетероциклоалкил возможно содержит один или более заместителей, выбранных из группы, состоящей из галогена, -ОН, оксо, -СООН, (С3-С14)арил(С1-С6)алкилена-, -CN, -NO2, -NH2, (С1-С6)алкил-S-, (С3-С14)циклоалкила, (С3-С14)гетероциклоалкила, (С3-С14)арила, (С3-С14)гетероарила, -С(O)NH-(С1-С6)алкила, -NHC(O)-(С1-С6)алкила, (С1-С6)алкила, (С2-С8)алкенила, (С2-С8)алкинила, (С1-С6)алкокси, (С1-С6)галогеналкила и (С1-С6)гидроксиалкила.
[0022] Следует понимать, что, несмотря на описание Формулы I, представленное в настоящей заявке. Формула I не включает 2-амино-4-бороно-2-метилбутановую кислоту.
[0023] В настоящем изобретении также предложены соединения, которые соответствуют Формуле II, их стереоизомеры, таутомеры, пролекарства и фармацевтически приемлемые соли или сложные эфиры, а также содержащие их фармацевтически приемлемые составы, применяемые в качестве терапевтических средств для лечения различных болезненных состояний, связанных с дисбалансом ферментов аргиназ.
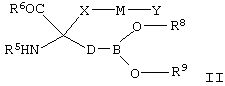
[0024] В Формуле II R6 выбран из группы, состоящей из OR3 и NRbRc.
[0025] Заместитель Ra выбран из группы, состоящей из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С8)циклоалкила, (С3-С14)арила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, (С3-С14)гетероарил-(С1-С6)алкилена- и (С3-С14)арил(С1-С6)алкилена-, при этом каждый заместитель Rb и Rc независимо выбран из группы, состоящей из Н, -ОН, линейного или разветвленного (С1-С6)алкила, -S(O)2-(C1-С6)алкила, (С3-С14)арил-S(O)2-, (С3-С14)гетероциклоалкил-(С1-С6)алкилена- и (С3-С14)гетероарил-(С1-С6)алкилена-.
[0026] Заместитель R7 выбран из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, (С3-С14)арил(С1-С6)алкилена-, (С3-С14)гетероарил-(С1-С6)алкилена-, (С3-С14)гетероциклоалкил-(С1-С6)алкилена- и (С1-С6)алкил-С(О)-.
[0027] Переменная Х в Формуле II выбрана из группы, состоящей из (С3-С14)-циклоалкилена и (С3-С14)гетероциклоалкилена, а переменная М выбрана из группы, состоящей из связи, (С1-С6)алкилена-, -O-, -С(O)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S-, -S(O)-, -S(O)2-, -NR′- и -C=NR11-.
[0028] Переменная Y в Формуле II выбрана из группы, состоящей из Н, (C1-С14)алкила, -NR′R′′, гидрокси(С1-С6)алкилена, (С3-С14)циклоалкила, (С3-С14)циклоалкил-(С1-С6)алкилена, (С3-С14)арила, (С3-С14)арил-(С1-С6)алкилена, (С3-С14)гетероциклоалкила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена, (С3-С14)гетероарила, (С3-С14)гетероарил-(С1-С6)алкилена, (С3-С14)гетероарил-(С3-С6)гетероциклоалкилена-, (С3-С14)арил-(С3-С14)гетероциклоалкилена-, (С3-С14)арил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена-, (С3-С14)гетероарил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена- и (С3-С14)гетероциклоалкил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена-.
[0029] В одном из вариантов реализации Х представляет собой (С3-С14)циклоалкилен, М представляет собой связь, а Y представляет собой -NH2. Согласно другим аспектам настоящего изобретения Х представляет собой (С3-С14)гетероциклоалкилен, a Y выбран из группы, состоящей из (С3-С14)циклоалкила, (С3-С14)арила, (С3-С14)арил-(С1-С6)алкилена, (С3-С14)гетероарила и (С3-С14)гетероарил-(С1-С6)алкилена. Например, Y может представлять собой (С3-С14)гетероарил, (С3-С14)арил, (С3-С14)циклоалкил или (С3-С14)арил-(С1-С6)алкилен.
[0030] Заместители R8 и R9 независимо выбраны из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С8)циклоалкила, (С3-С14)арила и C(O)-R′. В качестве альтернативы R8 и R9 совместно с атомом бора, с которым они связаны, образуют 5- или 6-членное кольцо, которое является полностью или частично насыщенным и которое возможно содержит 1-3 дополнительных гетероатома в кольце, выбранных из О, S и N. В одном из вариантов реализации изобретения R8 и R9 совместно с атомом бора, с которым они соединены, связаны с образованием 5-членного диоксабороланового или 6-членного диоксаборинанового кольца, которое возможно конденсировано с циклоалкильным, гетероциклическим или ароматическим кольцом.
[0031] В Формуле II D выбран из группы, состоящей из линейного или разветвленного (С3-С5)алкилена, линейного или разветвленного (С2-С8)алкенилена, линейного или разветвленного (С2-С8)алкинилена, (С3-С14)арилена и (С3-С14)циклоалкилена. В одном из вариантов реализации одна или более -CH2- групп в D возможно и независимо заменены на фрагмент, выбранный из группы, состоящей из О, NR′, S, SO, SO2 и CR′R′′. Тем не менее, две соседние -СН2- группы в D одновременно не могут представлять собой О, NR′, S, SO или SO2.
[0032] Для конкретных соединений Формулы II любые две соседние -СН2- группы в D возможно являются двумя членами (С3-С14)-циклоалкиленильной группы. В других вариантах реализации D соответствует одной из формул -L1-L2-CH2-CH2-, -CH2-L1-L2-CH2-, -CH2-CH2-L1-L2-, -L1-СН2-СН2-L2-, -L1-CH2-L2-CH2- или -CH2-L1-CH2-L2-. Переменные L1 и L2 независимо выбраны из группы, состоящей из О, NR′, S, SO, SO2 и CR′R′′, где R′ и R′′ определены ниже. В вариантах реализации, где -L1 и -L2 являются соседними, тем не менее, L1 и L2 одновременно не могут представлять собой О, NR′, S, SO или SO2 группами.
[0033] Заместители R′ и R′′ в Формуле II независимо выбраны из группы, состоящей из Н, (C1-C8)алкила, -С(O)-(С1-С8)алкилена, возможно замещенного (С3-С6)арила, возможно замещенного (С3-С14)арил(С1-С6)алкилена-, возможно замещенного (C1-С6)аминоалкила, возможно замещенного (С3-С6)циклоалкила, возможно замещенного (С3-С14)гетероциклоалкила, возможно замещенного (С3-С14)гетероарила.
[0034] Более того, любой алкил, алкилен, арил, гетероарил, циклоалкил или гетероциклоалкил, определенный в настоящем описании, возможно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, оксо, -СООН, -CN, -NO2, -ОН, -NRdRe, -NRgS(O)2Rh, (С1-С6)алкила, (С1-С6)галогеналкила, (С1-С6)галогеналкокси, (С1-С6)алкокси, (С3-С14)арила, (С3-С14)гетероарила, (С3-С14)гетероциклоалкила, (С3-С14)гетероарил-(С1-С6)алкилена и (С3-С14)арилокси.
[0035] Каждый из Rd, Re, Rg и Rh независимо выбран из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, возможно замещенного (С3-С14)арил-(С1-С6)алкилена-, возможно замещенного (С3-С14)арила, (С1-С6)гидроксиалкила, (С1-С6)аминоалкила, H2N(С1-С6)алкилена-, возможно замещенного (С3-С6)циклоалкила, возможно замещенного (С3-С14)гетероциклоалкила, возможно замещенного (С3-С14)гетероарила, возможно замещенного (С3-С14)арил-(С1-С6)алкилена- и NR′R′′C(O)-.
[0036] В настоящем изобретении также предложены фармацевтически приемлемая соль, стереоизомер, таутомер или пролекарство соединений Формулы II.
[0037] Соединения, соответствующие Формулам I или II, и содержащие их фармацевтически приемлемые составы подходят для лечения ряда заболеваний и состояний, включая, но не ограничиваясь ими, легочную гипертензию, эректильную дисфункцию (ЭД), гипертензию, атеросклероз, заболевания почек, астму, Т-клеточную дисфункцию, ишемическое реперфузионное повреждение, нейродегенеративные заболевания, заживление ран и фибротические заболевания.
[0038] В одном из вариантов реализации в настоящем изобретении предложена фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного из соединений Формулы I или Формулы II и фармацевтически приемлемый носитель.
[0039] В одном из вариантов реализации изобретения предложен способ ингибирования аргиназы I, аргиназы II или их комбинации в клетке, включающий приведение указанной клетки в контакт по меньшей мере с одним соединением Формулы I или Формулы II. В соответствии с другим вариантом реализации в изобретении предложен способ лечения или профилактики заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или их комбинации, у субъекта, включающий введение субъекту терапевтически эффективного количества по меньшей мере одного соединения Формулы I или Формулы II.
[0040] В соответствии с одним из вариантов реализации, отмеченным выше, в изобретении предложены соединения Формулы I или Формулы II для лечения или профилактики заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или их комбинации, у субъекта. В изобретении также предложено, согласно другому варианту реализации, применение соединения Формулы I или Формулы II для вышеуказанной задачи. В качестве альтернативы в другом варианте реализации предложено применение соединений Формулы I или Формулы II для получения лекарственного средства для лечения или профилактики заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или комбинации обоих ферментов в клетке.
ПОДРОБНОЕ ОПИСАНИЕ
[0041] Соединения, описанные в настоящей заявке, представляют собой низкомолекулярные ингибиторы аргиназы, которые соответствуют Формулам I или II. Из предложенного описания станет очевидным, что некоторые соединения Формулы II также являются соединениями Формулы I. Соединения и содержащие их фармацевтические композиции подходят для лечения или профилактики заболеваний или состояний, связанных с экспрессией или активностью аргиназы.
Определения
[0042] «Алкил» относится к линейным, разветвленным или циклическим гидрокарбильным группам, содержащим примерно от 1 до 20 атомов углерода. Например, алкил может содержать от 1 до 10 атомов углерода или от 1 до 5 атомов углерода. Типовые алкилы включают линейные алкильные группы, такие как метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил и т.д., а также включают разветвленные изомеры алкильных групп с линейной цепью, например, без ограничений, -СН(СН3)2, -CH(CH3)(СН2СН3), -СН(СН2СН3)2, -С(СН3)3, -С(СН2СН3)3, -СН2СН(СН3)2, -СН2СН(СН3)(СН2СН3), -СН2СН(СН2СН3)2, -СН2С(СН3)3, -СН2С(СН2СН3)3, -СН(СН3)СН(СН3)(СН2СН3), -СН2СН2СН(СН3)2, -СН2СН2СН(СН3)(СН2СН3), -СН2СН2СН(СН2СН3)2, -СН2СН2С(СН3)3, -СН2СН2С(СН2СН3)3, -СН(СН3)СН2СН(СН3)2, -СН(СН3)СН(СН3)СН(СН3)2 и т.д. Таким образом, алкильные группы включают первичные алкильные группы, вторичные алкильные группы и третичные алкильные группы.
[0043] Фраза «замещенный алкил» относится к алкилу, замещенному в 1 или более, например, в 1, 2, 3, 4, 5 или даже в 6 положениях, заместители которого присоединены к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке. «Возможно замещенный алкил» относится к алкилу или замещенному алкилу.
[0044] Каждый из терминов «галоген», «галид» и «галогенид» относится к -F, -Cl, -Br или -I.
[0045] Термины «алкилен» и «замещенный алкилен» относятся к бивалентному алкилу и бивалентному замещенному алкилу, соответственно. Примеры алкиленов включают без ограничений этилен (-СН2-СН2-). «Возможно замещенный алкилен» относится к алкилену или замещенному алкилену.
[0046] «Алкен» относится к линейным, разветвленным или циклическим гидрокарбильным группам, содержащим от 2 до 20 атомов углерода и имеющим одну или более двойных углерод-углеродных связей, например, от 1 до 3, от 1 до 2 или по меньшей мере одну двойную углерод-углеродную связь. «Замещенный алкен» относится к алкену, замещенному в 1 или более, например, в 1, 2, 3, 4, 5 или даже 6 положениях, заместители которого присоединены к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке. «Возможно замещенный алкен» относится к алкену или замещенному алкену.
[0047] Термин «алкенилен» относится к бивалентному алкену. Примеры алкениленов включают без ограничений этенилен (-СН=СН-) и все его стереоизомерные и конформационные изомерные формы. «Замещенный алкенилен» относится к бивалентному замещенному алкену. «Возможно замещенный алкенилен» относится к алкенилену или замещенному алкенилену.
[0048] «Алкин» или «алкинил» относится к линейному или разветвленному ненасыщенному углеводороду, содержащему указанное число атомов углерода и по меньшей мере одну тройную связь. Примеры (С2-С8)алкинильных групп включают, но не ограничиваются ими, ацетилен, пропин, 1-бутин, 2-бутин, 1-пентин, 2-пентин, 1-гексин, 2-гексин, 3-гексин, 1-гептин, 2-гептин, 3-гептин, 1-октин, 2-октин, 3-октин и 4-октин. Алкинильная группа может быть незамещенной или возможно замещенной одним или более заместителями, описанным ниже в настоящей заявке.
[0049] Термин «алкинилен» относится к бивалентному алкину. Примеры алкиниленов включают без ограничений этинилен, пропинилен. «Замещенный алкинилен» относится к бивалентному замещенному алкину.
[0050] Термин «алкокси» относится к -O-алкильной группе, содержащей указанное число атомов углерода. Например, (С1-С6)алкоксигруппа включает -O-метил (метокси), -O-этил (этокси), -O-пропил (пропокси), -O-изопропил (изопропокси), -O-бутил (бутокси), -O-втор-бутил (втор-бутокси), -О-трет-бутил (трет-бутокси), -O-пентил (пентокси), -O-изопентил (изопентокси), -O-неопентил (неопентокси), -O-гексил (гексилокси), -O-изогексил (изогексилокси) и -O-неогексил (неогексилокси).
[0051] Термин «арил», используемый индивидуально или в комбинации, относится к ароматической моноциклической или бициклической системе колец, такой как фенил или нафтил. «Арил» также включает ароматические системы колец, которые могут быть конденсированы с циклоалкильным кольцом, определенным в настоящем описании.
[0052] «Замещенный арил» представляет собой арил, который независимо замещен одним или более заместителями, присоединенными к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке. «Возможно замещенный арил» относится к арилу или замещенному арилу.
[0053] «Арилен» обозначает бивалентный арил, а «замещенный арилен» относится к бивалентному замещенному арилу. «Возможно замещенный арилен» относится к арилену или замещенному арилену.
[0054] Термин «гетероатом» относится к N, О и S. Соединения согласно настоящему изобретению, которые содержат атомы N или S, могут быть окислены с образованием соответствующих N-оксидов, сульфоксидов или сульфонов.
[0055] «Гетероарил», используемый индивидуально или в комбинации с любым другим фрагментом, описанным в настоящей заявке, относится к моноциклическому ароматическому кольцу, содержащему 5 или 6 атомов в кольце, или к бициклической ароматической группе, содержащей от 8 до 10 атомов, содержащим один или более, например, от 1 до 4, от 1 до 3 или от 1 до 2 гетероатомов, независимо выбранных из группы, состоящей из О, S и N. Предполагается, что гетероарил также включает окисленные формы S или N, такие как сульфинил, сульфонил и N-оксид третичного атома азота в кольце. Атом углерода или гетероатом являются местом присоединения гетероарильного кольца с образованием стабильного соединения. Примеры гетероарильных групп включают, но не ограничиваются ими, пиридинил, пиридазинил, пиразинил, хиноксалил, индолизинил, бензо[b]тиенил, хиназолинил, пуринил, индолил, хинолинил, пиримидинил, пирролил, пиразолил, оксазолил, тиазолил, тиенил, изоксазолил, оксатиадиазолил, изотиазолил, тетразолил, имидазолил, триазолил, фуранил, бензофурил и индолил. «Гетероарил» также охватывает конденсированные системы колец, где гетероарил конденсирован с арилом или циклоалкильным кольцом, определенным в настоящем описании.
[0056] «Замещенный гетероарил» представляет собой гетероарил, который независимо замещен, если не указано иное, одним или более, например, 1, 2, 3, 4 или 5 заместителями, присоединенными к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке. «Возможно замещенный гетероарил» относится к гетероарилу или замещенному гетероарилу.
[0057] «Гетероарилен» относится к бивалентному гетероарилу, а «замещенный гетероарилен» относится к бивалентному замещенному гетероарилу. «Возможно замещенный гетероарилен» относится к гетероарилену или замещенному гетероарилену.
[0058] «Гетероциклоалкил» означает насыщенную или ненасыщенную неароматическую моноциклическую, бициклическую, трициклическую или полициклическую систему колец, которая содержит от 5 до 14 атомов, в которой от 1 до 3 атомов углерода в кольце заменены на гетероатомы О, S или N. Гетероциклоалкил может быть конденсирован с бензо или гетероарилом, содержащим 5-6 членов в кольце, и включает окисленные формы S или N, такие как сульфинил, сульфонил и N-оксид третичного атома азота в кольце. Местом присоединения гетероциклоалкильного кольца являются атом углерода или гетероатом, при этом сохраняется стабильность кольца. Примеры гетероциклоалкильных групп включают без ограничений морфолин, тетрагидрофуранил, дигидропиридинил, пиперидинил, пирролидинил, пиперазинил, дигидробензофурил и дигидроиндолил.
[0059] «Возможно замещенный гетероциклоалкил» обозначает гетероциклоалкил, который замещен 1-3 заместителями, например, 1, 2 или 3 заместителями, присоединенными к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке.
[0060] «Гетероалкил» означает насыщенную алкильную группу, содержащую примерно от 1 до 20 атомов углерода, от 1 до 10 атомов углерода, от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, в которой от 1 до 3 атомов углерода заменены на гетероатомы О, S или N. Предполагается, что гетероалкил также включает окисленные формы S или N, такие как сульфинил, сульфонил и N-оксид третичного атома азота в кольце. Местом присоединения гетероалкильного заместителя является атом, в результате присоединения к которому образуется стабильное соединение. Примеры гетероалкильных групп включают, но не ограничиваются ими, N-алкиламиноалкил (например, CH3NHCH2-), N,N-диалкиламиноалкил (например, (CH3)2NCH2-) и т.д.
[0061] «Гетероалкилен» относится к бивалентному гетероалкилу. Термин «возможно замещенный гетероалкилен» относится к гетероалкилену, который замещен 1-3 заместителями, например, 1, 2 или 3 заместителями, присоединенными к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке.
[0062] «Гетероалкен» означает ненасыщенную алкильную группу, содержащую примерно от 1 до 20 атомов углерода, от 1 до 10 атомов углерода, от 1 до 6 атомов углерода или от 1 до 3 атомов углерода, в которой от 1 до 3 атомов углерода заменены на гетероатомы О, S или N, и содержащую от 1 до 3, от 1 до 2 или по меньшей мере одну двойную углерод-углеродную связь или двойную связь углерод-гетероатом.
[0063] «Гетероалкенилен» относится к бивалентному гетероалкену. Термин «возможно замещенный гетероалкенилен» относится к гетероалкенилену, который замещен 1-3 заместителями, например, 1, 2 или 3 заместителями, присоединенными к любому доступному атому с образованием стабильного соединения, где заместители описаны в настоящей заявке.
[0064] Термин «циклоалкил» относится к моноциклическим, бициклическим, трициклическим или полициклическим 3-14-членным системам колец, которые являются насыщенными, ненасыщенными или ароматическими. Циклоалкильная группа может быть присоединена через любой атом. Циклоалкил также охватывает конденсированные кольца, где циклоалкил конденсирован с арильным или гетероарильным кольцом, определенным выше. Типичные примеры циклоалкилов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкильная группа может быть незамещенной или возможно замещенной одним или более заместителями, описанными ниже в настоящей заявке.
[0065] Термин «циклоалкенил» относится к моноциклической, бициклической, трициклической или полициклической 3-14-членной системе колец, которая является ненасыщенной. Циклоалкенильная группа может быть присоединена через любой атом. Типичные примеры циклоалкенилов включают, но не ограничиваются ими, циклопропенил, циклобутенил, циклопентенил и циклогексенил.
[0066] Термин «циклоалкилен» относится к бивалентному циклоалкилу. Термин «возможно замещенный циклоалкилен» относится к циклоалкилену, который замещен 1-3 заместителями, например, 1, 2 или 3 заместителями, присоединенными к любому атому с образованием стабильного соединения, где заместители такие, как описано в настоящей заявке.
[0067] Термины «нитрил» и «циано», которые можно использовать взаимозаменяемо, относятся к группе -CN, которая связана с атомом углерода гетероарильного кольца, арильного кольца и гетероциклоалкильного кольца.
[0068] Термин «оксо» относится к атому =O, присоединенному к насыщенному или ненасыщенному (С3-С8)циклическому или (С1-С8)ациклическому фрагменту. Атом =O может быть присоединен к атомам углерода, серы и азота, которые являются частью циклического или ациклического фрагмента.
[0069] Термины «амин» или «амино» относятся к группе -NRdRe, где каждый Rd и Re независимо относится к водороду, (С1-С8)алкилу, арилу, гетероарилу, гетероциклоалкилу, (С1-С8)галогеналкилу и (С1-С6)гидроксиалкильной группе.
[0070] Термин «амид» относится к группе -NR′R′′C(O)-, где каждый R′ и R′′ независимо относится к водороду, (C1-C8)алкилу или (С3-С6)арилу.
[0071] Термин «карбоксамидо» относится к группе -C(O)NR′R′′, где каждый R′ и R′′ независимо относится к водороду, (C1-C8)алкилу или (С3-С6)арилу.
[0072] Термин «арилокси» относится к -O-арильной группе, содержащей указанное число атомов углерода. Примеры арилоксигрупп включают, но не ограничиваются ими, фенокси, нафтокси и циклопропенокси.
[0073] Термин «галогеналкокси» относится к -O-(С1-С6)алкильной группе, где один или более атомов водорода в C1-C8 алкильной группе заменены на атомы галогенов, которые могут быть одинаковыми или различными. Примеры галогеналкоксигрупп включают, но не ограничиваются ими, дифторметокси, трифторметокси, 2,2,2-трифторэтокси, 4-хлорбутокси, 3-бромпропилокси, пентахлорэтокси и 1,1,1-трифтор-2-бром-2-хлорэтокси.
[0074] Термин «гидроксиалкил» относится к алкильной группе, содержащей указанное число атомов углерода, где один или более атомов водорода алкильной группы заменен на -ОН группу. Примеры гидроксиалкильных групп включают, но не ограничиваются ими, -CH2OH, -CH2CH2OH, -CH2CH2CH2OH, -CH2CH2CH2CH2OH, -CH2CH2CH2CH2CH2OH, -CH2CH2CH2CH2CH2CH2OH и их разветвленные варианты.
[0075] Термин «алкилсульфонил» относится к (С1-С6)алкильной группе, где один или более атомов водорода в C1-С6 алкильной группе заменены на группы -S(O)a. Индекс «а» может быть равен 1 или 2, что соответствует алкилсульфоксиду (сульфинильной группе) или алкилсульфону, соответственно. Примеры алкилсульфонильных групп включают, но не ограничиваются ими, диметилсульфоксид, этилметилсульфоксил и метилвинилсульфон.
[0076] Термин «галогеналкил» относится к (С1-С6)алкильной группе, где один или более атомов водорода в C1-С6 алкильной группе заменены на атомы галогенов, которые могут быть одинаковыми или различными. Примеры галогеналкильных групп включают, но не ограничиваются ими, дифторметил, трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил, пентахлорэтил и 1,1,1-трифтор-2-бром-2-хлорэтил.
[0077] Термин «аминоалкил» относится к (С1-С6)алкильной группе, где один или более атомов водорода в C1-С6 алкильной группе заменены на группы -NRdRe, где Rd и Re могут быть одинаковыми или различными, например, каждый Rd и Re независимо относится к водороду, (С1-С8)алкилу, арилу, гетероарилу, гетероциклоалкилу, (C1-С8)галогеналкилу и (С1-С6)гидроксиалкильной группе. Примеры аминоалкильных групп включают, но не ограничиваются ими, аминометил, аминоэтил, 4-аминобутил и 3-аминобутил.
[0078] Термин «тиоалкил» или «алкилтио» относится к (С1-С6)алкильной группе, где один или более атомов водорода в C1-С6 алкильной группе заменены на группы -SRj, где Rj выбран из группы, состоящей из водорода, (С1-С6)алкила и (С3-С14)арила.
[0079] «Амино(С1-С6)алкилен» относится к бивалентному алкилену, где один или более атомов водорода в C1-С6 алкиленовой группе заменены на группы -NRdRe. Примеры амино-(С1-С6)алкиленов включают, но не ограничиваются ими, аминометилен, аминоэтилен, 4-аминобутилен и 3-аминобутилен.
[0080] Термин «сульфонамид» относится к группе -NRgS(O)2Rh, где каждый Rg и Rh независимо относится к водороду, (C1-C8)алкилу, арилу, гетероарилу, гетероциклоалкилу, (С1-С8)галогеналкилу и (С1-С6)гидроксиалкильной группе.
[0081] «Гидроксил» или «гидрокси» относится к -ОН группе.
[0082] Термин «(С3-С14)арил-(С1-С6)алкилен» относится к бивалентному алкилену, где один или более атомов водорода в C1-С6 алкиленовой группе заменены на (С3-С14)арильные группы. Примеры (С3-С14)арил-(С1-С6)алкиленовых групп включают без ограничений 1-фенилбутилен, фенил-2-бутилен, 1-фенил-2-метилпропилен, фенилметилен, фенилпропилен и нафтилэтилен.
[0083] Термин «(С3-С14)гетероарил-(С1-С6)алкилен» относится к бивалентному алкилену, где один или более атомов водорода в C1-С6 алкиленовой группе заменены на (С3-С14)гетероарильные группы. Примеры (С3-С14)гетероарил-(С1-С6)алкиленовых групп включают без ограничений 1-пиридилбутилен, хинолинил-2-бутилен и 1-пиридил-2-метилпропилен.
[0084] Термин «(С3-С14)гетероциклоалкил-(С1-С6)алкилен» относится к бивалентному алкилену, где один или более атомов водорода в C1-С6 алкиленовой группе заменены на (С3-С14)гетероциклоалкильные группы. Примеры (С3-С14)гетероциклоалкил-(С1-С6)алкиленовых групп включают без ограничений 1-морфолинилпропилен, азетидинил-2-бутилен и 1-тетрагидрофуранил-2-метилпропилен.
[0085] Термин «(С3-С14)гетероарил-(С1-С14)гетероциклоалкилен» относится к бивалентному гетероциклоалкилену, где один или более атомов водорода в C1-С6 гетероциклоалкиленовой группе заменены на (С3-С14) гетероарильные группы. Примеры (С3-С14)гетероарил-(С3-С14)гетероциклоалкиленовых групп включают без ограничений пиридилазетидинилен и 4-хинолинил-1-пиперазинилен.
[0086] Термин «(С3-С14)арил-(С1-С14)гетероциклоалкилен» относится к бивалентному гетероциклоалкилену, где один или более атомов водорода в С1-С14 гетероциклоалкиленовой группе заменены на (С3-С14)арильные группы. Примеры (С3-С14)арил-(С1-С14)гетероциклоалкиленовых групп включают без ограничений 1-нафтилпиперазинилен, фенилазетидинилен и фенилпиперидинилен.
[0087] Термин «(С3-С14)арил-(С1-С6)алкил-(С1-С14)гетероциклоалкилен» относится к бивалентному гетероциклоалкилену, где один или более атомов водорода в C1-С14 гетероциклоалкиленовой группе заменены на (С1-С6)алкильную группу, которая дополнительно замещена путем замены одного или более атомов водорода в (С1-С6)алкильной группе на (С3-С14)арильные группы.
[0088] Термин «(С3-С14)гетероарил-(С1-С6)алкил-(С1-С14)гетероциклоалкилен» относится к бивалентному гетероциклоалкилену, где один или более атомов водорода в C1-C14 гетероциклоалкиленовой группе заменены на (С1-С6)алкильную группу, которая дополнительно замещена путем замены одного или более атомов водорода в (С1-С6)алкильной группе на (С3-С14)гетероарильные группы.
[0089] Термин «(С3-С14)гетероциклоалкил-(С1-С6)алкил-(С1-С14)гетероциклоалкилен» относится к бивалентному гетероциклоалкилену, где один или более атомов водорода в C1-C14 гетероциклоалкиленовой группе заменены на (С1-С6)алкильную группу, которая дополнительно замещена путем замены одного или более атомов водорода в (С1-С6)алкильной группе на (С3-С14)гетероциклоалкильные группы.
[0090] Термин «(С3-С14)арил-(С1-С14)циклоалкилен» относится к бивалентному циклоалкилену, который является моноциклическим, бициклическим или полициклическим, где один или более атомов в (С1-С14)циклоалкиленовой группе заменены на (С3-С14)арильные группы. Примеры (С3-С14)арил-(С1-С14)циклоалкиленов включают без ограничений фенилциклобутилен, фенилциклопропилен и 3-фенил-2-метилбутилен-1-он.
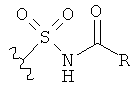
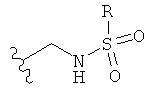
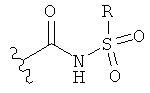
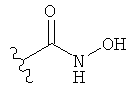
[0091] Заместитель -CO2H может быть замещен следующими биоизостерическими заместителями, например:
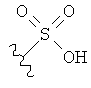 ,
, 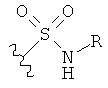 ,
,  ,
,  ,
,
 ,
,  ,
, 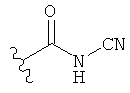 ,
, 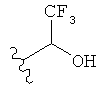 ,
,
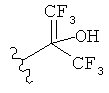 ,
, 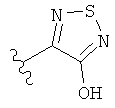 ,
, 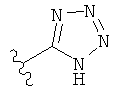 ,
, 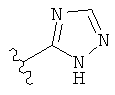 ,
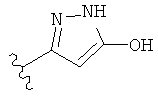
, 
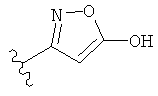 ,
, 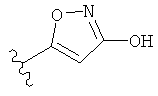 ,
, 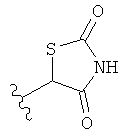 ,
, 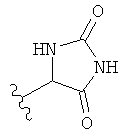 ,
,
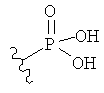 ,
,
и т.д., где R имеет то же определение, что и R′ и R′′, определенные в настоящем описании. См., например, The Practice of Medicinal Chemistry (Academic Press: New York, 1996), стр.203.
[0092] Соединение согласно настоящему изобретению может существовать в различных изомерных формах, включая конфигурационные, геометрические и конформационные изомеры, в том числе, например, цис- или транс-конформации. Соединения согласно настоящему изобретению также могут существовать в одной или более таутомерных формах, включая единственный таутомер и смеси таутомеров. Термин «изомер» охватывает все изомерные формы соединения согласно настоящему изобретению, включая таутомерные формы соединения.
[0093] Соединения согласно настоящему изобретению также могут существовать в открытой цепной или в циклической форме. В некоторых случаях одна или более циклических форм могут возникать в результате отщепления молекул воды. Конкретный состав открытой цепной и циклической формы может зависеть от выделения, хранения или введения соединения. Например, соединение может существовать, главным образом, в открытой цепной форме в кислых условиях, но циклизоваться в нейтральных условиях. Все формы включены в объем настоящего изобретения.
[0094] Некоторые соединения, описанные в настоящей заявке, могут иметь асимметрические центры и, таким образом, существовать в различных энантиомерных и диастереомерных формах. Соединение согласно настоящему изобретению может находиться в форме оптического изомера или диастереомера. Соответственно, изобретение охватывает соединения согласно настоящему изобретению в форме оптических изомеров, диастереоизомеров и их смесей, включая рацемические смеси, и их применения, описанные в настоящей заявке. Оптические изомеры соединений согласно настоящему изобретению можно получать при помощи известных способов, таких как асимметрический синтез, хиральная хроматография, хроматография с псевдодвижущимся слоем или путем химического разделения стереоизомеров с применением оптически активных расщепляющих агентов.
[0095] Если не указано иное, «стереоизомер» означает один из стереоизомеров соединения, который по существу не содержит другие стереоизомеры того же соединения. Таким образом, стереомерно чистое соединение, имеющее один хиральный центр, по существу не содержит другой энантиомер соединения. Стереомерно чистое соединение, имеющее два хиральных центра, по существу не содержит другие диастереомеры соединения. Как правило, стереомерно чистое соединение содержит более чем примерно 80% по массе одного стереоизомера соединения и менее чем примерно 20% по массе других стереоизомеров соединения, например, более чем примерно 90% по массе одного стереоизомера соединения и менее чем 10% по массе других стереоизомеров соединения или более чем примерно 95% по массе одного стереоизомера соединения и менее чем примерно 5% по массе других стереоизомеров соединения, или более чем примерно 97% по массе одного стереоизомера соединения и менее чем примерно 3% по массе других стереоизомеров соединения.
[0096] Если существует несоответствие между изображенной структурой и названием, прилагаемым к данной структуре, то следует рассматривать изображенную структуру. В дополнение, если стереохимия структуры или фрагмента структуры не обозначена, например, жирными или штриховыми линиями, то предполагается, что структура или фрагмент структуры охватывает все стереомерные формы. В некоторых случаях, тем не менее, если существует более одного хирального центра, то структуры и названия могут быть предложены для единственного энантиомера для описания относительной стереохимии. Специалистам в области органического синтеза известно, возможно ли получение соединений в виде единственного изомера при помощи способов, применяемых для получения этих соединений.
[0097] «Фармацевтически приемлемая соль» представляет собой фармацевтически приемлемую соль соединения согласно настоящему изобретению и органической или неорганической кислоты или основания. Типичные фармацевтически приемлемые соли включают, например, соли щелочных металлов, соли щелочноземельных металлов, соли аммония, водорастворимые и не растворимые в воде соли, такие как ацетат, амсонат (4,4-диаминостильбен-2,2-дисульфонат), бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, бутират, соли кальция, кальция эдетат, камзилат, карбонат, хлорид, цитрат, клавуланат, дигидрохлорид, эдетат, эдизилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексафторфосфат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напзилат, нитрат, аммонийная соль N-метилглюкамина, 3-гидрокси-2-нафтоат, олеат, оксалат, пальмитат, памоат (1,1-метен-бис-2-гидрокси-3-нафтоат, эйнбонат), пантотенат, фосфат/дифосфат, пикрат, полигалактуронат, пропионат, п-толуолсульфонат, салицилат, стеарат, субацетат, сукцинат, сульфат, сульфосалицилат, сурамат, таннат, тартрат, теоклат, тозилат, триэтйодид и валерат. Фармацевтически приемлемая соль может иметь более одного заряженного атома в структуре. В этом случае фармацевтически приемлемая соль может иметь несколько противоионов. Таким образом, фармацевтически приемлемая соль может иметь один или более заряженных атомов и/или один или более противоионов.
[0098] Термины «излечивать», «подвергать лечению» и «лечение» относятся к ослаблению или устранению заболевания или симптомов, связанных с заболеванием. В конкретных вариантах реализации эти термины относятся к локализации или минимизации степени тяжести заболевания в результате введения одного или более профилактических или терапевтических агентов пациенту, страдающему от указанного заболевания.
[0099] Термины «предотвращать», «предотвращение» и «профилактика» относятся к предотвращению проявлений, повторного возникновения или распространения заболевания у пациента в результате введения профилактического или терапевтического агента.
[0100] Термин «эффективное количество» относится к количеству соединения согласно настоящему изобретению, например, соединения Формулы I или Формулы II, или другого активного ингредиента, достаточному для обеспечения терапевтического или профилактического благоприятного действия при лечении или профилактике заболевания или для задержки или минимизации симптомов, связанных с заболеванием. В дополнение, терапевтически эффективное количество соединения согласно настоящему изобретению означает, что такое количество терапевтического агента, используемого отдельно или в комбинации с другими терапиями, которое обеспечивает терапевтическое благоприятное действие при лечении или профилактике заболевания. Этот термин, используемый в отношении соединения согласно настоящему изобретению, может охватывать количество, которое приводит к улучшению терапии в целом, к снижению или устранению симптомов или причин заболевания или улучшает терапевтическую эффективность или синергию в случае применения совместно с другим терапевтическим агентом.
[0101] Термины «модулировать», «модуляция» и т.д. относятся к способности соединения Формулы I или Формулы II увеличивать или снижать функцию или активность, например, аргиназы I или аргиназы II, «Модуляция», а также ее различные формы, охватывает ингибирование, антагонизм, неполный антагонизм, активацию, агонизм и/или неполный агонизм в отношении активности аргиназы. Ингибиторы аргиназы представляют собой соединения, которые, например, связываются, частично или полностью блокируют стимуляцию, снижают, предотвращают, задерживают активацию, деактивируют, делают менее чувствительной или вызывают понижающую регуляцию сигнальной трансдукции. Способность соединения модулировать активность аргиназы можно подтверждать при помощи ферментного исследования или клеточного исследования.
[0102] «Пациент» включает животных, таких как человек, корова, лошадь, овца, ягненок, свинья, цыпленок, индейка, перепел, кошка, собака, мышь, крыса, кролик или морская свинка. Животное может быть млекопитающим, например, отличным от примата или приматом (например, обезьяной или человеком). В одном из вариантов реализации пациент представляет собой человека, например, младенца, ребенка, подростка или взрослого человека.
[0103] Термин «пролекарство» относится к предшественнику лекарственного средства, представляющему собой соединение, которое после введения пациенту должно подвергаться химической конверсии в результате метаболических процессов перед превращением в активный фармакологический агент. Типичные пролекарства соединений Формул I и II представляют собой сложные эфиры, пинены, диоксабороланы и амиды.
СОЕДИНЕНИЯ ФОРМУЛЫ I
[0104] Согласно предложенному выше описанию настоящее изобретение относится к соединениям Формулы I.

[0105] В соединениях Формулы I D выбран из группы, состоящей из линейного или разветвленного (С1-С6)алкилена, линейного или разветвленного (С2-С8)алкенилена, линейного или разветвленного (С2-С8)алкинилена, (С3-С14)арилена и (С3-С14)циклоалкилена. В некоторых вариантах реализации одна или более -СН2- групп в D возможно и независимо заменены на фрагмент, выбранный из группы, состоящей из -O-, -NR′-, -S-, -SO-, -SO2- и -CR′R′′-. Например, D может представлять собой четырехатомный линкер, имеющий формулу -L1-L2-СН2-СН2-, -CH2-L1-L2-CH2-, -CH2-CH2-L1-L2-, -L1-CH2-СН2-L2-, -L1-СН2-L2-СН2- или -L1-CH2-CH2-L2-. Переменные L1 и L2 независимо выбраны из группы, состоящей из О, NR′, S, SO, SO2 и CR′R′′, где R′ и R′′ определены выше.
[0106] В других вариантах реализации D содержит (С3-С14)циклоалкиленильное кольцо, два члена которого представляют собой две соседние -СН2- группы в D, у каждой из которых удален один атом водорода. Конкретным примером D является н-бутилен, где второй и третий атомы углерода являются частью циклопропильной группы, как показано для фрагмента 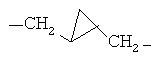 .
.
[0107] Переменная D преимущественно представляет собой трех-пятиатомный линкер. В конкретном преимущественном варианте реализации предложен D в виде четырехатомного линкера, который описан в настоящей заявке.
[0108] В одном из вариантов реализации, например, в изобретении предложены соединения Формулы I, в которых D представляет собой бутилен, R1 представляет собой -ОН, каждый из R3, R4 и R5 представляет собой водород, а R2 выбран из группы, состоящей из (С1-С6)алкила, (С3-С14)арила, (С3-С14)гетероарила, (С3-С14)гетероциклоалкила, (С3-С14)гетероарил-(С1-С6)алкилена-, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, (С3-С14)арил-(С1-С6)алкилена- и -(CH2)n-(X)u-(CH2)m-(Y)v-Rf.
[0109] В другом варианте реализации R2 представляет собой -(CH2)n-(X)u-(CH2)m-(Y)v-Rf. Каждый Х и Y независимо представляет собой -NH, индексы m и n равны 1 и 2, соответственно, а u и v оба равны 1.
[0110] В качестве альтернативы R2 может представлять собой алкильную группу, которая возможно замещена гидроксилом или -NRdRe, где каждый из Rd и Re независимо выбран из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, (С1-С6)аминоалкила, возможно замещенного (С3-С14)арил(С1-С6)алкилена-, возможно замещенного (С3-С14)арила и возможно замещенного (С3-С6)циклоалкила. Например, если R2 представляет собой аминоалкил, то каждый из Rd и Re может представлять собой (С1-С6)аминоалкил.
[0111] В другом варианте реализации R2 может представлять собой (С3-С14)гетероциклоалкил-(С1-С6)алкилен-, например, (С3-С6)гетероциклоалкил-(С1-С2)алкилен-. Подходящие (С3-С6)гетероциклоалкилы включают азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тетрагидро-2Н-пиранил и тиоморфолинил. (С3-С6)гетероциклоалкил может быть замещен одним или более заместителями, выбранными из группы, состоящей из -(С1-С6)алкокси, -(С1-С6)алкила и -ОН. В одном из вариантов реализации (С3-С6)гетероциклоалкил может представлять собой пиперидинил или пирролидинил, а -(С1-С6)алкилен- может представлять собой метилен или этилен.
[0112] В соединениях Формулы I, если R2 представляет собой (С3-С14)гетероарил-(С1-С6)алкилен-, то R2 может представлять собой (С3-С6)гетероарил-(С1-С6)алкиленовую группу. Типичные (С3-С6)гетероарильные группы без ограничений включают пиридинил, бензимидазолил, бензотиазолил, имидазол, 1,2,3-триазол, 1,2,4-триазол, тетразол, пиримидин, имидазо[1,2-а]пиридин, оксазол, изоксазол и фуран. В одном из вариантов реализации изобретения -(С1-С6)алкилен- может представлять собой метилен или этилен.
[0113] В некоторых вариантах реализации R3 и R4 совместно с атомом бора, с которым они связаны, образуют 5- или 6-членное кольцо, которое является полностью или частично насыщенным и которое возможно содержит 1-3 дополнительных гетероатома, выбранные из О, S и N. Кольцо возможно замещено одним или более заместителями, определенными в настоящей заявке для R′ и R′′.
[0114] Циклические структуры этого типа подходят в качестве пролекарств соединений согласно настоящему изобретению за счет того, что R3 и R4 образуют циклический сложный эфир из диольного фрагмента. Подходящим диолом для образования циклических сложных эфиров является пинакон, другим диолом является пинандиол. Другие диолы включают, но не ограничиваются ими, неопентилгликоль, 1,2-этандиол, 1,2-пропандиол, 1,3-пропандиол, 2,3-бутандиол, 1,2-диизопропилэтандиол и 5,6-декандиол.
[0115] Также в изобретении описаны соединения, где фрагмент бороновой кислоты в Формуле I этерифицирован сахаром. Соединения этого класса также являются подходящими пролекарствами. Подходящие сахара включают без ограничений моносахариды и дисахариды, например, сахара, выбранные из группы, состоящей из глюкозы, маннита и сорбита.
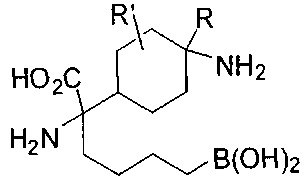
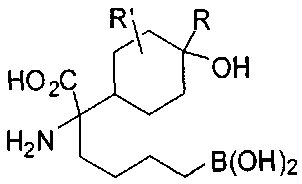
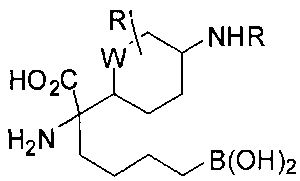
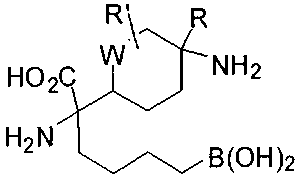
[0116] В других вариантах реализации R2 представляет собой (С3-С14)циклоалкил, возможно замещенный 1-3 заместителями, определенными выше в настоящем описании. Типичными циклоалкильными группами являются циклогексил и циклопентил. В качестве альтернативы R2 представляет собой (С3-С14)гетероциклоалкил, например, пяти- или шестичленный гетероциклоалкил. Примеры соединений Формулы I согласно этим вариантам реализации включают соединения, предложенные ниже в таблице, где R′ определен выше, R имеет одинаковое значение с R′, a W представляет собой гетероатом, определенный выше:
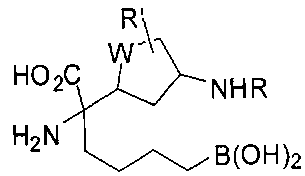
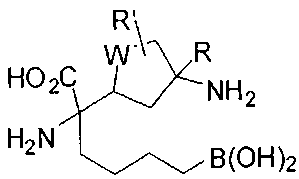
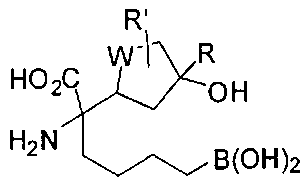
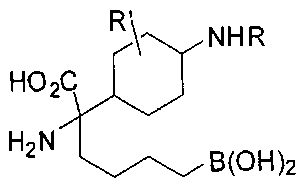
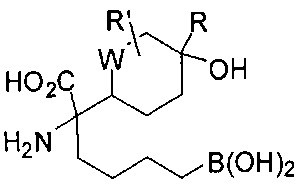
[0117] Следует понимать, что 2-амино-4-бороно-2-метилбутановая кислота исключена из Формулы I.
[0118] Типовые соединения Формулы I включают без ограничений соединения, указанные ниже в Таблице 1. Несмотря на то, что для некоторых типовых соединений изображена стереохимия, следует понимать, что изобретение включает все возможные стереоизомеры, например, диастереомеры, соединений.
[0119]
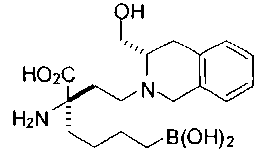
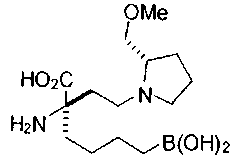
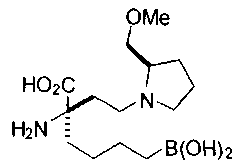
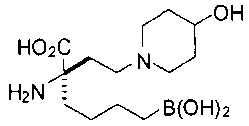
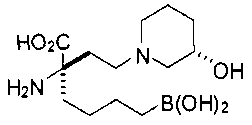
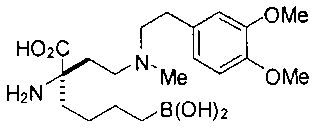
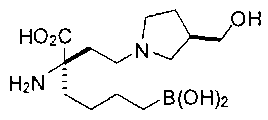
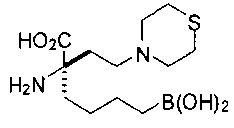
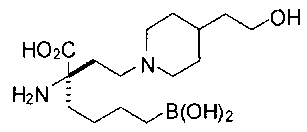
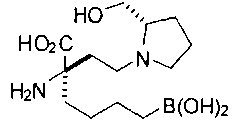
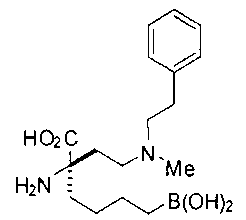
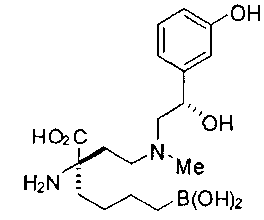
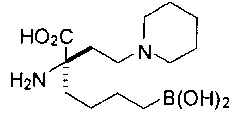
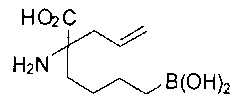
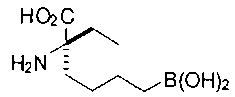
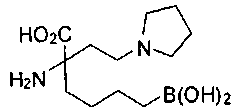
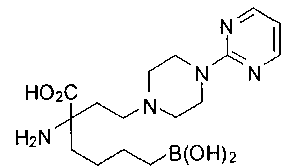
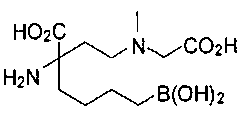
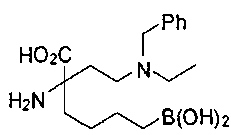
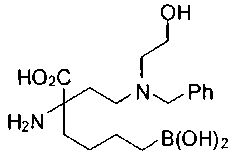
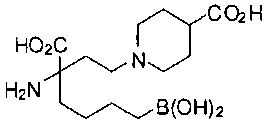
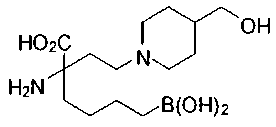
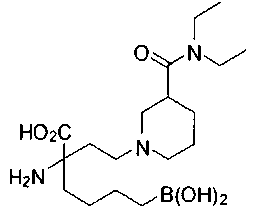
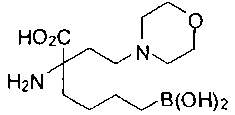
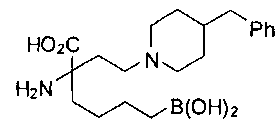
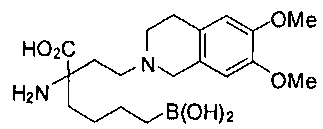
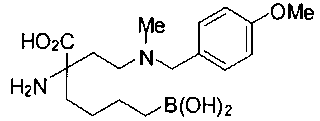
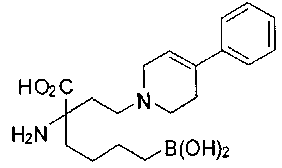
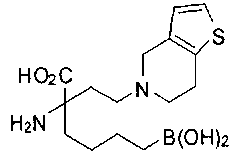
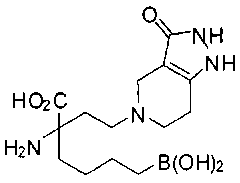
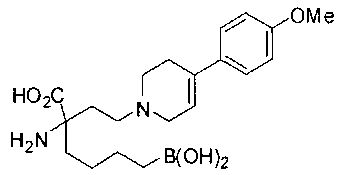
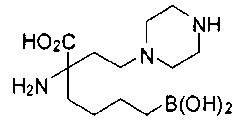
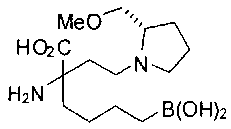
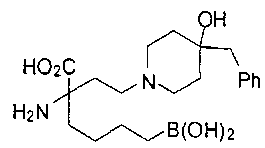
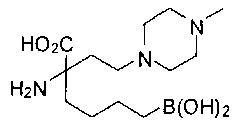
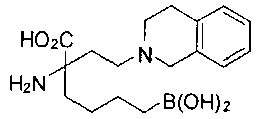
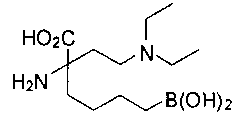
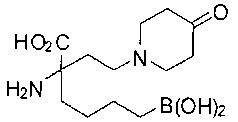
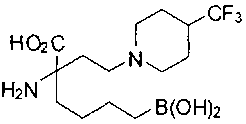
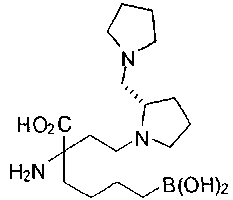
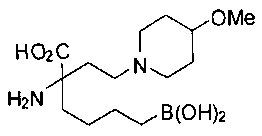
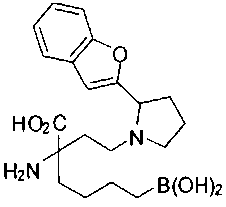
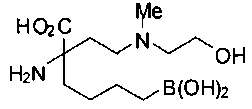
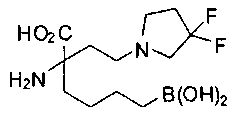
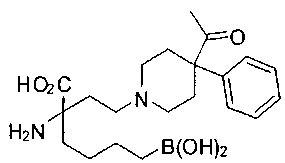
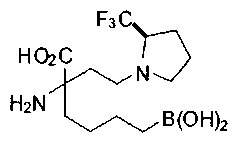
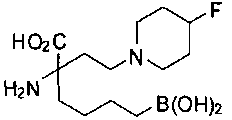
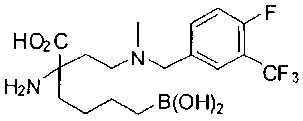
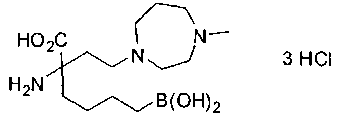
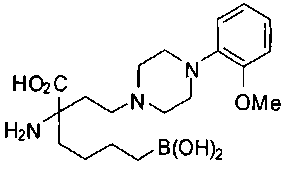
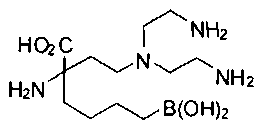
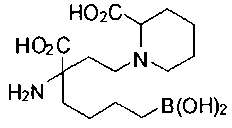
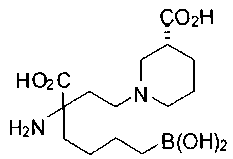
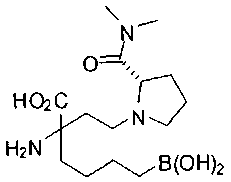
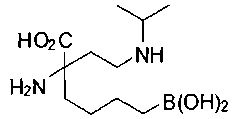
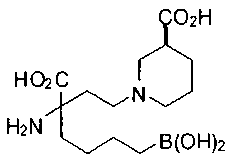
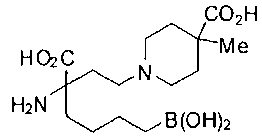
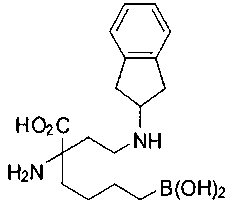
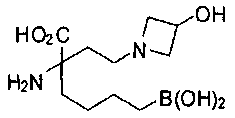
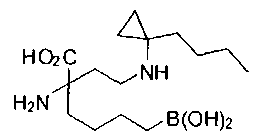
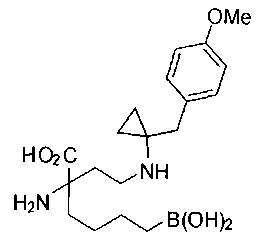
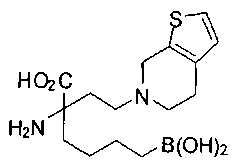
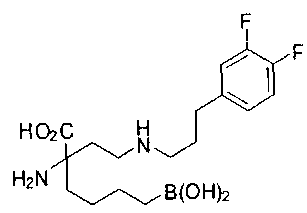
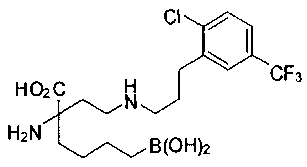
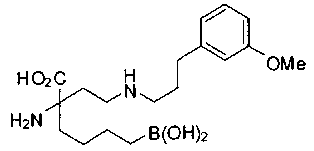
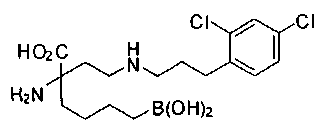
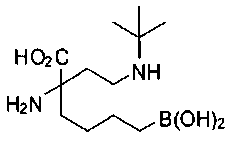
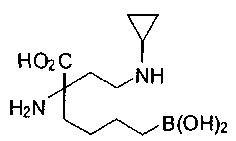
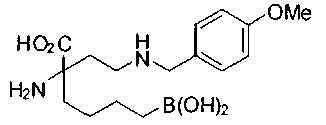
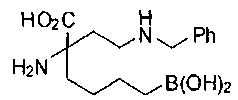
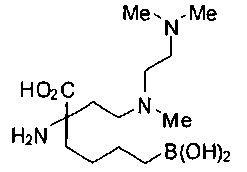
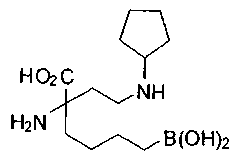
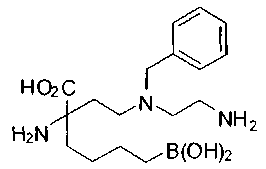
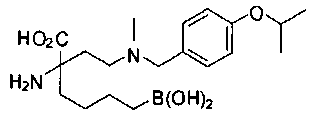
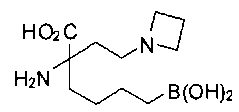
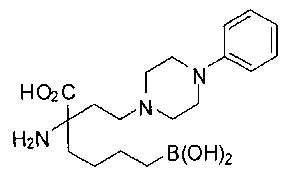
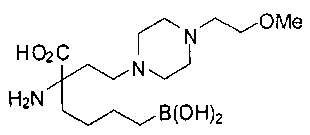
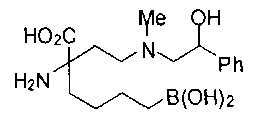
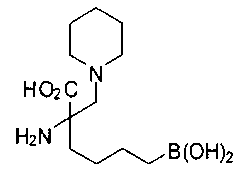
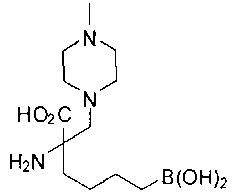
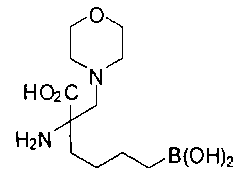
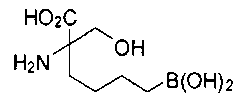
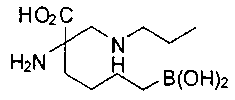
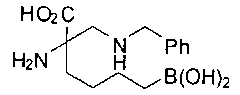
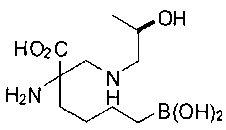
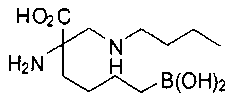
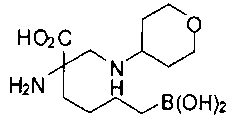
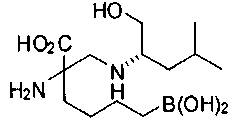
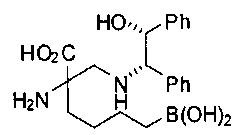
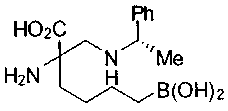
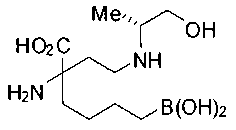
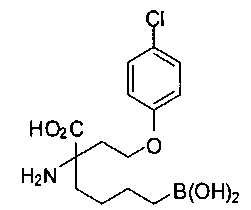
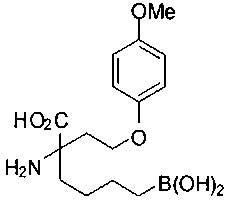
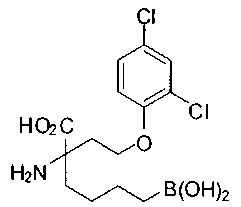
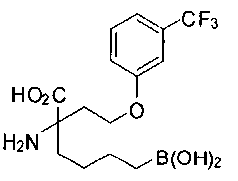
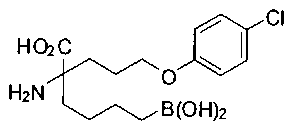
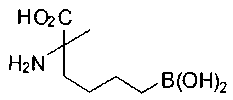
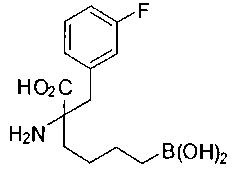
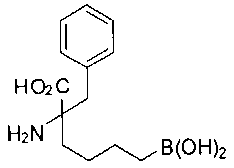
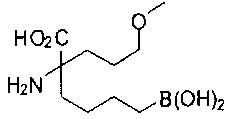
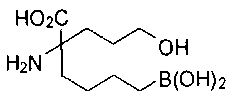
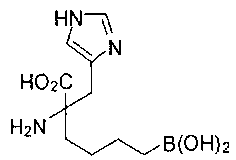
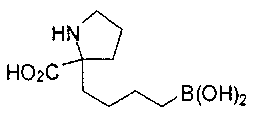
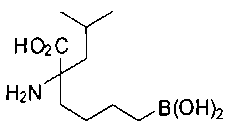
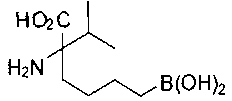
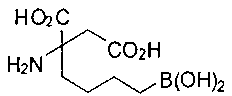
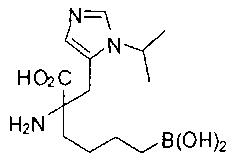
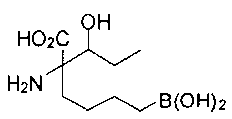
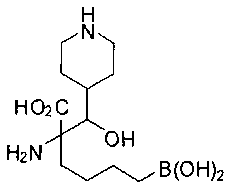
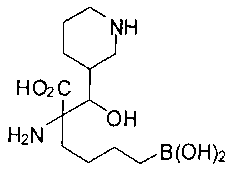
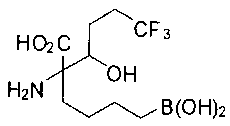
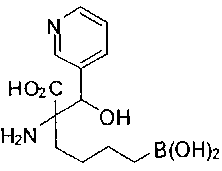
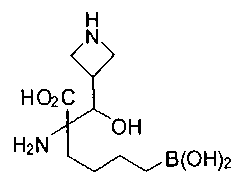
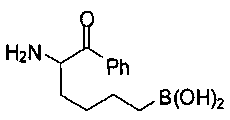
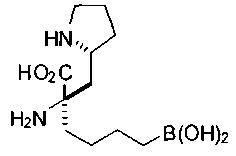
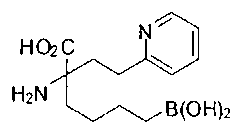
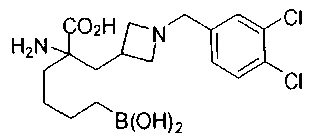
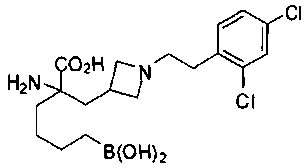
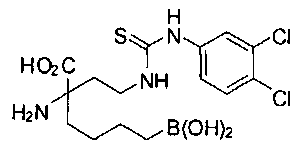
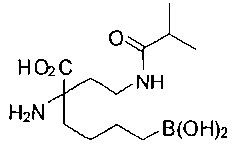
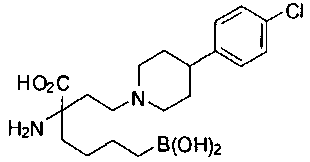
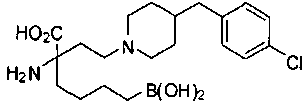
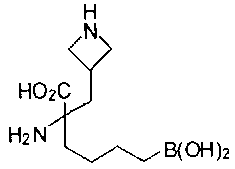
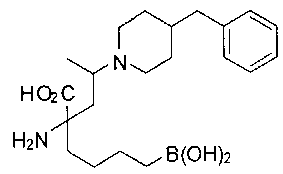
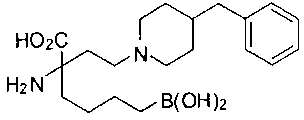
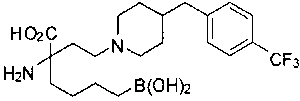
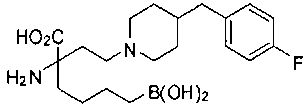
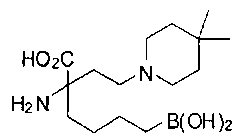
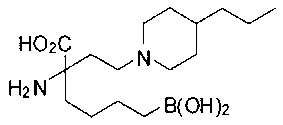
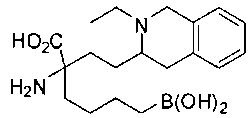
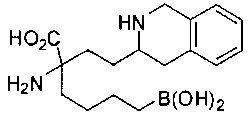
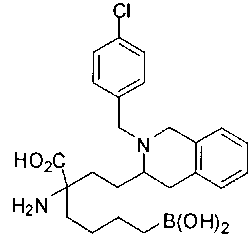
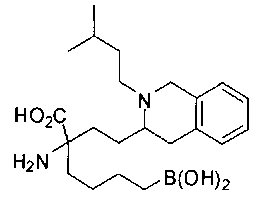
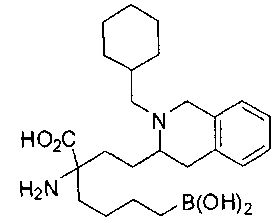
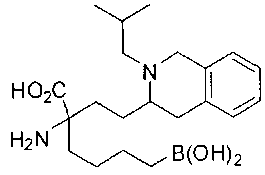
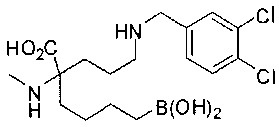
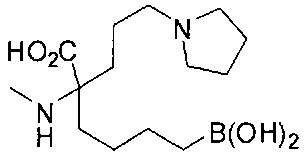
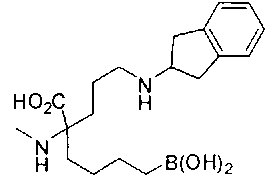
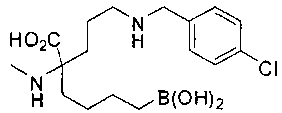
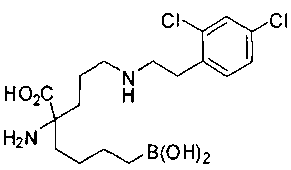
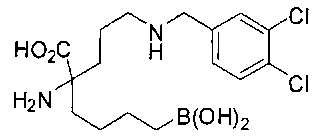
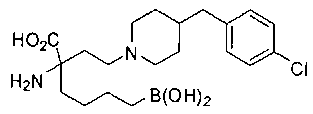
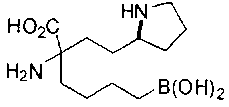
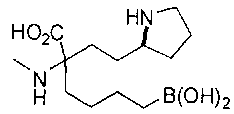
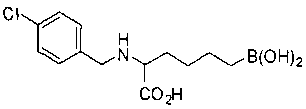
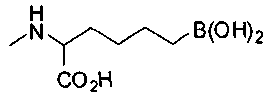
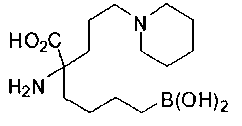
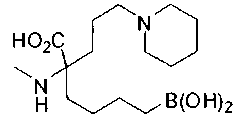
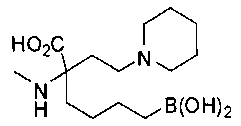
СОЕДИНЕНИЯ ФОРМУЛЫ II
[0120] Настоящее изобретение также относится к соединениям Формулы II.
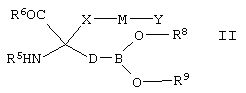
[0121] В соединениях, которые соответствуют Формуле II, D выбран из группы, состоящей из линейного или разветвленного (С3-С5)алкилена, линейного или разветвленного (С2-С8)алкенилена, линейного или разветвленного (С2-С8)алкинилена, (С3-С14)арилена и (С3-С14)циклоалкилена. В одном из вариантов реализации одна или более -СН2- групп в D возможно и независимо заменены на фрагмент, выбранный из группы, состоящей из О, NR′, S, SO, SO2 и CR′R′′. Тем не менее, любые две соседние -СН2- группы в D одновременно не заменены на О, NR′, S, SO или SO2.
[0122] Согласно одному из вариантов реализации D соответствует формуле -L1-L2-СН2-СН2-, -CH2-L1-L2-CH2-, -CH2-CH2-L1-L2-, -L1-CH2-CH2-L2-, -L1-CH2-L2-CH2- или -CH2-L1-CH2-L2-. Каждая переменная L1 и L2 независимо выбрана из группы, состоящей из О, NR′, S, SO, SO2 и CR′R′′, но если -L1 и -L2 являются соседними, то L1 и L2 одновременно могут представлять собой О, NR′, S, SO или SO2 группу.
[0123] В конкретных соединениях Формулы II любые две соседние -СН2- группы в D возможно являются двумя членами (С3-С14)циклоалкиленильной группы. Таким образом, например, если D представляет собой пропилен, то у каждого из атомов С2 и С3 один атом водорода заменен на связь с -СН2- группой с образованием циклопропильного кольца, проиллюстрированного предложенным ниже фрагментом 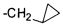 .
.
[0124] Переменная D преимущественно представляет собой трех-пятиатомный линкер. В особенно преимущественном варианте реализации предложен D в виде четырехатомного линкера, описанного в настоящей заявке.
[0125] В соединениях Формулы II заместитель Х выбран из группы, состоящей из (С3-С14)циклоалкилена и (С3-С14)гетероциклоалкилена. Переменная М выбрана из группы, состоящей из связи, (С1-С6)алкилена-, -O-, -С(O)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S-, -S(O)-, -S(O)2-, -NR′- и -C=NR11-.
[0126] Заместитель Y в Формуле II выбран из группы, состоящей из Н, (С1-С14)алкила, -NR′R′′, гидрокси(С1-С6)алкилена, (С3-С14)циклоалкила, (С3-С14)циклоалкил-(С1-С6)алкилена, (С3-С14)арила, (С3-С14)арил-(С1-С6)алкилена, (С3-С14)гетероциклоалкила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена, (С3-С14)гетероарила, (С3-С14)гетероарил-(С1-С6)алкилена, (С3-С14)гетероарил-(С3-С6)гетероциклоалкилена-, (С3-С14)арил-(С3-С14)гетероциклоалкилена-, (С3-С14)арил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена-, (С3-С14)гетероарил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена- и (С3-С14)гетероциклоалкил-(С1-С6)алкил-(С3-С14)гетероциклоалкилена-.
[0127] В конкретных соединениях Формулы II D представляет собой бутилен, Х представляет собой (С3-С14)гетероциклоалкилен, М выбран из группы, состоящей из связи, (С1-С6)алкилена-, -O-, -С(O)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S-, -S(O)-, -S(O)2-, -NR′- и -C=NR11-, a Y выбран из группы, состоящей из (С3-С14)гетероарила, (С3-С14)циклоалкила, (С3-С14)арила, (С3-С14)арил-(С1-С6)алкилена и (С3-С14)гетероарил-(С1-С6)алкилена. Согласно другому варианту реализации, тем не менее, М выбран из группы, состоящей из -С(O)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S(O)2- и -NR′-.
[0128] В конкретных соединениях Формулы II, если М представляет собой -NR′-, то заместитель R′ может представлять собой метиленовую группу или этиленовую группу. В качестве альтернативы R′ представляет собой -С(O)-(С1-С8)алкилен, например, -С(O)-метилен.
[0129] Типовые соединения Формулы II включают без ограничений соединения, проиллюстрированные ниже в Таблице 1-А. Несмотря на то, что для некоторых типовых соединений изображена стереохимия, следует понимать, что изобретение охватывает все возможные стереоизомерные формы, например, диастереомеры, соединений.
[0130]
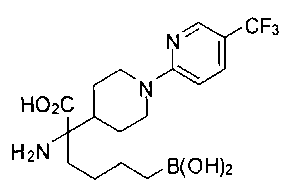
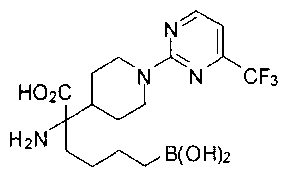
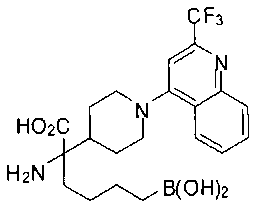
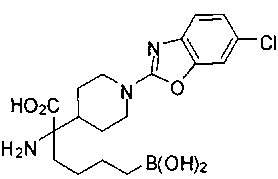
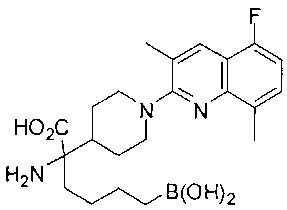
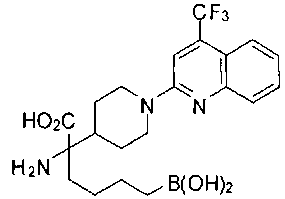
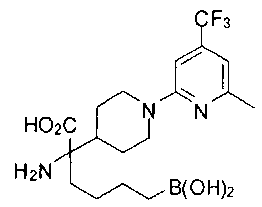
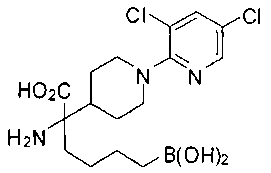
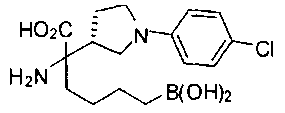
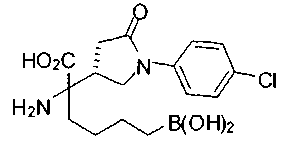
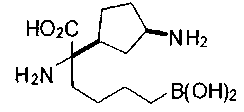
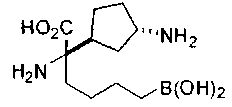
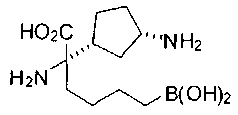
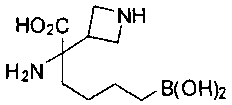
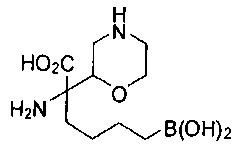
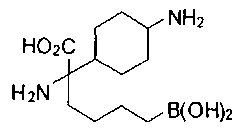
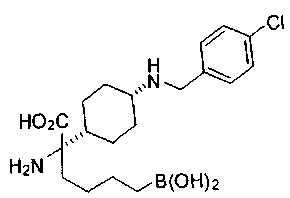
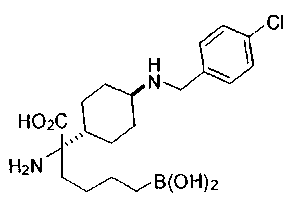
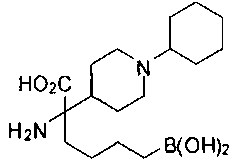
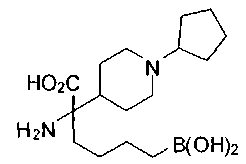
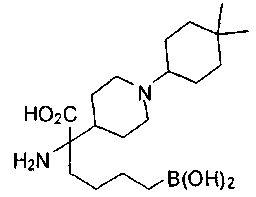
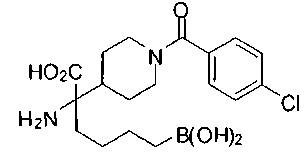
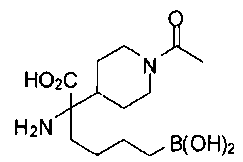
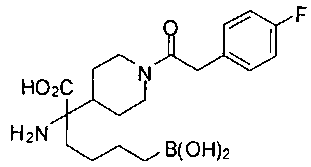
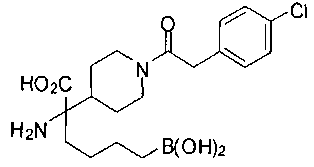
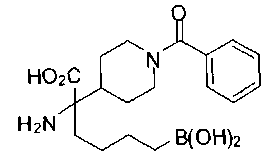
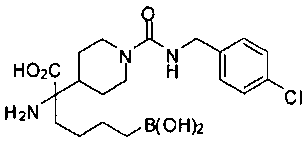
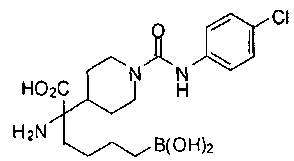
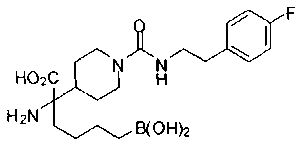
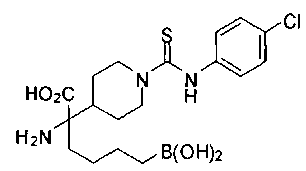
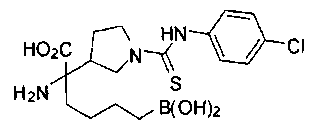
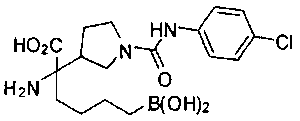
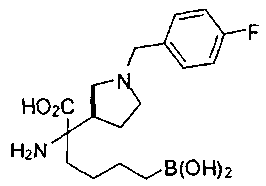
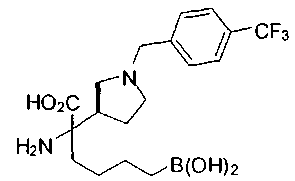
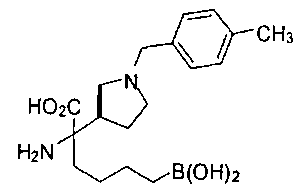
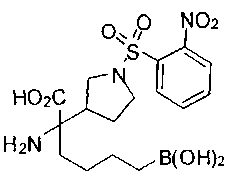
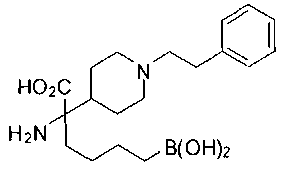
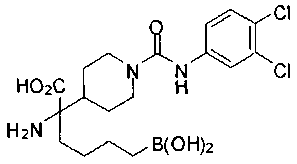
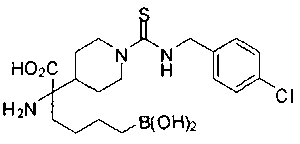
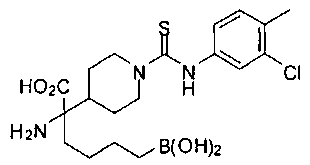
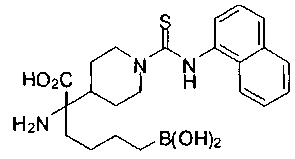
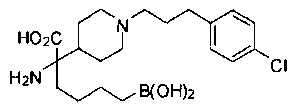
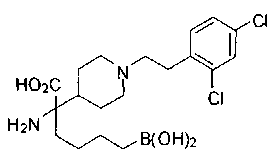
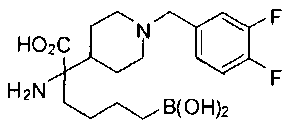
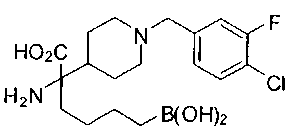
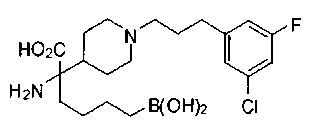
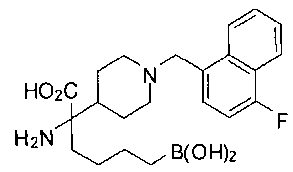
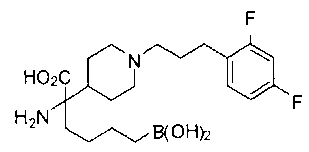
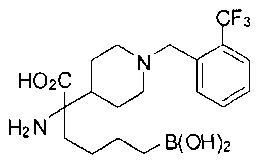
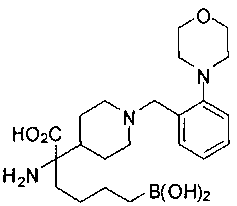
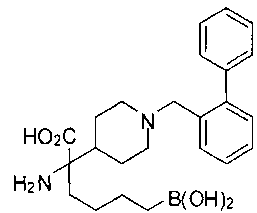
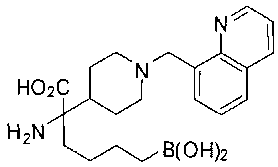
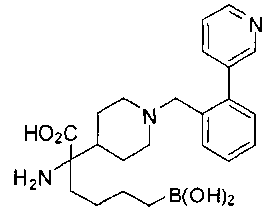
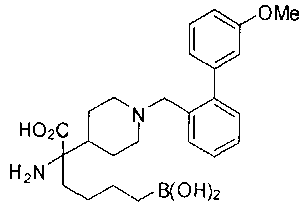
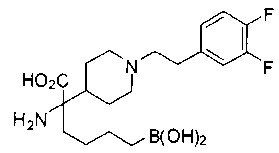
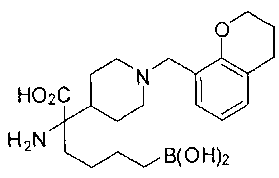
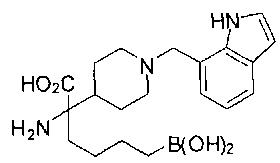
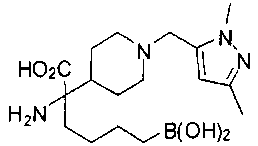
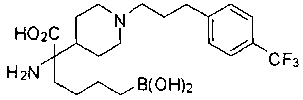
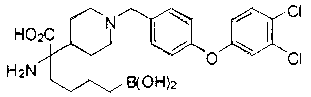
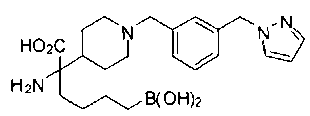
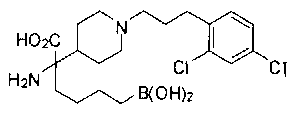
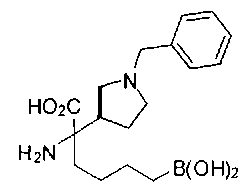
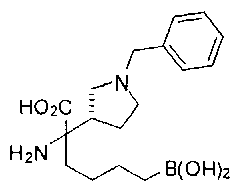
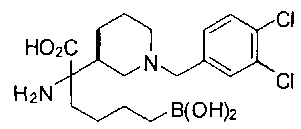
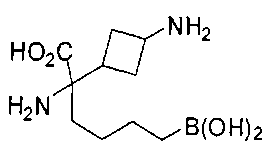
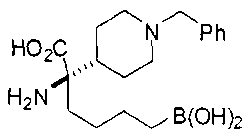
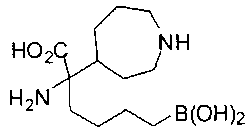
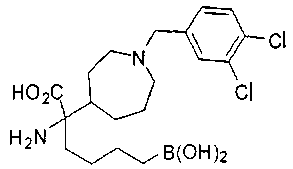
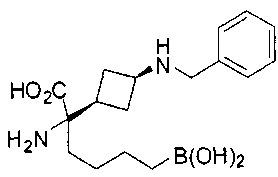
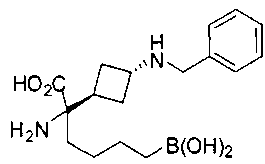
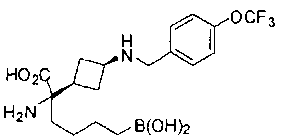
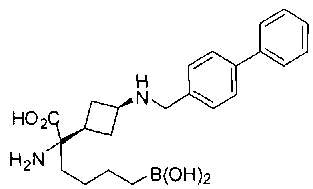
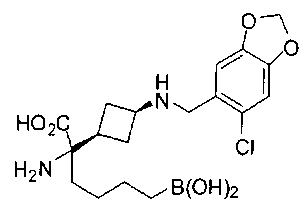
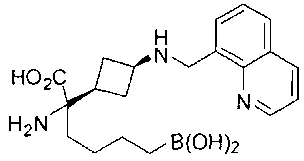
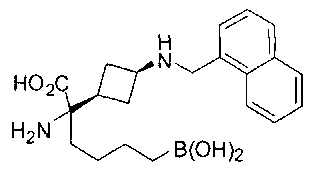
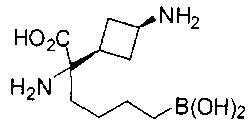
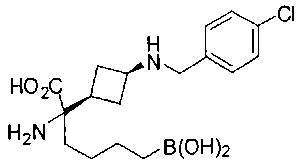
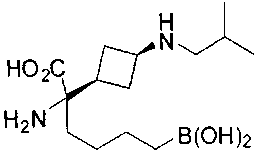
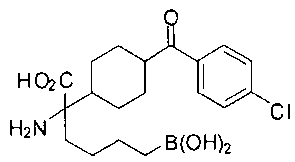
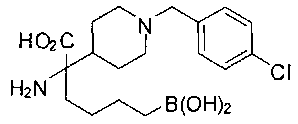
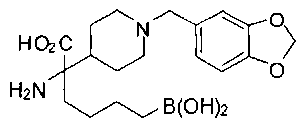
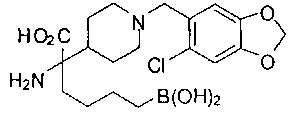
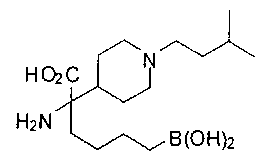
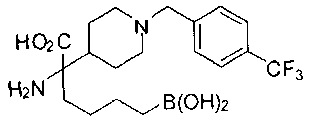
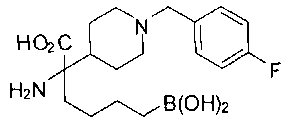
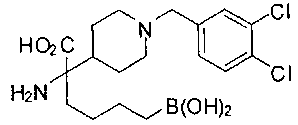
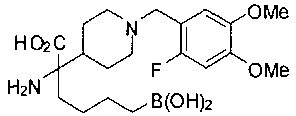
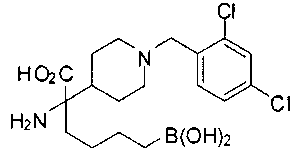
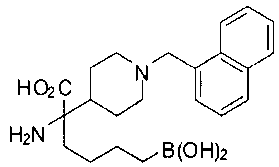
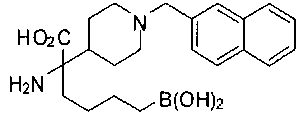
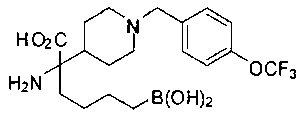
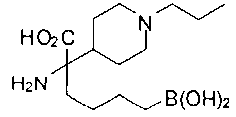
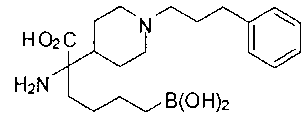
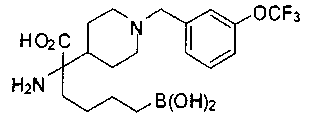
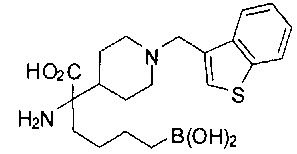
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ДОЗИРОВКИ
[0131] Настоящее изобретение частично направлено на фармацевтические составы, содержащие соединения Формулы I или Формулы II, и на применение составов согласно настоящему изобретению для лечения болезненных состояний, связанных с дисбалансом активности аргиназы или нарушенной функцией ферментов аргиназ. Согласно одному из аспектов в настоящем изобретении предложена комбинированная терапия, в которой пациенту или субъекту, нуждающемуся в терапии, вводят состав, содержащий соединение Формулы I или Формулы II, в комбинации с одним или более другими соединениями, имеющими схожую или отличающуюся биологическую активность.
[0132] Согласно одному из аспектов способа проведения комбинированной терапии терапевтически эффективную дозу соединения Формулы I или Формулы II можно вводить пациенту или субъекту отдельно от терапевтически эффективной дозы используемого в комбинации другого лекарственного средства. Специалистам в данной области техники будет очевидным, что две дозы можно вводить с интервалом в несколько часов или дней или две дозы можно вводить совместно.
[0133] Типичные болезненные состояния, для которых можно проводить комбинированную терапию согласно настоящему изобретению, включают любые состояния, более подробно описанные ниже, например, без ограничений, заболевания сердца, гипертензию, сексуальные расстройства, нарушения желудочно-кишечного тракта, аутоиммунные нарушения, паразитарные инфекции, легочные нарушения, нарушения расслабления гладких мышц и гемолитические нарушения.
[0134] Подходящие соединения, которые можно применять в комбинации с соединением Формулы I или Формулы II включают без ограничений:
Эректильная дисфункция: силденафил, варденафил, тадалафил и алпростадил.
Легочная гипертензия/гипертензия: эпопростенол, илопрост, босентан, амлодипин, дилтиазем, нифедипин, амбрисентан и варфарин.
Астма: флутиказон, будесонид, мометазон, флунизолид, беклометазон, монтелукаст, зафирлукаст, зилейтон, салметерол, формотерол, теофиллин, албутерол, левабутерол, пирбутерол, ипратропий, преднизон, метилпреднизолон, омализумаб, кортикостероиды и кромолин.
Атеросклероз: аторвастатин, ловастатин, симвастатин, правастатин, флувастатин, росувастатин, гемфиброзил, фенофибрат, никотиновая кислота, клопидогрел.
[0135] В изобретении также предложена фармацевтическая композиция, содержащая одно или более соединений Формулы I или Формулы II или их фармацевтически приемлемые соли, сольваты, стереоизомеры, таутомеры или пролекарства в смеси с фармацевтически приемлемым носителем. В некоторых вариантах реализации композиция дополнительно содержит, в соответствии с общепринятой практикой составления фармацевтических средств, один или более дополнительных терапевтических агентов, фармацевтически приемлемые наполнители, разбавители, адъюванты, стабилизаторы, эмульгаторы, консерванты, красители, буферы или ароматизаторы.
[0136] В одном из вариантов реализации фармацевтическая композиция содержит соединение, выбранное из проиллюстрированных в Таблице 1 или Таблице 1-А, или его фармацевтически приемлемую соль, сольват, стереоизомер, таутомер или пролекарство и фармацевтически приемлемый носитель.
[0137] Подходящие пероральные композиции согласно настоящему изобретению включают без ограничений таблетки, формованные пастилки (troches), пастилки (lozenges), водные и масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры.
[0138] В объем настоящего изобретения включены фармацевтические композиции, подходящие для введения одной стандартной дозировки, которые содержат соединение согласно настоящему изобретению, его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или таутомер и фармацевтически приемлемый носитель.
[0139] Композиции согласно настоящему изобретению, подходящие для перорального введения, можно получать при помощи любого способа получения фармацевтических композиций, известного в данной области техники. Например, жидкие составы, содержащие соединения согласно настоящему изобретению, могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов для получения фармацевтически простых и привлекательных для потребителя препаратов, содержащих ингибитор аргиназы.
[0140] В композициях, содержащих соединения Формулы I или Формулы II в форме таблеток, активный агент в смеси с нетоксичными фармацевтически приемлемыми наполнителями применяют для получения таблеток. Примеры указанных наполнителей включают без ограничений инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты или разрыхлители, например, кукурузный крахмал или альгиновая кислота; связывающие агенты, например, крахмал, желатин или камедь; и смазки, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть безоболочечными или могут быть покрыты оболочкой при помощи известных способов нанесения оболочки для задержки распадания и всасывания в желудочно-кишечном тракте и, таким образом, обеспечения продолжительного терапевтического действия в течение желаемого периода времени. Например, можно применять вещество, обеспечивающее задержку высвобождения лекарственного средства, такое как глицерилмоностеарат или глицерилдистеарат.
[0141] Составы для перорального применения также могут иметь вид твердых желатиновых капсул, где активный ингредиент смешивают с инертным твердым разбавителем, например, с карбонатом кальция, фосфатом кальция или каолином, или мягких желатиновых капсул, где активный ингредиент смешивают с водой или масляной средой, например, с арахисовым маслом, жидким парафином или оливковым маслом.
[0142] В водных суспензиях соединение согласно настоящему изобретению смешивают с наполнителями, подходящих для поддержания стабильной суспензии. Примеры указанных наполнителей включают без ограничений карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь.
[0143] Пероральные суспензии также могут содержать диспергирующие агенты или увлажнители, такие как природные фосфатиды, например, лецитин, или продукты конденсации алкиленоксидов и жирных кислот, например, полиоксиэтилена стеарат, или продукты конденсации этиленоксида и длинноцепочечных алифатических спиртов, например, гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида и неполных сложных эфиров жирных кислот и гекситола, такие как полиоксиэтиленсорбитола моноолеат, или продукты конденсации этиленоксида и неполных сложных эфиров жирных кислот и ангидридов гекситола, например, полиоксиэтиленсорбитана моноолеат. Водные суспензии также могут содержать один или более консервантов, например, этил или н-пропил-п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза или сахарин.
[0144] Масляные суспензии можно получать путем суспендирования активных ингредиентов в растительном масле, например, в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт.
[0145] Подсластители, например, предложенные выше, и ароматизаторы можно добавлять для получения привлекательных для потребителя пероральных препаратов. Эти композиции можно консервировать путем добавления антиоксиданта, такого как аскорбиновая кислота.
[0146] Диспергируемые порошки и гранулы, подходящие для получения водных суспензий в результате добавления воды, могут содержать активный ингредиент в смеси с диспергирующим агентом или увлажнителем, суспендирующим агентом и одним или более консервантами. Подходящие диспергирующие агенты или увлажнители и суспендирующие агенты представлены агентами, отмеченными выше. Дополнительные наполнители, например, подсластители, ароматизаторы и красители также могут входить в состав диспергируемых порошков и гранул.
[0147] Фармацевтические композиции согласно настоящему изобретению также могут находиться в форме эмульсий типа масло-в-воде. Масляная фаза может представлять собой растительное масло, например, оливковое масло или арахисовое масло, или минеральное масло, например, жидкий парафин, или их смеси. Подходящие эмульгаторы могут представлять собой природные камеди, например, аравийскую камедь или трагакантовую камедь, природные фосфатиды, например, соевый лецитин и сложные эфиры или неполные сложные эфиры жирных кислот и ангидридов гекситола, например, сорбитана моноолеат, продукты конденсации указанных неполных сложных эфиров и этиленоксида, например, полиоксиэтиленсорбитана моноолеат. Эмульсии также могут содержать подсластители или ароматизаторы.
[0148] Сиропы и эликсиры можно получать с применением подсластителей, например, глицерина, пропиленгликоля, сорбита или сахарозы. Указанные составы также могут содержать успокоительные средства, консерванты, ароматизаторы и красители. Фармацевтические композиции могут находиться в форме стерильных инъецируемых водных или масляных суспензий. Эти суспензии можно получать в соответствии с уровнем техники при помощи подходящих диспергирующих агентов или увлажнителей и суспендирующих агентов, указанных выше. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле. В число приемлемых носителей и растворителей, которые можно применять, входят вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение, стерильные жирные растительные масла традиционно применяют в качестве растворителя или суспендирующей среды. Для этого можно применять любые легкие растительные масла, включая синтетические моно- или диглицериды. В дополнение, жирные кислоты, такие как олеиновая кислота, применяют для получения инъецируемых препаратов.
[0149] Соединения, которые соответствуют Формуле I или Формуле II, также можно вводить в форме суппозиториев для ректального введения лекарственного средства. Эти композиции можно получать путем смешения лекарственного средства и подходящего не вызывающего раздражение наполнителя, который является твердым при обычной температуре, но жидким при ректальной температуре, таким образом, эти композиции плавятся в прямой кишке с высвобождением лекарственного средства. Примерами указанных веществ являются масло какао и полиэтиленгликоли.
[0150] Композиции для парентерального введения вводят в стерильной среде. В зависимости от применяемого носителя и концентрации лекарственного средства в составе парентеральный состав может представлять собой суспензию или раствор, содержащий растворенное лекарственное средство. Адъюванты, такие как местные анестетики, консерванты и буферные агенты, также можно добавлять в парентеральные композиции.
СИНТЕЗ СОЕДИНЕНИЙ
[0151] Соединения согласно настоящему изобретению получают при помощи любых общих методик, описанных ниже, которые можно адаптировать для синтеза соединений, для которых отсутствует конкретное описание. Выбор подходящей методики синтеза обусловлен выбором целевого соединения Формулы I или Формулы II и природой функциональных групп, присутствующих в промежуточных соединениях и конечном продукте. Таким образом, может быть необходимым проведение селективной защиты/снятия защиты во время синтеза в зависимости от конкретных желаемых функциональных групп и применяемых защитных групп. Описание указанных защитных групп, а также их введения и удаления представлено в: Protective Groups in Organic Synthesis, Third Edition, T.W. Green and P.G.M. Wuts, John Wiley and Sons, New York, 1999. Общие методики синтеза, применяемые для получения соединений Формулы I или Формулы II, проиллюстрированы ниже.
I. СИНТЕЗ СОЕДИНЕНИЙ ФОРМУЛЫ I
[0152] Соединения Формулы I, где D-B(OR3)(OR4) представляет собой -CH2-L1-L2-СН2-В(ОН)2, a R2 представляет собой замещенную алкильную группу можно подходящим образом проводить с применением иминоэфира глицина и бензофенона, что проиллюстрировано ниже на Схеме А. В этом способе исходный имин аминокислоты А-1 можно приобретать или получать путем взаимодействия имина бензофенона со сложным эфиром желаемой аминокислоты (O′Donnell, M.J., Aldrichimica Acta, 2001, 34, 3-15). Алкилирование А-1 на Схеме А электрофилом А-2 в типичных условиях алкилирования, таких как бис(триметилсилил)амид лития, LDA или гидрид натрия, в полярном апротонном растворителе, таком как ТГФ, приводит к получению продукта моноалкилирования А-3. Аналогичные условия проведения реакции можно применять для введения второго заместителя и получения промежуточного соединения А-4. Последующий гидролиз приводит к получению целевого соединения А-5 (Схема А).
[0153] В некоторых случаях может быть предпочтительным или необходимым введение одного или обоих заместителей аминокислоты в многостадийном процессе. Пример предложен на Схеме А, где аллилбромид применяют на второй стадии алкилирования для получения промежуточного соединения А-6 в условиях алкилирования, описанных выше. После удаления бензофенона и последующей защиты амина терминальный олефин окисляют с получением промежуточного альдегида А-8.
[0154] Вступающую во многие реакции альдегидную группу можно применять для получения широкого ряда целевых соединений. Одним из подходящих применений являются реакции восстановительного аминирования, показанные на Схеме А. В данном случае обработка целевым амином и восстановителем, таким как цианоборгидрид натрия, приводит к получению промежуточного амина А-9, из которого после гидролиза получают целевые соединения А-10. В зависимости от конкретной желаемой функциональной группы может требоваться применения определенных защитных групп.
[0155] Схема А
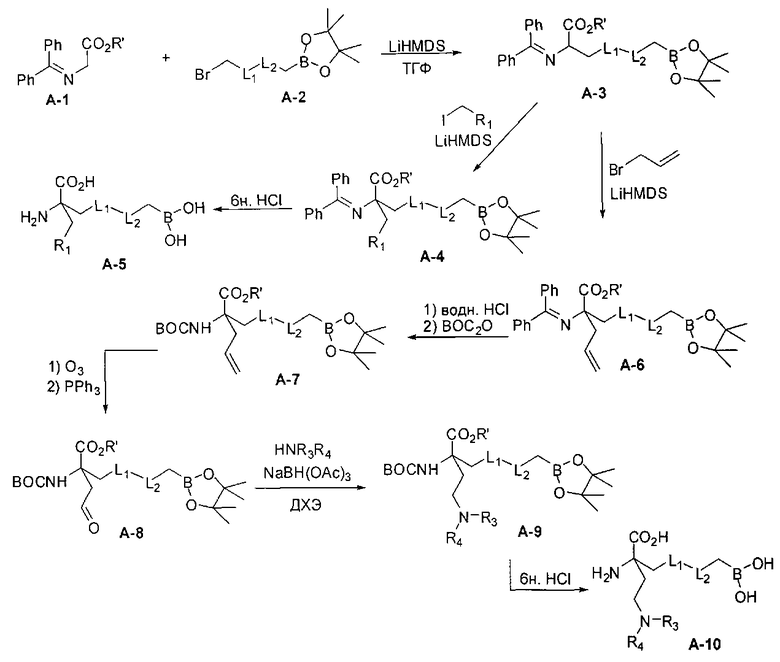
[0156] В качестве альтернативы, в случае если защищенная бороновая кислота, используемая в качестве электрофила, отсутствует или несовместима со способом синтеза, то соединения Формулы I можно синтезировать путем замены электрофила А-2 на терминальный олефин, введения бора на поздних стадиях и последующего алкилирования с использованием гидроборирования.
[0157] Для энантиоселективного синтеза соединений Формулы I можно применять ряд различных синтетических подходов. Соответственно, в одном из вариантов реализации оптически чистый кетон применяют вместо ахирального бензофенона. См., например, Tabcheh, et al. Tetrahedron 1991, 47, 4611-4618, и Belokon et al. Angew Chem, Int Ed 2001, 40, 1948-1951.
[0158] В качестве альтернативы асимметрическое введение можно проводить на второй стадии алкилирования с применением хирального катализатора. См., например, Ooi, et al. Tet Lett. 2004, 45, 1675-1678; Ohshima et al. J. Am. Chem. Soc. 2009, 725, 11206-11207; и Belokon et al. Tetrahedron 2001, 57, 2491-2498.
[0159] В другом варианте реализации энантиоселективность можно достигать за счет применения оптически чистого оксазинона для получения соединений Формулы I (Dastlik, K.A.; Sundermeier, U., Johns, D.M.; Chen, Y.; Williams, R.M. Synlett 2005, 4, 693-696). Этот подход проиллюстрирован на Схеме В.
[0160] Схема В
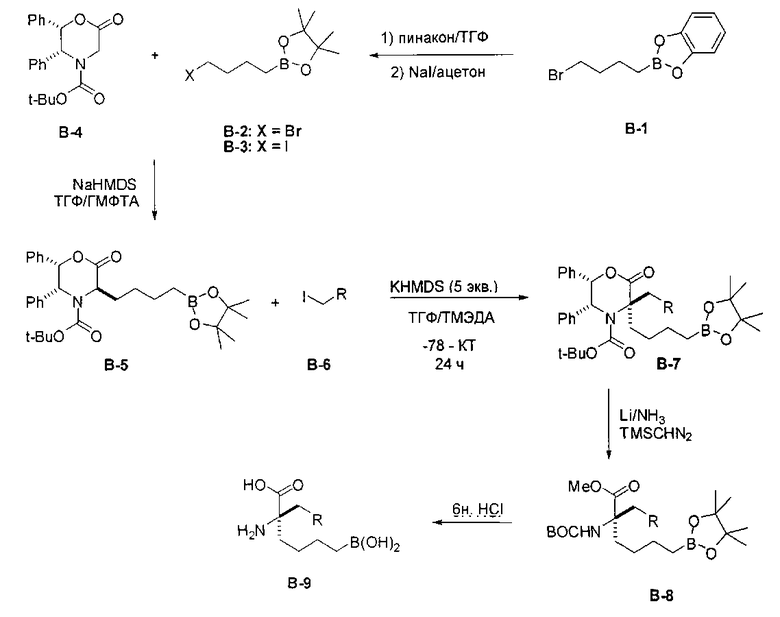
[0161] В этом случае оптически активный оксазинон В-4 применяют в последовательности реакций стереоселективного алкилирования для получения промежуточного соединения В-7. Алкилирование можно проводить в условиях, подходящих для конкретного применяемого электрофила (например, В-2, В-3 и В-6). Альтернативные подходы синтеза В-5 и В-7 включают альдольную реакцию, которая включает сочетание альдегида и оксазинона и последующее восстановление по получаемой двойной связи. Соединения согласно настоящему изобретению получают путем разложения дизамещенного оксазинона и последующего удаления защитных групп. Таким образом, расщепление оксазинонового гетероцикла путем гидрирования или восстановления с применением щелочного металла/аммиака и последующей обработки промежуточного соединения В-8 водной кислотой приводит к получению целевой дизамещенной аминокислоты В-9.
[0162] Если одним из желаемых заместителей конечного продукта является бутанбороновая кислота, то электрофилы В-2 или В-3 можно применять в качестве алкилирующего агента. В-2 можно легко получать из В-1 путем обработки пинаконом в ТГФ. Если необходимо йодсодержащее производное В-3, то его можно получать из соответствующего бромида путем обработки йодидом натрия в ацетоне.
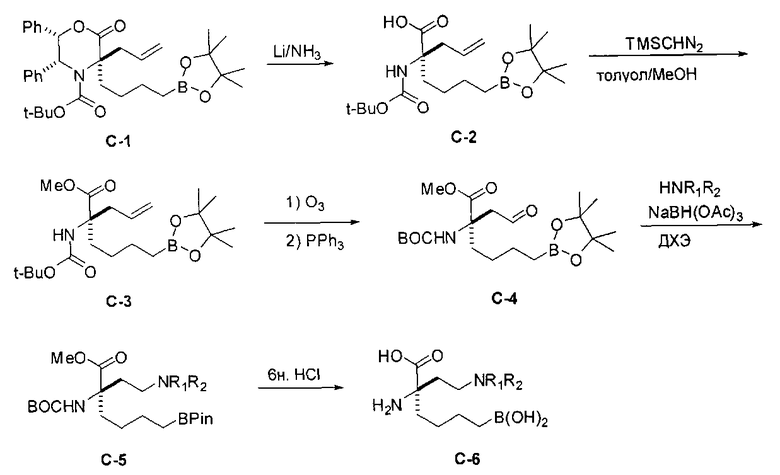
[0163] В качестве альтернативы, синтез включает модификацию одного или обоих заместителей после алкилирования. Эта модификация может требоваться, если необходимые функциональные группы конечного продукта несовместимы с условиями проведения реакции алкилирования, или если целевой заместитель неудобно вводить в виде электрофила из-за низкой реакционной способности. Пример проиллюстрирован на Схеме С, где аллилйодид применяют в качестве эффективного алкилирующего агента с последующей модификацией после отщепления оксазиноновой системы колец. В этом примере промежуточный аллил С-1 обрабатывают литием в аммиаке для удаления оксазинонового кольца. В полученную кислоту можно вводить защиту с получением сложного эфира С-3, а затем обрабатывать озоном с получением соответствующего альдегида.
[0164] Альдегид (С-4) имеет функциональную группу, вступающую в разнообразные реакции, и его можно применять во многих типах реакций для получения широкого ряда различных аналогов. Например, альдегид можно применять в реакциях восстановительного аминирования для получения соединений, содержащих аминовые заместители R1 и R2, например, промежуточного соединения С-5. Конечные целевые соединения (С-6) можно получать после снятия сложноэфирной защиты фрагментов аминокислоты и бороновой кислоты.
[0165] Схема С
[0166] В другом варианте реализации для синтеза некоторых соединений Формулы I применяют реакцию Уги (Doemling, A., Chem. Rev. 2006, 106, 17-89). Этот способ проиллюстрирован на Схеме D. В реакции Уги кетон или альдегид (D-3) обрабатывают изоцианатом, таким как трет-бутилизоцианат, и источником амина, например, ацетатом аммония, непосредственно с получением производного аминокислоты с карбоксильной группой и аминогруппой, защищенными трет-бутиламидом и ацетамидом, соответственно. В этой реакции можно применять различные изоцианаты и источники амина в зависимости от желаемых защитных групп амина и карбоновой кислоты. Если желательно получение оптически активных продуктов, то можно применять хиральные оптически чистые изоцианаты и/или источники амина. Реакции с применением этих реагентов могут быть энантиоселективными и/или по меньшей мере могут приводить к получению диастереомерных смесей продуктов, которые можно легко разделять.
[0167] Схема D
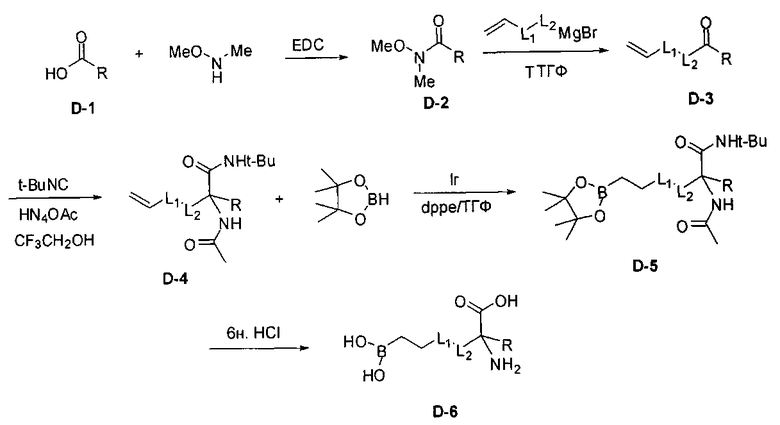
[0168] Синтез ключевого промежуточного соединения D-3 можно проводить при помощи большого числа способов. В одном очень удобном способе применяют карбоновую кислоту D-1. В этом способе карбоновую кислоту активируют и проводят сочетание с метоксиметиламином для получения амида Вайнреба D-2. Сочетание можно проводить с применением большого числа агентов сочетания, таких как EDC, DCC или РуВОР, или непосредственно с хлорангидридом D-1. Амид Вайнреба можно превращать в целевой кетон путем взаимодействия с соответствующим реактивом Гриньяра с получением промежуточного соединения D-3.
[0169] После завершения реакции Уги терминальный олефин можно обрабатывать источником борана, например, пинаколбораном, для введения фрагмента бороновой кислоты. Конечное снятие защиты промежуточного соединения D-5 приводит к получению целевого соединения D-6.
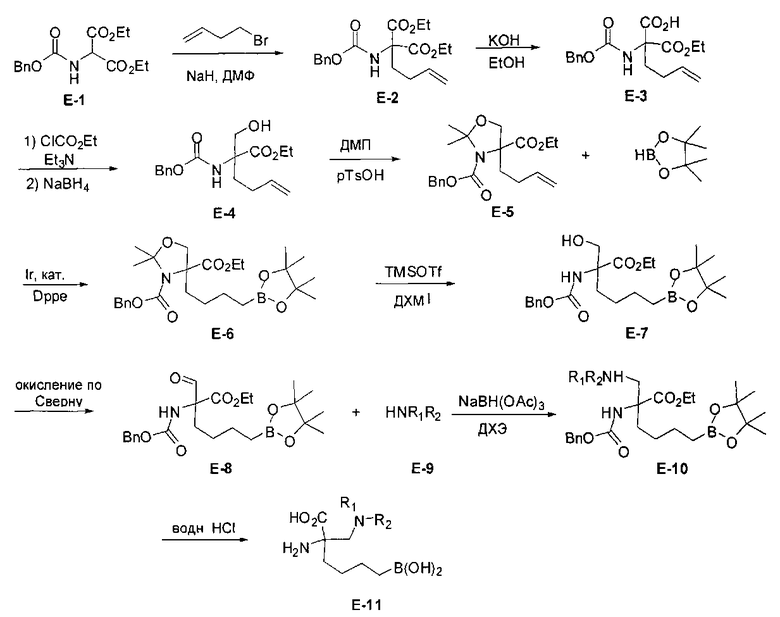
[0170] Много примеров соединений с аминометиленовым заместителем в α-положении можно удобно получать при помощи способа, проиллюстрированного на Схеме Е. В данном случае исходный аминомалонат, такой как Е-1, где амин защищен бензилкарбаматом (Cbz), а кислотные группы защищены сложноэфирными группами, применяют для получения дизамещенного производного аминокислоты Е-2 путем алкилирования 4-бромбутеном. Селективный гидролиз сложного диэфира при помощи гидроксида калия в этаноле приводит к получению сложного эфира Е-3. Селективное восстановление карбоновой кислоты при помощи хлорформиата и боргидрида натрия приводит к получению спирта Е-4, в который можно вводить защиту с применением диметоксипропана и органической кислоты, такой как п-толуолсульфокислота. Гидроборирование Е-5 пинаколбораном приводит к получению Е-6, из которого после снятия защиты получают спирт Е-7. Окисление спирта приводит к получению промежуточного альдегида Е-8, из которого после восстановительного аминирования и конечного снятия защиты получают целевое соединение Е-11.
[0171] Схема Е
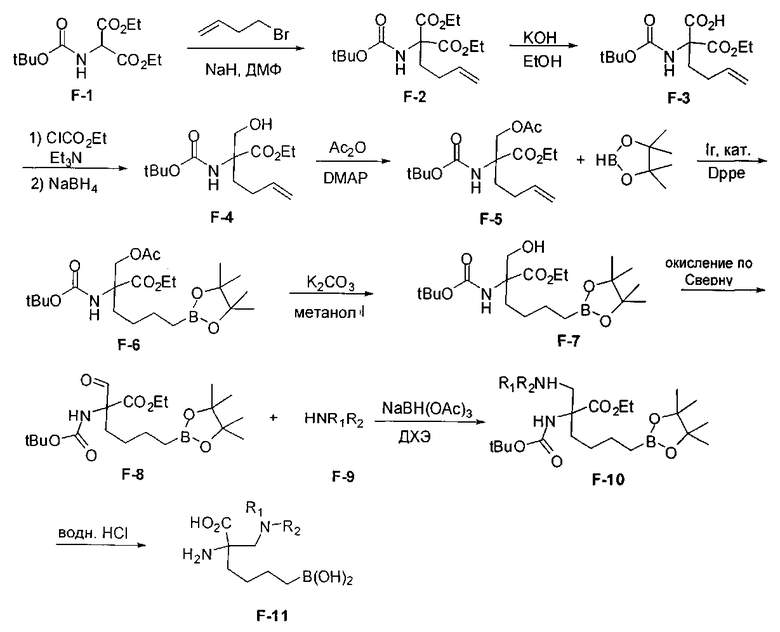
[0172] В качестве альтернативы способу, предложенному на Схеме Е, где бензилкарбамат применяют в качестве аминозащитной группы, также можно применять соответствующее т-бутилкарбамат (Вос)-защищенное аминомалонатное производное. В данном случае, проиллюстрированном на Схеме F, диэтил-2-(т-бутоксикарбониламино)-малонат F-1 алкилируют 4-бромбутеном с получением дизамещенного промежуточного малоната F-2. Селективный гидролиз сложного диэфира в основных условиях, например, с применением гидроксида калия в этаноле, приводит к получению одноосновной кислоты F-3. Восстановление карбоновой кислоты с применением этилхлорформиата и боргидрида натрия приводит к получению первичного спирта, который можно подходящим образом защищать при помощи ацетата в стандартных условиях, например, с применением уксусного ангидрида и DMAP. При желании можно применять множество альтернативных защитных групп. Эти группы легко вводить для ускорения последующей реакции гидроборирования, которая приводит к получению промежуточного соединения F-6. После завершения гидроборирования ацетат можно удалять и полученный спирт (F-7) можно окислять до соответствующего альдегида (F-8), который используют в реакции восстановительного аминирования с применением амина F-9 для получения защищенного продукта F-10. Снятие защиты с применением водного раствора кислоты затем приводит к получению целевого продукта F-11. В дополнение к реакции восстановительного аминирования промежуточный альдегид F-8 можно применять в большом числе реакций для введения желаемых заместителей. Применение альдегидов для получения гетероциклов или других продуктов хорошо известно специалистам в области органического синтеза.
[0173] Схема F
[0174] Специалистам в данной области техники будет понятно, что исходные вещества и условия проведения реакций могут различаться, последовательность реакций может быть разной, а также можно применять дополнительные стадии для получения соединений, входящих в объем настоящего изобретения, показанных в предложенных ниже примерах. В некоторых случаях защита определенных реакционноспособных функциональных групп может быть необходимой для проведения некоторых предложенных выше превращений. В целом, необходимость применения указанных защитных групп, а также условия присоединения и удаления указанных групп очевидны специалистам в области органического синтеза.
[0175] Получение соединений Формулы I согласно настоящему изобретению дополнительно проиллюстрировано предложенными ниже примерами, которые не ограничивают объем и сущность изобретения конкретными способами и соединениями, описанными в представленных примерах.
ТИПОВЫЕ СОЕДИНЕНИЯ ФОРМУЛЫ I
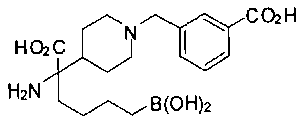
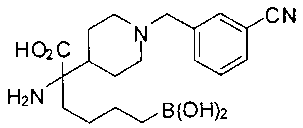
[0176] Пример 1: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил)этил)гексановой кислоты
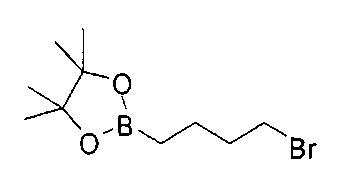
Стадия 1: 2-(4-бромбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
[0177] После осторожного нагревания с получением расплава катехоловый эфир 4-бром-1-бутилбороновой кислоты (112,2 г, 0,44 моль, 1,0 экв.) в токе азота добавляли в 3-горлую 500 мл круглодонную колбу, разбавляли свежеперегнанным ТГФ (150 мл, 3,0 М) и обрабатывали пинаконом (104,0 г, 0,88 моль, 2 экв.) за один раз. После перемешивания в течение 16 часов в атмосфере азота полученный раствор концентрировали. Неочищенный продукт разбавляли гептаном (500 мл) и охлаждали на ледяной бане. Через 1 час осажденный катехол удаляли путем фильтрования, а оставшийся раствор фильтровали через небольшую подложку с силикагелем (500 г), смоченную гептаном. После элюирования 5% раствором этилацетата в гептане (700 мл) и 10% раствором этилацетата в гептане (700 мл) фильтрат концентрировали с получением 2-(4-бромбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана в виде бесцветной маслянистой жидкости (112,7 г, 97%). 1Н ЯМР (CDCl3, 300 МГц) δ 3,38 (t, J=6,6 Гц, 2Н), 1,90-1,78 (m, 2H), 1,58 -1,44 (m, 2H), 1,26 (s, 12H), 0,78 (t, J=7,5 Гц, 2H); ИЭР-ЖХМС m/z расчет для С10Н20BBrO2: ожидаемое 262,1; эксперимент 263,1 (M+Н)+.
Стадия 2: 2-(4-йодбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
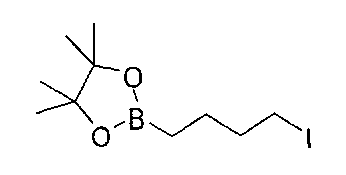
[0178] В атмосфере азота раствор 2-(4-бромбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (46,2 г, 0,176 моль, 1,0 экв.) и йодида натрия (52,8 г, 0,35 моль, 2 экв.) в ацетоне (176 мл, 1,0М) нагревали до 50°С в течение 4 часов. После охлаждения до комнатной температуры раствор концентрировали при пониженном давлении. Полученный остаток разбавляли гептаном (200 мл) и фильтровали через небольшую подложку с силикагелем (300 г), смоченную гептаном. После элюирования 10% раствором этилацетата в гептане (500 мл) фильтрат концентрировали с получением 2-(4-йодбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана в виде бесцветной маслянистой жидкости (53,5 г, 98%). 1Н ЯМР (CDCl3, 300 МГц) δ (3,18 (t, J=7,2 Гц, 2Н), 1,90-1,78 (m, 2H), 1,58-1,44 (m, 2H), 1,24 (s, 12H), 0,79 (t, J=7,5 Гц, 2H); ИЭР-ЖХМС m/z расчет для C10H20BIO2: ожидаемое 310,1; эксперимент 311,1 (M+Н)+.
Стадия 3: (3R,5R,6S)-трет-бутил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилат
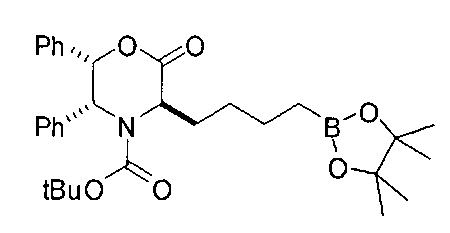
[0179] Раствор (2S,3R)-трет-бутил-6-оксо-2,3-дифенилморфолин-4-карбоксилата (4,69 г, 13,27 ммоль) и 2-(4-йодбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (d 1,38, 5,96 мл, 8,23 г, 26,5 ммоль, 2 экв.) в ТГФ (66 мл, 0,2М) и ГМФТА (6,6 мл) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом натрия (14,6 мл, 1,0М, 1,1 экв.) по каплям в течение 5 минут и перемешивали в течение 1 часа. После нагревания до комнатной температуры и дополнительного перемешивания в течение 2 часов раствор охлаждали до 0°С и реакцию гасили 0,5н. HCl (2-3 экв.). Полученный раствор разбавляли гептаном и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-60% этилацетат в гептане, 6 CV) приводила к получению (3R,5R,6S)-трет-бутил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилата в виде белого твердого вещества (6,66 г, 94%). ИЭР-ЖХМС m/z расчет для C31H42BNO2: ожидаемое 535,3; эксперимент 536,4 (M+H)+.
Стадия 4: (3R,5R,6S)-трет-бутил-3-аллил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилат
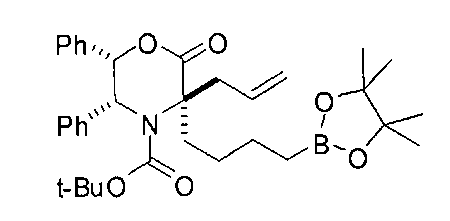
[0180] Раствор (3R,5R,6S)-трет-бутил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилата (5,00 г, 9,34 ммоль) и ТМЭДА (10 мл, 65 ммоль, 7 экв.) в ТГФ (51 мл, 0,2М) охлаждали до -78°С и обрабатывали аллилйодидом (17 мл, 187 ммоль, 20 экв.) и бис(триметилсилил)амидом калия (47 мл, 0,9М в ТГФ, 46,7 ммоль, 5 экв.) по каплям и перемешивали в течение 30 минут. После завершения добавления охлаждающую баню удаляли и смесь перемешивали в течение ночи. После определения завершения при помощи ТСХ реакцию гасили 0,5н. HCl (5-10 экв.), смесь разбавляли гептаном и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-60% этилацетат в гексане, 6CV) приводила к получению (3R,5R,6S)-трет-бутил-3-аллил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилата в виде бесцветной маслянистой жидкости (5,2 г, 96%). Rf 0,55 (30% этилацетат в гептане); 1Н ЯМР (CDCl3, 300 МГц) δ (7,39-7,14 (m, 10Н), 7,10 (dd. J1=5,4 Гц, J2=1,8 Гц, 1Н), 6,08 (d, J=5,4 Гц, 1Н), 5,95-5,80 (m, 1H), 5,27-5,17 (m, 2H), 3,30-3,15 (m, 1Н), 2,89-2,76 (m, 1Н), 2,20-2,07 (m, 2H), 1,54 (s, 9H), 1,35-1,21 (m, 4H), 1,78 (s, 12H), 0,46 (t, J=8,4 Гц, 2H); ИЭР-ЖХМС m/z расчет для С34Н46BNO6: ожидаемое 575,3; эксперимент 574,3 (M+Н)+.
Стадия 5: (R)-метил-2-аллил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
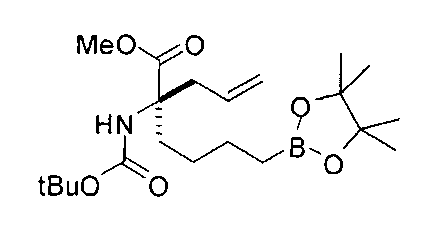
[0181] В трехгорлую круглодонную колбу, оборудованную подводом азота и холодильником с сухим льдом, помещали (3R,5R,6S)-трет-бутил-3-аллил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилат (4,60 г, 8,00 ммоль) и ТГФ (10 мл). После охлаждения холодильника до -78°С и колбы до -45°С (CO2 (тв.), СН3CN) аммиак (80 мл) конденсировали в колбе. После завершения металлический литий (0,55 г, 80 ммоль, небольшие кусочки) осторожно добавляли в течение 10 минут. После перемешивания в течение еще 40 минут реакцию осторожно гасили NH4Cl (тв.) до образования прозрачного раствора. Баню удаляли, и аммиак оставляли испаряться в течение ночи. Полученный остаток разбавляли этилацетатом и промывали последовательно 0,5н. HCl и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт растворяли в 50% метаноле в толуоле (80 мл, 0,1М) и обрабатывали TMSCHN2 (2,0М в гексане) до появления устойчивого бледно-желтого цвета. Когда анализ ТСХ показывал завершение реакции, избыток TMSCHN2 гасили уксусной кислотой до образования прозрачного раствора. Раствор концентрировали, разбавляли этилацетатом и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-60% этилацетат в гептане, 6CV) приводила к получению (R)-метил-2-аллил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (1,9 г, 58%). Rf 0,46 (30% этилацетат в гептане); 1H ЯМР (CDCl3, 300 МГц) δ (5,70-5,52 (m, 1Н), 5,49-5,36 (m, 1H), 5,05 (dd, J1=13,8 Гц, J2=1,2 Гц, 1H), 3,73 (s, 3H), 3,09-2,96 (m, 1H), 2,50 (dd, J1=13,8 Гц, J2=7,8 Гц, 1H), 2,29-2,10 (m, 1H), 1,78-1,65 (m, 1H), 1,43 (s, 9H), 1,42-1,26 (m, 4H), 1,23 (s, 12H), 0,74 (t, J=7,5 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C21H38BNO6: ожидаемое 411,3; эксперимент 412,3 (M+H)+.
Стадия 6: (R)-метил-2-(трет-бутоксикарбониламино)-2-(2-оксоэтил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
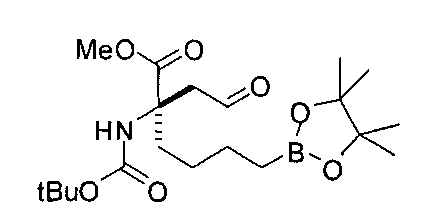
[0182] Раствор (R)-метил-2-аллил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (1,90 г, 4,62 ммоль) в дихлорметане (90 мл, 0,05М) охлаждали до -78°С и обрабатывали озоном до появления бледного сине-серого цвета. После того, как анализ ТСХ показывал отсутствие исходных веществ, подвод озона заменяли на подвод азота и азот продували через раствор в течение 20 минут для удаления избытка озона. Трифенилфосфин (3,6 г, 13,8 ммоль, 3 экв.) добавляли за один раз, охлаждающую баню удаляли и смесь перемешивали в течение 4 часов. Раствор концентрировали и очищали путем ЖХСД (1-50% этилацетат в гептане, 6CV) с получением (R)-метил-2-(трет-бутоксикарбониламино)-2-(2-оксоэтил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (1,28 г, 67%). Rf 0,55 (30% этилацетат в гептане); 1Н ЯМР (CDCl3, 300 МГц) δ (9,66 (s. 1H), 5,62 (br s, 1H), 3,75 (s, 3H), 3,60 (br d, J=17,4 Гц, 1Н), 2,95 (d, J=17,4 Гц, 1H), 2,30-2,15 (m, 1H), 1,70-1,54 (m, 1H), 1,40 (s, 9H), 1,39-1,24 (m, 4H), 0,74 (t, J=7,8 Гц, 2Н); ИЭР-ЖХМС m/z расчет для С20Н36BNO7: ожидаемое 413,3; эксперимент 414,3 (M+H)+.
Стадия 7: (R)-метил-2-(трет-бутоксикарбониламино)-2-(2-((S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
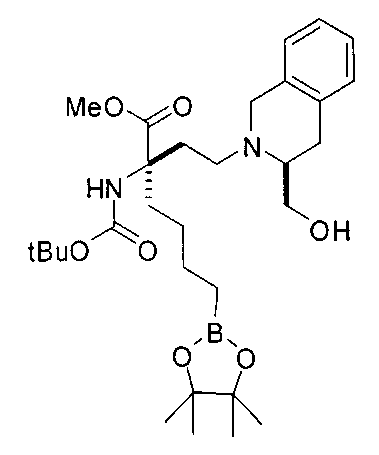
[0183] Раствор (R)-метил-2-(трет-бутоксикарбониламино)-2-(2-оксоэтил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (0,148 г, 0,358 ммоль, 1,0 экв.) и (S)-(1,2,3,4-тетрагидроизохинолин-3-ил)метанола (0,088 г, 0,54 ммоль, 1,5 экв.) в 1,2-дихлорэтане (0,34 мл, 0,5М) обрабатывали триацетоксиборгидридом натрия (0,19 г, 0,90 ммоль, 2,5 экв.) за один раз. После перемешивания в течение 1,5 часов реакцию гасили насыщенным водным NaHCO3 (1 мл) и дополнительно перемешивали в течение 5 минут. Полученную смесь добавляли в делительную воронку, разбавляли насыщенным водным NaCl (5 мл) и экстрагировали дихлорметаном (2×10 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем колоночной флэш-хроматографии с элюированием 5% метанолом в хлороформе приводила к получению (R)-метил-2-(трет-бутоксикарбониламино)-2-(2-((S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бледно-желтой маслянистой жидкости (0,187 г, 93%). Rf 0,52 (10% метанол в дихлорметане); 1Н ЯМР (CDCl3, 300 МГц) δ (7,15-7,08 (m, 2Н), 7,07-6,98 (m, 2Н), 5,90 (s, 1H), 3,78 (d, J=16,2 Гц, 1H), 3,70 (s, 3H), 3,60-3,47 (m, 2Н), 3,04-2,93 (m, 1H), 2,92-2,82 (m, 1H), 2,71-2,60 (m, 1H), 2,56-2,38 (m, 2H), 2,37-2,23 (m, 1H), 2,21-2,10 (m, 1H), 1,77-1,63 (m, 1H), 1,42 (s, 9H), 1,43-1,26 (m, 3H), 1,23 (s, 12H), 1,22-1,16 (m, 1H), 0,99-0,82 (m, 2H), 0,74 (t, J=7,5 Гц, 2Н); ИЭР-ЖХМС m/z расчет для С30Н49BN2O7: ожидаемое 560,4; эксперимент 561,4 (M+Н)+.
Стадия 8: дигидрохлорид (R)-2-амино-6-бороно-2-(2-((S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил)этил)гексановой кислоты
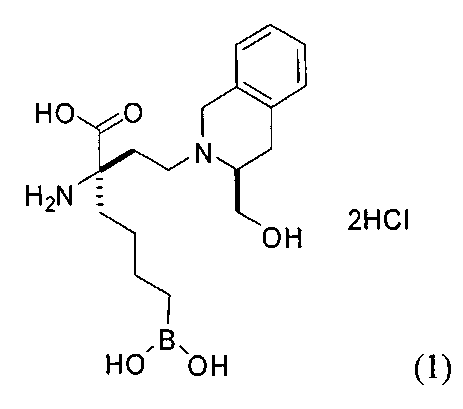
[0184] Раствор (R)-метил-2-(трет-бутоксикарбониламино)-2-(2-((S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (0,187 г, 0,334 ммоль) в 6н. HCl (5 мл) осторожно кипятили с обратным холодильником в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3×5 мл). Водный слой замораживали в жидком азоте и лиофилизировали с получением дигидрохлорида (R)-2-амино-6-бороно-2-(2-((S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил)этил)гексановой кислоты в виде беловатой пены (0,122 г, 89%). 1Н ЯМР (D2O, 300 МГц) δ 7,26-7,08 (m, 4H), 3,89-375 (m, 1H), 3,78-3,65 (m, 1H), 3,61-3,50 (m, 1H), 3,41-3,18 (m, 1H), 3,10-3,00 (m, 1H), 2,99-2,75 (m, 2H), 2,35-2,20 (m, 2H), 1,84-1,60 (m, 2H), 1,31-1,16 (m, 2H), 1,15-1,00 (m, 2H), 0,66-0,50 (m, 2H); ИЭР-ЖХМС m/z расчет для C18H29BN2O5: ожидаемое 364,2; эксперимент 365,2 (M+H)+.
[0185] Пример 2: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((S)-2-(метоксиметил)пирролидин-1-ил)этил)гексановой кислоты
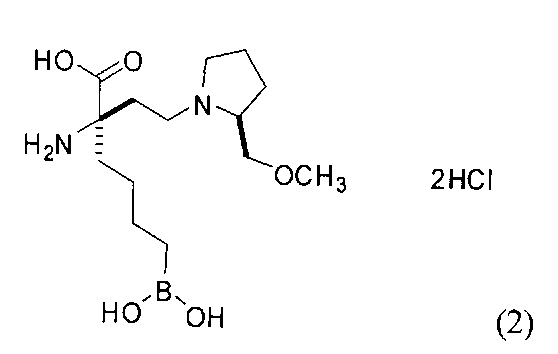
[0186] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-((S)-2-(метоксиметил)пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что (S)-2-(метоксиметил)пирролидин применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 300 МГц) δ (3,68-3,50 (m, 3H), 3,50-3,39 (m, 1H), 3,38-3,10 (m, 2H), 3,24 (s, 3H), 3,10-2,96 (m, 1H), 2,22-2,10 (m, 2H), 2,10-2,01 (m, 1H), 2,01-1,89 (m, 1H), 1,88-1,62 (m, 4H), 1,35-1,16 (m, 3H), 1,16-1,00 (m, 1H), 0,63 (t, J=7,8 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C14H29BN2O5: ожидаемое 316,2; эксперимент 317,2 (M+H)+.
[0187] Пример 3: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((R)-2-(метоксиметил)пирролидин-1-ил)этил)гексановой кислоты
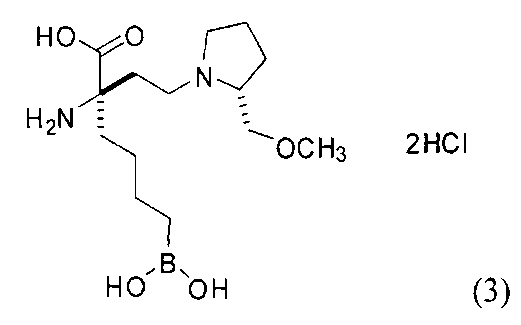
[0188] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-((R)-2-(метоксиметил)пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что (R)-2-(метоксиметил)пирролидин применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 300 МГц) δ 3,67-3,35 (m, 4H), 3,23 (s, 3H), 3,08-2,91 (m, 3H), 2,25-1,55 (m, 8H), 1,36-1,16 (m, 3H), 1,16-1,00 (m, 1H), 0,63 (br s, 2H); ИЭР-ЖХМС m/z расчет для C14H29BN2O5: ожидаемое 316,2; эксперимент 317,2 (M+Н)+.
[0189] Пример 4: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-(4-гидроксипиперидин-1-ил)этил)гексановой кислоты
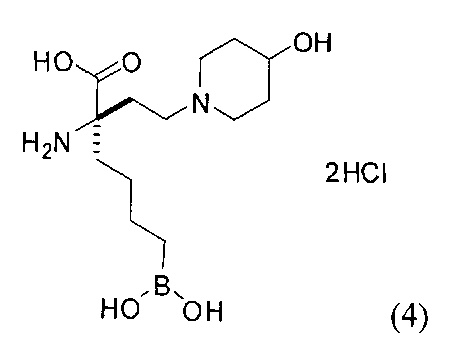
[0190] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-(4-гидроксипиперидин-1-ил)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что пиперидин-4-ол применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 300 МГц) δ 4,05-3,96 (m, 1H), 3,82-3,68 (m, 1H), 3,51-3,49 (m, 1H), 3,33-3,05 (m, 2H), 3,05-2,81 (m, 2H), 2,17-1,98 (m, 3H), 1,87-1,44 (m, 5H), 1,30-1,15 (m, 3H), 1,12-0,99 (m, 1H), 0,62 (t, J=7,8 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C13H27BN2O5: 302,2; эксперимент 303,2 (M+Н)+.
[0191] Пример 5: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((S)-3-гидроксипиперидин-1-ил)этил)гексановой кислоты
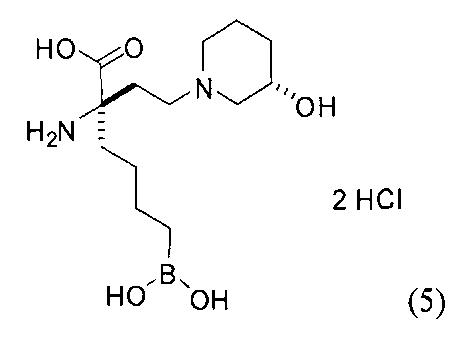
[0192] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-((S)-3-гидроксипиперидин-1-ил)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что (S)-пиперидин-3-ол применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 300 МГц) δ 4,16-4,04 (m, 1H), 3,48-3,12 (m, 4H), 3,07-2,90 (m, 1H), 2,88-2,70 (m, 1H), 2,25-2,00 (m, 2H), 2,00-1,80 (m, 1H), 1,80-1,45 (m, 5H), 1,32-1,14 (m, 3H), 1,14-1,00 (m, 1H), 0,63 (t, J=7,8 Гц, 2H); ИЭР-ЖХМС m/z расчет для C13H27BN2O5: 302,2; эксперимент 303,2 (M+H)+.
[0193] Пример 6: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((3,4-диметоксифенэтил)(метил)амино)этил)гексановой кислоты
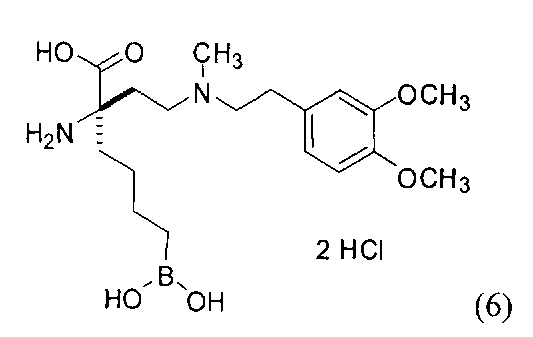
[0194] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-((3,4-диметоксифенэтил)(метил)-амино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что 2-(3,4-диметоксифенил)-N-метилэтанамин применяли в качестве амина на стадии 7. 1H ЯМР (D2O, 300 МГц) δ 6,83-6,59 (m, 3H), 3,68 (s, 3H), 3,66 (s, 3H), 3,40-2,99 (m, 4H), 2,97-2,79 (m, 2H), 2,75 (s, 3H), 2,20-2,01 (m, 2H), 1,81-1,47 (m, 2H), 1,33-1,08 (3H), 1,07-0,96 (m, 1H), 0,61 (t, J=6,9 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C19H33BN2O6: 396,2; эксперимент 397,2 (M+H)+.
[0195] Пример 7: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((R)-3-(гидроксиметил)пирролидин-1-ил)этил)гексановой кислоты
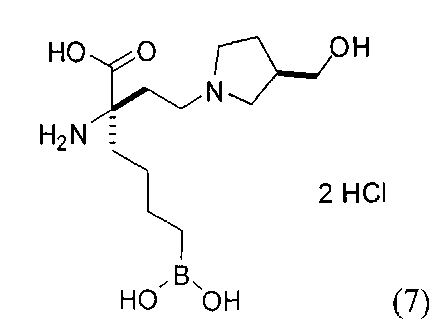
[0196] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-((R)-3-(гидроксиметил)пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что (R)-пирролидин-3-илметанол применяли в качестве амина на стадии 7. 1H ЯМР (D2O, 300 МГц) δ 3,70-3,18 (m, 5H), 3,16-2,88 (m, 3H), 2,11-1,85 (m, 3Н), 1,82-1,51 (3H), 1,30-1,14 m, 3H), 1,11-0,99 (m, 1H), 0,62 (t, J=7,8 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C13H27BN2O5: 302,2; эксперимент 303,3 (M+1)+.
[0197] Пример 8: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-тиоморфолиноэтил)гексановой кислоты
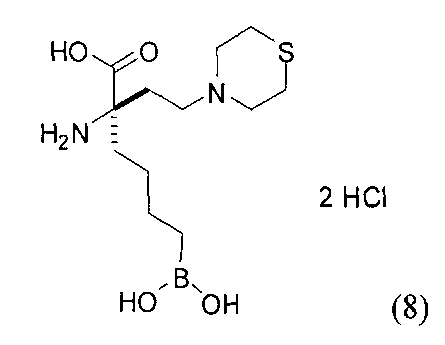
[0198] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-тиоморфолиноэтил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что тиоморфолин применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 300 МГц) δ 3,61-3,57 (m, 2Н), 3,30-3,17 (m, 1H), 3,16-2,99 (m, 3H), 2,98-2,80 (m, 2H), 2,73-2,60 (m, 2Н), 2,29-2,14 (m, 2Н), 1,90-1,61 (m, 2Н), 1,30-1,15 (m, 3H), 1,12-0,95 (m, 1H), 0,78 (t, J=7,2 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C12H25BN2O4S: 304,2; эксперимент 305,2 (M+1)+.
[0199] Пример 9: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-(4-(2-гидроксиэтил)пиперидин-1-ил)этил)гексановой кислоты
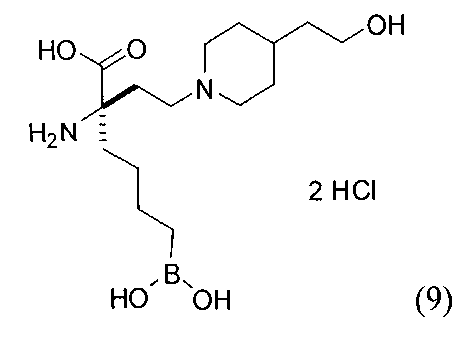
[0200] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-(4-(2-гидроксиэтил)пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что 2-(пиперидин-4-ил)этанол применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 300 МГц) δ 3,51-3,30 (m, 3H), 3,30-3,02 (m, 2H), 3,01-2,89 (m, 1H), 2,88-2,60 (m, 2H), 2,20-1,95 (m, 2H), 1,90-1,63 (m, 6H), 1,64-1,40 (m, 1H), 1,40-1,28 (m, 2H), 1,28-1,10 (m, 3H), 1,11-0,93 (m, 1H), 0,61 (t, J=7,5 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C15H31BN2O5: 330,2; эксперимент 331,3 (M+1)+.
[0201] Пример 10: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-((S)-2-(гидроксиметил)пирролидин-1-ил)этил)гексановой кислоты
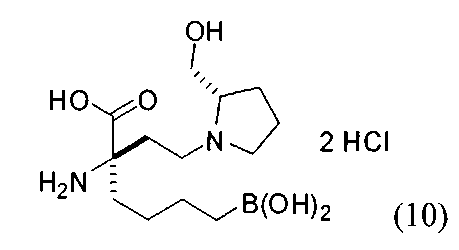
[0202] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-((S)-2-(гидроксиметил)пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что (S)-пирролидин-2-илметанол применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 400 МГц) δ 3,85-3,75 (m, 1H), 3,72-3,63 (m, 1H), 3,60-3,45 (m, 2H), 3,34-3,12 (m, 2H), 3,10-3,00 (m, 1H), 2,22-2,07 (m, 3H), 2,10-1,75 (m, 5H), 1,87 (s, 3H), 1,45-1,30 (m, 3H), 1,28-1,10 (m, 1H), 0,72 (t, J=7,5 Гц, 2H). ИЭР+ МС: эксперимент m/z 267,1 (M-36+H)+.
[0203] Пример 11: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-(метил-(фенэтил)амино)этил)гексановой кислоты
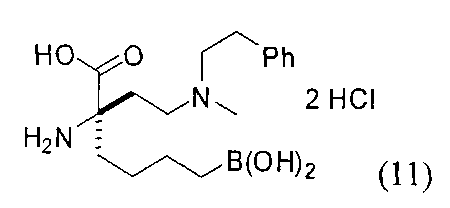
[0204] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-(метил(фенэтил)амино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что N-метил-2-фенилэтанамин применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 400 МГц) δ 7,45-7,38 (m, 2H), 7,37-7,31 (m, 3H), 3,51-3,36 (m, 3H), 3,25-3,13 (m, 1H), 3,09 (t, J=7,8 Гц, 2H), 2,92 (s, 3H), 2,26-2,16 (m, 2H), 1,88-1,70 (m, 2H), 1,45-1,33 (m, 2H), 1,26-1,12 (m, 2H), 0,78 (t, J=7,6 Гц, 2H). ИЭР+ МС: эксперимент m/z 319,1 (M-18+H)+, 301,1 (M-36+H)+.
[0205] Пример 12: Получение дигидрохлорида (R)-2-амино-6-бороно-2-(2-(((S)-2-гидрокси-2-(3-гидроксифенил)этил)(метил)амино)этил)гексановой кислоты
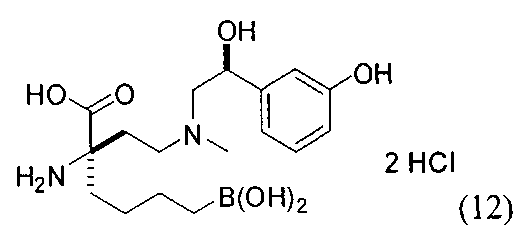
[0206] Дигидрохлорид (R)-2-амино-6-бороно-2-(2-(((S)-2-гидрокси-2-(3-гидроксифенил)-этил)(метил)амино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что (S)-3-(1-гидрокси-2-(метиламино)этил)фенол применяли в качестве амина на стадии 7. 1Н ЯМР (D2O, 400 МГц) δ 7,33 (t, J=7,8 Гц, 1H), 7,02-6,86 (m, 3H), 5,14-5,08 (m, 1H), 3,52-3,23 (m, 3H), 2,97 (s, 3H), 2,40-2,28 (m, 1H), 2,27-2,15 (m, 1H), 1,87-1,70 (m, 2H), 1,46-1,32 (m, 3H), 1,30-1,15 (m, 2H), 0,78 (t, J=7,6 Гц, 2H). ИЭР+ МС: эксперимент m/z 333,1 (M-36+H)+, 315,1 (M-54+H)+.
[0207] Пример 13: Получение дигидрохлорида (R)-2-амино-6-бороно-2-[2-(пиперидин-1-ил)этил]гексановой кислоты
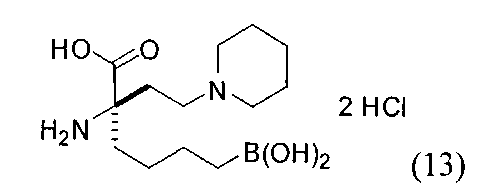
[0208] Дигидрохлорид (R)-2-амино-6-бороно-2-[2-(пиперидин-1-ил)этил]гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что пиперидин применяли в качестве амина на стадии 7. Конечная стадия предложена ниже: раствор метилового эфира (R)-2-трет-бутоксикарбониламино-2-(2-пиперидин-1-илэтил)-6-(4,4,5,5-тетраметил[1,3,2]-диоксаборолан-2-ил)гексановой кислоты (182 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением дигидрохлорида (R)-2-амино-6-бороно-2-[2-(пиперидин-1-ил)этил]гексановой кислоты в виде бесцветной пены (72 мг, 53%); 1Н ЯМР (D2O, 300 МГц) δ 3,34 (d, J=11,5 Гц, 2Н), 3,14 (m, 1H), 2,97 (m, 1H), 2,77 (t, J=12 Гц, 2Н), 2,19 (t, J=8,5 Гц, 2Н), 1,76 (m, 4H), 1,55 (m, 3H), 1,23 (m, 4H), 1,06 (m, 1H), 0,59 (t, J=7,5 Гц, 2Н).
[0209] Пример 14: Получение гидрохлорида (R)-2-амино-2-(4-боронобутил)пент-4-еновой кислоты
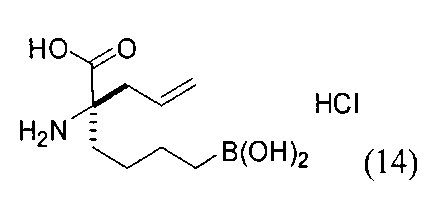
[0210] Гидрохлорид (R)-2-амино-2-(4-боронобутил)пент-4-еновой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что стадии 6 и 7 не проводили. Конечная стадия предложена ниже: раствор (R)-2-трет-бутоксикарбониламино-2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бутил]пент-4-еновой кислоты (85 мг) в 6н. хлороводородной кислоте (4 мл) перемешивали при 65°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением гидрохлорида (R)-2-амино-2-(4-боронобутил)пент-4-еновой кислоты в виде бесцветной пены (48 мг, 89%); 1Н ЯМР (D2O, 300 МГц) δ 5,60 (m, 1H), 5,16 (m, 2Н), 2,60 (m, 1H), 2,45 (m, 1H), 1,78 (m, 2Н), 1,26 (m, 3H), 1,09 (m, 1H), 0,63 (t, J=7,5 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C9H18BNO4: 215,1; эксперимент 216,1 (M+1)+.
[0211] Пример 15: Получение гидрохлорида (S)-2-амино-6-бороно-2-этилгексановой кислоты
Стадия 1: (3S,5R,6S)-трет-бутил-3-этил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилат
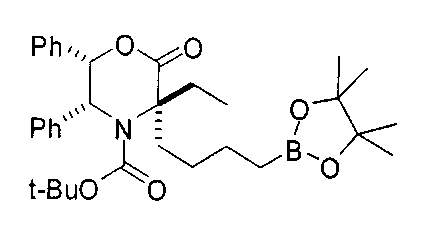
[0212] Раствор (3R,5R,6S)-трет-бутил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилата (1,00 г, 1,87 ммоль) и ТМЭДА (2 мл, 13 ммоль, 7 экв.) в 1,2-диметоксиэтане (9,4 мл, 0,2М) охлаждали до -78°С и обрабатывали этилйодидом (3 мл, 37 ммоль, 20 экв.) и бис(триметилсилил)амидом калия (9,4 мл, 0,9М в ТГФ, 9,4 ммоль, 5 экв.) по каплям. После дополнительного перемешивания в течение 30 минут при -78°С охлаждающую баню удаляли и смесь перемешивали в течение ночи. Реакцию считали незавершенной согласно анализу ТСХ и поэтому смесь повторно охлаждали до -78°С и дополнительно обрабатывали бис(триметилсилил)амидом калия (9,4 мл, 0,9М в ТГФ, 9,4 ммоль, 5 экв.) и этилйодидом (3 мл, 37 ммоль, 20 экв.). После завершения добавления баню удаляли и раствор перемешивали в течение ночи. После определения завершения при помощи ТСХ реакцию гасили 0,5н. HCl (5-10 экв.), разбавляли гептаном и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-60% этилацетат в гептане, 6CV) приводила к получению (3S,5R,6S)-трет-бутил-3-этил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилата в виде бесцветной маслянистой жидкости (0,68 г, 65%). Rf 0,40 (30% этилацетат в гептане); 1Н ЯМР (CDCl3, 300 МГц) δ 7,31-7,15 (m, 10Н), 7,08 (d, J=2,4 Гц, 1H), 6,02 (d, J=2,4 Гц, 1H), 2,35-2,22 (m, 2H), 2,22-2,07 (m, 2H), 1,47 (s, 9H), 1,26-1,21 (m, 4H), 1,15 (s, 12H), 1,00 (t, J=7,5 Гц, 3Н), 0,85 (t, J=6,8 Гц, 2H); ИЭР-ЖХМС m/z расчет для C33H46BNO6: 563,3; эксперимент 564,3 (M+1)+.
Стадия 2: (S)-метил-2-(трет-бутоксикарбониламино)-2-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
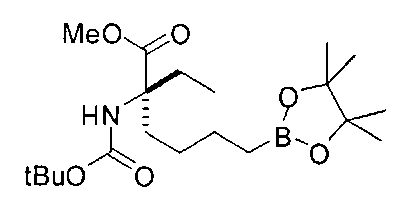
[0213] В трехгорлую круглодонную колбу, оборудованную подводом азота и холодильником с сухим льдом помещали (3S,5R,6S)-трет-бутил-3-этил-2-оксо-5,6-дифенил-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)морфолин-4-карбоксилат (0,57 г, 1,01 ммоль) и ТГФ (1 мл). После охлаждения холодильника до -78°С и колбы до -45°С (СО2 (тв.), CH3CN), аммиак (50 мл) конденсировали в колбу. После завершения металлический литий (0,07 г, 10 ммоль, небольшие кусочки) осторожно добавляли в течение 10 минут. После дополнительного перемешивания в течение 1 часа реакцию осторожно гасили NH4Cl (тв.) до получения прозрачного раствора. Баню удаляли и аммиак оставляли испаряться в течение ночи. Полученный остаток разбавляли этилацетатом и промывали последовательно 0,5н. HCl и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт растворяли в 50% метаноле в толуоле (50 мл, 0,1 М) и обрабатывали TMSCHN2 (2,0 М в гексане) до появления устойчивого бледно-желтого цвета. Когда анализ ТСХ показывал завершение реакции, избыток TMSCHN2 гасили уксусной кислотой до получения прозрачного раствора. Раствор концентрировали, разбавляли этилацетатом и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-60% этилацетат в гептане, 4CV) приводила к получению (S)-метил-2-(трет-бутоксикарбониламино)-2-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (0,283 г, 71%). Rf 0,88 (30% этилацетат в гептане); ИЭР-ЖХМС m/z расчет для C20H38BNO6: 399,3; эксперимент 400,3 (М+1)+.
Стадия 3: гидрохлорид (S)-2-амино-6-бороно-2-этилгексановой кислоты
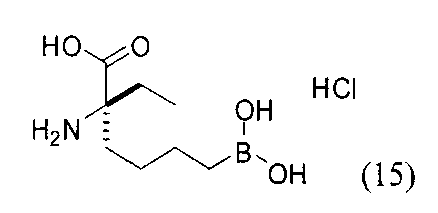
[0214] Раствор (S)-метил-2-(трет-бутоксикарбониламино)-2-этил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (0,283 г, 0,709 ммоль) в 6н. HCl (5 мл) осторожно кипятили с обратным холодильником в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3×10 мл). Водный слой концентрировали с получением беловатого твердого вещества, которое растворяли в деионизованной воде (3 мл) и пропускали через колонку С-18 Isolute SPE (20 г), элюируя 10% метанолом в деионизованной воде (200 мл). Фракции, содержащие продукт, концентрировали при пониженном давлении, перерастворяли в деионизованной воде (5 мл), замораживали в жидком азоте и лиофилизировали с получением гидрохлорида (S)-2-амино-6-бороно-2-этилгексановой кислоты в виде белой пены (0,096 г, 67%). 1Н ЯМР (D2O, 300 МГц) δ (m, 4Н), 1,31-1,17 (m, 3Н), 1,13-0,97 (m, 1H), 0,794 (t, J=7,6 Гц, 3Н), 0,63 (t, J=7,8 Гц, 2Н); ИЭР-ЖХМС m/z расчет для C8H18BNO4: 203,1; эксперимент 204,1 (M+1)+.
[0215] Пример 16: Получение гидрохлорида (R/S)-2-амино-6-бороно-2-[2-(пирролидин-1-ил)этил]гексановой кислоты
Стадия 1: этил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
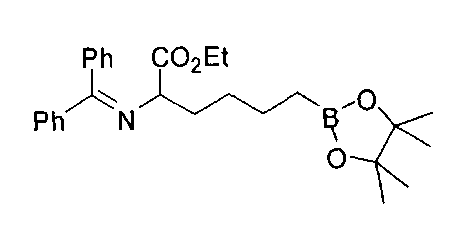
[0216] Раствор этилового эфира N-(дифенилметилен)глицина (8,24 г, 30,8 ммоль) и 2-(4-бромбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (8,92 г, 33,9 ммоль) в свежеперегнанном ТГФ (77 мл, 0,4М) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом лития (32,3 мл, 1,0М в ТГФ). После завершения добавления реакционную смесь нагревали до 50°С в течение 8 часов. После определения завершения реакции путем ТСХ реакционную смесь охлаждали до 0°С, разбавляли этилацетатом и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Быстрая очистка путем ЖХСД (1-15% этилацетат в гептане, содержащем 0,5% триэтиламина, 6CV) приводила к получению этил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (8,9 г, 64%). Rf 0,40 (30% этилацетат в гептане).
Стадия 2: этил-2-аллил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
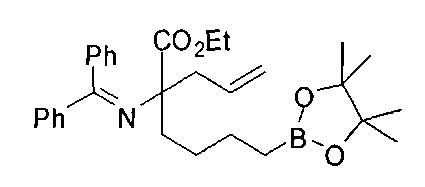
[0217] Раствор этил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (2,79 г, 6,21 ммоль) в свежеперегнанном ТГФ (15 мл, 0,4М) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом лития (6,8 мл, 1,0М в ТГФ). После перемешивания в течение 10 минут аллилбромид (2,25 г, 18,6 ммоль) добавляли в реакционную смесь, нагревали до комнатной температуры и перемешивали в течение 16 часов. После определения завершения реакции путем ТСХ реакционную смесь охлаждали до 0°С, разбавляли этилацетатом и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-20% этилацетат в гептане, содержащем 0,5% триэтиламина, 6CV) приводила к получению этил-2-аллил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (1,81 г, 59%). Rf 0,52 (30% этилацетат в гептане); 1Н ЯМР (CDCl3, 300 МГц) δ 7,58-7,53 (m, 2H), 7,39-7,22 (m, 6H), 7,16-7,12 (m, 2H), 5,89-5,74 (m, 1H), 5,07 (dd, J1=15,3 Гц, J2=2,1 Гц, 1H), 5,05 (dd, J1=8,7 Гц, J2=2,1 Гц, 1H), 3,70 (q, J=7,5 Гц, 1Hдиастереотоп), 3,69 (q, J=7,2 Гц, 1Ндиастереотоп), 2,70 (dd, J1=7,2 Гц, J2=1,2 Гц, 2H), 1,92-1,83 (m, 2H), 1,44-1,35 (m,2H), 1,35-1,23 (m, 2H), 1,19 (s, 12H), 1,10 (t, J=7,2 Гц, 3Н), 0,78 (t,J=6,6 Гц, 2H).
Стадия 3: этил-2-аллил-2-амино-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
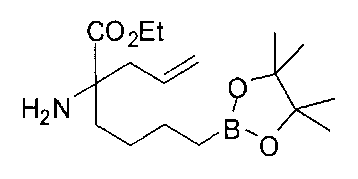
[0218] Раствор этил-2-аллил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (0,32 г, 0,65 ммоль) в диэтиловом эфире (3,4 мл, 0,2М) обрабатывали 1н. HCl (3 мл). После перемешивания в течение 16 часов слои разделяли и водную фазу разбавляли насыщенным водным K2СО3 и экстрагировали хлороформом с получением этил-2-аллил-2-амино-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (0,20 г, 94%). Rf 0,62 (10% метанол в дихлорметане); 1Н ЯМР (CDCl3, 300 МГц) δ 5,76-5,60 (m, 1H), 5,18-5,07 (m, 2H), 4,15 (q, J=7,2 Гц, 2H), 2,54 (ddt, J1=13,5 Гц, J2=6,3 Гц, J3=1,2 Гц, 1H), 2,23 (dd, J1=13,5 Гц, J2=8,7 Гц, 1H), 1,8-1,68 (m, 2H), 1,70-1,60 (m, 1H), 1,60-1,46 (m, 2H), 1,46-1,32 (m, 3Н), 1,24 (s, 12H), 1,20-1,06 (m, 1H), 0,766 (t, J=7,8 Гц, 2H); ИЭР-ЖХМС m/z расчет для C17H32BNO4: 325,2; эксперимент 326,2 (M+H)+.
Стадия 4: этил-2-аллил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
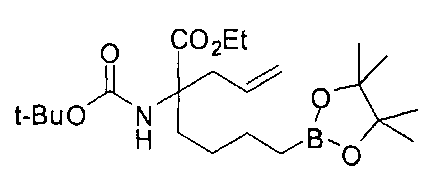
[0219] Раствор этил-2-аллил-2-амино-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (0,0897 г, 0,276 ммоль) в этилацетате (0,6 мл, 0,5М) и насыщенном водном NaHCO3 (0,6 мл) обрабатывали ди-трет-бутилкарбонатом (0,090 г, 0,414 ммоль) и перемешивали при комнатной температуре. Через 16 часов слои разделяли и водный слой экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (0-20% этилацетат в гептане, 6CV) приводила к получению этил-2-аллил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (0,096 г, 82%). Rf 0,53 (30% этилацетат в гептане); ИЭР-ЖХМС m/z расчет для C22H40BNO6: 425,3; эксперимент 426,3 (М+Н)+.
Стадия 5: этиловый эфир 2-трет-бутоксикарбониламино-2-(2-оксоэтил)-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты
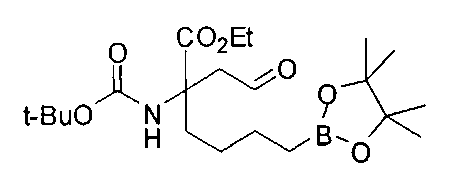
[0220] Раствор этил-2-аллил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (650 мг, 1,53 ммоль) в дихлорметане (30 мл) охлаждали до -78°С и обрабатывали озоном до появления бледного сине-серого цвета. После того, как анализ ТСХ показывал отсутствие исходных веществ, подвод озона заменяли на подвод азота, и азот продували через раствор в течение 20 минут для удаления избытка озона. Трифенилфосфин (1,20 г, 4,59 ммоль, 3 экв.) добавляли за один раз, охлаждающую баню удаляли и смесь перемешивали в течение 4 часов. Раствор концентрировали и очищали путем ЖХСД (0-40% этилацетат в гептане); 1Н ЯМР (CDCl3, 300 МГц): δ 9,64 (s, CHO, 1H), 5,60 (br, s, NH, 1H), 4,19 (q, J=7,5 Гц, 2Н), 3,56 (d, J=17 Гц, 1H), 2,93 (d, J=17,5 Гц, 1H), 2,20 (m, 1H), 1,62 (m, 1H), 1,38 (s, 9H), 1,28-1,43 (m, 4H), 1,23 (t, J=7 Гц, 3Н), 1,21 (s, 12H), 0,72 (t, J=7,5 Гц, 2Н).
Стадия 6: этиловый эфир 2-трет-бутоксикарбониламино-2-(2-пирролидин-1-илэтил)-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты
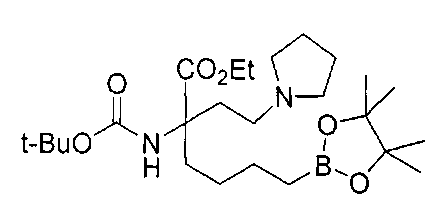
[0221] Раствор этилового эфира 2-трет-бутоксикарбониламино-2-(2-оксоэтил)-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты (100 мг, 0,23 ммоль, 1,0 экв.) и пирролидина (21 мг, 0,29 ммоль, 1,2 экв.) в 1,2-дихлорэтане (0,5 мл) обрабатывали триацетоксиборгидридом натрия (125 мг, 0,59 мг) за один раз. После перемешивания при комнатной температуре в течение ночи реакцию гасили насыщенным водным NaHCO3 (1 мл) и дополнительно перемешивали в течение 5 минут. Полученную смесь добавляли в делительную воронку, разбавляли насыщенным водным NaCl (5 мл) и экстрагировали дихлорметаном (2×10 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем колоночной флэш-хроматографии с элюированием 5% метанолом в хлороформе приводила к получению этилового эфира 2-трет-бутоксикарбониламино-2-(2-пирролидин-1-илэтил)-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты в виде бледно-желтой маслянистой жидкости (92 мг, 83%). Rf 0,32 (10% метанол в дихлорметане); 1Н ЯМР (CDCl3, 300 МГц) δ 5,67 (br, s, NH, 1H), 4,19 (m, 2H), 2,46-2,82 (m, 6H), 2,18 (m, 2H), 1,88 (m, 3H), 1,76 (m, 2H), 1,42 (s, 9H), 1,26-1,41 (m, 3Н), 1,28 (t, J=7,0 Гц, 3Н), 1,22 (s, 12H), 1,06 (m, 1H), 0,73 (t, J=7,5 Гц, 2H).
Стадия 7: дигидрохлорид 2-амино-6-бороно-2-[2-(пирролидин-1-ил)этил]гексановой кислоты
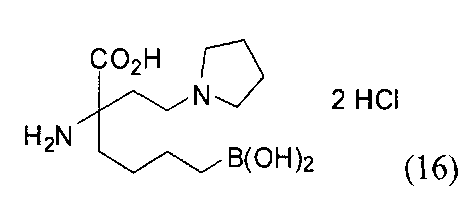
[0222] Раствор этилового эфира 2-трет-бутоксикарбониламино-2-(2-пирролидин-1-илэтил)-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты (98 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением дигидрохлорида 2-амино-6-бороно-2-[2-(пирролидин-1-ил)этил]гексановой кислоты в виде бесцветной пены (36 мг, 53%); 1Н ЯМР (D2O, 300 МГц) δ 3,47 (m, 2H), 3,24 (m, 1H), 3,07 (m, 1H), 2,88 m, 2H), 2,12 (t, J=8 Гц, 2H), 1,94 (m, 2H), 1,60-1,82 (m, 4H), 1,20 (m, 3Н), 1,04 (m, 1H), 0,59 (t, J=7 Гц, 2H); МС (+CI): m/z C12H25BN2O4: ожидаемое 272,2; эксперимент 273,2 (M+H)+.
[0223] Пример 17: Получение тригидрохлорида 2-амино-6-бороно-2-[2-(4-пиримидин-2-илпиперазин-1-ил)этил]гексановой кислоты
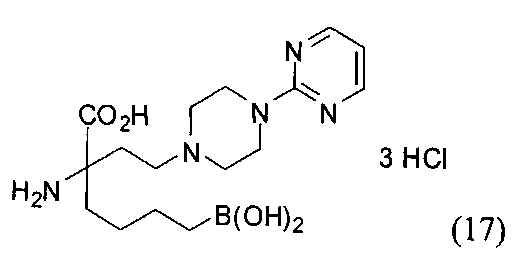
[0224] Тригидрохлорид 2-амино-6-бороно-2-[2-(4-пиримидин-2-илпиперазин-1-ил)этил]гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2-(1-пиперидинил)пиримидин применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира (R/S)-2-трет-бутоксикарбониламино-2-[2-(4-пиримидин-2-илпиперазин-1-ил)этил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (126 мг) в 6н. хлороводородной кислоте (6 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде белого твердого вещества (80 мг, 83%); 1Н ЯМР (D2O, 300 МГц) δ 8,47 (d, J=5,5 Гц, 2Н), 6,96 (t, J=5,5 Гц, 1Н), 3,48-3,76 (m, 4H), 3,14-3,40 (m, 6Н), 2,29 (t, J=8 Гц, 2Н), 1,81 (m, 2Н), 1,28 (m, 3H), 1,11 (m, 1Н), 0,62 (t,J=7,5 Гц, 2Н).
[0225] Пример 18: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((карбоксиметил)(метил)амино)этил)гексановой кислоты
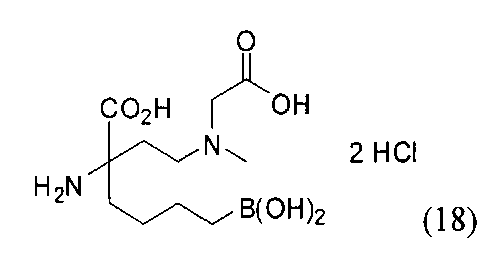
[0226] Дигидрохлорид 2-амино-6-бороно-2-(2-((карбоксиметил)(метил)амино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2-(метиламино)уксусную кислоту применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира (R/S)-2-трет-бутоксикарбониламино-2-[2-(2-этоксикарбонилметил-метиламино)этил]-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты (138 мг) в 6н. хлороводородной кислоте (6 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали и жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (72 мг, 76%); 1Н ЯМР (D2O, 300 МГц) δ 3,94 (s, 2Н), 3,37 (m, 1Н), 3,20 (m, 1Н), 2,83 (s, 3H), 2,24 (t, J=8 Гц, 2Н), 1,66-1,88 (m, 2Н), 1,27 (m, 3H), 1,11 (m, 1Н), 0,63(t, J=7,5 Гц,2Н).
[0227] Пример 19: Получение дигидрохлорида (R/S)-2-амино-2-[2-(бензилэтиламино)этил]-6-бороногексановой кислоты
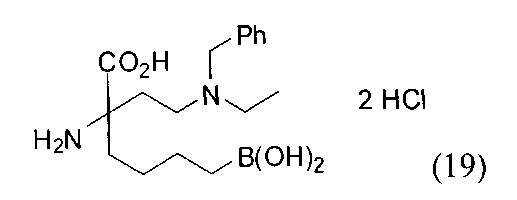
[0228] Дигидрохлорид 2-амино-2-[2-(бензилэтиламино)этил]-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что этилбензиламин применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира (R/S)-2-[2-(бензилэтиламино)этил]-2-трет-бутоксикарбониламино-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (104 мг) в 6н. хлороводородной кислоте (6 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (41 мг); 1Н ЯМР (D2O, 300 МГц) δ 7,36 (s, 5Н), 4,31 (m, 1H), 4,11 (m, 1H), 2,96-3,29 (m, 4H), 2,10 (m, 2H), 1,68 (m, 1H), 1,43 (t, J=8 Гц, 1H), 1,21 (t, J=6,5 Гц, 3Н), 0,89-1,20 (m, 4H),), 0,59 (m, 2H); MC (+CI): m/z C17H29BN2O4: ожидаемое 336,2; эксперимент 337,2 (M+Н)+, 319 (M+H-H2O)+.
[0229] Пример 20: Получение дигидрохлорида 2-амино-2-{2-[бензил-(2-гидроксиэтил)амино]этил}-6-бороногексановой кислоты
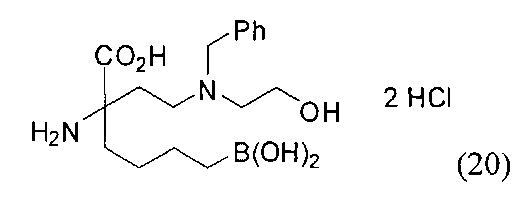
[0230] Дигидрохлорид 2-амино-2-{2-[бензил-(2-гидроксиэтил)амино]этил}-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2-(бензиламино)этанол применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира 2-{2-[бензил-(2-гидроксиэтил)-амино]этил}-2-трет-бутоксикарбониламино-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты (111 мг) в 6н. хлороводородной кислоте (6 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (48 мг); 1Н ЯМР (D2O, 300 МГц) δ 7,35 (s, 5H), 4,11-4,25 (m, 2H), 3,76 (s, 2H), 3,06-3,34 (m, 4H), 2,18 (m, 2H), 1,76 (m, 1H), 1,43 (m, 1H), 1,18 (m, 4H), 0,56 (m, 2H); MC (+CI): m/z C17H29BN2O5: ожидаемое 352,2; эксперимент 371,2 (M+Н+H2O)+, 353,2 (M+H)+, 335,2 (M+Н-H2O)+.
[0231] Пример 21: Получение дигидрохлорида (R/S)-1-[(3-амино-7-бороно-3-карбокси)гептил)пиперидин-4-карбоновой кислоты
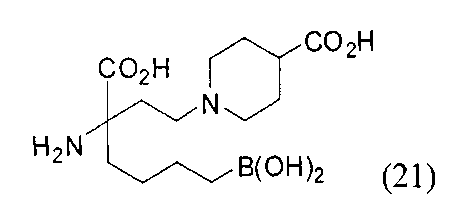
[0232] Дигидрохлорид 1-[(3-амино-7-бороно-3-карбокси)гептил)пиперидин-4-карбоновой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что этил-пиперидин-4-карбоксилат применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира 2-трет-бутоксикарбониламино-2-[2-(4-метилкарбамоилпиперидин-1-ил)этил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (106 мг) в 6н. хлороводородной кислоте (6 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (34 мг); 1Н ЯМР (D2O, 300 МГц) δ 3,50 (m, 1H), 3,22 (m, 1H), 2,84-3,08 (m, 3H), 2,58 (tt, J1=12 Гц, J2=3,5 Гц, 1H), 2,14 (m, 4H), 1,75 (m, 5H), 1,26 (m, 3H), 1,10 (m, 1H), 0,64 (t, J=7,5 Гц, 2H).
[0233] Пример 22: Получение дигидрохлорида 2-амино-6-бороно-2-[2-(4-гидроксиметилпиперидин-1-ил)этил]гексановой кислоты
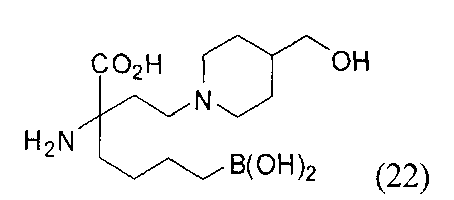
[0234] Дигидрохлорид 2-амино-6-бороно-2-[2-(4-гидроксиметилпиперидин-1-ил)этил]-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что пиперидин-4-илметанол применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира (R)-2-трет-бутоксикарбониламино-2-[2-(4-гидроксиметилпиперидин-1-ил)этил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (78 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (20 мг, 53%); 1Н ЯМР (D2O, 300 МГц) δ 3,48 (m, 2H), 3,33 (d, J=6 Гц, 2H), 3,21 (m, 1H), 3,04 (m, 1H), 2,86 (m, 2H), 2,19 (2H, t, J=8,5 Гц), 1,86 (m, 2H), 1,60-1,78 (m, 3Н), 1,20-1,36 (m, 5H), 1,09 (m, 1H), 0,64 (t, J=7,5 Гц, 2H); МС (+CI): m/z C12H25BN2O4: ожидаемое 272,2; эксперимент 273,2 (M+H)+.
[0235] Пример 23: Получение дигидрохлорида 2-амино-6-бороно-2-[2-(3-диэтилкарбамоилпиперидин-1-ил)этил]гексановой кислоты
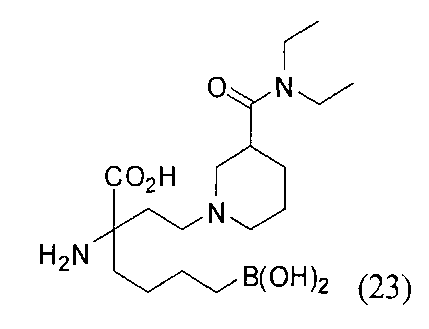
[0236] Дигидрохлорид 2-амино-6-бороно-2-[2-(3-диэтилкарбамоилпиперидин-1-ил)этил]-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что N,N-диэтилпиперидин-3-карбоксамид применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира (2R/S,3′′R/S)-2-трет-бутоксикарбониламино-2-[2-(3-диэтилкарбамоилпиперидин-1-ил)этил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (128 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением диастереомерной смеси титульных соединений в виде бесцветной пены (54 мг); 1Н ЯМР (D2O, 300 МГц) δ 3,46 (m, 2H), 3,26 (m, 4H), 3,10 (m, 2H), 2,94 (m, 4H), 2,20 (m, 2H), 1,62-1,92 (6Н, m), 1,28 (m, 2H), 1,10 (t, J=7,0 Гц, 3Н), 1,06 (m, 1H), 0,93 (t, J=7,0 Гц, 3Н), 0,64 (t, J=7,5 Гц, 2H); МС (+CI): m/z C18H36BN3O5: ожидаемое 385,3; эксперимент 386,2(M+H)+, 368,2 (M+Н-H2O)+.
[0237] Пример 24: Получение дигидрохлорида 2-амино-6-бороно-2-(2-морфолин-4-ил)этил)гексановой кислоты
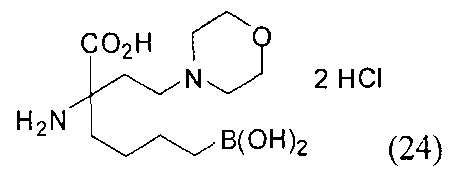
[0238] Дигидрохлорид 2-амино-6-бороно-2-(2-морфолин-4-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что морфолин применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира (R)-2-трет-бутоксикарбокиламино-2-(2-морфолин-4-илэтил)-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (102 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (61 мг); 1Н ЯМР (D2O, 300 МГц) δ 3,96 (d, J=12,5 Гц, 2H), 3,66 (t, J=12,5 Гц, 2H), 3,40 (m, 2H), 3,10 (m, 4H), 2,20 (m, 2H), 1,64-1,82 (m, 2H), 1,26 (m, 3Н), 1,08 (m, 1H), 0,62 (t, J=7,0 Гц, 2H); MC (+CI): m/z C12H25BN2O5: ожидаемое 288,2; эксперимент 289,2 (M+H)+.
[0239] Пример 25: Получение дигидрохлорида 2-амино-2-[2-(4-бензилпиперидин-1-ил)этил]-6-бороногексановой кислоты
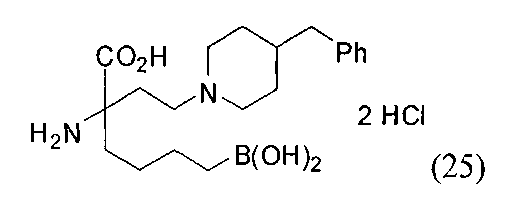
[0240] Дигидрохлорид 2-амино-2-[2-(4-бензилпиперидин-1-ил)этил]-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-бензилпиперидин применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира 2-[2-(4-бензилпиперидин-1-ил)этил]-2-трет-бутоксикарбониламино-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (95 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (42 мг); 1Н ЯМР (D2O, 300 МГц) δ 7,24 (m, 2H), 7,13 (m, 3H), 3,42 (m, 2H), 3,18 (m, 1H), 3,00 (m, 1H), 2,78 (m, 2H), 2,44 (d, J=7,0 Гц, 2H), 2,16 (t, J=7,0 Гц, 2H), 1,76 (m, 5H), 1,24 (m, 5H), 1,09 (m, 1H), 0,61 (t, J=7,0 Гц, 2H); МС (+CI): m/z C20H33BN2O4: ожидаемое 376,3; эксперимент 377,2 (M+Н)+, 359,2 (M+Н-H2O)+.
[0241] Пример 26: Получение дигидрохлорида 2-амино-6-бороно-2-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]гексановой кислоты
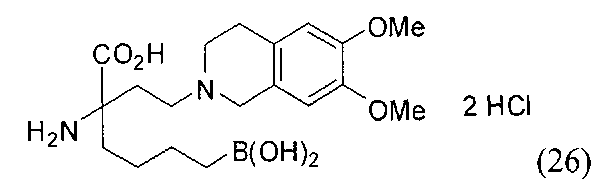
[0242] Дигидрохлорид 2-амино-6-бороно-2-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 6,7-диметокси-1,2,3,4-тетрагидроизохинолин применяли в качестве амина на стадии 6. Конечная стадия предложена ниже: раствор этилового эфира 2-трет-бутоксикарбониламино-2-[2-(6,7-диметокси-3,4-дигидро-1Н-изохинолин-2-ил)этил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (108 мг) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (66 мг); 1Н ЯМР (D2O, 300 МГц) δ 6,75 (s, 1H), 6,66 (s, 1H), 4,39 (d, J=15 Гц, 1H), 4,14 (d, J=15 Гц, 1H), 3,67 (s, 3H), 3,66 (s, 3H), 3,18-3,46 (m, 4H), 2,97 (m, 2H), 2,31 (t, J=8 Гц, 2H), 1,82 (m, 2H), 1,27 (m, 3H), 1,12 (m, 1H), 0,64 (m, 2H); МС (+CI): m/z C19H31BN2O6: ожидаемое 394,2; эксперимент 395,5 (M+H)+, 377,4 (M+H-Н2О)+, 359,4 (M+H-2H2O)+.
[0243] Пример 27: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((4-метоксибензил)(метил)амино)этил)гексановой кислоты
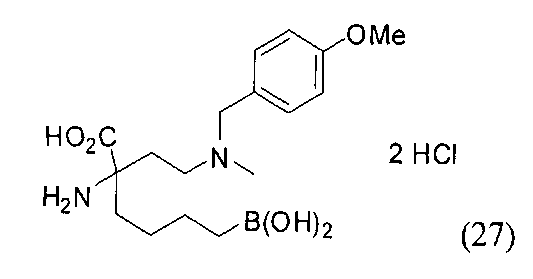
[0244] Дигидрохлорид 2-амино-6-бороно-2-(2-((4-метоксибензил)(метил)амино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(4-метоксифенил)-N-метилметанамин применяли в качестве амина на стадии 6. 1Н ЯМР (d4-MeOH, 300 МГц) δ 7,47 (d, J=8,7 Гц, 2H), 7,03 (d, J=9,0 Гц, 2Н), 4,40 (d, J=11,2 Гц, 1Н), 4,27 (d, J=11,2 Гц, 1Н), 3,83 (s, 3Н), 2,82 (s, 3H), 2,43-2,38 (m, 2H), 1,95-1,81 (m, 2H), 1,44-1,23 (m, 6H), 0,82 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C17H29B2NO5 m/z [353,6 (М+Н)].
[0245] Пример 28: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-фенил-5,6-дигидропиридин-1(2Н)-ил)этил)гексановой кислоты
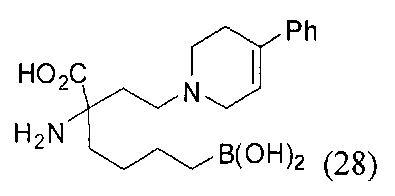
[0246] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-фенил-5,6-дигидропиридин-1(2Н)-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-фенил-1,2,3,6-тетрагидропиридин применяли в качестве амина на стадии 6. 1Н ЯМР (d4-MeOH, 300 МГц) δ 7,67-7,64 (m, 1Н), 7,50-7,45 (m, 2H), 7,40-7,31 (m, 2H), 6,14 (s, 1Н), 2,97-2,71 (m, 2H), 2,49 (t, J=7,8 Гц, 2H), 2,08-1,92 (m, 4H), 1,59-1,19 (m, 8H), 0,84 (t, J=7,8 Гц, 2H). ИЭР МС эксперимент C19H29B1N2O4 m/z [325,5 (M+1)-2H2O].
[0247] Пример 29: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ил)этил)гексановой кислоты
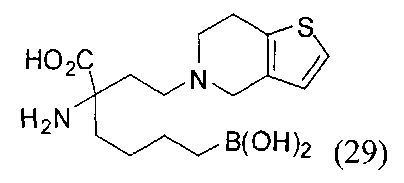
[0248] Дигидрохлорид 2-амино-6-бороно-2-(2-(6,7-дигидротиено[3,2-с]пиридин-5(4Н)-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4,5,6,7-тетрагидротиено[3,2-с]пиридин применяли в качестве амина на стадии 6. 1Н ЯМР (d4-MeOH, 300 МГц) δ 7,42 (d, J=5,1 Гц, 1Н), 6,91 (d, J=5,1 Гц, 1Н). 3,60-3,53 (m, 2H), 2,50 (t, J=8,1 Гц, 2H), 2,08-1,88 (m, 2H), 1,59-1,21 (m, 10Н), 0,84 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C15H25B1N2O4S1 m/z [305,1 (M+1)-2H2O].
[0249] Пример 30: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3-оксо-2,3,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-5(4Н)-ил)этил)гексановой кислоты
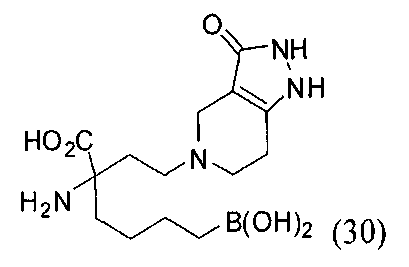
[0250] Дигидрохлорид 2-амино-6-бороно-2-(2-(3-оксо-2,3,6,7-тетрагидро-1Н-пиразоло-[4,3-с]пиридин-5(4Н)-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4,5,6,7-тетрагидро-1Н-пиразоло[4,3-с]пиридин-3(2Н)-он применяли в качестве амина на стадии 6. 1Н ЯМР (d4-МеОН, 300 МГц) δ 7,23-7,08 (m, 2H), 3,19 (s, 2H), 2,54 (t, J=8,4 Гц, 2Н), 2,08-1,89 (m, 4H), 1,50-1,28 (m, 8H), 0,84 (t, J=6,9 Гц, 2H). ИЭР МС эксперимент C14H25B1N2O5 m/z [341,3 (M+1)].
[0251] Пример 31: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(4-метоксифенил)-5,6-дигидропиридин-1(2Н)-ил)этил)гексановой кислоты
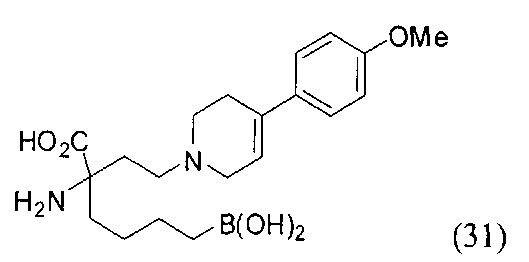
[0252] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-(4-метоксифенил)-5,6-дигидропиридин-1(2Н)-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(4-метоксифенил)-1,2,3,6-тетрагидропиридин применяли в качестве амина на стадии 6. 1Н ЯМР (d4-MeOH, 300 МГц) δ 7,42 (d, J=8,7 Гц, 2H), 6,92 (d, J=8,7 Гц, 2H), 6,40 (s, 1H), 3,80 (s, 3Н), 2,88 (s, 2H), 2,50-2,43 (m, 2H), 2,05-1,88 (m, 4H), 1,59-1,23 (m, 8H), 0,84 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C20H31B1N2O5 m/z [373,5 (М+1)-H2O].
[0253] Пример 32: Получение тригидрохлорида 2-амино-6-бороно-2-(2-(пиперазин-1-ил)этил)гексановой кислоты
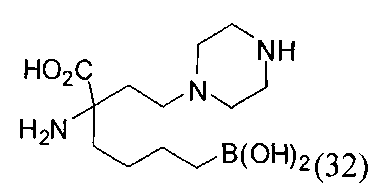
[0254] Тригидрохлорид 2-амино-6-бороно-2-(2-(пиперазин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что трет-бутил-пиперазин-1-карбоксилат применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде тригидрохлоридной соли. 1Н ЯМР (D2O, 300 МГц) δ 3,55-3,30 (m, 9Н), 3,26-3,14 (m, 1H), 2,30-2,11 (m, 2H), 1,88-1,62 (m, 2H), 1,31-1,14 (m, 3Н), 1,14-0,99 (m, 1H), 0,60 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C12H26BN3O4 m/z [288,2 (M+1)].
[0255] Пример 33: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((S)-2-(метоксиметил)пирролидин-1-ил)этил)гексановой кислоты
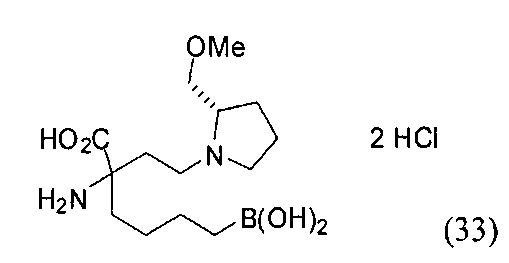
[0256] Дигидрохлорид 2-амино-6-бороно-2-(2-((S)-2-(метоксиметил)пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (S)-2-(метоксиметил)пирролидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 3,63-3,38 (m, 5H), 3,21 (s, 3Н), 3,07-2,95 (m, 2H), 2,24-1,60 (m, 8H), 1,32-1,17 (m, 3Н), 1,15-0,98 (m, 1H), 0,60 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C14H29BN2O5 m/z [317,2 (M+1)].
[0257] Пример 34: Получение дигидрохлорида 2-амино-2-(2-(4-бензил-4-гидроксипиперидин-1-ил)этил)-6-бороногексановой кислоты
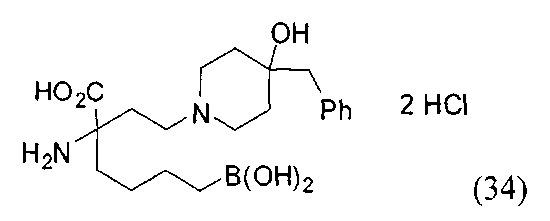
[0258] Дигидрохлорид 2-амино-2-(2-(4-бензил-4-гидроксипиперидин-1-ил)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-бензилпиперидин-4-ол применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 300 МГц) δ 7,20-7,01 (m, 5H), 3,32-3,10 (m, 3Н), 3,06-2,90 (m, 3Н), 2,61 (s, 2H), 2,16 (t, J=8,4 Гц, 2H), 1,81-1,64 (m, 4H), 1,57 (d, J=14,7 Гц, 2H), 1,27-1,12 (m, 3Н), 1,09-0,95 (m, 1H), 0,55 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C20H33BN2O5 m/z [393,2 (M+1)].
[0259] Пример 35: Получение тригидрохлорида 2-амино-6-бороно-2-(2-(4-метилпиперазин-1-ил)этил)гексановой кислоты
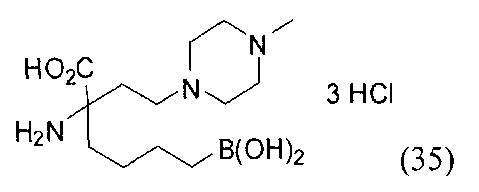
[0260] Тригидрохлорид 2-амино-6-бороно-2-(2-(4-метилпиперазин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-метилпиперазин применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде тригидрохлоридной соли. 1Н ЯМР (D2O, 300 МГц) δ 3,90-3,12 (m, 9H), 2,84 (s, 3Н), 2,30-2,11 (m, 2H), 1,87-1,63 (m, 3H), 1,33-1,14 (m, 3H), 1,14-0,97 (m, 1H), 0,60 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C13H28BN3O4 m/z [302,2 (M+1)].
[0261] Пример 36: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3,4-дигидроизохинолин-2(1Н)-ил)этил)гексановой кислоты
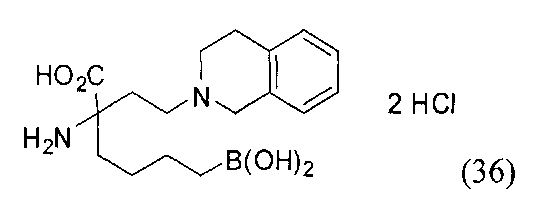
[0262] Дигидрохлорид 2-амино-6-бороно-2-(2-(3,4-дигидроизохинолин-2(1Н)-ил)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1,2,3,4-тетрагидроизохинолин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,22-7,10 (m, 3H), 4,45 ((dАВ, J=15,0 Гц, 1H), 4,21 (dAB, J=15,0 Гц, 1H), 3,72-3,62 (m, 1H), 3,48-3,00 (m, 4H), 2,38-2,28 (m, 2H), 1,92-1,69 (m, 3H), 1,35-1,20 (m, 3H), 1,18-1,03 (m, 1H), 0,62 (t, J=6,9 Гц, 2H). ИЭР МС эксперимент C17H27BN2O4 m/z [335,2 (M+1)].
[0263] Пример 37: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(диэтиламино)этил)гексановой кислоты
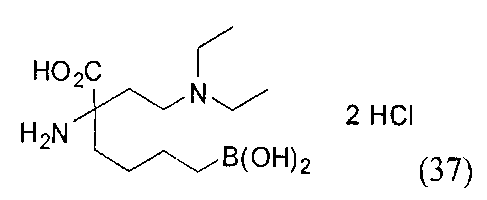
[0264] Дигидрохлорид 2-амино-6-бороно-2-(2-(диэтиламино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что диэтиламин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 3,28-3,14 (m, 1H), 3,06 (q, J=7,2 Гц, 4H), 3,08-2,95 (m, 1H), 2,21-2,11 (m, 2H), 1,89-1,68 (m, 2H), 1,31-1,17 (m, 3H), 1,09 (t, J=7,2 Гц, 6Н), 1,08-0,98 (m, 1H), 0,60 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C12H27BN2O4 m/z [275,2 (M+1)].
[0265] Пример 38: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-оксопиперидин-1-ил)этил)гексановой кислоты
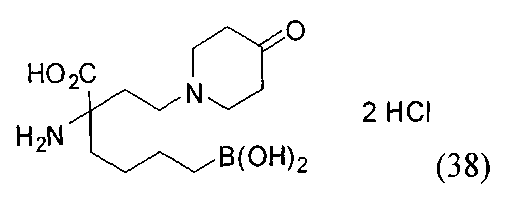
[0266] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-оксопиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что пиперидин-4-он применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,54-3,47 (m, 2H), 3,32 (dt, J=5,0, 6,0 Гц, 1H), 3,15-3,07 (m, 3H), 2,28-2,18 (m, 2H), 2,01-1,84 (m, 5H), 1,78-1,72 (m, 1H), 1,37-1,27 (m, 3H), 1,20-1,10 (m, 1H), 0,70 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C13H25BN2O5 m/z [283,6 (M+1-18) 7%, 265,5 (M+1-2×18) 100%].
[0267] Пример 39: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(трифторметил)пиперидин-1-ил)этил)гексановой кислоты
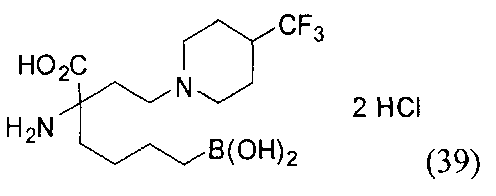
[0268] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-(трифторметил)-пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(трифторметил)пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,63 (t, J=12,0 Гц, 2H) 3,31 (ddd, J1=12,0 Гц, J2=10,0 Гц, J3=6,0 Гц, 1H), 3,11 (ddd, J1=12,0 Гц, J2=11,0 Гц, J3=6,0 Гц, 1H), 3,03-2,94 (m, 2H), 2,59-2,49 (m, 1H), 2,28-2,21 (m, 2H), 2,16-2,13 (m, 2H), 1,89-1,84 (m, 1H), 1,78-1,69 (m, 3H), 1,37-1,27 (m, 3H), 1,19-1,10 (m, 1H), 0,70 (t, J=8,0 Гц, 2H). 19F ЯМР - 73,45 (s, 3F). ИЭР МС эксперимент C14H26BF3N2O4 m/z [337,6 (М+1-18) 13%, 319,5 (M+1-2×18) 100%].
[0269] Пример 40: Получение тригидрохлорида 2-амино-6-бороно-2-(2-((S)-2-(пирролидин-1-илметил)пирролидин-1-ил)этил)гексановой кислоты

[0270] Тригидрохлорид 2-амино-6-бороно-2-(2-((S)-2-(пирролидин-1-илметил)-пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (S)-1,2′-метилендипирролидин применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде моногидрата тригидрохлоридной соли. 1Н ЯМР (D2O, 500 МГц) δ 3,89-3,81 (m, 1H), 3,72-3,65 (m, 4H), 3,53 (dd, J1=12,0 Гц, J2=4,0 Гц, 1H), 3,43 (dd, J1=12,0 Гц, J2=6,0 Гц, 1H), 2,28-2,17 (m, 2H), 2,16-2,01 (m, 4H), 1,94-1,83 (m, 4H), 1,76-1,71 (m, 1H), 1,37-1,32 (m, 3H), 1,18-1,09 (m, 1H), 0,69 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C17H34BN3O4 m/z [338,7 (M+1-18) 29%, 320,6 (M+1-2×18) 100%, 336,7 (M-1-18) 100%].
[0271] Пример 41: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-метоксипиперидин-1-ил)этил)гексановой кислоты
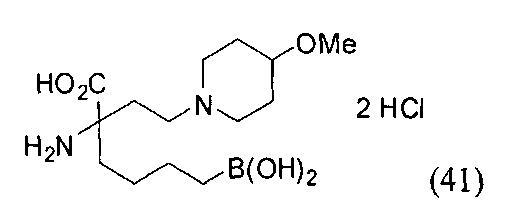
[0272] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-метоксипиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-метоксипиперидин применяли в качестве амина на стадии 6. 1H ЯМР (D2O, 500 МГц) δ 3,60-3,49 (m, 2H), [3,29 (s, 1й конформер), 3,26 (s, 2й конформер), 3H], 3,33-3,24 (m, 2H), 3,12-3,04 (m, 2H), 3,02-2,93 (m, 1H), 1,88-1,75 (m, 3H), 1,57-1,48 (m, 1H), 1,38-1,27 (m, 3H), 1,19-1,09 (m, 1H), 0,68 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C14H29BN2O5 m/z [299,6 (M+1-18) 15%, 281,5 (М+1-2×18) 100%, 297,6 (M-1-18) 75%].
[0273] Пример 42: Получение дигидрохлорида 2-амино-2-(2-(2-(бензофуран-2-ил)пирролидин-1-ил)этил)-6-бороногексановой кислоты
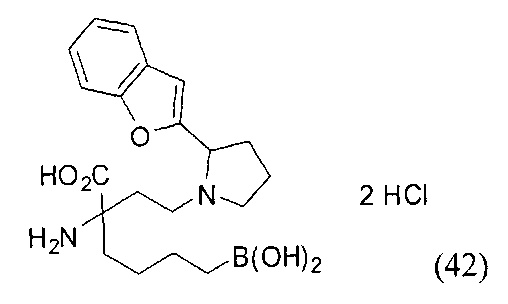
[0274] Моногидрат дигидрохлорида 2-амино-2-(2-(2-(бензофуран-2-ил)пирролидин-1-ил)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2-(бензофуран-2-ил)пирролидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,62 (dd, J1=8,0 Гц, J2=8,0 Гц, 1Н), 7,51 (dd, J1=8,0 Гц, J2=4,0 Гц, 1Н), 7,31-7,37 (m, 1H), 7,22-7,27 (m, 1H), [7,12 (s, 1й диастереомер), 7,09 (s, 2й диастереомер), 1H], 4,78-4,61 (m, 3H), 3,82-3,75 (m, 1H), 3,59-3,52 (m, 1H), 3,40-3,31 (m, 1H), 3,25-3,12 (m, 1H), 2,52-2,40 (m, 2H), 2,30-2,12 (m, 3H), [1,97-1,93 (m, 1й диастереомер), 2,05-2,00 (m, 2й диастереомер), 1H], 1,28-1,00 (m, 4H), [0,55-0,43 (m, 1й диастереомер), 0,81-0,62 (m, 2й диастереомер), 2H]. ИЭР МС эксперимент C20H29BN2O5 m/z [371,6 (M+1-18) 16%, 353,6 (M+1-2×18) 100%].
[0275] Пример 43: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((2-гидроксиэтил)(метил)амино)этил)гексановой кислоты
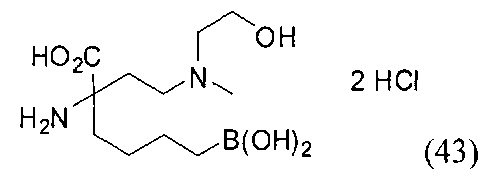
[0276] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-((2-гидроксиэтил)(метил)-амино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2-(метиламино)этанол применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,81 (brt, J=5,0 Гц, 2H), 3,55-3,42 (m, 1H), 3,36-3,13 (m, 3H), [2,84 (s, 1й ротамер), 2,83 (s, 2й ротамер), 3H], 2,27 (brt, J=7,0 Гц, 2H), 1,92-1,87 (m, 1H), 1,81-1,75 (m, 1H), 1,37-1,29 (m, 3H), 1,18-1,13 (m, 1H), 0,70 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C11H25BN2O5 m/z [277,6 (M+1) 5%, 259,6 (M+1-18) 25%, 241,5 (M+1-2×18) 100%, 257,6 (M-1-18) 100%].
[0277] Пример 44: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3,3-дифторпирролидин-1-ил)этил)гексановой кислоты
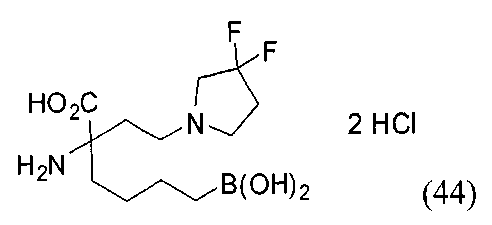
[0278] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(3,3-дифторпирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 3,3-дифторпирролидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,95-3,85 (m, 2H), 3,79-3,69 (m, 2H), 3,54 (ddd, J1=12,0 Гц, J2=10,0 Гц, J3=6,0 Гц, 1Н), 3,35 (ddd, J1=12,0, J2=10,0, J3=5,0 Гц, 1Н), 2,68-2,63 (m, 2H), 2,29-2,22 (m, 2H), 1,79 (ddd, J1=15,0, J2=12,0, J3=5,0 Гц, 1Н), 1,40-1,32 (m, 3H), 1,22-1,15 (m, 1Н), 0,73 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C12H23BF2N2O4 m/z [291,5 (M+1-18) 17%, 273,5 (M+1-2×18) 100%, 307,6 (M-1) 29%, 289,5 (M-1-18) 100%].
[0279] Пример 45: Получение дигидрохлорида 2-(2-(4-ацетил-4-фенилпиперидин-1-ил)этил)-2-амино-6-бороногексановой кислоты
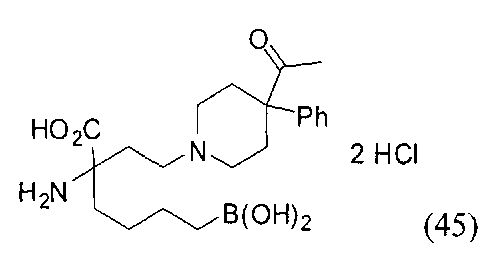
[0280] Моногидрат дигидрохлорида 2-(2-(4-ацетил-4-фенилпиперидин-1-ил)этил)-2-амино-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(4-фенилпиперидин-4-ил)этанон применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,27-7,44 (m, 5H), 3,64-3,60 (m, 1Н), 3,56-3,52 (m, 1Н), 3,33-3,08 (m, 2H), 3,04-2,89 (m, 2H), 2,85-2,82 (m, 2H), 2,29-2,25 (m, 1Н), 2,21-2,13 (m, 2H), 2,11-2,03 (m, 1Н), [1,93 (s, 1й конформер), 1,91 (s, 2й конформер), 3H], 1,88-1,69 (m, 2H), 1,37-1,25 (m, 3H), 1,16-1,09 (m, 1H), [0,69 (t, J=7,0 Гц, 1й конформер), 0,67 (t, J=7,0 Гц, 2й конформер), 2H]. ИЭР МС эксперимент C21H33BN2O5 m/z [387,7 (M+1-18) 30%, 369,6 (M+1-2×18) 100%].
[0281] Пример 46: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((R)-2-(трифторметил)пирролидин-1-ил)этил)гексановой кислоты
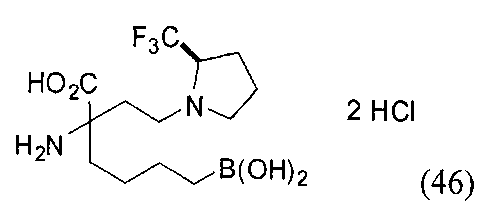
[0282] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-((R)-2-(трифторметил)-пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (R)-2-(трифторметил)пирролидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 4,44-4,34 (m, 1H), 3,78-3,71 (m, 1H), [3,54-3,47 (m, 1й диастереомер), 3,69-3,65 (m, 2й диастереомер), 1H], [3,37-3,32 (m, 1й диастереомер), 3,46-3,41 (m, 2й диастереомер), 1H], 3,29-3,19 (m, 1H), 2,44-2,35 (m, 1H), 2,33-2,27 (m, 1H), 2,22-2,13 (m, 3H), 2,05-1,96 (m, 1H), 1,92-1,86 (m, 1H), 1,80-1,73 (m, 1H), 1,35-1,29 (m, 3H), 1,20-1,11 (m, 1H), 0,69 (t, J=7,0 Гц, 2Н). 19F ЯМР [-71,29 (s, 1й диастереомер), -71,06 (s, 2й диастереомер), 3F]. ИЭР МС эксперимент C13H24BF3N2O4 m/z [323,5 (M+1-18) 10%, 305,5 (M+1-2×18) 100%, 321,5 (M-1-18) 100%].
[0283] Пример 47: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-фторпиперидин-1-ил)этил)гексановой кислоты
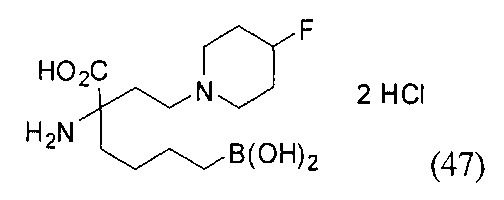
[0284] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-фторпиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-фторпиперидин применяли в качестве амина на стадии 6. 1H ЯМР (D2O, 500 МГц) δ 5,00 (brd, J=47 Гц, 0,7Н), 4,85 (d sept, J=47 Гц, 0,08Н), 3,65-3,58 (m, 0,3H), 3,48-3,44 (m, 1,5H), 3,37-3,33 (m, 1H), 3,27-3,20 (m, 1,5H), 3,19-3,14 (m, 1H), 3,12-3,06 (m, 0,3H), 2,34-2,26 (m, 2Н), 2,24-2,20 (m, 2Н), 2,05-1,88 (m, 3H), 1,81 (ddd, J=14,0, 12,0, 4,0 Гц, 1H), 1,40-1,32 (m, 3H), 1,22-1,16 (m, 1H), 0,73 (t, J=7,0 Гц, 2Н). 19F ЯМР [-188.10 - -188,05 (m, 1й конформер), -177.96 - -177,87 (m, 2й конформер), 1F].
[0285] Пример 48: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((4-фтор-3-(трифторметил)бензил)(метил)амино)этил)гексановой кислоты
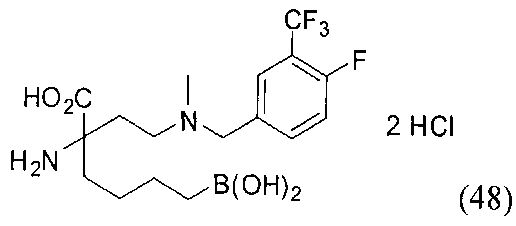
[0286] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-((4-фтор-3-(трифторметил)-бензил)(метил)амино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(4-фтор-3-(трифторметил)фенил)-N-метилметанамин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ [7,80 (brs, 1й ротамер), 7,79 (brs, 2й ротамер), 1Н], 7,75-7,69 (m, 1Н), 7,36 (dd, J1=10,0 Гц, J2=8,0 Гц, 1Н), 4,45-4,36 (m, 1Н), 4,32-4,23 (m, 1Н), 3,43-3,37 (m, 1Н), 3,13-3,05 (m, 1Н), 2,79 (brs, 2й ротамер), 3Н], [2,76 (brs, 1й ротамер), 2,26 (dt, J1=16,0 Гц, J2=8,0 Гц, 1Н), 2,18-2,06 (m, 1Н), 1,86-1,66 (m, 1Н), 1,46-0,98 (m, 5H), 0,69-0,57 (m, 2H). 19F ЯМР -112,29 (q, J=14,0 Гц, 1F), -60,85 (d, J=14,0 Гц, 3F). ИЭР МС эксперимент C17H25BF4N2O4 m/z [391,5 (M+1 -18) 33%, 373,6 (M+1-2×18) 100%].
[0287] Пример 49: Получение тригидрохлорида 2-амино-6-бороно-2-(2-(4-метил-1,4-диазепан-1-ил)этил)гексановой кислоты
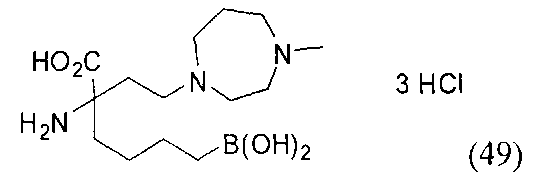
[0288] Моногидрат тригидрохлорида 2-амино-6-бороно-2-(2-(4-метил-1,4-диазепан-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-метил-1,4-диазепан применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,77-3,68 (m, 2 Н), 3,55-3,51 (m, 3Н), 3,47-3,41 (m, 2H), 3,28 -3,23 (m, 1Н), 2,91 (s, 3Н), 2,29-2,23 (m, 3Н), 2,21-2,14 (m, 1Н), 1,88-1,83 (m, 1H), 1,76-1,71 (m, 1Н), 1,37-1,27 (m, 3Н), 1,18-1,10 (m, 1Н), 0,70 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C14H30BN3O4 m/z [298,5 (M+1-18) 6%, 280,5 (M+1-2×18) 100%, 268,5 (M+1-3×18) 5%].
[0289] Пример 50: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(2-метоксифенил)пиперазин-1-ил)этил)гексановой кислоты
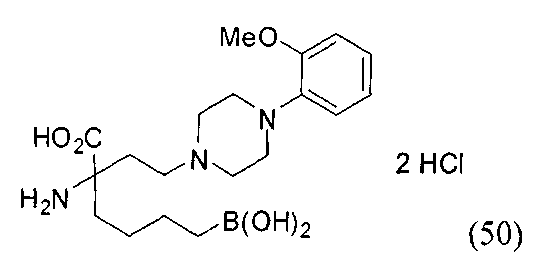
[0290] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-(2-метоксифенил)-пиперазин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(2-метоксифенил)пиперазин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,15 (ddd, J1=8,0 Гц, J2=8,0 Гц, J3=1,0 Гц, 1Н), 7,09 (dd, J1=8,0 Гц, J2=1,0 Гц, 1Н), 7,01 (d, J=8,0 Гц, 1Н), 6,95 (dd, J1=8,0 Гц, J2=8,0 Гц, 1Н), 3,78 (s, 3Н), 3,52-3,34 (m, 8H), 2,34-2,24 (m, 2H), 1,92-1,87 (m, 1H), 1,81-1,75 (m, 1H), 1,49-1,44 (m, 2H), 1,37-1,29 (m, 3Н), 1,20-1,15 (m, 1H), 0,70 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C19H32BN3O5 m/z [376,6 (M+1-18) 10%, 358,7 (M+1-2×18) 100%].
[0291] Пример 51: Получение тетрагидрохлорида 2-амино-2-(2-(бис(2-аминоэтил)-амино)этил)-6-бороногексановой кислоты
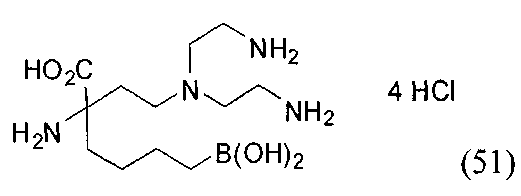
[0292] Тетрагидрохлорид 2-амино-2-(2-(бис(2-аминоэтил)амино)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что трет-бутил-2,2′-азандиилбис(этан-2,1-диил)дикарбамат применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде моногидрата тетрагидрохлоридной соли. 1Н ЯМР (D2O, 500 МГц) δ 3,15-3,12 (m, 4H), 3,00-2,92 (m, 5Н), 2,77 (ddd, J1=14,0 Гц, J2=7,0 Гц, J3=6,0 Гц, 1H), 2,07 (t, J=7,0 Гц, 2H), 1,86 (ddd, J1=18,0 Гц, J2=14,0 Гц, J3=4,0 Гц, 1H), 1,76 (ddd, J1=18,0 Гц, J2=14,0 Гц, J3=4,0 Гц, 1H), 1,37-1,32 (m, 3Н), 1,17-1,09 (m, 1H), 0,69 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C12H29BN4O4 m/z [287,6 (M+1-18) 5%, 269,5 (M+1-2×18) 100%, 303,6 (M-1) 28%, 285,6 (M-1-18) 100%].
[0293] Пример 52: Получение дигидрохлорида 1-(3-амино-7-бороно-3-карбоксигептил)пиперидин-2-карбоновой кислоты
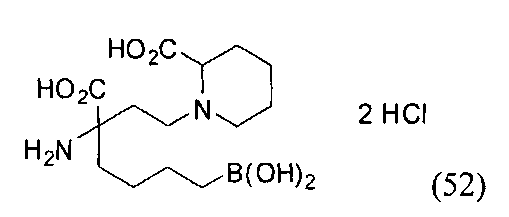
[0294] Моногидрат дигидрохлорида 1-(3-амино-7-бороно-3-карбоксигептил)пиперидин-2-карбоновой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что пиперидин-2-карбоксилат применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,98-3,88 (m, 1й конформер), 1H), 3,64 (brd, J=13,0 Гц, 1H), 3,44 (dt, J1=13,0 Гц, J2=6,0 Гц, 2й конформер), 3,32-3,25 (m, 2H), 3,10 (dt, J1=13,0 Гц, J2=5,0 Гц, 2й конформер), 1H], [3,03-2,96 (m, 1й конформер), 2,42-2,36 (m, 1H), 2,35-2,30 (m, 1H), 2,24 (brd, J=14,0 Гц, 1H), 1,94-1,88 (m, 2H), 1,84-1,81 (m, 2H), 1,78-1,72 (m, 1H), 1,70-1,64 (m, 1H), 1,55-1,50 (m, 1H), 1,38-1,32 (m, 3Н), 1,21-1,16 (m, 1H), 0,72 (t; J=7,0 Гц, 2Н). ИЭР МС эксперимент C12H29BN4O4 m/z [317,5 (M+Na+-2 x 18) 11%, 313,6 (M+1-18) 17%, 295,6 (M+1-2×18) 100%, 329,5 (M-1) 6%, 311,6 (M-1-18) 100%].
[0295] Пример 53: Получение дигидрохлорида 1-(3-амино-7-бороно-3-карбоксигептил)пиперидин-3-карбоновой кислоты
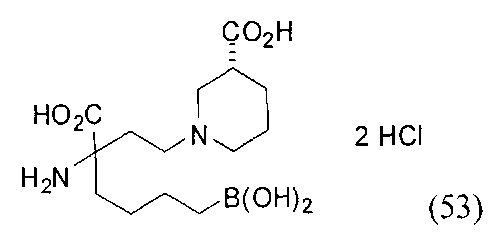
[0296] Моногидрат дигидрохлорида 1-(3-амино-7-бороно-3-карбоксигептил)пиперидин-3-карбоновой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (R)-пиперидин-3-карбоксилат применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ (два диастереомера + два конформера) 3,78 (brt, J=12,0 Гц, 0,35Н), 3,73 (brt, J=12,0 Гц, 0,65Н), 3,54 (brt, J=14,0 Гц, 0,65Н), 3,43 (brt, J=14,0 Гц, 0,35Н), 3,39-3,33 (m, 1H), 3,19-3,13 (m, 1H), 3,11-3,08 (m, 1H), 3,05-2,80 (m, 2Н), 2,40-2,19 (m, 2Н), 2,17-2,11 (m, 1H), 2,02 (brd, J=15,0 Гц, 0,65Н), 1,94-1,67 (m, 3,70H), 1,55 (ddd, J1=16,0 Гц, J2=13,0 Гц, J3=4,0 Гц, 0,65Н), 1,39-1,33 (m, 3H), 1,22-1,15 (m, 1H), 0,74 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C12H29BN4O4 m/z [317,4 (M+Na+-2 x 18) 5%, 313,6 (M+1-18) 10%, 295,6 (M+1-2×18)100%, 311,6 (М-1-18)100%].
[0297] Пример 54: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((S)-2-(диметилкарбамоил)пирролидин-1-ил)этил)гексановой кислоты
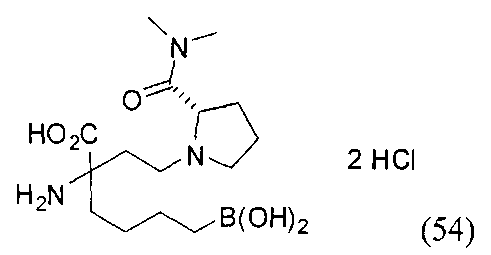
[0298] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-((S)-2-(диметилкарбамоил)-пирролидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (S)-N,N-диметилпирролидин-2-карбоксамид применяли в качестве амина на стадии 6. ИЭР МС эксперимент C13H26BN3O5 m/z [298,5 (M+1-18) 15%, 280,5 (M+1-2×18) 55%, 235,5 (M+1-2×18-45) 100%].
[0299] Пример 55: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(изопропиламино)этил)гексановой кислоты
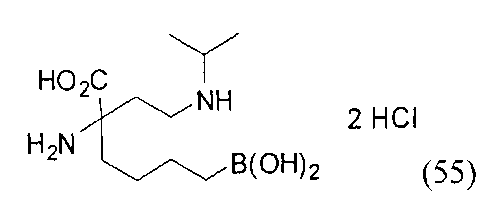
[0300] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(изопропиламино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что изопропиламин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,26 (sept, J=6,0 Гц, 1Н), 3,10-3,0,5 (m, 1H), 2,84-2,80 (m, 1H), 2,12 (t, J=8,0 Гц, 2Н), 1,80-1,71 (m, 2Н), 1,34-1,27 (m, 3H), 1,19 (d, J=6,0 Гц, 6Н), 1,11-1,07, (m, 1H), 0,58 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C11H25BN2O4 m/z [261,6 (M+1) 3%, 243,5 (M+1-18) 30%, 225,5 (M+1-2×18) 100%, 207,5 (M+1-3×18) 62%, 501,9 (2M-1-18) 13%, 259,6 (M-1) 23%, 241,5 (M-1-18) 100%].
[0301] Пример 56: Получение дигидрохлорида (3S)-1-(3-амино-7-бороно-3-карбоксигептил)пиперидин-3-карбоновой кислоты
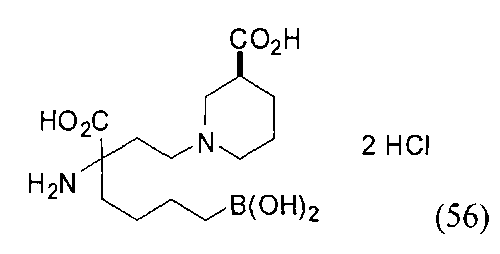
[0302] Моногидрат дигидрохлорида (3S)-1-(3-амино-7-бороно-3-карбоксигептил)-пиперидин-3-карбоновой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (S)-этил-пиперидин-3-карбоксилат применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ (два диастереомера + два конформера) 3,79 (brt, J=12,0 Гц, 0,35Н), 3,74 (brt, J=12,0 Гц, 0,65Н), 3,55 (brt, J=12,0 Гц, 0,65Н), 3,44 (brt, J=12,0 Гц, 0,35Н). 3,41-3,33 (m, 1H), 3,21-3,15 (m, 1H), 3,13-2,95 (m, 2Н), 2,92-2,81 (m, 1H), 2,42-2,11 (m, 3H), 2,03 (brd, J=14,0 Гц, 0,65Н), 1,94-1,70 (m, 3,80Н), 1,57 (dq, J=13,0, 4,0 Гц, 0,65Н), 1,40-1,32 (m, 3H), 1,24-1,15 (m, 1H), 0,74 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C11H27BN2O6 m/z [313,6 (M+1-18) 10%, 295,5 (M+1-2×18) 100%, 277,5 (M+1-3×18) 15%].
[0303] Пример 57: Получение 1-(3-амино-7-бороно-3-карбоксигептил)-4-метилпиперидин-4-карбоновой кислоты
[0304] 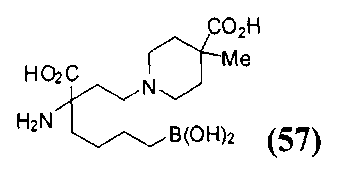
[0305] Моногидрат дигидрохлорида (2-(2-(4-ацетил-4-метилпиперидин-1-ил)этил)-2-амино-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(4-метилпиперидин-4-ил)этанон применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ (два конформера в соотношении 3/1) 3,48-3,40 (m, 2H), 3,34-3,21 (m, 1H), 3,15-3,11 (m, 0,5H), 3,08-3,02 (m, 1H), 2,96-2,87 (m, 1,5H), 2,28 (d, J=14,0 Гц, 1,5Н), 2,23-2,19 (m, 2H), 2,06-2,01 (m, 0,5H), 1,88-1,82 (m, 1,5H), 1,77-1,71 (m, 1H), 1,61 (t, J=14,0 Гц, 1,5Н), 1,34-1,27 (m, 3H), [1,25 (s, 1й конформер), 1,18 (s, 2й конформер), 3H], 1,16-1,10 (m, 1H), 0,69 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C15H29BN2O6 m/z [327,6 (M+1-18) 13%, 309,6 (M+1-2×18) 100%, 291,6 (M+1-3×18) 10%, 325,6 (M-1-18) 100%, 307,6 (M-1-2×18) 37%].
[0306] Пример 58: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(2,3-дигидро-1Н-инден-2-иламино)этил)гексановой кислоты
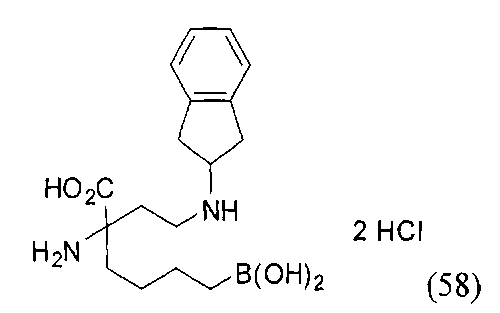
[0307] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(2,3-дигидро-1Н-инден-2-иламино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2,3-дигидро-1Н-инден-2-амин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,26-7,24 (m, 2H), 7,21-7,19 (m, 2H), 4,09-4,04 (m, 1H), 3,35 (dd, J1=17,0 Гц, J2=7,0 Гц, 2H), 3,31-3,25 (m, 1H), 3,12-3,07 (m, 1H), 3,04 (dd, J1=17,0 Гц, J2=4,0 Гц, 2H), 2,18 (t, J=8,0 Гц, 2H), 1,91-1,86 (m, 1H), 1,79-1,73 (m, 1H), 1,38-1,27 (m, 3H), 1,20-1,11 (m, 1H), 0,71 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C13H26BFN2O4 m/z [317,5 (M+1-18) 28%, 299,6 (M+1-2×18) 100%, 281,5 (M+1-3×18) 31%, 333,5 (M-1) 28%, 315,5 (M-1-18) 100%].
[0308] Пример 59: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3-гидроксиазетидин-1-ил)этил)гексановой кислоты
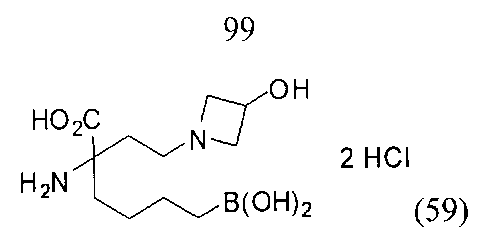
[0309] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(3-гидроксиазетидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что азетидин-3-ол применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 4,65-4,60 (m, 1H), 4,50-4,46 (m, 1H), 4,21-4,17 (m, 1H), 4,10-4,08 (m, 1H), 3,86-3,82 (m, 1H), 3,48-3,37 (m, 1H), 3,30-3,19 (m, 1H), 2,09-2,04 (m, 2H), 1,90-1,85 (m, 1H), 1,78-1,73 (m, 1H), 1,35-1,28 (m, 3H), 1,19-1,10 (m, 1H), 0,70 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C11H23BN2O5 m/z [275,5 (M+1) 5%, 257,5 (M+1-18) 11%, 239,4 (M+1-2×18) 100%, 273,5 (M-1) 10%, 255,5 (M-1-18) 100%].
[0310] Пример 60: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(1-бутилциклопропиламино)этил)гексановой кислоты
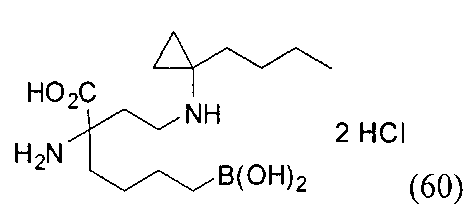
[0311] Дигидрохлорид 2-амино-6-бороно-2-(2-(1-бутилциклопропиламино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-бутилциклопропанамин применяли в качестве амина на стадии 6, и реакция проходила с образованием дигидрата. 1Н ЯМР (D2O, 500 МГц) δ 3,33-3,27 (m, 1H), 3,12-3,07 (m, 1H), 2,15 (t, J=8,0 Гц, 2H), 1,91-1,86 (m, 1H), 1,79-1,73 (m, 1H), 1,66-1,56 (m, 2H), 1,36-1,30 (m, 3H), 1,26 (brs, 4H), 1,17-1,11 (m, 1H), 0,89 (s, 2H), 0,79-0,77 (m, 5H), 0,70 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C15H31BN2O4 m/z [297,6 (M+1-18) 22%, 279,5 (M+1-2×18) 100%, 261,6 (M+1-3×18) 17%, 313,6 (M-1) 19%, 295,6 (M-1-18) 100%]. Элементный анализ, расчет для C15H31BN2O4×2HCl×2H2O: С, 42,57; Н, 8,81; N, 6,62. Эксперимент С, 41,19; Н, 8,24; N, 6,57.
[0312] Пример 61: Получение 2-амино-6-бороно-2-(2-(1-(4-метоксибензил)циклопропиламино)этил)гексановой кислоты
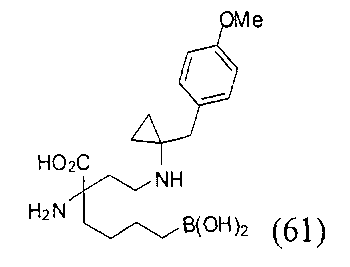
[0313] Дигидрохлорид 2-амино-6-бороно-2-(2-(1-(4-метоксибензил)циклопропиламино)-этил)гексановой кислоты получали аналогично способу, предложенному в Примере 1, с тем исключением, что 1-(4-метоксифенил)циклопропанамин применяли в качестве амина на стадии 6, и реакция проходила с образованием дигидрата. 1Н ЯМР (D2O, 500 МГц) δ 7,26 (d, J=8,0 Гц, 2Н), 6,92 (d, J=8,0 Гц, 2Н), 3,73 (s, 3Н), 3,29-3,249 (m, 1H), 3,11-3,05 (m, 1H), 2,97 (d, J=16,0 Гц, 1H), 2,93 (d, J=16,0 Гц, 1H), 2,07-2,00 (m, 2Н), 1,78-1,73 (m, 1H), 1,67-1,62 (m, 1H), 1,34-1,29 (m, 2Н), 1,27-1,21 (m, 1H), 1,12-1,07 (m, 1H), 1,00 (s, 2Н), 0,94 (s, 2Н), 0,69 (t, J=8,0 Гц, 2Н). ИЭР МС эксперимент C19H31BN2O5 m/z [361,6 (M+1-18) 16%, 343,6 (M+1-2×18) 100%, 325,5 (M+1-3×18) 16%, 377,7 (M-1) 17%, 359,6 (M-1-18) 100%], Элементный анализ, расчет для C19H31BN2O5×2HCl×2H2O: С, 46,84; Н, 7,65; N, 5,75, Эксперимент С, 46,94; Н, 7,58; N, 5,95.
[0314] Пример 62: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4,5-дигидротиено[2,3-с]пиридин-6(7Н)-ил)этил)гексановой кислоты
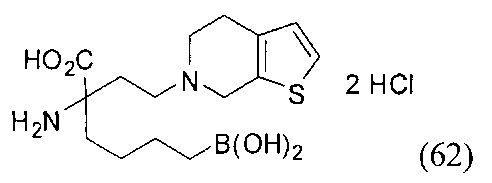
[0315] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4,5-дигидротиено[2,3-с]пиридин-6(7Н)-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4,5,6,7-тетрагидротиено[2,3-с]пиридин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,23 (d, J=5,0 Гц, 1H), 6,86 (d, J=5,0 Гц, 1H), [4,64 (d, J=14,0 Гц), 4,34 (d, J=14,0 Гц), 2Н, система АВ], 3,77-3,73 (m, 1H), 3,55-3,37 (m, 2Н), 3,34-3,26 (m, 1H), 2,99 (brs, 2H), 2,35-2,30 (m, 2Н), 1,88-1,93 (m, 1H), 1,76-1,82 (m, 1H), 1,29-1,39 (m, 3Н), 1,12-1,19 (m, 1H), 0,70 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C15H25BN2O4S m/z [341,5 (M+1) 1%, 323,5 (M+1-18) 12%, 305,5 (M+1-2×18) 100%, 661,9 (2M-1-18) 4%, (339,5 (M-1) 34%, 321,5 (M-1-18) 100%].
[0316] Пример 63: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3-(3,4-дифторфенил)пропиламино)этил)гексановой кислоты
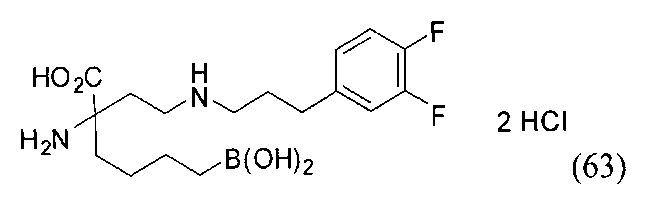
[0317] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(3-(3,4-дифторфенил)-пропиламино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 3-(3,4-дифторфенил)пропан-1-амин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,13-7,00 (m, 2H), 6,95-6,89 (m, 1H), 3,20-3,05 (m, 1H), 3,01-2,91 (m, 3H), 2,60 (t, J=8,0 Гц, 2H), 2,15 (t, J=8,0 Гц, 2H), 1,96-1,73 (m, 4H), 1,36-1,25 (m, 3H), 1,22-1,06 (m, 1H), 0,68 (t, J=7,0 Гц, 2Н). 19F ЯМР -142,00 (d, J=22,0 Гц, 1F), -138,58 (d, J=22,0 Гц, 1F). ИЭР МС эксперимент C17H27BF2N2O4 m/z [355,6 (M+1-18) 20%, 337,6 (M+1-2×18) 90%, 319,5 (M+1-3×18) 100%, 371,6 (M-1) 20%, 353,6 (M-1-18) 100%].
[0318] Пример 64: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3-(2-хлор-5-(трифторметил)фенил)пропиламино)этил)гексановой кислоты
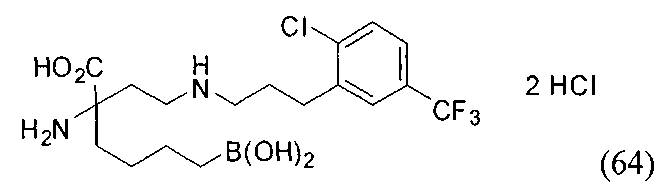
[0319] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(3-(2-хлор-5-(трифторметил)-фенил)пропиламино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 3-(2-хлор-5-(трифторметил)фенил)-пропан-1-амин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,56 (s, 1H), 7,48 (d, J=8,0 Гц, 1H), 7,44 (d, J=8,0 Гц, 1H), 3,19-3,13 (m, 1H), 3,01 (t, J=8,0 Гц, 2H), 2,99-2,95 (m, 1H), 2,79 (t, J=8,0 Гц, 2H), 2,13 (t, J=8,0 Гц, 2H), 1,91 (tt, J=8,0, 8,0 Гц, 2H), 1,87-1,81 (m, 1H), 1,75-1,69 (m, 1H), 1,33-1,25 (m, 3H), 1,15-1,08 (m, 1H), 0,66 (t, J=7,0 Гц, 2H). 19F ЯМР -61,66 (s, 3F). ИЭР МС эксперимент C18H27BC1F3N2O4 m/z [421,6/423,6 (M+1-18) 38%, 403,6/405,6 (M+1-2×18) 75%, 367,6 (M+1-2×18-Cl-) 100%, 437,6/439,7 (M-1) 30%, 419,6/421,6 (M-1-18) 100%, 383,6 (M-1-18-Cl-) 30%].
[0320] Пример 65: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3-(3-метоксифенил)пропиламино)этил)гексановой кислоты
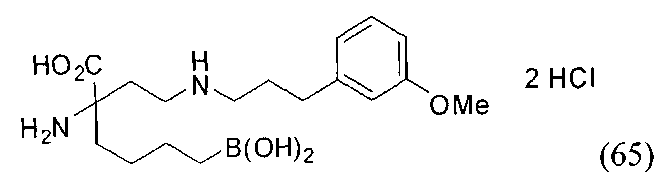
[0321] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(3-(3-метоксифенил)-пропиламино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 3-(3-метоксифенил)пропан-1-амин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,16-7,13 (m, 1H), 6,75-6,71 (m, 3Н), 3,64 (s, 3H), 3,11-3,04 (m, 1H), 2,93-2,83 (m, 3H), 2,53 (t, J=8,0 Гц, 2Н), 2,06 (t, J=8,0 Гц, 2Н), 1,85-1,75 (m, 3H), 1,68-1,60 (m, 1H), 1,27-1,17 (m, 3H), 1,10-1,00 (m, 1H), 0,60 (t, J=8,0 Гц, 2Н). ИЭР МС эксперимент C18H31BN2O5 m/z [389,7 (M+Na+) 5%, 331,6 (M+1-2×18) 70%, 313,6 (M+1-3×18) 100%].
[0322] Пример 66: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(3-(2,4-дихлорфенил)пропиламино)этил)гексановой кислоты
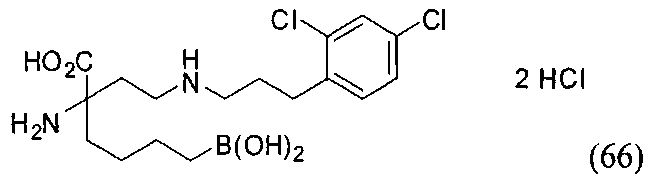
[0323] Дигидрохлорид 2-амино-6-бороно-2-(2-(3-(2,4-дихлорфенил)пропиламино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 3-(2,4-дихлорфенил)пропан-1-амин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,24 (m, 1H), 7,06 (m, 2Н), 3,12-3,06 (m, 1H), 2,95-2,89 (m, 3H), 2,58 (t, J=8,0 Гц, 2Н), 2,11 (t, J=8,0 Гц, 2Н), 1,84-1,74 (m, 3H), 1,70-1,65 (m, 1H), 1,25-1,15 (m, 3H), 1,10-1,00 (m, 1H), 0,56 (t, J=7,0 Гц, 2Н). 13С ЯМР (D2O) δ 23,24, 25,07, 25,10, 29,00, 31,30, 35,05, 42,84, 47,52, 62,48, 125,78, 127,14, 128,84, 131,25, 132,65, 133,84, 136,37, 172,94. ИЭР МС эксперимент C17H27BCl2N2O4 m/z [387,5 (M+1-18) 20%, 369,5 (M+1-2×18) 100%, 385,5 (M-1-18) 100%], Элементный анализ, расчет для C17H27BCl2N2O4: С, 42,67; Н, 6,06; N, 5,85). Эксперимент: С, 42,53; Н, 6,00; N, 5,68.
[0324] Пример 67: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(трет-бутиламино)этил)гексановой кислоты
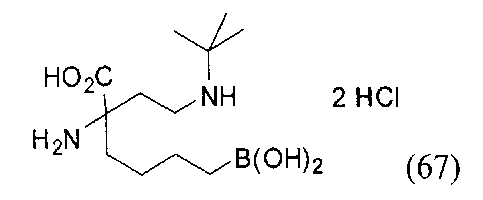
[0325] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(трет-бутиламино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что трет-бутиламин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,11-3,05 (m, 1H), 2,89-2,83 (m, 1H), 2,13-2,06 (m, 2H), 1,86-1,81 (m, 1H), 1,75-1,69 (m, 1H), 1,28-1,22 (m, 3H), 1,17 (s, 9H), 1,09-1,02 (m, 1H), 0,61 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C12H27BN2O4 m/z [239,5 (M+1-2×18) 100%, 255,5 (M-1-18) 90%].
[0326] Пример 68: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(циклопропиламино)этил)гексановой кислоты
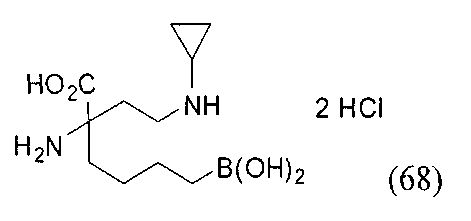
[0327] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(циклопропиламино)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что циклопропанамин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,32-3,25 (m, 1H), 3,14-3,10 (m, 1H), 2,69-2,63 (m, 1H), 2,25-2,16 (m, 2H), 1,90-1,86 (m, 1H), 1,80-1,75 (m, 1H), 1,39-1,24 (m, 3H), 1,15-1,08 (m, 1H), 0,81-0,76 (m, 4H), 0,75-0,68 (m, 2H). ИЭР МС эксперимент C11H23BN2O4 m/z [223,4 (M+1-2×18) 30%, 205,4 (M+1-3×18), 60%, 239,5 (M-1-18) 100%].
[0328] Пример 69: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-метоксибензиламино)этил)гексановой кислоты
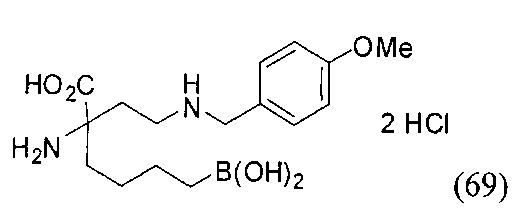
[0329] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-метоксибензиламино)-этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что (4-метоксифенил)метанамин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,28 (d, J=8,0 Гц, 2Н), 6,70 (d, J=8,0 Гц, 2Н), 4,09 (d, J=14,0 Гц, 1H), 4,06 (d, J=14,0 Гц, 1H), 3,69 (s, 3Н), 3,19-3,14 (m, 1H), 3,02-2,96 (m, 1H), 2,16 (t, J=8,0 Гц, 2Н), 1,82-1,77 (m, 1H), 1,72-1,67 (m, 1H), 1,30-1,18 (m, 3H), 1,10-1,02 (m, 1H), 0,61 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C16H27BN2O5 m/z [319,6 (M-1-18) 100%, 321,5 (M+1-18) 60%, 303,6 (M+1-2×18) 100%].
[0330] Пример 70: Получение дигидрохлорида 2-амино-2-(2-(бензиламино)этил)-6-бороногексановой кислоты
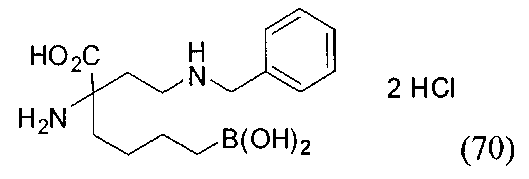
[0331] Моногидрат дигидрохлорида 2-амино-2-(2-(бензиламино)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что бензиламин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,42-7,38 (m, 1H), 7,36-7,32 (m, 4H), 4,13 (s, 2Н), 3,23-3,17 (m, 1H), 3,05-2,99 (m, 1H), 2,18 (t, J=8,0 Гц, 2Н), 1,88-1,78 (m, 1H), 1,74-1,69 (m, 1H), 1,30-1,18 (m, 3H), 1,10-1,06 (m, 1H), 0,63 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C15H25BN2O4 m/z [273,5 (M+1-2×18) 80%, 255,6 (M+1-3×18) 100%].
[0332] Пример 71: Получение тригидрохлорида 2-амино-6-бороно-2-(2-((2-(диметиламино)этил)(метил)амино)этил)гексановой кислоты
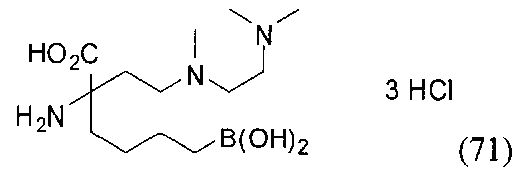
[0333] Тригидрохлорид 2-амино-6-бороно-2-(2-((2-(диметиламино)этил)(метил)амино)-этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что N1,N1,N2-триметилэтан-1,2-диамин применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде моногидрата тригидрохлоридной соли. 1Н ЯМР (D2O, 500 МГц) δ 3,58-3,52 (m, 4H), 3,45-3,39 (m, 1H), 3,27-3,22 (m, 1H), 2,89 (s, 9H), 2,33-2,23 (m, 2Н), 1,92-1,86 (m, 1H), 1,81-1,75 (m, 1H), 1,35-1,29 (m, 3H), 1,18-1,13 (m, 1H), 0,70 (t, J=8,0 Гц, 2Н). ИЭР МС эксперимент C13H30BN3O4 m/z [268,5 (M+1-2×18) 100%, 286,6 (M+1-18) 7%].
[0334] Пример 72: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(циклопентиламино)этил)гексановой кислоты
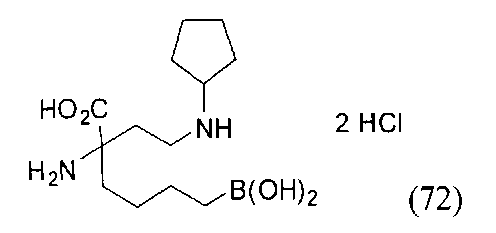
[0335] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(циклопентиламино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что циклопентанамин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,55-3,43 (m, 1H), 3,20-3,13 (m, 1H), 3,03-2,92 (m, 1H), 2,21-2,15 (m, 2H), 2,01-1,92 (m, 2H), 1,90-1,82 (m, 1H), 1,81-1,71 (m, 1H), 1,67-1,57 (m, 2H), 1,55-1,45 (m, 4H), 1,36-1,25 (m, 3H), 1,18-1,08 (m, 1H), 0,60-0,71 (m, 2H). ИЭР МС эксперимент C13H27BN2O4 m/z [251,5 (M+1-2×18) 100%, 233,5 (M+1-3×18) 70%].
[0336] Пример 73: Получение тригидрохлорида 2-амино-2-(2-((2-аминоэтил)(бензил)амино)этил)-6-бороногексановой кислоты
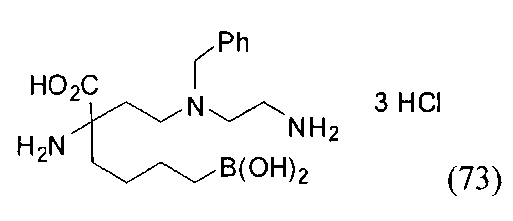
[0337] Тригидрохлорид 2-амино-2-(2-((2-аминоэтил)(бензил)амино)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что трет-бутил-2-(бензиламино)этилкарбамат применяли в качестве амина на стадии 6. Конечное соединение выделяли в виде моногидрата тригидрохлоридной соли. 1Н ЯМР (D2O, 500 МГц) δ 7,50-7,43 (m, 5H), [4,52 (d, J=13,0 Гц, 1H), 4,22 (d, J=13,0 Гц, 1H), система АВ], 3,56-3,50 (m, 1H), 3,46-3,37 (m, 4H), 3,24-3,19 (m, 1H), 2,31 (dt, J1=16,0 Гц, J2=8,0 Гц, 1H), 2,08-1,99 (m, 1H), 1,39-1,22 (m, 2H), 1,14-1,04 (m, 3H), 1,01-0,91 (m, 1H), 0,57 (t, J=6,0 Гц, 2H). ИЭР МС эксперимент C17H30BN3O4 m/z [316,5 (M+1-2×18) 100%, 298,6 (M+1-3×18) 20%, 332,6 (M-1-18) 100%].
[0338] Пример 74: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((4-изопропоксибензил)(метил)амино)этил)гексановой кислоты
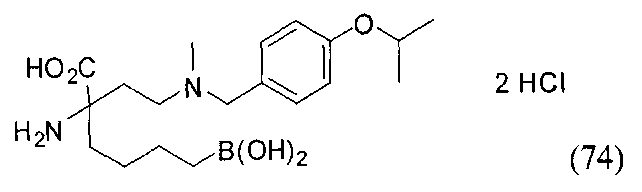
[0339] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-((4-изопропоксибензил)-(метил)амино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(4-изопропоксифенил)-N-метилметанамин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ [7,36 (d, J=9,0 Гц, 2й ротамер), 2Н, 7,34 (d, J=9,0 Гц, 1й ротамер)], 6,99 (d, J=9,0 Гц, 2Н), 4,67-4,61 (m, 1H), [4,30 (d, J=13,0 Гц, 1й ротамер), 4,28 (d, J=13,0 Гц, 2й ротамер), 1H], [4,16 (d, J=13,0 Гц, 1й конформер), 4,09 (d, J=13,0 Гц, 2й конформер), 1H], 3,24-3,14 (m, 1H), [3,05-3,11 (m, 2й ротамер), 2,96-3,01 (m, 1й ротамер), 1H], [2,78 (s, 1й ротамер), 2,73 (s, 2й ротамер), 3Н], 2,31-2,21 (m, 1H), [2,15-2,09 (m, 2й ротамер), 2,04-1,96 (m, 1й ротамер), 1H], 1,32-1,27 (m, 2Н), 1,24 (d, J=6,0 Гц, 6Н), 1,20-1,06 (m, 3Н), 1,01-0,93 (m, 1H), [0,66 (t, J=8,0 Гц, 1й ротамер), 0,58 (t, J=8,0 Гц, 2й ротамер), 2Н]. ИЭР МС эксперимент C19H33BN2O5 m/z [363,6 (M+1-18) 70%, 345,5 (M+1-2×18) 100%].
[0340] Пример 75: Получение дигидрохлорида 2-амино-2-(2-(азетидин-1-ил)этил)-6-бороногексановой кислоты
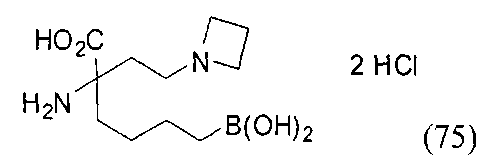
[0341] Моногидрат дигидрохлорида 2-амино-2-(2-(азетидин-1-ил)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что азетидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 4,24-4,15 (m, 2Н), 4,05-3,93 (m, 2Н), 3,39-3,32 (m, 1H), 3,22-3,13 (m, 1H), 2,54-2,41 (m, 1H), 2,39-2,29 (m, 1H), 2,00 (t, J=8,0 Гц, 2Н), 1,88-1,80 (m, 1H), 1,77-1,67 (m, 1H), 1,36-1,23 (m, 3Н), 1,19-1,08 (m, 1H), 0,69 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C11H23BN2O4 m/z [241,5 (M+1-18) 7%, 223,4 (M+1-2×18) 100%].
[0342] Пример 76: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-фенилпиперазин-1-ил)этил)гексановой кислоты
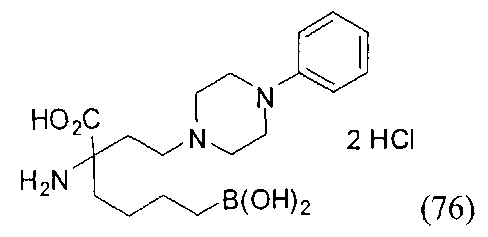
[0343] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-(4-фенилпиперазин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-фенилпиперазин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,31 (t, J=8,0 Гц, 2Н), 7,04 (d, J=8,0 Гц, 2Н), 7,00 (t, J=8,0 Гц, 1Н), 3,44-3,20 (m, 8H), 3,13-3,03 (m, 2Н), 2,25-2,12 (m, 2Н), 1,88-1,79 (m, 1H), 1,77-1,66 (m, 1H), 1,39-1,27 (m, 3H), 1,19-1,11 (m, 1H), 0,71 (t, J=8,0 Гц, 2Н). ИЭР МС эксперимент C18H30BN3O4 m/z [344,5 (M-1-18) 100%, 328,6 (M+1-2×18) 100%].
[0344] Пример 77: Получение тригидрохлорида 2-амино-6-бороно-2-(2-(4-(2-метоксиэтил)пиперазин-1-ил)этил)гексановой кислоты
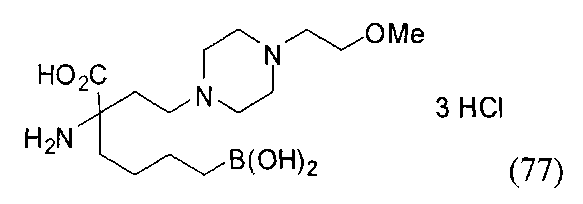
[0345] Моногидрат тригидрохлорида 2-амино-6-бороно-2-(2-(4-(2-метоксиэтил)-пиперазин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 1-(2-метоксиэтил)пиперазин применяли в качестве амина на стадии 6. ИЭР МС эксперимент C15H32BN3O5 m/z [310,6 (M+1-2×18) 89%, 328,6 (M+1-18) 3%, 326,6 (M-1-18) 13%].
[0346] Пример 78: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((2-гидрокси-2-фенилэтил)(метил)амино)этил)гексановой кислоты
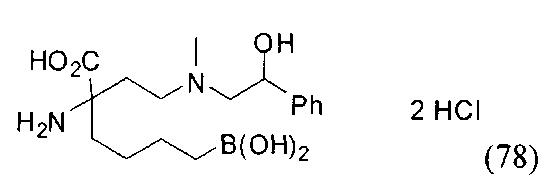
[0347] Моногидрат дигидрохлорида 2-амино-6-бороно-2-(2-((2-гидрокси-2-фенилэтил)-(метил)амино)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 2-(метиламино)-1-фенилэтанол применяли в качестве амина на стадии 6. ИЭР МС эксперимент C17H29BN2O5 m/z [317,5, (M+1-2×18) 20%, 299,5 (M+1-3×18) 100%].
[0348] Пример 79: Получение 2-амино-6-бороно-2-(пиперидин-1-илметил)гексановой кислоты
Стадия 1: диэтил-2-(бензилоксикарбониламино)-2-(бут-3-енил)малонат
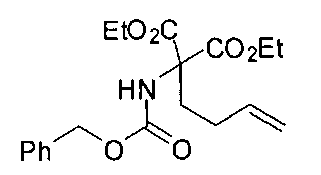
[0349] Суспензию гидрида натрия (510 мг, 21,24 ммоль, 60% суспензия) в диметилформамиде (30 мл) обрабатывали диэтилкарбобензилоксизащищенным аминомалонатом (6,0 г, 19,4 ммоль) в диметилформамиде (30 мл) при 0°С. После перемешивания в течение 30 минут бромбутен (2,89 г, 21,43 ммоль, 1,92 мл) добавляли и полученный раствор нагревали до 90°С и дополнительно перемешивали в течение 4 часов. Реакционную смесь разбавляли этилацетатом (200 мл) и промывали последовательно водой (2×100 мл) и насыщенным водным хлоридом натрия (1×100 мл). После выпаривания органического слоя насухо полученный остаток очищали на системе Combiflash (колонка с 80 г оксида кремния, элюировали 15-50% этилацетатом в гептане) с получением диэтил-2-(бензилоксикарбониламино)-2-(бут-3-енил)малоната (4,8 г, 67%). 1Н ЯМР (CDCl3) δ 7,36 (m, 5H), 7,26-6,93 (m, 1H), 6,20 (bs, 1H), 5,75 (m, 1H), 5,11 (s, 2H), 5,04-4,04 (m, 2H), 4,24 (m, 4H), 2,43 (m, 2H), 1,96-1,93 (m, 2H), 1,27-1,21 (m, 6H). МС эксперимент C19H25NO6, m/z [364 (M+1)].
Стадия 2: 2-(бензилоксикарбониламино)-2-(этоксикарбонил)гекс-5-еновая кислота
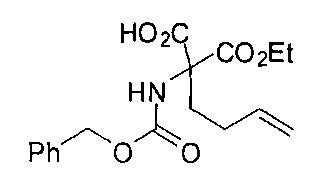
[0350] Раствор диэтил-2-(бензилоксикарбониламино)-2-(бут-3-енил)малоната (4,8 г, 13,23 ммоль) в этаноле (45 мл) охлаждали до -30°С и обрабатывали водным раствором гидроксида калия (1,55 г, 27,76 ммоль в 15 мл воды). После завершения добавления раствор нагревали до 0°С в течение 30 минут, затем до комнатной температуры в течение 1 часа. После завершения реакции смесь подкисляли АсОН (1,8 г) и экстрагировали этилацетатом (1×50 мл). Водный слой подкисляли до рН 3 при помощи 3н. хлороводородной кислоты и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои промывали насыщенным водным хлоридом натрия (1×50 мл), сушили над MgSO4 и концентрировали с получением 2-(бензилоксикарбониламино)-2-(этоксикарбонил)гекс-5-еновой кислоты (3,0 г, 68%). 1Н ЯМР (CDCl3) δ 10,00 (bs, 1H), 7,37 (m, 5H), 7,26-6,93 (m, 1H), 6,21 (bs, 1H), 5,76 (m, 1H), 5,94-5,22 (m, 4H), 4,27 (m, 2H) 2,43 (m, 2H), 1,96-1,93 (m, 2H), 1,27-1,21 (m, 3H). МС эксперимент C17H21NO6 m/z [336 (M+1)].
Стадия 3: этил-2-(бензилоксикарбониламино)-2-(гидроксиметил)гекс-5-еноат
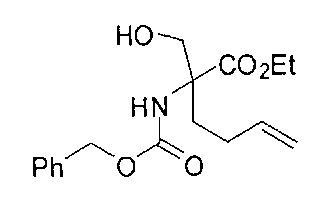
[0351] Раствор 2-(бензилоксикарбониламино)-2-(этоксикарбонил)гекс-5-еновой кислоты (1,54 г, 4,6 ммоль) и триэтиламина (557 мг, 5,52 ммоль, 0,76 мл) в тетрагидрофуране (10 мл) охлаждали до -30°С и обрабатывали этилхлорформиатом (522 мг, 4,82 ммоль, 0,46 мл) и перемешивали в течение 30 минут. Раствор боргидрида натрия (175 мг, 4,6 ммоль) в воде (2 мл) добавляли и смесь перемешивали в течение 30 минут. После завершения реакции 3н. хлороводородную кислоту (1 мл) добавляли и смесь разбавляли этилацетатом (50 мл), промывали водой (1×50 мл) и экстрагировали этилацетатом (1×50 мл). Объединенные органические слои концентрировали и очищали на системе Combiflash (колонки 2×12 г силикагеля, элюировали 10-50% этилацетатом в гептане) с получением этил-2-(бензилоксикарбониламино)-2-(гидроксиметил)гекс-5-еноата (700 мг, 48%). 1Н ЯМР (CDCl3) δ 7,29 (m, 5H), 5,82 (bs, 1H), 5,68-5,62 (m, 1H), 5,03 (s, 1H), 4,94-4,86 (m, 2H), 4,17 (m, 2H) 3,76 (dd, J=11,4 Гц, 1H), 1,97 (m, 2H), 1,77 (m, 2H), 1,21 (t, J=7,2 Гц, 3Н). МС эксперимент C17H23NO5 m/z [322 (M+1)].
Стадия 4: 3-бензил-4-этил-4-(бут-3-енил)-2,2-диметилоксазолидин-3,4-дикарбоксилат
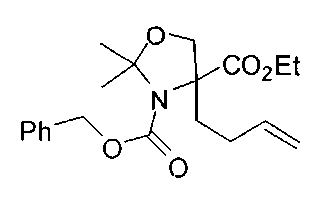
[0352] Раствор этил-2-(бензилоксикарбониламино)-2-(гидроксиметил)гекс-5-еноата (820 мг, 2,55 ммоль) в толуоле (10 мл) обрабатывали 2,2-диметоксипропаном (2 мл) и 4-толуолсульфокислотой (100 мг). Смесь кипятили с обратным холодильником в течение 1 часа, охлаждали, концентрировали и очищали на системе Combiflash (колонка с 12 г силикагеля, элюировали 5-50% этилацетатом в гептане) с получением 3-бензил-4-этил-4-(бут-3-енил)-2,2-диметилоксазолидин-3,4-дикарбоксилата (530 мг, 57%). 1H ЯМР (CDCl3) δ 7,36 (m, 5H), 5,75 (m, 1H), 4,51 (m, 4H), 4,06 (m, 4H) 2,08 (m, 4H), 1,65 (2s, 6H), 1,13 (t, J=7,1 Гц, 3Н). МС эксперимент C20H27NO5 m/z [332 (M+1)].
Стадия 5: 3-бензил-4-этил-2,2-диметил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)оксазолидин-3,4-дикарбоксилат
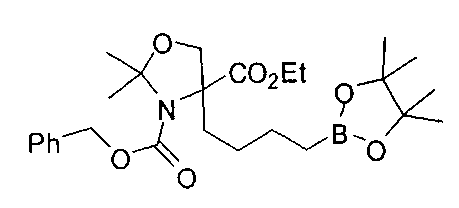
[0353] В атмосфере аргона раствор димера хлор(1,5-циклооктадиен)иридия (I) (15 мг, 0,022 ммоль) и 1,2-бис(дифенилфосфино)этана (18 мг, 0,044 ммоль) в дихлорметане (5 мл) обрабатывали пинаколбораном (225 мг, 1,76 ммоль, 0,26 мл) и перемешивали в течение 15 минут. К этой смеси добавляли раствор 3-бензил-4-этил-4-(бут-3-енил)-2,2-диметилоксазолидин-3,4-дикарбоксилата (530 мг, 1,47 ммоль) в дихлорметане (5 мл). После перемешивания в течение 19 часов при комнатной температуре раствор концентрировали и очищали на системе Combiflash (колонка 24 г, элюировали 5-50% этилацетатом в гептане) с получением 3-бензил-4-этил-2,2-диметил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)оксазолидин-3,4-дикарбоксилата (470 мг, 65%). 1Н ЯМР (CDCl3) δ: 7,22 (m, 5H), 5,01 (m, 2H), 3,91 (m, 4H), 2,20-2,01 (m, 1H), 1,75 (m, 1H), 1,51 (2s, 6H), 1,29 (m, 4H), 1,16 (s, 12H), 1,02 (t, J=7,2 Гц, 3Н), 0,69 (t, 2H). МС эксперимент C26H40BNO7 m/z [490 (M+1), 522 (M+Na)].
Стадия 6: этил-2-(бензилоксикарбониламино)-2-(гидроксиметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
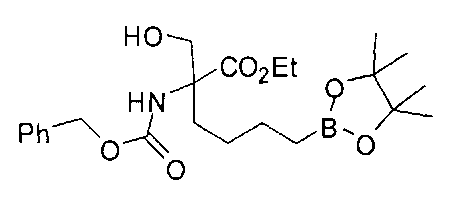
[0354] В атмосфере аргона раствор 3-бензил-4-этил-2,2-диметил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)оксазолидин-3,4-дикарбоксилата (350 мг, 0,72 ммоль) в дихлорметане (5 мл) охлаждали до -40°С и осторожно обрабатывали триметилсилилтрифторметансульфонатом (1,09 г, 4,29 ммоль, 0,94 мл). После перемешивания в течение 30 минут раствор нагревали до 0°С и дополнительно перемешивали в течение 2 часов, концентрировали и очищали на системе Combiflash (колонка с 12 г силикагеля, элюировали 20-100% этилацетатом в гептане) с получением этил-2-(бензилоксикарбониламино)-2-(гидроксиметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (180 мг, 56%). 1Н ЯМР (CDCl3) δ 7,38-7,31 (m, 5H), 5,81 (bs, 1H), 5,10 (s, 2H), 4,25-4,23 (m, 3Н), 3,84 (d, 1H), 2,84 (m, 1H), 1,76-1,68 (m, 1H), 1,41-1,35 (m, 2H), 1,28 (t, 3Н), 1,23 (s, 12H), 1,11-1,03 (m, 1H), 1,29 (m, 4H), 0,75 (t, 2H). MC эксперимент C23H36BNO7 m/z [450 (M+1)].
Стадия 7: этил-2-(бензилоксикарбониламино)-2-формил-6-(4,4,5,5-тетраметил-1,3,2-диоксаоборолан-2-ил)гексаноат
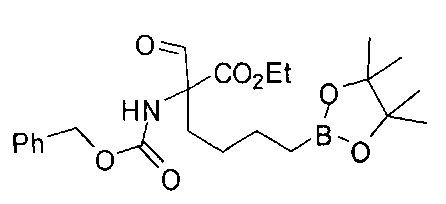
[0355] В атмосфере аргона раствор оксалилхлорида (1,56 г, 12,4 ммоль, 0,98 мл) в дихлорметане (15 мл) охлаждали до -78°С и обрабатывали диметилсульфоксидом (1,94 г, 1,8 мл, 24,84 ммоль) и перемешивали в течение 10 минут. В полученную смесь добавляли этил-2-(бензилоксикарбониламино)-2-(гидроксиметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат (2,79 г, 6,21 ммоль) в безводном дихлорметане (15 мл) и смесь перемешивали в течение 30 минут. Реакцию гасили путем добавления триэтиламина (3,76 г, 5,2 мл, 37,26 ммоль) при -78°С и медленно нагревали реакционную смесь до комнатной температуры. Смесь разбавляли дихлорметаном (25 мл) и промывали последовательно водой (2×25 мл) и насыщенным водным хлоридом натрия (25 мл). Органический слой сушили над сульфатом магния, фильтровали и выпаривали насухо. Полученный остаток очищали на системе Combiflash (40 г колонка, элюировали 20-40% этилацетатом в гептане) с получением этил-2-(бензилоксикарбониламино)-2-формил-6-(4,4,5,5-тетраметил-1,3,2-диоксаоборолан-2-ил)гексаноата (2,4 г, 86%). 1Н ЯМР (CDCl3) δ: 9,49 (s, 1H), 7,28 (m, 5H), 5,85 (bs, 1H), 5,03 (s, 2H), 4,17, 2,17-2,09 (m, 2H), 1,38-1,28 (m, 4H), 1,25-1,20 (m, 5H), 1,19 (s, 12H), 0,68 (t, J=7,8 Гц, 2H). MC эксперимент C23H34BNO7 w/z [471 (M+Na)].
Стадия 8: этил-2-(бензилоксикарбониламино)-2-(пиперидин-1-илметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
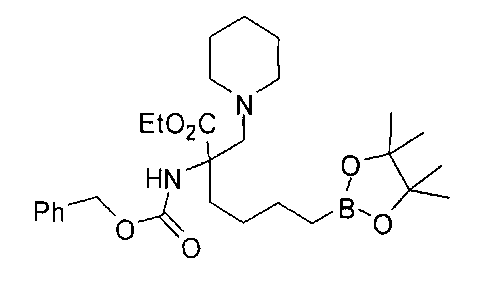
[0356] Раствор этил-2-(бензилоксикарбониламино)-2-формил-6-(4,4,5,5-тетраметил-1,3,2-диоксаоборолан-2-ил)гексаноата (0,503 г, 1,13 ммоль), пиперидина (0,39 мл, 4 ммоль) и уксусной кислоты (0,23 мл, 4 ммоль) в 1,2-дихлорэтане (20 мл) перемешивали в течение 15 минут, затем обрабатывали триацетоксиборгидридом натрия (0,85 г, 4 ммоль). После перемешивания в течение 2 часов при 65°С раствор охлаждали до комнатной температуры и концентрировали. Полученный остаток очищали на системе Combiflash (колонка с 12 г силикагеля, 10-100% этилацетат в гептане) с получением этил-2-(бензилоксикарбониламино)-2-(пиперидин-1-илметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (300 мг, 52%). 1Н ЯМР (CDCl3) δ: 7,36 (m, 5H), 6,05 (bs, 1H), 5,14 (d, 1H), 5,03 (d, J=11,2 Гц, 1H), 4,19 (m, 2H), 3,06 (d, J=13,8 Гц, 1Н,), 2,59 (d , J=13,8 Гц, 1H), 2,34 (m, 4H), 2,15 (m, 1H), 1,78-1,70 (m, 1H), 1,45-1,25 (m, 12H), 1,22 (s, 12H), 1,02 (m, 1H), 0,73 (t, J=7,8 Гц, 2H). МС эксперимент C28H45BN2O7 m/z [517 (M+1)].
Стадия 9: дигидрохлорид 2-амино-6-бороно-2-(пиперидин-1-илметил)гексановой кислоты
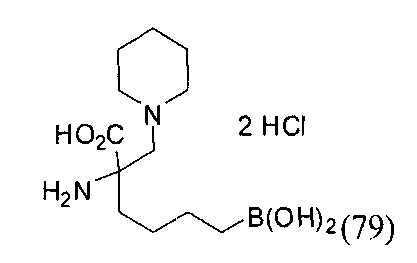
[0357] Раствор этил-2-(бензилоксикарбониламино)-2-(пиперидин-1-илметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (0,26 г, 0,51 ммоль) в 6н. HCl (20 мл) осторожно кипятили с обратным холодильником в течение 48 часов. После охлаждения до комнатной температуры раствор промывали дихлорметаном (5×15 мл) и концентрировали (водный слой). Полученный остаток растворяли в воде (3 мл) и пропускали через катионообменную смолу Dowex 50-200, элюируя 2н. аммиаком (4 г смолы помещали в колонку, промывали последовательно водой, 1н. HCl до нейтрального рН, 2н. раствором аммиака и водой до нейтрального рН). Фракции, содержащие продукт, концентрировали, разбавляли минимальным количеством воды, подкисляли 6н. HCl, замораживали и лиофилизировали с получением дигидрохлорида 2-амино-6-бороно-2-(пиперидин-1-илметил)гексановой кислоты (60 мг, 43%). 1Н ЯМР (D2O) δ 3,64-3,53 (m, 1H), 3,34 (d, J=13,9 Гц, 1H), 3,05-3,03 (m, 2Н), 2,93-2,91 (m, 3H), 1,76-1,67 (m, 5H), 1,53-1,46 (m, 3H), 1,31-1,30 (m, 3H), 1,09-1,07 (m, 1H), 0,70 (t, J=7,3 Гц, 2Н). МС эксперимент C12H25BN2O4 m/z [254 (M-18+1)].
[0358] Пример 80: Получение тригидрохлорида 2-амино-6-бороно-2-((4-метилпиперазин-1-ил)метил)гексановой кислоты
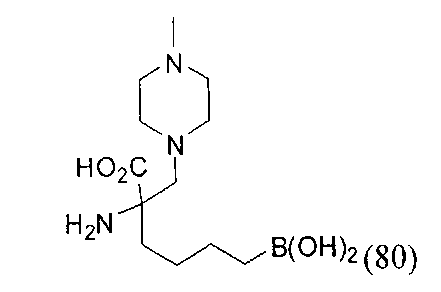
[0359] Тригидрохлорид 2-амино-6-бороно-2-((4-метилпиперазин-1-ил)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 79, с тем исключением, что 1-метилпиперазин применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде тригидрохлоридной соли. 1Н ЯМР (D2O) δ 2,93 (d, J=14,2 Гц, 1Н), 2,64 (bs 1H), 2,50 (d, J=14,3 Гц, 1H), 2,33 (s, 3H), 1,77-1,65 (m, 1H), 1,50-1,43 (m, 1H), 1,33-1,30 (m, 3H), 1,15-1,05 (m, 1H), 0,69 (t, J=8,2 Гц, 2Н). МС эксперимент C12H26BN3O4 m/z [270 (M-18+1)].
[0360] Пример 81: Получение дигидрохлорида 2-амино-6-бороно-2-(морфолинометил)гексановой кислоты
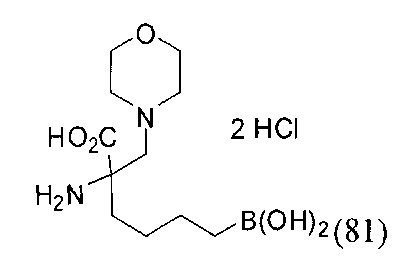
[0361] Дигидрохлорид 2-амино-6-бороно-2-(морфолинометил)гексановой кислоты получали аналогично способу, предложенному в Примере 79, с тем исключением, что морфолин применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1H ЯМР (D2O) δ 3,65 (m, 4H), 2,95 (d, J=14,3 Гц, 1H), 2,62-2,56 (m, 2Н), 2,49 (d, J=14,4 Гц, 1H), 2,47-2,41 (m, 2Н), 1,80-1,70 (m, 1H), 1,54-1,47 (m, 1H), 1,34-1,32 (m, 3H), 1,16-1,12 (m, 1H), 0,72 (t, J=8,1 Гц, 2Н). МС эксперимент C12H23BN2O5 m/z [257,1 (M-18+1)].
[0362] Пример 82: Получение гидрохлорида 2-амино-6-бороно-2-(гидроксиметил)гексановой кислоты
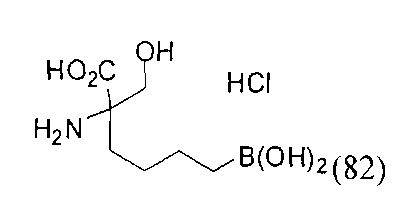
[0363] Гидрохлорид 2-амино-6-бороно-2-(гидроксиметил)гексановой кислоты получали аналогично способу, предложенному в Примере 79, с тем исключением, что на стадии 8 боргидрид натрия применяли вместо триацетоксиборгидрида натрия, а амин не применяли. Конечное соединение выделяли в виде гидрохлоридной соли. 1Н ЯМР (D2O) δ 3,81 (d, J=12,0 Гц, 1Н), 3,55 (d, J=12,0 Гц, 1Н), 1,73-1,52 (m, 2H), 1,39-1,06 (m, 4H), 0,67 (t, J=7,4 Гц, 2H). MC эксперимент C7H16BNO5 m/z [188,1 (M-18+1)].
[0364] Пример 83: Получение дигидрохлорида 2-амино-6-бороно-2-((пропиламино)метил)гексановой кислоты
Стадия 1: диэтил-2-(бут-3-енил)-2-(трет-бутоксикарбониламино)малонат
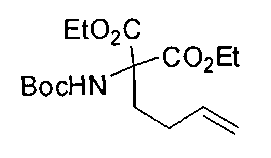
[0365] В суспензию гидрида натрия (8,7 г, 218 ммоль, 60% суспензия) в диметилформамиде (250 мл) при 0°С добавляли диэтил-2-(трет-бутоксикарбониламино)-малонат (50,0 г, 182 ммоль) в диметилформамиде (250 мл). После перемешивания в течение 30 минут 4-бромбут-1-ен (29,5 г, 218 ммоль, 22,2 мл) добавляли и смесь нагревали до 90°С. После дополнительного перемешивания в течение 4 часов раствор охлаждали до комнатной температуры и растворители удаляли путем выпаривания. Полученный остаток разбавляли этилацетатом (1,0 л), промывали последовательно водой (2×250 мл), насыщенным водным хлоридом натрия (1×200 мл) и концентрировали. Очистка на системе Combiflash (колонка с 330 г силикагеля, элюировали 15-50% этилацетатом в гептане) приводила к получению диэтил-2-(бут-3-енил)-2-(трет-бутоксикарбониламино)малоната (54 г, 90%). 1Н ЯМР (CDCl3) δ 5,92 (bs, 1Н), 5,79-5,71 (m, 1Н), 5,03-4,93 (m, 2H), 4,24-4,19 (m, 4H), 2,36 (m, 2H), 1,96-1,93 (m, 2H), 1,42 (s, 9H), 1,27-1,24 (m, 6H).
Стадия 2: 2-(трет-бутоксикарбониламино)-2-(этоксикарбонил)гекс-5-еновая кислота
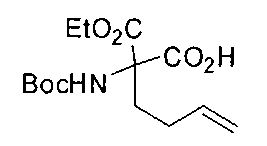
[0366] Раствор диэтил-2-(бут-3-енил)-2-(трет-бутоксикарбониламино)малоната (10,0 г, 30,4 ммоль) в этаноле (100 мл) охлаждали до 0°С и обрабатывали водным гидроксидом натрия (1н., 31 мл). После перемешивания в течение 30 минут охлаждающую баню удаляли и перемешивание продолжали в течение еще 19 часов. Растворитель удаляли путем выпаривания, полученный остаток разбавляли водой (150 мл) и промывали этилацетатом (2×100 мл). Водный слой подкисляли концентрированной хлороводородной кислотой до рН 2 и экстрагировали этилацетатом (2×150 мл). Объединенные органические слои промывали насыщенным водным хлоридом натрия (1×100 мл), сушили над MgSO4, фильтровали и концентрировали с получением 2-(трет-бутоксикарбониламино)-2-(этоксикарбонил)гекс-5-еновой кислоты (8,2 г, 82%). 1H ЯМР (CDCl3) δ 5,87-5,75 (m, 1H), 5,06-5,02 (m, 2H), 4,26 (m, 2H), 2,34 (m, 2H), 1,96-1,93 (m, 2H), 1,43 (s, 9H), 1,29 (m, 3Н).
Стадия 3: этил-2-(трет-бутоксикарбониламино)-2-(гидроксиметил)гекс-5-еноат
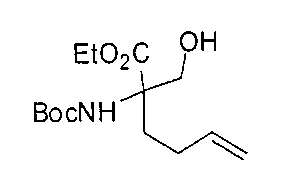
[0367] Раствор 2-(трет-бутоксикарбониламино)-2-(этоксикарбонил)гекс-5-еновой кислоты (7,5 г, 24,9 ммоль) и триэтиламина (3,01 г, 29,9 ммоль, 4,15 мл) в ТГФ (10 мл) охлаждали до -40°С и обрабатывали этилхлорформиатом (2,97 г, 27,4 ммоль, 2,65 мл). После перемешивания в течение 30 минут осадок (гидрохлорид триэтиламина) удаляли путем фильтрования, фильтрат собирали и охлаждали до -40°С. Раствор боргидрида натрия (950 мг, 24,9 ммоль) в воде (10 мл) добавляли и полученный раствор перемешивали в течение 30 минут. Реакцию гасили 3н. хлороводородной кислотой (5 мл), после чего смесь разбавляли этилацетатом (150 мл), промывали водой (1×50 мл) и экстрагировали этилацетатом (1×150 мл). Объединенные органические слои концентрировали, сушили над MgSO4, фильтровали и очищали на системе Combiflash (колонка с 80 г силикагеля, элюировали 10-50% этилацетатом в гептане) с получением этил-2-(трет-бутоксикарбониламино)-2-(гидроксиметил)гекс-5-еноата (5,6 г, 78%). 1Н ЯМР (CDCl3) δ 5,71-5,62 (m, 1H), 5,52 (bs, 1H), 4,96-4,87 (m, 2H), 4,20-4,12 (m, 2H) 4,07-4,03 (m, 2H), 3,73 (d, J=12,0 Гц, 1H), 2,22-1,62 (m, 4H), 1,37 (m, 9H), 1,22 (t, J=7,2 Гц, 3Н).
Стадия 4: этил-2-(ацетоксиметил)-2-(трет-бутоксикарбониламино)гекс-5-еноат
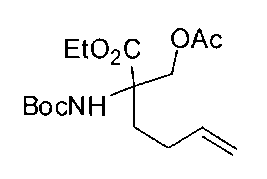
[0368] Раствор этил-2-(трет-бутоксикарбониламино)-2-(гидроксиметил)гекс-5-еноата (10,0 г, 35 ммоль) и диметиламинопиридина (4,48 г, 35 ммоль) в дихлорметане (100 мл) обрабатывали уксусным ангидридом и перемешивали при комнатной температуре в течение ночи. Раствор концентрировали и полученный остаток очищали на системе Combiflash (89 г колонка, элюировали 20-50% этилацетатом в гептане) с получением этил-2-(ацетоксиметил)-2-(трет-бутоксикарбониламино)гекс-5-еноата (10 г, 80%). 1Н ЯМР (CDCl3) δ 5,78-5,68 (m, 1H), 5,55 (bs, 1H), 5,03-4,93 (m, 2H), 4,73 (d, J=11,0 Гц, 1Н) 4,32 (d, J=11,0 Гц, 1H,), 4,20 (q, J=7,2 Гц, 2H), 2,36 (m, 1H), 2,07-2,05 (m, 1H), 2,02 (s, 3H), 1,89-1,75 (m, 2H), 1,43 (m, 9H), 1,27 (t, J=7,2 Гц, 3H). MC эксперимент C16H27NO6 m/z [330 (М+1)].
Стадия 5: этил-2-(ацетоксиметил)-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
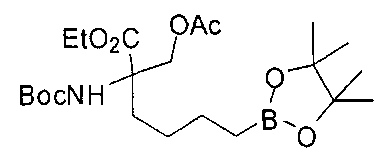
[0369] В атмосфере аргона раствор димера хлор(1,5-циклооктадиен)иридия (I) (160 мг, 0,23 ммоль) и 1,2-бис(дифенилфосфино)этана (190 мг, 0,48 ммоль) в дихлорметане (50 мл) обрабатывали пинаколбораном (7,78 г, 61 ммоль, 8,8 мл) и перемешивали в течение 15 минут. В эту смесь добавляли раствор этил-2-(ацетоксиметил)-2-(трет-бутоксикарбониламино)гекс-5-еноата (10 г, 30,4 ммоль) в дихлорметане (50 мл). После перемешивания в течение 19 часов при комнатной температуре раствор концентрировали и очищали на системе Combiflash (120 г колонка, элюировали 5-50% этилацетатом в гептане) с получением этил-2-(ацетоксиметил)-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (7,5 г, 54%). 1Н ЯМР (CDCl3) δ 5,49 (bs, 1H), 4,72 (d, 1H), 4,33 (d, 1H), 4,23 (q, 2H), 2,18 (m, 1H), 2,01 (s, 3H), 1,69 (m, 2H), 1,43 (s, 9H), 1,29 (m, 4H), 1,23 (s, 12H), 0,88 (t, 3H), 0,74 (t, 2H). MC эксперимент C22H40BNO8 m/z [480 (M+Na)].
Стадия 6: этил-2-(трет-бутоксикарбониламино)-2-(гидроксиметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
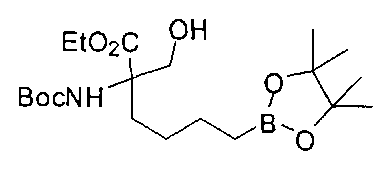
[0370] Раствор этил-2-(ацетоксиметил)-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (12,0 г, 26,3 ммоль) в этаноле (100 мл) обрабатывали твердым карбонатом калия (3,62 г, 26,3 ммоль) и перемешивали в течение 2 часов. Раствор фильтровали, фильтрат выпаривали насухо. Полученный остаток растворяли в этилацетате (150 мл) и промывали последовательно водой (50 мл) и насыщенным водным хлоридом натрия (50 мл). Органический слой концентрировали и очищали на системе Combiflash (120 г колонка, элюировали 20-30% этилацетатом в гептане) с получением этил-2-(трет-бутоксикарбониламино)-2-(гидроксиметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (7,0 г, 78%). 1H ЯМР (CDCl3) δ 5,25 (bs, 1Н), 4,00 (m, 2H), 3,91 (d, J=11,3 Гц, 1Н), 3,60 (d, J=11,3 Гц, 1Н), 1,53-1,46 (m, 1H), 1,23 (s, 9H), 1,21-1,15 (m, 1Н), 1,06 (m, 7H), 1,03 (s, 12H), 0,90 (m, 1Н), 0,54 (t, J=7,8 Гц, 2H). МС эксперимент С20Н38ВНО7 m/z [438 (M+Na)].
Стадия 7: этил-2-(трет-бутоксикарбониламино)-2-формил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
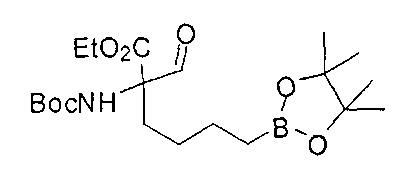
[0371] В атмосфере аргона раствор оксалилхлорида (1,46 г, 0,88 мл, 11,6 ммоль) в дихлорметане (15 мл) охлаждали до -78°С и обрабатывали диметилсульфоксидом (1,8 г, 1,64 мл, 23,2 ммоль) и перемешивали в течение 10 минут. В эту смесь добавляли этил-2-(трет-бутоксикарбониламино)-2-(гидроксиметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат (2,4 г, 5,78 ммоль) в безводном дихлорметане (15 мл) и смесь перемешивали в течение 30 минут. Реакцию гасили путем добавления триэтиламина (3,5 г, 4,8 мл, 34,7 ммоль) при -78°С и медленно нагревали реакционную смесь до комнатной температуры. Смесь разбавляли дихлорметаном (25 мл) и промывали последовательно водой (2×25 мл) и насыщенным водным хлоридом натрия (25 мл). Органический слой сушили над сульфатом магния, фильтровали и выпаривали насухо. Полученный остаток очищали на системе Combiflash (40 г колонка, элюировали 20-40% этилацетатом в гептане) с получением этил-2-(трет-бутоксикарбониламино)-2-формил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (1,35 г, 57%). 1Н ЯМР (CDCl3) δ 9,58 (s, 1Н), 5,64 (bs, 1Н), 4,25 (m, 2H), 2,13 (m, 2H), 1,45 (m, 9H), 1,28 (m, 4H), 1,24 (s, 12H), 0,88 (t, J=6,4 Гц, 3Н), 0,77 (t, J=7,9 Гц, 2H). МС эксперимент C20H36BNO7 m/z [436 (M+Na)].
Стадия 8: этил-2-(трет-бутоксикарбониламино)-2-((пропиламино)метил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
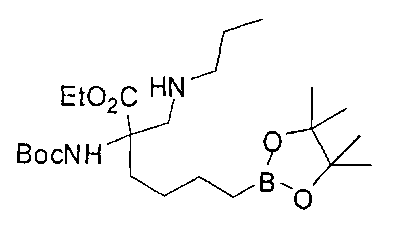
[0372] Суспензию этил-2-(трет-бутоксикарбониламино)-2-формил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (172 мг, 0,42 ммоль) и пропиламина (40 мкл, 0,49 ммоль, 1,3 экв.) в 1,2-дихлорэтане (3 мл) обрабатывали триацетоксиборгидридом натрия (352 мг, 1,66 ммоль, 4 экв.). Уксусную кислоту (2 капли, примерно 3-5 экв.) добавляли и смесь перемешивали при комнатной температуре в течение 17 часов, затем при 60°С в течение 1 часа. После завершения реакции насыщенный водный бикарбонат натрия добавляли и раствор экстрагировали дихлорметаном. Органические экстракты промывали насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем флэш-хроматографии (0-60% этилацетат в гексане) приводила к получению этил-2-(трет-бутоксикарбониламино)-2-((пропиламино)метил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде маслянистой жидкости (66 мг, 34%). 1Н ЯМР (CDCl3, 400 МГц) δ 4,16 (m, 2Н), 3,5-3,3 (m, 2H), 3,2 (br m, 2H), 2,9 (m, 1H), 1,8-1,6 (m, 4H), 1,5-1,4 (m, 2H), 1,38 (s, 9H), 1,36-1,3 (m, 3H), 1,22 (t, J=7,2 Гц, 3Н), 1,18 (s, 12Н), 1,05 (m, 1H), 0,75 (t, J=7,4 Гц, 3H), 0,68 (t, J=7,5 Гц, 2H). ИЭР+ МС: наблюдаемое m/z 457 (M+Н)+.
Стадия 9: 2-амино-6-бороно-2-((пропиламино)метил)гексановая кислота
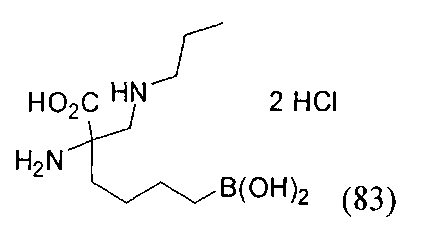
[0373] Раствор этил-2-(трет-бутоксикарбониламино)-2-((пропиламино)метил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (66 мг, 0,14 ммоль) в 6н. HCl (5 мл) и 1,4-диоксане (1 мл) нагревали при 100°С в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (5×25 мл). Водный слой замораживали (сухой лед/ацетон) и лиофилизировали с получением 2-амино-6-бороно-2-((пропиламино)метил)гексановой кислоты в виде дигидрохлоридной соли (40 мг). 1Н ЯМР (D2O, 400 МГц) δ 3,33 (dAB, JAB=13,7 Гц, 1H), 3,21 (dAB, JAB=13,7 Гц, 1H), 2,91-2,78 (m, 2H), 1,88-1,75 (m, 1H), 1,70-1,60 (m, 1H), 1,54-1,38 (m, 2H), 1,24-1,08 (m, 3H), 1,05-0,92 (m, 1H), 0,75-0,61 (m, 3H), 0,55-0,45 (m, 2H). ИЭР+ МС: наблюдаемое m/z 229,1 (M-18+Н)+, 211,1 (M-36+Н)-, ИЭР- МС: 227,1 (M-18-1)-.
[0374] Пример 84: Получение 2-амино-2-((бензиламино)метил)-6-бороногексановой кислоты
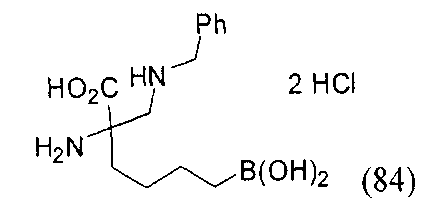
[0375] Дигидрохлорид 2-амино-2-((бензиламино)метил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что бензиламин применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 7,47-7,27 (m, 5H), 3,85 (dAB, JAB=13,4 Гц, 1Н), 3,80 (dAB, JAB=13,4 Гц, 1H), 3,05 (dAB, JAB=13,2 Гц, 1Н), 2,69 (dAB, JAB=13,2 Гц, 1Н), 1,76-1,64 (m, 1Н), 1,58-1,46 (m, 1Н), 1,37-1,18 (m, 3H), 1,17-1,02 (m, 1Н), 0,68 (t, J=7,8 Гц, 2Н). ИЭР+ МС: наблюдаемое m/z 277,1 (M-18+H)+, 259,1 (M-36+H)+, ИЭР-МС: 275,1 (М-18-1)-.
[0376] Пример 85: Получение дигидрохлорида 2-амино-6-бороно-2-(((R)-2-гидроксипропиламино)метил)гексановой кислоты
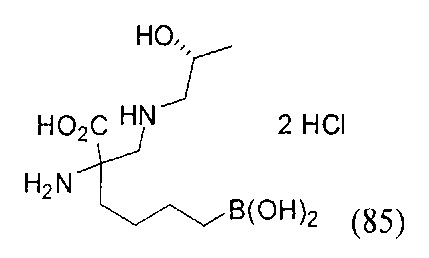
[0377] Дигидрохлорид 2-амино-6-бороно-2-(((R)-2-гидроксипропиламино)метил)-гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что (R)-1-аминопропан-2-ол применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 3,89-3,80 (m, 1Н), 3,70-3,40 (m, 4H), 3,31 (dAB, JAB=12,7 Гц, 1Н), 2,05-1,93 (m, 1Н), 1,87-1,74 (m, 1Н), 1,48-1,35 (m, 3H), 1,33-1,18 (m, 3H), 0,77 (t, J=7,8 Гц, 2Н). ИЭР+ МС: наблюдаемое m/z 227,1 (M-36+H)+, 243,1 (M-18-1)-.
[0378] Пример 86: Получение дигидрохлорида 2-амино-6-бороно-2-((бутиламино)метил)гексановой кислоты
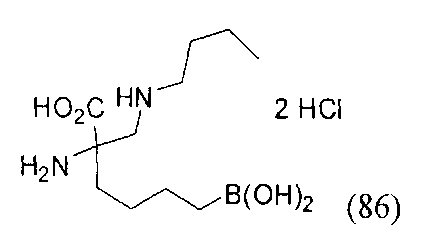
[0379] Дигидрохлорид 2-амино-6-бороно-2-((бутиламино)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что бутан-1-амин применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 3,38 (dAB, JAB=13,8 Гц, 1Н), 3,24 (dAB, JAB=13,8 Гц, 1Н), 3,10-2,94 (m, 2H), 1,92-1,82 (m, 1Н), 1,75-1,65 (m, 1H), 1,65-1,53 (m, 2H), 1,40-1,21 (m, 4H), 1,22-1,08 (m, 1Н), 0,68 (t, J=7,2 Гц, 2H). ИЭР+ МС: наблюдаемое m/z 243,1 (M-18+H)+ 225,1 (M-36+Н)+, ИЭР-МС: 241,1 (M-18-1)-.
[0380] Пример 87: Получение дигидрохлорида 2-амино-6-бороно-2-((тетрагидро-2Н-пиран-4-иламино)метил)гексановой кислоты
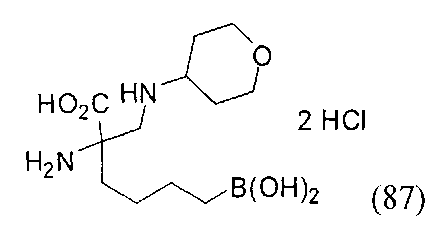
[0381] Дигидрохлорид 2-амино-6-бороно-2-((тетрагидро-2Н-пиран-4-иламино)метил)-гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что тетрагидро-2Н-пиран-4-амин применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 4,02-3,92 (m, 2H), 3,48-3,28 (m, 5H), 2,03-1,82 (m, 3H), 1,75-1,58 (m, 3H), 1,38-1,26 (m, 3Н), 1,20-1,10 (m, 1Н), 0,68 (t, J=7,2 Гц, 2H). ИЭР+ МС: м m/z 271,1 (M-18+Н)+, 253,1 (M-36+Н)+, ИЭР-МС: 269,1 (M-18-1)-.
[0382] Пример 88: Получение дигидрохлорида 2-амино-6-бороно-2-(((S)-1-гидрокси-4-метилпентан-2-иламино)метил)гексановой кислоты
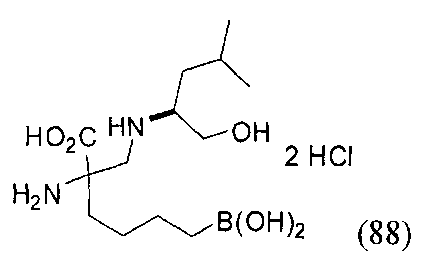
[0383] Дигидрохлорид 2-амино-6-бороно-2-(((S)-1-гидрокси-4-метилпентан-2-иламино)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что (R)-2-амино-4-метилпентан-1-ол применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 3,87-3,70 (m, 1Н), 3,65-3,48 (m, 1Н), 3,46-3,40 (m, 1H), 3,39-3,33 (m, 1H), 3,33-3,27 (m, 1H), 3,24 (dAB, JAB=13,8 Гц, 1H), 1,95-1,85 (m, 1H), 1,77-1,65 (m, 1H), 1,62-1,52 (m, 1H), 1,50-1,40 (m, 2H), 1,39-1,27 (m, 3H), 1,20-1,08 (m, 1H), 0,86-0,78 (m, 6H), 0,68 (t, J=7,4 Гц, 2H). ИЭР+ MC: наблюдаемое m/z 269,1 (M-36+H)+,285,1 (M-18-1)-.
[0384] Пример 89: Получение дигидрохлорида 2-амино-6-бороно-2-(((1R,2S)-2-гидрокси-1,2-дифенилэтиламино)метил)гексановой кислоты
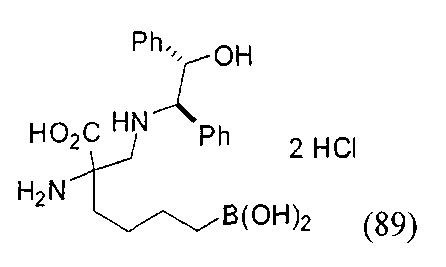
[0385] Дигидрохлорид 2-амино-6-бороно-2-(((1R,2S)-2-гидрокси-1,2-дифенилэтиламино)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что (1S,2R)-2-амино-1,2-дифенилэтанол применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 7,46-7,00 (m, 10Н), 5,37-5,04 (m, 1H), 4,57-4,46 (m, 1H), 3,35-2,85 (m, 2H), 1,96-1,82 (m, 1H), 1,76-1,60 (m, 1H), 1,56-1,44 (m, 1H), 1,39-1,26 (m, 2H), 1,26-0,87 (m, 2H), 0,74-0,56 (m, 2Н). ИЭР+ MC: наблюдаемое m/z 383,1 (M-18+Н)+, 365,1 (M-36+Н)+, ИЭР-MC: 381,1 (M-18-1)-.
[0386] Пример 90: Получение дигидрохлорида 2-амино-6-бороно-2-(((S)-1-фенилэтиламино)метил)гексановой кислоты
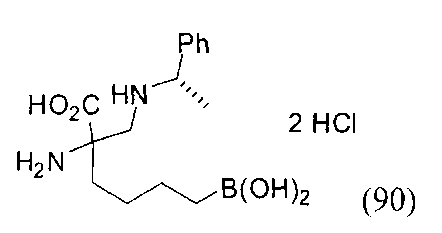
[0387] Дигидрохлорид 2-амино-6-бороно-2-(((S)-1-фенилэтиламино)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что (S)-1-фенилэтанамин применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 7,48-7,32 (m, 5H), 4,50-4,37 (m, 1H), 3,30-3,12 (m, 1H), 3,08-2,98 (m, 1H), 1,92-1,70 (m, 1H), 1,68-1,54 (m, 4H), 1,37-1,17 (m, 3H), 1,18-0,96 (m, 1H), 0,73-0,55 (m, 2H). ИЭР+ MC: наблюдаемое m/z 291,1 (M-18+H)+.
[0388] Пример 91: Получение дигидрохлорида 2-амино-6-бороно-2-(((R)-1-гидроксипропан-2-иламино)метил)гексановой кислоты
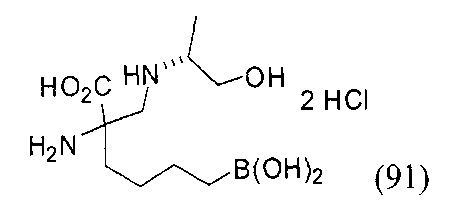
[0389] Дигидрохлорид 2-амино-6-бороно-2-(((R)-1-гидроксипропан-2-иламино)метил)-гексановой кислоты получали аналогично способу, предложенному в Примере 83, с тем исключением, что (R)-2-аминопропан-1-ол применяли в качестве амина на стадии 8. Конечное соединение выделяли в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 400 МГц) δ 4,07-3,87 (m, 2H), 3,80-3,71 (m, 1H), 3,51-3,27 (m, 2H), 3,17-3,02 (m, 1H), 2,99-2,80 (m, 1H), 1,95-1,81 (m, 1H), 1,79-1,65 (m, 1H), 1,45-1,35 (m, 1H), 1,32-1,18 (m, 2H), 1,15-0,90 (m, 3H), 0,61 (t, J=7,2 Гц, 2H). ИЭР+ МС: наблюдаемое m/z 227,1 (M-36+H)+.
[0390] Пример 92: Получение гидрохлорида 2-амино-6-бороно-2-(2-(4-хлорфенокси)этил)гексановой кислоты
Стадия 1: трет-бутил-4-(4-хлорфенокси)-2-(дифенилметиленамино)бутаноат
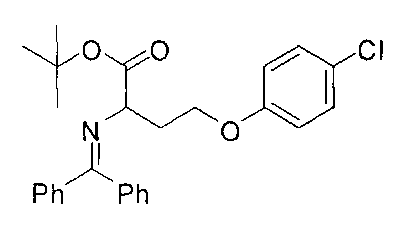
[0391] В атмосфере азота раствор трет-бутилового эфира (бензгидрилиденамино)-уксусной кислоты (400 мг, 1,35 ммоль) в тетрагидрофуране (7 мл) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом натрия (1,49 мл, 1,0М в тетрагидрофуране, 1,49 ммоль) по каплям. После завершения добавления перемешивание продолжали в течение 30 минут и 1-(2-бромэтокси)-4-хлорбензол (398 мг, 1,69 ммоль) медленно добавляли в реакционную смесь. Перемешивание продолжали в течение еще 2 часов, затем медленно нагревали до комнатной температуры в течение ночи. Полученный раствор выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 0-20% этилацетат в гептане) приводила к получению трет-бутил-4-(4-хлорфенокси)-2-(дифенилметиленамино)бутаноата в виде бесцветной маслянистой жидкости (450 мг, 74%); МС (+CI): m/z C27H28ClNO3: ожидаемое 449,2; эксперимент 450,2 (M+Н)+, 394,2 (M+Н-изобутен)+.
Стадия 2: трет-бутил-2-(2-(4-хлорфенокси)этил)-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
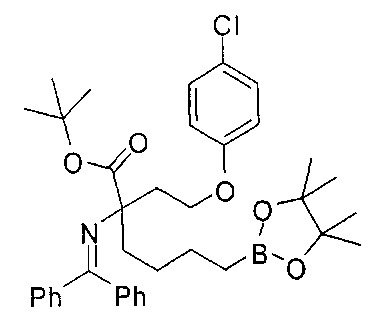
[0392] В атмосфере азота раствор трет-бутил-4-(4-хлорфенокси)-2-(дифенилметиленамино)бутаноата (450 мг, 1,0 ммоль) в тетрагидрофуране (7 мл) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом натрия (2,0 мл, 1,0М в тетрагидрофуране, 2,0 ммоль) по каплям. После завершения добавления перемешивание продолжали в течение 30 минут и 2-(4-йодбутил)-4,4,5,5-тетраметил[1,3,2]диоксаборолан (931 мг, 3,0 ммоль) медленно добавляли в реакционную смесь. Перемешивание продолжали в течение еще 2 часов, а затем медленно нагревали до комнатной температуры в течение ночи. Полученный раствор выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 0-15% этилацетат в гептане) приводила к получению трет-бутил-2-(2-(4-хлорфенокси)этил)-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (486 мг, 77%); 1Н ЯМР (CDCl3, 300 МГц) δН 7,54 (d, J=7 Гц, 2Н), 7,36 (m, 4H), 7,18-7,32 (m, 6H), 6,82 (d, J=9 Гц, 2Н), 4,19 (m, 1H), 4,04 (m, 1H), 2,39 (ddd, J1=14 Гц, J2=9,5 Гц, J3=5,0 Гц, 1H), 2,22 (ddd, J1=13,5 Гц, J2=9,5 Гц, J3=5,0 Гц, 1H), 1,73 (m, 2H), 1,14-1,46 (m, 4H), 1,34 (s, 9H), 1,18 (s, 12H), 0,76 (t, J=1 Гц, 2Н); МС (+ CI): m/z C37H47BClNO5: ожидаемое 631,3; эксперимент 632,3 (M+H)+, 576,3 (M+Н-изобутен)+.
Стадия 3: 2-амино-6-бороно-2-(2-(4-хлорфенокси)этил)гексановая кислота
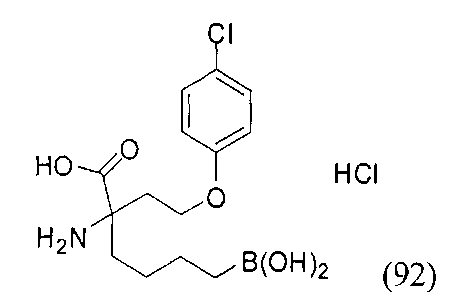
[0393] Раствор трет-бутилового эфира 2-(бензгидрилиденамино)-2-[2-(4-хлорфенокси)-этил]-6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)гексановой кислоты (486 мг) в 6н. HCl (6 мл) нагревали до 60°С и перемешивали в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (6 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением гидрохлорида 2-амино-6-бороно-2-(2-(4-хлорфенокси)этил)гексановой кислоты в виде бесцветной пены (125 мг, 85%); 1Н ЯМР (D4-MeOH, 300 МГц) δH 7,24 (2Н, d, J=7 Гц, 2Н), 6,94 (d, J=7 Гц, 2Н), 4,18 (m, 2Н), 2,52 (m, 1H), 2,46 (m, 1H), 1,92 (m, 2Н), 1,22-1,52 (m, 4H), 0,82 (t, J=7 Гц, 2Н); MC (+CI): m/z C14H21BClNO5: ожидаемое 329,1; эксперимент 330,2 (M+H)+, 312,2 (M+Н-H2O)+, 659,4 (2M+H)+, 641,4 (2M+Н-H2O)+.
[0394] Пример 93: Получение гидрохлорида 2-амино-6-бороно-2-(2-(4-метоксифенокси)этил)гексановой кислоты
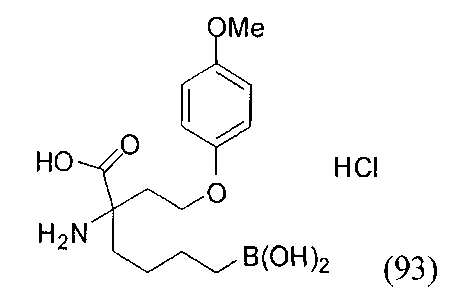
[0395] Гидрохлорид 2-амино-6-бороно-2-(2-(4-метоксифенокси)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что 1-(2-бромэтокси)-4-метоксибензол применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D4-MeOH, 300 МГц) δ 6,91 (d, J=9 Гц, 2Н), 6,85 (d, J=7 Гц, 2Н), 4,12 (m, 2Н), 3,74 (s, 3H), 2,46 (m, 1H), 2,34 (m, 1H), 1,96 (m, 2Н), 1,22-1,66 (m, 4H), 0,84 (t, J=7 Гц, 2Н); MC (+CI): m/z C15H24BClNO5: ожидаемое 325,2; эксперимент 326,2 (M+H)+, 308,2 (M+Н-H2O)+.
[0396] Пример 94: Получение гидрохлорида 2-амино-6-бороно-2-[2-(2,4-дихлорфенокси)этил] гексановой кислоты
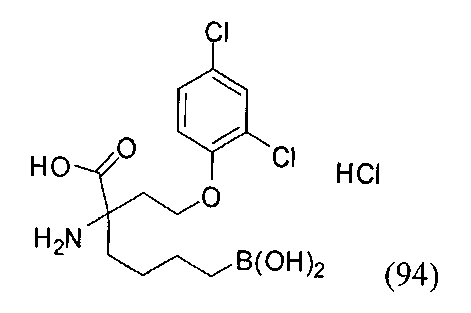
[0397] 2-амино-6-бороно-2-[2-(2,4-дихлорфенокси)этил]гексановую кислоту получали аналогично способу, предложенному в Примере 92, с тем исключением, что 1-(2-бромэтокси)-2,4-дихлорбензол применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D4-MeOH, 300 МГц) δ 7,43 (d, J=2 Гц, 1Н), 7,29 (dd, J1=9,0 Гц, J2=2,0 Гц, 1Н), 7,09 (d, J=9 Гц, 1Н), 4,30 (m, 1Н), 4,21 (m, 1Н), 2,53 (ddd, J1=15,5 Гц, J2=7,5 Гц, J3=4,5 Гц, 1Н), 2,44 (ddd, J1=15,5 Гц, J2=7,0 Гц, J3=4,5 Гц, 1Н), 2,01 (m, 2H), 1,46 (m, 3H), 1,32 (m, 1Н), 0,82 (t, J=7 Гц, 2H); MC (+CI): m/z C14H20BCl2NO5: ожидаемое 363,1; эксперимент 364,2 (M+H)+, 346,2 (M+H-H2O)+.
[0398] Пример 95: Получение гидрохлорида 2-амино-6-бороно-2-[2-(3-трифторметилфенокси)этил] гексановой кислоты
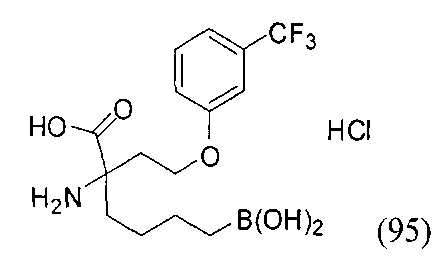
[0399] Гидрохлорид 2-амино-6-бороно-2-[2-(3-трифторметилфенокси)этил]гексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что 1-(2-бромэтокси)-3-(трифторметил)бензол применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D4-MeOH, 300 МГц) δ 7,49 (t, J=8 Гц, 1Н), 7,26 (m, 3H), 4,24 (m, 2H), 2,52 (m, 1Н), 2,37 (m, 1Н), 1,96 (m, 2H), 1,46 (m, 3H), 1,32 (m, 1Н), 0,83 (t, J=7 Гц, 2H); MC (+CI): m/z C15H21BF3NO5: ожидаемое 363,21; эксперимент 364,2 (M+H)+, 346,2 (M+Н-H2O)+, 727,4 (2M+H)+, 709,4 (2М+Н-Н2О)+.
[0400] Пример 96: Получение гидрохлорида 2-амино-6-бороно-2-[3-(4-хлорфенокси)пропил]гексановой кислоты
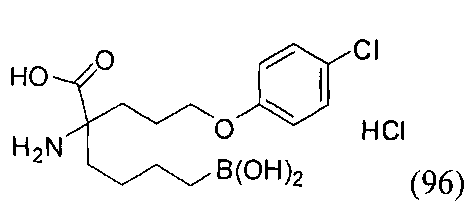
[0401] Гидрохлорид 2-амино-6-бороно-2-[3-(4-хлорфенокси)пропил]гексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что 1-(4-бромпропокси)-4-хлорбензол применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D4-MeOH, 300 МГц) δ 7,24 (d, J=9 Гц, 2H), 6,90 (d, J=9 Гц, 2H), 3,98 (m, 2H), 1,68-2,19 (m, 6H), 1,44 (m, 3H), 1,27 (m, 1Н), 0,82 (t, J=7 Гц, 2Н); МС (+CI): m/z C15H23BClNO5: ожидаемое 343,1; эксперимент 344,2 (М+Н)+, 326,2 (М+Н-H2O)+.
[0402] Пример 97: Получение гидрохлорида 2-амино-6-бороно-2-метилгексановой кислоты
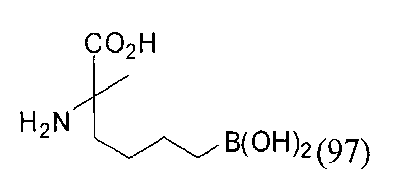
[0403] Гидрохлорид 2-амино-6-бороно-2-метилгексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что метилйодид применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 1,89-1,82 (m, 1H), 1,79-1,68 (m, 1H), 1,48 (s, 3H), 1,47-1,25 (m, 3Н), 1,22-1,13 (m, 1H), 0,69 (t, J=6,6 Гц, 2Н). ИЭР МС эксперимент C7H16BHO4 m/z [190,1 (М+1)].
[0404] Пример 98: Получение гидрохлорида 2-амино-6-бороно-2-(3-фторбензил)гексановой кислоты
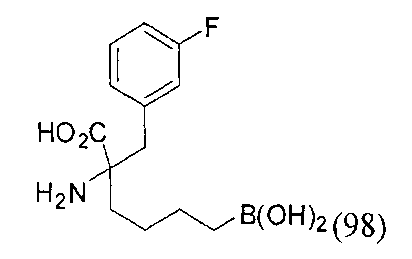
[0405] Гидрохлорид 2-амино-6-бороно-2-(3-фторбензил)гексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что 1-(бромметил)-3-фторбензол применяли в качестве алкилирующего агента на стадии 1. 1H ЯМР (CD3OD, 300 МГц) δ 7,41-7,32 (m, 1H), 7,14-7,02 (m, 3H), 3,33 (dAB, J=14,4 Гц, 1H), 3,14 (dAB, J=14,4 Гц, 1H), 2,10-1,80 (m, 2Н), 1,48-1,25 (m, 4H), 0,79 (t, J=6,9 Гц, 2Н). ИЭР МС эксперимент C13H19BFNO4 m/z [284,2 (M+1)].
[0406] Пример 99: Получение гидрохлорида 2-амино-2-бензил-6-бороногексановой кислоты

[0407] Гидрохлорид 2-амино-2-бензил-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что бензилбромид применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 7,32-7,21 (m, 3Н), 7,24-7,24 (m, 2H), 3,27 (dAB, J=12,8 Гц, 1Н), 3,04 (dAB, J=12,8 Гц, 1Н), 2,03-1,92 (m, 1Н), 1,84-1,75 (m, 1Н), 1,40-1,08 (m, 4H), 0,68 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C13H20BNO4 m/z [266,1(M+1)].
[0408] Пример 100: Получение гидрохлорида 2-амино-6-бороно-2-(3-метоксипропил)гексановой кислоты
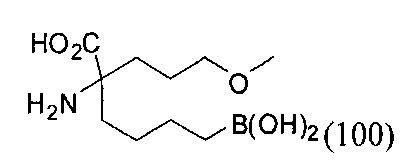
[0409] Гидрохлорид 2-амино-6-бороно-2-(3-метоксипропил)гексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что 1-бром-3-метоксипропан применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,29 (t, J=6,6 Гц, 2H), 3,13 (s, 3H), 1,90-1,62 (m, 4H), 1,58-1,42 (m, 1Н), 1,42-1,29 (m, 1Н), 1,28-1,14 (m, 3H), 1,11-0,97 (m, 1H), 0,58 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C10H22BNO5 m/z [248,1 (M+1)].
[0410] Пример 101: Получение гидрохлорида 2-амино-6-бороно-2-(3-гидроксипропил)гексановой кислоты
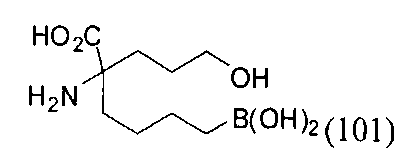
[0411] Гидрохлорид 2-амино-6-бороно-2-(3-гидроксипропил)гексановой кислоты получали аналогично способу, предложенному в Примере 92, с тем исключением, что 2-(3-бромпропокси)тетрагидро-2Н-пиран применяли в качестве алкилирующего агента на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,42 (t, J=6,3 Гц, 2H), 1,96-1,64 (m, 4H), 1,55-1,41 (m, 1Н), 1,40-1,19 (m, 4H), 1,11-0,96 (m, 1Н), 0,60 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C9H10BNO5 m/z [234,1 (M+1)].
[0412] Пример 102: Получение дигидрохлорида 2-((1Н-имидазол-5-ил)метил)-2-амино-6-бороногексановой кислоты
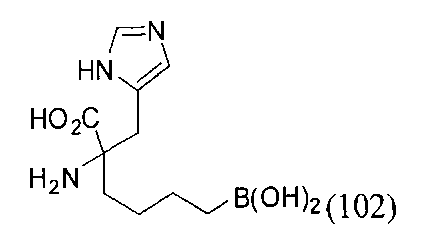
[0413] Раствор трет-бутилового эфира (1-тритил) N-(дифенилметилен)гистидина (400 мг, 0,65 ммоль) в свежеперегнанном ТГФ (4 мл) охлаждали до -78°С (в атмосфере аргона) и обрабатывали бис(триметилсилил)амидом лития (1,5 ммоль, 1,5 мл, 1,0М в ТГФ). 2-(4-йодбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (401 мг, 1,30 ммоль) добавляли за один раз и реакционную смесь нагревали до 50°С в течение 8 часов. После определения завершения реакции при помощи ТСХ реакционную смесь охлаждали до 0°С, разбавляли этилацетатом и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (50% этилацетат в гептане) приводила к получению неочищенного продукта в виде маслянистого вещества, которое перерастворяли в 6н. HCl (10 мл) и нагревали до 70°С в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (5×10 мл). Водный слой концентрировали с получением беловатого твердого продукта (68 мг, 42%) в виде дигидрохлоридной соли. 1Н ЯМР (D2O, 300 МГц) δ 8,51 (d, J=1,2 Гц, 1Н), 7,25 (d, J=1,2 Гц, 1Н), 3,30 (dAB, J=15,9 Гц, 1Н), 3,18 (dAB, J=15,9 Гц, 1Н),1,92-1,78 (m, 1Н), 1,70 (ddd, J=14,7, 12,0, 4,2 Гц, 1Н), 1,32-1,16 (m, 3H), 1,16-0,99 (m, 1H), 0,59 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C10H18BN3O4 m/z [256,2 (M+)].
[0414] Пример 103: Получение гидрохлорида 2-(4-боронобутил)пирролидин-2-карбоновой кислоты
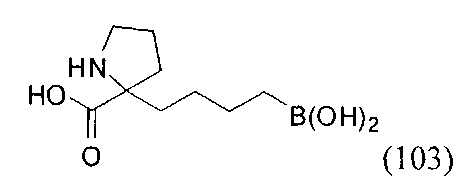
[0415] Гидрохлорид 2-(4-боронобутил)пирролидин-2-карбоновой кислоты получали аналогично способу, предложенному в Примере 102, с тем исключением, что ди-трет-бутилпирролидин-1,2-дикарбоксилат применяли в качестве исходного производного аминокислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,36-3,24 (m, 2Н), 2,41-2,33 (m, 1Н), 2,08-1,70 (m, 5H), 1,39-1,12 (m, 4H), 0,71 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C9H18BNO4 m/z [216,0 (M+1)].
[0416] Пример 104: Получение гидрохлорида 2-амино-6-бороно-2-изобутилгексановой кислоты
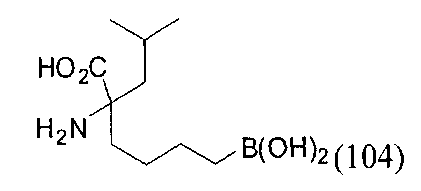
[0417] Гидрохлорид 2-амино-6-бороно-2-изобутилгексановой кислоты получали аналогично способу, предложенному в Примере 102, с тем исключением, что трет-бутил-2-(дифенилметиленамино)-4-метилпентаноат применяли в качестве исходного производного аминокислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 1,80-1,47 (m, 5H), 1,29-1,15 (m, 3Н), 1,08-0,94 (m, 1H), 0,75 (d, J=6,6 Гц, 3Н), 0,70 (d, J=6,6 Гц, 3Н), 0,58 (t, J=7,8 Гц, 2Н). ИЭР МС эксперимент C10H22BNO4 m/z [232,1 (M+1)].
[0418] Пример 105: Получение гидрохлорида 2-амино-6-бороно-2-изопропилгексановой кислоты
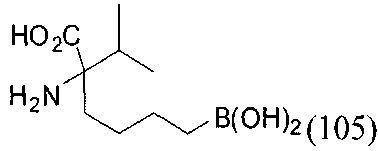
[0419] Гидрохлорид 2-амино-6-бороно-2-изопропилгексановой кислоты получали аналогично способу, предложенному в Примере 102, с тем исключением, что трет-бутил-2-(дифенилметиленамино)-3-метилбутаноат применяли в качестве исходного производного аминокислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 2,08 (heptet, J=6,9 Гц, 1H), 1,78-1,70 (m, 2Н), 1,31-1,15 (m, 3Н), 1,10-0,97 (m, 1H), 0,84 (d, J=6,9 Гц, 3Н), 0,82 (d, J=6,9 Гц, 3Н), 0,61 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C9H20BNO4 m/z [218,1 (M+1)].
[0420] Пример 106: Получение гидрохлорида 2-амино-2-(4-боронобутил)янтарной кислоты
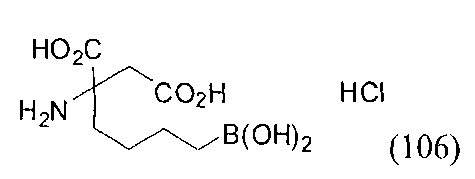
[0421] Гидрохлорид 2-амино-2-(4-боронобутил)янтарной кислоты получали аналогично способу, предложенному в Примере 102, с тем исключением, что ди-трет-бутил-2-(дифенилметиленамино)сукцинат применяли в качестве исходного производного аминокислоты на стадии 1. 1Н ЯМР (D2O, 500 МГц) δ 3,10 (d, J=18,0 Гц, 1H), 2,85 (d, J=18,0 Гц, 1Н [система AB], 1,85-1,78 (m, 2H), 1,37-1,32 (m, 3H), 1,23-1,19 (m, 1H), 0,72 (t, J=7,0 Hz, 2H). ИЭР MC эксперимент C8H16BNO6 m/z [216,4, (M+1-18) 100%, 198,3 (M+1-2×18) 35%, 232,4 (M-1) 50%, 214,4 (M-1-18) 100%].
[0422] Пример 107: Получение дигидрохлорида 2-амино-6-бороно-2-((1-изопропил-1Н-имидазол-5-ил)метил)гексановой кислоты
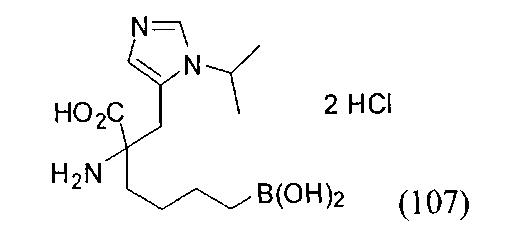
[0423] Раствор трет-бутил-2-(трет-бутоксикарбониламино)-2-(2-оксоэтил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (получен аналогично способу, описанному в Примере 16) (100 мг, 0,22 ммоль) в метаноле (1 мл) обрабатывали тозметилизоцианидом (59 мг, 0,30 ммоль), затем изопропиламином (59 мг, 85 мкл, 1,00 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 48 часов, затем выпаривали и очищали путем хроматографии (хлороформ:метанол; градиент от 100:1 до 10:1) с получением 35 мг алкилированного продукта (белое твердое вещество), который перерастворяли в 6н. HCl (10 мл) и нагревали до 70°С в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (5×10 мл). Водный слой концентрировали с получением дигидрохлорида 2-амино-6-бороно-2-((1-изопропил-1Н-имидазол-5-ил)метил)гексановой кислоты в виде беловатого твердого вещества (20 мг, выход 26%). 1Н ЯМР (D2O, 300 МГц) δ 8,71 (d, J=1,2 Гц, 1H), 7,24 (d, J=1,2 Гц, 1H), 4,45 (heptet, J=6,3 Гц, 1H), 3,35 (dAB, J=16,2 Гц, 1H), 3,21 (dAB, J=16,2 Гц, 1Н),1,98-1,86 (m, 1H), 1,82-1,68 (m, 1H), 1,38-1,20 (m, 3H), 1,37 (d, J=6,3 Гц, 3H), 1,32 (d, J=6,3 Гц, 3H), 1,17-1,03 (m, 1H), 0,62 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C13H24BN3O4 m/z [298,2 (M+1)].
[0424] Пример 108: Получение гидрохлорида 2-амино-6-бороно-2-(1-гидроксипропил)гексановой кислоты
Стадия 1: трет-бутил-2-(дифенилметиленамино)гекс-5-еноат
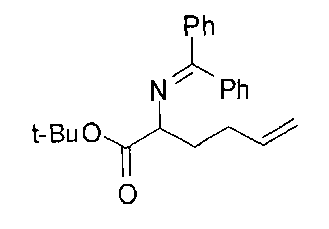
[0425] В атмосфере азота перемешиваемый раствор трет-бутилового эфира (бензгидрилиденамино)уксусной кислоты (5 г, 16,9 ммоль) в ТГФ (80 мл, 0,2М) осторожно обрабатывали бис(триметилсилил)амидом натрия (18,6 мл, 1,0М, 1,1 экв.) при -78°С. После перемешивания в течение 30 минут 4-бромбут-1-ен (2,1 мл, 20,3 ммоль, 1,2 экв.) медленно добавляли. Охлаждающую баню удаляли и реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. Раствор охлаждали до 0°С и реакцию гасили водой. Полученный раствор разбавляли этилацетатом и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-25% этилацетат в гептане приводила к получению) трет-бутилового эфира 2-(бензгидрилиденамино)гекс-5-еновой кислоты в виде бесцветной маслянистой жидкости (5,6 г, 15,9 ммоль, 94%).
Стадия 2: трет-бутил-4-(бут-3-енил)-5-этил-2,2-дифенилоксазолидин-4-карбоксилат
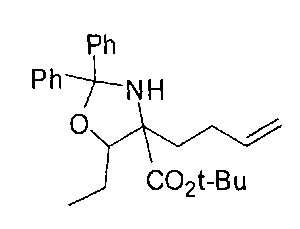
[0426] В атмосфере азота перемешиваемый раствор трет-бутилового эфира 2-(бензгидрилиденамино)гекс-5-еновой кислоты (350 мг, 1 ммоль) в ТГФ (5 мл, 0,2М) охлаждали до -78°С и осторожно обрабатывали бис(триметилсилил)амидом натрия (2 мл, 1М, 2 экв.). После перемешивания в течение 30 минут хлорид диэтилалюминия (2,4 мл, 1М, 2,4 экв.) добавляли и реакционную смесь дополнительно перемешивали в течение 30 минут. Пропанальдегид (94 мкл, 1,25 ммоль, 1,25 экв.) добавляли в раствор и охлаждающую баню удаляли. После перемешивания в течение ночи реакционную смесь охлаждали до 0°С и реакцию гасили насыщенным NH4Cl. Полученный раствор разбавляли этилацетатом и промывали последовательно водой и насыщенным тартратом калия-натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-40% этилацетат в гептане) приводила к получению трет-бутилового эфира 4-бут-3-енил-5-этил-2,2-дифенилоксазолидин-4-карбоновой кислоты (349 мг, 0,86 ммоль, 86%).
Стадия 3: трет-бутил-5-этил-2,2-дифенил-4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)оксазолидин-4-карбоксилат
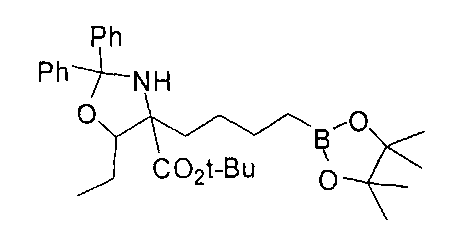
[0427] В раствор трет-бутилового эфира 4-бут-3-енил-5-этил-2,2-дифенилоксазолидин-4-карбоновой кислоты (230 мг, 0,56 ммоль) в дихлорметане (2 мл, 0,3М) добавляли хлорид трис(трифенилфосфин)родия (I) (60 мг, 0,065 ммоль, 10 мол.%) при комнатной температуре. После перемешивания в течение 30 минут 4,4,5,5-тетраметил-1,3,2-диоксаборолан (200 мкл, 1,3 ммоль, 2 экв.) добавляли в реакционную смесь и перемешивали в течение ночи. Реакцию гасили водой (3 мл), после чего полученный раствор разбавляли этилацетатом и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-40% этилацетат в гептане) приводила к получению трет-бутилового эфира 5-этил-2,2-дифенил-4-[4-(4,4,5,5-тетраметил[1,3,2]-диоксаборолан-2-ил)бутил]оксазолидин-4-карбоновой кислоты (152 мг, 0,28 ммоль, 50%).
Стадия 4: гидрохлорид 2-амино-6-бороно-2-(1-гидроксипропил)гексановой кислоты
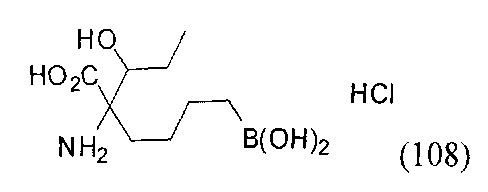
[0428] Раствор трет-бутилового эфира 5-этил-2,2-дифенил-4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бутил]оксазолидин-4-карбоновой кислоты (152 мг, 0,28 ммоль) в 6н. HCl (4 мл) перемешивали при 65°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (3 мл) и промывали дихлорметаном (3×4 мл). Водный слой замораживали в жидком азоте и лиофилизировали с получением гидрохлорида 2-амино-6-бороно-2-(1-гидроксипропил)гексановой кислоты в виде белой пены (20 мг, 0,074 ммоль, 27%). 1Н ЯМР (D2O, 300 МГц) δ 3,80 (dd, J=11,4, 1,8 Гц, 1Н), 1,88-1,50 (m, 2H), 1,48-0,92 (m, 5H), 0,85 (t, J=7,6 Гц, 3Н), 0,63 (t, J=7,6 Гц, 2H).
[0429] Пример 109: Получение дигидрохлорида 2-амино-6-бороно-2-(гидрокси(пиперидин-4-ил)метил)гексановой кислоты
[0430] Дигидрохлорид 2-амино-6-бороно-2-(гидрокси(пиперидин-4-ил)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 108, с тем исключением, что трет-бутил-4-формилпиперидин-1-карбоксилат применяли в качестве альдегида на стадии 2. 1Н ЯМР (D2O, 300 МГц) δ 3,80 (d, J=2,9 Гц, 1Н), 3,36-3,20 (m, 2H), 2,94-2,75 (m, 2H), 1,98-1,34 (m, 7H), 1,34-0,97 (m, 4H), 0,63 (t, J=7,6 Гц, 2H).
[0431] Пример 110: Получение дигидрохлорида 2-амино-6-бороно-2-(гидрокси(пиперидин-3-ил)метил)гексановой кислоты
[0432] Дигидрохлорид 2-амино-6-бороно-2-(гидрокси(пиперидин-3-ил)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 108, с тем исключением, что трет-бутил-3-формилпиперидин-1-карбоксилат применяли в качестве альдегида на стадии 2. 1Н ЯМР (D2O, 300 МГц) δ 4,05-3,70 (m, 1Н), 3,60-3,40 (m, 1Н), 3,00-2,70 (m, 3H), 2,70-1,60 (m, 7H), 1,60-1,15 (m, 4H), 0,85 (t, J=7,1 Гц, 2Н).
[0433] Пример 111: Получение гидрохлорида 2-амино-2-(4-боронобутил)-6,6,6-трифтор-3-гидроксигексановой кислоты
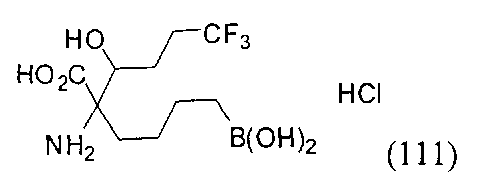
[0434] Гидрохлорид 2-амино-2-(4-боронобутил)-6,6,6-трифтор-3-гидроксигексановой кислоты получали аналогично способу, предложенному в Примере 108, с тем исключением, что 4,4,4-трифторбутаналь применяли в качестве альдегида на стадии 2. 1Н ЯМР (D2O, 300 МГц) δ 3,98-3,84 (m, 1Н), 2,50-2,12 (m, 2H), 2,06-1,66 (m, 4H), 1,47-1,12 (m, 4H), 0,75 (t, J=7,5 Гц, 2Н).
[0435] Пример 112: Получение дигидрохлорида 2-амино-6-бороно-2-(гидрокси(пиридин-3-ил)метил)гексановой кислоты
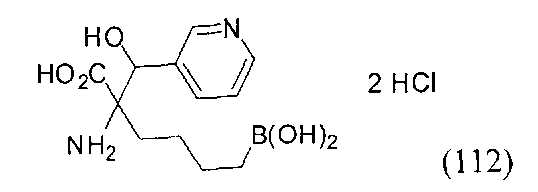
[0436] Дигидрохлорид 2-амино-6-бороно-2-(гидрокси(пиридин-3-ил)метил)гексановой кислоты получали аналогично способу, предложенному в Примере 108, с тем исключением, что никотинальдегид применяли в качестве альдегида на стадии 2. 1Н ЯМР (D2O, 300 МГц) δ 8,84 (s, 1H), 8,75 (d, J=5,9 Гц, 1H), 8,61 (d, J=8,2 Гц, 1Н), 8,06 (dd, J=8,2, 5,9 Гц, 1H), 5,27 (s, 1H), 2,06-1,86 (m, 1H), 1,84-1,67 (m, 1H), 1,54-1,28 (m, 3H), 1,28-1,08 (m, 1H), 0,74 (t, J=7,8 Гц, 2Н).
[0437] Пример 113: Получение дигидрохлорида 2-амино-2-(азетидин-3-ил(гидрокси)метил)-6-бороногексановой кислоты
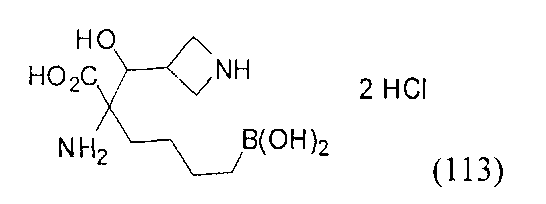
[0438] Дигидрохлорид 2-амино-2-(азетидин-3-ил(гидрокси)метил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 108, с тем исключением, что трет-бутил-3-формилазетидин-1-карбоксилат применяли в качестве альдегида на стадии 2. 1Н ЯМР (D2O, 300 МГц) δ 4,11 (d, J=6,0 Гц, 1H), 4,07-3,78 (m, 4H), 3,40-3,10 (m, 1H), 1,85-1,36 (m, 7H), 1,32-0,92 (m, 4H), 0,60 (t, J=7,6 Гц, 2Н).
[0439] Пример 114: Получение гидрохлорида 5-амино-6-оксо-6-фенилгексилбороновой кислоты
Стадия 1: трет-бутил-2-бензоил-2-(дифенилметиленамино)гекс-5-еноат
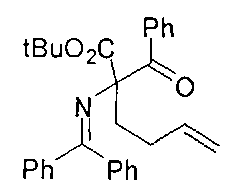
[0440] Раствор трет-бутилового эфира 2-(бензгидрилиденамино)гекс-5-еновой кислоты (350 мг, 1 ммоль) в ТГФ (5 мл, 0,2М) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом лития (2,2 мл, 1,0М, 2,2 экв.) по каплям в течение 5 минут и перемешивали в течение 30 минут. После добавления бензоилхлорида (140 мкл, 1,2 ммоль, 1,2 экв.) реакционную смесь нагревали до комнатной температуры и дополнительно перемешивали в течение 1,5 часов. Раствор охлаждали до 0°С и реакцию гасили водой (5 мл). Полученный раствор разбавляли этилацетатом и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-40% этилацетат в гептане) приводила к получению трет-бутилового эфира 2-(бензгидрилиденамино)-2-бензоилгекс-5-еновой кислоты (477 мг, 1 ммоль, 100%).
Стадия 2: трет-бутил-2-бензоил-2-(дифенилметиленамино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноат
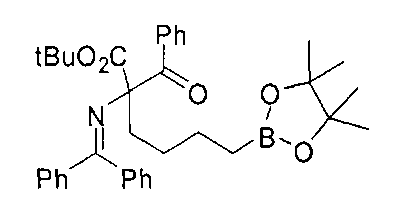
[0441] Раствор трет-бутилового эфира 2-(бензгидриленамино)-2-бензоилгекс-5-еновой кислоты (530 мг, 1,17 ммоль) в дихлорметане (3 мл, 0,4М) обрабатывали димером хлор-1,5-циклооктадиениридия (I) (24 мг, 0,036 ммоль, 3 мол.%) и 1,2-бис(дифенилфосфино)этаном (28 мг, 0,07 ммоль, 6 мол.%) при комнатной температуре. После перемешивания в течение 30 минут 4,4,5,5-тетраметил-1,3,2-диоксаборолан (204 мкл, 1,4 ммоль, 1,2 экв.) добавляли в реакционную смесь и перемешивание продолжали в течение ночи. Реакцию гасили водой (3 мл). Полученный раствор разбавляли этилацетатом и промывали последовательно водой и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-40% этилацетат в гептане) приводила к получению трет-бутилового эфира 2-(бензгидрилиденамино)-2-бензоил-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (370 мг, 0,64 ммоль, 54%).
Стадия 3: гидрохлорид 5-амино-6-оксо-6-фенилгексилбороновой кислоты
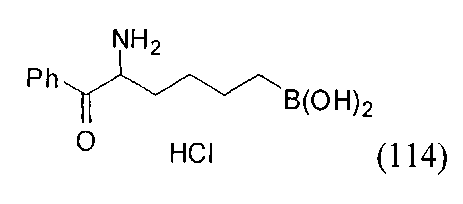
[0442] Раствор трет-бутилового эфира 2-(бензгидрилиденамино)-2-бензоил-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (186 мг, 0,32 ммоль) в 6н. HCl (6 мл) перемешивали при 65°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3×5 мл). Водный слой замораживали в жидком азоте и лиофилизировали с получением 2-амино-6-бороно-1-фенилгексан-1-она (76,5 мг, 88%). 1Н ЯМР (D2O, 300 МГц) δ 8,04-7,60 (m, 2H), 7,77 (tt, J=7,6, 1,2 Гц, 1Н), 7,61 (d, J=7,6 Гц, 2H), 5,18 (dd, J=7,5, 4,7 Гц, 1Н), 2,15-1,82 (m, 2H), 1,5-1,2 (m, 4H), 0,69 (t, J=7,2 Гц, 2Н).
[0443] Пример 115: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((R)-пирролидин-2-ил)этил)гексановой кислоты
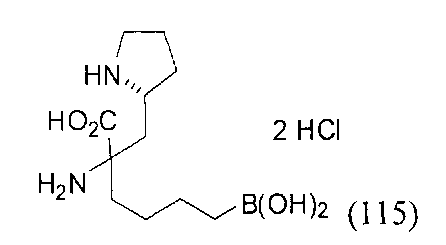
[0444] Дигидрохлорид 2-амино-6-бороно-2-(2-((R)-пирролидин-2-ил)этил)гексановой кислоты получали аналогично способу, предложенному ниже в Примере 87-А, с тем исключением, что (R)-2-(1-(трет-бутоксикарбонил)пирролидин-2-ил)уксусную кислоту применяли в качестве карбоновой кислоты на стадии 1. 1Н ЯМР (D2O, 500 МГц) δ 3,52 -3,48 (m, 1Н), 3,21-3,11 (m, 2H), 2,35 (dd, J=16,0, 6,0 Гц, 1Н), 2,19-2,12 (m, 2H), 1,96-1,89(m, 1H), 1,85-1,79 (m, 2H) 1,70 (dt, J=14,0, 4,0 Гц, 1H), 1,60-1,52(m, 1H), 1,29-1,21 (m, 3H), 1,12-1,05 (m, 1Н), 0,62 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C11H23BN2O4 m/z [481,9 (2M+1-2×18) 2%, 281,6 (M+Na+) 5%, 263,6 (M+Na+-18) 4%, 241,5 (M+1-18) 23%, 223,5 (M+1-2×18) 100%, 257,5 (M-1) 8%, 239,5 (M-1-18) 100%].
[0445] Пример 116: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(пиридин-2-ил)этил)гексановой кислоты
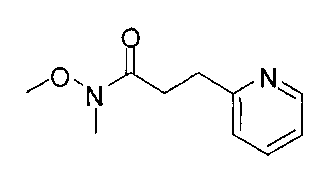
Стадия 1: N-метокси-N-метил-3-(пиридин-2-ил)пропанамид
[0446] Раствор 3-пиридин-2-илпропановой кислоты (1,0 г, 6,62 ммоль), DMAP (10 мг) и гидрохлорида N,О-диметилгидроксиламина (679 мг, 7,0 ммоль) и EDC (1,34 г, 7,0 ммоль) в дихлорметане (40 мл) обрабатывали триэтиламином (2,8 мл, 20,0 ммоль). После перемешивания при комнатной температуре в течение ночи раствор выливали в воду, экстрагировали этилацетатом (3х) и объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной хроматографии (силикагель, 30-100% этилацетат в гептане) приводила к получению N-метокси-N-метил-3-(пиридин-2-ил)пропанамида (1,02 г, 78%) в виде бесцветной маслянистой жидкости. ИЭР МС эксперимент C10H14N2O2 m/z [195,1 (М+1)].

Стадия 2: 1-(пиридин-2-ил)гепт-6-ен-3-он
[0447] В атмосфере азота раствор N-метокси-N-метил-3-(пиридин-2-ил)пропанамида (1,00 г, 5,15 ммоль) в тетрагидрофуране (10 мл) охлаждали до 0°С и обрабатывали бромидом 4-бутенилмагния (0,5М в ТГФ, 16 мл, 8,0 ммоль) по каплям. Раствор перемешивали в течение 1 часа при 0°С, затем оставляли нагреваться до комнатной температуры в течение 3 часов. Полученный раствор выливали в насыщенный водный хлорид натрия (100 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 0-25% этилацетат в гептане) приводила к получению 1-(пиридин-2-ил)гепт-6-ен-3-она в виде бесцветной маслянистой жидкости (828 мг, 85%). ИЭР МС эксперимент C12H15NO m/z [190,1 (М+1)].
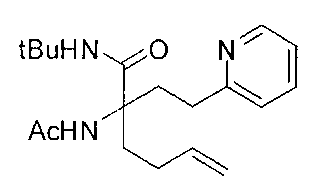
Стадия 3: 2-ацетамидо-N-трет-бутил-2-(2-(пиридин-2-ил)этил)гекс-5-енамид
[0448] Раствор 1-(пиридин-2-ил)гепт-6-ен-3-она (825 мг, 4,36 ммоль) и ацетата аммония (1,01 г, 13,09 ммоль) в 2,2,2-трифторэтаноле (3 мл) обрабатывали трет-бутилизоцианидом (730 мг, 0,99 мл, 8,80 ммоль). После перемешивания при комнатной температуре в течение 6 дней реакционную смесь очищали путем колоночной флэш-хроматографии (неочищенную реакционную смесь помещали в колонку; силикагель, 0-10% метанол в дихлорметане) с получением 2-ацетамидо-N-трет-бутил-2-(2-(пиридин-2-ил)этил)гекс-5-енамида в виде белого твердого вещества (1,37 г, 95%). ИЭР МС эксперимент C19H29N3O2 m/z [332,2 (М+1)].
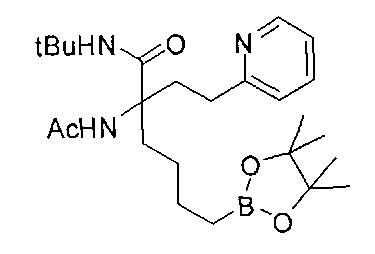
Стадия 6: 2-ацетамидо-N-трет-бутил-2-(2-(пиридин-2-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
[0449] Раствор 2-ацетамидо-N-трет-бутил-2-(2-(пиридин-2-ил)этил)гекс-5-енамида (810 мг, 2,45 ммоль) в дихлорметане (4 мл) обрабатывали димером хлор-1,5-циклооктадиен иридия (I) (35 мг, 2 мол.%) и 1,2-бис(дифенилфосфино)этаном (42 мг, 4 мол.%). Раствор перемешивали при комнатной температуре в течение 30 минут, а затем 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (0,76 мл, 5,20 ммоль) добавляли по каплям и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 0-10% метанол в дихлорметане) приводила к получению 2-ацетамидо-N-трет-бутил-2-(2-(пиридин-2-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида в виде бесцветной маслянистой жидкости (787 мг, 70%). ИЭР МС эксперимент C25H42BN3O4 m/z [460,3 (М+1)].
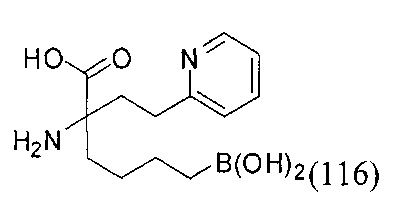
Стадия 7: 2-амино-6-бороно-2-(2-(пиридин-2-ил)этил)гексановая кислота
[0450] Гидролиз 2-ацетамидо-N-трет-бутил-2-(2-(пиридин-2-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида для получения 2-амино-6-бороно-2-(2-(пиридин-2-ил)этил)гексановой кислоты проводили аналогично способу, предложенному в Примере 1, Стадия 8. 1Н ЯМР (D2O, 300 МГц) δ 8,50 (ddd, J1=6,0 Гц, J2=1,5 Гц, J3=0,6 Гц, 1Н), 8,37 (ddd, J1=9,6 Гц, J2=7,8 Гц, J3=1,8 Гц, 1Н), 7,81-7,74 (m, 2H), 3,22-3,08 (m, 1H), 3,03-2,91 (m, 1H), 2,33-2,18 (m, 2H), 1,97-1,72 (m, 2H), 1,38-1,06 (m, 4H), 0,64 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C13H21BN2O4 m/z [281,2 (M+1)].
[0451] Пример 117: Получение дигидрохлорида 2-амино-6-бороно-2-((1-(3,4-дихлорбензил)азетидин-3-ил)метил)гексановой кислоты
[0452] Дигидрохлорид 2-амино-6-бороно-2-((1-(3,4-дихлорбензил)азетидин-3-ил)метил)гексановой кислоты получали из 1-Cbz-3-азетидинуксусной кислоты аналогично способу, предложенному в Примере 139. 1Н ЯМР (D2O, 500 МГц) δ 7,55-7,45 (m, 2H), 7,29-7,17 (m, 1H), 4,17 (pseudo-tAB, 2H), 4,12-4,03 (m, 1H), 3,91-3,80 (m, 1H), 3,14-2,90 (m, 2H), 2,23-2,05 (m, 2H), 2,01-1,55 (m, 3H), 1,33-1,16 (m, 3H), 1,09-1,01 (m, 1H), 0,63 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C17H25BCl2N2O4 m/z [385,5 (M-18+1)].
[0453] Пример 118: Получение дигидрохлорида 2-амино-6-бороно-2-((1-(2,4-дихлорфенэтил)азетидин-3-ил)метил)гексановой кислоты
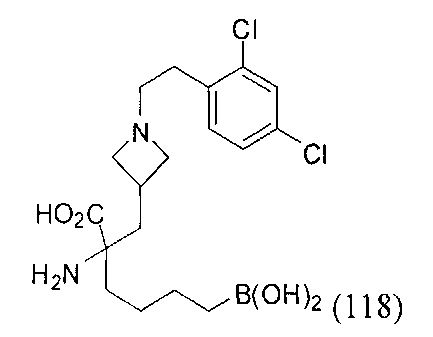
[0454] Дигидрохлорид 2-амино-6-бороно-2-((1-(2,4-дихлорфенэтил)азетидин-3-ил)метил)гексановой кислоты получали из 1-Cbz-3-азетидинуксусной кислоты аналогично способу, предложенному в Примере 116. 1Н ЯМР (D2O, 500 МГц) δ 7,55-7,30 (m, 3H), 3,55-3,45 (m, 1H), 3,31-3,20 (m, 1H), 3,18-2,90 (m, 4H), 2,77 (t, J=7,6 Гц, 1H), 2,12-2,05 (m, 1H), 2,02-1,61 (m, 5H), 1,32-1,17 (m, 3H), 1,13-1,00 (m, 1H), 0,65 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C18H27BCl2N2O4 m/z [397,5 (M-18+1)].
[0455] Пример 119: Получение гидрохлорида 2-амино-6-бороно-2-(2-(3-(3,4-дихлорфенил)тиоуреидо)этил)гексановой кислоты
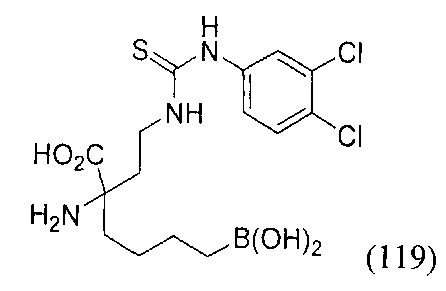
[0456] Гидрохлорид 2-амино-6-бороно-2-(2-(3-(3,4-дихлорфенил)тиоуреидо)этил)-гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что трет-бутил-2-(дифенилметиленамино)ацетат применяли на стадии 1, и предложенный ниже способ применяли на стадиях 6 и 7: раствор альдегида (5,92 ммоль) и бензиламина (11,85 ммоль) в дихлорэтане перемешивали при комнатной температуре в течение 1 часа, затем обрабатывали NaBH(ОАс)3 (17,76 ммоль). Через 16 часов реакцию гасили 5% раствором NaHCO3 и смесь экстрагировали дихлорметаном. Органические экстракты промывали последовательно 1М HCl, насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали. Неочищенный продукт очищали путем флэш-хроматографии, растворяли в пиридине и обрабатывали 3,4-дихлорфенилизотиоцианатом (1,5 экв.). После перемешивания в течение ночи при комнатной температуре реакционную смесь концентрировали, растворяли в дихлорметане, промывали 1М HCl, насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали. Очистка путем флэш-хроматографии приводила к получению мочевины, которую растворяли в этаноле и обрабатывали Pd(OH)2/C и водородом в аппарате Парра. Когда реакция завершалась катализатор отфильтровывали через подложку целита, а фильтрат концентрировали насухо. Полученную маслянистую жидкость обрабатывали 6н. HCl и нагревали до 100°С в течение 6 часов, охлаждали до комнатной температуре и концентрировали. Очистка путем ВЭЖХ приводила к получению гидрохлорида 2-амино-6-бороно-2-(2-(3-(3,4-дихлорфенил)-тиоуреидо)этил)гексановой кислоты. 1Н ЯМР (D2O, 500 МГц) δ 7,39(d, J=8,4 Гц, 1Н), 7,32 (s, 1H), 7,01 (d, J=8,4 Гц, 1H), 3,67-3,51 (m, 2H), 2,28-2,17 (m, 1H), 2,05-1,96 (m, 1H), 1,84-1,68 (m, 2H), 1,35-1,24 (m, 3H), 1,14-1,04 (m, 1H), 0,62 (t, J=7,0 Гц, 2H). ИЭР МС эксперимент C15H22BCl2N3O4S m/z [404,5 (M-18+ 1)].
[0457] Пример 120: Получение гидрохлорида 2-амино-6-бороно-2-(2-изобутирамидоэтил)гексановой кислоты
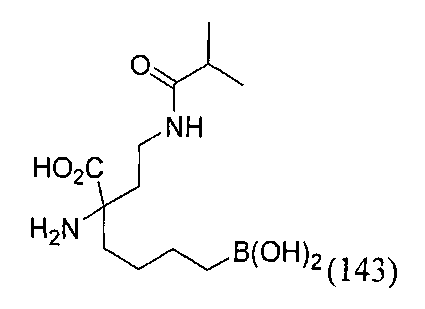
[0458] Гидрохлорид 2-амино-6-бороно-2-(2-изобутирамидоэтил)гексановой кислоты получали аналогично способу, предложенному в Примере 119, с тем исключением, что изобутирилхлорид применяли вместо 3,4-дихлорфенилизоцианата. 1Н ЯМР (D2O, 500 МГц) δ 3,22-3,15 (m, 2H), 2,32 (hept, J=6,3 Гц, 1H), 2,16-08 (m, 1H), 1,91-1,83 (m, 1H), 1,83-1,74 (m, 1H), 1,72-1,64 (m, 1H), 1,30-1,22 (m, 3H), 1,12-1,03 (m, 1H), 0,93 (d, J=6,3 Гц, 6H), 0,65 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C12H25BN2O5 m/z [271,5 (M-18+1)].
[0459] Пример 121: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(4-хлорфенил)пиперидин-1-ил)этил)гексановой кислоты
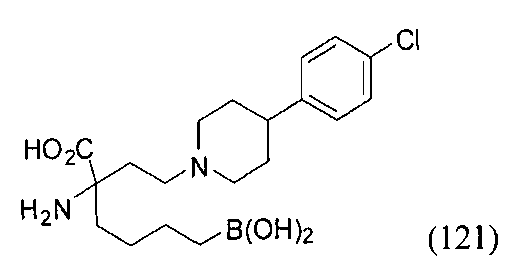
[0460] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-(4-хлорфенил)пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(4-хлорфенил)пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,22 (d, J=8,4 Гц, 2Н), 7,12 (d, J=8,4 Гц, 2Н), 3,60-3,47 (m, 2Н), 3,32-3,20 (m, 1H), 3,15-2,95 (m, 3H), 2,82-2,70 (m, 1H), 2,31-2,18 (m, 2Н), 2,05-1,65 (m, 6H), 1,35-1,15 (m, 3H), 1,15-1,01 (m, 1H), 0,63 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C19H30BClN2O4 m/z [397,3 (M+1)].
[0461] Пример 122: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(4-хлорбензил)пиперидин-1-ил)этил)гексановой кислоты
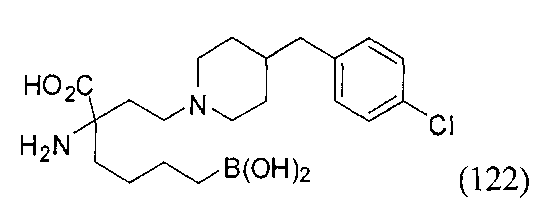
[0462] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-(4-хлорбензил)пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(4-хлорбензил)пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,20 (d, J=8,5 Гц, 2Н), 7,05 (d, J=8,5 Гц, 2Н), 3,45-3,38 (m, 2Н), 3,21-3,15 (m, 1H), 3,04-2,96 (m, 1H), 2,82-2,74 (m, 2Н), 2,45-2,41 (m, 2H), 2,20-2,14 (m, 2Н), 1,85-1,68 (m, 5H), 1,35-1,20 (m, 5H), 1,13-1,04 (m, 1H), 0,64 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C20H32BClN2O4 m/z [375,5 (M-2×18+1)].
[0463] Пример 123: Получение дигидрохлорида 2-амино-2-(азетидин-3-илметил)-6-бороногексановой кислоты
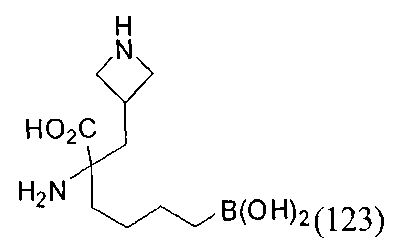
[0464] Дигидрохлорид 2-амино-2-(азетидин-3-илметил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что 2-(1-(трет-бутоксикарбонил)азетидин-3-ил)уксусную кислоту применяли в качестве карбоновой кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) 3,63-3,50 (m, 1H), 3,08-2,90 (m, 3Н), 2,68-2,43 (m, 2H), 2,12-1,94 (m, 1H), 1,82-1,64 (m, 2H), 1,32-1,00 (m, 4H), 0,61 (t, J=7,3 Гц, 2H). ИЭР МС эксперимент C10H21BN2O4 m/z [245,3 (M+1)].
[0465] Пример 124: Получение дигидрохлорида 2-амино-2-(2-(4-бензилпиперидин-1-ил)пропил)-6-бороногексановой кислоты
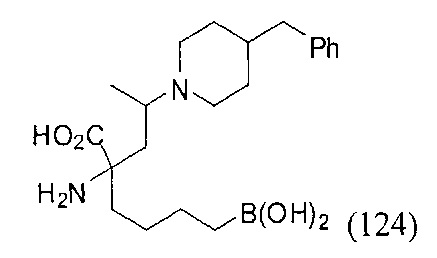
[0466] Дигидрохлорид 2-амино-2-(2-(4-бензилпиперидин-1-ил)пропил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 3-бром-2-метилпропен применяли в качестве алкилгалогенида на стадии 2 и стадию 6 проводили с применением 4-бензилпиперидина при помощи следующего способа: Смесь кетона (235 мг, 0,5 ммоль), амина (0,088 мл, 0,5 ммоль) и изопропоксида титана (IV) (0,186 мл, 0,63 ммоль) перемешивали при комнатной температуре в атмосфере азота. Через 1 час вязкий раствор разбавляли абсолютным этанолом (0,5 мл). Цианоборгидрид натрия (21 мг, 0,335 мл) добавляли и раствор перемешивали в течение 1 дня. Воду добавляли при перемешивании и полученный неорганический осадок отфильтровывали и промывали этанолом. Фильтрат затем концентрировали в вакууме. Неочищенный продукт растворяли в этилацетате, фильтровали для удаления оставшегося неорганического вещества и концентрировали в вакууме. Продукт затем очищали путем флэш-хроматографии. Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде бесцветной пены (97 мг); 1Н ЯМР (D2O, 300 МГц) δ 7,28-7,18 (m, 2H), 7,18-7,09 (m, 3Н), 3,37-3,08 (m, 3Н), 3,03-2,70 (m, 2H), 2,51-2,26 (m, 4H), 1,90-1,57 (m, 6H), 1,44-1,02 (m, 8H), 0,64 (t, J=7,5 Гц, 2Н); МС (+CI): m/z C21H35BN2O4: ожидаемое 390,32; эксперимент 391,2 (M+Н)+, 373,3 (M+H-H2O)+.
[0467] Пример 125: Получение дигидрохлорида 2-амино-2-(2-(4-бензилпиперидин-1-ил)этил)-6-бороногексановой кислоты
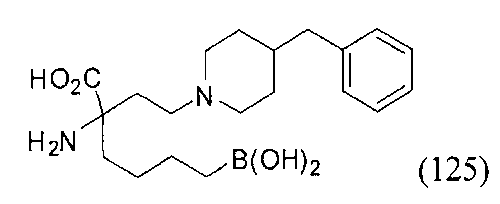
[0468] Дигидрохлорид 2-амино-2-(2-(4-бензилпиперидин-1-ил)этил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-бензилпиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,28-7,18 (m, 2Н), 7,18-7,08 (m, 3H), 3,50-3,36 (m, 2H), 3,24-3,12 (m, 1H), 3,08-2,91 (m, 1H), 2,89-2,71 (m, 2Н), 2,56-2,43 (m, 2Н), 2,23-2,10 (m, 2H), 1,89-1,64 (m, 5H), 1,43-1,22 (m, 5H), 1,19-1,04 (m, 1H), 0,66 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C20H33BN2O4 m/z [377,3 (M+1)].
[0469] Пример 126: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(4-(трифторметил)бензил)пиперидин-1-ил)этил)гексановой кислоты
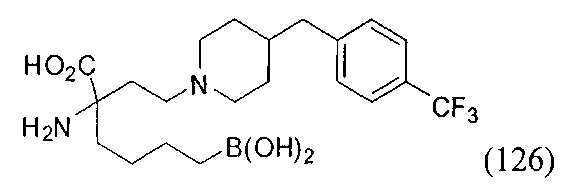
[0470] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-(4-(трифторметил)бензил)пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(4-(трифторметил)бензил)пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,53 (d, J=7,8 Гц, 2H), 7,27 (d, J=7,8 Гц, 2H), 3,50-3,36 (m, 2H), 3,27-3,12 (m, 1H), 3,07-2,91 (m, 1H), 2,90-2,71 (m, 2H), 2,61-2,51 (m, 2H), 2,22-2,09 (m, 2H), 1,90-1,62 (m, 5H), 1,45-1,19 (m, 5H), 1,17-1,04 (m, 1H), 0,67 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C21H32BF3N2O4 m/z [445,3 (M+1)].
[0471] Пример 127: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(4-фторбензил)пиперидин-1-ил)этил)гексановой кислоты
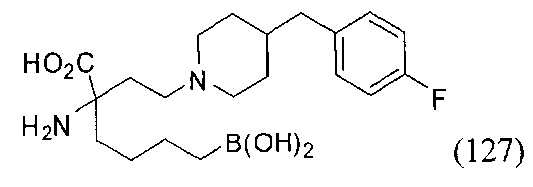
[0472] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-(4-фторбензил)пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(4-фторбензил)пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,09 (m, 2Н), 6,92 (m, 2H), 3,48-3,39 (m, 2H), 3,24-3,12 (m, 1H), 3,06-2,94 (m, 1H), 2,83-2,74 (m, 2H), 2,44-2,37 (m, 2H), 2,25-2,17 (m, 2H), 1,88-1,78 (m, 1H), 1,76-1,64 (m, 4H), 1,33-1,20 (m, 5H), 1,15-1,02 (m, 1H), 0,64 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C21H32BF3N2O4 m/z [395,4 (M+1)].
[0473] Пример 128: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4,4-диметилпиперидин-1-ил)этил)гексановой кислоты
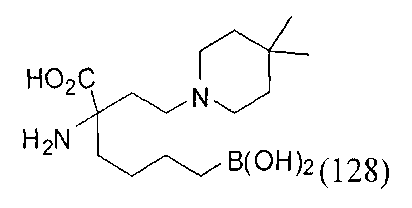
[0474] Дигидрохлорид 2-амино-6-бороно-2-(2-(4,4-диметилпиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4,4-диметилпиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,33-3,19 (m, 3Н), 3,12-2,94 (m, 3Н), 2,29-2,20 (m, 2H), 1,90-1,82 (m, 1H), 1,80-1,74 (m, 1H), 1,53-1,48 (m, 4H), 1,33-1,25 (m, 3Н), 1,16-1,08 (m, 1H), 0,89 (s, 3Н), 0,85 (s, 3Н), 0,66 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C15H31BN2O4 m/z [315,7 (M+1)].
[0475] Пример 129: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-пропилпиперидин-1-ил)этил)гексановой кислоты
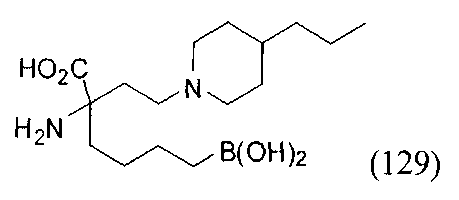
[0476] 2-амино-6-бороно-2-(2-(4-пропилпиперидин-1-ил)этил)гексановую кислоту получали аналогично способу, предложенному в Примере 16, с тем исключением что 4-пропилпиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,49-3,40 (m, 2H), 3,24-3,17 (m, 1H), 3,05-2,97 (m, 1H), 2,88-2,79 (m, 2H), 2,24-2,17 (m, 2H), 1,90-1,79 (m, 3Н), 1,76-1,70 (m, 1H), 1,53-1,42 (m, 1H), 1,35-1,05 (m, 10H), 0,74 (t, J=6,9 Гц, 2H), 0,65 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C16H33BN2O4 m/z [329,7 (M+1)].
[0477] Пример 130: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(2-этил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
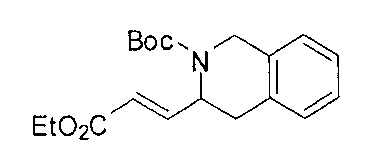
Стадия 1: Синтез (Е)-трет-бутил-3-(3-этокси-3-оксопроп-1-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата
[0478] Раствор трет-бутил-3-формил-3,4-дигидроизохинолин-2(1Н)-карбоксилата (8,4 г, 32,2 ммоль) в сухом ТГФ (200 мл, 0,16М) обрабатывали (этоксикарбонилметилен)-трифенилфосфораном (12,8 г, 37,0 ммоль) за один раз. После перемешивания при комнатной температуре в течение ночи растворитель выпаривали и полученный остаток растворяли в диэтиловом эфире. Гептан добавляли и осаждавшийся трифенилфосфиноксид отфильтровывали. Фильтрат концентрировали и очищали путем флэш-хроматографии (5-20% этилацетат в гексане) с получением (Е)-трет-бутил-3-(3-этокси-3-оксопроп-1-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата в виде желтой маслянистой жидкости (8,7 г, 82%). 1Н ЯМР (CDCl3, 500 МГц) δ 7,21-7,14 (m, 2H), 7,14-7,07 (m, 2H), 6,74 (dd, J1=15,8 Гц, J2=4,8 Гц, 1Н), 5,79 (dd, J1=15,8 Гц, J2=1,3 Гц, 1H), 4,72 (d, J=16,5 Гц, 1H),4,35 (d, J=16,5 Гц, 1H), 4,11 (qw, J=14,4 Гц, 2H), 3,18 (dd, J1=15,8 Гц, J2=6,2 Гц, 1H), 2,84 (d, J=15,8 Гц, 1H), 1,49 (s, 9H), 1,23 (t, J=14,4 Гц, 3Н). ИЭР МС эксперимент C19H25NO4 m/z [354,4 (М+23)].
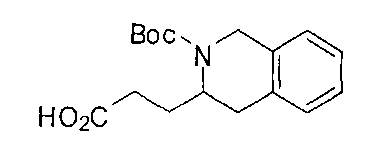
Стадия 2: Синтез 3-(2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил)пропановой кислоты
[0479] Из раствора (Е)-трет-бутил-3-(3-этокси-3-оксопроп-1-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата (8,7 г, 26,3 ммоль) и Pd/C (кат.) в этаноле (150 мл, 0,18М) откачивали воздух, затем обрабатывали баллонным водородом. После перемешивания в течение 4 часов 3М гидроксид натрия добавляли и доводили рН раствора до 11, смесь перемешивали в течение ночи. Полученный раствор фильтровали, концентрировали, подкисляли до рН 2 и экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали с получением 3-(2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил)пропановой кислоты в виде желтой маслянистой жидкости (7,7 г, 96%). ИЭР МС эксперимент C17H23NO4 [328,4 (М+23)]. Неочищенный продукт применяли без дополнительной очистки.
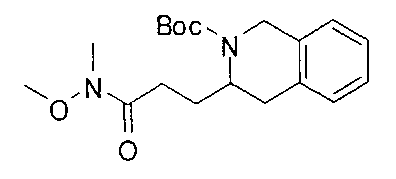
Стадия 3: Синтез трет-бутил-3-(3-(метокси(метил)амино)-3-оксопропил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата
[0480] Раствор 3-(2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил)пропановой кислоты (7,7 г, 25,2 ммоль) в дихлорметане (200 мл, 0,13М) обрабатывали тремя порциями CDI (6,1 г, 37,8 ммоль) в течение 10 минут при интенсивном перемешивании. После завершения добавления смесь дополнительно перемешивали в течение 40 минут и обрабатывали гидрохлоридом N,O-диметилгидроксиламина (3,7 г, 37,2 ммоль) и перемешивали в течение ночи. Полученный раствор промывали последовательно водой, 1М HCl, 1М NaOH, нас. водн. хлоридом натрия, сушили над безводным MgSO4, фильтровали и концентрировали с получением трет-бутил-3-(3-(метокси(метил)амино)-3-оксопропил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата в виде желтой маслянистой жидкости (8,6 г, 98%). ЖХМС, C19H28N2O4 m/z [371,4 (М+23)]. Неочищенный продукт применяли без дополнительной очистки.
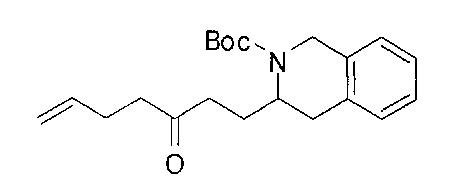
Стадия 4: Синтез трет-бутил-3-(3-оксогепт-6-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата
[0481] В атмосфере аргона в высушенную пламенем круглодонную колбу помещали магний (1,5 г, 62,9 ммоль), небольшой кристалл I2 и сухой ТГФ в количестве, достаточном для того, чтобы весь магний находился в растворителе. Смесь кипятили с обратным холодильником до обесцвечивания смеси (примерно 10 минут). Примерно 10% раствора 4-бром-1-бутена (61,7 ммоль) в ТГФ (100 мл) добавляли за один раз. Остаток раствора добавляли по каплям при осторожном кипячении. После завершения добавления нагревание продолжали в течение 5 минут (в реакцию вступал практически весь Mg).
Свежеполученный реактив Гриньяра затем добавляли в ледяной раствор трет-бутил-3-(3-(метокси(метил)амино)-3-оксопропил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата (8,6 г, 24,7 ммоль) в сухом ТГФ (100 мл). После перемешивания в течение ночи при комнатной температуре раствор выливали в насыщенный водный хлорид аммония и экстрагировали диэтиловым эфиром (3х). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением трет-бутил-3-(3-оксогепт-6-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата (8,0 г, 95%). ИЭР МС эксперимент C21H29NO3 m/z [366,5 (М+23)]. Неочищенный продукт применяли без дополнительной очистки.
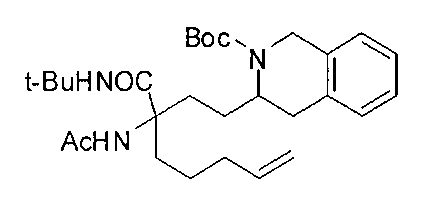
Стадия 5: Синтез трет-бутил-3-(3-ацетамидо-3-(трет-бутилкарбамоил)окт-7-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата
[0482] Раствор трет-бутил-3-(3-оксогепт-6-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата (2,0 г, 5,8 ммоль), т-бутилизонитрила (2,7 мл, 23,3 ммоль) и ацетата аммония (2,7 г, 34,8 ммоль) в 2,2,2-трифторэтаноле (3 мл, 1,9М) перемешивали при комнатной температуре до определения израсходования исходного кетона путем тонкослойной хроматографии (ТСХ). После завершения реакции реакционную смесь разбавляли этилацетатом, реакцию гасили 2М HCl и экстрагировали этилацетатом. Органический слой промывали последовательно 2М HCl и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной хроматографии (этилацетат в гексане) приводила к получению трет-бутил-3-(3-ацетамидо-3-(трет-бутилкарбамоил)окт-7-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата в виде желтой маслянистой жидкости (1,5 г, 53%). ИЭР МС эксперимент C28H43N3O4 m/z [508,6 (М+23)].
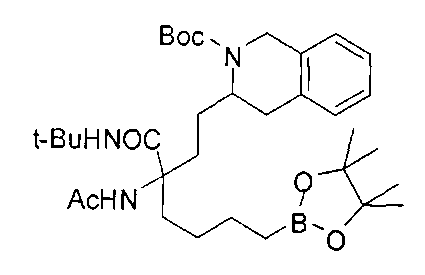
Стадия 6: Синтез трет-бутил-3-(3-ацетамидо-3-(трет-бутилкарбамоил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гептил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата
[0483] В атмосфере аргона раствор дихлорида бис(1,5-дициклооктадиен)дииридия (I) (54 мг, 3 мол.%), дифенилфосфиноэтана (64 мг, 6 мол.%) и 4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,5 мл, 10,7 ммоль) в сухом дихлорметане (20 мл) охлаждали до 0°С. Второй раствор трет-бутил-3-(3-ацетамидо-3-(трет-бутилкарбамоил)окт-7-енил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата (1,5 г, 2,67 ммоль) в сухом дихлорметане (20 мл) добавляли за один раз. Через 4 часа анализ ЖХМС показывал полное израсходование исходного олефина и реакционную смесь промывали последовательно водой, нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем флэш-хроматографии (20-35% этилацетат в гексане) приводила к получению трет-бутил-3-(3-ацетамидо-3-(трет-бутилкарбамоил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гептил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата в виде желтой маслянистой жидкости (1,5 г, 93%). ИЭР МС эксперимент С34Н56BN3О6 m/z [614,7 (M+1), 633,7 (М+23)].
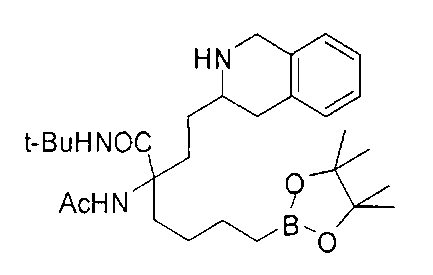
Стадия 7: Синтез 2-ацетамидо-N-трет-бутил-2-(2-(1,2,3,4-тетрагидроизохинолин-3-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида
[0484] Раствор трет-бутил-3-(3-ацетамидо-3-(трет-бутилкарбамоил)-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гептил)-3,4-дигидроизохинолин-2(1Н)-карбоксилата в этилацетате обрабатывали раствором HCl (газ.) в этилацетате (примерно 2М). После перемешивания в течение 30 минут реакционную смесь концентрировали насухо и неочищенный гидрохлорид применяли без дополнительной очистки.
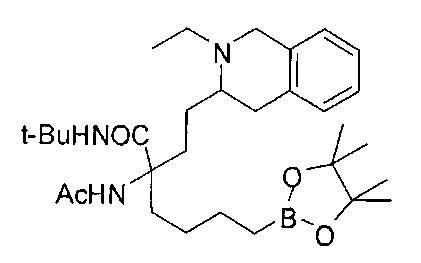
Стадия 8: Синтез 2-ацетамидо-N-трет-бутил-2-(2-(2-этил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида
[0485] Раствор ацетальдегида (0,06 мл, 1,1 ммоль) и 2-ацетамидо-N-трет-бутил-2-(2-(1,2,3,4-тетрагидроизохинолин-3-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (0,51 г, 1,0 ммоль) в дихлорметане перемешивали при комнатной температуре в течение 1 часа, затем обрабатывали триацетоксиборгидридом натрия (0,63 г, 3 ммоль). После перемешивания в течение ночи реакцию гасили 5% водн. NaHCO3 (масс./об.) и смесь экстрагировали дихлорметаном. Органический слой промывали последовательно 1М HCl, нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем флэш-хроматографии (1% метанол в хлороформе) приводила к получению 2-ацетамидо-N-трет-бутил-2-(2-(2-этил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида в виде маслянистой жидкости (0,45 г, 83%). ИЭР МС эксперимент C31H52BN3O4 m/z [b.e. 542,7 (M+1)].
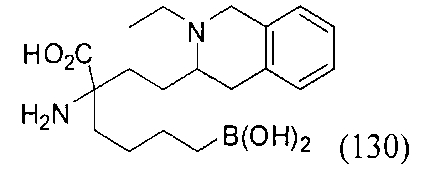
Стадия 9: Синтез 2-амино-6-бороно-2-(2-(2-этил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
[0486] Раствор 2-ацетамидо-N-трет-бутил-2-(2-(2-этил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (0,108 г, 0,2 ммоль) в 6н. HCl кипятили с обратным холодильником в течение 16 часов, охлаждали до комнатной температуры и концентрировали насухо. Очистка путем препаративной ВЭЖХ (20% ацетонитрил в воде, содержащей 0,1% трифторуксусную кислоту) приводила к получению 2-амино-6-бороно-2-(2-(2-этил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты в виде белого твердого вещества (90 мг, 83%). 1Н ЯМР (D2O, 500 МГц) δ 7,32-7,10 (m, 4H), 4,51-4,38 (m, 1H), 4,29-4,20 (m, 1H), 3,83-3,78 (m, 0,5H), 3,70-3,64 (m, 0,5H), 3,33-3,08 (m, 3H), 3,03-2,85 (m, 1H), 2,02-1,62 (m, 5,5H), 1,50-1,38 (m, 0,5H), 1,35-1,20 (m, 6Н), 1,17-1,05 (m, 1H), 0,70-0,60 (m, 2H). ИЭР МС эксперимент C19H31BN2O4 m/z [345,4 (M+1-18), 327,4 (M+1-2×18)].
[0487] Пример 131: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
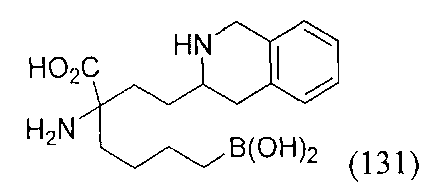
[0488] Дигидрохлорид 2-амино-6-бороно-2-(2-(1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что стадии 7 и 8 не проводили. 1Н ЯМР (D2O, 500 МГц) δ 7,29-7,13 (m, 4Н), 4,33 (bs, 2H), 3,59-3,50 (m, 1H), 3,18 (dd, J1=17,6 Гц, J2=5,3 Гц, 1Н), 2,87 (dd, J1=17,6 Гц, J2=10,6 Гц, 1H), 2,12-1,74 (m, 6H), 1,41-1,30 (m, 3H), 1,22-1,13 (m, 1H), 0,69 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C17H27BN2O4 m/z [335,4 (M+1), 317,4 (M+1-18)].
[0489] Пример 132: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(2-(4-хлорбензил)-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
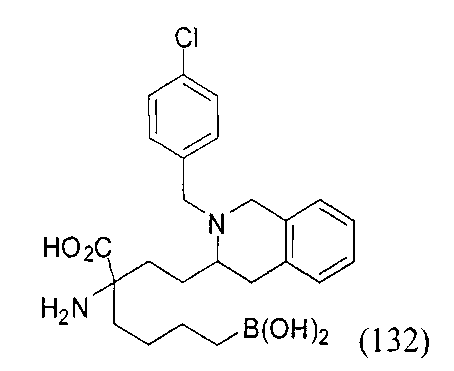
[0490] Дигидрохлорид 2-амино-6-бороно-2-(2-(2-(4-хлорбензил)-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что 4-хлорбензальдегид применяли в качестве альдегида на стадии 8. 1Н ЯМР (D2O, 500 МГц) δ 7,47-7,06 (m, 8H), 4,45-4,11 (m, 4Н), 3,83-3,64 (m, 1H), 3,32-3,20 (m, 1H), 3,07-2,90 (m, 1H), 2,05-1,40 (m, 6H), 1,39-1,21 (m, 3H), 1,22-1,06 (m, 1H), 0,71-0,60 (m, 2H). ИЭР МС эксперимент C24H32BClN2O4 m/z [441,4/443,5 (M+1-18)].
[0491] Пример 133: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(2-изопентил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
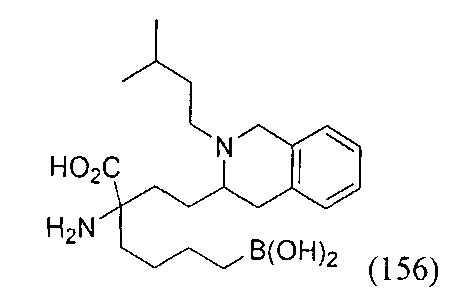
[0492] Дигидрохлорид 2-амино-6-бороно-2-(2-(2-изопентил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что изовалеральдегид применяли в качестве альдегида на стадии 8. 1H ЯМР (D2O, 500 МГц) δ 7,34-7,10 (m, 4H), 4,50-4,38 (m, 1H), 4,31-4,18 (m, 1H), 3,82-3,75 (m, 0,5H), 3,70-3,62 (m, 0,5H), 3,28-2,85 (m, 4H), 2,00-1,41 (m, 9H), 1,35-1,20 (m, 3H), 1,18-1,06 (m, 1H), 0,86-0,75 (m, 6H), 0,70-0,60 (m, 2H). ИЭР МС эксперимент C22H37BN2O4 m/z [427,2 (M+23), 387,5 (M+1-18)].
[0493] Пример 134: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(2-(циклогексилметил)-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
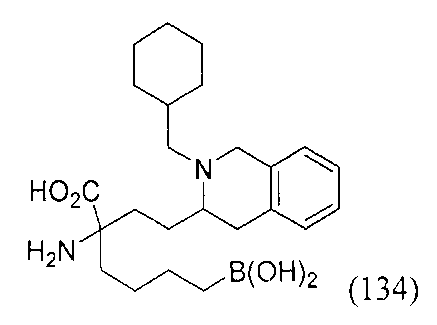
[0494] Дигидрохлорид 2-амино-6-бороно-2-(2-(2-(циклогексилметил)-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что циклогексанальдегид применяли в качестве альдегида на стадии 8. 1Н ЯМР (D2O, 500 МГц) δ 7,35-7,07 (m, 4H), 4,50-4,10 (m, 2H), 3,85-3,64 (m, 1H), 3,30-3,12 (m, 1H), 3,08-2,80 (m, 3H), 2,05-1,42 (m, 12H), 1,37-1,05 (m, 7H), 1,05-0,88 (m, 2H), 0,70-0,60 (m, 2H). ИЭР МС эксперимент C24H39BN2O4 m/z [431,6 (M+1), 413,6 (M+1-18)].
[0495] Пример 135: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(2-изобутил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты
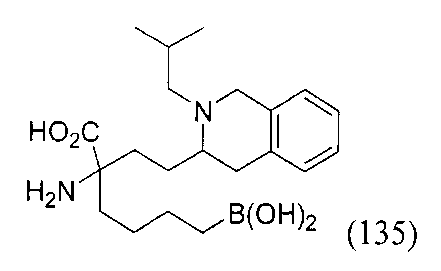
[0496] Дигидрохлорид 2-амино-6-бороно-2-(2-(2-изобутил-1,2,3,4-тетрагидроизохинолин-3-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что изобутиральдегид применяли в качестве альдегида на стадии 8. 1Н ЯМР (D2O, 500 МГц) δ 7,36-7,05 (m, 4H), 4,52-4,12 (m, 2H), 3,83-3,65 (m, 1H), 3,30-3,15 (m, 1H), 3,08-2,81 (m, 3H), 2,15-1,96 (m, 3,5H), 1,90-1,70 (m, 3H), 1,53-1,45 (m, 0,5H), 1,35-1,27 (m, 3H), 1,18-1,07 (m, 1H), 1,01-0,85 (m, 6H), 0,70-0,60 (m, 2H). ИЭР МС эксперимент C21H35BN2O4 m/z [391,5 (M+1), 373,5 (M+1-18)].
[0497] Пример 136: Получение дигидрохлорида 6-бороно-2-(3-(3,4-дихлорбензиламино)пропил)-2-(метиламино)гексановой кислоты
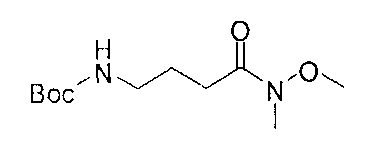
Стадия 1: Синтез трет-бутил-4-(метокси(метил)амино)-4-оксобутилкарбамата
[0498] В атмосфере аргона при комнатной температуре раствор 4-(трет-бутоксикарбониламино)бутановой кислоты (20 г, 0,098 моль) в дихлорметане (280 мл, 0,35М) обрабатывали CDI (17,6 г, 0,108 моль). Через 1,5 часа гидрохлорид O,N-диметилгидроксиламина (10,6 г, 0,108 моль) добавляли и полученный раствор перемешивали в течение ночи. Смесь добавляли в делительную воронку, разбавляли дихлорметаном (220 мл) и промывали последовательно 2М HCl (2х), 1М NaOH и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали с получением трет-бутил-4-(метокси(метил)амино)-4-оксобутилкарбамата (23,8 г, 98%). ИЭР МС эксперимент C11H22N2O4 m/z [269,4 (M+Na+].
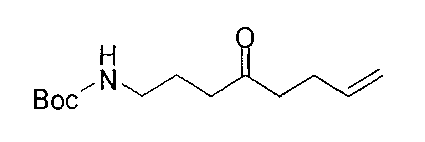
Стадия 2: Синтез трет-бутил-4-оксоокт-7-енилкарбамата
[0499] В атмосфере азота в высушенную пламенем круглодонную колбу помещали магний (3,95 г, 0,162 моль), небольшой кристалл I2 и сухой ТГФ в количестве, достаточном для того, чтобы весь магний находился в растворителе. Смесь кипятили с обратным холодильником до обесцвечивания раствора (примерно 10 минут). Затем добавляли раствор 4-бром-1-бутена (16,4 мл, 0,162 ммоль) в сухом ТГФ (70 мл), и нагревание продолжали в течение 10 минут. После охлаждения до комнатной температуры свежеприготовленный реактив Гриньяра добавляли в ледяной раствор трет-бутил-4-(метокси(метил)амино)-4-оксобутилкарбамата (10 г, 0,041 моль) в сухом ТГФ (100 мл). После перемешивания в течение ночи при комнатной температуре раствор выливали в насыщенный водный хлорид аммония (70 мл) и экстрагировали диэтиловым эфиром (2х). Органические экстракты объединяли и промывали последовательно 1,0М водн. HCl и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (15-30% этилацетат в гексане) приводила к получению трет-бутил-4-оксоокт-7-енилкарбамата в виде бесцветной маслянистой жидкости (6,04 г, 62%). ИЭР МС эксперимент C13H23NO3 m/z [264,3 (M+Na+)].
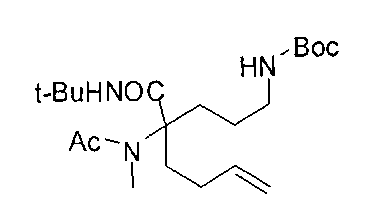
Стадия 3: Синтез трет-бутил-4-(трет-бутилкарбамоил)-4-(N-метилацетамидо)окт-7-енилкарбамата
[0500] Раствор трет-бутил-4-оксоокт-7-енилкарбамата (300 мг, 1,24 ммоль), ацетата метиламмония (680 мг, 7,46 ммоль) в 2,2,2-трифторэтаноле (2 мл) обрабатывали трет-бутилизоцианидом (0,56 мл, 5,0 ммоль) и перемешивали при комнатной температуре в течение 5 дней. Этилацетат (5 мл) и 2М водн. HCl (2 мл) добавляли и раствор интенсивно перемешивали в течение 3 часов. Фазы разделяли и органическую фазу промывали последовательно водой и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Неочищенный вязкий желтый маслянистый остаток очищали путем колоночной флэш-хроматографии (2% метанол в дихлорметане) с получением трет-бутил-4-(трет-бутилкарбамоил)-4-(N-метилацетамидо)окт-7-енилкарбамата (130 мг, 26%). 1Н ЯМР (CDCl3, 500 МГц) δ 5,81-5,73 (m, 1Н), 5,40 (s, 1H), 5,05-4,96 (m, 2H), 4,62 (bs, 1H), 3,15-3,09 (m, 2H), 3,01 (s, 3Н) 2,17-2,12 (m, 2H), 2,10 (s, 3Н) 2,04-1,94 (m, 2H), 1,77-1,71 (m, 2H), 1,43 (s, 9H), 1,38-1,34 (m, 2H), 1,32 (s, 9H). ИЭР МС эксперимент C21H39N3O4 m/z [420,5 (M+Na+), 442,4 (M+HCOO-), 396,6 (M-1)].
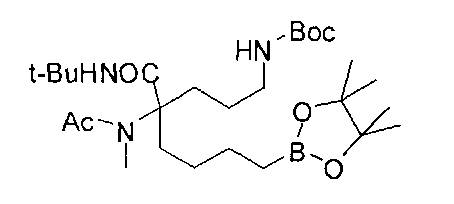
Стадия 4: Синтез трет-бутил-4-(трет-бутилкарбамоил)-4-(N-метилацетамидо)-8-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)октилкарбамата
[0501] В атмосфере аргона раствор дихлорида бис(1,5-дициклооктадиен)дииридия (I) (6 мг, 0,009 ммоль) и дифенилфосфиноэтана (7 мг, 0,018 ммоль) в дихлорметане (1 мл) охлаждали до 0°С и обрабатывали 4,4,5,5-тетраметил-1,3,2-диоксабороланом (0,174 мл, 1,2 ммоль). После перемешивания в течение 30 минут раствор трет-бутил-4-(трет-бутилкарбамоил)-4-(N-метилацетамидо)окт-7-енилкарбамата (120 мг, 0,3 ммоль) в дихлорметане (4 мл) добавляли и раствор дополнительно перемешивали в течение 16 часов. Дихлорметан (10 мл) добавляли и раствор промывали последовательно водой и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной хроматографии (3% метанол в дихлорметане) приводила к получению трет-бутил-4-(трет-бутилкарбамоил)-4-(N-метилацетамидо)-8-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)октилкарбамата (142 мг, 90%). ИЭР МС эксперимент C27H52BN3O6 m/z [548,7 (M+Na+), 526,7 (M+1), 570,8 (M+HCOO-), 524,6 (M-1)].
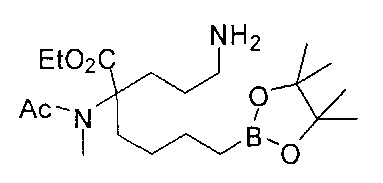
Стадия 5: Синтез гидрохлорида этил-2-(3-аминопропил}-2-(N-метилацетамидо)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата
[0502] Раствор трет-бутил-4-(трет-бутилкарбамоил)-4-(N-метилацетамидо)-8-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)октилкарбамата (140 мг, 0,266 ммоль) в этилацетате (2 мл) обрабатывали безв. HCl (2н. в этилацетате, 10 мл) и перемешивали при комнатной температуре. Через 30 минут раствор концентрировали с получением неочищенного гидрохлорида этил-2-(3-аминопропил)-2-(N-метилацетамидо)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде белого твердого вещества (130 мг). ИЭР МС эксперимент C20H39BN2O5 m/z [399,5 (M+1)]. Вещество применяли без дополнительной очистки.
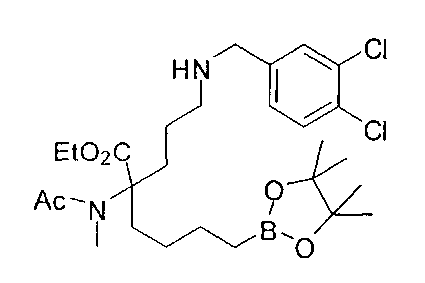
Стадия 6: Синтез гидрохлорида этил-2-(3-(3,4-дихлорбензиламино)пропил)-2-(N-метилацетамидо)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата
[0503] Раствор 3,4-дихлорбензальдегида (55 мг, 0,31 ммоль) и гидрохлорида этил-2-(3-аминопропил)-2-(N-метилацетамидо)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (120 мг, 0,26 ммоль) в дихлорметане (3 мл) перемешивали при комнатной температуре. Через 30 минут триацетоксиборгидрид натрия (138 мг, 0,65 ммоль) добавляли за один раз и перемешивание продолжали в течение ночи. После завершения раствор разбавляли дихлорметаном (10 мл), реакцию гасили 5% водн. NaHCO3 (масс./об., 5 мл) и интенсивно перемешивали в течение 30 минут. Слои разделяли и органическую фазу промывали водой и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (2-20% метанол в дихлорметане) приводила к получению этил-2-(3-(3,4-дихлорбензиламино)пропил)-2-(N-метилацетамидо)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (78 мг). ИЭР МС эксперимент C27H43BCl2N2O5 m/z [557,6/559,6 (М+1)].
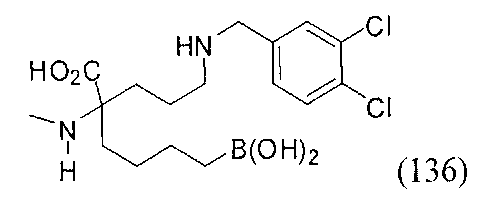
Стадия 7: Синтез дигидрохлорида 6-бороно-2-(3-(3,4-дихлорбензиламино)пропил)-2-(метиламино)гексановой кислоты
[0504] Раствор этил-2-(3-(3,4-дихлорбензиламино)пропил)-2-(N-метилацетамидо)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (76 мг) в 6М водн. HCl кипятили с обратным холодильником в течение 16 часов, концентрировали насухо и очищали путем препаративной ВЭЖХ. Полученный остаток перерастворяли в 2н. HCl и выпаривали с получением дигидрохлорида 6-бороно-2-(3-(3,4-дихлорбензиламино)пропил)-2-(метиламино)гексановой кислоты (19 мг, 12% - 3 стадии). 1Н ЯМР (D2O, 500 МГц) δ 7,55 (bs, 1H), 7,51 (d, J=7,5 Гц, 1Н), 7,28 (d, J=7,5 Гц, 1Н), 4,12 (s, 2Н), 3,02 (t, J=7,2 Гц, 2Н), 2,55 (s, 3Н), 1,91-1,68 (m, 5H), 1,60-1,49 (m, 1Н), 1,38-1,29 (m, 2Н), 1,28-1,19 (m, 1Н), 1,14-1,04 (m, 1Н), 0,70 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C17H27BCl2N2O4 m/z [405,4/407,4 (М+1)].
[0505] Пример 137: Получение дигидрохлорида 6-бороно-2-(метиламино)-2-(3-(пирролидин-1-ил)пропил)гексановой кислоты
Стадия 1: Получение трет-бутил-2-(дифенилметиленамино)гекс-5-еноата
[0506] В атмосфере аргона раствор трет-бутилового эфира N-(дифенилметилен)глицина (6,30 г, 21,33 ммоль) и 4-бромбутена (3,45 г, 25,56 ммоль) в свежеперегнанном ТГФ (50 мл) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом натрия (23,4 мл, 1,0М в ТГФ). После завершения добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 часов, охлаждали до 0°С, разбавляли диэтиловым эфиром и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Быстрая очистка путем ЖХСД (1-25% этилацетат в гептане, 8 CV) приводила к получению трет-бутил-2-(дифенилметиленамино)гекс-5-еноата в виде бесцветной маслянистой жидкости (7,00 г, 94%). Rf 0,50 (30% этилацетат в гептане).
Стадия 2: Получение трет-бутил-2-(дифенилметиленамино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата
[0507] В атмосфере аргона раствор трет-бутил-2-(дифенилметиленамино)гекс-5-еноата (7,00 г, 20,06 ммоль) в свежеперегнанном ТГФ (50 мл) охлаждали до -78°С и обрабатывали бис(триметилсилил)амидом натрия (60 мл, 1,0М в ТГФ). После перемешивания в течение 10 минут 2-(4-йодбутил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (12,4 г, 40,0 ммоль) добавляли и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 часов. Затем реакционную смесь охлаждали до 0°С, разбавляли диэтиловым эфиром и промывали последовательно насыщенным водным NaHCO3 и насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-20% этилацетат в гептане, содержащем 0,5% триэтиламина, 6 CV) приводила к получению трет-бутил-2-(дифенилметиленамино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата в виде бесцветной маслянистой жидкости (8,50 г, 80%). Rf 0,55 (30% этилацетат в гептане). ИЭР МС эксперимент C33H46BNO4 m/z [532,5 (М+1)].
Стадия 3: Получение трет-бутил-2-(трет-бутоксикарбониламино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата
[0508] Раствор трет-бутил-2-(дифенилметиленамино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата (5,31 г, 10,0 ммоль) в диэтиловом эфире (25 мл) обрабатывали 1н. HCl (25 мл). После перемешивания в течение 4 часов последовательно добавляли бикарбонат натрия (8,4 г, 0,1 моль) и ди-трет-бутилкарбонат (2,40 г, 11,0 ммоль). Через 16 часов слои разделяли и водный слой экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (0-20% этилацетат в гептане, 8 CV) приводила к получению трет-бутил-2-(трет-бутоксикарбониламино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата в виде бесцветной маслянистой жидкости (3,64 г, 78%). Rf 0,55 (30% этилацетат в гептане); ИЭР МС эксперимент C25H46BNO6 m/z [468,3 (М+1)].
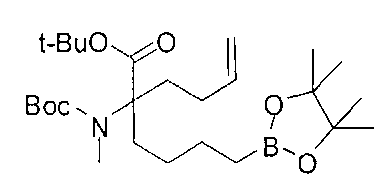
Стадия 5: Получение. трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата
[0509] В атмосфере аргона раствор трет-бутил-2-(трет-бутоксикарбониламино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата (1,35 г, 2,89 ммоль) в свежеперегнанном ТГФ (5 мл) охлаждали до 0°С и обрабатывали бис(триметилсилил)амидом натрия (6 мл, 1,0М в ТГФ) в атмосфере аргона. После перемешивания в течение 10 минут йодметан (2,04 г, 14,4 ммоль) добавляли и реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 часов. После определения завершения реакции путем ТСХ реакционную смесь охлаждали до 0°С, разбавляли диэтиловым эфиром и промывали насыщенным водным NaCl, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (1-20% этилацетат в гептане, содержащем 0,5% триэтиламина, 8 CV) приводила к получению трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата в виде бесцветной маслянистой жидкости (1,27 г, 91%). Rf 0,35 (20% этилацетат в гептане). ИЭР МС эксперимент C26H48BNO6 m/z [482,3 (М+1)].
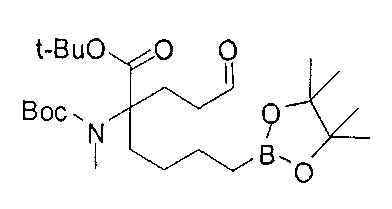
Стадия 6: Получение трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(3-оксопропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата
[0510] Раствор трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бутил)гекс-5-еноата (1,10 г, 2,29 ммоль) в дихлорметане (30 мл) охлаждали до -78°С и обрабатывали озоном до появления бледного сине-серого цвета. После того, как анализ ТСХ показывал отсутствие исходного вещества, подвод озона заменяли на подвод азота и азот продували через раствор в течение 20 минут для удаления избытка озона. Трифенилфосфин (1,50 г, 5,72 ммоль, 2,5 экв.) добавляли за один раз, охлаждающую баню удаляли и смесь перемешивали в течение 4 часов. Раствор концентрировали и очищали путем ЖХСД (0-40% этилацетат в гептане) с получением трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(3-оксопропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде бесцветной маслянистой жидкости (780 мг, 70%). Rf 0,40 (30% этилацетат в гептане). ИЭР МС эксперимент C25H46BNO7 m/z [484,3 (М+1)].
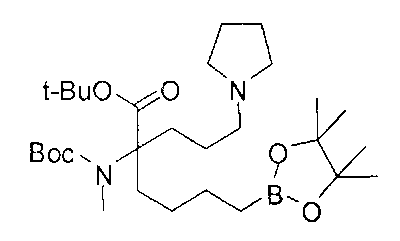
Стадия 6: Получение трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(3-(пирролидин-1-ил)пропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата
[0511] Раствор трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(3-оксопропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (193 мг, 0,40 ммоль, 1,0 экв.) и пирролидина (43 мг, 0,60 ммоль, 1,5 экв.) в 1,2-дихлорэтане (2 мл) обрабатывали триацетоксиборгидридом натрия (168 мг, 0,80 ммоль) за один раз. После перемешивания при комнатной температуре в течение ночи реакцию гасили насыщенным водным NaHCO3 (1 мл) и дополнительно перемешивали в течение 5 минут. Полученную смесь добавляли в делительную воронку, разбавляли насыщенным водным NaCl (5 мл) и экстрагировали дихлорметаном (2×10 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем колоночной флэш-хроматографии при градиентном элюировании 1-10% метанолом в хлороформе приводила к получению трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(3-(пирролидин-1-ил)пропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата в виде маслянистой жидкости (186 мг, 88%). Rf 0,35 (10% метанол в дихлорметане). ИЭР МС эксперимент C29H55BN2O6 m/z [539,4 (М+1)].
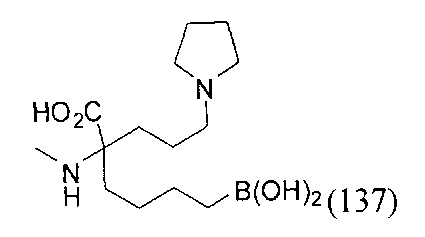
Стадия 7: Получение дигидрохлорида 6-бороно-2-(метиламино)-2-(3-(пирролидин-1-ил)пропил)гексановой кислоты
[0512] Раствор трет-бутил-2-(трет-бутоксикарбонил(метил)амино)-2-(3-(пирролидин-1-ил)пропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (183 мг, 0,33 ммоль) в 6н. хлороводородной кислоте (5 мл) перемешивали при 95°С в течение ночи. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (5 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением дигидрохлорида 6-бороно-2-(метиламино)-2-(3-(пирролидин-1-ил)пропил)гексановой кислоты в виде бесцветной пены (81 мг, 80%). 1Н ЯМР (D2O, 300 МГц) δ 3,55-3,45 (m, 2H), 3,14-3,05 (m, 2H), 2,98-2,87 (m, 2H), 2,53 (s, 3H), 2,03-1,92 (m, 2H), 1,92-1,76 (m, 6Н), 1,76-1,64 (m, 1H), 1,62-1,48 (m, 1H), 1,36-1,14 (m, 3H), 1,14-0,98 (m, 1H), 0,64 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C14H29BN2O4 m/z [301,2 (M+1)].
[0513] Пример 138: Получение дигидрохлорида 6-бороно-2-(3-(2,3-дигидро-1Н-инден-2-иламино)пропил)-2-(метиламино)гексановой кислоты
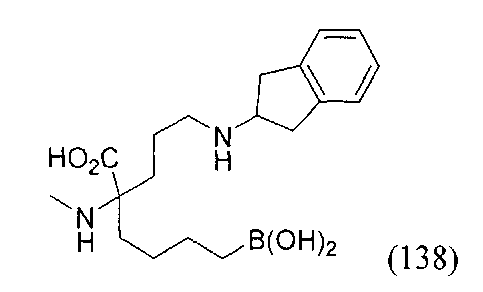
[0514] Дигидрохлорид 6-бороно-2-(3-(2,3-дигидро-1Н-инден-2-иламино)пропил)-2-(метиламино)гексановой кислоты получали аналогично способу, предложенному в Примере 137, с тем исключением, что 2,3-дигидро-1Н-инден-2-амин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,15-7,04 (m, 4H), 3,94-3,82 (m, 1H), 3,25-3,16 (m, 2H), 3,11-2,80 (m, 4H), 2,47 (s, 3H), 1,89-1,40 (m, 6Н), 1,27-1,07 (m, 3H), 1,07-0,92 (m, 1H), 0,58 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C19H31BN2O4 m/z [363,3 (M+1)].
[0515] Пример 139: Получение дигидрохлорида 6-бороно-2-(3-(4-хлорбензиламино)пропил)-2-(метиламино)гексановой кислоты
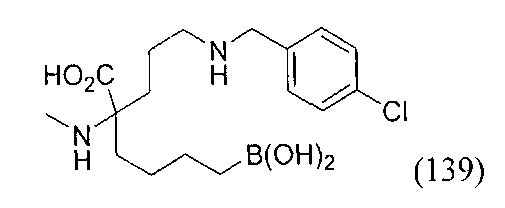
[0516] Дигидрохлорид 6-бороно-2-(3-(4-хлорбензиламино)пропил)-2-(метиламино)-гексановой кислоты получали аналогично способу, предложенному в Примере 137, с тем исключением, что 4-хлорбензиламин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,32-7,18 (m, 4H), 4,01 (s, 2H), 2,90 (t, J=7,2 Гц, 2Н), 2,46 (s, 3H), 1,84-1,38 (m, 6Н), 1,28-1,04 (m, 3H), 1,04-0,92 (m, 1H), 0,56 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C17H28BClN2O4 m/z [371,2 (M+1)].
[0517] Пример 140: Получение дигидрохлорида 2-амино-6-бороно-2-(3-(2,4-дихлорфенэтиламино)пропил)гексановой кислоты
Стадия 1: Синтез трет-бутил-4-ацетамидо-4-(трет-бутилкарбамоил)окт-7-енилкарбамата
[0518] Раствор трет-бутил-4-оксоокт-7-енилкарбамата (Пример 159, 2,17 г, 8,99 ммоль) и ацетата аммония (4,16 г, 53,9 ммоль) в 2,2,2-трифторэтаноле (7 мл) обрабатывали трет-бутилизоцианидом (4,1 мл, 35,9 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Этилацетат (15 мл) и 2М водн. HCl (10 мл) добавляли и раствор интенсивно перемешивали в течение 3 часов. Фазы разделяли и органическую фазу промывали последовательно водой и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Неочищенный вязкий желтый остаток очищали путем колоночной флэш-хроматографии (5-50% этилацетат в гексане) с получением трет-бутил-4-ацетамидо-4-(трет-бутилкарбамоил)окт-7-енилкарбамата (2,27 г, 66%). 1Н ЯМР (CDCl3, 500 МГц) δ 6,97 (s, 1H), 5,79-5,70 (m, 1H), 5,56 (s, 1H), 4,99-4,92 (m, 2H), 4,55 (bs, 1H), 3,08-3,06 (m, 2H), 2,78-2,67 (m, 2H), 2,03-1,93 (m, 1H), 1,99 (s, 3H), 1,84-1,76 (m, 1H), 1,42 (s, 9H), 1,38-1,34 (m, 2H), 1,36 (s, 9H), 1,29-1,24 (m, 2H), ИЭР МС эксперимент C20H37N3O4 m/z [406,5 (M+Na+), 384,6 (M+1), 382,5 (M-1)].
Стадия 2: Синтез трет-бутил-4-ацетамидо-4-(трет-бутилкарбамоил)окт-7-енилкарбамата
[0519] В атмосфере аргона раствор дихлорида бис(1,5-дициклооктадиен)дииридия (I) (26,2 мг, 0,039 ммоль) и дифенилфосфиноэтана (31 мг, 0,078 ммоль) в дихлорметане (3 мл) охлаждали до 0°С и обрабатывали 4,4,5,5-тетраметил-1,3,2-диоксабороланом (0,76 мл, 5,2 ммоль). После перемешивания в течение 30 минут раствор трет-бутил-4-ацетамидо-4-(трет-бутилкарбамоил)окт-7-енилкарбамата (500 мг, 1,3 ммоль) в дихлорметане (15 мл) добавляли и раствор дополнительно перемешивали в течение 16 часов. Дихлорметан (20 мл) добавляли и раствор промывали последовательно водой и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной хроматографии (3% метанол в дихлорметане) приводила к получению трет-бутил-4-ацетамидо-4-(трет-бутилкарбамоил)окт-7-енилкарбамата (530 мг, 80%). ИЭР МС эксперимент C26H50BN3O6 m/z [534,6 (M+Na+), 512,6 (M+1), 510,5 (M-1)].
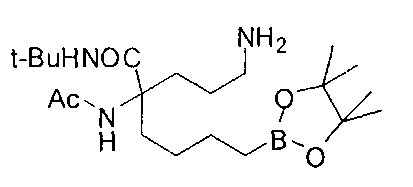
Стадия 3: Синтез 2-ацетамидо-2-(3-аминопропил)-N-трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида
[0520] Раствор трет-бутил-4-ацетамидо-4-(трет-бутилкарбамоил)окт-7-енилкарбамата (530 мг, 1,04 ммоль) в этилацетате (5 мл) обрабатывали безв. HCl (2н. в этилацетате, 15 мл) и перемешивали при комнатной температуре. Через 30 минут раствор концентрировали с получением неочищенного гидрохлорида 2-ацетамидо-2-(3-аминопропил)-N-трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида в виде белого твердого вещества (459 мг, 99%). ИЭР МС эксперимент C21H42BN3O4 m/z [434,6 (M+Na+), 412,6 (M+1), 410,5 (M-1)]. Вещество применяли без дополнительной очистки.
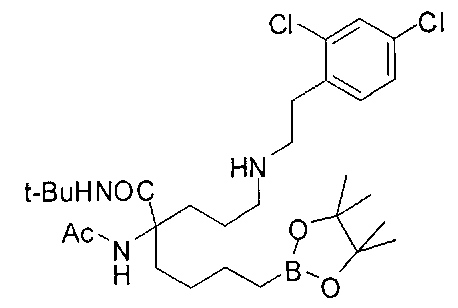
Стадия 4: Синтез 2-ацетамидо-N-трет-бутил-2-(3-(2,4-дихлорфенэтиламино)пропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида
[0521] Раствор (2,4-дихлорфенил)ацетальдегида (0,8 ммоль) и гидрохлорида 2-ацетамидо-2-(3-аминопропил)-N-трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (260 мг, 0,58 ммоль) в дихлорметане (5 мл) перемешивали при комнатной температуре. Через 30 минут триацетоксиборгидрид натрия (310 мг, 1,45 ммоль) добавляли за один раз и перемешивание продолжали в течение ночи. После завершения реакции раствор разбавляли дихлорметаном (10 мл), реакцию гасили 5% водн. NaHCO3 (масс./об., 5 мл) и интенсивно перемешивали в течение 30 минут. Слои разделяли и органическую фазу промывали водой и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (1-20% метанол в дихлорметане) приводила к получению 2-ацетамидо-N-трет-бутил-2-(3-(2,4-дихлорфенэтиламино)пропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (140 мг, 47%). ИЭР МС эксперимент C29H48BCl2N3O4 m/z [584,6/586,6 (M+1)].
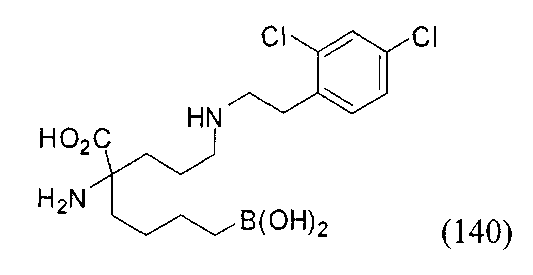
Стадия 5: Синтез 2-амино-6-бороно-2-(3-(2,4-дихлорфенэтиламино)пропил)гексановой кислоты
[0522] Раствор 2-ацетамидо-N-трет-бутил-2-(3-(2,4-дихлорфенэтиламино)пропил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (140 мг) в 6М водн. HCl кипятили с обратным холодильником в течение 16 часов, концентрировали насухо и очищали путем препаративной ВЭЖХ с получением дигидрохлорида 2-амино-6-бороно-2-(3-(2,4-дихлорфенэтиламино)пропил)гексановой кислоты (110 мг, 98%). 1Н ЯМР (D2O, 500 МГц) δ 7,45 (bs, 1Н), 7,23 (bs, 2H), 3,19 (t, J=7,5 Гц, 2Н), 3,06-2,95 (m, 4H), 1,91-1,71 (m, 5H), 1,60-1,49 (m, 1H), 1,34-1,25 (m, 3Н), 1,17-1,08 (m, 1H), 0,69 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C17H27BCl2N2O4 m/z [387,5/389,4 (M+1-18)].
[0523] Пример 141: Получение дигидрохлорида 2-амино-6-бороно-2-(3-(3,4-дихлорбензиламино)пропил)гексановой кислоты
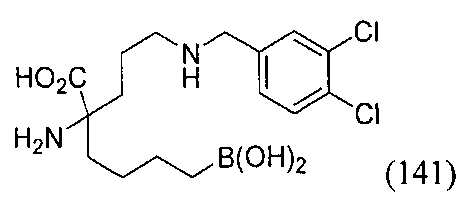
[0524] Дигидрохлорид 2-амино-6-бороно-2-(3-(3,4-дихлорбензиламино)пропил)-гексановой кислоты получали аналогично способу, предложенному в Примере 140, с тем исключением, что 3,4-дихлорбензальдегид применяли в качестве альдегида на стадии 4. 1Н ЯМР (D2O, 500 МГц) δ 7,57-7,48 (m, 2Н), 7,30-7,26 (m, 1H), 4,11 (s, 2Н), 3,00 (t, J=7,5 Гц, 2Н), 1,90-1,68 (m, 5H), 1,63-1,51 (m, 1H), 1,35-1,25 (m, 3H), 1,17-1,09 (m, 1H), 0,69 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C16H25BCl2N2O4 m/z [391,4/393,4 (M+1)].
[0525] Пример 142: Получение дигидрохлорида 2-амино-6-бороно-2-(2-(4-(4-хлорбензил)пиперидин-1-ил)этил)гексановой кислоты
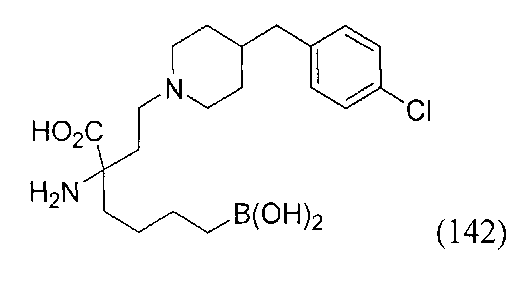
[0526] Дигидрохлорид 2-амино-6-бороно-2-(2-(4-(4-хлорбензил)пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 16, с тем исключением, что 4-(4-хлорбензил)пиперидин применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,20 (d, J=8,5 Гц, 2Н), 7,05 (d, J=8,5 Гц, 2Н), 3,45-3,38 (m, 2Н), 3,21-3,15 (m, 1H), 3,04-2,96 (m, 1H), 2,82-2,74 (m, 2Н), 2,45-2,41 (m, 2H), 2,20-2,14 (m, 2Н), 1,85-1,68 (m, 5H), 1,35-1,20 (m, 5H), 1,13-1,04 (m, 1H), 0,64 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C20H32BClN2O4 m/z [375,5 (M-2×18+1)].
[0527] Пример 143: Получение дигидрохлорида 2-амино-6-бороно-2-(2-((S)-пирролидин-2-ил)этил)гексановой кислоты
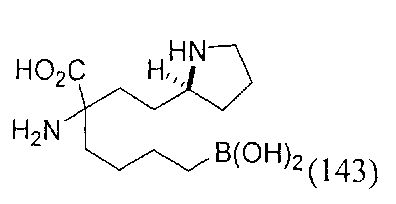
[0528] Дигидрохлорид 2-амино-6-бороно-2-(2-((S)-пирролидин-2-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что 1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту применяли в качестве карбоновой кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,48-3,36 (m, 1H), 3,23-3,10 (m, 2H), 2,19-2,04 (m, 1H), 2,00-1,45 (m, 9H), 1,37-1,21 (m, 3H), 1,19-1,03 (m, 1H), 0,64 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C12H25BN2O4 m/z [273,2 (M+1), 255,2 (M+1-18)].
[0529] Пример 144: Получение дигидрохлорида 6-бороно-2-(метиламино)-2-(2-((S)-пирролидин-2-ил)этил)гексановой кислоты
[0530] 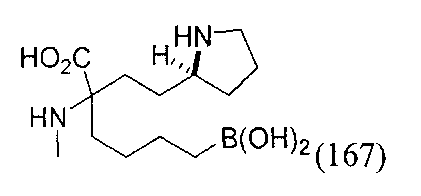
[0531] Дигидрохлорид 6-бороно-2-(метиламино)-2-(2-((S)-пирролидин-2-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 130, с тем исключением, что 1-(трет-бутоксикарбонил)пирролидин-2-карбоновую кислоту применяли в качестве карбоновой кислоты на стадии 1 и ацетат метиламмония применяли вместо ацетата аммония на стадии 5. 1Н ЯМР (D2O, 300 МГц) δ 3,48-3,34 (m, 1H), 3,23-3,10 (m, 2H), 2,52 (bs, 3H), 2,18-2,04 (m, 1H), 2,00-1,70 (m, 6H), 1,70-1,40 (m, 3H), 1,37-1,16 (m, 3H), 1,14-0,97 (m, 1H), 0,63 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C13H27BN2O4 m/z [287,3 (M+1), 269,3 (M+1-18)].
[0532] Пример 145: Получение гидрохлорида 6-бороно-2-(4-хлорбензиламино)гексановой кислоты
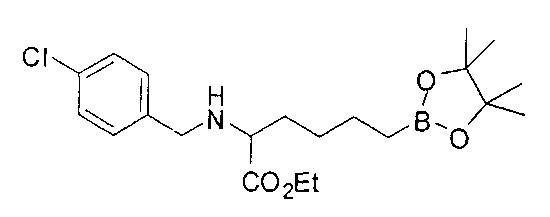
Стадия 1: Получение этил-2-(4-хлорбензиламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата
[0533] Раствор этил-2-амино-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (119 мг, 0,42 ммоль) в 1,2-дихлорэтане (1 мл) обрабатывали 4-хлорбензальдегидом (89 мг, 0,63 ммоль). После перемешивания в течение 10 минут триацетоксиборгидрид натрия (230 мг, 1,05 ммоль) добавляли и перемешивание продолжали в течение 18 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным водн. бикарбонатом натрия и нас. водн. хлоридом натрия, сушили над MgSO4 и концентрировали. Очистка путем колоночной хроматографии (4-32% этилацетат в гептане) приводила к получению этил-2-(4-хлорбензиламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (59 мг, 34%). Rf 0,28 (20% этилацетат в гептане). 1H ЯМР (CDCl3, 300 МГц) δ 7,29-7,25 (m, 4H), 4,21 (q, J=7,7 Гц, 2Н), 3,78, 3,58 (ABq, JAB=13,2 Гц, 2Н), 3,20 (t, J=7,0 Гц, 1Н), 1,80-1,57 (m, 2Н), 1,42-1,34 (m, 4H), 1,30-1,21 (m, 15H), 0,77 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C21H33B1Cl1N1O4 m/z [410,1 (M+1)].
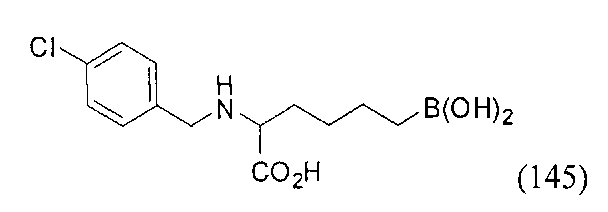
Стадия 2: Получение гидрохлорида 6-бороно-2-(4-хлорбензиламино)гексановой кислоты
[0534] Раствор этил-2-(4-хлорбензиламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (59 мг) в 6М водн. HCl кипятили с обратным холодильником в течение 16 часов, концентрировали насухо и очищали путем препаративной ВЭЖХ. Остаток перерастворяли в 2н. HCl и выпаривали с получением гидрохлорида 6-бороно-2-(4-хлорбензиламино)гексановой кислоты (36 мг, 83%). 1Н ЯМР (CD3OD, 300 МГц) δ 7,56-7,46 (m, 4H), 4,23 (s, 2Н), 4,09-3,98 (m, 1Н), 2,02-1,91 (m, 2Н), 1,52-1,37 (m, 4H), 0,81 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C13H19B1Cl1N1O4 m/z [300,2 (M+1)].
[0535] Пример 146: Получение гидрохлорида 6-бороно-2-(метиламино)гексановой кислоты
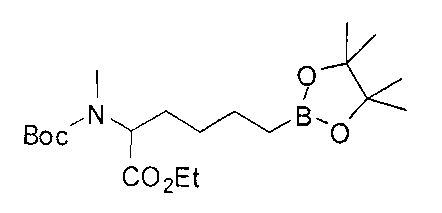
Стадия 1: Получение этил-2-(трет-бутоксикарбонил(метил)амино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата
[0536] Раствор этил-2-(трет-бутоксикарбониламино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (104 мг, 0,27 ммоль) в ТГФ (2,7 мл) охлаждали до 0°С и обрабатывали метилйодидом (0,084 мл, 1,35 ммоль) и NaHMDS (0,41 мл, 1М раствор в ТГФ, 0,41 ммоль). После перемешивания в течение 16 часов при комнатной температуре дополнительно добавляли метилйодид (0,042 мл, 0,77 ммоль) и смесь нагревали до 35°С в течение 6 часов. Реакцию гасили насыщенным раствором NH4Cl (2 мл), смесь разбавляли этилацетатом, промывали насыщенным водным раствором бикарбоната натрия, нас. водн. хлоридом натрия, сушили над MgSO4 и концентрировали. Очистка путем колоночной хроматографии (5-40% этилацетат в гептане) приводила к получению этил-2-(трет-бутоксикарбонил(метил)амино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (59 мг, 55%). Rf 0,34 (20% этилацетат в гептане). 1H ЯМР (CDCl3, 300 МГц) δ 4,72-4,68, 4,43-4,38 (m, 1H, ротамеры), 4,15 (q, J=7,3 Гц, 2Н), 2,81, 2,77 (s, 3H, ротамеры), 1,87-1,61 (m, 2Н), 1,53-1,23 (m, 28H), 0,78 (t, J=7,3 Гц, 2Н). ИЭР МС эксперимент C20H38B1N1O6 m/z [400,5 (M+1)].
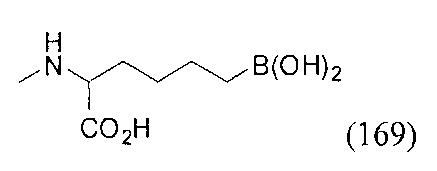
Стадия 2: Получение 6-бороно-2-(метиламино)гексановой кислоты
[0537] Раствор этил-2-(трет-бутоксикарбонил(метил)амино)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексаноата (59 мг) в 6М водн. HCl кипятили с обратным холодильником в течение 16 часов, концентрировали насухо и очищали путем препаративной ВЭЖХ. Остаток перерастворяли в 2н. HCl и выпаривали с получением 6-бороно-2-(метиламино)гексановой кислоты в виде белого твердого вещества (24 мг, 72%). 1Н ЯМР (CD3OD, 300 МГц) δ 3,94 (t, J=5,9 Гц), 2,72 (s, 3H), 1,45-1,34 (m, 4H), 0,81 (t, J=7,0 Гц, 2Н). ИЭР МС эксперимент C7H16B1N1O4 m/z [190,0 (M+1)].
[0538] Пример 147: Получение дигидрохлорида 2-амино-6-бороно-2-(3-(пиперидин-1-ил)пропил)гексановой кислоты
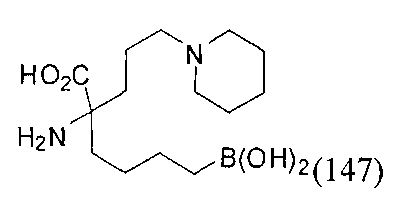
[0539] Дигидрохлорид 2-амино-6-бороно-2-(3-(пиперидин-1-ил)пропил)гексановой кислоты получали аналогично способу, предложенному в Примере 137, с тем исключением, что стадию 5 не проводили и пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (CD3OD, 300 МГц) δ 3,60-3,49 (m, 2Н), 3,24-2,93 (m, 4H), 1,99-1,79 (m, 10Н), 1,45-1,29 (m, 6H), 0,83 (t, J=6,6 Гц, 2Н). ИЭР МС эксперимент C14H29B1N2O4 m/z [301,10 (M+1)].
[0540] Пример 148: Получение дигидрохлорида 6-бороно-2-(метиламино)-2-(3-(пиперидин-1-ил)пропил)гексановой кислоты
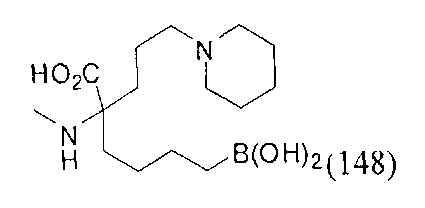
[0541] Дигидрохлорид 6-бороно-2-(метиламино)-2-(3-(пиперидин-1-ил)пропил)-гексановой кислоты получали аналогично способу, предложенному в Примере 137, с тем исключением, что пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 3,37 (d, J=13,2 Гц, 2Н), 2,98 (t, J=6,6 Гц, 2Н), 2,79 (t, J=12,5 Гц, 2Н), 2,49 (s, 3Н), 1,83-1,39 (m, 10Н), 1,35-1,01 (m, 6H), 0,67 (t, J=7,7 Гц, 2Н). ИЭР МС эксперимент C15H31B1N2O4 m/z [315,4 (M+1)].
[0542] Пример 149: Получение дигидрохлорида 6-бороно-2-(метиламино)-2-(2-(пиперидин-1-ил)этил)гексановой кислоты
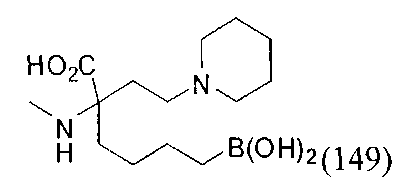
[0543] Дигидрохлорид 6-бороно-2-(метиламино)-2-(2-(пиперидин-1-ил)этил)гексановой кислоты получали аналогично способу, предложенному в Примере 137, с тем исключением, что аллилйодид применяли в качестве алкилирующего агента на стадии 1 и пиперидин применяли в качестве амина на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 3,48 (br t, J=12,1 Гц), 3,22-3,11 (m, 1H), 3,03-2,76 (m, 3Н), 2,52 (s, 3Н), 2,23-2,03 (m, 2Н), 1,85-1,51 (m, 8H), 1,40-1,03 (m, 6H), 0,67 (t, J=7,7 Гц, 2Н). ИЭР МС эксперимент C14H29B1N2O4 m/z [301,4 (M+1)].
II. СИНТЕЗ СОЕДИНЕНИЙ ФОРМУЛЫ II
[0544] В дополнение к предложенным выше методикам, которые в целом можно применять для получения всех соединений, описанных в настоящей заявке, в настоящем изобретении также предложены методики, которые больше подходят для получения соединений Формулы II. Таким образом, в одном из вариантов реализации синтез соединения Формулы II проводят при помощи реакции Уги (Doemling, A., Chem. Rev. 2006, ]06, 17-89). Этот способ проиллюстрирован на Схеме А-1. Таким образом, обработка кетона или альдегида (А-3) изоцианатом, таким как трет-бутилизоцианат, и источником амина, например, ацетатом аммония, приводит к получению производного аминокислоты, в котором карбоновая кислота защищена трет-бутиламидом, а α-аминогруппа защищена ацетамидом. Применяя различные изоцианаты и амины в качестве исходных веществ, таким образом, получают ряд предшественников аминокислот, аминогруппа и карбоксильная группа в которых ортогонально защищены. Если желательно получение оптически активных продуктов, то хиральные оптически чистые изоцианаты и/или источники амина можно применять. Реакции с использованием этих реагентов могут быть энантиоселективными или, по меньшей мере, могут приводить к получению диастереомерных смесей продуктов, которые можно разделять при помощи способов аналитического разделения, известных в химии.
[0545] Схема A-I
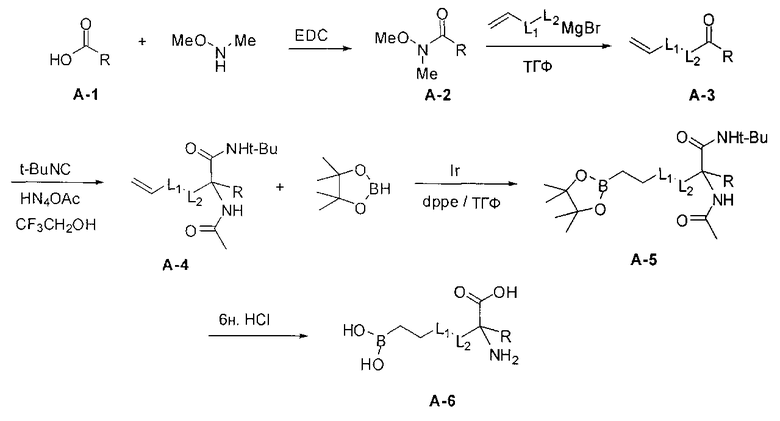
[0546] Синтез ключевого промежуточного соединения А-3, показанного на Схеме А-1, можно проводить при помощи нескольких способов. В одном из этих способов применяют активированную карбоновую кислоту А-1 и метоксиметиламин для получения амида Вайнреба А-2. В качестве альтернативы проводят сочетание карбоновой кислоты и амина с применением ряда агентов сочетания, таких как EDC, DCC или РуВОР, или применяют непосредственно хлорангидрид А-1. Амид Вайнреба затем превращают в целевой кетон путем взаимодействия с соответствующим реактивом Гриньяра для получения целевого промежуточного соединения А-3, которое подвергают взаимодействию с соответствующим изоцианатом в присутствии амина, например, ацетата аммония, для получения А-4.
[0547] Взаимодействие терминального олефина А-4 с источником борана, например, с пинаколбораном, приводит к получению производного бороновой кислоты (А-5), из которого после снятия защиты получают целевое соединение, α-бороноаминокислоту А-6.
[0548] Специалистам в области органического синтеза будет понятно, что существует несколько способов асимметрического синтеза замещенных аминокислот. См., например, Vogt, H. and Brase, S. Organic & Biomolecular Chemistry 2007, 5, 406-430.
[0549] В другом варианте реализации соединения Формулы II синтезируют при помощи общего способа, проиллюстрированного на Схеме B-I. Таким образом, взаимодействие промежуточного кетона В-1 (полученного при помощи способов, изображенных на Схеме A-I) с хиральным реагентом, например, с (R) или (S)-N-трет-бутансульфинамидом (В-2) в присутствии кислоты Льюиса, например, Ti(OEt)4, приводит к получению соответствующего трет-бутансульфинилимина В-3. См. Ellman, J.А.; Owens, Т.D. and Tang, Т.Р. Асc. Chem. Res. 2002, 35, 984-995.
[0550] Стереоселективное введение цианида проводят путем взаимодействия трет-бутансульфинилимина В-3 с Et2AlCN. Если соответствующий аминонитрил В-4 получают в виде смеси двух изомеров, то изомерную смесь разделяют путем хроматографии. Последующее гидроборирование терминальной двойной связи с применением большого числа боранов, например, пинаколборана, в присутствии иридиевого катализатора приводит к получению соответствующего промежуточного пинаколборана В-6. Гидролиз промежуточного соединения В-6 с применением сильной кислоты, например, 6н. HCl, приводит к превращению цианогруппы в карбоксильную группу, а также к снятию защиты диоксаборановой группы с получением целевого соединения В-7.
[0551] Схема В-I
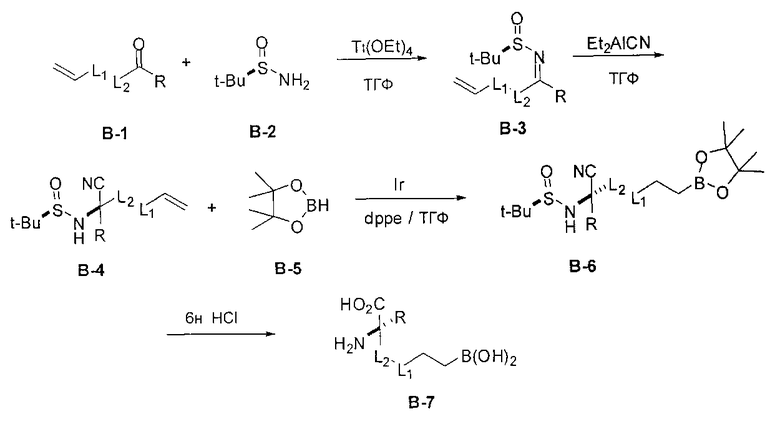
[0552] Специалистам в данной области техники будет понятно, что исходные вещества и условия могут различаться, последовательность реакций можно изменять, также можно проводить дополнительные стадии для синтеза соединений Формулы II, что показано в предложенных ниже Примерах. Как утверждалось выше, в некоторых случаях введение защиты определенных реакционноспособных функциональных групп может быть необходимым для проведения некоторых вышеуказанных превращений. В целом, необходимость введения указанных защитных групп, а также условия, необходимые для присоединения и удаления указанных групп, очевидны специалистам в области органического синтеза.
[0553] Описание всех статей и ссылок, указанных в настоящей заявке, включая патенты, включены посредством ссылок. Получение соединений согласно настоящему изобретению дополнительно проиллюстрировано предложенными ниже примерами, которые не следует рассматривать как ограничивающие объем или сущность изобретения описанными в этих примерах конкретными способами и соединениями.
ТИПОВЫЕ СОЕДИНЕНИЯ ФОРМУЛЫ II
[0554] Пример 1-А: гидрохлорид 2-амипо-6-бороно-2-(5′-трифторметил-3,4,5,6-тетрагидро-2H-[1,2′]бипиридин-4-ил)гексановой кислоты
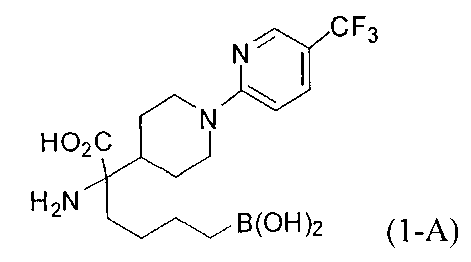
[0555] 2-амино-6-бороно-2-(5′-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 116, с тем исключением, что 5-трифторметил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-карбоновую кислоту применяли на стадии 1. Продукт выделяли в виде белого твердого вещества. 1H ЯМР (D2O, 300 МГц) δ 8,12, (s, 1H), 7,98 (d, J=9,5 Гц, 1Н), 7,28 (dd, J1=9,5 Гц, J2=1 Гц, Н), 4,15 (m, 2H), 3,20 (m, 2H), 2,22 (m, 1H), 1,99 (d, J=12,5 Гц, 1H), 1,72-1,88 (m, 3H), 1,61 (qd, J1=12,5 Гц, J2=3,5 Гц, 1H), 1,22-1,39 (m, 4H), 1,09 (m, 1H), 0,65 (t, J=7 Гц, 2H); МС (+CI): m/z C17H25BF3N3O4: ожидаемое 403,2; эксперимент 404,2 (М+Н)+, 386,3 (М+H-H2O)+, 367,9 (М+Н-2H2O)+.
[0556] Пример 2-А: гидрохлорид 2-амино-6-бороно-2-[(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]гексановой кислоты
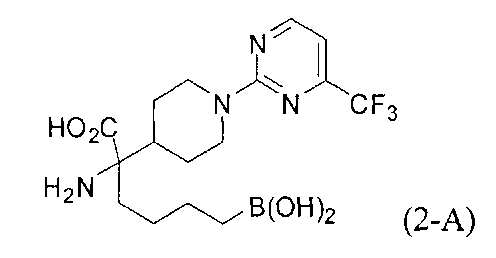
[0557] 2-амино-6-бороно-2-[(4-трифторметилпиримидин-2-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 116, с тем исключением, что 1-(4-трифторметилпиримидин-2-ил)пиперидин-4-карбоновую кислоту применяли на стадии 1. Продукт выделяли в виде белой твердой гидрохлоридной соли. 1H ЯМР (D2O, 300 МГц) δ 8,38, (d, J=5,5 Гц, 1H), 6,97 (d, J=5,5 Гц, 1H), 4,53 (m, 2H), 2,97 (m, 2H), 2,18 (m, 1H), 1,79-1,92 (m, 3H), 1,66, (m, 1H), 1,47 (qd, J1=13 Гц, J2=4 Гц, 1H), 1,17-1,34 (m, 4H), 1,09 (m, 1H), 0,65 (t, J=7,5 Гц, 2H); МС (+CI): m/z C16H24BF3N4O4: ожидаемое 404,2; эксперимент 405,2 (М+Н)+, 387,2 (М+Н-Н2О)+, 369,1 (М+Н-2H2O)+.
[0558] Пример 3-А: гидрохлорид 2-амино-6-бороно-2-[(2-трифторметилхинолин-4-ил)пиперидин-4-ил]гексановой кислоты
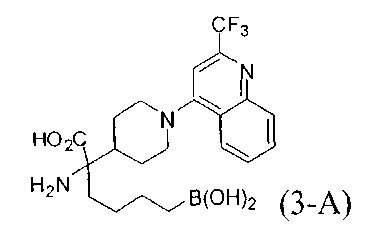
[0559] 2-амино-6-бороно-2-[(2-трифторметилхинолин-4-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 116, с тем исключением, что 1-(2-трифторметилхинолин-4-ил)пиперидин-4-карбоновую кислоту применяли на стадии 1. Продукт выделяли в виде бледно-желтой твердой гидрохлоридной соли. 1Н ЯМР (D2O, 300 МГц) δ 7,99, (d, J=7,5 Гц, 1H), 7,74-7,85 (m, 2H), 7,55 (ddd, J1=8,5 Гц, J2=6,5 Гц, J3=2,5 Гц, 1H), 7,28 (s, 1H), 4,35 (m, 2H), 3,46 (m, 2H), 2,29 (m, 1H,), 2,01 (m, 1H), 1,75-1,89 (m, 3Н), 1,49, (m, 1H), 1,22-1,36 (m, 4H), 1,12 (m, 1H), 0,67 (t, J=7,5 Гц, 2H); MC (+CI): m/z C21H27BF3N3O4: ожидаемое 453,2; эксперимент 454,4 (М+Н)+, 436,4 (М+Н-H2O)+, 418,0 (М+Н-2H2O)+.
[0560] Пример 4-А: гидрохлорид 2-амино-6-бороно-2-[(6-хлорбензоксазол-2-ил)пиперидин-4-ил]гексановой кислоты
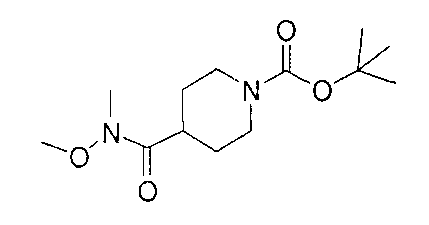
Стадия 1: трет-бутил-4-[метокси(метил)карбамоил]пиперидин-1-карбоксилат
[0561] EDC (6,29 г, 32,8 ммоль) добавляли несколькими частями в перемешиваемый раствор трет-бутилового моноэфира пиперидин-1,4-дикарбоновой кислоты (5,0 г, 21,8 ммоль), DMAP (10 мг) и гидрохлорида N,O-диметилгидроксиламина (3,21 г, 32,8 ммоль) в дихлорметане (100 мл). В полученный раствор добавляли по каплям триэтиламин (9,4 мл, 65,6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. На следующий день реакционную смесь выливали в воду и водный слой экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением бесцветной маслянистой жидкости. Очистка путем колоночной хроматографии (силикагель, 0-40% этилацетат в гептане) приводила к получению трет-бутил-4-[метокси(метил)карбамоил]пиперидин-1-карбоксилата (5,04 г, 85%) в виде бесцветной маслянистой жидкости; 1Н ЯМР (CDCl3, 300 МГц) δ 4,16 (m, 2H), 3,70 (s, 3Н), 3,17 (s, 3Н), 2,72-2,86 (m, 3H), 1,62-1,75 (m, 4H), 1,44 (s, 9H).
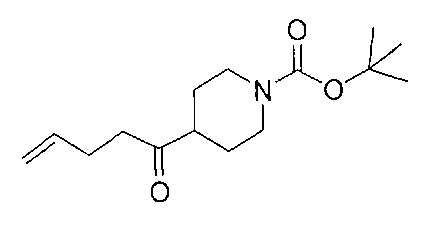
Стадия 2: трет-бутил-4-пент-4-елоилпиперидин-1-карбоксилат
[0562] Раствор трет-бутил-4-[метокси(метил)карбамоил]пиперидин-1-карбоксилата (5,04 г, 18,53 ммоль) в тетрагидрофуране (50 мл), выдерживаемый в атмосфере азота, охлаждали до 0°С. В охлажденный раствор добавляли раствор бромида 4-бутенилмагния в ТГФ (0,5М в ТГФ, 45 мл, 22,5 ммоль) по каплям. Раствор перемешивали в течение 1 часа при 0°С, затем оставляли нагреваться до комнатной температуры на ночь. Полученный раствор выливали в воду, подкисляли до рН 3-4 1н. хлороводородной кислотой и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 0-25% этилацетат в гептане) приводила к получению трет-бутил-4-пент-4-еноилпиперидин-1-карбоксилата в виде бесцветной маслянистой жидкости (4,37 г, 88%); 1Н ЯМР (CDCl3, 300 МГц) δ 5,79 (m, 1Н), 4,98 (m, 2Н), 4,10 (m, 2H), 2,76 (t, J=11,5 Гц, 2H), 2,54 (m, 2H), 2,46 (tt, J1=11,5 Гц, J2=3,5 Гц, 1Н), 2,32 (m, 2H), 1,78 (m, 2H), 1,48-1,58 (m, 2H), 1,45 (s, 9H).
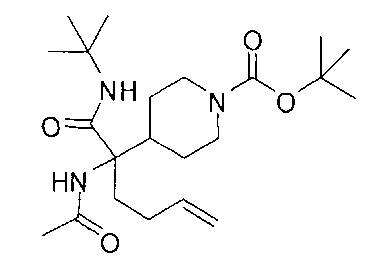
Стадия 3: трет-бутил-4-(1-ацетиламино)-1-трет-бутилкарбамоилпент-4-енил)пиперидин-1-карбоксилат
[0563] Раствор трет-бутил-4-пент-4-еноилпиперидин-1-карбоксилата (4,37 г, 16,36 ммоль) и ацетата аммония (5,11 г, 65,5 ммоль) в 2,2,2-трифторэтаноле (4 мл) обрабатывали трет-бутилизоцианидом (2,72 г, 3,70 мл, 32,75 ммоль). После перемешивания при комнатной температуре в течение 8 дней реакционную смесь добавляли в делительную воронку, разбавляли водой (100 мл) и экстрагировали этилацетатом (2×100 мл). Органический слой промывали насыщенным водным хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 10-60% этилацетат в гептане) приводила к получению трет-бутил-4-(1-ацетиламино)-1-трет-бутилкарбамоилпент-4-енил)пиперидин-1-карбоксилата в виде белого твердого вещества (5,4 г, 81%). 1Н ЯМР (CDCl3, 300 МГц) δ 6,99 (s, NH, 1H), 5,78 (m, 1H), 5,49 (s, NH, 1H), 4,97 (m, 2H), 4,12 (m, 2H), 2,96 (ddd, J1=16,5 Гц, J2=11,5 Гц, J3=5,5 Гц, 1H), 2,62 (m, 2H), 2,35 (tt, J1=12,5 Гц, J2=3 Гц, 1H), 2,10-1,96 (m, 1H), 2,00 (s, 3Н), 1,64-1,86 (m, 3H), 1,48 (m, 1H), 1,43 (s, 9H), 1,36 (s, 9H), 1,20-1,28 (m, 1H), 1,10(m, 1H).
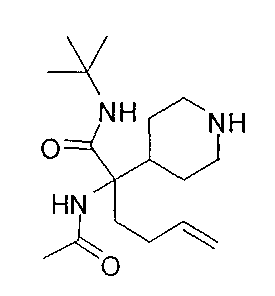
Стадия 4: гидрохлорид трет-бутиламида 2-ацетиламино-2-пиперидин-4-илгекс-5-еновой кислоты
[0564] 4н. хлороводород в диоксане (13,2 мл, 52,7 ммоль) добавляли в перемешиваемый раствор трет-бутил-4-(1-ацетиламино)-1-трет-бутилкарбамоилпент-4-енил)пиперидин-1-карбоксилата (5,4 г, 13,2 ммоль) в диоксане (30 мл). Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, а затем концентрировали в вакууме с получением титульного соединения в виде белого твердого вещества, которое применяли без дополнительной очистки (4,5 г, 99%). 1Н ЯМР (CDCl3, 300 МГц) δ 9,51 (br s, 2×NH, 2H), 7,26 (s, NH, 1H), 5,74 (m, винил CH+NH, 2H), 4,97 (m, 2H), 3,50 (m, 2H). 2,86 (m, 3H), 2,62 (m, 1H), 2,05 (s, 3H), 1,62-2,02 (m, 6H), 1,51 (m, 1H), 1,41 (s, 9H), 1,21-1,36 (m, 1H).
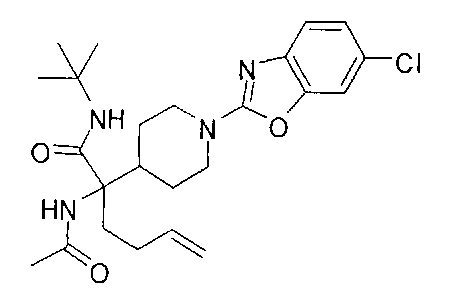
Стадия 5: 2-ацетамидо-N-трет-бутил-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)гекс-5-енамид
[0565] Основание Хюнига (2,5 мл) добавляли в перемешиваемую суспензию гидрохлорида трет-бутиламида 2-ацетиламино-2-пиперидин-4-илгекс-5-еновой кислоты (250 мг, 0,73 ммоль) и 2,6-дихлорбензоксазола (172 мг, 0,91 ммоль) в безводном диметилацетамиде (5 мл). Реакционную смесь перемешивали при 95°С в течение ночи в атмосфере азота. После нагревания в течение ночи реакционную смесь охлаждали до комнатной температуры, а затем разбавляли диэтиловым эфиром. Органический слой промывали насыщенным водным хлоридом натрия (3х), сушили над MgSO4, фильтровали и концентрировали. Неочищенный продукт очищали путем колоночной флэш-хроматографии (силикагель, 20-80% этилацетат в гептане) с получением 2-ацетамидо-N-трет-бутил-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)гекс-5-енамида в виде беловатого твердого вещества (240 мг, 72%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,24 (d, J=2 Гц, 1H), 7,21 (d, J=8,5 Гц, 1H), 7,12 (dd, J1=8,5 Гц, J2=2 Гц, 1Н), 7,02 (s, NH, 1H), 5,79 (m, 1H), 5,50 (s, NH, 1H), 4,98 (m, 2H), 4,34 (m, 2H), 3,00 (m, 3H), 2,49 (tt, J1=12,5 Гц, J2=3 Гц, 1H), 2,10-1,96 (m, 1H), 2,03 (s, 3H), 1,74-1,93 (m, 3H), 1,49 (m, 1H), 1,33 (s, 9H), 1,18-1,28 (m, 2H).
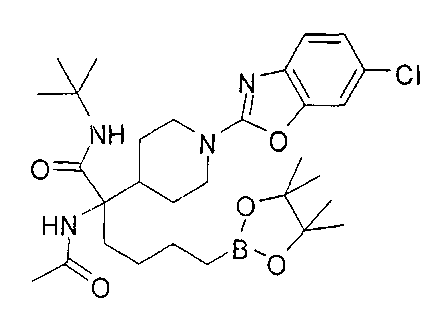
Стадия 6: 2-ацетамидо-N-трет-бутил-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
[0566] Раствор 2-ацетамидо-N-трет-бутил-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)гекс-5-енамида (240 мг, 0,52 ммоль) в дихлорметане (4 мл) обрабатывали димером хлор-1,5-циклооктадиениридия (10,4 мг, 3 мол.%) и 1,2-бис(дифенилфосфино)этаном (12,2 мг, 6 мол.%). Раствор перемешивали при комнатной температуре в течение 30 минут, а затем 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (0,152 мл, 1,01 ммоль) добавляли по каплям и реакционную смесь перемешивали в течение ночи при комнатной температуре. На следующий день реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка неочищенного продукта путем колоночной флэш-хроматографии (силикагель, 30-100% этилацетат в гептане) приводила к получению 2-ацетамидо-N-трет-бутил-2-(1-(6-хлорбензо[(d]оксазол-2-ил)пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида в виде бесцветной маслянистой жидкости (212 мг, 69%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,24 (d, J=2 Гц, 1Н), 7,20 (d, J=8,5 Гц, 1Н), 7,12 (dd, J1=8,5 Гц, J2=2 Гц, 1Н), 6,97 (s, NH, 1Н), 5,48 (s, NH, 1Н), 4,32 (m, 2H), 3,02 (m, 2H), 2,84 (m, 1Н), 2,47 (tt, J1=12,5 Гц, J2=3 Гц, 1Н), 2,01 (s, 3Н), 1,86 (m, 2H), 1,30-1,55 (m, 6H), 1,34 (s, 9H), 1,24 (s, 12H), 1,02-1,22 (m, 1Н), 0,75 (t, J=7,5 Гц, 2H).
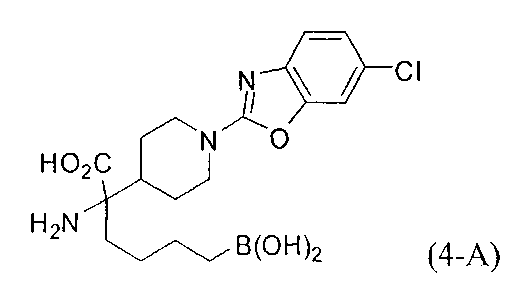
Стадия 7: 2-амино-6-бороно-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)гексановая кислота
[0567] Раствор 2-ацетамидо-N-трет-бутил-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (212 мг) в 6н. HCl (15 мл) перемешивали при 90°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (3х). Водный раствор концентрировали и очищали путем ОФ-ВЭЖХ (10-100% ацетонитрил в воде) с получением дигидрохлоридной соли 2-амино-6-бороно-2-(1-(6-хлорбензо[d]оксазол-2-ил)пиперидин-4-ил)гексановой кислоты в виде белого твердого вещества (55 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,40 (d, J=2 Гц, 1Н), 7,24 (dd, J1=8,5 Гц, J2=2 Гц, 1Н), 7,14 (d, J=8,5 Гц, 1Н), 4,14 (m, 2H), 3,30 (t, J=13 Гц, 2H), 2,21 (m, 1Н), 1,98 (m, 1Н), 1,80 (m, 3Н), 1,64 (m, 1Н), 1,38 (m, 1Н), 1,20-1,32 (m, 3Н), 1,06 (m, 1Н), 0,61 (t, J=7,5 Гц, 2H); МС (+CI): m/z C18H25BClN3O5: ожидаемое 409,2; эксперимент 431,7 (M+Na)+, 410,3 (М+Н)+, 392,0 (М+Н-Н2О)+, 374,4 (М+Н-2H2O)+.
[0568] Пример 5-А: дигидрохлорид 2-амино-6-бороно-2-(1-(5-фтор-3,8-диметилхинолин-2-ил)пиперидин-4-ил)гексановой кислоты
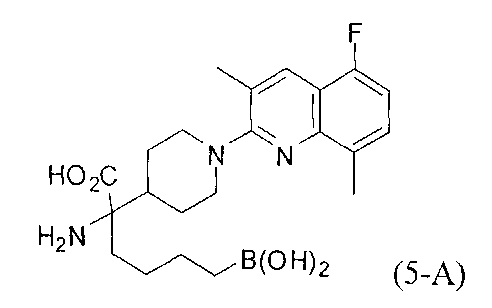
[0569] 2-амино-6-бороно-2-(1-(5-фтор-3,8-диметилхинолин-2-ил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2-хлор-5-фтор-3,8-диметилхинолин применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение выделяли в виде белой твердой дигидрохлоридной соли (54 мг). 1Н ЯМР (D2O, 300 МГц) δ 8,27 (s, 1H), 7,44 (dd, J1=9 Гц, J2=5,5 Гц, 1H), 7,05 (t, J=9 Гц, 1H), 4,10 (m, 2H), 3,36 (m, 2H), 2,41 (s, 3Н), 2,38 (s, 3Н), 2,36-2,51 (m, 1H), 2,03 (m, 1H), 1,74-1,93 (m, 4H), 1,49 (m, 1H), 1,20-1,38 (m, 3Н), 1,11 (m, 1H), 0,68 (t, J=7 Гц, 2H); МС (+CI): m/z C22H31BFN3O4: ожидаемое 431,2; эксперимент 432,4 (М+Н)+, 414,4 (M+H-H2O)+, 396,0 (М+Н-2H2O)+.
[0570] Пример 6-А: дигидрохлорид 2-амино-6-бороно-2-[2-(4-трифторметилхинолин-2-ил)пиперидин-4-ил]гексановой кислоты
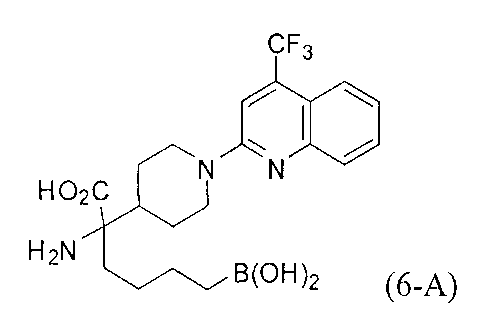
[0571] 2-Амино-6-бороно-2-[2-(4-трифторметилхинолин-2-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2-хлор-4-трифторметилхинолин применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение выделяли в виде белой твердой дигидрохлоридной соли (90 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,90 (d, J=7,5 Гц, 1H), 7,73 (m, 2H), 7,64 (s, 1H), 7,47 (ddd, J1=8,5 Гц, J2=6,5 Гц, J3=2 Гц, 1H), 4,44 (m, 2H), 3,34 (m, 2H), 2,27 (m, 1H), 2,05 (m, 1H), 1,83 (m, 3Н), 1,66 (m, 1H), 1,24-1,43 (m, 4H), 1,11 (m, 1H), 0,67 (t, J=7 Гц, 2H); МС (+CI): m/z C21H27BF3N3O4: ожидаемое 453,2; эксперимент 454,5 (М+Н)+, 436,5 (M+H-H2O)+, 418,0 (М+Н-2H2O)+.
[0572] Пример 7-А: 2-амино-6-бороно-2-[2-(6-метил-4-трифторметилпиридин-2-ил)пиперидин-4-ил]гексановая кислота
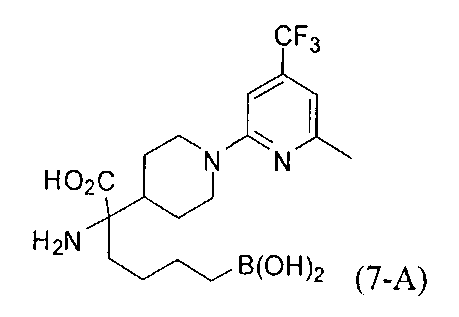
[0573] 2-Амино-6-бороно-2-[2-(6-метил-4-трифторметилпиридин-2-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2-хлор-6-метил-4-трифторметилпиридин применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение выделяли в виде белой твердой дигидрохлоридной соли (118 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,30 (s, 1H), 6,82 (s, 1H), 4,18 (m, 2H), 3,18 (m, 2H), 2,42 (s, 3Н), 2,23 (m, 1H), 1,96 (m, 1H), 1,83 (m, 3H), 1,72 (m, 1H), 1,59 (td, J1=13 Гц, J2=4 Гц, 1H), 1,23-1,38 (m, 3Н), 1,10 (m, 1H), 0,66 (t, J=7,5 Гц, 2H); МС (+CI): m/z C18H27BF3N3O4: ожидаемое 417,2; эксперимент 418,0 (М+Н)+, 400,1 (М+Н-H2O)+, 382,2 (М+Н-2Н2О)+.
[0574] Пример 8-А: дигидрохлорид 2-амино-6-бороно-2-[2-(6-метил-4-трифторметилпиридин-2-ил)пиперидин-4-ил]гексановой кислоты
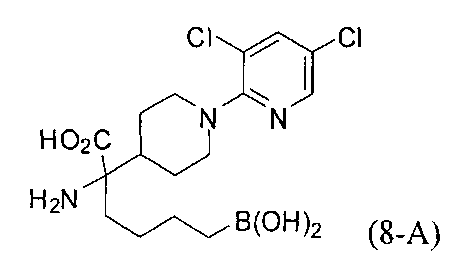
[0575] 2-Амино-6-бороно-2-[2-(6-метил-4-трифторметилпиридин-2-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2,3,5-трихлорпиридин применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение получали в виде белой твердой дигидрохлоридной соли (63 мг). 1Н ЯМР (D2O, 300 МГц) δ 8,04 (d, J=2,5 Гц, 1H), 8,01 (dd, J1=3 Гц, J2=2,5 Гц, 1H), 3,85 (m, 2H), 3,04 (m, 2H), 2,14 (m, 1H), 1,92 (m, 1H), 1,82 (m, 2H), 1,70 (m, 2H), 1,46 (m, 1H), 1,28 (m, 3Н), 1,08 (m, 1H), 0,64 (t, J=7,5 Гц, 2H); МС (+CI): m/z C16H24BCl2N3O4: ожидаемое 403,1; эксперимент 404,2 (М+Н)+, 386,3 (М+Н-H2O)+, 368,1 (М+Н-2Н2О)+.
[0576] Пример 9-А: дигидрохлорид 2-амино-6-бороно-2-[2-(4-трифторметилпиридин-2-ил)пиперидин-4-ил]гексановой кислоты
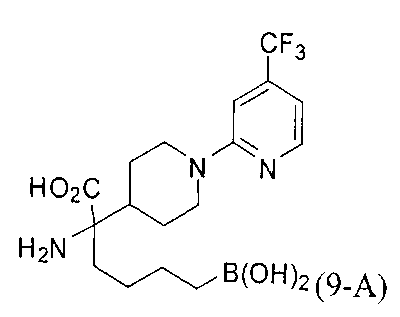
2-Амино-6-бороно-2-[2-(4-трифторметилпиридин-2-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2-хлор-4-трифторметилпиридин применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение выделяли в виде белой твердой дигидрохлоридной соли (58 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,87 (d, J=7 Гц, 1Н), 7,53, (s, 1H), 6,97 (dd, J1=7 Гц, J2=1,5 Гц, 1Н), 4,17 (m, 2H), 3,22 (m, 2H), 2,21 (m, 1Н), 1,98 (m, 1Н), 1,72-1,86 (m, 3Н), 1,59 (m, 1Н), 1,25-1,40 (m, 4H), 1,10 (m, 1Н), 0,68 (t, J=7,5 Гц, 2H); MC (+CI): m/z C17H25BF3N3O4: ожидаемое 403,2; эксперимент 404,4 (М+Н)+, 386,2 (М+Н-H2O)+, 368,3 (М+Н-2H2O)+.
[0577] Пример 10-А: дигидрохлорид 2-амино-6-бороно-2-(1-(3-хлор-5-(трифторметил)пиридин-2-ил)пиперидин-4-ил)гексановой кислоты
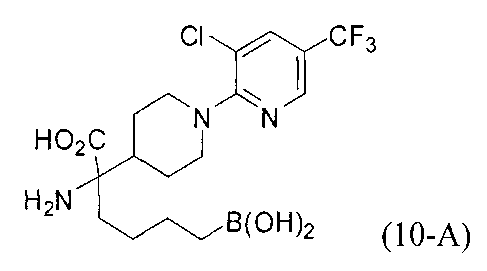
2-Амино-6-бороно-2-(1-(3-хлор-5-(трифторметил)пиридин-2-ил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2,3-дихлор-5-трифторметилпиридин применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение выделяли в виде белой твердой дигидрохлоридной соли (93 мг). 1Н ЯМР (D2O, 300 МГц) δ 8,27 (dd, J1=2 Гц, J2=1 Гц, 1Н), 8,06, (d, J=2 Гц, 1Н), 3,94 (m, 2H), 2,87 (m, 2H), 2,09 (m, 1Н), 1,78-1,93 (m, 3Н), 1,57-1,69 (m, 2H), 1,25-1,42 (m, 4H), 1,10 (m, 1Н), 0,66 (t, J=7 Гц, 2Н); MC (+CI): m/z C17H24BClF3N3O4: ожидаемое 437,15; эксперимент 438,5 (М+Н)+, 420,1 (М+Н-Н2О)+, 402,1 (М+Н-2H2O)+.
[0578] Пример 11-А: дигидрохлорид 2-амино-6-бороно-2-[(6-хлорбензотиазол-2-ил)пиперидин-4-ил]гексановой кислоты
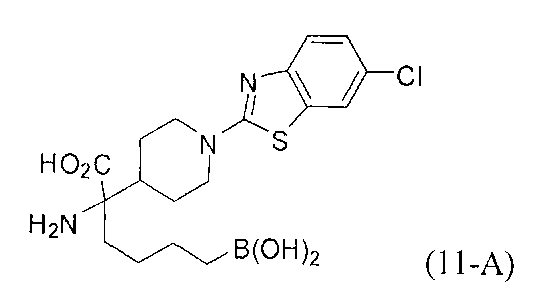
2-Амино-6-бороно-2-[(6-хлорбензотиазол-2-ил)пиперидин-4-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 4-А, с тем исключением, что 2,6-дихлорбензотиазол применяли в качестве гетероарильного агента сочетания на стадии 5. Титульное соединение выделяли в виде белой твердой дигидрохлоридной соли (117 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,62 (d, J=2 Гц, 1Н), 7,35 (dd, J1=8,5 Гц, J2=2 Гц, 1Н), 7,27 (d, J=8,5 Гц, 1Н), 3,96 (m, 2H), 3,40 (t, J=13 Гц, 2Н), 2,20 (m, 1Н), 2,02 (m, 1Н), 1,80 (m, 3Н), 1,68 (m, 1Н), 1,42 (m, 1Н), 1,24-1,32 (m, 3Н), 1,09 (m, 1Н), 0,66 (t, J=7,5 Гц, 2H); MC (+CI): m/z C18H25BClN3O4S: ожидаемое 425,1; эксперимент 426,0 (М+Н)+, 408,2 (М+Н-Н2О)+, 390,1 (М+Н-2H2O)+.
[0579] Пример 12-А: гидрохлорид (R)-2-амино-6-бороно-2-((S)-1-(4-хлорфенил)пирролидин-3-ил)гексановой кислоты
Стадия 1: метоксиметиламид 1-(4-хлорфенил)пирролидин-3-карбоновой кислоты
[0580] EDC (1,70 г, 8,86 ммоль) добавляли по частям в перемешиваемый раствор 1-(4-хлорфенил)пирролидин-3-карбоновой кислоты (1,0 г, 4,43 ммоль), DMAP (5 мг) и гидрохлорида N,O-диметилгидроксиламина (865 мг, 8,86 ммоль) в дихлорметане (20 мл). В полученный раствор добавляли по каплям триэтиламин (1,79 г, 2,47 мл, 17,7 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После завершения перемешивания реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением титульного соединения в виде белого твердого вещества (1,10 г, 98%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,14 (d, J=8 Гц, 2H), 6,46 (d, J=8 Гц, 2H), 3,74 (s, 3Н), 3,50-3,56 (m, 2H), 3,40-3,47 (m, 2H), 3,33 (m, 1Н), 3,23 (s, 3Н), 2,20-2,36 (m, 2H).
Стадия 2: 1-[1-(4-хлорфенил)пирролидин-3-ил]пент-4-ен-1-он
[0581] Раствор метоксиметиламида 1-(4-хлорфенил)пирролидин-3-карбоновой кислоты (1,1 г, 4,1 ммоль) в тетрагидрофуране (20 мл) охлаждали до 0°С, выдерживая раствор в атмосфере азота. В охлажденный раствор добавляли раствор бромида 4-бутенилмагния (0,5М в ТГФ, 16,4 мл, 8,2 ммоль) в ТГФ по каплям. После перемешивания в течение 1 часа баню удаляли и перемешивание продолжали в течение ночи. Полученный раствор выливали в воду, подкисляли до рН 3-4 1н. хлороводородной кислотой и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка неочищенного вещества путем колоночной флэш-хроматографии (силикагель, 0-25% этилацетат в гептане) приводила к получению титульного соединения в виде бесцветной маслянистой жидкости (940 мг, 87%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,15 (d, J=9 Гц, 2Н), 6,46 (d, J=9 Гц, 2H), 5,81 (m, 1Н), 5,12 (m, 2H), 3,54 (m, 2H), 3,26-3,39 (m, 3H), 2,62 (m, 2H), 2,36 (m, 2H), 2,12-2,26 (m, 2H).
Стадия 3: трет-бутиламид (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]гекс-5-еновой кислоты
[0582] Раствор 1-[1-(4-хлорфенил)пирролидин-3-ил]пент-4-ен-1-она (940 мг, 3,57 ммоль) и ацетата аммония (1,381 г, 17,85 ммоль) в 2,2,2-трифторэтаноле (2 мл) обрабатывали трет-бутилизоцианидом (594 мг, 810 мкл, 7,15 ммоль). После перемешивания при комнатной температуре в течение 8 дней реакционную смесь добавляли в делительную воронку, разбавляли водой (20 мл) и экстрагировали этилацетатом (2×30 мл). Органический слой промывали насыщенным водным хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка неочищенного вещества путем колоночной флэш-хроматографии (силикагель, 20-70% этилацетат в гептане) приводила к получению трет-бутиламида (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]гекс-5-еновой кислоты в виде бесцветной маслянистой жидкости (500 мг, 35%). Сдвиги 1Н ЯМР трет-бутиламида (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]гекс-5-еновой кислоты предложены ниже: 1Н ЯМР (CDCl3, 300 МГц) δ 7,12 (d, J=9 Гц, 2H), 6,98 (s, NH, 1Н), 6,44 (d, J=9 Гц, 2H), 5,73-5,86 (m, NH, 1H), 5,79 (s, 1H), 5,00 (m, 2H), 3,02-3,38 (m, 6H), 1,80-2,10 (m, 4H), 2,01 (s, 3H), 1,55 (m, 1H), 1,37 (s, 9H).
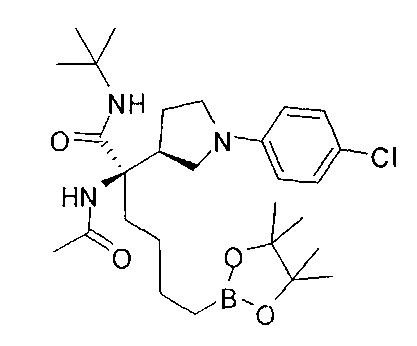
Стадия 4: трет-бутиламид (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты
[0583] Раствор трет-бутиламида (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]гекс-5-еновой кислоты (600 мг, 1,48 ммоль) в дихлорметане (10 мл) обрабатывали димером хлор-1,5-циклооктадиениридия (I) (30 мг, 3 мол.%) и 1,2-бис(дифенилфосфино)-этаном (36 мг, 6 мол.%). Раствор перемешивали при комнатной температуре в течение 30 минут, затем 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (0,43 мл, 2,96 ммоль) добавляли по каплям и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка неочищенного продукта путем колоночной флэш-хроматографии (силикагель, 30-100% этилацетат в гептане) приводила к получению трет-бутиламида (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты в виде бесцветной маслянистой жидкости (568 мг, 72%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,11 (d, J=8,5 Гц, 2H), 6,93 (s, NH, 1H), 6,43 (d, J=9 Гц, 2H), 5,77 (s, NH, 1H), 3,16-3,38 (m, 4H), 2,94-3,06 (m, 2H), 1,92-2,06 (m, 2H), 1,99 (s, 3H), 1,84 (m, 1H), 1,16-1,52 (m, 4H), 1,35 (s, 9H), 1,23 (s, 12H), 0,76 (t, J=7,5 Гц, 2Н).
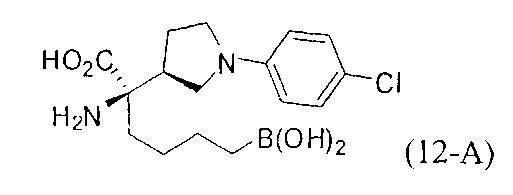
Стадия 5: (2S,3′S)-2-амино-6-бороно-2-[1-(4-хлорфенил)пирролидин-3-ил]гексановая кислота
[0584] Раствор трет-бутиламида (2S,3′S)-2-ацетиламино-2-[1-(4-хлорфенил)пирролидин-3-ил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (560 мг) в 6н. HCl (15 мл) перемешивали при 90°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (3х). Водный раствор концентрировали в вакууме. Очистка путем ОФ-ВЭЖХ (10-100% ацетонитрил в воде) приводила к получению целевого продукта, (2S,3′S)-2-амино-6-бороно-2-[1-(4-хлорфенил)пирролидин-3-ил]гексановой кислоты в виде белой твердой дигидрохлоридной соли (92 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,36 (d, J=8,5 Гц, 2Н), 7,12 (d, J=9 Гц, 2Н), 3,74 (dd, J1=11 Гц, J2=9 Гц, 1Н), 3,42-3,62 (m, 3H), 3,01 (quint, J=9 Гц, 1Н), 2,20 (m, 2Н), 1,96 (m, 1Н), 1,79 (m, 1Н), 1,26-1,40 m, (3H), 1,12 (m, 1Н), 0,67 (t, J=7,5 Гц, 2Н); MC (+CI): m/z C16H24BClN2O4: ожидаемое 354,15; эксперимент 355,1 (М+Н)+, 319,4 (М+Н-2Н2О)+.
[0585] Пример 13-А: дигидрохлорид (2R,3′S)-2-амино-6-бороно-2-[1-(4-хлорфенил)пирролидин-3-ил]гексановой кислоты
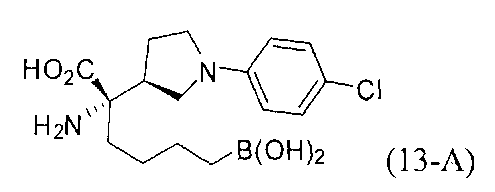
[0586] (2R,3′S)-2-амино-6-бороно-2-[1-(4-хлорфенил)пирролидин-3-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 12-А, с тем исключением, что применяли второй изомер, полученный на стадии 3. После очистки путем ОФ-ВЭЖХ (10-100% ацетонитрил в воде) его выделяли в виде белого твердого вещества (92 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,35 (2Н, d, J=8,5 Гц, 2Н), 7,14 (d, J=8 Гц, 2Н), 3,82 (dd, J1=11 Гц, J2=9,5 Гц, 1Н), 3,67 (dd, J1=11 Гц, J2=8,5 Гц, 1Н), 3,58 (dd, J1=8,5 Гц, J2=6 Гц, 2Н), 2,94 (quint, J=9 Гц, 1Н), 2,31 (m, 1Н), 1,70-1,91 (m, 3H), 1,24-1,36 (m, 3H), 1,12 (m, 1Н), 0,63 (t, J=7,5 Гц, 2Н); MC (+CI): m/z C16H24BClN2O4: ожидаемое 354,15; эксперимент 355,1 (М+Н)+, 337,5 (М+Н-H2O)+, 319,2 (М+Н-2Н2О)+.
[0587] Пример 14-А: гидрохлорид 2-амино-6-бороно-2-[1-(4-хлорфенил)-5-оксопирролидин-3-ил]гексановой кислоты
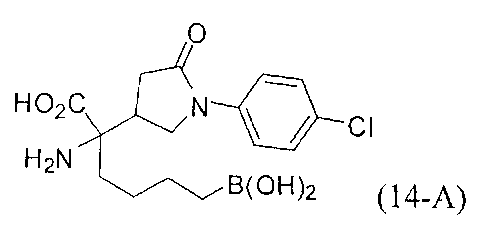
[0588] 2-амино-6-бороно-2-[1-(4-хлорфенил)-5-оксопирролидин-3-ил]гексановую кислоту получали аналогично способу, предложенному в Примере 12-А, с тем исключением, что 1-(4-хлорфенил)-5-оксопирролидин-3-карбоновую кислоту применяли в качестве карбоновой кислоты на стадии 1. После очистки путем ОФ-ЖХМС (10-100% ацетонитрил в воде) титульное соединение выделяли в виде белого твердого вещества (19 мг). 1Н ЯМР (D2O, 300 МГц) δ 7,29 (d, J=9 Гц, 2Н), 7,26 (d, J=9 Гц, 2Н), 3,84-3,98 (m, 2Н), 3,05 (quint, J=8,5 Гц, 1H), 2,74 (dd, J1=17,5 Гц, J2=9 Гц, 1Н), 2,46 (dd, J1=17,5 Гц, J2=9 Гц, 1H), 1,70-1,96 (m, 2Н), 1,24-1,46 (m, 3Н), 1,15 (m, 1H), 0,65 (t, J=7,5 Гц, 2Н); MC (+CI): m/z C16H22BClN2O5: ожидаемое 368,1; эксперимент 369,0 (М+Н)+, 351,0 (М+Н-H2O)+, 331,1 (M+H-2H2O)+.
[0589] Пример 15-А: дигидрохлорид (R)-2-амино-2-((1S,3R)-3-аминоциклопентил)-6-бороногексановой кислоты
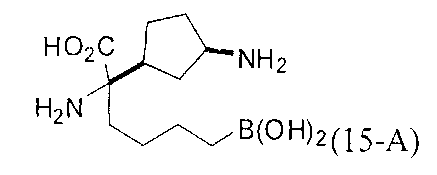
[0590] Дигидрохлорид (R)-2-амино-2-((1S,3R)-3-аминоциклопентил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что (1S,3R)-3-(трет-бутоксикарбониламино)циклопентанкарбоновую кислоту применяли в качестве кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,7-3,5 (m, 1H), 2,63-1,38 (m, 9H), 1,38-1,20 (m, 3Н), 1,15-1,0 (m, 1H), 0,67 (t, J=7,6 Гц, 2Н). ИЭР MC эксперимент C11H23BH2O4 m/z [259,4 (M+1)].
[0591] Пример 16-А: дигидрохлорид (R)-2-амино-2-((1S,3S)-3-аминоциклопентил)-6-бороиогексановой кислоты
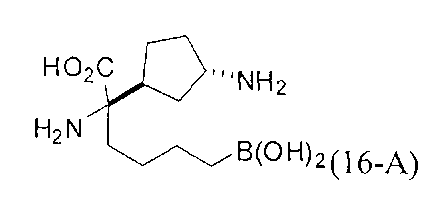
[0592] Дигидрохлорид (R)-2-амино-2-((1S,3S)-3-аминоциклопентил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что (1S,3S)-3-(трет-бутоксикарбониламино)циклопентанкарбоновую кислоту применяли в качестве кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,63-3,49 (m, 1H), 2,60-1,34 (m, 9H), 1,34-1,14 (m, 3Н), 1,13-0,96 (m, 1H), 0,64 (t, J=7,6 Гц, 2Н). ИЭР MC эксперимент C11H23BN2O4 m/z [241,7 (M+1-Н2О)].
[0593] Пример 17-А: дигидрохлорид (S)-2-амино-2-((1R,3S)-3-аминоциклопентил)-6-бороногексановой кислоты
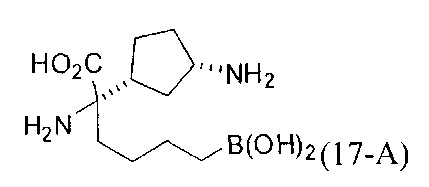
[0594] Дигидрохлорид (S)-2-амино-2-((1R,3S)-3-аминоциклопентил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что (1R,3S)-3-(трет-бутоксикарбониламино)циклопентанкарбоновую кислоту применяли в качестве кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,65-3,47 (m, 1H), 2,62-1,36 (m, 9H), 1,34-1,14 (m, 3Н), 1,13-0,96 (m, 1H), 0,63 (t, J=7,6 Гц, 2Н). ИЭР МС эксперимент C11H23BN2O4 m/z [259,1 (M+1)].
[0595] Пример 18-А; дигидрохлорид 2-амино-2-(азетидин-3-ил)-6-бороногексановой кислоты
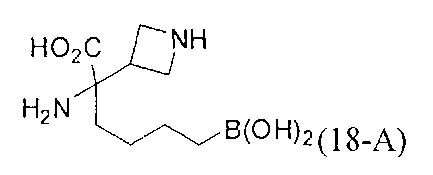
[0596] Дигидрохлорид 2-амино-2-(азетидин-3-ил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что 1-(трет-бутоксикарбонил)азетидин-3-карбоновую кислоту применяли в качестве кислоты на стадии 1. 1H ЯМР (D2O, 300 МГц) δ 4,74-4,57 (m, 1H), 4,45-4,2 (m, 1H), 3,47-2,99 (m, 3Н), 1,98-1,67 (m, 2Н), 1,42-1,20 (m, 4H), 0,73-0,62 (m, 2H). ИЭР МС эксперимент C9H19BN2O4 m/z [253,4 (M+Na)].
[0597] Пример 19-А: получение дигидрохлорида 2-амино-6-бороно-2-(морфолин-2-ил)гексановой кислоты
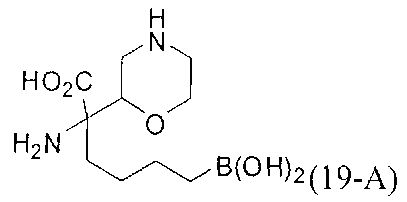
[0598] Дигидрохлорид 2-амино-6-бороно-2-(морфолин-2-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что 4-(трет-бутоксикарбонил)морфолин-2-карбоновую кислоту применяли в качестве кислоты на стадии 1. 1Н ЯМР (CD3OD, 300 МГц) δ 4,26-4,13 (m, 2Н), 3,96 (td, J=12,3, 2,7 Гц, 1H), 3,60-3,40 (m, 2H), 3,40-3,28 (m, 1Н), 3,17 (td, J=12,6, 4,2 Гц, 1Н), 2,02-1,86 (m, 2H), 1,5-1,36 (m, 3H), 1,34-1,18 (m, 1Н), 0,83 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C10H21BN2O5, m/z [243,1 (M+1-H2O)].
[0599] Пример 20-А: получение дигидрохлорида 2-амино-2-(4-аминоциклогексил)-6-бороногексановой кислоты
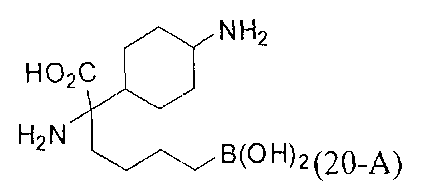
[0600] Дигидрохлорид 2-амино-2-(4-аминоциклогексил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 116, с тем исключением, что 4-(трет-бутоксикарбониламино)циклогексанкарбоновую кислоту применяли в качестве кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 3,15-2,92 (m, 1Н), 2,05-1,42 (m, 3H), 1,40-0,92 (m, 7H), 0,62 (t, J=7,4 Гц, 2H). ИЭР МС эксперимент C12H25BN2O4 m/z [273,2 (M+1)].
[0601] Пример 21-А: получение дигидрохлорида 2-амино-6-бороно-2-(цис-4-(4-хлорбензиламино)циклогексил)гексановой кислоты
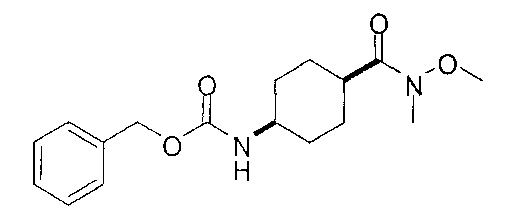
Стадия 1: бензил-цис-4-(метокси(метил)карбамоил)циклогексилкарбамат
[0602] EDC (6,9 г, 36 ммоль) добавляли несколькими частями в перемешиваемый раствор цис-4-бензилоксикарбониламиноциклогексанкарбоновой кислоты (5,0 г, 18 ммоль), DMAP (10 мг), HOBt (10 мг) и гидрохлорида N,O-диметилгидроксиламина (3,5 г, 36 ммоль) в дихлорметане (100 мл). В полученный раствор добавляли по каплям триэтиламин (10 мл, 72,0 ммоль) и реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи. После завершения перемешивания реакционную смесь выливали в воду и водный слой экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением бензил-цис-4-(метокси-(метил)карбамоил)циклогексилкарбамата в виде бесцветной маслянистой жидкости (5,48 г, 17,1 ммоль, 95%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,38-7,28 (m, 5H), 5,09 (bs, 2H), 5,02 (m, 1H), 3,92-3,82 (m, 1H), 3,69 (s, 3H), 3,17(s, 3H), 2,81-2,68 (m, 1H), 1,91-1,78 (m, 2H), 1,74-1,6 (m, 6H).
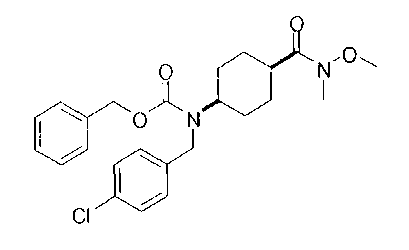
Стадия 2: бензил-4-хлорбензил(цис-4-(метокси(метил)карбамоил)циклогексил)карбамат
[0603] Раствор бензил-цис-4-(метокси(метил)карбамоил)циклогексилкарбамата в ДМФ (12 мл) в атмосфере азота охлаждали до 0°С, затем обрабатывали гидридом натрия (150 мг 60 масс.% NaH а масле, 3,75 ммоль). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь охлаждали до 0°С и добавляли 4-хлорбензилбромид (793 мг, 3.75 ммоль). Полученный раствор медленно нагревали до комнатной температуры и дополнительно перемешивали в течение 16 часов, после чего разделяли раствор в насыщенном водном NaHCO3 и этилацетате. Водный слой дополнительно экстрагировали этилацетатом. После отделения органического слоя объединенные органические слои промывали насыщенным водным хлоридом натрия, сушили MgSO4, фильтровали и концентрировали с получением бензил-4-хлорбензил(цис-4-(метокси(метил)карбамоил)-циклогексил)карбамата в виде бесцветной маслянистой жидкости (1,19 г, 2,67 ммоль, 86%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,45-7,05 (m, 9H), 5,09 (bs, 2H), 4,41 (bs, 2H), 4,30-4,04 (m, 1H), 3,65 (s, 3H), 3,14 (s, 3H), 2,91 (m, 1H), 2,02-1,84 (m, 4H),1,70-1,47(m, 4H).
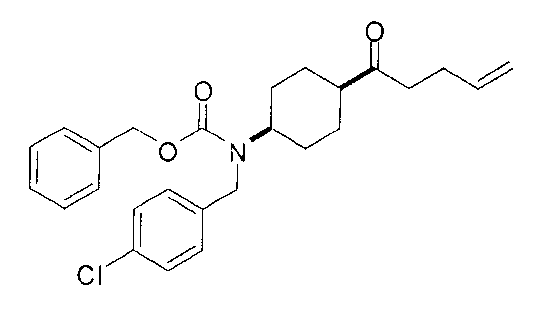
Стадия 3: 1-бензил-4-хлорбензил(цис-4-пент-4-еноилциклогексил)карбамат
[0604] Раствор бензил-4-хлорбензил(цис-4-(метокси(метил)карбамоил)циклогексил)-карбамата (1,19 г, 2,69 ммоль) в тетрагидрофуране (15 мл), выдерживаемый в инертной атмосфере азота, охлаждали до 0°С, после чего подвергали взаимодействию с бромидом 4-бутенилмагния (0,5М в ТГФ, 13,4 мл, 6,7 ммоль), который добавляли по каплям в виде раствора в ТГФ. После перемешивания в течение 1 часа при 0°С реакционную смесь нагревали до комнатной температуры в течение ночи, выливали в воду, подкисляли до рН 3-4 1н. хлороводородной кислотой и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии приводила к получению 1-бензил-4-хлорбензил(цис-4-пент-4-еноилциклогексил)карбамата в виде бесцветной маслянистой жидкости (0,98 г, 2,22 ммоль, 83%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,44-7,02 (m, 9H), 5,84-5,68 (m, 1H), 5,13 (bs, 2H), 5,05-4,92 (m, 2H), 4,34 (bs, 2H), 4,20-4,00 (m, 1H), 2,58 (m, 3H), 2,33-2,), 2,24 (m, 2H 19-2,07 (m, 2H), 1,7-1,4 (m, 6H).
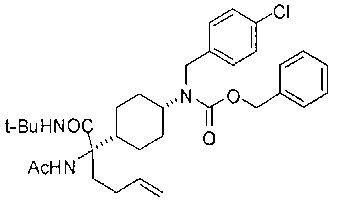
Стадия 4: бензил-(1R,4s)-4-((S)-2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклогексил(4-хлорбензил)карбамат
[0605] Трет-бутилизоцианид (0,627 мл, 5,55 ммоль) добавляли в перемешиваемую суспензию 1-бензил-4-хлорбензил(цис-4-пент-4-еноилциклогексил)карбамата (978 мг, 2,22 ммоль) и ацетата аммония (856 мг, 11,1 ммоль) в 2,2,2-трифторэтаноле (2 мл). После перемешивания при комнатной температуре в течение 8 дней реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка неочищенной реакционной смеси путем колоночной флэш-хроматографии приводила к получению бензил-(1R,4s)-4-((S)-2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклогексил(4-хлорбензил)карбамата в виде бесцветной маслянистой жидкости (850 мг, 1,5 ммоль, 68%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,39-6,9 (m, 9H), 5,84-5,68 (m, 1H), 5,54 (bs, 1H), 5,24-5,04 (m, 2H), 5,02-4,91 (m, 2H), 4,44-4,28 (bs, 2H), 4,1-3,9 (m, 1H), 2,97-2,82 (m, 1H), 2,23-1,93 (m, 5H), 1,90-1,65 (m, 5H), 1,51-0,96 (m, 14H).
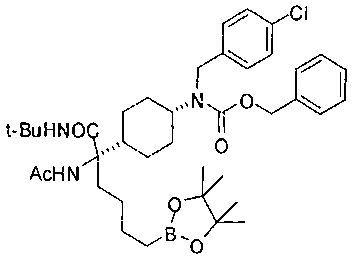
Стадия 5: бензил-(1R,4S)-((S)-2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)циклогексил(4-хлорбензил)карбамат
[0606] Раствор бензил-(1R,4S)-4-((S)-2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклогексил(4-хлорбензил)карбамата (850 мг, 1,5 ммоль) в дихлорметане (4 мл) обрабатывали димером хлор-1,5-циклооктадиениридия (I) (30 мг, 3 мол.%) и 1,2-бис(дифенилфосфино)этаном (36 мг, 6 мол.%). После перемешивания в течение 30 минут 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (0,44 мл, 3 ммоль) добавляли по каплям и перемешивание продолжали в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии приводила к получению бензил-(1R,4s)-((S)-2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)циклогексил(4-хлорбензил)карбамата в виде бесцветной маслянистой жидкости (770 мг, 1,10 ммоль, 74%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,4-6,85 (m, 9H), 5,43 (br s, 1H), 5,25-5,0 (m, 2H), 4,44-4,28 (m, 2H), 4,08-3,72 (m, 2H), 2,80-2,64 (m, 1H), 2,22-2,04 (m, 1H), 1,98-1,90 (m, 4H), 1,90-1,62 (m, 4H), 1,46-0,93 (m, 2H), 0,725 (t, J=7,6 Гц, 2Н).
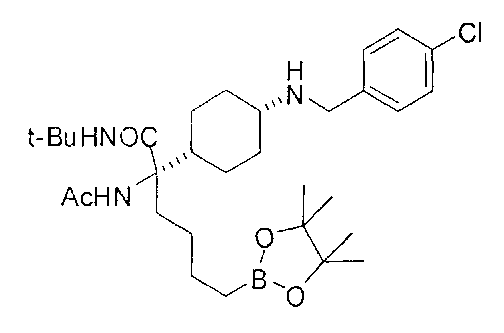
Стадия 6: (S)-2-ацетамидо-N-трет-бутил-2-((1s,4R)-4-(4-хлорбензиламино)циклогексил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
[0607] Раствор (1R,4s)-((S)-2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)циклогексил(4-хлорбензил)карбамата (770 мг, 1,1 ммоль, 10 мл метанола) в метаноле дегазировали аргоном в 100 мл круглодонной колбе, которую насыщали аргоном. В раствор добавляли палладий (25 мг, 10 масс.% на активированном угле, увлажненный, Degussa E101 NE/W). После продувания аргона через раствор в течение 10 минут аргон заменяли на медленный ток водорода. Через 1,5 часа реакция завершалась, и раствор продували аргоном, фильтровали через Celite 545 и осадок промывали метанолом. Раствор в метаноле концентрировали, растворители выпаривали с получением неочищенного (S)-2-ацетамидо-N-трет-бутил-2-((1s,4R)-4-(4-хлорбензиламино)-циклогексил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (660 мг, 100%), который применяли без дополнительной очистки.
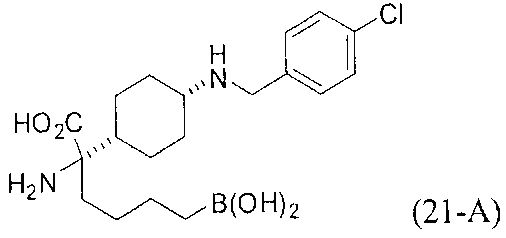
Стадия 7: дигидрохлорид (S)-2-амино-6-бороно-2-((1s,4R)-4-(4-хлорбензиламино)циклогексил)гексановой кислоты
[0608] Раствор (S)-2-ацетамидо-N-трет-бутил-2-((1s,4R)-4-(4-хлорбензиламино)-циклогексил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (195 мг) в 6н. HCl (6 мл) перемешивали при 95°С в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением дигидрохлорида (S)-2-амино-6-бороно-2-((1s,4R)-4-(4-хлорбензиламино)циклогексил)гексановой кислоты (105 мг); 1Н ЯМР (D2O, 300 МГц) δ 7,40-7,24 (m, 4), 4,10 (s, 2H), 3,50-2,94 (m, 1H), 2,22-2,06 (m, 2H), 1,98-1,84 (m, 1H), 1,78-1,52 (m, 4H), 1,44-1,10 (m, 6Н), 1,10-0,88 (m, 2H), 0,63 (t, J=7,6 Гц, 2H); МС (+CI): m/z C19H30BClN2O4: эксперимент 379,6 (M+1-H2O)+.
[0609] Пример 22-А: получение дигидрохлорида (S)-2-амино-6-бороно-2-((1r,4S)-4-(4-хлорбензиламино)циклогексил)гексановой кислоты
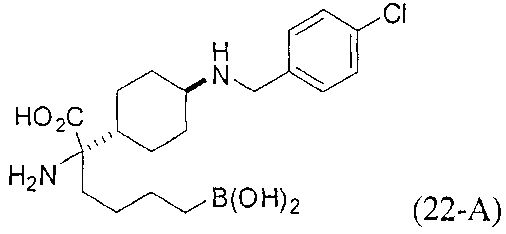
[0610] Дигидрохлорид (S)-2-амино-6-бороно-2-((1r,4S)-4-(4-хлорбензиламино)-циклогексил)гексановой кислоты получали аналогично способу, предложенному в Примере 21-А, с тем исключением, что транс-4-трет-бутоксикарбониламиноциклогексанкарбоновую кислоту применяли в качестве кислоты на стадии 1. 1Н ЯМР (D2O, 300 МГц) δ 7,33 (d, J=7,8 Гц, 2H), 7,27 (d, J=8,4 Гц, 2H), 4,09 (s, 2H), 3,08-2,96 (m, 1H), 2,20-2,07 (m, 2H), 1,98-1,85 (m, 1H), 1,78-1,56 (m, 4H), 1,43-1,10 (m, 6Н), 1,10-0,90 (m, 2H), 0,63 (t, J=7,6 Гц, 2H); МС (+CI): m/z C19H30BClN2O4: эксперимент 397,4 (M+1)+.
[0611] Пример 23-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-циклогексилпиперидин-4-ил)гексановой кислоты
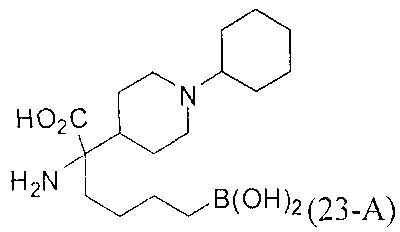
[0612] Дигидрохлорид 2-амино-6-бороно-2-(1-циклогексилпиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что циклогексанон применяли вместо бензальдегида на стадии 6 и реакцию проводили в течение 18 часов. 1Н ЯМР (МеОН-d6, 400 МГц) δ 3,61 (m, 2H), 3,16 (m, 3Н), 2,32-2,05 (m, 5Н), 1,97 (m, 5H), 1,78 (m, 2H), 1,55-1,35 (m, 7H), 1,33 (m, 2H), 0,86 (bt, J=7,2 Гц, 2H). ИЭР+ МС эксперимент C17H33BN2O4 m/z 323,4 (M-18+Н); ИЭР- МС m/z 339,5 (M-Н), 321,4 (M-18-Н).
[0613] Пример 24-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-циклопентилпиперидин-4-ил)гексановой кислоты
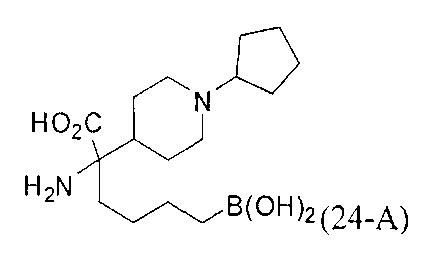
[0614] Дигидрохлорид 2-амино-6-бороно-2-(1-циклопентилпиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что циклопентанон применяли вместо бензальдегида на стадии 6 и реакцию проводили в течение более 18 часов. 1Н ЯМР (D2O, 400 МГц) δ 3,61 (m, 2H), 3,39 (m, 1H), 2,90 (m, 2H), 2,04 (m, 3Н), 1,88-1,20 (m, 15H), 1,10 (m, 1H), 0,69 (bt, J=7,6 Гц, 2H). ИЭР+ МС эксперимент C16H31BN2O4 m/z 309,4 (M-18+Н); ИЭР- МС m/z 325,4 (M-Н), 307,4 (М-18-Н).
[0615] Пример 25-А: получение дигидрохлорида 2-амино-6-бороно-2-[1-(4,4-диметилциклогексил)пиперидин-4-ил]гексановой кислоты
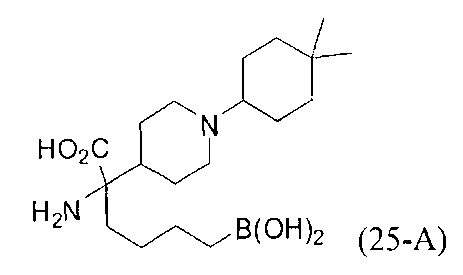
[0616] Дигидрохлорид 2-амино-6-бороно-2-[1-(4,4-диметилциклогексил)пиперидин-4-ил]гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что 4,4-диметилциклогексанон применяли вместо бензальдегида на стадии 6 и реакцию проводили в течение 24 часов. 1Н ЯМР (D2O, 400 МГц) δ 3,53 (m, 2H), 3,00 (m, 3Н), 2,10 (m, 2H), 1,90-1,70 (m, 6H), 1,65-1,40 (m, 5H), 1,35-1,05 (m, 6H), 0,80 (s, 6H), 0,69 (bt, J=7,6 Гц, 2H). ИЭР+ МС эксперимент C19H37BN2O4 m/z 351,5 (M-18+H); ИЭР- МС m/z 367,5 (M-H), 349,5 (M-18-H).
[0617] Пример 26-А: получение гидрохлорида 2-амино-6-бороно-2-[1-(4-хлобензоил)пиперидин-4-ил]гексановой кислоты
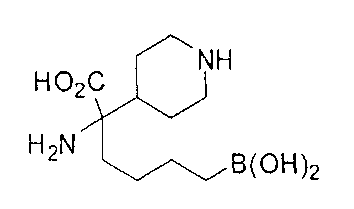
Стадия 1: дигидрохлорид 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты
[0618] Раствор бензил-4-[1-(трет-бутиламино)-1-оксо-2-ацетамидо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил]пиперидин-1-карбоксилата (Пример 118, стадия 4, 9,00 г, 15,7 ммоль) в 6н. HCl (157 мл) кипятили с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры реакционную смесь промывали дихлорметаном (2×50 мл). Водный слой концентрировали при пониженном давлении и вязкий остаток дважды перегоняли с азеотропом из толуола в глубоком вакууме с получением дигидрохлорида 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты (6,84 г, выход >99%, примесь примерно 1 экв. гидрохлорида трет-бутиламина, образовавшегося в результате реакции) в виде беловатой пены, которую применяли без дополнительной очистки. ИЭР+ МС эксперимент C11H23BN2O4 m/z 241,3 (M-18+H); ИЭР- МС m/z 357,3 (M-H), 239,3 (M-18-H).
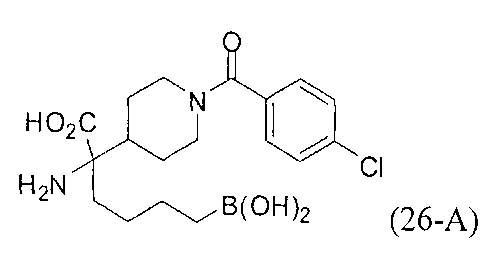
Стадия 2: гидрохлорид 2-амино-6-бороно-2-[1-(4-хлорбензоил)пиперидин-4-ил]гексановой кислоты
[0619] В перемешиваемый раствор дигидрохлорида 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты (150 мг, 0,371 ммоль) в сухом ДМФ (7,4 мл) в атмосфере азота добавляли триэтиламин (0,31 мл, 2,23 ммоль) с получением белой суспензии. 4-хлорбензоилхлорид (0,106 мл, 0,835 ммоль) добавляли по каплям в суспензию и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли водой (15 мл) и экстрагировали этилацетатом (2×20 мл), органическую фазу экстрагировали 1н. HCl (15 мл). Органический слой отбрасывали, все водные слои объединяли и промывали этилацетатом (2×15 мл). Водный слой концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем обращено-фазовой ВЭЖХ (Phenomenex Luna 250×30,00 мм, колонка 10 микрон. Расход 40 мл/мин. Градиент: растворитель А представлял собой 0,07% ТФА в ацетонитриле; растворитель В представлял собой 0,10% ТФА в воде; 5%-50% А, 24 минуты, затем 50%-100% А, 1 минута). Фракции, содержащие продукт, объединяли и концентрировали, остаток помещали в 0,5н. HCl (3 мл)/ацетонитрил (6 мл) и концентрировали. Остаток снова обрабатывали 0,5н. HCl (3 мл)/ацетонитрил (6 мл), концентрировали и сушили в глубоком вакууме в течение ночи с получением гидрохлорида 2-амино-6-бороно-2-[1-(4-хлорбензоил)-пиперидин-4-ил]гексановой кислоты (75 мг, 47%) в виде бледно-желтого твердого вещества. 1Н ЯМР (МеОН-d6,, 400 МГц) δ 7,51 (d, J=8,4 Гц, 2Н), 7,42 (d, J=8,4 Гц, 2Н), 4,77 (m, 1Н), 3,82 (m, 1Н), 3,19 (m, 1Н), 2,85 (m, 1Н), 2,25 (m, 1Н), 2,10-1,40 (m, 8H), 1,28 (m, 2Н), 0,85 (bt, J=7,2 Гц, 2Н). ИЭР+ МС эксперимент C18H26BClN2O5 m/z 379,3 (M-18+Н); ИЭР- МС m/z 395,4 (M-Н), 377,4 (M-18-Н).
[0620] Пример 27-А: гидрохлорид 2-амино-6-бороно-2-[1-ацетилпиперидин-4-ил]гексановой кислоты
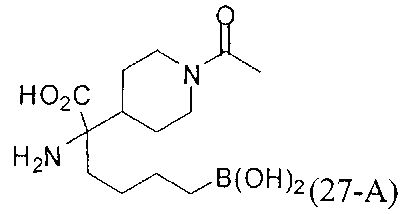
[0621] В перемешиваемый раствор неочищенного дигидрохлорида 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты (Пример 26-А, стадия 1, 250 мг, 0,618 ммоль) в сухом ДМФ (13 мл) в атмосфере азота добавляли триэтиламин (0,69 мл, 4,95 ммоль) с получением белой суспензии. Полученную суспензию обрабатывали уксусным ангидридом (0,131 мл, 1,39 ммоль) по каплям и реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов. Смесь затем разбавляли ледяной водой (10 мл) и 3н. HCl (5 мл), после чего экстрагировали этилацетатом (2×25 мл). Водный слой концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем обращенно-фазовой ВЭЖХ [Phenomenex Luna 250×30,00 мм, колонка 10 микрон. Расход 40 мл/мин. Градиент: растворитель А представлял собой 0,07% ТФА в ацетонитриле; растворитель В представлял собой 0,10% ТФА в воде; 2% А, 2 мин; 2%-20% А, 23 мин; затем 20%-100% А, 1 мин.]. Фракции, содержащие продукт, объединяли и концентрировали, а остаток помещали в 0,25н. HCl (3 мл)/ацетонитрил (8 мл) и концентрировали. Остаток снова обрабатывали смесью 0,25н. HCl (3 мл)/ацетонитрил (8 мл), концентрировали и сушили в глубоком вакууме в течение ночи с получением гидрохлорида 2-амино-6-бороно-2-[1-ацетилпиперидин-4-ил]гексановой кислоты (110 мг, 53%) в виде белого твердого вещества. 1Н ЯМР (D2O, 400 МГц) δ 4,38 (bt, J=12 Гц, 1Н), 3,92 (bt, J=12 Гц, 1H), 3,03 (m, 1H), 2,55 (m, 1H), 2,11 (m, 1H), 2,00 (s, 3Н), 1,87-1,78 (m, 3Н), 1,55 (m, 1H), 1,50-1,00 (m, 6H), 0,68 (t, J=7,2 Гц, 2H). ИЭР+ MC эксперимент C13H25BN2O5 m/z 583,3 (2М-18+Н), 565,6 (2М-2×18+Н), 283,4 (M-18+Н), 265,3 (M-2×18+Н); ИЭР-MC m/z 581,6 (2М-18-Н), 299,4 (M-Н), 281,4 (M-18-Н).
[0622] Пример 28-А: получение гидрохлорида 2-амино-6-бороно-2-{1-[(4-фторфенил)ацетил]пиперидин-4-ил}гексановой кислоты
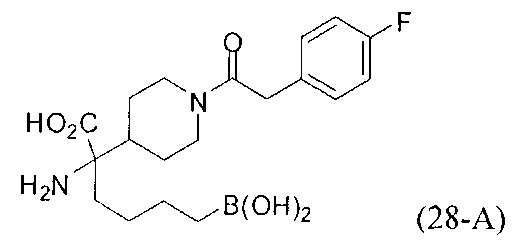
[0623] Раствор 4-фторбензолуксусной кислоты (126 мг, 0,816 ммоль), гидрохлорида N-(3-диметиламинопропил)-N′-этилкарбодиимида (156 мг, 0,816 ммоль) и гидрата 1-гидроксибензотриазола (125 мг, 0,816 ммоль) в сухом ДМФ (4 мл) перемешивали в течение 30 минут в атмосфере азота. В перемешиваемый раствор добавляли раствор неочищенного дигидрохлорида 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты (Пример 26-А, стадия 1, 150 мг, 0,371 ммоль) в сухом ДМФ (4 мл) за один раз. Триэтиламин (0,31 мл, 2,23 ммоль) добавляли и полученную опалесцирующую смесь перемешивали при комнатной температуре в течение 1,75 часа. После завершения реакции раствор разбавляли 1н. HCl и промывали этилацетатом (2х), после чего концентрировали объединенные органические слои. Неочищенный продукт очищали путем обращенно-фазовой ВЭЖХ [Phenomenex Luna 250×30,00 мм, колонка 10 микрон. Расход 40 мл/мин. Градиент: растворитель А представлял собой 0,07% ТФА в ацетонитриле; растворитель В представлял собой 0,10% ТФА в воде. Цикл 1: 5%-50% А, 24 мин, затем 50%-100% А, 1 мин. Цикл 2: 5%-40% А, 24 мин, затем 40%-100% А, 1 мин. Цикл 3: 5%-30% А, 24 мин, затем 30%-100% А, 1 мин]. Фракции, содержащие продукт, объединяли и концентрировали, остаток помещали в 0,5н. HCl (4 мл)/ацетонитрил (6 мл) и концентрировали. Остаток снова обрабатывали смесью 0,5н. HCl (4 мл)/ацетонитрил (6 мл), концентрировали и сушили в глубоком вакууме с получением гидрохлорида 2-амино-6-бороно-2-{1-[(4-фторфенил)ацетил]пиперидин-4-ил}гексановой кислоты (56 мг, 35%) в виде белого твердого вещества. 1Н ЯМР (МеОН-d6, 400 МГц) δ 7,28 (m, 2Н), 7,07 (m, 2H), 4,69 (m, 1H), 4,15 (m, 1H), 3,78 (m, 2H), 3,08 (m, 1H), 2,63 (m, 1H), 2,14 (m, 1H), 1,89 (m, 3H), 1,64 (m, 1H), 1,45 (m, 4H), 1,30-0,95 (m, 2H), 0,84 (bt, J=6,8 Гц, 2H). ИЭР+ MC эксперимент C19H28BFN2O5 m/z 377,3 (M-18+Н), 359,4 (M-2×18+Н); ИЭР- MC m/z 393,4 (M-Н), 375,4 (M-18-Н).
[0624] Пример 29-А: получение гидрохлорида 2-амино-6-бороно-2-{1-[(4-хлорфенил)ацетил]пиперидин-4-ил}гексановой кислоты
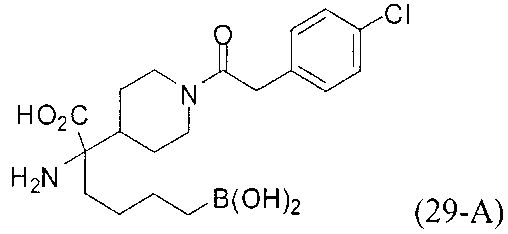
[0625] Гидрохлорид 2-амино-6-бороно-2-{1-[(4-хлорфенил)ацетил]пиперидин-4-ил}гексановой кислоты получали аналогично способу, предложенному в Примере 28-А, с тем исключением, что 4-хлорфенилуксусную кислоту применяли вместо 4-фторбензолуксусной кислоты. 1Н ЯМР (МеОН-d6,, 400 МГц) δ 7,34 (m, 2H), 7,25 (m, 2H), 4,70 (bd, J=13,2 Гц, 1H), 4,14 (bd, J=12,8 Гц, 1H), 3,79 (m, 2H), 3,08 (m, 1H), 2,63 (m, 1H), 2,14 (m, 1H), 1,89 (m, 3H), 1,64 (m, 1H), 1,45 (m, 4H), 1,30-0,95 (m, 2H), 0,84 (bt, J=6,8 Гц, 2H). ИЭР+ MC эксперимент C19H28BClN2O5 m/z 393,3 (M-18+Н), 375,3 (M-2×18+Н); ИЭР- MC m/z 409,4 (M-Н), 391,4 (M-18-Н).
[0626] Пример 30-А: получение гидрохлорида 2-амино-6-бороно-2-[1-бензоилпиперидин-4-ил]гексановой кислоты
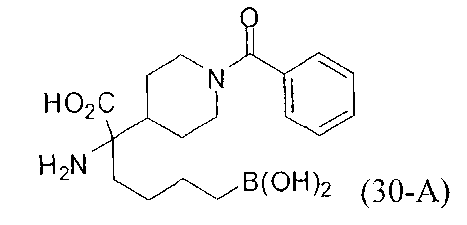
[0627] Гидрохлорид 2-амино-6-бороно-2-[1-бензоилпиперидин-4-ил]гексановой кислоты получали аналогично способу, предложенному в Примере 28-А, с тем исключением, что бензойную кислоту применяли вместо 4-фторбензолуксусной кислоты. 1Н ЯМР (D2O, 400 МГц) δ 7,41 (m, 3H), 7,30 (m, 2H), 4,53 (bt, J=12 Гц, 1Н), 3,72 (bt, J=12 Гц, 1Н), 3,05 (m, 1Н), 2,80 (m, 1Н), 2,16 (bt, J=13 Гц, 1Н), 1,95 (m, 1Н), 1,83 (m, 2H), 1,71 (m, 1Н), 1,55-1,05 (m, 6H), 0,68 (bt, J=7,2 Гц, 2H). ИЭР+ МС эксперимент C18H27BN2O5 m/z 345,4 (M-18+Н), 327,4 (M-2×18+Н); ИЭР- МС m/z 361,4 (M-Н), 343,4 (M-18-Н).
[0628] Пример 31-А: получение гидрохлорида 2-амино-6-бороно-2-{1-[(4-хлорбензил)карбамоил]пиперидин-4-ил}гексановой кислоты
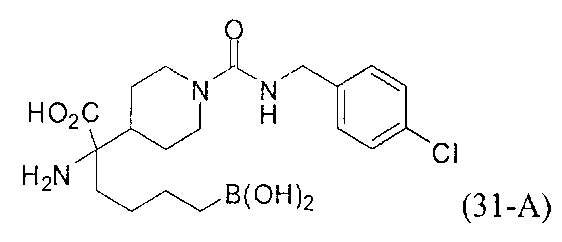
[0629] Перемешиваемый раствор неочищенного дигидрохлорида 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты (Пример 26-А, стадия 1, 0,240 г, 0,594 ммоль) в сухом ДМФ (12 мл) в атмосфере азота обрабатывали триэтиламином (0,662 мл, 4,75 ммоль) с получением белой суспензии. 1-хлор-4-(изоцианатометил)бензол (0,177 мл, 1,34 ммоль) добавляли по каплям и полученную опалесцирующую смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли 1н. HCl (15 мл) и промывали этилацетатом (2×20 мл), водный слой концентрировали при пониженном давлении с получением неочищенного продукта, который очищали путем обращенно-фазовой ВЭЖХ [Phenomenex Luna 250×30,00 мм, колонка 10 микрон. Расход 40 мл/мин. Градиент: растворитель А представлял собой 0,07% ТФА в ацетонитриле; растворитель В представлял собой 0,10% ТФА в воде; 5%-50% А, 24 мин, затем 50%-100% А, 1 мин] Фракции, содержащие продукт, объединяли и концентрировали, остаток помещали в 0,5н. HCl (5 мл)/ацетонитрил (8 мл) и концентрировали. Остаток снова обрабатывали смесью 0,5н. HCl (5 мл)/ацетонитрил (8 мл), концентрировали и сушили в глубоком вакууме с получением гидрохлорида 2-амино-6-бороно-2-{1-[(4-хлорбензил)карбамоил]пиперидин-4-ил}гексановой кислоты (92 мг, 34%) в виде беловатого твердого вещества. 1Н ЯМР (D2O, 400 МГц) δ 7,26 (m, 2H), 7,15 (m, 2H), 4,19 (s, 2H), 3,95 (bt, J=14,6 Гц, 2Н), 2,75 (bt, J=12,8 Гц, 2H), 2,06 (bt, J=12,4 Гц, 1H), 1,81 (m, 3Н), 1,53 (bd, J=12,8 Гц, 1H), 1,32 (m, 4H), 1,11 (m, 2H), 0,69 (t, J=7,6 Гц, 2H). ИЭР+ МС эксперимент C19H29BClN3O5 m/z 408,4 (M-18+Н); ИЭР- МС m/z 424,4 (M-Н), 406,4 (M-18-H).
[0630] Пример 32-A: получение гидрохлорида 2-амино-6-бороно-2-{1-[(4-хлорфенил)карбамоил]пиперидин-4-ил}гексановой кислоты
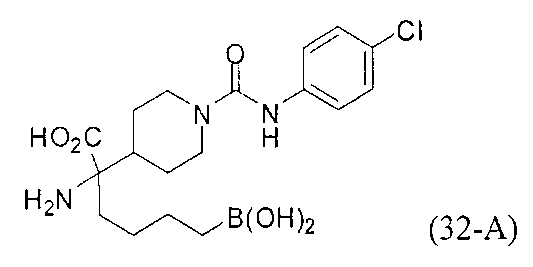
[0631] Гидрохлорид 2-амино-6-бороно-2-{1-[(4-хлорфенил)карбамоил]пиперидин-4-ил}гексановой кислоты получали аналогично способу, предложенному в Примере 31-А, с тем исключением, что 1-хлор-4-изоцианатобензол применяли вместо 1-хлор-4-(изоцианатометил)бензола. 1Н ЯМР (D2O, 400 МГц) δ 7,25 (d, J=8 Гц, 2H), 7,09 (d, J=8 Гц, 2H), 4,07 (bt, J=14,4 Гц, 2H), 2,83 (bt, J=12,6 Гц, 2H), 2,08 (bt, J=12 Гц, 1H), 1,82 (m, 3Н), 1,56 (bd, J=12,4 Гц, 1H), 1,50-1,05 (m, 6H), 0,69 (t, J=7,6 Гц, 2H). ИЭР+ МС эксперимент C18H27BClN3O5 m/z 394,3 (M-18+Н), 376,3 (M-2×18+Н); ИЭР- МС m/z 410,4 (M-Н), 392,4 (M-18-Н).
[0632] Пример 33-А: получение гидрохлорида 2-амино-6-бороно-2-(1-{[2-(4-фторфенил)этил]карбамоил}пиперидин-4-ил)гексановой кислоты
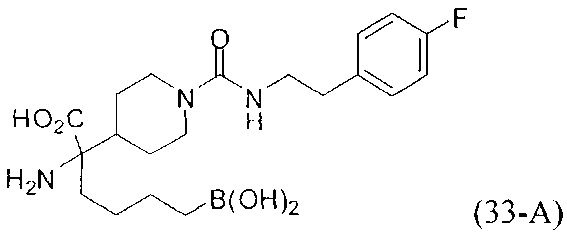
[0633] Гидрохлорид 2-амино-6-бороно-2-(1-{[2-(4-фторфенил)этил]карбамоил}-пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 31-А, с тем исключением, что 4-фторфенэтилизоцианат применяли вместо 1-хлор-4-(изоцианатометил)бензола. 1Н ЯМР (D2O, 400 МГц) δ 7,12 (dd, J1=8 Гц, J2=5,6 Гц, 2H), 6,97 (t, J=8,8 Гц, 2H), 3,80 (bt, J=12,8 Гц, 2H), 3,27 (t, J=6,8 Гц, 2H), 2,65 (m, 4H), 1,99 (bt, J=12,8 Гц, 1H), 1,81 (m, 2H), 1,73 (bd, J=12,8 Гц, 1Н), 1,49 (bd, J=12,4 Гц, 1H), 1,40-1,23 (m, 4H), 1,20-0,95 (m, 2H), 0,70 (t, J=7,6 Гц, 2H). ИЭР+ МС эксперимент C20H31BFN3O5 m/z 406,4 (M-18+H), 388,3 (M-2×18+H); ИЭР- MC m/z 422,5 (M-H), 404,5 (M-18-H).
[0634] Пример 34-А: получение гидрохлорида 2-амино-6-бороно-2-(1-{[(4-хлорфенил)амино]карбонотиоил}пиперидин-4-ил)гексановой кислоты
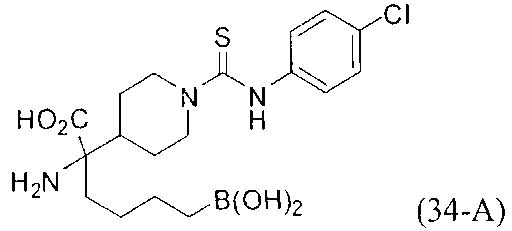
[0635] Гидрохлорид 2-амино-6-бороно-2-(1-{[(4-хлорфенил)амино]карбонотиоил}-пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 31-А, с тем исключением, что 4-хлорфенилизотиоцианат применяли вместо 1-хлор-4-(изоцианатометил)бензола и фракции, содержащие чистый продукт, выделенные в результате очистки ВЭЖХ, обрабатывали следующим образом. Объединенные фракции концентрировали при пониженном давлении при 35°С для удаления ацетонитрила и замораживали, после чего лиофилизировали для удаления воды. Остаток помещали в ~1н. HCl (10 мл), замораживали и лиофилизировали. Затем снова остаток помещали в ~1н. HCl (10 мл), замораживали и лиофилизировали с получением титульного соединения. 1Н ЯМР (D2O, 400 МГц) δ 7,31 (d, J=8,9 Гц, 2Н), 7,08 (d, J=8,8 Гц, 2Н), 4,70 (m, 2H), 3,08 (bt, J=13,2 Гц, 2Н), 2,20 (bt, J=12,4 Гц, 1H), 1,87 (m, 3Н), 1,65 (bd, J=13,2 Гц, 1Н), 1,53 (qd, J1=12,8 Гц, J2=3,6 Гц, 1H), 1,33 (m, 4H), 1,14 (m, 1H), 0,70 (t, J=7,6 Гц, 2Н). ИЭР+ MC эксперимент C18H27BClN3O4S m/z 410,4 (M-18+Н); ИЭР- MC m/z 426,5 (M-H), 408,4 (М-18-H).
[0636] Пример 35-А: получение гидрохлорида 2-амино-6-бороно-2-((S)-1-(4-хлорфенилкарбамотиоил)пирролидин-3-ил)гексановой кислоты
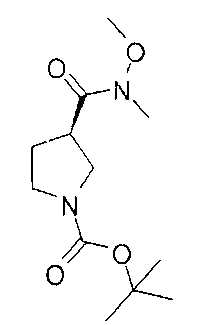
Стадия 1: трет-бутил-(3R)-3-[метокси(метил)карбамоил]пирролидин-1-карбоксилат
[0637] В 500 мл круглодонную колбу при повышенном давлении азота добавляли раствор (R)-N-Вос-пирролидин-3-карбоновой кислоты (7,00 г, 0,0325 моль) в метиленхлориде (125 мл). Раствор охлаждали до 0°С на ледяной бане и обрабатывали последовательно гидрохлоридом N-(3-диметиламинопропил)-N′-этилкарбодиимида (7,48 г, 0,0390 моль) и 1-гидроксибензотриазолом (5,29 г, 0,0391 моль), каждый реагент добавляли за один раз. После завершения добавления агентов сочетания реакционная смесь становилась мутной, но при перемешивании раствор становился прозрачным. Реакционную смесь перемешивали при 0°С в течение 20 минут, затем помещали гидрохлорид N,O-диметилгидроксиламина (4,78 г, 0,0490 моль) и триэтиламин (13,5 мл, 0,0968 моль). Охлаждающую баню удаляли, и реакционную смесь оставляли нагреваться до комнатной температуры при перемешивании в течение 1 часа. Полученный раствор разбавляли дихлорметаном (600 мл) и 1н. HCl (1000 мл), тщательно перемешивали и разделяли. Органический слой промывали насыщенным водным бикарбонатом натрия (300 мл) и насыщенным водным хлоридом натрия (300 мл), затем сушили над Na2SO4, фильтровали и концентрировали с получением трет-бутил-(3R)-3-[метокси(метил)карбамоил]пирролидин-1-карбоксилата в виде бесцветной маслянистой жидкости (7,00 г, 83%). 1Н ЯМР (400 МГц, CDCl3) δ 3,73 (s, 3Н), 3,60-3,37 (m, 4H), 3,21 (s, 3Н), 2,35-2,09 (m, 3Н) 1,47 (s, 9Н); ИЭР МС эксперимент C12H22N2O4 m/z [159,1 (M+1-Boc)].
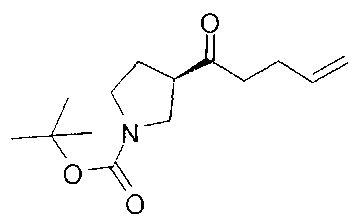
Стадия 2: трет-бутил-(3R)-3-гекс-5-еноилпирролидин-1-карбоксилат
[0638] В 500 мл одногорлой круглодонной колбе раствор трет-6утил-(3R)-3-[метокси(метил)карбамоил]пирролидин-1-карбоксилата (7,00 г, 27,1 ммоль) в тетрагидрофуране (100 мл) охлаждали до 0°С и обрабатывали 0,5М раствором бромида 3-бутенилмагния в ТГФ (130 мл, 65 ммоль) через капельную воронку с отводом для выравнивания давления в течение 20 минут. После завершения добавления охлаждающую баню удаляли и смесь оставляли нагреваться до комнатной температуры и дополнительно перемешивали в течение 4 часов. Реакцию осторожно гасили 1н. HCl (300 мл) и смесь дополнительно перемешивали в течение 20 минут. Водный слой экстрагировали этилацетатом (3×200 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением желтой маслянистой жидкости. Очистка неочищенного продукта путем колоночной флэш-хроматографии (силикагель, 10% этилацетат в гексане) приводила к получению трет-бутил-(3R)-3-гекс-5-еноилпирролидин-1-карбоксилата (6,62 г, 96%) в виде светло-желтой маслянистой жидкости. 1Н ЯМР (400 МГц. CDCl3) δ 5,73-5,69 (m, 1H), 4,99-4,91 (m, 2H), 3,61-3,42 (m, 2H), 3,13-3,05 (m, 1H), 2,50 (t, J=7,2 Гц, 2H), 2,26 (q, J=7,2 Гц, 2Н), 2,11-1,90 (m, 3Н), 1,38 (s, 9H); ИЭР МС эксперимент C14H23NO3 m/z [154,1 (M+1-Boc)].
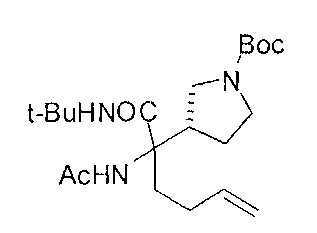
Стадия 3: 2-ацетамидо-N-трет-бутил-2-[(3R)-1-трет-бутилкарбоксилпирролидин-3-ил]гекс-5-енамид
[0639] Раствор трет-бутил-(3R)-3-гекс-5-еноилпирролидин-1-карбоксилата (1,00 г, 3,95 ммоль), ацетата аммония (761 мг, 9,87 ммоль) и трет-бутилизоцианида (2 мл, 30 ммоль) в 2,2,2-трифторэтаноле (2 мл) закрывали в 10 мл пробирке для микроволнового реактора. Реакционную смесь облучали в микроволновом реакторе СЕМ при 85°С в течение 1,5 часов. После охлаждения до комнатной температуры раствор разбавляли этилацетатом (75 мл) и промывали насыщенным водным бикарбонатом натрия (30 мл), водой (30 мл) и насыщенным водным хлоридом натрия (30 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, элюировали 20% этилацетатом в гексане) приводила к выделению исходного вещества (0,265 г, 27%) и 2-ацетамидо-N-трет-бутил-2-[(3R)-1-трет-бутилкарбоксилпирролидин-3-ил]гекс-5-енамида в виде смеси диастереомеров (1,06 г, 68%); ИЭР МС эксперимент C21H37N3O4 m/z.
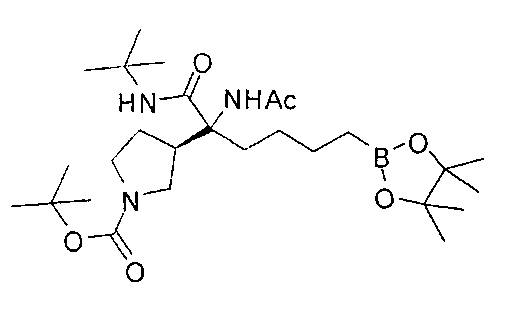
Стадия 4: трет-бутил-(3R)-3-[1-ацетамидо-1-(трет-бутилкарбамоил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пентил]пирролидин-1-карбоксилат
[0640] В 50 мл круглодонной колбе раствор дихлорида бис(1,5-циклооктадиен)дииридия (1) (92 мг, 0,14 ммоль) и 1,2-бис(дифенилфосфино)этана (117 мг, 0,294 ммоль) в тетрагидрофуране (12 мл) перемешивали в течение 5 минут, после чего охлаждали до 0°С на ледяной бане. Через 15 минут 4,4,5,5-тетраметил-1,3,2-диоксаборолан (600 мкл, 4 ммоль) добавляли за один раз через шприц. Еще через 5 минут при 0°С раствор нагревали до комнатной температуры и дополнительно перемешивали в течение 15 минут. Реакционную смесь охлаждали еще один раз на ледяной бане и перемешивали в течение 10 минут. Из отдельной колбы раствор 2-ацетамидо-N-трет-бутил-2-[(3R)-1-трет-бутилкарбоксилпирролидин-3-ил]гекс-5-енамида (1,06 г, 2,68 ммоль) в тетрагидрофуране (4 мл) переносили при помощи шприца в реакционную смесь при перемешивании при 0°С в течение 10 минут. Охлажденную реакционную смесь затем оставляли нагреваться до комнатной температуры и дополнительно перемешивали в течение 4 часов, после чего реакцию гасили путем выливания смеси в раствор насыщенного водного бикарбоната натрия (20 мл) и этилацетата (20 мл). После экстракции органический слой отделяли, а водный слой дополнительно экстрагировали этилацетатом (2×20 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением трет-бутил-(3R)-3-[1-ацетамидо-1-(трет-бутилкарбамоил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пентил]пирролидин-1-карбоксилата (1,46 г) в виде маслянистой жидкости, которую применяли без дополнительной очистки. ИЭР МС эксперимент C27H50BN3O6 m/z 524,5 (М+Н)+; 522,7 (М-Н)-.
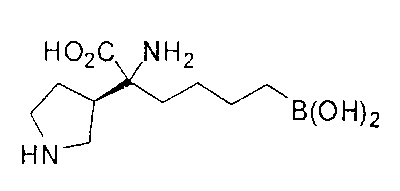
Стадия 5: (R)-2-амино-6-бороно-2-((R)-пирролидин-3-ил)гексановая кислота
[0641] В 50 мл круглодонной колбе трет-бутил-(3R)-3-[1-ацетамидо-1-(трет-бутилкарбамоил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пентил]пирролидин-1-карбоксилат (1,41 г, 2,69 ммоль) растворяли в 1,4-диоксане (10 мл). В полученный раствор добавляли 6М водный раствор хлороводорода (10 мл) за один раз и реакционную смесь кипятили с обратным холодильником в течение 18 часов. По прошествии 18 часов реакционную смесь охлаждали до комнатной температуры, после чего разбавляли водой (10 мл). Водный слой промывали этилацетатом (20 мл) и концентрировали в вакууме, после чего лиофилизировали с получением дигидрохлорида (R)-2-амино-6-бороно-2-((R)-пирролидин-3-ил)гексановой кислоты в виде смеси диастереомеров. Неочищенную пену применяли без очистки на следующей стадии. ИЭР МС эксперимент C10H21BN2O4 m/z 227,2 (М+Н-H2O)+.
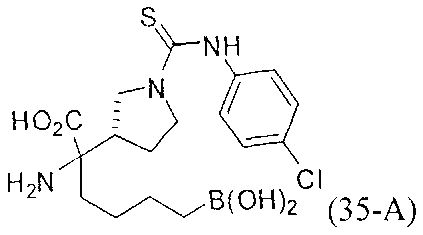
Стадия 6: гидрохлорид 2-амино-6-бороно-2-((S)-1-(4-хлорфенилкарбамотиоил)пирролидин-3-ил)гексановой кислоты
[0642] Раствор (R)-2-амино-6-бороно-2-((R)-пирролидин-3-ил)гексановой кислоты (200 мг, 0,8 ммоль) и триэтиламина (700 мг, 6 ммоль) в N,N-диметилформамиде (4 мл, 50 ммоль) обрабатывали 4-хлорфенилизотиацианатом (300 мг, 1,8 ммоль) за один раз. После перемешивания при комнатной температуре в течение 30 минут реакционную смесь разбавляли 1н. НСl (20 мл) и промывали этилацетатом (20 мл). Водный раствор концентрировали и очищали путем ВЭЖХ с получением гидрохлорида 2-амино-6-бороно-2-((S)-1-(4-хлорфенилкарбамотиоил)пирролидин-3-ил)гексановой кислоты (81 мг, 20%). 1H ЯМР (400 МГц, D2O, Смесь диастереомеров) δ 7,40-7,23 (m, 4H), 4,29-3,46 (m, 4H), 2,95-2,81 (m, 1Н), 2,41-1,76 (m, 4H), 1,58-1,40 (br, m, 2H), 1,36-1,20 (br, m, 1H), 0,90-0,80 (br, m, 2H); МС ИЭР эксперимент C17H25BClN3O4S m/z (М-H2O+H)+ 396,2; МС (ИЭР-) m/z (M-H)- 412,3, (M-Н2О-Н)- 394,3.
[0643] Пример 36-А: получение гидрохлорида 2-амино-6-бороно-2-((S)-1-(4-хлорфенилкарбамоил)пирролидин-3-ил)гексановой кислоты
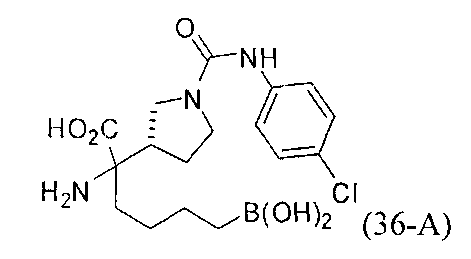
[0644] Раствор (R)-2-амино-6-бороно-2-((R)-пирролидин-3-ил)гексановой кислоты (Пример 35-А, стадия 5, 200 мг, 0,8 ммоль) и триэтиламина (900 мкл, 6 ммоль) в N,N-диметилформамиде (4 мл, 50 ммоль) обрабатывали 4-хлорбензоизоцианатом (280 мг, 1,8 ммоль) за один раз. После перемешивания при комнатной температуре в течение 30 минут реакционную смесь разбавляли 1н. HCl (20 мл) и промывали этилацетатом (20 мл). Водный раствор концентрировали и очищали путем ВЭЖХ с получением 2-амино-6-бороно-2-((S)-1-(4-хлорфенилкарбамоил)пирролидин-3-ил)гексановой кислоты (0,021 г, 6%). 1Н ЯМР (400 МГц, D2O, Смесь диастереомеров) δ 7,26 (d, J=8,1 Гц, 2H), 7,14 (d, J=8,1 Гц, 2H), 3,70-3,48 (br, m, 2H), 3,99-3,08 (br, m, 2H), 2,79-2,65 (br, m, 1Н), 2,30-1,75 (br, m, 4H), 1,54-1,44 (br, m, 2H), 1,35-1,27 (br, m, 1H), 0,87 (t, J=6,5 Гц, 2Н), MC (ИЭР+) эксперимент C17H25ClBN3O5 m/z (M-H2O+H)+ 380,2; MC (M-H2O+Na)+ 403,3.
[0645] Пример 37-А: получение дигидрохлорида 2-амино-6-бороно-2-((S)-1-(4-фторбензил)пирролидин-3-ил)гексановой кислоты
Стадия 1: 2-ацетамидо-N-трет-бутил-2-((R)-пирролидин-3-ил)гекс-5-енамид
[0646] В 100 мл круглодонную колбу, содержащую раствор 2-ацетамидо-N-трет-бутил-2-[(3R)-1-трет-бутилкарбоксилпирролидин-3-ил]гекс-5-енамида (Пример 35-А, стадия 3, 1,42 г, 3,59 ммоль) в метиленхлориде (20 мл, 300 ммоль) добавляли трифторуксусную кислоту (2,4 мл, 31 ммоль) за один раз через шприц. После перемешивания в течение 4 часов раствор выливали в насыщенный водный бикарбонат натрия (100 мл) и водный слой экстрагировали 10% ТФЭ в ДХМ (2×50 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением 2-ацетамидо-N-трет-бутил-2-[(3R)-пирролидин-3-ил]гекс-5-енамида (0,95 г, 90%) в виде светло-желтой маслянистой жидкости. Применяли без дополнительной очистки на следующей стадии. 1Н ЯМР (400 МГц, CDCl3, Смесь диастереомеров) δ 7,80 (br, s, 0,5H), 7,60 (br, s, 0,5H), 7,45 (br, s, 0,5H), 1,96-1,65 (br, s, 0,5H), 1,80-1,55 (m, 4H), 1,36-1,34 (2x s, 9H), ИЭР MC эксперимент C16H29N3O2 m/z 296,3 (M+H)+.
Стадия 2: 2-ацетамидо-N-трет-бутил-2-((R)-1-(4-фторбензил)пирролидин-3-ил)гекс-5-енамид
[0647] Раствор 2-ацетамидо-N-трет-бутил-2-[(3R)-пирролидин-3-ил]гекс-5-енамида (315 мг, 1,07 ммоль), 4-фторбензальдегида (140 мкл, 1,3 ммоль) и уксусной кислоты (60 мкл, 1 ммоль) в метиленхлориде (10 мл, 200 ммоль) перемешивали в течение 10 минут, после чего добавляли триацетоксиборгидрид натрия (377 мг, 1,78 ммоль) за один раз. После перемешивания при комнатной температуре в течение ночи реакцию гасили 1н. NaOH (10 мл). Полученный в результате органический слой отделяли, а водный слой дополнительно экстрагировали ДХМ (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением 2-ацетамидо-N-трет-бутил-2-((R)-1-(4-фторбензил)пирролидин-3-ил)гекс-5-енамида (0,387 г, 89,9%) в виде маслянистой жидкости. Маслянистую жидкость применяли на следующей стадии без очистки. ИЭР МС эксперимент C23H34FN3O2 m/z 404,3 (М+Н)+.
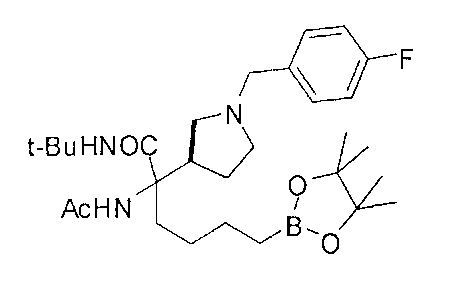
Стадия 3: 2-ацетамидо-N-трет-бутил-2-((R)-1-(4-фторбензил)пирролидин-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
[0648] Раствор дихлорида бис(1,5-циклооктадиен)дииридия (I) (35,0 мг, 0,0520 ммоль) и 1,2-бис(дифенилфосфино)этана (44 мг, 0,11 ммоль) в тетрагидрофуране (5 мл, 60 ммоль) охлаждали до 0°С. После перемешивания в течение 10 минут 4,4,5,5-тетраметил-1,3,2-диоксаборолан (120 мкл, 0,83 ммоль) добавляли за один раз через шприц и реакционную смесь перемешивали при 0°С в течение 5 минут, после чего нагревали до комнатной температуры и дополнительно перемешивали в течение 15 минут. Реакционную смесь повторно охлаждали до 0°С и обрабатывали 2-ацетамидо-N-трет-бутил-2-((R)-1-(4-фторбензил)пирролидин-3-ил)гекс-5-енамидом (210 мг, 0,52 ммоль) в тетрагидрофуране (3 мл, 40 ммоль) за один раз. После перемешивания в течение 10 минут при 0°С реакционную смесь нагревали до комнатной температуры и дополнительно перемешивали в течение 4 часов. Смесь разбавляли водным бикарбонатом натрия, экстрагировали ДХМ (3×50 мл), сушили над Na2SO4, фильтровали и концентрировали с получением 2-ацетамидо-N-трет-бутил-2-((R)-1-(4-фторбензил)пирролидин-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида в виде светло-оранжевой маслянистой жидкости, которую применяли без дополнительной очистки. ИЭР МС эксперимент C29H47BFN3O4 m/z 532,3 (М+Н)+.
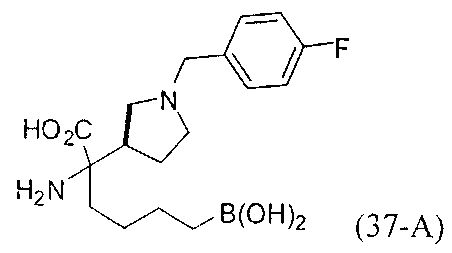
Стадия 4: дигидрохлорид 2-амино-6-бороно-2-((R)-1-(4-фторбензил)пирролидин-3-ил)гексановой кислоты
[0649] Водный раствор 2-ацетамидо-N-трет-бутил-2-((R)-1-(4-фторбензил)пирролидин-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (0,280 г, 0,527 ммоль) в 6М хлороводороде (10 мл, 60 ммоль) кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли 20 мл воды и промывали этилацетатом (20 мл). Водный слой очищали путем ВЭЖХ (3 инъекции) с применением 5-20% ацетонитрила в воде. Фракции, соответствующие целевому продукту, концентрировали и лиофилизировали с получением дигидрохлорида 2-амино-6-бороно-2-((R)-1-(4-фторбензил)пирролидин-3-ил)гексановой кислоты в виде белого порошка, который становился маслянистым на воздухе (гигроскопичен) (0,003 г, 2%). 1Н ЯМР (400 МГц, CDCl3, Смесь диастереомеров) δ 7,41 (dd, J1=8,1 Гц, J2=6,5 Гц, 2Н), 7,12 (t, J=8,1 Гц, 2Н), 4,35-4,25 (br, m, 2H), 3,77-3,09 (br, m, 3H), 2,99-2,60 (br, m, 1H), 2,39-1,57 (br, m, 4H), 1,34-1,18 (br, m, 2Н), 1,15-1,03 (br, m, 1H), 0,70-0,61 (m, 2Н); ИЭР МС эксперимент C17H26BFN2O4 m/z 335,3 (M+H-H2O)+; 351,4 (M-H)-; 333,4 (M-H-H2O)-.
[0650] Пример 38-А: получение дигидрохлорида 2-амино-6-бороно-2-((R)-1-(4-(трифторметил)бензил)пирролидин-3-ил)гексановой кислоты
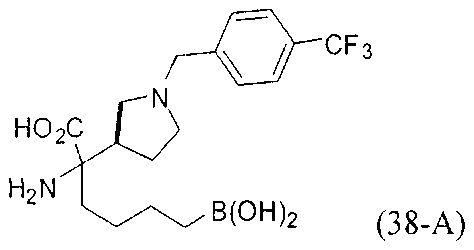
[0651] 2-амино-6-бороно-2-((R)-1-(4-(трифторметил)бензил)пирролидин-3-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 37-А, с тем исключением, что 4-трифторметилбензальдегид применяли на стадии 2. 1H ЯМР (400 МГц, D2O, Смесь диастереомеров) δ 7,73 (d, J=8,1 Гц, 2Н), 7,58 (d, J=8,1 Гц, 2Н), 4,41 (s, 2Н), 2,82-3,63 (m, 4H), 2,42-1,58 (m, 4H), 1,38-1,20 (m, 2Н), 1,18-1,03 (m, 1H), 0,72-0,63 (m, 2Н); ИЭР МС эксперимент C18H26BF3N2O4 m/z 385,3 (M+H-H2O)-: 401,4 (M-H)-; 383,4 (М-Н-H2O)-.
[0652] Пример 39-А: получение дигидрохлорида 2-амино-6-бороно-2-((R)-1-(4-метилбензил)пирролидин-3-ил)гексановой кислоты
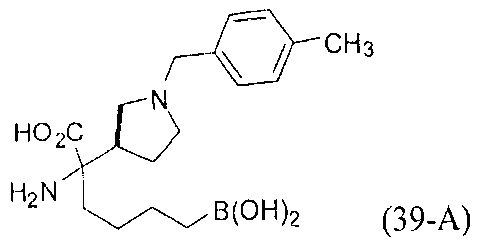
[0653] Дигидрохлорид 2-амино-6-бороно-2-((R)-1-(4-метилбензил)пирролидин-3-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 37-А, с тем исключением, что 4-метилбензальдегид применяли на стадии 2. 1Н ЯМР (400 МГц, D2O, смесь диастереомеров) δ 7,22 (d, J=8,1 Гц, 2Н), 7,18 (d, J=8,1 Гц, 2Н), 4,30-4,11 (m, 2Н), 3,69-3,28 (m, 3Н). 3,24-2,66 (m, 2Н), 2,33-2,02 (m, 4Н), 1,92-1,55 (m, 3H), 1,34-1,17 (m, 2Н), 1,15-1,00 (m, 1Н), 0,67-0,57 (m, 2Н); ИЭР МС эксперимент C18H29BN2O4 m/z 349,5 (M+H)+; 331,4 (М+Н-H2O)+; 347,5 (М-Н)-; 329,4 (М-Н-Н2О)-.
[0654] Пример 40-А: получение 2-амино-6-бороно-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)гексановой кислоты
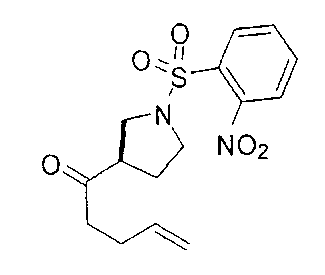
Стадия 1: (R)-1-(1-(2-нитрофенилсульфонил)пирролидин-3-ил)пент-4-ен-1-он
[0655] В раствор (R)-трет-бутил-3-пент-4-еноилпирролидин-1-карбоксилата (300 мг, 1 ммоль) в метиленхлориде (5 мл, 80 ммоль) добавляли трифторуксусную кислоту (2 мл, 20 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Неочищенную реакционную смесь затем концентрировали с получением неочищенного маслянистого вещества, которое перерастворяли в метиленхлориде (5 мл, 80 ммоль), после чего добавляли триэтиламин (1 мл, 7 ммоль). Полученный раствор охлаждали до 0°С, после чего добавляли 2-нитробензолсульфонилхлорид (450 мг, 2,0 ммоль) за один раз. Реакционную смесь, которая мгновенно приобретала синий цвет, перемешивали в течение ночи при комнатной температуре. После завершения реакции раствор разбавляли насыщенным водным бикарбонатом натрия (50 мл) с получением двух слоев, которые разделяли. Водный слой дополнительно экстрагировали метиленхлоридом (2×20 мл), объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением синей маслянистой жидкости, которую очищали путем колоночной флэш-хроматографии (силикагель, элюировали 0-100% этилацетатом в гексане) с получением (R)-1-(1-(2-нитрофенилсульфонил)пирролидин-3-ил)пент-4-ен-1-она (305 мг, 80%). 1Н ЯМР (400 МГц, CDCl3; δ 8,07-8,03 (m, 1H), 7,76-7,70 (m, 2H), 7,66-7,62 (m, 1H), 5,78 (ddt, J1=17,0 Гц, J2=10,4 Гц, J3=6,5 Гц, 1H), 5,07-4,97 (m, 2H), 3,70 (dd, J1=12,0 Гц, J2=8,0 Гц, 1H) 3,61 (dd, J1=12,0 Гц, J2=8,1 Гц, 1H), 3,52 (t, J=8,1 Гц, 2H), 3,24 (р, J=8,0 Гц, 1H), 2,59 (td, J1=7,3 Гц, J2=3,6 Гц, 2H), 2,32 (q, J=6,8 Гц, 2H), 2,24-2,16 (m, 1H), 2,14-2,05 (m, 1H), 1,28 (ddd, J1=17,8 Гц, J2=10,6 Гц, J3=7,3 Гц, 1H); ИЭР МС эксперимент C15H18N2O5S m/z 339,3 (М+Н)+.
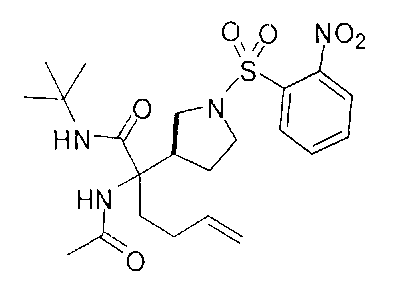
Стадия 2: 2-ацетамидо-N-трет-бутил-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)гекс-5-енамид
[0656] Раствор (R)-1-(1-(2-нитрофенилсульфонил)пирролидин-3-ил)пент-4-ен-1 -она (1,03 г, 3,04 ммоль) и ацетата аммония (0,548 г, 7,11 ммоль) в 2,2,2-трифторэтаноле (1,5 мл, 2,0 ммоль) обрабатывали трет-бутилизоцианидом (1,5 мл, 24 ммоль), после чего перемешивали при комнатной температуре. Через 8 часов дополнительно добавляли 0,5 мл изоцианата и температуру реакционной смеси повышали до 40°С. После перемешивания в течение ночи при 40°С неочищенную реакционную смесь разделяли в этилацетате и насыщенном водном бикарбонате натрия. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали, затем очищали неочищенную маслянистую жидкость путем колоночной флэш-хроматографии (силикагель, 0-100% этилацетат в гексане) с получением 2-ацетамидо-N-трет-бутил-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)гекс-5-енамида (1,00 г, 68,4%) в виде коричневой пены. 1Н ЯМР (400 МГц, CDCl3, смесь диастереомеров) δ 8,07-8,02 (m, 1H), 7,81-7,71 (m, 2H), 7,64-7,59 (m, 1H), 6,85 (2x s, 1H), 5,98-5,63 (br, m, 2H), 5,06-4,95 (m, 2H), 3,61-2,90 (m, 6H), 2,02-2,00 (2x s, 3H), 1,95-1,41 (m, 5H), 1,38-1,36 (2x s, 9H); ИЭР МС эксперимент C22H32N4O6S m/z 481,2 (M+H)+; 479,3 (М-Н)+.
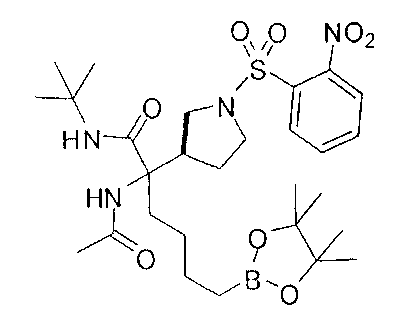
Стадия 3: 2-ацетамидо-N-трет-бутил-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
[0657] В 50 мл круглодонной колбе раствор дихлорида бис(1,5-циклооктадиен)дииридия (I) (72 мг, 0,11 ммоль) и 1,2-бис(дифенилфосфино)этана (84 мг, 0,21 ммоль) в тетрагидрофуране (10 мл, 100 ммоль) охлаждали до 0°С, перемешивали в течение 15 минут и обрабатывали 4,4,5,5-тетраметил-1,3,2-диоксабороланом (450 мкл, 3,1 ммоль). После дополнительного перемешивания в течение 5 минут охлаждающую баню удаляли и реакционную смесь оставляли нагреваться до комнатной температуры при перемешивании в течение 15 минут. Реакционную смесь затем повторно охлаждали до 0°С и обрабатывали раствором 2-ацетамидо-N-трет-бутил-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)гекс-5-енамида (1,00 г, 2,08 ммоль) в тетрагидрофуране (2 мл, 20 ммоль), который добавляли по каплям через шприц. После перемешивания в течение 5 минут при 0°С реакционную смесь нагревали до комнатной температуры и перемешивали до получения целевого продукта с хорошим выходом. Реакцию гасили, выливая неочищенную смесь в насыщенный водный раствор карбоната натрия (50 мл). Водный слой экстрагировали этилацетатом (3×30 мл), объединенные органические слои промывали насыщенным водным хлоридом натрия (20 мл), сушили над Na2SO4, фильтровали и концентрировали с получением 2-ацетамидо-N-трет-бутил-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (1,20 г, 94,8%) в виде пены. Титульное соединение применяли без дополнительной очистки. ИЭР МС эксперимент C28H45N4O8BS m/z 609,5 (М+Н)+; 607,5 (М-Н)-.
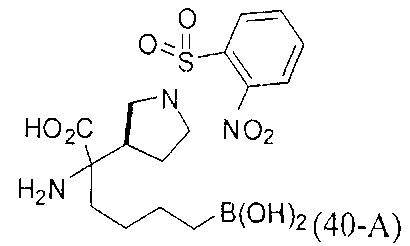
Стадия 4: 2-амино-6-бороно-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)гексановая кислота
[0658] Раствор 2-ацетамидо-N-трет-бутил-2-((R)-1-(2-нитрофенилсульфонил)-пирролидин-3-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (500мг, 0,8 ммоль) в 1,4-диоксане (3 мл, 40 ммоль) обрабатывали 6М водным раствором хлороводорода (6 мл, 40 ммоль), затем нагревали до 100°С в течение 24 часов. По прошествии 24 часов реакционную смесь разбавляли водой и фильтровали. Полученный фильтрат очищали путем ВЭЖХ с применением 5-50% ацетонитрила в воде в течение 30 минут. Фракции, содержащие продукт, концентрировали, затем растворяли в 1н. HCl и замораживали, после чего лиофилизировали с получением 2-амино-6-бороно-2-((R)-1-(2-нитрофенилсульфонил)пирролидин-3-ил)гексановой кислоты (79 мг, 20%) в виде белой пены. 1Н ЯМР (400 МГц, ДМСО-d6, Смесь диастереомеров) δ 8,55-8,35 (2Н), 8,05-7,98 (m, 2Н), 7,96-7,85 (m, 2Н), 5,83 (t, J=6,5 Гц, 2Н), 3,70-3,14 (m, 4H), 2,78-2,65 (m, 1Н), 2,19-1,60 (m, 4H), 1,47-1,23 (m, 3H), 1,14-1,00 (m, 1Н); ИЭР МС эксперимент C16H24BN3O8S т/г 412,1 (М-ОН)+; 410,2 (М-Н2О)-.
Пример 41-А: получение 2-амино-6-бороно-2-(1-фенэтилпиперидин-4-ил)гексановой кислоты
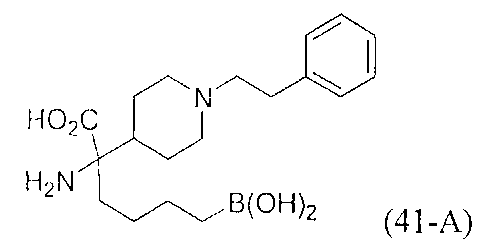
[0659] 2-Амино-6-бороно-2-(1-фенэтилпиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-фенилэтаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,35-7,28 (m, 2Н), 7,30-7,20 (m, 3H), 3,71-3,62 (m, 2Н), 3,35-3,25 (m, 2Н), 3,04-2,90 (m, 4H), 2,2-2,05 (m, 2Н), 1,93-1,75 (m, 4H), 1,55-1,45 (m, 1Н), 1,38-1,22 (m, 3H), 1,18-1,05 (m, 1Н), 0,69 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C19H31BN2O4 m/z [363,2 (M+1)].
[0660] Пример 42-А: получение 2-амино-6-бороно-2-(1-(3,4-дихлорфенилкарбамоил)пиперидин-4-ил)гексановой кислоты
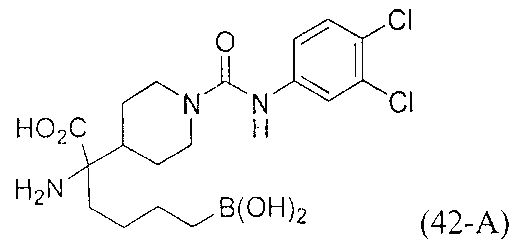
[0661] 2-Амино-6-бороно-2-(1-(3,4-дихлорфенилкарбамоил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 31-А, с тем исключением, что 1,2-дихлор-4-изоцианатобензол применяли в качестве изоцианата. 1Н ЯМР (D2O, 500 МГц) δ 7,33-7,25 (m, 2H), 7,01-6,96 (m, 1H), 4,01 (t, J=11,4 Гц, 2Н), 2,80 (t, J=11,1 Гц, 2H), 2,08-2,01 (m, 1H), 1,83-1,77 (m, 3H), 1,58-1,51 (m, 1H), 1,47-1,32 (m, 1H), 1,33-1,18 (m, 3H), 1,18-1,04 (m, 2H), 0,65 (t. J=7,2 Гц, 2H). ИЭР МС эксперимент C18H27BCl2N3O5 m/z [428,5 (M-18+1)].
[0662] Пример 43-А: получение 2-амино-6-бороно-2-(1-(4-хлорбензилкарбамотиоил)пиперидин-4-ил)гексановой кислоты
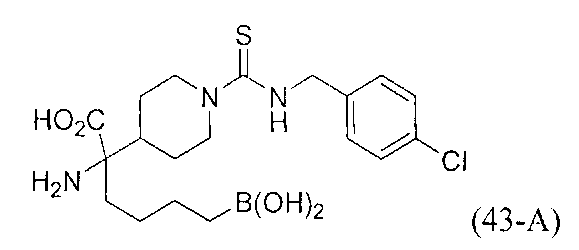
[0663] 2-Амино-6-бороно-2-(1-(4-хлорбензилкарбамотиоил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 31-А, с тем исключением, что 1-хлор-4-(изотиоцианатометил)бензол применяли в качестве изоцианата. 1Н ЯМР (D2O, 300 МГц) δ 7,21 (d, J=8,4 Гц, 2H), 7,09 (d, J=8,4 Гц, 2H), 4,62 (bs, 2H), 4,59 (m, 2H), 2,95 (bt, J=11,4 Гц, 2H), 2,14 (bt, J=11,4 Гц, 1H), 1,85-1,70 (m, 3H), 1,62-1,51 (m, 1H), 1,48-1,00 (m, 6H), 0,63 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C19H29BClN3O4S m/z [442,6 (M+1)].
[0664] Пример 44-А: получение 2-амино-6-бороно-2-(1-(3-хлор-4-метилфенилкарбамотиоил)пиперидин-4-ил)гексановой кислоты
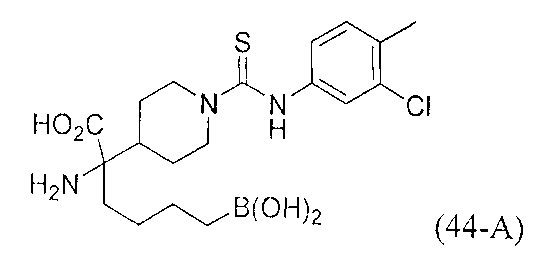
[0665] 2-Амино-6-бороно-2-(1-(3-хлор-4-метилфенилкарбамотиоил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 32-А, с тем исключением, что 2-хлор-4-изотиоцианато-1-метилбензол применяли в качестве изоцианата.
[0666] Пример 45-А: получение 2-амино-6-бороно-2-(1-(нафталин-1-илкарбамотиоил)пиперидин-4-ил)гексановой кислоты
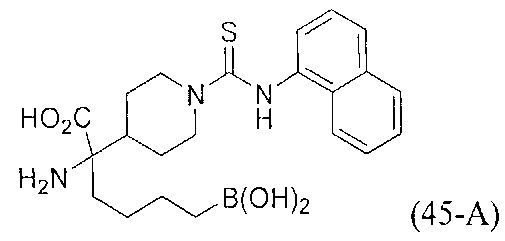
[0667] 2-Амино-6-бороно-2-(1-(нафталин-1-илкарбамотиоил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 32-А, с тем исключением, что 1-изотиоцианатонафталин применяли в качестве изоцианата. 1Н ЯМР (D2O, 300 МГц) δ 7,87-7,78 (m, 2Н), 7,70-7,64 (m, 1H), 7,46-7,37 (m, 3H), 7,22-7,17 (m, 1H), 4,60-4,55 (m, 2Н), 3,06 (bt, J=11,4 Гц, 2Н), 2,20 (bt, J=11,4 Гц, 1H), 1,92-1,76 (m, 3H), 1,70-1,50 (m, 2Н), 1,40-1,20 (m, 4H), 1,18-1,03 (m, 1H), 0,67 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C22H30BN3O4S m/z [444,6 (M+1)].
[0668] Пример 46-А: получение 2-амино-6-бороно-2-(1-(3-(4-хлорфенил)пропил)пиперидин-4-ил)гексановой кислоты
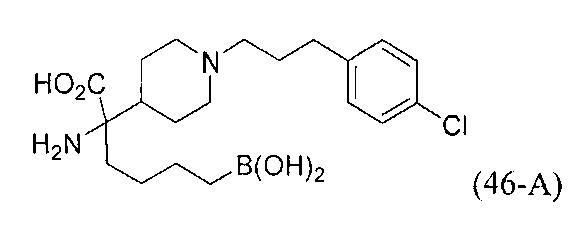
[0669] 2-Амино-6-бороно-2-(1-(3-(4-хлорфенил)пропил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-(4-хлорфенил)пропаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,16 (d, J=8,4 Гц, 2Н), 7,04 (d, J=8,4 Гц, 2Н), 3,54-3,45 (m, 2Н), 2,97-2,88 (m, 2Н), 2,87-2,72 (m, 2Н), 2,58-2,50 (m, 2Н), 2,10-1,95 (m, 1H), 1,96-1,85 (m, 1H), 1,88-1,62 (m, 6H), 1,48-1,32 (m, 1H), 1,30-1,15 (m, 3H), 1,09-0,98 (m, 1H), 0,60 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C20H32BClN2O4 m/z [393,6 (M-18+1)].
[0670] Пример 47-А: получение 2-амино-6-бороно-2-(1-(2,4-дихлорфенэтил)пиперидин-4-ил)гексановой кислоты
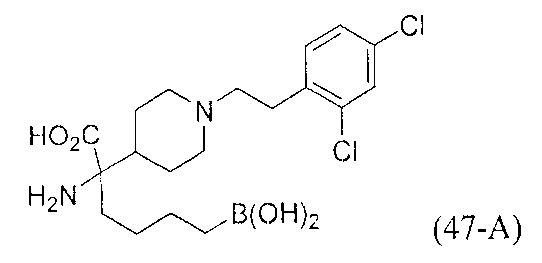
[0671] 2-Амино-6-бороно-2-(1-(2,4-дихлорфенэтил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 2-(2,4-дихлорфенил)ацетальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,41 (s, 1Н), 7,20 (bs, 2H), 3,26-3,17 (m, 2H), 3,09-3,01 (m, 2H). 3,00-2,89 (m, 2H), 2,11-2,02 (m, 2H), 1,88-1,70 (m, 4H), 1,51-1,42 (m, 1Н), 1,34-1,20 (m, 3Н), 1,12-1,02 (m, 1Н), 0,67 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C19H29BCl2N2O4 m/z [413,6 (M-18+1)].
[0672] Пример 48-А: получение 2-амино-6-бороно-2-(1-(3,4-дифторбензил)пиперидин-4-ил)гексановой кислоты
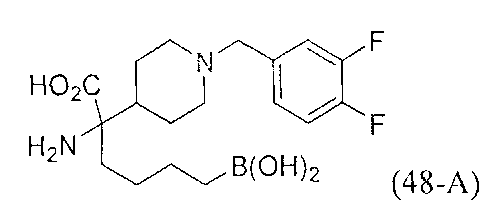
[0673] 2-Амино-6-бороно-2-(1-(3,4-дифторбензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3,4-дифторбензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,35-7,05 (m, 3Н), 4,14 (s, 2H), 3,50-3,36 (m, 2H), 2,94-2,84 (m, 2H), 2,16-1,95 (m, 2H), 1,86-1,54 (m, 4H), 1,50-1,35 (m, 1Н), 1,36-1,14 (m, 3Н), 1,14-0,97 (m, 1Н), 0,65 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C18H27BF2N2O4 m/z [385,1 (M+1)].
[0674] Пример 49-А: получение 2-амино-6-бороно-2-(1-(4-хлор-3-фторбензил)пиперидин-4-ил)гексановой кислоты
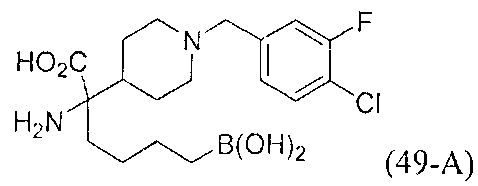
[0675] 2-Амино-6-бороно-2-(1-(4-хлор-3-фторбензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 4-хлор-3-фторбензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,51-7,43 (m, 1Н), 7,32-7,23 (m, 1Н), 7,22-7,10 (m, 1Н), 4,13 (s, 2H), 3,51-3,38 (m, 2H), 2,98-2,82 (m, 2H), 2,18-1,94 (m, 2H), 1,88-1,61 (m, 4H), 1,50-1,32 (m, 1H), 1,33-1,14 (m, 3H), 1,13-0,96 (m, 1H), 0,61 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C18H27BClFN2O4 m/z [401,2 (M+1)].
[0676] Пример 50-А: получение 2-амино-6-бороно-2-(1-(3-(3-хлор-5-фторфенил)пропил)пиперидин-4-ил)гексановой кислоты
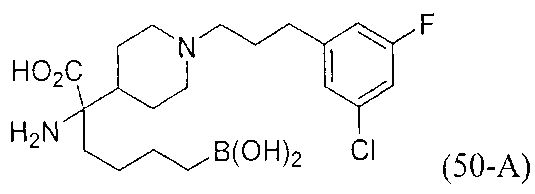
[0677] 2-Амино-6-бороно-2-(1-(3-(3-хлор-5-фторфенил)пропил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-(3-хлор-5-фторфенил)пропаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,01-6,91 (m, 2H), 6,86-6,78 (m, 1H), 3,55-3,45 (m, 2H), 2,97-2,85 (m, 2H), 2,86-2,74 (m, 2H), 2,60-2,49 (m, 2H), 2,09-1,60 (m, 8H), 1,48-1,35 (m, 1H), 1,35-1,15 (m, 3H), 1,10-0,97 (m, 1H), 0,62 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C20H31BClFN2O4 m/z [429,5 (M+1)].
[0678] Пример 51-А: получение 2-амино-6-бороно-2-(1-((4-фторнафталин-1-ил)метил)пиперидин-4-ил)гексановой кислоты
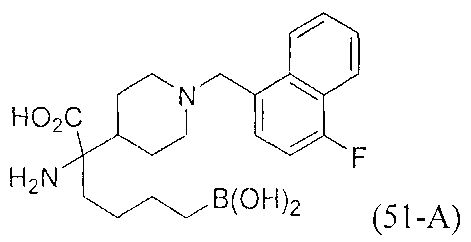
[0679] 2-Амино-6-бороно-2-(1-((4-фторнафталин-1-ил)метил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 4-фтор-1-нафтальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 8,03 (d, J=8,4 Гц, 1H), 7,95 (d, J=8,4 Гц, 1H), 7,64-7,44 (m, 3H), 7,10 (t, J=8,4 Гц, 1H), 4,60 (bs, 2H), 3,51-3,40 (m, 2H), 3,11-2,97 (m, 2H), 2,20-2,04 (m, 1H), 2,00-1,85 (m, 1H), 1,80-1,60 (m, 4H), 1,46-1,31 (m, 1H), 1,30-1,10 (m, 3H), 1,10-0,95 (m, 1H), 0,59 (t, J=7,2 Гц, 2 Н). ИЭР МС эксперимент C22H30BFN2O4 m/z [417,1 (M+1)].
[0680] Пример 52-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(3-(2,4-дифторфенил)пропил)пиперидин-4-ил)гексановой кислоты
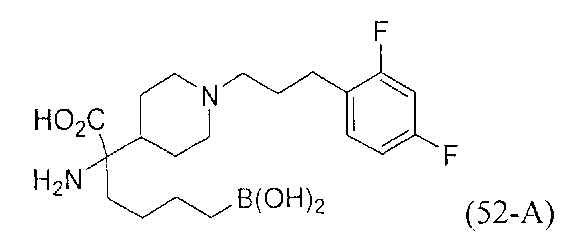
[0681] Дигидрохлорид 2-амино-6-бороно-2-(1-(3-(2,4-дифторфенил)пропил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-(2,4-дифторфенил)пропаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,22-7,15 (m, 1), 6,88-6,70 (m, 2H), 3,60-3,49 (m, 2H), 3,05-3,94 (m, 2H), 2,93-2,83 (m, 2H), 2,66-2,58 (m, 2H), 2,15-2,02 (m, 2H), 1,98-1,70 (m, 6H), 1,50-1,41 (m, 1H), 1,39-1,25 (m, 3Н), 1,15-1,05 (m, 1H), 0,70 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C20H31BF2N2O4 m/z [395,7 (M+1-18)].
[0682] Пример 53-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(2-(трифторметил)бензил)пиперидин-4-ил)гексановой кислоты
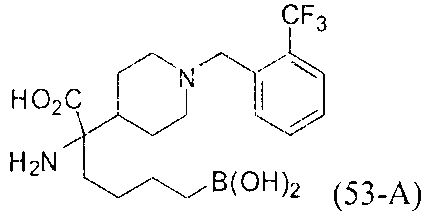
[0683] 2-Амино-6-бороно-2-(1-(2-(трифторметил)бензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 2-(трифторметил)бензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,79-7,74 (m, 1H), 7,67-7,52 (m, 3Н), 4,39 (s, 2H), 3,62-3,48 (m, 2H), 3,14-3,00 (m, 2H), 2,15-1,95 (m, 2H), 1,87-1,65 (m, 4H), 1,55-1,38 (m, 1H), 1,35-1,20 (m, 3Н), 1,15-0,96 (m, 1H), 0,65 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C19H28BF3N2O4 m/z [417,2 (M+1)].
[0684] Пример 54-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(2-морфолинобензил)пиперидин-4-ил)гексановой кислоты
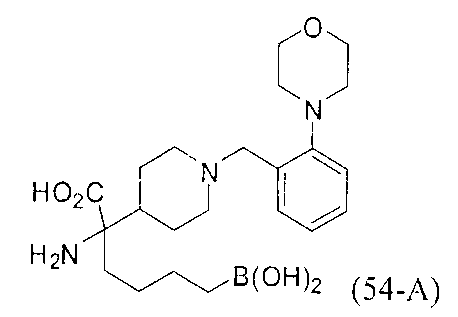
[0685] 2-Амино-6-бороно-2-(1-(2-морфолинобензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 2-морфолинобензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,43 (dd, J1=8,7 Гц, J2=1,5 Гц, 1Н), 7,36-7,30 (m, 2H), 7,18 (dd, J1=8,4 Гц, J2=1,2 Гц, 1Н), 4,32 (s, 2H), 3,82-3,75 (m, 4H), 3,55-3,45 (m, 2H), 3,10-2,95 (m, 2H), 3,90-3,82 (m, 4H), 2,18-1,98 (m, 2H), 1,89-1,70 (m, 4H), 1,50-1,35 (m, 1Н), 1,35-1,20 (m, 3Н), 1,15-0,99 (m, 1Н), 0,64 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C22H36BN3O5 m/z [434,1(М+1)].
[0686] Пример 55-А: получение дигидрохлорида 2-амино-2-(1-(бифен-2-илметил)пиперидин-4-ил)-6-бороногексановой кислоты
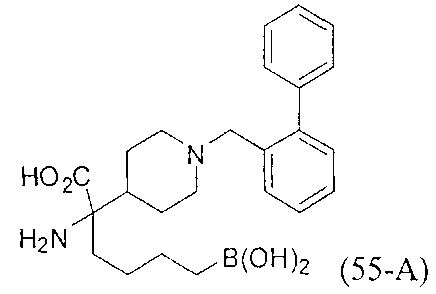
[0687] 2-Амино-2-(1-(бифен-2-илметил)пиперидин-4-ил)-6-бороногексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что бифенил-2-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,53-7,24 (m, 9Н), 4,29 (s, 2H), 3,32-3,18 (m, 2H), 2,58-2,42 (m, 2H), 1,90-1,75 (m, 2H), 1,73-1,52 (m, 4H), 1,52-1,48 (m, 1Н), 1,35-1,10 (m, 3Н), 1,10-0,95 (m, 1Н), 0,62 (t,J=7,2 Гц, 2H). ИЭР МС эксперимент C24H33BN2O4 m/z [425,2 (M+1)].
[0688] Пример 56-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(хинолин-8-илметил)пиперидин-4-ил)гексановой кислоты
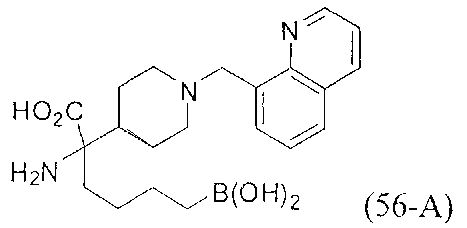
[0689] 2-Амино-6-бороно-2-(1-(хинолин-8-илметил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что хинолин-8-карбальдегид применяли в качестве альдегида на стадии 6. 1H ЯМР (D2O, 300 МГц) δ 8,98 (bd, J=4,3 Гц, 1Н), 8,82 (d, J=8,2 Гц, 1Н), 8,21 (d, J=8,4 Гц, 1Н), 8,04 (d, J=8,0 Гц, 1Н), 7,89-7,75 (m, 4H), 4,85 (s, 2H), 3,65-3,50 (m, 2H), 3,20-3,03 (m, 2Н), 2,22-2,08 (m, 1H), 2,10-1,96 (m, 1H), 1,88-1,65 (m, 4H), 1,54-1,38 (m, 1H), 1,38-1,17 (m, 3H), 1,15-0,99 (m, 1H), 0,67 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C21H30BN3O4 m/z [400,5 (M+1)].
[0690] Пример 57-A: получение дигидрохлорида 2-амино-6-бороно-2-(1-(2-(пиридин-3-ил)бензил)пиперидин-4-ил)гексановой кислоты
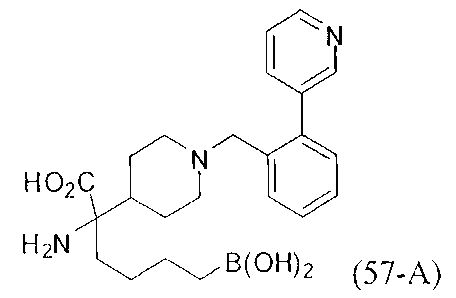
[0691] 2-Амино-6-бороно-2-(1-(2-(пиридин-3-ил)бензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 2-(пиридин-3-ил)бензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 8,82-8,75 (m, 2Н), 8,56-8,50 (m, 1H), 8,12-8,05 (m, 1H), 7,65-7,53 (m, 3H), 7,38-7,34 (m, 1H), 4,25 (s, 2Н), 3,44-3,35 (m, 2H), 2,68-2,51 (m, 2Н), 1,96-1,80 (m, 2Н), 1,70-1,52 (m, 4H), 1,52-1,48 (m, 1H), 1,35-1,10 (m, 3H), 1,10-0,95 (m, 1H), 0,66 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C23H32BN3O4 m/z [426,3 (M+1)].
[0692] Пример 58-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-((3′-метоксибифен-2-ил)метил)пиперидин-4-ил)гексановой кислоты
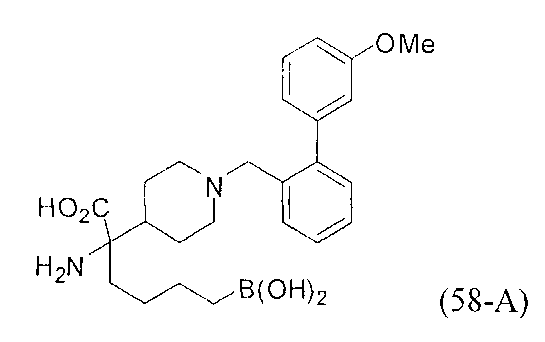
[0693] 2-Амино-6-бороно-2-(1-((3′-метоксибифен-2-ил)метил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3′-метоксибифенил-2-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,52-7,28 (m, 5Н), 7,00-6,83 (m, 3H), 4,28 (s, 2Н), 3,73 (s, 3H), 3,32-3,22 (m, 2Н), 2,60-2,45 (m, 2Н), 1,90-1,75 (m, 2Н), 1,70-1,50 (m, 4H), 1,38-1,10 (m, 4H), 1,10-0,94 (m, 1H), 0,62 (t, J=7,5 Гц, 2Н). ИЭР МС эксперимент C25H35BN2O5 m/z [455,4 (M+1)].
[0694] Пример 59-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(3,4-дифторфенэтил)пиперидин-4-ил)гексановой кислоты
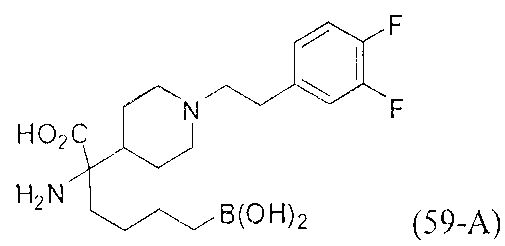
[0695] 2-Амино-6-бороно-2-(1-(3,4-дифторфенэтил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 2-(3,4-дифторфенил)ацетальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,15-7,03 (m, 2Н), 6,97-6,90 (m, 1H), 3,63-3,51 (m, 2H), 3,28-3,15 (m, 2H), 2,99-2,80 (m, 4H), 2,10-1,97 (m, 2H), 1,87-1,63 (m, 4H), 1,52-1,35 (m, 1H), 1,35-1,15 (m, 3H), 1,14-0,98 (m, 1H), 0,65 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C19H29BF2N2O4) m/z [399,2 (M+1)].
[0696] Пример 60-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(хроман-8-илметил)пиперидин-4-ил)гексановой кислоты
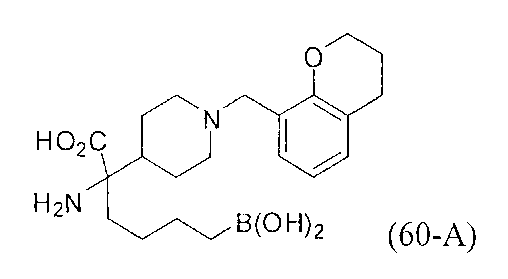
[0697] 2-Амино-6-бороно-2-(1-(хроман-8-илметил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что хроман-8-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,12 (d, J=8,2 Гц, 1H). 7,06 (d, J=8,2 Гц, 1H), 6,80 (dd, J1=8,2 Гц, J2=8,2 Hz, 1H), 4,17-4,09 (m, 4H), 3,52-3,42 (m, 2H), 3,00-2,86 (m, 2H), 2,71-2,64 (m, 2H), 2,09-1,95 (m, 2H), 1,91-1,64 (m, 6H), 1,49-1,34 (m, 1H), 1,35-1,18 (m, 3H), 1,16-0,99 (m, 1H), 0,64 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C21H33BN2O5 m/z [405,3 (M+1)].
[0698] Пример 61-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(индолин-7-илметил)пиперидин-4-ил)гексановой кислоты
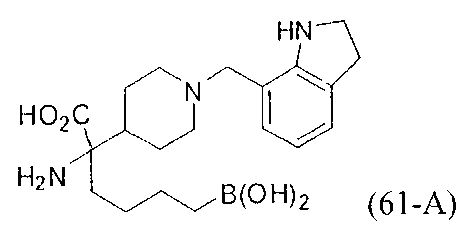
[0699] 2-Амино-6-бороно-2-(1-(индолин-7-илметил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что индолин-7-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,54-7,36 (m, 3H), 4,30 (s, 2H), 3,80 (t, J=7,8 Гц, 2Н), 3,60-3,45 (m, 2Н), 3,25 (t, J=7,8 Гц, 2Н), 3,11-2,95 (m, 2Н), 2,13-1,98 (m, 2Н), 1,90-1,65 (m, 4H), 1,50-1,35 (m, 1H), 1,38-1,14 (m, 3H), 1,16-0,99 (m, 1H), 0,66 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C20H32BN3O4 m/z [390,3 (M+1)].
[0700] Пример 62-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-((1,3-диметил-1Н-пиразол-5-ил)метил)пиперидин-4-ил)гексановой кислоты
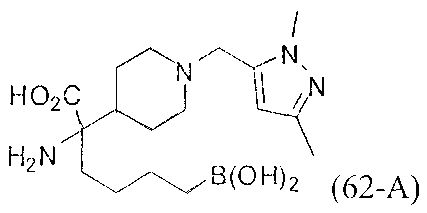
[0701] 2-Амино-6-бороно-2-(1-((1,3-диметил-1Н-пиразол-5-ил)метил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 1,3-диметил-1Н-пиразол-5-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 6,30 (s, 1H), 4,32 (s, 2Н), 3,73 (s, 3H), 3,58-3,47 (m, 2Н), 3,07-2,94 (m, 2Н), 2,12 (s, 3H), 2,11-2,00 (m, 2Н), 1,90-1,68 (m, 4H), 1,51-1,4 (m, 1H), 1,36-1,22 (m, 3H), 1,18-1,04 (m, 1H), 0,66 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C17H31BN4O4 m/z [367,4 (M+1)].
[0702] Пример 63-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(3-(4-(трифторметил)фенил)пропил)пиперидин-4-ил)гексановой кислоты
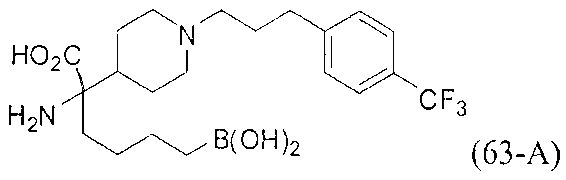
[0703] 2-Амино-6-бороно-2-(1-(3-(4-(трифторметил)фенил)пропил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-(4-(трифторметил)фенил)пропаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,56 (d, J=8,6 Гц, 1Н), 7,32 (d, J=8,6 Гц, 1Н), 3,60-3,47 (m, 2H), 3,03-2,92 (m, 2H), 2,92-2,75 (m, 2H), 2,72-2,61 (m, 2H), 2,11-1,88 (m, 4H), 1,90-1,64 (m, 4H), 1,52-1,35 (m, 1Н), 1,35-1,15 (m, 3Н), 1,16-0,99 (m, 1Н), 0,65 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C21H32BF3H2O4 m/z [445,2 (M+1)].
[0704] Пример 64-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(4-(3,4-дихлорфенокси)бензил)пиперидин-4-ил)гексановой кислоты
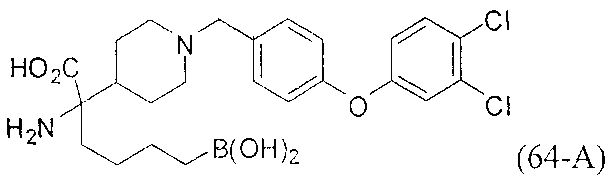
[0705] 2-Амино-6-бороно-2-(1-(4-(3,4-дихлорфенокси)бензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 4-(3,4-дихлорфенокси)бензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,44-7,36 (m, 2H), 7,20-7,03 (m, 4H), 6,89 (dd, J1=8,8 Гц, J2=3,0 Гц, 1Н), 4,14 (s, 2H), 3,54-3,48 (m, 2H), 2,98-2,84 (m, 2H), 2,10-1,95 (m, 2H), 1,85-1,64 (m, 4H), 1,50-1,32 (m, 1Н), 1,35-1,18 (m, 3Н), 1,16-1,01 (m, 1H), 0,66 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C24H31BCl2N2O5 m/z [509,3 (M+1), 511,3 (M+1)].
[0706] Пример 65-А: получение дигидрохлорида 2-(1-(3-((1Н-пиразол-1-ил)метил)бензил)пиперидин-4-ил)-2-амино-6-бороногексановой кислоты
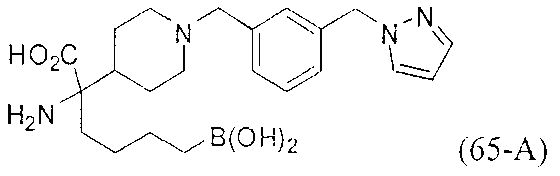
[0707] 2-(1-(3-((1Н-пиразол-1-ил)метил)бензил)пиперидин-4-ил)-2-амино-6-бороногексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-((1Н-пиразол-1-ил)метил)бензальдегид применяли в качестве альдегида на стадии 6. 1H ЯМР (D2O, 300 МГц) δ 7,82 (d, J=2,6 Гц, 1Н), 7,66 (d, J=2,6 Гц, 1Н), 7,41-7,18 (m, 4H), 6,41 (dd, J1=2,6 Гц, J2=2,6 Гц, 1Н), 5,39 (s, 2H), 4,15 (s, 2H), 3,50-3,38 (m, 2H), 2,97-2,82 (m, 2H), 2,15-1,92 (m, 2H), 1,87-1,62 (m, 4H), 1,49-1,32 (m, 1H), 1,35-1,18 (m, 3Н), 1,16-0,99 (m, 1H), 0,64 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C22H33BN4O4 m/z [429,3 (M+1)].
[0708] Пример 66-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(3-(2,4-дихлорфенил)пропил)пиперидин-4-ил)гексановой кислоты
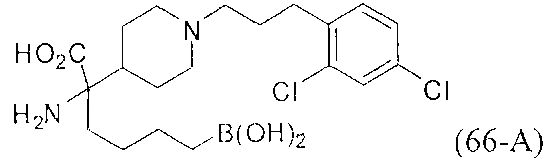
[0709] 2-Амино-6-бороно-2-(1-(3-(2,4-дихлорфенил)пропил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3-(2,4-дихлорфенил)пропаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,42 (s, 1H), 7,22 (bs, 2H), 3,65-3,55 (m, 2H), 3,14-3,05 (m, 2H), 3,00-2,97 (m, 2H), 2,75-2,67 (m, 2H), 2,29-2,19 (m, 1H), 2,17-2,08 (m, 1H), 2,02-1,79 (m, 6H), 1,62-1,50 (m, 1H), 1,45-1,29 (m, 3H), 1,21-1,10 (m, 1H), 0,63 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C20H31BCl2N2O4 m/z [427,7 (M+1-18)].
[0710] Пример 67-А: получение дигидрохлорида 2-амино-2-((R)-1-бензилпирролидин-3-ил)-6-бороногекановой кислоты
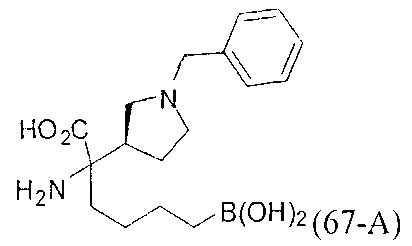
[0711] Дигидрохлорид 2-амино-2-((R)-1-бензилпирролидин-3-ил)-6-бороногекановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что (R)-1-(трет-бутоксикарбонил)пирролидин-3-карбоновую кислоту применяли в качестве карбоновой кислоты на стадии 1. ИЭР МС эксперимент C17H27BN2O4 m/z [335,2 (M+1)].
[0712] Пример 68-А: получение дигидрохлорида 2-амино-2-((S)-1-бензилпирролидии-3-ил)-6-бороногексановой кислоты

[0713] Дигидрохлорид 2-амино-2-((S)-1-бензилпирролидин-3-ил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что (S)-1-(трет-бутоксикарбонил)пирролидин-3-карбоновую кислоту применяли в качестве карбоновой кислоты на стадии 1. ИЭР МС эксперимент C17H27BN2O4 m/z [335,1 (М+1)].
[0714] Пример 69-А: получение дигидрохлорида 2-амино-6-бороно-2-((S)-1-(3,4-дихлорбензил)пиперидин-3-ил)гексановой кислоты
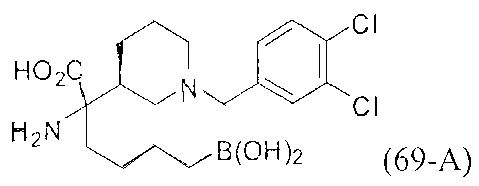
[0715] Дигидрохлорид 2-амино-6-бороно-2-((S)-1-(3,4-дихлорбензил)пиперидин-3-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что (S)-1-(трет-бутоксикарбонил)пиперидин-3-карбоновую кислоту применяли в качестве карбоновой кислоты на стадии 1 и 3,4-дихлорбензальдегид применяли в качестве альдегида на стадии 6. ИЭР МС эксперимент C18H27BCl2N2O4 m/z [417,4 (М+1)].
[0716] Пример 71-А: получение (R)-2-амино-2-(1-бензилпиперидин-4-ил)-6-бороногексановой кислоты
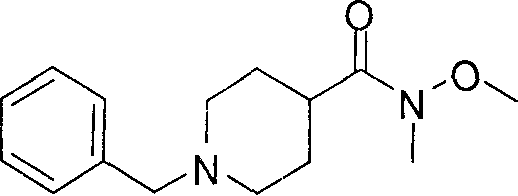
Стадия 1: 1-бензил-N-метокси-N-метилпиперидин-4-карбоксамид
Раствор этил-1-бензилпиперидин-4-карбоксилата (10,0 г, 40,4 ммоль) и гидрохлорида N,O-диметилгидроксиламина (6,12 г, 62,6 ммоль) в ТГФ (80 мл) охлаждали до 0°С, после чего добавляли i-PrMgCl (121,2 ммоль, 60,6 мл, 2М в ТГФ) по каплям. Реакционную смесь перемешивали в течение 1 часа, затем реакцию гасили путем добавления насыщенного водного хлорида аммония (90 мл). Водный и органический слои разделяли. Отделенную водную фазу дополнительно экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали в вакууме. Остаток подвергали хроматографии на силикагеле (2-18% метанол в дихлорметане) с получением целевого продукта (8,88 г, 84%). Rf 0,45 (10% МеОН/CH2Cl2). 1Н ЯМР (CDCl3, 300 МГц) δ 7,40-7,20 (m, 5H), 3,69 (s, 3H), 3,51 (s, 2H), 3,17 (s, 3H), 2,94 (d, 2H, J=11,4 Гц), 2,63-2,66 (m, 1H), 2,01 (td, J=11,7, 2,9 Гц, 2H), 1,83 (qd, J=12,8, 3,7 Гц, 2H), 1,72-1,67 (m, 2H). ИЭР МС эксперимент C15H22N2O2 m/z [263,3 (М+1)].
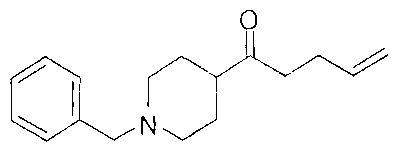
Стадия 2: 1-(1-бензилпиперидин-4-ил)пент-4-ен-1-он
[0717] Раствор 1-бензил-N-метокси-N-метилпиперидин-4-карбоксамида (8,88 г, 33,0 ммоль) в ТГФ (40 мл, 0,8М) охлаждали до 0°С и обрабатывали 0,5М раствором бромида 3-бутенилмагния (51 ммоль, 102 мл) по каплям. После перемешивания в течение 4 часов реакцию гасили 1н. НСl (24 мл), смесь нейтрализовали 5% водным бикарбонатом натрия и разбавляли этилацетатом. Слои разделяли, и водную фазу экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали в вакууме. Остаток подвергали хроматографии на оксиде кремния (2-20% метанол в дихлорметане) с получением целевого продукта (4,95 г, 57%). Rf 0,22 (10% МеОН/CH2Cl2). 1Н ЯМР (CDCl2, 300 МГц) δ 7,38-7,21 (m, 5H), 5,82-5,76 (m, 1Н), 5,15-4,95 (m, 2H), 3,50 (s, 2H), 2,91 (d, J=11,2 Гц, 2Н), 2,54 (t, J=7,3 Гц, 2H), 2,39-2,23 (m, 3Н), 2,06-1,97 (m, 2H), 1,82-1,61 (m, 4H). ИЭР МС эксперимент C17H23NO m/z [258,2 (M+1)].
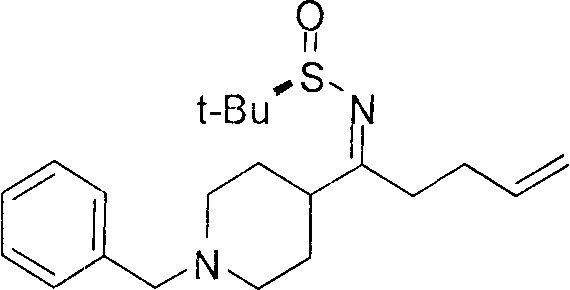
Стадия 3: (R,Z)-N-(1-(1-бензилпиперидин-4-ил)пент-4-енилиден)-2-метилпропан-2-сульфинамид
[0718] Раствор 1-(1-бензилпиперидин-4-ил)пент-4-ен-1-она (6,11 г, 21,3 ммоль) и (R)-2-метилпропан-2-сульфинамида (3,62 г, 27,6 ммоль) в ТГФ (71 мл, 0,3М) обрабатывали этоксидом титана (IV) (12,6 г, 55,3 ммоль) и нагревали до 70°С в течение ночи. Так как реакция не проходила до конца, дополнительно добавляли (R)-2-метилпропан-2-сульфинамид (1,81 г, 13,8 ммоль) и этоксид титана (IV) (6,3 г, 27,7 ммоль) и смесь нагревали до 75°С еще на 6 часов. Реакцию гасили, медленно выливая ее в быстро перемешиваемый насыщенный водный хлорид натрия (100 мл), и фильтровали через Celite. Подложку Celite промывали этилацетатом (3х) и объединенные органические слои промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали в вакууме. Остаток подвергали хроматографии на силикагеле (60% этилацетат в гептане) с получением целевого продукта (3,24 г, 42%). Rf 0,44 (EtOAc). 1H ЯМР (CDCl3, 300 МГц) δ 7,34-7,19 (m, 5H), 5,88-5,75 (m, 1H), 5,09-4,94 (m, 2H), 3,50 (d, J=5,5 Гц, 2H), 2,97-2,83 (m, 2H), 2,74-2,70 (m, 1H), 2,55-2,23 (m, 4H), 2,00 (t, J=8,8 Гц, 2H), 1,77-1,63 (m, 4H), 1,23 (s, 9H). ИЭР МС эксперимент C21H32N2OS m/z [361,4 (M+1)].
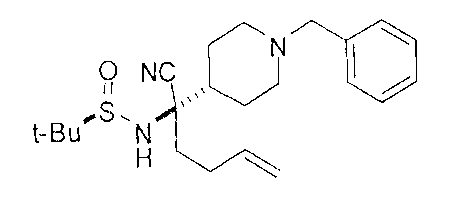
Стадия 4: (R)-N-((R)-1-(1-бензилпиперидин-4-ил)-1-цианопент-4-енил)-2-метилпропан-2-сулъфинамид
[0719] Раствор (R,Z)-N-(1-(1-бензилпиперидин-4-ил)пент-4-енилиден)-2-метилпропан-2-сульфинамида (2,74 г, 7,6 ммоль) в ТГФ (130 мл, 0,06М) охлаждали до -78°С. В отдельном сосуде 1М раствор Et2AlCN (11,4 ммоль, 11,4 мл) растворяли в ТГФ (20 мл) и охлаждали до -78°С. iPrOH (0,64 мл, 8,26 ммоль) добавляли по каплям и раствор нагревали до КТ в течение 20 минут, затем добавляли по каплям в раствор сульфинамида. Реакционную смесь оставляли постепенно нагреваться до КТ и перемешивали в течение ночи. Реакцию гасили насыщенным водным хлоридом аммония (50 мл) и фильтровали через Celite. Подложку Celite промывали этилацетатом (3х) и объединенные органические слои промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали в вакууме. Остаток подвергали хроматографии на силикагеле (1-9% метанол в дихлорметане, затем 2-5% метанол в этилацетате) с получением целевого продукта (1,99 г, 67%) совместно с нежелательным диастереомером (0,46 г, 15%). Rf 0,26 (10% МеОН/CH2Cl2). 1Н ЯМР (CDCl3, 300 МГц) δ 7,31-7,25 (m, 5H), 5,83-5,78 (m, 1H), 5,13-5,03 (m, 2H), 3,51 (d, J=1,5 Гц, 2H), 3,41 (s, 1H), 3,00 (d, J=11,0 Гц, 2H), 2,34-2,29 (m, 2H), 2,05-1,83 (m, 6H), 1,60-1,44 (m, 3H), 1,25 (s, 9H). ИЭР МС эксперимент C22H33N3OS m/z [388,4 (M+1)].
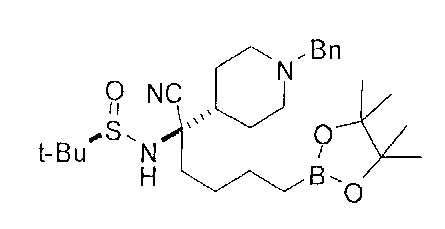
Стадия 5: (R)-N-((R)-1-(1-бензилпиперидин-4-ил)-1-циано-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пентил)-2-метилпропан-2-сулъфинамид
[0720] Раствор (R)-N-((R)-1-(1-бензилпиперидин-4-ил)-1-цианопент-4-енил)-2-метилпропан-2-сульфинамида (364 мг, 0,94 ммоль), [Ir(COD)Cl]2 (31 мг, 0,047 ммоль) и dppe (37 мг, 0,094 ммоль) в дихлорметане (9,4 мл) перемешивали в течение 20 минут, затем обрабатывали пинаколбораном (180 мг, 1,41 ммоль). После перемешивания в течение ночи при комнатной температуре реакционную смесь разбавляли этилацетатом, промывали насыщенным водным хлоридом натрия, сушили над MgSO4 и концентрировали. Полученный остаток очищали путем колоночной флэш-хроматографии (силикагель, элюировали 1-10% метанолом в дихлорметане) с получением целевого продукта (170 мг, 35%). Rf 0,43 (10% МеОН/CH2Cl2). 1Н ЯМР (CDCl3, 300 МГц) δ 7,34-7,24 (m, 5H), 3,50 (s, 2H), 3,34 (s, 1H), 2,98 (d, J=11,4 Гц, 2Н), 2,03-1,94 (m, 2H), 1,87-1,71 (m, 3H), 1,60-1,40 (m, 8H), 1,26 (s, 9H), 1,24 (s, 12H), 0,81 (t, J=7,3 Гц, 2H). ИЭР МС эксперимент C28H46BN3O3S m/z [515,9 (M+1)].
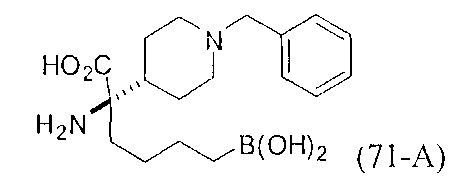
Стадия 6: (R)-2-амино-2-(1-бензилпиперидин-4-ил)-6-бороногексановая кислота
[0721] (R)-N-((R)-1-(1-бензилпиперидин-4-ил)-1-циано-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пентил)-2-метилпропан-2-сульфинамид (170 мг, 0,33 ммоль) обрабатывали 6н. HCl (3,3 мл) и нагревали до 105°С. После перемешивания в течение ночи реакционную смесь разбавляли водой, промывали дихлорметаном и концентрировали. Полученный остаток кипятили с азеотропом в толуоле, сушили в глубоком вакууме и очищали путем ВЭЖХ (10-100% ацетонитрил/H2O) с получением целевого продукта (39 мг, 34%). 1Н ЯМР (CD3OD, 300 МГц) δ 7,56-7,43 (m, 5H), 4,29 (s, 2H), 3,47 (br, 2H), 3,06 (br, 2H), 2,76 (br, 1H), 2,54 (t, J=7,0 Гц, 2H), 2,11 (d, J=13,9 Гц, 2H), 1,77 (br, 2H), 1,59-1,44 (m, 2H), 1,40-1,29 (m, 2H), 0,78 (t, J=8,1 Гц, 2H). ИЭР МС эксперимент C18H29BN2O4 m/z [331,2 (M+1)-H2O].
[0722] Пример 72-А: получение дигидрохлорида 2-амино-2-(азепан-4-ил)-6-бороногексановой кислоты
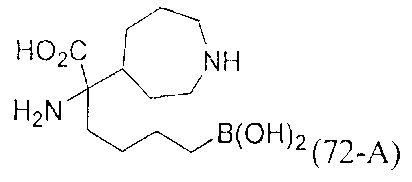
[0723] Дигидрохлорид 2-амино-2-(азепан-4-ил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что 1-(бензилоксикарбонил)азепан-4-карбоновую кислоту применяли в качестве кислоты на стадии 1, а стадии 5 и 6 не проводили. 1Н ЯМР (D2O, 300 МГц) δ 3,39-3,26 (m, 1H), 3,26-3,15 (m, 1H), 3,12-2,97 (m, 2H), 2,20-1,40 (m, 9H), 1,35-1,13 (m, 3H), 1,13-0,99 (m, 1H), 0,65 (t, J=7,2 Гц, 2H). ИЭР МС эксперимент C12H25BN2O4 m/z [272,2 (M+1), 255,0 (M+1-18)].
[0724] Пример 73-А: получение дигидрохлорида 2-амино-6-бороно-2-(1-(3,4-дихлорбензил)азепан-4-ил)гексановой кислоты
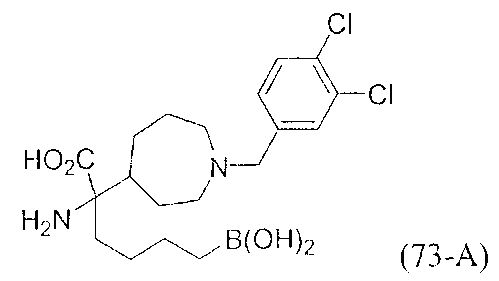
[0725] Дигидрохлорид 2-амино-6-бороно-2-(1-(3,4-дихлорбензил)азепан-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что 1-(бензилоксикарбонил)азепан-4-карбоновую кислоту применяли в качестве кислоты на стадии 1 и 3,4-дихлорбензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,54 (bs, 1H), 7,48 (d, J=7,8 Гц, 1H), 7,26 (bd, J=7,8 Гц, 1H), 4,20 (bs, 2H), 3,52-2,90 (m, 4H), 2,31-2,10 (m, 1H), 2,11-1,44 (m, 8H), 1,35-1,14 (m, 3H), 1,16-0,98 (m, 1H), 0,64 (t, J=7,5 Гц, 2H). ИЭР МС эксперимент C19H29BCl2N2O4 m/z [431,2 & 433,2 (М+1), 413,1 & 315,1 (М+1-18)].
[0726] Пример 74-А: получение дигидрохлорида цис-2-амино-2-(3-(бензиламино)циклобутил)-6-бороногексановой кислоты
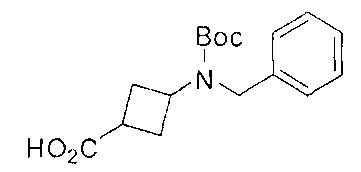
Стадия 1: Синтез 3-(бензил(трет-бутоксикарбонил)амино)циклобутанкарбоновой кислоты
[0727] Раствор 3-оксо-1-циклобутанкарбоновой кислоты (4 г, 35 ммоль, 1 экв.), бензиламина (19 мл, 175 ммоль, 5 экв.) и уксусной кислоты (2,1 мл, 35 ммоль, 1 экв.) в 1,2-дихлорэтане перемешивали при комнатной температуре в течение 1 часа. Триацетоксиборгидрид натрия (11,1 г, 52,5 ммоль, 1,5 экв.) добавляли и перемешивание продолжали в течение 2 дней, раствор подщелачивали до рН 13 при помощи водн. NaOH (1н.) и промывали дихлорметаном. Водный слой помещали в ди-трет-бутилдикарбонат (45 г, 210 ммоль, 6 экв.) и перемешивали в течение ночи. Подкисляли до рН 5 и реакционную смесь экстрагировали этилацетатом, промывали нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем флэш-хроматографии (1-20% метанол в дихлорметане) приводила к получению 3-(бензил(трет-бутоксикарбонил)амино)-циклобутанкарбоновой кислоты в виде белого твердого вещества (7,96 г, 24,3 ммоль, 69%). ИЭР МС эксперимент C17H23BNO4 m/z [304 (M-1)].
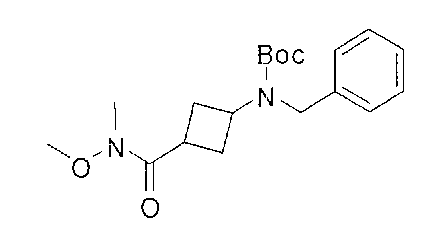
Стадия 2: Синтез трет-бутил-бензил(3-(метокси(метил)карбамоил)циклобутил)карбамата
[0728] Раствор 3-(бензил(трет-бутоксикарбонил)амино)циклобутанкарбоновой кислоты (4,96 г, 15,2 ммоль) в дихлорметане (80 мл, 0,19М) обрабатывали EDC (5,8 г, 30,3 ммоль, 2 экв.), гидрохлоридом N,O-диметилгидроксиламина (3,0 г, 30,3 ммоль, 2 экв.) и триэтиламином (8,5 мл, 60,7 ммоль, 4 экв.) и перемешивали в течение 16 часов. Полученный раствор промывали последовательно водой, 1М HCl, нас. водн. хлоридом натрия, сушили над безводным MgSO4, фильтровали и концентрировали. Очистка путем флэш-хроматографии (1-20% метанол в дихлорметане) приводила к получению трет-бутил-бензил(3-(метокси(метил)карбамоил)циклобутил)карбамата в виде беловатого твердого вещества (4,04 г, 72%). 1Н ЯМР (CD3OD, 300 МГц) δ 7,40-7,16 (m, 5H), 4,60-4,20 (m, 1H), 4,52 (brs, 2H), 3,77 (s, 3Н), 3,22-3,00 (brs, 4H), 2,60-2,20 (m, 4H), 1,58-1,08 (brs, 9H), ЖХМС, C19H28N2O4 m/z [349 (M+1), 371,3 (М+23)].
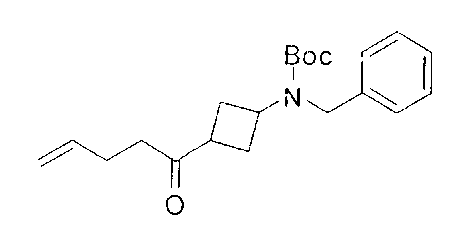
Стадия 3: Синтез трет-бутил-бензил(3-пент-4-еноилциклобутил)карбамата
[0729] В атмосфере азота раствор трет-бутил-бензил(3-(метокси(метил)карбамоил)-циклобутил)карбамата (8,68 г, 23,5 ммоль, 1 экв.) в тетрагидрофуране (100 мл) охлаждали до 0°С и обрабатывали бромидом 4-бутенилмагния (0,5М в ТГФ, 70,4 мл, 35,2 ммоль, 1,5 экв.) по каплям. После перемешивания в течение 0,5 часа при 0°С реакционную смесь нагревали до комнатной температуры в течение еще 3 часов. После завершения реакционную смесь выливали в воду, подкисляли до рН 3-4 при помощи 1н. хлороводородной кислоты и экстрагировали этилацетатом (3х). Объединенные органические слои промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 0-40% этилацетат в гептане) приводила к получению трет-бутил-бензил(3-пент-4-еноилциклобутил)карбамата в виде бесцветной маслянистой жидкости (7,7 г, 21,1 ммоль, 90%). 1H ЯМР (CDCl3, 300 МГц) δ 7,33-7,11 (m, 5H), 5,84-5,67 (m, 1H), 5,04-4,92 (m, 2H), 4,45 (brs, 3H), 2,89-2,70 (m, 1H), 2,48-2,15 (m, 8H), 1,5-1,08 (brs, 9H), ИЭР МС эксперимент C21H29NO3 m/z [366,2 (М+23)].
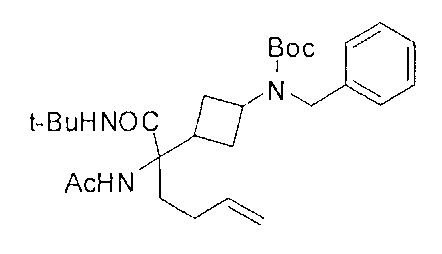
Стадия 4: Синтез трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклобутил(бензил)карбамата
[0730] Раствор трет-бутил-бензил(3-пент-4-еноилциклобутил)карбамата (7,7 г, 21,1 ммоль, 5 экв.), т-бутилизонитрила (12 мл, 106 ммоль, 10 экв.) и ацетата аммония (16,3 г, 212 ммоль) в 2,2,2-трифторэтаноле (24 мл, 0,9М) перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь разбавляли этилацетатом, реакцию гасили 2М НСl и экстрагировали этилацетатом. Органический слой промывали последовательно 2М HCl и нас. водн. хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем колоночной хроматографии (этилацетат в гексане) приводила к получению цис-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклобутил(бензил)-карбамата в виде желтого твердого вещества (8,9 г, 17,5 ммоль, 83%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,32-7,10 (m, 6H), 6,08 (brs, 1H), 5,80-5,64 (m, 1H), 5,01-4,87(m, 2H), 4,42 (brs, 2H), 4,41-4,08 (m, 1H), 2,79-2,58 (m, 1H), 2,40-1,99 (m, 8H), 1,98-1,80 (m, 3H), 1,56-1,08 (m, 18H), ИЭР МС эксперимент C29H43N3O4 m/z [508,2 (М+23)]; и транс-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклобутил(бензил)карбамата в виде белой пены (1,1 г, 2,2 ммоль, 10%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,32-7,11 (m, 5H), 6,79 (brs, 1H), 5,83-5,68 (m, 1H), 5,56 (brs, 1H), 5,02-4,88(m, 2H), 4,54-4,37 (m, 2H), 4,35-4,16 (m, 1H), 2,94-2,75 (m, 2H), 2,51-2,39 (m, 1H), 2,38-2,19 (m, 2H), 2,18-1,90 (m, 5H), 1,86-1,70 (m, 1H), 1,67-1,58 (m, 1H), 1,47-1,22 (m, 18H), ИЭР МС эксперимент C28H43N3O4 m/z [486,5 (M+1), 508,0 (М+23)].
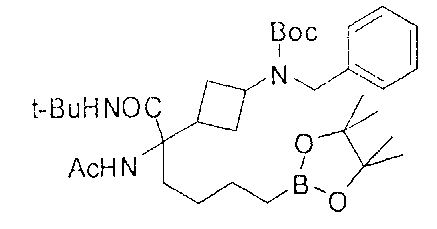
Стадия 5: Синтез цис-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)циклобутил(бензил)карбамата
[0731] После перемешивания в течение 30 минут раствор цис-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклобутил(бензил)карбамата (5,34 г, 10,5 ммоль), димера хлор-1,5-циклооктадиениридия (I) (212 мг, 0,32 ммоль, 3 мол.%) и 1,2-бис(дифенилфосфино)этана (252 мг, 0,63 ммоль, 6 мол.%) в дихлорметане (50 мл) охлаждали до 0°С и осторожно обрабатывали 4,4,5,5-тетраметил-[1,3,2]диоксабороланом (3,1 мл, 21,1 ммоль, 2 экв.) в течение 5 минут. После медленного нагревания до комнатной температуры и перемешивания в течение ночи реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 10-40% этилацетат в гептане) приводила к получению цис-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)циклобутил(бензил)карбамата (4,8 г, 7,83 ммоль, 74%). ИЭР МС эксперимент C34H56BN3O6 m/z [614,2 (М+1), 636,2 (М+23)].
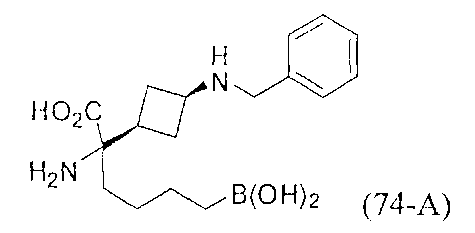
Стадия 6: дигидрохлорид цис-2-амино-2-(3-(бензиламино)циклобутил)-6-бороногексановой кислоты
[0732] Раствор цис-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)циклобутил(бензил)карбамата (200 мг, 0,33 ммоль) в 6н. HCl кипятили с обратным холодильником в течение 16 часов, охлаждали до комнатной температуры и концентрировали насухо. Очистка путем препаративной ВЭЖХ (20% ацетонитрил в воде, содержащей 0,1% трифторуксусной кислоты) и последующая обработка водн. HCl и выпаривание приводили к получению дигидрохлорида цис-2-амино-2-(3-(бензиламино)циклобутил)-6-бороногексановой кислоты в виде белого твердого вещества (73,6 мг, 0,23 ммоль, 70%). 1Н ЯМР (D2O) δ 7,42-7,29 (m, 5H), 4,03 (s, 2H), 3,63-3,50 (m, 1H), 2,58-2,43 (m, 1H), 2,43-2,12 (m, 3Н), 1,97-1,72 (m, 2H), 1,68-1,52 (m, 1H), 1,36-0,96 (m, 4H), 0,65 (t, J=7,5 Гц, 2H). МС эксперимент C17H27BN2O4 m/z [317 (M-18+1)].
[0733] Пример 75-А: получение дигидрохлорида транс-2-амино-2-(3-(бензиламино)циклобутил)-6-бороногексановой кислоты
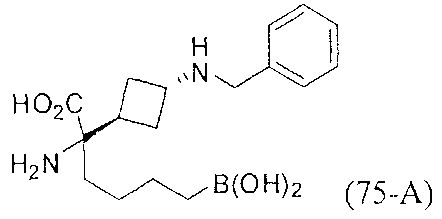
[0734] Дигидрохлорид транс-2-амино-2-(3-(бензиламино)циклобутил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 74-А, с тем исключением, что транс-трет-бутил-3-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)циклобутил(бензил)карбамат применяли в качестве алкена на стадии 4. 1H ЯМР (D2O) δ 7,42-7,27 (m, 5H), 4,02 (s, 2H), 3,72-3,57 (m, 1H), 3,01-2,84 (m, 1H), 2,64-2,48 (m, 1H), 2,40-2,20 (m, 3Н), 1,93-1,76 (m, 1H), 1,68-1,55 (m, 1H), 1,35-0,96 (m, 4H), 0,64 (t, J=7,5 Гц, 2H). МС эксперимент C17H27BN2O4 m/z [317 (M-18+1)].
[0735] Пример 76-А: получение дигидрохлорида цис-2-амино-6-бороно-2-(3-(4-(трифторметокси)бензиламино)циклобутил)гексановой кислоты
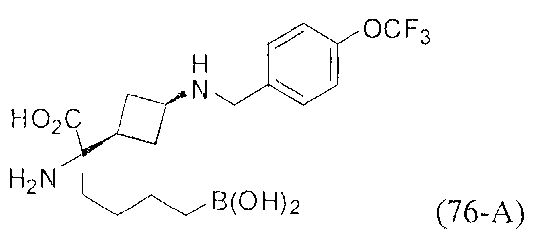
[0736] Дигидрохлорид цис-2-амино-6-бороно-2-(3-(4-(трифторметокси)бензиламино)-циклобутил)гексановой кислоты получали аналогично способу, предложенному в Примере 74-А, с тем исключением, что 4′-трифторметоксибензиламин применяли в качестве амина на стадии 1. 1Н ЯМР (CD3OD) δ 7,66 (dt, J=8,7, 2,4 Гц, 2H), 7,37 (dd, J=8,7, 0,9 Гц, 2H), 4,18 (s, 2H), 3,81-3,67 (m, 1H), 2,75-2,58 (m, 1H), 2,57-2,34 (m, 3H), 2,33-2,19 (m, 1H), 2,06-1,90 (m, 1H), 1,86-1,72 (m, 1H), 1,54-1,36 (m, 3Н), 1,34-1,13 (m, 1H), 0,83 (t, J=7,4 Гц, 2H). МС эксперимент C18H26BF3H2O5 m/z [419 (M+1)].
[0737] Пример 77-А: получение дигидрохлорида цис-2-амино-2-(3-(бифен-4-илметиламино)циклобутил)-6-бороногексановой кислоты
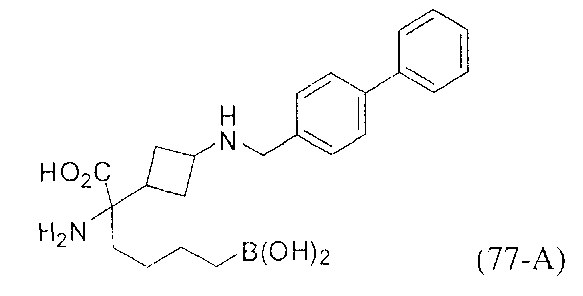
[0738] Дигидрохлорид цис-2-амино-2-(3-(бифен-4-илметиламино)циклобутил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 74-А, с тем исключением, что бифен-4-илметанамин применяли в качестве амина на стадии 1. 1Н ЯМР (CD3OD) δ 7,75-7,69 (m, 2H), 7,67-7,57 (m, 4H), 7,49-7,42 (m, 2H), 7,41-7,13 (m, 1H), 4,19 (s, 2H), 3,82-3,65 (m, 1H), 2,75-2,60 (m, 1H), 2,58-2,34 (m, 3H), 2,32-2,18 (m, 1H), 2,06-1,92 (m, 1H), 1,86-1,72 (m, 1H), 1,54-1,36 (m, 3H), 1,32-1,15 (m, 1H), 0,83 (t, J=7,5 Гц, 2H). МС эксперимент C23H31BN2O4 m/z [411 (M+1)].
[0739] Пример 78-А: получение дигидрохлорида цис-2-амино-6-бороно-2-(3-((6-хлорбензо[d][1,3]диоксол-5-ил)метиламино)циклобутил)гексановой кислоты
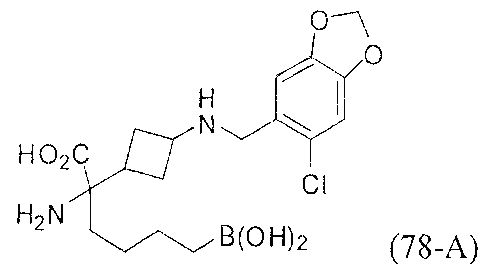
[0740] Дигидрохлорид цис-2-амино-6-бороно-2-(3-((6-хлорбензо[d][1,3]диоксол-5-ил)метиламино)циклобутил)гексановой кислоты получали аналогично способу, предложенному в Примере 74-А, с тем исключением, что (6-хлорбензо[d][1,3]диоксол-5-ил)метанамин применяли в качестве амина на стадии 1. 1H ЯМР (CD3OD) δ 7,13 (s, 1H), 7,03 (s, 1H), 6,06 (s, 2H), 4,20 (s, 2H), 3,82-3,70 (m, 1H), 2,76-2,61 (m, 1H), 2,60-2,36 (m, 3H), 2,32-2,18 (m, 1H), 2,06-1,90 (m, 1H), 1,88-1,72 (m, 1H), 1,54-1,34 (m, 3H), 1,32-1,14 (m, 1H), 0,83 (t, J=7,2 Гц, 2H). МС эксперимент C18H26BClN2O6 m/z [413,0 (M+1)].
[0741] Пример 79-А: получение дигидрохлорида цис-2-амино-6-бороно-2-(3-(хинолин-8-илметиламино)циклобутил)гексановой кислоты
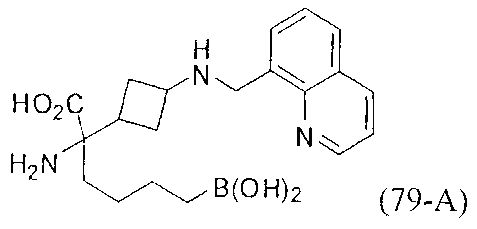
[0742] Дигидрохлорид цис-2-амино-6-бороно-2-(3-(хинолин-8-илметиламино)-циклобутил)гексановой кислоты получали аналогично способу, предложенному в Примере 74-А, с тем исключением, что хинолин-8-илметанамин применяли в качестве амина на стадии 1. 1Н ЯМР (CD3OD) δ 9,20 (dd, J=5,1, 1,5 Гц, 1Н), 9,00 (dd, J=8,7, 1,5 Гц, 1Н), 8,33 (dd, J=8,4, 1,2 Гц, 1Н), 8,29 (dd, J=7,2, 1,2 Гц, 1Н), 8,01 (dd, J=8,4, 5,1 Гц, 1Н), 7,92 (dd, J=8,4, 7,2 Гц, 1Н), 4,84 (s, 2H), 4,08-3,92 (m, 1Н), 2,80-2,32 (m, 5H), 2,08-1,92 (m, 1Н), 1,89-1,74 (m, 1Н), 1,54-1,36 (m, 3H), 1,34-1,15 (m, 1Н), 0,83 (t, J=7,5 Гц, 2Н). МС эксперимент C20H28BN3O4 m/z [386 (M+1)].
[0743] Пример 80-А: получение дигидрохлорида цис-2-амино-6-бороно-2-(3-(нафталин-1-илметиламино)циклобутил)гексановой кислоты
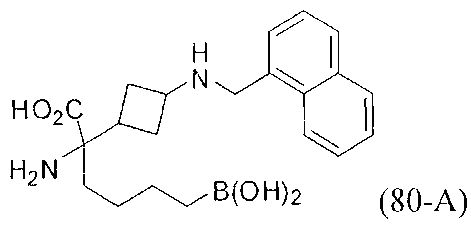
[0744] Дигидрохлорид цис-2-амино-6-бороно-2-(3-(нафталин-1-илметиламино)-циклобутил)гексановой кислоты получали аналогично способу, предложенному в Примере 74-А, с тем исключением, что нафталин-1-илметанамин применяли в качестве амина на стадии 1. 1Н ЯМР (CD3OD) δ 8,20-8,14 (m, 1Н), 8,03-7,96 (m, 2H), 7,76-7,66 (m, 2H), 7,64-7,53 (m, 2H), 4,66 (s, 2H), 3,96-3,77 (m, 1Н), 2,76-2,62 (m, 1H), 2,60-2,36 (m, 3H), 2,35-2,21 (m, 1Н), 2,05-1,89 (m, 1Н), 1,88-1,72 (m, 1Н), 1,53-1,35 (m, 3H), 1,34-1,13 (m, 1Н), 0,82 (t, J=7,5 Гц, 2H). МС эксперимент C21H29BN2O4 m/z [385 (M+1)].
[0745] Пример 81-А: получение дигидрохлорида цис-2-амино-2-(3-аминоциклобутил)-6-бороногексановой кислоты
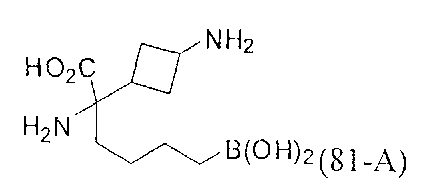
[0746] Дигидрохлорид цис-2-амино-2-(3-аминоциклобутил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что (1s,3s)-3-(трет-бутоксикарбониламино)циклобутанкарбоновую кислоту применяли в качестве кислоты на стадии 1, а стадии 5 и 6 не проводили. 1Н ЯМР (D2O, 300 МГц) δ 3,62-3,52 (m, 1Н), 2,58-2,31 (m, 3H), 2,21 (q, J=10,3 Гц, 1Н), 1,92-1,78 (m, 2H), 1,65-1,55 (m, 1H), 1,36-1,20 (m, 3Н), 1,18-1,01 (m, 1H), 0,66 (t, J=7,7 Гц, 2Н). ИЭР МС эксперимент C10H21B1N2O4 m/z [245,1 (M+1)].
[0747] Пример 82-A: получение дигидрохлорида цис-2-амино-6-бороно-2-(3-(4-хлорбензиламино)циклобутил)гексановой кислоты
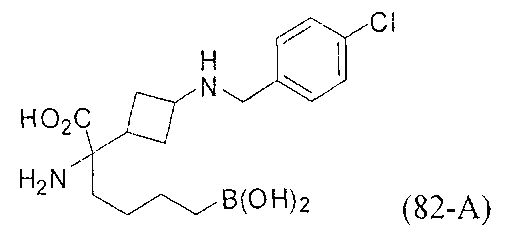
[0748] Дигидрохлорид цис-2-амино-6-бороно-2-(3-(4-хлорбензиламино)циклобутил)-гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что (1s,3s)-3-(трет-бутоксикарбониламино)циклобутанкарбоновую кислоту применяли в качестве кислоты на стадии 1 и 4-хлорбензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,38 (d, J=8,4 Гц, 2Н), 7,30 (d, J=8,4 Гц, 2Н), 4,02 (s, 3Н), 3,61-3,53 (m, 1H), 2,45-2,20 (m, 4H), 1,94-1,69 (m, 2Н), 1,56-1,45 (m, 1H), 1,32-1,03 (m, 4H), 0,66 (t, J=7,7 Гц, 2Н). ИЭР МС эксперимент C17H26B1Cl1N2O4 m/z [369,3 (M+1)].
[0749] Пример 83-А: получение дигидрохлорида цис-2-амино-6-бороно-2-(3-(изобутиламино)циклобутил)гексановой кислоты
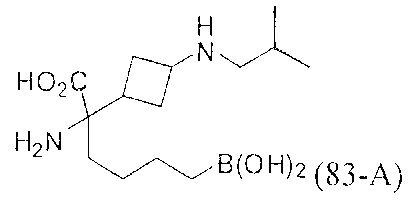
[0750] Дигидрохлорид цис-2-амино-6-бороно-2-(3-(изобутиламино)циклобутил)-гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что (1s,3s)-(трет-бутоксикарбониламино)циклобутанкарбоновую кислоту применяли в качестве кислоты на стадии 1 и изобутиральдегид применяли в качестве альдегида на стадии 6. ИЭР МС эксперимент C14H29B1N2O4 m/z [301,1 (M+1)].
[0751] Пример 84-А: Получение гидрохлорида цис-2-амино-6-бороно-2-[4-(4-хлорбензоил)циклогексил]гексановой кислоты
Стадия 1: метоксиметиламид цис-4-(4-хлорбензоил)циклогексанкарбоновой кислоты
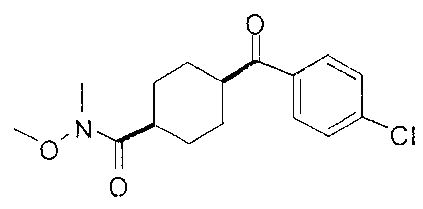
[0752] EDC (2,87 г, 15,0 ммоль) добавляли по частям в перемешиваемый раствор цис-4-(4-хлорбензоил)циклогексанкарбоновой кислоты (2,0 г, 7,5 ммоль), DMAP (5 мг), HOBt (5мг) и гидрохлорида N,О-диметилгидроксиламина (1,46 г, 15 ммоль) в дихлорметане (40 мл). Триэтиламин (2,28 г, 3,14 мл, 22,5 ммоль) добавляли по каплям и реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученный раствор выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением метоксиметиламида цис-4-(4-хлорбензоил)циклогексанкарбоновой кислоты в виде бесцветной маслянистой жидкости (1,6 г, 69%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,82 (d, J=8,5 Гц, 2Н,), 7,41 (d, J=8,5 Гц, 2Н), 3,69 (s, 3H), 3,35 (quin, J=5 Гц, 1Н), 3,16 (s, 3Н), 2,80 (sept, J=4 Гц, 1Н), 2,15 (m, 2Н), 1,89 (m, 2Н), 1,72 (m, 4H).
Стадия 2: метоксиметиламид цис-4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексанкарбоновой кислоты
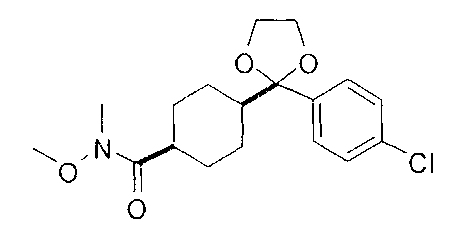
[0753] Раствор метоксиметиламида цис-4-(4-хлорбензоил)циклогексанкарбоновой кислоты (1,6 г, 5,17 ммоль), триэтилортоформиата (843 мг, 0,95 мл, 5,7 ммоль), этиленгликоля (1,6 г, 1,45 мл, 25,9 ммоль) и моногидрата толуолсульфокислоты (50 мг) в толуоле (50 мл) перемешивали в течение ночи при 60°С, а затем охлаждали до комнатной температуры и концентрировали насухо в вакууме. Реакционную смесь перерастворяли в этилацетате, промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 0-30% этилацетат в гептане) приводила к получению метоксиметиламида цис-4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексанкарбоновой кислоты в виде бесцветной маслянистой жидкости (1,36 г, 74%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,33 (d, J=8,5 Гц,), 7,27 (d, J=8,5 Гц, 2Н), 3,96 (m, 2Н), 3,68 (m, 2Н), 3,64 (s, 3Н), 3,14 (s, 3Н), 2,83 (m, 1Н), 1,96 (m, 2Н), 1,76 (m, 1Н), 1,67 (m, 3Н), 1,47 (m, 4H); MC (+CI): m/z C18H24ClNO4: ожидаемое 353,1; эксперимент 354,2 (М+Н)+.
Стадия 3: цис-1-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}пент-4-ен-1-он
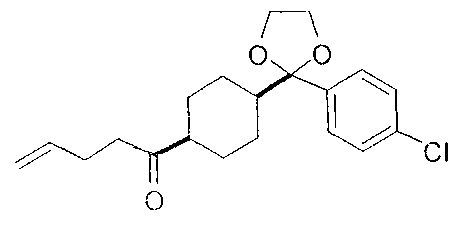
[0754] В атмосфере азота раствор метоксиметиламида цис-4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексанкарбоновой кислоты (1,36 г, 3,85 ммоль) в тетрагидрофуране (10 мл) охлаждали до 0°С и обрабатывали бромидом 4-бутенилмагния (0,5М в ТГФ, 19,24 мл, 9,62 ммоль) по каплям. Раствор перемешивали в течение 1 часа при 0°С, затем оставляли нагреваться до комнатной температуры в течение ночи. Полученный раствор выливали в воду, подкисляли до рН 3-4 при помощи 1н. хлороводородной кислоты и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 0-25% этилацетат в гептане) приводила к получению цис-1-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}пент-4-ен-1-она в виде бесцветной маслянистой жидкости (1,13 г, 84%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,31 (d, J=7,5 Гц, 2H), 7,27 (d, J=7,5 Гц, 2Н), 5,78 (m, 1Н), 4,96 (m, 2H), 3,94 (m, 2H), 3,68 (m, 2H), 2,50 (m, 3Н), 2,30 (m, 2H), 2,15 (dd, J=13,3 Гц, 2H), 1,76 (tt, J=11,3 Гц, 1Н), 1,36-1,56 (m, 4H), 1,25 (td, J=13,3 Гц, 2H); MC (+CI): m/z C20H25ClO3: ожидаемое 348,2; эксперимент 349,2 (M+H)+.
Стадия 4: трет-бутиламид цис-2-ацетиламино-2-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}гекс-5-еновой кислоты
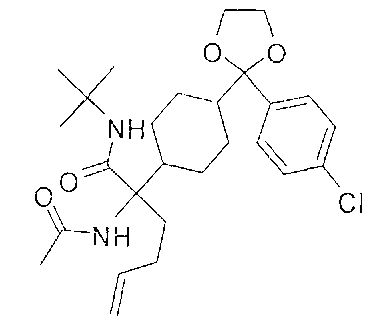
[0755] Трет-бутилизоцианид (404 мг, 0,55 мл, 4,86 ммоль) добавляли в перемешиваемую суспензию цис-1-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}пент-4-ен-1-она (1,13 г, 3,24 ммоль) и ацетата аммония (999 мг, 12,96 ммоль) в 2,2,2-трифторэтаноле (0,5 мл) и полученную суспензию перемешивали при комнатной температуре. Через 8 дней реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 10-50% этилацетат в гептане) приводила к получению трет-бутиламида цис-2-ацетиламино-2-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}гекс-5-еновой кислоты в виде бесцветной маслянистой жидкости (1,16 г, 71%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,29 (m, 4H), 6,96 (br s, 1H NH), 5,76 (m, 1H), 5,44 (br s, NH, 1H), 4,94 (m, 2H), 3,94 (m, 2H), 3,68 (m, 2H), 2,93 (ddd, J1=16,5 Гц, J2=11,5 Гц, J3=5,0 Гц, 1H), 1,90-2,08 (m, 2H), 1,96 (s, 3Н), 1,60-1,86 (m, (6H), 1,42 (m, 1H), 1,34 (s, 9H), 1,06 (m, 3H), 0,86 (m, 1H).
Стадия 5: трет-бутиламид цис-2-ацетиламино-2-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гекс-5-еновой кислоты
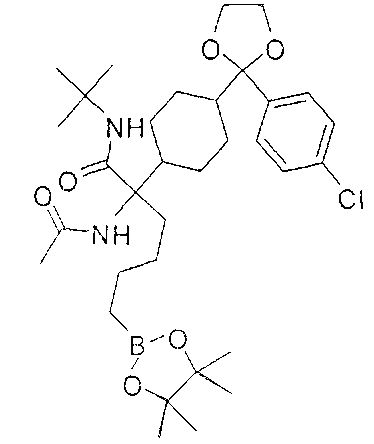
[0756] Раствор трет-бутиламида цис-2-ацетиламино-2-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}гекс-5-еновой кислоты (1,13 г, 2,3 ммоль) в дихлорметане (10 мл) обрабатывали димером хлор-1,5-циклооктадиениридия (I) (46 мг, 3 мол.%) и 1,2-бис(дифенилфосфино)этаном (55 мг, 6 мол.%). Раствор перемешивали при комнатной температуре в течение 30 минут, а затем 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (588 мг, 0,67 мл, 4,6 ммоль) добавляли по каплям и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 10-40% этилацетат в гептане) приводила к получению трет-бутиламида цис-2-ацетиламино-2-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гекс-5-еновой кислоты в виде бесцветной маслянистой жидкости (970 мг, 68%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,28 (m, 4H), 6,92 (br s, NH, 1H), 5,41 (br s, NH, 1H), 3,94 (m, 2H), 3,67 (m, 2H), 2,76 (m, 1H), 1,90-2,08 (m, 2H), 1,94 (s, 3H), 1,60-1,86 (m, 4H), 1,18-1,42 (m, 5H), 1,32 (s, 9H), 1,23 (s, 12H), 0,90-1,10 (m, 4H), 0,72 (t, J=7,5 Гц, 2H); MC (+CI): m/z C33H52BClN2O6: ожидаемое 618,4; эксперимент 619,3 (M+Н)+, 641,4 (M+Na)+.
Стадия 6: (R)-2-амино-6-бороно-2-((1s,4S)-4-(4-хлорбензоил)циклогексил)гексановая кислота
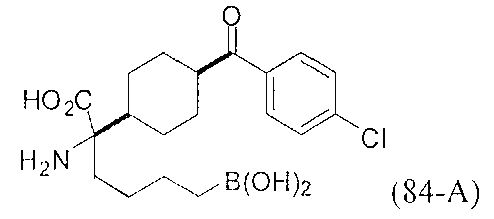
[0757] Раствор трет-бутиламида цис-2-ацетиламино-2-{4-[2-(4-хлорфенил)-[1,3]диоксолан-2-ил]циклогексил}-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гекс-5-еновой кислоты (970 мг) в 6н. HCl (15 мл) перемешивали при 90°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения (545 мг, 88%). 1H ЯМР (D2O, 300 МГц) δ 7,77 (d, J=7,0 Гц, 2H), 7,38 (dd, J=7,0 Гц, 2H), 3,24 (m, 1H), 1,76 (m, 6Н), 1,54 (m, 1H), 1,24 (m, 6Н), 1,06 (m, 2H), 0,64 (t, J=6,5 Гц, 2H); MC (+CI): m/z C19H27BClNO5: ожидаемое 395,2; эксперимент 396,2 (M+H)+, 378,2 (M+Н-H2O)+.
[0758] Пример 85-А: Получение гидрохлорида 2-амино-6-бороно-2-(1-(5-хлорпиридин-2-ил)пиперидин-4-ил)гексановой кислоты
Стадия 1: метоксиметиламид 5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбоновой кислоты
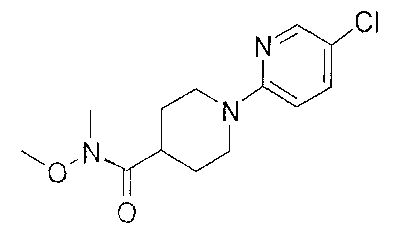
[0759] EDC (1,61 г, 8,4 ммоль) добавляли по частям в перемешиваемый раствор гидрохлорида 5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбоновой кислоты (1,16 г, 4,19 ммоль), DMAP (5 мг), HOBt (5 мг) и гидрохлорида N,O-диметилгидроксиламина (818 мг, 8,4 ммоль) в дихлорметане (20 мл). Триэтиламин (1,69 г, 2,33 мл, 16,8 ммоль) добавляли по каплям и реакционную смесь перемешивали при комнатной температуре в течение ночи. Полученный раствор выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением метоксиметиламида 5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбоновой кислоты в виде белого твердого вещества (1,05 г, 86%); 1Н ЯМР (CDCl3, 300 МГц) δ 8,05 (d, J=2,5 Гц, 1Н), 7,36 (dd, J1=9,0 Гц, J2=2,5 Гц, 1Н), 6,57 (d, J=9,0 Гц, 1Н), 4,25 (dt, J1=13,0 Гц, J2=3,0 Гц, 1Н), 3,69 (s, 3H), 3,16 (s, 3H), 2,88 (m, 3H), 1,78 (m, 4H); МС (+CI): m/z C13H18ClN3O2: ожидаемое 283,1; эксперимент 284,2 (M+Н)+.
Стадия 2: 1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)пент-4-ен-1-он
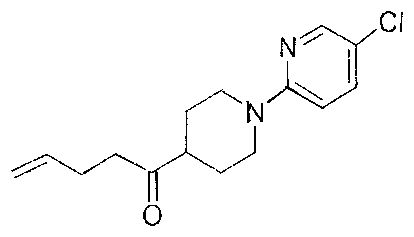
[0760] В атмосфере азота раствор метоксиметиламида 5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-4-карбоновой кислоты (1,0 г, 3,5 ммоль) в тетрагидрофуране (10 мл) охлаждали до 0°С и обрабатывали бромидом 4-бутенилмагния (0,5М в ТГФ, 17,6 мл, 8,8 ммоль) по каплям. После перемешивания в течение 1 часа при 0°С и при комнатной температуре в течение ночи реакционную смесь выливали в воду, подкисляли до рН 3-7 при помощи 1н. хлороводородной кислоты и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали. Очистка путем колоночной флэш-хроматографии (силикагель, 0-25% этилацетат в гептане) приводила к получению 1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)пент-4-ен-1-она в виде бесцветной маслянистой жидкости (904 мг, 93%); 1Н ЯМР (CDCl3, 300 МГц) δ 8,05 (d, J=2,5 Гц, 1Н), 7,42 (dd, J1=9,0 Гц, J2=2,5 Гц, 1Н), 6,62 (d, J=9,0 Гц, 1Н), 5,80 (m, 1Н), 5,04 (m, 2H), 4,23 (m, 2H), 2,92 (m, 2H), 2,59 (m, 3H), 2,36 (m, 2H), 1,98 (m, 2H), 1,70 (m, 2H); МС (+CI): m/z C15H19ClN2O: ожидаемое 278,1; эксперимент 279,2 (M+Н)+.
Стадия 3: трет-бутиламид 2-ацетиламино-2-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридил-4-ил)гекс-5-еновои кислоты
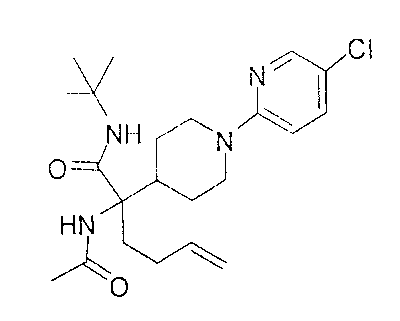
[0761] Трет-бутилизоцианид (538 мг, 0,73 мл, 6,48 ммоль) добавляли в перемешиваемую суспензию 1-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)пент-4-ен-1-она (900 мг, 3,24 ммоль) и ацетата аммония (1,0 г, 12,96 ммоль) в 2,2,2-трифторэтаноле (0,5 мл). После перемешивания при комнатной температуре в течение 5 дней реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 10-40% этилацетат в гептане) приводила к получению титульного соединения в виде белого твердого вещества (1,02 г, 74%); 1Н ЯМР (CDCl3, 300 МГц) δ 8,06 (dd, J1=2,5 Гц, J2=0,5 Гц, 1Н), 7,37 (dd, J1=9 Гц, J2=2,5 Гц, 1Н), 7,01 (br s, NH, 1Н), 6,55 (dd, J1=9,0 Гц, J2=0,5 Гц, 1Н), 5,78 (m, 1Н), 5,50 (br s, NH, 1Н), 4,97 (m, 2H), 4,38 (m, 1Н), 4,14 (m, 1Н), 3,00 (ddd, J1=14,5 Гц, J2=11,5 Гц, J3=5,0 Гц, 1Н), 2,72 (td, J1=13 Гц, J2=2,5 Гц, 2H), 2,44 (tt, J1=2,5 Гц, J2=3 Гц, 1Н), 1,97-2,08 (m, 1Н), 2,00 (s, 3H), 1,80 (m, 3H), 1,20-1,52 (m, 3H), 1,30 (s, 9Н).
Стадия 4: трет-бутиламид 2-ацетиламино-2-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты
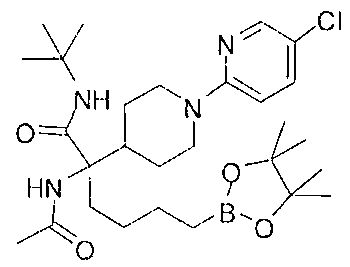
[0762] Раствор трет-бутиламида 2-ацетиламино-2-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)гекс-5-еновой кислоты (1,0 г, 2,38 ммоль) в дихлорметане (10 мл) обрабатывали димером хлор-1,5-циклооктадиениридия (I) (48 мг, 3 мол.%) и 1,2-бис(дифенилфосфино)этаном (57 мг, 6 мол.%) в атмосфере азота. Раствор перемешивали при комнатной температуре в течение 30 минут, а затем 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (609 мг, 0,69 мл, 4,76 ммоль) добавляли по каплям и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 10-40% этилацетате в гептане) приводила к получению титульного соединения в виде белого твердого вещества (1,07 г, 82%); 1Н ЯМР (CDCl3, 300 МГц) δ 8,05 (d, J=2 Гц, 1Н), 7,35 (dd, J1=9,0 Гц, J2=2,5 Гц, 1Н), 6,96 (br s, NH, 1Н), 6,53 (d, J=9,0 Гц, 1Н), 5,78 (m, 1Н), 5,46 (br s, NH, 1Н), 4,36 (d, J=13 Гц, 1Н), 4,12 (d, J=13 Гц, 1Н), 2,83 (td, J1=13,5 Гц, J2=5 Гц, 1Н), 2,72 (td, J1=12,5 Гц, J2=2 Гц, 2Н), 2,42 (tt, J1=12 Гц, J2=3 Гц, 1Н). 1,97 (s, 3Н), 1,77 (m, 2Н), 1,32-1,48 (m, 4H), 1,28 (s, 9H), 1,20 (s, 12H), 1,03-1,25 (m, 2Н), 0,72 (t, J=7,5 Гц, 2Н); MC (+CI): m/z C28H46BClN4O4: ожидаемое 548,3; эксперимент 549,3 (M+H)+, 571,3 (M+Na)+.
Стадия 5: 2-амино-6-бороно-2-(1-(5-хлорпиридин-2-ил)пиперидин-4-ил)гексановая кислота
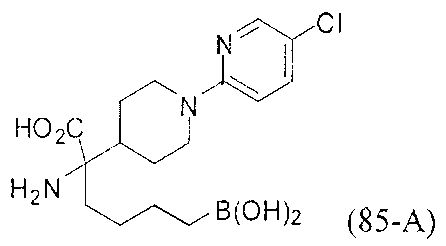
[0763] Раствор трет-бутиламида 2-ацетиламино-2-(5′-хлор-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридин-4-ил)-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (1,07 г) в 6н. НСl (20 мл) перемешивали при 90°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением титульного соединения в виде белого твердого вещества (590 мг, 82%); 1Н ЯМР (D2O, 300 МГц) δ 8,00 (d, J=2,5 Гц, 1Н), 7,47 (dd, J1=9,0 Гц, J2=2,5 Гц, 1Н), 6,79 (d, J=9 Гц, 1Н), 4,42 (d, J=13,5 Гц, 1Н), 4,32 (d, J=13 Гц, 1Н), 2,79 (t, J=12 Гц, 2Н), 2,06 (m, 1Н), 1,78-1,94 (m, 3Н), 1,55-1,70 (m, 2Н), 1,43 (m, 4H), 1,30 (m, 1Н), 0,82 (t, J=7 Гц, 2Н); MC (+CI): m/z C16H25BClN3O4: ожидаемое 369,2; эксперимент 370,2 (M+Н)+, 352,23 (M+Н-H2O)+.
[0764] Пример 86-А: Получение гидрохлорида 2-амино-6-бороно-2-(4-(4-хлорфенил)циклогексил)гексановой кислоты
Стадия 1: метоксиметиламид 4-(4-хлорфенил)циклогексанкарбоновой кислоты
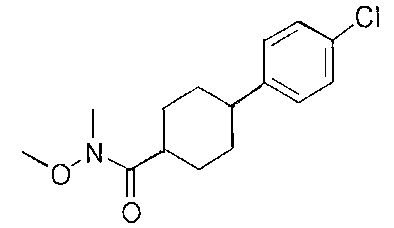
[0765] EDC (3,21 г, 16,8 ммоль) добавляли по частям в перемешиваемый раствор 4-(4-хлорфенил)циклогексанкарбоновой кислоты (2,0 г, 8,4 ммоль), DMAP (5 мг), HOBt (5 мг) и гидрохлорида N,O-диметилгидроксиламина (1,63 г, 16,8 ммоль) в дихлорметане (40 мл). Триэтиламин (3,4 г, 4,7 мл, 33,5 ммоль) добавляли по каплям и реакционную смесь перемешивали при комнатной температуре. После перемешивания в течение ночи реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме с получением метоксиметиламида 4-(4-хлорфенил)циклогексанкарбоновой кислоты в виде бесцветной маслянистой жидкости (1,85 г, 78%); МС (+СI): m/z C15H20ClNO2: ожидаемое 281,1; эксперимент 282,2 (М+H)+.
Стадия 2: 1-[4-(4-хлорфенил)циклогексил]пент-4-ен-1-он
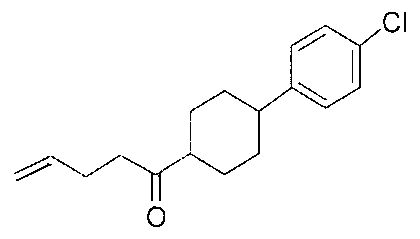
[0766] В атмосфере азота раствор метоксиметиламида 4-(4-хлорфенил)-циклогексанкарбоновой кислоты (1,8 г, 6,39 ммоль) в тетрагидрофуране (10 мл) охлаждали до 0°С и обрабатывали бромидом 4-бутенилмагния (0,5М в ТГФ, 31,95 мл, 15,98 ммоль) по каплям. После перемешивания в течение 1 часа при 0°С реакционную смесь нагревали до комнатной температуры в течение ночи, выливали в воду, подкисляли до рН 3-4 при помощи 1н. хлороводородной кислоты и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 0-20% этилацетат в гептане) приводила к получению 1-[4-(4-хлорфенил)циклогексил]пент-4-ен-1-она в виде бесцветной маслянистой жидкости (1,62 г, 92%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,26 (m, 2H), 7,12 (d, J=8 Гц, 2H), 5,81 (m, 1H), 5,02 (m, 2H), 2,58 (t, J=7 Гц, 2Н), 2,44 (m, 2H), 2,34 (m, 2H), 1,99 (m, 4H), 1,47 (m, 4H).
Стадия 3: 2-ацетамидо-N-трет-бутил-2-(4-(4-хлорфенил)циклогексил)гекс-5-енамид
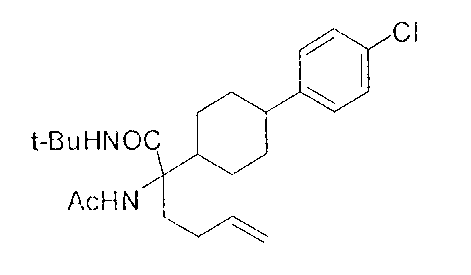
[0767] Трет-бутилизоцианид (301 мг, 0,41 мл, 3,6 ммоль) добавляли в перемешиваемую суспензию 1-[4-(4-хлорфенил)циклогексил]пент-4-ен-1-она (800 мг, 2,9 ммоль) и ацетата аммония (671 мг, 8,7 ммоль) в 2,2,2-трифторэтаноле (0,4 мл). После перемешивания при комнатной температуре в течение 8 дней реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 10-50% этилацетат в гептане) приводила к получению 2-ацетамидо-N-трет-бутил-2-(4-(4-хлорфенил)циклогексил)гекс-5-енамида в виде бесцветной маслянистой жидкости (940 мг, 77%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,24 (m, 2H), 7,15 (m, 2H), 7,04 (br s, NH, 1H), 5,80 (m, 1H), 5,544 (br s, NH, 1H), 4,97 (m, 2H), 3,04 (ddd, J1=14 Гц, J2=11,5 Гц, J3=5,0 Гц, 1H), 2,38 (tt, J1=12 Гц, J2=2 Гц, 1H), 2,28 (tt, J1=12 Гц, J2=2 Гц, 1H), 2,03 (s, 3Н), 1,68-1,95 (m, 5H), 1,42-1,61 (m, 4H), 1,41 (s, 9H), 1,26 (m, 1H), 1,12 (m, 1H); MC (+CI): m/z C24H35ClN2O2: ожидаемое 418,2; эксперимент 419,2 (M+H)+.
Стадия 4: 2-ацетамидо-N-трет-бутил-2-(4-(4-хлорфенил)циклогексил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
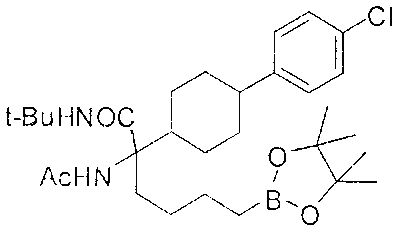
[0768] Раствор трет-бутиламида 2-ацетиламино-2-[4-(4-хлорфенил)циклогексил]гекс-5-еновой кислоты (940 мг, 2,25 ммоль) в дихлорметане (9 мл) обрабатывали димером хлор-1,5-циклооктадиениридия (I) (45 мг, 3 мол.%) и 1,2-бис(дифенилфосфино)этаном (54 мг, 6 мол.%). После перемешивания в течение 30 минут 4,4,5,5-тетраметил-[1,3,2]диоксаборолан (576 мг, 0,65 мл, 4,5 ммоль) добавляли по каплям и перемешивание продолжали в течение ночи. Реакционную смесь выливали в воду и экстрагировали этилацетатом (3х). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали в вакууме. Очистка путем колоночной флэш-хроматографии (силикагель, 10-40% этилацетат к гептане) приводила к получению 2-ацетамидо-N-трет-бутил-2-(4-(4-хлорфенил)циклогексил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида в виде бесцветной маслянистой жидкости (985 мг, 80%); 1Н ЯМР (CDCl3, 300 МГц) δ 7,25 (d, J=7,5 Гц, 2Н), 7,08 (d, J=7,5 Гц, 2Н), 6,99 (br s, NH, 1H), 5,52 (br s, NH, 1H), 2,84 (td, J1=13 Гц, J2=3,0 Гц, 1Н), 2,37 (t, J=12 Гц, 1Н), 2,24 (t, J=12 Гц, 1H), 2,00 (s, 3Н), 1,90 (m, 4H), 1,20-1,48 (m, 7H), 1,38 (s, 9H), 1,22 (s, 12H), 1,06 (m, 2Н), 0,75 (t, J=7,5 Гц, 2Н); МС (+CI): m/z C30H48BClN2O4: ожидаемое 546,3; эксперимент 547,3 (M+H)+, 569,3 (M+Na)+.
Стадия 5: 2-амино-6-бороно-2-(4-(4-хлорфенил)циклогексил)гексановая кислота
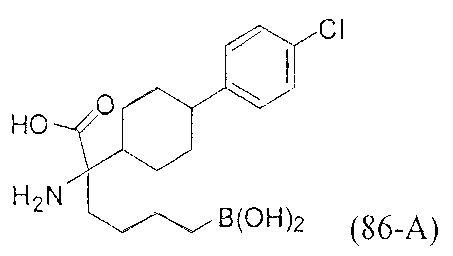
[0769] Раствор трет-бутиламида 2-ацетиламино-2-[4-(4-хлорфенил)циклогексил]-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)гексановой кислоты (980 мг) в 6н. HCl (15 мл) перемешивали при 90°С в течение 1 дня. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (10 мл) и промывали дихлорметаном (3х). Водный слой замораживали в жидком азоте и лиофилизировали с получением 2-амино-6-бороно-2-(4-(4-хлорфенил)циклогексил)-гексановой кислоты (535 мг, 81%). 1Н ЯМР (D4-MeOH, 300 МГц) δ 7,24 (d, J=8,5 Гц, 2Н), 7,19 (dd, J=8,5 Гц, 2Н), 2,50 (m, 1H), 1,78-2,06 (m, 7H), 1,38-1,56 (m, 7H), 1,21 (m, 1H), 0,82 (t, J=6,5 Гц, 2Н); МС (+CI): m/z C18H27BClNO4: ожидаемое 367,2; эксперимент 368,2 (M+H)+, 350,2 (M+Н-H2O)+.
[0770] Пример 87-А: Получение дигидрохлорида 2-амино-2-(1-бензилпиперидин-4-ил)-6-бороногексановой кислоты
Стадия 1: бензил-4-(метокси(метил)карбамоил)пиперидин-1-карбоксилат
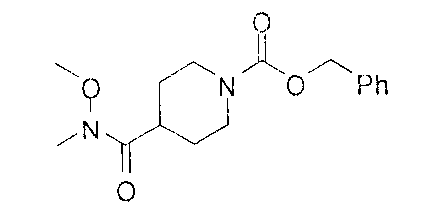
[0771] В 1 л круглодонной колбе раствор 1-(бензилоксикарбонил)пиперидин-4-карбоновой кислоты (21,0 г, 80 ммоль) в безводном дихлорметане (250 мл) перемешивали при комнатной температуре до полного растворения. После получения прозрачного раствора реакционную смесь охлаждали до 0°С и последовательно обрабатывали гидрохлоридом N,О-диметилгидроксиламина (9,74 г, 100 ммоль), EDC (19,2 г, 100 ммоль) и триэтиламином (30,4 г, 41,81 мл, 300 ммоль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение ночи. 1н. HCl (250 мл) добавляли и после 5-минутного перемешивания органическую фазу отделяли, промывали 1н. НСl (100 мл), насыщенным водным NaHCO3 (150 мл), сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (колонка 100 г, 50-100% этилацетат в гептане) приводила к получению бензил-4-(метокси(метил)карбамоил)пиперидин-1-карбоксилата (22,23 г, 91%) в виде бесцветной маслянистой жидкости. 1Н ЯМР (CDCl3, 300 МГц) δ 7,42-7,29 (m, 5H), 5,21 (s, 2H), 4,32-4,16 (m, 2H), 3,70 (s, 3Н), 3,18 (s, 3Н), 2,96-2,78 (m, 3Н), 1,80-1,64 (m, 4H). ИЭР МС эксперимент C16H22N2O4 m/z [307,1 (M+1), 329,2 (M+23)].
Стадия 2: бензил-4-пент-4-еноилпиперидин-1-карбоксилат
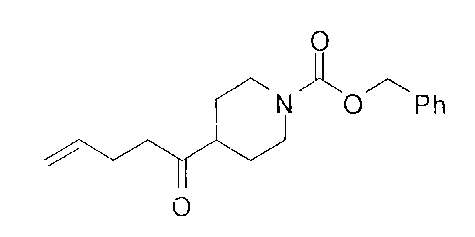
[0772] В атмосфере аргона раствор бензил-4-(метокси(метил)карбамоил)пиперидин-1-карбоксилата (15,0 г, 49,0 ммоль) в ТГФ (100 мл) охлаждали до -78°С (баня сухой лед/ацетон) и обрабатывали бромидом 3-бутенилмагния (250 мл, 0,5М раствор в ТГФ, 125 ммоль, Aldrich) через шприц. После завершения добавления охлаждающую баню удаляли и оставляли раствор медленно нагреваться до комнатной температуры. После перемешивания в течение ночи (16 ч) реакцию гасили 0,1н. HCl (200 мл) и смесь разбавляли этилацетатом (300 мл). После перемешивания в течение еще 5 минут органическую фазу отделяли, промывали насыщенным бикарбонатом натрия (200 мл), сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (колонка 100 г, 20-50% этилацетат в гептане) приводила к получению бензил-4-пент-4-еноилпиперидин-1-карбоксилата (14,5 г, 98%) в виде бесцветной маслянистой жидкости. 1Н ЯМР (CDCl3, 300 МГц) δ 7,38-7,32 (m, 5H), 5,79 (dddd, J1=17,1 Гц, J2=10,2 Гц, J3=6,9 Гц, J4=6,6 Гц, 1H), 5,12 (s, 2H), 5,02 (dd, J1=17,1 Гц, J2=1,5 Гц, 1Н), 4,97 (dd, J1=10,2 Гц, J2=1,5 Гц, 1H), 4,28-4,10 (m, 2H), 2,86 (br t, J=12 Гц, 2H), 2,58-2,43 (m, 3H), 2,35-2,28 (m, 2H), 1,9-1,74 (m, 2H), 1,62-1,48 (m, 2H). ИЭР МС эксперимент C18H23NO3 m/z [302,3 (M+1), 324,1 (M+23)].
Стадия 3: бензил-4-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)пиперидин-1-карбоксилат
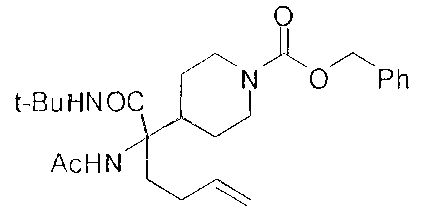
[0773] Раствор бензил-4-пент-4-еноилпиперидин-1-карбоксилата (10,0 г, 33,2 ммоль) и ацетата аммония (6,16 г, 80 ммоль) в 2,2,2-трифторэтаноле (10 мл) обрабатывали трет-бутилизоцианидом (2,57 г, 3,50 мл, 31 ммоль). После перемешивания при комнатной температуре в течение 14 дней реакционную смесь добавляли в делительную воронку, разбавляли деионизованной водой (100 мл) и экстрагировали этилацетатом (2×100 мл). Органический слой промывали насыщенным водным хлоридом натрия, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (колонка 100 г, 50-100% этилацетат в гептане) приводила к получению бензил-4-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)пиперидин-1-карбоксилата в виде бесцветной маслянистой жидкости (8,2 г, 56%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,36-7,31 (m, 5H), 6,98 (bs, 1H), 5,85-5,71 (m, 1H), 5,49 (bs, 1H), 5,11 (s, 2H), 5,00 (dd, J1=16,8 Гц, J2=1,5 Гц, 1H), 4,95 (dd, J1=9,9 Гц, J2=1,5 Гц, 1H), 4,36-4,12 (m, 2H), 2,96 (ddd, J1=14,1 Гц, J2=1,7 Гц, J3=5,4 Гц, 1H), 2,78-2,61 (m, 2H), 2,37 (ddd, J1=12,0 Гц, J2=11,7 Гц, J3=0,9 Гц, 1H), 2,10-1,96 (m, 1H), 2,00 (s, 3H), 1,84-1,64 (m, 3H), 1,56-1,39 (m, 1H), 1,39-1,21 (m, 1H), 1,34 (s, 9H), 1,20-1,03 (m, 1H). ИЭР МС эксперимент C25H37N3O4 m/z [444,3 (M+1), 466,1 (M+23)].
Стадия 4: бензил-4-(2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)пиперидин-1-карбоксилат
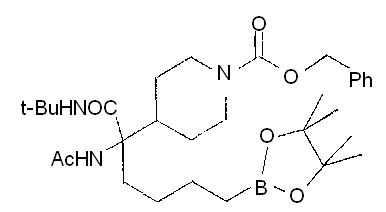
[0774] В атмосфере аргона раствор 1,2-бис(дифенилфосфино)этана (306 мг, 0,77 ммоль) и димера хлор-1,5-циклооктадиениридия (I) (258 мг, 0,39 ммоль) в безводном ТГФ (30 мл) обрабатывали 4,4,5,5-тетраметил-1,3,2-диоксабороланом (1,48 г, 1,67 мл, 11,6 ммоль) за один раз. После перемешивания в течение 15 минут раствор охлаждали до 5°С (баня с ледяной водой) и обрабатывали бензил-4-(2-ацетамидо-1-(трет-бутиламино)-1-оксогекс-5-ен-2-ил)пиперидин-1-карбоксилатом (3,42 г, 7,70 ммоль) за один раз. После завершения добавления охлаждающую баню удаляли и реакционную смесь оставляли нагреваться до комнатной температуры. После 2-часового перемешивания реакцию гасили насыщенным водным бикарбонатом натрия (50 мл) и экстрагировали этилацетатом (2×150 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (колонка 100 г, 40-80% этилацетат в гептане) приводила к получению бензил-4-(2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)пиперидин-1-карбоксилата в виде бесцветной маслянистой жидкости (3,10 г, выход 71%). 1Н ЯМР (CDCl3, 300 МГц) δ 7,36-7,30 (m, 5H), 6,94 (bs, 1H), 5,46 (s, 1H), 5,10 (s, 211), 4,36-4,10 (m, 2H), 2,86-2,60 (m, 3Н), 2,40-2,28 (bt, J=12,3 Hz, 1H), 1,98 (s, 3Н), 1,78-1,61 (m, 2H), 1,49-1,17 (m, 5H), 1,33 (s, 9H), 1,20 (s, 8Н), 1,12-0,94 (m, 2H), 0,73 (t, J=7,8 Гц, 2Н).
Стадия 5: 2-ацетамидо-N-трет-бутил-2-(пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
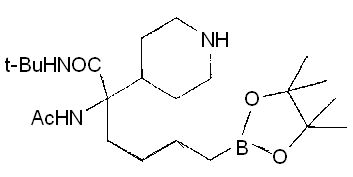
[0775] В 100 мл круглодонной колбе в атмосфере аргона бензил-4-(2-ацетамидо-1-(трет-бутиламино)-1-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексан-2-ил)пиперидин-1-карбоксилат (3,0 г, 5,25 ммоль) в метаноле (40 мл) дегазировали аргоном (продувая через раствор) и затем обрабатывали палладием (25 мг, 10 масс.% на подложке активированного угля, влажный, Degussa E101 NE/W). Продолжали продувать аргон в течение 10 минут, после чего заменяли его медленным током водорода. Через 1,5 часа реакция завершалась (прохождение реакции отслеживали путем ТСХ для определения исчезновения исходного вещества (50% этилацетат в гептане, Rf 0,3)) и раствор продували аргоном, фильтровали через Celite 545, а осадок на фильтре промывали метанолом. Раствор в метаноле концентрировали, растворители выпаривали с получением неочищенного 2-ацетамидо-N-трет-бутил-2-(пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (2,20 г, 96%), который применяли без дополнительной очистки (содержал примерно 10% продукта, не содержащего защитную группу бороновой кислоты). 1Н ЯМР (CDCl3, 300 МГц) δ 6,95 (s, 1Н), 5,53 (s, 1H), 3,09 (bt, J=11,1 Гц, 2Н), 2,80 (ddd, J1=14,1 Гц, J2=13,5 Гц, J3=4,5 Гц, 1H), 2,65-2,48 (m, 2Н), 2,26 (dddd, J1=12,0 Гц, J2=12,0 Гц, J3=3,0 Гц, J4=2,7 Гц, 1H), 2,00-1,90 (m, 1H), 1,98 (s, 3H), 1,78-1,63 (m, 2Н), 1,45-1,00 (m, 5H), 1,36 (s, 9H), 1,21 (s, 8H), 0,73 (t, J=7,5 Гц, 2Н).
Стадия 6: 2-ацетамидо-2-(1-бензилпиперидин-4-ил)-N-трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамид
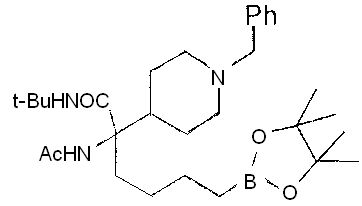
[0776] Раствор 2-ацетамидо-N-трет-бутил-2-(пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (480 мг, 1,10 ммоль) и бензальдегида (138 мг, 131 мкл, 1,30 ммоль) в 1,2-дихлорэтане (1 мл) перемешивали в течение 20 минут, затем обрабатывали триацетоксиборгидридом натрия (420 мг, 2,20 ммоль). Через 5 часов реакцию гасили насыщенным водным бикарбонатом натрия (10 мл), разбавляли насыщенным водным хлоридом натрия (50 мл) и экстрагировали дихлорметаном (3×40 мл). Органические слои собирали, сушили над MgSO4, фильтровали и концентрировали. Очистка путем ЖХСД (колонка 25 г, 1-10% метанол в дихлорметане) приводила к получению 2-ацетамидо-2-(1-бензилпиперидин-4-ил)-N-трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (538 мг, 93%), который немедленно применяли на следующей стадии (примерно в 10% продукта была удалена защитная группа бороновой кислоты).
Стадия 7: 2-амино-2-(1-бензилпиперидин-4-ил)-6-бороногексановая кислота
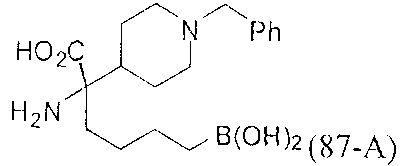
[0777] Раствор 2-ацетамидо-2-(1-бензилпиперидин-4-ил)-N-трет-бутил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида (510 мг, 0,97 ммоль) в 6н. НСl (15 мл) осторожно кипятили с обратным холодильником к течение 16 часов. После охлаждения до комнатной температуры реакционную смесь переносили в делительную воронку, разбавляли деионизованной водой (15 мл) и промывали дихлорметаном (3×25 мл). Водный слой концентрировали с получением беловатого твердого вещества, которое очищали путем ВЭЖХ (5-95% ацетонитрил в воде). Фракции, содержащие продукт, концентрировали, перерастворяли в деионизованной воде (15 мл), замораживали в жидком азоте и лиофилизировали с получением 2-амино-2-(1-бензилпиперидин-4-ил)-6-бороногексановой кислоты (210 мг, 62%) в виде тригидрата дигидрохлоридной соли. 1Н ЯМР (D2O, 500 МГц) δ 7,37-7,43 (m, 5H), 4,21 (s, 2H), 3,51 (brt, J=10 Гц, 2Н), 2,92-2,99 (m, 2H), 2,02-2,10 (m, 2H), 1,66-1,84 (m, 4H), 1,41 (dq, J1=13,0 Гц, J1=4,0 Гц, 1Н), 1,29-1,35 (m, 2H), 1,23-1,28 (m, 1Н), 1,08-1,12 (m, 1Н), 0,68 (t; J=8,0 Гц, 2H). ИЭР МС эксперимент C18H29BFN2O4 m/z [331,6 (M+1-18) 13%, 313,6 (M+1-2×18) 100%, 329,6 (M-1-18) 100%]. Элементный анализ, расчет C18H29BN2O4×2HCl×3H2O: С, 45,49; Н, 7,85; N, 5,89. Эксперимент С, 45,60; Н, 7,10; N, 5,55.
[0778] Пример 88-А: Получение дигидрохлорида 2-амино-6-бороно-2-(пиперидин-4-ил)гексановой кислоты
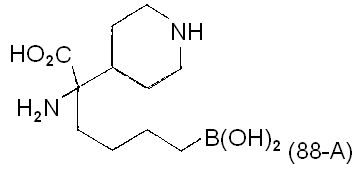
[0779] Дигидрохлорид 2-амино-6-бороно-2-(пинеридин-4-ил)гексановой кислоты получали аналогично способу синтеза, предложенному в Примере 87-А, с тем исключением, что проводили снятие защиты непосредственно промежуточного соединения, полученного на стадии 5 (2-ацетамидо-N-трет-бутил-2-(пиперидин-4-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)гексанамида), согласно описанию стадии 7. 1Н ЯМР (D2O, 300 МГц) δ 3,45 (brd, J=12,0 Гц, 2H), 2,92-2,98 (m, 2H), 2,15 (brt, J=12,0 Гц, 1Н), 2,04 (brd, J=14,0 Гц, 1Н), 1,79-1,86 (m, 3H), 1,71 (dq, J1=13,0 Гц, J2=3,0 Гц, 1Н), 1,43 (dq, J1=13,0 Гц, J2=3,0 Гц, 1Н), 1,27-1,38 (m, 3H), 1,09-1,17 (m, 1Н), 0,71 (t, J=8,0 Гц, 2H). ИЭР МС эксперимент C11H23BN2O4 m/z [281,5 (M+Na+) 3%, 263,5 (M+Na+-18) 5%, 241,5 (M+1-18) 15%, 223,4 (M+1-2×18) 100%].
[0780] Пример 89-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(4-хлорбензил)пиперидин-4-ил)гексановой кислоты
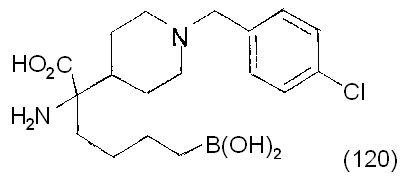
[0781] Дигидрохлорид 2-амино-6-бороно-2-(1-(4-хлорбензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 4-хлорбензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 7,31 (dAB, J=8,4 Гц, 2Н), 7,25 (dAB, J=8,4 Гц, 2Н), 4,11 (s, 2H), 3,47-3,35 (m, 2Н), 2,93-2,80 (m, 2Н), 2,09 (bt, J=12,3 Гц, 1Н), 1,92 (d, J=13,8 Гц, 1Н), 1,84-1,60 (m, 4H), 1,45-1,31 (m, 1Н), 1,30-1,13 (m, 3H), 1,10-0,95 (m, 1H), 0,59 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C18H28BClN2O4 m/z [383,2 (M+1)].
[0782] Пример 90-A: Получение дигидрохлорида 2-амино-2-(1-(бензо[d][1,3]диоксол-5-илметил)пиперидин-4-ил)-6-бороногексановой кислоты
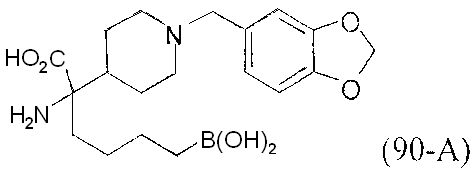
[0783] Дигидрохлорид 2-амино-2-(1-(бензо[d][1,3]диоксол-5-илметил)пиперидин-4-ил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что бензо[d][1,3]диоксол-5-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 300 МГц) δ 6,87-6,74 (m, 3H), 5,85 (s, 2Н), 4,05 (s, 2Н), 3,50-3,32 (m, 2Н), 2,95-2,75 (m, 2Н), 2,04-1,90 (m, 2Н), 1,80-1,60 (m, 4H), 1,50-0,95 (m, 5H), 0,62 (t, J=7,2 Гц, 2Н). ИЭР МС эксперимент C19H29BN2O6 m/z [393,2 (M+1)].
[0784] Пример 91-A: Получение дигидрохлорида 2-амино-6-бороно-2-(1-((6-хлорбензо[d][1,3]диоксол-5-ил)метил)пиперидин-4-ил)гексановой кислоты
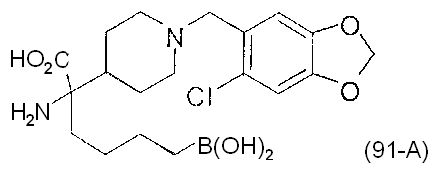
[0785] Дигидрохлорид 2-амино-6-бороно-2-(1-((6-хлорбензо[d][1,3]диоксол-5-ил)метил)-пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 6-хлорбензо[d][1,3]диоксол-5-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 6,98, (s, 1H), 6,94, (s, 1H), 5,97 (s, 2H), 4,29 (s, 2H), 3,58 (t, J=11,6 Гц, 2Н), 3,11-3,05 (m, 2H), 2,15-2,04 (m, 2H), 1,50-1,42 (m, 1H), 1,36-1,25 (m, 3Н), 1,14-1,07 (m, 1H), 0,69 (t, J=7,6 Гц, 2H). ИЭР МС эксперимент C19H28BClN2O6 m/z [409,6/411,6 (M+1-18) 10%, 391,5/393,5 (M+1-2×18) 63%, 425,5/427,5 (M-1) 27%, 407,6/409,6 (M-1-18) 100%].
[0786] Пример 92-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-изопентилпиперидин-4-ил)гексановой кислоты
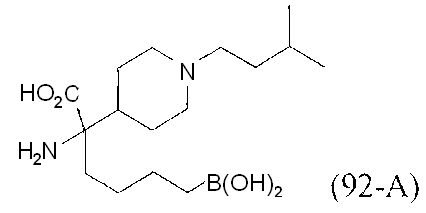
[0787] Дигидрохлорид 2-амино-6-бороно-2-(1-изопентилпиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что изопентаналь (3-метилбутаналь) применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,55 (1, J=11,7 Гц, 2H), 3,00-2,97 (m, 2H), 2,88-2,82 (m, 2H), 2,11-2,01 (m, 2H), 1,84-1,70 (m, 4H), 3,52-1,38 (m, 4H), 1,33-1,21 (m, 3H), 1,10-1,03 (m, 1H), 0,77 (d, J=5,5 Гц, 6Н), 0,66 (t, J=7,6 Гц, 2H). ИЭР МС эксперимент C16H33BN2O4 m/z [329,7 (M+1) 2%, 311,6 (M+1-18) 20%, 293,6 (M+1-2×18) 100%, 327,7 (M-1) 10%, 309,6 (M-1-18) 100%].
[0788] Пример 93-А: Получение 2-амино-6-бороно-2-(1-(4-(трифторметил)бензил)пиперидин-4-ил)гексановой кислоты
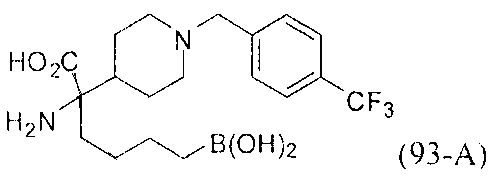
[0789] 2-Амино-6-бороно-2-(1-(4-(трифторметил)бензил)пиперидин-4-ил)гексановую кислоту получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 4-(трифторметил)бензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 7,76-7,70 (m, 2H), 7,65-7,54 (m, 2H), 4,25 (s, 2H), 3,60-3,37 (m, 2H), 3,07-2,84 (m, 2H), 2,07-1,95 (m, 2H), 1,82 (s, 3H), 1,81-1,63 (m, 4H), 1,47-1,16 (m, 4H), 1,14-1,00 (m, 1H), 0,67 (t, J=8,29 Гц, 2H), МС эксперимент C19H28BF3N2O4 m/z [399,1, (M-18+1), 381,1(M-36+1)].
[0790] Пример 94-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(4-фторбензил)пиперидин-4-ил)гексановой кислоты
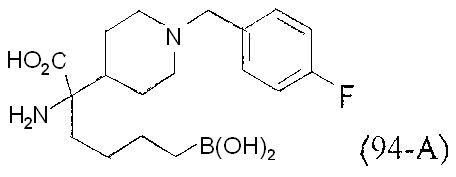
[0791] Дигидрохлорид 2-амино-6-бороно-2-(1-(4-фторбензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 4-фторбензальдегид применяли в качестве альдегида на стадии 6. 1H ЯМР (D2O, 400 МГц) δ 7,42-7,35 (m, 2Н), 7,16-7,07 (m, 2H), 4,19 (s, 2H), 3,60-3,35 (m, 2H), 3,06-2,81 (m, 2H), 2,07-1,94 (m, 2H), 1,86 (s, 3H), 1,84-1,60 (m, 4H), 1,45-1,16 (m, 4H), 1,14-0,99 (m, 1H), 0,68 (t, J=8,3 Гц, 2H). МС эксперимент C18H28BFN2O4 m/z [349,1, (M-18+1), 331,1 (М-36+1)].
[0792] Пример 95-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(3,4-дихлорбензил)пиперидин-4-ил)гексановой кислоты
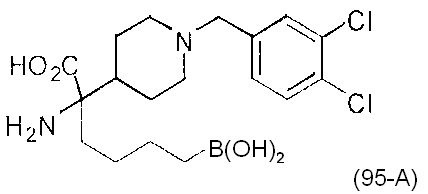
[0793] Дигидрохлорид 2-амино-6-бороно-2-(1-(3,4-дихлорбензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 118, с тем исключением, что 3,4-дихлорбензальдегад применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 7,56-7,50 (m, 2H), 7,29-7,24 (m, 1H), 4,16 (s, 2H), 3,57-3,32 (m, 2H), 3,01-2,76 (m, 2H), 2,05-1,95 (m, 2H), 1,80 (s, 3H), 1,79-1,63 (m, 4H), 1,45-1,15 (m, 4H), 1,14-0,99 (m, 1H), 0,68 (t, J=8,29 Гц, 2H); МС эксперимент C18H27BCl2N2O4 m/z [399,2, (M-18+1), 381,2 (M-36+1)].
[0794] Пример 96-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(2-фтор-4,5-диметоксибензил)пиперидин-4-ил)гексановой кислоты
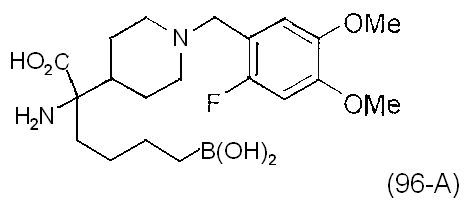
[0795] Дигидрохлорид 2-амино-6-бороно-2-(1-(2-фтор-4,5-диметоксибензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 2-фтор-4,5-диметоксибензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 6,97 (d, J=7,1 Гц, 1H), 6,89 (d, J=7,1 Гц, 1H), 4,02 (s, 2H), 3,82 (s, 3H), 3,79 (s, 3Н), 3,47-3,34 (m, 2H), 2,85-2,69 (m, 2H), 2,05-1,90 (m, 2H), 1,85 (s, 3H), 1,81-1,61 (m, 4H), 1,45-1,22 (m, 4H), 1,20-1,08 (m, 1H]), 0,72 (t, J=8,3 Гц, 2H). МС эксперимент C20H32BFN2O6 m/z [409,2, (M-18+1), 391,2 (M-36+1)].
[0796] Пример 97-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(2,4-дихлорбензил)пиперидин-4-ил)гексановой кислоты
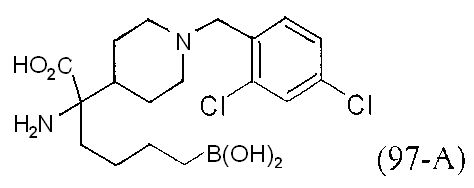
[0797] Дигидрохлорид 2-амино-6-бороно-2-(1-(2,4-дихлорбензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 2,4-дихлорбензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 7,66 (d, J=2,0 Гц, 1Н), 7,53 (s, 1Н), 7,47 (d, J=2,1 Гц, 1Н), 4,46 (s, 2H), 3,71-3,61 (m, 2H), 3,26-3,12 (m, 2H), 2,18-2,07 (m, 2H), 1,90-1,76 (m, 3Н), 1,61-1,47 (m, 1Н), 1,46-1,19 (m, 3H), 1,25-1,11 (m, 1Н), 0,77 (t, J=7,4 Гц, 2H). ИЭР+/ИЭР- МС: ожидаемое m/z 400,1 (M-18+H)+, 381,1 (M-36+H)+, 399,1 (M-18-1)-, 381,1 (M-36-1)-.
[0798] Пример 98-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(нафталин-1-илметил)пиперидин-4-ил)гексановой кислоты
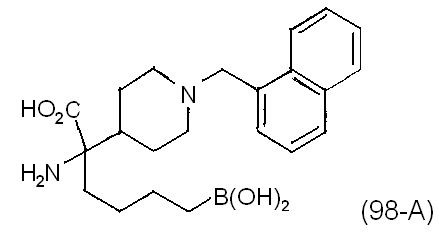
[0799] Дигидрохлорид 2-амино-6-бороно-2-(1-(нафталин-1-илметил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 1-нафтальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 8,15 (d, J=8,4 Гц, 1Н), 8,09 (d, J=8,4 Гц, 1Н), 8,05 (d, J=8,4 Гц, 1Н), 7,74-7,58 (m, 4H), 4,81 (s, 2H), 3,71-3,56 (m, 2H), 3,27-3,11 (m, 2H), 2,19-2,03 (m, 2H), 1,90-1,70 (m, 4H), 1,57-1,27 (m, 4H), 1,25-1,09 (m, 1Н), 0,77 (t, J=7,6 Гц, 2Н). ИЭР+/ИЭР- МС: эксперимент m/z 381,1 (M-18+H)+, 363,1 (M-36+H)+, 379,1 (M-18-1)-.
[0800] Пример 99-A: Получения дигидрохлорида 2-амино-6-бороно-2-(1-(нафталин-2-илметил)пиперидин-4-ил)гексановой кислоты
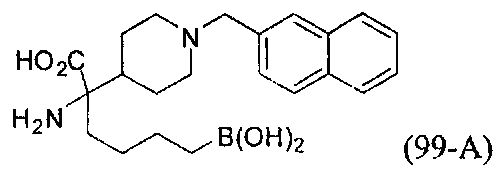
[0801] Дигидрохлорид 2-амино-6-бороно-2-(1-(нафталин-2-илметил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 2-нафтальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 8,04-7,96 (m, 4H), 7,67-7,57 (m, 2H), 7,55 (d, J=8,4 Гц, 1Н), 4,41 (s, 2H), 3,65-3,52 (m, 2H), 3,11-2,95 (m, 2H), 2,16-2,04 (m, 2H), 1,87-1,70 (m, 4H), 1,57-1,27 (m, 4H), 1,25-1,11 (m, 1H), 0,77 (t, J=7,6 Гц, 2H). ИЭР+/ИЭР- МС: эксперимент m/z 381,1 (M-18+H)+, 363,1 (M-36+H)+, 379,1 (M-18-1)-.
[0802] Пример 100-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(4-(трифторметокси)бензил)пиперидин-4-ил)гексановой кислоты
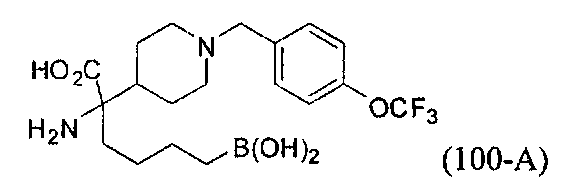
[0803] Дигидрохлорид 2-амино-6-6ороно-2-(1-(4-(трифторметокси)бензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 4-(трифторметокси)бензальдегид применяли в качестве альдегида на стадии 6. 1H ЯМР (D2O, 400 МГц) δ 7,55 (d, J=8,8 Гц, 2H), 7,41 (d, J=8,8 Гц, 2Н), 4,28 (s, 2H), 3,60-3,50 (m, 2H), 3,06-2,92 (m, 2H), 2,14-2,04 (m, 2H), 1,88-1,73 (m, 4H), 1,56-1,28 (m, 4H), 1,25-1,11 (m, 1H), 0,77 (t, J=7,6 Гц, 2H). 19F ЯМР (D2O, 400 МГц) δ -57,9 (s, 3F). ИЭР+/ИЭР- МС: эксперимент m/z 415,2 (M-18+1)+, 397,2 (M-36+1)+, 413,2 (M-18-1)-.
[0804] Пример 101-A: Получение дигидрохлорида 2-амино-6-бороно-2-(1-пропилпиперидин-4-ил)гексановой кислоты
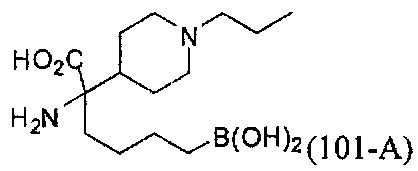
[0805] Дигидрохлорид 2-амино-6-бороно-2-(1-пропилпиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что пропиональдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 3,51 (t, J=11,0 Гц, 2Н), 2,91-2,88 (m, 2H), 2,86-2,81 (m, 2H), 2,10 (t, J=12,4 Гц, 1Н), 2,00 (d, J=13,7 Гц, 1Н), 1,83-1,67 (m, 4H), 1,59-1,52 (m, 2H), 1,46-1,37 (m, 1Н), 1,30-1,20 (m, 3H), 1,07-1,00 (m, 1Н), 0,77 (t, J=7,6 Гц, 3Н), 0,62 (t, J=7,6 Гц, 2H). ИЭР МС эксперимент C14H29BN2O4 m/z [301,5 (M+1) 1%, 283,5 (M+1-18) 17%, 265,5 (M+1-2×18) 100%, 581,9 (2M-1-18) 13%, 299,6 (M-1) 25%, 281,5 (M-1-18) 100%].
[0806] Пример 102-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(3-фенилпропил)пиперидин-4-ил)гексановой кислоты
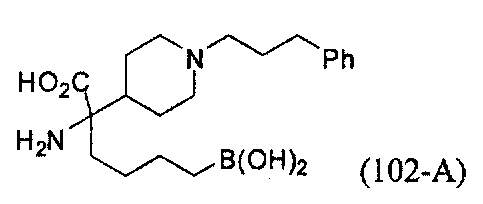
[0807] Дигидрохлорид 2-амино-6-бороно-2-(1-(3-фенилпропил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 3-фенилпропаналь применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 500 МГц) δ 7,30 (d, J=7,6 Гц, 1Н), 7,29 (d, J=7,6 Гц, 1Н), 7,21-7,20 (m, 3H), 3,56 (t, J=11,6 Гц, 2H), 3,02-2,99 (m, 2H), 2,90-2,83 (m, 2H), 2,62 (t, J=7,6 Гц, 2Н), 2,12-2,04 (m, 2H), 1,99-1,93 (m, 2H), 1,86-1,74 (m, 4H), 1,49-1,41 (m, 1Н), 1,37-1,24 (m, 3H), 1,14-1,08 (m, 1Н), 0,70 (t, J=7,6 Гц, 2H). ИЭР МС эксперимент C20H33BN2O4 m/z [359,6 (M+1-18) 15%, 341,6 (M+1-2×18) 100%, 734,0 (2M-1-18) 15%, 375,6 (M-1) 11%, 357,6 (M-1-18) 100%]. Элементный анализ: расчет C20H33BN2O4×2HCl×2H2O: С, 49,50; Н, 8,10; N, 5,77. Эксперимент С, 49,50; Н, 8,49; N, 5,86.
[0808] Пример 103-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(3-(трифторметокси)бензил)пиперидин-4-ил)гексановой кислоты
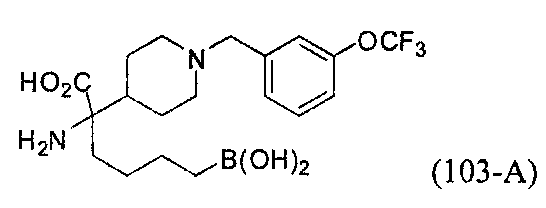
[0809] Дигидрохлорид 2-амино-6-бороно-2-(1-(3-(трифторметокси)бензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 3-(трифторметокси)бензальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 7,54 (t, J=7,8 Гц, 1H), 7,45-7,38 (m, 3H), 4,14 (s, 2H), 3,51-3,37 (m, 2Н), 2,92-2,76 (m, 2H), 2,11-1,98 (m, 2H), 1,86-1,65 (m, 4H), 1,50-1,28 (m, 4H), 1,24-1,10 (m, 1H), 0,77 (t, J=7,6 Гц, 2H). 19F ЯМР (D2O, 400 МГц) δ -57,9 (s, 3F), ИЭР+/ИЭР- МС: эксперимент m/z 415,1 (M-18+H)+, 397,1 (M-36+H)+, 413,1 (M-18-1)-.
[0810] Пример 104-А: Получение дигидрохлорида 2-амино-2-(1-(бензо[b]тиофен-3-илметил)пиперидин-4-ил)-6-бороногексановой кислоты
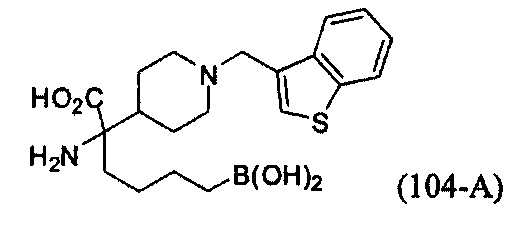
[0811] Дигидрохлорид 2-амино-2-(1-(бензо[b]тиофен-3-илметил)пиперидин-4-ил)-6-бороногексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что бензо[b]тиофен-3-карбальдегид применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 8,05 (d, J=7,7 Гц, 1H), 7,95-7,92 (m, 2H), 7,58-7,47 (m, 2H), 4,61 (s, 2H), 3,70-3,60 (m, 2H), 3,21-3,08 (m, 2H), 2,16-2,05 (m, 2H), 1,92-1,74 (m, 4H), 1,58-1,26 (m, 4H), 1,23-1,10 (m, 1H), 0,77 (t, J=7,6 Гц, 2Н). ИЭР+/ИЭР- МС: эксперимент m/z 387,1 (M-18+H)+, 369,1 (M-36+H)+, 385,1 (M-18-1)-.
[0812] Пример 105-А: Получение дигидрохлорида 3-((4-(1-амино-5-бороно-1-карбоксипентил)пиперидин-1-ил)метил)бензойной кислоты
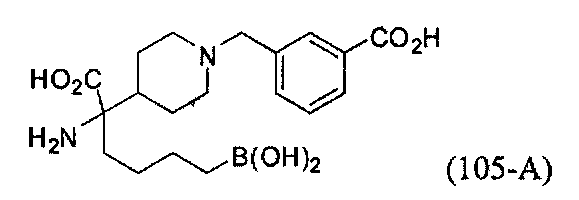
[0813] Дигидрохлорид 3-((4-(1-амино-5-бороно-1-карбоксипентил)пиперидин-1-ил)метил)бензойной кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что трет-бутил-3-формилбензоат применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 7,84 (d, J=8,7 Гц, 1H), 7,79 (s, 1H), 7,52-7,42 (m, 2H), 4,25 (s, 2H), 3,55-3,43 (m, 2H), 3,05-2,89 (m, 2H), 2,09-1,79 (m, 2H), 1,83 (s, 3H), 1,80-1,65 (m, 6H), 1,49-1,35 (m, 1H), 1,35-1,71 (m, 1H), 1,14-0,99 (m, 1H), 0,67 (t, J=8,3 Гц, 2H). МС эксперимент C19H29BN2O6 m/z [375,1, (M-18+1), 357,1 (M-36+1)].
[0814] Пример 106-А: Получение дигидрохлорида 2-амино-6-бороно-2-(1-(3-цианобензил)пиперидин-4-ил)гексановой кислоты
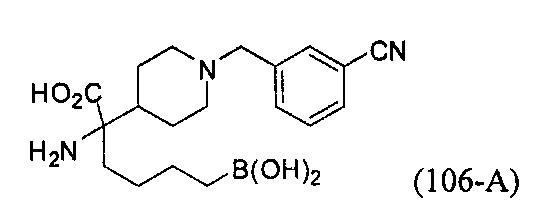
[0815] Дигидрохлорид 2-амино-6-бороно-2-(1-(3-цианобензил)пиперидин-4-ил)гексановой кислоты получали аналогично способу, предложенному в Примере 87-А, с тем исключением, что 3-формилбензонитрил применяли в качестве альдегида на стадии 6. 1Н ЯМР (D2O, 400 МГц) δ 7,82-7,76 (m, 2H), 7,69 (d, J=7,4 Гц, 1Н), 7,56 (t, J=8,0 Гц, 1H), 4,19 (s, 2H), 3,49-3,36 (m, 2H), 2,91-2,78 (m, 2H), 2,06-1,94 (m, 2H), 1,81 (s, 3H), 1,80-1,62 (m, 4H), 1,46-1,19 (m, 4H), 1,16-1,03 (m, 1H), 0,69 (t, J=8,29 Гц, 2H). МС эксперимент C19H28BN3O4 m/z [356,2 (M-18+1), 338,2 (M-36+1)].
СПОСОБЫ И ПРИМЕНЕНИЯ
[0816] Соединения Формулы I и Формулы II согласно настоящему изобретению подходят для ингибирования экспрессии или активности аргиназы I, аргиназы II или комбинации указанных ферментов. Ферменты семейства аргиназ играют важную роль в регуляции физиологического содержания L-аргинина, предшественника сигнальной молекулы оксида азота (NO), а также в регуляции содержания L-орнитина, предшественника определенных полиаминов, которые являются важными физиологическими сигнальными трансдукторами.
[0817] Более конкретно, в изобретении предложены способы и применения для ингибирования аргиназы I, аргиназы II или их комбинации в клетке, включающие приведение указанной клетки в контакт по меньшей мере с одним соединением Формулы I или Формулы II или с композицией, их содержащей, описанными в настоящей заявке. В некоторых вариантах реализации в изобретении предложен способ лечения или предотвращения заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или их комбинации у субъекта.
[0818] Например, заболевание или состояние выбрано из группы, состоящей из заболеваний сердца, гипертензии, сексуальных нарушений, нарушений ЖКТ, аутоиммунных нарушений, паразитарных инфекций, легочных нарушений, нарушений расслабления гладких мышц и гемолитических нарушений.
[0819] Более конкретно, гипертензия включает системную гипертензию, легочную артериальную гипертензию (ЛАГ) и высотную легочную артериальную гипертензию.
[0820] Типичными сексуальными нарушениями являются заболевания или состояния, выбранные из группы, состоящей из болезни Пейрони и эректильной дисфункции (ЭД).
[0821] В одном из вариантов реализации ингибитор аргиназы согласно настоящему изобретению подходит для лечения легочного нарушения, выбранного из группы, состоящей из фиброза легких, вызванного действием химических веществ, идиопатического фиброза легких, кистозного фиброза, хронической обструктивной болезни легких (ХОБЛ).
[0822] Соединения согласно настоящему изобретению также подходят для лечения нарушений желудочно-кишечного тракта, например, заболеваний или нарушений, выбранных из группы, состоящей из нарушений моторики желудочно-кишечного тракта, раковых заболеваний ЖКТ, замедления тока крови в печени, воспалительной болезни кишечника, болезни Крона, язвенного колита и язвенных болезней желудка.
[0823] Транспортировка органов повышает риск ишемического реперфузионного повреждения (ИР), например, ИР печени, ИР почки и ИР миокарда. Соединения Формулы I или Формулы II согласно настоящему изобретению подходят для защиты органов во время транспортировки.
[0824] В другом варианте реализации ингибиторы аргиназы согласно настоящему изобретению применяют для лечения гемолитических нарушений, выбранных из группы, состоящей из пароксизмальной ночной гемоглобинурии (ПНГ), серповидноклеточной анемии, талассемии, наследственного сфероцитоза и стоматоцитоза, микроангиопатической гемолитической анемии, недостаточности пируваткиназы, трансфузионной реакции в результате несовместимости с АВО, пароксизмальной холодовой гемоглобинурии, тяжелой идиопатической аутоиммунной гемолитической анемии, анемии, вызванной инфекцией, экстракорпорального кровообращения, анемии, вызванной применением искусственного сердечного клапана, и анемии, вызванной действием химических веществ. В дополнение, соединения, описанные в настоящей заявке, подходят для лечения малярии.
[0825] Соединения согласно настоящему изобретению подходят для лечения аутоиммунных заболеваний, выбранных из группы, состоящей из энцефаломиелита, рассеянного склероза, антифосфолипидного синдрома 1, аутоиммунной гемолитической анемии, хронической воспалительной демиелинизирующей полирадикулонейропатии, герпетиформного дерматита, дерматомиозита, миастении, пузырчатки, ревматоидного артрита, синдрома мышечной скованности, диабета I типа и анкилозирующего спондилита. В другом варианте реализации соединения Формулы I или II подходят для лечения иммунных нарушений, выбранных из группы, состоящей из иммунного ответа, Т-клеточной дисфункции, например, Т-клеточной дисфункции, опосредованной супрессорными клетками миелоидного ряда (MDSC), вируса иммунодефицита человека (ВИЧ) и аутоиммунного энцефаломиелита.
[0826] Другими типичными болезненными состояниями, возможными терапевтическими средствами для лечения которых являются соединения, описанные в настоящей заявке, являются африканская сонная болезнь, болезнь Чагаса, нарушения расслабления гладких мышц, например, нарушения гладких мышц, выбранные из группы, состоящей из нарушений гладких мышц желудочно-кишечного тракта, гладких мышц анального сфинктера, мышц нижнего пищеводного сфинктера, пещеристого тела, сфинктера Одди, гладких мышц артерий, гладких мышц сердца, гладких мышц легкого, гладких мышц почки, гладких мышц матки, гладких мышц влагалища, гладких мышц шейки матки, гладких мышц плаценты и гладких мышц глаза.
[0827] Повышенное содержание аргиназы у конкретных раковых пациентов объясняет терапевтическое значение ингибиторов аргиназы согласно настоящему изобретению для лечения определенных раковых заболеваний, например, почечноклеточной карциномы, рака простаты, колоректального рака, рака груди, рака кожи, рака легких, рака яичников, рака желудка.
[0828] Преимущественно, соединения согласно настоящему изобретению особенно подходят для лечения состояний или нарушений, выбранных из группы, состоящей из артрита, инфаркта миокарда и атеросклероза, заболеваний почек, астмы, воспаления, псориаза, лейшманиоза, серповидноклеточной анемии (СКА), нейродегенеративных заболеваний, заживающих ран, например, инфицированных и неинфицированных заживающих ран, вируса гепатита B (HBV), инфекций H pylori, фиброзных заболеваний, например, кистозного фиброза, кандидоза, периодонтита, келоидов, аденотонзиллита, церебральных васоспазмов и синдрома Гудпасчера.
[0829] В некоторых вариантах реализации субъектом, получающим лечение, является млекопитающее. Например, способы и применения, описанные в настоящей заявке, подходят для медицинского применения у людей. В качестве альтернативы, способы и применения также подходят для ветеринарного применения, где субъекты включают, но не ограничиваются ими, собак, кошек, лошадей, коров, овец, ягнят и рептилий.
[0830] Более подробные описания заболеваний и состояний предложены ниже.
Эректильная дисфункция
[0831] Тот факт, что существуют различия активностей аргиназы в пенисе молодых мышей и более старых мышей, приводит к заключению, что аргиназа может иметь значение при эректильной дисфункции (ЭД). В этом контексте Чемпион с соавторами (Champion et al.) (Am. J. Physiol. Heart Circ. Physiol. 292:340-351, (2006) и Biochem. and Biophys. Research Communications, 283:923-27, (2001)) наблюдали увеличение уровня экспрессии иРНК и содержания аргиназы с возрастом у мышей наряду со снижением активности постоянно активной NO-синтазы.
[0832] Оксид азота задействован в неадренергической нехолинергической нейротрансмиссии, которая приводит к расслаблению гладких мышц пещеристых тел, обеспечивая пенильную эрекцию (New England Journal of Medicine, 326, (1992)). Следовательно, эректильную дисфункцию часто можно излечивать путем повышения содержания оксида азота (NO) в пенильной ткани. Указанное повышение содержания оксида азота (NO) в пенильной ткани можно достигать путем ингибирования активности аргиназы в пенильной ткани взрослых субъектов. Другими словами, полагают, что аргиназа снижает запасы свободного L-аргинина, доступного NO-синтазе, в клетках, что приводит к снижению содержания оксида азота (NO) и эректильной дисфункции. См., Christianson et. al., (Асc. Chem. Res., 38:191-201, (2005)), и (Nature Structural BioL., 6(11):1043-1047, (1999)). Ингибиторы аргиназы, таким образом, могут иметь значение при лечении эректильной дисфункции.
Легочная гипертензия
[0833] Существуют предположения, что изменения метаболизма аргинина задействованы в патогенезе легочной гипертензии (Xu et al., FASEB J., 18:1746-48, 2004). Предположение основано, в частности, на факте, что экспрессия аргиназы II и активность аргиназы существенно повышены в клетках эндотелия легочных артерий, полученных из эксплантов легочной ткани пациентов с легочной гипертензией I класса.
[0834] Кроме того, вторичная легочная гипертензия становится одной из главных причин смертности и заболеваемости у пациентов, страдающих от гемолитической анемии, например, талассемии и серповидноклеточной анемии. Причиной, лежащей в основе вторичной легочной гипертензии, является нарушенная биодоступность оксида азота, вызванная высвобождением аргиназы в результате гемолиза, что снижает запасы свободного аргинина, требуемого для синтеза оксида азота (NO). Соответственно, ингибирование активности аргиназы может представлять собой потенциальный терапевтический подход к лечению легочной гипертензии.
Гипертензия
[0835] Xu, W. et al., FASEB 2004, 14, 1746-8 высказали предположение, что аргиназа II имеет основополагающее значение в регуляции кровяного давления. В этом контексте высокое содержание аргиназы в сосудах связывают с сопутствующим снижением оксида азота (NO) в сосудах у животных, страдающих от гипертензии. Например, повышающая регуляция активности аргиназы предшествует повышению кровяного давления у крыс, которые генетически предрасположены к гипертензии (т.е. у крыс со спонтанной гипертензией), но введение антигипертензивного агента, гидралазина, приводит к снижению кровяного давления, а также к снижению уровня экспрессии аргиназы в сосудах, что тем самым показывает на наличие сильной связи между активностью аргиназы и кровяным давлением (Berthelot et al. Life Sciences, 80:1128-34, (2008)). Аналогично, введение известного ингибитора аргиназы, Nω-гидрокси-нор-L-аргинина (nor-NOHA) снижало кровяное давление и улучшало сосудистое сопротивление кровотоку и давлению у животных со спонтанной гипертензией, что, таким образом, выделяет ингибиторы аргиназы в качестве возможных терапевтических средств для лечения гипертензии (Demougeot et al., (J. Hypertension, 26:1110-18, (2008)).
[0836] Аргиназа также имеет значение при гипертензии кожных сосудов, вызванной иммунным ответом, за счет снижения содержания оксида азота (NO) в клетках. Оксид азота вызывает расширение сосудов, и обычно содержание оксида азота (NO) повышается или снижается для поддержания кровяного давления на физиологически приемлемом уровне. Кенни с соавторами (Kenny et al.), (J. of Physiology 581 (2007) 863-872) предположили, что расширение сосудов, вызванное иммунным ответом, у субъектов с гипертензией может снижаться в результате ингибирования аргиназы, что, таким образом, определяет значение ингибиторов аргиназы при лечении гипертензии.
Астма
[0837] Активность аргиназы также связана с гиперчувствительностью дыхательных путей при астме. Например, у людей-астматиков и у мышей, страдающих от острой и хронической астмы, наблюдается повышающая регуляция аргиназы I, в то время как содержание изоформ аргиназы II и NO-синтазы остается неизменным (Scott et al., Am. J. Physiol. Lung Cell Mol. Physiol. 296:911-920 (2009)). Более того, вызванная метахолином чувствительность центральных дыхательных путей в модели хронической астмы у мышей снижалась в результате введения ингибитора аргиназы, S-(2-бороноэтил)-L-цистеина. Сходство профилей экспрессии ARG I у людей и мышей, страдающих от хронической астмы, показывает, что соединения, способные ингибировать активность аргиназы, являются возможными терапевтическими средствами для лечения астмы.
[0838] Другая серия фактов раскрывает дополнительные связи между повышенной активностью аргиназы в легочной ткани астматиков и прогрессированием заболевания, например, с повышающей регуляцией генов, связанных с метаболизмом катионных аминокислот, включая аргиназу I и II, у мышей, страдающих астмой (Rothenberg et al., (J. Clin. Invest., 111:1863-74 (2003), и Meurs et. al., (Expert Opin. Investig Drugs, 14(10:12211231, (2005)).
[0839] Кроме того, несмотря на то, что в плазме у астматиков снижено содержание всех аминокислот, содержание аргинина в плазме значительно ниже по сравнению с содержанием у нормального, не страдающего астмой, субъекта (Morris et al., (Am. J. Respir. Crit Care Med., 170:148-154, (2004)). Таким образом, в плазме у астматиков значительно увеличена активность аргиназы, то есть повышенную активность аргиназы можно связывать со снижением биодоступности аргинина плазмы, что приводит к дефициту оксида азота (NO), который способствует усилению гиперреактивности дыхательных путей у астматиков.
Воспаление
[0840] Активность аргиназы также связана с аутоиммунными воспалениями (Chen et al., Immunology, 110:141-148, (2003)). Авторы определили повышающую регуляцию экспрессии гена ARG I в спинномозговых клетках мышей, подверженных экспериментальному аутоиммунному энцефаломиелиту (ЭАЭ). Введение ингибитора аргиназы, амино-6-бороногексановой кислоты (АБГ), тем не менее, приводило к развитию у животных значительно более мягкой формы ЭАЭ по сравнению с контрольными животными. Эти результаты определяют терапевтическое значение ингибиторов аргиназы для лечения аутоиммунного энцефаломиелита.
[0841] Более того, Хорович с соавторами (Horowitz et al.,) (American J. Physiol Gastrointestinal Liver Physiol., 292:G1323-36, (2007)) предположили участие ферментов аргиназ в патофизиологии сосудов. Например, авторы показали снижение продуцирования оксида азота (NO) в хронически воспаленных кровеносных сосудах кишечника у пациентов, страдающих болезнью воспаленного кишечника (IBD), болезнью Крона и язвенным колитом. Снижение продуцирования оксида азота (NO) связывают с повышающей регуляцией экспрессии аргиназы и активностью, которая приводит к снижению содержания аргинина и предотвращает синтез оксида азота (NO) NO-синтазой (NOS). Ингибиторы активности аргиназы, таким образом, могут представлять собой терапевтические средства для лечения патофизиологии сосудов.
Ишемия-реперфузия
[0842] Предполагают, что ингибирование аргиназы также обладает кардиозащитным действием при ишемии-реперфузии. Более конкретно, ингибирование аргиназы обеспечивает защиту от инфаркта миокарда за счет механизма, который может зависеть от активности NO-синтазы, а следовательно и биодоступности оксида азота (NO) (Pernow et al., (Cardiovascular Research, 85:147-154 (2010)).
Инфаркт миокарда и атеросклероз
[0843] Полиморфизм аргиназы I связан с инфарктом миокарда, а также с повышенным риском увеличения толщины комплекса интима-медиа сонной артерии, которое, как полагают, является достоверным признаком атеросклероза, а также других заболеваний коронарных артерий (Brousseau et al., (J. Med Genetics, 44:526-531, (2007)). Повышенная активность аргиназы приводит к увеличению содержания орнитина, который биохимически задействован в промотировании образования матрицы и клеточных компонентов атеросклеротической бляшки. См. выше. Таким образом, ингибиторы аргиназы можно применять в качестве терапевтических средств для лечения атеросклероза. Беркович с соавторами (Berkowitz et al.}, (Circulation Res. 102, (2008)) определили значение ARGII при образовании бляшек и атеросклерозе. Окисление ЛПНП, которое сопутствует образованию бляшек, увеличивает активность аргиназы и снижает содержание оксида азота (NO) в клетках эндотелия. В частности, содержание ARGII повышено у мышей, страдающих от атеросклероза, что определяет применение ингибиторов аргиназы в качестве возможных терапевтических средств для лечения атеросклероза.
[0844] Кроме того, исследования, проведенные Ming et. al., (Current Hypertension Reports., 54:54-59, (2006)), показывают, что повышающая регуляция аргиназы играет более важную роль при сердечнососудистых нарушениях, включая атеросклероз, по сравнению с дисфункцией оксида азота (NO) в эндотелии. То, что аргиназа задействована в сердечнососудистых заболеваниях, также подтверждается тем фактом, что наблюдается повышающая регуляция активности ARGI и ARGII в кардиомиоцитах, что в свою очередь отрицательно влияет на активность NO-синтазы и сократимость миокарда. (См., Margulies et. al., Am. J. Physiol. Heart Circ. PhysioL, 290:1756-62, (2006)).
Иммунный ответ
[0845] Путь аргинин/оксид азота (NO) также может иметь значение при иммунном ответе, например, после трансплантации органов. Например, было установлено, что реперфузия при ортотопической трансплантации печени вызывала значительное увеличение содержания орнитина вследствие повышающей регуляции активности аргиназы в трансплантате (Tsikas et al., (Nitric oxide, 20:61-67, (2009)). Повышенное содержание гидролитических и протеолитических ферментов в трансплантате может приводить к менее благоприятному исходу для трансплантированного органа. Таким образом, ингибирование ферментов аргиназ может представлять собой альтернативный терапевтический подход к увеличению эффективности трансплантации.
Псориаз
[0846] Было установлено, что аргиназа играет роль в патогенезе псориаза. Например, ARGI в больших количествах экспрессируется при гиперпролиферативном псориазе и фактически ответственна за понижающую регуляцию оксида азота (NO), ингибитора пролиферации клеток, за счет конкурентного потребления общего субстрата L-аргинина, что определено D. Bruch-Gerharz et al. American Journal of Pathology 162(1) (2003) 203-211. Более поздние работы Abeyakirthi et al. (British J. Dermatology, (2010)) и Berkowitz et al, (WO/2007/005620) подтверждают факт низкого содержания оксида азота (NO) в псориатических кератиноцитах. Абейакирти с соавторами (Abeyakirthi et al) обнаружили, что псориатические кератиноциты были слабо дифференцированными и гиперпролиферирующими. Установили, что низкая дифференцировка возникает в результате низкого содержания оксида азота (NO), вызванного не слабой экспрессией NO-синтазы, а сверхэкспрессией аргиназы, которая конкурирует с NO-синтазой за субстрат L-аргинин. Таким образом, ингибирование аргиназы может обеспечивать терапевтическое ослабление симптомов псориаза.
Заживление ран
[0847] В нормальных физиологических условиях оксид азота (NO) играет важную роль в ускорении заживления ран. Например, Халст с соавторами (Hulst et al.), (Nitric Oxide, 21:175-183, (2009)) исследовали роль ARGI и ARG II в заживлении ран. Непосредственно после повреждения желательно повышать содержание оксида азота (NO) в тканях для ускорения ангиогенеза и пролиферации клеток, важных для заживления. Ингибиторы аргиназы, таким образом, можно применять в качестве терапевтических средств для заживления ран, так как эти соединения повышают содержание оксида азота (NO) в тканях. Дополнительные факты, подтверждающие применение ингибиторов аргиназы в качестве возможных терапевтических средств для заживления ран, предложены в работе South ef al. (Experimental Dermatology, 29:664-668 (2004)), где обнаружили 5-кратное увеличение содержания аргиназы I в хронических ранах, например, эрозии кожи и волдырях.
Кистозный фиброз
[0848] Кистозный фиброз (КФ) представляет собой мультисистемное нарушение, вызванное мутациями гена трансмембранного регулятора проходимости (CFTR). Общими симптомами КФ являются устойчивая легочная инфекция, затруднения дыхания, недостаточность поджелудочной железы и повышенное содержание хлоридов в поте. При отсутствии лечения КФ может приводить к смерти, при этом легочная форма заболевания, возникающая в результате накопления слизи и снижения мукоцилиарного клиренса, является основной причиной заболеваемости и смертности.
[0849] Утверждается, что пациенты с кистозным фиброзом (КФ) имеют повышенную активность аргиназы в плазме и слюне, а также пониженное содержание L-аргинина в плазме (Н. Grasemann et al., Am. J. Respir. Crit. Care Med. 172(12) (2005) 1523-1528). Повышенная активность аргиназы, тем не менее, приводит к снижению физиологического содержания оксида азота (NO), которое может вызывать обструкцию дыхательных путей, снижающую легочную функцию у пациентов, страдающих от кистозного фиброза (КФ).
[0850] Ослабленная действием электрического поля стимуляция расслабления гладких мышц в дыхательных путях в модели КФ у мышей и введение L-аргинина и NO обращают вспять это действие согласно предположению М. Mhanna et al. Am. J. Respir. Cell Mol. Biol. 24(5) (200)1 621-626. Грайсманн с соавторами (Graesmann et al.) обнаружили положительную связь между легочной функцией и концентрацией выдыхаемого NO и концентрацией метаболитов NO в слюне пациентов с КФ (Grasemann, Н; Michler, E; Wallot, М; Ratjen, F., Pediatr Pulmonol. 1997, 24,173-7).
[0851] Вместе эти результаты показывают, что повышенная активность аргиназы при КФ вызывает дефицит NO и обструкцию легких при КФ за счет ограничения биодоступности L-аргинина для NO-синтазы. Таким образом, ингибиторы активности аргиназы являются возможными терапевтическими средствами для лечения кистозного фиброза (КФ).
Защита органов
[0852] Другим терапевтическим применением соединений согласно настоящему изобретению является защита органов при транспортировке от донора до места трансплантации реципиенту. Ишемическое реперфузионное повреждение (ИР), вызванное воздействием на трансплантируемые органы тепловой ишемии (время от изъятия у донора до помещения в фиксирующую среду) и холодовой ишемии (криоконсервация), часто наблюдают у пациентов, которым проводили трансплантационную хирургию. Ишемическое реперфузионное повреждение (ИР) и сопутствующая первичная дисфункция трансплантата и/или острое или хроническое отторжение возникают в результате изменения клеточной активности пути L-аргинин/NO.
[0853] Полагают, что аргиназа 1 и аргиназа 2 высвобождаются апоптотическими клетками эндотелия и почек в течение первых 24 часов после удаления органа из организма. Для противодействия высвобожденной аргиназе L-аргинин добавляют в фиксирующую среду. Результаты исследований с трансплантатами почек у собак показывают, что добавление L-аргинина снижало частоту и степень тяжести ишемии, приводило к снижению содержания МДА через 1 час после введения импланта и снижало содержание АМК и креатинина в сыворотке в течение первых 72 часов. См., Erkasap, S; Ates, E., Nephrol Dial Transplant. 2000, 15, 1224-7.
[0854] Аналогичные результаты наблюдали в случае трансплантатов легкого у собак в течение 24 часов, где легкие консервировали в растворе Университета штата Висконсин, содержащем L-аргинин. Йен с соавторами (Yen et al.) наблюдали, что добавление L-аргинина в фиксирующую среду повышало защиту легочного эндотелия и снижало частоту появления ишемии по сравнению с контролем, который консервировали в среде, не содержавшей L-аргинина (Chu, Y; Wu, Y.C.; Chou, Y.C.; Chueh, H.Y, Liu HP, Chu JJ, Lin PJ., J Heart Lung Transplant. 2004, 23, 592-8).
[0855] Кох с соавторами (Koch et al.) определили улучшенную сократимость миокарда и расслабление сердечной мышцы у крыс после трансплантации, если сердца консервировали в растворе НТК, содержащем L-аргинин и N-альфа-ацетилгистидин (Koch A, Radovits Т, Loganathan S, Sack FU, Karck M, Szabo GB., Transplant Proc. 2009, 41, 2592-4).
[0856] Добавление ингибитора аргиназы, таким образом, может представлять собой терапевтическое средство для предотвращения и/или снижения возникновения риска ишемического реперфузионного повреждения за счет синергичного увеличения защиты органов фиксирующей средой. С учетом небольшого числа органов, которые подходят для трансплантации, и потери и повреждения органов, вызванных проявлением ишемии, ингибиторы аргиназы согласно настоящему изобретению можно применять в качестве терапевтических средств для консервации органов, которые увеличивают доступность органов за счет снижения частоты появления ишемического реперфузионного повреждения при транспортировке органов.
Лейшманиоз
[0857] Лейшманиоз вызван простейшими организмами и проявляется в виде кожного лейшманиоза (т.е. кожной инфекции, вызывающей появление гипопигментированных пятен) и висцерального лейшманиоза (более тяжелая форма, воздействующая на внутренние органы). Установлено, что аргиназа играет роль в прогрессировании заболевания, так как действие паразитов обусловлено синтезом аргиназой клеточных полиаминов, которые необходимы для патогенеза. Ингибирование аргиназы, таким образом, снижает паразитарную нагрузку на клетку и способствует повышению содержания оксида азота (NO), ускоряя выведение паразитов. См., Liew FY et al. Eur J Immunol 21 (1991) 2489, Iniesta V et al. Parasite Immunol. 24 (2002) 113-118, и Kane MM et al. J. Immunol 166 (2001) 1141-1147. Соединения Формулы I или Формулы II, таким образом, можно применять в качестве терапевтических средств для лечения лейшманиоза.
Супрессорные клетки миелоидного ряда (MDSC)
[0858] MDSC являются высокоактивными иммуномодуляторами, которые ограничивают иммунные ответы несколькими путями, такими как, например, расход L-аргинина в результате высвобождения аргиназы 1 в микросреду (Rodriguez 2009 Cancer Res), ограниченная супрессия МНС (Nagaraj S, Gupta K, Pisarev V, Kinarsky L, Sherman S, Kang L, Herber DL, Schneck J, Gabrilovich DI., Nat Med. 2007, 13, 828-35), индукция Т-регуляторных клеток (Serafini P, Mgebroff S, Noonan K, Borrello I., Cancer Res. 2008, 68, 5439-49) и продуцирование IL10 (Rodrigues JC, Gonzalez GC, Zhang L, Ibrahim G, Kelly JJ, Gustafson MP, Lin Y, Dietz AB, Forsyth PA, Yong VW, Parney IF., Neuro Oncol. 2010, 12, 351-65) (Sinha P, Clements VK, Bunt SK, Albelda SM, Ostrand-Rosenberg S., J Immunol. 2007, 179, 977-83).
[0859] Установлено, что развитие опухоли сопровождается увеличением числа MDSC на периферии, а также MDSC, инфильтрованных в опухоль. См., Almand В, Clark JI, Nikitina Е, van Beynen J, English NR, Knight SC, Carbone DP, Gabrilovich DI., J Immunol. 2001, 166, 678-89 и Gabrilovich D., Nat Rev Immunol. 2004, 4, 941-52. Лечение мышей, имеющих опухоль, традиционными химиотерапевтическими средствами, такими как гемцитабин и 5-фторурацил, предотвращает иммуносупрессию MDSC и приводит к задержке роста опухоли. См., Le HK, Graham L, Cha E, Morales JK, Manjili MH, Bear HD., Int Immunopharmacol. 2009, 9, 900-9 и Vincent J, Mignot G, Chalmin F, Ladoire S, Bruchard M, Chevriaux A, Martin F, Apetoh L, Rebe C, Ghiringhelli F., Cancer Res. 2010, 70, 3052-61, соответственно. Более того, ингибирование аргиназы 1 усиливало иммунитет к опухолям за счет снижения функции MDSC. Таким образом, ингибиторы аргиназы, например, соединения согласно настоящему изобретению, снижают или задерживают рост опухоли, и их можно применять в комбинации с традиционными противораковыми агентами для лечения рака.
Helicobacter pylori (H. pylori)
[0860] Helicobacter pylori (H. pylori) представляет собой грамотрицательную бактерию, которая образует колонии в слизистой желудка человека. Бактериальная колонизация может приводить к острому или хроническому гастриту и тесно связана с пептическими язвами и раком желудка. Тот факт, что добавление L-аргинина в совместную культуру H. pylori и макрофагов повышало опосредованное оксидом азота (NO) уничтожение H. pylori (Chaturvedi R, Asim M, Lewis ND, Algood HM, Cover TL, Kim PY, Wilson KT., Infect Immun. 2007, 75, 4305-15), подтверждает гипотезу о том, что аргиназа бактерий конкурирует с аргиназой макрофагов за свободный аргинин, который требуется для синтеза оксида азота (NO). См., Gobert АР, McGee DJ, Akhtar M, Mendz GL, Newton JC, Cheng Y, Mobley HL, Wilson KT., Proc Natl Acad Sci USA. 2001, 98, 13844-9. L-аргинин необходим для активации Т-клеток и быстрого выведения бактерий из инфицированных клеток. В результате истощения запасов свободного L-аргинина in vivo H. pylori снижает вызванную аргинином экспрессию CD3-дзета в Т-клетках и предотвращает активацию и пролиферацию Т-клеток. См., Zabaleta J, McGee DJ, Zea АН, Hernandez CP, Rodriguez PC, Sierra RA, Correa P, Ochoa AC., J Immunol. 2004, 173, 586-93.
[0861] Ингибирование аргиназы бактерий при помощи известного ингибитора, NOHA, тем не менее, восстанавливало экспрессию CD3 Т-клетками (Сабалета, X., 2004 (Zabaleta J 2004)) и увеличивало продуцирование NO макрофагами, что, таким образом, ускоряло опосредованное макрофагами выведение бактерий из инфицированных клеток. См., Chaturvedi R, Asim M, Lewis ND, Algood HM, Cover TL, Kim PY, Wilson KT., Infect Immun. 2007, 75, 4305-15.
[0862] Более того, Льюис с соавторами (Lewis et al.) предположили участие аргиназы II в инфекциях H. pylori. Например, авторы показали, что argII-/- первичные макрофаги, которых инкубировали с экстрактами Н. pylori, имели повышенное продуцирование NO и соответствующее повышенное (~15%) опосредованное NO уничтожение бактериальных клеток (Lewis ND, Asim M, Barry DP, Singh K, de Sablet Т, Boucher JL, Gobert AP, Chaturvedi R, Wilson KT., J Immunol. 2010, 184, 2572-82). Ингибиторы активности аргиназы, таким образом, могут представлять собой терапевтические средства для лечения патофизиологии сосудов. Ингибиторы активности аргиназы, таким образом, могут представлять собой терапевтические средства для лечения инфекций Н. pylori и лечения язвенных болезней желудка, пептических язв и рака.
Серповидноклеточная болезнь (SCD)
[0863] Серповидноклеточная болезнь (SCD) или серповидноклеточная анемия, или дрепаноцитоз, представляет собой генетическое нарушение крови, характеризуемое красными кровяными тельцами, которые принимают патологическую жесткую серповидную форму. Серповидность снижает гибкость клеток и повышает риск осложнений. Увеличение концентрации активных форм кислорода (АФК) в кровотоке вызывает слипание кровяных клеток и расходование NO, которое приводит к слабому расширению сосудов или потере сосудорасширяющей способности. Потеря сосудорасширяющей способности наряду с повышенным слипанием кровяных клеток при SCD приводит к вазоокклюзивному кризу и боли.
[0864] У пациентов с SCD, как правило, наблюдается низкое содержание L-аргинина в плазме (Morris CR, Kato GJ, Poljakovic M, Wang X, Blackwelder WC, Sachdev V, Hazen SL, Vichinsky EP, Morris SM Jr, Gladwin MT., JAMA. 2005, 294, 81-90). Согласно указанной работе лизис красных кровяных телец (ККТ) у пациентов, страдающих SCD, вызывает высвобождение аргиназы и последующее снижение физиологического содержания L-аргинина. Эта последовательность биологических событий снижает физиологическую концентрацию оксида азота (NO), сигнальной молекулы, которая играет роль в расширении сосудов. Другие биологические события, которые также ограничивают биодоступность NO, включают, например, разъединение NO-синтазы (NOS) и последующее снижение физиологического содержания NO, а также взаимодействие активной формы кислорода, супероксида (О-2) с NO и блокаду последнего в виде ONOO-.
[0865] На основании этих фактов авторы настоящего изобретения предполагают, что ингибиторы аргиназы, в частности, ингибиторы аргиназы I, являются возможными терапевтическими средствами для лечения пациентов с серповидноклеточной болезнью. Как утверждалось выше, SCD является причиной разъединения eNOS вследствие низкого физиологического содержания L-аргинина. Ингибирование аргиназы в кровотоке, тем не менее, может решить эту проблему за счет увеличения физиологического содержания L-аргинина, субстрата для эндотелиальной NO-синтазы (eNOS). Авторы настоящего изобретения полагают, что эта последовательность событий, главным образом, усиливает функцию эндотелия и облегчает вазоконстрикцию, связанную с SCD.
Вирус иммунодефицита человека (ВИЧ)
[0866] ВИЧ вызван вирусом, который инфицирует CD4+ хелперные Т-клетки и вызывает тяжелую лимфопению, которая делает инфицированных индивидуумов предрасположенными к оппортунистическим инфекциям. Несмотря на то, что антиретровирусную терапию (APT) широко применяют для противостояния инфекции ВИЧ, повсеместное применение антиретровирусных лекарственных средств привело к появлению резистентных штаммов ВИЧ.
[0867] Существует связь между активностью аргиназы у пациентов, страдающих от ВИЧ, и тяжестью ВИЧ, т.е. повышенная активность аргиназы связана с повышенным титром вируса у пациентов с ВИЧ. У этих пациентов также наблюдают сниженное содержание аргинина в сыворотке, а также сниженное содержание CD4+/CD8+ клеток.
[0868] Вместе эти факты предполагают применение ингибиторов аргиназы, например, соединений Формулы I или II, в качестве возможных терапевтических средств для лечения инфекции ВИЧ.
Хронический вирусный гепатит B (HBV)
[0869] Хроническая инфекция гепатита B представляет собой вирусное заболевание, которое передается в результате взаимодействия с жидкостью инфицированного организма. Хронические инфекции, вызываемые вирусом гепатита Б (HBV), характеризуются воспалением печени и разлитием желчи, а в случае отсутствия лечения могут вызывать цирроз печени, который может прогрессировать до гепатоклеточных карцином. Противовирусные лекарственные средства, применяемые в настоящее время, тем не менее имеют низкую эффективность в отношении хронических инфекций HBV. В гомогенатах сыворотки и печени пациентов с хроническими инфекциями HBV наблюдают пониженное содержание аргинина и повышенную активность аргиназы. Более того, у инфицированных пациентов повышенную активность аргиназы связывают с нарушенным ответом цитотоксических Т-лимфоцитов (ЦТЛ), пониженным продуцированном IL-2 и экспрессией CD3z.
[0870] Восполнение содержания аргинина в сыворотке до физиологически приемлемого уровня, тем не менее, восстанавливало экспрессию CD3z и IL-2, что объясняет применение ингибиторов аргиназы в качестве возможных терапевтических средств для лечения хронических инфекций HBV.
[0871] Способы введения и схема дозирования
[0872] Несмотря на многочисленные данные, связывающие ингибирование аргиназы с терапиями различных заболеваний и состояний, известно очень ограниченное число соединений, обладающих ингибирующей активностью в отношении аргиназы. В настоящем изобретении, таким образом, предложены соединения и содержащие их фармацевтические композиции, которые подходят для лечения субъекта, страдающего от указанных заболеваний или состояний, более конкретно описанных выше.
[0873] Соединение или композицию согласно настоящему изобретению можно вводить в состав, описанный выше, который подходит для введения в терапевтически эффективном количестве субъекту при помощи любого числа способов. Терапевтически эффективное количество соединения Формулы I или Формулы II может зависеть от количества и типа применяемых наполнителей, количества и типа конкретных активных ингредиентов, входящих в состав лекарственной формы, и способа введения соединения пациентам. Тем не менее, типичные лекарственные формы согласно настоящему изобретению содержат соединение или его фармацевтически приемлемую соль, сольват, гидрат, изомер или пролекарство.
[0874] Типичная дозировка соединений Формулы I или Формулы II, в целом, находится в диапазоне примерно от 0,001 до 100 мг на кг массы тела пациента в день, при этом дозировку можно вводить в виде единичной дозы или нескольких доз. Типичные дозировки составляют примерно от 0,01 до 25 мг/кг в день или примерно от 0,05 до 10 мг/кг в день. В других вариантах реализации дозировка составляет примерно от 0,01 до 25 мг/кг в день, примерно от 0,05 до 10 мг/кг в день или примерно от 0,1 до 5 мг/кг в день.
[0875] Доза, как правило, находится в диапазоне примерно от 0,1 мг до 2000 мг в день, дозу вводят один раз в день или, в качестве альтернативы, в виде раздельных доз в течение дня возможно совместно с пищей. В одном из вариантов реализации дозу вводят ежедневно два раза в день в виде равных отдельных доз. Ежедневная доза может находиться в диапазоне примерно от 5 мг до 500 мг в день, например, в диапазоне примерно от 10 мг до 300 мг в день. При лечении пациентов терапию можно начинать с пониженных доз, возможно в диапазоне примерно от 1 мг до 25 мг, повышать дозу при необходимости примерно до 200-2000 мг в день и вводить в виде единственной дозы или отдельных доз в зависимости от общего ответа пациента.
[0876] В зависимости от заболевания, требующего лечения, и состояния субъекта соединения Формулы I или Формулы II можно вводить при помощи перорального, парентерального (например, внутримышечной, интраперитонеальной, внутривенной, ICV (внутрь желудочков головного мозга), интрацистернальной инъекции или инфузии, подкожной инъекции или имплантации), ингаляции, назального, вагинального, ректального, подъязычного или местного (например, чрескожного, местного) способа введения. Соединения можно вводить в составы по отдельности или в комбинации в подходящих лекарственных формах, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители, описанные выше, которые подходят для каждого способа введения. Изобретение также охватывает введение соединений согласно настоящему изобретению в виде депо, в котором активный ингредиент высвобождается в течение определенного времени.
ИНГИБИРОВАНИЕ АРГИНАЗЫ
[0877] Соединения согласно настоящему изобретению ингибируют аргиназу I (ARG I) и аргиназу II (ARG II) человека, что подтверждается ex vivo исследованием, изложенным в опубликованном протоколе (Baggio et al. J. Pharmacol. Exp. Ther. 1999, 290, 1409-1416). В исследовании определяли концентрацию ингибитора, необходимую для снижения активности аргиназы на 50% (IC50).
ПРОТОКОЛ ИССЛЕДОВАНИЯ
[0878] Ингибирование аргиназы I (ARG I) и аргиназы II (ARG II) соединениями Формулы I и Формулы II определяли спектрофотометрически при 530 нм. Исследуемое соединение растворяли в ДМСО в начальной концентрации, в 50 раз превышающей конечную концентрацию в кювете. 10 мкл маточного раствора разбавляли в 90 мкл буфера для исследования, который содержал 0,1М буферный раствор фосфата натрия, содержащий 130 мМ NaCl, pH 7,4, в который добавляли овальбумин (OVA) в концентрации 1 мг/мл. Растворы аргиназы I и II получали в 100 мМ буферном растворе фосфата натрия, рН 7,4, содержащем 1 мг/мл OVA, для получения маточного раствора аргиназы с конечной концентрацией 100 нг/мл.
[0879] В каждую лунку 96-луночного планшета для микротитрования добавляли 40 мкл фермента, 10 мкл соединения согласно настоящему изобретению и 10 мкл субстрата фермента (L-аргинин + сульфат марганца). В лунки, которые использовали в качестве положительного контроля, добавляли только фермент и субстрат, лунки, которые использовали для отрицательного контроля, содержали только сульфат марганца.
[0880] После инкубирования планшета для микротитрования при 37°С в течение 60 минут 150 мкл мочевины, полученной в результате смешения в равных пропорциях реагента А и В, добавляли в каждую лунку планшета для микротитрования для прекращения реакции. Мочевину получали непосредственно перед применением путем смешения Реагента А (10 мМ о-фталдиальдегид и 0,4% полиоксиэтилен(23)лауриловый эфир (масс./об.) в 1,8М серной кислоте) и Реагента В (1,3 мМ примахина дифосфат, 0,4% полиоксиэтилен(23)-лауриловый эфир (масс./об.), 130 мМ борная кислота в 3,6М серной кислоте). После гашения реакции планшет для микротитрования отстаивали в течение 10 минут при комнатной температуре для появления окрашивания. Ингибирование аргиназы рассчитывали путем измерения оптической плотности (ОП) реакционной смеси при 530 нм и нормирования значения ОП по ингибированию в процентах, наблюдаемому в контрольных лунках. Нормированные значения ОП затем использовали для получения кривой зависимости доза-эффект путем графического построения зависимости нормированных значений ОП от log[концентрация], после чего использовали регрессионный анализ для расчета значений IC50.
[0881] В Таблице 2 ниже активность соединений Формулы I классифицирована по шкале от 1 до 5, где наиболее активные соединения обозначены 1, а наименее активные соединения обозначены 5. Аналогичный анализ активности соединений Формулы II проиллюстрирован в Таблице 2-А. Таким образом, значение активности 1 относится к соединениям согласно настоящему изобретению со значением IC50 в диапазоне от 0,1 нМ до 250 нМ; значение активности 2 относится к соединениями согласно настоящему изобретению со значением IC50 в диапазоне от 251 нМ до 1000 нМ; соединения, имеющие активность, обозначенную 3, имеют значение IC50 в диапазоне от 1001 нМ до 2000 нМ; соединения согласно настоящему изобретению со значением IC50 в диапазоне от 2001 нМ до 5000 нМ имеют активность, обозначенную 4, а соединения со значением IC50 более 5001 нМ имеют активность, обозначенную 5.
[0882]
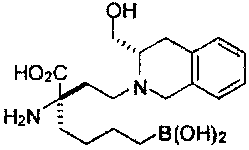
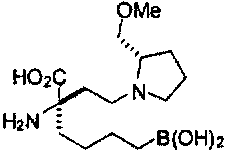
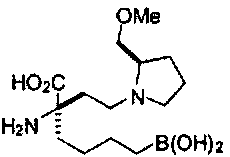
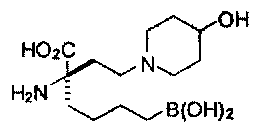
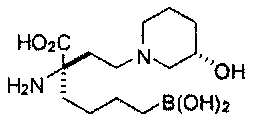
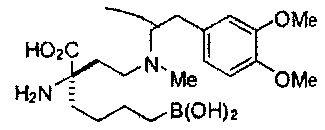
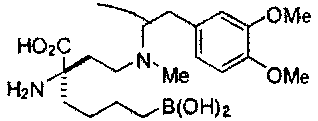
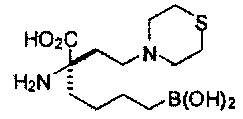
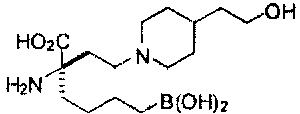
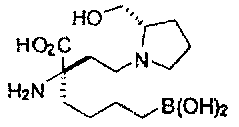
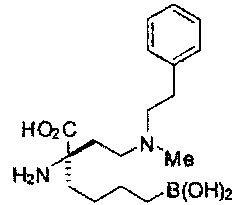
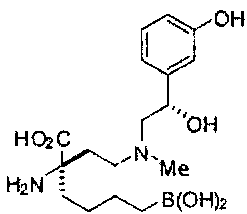
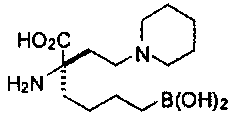
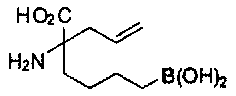
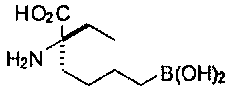
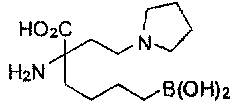
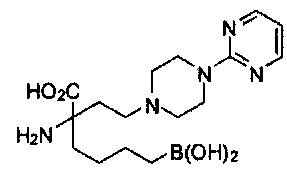
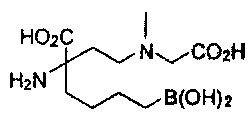
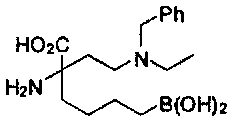
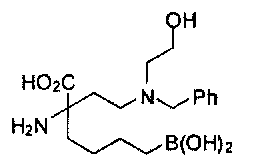
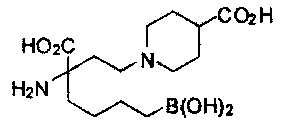
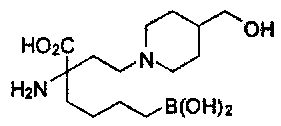
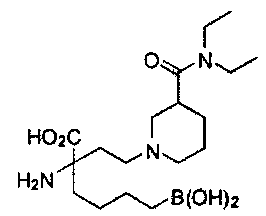
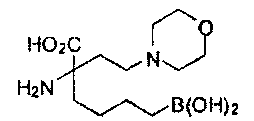
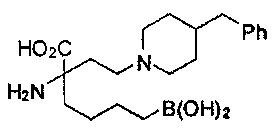
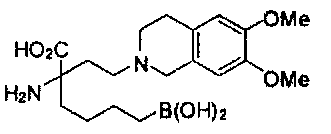
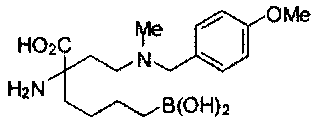
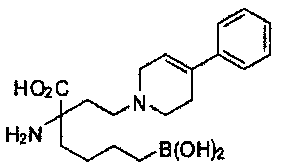
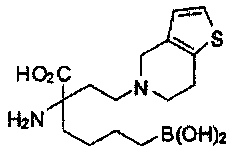
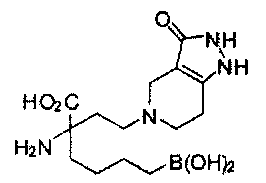
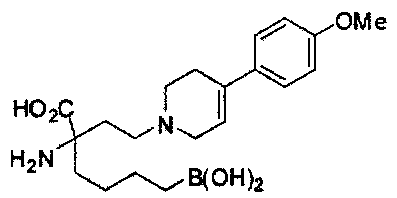

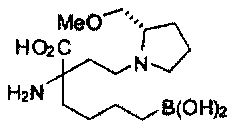
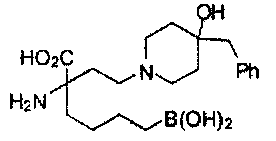
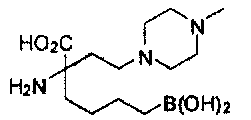
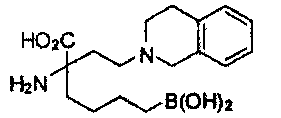
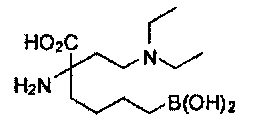
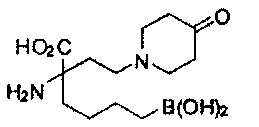
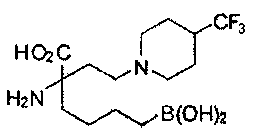
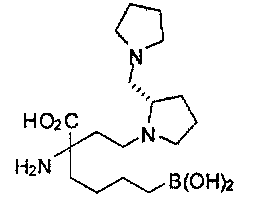
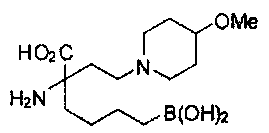
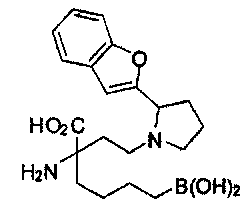
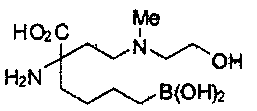
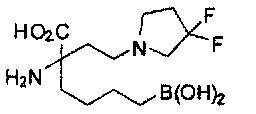
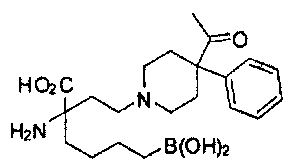
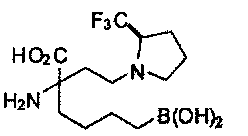
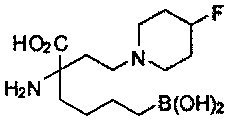
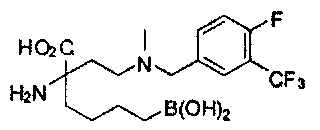
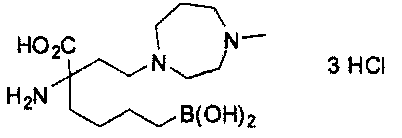
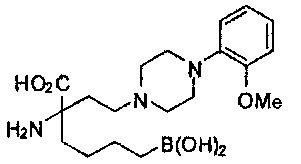
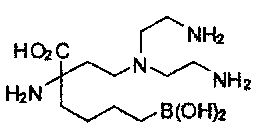
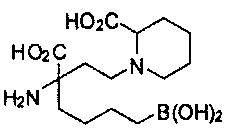
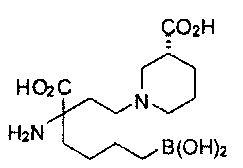
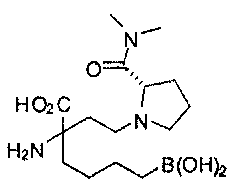
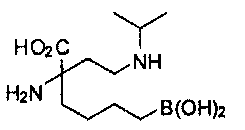
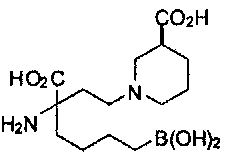
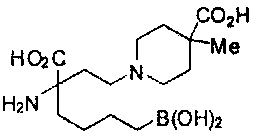
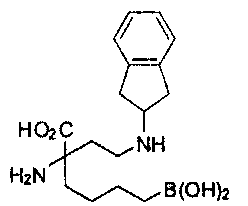
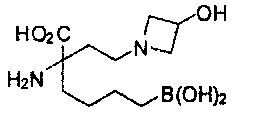
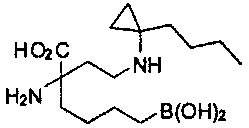
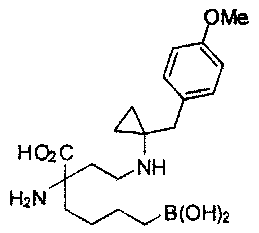
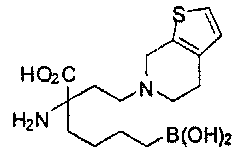
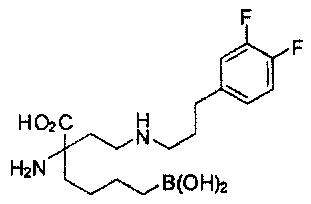
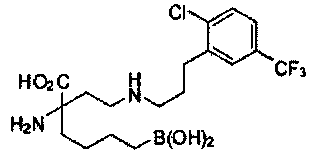
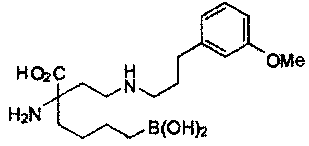
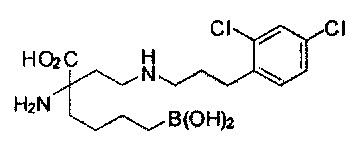
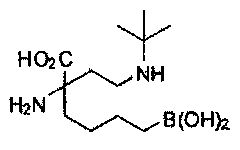
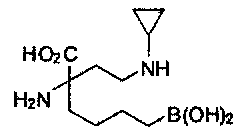
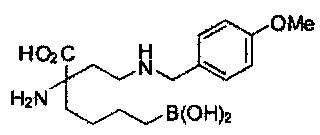
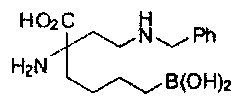
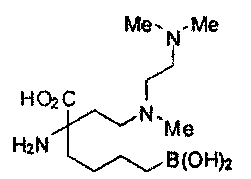
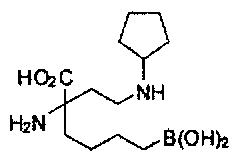
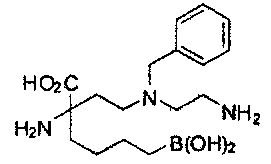
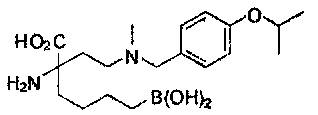
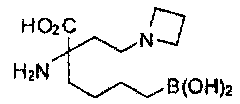
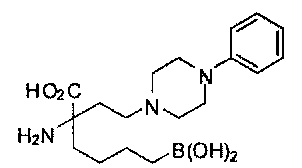
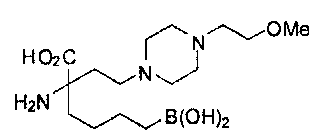
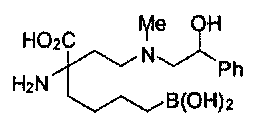
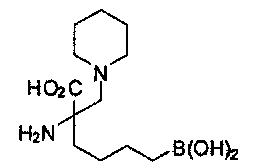
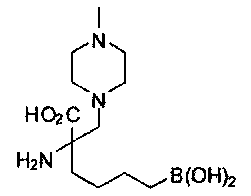
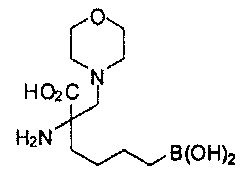
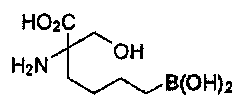
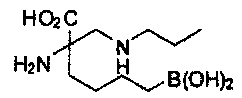
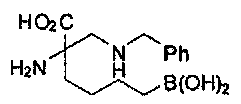
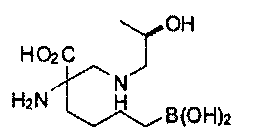
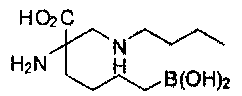
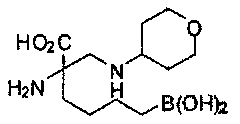
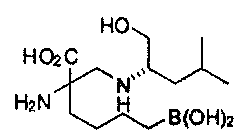
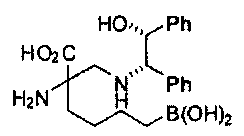
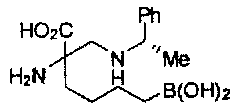
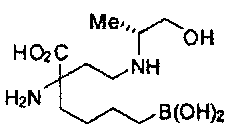
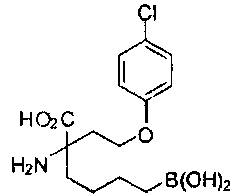
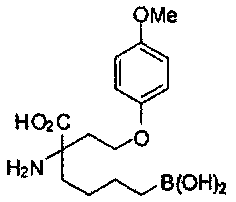
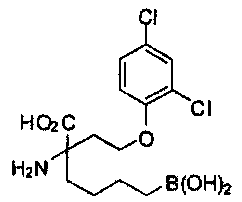
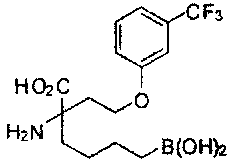
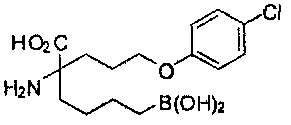
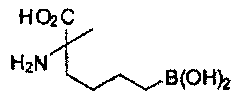
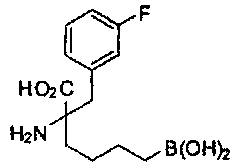
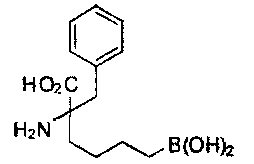
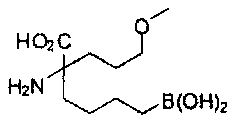
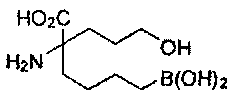
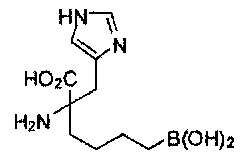
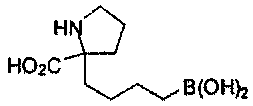
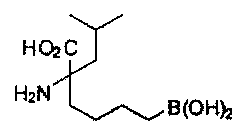
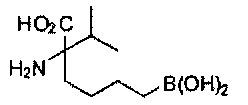
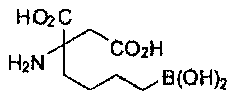
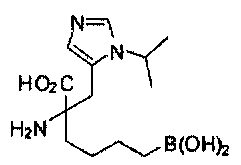
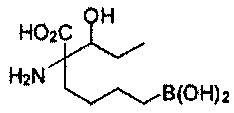
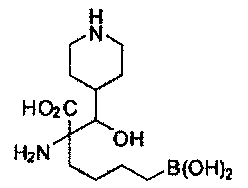
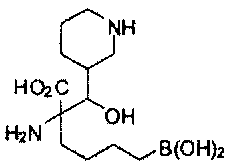
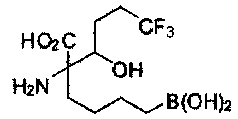
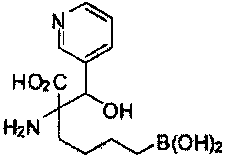
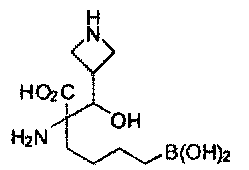
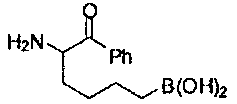
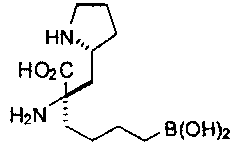
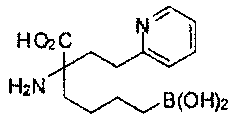
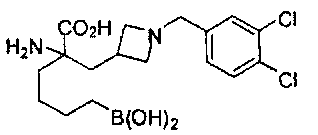
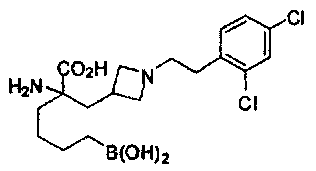
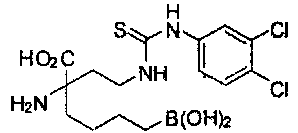
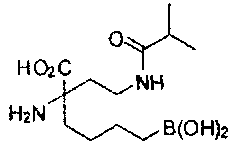
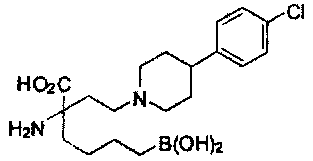
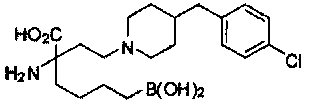
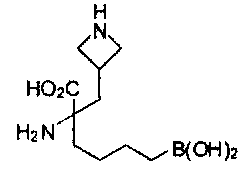
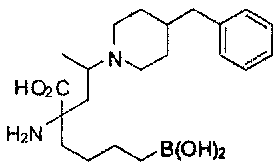
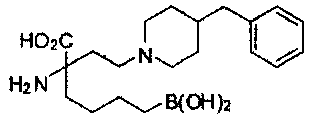
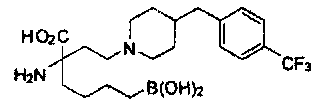
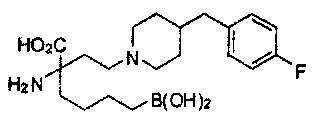
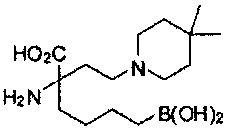
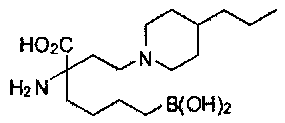
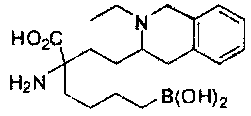
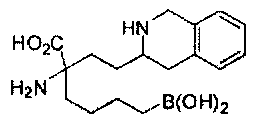
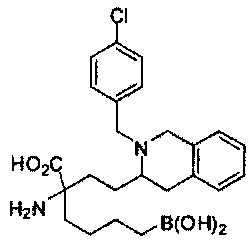
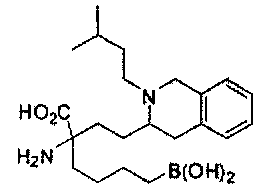
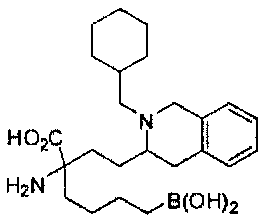
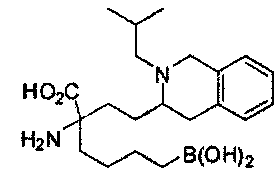
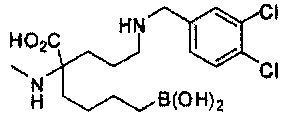
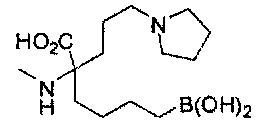
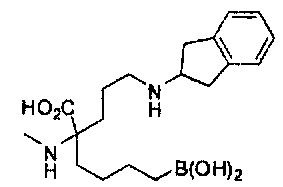
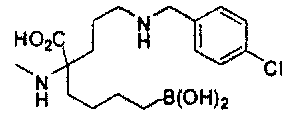
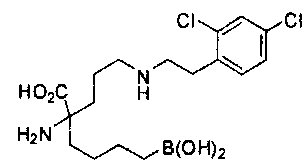
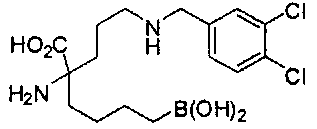
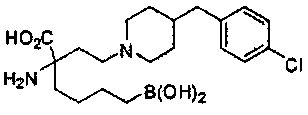
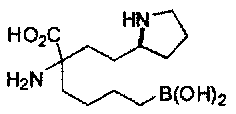
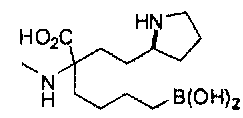
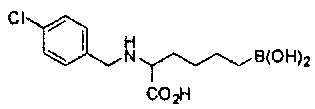
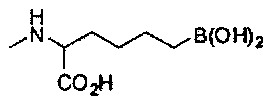
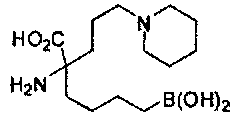
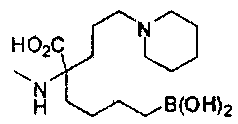
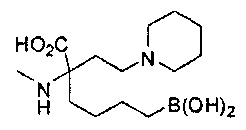
[0883] В Таблице 2-А ниже предложена классификация ингибирующей активности типовых соединений Формулы II в отношении аргиназы I (ARG I) и аргиназы II (ARG II).
[0884]
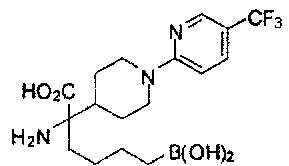
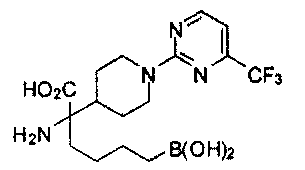
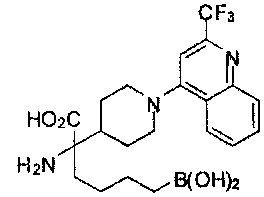
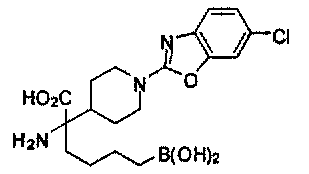
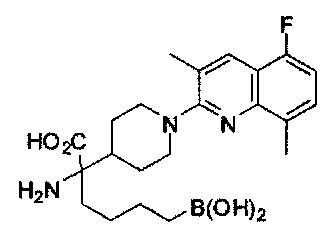
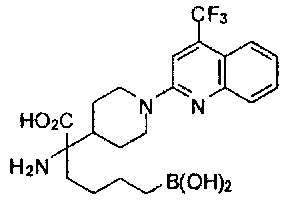
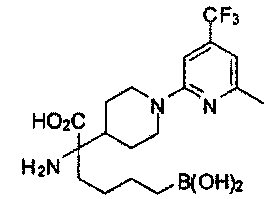
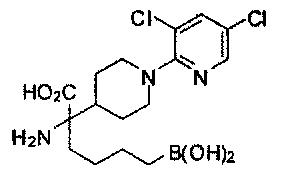
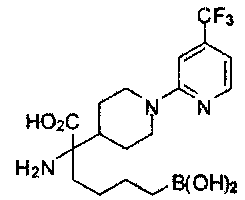
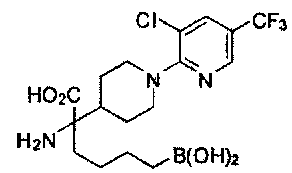
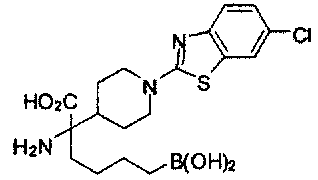
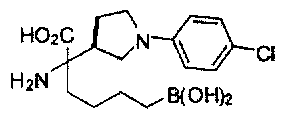
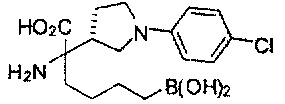
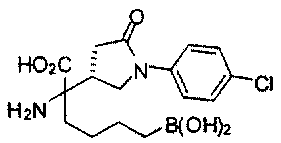
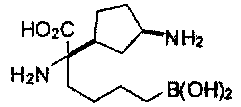
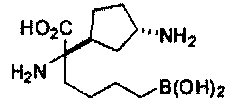
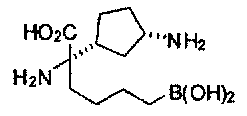
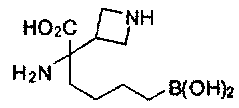
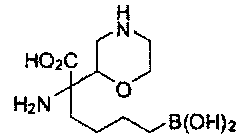
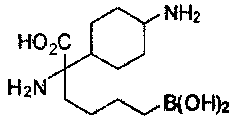
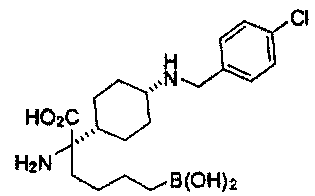
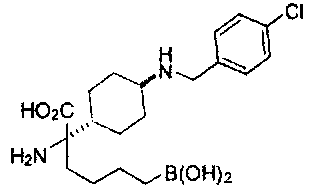
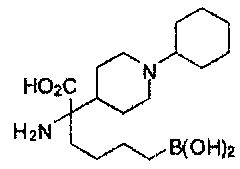
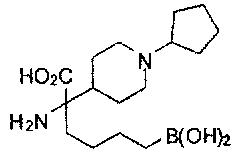
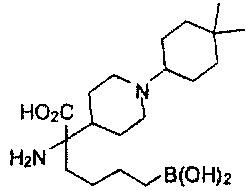
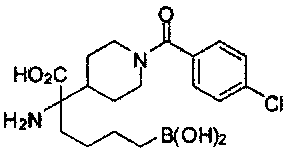
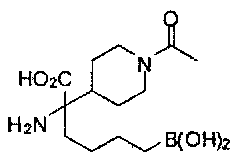
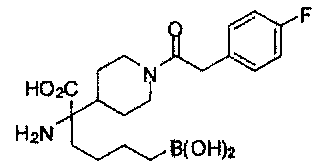
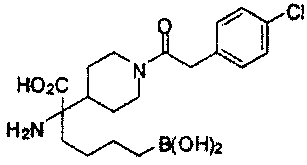
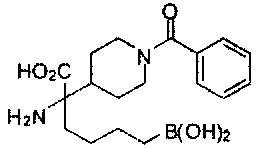
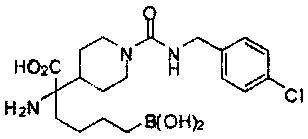
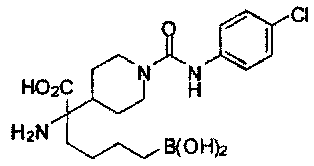
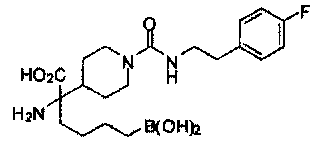
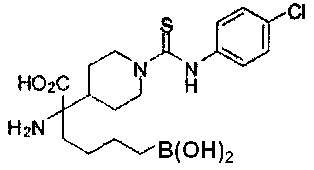
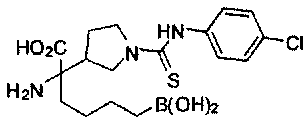
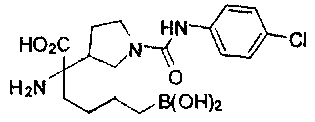
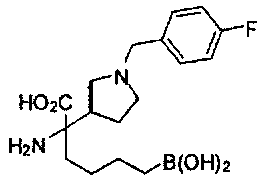
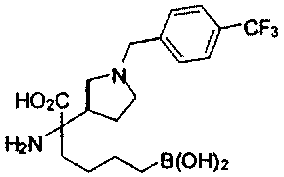
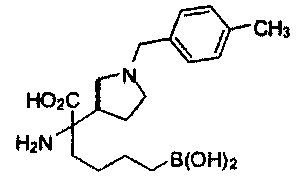
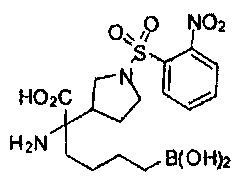
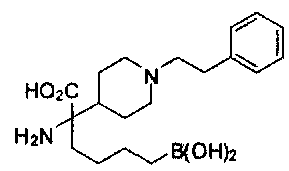
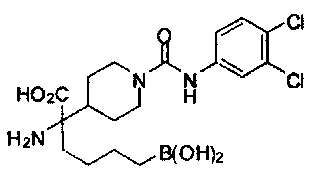
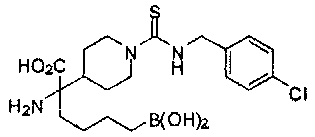
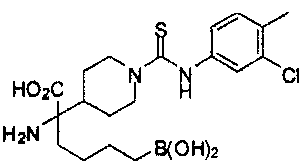
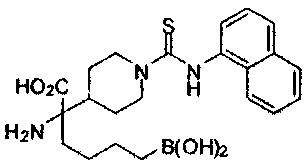
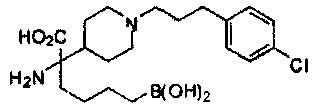
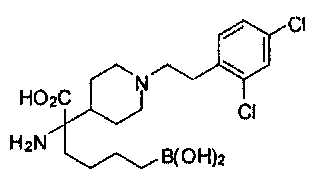
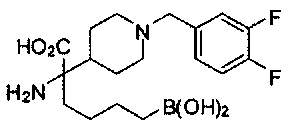
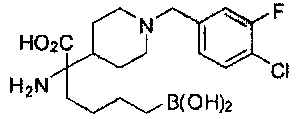
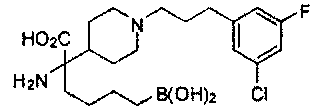
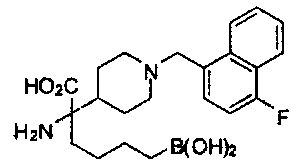
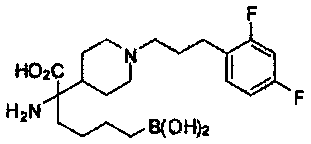
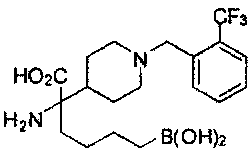
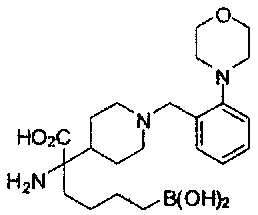
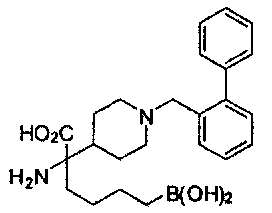
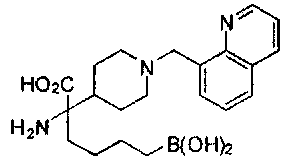
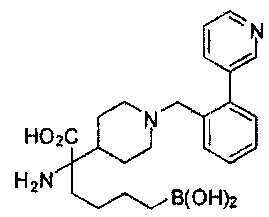
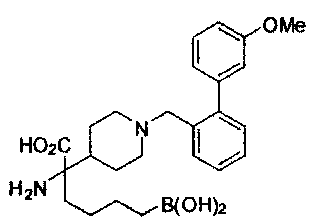
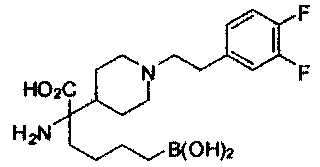
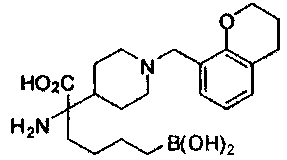
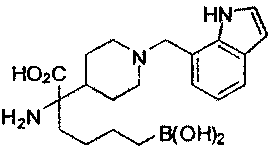
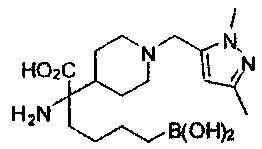
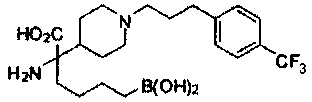
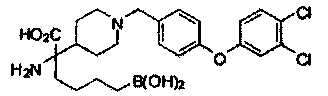
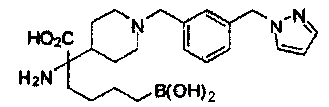
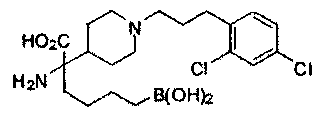
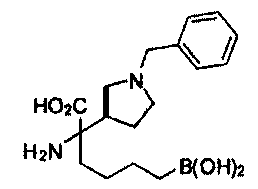
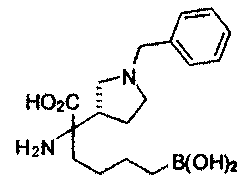
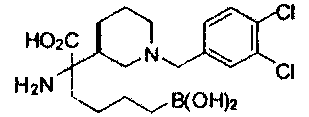
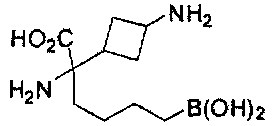
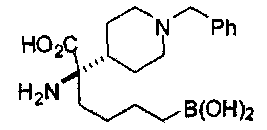
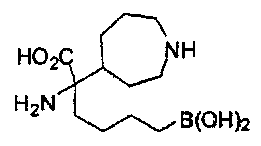
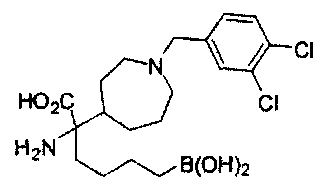
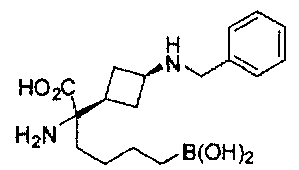
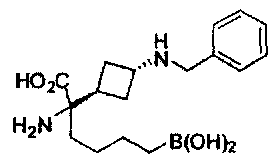
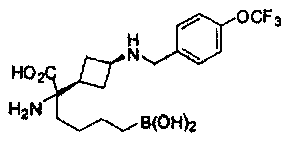
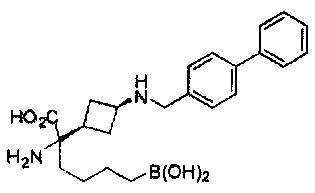
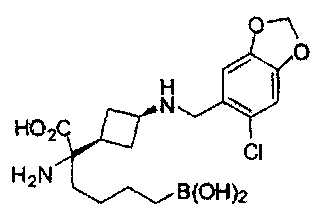
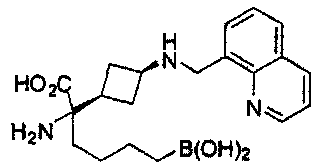
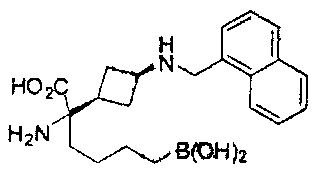
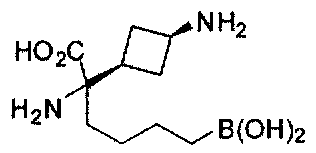
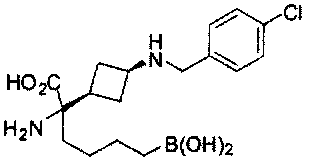
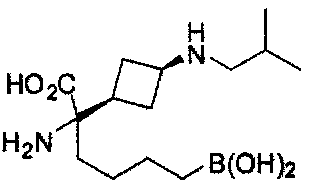
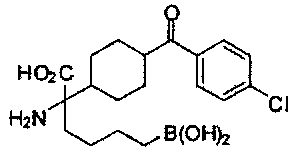
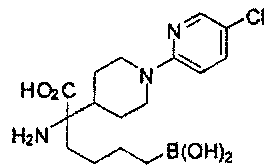
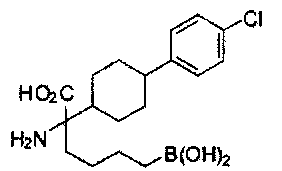
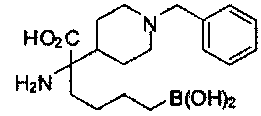
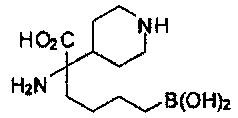
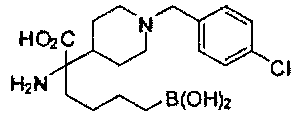
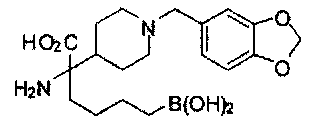
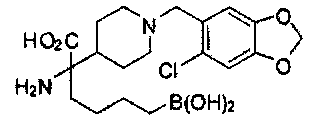
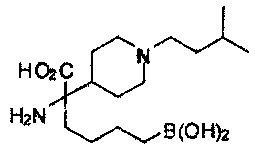
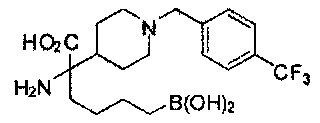
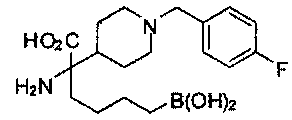
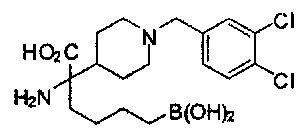
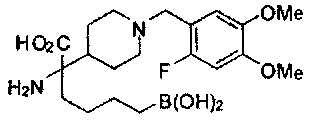
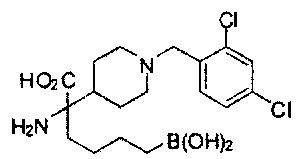
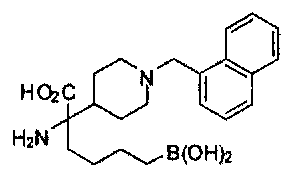
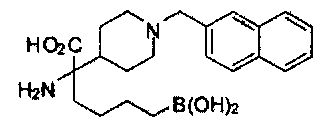
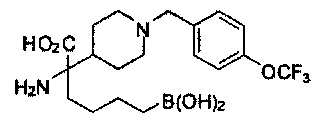
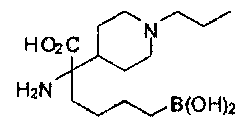
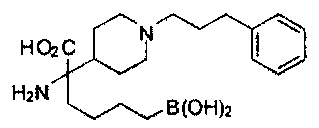
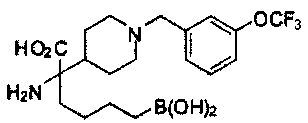
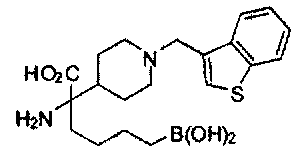
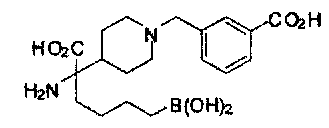
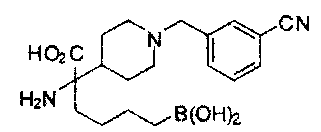
МОДЕЛЬ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОСТИ
[0885] Согласно предложенному выше описанию соединения согласно настоящему изобретению подходят для лечения и предотвращения ряда нарушений и состояний, на которые оказывает влияние содержание оксида азота (NO), регулируемое, в частности, ферментами аргиназами. Эффективность соединений для указанного лечения и предотвращения определяют по поведению в стандартных исследованиях in vivo. In vivo модели для определения эффективности, разработанные для этой задачи, описаны ниже.
Эректильная дисфункция (ЭД)
[0886] Соединения согласно настоящему изобретению являются потенциальными терапевтическими средствами для лечения ЭД, что определено при помощи измерений пенильного эректильного ответа согласно протоколу, описанному в Wingard С, Fulton J, and Husain S, J Sex Med 4: 348-363, 2007. В Таблице 3 ниже предложены эректильные ответы:
[0887]
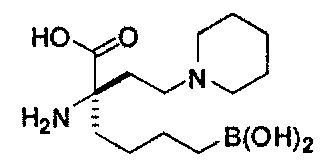
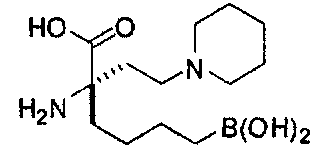
[0888] В этом примере показано, что соединение согласно Примеру 13 способно эффективно вызывать эректильный ответ in vivo, в то время как энантиомер соединения согласно Примеру 13 является неэффективным.
[0889] Предложенные выше примеры иллюстрируют конкретные варианты реализации изобретения, которое полностью определено ниже в формуле изобретения. Кроме того, все публикации, представленные в настоящем описании, включены посредством ссылок в том же объеме, как и в случае, если бы они были полностью приведены в настоящем описании.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1,5-НАФТИРИДИНА И ИНГИБИТОРЫ MELK, СОДЕРЖАЩИЕ ИХ | 2012 |
|
RU2645339C1 |
| ПРОИЗВОДНЫЕ ПИРИДИНОНА И ПИРИДАЗИНОНА | 2012 |
|
RU2632915C2 |
| КОМПОЗИЦИИ ТЕТРАГИДРОХИНОЛИНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ БРОМОДОМЕНА ВЕТ | 2014 |
|
RU2727169C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2658919C2 |
| Соединения триазоло-пиримидина и их применение | 2019 |
|
RU2802866C2 |
| ИНГИБИТОРЫ ФОСФОИНОЗИТИД-3-КИНАЗЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2468027C2 |
| ТИАЗОЛОПИРИМИДИНЫ | 2012 |
|
RU2610840C2 |
| ПРОТИВОФИБРОЗНЫЕ ПИРИДИНОНЫ | 2015 |
|
RU2692485C2 |
| ЗАМЕЩЕННЫЙ 2-АМИНОПИРИДИН В КАЧЕСТВЕ ИНГИБИТОРА ПРОТЕИНКИНАЗЫ | 2014 |
|
RU2671212C2 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОАРИЛЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2552114C2 |
Изобретение относится к соединению Формулы I
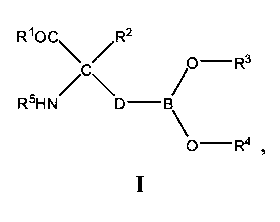
где R1 выбран из группы, состоящей из -ОН и ORa; Ra выбран из группы, состоящей из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С14)арила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, (С3-С14)гетероарил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С3-С14)арил(С1-С6)алкилена-; и где (A) R2 выбран из группы, состоящей из (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, и -(CH2)m-(X)u-(CH2)n-(Y)v-Rf; где u представляет собой 1; v представляет собой 0; каждый m и n независимо равен 0, 1, 2, 3, 4, 5 или 6, где m+n≥1; каждый X и Y представляет собой -NH-; Rf представляет собой (С3-С14)арил; и R5 представляет собой линейный или разветвленный (С1-С6)алкил; или где (B) R2 представляет собой (С3-С14)гетероциклоалкил-(С1-С2)алкилен, содержащий 1-4 гетероатома, выбранных из О, S и N, и R5 выбран из группы, состоящей из Н и линейного или разветвленного (С1-С6)алкила; и где каждый R3 и R4 представляет собой водород; D представляет собой -СН2СН2СН2СН2-; и где любой алкил или алкилен возможно содержит один или более заместителей, выбранных из группы, состоящей из галогена, -ОН и (С1-С6)алкокси; и где любой арил, гетероарил или гетероциклоалкил возможно содержит один или более заместителей, выбранных из группы, состоящей из галогена, -ОН, оксо, -СООН, (С3-С14)арил(С1-С6)алкилена-, (С3-С14)арила, (С3-С14)гетероарила, содержащего 1-4 гетероатома, выбранных из О, S и N, (С1-С6)алкила, (С1-С6)алкокси, (С1-С6)галогеналкила и (С1-С6)гидроксиалкила; или его фармацевтически приемлемой соли, стереоизомеру, таутомеру или пролекарству. Также предложены соединение формулы II, фармацевтическая композиция, способ ингибирования аргиназы I, аргиназы II или их комбинации в клетке, способ лечения или предотвращения заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или их комбинации, и соединение, указанное в таблице. Соединения Формулы I и Формулы II представляют собой высокоактивные ингибиторы активности аргиназы I и II. 6 н. и 24 з.п. ф-лы, 6 табл., 255 пр.
1. Соединение Формулы I

где
R1 выбран из группы, состоящей из -ОН и ORa;
Ra выбран из группы, состоящей из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С14)арила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, (С3-С14)гетероарил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С3-С14)арил(С1-С6)алкилена-;
и где
(A) R2 выбран из группы, состоящей из (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, и -(CH2)m-(X)u-(CH2)n-(Y)v-Rf;
где
u представляет собой 1;
v представляет собой 0;
каждый m и n независимо равен 0, 1, 2, 3, 4, 5 или 6, где m+n≥1;
каждый X и Y представляет собой -NH-;
Rf представляет собой (С3-С14)арил; и
R5 представляет собой линейный или разветвленный (С1-С6)алкил;
или где
(B) R2 представляет собой (С3-С14)гетероциклоалкил-(С1-С2)алкилен, содержащий 1-4 гетероатома, выбранных из О, S и N, и
R5 выбран из группы, состоящей из Н и линейного или разветвленного (С1-С6)алкила;
и где
каждый R3 и R4 представляет собой водород;
D представляет собой -СН2СН2СН2СН2-;
и где любой алкил или алкилен возможно содержит один или более заместителей, выбранных из группы, состоящей из галогена, -ОН и (С1-С6)алкокси;
и где любой арил, гетероарил или гетероциклоалкил возможно содержит один или более заместителей, выбранных из группы, состоящей из галогена, -ОН, оксо, -СООН, (С3-С14)арил(С1-С6)алкилена-, (С3-С14)арила, (С3-С14)гетероарила, содержащего 1-4 гетероатома, выбранных из О, S и N, (С1-С6)алкила, (С1-С6)алкокси, (С1-С6)галогеналкила и (С1-С6)гидроксиалкила;
или его фармацевтически приемлемая соль, стереоизомер, таутомер или пролекарство.
2. Соединение по п.1, отличающееся тем, что D представляет собой бутилен, a R1 представляет собой -ОН.
3. Соединение по п.2, отличающееся тем, что
R2 представляет собой (С3-С14)гетероциклоалкил-(С1-С2)алкилен-, содержащий 1-4 гетероатома, выбранных из О, S и N, и
каждый из R3, R4 и R5 представляет собой водород.
4. Соединение по п.3, отличающееся тем, что R2 представляет собой (С3-С6)гетероциклоалкил-(С1-С2)алкилен, содержащий 1-4 гетероатома, выбранных из О, S и N, возможно содержащий один или более заместителей, выбранных из группы, состоящей из -(С1-С6)алкокси, -(С1-С6)алкила и -ОН.
5. Соединение по п.1, выбранное из соединений, представленных в следующей таблице: 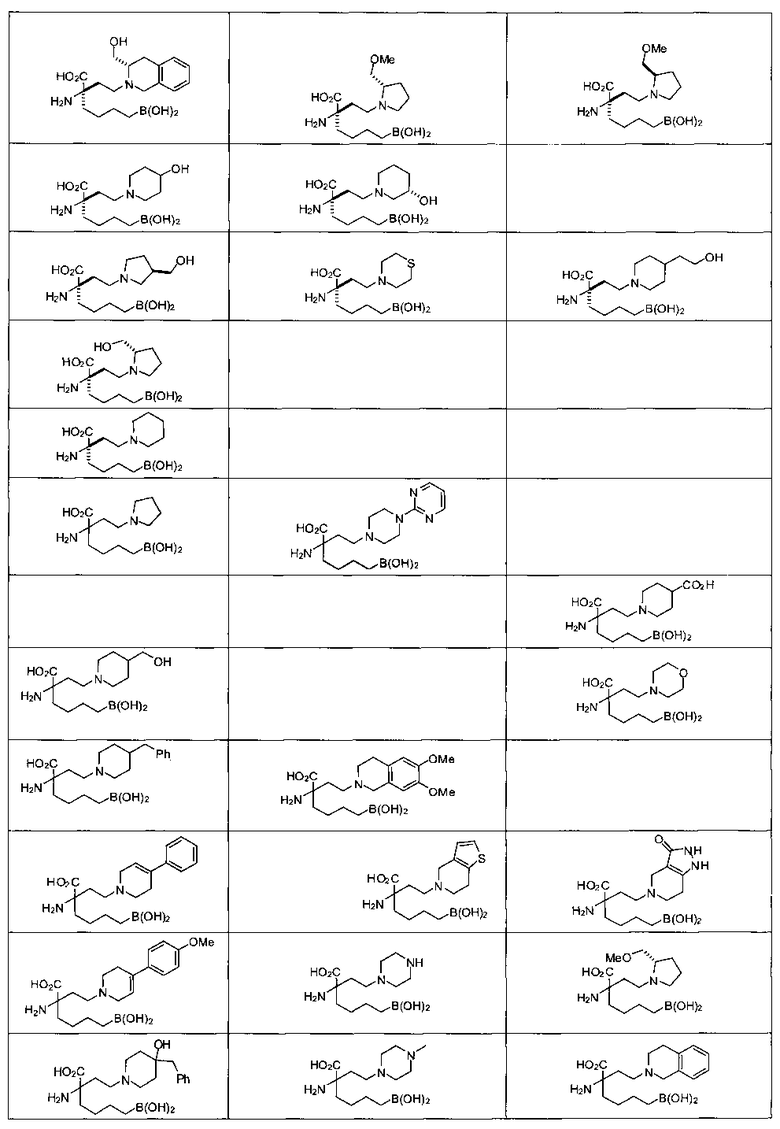
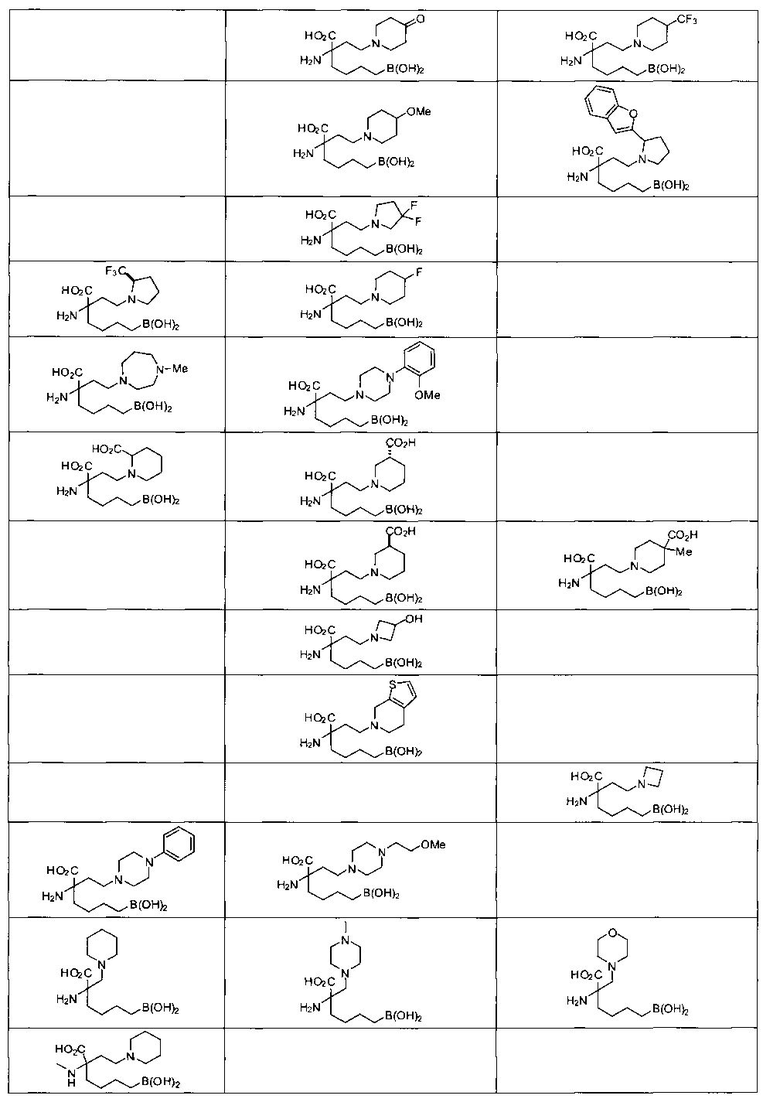
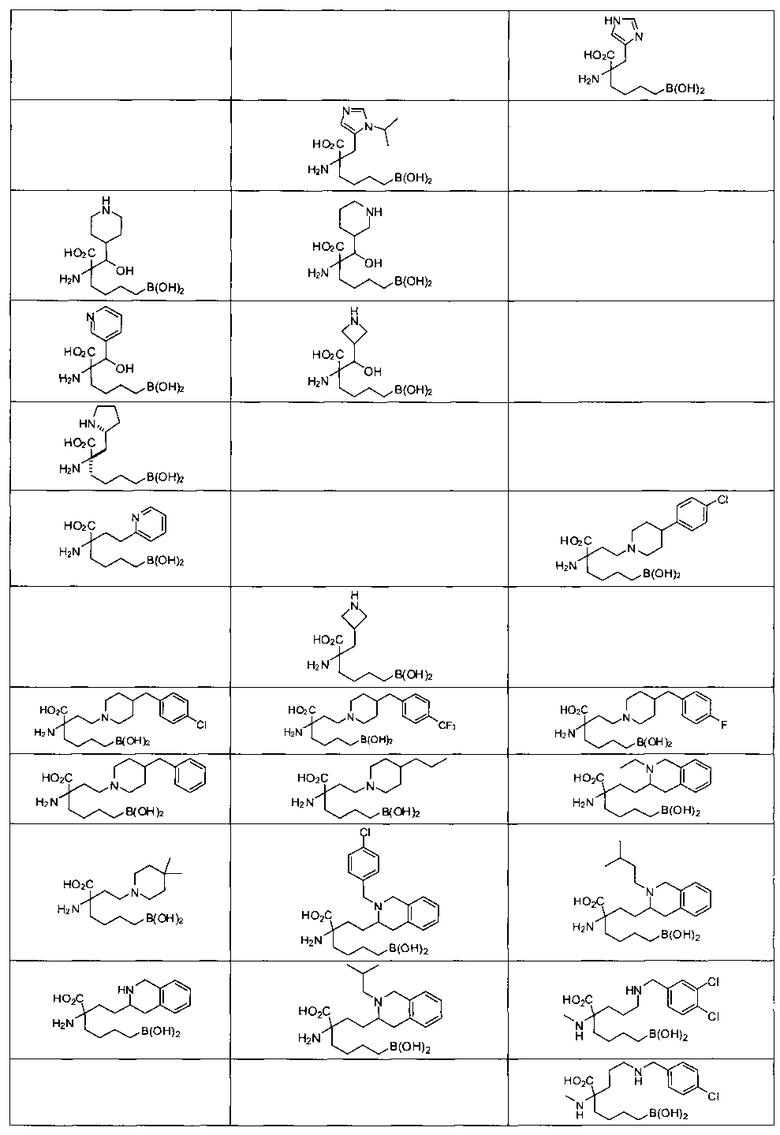
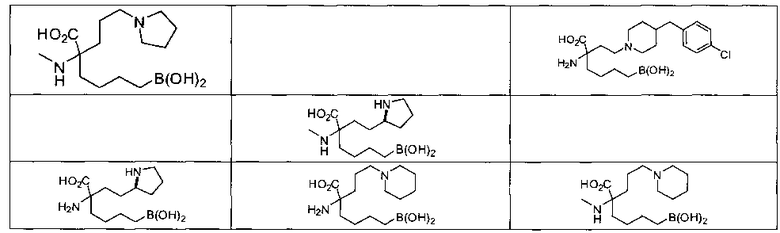
или его фармацевтически приемлемая соль, пролекарство или стереоизомер.
6. Соединение по п.5, выбранное из группы, состоящей из:
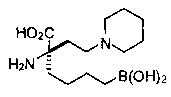 ,
, 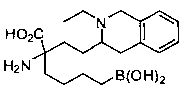 и
и 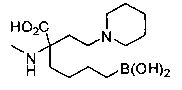 ,
,
или его фармацевтически приемлемая соль, пролекарство или стереоизомер.
7. Соединение Формулы II
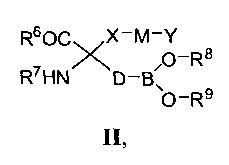
где
R6 представляет собой ORa;
Ra выбран из группы, состоящей из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С8)циклоалкила, (С3-С14)арила, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, (С3-С14)гетероарил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С3-С14)арил-(С1-С6)алкилена-;
R7 выбран из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, (С3-С14)арил(С1-С6)алкилена-, (С3-С14)гетероарил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, (С3-С14)гетероциклоалкил-(С1-С6)алкилена-, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С1-С6)алкил-С(О)-;
X выбран из группы, состоящей из (С3-С14)циклоалкилена и (С3-С14)гетероциклоалкилена, содержащего 1-4 гетероатома, выбранных из О, S и N,
Y выбран из группы, состоящей из Н, (С1-С14)алкила, -NR′R″, (С3-С14)циклоалкила, (С3-С14)арила, (С3-С14)арил-(С1-С6)алкилена, (С3-С14)гетероарила, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С3-С14)гетероарил-(С1-С6)алкилена, содержащего 1-4 гетероатома, выбранных из О, S и N;
М выбран из группы, состоящей из связи, -(С1-С6)алкилена-, -С(О)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S(O)2- и -NR′-;
R8 и R9 представляют собой водород;
D представляет собой -СН2СН2СН2СН2-;
R′ и R″ независимо выбраны из группы, состоящей из Н, (С1-С8)алкила, возможно замещенного (С3-С6)арила и возможно замещенного (С3-С14)арил(С1-С6)алкилена-; и
где любой алкил, арил, гетероарил, циклоалкил или гетероциклоалкил возможно замещен одним или более членами группы, состоящей из галогена, оксо, -СООН, -CN, -NO2, (С1-С6)алкила, (С1-С6)галогеналкила, (С1-С6)галогеналкокси, (С1-С6)алкокси, (С3-С14)арила, (С3-С14)гетероарила, содержащего 1-4 гетероатома, выбранных из О, S и N, (С3-С14)гетероциклоалкила, содержащего 1-4 гетероатома, выбранных из О, S и N, (С3-С14)гетероарил-(С1-С6)алкилена, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С3-С14)арилокси;
или его фармацевтически приемлемая соль, стереоизомер, таутомер или пролекарство.
8. Соединение по п.7, отличающееся тем, что
D представляет собой бутилен;
R6 представляет собой -ОН; и
каждый из R7, R8 и R9 представляет собой водород.
9. Соединение по п.7, отличающееся тем, что
X представляет собой (С3-С14)циклоалкилен, и
М выбран из группы, состоящей из связи, -(С1-С6)алкилена-, -С(О)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S(O)2- и -NR′-, и
Y представляет собой -NR′R″.
10. Соединение по п.7, отличающееся тем, что
X представляет собой (С3-С14)гетероциклоалкилен, содержащий 1-4 гетероатома, выбранных из О, S и N;
М выбран из группы, состоящей из связи, -(С1-С6)алкилена-, -С(О)-, -C(S)-, -C(O)NH-, -C(S)NH-, -S(O)2- и -NR′-; и
Y выбран из группы, состоящей из (С3-С14)циклоалкила, (С3-С14)арила, (С3-С14)арил-(С1-С6)алкилена, (С3-С14)гетероарила, содержащего 1-4 гетероатома, выбранных из О, S и N, и (С3-С14)гетероарил-(С1-С6)алкилена, содержащего 1-4 гетероатома, выбранных из О, S и N.
11. Соединение по п.7, выбранное из приведенной ниже таблицы:
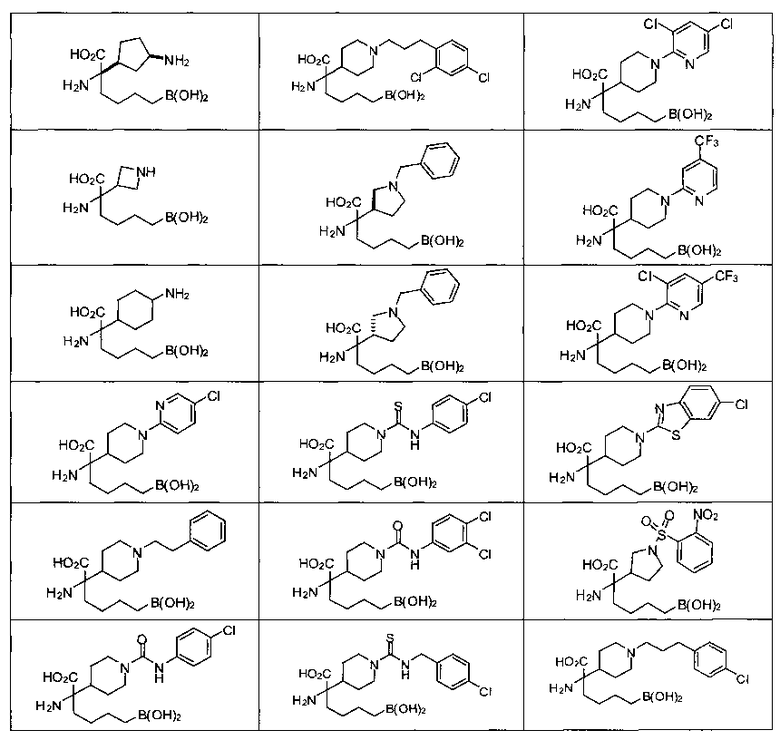
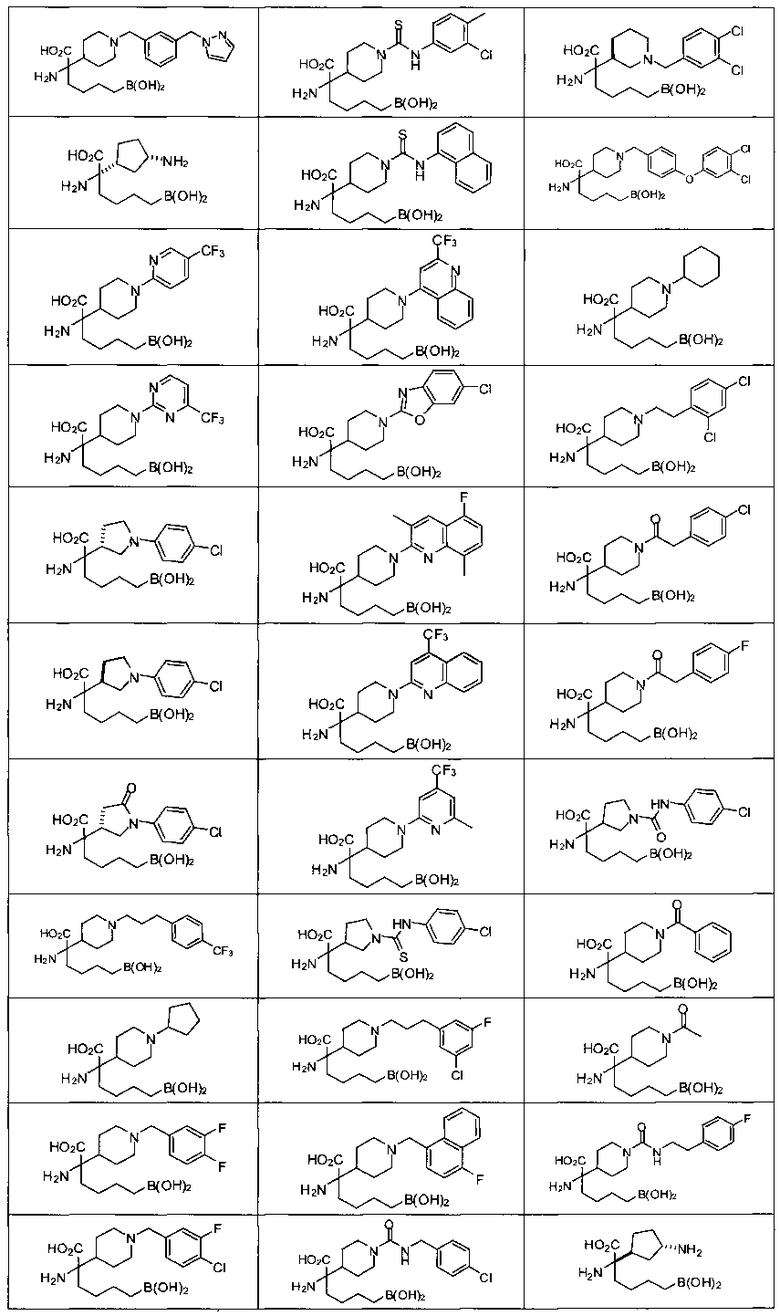
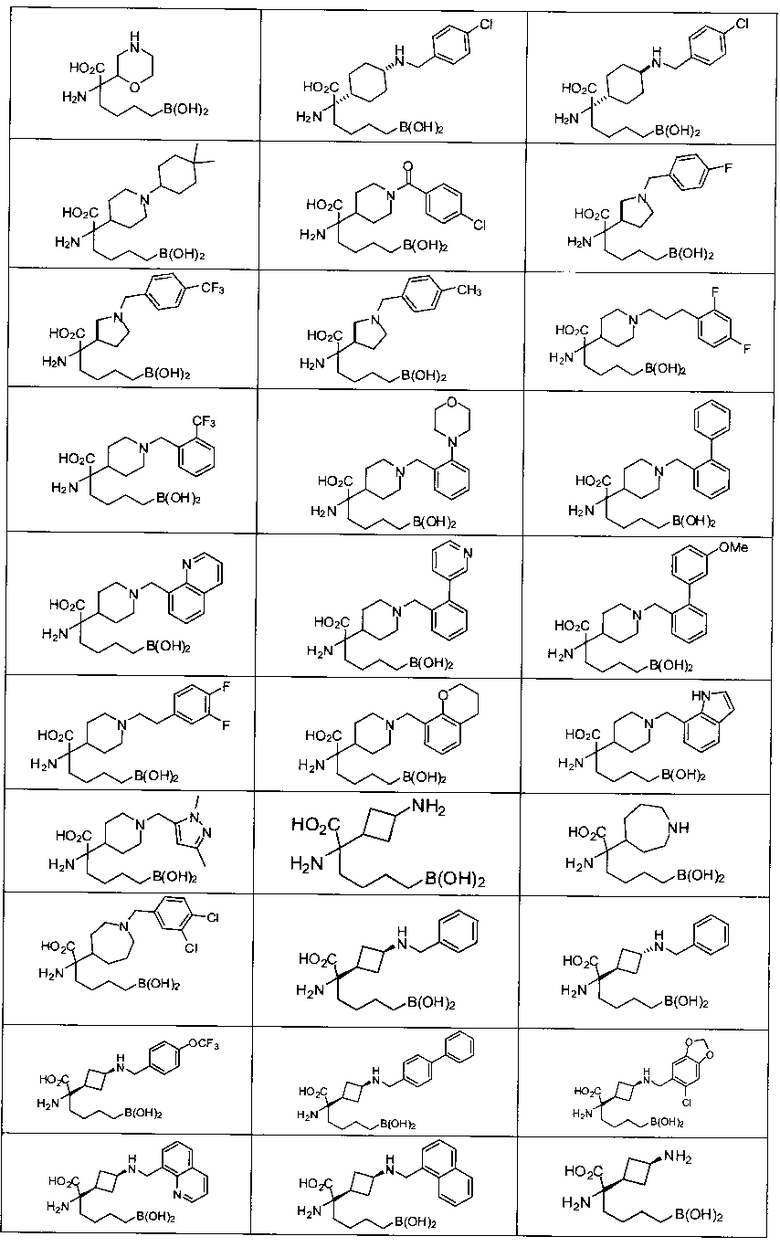
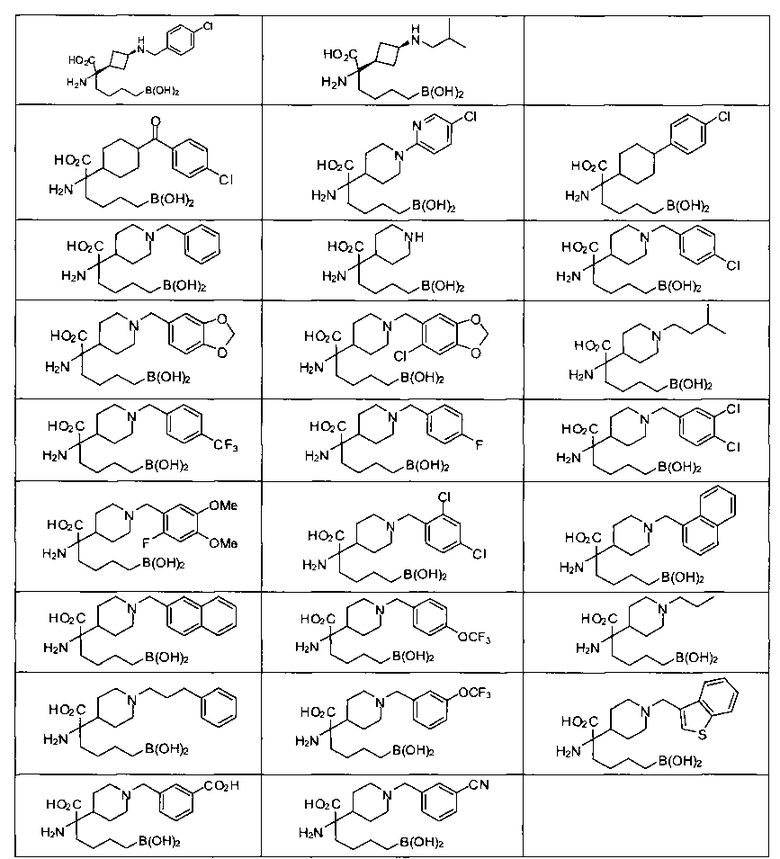
или его фармацевтически приемлемая соль, пролекарство или стереоизомер.
12. Соединение по п.11, выбранное из группы, состоящей из:
 ,
,  и
и 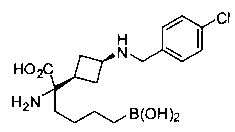 ,
,
или его фармацевтически приемлемая соль, пролекарство или стереоизомер.
13. Фармацевтическая композиция для лечения или предотвращения заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или их комбинации, содержащая терапевтически эффективное количество по меньшей мере одного соединения по любому из пп.1-12 или его фармацевтически приемлемой соли, стереоизомера, таутомера или пролекарства и фармацевтически приемлемый носитель.
14. Способ ингибирования аргиназы I, аргиназы II или их комбинации в клетке, включающий приведение указанной клетки в контакт по меньшей мере с одним соединением по любому из пп.1-12 или его фармацевтически приемлемой солью, стереоизомером, таутомером или пролекарством.
15. Способ лечения или предотвращения заболевания или состояния, связанного с экспрессией или активностью аргиназы I, аргиназы II или их комбинации, у субъекта, включающий введение субъекту терапевтически эффективного количества по меньшей мере одного соединения по любому из пп.1-12 или его фармацевтически приемлемой соли, стереоизомера, таутомера или пролекарства.
16. Способ по п.15, отличающийся тем, что заболевание или состояние выбрано из группы, состоящей из нарушений сердечно-сосудистой системы, нарушений желудочно-кишечного тракта, аутоиммунных нарушений, нарушений иммунной системы, инфекций, легочных нарушений и гемолитических нарушений.
17. Способ по п.16, отличающийся тем, что заболевание или состояние представляет собой нарушение сердечно-сосудистой системы, выбранное из группы, состоящей из системной гипертензии, легочной артериальной гипертензии (ЛАГ), высотной легочной артериальной гипертензии, ишемического реперфузионного повреждения (ИР), инфаркта миокарда, атеросклероза, болезни Пейрони, эректильной дисфункции, нарушений кровотока в печени и церебральных вазоспазмов.
18. Способ по п.16, отличающийся тем, что заболевание или состояние представляет собой легочное нарушение.
19. Способ по п.17, отличающийся тем, что заболевание или состояние представляет собой легочную артериальную гипертензию.
20. Способ по п.17, отличающийся тем, что заболевание или состояние представляет собой эректильную дисфункцию.
21. Способ по п.18, отличающийся тем, что заболевание или состояние выбрано из группы, состоящей из фиброза легких, вызванного действием химических веществ, идиопатического фиброза легких, кистозного фиброза, хронической обструктивной болезни легких (ХОБЛ) и астмы.
22. Способ по п.16, отличающийся тем, что заболевание или состояние представляет собой аутоиммунное нарушение, выбранное из группы, состоящей из энцефаломиелита, рассеянного склероза, антифосфолипидного синдрома 1, аутоиммунной гемолитической анемии, хронической воспалительной демиелинизирующей полирадикулонейропатии, герпетиформного дерматита, дерматомиозита, миастении, пузырчатки, ревматоидного артрита, синдрома мышечной скованности, диабета I типа, анкилозирующего спондилита, пароксизмальной ночной гемоглобинурии (ПНГ), пароксизмальной холодовой гемоглобинурии, тяжелой идиопатической аутоиммунной гемолитической анемии и синдрома Гудпасчера.
23. Способ по п.16, отличающийся тем, что заболевание или состояние представляет собой нарушение иммунной системы, выбранное из группы, состоящей из Т-клеточной дисфункции, опосредованной супрессорными клетками миелоидного ряда (MDSC), вируса иммунодефицита человека (ВИЧ), аутоиммунного энцефаломиелита и трансфузионной реакции в результате несовместимости с АВО.
24. Способ по п.16, отличающийся тем, что заболевание или состояние представляет собой гемолитическое нарушение, выбранное из группы, состоящей из серповидноклеточной болезни, талассемии, наследственного сфероцитоза, стомацитоза, микроангиопатической гемолитической анемии, недостаточности пируваткиназы, анемии, вызванной инфекцией, экстракорпорального кровообращения, анемии, вызванной применением искусственного сердечного клапана, и анемии, вызванной действием химических веществ.
25. Способ по п.16, отличающийся тем, что заболевание или состояние представляет собой нарушение желудочно-кишечного тракта, выбранное из группы, состоящей из нарушений моторики желудочно-кишечного тракта, раковых заболеваний ЖКТ, воспалительной болезни кишечника, болезни Крона, язвенного колита и язвенных болезней желудка.
26. Способ по п.16, отличающийся тем, что заболевание или состояние выбрано из группы, состоящей из заболеваний почек, воспаления, псориаза, лейшманиоза, нейродегенеративных заболеваний, заживающих ран, вируса гепатита В (HBV), инфекций Н. pylori, фибротических заболеваний, артрита, кандидоза, периодонтита, келоидов, аденотонзиллита, африканской сонной болезни и болезни Чагаса.
27. Способ по п.26, отличающийся тем, что заболевание или состояние выбрано из группы, состоящей из заживления инфицированных и неинфицированных ран.
28. Способ по п.15, отличающийся тем, что заболевание или состояние представляет собой рак.
29. Способ по п.28, отличающийся тем, что рак представляет собой почечноклеточную карциному, рак простаты, колоректальный рак, рак груди, рак кожи, рак легких, рак яичников или рак желудка.
30. Соединение, выбранное из приведенной ниже таблицы:
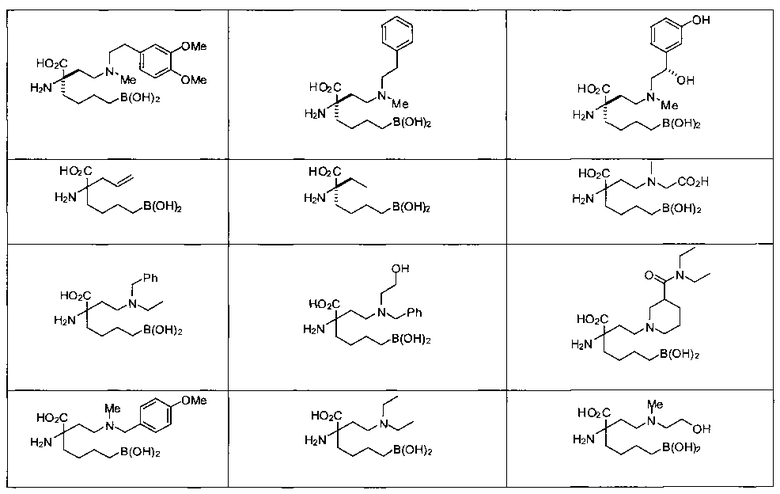
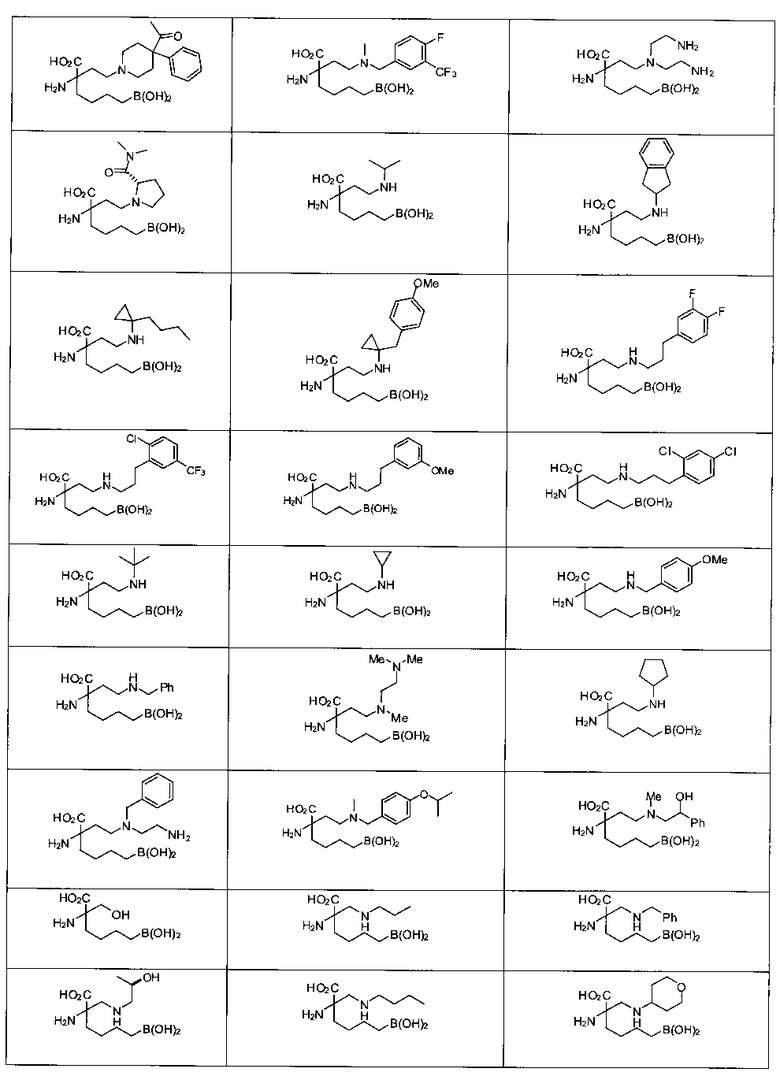
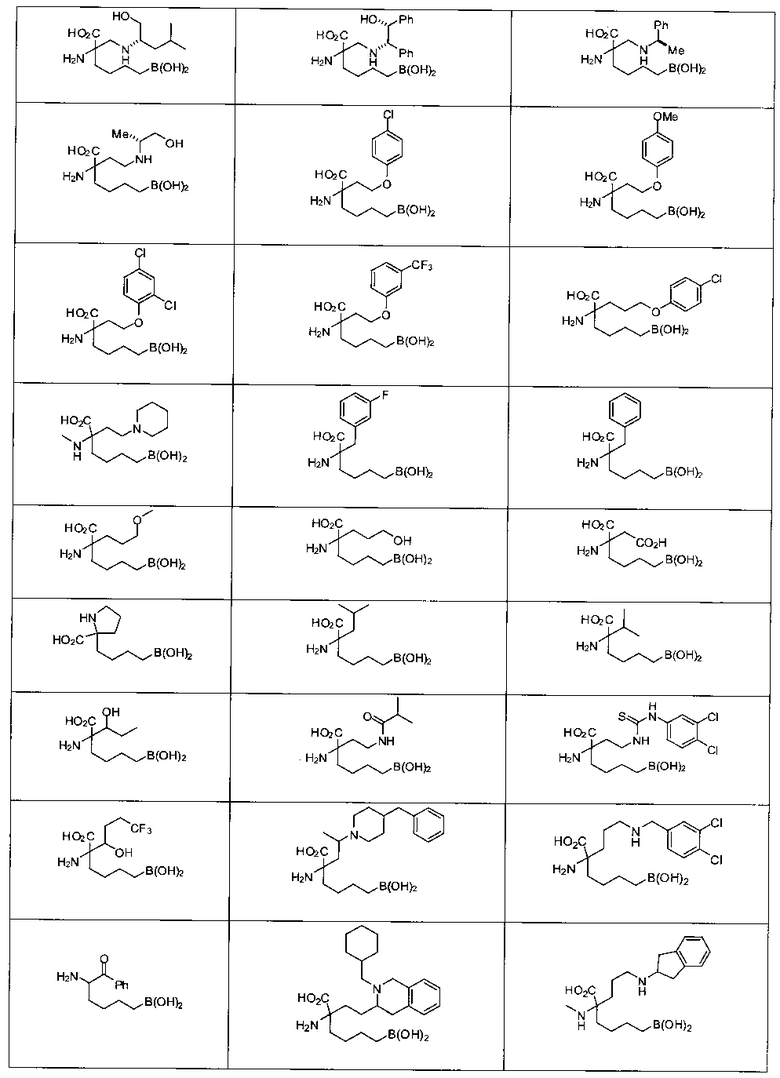
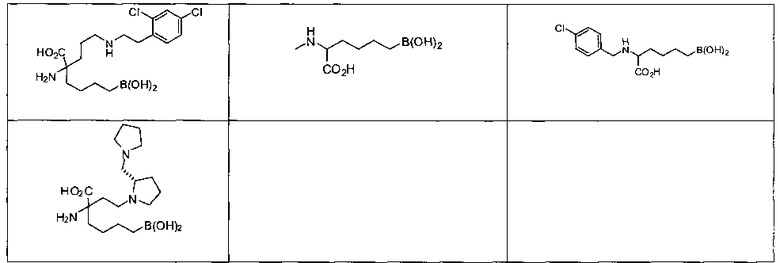
или его фармацевтически приемлемая соль, пролекарство или стереоизомер.
| WO 1999019295 A1, 22.04.1999 | |||
| US 20070185060 A1, 09.08.2007 | |||
| US 20040057926 A1, 25.03.2004 | |||
| ГЕВОРКЯН М.Л | |||
| и др., Строение активного центра печеночной аргиназы млекопитающих | |||
| II | |||
| Субстраты и ингибиторы, Биологич | |||
| журн | |||
| Армении, 2008, т | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2016-06-10—Публикация
2011-04-20—Подача