Область техники
Данное изобретение относится к химии органических соединений, фармакологии и медицине и касается терапии заболеваний, связанных с избыточной активацией гистаминового рецептора третьего типа на пресинаптических гистаминергических нейронах, в частности для терапии аллергических заболеваний, предпочтительно терапии круглогодичного и персистирующего аллергического ринита посредством применения соединения, обладающего эффективностью в подавлении активности гистаминового рецептора третьего типа, вовлеченного, в частности, в процессы вазодилатации, развития отека в назальной полости и возникновения болевой симптоматики.
Уровень техники
Рецепторы гистамина третьего типа были впервые обнаружены в 1983 году в головном мозге человека и ряда лабораторных животных (Nature 1983; 302(5911):832-837). Гистаминовые рецепторы третьего типа экспрессируются в областях мозга, которые имеют решающее значение для познания (кора головного мозга и гиппокамп) и регуляции циркадных ритмов (гипоталамус) (Expert Opin Investig Drugs 2004; 13(10):1237-1248). Гистамин является высокоактивным агонистом H3-рецептора. Активация H3-рецепторов головного мозга под действием H3-агонистов регулирует высвобождение и синтез гистамина и ряда других нейротрансмиттеров, которые играют роль в регуляции внимания, импульсивности и потребления пиши. Поэтому антагонисты H3-рецептора в настоящее время изучаются в нескольких терапевтических областях, включая когнитивные расстройства и нарушения сна (Expert Opin Investig Drugs 2007; 16(7):967-985). Таким образом H3-рецепторы центральной нервной системы является привлекательной лекарственной мишенью как для научных исследований, так и для фармацевтической промышленности (Biochem Pharmacol 2007; 73(8):1084-1096, Biochem Pharmacol 2006; 71(8):1103-1113). Необходимо однако отметить, что воздействие на H3-рецепторы головного мозга может привести к ряду нежелательных побочных эффектов, таких как развитие депрессии, нарушения сна и т.д.
Позднее было обнаружено, что рецепторы гистамина третьего типа также экспрессируются в периферических тканях и локализуются на эпителии и нервах слизистой оболочки носа человека (Mol Pharmacol 1999; 55(6):1101-1107). Это открытие позволило рассматривать периферические рецепторы гистамина третьего типа как перспективную мишень для терапии некоторых аллергических состояний и, в частности, аллергического ринита. Аллергическая реакция в назальной полости инициирует дегрануляцию тучных клеток и выделение гистамина, который в свою очередь воздействует на постсинаптические рецепторы H1, вызывая экстравазацию H1-мезонами, вазодилатацию и секрецию слизи. Кроме того, гистамин вызывает вазодилатацию путем активации пресинаптических рецепторов H3, расположенных на постганглионарных симпатических нейронах, что приводит к уменьшению высвобождения норадреналина, увеличению проницаемости сосудов, развитию отека и болевой симптоматики. Помимо этого, активация H3-рецепторов, расположенных на ноцицептивных сенсорных нервах индуцирует высвобождение вещества P, что в свою очередь вызывает ринорею и заложенность носа (Am Rev Respir Dis 1991; 144:630-5; J Pharmacol Sci 2008; 108:206-11).
В различных моделях на животных, а также в исследованиях на здоровых добровольцах, было показано, что блокада периферических H3-рецепторов существенно снижает назальное сопротивление и выраженность симптомов аллергического ринита (Br J Pharmacol. 2005 Mar;144(6):867-74). Так например, интраназальное введение R-альфа-метилгистамина, агониста H3-рецептора, вызывает назальную блокаду у людей, которая снижается при местном применении антагониста H3 рецептора тиоперидамида (Br J Pharmacol. 2005 Mar;144(6):867-74). В in vitro исследованиях образцов ткани, взятых у свиней и людей, было показано, что R-альфа-метилгистамин вызывает вазодилатацию, уменьшая высвобождение вазоконстриктора норадреналина из носовых симпатических нервных окончаний (Eur J Pharmacol 2004; 484:83-9; Eur J Pharmacol 2002; 452:339-45).
Несколько антагонистов гистаминовых рецепторов третьего типа (H3-рецепторов) были изучены в ходе клинических исследований для терапии аллергического ринита. Все три препарата показали эффективность в клинических исследованиях второй фазы для контроля симптоматики аллергического ринита. Однако, поскольку все три препарата обладают способностью проникать через гематоэнцефалический барьер и блокировать H3-рецепторы центральной нервной системы, все данные лекарственные кандидаты в большей или меньшей степени ассоциированы с развитием побочных эффектов. Таким образом, существующие антагонисты H3-рецептора, или не обладают селективностью относительно H3-рецептора (тиоперидамид), или проникают через гематоэнцефалический барьер (JNJ-39220675, PF-03654746) и не подходят для клинической разработки лекарственных средств для терапии аллергического ринита.
Таким образом на сегодняшний день нет ни одного препарата, действующего как антагонист гистаминового рецептора третьего типа, который бы применяли в терапии аллергических заболеваний человека. Поэтому сохраняется потребность в создании и внедрении в клинику новых эффективных лекарственных средств на основе антагонистов гистаминового рецептора третьего типа.
Данное изобретение касается применения химического соединения, обладающего эффективностью в подавлении активности гистаминового рецептора третьего типа, в терапии аллергических заболеваний (таких как круглогодичный и персистирующий аллергический ринит), а также других заболеваний, связанных с избыточной стимуляцией гистаминового рецептора третьего типа на пресинаптических гистаминергических нейронах.
Раскрытие изобретения
Задачей настоящего изобретения является разработка нового лекарственного средства, являющегося антагонистом гистаминового рецептора третьего типа, и эффективного для терапии аллергических заболеваний, предпочтительно для терапии круглогодичного и персистирующего аллергического ринита, а также других заболеваний, связанных с активностью гистаминового рецептора третьего типа на пресинаптических гистаминергических нейронах.
Техническим результатом данного изобретения является разработка и получение эффективного антагониста гистаминового рецептора третьего типа, характеризующегося высокой активностью и фармакокинетическими характеристиками, позволяющими использовать данное соединение, в частности, при пероральном и интраназальном применении для терапии аллергических заболеваний, таких как круглогодичный и персистирующий аллергический ринит.
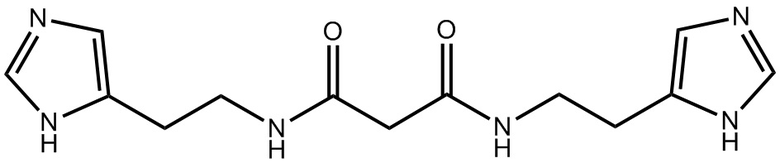
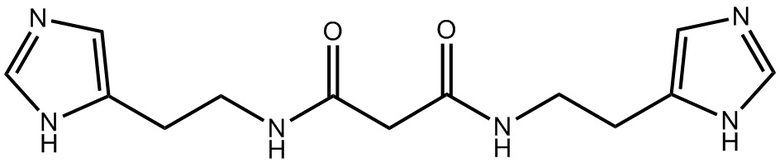
Указанный технический результат достигается путем предоставления антагониста гистаминовых рецепторов третьего типа, представляющего собой соединение: N,N'-бис(2-(1H-имидазол-5-ил)этил)малонамид (Соединение I)
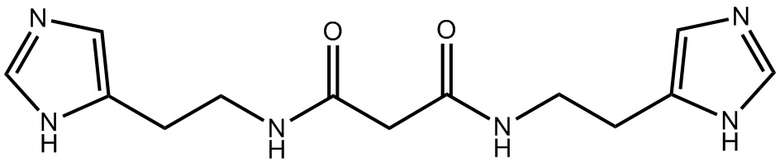
или его фармацевтически приемлемую соль, гидрат, сольват.
Объектом настоящего изобретения является применение антагониста, описанного выше, для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, включая аллергические расстройства, в частности круглогодичный или персистирующий аллергический ринит.
Указанный технический результат достигается также посредством применения соединения N,N'-бис(2-(1H-имидазол-5-ил)этил)малонамида или его фармацевтически приемлемой соли, гидрата, сольвата для получения фармацевтической композиции для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, содержащая терапевтически эффективное количество антагониста, описанного выше, и по меньшей мере один фармацевтически приемлемый носитель. При этом расстройство, связанное с активностью гистаминового рецептора третьего типа, включает аллергическое расстройство, в частности круглогодичный или персистирующий аллергический ринит.
При этом фармацевтическая композиция может дополнительно содержать один или несколько других терапевтических агентов, где другой дополнительный терапевтический агент включает выбранные из антигистаминного средства, кромогликата натрия, интраназального глюкокортикоида, ипратропиум бромида, сосудосуживающего средства, антибиотика, нестероидного противовоспалительного препарата или обезболивающего средства.
Указанный технический результат достигается также посредством применения соединения (I) или его фармацевтически приемлемой соли, гидрата, сольвата для получения лекарственного средства для предупреждения и/или лечения расстройства, связанного с избыточной стимуляцией гистаминового рецептора третьего типа на пресинаптических гистаминергических нейронах.
Кроме того, изобретение предусматривает фармацевтические композиции для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, и отличающиеся тем, что они содержит эффективное количество соединения по изобретению и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах воплощениях изобретения вспомогательное вещество представляет собой фармацевтически приемлемый носитель и/или эксципиент.
Изобретение также включает способ предупреждения и/или лечения расстройства, связанного с избыточной активацией гистаминового рецептора третьего типа в организме, включающий введение в указанный организм соединения I по изобретению. Такое расстройство, связанное с активностью гистаминового рецептора третьего типа, представляет собой аллергическое заболевание, в особенности заболевание легких и дыхательных путей. В некоторых неограничивающих вариантах воплощения изобретения заболевание представляет круглогодичный и/или персистирующий аллергический ринит. В частных случаях воплощения изобретения организм представляет собой организм человека или животного.
Также, изобретение относится к способу предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, у субъекта, нуждающегося в таком лечении, включающему введение терапевтически эффективного количества Соединения I указанному субъекту.
Также, изобретение относится к способу предупреждения и/или лечения круглогодичного и/или персистирующего аллергического ринита у субъекта, нуждающегося в таком лечении, включающий введение терапевтически эффективного количества Соединения I указанному субъекту.
Изобретение относится также к применению Соединения I для получения лекарственного средства.
Также, настоящее изобретение относится к комбинации, содержащей Соединение I в сочетании с одним или несколькими другими дополнительными терапевтическими агентами.
Соединение N,N'-бис(2-(1H-имидазол-5-ил)этил)малонамид известно и описано в заявке на изобретение RU 2013/116822.
Подробное раскрытие изобретения
Получение Соединения 1 описано в заявке на изобретение RU 2013/116822. В указанной патентной заявке описаны производные бисамидов дикарбоновых кислот, обладающие способностью к комплексообразованию или хелатированию ионов металлов, а также их применение в качестве средства для профилактики и/или лечения вирусного гепатита, ВИЧ-инфекции, онкологических, нейродегенеративных, сердечнососудистых, воспалительных заболеваний, диабета, геронтологических заболеваний, заболеваний, вызываемых токсинами микроорганизмов, а также алкоголизма, алкогольного цирроза печени, анемии, поздней порфирии, отравлений солями переходных металлов.
Автором настоящего изобретения неожиданно было обнаружено, что Соединение I является антагонистом гистаминового рецептора третьего типа. Применение Соединения I перспективно для терапии аллергических заболеваний, в частности для терапии круглогодичного и персистирующего аллергического ринита.
Таким образом, Соединение I является новым антагонистом гистаминового рецептора третьего типа, который может применяться для терапии аллергических заболеваний, таких, как круглогодичный и персистирующий аллергический ринит.
Термины и определения
Термин «Соединение I» относится к N,N'-бис(2-(1H-имидазол-5-ил)этил)малонамиду, также представленному структурной формулой:
 .
.
Термин «С», когда он используется со ссылкой на температуру, означает стоградусную шкалу или температурную шкалу Цельсия.
Термин «IC50» означает концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование фермента.
Термин «фармацевтически приемлемые соли» или «соли» включает соли активных соединений, которые получены с помощью относительно нетоксичных кислот. Примерами фармацевтически приемлемых нетоксичных солей могут служить соли, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная, лимонная или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат (мезилат), 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, полуфумарат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат (тозилат), ундеканат, валериат и подобные.
Термин «сольват» используется для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин «гидрат» используется, когда указанным растворителем является вода.
Термин «вспомогательное вещество» означает любое фармацевтически приемлемое вещество неорганического или органического происхождения, входящее в состав лекарственного средства или используемое в процессе производства, изготовления лекарственного средства для придания ему необходимых физико-химических свойств.
Термины «лечение», «терапия» охватывают лечение патологических состояний у млекопитающих, предпочтительно у человека, и включают: а) снижение, б) блокирование (приостановку) течения заболевания, в) облегчение тяжести заболевания, т.е. индукцию регрессии заболевания, г) реверсирование заболевания или состояния, к которому данный термин применяется, или одного или более симптомов данного заболевания или состояния.
Термин «профилактика», «предотвращение» охватывает устранение факторов риска, а также профилактическое лечение субклинических стадий заболевания у млекопитающих, предпочтительно у человека, направленное на уменьшение вероятности возникновения клинических стадий заболевания. Пациенты для профилактической терапии отбираются на основе факторов, которые, на основании известных данных, влекут увеличение риска возникновения клинических стадий заболевания по сравнению с общим населением. К профилактической терапии относится а) первичная профилактика и б) вторичная профилактика. Первичная профилактика определяется как профилактическое лечение у пациентов, клиническая стадия заболевания у которых еще не наступила. Вторичная профилактика - это предотвращение повторного наступления того же или близкого клинического состояния заболевания.
Соединение I перспективно для лечения заболеваний, связанных активностью и в частности с избыточной стимуляцией гистаминового рецептора третьего типа, в частности для терапии аллергических заболеваний, имеющих как системный, так и локальный характер, в том числе, связанных с различными заболеваниями или обусловленных длительным приемом некоторых лекарственных препаратов.
Способ терапевтического применения соединений
Предмет данного изобретения также включает введение субъекту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения по изобретению. Под терапевтически эффективным количеством подразумевается такое количество соединения, вводимого или доставляемого пациенту, при котором у пациента с наибольшей вероятностью проявится желаемая реакция на лечение (профилактику). Точное требуемое количество может меняться от субъекта к субъекту в зависимости от возраста, массы тела и общего состояния пациента, тяжести заболевания, методики введения препарата, комбинированного лечения с другими препаратами и т.п.
Соединение I или фармацевтическая композиция, содержащая соединение I, может быть введено в организм пациента в любом приемлемом количестве (предпочтительно, суточная доза действующего вещества составляет до 0,5 г на пациента в сутки, наиболее предпочтительно, суточная доза составляет 5-50 мг/сутки) и любым путем введения (предпочтительно, пероральный путь введения), эффективным для лечения или профилактики заболевания.
После смешения лекарственного препарата с конкретным подходящим фармацевтически приемлемым носителем в желаемой дозировке, композиции, составляющие суть изобретения, могут быть введены в организм человека или других животных перорально, парентерально, местно и т.п.
Введение может осуществляться как разово, так и несколько раз в день, неделю (или любой другой временной интервал), или время от времени. Кроме того, соединение может вводиться в организм пациента ежедневно в течение определенного периода дней (например, 2-10 дней), а затем следует период без приема вещества (например, 1-30 дней).
В том случае, когда соединение 1 используется в составе компонентов режима комбинированной терапии, доза каждого из компонентов комбинированной терапии вводится в течение требуемого периода лечения. Соединения, являющиеся компонентами комбинированной терапии, могут вводить в организм пациента как единовременно, в виде дозировки, содержащей все компоненты, так и в виде индивидуальных дозировок компонентов.
Фармацевтические композиции
Изобретение также относится к фармацевтическим композициям, которые содержат соединение 1 (или пролекарственную форму или другое фармацевтически приемлемое производное, в частности, соль, гидрат или сольват) и один или несколько фармацевтически приемлемых носителей, адъювантов, растворителей и/или наполнителей, таких, которые могут быть введены в организм пациента совместно с соединением 1, и которые не влияют на фармакологическую активность этого соединения, и являются нетоксичными при введении в дозах, достаточных для доставки терапевтического количества соединения 1.
Фармацевтические композиции, заявляемые в данном изобретении, содержат соединение I совместно с фармацевтически приемлемыми носителями, которые могут включать в себя любые растворители, разбавители, дисперсии или суспензии, поверхностно-активные вещества, изотонические агенты, загустители и эмульгаторы, консерванты, вяжущие вещества, скользящие материалы и т.д., подходящие для конкретной формы дозирования. Материалы, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничиваются, моно- и олигосахаридами, а также их производными; желатин; тальк; эксципиенты, такие как какао-масло и воск для суппозиториев; масла, такие как арахисовое, хлопковое, сафроловое, кунжутное, оливковое, кукурузное и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор, раствор Рингера; этиловый спирт и фосфатные буферные растворы. Также в составе композиции могут быть другие нетоксичные совместимые скользящие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, пленкообразователи, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты.
Предметом данного изобретения являются также лекарственные средства - класс фармацевтических композиций, состав которых оптимизирован для определенного пути введения в организм в терапевтически эффективной дозе, например, для введения в организм орально, местно, ингаляционно, например, в виде ингаляционного спрея, или внутрисосудистым способом, интраназально, подкожно, внутримышечно, а также инфузионным способом, в рекомендованных дозировках.
Лекарственные средства данного изобретения могут содержать составы, полученные методами использования липосом, методами микрокапсулирования, методами приготовления наноформ препарата, или другими методами, известными в фармацевтике.
При получении лекарственного средства, например в форме таблетки, активное начало смешивают с одним или несколькими фармацевтическими приемлемыми эксципиентами, такими как желатин, крахмал, лактоза, стеарат магния, тальк, кремнезем, аравийская камедь, маннит, микрокристаллическая целлюлоза, гипромеллоза или аналогичные соединения.
Таблетки можно покрыть сахарозой, целлюлозным производным или другими веществами, подходящими для нанесения оболочки. Таблетки могут быть получены различными способами, такими как непосредственное сжатие, сухое или влажное гранулирование или горячее сплавление в горячем состоянии.
Лекарственное средство в форме желатиновой капсулы можно получить, смешивая Соединение I с другими компонентами и заполняя полученной смесью мягкие или твердые капсулы.
Для введения парентеральным путем используются водные суспензии, изотонические солевые растворы или стерильные растворы для инъекций, которые содержат фармакологически совместимые агенты, например пропиленгликоль или бутиленгликоль.
Примеры фармацевтических композиций
Cоединение I может быть использовано для профилактики и/или лечения болезней человека, или животных в виде следующих составов (под «Веществом» понимается активный ингредиент в виде соединения I или его фармацевтически приемлемой соли, гидрата или сольват:
Таблетка I мг/таблетка
Вещество 2,0
Микрокристаллическая целлюлоза 73,2
Карбоксиметилкрахмал натрия 4,0
Магния стеарат 0.8
Таблетка II мг/таблетка
Вещество 10,0
Микрокристаллическая целлюлоза 366,0
Карбоксиметилкрахмал натрия 20,0
Магния стеарат 4,0
Таблетка III мг/таблетка
Вещество 20,0
Микрокристаллическая целлюлоза 732,0
Карбоксиметилкрахмал натрия 40,0
Магния стеарат 8,0
Таблетка IV мг/таблетка
Вещество 50
Лактоза Ph. Eur 223.75
Кроскармеллоза натрия 6.0
Кукурузный крахмал 15
Поливинилпироллидон (5% w/v паста) 2.25
Стеарат магния 3.0
Таблетка V мг/таблетка
Вещество 200
Лактоза Ph. Eur 182.75
Кроскармеллоза натрия 12.0
Кукурузный крахмал (5% w/v паста) 2.25
Стеарат магния 3.0
Капсула мг/капсула
Вещество 10
Лактоза Ph. Eur 488.5
Магнезия 1.5
Состав для инъекций I (50 мг/мл)
Вещество 5.0% w/v
1M раствор гидроксида натрия 15.0% w/v
1M раствор соляной кислоты до pH 7.6
Полиэтиленгликоль 400 4.5% w/v
Вода для инъекций до 100%
Мазь (мл)
Вещество 40 мг
Этанол 300 мкл
Вода 300 мкл
1-додецилазациклогептанон 50 мкл
Пропиленгликоль до 1 мл
Состав для интраназального введения I (мг/мл)
Вещество 10,0
Натрия цитрата дигидрат 3,823
Лимонной кислоты моногидрат 0,609
Глицерин 25,0
Декстроза 5,5
Бензиловый спирт 2,5
Вода до 100%
Состав для интраназального введения II (мг/мл)
Вещество 10,0
Натрия цитрата дигидрат 3,823
Лимонной кислоты моногидрат 0,609
Глицерин 25,0
Декстроза 5,5
Вода до 100%
Состав для интраназального введения III (мг/мл)
Вещество 10,0
Натрия дигидрофосфата дигидрат 3,38
Динатрия гидрофосфата дигидрат 2,08
Глицерин 25,0
Декстроза 5,5
Бензиловый спирт 2,5
Вода до 100%
Состав для интраназального введения IV (мг/мл)
Вещество 10,0
Натрия дигидрофосфата дигидрат 3,38
Динатрия гидрофосфата дигидрат 2,08
Глицерин 25,0
Декстроза 5,5
Бензиловый спирт 2,5
Вода до 100%
Данные составы могут быть приготовлены в соответствии со стандартными методиками. Таблетки (I)-(V) могут быть покрыты кишечнорастворимой оболочкой с использованием, например, ацетат-фталата целлюлозы.
Применение Соединения 1 в комбинированной терапии
Несмотря на то, что Соединение 1 по данному изобретению может вводиться в качестве индивидуального активного ингредиента, его также можно использовать в сочетании с одним или несколькими другими активными ингредиентами, в частности, другой активный ингредиент может представлять собой антигистаминный препарат, кромогликат натрия, интраназальный глюкокортикоид, ипратропиум бромид, сосудосуживающие средство, антибиотик, нестероидный противовоспалительный препарат (НПВС) или другое противовоспалительное средство и т.д. При совместном приеме внутрь терапевтические агенты могут быть помещены в разные лекарственные формы, которые вводят одновременно или последовательно в разное время, либо терапевтические агенты могут быть объединены в одну лекарственную форму.
Фраза «комбинированная терапия» в отношении соединений данного изобретения в сочетании с другими фармацевтическими агентами, означает одновременный или последовательный прием всех агентов, который так или иначе обеспечит благоприятное воздействие сочетания лекарств. Совместное введение подразумевает, в частности, совместную доставку, например, в одной таблетке, капсуле, инъекции или в другой форме, имеющий фиксированное соотношение активных веществ, также как и одновременную доставку в нескольких, отдельных лекарственных формах для каждого соединения соответственно.
Таким образом, введение соединения данного изобретения может быть осуществлено в сочетании с дополнительными методами лечения, известными специалистам в области профилактики и лечения соответствующих заболеваний, включающими применение антибактериальных и противовоспалительных препаратов, препаратов для подавления симптомов или побочных эффектов одного из лекарств.
Если лекарственная форма представляет собой фиксированную дозу, такая комбинация использует соединение данного изобретения в приемлемом дозовом диапазоне. Соединение 1 по данному изобретению также может быть введено в организм пациента последовательно с другими агентами, в том случае, когда комбинация этих препаратов невозможна. Изобретение не ограничено последовательностью введения; соединение данного изобретения может быть введено в организм пациента совместно, до или после введения другого препарата.
Примеры
Получение соединения 1
Получение Соединения 1 описано в заявке на изобретение RU 2013/116822. В той же заявке описана способность Соединения 1 к комплексообразованию или хелатированию ионов металлов.
Характеристика биологической активности соединений по изобретению
Биологическая активность Соединения 1 была изучена в различных in vitro и in vivo экспериментах. В частности, при изучении активности Соединения 1 в различных in vitro и in vivo моделях было показано ингибирующее действие Соединения 1 в модели овальбумин-индуцированного аллергического ринита у морских свинок. Данное биологическая активность Соединения 1 не может быть предсказана или объяснена основе предшествующих знаний о способности Соединения I к хелатированию ионов металлов.
Исследования биологической активности Соединения 1 in vitro, позволили установить, что Соединение 1 является антагонистом гистаминового рецептора третьего типа. По-видимому, активность Соединения 1 в моделях аллергического ринита связана с действием на вышеуказанный рецептор.
Пример 1. Исследование влияния Соединения 1 на активность гистаминового рецептора третьего типа
Соединение I растворяли в ДМСО до концентрации 100 мМ; затем стоковый раствор серийно разбавляли ДМСО. Максимальная стартовая концентрация вещества - 100 μМ. Эффект определяли при 8 концентрациях тестируемого соединения, каждую концентрацию исследовали дважды. В эксперименте использовались клетки CHO, экспрессирующие гистаминовый рецептор человека третьего типа, которые после преинкубации с гистамином инкубировали с Соединением 1. Активность рецепторов определяли по внутриклеточной концентрации сAMP методом флуоресцентной спектроскопии (Lim, H.D. et al. (2005) J. Pharmacol. Exp. Ther., 314: 1310-1321).
В результате исследования было установлено, что Соединение 1 является антагонистом гистаминового рецептора третьего типа c IC50=20 мкM.
Пример 2. Исследование активности Соединения 1 в модели овальбумин-индуцированного аллергического ринита у морских свинок
Модель аллергического ринита реализовали по стандартной методике [Thakare V.N., Osama M.M.,Naik S.R.Therapeutic potential of curcumin in experimentally induced allergic rhinitis in guinea pigs. Int Immunopharmacol. 2013. V. 17(1). P. 18-25]. Морских свинок (250-300 гр) иммунизировали 4х кратным (на 0, 7, 14 и 21 сутки) внутрибрюшинным введением смеси овальбумина (100 мкг/свинка) и гидроксида аллюминия (5 мг/свинка), разведенных и суспендированных в физиологическом растворе. На 28-е сутки исследования раствор овальбумина (60 мг/мл) животным вводили интраназально по 20 мкл в каждую ноздрю. На 35-е сутки животным вводили раствор овальбумина (200 мкг/мл, 25 мкл) внутрикожно, предварительно выбрив участок кожи на спине. Подтверждением наличия сенсибилизации было формирование отека и покраснения в месте инъекции. На 42-е сутки исследования проводили интраназальное введение раствора овальбумина (60 мг/мл, 20 мкл/ноздря). С целью контроля формирования именно аллергического воспаления была сформирована группа ложноиммунизированных животных: на 0, 7, 14 и 21 сутки свинки получали раствор гидроксида аллюминия (5 мг/свинка), на 28-е и 35-е сутки - физ. раствор, на 42-е овальбумина (60 мг/мл, 20 мкл/ноздря).
Таблица 1 - Клинические проявления патологии у морских свинок на экспериментальной модели аллергического ринита при пероральном введении (M±m, n=10)
Соединение 1 вводили животным внутрижелудочно за 48, 24 и 1 ч до интраназального введения овальбумина. В течение 2 ч после последнего введения овальбумина проводили оценку клинических проявлений ринита: подсчитывали количество чихов, почесываний носа.
Учет клинических проявлений аллергического ринита в течение 2х часов после последнего интраназального введения овальбумина животным показал выраженное увеличение у экспериментальных животных количества чихов и почесываний носа, что свидетельствует о корректности реализованной модели аллергического ринита. Внутрижелудочное введение Соединения 1 снижало количество клинических проявлений ринита (таблица 1). Полученные результаты дают основание заключить, что Соединение 1 при пероральном введении оказывает выраженный терапевтический эффект при аллергическом рините.
Пример 3. Исследование активности 1% раствора Соединения 1 при назальном введении морским свинкам на модели аллергического ринита
Модель аллергического ринита реализовали по стандартной методике [Thakare V.N., Osama M.M.,Naik S.R.Therapeutic potential of curcumin in experimentally induced allergic rhinitis in guinea pigs. Int Immunopharmacol. 2013. V. 17(1). P. 18-25]. Морских свинок (250-300 гр) иммунизировали 4х кратным (на 0, 7, 14 и 21 сутки) внутрибрюшинным введением смеси овальбумина (100 мкг/свинка) и гидроксида алюминия (5 мг/свинка), разведенных и суспендированных в физиологическом растворе. На 28-е сутки исследования раствор овальбумина (60 мг/мл) животным вводили интраназально по 20 мкл в каждую ноздрю. На 35-е сутки животным вводили раствор овальбумина (200 мкг/мл, 25 мкл) внутрикожно, предварительно выбрив участок кожи на спине. Подтверждением наличия сенсибилизации было формирование отека и покраснения в месте инъекции. На 42-е сутки исследования проводили интраназальное введение раствора овальбумина (60 мг/мл, 20 мкл/ноздря). С целью контроля формирования именно аллергического воспаления была сформирована группа ложноиммунизированных животных: на 0, 7, 14 и 21 сутки свинки получали раствор гидроксида алюминия (5 мг/свинка), на 28-е и 35-е сутки - физ. раствор, на 42-е овальбумина (60 мг/мл, 20 мкл/ноздря).
1% раствор Соединения 1 вводили животным интраназально однократно за 1 ч или за 3 ч до интраназального введения овальбумина в объеме 10 мкл/ноздря. В течение 2 ч после последнего введения овальбумина проводили оценку клинических проявлений ринита: подсчитывали количество чихов, почесываний носа.
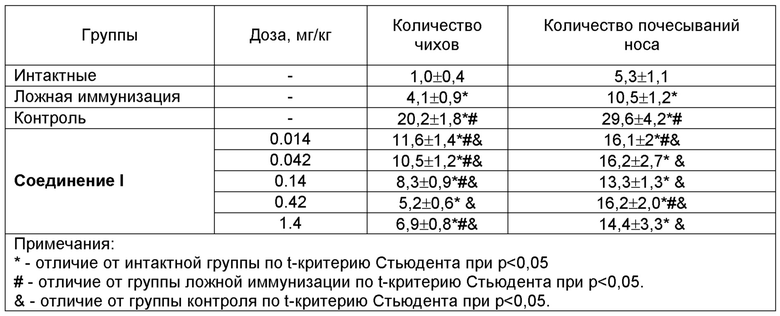
Таблица 2 - Клинические проявления патологии у морских свинок на экспериментальной модели аллергического ринита при назальном введении Соединения 1 (M±m, n=10)
* - отличие от интактной группы по t-критерию Стьюдента при p<0,05
# - отличие от группы ложной иммунизации по t-критерию Стьюдента при p<0,05.
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05
Учет клинических проявлений аллергического ринита в течение 2х часов после последнего интраназального введения овальбумина животным показал выраженное увеличение у экспериментальных животных количества чихов и почесываний носа, что свидетельствует о корректности реализованной модели аллергического ринита. Интраназальное введение 1% раствора Соединения 1 снижало количество клинических проявлений ринита (таблица 2). Терапевтический эффект в равной степени проявлялся при обоих режимах введения 1% раствора Соединения 1: при однократном введении за 1 ч до последнего интраназального введения овальбумина и при однократном введении за 3 ч до последнего интраназального введения овальбумина.
Полученные результаты дают основание заключить, что Соединение 1 оказывает выраженный терапевтический эффект при аллергическом рините. Длительность терапевтического эффекта составляет не менее 3 ч.
Пример 4. Исследование активности 1% раствора Соединения 1 при назальном введении на модели гистамин-индуцированной заложенности носа у морских свинок
Модель гистамин-индуцированной заложенности носа у морских свинок реализовали по стандартной методике [Slack RJ1, Russell LJ, Hall DA, Luttmann MA, Ford AJ, Saunders KA, Hodgson ST, Connor HE, Browning C, Clark KL. Pharmacological characterization of GSK1004723, a novel, long-acting antagonist at histamine H(1) and H(3) receptors// Br J Pharmacol. 2011. V. 164(6). P. 1627-1641]. Морских свинок наркотизировали, выделяли трахею и вставляли через нее канюлю в носоглотку. Канюлю подсоединяли к датчику давления и аппарату искусственного дыхания (Ugo Basile). Ингалировали раствор гистамина с концентрацией 0.2% в течение 3 минут. В течение 15 минут после окончания ингалирования раствора гистамина оценивали сопротивление воздушному потоку в носовых ходах. Соединение I вводили морским свинкам однократно интраназально в виде 1% раствора (10 мкл/ноздря) за 1 ч и 4 ч до начала ингаляции гистамина. Для объективной оценки был введен интегральный показатель - площадь под кривой (AUC), характеризующий сопротивление воздушному потоку в носовых ходах на временных точках - 0-15 минут.
Таблица 3 - Сопротивление потоку воздуха в носовых ходах у морских свинок на экспериментальной модели гистамин-индуцированной заложенности носа при назальном введении, см H2O×c, AUC(M±m)
AUC
* - отличие от интактной группы по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Однократное интраназальное введение 1% раствора Соединения 1 морским свинкам на модели гистамин-индуцированной заложенности носа существенно снизило сопротивление потоку воздуха в носовых ходах (таблица 3). Терапевтический эффект проявлялся при обоих режимах введения 1% раствора Соединения 1: при введении за 1ч до ингаляции гистамина и при введении за 4 ч до ингаляции гистамина.
Полученные результаты дают основание заключить, что 1% раствор Соединения 1 оказывает выраженный терапевтический эффект на модели гистамин-индуцированной заложенности носа у морских свинок. Длительность терапевтического эффекта составляет не менее 4 ч.
Пример 5. Исследование активности 1% раствора Соединения I при назальном введении на модели гистамин-индуцированной заложенности носа у собак
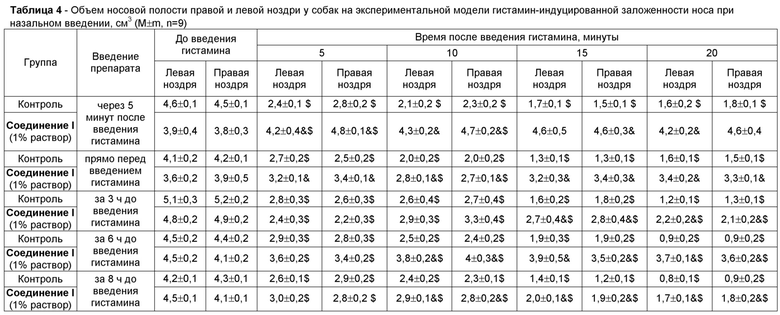
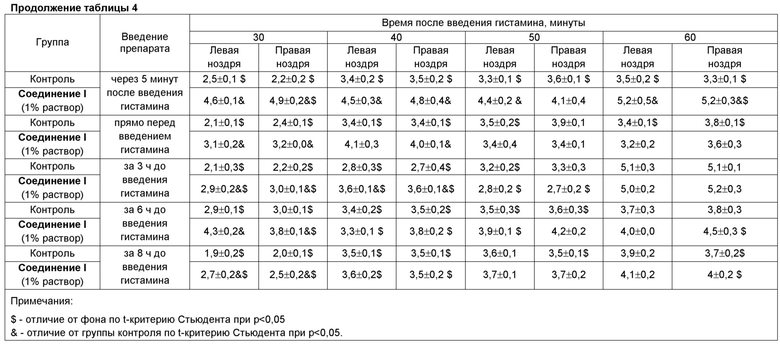
Модель гистамин-индуцированной заложенности носа у собак реализовали по стандартной методике [Tiniakov R.L., Tiniakova O.P., McLeod R.L., Hey J.A., Yeates D.B. Canine model of nasal congestion and allergic rhinitis// J Appl Physiol. 2003. V. 94(5). P. 1821-1828]. Собакам породы Бигль в носовую полость впрыскивали 5% раствор гистамина в объеме 250 мкл/ноздря. До введения гистамина, через 5, 10, 15, 20, 30, 40, 50 и 60 минут после введения гистамина с помощью ринометра производили измерение объема носовой полости правой и левой ноздри. Было проведено 5 экспериментов, в которых Соединение 1 вводили интраназально однократно в виде 1% раствора в объеме 50 мкл на разных временных сроках: 1) через 5 минут после введения гистамина; 2) прямо перед введением гистамина; 3) за 3 ч до введения гистамина; 4) за 6 ч до введения гистамина; 5) за 8 ч до введения гистамина.
Результаты проведенного исследования показали, что ингаляция 5% раствора гистамина собакам снижает объем носовой полости ноздрей животных. Однократное интраназальное введение 1% раствора Соединения 1 выраженно дозозависимо увеличило сниженный объем носовой полости ноздрей собак (таблица 4). Скорость наступления терапевтического эффекта введения Соединения 1 составила не более 5 минут, длительность терапевтического эффекта была не менее 8 ч.
Таким образом, Соединение 1 при интраназальном пути введения является сильным деконгестантом с высокой скоростью наступления эффекта и продолжительностью действия не менее 8 ч.
Пример 6. Исследование активности Соединения I при пероральном введении на модели гистамин-индуцированной заложенности носа у собак
Модель гистамин-индуцированной заложенности носа у собак проводили по стандартной методике [Tiniakov R.L., Tiniakova O.P., McLeod R.L., Hey J.A., Yeates D.B. Canine model of nasal congestion and allergic rhinitis// J Appl Physiol. 2003. V. 94(5). P. 1821-1828]. Собакам породы Бигль в носовую полость впрыскивали 5% раствор гистамина в объеме 250 мкл/ноздря. До введения гистамина, через 5, 10, 15, 20, 30, 40, 50 и 60 минут после введения гистамина с помощью ринометра производили измерение объема носовой полости правой и левой ноздри. Было проведено 3 эксперимента, в которых Соединение 1 вводили перорально однократно на разных временных сроках: 1) за 30 минут до введения гистамина; 2) за 1 ч до введения гистамина; 3) за 6 ч до введения гистамина, и один эксперимент, в котором Соединение 1 вводили перорально ежедневно 1 раз в сутки в течение 14 дней, последнее введение осуществляли за 1 ч до введения гистамина.
Результаты проведенного исследования показали, что ингаляция 5% раствора гистамина собакам снижает объем носовой полости ноздрей животных. Однократное пероральное введение Соединения 1 выраженно дозозависимо увеличило сниженный объем носовой полости ноздрей собак. Терапевтический эффект Соединение 1 оказывало как при введении за 30 минут, за 1 ч, так и за 6 ч до ингаляции гистамина (таблицы 5-7). Многократное ежедневное введение Соединения 1 в течение 14 дней также увеличивало сниженный объем носовой полости ноздрей собак. От длительности введения Соединения 1 выраженность терапевтического эффекта не менялась (таблица 8).
Полученные данные позволяют заключить, что Соединение 1 оказывает выраженный терапевтический эффект, снижая заложенность носа. Наступление терапевтического эффекта происходит в течение первых 30 минут после однократного введения Соединения 1, длительность эффекта составляет не менее 6 ч. Соединение I снижает заложенность носа как при однократном применении, так и при многократном. Толерантность к Соединению 1 не формируется.
Таблица 5 - Объем носовой полости правой и левой ноздри у собак на экспериментальной модели гистамин-индуцированной заложенности носа при пероральном введении за 30 минут до введения гистамина, см3 (M±m, n=9)
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Продолжение таблицы 5
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Таблица 6 - Объем носовой полости правой и левой ноздри у собак на экспериментальной модели гистамин-индуцированной заложенности носа при пероральном введении за 1 час до введения гистамина, см3 (M±m, n=9)
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Продолжение таблицы 6
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Таблица 7 - Объем носовой полости правой и левой ноздри у собак на экспериментальной модели гистамин-индуцированной заложенности носа при пероральном введении за 6 часов до введения гистамина, см3 (M±m, n=9)
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Продолжение таблицы 7
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Таблица 8 - Объем носовой полости правой и левой ноздри у собак на экспериментальной модели гистамин-индуцированной заложенности носа при пероральном введении в течение 14 дней, см3 (M±m, n=9)
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Продолжение таблицы 8
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
ноздря
$ - отличие от фона по t-критерию Стьюдента при p<0,05
& - отличие от группы контроля по t-критерию Стьюдента при p<0,05.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
Изобретение описывает применение соединения 1 или его фармацевтически приемлемой соли, гидрата или сольвата в качестве антагониста гистаминовых рецепторов третьего типа. Также раскрываются фармацевтическая композиция, содержащая соединение 1, способы предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, и применения соединения формулы 1. Технический результат заключается в получении эффективного антагониста гистаминового рецептора третьего типа, характеризующегося высокой активностью и фармокинетическими характеристиками, позволяющими использовать соединение 1 при применении для терапии аллергических заболеваний. 8 н. и 4 з.п. ф-лы, 8 табл., 6 пр.
 (1).
(1).
1.Применение соединения 1:
или его фармацевтически приемлемой соли, гидрата или сольвата в качестве антагониста гистаминовых рецепторов третьего типа.
2. Применение соединения 1

или его фармацевтически приемлемой соли, гидрата или сольвата в качестве антагониста гистаминовых рецепторов третьего типа, для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, включая аллергические расстройства, в частности круглогодичный или персистирующий аллергический ринит.
3. Фармацевтическая композиция для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, содержащая терапевтически эффективное количество соединения 1
 , или его фармацевтически приемлемой соли, гидрата или сольвата, и по меньшей мере один фармацевтически приемлемый носитель.
, или его фармацевтически приемлемой соли, гидрата или сольвата, и по меньшей мере один фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п.3, где расстройство, связанное с активностью гистаминового рецептора третьего типа, включает аллергическое расстройство, в частности круглогодичный или персистирующий аллергический ринит.
5. Применение соединения формулы 1
 или его фармацевтически приемлемой соли, гидрата или сольвата для получения фармацевтической композиции по п.3.
или его фармацевтически приемлемой соли, гидрата или сольвата для получения фармацевтической композиции по п.3.
6. Способ предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа, у субъекта, нуждающегося в таком лечении, включающий введение терапевтически эффективного количества соединения формулы 1
 или его фармацевтически приемлемой соли, гидрата или сольвата, указанному субъекту.
или его фармацевтически приемлемой соли, гидрата или сольвата, указанному субъекту.
9. Способ предупреждения и/или лечения круглогодичного или персистирующего аллергического ринита у субъекта, нуждающегося в таком лечении, включающий введение терапевтически эффективного количества соединения формулы 1
 или его фармацевтически приемлемой соли, гидрата или сольвата, указанному субъекту.
или его фармацевтически приемлемой соли, гидрата или сольвата, указанному субъекту.
10. Применение соединения формулы 1
 или его фармацевтически приемлемой соли, гидрата или сольвата для получения лекарственного средства для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа.
или его фармацевтически приемлемой соли, гидрата или сольвата для получения лекарственного средства для предупреждения и/или лечения расстройства, связанного с активностью гистаминового рецептора третьего типа.
11. Применение соединения формулы 1
 или его фармацевтически приемлемой соли, гидрата или сольвата, для получения лекарственного средства для предупреждения и/или лечения аллергического расстройства.
или его фармацевтически приемлемой соли, гидрата или сольвата, для получения лекарственного средства для предупреждения и/или лечения аллергического расстройства.
12. Применение по п.11, где расстройство представляет собой круглогодичный или персистирующий аллергический ринит.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| АСПАРТИЛЬНЫЕ ПРОИЗВОДНЫЕ ГИСТАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ ФЕРМЕНТОВ АНТИОКСИДАНТНОЙ ЗАЩИТЫ | 2005 |
|
RU2287524C1 |
Авторы
Даты
2019-04-17—Публикация
2018-05-24—Подача