Изобретение относится к области биотехнологии и может быть использовано для стимуляции регенерации глубоких ожоговых ран.
Ожоговые травмы являются важнейшей медико-социальной проблемой современного общества, что обусловлено их распространенностью, высокой смертностью, значительными показателями временных трудовых потерь и первичной инвалидности. Ожоги находятся на 4 месте в мире среди наиболее распространенных видов травмы. По оценкам ВОЗ ежегодно происходит 265 000 случаев смерти, вызванных ожогами [1]. В Российской Федерации термические ожоги занимают третье место среди прочих травм [2]. Ежегодно регистрируется более 800 тыс. ожоговых больных. Частота термических ожогов составляет 300-350 случаев на 10 тыс. населения, из них 190-200 тыс. госпитализируются, около 15 тыс. пострадавших погибают [3].
Высокая смертность и инвалидизация ожоговых больных приводит к необходимости создания новых высокоэффективных способов терапии. Новые подходы должны обеспечивать быстрое закрытие кожных дефектов при обширных ожогах, восстановление правильной структуры всех слоев кожи при глубоких ожогах, отсутствие/минимизацию рубцов - эстетический эффект для возвращения пациента к обычному образу жизни. Также немаловажным является экономический аспект: метод должен быть финансово выгоден для применения в государственных учреждениях здравоохранения.
Широкие возможности применения клеточных технологий в области регенеративной медицины делают их одним из наиболее перспективных направлений для терапии ожоговых ран.
На данный момент известен способ лечения ожоговых ран, разработанный в Научно-исследовательском институте скорой помощи им. Н.В. Склифософского (RU №2373944, опубл. 27.11.2009) [4]. Данный способ заключается в использовании повязки, основание которой выполнено из гидрофобной перфорированной кремнийорганической пленки «Карбосил-П», покрытой слоем человеческого коллагена I типа и аллогенными фибробластами человека. При этом в качестве аллогенных фибробластов используют охарактеризованные клетки линии диплоидных фибробластов человека М-22 на уровне пассажей №15-22. Способ позволяет обеспечить быстрое полноценное восстановление эпителия всей поверхности раны с хорошим функциональным и косметическим результатом, а также предотвратить развитие гнойно-некротических осложнений. Между тем данный подход применим лишь при ожогах не более IIIа степени, не охватывая глубокие ожоговые раны IIIб степени.
Также в Научно-исследовательском институте скорой помощи им. Н.В. Склифософского разработан способ восстановления кожного покрова у пациентов с обширными ранами с дефектом мягких тканей (RU №2526814, опубл. 27.08.2014) [5]. Метод заключается трансплантации в дно раны аллогенных мезенхимальных мультипотентных стромальных клеток (ММСК) в виде суспензии при помощи инъекций на глубину 0,1-0,3 мм с частотой 10 инъекций на 1 см2. Затем моделируют дермальный матрикс, изготовленный из кожи донора-трупа, по форме раны. Перфорируют его для создания путей раневого отделяемого, укладывают на дно раны. Затем рану укрывают стерильной марлевой повязкой. Необходимо отметить, что данный подход подразумевает использование столовых клеток, полученных из костного мозга донора. Это сопровождается рядом недостатков, связанных с инвазивностью получения материала, высокой стоимостью выделения и культивирования клеток, а также необходимостью подтверждения инфекционной безопасности образца.
Альтернативный подход к терапии повреждений кожных покровов, заключающийся в применении клеточного импланта, предложен коллективом ЗАО “Биннофарм” (RU106528, опубл. 20.07.2010) [6]. Клеточный имплант выполнен в виде живого эквивалента кожи. Он содержит подложку биоматрикса, образующую трехмерный каркас и являющийся стромой для новой формирующейся ткани. Подложка биоматрикса выполнена из биосовместимого биополимера. Внутри подложки биоматрикса распределены аллогенные мезенхимальные клетки человека. В качестве аллогенных мезенхимальных клеток человека используют фибробласты или мультипотентные мезенхимальные стромальные клетки жировой ткани или их смесь. Сверху подложка покрыта слоем эпидермальных кератиноцитов, выделенных из биоптатов кожи, полученных в результате косметологических операций. Однако данный подход включает в себя применение донорского биоматериала, что сопряжено с необходимостью проверки его безопасности.
В качестве прототипа был выбран способ модификации моноцитов периферической крови для повышения их паракринной активности при аутологической трансплантации (RU 2497947, опубл. 10.11.2013) [7]. Способ модификации включает в себя выделение фракции моноцитов периферической крови. Клетки культивируют в питательной среде с добавлением 20 нг/мл IL-4 и 20 нг/мл GM-CSF. При этом модификацию моноцитов осуществляют путем стимуляции негидролизируемым аналогом аденозина NECA (5'-N-этилкарбоксамидоаденозина) в концентрации 100 мкМ при инкубации клеток в CO2-инкубаторе во влажной атмосфере 5% CO2 при +37°C в течение 72 часов. Изобретение позволяет провести модификацию клеток периферической крови с целью повышения их репаративного потенциала при аутологической трансплантации. Эффективность модифицированных таким образом клеток продемонстрирована в исследовании in vivo на ожоговой ране у крыс. Необходимо отметить, что использование данного метода подразумевает введение клеток сразу после окончания времени культивирования, что является препятствием для применения подхода в клинической медицине.
Альтернативным решением может быть использование модифицированных клеток после криоконсервации, что позволит использовать в клинической практике предварительно замороженные готовые к трансплантации клетки.
Новая техническая задача – разработка метода криоконсервации модифицированных аденозином моноцитов и проверка сохранения их регенеративного потенциала.
Для решения поставленной задачи предлагается криоконсервировать аденозин-модифицированные моноциты в бессывороточной криоконсервационной среде Bambanker (Lymphotech, Япония) с последующим хранением при -196°C. После чего клетки размораживать при +37°C на водяной бане. Далее 2 раза отмыть раствором Хэнкса от остатков криоконсервационной среды. После чего клетки ресуспендировать в физиологическом растворе и ввести подкожно вокруг области повреждения.
Изобретение поясняется чертежами:
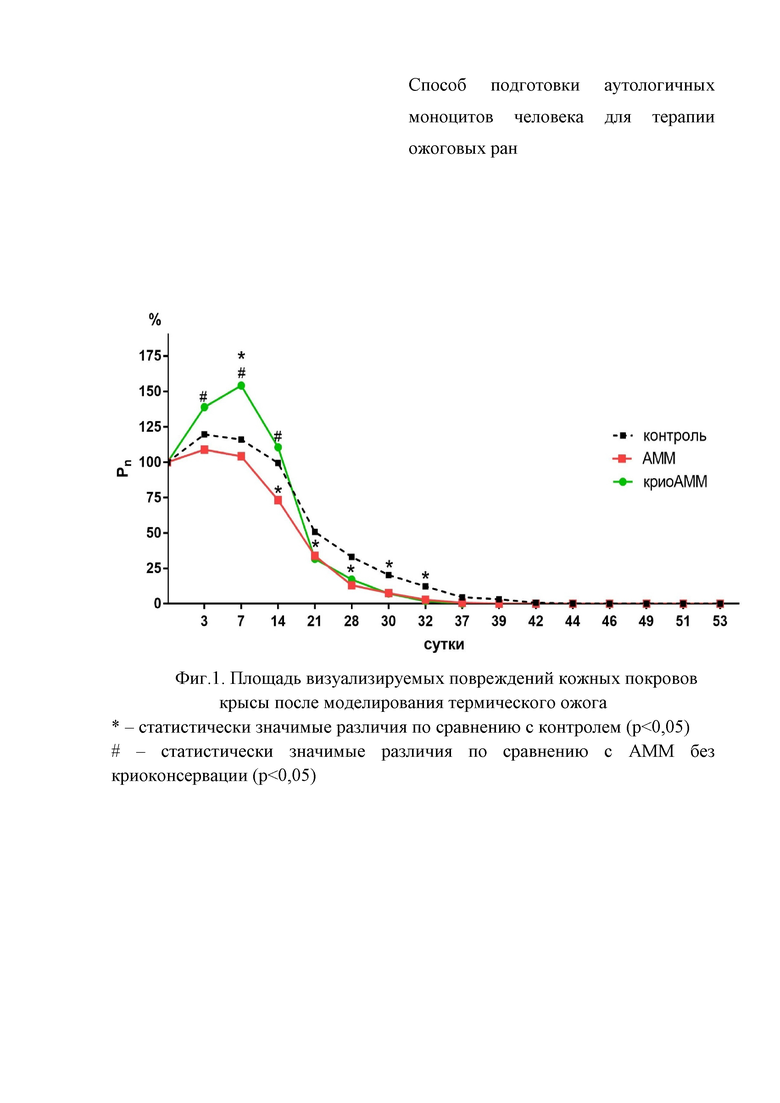
Фигура 1. Площадь визуализируемых повреждений кожных покровов крысы после моделирования термического ожога
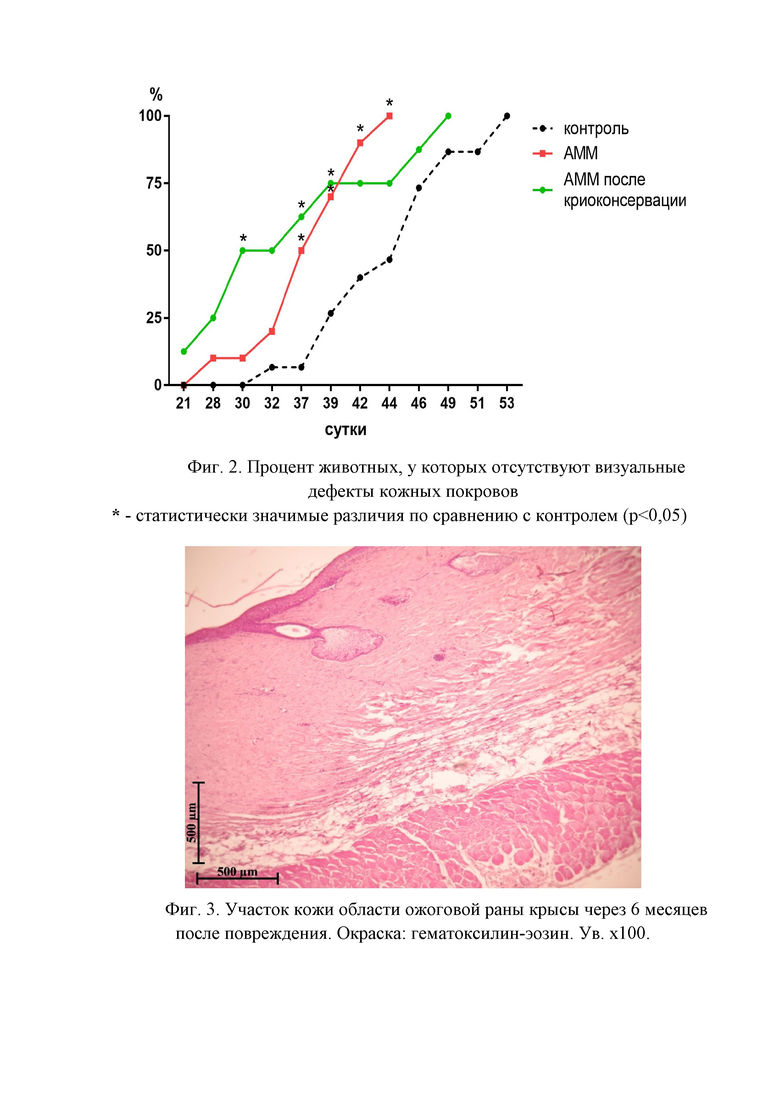
Фигура 2. Процент животных, у которых отсутствуют визуальные дефекты кожных покровов.
Фигура 3. Участок кожи области ожоговой раны крысы через 6 месяцев после повреждения. Окраска: гематоксилин-эозин. Ув. х100.
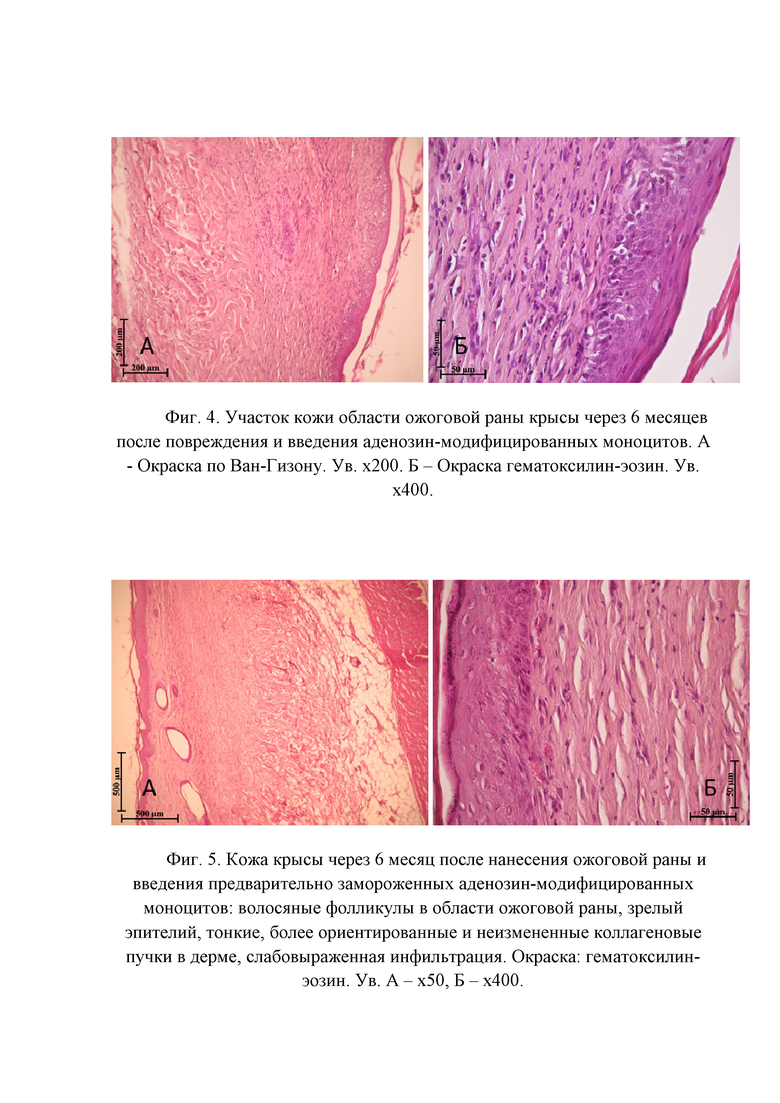
Фигура 4. Участок кожи области ожоговой раны крысы через 6 месяцев после повреждения и введения аденозин-модифицированных моноцитов. А - Окраска по Ван-Гизону. Ув. х200. Б – Окраска гематоксилин-эозин. Ув. х400.
Фигура 5. Кожа крысы через 6 месяц после нанесения ожоговой раны и введения предварительно замороженных аденозин-модифицированных моноцитов: волосяные фолликулы в области ожоговой раны, зрелый эпителий, тонкие, более ориентированные и неизмененные коллагеновые пучки в дерме, слабовыраженная инфильтрация. Окраска: гематоксилин-эозин. Ув. А – х50, Б – х400.
Способ включает в себя выделение моноцитарной фракции клеток крови методами градиентного центрифугирования (градиент фиколла; двойной градиент перколла), которую затем культивируют в питательной среде с IL-4, GM-CSF, NECA (5`-N-карбоксамидоаденозина) в течение 72 часов. По окончании времени культивирования клетки замораживают в бессывороточной криоконсервационной среде при -80°C на 24 часа, после чего перемещают в жидкий азот (-196°C) для длительного хранения. Введение таких клеток ускоряет процесс регенерации ожоговой раны.
Способ осуществляют следующим образом:
1. Выделение моноцитов из венозной крови донора.
В стерильных центрифужных пробирках объемом 50 мл разбавляют венозную кровь 1:1 раствором Хэнкса («ПанЭко», Россия). Под 30 мл полученной смеси подслаивают 13 мл раствора фиколла (1,077 г/мл, «ПанЭко», Россия). Полученный градиент центрифугируют в течение 30 минут с ускорением 500g при температуре 20ºС. Далее собирают мононуклеарную фракцию на границе раздела фаз и переносят в новые стерильные центрифужные пробирки. Для отмывки полученных клеток от примесей фиколла объем клеточной суспензии доводят до 50 мл раствором Хэнкса и центрифугируют 20 минут с ускорением 165g при температуре 20ºС. С помощью аспиратора удаляют супернатант, осажденные клетки ресуспендируют в 1 мл раствора Хэнкса. Полученный объем смеси повторно доводят до 50 мл раствором Хэнкса и центрифугируют 20 минут с ускорением 165g при температуре 20ºС.
Выделение моноцитов из фракции мононуклеаров проводят методом центрифугирования в двойном градиенте плотности перколла (1,131г/см3, «Sigma», США). Готовят 10-кратный забуференный фосфатный раствор: 25 г NaCl, 0,25 г Na2HPO4, 4,2 г KH2PO4 доводят дистиллированной водой до 400 мл, pH=7,2-7,4. Далее готовят стандартный изотонический раствор перколла (с плотностью 1,123 г/мл): к 1 мл 10-кратного забуференного фосфатного раствора добавляют 9 мл перколла с плотностью 1,131 г/мл. После чего готовят раствор перколла с плотностью 1,064 г/мл (5226 мкл стандартного изотонического раствора перколла смешивают с 5776 мкл RPMI) и 1,032 г/мл (750 мкл стандартного изотонического раствора перколла смешивают с 4250 мкл RPMI).
Полученные после отмывки от фиколла мононуклеары ресуспендируют в 1 мл среды RPMI. Добавляют 1,5 мл стандартного изотонического раствора перколла. Полученную смесь переносят в новые 15 мл стерильные центрифужные пробирки. С помощью одноразового шприца наслаивают 5 мл раствора перколла с плотностью 1,064 г/мл, после чего сверху наслаивают 2 мл раствора перколла с плотностью 1,032 г/мл. Полученный градиент центрифугируют в течение 50 минут с ускорением 2060g при температуре 20ºС. Верхнее кольцо, содержащее фракцию моноцитов, собирают пастеровской пипеткой и переносят в чистую 50 мл пробирку. Объем клеточной суспензии доводят раствором Хэнкса до 30 мл. Центрифугируют в течение 15 минут с ускорением 660g при температуре 20ºС. После отмывки от перколла проводят подсчет количества клеток в камере Горяева.
2. Стимуляция и культивирование моноцитов.
Клеточную суспензию помещают в 24-луночные пластиковые культуральные планшеты из расчета 0,5 млн клеток в 1 мл полной питательной среды на лунку. Полная питательная среда состоит из 450 мл среды RPMI-1640 («ПанЭко», Россия), 5 мл пирувата натрия (11 мг/мл) («ПанЭко», Россия), 146 мг глутамина («ПанЭко», Россия), 50 мл эмбриональной телячьей сыворотки («HyClone», США), 3 мкл β-меркаптоэтанола («Sigma», США), 50000 ед/литр пенициллина («Панэко», Россия), 50 мг/л стрептомицина («Панэко», Россия), 20 нг/мл IL-4 («ProSpec», США) и 20 нг/мл GM-CSF («ProSpec», США). Для стимуляции клеток добавляют негидролизуемый аналог аденозина - NECA («Sigma», США) в концентрации 100 мкМ и инкубируют в СО2 - инкубаторе во влажной атмосфере 5% СО2 при +37˚С в течение 72 часов.
3. Криоконсервация аденозин-модифицированных моноцитов.
По окончании времени культивирования неадгезированную фракцию клеток собирают в новые пробирки и центрифугируют в течение 10 минут с ускорением 660g при температуре 20ºС. Надосадочную жидкость аспирируют, а клеточный осадок ресуспендируют в 1 мл бессывороточной среды Bambanker (Lymphotech, Япония). Полученную суспензию переносят в криопробирки и незамедлительно переносят в низкотемпературный морозильник (-80°C) на 24 часа, после чего помещают в криохранилище с жидким азотом на длительное хранение.
4. Подготовка аденозин-модифицированных моноцитов к введению в поврежденную область
Описанным выше способом выделяли, стимулировали, культивировали и криоконсервировали моноциты крыс линии Wistar. Через 12 недель после криоконсервации клетки размораживали на водяной бане при +37°C. Клеточную суспензию переносили в новые 15 мл пробирки, доводили объем до 10 мл раствором Хэнкса и центрифугировали в течение 10 минут с ускорением 660g при температуре 20ºС. Надосадочную жидкость аспирировали, а осадок ресуспендировали в 1мл раствора Хэнкса, доводили объем до 10 мл и в течение 10 минут с ускорением 660g при температуре 20ºС. Надосадочную жидкость аспирировали, а осадок ресуспендировали из расчета 0,2 млн клеток в 1 мл физиологического раствора.
5. Исследование регенеративного потенциала аденозин-модифицированных моноцитов после криоконсервации и отдаленных последствий их введения на модели ожоговой раны.
Для оценки регенеративного потенциала клеток после криоконсервации проводили исследование in vivo на модели ожоговой раны у крыс.
С этой целью у 35 предварительно наркотизированных крыс контактным способом моделировали термический ожог IIIб степени площадью 4,9 см2, что соответствует 1% площади поверхности животного. После чего животных произвольным образом делили на 3 группы:
1) контрольная группа – вокруг области ожога подкожно вводили 1 мл стерильного физиологического раствора (15 животных);
2) опытная группа №1 - вокруг области ожога подкожно вводили 1 мл суспензии аденозин-модифицированных моноцитов в физиологическом растворе (10 животных);
3) опытная группа №1 - вокруг области ожога подкожно вводили 1 мл суспензии аденозин-модифицированных моноцитов после криоконсервации в физиологическом растворе (10 животных).
Далее рану закрывали стерильной повязкой на нетканой основе (Silcofix, Египет). Для оценки динамики регенерации через 3, 7, 14, 21 суток после моделирования ожога, далее с интервалом в 2 дня до 53 суток, были сделаны снимки области ожоговой раны. Анализ области повреждения проводили с использованием компьютерной программы ImageJ (National Institutes of Health, США).
При проведении планиметрического анализа с 3 по 14 сутки после ожога наблюдали пик воспалительной реакции, что сопровождалось увеличением визуальных дефектов кожных покровов. Наиболее интенсивная реакция отмечалась в группе с введением аденозин-модифицированных после криоконсервации, а наименьшая – в группе, где вводили аденозин-модифицированные моноциты без криоконсервации. Однако после 14 суток воспалительная реакция снижалась, и площадь визуализируемых дефектов кожных покровов в группе введения клеток после криоконсервации становилась сопоставима с группой клеток без криоконсервации. В период с 21 по 32 сутки площадь дефектов в этих группах была статистически значимо меньше, чем в группе контроля. После 39 суток площадь дефектов во всех исследуемых группах была сопоставима и крайне незначительна (от 0,02 до 0,6 см2) (Фигура 1).
Кроме того, начиная с 21 суток, оценивали процент животных с полной регенерацией, то есть животных, у которых не визуализировались дефекты кожных покровов. Так в группе введения аденозин-модифицированных моноцитов без криоконсервации средний срок заживления составил 37 суток, в группе введения моноцитов после криоконсервации – 35 суток, в контроле – 44 суток. Таким образом, регенеративный потенциал аденозин-модифицированных моноцитов без криоконсервации и аденозин-модифицированных после криоконсервации оказался сопоставим, а темпы регенерации в обеих опытных группах были выше, чем в контроле (Фигура 2).
Для оценки отдаленных последствий введения клеток животных экспериментальных групп выводили из эксперимента через 6 месяцев после моделирования ожога. При гистологическом анализе препаратов установлено, что у животных контрольной группы дерма, сформировавшаяся в области ожоговой раны, имеет высокую клеточность, содержит обилие капилляров и, в некоторых случаях, лимфоцитарную инфильтрацию с единичными макрофагами и эозинофилами (Фигура 3). Поверхность раны покрыта зрелым эпидермисом, несколько утолщенным и, в редких случаях, инфильтрированным единичными лимфоцитами. Местами эпидермис утолщен за счет слоя шиповатых клеток, в которых отмечается перинуклеарный отёк. В группе животных, которым в область ожоговой раны вводили аденозин-модифицированные моноциты, также формируется атрофический рубец, однако, коллагеновые волокна местами имеют нормальное строение (Фигура 4). Волосяные фолликулы и сальные железы отсутствуют в незначительных размерах центрально расположенной зоны, которая не определяется у части животных. Таким образом, у некоторых животных сложно определить, где была нанесена ожоговая рана, и данная зона отличается только меньшей толщиной дермы. Морфологическая картина ожоговой раны через 6 месяцев после повреждения и введения предварительно замороженных аденозин-модифицированных моноцитов соответствует таковой при введении аденозин-модифицированных моноцитов без замораживания, однако, отличается меньше степенью выраженности эффектов, что, вероятнее всего, может быть скорректировано увеличением количества введенных клеток или дополнительной их обработкой после размораживания (Фигура 5).
Таким образом, введение аденозин-модифицированных моноцитов после криоконсервации вокруг области ожоговой раны стимулирует регенеративные процессы в поврежденной ткани, а также способствует восстановлению нормальной структуры кожи. Полученные результаты свидетельствуют о перспективности данного направления для применения в клинической практике для терапии глубоких термических ожогов.
Источники информации:
1. Ожоги [Электронный ресурс]. Информационный бюллетень ВОЗ №365. – 2016. – URL: http://www.who.int/mediacentre/factsheets/fs365/ru/.
2. 2. Пономарева Н.А., Воробьев А.В., Жегалов В.А., Перетягин С.Н. История и этапы развития комбустиологической службы в России //Здравоохранение Российской Федерации. 2009. №6. С. 45-48.
3. Патогенез типовых реакций организма на травму / Н.П. Чеснокова, П.В. Глыбочко, В.Ю. Барсуков и др. – Саратов: Изд-во СМУ, 2011. – 230 c.
4. Патент RU 2373944 «Способ лечения ожоговой раны» / Ермолов А.С., Смирнов С.В., Хватов В.Б., Миронова Л.Л., Конюшко О.И., Жиркова Е.А., Бочарова В.С.
5. Патент RU 2526814 «Способ восстановления кожного покрова у пациентов в обширными ранами с дефектом мягких тканей (варианты)» / Хбутия М.Ш. Боровкова Н.В,, Хватов В.Б., Филиппов О.П,, Клюквин И.Ю., Похитонов Д.Ю., Пономарев И.Н., Андреев Ю.В., Миронов А.С., Конюшко О.И.
6. Патент RU 106528 «Клеточный имплант для восстановления дефектов кожного покрова» / Терских В.В., Васильев А.В., Роговая О.С., Киселева Е.В., Дашинимаев Э.Б., Ивашкин А.Н.
7. Патент RU 2497947 «Способ модификации моноцитов периферической крови для повышения их паракринной активности при аутологической трансплантации» / Сазонов А.Э., Юрьева К.С., Хворилова К.В., Кремер Е.Э., Иккерт О.П., Салтыкова И.В.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДИФИКАЦИИ МОНОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ ДЛЯ ПОВЫШЕНИЯ ИХ ПАРАКРИННОЙ АКТИВНОСТИ ПРИ АУТОЛОГИЧЕСКОЙ ТРАНСПЛАНТАЦИИ | 2012 |
|
RU2497947C1 |
| СПОСОБ НАГРУЗКИ ДЕНДРИТНЫХ КЛЕТОК АНТИГЕНОМ ИНФЕКЦИОННОГО ПРОИСХОЖДЕНИЯ Opisthorchis felineus | 2011 |
|
RU2486238C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТЯЖЕЛОЙ БРОНХИАЛЬНОЙ АСТМЫ | 2012 |
|
RU2497117C2 |
| Способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга | 2020 |
|
RU2748539C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКИХ ЦЕЛЕЙ | 2009 |
|
RU2398873C1 |
| КОМПОЗИЦИЯ ДЛЯ РЕГЕНЕРАЦИИ КЛЕТОК КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2010 |
|
RU2455354C1 |
| Способ стимуляции заживления ожоговых травм в эксперименте | 2023 |
|
RU2811662C1 |
| Лекарственный препарат в виде золя для лечения заболевания и/или состояния, характеризующегося нарушением целостности кожного покрова, и способ его получения | 2019 |
|
RU2742752C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА АМНИОТИЧЕСКОЙ МЕМБРАНЫ ДЛЯ ПОСЛЕДУЮЩЕЙ РЕКОНСТРУКЦИИ ДЕФЕКТОВ ТКАНЕЙ | 2020 |
|
RU2751353C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ КОСМЕТИЧЕСКИХ ДЕФЕКТОВ КОЖИ (ВАРИАНТЫ) | 2004 |
|
RU2271818C1 |
Изобретение относится к области биотехнологии, в частности к подготовке аутологичных моноцитов человека для терапии ожоговых ран. Способ включает выделение моноцитов венозной крови методами градиентного центрифугирования (на градиенте фиколла и двойном градиенте перколла). Затем осуществляют стимулирование 100 мкМ негидролизуемого аналога аденозина 5’-N-этилкарбоксамидоаденозном в присутствии 20 нг/мл IL-4 и 20 нг/мл GM-CSF, культивирование в течение 72 ч в CO2-инкубаторе во влажной атмосфере 5% CO2 при +37°C, после чего замораживают в бессывороточной среде Bambanker с последующим хранением 24 ч при температуре -80˚С и далее в жидком азоте при -196°С. Изобретение позволяет расширить арсенал средств. 5 ил., 1 пр.
Способ подготовки аутологичных моноцитов человека для терапии ожоговых ран, включающий выделение моноцитов венозной крови, стимуляцию аналогом аденозина NECA, культивирование и криоконсервацию, отличающийся тем, что моноциты выделяют методами градиентного центрифугирования (на градиенте фиколла и двойном градиенте перколла), стимулируют 100 мкМ негидролизуемого аналога аденозина 5’-N-этилкарбоксамидоаденозном в присутствии 20 нг/мл IL-4 и 20 нг/мл GM-CSF, культивируют в течение 72 ч в CO2-инкубаторе во влажной атмосфере 5% CO2 при +37°C, после чего замораживают в бессывороточной среде Bambanker с последующим хранением 24 ч при температуре -80°С и далее в жидком азоте при -196°С.
| НЕВСКАЯ К.В | |||
| "Роль модифицированных аденозоном моноцитов в репаративной регенерации кожи при ожоговой травме", ГБОУ ВПО "Сибирский государственный медицинский университет" МЗ РФ, дисс | |||
| канд.мед.наук | |||
| Томск, 2015 | |||
| Упругое экипажное колесо | 1918 |
|
SU156A1 |
| ХАРЧЕНКО Н.В | |||
| "Выделение бифидобактерий и изучение их пробиотических свойств при длительном хранении", МГУ им | |||
| М.В | |||
| Ломоносова, дисс | |||
| канд.биол.наук | |||
| Москва, 2016 | |||
| Топливник с глухим подом | 1918 |
|
SU141A1 |
Авторы
Даты
2019-04-18—Публикация
2017-09-29—Подача