ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам и композициям для лечения причин дисмиелинизации и/или демиелинизации нейронов и/или предупреждения развития обусловленных миелином и аксонами заболеваний и/или для стимуляции ремиелинизации путем введения индивидууму, нуждающемуся в этом, эффективного количества (либо терапевтического, либо профилактического) и концентрации наносуспензии элементарного золота и в предпочтительном варианте осуществления суспензии поверхностно чистых нанокристаллов на основе золота, описанных в настоящем описании.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Демиелинизирующее заболевание представляет собой любое заболевание центральной нервной системы ("ЦНС") и/или периферической нервной системы ("ПНС"), при котором повреждается миелиновая оболочка нейронов. Повреждение миелиновой оболочки, как правило, неблагоприятно влияет на передачу сигналов в пораженных нервах и/или приводит к некоторому типу аномальной или ухудшенной работы лежащего под ней нейрона(ов). Ассоциированное повреждение миелина приводит к дефициту одного или нескольких из: чувствительности, когнитивной деятельности, двигательных навыков или других функций в зависимости от того, какие нейроны/миелиновые оболочки повреждены или не являются нормальными.
Точные механизмы демиелинизации и дисмиелинизации не до конца понятны. Известно, что миелин является жизненно необходимой белковой оболочкой нейронов как в центральной нервной системе, так и в периферической нервной системе. Этот жизненно необходимой белок образует оболочку, как правило, называемую "миелиновой оболочкой" вокруг множества нейронов млекопитающего. Миелиновые оболочки, которые являются здоровыми и не являются дефектными, обеспечивают быстроту и полноту сигналов, поскольку здоровая миелиновая оболочка позволяет электрическим потенциалам быстро передаваться аксонами нейронов; и/или обеспечивает здоровую структуру и/или функцию находящихся под ней нейронов, например, трофическую и метаболическую поддержку. Когда миелин удаляется частично или полностью с аксонов (например, демиелинизация), фактическая потенциальная скорость сигналов может замедляться на >> чем в 30 раз относительно нормальной скорости в присутствии миелина.
Кроме того, миелиновая оболочка образуется некоторой структурой, которая известна как плазмалемма глиальных клеток (например, олигодендроциты в центральной нервной системе и шванновские клетки в периферической нервной системе), также известная как плазматическая мембрана. Миелиновые оболочки образуются относительно быстро в процессе активной фазы миелинизации. В частности, олигодендроциты в центральной нервной системе должны продуцировать достаточно миелина для достижения естественной "ремиелинизации" в процессе нормального здорового функционирования. Таким образом, является важным, чтобы вновь синтезированный миелин продуцировался на регулярной основе.
Во взрослой ЦНС ремиелинизация вовлекает образование новых миелиновых оболочек вокруг обнаженных аксонов. Непосредственное последствие ремиелинизации включает надлежащее перераспределение ионных каналов в перехватах Ранвье, а также восстановление сальтаторной проводимости. Таким образом, ремиелинизация частично компенсирует увеличенную потребность в энергии, которая наблюдается в результате сниженного содержания митохондрий в аксонах. Кроме того, ремиелинизация приводит к устранению функциональных дефицитов, вызванных демиелинизацией. Также свидетельства указывают на то, что демиелинизированные аксоны лучше защищены от последующего повреждения, когда они становятся ремиелинизированными. Такая ремиелинизация может восстанавливать надлежащую передачу сигнала факторами роста между олигодендроцитом и аксоном. Также существуют свидетельства того, что симбиотическая взаимосвязь между аксоном и олигодендроцитом является активной и роль миелина состоит не только в электроизоляции. В частности, аксоны могут стать интенсивно поврежденными, когда клеточные тела олигодендроцитов являются мишенью для разрушения, даже в отсутствие какой-либо заметной демиелинизации. Такой процесс может приводить к дисмиелинизации или дисфункции.
Демиелинизация или дисмиелинизация ассоциирована с большим числом как приобретенных нарушений, так и наследственных состояний центральной нервной системы и периферической нервной системы.
Экспериментальные системы, которые создают набор условий в попытках получить животного, которое коррелирует с или имитирует по меньшей мере некоторые из механизмов/результатов, ответственных или ассоциированных с заболеваниями человека, хорошо известны. Одна из этих систем известна как модель на животных с купризоном15. Эта "модель токсической демиелинизации" приводит к изменениям морфологии митохондрий и полагают, что нейротоксические свойства этого хелатирующего медь соединения являются следствием нарушения клеточного дыхания.9 Индуцируемая купризоном демиелинизация является результатом скорее дегенерации поддерживающих олигодендроцитов, чем прямой атаки на миелиновые оболочки.10, 11, 12
Более того, механизмы, ответственные за гибель олигодендроглии в очагах повреждения при MS, неясны. Остается под вопросом, являются сходные патологические механизмы ответственными за утрату олигодендроглии в очагах повреждения при рассеянном склерозе ("MS") и в модели с купризоном9. MS в настоящее время считается нарушением с множеством различных аспектов и признаков. Эксперты в данной области сомневаются в том, что индуцируемая купризоном демиелинизация моделирует утрату миелина у людей-пациентов с MS9. Конкретный патогенез MS остается неизвестным.
Кроме того, нарушения и заболевания, которые включают демиелинизацию, которая может быть ассоциирована с моделями токсической демиелинизации, такими как модель на животных с купризоном, включают прогрессирующий надъядерный паралич, болезнь Александера, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Канавана, лейкодистрофии, энцефаломиелит, центральный понтинный миелинолиз (CPM), болезнь анти-MAG, болезнь Пелицеуса-Мерцбахера, болезнь Рефсума, синдром Кокейна, синдром Цельвегера, синдром Гийена-Барре (GBS), синдром Ван дер Кнаппа, хроническую воспалительную демиелинизирующую полиневропатию (CIDP), многоочаговую двигательную невропатию (MMN), оптический нейромиелит (NMO), прогрессирующую многоочаговую лейкоэнцефалопатию (PML), уоллеровское перерождение и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александера, мягкое когнитивное нарушение (MCI), также известное как старческое снижение когнитивных способностей и болезнь Пелицеуса-Мерцбахера (PMZ). Для многих из этих вышеупомянутых нарушений существует мало или не существует способов излечения и существует очень мало, или даже не существует, эффективных способов терапии.
Оптический нейромиелит (NMO), также иногда называют болезнью Дэвика.
NMO представляет собой нарушение центральной нервной системы (ЦНС), которое в основном поражает оптический нерв и спинной мозг пациентов. NMO представляет собой одно из основных нейроиммунологических заболеваний в Азии.
В сыворотке пациентов с NMO был обнаружен NMO-иммуноглобулин G (IgG), который связывается с или вблизи гематоэнцефалического барьера в головном мозге мыши. В качестве эпитопа NMO-IgG был идентифицирован аквапорин-4 (AQP4), водный канал, плотно экспрессируемый в астроцитарных ножках в гематоэнцефалическом барьере.
NMO характеризуется возникновением тяжелого оптического неврита и миелита, по большей части наблюдаемого в качестве продольно распространенного поперечного миелита (LETM), оба из которых иногда возникают одновременно, а иногда возникают последовательно. Большинство пациентов с NMO имеют аутоантитела против AQP4 в их сыворотке. Таким образом, диагностические критерии NMO требуют присутствия как оптического неврита, так и миелита, и удовлетворения по меньшей мере двух из трех вспомогательных критериев: признаки на MRI непрерывного очага повреждения спинного мозга на протяжении трех или более сегментов позвоночника; отрицательные результаты диагностических критериев для MS на MRI34 головного мозга, проведенном при возникновении; и сероположительный результат в отношении NMO-IgG (или антитела против AQP4).
Таким образом, NMO в настоящее время считается опосредуемой антителами против AQP4 астроцитопатией, и он отличается от демиелинизирующего нарушения, такого как MS. Однако, млекопитающие, имеющие NMO, отчетливо демонстрируют патологические результаты демиелинизации или дисмиелинизации.
Сравнение регенерации при ПНС и ЦНС
Исторически полагают, что регенерация нервов значительно более эффективна в ПНС, чем в ЦНС. Исследователи некогда предположили, что нейроны ЦНС просто имеют меньшую имманентную способность регенерировать, однако эта парадигма была оспорена путем открытия, что нейроны ЦНС могут расти через трансплантат периферического нерва. Сравнения этих двух систем показали, что ингибиторное окружение ЦНС является наибольшей проблемой для регенерации аксонов ЦНС, и привели к открытию нескольких факторов, которые стимулируют рост в ПНС или ингибируют рост в ЦНС. Например, как миелин олигодендроцитов, так и миелин шванновских клеток содержит ингибиторные молекулы. В ЦНС прорастание аксонов также блокируется в области повреждения глиальным рубцом, который состоит из реактивных астроцитов и микроглии. Напротив, в ПНС не образуется глиальных рубцов, и ленты Бюнгнера, образуемые шванновскими клетками, фактически способствуют аксональному наведению и регенерации. Понимание этих важных отличий в регенерации ЦНС и ПНС может помочь сформировать стратегии для повышения регенерации в непермиссивной среде, а именно, в ЦНС и хронически денервированной ПНС.
Остается существенная потребность в материалах и/или способах лечения, для способствования остановке или замедлению демиелинизации или дисмиелинизации и/или для стимуляции ремиелинизации и/или сохранения или восстановления функционирования миелина и/или аксонов.
ОПРЕДЕЛЕНИЯ
На протяжении настоящего описания и формулы изобретения слово "содержать" или его варианты, такие как "содержит" или "содержащий", указывают на включение какого-либо указанного целого числа или группы целых чисел, но не исключение какого-либо другого целого числа или группы чисел. Термин "содержащий" является инклюзивным или открытым и не исключает дополнительных неуказанных элементов или стадий способа. Выражение "по существу состоящий из" указывает на включение указанных материалов или стадий, а также материалов или стадий, которые не оказывают существенного влияния на основные и новые характеристики заявленного изобретения. Как используют в рамках изобретения, термин "состоящий" относится только к указанному материалу или стадиям способа.
Как используют в рамках изобретения, "терапевтически эффективное количество" относится к количеству, эффективному, при необходимых концентрациях нанокристаллов золота и объеме суспензии, и в течение необходимых периодов времени и/или при необходимой дозировке, для достижения желаемого терапевтического результата. Желаемый терапевтический результат может включать, но не ограничивается ими, уменьшение симптомов, продление выживания, повышение подвижности или функции, снижение тяжести рецидивов, более длительные периоды ремиссии или сходные с ними. "Терапевтически эффективное количество" может достигать любого из желаемых терапевтических результатов или комбинации множества желаемых терапевтических результатов. Терапевтический результат может не являться "излечением". терапевтический результат также включает поддающиеся измерению отличия в величине(ах) повреждения миелина, снижения демиелинизации миелина и/или увеличения ремиелинизации.
Как используют в рамках изобретения, "профилактически эффективное количество" относится к количеству, эффективному в необходимых концентрациях золотых частиц и объеме суспензии и в течение необходимых периодов времени и/или при необходимом дозировании, для достижения желаемого профилактического результата. Как правило, поскольку профилактическую дозу используют у индивидуумов до или на ранней стадии заболевания, профилактически эффективное количество может быть меньшим, чем терапевтически эффективное количество. Профилактический результат также включает поддающиеся измерению отличия в величине(ах) повреждения миелина, снижения демиелинизации миелина и/или увеличения ремиелинизации.
Как используют в рамках изобретения, термин "лечение" или "осуществление лечения" относится к введению наносуспензии на основе элементарного золота и в предпочтительном варианте осуществления новой суспензии нанокристаллов на основе золота, упоминаемой в настоящем описании как "CNM-Au8", млекопитающему для смягчения или уменьшения симптомов заболевания. Кроме того, термины "лечение" или "осуществление лечения" относятся к введению вышеупомянутых наносуспензий на основе золота млекопитающему для предупреждения прогрессирования заболевания. Предупреждение прогрессирования заболевание также включает поддающиеся измерению отличия в величине(ах) повреждения миелина, снижения демиелинизации миелина и/или увеличения ремиелинизации.
Под "субъектом", или "индивидуумом", или "животным", или "пациентом" или "млекопитающим" подразумевают любого индивидуума, в частности, млекопитающее, для которого является желательной диагностика, прогнозирование, терапия и/или профилактика. Млекопитающие включают, но не ограничиваются ими, людей, домашних животных, сельскохозяйственных животных, животных зоопарка, спортивных животных, комнатных животных, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, коровы; приматов, таких как человекообразные обезьяны, макаки, орангутаны и шимпанзе; животных семейства собачьих, таких как собаки и волки; животных семейства кошачьих, таких как кошки, львы и тигры; животных семейства лошадиных, таких как лошади, ослы и зебры; мясомолочных животных, таких как коровы, свиньи и овцы; копытных животных, таких как олени и жирафы; грызунов, таких как мыши, крысы, хомяки и морские свинки; и т.д. В определенных вариантах осуществления, млекопитающим является человек.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В предпочтительном варианте осуществления новые нанокристаллы золота суспендируют в высокочистой воде и нанокристаллы золота имеют нанокристаллические поверхности, которые по существу свободны (как определено в настоящем описании) от органических или других примесей или пленок, но остаются стабильно суспендированными в воде. В частности, поверхности являются "чистыми" относительно поверхностей, в которых используются процессы химического восстановления, которые требуют химических восстановителей и/или поверхностно-активных веществ для роста наночастиц золота из ионов золота в растворе. Большинство выращенных нанокристаллов золота имеют уникальные и идентифицируемые характеристики поверхности, такие как низкий индекс пространственной протяженности, кристаллические плоскости {111}, {110} и/или {100} и группы таких плоскостей (и их эквиваленты). Полученные суспензии нанокристаллического золота или коллоиды имеют желаемые диапазоны pH, такие как 4,0-9,5, но более конкретно 5,0-9,5, и величины зета-потенциала по меньшей мере -20 мВ, и более конкретно по меньшей мере -40 мВ и еще более конкретно по меньшей мере -50 мВ для представляющих интерес диапазонов pH.
Форма и распределение формы этих золотых нанокристаллов, полученных согласно процессу изготовления, описанному ниже, включают, но не ограничиваются ими, треугольники (например, четырехгранники), пятиугольники (например, пятиугольные бипирамиды или десятигранники), шестиугольники (например, шестиугольные бипирамиды, двадцатигранники, восьмигранники), ромбы (например, восьмигранники, различные удлиненные бипирамиды, сочлененные четырехгранники, боковые фасады бипирамид) и "другие". Распределение(я) формы нанокристаллов, содержащих упомянутые выше пространственно удлиненные кристаллические плоскости с малыми индексами (которые образуют упомянутые формы) и имеющих "чистые" поверхности, является уникальным.
Может предусматриваться любой желаемый средний размер наночастиц золота менее 100 нм. Наиболее желаемые диапазоны размеров кристаллов золота включают диапазоны, имеющие средний размер кристаллов или "моду" (как измеряют и определяют конкретными способами, подробно описанными в настоящем описании, и указывают как "средний диаметр TEM"), которые в основном составляют менее 100 нм, и, более конкретно, менее 50 нм, еще более конкретно, менее 30 нм, и во многих предпочтительных вариантах осуществления, описанных в настоящем описании, мода для распределения размера нанокристаллов составляет менее 21 нм и находится в еще более предпочтительном диапазоне 8-18 нм.
в рамках изобретения может предусматриваться любая концентрация наночастицы (наночастиц) золота для достижения терапевтически эффективного количества или профилактически эффективного количества.
В предпочтительном варианте осуществления предусматривается новый процесс получения этих уникальных нанокристаллов золота с чистой поверхностью, стабильно суспендированных в воде. Процесс вовлекает выращивание наночастиц золота в воде. В предпочтительном варианте осуществления вода содержат дополнительный "усилитель процесса", который по существу не связывается с образовавшимися нанокристаллами, а скорее способствует образованию центров кристаллизации/росту кристалла в ходе электрохимически стимулируемых процессов роста. Усилитель процесса выполняет важные роли в процессе, включающем предоставление заряженных ионов в электрохимический раствор для обеспечения роста кристаллов. Эти новые электрохимические процессы могут происходить либо в периодическом, либо в полунепрерывном, либо в непрерывном процессе. Эти процессы приводят к контролируемым концентрациям наночастиц золота, контролируемым размерам нанокристаллов и контролируемым диапазонам размеров нанокристаллов; а также к контролируемым формам нанокристаллов и контролируемым распределениям форм нанокристаллов. Предусматриваются новые производственные системы для получения этих наночастиц золота. Для получения более высоких чнм золота и для достижения стабильности (т.е. суспензии с величинами зета-потенциала по меньшей мере -20 мВ, и более конкретно по меньшей мере -40 мВ и еще более конкретно по меньшей мере -50 мВ для представляющих интерес диапазонов pH) при концентрации вплоть до 3000 чнм (т.е. 3000 мкг/мл) используют новые способы проточной фильтрации вдоль потока ("TFF").
Предусматриваются фармацевтические композиции, которые являются пригодными для системного применения, в том числе для перорального, внутривенного, подкожного, внутриартериального, буккального, ингаляционного, осуществляемого с помощью аэрозоля, пропеллента или другой подходящей жидкости и т.д., как описано в настоящем описании далее.
Также предусматриваются фармацевтические композиции, которые включают терапевтически эффективное количество или профилактически эффективное количество нанокристаллов золота для лечения, смягчения или предупреждения какого-либо из медицинских/патологических состояний, описанных в настоящем описании. В предпочтительном варианте осуществления наночастицы золота вводят в перорально доставляемой жидкости, где наночастицы золота остаются в воде, в которой они производятся, и могут быть сконцентрированными или разбавленными, но предпочтительно не являются высушенными до состояния, когда поверхности нанокристаллов золота становятся полностью сухими или их поверхности иным образом изменяются относительно их первоначального состояния при производстве.
Важно понять, что в фармацевтических продуктах задачей является установление минимальной дозы, необходимой для достижения эффективности, таким образом, минимизируя потенциал токсичности или осложнений. Новый перорально вводимый продукт со значительно большей активностью может достигать эффективности при уровнях доз, которые ниже доз продуктов уровня техники и/или может достигать существенно большей эффективности при эквивалентных уровнях доз. Для подтверждения, например, терапевтически эффективного количества требуются клинические испытания. Однако титрование для определения клинического эффекта можно осуществлять, например, варьируя концентрацию, объем, время и/или частоту дозирования.
Предусматриваются фармацевтические композиции, которые являются пригодными для системного применения, в том числе для перорального, внутривенного, подкожного, внутриартериального, буккального, ингаляционного, осуществляемого с помощью аэрозоля, пропеллента или другой подходящей жидкости и т.д., как описано в настоящем описании далее.
Пригодные величины дозировок и режимы дозирования может определять лечащий врач или ветеринар, и они могут зависеть от желаемого уровня ингибирования и/или модификации активности, конкретного подвергаемого лечению состояния, тяжести состояния, того, является ли дозировка терапевтически эффективным количеством или профилактически эффективным количеством, а также от возраста, общего состояния здоровья и массы тела индивидуума.
Нанокристаллы золота, содержащиеся в водной среде, можно вводить в однократной дозе или серией доз. Хотя является возможным введение водной среды, содержащей нанокристаллы на металлической основе отдельно, например, в коллоидной форме, может быть приемлемым включение смеси активных ингредиентов, включающей другие композиции и/или терапевтические средства. Кроме того, различные фармацевтические композиции могут быть добавлены к активному ингредиенту(ам)/суспензии(ям)/коллоиду(ам).
Таким образом, в предпочтительном варианте осуществления суспензии нанокристаллов золота по изобретению или коллоиды (например, содержащие водную суспензию металла на основе золота) можно вводить вместе со вторым лекарственным средством. Второе лекарственное средство может включать глюкокортикоид.
Суспензии нанокристаллов золота в соответствии с настоящим изобретением, пригодные для введения, присутствуют, как правило, в качестве стабильного раствора, коллоида или частично стабильной суспензии в воде. Однако такие нанокристаллы золота также могут быть включены в неводную жидкость в качестве отдельных единиц, таких как капсулы с жидкостью, саше или даже таблетки (например, высушенные суспензии или коллоиды с получением нанокристаллов на основе золота с активным ингредиентом при условии, что такая обработка не оказывает неблагоприятного эффекта на функциональность поверхностей исходных нанокристаллов золота), каждый из которых содержит заданное количество, например, активного ингредиента нанокристалла золота; в качестве порошка или гранул; в качестве раствора, коллоида или суспензии в водной или неводной жидкости; или в качестве жидкой эмульсии типа "масло в воде" или жидкой эмульсии типа "вода в масле". Активный ингредиент из нанокристаллов золота также можно комбинировать в болюс, электуарий или пасту. Следует понимать что в качестве материала для лечения, описанного в настоящем описании, можно использовать различные наносуспензии элементарного золота.
Композиции, пригодные для перорального введения через рот включают пастилки, содержащие суспензии или коллоиды, содержащие нанокристаллы золота с одним или несколькими активными ингредиентами(ов) во вкусовой основе, такой как сахароза и гуммиарабик или трагакантовая камедь; пастилки, содержащие активный ингредиент из нанокристаллов золота в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; и средства для полоскания рта, содержащие активный ингредиент из нанокристаллов золота в подходящем жидком носителе.
Суспензии или коллоиды нанокристаллов золота также можно вводить интраназально или посредством ингаляции, например, через распылитель, устройство для аэрозоля или небулайзер, чтобы один или несколько компонентов в растворе или коллоиде (например, нанокристаллы золота) содержался, например, в виде водяной пыли или спрея.
Композиции для ректального введения могут быть предоставлены в качестве суппозиториев с подходящей основой, содержащей, например, масло какао, желатин, глицерин или полиэтиленгликоль.
Композиции, пригодные для вагинального введения, могут быть предоставлены в качестве пессариев, тампонов, кремов, гелей, паст, пен или составов спреев, содержащих в дополнение к активному ингредиенту такие носители, которые известны в данной области в качестве пригодных.
Композиции, пригодные для парентерального введения, включают водные и неводные изотонические стерильные инъекционные суспензии или коллоиды, которые могут содержать антиоксиданты, буферы, бактерицидные средства и растворенные вещества, которые сообщают композиции изотоничность с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие вещества и загустители. Композиции могут быть представлены в герметичных контейнерах для однократной дозы или для многократных доз, например, в ампулах и флаконах, и они могут храниться в высушенном сублимационной сушкой (лиофилизированном) состоянии, требующем добавления только стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Инъекционные растворы, коллоиды и суспензии, приготавливаемые непосредственно перед применением, можно получать из стерильных порошков, гранул и таблеток ранее описанного типа.
Предпочтительные единичные дозированные композиции представляют собой композиции, содержащие суточную дозу или единицу активного ингредиента, суточную субдозу, как описано в настоящем описании выше, или их соответствующую часть.
Следует понимать, что в дополнение к золотым нанокристаллическим активным ингредиентам, конкретно упомянутым выше, композиции по настоящему изобретению могут включать другие средства, общепринятые в данной области, учитывая тип рассматриваемой композиции, например, композиции, пригодные для перорального введения, могут включать дополнительные средства, такие как связующие вещества, подсластители, загустители, вкусовые добавки, дезинтегрирующие вещества, средства покрытия, консерванты, смазывающие вещества, средства, замедляющие высвобождение, и/или средства, обеспечивающие положение высвобождения. Пригодные подсластители включают сахарозу, лактозу, глюкозу, аспартам или сахарин. Пригодные дезинтегрирующие вещества включают кукурузный крахмал, метилцеллюлозу, поливинилпирролидон, ксантановую смолу, бентонит, альгиновую кислоту или агар. Пригодные вкусовые добавки включают масло мяты перечной, масло грушанки, вкусовые добавки вишни, апельсина или малины. Пригодные средства покрытия включают полимеры или сополимеры акриловой кислоты и/или метакриловой кислоты и/или их сложных эфиров, воски, жирные спирты, зеин, шеллак или глютен. Пригодные консерванты включают бензоат натрия, витамин E, альфа-токоферол, аскорбиновую кислоту, метилпарабен, пропилпарабен или бисульфит натрия. Пригодные смазывающие вещества включают стеарат магния, стеариновую кислоту, олеат натрия, хлорид натрия или тальк. Пригодные средства, замедляющие высвобождение, включают глицерилмоностеарат или глицерилдистеарат.
Эти наносуспензии элементарного золота и в предпочтительном варианте осуществления по существу поверхностно очищенные или поверхностно чистые нанокристаллы золота, суспендированные в высокочистой воде, можно использовать для лечения любого нарушения, описанного в разделе "Уровень техники, к которому относится изобретение," выше. Кроме того, выражение "наносуспензии элементарного золота" или "наносуспензии кристаллов элементарного золота" и т.п. следует понимать, как означающее наносуспензии CNM-Au8, явно описанные в настоящем описании, но также его следует понимать как включающее другие наносуспензии элементарного золота, полученные полностью другими способами при условии, что общие физические свойства, включающие размер наночастиц, концентрацию(и), pH, и т.д. находятся в тех же диапазонах, что и физические свойства наносуспензий CNM-Au8, подробно описанных в настоящем описании, даже если такие наносуспензии имеют определенные недостатки, ассоциированные с ними.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлен первый корытообразный элемент 30a’, в котором образуется одна плазма 4a. Продукт этого первого корытообразного элемента 30a’ подается во второй корытообразный элемент 30b’.
На фиг.2A-2C представлена альтернативная конструкция корытообразного элемента 30b’, где части 30a’ и 30b’ корытообразного элемента являются смежными.
На фиг.3 представлен корытообразный элемент 30b’, использованный для фиг.2A-2C и примера 1 в настоящем описании.
На фиг.4A-4B показаны два поперечных сечения двух корытообразных элементов 30.
На фиг.5A показан электромонтажный чертеж трансформатора AC, для применения для получения плазмы 4, использованной для получения нанокристаллической суспензии, описанной в примере 1. На фиг.5B показана схема трансформатора 60 и на фиг.5C и 5D представлены схематические представления двух синусоидальных волн в синфазном и несинфазном состоянии, соответственно.
На фиг.6 представлен иллюстративный вариант осуществления одной из конфигураций электрода 1.
На фиг.7 представлено изображение золотой проволоки 5a и 5b, использованной в примере 1 настоящего описания.
На фиг.8 представлена схема электрической установки для подвода энергии, использованной для получения суспензий нанокристаллического золота, описанных в примере 1.
На фиг.9 показано схематическое поперечное сечение набора управляющих устройств 20, расположенных на корытообразном элементе 30 с жидкостью 3, протекающей через него в контейнер 41 для хранения.
На фиг.10A представлена иллюстративная микрофотография TEM высушенных нанокристаллов золота, полученных согласно примеру 1.
На фиг.10B представлена гистограмма распределения размера частиц при измерении с помощью TEM для высушенных нанокристаллов золота, полученных согласно примеру 1.
На фиг.10C демонстрирует спектрограмму в ультрафиолетовой и видимой области спектра для суспензии золота, полученной согласно примеру 1.
На фиг.11 представлена схема устройства TFF, использованного для концентрации наносуспензий золота.
На фиг.12 представлено перспективное изображение устройства и процесса, использованных для получения коронарных срезов головного мозга, рассмотренных в примере 2.
На фиг.13 представлена гистограмма, которая демонстрирует относительную величину окрашивания миелина, присутствующую у мышей групп 1-4 примера 2.
На фиг.14A-14D представлены изображения TEM репрезентативных частей мозолистого типа для одной мыши из каждой групп мышей 1-4, соответственно, из примера 2.
На фиг.15 показана гистограмма соотношений G, измеренных/откалиброванных при наблюдении приблизительно 100 аксонов в каждом изображении TEM мозолистого тела из одной мыши из каждой из групп 1-4, соответственно, из примера 2.
На фиг.16 представлены профили распределения данных, ассоциированные с вычислением соотношения G для одной мыши из каждой из групп 1-4, соответственно, из примера 2.
На фиг.17A-D показаны гистограммы фактических данных соотношения G по сравнению с полученными кривыми нормального распределения для одной мыши из каждой из групп мышей 1-4, соответственно, из примера 2.
На фиг.18 показана серия графиков, соответствующих средней величине жидкости, употребленной каждой мышью из групп 1-4 из примера 2 на протяжении испытания.
На фиг.19 показана серия графиков, соответствующая средней массе каждой мыши из групп мышей 1-4 примера 2, измеряемой на протяжении испытания.
На фиг.20A-20F показано несколько схематических изображений частей головного мозга, из которых получали образцы способами, рассмотренными в примере 3.
На фиг.21A-21B показано устройство для удерживания и нарезания секций головного мозга, использованных для получения тонких срезов для изображений TEM, описанных в примере 3.
На фиг.22 представлена серия графиков, соответствующая среднему увеличению массы тела каждой мыши в группах 1-7, начиная с возраста 8 недель, как описано в примере 3.
Фиг.23A-23C соответствуют изображениям TEM, исходно полученным при 4000x, репрезентативных частей мозолистого тела для мышей из группы 1 примера 3.
Фиг.24A-24E соответствуют изображениям TEM, исходно полученным при 4000x, репрезентативных частей мозолистого тела для мышей из группы 2 примера 3.
Фиг.25A-25G соответствуют изображениям TEM, исходно полученным при 4000x, репрезентативных частей мозолистого тела для мышей из группы 3 примера 3.
Фиг.26A-26E соответствуют изображениям TEM, исходно полученным при 4000x, репрезентативных частей мозолистого тела для мышей из группы 4 примера 3. Зоны наблюдаемой ремиелинизации указаны стрелками 201.
Фиг.27A-27D соответствуют изображениям TEM, исходно полученным при 4000x и 5000x, репрезентативных частей мозолистого тела для мышей из группы 5 примера 3. Зоны наблюдаемой ремиелинизации указаны стрелками 201.
Фиг.28A-28G соответствуют изображениям TEM, исходно полученным при 4000x, репрезентативных частей мозолистого тела для мышей из группы 6 примера 3. Зоны наблюдаемой ремиелинизации указаны стрелками 201.
Фиг.29A-29D соответствуют изображениям TEM, исходно полученным при 4000x, репрезентативных частей мозолистого тела для мышей из группы 7 примера 3. Зоны наблюдаемой ремиелинизации указаны стрелками 201.
На фиг.30A-30C представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны указаны как являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, черной рамкой и стрелками 202S, на фиг.30A (и только стрелками 202 на фиг.30B и фиг.30C), относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 1 примера 3.
На фиг.31A-31B представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны, являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, указаны стрелками 202, относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 2 примера 3.
На фиг.32A-32B представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны, являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, указаны стрелками 202, относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 3 примера 3.
На фиг.33A-33B представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны, являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, указаны стрелками 202, относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 4 примера 3.
На фиг.34A-34B представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны, являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, указаны стрелками 202, относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 5 примера 3.
На фиг.35A-35B представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны, являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, указаны стрелками 202, относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 6 примера 3.
На фиг.36A-36B представлены репрезентативные изображения TEM, исходно полученные при приблизительно 16000x, демонстрирующие репрезентативные части мозолистого тела, где аксоны, являющиеся поврежденными, демиелинизированными и/или дисмиелинизированными, указаны стрелками 202, относительно эталонного аксона, обозначенного звездочкой 203, для мышей из группы 7 примера 3.
На фиг.37A-37K представлены репрезентативные изображения TEM, исходно полученные при 16000x или 40000x, которые соответствуют репрезентативным частям мозолистого тела мышей группы 4. Зоны наблюдаемой ремиелинизации указаны стрелками 201M.
На фиг.38A-38L представлены репрезентативные изображения TEM, исходно полученные при 16000x или 40000x, которые соответствуют репрезентативным частям мозолистого тела мышей группы 5. Зоны наблюдаемой ремиелинизации указаны стрелками 201M.
На фиг.39A-39J представлены репрезентативные изображения TEM, исходно полученные при 16000x или 40000x, которые соответствуют репрезентативным частям мозолистого тела мышей группы 6. Зоны наблюдаемой ремиелинизации указаны стрелками 201M.
На фиг.40A-40G представлены репрезентативные изображения TEM, исходно полученные при 16000x или 40000x, которые соответствуют репрезентативным частям мозолистого тела мышей группы 7. Зоны наблюдаемой ремиелинизации указаны стрелками 201M.
На фиг.41A-41C представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 1 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний (204I) и наружный (204O) периметры миелина, обозначенные на этих изображениях.
На фиг.42A-42D представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 2 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний (204I) и наружный (204O) периметры миелина, обозначенные на этих изображениях.
На фиг.43A-43C представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 3 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.44A-44B представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 4 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.45A-45C представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 5 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.46A-46B представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 6 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.47A-47E представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 7 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
Фиг.48A, 48B и 48C содержат модифицированные гистограммы, на которых представлены данные о соотношении G, соответствующие мышам в группе 1 (положительный контроль), группе 2 (отрицательный контроль 2 недели) и группе 3 (отрицательный контроль 5 недель), соответственно. Эти три модифицированных гистограммы помещены рядом для целей сравнения.
Фиг.49A, 49B и 49C содержат модифицированные гистограммы, на которых указаны данные соотношения G, соответствующие мышам в группе 3 (отрицательный контроль 5 недель), группе 5 и группе 7, соответственно. Эти три модифицированных гистограммы помещены рядом для целей сравнения.
Фиг.49A, 49B и 49C содержат модифицированные гистограммы, на которых указаны данные соотношения G, соответствующие мышам в группе 3 (отрицательный контроль 5 недель), группе 4 и группе 6, соответственно. Эти три модифицированных гистограммы помещены рядом для целей сравнения.
Фиг.51 содержит модифицированные гистограммы, на которых указаны данные соотношения G, соответствующие мышам всех из групп 1-7.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Получение наносуспензий золота (CNM-Au8)
В предпочтительном варианте осуществления наночастицы элементарного золота суспендируют в высокочистой воде и нанокристаллы золота имеют нанокристаллические поверхности, которые по существу свободны (как определено в настоящем описании) от органических или других примесей или пленок. В частности, поверхности являются "чистыми" относительно поверхностей, полученных с использованием процессов химического восстановления, которые требуют химических восстановителей и/или поверхностно-активных веществ для формирования наночастиц золота из ионов золота в растворе. Предпочтительные нанокристаллы золота получают посредством новых методик производства, подробно описанных в настоящем описании. Методики производства лишены ранее применяемых добавляемых химических восстановителей и/или поверхностно-активных веществ (например, органические соединения) или других средств, которые, как правило, присутствуют в или на частицах или нанесены на поверхность химически восстановленных частиц; или затем восстановители счищают или удаляют с использованием нежелательных процессов, которые сами по себе влияют на частицы.
В предпочтительном варианте осуществления процесс вовлекает образование центра кристаллизации и выращивание нанокристаллов элементарного золота в воде, которая содержит "усилитель процесса" или "усилитель обработки" (как правило, неорганический материал или карбонат и т.п.) который по существу не связывается с образованными нанокристаллами, а скорее облегчает образование центра кристаллизации/рост в процессах элетрохимически стимулируемого роста. Усилитель процесса играет важные роли в процессе, включая предоставление заряженных ионов в электрохимический раствор, чтобы позволить кристаллам расти. Важно, чтобы усилитель процесса представлял собой соединение(я), которое остается в растворе и/или не образует покрытие (например, органическое покрытие) и/или не оказывает неблагоприятного влияния на образовавшиеся нанокристаллы или образовавшуюся суспензию(и), и/или не разрушается, выпаривается или иным образом не утрачивается в ходе электрохимического процесса. Предпочтительным усилителем процесса является бикарбонат натрия. Примерами других усилителей процесса являются карбонат натрия, бикарбонат калия, карбонат калия, трифосфат натрия, дифосфат натрия, монофосфат натрия, фосфаты калия или другие соли угольной кислоты и т.п. Кроме того, усилители процесса могут представлять собой соли, включая бисульфит или сульфит натрия или калия. Другие усилители процесса для получения нанокристаллов золота для применения для медикаментозного лечения могут представлять собой другие соли, включая натрий или калий, или любой материал, который облегчает электрохимические процессы роста, описанные в настоящем описании; который по существу не включен в или на поверхность нанокристаллов золота; и который не сообщает нежелательной токсичности нанокристаллам или суспензионной среде, содержащей нанокристаллы.
Желаемые диапазоны концентраций для усилителя обработки включают, как правило, 0,01-20 грамм/галлон (0,0026-2,1730 мг/мл), более конкретно, 0,1-7,5 грамм/галлон (0,0264-1,9813 мг/мл) и наиболее часто 0,5-2,04 грамм/галлон (0,13210-0,54 мг/мл).
Поскольку выращенные нанокристаллы золота имеют "обнаженную" или "чистую" поверхность металлического золота (например, в нулевом окислительном состоянии) поверхности являются высоко реакционноспособными или высокобиокаталитическими (а также высокобиодоступными). Наночастицы по существу окружены водной рубашкой. Эти признаки обеспечивают увеличенную эффективность in vivo относительно поверхностей наночастиц, которые содержат, например, органический материал, присутствующий вследствие восстановительных химических процессов. "Чистые" поверхности также или альтернативно могут снижать нежелательную токсичность нанокристаллов относительно наночастиц, которые содержат покрытые или "отделанные" поверхности. Увеличенная эффективность этих "чистых" нанокристаллов золота может обеспечить увеличенный терапевтический индекс вследствие более низкой дозы, необходимой для достижения желаемого терапевтически эффективного количества или желаемого профилактически эффективного количества у индивидуума.
Существуют другие важные преимущества использования новых нанокристаллов для лечения индивидуума, которые включают относительную токсичность и/или относительную скорость появления полезных эффектов у индивидуума.
В соответствии со способами, описанными в настоящем описании, предпочтительные нанокристаллы золота можно выращивать так, чтобы обеспечивались уникальные и поддающиеся идентификации характеристики поверхности, такие как пространственно удлиненные кристаллические плоскости {111}, {110} и/или {100} с малыми индексами и группы таких плоскостей (и их эквиваленты). Формы нанокристаллов золота, полученных способами, описанными в настоящем описании, включают, но не ограничиваются ими, треугольники (например, четырехгранники), пятиугольники (например, пятиугольные бипирамиды или десятигранники), шестиугольники (например, шестиугольные бипирамиды, двадцатигранники, восьмигранники), ромбы (например, восьмигранники, различные удлиненные бипирамиды, сочлененные четырехгранники, боковые фасады бипирамид) и "другие". Процент нанокристаллов (т.е. выращенных согласно различным вариантам осуществления, указанным в настоящем описании), содержащих упомянутые выше пространственно удлиненные кристаллические плоскости с малыми индексами и имеющие "чистые" поверхности, является другим новым признаком по изобретению. Более того, процент четырехгранников и/или пятиугольных бипирамид, образовавшихся или присутствующих в нанокристаллических суспензиях, также является уникальным.
Может предусматриваться любой средний размер нанокристаллов золота менее 100 нм. Наиболее желаемые диапазоны размеры кристаллов для лечения включают диапазоны, имеющие средний размер кристаллов или "моду" (как измеряют и определяют конкретными способами, подробно описанными в настоящем описании, и указывают как "средний диаметр TEM"), которая в основном составляет менее 100 нм, и, более конкретно, менее 50 нм, еще более конкретно, менее 30 нм, и во многих предпочтительных вариантах осуществления, описанных в настоящем описании мода для распределения размера нанокристаллов составляет менее 21 нм и находится в еще более предпочтительном диапазоне 8-18 нм.
Могут предусматриваться полученные суспензии нанокристаллов золота для лечения, которые имеют заданные диапазоны pH или доведены до них. Когда их получают, например, с усилителем процесса, представляющим собой бикарбонат натрия, в количествах, подробно описанных в настоящем описании, диапазон pH, как правило, составляет 8-9, который при желании можно корректировать.
Природа и/или величина изменения поверхности (т.е., положительное или отрицательное) на образовавшихся наночастицах или нанокристаллах могут иметь большое влияние на поведение и/или эффекты наночастиц/суспензии или коллоида. Например, поверхностный заряд или поверхностные характеристики наночастиц могут влиять на образование белковых колец, таких как альбуминовые кольца. Такой поверхностный заряд обычно называют "зета-потенциалом". Известно, что чем более высоким является зета-потенциал (либо положительный, либо отрицательный), тем более высокой является стабильность наночастиц в растворе (т.е. суспензия является более стабильной). Путем контроля природы и/или количества поверхностных зарядов образовавшихся наночастиц или нанокристаллов можно контролировать эффективность таких суспензий наночастиц.
Зета-потенциал известен в качестве меры электрокинетического потенциала в коллоидных системах и его также называют поверхностным зарядом частиц. Зета-потенциал представляет собой разность потенциалов, которая существует между стационарным слоем жидкости и жидкостью, в которой диспергированы частицы. Зета-потенциал часто измеряют в милливольтах (т.е. мВ). Величина зета-потенциала приблизительно 20-25 мВ представляет собой произвольную величину, которая выбрана для определения того, является ли диспергированная частица стабильной в дисперсионной среде. Таким образом, когда в настоящем описании упоминается "зета-потенциал", следует понимать, что указанный зета-потенциал представляет собой описание или количественное определение величины электрического заряда, присутствующего в двойном слое.
Зета-потенциал вычисляют из электрофоретической подвижности по уравнению Генри:

где z представляет собой зета-потенциал, UE представляет собой электрофоретическую подвижность, ε представляет собой диэлектрическую константу, η представляет собой вязкость, f(ka) представляет собой функцию Генри. Для аппроксимации Смолуховского f(ka)=1,5.
Зета-потенциалы ("ZP") для нанокристаллов золота, полученных способами, описанными в настоящем описании, как правило, имеют ZP по меньшей мере -20 мВ, более конкретно по меньшей мере приблизительно -30 мВ, еще более конкретно, по меньшей мере приблизительно -40 мВ и еще более конкретно по меньшей мере приблизительно -50 мВ.
Суспензии можно концентрировать до более высоких уровней чнм (например, вплоть до 5000 чнм, но более конкретно вплоть до 3000 чнм) с использованием способов TFF, описанных в примере 1 настоящего описания.
ПРИМЕР 1
Получение наносуспензии золота "CNM-Au8" для применения для лечения индивидуума
Как правило, наносуспензии CNM-Au8, используемые для лечения в примерах 2 и 3, являются концентрированными "чистыми" наносуспензиями CNM-Au8, причем чистый продукт получают с использованием определенных вариантов осуществления изобретения, связанных с устройствами, в основном показанными на фиг.1, 2C и 3. Все корытообразные элементы 30a’ и 30b’ на упомянутых выше фигах были изготовлены из плексигласа толщиной 1/8" (приблизительно 3 мм) и поликарбоната толщиной 1/4" (приблизительно 6 мм), соответственно. Подложка 34 (не показанная на многих из фигур, но показанная на фиг.1) также была изготовлена из плексигласа, который имел толщину приблизительно 1/4" (толщину приблизительно 6-7 мм). Каждый корытообразный элемент 30a’ составлял одно целое с корытообразным элементом 30b’. Поперечное сечение корытообразного элемента 30a’, описанного в настоящем описании, соответствовало форме, показанной на фиг.4B (т.е. представляло собой трапецевидное поперечное сечение). Относительные размеры для 30a’ представляли собой "S,S’", который составлял приблизительно 1,5" (приблизительно 3,см), "M", который составлял приблизительно 2,5" (приблизительно 6,см), "R", который составлял приблизительно 3/4" (приблизительно 1,9 см) и "d’", который составлял приблизительно ½" (приблизительно 1,3 см).
Каждая часть в виде корытообразного элемента 30b’ имела поперечное сечение, соответствующее фиг.4A. Относительные размеры для части в виде корытообразного элемента 30b’ представлены в таблице 1 в качестве "M" (т.е. внутренняя ширина корыта на входе и в конкретной части корытообразного элемента 30b’), "LT" (т.е. поперечная длина или длина потока корытообразного элемента 30b’), "S" (т.е. высота корытообразного элемента 30b’) и "d"" (т.е. глубина жидкости 3" в корытообразном элементе 30b’). Также измеренная толщина каждой боковой части корыта 30b’ составляла приблизительно 1/4" (приблизительно 6 мм).
Воду 3, использованную на входе в корытообразный элемент 30a’ (т.е. использовали в комбинации с усилителем обработки NaHCO3) получали посредством процесса деионизации (она обозначается в настоящем описании как деионизированная вода). Использовали смешанный фильтр для деионизации в смешанном слое. Общее число растворенных растворителей ("TDS") после обработки для деионизации составляло приблизительно 0,2 чнм при измерении с использованием измерителя pH/проводимости Accumet® AR20.
В таблице 1 показано, что количество усилителя обработки (PE) (NaHCO3), которое добавляли к очищенной воде, составляло приблизительно 0,54 мг/мл. Следует понимать, что другие количества этого усилителя обработки также являются функциональными в пределах и границах предпочтительного варианта осуществления изобретения. Смесь очищенная вода/ NaHCO3 использовали в качестве жидкости 3 на входе в корытообразный элемент 30a’. Глубина "d’" жидкости 3’ в корытообразном элементе 30a’ (т.е. где образуется плазма(ы) 4) составляла от приблизительно 7/16" до приблизительно 1/2" (от приблизительно 11 мм до приблизительно 13 мм) в различные моменты времени в корытообразном элементе е30a’. Глубину "d’" частично контролировали с использованием перемычки 80 (показанная на фиг.1). В частности, перемычка 80 была предоставлена вблизи выходного конца 32 корытообразного элемента 30a’, и она способствовала обеспечению глубины "d’" (показана на фиг.4B в качестве "d"), составляющей приблизительно 7/6"-1/2" (приблизительно 11-13 мм). Высота перемычки 80 составляет приблизительно 1/4" (приблизительно 6 мм) и продольная длина составляет приблизительно 1/2" (приблизительно 13 мм). Ширина полностью соответствовала нижнему размеру "R" корытообразного элемента 30a’. Таким образом, общий объем жидкости 3’ в корытообразном элементе 30a’ в процессе работы составлял от приблизительно 2,14 дюймов3 (приблизительно 35 мл) до приблизительно 0,89 дюйма3 (приблизительно 14,58 мл).
Скорость потока жидкости 3’ в корытообразный элемент 30a’, а также в корытообразный элемент 30b’, составляла приблизительно 215 мл/минута и скорость потока из корытообразного элемента 30b’ в точке 32 составляла приблизительно 215 мл/минута. Другие приемлемые скорости потока считаются входящими в пределы и границы производства предпочтительных суспензий нанокристаллов золота.
Такой поток жидкости 3’ был получен с использованием привода насоса Masterflex® L/S 40, рассчитанного на 0,1 лошадиных сил, 10-600 об./мин. Номер модели насоса Masterflex® 40 представлял собой 7523-80. Привод насоса имел насадку насоса, также изготавливаемую Masterflex®, известную как модель Easy-Load №77201-60. Главным образом, известно, что насадка насоса 40 представляет собой перистальтическую насадку. Точные параметры насоса представляли собой 215 миллилитров в минуту. В перистальтическую насадку была вставлена трубка Tygon®, имеющая диаметр 1/4" (т.е. размер 06419-25). Трубка была изготовлена Saint Gobain для Masterflex®. Один конец трубки доходил до первого конца 31 корытообразного элемента 30’a.
В таблице 1 показано, что существовал один набор электродов 1a/5a. Источник питания для каждого набора электродов 1/5 представлял собой трансформатор AC 60. В частности, на фиг.5A показан источник питания AC 62, соединенный с трансформатором 60. Кроме того, был предоставлен конденсатор 61, чтобы, например, можно было корректировать коэффициент потерь в контуре. На выходе трансформер 60 был соединен с электродом(ами) 1/5 через устройство 20 управления. Предпочтительным трансформатором для применения с устройством согласно примеру 1 является трансформатор, в котором используется переменный ток в первичной катушке 601 для установления переменного магнитного тока в сердцевине 602, которая легко проводит ток.
Когда вторичная катушка 603 расположена вблизи первичной катушки 601 и сердцевины 602, этот ток соединяет вторичную катушку 603 с первичной катушкой 601. Это соединение с вторичной катушкой 603 индуцирует разность потенциалов между вторичными клеммами. Величина разности потенциалов на вторичных клеммах прямо связана с соотношением витков вторичной катушки и витков первичной катушки. Большее количество витков на вторичной катушке 603, чем на первичной катушке 601, приводит к повышению разности потенциалов, в то время как меньшее количество витков приводит к снижению разности потенциалов.
Предпочтительный трансформатор(ы) 60 для применения в методиках, описанных в настоящем описании, имеет преднамеренно слабую регулировку выходного напряжения вследствие использования магнитных шунтов в трансформаторе 60. Эти трансформаторы 60 известны в качестве трансформаторов неоновых вывесок. Эта конфигурация ограничивает прохождение тока на электрод(ы) 1/5. При большом изменении напряжения выходной нагрузки трансформатор 60 сохраняет ток выходной нагрузки в относительно узком диапазоне.
Трансформатор 60 известен как эталонное устройство со сбалансированной средней точкой (например, также ранее известное как устройство со сбалансированной средней точкой с заземлением). Он наиболее часто встречается в трансформаторах, рассчитанных на напряжение от среднего до высокого, и в большинстве трансформаторах на 60 мА. Он является единственным типом трансформатора, приемлемым в системе "заземляющего устройства средней точки". "Сбалансированный" трансформатор 60 имеет одну первичную катушку 601 с двумя вторичными катушками 603, по одной с каждой стороны от первичной катушки 601 (как показано в общем на схеме на фиг.5B). Этот трансформатор 60 может во многих случаях функционировать подобно двум трансформаторам. Также как и в случае эталонной сердцевины и катушки с несбалансированной средней точкой, один конец каждой вторичной катушки 603 соединен с сердцевиной 602, а затем с кожухом трансформатора, а другой конец каждой вторичной катушки 603 соединен с выходным концом или клеммой. Таким образом, без присутствия соединителя ненагруженный трансформатор того типа на 15000 вольт будет отмерять приблизительно 7500 вольт с каждой вторичной клеммы на кожух трансформатора, но будет отмерять приблизительно 15000 вольт между двумя выходными клеммами.
В контурах переменного тока (AC), имеющих коэффициент мощности на линии 1 (или 100%), каждый из напряжения и тока начинаются с нуля, возрастают до пика, падают до нуля, доходят до отрицательного пика и возвращаются к нулю. Это завершает один цикл с типичной синусоидальной волны. В типичном применении в США это происходит 60 раз в минуту. Таким образом, такое напряжение или ток имеют характерную "частоту" 60 циклов в секунду (или 60 Герц). Коэффициент мощности относится к положению формы колебаний напряжения относительно формы колебаний тока. Когда обе формы колебаний проходят через ноль вместе и их пики достигаются совместно, они находятся в фазе и коэффициент мощности составляет 1 или 100%. На фиг.5C показаны две формы кривых "V" (напряжение) и "C" (ток), которые находятся в фазе друг с другом и имеют коэффициент мощности 1 или 100%; в то время как на фиг.5D представлены две формы кривых "V" (напряжение) и "C" (ток), которые находится не в фазе друг с другом и имеют коэффициент мощности приблизительно 60%; обе формы колебаний не проходят через ноль одновременно и т.д. Формы колебаний находятся не в фазе и их коэффициент мощности составляет менее 100%.
Нормальный коэффициент мощности большинства таких трансформаторов 60 по большей части является следствием действия магнитных шунтов 604 и вторичной катушки 603, которая эффективно добавляет индуктор на выходную часть контура трансформатора 60 для ограничения тока электродами 1/5. Коэффициент мощности может быть увеличен до более высокого коэффициента мощности с использованием конденсатора(ов) 61, помещенного в параллельно первичной катушке 601 трансформатора 60 что приводит входные колебания напряжение и тока в большей степени в фазу.
Напряжение без нагрузки на любом трансформаторе 60 для применения в рамках настоящего изобретения является важным, также как и его внутренняя структура. Желаемые трансформаторы без нагрузки для применения в рамках настоящего изобретения включают трансформаторы на 9000 вольт, 10000 вольт, 12000 вольт и 15000 вольт. Однако эти конкретные показатели количества вольт на трансформаторе без нагрузки не следует рассматривать как ограничивающие объем приемлемых источников мощности в качестве дополнительных вариантов осуществления. Конкретный желаемый трансформатор для применения в методиках, описанных в настоящем описании, изготовлен Franceformer, каталожный номер № 9060-P-E, который функционирует при: первично 120 вольт, 60 Гц; и вторично 9000 вольт, 60 мА.
Таким образом, трансформатор 60 может представлять собой такой же трансформатор, или он может представлять собой отличающийся трансформатор (также с другой полярностью). Выбор трансформатора, коэффициента мощности, конденсатора(ов) 61, полярности, конструкций электродов, положения электродов, состава электродов, формы(форм) поперечного сечения корытообразного элемента 30a’, локального или общего состава электродов, атмосферы(атмосфер), локальной или общей скорости(ей) течения жидкости 3, локальных компонентов жидкости 3’, объема жидкости 3’, локально подвергнутого различным полям в корытообразном элементе 30a’, соседних (например, как вышерасположенных, так и нижерасположенных) наборов электродов, локальных концентраций поля, применения и/или положения и/или состава любой мембраны, используемой в корытообразном элементе и т.д. является фактором, который влияет на условия обработки, также как и композиция и/или объем компонентов, продуцированных в жидкости 3’, нанокристаллов и нанокристаллических суспензий или коллоидов, полученных согласно различным вариантам осуществления, описанным в настоящем описании. Таким образом, множество вариантов осуществления можно применять на практике в соответствии с детальным описанием настоящего изобретения, представленным в настоящем описании.
Плазму 4 получали посредством электрода 1, по форме сходного с электродом, представленным на фиг.6 и имеющего массу приблизительно 9,2 грамма. Этот электрод состоял на 99,995% (4N5) из чистого золота. Другой электрод 5a состоял из золотой проволоки толщиной приблизительно 1 мм (99,995%) и был приблизительно на 9 мм погружен в жидкость 3’.
Как показано на фиг.2A и 2C на выходе из корытообразного элемента 30a’ была кондиционированная жидкость 3’ и эта кондиционированная жидкость 3’ перетекала прямо во второй корытообразный элемент 30b’. Второй корытообразный элемент 30b’, показанный на фиг.2A, 2C и 3, имел показатели, показанные в таблице 1. Этот корытообразный элемент 30b’ содержал приблизительно 885 мл жидкости 3". В таблице 1 указана конфигурация электродов, как показано на фиг.7 и 3, что означает, что семь наборов электродов 5/5’ (показанных на фиг.7) было расположено так, как показано на фиг.3 (т.е. перпендикулярно направлению потока жидкости 3"). Каждый из наборов электродов 5/5’ состоял из проволоки на 99,99% из чистого золота размером приблизительно 1,0 мм в диаметре, как описано в таблице 1. Длина каждого проволочного электрода 5, который находился в контакте с жидкостью 3" (указанная как "WL" в таблице 1) составляла приблизительно 1" (приблизительно 25,4 мм). Другие ориентации входят в объемы и границы настоящего изобретения.
Источник питания AC (или трансформатор) 501AC, проиллюстрированный на фиг.8, использовали в качестве источника питания. Этот трансформатор 501 AC представлял собой источник питания AC (Chroma 61604), имеющий диапазон напряжений AC 0-300 В, диапазон частот 15-1000 Гц и максимально допустимую мощность приблизительно 2 кВА. Что касается фиг.2A, 2C и 3, каждый отдельный набор электродов 5/5’ (например, набор 2, набор 3 - набор 8 или набор 9) был электрически соединен с источником питания 501AC, как показано на фиг.2A. В частности, источник питания 501AC был электрически соединен с каждым набором электродов согласно электрической монтажной схеме, показанной на фиг.2A.
В таблице 1 каждый из наборов электродов указывается как "набор №" (например, с "набора 1" по "набор 8"). Каждый электрод наборов электродов 1/5 или 5/5 был настроен на работу при конкретном напряжении. Напряжения, приведенные в таблице 1, представляют собой напряжения, использованные для каждого набора электродов. Также указано расстояние "c-c" (относительно фиг.9) от центральной линии каждого набора электродов до соседнего набора электродов. Кроме того, также указано расстояние "x", ассоциированное с каждым используемым электродом 1. Для электрода 5, расстояние "x" не указано. В таблице 1 также сообщены другие соответствующие параметры. Все материалы электродов 1/5 были получены от Hi-Rel, имеющей адрес 23 Lewis Street, Fort Erie, Ontario, Canada, L2A 2P6. Что касается фиг.2A, 2C и 3, каждый электрод 5/5’ сначала приводили в контакт с жидкостью 3", как только она входила в внешнюю приемную трубку o5. После определенного времени процесса металлическое золото удаляли с каждого проволочного электрода 5, что вызывало истончение электрода 5 (т.е. его диаметр становился меньше), что изменяло, например, плотность тока и/или скорость образования наночастиц золота. Таким образом, электроды 5 смещались в направлении внешних приемных трубок o5, что приводило к тому, что в жидкость 3" в ее верхней поверхностной части поступали свежие и более толстые электроды 5. По существу, профиль разъедания или эффект утоньшения появлялся на электродах 5 после прохождения некоторого времени обработки (т.е. части проволоки вблизи поверхности жидкости 3", как правило, были более толстыми, чем части вблизи наружных приемных трубок o5), и такой профиль или утоньшение проволочного электрода могут оставаться по существу постоянными на протяжении процесса продуцирования, если желательно, что приводит к продуцированию по существу идентичного продукта в любой момент времени после первоначальной предравновесной фазы в процессе продуцирования, что позволяет, например, процессу соответствовать cGMP согласно руководствам FDA и/или также соответствовать ISO 9000.
Электроды 5/5 приводили в действие или смещали со скоростью приблизительно 1 дюйм (2,5 см) в 8 часов. Образцы собирали только из равновесной фазы. Предравновесная фаза возникает, например, поскольку концентрация нанокристаллов, продуцированных в жидкости 3", возрастает в зависимости от времени до тех пор, пока концентрация не достигает равновесных условий (например, по существу постоянное образование центра кристаллизации и условия роста в устройстве), причем эти равновесные условия остаются по существу постоянными в процессе остальной обработки вследствие контролирующих процессов, описанных в настоящем описании. Предравновесная фаза длилась приблизительно 30 минут и она продуцировала приблизительно 1,7 галлонов (6,4 литра).
Все восьмые наборы электродов 1/5 и 5/5 были подсоединены к устройствам 20 контроля через 20g, который автоматически корректировал высоту, например, каждого электрода 1/5 или 5/5 в каждом наборе электродов. Две внешних приемных трубки o5a/o5a’ - o5g/o5g’ были подсоединены к нижней части корытообразного элемента 30b’, так что электроды в каждом наборе электродов 5/5 были помещены съемным путем в каждую наружную приемную трубку o5 когда и если желательно. Каждая внешняя приемная трубка o5 состояла из поликарбоната и имела внутренний диаметр приблизительно 1/8 дюйма (приблизительно 3,2 мм) и была фиксирована клеем в виде раствора к нижней части корытообразного элемента 30b’. Отверстия в нижней части корытообразного элемента 30b’ позволяли фиксацию наружного диаметра каждой пробирки o5 так, чтобы один конец трубки o5 был на одном уровне с поверхностью нижней части корыта 30b’. Нижняя часть трубки o5 является запаянной. Внутренние диаметры трубок o5 эффективно препятствовали вхождению каких-либо значительных количеств жидкости 3" во внешнюю приемную трубку o5. Однако часть жидкости может протекать внутрь одной или нескольких внешних приемных трубок o5. Длина или вертикальная высота каждой внешней приемной трубки o5 составляла приблизительно 6 дюймов (приблизительно 15,24 см), однако меньшая или большая длины входят в пределы и границы настоящего изобретения. Кроме того, хотя показано, что внешние приемные трубки o5 далее являются прямыми, каждая трубка может быть искривлена в J-образной форме или в U-образной форме, чтобы ее отверстия вдали от корытообразного элемента 30b’ могли быть выше верхней поверхности жидкости 3", если желательно.
В системе, описанной в настоящем описании, исследуется следующий усилитель обработки. В частности, приблизительно 2,04 грамм/галлон (т.е. приблизительно 0,54 г/литр) гидрокарбоната натрия ("сода"), имеющего формулу NaHCO3, добавляли к и смешивали с водой 3. Соду получали от Alfa Aesar и сода имела молекулярный вес 84,01 и плотность приблизительно 2,159 г/см3.
В частности, частоту синосоидальной волны AC 60 Гц использовали для получения суспензий нанокристаллов золота в соответствии с настоящим изобретением. В источнике питания AC 501AC использовался программируемый источник AC Chroma 61604. Применяемое напряжение составляло 220 вольт. Применяемый ток составлял от приблизительно 6 ампер до приблизительно 6,5 ампер.
В таблице 1 обобщенно представлены ключевые параметры обработки, использованные применительно к фиг.1, 2A и 2C. Также в таблице 1 описаны: 1) "продуцированные чнм Au" (например, концентрации нанокристаллов золота); 2) "средний диаметр при TEM", который представляет собой конфигурацию, соответствующую диаметру нанокристаллов золота, которая встречается наиболее часто при определении в анализе TEM; и 3) "гидродинамический радиус" при измерении согласно Zetasizer ZS-90. Эти физические охарактеризации проводили, как описано в настоящем описании.
Трансмиссионная электронная микроскопия
В частности, образцы TEM получали с использованием покрытой решетки Formvar, стабилизированной углеродом, имеющей размер ячеек 200. Решетки сначала предварительно обрабатывали посредством обработки плазмой в вакууме. Решетки помещали на предметное стекло микроскопа, покрытое прямоугольным фрагментом фильтровальной бумаги, а затем помещали в устройство Denton Vacuum с установленными необходимыми устройствами генератора плазмы. Вакуум поддерживали при 75 мТорр и плазму инициировали и прогоняли в течение приблизительно 30 секунд. После завершения систему вентилировали и решетки извлекали. Решетки были стабильными вплоть до 7-10 суток в зависимости от влажности, однако во всех случаях их использовали в течение 12 часов.
Приблизительно 1 мкл суспензии нанокристаллов CNM-Au8 помещали на решетки и ей позволяли высохнуть на воздухе при комнатной температуре в течение 20-30 минут или до тех пор, пока капли не испарятся. После завершения испарения решетки помещали на держатель до тех пор, пока не проводили анализ TEM.
Для исследования всех полученных образцов использовали трансмиссионный электронный микроскоп Philips/FEI Tecnai 12. Устройство использовали при ускоряющем напряжении 100 кэВ. После регулировки положения пучка образцы исследовали при различных увеличениях вплоть до и включая 630000x. Изображения получали с помощью подсоединенной камеры Olympus Megaview III с боковым монтажом, которая передавала изображения прямо на PC, оборудованный программным обеспечением iTEM и Tecnai User Interface, которое обеспечивало как контроль камеры, так и устройства TEM, соответственно.
На фиг.10A представлена репрезентативная микрофотография TEM для нанокристаллов золота, соответствующая высушенной суспензии CNM-Au8, полученной согласно методикам, описанным в настоящем описании выше. Фиг.10B соответствует измеренному распределению размеров при TEM, использованному для вычисления среднего диаметра при TEM и указанному в таблице 1.
Измерения pH
Измерения pH проводили с использованием измерителя pH/проводимости Accumet® AR20, где pH-зонд помещали в 50-мл флакон, содержавший представляющие интерес образцы, и позволяли им стабилизироваться. Проводили три отдельных измерения pH на образец и их усредняли. Наносуспензия CNM-Au8 имела измеренное значение pH приблизительно 9,08.
Спектроскопия в ультрафиолетовой и видимой области спектра
Спектры поглощения энергии получали для образцов с использованием спектроскопии в ультрафиолетовой и видимой области спектра. Эту информацию получали с использованием спектрометра ультрафиолетовой и видимой области Thermofisher Evolution 201, оборудованного двухлучевой монохроматорной системой Czerny-Turner и двойными кремниевыми фотодиодами. Устройство было предоставлено для проведения измерения в жидких образцах с низкой концентрацией с использованием одного из множества держателей образцов из плавленого кварца или "кювет". Данные получали для диапазона длин волн приблизительно 300-900 нм со следующими параметрами: ширина полосы 1 нм, шаг данных 0,5 нм. Основным источником энергии была ксеноновая импульсная лампа. Оптический путь спектрометра был организован так, чтобы позволить пучку энергии пройти через центр каждой кюветы с образцом. Подготовка образца ограничивалась заполнением и закрыванием кювет, а затем физическим помещением образцов в держатель кюветы в полностью закрытом отделении для образца спектрометра. Определяли оптическое поглощение энергии каждого образца. Выходные данные измеряли и представляли в качестве единиц поглощения (согласно закону Beer-Lambert) против длины волны.
На фиг.10C показаны спектрограммы в ультрафиолетовой и видимой области спектра для суспензии CNM-Au8 для диапазона длин волн приблизительно 350 нм-900 нм.
Динамическое рассеяние света в Zetasizer
Измерение динамического рассеяния света (DLS) для суспензии CNM-Au8 проводили на устройстве Zetasizer Nano ZS-90 DLS. В DLS по мере того, как лазерное излучение сталкивается с мелкими частицами и/или организованными водными структурами вокруг нанокристаллов (меньшими, чем длина волны), свет рассеивается во всех направлениях, что приводит к зависимому от времени колебанию интенсивности рассеяния. Колебания интенсивности являются следствием броуновского движения комбинации рассеивающих частиц/водной структуры, и они содержат информацию о распределении размеров кристаллов.
Устройству позволяли прогреться в течение по меньшей мере 30 мин перед экспериментами. Измерения проводили с использованием квадратной стеклянной ячейки PCS8501 с длиной пути 1 см. Использовали следующую методику:
1. Сначала 1 мл воды DI добавляли в ячейку с использованием 1-мл микропипетки, затем воду выливали из ячейки в стакан с отходами и остальную часть воды стряхивали из полости измерения ячейки. Первую стадию повторяли два или более раз для тщательного ополаскивания ячейки.
2. В ячейку добавляли 1 мл образца с использованием микропипетки объемом 1 мл. После этого всю жидкость извлекали из ячейки той же пипеткой с использованием того же наконечника пипетки и переносили в стакан для отходов. Вновь добавляли 1 мл образца с использованием того же наконечника.
3. Ячейку с образцом помещали в ячеечный блок с контролируемой температурой устройства Zetasizer гравированной буквой вперед. Открывали новый эксперимент в программном обеспечении Zetasizer. Измерение начинали через 1 мин после уравновешивания температуры и снижения мощности лазера до надлежащей величины. Результаты сохраняли после завершения всех экспериментов.
4. Ячейку извлекали из устройства и образец извлекали из ячейки с использованием той же пипетки и наконечника, которые использовались на стадии 2.
5. Стадии 2-4 повторяли два или более раз для каждого образца.
6. Для нового образца брали новый наконечник для 1-мл пипетки во избежание контаминации предшествующим образцом и стадии 1-5 повторяли.
Сбор и обработку данных проводили с использованием программного обеспечения Zetasizor, версия 6.20. Во всех экспериментах использовали следующие параметры: длительность прогона - 2o; эксперименты - 10; растворитель - вода, 0 ммоль; вязкость - 0,8872 сП; индекс рефракции - 1,333; температура блока - +25°C. После сохранения данных для каждого эксперимента результаты просматривали на странице "Records View" программного обеспечения. Распределение размера частиц (т.е. гидродинамические радиусы) анализировали в графе "Intensity PSD". Способы динамического рассеяния света использовали для получения информации о размере кристаллов (например, гидродинамические радиусы), полученных согласно этой методике. Гидродинамический радиус сообщен в таблице 1 как 19,43 нм. Кроме того, измеренный зета-потенциал для чистой наносуспензии CNM-Au8 составил -42,9 мВ.
Атомно-абсорбционная спектроскопия
Величины AAS получали на спектрометрической системе Perkin Elmer AAnalyst 400. Атомно-абсорбционную спектроскопию используют для определения концентрации частиц, сообщаемой в "чнм" (части на миллион).
I) Принцип
Способ пламенной атомной абсорбционной спектроскопии требует аспирирования жидкого образца, распыления и смешения с горючими газами, такими как ацетилен и воздух. Смесь воспламеняется в пламени, температура которого находится в диапазоне от приблизительно 2100 до приблизительно 2400 градусов C. В процессе горения атомы представляющих интерес элементов в образце восстанавливаются до свободных невозбужденных атомов в основном состоянии, которые поглощают свет при характерных длинах волн. Характерные длины волн являются специфическими для элементов и являются точными до 0,01-0,1 нм. Для получения специфических для элементов длин волн, световой пучок из лампы с полым катодом (HCL), катод которой состоит из элемента, подвергаемого определению, пропускают через пламя. Фотодатчик выявляет величину снижения интенсивности света вследствие поглощения анализируемым соединением. Перед фотодатчиком используют монохроматор для уменьшения фонового внешнего света и для выбора конкретной длины волны из HCL, подлежащей обнаружению. Кроме того, дейтериевая дуговая лампа вносит поправку на фоновое поглощение, вызываемое неатомными частицами в облаке атомов.
II) Подготовка образца
10 мл образца, 0,6 мл 36% об./об. хлористоводородной кислоты и 0,15 мл 50% об./об. азотной кислоты смешивают в стеклянном флаконе и инкубируют в течение приблизительно 10 минут на водяной бане при 70 градусах C. Если ожидается, что концентрация золота в суспензии будет составлять выше 10 чнм образце разбавляют водой DI перед добавлением кислот для доведения конечной концентрации золота до диапазона 1-10 чнм. Например, для концентрации золота приблизительно 100 чнм, 0,5 мл образца разбавляют 9,5 мл воды DI перед добавлением кислот. Разделение на аликвоты проводят с использованием регулируемых микропипеток и точное количество образца, воды DI и кислот измеряют с использованием микровесов Ohaus PA313. Массы компонентов используют для внесения поправки в измеренную концентрацию на разведение водой DI и кислотами.
Каждый образец приготавливают в трех экземплярах и после инкубации на водяной бане ему позволяют остыть до комнатной температуры перед проведением измерений.
III) Подготовка устройства
Следующие параметры используют для спектрометрической системы Perkin Elmer AAnalyst 400:
a) Головка форсунки: 10-см однощелевого типа, ориентированная по трем осям согласно методике изготовления для получения максимального поглощения со стандартом, представляющим собой 2 чнм Cu.
b) Распылитель: пластмассовый с разделителем перед импульсным шариком.
c) Поток газа: скорость потока окислителя (воздух) приблизительно 12 л/мин, скорость потока топлива (ацетилен) приблизительно 1,9 мл/мин.
d) Лампа/монохроматор: лампа с полым катодом из Au, рабочий ток 10 мА, щель 1,8/1,35 мм, длина волны 242,8 нм, поправка на фон (дейтериевая лампа) включена.
IV) Методика анализа
a) Запустить лампу Au и пламя приблизительно на 30 минут для прогрева системы.
b) Откалибровать устройство с использованием стандартов Au на уровне 1 чнм, 4 чнм и 10 чнм в матрице из 3,7% об./об. хлористоводородной кислоты. Использовать 3,7% об./об. хлористоводородной кислоты.
c) Проверить калибровочную шкалу путем измерения стандарта 4 чнм в качестве образца. Измеренная концентрация должна находиться между 3,88 чнм и 4,12 чнм. Повторить стадию b) если концентрация находится вне этого диапазона.
d) Измерить три реплики образца. Если стандартное отклонение между репликами превышает 5%, повторить измерение, в ином случае перейти к следующему образцу.
e) Провести проверку стадии c) после измерения шести образов или чаще. Если проверка провалится, провести стадии b) и c) и повторно измерить все образцы, измеренные после последней успешной проверки.
V) Анализ данных
В измеренную величину концентрации для каждой реплики вносят поправку на разведение водой и кислотой для вычисления истинной концентрации в образце. Сообщенная величина Au в чнм является средним значением для трех величин для индивидуальных реплик после внесения поправки.
В таблице 1 указывается измеренная концентрация в AAS как "продуцированные чнм Au" с соответствующей величиной приблизительно 7,2 чнм.
Проточная фильтрация вдоль потока (TFF)
Для повышения концентрации нанокристаллов золота, продуцированных в чистой наносуспензии CNM-Au8 для применения в примерах 2 и 3, использовали способ проточной фильтрации вдоль потока (TFF). Концентрирование в процессе TFF представляет собой процесс осуществляемого под давлением разделения, в котором используются мембраны для предпочтительного отделения жидкости, составляющей суспензию, от нанокристаллов в суспензии. Таким образом, процесс TFF приводит к относительно более высокой концентрации нанокристаллов золота в жидкости на одной стороне мембраны. В процессе TFF суспензия CNM-Au8 прокачивается по касательной вдоль поверхности мембраны. Схема простой системы TFF представлена на фиг.11.
Сырьевой бак 1001 подавал суспензию CNM-Au8 в нагнетательный насос 1002 и в фильтрационный модуль 1003. Поток фильтрата 1004 выбрасывали. Ретентат отклонялся с помощью клапана 1005 ретентата и возвращался в качестве 1006 в сырьевой бак 1001. В ходе каждого прохождения суспензии над поверхностью мембраны в фильтрационном модуле 1003, применяемое давление проталкивало часть жидкости, составляющей суспензию, через мембрану и в поток 1004 фильтрата. Нанокристаллы золота являются слишком крупными, чтобы пройти через мембрану и, таким образом, они остаются в верхнем потоке и уносятся тангенциальным потоком в ретентат 1006. Ретентат имеющий более высокую концентрацию нанокристаллов золота, возвращался обратно в сырьевой бак 1001. Если в сырьевой бак не добавлять буфер для диафильтрации, тогда объем жидкости в сырьевой емкости 1001, будет снижаться на величину удаленного фильтрата (т.е. жидкости) и нанокристаллы золота будут концентрироваться в суспензии.
В этом примере кассеты Millipore Pellicon XL использовали с целлюлозными мембранами с MWCO 5 кДа и 10 кДа. Давление ретентата было устанавливалось как 40 фунт./кв. дюйм (276 кПа) клапаном 1005 ретентата. Мембрана 10 кДа позволяла приблизительно в 4 раза более высокую скорость потока относительно мембраны 5 кДа при одинаковом трансмембранном давлении, как и ожидалось для более крупного размера частиц. В то же время поры мембраны размером 10 кДа являются достаточно мелкими, чтобы удерживать все образовавшиеся нанокристаллы золота в ретентате, тем самым, концентрируя нанокристаллы золота в суспензии CNM-Au8. После прохождения суспензии CNM-Au8 через систему TFF достигали желаемой концентрации суспендированных нанокристаллов золота в суспензии CNM-Au8 и она возрастала от приблизительно 7,2 чнм до приблизительно 51 чнм (например 2); и концентрация суспендированных нанокристаллов золота в CNM-Au8 суспензии возрастала от приблизительно 7,2 чнм до приблизительно 50 чнм и 1000 чнм (для двух различных используемых наносуспензий в примере 3).
Концентрированная суспензия нанокристаллов CNM-Au8 охарактеризовывали как по гидродинамическому радиусу, так и по зета-потенциалу, для определения того, влияла ли стадия концентрирования на какую-либо из этих величин. Для суспензий примера 2 измеренный зета-потенциал концентрированной наносуспензии CNM-Au8 (51 чнм) составлял приблизительно -45,5 мВ и измеренный гидродинамический радиус составлял приблизительно 18 нм. Для суспензий согласно примеру 3 измеренный зета-потенциал концентрированной наносуспензии CNM-Au8 (50 чнм) составлял приблизительно -43,6 мВ и измеренный гидродинамический радиус составлял приблизительно 18,6 нм; и измеренный зета-потенциал концентрированной наносуспензии CNM-Au8 (1000 чнм) составлял приблизительно -47,2 мВ и измеренный гидродинамический радиус составлял приблизительно 20,1 нм. Таким образом, стадия концентрирования не оказывала неблагоприятного влияния ни на один из этих важных параметров физической охарактеризации.
Детальные способы получения и детальная физическая охарактеризация чистых суспензий CNM-Au8 могут быть найдены в международной заявке PCT/US2010/041427, опубликованной 3 октября 2013, и имеющей название Novel Gold-Based Nanocrystals for Medical Treatments and Electrochemical Manufacturing Processes Therefor, полное содержание которой включено в настоящее описание в качестве ссылки.
Способы применения золотых (предпочтительно CNM-Au8) наносуспензий в качестве терапевтических средств
Один вариант осуществления настоящего изобретения относится к способам предупреждения демиелинизации или дисмиелинизации и/или стимуляции миелинизации или ремиелинизации нейронов, включая нейроны ЦНС и/или нейроны ПНС. Для целей способов по настоящему изобретению кристаллические наносуспензии элементарного золота могут уменьшать ингибирование миелинизирования ЦНС и/или стимуляции выживания нейрональных клеток ЦНС и/или могут снижать или ингибировать экспрессию некоторых антагонистов. В предпочтительном варианте осуществления нанокристаллические суспензии CNM-Au8 согласно примеру 1 используют в таких способах.
Следующие варианты осуществления изобретения включают способ стимуляции миелинизации нейронов (включая нейроны ЦНС) у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, эффективного количества (либо терапевтического, либо профилактического) композиции, содержащей кристаллическую наносуспензию элементарного золота. В предпочтительном варианте осуществления в таких способах используют нанокристаллические суспензии CNM-Au8 согласно примеру 1.
Дополнительный вариант осуществления настоящего изобретения относится к способам лечения заболевания, нарушения, патологического состояния и/или повреждения, ассоциированного с дисмиелинизацией или демиелинизацией, у животного (например млекопитающего), страдающего таким состоянием, причем способ включает, по существу состоит или состоит из введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества наносуспензии золотых кристаллов, и в предпочтительном варианте осуществления используют нанокристаллические суспензии CNM-Au8 согласно примеру 1.
Другие варианты осуществления изобретения включают способы стимуляции выживания нейронов ЦНС и/или нейронов ПНС у млекопитающего, нуждающегося в этом, включающие введение эффективного количества наносуспензии золотых кристаллов. В предпочтительном варианте осуществления в таких способах используют нанокристаллические суспензии CNM-Au8 согласно примеру 1.
Следующие варианты осуществления изобретения включают способы стимуляции дифференцировки олигодендроцитов у млекопитающего, включающие введение млекопитающему, нуждающемуся в этом, эффективного количества композиции, содержащей наносуспензию золотых кристаллов. В предпочтительном варианте осуществления в таких способах используют нанокристаллические суспензии CNM-Au8 согласно примеру 1.
Дополнительные варианты осуществления изобретения включают способы снижения или ингибирования экспрессии поврежденного миелина, демиелинизации или дисмиелинизации относительно отсутствия предоставления эффективного количества нанокристаллической суспензии золота, включающие модификацию миелинизации нейронов (ЦНС и/или ПНС) композицией, содержащей эффективное количество (как профилактическое, так и терапевтическое) нанокристаллической суспензии золота. В предпочтительном варианте осуществления в таких способах используют нанокристаллические суспензии CNM-Au8 согласно примеру 1.
Дополнительные варианты осуществления изобретения включают способы ингибирования или снижения нежелательных патологических явлений, ассоциированных с повреждением миелина в отсутствие предоставления эффективного количества нанокристаллической суспензии CNM-Au8 согласно примеру 1, включающие предоставление индивидууму, нуждающемуся в этом, композиции, содержащей наносуспензию CNM-Au8.
В способах лечения по настоящему изобретению нанокристаллические суспензии, предпочтительно нанокристаллические суспензии CNM-Au8, можно вводить путем перорального введения, посредством инъекций и/или назальным путем.
В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить посредством болюсной инъекции или длительной инфузии. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить прямо в центральную нервную систему посредством, например, интратекального или эпидурального введения. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить прямо в хронический очаг повреждения, где выражено повреждение миелина. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить прямо в кровоток млекопитающего.
В определенных вариантах осуществления изобретения золотые наносуспензии и предпочтительно нанокристаллические суспензии CNM-Au8 вводят в качестве терапевтического средства от заболевания, которое включает прогрессирующий надъядерный паралич, болезнь Александера, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Канавана, лейкодистрофии, энцефаломиелит, центральный понтинный миелолиз (CPM), болезнь анти-MAG, болезнь Пелицеуса-Мерцбахера, болезнь Рефсума, синдром Кокейна, синдром Цельвегера, cиндром Гийена-Барре (GBS), синдром Ван дер Кнаппа, хроническую воспалительную демиелинизирующую полиневропатию (CIDP), многоочаговую двигательную невропатию (MMN), оптический нейромиелит (NMO), прогрессирующую многоочаговую лейкоэнцефалопатию (PML), уоллеровское перерождение и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александера, мягкое нарушение когнитивной способности (MCI), также известное как старческое нарушение когнитивной способности и болезнь Пелицеуса-Мерцбахера (PMZ). Нанокристаллическую суспензию золота можно получать и использовать в качестве лекарственного средства, которое останавливает, снижает, предотвращает или ингибирует способность к повреждающим событиям, которые приводят к дисмиелинизации, демиелинизации и/или событиям, которые подавляют миелинизацию и/или нейрональную выживаемость и/или увеличивают экспрессию хорошего миелина (например, ремиелинизацию) или взаимодействия хороший миелин/аксон.
Один вариант осуществления настоящего изобретения относится к способам лечения у индивидуума заболевания, нарушения или повреждения, обусловленного дисмиелинизацией или демиелинизацией (например, оптический нейромиелит у индивидуума, страдающего таким заболеванием), причем способ включает, по существу состоит из или состоит из введения индивидууму терапевтически эффективного количества наносуспензии золота и в предпочтительном варианте осуществления наносуспензии CNM-Au8 путем титрования клинического эффекта посредством варьирования концентрации, объема и/или частоты дозирования.
Кроме того, изобретение относится к способу стимуляции миелинизации нейронов (включая ремиелинизацию) у млекопитающего, включающему, по существу состоящему или состоящему из ведения эффективного количества (как терапевтического, так и профилактического) наносуспензии золота, и предпочтительно наносуспензии CNM-Au8.
Дополнительный вариант осуществления настоящего изобретения относятся к способам лечения заболевания, нарушения или повреждения, обусловленных гибелью олигодендроцитов или недостаточностью дифференцировки, например, оптического нейромиелита, болезни Пелицеуса-Мерцбахера или глобоидно-клеточной лейкодистрофии (болезнь Краббе), у животного, страдающего таким заболеванием, причем способ включает, по существу состоит или состоит из введения животному эффективного количества наносуспензии золота и в предпочтительном варианте осуществления наносуспензии CNM-Au8.
Другой аспект изобретения относятся к способу стимуляции пролиферации, дифференцировки и выживания олигодендроцитов у млекопитающего, включающему, по существу состоящему или состоящему из введения терапевтически эффективного количества наносуспензии золота и в предпочтительном варианте осуществления наносуспензии CNM-Au8.
Наносуспензию золота и в предпочтительном варианте осуществления наносуспензию CNM-Au8 для применения в способах лечения, описанных в настоящем описании, можно получать и использовать в качестве лекарственного средства, которое останавливает, снижает, предотвращает или ингибирует способность патологических событий, которые подавляют ремиелинизацию нейронов олигодендроцитами. Кроме того наносуспензию золота и предпочтительно наносуспензию CNM-Au8 для применения в способах введения, описанных в настоящем описании, можно получать и использовать в качестве лекарственного средства, которое останавливает, снижает, препятствует или ингибирует способность патологических событий подавлять дифференцировку, пролиферацию и выживаемость олигодендроцитов.
Следующие варианты осуществления изобретения включают способ индукции пролиферации или выживания олигодендроцитов для лечения заболевания, нарушения или повреждения, вовлекающих разрушение олигодендроцитов или миелина, включающий доставку млекопитающему в или вблизи области заболевания, нарушения или повреждения, нанокристаллов золота из наносуспензии CNM-Au8 в количестве, достаточном для снижения ингибирования удлинения аксонов и/или стимуляции миелинизации и/или смягчения демиелинизации.
В способах лечения по настоящему изобретению наносуспензии золота можно вводить посредством перорального введения, инъекций и/или назального введения.
В некоторых вариантах осуществления наносуспензию золота и предпочтительно наносуспензию CNM-Au8 можно вводить посредством болюсной инъекции или длительной инфузии. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить прямо в центральную нервную систему посредством, например, интратекального или эпидурального ведения. В некоторых вариантах осуществления суспензию CNM-Au8 можно вводить прямо в хронический очаг повреждения, где выражено повреждение миелина. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить прямо в кровоток млекопитающего.
Заболевания или нарушения, которые можно лечить или смягчать способами по настоящему изобретению, включают заболевания, нарушения или повреждения, которые связаны с дисмиелинизацией или демиелинизацией нейронов млекопитающих. В частности, такие заболевания и нарушения включают заболевания и нарушения, при которых миелин, который окружает нейрон, либо отсутствует, либо является неполным, либо не образуется надлежащим образом, либо ухудшается. Такие заболевания включают, но не ограничиваются ими, прогрессирующий надъядерный паралич, болезнь Александера, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Канавана, лейкодистрофии, энцефаломиелит, центральный понтинный миелолиз (CPM), болезнь анти-MAG, болезнь Пелицеуса-Мерцбахера, болезнь Рефсума, синдром Кокейна, синдром Цельвегера, синдром Гийена-Барре (GBS), синдром Ван дер Кнаппа, хроническую воспалительную демиелинизирующую полиневропатию (CIDP), многоочаговую двигательную невропатию (MMN), оптический нейромиелит (NMO), прогрессирующую многоочаговую лейкоэнцефалопатию (PML), мягкое нарушение когнитивной способности (MCI), также известное как старческое нарушение когнитивной способности, уоллеровское перерождение и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александера и Пелицеуса-Мерцбахера (PMZ).
Заболевания или нарушения, которые можно лечить или смягчать способами по настоящему изобретению, включают заболевания, нарушения или повреждения, которые связаны с гибелью или недостаточностью пролиферации или дифференцировки олигодендроцитов. Такие заболевания включают, но не ограничиваются ими, прогрессирующий надъядерный паралич, болезнь Александера, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Канавана, лейкодистрофии, энцефаломиелит, центральный понтинный миелолиз (CPM), болезнь анти-MAG, болезнь Пелицеуса-Мерцбахера, болезнь Рефсума, синдром Кокейна, синдром Цельвегера, cиндром Гийена-Барре (GBS), синдром Ван дер Кнаппа, хроническую воспалительную демиелинизирующую полиневропатию (CIDP), многоочаговую двигательную невропатию (MMN), оптический нейромиелит (NMO), прогрессирующую многоочаговую лейкоэнцефалопатию (PML), мягкое нарушение когнитивной способности (MCI), также известное как старческое нарушение когнитивной способности, уоллеровское перерождение и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александера и Пелицеуса-Мерцбахера (PMZ).
Заболевания или нарушения, которые можно лечить или смягчать способами по настоящему изобретению, включают нейродегенеративные заболевания или нарушения. Такие заболевания включают, но не ограничиваются ими прогрессирующий надъядерный паралич, болезнь Александера, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Канавана, лейкодистрофии, энцефаломиелит, центральный понтинный миелолиз (CPM), болезнь анти-MAG, болезнь Пелицеуса-Мерцбахера, болезнь Рефсума, синдром Кокейна, синдром Цельвегера, cиндром Гийена-Барре (GBS), синдром Ван дер Кнаппа, хроническую воспалительную демиелинизирующую полиневропатию (CIDP), многоочаговую двигательную невропатию (MMN), оптический нейромиелит (NMO), прогрессирующую многоочаговую лейкоэнцефалопатию (PML), мягкое нарушение когнитивной способности (MCI), также известное как старческое нарушение когнитивной способности, уоллеровское перерождение и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александера и Пелицеуса-Мерцбахера (PMZ).
Примеры дополнительных заболеваний, нарушений или повреждений, которые можно лечить или смягчать способами по настоящему изобретению, включают, но не ограничиваются ими, травму спинного мозга, хроническую миелопатию или радикулопатию, травматическое повреждение головного мозга, болезнь двигательного нейрона, разрыв аксонов, ушибы, паралич, пострадиационное повреждение или другие неврологические осложнения химиотерапии, инсульт, крупные полости, окклюзии сосудов от средних до крупных, лейкоареоз, острую ишемическую оптическую невропатию, дефицит витамина E (синдром изолированного дефицита, AR, синдром Бессена-Корнцвейга), дефицит B12, B6 (пиридоксиновая пеллагра), тиамина, фоллатов, никотиновой кислоты, болезнь Маркиафавы-Биньями, метахроматическую лейкодистрофию, невралгию тройничного нерва, паралич Белла или любое нейрональное повреждение, которое может потребовать регенерации аксонов, ремиелинизации или выживания или дифференцировки/пролиферации олигодендроцитов.
ПРИМЕР 2
Модель демиелинизации с купризоном - пилотное исследование на 16 мышах
Целью этого пилотного исследования было определение того могут ли нанокристаллические суспензии "CNM-Au8", концентрированные до 51 чнм и употребляемые без ограничений, влиять на количество и степень повреждения миелиновой оболочки (или репарацию), которая как правило, возникает при индуцируемой купризоном демиелинизации нейронов в головном мозге мыши. Модель с купризоном на мышах предназначена для имитации повреждения миелиновой оболочки у млекопитающих при множестве заболеваний, которые патологически проявляются как демиелинизация или дисмиелинизация.
Всего 16 самцов мышей C57BL6 было разделено на 4 группы (четыре на группы), как показано в таблице 2. Две дополнительных мыши использовали в качестве дублеров, и они не потребовались в исследовании. Возраст мышей в начале исследования составлял 8 недель.
В попытках индуцировать демиелинизацию путем введения токсического купризона и наблюдения возможного уменьшения демиелинизации и/или стимуляции ремиелинизации посредством введения наносуспензий золота, две из четырех группы мышей кормили кормом с купризоном в течение 5 недель. Наносуспензии CNM-Au8 (концентрация нанокристаллов золота 51 чнм) предоставляли без ограничений (в качестве единственной питьевой жидкости для мышей) для всех мышей в группах 3 и 4 (как группа введения, так и группа контроля), как показано в таблице 2. Всех мышей наблюдали в процессе исследования и любое аномальное поведение регистрировали.
Всех мышей умерщвляли после исследования в течение 5 недель, как показано в таблице 2. В каждой из четырех групп заданную область головного мозга из трех из четырех мышей фиксировали для иммунного окрашивания (например, для определения относительного количества присутствующего миелина). В частности, коронарная область от брегмы-0,82 мм до брегмы-1,82 мм представляет собой представляющую особый интерес область в этой модели на животных.1,2 Эти области головного мозга трех из четырех мышей для каждой группы окрашивали в отношении присутствия протеолипидного белка миелина ("PLP"), как рассмотрено в литературе.3 Результаты окрашивания представлены на фиг.13A-13C. Головной мозг из четвертой мыши в каждой группе обрабатывали иным образом и специально подготавливали для исследований с использованием трансмиссионной электронной микроскопии ("TEM").
Область мозолистого тела головного мозга имеет высокую плотность аксонов, и эта область была объектом исследований TEM. По меньшей мере девять репрезентативных изображений TEM аксонов/миелиновых оболочек, полученных для области мозолистого тела, представлены на фиг.14A-14D для одной мыши из каждой из групп 1-4, соответственно. По меньшей мере девять изображений TEM предоставлены на каждой из фиг.14A-14D, чтобы показать типичные колебания для аксонов/миелина в мозолистом теле для каждого головного мозга мыши. Результаты, показанные на фиг.13A-13C и 14A-14D каждого исследования, указывают на то, что нанокристаллические суспензии CNM-Au8 благоприятно влияют на величину повреждения миелина и/или репарации миелина в головном мозге в наблюдаемых областях между брегмой-0,82 мм и брегмой-1,82 мм (например, см. для сравнения фиг.14B, группа 2, и фиг.14D, группа 4) и важное значение имеет то, что наносуспензии CNM-Au8, как оказалось, не оказывают неблагоприятного эффекта на количество присутствующего миелина при предоставлении отдельно с нормальным кормом (например, см. фиг.14C-группа 3).
Материалы и способы
Подготовка животных и индукция демиелинизации
Самцов мышей C57BL6 получали от Harlan Labs. Всех мышей наблюдали в течение 7-11 суток перед началом исследования в течение 5 недель. Клетки с мышами подвергали стандартному уходу один раз в неделю и проводили мониторинг мышей в отношении изменений поведения и взвешивали один раз в неделю как до, так и в процессе исследования в течение 5 недель. На фиг.19 представлено среднее увеличение массы тела в процессе исследования на мышь для каждой из групп 1-4. Мышам во всех группах позволяли есть и пить столько, сколько они хотели. В частности, все из корма, воды и терапевтических суспензий CNM-Au8 (51 чнм золота) предоставлялись без ограничений. Количество употребляемой воды и терапевтической суспензии CNM-Au8 регистрировали каждые сутки. Среднее количество жидкости, употребляемое каждые сутки мышами в каждой из групп 1-4, показано на фиг.18. Свежую воду и свежие наносуспензии CNM-Au8 предоставляли каждые сутки.
Демиелинизацию индуцировали путем кормления самцов мышей C57BL6 в возрасте 8 недель кормовыми гранулами, содержавшими 0,2% купризона (бис-циклогексанон оксальдигидразон) (обозначаемый в настоящем описании как "корм с купризоном "), полученными от Harlan Labs (TD 06172) и предварительно смешанными в стандартные кормовые гранулы. Кормовые гранулы контрольного рациона заменяли каждую неделю, в то время как корм с купризоном заменяли каждые 48 часов. Корм с купризоном предоставляли в течение пяти недель в группах 2 и 4, в соответствии с таблицей 2. Для каждой из четырех групп использовали размер группы, составляющий четыре мыши, причем только 2 мыши содержали в одной клетке вследствие агрессивного характера этих самцов мышей.
В этом пилотном исследовании мышей подвергали анестезии с использованием пентобарбитала натрия (80 мг/кг) путем инъекции пентобарбитала натрия в брюшину иглой калибра 27, 0,5 дюйма (1,25 см). Для минимизации ишемии головного мозга стадии перфузии начинали сразу после того, как каждая мышь достигала бессознательного состояния. Использовали два различных набора буферов для перфузии, в зависимости от того, намеревались ли головной мозг мыши подвергать иммунному окрашиванию или фотомикроскопии TEM. Для перфузии, ассоциированной с иммунным окрашиванием, использовали всего 50 мл холодного солевого раствора (0,9% NaCl в dH2O), а затем всего 150 мл фиксажа (4% параформальдегид ("PFA")) при 4°C, которые последовательно пропускали в кровоток мыши посредством перистальтического насоса. Для перфузии, ассоциированной с трансмиссионной электронной фотомикроскопией, аналогично использовали 50 мл холодного солевого раствора, а затем 150 мл фиксажа (3,5% PFA, 1,5% глутаральдегид в 0,1M какодилате). Перистальтический насос доставлял каждую жидкость со скоростью приблизительно 8-10 мл/мин. Следили за тем, чтобы избегать образования каких-либо воздушных пузырьков в трубках перистальтического насоса на протяжении стадии перфузии.
Для достижения достаточной перфузии правое предсердие сердца каждой мыши вскрывали небольшими ножницами. Затем в вершину левого желудочка вставляли иглу-бабочку, и насос начинал качать упомянутые выше жидкости, в то время как часть каждого сердца, представляющую собой правый желудочек, осторожно держали пинцетом. Головной мозг трех мышей в каждой группе подготавливали для заливки в парафиновый блок (для иммунного окрашивания) в то время как головной мозг одной мыши подготавливали для фотомикроскопии TEM. После извлечения головного мозга каждой мыши, каждый головной мозг подвергали постфиксации в заранее подготовленных холодных буферах (4°C), соответственно, и либо заливали парафином для иммунного окрашивания, либо заливали смолой для фотомикроскопии TEM, в соответствии с литературой4.
Иммуногистохимия
Для иммунного окрашивания PLP, серийные коронарные срезы толщиной 7 мкм между брегмой-0,82 мм и брегмой-1,82 мм (согласно атласу мышей Paxinos and Franklin3) получали с использованием специализированного держателя, показанного на фиг.12A и 12B, а затем анализировали.
В частности, головной мозг каждой мыши сначала заключали в блок агара. Приблизительно 40 грамм порошка агара (триптический соевый агар, REF 236950, BD) смешивали тщательно приблизительно с 1 литром очищенной воды, а затем смесь нагревали при частом встряхивании и кипятили в течение приблизительно 1 минуты для полного растворения порошка. Форму 301 помещали в основание 302 как показано на фиг.12A. Затем в установленную форму 301 помещали головной мозг мыши. Когда температура нагретого агара/водной смеси снижалась до температуры, немного превышающей комнатную температуру, установленную форму 301 заполняли. Приблизительно через 2-3 минуты форму 301 снимали с основания 302 и формировали блок агара, содержащий головной мозг.
Затем блок агара помещали в держатель 303 и часть головного мозга, соответствующую голове каждой мыши, помещали так, чтобы она была обращена к краю отреза 304. Как показано на фиг.12B, затем держатель 303 перемещали в направлении головного мозга, соответствующем хвосту мыши, и помещали в положении, которое соответствовало брегме-0,82, и головной мозг разрезали вдоль края отреза 304 лезвием. Затем держатель 303 смешали приблизительно на 1 мм в хвостовом направлении головного мозга и затем край отреза 304 помещали на уровне брегмы-1,82. Затем блок головного мозга вновь разрезали по краю отреза 304 тем же лезвием с получением среза толщиной 1 мм между брегмой-0,82 и -1,82.
В соответствии со способами, упомянутыми выше3, залитые парафином срезы депарафинировали, регидратировали, пока они находились в стеклянном контейнере, частично заполненном 10 мМ цитратным буфером (pH 6,0), а затем нагревали с использованием микроволнового излучения в обычной домашней микроволновой печи мощностью 1,65 КВт до тех пор, пока буфер не начинал кипеть. Затем срезы головного мозга гасили 0,3% H2O2, блокировали в течение приблизительно 1 ч в PBS, содержавшем 3% нормальную сыворотку лошади и 0,1% Triton X-100. Затем срезы головного мозга инкубировали при 4°C в течение ночи в контакте с первичным антителом против PLP, а именно, с IgG мыши (от AbD Serotec) с коэффициентом разведения 1:500. IgG мыши был выбран в качестве первичного антитела, поскольку в головном мозге IgG практически не присутствует за исключением твердой оболочки головного мозга.
После промывания промывочным буфером (буфер PBS, pH 7,4), коронарные срезы головного мозга далее инкубировали с биотинилированным вторичным антителом против IgG мыши (приобретенное от Vector Laboratories) в течение приблизительно 1 часа, а затем подвергали воздействию связанного с пероксидазой комплекса авидин-биотин (ABC Kit, Vector Laboratories) в течение приблизительно 30 минут. Затем материал, о котором известно, что он реагирует со связанным с пероксидазой комплексом авидин-биотин, называемый диамино-3,3’бензидином ("DAB", Vector Laboratories), приводили в контакт со срезами головного мозга, чтобы каждый из срезов изменял цвет от светло-коричневого цвета до темно-коричневого цвета в зависимости от степени реакции, которая происходила между связанным с пероксидазой комплексом авидин-биотин и DAB. Более темно-коричневый цвет соответствовал большему присутствию миелина. На фиг.13B представлен репрезентативный коронарный срез головного мозга с окрашиванием миелина для мыши в каждой из групп 1-4. Для определения общей площади каждого наблюдаемого среза головного мозга (т.е. общей площади поперечного сечения всего вещества головного мозга, присутствующего на каждом предметном стекле) дополнительные серийные образцы срезов головного мозга, расположенные рядом с окрашенными коричневым цветом срезами, окрашивали как антителом PLP (как описано выше), так и гематоксилином, который придавал срезам головного мозга синий цвет (в дополнение к уже присутствующему коричневому окрашиванию). На фиг.13C представлены репрезентативные окрашенные на миелин + окрашенные гематоксилином срезы головного мозга для одной мыши в каждой из групп 1-4.
В частности, для количественного определения иммуноположительных PLP в коронарной части головного мозга каждой мыши исследовали коронарные срезы (т.е. между брегмой -0,82 мм и 1,82 мм). Вместо субъективного присвоения числа, ассоциированного со степенью визуально наблюдаемого окрашивания (т.е. от светло-коричневого до темно-коричневого), использовали уникальный способ, разработанный исследователями.
Сначала специально приспособленный сканер Cannon Scanner (разрешение на выходе 2400 dpi) сканировал каждый из окрашенных коричневым цветом коронарных срезов головного мозга, показанных на фиг.13B. Затем каждый пиксель на сканированном изображении оценивали, и ему автоматический (с помощью Photoshop) присваивалась величина от 1 до 255, причем "255" соответствует наиболее светлому оттенку и "1" соответствует наиболее темному оттенку. Затем данные экспортировали в Excel. Затем общее число пикселей, которым было присвоено число от 1 до 255, вносили в таблицу с получением гистограммы. Затем данные для каждой гистограммы анализировали и определяли количественное средневзвешенное значение "окрашивания" или "оттенка" на каждом окрашенном на миелин коронарном срезе. Эта количественная величина (с соответствующей поправкой на фоновый оттенок) обеспечила возможность проведения прямого сравнения величины цвета для равной площади в каждом окрашенном на миелин коронарном срезе. Для учета фоновых данных при определении цвета или оттенка, соседний серийный коронарный срез использовали в качестве отрицательного контроля. В частности, соседний серийный коронарный срез окрашивали без использования первичного IgG-антитела.
Кроме того, для проведения значимого научного сравнения количества присутствующего миелина (т.е. интенсивность цвета или оттенка), которое может коррелировать с определенными аспектами предупреждения демиелинизации и/или стимуляции ремиелинизации, в исследованных коронарных срезах головного мозга каждой мыши в каждой группе мышей, также было необходимо определить общее количество (т.е. площадь поперечного сечения) вещества головного мозга, присутствующего в каждом из коронарных срезов. Таким образом, необходимо было определить общую площадь вещества головного мозга для каждой коронарной секции, представленную на фиг.13C, чтобы количественно определить и нормализовать общую величину окрашивания/площадь вещества головного мозга. Затем величину окрашивания на единичную площадь использовали для прямого сравнения относительного количества присутствующего миелина. Таким образом, гематоксилин использовали для окрашивания всего вещества головного мозга в другом непосредственно соседнем серийном коронарном срезе. Эти срезы головного мозга аналогичным образом количественно определяли и общую "величину окрашивания" (т.е. светлота или темнота), определенную для первой коронарной секции, сравнивали с общей площадью поперечного сечения присутствующего вещества головного мозга (соответствующая интенсивности как синего окрашивания, так светло- или темно-коричневого окрашивания выше минимальной пороговой величины), определенной в соседней или серийной коронарной секции для определения общей величины окрашивания или оттенка/единица площади головного мозга.
Как утверждалось выше, существовало 4 группы мышей, и для целей окрашивания каждая группа имела 3 мыши. Поскольку интенсивность окрашивания может варьироваться в зависимости от условий окружающей среды, которые могут варьироваться, когда стадии окрашивания проводят для очень большого количества образцов, значительное внимание уделялось нормализации вариаций окрашивания или интенсивности цвета, чтобы экспериментальные результаты не были искаженными. Следующие хорошо известные и общепризнанные стадии проводили по существу в соответствии с литературой.
В кратком изложении, после определении величины цвета или оттенка на единицу площади вещества головного мозга, из каждого результата вычитали отрицательный контроль (соответствующий интенсивности окрашивания или оттенка без применения упомянутого выше первичного антитела).
Более того, для количественного определения планировали и использовали три отдельных набора для окрашивания. Каждый набор содержал четыре партии с одинаковыми характеристиками окрашивания. Каждая партия содержала один образец из каждой группы и один отрицательный контроль. Окрашивание каждого образца повторяли четыре раза для получения четырех партий окрашивания. Наконец, три образца из группы 1 и отрицательный контроль окрашивали в пятой партии.
Относительную плотность окрашивания или оттенка в каждой партии сначала представляли в качестве относительного процента против соответствующего образца группы 1 в каждой партии. В трех образцах из группы 1 коэффициенты нормализации выражали в качестве относительного соотношения против образца 1 согласно окрашиванию в пятой партии.
Кроме того, относительную плотность против образца 1 группы 1 вновь вычисляли путем умножения относительной плотности в каждой партии на их соответствующие (и вычисленные) коэффициенты нормализации.
Наконец, в каждом образце среднее значение относительной плотности против образца 1 группы 1 из четырех партий вычисляли и определяли как "относительную плотность PLP", которую затем наносили на столбчатую диаграмму (см. фиг.13A). Все результаты окрашивания миелина представлены на фиг.13A-13C.
Получение срезов головного мозга мыши для трансмиссионной электронной микроскопии
После перфузии образцы подвергали постфиксации в упомянутом выше фиксаже в течение 4-6 часов при 4°C, а затем промывали буфером на основе какодилата (0,1M, pH 7,4) три раза и хранили в том же буфере при 4°C в течение 2-3 суток.
Коронарный препарат вырезали из среза головного мозга между брегмой-0,82 мм и -1,82 мм с использованием специализированного держателя/методики, показанных на фиг.12.
В частности, головной мозг каждой мыши сначала заключали в блок агара. Приблизительно 40 грамм порошка агара (триптический соевый агар, REF 236950, BD) тщательно смешивали приблизительно с 1 литром очищенной воды, а затем смесь нагревали при частом встряхивании и кипятили в течение приблизительно 1 минуты для полного растворения порошка. Форму 301 помещали в основание 302 как показано на фиг.12A. Затем в установленную форму 301 помещали головной мозг мыши. Когда температура нагретого агара/водной смеси снижалась до температуры, немного превышающей комнатную температуру, установленную форму 301 заполняли. Приблизительно через 2-3 минуты форму 301 снимали с основания 302 и формировали блок агара, содержащий головной мозг.
Затем блок агара помещали в держатель 303 и часть головного мозга, соответствующую голове каждой мыши, помещали так, чтобы она была обращена к краю отреза 304. Как показано на фиг.12B, затем держатель 303 перемещали в направлении головного мозга, соответствующем хвосту мыши, и помещали в положении, которое соответствовало брегме-0,82, и головной мозг разрезали вдоль края отреза 304 лезвием. Затем держатель 303 смешали приблизительно на 1 мм в хвостовом направлении головного мозга и затем край отреза 304 помещали на уровне брегмы-1,82. Затем блок головного мозга вновь разрезали по краю отреза 304 тем же лезвием с получением среза толщиной 1 мм между брегмой-0,82 и -1,82.
Ткани препарата подвергали постфиксации в 1,5% фероцианиде калия и 1% тетроксиде осмия в буфере на основе какодилата в течение приблизительно 40 минут 4°C. После промывания в буфере на основе какодилата 3 раза блоки ткани вновь подвергали постфиксации в 1% тетроксиде осмия в буфере на основе какодилата в течение приблизительно 1 часа при 4°C, а затем проводили промывание три раза в dH2O. Наконец, блоки подвергали постфиксации в 1% уранилацетате в dH2O в течение приблизительно 40 мин при комнатной температуре. Затем после стадий дегидратации следовало погружение блоков в 30% этанол приблизительно на 5 минут, 50% этанол в приблизительно на 5 минут, 70% этанол приблизительно на 5 минут, два раза, в 80% этанол приблизительно на 5 минут, два раза, в 95% этанол приблизительно на 10 минут, два раза, в 100% этанол три раза каждый раз приблизительно на 10 минут, 20 минут и 30 минут, в пропиленоксид приблизительно на 5 минут, два раза, в пропилен оксид плюс смола (соотношение 1:1) приблизительно на 60 минут, и, наконец, помещали в смолу на ночь при комнатной температуре. Затем образцы инкубировали со смолой при 37°C в течение приблизительно 1 часа, затем со смолой плюс катализатор DMP при 37°C в течение приблизительно другого часа и, наконец, погружали в смолу плюс катализатор DMP при приблизительно 60°C в течение приблизительно 48 часов.
Ткань препарата вырезали в средней сагиттальной плоскости головного мозга и получали ультратонкие срезы вдоль поверхности, на которой располагается средняя сагиттальная плоскость. Срезы толщиной приблизительно 90 нм получали с использованием ультрамикротома (Reichert Jung Ultracut, Capovani Brothers Inc.; Scotic, NY) и микрофотографии получали с помощью трансмиссионного электронного микроскопа (TEM, Zeiss Libra 120).
Измерение и количественное определение соотношения G
С использованием предоставленного программного обеспечения для TEM (Zeiss Libra 120) измеряли как площади поперечного сечения нейрональных аксонов, так и общие площади (т.е. площади поперечного сечения аксонов и миелиновых оболочек в комбинации), для 100 случайным образом выбранных аксонов в каждой из четырех групп; а затем с использованием специально адаптированного программного обеспечения оценивали внутренний и наружный диаметры (т.е. наблюдаемые площади поперечного сечения аксона/миелиновой оболочки принимали за концентрические окружности). Соотношения G вычисляли путем деления вычисленного диаметра аксонов на вычисленный общий суммарный наружный диаметр аксонов и миелиновых оболочек. Распределение соотношений G показано на фиг.16 в качестве графика рассеяния с использованием программного обеспечения GraphPad.
Для более ясного предоставления данных нормальные кривые распределения соотношений G наносили на график в Excel. В частности, на фиг.17A-17D показаны гистограммы для каждой из групп 1-4. Набор случайных чисел был получен в соответствии со средним значением и стандартным отклонением и была получена гистограмма под названием "Гистограмма-случайная частота"; а затем реальные данные использовали для построения другой гистограммы под названием "Гистограмма-исходная частота". Затем различия между кривой случайного распределения и кривой исходного распределения сравнивали в каждой группе.
Количественное определение иммунного окрашивания PLP
Как показано на фиг.13A-13D, после употребления корма с купризоном в течение 5 недель мыши группы 2 продемонстрировали выраженную утрату миелина относительно миелина, присутствующего, например, в группах 1, 3 и 4, таким образом, указывая на то, что условия, указанные в таблице 2 для группы 2, были успешными для возникновения демиелинизации по меньшей мере некоторых из коронарных аксонов. Конкретное сравнение между количеством миелина, присутствующего у мышей группы 1 (которых поили водой и кормили контрольным рационом) и мышей группы 2 (которых поили водой и кормили кормом с купризоном) продемонстрировало статистически значимую потерю миелина, p<0,01. Кроме того, мыши группы 4, которые употребляли корм с купризоном в течение всех 5 недель, и которым проводили лечение CNM-Au8 (51 чнм) без ограничений в течение только 3 из 5 недель, продемонстрировали большее количество присутствующего миелина, что указывает на сохранение миелина и/или ремиелинизацию (при сравнении группы 2 и группы 4, p<0,005). Также обращается внимание на количество присутствующего миелина, как показано, например, на изображениях TEM на фиг.14D, как описано в настоящем описании.
Наблюдение миелиновой оболочки в исследованиях с использованием фотомикроскопии TEM
На фиг.14A-14D показаны репрезентативные микрофотографии TEM поперечного сечения областей репрезентативных областей мозолистого тела для четырех различных мышей, а именно, областей одной мыши из каждой из групп 1-4. Условия эксперимента для групп 1, 2, 3 и 4, указанные в таблице 2, как оказалось, обеспечили данные, согласующиеся с тем, что ожидалось для исследования демиелинизации с купризоном, а именно, поддающуюся измерению потерю миелина в группе 2, за период времени, который позволяет определение того, может ли являющееся кандидатом терапевтическое средство (такое как наносуспензия золота CNM-Au) продемонстрировать какие-либо терапевтические или профилактические результаты, такие как предупреждение или замедление демиелинизации и/или стимуляция ремиелинизации.
Репрезентативные образцы поперечного сечения мозолистого тела головного мозга этих четырех мышей сначала наблюдали с использованием TEM при увеличении приблизительно 16000x (и на каждой микрофотографии присутствуют масштабные метки, соответствующие фактическому увеличению). Исследовали сотни областей в мозолистом теле каждой мыши для получения репрезентативного набора микрофотографий TEM. Таким образом, репрезентативные изображения областей поперечного сечения, полученные для мозолистого тела четырех мышей, представлены на фиг.14A-14D (т.е. на каждой фигуре показано 9-10 изображений). С использованием только невооруженного глаза толщина миелиновых оболочек и характеристики аксонов были очень сходными между двумя группами, которым давали контрольный рацион (т.е. контроль (группа 1) и введение только CNM-Au8 (группа 3)). Однако напротив, группа мышей, которые получали корм с купризоном и воду (группа 2), отчетливо показали меньшее общее количество присутствующего миелина (например, что указывает на повреждение и/или демиелинизацию показанных аксонов) в участках наблюдаемых поперечных срезов мозолистого тела. В соответствии с литературой, было обнаружено, что деградация миелина, вызванная рационом с купризомном, имеет не единообразные эффекты (т.е. была неоднородной) на миелине/аксонах в рассмотренных областях поперечного сечения мозолистого тела. В частности, на поперечных срезах мозолистого тела, наблюдаемых в этом исследовании, оказалось, что приблизительно менее чем 40% исследованных областей поперечных срезов проявляли некоторый уровень повреждения миелина, в то время как остальные области поперечного сечения оказались сходными с контролем (т.е. сходными с группой 1). Следует отметить, что это считается типичным и согласуется с модельными исследованиями на мышах с купризоном, описанными в литературе.
Микрофотографии TEM поперечного сечения областей мозолистого тела мышей группы 4 представляют большой интерес. Этим мышам давали корм с купризоном в течение всех 5 недель исследования и терапевтическую суспензию CNM-Au8 без ограничений в течение недель 3-5 исследования. Микрофотографии TEM на фиг.14D показывают, что существовало мало, или даже не существовало, демиелинизированных аксонов и что общее количество присутствующего миелина было сходным с общим количеством миелина, присутствующим в контроле (группа 1). Эта наблюдения соответствуют общему количеству присутствующего миелина, определенного по результатам иммунного окрашивания окрашенных коронарных срезов головного мозга для трех мышей в каждой из групп 1-4, как указано на фиг.13A-13D. В частности, относительная величина окрашивания PLP, показанная на фиг.13A-13D для коронарных срезов трех мышей в каждой из групп мышей 1, 3 и 4 является более высокой (т.е. соответствующей большему количеству присутствующего миелина), чем относительная величина окрашивания PLP для трех мышей в группе 2, которые употребляли корм с купризоном и воду.
Измерение соотношения G и распределения соотношений G
Измерение и количественное определение соотношения G широко используют в качестве функционального и структурного показателя относительной величины покрытия миелином аксонов (т.е. миелинизация аксонов). Чем более высоким является соотношение G, тем более тонким является миелин относительно диаметра аксонов; и напротив, чем более низким является соотношение g, тем более толстой является миелиновая оболочка относительно аксона. Таким образом, как правило и в норме, чем более низким является сообщенное соотношение G, тем лучше. В частности, сообщалось, что средние диапазоны соотношений G для миелинизированных аксонов области мозолистого тела головного мозга находятся в диапазоне 0,75-0,815.
Соотношения G, измеренные в этом исследовании, представлены в таблице 15. Наиболее высокое сообщенное соотношение G присутствует в группе 2, а именно, у мышей, которые употребляли корм с купризоном и воду. Сообщенное соотношение G для мышей группы 2 было более высоким, чем сообщенные соотношения G для других групп. Наиболее низким сообщенное соотношение G было для мышей группы 1, а именно, для мышей, которых кормили контрольным рационом и поили водой.
Интересно, что сравнение соотношений G между мышами группы 1 (вода и корм с купризоном) и мышами группы 3 (суспензия CNM-Au8 без ограничений и контрольный рацион) продемонстрировало очень небольшое различие согласно изображениям TEM на фиг.14A и фиг.14C, соответственно. Эти дополнительные данные также указывают на то, что суспензии CNM-Au8 не имели каких-либо поддающихся количественному определению побочных эффектов, касающихся присутствующего количества миелина.
Для дальнейшего понимания сообщенных соотношений G проводили построение графиков рассеяния данных для каждой из групп 1-4. Как показано на фиг.16, мыши группы 2 (например, более высокое соотношение G; которое может соответствовать менее здоровой или отрицательно модифицированной функции аксонов) проявляли наиболее высокое рассеяния данных по сравнению с тремя другими группами мышей. Рассеяние данных в остальных трех группах мышей было очень сходным; причем значимые различия между группой 1 и группой 3 отсутствовали.
Для дальнейшего количественного определения данных соотношения G данные выражали по-разному на фиг.17A-17D. В частности, кривые нормального распределения составляли и строили, чтобы продемонстрировать непрерывное распределение вероятностей для данных соотношения G в каждой из четырех групп мышей. Каждый из четырех графиков на фиг.17A-17D включает кривую, обозначенную "Гистограмма-случайная частота", которая была получена для "среднего значения" данных соотношения G и стандартного отклонения данных соотношения G для этой группы (эффективно созданной в качестве внутреннего контроля). Кроме того, каждый из четырех графиков на фиг.17A-17D включает кривую, обозначаемую "Гистограмма-исходная частота", которая была получена для фактических данных соотношений G.
Данные, нанесенные на график на фиг.17A-17D, демонстрируют, что график "Гистограмма-случайная частота" и график "Гистограмма-исходная частота" являются в высокой степени сходными для каждой из групп 1, 3 и 4. Напротив, мыши, которые употребляли корм с купризоном (т.е. группа 2) демонстрируют два больших пика, ассоциированных с исходными данными о соотношении G. Более того, кривая "Гистограмма-исходная частота" довольно отличается от кривой распределения "Гистограмма-случайная частота". Интересно, что суспензия для лечения CNM-Au8, предоставляемая без ограничений мышам в группе 4, как оказалось, минимизирует различия в кривых относительно мышей, на которых неблагоприятно воздействовал корм с купризоном. Для данных, ассоциированных с мышами группы 4, кривая "исходного" распределения в основном является сходной с ее кривой "случайного" распределения, причем только очень небольшой пик появлялся на конце кривой, соответствующем более высокому соотношению.
Заключения
Данные указывают на следующее:
1. У мышей, которым давали корм с купризоном и воду в течение 5 недель, развивалась потеря миелина или повреждение (например, демиелинизация), которую добивались исследователи (т.е. группа 2 их таблицы 2).
2. Мыши, которым давали контрольный рацион и суспензию CNM-Au8 без ограничений (т.е. группа 3) не продемонстрировали какого-либо аномального поведения или отличий в показателях миелина относительно мышей, которым давали контрольный рацион и воду (группа 1).
3. Терапевтические суспензии CNM-Au8, предоставляемые без ограничений, положительно влияли на количество присутствующего миелина (например, снижали повреждение миелина и/или стимулировали ремиелинизацию) у мышей группы 4, которым давали корм с купризоном в течение всех 5 недель и суспензию CNM-Au8 (концентрация золота 51 чнм) в течение последних трех недель 3 исследования.
ПРИМЕР 3
Модель демиелинизации с купризоном - 2 неделя/5 неделя - исследование на 105 мышах
Краткое изложение
Целью этого исследования на 105 мышах было определение того, могут ли наносуспензии "CNM-Au8", предоставляемые мышам: (1) либо в качестве лечения без ограничения из бутылок воды с концентрацией золота приблизительно 50 чнм (в качестве единственной питьевой жидкости для мышей в течение последних 3 недель или всех 5 недель исследования); либо (2) путем введения через зонд (в течение последних 3 недель или всех 5 недель исследования) при концентрации золота приблизительно 1000 чнм (и проводимого один раз в сутки через зонд, исходя из массы каждой мыши в объеме приблизительно 10 мл наносуспензии CNM-Au8 /кг массы тела мыши, "10 мл/кг"), действовать в качестве терапевтически эффективного количества или профилактически эффективного количества и, таким образом, влиять на уровень повреждения миелина, присутствующего в мозолистом теле, и/или стимулировать ремиелинизацию по меньшей мере некоторых экзонов в мозолистом теле. Как и в примере 2, повреждение миелина индуцировали посредством употребления мышами корма с купризоном.
Всего 105 самцов мышей C57BL6 разделяли на 7 групп (15 мышей на группу), как показано в таблице 3. Возраст мышей в начале исследования составил приблизительно 8 недель.
В попытках индуцировать повреждение миелина (например, отрицательная реакция миелина и/или демиелинизация), шесть из семи групп (т.е. группы 2-7) кормили тем же кормом с купризоном, который описан в примере 2. Семь группы мышей и соответствующие условия, которым подвергали сем групп мышей, кратко описаны ниже, а также обобщенно представлены в таблице 3.
Группа 1. 15 мышей в группе 1 употребляли обычный корм в течение всех 5 недель исследования (т.е. их не кормили кормом с купризоном) и также пили воду в течение всех 5 недель исследования, а затем их исследовали, как описано в настоящем описании.
Группа 2 . 15 мышей в группе 2 кормили кормом с купризоном в течение двух недель и их поили водой в течение тех же двух недель, а затем исследовали через две недели, как описано в настоящем описании.
Группа 3. 15 мышей в группе 3 кормили кормом с купризоном в течение всех 5 недель и поили водой в течение всех 5 недель исследования, а затем исследовали, как описано в настоящем описании.
Группа 4. 15 мышей в группе 4 кормили кормом с купризоном в течение всех 5 недель исследования и им проводили введение через зонд в течение всех 5 недель один раз сутки концентрированной суспензии CNM-Au8 в объеме 10 мл/кг при концентрации кристаллов золота приблизительно 1000 чнм, а затем использовали, как описано в настоящем описании, для определения того, была ли предоставленная наносуспензия золота профилактически эффективным количеством.
Группаа 5. 15 мышей в группе 5 кормили кормом с купризоном в течение всех 5 недель и поили водой в течение первых 2 недель исследования, а затем проводили введение через зонд в течение следующих 3 недель один раз в сутки концентрированной суспензии CNM-Au8 в объеме 10 мл/кг при концентрации кристаллов золота приблизительно 1000 чнм, а затем использовали, как описано в настоящем описании, для определения того, была ли предоставленная наносуспензия золота терапевтически эффективным количеством.
Группа 6. 15 мышей в группе 6 кормили кормом с купризоном в течение всех 5 недель исследования и поили без ограничений из бутылок с водой терапевтической суспензией CNM-Au8 при концентрации кристаллического золота приблизительно 50 чнм в течение всех 5 недель исследования, и а затем исследовали, как описано в настоящем описании, для определения того, действовала ли представленная наносуспензия золота как эффективный способ лечения.
Группа 7. 15 мышей в группе 7 кормили кормом с купризоном в течение всех 5 недель исследования и поили водой в течение первых 2 недель исследования, а затем поили без ограничений из бутылок с водой терапевтической суспензией CNM-Au8 при концентрации золота приблизительно 50 чнм в течение последующих 3 недель исследования, а затем обрабатывали, как описано в настоящем описании, для определения того, действует ли предоставленная наносуспензия золота в качестве эффективного лечения (например, действует в качестве терапевтически эффективного количества).
Материалы и способы
Подготовка животных и индукция повреждения миелина
Самцов мышей C57BL6 получали от Taconic Farms. Всем мышам позволяли акклиматизироваться в течение 2-4 недель перед началом исследования в течение 2/5 недель. Клетки с мышами подвергали стандартному уходу один раз в неделю и проводили мониторинг мышей в отношении изменений поведения. Мышей взвешивали перед началом исследования, а затем два раза в неделю в процессе исследования. На фиг.22 показано среднее увеличение массы тела на мышь для мышей в каждой из групп 1-7.
15 мышам в каждой из групп 1-7 позволяли есть и пить, сколько они хотели. В частности, все из корма, воды и терапевтических суспензий CNM-Au8 (50 чнм золота) предоставлялись без ограничений или предоставляли через зонд (концентрация золота 1000 чнм), как указано выше. Свежую воду и свежие суспензии CNM-Au8 предоставляли каждые сутки.
Всех мышей подвергали анестезии с использованием авертина (250-400 мг/кг) путем инъекции авертина в брюшину иглой калибра 27, 0,5 дюйма (1,25 см). Для минимизации ишемии головного мозга стадии перфизии начинали сразу после того, как каждая мышь достигала бессознательного состояния. В использованных буферах для перфузии использовали вплоть до 50 мл холодного солевого раствора (0,9% NaCl в dH2O) до тех пор, пока печень не становилась полностью очищенной, как наблюдали для мышей с использованием луп (увеличивающие стекла), а затем всего приблизительно 150-180 мл фиксажа (3,5% PFA, 1,5% глутаральдегид в 0,1M какодилате). Перистальтический насос доставлял каждую жидкость со скоростью приблизительно 4-6 мл/мин. Следили за тем, чтобы избегать образования каких-либо воздушных пузырьков в трубках перистальтического насоса на протяжении стадии перфузии.
Для достижения достаточной перфузии правое предсердие сердца каждой мыши вскрывали небольшими ножницами. Затем в вершину левого желудочка вставляли иглу и насос начинал качать упомянутые выше жидкости. После прохождения по меньшей мере 150 мл PFA (глутаральдегид) перистальтический насос останавливали. С использованием ножниц голову отрезали, проводили небольшой разрез в черепе, который затем отламывали до тех пор, пока не становилось возможно без труда извлечь головной мозг. После извлечения головного мозга каждой мыши каждый головной мозг подвергали постфиксации в заранее подготовленных холодных (4°C) буферах, соответственно, и заключали в смолу для фотомикроскопии TEM, в соответствии с литературой4.
Исходные материалы для перфузии получали из следующих источников:
(1) Натрия какодилата тригидрат (для EM): Sigma Aldrich, каталожный номер №: C0250-100G
(2) Параформальдегид категории EM, очищенный с использованием гранул, 1 кг: Ted Pella, каталожный номер №: 18501
(3) Глутаральдегид, 50%, категории EM, 10×10 мл: Ted Pella, каталожный номер №: 18431
(4) Элемента фильтра для стерилизации: Fisher Scientific, каталожный номер №: 09-740-2A
1-15
1-15
1-15
1-15
1-15
1-15
Получение срезов головного мозга мыши для трансмиссионной электронной микроскопии
После перфузии образцы подвергали постфиксации в упомянутом выше фиксаже в течение 4-6 часов при 4°C, а затем промывали буфером на основе какодилата (0,1M, pH 7,4) три раза и хранили в том же буфере при 4°C в течение 2-3 суток.
Головной мозг извлекали из буфера на основе какодилата и помещали на бумажную салфетку. Лезвие бритвы помещали сагиттально по средней линии головного мозга. Головной мозг, в котором лезвие бритвы было все еще помещено по средней линии, помещали в сагиттальные матрицы 109 головного мозга мыши, показанные на фиг.21A, и лезвие бритвы направляли в центральную борозду 111 сагиттальных матриц 109 головного мозга мыши. Сагиттальные матрицы 109 головного мозга мыши состоят из тринадцати борозд на расстоянии 1 мм друг от друга. Без перемещения головного мозга второе лезвие помещали в борозду 110R, находящуюся на расстоянии 2 мм от центральной борозды с правой стороны, и третье лезвие помещали в борозду 110L, находящуюся на расстоянии 2 мм от центральной борозды с левой стороны. Получали два зеркальных среза ткани головного мозга 103a и 103b, как показано на фиг.20B, 20 C и 20D. Затем вырезали цилиндрические блоки ткани 104R и 104L диаметром 2 мм с использованием Harris Uni-Core (Ted Pella, продукт № 15076), как показано на фиг.20C и 20D. Выбирали положение цилиндрического блока ткани 104R и 104L, где задняя часть (т.е. часть утолщения мозолистого тела) мозолистого тела 105R и 105L проходит через срезы ткани 103a и 103b. Поверхность блока тканей, которая находится на средней сагиттальной плоскости головного мозга, обозначали и на этой поверхности проводили срезы EM.
Блоки тканей подвергали постфиксации в 1,5% фероцианиде калия и 1% тетроксиде осмия в буфере на основе какодилата в течение 40 минут 4°C. После промывания в буфере на основе какодилата 3 раза блоки ткани вновь подвергали постфиксации в 1% тетроксиде осмия в буфере на основе какодилата в течение приблизительно 1 часа при 4°C, а затем проводили промывание три раза в dH2O. Наконец, блоки подвергали постфиксации в 1% уранилацетате в dH2O в течение приблизительно 40 мин при комнатной температуре. Затем после стадий дегидратации следовало погружение блоков в 30% этанол приблизительно на 5 минут, 50% этанол в приблизительно на 5 минут, 70% этанол приблизительно на 5 минут, два раза, в 80% этанол приблизительно на 5 минут, два раза, в 95% этанол приблизительно на 10 минут, два раза, в 100% этанол три раза каждый раз приблизительно на 10 минут, 20 минут и 30 минут, в пропиленоксид приблизительно на 5 минут, два раза, в пропилен оксид плюс смола (соотношение 1:1) приблизительно на 60 минут, и, наконец, помещали в смолу на ночь при комнатной температуре. Затем образцы инкубировали со смолой при 37°C в течение приблизительно 1 часа, затем со смолой плюс катализатор DMP при 37°C в течение приблизительно другого часа и, наконец, погружали в смолу плюс катализатор DMP при приблизительно 60°C в течение приблизительно 48 часов.
Срезы толщиной приблизительно 90 нм получали с использованием ультрамикротома (Reichert Jung Ultracut, Capovani Brothers Inc.; Scotic, NY) и микрофотографии получали с помощь трансмиссионного электронного микроскопа (TEM, Zeiss Libra 120).
15 мышей в группе 2 умерщвляли после 2 недель кормления кормом с купризоном и питья только воды для оценки уровня и типа повреждения аксонального миелина в мозолистом теле после воздействия в течение 2 недель корма с купризоном; и другие 90 мышей в остальных шести группах умерщвляли после 5 недель, как указано в таблице 3.
В каждой из семи групп мышей извлекали заданную область головного мозга каждой мыши. Область мозолистого тела головного мозга плотно заполнена аксонами, которые являются чувствительными к введению купризоном, и эта область была объектом всех исследований TEM. Затем несколько количественных и качественных способов оценки использовали для наблюдения и количественного определения многих из полученных изображений TEM.
I. Сравнение изображений TEM мозолистого тела, полученных при 4000x и 5000x
Первый набор изображений TEM получали при наиболее низком увеличении, исходно при 4000x - 5000x, и этот набор изображений TEM представлен как фиг.23-29. Каждое из этих изображений соответствует небольшой части всей области мозолистого тела головного мозга каждой мыши. Кроме того, эти изображения были выбраны не случайным образом, а они были выбраны, поскольку они соответствуют области(ям) мозолистого тела, которые продемонстрировали наиболее выраженное повреждение миелина.
Вновь следует отметить, что токсическая модель с купризоном не приводит к единообразному повреждению миелина по всему мозолистому телу, так что большое внимание уделялось квалифицированными операторами выбору тех участков, которые проявляли наибольшую величину повреждения вследствие рациона с купризоном.
Все из фиг.23A, 23B и 23C, исходно полученные при 4000x, соответствуют головному мозгу мышей из группы 1. Микрофотографии TEM на фиг.23 демонстрируют, относительно всех других микрофотографий TEM на фиг.24-29, что наибольшее количество миелина присутствует на аксонах мозолистого тела. Нельзя было идентифицировать обширных областей демиелинизации или дисмиелинизации где-либо в областях мозолистого тела этих мышей группы 1.
Все микрофотографии TEM, соответствующие мышам из группы 2, исходно полученные при 4000x, показаны на фиг.24A-24E. Эти репрезентативные изображения TEM демонстрируют области с меньшим присутствием миелина относительно фиг.23A-23C (т.е. контрольная группа 1). Следует отметить, что при осмотре головного мозга мышей группы 2, в головном мозге мышей группы 2 было несколько областей, которые продемонстрировали меньшее содержание миелина, присутствующим в мозолистом теле; и такие области не наблюдали на контрольных изображениях (группы 1), представленных на фиг.23A-23C.
Также следует отметить, что ряд аксонов, показанных на микрофотографиях на фиг.24A-24E, имеют больший диаметр, чем любые аксоны, наблюдаемые и сфотографированные в контрольной группе 1. Наблюдаемый ненормальный более толстый миелин на некоторых аксонах, вероятно, является реакцией на токсический корм с купризоном. В частности, см. фиг.24A, 24D и 24E.
Микрофотографии TEM, соответствующие головному мозгу мышей в группе 3 (т.е. мышей, которым давали корм с купризоном в течение 5 недель), представлены на фиг.25A-25G. Эти репрезентативные изображения TEM, все из которых исходно были получены при 4000x, демонстрируют области мозолистого тела, где еще меньшее количество миелина присутствует относительно мышей группы 2, которые употребляли корм с купризоном в течение только 2 недель. Кроме того, оказалось, что существует еще больше аксонов, имеющих более крупный диаметр и более тонкие миелиновые оболочки, чем любые аксоны, которые наблюдали и для которых получали микрофотографию у мышей из контрольной группы 1. В частности, см. фиг.25D, фиг.25E, фиг.25F и фиг.25G. Повреждение миелина является доказанным событием при индуцируемой купризоном демиелинизации в течение недель 2-613 и аксональные сфероиды, такие как наблюдали в этом примере, описывались ранее.14 Кроме того, большое наблюдаемое набухание аксонов может быть реакцией на утрату миелина.
Изображения TEM, соответствующие головному мозгу мышей из группы профилактического лечения 4, представлены на фиг.26A-26E, все изображения были исходно получены при 4000x. Мышам в группе 4 давали корм с купризоном в течение 5 недель и им проводили зондовое введение один раз в сутки при концентрации золота 1000 чнм (1000 мкг/мл), находящегося в наносуспензиях CNM-Au8, в объеме 10 мл наносуспензии на килограммы массы тела мыши (т.е. 10 мл/кг). На изображении TEM для группы 4 нельзя было выявить областей повреждения миелина, таких как области, показанные на фиг.25A-25G (т.е. группа 3). В действительности, изображения TEM их группы 4 были в некоторой степени сходными с изображениями TEM из контрольной группы 1 (см. фиг.23A-23C для сравнения).
Кроме того, белые стрелки 201, присутствующие на каждой из фиг.26A-26E, соответствуют аксонам, которые в соответствии с литературой демонстрируют характеристики, соответствующие ремиелинизации8. В частности, эти обозначенные аксоны 201 демонстрируют тонкую и темную плотную миелиновую оболочку относительно других аксонов со сходной или большей площадью поперечного сечения.
Изображения TEM, соответствующие головному мозгу мышей из группы 5, показаны на фиг.27A-27D. Эти изображения TEM исходно были получены как при 4000x, так и при 5000x, как отмечено на масштабных метках изображений TEM. Эти изображения, подобно изображениям на фиг.26A-26E, также не имеют каких-либо областей выраженного повреждения миелина, подобно демиелинизированным областям мышей группы 3 (например, существуют значительно сниженные количества областей, проявляющих обширное повреждение миелина или демиелинизацию у мышей в группе 5). Мышей группы 5 кормили кормом с купризоном в течение 5 недель и им вводили наносуспензии CNM-Au8 через зонд один раз в сутки в концентрации 1000 чнм (1000 мкг/мл) и в количестве 10 мл/кг в течение недель 3-5 исследования в качестве терапевтического лечения. Очевидно, что на фиг.27A-27D показано, что зондовое введение упомянутых выше наносуспензий CNM-Au8 имело терапевтический эффект (например, пользу) на мышей группы 5 относительно мышей группы 3.
Изображения TEM, соответствующие головному мозгу мышей из группы 6, представлены на фиг.28A-28G. Эти изображения TEM также исходно были получены при 4000x, как отмечено на масштабных метках изображений. Эти изображения, подобно изображениям на фиг.26A-26E, также демонстрируют значительно сниженные величины площадей или областей, проявляющих обширное повреждение миелина или демиелинизацию, аналогично нежелательным областям, наблюдаемым у мышей группы 3. Мышей группы 6 кормили кормом с купризоном в течение 5 недель и им вводили профилактические суспензии CNM-Au8 без ограничений при концентрации золота 50 чнм (50 мкг/мл) в течение всех 5 недель исследования в качестве лечения. Очевидно, что воздействие без ограничений наносуспензий CNM-Au8 в дозе 50 мкг/мл, имело любой или оба из профилактического и/или терапевтического эффекта на миелин у мышей в группе 6 относительно миелина, наблюдаемого для мышей группы 3.
Кроме того, белые стрелки 201, присутствующие на каждой из фиг.28A-28G, соответствуют аксонам, которые в соответствии с литературой, как полагают, подвергаются ремиелинизации8. В частности, эти обозначенные аксоны демонстрируют тонкую и темную плотную миелиновую оболочку относительно других аксонов со сходной или большей площадью поперечного сечения.
Изображения TEM, соответствующие мышам группы 7, представлены на фиг.29A-29D. Эти изображения TEM исходно были получены при 4000x, как отмечено на масштабных метках изображений. Эти изображения, подобно изображениям на фиг.26A-26E, также демонстрируют значительно сниженные количества областей, проявляющих обширное повреждение миелина или демиелинизацию, сходные с нежелательными областями у мышей в группе 3. Мышей группы 7 кормили кормом с купризоном в течение 5 недель и вводили терапевтические наносуспензии CNM-Au8 без ограничений при концентрации золота 50 чнм (50 мкг/мл) в течение недель 3-5 исследования в качестве способа лечения. Очевидно, что воздействие без ограничений наносуспензий CNM-Au8 в дозе 50 мкг/мл, имело любой или оба из профилактического и/или терапевтического эффекта на мышей группы 3 относительно мышей группы.
Кроме того, белые стрелки 201, присутствующие на каждой из фиг.29A-29D, соответствуют аксонам, которые в соответствии с литературой, как полагают, подвергаются ремиелинизации8. В частности, эти обозначенные аксоны демонстрируют тонкую и темную плотную миелиновую оболочку относительно других аксонов со сходной или большей площадью поперечного сечения.
Эти данные указывают на то, что корм с купризоном приводил к некоторым демиелинизированным аксонам в областях мозолистого тела головного мозга мышей и что суспензии нанокристаллов золота CNM-Au8 были эффективным способом лечения (как терапевтическим, так и профилактическим) для млекопитающих для уменьшения величины демиелинизации аксонов и/или обеспечения ремиелинизации аксонов.
II. Количественное определение демиелинизированных аксонов/единичной площади
Другим способом определения того, существуют ли какие-либо положительные эффекты лечения суспензий нанокристаллов золота CNM-Au8 на величину повреждения миелина вследствие рациона с купризоном, является подсчет числа демиелинизированных аксонов и/или явно поврежденного миелина, находящегося на аксонах, и сравнение числа демиелинизированных аксонов в каждой из групп мышей 1-7. Этот подход упрощается посредством наблюдения серий изображений TEM со сходным увеличением (т.е. исходно полученных при 16000x), полученных случайным образом из области мозолистого тела головного мозга мышей в каждой из групп 1-7. Детали исследования для групп 1-7 указаны в таблице 3, как рассмотрено выше. Эта методология стремится различить демиелинизированные аксоны и недемиелинизированные аксоны, а затем сравнить число демиелинизированных аксонов (на единичную площадь) в каждой группе мышей.
В кратком изложении, в этом подходе наименьший полностью миелинизированный аксон (т.е. полностью миелинизированный аксон с наименьшей площадью поперечного сечения) идентифицирован в каждом изображении TEM белой звездочкой, пронумерованной 203. Этот наименьший полностью миелинизированный аксон 203 служит в качестве исходного "эталонного аксона" на каждой индивидуальной микрофотографии TEM. Затем все немиелинизированные аксоны и/или демиелинизированные аксоны и/или аксоны, которые содержат явно поврежденный миелин, которые имеют приблизительно ту же площадь поперечного сечения или большую площадь поперечного сечения, чем у эталонного аксона 203, классифицируют как являющиеся "демиелинизироваанными", а затем обозначают соответствующей отметкой. Затем отмеченные аксоны подсчитывают индивидуально и складывают, как более подробно описано ниже.
Размер эталонного аксона 203 может изменяться в некоторой степени на каждой микрофотографии TEM, поскольку различные части неоднородного мозолистого тела могут выглядеть в некоторой степени по-разному. После определения среднего количества "демиелинизироваанных" аксонов для контрольной группы 1, среднее число служит в качестве разновидности "фонового шума" и это среднее число вычитают из "средневзвешенного" числа демиелинизированных аксонов в каждой из групп 2-7. Полагают, что с использованием подхода с эталонным аксоном может быть достигнуто более точное понимание локального окружения в мозолистом теле, обеспечивающее более точный подсчет и представление поврежденных или демиелинизированных аксонов.
В частности, на фиг.30A показана репрезентативная микрофотография TEM, исходно полученная при 16000x, случайным образом полученная для области мозолистого тела мыши из контрольной группы 1. На этой микрофотографии TEM наименьшая площадь поперечного сечения полностью миелинизированного аксона обозначена белой звездочкой и пронумерована как 203S. Этот эталонный аксон 203S, идентифицированный квалифицированным оператором, становится эталонным аксоном на этой микрофотографии TEM на фиг.30A.
После выбора этого наименьшего полностью миелинизированного аксона квалифицированным оператором в качестве эталонного аксона 203S на этом изображении TEM, тот же квалифицированный оператор использует компьютер с сенсорной панелью, на которой представляется истинное изображение TEM, и с помощью сенсорного карандаша дотрагивается до экрана и накладывает черную рамку на часть экрана (и, таким образом, накладывает на микрофотографию TEM), соответствующую эталонному аксону 203S. После идентификации эталонного аксона 203S каждый другой аксон, определяемый квалифицированным специалистом как: (1) имеющий такую же площадь поперечного сечения, как и эталонный аксон 203S, и не являющийся миелинизированным (т.е. либо лишен четко определенного миелина, либо миелин отчетливо поврежден), или (2) имеющий большую площадь поперечного сечения, чем у эталонного аксона 203S и не являющийся миелинизированным (т.е. либо лишен четко определенного миелина, либо миелин явно поврежден) обозначается другой черной прямоугольной рамкой (показанной в качестве черной рамки на фиг.30A) путем касания сенсорного экрана аналогичным образом. Когда оператор завершает обозначение всех таких аксонов (1) и (2), программа автоматически подсчитывает все прямоугольные рамки на каждой микрофотографии (т.е. соответствующие всем аксонам (1) и (2), обозначенным квалифицированным оператором и определенные квалифицированным оператором как поврежденные). На фиг.30A также присутствуют белые стрелки, пронумерованные как 202S, наложенные на нее, указывающие на каждую из черных рамок. Эти белые стрелки 202S были добавлены, чтобы облегчить пользователю идентификацию того, какие аксоны из (1) и (2) были отмечены черными рамками (т.е. аксоны, которые были идентифицированы квалифицированным оператором как поврежденные). Однако белые стрелки добавлены вручную после автоматического подсчета (например, подсчет числа поврежденных или демиелинизированных аксонов (1) и (2)).
На фиг.30B представлена та же микрофотография TEM, которая показана на фиг.30A, на которой белой звездочкой идентифицирован эталонный аксон 203 и белыми стрелками 202 указаны аксоны, которые когда-либо содержали черную рамку, однако черные рамки были удалены и остались только белые стрелки 202. На всех остальных микрофотографиях TEM, показанных на фиг.30B - фиг.36B, все из черных рамок были удалены. Однако следует понимать, что белые стрелки 202, хотя и были вручную добавлены позднее, соответствуют аксонам (1) и (2), определенным квалифицированным оператором как поврежденные, при определении, исходя из другого эталонного аксона 203 на каждой микрофотографии TEM.
Таким образом, на фиг.30B представлено репрезентативное поперечное сечение мозолистого тела мышей в контрольной группе 1. На фиг.30B представлена одна белая звездочка 203 в качестве талонного аксона и 12 белых стрелок 202, соответствующих демиелинизированным аксонам (1) и (2), определенным квалифицированным оператором как поврежденные.
Аналогично, фиг.30C соответствует другому репрезентативному поперечному сечению мозолистого тела мыши в контрольной группе 1. В этом случае эталонный аксон 203 также обозначен таким же образом с использованием белой стрелки 203 и каждый из этих демиелинизированных аксонов (1) и (2) также обозначен белой стрелкой, пронумерованной как 202. На фиг.30C представлены 11 демиелинизированных аксонов.
Аналогично, на фиг.31A и 31B представлены две репрезентативные микрофотографии TEM, также полученные при 16000X, полученные для репрезентативных мышей группы 2, и также идентифицирующие сходный эталонный аксон 203 на каждом изображении TEM белой звездочкой и 15 демиелинизирвоанных аксонов 202 на фиг.31A; и 17 демиелинизированных аксонов 202 на фиг.31B.
Аналогичным образом мыши из каждой из групп 3-7 также показаны двумя сходными репрезентативными микрофотографиями TEM мозолистого тела, полученными для мышей каждой из этих групп.
Фиг.32A и 32B соответствуют репрезентативным изображениям TEM мозолистого тела от мышей группы 3, на которых показан эталонный аксон 203 и 23 демиелинизированных аксона 202; и 20 демиелинизированных аксонов 202, соответственно.
Фиг.33A и 33B соответствуют репрезентативным изображениям TEM мозолистого тела от мышей группы 4, на которых показан эталонный аксон 203 и 17 демиелинизированных аксонов 202; и 19 демиелинизированных аксонов 202, соответственно.
Фиг.34A и 34B соответствуют репрезентативным изображениям TEM мозолистого тела от мышей группы 5, на которых показан эталонный аксон 203 и 13 демиелинизированных аксонов 202; и 15 демиелинизированных аксонов 202, соответственно.
Фиг.35A и 35B соответствуют репрезентативным изображениям TEM мозолистого тела от мышей группы 6, на которых показан эталонный аксон 203 и 18 демиелинизированных аксонов 202; и 15 демиелинизированных аксонов 202, соответственно.
Фиг.36A и 36B соответствуют репрезентативным изображениям TEM мозолистого тела от мышей группы 7, на которых показан эталонный аксон 203 и 15 демиелинизированных аксонов 202; и 14 демиелинизированных аксонов 202, соответственно.
В таблице 4 показано в форме обобщения общее число микрофотографий TEM, сходных с микрофотографиями, являющимися репрезентативными микрофотографиями, показанными на фиг.30-36, которые исследовали сходным образом. В этом отношении, например, всего 45 микрофотографий TEM было исследовано для мышей в группе 1. Кроме того, среди этих 45 микрофотографий TEM, исследованных для группы 1, было подсчитано всего 419 демиелинизированных аксонов. В четвертой колонке таблицы 4 приведено "средневзвешенное количество подсчитанных демиелинизированных аксонов на микрофотографию" и показано, что их было "10" для группы 1. Следует отметить, что средневзвешенное значение было получено следующим образом.
В каждой из групп 1-7 репрезентативные образцы мозолистого тела из каждой мыши фотографировали в множестве положений. Для каждого образца в мозолистом теле "Общее число подсчитанных демиелинизированных аксонов" на всех микрофотографиях было суммировано и было определено среднее число демиелинизированных аксонов на микрофотографию для каждого образца (результаты не представлены). Вследствие вариабельности некоторых стадий перфузии, некоторые образцы мозолистого тела имели большее число микрофотографий лучшего качества, которые можно было использовать для подсчета. Таким образом, среднему числу демиелинизированных аксонов для каждого образца мозолистого тела приписывали вес в соответствии с качеством набора микрофотографий этого образца. Массу определяли следующим образом. Для каждого образца мозолистого тела из группы мышей число демиелинизированных аксонов, идентифицированных для этого образца, делили на общее число демиелинизированных аксонов, идентифицированных для этой группы. Оно представляет собой вес образца. Вес каждого образца умножали на среднее число демиелинизированных аксонов на микрофотографию для образца. Эти взвешенные средние значения для образца обобщали для каждой группы и указывали как "средневзвешенное число демиелинизированных аксонов на микрофотографию" в таблице 4.
В последнем столбце в таблице 4 приводится "Средневзвешенное значение демиелинизированных аксонов на микрофотографию с внесенной поправкой". Эти числа определяли путем вычитания "10" из предшествующего столбца, где "10" фактически соответствует "фоновому шуму" на микрофотографиях.
Таким образом, наивысшее число для "Средневзвешенного значения демиелинизированных аксонов на микрофотографию с внесенной поправкой" встречается в группе 3, и наиболее низкое число для "Средневзвешенного значения демиелинизированных аксонов на микрофотографию с внесенной поправкой" встречается в группе 1 (т.е. контрольная группа).
В сумме, всего 313 микрофотографий TEM репрезентативных частей мозолистого тела было рассмотрено для различного числа мышей в каждой из групп 1-7 с получением общего числа подсчитанных демиелинизированных аксонов, составляющего приблизительно 4200. В таблице 2 описано средневзвешенное значение подсчитанных демиелинизированных аксонов для каждой группы мышей.
Следует понимать, что определение общего числа "демиелинизированных" аксонов на TEM микрофотографий проводили так, чтобы оно было осуществлено настолько объективно, насколько это возможно. В этом отношении, микрофотографии для случайно выбранных частей мозолистого тела получали по отдельности. Микрофотографии (все из которых исходно получены при 16000x), которые обеспечили достаточно отчетливое различение между аксонами, были микрофотографиями-кандидатами для подсчета "демиелинизированных" аксонов. Следует отметить, что некоторые из головных мозгов мышей не подвергались полной перфузии на стадиях получения образцов, что привело к тому, что некоторые из изображений TEM были расплывчатыми или содержали неприемлемые артефакты. После исключения всех случайным образом отобранных микрофотографий, которые были, например, слишком расплывчатыми для исследования и/или содержали слишком много артефактов, каждую оставшуюся микрофотографию TEM анализировали, как описано выше, и результаты обобщенно представлены в таблице 4.
Таким образом, каждая из суспензий нанокристаллов золота CNM-Au8, использованных для мышей в каждой из групп 4-7, приводила к (i) меньшему "Средневзвешенному значению демиелинизированных аксонов на микрофотографию с внесенной поправкой", чем "Средневзвешенное значение демиелинизированных аксонов на микрофотографию с внесенной поправкой" мышей в группе 3; и (ii) к большему "Средневзвешенному значению демиелинизированных аксонов на микрофотографию с внесенной поправкой", чем "Средневзвешенное значение демиелинизированных аксонов на микрофотографию с внесенной поправкой" у мышей в контрольной группе 1.
Эти данные указывают на то, что корм с купризоном приводил к некоторому числу демиелинизированных аксонов в мозолистом теле головного мозга мышей и что нанокристаллические суспензии золота CNM-Au8 были эффективным лечением (как терапевтическим, так и профилактическим) для снижения величины демиелинизации аксонов у млекопитающих.
III. Ремиелинизация аксонов, представленная на изображениях, полученных при 16000x и 40000x
Другим объективным способом определения того, существуют ли какие-либо положительные эффекты лечения суспензией нанокристаллов золота CNM-Au8 на величину повреждения миелина вследствие рациона с купризоном, является определение того, можно ли наблюдать какую-либо ремиелинизацию в областях мозолистого тела головного мозга мышей каждой из групп 1-7. Детали исследования для групп 1-7 указаны в таблице 3, как описано выше.
В этом отношении на фиг.37-40 представлены репрезентативные микрофотографии TEM, полученные либо при 16000x, либо при 40000x, как указано с помощью масштабной метки на каждой микрофотографии, репрезентативных областей мозолистого тела мышей в группах 4-7. Следует отметить, что на репрезентативных изображениях TEM показаны только группы профилактического лечения 4 и 6, и группы терапевтического лечения 5 и 7, поскольку аксоны, сходные с аксонами, обозначаемыми как "201M" на изображениях TEM, не наблюдали в областях мозолистого тела мышей групп 1-3. В частности, стрелки 201M указывают на тонкие, темные и плотные миелинизированные области, которые, как полагают в соответствии с литературой, являются ремиелинизированными аксонами8. Аналогичные тонкие, темные и плотные области на аксонах не были обнаружены на репрезентативных микрофотографиях, соответствующих мышам в группах 1-3.
Фиг.37A-37K соответствуют изображениям TEM для мышей группы 4, полученным как при 16000x, так и при 40000x. На этих фигурах показан ряд стрелок 201M. Эти стрелки 201M указывают на то, что в литературе считается ремиелинизированными аксонами8. Следует понимать, что более темные области миелина не являются артефактами получения образца или процесса визуализации TEM, поскольку близкорасположенные или соседние аксоны можно использовать в качестве эталона и эти соседние аксоны не имеют более темных областей миелина.
Фиг.38A-38L соответствуют изображениям TEM для мышей группы 5, полученным как при 16000x, так и при 40000x. На фигурах показан ряд стрелок 201M. Эти стрелки 201M указывают на то, что в литературе считается ремиелинизированными аксонами8. Следует понимать, что более темные области миелина не являются артефактами получения образца или процесса визуализации TEM, поскольку близкорасположенные или соседние аксоны можно использовать в качестве эталона и эти соседние аксоны не имеют сходных более темных областей миелина.
ФИГ.39A-39J соответствуют изображениям TEM для группы 6, полученным как при 16000x, так и при 40000x. На этих фигурах показан ряд стрелок 201M. Эти стрелки 201M указывают на то, что в литературе считается ремиелинизированными аксонами8. Следует понимать, что более темные области миелина не являются артефактами получения образца или процесса визуализации TEM, поскольку близкорасположенные или соседние аксоны можно использовать в качестве эталона и эти соседние аксоны не имеют сходных более темных областей миелина.
ФИГ.40A-40G соответствуют изображениям TEM для группы 7, полученным как при 16000x, так и при 40000x. На этих фигурах также показан ряд стрелок 201M. Эти стрелки 201M указывают на то, что в литературе считается ремиелинизированными аксонами8. Следует понимать, что более темные области миелина не являются артефактами получения образца или процесса визуализации TEM, поскольку близкорасположенные или соседние аксоны можно использовать в качестве эталона и эти соседние аксоны не имеют сходных более темных областей миелина.
Присутствие ремиелинизированных аксонов, как показано стрелками 201M, указывает на то, что суспензии нанокристаллического золота CNM-Au8 были эффективным способом лечения (как терапевтическим, так и профилактическим) для достижения ремиелинизированных аксонов у млекопитающего (например, увеличение количества ремиелинизированных аксонов относительно аксонов в сходных областях мозолистого тела, наблюдаемых у мышей в группах 1-3).
IV. Измерение соотношения G для миелина на аксонах и количественное определение
Другим объективным способом определения того, существуют ли какие-либо возможные эффекты лечения нанокристаллическими суспензиями золота CNM-Au8 на величину повреждения миелина вследствие рациона с купризоном, является вычисление и сравнение соотношений G для миелина на аксонах областей мозолистого тела головного мозга мышей в каждой из групп 1-7, в соответствии с литературой5,6. Вычисление соотношения G является другим общеизвестным способом оценки различных патологических эффектов.
В частности, измерение и количественное определение соотношения G широко используется в качестве функционального и структурного показателя относительной величины миелинового покрытия, присутствующего на аксонах (т.е. аксональной миелинизации). Чем более высоким является соотношение G, тем более тонким является миелин относительно диаметра аксонов; и напротив, чем более низким является соотношение g, тем более толстой является миелиновая оболочка относительно аксона. Таким образом, как правило и в норме, чем более низким является сообщенное соотношение G, тем лучше. В частности, сообщалось, что средние диапазоны соотношений G для миелинизированных аксонов области мозолистого тела головного мозга находятся в диапазоне 0,75-0,815.
На фиг.41-47 представлены репрезентативные микрофотографии TEM, исходно полученные при 40000x, как указано на масштабных метках на изображениях, репрезентативных площадей поперечного сечения областей мозолистого тела мышей из каждой из групп 1-7, соответственно. Детали исследования для групп 1-7, как описано выше, указаны в таблице 3.
В кратком изложении, внутренний и наружный диаметры миелина соответствующих аксонов, полученные из репрезентативных изображений TEM, отмечали путем маркировки, а затем измеряли, суммировали, усредняли и использовали для определения соотношений G, как описано в настоящем описании.
В частности, сначала случайным образом выбирали площади поперечного сечения, содержавшие нейрональные аксоны мышей, соответствующие мышам в каждой из семи групп. Затем получали микрофотографии TEM, исходно полученные при 40000x, для случайным образом выбранных областей. С использованием программного обеспечения Image J, внутренний (204I) и наружный (204O) периметры большого числа аксонов, показанных на микрофотографии TEM, сначала отмечали сенсорным карандашом на сенсорном экране компьютера. Затем проводили измерения с использованием нанесенных с помощью сенсорного карандаша отметок внутреннего (204I) и наружного (204O) периметров отслеживаемых аксонов. В соответствии с литературой наблдаемые площади поперечного сечения аксона/миелиновой оболочки принимали за концентрические окружности.
Затем вычисляли соотношения G путем деления определенного наружного периметра аксона (204I) (также соответствующего внутреннему периметру миелина и обозначаемого обоими способами в настоящем описании) на наружный периметр (204O) аксона и миелиновой оболочки, суммированных вместе.
На фиг.41-47 показаны некоторые из случайных образом выбранных репрезентативных изображений TEM поперечных сечений нейральных аксонов в мозолистом теле с отметками, соответствующими внутреннему (204I) и наружному (204O) периметру миелина, на которые они наложены.
На фиг.41A-41C представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 1 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний (204I) и наружный (204O) периметры миелина, обозначенные на этих изображениях.
На фиг.42A-42D представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 2 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний (204I) и наружный (204O) периметры миелина, обозначенные на этих изображениях.
На фиг.43A-43C представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 3 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.44A-44B представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 4 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.45A-45C представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 5, Пример 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.46A-46B представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 6 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
На фиг.47A-47E представлены репрезентативные микрофотографии TEM, которые соответствуют репрезентативным частям мозолистого тела мышей группы 7 примера 3. Эти изображения представляют собой изображения с высоким увеличением, составляющим 40000x, демонстрирующие внутренний и наружный периметры миелина, обозначенные на этих изображениях.
Таблица 5 содержит обобщение результатов, полученных в результате упомянутых выше измерений. В частности, в таблице 5 показано общее число аксонов, которые были отмечены, суммированы и измерены для вычисления соотношений G. Измерения проводили на наименьшем количестве аксонов, составляющем 77, в группе 1; в то время как измерения проводили на наивысшем количестве аксонов, составляющем 374, в группе 2.
"Стандартная ошибка среднего значения" ("SEM"), указанная в столбце 4 таблицы 5, представляет собой стандартное отклонение оценки среднего значения для совокупной выборки. (SEM также можно рассматривать как стандартное отклонение ошибки среднего значения для выборки относительно истинного значения, поскольку среднее значение для выборки представляет собой несмещенную оценку). SEM оценивали посредством оценки совокупности стандартных отклонений для выборки (стандартное отклонение для выборки), деленных на квадратный корень из размера выборки.
Как отмечалось выше в настоящем описании, было обнаружено, что деградация миелина, вызванная кормом с купризоном, имеет неоднородные эффекты на миелинизированные аксоны в различных частях площадей поперечного сечения мозолистого тела, исследованных с помощью TEM.
В этом отношении на фиг.48-50 по-разному выражены измеренные соотношения G, обобщенно представленные в таблице 5. На этих фиг.48-50 представлены столбиковые диаграммы соотношений G, демонстрирующие частотный процент соотношений G для аксонов на оси Y; против распределения соотношений G на оси X для каждой группы мышей.
На этих фиг.48-50 также содержится столбик, обозначенный "NMY", который не является частью вычислений соотношения G для других столбиков в гистограмме, а скорее соответствует нормализованному к площади числу "демиелинизированных" аксонов в каждой группе мышей (т.е. как ранее определено и сообщено в разделе II настоящего описания под названием "Количественное определение демиелинизированных аксонов/единичная площадь"). Вследствие присутствия столбика NMY каждую гистограмму в дальнейшем в настоящем описании обозначают как "Модифицированная столбиковая гистограмма".
Модифицированные столбиковые диаграммы, содержащие данные о соотношении G для групп мышей 1, 2 и 3 представлены на фиг.48A, 48B и 48C, соответственно.
Модифицированные столбиковые диаграммы, содержащие данные о соотношении G для групп мышей 3, 5 и 7 представлены на фиг.49A, 49B и 48C, соответственно.
Модифицированные столбиковые диаграммы, содержащие данные о соотношении G для групп мышей 3, 4 и 6 представлены на фиг.50A, 50B и 48C, соответственно.
Кроме того, на фиг.48A представлена модифицированная столбиковая гистограмма, содержащая данные о соотношении G для контрольной группы мышей 1. Обращается внимание на числа сверху каждого столбика. Эти числа соответствуют проценту встречаемости на единицу площади аксонов, имеющих соотношение G, отмеченных на ней. В частности, процентное число было нормализовано к количеству "демиелинизированных" аксонов на одну и ту же единичную площадь, которые ранее были подсчитаны (т.е. процентные числа включают величины NMY). Полагают, что указание обоих наборов чисел на модифицированной столбиковой гистограмме может дать более полное понимание некоторых терапевтических эффектов наносуспензий CNM-Au8.
Кроме того, обращается внимание на обе затененные области как с левой, так и с правой стороны модифицированной столбиковой гистограммы. Эти затененные области перекрываются, например, с фиг.48B и 48C, и предназначены для обращения внимания на те части модифицированных столбиковых гистограмм, которые содержат в некоторой степени отличающиеся или в некоторой степени сходные данные. Также обращается внимание на поперечную штриховку на столбике 210 NMY. Такая же поперечная штриховка встречается на всех других столбиках "NMY" на каждой из модифицированных столбиковых гистограмм. Поскольку мышей в контрольной группе 1 следует считать нормальными или здоровыми, модифицированную столбиковую гистограмму фиг.48A можно считать хорошей начальной точкой (т.е. "положительным контролем") для проведения сравнений между различными группами.
Аналогично, модифицированные столбиковые гистограммы, соответствующие мышам, которым давали корм с купризоном, представлены на фиг.48B и 48C. Таким образом, модифицированную столбиковую гистограмму на фиг.48C также можно считать хорошей начальной точкой (т.е. "отрицательным контролем") для проведения сравнений между различными группами. Например, столбик 210b содержит поперечную штриховку, которая соответствует столбику 210 на фиг.48A, но также содержит сплошную часть, демонстрирующую большее число "демиелинизированных" аксонов, как рассмотрено выше.
Фиг.49A, 49B и 49C содержат модифицированные столбиковые гистограммы, соответствующие мышам в группе 3 (отрицательный контроль), группе 5 и группе 7, соответственно. Эти три модифицированных столбиковых диаграммы размещены рядом для целей сравнения. Признаки модифицированных столбиковых гистограмм являются довольно сходными.
Фиг.50A, 50B и 50C содержат модифицированные столбиковые гистограммы, соответствующие мышам группы 3 (отрицательный контроль), группы 4 и группы 6, соответственно. Эти три модифицированных столбиковых гистограммы размещены рядом для целей сравнения. Признаки, содержащиеся на фиг.50B и 50C являются довольно сходными друг с другом, и также довольно отличающимися от отрицательного контроля, показанного на фиг.50A.
Для простоты сравнения те же модифицированные столбиковые гистограммы представлены на фиг.51.
Следует отметить, что на фиг.48 A, B и C для величины соотношения G 0,65, на фиг.48B показано, что группа 2 имела 17% аксонов, имеющих величину соотношения G 0,65. Как рассмотрено в литературе, существует теоретический предел для индивидуальных аксонов, который не позволяет неограниченную экспансию аксонов, которая приводит к перевешиванию объемом пользы, ассоциированной с миелинизацией этого аксона5. Ожидаемый экспериментально наблюдаемый диапазон соотношений G для коронарных аксонов при оптимальной эффективности должен составлять порядка от 0,76 до немного выше чем 0,805. На фиг.48B, небольшая совокупность аксонов с величиной соотношения G 0,65 была меньшей, чем то, что считалось нормальным соотношением G, и считалась ранним ответом на корм с купризоном. Таким образом, такие аксоны не считались нормальными или хорошими5.
Следует отметить, что сходные модифицированные столбиковые гистограммы, показанные на фиг.50B и 50C, соответствуют мышам, которые были из; (1) Группы 4 и которых кормили кормом с купризоном в течение всех 5 недель исследования и которым давали через зонд в течение всех 5 недель один раз в сутки лечения в объеме приблизительно 10 мл/кг концентрированной суспензии NM-Au8 при концентрации кристаллов золота приблизительно 1000 чнм для определения того, была ли предоставленная наносуспензия золота эффективным для лечения количеством; и из (2) Группы 6, которую кормили кормом с купризоном в течение всех 5 недель исследования и поили без ограничений из бутылок с терапевтической суспензией CNM-Au8 при концентрации кристаллического золота приблизительно 50 чнм в течение всех 5 недель исследования, для определения того, действовала ли предоставленная наносуспензия золота в качестве эффективного терапевтического количества.
На фиг.50B и 50C, показано, что как мыши группы 4, так и мыши группы 6, имели приблизительно 5% их аксонов с соотношением G 0,65. Это соотношение G описано в литературе в качестве соответствующего асконам/миелину, претерпевающим процесс восстановления от демиелинизирующего заболевания; где аксоны ЦНС претерпевают первоначальный период гиперремиелинизации в процессе восстановления и демонстрируют увеличенный диаметр в течение некоторого времени перед окончательным возвращением к нормальному соотношению G5. Эти данные следует понимать как означающие, что может происходить сохранение миелина.
Хотя является трудным определение требуемых концентраций, количеств и/или времени лечения из этих данных (а также всех других данных в настоящем описании) очевидно, что различные биологические (патологические) события происходят в зависимости от предоставления лечения CNM-Au8, описанного в настоящем описании.
Заключения
Данные указывают на следующее:
1. У мышей, которым давали корм с купризоном и воду в течение 5 недель, развивалась типичная демиелинизация, которую добивались исследователи, как показано путем сравнения модифицированных столбиковых гистограмм на фиг.48A с одной или обеими из модифицированных столбиковых гистограмм на фиг.48B и 48C.
2. Мыши, которым давали корм с купризоном и наносуспензии CNM-Au8 (либо через зонд, либо без ограничений) в течение всех 5 недель исследования имели сходные модифицированные столбиковые гистограммы (см. фиг.50B и 50C), обе из которых были лучше отрицательного контроля (см. фиг.50A).
3. Данные для соотношения G отдельно указывают на то, что наносуспензии CNM-Au8 имели положительное влияние (т.е. либо снижали демиелинизацию, либо вызывали ремиелинизацию) у мышей в группах 4 и 6, которым давали корм с купризоном и наносуспензии CNM-Au8 в течение всех 5 недель исследования.
ССЫЛКИ
1. Cortical Demyelination Is Prominent in the Murine Cuprizone Model and Is Strain Dependent. Skripuletz T, et al. (Apr 2008)
2. The Neurotoxicant, Cuprizone, as a Model to Study Demyelination and Remyelination in the Central Nervous System. Matsushima GK, et al. (Jan 2001)
3. Beneficial Effects of Minocycline on Cuprizone Induced Cortical Demyelination. Skripuletz T, et al. (Sep 2010)
4. Preparation of Mouse Brain Tissue for Immunoelectron Microscopy. Tremblay ME et al. (Jul 2010)
5. What is the Optimal Value of the G-Ratio for Myelinated Fibers in the Rat CNS? A Theoretical Approach. Chomiak T. et al. (Nov 2009)
6. NG2 cells response to axonal alteration in the spinal cord white matter in mice with genetic disruption of neurofilament light subunit expression. Wu YJ et al. (Oct 2008)
7. Remyelination Therapy for Multiple Sclerosis. Keough, Michael B., et al. (Nov 2012)
8. Spontaneous Remyelination Following Prolonged Inhibition of Alpha4 Integrin in Chronic EAE. Piraino P.S. et al (June 2005)
9. The Cuprizone Animal Model: New Insights into an Old Story. Kipp Markus, et al. (Sept 2009)
10. Response of Mice to the Chelating Agents Sodium Diethyldithiocarbamate, Alpha-Benzoinoxime, and Biscyclohexanone Oxaldihydrazone. Carlton WW. (1966)
11. Studies On the Induction of Hydrocephalus and Spongy Degeneration by Cuprizone Feeding and Attempts to Antidote the Toxicity. Carlton WW. (1967)
12. Expression of Carbonic Anhydrase II mRNA and Protein in Oligodendrocytes During Toxic Demyelination in the Young Adult Mouse. Tansey FA, et al. ((1996)
13. Noninvasive Detection of Cuprizone Induced Axonal Damage and Demyelination in the Mouse Corpus Callosum. Sun SW1, et al. (2006)
14. GAS6 Enhances Repair Following Cuprizone-Induced Demyelination. Tsiperson V, et al. (2010)
15. Glial Response During Cuprizone-Induced De- and Remyelination in the CNS: Lessons Learned. Gudi V1, et al. (2014)
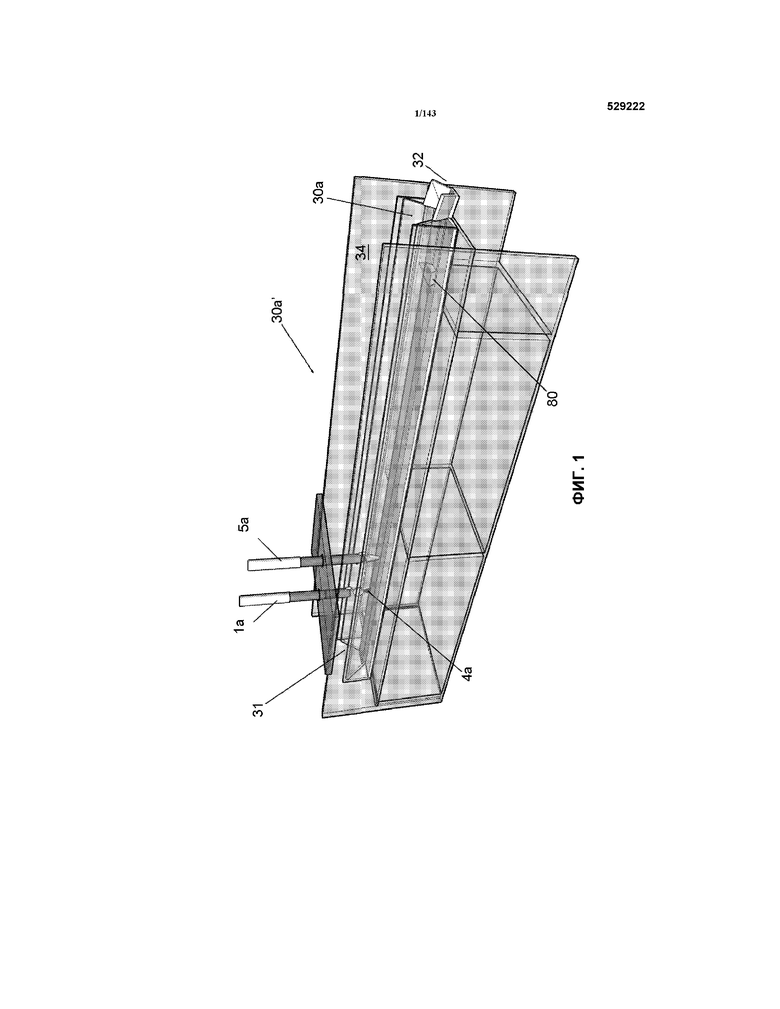
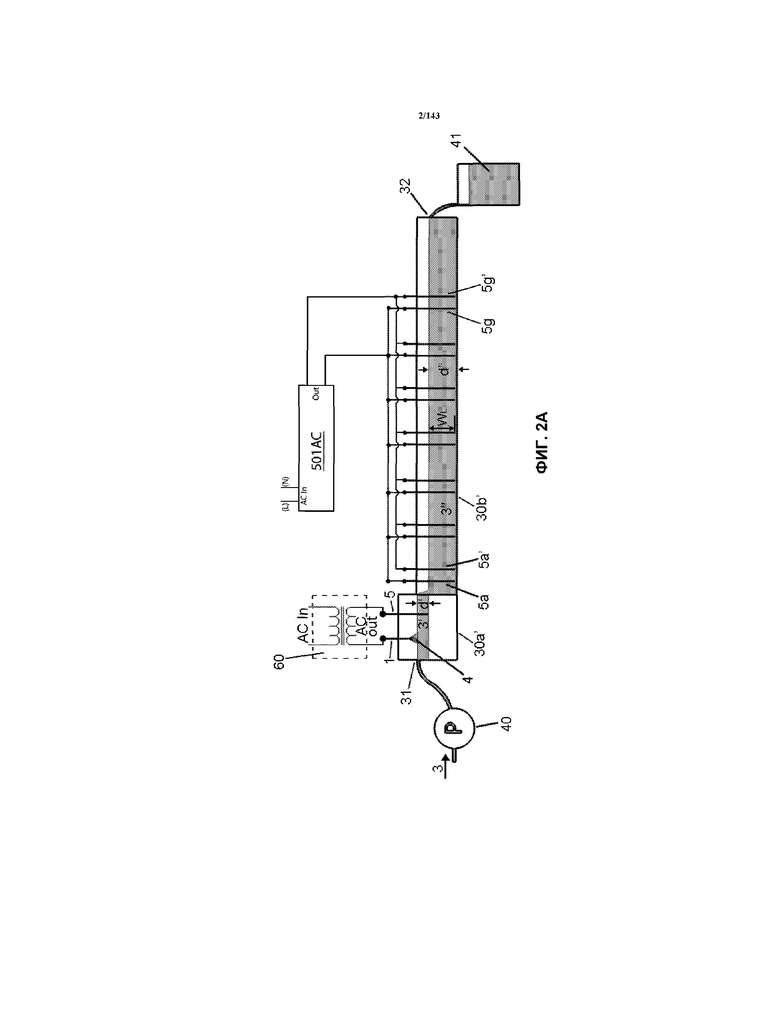
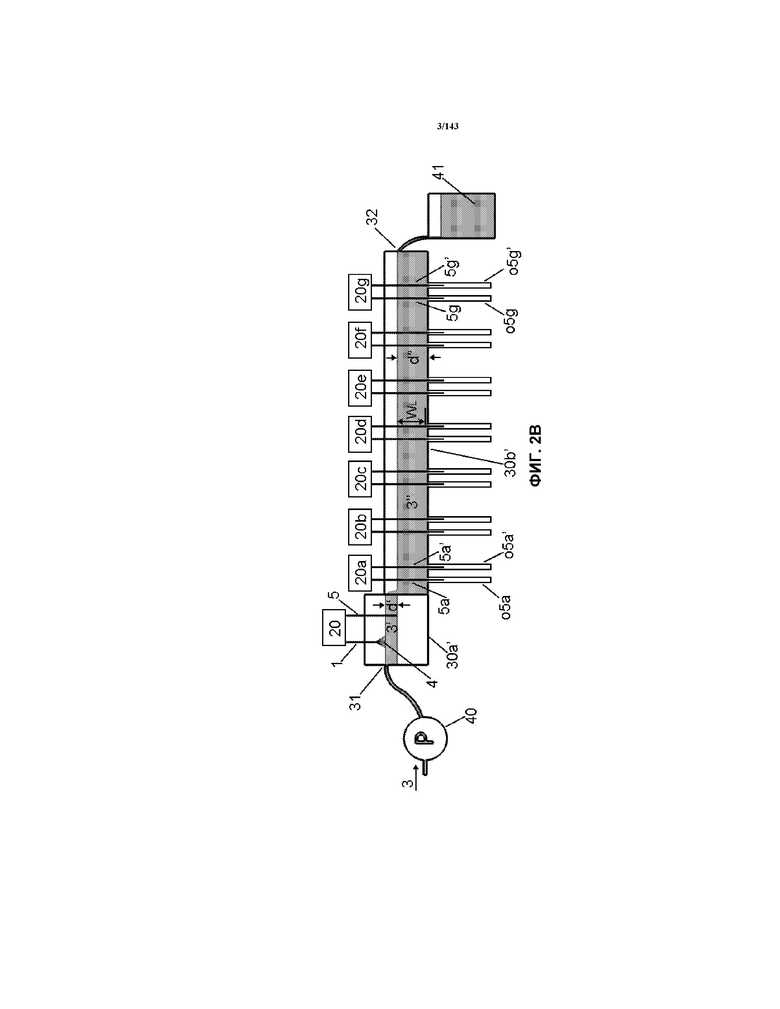
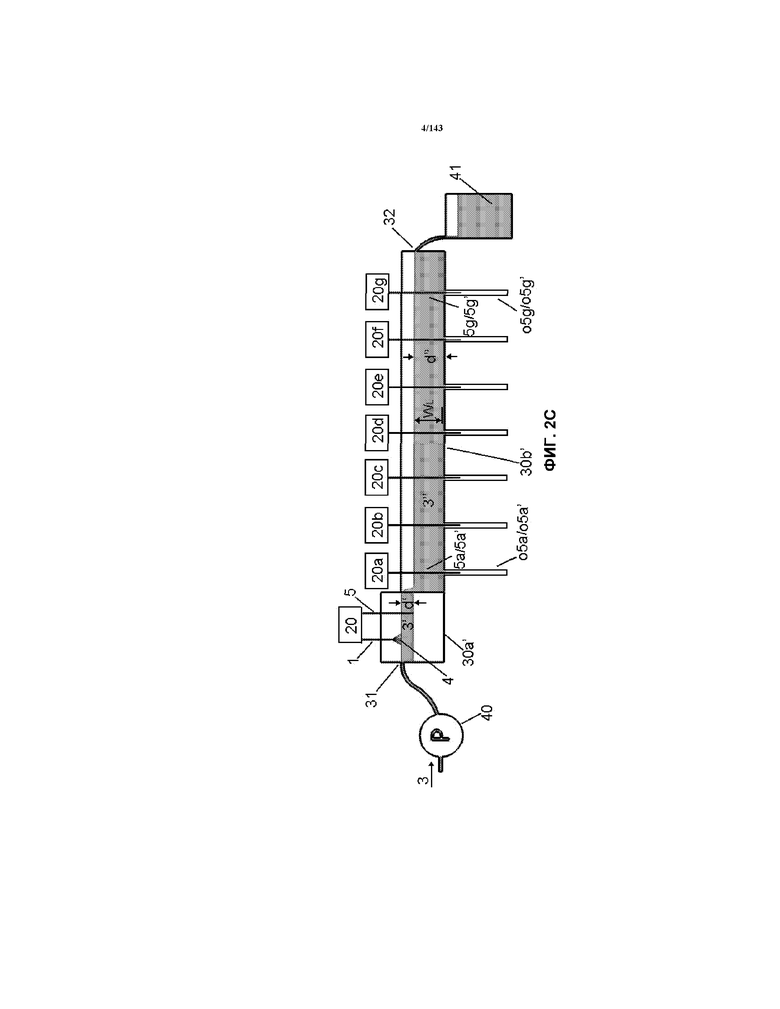
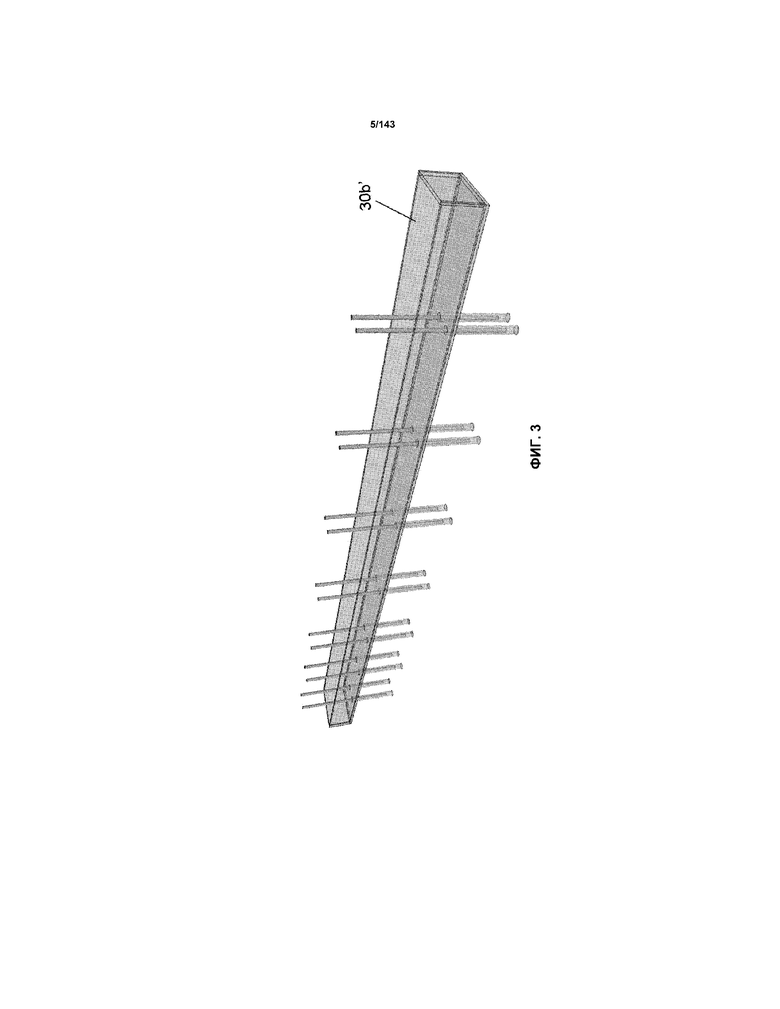
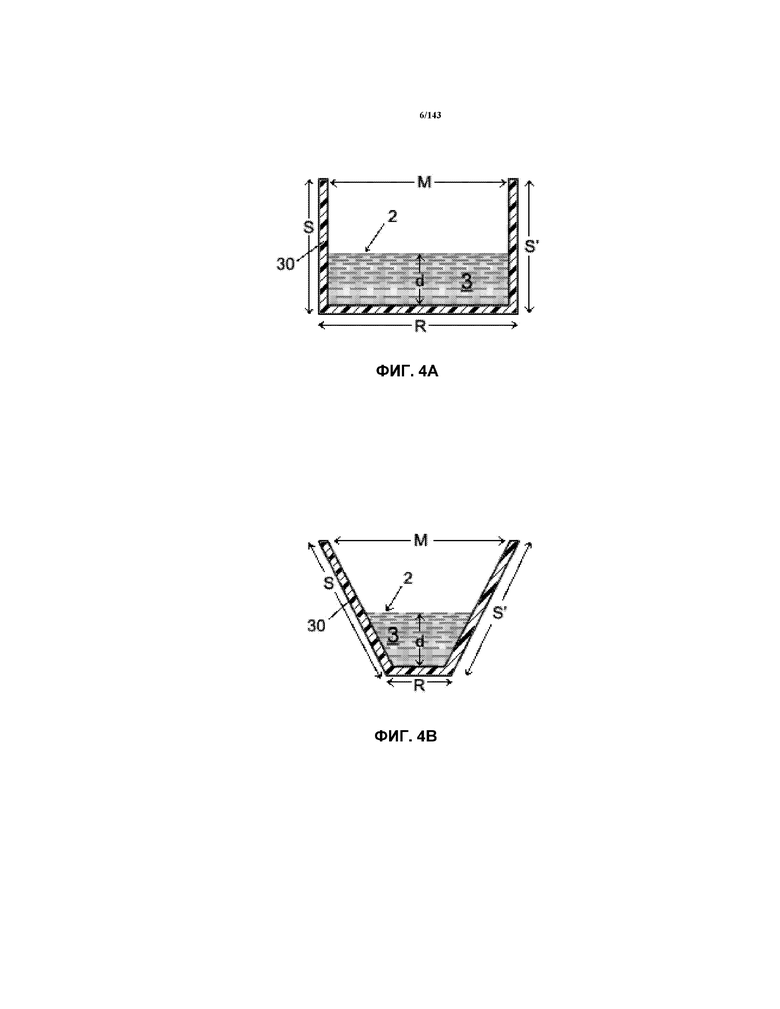
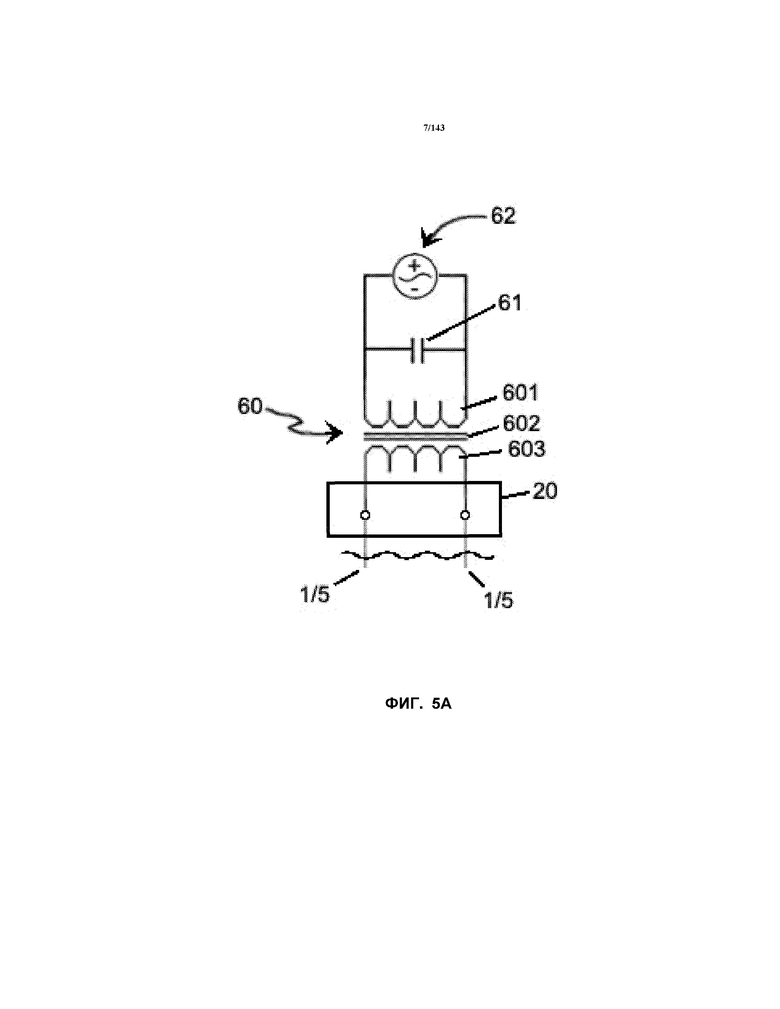
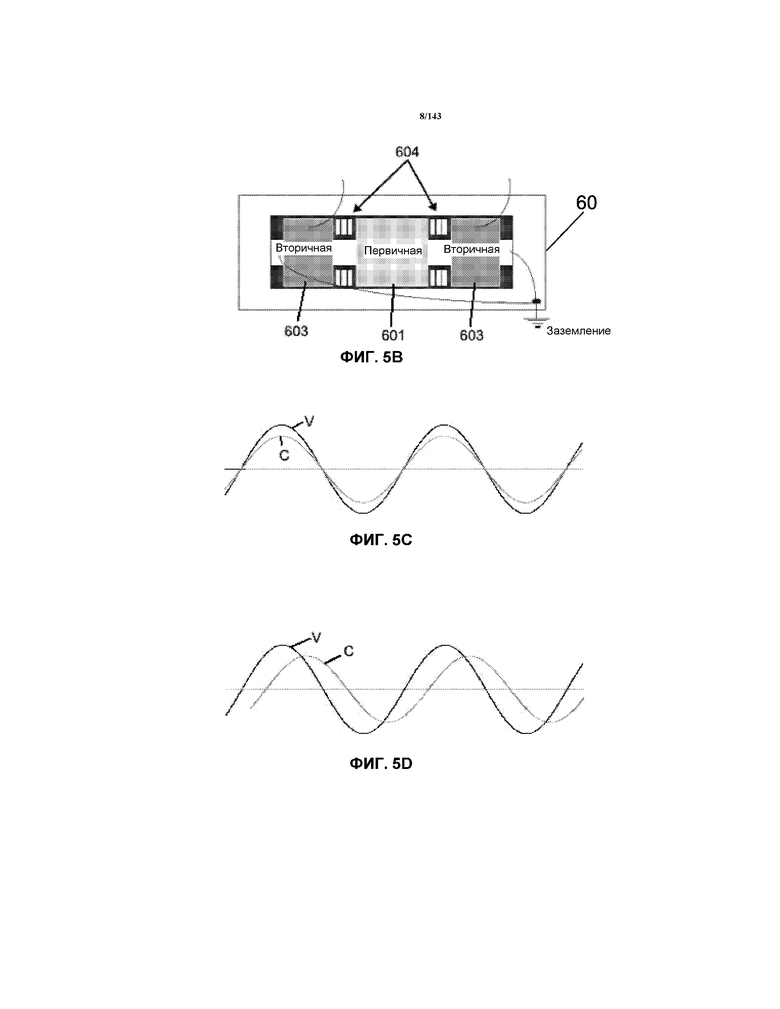
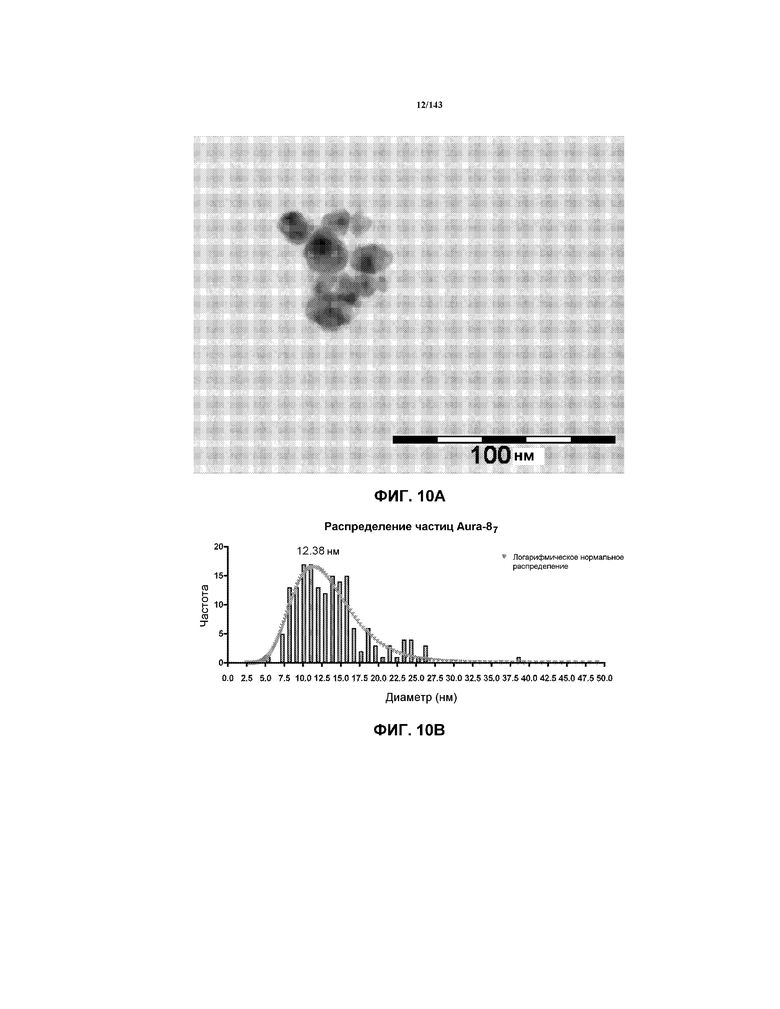
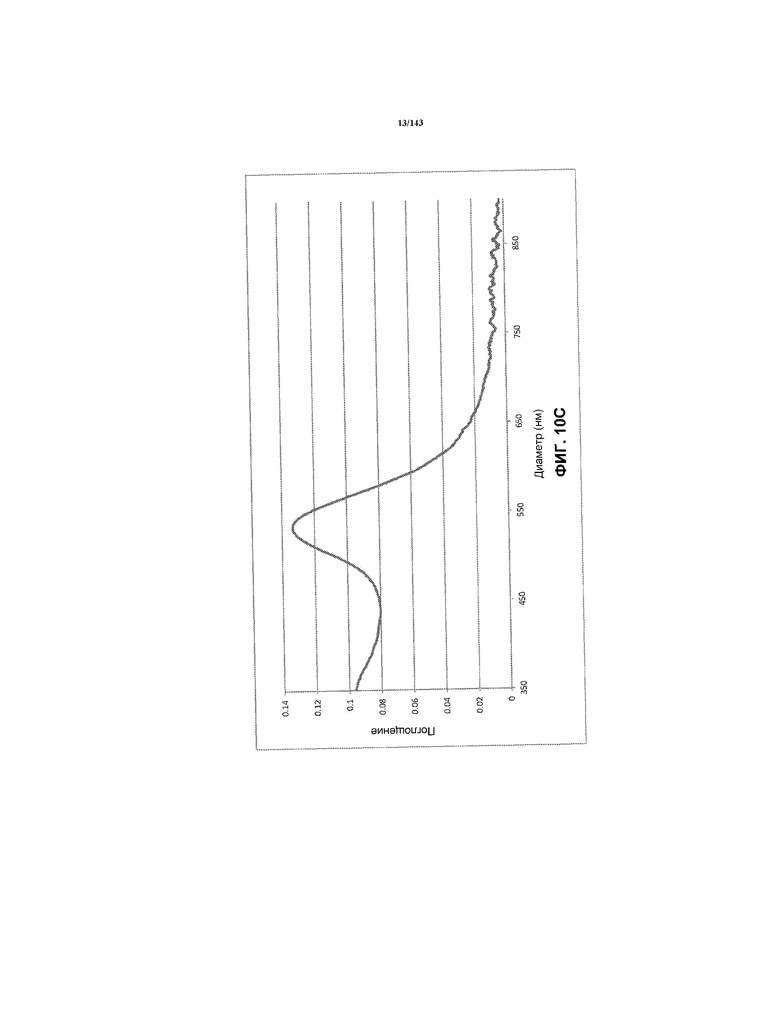
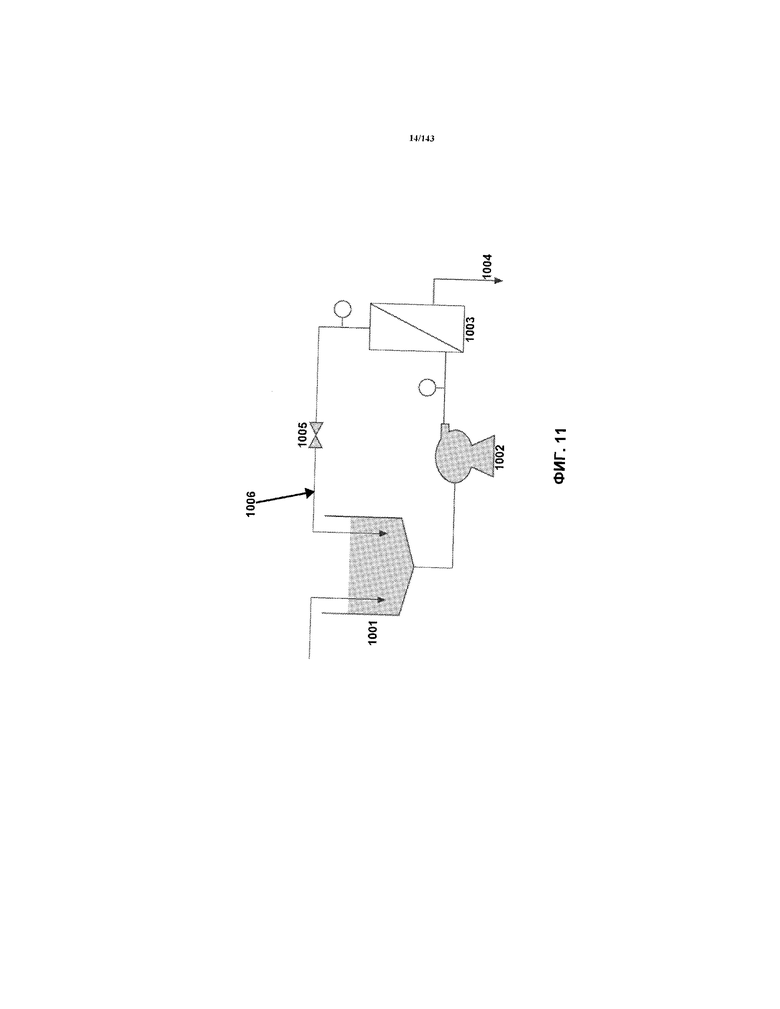
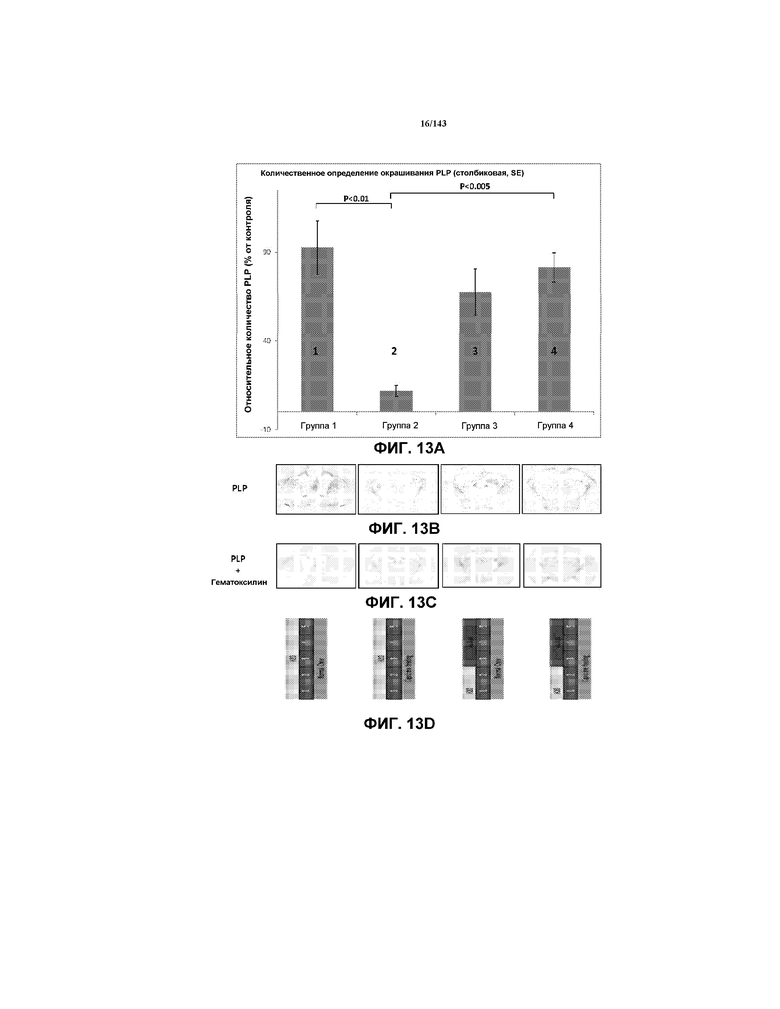



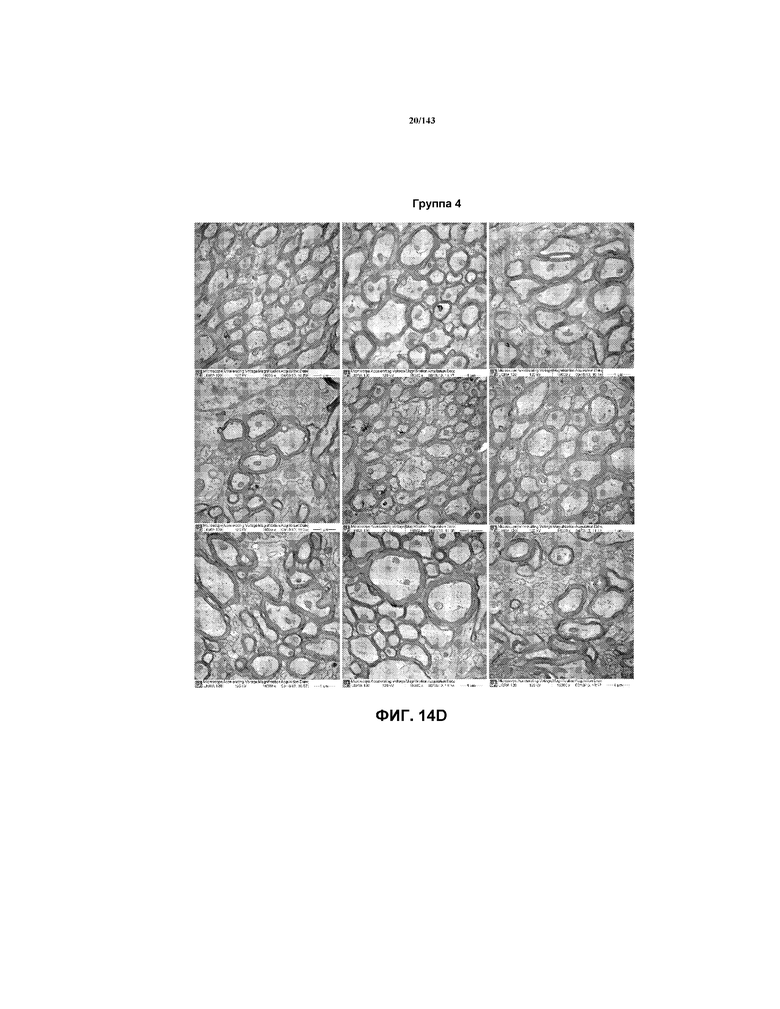
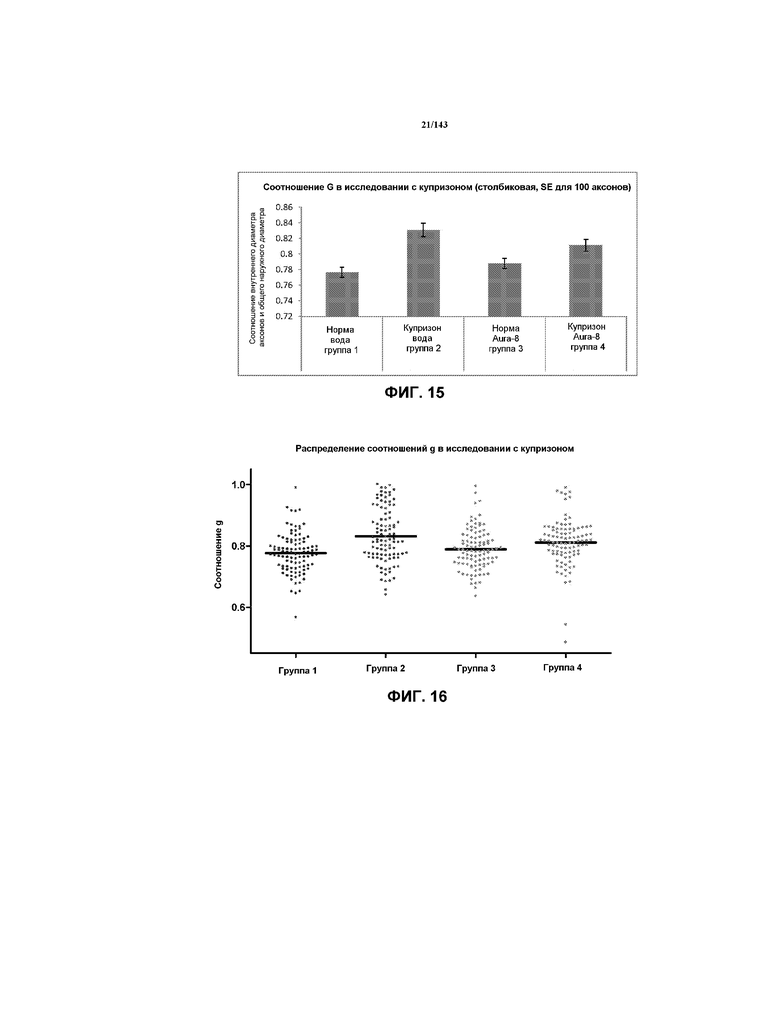
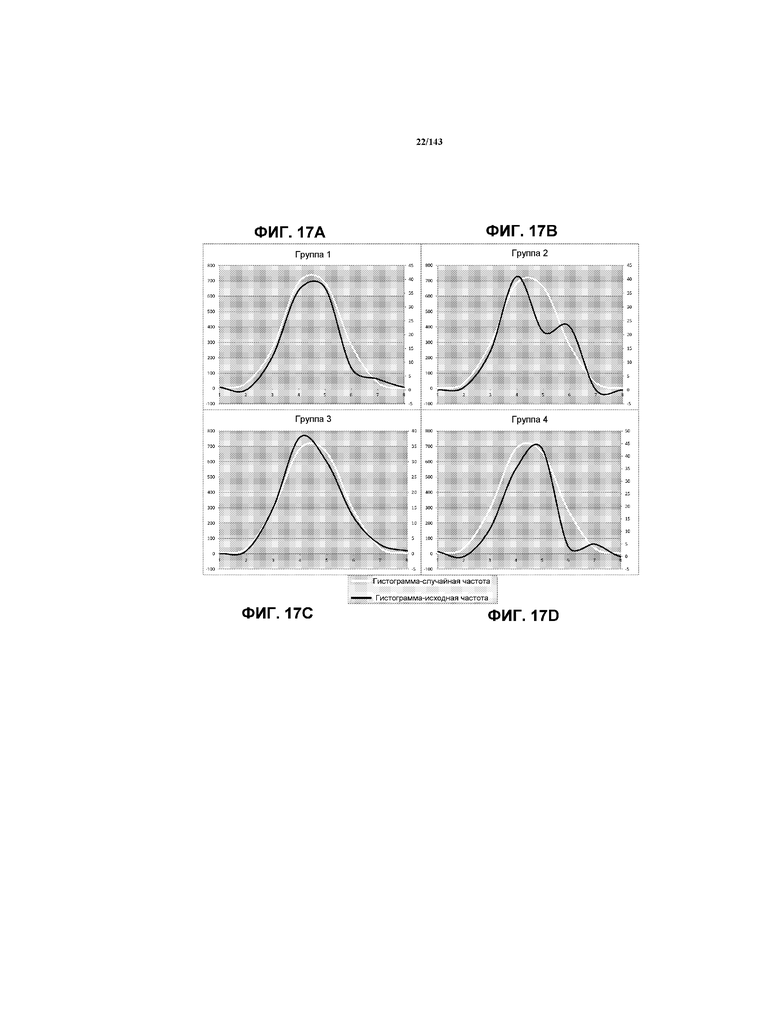
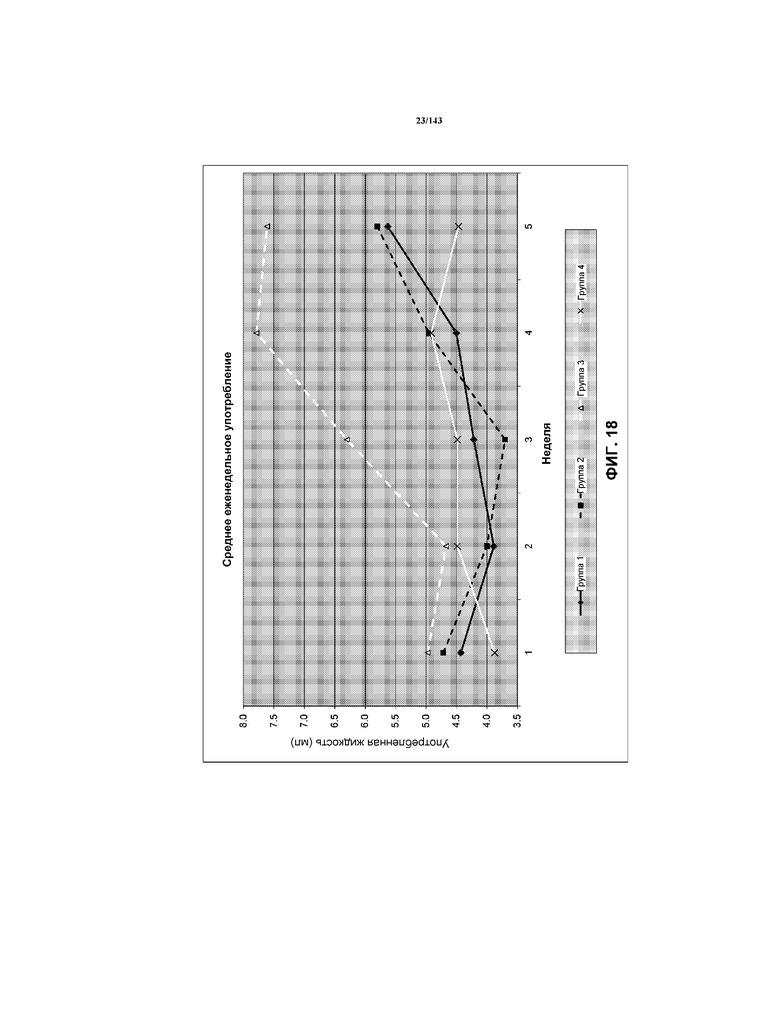
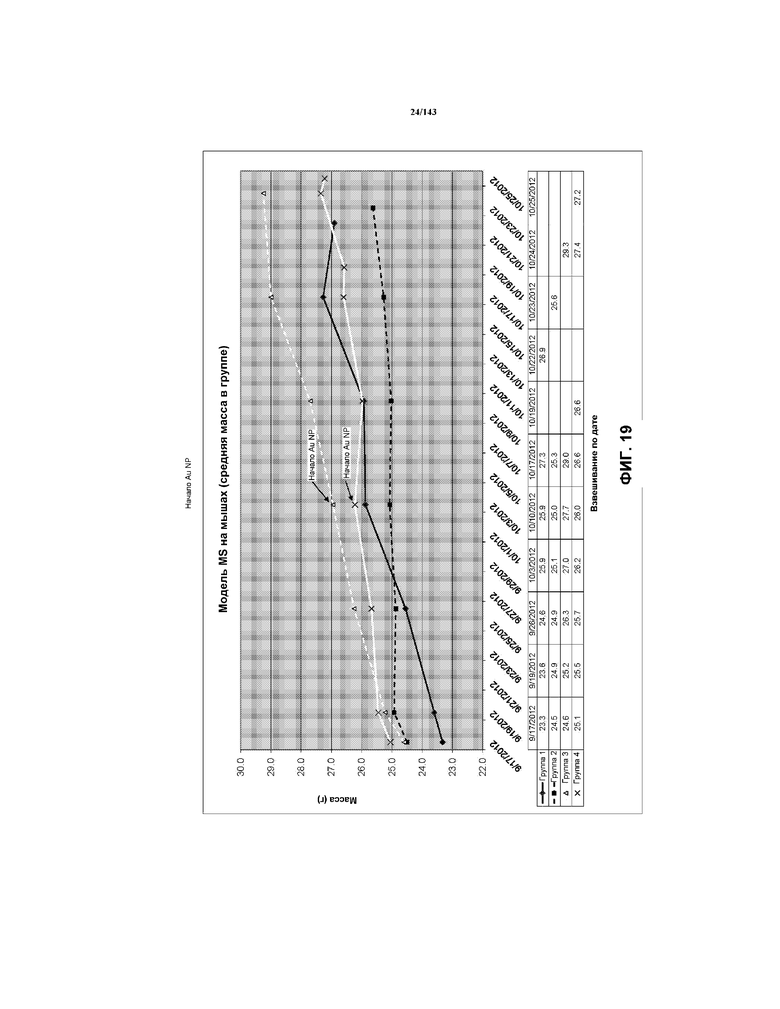
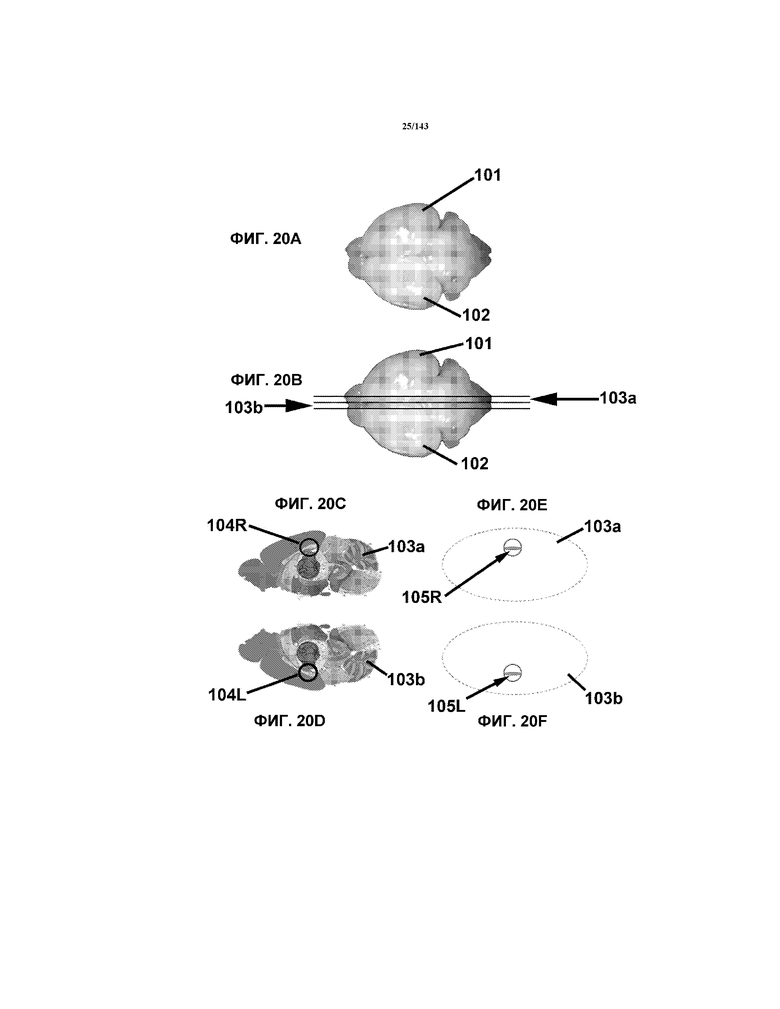
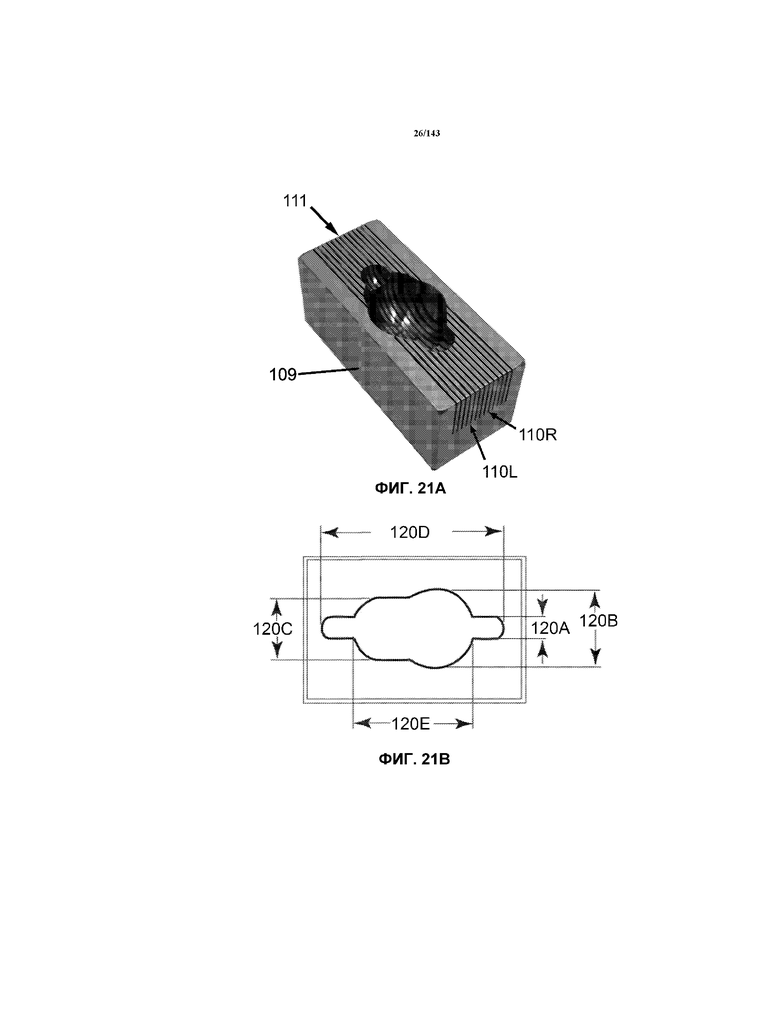
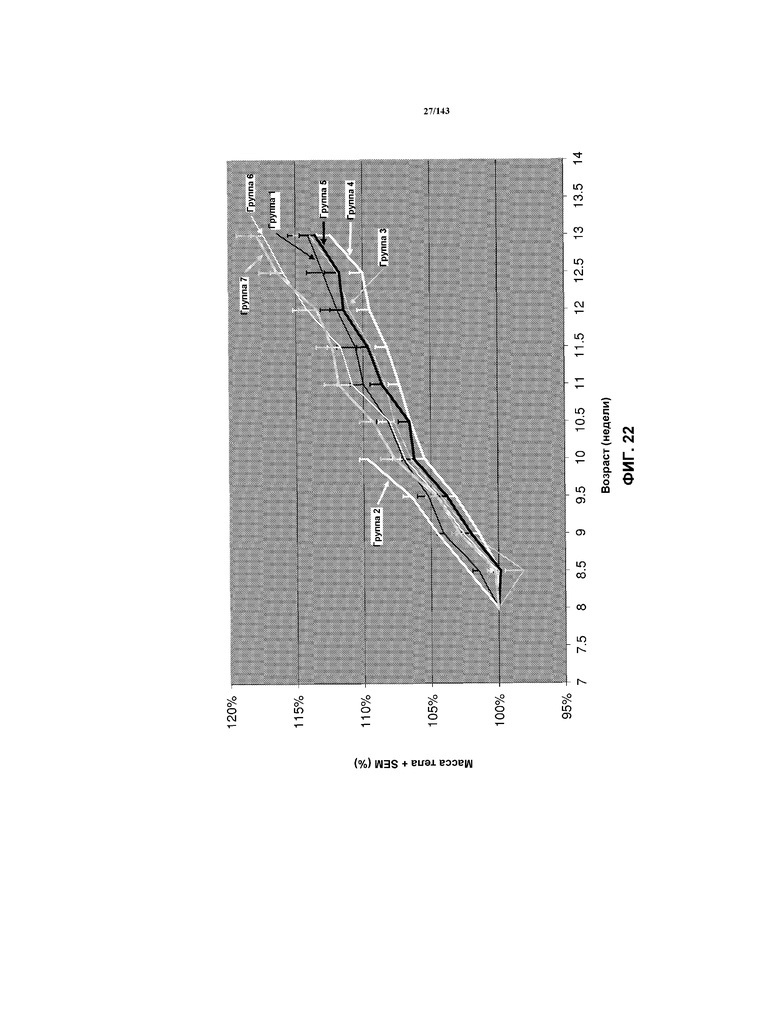
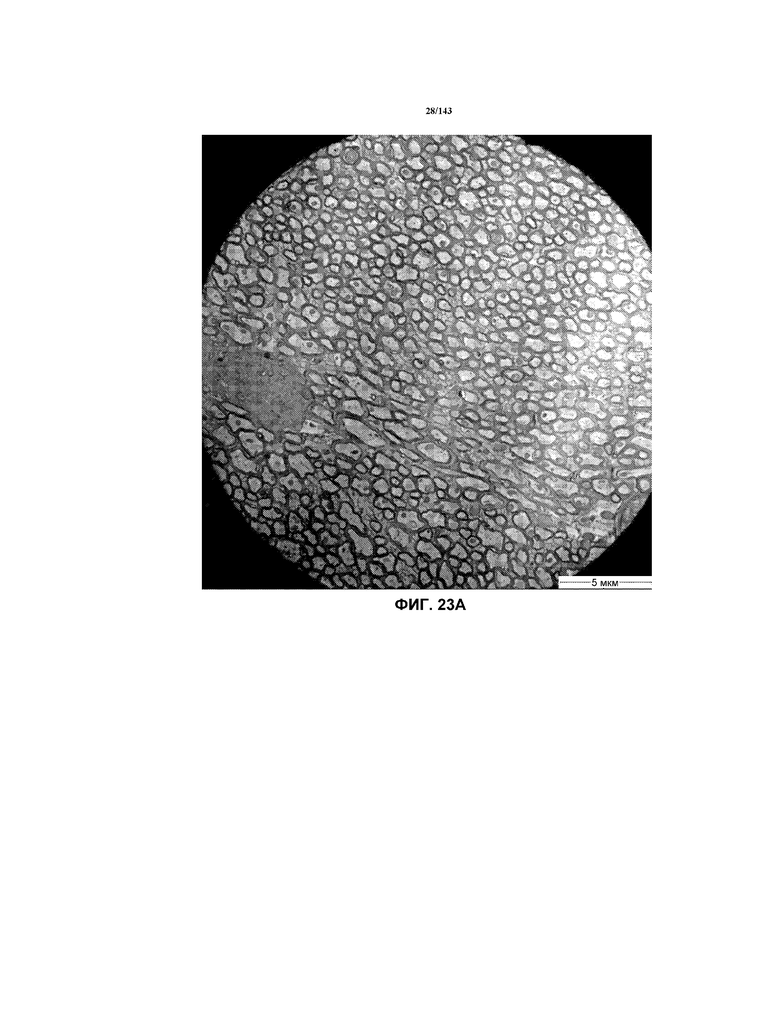
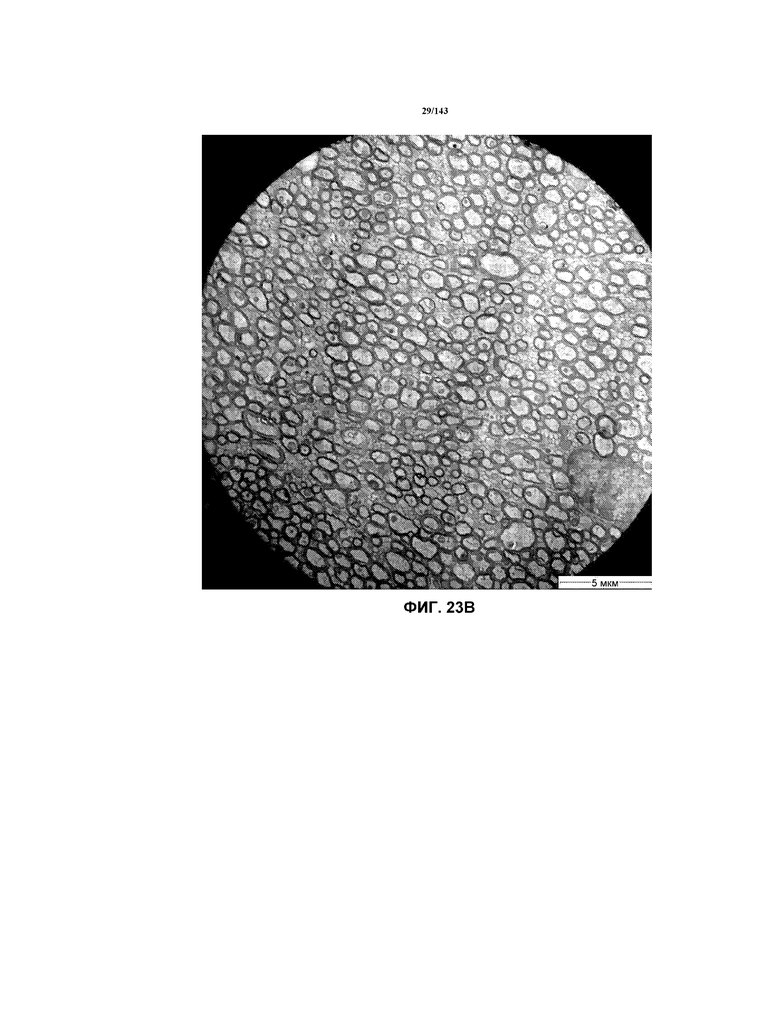
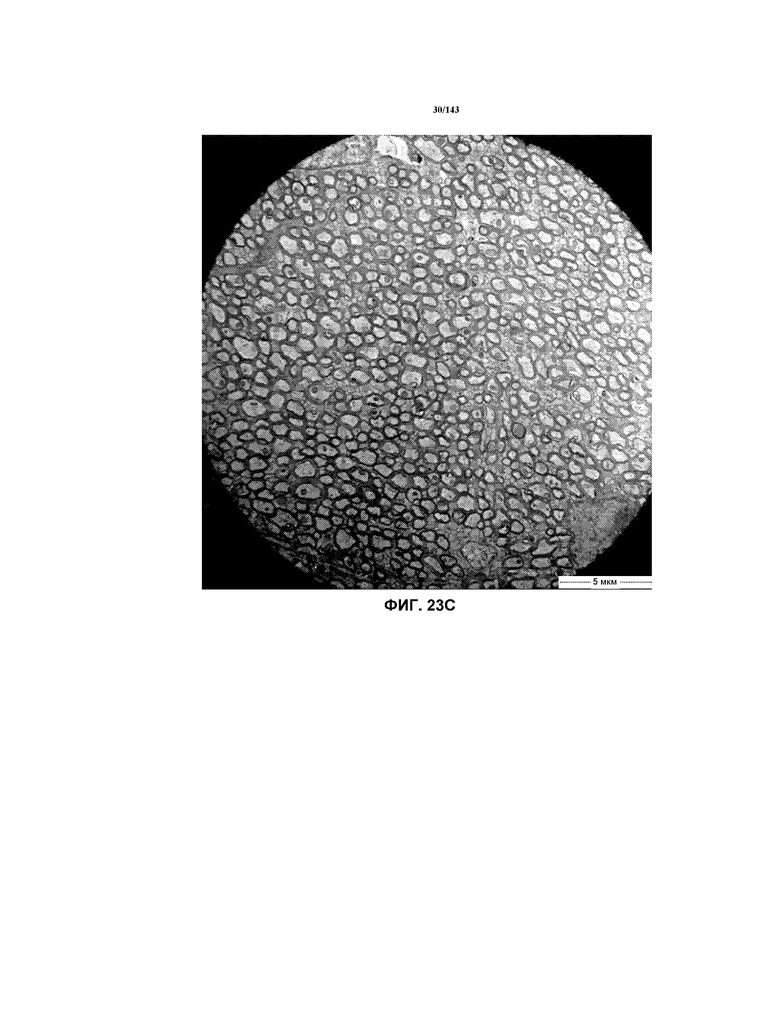
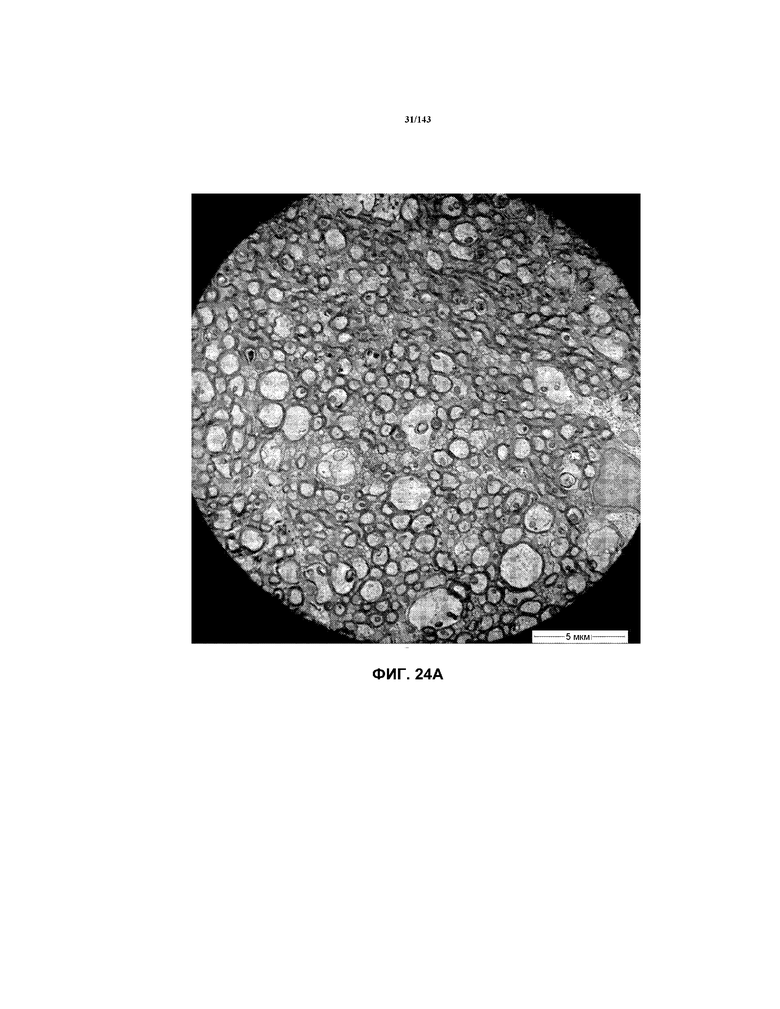


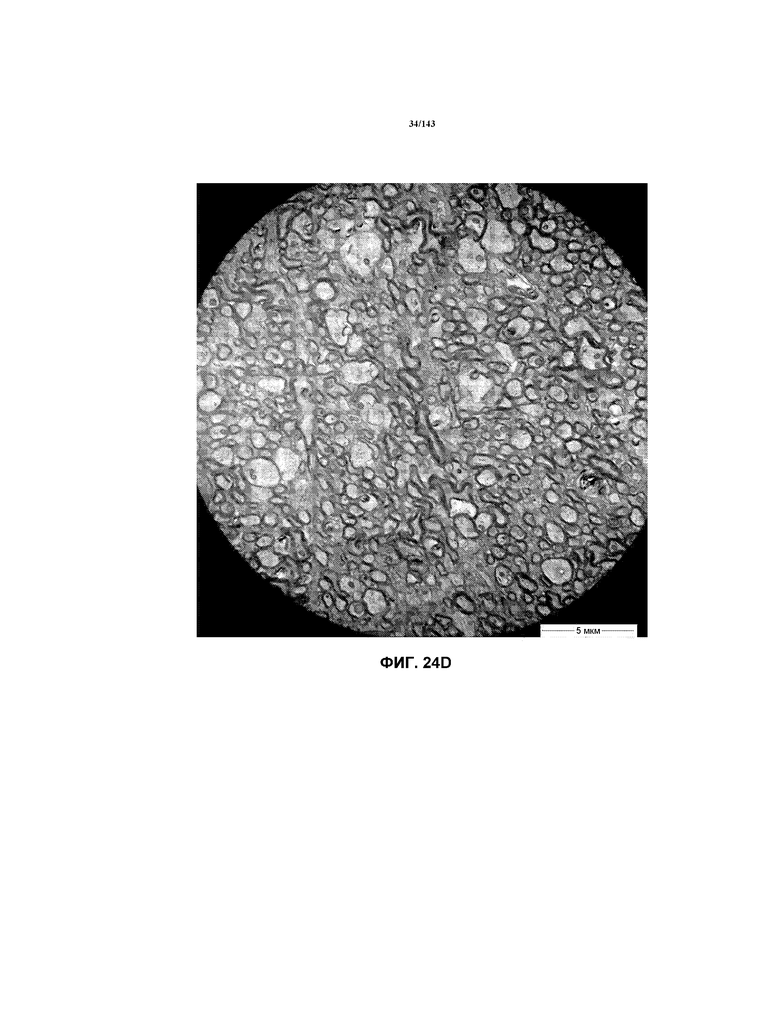

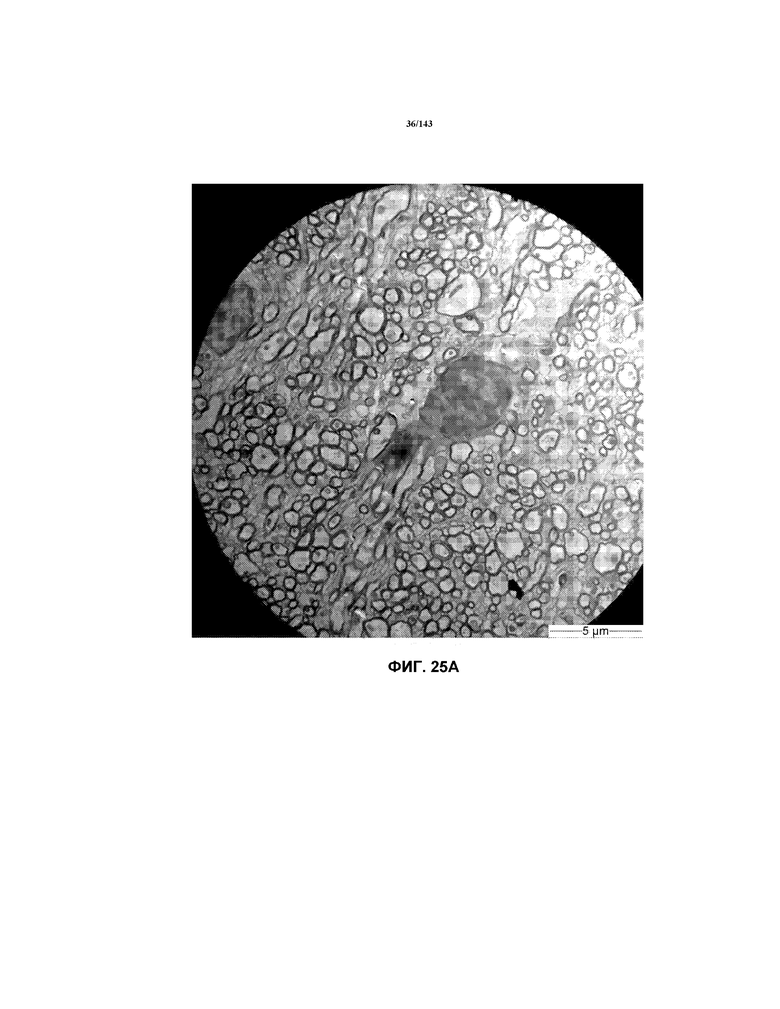


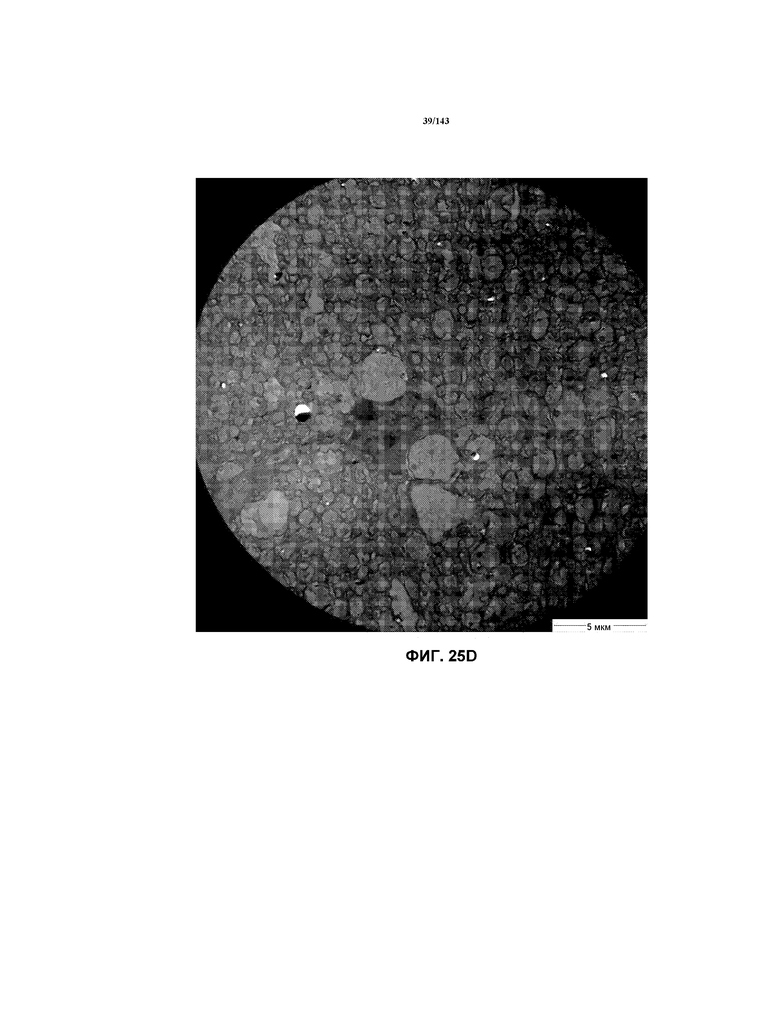
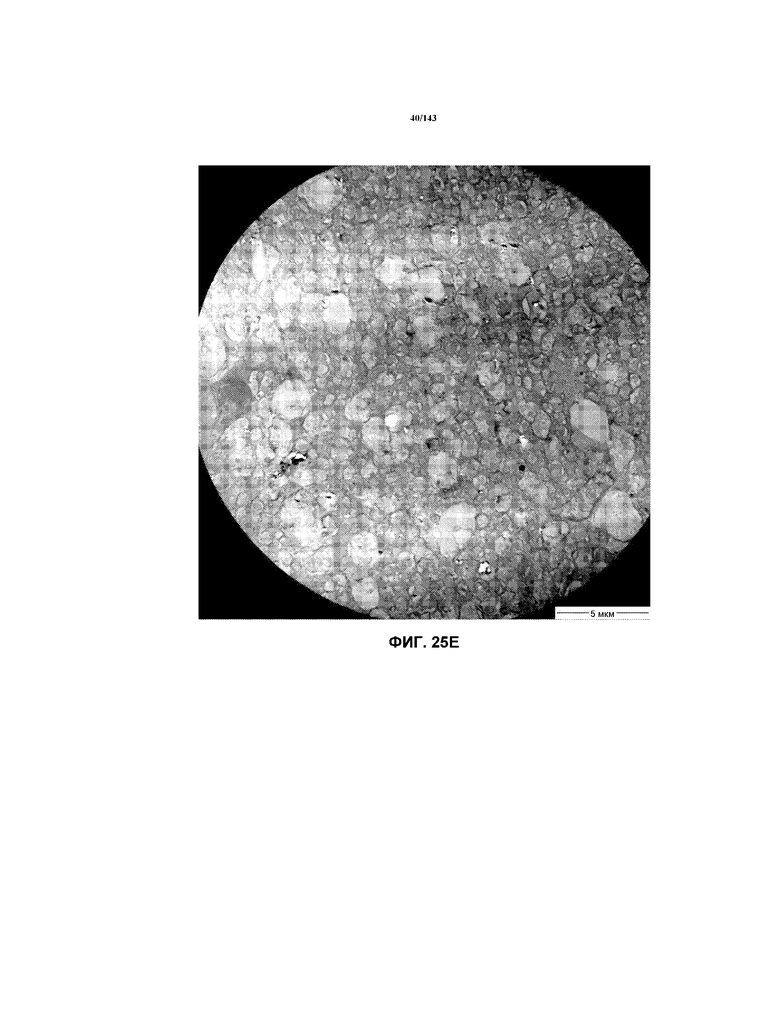
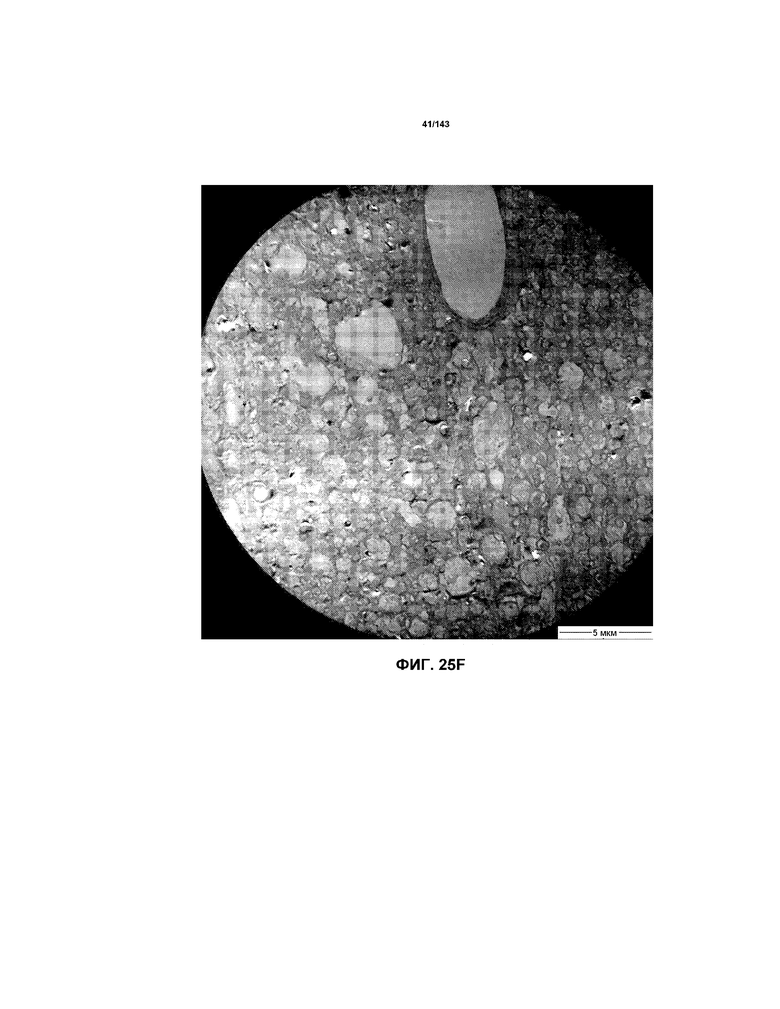







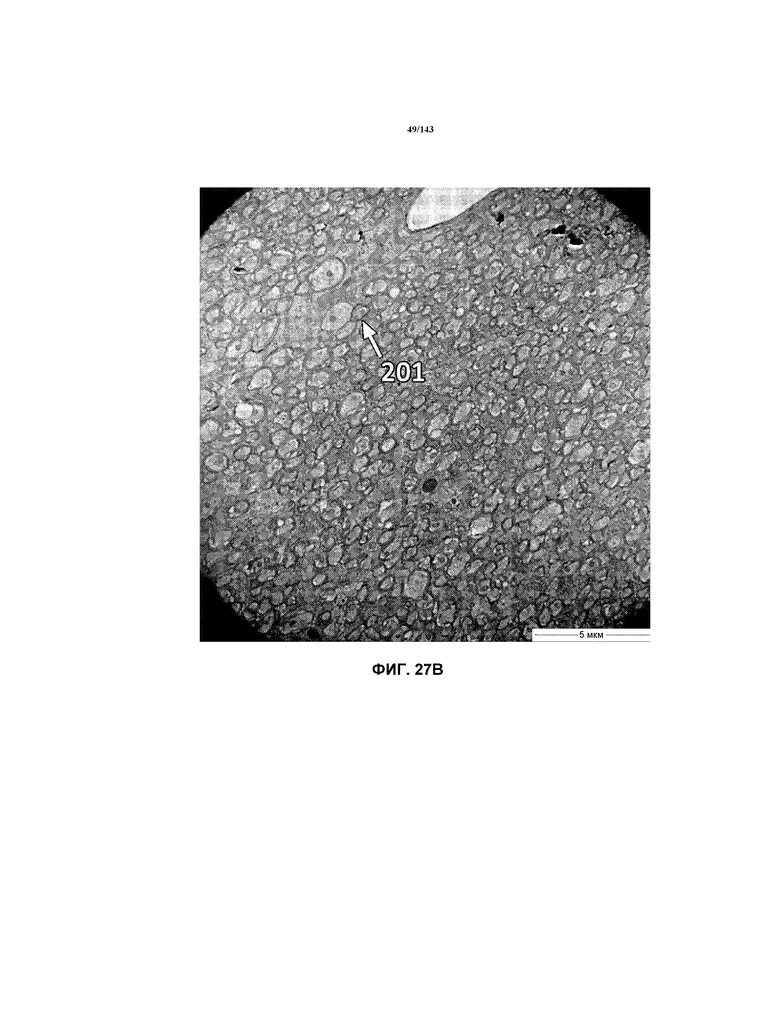




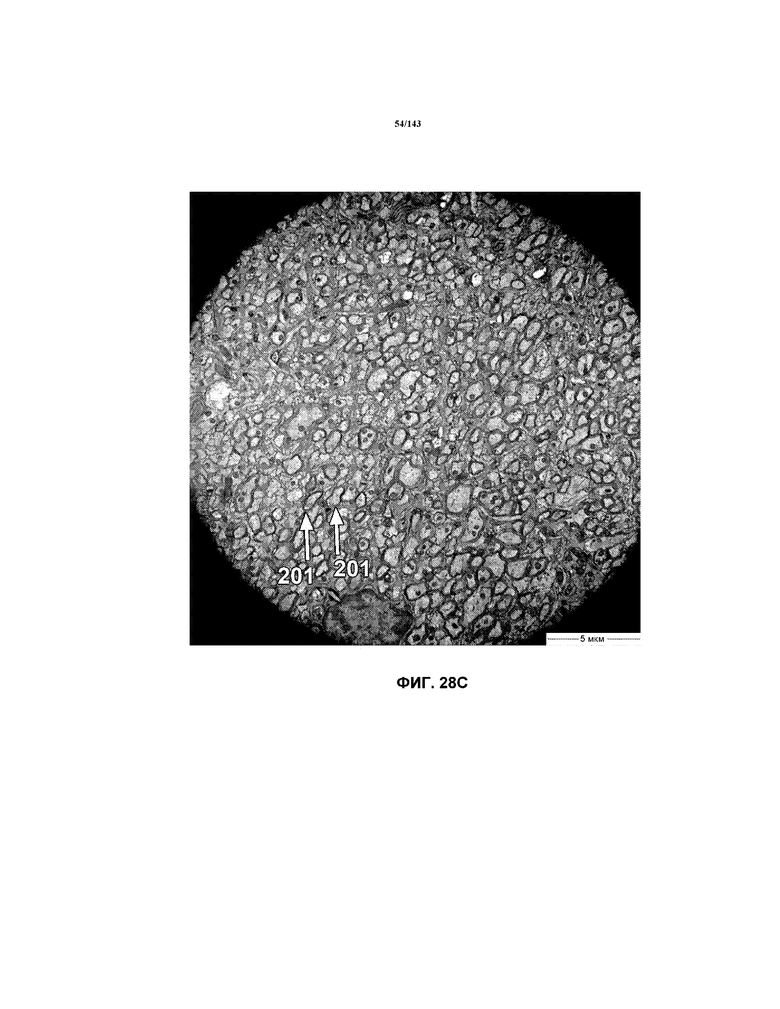













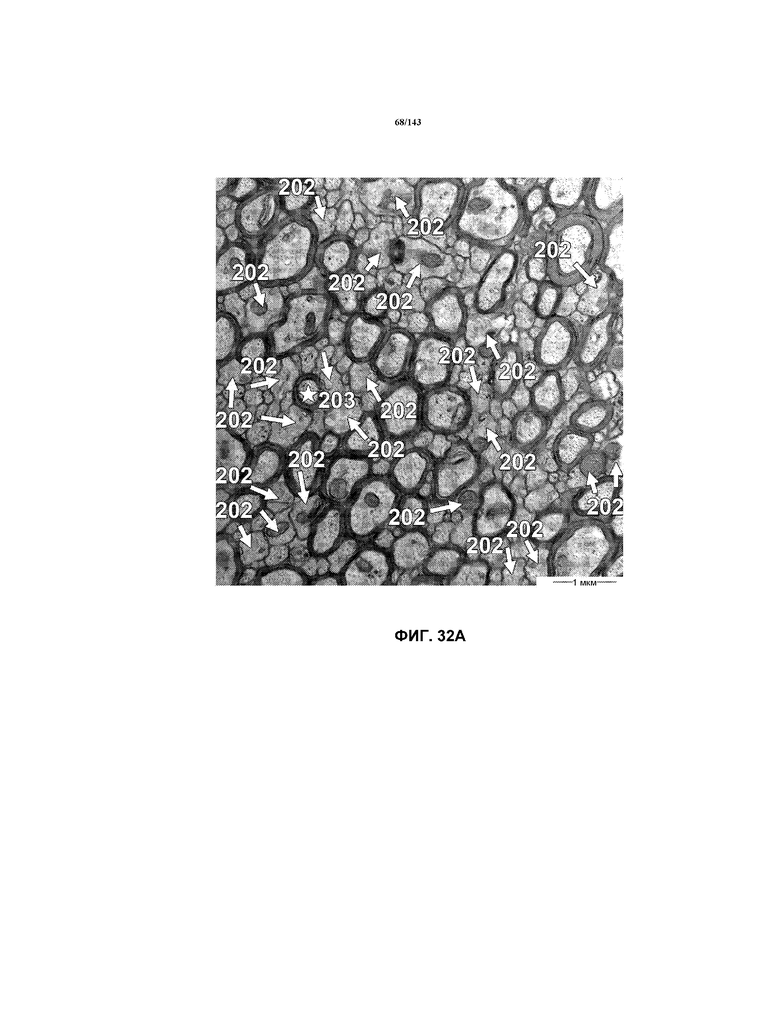









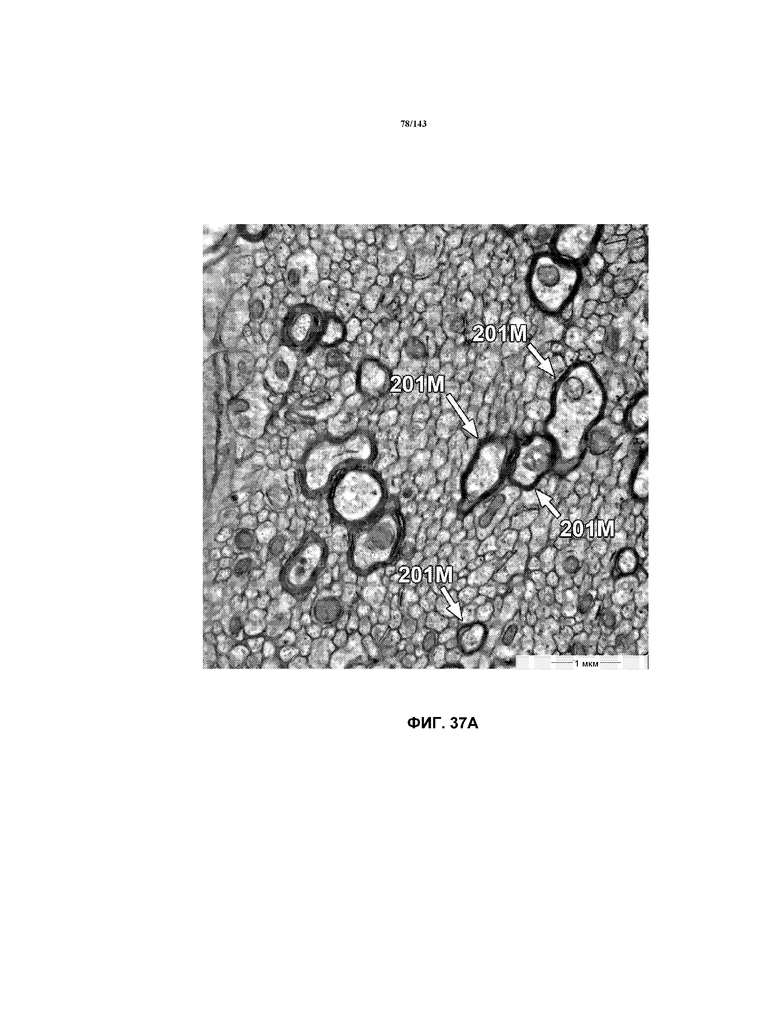
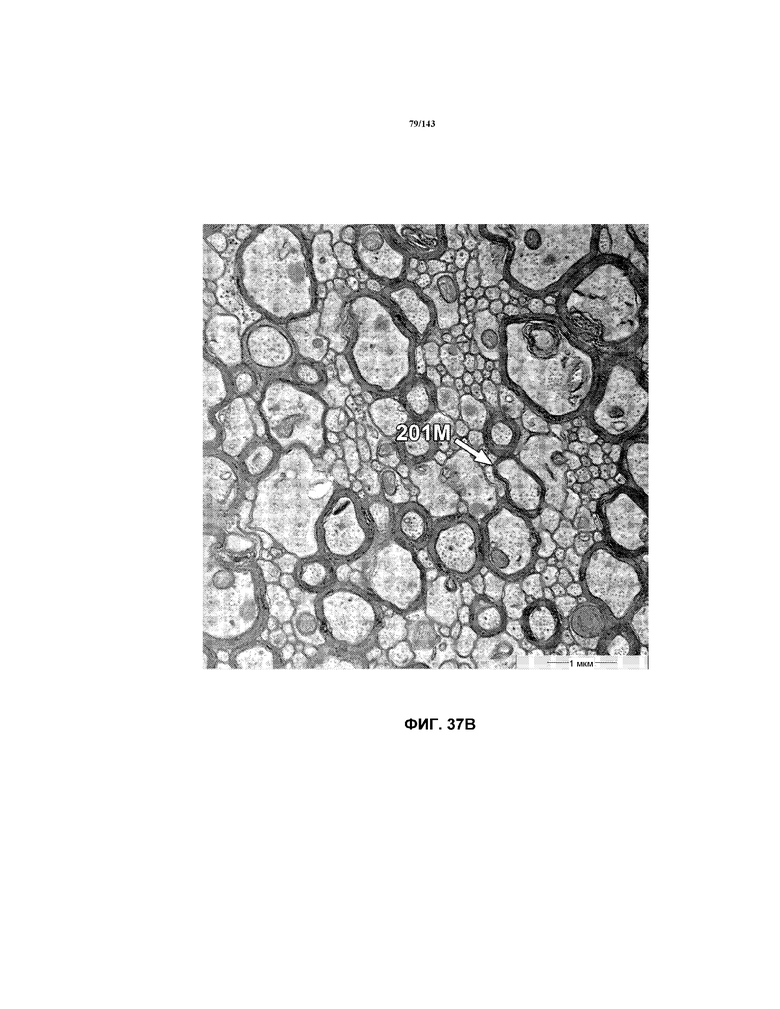
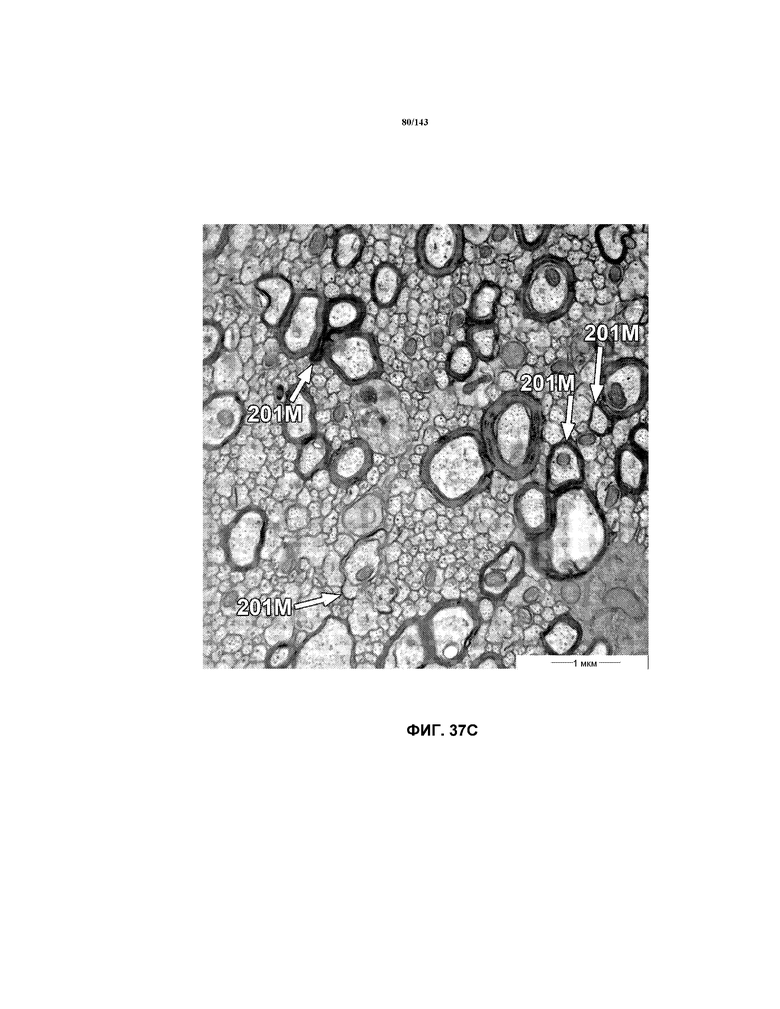


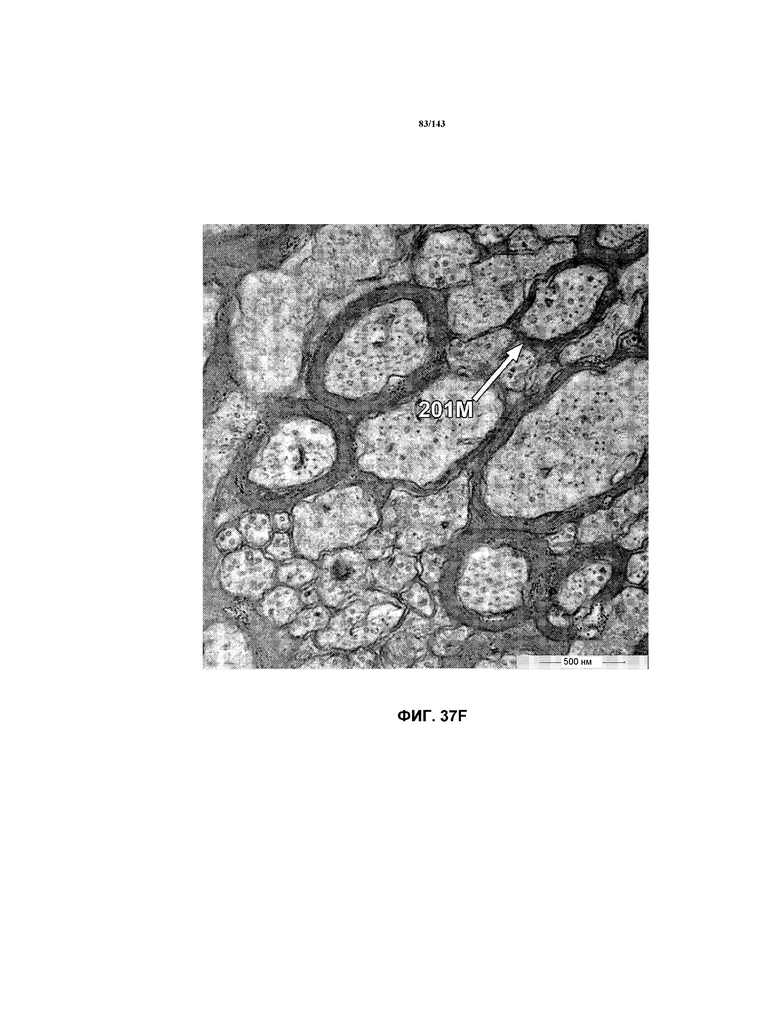
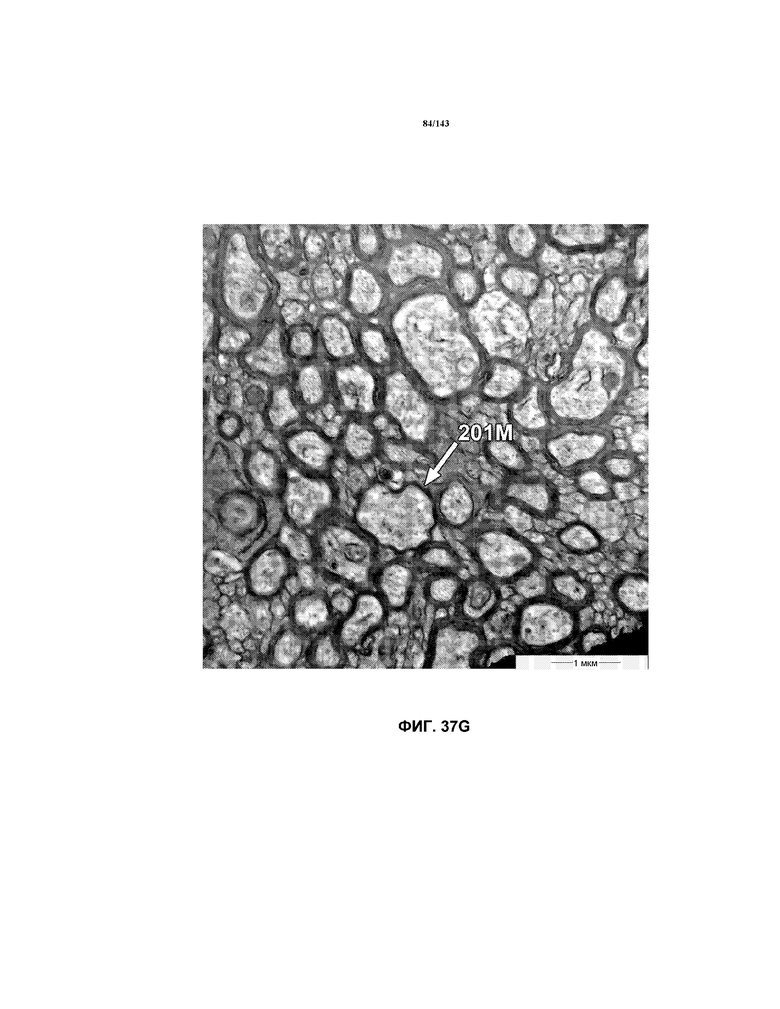
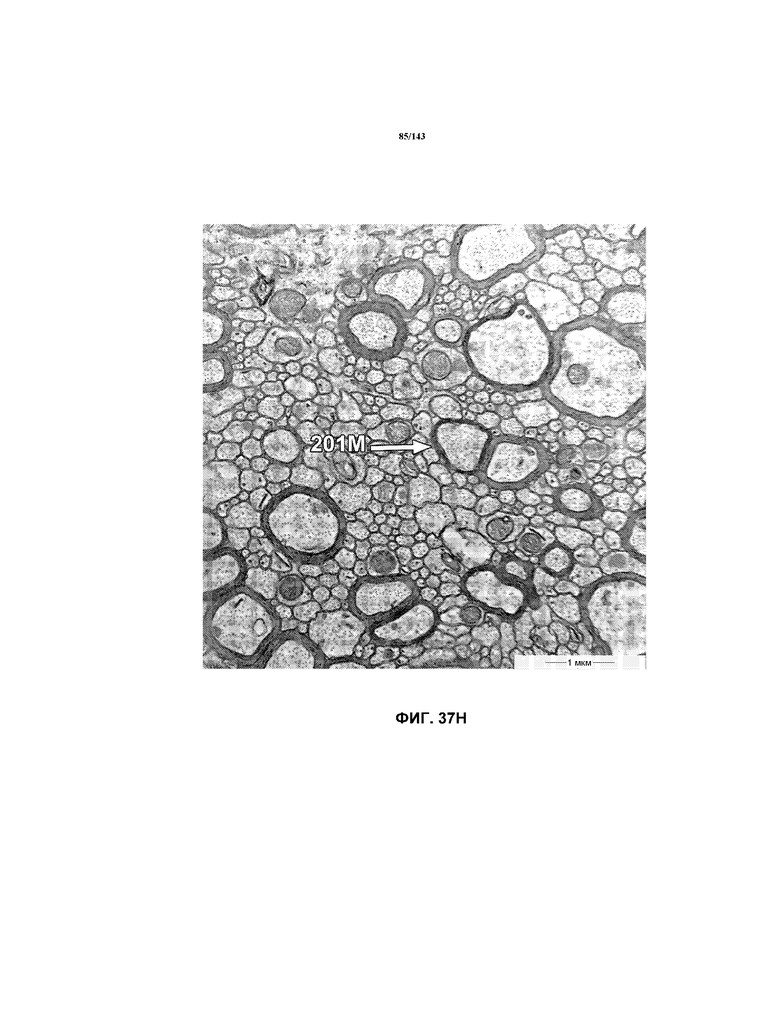
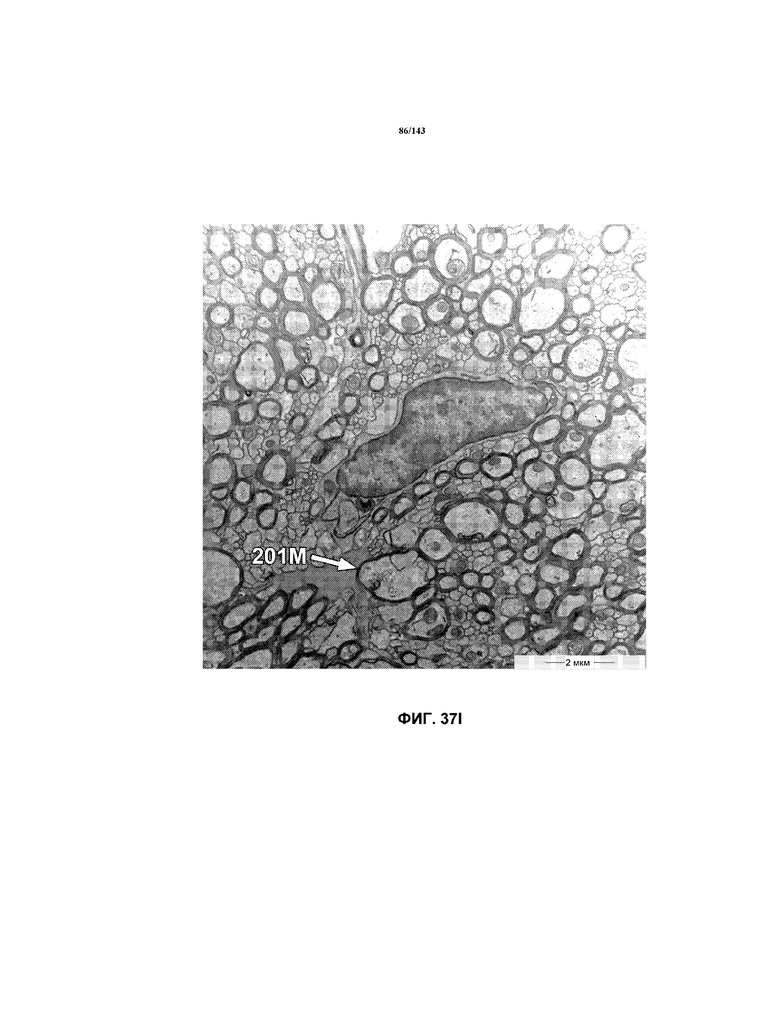
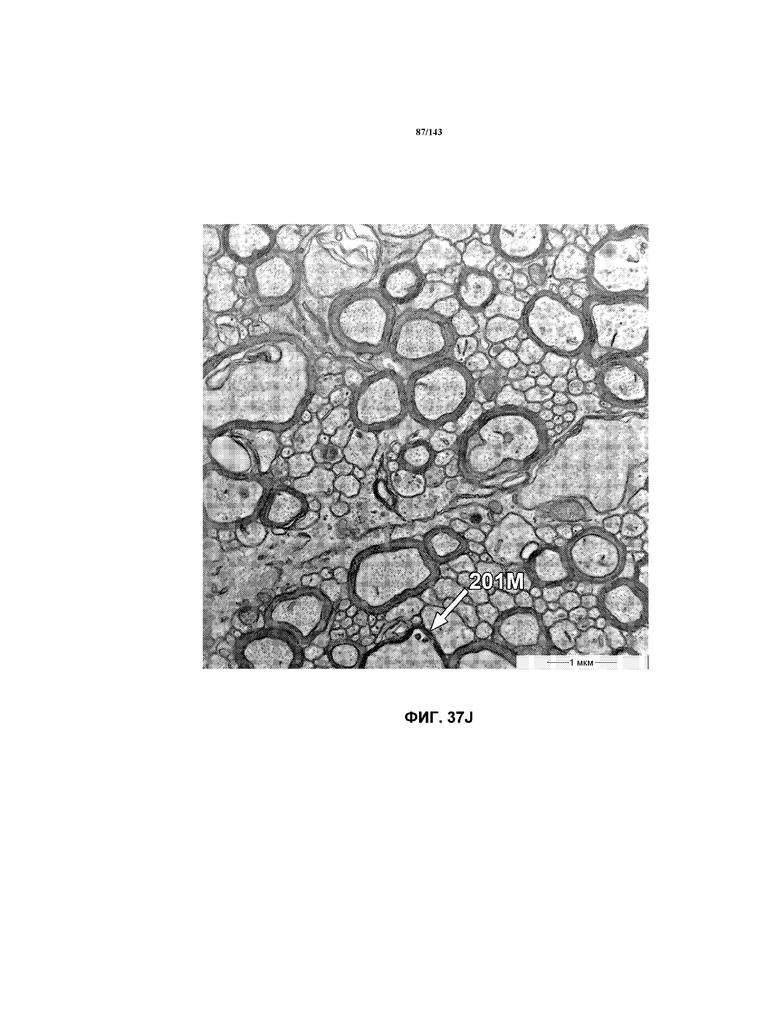

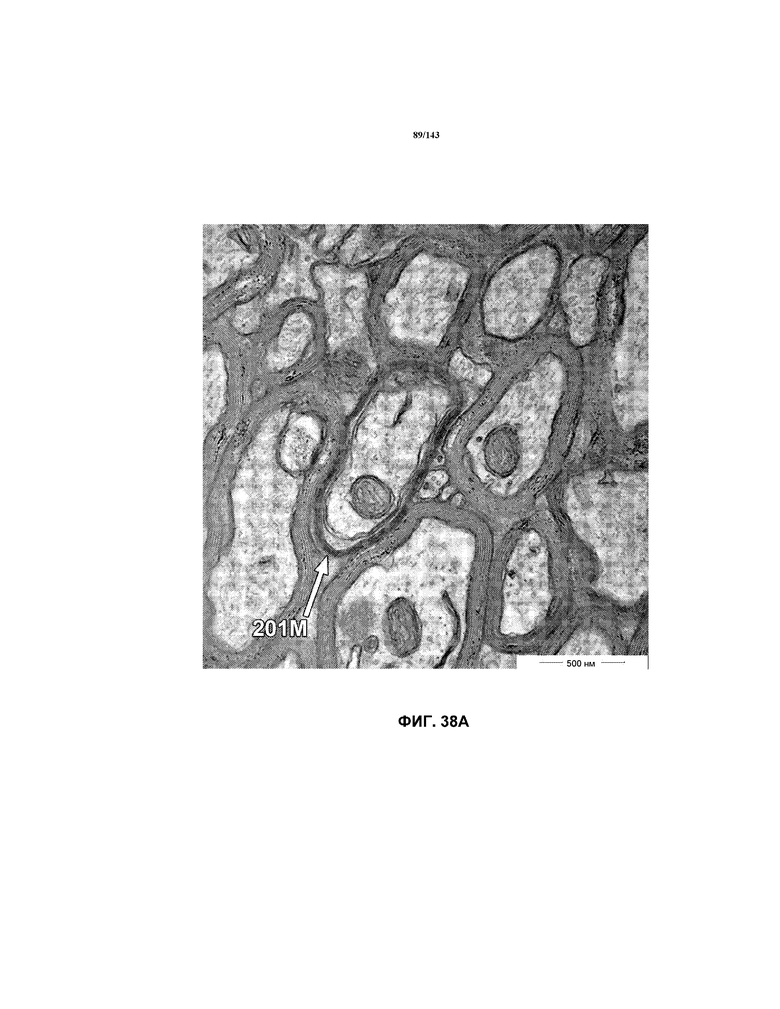



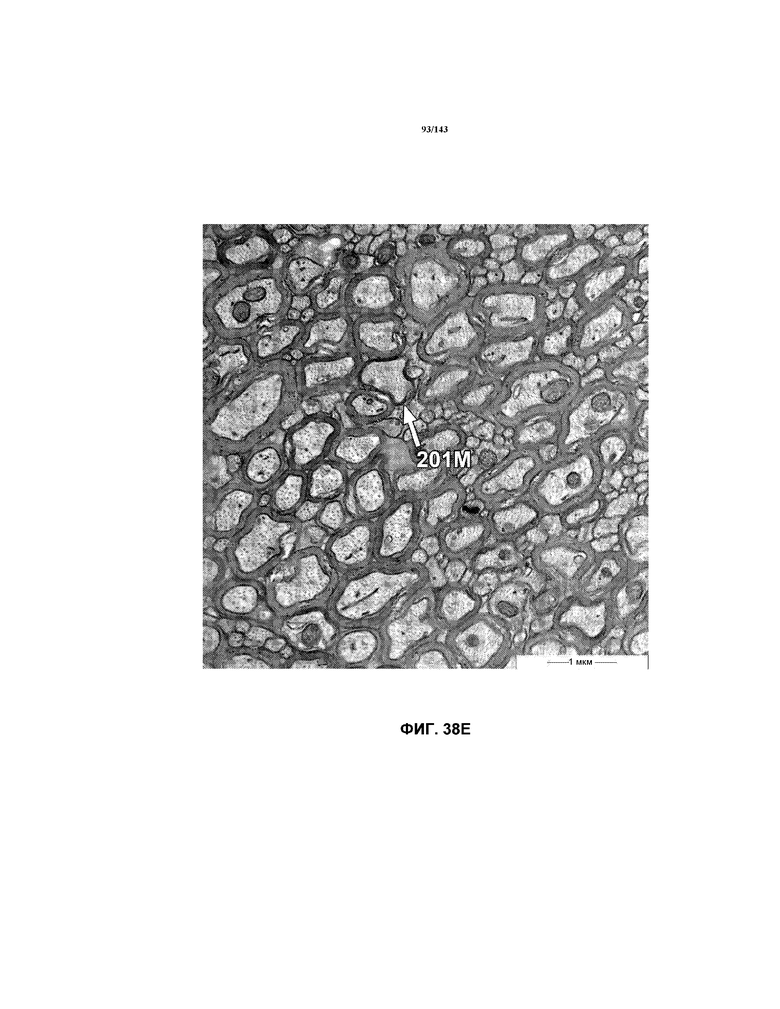

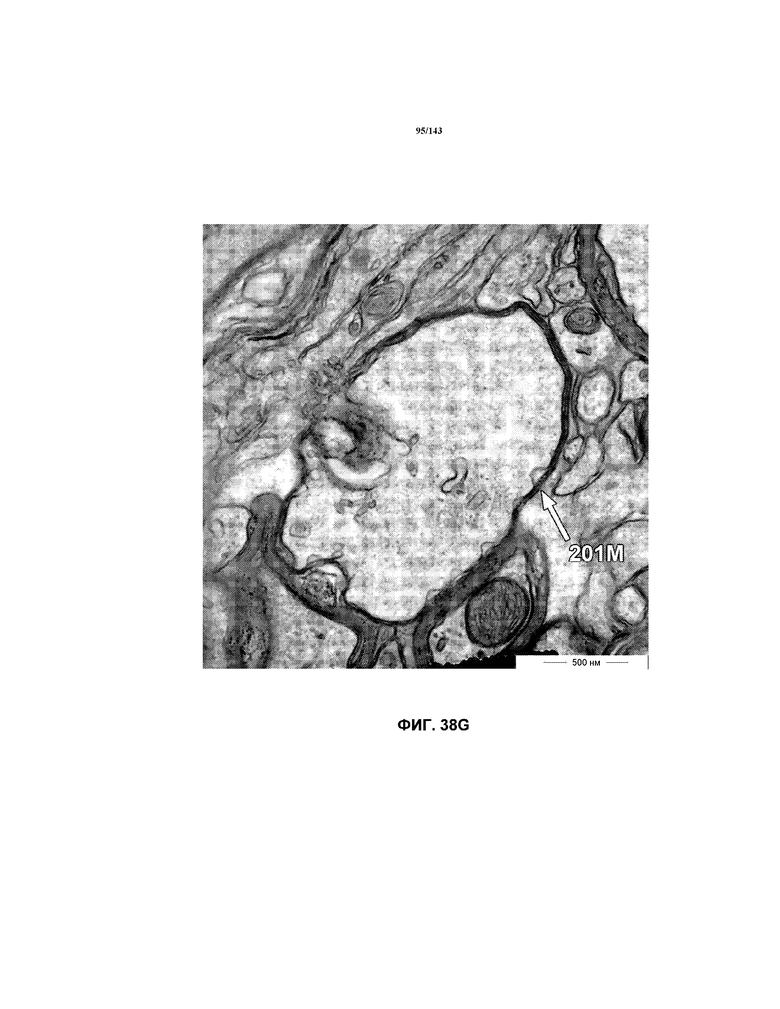



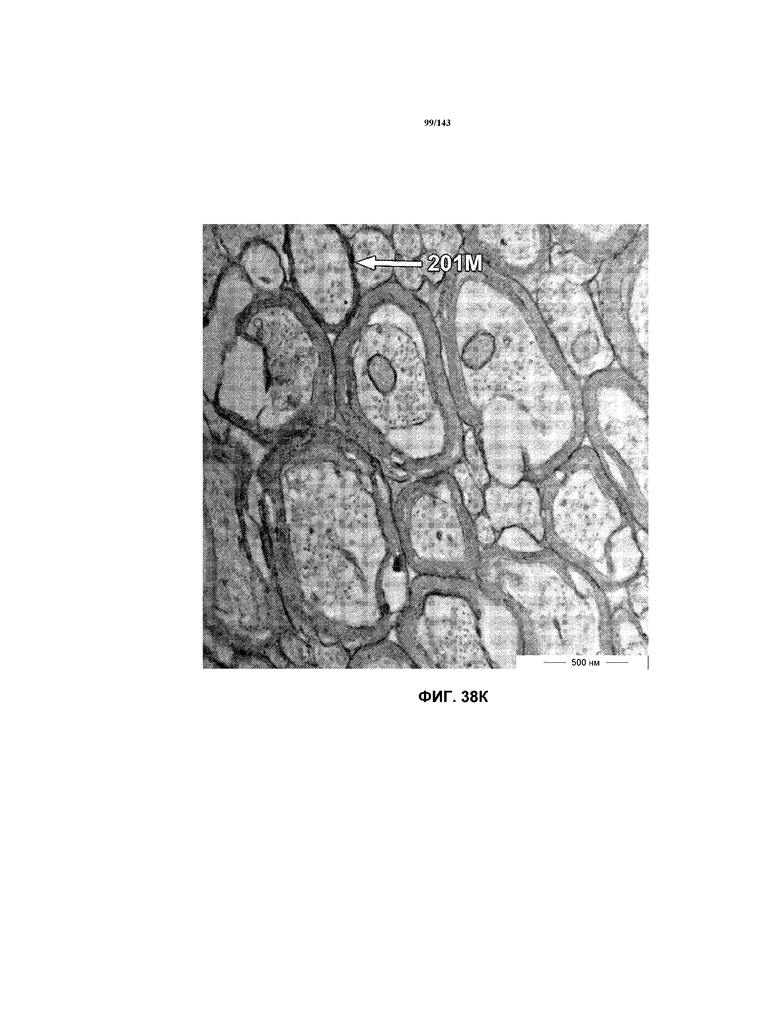

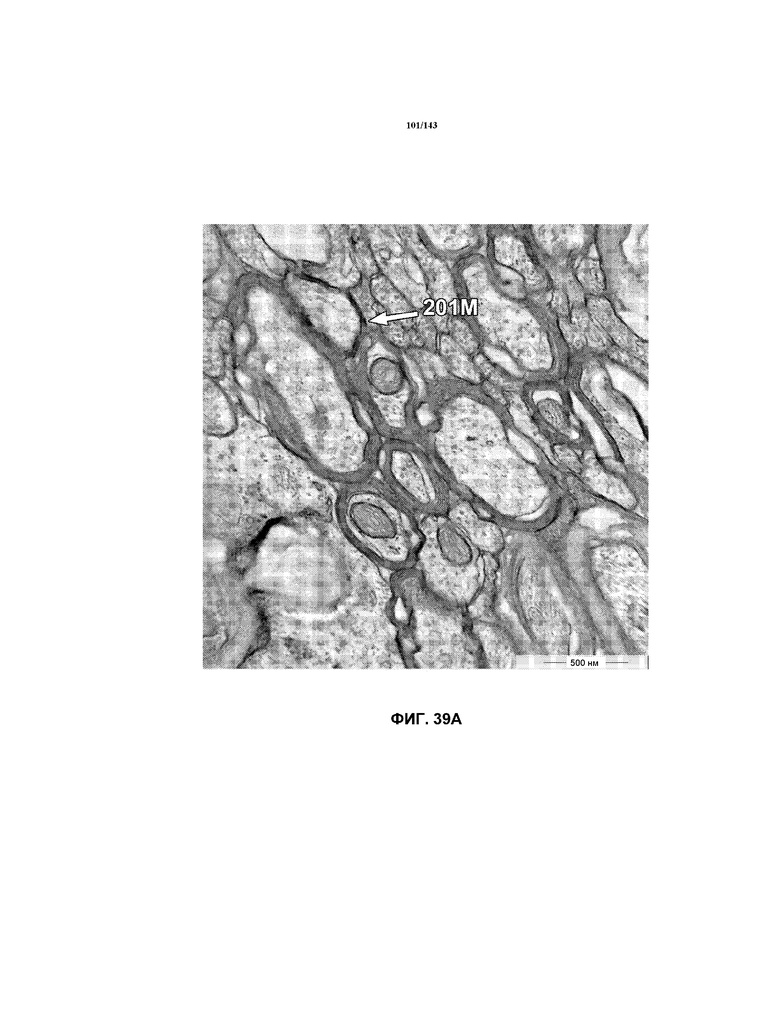




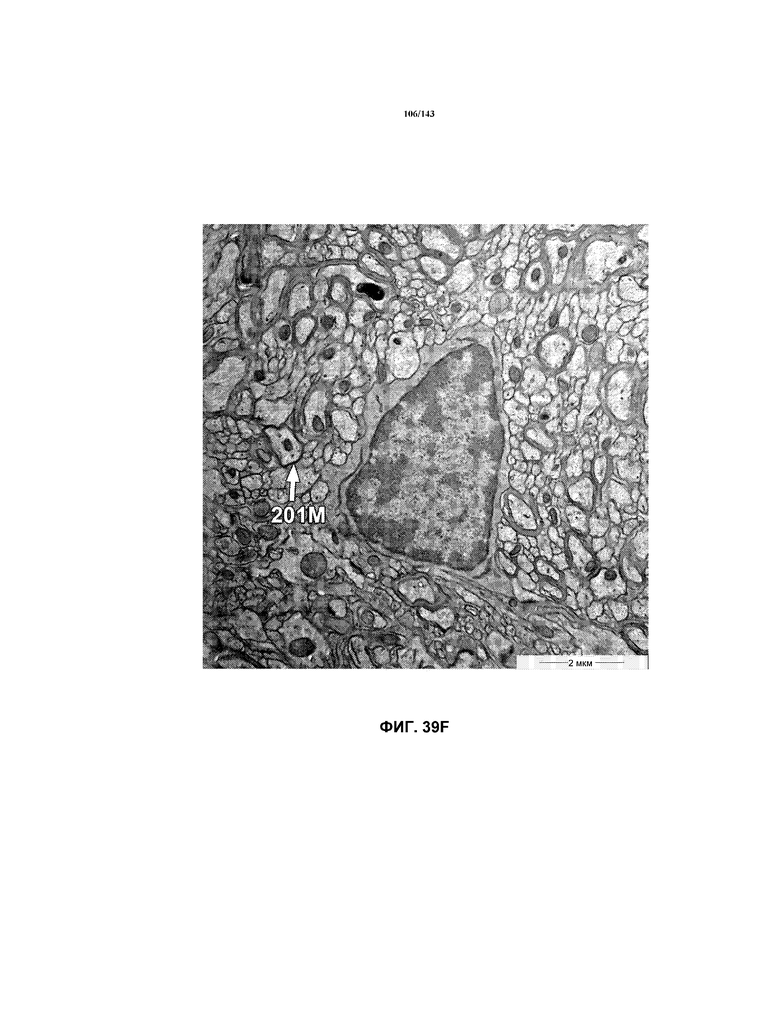

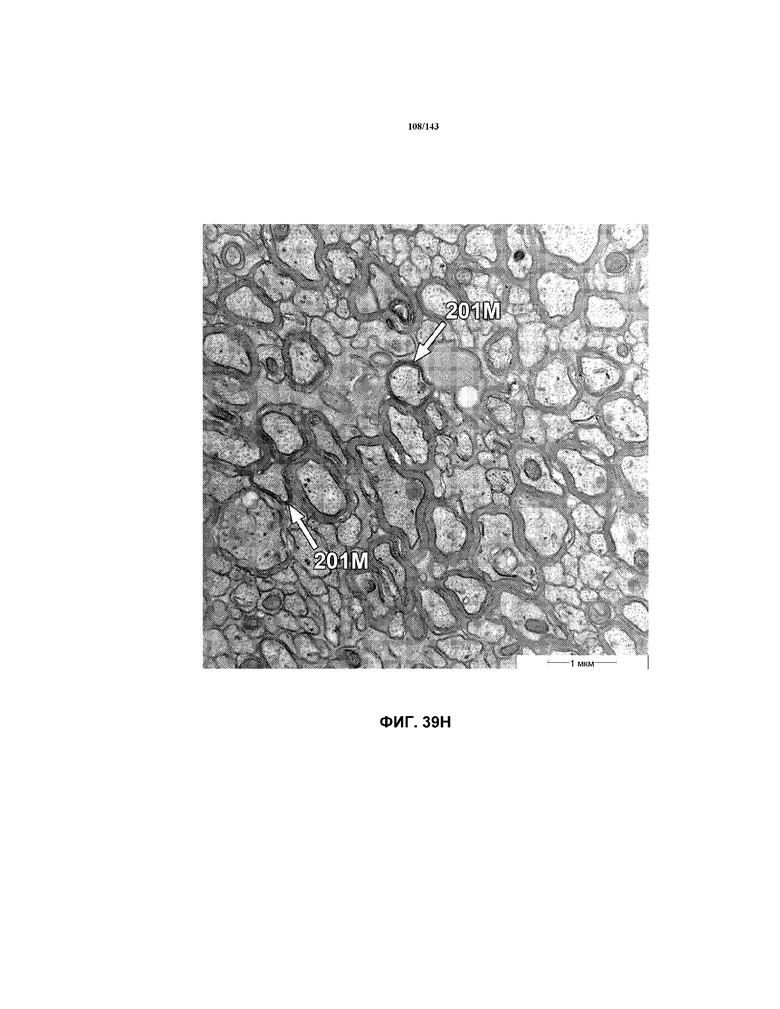



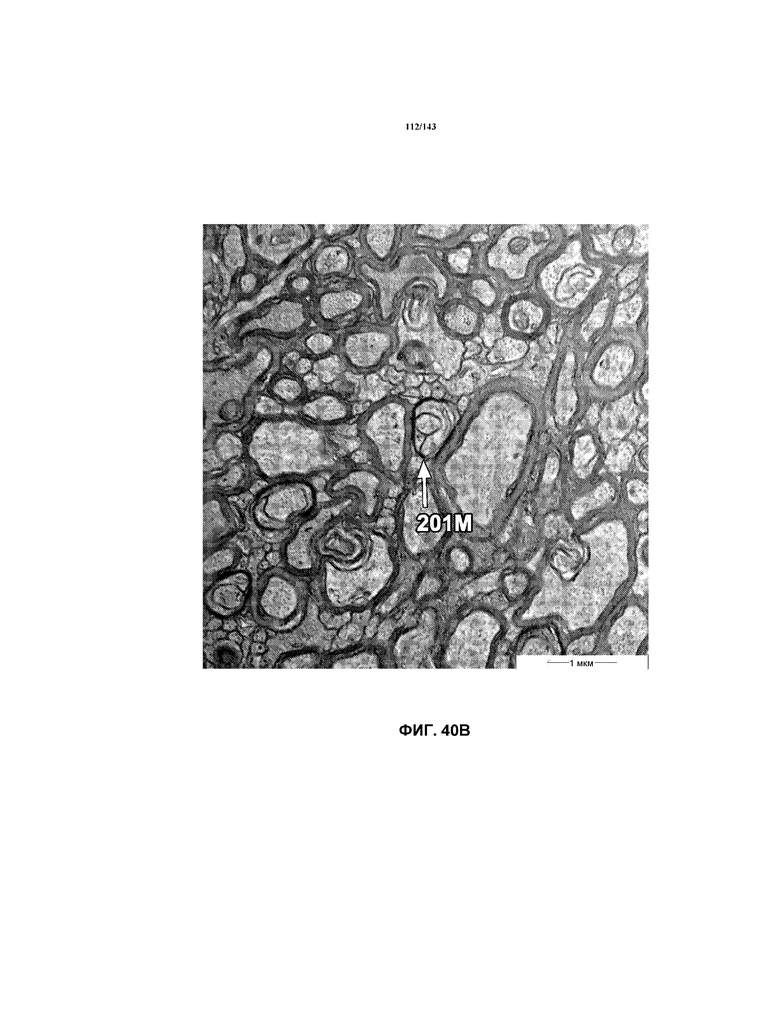
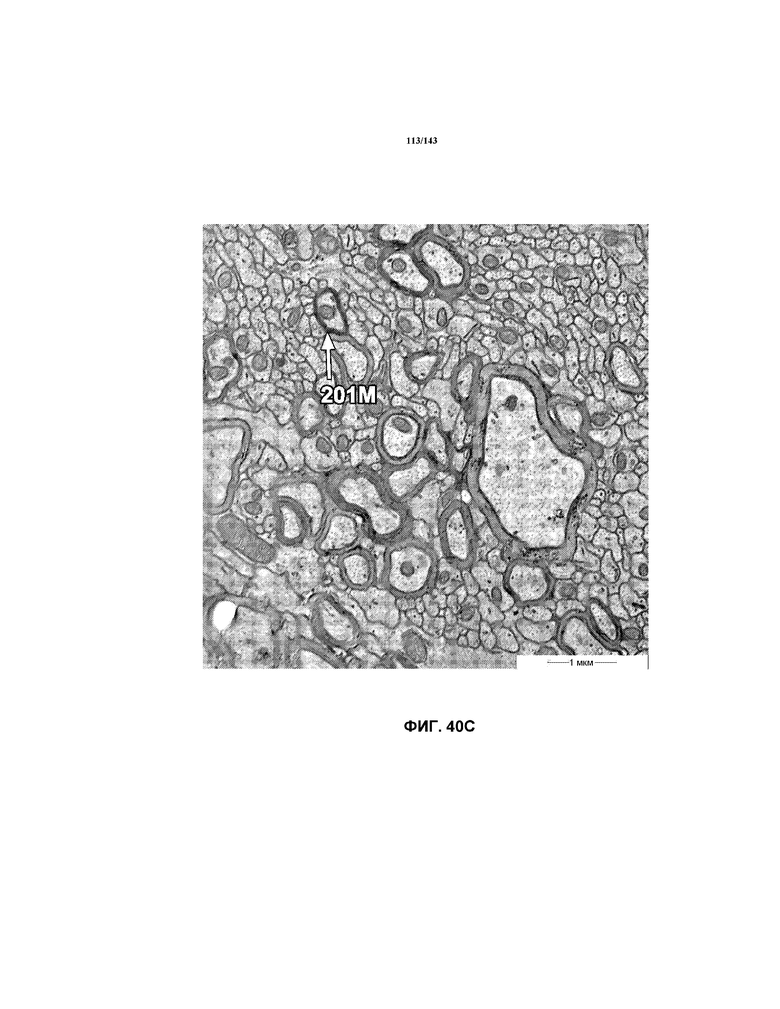














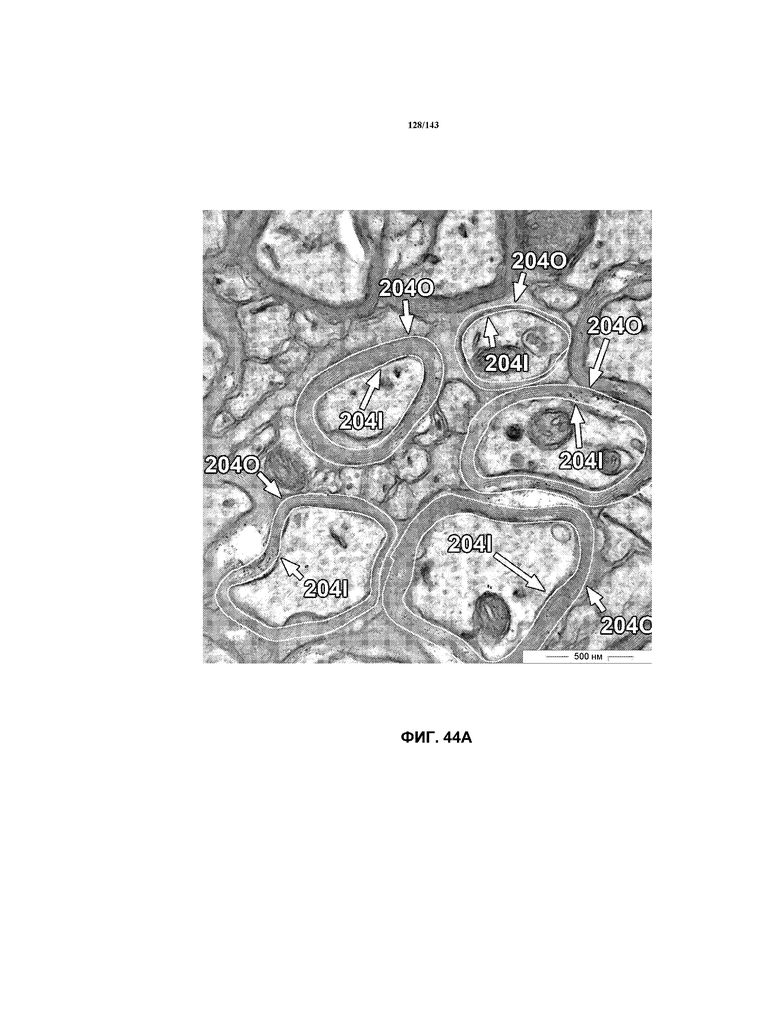



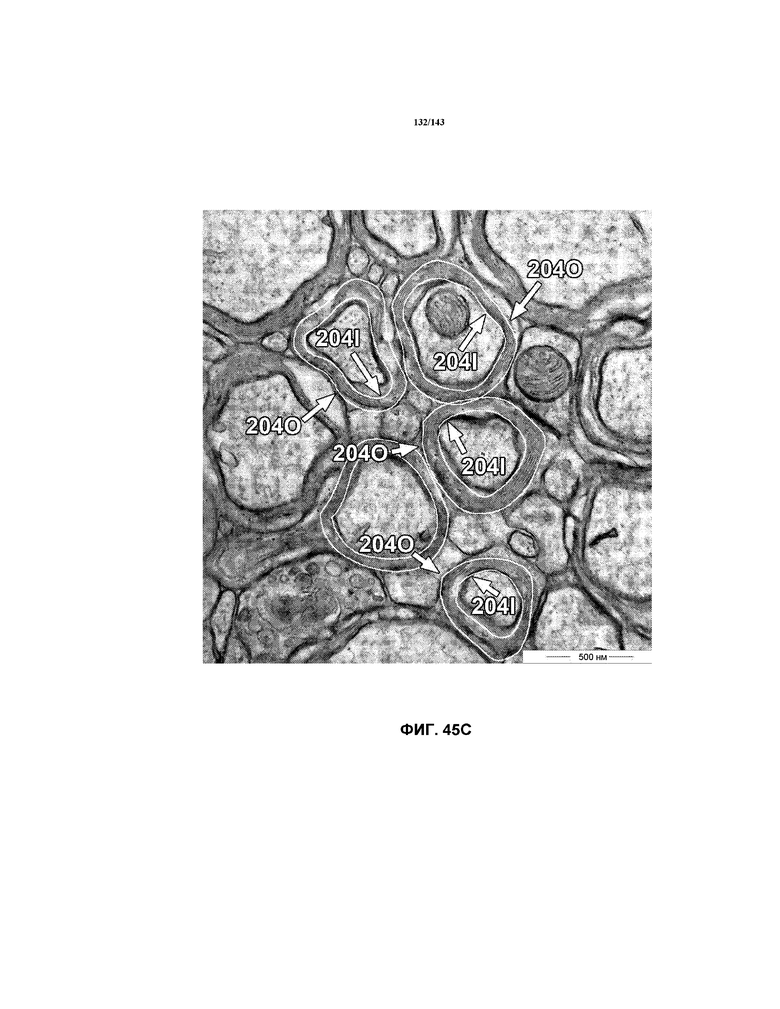
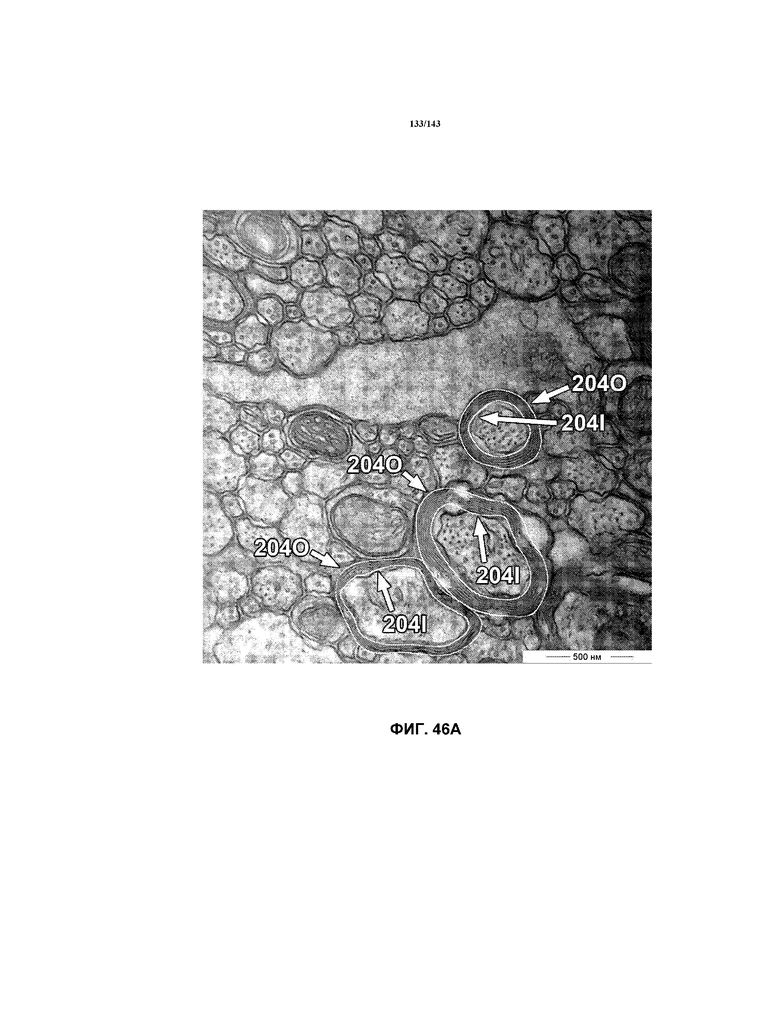
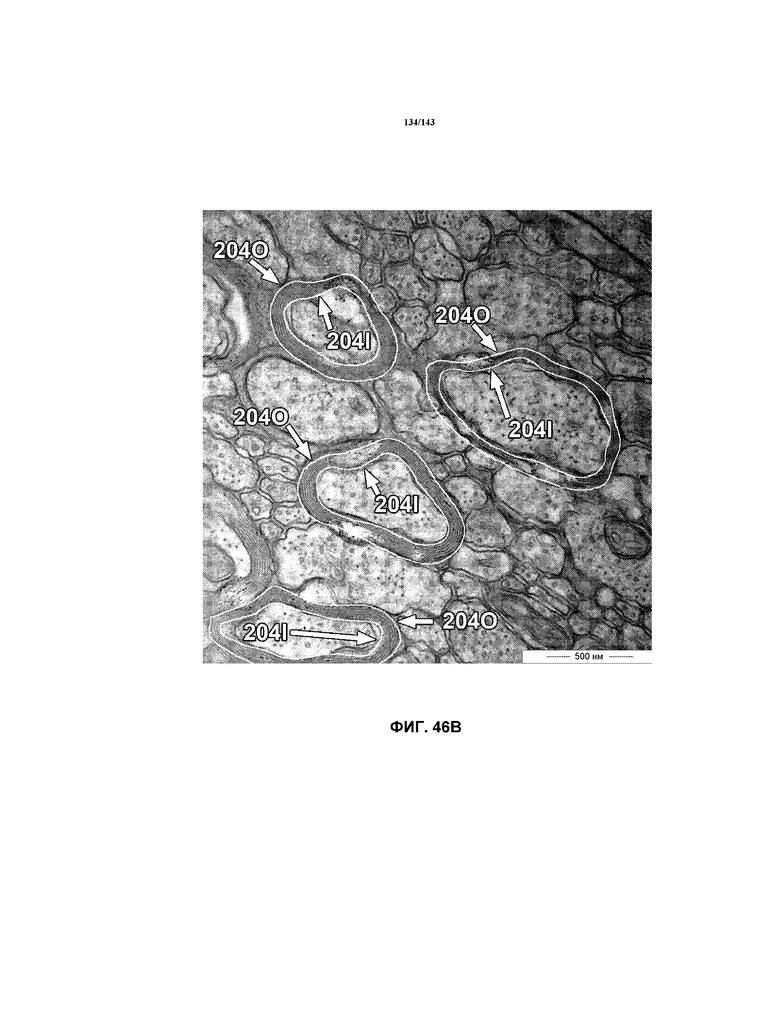
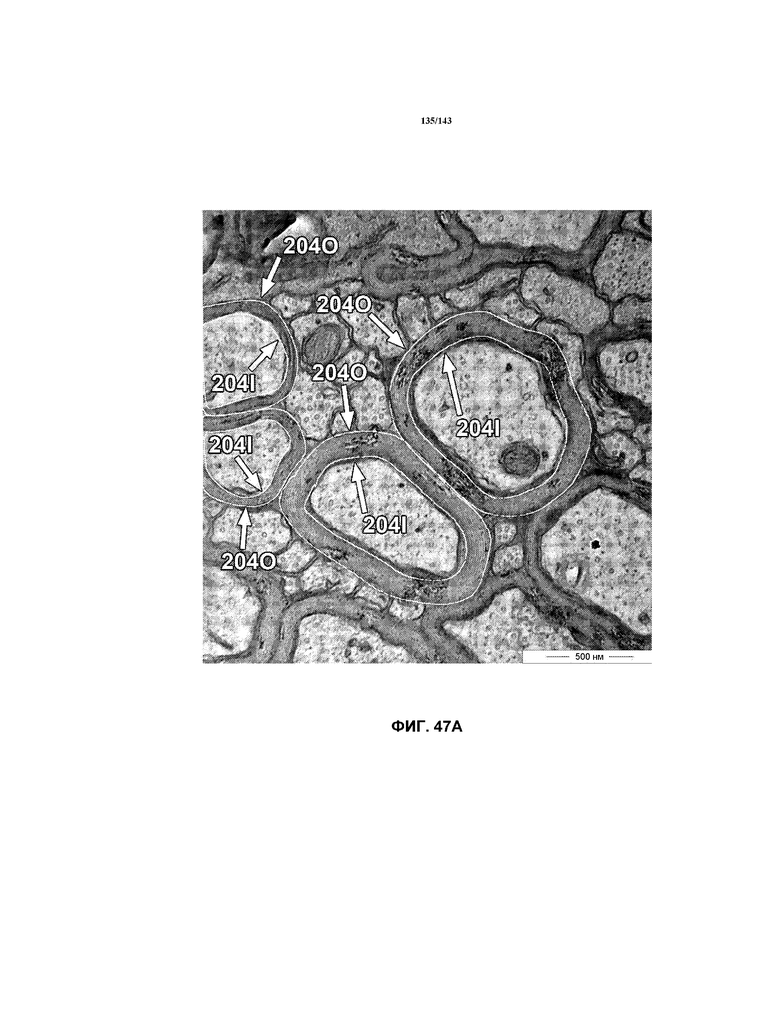
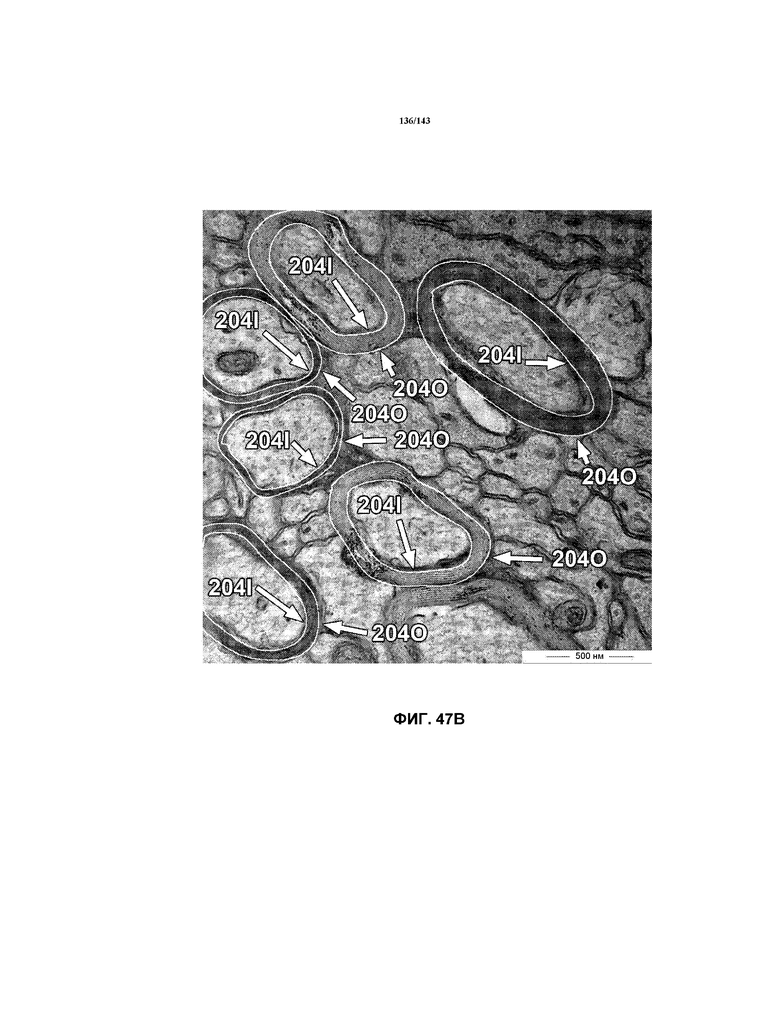
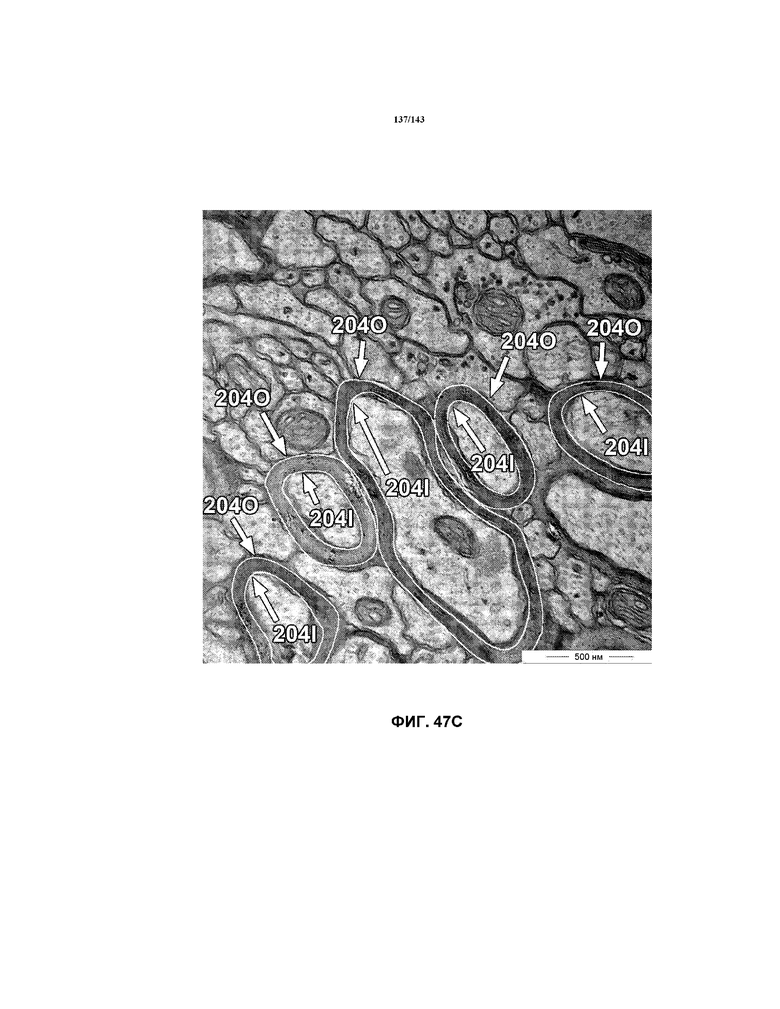


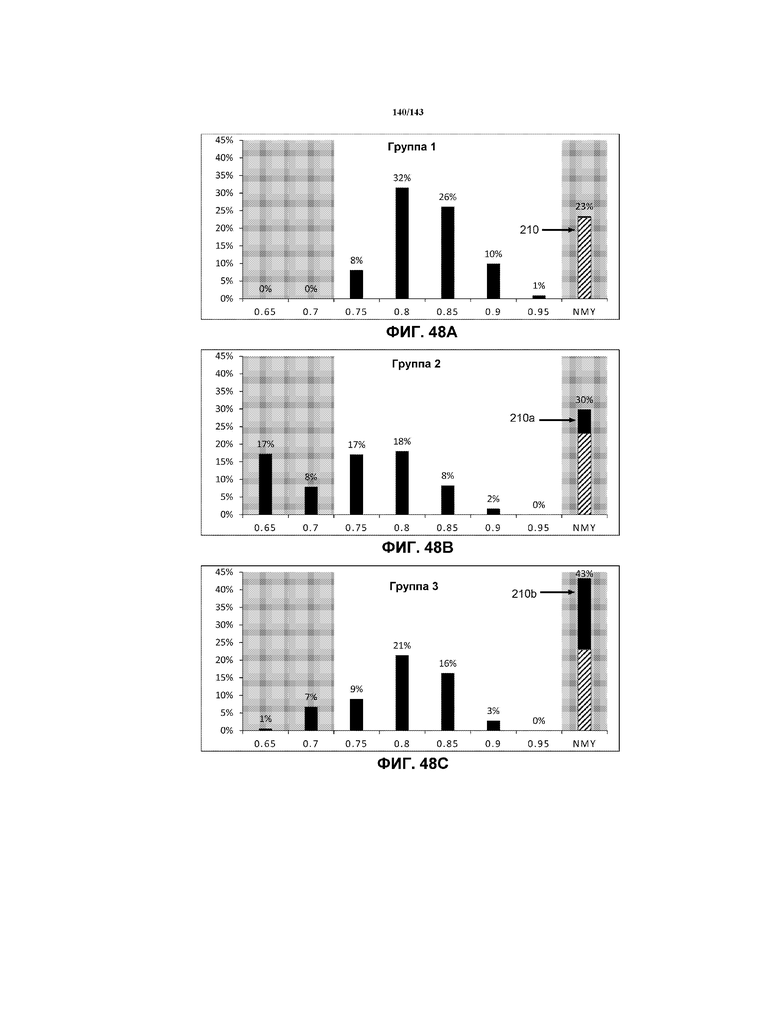
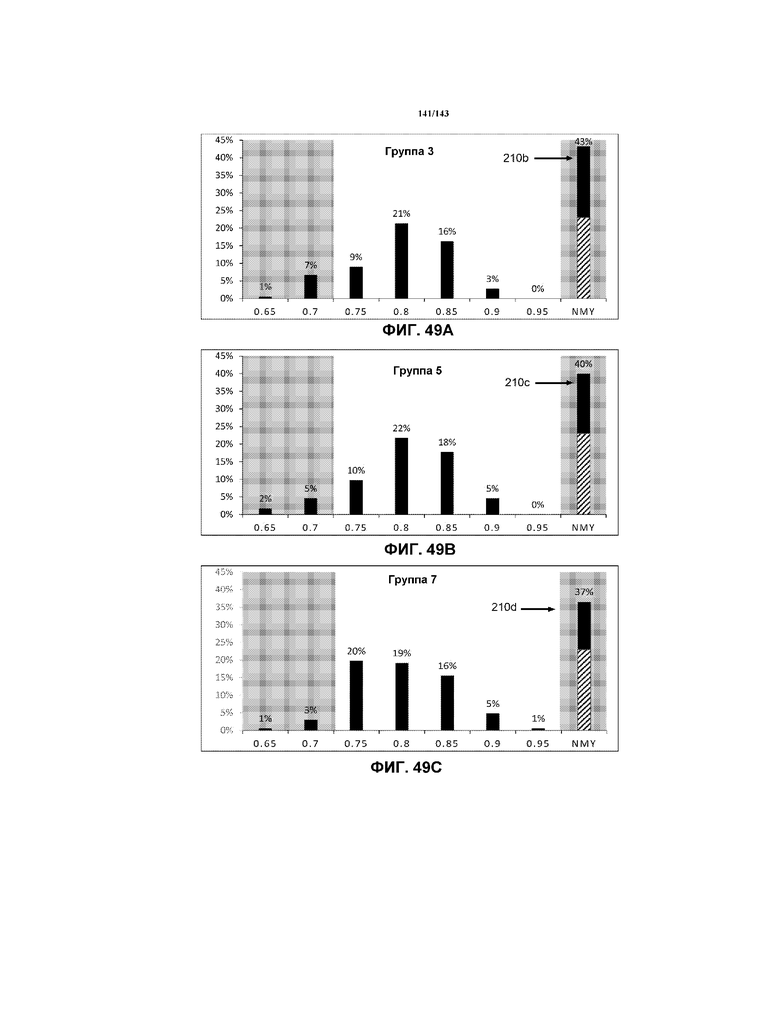
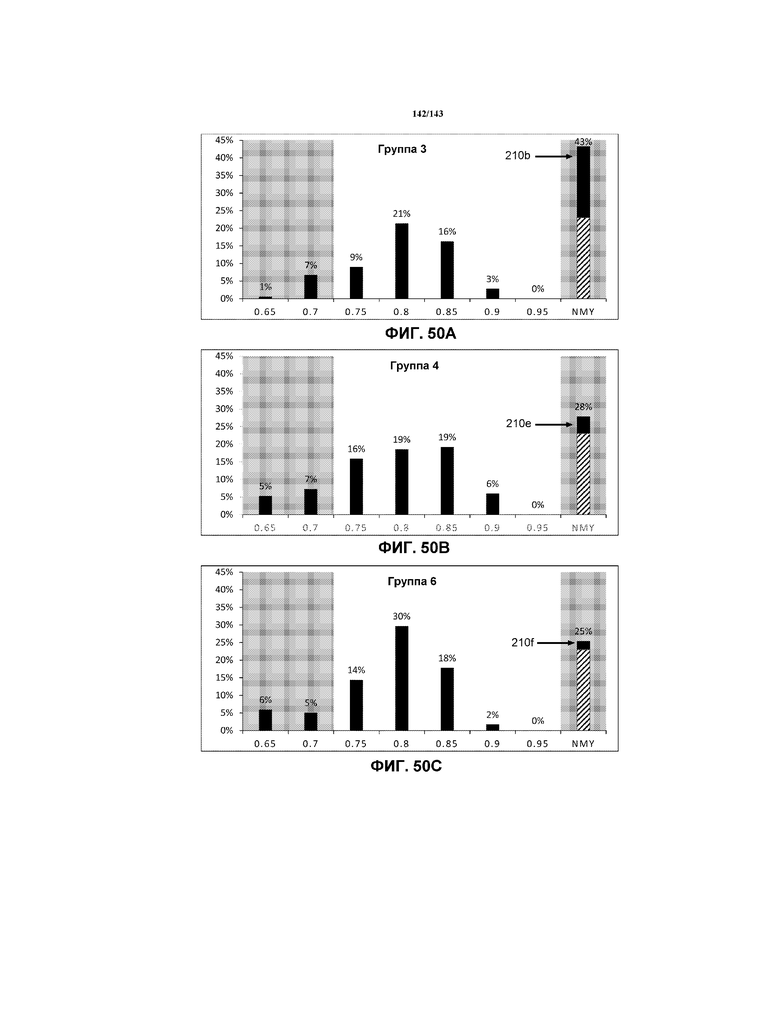

Группа изобретений относится к медицине, а именно к неврологии, и касается применения терапевтически эффективного количества композиции для получения лекарственного средства для стимуляции ремиелинизации нейронов у млекопитающего, где указанные нейроны демиелинизированы вследствие нарушения клеточного дыхания. Композиция содержит a.) воду фармацевтической категории; b.) по меньшей мере один усилитель обработки, выбранный из группы материалов, состоящей из бикарбоната натрия, карбоната натрия, бикарбоната калия, карбоната калия, трифосфата натрия, дифосфата натрия, монофосфата натрия и фосфатов калия; и c.) нанокристаллы золота, суспендированные в указанной воде с образованием суспензии. Указанные нанокристаллы: i.) имеют поверхности, которые включают по меньшей мере одну характеристику, выбранную из группы характеристик, состоящей из: (1) органические химические компоненты не прикрепляются или не прилипают к указанным поверхностям, и/или (2) они имеют чистую поверхность и не имеют химических компонентов, прикрепленных или прилипших к поверхностям, отличных от воды или указанного усилителя обработки, которые изменяют функционирование указанных нанокристаллов; ii.) имеют моду размера частиц менее чем 50 нм; iii.) присутствуют в указанной суспензии в концентрации 2-3000 чнм; и d.) указанная суспензия имеет pH от 5 до 9,5 и зета-потенциал по меньшей мере -30 мВ. Также предложено применение терапевтически эффективного количества наносуспензии для получения лекарственного средства для лечения заболевания у млекопитающего, включающего демиелинизацию нейронов, вызванную нарушением клеточного дыхания в указанных нейронах, при этом указанное лекарственное средство стимулирует ремиелинизацию указанных нейронов. Группа изобретений обеспечивает стимуляцию ремиелинизации нейронов у млекопитающего, где указанные нейроны демиелинизированы вследствие нарушения клеточного дыхания, причем композиция содержит наносуспензию элементарного золота. 3 н. и 9 з.п. ф-лы, 51 ил., 5 табл., 3 пр.
1. Применение терапевтически эффективного количества композиции для получения лекарственного средства для стимуляции ремиелинизации нейронов у млекопитающего, нуждающегося в этом, где указанные нейроны демиелинизированы вследствие нарушения клеточного дыхания, причем композиция содержит
a.) воду фармацевтической категории;
b.) по меньшей мере один усилитель обработки, выбранный из группы материалов, состоящей из бикарбоната натрия, карбоната натрия, бикарбоната калия, карбоната калия, трифосфата натрия, дифосфата натрия, монофосфата натрия и фосфатов калия; и
c.) нанокристаллы золота, суспендированные в указанной воде с образованием суспензии, где указанные нанокристаллы:
i.) имеют поверхности, которые включают по меньшей мере одну характеристику, выбранную из группы характеристик, состоящей из: (1) органические химические компоненты не прикрепляются или не прилипают к указанным поверхностям, и/или (2) они имеют чистую поверхность и не имеют химических компонентов, прикрепленных или прилипших к поверхностям, отличных от воды или указанного усилителя обработки, которые изменяют функционирование указанных нанокристаллов;
ii.) имеют моду размера частиц менее чем 50 нм;
iii.) присутствуют в указанной суспензии в концентрации 2-3000 чнм; и
d.) указанная суспензия имеет pH от 5 до 9,5 и зета-потенциал по меньшей мере -30 мВ.
2. Применение по п. 1, где указанная суспензия имеет зета-потенциал по меньшей мере -40 мВ.
3. Применение по п. 1, где указанные нанокристаллы золота присутствуют в концентрации 2-200 чнм.
4. Применение терапевтически эффективного количества наносуспензии для получения лекарственного средства для лечения заболевания у млекопитающего, включающего демиелинизацию нейронов, вызванную нарушением клеточного дыхания в указанных нейронах, при этом указанное лекарственное средство стимулирует ремиелинизацию указанных нейронов, причем наносуспензия содержит:
a.) воду фармацевтической категории;
b.) по меньшей мере один усилитель обработки, выбранный из группы материалов, состоящей из бикарбоната натрия, карбоната натрия, бикарбоната калия, карбоната калия, трифосфата натрия, дифосфата натрия, монофосфата натрия и фосфатов калия; и
c.) нанокристаллы золота, суспендированные в указанной воде с образованием суспензии, где указанные нанокристаллы:
i.) имеют поверхности, которые включают по меньшей мере одну характеристику, выбранную из группы характеристик, состоящей из: (1) органические химические компоненты не прикрепляются или не прилипают к указанным поверхностям, и/или (2) они имеют чистую поверхность и не имеют химических компонентов, прикрепленных или прилипших к поверхностям, отличных от воды или указанного усилителя обработки, которые изменяют функционирование указанных нанокристаллов;
ii.) имеют моду размера частиц менее чем 50 нм;
iii.) присутствуют в указанной суспензии в концентрации 2-2000 чнм; и
d.) указанная суспензия имеет pH от 5 до 9,5 и зета-потенциал по меньшей мере -30 мВ.
5. Применение по п. 1 или 4, где указанные нейроны включают нейроны центральной нервной системы.
6. Применение по п. 5, где указанное заболевание включает по меньшей мере одно заболевание, выбранное из группы, состоящей из прогрессирующего надъядерного паралича, болезни Александера, болезни Краббе, метахроматической лейкодистрофии, болезни Канавана, лейкодистрофий, энцефаломиелита, центрального понтинного миелолиза (CPM), болезни анти-MAG, болезни Пелицеуса-Мерцбахера, болезни Рефсума, синдрома Кокейна, синдрома Цельвегера, синдрома Гийена-Барре (GBS), синдрома Ван дер Кнаппа, хронической воспалительной демиелинизирующей полиневропатии (CIDP), многоочаговой двигательной невропатии (MMN), оптического нейромиелита (NMO), прогрессирующей многоочаговой лейкоэнцефалопатии (PML), уоллеровского перерождения и некоторых наследственных заболеваний, таких как адренолейкодистрофия, болезнь Александера и Пелицеуса-Мерцбахера (PMZ).
7. Применение по п. 5, где указанное заболевание включает оптический нейромиелит (NMO).
8. Применение терапевтически эффективного количества композиции для получения лекарственного средства для стимуляции ремиелинизации нейронов у млекопитающего, нуждающегося в этом, где указанные нейроны демиелинизированы вследствие нарушения клеточного дыхания, причем композиция содержит наносуспензию элементарного золота.
9. Применение по п. 8, где указанная ремиелинизация включает по меньшей мере одно из пролиферации или дифференцировки олигодендроцитов.
10. Применение по п. 8 или 9, где указанная ремиелинизация включает ремиелинизацию нейронов центральной нервной системы.
11. Применение по пп. 8 и 9, где указанная ремиелинизация включает ремиелинизацию нейронов, поврежденных в результате по меньшей мере одного заболевания, выбранного из группы, состоящей из прогрессирующего надъядерного паралича, болезни Александера, болезни Краббе, метахроматической лейкодистрофии, болезни Канавана, лейкодистрофий, энцефаломиелита, центрального понтинного миелолиза (CPM), болезни анти-MAG, болезни Пелицеуса-Мерцбахера, болезни Рефсума, синдрома Кокейна, синдрома Цельвегера, синдрома Гийена-Барре (GBS), синдрома Ван дер Кнаппа, хронической воспалительной демиелинизирующей полиневропатии (CIDP), многоочаговой двигательной невропатии (MMN), оптического нейромиелита (NMO), прогрессирующей многоочаговой лейкоэнцефалопатии (PML), мягкого нарушения когнитивной способности (MCI), уоллеровского перерождения и некоторых наследственных заболеваний, таких как адренолейкодистрофия, болезнь Александера и Пелицеуса-Мерцбахера (PMZ).
12. Применение по п. 11, где указанное заболевание включает оптический нейромиелит (NMO).
| WO2011006007 A1, 13.01.2011 | |||
| WO2012061828 A2, 10.05.2012 | |||
| US2010092470 А1, 15.04.2010 | |||
| US2007140966 А1, 21.06.2007 | |||
| DAN SONNE PEDERSEN et al, Metallic gold slows disease progression, reduces cell death and induces astrogliosis while simultaneously increasing stem cell responses in an EAE rat model of multiple sclerosis// HISTOCHEMISTRY AND CELL BIOLOGY, SPRINGER, BERLIN, DE, (20120722), vol | |||
| Прибор для определения всасывающей силы почвы | 1921 |
|
SU138A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для передвигания ленты в кинематографическом аппарате | 1920 |
|
SU788A1 |
Авторы
Даты
2019-04-30—Публикация
2014-05-08—Подача