Изобретение относится к медицине, а также к генной инженерии, конкретно – к генно-клеточным везикулярным терапевтическим препаратам и способам терапии рассеянного склероза. Предназначено для лечения нейродегенеративных заболеваний, в частности, рассеянного склероза посредством трансплантации, конкретно, внутривенному введению генно-клеточного везикулярного терапевтического препарата на основе микровезикул в качестве вектора (средства) доставки в пораженные участки нервной системы человека. Может быть использовано для снижения площади очагов демиелизации в центральной нервной системе человека, для снижения количества реактивных астроцитов, являющихся маркерами прогрессирования нейрогенеративного заболевания и для снижения уровня провоспалительных цитокинов в сыворотке крови больных нейрогенеративными заболеваниями, например рассеянным склерозом и снижения в целом нейровоспаления.
Термины и определения, используемые в заявочных материалах, приведены для исключения недостоверного трактования текста заявочных материалов.
– мезенхимные стромальные клетки выделенные из жировой ткани (далее ЖМСК) - в контексте настоящего описания заявитель подразумевает под указанным термином недифференцированные стволовые клетки, выделяемые из подкожной жировой ткани.
– центральная нервная система – (далее ЦНС) - в контексте настоящего описания заявитель подразумевает ткани головного и спинного мозга.
– нейроны – клетки нервной ткани, состоящие из тела и отростков: дендритов и аксона. Клетки являются возбудимыми – могут генерировать и передавать нервный импульс в виде электрического тока, который передается по миелинизированным (покрытым миелиновой оболочкой) аксонам по перехватам Ранвье (немиелинезированным участкам между соседними олигодендроцитами).
– глия - вспомогательные клетки нервной ткани: астроциты, олигодендроциты, микроглия, эпендимоглия.
– олигодендроциты - клетки глии, поддерживающие не нейрональные клетки, функция которых – образование миелиновой оболочки вокруг аксонов нейронов – концентирических наслоений мембран олигодендроцитов, необходимой для быстрого проведения нервных импульсов по аксону, что обеспечивает нормальное функционирования ЦНС.
– астроциты – клетки глии, поддерживающие не нейрональные клетки, содержащиеся в тканях ЦНС в норме, их количество увеличивается при различных патологиях нервной системы, они переходят в активизированное состояние – становятся реактивными астроцитами.
– глиальный рубец – скопление астроцитов и других глиальных клеток (микроглиальных, NG2) вокруг демиелинезированных участков ЦНС.
– демиелинезация (очаги демиелинезации) - в контексте настоящего описания заявитель подразумевает под указанным термином области дегенерации нервной ткани, включающие не только разрушение миелиновой оболочки и гибель аксонов и олигодендроцитов, но и гибель тел самих нейронов.
– цитокины - в контексте настоящего описания заявитель подразумевает под указанным термином множество (гормоноподобных молекул), которые клетки начинают синтезировать и выделять в зоне повреждения, оказывающих воздействие на близлежащие клетки и клетки отдаленных органов, опосредуя воспаление, аутоиммунные процессы, дегенерацию либо регенерацию.
– нейротрофические факторы – в контексте настоящего описания заявитель подразумевает под указанным термином полипептиды, которые воздействуя в на различные клетки через рецепторы, участвуют в регуляции различных биологических процессов через регуляцию экспрессии генов функционально значимых белков.
– фактор роста нервов (NGF) – нейротрофический фактор, регулирующий и жизнеспособность как нейрональных, так и ненейрональных клеток, поддерживает нейрональную активность взрослых нейронов в норме, регулирует регенерацию и рост аксонов при патологиях, тормозит проявления нейроиммунологических воспалительных процессов при рассеянном склерозе.
– микровезикулы - в контексте настоящего описания заявитель использует в качестве указанного термина мембраноограниченные везикулы мультипотентных стромальных клеток, индуцированных цитохалазином В.
– трансдукция - генетическая модификация клеток при помощи вирусов (в настоящем проекте использовали лентивирус).
– иммуноблотинг метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА.
– ЭАЭ - экспериментальный аутоимунный энцефаломиелит - искусственная модель рассеянного склероза у животных.
На дату подачи настоящей заявки существует проблема того, что рассеянный склероз (РС) - в целом является неизлечимым прогрессирующим хроническим аутоиммунным демиелинизирующим заболеванием, характеризующимся множественными поражениями центральной и периферической нервной системы.
Из исследованного заявителем уровня техники выявлено, что РС - многофакторное заболевание, вызванное выраженными воспалительными, миелиновыми и аксон-дегенеративными компонентами и вовлечением клеток иммунной системы в развитие патологического процесса [Nylander, Hafler, 2012, Thompson et al., 2018] .
При этом выявлено, что мультифокальные зоны воспаления, вызванные очаговой инфильтрацией Т-лимфоцитов и макрофагов, а также гибель олигодендроцитов являются первопричинами разрушения миелиновой оболочки, что приводит к образованию бляшек в центральной нервной системе (ЦНС), состоящих из воспалительных клеток, т.е. клеток, опосредующих воспалительный процесс (нейтрофилы, макрофаги, лимфоциты) и их продуктов метаболизма, демиелинизированных и поврежденных аксонов, это сопровождается астроглиозом (пролиферацией реактивных астроцитов) как в белом, так и в сером веществе ЦНС.
Эти поражения при РС влияют на когнитивное функционирование мозга, что коррелирует с неврологическим дефицитом, выражающимся парезами конечностей, потерей двигательных функций. Эти клинические симптомы приводят к глубоким функциональным ограничениям пациента, которые влияют на повседневную работу, профессиональную деятельность и социализацию, а также могут изменять поведение или настроение, приводя к поведенческим расстройствам, таким как агрессия или импульсивность, депрессия или апатия [Oreja-Guevara et al., 2019] .
На дату представления настоящей заявки заболевание является неизлечимым, таким образом, терапия этого заболевания основана исключительно на замедлении процессов нейродегенерации и подавлении иммунной системы пациентов, с целью подавить аутоиммунные процессы – процессы, направленные на иммунный ответ против собственных клеток организма.
В соответствии с протоколами лечения, и стратегиями, направленными на минимизацию симптомов заболевания, применяют иммуномодулирующие препараты, однако эти стратегии и протоколы лечения являются малоэффективными [Ghasemi et al., 2017].
Решение указанной проблемы представляется актуальным ввиду отсутствия на дату представления настоящей заявки специфического эффективного лечения, следовательно, является актуальной задача поиска новой, более эффективной стратегии лечения РС.
Одной из стратегий поиска нового эффективного лечения РС может быть клеточная терапия или секреторные компоненты клеток
Заявителем проведен анализ существующего уровня техники по научной и патентной информации в области терапии РС. Согласно выявленным данным, клетки, синтезирующие цитокины и нейропротекторные молекулы, способствуют снижению или увеличению скорости дегенерации нейронов [Scolding et al., 2017]. Было выявлено, что мезенхимальные стволовые клетки (МСК) эффективны при лечении рассеянного склероза благодаря их иммуномодулирующим и регенеративным свойствам [Mohyeddin Bonab et al., 2013, Staff et al., 2019]. Выявлено, что цитокинов и факторов, секретируемых МСК, достаточно для стимуляции регенерации нервной ткани[Takahashi et al., 2006]. На основе этого факта была сформирована паракринная гипотеза о терапевтическом эффекте МСК [Hodgkinson et al., 2016], которая в настоящее время широко признана.
Внеклеточные везикулы (ЭВ) идентифицированы как потенциальная терапевтическая альтернатива использованию МСК [Keshtkar et al., 2018].
В дополнение к этим двум подходам выявлена идея лентивирусной трансдукции для доставки генов, необходимых для нейрогенеза, в МСК, таких как ген фактора роста нервов (NGF), чтобы получить повышенное количество этого фактора и доставить его как компонент микровезикул, секретируемых этими клетками. NGF является цитокином, который способствует биосинтезу миелина олигодендроцитами в ЦНС и шванновских клетках периферической нервной системы. Иммуномодулирующие свойства NGF и его трофические эффекты на миелин-продуцирующие клетки обеспечивают основу для использования NGF при лечении иммуноопосредованных демиелинизирующих расстройств [Razavi et al., 2015].
В связи со сложностями изучения патогенеза рассеянного склероза и разработки методов его лечения у пациентов одним из подходов к изучению патологических процессов является экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) на модели рассеянного склероза, отработанной на мышах. Принимая во внимание сходство строения нервной системы человека и млекопитающих, полученные данные возможно экстраполировать на человека в качестве основы для разработки лекарственных средств для лечения человека. С помощью этой модели все перечисленные терапевтические стратегии можно изучить и сравнить, чтобы найти лучшую и наиболее эффективную стратегию.
Согласно выявленным данным, трансплантация МСК и микровезикул, полученных из трансдуцированных МСК, может оказывать терапевтическое воздействие на патогенез и прогрессирование нейродегенеративных расстройств [Галиева и др., 2019, Риазифар и др., 2019, Шаймарданова и др., 2020], однако исследования патологических изменений в сочетании с применением микровезикул с NGF на дату подачи настоящей заявки не выявлены. Таким образом, терапевтические возможности микровезикул МСК, трансдуцированных NGF приводятся заявителем впервые.
На дату представления заявочных материалов в исследуемой области техники существует практически не разрешимая проблема по лечению нейродегенеративных заболеваний – таких как рассеянный склероз, суть которой заключается в том, что указанные болезни практически не поддаются лечению, вследствие чего в медицине используется исключительно поддерживающая терапия на уровне либо замедления развития прогрессирования заболеваний, либо поддержания состояния пациента.
Далее заявителем представлены методы, замедляющие развитие данного вида заболеваний, которые преимущественно связаны с введением иммуносупрессоров и т.д.
Заявителем проведен анализ существующего уровня техники по научной и патентной информации в области терапии нейродегенеративных заболеваний, в частности, рассеянного склероза с использованием конструкций на основе клеток МСК и терапевтических генов.
Из исследованного уровня техники выявлен аналог по принципу использования генно-везикулярной конструкции для таргетной доставки к органу-мишени, но разработанной для лечения других патологий, не связанных с нейродегенеративными заболеваниями, а именно –выявлено изобретение по патенту CN108606981A, которое относится к лечению фиброза легких путем применения свойств МСК мигрировать по хемотаксису к месту воспаления к переносу гена ЭПО (эритропоэтина). Согласно известному изобретению, МСК используются в качестве вектора, в них вводится ген ЭПО с использованием средств генной инженерии, чтобы обеспечить секрецию ЭПО в легких и локально формировать микросреду. При этом происходит секреция натуральных микровезикул (MV), несущих противовоспалительные и антифиброзные молекулы, MV проникают в клетки легких путем эндоцитоза, предотвращая или останавливая фиброз. Таким образом, МСК, несущие и экспрессирующие ЭПО, могут напрямую нацеливаться на орган мишень, кроме того, МСК стимулируют секрецию противовоспалительных и антифиброзных молекул, что повышает эффективность лечения.
Недостатком известного технического решения является невозможность лечения РС, кроме этого, изначальное введение клеток МСК, как показано, может привести к канцерогенезу и неконтролируемой дифференцировке клеток в нежелательном направлении, в том числе в фибробластном направлении, и, наоборот, усилению фиброза.
Другим недостатком известного технического решения является расчет на секрецию натуральных микровезикул МСК, выход которых чрезвычайно мал, количество образующихся под влиянием микроокружения в тканях натуральных микровезикул и соответственно количество имеющих терапевтическое значение молекул прогнозировать невозможно.
В заявленном техническом решении клетки МСК заранее «разбиты» на микровезикулы и соответственно неспособны к делению и дифференцировке в нежелательном направлении, что исключает возможности вышеприведенных осложнений, причем индуцированные цитохалазином Б микровезикулы МСК возможно получить в большом промышленно пригодном масштабе, измерить их количество, количество экспрессируемого терапевтического агента, а также легко рассчитать в определенном объеме микровезикул и определить терапевтически необходимую дозу разработанного препарата.
Из исследованного уровня техники выявлено изобретение по патенту US2014134264A1. Изобретение относится к применению микровезикул (МВ), полученных из стволовых клеток, для приготовления лекарственного средства для эндо / эпителиальной регенерации поврежденных тканей или органов и / или для ингибирования апоптоза, индуцированного цитостатическими агентами. Стволовые клетки, из которых получены микровезикулы, предпочтительно выбирают из группы, состоящей из эндотелиальных клеток-предшественников (EPC), мезенхимных стволовых клеток (МСК), предшественников почек CD133 +, стволовых клеток печени взрослого человека (HLSC) и любой их комбинации. Микровезикулы можно использовать как in vitro, так и in vivo, например, для регенерации поврежденных тканей или органов и лечения повреждения почек и печени, особенно острой почечной недостаточности (ARF) и острой печеночной недостаточности (AHF).
Недостатком известного технического решения в отношении способа получения является использование микровезикул, выход которых по известным технологиям мал, для использования в промышленном масштабе. Кроме того, используя известную технологию, невозможно точно рассчитать, какие конкретно факторы и в каком количестве будут являться необходимой терапевтической дозой.
Недостатком известного технического решения в отношении лекарственного средства заключается в отсутствии примеров лечения РС и как следствие возможности лечения РС.
Из исследованного уровня техники выявлено изобретение по патенту CN103040867A. Изобретение относится к применению микровезикул МСК в препарате для лечения травм почек и фиброза почечной ткани. В тестах in vitro, вызывающих фиброз почечных клеток с помощью TGF-β 1, исследования показывают, что в группе МВ очевидно уменьшение фиброза клеток и степени повреждения клеток. В опыте, проведенном на животной модели с односторонней окклюзией мочеточника (UUO) in vivo, показано, что при инъекции МВ степень повреждения почечной ткани достоверно снижается, а также достоверно уменьшаются почечный интерстициальный фиброз, лимфоцитарная инфильтрация и степень некроза почечных канальцев.
Недостатком известного технического решения в отношении способа является невозможность использования РС, в силу использования другого гена, направленного не на мишени, специфичные для лечения РС.
Из исследованного уровня техники выявлен ряд функциональных аналогов (по назначению), применяющихся для лечения системных аутоиммунных нейровоспалительных, нейродегенеративных заболеваний.
Так, выявлено изобретение по патенту CA3073879A. Сущностью является способ лечения фармацевтически пригодным препаратом, состоящим из внеклеточных везикул, полученных из активированных МСК. Этот препарат практически не содержит целых клеток МСК и демонстрирует противовоспалительную ингибирующую фармакологическую активность in vivo. Известный способ заключается в использования препарата для предотвращения возникновения аутоиммунных процессов посредством подавления клеток, задействованным в аутоимунном ответе организма Т-лимфоциты.
При этом внеклеточные везикулы МСК с носителем, таким как физиологический раствор, могут использоваться для ингибирования активации антигенпрезентирующих клеток, для подавления развития клеток Т-хелперов 1 (Th1) и Th17. Известный способ и препарат предложен для лечения и / или ингибирования воспалительной реакции, сопутствующей трансплантации органов, заболеваний, включающих увеит человека, диабет 1 типа, склеродермию, ревматоидный артрит, синдром Шоргрена, спондилоартриты, рассеянный склероз, системную красную волчанку, антифосфолипидный синдром, синдрома антигломерулярной базальной мембраны.
Недостатком известного технического решения является использование натуральных микровезикул, выход которых по известным технологиям мал для использования в промышленном масштабе, при этом учитывались только иммуномодулирующие свойства микровезикул МСК, тогда как в заявленном техническом решении рассматриваются не только противовоспалительные, но и нейрорегенеративные и нейропротекторные свойства МСК, усиленные за счет переноса терапевтического гена.
Из исследованного уровня техники выявлено изобретение по патенту US2018037868A, которое представляет собой генетически модифицированную мезенхиманую стволовую клетку (MSC), модифицированную экзогенной нуклеиновой кислотой, которая включает кодирующую область Klotho, функционально связанную с промотором или комбинацией промотор / энхансер. Модифицированные МСК могут использоваться для лечения рака, фиброза органов, почечной недостаточности, возрастных изменений органов или систем органов, артериосклероза и нейродегенеративных заболеваний, таких как болезнь Альцгеймера (БА), рассеянный склероз (РС), болезнь Хантингтона, Боковой амиотрофический склероз (БАС), болезнь Паркинсона и шизофрения, а также деменция, сахарный диабет, сепсис, и аутоиммунные заболевания.
Недостатком известного технического решения является то, что способ требует достаточно серьезного оперативного вмешательства, однако, принимая во внимание то, что МСК, полученные из костного мозга обладают значительным потенциалом, является неоспоримым преимуществом для регенерации ткани, т.к. они выделяют сигнальные молекулы, которые включают нейротрофические факторы, факторы роста VEGF и FGF, и цитокины. Однако получение аутологичных МСК для предотвращения реакций отторжения у реципиента требует получение клеток у пациента посредством хирургического вмешательства в костный мозг, что достаточно травматично и может привести к дополнительным осложнениям.
Из исследованного уровня техники выявлено изобретение по патенту IN2045MU2013A, которое относится к способу выделения, очистки и распространения в промышленных масштабах мезенхимных стволовых клеток полученных из жировой ткани человека (ЖМСК). Изобретение также относится к способу лечения и терапевтическому продукту для лечения сахарного диабета 1 типа, критической ишемии конечностей, рассеянного склероза, мышечной дистрофии Дюшенна, ревматоидного артрита, церебрального инсульта, диабета 2 типа, идиопатического легочного фиброза, дилатационной кардиомиопатии, и остеоартрит, включающий МСК.
Несомненным преимуществом известного изобретения является применение МСК из жировой ткани (ЖМСК), т.к. по сравнению с костномозговыми их получение не сопряжено с тяжелым хирургическим вмешательством, и клетки можно получать для каждого конкретного пациента без дополнительных осложнений а также в промышленных количествах, однако этот способ вызывает сомнение, в связи с возможным отторжением клеток не аллогенного происхождения.
Недостатком известного технического решения также является применение клеточной конструкции, в связи с возможностью клеток ЖМСК к дифференцировке в нежелательном направлении и канцерогенезу, т.е. возможностью не прогнозируемого образования опухолей.
Из исследованного уровня техники выявлено изобретение по патенту KR20140147493A Известное изобретение относится к композиции, содержащей мезенхимные стволовые клетки (МСК) и IFN-β-hBM, в которые введен ген IFN-β в качестве активного ингредиента для предотвращения или лечения рассеянного склероза или энцефаломиелита; и к способу его получения. Более конкретно, IFNβ-hBM-MSC по известному изобретению обладают иммуномодулирующими функциями по снижению цитокинаов Th1 в плазме крови и увеличения цитокинов пути Th2 в плазме крови; предотвращают демиелинизацию нервных клеток; обладают нейропротекторным действием; и подавляют воспалительную инфильтрацию или ингибируют проницаемость гематоэнцефалического барьера (ГЭБ). Следовательно, композиция может быть использована для профилактики и лечения рассеянного склероза и энцефаломиелита.
Модификация выбранным геном несомненно является преимуществом известного изобретения, однако действие IFNβ обуславливает иммуномодулирующие свойства конструкции, но не обеспечивает нейрорегенерацию. Следовательно, известная конструкция будет эффективна лишь на ранних стадиях заболевания и малоэффективна на более поздних сроках. Кроме того, использование в известном техническом решении цельных клеток также может повлечь терратогенный эффект.
Заявленное настоящее техническое решение будет решать эти проблемы, так как NGF обеспечивает не только иммуномодулирующий эффект, но и ярко выраженный нейрорегенеративный и нейропротекторный эффект, что обеспечивает комплексное терапевтическое действие. При этом использование микровезикул МСК в качестве носителя решает проблемы, связанные с применением целостных клеток (тератогенность, неконтролируемая дифференцировка).
Из исследованного уровня техники выявлено изобретение по патенту KR101455933B1, относящееся к введению мезенхимных стромальных клеток из костного мозга человека - КМ МСК (Bone marrow derived mesenchymal steem cells, BM MSCs). Основное отличие от описанных выше технических решений заключается в использовании совместного введения костномозговых МСК с препаратом миноциклином. Миноциклин улучшает клинические проявления рассеянного склероза, проявляет хорошие противовоспалительные эффекты, защищает нервную систему и при длительном применении, но при этом токсичен для ЦНС. Совместное применение миноциклина с МСК решает проблему нейротоксичности. Кроме того, когда вводятся как миноциклин, так и мезенхимные стромальные клетки из костного мозга человека КМ МСК (Bone marrow derived mesenchymal steem cells, BM MSCs), усиливаются эффекты регулирования иммунитета и контролируются воспалительные цитокины (IFN-γ, TNF-α). Напротив, противовоспалительные цитокины (IL-4, IL-10) увеличиваются. Кроме того, когда вводятся и миноциклин, и мезенхимные стромальные клетки из костного мозга человека КМ МСК (Bone marrow derived mesenchymal steem cells, BM MSCs), количество мертвых клеток заметно снижается по сравнению с индивидуальным введением.
Из исследованного уровня техники выявлено изобретение по патенту US6673606B1, сущностью является способ индуцирования к дифференцировке МСК в олигодендроциты и нейроны соответственно. Таким образом, для этих типов клеток МСК могут быть терапевтическим источником, либо in vitro, либо in vivo, в контексте лечения патологий центральной нервной системы, которые характеризуются потерей нейронов, таких как, например, болезнь Паркинсона, болезнь Альцгеймера и инсульт, а также травмы головы или дисфункция накопления ганглиозидов или демиелинизация, например, болезнь Тея-Сакса, ганглиозидоз G1, метахроматическая лейкодистрофия и рассеянный склероз.
Из исследованного уровня техники в Российской базе данных выявлено ряд технических решений по применению фактора роста нервов (NGF) в фармокологических композициях.
Так, выявлено изобретение по патенту RU 2429007 «Применение фактора роста нервов в глазных каплях для лечения патологий центральной нервной системы, таких как болезнь Альцгеймера и Паркинсона». Изобретение относится к фармакологии и медицине и представляет собой применение фактора роста нервов (NGF) для получения глазной композиции для введения на поверхность глаза для лечения и/или профилактики патологий, затрагивающих центральную нервную систему, при этом указанная глазная композиция находится в форме глазных капель и содержит от 10 до 500 мкг/мл NGF . Изобретение обеспечивает повышение уровней NGF во всех тканях мозга, включая спинномозговую жидкость, что позволяет проявить свои терапевтические способности in situ при нейродегенеративных и ишемических заболеваниях мозга, включая особенности болезней Альцгеймера и Паркинсона.
Из исследованного уровня техники выявлено изобретение по патенту RU 2126265 «Фармацевтические композиции с фактором роста нерва». Сущностью являются стабильные, водные фармацевтические композиции с фактором роста нервов (NGF) человека в водных изотонических растворах, забуференных для поддержания рН от приблизительно 4,5 до приблизительно 6,0, и необязательно включающие носитель, такой как сывороточный альбумин человека. Также предложены водные композиции с NGF, пригодные для лиофилизации и последующего восстановления, в которых rhNGF смешан с сахарами, необязательно с сывороточным альбумином человека и буфером. Композиции пригодны для применения при лечении болезни Альцгеймера и других нейронных расстройств. Предложенные составы более стабильны. Водные композиции сохраняют биоактивность более длительное время.
Таким образом, описанные выше известные технические решения имеют общий недостаток. Водная композиция с выбранным фактором в принципе должна пройти ГЭБ, однако этот факт может быть подвергнут сомнению, в силу того, что не для всех молекул с большой молекулярной массой этот барьер может быть преодолен, что не гарантирует однозначного лечебного эффекта, т.к. невозможно рассчитать объем адресной доставки препарата водной композиции NGF.
Если в RU 2429007 эта проблема решается путем введения в виде капель в камеру глаза и некоторая часть препарата, вероятно, попадет к клеткам-мишеням, то в RU 2126265 пути введения препарата, а также проблемы проникновения ГЭБ остаются неразрешимыми.
Из исследованного уровня техники выявлено изобретение по патенту RU 2732479 «Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов BDNF, VEGFA, BFGF, NGF , GDNF, NT3, CNTF, IGF1, для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-BDNF, или Escherichia coli SCS110-AF/VTvaf17-VEGFA, или Escherichia coli SCS110-AF/VTvaf17-BFGF, или Escherichia coli SCS110-AF/VTvaf17- NGF , или Escherichia coli SCS110-AF/VTvaf17-GDNF, или Escherichia coli SCS110-AF/VTvaf17-NT3, или Escherichia coli SCS110-AF/VTvaf17-CNTF, или Escherichia coli SCS110-AF/VTvaf17-IGF1, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора». Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Сущностью является генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов для повышения уровня экспрессии этого целевого гена в организме человека и животных. При этом генотерапевтический ДНК-вектор VTvaf17-BDNF, или VTvaf17-VEGFA, или VTvaf17-BFGF, или VTvaf17- NGF , или VTvaf17-GDNF, или VTvaf17-NT3, или VTvaf17-CNTF, или VTvaf17-IGF1 имеет нуклеотидную последовательность SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4, или SEQ ID №5, или SEQ ID №6, или SEQ ID №7, или SEQ ID №8 соответственно. Предложены также способ получения указанного вектора, применение вектора для повышения уровня экспрессии целевых генов, штамм Escherichia coli, несущий указанный вектор, а также способ производства в промышленных масштабах указанного вектора. Изобретение обеспечивает возможность его безопасного применения для генетической терапии человека и животных. Недостатком является не ясно описанный способ использования и каким образом он вводится в организм, т.е. нет способа его доставки к мишеням.
Из исследованного уровня техники выявлено изобретение по патенту RU 2458984 «Способ получения эмбриональных стволовых клеток млекопитающих, модифицированных геном фактора роста нервов человека». Изобретение относится к биотехнологии. Сущностью является способ получения эмбриональных стволовых клеток млекопитающих, исключая человеческие, модифицированных геном фактора роста нервов человека, включающий культивирование эмбриональных стволовых клеток в среде а-МЕМ с добавками, посев клеток на чашку, трансфекцию эмбриональных стволовых клеток векторами pMT- NGF и pcNGF и последующий отбор стабильных трансфектантов на селективной среде. Изобретение позволяет получать генетически-модифицированные эмбриональные стволовые клетки млекопитающих, продуцирующие в среду фактор роста нервов человека, что позволит использовать их для создания модели нейрональной дифференцировки клеток in vitro, а также использовать эти клетки для трансплантации в мозг экспериментальных животных и скрининга соединений на наличие нейропротекторной активности.
Недостатком является не ясно описанный способ использования и высокая вероятность онкогенеза.
Из исследованного уровня техники выявлено изобретение по патенту RU 2720002 «Биомедицинский клеточный продукт для лечения нервных болезней и психических расстройств, способ его получения и его применение». Группа изобретений относится к фармацевтической промышленности, а именно к биомедицинскому клеточному продукту (БМКП) для регенерации нервной ткани, способу его получения и применения. Биомедицинский клеточный продукт (БМКП) для регенерации нервной ткани содержит аутологичные или иммуносовместимые аллогенные очищенные мобилизованные мононуклеарные клетки (МНК) лейконцентрата (ЛК) периферической крови (ПК) человека (компонент А), содержащие гемопоэтические клетки -предшественники (ГКП) в количестве 1-2% от общего числа МНК и мезенхимные стромальные клетки -предшественники (МСКП) в количестве 1-1,5% от общего числа клеток МНК, линию аутологичных или иммуносовместимых аллогенных мезенхимальных стромальных стволовых клеток (МСК), предобработанных в биологически стабильной среде, индуцирующей их нейральную дифференцировку (компонент Б), и вспомогательное вещество в виде стерильной трансфузионной среды при следующих концентрациях клеток на 1 мл вспомогательного вещества: компонент А (МНК) - 1,75×105 - 4×106 клеток ; компонент Б (МСК) - 3×105 - 1,5×106 клеток .
По мнению заявителя, общими недостатками известных изобретения, как и всех клеточных препаратов, является риск дифференцировки в нежелательном направлении, хотя в известном изобретении учтена эта возможность и добавлена специальная среда для дифференцировки в нейтральном направлении. Вопрос о прохождении гематоэнцефалического барьера данными клетками также представляется не разрешенным, в силу чего может быть поставлено под сомнение его эффективность при использованию по назначению.
Техническим результатом заявленного технического решения является разработка генно-клеточного везикулярного терапевтического препарата и способа терапии рассеянного склероза посредством трансплантации указанного препарата, в результате чего достигается:
– снижение площади очагов демиелизации в центральной нервной системе человека,
– снижение количества реактивных астроцитов, являющихся маркерами прогрессирования рассеянного склероза,
– снижение уровня провоспалительных цитокинов в сыворотке крови больных нейрогенеративным заболеванием, в частности, рассеянным склерозом,
– снижение в целом нейровоспаления.
Сущностью заявленного технического решения является генно-клеточный везикулярный терапевтический препарат, состоящий из индуцированных цитохалазином Б микровезикул мезенхимных стромальных клеток из жировой ткани, предварительно генетически модифицированных рекомбинантным лентивирусом, содержащим нуклеотидную последовательность гена фактора роста нервов NGF. Способ терапии рассеянного склероза, заключающийся в том, что проводят трансплантацию генно-клеточного везикулярного терапевтического препарата по п.1 посредством однократного внутривенного введения.
Заявленное техническое решение иллюстрируется Фиг.1 – Фиг.13.
На Фиг.1 представлена расшифровка последовательности гена NGF.
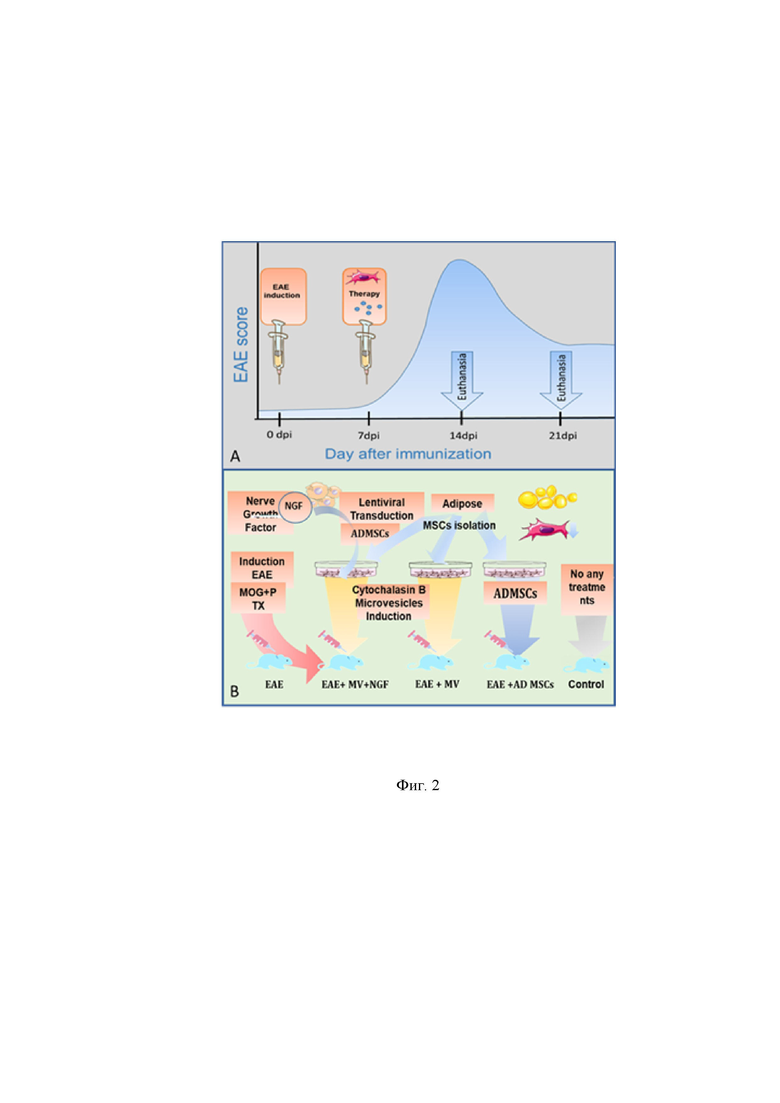
На Фиг.2 представлен временной график эксперимента и экспериментальные группы животных, где:
А: Dpi – сутки после начала эксперимента, ЕАЕ – экспериментальный аутоимунный энцефаломиелит – модель рассеянного склероза у мышей, score –течение заболевания, euthanasia – эвтаназия.
В: ЕАЕ – экспериментальный аутоимунный энцефаломиелит – модель рассеянного склероза у мышей, MV – микровезикулы, AD MSCs – мезенхимные стромальные клетки из жировой ткани (ЖМСК), NGF - фактор роста нервов, MOG – главный глипротеин олигодендроцитов, PTX – пертусис токсин, lentiviral transduction – лентивирусная трансдукция,
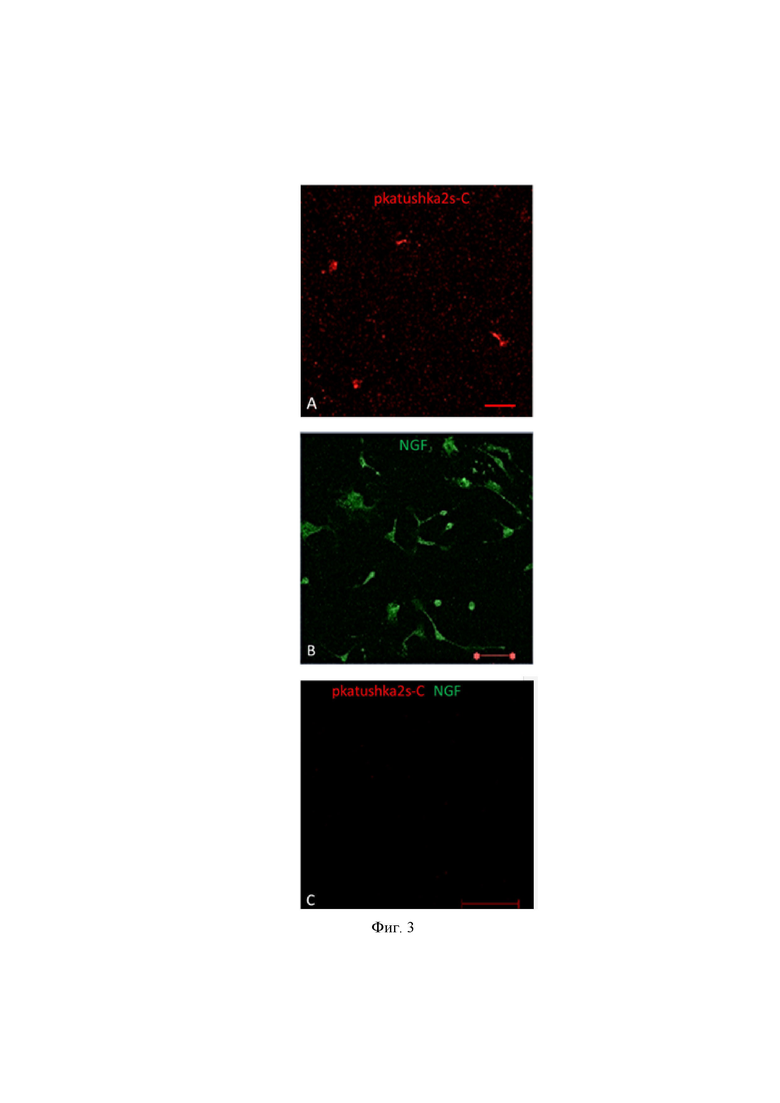
На Фиг. 3 представлены микрофотографии клеток МСК, трансдуцированных NGF (зеленое свечение), и контрольным геном Katushka2S (красное свечение), а также не трансдуцированные какими либо генами клетки (отсутствие свечения),
где А: pcatushka2S-c – плазмидная конструкция, несущая ген красного флюоресцентного белка, В: NGF – плазмидная конструкция, несущая ген фактора роста нервов, коньюгированная с зеленой флюоресцентной меткой, С – контроль.
На Фиг. 4 представлена электронограмма, показывающая внешний вид индуцированных микровезикул МСК.
На Фиг.5 представлена электронограмма, показывающая индуцированные микровезикулы, несущие NGF (иммуноцитохимическая реакция с антелами меченными наночастицами золота).
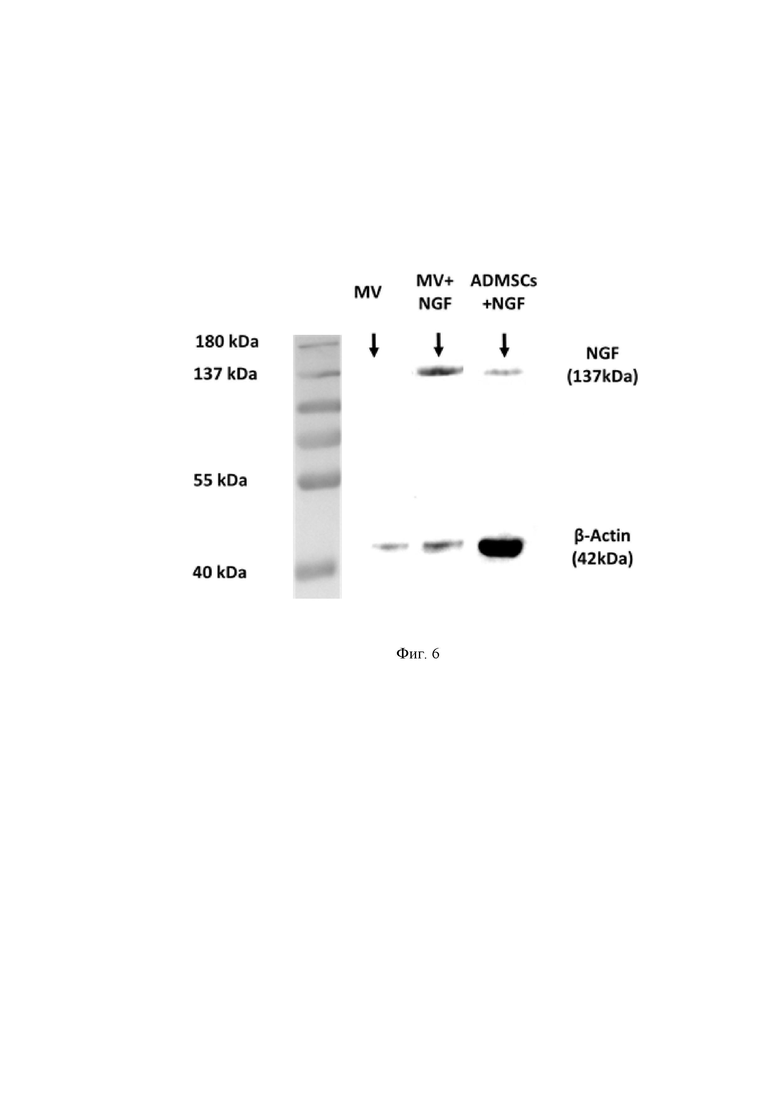
На Фиг. 6 представлен вестерн блот, показывающий наличие белка NGF в микровезикулах МСК, трансдуцированных соответствующим геном, где:
NGF - фактор роста нервов, β-Actin – маркерный белок, MV – микровезикулы, ADMSCs – мезенхимные стромальные клетки из жировой ткани (ЖМСК), kDa – килодальтон.
На Фиг. 7 представлены микрофотографии полутонких (толщиной 1 мкм) окрашенных метиленовым синим поперечных срезов спинного мозга мышей экспериментальных групп на 14 и 21 сутки после формирования экспериментальной модели рассеянного склероза, где: ЕАЕ – экспериментальный аутоимунный энцефаломиелит – модель рассеянного склероза у мышей, NGF – фактор роста нервов, MV – микровезикулы, AD MSCs – мезенхимные стромальные клетки из жировой ткани (ЖМСК), intact – интактные животные, dpi – день после начала эксперимента.
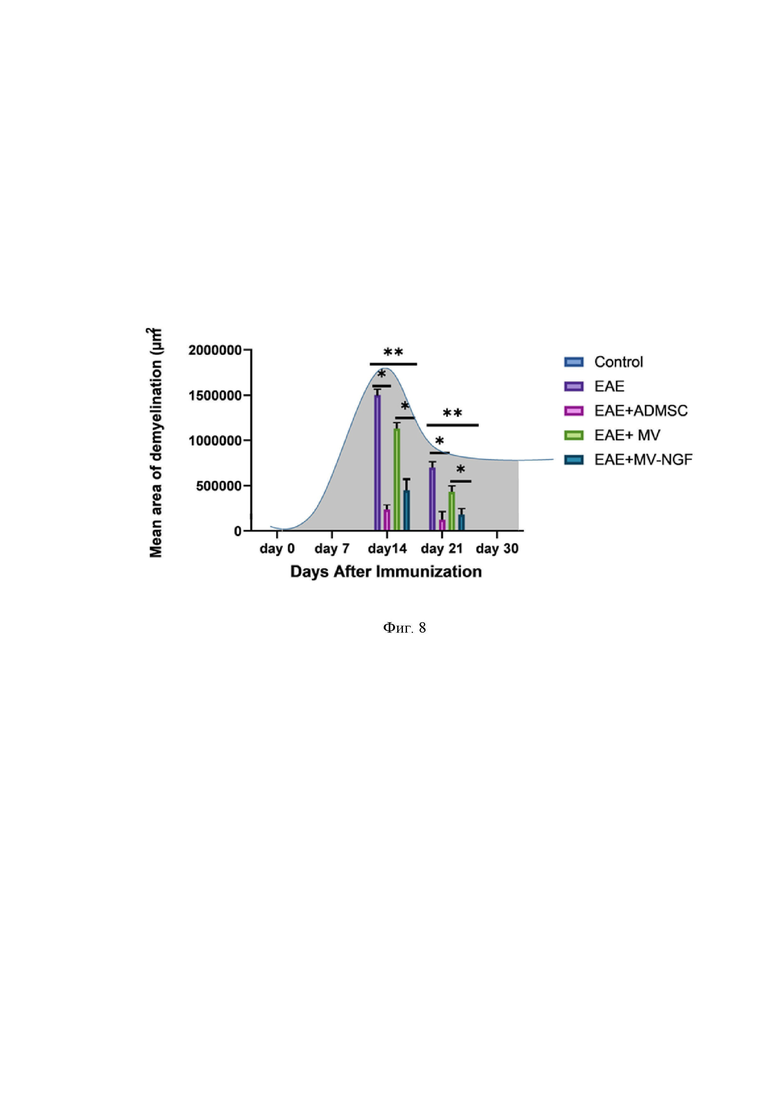
На Фиг. 8 представлена диаграмма, отражающая динамику изменения площади демиелинизации в спинном мозге мышей исследуемых групп на 14 и 21 сутки после формирования экспериментальной модели рассеянного склероза, где: ЕАЕ – экспериментальный аутоимунный энцефаломиелит – модель рассеянного склероза у мышей, NGF - фактор роста нервов, MV – микровезикулы, AD MSCs – мезенхимные стромальные клетки из жировой ткани (ЖМСК), control – контрольная группа интактных животных, main area of demyelination – средняя площадь демиелинезации, Days After Imunisation – день после иммунизации (начала эксперимента).
На Фиг. 9 представлены микрофотографии серого вещества спинного мозга мышей с моделью рассеянного склероза, показывающие наличие большого количества реактивных астроцитов (полутонкие срезы толщиной 1 μm, окрашенные метиленовым синим). Масштабный отрезок на верхней микрофотографии 200 μm, на нижней - 50 μm.
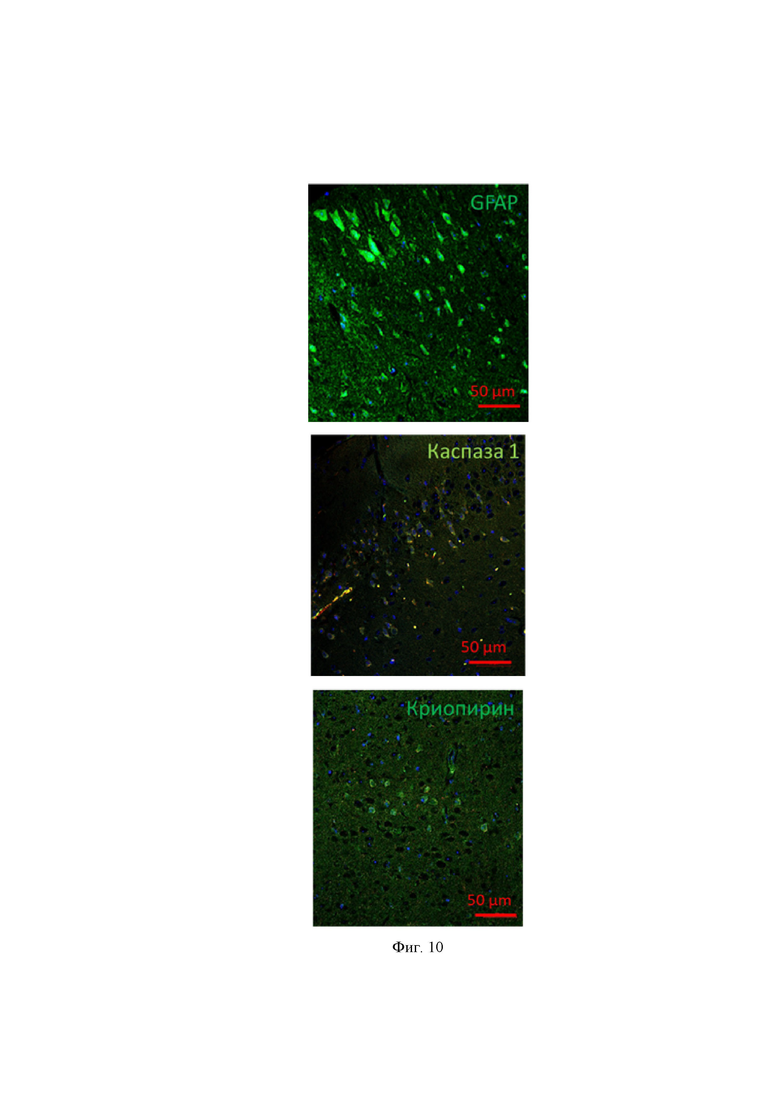
На Фиг. 10 представлены микрофотографии, показывающие положительную иммунофлюоресцентную реакцию реактивных астроцитов на маркеры астроцитов GFAP, а также маркеры воспаления Каспазу-1 и Криопирин. Флюоресцентная конфокальная микроскопия (LSM 710 Meta, Carl- Zeiss, Германия), где GFAP – кислый глиальный фибриллярный белок.
На Фиг. 11 представлена электронномикроскопическая микрофотография, показывающая ультраструктуру выявленных реактивных астроцитов. Масштабный отрезок 10 µм.
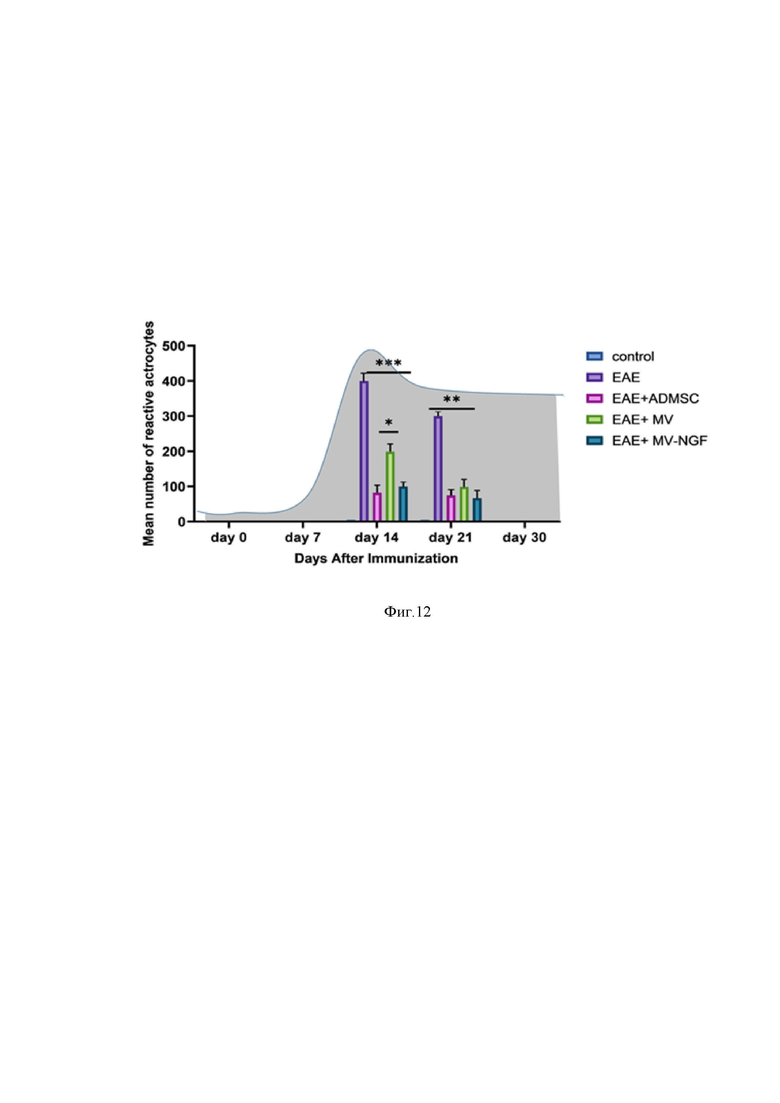
На Фиг. 12 представлена диаграмма, отражающая динамику количества реактивных астроцитов в сером веществе спинного мозга мышей всех исследуемых экспериментальных групп на 14 и 21 сутки после формирования экспериментальной модели рассеянного склероза, где:
ЕАЕ – экспериментальный аутоимунный энцефаломиелит – модель рассеянного склероза у мышей, NGF - фактор роста нервов, MV – микровезикулы, AD MSCs – мезенхимные стромальные клетки из жировой ткани (ЖМСК), control – контрольная группа интактных животных, main number of reactive astocytes – среднее количество реактивных астроцитов, Days After Imunisation – день после иммунизации (начала эксперимента).
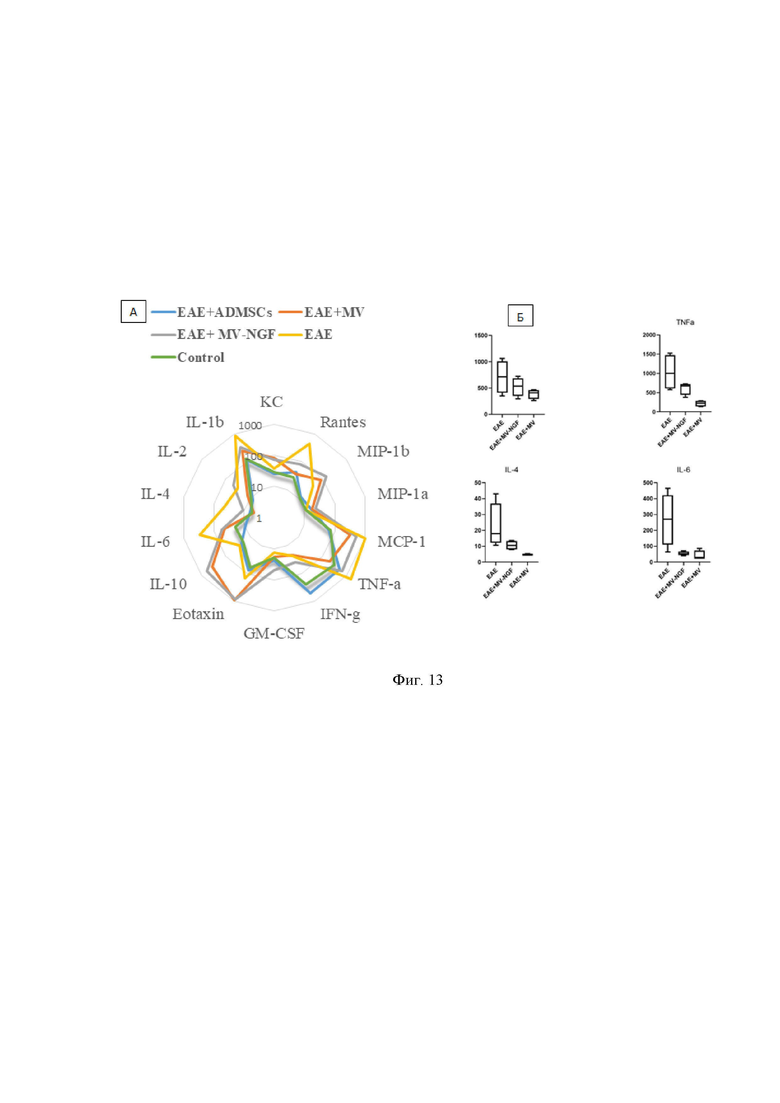
На Фиг. 13 представлена диаграмма, отражающая уровень цитокинов в сыворотке крови животных исследуемых групп на 14 и 21 сутки после формирования экспериментальной модели рассеянного склероза: А - цитокиновый профиль всех исследованных цитокинов, Б - уровень наиболее значимых цитокинов, показавших значимые различия, где: ЕАЕ – экспериментальный аутоимунный энцефаломиелит – модель рассеянного склероза у мышей, NGF - фактор роста нервов, MV – микровезикулы, AD MSCs – мезенхимные стромальные клетки из жировой ткани (ЖМСК), control – контрольная группа интактных животных, Eotaxin, GM-CSF, IFN-g, TNF-a, MCP-1, Il-10, IL-6, Il-4, IL-2, IL-1b, MIP-1a, MIP-1b, Rantes, KS – интерлейкины, опосредующие провоспалительную/притивовоспалительную реакцию.
Далее заявителем приведено описание заявленного технического решения.
Далее заявителем представлены в целом методы, использованные при выполнении экспериментальных исследований на модели животных.
Эксперименты проведены на самках мышей линии C57BL / 6 в возрасте 6 - 7 недель массой 16 - 21 г. Содержание лабораторных животных и работа с ними осуществлялись в соответствии с требованиями приказа Минздрава РФ от 23 августа 2010 г. № 708н «Об утверждении правил лабораторной практики».
Экспериментальный аутоиммунный энцефаломиелит был достигнут у животных с использованием иммунизированного пептид-индуцированного гликопротеина миелиновых олигодендроцитов (MOG35-55).
Первая группа служила отрицательным контролем (РС без лечения).
Второй группе вводили индуцированные цитохалазином В микровезикулы, полученные из 500 миллионов ЖМСК, ресуспендированных в 100 мкл на животное.
Третьей группе вводили индуцированные цитохалазином В микровезикулы ЖМСК, которые предварительно в том же количестве трансдуцировали NGF.
Четвертая группа - интактные животные, которых использовали в качестве положительного контроля.
Отбор образцов производился на 14 и 21 сутки после назначения терапии (Фиг.2). Эвтаназию животных проводили после анестезии хлоралгидратом путем декапитации.
Для создания модели рассеянного склероза 1 ампулу (100 мг) высушенной Mycobacterium tuberculosis смешивали с 10 мл неполного адъюванта Фрейнда (AФ), к которому в том же объеме добавляли MOG35-55 до 2 мг / мл в фосфатном буферном растворе (ФБС) и AФ. Эмульсию хорошо перемешивали и оставляли при температуре +4 °C. Рабочий раствор токсина коклюша (PTX, Tocris bioscience) готовили разбавлением его в фосфатном буферном растворе (ФБС) (1:20) (конечная концентрация 5 нг / мл).
100 мл эмульсии MOG + AF вводили подкожно в паховые лимфатические узлы с обеих сторон. PTX в дозе 100 мкл вводили в хвостовую вену. Через 48 часов мышам внутрибрюшинно вводили PTX в той же концентрации (Фиг. 1).
Выделение и культивирование МСК жировой ткани.
МСК выделяли из жировой ткани мыши путем инкубации с 0,2% раствором коллагеназы гепатопанкреаса краба (БиоЛот, Москва, Россия) в течение 1 часа при 37 ° C со встряхиванием при 180 об / мин по стандартному протоколу и культивировали в среде α-MEM с добавлением 10% сыворотки крови плодов коровы, 2 мМ L-глутамин и 1% смеси антибиотиков пенициллина-стрептомицина (ПанЭко, Москва, Россия).
Далее представлено описание получения рекомбинантного лентивируса.
– Клетки HEK293T высевали на 10-сантиметровую культуральную чашку в количестве 2-2,5 × 106 клеток в 10 мл полной среды DMEM.
– Клетки HEK293T культивировали до плотности монослоя клеток 70% в термостате при 37 ° C во влажной атмосфере, содержащей 5% CO2.
– Трансфекцию проводили через 2 часа после смены среды. В стерильной пробирке на 15 мл смешивали следующие компоненты: векторную плазмиду pLX-NGF-10,14 мкг; упаковочную плазмиду psPAX2-6,63 мкг; плазмиду оболочки pCMV-VSVG-3,51 мкг; стерильный MilliQ H2O - 151 мкл; 2,5 М CaCl2 - 50 мкл; 0,1 x TE (10 мМ Трис + 1 мМ ЭДТА pH 8,0) - 293 мкл. Затем по капле, держа на вортексе 15 мл пробирку со смесью, добавляли 2x HBS (0,280 М NaCl, 0,1 М Hepes, 0,0015 М Na2HPO4, pH 7,12) - 506 мкл.
– Смесь перемешивали на вортексе (вихревой смеситель или Вортекс – прибор, широко используемый в лабораториях для смешивания небольших флаконов жидкости фирмы Vortex V-1+ (Biosan, Латвия) и инкубировали при комнатной температуре в течение 20-25 минут.
– После инкубации смесь добавляли по каплям в 10 см чашку с клетками HEK293T.
– Через 6-8 часов после трансфекции среду меняли на свежую.
– Через 24 часа после трансфекции собирали супернатант, содержащий рекомбинантный лентивирус, и среду заменяли свежей.
– Вирусный супернатант собирали 3 раза каждые 12 часов. Во время сбора супернатанты хранили в холодильнике при 4 °C.
– По завершении сбора супернатанты центрифугировали в течение 5 минут при 1500 об / мин, фильтровали через фильтр с диаметром пор 0,22 мкм и использовали для концентрирования лентивирусных частиц. 30 мл полученного вируса переносили в коническую центрифужную пробирку ultra-Clear ™ объемом 33 мл (Beckman).
– Далее центрифугировали при 26000 об / мин в течение 2 часов при 4 °C с использованием ультрацентрифуги Optima ™ L-90K (Beckman).
– После центрифугирования супернатант удаляли и вирусный осадок ресуспендировали в растворе ФСБ.
– Аликвоты по 2 мл в хранили в криопробирках в низкотемпературном морозильнике при –80 °C.
Получение культуры клеток ЖМСК – NGF:
– Клетки линии ЖМСК культивировали в 6-луночном культуральном планшете до плотности монослоя клеток 50%.
– Клетки инфицировали полученным рекомбинантным лентивирусом, экспрессирующим NGF (2 лунки) и pKatushka2S (2 лунки) в качестве контроля с множественностью инфицировния (MOI) 10.
– Количество вирусного стока, добавляемого к клеткам, рассчитывали по формуле:
необходимое количество вируса TU = MOI × количество клеток.
– В зависимости от титра рекомбинантного лентивируса (5,2 × 106 TU / мл) рассчитывали объем вирусного стока (V), содержащий необходимое количество TU:
V = 500000/5200000 = 0,096 мл = 96 мкл
– После добавления рекомбинантного лентивируса (96 мкл вирусного стока в 1 мл среды DMEM) клетки инкубировали в течение 3 дней при 37 °C во влажной атмосфере, содержащей 5% CO2.
– В качестве отрицательного контроля клетки в двух лунках инкубировали в одинаковых условиях без добавления вирусных эффлюентов.
Индукция микровезикул из ЖМСК.
– Микровезикулы (МВ) получали из культуры клеток ЖМСК согласно Pick et al. с модификациями [Pick et al., 2005].
– Когда культура клеток достигает плотности монослоя 90%, культуральную среду отбирали, и культуру дважды промывали ФБС («Панеко», Россия) от остатков среды. Клетки открепляли 0,25%-ным раствором трипсин-ЭДТА (Paneco, Россия), затем клетки промывали PBS (Paneco, Россия).
– Клетки инкубировали в модифицированной среде Дульбекко DMEM без сыворотки, содержащей 10 мкг / мл цитохалазина B (Sigma-Aldrich, США), в течение 30 минут при 37 °C во влажной среде, содержащей 5% CO2, и подвергали активному перемешиванию в течение 60 секунд.
– Затем провели серию последовательных центрифугирований: 500 об / мин 10 мин, супернатант отбирали и центрифугировали при 700 об / мин 10 минут, и супернатант выбирали и центрифугировали при 4000 об / мин 25 минут на приборе LMC-3000 (Biosan) Осадок, содержащий МВ, промывали большим количеством ФБС (Paneco, Россия) и центрифугировали при 4000 об. / мин в течение 25 минут.
– Полученный осадок использовали в дальнейшем в работе.
Просвечивающая электронная микроскопия.
Для просвечивающей электронной микроскопии образцы фиксировали 2,5%-ным фосфатно-буферным раствором глутаральдегида (Merck, Kenilworth, NJ, USA) при 4 °С в течение 24 часов с последующей фиксацией в 1% OsO4 (Electron Microscopy Sciences, Hatfield, США) в течение 1 часа, после этого образцы обезвоживали в градиенте этанола и помещали в EPON (Electron Microscopy Sciences, Хатфилд, США). Ультратонкие срезы толщиной 0,1 мкм окрашивали уранилацетатом и цитратом свинца и оценивали с помощью просвечивающего электронного микроскопа (Hitachi HT7700, Tokio, Япония).
Иммуногистохимическое исследование тканей головного и спинного мозга на мышах.
Образцы фиксировали в 10% забуференном формалине, заливали парафином и делали срезы размером 6 мкм. Окрашивание гематоксилином и эозином проводили по стандартным протоколам. Флуоресцентный иммуногистохимический анализ проводили с использованием специфических антител к белкам ЕСМ, анти-каспаза1 (1: 500, sc-392736, Санта-Крус), анти-каспаза8 (1: 500, sc-70501, Санта-Крус). Ядра визуализировали с использованием раствора тригидрохлорида (hoechst 33342) (1: 1000, H3570, ThermoFisher). Результаты оценивали с помощью лазерного конфокального сканирующего микроскопа LSM 780 (Carl Zeiss, Оберкохен, Германия).
Иммуноцитохимическое окрашивание ультратонких срезов.
Для иммуноцитхимического окрашивания образцы ЖМСК, нативные индуцированные микровезикулы ЖМСК, и индуцированные микровезикулы NGF-трансдуцированных ЖМСК осаждали центрифугированием в растворе DPBS (Paneco, Russia), фиксировали в 10% забуференном формальдегиде, смешанном с 0,2% фосфатно-буферным раствором глутаральдегида (Alfa Aesar, Thermo Fisher Scientific, Германия) при 4 °С в течение 12 часов с последующей постфиксацией в 0,5% ОsO4 (Sigma-Aldrich, США) в течение 30 минут при комнатной температуре. После фиксации образцы обезвоживали в градиенте этанола и заключали в полимерную смолу LR White (Electron Microscopy Sciences, Hatfield). С помощью ультрамикротома Leica UC7 (Leica, Germany) получали ультратонкие срезы толщиной 0,1 мкм. Ультратонкие срезы монтировали на никелевые сетки, покрытые формваровой пленкой. Далее срезы блокировали TBS-NDS-BSA-TX-100 (трис-буферный раствор (Трис 0,01 M, NaCl 0,15 M pH=8,2), 10% нормальной ослиной сывороткой, бычьим сывороточным альбумином 0,2% и Triton X-100 0,1%) в течение 1 часа при комнатной температуре. После промывки в TBS срезы инкубировали в течение ночи при 4 °C с антителами против NGF (Sigma-Aldrich, N8912, 1:100), а затем, после промывки, со вторичными антителами, конъюгированными с коллоидным золотом (диаметр наночастиц золота 5 нм) (Sigma-Aldrich, США) в течение 2 часов при комнатной температуре. Далее для увеличения диаметра наночастиц и увеличения контраста срезы инкубировали в растворе Silver enhancing kit (BBI Solutions, UK) в течение 2 минут при комнатной температуре в темноте, и затем отмывали TBS (pH8,2). Срезы контрастировали уранилацетатом и цитратом свинца и оценивали с помощью просвечивающего электронного микроскопа (Hitachi HT7700, Япония).
Иммуноблотинг.
Микровезикулы для вестерн-блоттинга выделяли описанным выше способом.
Для получения общего белка (количества) микровезикулы растворяли в лизирующем буфере для радиоиммунопреципитации (RIPA) (Cell Signaling Technology) с коктейлем ингибиторов протеаз (ThermoFisher Scientific), затем инкубировали на мульти-ротаторе (Biosan) в течение 1 часа при 4 °C, гомогенизировали на приборе FastPrep-24 ™ Classic и система лизиса (MP Biomedicals) 4 м/с 20 секунд, обработка ультразвуком в ультразвуковой ванне в течение 10 минут и, наконец, центрифугирование при 15000 об / мин в течение 30 минут при 4 °C.
Концентрации общего белка измеряли с помощью набора BCA Protein Assay Kit (ThermoFisher Scientific). Двухкратный буфер для внесения образцов добавляли к каждому образцу перед инкубацией при 95 ° C в течение 5 минут. 5 мкг образца белка загружали в каждую полосу геля SDS-PAGE с градиентом 4–12%, а затем после электрофореза переносили на мембрану из PVDF (поливинилиденфторида) (Bio-Rad Laboratories). PVDF-мембрану блокировали 5% обезжиренным сухим молоком, разбавленным в PBS с Tween-20 (PBS-T) (pH 7,4) в течение 1 часа при комнатной температуре. Первичные антитела (АТ) (Sigma-Aldrich, N8912, 1:100 разбавляли и инкубировали с мембранами в течение ночи при 4 ° C.
На следующий день после промывки в PBS-T мембран инкубировали с HRP-конъюгированными видоспецифичными вторичными Abs (HRP-conjugated anti-rabbit IgG Cell Signaling (7074P2)) в течение 2 часов при комнатной температуре и визуализировали с помощью набора Clarity Western ECL Substrate kit (Bio-Rad Laboratories).
Первичные и вторичные АТ разводили в 5% обезжиренном сухом молоке в PBS-T. Анализ результатов вестерн-блоттинга с нормализацией общего белка выполняли с использованием программного обеспечения Image Lab (Bio-Rad Laboratories).
Оценка цитокинового профиля сыворотки крови мышей.
Кровь оставляли при комнатной температуре на 30 минут, после чего центрифугировали 20 минут при 2000×g.
Полученную сыворотку хранили при минус 80 °C.
Для оценки цитокинового профиля сыворотки мышей использовали набор Bio-Plex Pro Mouse Cytokine 23-plex Assay # M60-009RDPD (BioRad), который позволяет проводить одновременный мультиплексный анализ 23 цитокинов / хемокинов / мыши в 50 мкл тестовый образец (IL-1альфа, IL-1beta, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (P40), Il-12 ( P70), Il-13, Il-17A, эотаксин, G-CSF, GM-CSF, IFN-гамма, KC, MCP-1 (mcaf), MIP-1alpha, MIP-1beta, RANTES, TNF-alpha).
Статистическая обработка результатов.
Статистическую обработку полученных результатов проводили с помощью программного пакета SPSS, MS Excel. Для всех статистических данных уровень достоверности был принят менее 0,05 (P <0,05).
Эксперименты проводились в трех технических повторениях.
На Фиг. 2 отражены основные методы и группы экспериментальных животных, а также течение ЭАЭ во времени и временные точки, на которых проводили анализ показателей.
Далее заявителем приведен Пример реализации заявленного технического решения.
Пример. Способ терапии ЭАЭ – экспериментального аутоиммунного энцефаломиелита, модели РС , у лабораторных мышей.
На Фиг.2 представлен временной график эксперимента и экспериментальные группы животных, которые были использованы для доказательства эффективности применения микровезикул ЖМСК, трансдуцированных NGF, для терапии ЭАЭ – экспериментального аутоиммунного энцефаломиелита, модели РС, у лабораторных мышей.
Осуществление заявленного способа выполняется в следующей последовательности и состоит в целом из 4-х этапов:
Первый этап: выделение и культивирование культур клеток ЖМСК из жировой ткани мышей. Лентивирусная трансдукция ЖМСК геном NGF , верификация полученного продукта и получение микровезикул из этих клеток с помощью индукции цитохалазином В.
Второй этап: характеризация полученного продукта: определение размеров и ультраструктуры микровезикул методом трансмиссионной электронной микроскопии, определение содержания и количества в них белка NGF c помощью иммуноблотинга, локализацию NGF внутри везикул помощью иммуноцитохимических методов. Введение полученного продукта животным с сформированным ЭАЭ, оценка количества реактивных астроцитов и площади демиелинезации спинного мозга на разных сроках после введения.
Третий этап: введение полученного продукта животным со сформированным ЭАЭ, оценка количества реактивных астроцитов и площади демиелинезации спинного мозга на разных сроках после введения, ультраструктурный анализ тканей и клеток спинного мозга при ЭАЭ на фоне терапии микровезикулами, содержащими NGF.
Четвертый этап: мультиплексный анализ уровня цитокинов, характеризующих воспаление в сыворотке крови опытных животных.
Далее заявителем приведено более детальное описание вышеприведенных этапов.
Первый этап: Выделение и культивирование культур клеток ЖМСК из жировой ткани мышей. Лентивирусная трансдукция ЖМСК геном NGF , верификация полученного продукта и получение микровезикул из этих клеток с помощью индукции цитохалазином В.
Выполняют выделение и культивирование культур клеток МСК из жировой ткани мышей. После наркотизации животных выделяли МСК из жировой ткани мыши путем забора подкожной жировой ткани с помощью хирургических инструментов и дальнейшей инкубации с 0,2% раствором коллагеназы гепатопанкреаса краба (БиоЛот, Москва, Россия) в течение 1 часа при 37 ° C со встряхиванием при 180 об / мин по стандартному протоколу (Bunnell B.A., 2008) и культивировали в α-MEM с добавлением 10% ФБС, L-глутамин и антибиотики (все от ПанЭко, Москва, Россия).
Лентивирусная трансдукция ЖМСК геном NGF и получение микровезикул из этих клеток с помощью индукции цитохалазином В. Результаты экспериментов представлены на Фиг.1 , из которой видно, что трансдукция ЖМСК как с NGF, так и с pKatushka2S-C была успешно выполнена. Об этом можно судить по свечению ядер клеток в красном диапазоне под флуоресцентным (конфокальным) микроскопом, что указывает на локализацию плазмиды pKatushka2S внутри ядра, в то время как на контрольном фото не было никаких признаков свечения. Иммуноцитохимическое окрашивание с использованием антител к NGF также выявило позитивное окрашивание: клетки светились в зеленом диапазоне, что указывает на наличие экспрессии NGF в клетке ЖМСК и это свидетельствует об успешной трансдукции геном NGF клеток ЖМСК, что соответствует заявленному результату. Контрольные же клетки не светились, что означает, что ЖМСК в природе не способны экспрессировать NGF.
Второй этап:Характеризация полученного продукта: определение размеров и ультраструктуры микровезикул методом трансмиссионной электронной микроскопи, определение содержания и количества в них белка NGF c помощью иммуноблотинга, локализацию NGF внутри везикул помощью иммуноцитохимических методов.
Как видно из Фиг. 3, морфологический анализ индуцированных реагентом «Цитохалазином B» ЖМСК микровезикул с использованием электронной микроскопии показал, что клетки распадаются на множество мембраноограниченных структур.
Далее была охарактеризована популяция микровезикул и определены их размеры и морфологию. Таким образом было выявлено, что микровезикулы имеют двойную мембранную структуру и имеют сферическую или неправильную форму. Их диаметр колеблется в широких пределах от 50 до 200 нм. В популяции везикул часто можно найти как отдельно визуализирующиеся митохондрии, так и мультивезикулярные тела. Ядра клеток часто встречаются среди микровезикул. Однако заявленный оптимизированный метод получения микровезикул позволяет стабильно разбивать клетки на микровезикулы и полностью разрушать внешние мембраны клеток, что соответствует заявленным результатам.
Далее рассмотрена Фиг.4, на которой представлены результаты иммуноблотинга. Как видно из Фиг. 4, в полученном продукте экспрессируется белок NGF.
Чтобы определить, содержится ли белок NGF внутри полученных нами микровезикул был проведен иммуноблотинг.
Результаты иммуноблотингаа показывают, что белок NGF с молекулярной массой 130 кДа был заключен внутри индуцированных микровезикул, полученных из трансдуцированных ЖМСК, о чем мы можем судить по соответствующей специфической полосе.
Трансдуцированные NGF клетки ЖМСК также экспрессировали NGF (имеется видимая специфическая полоса на уровне 130 кДа), тогда как в контрольном образце микровезикул, полученных из нетрансдуцированных ЖМСК, не было видно какой-либо окрашенной полосы, следовательно, нативные микровезикулы не экспрессируют этот белок.
Принимая во внимание, что B-актин был обнаружен во всех образцах (в высокой концентрации в клеточном экстракте), можно сделать вывод, что микровезикулы, индуцированные цитохалазином-B, содержат NGF, что соответствует заявленному техническому результату.
Результаты иммуноцитохимического анализа представлены на Фиг. 5, из которого видно, что белок NGF локализован в цитоплазме микровезикул, о чем можно судить по наличию специфического осадка наночастиц золота диаметром 5 нм (точки черного цвета) в составе мембраноограниченных структур округлой или неправильной формы, что свидетельствует о положительной иммуноцитохимической реакции против белка NGF, с аттителами, коньюгированными с наночастицами золота, что позволяет сделать вывод о достижении заявленного технического результата.
Третий этап: Выполняют введение полученного в примере 2 продукта животным со сформированным ЭАЭ, выполняется оценка количества реактивных астроцитов и площади деемиелинезации спинного мозга на разных сроках после введения, делается ультраструктурный анализ тканей и клеток спинного мозга при ЭАЭ на фоне терапии микровезикулами, содержащими NGF.
Таким образом, после введения заявленного продукта животным с ЭАЭ в соответствии с вышеозначенными сроками (см. Фиг.7) ткань поперечных срезов спинного мозга просматривают и анализируют под световым микроскопом после окрашивания метиленовым синим, и получают микрофотографии, представленные на Фиг. 7.
Из Фиг. 7 становится очевидной разная степень сохранности тканей спинного мозга в группах с лечением и без него.
В группах ЭАЭ без лечения как на 14, так и на 21 сутки визуализируются полости, образованные в результате дегенерации и обширные очаги демиелинезации, тогда как в группах с лечением, в особенности с введением МВ, содержащих NGF, структуры спинного мозга практически остаются сохранными, очаги демиелинизации видимо уменьшаются или исчезают совсем, что является доказательством наличия положительного эффекта по заявленному техническому решению.
На Фиг. 8 продемонстрирован график, численно и статистически подтверждающий, что введение заявленного препарата значимо снижает площадь демиелинизированных участков спинного мозга у мышей с ЭАЭ, по сравнению с нелеченными животными, а также с группами животных, которым вводили нетрансдуцированные МСК или их микровезикулы.
Значительная разница (20 % к 14-м суткам и 80% к 21 суткам ) в площади демиелинизации была обнаружена между группой, получавшей только нетрансдуцированные микровезикулы на 7 день, и всеми другими группами (P <0,05). Уже к 14-м суткам при введении трансдуцированных NGF ЖМСК произошло значительное уменьшение площади деструкции 85% , к 21-м суткам - 90%.
Так, группы, которым вводили микровезикулы с NGF, показали значительное уменьшение площади демиелинизации по сравнению с группой, не получавшей терапию на 14-е и 21-е сутки после формирования ЭАЭ, на 65% и на 80% соответственно, а показатели достоверно различались на 14-й и 21-й дни лечения (P <0,05). Таким образом, заявленное техническое решение может успешно применяться для снижения очагов демиелинезации в тканях ЦНС.
Также отмечено присутствие большого количества клеток с темной цитоплазмой в областях, окружающих демиелинезированную ткань, преимущественно в группах с ЭАЭ, не получавших терапию (Фиг.7) – пролиферирующие реактивные астроциты.
Из Фиг.9 видно, что реактивные астроциты имеют гипертрофическую морфологию, характеризовавшуюся массивным увеличением сомы клеток с темным окрашиванием и пониженной плотностью отростков.
Эти реактивные астроциты присутствовали на активных краях демиелинизирующих поражений и распространялись на соседнее нормальное белое вещество, что позволяет достоверно утверждать, что они являются участниками развития рассеянного склероза, а в свою очередь снижение их количества характеризует успешность заявленной терапии.
На Фиг. 10 продемонстрирован фенотип выявленных пролиферирующих клеток. Из Фиг. 10 видно, что иммуногистохимически эти пролиферирующие клетки приобретали положительное окрашивание (т.е. приобретали зеленое свечение, окрашивались антителами на глиальный кислый фибриллярный белок – GFAP (белок промежуточных филаментов астроцитов, маркер астроцитов), маркер воспаления каспазу-1 и маркер инфламмасом и, соответственно, воспаления криопирин, меченными флюорофорами, что подтверждает их принадлежность к популяции реактивных астроцитов.
На Фиг. 10 представлена электронограмма реактивного астроцита.
Из Фиг.10 видно, что цитоплазма реактивного астроцита имеет повышенную электронную плотность, заполнена фибриллами и активной гранулярной ЭПР, что является признаком активации и повышенной экспресии белка, в том числе цитокинов, характеризуется значительным увеличением количества гранул гликогена и митохондрий, что служит морфологическим признаком активного метаболизма клеток, эти клетки показали гипертрофию и увеличенный объем, что является признаком активации и не показали признаков гибели в тканях серого вещества спинного мозга животных с ЭАЭ, не получавших терапию.
Клетки с выявленной морфологией визуализируются намного реже в ЦНС животных, получавших терапию, в особенности микровезикулы с NGF. Выявленные клетки являются важным критерием оценки успешности терапии, в том числе заявленного технического решения.
На Фиг. 11 продемонстрирован количественный анализ реактивных астроцитов в тканях спинного мозга мыши с ЭАЭ в зависимости от получаемого лечения.
Из Фиг. 11 становится очевидным, что количество астроцитов было значительно и достоверно снижено во всех группах лечения по сравнению группами животных, не получавших терапию (P <0,05). Например, на 14 день после введения микровезикул в спинной мозг количество астроцитов снизилось на 50% и на 21 день было на 70% меньше по сравнению с таковым в спинном мозге без лечения (P <0,05).
После введения нативных микровезикул к 14-м суткам количество реактивных астроцитов снизилось на 50% и к 21-м на 75%.
После введения микровезикул с NGF на 14 день количество астроцитов в спинном мозге уменьшилось на 70% и на 21-й день на 80% по сравнению с тканью спинного мозга без лечения (P < 0,05).
Однако достоверной разницы между 7-м и 14-м днями не было. Полученные результаты свидетельствуют о том, что заявленное техническое решение имеет терапевтический эффект, причем уже к 14 суткам, то есть на ранних сроках после начала лечения.
Четвертый этап: Мультиплексный анализ уровня цитокинов, характеризующих воспаление в сыворотке крови опытных животных.
На Фиг.13 представлена диаграмма содержания общего количества цитокинов в сыворотке крови изученных групп животных.
Согласно Фиг. 13 А и Фиг. 13 Б было зафиксировано значительное снижение общего количества цитокинов, которые отвечают за провоспалительный эффект, высвобождающихся во всех группах лечения по сравнению с образцами ЭАЭ без лечения.
Например TNF-α (Фиг. 13 Б) показал увеличение на 80 % у нелеченых мышей, по сравнению с интактными, концентрация резко снизилась после введения нативных микровезикул на 88% , а после введения трансдуцированных NGF микровезикул на 60 %.
При этом концентрация TNF-α после введения обоих типов микровезикул была значительно ниже, чем в группе, получавшей ЖМСК. Таким образом, сильное снижение уровней TNF-α является индикатором положительного эффекта терапии, поскольку антитела, нейтрализующие TNF-α, предотвращают ЭАЭ [Ruddle et al., 1990], это является экспериментальным доказательством достижения заявленного технического результата.
Наблюдалось изменение уровня IL-6, но в несколько меньшей степени:
увеличение при ЭАЭ на 92% по сравнению с интактными, снижение на 86% при введении нативных МВ и на 80 % при введении МВ с NGF.
IL-6 представляет собой провоспалительный цитокин, участвующий в поляризации и направлении дифференцировки Th1 / TH17, которые являются клетками, ответственными за индукцию иммунного воспалительного ответа.
Кроме того, были значительно снижены MCP-1 (на 69% в группе с введением МВ, 42% в группе введения МВ с NGF), Rantes (91% в группе с введением МВ, 82% в группе введения МВ с NGF) и IL-1b (72 в группе с введением МВ, 60% в группе введения МВ с NGF) в группах лечения микровезикулами.
Хемокины, такие как MCP-1, MIP-1a, MIP-1b, Rantes и Eotaxin, могут действовать как хемоаттрактанты, привлекая аутореактивные клетки с периферии в ЦНС и индуцируя секрецию провоспалительных цитокинов, которые способствуют окончательной демиелинизации и потере нейронов и продуцируются иммунными клетками и глией ЦНС при РС.
Как противовоспалительный цитокин, IL-4 был увеличен на 60% после введения микровезикул с NGF по сравнению с другими видами терапии, что указывает на влияние NGF не только на ремиелинизацию, но также через модуляцию клеточного каскада в EAE, направленную на Клетки Th2, подавляющие иммунную систему.
После терапии наблюдалось общее снижение уровня провоспалительных цитокинов, но было зарегистрировано умеренное повышение уровня IL-10 в группе, которой вводили МВ с NGF, которое не коррелировало с уровнями в других группах лечения (38%). IL-10 описывается как цитокин, производный от Т-хелперов / 2, ключевой противовоспалительный цитокин, который играет решающую и часто важную роль в предотвращении воспалительных и аутоиммунных патологий [Iyer, Cheng, 2012].
Следовательно, учитывая вышеописанные изменения в уровне цитокинов, заявленное техническое решение имеет также противовоспалительный терапевтический эффект при лечении РС, таким образом это является экспериментальным подтверждением противовоспалительного терапевтического эффекта, т.е. достижения поставленной цели и заявленного технического результата.
Результаты проведенных экспериментов показали на уровне экспериментальных данных достижение поставленных целей и заявленного технического результата, а именно – получено лекарственный препарат, позволяющий предотвратить развитие рассеянного склероза и обеспечить восстановление тканей ЦНС, кроме того, заявителем разработан способ терапии рассеянного склероза.
Полученные результаты имеют положительные и многообещающие эффекты и могут быть экстраполированы на другие виды млекопитающих, в том числе и человека, в силу того, что ЦНС у млекопитающих и человека имеют сходства.
Критерии, которые использовались для получения этих результатов, заключались в оценке области демиелинизации спинного и головного мозга после лечения, в дополнение к подсчету количества реактивных астроцитов в этих тканях.
Очевидно, что уменьшение площади демиелинизации является положительным результатом лечения, однако количество реактивных астроцитов все еще остается под вопросом. Выявлено уменьшение количества астроцитов после применения всех видов исследуемой терапии по сравнению с контрольными необработанными образцами.
Если вникнуть глубже в эту проблему, то из уровня техники известно, что астроглиоз является уникальной особенностью патологии ЦНС как ответ на неврологические расстройства. Модель EAE демонстрирует активацию астроцитов, включая усиление регуляции GFAP, гипертрофию и пролиферацию, прогрессирующие изменения в экспрессии генов и белков и образование рубцов [Sofroniew, 2009, Zamanian et al., 2012], сопровождаемую потерей терминальных отростков вокруг кровеносных сосудов. сосуды, потеря функции ГЭБ, а затем воспаление ЦНС и периваскулярный отек.
Это связано с повышенной инфильтрацией лейкоцитов в ЦНС. Реактивные астроциты были классифицированы в соответствии с их профилями транскриптомов как «A1» или «A2». Астроциты типа A1 индуцируются воспалением, в большом количестве при РС и секретируют нейротоксин, который еще не был идентифицирован. В отличие от астроцитов типа A2 индуцированные ишемией и экспресс-нейротрофическими факторами [Liddelow, Barres, 2017]. Астроциты A1 и A2 могут появляться на разных фазах патологического процесса и сосуществовать.
Хотя реактивные астроциты обладают общими свойствами, они также проявляют уникальные особенности, характерные для различных невропатологий [Zamanian, et al., 2012]. Кроме того, различные фенотипы астроцитов могут развиваться последовательно на разных этапах патологического процесса. Сначала они могут продуцировать провоспалительные цитокины и активные формы кислорода в сочетании с гипертрофией и пролиферацией.
Во второй фазе астроциты могут стимулируют противовоспалительные и нейрорегенеративные функции с помощью нейротрофических факторов астроцитов [Malatesta et al., 200 3]. Не существует исключительного маркера, который четко различает реактивные и нереактивные астроциты. Основным маркером астроглиоза является GFAP, который присутствует во всех популяциях астроцитов, но увеличивается при активации [?]. Астроцит, который показал положительное цитохимическое окрашивание по воспалительным маркерам, каспазе 1 и криопирину, играет ключевую роль в индукции воспаления и астроглиоза [Aras et al., 2012, Abderrazak et al., 2015]. Это коррелирует с представленным нами фактом, указывающим на положительное иммуноокрашивание к GFAP, каспазе 1 и криопирину, а также с морфологическим описанием, аналогичным литературным исследованиям реактивных астроцитов при нарушениях ЦНС. Таким образом, эти пролиферирующие астроцитарные клетки играют решающую роль в развитии рассеянного склероза. Их уменьшение и истощение после лечения может быть положительным признаком оценки рассеянного склероза. Литературные обзоры относительно роли астроцитов в развитии рассеянного склероза разделены на три области, в которых существуют противоречивые взгляды. Одна часть поддерживает точку зрения о том, что астроциты критически влияют на развитие, вызывают воспалительные и нейротоксические реакции при поражениях РС [Ponath, et al., 2018, Brosnan, Raine, 2013]. Другая часть, напротив, поддерживает точку зрения, что реактивные астроциты участвуют в уменьшении воспаления и вносят свой вклад в нейропротекцию и восстановление повреждений [Xie et al., 2020]. Однако существует гораздо больше взглядов, которые поддерживают двойную защитную и дегенеративную роль астроцитов [Nair et al., 2008, Ohtake et al., 2016].
Статистический анализ количества астроцитов показал, насколько значительно уменьшилось количество этих клеток после введения различных видов терапии. Это открытие подтверждается работой Поната [Ponath, et al., 2017], который показал, что астроциты на переднем крае активно демиелинизирующих очагов РС содержат фрагменты миелина. Он показал, что поглощение миелина индуцирует передачу сигналов астроглиального фактора NF-KB и хемокины, рекрутирующие секрецию клеток. Таким образом, мы предположили, что поглощение поврежденного миелина астроцитами может быть ранним триггером их активации. В литературе обсуждается роль астроцитов в предотвращении миграции и созревания клеток-предшественников олигодендроцитов. Чтобы гарантировать успешную ремиелинизацию, олигодендроциты должны мигрировать из субвентрикулярных зон в зоны демиелинизации. Исследования in vitro показывают, что миграция олигодендроцитов и шванновских клеток ингибируется астроцитами [Wilby et al., 1999], поскольку олигодендроциты не способны мигрировать на большие расстояния через паренхиму ЦНС, богатую астроцитами [Franklin et al., 1997].
Эффект нативных микровезикул МСК на модели EAE уже изучен Фернандо Ласо-Гарсия, однако трансдукция МСК с помощью NGF делает это исследование уникальным и первым в своем роде в отношении исследований лечения нейродегенерации.
Титрование цитокинов подтвердило результаты гистологического анализа, поскольку сильное снижение TNF-α может быть индикатором положительного эффекта терапии, поскольку нейтрализующие TNF-α антитела предотвращают EAE [Ruddle et al., 1990]. то же самое для IL-6, который представляет собой провоспалительный цитокин, участвующий в поляризации в направлении дифференцировки TH1 / TH17, которые являются клетками, ответственными за индукцию иммунного воспалительного ответа. Хемокины, такие как MCP-1, MIP-1a, MIP-1b, Rantes и Eotaxin, могут действовать как хемоаттрактант, привлекая аутореактивные клетки с периферии к центральной нервной системе и индуцируя секрецию провоспалительных цитокинов, которые способствуют окончательной демиелинизации. и потеря нейронов [Tejera-Alhambra et al., 2015] и продуцируются иммунными клетками и глиями ЦНС при РС. Как противовоспалительный цитокин, повышенный уровень IL-4 указывает на влияние NGF не только на ремиелинизацию, но также через модуляцию клеточного каскада в EAE, нацеленного на клетки Th2, которые подавляют иммунную систему. Хотя после терапии наблюдалось общее снижение уровней провоспалительных цитокинов, были получены некоторые неожиданные результаты, которые потребовали дальнейшего обсуждения для понимания.
В группе NGF наблюдалось умеренное повышение уровня IL-10, которое не коррелировало с уровнями в других группах лечения. IL-10 описывается как цитокин, производный от Т-хелпера / 2, мощный противовоспалительный цитокин, который играет решающую и часто важную роль в предотвращении воспалительных и аутоиммунных патологий [Iyer, Cheng, 2012]. Ранее было показано, что астроциты являются основным источником ИЛ-10 при поражениях РС [Nair, et al., 2008], и, согласно Ransohoff, секреция опосредуется действием NGF на астроциты. Автор пришел к выводу, что высокая экспрессия IL-10 паренхимными астроцитами была напрямую вызвана NGF [Ransohoff, Trebst, 2000].
Это может объяснить уникальное увеличение уровней IL-10 в группе, получавшей NGF, по сравнению с нативными микровезикулами, что открывает новые многообещающие эффекты доставки NGF через микровезикулы.
Нейропротекторная активность NGF в олигодендроцитах и нейронах вместе с его иммуномодулирующим действием делают этот белок привлекательным кандидатом для лечения РС. Доставка этого белка в виде закрытых микровезикул делает его еще более надежным и многообещающим, потому что, к сожалению, терапевтическое применение рекомбинантного NGF у людей невозможно из-за неспособности этого белка пересекать ГЭБ. Кроме того, при системном введении NGF вызывает серьезные побочные эффекты из-за своих плейотропных свойств. Трудности, возникающие при клиническом применении терапии NGF, открыли путь для изучения других возможных механизмов доставки NGF в мозг и разработки новых терапевтических стратегий для преодоления ограничений, накладываемых прямым применением NGF.
Таким образом, из описанного выше можно сделать вывод, что заявителем достигнут заявленный технический результат, а именно: разработан генно-клеточный везикулярный терапевтический препарат и способ терапии рассеянного склероза посредством трансплантации указанного препарата, в результате чего достигнуто:
– снижение площади очагов демиелизации в центральной нервной системе человека,
– снижение количества реактивных астроцитов, являющихся маркерами прогрессирования рассеянного склероза,
– снижение уровня провоспалительных цитокинов в сыворотке крови больных нейрогенеративным заболеванием, в частности, рассеянным склерозом,
– снижение в целом нейровоспаления.
Заявленное техническое решение соответствует условию патентоспособности «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, характеризующиеся указанными признаками, приводящими к реализации заявленных технических результатов заявленного технического решения, которыми является применение индуцированных микровезикул МСК трансдуцированных геном NGF для лечения нейродегенеративных демиелинезирующих нейровоспалительных заболеваний, в частности, рассеянного склероза.
Заявленное техническое решение удовлетворяет условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники заявителем не выявлены технические решения, характеризующиеся применением индуцированных микровезикул МСК, трансдуцированных NGF для лечения нейродегенеративных заболеваний, в частности, рассеянного склероза.
Заявленное техническое решение соответствует условию патентоспособности «промышленная применимость» предъявляемому к изобретениям, т.к. заявленное применение известного микровезикул может быть осуществлено из известных отечественных компонентов с применением стандартного оборудования и известных приемов, и может найти применение в области медицины в качестве лекарственного средства для лечения нейродегенеративных заболеваний, в частности рассеянного склероза.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ терапии бокового амиотрофического склероза | 2023 |
|
RU2804196C1 |
| ПРИМЕНЕНИЕ 5'-МЕТИЛТИОАДЕНОЗИНА (МТА) ДЛЯ ПРЕДОТВРАЩЕНИЯ И/ИЛИ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ И/ИЛИ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА | 2005 |
|
RU2393866C2 |
| НОВОЕ ЛЕЧЕНИЕ РАССЕЯННОГО СКЛЕРОЗА ( РС ) | 2011 |
|
RU2595861C2 |
| ПРИМЕНЕНИЕ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, И ИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ) | 2017 |
|
RU2742828C2 |
| Препарат для лечения метахроматической лейкодистрофии и способ ее лечения | 2021 |
|
RU2769577C1 |
| СПОСОБЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИЗДЕЛИЯ ДЛЯ ВВЕДЕНИЯ ТЕРАПЕВТИЧЕСКИХ КЛЕТОК В ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ ЖИВОТНОГО | 2008 |
|
RU2468818C2 |
| ПРЕПАРАТ СТВОЛОВЫХ КЛЕТОК С РЕПРОГРАММИРОВАННЫМ КЛЕТОЧНЫМ СИГНАЛИНГОМ, СПОСОБ ПОЛУЧЕНИЯ ЭТОГО ПРЕПАРАТА И ЕГО ПРИМЕНЕНИЕ | 2008 |
|
RU2428475C2 |
| СПЕЦИФИЧЕСКИЕ АНТИТЕЛА К АЛЬФА-ЕНОЛАЗЕ И СПОСОБ ПРИМЕНЕНИЯ ПРИ ИММУННЫХ ЗАБОЛЕВАНИЯХ | 2014 |
|
RU2707812C1 |
| ПРИМЕНЕНИЕ ПРОГРАММЫ ПРОТИВОПОЛОЖНОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК (ППДК) ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРИРОВАВШИХ ОРГАНОВ В ПАТОЛОГИЧЕСКОМ СОСТОЯНИИ | 2008 |
|
RU2528084C2 |
| ВЫДЕЛЕНИЕ И ИДЕНТИФИКАЦИЯ Т-КЛЕТОК | 2003 |
|
RU2327487C2 |






Настоящее изобретение относится к генетической инженерии и медицине, в частности к генно-клеточному везикулярному терапевтическому препарату для терапии рассеянного склероза и способу терапии рассеянного склероза путём трансплантации указанного препарата посредством однократного внутривенного введения. Препарат согласно изобретению состоит из индуцированных цитохалазином Б микровезикул мезенхимных стромальных клеток из жировой ткани, предварительно генетически модифицированных рекомбинантным лентивирусом, содержащим нуклеотидную последовательность гена фактора роста нервов NGF. Настоящее изобретение позволяет снизить площадь очагов демиелизации в центральной нервной системе человека, количество реактивных астроцитов, уровень провоспалительных цитокинов в сыворотке крови больных нейрогенеративными заболеваниями и снизить нейровоспаления в целом. 2 н.п. ф-лы, 13 ил., 1 пр.
1. Генно-клеточный везикулярный терапевтический препарат для терапии рассеянного склероза, состоящий из индуцированных цитохалазином Б микровезикул мезенхимных стромальных клеток из жировой ткани, предварительно генетически модифицированных рекомбинантным лентивирусом, содержащим нуклеотидную последовательность гена фактора роста нервов NGF.
2. Способ терапии рассеянного склероза, заключающийся в том, что проводят трансплантацию генно-клеточного везикулярного терапевтического препарата по п.1 посредством однократного внутривенного введения.
| ГОМЗИКОВА М.О | |||
| и др., Исследование свойств мембранных везикул, полученных с помощью цитохалазина В из клеток человека НЕК293, Гены & клетки, Том X, No | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| КОДОН-ОПТИМИЗИРОВАННАЯ РЕКОМБИНАНТНАЯ ПЛАЗМИДА, СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕРИФЕРИЧЕСКОГО НЕРВА, СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕННОГО НЕРВА ЧЕЛОВЕКА | 2014 |
|
RU2558294C1 |
| GUGLIANDOLO A | |||
| et al., Mesenchymal stem cells in multiple sclerosis: recent evidence from pre-clinical to clinical studies, Int | |||
| J | |||
| Mol | |||
| Sci., 2020, 21, | |||
Авторы
Даты
2021-12-23—Публикация
2021-04-08—Подача