Родственные заявки
Настоящая заявка является частичным продолжением заявки на выдачу патента США №13/835613, поданной 15 марта 2013, а также притязает на приоритет на основании предварительной заявки на выдачу патента США №61/622288, поданной 10 апреля 2012. Полное содержание каждой из вышеупомянутых заявок включено в настоящее описание в полном объеме.
Область техники, к которой относится изобретение
Изобретение относится к специфичному ингибированию экспрессии гена ALAS1.
Уровень техники
Наследственные порфирии представляют собой семейство расстройств, возникающих в результате недостаточной активности специфичных ферментов в пути биосинтеза гема, также называемого в настоящем описании путем порфиринов. Недостаточность ферментов пути порфиринов приводит к недостаточной продукции гема и к накоплению предшественников порфирина и порфиринов, которые являются токсичными для ткани в высоких концентрациях.
Среди наследственных порфирий острую интермиттирующую порфирию (AIP, например, аутосомно-доминантную AIP), смешанную порфирию (VP, например, аутосомно-доминантную VP), наследственную копропорфирию (копропорфирию или HCP, например, аутосомно-доминантную HCP) и порфирию вследствие недостаточности дегидратазы 5'-аминолевулиновой кислоты (также известной как δ-аминолевулиновая кислота или ALA) (ADP, например, аутосомно-доминантную ADP) классифицируют как острые печеночные порфирии, и они проявляются острыми неврологическими приступами, которые могут угрожать жизни. Острые приступы характеризуются симптомами автономной, периферической и центральной нервной систем, включая тяжелую боль в области живота, гипертонию, тахикардии, запор, моторную слабость, паралич и судороги. В отсутствие правильного лечения может наступить квадриплегия, нарушение функции дыхания и смерть. Различные факторы, включая индуцирующие цитохром P450 лекарственные средства, диета и гормональные изменения, могут провоцировать острые приступы за счет повышения активности печеночной синтазы 5'-аминолевулиновой кислоты 1 (ALAS1), первого и лимитирующего скорость фермента пути биосинтеза гема. При острых порфириях, например, AIP, VP, HCP и ADP, недостаточности соответствующих ферментов приводят к продукции и накоплению в печени одного или нескольких веществ (например, порфиринов и/или предшественников порфиринов, например, ALA и/или PBG), которые могут быть нейротоксичными и могут приводить к возникновению острых приступов. См., например, Balwani M. and Desnick, R.J., Blood, 120: 4496-4504, 2012.
Современная терапия острых неврологических приступов заключается во внутривенном введении гемина (пангематин®, Lundbeck или нормосанг®, Orphan Europe), который обеспечивает экзогенный гем для ингибирования ALAS1 по принципу отрицательной обратной связи, и тем самым снижает продукцию ALA и PBG. Гемин применяют для лечения во время острого приступа и для профилактики приступов, в частности, у женщин с острыми порфириями, которые страдают от частых атак, с гормональными изменениями во время их менструальных циклов. Хотя пациенты обычно хорошо реагируют, его эффект является медленным, обычно занимающим от двух до четырех дней или дольше для нормализации концентраций ALA и PBG в моче до нормальных уровней. Так как внутривенно вводимый гемин быстро метаболизируется, обычно требуется от трех до четырех инфузий для эффективного лечения или профилактики острого приступа. Кроме того, многократные инфузии могут вызывать перенасыщение железом и флебит, который может нарушать доступ к периферическим венам. Хотя для лечения используют ортотропную трансплантацию печени, такая процедура связана со значительной заболеваемостью и смертностью и наличие доноров печени ограничено. Таким образом, необходим альтернативный терапевтический способ, который является более эффективным, быстродействующим и безопасным. Было бы особенно предпочтительно, чтобы такое лечение могло быть осуществлено путем подкожного введения, так как это могло бы исключить необходимость в инфузиях и длительной госпитализации.
AIP, также называемая недостаточностью дезаминазы порфобилиногена (PBGD) или недостаточностью синтазы гидроксиметилбилана (HMBS), является наиболее распространенной из острых печеночных порфирий. Она является аутосомно-доминантным расстройством, вызванным мутациями в гене HMBS, которые приводят к пониженной активности, например, активности, пониженной наполовину по сравнению с нормальной активностью фермента. Ранее с использованием гомологичной рекомбинации была создана мышиная модель AIP, в которой выявлено ~30% от активности HMBS дикого типа. Подобно больным людям у таких мышей повышена активность ALAS1 печени и накапливаются большие количества ALA и PBG в плазме и моче при введении порфириногенных лекарственных средств, таких как фенобарбитал. Таким образом, такие мыши служат в качестве прекрасной модели для оценки эффективности новых терапевтических средств для лечения острых печеночных порфирий.
Сущность изобретения
В настоящем изобретении описаны способы и композиции и-РНК для модулирования экспрессии гена ALAS1. В некоторых вариантах экспрессию гена ALAS1 снижают или ингибируют, используя ALAS1-специфичную и-РНК. Такое ингибирование может быть полезным для лечения расстройств, связанных с экспрессией ALAS1 экспрессия, таких как порфирии.
Соответственно, в настоящей публикации описаны композиции и способы, которые вызывают опосредованное РНК-индуцируемым комплексом сайленсинга (RISC) расщепление РНК-транскриптов гена ALAS1, например, в клетке или у субъекта (например, у млекопитающего, такого как человек). Также описаны композиции и способы лечения расстройства, связанного с экспрессией гена ALAS1, такого как порфирия, например, X-сцепленная сидеробластная анемия (XLSA), порфирия вследствие недостаточности ALA-дегидратазы (ночная порфирия или ADP), острая интермиттирующая порфирия (AIP), врожденная эритропоэтическая порфирия (CEP), поздняя кожная порфирия (PCT), наследственная копропорфирия (копропорфирия или HCP), смешанная порфирия (VP), эритропоэтическая протопорфирия (EPP) или временная эритропорфирия новорожденных. В некоторых вариантах расстройство представляет собой острую печеночную порфирию, например, порфирию вследствие недостаточности ALA-дегидратазы (ADP), AIP, HCP или VP. В некоторых вариантах расстройство представляет собой порфирию вследствие недостаточности ALA-дегидратазы (ADP) или AIP.
В некоторых вариантах порфирия представляет собой печеночную порфирию, например, порфирию, выбранную из острой интермиттирующей порфирии (AIP), наследственной копропорфирии (HCP), смешанной порфирии (VP), порфирии вследствие недостаточности ALA-дегидратазы (ADP) и гепатоэритропоэтической порфирии. В некоторых вариантах порфирия представляет собой гомозиготную доминантную печеночную порфирию (например, гомозиготную доминантную AIP, HCP или VP) или гепатоэритропоэтическую порфирию. В некоторых вариантах порфирия представляет собой двойную порфирию.
В используемом в настоящем описании смысле термин «и-РНК», «РНК-и», «и-РНК-средство» или «РНК-и-средство» относится к средству, которое содержит РНК, которая определена в настоящем описании и которая опосредует целенаправленное расщепление РНК-транскрипта, например, посредством пути РНК-индуцируемого комплекса сайленсинга (RISC). В одном варианте и-РНК, которая описана в настоящей публикации, осуществляет ингибирование экспрессии ALAS1 в клетке или в организме млекопитающего.
И-РНК, входящие в состав композиций, охарактеризованных в настоящем описании, охватывают днРНК, имеющие нить РНК (антисмысловую нить), имеющую область, например, область длиной 30 нуклеотидов или меньше, обычно 19-24 нуклеотида, которая в значительной степени комплементарна, по меньшей мере, части транскрипта мРНК гена ALAS1 (например, гена ALAS1 мыши или человека) (также называемую в настоящем описании «ALAS1-специфичной и-РНК»). Альтернативно или вместе с тем, и-РНК охватывают днРНК, имеющие нить РНК (антисмысловую нить), имеющую область, которая имеет длину 30 нуклеотидов или меньше, обычно 19-24 нуклеотида, которая значительной степени комплементарна, по меньшей мере, части транскрипта мРНК гена ALAS1 (например, гена ALAS1 варианта 1 или 2 человека) (также называемую в настоящем описании «ALAS1- специфичной и-РНК»).
В некоторых вариантах и-РНК (например, днРНК), описанная в настоящей публикации, содержит антисмысловую нить, имеющую область, которая в значительной степени комплементарна области ALAS1 человека. В некоторых вариантах ALAS1 человека имеет последовательность NM_000688.4 (SEQ ID NO: 1) или NM_000688.5 (SEQ ID NO: 382).
В других вариантах и-РНК охватывает днРНК, имеющую нить РНК (антисмысловую нить), имеющую область, которая в значительной степени комплементарна части мРНК ALAS1 согласно любой из таблиц 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20. В одном варианте и-РНК охватывает днРНК, имеющую нить РНК (антисмысловую нить), имеющую область, которая в значительной степени комплементарна части мРНК ALAS1, например, мРНК ALAS1 человека (например, мРНК ALAS1 человека, которая представлена в SEQ ID NO: 1 или SEQ ID NO: 382).
В одном варианте и-РНК для ингибирования экспрессии гена ALAS1 включает в себя, по меньшей мер, две последовательности, которые комплементарны друг другу. и-РНК включает в себя смысловую нить, имеющую первую последовательность, и антисмысловую нить, имеющую вторую последовательность. Антисмысловая нить содержит нуклеотидную последовательность, которая в значительной степени комплементарна, по меньшей мере, части мРНК, кодирующей транскрипт ALAS1, и область комплементарности имеет длину 30 нуклеотидов или меньше, и по меньшей мере, 15 нуклеотидов. Обычно и-РНК имеет длину 19-24 нуклеотида.
В некоторых вариантах и-РНК имеет длину 19-21 нуклеотид. В некоторых вариантах и-РНК имеет длину 19-21 нуклеотид и входит в состав липидного препарата, например, препарата в виде липидных наночастиц (LNP) (например, препарата LNP11).
В некоторых вариантах и-РНК имеет длину 21-23 нуклеотида. В некоторых вариантах и-РНК имеет длину 21-23 нуклеотида и находится в форме конъюгата, например, конъюгирована с одним или несколькими производными GalNAc, которые описаны в настоящей публикации.
В некоторых вариантах и-РНК имеет длину примерно от 15 до примерно 25 нуклеотидов, и в других вариантах и-РНК имеет длину примерно от 25 до примерно 30 нуклеотидов. и-РНК, мишенью которой является ALAS1, при контакте с клеткой, экспрессирующей ALAS1, ингибирует экспрессию гена ALAS1, по меньшей мере, на 10%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35% или, по меньшей мере, на 40% или больше, так как в анализе способом, который описан в настоящей публикации. В одном варианте и-РНК, мишенью которой является ALAS1, приготовлена в виде стабильной частицы, состоящей из нуклеиновой кислоты и липида (SNALP).
В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, содержит первую последовательность днРНК, которая выбрана из группы, состоящей из смысловых последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14 и 15, и вторую последовательность, которая выбрана из группы, состоящей из соответствующих антисмысловых последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14 и 15.
В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, содержит первую последовательность днРНК, которая выбрана из группы, состоящей из смысловых последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20, и вторую последовательность, которая выбрана из группы, состоящей из соответствующих антисмысловых последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20. В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, имеет смысловые и/или антисмысловые последовательности, выбранные из последовательностей AD-58882, AD-58878, AD-58886, AD-58877, AD-59115, AD-58856, AD-59129, AD-59124, AD-58874, AD-59125, AD-59105, AD-59120, AD-59122, AD-59106, AD-59126 и AD-59107, которые раскрыты в настоящем описании в примерах. В некоторых вариантах и-РНК (например, днРНК) имеет смысловые и/или антисмысловые последовательности, выбранные из последовательностей AD-58882, AD-58878, AD-58886, AD-58877, AD-59115, AD-58856 и AD-59129.
Молекулы и-РНК, охарактеризованные в настоящем описании, могут содержать встречающиеся в природе нуклеотиды или могут содержать, по меньшей мере, один модифицированный нуклеотид, включая без ограничения модифицированный 2'-O-метилом нуклеотид, нуклеотид, имеющий 5'-фосфоротиоатную группу, и концевой нуклеотид, связанный с холестериловым производным. Альтернативно модифицированный нуклеотид может быть выбран из группы, состоящей из: 2'-дезокси-2'-фтор-модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, закрытого нуклеотида, лишенного основания нуклеотида, 2'-амино-модифицированного нуклеотида, 2'-алкил-модифицированного нуклеотида, морфолинонуклеотида, содержащего фосфорамидат и неприродное основание нуклеотида. Такая модифицированная последовательность может быть основана, например, на первой последовательности указанной и-РНК, выбранной из группы, состоящей из смысловых последовательностей, указанных в таблице 2, и второй последовательности, выбранной из группы, состоящей из соответствующих антисмысловых последовательностей, указанных в таблице 2.
В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, содержит смысловую нить, содержащую последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 330, SEQ ID NO: 334, SEQ ID NO: 342, SEQ ID NO: 344, SEQ ID NO: 346, SEQ ID NO: 356, SEQ ID NO: 358, SEQ ID NO: 362, SEQ ID NO: 366, SEQ ID NO: 376 и SEQ ID NO: 380.
В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, содержит антисмысловую нить, содержащую последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 331, SEQ ID NO: 335, SEQ ID NO: 343, SEQ ID NO: 345, SEQ ID NO: 347, SEQ ID NO: 357, SEQ ID NO: 359, SEQ ID NO: 363, SEQ ID NO: 367, SEQ ID NO: 377 и SEQ ID NO: 381.
В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, содержит смысловую нить, содержащую последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 140, SEQ ID NO: 144, SEQ ID NO: 152, SEQ ID NO: 154, SEQ ID NO: 156, SEQ ID NO: 166, SEQ ID NO: 168, SEQ ID NO: 172, SEQ ID NO: 176, SEQ ID NO: 186 и SEQ ID NO: 190. В одном варианте и-РНК (например, днРНК), охарактеризованная в настоящем описании, содержит антисмысловую нить, содержащую последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 141, SEQ ID NO: 145, SEQ ID NO: 153, SEQ ID NO: 155, SEQ ID NO: 157, SEQ ID NO: 167, SEQ ID NO: 169, SEQ ID NO: 173, SEQ ID NO: 177, SEQ ID NO: 187 и SEQ ID NO: 191.
В одном варианте мишенью и-РНК, которая описана в настоящей публикации, является вариант РНК-транскрипта ALAS1 дикого типа, и в другом варианте мишенью и-РНК является мутантный транскрипт (например, РНК ALAS1, несущая аллельный вариант). Например, мишенью и-РНК, охарактеризованной в изобретении, может быть полиморфный вариант, такой как вариант, возникший вследствие однонуклеотидного полиморфизма (SNP) ALAS1. В другом варианте мишенью и-РНК является как транскрипт дикого типа, так мутантный транскрипт ALAS1. В следующем варианте мишенью и-РНК является конкретный вариант транскрипта ALAS1 (например, вариант 1 ALAS1 человека). В следующем варианте мишенью и-РНК-средства являются множественные варианты транскриптов (например, как вариант 1, так и вариант 2 ALAS1 человека).
В одном варианте мишенью и-РНК, охарактеризованной в изобретении, является некодирующая область РНК-транскрипта ALAS1, такая как 5'- или 3'-нетранслируемая область транскрипта.
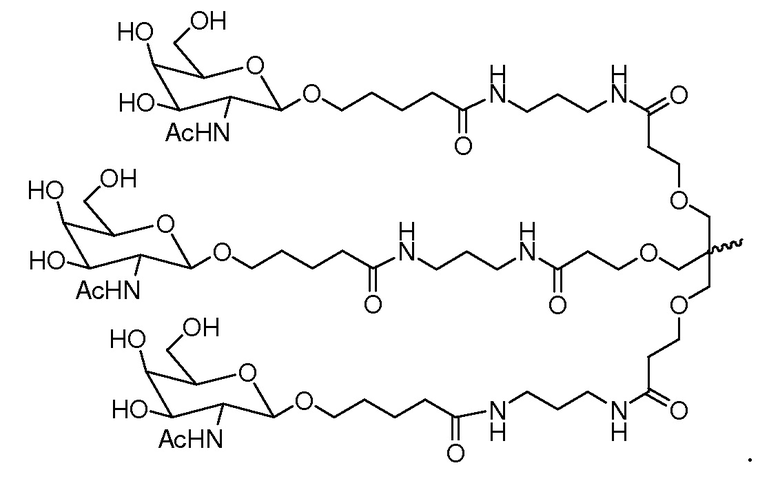
В некоторых вариантах и-РНК, которая описана в настоящей публикации, имеет форму конъюгата, например, конъюгата с углеводом, который может служить в качестве направляющего к мишени остатка и/или лиганда, который описан в настоящей публикации. В одном варианте конъюгат связан с 3'-концом смысловой нити днРНК. В некоторых вариантах конъюгат связан через линкер, например, через бивалентный или трехвалентный разветвленный линкер.
В некоторых вариантах конъюгат содержит одно или несколько производных N-ацетилгалактозамина (GalNAc). Такой конъюгат также называют в настоящем описании GalNAc-конъюгатом. В некоторых вариантах конъюгат направляет РНК-и-средство к конкретной клетке, например, клетке печени, например, к гепатоциту. GalNAc-производные могут быть связаны через линкер, например, бивалентный или трехвалентный разветвленный линкер. В конкретных вариантах конъюгат представляет собой
В некоторых вариантах РНК-и-средство связано с углеводным конъюгатом через линкер, например, линкер, который показан на следующей схеме, где X означает O или S
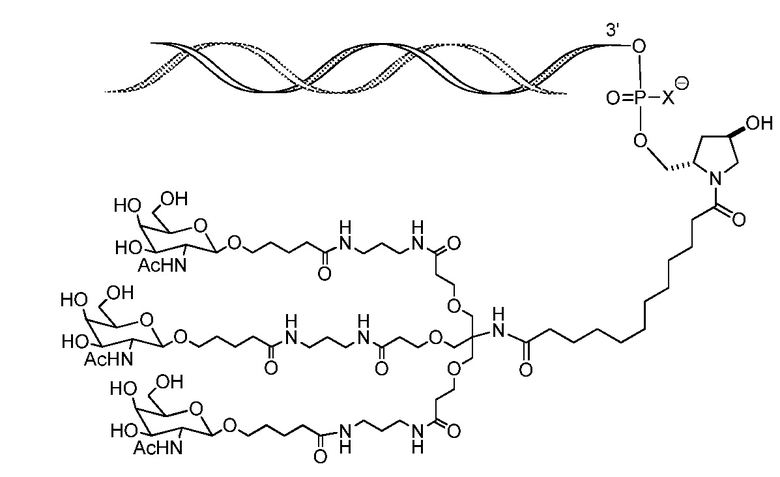
В некоторых вариантах X означает O. В некоторых вариантах X означает S.
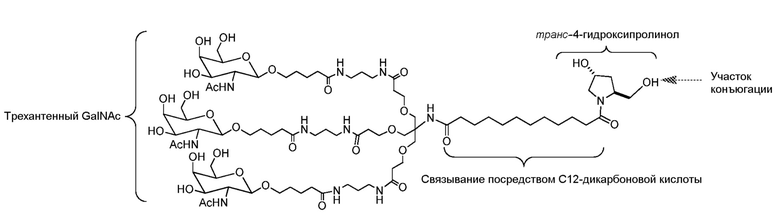
В некоторых вариантах РНК-и-средство конъюгировано с L96, который определен в таблице 1 и показан ниже
В одном аспекте в изобретении предлагается фармацевтическая композиция для ингибирования экспрессии гена ALAS1 в организме, обычно у человека. Композиция обычно содержит одну или несколько и-РНК, описанных в настоящей публикации, и фармацевтически приемлемый носитель или наполнитель для доставки. В одном варианте композицию применяют для лечения порфирии, например, AIP.
В одном аспекте и-РНК, предлагаемая в настоящем изобретении, является двунитевой рибонуклеиновой кислотой (днРНК) для ингибирования экспрессии ALAS1, при этом указанная днРНК содержит смысловую нить и антисмысловую нить длиной 15-30 пар оснований, и антисмысловая нить комплементарна, по меньшей мере, 15 непрерывно следующих друг за другом нуклеотидов последовательности SEQ ID NO: 1 или 382.
В следующем аспекте и-РНК, предлагаемая в настоящем изобретении, является двунитевой РНК-и (днРНК), содержащей смысловую нить, комплементарную антисмысловой нити, при этом указанная антисмысловая нить содержит область, комплементарную РНК-транскрипту ALAS1, при этом каждая нить имеет длину примерно от 14 до примерно 30 нуклеотидов, при этом указанное средство в виде двунитевой РНК-и представлено формулой (III):
смысловая: 5' np-Na-(X X X)i-Nb-Y Y Y - Nb-(Z Z Z)j -Na - nq 3'
антисмысловая: 3' np'-Na'-(X'X'X')k-Nb'-Y'Y'Y'-Nb'-(Z'Z'Z')l -Na'- nq' 5'
(III)
где:
i, j, k и l каждый независимо означают 0 или 1;
p, p', q и q' каждый независимо равен 0-6;
каждый Na и Na' независимо означает олигонуклеотидную последовательность, содержащую 0-25 нуклеотидов, которые либо модифицированы, либо немодифицированы, либо представлены сочетанием модифицированных и немодифифированных нуклеотидов, при этом каждая последовательность содержит, по меньшей мере, два по-разному модифицированных нуклеотида;
каждый Nb и Nb' независимо означает олигонуклеотидную последовательность, содержащую 0-10 нуклеотидов, которые либо модифицированы, либо немодифицированы, либо представлены сочетанием модифицированных и немодифифированных нуклеотидов;
каждый np, np', nq и nq' независимо означает выступающий нуклеотид;
XXX, YYY, ZZZ, X'X'X', Y'Y'Y' и Z'Z'Z' каждый независимо означает один мотив из трех идентичных модификаций трех непрерывно следующих друг за другом нуклеотидов;
модификации на Nb отличаются от модификации на Y, и модификации на Nb' отличаются от модификации на Y'.
В некоторых вариантах смысловая нить конъюгирована, по меньшей мере, с одним лигандом.
В некоторых вариантах i равен 1; j равен 1; или оба i и j равны 1.
В некоторых вариантах k равен 1; l равен 1; или оба k и l равны 1.
В некоторых вариантах XXX комплементарен X'X'X', YYY комплементарен Y'Y'Y', и ZZZ комплементарен Z'Z'Z'.
В некоторых вариантах мотив Y'Y'Y' встречается в 11, 12 и 13 положениях антисмысловой нити от 5'-конца.
В некоторых вариантах Y' означает 2'-O-метил.
В некоторых вариантах область дуплекса имеет длину 15-30 пар нуклеотидов.
В некоторых вариантах область дуплекса имеет длину 17-23 пар нуклеотидов.
В некоторых вариантах область дуплекса имеет длину 19-21 пар нуклеотидов.
В некоторых вариантах область дуплекса имеет длину 21-23 пары нуклеотидов.
В некоторых вариантах модификации нуклеотидов выбраны из группы, состоящей из LNA, HNA, CeNA, 2'-метоксиэтил, 2'-O-алкил, 2'-O-аллил, 2'-C-аллил, 2'-фтор, 2'-дезоксигруппы, 2'-гидроксила и их сочетаний.
В некоторых вариантах модификациями нуклеотидов являются 2'-O-метил, 2'-фтор или оба.
В некоторых вариантах лиганд содержит углевод.
В некоторых вариантах лиганд связан через линкер.
В некоторых вариантах линкер представляет собой бивалентный или трехвалентный разветвленный линкер.
В некоторых вариантах лиганд представляет собой
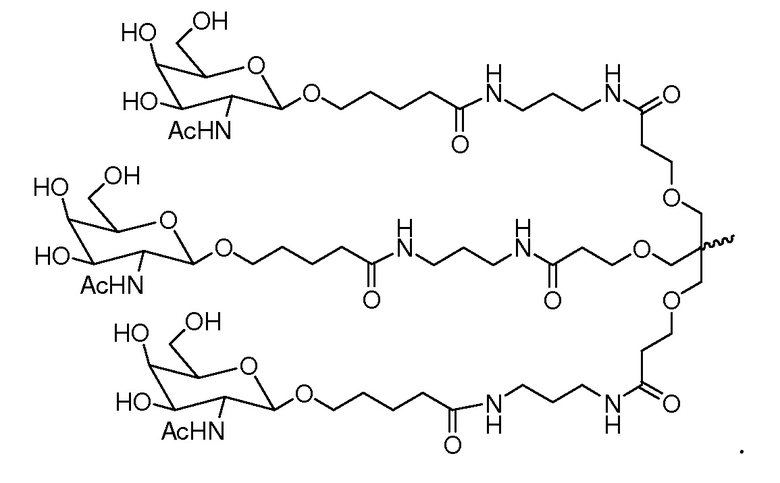
В некоторых вариантах лиганд и линкер представляют собой лиганд и ликер, показанные в формуле XXIV:
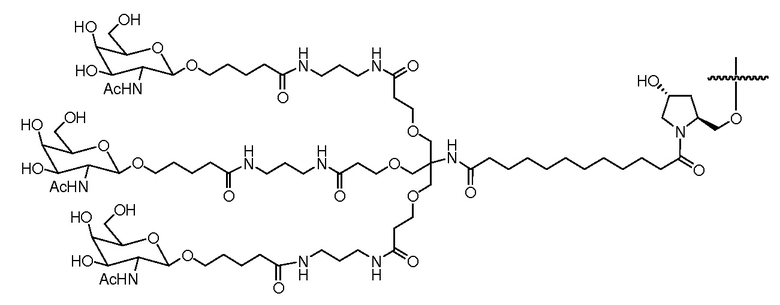
В некоторых вариантах лиганд связан с 3'-концом смысловой нити.
В некоторых вариантах днРНК имеет (например, содержит) нуклеотидную последовательность, выбранную из группы последовательностей, представленных в таблицах 2 и 3. В некоторых вариантах днРНК имеет нуклеотидную последовательность, выбранную из группы последовательностей, представленных в таблицах 2, 3, 6, 7, 8 и 9. В некоторых вариантах днРНК имеет нуклеотидную последовательность, выбранную из группы последовательностей, представленных в таблицах 2, 3, 6, 7, 8, 9, 14 и 15. В некоторых вариантах днРНК имеет нуклеотидную последовательность, выбранную из группы последовательностей, представленных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20. В некоторых вариантах днРНК имеет нуклеотидную последовательность, указанную в таблице 18. В некоторых вариантах днРНК имеет нуклеотидную последовательность, выбранную из группы последовательностей, представленных в таблицах 14 и 15.
В некоторых вариантах днРНК имеет нуклеотидную последовательность, выбранную из группы последовательностей, представленных в таблицах 3 и 8.
В следующем аспекте и-РНК, предлагаемая в настоящем изобретении, представляет собой двунитевую рибонуклеиновую кислоту (днРНК) для ингибирования экспрессии ALAS1, при этом указанная днРНК содержит смысловую нить и антисмысловую нить, при этом антисмысловая нить содержит область комплементарности РНК-транскрипту ALAS1, и такая антисмысловая нить содержит, по меньшей мере, 15 непрерывно следующих друг за другом нуклеотидов, отличающихся не более чем 3 нуклеотидами от одной из антисмысловых последовательностей, перечисленных в любой из таблиц 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20. В некоторых таких вариантах смысловые и антисмысловые последовательности выбраны из последовательностей дуплексов AD-58882, AD-58878, AD-58886, AD-58877, AD-59115, AD-58856, AD-59129, AD-59124, AD-58874, AD-59125, AD-59105, AD-59120, AD-59122, AD-59106, AD-59126 и AD-59107, которые раскрыты в настоящем описании в примерах. В некоторых вариантах смысловые и антисмысловые последовательности выбраны из последовательностей дуплексов AD-58882, AD-58878, AD-58886, AD-58877, AD-59115, AD-58856 и AD-59129. В некоторых вариантах смысловые и антисмысловые последовательности представляют собой последовательности дуплекса AD-58632. В некоторых вариантах смысловые и антисмысловые последовательности выбраны из последовательностей дуплексов AD-59453, AD-59395, AD-59477 и AD-59492. В некоторых вариантах смысловые и антисмысловые последовательности представляют собой последовательности дуплекса, раскрытого в настоящем описании, который подавляет экспрессию мРНК ALAS1, по меньшей мере, на 50%, 60%, 70%, 80%, 85% или 90%, например, судя по оценке с использованием анализа, описанного в примерах, предлагаемых в настоящем изобретении.
В некоторых вариантах днРНК содержит, по меньшей мере, один модифицированный нуклеотид.
В некоторых вариантах, по меньшей мере, один из модифицированных нуклеотидов выбран из группы, состоящей из: модифицированного 2'-O-метилом нуклеотида, нуклеотида, содержащего 5'-фосфоротиоатную группу, и концевого нуклеотида, связанного с группой холестерилового производного или бисдециламида додекановой кислоты.
В некоторых вариантах модифицированный нуклеотид выбран из группы, состоящей из: 2'-дезокси-2'-фтор-модифицированного нуклеотида, 2'-дезокси-модифицированного нуклеотида, закрытого нуклеотида, лишенного основания нуклеотида, 2'-амино-модифицированного нуклеотида, 2′-алкил-модифицированного нуклеотида, морфолинонуклеотида, содержащего фосфорамидат и нуклеотида, содержащего неприродное основание.
В некоторых вариантах область комплементарности имеет длину, по меньшей мере, 17 нуклеотидов.
В некоторых вариантах область комплементарности имеет длину от 19 до 21 нуклеотида.
В некоторых вариантах область комплементарности имеет длину 19 нуклеотидов.
В некоторых вариантах каждая нить имеет длину, составляющую не более чем 30 нуклеотидов.
В некоторых вариантах, по меньшей мере, одна нить содержит 3'-липкий конец, состоящий, по меньшей мере, из 1 нуклеотида.
В некоторых вариантах, по меньшей мере, одна нить содержит 3'-липкий конец, состоящий, по меньшей мере, из 2 нуклеотидов.
В некоторых вариантах днРНК, описанная в настоящей публикации, дополнительно содержит лиганд.
В некоторых вариантах лигандом является лиганд GalNAc.
В некоторых вариантах лиганд направляет днРНК в гепатоциты.
В некоторых вариантах лиганд конъюгирован с 3'-концом смысловой нити днРНК.
В некоторых вариантах область комплементарности состоит из антисмысловой последовательности, выбранной из последовательностей, указанных в таблице 2 или таблице 3. В некоторых вариантах область комплементарности состоит из антисмысловой последовательности, выбранной из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14 или 15. В некоторых вариантах область комплементарности состоит из антисмысловой последовательности, выбранной из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20. В некоторых вариантах область комплементарности состоит из антисмысловой последовательности, выбранной из последовательностей AD-58882, AD-58878, AD-58886, AD-58877, AD-59115, AD-58856, AD-59129, AD-59124, AD-58874, AD-59125, AD-59105, AD-59120, AD-59122, AD- 59106, AD-59126 или AD-59107, которые раскрыты в настоящем описании в примерах. В некоторых вариантах область комплементарности состоит из антисмысловой последовательности дуплекса AD-58632. В некоторых вариантах область комплементарности состоит из антисмысловой последовательности, выбранной из последовательностей AD-59453, AD-59395, AD-59477 и AD-59492. В некоторых вариантах область комплементарности состоит из антисмысловой последовательности, выбранной из дуплекса, раскрытого в настоящем описании, который подавляет экспрессию мРНК ALAS1, по меньшей мере, на 50%, 60%, 70%, 80%, 85% или 90%, например, судя по оценке с использованием анализа, описанного в примерах, приведенных в настоящем описании.
В некоторых вариантах днРНК содержит смысловую нить, состоящую из последовательности смысловой нити, выбранной из последовательностей, указанных в таблице 2 или таблице 3, и антисмысловую нить, состоящую из антисмысловой последовательности, выбранной из последовательностей, указанных в таблице 2 или таблице 3.
В некоторых вариантах днРНК содержит смысловую нить, состоящую из последовательности смысловой нити, выбранной из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14 или 15, и антисмысловую нить, состоящую из антисмысловой последовательности, выбранной из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14 или 15. В некоторых вариантах днРНК содержит пару соответствующих смысловых и антисмысловых последовательностей, выбранных из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14 и 15.
В некоторых вариантах днРНК содержит смысловую нить, состоящую из последовательности смысловой нити, выбранной из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20, и антисмысловую нить, состоящую из антисмысловой последовательности, выбранной из последовательностей, указанных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20. В некоторых вариантах днРНК содержит пару соответствующих смысловых и антисмысловых последовательностей, выбранных из последовательностей дуплексов, указанных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20.
В одном аспекте изобретение относится к клетке, содержащей, по меньшей мере, одну из и-РНК (например, днРНК), охарактеризованную в настоящем описании. Клетка обычно представляет собой клетку млекопитающего, такую как клетка человека. В некоторых вариантах клетка является эритроидной клеткой. В других вариантах клетка является клеткой печени (например, гепатоцитом).
В одном аспекте в настоящем изобретении предлагается фармацевтическая композиция для ингибирования экспрессии гена ALAS1, при этом композиция содержит и-РНК (например, днРНК), описанную в настоящей публикации.
В некоторых вариантах фармацевтических композиций, описанных в настоящей публикации, и-РНК (например, днРНК) вводят в небуферном растворе. В некоторых вариантах небуферным раствором является физиологический раствор или вода.
В некоторых вариантах фармацевтических композиций, описанных в настоящей публикации, и-РНК (например, днРНК вводят в небуферном растворе. В некоторых вариантах небуферный раствор содержит ацетат, цитрат, проламин, карбонат или фосфат или любое их сочетание. В некоторых вариантах буферный раствор представляет собой фосфатно-солевой буфер (PBS).
В некоторых вариантах фармацевтических композиций, описанных в настоящей публикации, и-РНК (например, днРНК) нацелена на гепатоциты.
В некоторых вариантах фармацевтических композиций, описанных в настоящей публикации, композицию вводят внутривенно.
В некоторых вариантах фармацевтических композиций, описанных в настоящей публикации, композицию вводят подкожно.
В некоторых вариантах фармацевтическая композиция содержит и-РНК (например, днРНК), описанную в настоящей публикации, которая содержит лиганд (например, лиганд GalNAc), который направляет и-РНК (например, днРНК) к гепатоцитам.
В некоторых вариантах фармацевтическая композиция содержит и-РНК (например, днРНК), описанную в настоящей публикации, которая содержит лиганд (например, лиганд GalNAc), и фармацевтическую композицию вводят подкожно. В некоторых вариантах лиганд направляет и-РНК (например, днРНК) к гепатоцитам.
В некоторых вариантах фармацевтическая композиция, например, композиция, описанная в настоящей публикации, включает липидный препарат. В некоторых вариантах РНК-и-средство находится в препарате LNP, например, препарате MC3. В некоторых вариантах препарат LNP направляет РНК-и-средство к конкретной клетке, например, клетке печени, например, к гепатоциту. В некоторых вариантах липидный препарат представляет собой препарат LNP11. В некоторых вариантах композицию вводят внутривенно.
В другом варианте фармацевтическую композицию готовят для введения согласно схеме дозирования, описанной в настоящей публикации, например, не более чем один раз каждые четыре недели, не более чем один раз каждые три недели, не более чем один раз каждые две недели или не более чем один раз в неделю. В другом варианте введение фармацевтической композиции можно осуществлять в течение месяца или дольше, например, один, два, три или шесть месяцев, или в течение одного года или дольше.
В другом варианте композицию, содержащую и-РНК, охарактеризованную в изобретении, например, днРНК, мишенью которой является ALAS1, вводят с терапевтическим средством, не являющимся и-РНК, таким как средство, которое, как известно, лечит порфирию (например, AIP) или симптом порфирии (например, боль). В другом варианте композицию, содержащую и-РНК, охарактеризованную в изобретении, например, днРНК, мишенью которой является AIP, вводят вместе с применением терапевтической схемы, в которой не используют и-РНК, такой как введение гемина или глюкозы (например, инфузия глюкозы (например, внутривенная глюкоза)). Например, и-РНК, охарактеризованную в изобретении, можно вводить до, после или одновременно с глюкозой, декстрозой или сходным средством лечения, которое служит для восстановления энергетического баланса (например, полное парентеральное питание). и-РНК, охарактеризованную в изобретении, также можно вводить до, после или одновременно с введением продукта гема (например, гемина, аргината гема или гемальбумина), и необязательно также с сочетании с глюкозой (например, внутривенной глюкозой) или тому подобным.
Обычно глюкозу, вводимую для лечения порфирии, вводят внутривенно (в/в). Введение глюкозы внутривенно в настоящем описании называют «в/в-глюкоза». Однако также предполагаются альтернативные варианты, в которых глюкозу вводят другими способами.
В одном варианте ALAS1-и-РНК вводят пациенту и затем пациенту вводят средство, не являющееся и-РНК, или терапевтическую схему без и-РНК (например, глюкозу и/или продукт гема) (или наоборот). В другом варианте ALAS1-и-РНК и терапевтическое средство, не являющееся и-РНК, или терапевтическую схему без и-РНК вводят одновременно.
В одном аспекте в настоящем изобретении предлагается способ ингибирования экспрессии ALAS1 в клетке, при этом способ включает в себя: (a) введение в клетку и-РНК (например, днРНК), описанной в настоящей публикации, и (b) поддержание клетки со стадии (a) в течение периода времени, достаточного для получения распада транскрипта мРНК гена ALAS1, с ингибированием, тем самым, экспрессии гена ALAS1 в клетке.
В одном аспекте в настоящем изобретении предлагается способ снижения или ингибирования экспрессии гена ALAS1 в клетке (например, эритроидной клетке или в клетке печени, такой как, например, гепатоцит). При этом способ включает в себя:
(a) введение в клетку двунитевой рибонуклеиновой кислоты (днРНК), при этом днРНК содержит, по меньшей мере, две последовательности, которые комплементарны друг другу. днРНК имеет смысловую нить, имеющую первую последовательность, и антисмысловую нить, имеющую вторую последовательность; при этом антисмысловая нить имеет область комплементарности, которая в значительной степени комплементарна, по меньшей мере, части мРНК, кодирующей ALAS1, и при этом область комплементарности имеет длину 30 нуклеотидов или меньше, т.е., 15-30 нуклеотидов и обычно имеет длину 19-24 нуклеотида, и при этом днРНК при контакте с клеткой, экспрессирующей ALAS1, ингибирует экспрессию гена ALAS1, по меньшей мере, на 10%, например, по меньшей мере, на 20%, по меньшей мере, на 30%, по меньшей мере, на 40% или больше; и
(b) поддержание клетки со стадии (a) в течение периода времени, достаточного для распада транскрипта мРНК гена ALAS1, тем самым, снижая или ингибируя экспрессию гена ALAS1 в клетке.
В некоторых вариантах описанных выше способов ингибирования экспрессии ALAS1 в клетку, клетку обрабатывают ex vivo, in vitro или in vivo. В некоторых вариантах клетка представляет собой гепатоцит.
В некоторых вариантах клетка присутствует в организме субъекта, нуждающегося в лечении, профилактике и/или контроле расстройства, связанного с экспрессией ALAS1.
В некоторых вариантах расстройством является порфирия. В некоторых вариантах порфирия представляет собой острую интермиттирующую порфирию или порфирию вследствие недостаточности ALA-дегидратазы.
В некоторых вариантах порфирия представляет собой печеночную порфирию, например, порфирию, выбранную из острой интермиттирующей порфирии (AIP), наследственной копропорфирии (HCP), смешанной порфирии (VP), порфирии вследствие недостаточности ALA-дегидратазы (ADP) и гепатоэритропоэтической порфирии. В некоторых вариантах порфирия является гомозиготной доминантной печеночной порфирией (например, гомозиготной доминантной AIP, HCP или VP) или гепатоэритропоэтической порфирией. В некоторых вариантах порфирия представляет собой двойную порфирию.
В некоторых вариантах экспрессию ALAS1 ингибируют, по меньшей мере, на 30%.
В некоторых вариантах и-РНК (например, днРНК) имеет IC50 в диапазоне 0,01-1 нМ.
В некоторых вариантах клетка (например, гепатоцит) является клеткой млекопитающего (например, клеткой человека, примата, отличного от человека, или грызуна).
В одном варианте клетку обрабатывают ex vivo, in vitro или in vivo (например, клетка присутствует в организме субъекта (например, пациента, нуждающегося в лечении, профилактике и/или контроле расстройства, связанного с экспрессией ALAS1).
В одном варианте субъектом является млекопитающее (например, человек) для которого существует риск или у которого диагностирована порфирия, например, X-сцепленная сидеробластная анемия (XLSA), порфирия вследствие недостаточности ALA-дегидратазы (ADP или ночная порфирия), острая интермиттирующая порфирия (AIP), врожденная эритропоэтическая порфирия (CEP), поздняя кожная порфирия (PCT), наследственная копропорфирия (копропорфирия или HCP), смешанная порфирия (VP), эритропоэтическая протопорфирия (EPP) или временная эритропорфирия новорожденных. В некоторых вариантах расстройством является острая печеночная порфирия, например, порфирия вследствие недостаточности ALA-дегидратазы (ADP), AIP, HCP или VP. В конкретных вариантах расстройством является порфирия вследствие недостаточности ALA-дегидратазы (ADP) или AIP.
В некоторых вариантах порфирия представляет собой печеночную порфирию, например, порфирию, выбранную из острой интермиттирующей порфирии (AIP) наследственной копропорфирии (HCP), смешанной порфирии (VP), порфирии вследствие недостаточности ALA-дегидратазы (ADP) и гепатоэритропоэтической порфирии. В некоторых вариантах порфирия представляет собой гомозиготную доминантную печеночную порфирию (например, гомозиготную доминантную AIP, HCP или VP) или гепатоэритропоэтическую порфирию. В некоторых вариантах порфирия представляет собой двойную порфирию.
В одном варианте введенная днРНК снижает или ингибирует экспрессию гена ALAS1 в клетке.
В одном варианте введенная днРНК снижает или ингибирует экспрессию гена ALAS1 или уровень одного или нескольких порфиринов или предшественников порфиринов (например, δ-аминолевулиновой кислоты (ALA), порфопилиногена (PBG), гидроксиметилбилана (HMB), уропорфириногена I или III, копропорфириногена I или III, протопорфириногена IX и протопорфирина IX) или продуктов или метаболитов порфирина, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или больше по сравнению с эталоном (например, необработанной клеткой или клеткой, обработанной не направленной к мишени контрольной днРНК). Без связи с какой-либо теорией полагают, что ALAS1 является первым ферментов порфиринового пути. Поэтому снижение экспрессии гена ALAS1 вероятно снижает уровень одного или нескольких предшественников порфиринов, порфиринов или продуктов или метаболитов порфиринов.
В других аспектах изобретение относится к способам лечения, профилактики или контроля патологических процессов, связанных с экспрессией ALAS1 (например, патологических процессов, в которые вовлечены порфирины, предшественники порфиринов или дефекты порфиринового пути, такие как, например, порфирии). В одном варианте способ включает в себя введение субъекту, например, пациенту, нуждающемуся в таком лечении, профилактике или контроле, эффективного (например, терапевтически или профилактически эффективного) количества одной или нескольких и-РНК, охарактеризованных в настоящем описании.
В одном аспекте в настоящем изобретении предлагается способ лечения и/или профилактики расстройства, связанного с экспрессией ALAS1, включающий в себя введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества и-РНК (например, днРНК), описанной в настоящей публикации, или композиции, содержащей и-РНК (например, днРНК), описанной в настоящей публикации.
В одном аспекте в настоящем изобретении предлагается способ лечения и/или профилактики порфирии, включающий в себя введение субъекту, нуждающемуся в таком лечении, двунитевой рибонуклеиновой кислоты (днРНК), при этом указанная днРНК содержит смысловую нить и антисмысловую нить длиной 15-30 пар оснований, и антисмысловая нить комплементарна, по меньшей мере, 15 непрерывно следующим друг за другом нуклеотидам последовательности SEQ ID NO: 1 или SEQ ID NO: 382.
В одном варианте субъект (например, пациент) имеет порфирию. В другом варианте для субъекта (например, пациента) существует риск развития порфирии. В некоторых вариантах введение и-РНК, нацеленной на ALAS1, облегчает или ослабляет тяжесть, по меньшей мере, одного симптома расстройства, связанного с ALAS1, у пациента.
В одном варианте субъектом является млекопитающее (например, человек), который подвержен риску или у которого было диагностировано расстройство, связанное с экспрессией ALAS1, например, порфирия, например, X-сцепленная сидеробластная анемия (XLSA), порфирия вследствие недостаточности ALA-дегидратазы (ночная порфирия), острая интермиттирующая порфирия (AIP), врожденная эритропоэтическая порфирия (CEP), поздняя кожная порфирия (PCT), наследственная копропорфирия (копропорфирия или HCP), смешанная порфирия (VP), эритропоэтическая протопорфирия (EPP) или временная эритропорфирия новорожденных. В следующем варианте порфирия представляет собой острую печеночную порфирию, например, порфирию вследствие недостаточности ALA-дегидратазы (ADP), AIP, HCP или VP. В некоторых таких вариантах расстройством является порфирия вследствие недостаточности ALA-дегидратазы (ADP) или AIP.
В некоторых вариантах субъект имеет или подвергается риску развития порфирии. В некоторых вариантах порфирия представляет собой печеночную порфирию, например, порфирию, выбранную из острой интермиттирующей порфирии (AIP), наследственной копропорфирии (HCP), смешанной порфирии (VP), порфирии вследствие недостаточности ALA-дегидратазы (ADP) и гепатоэритропоэтической порфирии. В некоторых вариантах порфирия представляет собой гомозиготную доминантную печеночную порфирию (например, гомозиготную доминантную AIP, HCP или VP) или гепатоэритропоэтическую порфирию. В некоторых вариантах порфирия представляет собой двойную порфирию.
В некоторых вариантах порфирия, симптом порфирии, продром или приступ порфирии индуцированы воздействием провоцирующего фактора, который описан в настоящей публикации. В некоторых вариантах провоцирующим фактором является химическое воздействие. В некоторых вариантах провоцирующим фактором является лекарственное средство, например, отпускаемое по рецепту лекарственное средство или безрецептурное лекарственное средство. В некоторых вариантах провоцирующим фактором является менструальный цикл, например, конкретная фаза менструального цикла, например, фаза лютеинизации.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК вводят после острого приступа порфирии.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят во время острого приступа порфирии.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят профилактически, чтобы предотвратить острый приступ порфирии.
В некоторых вариантах и-РНК (например, днРНК) готовят в виде препарата LNP.
В некоторых вариантах и-РНК (например, днРНК) находится в форме конъюгата с GalNAc.
В некоторых вариантах и-РНК (например, днРНК) вводят в дозе 0,05-50 мг/кг.
В некоторых вариантах и-РНК (например, днРНК) вводят в концентрации 0,01 мг/кг - 5 мг/кг массы тела субъекта.
В некоторых вариантах и-РНК (например, днРНК) готовят в виде препарата LNP и вводят в дозе 0,05-5 мг/кг.
В некоторых вариантах и-РНК (например, днРНК) находится в форме конъюгата с GalNAc, и его вводят в дозе 0,5-50 мг/кг.
В некоторых вариантах способ снижает уровень порфирина или предшественника порфирина у субъекта.
В некоторых вариантах уровень снижается, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%. В одном варианте уровень снижается, по меньшей мере, на 30%.
В некоторых вариантах предшественником порфирина является δ-аминолевулиновая кислота (ALA) или порфопилиноген (PBG). В некоторых вариантах и-РНК (например, днРНК) имеет IC50 в диапазоне 0,01-1 нМ.
В некоторых вариантах способ, описанный в настоящей публикации
(i) ослабляет симптом, ассоциированный с расстройством, связанным с ALAS1 (например, порфирией);
(ii) ингибирует экспрессию ALAS1 у субъекта,
(iii) снижает уровень предшественника порфирина (например, ALA или PBG) или порфирина у субъекта,
(iv) снижает частоту острых приступов симптомов, ассоциированных с порфирией, у субъекта, или
(v) снижает частоту острых приступов симптомов, ассоциированных с порфирией, у субъекта, когда субъект подвергается воздействию провоцирующего фактора (например, предменструальной фазы или фазы лютеинизации).
В некоторых вариантах способ облегчает боль и/или прогрессирующую нейропатию.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят согласно схеме дозирования.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят до или во время острого приступа порфирии. В некоторых вариантах и-РНК вводят до острого приступа порфирии.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят во время продрома. В некоторых вариантах продром характеризуется болью в животе, тошнотой, психологическими симптомами (например, тревожностью), беспокойством и/или бессонницей.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят во время конкретно фазы менструального цикла, например, во время фазы лютеинизации. В некоторых вариантах способ ослабляет или предотвращает периодические приступы порфирии, например, благодаря снижению тяжести, продолжительности или частоты приступов. В некоторых вариантах периодические приступы ассоциированы с провоцирующим фактором. В некоторых вариантах провоцирующим фактором является менструальный цикл, например, конкретная фаза менструального цикла, например, фаза лютеинизации.
В некоторых вариантах субъект имеет повышенный уровень ALA и/или PBG. В некоторых вариантах субъект имеет или подвержен риску развития порфирии, например, печеночной порфирии. В некоторых вариантах у субъекта нет симптомов. В некоторых вариантах субъект несет генетическое изменение (например, генную мутацию), ассоциированное с порфирией, которое описано в настоящей публикации.
В некоторых вариантах субъект имеет или подвержен риску развития порфирии и страдает от боли (например, хронической боли, например, хронической нейропатической боли) и/или нейропатии (например, прогрессирующей нейропатии). В некоторых вариантах субъект не страдает от острых приступов, но страдает от боли (например, хронической боли, например, хронической нейропатической боли) и/или нейропатии (например, прогрессирующей нейропатии). В некоторых вариантах боль представляет собой боль в области живота.
В некоторых вариантах субъект (a) имеет повышенный уровень ALA и/или PBG и (b) страдает от боли (например, хронической боли, например, хронической нейропатической боли) и/или нейропатии (например, прогрессирующей нейропатии). В некоторых вариантах боль представляет собой боль в области живота.
В некоторых вариантах субъект имеет уровень в плазме и/или уровень в моче ALA и/или PBG, который повышен. В некоторых вариантах повышенный уровень ALA и/или PBG сопровождается другими симптомами, например, болью (например, хронической болью, например, хронической нейропатической болью) или нейропатией (например, прогрессирующей нейропатией). В некоторых вариантах боль представляет собой боль в области живота. В некоторых вариантах у субъекта нет симптомов. В некоторых вариантах субъект имеет генетическую мутацию, ассоциированную с порфирией, например, мутацию, которая описана в настоящей публикации.
В некоторых вариантах субъект имеет уровень (например, уровень в плазме или уровень в моче) предшественника порфирина, например, ALA и/или PBG, который повышен, например, уровень выше или выше или равен эталонному значению. В некоторых вариантах уровень выше эталонного значения. В некоторых вариантах эталонное значение на два стандартных отклонения выше среднего уровня в образце от здоровых индивидуумов. В некоторых вариантах эталонное значение является верхним пределом для эталона.
В некоторых вариантах субъект имеет уровень в плазме и/или уровень в моче ALA и/или PBG, который выше или выше или равен 2-кратному, 3-кратному, 4-кратному или 5-кратному верхнему пределу эталона. В используемом в настоящем описании смысле «верхний предел эталона» относится к уровню, который является верхним пределом 95% доверительного интервала для эталонного образца, например, образца от нормальных (например, дикого типа) или здоровых индивидуумов, например, индивидуумов, которые не несут генетической мутации, ассоциированной с порфирией, и/или индивидуумов, которые не страдают от порфирии. В некоторых вариантах субъект имеет уровень ALA и/или PBG в моче, который в 2-4 раза превышает верхний предел эталона. В некоторых вариантах субъект имеет уровень ALA и/или PBG в моче, который в 4 раза превышает верхний предел эталона.
В некоторых вариантах эталонное значения PBG в плазме составляет 0,12 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в плазме, который превышает или выше или равен 0,12 мкмоль/л, 0,24 мкмоль/л, 0,36 мкмоль/л, 0,48 мкмоль/л или 0,60 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в плазме, который превышает или выше или равен 0,48 мкмоль/л.
В некоторых вариантах эталонное значение для PBG в моче составляет 1,2 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в моче, который превышает или выше или равен 1,2 ммоль/моль креатинина, 2,4 ммоль/моль креатинина, 3,6 ммоль/моль креатинина, 4,8 ммоль/моль креатинина или 6,0 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в моче, который превышает или выше или равен 4,8 ммоль/моль креатинина.
В некоторых вариантах эталонное значение для ALA в плазме составляет 0,12 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень ALA в плазме, который превышает или выше или равен 0,12 мкмоль/л, 0,24 мкмоль/л, 0,36 мкмоль/л, 0,48 мкмоль/л или 0,60 мкмоль/л. В некоторых вариантах субъектом является человек и он имеет уровень ALA в плазме, который превышает или выше или равен 0,48 мкмоль/л.
В некоторых вариантах эталонное значение для ALA в моче составляет 3,1 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень ALA в моче, который превышает или выше или равен 3,1 ммоль/моль креатинина, 6,2 ммоль/моль креатинина, 9,3 ммоль/моль креатинина, 12,4 ммоль/моль креатинина или 15,5 ммоль/моль креатинина.
В некоторых вариантах способ снижает повышенный уровень ALA и/или PBG. В некоторых вариантах способ уменьшает боль (например, хроническую боль, например хроническую нейропатическую боль) и/или нейропатию (например, прогрессирующую нейропатию). В некоторых вариантах боль представляет собой боль в области живота. В некоторых вариантах боль представляет собой нейропатическую боль (например, боль, ассоциированную с прогрессирующей нейропатией при острых порфириях). Уменьшение боли может включать, например, предотвращение боли, задержку появления боли, снижение частоты болей и/или снижение тяжести боли.
В некоторых вариантах способ ослабляет или предотвращает острые приступы порфирии, например, уменьшая тяжесть, продолжительность или частоту приступов.
В некоторых вариантах способ уменьшает или предотвращает повреждение нервов.
В некоторых вариантах способ предотвращает нарушения (например, предотвращает развитие аномалий) или приводит к улучшению клинических показателей, например, клинических показателей мышечной и/или нервной функции, например, ЭМГ и/или скорости проводимости нервов.
В некоторых вариантах способ является эффективным в отношении снижения уровня ALA и/или PBG (например, уровня ALA и/или PBG в плазме или моче). В некоторых вариантах способ является эффективным в отношении получения предварительно определяемого снижения повышенного уровня ALA и/или PBG.
В некоторых вариантах предварительно определяемым снижением является снижение до значения, которое меньше или равно эталонному значению. В некоторых вариантах эталонное значение является верхним пределом эталона. В некоторых вариантах эталонным значением является значение, которое на два стандартных отклонения выше среднего уровня в эталонном образце.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят многократно, например, согласно схеме дозирования.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят профилактически субъекту, который подвергается риску развития порфирии. В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят профилактически, начиная с пубертатного периода. В некоторых вариантах субъект несет генетическую мутацию, ассоциированную с порфирией, и/или имеет повышенный уровень ALA и/или PBG (например, повышенный уровень ALA и/или PBG в плазме или моче). В некоторых вариантах мутация делает индивидуума чувствительным к острому приступу (например, при воздействии провоцирующего фактора, например, лекарственного средства, питания или другого провоцирующего фактора, например, провоцирующего фактора, который раскрыт в настоящем описании). В некоторых вариантах мутация ассоциирована с повышенными уровнями порфирина или предшественника порфирина (например, ALA и/или PBG). В некоторых вариантах мутация ассоциирована с хронической болью (например, хронической нейропатической болью) и/или нейропатией (например, прогрессирующей нейропатией).
В некоторых вариантах мутация представляет собой мутацию гена ALAS1. В некоторых вариантах мутация представляет собой мутацию в промоторе гена ALAS1 или в областях выше или ниже гена ALAS1. В некоторых вариантах мутация представляет собой мутацию в факторах транскрипции или других генах, которые взаимодействуют с ALAS1. В некоторых вариантах мутация представляет собой мутацию в гене, который кодирует фермент пути биосинтеза гема.
В некоторых вариантах и-РНК (например, днРНК) или композицию, содержащую и-РНК, вводят подкожно. В некоторых вариантах и-РНК находится в форме конъюгата с GalNAc. В некоторых вариантах и-РНК (например, днРНК) вводят в дозе 0,5-50 мг/кг.
В одном аспекте в настоящем изобретении предлагается способ лечения субъекта с повышенным уровнем ALA и/или PBG, при этом способ включает в себя введение субъекту двунитевой рибонуклеиновой кислоты (днРНК), при этом указанная днРНК содержит смысловую нить и антисмысловую нить длиной 15-30 пар оснований, и антисмысловая нить комплементарна, по меньшей мере, 15 непрерывно следующих друг за другом нуклеотидам последовательности SEQ ID NO: 1 или SEQ ID NO: 382.
В одном аспекте в настоящем изобретении предлагается способ лечения субъекта с повышенным уровнем ALA и/или PBG, при этом способ включает в себя введение субъекту терапевтически эффективного количества днРНК или композиции, содержащей днРНК, которая описана в настоящей публикации.
В некоторых вариантах способы, описанные в настоящей публикации, являются эффективными в отношении снижения уровня ALA и/или PBG. В некоторых вариантах уровень ALA и/или PBG снижен так, что он ниже или ниже или равен эталонному значению, например, верхнему пределу эталона. В другом аспекте изобретение относится к способам снижения уровня порфирина или предшественника порфирина в клетке (например, эритроидной клетке или клетке печени, такой как, например, гепатоцит). В одном варианте клетку обрабатывают ex vivo, in vitro или in vivo (например, клетка присутствует в организме субъекта (например, пациента, нуждающегося в лечении, профилактике и/или контроле расстройства, связанного с экспрессией ALAS1). Способ включает в себя осуществление контакта клетки с эффективным количеством одной или нескольких и-РНК, мишенью которых является ALAS1, например, одной или нескольких и-РНК, раскрытых в настоящем описании, тем самым, снижая уровень порфирина или предшественника порфирина в клетке; или снижая уровень порфирина или предшественника порфирина в других клетках, тканях или жидкостях в организме субъекта, в котором клетка находится; относительно уровня до осуществления контакта. Такие способы можно применять для лечения (например, ослабления тяжести) расстройств, связанных с экспрессией ALAS1, таких как порфирии, например, AIP или порфирии вследствие недостаточности дегидратазы ALA.
В одном варианте стадию осуществления контакта осуществляют ex vivo, in vitro или in vivo. Например, клетка может присутствовать в организме субъекта, например, млекопитающего (например, человека), подверженного риску развития порфирии, или у которого диагностирована порфирия. В одном варианте порфирия представляет собой острую печеночную порфирию. В некоторых вариантах порфирия представляет собой печеночную порфирию, например, порфирию, выбранную из острой интермиттирующей порфирии (AIP), наследственной копропорфирии (HCP), смешанной порфирии (VP), порфирии вследствие недостаточности ALA-дегидратазы (ADP), и гепатоэритропоэтической порфирии. В некоторых вариантах порфирия представляет собой гомозиготную доминантную печеночную порфирию (например, гомозиготную доминантную AIP, HCP или VP) или гепатоэритропоэтическую порфирию. В некоторых вариантах порфирия представляет собой двойную порфирию.
В одном аспекте в настоящем изобретении предлагается способ снижения уровня порфирина или предшественника порфирина (например, ALA или PBG) в клетке, включающий в себя осуществление контакта клетки с и-РНК (например, днРНК), которая описана в настоящей публикации, в количестве, эффективном для снижения уровня порфирина или предшественника порфирина в клетке. В некоторых вариантах клеткой является гепатоцит. В некоторых вариантах порфирином или предшественником порфирина является δ-аминолевулиновая кислота (ALA), порфопилиноген (PBG), гидроксиметилбилан (HMB), уропорфириноген I или III, копропорфириноген I или III, протопорфириноген IX или протопорфирин IX. В некоторых вариантах предшественником порфирина является ALA или PBG.
В одном варианте клетка является эритроидной клеткой. В следующем варианте клетка является клеткой печени (например, гепатоцитом).
В одном аспекте в настоящем изобретении предлагается вектор, кодирующий, по меньшей мере, одну нить и-РНК (например, днРНК), которая описана в настоящей публикации.
В одном аспекте в настоящем изобретении предлагается вектор, кодирующий, по меньшей мере, одну нить днРНК, при этом указанная днРНК содержит область комплементарности, по меньшей мере, с частью мРНК, кодирующей ALAS1, при этом указанная днРНК имеет длину 30 пар оснований или меньше, и при этом указанная днРНК целенаправленно воздействует на указанную мРНК, приводит к ее расщеплению.
В некоторых вариантах область комплементарности имеет длину, по меньшей мере, 15 нуклеотидов.
В некоторых вариантах область комплементарности имеет длину от 19 до 21 нуклеотида. В одном аспекте изобретение относится к вектору для ингибирования экспрессии гена ALAS1 в клетке. В одном варианте вектор содержит и-РНК, которая описана в настоящей публикации. В одном варианте вектор содержит, по меньшей мере, одну регуляторную последовательность, оперативно связанную с нуклеотидной последовательностью, которая кодирует, по меньшей мере, одну нить и-РНК, которая описана в настоящей публикации. В одном варианте вектор содержит, по меньшей мере, одну нить и-РНК ALAS1.
В одном аспекте в настоящем изобретении предлагается клетка, содержащая вектор, который описан в настоящей публикации. В одном аспекте в настоящем изобретении предлагается клетка, содержащая вектор для ингибирования экспрессии гена ALAS1 в клетке. Вектор содержит регуляторную последовательность, оперативно связанную с нуклеотидной последовательностью, которая кодирует, по меньшей мере, одну нить одной из и-РНК, которые описаны в настоящей публикации. В одном варианте клетка представляет собой клетку печени (например, гепатоцит). В другом варианте клетка является эритроидной клеткой.
Все публикации, заявки на выдачу патентов, патенты и другие ссылки, упоминаемые в настоящем описании, включены в виде ссылки в полном объеме.
Подробности различных вариантов осуществления изобретения указаны в описании ниже. Другие признаки, цели и преимущества изобретения будут понятны из описания и чертежей и из формулы изобретения.
Описание чертежей
На фиг. 1 изображен путь биосинтеза гема.
На фиг. 2 суммированы некоторые порфирии, ассоциированные с генетическими ошибками в метаболизме гема.
На фиг. 3 изображен вариант 1 транскрипта последовательности мРНК ALAS1 человека (эталонная последовательность NM_000688.4 (GI:40316942, запись, датированная 19 ноября 2011), SEQ ID NO: 1).
На фиг. 4 изображен вариант 2 транскрипта последовательности мРНК ALAS1 человека (эталонная последовательность NM_000688.5 (GI: 362999011, запись, датированная 1 апреля 2012), SEQ ID NO: 382).
На фиг. 5 показана зависимость доза-ответ для ми-РНК AD-53558 в подавлении мРНК ALAS1 мыши (mALAS1) относительно PBS-контроля. Также показаны результаты для контроля с люциферазой (LUC) AD-1955.
На фиг. 6 показана зависимость доза-ответ для ми-РНК AD-53558 в подавлении мРНК ALAS1 у крыс относительно PBS-контроля. Также показаны результаты для контроля с люциферазой (LUC) AD-1955.
На фиг. 7 показана продолжительность подавления мРНК ALAS1 мыши (mALAS1) под действием ми-РНК AD-53558 относительно PBS-контроля.
На фиг. 8 показаны средние значения ± стандартные отклонения уровня ALA в плазме (в мкМ) исходного уровня и после обработки фенобарбиталом в экспериментальной (ми-РНК ALAS1) и контрольной (ми-РНК LUC) группах.
На фиг. 9 показаны уровни ALA в плазме (в мкМ) отдельных животных исходного уровня и после обработки фенобарбиталом у животных, которые получали обработку ми-РНК ALAS1 и контрольную обработку (ми-РНК LUC).
На фиг. 10 показаны средние значения ± стандартные отклонения уровней PBG в плазме (в мкМ) исходного уровня и после обработки фенобарбиталом у животных, которые получали обработку ми-РНК ALAS1 и контрольную обработку (ми-РНК LUC).
На фиг. 11 показаны уровни PBG в плазме (в мкМ) отдельных животных исходного уровня и после обработки фенобарбиталом у животных, которые получали обработку ми-РНК ALAS1 и контрольную обработку (ми-РНК LUC).
На фиг. 12 показан относительный уровень мРНК mALAS1 в печени на исходном уровне и после обработки фенобарбиталом у выбранных соответствующих экспериментальных (ми-РНК ALAS1) и контрольных (PBS) животных.
На фиг. 13 показано влияние трех GalNAc-конъюгированных ми-РНК mALAS1 на экспрессию mALAS1 (относительно PBS-контроля) в ткани печени мышей.
На фиг. 14 показаны уровни ALA и PBG в плазме с течением времени после введения фенобарбитала и обработки ми-РНК ALAS1 или контрольной ми-РНК LUC.
На фиг. 15 показано влияние GalNAc-конъюгированной ми-РНК ALAS1 на уровни ALA в плазме и уровни PBG в плазме в мышиной модели индуцированной фенобарбиталом AIP.
Подробное описание изобретения
и-РНК нацелена на специфичный для последовательности распад мРНК в результате процесса, известного как РНК-интерференция (РНК-и). В настоящей публикации описаны и-РНК и способы их применения для ингибирования экспрессии гена ALAS1 в клетке или в организме млекопитающего, при этом мишенью и-РНК является ген ALAS1. Также предлагаются композиции и способы лечения расстройств, связанных с экспрессией ALAS1, таких как порфирии (например, порфирия вследствие недостаточности ALA-дегидратазы (ADP или ночная порфирия), острая интермиттирующая порфирия, врожденная эритропоэтическая порфирия, поздняя кожная порфирия, наследственная копропорфирия (копропорфирия), смешанная порфирия, эритропоэтическая протопорфирия (EPP), X-сцепленная сидеробластная анемия (XLSA) и временная эритропорфирия новорожденных).
Порфирии являются врожденными или приобретенными расстройствами, которые могут быть вызваны сниженной или усиленной активностью конкретных ферментов в пути биосинтеза гема, также называемым в настоящем описании путем порфирина (См. фиг. 1). Порфирины являются основными предшественниками гема. Порфирины и предшественники порфиринов включают δ-аминолевулиновую кислоту (ALA), порфопилиноген (PBG), гидроксиметилбилан (HMB), уропорфириноген I или III, копропорфириноген I или III, протопорфириноген IX и протопорфирин IX. Гем является важной частью гемоглобина, миоглобина, каталаз, пероксидаз и цитохромов, при этом последние включают цитохромы дыхательной цепи и цитохромы P450 печени. Гем синтезируется в большинстве или во всех клетках человека. Примерно 85% гема образуется в эритроидных клетках, главным образом, для гемоглобина. Большая часть остального гема образуется в печени, 80% которого используется для синтеза цитохромов. Недостаточность специфичных ферментов в порфириновом пути приводит к недостаточной продукции гема, а также к накоплению предшественников порфиринов и/или порфиринов, которые в высоких концентрациях могут быть токсичными для функционирования клетки или органа.
Порфирии могут проявляться неврологическими осложнениями («острыми»), проблемами с кожей («кожными») или и тем и другим. Порфирии можно классифицировать по первичному месту сверхпродукции и накопления порфиринов или их предшественников. В случае печеночных порфирий порфирины и предшественники порфиринов преимущественно сверхпродуцируются в печени, тогда как в случае эритропоэтических порфирий порфирины сверхпродуцируются в эритроидных клетках в костях. Острые или печеночные порфирии приводят к нарушению функции нервной системы и неврологическим проявлениям, которые могут влиять как на центральную, так и на периферическую нервную систему, приводя к таким симптомам как, например, боль (например, боль в области живота и/или хроническая нейропатическая боль), рвоте, нейропатии (например, острой нейропатии, прогрессирующей нейропатии), мышечной слабости, судорогам, психическим нарушениям (например, галлюцинациям, депрессии и тревоге, паранойе), аритмиям сердца, тахикардии, запору и диарее. Кожные или эритропоэтические порфирии, главным образом, поражают кожу, вызывая такие симптомы, как повышенная чувствительность к свету, которая может быть болезненной, буллезным поражениям, некрозу, зуду, опуханию и усиленному росту волос в таких областях, как лоб. Последующая инфекция поражений кожи может приводить к потере костной и тканевой массы, а также рубцеванию, обезображиванию и утрате пальцев (например, пальцев рук и ног). Большинство порфирий вызваны мутациями, которые кодируют ферменты пути биосинтеза гема. Краткое описание порфирий, ассоциированных с генетическими ошибками метаболизма гема, представлено на фиг. 2.
Не все порфирии являются генетическими расстройствами. Например, у пациентов с заболеванием печени может развиваться порфирия в результате нарушения функции печени, и временная форма эритропорфирии (временная эритропорфирия новорожденных) была описана у новорожденных (См. публикацию Crawford, R.I. с соавторами, J. Am. Acad. Dermatol. 1995 Aug; 33(2 Pt 2): 333-6). Пациенты с PCT могут приобретать недостаточность активности уропорфириногендекарбоксилазы (URO-D), вследствие образования фермента ORO-D с более низкой по сравнению с нормальной ферментативной активностью (См. публикацию Phillips с соавторами Blood, 98: 3179-3185, 2001).
Острая интермиттирующая порфирия (AIP) (также называемая недостаточностью порфобилиноген (PBG)-дезаминазы или недостаточностью гидроксиметилбилансинтазы (HMBS)) является наиболее распространенным типом острой печеночной порфирии. Другие типы острых печеночных порфирий включают наследственную копропорфирию (HCP), смешанную порфирия (VP) и порфирию вследствие недостаточности ALA-дегидратазы (ADP). Острые печеночные порфирии описаны, например, в публикации Balwani M. and Desnick R.J., Blood, 120: 4496-4504, 2012.
AIP обычно является аутосомным доминантным заболеванием, которое характеризуется недостаточностью фермента порфобилиногендезаминазы (PBG-дезаминазы); указанный фермент также известен как гидроксиметилбилансинтаза (HMB-синтаза или HMBS). PBG-дезаминаза является третьим ферментом в пути биосинтеза гема (См. фиг. 1) и катализирует конденсацию «голова к хвосту» четырех молекул порфобилиногена в линейный тетрапиррол, гидроксиметилбилан (HMB). Были описаны альтернативно сплайсируемые варианты транскриптов, кодирующих разные изоформы PBG-дезаминазы. Мутации в гене PBG-дезаминазы ассоциированы с AIP. Такие мутации могут приводить к пониженным количествам PBG-дезаминазы и/или пониженной активности PBG-дезаминазы (у пораженных индивидуумов обычно имеет место ~50% снижение активности PBG-дезаминазы).
Существует, по меньшей мере, две разных модели патофизиологии AIP и других острых печеночных порфирий (См., например, Lin CS-Y с соавторами, Clinical Neurophysiology, 2011; 122:2336-44). Согласно одной модели пониженная продукция гема, возникающая, вследствие недостаточности PBG-дезаминазы, приводит к дефициту энергии и дегенерации аксонов. Согласно другой, более предпочтительной в настоящее время модели, накопление предшественников порфиринов (например, ALA и PBG) приводит к нейротоксичности.
Было обнаружено, что AIP распространена в некоторых популяциях с частотой 1 на 10000 (например, в Северной Швеции; См. Floderus Y. С соавторами, Clin Genet. 2002; 62: 288-97). Распространенность в общей популяции в Соединенных Штатах и Европе, за исключением Великобритании, оценивается примерно от 1 на 10000 до 1 на 20000. Клиническое заболевание проявляется само по себе только примерно у 10-15% индивидуумов, которые несут мутации, которые, как известно, ассоциированы с AIP. Однако пенетрантность у индивидуумов с некоторыми мутациями достигает 40% (например, в случае мутации W198X). AIP обычно не проявляется до пубертатного периода. Симптомы более распространены у женщин, чем у мужчин. Распространенность заболевания вероятно недооценена из-за неполной пенетрантности и длительных латентных периодов. В Соединенных Штатах, судя по оценкам, живет примерно 2000 пациентов, которые страдали, по меньшей мере, от одного приступа. Судя по оценкам, имеется примерно 150 активных повторных случаев во Франции, Великобритании и Польше; такими пациентами преимущественно являются молодые женщины среднего возраста 30 лет. См., например, публикацию Elder с соавторами, J. Inherit. Metab. Dis., опубликованную он-лайн 1 ноября, 2012.
AIP поражает, например, висцеральную, периферическую, автономную и центральную нервные системы. Симптомы AIP изменчивы и включают симптомы желудочно-кишечного тракта (например, тяжелую и плохо локализованную боль в области живота, тошноту/рвоту, запор, диарею, непроходимость кишечника), симптомы мочевой системы (дизурию, задержку мочеиспускания/недержание мочи или темную мочу), неврологические симптомы (например, сенсорную нейропатию, моторную нейропатию (например, поражение черепно-мозговых нервов и/или симптомы, приводящие к слабости рук и ног), судороги, нейропатическую боль (например, боль, ассоциированную с прогрессирующей нейропатией, например, хроническую нейропатическую боль), нейропсихиатрические симптомы (например, спутанность сознания, тревожность, возбуждение, галлюцинации, истерию, бред, апатию, депрессию, фобии, психоз, бессонницу, сонливость, кому), вовлечение автономной нервной системы (приводящее, например, к сердечно-сосудистым симптомам, таким как тахикардия, гипертония и/или аритмии, а также другие симптомы, такие как, например, повышенные уровни циркулирующего катехоламина, потливость, возбужденное состояние и/или тремор), обезвоживание и электролитные аномалии. Наиболее распространенными симптомами являются боль в области живота и тахикардия. Кроме того, пациенты часто имеют хроническую нейропатическую боль, и у них развивается прогрессирующая нейропатия. Пациенты с повторными приступами, часто имеют предвестники заболевания. Может возникать длительный паралич после тяжелого приступа. Восстановление после тяжелых приступов, которые своевременно не лечили, может занимать недели или месяцы. Острый приступ может быть смертельным, например, вследствие паралича дыхательных мышц или сердечно-сосудистой недостаточности из-за дисбаланса электролитов (См., например, Thunell S. Hydroxymethylbilane Synthase Deficiency. 2005 Sep. 27 [новая версия 11 сентября 2011]. В: Pagon RA, Bird TD, Dolan CR, et al., editors. GeneReviews(TM) [интернет]. Seattle (WA): University of Washington, Seattle; 1993 (далее Thunell (1993)), которые включены в настоящее описание в виде ссылки в полном объеме). До появления возможности лечения гемином до 20% пациентов с AIP умирали от заболевания.
У индивидуумов, которые несут гены для AIP, повышен риск возникновения гепатоклеточных видов рака. У пациентов с повторяющимися приступами риск гепатоклеточного рака особенно велик: после 50 лет риск примерно в 100 раз выше, чем в общей популяции.
Приступы острой порфирии могут быть спровоцированы эндогенными или экзогенными факторами. Механизмы, посредством которых такие факторы индуцируют приступы, могут включать например, повышенную потребность в печеночных ферментах P450 и/или индукцию активности ALAS1 в печени. Повышенная потребность в печеночных ферментах P450 приводит к уменьшению свободного гема в печени и, тем самым, к индукции синтеза печеночной ALAS1.
Провоцирующие факторы включают голодание (или другие формы пониженной или неполноценной калорийности потребляемой пищи, вследствие жестких диет, занятий бегом на длинные дистанции и т.д.), метаболические стрессы (например, инфекции, хирургическую операцию, международные авиационные перелеты и психологический стресс), эндогенные гормоны (например, прогестерон), курение сигарет, растворимые в липидах чужеродные химические вещества (включая, например, химические вещества, присутствующие в табачном дыму, некоторые лекарственные средства, отпускаемые по рецепту, органические растворители, биоциды, компоненты алкогольных напитков), эндокринные факторы (например, половые гормоны (женщины могут испытывать обострения во время предменструального периода), синтетические эстрогены, прогестероны, стимуляторы овуляции и гормонозаместительную терапию). См., например, Thunell (1993).
Более 1000 лекарственных средства противопоказано при острых печеночных порфириях (например, AIP, HCP, ADP и VP), включая, например, спирт, барбитураты, карбамазепин, карисопродол, клоназепам (высокие дозы), даназол, диклофенак и возможно другие НПВС, алкалоиды спорыньи, эстрогены, этхлорвинол, глутетимид, гризеофульвин, мефенитоин, мепробамат (также мебутамат и тибутамат), метиприлон, методопрамид, фенитоин, примидон, прогестерон и синтетические прогестины, пиразинамид, пиразолоны (аминопурин и антипирин), рифампин, сукцинимиды (этосуксимид и метсуксимид), сульфонамидные антибиотики и вальпроевую кислоту.
Объективные симптомы AIP включают изменение окраски мочи во время острого приступа (моча может казаться красной или красно-коричневой) и повышенные концентрации PBG и ALA в моче во время острого приступа. Молекулярно-генетическое тестирование выявляет мутации в гене PBG-дезаминазы (также известной как HMBS) у более чем 98% пораженных заболеванием людей. Thunell (1993).
Дифференциальная диагностика порфирий может включать в себя определение типа порфирии путем измерения индивидуальных уровней порфиринов или предшественников порфиринов (например, ALA, PBG) в моче, кале и/или плазме (например, с использованием хроматографии и флуорометрии) во время приступа. Диагноз AIP может быть подтвержден, благодаря установлению того, что активность PBG-дезаминазы эритроцитов составляет 50% или меньше от нормального уровня. ДНК-тестирование в отношении мутаций может быть осуществлено у пациентов и подверженных риску членов семьи. Диагноз AIP обычно подтверждают, используя тестирование ДНК, чтобы идентифицировать специфичную вызывающую заболевание генную мутацию (например, мутацию HMBS).
Лечение острых приступов обычно требует госпитализации, чтобы контролировать и лечить острые симптомы, включая, например, боль в области живота, судороги, обезвоживание/гипонатриемию, тошноту/рвоту, тахикардию/гипертонию, задержку мочеиспускания/непроходимость кишечника. Например, боль в области живота можно лечить, например, наркотическими анальгетиками, судороги можно лечить, принимая превентивные меры против судорог и возможно лекарственные средства (хотя многие противосудорожные лекарственные средства противопоказаны), тошноту/рвоту можно лечить, например, фенотиазинами, и тахикардию/гипертонию можно лечить, например, бета-блокаторами. Лечение может включать в себя отмену опасных лекарственных средств, мониторинг дыхательной функции, а также мышечной силы и неврологического статуса. Слабые приступы (например, приступы без пареза или гипонатриемии) можно лечить, используя, по меньшей мере, 300 г внутривенной 10% глюкозы в сутки, хотя в последнее время все чаще немедленно дают гемин. Тяжелые приступы следует лечить как можно скорее, используя внутривенный гемин (3-4 мг/кг сутки в течение 4-14 дней) и внутривенную глюкозу, пока ожидают эффекта от внутривенного введения гемина. Обычно приступы лечат, используя внутривенный гемин в течение 4 дней и внутривенную глюкозу в период ожидания эффекта от введения внутривенного гемина.
Гемин (пангематин® или гемин для инъекций, ранее известный как гематин) является единственным продуктом гема, разрешенным к применению в Соединенных Штатах, и был первым лекарственным средством, разрешенным законом о лекарственных средствах для лечения редких заболеваний. Пангематин® представляет собой гемин, полученный из обработанных эритроцитов (PRBC), и является протопорфирином IX, содержащим ион трехвалентного железа (гем B) с хлоридным лигандом. Гем действует, ограничивая синтез порфирина в печени и/или костном мозге. Точный механизм, посредством которого гемин вызывает симптоматическое улучшение у пациентов с острыми эпизодами печеночных порфирий, не установлен; однако его действие вероятно является следствием (обратного) ингибирования синтазы δ-аминолевулиновой кислоты (ALA), фермента, который ограничивает скорость пути биосинтеза порфирина/гема. См. этикетку к продукту пангемину®, Lundbeck, Inc., October 2010. Ингибирование ALA-синтазы должно приводить к пониженной продукции ALA и PBG, а также порфиринов и промежуточных продуктов синтеза порфиринов.
Недостатки гемина включают его замедленное влияние на клинические симптомы и его неспособность предотвращать рецидивы приступов. Неблагоприятные реакции, ассоциированные с введением гемина, могут включать тромбофлебит, антикоагулирующее действие, тромбоцитопению, остановку работы почек или перенасыщение железом, которое особенно вероятно у пациентов, которым требуются многократные курсы лечения гемином в связи с повторными приступами. Чтобы предотвратить флебит, необходим постоянный венозный катетер для доступа у пациентов с повторяющимися приступами. Необычные побочные эффекты включают лихорадку, болевые ощущения, недомогание, гемолиз, анафилаксию и циркуляционный коллапс. См. Anderson, K.E., Approaches to Treatment and Prevention of Human Porphyrias, in The Porphyrin Handbook: Medical Aspects of Porphyrins, Edited by Karl M. Kadish, Kevin M. Smith, Roger Guilard (2003)(далее Anderson).
Гем трудно получить в стабильной форме для внутривенного введения. Он нерастворим при нейтральном значении pH, но может быть получен в виде гидроксида гема при pH 8 или выше (Anderson). Пангематин представляет собой лиофилизированный препарат гемина. Когда лиофилизированный гемин растворяют для внутривенного введения, быстро образуются продукты распада; такие продукты распада ответственны за временное антикоагулянтное действие и флебит в месте инфузии (Anderson). Гемальбумин и аргинат гема (нормосанг, европейский вариант гемина) являются более стабильными и потенциально могут в меньшей степени вызывать тромбофлебит. Однако аргинат гема не разрешен для применения в Соединенных Штатах. Пангемин может быть стабилизирован при его солюбилизации для инфузии в 30% альбумине человека, а не в стерильной воде; однако, альбумин усиливает эффекты увеличения внутрисосудистого объема и повышает стоимость лечения, а также риск попадания патогенов, так как его выделяют из крови человека. См., например, публикацию Anderson.
Успешное лечение острого приступа не предотвращает или не задерживает появления рецидива. Возникает вопрос, может ли сам гемин запускать повторяющиеся приступы, вследствие индукции гемоксигеназы. При этом в некоторых регионах (особенно во Франции) молодых женщин с многократными повторяющимися приступами лечат еженедельным введением гемина в профилактических целях.
Ограниченный опыт по трансплантации печени свидетельствует о том, что в случае успеха это приводит к эффективному лечению AIP. Проведено примерно 12 трансплантаций пациентам в Европе с излечением или различными эффектами. Трансплантация печения может восстанавливать нормальную экскрецию ALA и PBG и предотвращать острые приступы. См., например, публикацию Dar F.S. с соавторами (Hepatobiliary Pancreat. Dis. Int., 9(1): 93-96 (2010)). Кроме того, если печень пациента с AIP трансплантировать другому пациенту («трансплантация по принципу домино»), у пациента, получающего трансплантат, может развиваться AIP.
Среди длительных клинических эффектов острых порфирий имеет место хроническая нейропатическая боль, которая может возникать в результате прогрессирующей нейропатии, вследствие нейротоксических эффектов, например, повышенных уровней предшественников порфиринов (например, ALA и/или PBG). Пациенты могут страдать от нейропатической боли до или во время острого приступа. Пациенты пожилого возраста с возрастом могут испытывать усиленную нейропатическую боль, по поводу которой обычно назначают различные наркотические лекарственные средства. Нарушения на электромиограммах и уменьшенное время проведения возбуждения было документально подтверждено у пациентов с острыми печеночными порфириями. Следует отметить, что у необработанных, не подвергаемых индукции мышей с AIP (недостаточность PBG-дезаминазы) развивается прогрессирующая моторная нейропатия, которая, как было показано, вызывает прогрессирующую дегенерацию и утрату аксонов четырехглавой мышцы и, предположительно, вследствие конститутивно повышенных уровней предшественников порфирина (ALA и PBG), недостаточности порфиринов и/или гема (Lindberg с соавторами, J. Clin. Invest., 103(8): 1127-1134, 1999). У пациентов с острой порфирией (например, ADP, AIP, HCP или VP) уровни предшественников порфиринов (ALA и PBG) часто повышены у пациентов, не имеющих симптомов, и у пациентов с симптомами между приступами. Таким образом, предполагается, что снижение уровней предшественников порфиринов и восстановление нормального процесса биосинтеза гема за счет снижения уровня экспрессии и/или активности ALAS1, предотвращает и/или минимизирует развитие хронической и прогрессирующей нейропатии. Лечение, например, хроническое лечение (например, периодическое лечение с использованием и-РНК, которая описана в настоящей публикации, например, лечение в соответствии со схемой дозирования, которая описана в настоящей публикации, например, лечение еженедельно или раз в две недели) может непрерывно снижать экспрессию ALAS1 у пациентов с острой порфирией, которые имеют повышенные уровни предшественников порфиринов, порфиринов, продуктов порфиринов или их метаболитов. Такое лечение может быть осуществлено при необходимости, чтобы предотвратить или уменьшить частоту или тяжесть симптомов у отдельных пациентов (например, боль и/или нейропатию) и/или снизить уровень предшественника порфирина, порфирина, продукта или метаболита порфирина.
Существует необходимость в идентификации новых терапевтических средств, которые можно применять для лечения порфирий. Как обсуждалось выше, существующие средства лечения, такие гемин, имеют многочисленные недостатки. Например, влияние гемина на клинические симптомы замедлено, он дорого стоит, и он может иметь побочные эффекты (например, тромбофлебит, антикоагулирующее действие, тромбоцитопению, перенасыщение железом, остановку работы почек). Новые терапевтические средства, такие как средства, описанные в настоящей публикации, могут устранить такие недостатки и обеспечить неудовлетворенную потребность пациентов, например, действуя быстрее, не индуцируя флебит, обеспечивая возможность подкожного введения, успешно предотвращая повторные приступы, предотвращая или ослабляя боль (например, хроническую нейропатическую боль) и/или прогрессирующую нейропатию, и/или не вызывая некоторых неблагоприятных эффектов, ассоциированных с гемином (например, перенасыщение железом, повышенный риск возникновения гепатоклеточного рака).
Настоящее изобретение относится к способам и композициям и-РНК для модулирования экспрессии гена ALAS1. В некоторых вариантах экспрессию ALAS1 снижают или ингибируют, используя ALAS1-специфичную и-РНК, что приводит к пониженной экспрессии гена ALAS1. Пониженная экспрессия гена ALAS1 может снижать уровень одного или нескольких предшественников порфиринов, порфиринов или продуктов или метаболитов порфиринов. Пониженная экспрессия гена ALAS1, а также связанные снижения уровня одного или нескольких предшественников порфиринов и/или порфиринов могут быть полезны при лечении расстройств, связанных с экспрессией ALAS1, например, порфирий.
и-РНК в композициях, охарактеризованных в настоящем описании, включают РНК-нить (антисмысловую нить), имеющую область, которая имеет длину 30 нуклеотидов или меньше, т.е., длиной 15-30 нуклеотидов, обычно длиной 19-24 нуклеотида, и такая область в значительной степени комплементарна, по меньшей мере, части транскрипта мРНК гена ALAS1 (также называемую в настоящем описании «ALAS1-специфичной и-РНК»). Применение такой и-РНК делает возможным целенаправленный распад мРНК генов, которые вовлечены в патологии, ассоциированные с экспрессией ALAS1 у млекопитающих, например, порфирии, такие как порфирия с недостаточностью ALA-дегидрогеназы (ночная порфирия) или острая интермиттирующая порфирия. Очень низкие дозы ALAS1-специфичных и-РНК могут специфично и эффективно опосредовать РНК-и, приводящую к значительному ингибированию экспрессии гена ALAS1. и-РНК, мишенью которой является ALAS1, может специфично и эффективно опосредовать РНК-и, приводящую к значительному ингибированию экспрессии гена ALAS1, например, в основанных на клетках анализах. Таким образом, способы и композиции, содержащие такие и-РНК, применимы для лечения патологических процессов, связанных с экспрессией ALAS1, таких как порфирии (например, X-сцепленная сидеробластная анемия (XLSA), порфирия вследствие недостаточности ALA-дегидратазы (ночная порфирия), острая интермиттирующая порфирия (AIP), врожденная эритропоэтическая порфирия, поздняя кожная порфирия, наследственная копропорфирия (копропорфирия), смешанная порфирия, эритропоэтическая протопорфирия (EPP) и временная эритропорфирия новорожденных).
В следующем далее описании раскрыто, как получать и применять композиции, содержащие и-РНК, чтобы ингибировать экспрессию гена ALAS1, а также композиции и способы лечения заболеваний и расстройств, вызванных или модулированных экспрессией такого гена. Варианты фармацевтических композиций, охарактеризованных в изобретении, включают и-РНК, имеющую антисмысловую нить, содержащую область, которая имеет длину 30 нуклеотидов или меньше, обычно длиной 19-24 нуклеотида, и такая область в значительной степени комплементарна, по меньшей мере, части транскрипта мРНК гена ALAS1, наряду с фармацевтически приемлемым носителем. Варианты композиций, охарактеризованных в изобретении, также включают в себя и-РНК, имеющую антисмысловую нить, содержащую область комплементарности, которая имеет длину 30 нуклеотидов или меньше, обычно длиной 19-24 нуклеотида, и в значительной степени комплементарна, по меньшей мере, части транскрипта РНК гена ALAS1.
Соответственно, в некоторых аспектах в изобретении охарактеризованы фармацевтические композиции, содержащие и-РНК ALAS1 и фармацевтически приемлемый носитель, способы применения композиций для ингибирования экспрессии гена ALAS1 и способы применения фармацевтических композиций для лечения расстройств, связанных с экспрессией ALAS1.
I. Определения
Для удобства ниже приведены значения некоторых терминов и фраз, используемых в описании, примерах и прилагаемой формуле изобретения. Если есть явное расхождение между использованием термина в других частях настоящего описания и его определением, приведенным в настоящем разделе, определение в данном разделе имеет преимущественную силу.
Каждый из «G», «C», «A», «T» и «U» означает нуклеотид, который содержит гуанин, цитозин, аденин, тимидин и урацил в качестве основания, соответственно. Однако, будет понятно, что термин «рибонуклеотид» или «нуклеотид» также может относиться к модифицированному нуклеотиду, который подробно описан ниже, или к заменяющему остатку. Специалисту хорошо известно, что гуанин, цитозин, аденин и урацил могут быть заменены другими остатками без существенного изменения, относящихся к спариванию оснований свойств олигонуклеотида, содержащего нуклеотид, несущий такой заменяющий остаток. Например, и без ограничения нуклеотид, содержащий инозин в качестве основания, может образовывать пары оснований с нуклеотидами, содержащими аденин, цитозин или урацил. Следовательно, нуклеотиды, содержащие урацил, гуанин или аденин, могут быть заменены в нуклеотидных последовательностях днРНК, охарактеризованной в изобретении, нуклеотидом, содержащим, например, инозин. В другом примере, аденин и цитозин в любом месте олигонуклеотида могут быть заменены гуанином и урацилом, соответственно, с образованием неоднозначных пар оснований G-U с мРНК-мишенью. Последовательности, содержащие такие заменяющие остатки, являются подходящими для композиций и способов, охарактеризованных в изобретении.
В используемом в настоящем описании смысле «ALAS1» (также известный как ALAS-1; δ-аминолевулинатсинтаза 1; δ-ALA-синтаза 1; синтаза 1 5'-аминолевулиновой кислоты 1; ALAS-H; ALASH; ALAS-N; ALAS3; EC2.3.1.37; 5-аминолевулинатсинтаза, неспецифичная митохондриальная; ALAS; MIG4; OTTHUMP00000212619; OTTHUMP00000212620; OTTHUMP00000212621; OTTHUMP00000212622; индуцирующий миграцию белок 4; EC 2.3.1) относится к кодируемому в ядре митохондриальному ферменту, который является первым и обычно ограничивающим скорость ферментом в пути биосинтеза гема млекопитающих. ALAS1 катализирует конденсацию глицина с сукцинил-CoA с образованием δ-аминолевулиновой кислоты (ALA). Ген ALAS1 человека экспрессируется повсеместно, находится в хромосоме 3p21.1 и обычно кодирует последовательность из 640 аминокислот. Напротив, ген ALAS-2, который кодирует изозим, экспрессируется только в эритроцитах, находится в хромосоме Xp11.21 и обычно кодирует последовательность длиной 550 аминокислот. В используемом в настоящем описании смысле «белок ALAS1» означает любой вариант белка ALAS1 из любого вида (например, человека, мыши, примата, отличного от человека), а также любые его мутанты и фрагменты, которые сохраняют активность ALAS1. Подобным образом «транскрипт ALAS» относится к любому варианту транскрипта ALAS1 из любого вида (например, человека, мыши, примата, отличного от человека). Последовательность транскрипта мРНК варианта 1 ALAS1 человека можно найти под номером NM_000688.4 (фиг. 3; SEQ ID NO: 1). Другой вариант, транскрипт мРНК варианта 2 ALAS1 человека можно найти под номером NM_000688.5 (фиг. 4; SEQ ID NO: 382). Уровень зрелого кодируемого ALAS1 белка регулируется гемом: высокие уровни гема понижающим образом регулируют зрелый фермент в митохондриях, тогда как низкие уровни гема приводят к повышающей регуляции. Идентифицированы множественные альтернативно сплайсируемые варианты, кодирующие один и тот же белок.
В используемом в настоящем описании смысле термин «и-РНК», «РНК-и», «и-РНК-средство» или «РНК-и-средство» относится к средству, которое содержит РНК в соответствии с термином, который определен в настоящем описании, и которое опосредует целенаправленное расщепление РНК-транскрипта, например, посредством путем РНК-индуцируемого комплекса сайленсинга (RISC). В одном варианте и-РНК, которая описана в настоящей публикации, осуществляет ингибирование экспрессии ALAS1. Ингибирование экспрессии ALAS1 можно оценить на основе снижения уровня мРНК ALAS1 или снижения уровня белка ALAS1. В используемом в настоящем описании смысле «последовательность-мишень» относится к непрерывной части нуклеотидной последовательности молекулы мРНК, образованной в ходе транскрипции гена ALAS1, включая мРНК, которая является продуктом РНК-процессинга первичного продукта транскрипции. Часть-мишень последовательности будет, по меньшей мере, такой длины, которая достаточна для того, чтобы она служила субстратом для и-РНК-направленного расщепления в такой части или вблизи такой части. Например, последовательность-мишень в общем может быть длиной 9-36 нуклеотидов, например, длиной 15-30 нуклеотидов, включая все поддиапазоны между указанными значениями. В качестве не ограничивающих примеров последовательность-мишень может быть длиной 15-30 нуклеотидов, 15-26 нуклеотидов, 15-23 нуклеотида, 15-22 нуклеотида, 15-21 нуклеотид, 15-20 нуклеотидов, 15-19 нуклеотидов, 15-18 нуклеотидов, 15-17 нуклеотидов, 18-30 нуклеотидов, 18-26 нуклеотидов, 18-23 нуклеотида, 18-22 нуклеотида, 18-21 нуклеотид, 18-20 нуклеотидов, 19-30 нуклеотидов, 19-26 нуклеотидов, 19-23 нуклеотида, 19-22 нуклеотида, 19-21 нуклеотид, 19-20 нуклеотидов, 20-30 нуклеотидов, 20-26 нуклеотидов, 20-25 нуклеотидов, 20-24 нуклеотида, 20-23 нуклеотида, 20-22 нуклеотида, 20-21 нуклеотид, 21-30 нуклеотидов, 21-26 нуклеотидов, 21-25 нуклеотидов, 21-24 нуклеотида, 21-23 нуклеотида или 21-22 нуклеотида.
В используемом в настоящем описании смысле термин «нить, содержащая последовательность» относится к олигонуклеотиду, содержащему цепь нуклеотидов, которая описана последовательностью, обозначаемой с использованием стандартной номенклатуры нуклеотидов.
В используемом в настоящем описании смысле, и если не указано иное, термин «комплементарная» при использовании для описании первой нуклеотидной последовательности в сравнении со второй нуклеотидной последовательностью относится к способности олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, гибридизоваться и образовывать структуру дуплекса в некоторых условиях с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, что будет понятно специалисту. Такие условия могут представлять собой, например, жесткие условия, при этом жесткие условия могут включать: 400 мМ NaCl, 40 мМ PIPES pH 6,4, 1 мМ EDTA, 50°C или 70°C в течение 12-16 часов с последующей промывкой. Могут быть применимы другие условия, такие как физиологически подходящие условия, которые могут иметь место в нутрии организма. Специалист сможет определить набор условий, наиболее подходящих для проверки комплементарности двух последовательностей в соответствии с конечным применением гибридизуемых нуклеотидов.
Комплементарные последовательности в и-РНК, например, в днРНК, которая описана в настоящей публикации, включают спаривание оснований олигонуклеотида или полинуклеотида, содержащего первую нуклеотидную последовательность, с олигонуклеотидом или полинуклеотидом, содержащим вторую нуклеотидную последовательность, по всей длине одной или обеих нуклеотидных последовательностей. Такие последовательности могут быть названы в настоящем описании «полностью комплементарными» друг другу. Однако когда первую последовательность называют в настоящем описании «в значительной степени комплементарной» второй последовательности, две последовательности могут быть полностью комплементарными или они могут образовывать одну или несколько, но обычно не более 5, 4, 3 или 2 несовпадающих пар оснований при гибридизации в случае дуплекса длиной до 30 пар оснований, хотя при этом сохраняют способность гибридизоваться в условиях, наиболее подходящих для конечного применения, например, ингибирования экспрессии генов посредством пути RISC. Однако, когда два олигонуклеотида сконструированы для образования при гибридизации одного или нескольких однонитевых выступающих концов, такие выступающие концы не следует считать несовпадениями оснований при определении комплементарности. Например, днРНК, содержащая один олигонуклеотид длиной 21 нуклеотид и другой олигонуклеотид длиной 23 нуклеотида, в которой более длинный олигонуклеотид содержит последовательность из 21 нуклеотида, которые полностью комплементарны более короткому олигонуклеотиду, все еще можно называть «полностью комплементарной в целях, описанных в настоящей публикации.
«Комплементарные» последовательности в используемом в настоящем описании смысле также могут включать в себя или могут быть полностью образованы парами оснований, не соответствующими модели Уотосона-Крика, и/или парами оснований, образованными из неприродных и модифицированных нуклеотидов, в такой мере, чтобы были удовлетворены указанные выше требования в отношении их способности к гибридизации. Такие не соответствующие модели Уотсона-Крика пары оснований включают без ограничения неоднозначное спаривание оснований G:U или Хустиновские пары оснований.
Термины «комплементарные», «полностью комплементарные» и «в значительной степени комплементарные» в настоящем описании могут быть использованы по отношению к спариванию основания между смысловой нитью и антисмысловой нитью днРНК или между антисмысловой нитью и-РНК-средства и последовательностью-мишенью, что будет понятно в контексте их применения.
В используемом в настоящем описании смысле полинуклеотид, который «в значительной степени комплементарен», по меньшей мере, части матричной РНК (мРНК), относится к полинуклеотиду, который в значительной степени комплементарен непрерывной части, представляющей интерес мРНК (например, мРНК, кодирующей белок ALAS1). Например, полинуклеотид комплементарен, по меньшей мере, части мРНК ALAS1, если последовательность в значительной степени комплементарная непрерывной части мРНК, кодирующей ALAS1. В качестве другого примера полинуклеотид комплементарен, по меньшей мере, части мРНК ALAS1, если последовательность в значительной степени комплементарна непрерывной части мРНК, кодирующей ALAS1.
Термин «двунитевая РНК» или «днРНК» в используемом в настоящем описании смысле относится к и-РНК, которая включает молекулу РНК или комплекс молекул, имеющих гибридизуемую область дуплекса, которая содержит две антипараллельных и в значительной степени комплементарных нитей нуклеиновой кислоты, которые могут быть обозначены, как имеющие «смысловую» и «антисмысловую» ориентации по отношению к РНК-мишени. Область дуплекса может быть любой длины, которая обеспечивает возможность специфичного распада требуемой РНК-мишени, например, посредством пути RISC, но обычно будет иметь длину в диапазоне от 9 до 36 пар оснований, например, длину 15-30 пар оснований. При рассмотрении дуплекса длиной от 9 до 36 пар оснований дуплекс может быть любой длины в данном диапазоне, например, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35 или 36, и любом поддиапазоне в данном диапазоне, включая без ограничения 15-30 пар оснований, 15-26 пар оснований, 15-23 пары оснований, 15-22 пары оснований, 15-21 пару оснований, 15-20 пар оснований, 15-19 пар оснований, 15-18 пар оснований, 15-17 пар оснований, 18-30 пар оснований, 18-26 пар оснований, 18-23 пары оснований, 18-22 пары оснований, 18-21 пару оснований, 18-20 пар оснований, 19-30 пар оснований, 19-26 пар оснований, 19-23 пары оснований, 19-22 пары оснований, 19-21 пару оснований, 19-20 пар оснований, 20-30 пар оснований, 20-26 пар оснований, 20-25 пар оснований, 20-24 пары оснований, 20-23 пары оснований, 20-22 пары оснований, 20-21 пару оснований, 21-30 пар оснований, 21-26 пар оснований, 21-25 пар оснований, 21-24 пары оснований, 21-23 пары оснований или 21-22 пары оснований. днРНК, образованные в клетке в результате процессинга с участием дайсер-фермента и сходных ферментов обычно имеют длину в диапазоне 19-22 пары оснований. Одна нить области дуплекса днДНК содержит последовательность, которая в значительной степени комплементарна области РНК-мишени. Две нити, образующие структуру дуплекса, могут быть из одной молекулы РНК, имеющей, по меньшей мере, одну самокомплементарную область, или могут быть образованы из двух или более отдельных молекул РНК. В том случае, когда область дуплекса образована из двух нитей одной молекулы, молекула может иметь область дуплекса, разделенную однонитевой цепью нуклеотидов (называемой в настоящем описании «петлей типа шпильки»), находящейся между 3'-концом одной нити и 5'-концом соответствующей другой нити, образующих структуру дуплекса. Петля типа шпильки может содержать, по меньшей мере, одни неспаренный нуклеотид; в некоторых вариантах петля типа шпильки может содержать, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 20, по меньшей мере 23 или больше неспаренных нуклеотидов. В том случае, когда две в значительной степени комплементарные нити днРНК состоят из отдельных молекул РНК, такие молекулы не обязательно, но могут быть ковалентно связаны. В том случае, когда две нити ковалентно связаны другим образом, отличным от петли типа шпильки, соединяющую структуру называют «линкером». Термин «ми-РНК» также используют в настоящем описании по отношению к днРНК, которая описана выше.
В другом варианте и-РНК-средство может представлять собой «однонитевую ми-РНК», которую вводят в клетку или организм для ингибирования мРНК-мишени. Средства в виде однонитевых РНК-и связываются с RISC-эндонуклеазой Argonaute 2, которая затем расщепляет мРНК-мишень. Однонитевые ми-РНК обычно имеют длину 15-30 нуклеотидов и химически модифицированы. Конструирование и тестирование однонитевых ми-РНК описано в патенте США № 8101348 и в публикации Lima с соавторами (2012), Cell 150: 883-894, при этом полное содержание каждой из публикаций включено в настоящее описание в виде ссылки. Любую из антисмысловых нуклеотидных последовательностей, описанных в настоящей публикации, (например, последовательности, представленные в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20) можно применять в качестве однонитевой ми-РНК, которая описана в настоящей публикации, или в после химической модификации способами, описанными Lima с соавторами, (2012) Cell 150: 883-894.
В другом аспекте РНК-средство представляет собой «однонитевую антисмысловую молекулу РНК». Однонитевая антисмысловая молекула РНК комплементарная последовательности в мРНК-мишени. Однонитевые антисмысловые молекулы РНК могут ингибировать трансляцию стехиометрическим образом за счет спаривания оснований с мРНК и создания физического препятствия для аппарата трансляции, См. публикацию Dias N. С соавторами (2002) Mol. Cancer. Ther. 1: 347-355. Альтернативно однонитевые антисмысловые молекулы ингибируют мРНК-мишень за счет гибридизации с мишенью и расщепления мишени в результате события расщепления РНК-азой H. Однонитевая антисмысловая молекула РНК может иметь длину примерно от 10 до примерно 30 нуклеотидов и иметь последовательность, которая комплементарна последовательности-мишени. Например, однонитевая антисмысловая молекула РНК может содержать последовательность, которая представляет собой, по меньшей мере, примерно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше непрерывно следующих друг за другом нуклеотидов из любой из антисмысловых нуклеотидных последовательностей, описанных в настоящей публикации, например, последовательностей, представленных в любой из таблиц 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20.
Специалисту в данной области будет понятно, что термины «молекула РНК» или «молекула рибонуклеиновой кислоты» охватывают не только молекулы РНК, которые экспрессируются и встречаются в природе, но также аналоги и производные РНК, содержащие один или несколько аналогов или производных рибонуклеотидов/рибонуклеозидов, которые описаны в настоящей публикации или которые известны в данной области. Строго говоря, «рибонуклеозид» включает нуклеозидное основание и сахар рибозу, а «рибонуклеотид» представляет собой рибонуклеозид с одним, двумя или тремя остатками фосфата. Однако термины «рибонуклеозид» и «рибонуклеотид» можно считать эквивалентными в используемом в настоящем описании смысле. РНК может быть модифицирована в структуре оснований нуклеотидов или в структуре рибозо-фосфатного остова, например, как описано в настоящей публикации ниже. Однако молекулы, содержащие аналоги или производные рибонуклеозидов, должны сохранять способность образовывать дуплекс. В качестве не ограничивающих примеров молекула РНК также включает в себя, по меньшей мере, один модифицированный рибонуклеозид, включая без ограничения модифицированный 2'-O-метилом нуклеозид, нуклеозид, содержащий 5'-фосфоротиоатную группу, концевой нуклеозид, связанный с производным холестерина или группой бисдециламида додекановой кислоты, закрытый нуклеозид, лишенный основания нуклеозид, модифицированный 2'-дезокси-2'-фтором нуклеозид, 2'-амино-модифицированный нуклеозид, 2'-алкил-модифицированный нуклеозид, морфолинонуклеозид, содержащий фосфорамидат или неприродное основание нуклеозид или любое их сочетание. Альтернативно молекула РНК может содержать, по меньшей мере, два модифицированных рибонуклеозида, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20 или больше до полной длины молекулы днРНК. Модификации не должны быть обязательно одинаковыми в случае каждого из множества модифицированных рибонуклеозидов в молекуле РНК. В одном варианте модифицированные РНК, которые предполагают применять в способах и композициях, описанных в настоящей публикации, представляют собой пептидонуклеиновые кислоты (ПНК), которые обладают способностью образовывать требуемую структуру дуплекса и которые обеспечивают возможность или опосредуют специфичный распад РНК-мишени, например, посредством пути RISC.
В одном аспекте модифицированный рибонуклеозид включает дезоксирибонуклеозид. В таком случае средство в виде и-РНК может содержать один или несколько дезоксинуклеозидов, включая, например, дезоксинуклеозидный липкий конец(цы) или один или несколько дезоксинуклеозидов в двунитевой части днРНК. Однако, само собой разумеется, что ни при каких обстоятельствах термин «и-РНК» не охватывает молекулу двунитевой ДНК.
В одном аспекте средство для РНК-интерференции включает однонитевую РНК, которая взаимодействует с последовательностью РНК-мишени, запуская расщепление РНК-мишени. Не имея намерения быть связанными с какой-либо теорией, полагают, что длинная двунитевая РНК, вводимая в клетки, разрушается с образованием ми-РНК эндонуклеазой типа III, известной как эндонуклеаза Дайсер (Sharp с соавторами, Genes Dev. 2001, 15: 485). Дайсер, фермент рибонуклеаза типа III, процессирует днРНК на короткие интерферирующие РНК длиной 19-23 пары оснований с характерными 3'-линейными концами длиной в два основания (Bernstein с соавторами, (2001) Nature 409: 363). Затем ми-РНК включаются в РНК-индуцируемый комплекс сайленсинга (RISC), где одна или несколько геликаз расплетают дуплекс ми-РНК, позволяя комплементарной антисмысловой нити осуществлять узнавание мишени (Nykanen с соавторами, (2001) Cell 107: 309). После связывания с соответствующей мРНК-мишенью, одна или несколько эндонуклеаз в RISC расщепляют мишень, индуцируя сайленсинг (Elbashir с соавторами (2001) Genes Dev. 15: 188). Таким образом, в одном аспекте изобретение относится к однонитевой РНК, которая стимулирует образование комплекса RISC, чтобы вызвать сайленсинг гена-мишени.
В используемом в настоящем описании смысле термин «нуклеотидный липкий конец» относится, по меньшей мере, к одному неспаренному нуклеотиду, который выдается из структуры дуплекса и-РНК, например, днРНК. Например, когда 3'-конец одной нити днРНК выступает за пределы 5'-конца другой нити или наоборот, имеет место нуклеотидный липкий конец. днРНК может содержать липкий конец длиной, по меньшей мере, в один нуклеотид; альтернативно липкий конец может содержать, по меньшей мере, два нуклеотида, по меньшей мере, три нуклеотида, по меньшей мере, четыре нуклеотида, по меньшей мере, пять нуклеотидов или больше. Нуклеотидный липкий конец может содержать или состоять из аналога нуклеотида/нуклеозида, включая дезоксинуклеотид/нуклеозид. липкий конец(цы) может быть на смысловой нити, антисмысловой нити или их сочетании. Кроме того, нуклеотид(ды) липкого конца может присутствовать на 5'-конце, 3'-конце или обоих концах либо антисмысловой, либо смысловой нити днРНК.
В одном варианте антисмысловая нить днРНК имеет липкий конец из 1-10 нуклеотидов на 3'-конце и/или 5'-конце. В одном варианте смысловая нить днРНК имеет липкий конец из 1-10 нуклеотидов на 3'-конце и/или 5'-конце. В другом варианте один или несколько нуклеотидов липкого конца заменяют тиофосфатом нуклеозида.
Термины «тупой» или «имеющий тупые концы» в используемом в настоящем описании смысле в отношении днРНК означает, что нет неспаренных нуклеотидов или аналогов нуклеотидов на данном конце днРНК, т.е., не нуклеотидного липкого конца. Один или оба конца днРНК могут быть тупыми. В том случае, когда оба конца днРНК являются тупыми, говорят, что днРНК имеет тупые концы. Для ясности «имеющая тупые концы» днРНК представляет собой днРНК, которая является тупой на обоих концах, т.е., нет нуклеотидного липкого конца ни одном конце молекулы. Чаще всего такая молекула будет двунитевой на протяжении всей ее длины.
Термин «антисмысловая нить» или «направляющая нить» относится к нити и-РНК, например, днРНК, которая содержит область, которая в значительной степени комплементарна последовательности-мишени. В используемом в настоящем описании смысле термин «область комплементарности» относится к области на антисмысловой нити, которая в значительной степени комплементарна последовательности, например, последовательности-мишени, которая определена в настоящем описании. В том случае, когда область комплементарности не полностью комплементарна последовательности-мишени, несоответствующие спаривания могут быть во внутренних или концевых областях молекулы. Обычно наиболее допустимые несоответствующие спаривания находятся в концевых областях, например, в пределах 5, 4, 3 или 2 нуклеотидов 5'- и/или 3'-конца.
Термин «смысловая нить» или «сопровождающая нить» в используемом в настоящем описании смысле относится к нити и-РНК, которая содержит область, которая в значительной степени комплементарна области антисмысловой нити в соответствии с термином, который определен в настоящем описании.
В используемом в настоящем описании смысле термин «SNALP» относится к стабильной частице нуклеиновой кислоты-липида. SNALP означает везикулу из липидов, покрывающих уменьшенное водное внутреннее пространство, содержащее нуклеиновую кислоту, такую как и-РНК или плазмида, с которой и-РНК транскрибируется. SNALP описаны, например, в публикациях заявок на выдачу патента США № 20060240093, 20070135372 и в международной заявке № WO 2009082817. Указанные заявки включены в настоящее описание в виде ссылки в полном объеме.
«Введение в клетку» в отношении и-РНК означает облегчение или осуществление захвата или абсорбции в клетку, как понятно специалистам в данной области. Абсорбция или захват и-РНК могут быть осуществлены посредством самостоятельных диффузионных или активных клеточных процессов или посредством вспомогательных средств или устройств. Значение такого термина не ограничено клетками in vitro; и-РНК также может быть «введена в клетку» в том случае, когда клетка является частью живого организма. В таком случае введение в клетку будет включать доставку в организм. Например, в случае доставки in vivo и-РНК может быть инъецирована в участок ткани или введена системно. Доставка in vivo также может быть осуществлена с использованием системы доставки β-глюкана, такой как системы, описанные в патентах США №5032401 и 5607677 и в публикации США №2005/0281781, которые включены в настоящее описание в виде ссылки в полном объеме. Введение in vitro в клетку включает способы, известные в данной области, такие как электропорация и липофекция. Дополнительные способы описаны в настоящей публикации ниже или известны в данной области.
В используемом в настоящем описании смысле термин «модулировать экспрессию» относится, по меньшей мере, к частичному «ингибированию» или частичной «активации» экспрессии гена ALAS1 в клетке, обработанной композицией и-РНК, которая описана в настоящей публикации, по сравнению с экспрессией ALAS1 в контрольной клетке. Контрольная клетка включает необработанную клетку или клетку, обработанную не направленной к мишени контрольной и-РНК.
Термины «активировать», «усиливать», «осуществлять повышающую регуляцию экспрессии», «увеличивать экспрессию», и тому подобные в той части, в которой они относятся к гену ALAS1, в настоящем описании относятся, по меньшей мере, к частичной активации экспрессии гена ALAS1, которая проявляется в увеличении количества мРНК ALAS1, которая может быть выделена или может быть выявлена в первой клетке или группе клеток, в которых ген ALAS1 транскрибируется, и которая была или которые были обработаны так, чтобы повысить экспрессию гена ALAS1, по сравнению со второй клеткой или группой клеток, по существу идентичных первой клетке или группе клеток, но которая не была или которые не были обработаны таким образом (контрольные клетки).
В одном варианте экспрессию гена ALAS1 активируют, по меньшей мере, примерно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% введением и-РНК, которая описана в настоящей публикации. В некоторых вариантах ген ALAS1 активируют, по меньшей мере, примерно на 60%, 70% или 80% введением и-РНК, охарактеризованной в изобретении. В некоторых вариантах экспрессию гена ALAS1 активируют, по меньшей мере, примерно на 85%, 90% или 95% или больше введением и-РНК, которая описана в настоящей публикации. В некоторых вариантах экспрессию гена ALAS1 увеличивают, по меньшей мере, в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 5 раз, по меньшей мере, в 10 раз, по меньшей мере, в 50 раз, по меньшей мере, в 100 раз, по меньшей мере, в 500 раз, по меньшей мере, в 1000 раз или больше в клетках, обработанных и-РНК, которая описана в настоящей публикации, по сравнению с экспрессией в необработанных клетках. Активация экспрессии малыми днРНК описана, например, в публикации Li с соавторами, 2006, Proc. Natl. Acad. Sci. U.S.A. 103: 17337-42, и в US 20070111963 и US 2005226848, каждая из которых включена в настоящее описание в виде ссылки.
Термины «вызывать сайленсинг», «ингибировать экспрессию», «осуществлять понижающую регуляцию экспрессии», «подавлять экспрессию» и тому подобные в той части, в которой они относятся к гену ALAS1, в настоящем описании относятся, по меньшей мере, к частичному подавлению экспрессии гена ALAS1, которое оценивают, например, на основании экспрессии мРНК ALAS1, экспрессии белка ALAS1 или на основании другого параметра, функционально связанного с экспрессией гена ALAS1 (например, на основании концентраций ALA или PBG в плазме или моче). Например, ингибирование экспрессии ALAS1 может проявляться в виде снижения количества мРНК ALAS1, которая может быть выделена или может быть выявлена в первой клетке или группе клеток, в которых ген ALAS1 транскрибируется, и которая была или которые были обработаны так, чтобы ингибировать экспрессию гена ALAS1, по сравнению с контролем. Контролем может быть вторая клетка или группа клеток, по существу идентичных первой клетке или группе клеток, за исключением того, что вторая клетка или группа клеток не были обработаны таким образом (контрольные клетки). Степень ингибирования обычно выражают в виде процента от контрольного уровня, например,
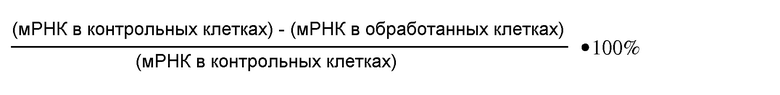
Альтернативно степень ингибирования может быть приведена в виде уменьшения параметра, который функционально связан с экспрессией гена ALAS1, например, количества белка, кодируемого геном ALAS1, или уровня одного или нескольких порфиринов. Уменьшение параметра, функционально связанного с экспрессией гена ALAS1, можно подобным образом выразить в виде процента от контрольного уровня. В принципе, сайленсинг гена ALAS1 можно определить в любой клетке, экспрессирующей ALAS1 либо конститутивно, либо в результате конструирования генома и в любом подходящем анализе. Однако в том случае, когда необходим эталон для того, чтобы определить ингибирует ли данная и-РНК экспрессию гена ALAS1 в определенной степени и поэтому входит в объем настоящего изобретения, анализы, представленные в примерах ниже должны служить в качестве такого эталона.
Например, в некоторых случаях экспрессию гена ALAS1 подавляют, по меньшей мере, примерно на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% введением и-РНК, охарактеризованной в изобретении. В некоторых вариантах ген ALAS1 подавляют, по меньшей мере, примерно на 60%, 65%, 70%, 75% или 80% введением и-РНК, охарактеризованной в изобретении. В некоторых вариантах ген ALAS1 подавляют, по меньшей мере, примерно на 85%, 90%, 95%, 98%, 99% или больше введением и-РНК, которая описана в настоящей публикации.
В используемом в настоящем описании смысле в контексте экспрессии ALAS1 термины «лечить», «процесс лечения», «лечение» и тому подобные относятся к облегчению или ослаблению патологических процессов, связанных с экспрессией ALAS1 (например, патологических процессов, в которые вовлечены порфирины или дефекты порфиринового пути, такие как, например, порфирии). В контексте настоящего изобретения в той части, которая относится к любому из других состояний, перечисленных в настоящем описании ниже (отличных от патологических процессов, связанных с экспрессией ALAS1), термины «лечить», «лечение» и тому подобные означают предотвращать, облегчать или ослаблять, по меньшей мере, один симптом, ассоциированный с таким состоянием, или замедлять или реверсировать прогрессирование такого состояния. Например, способы, охарактеризованные в настоящем описании, в случае применения для лечения порфирии, могут служить для уменьшения или предотвращения одного или нескольких симптомов ассоциированных с порфирией (например, боли), снижения тяжести или частоты приступов, ассоциированных с порфирией, уменьшения вероятности того, что приступ одного или нескольких симптомов, ассоциированных с порфирией, будет происходить после воздействия провоцирующего условия, укорочения приступа, ассоциированного с порфирией, и/или уменьшения риска развития состояний, ассоциированных с порфирией (например, гепатоклеточного рака или нейропатии (например, прогрессирующей нейропатии)). Таким образом, если контекст ясно не указывает иное, подразумевается, что термины «лечить», «лечение» и тому подобные охватывают профилактику, например, предотвращение расстройств и/или симптомов расстройств, связанных с экспрессией ALAS1.
«Более низкий» в контексте заболевания показатель или симптом означает статистически или клинически значимое снижение такого уровня. Снижение может составлять, например, по меньшей мере, 10%, по меньшей мере, 20%, по меньшей мере, 30%, по меньшей мере, 40% или больше, и обычно снижается до уровня в приятом диапазоне нормы для индивидуума без такого расстройства.
В используемом в настоящем описании смысле фразы «терапевтически эффективное количество» и «профилактически эффективное количество» относится к количеству, которое дает терапевтическую пользу при лечении, профилактике или контролировании патологических процессов, связанных с экспрессией ALAS1. Конкретное количество, которое является терапевтически эффективным, легко может определить опытный лечащий врач, и количество может варьировать, в зависимости от факторов, известных в данной области, таких как, например, тип патологического процесса, история болезни и возраст пациента, стадия патологического процесса и введение других средств.
В используемом в настоящем описании смысле «фармацевтическая композиция» содержит фармакологически эффективное количество и-РНК и фармацевтически приемлемый носитель. В используемом в настоящем описании смысле «фармакологически эффективное количество», «терапевтически эффективное количество» или просто «эффективное количество» относится к такому количеству и-РНК, которое эффективно в отношении получения предполагаемого фармакологического, терапевтического или профилактического результата. Например, в способе лечения расстройства, связанного с экспрессией ALAS1 (например, в способе лечения порфирии), эффективное количество включает количество эффективное в отношении уменьшения одного или нескольких симптомов, ассоциированных с порфирией, количество, эффективное в отношении снижения частоты приступов, количество, эффективное в отношении снижения вероятности того, что приступ одного или нескольких симптомов, ассоциированных с порфирией, будет происходить при воздействии провоцирующего фактора, или количество, эффективное в отношении снижения риска развития состояний, ассоциированных с порфирией (например, нейропатии (например, прогрессирующей нейропатии), гепатоклеточного рака). Например, если данное клиническое лечение считают эффективным, когда имеет место снижение, по меньшей мере, на 10% измеряемого параметра, ассоциированного с заболеванием или расстройством, терапевтически эффективное количество лекарственного средства для лечения такого заболевания или расстройства представляет собой количество, которое необходимо для получения уменьшения такого параметра, по меньшей мере, на 10%. Например, терапевтически эффективное количество и-РНК, мишенью которой является ALAS1, может снижать уровни белка ALAS1 на любое измеряемое количество, например, по меньшей мере, на 10%, 20%, 30%, 40% или 50%.
Термин «фармацевтически приемлемый носитель» относится к носителю для введения терапевтического средства. Такие носители включают без ограничения физиологический раствор, буферный физиологический раствор, декстрозу, воду, глицерин, этанол и их сочетания. Из термина специально исключена среда для культивирования клеток. В случае лекарственных средств, вводимых перорально, фармацевтически приемлемые носители включают без ограничения фармацевтически приемлемые эксципиенты, такие как инертные разбавители, дезинтегрирующие средства, связывающие средства, скользящие вещества, подсластители, корригенты, красители и консерванты. Подходящие инертные разбавители включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, тогда как кукурузный крахмал и альгиновая кислота являются подходящими дезинтегрирующими средствами. Связывающие средства могут включать крахмал и желатин, тогда как скользящим веществом, в случае его наличия, обычно будет стеарат магния, стериновая кислота или тальк. При необходимости таблетки могут быть покрыты таким материалом, как моностеарат глицерина или дистеарат глицерина, чтобы замедлить всасывание в желудочно-кишечном тракте. Средства, включаемые в препараты лекарственных средств, дополнительно описаны в настоящей публикации ниже.
Термин «примерно» в отношении количества или числового диапазона означает, что указанное количество или числовой диапазон является приблизительным в пределах вариабельности эксперимента (или в пределах статистической погрешности эксперимента) и, таким образом, количество или числовой диапазон может варьировать, например, от 1% до 15% от указанного числа или числового диапазона.
II. Двунитевая рибонуклеиновая кислота (днРНК)
В настоящей публикации описаны и-РНК-средства, которые ингибируют экспрессию гена ALAS1. В одном варианте и-РНК-средство включает молекулы двунитевой рибонуклеиновой кислоты (днРНК) для ингибирования экспрессии гена ALAS1 в клетке или у субъекта (например, у млекопитающего, например, у человека, имеющего порфирию), при этом днРНК содержит антисмысловую нить, имеющую область комплементарности, которая комплементарна, по меньшей мере, части мРНК, образованной при экспрессии гена ALAS1, и при этом область комплементарности имеет длину 30 нуклеотидов или меньше, обычно длину 19-24 нуклеотида, и при этом днРНК при контакте с клеткой, экспрессирующей ген ALAS1, ингибирует экспрессию гена ALAS1, по меньшей мере, на 10%, что анализируют, например, с использованием ПЦР или основанного на разветвленной ДНК (bDNA) способа или основанного на белках способа, такого как Вестерн-блоттинг. В одном варианте и-РНК-средство активирует экспрессию гена ALAS1 в клетке или в организме млекопитающего. Экспрессию гена ALAS1 в культуре клеток, такой как клетки COS, клетки HeLa, первичные гепатоциты, клетки HepG2, первичные культивируемые клетки, или в биологическом образце, полученном от субъекта, можно анализировать, измеряя уровни мРНК ALAS1, например, с использованием анализа bDNA или TaqMan, или измеряя уровни белка, например в анализе иммунофлуоресценции, используя, например, Вестерн-блоттинг или проточно-цитометрический способ.
днРНК содержит две нити РНК, которые комплементарны в достаточной степени, чтобы гибридизоваться с образованием структуры дуплекса в условиях, в которых днРНК будет использована. Одна нить днРНК (антисмысловая нить) содержит область комплементарности, которая в значительной степени комплементарна и обычно полностью комплементарна последовательности-мишени, полученной из последовательности мРНК, образованной во время экспрессии гена ALAS1. Другая нить (смысловая нить) содержит область, которая комплементарна антисмысловой нити, так что две нити гибридизуются и образуют структуру дуплекса при объединении в подходящих условиях. Обычно структура дуплекса имеет длину от 15 до 30 включительно, чаще от 18 до 25 включительно, еще более часто от 19 до 24 включительно и наиболее часто от 19 до 21 пары оснований включительно. Подобным образом область комплементарности с последовательностью-мишенью имеет длину от 15 до 30 включительно, чаще от 18 до 25 включительно, еще более часто от 19 до 24 включительно и наиболее часто от 19 до 21 нуклеотида включительно. В некоторых вариантах днРНК имеет длину от 15 до 20 нуклеотидов включительно, и в других вариантах днРНК имеет длину от 25 до 30 нуклеотидов включительно. Как будет понятно специалисту область-мишень в РНК, являющейся мишенью расщепления, чаще всего является частью более крупной молекулы РНК, часто молекулы мРНК. В соответствующем случае «часть» мРНК-мишени представляет собой непрерывную последовательность мРНК-мишени достаточной длины, чтобы быть субстратом РНК-и-направленного расщепления (т.е., расщепления посредством пути RISC). днРНК, имеющие короткие дуплексы даже длиной 9 пар оснований в некоторых случаях могут опосредовать РНК-и-направленное расщепление РНК. Чаще всего мишень будет иметь длину, по меньшей мере, 15 нуклеотидов, например, длину 15-30 нуклеотидов.
Специалисту в данной области также будет понятно, что область дуплекса является основной функциональной частью днРНК, например, область дуплекса длиной от 9 до 36, например, 15-30 пар оснований. Таким образом, в одном варианте в случае, если молекула РНК или комплекс молекул РНК оказывается процессированным до функционального дуплекса, например, длиной 15-30 пар оснований, который целенаправленно приводит к расщеплению требуемой РНК, молекула РНК или комплекс молекул РНК, имеющих область дуплекса больше 30 пар оснований, является днРНК. Таким образом, специалисту в данной области будет понятно, что в одном варианте ми-РНК является днРНК. В другом варианте днРНК не является встречающейся в природе ми-РНК. В другом варианте и-РНК-средство, применимое для целенаправленного действия на экспрессию ALAS1, не образуется в клетке-мишени в результате расщепления более крупной днРНК.
днРНК, которая описана в настоящей публикации, может дополнительно содержать один или несколько однонитевых нуклеотидных липких концов. днРНК может быть синтезирована стандартными способами, известными в данной области, которые дополнительно обсуждаются ниже, например, с использованием автоматического синтезатора ДНК, такого как коммерчески доступный синтезатор, например, из Biosearch, Applied Biosystems, Inc. В одном варианте ген ALAS1 представляет собой ген ALAS1 человека. В другом варианте ген ALAS1 представляет собой ген ALAS1 мыши или крысы. В конкретных вариантах первая последовательность является смысловой нитью днРНК, которая содержит смысловую последовательность, указанную в таблице 2 или таблице 3, и вторая последовательность является антисмысловой нитью днРНК, которая содержит антисмысловую последовательность, указанную в таблице 2 или таблице 3. В некоторых вариантах первая последовательность является смысловой нитью днРНК, которая содержит смысловую последовательность из таблицы 2, 3, 6, 7, 8, 9, 14 или 15, и вторая последовательность является антисмысловой нитью днРНК, которая содержит антисмысловую последовательность из таблицы 2, 3, 6, 7, 8, 9, 14 или 15. В некоторых вариантах первая последовательность является смысловой нитью днРНК, которая содержит смысловую последовательность из таблицы 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20, и вторая последовательность является антисмысловой нитью днРНК, которая содержит антисмысловую последовательность из таблицы 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20. Альтернативные днРНК-средства, мишенью которых являются другие последовательности, отличные от последовательностей днРНК, раскрытых в настоящем описании (например, в таблице 2 или таблице 3), легко могут быть определены с использованием последовательности-мишени и фланкирующей последовательности ALAS1.
В одном аспекте днРНК может содержать, по меньшей мере, смысловую и антисмысловую нуклеотидные последовательности, при этом смысловая нить выбрана из групп последовательностей, представленных в таблицах 2 и 3, и антисмысловая нить, соответствующая смысловой нити, выбрана из последовательностей, представленных в таблицах 2 и 3. В следующем аспекте днРНК может содержать, по меньшей мере, смысловую и антисмысловую нуклеотидные последовательности, при этом смысловая нить выбрана из групп последовательностей, представленных в таблицах 2, 3, 6, 7, 8, 9, 14 и 15, и антисмысловая нить, соответствующая смысловой нити, выбрана из таблиц 2, 3, 6, 7, 8, 9, 14 и 15. В следующем аспекте днРНК может содержать, по меньшей мере, смысловую и антисмысловую нуклеотидные последовательности, при этом смысловая нить выбрана из групп последовательностей, представленных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20, и антисмысловая нить, соответствующая смысловой нити, выбрана из таблиц 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20. В таких аспектах одна из двух последовательностей комплементарна другой из двух последовательностей, при этом одна из последовательностей по существу комплементарна последовательности мРНК, образуемой при экспрессии гена ALAS1. Как таковая, днРНК может содержать два олигонуклеотида, при этом один олигонуклеотид описан как смысловая нить в таблице 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20, а второй олигонуклеотид описан как антисмысловая нить, соответствующая смысловой нити из таблиц 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20. Как описано в настоящей публикации и как известно в данной области, комплементарные последовательности днРНК также могут быть представлены в виде самокомплементарных областей одной молекулы нуклеиновой кислоты, а не в виде отдельных олигонуклеотидов.
Специалисту хорошо известно, что днРНК, имеющая структуру дуплекса длиной от 20 до 23, но в частности 21 пару оснований, считается особенно эффективной в индукции РНК-интерференции (Elbashir с соавторами, EMBO 2001, 20: 6877-6888). Однако другими авторами было обнаружено, что также эффективными могут быть более короткие или более длинные структуры РНК-дуплексов. В описанных выше вариантах в силу природы олигонуклеотидных последовательностей, представленных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20, днРНК, описанные в настоящей публикации, могут содержать, по меньшей мере, одну нить с минимальной длиной 21 нуклеотид. Обоснованно можно ожидать, что более короткие дуплексы, имеющие одну из последовательностей, указанных в таблице 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20, в которых отсутствуют только несколько нуклеотидов на одном или обоих концах, могут быть также эффективными при сравнении с днРНК, описанными выше. Следовательно, согласно настоящему изобретению предусмотрены днРНК, имеющие неполную последовательность, по меньшей мере, 15, 16, 17, 18, 19, 20 или больше непрерывно следующих друг за другом нуклеотидов из одной из последовательностей, указанных в таблице 2, 3, 6, 7, 8, 9, 14, 15, 18 или 20, и отличающиеся по своей способности ингибировать экспрессию гена ALAS1 не более чем на 5, 10, 15, 20, 25 или 30% ингибирования от днРНК, содержащей полную последовательность.
Кроме того, РНК, представленные в таблицах 2 и 3, а также РНК, представленные в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20, имеют участок транскрипта ALAS1, который чувствителен к RISC-опосредованному расщеплению. В связи с этим дополнительным характерным признаком настоящего изобретения являются и-РНК, мишень которых находится в пределах одной из таких последовательностей. В используемом в настоящем описании смысле говорят, что мишень и-РНК находится в пределах конкретного участка РНК-транскрипта, если и-РНК стимулирует расщепление транскрипта в любом месте в пределах конкретного участка. Такая и-РНК обычно будет содержать, по меньшей мере, 15 непрерывно следующих друг за другом нуклеотидов из одной из последовательностей, представленных в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20, связанных с дополнительными нуклеотидными последовательностями, взятыми из области, являющейся соседней с выбранной последовательностью в гене ALAS1.
Хотя последовательность-мишень обычно имеет длину 15-30 нуклеотидов, имеет место широкая изменчивость в отношении применимости конкретных последовательностей в таком диапазоне для направленного расщепления любой данной РНК-мишени. В различных пакетах компьютерных программ и руководствах, указанных в настоящем описании, представлены инструкции по идентификации оптимальных последовательностей-мишеней для любого данного генной мишени, но также может быть использован эмпирический подход, в случае которого «окно» или «рамка» заданного размера (в качестве не ограничивающего примера, 21 нуклеотид) буквально или фигурально (включая, например, in silico) помещают на последовательность РНК-мишени, чтобы идентифицировать последовательности в данном размерном диапазоне, которые могут служить в качестве последовательностей-мишеней. Постепенно перемещая «окно» последовательности по одному нуклеотиду выше или ниже начального положения последовательности-мишени, можно идентифицировать следующую потенциальную последовательность-мишень, пока не будет идентифицирован полный набор возможных последовательностей для любого заданного выбранного размера мишени. Указанным способом вместе с последовательным синтезом и тестированием идентифицированных последовательностей (с использованием анализов, которые описаны в настоящей публикации или которые известны в данной области) для идентификации таких последовательностей, которые функционируют оптимально, можно идентифицировать такие последовательности РНК, которые в случае целенаправленного действия и-РНК-средства опосредуют наилучшее ингибирование экспрессии гена-мишени. Таким образом, хотя последовательности, указанные, например, в таблицах 2, 3, 6, 7, 8, 9, 14, 15, 18 и 20, представляют собой эффективные последовательности-мишени, предполагается, что дополнительная оптимизация эффективности ингибирования может быть осуществлена последовательным «прохождением окна» по одному нуклеотиду вверх или вниз заданных последовательностей, чтобы идентифицировать последовательности с равными или лучшими характеристиками ингибирования.
Кроме того, предусмотрено, что в случае любой идентифицированной последовательности, например, указанной в таблицах 2, 3, 6, 7, 8, 14, 15, 18 и 20, дополнительная оптимизация может быть осуществлена последовательными добавлением или удалением нуклеотидов, чтобы создать более длинные или более короткие последовательности, и тестированием таких образованных последовательностей путем прохождения окна более длинного или более короткого размера вверх или вниз РНК-мишени от данной точки. И в этом случае сочетание такого способа создания новых кандидатов в мишени с тестированием в отношении эффективностей и-РНК, основанных на таких последовательностях-мишенях, в анализе ингибирования, который известен в данной области или который описан в настоящей публикации, может приводить к дополнительному повышению эффективности ингибирования. Более того, такие оптимизированные последовательности могут быть скорректированы, например, введением модифицированных нуклеотидов, которые описаны в настоящей публикации или которые известны в данной области, добавлением или изменениями липких концов или другими модификациями, которые известны в данной области и/или обсуждаются в настоящем описании, чтобы дополнительно оптимизировать молекулу (например, повышение стабильности в сыворотке или увеличение времени полужизни в циркуляции, повышение термостабильности, усиление трансмембранной доставки, направление в конкретное место или тип клеток, усиление взаимодействия с ферментами в пути сайленсинга, усиление высвобождения из эндосом и т.д.) в качестве ингибитора экспрессии.
Описанная в настоящей публикации и-РНК может содержать одно или несколько ошибочных спариваний с последовательностью-мишенью. В одном варианте и-РНК, которая описана в настоящей публикации, содержит не более 3 ошибочных спариваний. Если антисмысловая нить и-РНК имеет ошибочные спаривания с последовательностью-мишенью, предпочтительно, чтобы область ошибочного спаривания не была расположена в центре области комплементарности. Если антисмысловая нить и-РНК содержит ошибочные спаривания с последовательностью-мишенью, предпочтительно, чтобы ошибочное спаривание было ограничено в пределах последних 5 нуклеотидов либо от 5'-, либо от 3'-конца области комплементарности. Например, в случае нити РНК 23-нуклеотидного и-РНК-средства нить РНК, которая комплементарна области гена ALAS1, нить РНК обычно не содержит никакого ошибочного спаривания в пределах центральных 13 нуклеотидов. Способы, описанные в настоящей публикации, или способы, известные в данной области, можно использовать для определения того является ли и-РНК, содержащая ошибочное спаривание с последовательностью-мишенью, эффективной в ингибировании экспрессии гена ALAS1. Важно учитывать эффективность и-РНК с ошибочными спариваниями в ингибировании экспрессии гена ALAS1, особенно если известно, что для конкретной области комплементарности в гене ALAS1 в популяции существует обусловленная полиморфизмом изменчивость последовательности.
В одном варианте, по меньшей мере, один конец днРНК имеет однонитевой нуклеотидный липкий конец длиной от 1 до 4 нуклеотидов, обычно 1 или 2 нуклеотида. днРНК, имеющие, состоящий, по меньшей мере, из одного нуклеотида липкий конец, обладают неожиданно превосходными ингибирующими свойствами по сравнению с их аналогами с тупыми концами. В еще одном варианте РНК в и-РНК, например, днРНК, химически модифицирована для того, чтобы повысить стабильность или другие полезные характеристики. Нуклеиновые кислоты, охарактеризованные в изобретении, могут быть синтезированы и/или модифицированы способами, хорошо разработанными в данной области, такими как способы, описанные в публикации «Current protocols in nucleic acid chemistry», Beaucage, S.L. et al. (Edr.), John Wiley and Sons, Inc., New York, NY, USA, которая включена в настоящее описание в виде ссылки. Модификации включают, например, (a) концевые модификации, например, 5'-концевые модификации (фосфорилирование, конъюгацию, связывание инвертированных повторов и т.д.), 3'-концевые модификации (конъюгации, ДНК-нуклеотиды, связывание инвертированных повторов и т.д.), (b) модификации оснований, например, замену стабилизирующими основаниями, дестабилизирующими основаниями или основаниями, которые, которые образуют пары оснований с более широким репертуаром партнеров, удаление оснований (нуклеотиды, лишенные оснований) или конъюгированные основания, (c) модификации сахаров (например, в 2'-положении или 4'-положении) или замену сахара, а также (d) модификации остова, включая модификацию или замену фосфодиэфирных связей. Конкретные примеры РНК-соединений, применимых в настоящем изобретении, включают без ограничения РНК, содержащие модифицированные остовы или не содержащие природных межнуклеозидных связей. РНК, имеющие модифицированные остовы, включают наряду с прочими остовы, которые не имеют атома фосфора в остове. В целях настоящего описания и как иногда указывают в данной области, модифицированные РНК, которые не имеют атома фосфора в своем межнуклеозидном остове, также можно считать олигонуклеозидами. В конкретных вариантах модифицированная РНК может иметь атом фосфора в своем межнуклеозидном остове.
Модифицированные остовы РНК включают, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил- и другие алкилфосфонаты, включая 3'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и боранофосфаты, имеющие нормальные 3'-5'-связи, 2'-5'-связанные аналоги и тех и других), имеющие обратную ориентацию, в которых соседние пары нуклеозидных единиц связаны 3'-5' с 5'-3' или 2'-5' с 5'-2'. Также включены различные соли, смешанные соли и формы свободных кислот.
Соответствующие патенты США, в которых содержатся инструкции по получению указанных выше фосфорсодержащих связей, включают без ограничения патенты США №3687808, 4469863, 4476301, 5023243, 5177195, 5188897, 5264423, 5276019, 5278302, 5286717, 5321131, 5399676, 5405939, 5453496, 5455233, 5466677, 5476925, 5519126, 5536821, 5541316, 5550111, 5563253, 5571799, 5587361, 5625050, 6028188, 6124445, 6160109, 6169170, 6172209, 6239265, 6277603, 6326199, 6346614, 6444423, 6531590, 6534639, 6608035, 6683167, 6858715, 6867294, 6878805, 7015315, 7041816, 7273933, 7321029 и патент США RE39464, каждый из которых включен в настоящее описание в виде ссылки.
Модифицированные РНК-остовы, которые не содержат атома фосфора, имеют остовы, которые образованы короткоцепочечными алкил- или циклоалкильными межнуклеозидными связями, смешанными гетероатомами и алкильными или циклоалкильными межнуклеозидными связями или одной или несколькими короткоцепочечными гетероматомными или гетероциклическими межнуклеозидными связями. Такие остовы включают остовы, имеющие морфолиносвязи (образованные частично из представленной сахаром части нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; содержащие алкен остовы; сульфаматные остовы; метиленимино- и метиленгидразино-остовы; сульфонатные и сульфонамидные остовы; амидные остовы; и другие, имеющие смешанные компоненты N, O, S и CH2.
Соответствующие патенты США, в которых имеются инструкции по получению указанных выше олигонуклеозидов, включают без ограничения патенты США №5034506, 5166315, 5185444, 5214134, 5216141, 5235033, 564562, 5264564, 5405938, 5434257, 5466677, 5470967, 5489677, 5541307, 5561225, 5596086, 5602240, 5608046, 5610289, 5618704, 5623070, 5663312, 5633360, 5677437 и 5677439, каждый из которых включен в настоящее описание в виде ссылки.
В других миметиках РНК, подходящих или предполагаемых для применения в и-РНК, и сахар и межнуклеозидные связи, т.е. остов из нуклеотидных единиц, заменяют новыми группами. Единицы, представленные основаниями, сохраняют для гибридизации с соответствующим соединением-мишенью в виде нуклеиновой кислоты. Одно такое олигомерное соединение, миметик РНК, которое, как было показано, обладает превосходными свойствами в отношении гибридизации, называют пептидо-нуклеиновой кислотой (ПНК). В РНК-соединениях сахарный остов РНК заменяют остовом, содержащим амиды, в частности аминоэтилглициновым остовом. Основания нуклеотидов сохраняют, и они связаны прямо или опосредованно с атомами азота аза-группы в амидной части остова. Соответствующие патенты США, в которых содержатся руководства по получению соединений ПНК, включают без ограничения, патенты США №5539082, 5714331 и 5719262, каждый из которых включен в настоящее описание в виде ссылки. Дополнительные инструкции, касающиеся соединений ПНК, можно найти, например, в публикации Nielsen с соавторами, Science, 1991, 254, 1497-1500.
Некоторые варианты, охарактеризованные в изобретении, включают РНК с фосфоротиоатными остовами и олигонуклеозиды с остовами, содержащими гетероатомы, и в частности --CH2--NH--CH2--, --CH2--N(CH3)--O--CH2-- [известный как метилен(метилимино)- или MMI-остов], --CH2-O--N(CH3)--CH2--, --CH2-N(CH3)--N(CH3)--CH2-- и --N(CH3)--CH2--CH2-- [где нативный фосфодиэфирный остов представлен в виде -O-P-O--CH2--], описанные в указанном выше патенте США №5489677, и амидные остовы, описанные в указанном выше патенте США №5602240. В некоторых вариантах РНК, охарактеризованные в настоящем описании, имеют структуры морфолино-остова, описанные в указанном выше патенте США №5034506.
Модифицированные РНК также могут содержать один или несколько замещенных остатков сахаров. и-РНК, например, днРНК, охарактеризованные в настоящем описании, могут содержать одну из следующих групп в 2'-положении: OH; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S- или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-C10-алкил или C2-C10-алкенил и -алкинил. Примеры подходящих модификаций включают O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)nON[(CH2)nCH3)]2, где n и m составляют от 1 до примерно 10. В других вариантах днРНК содержат одну из следующих групп в 2'-положении: низший C1-C10-алкил, замещенный низший алкил, алкиларил, аралкил, O-алкиларил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкиларил, аминоалкиламиногруппу, полиалкиламиногруппу, замещенный силил, РНК-расщепляющую группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств и-РНК или группу для улучшения фармакодинамических свойств и-РНК и другие заместители, обладающие сходными свойствами. В некоторых вариантах модификация включает 2'-метоксиэтоксигруппу (2'-O--CH2CH2OCH3, также известную как 2'-О-(2-метоксиэтил) или 2'-MOE) (Martin с соавторами, Helv. Chim. Acta, 1995, 78: 486-504) т.е., алкокси-алкоксигруппу. Другим примером модификации является 2'-диметиламинооксиэтоксигруппа, т.е., группа O(CH2)2ON(CH3)2, также известная как 2'-DMAOE, которая описана в настоящей публикации в примерах ниже, и 2'-диметиламиноэтоксиэтоксигруппа (также известная в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е., 2'-O--CH2--O--CH2--N(CH2)2, также описанная в настоящей публикации в примерах ниже.
Другие модификации включают 2'-метоксигруппу (2'-OCH), 2'-аминопропоксигруппу (2'-OCH2CH2CH2NH2) и 2'-фтор (2'-F). Сходные модификации также могут быть получены в других положениях РНК в и-РНК, в частности в 3'-положении сахара 3'-концевого нуклеотида или в 2'-5'-связанных днРНК и в 5'-положении 5'-концевого нуклеотида. и-РНК также могут содержать миметики сахара, такие как остатки циклобутила, вместо сахара пентофуранозила. Соответствующие патенты США, в которых описано получение таких структур модифицированных сахаров, включают без ограничения патенты США №4981957, 5118800, 5319080, 5359044, 5393878, 5446137, 5466786, 5514785, 5519134, 5567811, 5576427, 5591722, 5597909, 5610300, 5627053, 5639873, 5646265, 5658873, 5670633 и 5700920, авторы некоторых из которых также являются авторами настоящей заявки, и каждый из которых включен в настоящее описание в виде ссылки.
и-РНК также может содержать модификации или замещения оснований нуклеотидов (часто называемых в данной области просто «основаниями»). В используемом в настоящем описании смысле «немодифицированные» или «природные» основания нуклеотидов включают пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные основания нуклеотидов включают другие синтетические и природные основания нуклеотидов, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил- и другие алкильные производные аденина и гуанина, 2-пропил- и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и -цитозин, 5-пропинилурацил и -цитозин, 6-азоурацил, -цитозин и -тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил-, 8-гидроксил- и другие 8- замещенные аденины и гуцанины, 5-галоген-, в частности 5-бром-, 5-трифторметил- и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Дополнительные основания нуклеотидов включают основания, описанные в патенте США №3687808, основания, раскрытые в публикации «Modified Nucleosides in Biochemistry, Biotechnology and Medicine», Herdewijn, P. ed. Wiley-VCH, 2008; основания, раскрытые в публикации «The Concise Encyclopedia Of Polymer Science and Engineering, pages 858-859, Kroschwitz, J. L, ed. John Wiley and Sons, 1990, основания, раскрытые в публикации Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613, и основания, раскрытые в публикации Sanghvi, Y S., Chapter 15, dsRNA Research and Applications, pages 289-302, Crooke, S. T. and Lebleu, B., Ed., CRC Press, 1993. Некоторые из таких оснований нуклеотидов особенно применимы для повышения аффинности связывания олигомерных соединений, охарактеризованных в изобретении. Такие основания включают 5-замещенные пиримидины, 6-азапиримидины и N-2-, N-6- и 0-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Было показано, что замены 5-метилцитозином повышают стабильность дуплексов нуклеиновых кислот на 0,6-1,2°C (Sanghvi, Y. S., Crooke, S. T. and Lebleu, B., Eds., dsRNA Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и являются примером замен оснований, еще более предпочтительно в сочетании с 2'-O-метоксиэтильными модификациями сахара.
Соответствующие патенты США, в которых описано получение некоторых указанных выше модифицированных оснований нуклеотидов, а также другие модифицированных оснований нуклеотидов, включают без ограничения упомянутый выше патент США №3687808, а также патенты США №4845205, 513030, 5134066, 5175273, 5367066, 5432272, 5457187, 5459255, 5484908, 5502177, 5525711, 5552540, 5587469, 5594121, 5596091, 5614617, 5681941, 6015886, 6147200, 6166197, 6222025, 6235887, 6380368, 6528640, 6639062, 6617438, 7045610, 7427672 и 7495088, каждый из которых включен в настоящее описание в виде ссылки, и патент США №5750692, также включенный в настоящее описание в виде ссылки.
РНК в и-РНК также может быть модифицирована так, чтобы она содержала одну или несколько закрытых нуклеиновых кислот (LNA). Закрытая нуклеиновая кислота представляет собой нуклеотид, имеющий модифицированный остаток рибозы, при этом остаток рибозы содержит дополнительный мостик, связывающий 2'- и 4'-атомы углерода. Такая структура эффективно «запирает» рибозу в структурной 3'-эндо-конформации. Было показано, что добавление закрытых нуклеиновых кислот к ми-РНК повышает стабильность ми-РНК в сыворотке и снижает нецелевые эффекты (Elmen, J. et al., (2005) Nucleic Acids Research 33(1):439-447; Mook, OR. et al., (2007) Mol Canc Ther 6(3):833-843; Grunweller, A. et al., (2003) Nucleic Acids Research 31(12):3185-3193).
Соответствующие патенты США, в которых описано получение закрытых нуклеотидов нуклеиновой кислоты, включают без ограничения следующие патенты: патенты США №6268490, 6670461, 6794499, 6998484, 7053207, 7084125 и 7399845, каждый из которых включен в настоящее описание в виде ссылки в полном объеме.
Потенциально стабилизирующие модификации на концах молекул РНК могут включать N-(ацетиламинокапроил)-4-гидроксипролинол (Hyp-C6-NHAc), N-(капроил-4-гидроксипролинол (Hyp-C6), N-(ацетил-4-гидроксипролинол (Hyp-NHAc), тимидин-2'-O-дезокситимидин (простой эфир), N-(аминокапроил)-4-гидроксипролинол (Hyp-C6-амино), 2-докозаноилуридин-3”-фосфат, инвертированное основание dT(idT) и другие. Описание такой модификации можно найти в публикации PCT № WO 2011/005861.
МОТИВЫ И-РНК
В одном варианте последовательность смысловой нити может быть представлена формулой (I):
5' np-Na-(X X X)i-Nb-Y Y Y-Nb-(Z Z Z)j-Na-nq 3' (I)
где:
i и j каждый независимо означают 0 или 1;
p и q каждый независимо означают 0-6;
каждый Na независимо означает олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, при этом каждая последовательность содержит, по меньшей мере, два по-разному модифицированных нуклеотида;
каждый Nb независимо означает олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
каждый np и nq независимо означает выступающий нуклеотид;
где Nb и Y не имеют одной и той же модификации; и
XXX, YYY и ZZZ каждый независимо означают один мотив из трех идентичных модификаций трех следующих друг за другом нуклеотидов. Предпочтительно все YYY являются 2'-F-модифицированными нуклеотидами.
В одном варианте Na и/или Nb содержат модификации с изменяющегося характера.
В одном варианте мотив YYY находится в сайте расщепления или вблизи сайта расщепления смысловой нити. Например, когда РНК-и-средство имеет область дуплекса длиной 17-23 нуклеотида, мотив YYY может находиться в сайте расщепления или вблизи сайта расщепления (например: может находиться в положениях 6, 7, 8; 7, 8, 9; 8, 9, 10; 9, 10, 11; 10, 11, 12 или 11, 12, 13) смысловой нити, при этом нумерация начинается с 1-го нуклеотида от 5'-конца; или необязательно нумерация начинается с 1-ого спаренного нуклеотида в области дуплекса от 5'-конца.
В одном варианте i равен 1 и j равен 0, или i равен 0 и j равен 1, или оба i и j равны 1. Поэтому, смысловую нить может быть представлена следующими формулами:
5' np-Na-YYY-Nb-ZZZ-Na-nq 3' (Ib);
5' np-Na-XXX-Nb-YYY-Na-nq 3' (Ic); или
5' np-Na-XXX-Nb-YYY-Nb-ZZZ-Na-nq 3' (Id).
В том случае, когда смысловая нить представлена формулой (Ib), Nb означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо может означать олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда смысловая нить представлена формулой (Ic), Nb означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо может означать олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда смысловая нить представлена формулой (Id), каждый Nb независимо означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Предпочтительно Nb означает 0, 1, 2, 3, 4, 5 или 6. Каждый Na независимо может означать олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Каждый X, Y и Z могут быть одинаковыми или могут отличаться друг от друга.
В других вариантах i равен 0 и j равен 0, и смысловая нить может быть представлена формулой:
5' np-Na-YYY-Na-nq 3' (Ia).
В том случае, когда смысловая нить представлена формулой (Ia), каждый Na независимо может означать олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В одном варианте последовательность антисмысловой нити РНК-и может быть представлена формулой (II):
5' nq'-Na'-(Z'Z'Z')k-Nb'-Y'Y'Y'-Nb'-(X'X'X')l-Na'-np' 3' (II)
где:
k и l каждый независимо означают 0 или 1;
p' и q' каждый независимо означают 0-6;
каждый Na' независимо означает олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, при этом каждая последовательность содержит, по меньшей мере, два по-разному модифицированных нуклеотида;
каждый Nb' независимо означает олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
каждый np' и nq' независимо означают выступающий нуклеотид;
при этом Nb' и Y' не имеют одной и той же модификации;
и
X'X'X', Y'Y'Y' и Z'Z'Z' каждый независимо означают один мотив из трех идентичных модификаций трех следующих друг за другом нуклеотидов.
В одном варианте Na' и/или Nb' содержат модификации изменяющегося характера.
Мотив Y'Y'Y' находится в сайте расщепления или вблизи сайта расщепления антисмысловой нити. Например, в том случае, когда РНК-и-средство имеет область дуплекса длиной 17-23 нуклеотида, мотив Y'Y'Y' может находиться в положениях 9, 10, 11; 10, 11, 12; 11, 12, 13; 12, 13, 14; или 13, 14, 15 антисмысловой нити, при этом нумерация начинается с 1-ого нуклеотида от 5'-конца; или необязательно нумерация начинается с 1-ого спаренного нуклеотида в области дуплекса от 5'-конца. Предпочтительно мотив Y'Y'Y' находится в положениях 11, 12, 13.
В одном варианте все нуклеотиды мотива Y'Y'Y' 2'-OMe-модифицированы.
В одном варианте k равен 1, и l равен 0, или k равен 0 и l равен 1, или оба k и l равны 1.
Таким образом, антисмысловая нить может быть представлена следующими формулами:
5' nq'-Na'-Z'Z'Z'-Nb'-Y'Y'Y'-Na'-np' 3' (IIb);
5' nq'-Na'-Y'Y'Y'-Nb'-X'X'X'-np' 3' (IIc); или
5' nq'-Na'-Z'Z'Z'-Nb'-Y'Y'Y'-Nb'-X'X'X'-Na'-np' 3′ (IId).
В том случае, когда антисмысловая нить представлена формулой (IIb), Nb' означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na' независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда антисмысловая нить представлена формулой (IIc), Nb' означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na' независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда антисмысловая нить представлена формулой (IId), каждый Nb' независимо означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na' независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Предпочтительно, Nb означает 0, 1, 2, 3, 4, 5 или 6.
В других вариантах k равен 0, и l равен 0, и антисмысловая нить может быть представлена формулой:
5' np'-Na'-Y'Y'Y'-Na'-nq' 3' (Ia).
В том случае, когда антисмысловая нить представлена формулой (IIa), каждый Na' независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
Каждый из X', Y' и Z' могут быть одинаковыми или могут отличаться друг от друга.
Каждый нуклеотид смысловой нити и антисмысловой нити могут быть независимо модифицированы LNA, HNA, CeNA, 2'-метоксиэтилом, 2'-O-метилом, 2'-O-аллилом, 2'-C-аллилом, 2'-гидроксилом или 2'-фтором. Например, каждый нуклеотид смысловой нити и антисмысловой нити независимо модифицирован 2'-O-метилом или 2'-фтором. В частности, каждый X, Y, Z, X', Y' и Z' может означать модификацию 2'-O-метилом или модификацию 2'-фтором.
В одном варианте смысловая нить РНК-и-средства может содержать мотив YYY, находящийся в положениях 9, 10 и 11 нити, когда область дуплекса имеет длину 21 нуклеотид, при этом нумерация начинается с 1-ого нуклеотида от 5'-конца или необязательно нумерация начинается с 1-ого спаренного нуклеотида в области дуплекса от 5'-конца; и Y означает 2'-F-модификацию. Смысловая нить может дополнительно содержать мотив XXX или мотивы ZZZ, в качестве боковых модификаций на противоположных концах области дуплекса; и XXX и ZZZ каждый независимо означают 2'-Ome-модификацию или 2'-F-модификацию.
В одном варианте антисмысловая нить может содержать мотив Y'Y'Y', находящийся в положениях 11, 12, 13 нити, при этом нумерация начинается с 1-ого нуклеотида от 5'-конца или необязательно нумерация начинается с 1-ого нуклеотида в пределах области дуплекса от 5'-конца; и Y' означает модификацию 2'-O-метилом. Антисмысловая нить может дополнительно содержать мотив X'X'X' или мотивы Z'Z'Z' в качестве боковых модификаций на противоположных концах области дуплекса; и X'X'X' и Z'Z'Z' каждый независимо означают 2'-Ome-модификацию или 2'-F-модификацию.
Смысловая нить, представленная любой из указанных выше формул (Ia), (Ib), (Ic) и (Id), образует дуплекс с антисмысловой нитью, представленной любой из формул (IIa), (IIb), (IIc) и (IId), соответственно.
Соответственно, РНК-и-средства для применения в способах согласно изобретению могут содержать смысловую нить и антисмысловую нить, при этом каждая нить имеет длину от 14 до 30 нуклеотидов, и при этом дуплекс РНК-и представлен формулой (III):
смысловая: 5' np-Na-(X X X)i-Nb-Y Y Y-Nb-(Z Z Z)j-Na-nq 3'
антисмысловая: 3' np'-Na'-(X'X'X')k-Nb'-Y'Y'Y'-Nb'-(Z'Z'Z')l-Na'-nq' 5'
(III)
где:
i, j, k и l каждый независимо означают 0 или 1;
p, p', q и q' каждый независимо означают 0-6;
каждый Na и Na' независимо означают олигонуклеотидную последовательность, содержащую 0-25 модифицированных нуклеотидов, при этом каждая последовательность содержит, по меньшей мере, два по-разному модифицированных нуклеотида;
каждый Nb и Nb' независимо означают олигонуклеотидную последовательность, содержащую 0-10 модифицированных нуклеотидов;
где
каждый np', np, nq' и nq, каждый из которых может присутствовать или может не присутствовать, независимо означает выступающий нуклеотид; и
XXX, YYY, ZZZ, X'X'X', Y'Y'Y' и Z'Z'Z' каждый независимо означают один мотив из трех идентичных модификаций трех следующих друг за другом нуклеотидов.
В одном варианте i равен 0 и j равен 0; или i равен 1 и j равен 0; или i равен 0 и j равен 1; или оба i и j равны 0; или оба i и j равны 1. В другом варианте k равен 0 и l равен 0; или k равен 1 и l равен 0; k равен 0 и l равен 1; или оба k и l равны 0; или оба k и l равны 1.
Примеры сочетаний смысловой нити и антисмысловой нити, образующих дуплекс РНК-и, включают приведенные ниже формулы:
3′ np'-Na'-Y′Y′Y′ -Na'nq' 5′
3′ np'-Na'-Y′Y′Y′-Nb'-Z′Z′Z′-Na'nq' 5′
3′ np'-Na'-X′X′X′-Nb'-Y′Y′Y′-Na'-nq' 5′
3′ np'-Na'-X′X′X′-Nb'-Y′Y′Y′-Nb'-Z′Z′Z′-Na-nq' 5′
В том случае, когда РНК-и-средство представлено формулой (IIIa), каждый Na независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда РНК-и-средство представлено формулой (IIIb), каждый Nb независимо означает олигонуклеотидную последовательность, содержащую 1-10, 1-7, 1-5 или 1-4 модифицированных нуклеотида. Каждый Na независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда РНК-и-средство представлено в виде формулы (IIIc), каждый Nb, Nb' независимо означают олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5, 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов.
В том случае, когда РНК-и-средство представлено в виде формулы (IIId), каждый Nb, Nb' независимо означает олигонуклеотидную последовательность, содержащую 0-10, 0-7, 0-5 0-4, 0-2 или 0 модифицированных нуклеотидов. Каждый Na, Na' независимо означает олигонуклеотидную последовательность, содержащую 2-20, 2-15 или 2-10 модифицированных нуклеотидов. Каждый Na, Na', Nb и Nb' независимо содержит модификации изменяющегося характера.
Каждый X, Y и Z в формулах (III), (IIIa), (IIIb), (IIIc) и (IIId) могут быть одинаковыми или могут отличаться друг от друга.
В том случае, когда РНК-и-средство представлено формулой (III), (IIIa), (IIIb), (IIIc) и (IIId), по меньшей мере, один из нуклеотидов Y может образовывать пару оснований с одним из нуклеотидов Y'. Альтернативно, по меньшей мере, два из нуклеотидов Y образуют пары оснований с соответствующими нуклеотидами Y'; или все три нуклеотида Y образуют пары оснований с соответствующими нуклеотидами Y'.
В том случае, когда РНК-и-средство представлено формулой (IIIb) или (IIId), по меньшей мере, один из нуклеотидов Z может образовывать пару оснований с одним из нуклеотидов Z'. Альтернативно, по меньшей мере, два нуклеотида Z образуют пары оснований с соответствующими нуклеотидами Z'; или все три нуклеотида Z образуют пары оснований с соответствующими нуклеотидами Z'.
В том случае, когда РНК-и-средство представлено в виде формулы (IIIc) или (IIId), по меньшей мере, один из нуклеотидов X может образовывать пару оснований с одним из нуклеотидов X'. Альтернативно, по меньшей мере, два из нуклеотидов X образуют пары оснований с соответствующими нуклеотидами X'; или все три нуклеотида X образуют пары оснований с соответствующими нуклеотидами X'.
В одном варианте модификация нуклеотида Y отличается от модификации нуклеотида Y', модификация нуклеотида Z отличается от модификации нуклеотида Z' и/или модификация нуклеотида X отличается от модификации нуклеотида X'.
В одном варианте в том случае, когда РНК-и-средство представлено формулой (IIId), модификации Na представляют собой модификации 2'-O-метилом или 2'-фтором. В другом варианте в том случае, когда РНК-и-средство представлено формулой (IIId), модификации Na представляют собой модификации 2'-O-метилом или 2'-фтором и np' > 0 и, по меньшей мере, один np' связан с соседним нуклеотидом фосфоротиоатной связью. В еще одном варианте в том случае, когда РНК-и-средство представлено формулой (IIId), модификации Na представляют собой модификации 2'-O-метилом или 2'-фтором, np' > 0 и, по меньшей мере, один np' связан с соседним нуклеотидом фосфоротиоатной связью, и смысловая нить конъюгирована с одним или несколькими производными GalNAc, связанными бивалентным или трехвалентным разветвленным линкером. В другом варианте в том случае, когда РНК-и-средство представлено формулой (IIId), модификации Na представляют собой модификации 2'-O-метилом или 2'-фтором, np' > 0 и, по меньшей мере, один np' связан с соседним нуклеотидом фосфоротиоатной связью, смысловая нить содержит, по меньшей мере, одну фосфоротиоатную связь, и смысловая нить конъюгирована с одним или несколькими производными GalNAc, связанными бивалентным или трехвалентным разветвленным линкером.
В одном варианте в том случае, когда РНК-и-средство представлено формулой (IIIa), модификации Na представляют собой представляют собой модификации 2'-O-метилом или 2'-фтором, np' > 0 и, по меньшей мере, один np' связан с соседним нуклеотидом фосфоротиоатной связью, смысловая нить содержит, по меньшей мере, одну фосфоротиоатную связь, и смысловая нить конъюгирована с одним или несколькими производными GalNAc, связанными бивалентным или трехвалентным разветвленным линкером.
В одном варианте РНК-и-средство является мультимером, содержащим, по меньшей мере, два дуплекса, представленных формулами (III), (IIIa), (IIIb), (IIIc) и (IIId), при этом дуплексы связаны линкером. Линкер может быть расщепляемым или нерасщепляемым. Необязательно мультимер дополнительно содержит лиганд. Дуплексы могут иметь в качестве мишени один и тот же ген или два разных гена; или каждый из дуплексов может иметь в качестве мишени один и тот же ген, но два разных сайта-мишени.
В одном варианте РНК-и-средство является мультимером, содержащим три, четыре, пять, шесть или больше дуплексов, представленных формулами (III), (IIIa), (IIIb), (IIIc) и (IIId), при этом дуплексы связаны линкером. Линкер может быть расщепляемым или нерасщепляемым. Необязательно мультимер дополнительно содержит лиганд. Дуплексы могут иметь в качестве мишени один и тот же ген или два разных гена; или дуплексы могут иметь в качестве мишени один и тот же ген, но два разных сайта-мишени.
В одном варианте два РНК-и-средства, представленные формулами (III), (IIIa), (IIIb), (IIIc) и (IIId) связаны друг с другом на 5'-конце и одном или обоих 3'-концах и необязательно конъюгированы с лигандом. Средства могут иметь в качестве мишени один и тот же ген или два разных гена; или средства могут иметь в качестве мишени один и тот же ген, но два разных сайта-мишени.
Конъюгаты и-РНК
и-РНК-средства, раскрытые в настоящем описании, могут быть в форме конъюгатов. Конъюгат может быть связан в любом подходящем положении в молекуле и-РНК, например, на 3'-конце или 5'-конце смысловой или антисмысловой нити. Конъюгаты необязательно связаны через линкер.
В некоторых вариантах и-РНК-средство, описанное в настоящей публикации, химически связано с одним или несколькими лигандами, остатками или конъюгатами, которые могут придавать функциональность, например, влияя (например, усиливая) на активность, распределение в клетке или захват и-РНК клеткой. Такие остатки включают без ограничения липидные остатки, такие как остаток холестерина (Letsinger с соавторами, Proc. Natl. Acid. Sci. USA, 1989, 86: 6553-6556), холевой кислоты (Manoharan с соавторами, Biorg. Med. Chem. Let., 1994, 4: 1053-1060), тиоэфира, например, берил-S-тритилтиола (Manoharan с соавторами, Ann. N.Y. Acad. Sci., 1992, 660:306-309; Manoharan с соавторами, Biorg. Med. Chem. Let., 1993, 3: 2765-2770), тиохолестерина (Oberhauser с соавторами, Nucl. Acids Res., 1992, 20: 533-538), алифатической цепи, например, остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J, 1991, 10:1111-1118; Kabanov et al., FEBS Lett., 1990, 259:327-330; Svinarchuk et al., Biochimie, 1993, 75:49-54), фосфолипида, например, дигексадецил-рац-глицерина или 1,2-ди-O-гексадецил-рац-глицеро-3-фосфоната триэтиламмония (Manoharan с соавторами, Tetrahedron Lett., 1995, 36: 3651-3654; Shea с соавторами, Nucl. Acids Res., 1990, 18: 3777-3783), полиамина или цепи полиэтиленгликоля (Manoharan с соавторами, Nucleosides and Nucleotides, 1995, 14: 969-973) или адамантануксусной кислоты (Manoharan с соавторами, Tetrahedron Lett., 1995, 36: 3651-3654), остатка пальмитила (Mishra с соавторами, Biochim. Biophys. Acta, 1995, 1264: 229-237) или остатка окстадециламина или остатка гексиламинокарбонилоксихолестерина (Crooke с соавторами, J. Pharmacol. Exp. Ther., 1996, 277: 923-937).
В одном варианте лиганд изменяет распределение, целенаправленное действие или время жизни и-РНК-средства, в которое он включен. В некоторых вариантах лиганд обеспечивает повышенную аффинность по отношению к выбранной мишени, например, молекуле, клетке или типу клеток, компартменту, например, клеточному или органному компартменту, ткани, органу или области тела, например, по сравнению с видами, в которых такой лиганд отсутствует. Типичные лиганды не будут принимать участия в спаривании дуплекса в образующей дуплекс нуклеиновой кислоте.
Лиганды могут включать встречающиеся в природе вещество, такое как белок (например, сывороточный альбумин человека (HSA), липопротеид низкой плотности (ЛПНП) или глобулин); углевод (например, декстран, пуллулан, хитин, хитозан, инулин, циклодекстрин или гиалуроновая кислота); или липид. Лиганд также может представлять собой рекомбинантную или синтетическую молекулу, такую как синтетический полимер, например, синтетическая полиаминокислота. Примеры полиаминокислот включают полиаминокислоту полилизин (PLL), поли-L-аспарагиновую кислоту, поли-L-глутаминовую кислоту, сополимер стирола-ангидрида малеиновой кислоты, сополимер поли(L-лактид-гликолид), сополимер дивиниловый эфир-малеиновый ангидрид, сополимер N-(2- гидроксипропил)метакриламид (HMPA), полиэтиленгликоль (ПЭГ), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловую кислоту), полимеры N-изопропилакриламида или полифосфазин. Примеры полиаминов включают: полиэтиленимин, полилизин (PLL), спермин, спермидин, полиамин, полиаминовый псевдопептид, полиаминовый пептидомиметик, дендримерный полиамин, аргинин, амидин, протамин, катионный липид, катионный порфирин, четвертичную соль полиамина или α-спиральный пептид.
Лиганды также могут содержать направляющие к мишени группы, например, средство, направляющее к клетке или ткани в качестве мишени, например, лектин, гликопротеид, липид или белок, например, антитело, которое связывается с конкретным типом клеток, таким как клетка почки. Направляющая к мишени группа может представлять собой тиротропин, меланотропин, лектин, гликопротеид, поверхностно-активный белок A, углевод муцин, поливалентную лактозу, поливалентную галактозу, N-ацетилгалактозамин, N-ацетилглюкозамин, поливалентную маннозу, поливалентную фукозу, гликозилированные полиаминокислоты, поливалентную галактозу, трансферрин, бисфосфонат, полиглютамат, полиаспартат, липид, холестерин, стероид, желчную кислоту, фолат, витамин B12, биотин или пептид RGD или миметик пептида RGD.
В некоторых вариантах лигандом является лиганд GalNAc, который содержит одно или несколько производных N-ацетилгалактозамина (GalNAc). Дополнительное описание лигандов GalNAc представлено в разделе, озаглавленном «Конъюгаты с углеводами».
Другие примеры лигандов включают красители, интеркаляторы (например акридины), поперечные линкеры (например, псорален, митомицин C), порфирины (TPPC4, тексафирин, сапфирин), полициклические ароматические углеводороды (например, феназин, дигидрофеназин), искусственные эндонуклеазы (например EDTA), липофильные молекулы, например, холестерин, холевую кислоту, адамантануксусную кислоту, 1-пиренмасляную кислоту, дигидротестостерон, 1,3-бис-O(гексадецил)глицерин, жеранилоксигексильную группу, гексадецилглицерин, борнеол, ментол, 1,3-пропандиол, гептадецильную группу, пальмитиновую кислоту, миристиновую кислоту, O3-(олеоил)литохолевую кислоту, O3-(олеоил)холеновую кислоту, диметокситритил или феноксазин) и конъюгаты пептидов (например, пептида antennapedia, пептида Tat), алкилирующие агенты, фосфат, амино-, меркапто-, ПЭГ (например, ПЭГ-40K), MPEG, [MPEG]2, полиамино-, алкил, замещенный алкил, радиоактивно меченые маркеры, ферменты, гаптены (например, биотин), средства, облегчающие транспорт/всасывание (например, аспирин, витамин E, фолиевую кислоту), синтетические рибонуклеазы (например, имидазол, бисимидазол, гистамин, кластеры имидазола, конъюгаты акридина-имидазола, комплексы Eu3+ тетраазамакроциклов), динитрофенил, HRP или AP.
Лиганды могут представлять собой белки, например, гликопротеиды, или пептиды, например, молекулы, обладающие специфичной аффинностью по отношению к колиганду, или антитела, например, антитело, которое связывается с конкретным типом клеток, таким как раковая клетка, эндотелиальная клетка или костная клетка. Лиганды также могут включать гормоны и рецепторы гормонов. Лиганды также могут включать непептидные формы, такие как липиды, лектины, углеводы, витамины, кофакторы, поливалентная лактоза, поливалентная галактоза, N-ацетилгалактозамин, N-ацетилглукозамин, поливалентная манноза или поливалентная фукоза. Лигандом может быть, например, липополисахарид, активатор MAP-киназы p38 или активатор NF-κB.
Лигандом может быть вещество, например, лекарственное средство, которое может увеличивать захват и-РНК-средства в клетку, например, за счет разрушения клеточного цитоскелета, например, за счет разрушения клеточных микротрубочек, микрофиламентов и/или промежуточных филаментов. Лекарственным средством может быть, например, таксол, винкристин, винбластин, цитохалазин, нокодазол, джаплакинолид, латрункулин A, фаллоидин, свинхолид A, инданоцин или миосервин.
В некоторых вариантах лиганд, связанный с и-РНК, которая описана в настоящей публикации, действует в качестве фармакокинетического модулятора (ФК-модулятора). ФК-модуляторы включают липофильные вещества, желчные кислоты, стероиды, аналоги фосфолипидов, пептиды, связывающие белки средства, ПЭГ, витамины и т.д.. Примеры ФК-модуляторов включают без ограничения холестерин, жирные кислоты, холевую кислоту, литохолевую кислоту, диалкилглицериды, диацилглицерид, фосфолипиды, сфингодипиды, напроксен, ибупрофен, витамин E, биотин и т.д.. Также известно, что олигонуклеотиды, которые содержат множество фосфоротиоатных связей, связываются с сывороточным белком, таким образом, короткие олигонуклеотиды, например, олигонуклеотиды длиной примерно 5 оснований, 10 оснований, 15 оснований или 20 оснований, содержащие множество фосфоротиоатных связей в остове, также приемлемы для настоящего изобретения в качестве лигандов (например, в качестве ФК-модулирующих лигандов). Кроме того, аптамеры, которые связывают компоненты сыворотки (например, сывороточные белки) также подходят для применения в качестве ФК-модулирующих лигандов в вариантах, описанных в настоящей публикации.
Конъюгированные с лигандом олигонуклеотиды согласно изобретению могут быть синтезированы с использованием олигонуклеотида, который несет боковую реакционно-способную функциональную группу, такую как функциональная группа, полученная в результате связывания линкерной молекулы с олигонуклеотидом (описанным ниже). Такой реакционно-способный олигонуклеотид может непосредственно взаимодействовать с коммерчески доступными лигандами, лигандами, которые синтезируют, несущими любую из множества защитных групп, или лигандами, которые имеют связанный с ними линкерный остаток.
Олигонуклеотиды, используемые в конъюгатах согласно настоящему изобретению, могут быть получены удобным и обычным образом с применением хорошо известных способов твердофазного синтеза. Оборудование для такого синтеза продается несколькими поставщиками, включая, например, Applied Biosystems (Foster City, Calif.). Дополнительно или альтернативно можно применять любые другие способы такого синтеза, известные в данной области. Также известно применение сходных способов для получения других олигонуклеотидов, таких как фосфоротиоаты и алкилированные производные.
В случае конъюгированных с лигандами олигонуклеотидов и несущих молекулу лиганда связанных в специфичную последовательность нуклеозидов согласно настоящему изобретению, олигонуклеотиды и олигонуклеозиды могут быть собраны на подходящем ДНК-синтезаторе с использованием стандартных предшественников нуклеотидов или нуклеозидов или предшественников конъюгатов нуклеотидов или нуклеозидов, которые уже несут связывающий остаток, предшественников лиганд-нуклеотидов или нуклеозидных конъюгатов, которые уже несут молекулу лиганда, или строительных блоков, несущих ненуклеозидные лиганды.
В случае использования предшественников нуклеотидных конъюгатов, которые уже несут линкерный остаток, обычно осуществляют синтез связанных в специфичную последовательность нуклеозидов и затем молекулу лиганда подвергают взаимодействию с линкерным остатком с образованием конъюгированного с лигандом олигонуклеотида. В некоторых вариантах олигонуклеотиды или связанные нуклеозиды согласно настоящему изобретению синтезируют с помощью автоматического синтезатора, используя фосфорамидиты, полученные из конъюгатов лиганд-нуклеозид, в дополнение в стандартным фосфорамидитам и нестандартным фосфорамидитам, которые коммерчески доступны и которые обычно используют для синтеза олигонуклеотидов.
Конъюгаты с липидами
В одном варианте лиганд является липидом или основанной на липиде молекулой. Такой липид или основанная на липиде молекула обычно может связываться с сывороточным белком, таким как сывороточный альбумин человека (HAS). Лиганд, связывающий HSA, обеспечивает возможность распределения конъюгата в ткань-мишень, например, непочечную ткань-мишень организма. Например, тканью-мишенью может быть печень, включая паренхиматозные клетки печени. В качестве лигандов также можно использовать другие молекулы, которые могут связываться с HSA. Например, можно использовать непроксин или аспирин. Липид или лиганд на основе липида могут (a) повышать устойчивость конъюгата к разложению, (b) улучшать направление к мишени или транспорт в клетку-мишень или клеточную мембрану, и/или (c) можно использовать для регуляции связывания с белком сыворотки, например, HSA.
Лиганд на основе липидов можно использовать для того, чтобы модулировать, например, контролировать (например, ингибировать) связывание конъюгата с тканью-мишенью. Например, липид или лиганд на основе липидов, который связывает с HSA более прочно, будет с меньшей вероятностью прицельно направлен в почки и, следовательно, с меньшей вероятностью будет выводиться из организма. Липид или лиганд на основе липидов, который связывается с HSA менее прочно, можно использовать для того, чтобы прицельно направить конъюгат в почки.
В одном варианте лиганд, основанный на липиде, связывается с HSA. Например, лиганд может связывать HSA с аффинностью, достаточной для того, чтобы усилить распределение конъюгата в непочечную ткань. Однако обычно аффинность не настолько высокая, чтобы связывание HAS с лигандом не могло быть обратимым.
В другом варианте лиганд, основанный на липиде, связывает HSA слабо или совсем не связывает, так что распределение конъюгата в почки усиливается. Другие остатки, которые нацеливают в почечные клетки, также можно использовать вместо или дополнительно к лиганду, основанному на липиде.
В другом аспекте лиганд представляет собой остаток, например витамин, который захватывается клеткой-мишенью, например пролиферирующей клеткой. Такие лиганды особенно применимы для лечения расстройств, характеризующихся нежелательной клеточной пролиферацией, например, злокачественного или доброкачественного типа, например раковых клеток. Примеры витаминов включают витамин A, E и K. Другие примеры витаминов включают витамин B, например фолиевую кислоту, B12, рибофлавин, биотин, пиридоксаль или другие витамины или питательные вещества, захватываемые раковыми клетками. Также включены HSA и липопротеид низкой плотности (ЛПНП).
Средства для проникновения в клетку
В другом аспекте лиганд представляет собой средство для проникновения в клетку, предпочтительно спиральное средство для проникновения в клетку. В одном варианте средство является амфипатическим. Примером средства является пептид, такой как tat или antennopedia. Если средство представляет собой пептид, то оно может быть модифицировано, включая пептидилмиметики, инвертомеры, непептидные или псевдопептидные связи и применение D-аминокислот. Спиральное средство предпочтительно представляет собой средство в форме α-спирали и оно может иметь липофильную и липофобную фазу.
Лигандом может быть пептид или пептидомиметик. Пептидомиметик (также называемый в настоящем описании олигопептидомиметиком) представляет собой молекулу, способную укладываться в определенную трехмерную структуру, сходную со структурой природного пептида. Связывание пептида пептидомиметиков с и-РНК-средствами может влиять на фармакокинетическое распределение и-РНК, например за счет усиления клеточного распознавания и всасывания. Остаток пептида или пептидомиметика может иметь длину примерно 5-50 аминокислот, например, длиной примерно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 аминокислот.
Пептидом или пептидомиметиком может быть, например, пептид для проникновения в клетку, катионный пептид, амфипатический пептид или гидрофобный пептид (например, состоящий, главным образом, из Tyr, Trp или Phe). Пептидный остаток может представлять собой дендримерный пептид, конформационно ограниченный пептид или поперечно сшитый пептид. В другом альтернативном варианте пептидный остаток может содержать гидрофобную последовательность транслокации через мембрану (MTS). Примером пептида, содержащего гидрофобную MTS, является RFGF, имеющий аминокислотную последовательность AAVALLPAVLLALLAP (SEQ ID NO: 3367). Аналог RFGF (например, аминокислотная последовательность AALLPVLLAAP (SEQ ID NO: 3368)), содержащий гидрофобную MTS, также может быть направляющим к мишени остатком. Пептидный остаток может представлять собой пептид «для доставки», который может нести крупные полярные молекулы, включая пептиды, олигонуклеотиды и белок, через клеточные мембраны. Например, было обнаружено, что последовательности из белка Tat ВИЧ (GRKKRRQRRRPPQ (SEQ ID NO: 3369)) и белка Antennapedia Drosophila (RQIKIWFQNRRMKWKK (SEQ ID NO: 3370)) способны функционировать в качестве пептидов для доставки. Пептид или пептидомиметик могут кодироваться случайной последовательностью ДНК, например, как пептид, идентифицированный из библиотеки в фаговом дисплее или комбинаторной библиотеки «один шарик-одно соединение» (OBOC) (Lam с соавторами, Nature, 354: 82-84, 1991). Обычно пептид или пептидомиметик, связанный с днРНК-средством через включенную мономерную единицу, является направляющим в клетку-мишень пептидом, таким как пептид аргинин-глицин-аспарагиновая кислота (RGD) или миметик RGD. Пептидный остаток может иметь длину в диапазоне примерно от 5 аминокислот до примерно 40 аминокислот. Пептидные остатки могут иметь структурную модификацию, в частности для повышения стабильности или прямых конформационных свойств. Можно использовать любую из структурных модификаций, описанных ниже.
Пептид RGD для применения в композициях и способах согласно изобретению может быть линейным или циклическим и может быть модифицированным, например, гликозилированным или метилированным, чтобы облегчить нацеливание на конкретную ткань (ткани). RGD-содержащие пептиды и пептидомиметики могут содержать D-аминокислоты, а также синтетические миметики RGD. Кроме RGD можно использовать другие остатки, мишенью которых является лиганд интегрин. Мишенью предпочтительных конъюгатов такого лиганда является PECAM-1 или VEGF.
Пептидный остаток RGD можно использовать для целенаправленного действия на конкретный тип клеток, например, опухолевую клетку, такую как эндотелиальная опухолевая клетка или клетка рака молочной железы (Zitzmann с соавторами, Cancer Res., 62: 5139-43, 2002). Пептид RGD может облегчать целенаправленное действие днРНК-средства на опухоли множества других тканей, включая легкое, почки, селезенку или печень (Aoki с соавторами, Cancer Gene Therapy 8: 783-787, 2001). Обычно пептид RGD может способствовать целенаправленному действию и-РНК-средства на почки. Пептид RGD может быть линейным или циклическим, и может быть модифицирован, например, гликозилирован или метилирован для облегчения целенаправленного действия на конкретные ткани. Например, гликозилированный пептид RGD может доставлять и-РНК-средство к опухолевой клетке, экспрессирующей αvβ3 (Haubner с соавторами, Jour. Nucl. Med., 42: 326-336, 2001).
«Пептид для проникновения в клетку» способен обеспечивать проницаемость клетки, например, клетки микроорганизма, такой как бактериальная клетка или клетка гриба, или клетки млекопитающего, такой как клетка человека. Пептид для проницаемости клеток микроорганизмов может представлять собой, например, α-спиральный линейный пептид (например, LL-37 или церопорин PI), пептид, содержащий дисульфидную связь (например, α-дефензин, β-дефензин или бактенецин), или пептид, содержащий только одну или две преобладающие аминокислоты (например, PR-39 или индолицидин). Пептид для проникновения в клетку также может содержать сигнал ядерной локализации (NLS). Например, пептид для проникновения в клетку может представлять собой состоящий из двух частей амфипатический пептид, такой как MPG, который получен из слитого пептидного домена gp41 ВИЧ-1 и NLS большого T-антигена SV40 (Simeoni с соавторами, Nucl. Acids Res. 31: 2717-2724, 2003).
Конъюгаты с углеводами
В некоторых вариантах композиций и способов согласно изобретению олигонуклеотид и-РНК дополнительно содержит углевод. Конъюгированные с углеводами и-РНК являются предпочтительными для доставки in vivo нуклеиновых кислот, а также композиций, подходящих для терапевтического применения in vivo, которые описаны в настоящей публикации. В используемом в настоящем описании смысле «углевод» относится к соединению, которое является либо углеводом как таковым, состоящим из одной или нескольких моносахаридных единиц, имеющих, по меньшей мере, 6 атомов углерода (который может быть линейным, разветвленным или циклическим), при этом с каждым атомом углерода связан атом кислорода, азота или серы; либо соединением, имеющим в качестве его части остаток углевода, состоящий из одной или нескольких моносахаридных единиц, каждая из которых имеет, по меньшей мере, шесть атомов углерода (который может быть линейным, разветвленным или циклическим), при этом с каждым атомом углерода связан атом кислорода, азота или серы. Соответствующие углеводы включают сахара (моно-, ди-, три- и олигосахариды, содержащие примерно 4, 5, 6, 7, 8 или 9 моносахаридных единиц), и полисахариды, такие как крахмалы, гликоген, целлюлоза и полисахаридные камеди. Конкретные моносахариды включают C5-сахара и выше (например, C5, C6, C7 или C8); ди- и трисахариды включают сахара, имеющие две или три моносахаридных единицы (например, C5, C6, C7 или C8).
В одном варианте конъюгат с углеводом содержит моносахарид. В одном варианте моносахаридом является N-ацетилгалактозамин (GalNAc). GalNAc-конъюгаты описаны, например, в патенте США № 8106022, полное содержание которого включено в настоящее описание в виде ссылки. В некоторых вариантах GalNAc-конъюгат служит в качестве лиганда, который направляет и-РНК к конкретным клеткам. В некоторых вариантах GalNAc-конъюгат направляет и-РНК в клетки печени, например, за счет того, что он служит в качестве лиганда рецептора асиалогликопротеида клеток печени (например, гепатоцитов).
В некоторых вариантах углеводный конъюгат содержит одно или несколько производных GalNAc. Производные GalNAc могут быть связаны через линкер, например, бивалентный или трехвалентный разветвленный линкер. В некоторых вариантах GalNAc-конъюгат конъюгирован с 3'-концом смысловой нити. В некоторых вариантах GalNac-конъюгат конъюгирован с и-РНК-средством (например, с 3'-концом смысловой нити) через линкер, например, линкер, который описан в настоящей публикации.
В некоторых вариантах GalNAc-конъюгат представляет собой
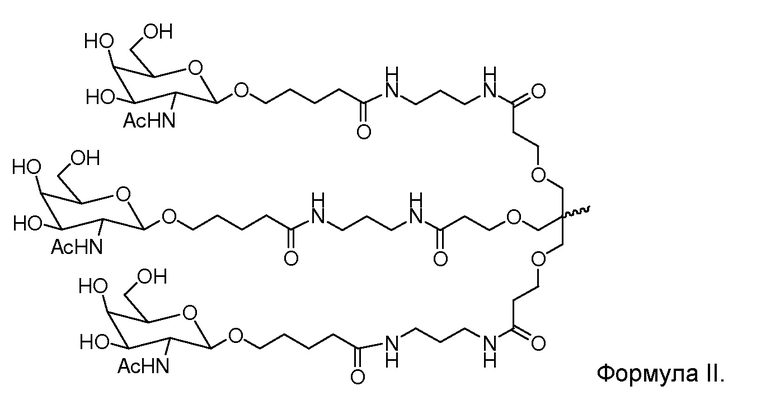
В некоторых вариантах РНК-и-средство связано в конъюгате с углеводом через линкер, который показан на следующей схеме, где X означает O или S.
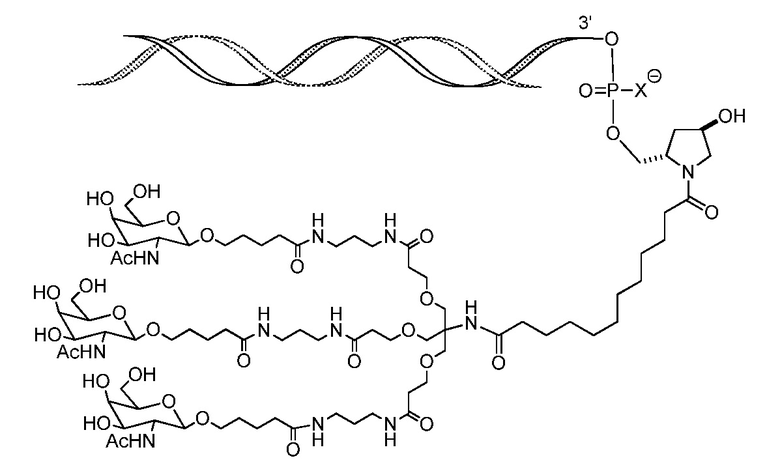
В некоторых вариантах РНК-и-средство конъюгировано с L96, который определен в таблице 1 и показан ниже
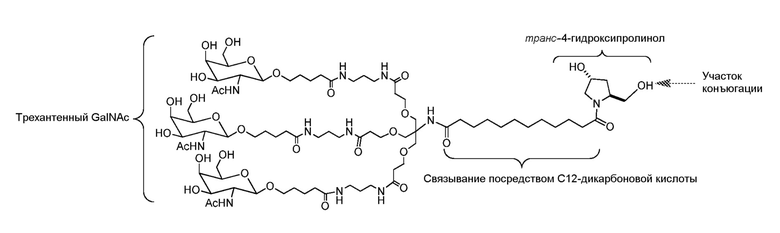
В некоторых вариантах углеводный конъюгат для применения в композициях и способах согласно изобретению выбран из группы, состоящей из:
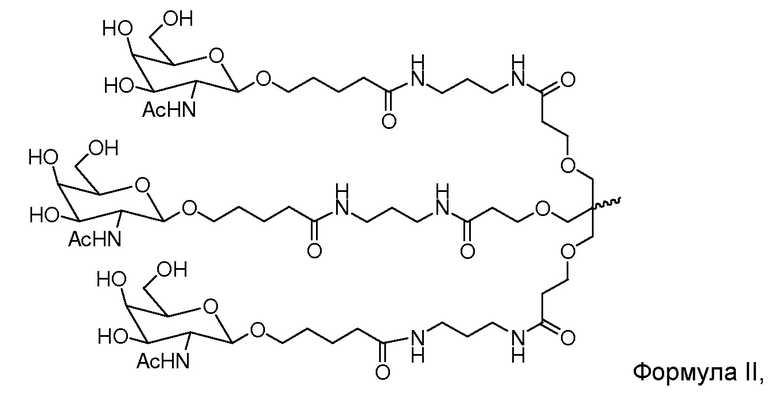
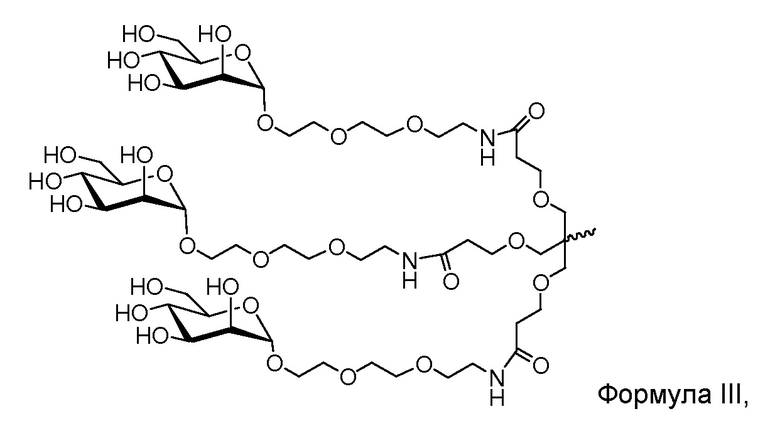
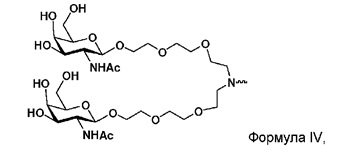
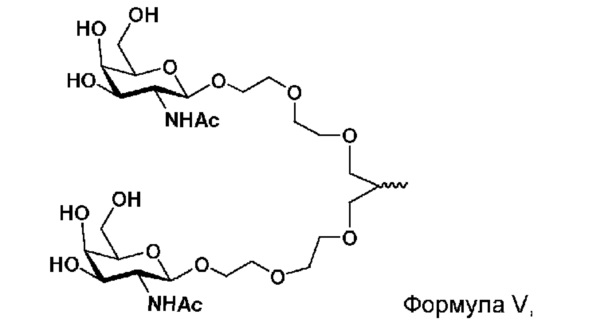
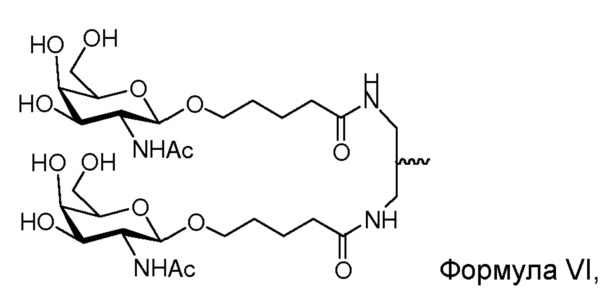
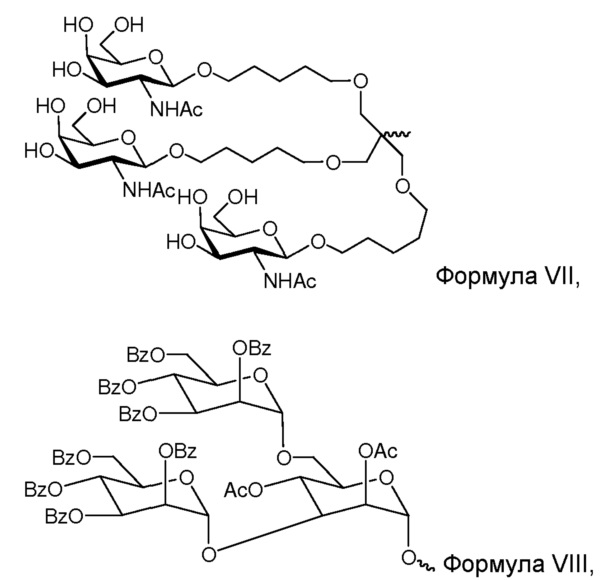
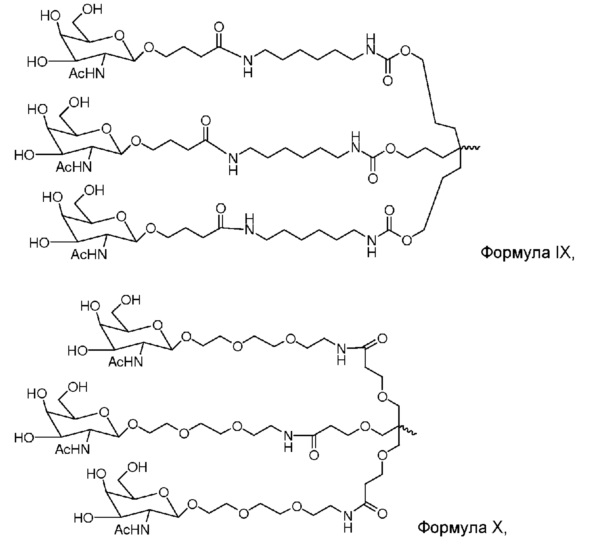
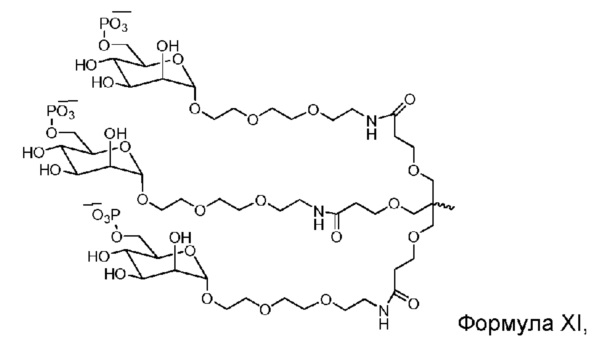
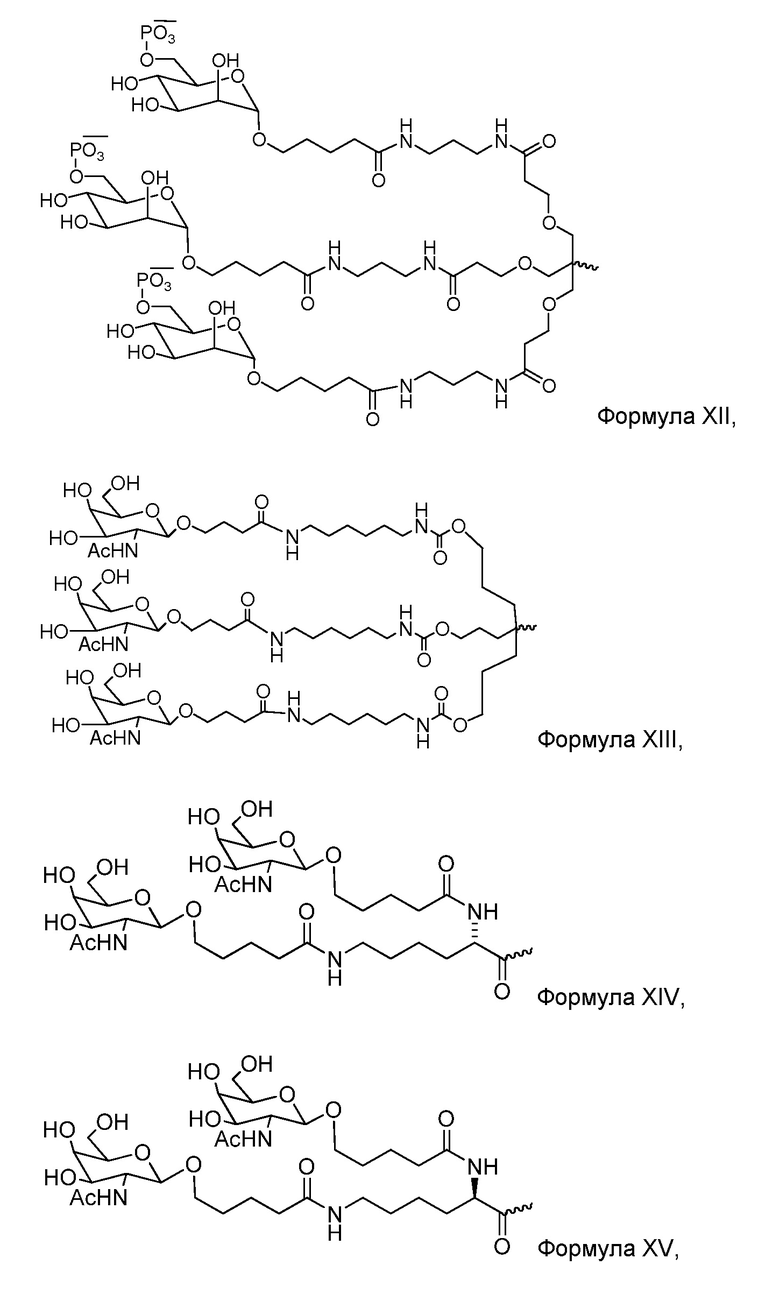
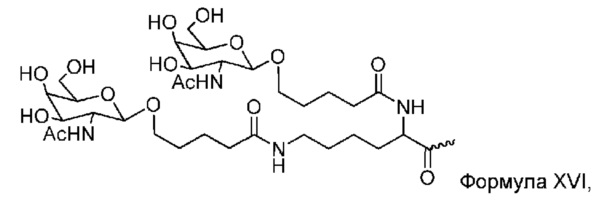
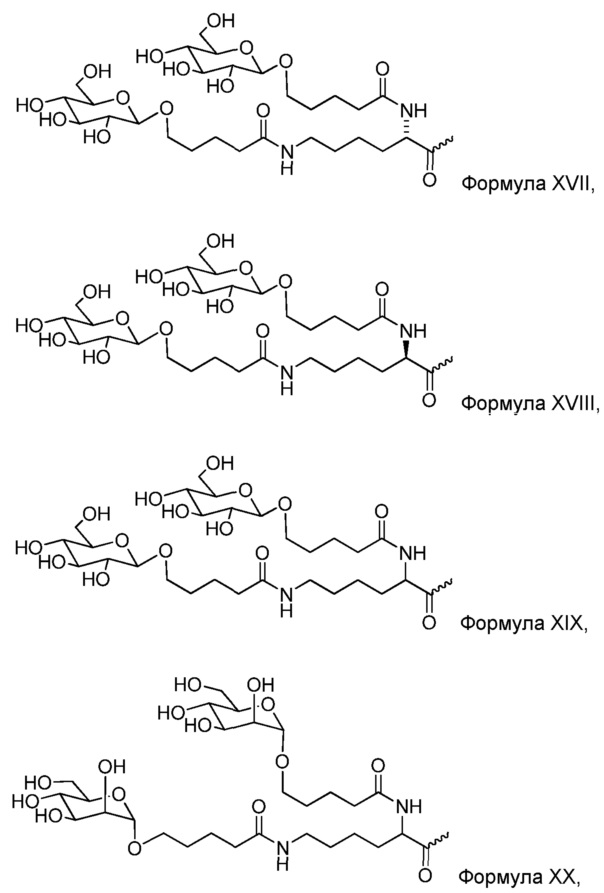
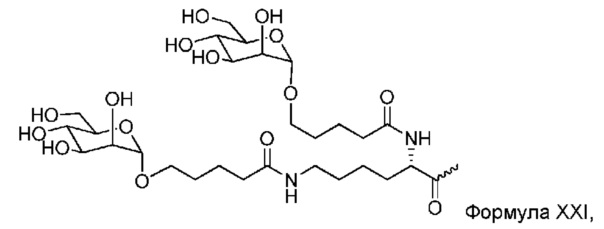
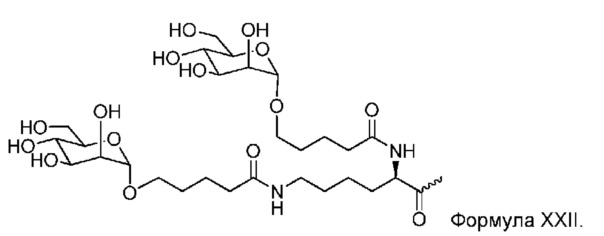
Другой типичный углеводный конъюгат для применения в вариантах, описанных в настоящей публикации, включает без ограничения
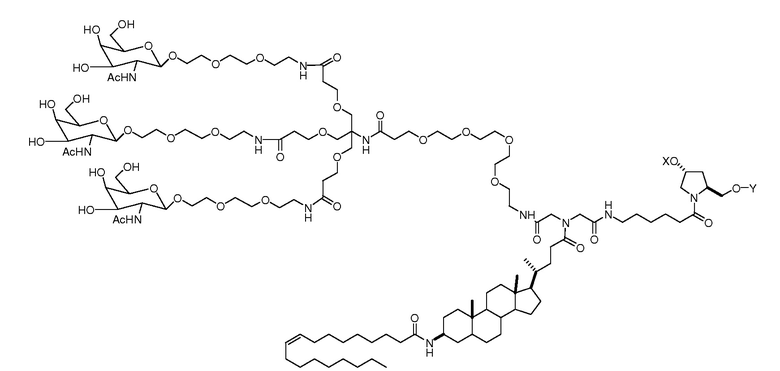
(формула XXIII), где один из X или Y означает олигонуклеотид, а другой означает водород.
В некоторых вариантах углеводный конъюгат дополнительно содержит один или несколько дополнительных лигандов, которые описаны выше, например, но без ограничения ФК-модулятор и/или пептид для проникновения в клетку.
В одном варианте и-РНК согласно изобретению конъюгирована с углеводом через линкер. Не ограничивающие примеры и-РНК-углеводных конъюгатов с линкерами в композициях и способы согласно изобретению включают без ограничения
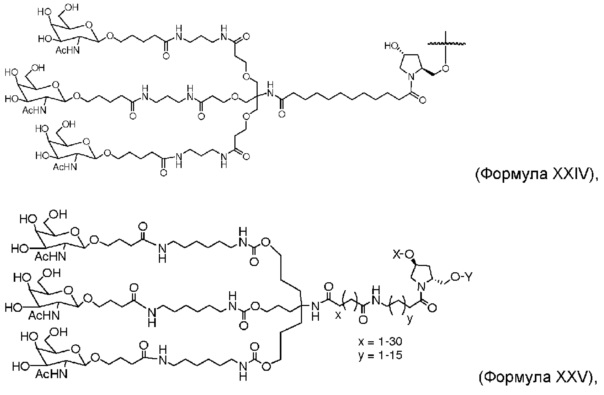
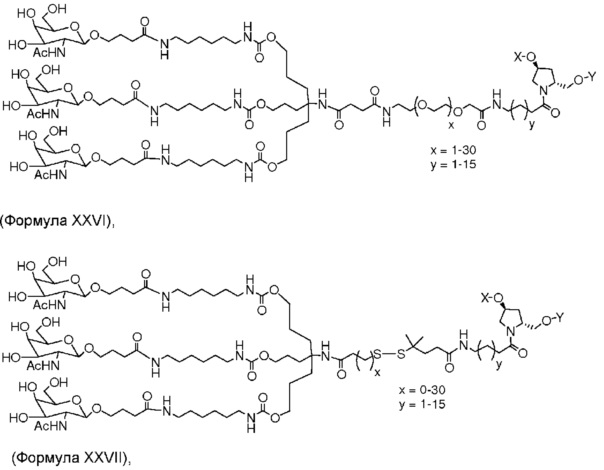
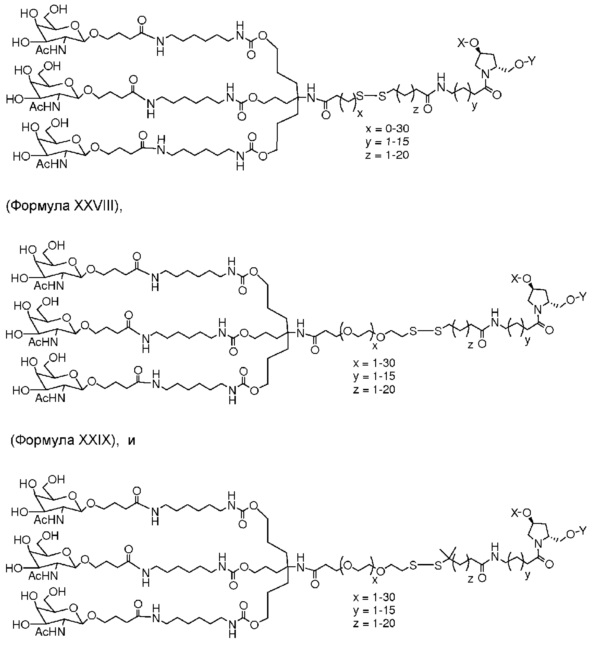
(формула XXX), где один из X или Y означает олигонуклеотид, а другой означает водород.
Линкеры
В некоторых вариантах конъюгат или лиганд, описанный в настоящей публикации, может быть связан с олигонуклеотидом и-РНК с использованием различных линкеров, которые могут быть расщепляемыми или нерасщепляемыми.
Термин «линкер» или «линкерная группа» означает органический остаток, который связывает две части соединения, например, ковалентно связывает две части соединения. Линкеры обычно содержат непосредственную связь или такой атом как атом кислорода или серы, такую единицу как NR8, C(O), C(O)NH, SO, SO2, SO2NH или цепь из атомов, такую как без ограничения замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арилалкил, арилалкенил, арилалкинил, гетероарилалкил, гетероарилалкенил, гетероарилалкинил, гетероциклилалкил, гетероциклилалкенил, гетероциклилалкинил, арил, гетероарил, гетероциклил, циклоалкил, циклоалкенил, алкиларилалкил, алкиларилалкенил, алкиларилалкинил, алкениларилалкил, алкениларилалкенил, алкениларилалкинил, алкиниларилалкил, алкиниларилалкенил, алкиниларилалкинил, алкилгетероарилалкил, алкилгетероарилалкенил, алкилгетероарилалкинил, алкенилгетероарилалкил, алкенилгетероарилалкенил, алкенилгетероарилалкинил, алкинилгетероарилалкил, алкинилгетероарилалкенил, алкинилгетероарилалкинил, алкилгетероциклилалкил, алкилгетероциклилалкенил, алкилгетероциклилалкинил, алкенилгетероциклилалкил, алкенилгетероциклилалкенил, алкенилгетероциклилалкинил, алкинилгетероциклилалкил, алкинилгетероциклилалкенил, алкинилгетероциклилалкинил, алкиларил, алкениларил, алкиниларил, алкилгетероарил, алкенилгетероарил, алкинилгетероарил, при этом один или несколько метиленов могут быть прерваны или иметь на конце O, S, S(O), SO2, N(R8), C(O), замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный гетероцикл; где R8 означает водород, ацил, алифатическую или замещенную алифатическую группу. В одном варианте линкер содержит примерно 1-24 атома, 2-24, 3-24, 4-24, 5-24, 6-24, 6-18, 7-18, 8-18 атомов, 7-17, 8-17, 6-16, 7-16 или 8-16 атомов.
В одном варианте днРНК согласно изобретению конъюгирована с бивалентным или трехвалентным разветвленным линкером, выбранным из группы структур, показанных в любой из формул (XXXI) - (XXXIV):
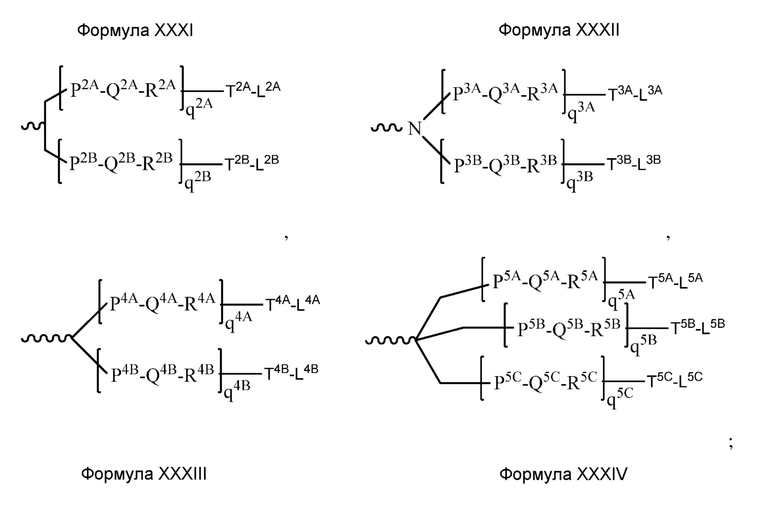
где:
q2A, q2B, q3A, q3B, q4A, q4B, q5A, q5B и q5C независимо в каждом случае означают 0-20, и где повторяющиеся единицы могут быть одинаковыми или разными;
P2A, P2B, P3A, P3B, P4A, P4B, P5A, P5B, P5C, T2A, T2B, T3A, T3B, T4A, T4B, T5A, T5B, T5C независимо в каждом случае отсутствуют, означают CO, NH, O, S, OC(O), NHC(O), CH2, CH2NH или CH2O;
Q2A, Q2B, Q3A, Q3B, Q4A, Q4B, Q5A, Q5B, Q5C независимо в каждом случае отсутствуют, означают алкилен, замещенный алкилен, где один или несколько метиленов могут быть прерваны или иметь на конце один или несколько из O, S, S(O), SO2, N(RN), C(R')=C(R”), C≡С или C(O);
R2A, R2B, R3A, R3B, R4A, R4B, R5A, R5B, R5C каждый независимо в каждом случае отсутствует, означает NH, O, S, CH2, C(O)0, C(O)NH, NHCH(Ra)C(O), -C(O)-CH(Ra)-NH-, CO, CH=N-0,
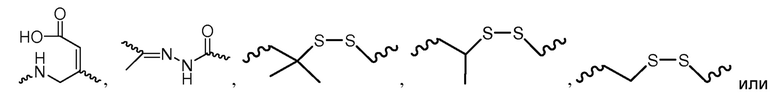
или гетероциклил;
L2A, L2B, L3A, L3B, L4A, L4B, L5A, L5B и L5C означают лиганд; т.е. каждый независимо в каждом случае означает моносахарид (такой как GalNAc), дисахарид, трисахарид, тетрасахарид, олигосахарид или полисахарид; и Ra означает H или боковую цепь аминокислоты. Трехвалентный конъюгируемые производные GalNAc особенно полезны в случае применения с РНК-и-средствами для ингибирования экспрессии гена-мишени, такие как соединения формулы (XXXV):
Формула XXXV
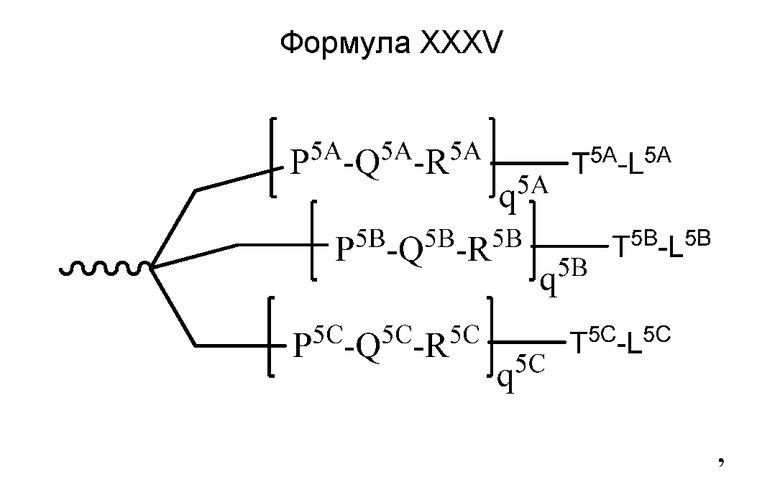
где L5A, L5B и L5C означают моносахарид, такой как производное GalNAc.
Примеры подходящих бивалентных и трехвалентных разветвленных линкерных групп конъюгируемых производных GalNAc включают без ограничения структуры, перечисленные выше, представленные формулами II, VII, XI, X и XIII.
Расщепляемой линкерной группой является группа, которая в достаточной мере стабильна вне клетки, но которая при проникновении в клетку-мишень расщепляется, высвобождая две части, удерживаемые вместе в линкере. В предпочтительном варианте расщепляемая линкерная группа расщепляется, по меньшей мере, примерно в 10 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или больше или, по меньшей мере, примерно в 100 раз быстрее в клетке-мишени или в определенных эталонных условиях (которые могут быть, например, выбраны для того, чтобы имитировать или представить условия внутри клетки), чем в крови субъекта или в случае других эталонных условий (которые могут быть, например, выбраны для того, чтобы имитировать или представить условия, встречающиеся в крови или сыворотке).
Расщепляемые линкерные группы чувствительны к расщепляющим агентам, например, pH, окислительно-восстановительному потенциалу или присутствию вызывающих распад молекул. Обычно расщепляющие агенты преобладают или встречаются на более высоких уровнях или с более высокими активностями внутри клеток, чем в сыворотке или крови. Примеры таких агентов, вызывающих распад, включают: окислительно-восстановительные агенты, которые выбраны для конкретных субстратов или которые не обладают субстратной специфичностью, включая, например, окислительные или восстановительные ферменты или такие восстановители, как меркаптаны, которые присутствуют в клетках, которые могут вызывать распад расщепляемых в реакции окисления-восстановления линкерных групп в результате восстановления; эстеразы; эндосомы или средства, которые могут создавать кислую среду, например, средства, которые приводят к значению pH пять или ниже; ферменты, которые могут гидролизовать или приводить к распаду расщепляемой кислотами линкерной группы, действуя как обычная кислота, пептидазы (которые могут обладать субстратной специфичностью) и фосфатазы.
Расщепляемая линкерная группа, такая как дисульфидная связь, может быть чувствительной к pH. Значение pH сыворотки человека равно 7,4, тогда как среднее значение внутриклеточного pH немного ниже в диапазоне примерно от 7,1 до 7,3. Эндосомы имеют более кислое значение pH, в диапазоне 5,5-6,0, и лизосомы имеют еще более кислый pH около 5,0. Некоторые линкеры будут иметь расщепляемую линкерную группу, которая расщепляется при предпочтительном значении pH, высвобождая при этом катионный липид из лиганда в клетку или в требуемый компартмент клетки.
Линкер может содержать расщепляемую линкерную группу, которая расщепляется конкретным ферментом. Тип расщепляемой линкерной группы, включенной в линкер, может зависеть от клетки, которая является мишенью. Например, направляющий в печень лиганд может быть связан с катионным липидом через линкер, который содержит сложноэфирную группу. Клетки печени богаты эстеразами, и поэтому линкер будет расщепляться более эффективно в клетках печени, чем в типах клеток, которые не богаты эстеразами. Другие типы клеток, богатых эстеразами, включают клетки легкого, коркового вещества почки и семенников.
Линкеры, которые содержат пептидные связи, можно использовать в том случае, когда типы клеток-мишеней богаты пептидазами, такие как клетки печени и синовиоциты.
В общем, чувствительность расщепляемых линкерных групп-кандидатов можно оценить, тестируя способность вызывающего распад агента (или условия) расщеплять выбранную для исследования линкерную группу. Также может требоваться тестирование выбранной для исследования линкерной группы в отношении способности быть резистентной к расщеплению в крови или в случае контакта с другой тканью, не являющейся мишенью. Таким образом, можно определить относительную чувствительность к расщеплению в случае первого и второго условия, при этом первое выбирают так, чтобы оно указывало на расщепление в клетке-мишени, а второе выбирают так, чтобы оно указывало на расщепление в других тканях или биологических жидкостях, например, в крови или сыворотке. Оценки можно осуществлять в бесклеточных системах, в клетках, в культуре клеток, в культуре органа или ткани или в целом организме животного. Могут быть полезными начальные оценки в бесклеточных условиях или в условиях культуры и для подтверждения дальнейшие оценки в целом организме животного. В предпочтительных вариантах применимые выбранные для исследования соединения расщепляются, по меньшей мере, примерно в 2, 4, 10, 20, 30, 40, 50, 60, 70, 80, 90 или примерно 100 раз быстрее в клетке (или в условиях in vitro, выбранных с целью имитации внутриклеточных условий) по сравнению с кровью или сывороткой (или в условиях in vitro, выбранных с целью имитации внеклеточных условий).
Расщепляемые при окислении-восстановлении линкерные группы
В одном варианте расщепляемая линкерная группа представляет собой расщепляемую при окислении-восстановлении линкерную группу, которая расщепляется при восстановлении или окислении. Примером расщепляемой при восстановлении линкерной группы является дисульфидная линкерная группа (-S-S-). Чтобы определить, является ли выбранная для исследования расщепляемая линкерная группа подходящей «расщепляемой при восстановлении линкерной группой» или, например, подходящей для применения с конкретным остатком и-РНК и конкретным направляющим к мишени агентом, можно обратиться к способам, описанным в настоящей публикации. Например, кандидата можно оценивать посредством инкубации с дитиотреитолом (DTT) или другим восстановителем, используя реагенты, известные в данной области, которые имитируют скорость расщепления, которую можно наблюдать в клетке, например, в клетке-мишени. Выбранных для исследования кандидатов также можно оценивать в условиях, которые выбирают так, чтобы имитировать условия в крови или сыворотке. В одном варианте выбранные для исследования соединения расщепляются не больше чем примерно на 10% в крови. В других вариантах полезные выбранные для исследования соединения распадаются, по меньшей мере, примерно в 2, 4, 10, 20, 30, 40, 50, 60, 70, 80, 90 или примерно в 100 раз быстрее в клетке (или в условиях in vitro, выбранных так, чтобы они имитировали внутриклеточные условия) по сравнению с кровью (или в условиях in vitro, выбранных так, чтобы они имитировали внутриклеточные условия). Скорость расщепления выбранных для исследования соединений также можно определить, используя стандартные ферментативные кинетические анализы в условиях, выбранных так, чтобы они имитировали внутриклеточную среду, и сравнивая с условиями, выбранными так, чтобы они имитировали внеклеточную среду.
Основанные на фосфате расщепляемые линкерные группы
В другом варианте расщепляемый линкер содержит основанную на фосфате расщепляемую линкерную группу. Основанная на фосфате расщепляемая линкерная группа расщепляется агентами, которые или вызывают распад или гидролизируют фосфатную группу. Примерами средства, которое расщепляет фосфатные группы в клетках, являются ферменты, такие как фосфатаза в клетках. Примерами основанных на фосфате линкерных групп являются -O-P(O)(ORk)-O-, -O-P(S)(ORk)-O-, -O-P(S)(SRk)-O-, -S-P(O)(ORk)-O-, -O-P(O)(ORk)-S-, -S-P(O)(ORk)-S-, -O-P(S)(ORk)-S-, -S-P(S)(ORk)-O-, -O-P(O)(Rk)-O-, -O-P(S)(Rk)-O-, -S-P(O)(Rk)-O-, -S-P(S)(Rk)-O-, -S-P(O)(Rk)-S-, -O-P(S)(Rk)-S-. Предпочтительными вариантами являются -O-P(O)(OH)-O-, -O-P(S)(OH)-O-, -O-P(S)(SH)-O-, -S-P(O)(OH)-O-, -O-P(O)(OH)-S-, -S-P(O)(OH)-S-, -O-P(S)(OH)-S-, -S-P(S)(OH)-O-, -O-P(O)(H)-O-, -0-P(S)(H)-0-, -S-P(O)(H)-0, -S-P(S)(H)-O-, -S-P(O)(H)-S-, -O-P(S)(H)-S-. Предпочтительным вариантом является -O-P(O)(OH)-O-. Указанные выбранные для исследования кандидаты можно оценить, используя способы, аналогичные описанным выше способам.
Расщепляемая кислотой линкерная группа
В другом варианте расщепляемый линкер содержит расщепляемую кислотой линкерную группу. Расщепляемая кислотой линкерная группа представляет собой группу, которая расщепляется в кислых условиях. В предпочтительных вариантах расщепляемые кислотой линкерные группы расщепляются в кислой среде с pH примерно 6,5 или ниже (например, примерно 6,0, 5,75, 5,5, 5,25, 5,0 или ниже) или такими агентами, как ферменты, которые могут действовать как обычная кислота. В клетке специальные органеллы с низким pH, такие как эндосомы и лизосомы, могут обеспечивать среду для расщепления расщепляемых кислотой линкерных групп. Примеры расщепляемых кислотой линкерных групп включают без ограничения гидразоны, сложные эфиры и сложные эфиры аминокислот. Расщепляемые кислотой группы могут иметь общую формулу -C=NN-, C(O)O или -OC(O). Предпочтительным вариантом в том случае, когда атом углерода связан с атомом кислорода сложного эфира (алкоксигруппа) является арильная группа, замещенная алкильная группа или третичная алкильная группа, такая как диметилпентил или трет-бутил. Такие кандидаты можно оценить, используя способы, аналогичные описанным выше способам.
Основанные на сложных эфирах расщепляемые линкерные группы
В другом варианте расщепляемый линкер содержит основанную на сложном эфире расщепляемую линкерную группу. Основанная на сложном эфире расщепляемая линкерная группа расщепляется в клетке такими ферментами как эстеразы и амидазы. Примеры основанных на сложных эфирах расщепляемых линкерных групп включают без ограничения сложные эфиры групп алкилена, алкенилена и алкинилена. Сложноэфирные расщепляемые линкерные группы имеют общую формулу -C(O)O- или -OC(O)-. Такие кандидаты можно оценить, используя способы, аналогичные описанным выше способам.
Основанные на пептидах расщепляемые линкерные группы
В еще одном варианте расщепляемый линкер содержит основанную на пептиде расщепляемую линкерную группу. Основанная на пептиде расщепляемая линкерная группа расщепляется в клетке такими ферментами, как пептидазы и протеазы. Основанные на пептидах расщепляемые линкерные группы представляют собой пептидные связи, образованные между аминокислотами, которые приводят к образованию олигопептидов (например, дипептидов, трипептидов и т.д.) и полипептидов. Основанные на пептидах расщепляемые группы не включают амидную группу (-C(O)NH-). Амидная группа может быть образована между любыми алкиленами, алкениленами или алкиниленами. Пептидная связь представляет собой специальный тип амидной связи, образованной между аминокислотами и приводящей к образованию пептидов и белков. Основанная на пептиде расщепляемая группа обычно ограничена пептидной связью (т.е. амидной связью), образованной между аминокислотами с получением пептидов и белков и не включает полную амидную функциональную группу. Основанные на пептидах расщепляемые линкерные группы имеют общую формулу - NHCHRAC(O)NHCHRBC(O) - (SEQ ID NO: 13), где RA и RB представляют собой R-группы двух соседних аминокислот. Такие кандидаты можно оценивать с использованием способов, аналогичных описанным выше способам.
Соответствующие патенты США, в которых описано получение конъюгатов РНК, включают без ограничения патенты США №4828979, 4948882, 5218105, 5525465, 5541313, 5545730, 5552538, 5578717, 5580731, 5591584, 5109124, 5118802, 5138045, 5414077, 5486603, 5512439, 5578718, 5608046, 4587044, 4605735, 4667025, 4762779, 4789737, 4824941, 4835263, 4876335, 4904582, 4958013, 5082830, 5112963, 5214136, 5082830, 5112963, 5214136, 5245022, 5254469, 5258506, 5262536, 5272250, 5292873, 5317098, 5371241, 5391723, 5416203, 5451463, 5510475, 5512667, 5514785, 5565552, 5567810, 5574142, 5585481, 5587371, 5595726, 5597696, 5599923, 5599928 и 5688941, 6294664, 6320017, 6576752, 6783931, 6900297, 7037646, 8106022, полное содержание каждого из которых включено в настоящее описание в виде ссылки.
Необязательно, чтобы данное соединение было единообразно модифицировано во всех положениях, и в действительности в одно соединение или даже в один нуклеозид в и-РНК может быть включено более одной из вышеуказанных модификаций. Настоящее изобретение также относится к соединениям и-РНК, которые являются химерными соединениями.
«Химерные» соединения и-РНК или «химеры» в контексте настоящего изобретения представляют собой соединения и-РНК, например, днРНК, которые содержат две или больше химически отличающихся областей, каждая из которых состоит, по меньшей мере, из одной мономерной единицы, т.е. нуклеотида в случае соединения днРНК. Такие и-РНК обычно содержат, по меньшей мере, одну область, в которой РНК модифицирована так, чтобы придать и-РНК повышенную устойчивость к расщеплению нуклеазами, увеличенный захват в клетки и/или повышенную аффинность связывания нуклеиновой кислоты-мишени. Дополнительная область и-РНК может служить в качестве субстрата для ферментов, способных расщеплять гибриды РНК:ДНК или РНК:РНК. В качестве примера РНК-аза H является клеточной эндонуклеазой, которая расщепляет нить РНК дуплекса РНК:ДНК. Поэтому активация РНК-азы H приводит к расщеплению РНК-мишени, тем самым значительно повышая эффективность ингибирования экспрессии генов под действием и-РНК. Следовательно, при использовании химерных днРНК часто можно получить сравнимые результаты в случае более коротких и-РНК по сравнению с фосфоротиоатными дезокси-днРНК, гибридизующимися с той же областью-мишенью. Расщепление РНК-мишени можно выявить обычным образом, используя гель-электрофорез, и при необходимости ассоциированные способы гибридизации нуклеиновых кислот, известные в данной области.
В некоторых случаях РНК в и-РНК может быть модифицирована нелигандной группой. Множество нелигандных молекул было конъюгировано с и-РНК, чтобы повысить активность, распределение в клетках или клеточный захват и-РНК, и способы получения таких конъюгатов доступны в научной литературе. Такие нелигандные остатки включали липидные остатки, такие как холестерин (Kubo, T. et al., Biochem. Biophys. Res. Comm., 2007, 365(1): 54-61; Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86: 6553), холевую кислоту (Manoharan et al., Bioorg. Med. Chem. Lett., 1994, 4: 1053), тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660: 306; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3: 2765), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20: 533), алифатическую цепь, например, остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J., 1991, 10:111; Kabanov et al., FEBS Lett., 1990, 259:327; Svinarchuk et al., Biochimie, 1993, 75:49), фосфолипид, например, дигексадецил-рац-глицерин или 1,2-ди-O-гексадецил-рац-глицеро-3-H-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36: 3651; Shea et al., Nucl. Acids Res., 1990, 18: 3777), полиамин или цепь полиэтиленгликоля (Manoharan et al., Nucleosides and Nucleotides, 1995, 14: 969), или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36: 3651), остаток пальмитоила (Mishra et al., Biochim. Biophys. Acta, 1995, 1264: 229), или остаток октадециламина или гексиламинокарбонилоксихолестерина (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277: 923). Соответствующие патенты США, в которых описано получение таких конъюгатов РНК, было описано выше. Типичные протоколы конъюгации включают синтез РНК, несущих аминолинкер в одном или нескольких положениях последовательности. Затем аминогруппу подвергают взаимодействию с конъюгируемой молекулой, используя соответствующие реагенты для связывания или активации. Реакция конъюгации может быть осуществлена либо с РНК, все еще связанной с твердой подложкой, либо после отщепления РНК в фазе раствора. Очистку РНК-конъюгата с использованием ВЭЖХ обычно дает чистый конъюгат.
Доставка и-РНК
Доставка и-РНК в организм субъекта, нуждающегося в такой доставке, может быть осуществлена несколькими различными путями. Доставка in vivo может быть осуществлена непосредственно введением композиции, содержащей и-РНК, например, днРНК, субъекту. Альтернативно, доставка может быть осуществлена опосредованно введением одного или нескольких векторов, которые кодируют и направляют экспрессию и-РНК. Такие альтернативные варианты дополнительно обсуждаются ниже.
Прямая доставка
В общем, любой способ доставки молекулы нуклеиновой кислоты может быть адаптирован для применения с и-РНК (См., например, публикации Akhtar S. and Julian RL. (1992) Trends Cell. Biol. 2(5): 139-144 и WO94/02595, которые включены в настоящее описание в виде ссылки в полном объеме). Однако существует три фактора, которые важно учитывать, чтобы успешно доставить молекулу и-РНК in vivo: (a) биологическая стабильность доставляемой молекулы, (2) предотвращение неспецифичных эффектов и (3) накопление доставляемой молекулы в ткани-мишени. Неспецифичные эффекты и-РНК могут быть минимизированы при локальном введении, например, посредством прямой инъекции или имплантации в ткань (в качестве не ограничивающего примера, в опухоль) или местом введении препарата. Локальное введение в место лечения максимизирует местную концентрацию средства, ограничивает воздействие средства на ткани всего организма, которые могут в ином случае могут пострадать при действии средства или которые могут вызвать распад средства, и позволяет вводить более низкую общую дозу молекулы и-РНК. В нескольких исследованиях показан успешный нокдаун генных продуктов при локальном введении и-РНК. Например, было показано, что внутриглазная доставка днРНК VEGF посредством инъекции в стекловидное тело макакам-крабоедам (Tolentino, ML, et al. (2004) Retina 24: 132-138) и субретинальные инъекции у мышей (Reich, SL, et al. (2003) Mol. Vis. 9: 210-216) предотвращают неоваскуляризацию в экспериментальной модели возрастной макулярной дегенерации. Кроме того, прямая внутриопухолевая инъекция днРНК мышам уменьшает объем опухоли (Pille, L, et al. (2005) Mol. Ther. 11: 267-274) и может увеличивать продолжительность жизни мышей, несущих опухоли (Kim, WL, et al. (2006) Mol. Ther. 14: 343-350; Li, S., et al. (2007) Mol. Ther. 15: 515-523). Также была показана успешная интерференция РНК в случае локальной доставки в ЦНС посредством прямой инъекции (Dorn, G., et al. (2004) Nucleic Acids 32:e49; Tan, PH., et al (2005) Gene Ther. 12:59-66; Makimura, H., et al (2002) BMC Neurosci. 3:18; Shishkina, GT., et al (2004) Neuroscience 129:521-528; Thakker, ER., et al (2004) Proc. Natl. Acad. Sci. U.S.A. 101:17270-17275; Akaneya,Y., et al (2005) J. Neurophysiol. 93:594-602) и в легкие посредством интраназального введения (Howard, KA., et al (2006) Mol. Ther. 14:476-484; Zhang, X., et al (2004) J. Biol. Chem. 279:10677-10684; Bitko, V., et al (2005) Nat. Med. 11:50-55). В случае системного введения и-РНК для лечения заболевания РНК может быть модифицирована или альтернативно доставлена с использованием системы доставки лекарственного средства; при этом оба способа действуют, предотвращая быстрый распад днРНК под действием эндо- и экзонуклеаз in vivo.
Модификация РНК или фармацевтического носителя также может позволять направлять композицию и-РНК в ткань-мишень и избегать нежелательных нецелевых эффектов. Молекулы и-РНК могут быть модифицированы в результате химической конъюгации с другими группами, например, липидной или углеводной группой, которые описаны в настоящей публикации. Такие конъюгаты можно применять для того, чтобы направить и-РНК в конкретные клетки, например, клетки печени, например, гепатоциты. Например, препараты GalNAc-конъюгатов или липидные (например, LNP) можно использовать для того, чтобы направить и-РНК в конкретные клетки, например, клетки печени, например, гепатоциты.
Липофильные группы, такие как холестерин, усиливают захват клетками и предотвращают распад. Например, и-РНК, направленную против ApoB, конъюгированного с липофильным остатком холестерина, инъецировали системно мышам, что приводило к нокдауну мРНК apoB как в печени, так и в тонкой кишке (Soutschek, J., et al. (2004) Nature 432: 173-178). Было показано, что конъюгация и-РНК с аптамером ингибирует рост опухолей и опосредует регрессию опухоли в мышиной модели рака простаты (McNamara, JO., et al. (2006) Nat. Biotechnol. 24: 1005-1015). В альтернативном варианте и-РНК может быть доставлена с использованием систем доставки лекарственных средств, таких как наночастица, дендример, полимер, липосомы или катионные системы доставки. Положительно заряженные катионные системы доставки способствуют связыванию молекулы и-РНК (отрицательно заряженной), а также усиливают взаимодействия в отрицательно заряженной клеточной мембране, обеспечивая возможность эффективного захвата и-РНК клеткой. Катионные липиды, дендримеры или полимеры могут либо быть связаны с и-РНК, либо индуцированы с целью образования везикулы или мицеллы (См., например, Kim SH., et al. (2008) Journal of Controlled Release 129(2): 107-116), которая заключает в себе и-РНК. Образование везикул или мицелл дополнительно предотвращает распад и-РНК при системном введении. Способы получения и введения катионных и-РНК-комплексов может осуществить специалист в данной области (См., например, публикации Sorensen, DR., et al (2003) J. Mol. Biol 327:761-766; Verma, UN., et al (2003) Clin. Cancer Res. 9:1291-1300; Arnold, AS et al (2007) J. Hypertens. 25:197-205, которые включены в настоящее описание в виде ссылки в полном объеме). Некоторые не ограничивающие примеры систем доставки лекарственных средств, применимых для системной доставки и-РНК, включают DOTAP (Sorensen, DR., et al. (2003), выше; Verma, UN., et al. (2003), выше), олигофектамин, «твердые частицы нуклеиновой кислоты-липида» (Zimmermann, TS., et al. (2006) Nature 441: 111-114), кардиолипин (Chien, PY., et al. (2005) Cancer Gene Ther. 12: 321-328; Pal, A., et al. (2005) Int. J. Oncol. 26: 1087-1091), полиэтиленимин (Bonnet ME., et al. (2008) Pharm. Res. Aug. 16 Epub. ahead of print; Aigner, A. (2006) J. Biomed. Biotechnol. 71659), пептиды Arg-Gly-Asp (RGD) (Liu, S. (2006) Mol. Pharm. 3: 472-487) и полиамидоамины (Tomalia, DA., et al. (2007) Biochem. Soc. Trans. 35: 61-67; Yoo, H., et al. (1999) Pharm. Res. 16: 1799-1804). В некоторых вариантах и-РНК образует комплекс с циклодекстрином для системного введения. Способы введения и фармацевтические композиции и-РНК и циклодекстринов можно найти в патенте США №7427605, который включен в настоящее описание в виде ссылки в полном объеме.
Кодируемые вектором и-РНК
В другом аспекте и-РНК, мишенью которой является ген ALAS1, может быть экспрессирована с транскрипционных единиц, встроенных в ДНК- или РНК-векторы (См., например, Couture, A с соавторами, TIG. (1996), 12: 5-10; Skillern, A. с соавторами, международная публикация PCT № WO 00/22113, Conrad, международная публикация PCT № WO 00/22114 и Conrad, патент США №6054299). Экспрессия может быть временной (порядка от нескольких часов до недель) или продолжительной (от недель до месяцев и дольше), в зависимости от конкретной используемой конструкции и ткани-мишени или типа клеток-мишеней. Такие трансгены могут быть введены в виде линейной конструкции, кольцевой плазмиды или вирусного вектора, который может представлять собой интегрируемый или неинтегрируемый вектор. Трансген также может быть сконструирован так, чтобы обеспечить его наследование в виде внехромосомной плазмиды (Gassmann с соавторами, Proc. Natl. Acad. Sci. USA (1995) 92: 1292).
Отдельная нить или нити и-РНК могут быть транскрибированы с промотора, имеющегося в экспрессирующем векторе. В том случае, когда необходимо экспрессировать две отдельных нити, чтобы создать, например, днРНК, в клетку-мишень могут быть совместно введены два отдельных экспрессирующих вектора (например, посредством трансфекции или инфекции). Альтернативно каждая отдельная нить днРНК может быть транскрибирована с промоторов, которые оба находятся в одной и той же экспрессирующей плазмиде. В одном варианте днРНК экспрессируется в виде инвертированного повтора, соединенного линкерной полинуклеотидной последовательностью, так что днРНК имеет структуру «стебель-петля».
Вектор, экспрессирующий и-РНК, обычно представляет собой ДНК-плазмиду или вирусный вектор. Экспрессирующий вектор, совместимый с эукариотическими клетками, например, с клетками позвоночных, можно использовать для получения рекомбинантных конструкций для экспрессии и-РНК, которая описана в настоящей публикации. Векторы экспрессии в эукариотических клетках хорошо известны в данной области и доступны из множества коммерческих источников. Обычно такие векторы содержат подходящие сайты рестрикции для инсерции требуемого участка нуклеиновой кислоты. Доставка векторов, экспрессирующих и-РНК, может быть системной, такой как внутривенное или внутримышечное введение, путем введения в клетки-мишени, эксплантированных из организма пациента с последующим повторным введением в организм пациента или любыми другими способами, которые позволяют осуществлять введение в требуемую клетку-мишень.
Плазмида, экспрессирующая и-РНК, может быть трансфицирована в клетку-мишень в виде комплекса с катионным липидным носителем (например, олигофектамином) или не основанном на катионном липиде носителем (например, Transit-TKO™). Многократные трансфекции с использованием липидов для и-РНК-опосредованных нокдаунов, нацеленных на разные области РНК-мишени, в течение периода времени, составляющего неделю или больше, также предусмотрены в изобретении. Успешное введение векторов в клетки-хозяева можно наблюдать, используя различные известные способы. Например, сигналы, свидетельствующие о временной трансфекции, можно получать, благодаря репортеру, такому как флуоресцирующий маркер, такой как зеленый флуоресцирующий белок (GFP). В стабильной трансфекции клеток ex vivo можно удостовериться, используя маркеры, которые придают трансфицированной клетке резистентность к конкретным факторам окружающей среды (например, антибиотикам и лекарственным средствам), такую как резистентность к гигромицину B.
Системы вирусных векторов, которые можно использовать в способах и композициях, описанных в настоящей публикации, включают без ограничения (a) аденовирусные векторы; (b) ретровирусные векторы, включая без ограничения лентивирусные векторы, вирус лейкоза мышей Молони и т.д.; (c) векторы на основе аденоассоциированных вирусов; (d) векторы на основе вируса простого герпеса; (e) векторы SV40; (f) векторы на основе вируса полиомы; (g) векторы на основе вируса папилломы; (h) пикорнавирусные векторы; (i) векторы на основе поксвирусов, таких как ортопоксвирус, например, векторы на основе вируса вакцинии или авипоксвируса, например, поксвируса канареек или вируса оспы птиц; и (j) зависимый от хелперов или имеющий усеченный геном аденовирус. Дефектные по репликации вирусы также могут быть предпочтительными. Разные векторы будут включаться или не будут включаться в геном клеток. Конструкции при необходимости могут содержать вирусные последовательности для трансфекции. Альтернативно, конструкция может быть включена в векторы, способные к эписомной репликации, например, векторы EPV и EBV. Конструкции для рекомбинантной экспрессии и-РНК обычно могут требовать регуляторных элементов, например, промоторов, энхансеров и т.д., чтобы обеспечить экспрессию и-РНК в клетках-мишенях. Другие аспекты, которые следует учитывать в случае векторов и конструкций, дополнительно описаны ниже.
Векторы, применимые для доставки и-РНК, будут содержать регуляторные элементы (промотор, энхансер и т.д.), достаточные для экспрессии и-РНК в требуемой клетке-мишени или ткани-мишени. Регуляторные элементы могут быть выбраны так, чтобы они обеспечивали либо конститутивную, либо регулируемую/индуцируемую экспрессию.
Экспрессия и-РНК можно точно регулировать, например, используя индуцируемую регуляторную последовательность, которая чувствительна к некоторым физиологическим регуляторам, например, уровням глюкозы в циркуляции или гормонам (Docherty с соавторами, 1994, FASEB J. 8:20-24). Такие индуцируемые системы экспрессии, подходящие для регуляции экспрессии днРНК в клетках или в организмах млекопитающих, включают, например, регуляцию экдизоном, прогестероном, тетрациклином, химическими индукторами димеризации и изопропил-β-D1-тиогалактопиранозидом (IPTG). Специалист в данной области сможет выбрать подходящую регуляторную/промоторную последовательность на основе предполагаемого применения трансгена и-РНК.
В конкретном варианте можно использовать вирусные векторы, которые содержат последовательности нуклеиновой кислоты, кодирующие и-РНК. Например, можно использовать ретровирусный вектор (См. публикацию Miller с соавторами, Meth. Enzymol. 217: 581-599 (1993)). Такие ретровирусные векторы содержат компоненты, необходимые для правильной упаковки вирусного генома и интеграции в ДНК клетки-хозяина. Последовательности нуклеиновых кислот, кодирующие и-РНК, клонируют в одном или нескольких векторах, которые обеспечивают доставку нуклеиновой кислоты в организм пациента. Более подробную информацию о ретровирусных векторах можно найти, например, в публикации Boesen с соавторами (Biotherapy 6: 291-302 (1994)), в которой описано применение ретровирусного вектора для доставки гена mdr1 в гематопоэтические стволовые клетки, чтобы получить стволовые клетки, более устойчивые к химиотерапии. Другими публикациями, иллюстрирующими применение ретровирусных векторов в генной терапии, являются: Clowes et al., J. Clin. Invest. 93:644-651 (1994); Kiem et al., Blood 83:1467-1473 (1994); Salmons and Gunzberg, Human Gene Therapy 4:129-141 (1993); and Grossman and Wilson, Curr. Opin. in Genetics and Devel. 3:110-114 (1993). Лентивирусные векторы, предполагаемые для применения, включают, например, векторы на основе ВИЧ, описанные в патентах США №6143520, 5665557 и 5981276, которые включены в настоящее описание в виде ссылки.
Аденовирусы также предполагаются для применения для доставки и-РНК. Аденовирусы являются особенно привлекательными носителями, например, для доставки генов в эпителий дыхательных путей. Аденовирусы в природе инфицируют эпителий дыхательных путей, при этом они вызывают легкое заболевание. Другими мишенями основанных на вирусах систем доставки являются печень, центральная нервная система, эндотелиальные клетки и мышцы. Аденовирусы имеют преимущество, так как способны инфицировать неделящиеся клетки. Kozarsky и Wilson (Current Opinion in Genetics and Development 3: 499-503 (1993)) представили обзор генной терапии на основе аденовирусов. Bout с соавторами (Human Gene Therapy 5: 3-10 (1994)) продемонстрировали применение аденовирусных векторов для переноса генов в эпителий дыхательных путей макак-резус. Другие случаи применения аденовирусов для генной терапии можно найти в публикациях Rosenfeld с соавторами, (Science 252: 431-434 (1991)), Rosenfeld с соавторами (Cell 68: 143-155 (1992)), Mastrangeli с соавторами (J. Clin. Invest. 91: 225-234 (1993)), в публикации PCT WO94/12649; и в публикации Wang с соавторами (Gene Therapy 2: 775-783 (1995)). Подходящий AV-вектор для экспрессии и-РНК, охарактеризованной в изобретении, способ конструирования рекомбинантного AV-вектора и способ доставки вектора в клетки-мишени описаны Xia H. с соавторами ((2002), Nat. Biotech. 20: 1006-1010).
Также предполагается применение векторов на основе аденоассоциированных вирусов (AAV) (Walsh с соавторами, Proc. Soc. Exp. Biol. Med. 204: 289-300 (1993); патент США №5436146). В одном варианте и-РНК может быть экспрессирована в виде двух отдельных комплементарных однонитевых молекул РНК с рекомбинантного AAV-вектора, имеющего, например, промоторы либо U6-, либо H1-РНК, или промотор цитомегаловируса (CMV). Подходящие AAV-векторы для экспрессии днРНК, охарактеризованной в изобретении, способы конструирования рекомбинантного AV-вектора и способы доставки векторов в клетки-мишени описаны в Samulski R et al. (1987), J. Virol. 61: 3096-3101; Fisher K J et al. (1996), J. Virol, 70: 520-532; Samulski R et al. (1989), J. Virol. 63: 3822-3826;
в патенте США №5252479, патенте США №5139941, международной заявке на выдачу патента № WO 94/13788 и международной заявке на выдачу патента № WO 93/24641, полное содержание которых включено в настоящее описание в виде ссылки.
Другим типичным вирусным вектором является поксвирус, такой как вирус вакцинии, например, ослабленный вирус вакцинии, такой как модифицированный вирус Ankara (MVA) или NYVAC, авипоксвирус, такой как вирус оспы птиц или поксвирус канареек.
Тропизм вирусных векторов можно модифицировать, псевдотипируя векторы с использованием белков оболочки или других поверхностных антигенов из других вирусов, или при необходимости заменяя другими вирусными капсидными белками. Например, лентивирусные векторы могут быть псевдотипированы с использованием поверхностных белков из вируса везикулярного стоматита (VSV), бешенства, Эбола, Мокола и тому подобного. Могут быть получены AAV-векторы для целенаправленного действия на разные клетки путем конструирования векторов, экспрессирующих разные серотипа капсидных белков; См., например, публикацию Rabinowitz J. E. с соавторами ((2002), J. Virol. 76: 791-801), полное содержание которой включено в настоящее описание в виде ссылки.
Фармацевтический препарат вектора может содержать вектор в приемлемом разбавителе или может содержать матрикс для медленного высвобождения, в который помещен носитель для доставки генов. Альтернативно, в том случае, когда полный вектор для доставки генов может быть получен интактным из рекомбинантных клеток, например, ретровирусные векторы, фармацевтический препарат может содержать одну или несколько клеток, которые продуцируют систему доставки генов.
III. Фармацевтические композиции, содержащие и-РНК
В одном варианте изобретение относится к фармацевтическим композициям, содержащим и-РНК, которые описаны в настоящей публикации, и фармацевтически приемлемый носитель. Фармацевтическая композиция, содержащая и-РНК, применима для лечения заболевания или расстройства, связанного с экспрессией или активностью гена ALAS1 (например, расстройства, в которое вовлечен путь порфирина). Такие фармацевтические композиции готовят на основе способа доставки. Например, композиции могут быть приготовлены для системного введения посредством парентеральной доставки, например, с использованием внутривенной (в/в) доставки. В некоторых вариантах композицию, предлагаемую в настоящем изобретении (например, препарат LNP), готовят для внутривенной доставки. В некоторых вариантах композицию, предлагаемую в настоящем изобретении (например, композицию, содержащую GalNAc-конъюгат) готовят для подкожной доставки.
Фармацевтические композиции, охарактеризованные в настоящем описании, вводят в дозе, достаточной для ингибирования экспрессии гена ALAS1. В общем, подходящая доза и-РНК будет в диапазоне от 0,01 до 200,0 миллиграмм на килограмм массы тела реципиента в сутки, обычно в диапазоне от 1 до 50 мг на килограмм массы тела в сутки. Например, днРНК можно вводить в количестве 0,05 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 3 мг/кг, 10 мг/кг, 20 мг/кг, 30 мг/кг, 40 мг/кг или 50 мг/кг на одну дозу. Фармацевтическую композицию можно вводить один раз в сутки или и-РНК можно вводить в виде двух, трех или большего количества поддоз с соответствующими интервалами на протяжении суток или даже с использованием непрерывной инфузии или доставки посредством препарата с контролируемым высвобождением. В таком случае количество и-РНК в каждой поддозе должно быть соответственно меньше, чтобы достичь суммарную суточную дозу. Единичная доза также может быть составлена для доставки в течение нескольких суток, например, с использованием подходящего препарата замедленного высвобождения, который обеспечивает длительное высвобождение и-РНК в течение периода времени, составляющего несколько суток. Препараты длительного высвобождения хорошо известны в данной области и особенно применимы для доставки средств в конкретное место, и в частности, могут быть использованы в случае средств согласно настоящему изобретению. В указанном варианте единичная доза содержит соответствующее количество суточных доз.
Влияние однократной дозы на уровни ALAS1 может быть длительным, так что последующие дозы вводят с интервалами, составляющими не более чем 3, 4 или 5 дней или с интервалами, составляющими не более чем 1, 2, 3 или 4 недели.
Специалисту в данной области будет понятно, что некоторые факторы могут влиять на дозу и время введения, необходимые для того, чтобы эффективно лечить субъекта, включая без ограничения тяжесть заболевания или расстройства, предварительное лечение, общее состояние здоровья и/или возраст субъекта и другие присутствующие заболевания. Кроме того, лечение субъекта терапевтически эффективным количеством композиции может включать одно введение или серию введений. Оценки эффективных доз и времени полужизни in vivo для отдельных и-РНК, входящих в объем изобретения, можно осуществлять, используя обычные способы, или на основе тестирования in vivo с использованием подходящей животной модели, как описано в настоящей публикации.
Успехи в генетике мышей позволили создать ряд мышиных моделей для исследования различных заболеваний человека, таких как патологические процессы, связанные с экспрессией ALAS1 (например, патологические процессы, в которые вовлечены порфирины или дефекты пути порфиринов, такие как, например, порфирии). Такие модели можно использовать для тестирования и-РНК in vivo, а также для определения терапевтически эффективной дозы и/или эффективной схемы дозирования.
Подходящей мышиной моделью является, например, мышь, содержащая трансген, экспрессирующий ALAS1 человека. Мыши, которые имеют нокин-мутации (например, мутации, которые ассоциированы с острыми печеночными порфириями у человека), можно использовать для определения терапевтически эффективной дозы и/или продолжительности введения ми-РНК ALAS1. Настоящее изобретение также относится к фармацевтическим композициям и препаратам, которые содержат соединения и-РНК, охарактеризованные в изобретении. Фармацевтические композиции согласно настоящему изобретению можно вводить несколькими путями, в зависимости от того, требуется ли локальное или системное лечение, и от области, которую необходимо лечить. Введение может быть местным (например, посредством трансдермального пластыря), легочным, например, посредством ингаляции или инсуффляции порошков или аэрозолей, включая использование ингалятора; внутритрахеальным, интраназальным, эпидермальным и трансдермальным, пероральным или парентеральным. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию; субдермальное, например, посредством имплантируемого устройства; или внутричерепное, например, интрапаренхимное, интратекальное или внутрижелудочковое введение.
и-РНК может быть доставлена таким образом, чтобы целенаправленно воздействовать на конкретную ткань, такую как ткань, которая продуцирует эритроциты. Например, и-РНК может быть доставлена в костный мозг, печень (например, гепатоциты печени), лимфатические узлы, селезенку, легкие (например, плевру легких) или спинной мозг. В одном варианте и-РНК доставляют в костный мозг.
Фармацевтические композиции и препараты для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Могут быть необходимы или желательны обычные фармацевтические носители, водные, порошкообразные или масляные основы, загустители и тому подобное. Также могут быть применимы покрытые слоем презервативы, перчатки и тому подобное. Подходящие местные препараты включают препараты, в которых и-РНК, охарактеризованные в изобретении, находятся в смеси со средством для местной доставки, таким как липиды, липосомы, жирные кислоты, сложные эфиры жирных кислот, стероиды, хелатирующие средства и поверхностно-активные вещества. Подходящие липиды и липосомы включают нейтральные (например, диолеоилфосфатидилэтаноламин DOPE, димиристоилфосфатидилхолин DMPC, дистеароилфосфатидилхолин), отрицательные (например, димеристоилфосфатидилглицерин DMPG) и катионные (например, диолеоилтетраметиламинопропил DOTAP и диолеоилфосфатидилэтаноламин DOTMA). и-РНК, охарактеризованные в изобретении, могут быть инкапсулированы в липосомы или могут образовывать с ними комплексы, в частности с катионными липосомами. Альтернативно, и-РНК могут быть в комплексе с липидами, в частности, с катионными липидами. Подходящие жирные кислоты и сложные эфиры включают без ограничения арахидоновую кислоту, олеиновую кислоту, эйкозановую кислоту, лауриновую кислоту, каприловую кислоту, каприновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или сложный C1-20-алкиловый эфир (например, изопропилмиристат IPM), моноглицерид, диглицерид или их фармацевтически приемлемая соль. Местные препараты подробно описаны в патенте США №6747014, который включен в настоящее описание в виде ссылки.
Липосомные препараты
Существует множество организованных поверхностно-активных структур кроме микроэмульсий, которые были исследованы и использованы для приготовления препаратов лекарственных средств. Такие структуры включают монослои, мицеллы, бислои и везикулы. Везикулы, такие как липосомы, привлекли большой интерес, вследствие их специфичности и продолжительности действия, которые они обеспечивают с точки зрения доставки лекарственных средств. В используемом в настоящем описании смысле термин «липосома» означает везикулу, состоящую из амфипатических липидов в сферическом бислое или бислоях.
Липосомы представляют собой однослойные или многослойные везикулы, которые имеют мембрану, образованную из липофильного материала и водной внутренней части. Водная часть содержит композицию, которую необходимо доставить. Катионные липосомы обладают преимуществом, которое заключается в их способности сливаться с клеточной стенкой. Некатионные липосомы, хотя и не способны сливаться так эффективно с клеточной стенкой, захватываются макрофагами in vivo.
Чтобы пройти через интактную кожу млекопитающего, липидные везикулы должны пройти через серию мелких пор, каждая из которых имеет диаметр менее 50 нм, под действием подходящего трансдермального градиента. Поэтому желательно использовать липосому, которая легко деформируется и способна проходить через такие тонкие поры.
Дополнительные преимущества липосом включают: липосомы, полученные из природных фосфолипидов, являются биологически совместимыми и поддаются биологическому разрушению; липосомы могут включать в себя широкое множество растворимых в воде и растворимых в липидах лекарственных средств; липосомы могут защищать инкапсулированные лекарственные средства в своих внутренних отсеках от метаболизма и разрушения (Rosoff, в Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., v. 1, p. 245). Важными факторами, которые необходимо учитывать при получении липосомных препаратов, являются поверхностный заряд липидов, размер везикул и объем водной части липосом.
Липосомы применимы для переноса и доставки активных ингредиентов к месту действия. Поскольку мембрана липосом структурно сходна с биологическими мембранами, в том случае, когда липосомы наносят на ткань, липосомы начинают сливаться с клеточными мембранами и по мере слияния липосомы и клетки содержимое липосомы перетекает в клетку, в которой может действовать активное средство.
На липосомных препаратах было сфокусировано всестороннее исследование, в котором их использовали в качестве средств доставки множества лекарственных средств. Появляется все больше доказательств того, что для местного введения липосомы обладают несколькими преимуществами по сравнению с другими препаратами. Такие преимущества включают сниженные побочные эффекты, связанные с высоким системным поглощением вводимого лекарственного средства, повышенным накоплением вводимого лекарственного средства в требуемой мишени и возможностью вводить широкое множество лекарственных средств, как гидрофильных, так и гидрофобных, в кожу.
В нескольких сообщениях подробно описана способность липосом доставлять средства, включая высокомолекулярную ДНК, в кожу. В кожу вводили разные соединения, включая анальгетики, антибиотики, гормоны и высокомолекулярные ДНК. Большинство применений приводило к целенаправленному воздействию на верхний эпидермис.
Липосомы делятся на два больших класса. Катионные липосомы представляют собой положительно заряженные липосомы, которые взаимодействуют с отрицательно заряженными молекулами ДНК с образованием стабильного комплекса. Положительно заряженный комплекс ДНК/липосома связывается с отрицательно заряженной поверхностью клетки и интернализуется в эндосому. Благодаря кислому pH в эндосоме липосомы разрываются, высвобождая свое содержимое в цитоплазму клеток (Wang с соавторами, Biochem. Biophys. Res. Commun., 1987, 147, 980-985).
Липосомы, которые являются pH-чувствительными или отрицательно заряженными, улавливают ДНК, а не комплекс с ДНК. Так как и ДНК и липид заряжены сходным образом, то происходит отталкивание, а не образование комплекса. Тем не менее, некоторое количество ДНК захватывается в водную внутреннюю часть таких липосом. pH-чувствительные липосомы использовали для доставки ДНК, кодирующей ген тимидинкиназы, в клеточный монослой в культуре. В клетках-мишенях выявляли экспрессию экзогенного гена (Zhou с соавторами, Journal of Controlled Release, 1992, 19, 269-274).
Один из основных типов липосомной композиции содержит другие фосфолипиды, отличные от природно получаемого фосфатидилхолина. Нейтральные липосомные композиции могут быть образованы, например, из димиристоилфосфатидилхолина (DMPC) или дипальмитоилфосфатидилхолина (DPPC). Анионные липосомные композиции обычно образованы из димиристоилфосфатидилглицерина, тогда как анионные способные к слиянию липосомы в основном образованы из диолеоилфосфатидилэтаноламина (DOPE). Липосомная композиция другого типа образована из фосфатидилхолина (PC), такого как, например, PC сои и PC яиц. Другой тип образован из смеси фосфолипида и/или фосфатидилхолина и/или холестерина.
В нескольких исследованиях оценивали местную доставку липосомных препаратов лекарственных средств в кожу. Нанесение липосом, содержащих интерферон, на кожу морских свинок приводило к снижению количества герпесных язв, тогда как доставка интерферона другими способами (например, в виде раствора или в виде эмульсии) была неэффективной (Weiner с соавторами, Journal of Drug Targeting, 1992, 2, 405-410). Кроме того, в дополнительном исследовании тестировали эффективность интерферона, вводимого в виде части липосомного препарата по сравнению с введением интерферона с использованием водной системы и пришли к выводу, что липосомный препарат превосходил введение в водной системе (du Plessis с соавторами, Antiviral Research, 1992, 18, 259-265).
Также исследовали неионогенные липосомные системы, чтобы определить их применимость для доставки лекарственных средств в кожу, в частности, системы, содержащие неионогенное поверхностно-активное вещество и холестерин. Неионогенные липосомные препараты, содержащие новасом™ I (глицерилдилаурат/холестерин/полиоксиэтилен-10-стеариловый эфир) и новасом™ II (глицерилдистеарат/холестерин/полиоксиэтилен-10-стеариловый эфир), использовали для доставки циклоспорина-A в дерму кожи мышей. Результаты показали, что такие неионогенные липосомные системы эффективны в обеспечении отложения циклоспорина-A в разных слоях кожи (Hu с соавторами, S.T.P. Pharma. Sci., 1994, 4, 6, 466).
Липосомы также включают «стерически стабилизированные» липосомы, термин, который в используемом в настоящем описании смысле относится к липосомам, содержащим один или несколько специализированных липидов, которые при включении в липосомы приводят к повышению времени жизни в циркуляции по сравнению с липосомами, в которых отсутствуют такие специализированные липиды. Примерами стерически стабилизированных липосом являются липосомы, в которых часть образующих везикулы липидов липосомы (A) содержит один или несколько гликолипидов, таких как моносиалоганглиозид GM1, или (B) дериватизована одним или несколькими гидрофильными полимерами, такими как остаток полиэтиленгликоля (ПЭГ). Не имея намерения быть связанными с какой-либо конкретной теорией, в данной области полагают, что, по меньшей мере, в случае стерически стабилизированных липосом, содержащих ганглиозиды, сфингомиелин или ПЭГ-дериватизованные липиды, увеличенное время жизни таких стерически стабилизированных липосом в циркуляции происходит, вследствие пониженного захвата в клетки ретикулоэндотелиальной системы (RES) (Allen с соавторами, FEBS Letters, 1987, 223, 42; Wu с соавторами, Cancer Research, 1993, 53, 3765).
Различные липосомы, содержащие один или несколько гликолипидов, известны в данной области. Papahadjopoulos с соавторами (Ann. N.Y. Acad. Sci., 1987, 507, 64) сообщили о способности моносиалоганглиозида GM1, галактоцереброзидсульфата и фосфатидилинозитола увеличивать время полужизни липосом в крови. Такие данные были уточнены Gabizon с соавторами (Proc. Natl. Acad. Sci. U.S.A., 1988, 85, 6949). В патенте США №4837028 и в публикации WO 88/04924 Allen с соавторами раскрыли липосомы, содержащие (1) сфингомиелин и (2) ганглиозид GM1 или сложный эфир галактоцереброзидсульфата. В патенте США №5543152 (Webb с соавторами) раскрыты липосомы, содержащие сфингомиелин. Липосомы, содержащие 1,2-sn-димиристоилфосфатидилхолин, раскрыты в WO 97/13499 (Lim с соавторами).
Многие липосомы, содержащие липиды, дериватизованные одним или несколькими гидрофильными полимерами, и способы их получения известны в данной области. В публикации Sunamoto с соавторами (Bull. Chem. Soc. Jpn., 1980, 53, 2778) описаны липосомы, содержащие неионогенный детергент, 2C1215G, которые содержат молекулу ПЭГ. В публикации Illum с соавторами (FEBS Lett., 1984, 167, 79) отмечено, что гидрофильное покрытие полистироловых частиц полимерными гликолями приводит к значительному увеличению времени полужизни в крови. Синтетические фосфолипиды, модифицированные путем присоединения карбоксильных групп полиалкиленгликолей (например, ПЭГ), описаны Sears (патенты США №№4426330 и 4534899). В публикации Klibanov с соавторами (FEBS Lett., 1990, 268, 235) описаны эксперименты, демонстрирующие, что липосомы, содержащие фосфатидилэтаноламин (PE), дериватизованный ПЭГ или стеаратом ПЭГ, имеют значительно более длительное время полужизни в кровотоке. В публикации Blume с соавторами (Biochimica et Biophysica Acta, 1990, 1029, 91) такие наблюдения были продолжены с использованием других ПЭГ-дериватизованных фосфолипидов, например, DSPE-ПЭГ, образованных в результате сочетания дистеароилфосфатидилэтаноламина (DSPE) и ПЭГ. Липосомы, имеющие ковалентно связанные остатки ПЭГ на своей наружной поверхности, описаны в европейском патенте № EP 0445131 B1 и в WO 90/04384, Fisher. Липосомные композиции, содержащие 1-20 моль % ПЭГ-дериватизованного PE, и способы их применения описаны Woodle с соавторами (патенты США №№5013556 и 5356633) и Martin с соавторами (патент США №5213804 и европейский патент № EP 0496813 B1). Липосомы, содержащие ряд других конъюгатов “липид-полимер”, описаны в WO 91/05545 и в патенте США №5225212 (обе публикации Martin с соавторами), и в WO 94/20073 (Zalipsky с соавторами). Липосомы, содержащие ПЭГ-модифицированные церамидные липиды, описаны в WO 96/10391 (Choi с соавторами). В патенте США №5540935 (Miyazaki с соавторами) и в патенте США №5556948 (Tagawa с соавторами) описаны ПЭГ-содержащие липосомы, которые на своих поверхностях могут быть дополнительно дериватизованы функциональными остатками.
Ряд липосом, содержащих нуклеиновые кислоты, известны в данной области. В WO 96/4062 Thierry с соавторами описали способы инкапсулирования высокомолекулярных нуклеиновых кислот в липосомы. В патенте США №5264221 Tagawa с соавторами описали связанные с белком липосомы и утверждают, что содержимое таких липосом может включать днРНК. В патенте США №5665710 Rahman с соавторами описали некоторые способы инкапсулирования олигодезоксинуклеотидов в липосомы. В WO 97/04787 Love с соавторами описали липосомы, содержащие днРНК, нацеленные на ген raf.
Трансферсомы представляют собой еще один тип липосом, являющихся в высокой степени деформируемыми липидными агрегатами, которые могут быть привлекательными кандидатами на использование их в качестве везикул для доставки лекарственных средств. Трансферсомы могут быть описаны как липидные капельки, степень деформируемости которых настолько высока, что они могут легко проникать через поры, размеры которых меньше, чем сами капли. Трансферсомы могут быть адаптированы к условиям окружающей среды, в которых они используются, например, они подвергаются самооптимизации (адаптируются к форме пор в коже), саморепарации, часто достигают своих мишеней без фрагментации и подвергаются самозагрузке. Для получения трансферсом в стандартную липосомную композицию могут быть добавлены активаторы поверхности раздела фаз, обычно поверхностно-активные вещества. Трансферсомы были использованы для доставки сывороточного альбумина в кожу. Было показано, что опосредуемая трансферсомами доставка сывороточного альбумина является эффективной при подкожной инъекции раствора, содержащего сывороточный альбумин.
Поверхностно-активные вещества находят широкое применение в таких препаратах, как эмульсии (включая микроэмульсии) и липосомы. Наиболее распространенным путем классификации и ранжирования свойств многих поверхностно-активных веществ различных типов, как природных, так и синтетических, заключается в использовании гидрофильно-липофильного баланса (ГЛБ). Природа гидрофильной группы (также известной как «головка») является наиболее часто применяемым критерием для определения категории различных поверхностно-активных веществ, используемых в препаратах (Rieger, в Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
Если молекула поверхностно-активного вещества не ионизована, то такая молекула принадлежит к классу неионогенных поверхностно-активных веществ. Неионогенные поверхностно-активные вещества широко применяются в фармацевтических и косметических продуктах и используются в широком интервале значений рН. Обычно значения их ГЛБ находятся в диапазоне от 2 до примерно 18, в зависимости от их структуры. Неионогенные поверхностно-активные вещества включают неионогенные сложные эфиры, такие как сложные эфиры этиленгликоля, сложные эфиры пропиленгликоля, глицериловые сложные эфиры, полиглицериловые сложные эфиры, сложные эфиры сорбитана, сложные эфиры сахарозы и этоксилированные сложные эфиры. В класс таких соединений также включены неионогенные алканоламиды и простые эфиры, такие как этоксилаты жирного спирта, пропоксилированные спирты и этоксилированные/пропоксилированные блоксополимеры. Наиболее известными представителями класса неионогенных поверхностно-активных веществ являются полиоксиэтиленовые поверхностно-активные вещества.
Если молекула поверхностно-активного вещества несет отрицательный заряд, в том случае, когда она растворена или диспергирована в воде, то такое поверхностно-активное вещество классифицируют как анионогенное. Анионогенными поверхностно-активными веществами являются карбоксилаты, такие как мыла, ациллактилаты, ациламиды аминокислот, сложные эфиры серной кислоты, такие как алкилсульфаты и этоксилированные алкилсульфаты, сульфонаты, такие как алкилбензолсульфонаты, ацилизетионаты, ацилтаураты и сульфосукцинаты, и фосфаты. Наиболее важными представителями класса анионогенных поверхностно-активных веществ являются алкилсульфаты и мыла.
Если молекула поверхностно-активного вещества несет положительный заряд, в том случае, когда она растворена или диспергирована в воде, то такое поверхностно-активное вещество классифицируют как катионогенное. Катионогенными поверхностно-активными веществами являются четвертичные аммониевые соли и этоксилированные амины. Наиболее часто используемыми представителями такого класса являются четвертичные аммониевые соли.
Если молекула поверхностно-активного вещества способна нести либо положительный, либо отрицательный заряд, то такое поверхностно-активное вещество классифицируют как амфотерное. Амфотерные поверхностно-активные вещества включают производные акриловой кислоты, замещенные алкиламиды, N-алкилбетаины и фосфатиды.
Был опубликован обзор применения поверхностно-активных веществ в лекарственных продуктах, препаратах и в эмульсиях (Rieger, в Pharmaceutical Dosage Forms, Marcel Dekker, Inc., New York, N.Y., 1988, p. 285).
Частица нуклеиновая кислота-липид
В одном варианте днРНК ALAS1, охарактеризованная в изобретении, полностью инкапсулирована в липидный препарат, например, с образованием SPLP, pSPLP, SNALP или другой частицы нуклеиновой кислоты-липида. В используемом в настоящем описании смысле термин «SNALP» относится к стабильной частице нуклеиновая кислота-липид, включая SPLP. В используемом в настоящем описании смысле термин «SPLP» относится к частице нуклеиновая кислота-липид, содержащей плазмидную ДНК, инкапсулированную в липидную везикулу. SNALP и SPLP обычно содержат катионный липид, некатионный липид и липид, который предотвращает агрегацию частицы (например, конъюгат ПЭГ-липид). SNALP и SPLP особенно полезны для системного применения, так как они имеют увеличенное время полужизни в циркуляции после внутривенной (в/в) инъекции и накапливаются в дистальных участках (например, участках, физически отделенных от места введения). SPLP включают «pSPLP», которые содержат инкапсулированный комплекс конденсирующее средство-нуклеиновая кислота, который описан в публикации PCT № WO 00/03683. Частицы согласно настоящему изобретению обычно имеют средний диаметр примерно от 50 нм до примерно 150 нм, чаще примерно от 60 нм до примерно 130 нм, чаще примерно от 70 нм до примерно 110 нм, чаще всего примерно от 70 нм до примерно 90 нм и по существу являются нетоксичными. Кроме того, нуклеиновые кислоты в том случае, когда они присутствуют в частицах нуклеиновая кислота-липид согласно настоящему изобретению, устойчивы в водном растворе к разрушению нуклеазой. Частицы нуклеиновая кислота-липид и способ их получения описаны, например, в патентах США №5976567, 5981501, 6534484, 6586410, 6815432 и в публикации PCT № WO 96/40964.
В одном варианте отношение липида к лекарственному средству (масс./масс.-отношение) (например, отношение липида к днРНК) будет в диапазоне примерно от 1:1 до примерно 50:1, примерно от 1:1 до примерно 25:1, примерно от 3:1 до примерно 15:1, примерно от 4:1 до примерно 10:1, примерно от 5:1 до примерно 9:1 или примерно от 6:1 до примерно 9:1.
Катионным липидом может быть, например, хлорид N,N-диолеил-N,N-диметиламмония (DODAC), бромид N,N-дистеарил-N,N-диметиламмония (DDAB), хлорид N-(I-(2,3-диолеоилокси)пропил)-N,N,N-триметиламмония (DOTAP), хлорид N-(I-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTMA), N,N-диметил-2,3-диолеилокси)пропиламин (DODMA), 1,2-дилинолеилокси-N,N-диметиламинопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLenDMA), 1,2-дилинолеилкарбамоилокси-3-диметиламинопропан (DLin-C-DAP), 1,2-дилинолеилокси-3- (диметиламино)ацетоксипропан (DLin-DAC), 1,2-дилинолеилокси-3-морфолинопропан (DLin-MA), 1,2-дилинолеоил-3-диметиламинопропан (DLinDAP), 1,2-дилинолеилтио-3-диметиламинопропан (DLin-S-DMA), 1-линолеоил-2-линолеилокси-3-диметиламинопропан (DLin-2-DMAP), хлоридная соль 1,2-дилинолеилокси-3-триметиламинопропана (DLin-TMA.Cl), хлоридная соль 1,2-дилинолеоил-3-триметиламинопропана (DLin-TAP.Cl), 1,2-дилинолеилокси-3-(N-метилпиперазино)пропан (DLin-MPZ) или 3-(N,N-дилинолеиламино)-1,2-пропандиол (DLinAP), 3-(N,N-диолеиламино)-1,2-пропандио (DOAP), 1,2-дилинолеилоксо-3-(2-N,N-диметиламино)этоксипропан (DLin-EG-DMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA), 2,2-дилинолеил-4-диметиламинометил-[1,3]-диоксолан (DLin-K-DMA) или их аналоги, (3aR,5s,6aS)-N,N-диметил-2,2-ди((9Z,12Z)-октадека-9,12-диенил)тетрагидро-3aH-циклопента[d][1,3]диоксол-5-амин (ALN100), (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноат (MC3), 1,1'-(2-(4-(2-((2-(бис(2-гидроксидодецил)амино)этил)(2-гидроксидодецил)амино)этил)пиперазин-1-ил)этилазанедиил)дидодекан-2-ол (Tech G1) или их смесь. Катионный липид может составлять примерно от 20 моль % до примерно 50 моль % или примерно от 40 моль % от общего содержания липидов в частице.
В другом варианте можно использовать соединение 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан для получения наночастиц липид-ми-РНК. Синтез 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолана описан в предварительной заявке на выдачу патента США номер 61/107998, поданной 23 октября 2008, который включен в настоящее описание в виде ссылки.
В одном варианте частица липид-ми-РНК содержит 40% 2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан: 10% DSPC: 40% холестерина: 10% ПЭГ-C-DOMG (молярных процентов) с размером частиц 63,0±20 нм и соотношением ми-РНК/липид 0,027.
Некатионным липидом может быть анионный липид или нейтральный липид, включая без ограничения дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеоилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), диолеоилфосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (POPC), пальмитоилолеоилфосфатидилэтаноламин (POPE), диолеоилфосфатидилэтаноламин-4-(N-малеимидометил)циклогексан-1-карбоксилат (DOPE-mal), дипальмитоилфосфатидилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфатидилэтаноламин (DSPE), 16-O-монометил-PE, 16-O-диметил-PE, 18-1-транс-PE, 1-стеароил-2-олеоилфосфатидилэтаноламин (SOPE), холестерин или их смесь. Некатионный липид может составлять примерно от 5 моль % до примерно 90 моль %, примерно 10 моль % или примерно 58 моль %, если включен холестерин, от общего содержания липидов в частице.
Конъюгированным липидом, который ингибирует агрегацию частиц, может быть, например, полиэтиленгликоль (ПЭГ)-липид, включая без ограничения ПЭГ-диацилглицерин (DAG), ПЭГ-диалкилоксипропил (DAA), ПЭГ-фосфолипид, ПЭГ-церамид (Cer) или их смесь. Конъюгат ПЭГ-DAA может представлять собой, например, ПЭГ-дилаурилоксипропил (Ci2), ПЭГ-димиристилоксипропил (Ci4), ПЭГ-дипальмитилоксипропил (Ci6) или ПЭГ-дистеарилоксипропил (Ci8). Конъюгированный липид, который предотвращает агрегацию частиц, может составлять от 0 моль % до примерно 20 моль % или примерно 2 моль % от общего содержания липидов в частице.
В некоторых вариантах частица нуклеиновая кислота-липид дополнительно содержит холестерин, например, примерно от 10 моль % до примерно 60 моль % или примерно 48 моль % от общего содержания липидов в частице.
В некоторых вариантах и-РНК готовят в липидной наночастице (LNP).
LNP01
В одном варианте липидоид ND98-4HC1 (М.м. 1487) (См. заявку на выдачу патента США №12/056230, поданную 3/26/2008, которая включена в настоящее описание в виде ссылки), холестерин (Sigma-Aldrich) и ПЭГ-церамид C16 (Avanti Polar Lipids) можно использовать для получения наночастиц липид-днРНК (например, частиц LNP01). Маточные растворы каждого из них в этаноле можно получить следующим образом: ND98, 133 мг/мл; холестерин, 25 мг/мл, ПЭГ-церамид C16, 100 мг/мл. Затем маточные растворы ND98, холестерина и ПЭГ-церамида C16 могут быть объединены, например, в молярном соотношении 42:48:10. Раствор объединенных липидов можно смешать с водным раствором днРНК (например, в ацетате натрия, pH 5) так, чтобы конечная концентрация этанола составляла примерно 35-45% и конечная концентрация ацетата натрия составляла примерно 100-300 мМ. Наночастицы липид-днРНК обычно образуются спонтанно при смешивании. В зависимости от требуемого распределения по размеру частиц полученная смесь наночастиц может быть подвергнута экструзии через поликарбонатную мембрану (например, с пределом отсечения 100 нм), с использованием, например, экструдера Thermobarrel, такого как экструдер Lipex (Northern Lipids, Inc). В некоторых случаях стадия экструзии может быть исключена. Удаление этанола и одновременная замена буфера могут быть осуществлены, например, посредством диализа или тангенциальной проточной фильтрацией. Буфер может быть заменен, например, фосфатно-солевым буфером (PBS) с pH примерно 7, например, pH примерно 6,9, pH примерно 7,0, pH примерно 7,1, pH примерно 7,2, pH примерно 7,3 или pH примерно 7,4.
Препараты LNP01 описаны, например, в международной публикации заявки № WO 2008/042973, которая включена в настоящее описание в виде ссылки.
Дополнительные примеры препаратов липид-днРНК представлены в следующей таблице.
Примеры липидных препаратов
Соотношение липид:ми-РНК
(57.1/7.1/34.4/1.4)
липид:ми-РНК ~ 7:1
57.1/7.1/34.4/1.4
липид:ми-РНК ~ 7:1
57.5/7.5/31.5/3.5
липид:ми-РНК ~ 6:1
57.5/7.5/31.5/3.5
липид:ми-РНК ~ 11:1
60/7.5/31/1.5,
липид:ми-РНК ~ 6:1
60/7.5/31/1.5,
липид:ми-РНК ~ 11:1
50/10/38.5/1.5
Липид:ми-РНК 10:1
50/10/38.5/1.5
Липид:ми-РНК 10:1
50/10/38.5/1.5
Липид:ми-РНК 10:1
50/10/38.5/1.5
Липид:ми-РНК 10:1
50/10/38.5/1.5
40/15/40/5
Липид:ми-РНК: 11:1
50/10/35/4.5/0.5
Липид:ми-РНК: 11:1
50/10/38.5/1.5
Липид:ми-РНК: 7:1
50/10/38.5/1.5
Липид:ми-РНК: 10:1
50/10/38.5/1.5
Липид:ми-РНК: 12:1
50/10/35/5
Липид:ми-РНК: 8:1
50/10/38.5/1.5
Липид:ми-РНК: 10:1
50/10/38.5/1.5
Липид:ми-РНК: 7:1
50/10/38.5/1.5
Липид:ми-РНК: 10:1
DSPC: дистерароилфосфатидилхолин
DPPC: дипальмитоилфосфатидилхолин
ПЭГ-DMG: ПЭГ-дидимиристоилглицерин (C14-ПЭГ или ПЭГ-C14) (ПЭГ со средней молекулярной массой 2000)
ПЭГ-DSG: ПЭГ-дистирилглицерин (C18-ПЭГ или ПЭГ-C18) (ПЭГ со средней молекулярной массой 2000)
ПЭГ-cDMA: ПЭГ-карбамоил-1,2-димиристилоксипропиламин (ПЭГ со средней молекулярной массой 2000)
Препараты, содержащие SNALP (1,2-дилиноленилокси-N,N-диметиламинопропан (DLinDMA)), описаны в международной публикации № WO 2009/127060, поданной 15 апреля 2009, которая включена в настоящее описание в виде ссылки.
Препараты, содержащие XTC, описаны, например, в предварительной заявке на выдачу патента США с регистрационным № 61/148366, поданной 29 января 2009; предварительной заявке на выдачу патента США с регистрационным №61/156851, поданной 2 марта 2009; предварительной заявке на выдачу патента США с регистрационным №, поданной 10 июня 2009; предварительной заявке на выдачу патента США с регистрационным №61/228373, поданной 24 июля 2009; предварительной заявке на выдачу патента США с регистрационным №61/239686, поданной 3 сентября 2009, и в международной заявке № PCT/US 2010/022614, поданной 29 января 2010, которые включены в настоящее описание в виде ссылки.
Препараты, содержащие MC, описаны, например, в предварительной заявке на выдачу патента США с регистрационным №61/244834, поданной 22 сентября 2009, предварительной заявке на выдачу патента США с регистрационным №61/185800, поданной 10 июня 2009, и международной заявке No. PCT/US 10/28224, поданной 10 июня 2010, которые включены в настоящее описание в виде ссылки.
Препараты, содержащие ALNY-100, описаны, например, в международной заявке на выдачу патента номер PCT/US 09/63933, поданной 10 ноября 2009, которая включена в настоящее описание в виде ссылки.
Препараты, содержащие C12-200, описаны в предварительной заявке на выдачу патента США с регистрационным №61/175770, поданной 5 мая 2009, и международной заявке № PCT/US 10/33777, поданной 5 мая 2010, которые включены в настоящее описание в виде ссылки.
Синтез катионных липидов
Любое из соединений, например, катионные липиды и тому подобные, используемые в частицах нуклеиновая кислота-липид, охарактеризованных в изобретении, могут быть получены известными способами органического синтеза, включая способы, описанные более подробно в примерах. Все заместители имеют значение, которое определено ниже, если не указано иное.
«Алкил» означает имеющий прямую цепь или разветвленный, нециклический или циклический, насыщенный алифатический углеводород, содержащий от 1 до 24 атомов углерода. Типичные насыщенные алкилы с прямой цепью включают метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и тому подобные; тогда как насыщенные разветвленные алкилы включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил и тому подобные. Типичные насыщенные циклические алкилы включают циклопропил, циклобутил, циклопентил, циклогексил и тому подобные; в то время как ненасыщенные циклические алкилы включают циклопентенил и циклогексенил и тому подобные.
«Алкенил» означает алкил, который описан выше, содержащий, по меньшей мере, одну двойную связь между соседними атомами углерода. Алкенилы включают как цис-, так и транс-изомеры. Типичные, имеющие прямую цепь и разветвленные алкенилы, включают этиленил, пропиленил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил и тому подобные.
«Алкинил» означает любой алкил или алкенил, который определен выше, который дополнительно содержит, по меньшей мере, одну тройную связь между соседними атомами углерода. Типичные, имеющие прямую цепь и разветвленные алкинилы, включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутенил и тому подобные.
«Ацил» означает любой алкил, алкенил или алкинил, в котором атом углерода в точке связывания замещен оксогруппой, которая определена ниже. Например, -C(=O)алкил, -C(=O)алкенил и -C(=O)алкинил являются ацильными группами.
«Гетероцикл» означает 5-7-членное моноциклическое или 7-10-членное бицилическое гетероциклическое кольцо, которое является насыщенным, ненасыщенным или ароматическим и которое содержит 1 или 2 гетероатома, независимо выбранных из азота, кислорода и серы, и в котором гетероатомы азота и серы необязательно могут быть окислены, и гетероатом азота необязательно может быть кватернизован, включая бициклические кольца, в которых указанные выше гетероциклы слиты с бензольным циклом. Гетероцикл может быть связан через любой гетероатом или атом углерода. Гетероциклы включают гетероарилы, которые определены ниже. Гетероциклы включают морфолинил, пирролидинонил, пирролидинил, пиперидинил, пиперизинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и тому подобные.
Термины «необязательно замещенный алкил», «необязательно замещенный алкенил», «необязательно замещенный алкинил», «необязательно замещенный ацил» и «необязательно замещенный гетероцикл» означает, что в том случае, когда он замещен, по меньшей мере, один атом водорода заменен заместителем. В случае оксо-заместителя (=O) заменены два атома водорода. В этом отношении заместители включают оксогруппу, галоген, гетероцикл, -CN, -ORx, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy, где n равен 0, 1 или 2, Rx и Ry являются одинаковыми или разными и независимо означают водород, алкил или гетероцикл, и каждый из указанных заместителей алкила и гетероцикла может быть дополнительно замещен одним или несколькими заместителями: оксогруппой, галогеном, -OH, -CN, алкилом, -ORx, гетероциклом, -NRxRy, -NRxC(=O)Ry, -NRxSO2Ry, -C(=O)Rx, -C(=O)ORx, -C(=O)NRxRy, -SOnRx и -SOnNRxRy.
«Галоген» означает фтор, хлор, бром и йод.
В некоторых вариантах в способах, охарактеризованных в изобретении, может требоваться применение защитных групп. Методика использования защитных групп хорошо известна в данной области (См., например, Protective groups in organic synthesis, Green, T.W. et al, Wiley-Interscience, New York City, 1999). Коротко, защитные группы в контексте настоящего изобретения представляют собой любую группу, которая снижает или исключает нежелательную реактивность функциональной группы. Защитная группа может быть добавлена к функциональной группе, чтобы маскировать ее реактивность во время некоторых реакций, и затем удалена, чтобы демаскировать исходную функциональную группу. В некоторых вариантах используют «защитную группу спирта». «Защитная группа спирта» представляет собой любую группу, которая уменьшает или исключает нежелательную реактивность спиртовой функциональной группы. Защитные группы могут быть добавлены и удалены с использованием способов, хорошо известных в данной области.
Синтез соединений формулы A
В одном варианте частицы нуклеиновая кислота-липид, охарактеризованные в изобретении, готовят, используя катионный липид формулы A:
где R1 и R2 независимо означают алкил, алкенил или алкинил, каждый из которых необязательно может быть замещен, и R3 и R4, каждый независимо, означают низший алкил, или R3 и R4, вместе взятые, могут образовывать необязательно замещенное гетероциклическое кольцо. В некоторых вариантах катионный липид представляет собой XTC (2,2-дилинолеил-4-диметиламиноэтил-[1,3]-диоксолан). В общем, липид формулы A, указанной выше, может быть получен с использованием следующих схем реакций 1 или 2, где все заместители имеют значение, которое определено выше, если не указано иное.
Схема 1
Липид A, в котором R1 и R2 независимо означают алкил, алкенил или алкинил, каждый из которых необязательно может быть замещен, и R3 и R4 независимо означают низший алкил, или R3 и R4, вместе взятые могут образовывать необязательно замещенное гетероциклическое кольцо, может быть получен согласно схеме 1. Кетон 1 и бромид 2 могут быть приобретены или получены согласно способам, известным в данной области. Взаимодействие 1 и 2 дает кеталь 3. Обработка кеталя 3 амином 4 дает липиды формулы A. Липиды формулы A могут быть превращены в соответствующую соль аммония с использованием органической соли формулы 5, где X означает анионный противоион, выбранный из галогена, гидроксида, фосфата, сульфата или тому подобного.
Схема 2
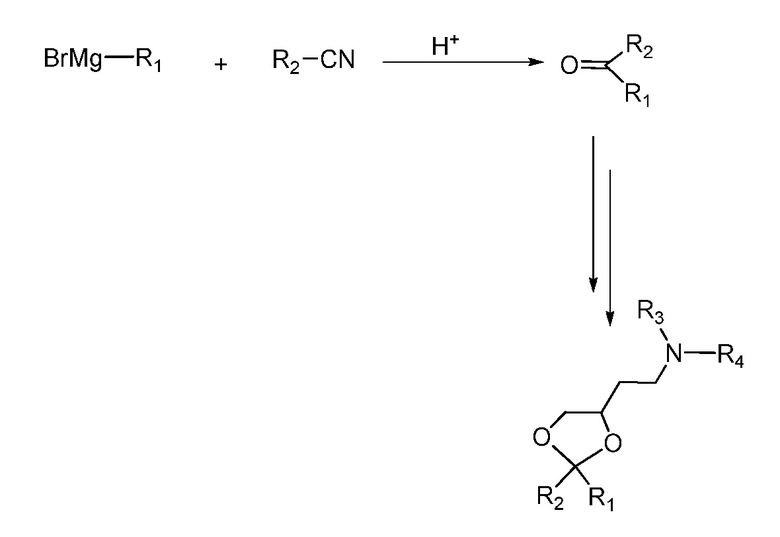
Альтернативно, исходное вещество кетон 1 может быть получен согласно схеме 2. Реактив Гриньяра 6 и цианид 7 могут быть приобретены или получены согласно способам, известным специалистам в данной области. Взаимодействие 6 и 7 дает кетон 1. Превращение кетона 1 в соответствующие липиды формулы A осуществляют, как описано на схеме 1.
Синтез MC3
Получение DLin-M-C3-DMA (т.е., (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ил-4-(диметиламино)бутаноата) осуществляли следующим образом. Раствор (6Z,9Z,28Z,31Z)-гептатриаконта-6,9,28,31-тетраен-19-ола (0,53 г), гидрохлорида 4-N,N-диметиламиномасляной кислоты (0,51 г), 4-N,N-диметиламинопиридина (0,61 г) и гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (0,53 г) в дихлорметане (5 мл) перемешивали при комнатной температуре в течение ночи. Раствор промывали разбавленной хлористоводородной кислотой, затем разбавленным водным раствором бикарбоната натрия. Органические фракции сушили над безводным сульфатом магния, фильтровали и растворитель удаляли на роторном вакуумной испарителе. Остаток пропускали через колонку с силикагелем (20 г), используя градиентное элюирование 1-5% метанолом/дихлорметаном. Фракции, содержащие очищенный продукт, объединяли и растворитель удаляли, получая бесцветное масло (0,54 г).
Синтез ALNY-100
Синтез кеталя 519 [ALNY-100] осуществляли, используя следующую схему 3:
Синтез 515:
К перемешиваемой суспензии LiA1H4 (3,74 г, 0,09852 моль) в 200 мл безводного ТГФ в двугорлой круглодонной колбе (1 л) медленно добавляли раствор 514 (10 г, 0,04926 моль) в 70 мл ТГФ при 0°C в атмосфере азота. После завершения добавления реакционную смесь нагревали до комнатной температуры и затем кипятили с обратным холодильником в течение 4 часов. Протекание реакции контролировали, используя ТСХ. После завершения реакции (по данным ТСХ) смесь охлаждали до 0°C и гасили, осторожно добавляя насыщенный раствор Na2SO4. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре и фильтровали. Остаток тщательно промывали ТГФ. Фильтрат и промывки смешивали и разбавляли, используя 400 мл диоксана и 26 мл концентрированной HCl, и перемешивали в течение 20 минут при комнатной температуре. Летучие вещества удаляли в вакууме, получая гидрохлоридную соль 515 в виде белого твердого вещества. Выход: 7,12 г. 1H-ЯМР (ДМСО, 400 МГц): δ = 9,34 (уширенный, 2H), 5,68 (с, 2H), 3,74 (м, 1H), 2,66-2,60 (м, 2H), 2,50-2,45 (м, 5H).
Синтез 516:
К перемешиваемому раствору соединения 515 в 100 мл безводного ДХМ в двугорлой круглодонной колбе объемом 250 мл добавляли NEt3 (37,2 мл, 0,2669 моль) и охлаждали до 0°C в атмосфере азота. После медленного добавления N-(бензилоксикарбонилокси)сукцинимида (20 г, 0,08007 моль) в 50 мл безводного ДХМ реакционной смеси давали возможность нагреться до комнатной температуры. После завершения реакции (2-3 часа по данным ТСХ) смесь последовательно промывали 1N раствором HCl (1×100 мл) и насыщенным раствором NaHCO3 (1×50 мл). Затем органический слой сушили над безводным Na2SO4 и растворитель выпаривали, получая неочищенное вещество, которое очищали хроматографией на колонке с силикагелем, получая 516 в виде липкой массы. Выход: 11 г (89%). 1H-ЯМР (CDCl3, 400 МГц): δ = 7,36-7,27(м, 5H), 5,69 (с, 2H), 5,12 (с, 2H), 4,96 (уш., 1H), 2,74 (с, 3H), 2,60(м, 2H), 2,30-2,25(м, 2H). ЖХ-МС [M+H]-232,3 (96,94%).
Синтез 517A и 517B:
Циклопентен 516 (5 г, 0,02164 моль) растворяли в растворе 220 мл ацетона и воды (10:1) в одногорлой круглодонной колбе объемом 500 мл и к ней добавляли N-метилморфолин-N-оксид (7,6 г, 0,06492 моль), затем 4,2 мл 7,6% раствора OsO4 (0,275 г, 0,00108 моль) в трет-бутаноле при комнатной температуре. После завершения реакции (~ 3 часа) смесь гасили добавлением твердого Na2SO3 и полученную смесь перемешивали в течение 1,5 часов при комнатной температуре. Реакционную смесь разбавляли ДХМ (300 мл) и промывали водой (2×100 мл), затем насыщенным раствором NaHCO3 (1×50 мл), водой (1×30 мл) и, наконец, насыщенным раствором соли (1×50 мл). Органическую фазу сушили над безводным Na2SO4 и растворитель удаляли в вакууме. Хроматографическая очистка на колонке с силикагелем сырого вещества давала смесь диастереомеров, которые разделяли препаративной ВЭЖХ. Выход: - грубый 6 г.
517A - пик-1 (белок твердого вещества), 5,13 г (96%). 1H-ЯМР (ДМСО, 400 МГц): δ = 7,39-7,31(м, 5H), 5,04(с, 2H), 4,78-4,73 (м, 1H), 4,48-4,47(d, 2H), 3,94-3,93(м, 2H), 2,71(с, 3H), 1,72- 1,67(м, 4H). ЖХ-МС - [M+H]-266,3, [M+NH4 +]-283,5 фактический, ВЭЖХ-97,86%.
Стереохимию подтверждали рентгенографией.
Синтез 518:
Применяя способ, аналогичный способу, описанному для синтеза соединения 505, получали соединение 518 (1,2 г, 41%) в виде бесцветного масла. 1H-ЯМР (CDCl3, 400 МГц): δ= 7,35-7,33 (м, 4H), 7,30-7,27 (м, 1H), 5,37-5,27 (м, 8H), 5,12 (с, 2H), 4,75 (м,1H), 4,58-4,57 (м, 2H), 2,78-2,74 (м, 7H), 2,06-2,00 (м, 8H), 1,96-1,91 (м, 2H), 1,62 (м, 4H), 1,48 (м, 2H), 1,37-1,25 (уш.м, 36H), 0,87 (м, 6H). ВЭЖХ-98,65%.
Общий способ синтеза соединения 519:
Раствор соединения 518 (1 экв.) в гексане (15 мл) добавляли по каплям в ледяной раствор LAH в ТГФ (1 М, 2 экв.). После завершения добавления смесь нагревали при 40°C в течение 0,5 часа, затем снова охлаждали на бане со льдом. Смесь осторожно гидролизовали насыщенным водным раствором Na2SO4, затем фильтровали через целит, и восстанавливали до масла. Хроматография на колонке давала чистый 519 (1,3 г, 68%), который получали в виде бесцветного масла. 13C ЯМР = 130,2, 130,1 (x2), 127,9 (x3), 112,3, 79,3, 64,4, 44,7, 38,3, 35,4, 31,5, 29,9 (x2), 29,7, 29,6 (x2), 29,5 (x3), 29,3 (x2), 27,2 (x3), 25,6, 24,5, 23,3, 226, 14,1; электроспрей МС (+ve): молекулярная масса для C44H80NO2 (M+H)+ вычисленная 654,6, найденная 654,6.
Препараты, полученные либо стандартным способом, либо способом без экструзии, могут быть охарактеризованы сходным образом. Например, препараты обычно характеризуют, используя визуальный просмотр. Они должны представлять собой беловатые прозрачные растворы, не содержащие агрегатов или осадка. Размер частиц и распределение частиц по размеру в случае липидных наночастиц можно измерить на основании светорассеяния, используя, например, Malvern Zetasizer Nano ZS (Malvern, USA). Частицы должны иметь размер примерно 20-300 нм, например, размер 40-100 нм. Распределение по размеру частиц должно быть унимодальным. Концентрацию суммарной днРНК в препарате, а также улавливаемой фракции оценивают в основанном на исключении анализе с использованием красителя. Образец приготовленной днРНК можно подвергнуть инкубации с РНК-связывающим красителем, таким как Ribogreen (Molecular Probes), в присутствии или в отсутствие разрушающего препарат поверхностно-активного вещества, например, 0,5% тритона-X100. Суммарную днРНК в препарате можно определить по сигналу от образца, содержащего поверхностно-активное вещество, по сравнению со стандартной кривой. Улавливаемую фракцию можно определить, вычитая содержание «свободной» днРНК (которое измеряют по сигналу в отсутствие поверхностно-активного вещества) из содержания суммарной днРНК. Процентное содержание улавливаемой днРНК обычно >85%. В случае препарата SNALP размер частиц составляет, по меньшей мере 30 нм, по меньшей мере 40 нм, по меньшей мере 50 нм, по меньшей мере 60 нм, по меньшей мере 70 нм, по меньшей мере 80 нм, по меньшей мере 90 нм, по меньшей мере 100 нм, по меньшей мере 110 нм и по меньшей мере 120 нм. Подходящий диапазон обычно составляет от примерно, по меньшей мере, 50 нм до примерно, по меньшей мере, 110 нм, примерно, по меньшей мере, от 60 нм до примерно, по меньшей мере, 100 нм или примерно, по меньшей мере, от 80 нм до примерно, по меньшей мере, 90 нм.
Композиции и препараты для перорального введения включают порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в воде или в безводных средах, капсулы, гелевые капсулы, саше, таблетки или мини-таблетки. Для их получения может оказаться желательным использование загустителей, ароматизаторов, разбавителей, эмульгаторов, диспергирующих добавок или связующих агентов. В некоторых вариантах пероральными препаратами являются препараты, в случае которых днРНК, охарактеризованную в изобретении, вводят в сочетании с одним или несколькими усилителями проницаемости, поверхностно-активными веществами и хелатообразующими агентами. Подходящие поверхностно-активные вещества включают жирные кислоты и/или их сложные эфиры или соли, желчные кислоты и/или их соли. Подходящими желчными кислотами/солями являются хенодезоксихолевая кислота (CDCA) и урзодезоксихенодезоксихолевая кислота (UDCA), холевая кислота, дегидрохолевая кислота, дезоксихолевая кислота, глюкохолевая кислота, гликохолевая кислота, гликодезоксихолевая кислота, таурохолевая кислота, тауродезоксихолевая кислота, тауро-24,25-дигидрофузидат натрия и гликодигидрофузидат натрия. Подходящими жирными кислотами являются арахидоновая кислота, ундекановая кислота, олеиновая кислота, лауриновая кислота, каприловая кислота, каприновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, линолевая кислота, линоленовая кислота, дикапрат, трикапрат, моноолеин, дилаурин, глицерил-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнитин, ацилхолин или моноглицерид, диглицерид или их фармацевтически приемлемые соли (например, соли натрия). В некоторых вариантах используют комбинации усилителей проницаемости, например жирных кислот/солей в сочетании с желчными кислотами/солями. Одним примером комбинации является натриевая соль лауриновой кислоты, каприновой кислоты и UDCA. Другими усилителями проницаемости являются полиоксиэтилен-9-лауриловый эфир, полиоксиэтилен-20-цетиловый эфир. днРНК, охарактеризованные в изобретении, могут быть доставлены перорально, в гранулярной форме, включая распыляемые сухие частицы, или в комплексе с образованием микро- или наночастиц. Агенты, образующие комплексы с днРНК, включают полиаминокислоты; полимимины; полиакрилаты; полиалкилакрилаты, полиоксэтаны, полиалкилцианоакрилаты; катионизированные желатины, альбумины, крахмалы, акрилаты, полиэтиленгликоли (ПЭГ) и крахмалы; полиалкилцианоакрилаты; DEAE-дериватизированные полиимины, пуллуланы, целлюлозы и крахмалы. Подходящими комплексообразующими агентами являются хитозан, N-триметилхитозан, поли-L-лизин, полигистидин, полиорнитин, полиспермины, протамин, поливинилпиридин, политиодиэтиламинометилэтилен P(TDAE), полиаминостирол (например, п-амино), поли(метилцианоакрилат), поли(этилцианоакрилат), поли(бутилцианоакрилат), поли(изобутилцианоакрилат), поли(изогексилцианоакрилат), DEAE-метакрилат, DEAE-гексилакрилат, DEAE-акриламид, DEAE-альбумин и DEAE-декстран, полиметилакрилат, полигексилакрилат, поли(D,L-молочная кислота), сополимер DL-молочной и гликолевой кислоты (PLGA), альгинат и полиэтиленгликоль (ПЭГ). Пероральные препараты днРНК и их получение подробно описаны в патенте США 6887906, публикации патента США №20030027780 и в патенте США №6747014, каждый из которых включен в настоящее описание в виде ссылки.
Композиции и препараты для парентерального, интрапаренхимного (в головной мозг), интратекального, внутрижелудочкового введения или введения в печень могут включать стерильные водные растворы, которые могут также содержать буферы, разбавители и другие подходящие добавки, такие как без ограничения усилители проницаемости, соединения-носители и другие фармацевтически приемлемые носители или эксципиенты.
Фармацевтические композиции согласно настоящему изобретению могут включать без ограничения растворы, эмульсии и препараты, содержащие липосомы. Такие композиции могут быть созданы из различных компонентов, которые включают без ограничения предварительно приготовленные жидкости, самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полутвердые вещества.
Фармацевтические препараты, охарактеризованные в настоящем изобретении, которые обычно могут представлять собой стандартную лекарственную форму, могут быть получены обычными способами, хорошо известными в фармацевтической промышленности. Такие способы включают в себя стадию смешивания активных ингредиентов с фармацевтически приемлемым(и) носителем(ями) и эксципиентом(ами). В общем, препараты получают путем равномерного и тщательного смешивания активных ингредиентов с жидкими носителями и с тонко измельченными твердыми носителями или с теми и другими, с последующим, если это необходимо, формованием продукта.
Композиции, охарактеризованные в настоящем изобретении, могут быть приготовлены в любой из многих возможных дозированных форм, таких как без ограничения таблетки, капсулы, гелевые капсулы, жидкие сиропы, мягкие гели, суппозитории и клизмы. Композиции также могут быть приготовлены в виде суспензий в водной, безводной или смешанной среде. Водные суспензии могут дополнительно содержать вещества, которые повышают вязкость суспензии, включая, например, натрий-карбоксиметилцеллюлозу, сорбит и/или декстран. Такая суспензия может также содержать стабилизаторы.
Дополнительные препараты
Эмульсии
Композиции согласно настоящему изобретению могут быть получены и приготовлены в виде эмульсий. Эмульсии обычно представляют собой гетерогенные системы, состоящие из одной жидкости, диспергированной в другой жидкости в виде капелек, диаметр которых обычно превышает 0,1 мкм (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., Volume 1, p. 245; Block in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 2, p. 335; Higuchi et al., in Remington′s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 301). Эмульсии часто представляют собой двухфазные системы, содержащие две несмешивающиеся жидкие фазы, однородно смешанные и диспергированные одна в другой. В общем, эмульсии могут представлять собой либо эмульсии типа «вода в масле» (в/м), либо «масло в воде» (м/в). Если водная фаза является тонкодисперсной и диспергирована в виде небольших капелек в объемной масляной фазе, то получаемую в результате композицию называют эмульсией типа «вода в масле» (в/м). Альтернативно, если масляная фаза является тонкодисперсной и диспергирована в виде небольших капелек в объемной водной фазе, то получаемую в результате композицию называют эмульсией типа «масло в воде» (м/в). Помимо диспергированных фаз, эмульсии могут содержать дополнительные компоненты и активное лекарственное средство, которое может присутствовать в виде раствора в водной фазе, масляной фазе или в виде отдельной фазы. При необходимости, в эмульсии могут быть также добавлены фармацевтические эксципиенты, такие как эмульгаторы, стабилизаторы, красители и антиоксиданты. Фармацевтические эмульсии могут также представлять собой многосоставные эмульсии, состоящие более чем из двух фаз, например, в случае эмульсий типа «масло - в воде - в масле» (м/в/м) и типа «вода - в масле - в воде» (в/м/в). Такие сложные препараты часто имеют определенные преимущества, которыми не обладают простые бинарные эмульсии. Многосоставные эмульсии, в которых отдельные масляные капельки эмульсии типа м/в заключены в небольшие водные капельки, составляют эмульсию типа в/м/в. Подобным образом, система масляных капелек, включенных в глобулы воды, стабилизированные в масляной непрерывной фазе, составляют эмульсию типа м/в/м.
Эмульсии характеризуются невысокой термодинамической стабильностью или ее отсутствием. Часто дисперсная или прерывистая фаза эмульсии хорошо диспергируется во внешней или в непрерывной фазе и поддерживается в этой форме, благодаря эмульгаторам или вязкости данного препарата. Любая из фаз эмульсии может быть полутвердой или твердой, как в случае основ для мазей типа эмульсии и кремов. Другой способ стабилизации эмульсий заключается в использовании эмульгаторов, которые могут быть включены в любую фазу эмульсии. В общих чертах, эмульгаторы могут быть подразделены на четыре категории: синтетические поверхностно-активные вещества, встречающиеся в природе эмульгаторы, абсорбционные основы и тонкодисперсные твердые вещества (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Синтетические поверхностно-активные вещества, также известные как поверхностно-активные агенты, находят широкое применение в изготовлении эмульсионных препаратов и описаны в литературе (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), Marcel Dekker, Inc., New York, N.Y., 1988, volume 1, p. 199). Поверхностно-активные вещества обычно являются амфифильными и содержат гидрофильную и гидрофобную часть. Отношение гидрофильности к гидрофобности поверхностно-активного вещества называется гидрофильно-липофильным балансом (ГЛБ) и является ценным инструментом при определении категорий и при отборе поверхностно-активных веществ для приготовления препаратов. Поверхностно-активные вещества могут быть разделены на разные классы на основе природы их гидрофильной группы: неионогенные, анионогенные, катионогенные и амфотерные (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY Rieger, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 285).
Природными эмульгаторами, используемыми в эмульсионных препаратах, являются ланолин, пчелиный воск, фосфатиды, лецитин и аравийская камедь. Абсорбционные основы обладают гидрофильными свойствами, и поэтому они могут впитывать воду и образовывать эмульсии типа в/м, которые еще сохраняют свою полутвердую консистенцию, и такими основами являются безводный ланолин и гидрофильный вазелин. Тонко измельченные твердые вещества также применяли в качестве хороших эмульгаторов, особенно в сочетании с поверхностно-активными веществами и в вязких препаратах. Указанные вещества включают полярные неорганические твердые вещества, такие как гидроксиды тяжелых металлов, ненабухающие глины, такие как бентонит, аттапульгит, гекторит, каолин, монтмориллонит, коллоидный силикат алюминия и коллоидный силикат магния-алюминия, пигменты и неполярные твердые вещества, такие как уголь или глицерилтристеарат.
Большое разнообразие эмульгирующих веществ также включают в эмульсионные препараты, и такие вещества вносят вклад в определенные свойства эмульсий. Такими веществами являются жиры, масла, воски, жирные кислоты, жирные спирты, сложные эфиры жирных кислот, увлажнители, гидрофильные коллоиды, консерванты и антиоксиданты (Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199).
Гидрофильными коллоидами или гидроколлоидами являются встречающиеся в природе смолы и синтетические полимеры, такие как полисахариды (например, аравийская камедь, агар, альгиновая кислота, каррагенан, гуаровая камедь, камедь карайи и трагакантовая камедь), производные целлюлозы (например, карбоксиметилцеллюлоза и карбоксипропилцеллюлоза) и синтетические полимеры (например, карбомеры, эфиры целлюлозы и карбоксивиниловые полимеры). Такие вещества диспергируются или набухают в воде с образованием коллоидных растворов, которые стабилизируют эмульсию за счет образования прочных межфазных пленок вокруг капелек дисперсионной фазы и посредством повышения вязкости внешней фазы.
Так как эмульсии часто содержат ряд ингредиентов, таких как углеводы, белки, стиролы и фосфатиды, которые могут хорошо поддерживать рост микробов, то часто в такие препараты включают консерванты. Широко используемыми консервантами, включаемыми в эмульсионные препараты, являются метилпарабен, пропилпарабен, четвертичные аммониевые соли, хлорид бензалкония, сложные эфиры п-гидроксибензойной кислоты и борная кислота. В эмульсионные препараты также обычно добавляют антиоксиданты для предотвращения разложения препарата. Используемыми антиоксидантами могут быть акцепторы свободных радикалов, такие как токоферолы, алкилгаллаты, бутилированный гидроксианизол, бутилированный гидрокситолуол, или восстановители, такие как аскорбиновая кислота и метабисульфит натрия, и антиоксиданты-синергисты, такие как лимонная кислота, винная кислота и лецитин.
Применение эмульсионных препаратов чрескожным, пероральным и парентеральным путями и способы их производства описаны в литературе (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Эмульсионные препараты для пероральной доставки очень широко применяли, вследствие простоты их приготовления, а также их эффективности с точки зрения всасывания и биологической доступности (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Idson, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 199). Слабительные на основе минерального масла, растворимые в масле витамины и питательные препараты с высоким содержание жира относятся к веществам, которые обычно вводят перорально в виде эмульсий «м/в».
В одном варианте осуществления настоящего изобретения композиции и-РНК и нуклеиновых кислот готовят в виде микроэмульсий. Микроэмульсия может быть определена как система, состоящая из воды, масла и амфифильного вещества, которая представляет собой оптически изотропный и термодинамически стабильный жидкий раствор (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245). Обычно микроэмульсии представляют собой системы, которые получают сначала путем диспергирования масла в водном растворе поверхностно-активного вещества с последующим добавлением достаточного количества четвертого компонента, обычно спирта со средней длиной цепи, с образованием прозрачной системы. Поэтому микроэмульсии были также описаны как термодинамически стабильные изотропно чистые дисперсии двух несмешивающихся жидкостей, которые стабилизируются межфазными пленками, состоящими из поверхностно-активных молекул (Leung and Shah, в: Controlled Release of Drugs: Polymers and Aggregate Systems, Rosoff, M., Ed., 1989, VCH Publishers, New York, p. 185-215). Микроэмульсии обычно получают путем объединения от трех до пяти компонентов, которые включают масло, воду, поверхностно-активное вещество, вторичное поверхностно-активное вещество и электролит. Является ли микроэмульсия микроэмульсией типа «вода в масле» (в/м) или «масло в воде» (м/в), зависит от свойств масла и используемого поверхностно-активного вещества и от структуры и геометрической упаковки полярных головок и углеводородных хвостов поверхностно-активных молекул (Schott, in Remington′s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pa., 1985, p. 271).
Были проведены всесторонние исследования фазовых диаграмм с использованием феноменологического подхода и были получены исчерпывающие сведения о том, как специалист в данной области может приготовить микроэмульсии (См., например, Ansel′s Pharmaceutical Dosage Forms and Drug Delivery Systems, Allen, LV., Popovich NG., and Ansel HC., 2004, Lippincott Williams & Wilkins (8th ed.), New York, NY; Rosoff, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 245; Block, in Pharmaceutical Dosage Forms, Lieberman, Rieger and Banker (Eds.), 1988, Marcel Dekker, Inc., New York, N.Y., volume 1, p. 335). По сравнению со стандартными эмульсиями микроэмульсии обеспечивают преимущество, которое заключается в солюбилизации не растворимых в воде лекарственных средств в препарате, состоящем из термодинамически стабильных капелек, которые образуются спонтанно.
Поверхностно-активные вещества, используемые для получения микроэмульсий, включают без ограничения ионогенные поверхностно-активные вещества, неионогенные поверхностно-активные вещества, Brij 96, простые олеиловые эфиры полиоксиэтилена, сложные эфиры полиглицерина и жирных кислот, монолаурат тетраглицерина (ML310), моноолеат тетраглицерина (MO310), моноолеат гексаглицерина (PO310), пентаолеат гексаглицерина (PO500), монокапрат декаглицерина (MCA750), моноолеат декаглицерина (MO750), секвиолеат декаглицерина (SO750), декаолеат декаглицерина (DAO750), отдельно или в сочетании со вторичными поверхностно-активными веществами. Вторичное поверхностно-активное вещество, обычно спирт с короткой цепью, такой как этанол, 1-пропанол и 1-бутанол, служит для повышения текучести за счет проникновения в пленку поверхностно-активного вещества с последующим образованием неупорядоченной пленки в результате образования пустого пространства между молекулами поверхностно-активного вещества. Однако микроэмульсии могут быть получены и без использования вторичных поверхностно-активных веществ, и в данной области известны самоэмульгирующиеся микроэмульсионные системы, не содержащие спирта. Водной фазой обычно могут служить без ограничения вода, водный раствор лекарственного средства, глицерин, ПЭГ300, ПЭГ400, полиглицерины, пропиленгликоли и производные этиленгликоля. Масляной фаза может содержать без ограничения такие вещества, как Captex 300, Captex 355, Capmul MCM, сложные эфиры жирных кислот, моно-, ди- и триглицериды со средней длиной цепи (C8-C12), полиоксиэтилированные эфиры глицерина и жирных кислот, жирные спирты, полигликолевые глицериды, насыщенные полигликолизированные С8-С10-глицериды, растительные масла и силиконовое масло.
Микроэмульсии представляют особый интерес с точки зрения солюбилизации и усиления всасывания лекарственных средств. Было высказано предположение, что микроэмульсии на основе липидов (как м/в, так и в/м) повышают пероральную биологическую доступность лекарственных средств, включая пептиды (См., например, патенты США №6191105, 7063860, 7070802, 7157099; публикацию Constantinides с соавторами, Pharmaceutical Research, 1994, 11, 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 1993, 13, 205). Преимущества микроэмульсий заключаются в улучшенной солюбилизации лекарственных средств, защите лекарственного средства от ферментативного гидролиза, возможном усилении всасывания лекарственного средства, обусловленном индуцированным поверхностно-активным веществом изменением текучести и проницаемости мембраны, легкости приготовления, легкости перорального введения в виде твердых лекарственных форм, улучшенной клинической эффективности и пониженной токсичности (См., например, патенты США №6191105, 7063860, 7070802, 7157099; Constantinides et al., Pharmaceutical Research, 1994, 11, 1385; Ho et al., J. Pharm. Sci., 1996, 85, 138-143). Часто микроэмульсии могут образовываться спонтанно при взаимодействии их компонентов при температуре окружающей среды. Это может быть особенно предпочтительным в случае приготовления термолабильных лекарственных средств, пептидов или и-РНК. Микроэмульсии также являются эффективными при трансдермальной доставке активных компонентов в случае как косметических, так и фармацевтических применений. Предполагается, что имеющие форму микроэмульсий композиции и препараты согласно настоящему изобретению будут способствовать повышению уровня системного всасывания и-РНК и нуклеиновых кислот из желудочно-кишечного тракта, а также повышению локального поглощения и-РНК и нуклеиновых кислот клетками.
Микроэмульсии согласно настоящему изобретению могут также содержать дополнительные компоненты и добавки, такие как моностеарат сорбитана (Grill 3), лабразол и усилители проницаемости, улучшающие свойства препарата и усиливающие всасывание и-РНК и нуклеиновых кислот согласно настоящему изобретению. Усилители проницаемости, используемые в микроэмульсиях согласно настоящему изобретению, могут быть классифицированы как вещества, принадлежащие к одной из пяти широких категорий, а именно поверхностно-активным веществам, жирным кислотам, солям желчных кислот, хелатообразующим агентам и веществам, не являющимся ни хелатообразующими, ни поверхностно-активными веществами (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92). Каждый из таких классов обсуждался выше.
Усилители проницаемости
В одном варианте осуществления настоящего изобретения используют различные усилители проницаемости в целях обеспечения эффективной доставки нуклеиновых кислот, в частности и-РНК, в кожу животных. Большинство лекарственных средств присутствует в растворе как в ионизованной, так и в неионизованной формах. Однако обычно через клеточные мембраны легко проходят только растворимые в липидах или липофильные лекарственные средства. Было обнаружено, что через клеточные мембраны могут проходить даже нелипофильные лекарственные средства, если такая пересекаемая мембрана обработана усилителем проницаемости. Усилители проницаемости, помимо стимуляции диффузии нелипофильных лекарственных средств через клеточные мембраны, также повышают проницаемость для липофильных лекарственных средств.
Усилители проницаемости могут быть классифицированы как соединения, принадлежащие к одной из пяти широких категорий, то есть поверхностно-активные вещества, жирные кислоты, соли желчных кислот, хелатообразующие агенты и соединения, не образующие хелатные комплексы и не являющиеся поверхностно-активными веществами (См., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92). Каждый из вышеупомянутых классов усилителей проницаемости более подробно описан ниже.
Поверхностно-активные вещества: В соответствии с настоящим изобретением, поверхностно-активные вещества (или «поверхностно-активные агенты) представляют собой химические молекулы, которые при их растворении в водном растворе снижают поверхностное натяжение раствора или межфазное поверхностное натяжение между водным раствором и другой жидкостью, в результате чего повышается уровень всасывания и-РНК через слизистую оболочку. Помимо солей желчных кислот и жирных кислот, такими усилителями проницаемости являются, например, лаурилсульфат натрия, полиоксиэтилен-9-лауриловый эфир и полиоксиэтилен-20-цетиловый эфир (См., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92); и перфторированные эмульсии, такие как FC-43 (Takahashi et al., J. Pharm. Pharmacol., 1988, 40, 252).
Жирные кислоты: Различные жирные кислоты и их производные, которые действуют как усилители проницаемости, включают, например, олеиновую кислоту, лауриловую кислоту, каприновую кислоту (н-декановую кислоту), миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, линолевую кислоту, линоленовую кислоту, дикапрат, трикапрат, моноолеин (1-моноолеоил-рац-глицерин), дилаурин, каприловую кислоту, арахидоновую кислоту, 1-монокапрат глицерина, 1-додецилазациклогептан-2-он, ацилкарнитины, ацилхолины или их сложные С1-20 алкиловые эфиры (например, метиловый, изопропиловый и трет-бутиловый) и моно- и диглицериды (т.е., олеат, лаурат, капрат, миристат, пальмитат, стеарат, линолеат и т.п.) (См., например, Touitou, E., et al. Enhancement in Drug Delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p.92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; El Hariri et al., J. Pharm. Pharmacol., 1992, 44, 651-654).
Соли желчных кислот: Физиологическая роль желчи состоит в облегчении диспергирования и всасывания липидов и жирорастворимых витаминов (См., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Brunton, Chapter 38 in: Goodman & Gilman′s The Pharmacological Basis of Therapeutics, 9th Ed., Hardman et al. Eds., McGraw-Hill, New York, 1996, pp. 934-935). Различные природные соли желчных кислот и их синтетические производные действуют как усилители проницаемости. Таким образом, термин «соли желчных кислот» включает любой из встречающихся в природе компонентов желчи, а также любое из их синтетических производных. Подходящие соли желчных кислот включают, например, холевую кислоту (или ее фармацевтически приемлемую натриевую соль, холат натрия), дегидрохолевую кислоту (дегидрохолат натрия), дезоксихолевую кислоту (дезоксихолат натрия), глюкохолевую кислоту (глюкохолат натрия), гликохолевую кислоту (гликохолат натрия), гликодезоксихолевую кислоту (гликодезоксихолат натрия), таурохолевую кислоту (таурохолат натрия), тауродезоксихолевую кислоту (тауродезоксихолат натрия), хенодезоксихолевую кислоту (хенодезоксихолат натрия), урсодезоксихолевую кислоту (UDCA), тауро-24,25-дигидрофузидат натрия (STDHF), гликодигидрофузидат натрия и полиоксиэтилен-9-лауриловый эфир (POE) (См., например, Malmsten, M. Surfactants and polymers in drug delivery, Informa Health Care, New York, NY, 2002; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Swinyard, Chapter 39 In: Remington′s Pharmaceutical Sciences, 18th Ed., Gennaro, ed., Mack Publishing Co., Easton, Pa., 1990, pages 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Yamamoto et al., J. Pharm. Exp. Ther., 1992, 263, 25; Yamashita et al., J. Pharm. Sci., 1990, 79, 579-583).
Хелатообразующие агенты: Хелатообразующие агенты, используемые в настоящем изобретении, могут быть определены как соединения, которые удаляют ионы металлов из раствора посредством образования комплексов с такими ионами, что приводит к усилению всасывания и-РНК через слизистую оболочку. Что касается использования таких агентов в качестве усилителей проницаемости в настоящем изобретении, то такие хелатообразующие агенты имеют дополнительное преимущество, которое состоит в том, что они также служат в качестве ингибиторов ДНКазы, поскольку наиболее известным ДНК-нуклеазам для осуществления катализа необходим ион двухвалентного металла, и поэтому они ингибируются хелатообразующими агентами (Jarrett, J. Chromatogr., 1993, 618, 315-339). Подходящие хелатообразующие агенты включают без ограничения этилендиаминотетраацетат динатрия (EDTA), лимонную кислоту, салицилаты (например, салицилат натрия, 5-метоксисалицилат и гомованилат), N-ацильные производные коллагена, лаурет-9 и N-аминоацильные производные β-дикетонов (енаминов) (См., например, Katdare, A. et al., Excipient development for pharmaceutical, biotechnology, and drug delivery, CRC Press, Danvers, MA, 2006; Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, page 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33; Buur et al., J. Control Rel., 1990, 14, 43-51).
Соединения, не образующие хелатные комплексы и не являющиеся поверхностно-активными веществами: В используемом в настоящем описании смысле усилители проницаемости, не образующие хелатные комплексы и не являющиеся поверхностно-активными веществами, могут быть определены как соединения, которые проявляют незначительную активность в качестве хелатообразующих агентов или в качестве поверхностно-активных веществ, но, тем не менее, усиливают всасывание и-РНК через слизистую оболочку пищеварительного тракта (См., например, Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 1990, 7, 1-33). Такой класс усилителей проницаемости включает, например, ненасыщенные циклические мочевины, производные 1-алкил- и 1-алкенилазациклоалканонов (Lee et al., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, p. 92); и нестероидные противовоспалительные средства, такие как диклофенак-натрий, индометацин и фенилбутазон (Yamashita et al., J. Pharm. Pharmacol., 1987, 39, 621-626).
Средства для усиления захвата и-РНК на клеточном уровне также могут быть добавлены в фармацевтические и другие композиции согласно настоящему изобретению. Например, известно, что катионные липиды, такие как липофектин (Junichi с соавторами, патент США №5705188), катионные производные глицерина и поликатионные молекулы, такие как полилизин (Lollo с соавторами, заявка PCT WO 97/30731), усиливают захват днРНК клетками. Примеры коммерчески доступных реагентов для трансфекции наряду с другими включают, например, липофектамин™ (Invitrogen; Carlsbad, CA), липофектамин 2000™ (Invitrogen; Carlsbad, CA), 293-фектин™ (Invitrogen; Carlsbad, CA), селлфектин™ (Invitrogen; Carlsbad, CA), DMRIE-C™ (Invitrogen; Carlsbad, CA), FreeStyle™ MAX (Invitrogen; Carlsbad, CA), липофектамин™ 2000 CD (Invitrogen; Carlsbad, CA), липофектамин™ (Invitrogen; Carlsbad, CA), RNAiMAX (Invitrogen; Carlsbad, CA), олигофектамин™ (Invitrogen; Carlsbad, CA), оптифект™ (Invitrogen; Carlsbad, CA), реагент для трансфекции X-tremeGENE Q2 (Roche; Grenzacherstrasse, Switzerland), реагент для липосомной трансфекции DOTAP (Grenzacherstrasse, Switzerland), реагент для липосомной трансфекции DOSPER (Grenzacherstrasse, Switzerland) или Fugene (Grenzacherstrasse, Switzerland), реагент трансфектам® (Promega; Madison, WI), реагент для трансфекции TransFast™ (Promega; Madison, WI), реагент Tfx™-20 (Promega; Madison, WI), реагент Tfx™-50 (Promega; Madison, WI), DreamFect™ (OZ Biosciences; Marseille, France), EcoTransfect (OZ Biosciences; Marseille, France), реагент для трансфекции TransPassa D1 (New England Biolabs; Ipswich, MA, USA), LyoVec™/LipoGen™ (Invivogen; San Diego, CA, USA), реагент для трансфекции PerFectin (Genlantis; San Diego, CA, USA), реагент для трансфекции NeuroPORTER (Genlantis; San Diego, CA, USA), реагент для трансфекции GenePORTER (Genlantis; San Diego, CA, USA), реагент для трансфекции GenePORTER 2 (Genlantis; San Diego, CA, USA), реагент для трансфекции цитофектин (Genlantis; San Diego, CA, USA), реагент для трансфекции BaculoPORTER (Genlantis; San Diego, CA, USA), реагент для трансфекции TroganPORTER™ (Genlants; San Diego, CA, USA), RiboFect (Bioline; Taunton, MA, USA), PlasFect (Bioline; Taunton, MA, USA), UniFECTOR (B-Bridge International; Mountain View, CA, USA), SureFECTOR (B-Bridge International; Mountain View, CA, USA), или HiFect™ (B-Bridge International, Mountain View, CA, USA).
Другие средства, которые могут быть использованы для усиления проницаемости для вводимых нуклеиновых кислот, включают гликоли, такие как этиленгликоль и пропиленгликоль, пирролы, такие как 2-пиррол, азоны и терпены, такие как лимонен и ментон.
Носители
Некоторые композиции согласно настоящему изобретению в препарате также содержат соединения-носители. В используемом в настоящем описании смысле термины «соединение-носитель» или «носитель» могут относиться к нуклеиновой кислоте или ее аналогу, которые являются инертными (т.е. не обладают биологической активностью как таковые), но распознаются как нуклеиновая кислота в процессах in vivo, которые снижают биологическую доступность нуклеиновой кислоты, обладающей биологической активностью, посредством, например, расщепления биологически активной нуклеиновой кислоты или стимуляции ее удаления из кровотока. Совместное введение нуклеиновой кислоты и соединения-носителя, обычно с избытком последнего вещества, может приводить к значительному снижению количества нуклеиновой кислоты, извлекаемой в печени, почках или в других не относящихся к циркуляции резервуарах, вероятно вследствие конкуренции между соединением-носителем и нуклеиновой кислотой за их общий рецептор. Например, извлечение частично фосфортиоатной днРНК в ткани печени может быть уменьшено при совместном введении с полиинозиновой кислотой, сульфатом декстрана, полицитидиновой кислотой или 4-ацетамидо-4'-изотиоцианостильбен-2,2'-дисульфоновой кислотой (Miyao et al., DsRNA Res. Dev., 1995, 5, 115-121; Takakura et al., DsRNA & Nucl. Acid Drug Dev., 1996, 6, 177-183).
Эксципиенты
В отличие от соединения-носителя «фармацевтический носитель» или «эксципиент» представляет собой фармацевтически приемлемый растворитель, суспендирующий агент или любой другой фармакологически инертный носитель для доставки одной или нескольких нуклеиновых кислот в организм животного. Эксципиент может быть жидким или твердым, и он может быть выбран в соответствии с планируемым способом введения, так чтобы при объединении с нуклеиновой кислотой и с другими компонентами данной фармацевтической композиции он обеспечивал желаемый объем, консистенцию и т.д.. Типичные фармацевтические носители включают без ограничения связывающие вещества (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу и т.д.); наполнители (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты или бифосфат кальция и т.д.); скользящие вещества (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т.д.); дезинтегрирующие средства (например, крахмал, гликолят натрия-крахмала и т.д.); и увлажнители (например, лаурилсульфат натрия и т.д.).
Фармацевтически приемлемые органические или неорганические эксципиенты, подходящие для непарентерального введения, которые не вступают во взаимодействия с нуклеиновыми кислотами, вызывающими их разрушение, также могут быть использованы для приготовления композиций согласно настоящему изобретению. Подходящие фармацевтически приемлемые носители включают без ограничения воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Препараты для местного введения нуклеиновых кислот могут включать стерильные и нестерильные водные растворы, неводные растворы в стандартных растворителях, таких как спирты, или растворы нуклеиновых кислот в жидких или твердых масляных основах. Такие растворы также могут содержать буферы, разбавители и другие подходящие добавки. Могут быть также использованы фармацевтически приемлемые органические или неорганические эксципиенты, подходящие для непарентерального введения, которые не вступают во взаимодействия с нуклеиновыми кислотами, которые приводят к их разрушению.
Подходящие фармацевтически приемлемые эксципиенты включают без ограничения воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и тому подобное.
Другие компоненты
Композиции согласно изобретению могут дополнительно содержать другие вспомогательные компоненты, обычно присутствующие в фармацевтических композициях на уровнях применения, установленных в данной области. Таким образом, композиции могут содержать, например, дополнительные совместимые фармацевтически активные вещества, такие как, например, противозудные средства, вяжущие средства, местные анестетики или противовоспалительные средства, либо они могут содержать дополнительные вещества, применимые при физическом приготовлении различных дозированных форм композиций согласно настоящему изобретению, такие как красители, корригенты, консерванты, антиоксиданты, вещества для придания светопоглощающих свойств, загустители и стабилизаторы. Однако такие вещества при их добавлении не должны оказывать чрезмерного влияния на биологическую активность компонентов композиций согласно настоящему изобретению. Препараты можно стерилизовать и при необходимости смешивать с вспомогательными средствами, например, скользящими веществами, консервантами, стабилизаторами, увлажнителями, эмульгаторами, солями, влияющими на осмотическое давление, буферами, красителями, корригентами и/или ароматизириюущими веществами и тому подобными, которые не вступают во взаимодействие с нуклеиновой кислотой (кислотами) в препарате, вызывающими из разрушение.
Водные суспензии могут содержать вещества, которые повышают вязкость суспензии, включая, например, натрий-карбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия также может содержать стабилизаторы.
В некоторых вариантах фармацевтические композиции, охарактеризованные в изобретении, содержат (a) одно или несколько и-РНК-соединение и (b) одно или несколько биологических средств, которые действуют по механизму, отличному от механизма РНК-и. Примерами таких биологических средств включают средства, которые мешают взаимодействию ALAS1 и, по меньшей мере, одного партнера, связывающегося с ALAS1.
Токсичность и терапевтическую эффективность таких соединений можно определять стандартными фармацевтическими способами с использованием клеточных культур или экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Отношение дозы, оказывающей токсическое действие, к дозе, оказывающей терапевтическое действие, является терапевтическим индексом и может быть выражено в виде отношения LD50/ED50. Обычными являются соединения, которые имеют высокие терапевтические индексы.
Данные, полученные в результате анализов клеточной культуры или в исследованиях на животных, могут быть использованы в целях приготовления доз в определенном диапазоне для применения на человеке. Дозы композиций, охарактеризованных в изобретении, обычно лежат в диапазоне концентрации в кровотоке, который включает ED50, с небольшой токсичностью или в отсутствие токсичности. Доза может варьировать в таком диапазоне, в зависимости от используемой лекарственной формы и от применяемого способа введения. Для любого соединения, используемого в способах, охарактеризованных в изобретении, терапевтически эффективную дозу сначала можно оценить в анализах на культуре клеток. В случае моделей на животных доза может быть приготовлена так, чтобы достичь циркулирующего в плазме диапазона концентраций соединения или, в соответствующем случае, полипептидного продукта последовательности-мишени (например, достижение пониженной концентрации полипептида), который включает IC50 (т.е., концентрацию тестируемого соединения, которая приводит к полумаксимальному подавлению симптомов), которую определяют в культуре клеток. Такая информация может быть использована для более точного определения доз для человека. Уровни в плазме могут быть измерены, например, с использованием высокоэффективной жидкостной хроматографии.
Помимо обсуждаемого выше введения и-РНК, охарактеризованные в изобретении, можно вводить в сочетании с другими известными средствами, эффективными при лечении заболеваний или расстройств, связанных с экспрессией ALAS1. В любом случае, лечащий врач может скорректировать количество и время введения и-РНК на основе результатов, получаемых с использованием стандартных критериев эффективности, известных в данной области или описанных в настоящей публикации.
Способы лечения заболеваний, связанных с экспрессией гена ALAS1
Изобретение, в частности, относится к применению и-РНК, мишенью которой является ALAS1, для ингибирования экспрессии ALAS1 и/или лечения заболевания, расстройства или патологического процесса, который связан с экспрессией ALAS1.
В используемом в настоящем описании смысле термины «расстройство, связанное с экспрессией ALAS1», «заболевание, связанное с экспрессией ALAS1», «патологический процесс, связанный с экспрессией ALAS1»" или тому подобные включают любое состояние, расстройство или заболевание, при котором экспрессия ALAS1 изменена (например, повышена), уровень одного или нескольких порфиринов изменен (например, повышен), уровень или активность одного или нескольких ферментов в пути биосинтеза гема (пути порфирина) изменены, или действуют другие механизмы, которые приводят к патологическим изменениям пути биосинтеза гема. Например, и-РНК, мишенью которой является ген ALAS1, или ее сочетания можно использовать для лечения состояний, при которых уровни порфирина или предшественника порфирина (например, ALA или PBG) повышены (например, некоторых порфирий), или состояний, при которых существуют дефекты ферментов в пути биосинтеза гема (например, некоторых порфирий). Расстройства, связанные с экспрессией ALAS1, включают, например, X-сцепленную сидеробластную анемию (XLSA), порфирию вследствие недостаточности ALA-дегидратазы (ночную порфирию), острую интермиттирующую порфирию (AIP), врожденную эритропоэтическую порфирию, позднюю кожную порфирию, наследственную копропорфирию (копропорфирию), смешанную порфирию, эритропоэтическую протопорфирию (EPP), и временную эритропорфирию новорожденных.
В используемом в настоящем описании смысле «субъектом», подвергаемым лечению согласно способам, описанным в настоящей публикации, является человек или животное, отличное от человека, например, млекопитающее. Млекопитающим может быть, например, грызун (например, крыса или мышь) или примат (например, обезьяна). В некоторых вариантах субъектом является человек.
В некоторых вариантах субъект страдает от расстройства, связанного с экспрессией ALAS1 (например, у него диагностирована порфирия или он страдает от одного или нескольких симптомов порфирии и является носителем мутации, ассоциированной с порфирией), или для него существует риск развития расстройства, связанного с экспрессией ALAS1 (например, субъект с порфирией в семейном анамнезе или субъект, который является носителем генетической мутации, ассоциированной с порфирией).
Классификация порфирий, включая острые печеночные порфирии, описана, например, в работе Balwani, M. и Desnick, R.J., Blood, 120(23), опубликованной он-лайн: Blood First Edition paper, 12 июля, 102; DOI 10.1182/blood-2012-05-423186. Как описано в публикации Balwain и Desnick, острая интермиттирующая порфирия (AIP), наследственная копропорфирия (HCP), смешанная порфирия (VP) являются аутосомно-доминантными порфириями, а порфирия вследствие недостаточности ALA-дегидратазы (ADP) является аутосомно-рецессивной. В редких случаях AIP, HCP, и VP встречаются в виде гомозиготных доминантных форм. Кроме того, существует редкая гомозиготная рецессивная форма поздней кожной порфирии (PCT), которая является единственной кожной формой печеночной порфирии и также известна как гепатоэритропоэтическая порфирия. Клинические и лабораторные признаки таких порфирий описаны в таблице 11 ниже.
Печеночные порфирии человека: клинические и лабораторные признаки
* Повышение, которое может быть важным для диагностики.
В некоторых вариантах субъект имеет порфирию или для него существует риск развития порфирии, например, печеночной порфирии например, AIP, HCP, VP, ADP или гепатоэритропоэтической порфирии.
В некоторых вариантах порфирия представляет собой острую печеночную порфирию, например, острую печеночную порфирию, выбранную из острой интермиттирующей порфирии (AIP), наследственной копропорфирии (HCP), смешанной порфирии (VP), и порфирии вследствие недостаточности ALA-дегидратазы (ADP).
В некоторых вариантах порфирия представляет собой двойную порфирию, например, по меньшей мере, две порфирии. В некоторых вариантах двойная порфирия включает две или более порфирий, выбранных из острой интермиттирующей порфирии (AIP) наследственной копропорфирии (HCP), смешанной порфирии (VP) и порфирии вследствие недостаточности ALA-дегидратазы (ADP).
В некоторых вариантах порфирия представляет собой гомозиготную доминантную печеночную порфирию (например, гомозиготную доминантную AIP, HCP, или VP) или гепатоэритропоэтическую порфирию. В некоторых вариантах порфирия представляет собой AIP, HCP, VP или гепатоэритропоэтическую порфирию или их сочетание (например, двойную порфирию). В некоторых вариантах AIP, HCP или VP являются либо гетерозиготными доминантными, либо гомозиготными доминантными.
В некоторых вариантах субъект подвергается риску развития порфирии, например, ADP, и у него наблюдают повышенный уровень (например, повышенный уровень в моче) ALA и/или копропорфирина III. В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, ADP, и у него наблюдают повышенный уровень Zn-протопорфирина в эритроцитах.
В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, AIP, и у него наблюдают повышенный уровень (например, повышенный уровень в моче) ALA, PBG и/или уропорфирина.
В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, HCP, и у него наблюдают повышенный уровень (например, повышенный уровень в моче) ALA, PBG и/или копропорфирина III. В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, HCP, и у него наблюдают повышенный уровень (например, повышенный уровень в кале) копропорфирина III.
В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, VP, и у него наблюдают повышенный уровень (например, повышенный уровень в моче) ALA, PBG, и/или копропорфирина III.
В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, HCP, и у него наблюдают повышенный уровень (например, повышенный уровень в кале) копропорфирина III и/или протопорфирина.
В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, PCT, (например, гепатоэритропоэтической порфирии), и у него наблюдают повышенный уровень (например, повышенный уровень в моче) уропорфирина и/или 7-карбоксилатпорфирина. В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например, PCT, (например, гепатоэритропоэтической порфирии), и у него наблюдают повышенный уровень (например, повышенный уровень в кале) уропорфирина и/или 7-карбоксилатпорфирина.
Мутация, ассоциированная с порфирией, включает любую мутацию в гене, кодирующую фермент в пути биосинтеза гема (пути порфирина), или в гене, который изменяет экспрессию гена в пути биосинтеза гема. Во многих вариантах субъект несет одну или несколько мутаций в ферменте пути порфирина (например, мутацию ALA-дегидратазы или PBG-дезаминазы). В некоторых вариантах субъект страдает от острой порфирии (например, AIP, порфирии вследствие недостаточности ALA-дегидратазы).
В некоторых случаях пациенты с острой печеночной порфирией (например, AIP), или пациенты, которые несут мутации, ассоциированные с острой печеночной порфирией (например, AIP), но у которых нет симптомов, имеют повышенные уровни ALA и/или PBG по сравнению со здоровыми людьми. См., например, Floderus, Y. et al, Clinical Chemistry, 52(4): 701-707, 2006; Sardh et al., Clinical Pharmacokinetics, 46(4): 335-349, 2007. В таких случаях уровень ALA и/или PBG может быть повышен даже в том случае, когда у пациента нет или никогда не было приступа. В некоторых подобных случаях у пациента совсем нет симптомов. В некоторых подобных случаях пациент страдает от боли, например, нейропатической боли, которая может представлять собой хроническую боль (например, хроническую нейропатическую боль). В некоторых случаях пациент имеет нейропатию. В некоторых случаях пациент имеет прогрессирующую нейропатию.
В некоторых вариантах субъект, подвергаемый лечению согласно способам, описанным в настоящей публикации, имеет повышенный уровень порфирина или предшественника порфирина, например, ALA и/или PBG. Уровни порфирина или предшественника порфирина можно оценить, используя способы, известные в данной области, или способы, описанные в настоящей публикации. Например, способы оценки уровней ALA и PBG в моче и плазме, а также уровней порфирина в моче и плазме описаны в публикациях Floderus, Y. et al, Clinical Chemistry, 52(4): 701-707, 2006; and Sardh et al., Clinical Pharmacokinetics, 46(4): 335-349, 2007, полное содержание которых включено в настоящее описание в полном объеме.
В некоторых вариантах субъектом является животное, которое является моделью порфирии, например, мышиной моделью порфирии (например, мутантная мышь, которая описана в публикации Lindberg с соавторами Nature Genetics, 12: 195-199, 1996). В некоторых вариантах субъектом является человек, например, человек, который имеет порфирию или подвергается риску развития порфирии, которая описана в настоящей публикации. В некоторых вариантах у субъекта в данный момент нет острого приступа порфирии. В некоторых вариантах у субъекта никогда не было приступа. В некоторых вариантах пациент страдает от хронической боли. В некоторых вариантах у пациента имеется повреждение нерва. В некоторых вариантах субъект имеет изменение на ЭМГ и/или изменения в скорости проводимости нерва. В некоторых вариантах у субъекта нет симптомов. В некоторых вариантах субъект подвергается риску развития порфирии (например, несет генную мутацию, ассоциированную с порфирией) и не имеет симптомов. В некоторых вариантах субъект ранее имел острый приступ, но во время лечения не имеет симптомов.
В некоторых вариантах субъект подвергается риску развития порфирии и подвергается профилактическому лечению, чтобы предотвратить развитие порфирии. В некоторых вариантах субъект имеет повышенный уровень порфирина или предшественника порфирина, например, ALA и/или PBG. В некоторых вариантах профилактическое лечение начинается в пубертатный период. В некоторых вариантах лечение снижает уровень (например, уровень в плазме или уровень в моче) порфирина или предшественника порфирина, например, ALA и/или PBG. В некоторых вариантах лечение предотвращает развитие повышенного уровня порфирина или предшественника порфирина, например, ALA и/или PBG. В некоторых вариантах лечение предотвращает развитие или уменьшает частоту или тяжесть симптома, ассоциированного с порфирией, например, боли или повреждения нерва.
В некоторых вариантах уровень порфирина или предшественника порфирина, например, ALA или PBG, повышен, например, в образце плазмы или моче субъекта. В некоторых вариантах уровень порфирина или предшественника порфирина, например, ALA или PBG, у субъекта оценивают на основе абсолютного уровня порфирина или предшественника порфирина, например, ALA или PBG в образце, полученном от субъекта. В некоторых вариантах уровень порфирина или предшественника порфирина, например, ALA или PBG, у субъекта оценивают на основе относительного уровня порфирина или предшественника порфирина, например, ALA или PBG, в образце, полученном от субъекта. В некоторых вариантах относительный уровень определяют по отношению к уровню другого белка или соединения, например, к уровню креатинина в образце, полученном от субъекта. В некоторых вариантах образец представляет собой образец мочи. В некоторых вариантах образец представляет собой образец плазмы. В некоторых вариантах образец представляет собой образец кала.
Повышенный уровень порфирина или предшественника порфирина, например, ALA и/или PBG, может быть установлен, например, в том случае, когда показано, что субъект имеет уровень порфирина или предшественника порфирина, например, ALA и/или PBG (например, уровень ALA и/или PBG в плазме или моче), который превышает или выше или равен эталонному значению. Лечащий врач, компетентный в отношении лечения порфирий может определить, является ли уровень порфирина или предшественника порфирина (например, ALA и/или PBG) повышенным, например, в целях диагностики порфирии или для определения того, подвергается ли субъект риску развития порфирии, например, субъект может быть предрасположен к острому приступу или к патологии, ассоциированной с порфирией, такой как, например, хроническая боль (например, нейропатическая боль) и нейропатия (например, прогрессирующая нейропатия).
В используемом в настоящем описании смысле «эталонное значение» относится к значению, полученному для субъекта в том случае, когда у субъекта нет патологического заболевания, или значению, полученному для нормального или здорового субъекта, или значению для эталонного образца или популяции, например, группы нормальных или здоровых субъектов (например, группы субъектов, которые не несут мутации, ассоциированной с порфирией, и/или группы субъектов, которые не страдают от симптомов, ассоциированных с порфирией).
В некоторых вариантах эталонным значением является значение, полученное до заболевания для того же самого индивидуума. В некоторых вариантах эталонным значением является уровень в эталонном образце или популяции. В некоторых вариантах эталонным значением является среднее или медианное значение в эталонном образце или популяции. В некоторых вариантах эталонным значением является значение, которое на два стандартных отклонения выше среднего значения в эталонном образце или популяции. В некоторых вариантах эталонным значением является значение, которое на 2,5, 3, 3,5, 4, 4,5 или 5 стандартных отклонений выше среднего в эталоннм образце или популяции.
В некоторых вариантах, когда субъект имеет повышенный уровень порфирина или предшественника порфирина, например, ALA и/или PBG, субъект имеет уровень ALA и/или PBG, который, по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% выше, чем эталонное значение. В некоторых вариантах субъект имеет уровень порфирина или предшественника порфирина, например, ALA и/или PBG, который, по меньшей мере, в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз выше, чем эталонное значение.
В некоторых вариантах эталонное значение является верхним пределом эталона. В используемом в настоящем описании смысле «верхний предел эталона» относится к уровню, который является верхним пределом 95% доверительного интервала для эталонного образца или популяции, например, группы нормальных (например, дикого типа) или здоровых индивидуумов, например, индивидуумов, которые не несут генетической мутации, ассоциированной с порфирией, и/или индивидуумов, которые не страдают от порфирии. Соответственно, нижний предел эталона относится к уровню, который является нижним пределом того же 95% доверительного интервала.
В некоторых вариантах, когда субъект имеет повышенный уровень, например, уровень в плазме или уровень в моче, порфирина или предшественника порфирина, например, ALA или PBG, уровень выше или равен 2-кратному, 3-кратному, 4-кратному или 5-кратному эталонному значению, например, верхнему пределу эталона. В некоторых вариантах субъект имеет уровень порфирина или предшественника порфирина, например, ALA или PBG, в моче, которые более чем в 4 раза превышают верхний предел эталона.
В некоторых вариантах эталонным значением является значение, приведенное в публикации Floderus, Y. с соавторами (Clinical Chemistry, 52(4): 701-707, 2006) или Sardh с соавторами (Clinical Pharmacokinetics, 46(4): 335-349, 2007). В некоторых вариантах эталонным значением является значение, приведенное в таблице 1 в публикации Sardh с соавторами.
В некоторых вариантах субъектом является человек, и он имеет уровень PBG в моче, который выше или равен 4,8 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в моче, который превышает или выше или равен примерно 3, 4, 5, 6, 7 или 8 ммоль/моль креатинина.
В некоторых вариантах эталонное значение PBG в плазме равно 0,12 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в плазме, который превышает или выше или равен 0,10 мкмоль/л, 0,12 мкмоль/л, 0,24 мкмоль/л, 0,36 мкмоль/л, 0,48 мкмоль/л или 0,60 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в плазме, который превышает или выше или равен 0,48 мкмоль/л.
В некоторых вариантах эталонное значение PBG в моче равно 1,2 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в моче, который превышает или выше или равен 1,0 ммоль/моль креатинина, 1,2 ммоль/моль креатинина, 2,4 ммоль/моль креатинина, 3,6 ммоль/моль креатинина, 4,8 ммоль/моль креатинина или 6,0 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень PBG в моче, который превышает или выше или равен 4,8 ммоль/моль креатинина.
В некоторых вариантах эталонное значение ALA в плазме равно 0,12 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень ALA в плазме, который превышает или выше или равен 0,10 мкмоль/л, 0,12 мкмоль/л, 0,24 мкмоль/л, 0,36 мкмоль/л, 0,48 мкмоль/л или 0,60 мкмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень ALA в плазме, который превышает или выше или равен 0,48 мкмоль/л.
В некоторых вариантах эталонное значение ALA в моче составляет 3,1 ммоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень ALA в моче, который превышает или выше или равен 2,5 ммоль/моль креатинина, 3,1 ммоль/моль креатинина, 6,2 ммоль/моль креатинина, 9,3 ммоль/моль креатинина, 12,4 ммоль/моль креатинина или 15,5 ммоль/моль креатинина.
В некоторых вариантах эталонное значение порфирина в плазме равно 10 нмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень порфирина в плазме, который превышает или выше или равен 10 нмоль/л. В некоторых вариантах субъектом является человек, и он имеет уровень порфирина в плазме, который превышает или выше или равен 8, 10, 15, 20, 25, 30, 35, 40, 45 или 50 нмоль/л, субъектом является человек, и он имеет уровень порфирина в плазме, который превышает или выше или равен 40 нмоль/л. В некоторых вариантах эталонное значение порфирина в моче составляет 25 мкмоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень порфирина в моче, который превышает или выше или равен 25 мкмоль/моль креатинина. В некоторых вариантах субъектом является человек, и он имеет уровень порфирина в моче, который выше или равен 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, или 80 мкмоль/моль креатинина.
В некоторых вариантах субъект имеет уровень, например, уровень в плазме или уровень в моче порфирина или предшественника порфирина, например, ALA или PBG, который выше чем уровень у 99% индивидуумов в образце от здоровых индивидуумов.
В некоторых вариантах субъект имеет уровень, например, уровень в плазме или уровень в моче ALA или PBG, который на два стандартных отклонения превышает средний уровень в образце от здоровых индивидуумов.
В некоторых вариантах субъект имеет уровень ALA в моче, который в 1,6 или большее число раз превышает средний уровень у нормального субъекта (например, субъекта, который не несет мутацию, ассоциированную с порфирией). В некоторых вариантах субъект имеет уровень ALA в плазме, который в 2 или 3 раза выше среднего уровня у нормального субъекта. В некоторых вариантах субъект имеет уровень PBG в моче, который в четыре или большее число раз превышает средний уровень у нормального субъекта. В некоторых вариантах субъект имеет уровень PBG в плазме, который в четыре или большее число раз превышает средний уровень у нормального субъекта.
В некоторых вариантах способ эффективно снижает уровень порфирина или предшественника порфирина, например, ALA и/или PBG. В некоторых вариантах способ является эффективным в отношении получения предварительно определяемого снижения повышенного уровня порфирина или предшественника порфирина, например, ALA или PBG. В некоторых вариантах предварительно определяемым снижением является уменьшение, по меньшей мере, на 10%, 20%, 30%, 40% или 50%. В некоторых вариантах предварительно определяемым снижением является снижение, которое эффективно предотвращает или ослабляет симптомы, например, боль или рецидивы приступов.
В некоторых вариантах предварительно определяемым снижением является снижение, которое составляет, по меньшей мере, 1, 2, 3 или больше стандартных отклонений, при этом стандартное отклонение определяют на основе значений для эталонного образца, например, эталонного образца, который описан в настоящей публикации.
В некоторых вариантах предварительно определяемым снижением является снижение, которое приводит уровень порфирина или предшественника порфирина к уровню, который меньше эталонного значения, или к уровню, который меньше или равен эталонному значению (например, эталонному значению, которое описано в настоящей публикации).
В некоторых вариантах субъект, подвергаемый лечению согласно описанным способам, страдает от боли, например, хронической боли. В некоторых вариантах субъект имеет порфирию или подвергается риску развития порфирии, например острой печеночной порфирии, например, AIP. В некоторых вариантах способ эффективен в лечении боли, например, благодаря снижению тяжести боли или излечению от боли. В некоторых вариантах способ эффективен в снижении или предотвращении повреждения нервов.
В некоторых вариантах субъект, подвергаемый лечению согласно способам, описанным в настоящей публикации, (a) имеет повышенный уровень ALA и/или PBG, и (b) страдает от боли, например, хронической боли. В некоторых вариантах способ эффективен в снижении повышенного уровня ALA и/или PBG и/или в лечении боли, например, благодаря снижению тяжести боли или излечению от боли.
В некоторых вариантах субъектом является животное, которое служит в качестве модели расстройства, связанного с экспрессией ALAS1.
В некоторых вариантах субъектом является животное, которое служит в качестве модели порфирии (например, генетически модифицированное животное с одной или несколькими мутациями). В некоторых вариантах порфирия представляет собой AIP, и субъектом является животное, представляющее собой модель AIP. В одном таком варианте субъектом является генетически модифицированная мышь, имеющая недостаточность порфобилиногендезаминазы, такая как, например, мышь, описанная в публикации Lindberg с соавторами (Nature Genetics, 12: 195-199, 1996), или гомозиготная R167Q-мышь, описанная в публикации Yasuda, M., Yu, C. Zhang, J., Clavero, S., Edelmann, W., Gan, L., Phillips, J.D., & Desnick, R.J. Acute intermittent porphyria: A severely affected knock-in mouse that mimics the human homozygous dominant phenotype. (Abstract of Presentation on October 14, 2011 at the American Society of Human Genetics; Program No. 1308F; опубликованной он-лайн 4 апреля 2012 на сайте ichg2011.org/cgi-bin/showdetail.pl?absno=21167); обе указанных публикации включены в настоящее описание в полном объеме. Было создано несколько нокин-моделей с мутациями, вызывающими гомозиготную доминантную AIP у человека. Используемые мутации включают, например, R167Q, R173Q и R173W в PBG-дезаминазе. Жизнеспособные гомозиготы содержали R167Q/R176Q и R167Q/R173Q, и в обоих случаях у них наблюдали конститутивно повышенные уровни ALA и PBG, аналогичные фенотипу при гомозиготной доминантной AIP человека; в некоторых вариантах такая жизнеспособная гомозиготная мышиная модель AIP является субъектом.
В одном варианте субъект, которого необходимо лечить согласно способам, описанным в настоящей публикации (например, человек (субъект или пациент)), подвергается риску развития или у которого было диагностировано расстройство, связанное с экспрессией ALAS1, например, порфирии. В некоторых вариантах субъектом является субъект, который страдал от одного или нескольких острых приступов одного или нескольких симптомов порфирии. В других вариантах субъектом является субъект, который хронически страдал от одного или нескольких симптомов порфирии (например, боли, например, нейропатической боли и или нейропатии, например, прогрессирующей нейропатии). В некоторых вариантах субъект несет генетическое изменение (например, мутацию), которая описана в настоящей публикации, но не имеет никаких иных симптомов. В некоторых вариантах субъект ранее подвергался лечению продуктом гема (например, гемином, аргинатом гема или гемальбумином), который описан в настоящей публикации.
В некоторых вариантах субъект (например, субъект с порфирией, такой как, например, AIP), подвергаемый лечению согласно способам, описанным в настоящей публикации, недавно перенес или в настоящее время переживает состояние продрома. В некоторых таких вариантах субъекту проводят комбинированное лечение, например, используя и-РНК, которая описана в настоящей публикации, и одно или несколько дополнительных средств лечения, которые, как известно, эффективны против порфирии (например, глюкозу и/или продукт гема, такой как гемин, который описан в настоящей публикации) или ассоциированных с ней симптомов.
В одном варианте и-РНК, которая описана в настоящей публикации, вводят в сочетании с глюкозой или декстрозой. Например, может быть введено 10-20% декстрозы в физиологическом растворе внутривенно. Обычно, когда вводят глюкозу, ежедневно вводят, по меньшей мере, 300 г 10% глюкозы внутривенно. и-РНК (например, и-РНК в LNP-препарате) также может быть введена внутривенно, в виде части той же процедуры инфузии, которую используют для введения глюкозы или декстрозы, или в виде отдельной инфузии, которую проводят до, одновременно или после введения глюкозы или декстрозы. В некоторых вариантах и-РНК вводят другим путем введения (например, подкожно). В еще одном варианте и-РНК вводят в сочетании с полным парентеральным питанием. и-РНК можно вводить до, одновременно или после введения полного парентерального питания.
В одном варианте и-РНК вводят в сочетании с продуктом гема (например, гемином, аргинатом гема или гемальбумином). В следующем варианте и-РНК вводят в сочетании с продуктом гема и глюкозой, продуктом гема и декстрозой или продуктом гема и полным парентеральным питанием.
«Продром» в используемом в настоящем описании смысле включает любой симптом, который отдельный субъект перенес ранее, непосредственно перед развитием острого приступа. Типичные симптомы продрома включают, например, боль в области живота, тошноту, головные боли, психологические симптомы (например, тревожность), беспокойное состояние и/или бессонницу. В некоторых вариантах субъект претерпевает боль (например, боль в области живота и/или головную боль) во время продрома. В некоторых вариантах субъект чувствует тошноту во время продрома. В некоторых вариантах у субъекта проявляются психологические симптомы (например, тревожность) во время продрома. В некоторых вариантах субъект испытывает беспокойство и/или страдает от бессонницы во время продрома.
Острый «приступ» порфирии заключается в появлении одного или нескольких симптомов порфирии, обычно у пациента, который несет мутацию, ассоциированную с порфирией (например, мутацию в гене, который кодирует фермент в пути порфирина).
В некоторых вариантах введение и-РНК ALAS1 приводит к снижению уровня одного или нескольких порфиринов или предшественников порфиринов, которые описаны в настоящей публикации (например, ALA и/или PBG). Снижение может быть измерено относительно любого подходящего контрольного или эталонного значения. Например, снижение уровня одного или нескольких порфиринов или предшественников порфиринов может быть установлено у отдельного субъекта, например, в виде снижения, по меньшей мере, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или больше по сравнению с уровнем до лечения (например, непосредственно перед лечением). Снижение уровня предшественника порфирина, порфирина или метаболита порфирина можно измерить, используя любой способ, известный в данной области. Например, уровень PBG и/или ALA в моче или плазме можно оценить, используя тест Уотсона-Шварца, ионообменную хроматографию или высокоэффективную жидкостную хроматографию - масс-спектрометрию. См., например, Thunell (1993).
В некоторых вариантах введение ми-РНК ALAS1 эффективно снижает уровень ALA и/или PBG у субъекта. Уровень ALA или PBG у субъекта можно оценить, например, на основе абсолютного уровня ALA или PBG или на основе относительного уровня ALA или PBG (например, относительно уровня другого белка или соединения, например, уровня креатинина) в образце от субъекта. В некоторых вариантах образец представляет собой образец мочи. В некоторых вариантах образец представляет собой образец плазмы.
В некоторых вариантах и-РНК, мишенью которой является ALAS1, вводят в сочетании с одним или несколькими дополнительными средствами лечения, например, с другим средством лечения, которое, как известно, является эффективным в лечении порфирии или симптомов порфирии. Например, другим средством лечения может быть глюкоза (например, глюкоза в/в) или продукт гема (например, гемин, аргинат гема или гемальбумин). Дополнительное средство (средства) лечения можно вводить до, после или одновременно с введением и-РНК.
и-РНК и дополнительное терапевтическое средство можно вводить в сочетании в одной и той же композиции, например, внутривенно, или дополнительное терапевтическое средство можно вводить в виде части отдельной композиции или другим способом, описанным в настоящей публикации.
В некоторых вариантах введение и-РНК или введение и-РНК в сочетании с одним или несколькими дополнительными средствами лечения (например, глюкозой, декстрозой или тому подобным) уменьшает частоту острых приступов (например, за счет предотвращения острых приступов, так чтобы они больше не происходили, или за счет снижения количества приступов, которые происходят в определенный период времени, например, происходит меньшее количество приступов в год). В некоторых таких вариантах и-РНК вводят согласно схеме регулярного введения доз, например, ежедневно, еженедельно, раз в две недели или ежемесячно.
В некоторых вариантах и-РНК вводят после острого приступа порфирии. В некоторых таких вариантах и-РНК находится в композиции, например, в композиции, содержащей липидный препарат, например, LNP-препарат.
В некоторых вариантах и-РНК вводят во время острого приступа порфирии. В некоторых таких вариантах и-РНК находится в композиции, например, в композиции, содержащей липидный препарат (например, LNP-препарат), или в композиции, содержащей GalNAc-конъюгат.
В некоторых вариантах введение ми-РНК ALAS1 является эффективным в снижении тяжести приступа (например, благодаря ослаблению одного или нескольких признаков или симптомов, ассоциированных с приступом). В некоторых вариантах введение ми-РНК ALAS1 является эффективным в уменьшении продолжительности приступа. В некоторых вариантах введение ми-РНК ALAS1 является эффективным в отношении остановки приступа. В некоторых вариантах и-РНК вводят профилактически, чтобы предотвратить острый приступ порфирии. В некоторых таких вариантах и-РНК находится в форме GalNAc-конъюгата, например, в композиции, содержащей GalNAc-конъюгат. В некоторых вариантах профилактическое введение осуществляют до, во время или после воздействия или появления провоцирующего фактора. В некоторых вариантах субъект подвергается риску развития порфирии.
В некоторых вариантах ми-РНК вводят во время продрома. В некоторых вариантах продром характеризуется болью (например, головной болью и/или болью в области живота), тошнотой, психологическими симптомами (например, тревожностью), беспокойным состоянием и/или бессонницей.
В некоторых вариантах ми-РНК вводят во время конкретной фазы менструального цикла, например, во время фазы лютеинизации.
В некоторых вариантах введение ми-РНК ALAS1 эффективно предотвращает приступы (например, рецидивы приступов, которые ассоциированы с продромом и/или с провоцирующим фактором, например, с конкретной фазой менструального цикла, например, фазой лютеинизации). В некоторых вариантах введение ми-РНК ALAS1 эффективно снижает частоту приступов. В некоторых вариантах введение ми-РНК ALAS1 эффективно уменьшает тяжесть приступа (например, благодаря ослаблению одного или нескольких признаков или симптомов, ассоциированных с приступом). В некоторых вариантах введение ми-РНК ALAS1 эффективно уменьшает продолжительность приступа. В некоторых вариантах введение ми-РНК ALAS1 эффективно в отношении остановки приступа.
В некоторых вариантах введение ми-РНК ALAS1 эффективно предотвращает или снижает частоту или тяжесть боли, например, нейропатической боли.
В некоторых вариантах введение ми-РНК ALAS1 эффективно предотвращает или снижает частоту или тяжесть нейропатии.
Эффекты введения ми-РНК ALAS1 могут быть установлены, например, при сравнении с соответствующим контролем. Например, снижение частоты острых приступов, а также снижение уровня одного или нескольких порфиринов или предшественников порфиринов могут быть установлены, например, в группе пациентов с AIP в виде пониженной частоты по сравнению с соответствующей контрольной группой. Контрольная группа (например, группа сходных индивидуумов или такая же группа индивидуумов в перекрестном исследовании) может включать, например, не подвергаемую лечению популяцию, популяцию, которая получала лечение с использованием обычного средства лечения порфирии (например, обычное средство лечения AIP может включать глюкозу, гемин или оба средства); популяцию, которую лечили с использованием плацебо или не направленной к мишени и-РНК, необязательно в сочетании с одним или несколькими обычными средствами лечения порфирии (например, глюкозы, например, в/в-глюкозы) и тому подобными.
Субъектом, подвергаемым «риску» развития порфирии, в используемом в настоящем описании смысле является субъект с порфирией в семейном анамнезе и/или с одним или несколькими рецидивами или хроническими симптомами порфирии и/или субъект, который несет генетическое изменение (например, мутацию) в гене, кодирующем фермент пути биосинтеза гема, и субъект, который несет генетическое изменение, например, мутацию, которая, как известно, ассоциирована с порфирией.
В некоторых вариантах изменение, например, мутация, делает индивидуумов чувствительными к острому приступу (например, при воздействии провоцирующего фактора, например, лекарственного средства, питания или другого провоцирующего фактора, например, провоцирующего фактора, который раскрыт в настоящем описании). В некоторых вариантах изменение, например, мутация, ассоциировано с повышенными уровнями порфирина или предшественника порфирина (например, ALA и/или PBG). В некоторых вариантах изменение, например, мутация, ассоциирована с хронической болью (например, хронической нейропатической болью) и/или нейропатией (например, прогрессирующей нейропатией). В некоторых вариантах изменение, например, мутация, ассоциировано с изменениями в ЭМГ и/или скорости проводимости нерва.
В некоторых вариантах изменением является мутация в гене ALAS1. В некоторых вариантах изменением является мутация в промоторе гена ALAS1 или в областях выше или ниже гена ALAS1. В некоторых вариантах изменением является мутация в факторах транскрипции или других генах, которые взаимодействуют с ALAS1. В некоторых вариантах изменение представляет собой изменение, например, мутацию, в гене, который кодирует фермент пути биосинтеза гема.
В некоторых вариантах субъект имеет генетическое изменение, которое описано в настоящей публикации (например, генетическую мутацию, которая, как известно, ассоциирована с порфирией). В некоторых таких вариантах субъект имеет повышенный уровень (например, уровень в моче или в плазме) ALA и/или PBG. В некоторых таких вариантах субъект не имеет повышенного уровня ALA и/или PBG. В некоторых вариантах субъект имеет генетическое изменение, которое описано в настоящей публикации, и имеет другие симптомы, например, хроническую боль, изменения ЭМГ, изменения скорости проводимости нерва и/или другие симптомы, ассоциированные с порфирией. В некоторых вариантах субъект имеет генетическое изменение, но не страдает от острых приступов.
В некоторых вариантах субъект имеет мутацию, ассоциированную с AIP, HCP, VP или ADP.
В некоторых вариантах порфирия представляет собой AIP. В некоторых таких вариантах субъект имеет изменение, например, по меньшей мере, одну мутацию, в гене PBG-дезаминазы. В данной области известно множество мутаций PBG-дезаминазы, например, мутации, описанные в публикации Hrdinka, M. с соавторами (Physiological Research, 55 (Suppl. 2): S119-136 (2006)). В некоторых вариантах субъект является гетерозиготным по мутации PBG-дезаминазы. В других вариантах субъект является гомозиготным по мутации PBG-дезаминазы. Гомозиготный субъект может нести две идентичные мутации или две разные мутации в гене PBG-дезаминазы.
В некоторых вариантах порфирия представляет собой HCP. В некоторых таких вариантах субъект имеет изменение, например, по меньшей мере, одну мутацию в гене, который кодирует фермент копропорфириноген III-оксидазы.
В некоторых вариантах порфирия представляет собой VP. В некоторых таких вариантах субъект имеет изменение, например, по меньшей мере, одну мутацию в гене, который кодирует протопорфириногеноксидазу.
В некоторых вариантах порфирия представляет собой ADP, например, аутосомно-рецессивную ADP. В некоторых таких вариантах субъект имеет изменение, например, по меньшей мере, одну мутацию, в гене, который кодирует ALA-дегидратазу.
Способы лечения, предлагаемые в настоящем изобретении, могут служить для облегчения одного или нескольких симптомов, ассоциированных с порфирией, снижения частоты приступов, ассоциированных с порфирией, снижения вероятности того, что приступ с проявлением одного или нескольких симптомов, ассоциированных с порфирией, будет возникать при воздействии провоцирующего фактора, или снижения риска развития состояний, ассоциированных с порфирией {например, нейропатии (например, прогрессирующей нейропатии), гепатоклеточного рака). Кроме того, способы, предлагаемые в настоящем изобретении, могут служить для снижения уровня одного или нескольких предшественников порфиринов, порфиринов и/или родственных продуктов или метаболитов порфиринов. Уровень предшественника порфирина или порфирина можно измерить в любом биологическом образце, таком как, например, образец мочи, крови, кали, спинномозговой жидкости или ткани. Образец может находиться в организме субъекта или может быть получен или выделен из организма субъекта. В некоторых вариантах порфирия представляет собой AIP, и уровень PBG и/или ALA снижен. В некоторых вариантах продуктом или метаболитом порфирина является порфобилин, порфобилиноген или уропорфирин. Снижение уровня продукта или метаболита порфирина можно измерить любым способом, известным в данной области. Например, уровень PBG и/или ALA в моче или плазме можно оценить, используя тест Уотсона-Шварца, ионообменную хроматографию или высокоэффективную жидкостную хроматографию - масс-спектрометрию. См., например, Thunell (1993).
Способы, описанные в настоящей публикации, также могут служить для снижения хронически повышенных уровней предшественников порфирина (например, ALA и/или PBG) у субъектов, страдающих от порфирии (например, острой печеночной порфирии, например, AIP), или подвергающихся риску развития порфирии. Способы оценки уровней в плазме и в моче (например, хронически повышенных уровней) предшественников порфиринов включают, например, ВЭЖХ-масс-спектрометрию и ионообменную хроматографию. Уровни предшественников порфиринов могут быть выражены в виде уровня относительно другого белка или соединения, например, креатинина. См., например, Floderus, Y. et al, Clinical Chemistry, 52(4): 701-707, 2006; Sardh et al., Clinical Pharmacokinetics, 46(4): 335-349, 2007.
Термин «провоцирующий фактор» в используемом в настоящем описании смысле относится к эндогенному или экзогенному фактору, который может индуцировать острый приступ в виде одного или нескольких симптомов, ассоциированных с порфирией. Провоцирующие факторы включают голодание (или другие формы пониженной или неадекватной калорийности потребляемой пищи, вследствие жестких диет, занятий бегом на длинные дистанции и т.д.), метаболические стрессы (например, инфекции, хирургическую операцию, международные авиационные перелеты и психологический стресс), эндогенные гормоны (например, прогестерон), курение сигарет, растворимые в липидах чужеродные химические вещества (включая, например, химические вещества, присутствующие в табачном дыму, некоторые лекарственные средства, отпускаемые по рецепту, органические растворители, биоциды, компоненты алкогольных напитков), эндокринные факторы (например, половые гормоны (женщины могут испытывать обострения во время предменструального периода), синтетические эстрогены, прогестероны, стимуляторы овуляции и гормонозаместительную терапию). См., например, Thunell (1993). Обычно провоцирующими факторами являются индуцирующие цитохром P450 лекарственные средства и фенобарбитал.
Симптомы, ассоциированные с порфирией, могут включать боль или спазмы в области живота, головные боли, эффекты, вызванные аномалиями нервной системы и светочувствительность, вызывающая сыпи, нарывы и рубцевание кожи (световой дерматоз). В некоторых вариантах порфирия представляет собой AIP. Симптомы AIP включают симптомы, проявляющиеся в желудочно-кишечном тракте (например, тяжелую и плохо локализуемую боль в области живота, тошноту/рвоту, запор, диарею, непроходимость кишечника), симптомы мочевой системы (дизурию, задержку мочеиспускания/недержание мочи или темную мочу), неврологические симптомы (например, сенсорную нейропатию, моторную нейропатию (например, поражение черепно-мозговых нервов и/или симптомы, приводящие к слабости рук и ног), судороги, нейропатическую боль, прогрессирующую нейропатию, головные боли, нейропсихиатрические симптомы (например, спутанность сознания, тревожность, возбуждение, галлюцинации, истерию, бред, апатию, депрессию, фобии, психоз, бессонницу, сонливость, кому), вовлечение автономной нервной системы (приводящее, например, к сердечно-сосудистым симптомам, таким как тахикардия, гипертония и/или аритмии, а также другим симптомам, таким как, например, повышенные уровни циркулирующего катехоламина, потливость, возбужденное состояние и/или тремор), обезвоживание и электролитные аномалии.
В некоторых вариантах и-РНК, мишенью которой является ALAS1, вводят вместе (например, до, после или одновременно с другим средством лечения, которое может служить для облегчения одного или нескольких указанных выше симптомов. Например, боль в области живота можно лечить, например, наркотическим анальгетиком, судороги можно лечить, например, противосудорожными лекарственными средствами, тошноту/рвоту можно лечить, например, фенотриазинами, и тахикардию/гипертонию можно лечить, например, бета-блокаторами.
Подразумевается, что термин «снижение» (или «повышение») относится к измеряемому изменению, например, статистически значимому изменению. Изменение может составлять, например, изменение, по меньшей мере, на 5%, 10%, 20%, 30%, 40%, 50% или больше (например, снижение (или повышение) относительно эталонного значения, например, эталона, получаемого в том случае когда и-РНК не вводят).
Изобретение, кроме того, относится к применению и-РНК или ее фармацевтической композиции, например, для лечения расстройства, связанного с экспрессией ALAS1, в сочетании с другими фармацевтическими средствами и/или другими способами терапии, например, с известными фармацевтическими средствами и/или известными терапевтическими способами, такими как, например, средства и способы, используемые в настоящее время для лечения расстройства. В одном варианте и-РНК или его фармацевтическую композицию можно вводить вместе с продуктом гема (например, гемином, аргинатом гема или гемальбумином, которые описаны в настоящей публикации,) и/или вместе с внутривенными инфузиями глюкозы. В некоторых вариантах и-РНК или ее фармацевтическую композицию применяют профилактически, например, чтобы предотвратить или ослабить симптомы ожидаемых приступов острой порфирии. Профилактическое применение может быть приурочено к воздействию или ожидаемому воздействию на субъекта провоцирующего фактора. Как описано в настоящей публикации, провоцирующим фактором может быть любой эндогенный или экзогенный фактор, который, как известно, провоцирует острый приступ. Например, предменструальная фаза является эндогенным провоцирующим фактором, а индуцирующее цитохром P450 лекарственное средство является экзогенным провоцирующим фактором.
Эффективное количество лекарственного средства для лечения расстройства, связанного с экспрессией ALAS1 (например, порфирии, такой как AIP) зависит от типа расстройства, подвергаемого лечению, тяжести симптомов, субъекта, подвергаемого лечению, пола, возраста и общего состояния субъекта, способа введения и так далее. В любом конкретном случае соответствующее «эффективное количество» может определить специалист в данной области, используя обычное экспериментирование. Специалист в данной области может контролировать эффективность лечения или профилактики, измеряя любой из таких параметров или любое сочетание параметров. В связи с введением и-РНК, нацеленной на ALAS1, или ее фармацевтической композиции фраза «эффективна против» расстройства, связанного с экспрессией ALAS1, указывает, что введение клинически подходящим способом приводит к полезному эффекту, например, у отдельного пациента или, по меньшей мере, у части пациентов, например, статистически значимой части пациентов. Полезные эффекты включают, например, предотвращение или снижение симптомов или другие эффекты. Например, полезные эффекты включают, например, улучшение (например, снижение тяжести или частоты) симптомов, уменьшение тяжести или частоты приступов, пониженный риск развития ассоциированного заболевания (например, нейропатии (например, прогрессирующей нейропатии), гепатоклеоточного рака), повышенной способности переносить действие провоцирующего фактора, улучшенное качество жизни, снижение экспрессии ALAS1, снижение уровня (например, уровня в плазме или моче) порфирина или предшественника порфирина (например, ALA и/или PBG) или другой эффект, обычно расцениваемый как позитивный лечащими врачами, которым известно лечение конкретного типа расстройства.
Лечебный или профилактический эффект очевиден, когда имеет место улучшение, например, статистически значимое улучшение одного или нескольких параметров патологического состояния, или когда нет ухудшения или развития симптомов, тогда как в ином случае они ожидаются. В качестве примера, благоприятное изменение измеряемого параметра заболевания, по меньшей мере, на 10%, например, по меньшей мере, на 20%, 30%, 40%, 50% или больше может быть показателем эффективного лечения. Об эффективности данного основанного на и-РНК лекарственного средства или препарата данного лекарственного средства также можно судить, используя экспериментальную животную модель такого заболевания, которая известна в данной области. При использовании экспериментальной животной модели эффективность лечения доказана в том случае, когда наблюдают статистически значимое снижение маркера (например, уровня ALA или PBG в плазме или моче) или симптома.
Пациентам можно вводить терапевтическое количество и-РНК. Терапевтическое количество может составлять, например, 0,05-50 мг/кг. Например, терапевтическое количество может составлять 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0 или 2,5, 3,0, 3,5, 4,0, 4,5, 5, 10, 15, 20, 25, 30, 35, 40, 45, или 50 мг/кг днРНК.
В некоторых вариантах и-РНК готовят в виде липидного препарата, например, LNP-препарата, который описан в настоящей публикации. В некоторых таких вариантах терапевтическое количество составляет 0,05-5 мг/кг, например, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 или 5,0 мг/кг днРНК. В некоторых вариантах липидный препарат, например, LNP-препарат, вводят внутривенно.
В некоторых вариантах и-РНК вводят посредством внутривенной инфузии в течение такого периода времени как более чем 5-минутный, 10-минутный, 15-минутный, 20-минутный или 25-минутный период.
В некоторых вариантах и-РНК находится в форме GalNAc-конъюгата, который описан в настоящей публикации. В некоторых таких вариантах терапевтическое количество составляет 0,5-50 мг, например, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 мг/кг днРНК. В некоторых вариантах GalNAc-конъюгат вводят подкожно.
В некоторых вариантах введение повторяют, например, на регулярной основе, например, ежедневно, раз в две недели (т.е. каждые две недели) в течение одного месяца, двух месяцев, трех месяцев, четырех месяцев или дольше. После осуществления начальной схемы лечения средства лечения можно вводить менее часто. Например, после введения раз в две недели в течение трех месяцев введение можно повторять один раз в месяц в течение шести месяцев или года или дольше.
В некоторых вариантах и-РНК-средство вводят в виде двух или большего количества доз. В некоторых вариантах число или количество последующих доз зависит от достижения требуемого эффекта, например, подавления гена ALAS, снижения уровня порфирина или предшественника порфирина (например, ALA и/или PBG) или достижения терапевтического или профилактического эффекта, например, снижения или предотвращения одного или нескольких симптомов, ассоциированных с порфирией (например, боли, например, нейропатической боли), и/или предотвращения приступов или уменьшения частоты и/или тяжести приступов, ассоциированных с порфирией.
В некоторых вариантах и-РНК-средство вводят согласно схеме. Например, и-РНК-средство можно вводить один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю или пять раз в неделю. В некоторых вариантах схема включает в себя введения, разделенные регулярными интервалами, например, ежечасно, каждые четыре часа, каждые шесть часов, каждые восемь часов, каждые двенадцать часов, ежедневно, каждые 2 дня, каждые 3 дня, каждые 4 дня, каждые 5 дней, еженедельно, раз в две недели или ежемесячно. В некоторых вариантах и-РНК-средство вводят еженедельно или раз в две недели, чтобы добиться требуемого эффекта, например, снижения уровня ALA и/или PBG, снижения боли и/или предотвращения острых приступов.
В некоторых вариантах схема включает введения, разделенные короткими интервалами с последующим более длительным периодом времени, в течение которого средство не вводят. Например, схема может включать начальный набор доз, которые вводят в относительно короткий период времени (например, примерно каждые 6 часов, примерно каждые 12 часов, примерно каждые 24 часа, примерно каждые 48 часов или примерно каждые 72 часа) с последующим более длительным периодом времени (например, примерно 1 неделю, примерно 2 недели, примерно 3 недели, примерно 4 недели, примерно 5 недель, примерно 6 недель, примерно 7 недель или примерно 8 недель), в течении которого и-РНК-средство не вводят. В одном варианте и-РНК-средство сначала вводят ежечасно, а позже вводят с более длительным интервалом (например, ежедневно, еженедельно, раз в две недели или ежемесячно). В другом варианте и-РНК-средство сначала вводят ежедневно, а затем вводят с более длительным интервалом (например, еженедельно, раз в две недели или ежемесячно). В некоторых вариантах более длительный интервал увеличивается с течением времени, или его определяют на основе достижения требуемого эффекта. В конкретном варианте и-РНК-средство вводят один раз в день во время острого приступа с последующим еженедельным введением дозы, начиная с восьмого дня введения. В другом конкретном варианте и-РНК-средство вводят через день в течение первой недели с последующим еженедельным введением дозы, начиная с восьмого дня введения.
В одном варианте и-РНК-средство вводят для предотвращения или снижения тяжести или частоты рецидивов приступов, например, циклических приступов, ассоциированных с провоцирующим фактором. В некоторых вариантах провоцирующим фактором является менструальный цикл. В некоторых вариантах и-РНК вводят многократно, например, с регулярными интервалами, чтобы предотвратить или уменьшить тяжесть или частоту рецидивов приступов, например, циклических приступов, ассоциированных с провоцирующим фактором, например, менструальным циклом, например, с конкретной фазой менструального цикла, например, фазой лютеинизации. В некоторых вариантах и-РНК вводят во время конкретной фазы менструального цикла или на основе уровней гормонов у пациента, подвергаемого лечению (например, на основе уровней гормонов, которые ассоциированы с конкретной фазой менструального цикла). В некоторых вариантах и-РНК вводят в один или несколько конкретных дней менструального цикла, например, в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 , 21, 22, 23, 24, 25, 26, 27 или 28 день (или позже в случае субъектов, которые имеют более длительный менструальный цикл). В некоторых вариантах и-РНК вводят во время фазы лютеинизации, например, в один или несколько дней в период от 14 до 28 дня менструального цикла (или позже в случае субъектов, которые имеют менструальный цикл длиннее, чем 28 дней). В некоторых вариантах оценивают овуляцию у субъекта (например, используя тестирование крови или мочи, при котором выявляют гормон, ассоциированный с овуляцией, например, LH), и и-РНК вводят в предварительно определенный интервал времени после овуляции. В некоторых вариантах и-РНК вводят сразу после овуляции. В некоторых вариантах и-РНК вводят через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 дней после овуляции. Любую из указанных схем необязательно можно повторять один или несколько раз. Количество повторений может зависеть от достижения требуемого эффекта, например, подавления гена ALAS1 и/или достижения терапевтического или профилактического эффекта, например, снижения или подавления одного или нескольких симптомов, ассоциированных с порфирией, снижения частоты приступов, ассоциированных с порфирией.
В некоторых вариантах вводят начальную дозу и-РНК-средства и тестируют уровень ALA или PBG, например, через 1-48 часов, например, через 2, 4, 8, 12 или 24 часа после введения начальной дозы. В некоторых вариантах в том случае, если уровень ALA и/или PBG снизился (например, достигнуто предварительно определяемое снижение, например, нормализация) и/или если симптомы, ассоциированные с порфирией (например, боль), улучшились (например, так что у пациента не проявляются симптомы), больше дозу не вводят, тогда как в случае, когда уровень ALA и/или PBG не снизился (например, не было достигнуто предварительно определяемое снижение, например, не произошла нормализация), вводят дополнительную дозу ALA или PBG. В некоторых вариантах дополнительную дозу вводят через 12, 24, 36, 48, 60 или 72 часа после начальной дозы. В некоторых вариантах в том случае, когда начальная доза является неэффективной в снижении уровня ALA и/или PBG, дополнительную дозу модифицируют, например, увеличивают, чтобы добиться требуемого снижения (например, предварительно определяемого снижения, например, нормализации) уровней ALA или PBG.
В некоторых вариантах предварительно определяемое снижение представляет собой снижение, по меньшей мере, на 10%, 20%, 30%, 40% или 50%. В некоторых вариантах предварительно определяемое снижение представляет собой снижение, которое эффективно предотвращает или ослабляет симптомы, например, боль, симптомы продрома или рецидивы приступов.
В некоторых вариантах предварительно определяемое снижение представляет собой снижение, по меньшей мере, на 1, 2, 3 или больше стандартных отклонений, при этом стандартное отклонение определяют на основе значений, полученных для эталонного образца, например, эталонного образца, который описан в настоящей публикации.
В некоторых вариантах предварительно определяемое снижение представляет собой снижение, которое приводит уровень порфирина или предшественника порфирина к уровню, который ниже, или к уровню, который ниже или равен эталонному значению (например, эталонному значению, которое описано в настоящей публикации).
В используемом в настоящем описании смысле термин «нормализация» уровней ALA или PBG (или «нормальный» или «нормализованный» уровень) относится к уровню (например, уровню в моче и/или в плазме) либо ALA, либо PBG, либо обоих, который находится в ожидаемом диапазоне для здорового индивидуума, для индивидуума, у которого нет симптомов (например, индивидуума, который не испытывает боли и/или не страдает от нейропатии), или для индивидуума, который не имеет мутации, ассоциированной с порфирией. Например, в некоторых вариантах нормализованный уровень находится в пределах двух стандартных отклонений от нормального среднего значения. В некоторых вариантах нормализованный уровень находится в пределах нормального эталона, например, в 95% доверительном интервале для соответствующего контрольного образца, например, образца от здоровых индивидуумов или индивидуумов, которые не несут генной мутации, ассоциированной с порфирией. В некоторых вариантах уровень ALA и/или PBG у субъекта (например, уровень ALA и/или PBG в моче и/или плазме) контролируют с определенными интервалами, и дополнительную дозу и-РНК-средства вводят в том случае, когда уровень возрастает выше эталонного значения.
Введение и-РНК может снижать уровни мРНК или белка ALAS1, например, в клетке, ткани, крови, моче или другом отделе организма пациента, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 40%, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80% или, по меньшей мере, на 90% или больше. Введение и-РНК может снижать уровни продуктов, ассоциированных с экспрессией гена ALAS1, например, уровни одного или нескольких порфиринов или предшественников порфиринов (например, уровень of ALA и/или PBG). Введение и-РНК-средства также может ингибировать или предотвращать повышающую регуляцию уровней мРНК или белка ALAS1 во время острого приступа AIP.
Перед введением полной дозы и-РНК пациентам можно вводить меньшую дозу, такую как 5% инфузионной дозы, и контролировать неблагоприятные эффекты, такие как аллергическая реакция или повышенные уровни липидов или давления крови. В другом примере можно контролировать нежелательные эффекты у пациента.
Способы модулирования экспрессии гена ALAS1
В еще одном аспекте изобретение относится к способу модулирования (например, ингибирования или активации) экспрессии гена ALAS1, например, в клетке или в организме субъекта. В некоторых вариантах клетка находится ex vivo, in vitro или in vivo. В некоторых вариантах клеткой является эритроидная клетка или гепатоцит. В некоторых вариантах клетка находится в организме субъекта (например, млекопитающего, такого как, например, человек). В некоторых вариантах субъект (например, человек) подвергается риску или у него диагностировано заболевание, связанное с экспрессией ALAS1, которое описано выше.
В одном варианте способ включает в себя осуществление контакта клетки с и-РНК, которая описана в настоящей публикации, в количестве, эффективном для снижения экспрессии гена ALAS1 в клетке. «Осуществление контакта» в используемом в настоящем описании смысле включает непосредственный контакт клетки, а также опосредованный контакт клетки. Например, клетка в организме субъекта (например, эритроидная клетка или клетка печени, такая как гепатоцит) может быть подвергнута контакту в том случае, когда субъекту вводят (например, внутривенно или подкожно) композицию, содержащую и-РНК.
Экспрессию гена ALAS1 можно оценить на основе уровня экспрессии мРНК ALAS1, белка ALAS1 или уровня параметра, функционально связанного с уровнем экспрессии гена ALAS1 (например, уровня порфирина или частоты или тяжести симптома, связанного с порфирией). В некоторых вариантах экспрессию ALAS1 ингибируют, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 15%, по меньшей мере, на 20%, по меньшей мере, на 25%, по меньшей мере, на 30%, по меньшей мере, на 35%, по меньшей мере, на 40%, по меньшей мере, на 45%, по меньшей мере, на 50%, по меньшей мере, на 55%, по меньшей мере, на 60%, по меньшей мере, на 65%, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90% или, по меньшей мере, на 95%. В некоторых вариантах и-РНК имеет IC50 в диапазоне 0,001-0,01 нМ, 0,001-0,10 нМ, 0,001-1,0 нМ, 0,001-10 нМ, 0,01-0,05 нМ, 0,01-0,50 нМ, 0,02-0,60 нМ, 0,01-1,0 нМ, 0,01-1,5 нМ, 0,01-10 нМ. Значение IC50 может быть нормализовано по сравнению с соответствующим контрольным значением, например, IC50 и-РНК, не нацеленной на данную мишень.
В некоторых вариантах способ включает в себя введение в клетку и-РНК, которая описана в настоящей публикации, и поддерживание клетки в течение периода времени, достаточного для получения распада транскрипта мРНК гена ALAS1, и тем самым, ингибирования экспрессии гена ALAS1 в клетке.
В одном варианте способ включает в себя введение композиции, описанной в настоящей публикации, например, композиции, содержащей и-РНК, мишенью которой является ALAS1, млекопитающему так, чтобы экспрессия гена-мишени ALAS1 снизилась, например, на длительный период времени, например, по меньшей мере, на два, три, четыре дня или больше, например, одну неделю, две недели, три недели или четыре недели или дольше. В некоторых вариантах снижение экспрессии ALAS1 выявляют в пределах 1 часа, 2 часов, 4 часов, 8 часов, 12 часов или 24 часов после первого введения.
В другом варианте способ включает в себя введение композиции, которая описана в настоящей публикации, млекопитающему, так что экспрессия гена-мишени ALAS1 увеличивается, например, по меньшей мере, на 10% по сравнению с животным, не подвергаемым лечению. В некоторых вариантах активация ALAS1 происходит в течение длительного периода, например, по меньшей мере, два, три, четыре дня или больше, например, одну неделю, две недели, три недели, четыре недели или больше. Не имея намерения быть связанными с какой-либо теорией, полагают, что и-РНК может активировать экспрессию ALAS1 за счет стабилизации транскрипта мРНК ALAS1, взаимодействия с промотором в геноме и/или ингибирования ингибитора экспрессии ALAS1.
и-РНК, применимые в способах и композициях, охарактеризованных в изобретении, специфично целенаправленно действуют на РНК (первичную или процессированную) гена ALAS1. Композиции и способы ингибирования экспрессии гена ALAS1 с использованием и-РНК могут быть получены и осуществлены в соответствии с описанием, приведенным в настоящей публикации.
В одном варианте способ включает в себя введение композиции, содержащей и-РНК, при этом и-РНК содержит нуклеотидную последовательность, которая комплементарна, по меньшей мере, части РНК-транскрипта гена ALAS1 млекопитающего, подвергаемого лечению. В том случае, когда организмом, подвергаемым лечению, является млекопитающее, такое как человек, композицию можно вводить любыми способами, известными в данной области, включая без ограничения пероральный, внутрибрюшинный или парентеральный пути, включая внутричерепное (например, внутрижелудочковое, интрапаренхимальное и интратекальное), внутривенное, внутримышечное, подкожное, трансдермальное введение, введение через дыхательные пути (аэрозольное), назальное, ректальное и местное (включая буккальное и подъязычное) введение.
В некоторых вариантах композиции вводят путем внутривенной инфузии или инъекции. В некоторых таких вариантах композиции содержат приготовленную в липидном препарате ми-РНК (например, LNP-препарат, такой как LNP11-препарат) для внутривенной инфузии. В конкретных вариантах такие композиции можно использовать для лечения острых приступов порфирии и/или для профилактики (например, для снижения тяжести или частоты приступов).
В других вариантах композиции вводят подкожно. В некоторых таких вариантах композиции содержат и-РНК, конъюгированную с GalNAc-лигандом. В конкретных вариантах такие композиции можно использовать для лечения острых приступов порфирии или для профилактики (например, для снижения тяжести или частоты приступов).
Способы снижения уровня порфирина или предшественника порфирина
В другом аспекте изобретение относится к способу снижения уровня порфирина или предшественника порфирина, например, в клетке или в организме субъекта.
В некоторых вариантах клетка находится ex vivo, in vitro или in vivo. В некоторых вариантах клеткой является эритроидная клетка или гепатоцит. В некоторых вариантах клетка представляет собой гепатоцит. В некоторых вариантах клетка находится в организме субъекта (например, млекопитающего, такого как, например, человек).
В некоторых вариантах субъект (например, человек) подвергается риску или у него диагностирована порфирия, которая описана в настоящей публикации. В некоторых вариантах способ является эффективным для лечения порфирии, которая описана в настоящей публикации (например, благодаря ослаблению одного или нескольких симптомов, ассоциированных с порфирией, снижению частоты приступов, ассоциированных с порфирией, уменьшению вероятности того, что приступ одного или нескольких симптомов, ассоциированных с порфирией, будет происходить после воздействия провоцирующего условия или снижению риска развития состояний ассоциированных с порфирией (например, нейропатии (например, прогрессирующей нейропатии), гепатоклеточного рака). В одном варианте способ включает в себя осуществление контакта клетки с РНК-и, которая описана в настоящей публикации, в количестве, достаточном для снижения уровня порфирина или предшественника порфирина (например, ALA или PBG) в данной клетке или в другой связанной клетке или группе клеток или в организме субъекта. «Осуществление контакта» в используемом в настоящем описании смысле относится к непосредственному контакту клетки, а также опосредованному контакту клетки. Например, клетка в организме субъекта (например, эритроидная клетка или клетка печени, такая как гепатоцит) может быть подвергнута контакту в том случае, когда субъекту вводят (например, внутривенно или подкожно) композицию, содержащую и-РНК. «Другая связанная клетка или группа клеток» в используемом в настоящем описании смысле включает любую клетку или группу клеток, в которых уровень порфирина или предшественника порфирина снижается в результате контакта. Например, клетка может быть частью ткани, присутствующей в организме субъекта (например, клетка печени, присутствующая в организме субъекта), и контактирование клетки в организме субъекта (например, контактирование одной или нескольких клеток печени, присутствующих в организме субъекта) с РНК-и может приводить к снижению уровня порфирина или предшественник порфирина в другой связанной клетке или группе клеток (например, в нервных клетках субъекта) или в ткани или жидкости в организме субъекта (например, в моче, крови, плазме или спинномозговой жидкости субъекта).
В некоторых вариантах порфирин или предшественник порфирина выбран из группы, состоящей из δ-аминолевулиновой кислоты (ALA), порфопилиногена (PBG), гидроксиметилбилана (HMB), уропорфириногена III, копропорфириногена III, протопорфириногена IX и протопорфирина IX. В некоторых вариантах предшественником порфирина является ALA. В некоторых вариантах предшественником порфирина является PBG. В некоторых вариантах способ снижает уровень ALA и PBG. Уровень порфирина или предшественника порфирина можно измерить как описано в настоящей публикации и как известно в данной области.
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно подразумевает специалист в той области, к которой относится изобретение. Хотя при практическом осуществлении или тестировании и-РНК и способов, охарактеризованных в изобретении, могут быть использованы способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящей публикации, подходящие способы и материалы описаны ниже. Все публикации, заявки на выдачу патентов, патенты и другие ссылки, приведенные в настоящем описании, включены в виде ссылки в полном объеме. В случае конфликта настоящее описание, включая определение, будет проверено. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения объема изобретения.
ПРИМЕРЫ
Пример 1. Синтез ми-РНК
Источник реагентов
В том случае, когда источник реагента специально не указан в настоящем описании, такой реагент может быть получен от любого поставщика реагентов для молекулярной биологии в соответствии со стандартом качества/чистоты для применения в молекулярной биологии.
Синтез олигонуклеотидов.
Все олигонуклеотиды синтезировали на синтезаторе AKTAoligopilot. Для синтеза олигонуклеотидов использовали твердую подложку из стекла с контролируемым размером пор (dT-CPG, 500A, Prime Synthesis) и РНК-фосфорамидиты со стандартными защитными группами, 5'-O-диметокситритил-N6-бензоил-2'-трет- бутилдиметилсилиладенозин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидит, 5'-O-диметокситритил-N4-ацетил-2'-трет-бутилдиметилсилилцитидин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидит, 5'-O-диметокситритил-N2-изобутирил-2'-трет-бутилдиметилсилилгуанозин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидит и 5'-O-диметокситритил-2'-трет- бутилдиметилсилилуридин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидит (Pierce Nucleic Acids Technologies). 2'-F-фосфорамидиты, 5'-O-диметокситритил-N4-ацетил-2'-фторцитидин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидит и 5'-O-диметокситритил-2'-фторуридин-3'-O-N,N'-диизопропил-2-цианоэтилфосфорамидит приобретали из (Promega). Все фосфорамидиты использовали в концентрации 0,2 М в ацетонитриле (CH3CN), за исключением гуанозина, который использовали в концентрации 0,2 М в 10% ТГФ/ANC (об./об.). Использовали время связывания/рециклинга, равное 16 минутам. Активатором был 5-этилтиотетразол (0,75 М, American International Chemicals); для PO-окисления использовали йод/воду/пиридин, и для PS-окисления использовали PADS (2%) в 2,6-лутидине/ACN (1:1 об./об.).
3'-конъюгированные с лигандом нити синтезировали, используя твердую подложку, содержащую соответствующий лиганд. Например, введение холестериновой единицы в последовательность осуществляли из гидроксипролинолхолестеринфосфорамидита. Холестерин связывали с транс-4-гидроксипролинолом 6-аминогексаноатной связью, получая остаток гидроксипролинолхолестерина. и-РНК, меченые на 5'-конце с использованием Cy-3 и Cy-5.5 (флуорофор), которые были синтезированы из соответствующего фосфорамидита Quasar-570 (Cy-3), приобретали из Biosearch Technologies. Конъюгацию лигандов с 5'-концом и/или внутренним положением осуществляли, используя соответствующим образом защищенный строительный блок лиганд-фосфорамидит. Осуществляли длительное 15-минутное связывание 0,1 М раствора фосфорамидита в безводном CH3CN в присутствии активатора 5-(этилтио)-1H-тетразола со связанным с твердой подложкой олигонуклеотидом. Окисление межнуклеотидного фосфита до фосфата осуществляли, используя стандартный раствор йод-вода, как сообщается в публикации (1), или путем обработки смесью трет-бутилгидропероксид/ацетонитрил/вода (10:87:3) c 10-минутным периодом ожидания окисления конъюгированного олигонуклеотида. Фосфоротиоат вводили посредством окисления фосфита в фосфоротиоат с использованием реагента для переноса атома серы, такого как DDTT (приобретенного из AM Chemicals), PADS и/или реагента Бокажа. Холестеринфосфорамидит синтезировали самостоятельно и использовали в концентрации 0,1 М в дихлорметане. Время связывания холестеринфосфорамидита составляло 16 минут.
Удаление защиты I (удаление защиты нуклеотидного основания)
После завершения синтеза подложку переносили в стеклянный флакон объемом 100 мл (VWR). Олигонуклеотид отщепляли от подложки с одновременным удалением защиты основания и фосфатных групп с использованием 80 мл смеси этанольного раствора аммиака [аммиак:этанол (3:1)] в течение 6,5 часов при 55°C. Флакон недолго охлаждали на льду и затем этанольный раствор аммиака фильтровали в новый флакон объемом 250 мл. CPG промывали 2 частями по 40 мл смеси этанол/вода (1:1 об./об.). Затем объем смеси уменьшали до ~ 30 мл в роторном испарителе. Затем смесь замораживали, используя сухой лед, и сушили в вакууме на Speed vac.
Удаление защиты II (удаление группы 2'-TBDMS)
Высушенный остаток ресуспендировали в 26 мл триэтиламина, тригидрофторида триэтиламина (TEA⋅3HF) или пиридина-HF и ДМСО (3:4:6) и нагревали при 60°C в течение 90 минут, чтобы удалить группы трет-бутилдиметилсилила (TBDMS) в 2'-положении. Затем реакцию гасили, используя 50 мл 20 мМ ацетата натрия, и pH доводили до 6,5. Олигонуклеотид хранили в морозильной камере вплоть до очистки.
Анализ
Олигонуклеотиды анализировали высокоэффективной жидкостной хроматографией (ВЭЖХ) перед очисткой, и выбор буфера и колонки при этом зависит от природы последовательности и/или конъюгируемого лиганда.
Очистка с использованием ВЭЖХ
Конъюгированные с лигандом олигонуклеотиды очищали обращено-фазовой препаративной ВЭЖХ. Неконъюгированные олигонуклеотиды очищали анионообменной ВЭЖХ на колонке с гелем TSK, упакованной своими силами. Буферы представляли собой 20 мМ фосфат натрия (pH 8,5) в 10% CH3CN (буфер A) и 20 мМ фосфат натрия (pH 8,5) в 10% CH3CN, 1 М NaBr (буфер B). Фракции, содержащие полноразмерные олигонуклеотиды, объединяли, обессоливали и лиофилизировали. Примерно 0,15 OD обессоленных олигонуклеотидов разбавляли в воде до 150 мкл и затем пипеткой переносили в специальные флаконы для КГЭ и ЖХ-МС-анализа. Затем соединения анализировали, используя ЖХ-ESMS и КГЭ.
Получение ми-РНК
Для обычного получения ми-РНК эквимолярные количества смысловой и антисмысловой нитей нагревали в 1 x PBS при 95°C в течение 5 минут и медленно охлаждали до комнатной температуры. Целостность дуплекса подтверждали в ВЭЖХ-анализе.
Последовательности нуклеиновых кислот представлены ниже с использованием стандартной номенклатуры и специальных сокращений, указанных в таблице 1.
Таблица 1
Сокращенные обозначения нуклеотидных мономеров, используемые для представления последовательностей нуклеиновых кислот. Будет понятно, что такие мономеры, в том случае, когда они присутствуют в олигонуклеотиде, связаны друг с другом 5'-3'-фосфодиэфирными связями.
Пример 2. Конструирование и синтез ми-РНК ALAS1
Экспериментальные способы
Биоинформатика
Транскрипты
Осуществляли конструирование ми-РНК, чтобы идентифицировать ми-РНК, мишенью которых являются транскрипты ALAS1 человека, макака-резус (Macaca mulatto), мыши и крысы, описанные в базе данных о генах NCBI (http://www.ncbi.nlm.nih.gov/gene/). Для конструирования использовали следующие транскрипты из коллекции NCBI RefSeq: человек - NM_000688.4 (См. фиг. 3), NM_199166,1; резус - XM_001090440.2, XM_001090675.2; мышь - NM_020559.2; крыса - NM_024484.2. Вследствие высокой дивергенции последовательностей высших приматов/грызунов дуплексы ми-РНК конструировали несколькими отдельными партиями, включая без ограничения партии, содержащие дуплексы, соответствующие только транскриптам человека и макака-резус; только транскриптам человека, макака-резус, мыши и крысы; и только транскриптам мыши и крысы. Было сконструировано большинство дуплексов ми-РНК, которые имели 100% идентичность с указанным транскриптом человека и транскриптами других видов, предполагаемыми в каждой конструируемой партии (выше). В некоторых случаях (См. таблицу 8) были допустимы ошибочные спаривания между дуплексом и мРНК-мишенью в первом антисмысловом (последнем смысловом) положении, когда комплементарной парой оснований антисмысловая нить:мРНК-мишень была пара GC или CG. В указанных случаях конструировали дуплексы с парами UA или AU в паре первого антисмыслового:последнего смыслового положения. Таким образом, дуплексы сохраняли комплементарность, но имели несовпадения по отношению к мишени (U:C, U:G, A:C или A:G). Сконструировали восемнадцать таких дуплексов «с подстановкой UA» в виде части набора дуплексов человек/макак-резус/мышь/крыса (См. дуплексы в таблице 8 с пометкой «C19U», «G19U», «C19A» или «G19A» в колонке «Положение»).
Конструирование, прогноз специфичности и эффективности ми-РНК
Предположительную специфичность всех возможных 19-меров прогнозировали на основании каждой последовательности. Затем отбирали такие 19-мерные последовательности-кандидаты, в которых не было повторов длиннее 7 нуклеотидов. Такие выбранные для исследования 1510 ми-РНК человека/макака-резус, 114 ми-РНК человека/макака-резус/мыши/крысы и 717 ми-РНК мыши/крысы использовали в широких поисках против соответствующих транскриптомов (определяемых как набор данных NM_ и XM_ в наборах последовательностей NCBI Refseq человека, макака-резус, собаки, мыши или крысы) с помощью алгоритма полного «грубого перебора» вариантов, воплощенного в «BruteForce.py» с использованием скрипта Ppython. Скрипт подробно анализирует выравнивания олигомерных транскриптов, чтобы получить оценку на основании положения и количества несовпадений между ми-РНК и любым возможным транскриптом «вне мишени». Оценка вне мишени взвешивается, чтобы подчеркнуть отличия в области «затравки» ми-РНК, в положениях 2-9 от 5'-конца молекулы. Для каждой пары олиго-транскриптов, полученной в результате поиска с помощью «грубого перебора» вариантов, была дана оценка несовпадений посредством суммирования оценок отдельных несовпадений; несовпадения в положении 2-9 оценивали как 2,8, несовпадения положениях сайта расщепления 10-11 оценивали как 1,2, и несовпадения в области 12-19 оценивали как 1,0. Дополнительный прогноз вне мишени осуществляли путем сравнения частоты гептамеров и октомеров, полученных из 3 отдельных происходящих из затравки гексамеров каждого олигонуклеотида. Гексамеры из положений 2-7 относительно 5'-старта использовали для создания 2 гептамеров и одного октомера. Авторы создали «гептамер1», добавляя 3'-A к гексамеру; авторы создали гептамер2, добавляя 5'-A к гексамеру; авторы создали октомер, добавляя A как к 5'-, так и к 3'-концу гексамера. Предварительно вычисляли частоту октомеров и гептамеров в 3'UTRome человека, макака-резус, мыши или крысы (определяемым, как подпоследовательность транскриптома из базы данных NCBI Refseq, где конец кодирующей области «CDS» ясно определен). Частоту октомера нормализовали по отношению к частоте гептамеров, используя медианное значение из диапазоне частот октомера. Затем вычисляли «mirSeedScore», определяя сумму ((3 X нормализованная оценка октомера) + (2 X оценка гептамера2) + (1 X оценка гептамера1)).
Обе нити ми-РНК относили к определенной категории специфичности в соответствии с рассчитанными оценками в баллах: оценка выше 3 расценивается как высоко специфичная, равная 3 как специфичная и от 2,2 до 2,8 как умеренно специфичная. Авторы осуществляли сортировку по специфичности антисмысловой нити. Затем авторы отбирали дуплексы, в антисмысловых олигонуклеотидах, в которых отсутствовали GC в первом положении, отсутствовал G в обоих положениях 13 и 14, и которые имели 3 или больше Us или As в области затравки (характеристики дуплексов с высокой прогнозируемой эффективностью).
GalNac-конъюгированные дуплексы-кандидаты длиной 21 и 23 нуклеотида в смысловой и антисмысловой нитях, соответственно, конструировали, удлиняя антисмысловые 19-меры на 4 дополнительных нуклеотида в 3'-направлении (сохраняя точную комплементарность с транскриптом-мишенью). Смысловую нить определяли как обратный комплемент первых 21 нуклеотидов антисмыслового 23-мера. Отбирали дуплексы, которые сохраняли превосходные совпадения со всеми транскриптами выбранных видов на протяжении всех 23 нуклеотидов.
Отбор последовательностей ми-РНК
В общей сложности 90 смысловых и 90 антисмысловых, полученных для человека/макака-резус, 40 смысловых и 40 антисмысловых, полученных для человека/макака-резус/мыши/мыши/крысы, и 40 смысловых и 40 антисмысловых, полученных для мыши/крысы, 19-мерных олигомеров ми-РНК были синтезированы и сформированы в виде дуплексов. Всего синтезировали 45 смысловых и 45 антисмысловых полученных для человека/макака-резус 21/23-мерных олигонуклеотидов для получения 45 GalNac-конъюгированных дуплексов. Последовательности смысловых и антисмысловых нитей модифицированных дуплексов показаны в таблице 2, и последовательности смысловых и антисмысловых нитей немодифицированных дуплексов показаны в таблице 3.
Синтез последовательностей ALAS1
Последовательности ALAS1 синтезировали на синтезаторе MerMade 192 в масштабе либо 1, либо 0,2 мкмоль. Отдельные нити получали с 2'-O-метил-модификациями для скрининга in vitro с использованием реагентов для трансфекции. 3'-GalNAc-конъюгаты получали с использованием последовательностей, содержащих 2'-F- и 2'-O-метил-модификации в смысловой нити в 21-23-мерных конструкциях для свободного захвата клетками. В случае всех 21-мерных последовательностей в списке, применяли химию «endolight» («с ограниченной модификацией»), которая подробно описана ниже.
- Все пиримидины (цитозин и уридин) в смысловой нити содержали 2'-O-метил-основания (2'-O-метил-C и 2'-O-метил-U).
- В антисмысловой нити пиримидины, лежащие рядом (по направлению к 5'-положению) с рибо-A-нуклеозидом заменяли соответствующими им 2-O-метил-нуклеозидами.
- Вводили удлинение на два основания dTsdT на 3'-конце обеих смысловой и антисмысловой последовательностей.
- Файл с последовательностями преобразовывали в текстовый файл, чтобы сделать его совместимым в случае загрузки в программное обеспечение для синтеза MerMade 192.
В случае GalNAc-конъюгированных смысловых нитей и комплементарных антисмысловых последовательностей 2'F- и другие модифицированные нуклеозиды вводили в сочетании с 2'O-метил-рибонуклеозидами. Синтез осуществляли на GalNAc-модифицированной подложке на CPG в случае смысловой нити и на CPG, модифицированном универсальным носителем, в случае антисмысловой последовательности.
Синтез, отщепление и удаление защиты:
Для синтеза последовательностей ALAS1 использовали синтез олигонуклеотидов на твердой подложке с применением химии фосфорамидитов. Для 21-мерных последовательностей с ограниченной модификацией использовали дезокситимидин-CPG в качестве твердой подложки, тогда как в случае GalNAc-конъюгатов использовали GalNAc-твердую подложку для смысловой нити и универсальную CPG-подложку для антисмысловой нити.
Синтез указанных выше последовательностей осуществляли в масштабе либо 1, либо 0,2 мкмоль в 96-луночных планшетах. Растворы амидитов готовили в концентрации 0,1 М и использовали этилтиотетразол (0,6 М в ацетонитриле) в качестве активатора.
Синтезированные последовательности отщепляли и осуществляли удаление защиты в 96-луночных планшетах, используя метиламин на первой стадии и фторидный реагент на второй стадии. В случае последовательностей, содержащих GalNAc и 2'F-нуклеозиды, условия удаления защиты модифицировали. Последовательности после отщепления и удаления защиты преципитировали, используя смесь ацетон:этанол (80:20) и осадок ресуспендировали в 0,2 М натрий-ацетатном буфере. Образцы каждой последовательности анализировали, используя ЖХ-МС, чтобы подтвердить идентичность, используя УФ для количественной оценки, отобранный набор образцов анализировали, используя IEX-хроматографию, чтобы определить чистоту.
Очистка и обессоливание:
Последовательности ALAS1 преципитировали и очищали с помощью системы AKTA Purifier, используя колонку с сефадексом. Последовательности ALAS1 прогоняли при комнатной температуре. Инъекцию и сбор образцом осуществляли в 96-луночных планшетах (с глубиной лунок 1,8 мл). В элюенте собирали один пик, соответствующий полноразмерной последовательности. Обессоленные последовательности ALAS1 анализировали в отношении концентрации (используя УФ-измерения при A260) и чистоты (используя ионообменную ВЭЖХ). Затем отдельные комплементарные нити объединяли в стехиометрическом соотношении 1:1 с образованием дуплексов ми-РНК.
Отдельные модифицированные нити ALAS1 человека и последовательности дуплексов
(5'-3')
Отдельные немодифицированные нити ALAS1 человека и последовательности дуплексов
Пример 3. Скрининг дуплексов ми-РНК ALAS1 in vitro в отношении активности в нокдауне ALAS1.
Дуплексы ми-РНК ALAS1 подвергали скринингу в отношении их способности вызывать нокдаун экспрессии ALAS1 in vitro.
Скрининг in vitro
Культура клеток и трансфекции
Клетки Hep3B (ATCC, Manassas, VA) выращивали почти до слияния при 37°C в атмосфере 5% CO2 в MEM (ATCC) с добавлением 10% FBS, затем снимали с планшета обработкой трипсином. Трансфекцию осуществляли, добавляя 14,8 мкл Opti-MEM плюс 0,2 мкл липофектамина RNAiMax на лунку (Invitrogen, Carlsbad CA, № в каталоге 13778-150) к 5 мкл дуплексов ми-РНК на лунку в 96-луночный планшет и инкубировали при комнатной температуре в течение 15 минут. Затем к смеси ми-РНК добавляли 80 мкл полной ростовой среды, содержащей ~2×104 клеток Hep3B. Клетки инкубировали либо в течение 24 часов, либо в течение 120 часов до очистки РНК. Эксперименты с одной дозой осуществляли с использованием конечной концентрации дуплекса 10 нМ и 0,1 нМ, а эксперименты по определению зависимости доза-ответ осуществляли, используя конечную концентрацию дуплекса 10, 1,67, 0,27, 0,046, 0,0077, 0,0013, 0,00021, 0,00004 нМ.
Выделение суммарной РНК с использованием набора для выделения мРНК DYNABEADS (Invitrogen, серия №: 610-12)
Клетки собирали и лизировали в 150 мкл буфера для лизиса/связывания, затем перемешивали в течение 5 минут при 850 об./мин, используя термомиксер Eppendorf (скорость перемешивания была одинаковой на протяжении всего процесса). Добавляли десять микролитров магнитных шариков и 80 мкл буфера для лизиса/связывания в лунки планшета с круглым дном и перемешивали в течение 1 минуты. Магнитные шарики улавливали, используя магнитную подставку, и надосадок удаляли, не нарушая шарики. После удаления надосадка к оставшимся шарикам добавляли лизированные клетки и перемешивали в течение 5 минут. После удаления надосадка магнитные шарики промывали 2 раза, используя 150 мкл буфера для промывки A, и перемешивали в течение 1 минуты. Шарики снова улавливали и надосадок удаляли. Затем шарики промывали, используя 150 мкл буфера для промывки B, улавливали и надосадок удаляли. Шарики снова промывали 150 мкл буфера для элюирования, улавливали и надосадок удаляли. Шарикам давали возможность высохнуть в течение 2 минут. После сушки добавляли 50 мкл буфера для элюирования и перемешивали в течение 5 минут при 70°C. Шарики улавливали на магните в течение 5 минут. 40 мкл надосадка извлекали и добавляли в другой 96-луночный планшет.
Синтез кДНК с использованием набора для высокопроизводительной обратной транскрипции кДНК ABI (Applied Biosystems, Foster City, CA, № в каталоге 4368813)
Маточную смесь, состоящую из 2 мкл 10X буфера, 0,8 мкл 25X dNTP, 2 мкл случайных праймеров, 1 мкл обратной транскриптазы, 1 мкл ингибитора РНКаз и 3,2 мкл H2O на реакцию, добавляли к 10 мкл суммарной РНК. кДНК получали, используя термоциклер Bio-Rad C-1000 или S-1000 (Hercules, CA), выполняя следующие стадии: 25°C 10 минут, 37°C 120 минут, 85°C 5 секунд, 4°C - хранение.
ПЦР в реальном времени
2 мкл кДНК добавляли к маточной смеси, содержащей 0,5 мкл зонда GAPDH TaqMan (Applied Biosystems, № в каталоге 4326317E), 0,5 мкл зонда ALAS1 TaqMan (Applied Biosystems, № в каталоге Hs00167441_m1) и 5 мкл маточной смеси зонда Lightcycler 480 (Roche, № в каталоге 04887301001), на лунку в 384-луночный планшет (Roche, № в каталоге 04887301001). ПЦР в реальном времени осуществляли в системе для ПЦР в реальном времени Roche LC480 (Roche), используя анализ ΔΔCt(RQ). Каждый дуплекс тестировали, используя две независимых трансфекции с двумя биологическими повторами в каждом случае, и каждую трансфекцию анализировали в двух повторах, если не указано иное в сводных таблицах.
Чтобы вычислить относительное кратное изменение, данные, полученные в реальном времени, анализировали, используя способ ΔΔCt, и нормализовали по отношению к данным анализов, осуществляемых с использованием клеток, трансфицированных 10 нм AD-1955, или ложно трансфицированных клеток. IC50 вычисляли с помощью модели подгонки по 4 параметрам, используя XLFit, и нормализовали по отношению к клеткам, трансфицированным AD-1955, или наивным клеткам в том же диапазоне доз или по отношению к собственной наименьшей дозе.
Нокдаун in vitro эндогенной экспрессии ALAS1 дуплексами ми-РНК ALAS1
Таблица 4 иллюстрирует нокдаун ALAS1 в клетках Hep3B под действием дуплексов модифицированных ми-РНК ALAS1 (См. таблицу 2). Сайленсинг выражали в виде доли оставшейся матричной РНК относительно негативной (люцифераза) контрольной ми-РНК AD- 1955. Данные получали, как описано выше, после трансфекции 10 нМ или 0,1 нМ каждой ми-РНК. кПЦР осуществляли, используя зонд ALAS1 TaqMan Hs00167441_m1.
Экспрессия ALAS1 в клетках Hep3B после трансфекции ми-РНК ALAS1
IC50 выбранных дуплексов ми-РНК ALAS1 в скрининге in vitro
Таблица 5 иллюстрирует значения IC50 выбранных дуплексов ми-РНК ALAS1, определенные на основании нокдауна эндогенно экспрессируемого ALAS1 в линии клеток Hep3B дуплексами модифицированной ми-РНК ALAS1 (См. таблицу 2). Данные получали, как описано выше, через 24 или 120 часов после трансфекции каждым дуплексом ми-РНК. Сайленсинг ALAS1 выражали в виде доли оставшейся мРНК относительно ми-РНК AD-1955, т.е. ми-РНК, не неправленой к мишени, которую использовали в качестве негативного контроля. Данные из экспериментов по трансфекции с повторами использовали для подгонки к одной линии, чтобы определить IC50. Несколько дуплексов (например, AD-53541.1, AD-53542.1 и AD-53547.1) имели низкие IC50 примерно до 0,03 нМ во временной точке 24 часа. Множество дуплексов имели IC50 меньше 0,1 нМ (например, AD-53534.1, AD-53536.1, AD-53540.1, AD-53541.1, AD-53542.1, AD-53547.1, AD-53548.1, AD-53550.1, AD-53552.1) во временной точке 24 часа, и некоторые из них также имели IC50 меньше 0,1 нМ (например, AD-53534.1, AD-53540.1, AD-53541.1, AD-53542.1, AD-53547.1, AD-53552.1) во временной точке 120 часа.
IC50 выбранных дуплексов ми-РНК ALAS1, нормализованные по отношению к AD-1955
Пример 4. Сайленсинг in vivo с использованием ми-РНК ALAS1 мыши/крысы, приготовленной в виде LNP
Последовательности модифицированного дуплекса AD-53558 показаны в таблице 6 ниже.
Последовательности дуплекса ми-РНК ALAS1 AD-53558.4
Такой дуплекс готовили в виде препарата LNP11 (См. таблицу 10 выше). Приготовленную в виде LNP-препарата ми-РНК AD-53558 тестировали in vivo у мышей (N=25 животных; 5 животных на группу) и крыс (N=20 животных; 4 животных на группу) и был подтвержден сайленсинг мРНК ALAS1 in vivo. Результаты показаны на фиг. 5 и фиг. 6.
На фиг. 5 показано, что ми-РНК оказывала зависимый от дозы эффект у мышей. Экспрессия мышиной мРНК ALAS1 (mALAS1) снижалась примерно на 78% при введении ми-РНК в дозе 1 мг/кг; количество мышиной мРНК ALAS1 снижалось примерно на 60% при введении ми-РНК в дозе 0,3 мг/кг; и количество мышиной мРНК ALAS1 снижалось примерно на 49% при введении ми-РНК в дозе 0,1 мг/кг. Указанные снижения выражали относительно контроля с PBS. Также использовали контроль AD-1955 LUC, как показано на фиг. 5.
Подобным образом, на фиг. 6 показано, что ми-РНК проявляет зависимый от дозы эффект у крыс. Экспрессия РНК ALAS1 была снижена примерно на 70% при введении ми-РНК в дозе 1 мг/кг; количество мРНК ALAS1 было снижено примерно на 62% при введении ми-РНК в дозе 0,3 мг/кг; и количество ALAS1 было снижено примерно на 34% при введении ми-РНК в дозе 0,1 мг/кг.
Также тестировали продолжительность сайленсинга у мышей (N=15; 3 животных на временную точку. Результаты показаны на фиг. 7, на которой показано, что AD-53558 подавляла мРНК mALAS1 примерно на 80% в течение, по меньшей мере, 9 суток. Подавление, по меньшей мере, примерно на 50% длилось, по меньшей мере, 14 суток.
Пример 5. Эффективность ми-РНК ALAS1 в животной модели AIP
Влияние LNP11-препарата AD-53558 (ми-РНК ALAS1 мыши/крысы, описанная в предыдущем примере) исследовали в мышиной модели AIP. При нокауте PBGD животные нежизнеспособны (-/-, 0% активность). Доступны гетерозиготные нокаутированные по PBGD мыши (+/-, ~ 50% активность), но они не имеют полного биохимического фенотипа и поэтому не могут повторять фенотип заболевания человека. Таким образом, была разработана мышиная модель AIP, которая является сложной гетерозиготой с аллелями T1/T2, содержащей нарушение промотора T1 (+/-) и изменение сайта сплайсинга T2 (-/-). Было показано, что такие мыши имеют остаточную активность PBGD в печени, которая составляет примерно ~30% от уровня дикого типа, и нормальные или слегка повышенные исходные уровни ALA и PBG в плазме. Было обнаружено, что мыши выглядят нормальными в раннем возрасте и становятся немного медлительными и атаксическими с возрастом. При функциональном исследовании было документально показано, что к шестимесячному возрасту у мышей развивается нарушенная координация движений и работа мышц, и дегенерация аксонов. Исследование патологии в мышиной модели показывает дегенерацию аксонов, нарушенную координацию движений и работу мышц у старых мышей. Обнаружено, что уровни ALA и PBG в моче и плазме заметно возрастают при периодическом внутрибрюшинном введении фенобарбитала (См. Lindberg et al., (1996), Nature Genetics, 12:195-219 and Lindberg et al., (1999), Journal of Clinical Investigation, 103:1127-34). Мышей спасали посредством AAV-опосредованной экспрессии PBGD в печени Yasuda et al., (2010), Molecular Medicine, 1:17-22 and Unsu et al., (2011), Molecular Medicine, 2:243-50).
В 1 день мышам вводили 1 мг/кг ми-РНК ALAS1 (n=5) или контрольной LUC AD-1955 (n=3) путем внутривенной инъекции. Вводили три инъекции фенобарбитала (1 инъекция в сутки в 2, 3 и 4 день), чтобы индуцировать печеночную ALAS1 и предшественники порфирина, ALA и PBG. Образцы плазмы и утренней мочи собирали на 5 день и измеряли уровни метаболитов, используя ЖХ-МС. Уровни метаболитов измеряли в плазме, используя ЖХ-МС, а также измеряли в моче. Исходные уровни метаболитов измеряли перед первой обработкой в 1 день. Результаты показаны на фиг. 8-12 и в таблицах 12 и 13.
На фиг. 8 и фиг. 9 показаны уровни ALA в плазме в мкМ. Исходные уровни ALA были низкими (n=4), и обработка фенобарбиталом индуцировала значимое повышение уровней ALA в плазме у контрольных обработанных ми-РНК LUC животных (n=3). Обработка ми-РНК ALAS1 ингибировала индукцию ALA в плазме (n=5), как показано на фиг. 8. ми-РНК ALAS1 в равной мере эффективно блокировала индукцию ALA в плазме у каждого отдельного исследуемого животного (См. фиг. 9). Полученные результаты показывают, что обработка ми-РНК ALAS1 эффективно предотвращала повышения уровней ALA в плазме, ассоциированные с индуцированными фенобарбиталом острыми приступами в данной животной модели AIP.
На фиг. 10 и фиг. 11 показаны уровни PBG в плазме в мкМ. Исходные уровни PBG были низкими (n=4), и обработка фенобарбиталом индуцировала значимое повышение уровней PBG в плазме у контрольных обработанных ми-РНК LUC животных (n=3). Обработка ми-РНК ALAS1 ингибировала индукцию PBG в плазме (n=5), как показано на фиг. 10. ми-РНК ALAS1 в равной мере эффективно блокировала индукцию PBG в плазме у каждого отдельного исследуемого животного (См. фиг. 11). Полученные результаты показывают, что обработка ми-РНК ALAS1 эффективно предотвращала повышения уровней PBG в плазме, ассоциированные с индуцированными фенобарбиталом острыми приступами в данной животной модели AIP.
В таблицах 12 и 13 показаны уровни ALA и PBG в моче на исходном уровне и после обработки фенобарбиталом в случае животных, обработанных ми-РНК LUC (n=2), в контроле (CTR, который относится к животному, обработанному буфером PBS, n=1), и у животных, обработанных ми-РНК ALAS1 (n=5).
Данные, полученные для образцов мочи от отдельных животных, показывающие предотвращение индуцированного острого приступа
1 мг/кг
1 мг/кг
1 мг/кг
Средние данные для образцов мочи
Обработка фенобарбиталом индуцировала сильное повышение уровня (повышение ~25-30 раз) ALA в моче (~9-кратное по сравнению с исходными уровнями) и PBG (~ 19-кратное по сравнению с исходными уровнями) у мышей, обработанных ми-РНК LUC, в контроле, тогда как такое увеличение не наблюдали у животных, обработанных ми-РНК ALAS1. Таким образом, ми-РНК ALAS1 блокировала индуцированное фенобарбиталом повышение ALA и PBG в моче. Полученные результаты согласуются с измерениями в плазме и показывают, что обработка ми-РНК ALAS1 эффективно предотвращала повышение уровней метаболитов в моче (ALA и PBG), ассоциированное с индуцированными фенобарбиталом острыми приступами в модели AIP на животных.
В следующих экспериментах (фиг. 12) было обнаружено, что обработка фенобарбиталом индуцировала значительное повышение (~25 раз) экспрессии мРНК ALAS1 в печени модельной мыши. Введение ми-РНК ALAS1 полностью блокировало индукцию такой мРНК ALAS1. Полученные результаты являются дополнительным доказательством того, что ми-РНК ALAS1 эффективна в животной модели AIP.
Результаты, представленные в данном примере, вместе взятые, показывают, что ми-РНК ALAS1 является эффективной в лечении острых приступов в животной модели острой печеночной порфирии AIP. Многочисленные измерения результатов подтверждают такое заключение, включая уровни ALA в плазме, уровни PBG в плазме, уровни ALA в моче, уровни PBG в моче и уровни экспрессии мРНК ALAS1 в печени.
Пример 6. Сайленсинг in vivo с использованием GalNAc-конъюгированной ми-РНК ALAS1 мыши
В экспериментах, описанных в данном примере, исследовали эффективность in vivo трех GalNAc-конъюгированных ми-РНК (См. таблицу 7). Такие ми-РНК конструировали и получали такими способами, как способы, описанные в примере 2.
Последовательности AD-57929
(5'-3')
Мышей (n=40; n=4 на экспериментальное условие) делили на группы, которые получали PBS или дозы 3 мг/кг, 10 мг/кг или 30 мг/кг ми-РНК, вводимые подкожно. Уровень мРНК mALAS1/mGAPDH относительно PBS-контроля определяли в клетках печени через 72 часа после введения. Результаты показаны на фиг. 13. Имела место неясная зависимость эффекта от дозы в случае ми-РНК AD-56211 и AD-56173. Напротив, в случае ми-РНК ALAS1 AD-57929 наблюдали зависимый от дозы эффект в отношении ингибирования экспрессии mALAS1. Полученные результаты показывают, что конъюгат GalNAc-конъюгат ALAS1 эффективно ингибировал экспрессию мРНК ALAS1 мРНК in vivo и оказывал зависимый от дозы эффект.
Пример 7. ми-РНК человека
Дополнительные ми-РНК человека конструировали и получали, как описано в примере 2. 45 наилучших ми-РНК отбирали на основе их прогнозируемой эффективности. Последовательности таких 45 ми-РНК представлены в таблице 8.
Смысловые и антисмысловые последовательности ми-РНК ALAS1 человека
(5'-3')
Пример 8. ми-РНК человека
Создавали дополнительные 19-мерные ми-РНК человека. Последовательности таких ми-РНК представлены в таблице 9. Такие ми-РНК могут быть протестированы в отношении эффективности с использованием способов, описанных в настоящей публикации, и/или способов, известных в данной области.
Смысловые и антисмысловые последовательности ми-РНК ALAS1 человека
(5'-3')
Пример 9. Подавление предшественников порфиринов с использованием ми-РНК ALAS1 в случае применения подхода острого лечения
Мышиную модель AIP (См. пример 5) использовали для исследования того, может ли ми-РНК ALAS1 работать в случае применения подхода острого лечения, снижая уже повышенные уровни ALA и PBG, что может иметь место, например, когда пациент с порфирией страдает от острого приступа. Введение LND11-препарат ми-РНК AD-53558 в дозе 1 мг/кг через 12 часов после последней дозы фенобарбитала быстро снижало уровни ALA и PBG в плазме мышей, тогда как у контрольных обработанных Luc животных уровни продолжали возрастать (фиг. 14). Полученные результаты показывают, что ми-РНК ALAS является эффективной при лечении острого приступа. ми-РНК ALAS1 эффективно снижала и предотвращала дальнейшее повышение уровней ALA и PBG.
Пример 10. ми-РНК, мишенью которых является ALAS1
Дополнительные немодифицированные и модифицированные последовательности ми-РНК, мишенью которых является ALAS1, конструировали и получали, как описано в примере 2. Активность in vitro модифицированных дуплексов тестировали, как описано ниже.
Способы
Опосредованная липидами трансфекция
В случае Hep3B, PMH и первичных гепатоцитов макак-крабоедов трансфекцию осуществляли, добавляя по 14,8 мкл Opti-MEM плюс 0,2 мкл липофектамина RNAiMax на лунку (Invitrogen, Carlsbad CA, номер в каталоге 13778-150) к 5 мкл каждого дуплекса ми-РНК в отдельной лунке в 96-луночном планшете. Затем смесь инкубировали при комнатной температуре в течение 20 минут. Затем к смеси ми-РНК добавляли восемнадцать микролитров полной ростовой среды без антибиотика, содержащей соответствующее количество клеток. Клетки инкубировали в течение 24 часов перед очисткой РНК.
Эксперименты с введением однократной дозы осуществляли, используя конечную концентрацию дуплекса 1 мкМ, 500 нМ, 20 нМ, 10 нМ и 0,2 нМ в случае GalNAc-модифицированных последовательностей.
Трансфекция в результате свободного захвата
Криозамороженные первичные гепатоциты макака-крабоеда (Celsis In Vitro Technologies, M003055-P) размораживали на водяной бане при 37°C непосредственно перед использованием и ресуспендировали в концентрации 0,26×106 клеток/мл в среде InVitroGRO CP (посев) (Celsis In Vitro Technologies, номер в каталоге Z99029). Во время трансфекции клетки высевали на 96-луночный планшет с коллагеном BD BioCoat (BD, 356407) по 25000 клеток на лунку и инкубировали при 37°C в атмосфере 5% CO2. Эксперименты по свободному захвату осуществляли, добавляя по 10 мкл дуплексов ми-РНК в PBS на лунку в 96-луночный (96л) планшет. Затем к ми-РНК добавляли девяносто микролитров полной ростовой среды, содержащей соответствующее количество клеток для данного типа клеток. Клетки инкубировали в течение 24 часов перед очисткой РНК. Эксперименты с введением однократных доз осуществляли, используя конечную концентрацию дуплекса 1 мкМ, 500 нМ, 20 нМ и 10 нМ.
Выделение суммарной РНК с использованием набора для выделения мРНК DYNABEADS (Invitrogen, серия №: 610-12)
Клетки собирали и лизировали в 150 мкл буфера для лизиса/связывания, затем перемешивали в течение 5 минут при 850 об./мин, используя термомиксер Eppendorf (скорость перемешивания была одинаковой на протяжении всего процесса). Добавляли десять микролитров магнитных шариков и 80 мкл буфера для лизиса/связывания в лунки планшета с круглым дном и перемешивали в течение 1 минуты. Магнитные шарики улавливали, используя магнитную подставку, и надосадок удаляли, не нарушая шарики. После удаления надосадка к оставшимся шарикам добавляли лизированные клетки и перемешивали в течение 5 минут. После удаления надосадка магнитные шарики промывали 2 раза, используя 150 мкл буфера для промывки A, и перемешивали в течение 1 минуты. Шарики улавливали и надосадок удаляли. Затем шарики промывали, используя 150 мкл буфера для промывки B, улавливали и надосадок удаляли. Шарики снова промывали 150 мкл буфера для элюирования, улавливали и надосадок удаляли. Шарикам давали возможность высохнуть в течение 2 минут. После сушки добавляли 50 мкл буфера для элюирования и перемешивали в течение 5 минут при 70°C. Шарики улавливали на магните в течение 5 минут. Сорок пять мкл надосадка извлекали и добавляли в другой 96-луночный планшет.
Синтез кДНК с использованием набора для высокопроизводительной обратной транскрипции кДНК ABI (Applied Biosystems, Foster City, CA, № в каталоге 4368813)
Готовили маточную смесь, состоящую из 2 мкл 10X буфера, 0,8 мкл 25X dNTP, 2 мкл случайных праймеров, 1 мкл обратной транскриптазы, 1 мкл ингибитора РНКаз и 3,2 мкл H2O на реакцию. Смешивали равные объемы маточной смеси и РНК до конечного объема 12 мкл в случае образцов, которые были подвергнуты скринингу in vitro, или 20 мкл в случае образцов, которые были подвергнуты скринингу in vivo. кДНК получали, используя термоциклер Bio-Rad C-1000 или S-1000 (Hercules, CA), выполняя следующие стадии: 25°C 10 минут, 37°C 120 минут, 85°C 5 секунд, 4°C - хранение.
ПЦР в реальном времени
Два мкл кДНК добавляли к маточной смеси, содержащей 2 мкл H2O, 0,5 мкл зонда GAPDH TaqMan (Life Technologies, № в каталоге 4326317E в случае клеток Hep3B cells, номер в каталоге 352339E в случае первичных гепатоцитов мыши или специально приготовленного зонда в случае первичных гепатоцитов макака-крабоеда), 0,5 мкл зонда C5 TaqMan probe (Life Technologies, номер в каталоге Hs00167441_m1 в случае клеток Hep3B или Mm00457879_m1 в случае первичных гепатоцитов мыши или специально приготовленного зонда в случае первичных гепатоцитов макака-крабоеда) и 5 мкл маточной смеси зонда Lightcycler 480 (Roche, номер в каталоге 04887301001) на лунку в 384-луночные (384 w) планшеты (Roche, номер в каталоге 04887301001). ПЦР в реальном времени осуществляли в системе для ПЦР в реальном времени Roche LC480 (Roche), используя анализ ΔΔCt(RQ). В случае скрининга in vitro каждый дуплекс тестировали с двумя биологическими повторами, если не указано иное, и каждую ПЦР в реальном времени осуществляли в двух технических повторах. В случае скрининга in vivo каждый дуплекс тестировали в одном или нескольких экспериментах (3 мыши на группу), и каждую ПЦР в реальном времени осуществляли в двух технических повторах.
Чтобы вычислить относительное кратное изменение уровней мРНК ALAS1, данные, полученные в реальном времени, анализировали, используя способ ΔΔCt, и нормализовали по отношению к данным анализов, осуществляемых с использованием клеток, трансфицированных 10 нм AD-1955, или ложно трансфицированных клеток. IC50 вычисляли с помощью модели подгонки по 4 параметрам, используя XLFit, и нормализовали по отношению к клеткам, трансфицированным AD-1955, в том же диапазоне доз или по отношению к собственной наименьшей дозе.
Смысловые и антисмысловые последовательности AD-1955:
Смысловая: cuuAcGcuGAGuAcuucGAdTsdT (SEQ ID NO: 3682)
Антисмысловая: UCGAAGuACUcAGCGuAAGdTsdT (SEQ ID NO: 3683).
Последовательности одиночных нитей и дуплексов модифицированных и немодифицированных ми-РНК представлены в таблице 14 и таблице 15, соответственно.
Модифицированные последовательности одиночных нитей и дуплексов ALAS1 человека
Немодифицированные последовательности одиночных нитей и дуплексов ALAS1 человека
(5'-3')
Результаты анализов in vitro представлены в таблице 16. В таблице 16 также указаны виды-мишени для каждой ми-РНК.
Результаты функциональных анализов
Таблица 17 иллюстрирует IC50 выбранных дуплексов ми-РНК ALAS1. IC50 определяли на основании нокдауна эндогенно экспрессируемого ALAS1 в линии клеток Hep3B через 24 часа после трансфекции каждого модифицированного дуплекса ми-РНК ALAS1 (См. таблицу 14). По меньшей мере, семь дуплексов, включая AD-58882, AD-58878, AD-58886, AD-58877, AD-59115, AD-58856 и AD-59129, соответственно имели IC50 меньше 0,1 нМ, что свидетельствует о том, что такие дуплексы особенно эффективны в подавлении экспрессии ALAS1.
IC50 выбранных дуплексов ми-РНК ALAS1
Пример 11. Активность ALAS1-GalNAc в мышиной модели индуцированной фенобарбиталом AIP
Мышиную модель AIP использовали для исследования эффекта ми-РНК, которая представляла собой конъюгат ALAS1-GalNAc. ми-РНК имела последовательность дуплекса AD-58632 (См. таблицу 20).
Последовательности дуплекса ми-РНК ALAS1 AD-58632
Мышей AIP не обрабатывали (исходный уровень) или им подкожно инъецировали в 1 день физиологический раствор или конъюгат ALAS1-GalNAc в дозе 20 мг/кг. На 2, 3 и 4 день их оставляли необработанными (исходный уровень), или их обрабатывали с использованием внутрибрюшинных инъекций фенобарбитала. На 5 день собирали плазму и измеряли уровни ALA и PBG, используя анализ ЖХ-МС. Как показано на фиг. 15, конъюгат ALAS1-GalNAc ослаблял продукцию ALA и PBG в плазме примерно на 84 и 80%, соответственно. Полученные результаты свидетельствуют, что лечение конъюгатом ALAS1-GalNAc эффективно предотвращает повышение уровней ALA и PBG в плазме, ассоциированные с индуцированными фенобарбиталом острыми приступами, в такой животной модели AIP.
Пример 12. Дополнительные ми-РНК, которые нацелены на ALAS1 в качестве мишени и ингибируют экспрессию ALAS1
Модифицированные последовательности ми-РНК, мишенью которых является мРНК ALAS1, конструировали и получали, как описано в примере 2. Последовательности представлены в таблице 18. Активность in vitro модифицированных дуплексов тестировали, как описано ниже.
Модифицированные последовательности одиночных нитей и дуплексов ALAS1 человека
Активность in vitro ми-РНК в подавлении мРНК ALAS1 тестировали в ходе скрининга по одной дозе на клетках Hep3B, которые были трансфицированы с использованием липофектамина 2000 в качестве реагента для трансфекции. Эксперименты с использованием одной дозы осуществляли при концентрации дуплекса 10 нМ и анализировали в анализе разветвленной ДНК (р-ДНК). Результаты показаны в таблице 19 и выражены в виде процента сохраняемой мРНК.
Подавление мРНК ALAS1, которое оценивали в анализе р-ДНК
Двести тридцать два дуплекса, которые были тестированы, в различной степени подавляли мРНК ALAS1 в таком анализе по одной дозе. Согласно проведенному анализу, по меньшей мере, четыре дуплекса (AD-59453, AD-59395, AD-59477,и AD-59492) подавляли мРНК ALAS1 на 85% или больше, 39 дуплексов подавляли мРНК ALAS1 на 80% или больше, 101 дуплекс подавлял мРНК ALAS1 на 70% или больше, и 152 дуплекса подавляли мРНК ALAS1 на 50% или больше. Напротив, некоторые дуплексы не оказывали заметного подавления в данном анализе.
ЭКВИВАЛЕНТЫ
Специалистам в данной области будет понятно, или они смогут установить, используя ничего более, кроме обычных экспериментов, множество эквивалентов конкретных вариантов осуществления изобретения, описанных в настоящей публикации. Подразумевается, что такие эквиваленты входят в объем следующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АССОЦИИРОВАННОГО С SERPINC1 РАССТРОЙСТВА | 2016 |
|
RU2754188C2 |
| КОМПОЗИЦИИ НА ОСНОВЕ iRNA SERPINA1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2761667C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ЭНДОТЕЛИЯ СОСУДОВ (VEGF), ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА К VEGF | 2009 |
|
RU2569182C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С НЕЙТРОФИЧЕСКИМ ФАКТОРОМ ГОЛОВНОГО МОЗГА (BDNF), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА BDNF | 2013 |
|
RU2661104C2 |
| ЛЕЧЕНИЕ НАРУШЕНИЙ ЦНС | 2007 |
|
RU2426544C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЯВЛЕНИЯ КРОВОТЕЧЕНИЯ У БОЛЬНОГО ГЕМОФИЛИЕЙ | 2018 |
|
RU2801263C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ИНФЕКЦИИ ГЕПАТИТА В | 2018 |
|
RU2780021C2 |
| СРЕДСТВА ДЛЯ РНКи, КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ТРАНСТИРЕТИНОМ (TTR) | 2012 |
|
RU2678807C2 |
| МОЛЕКУЛЫ ХИМИЧЕСКИ МОДИФИЦИРОВАННОЙ КОРОТКОЙ ИНТЕРФЕРИРУЮЩЕЙ НУКЛЕИНОВОЙ КИСЛОТЫ, КОТОРЫЕ ОПОСРЕДУЮТ ИНТЕРФЕРЕНЦИЮ РНК | 2006 |
|
RU2418068C2 |
| ЛИПОСОМЫ С РЕТИНОИДОМ ДЛЯ УСИЛЕНИЯ МОДУЛЯЦИИ ЭКСПРЕССИИ HSP47 | 2012 |
|
RU2628694C2 |































































































































































































































































































































































































































































































































































































































































































































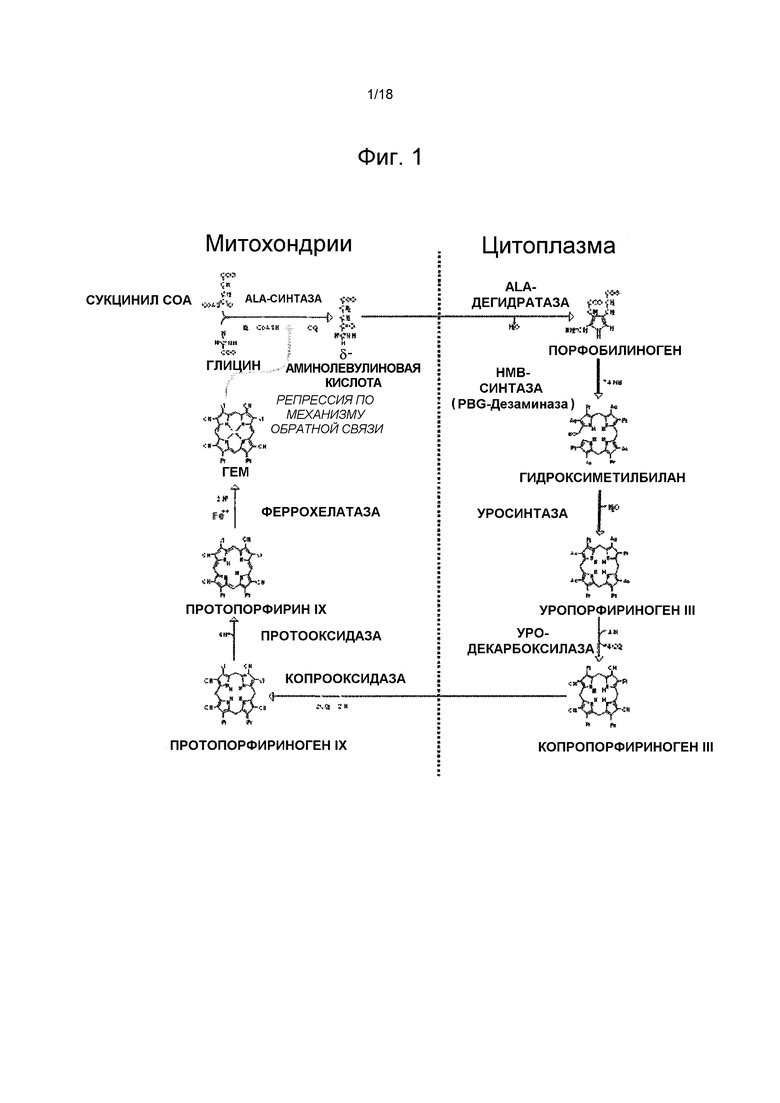
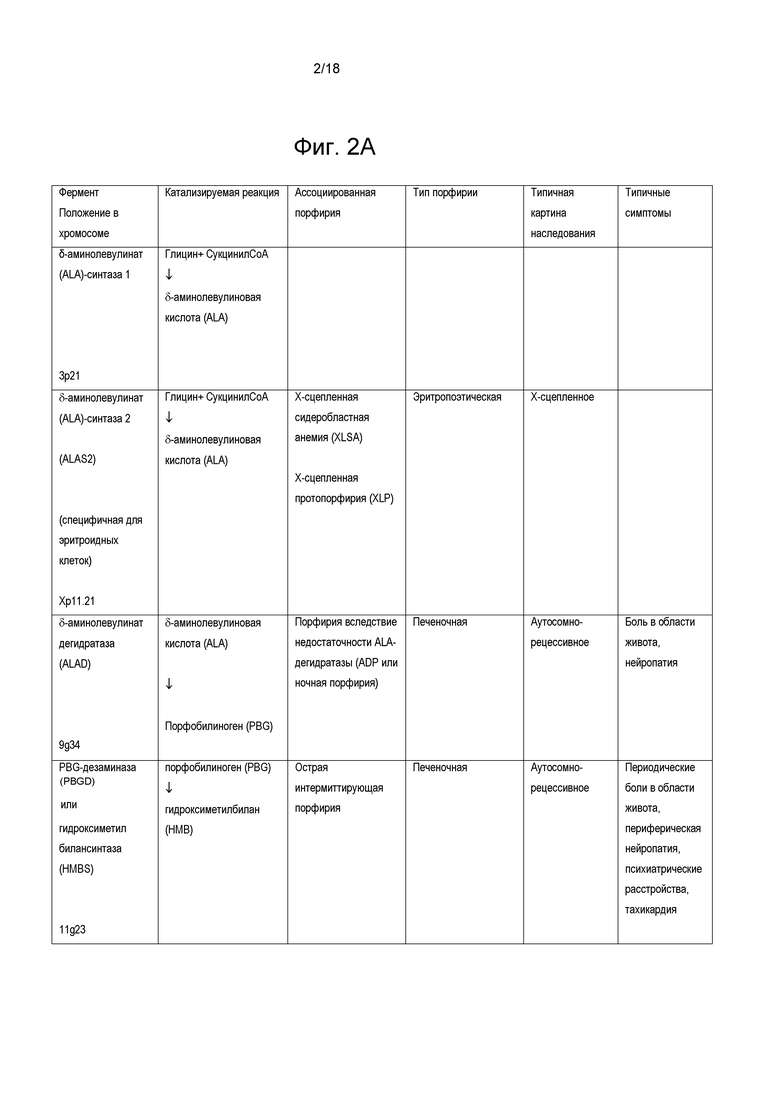
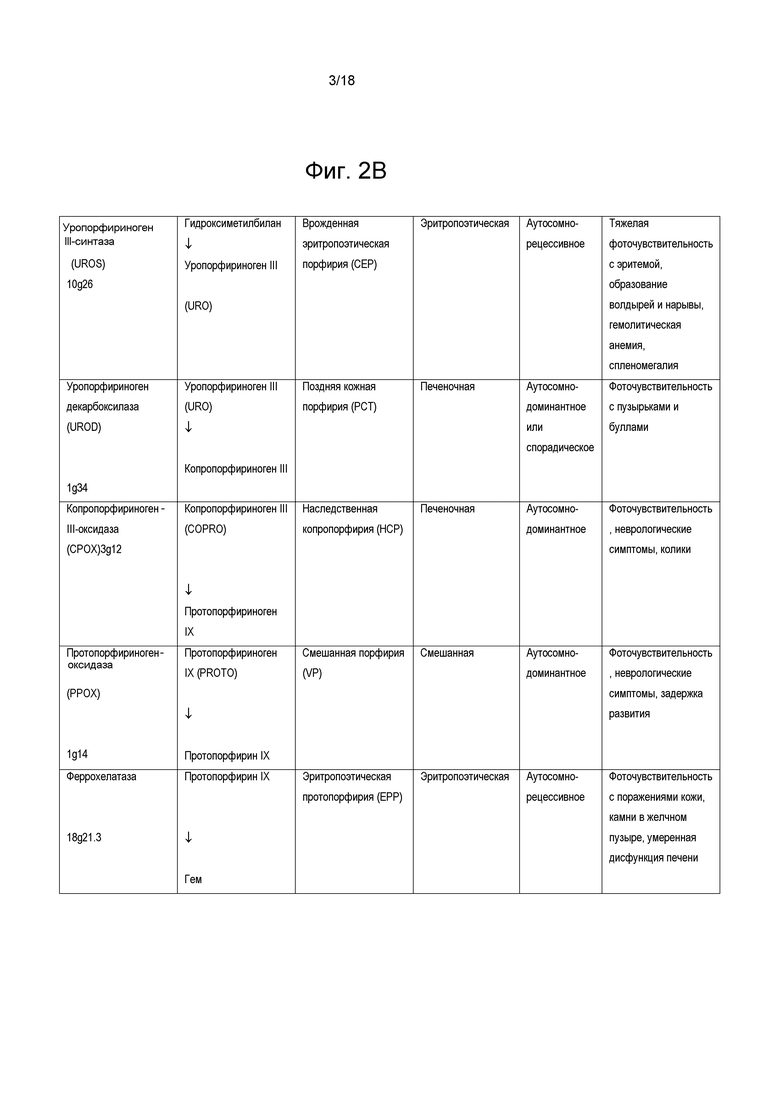




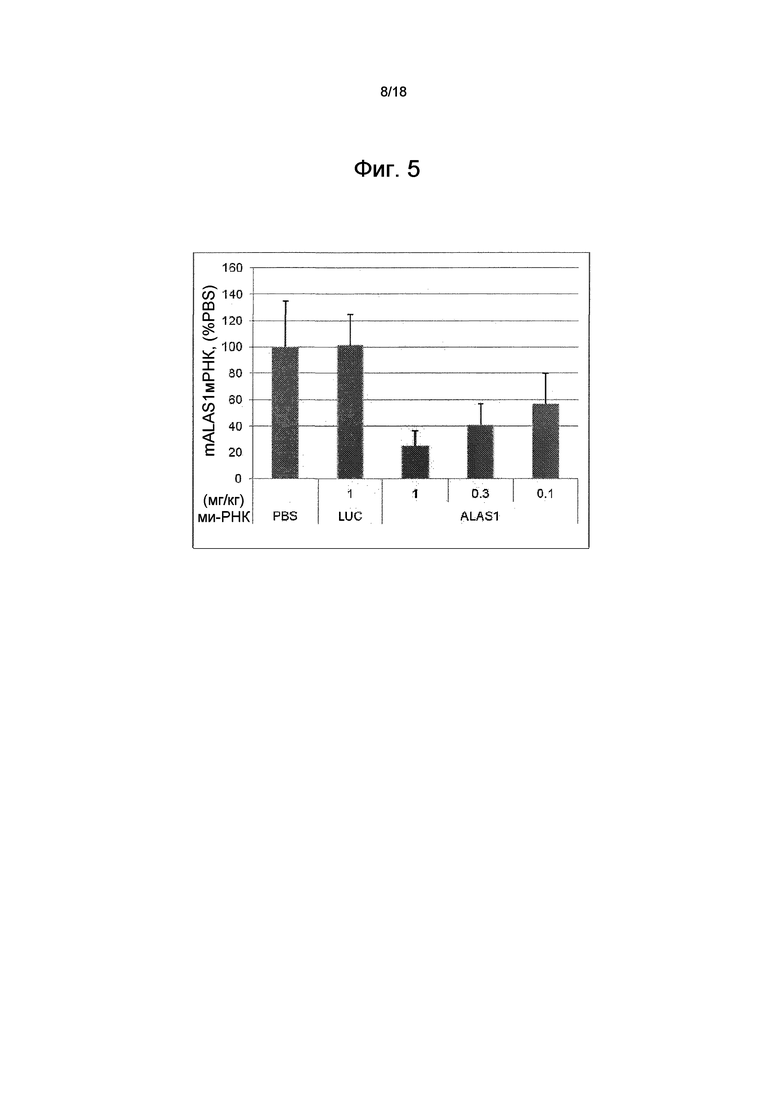
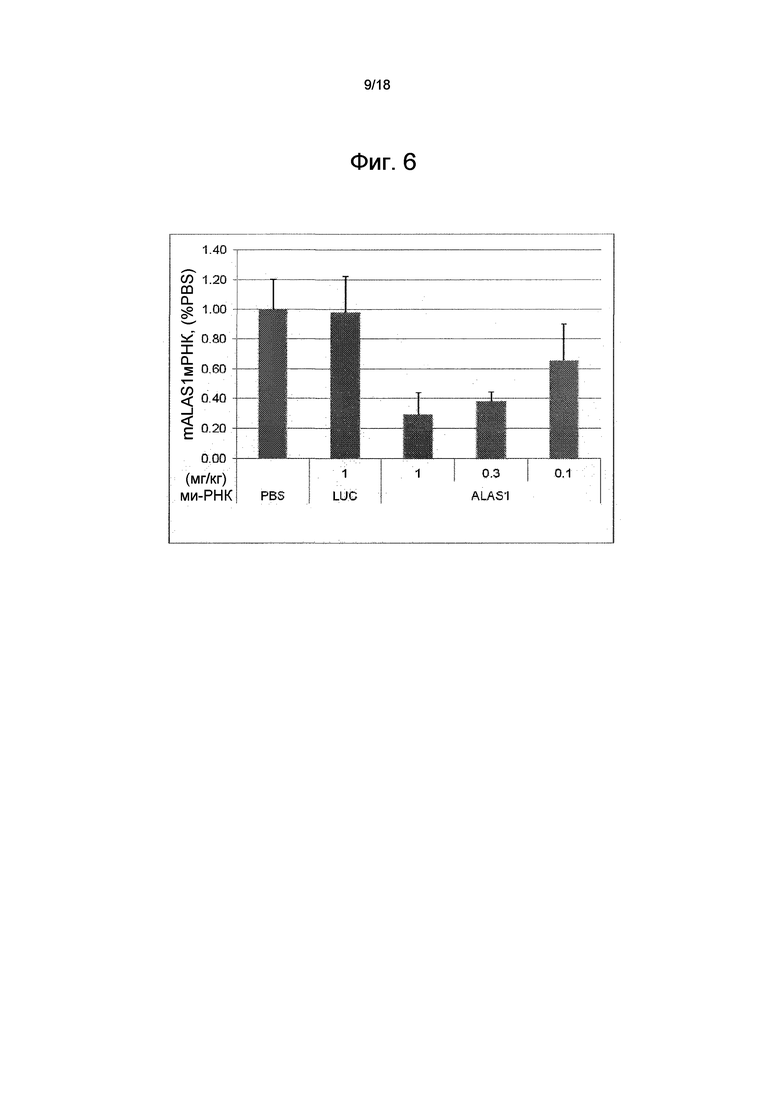
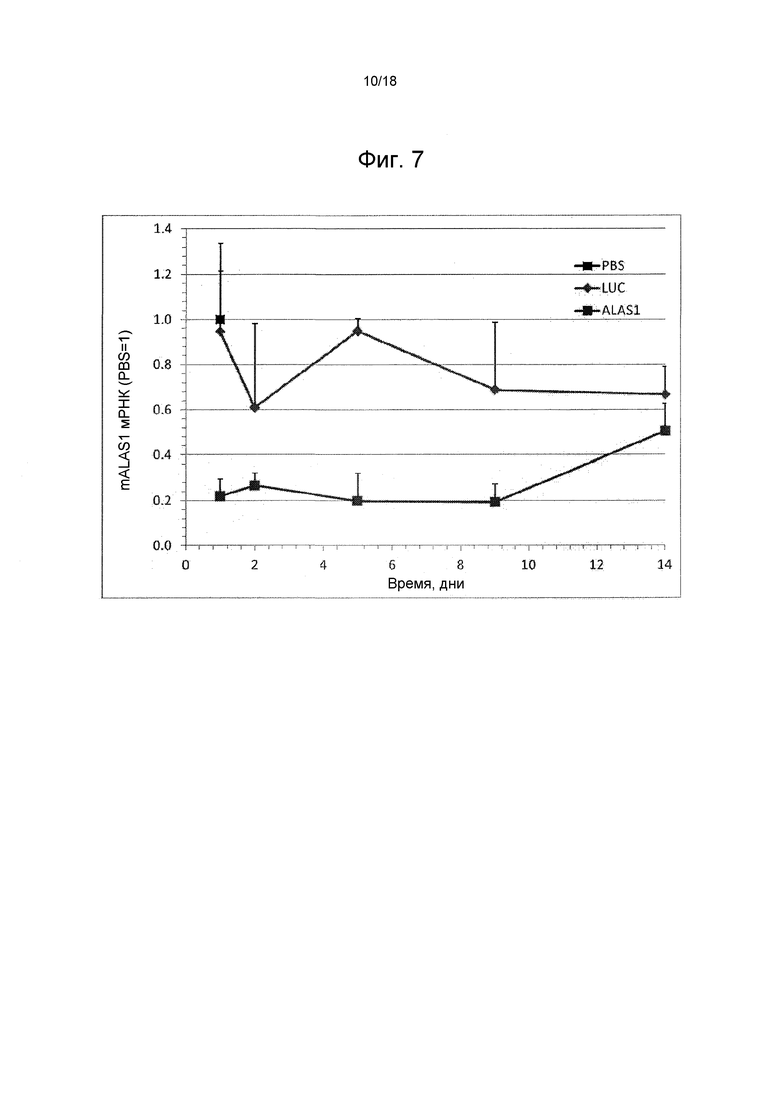
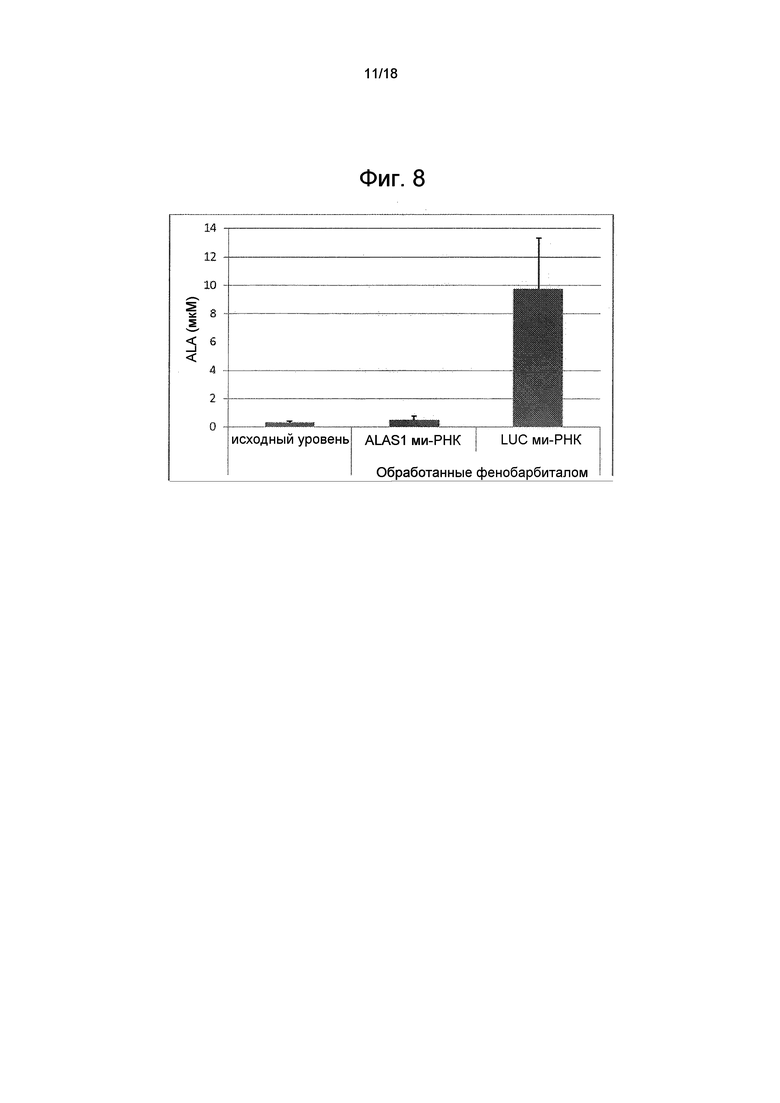
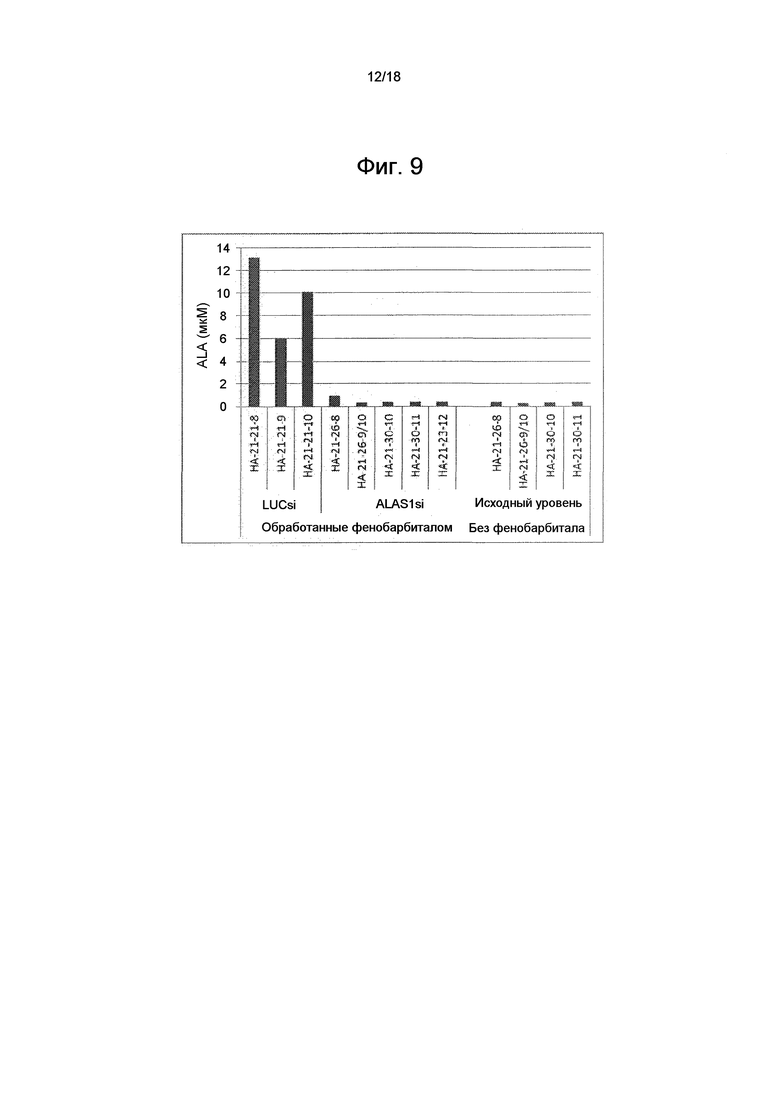
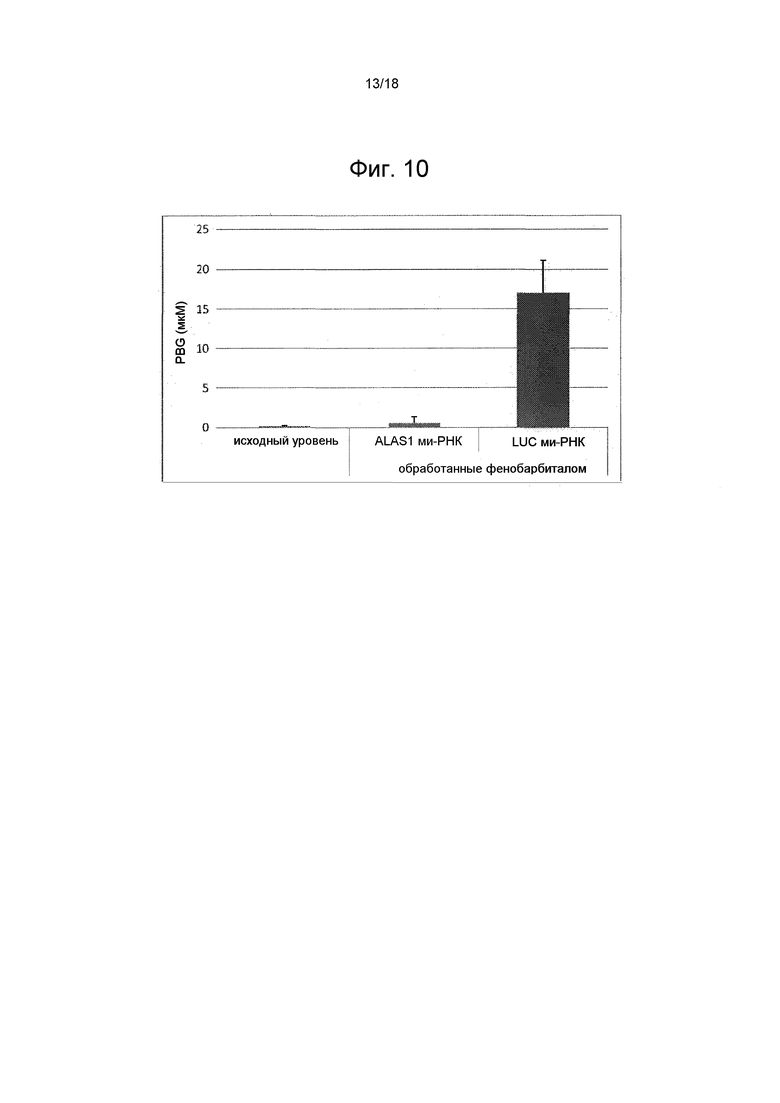
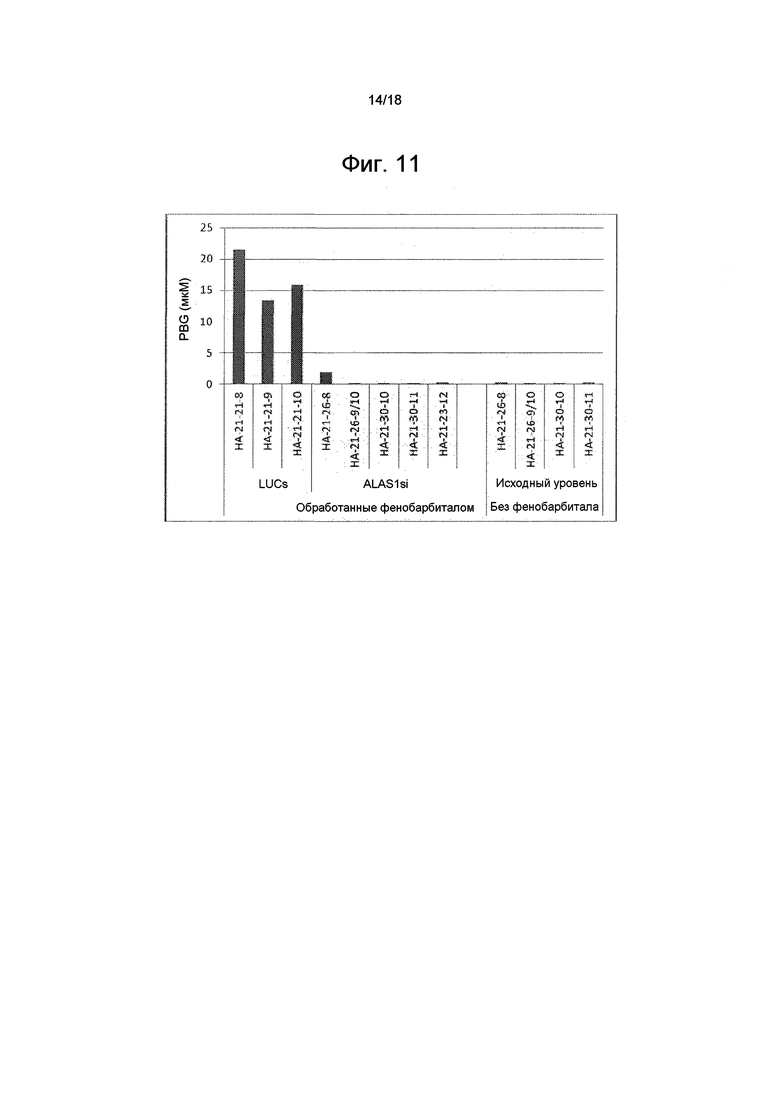
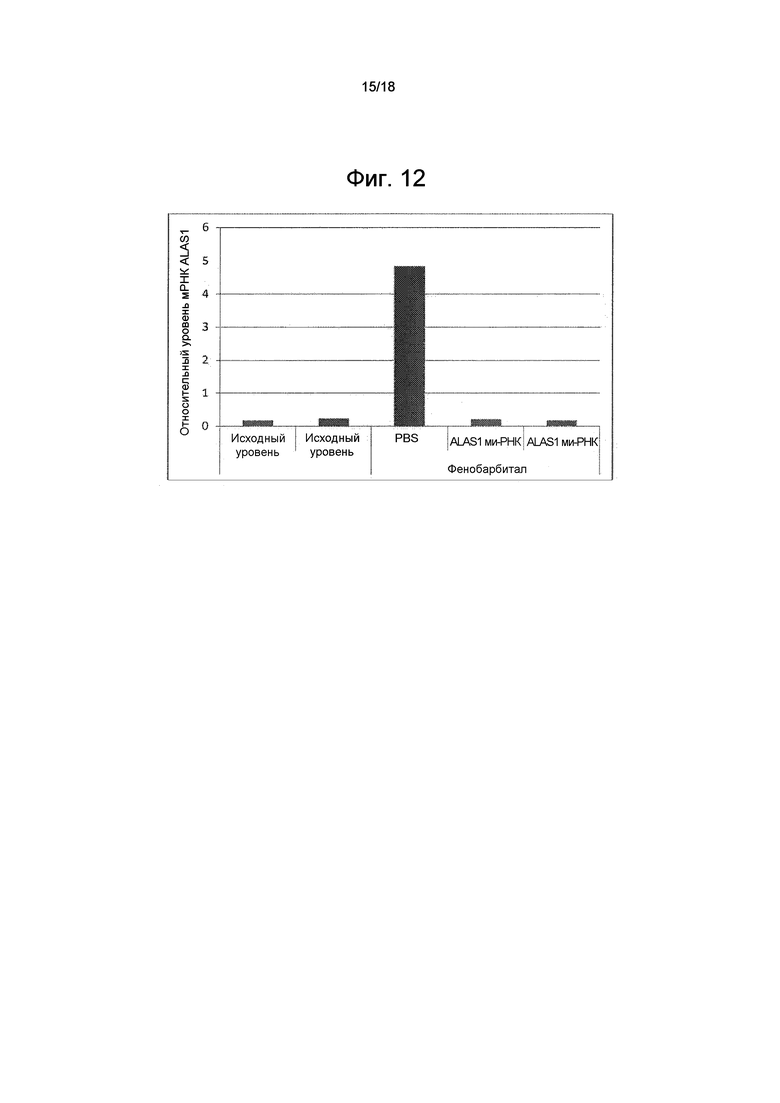
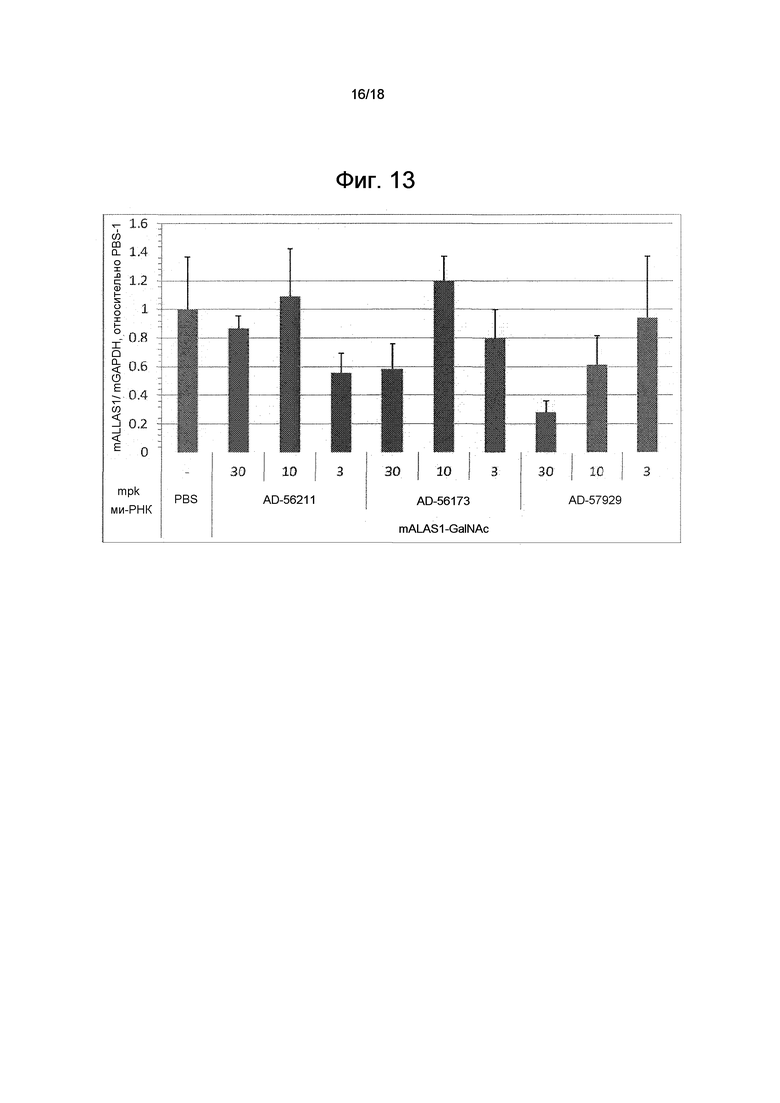
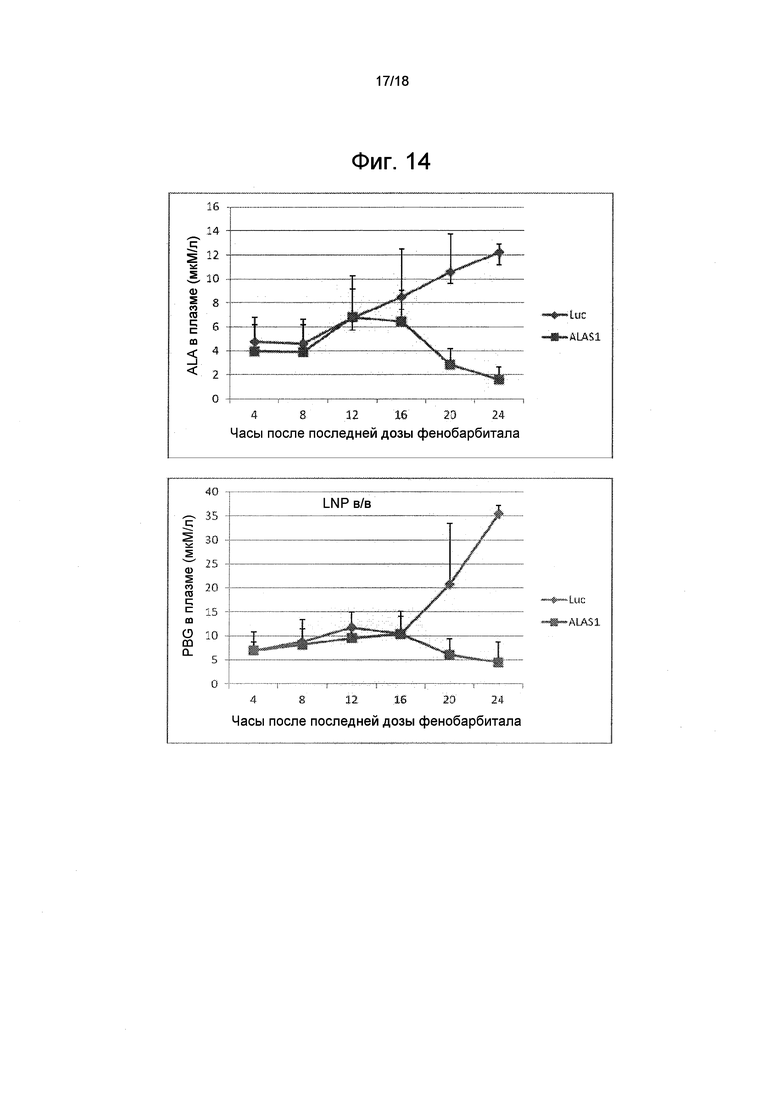
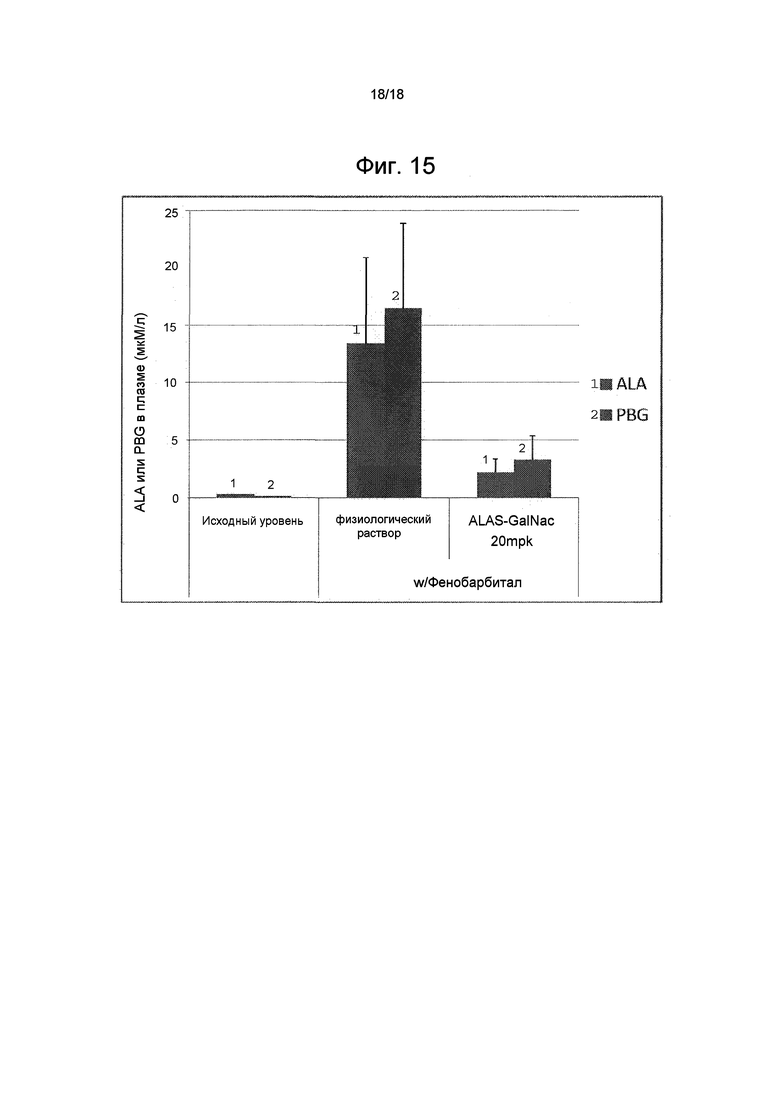
Изобретение относится к биотехнологии. Описана двунитевая рибонуклеиновая кислота (днРНК) для ингибирования экспрессии ALAS1. Указанная днРНК содержит смысловую нить и антисмысловую нить. Антисмысловая нить комплементарна по меньшей мере нуклеотидам 871-889 последовательности SEQ ID NO: 1 и включает SEQ ID NO: 1296. Смысловая нить содержит по меньшей мере 15 непрерывно следующих друг за другом нуклеотидов последовательности SEQ ID NO: 1295. Каждая из смысловой и антисмысловой нитей имеет длину от 19 до 24 нуклеотидов. днРНК включает один или более нуклеотидов с модификацией, выбранной из 2’-O-метил-модифицированного нуклеотида, 2’-фтор-модифицированного нуклеотида или обоих. Также представлена фармацевтическая композиция для ингибирования экспрессии гена ALAS1, содержащая терапевтически эффективное количество днРНК. Представлены способы ингибирования экспрессии ALAS1 в клетке, лечения расстройства и снижения уровня порфирина или предшественника порфирина в клетке, связанного с экспрессией ALAS1, включающие введение днРНК. Изобретение позволяет ингибировать экспрессию гена ALAS1. 8 н. и 37 з.п. ф-лы, 15 ил., 20 табл., 12 пр.
1. Двунитевая рибонуклеиновая кислота (днРНК) для ингибирования экспрессии ALAS1, при этом указанная днРНК содержит смысловую нить и антисмысловую нить, причем:
(i) антисмысловая нить комплементарна по меньшей мере нуклеотидам 871-889 последовательности SEQ ID NO: 1 и включает SEQ ID NO: 1296,
(ii) смысловая нить содержит по меньшей мере 15 непрерывно следующих друг за другом нуклеотидов последовательности SEQ ID NO: 1295,
(iii) каждая из смысловой и антисмысловой нитей имеет длину от 19 до 24 нуклеотидов,
(iv) лиганд и линкер со структурой, показанной ниже, присоединен к 3’-концу смысловой нити днРНК
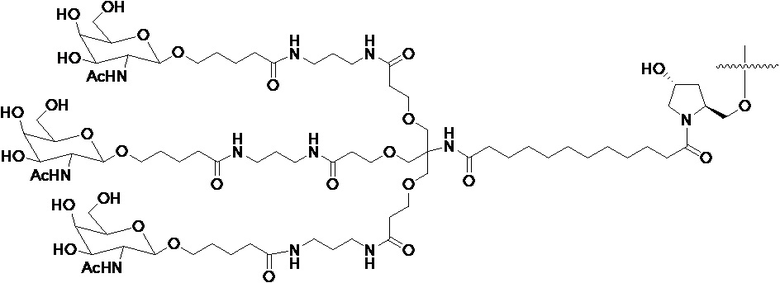
и
(v) днРНК включает один или более нуклеотидов с модификацией, выбранной из 2’-O-метил-модифицированного нуклеотида, 2’-фтор-модифицированного нуклеотида или обоих.
2. Двунитевая рибонуклеиновая кислота (днРНК) для ингибирования экспрессии ALAS1, содержащая:
(i) антисмысловую нить, комплементарную по меньшей мере нуклеотидам 871-889 последовательности SEQ ID NO: 1;
(ii) смысловую нить, содержащую по меньшей мере 15 непрерывно следующих друг за другом нуклеотидов последовательности SEQ ID NO: 1295;
(iii) каждая из смысловой и антисмысловой нитей имеет длину от 19 до 24 нуклеотидов;
(iv) одно или более производных N-ацетилгалактозамина (GalNAc) и
(v) один или более нуклеотидов с модификацией, выбранной из 2’-O-метил-модифицированного нуклеотида, 2’-фтор-модифицированного нуклеотида или обоих.
3. ДнРНК по п. 2, в которой антисмысловая нить содержит последовательность SEQ ID NO: 1296.
4. ДнРНК по п. 3, содержащая по меньшей мере пять 2’-O-метил-модифицированных нуклеотидов и по меньшей мере пять 2’-фтор-модифицированных нуклеотидов.
5. ДнРНК по п. 4, содержащая одну или более фосфоротиоатных связей.
6. ДнРНК по п. 2, содержащая по меньшей мере 20 2’-O-метил-модифицированных нуклеотидов и/или 2’-фтор-модифицированных нуклеотидов.
7. ДнРНК по п. 5, содержащая 2’-O-метил-модифицированные нуклеотиды и/или 2’-фтор-модифицированные нуклеотиды по всей длине смысловой и антисмысловой нитей.
8. ДнРНК по п. 3, включающая по меньшей мере один тупой конец.
9. ДнРНК по п. 3, в которой оба конца днРНК являются тупыми концами.
10. ДнРНК по п. 3, в которой по меньшей мере одна нить включает 3’-липкий конец, состоящий из по меньшей мере 1 нуклеотида.
11. ДнРНК по п. 10, в которой 3’-липкий конец имеет длину 2 нуклеотида.
12. ДнРНК по п. 10, в которой 3’-липкий конец присутствует на 3’-конце либо антисмысловой нити, либо смысловой нити, либо на обоих 3’-концах антисмысловой нити и смысловой нити днРНК.
13. ДнРНК по п. 10, в которой 3’-липкий конец находится на антисмысловой нити.
14. ДнРНК по п. 13, в которой один или более нуклеотидов липкого конца представляют собой нуклеозид трифосфат.
15. ДнРНК по п. 1 или 2, в которой лиганд или производное GalNAc конъюгирован(о) с 3’-концом смысловой нити днРНК.
16. ДнРНК по п. 2, в которой одно или более производных GalNAc является двухантенным или трехантенным лигандом GalNAc.
17. ДнРНК по п. 16, в которой лиганд GalNAc представляет собой
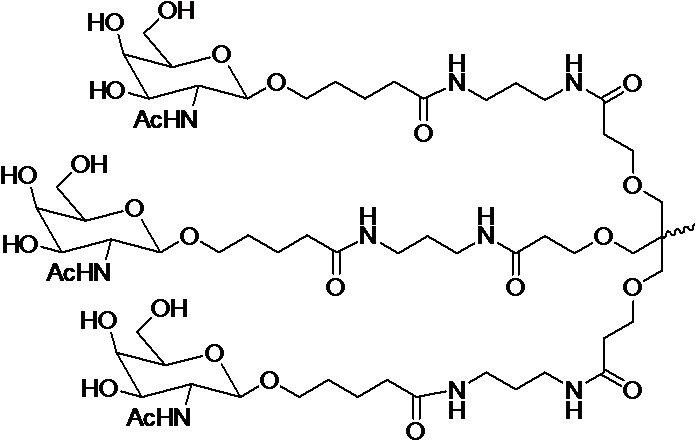
18. ДнРНК по п. 16, в которой лиганд GalNAc присоединен к 3’-концу смысловой нити.
19. ДнРНК по п. 16, в которой лиганд GalNAc присоединен к 3’-концу смысловой нити посредством линкера.
20. ДнРНК по п. 16, в которой лиганд GalNAc и линкер имеют структуру

21. ДнРНК по п. 1 или 2, в которой антисмысловая нить полностью комплементарна по меньшей мере нуклеотидам 871-889 последовательности SEQ ID NO: 1.
22. Двунитевая рибонуклеиновая кислота (днРНК) для ингибирования экспрессии ALAS1, содержащая:
(i) антисмысловую нить, которая включает последовательность SEQ ID NO: 1296;
(ii) смысловую нить, содержащую по меньшей мере 15 непрерывно следующих друг за другом нуклеотидов последовательности SEQ ID NO: 1295;
(iii) область дуплекса длиной от 19 до 30 пар оснований;
(iv) двухантенный или трехантенный лиганд GalNAc;
(v) 20 или более модифицированных нуклеотидов, выбранных из 2’-O-метил-модифицированных нуклеотидов и 2’-фтор-модифицированных нуклеотидов, и
(vi) по меньшей мере одну нить, содержащую 3’-липкий конец, состоящий из по меньшей мере 1 нуклеотида.
23. ДнРНК по п. 22, в которой каждая из смысловой и антисмысловой нитей имеет длину от 19 до 24 нуклеотидов.
24. ДнРНК по п. 23, в которой антисмысловая нить включает 3’-липкий конец.
25. ДнРНК по п. 24, в которой 3’-липкий конец имеет длину 2 нуклеотида.
26. ДнРНК по п. 25, содержащая смысловую нить с тупым концом.
27. ДнРНК по п. 26, содержащая одну или более фосфоротиоатных связей.
28. ДнРНК по п. 27, содержащая 2’-O-метил-модифицированные нуклеотиды и/или 2’-фтор-модифицированные нуклеотиды по всей длине смысловой и антисмысловой нитей.
29. ДнРНК по п. 22, в которой лиганд GalNAc представляет собой

30. ДнРНК по п. 29, в которой лиганд GalNAc присоединен к 3’-концу смысловой нити.
31. ДнРНК по п. 30, в которой лиганд GalNAc присоединен к 3’-концу смысловой нити посредством линкера.
32. ДнРНК по п. 16, в которой лиганд GalNAc и линкер имеют структуру

33. Двунитевая рибонуклеиновая кислота (днРНК) для ингибирования экспрессии ALAS1, содержащая:
(i) антисмысловую нить, которая полностью комплементарна по меньшей мере нуклеотидам 871-889 последовательности SEQ ID NO: 1;
(ii) смысловую нить, содержащую по меньшей мере 15 непрерывно следующих друг за другом нуклеотидов последовательности SEQ ID NO: 1295, причем каждая из смысловой и антисмысловой нитей имеет длину от 19 до 24 нуклеотидов;
(iii) лиганд, присоединенный к 3’-концу смысловой нити и имеющий структуру

(iv) модифицированные нуклеотиды по всей длине смысловой нити и антисмысловой нити, состоящие из 2’-O-метил-модифицированных нуклеотидов, 2’-фтор-модифицированных нуклеотидов, и фосфоротиоатные связи;
(v) антисмысловую нить, включающую 3’-липкий конец длиной 2 нуклеотида, и
(vi) смысловую нить с тупым концом.
34. Фармацевтическая композиция для ингибирования экспрессии гена ALAS1, содержащая терапевтически эффективное количество днРНК по любому из пп. 1-33.
35. Фармацевтическая композиция по п. 34, причем указанную композицию вводят внутривенно или подкожно.
36. Способ ингибирования экспрессии ALAS1 в клетке, включающий:
(a) введение в клетку днРНК по любому из пп. 1-33 или фармацевтической композиции по п. 34 и
(b) поддержание клетки со стадии (a) в течение периода времени, достаточного для получения распада транскрипта мРНК гена ALAS1 с ингибированием тем самым экспрессии гена ALAS1 в клетке.
37. Способ лечения расстройства, связанного с экспрессией ALAS1, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества днРНК по любому из пп. 1-33 или фармацевтической композиции по п. 34.
38. Способ по п. 37, в котором субъект подвергается риску развития порфирии или у него диагностирована порфирия.
39. Способ снижения уровня порфирина или предшественника порфирина в клетке, включающий осуществление контакта клетки с днРНК по п. 1 в количестве, эффективном для снижения уровня порфирина или предшественника порфирина в клетке.
40. Способ по п. 38, в котором порфирия представляет собой печеночную порфирию.
41. Способ по п. 40, в котором печеночная порфирия выбрана из острой интермиттирующей порфирии (AIP), наследственной копропорфирии (HCP), смешанной порфирии (VP), порфирии вследствие недостаточности ALA-дегидратазы (ADP) и гепатоэритропоэтической порфирии.
42. Способ по п. 38, в котором днРНК или композицию, содержащую днРНК, вводят до, во время или после острого приступа порфирии.
43. Способ по п. 38, в котором днРНК или композицию, содержащую днРНК, вводят в продромальный период.
44. Способ по п. 43, в котором продромальный период характеризуется болью, тошнотой, психологическими симптомами, беспокойством или бессонницей.
45. Способ по п. 38, в котором пациент имеет повышенный уровень ALA и/или PBG.
| С. М. РЫБКИН, Н. Б. Строкан и А. X. Хусаинов Физико-технический институт им. А. Ф. Иоффе | 0 |
|
SU260745A1 |
| US 20050080032 А1, 14.04.2005 | |||
| US 20100112687 А1, 06.05.2010 | |||
| RICHARD T | |||
| PON, Tandem oligonucleotide synthesis using linker phosphoramidites, Nucleic Acids Res, 2005; 33(6), 1940-1948 | |||
| RICHARD J | |||
| ROBERTS, REBASE - enzymes and genes for DNA restriction and modification, Nucleic Acids Res, 2007; 35(Database issue):D269-70. | |||
Авторы
Даты
2019-05-07—Публикация
2013-04-10—Подача