Изобретение относится к области биотехнологии, в частности, к антителам, связывающим компонент С3 комплемента человека и подавляющих активацию системы комплемента по альтернативному пути.
Система комплемента играет важную роль в иммунной защите организма, в частности, при аутоиммунных заболеваниях и заболеваниях, связанных с воспалением тканей. Список заболеваний, связанных с активацией комплемента, включает такие аутоиммунные заболевания, как ревматоидный артрит, системная красная волчанка, васкулиты, рассеянный склероз и др. [Ballanti Е., Perricone С., Greco Е. et al. Complement and autoimmunity // Immunol Res, 2013, 56: 477-491], а также повреждения тканей после ишемии и реперфузии, хронический легочный дистресссиндром, тиреоидит, сахарный диабет, ряд глазных заболеваний и многие другие заболевания [Walport M.J. Complement // N Engl J Med 2001, 344:1058-1066]. Система включает более 30 белков, выполняющих регуляторные и иные функции. Так, повышение концентрации его компонентов С3а, С5а, С5b-9, циркулирующих в крови и других жидкостях организма в условиях острого или хронического воспаления, вызывает и поддерживает активацию нейтрофилов, моноцитов, тромбоцитов, клеток эндотелия сосудов.
Система комплемента активируется тремя различными путями: классическим, альтернативным и лектиновым. [Pyz Е., Marshall A.S.J., Gordon S., Brown G.D. C-type lectin-like receptors on myeloid cells // Annals of Medicine, 2009, 38(4):242-251]. Классический путь активируется комплексами антиген-антитело, лектиновый - узнаванием углеводных компонентов лектинами, альтернативный - связыванием С3 с распознаваемыми мотивами на поверхности патогена.
Альтернативный путь (АП) активации относится к одному из факторов врожденного иммунитета и направлен на распознавание и уничтожение патогенов, а также на клиренс клеток, погибших вследствие апоптоза, некроза, и их дериватов [Merle N.S., Church S.E., Fremeaux-Bacchi V., Roumenina L.T. Complement System Part I - Molecular Mechanisms of Activation and Regulation // Front Immunol. 2015, 6: Article 262]. Активация комплемента по альтернативному пути происходит непрерывно за счет медленного спонтанного гидролиза тиоэфирной связи в молекуле С3, в результате которой происходит изменение ее конформации и переход из неактивной формы в биоактивную форму С3(Н2О). Время существования активной формы С3(Н2O) исчисляется миллисекундами, после чего молекула превращается в неактивную форму, обозначаемую C3i, и быстро выводится из организма. Количество измененного С3 в форме С3(Н20) и/или C3i составляет 1-2% от всего циркулирующего С3 и равно приблизительно 1 мкг.
При физиологических условиях в нормальной сыворотке крови существует баланс между белками, участвующими в активации по альтернативному пути, такими как С3, фактор В, фактор D, белок Р, и регуляторными белками, такими как Н-фактор, фактор I, CD35, CD46 и CD55. Однако есть множество причин, приводящих к нарушению этого баланса. В частности, в случае генетических нарушений, связанных с мутациями в генах, ответственных за продукцию хотя бы одного из регуляторных белков, возникает нерегулируемая активация, которая приводит к атаке комплементом собственных клеток, что становится причиной серьезных болезней. Среди них хорошо изучены пароксизмальная ночная гемоглобинурия, атипический гемолитический синдром, возрастная дегенерация сетчатки глаза. Такие болезни относят к комплемент-ассоциированным болезням. Таким образом, нерегулируемая активация комплемента ведет к патологическому воспалению и тяжелым болезням [Holers V.М. Complement and Its Receptors: New Insights Into Human Disease. Annu. Rev. Immunol. 2014. 32:433-59; He S, Atkinson C, Qiao F, Cianflone K, Chen C, Tomlinson S. 2009. A complement-dependent balance between hepatic ischemia/reperfusion injury and liver regeneration in mice. J. Clin. Investig. 119:2304-16; Chen M, Daha MR, Kallenberg CG. The complement system in systemic autoimmune disease. J Autoimmun. 2010; 34:J276-86; Parkes M, Cortes A, van Heel DA, Brown MA. 2013. Genetic insights into common pathways and complex relationships among immune-mediated diseases. Nat. Rev. Genet. 14:661-73; Holers V.M. The spectrum of complement alternative pathway-mediated disease. Immunol. Rew. 2008, V. 223, P. 300-316; Mastellos DC, Ricklin D, Hajishengallis E, Hajishengallis G, Lambris JD. Complement therapeutics in inflammatory diseases: promising drug candidates for C3-targeted intervention. Mol Oral Microbiol. 2016; 31(1):3-17].
Для решения проблемы нерегулируемой активации комплемента в качестве терапевтических средств целесообразно использование искусственных блокаторов комплемента, которые способны прерывать каскад реакций активации на каком-либо из его этапов. Наиболее эффективным представляется блокирование активации альтернативного пути за счет связывания или блокирования активации активного сайта на молекуле С3, который вовлечен во взаимодействие с другими компонентами реакционной цепи на стадии инициации активации, но не экспонирован на нативной молекуле, в организме больного, например, с помощью химерных или гуманизированных антител. При этом прямая нейтрализация С3 компонента является нецелесообразной из-за его высокой концентрации в сыворотке крови.
Известно, что все последовательные превращения С3 и его дочерних компонентов, происходящие в процессе активации альтернативного пути комплемента, сопровождаются конформационными перестройками молекул, что приводит к появлению новых антигенных детерминант, так называемых неоантигенов. Были получены моноклональные антитела к некоторым неоантигенам, способные подавлять активацию альтернативного пути комплемента, в частности, мышиные, химерные и гуманизированные антитела к С3 и С3b и их функциональные фрагменты (WO 2004031240, WO 2013152024, RU 2473563, ЕА 2011101593, WO 2006012621), которые избирательно подавляют альтернативный путь активации комплемента. Однако ни одно из заявленных ранее антител до сих пор не применяется в медицинской практике в связи с недостаточной эффективностью технологии их получения.
Наиболее близкими по технической сущности к заявляемому изобретению являются разработанные ранее авторами мышиные моноклональные антитела СС3-4 и гуманизированные моноклональные антитела hC34, распознающие конформационный эпитоп (неоантиген), который обычно отсутствует в молекуле С3 и появляется при его активации по альтернативному пути. Антитело СС3-4 [RU 2584582, 2016], созданное на основе использования штамма гибридомы мыши, депонированного в коллекции РККК под номером РККК(П)764Д и продуцирующего данное антитело, специфично и с высокой аффинностью связывается с молекулой С3 компонента комплемента человека и блокирует альтернативный путь активации комплемента. Антитело hC34 [RU 2630647, 2017], созданное на основе использования штамма гибридомы мыши, депонированного в коллекции РККК под номером РККК(П)776Д и продуцирующего данное антитело, специфично и с высокой аффинностью связывается с молекулой С3 компонента комплемента человека и блокирует альтернативный путь активации комплемента.
Задачей настоящего изобретения является расширение круга антител к компоненту С3 человека, способных к ингибированию его биологической активности, путем создания нового гуманизированного антитела к конформационному эпитопу С3 компонента комплемента человека, обладающего более высокой ингибирующей активностью, гуманизированного антитела, которое может быть испытано в качестве терапевтического антитела для блокирования нерегулируемой активации системы комплемента по альтернативному пути.
Технический результат достигается созданием моноклонального гуманизированного антитела hC34m, характеризующегося наличием дополнительных мутаций в CDR-участках вариабельной области легкой и тяжелой цепей антитела hC34. Моноклональное антитело hC34m содержит участки, связывающие конформационный эпитоп С3 компонента комплемента человека (CDR-участки) мышиного моноклонального антитела СС3-4, окруженные каркасными участками IgG человека, а также константные области IgG человека; оно специфично и с высокой аффинностью связывается с молекулой С3 компонента комплемента человека и блокирует альтернативный путь активации комплемента. Заявленное антитело по сравнению с антителом hC34 содержит в качестве вариабельной области легкой цепи последовательность по Seq ID No: 3, в которой полярный незаряженный серии в позиции 55 заменен на химически подобный треонин, а глутамин в позиции 91 заменен на аспарагин, и в качестве вариабельной области тяжелой цепи последовательность по Seq ID No: 4, в которой гидрофобный фенилаланин в позиции 104 заменен на гидрофобный же валин. После мутаций достигнутая степень гуманизации составляет 91%.
Полученное моноклональное антитело узнает конформационный эпитоп (неоантиген), который обычно отсутствует в молекуле С3 и появляется при его активации по альтернативному пути. Моноклональное антитело по настоящему изобретению не связывается с нативным С3, у которого тиоэфирная связь находится внутри молекулы, изолированная от ее поверхности петлей, образованной α-цепью фрагмента молекулы и не блокирует активацию комплемента по классическому пути. Полученное моноклональное антитело обладает в 4 раза большей ингибирующей активностью по сравнению с разработанным нами ранее моноклональным антителом hC34 и, следовательно, его использование в качестве активного компонента лекарственного средства экономически более выгодно. Поскольку при введении в организм потребуется меньшее количество заявленного антитела, можно ожидать меньшую иммуногенность и снижение количества побочных эффектов по сравнению с известными антителами.
Сущность и промышленная применимость изобретения иллюстрируются следующими примерами:
Пример 1. Гуманизация вариабельных областей моноклонального антитела hC34m.
1.1. Анализ структуры антител и конструирование гуманизированного антитела к конформационному эпитопу С3-компонента комплемента человека.
Исходя из определенных нами ранее последовательностей аминокислот в вариабельных областях тяжелой (Н) и легкой (L) цепей гуманизированного антитела hC34 для повышения степени гуманизации внесены мутации в CDR-участках вариабельных областей легкой и тяжелой цепи. Места этих мутаций определены с учетом пространственного расположения и с соблюдением химического подобия заменяемых аминокислотных остатков. Так, в вариабельной области легкой цепи полярный незаряженный серии в позиции 55 заменен на химически подобный треонин, а глутамин в позиции 91 заменен на очень похожий аспарагин. В вариабельной области тяжелой цепи гидрофобный фенилаланин в позиции 104 на заменен гидрофобный же валин. После мутаций достигнутая степень гуманизации составляет 91%.
1.2. Получение генов, кодирующих вариабельные участки гуманизированного антитела к конформационному эпитопу С3-компонента комплемента человека, и содержащих их экспрессионных плазмид.
Последовательности ДНК, кодирующие вариабельные фрагменты тяжелой и легкой цепей мышиного моноклонального антитела СС3-4 были получены с помощью ПЦР на матрице кДНК, полученной из гибридомы СС3-4 (описано нами ранее в RU 2584582, 2016).
Последовательности ДНК, кодирующие вариабельные фрагменты тяжелой и легкой цепей гуманизированного антитела hC34 были получены синтетическим путем (описано нами ранее в RU 2630647, 2017).
При проектировании последовательностей триплеты нуклеотидов, кодирующие необходимые аминокислоты выбирались с учетом частоты использования кодонов в геноме китайского хомячка (Cricetulus griseus), представленной в базе codon usage database (kazusa.or.jp).
Последовательность ДНК, кодирующую сигнальный пептид легкой цепи иммуноглобулина мыши - MDFQVQIFSFLLISASVIISRG и последовательность Козак, собирали из синтетических олигонуклеотидов. В качестве источника генов константной части тяжелой и легкой цепей использовали векторы pAL-TA/IGG1const и pAL-TA/IGKconst, созданные нами ранее (RU 2550262). Дальнейшая сборка генов проводилась с помощью перекрывающей ПНР. Для легкой цепи независимо амплифицировали фрагмент, содержащий сигнальный пептид и последовательность Козак, фрагмент вариабельного участка и фрагмент константного участка, при этом использованные праймеры обеспечивали необходимое перекрывание концов соседних последовательностей. Далее цельную конструкцию амплифицировали из полученных фрагментов за два этапа перекрывающего ПЦР, после чего конечный продукт амплификации клонировали в экспрессионный вектор pIRES-DHFR [RU 2550262, 2015] по сайтам рестрикции BamHI и NotI и подтверждали соответствие полученной нуклеотидной последовательности запланированной с помощью секвенирования. Сборку тяжелой цепи проводили аналогичным способом. В первой реакции ПНР объединяли последовательности Козак, сигнального пептида и вариабельной области, а затем присоединяли константную часть тяжелой цепи и клонировали в идентичный экспрессионный вектор так же, как легкую цепь. В результате были получены экспрессионные плазмиды pID/hC34-H и pID/hC34-L2, кодирующие тяжелую и легкую цепи гуманизированного антитела hC34.
Для получения генов, кодирующих легкую цепь заявленного гуманизированного антитела hC34m, был проведен мутагенез с помощью ПЦР. В качестве матрицы использовали плазмиду pID/hC34-L2. Изменения в последовательность нуклеотидов вносили с помощью двух комплементарных праймеров длиной не менее 24 п. о., содержащих необходимые мутации. После проведения ПЦР и удаления исходной плазмиды обработкой рестриктазой DpnI реакционную смесь использовали для трансформации компетентных клеток. Из полученной колонии выделяли плазмиду и определяли наличие необходимых мутаций с помощью секвенирования. Полученную плазмиду обозначили pID/hC34m-L. Для получения генов, кодирующих тяжелую цепь заявленного гуманизированного антитела hC34m, был проведен мутагенез с помощью ПЦР. В качестве матрицы использовали плазмиду pID/hC34-H. Изменения в последовательность нуклеотидов вносили с помощью двух комплементарных праймеров длиной не менее 24 п. о., содержащих необходимую мутацию. После проведения ПЦР и удаления исходной плазмиды обработкой рестриктазой DpnI реакционную смесь использовали для трансформации компетентных клеток. Из полученной колонии выделяли плазмиду и определяли наличие необходимых мутаций с помощью секвенирования. Полученную плазмиду обозначили pID/hC34m-Н.
Нуклеотидные последовательности вариабельных участков легкой и тяжелой цепей заявленного гуманизированного антитела hC34m представлены в Seq ID No: 1 и Seq ID No: 2.
Пример 2. Анализ нейтрализующей активности гуманизированных антител hC34m к конформационному эпитопу С3 человека
Для получения аналитических образцов гуманизированного антитела hC34m культуру клеток НЕK-293 котрансфецировали смесью плазмид, кодирующих тяжелую и легкую цепь антител. В качестве плазмиды, кодирующей тяжелую цепь, использовали pID/hC34m-H, в качестве плазмиды, кодирующей легкую цепь - pID/hC34m-L. Трансфекцию выполняли в 24-луночных микротитровальных планшетах с помощью коммерческого липосомального реагента. Супернатанты для анализа собирали через 5 суток после трансфекции, затем в них определяли концентрацию иммуноглобулинов человека.
Активацию комплемента по альтернативному пути проводили в 20 мМ буфере HEPES (рН 7,2-7,4), содержащем 150 мМ NaCl, 10 мМ ЭГТА, 5 мМ MgCl2, 1 мг/мл БСА (буфер для АПК) путем инкубации сыворотки с активатором АПК зимозаном в 96-луночном планшете для ИФА. В лунки микротитровального планшета вносили по 50 мкл раствора гуманизированных антител hC34m различной концентрации и 100 мкл сыворотки крови здоровых доноров, содержащей 1М ε-аминокапроновой кислоты, разведенной в 10 раз в буфере для АПК. Молярное соотношение антител и антигена С3 в инкубационных пробах варьировало от 1:8 до 1:256. Схема расположения проб на планшете приведена в таблице 1. Планшет инкубировали при 37°С при постоянном перемешивании в течение 10 мин, после чего в ячейки вносили по 10 мкл суспензии зимозана с концентрацией 10 мг/мл, приготовленной в буфере для АПК. Для отрицательного контроля вместо зимозана вносили буфер АПК. Планшет инкубировали 1 час при температуре 37°С при постоянном перемешивании на шейкере. Активацию комплемента останавливали внесением в ячейки 10 мкл раствора, содержащего 0,2 М ЭДТА, 10 мМ PMSF. После остановки активации комплемента в пробах в каждой лунке определяли концентрацию С3а с помощью набора ИФА для определения анафилатоксина С3а комплемента человека (ООО «Цитокин») согласно инструкции производителя.
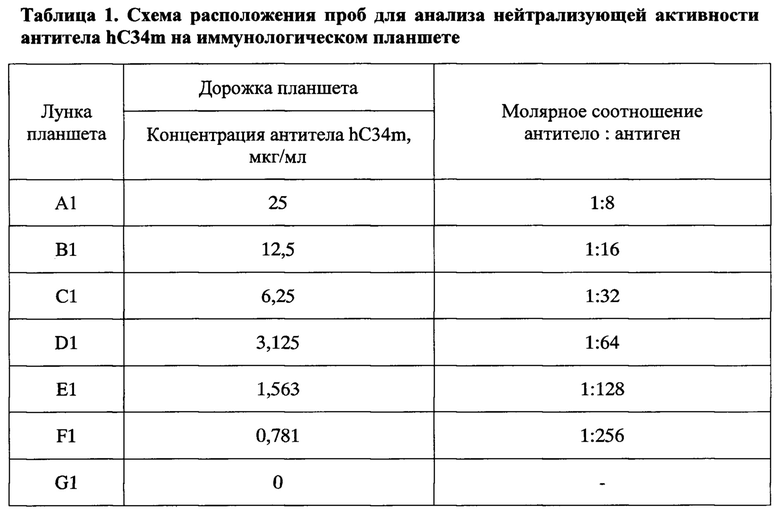
Для каждой концентрации испытуемого антитела вычисляли ингибирование (в процентах) по формуле:
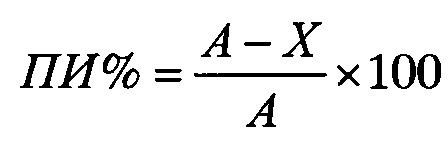
где ПИ - ингибирующая активность (процент ингибирования);
А - максимальная концентрация С3а в образце, в котором проводилась активация комплемента по альтернативному пути в отсутствии антител hC34m (лунка G1);
X - концентрация С3а в образце, соответствующая определенному соотношению антиген: антитело (лунки B1-F1).
В таблицах 2-4 приведены результаты ингибирующей активности тестируемых субстанций антитела hC34m, полученные по описанной методике.
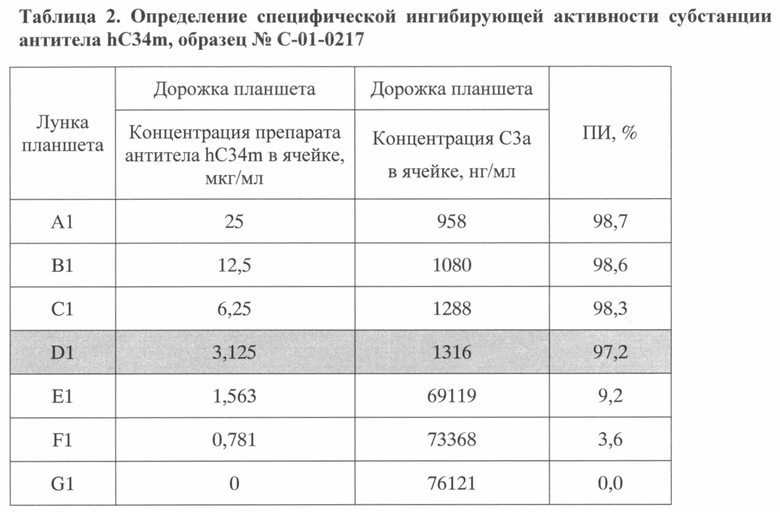
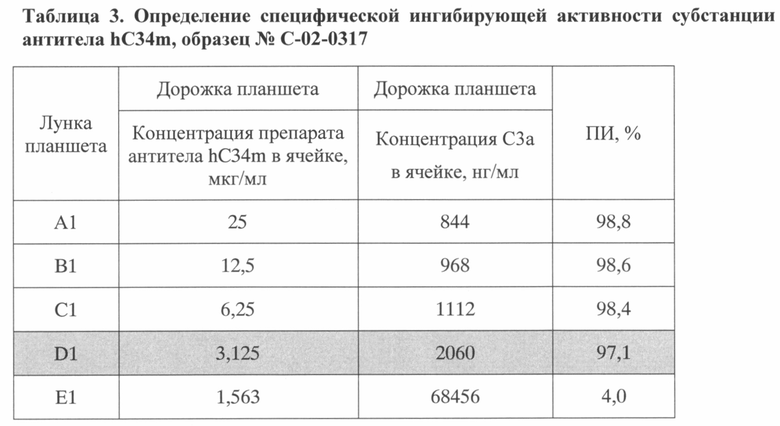
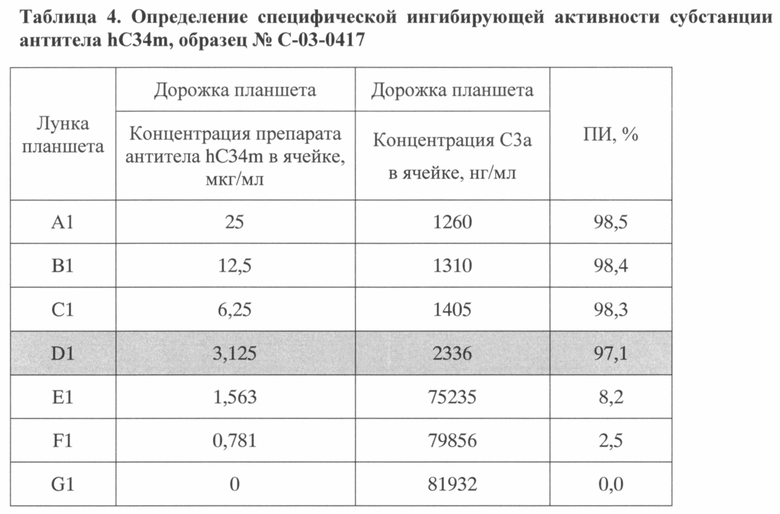
Как видно из таблиц, для тестируемых субстанций наименьшая концентрация антитела, при которой активация комплемента по альтернативному пути ингибировалась более чем на 90% (ПИ>90%), составляла не более 3,125 мкг/мл, что соответствовало 64-кратному молярному дефициту антитела по отношению к антигену и удовлетворяло установленным требованиям к качеству субстанции.
Таким образом, было получено антитело, обладающее ингибирующей активностью в концентрации по крайней мере в 4 раза меньшей, чем разработанное ранее антитело hC34.
Моноклональное антитело по настоящему изобретению может служить основой для создания лекарственных препаратов, блокирующих альтернативный путь активации системы комплемента, и потребует как минимум в 4 раза меньшего количества активной субстанции, чем ранее разработанные аналоги.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 КОМПОНЕНТА КОМПЛЕМЕНТА ЧЕЛОВЕКА, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), ЭКСПРЕССИОННЫЙ ВЕКТОР, СОДЕРЖАЩИЙ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), И ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА CHO-humC34-ПРОДУЦЕНТ ДАННОГО ГУМАНИЗИРОВАННОГО АНТИТЕЛА | 2016 |
|
RU2630647C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО СС3-4 К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 ЧЕЛОВЕКА, ШТАММ ГИБРИДНОЙ ДНК МЫШИ РККК(П)764Д - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА СС3-4 | 2015 |
|
RU2584582C1 |
| АНТИТЕЛА ПРОТИВ ИНТЕРЛЕЙКИНА 17 (ИЛ-17) ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2539029C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО CSF-1R И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2658603C2 |
| АНТИТЕЛА ПРОТИВ C3b И СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С КОМПЛЕМЕНТОМ НАРУШЕНИЙ | 2008 |
|
RU2473563C2 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА D И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2799044C2 |
| АНТИТЕЛА К Р-СЕЛЕКТИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ И ИДЕНТИФИКАЦИИ | 2011 |
|
RU2603097C2 |
| ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ГЛАЗ, ВЫЗВАННЫХ КОМПЛЕМЕНТОМ | 2008 |
|
RU2522976C2 |
| АНТИТЕЛА ПРОТИВ ПРОПЕРДИНА И ИХ ПОЛУЧЕНИЕ | 2021 |
|
RU2830308C1 |
| АНТИТЕЛА-АНТАГОНИСТЫ ПРОТИВ Notch3 И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С Notch3 ЗАБОЛЕВАНИЙ | 2007 |
|
RU2493167C2 |





Группа изобретений относится к области биотехнологии, медицине и иммунологии, в частности к антителу, связывающему компонент С3 комплемента человека и подавляющему активацию системы комплемента по альтернативному пути, и молекулам ДНК, кодирующим его легкую и тяжелую цепи. Гуманизированное антитело к конформационному эпитопу С3 компонента комплемента человека содержит вариабельную область легкой цепи по Seq ID No: 3 и вариабельную область тяжелой цепи по Seq ID No: 4. Гуманизированное моноклональное антитело не связывается с нативным С3, у которого тиоэфирная связь находится внутри молекулы, и не блокирует активацию комплемента по классическому пути. Полученное моноклональное антитело обладает в 4 раза большей ингибирующей активностью по сравнению с разработанным ранее моноклональным антителом hС34. Заявленное антитело может быть использовано для создания лекарственных препаратов, блокирующих альтернативный путь активации системы комплемента. 3 н.п. ф-лы, 4 табл., 2 пр.
1. Гуманизированное антитело к конформационному эпитопу С3 компонента комплемента человека, содержащее вариабельную область легкой цепи по Seq ID No: 3 и вариабельную область тяжелой цепи по Seq ID No: 4.
2. Последовательность ДНК, кодирующая легкую цепь гуманизированного антитела по п. 1, представленная на Seq ID No 1.
3. Последовательность ДНК, кодирующая тяжелую цепь гуманизированного антитела по п. 1, представленная на Seq ID No 2.
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 КОМПОНЕНТА КОМПЛЕМЕНТА ЧЕЛОВЕКА, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), ЭКСПРЕССИОННЫЙ ВЕКТОР, СОДЕРЖАЩИЙ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), И ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА CHO-humC34-ПРОДУЦЕНТ ДАННОГО ГУМАНИЗИРОВАННОГО АНТИТЕЛА | 2016 |
|
RU2630647C1 |
| АНТИТЕЛА ПРОТИВ C3b И СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С КОМПЛЕМЕНТОМ НАРУШЕНИЙ | 2008 |
|
RU2473563C2 |
| WO 2009114585 A1, 17.09.2009 | |||
| US 20090280116 A1, 12.11.2009 | |||
| HACK C | |||
| E | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| An analysis with monoclonal antibodies." The Journal of Immunology, 1988, 141(5): 1602-1609. | |||
Авторы
Даты
2019-05-15—Публикация
2018-05-30—Подача