ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивает приоритет предварительной заявки на патент США 62/457,477, поданной 10 февраля 2017 года, содержание которой полностью включено в настоящий документ посредством отсылки.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА НАУЧНЫХ ИССЛЕДОВАНИЙ ИЛИ РАЗРАБОТОК
Настоящее изобретение было сделано при правительственной поддержке по гранту NIH AI085596 и NIH AI117410, выданному Национальными институтами здравоохранения США (NIH). Правительство обладает некоторыми правами на изобретение.
УРОВЕНЬ ТЕХНИКИ
Система комплемента обеспечивает первую линию иммунной защиты организма от чужеродных патогенов. Комплемент также играет патогенную роль при воспалительных заболеваниях человека. Активация системы комплемента проходит по трем различным путям: классический путь (CP), лектиновый путь (LP) и альтернативный путь (AP). CP инициируется при связывании антигена–антитела. LP включается, когда маннозосвязывающие лектины (MBL) взаимодействуют с поверхностными молекулами сахаров на микроорганизмах. Активация обоих путей приводит к сборке CP C3 конвертазы C4b2a, хотя также может происходить прямое расщепление C3 MBL–ассоциированными сериновыми протеазами. AP представляет собой самоусиливающуюся петлю, регулируемую C3 конвертазой AP, C3bBb. Активация AP может происходить вторично по отношению к активации CP или LP или инициируется независимо. В последнем случае низкий уровень спонтанной "номинальной" активности C3 генерирует первичную C3bBb, которая быстро ускоряет AP в отсутствие достаточной регуляции. Таким образом, обычно предполагают, что активация AP на чужих поверхностях с отсутствием или недостаточной негативной регуляцией считается процессом по умолчанию, тогда как аутологичные клетки обычно избегают такого результата с помощью множества мембраносвязанных и присутствующих в жидкой фазе белков, ингибирующих комплемент. При некоторых условиях измененные, поврежденные или подвергшиеся стрессу аутологичные клетки и ткани также могут активировать AP и вызывать воспалительное повреждение.
Фактор D (FD) является важным ферментом для активации AP комплемента. Он расщепляет фактор B после того, как последний связывается с C3b, с образованием активной C3 конвертазы, C3bBb. Фактор D представляет собой сериновую протеазу размером приблизительно 24 кДа и циркулирует в крови как конститутивно активный фермент после образования из про–фактора D под действием фермента маннозо-связывающей лектин–ассоциированной сериновой протеазы–3 (MASP–3). По сравнению с другими белками комплемента в крови, концентрация фактора D в крови довольно низкая (приблизительно 2 мкг/мл). Хотя последний факт может указывать на то, что терапевтическое ингибирование активности фактора D в крови возможно и может быть легко достигнуто, предыдущие исследования показали, что фактор D обладает быстрым метаболизмом, и, соответственно, консенсус в области исследований комплемента заключается в том, что может не получиться блокировать фактор D системно. В данной области существует потребность в мАт против фактора D человека, которые могут системно ингибировать АР активность комплемента и, таким образом, лечить АР комплемент–зависимые патологии, при этом существует потребность в соответствующих моделях на животных для тестирования и использования таких мАт против фактора D человека. Настоящее изобретение направлено на удовлетворение этих и других потребностей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против фактора D и способам ингибирования альтернативного пути (AP) комплемента с применением антитела против фактора D.
В одном из вариантов осуществления изобретения предложена композиция, включающая антитела, которые специфично связываются с фактором D. В некоторых вариантах осуществления фактор D является фактором D человека. В некоторых вариантах осуществления антитела согласно изобретению являются моноклональными антителами. В некоторых вариантах осуществления антитела согласно изобретению являются гуманизированными антителами. В некоторых вариантах осуществления антитело по изобретению является химерным антителом. В некоторых вариантах осуществления антитело является полноразмерным антителом. В некоторых вариантах осуществления антитело является фрагментом антитела, который включает, без ограничения перечисленными, Fab, Fab', F(ab)2, F(ab')2 и scFv. В некоторых вариантах осуществления антитело является частью конструкции, например слитой конструкции, включающей антитело и направляющий фрагмент или эффекторный фрагмент. В некоторых вариантах осуществления антитело является частью конъюгированной конструкции, такой как конъюгированная конструкция антитела–лекарственного средства.
В одном из вариантов осуществления антитело по изобретению включает по меньшей мере одну из CDR–областей, выбранных из группы, состоящей из: VH–CDR1: SEQ ID NO:3; VH–CDR2: SEQ ID NO:4; VH–CDR3: SEQ ID NO:5; VL–CDR1: SEQ ID NO:8; VL–CDR2: SEQ ID NO:9; и VL–CDR3: SEQ ID NO:10 или их варианта или вариантов. В другом варианте осуществления антитело по изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:2 или ее вариант. В одном из вариантов осуществления антитело по изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO:7 или ее вариант. В другом варианте осуществления антитело по изобретению включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:2, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO:7, или их вариант или варианты.
В одном из вариантов осуществления антитело по изобретению включает по меньшей мере одну из CDR–областей, выбранных из группы, состоящей из: VH–CDR1: SEQ ID NO:13; VH–CDR2: SEQ ID NO:14; VH–CDR3: SEQ ID NO:15; VL–CDR1: SEQ ID NO:18; VL–CDR2: SEQ ID NO:19; и VL–CDR3: SEQ ID NO:20, или их вариант или варианты. В другом варианте осуществления антитело по изобретению является антителом, которое включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:12 или ее вариант. В одном из вариантов осуществления антитело по изобретению включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO:17 или ее вариант. В другом варианте осуществления антитело по изобретению является антителом, которое включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:12, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO:17, или их вариант или варианты.
В одном из вариантов осуществления антителом согласно изобретению является мАт 11–8A1 или мАт 1F10–5. В одном из вариантов осуществления антитело по изобретению является антителом, которое связывается с фактором D и конкурирует за связывание по меньшей мере с еще одним антителом против фактора D. В одном из вариантов осуществления антитело по изобретению является антителом, которое связывается с фактором D и конкурирует за связывание по меньшей мере с одним из антител против фактора D, описанных в настоящем документе. В другом варианте осуществления антитело по изобретению является антителом, которое связывается с фактором D и конкурирует за связывание с фактором D с антителом, обозначенным как мАт 11–8A1. В другом варианте осуществления антитело по изобретению является антителом, которое связывается с фактором D и конкурирует за связывание с фактором D с антителом, обозначенным как мАт 1F10–5.
В другом варианте осуществления изобретения предложен способ лечения заболевания или нарушения, опосредованного альтернативным путем (AP), у пациента, включающий этап введения указанному пациенту по меньшей мере одного антитела против фактора D. В различных вариантах осуществления заболевание или нарушение, опосредованное альтернативным путем (AP), по меньшей мере, выбрано из группы, состоящей из: макулодистрофии (МД), возрастной макулодистрофии (ВМД), ишемического и реперфузионного повреждения, артрита, ревматоидного артрита, астмы, аллергической астмы, синдрома пароксизмальной ночной гемоглобинурии (ПНГ), атипичного гемолитико–уремического синдрома (аГУС), буллезного эпидермолиза, сепсиса, трансплантации органа, воспаления (в том числе, без ограничения перечисленным, воспаления, связанного с хирургической операцией в условиях искусственного кровообращения и гемодиализом), C3 гломерулопатии, мембранозной нефропатии, гломерулонефрита (в том числе, без ограничения перечисленным, опосредованного антинейтрофильными цитоплазматическими антителами (АНЦА) гломерулонефрита, волчанки и их комбинаций), АНЦА–опосредованного васкулита, шигатоксин–индуцированного ГУС и вызванного антифосфолипидными антителами невынашивания, а также их комбинаций. В некоторых вариантах осуществления антитело против фактора D ингибирует альтернативный путь, но не ингибирует активацию классического пути и лектинового пути. В некоторых вариантах осуществления антитело против фактора D ингибирует образование белка C3bBb. В некоторых вариантах осуществления антитело против фактора D ингибирует влияние AP на последующую сигнализацию комплемента. В некоторых вариантах осуществления опосредованным AP заболеванием является C3 гломерулопатия. В некоторых вариантах осуществления опосредованным AP заболеванием является макулодистрофия, такая как возрастная макулодистрофия.
В одном из вариантов осуществления изобретения предложен способ снижения активности альтернативного пути системы комплемента пациента, включающий введение антитела пациенту путем введения, включающим энтеральное введение, парентеральное введение и их комбинацию, и где антитело включает шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:9 и SEQ ID NO:10, или их вариант или варианты. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложен способ снижения активности альтернативного пути системы комплемента пациента, включающий введение антитела пациенту путем введения, включающим энтеральное введение, парентеральное введение и их комбинацию, и где антитело включает шесть определяющих комплементарность областей, имеющие следующие аминокислотные последовательности: SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:18, SEQ ID NO:19 и SEQ ID NO:20, или их вариант или варианты. В другом варианте осуществления антитело является фрагментом антитела, включающим Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинации.
В одном из вариантов осуществления изобретения предложено выделенное антитело, которое связывается с фактором D человека, где антитело альтернативно связывается с любым из первого эпитопа и второго эпитопа фактора D, при этом первый эпитоп и второй эпитоп имеют части, которые принимают спиральную конформацию в своей вторичной структуре, и где часть фактора D, которая принимает конформацию бета–тяжа в своей вторичной структуре, расположена между первым эпитопом и вторым эпитопом. В другом варианте осуществления первый эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:21, и второй эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:22. В другом варианте осуществления первый эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:23, и второй эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:24. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций. В другом варианте осуществления антитело связывается с эпитопом фактора D, и где эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:21. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложено выделенное антитело, которое связывается с фактором D человека, где антитело связывается с эпитопом фактора D, и где эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:22. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложено выделенное антитело, которое связывается с фактором D человека, где антитело связывается с эпитопом фактора D, и где эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:23. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложено выделенное антитело, которое связывается с фактором D человека, где антитело альтернативно связывается с любым из первого эпитопа и второго эпитопа фактора D, где первый эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:21, и где второй эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:22. В другом варианте осуществления антитело состоит из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложен выделенный полипептид, который связывается с фактором D человека, где полипептид связывается с эпитопом фактора D, при этом эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:21 или SEQ ID NO:22, и полипептид включает по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:9 и SEQ ID NO:10, или их варианта или вариантов.
В одном из вариантов осуществления изобретения предложен выделенный полипептид, который связывается с фактором D человека, где полипептид связывается с эпитопом фактора D, при этом эпитоп имеет аминокислотную последовательность, которая включает SEQ ID NO:24, и полипептид включает по меньшей мере одну аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:18, SEQ ID NO:19 и SEQ ID NO:20, или их варианта или вариантов.
В одном из вариантов осуществления изобретения предложено антитело против фактора D человека, где антитело имеет вариабельную область тяжелой цепи (VH), которая имеет аминокислотную последовательность, которая больше чем на 90% (например, больше чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:2. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложено антитело против фактора D человека, где антитело имеет вариабельную область легкой цепи (VL), которая имеет аминокислотную последовательность, которая больше чем на 90% (например, больше чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:7. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложено антитело против фактора D человека, где антитело имеет вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где VH область имеет аминокислотную последовательность, которая больше чем на 90% (например, больше чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:2, и где VL область имеет аминокислотную последовательность, которая больше чем на 90% (например, больше чем на 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:7. В другом варианте осуществления антитело является фрагментом антитела, выбранным из группы, состоящей из Fab, Fab', F(ab)2, F(ab')2, scFv и их комбинаций.
В одном из вариантов осуществления изобретения предложена клетка, которая продуцирует антитело, где антитело направленно взаимодействует с фактором D. В одном из вариантов осуществления клетка является гибридомой. В другом варианте осуществления клетка является клеточной линией.
В другом варианте осуществления изобретения предложено генетически модифицированное, не относящееся к человеку животное, которое экспрессирует фактор D человека. В некоторых вариантах осуществления не относящееся к человеку животное является грызуном, таким как крыса или мышь. В одном из вариантов осуществления изобретения предложена генетически модифицированная мышь, которая экспрессирует фактор D человека. В одном из вариантов осуществления изобретения предложена генетически модифицированная мышь, которая экспрессирует фактор D человека, но не экспрессирует фактора D мыши. В другом варианте осуществления изобретения предложена генетически модифицированная мышь, которая экспрессирует фактор D человека с регуляторных элементов мыши, но не экспрессирует фактора D мыши.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Предыдущее краткое описание, а также последующее подробное описание примеров осуществления изобретения будет лучше понято при прочтении в сочетании с прилагаемыми чертежами. Однако следует понимать, что изобретение не ограничено точными структурами и техническими средствами вариантов осуществления, показанных на чертежах. На чертежах:
Фигура 1 – схема путей комплемента. Система комплемента может быть активирована тремя различными путями в зависимости от инициирующего стимула: классический путь (CP), лектиновый путь (LP) и альтернативный путь (AP) (Фигура 1). CP активируется в основном иммунными комплексами, состоящими из антигена и специфичного антитела. Связывание C1q с антителом, присоединенным к антигену, активирует C1r и C1s. Активированный C1s расщепляет C4 и C2. LP активируется, когда маннозосвязывающий лектин (MBL) связывается с маннозными группами микробных углеводов, активируя MBL–ассоциированные сериновые протеазы (MASP), и снова расщепляет C4 и C2. Продукты расщепления C4 и C2 образуют CP и LP C3 конвертазу, C4bC2a, которая расщепляет С3 с образованием С3b и С3а. Вторая молекула C3b может связываться с C4bC2a с образованием C5 конвертазы CP и LP. AP активируется, когда C3 подвергается спонтанному гидролизу и образует первичную C3 конвертазу AP, C3(H2O)Bb, в присутствии факторов B и D, что приводит к дополнительному расщеплению C3 и, в конечном счете, образованию C3 конвертазы AP (C3bBb) и C5 конвертазы AP (C3bBbC3b). Пропердин способствует активации AP, стабилизируя конвертазы AP. Все три пути завершаются образованием конвертаз, которые, в свою очередь, генерируют основные эффекторы системы комплемента: анафилатоксины (C4a/C3a/C5a), мембраноатакующий комплекс (MAC) и опсонины (например, C3b). Анафилатоксины являются мощными провоспалительными молекулами и образуются в результате расщепления C4, C3 и C5, соответственно. C5b образует комплекс при последовательном связывании белков C6–C9, что ведет к образованию MAC (C5b–9), который может непосредственно лизировать служащие мишенями поверхности. C3b индуцирует фагоцитоз опсонизированных мишеней, а также служит для усиления активации комплемента по пути AP.
На Фигуре 2 показаны результаты экспериментов, демонстрирующих дозо-зависимое ингибирование ЛПС–индуцированной активации AP комплемента мАт против фактора D человека, 11–8A1 и 1F10–5. Оба мАт эффективно ингибировали активацию AP комплемента при добавлении к 50% нормальной человеческой сыворотке (НЧС) в конечной концентрации 5 мкг/мл или выше. Образец с добавлением ЭДТА служил в качестве отрицательного контроля (ЭДТА блокирует активацию комплемента). Образец без добавления мАт (0 Ab) служил в качестве базового уровня активации AP комплемента. Эксперимент проводили в буфере GVB–ЭГТА–Mg++. Планшеты для ИФА покрывали ЛПС, 37°C, 1 час. НЧС предварительно инкубировали с мАт перед добавлением в планшет. Активацию AP комплемента обнаруживали путем измерения количества осаждаемого C3 на поверхности планшета (OD450).
На Фигуре 3 показана нуклеотидная и аминокислотная последовательность последовательностей вариабельных областей тяжелой (SEQ ID NO:1; SEQ ID NO:2) и легкой (SEQ ID NO:6; SEQ ID NO:7) цепей мАт 11–8A1, включая CDR–области (VH–CDR1: SEQ ID NO:3; VH–CDR2: SEQ ID NO:4; VH–CDR3: SEQ ID NO:5; VL–CDR1: SEQ ID NO:8; VL–CDR2: SEQ ID NO:9; VL–CDR3: SEQ ID NO:10) мАт 11–8A1.
На Фигуре 4 показана нуклеотидная и аминокислотная последовательность последовательностей вариабельных областей тяжелой (SEQ ID NO:11; SEQ ID NO:12) и легкой (SEQ ID NO:16; SEQ ID NO:17) цепей мАт 1F10–5, включая CDR–области (VH–CDR1: SEQ ID NO:13; VH–CDR2: SEQ ID NO:14; VH–CDR3: SEQ ID NO:15; VL–CDR1: SEQ ID NO:18; VL–CDR2: SEQ ID NO:19; VL–CDR3: SEQ ID NO:20) мАт 1F10–5.
На Фигуре 5 показаны результаты экспериментов по оценке относительной активности мАт 11–8A1 и 1F10–5 при блокировании ЛПС–индуцированной активации AP комплемента у человека, обезьяны, морской свинки и мыши. Способность мАт 11A8–1 и 1F10–5 ингибировать активность альтернативного пути в сыворотках различных видов млекопитающих исследовали при использовании ЛПС–AP анализа. Планшеты для ИФА покрывали ЛПС, 37°C, 1 час, затем добавляли 50% нормальной сыворотки человека, обезьяны, морской свинки или мыши, разведенной в GVB–Mg++–ЭГТА и инкубировали при 37°C в течение 1 часа перед обнаружением осаждения C3 с использованием антител против С3 человека или антител против С3 мыши. Для мАт 11–8A1 концентрации 5–20 мкг/мл были достаточными для ингибирования активации AP комплемента человека, тогда как мАт 11–8A1 не могло ингибировать активацию AP комплемента мыши, морской свинки, обезьяны (резуса и циномолгуса). Для мАт 1F10–5 концентрации 5–20 мкг/мл были достаточными для ингибирования активации комплемента АР человека, тогда как мАт 1F10–5 не могло ингибировать активацию АР комплемента мыши и морской свинки. МАт 1F10–5 в концентрации 10 или 20 мкг/мл эффективно ингибировало активацию AP комплемента яванского макака. С другой стороны, 50 мкг/мл мАт 1F10–5 вызывало частичное ингибирование активации АР комплемента макака–резуса.
На Фигуре 6 показаны результаты эксперимента, в котором сравнивали активность полученного из гибридомы мышиного 11–8A1 и рекомбинантного химерного 11–8A1 (вариабельная область 11–8A1+константная область человеческого IgG4) при блокировании ЛПС–индуцированной активации AP комплемента человека. Планшеты для ИФА покрывали ЛПС, 37°C, 1 час, затем добавляли 50% нормальную человеческую сыворотку (НЧС), разведенную в GVB–Mg++–ЭГТА, и инкубировали при 37°C в течение 1 часа перед обнаружением осаждения C3 при использовании антител против C3 человека. НЧС с добавлением ЭДТА использовали в качестве отрицательного контроля (ЭДТА). При концентрациях 1,25–10 мкг/мл обе формы мАт 11–8A1 были достаточными для ингибирования активации AP комплемента человека, при этом не наблюдали никакого различия по активности.
На Фигуре 7 показаны результаты экспериментов, в которых сравнивали антигенсвязывающую аффинность полученных из гибридомы мышиного мАт 11–8A1 и рекомбинантного химерного мАт 11–8A1 при использовании BiaCore. Очищенный фактор D человека связывали на чипе CM4 при использовании метода аминосочетания. Анализ BiaCore выполняли на приборе BiaCore–2000. Чип регененрировали между каждым связыванием при использовании 50 мМ NaOH. Две формы мАт 11–8A1 показали аналогичную аффинность.
На Фигуре 8 показаны результаты измерения антигенсвязывающей аффинности мАт 1F10–5 при использовании BiaCore. Очищенный фактор D человека связывали на чипе CM4 при использовании метода аминосочетания. Анализ BiaCore выполняли на приборе BiaCore–2000. Чип регененрировали между каждым связыванием при использовании 50 мМ NaOH. При определении Kd 1F10–5 составило 1,5 E–10 М.
На Фигуре 9, включая Фигуры 9А–9D, показаны результаты картирования эпитопов для мАт 11–8A1 с использованием делеционных конструкций. (Фигура 9A) Показанная последовательность (228 аминокислот) является зрелой формой фактора D человека без пропептида. Аминокислоты 107–110 (SEQ ID NO:21), 130–134, 148–151 (SEQ ID NO:22) и 178–184 подчеркнуты. (Фигура 9B) Схематическая диаграмма интактного и 9 мутантов с делециями фактора D человека для картирования эпитопов. Эти белки экспрессировали в клетках CHO. (Фигура 9C) Подтверждение экспрессии белка. Рекомбинантные интактный и делеционные мутанты фактора D человека из супернатанта (Sup) или из лизата (CL) клеток CHO подвергали иммуноблоттингу с антителом козы против фактора D человека. “+” и “–” обозначают положительное и отрицательное обнаружение, соответственно. (Фигура 9D) Реактивность мАт 11–8A1 в отношении полноразмерного и делеционных мутантных белков оценивали с помощью Вестерн–блоттинга (WB) с поликлональным антителом козы против фактора D человека после иммунопреципитации (IP) с мАт 11–8A1. “+” и “–”обозначают положительное и отрицательное обнаружение, соответственно. NT – не исследовали.
Для картирования областей или сайтов в факторе D человека, которые являются важными для связывания мАт, мАт 11–8A1 тестировали на реактивность с серией мутантов с делециями в полноразмерном (Full) факторе D человека. Вестерн–блоттинг с использованием поликлонального антитела козы против фактора D человека подтвердил экспрессию большинства мутантов с делециями при ожидаемой молекулярной массе. Однако в нескольких попытках не удалось получить рекомбинантные белкис с делецией–6 и 9. Как показано на Фигуре 9, мАт 11–8A1 распознавало Full, делецию–2 и 4, но не распознавало делецию–1, 3, 5, 7 и 8. Эти результаты подтверждают, что делеция четырех аминокислот PLPW в положениях 107–110 (SEQ ID NO:21) или VLDR в положениях 148–151 (SEQ ID NO:22) нарушала связывание с мАт 11–8A1.
На Фигуре 10 показаны результаты картирования эпитопов для мАт 11–8A1 с помощью сайт–направленного мутагенеза. Исследования с сайт–направленным мутагенезом проводили для подтверждения двух сайтов связывания (107–110 и 148–151) в факторе D человека, которые влияют на распознавание мАт 11–8A1. Производили замену четырех аминокислот PLPW в положениях 107–110 или VLDR в положениях 148–151 на остатки аланина (AAAA). Клетки СНО трансфицировали векторами для получения мутантного белка. Экспрессию мутантного белка в супернатантах и лизатах клеток (через 48 часов после трансфекции) подтверждали с помощью Вестерн–блоттинга при использовании поликлонального антитела козы против фактора D человека. Обе мутации, как и ожидали, нарушали распознавание белка мАт 11–8A1 при IP с последующим Вестерн–блоттингом с антителами козы против фактора D человека. Результаты исследований мутантов с делециями и мутагенеза (PLPW–AAAA и VLDR–AAAA) показали, что четыре аминокислоты, расположенные в PLPW107–110 и VLDR148–151 фактора D человека, являются ключевыми для активности связывания и функционального блокирования 11–8A1.
На Фигуре 11, включая Фигуры 11А–11D, показана схема получения мышей с нокаутом фактора D человека. (Фигура 11A) Схематические диаграммы, на которых представлены конструкции, направленно воздействующие на фактор D человека, локус фактора D мыши, аллель–мишень и неоделетированный аллель (сверху вниз). кДНК фактора D человека кодирует весь белок из 253 аминокислот, включающий сигнальный пептид, пропептид и зрелый пептид. Пунктирными линиями обозначены сайты интеграции кДНК фактора D человека в ген фактора D мыши. Положение зонда для скрининга клеток ES указано внизу на диаграммах. Сокращенные обозначения: сайты рестрикции BamHI (B), HindIII (H), NotI (N) и XhoI (X). FRT, мишень, распознаваемая флиппазой. LoxP, локус кроссинговера в P1. (Фигура 11B) Кодирующая последовательность фактора D человека фланкирована 5' и 3'–некодирующими последовательностями фактора D мыши в направляющей конструкции. Последовательность нуклеиновой кислоты фактора D человека подчеркнута (SEQ ID NO:25), и сайт рестриктазы XhoI выделен жирным шрифтом, и последовательность нуклеиновой кислоты 5' и 3'–нетранслируемой области фактора D мыши показана заглавными и строчными буквами, соответственно. (Фигура 11C) Данные Саузерн–блоттинга, показывающие, что положительный клон клеток ES продуцировал два рестрикционных фрагмента BamHI (5 тому подобноен. и 4,5 тому подобноен.), тогда как репрезентативный нецелевой клон клеток ES продуцировал только полосу 5 тому подобноен. (Фигура 11D) ПЦР генотипирование мышей дикого типа (WT), мышей с нокаутом, гетерозиготных (Het) и гомозиготных (Homo) по фактору D человека, при использовании специфичных к фактору D человека (размер мишени: 450 пн) 5'–GTC AGG GTG CCA TGC AGG AG–3'(SEQ ID NO:26) и 5'–CCC AGG AGA ACC TGC ACC TTC–3' (SEQ ID NO:27), специфичных к фактору D мыши (размер мишени: 292 пн) 5'–CCTCCCACCCTTAGCTATCC–3 '(SEQ ID NO:28) и 5'–ACCCAGACTGTGTCCCTCAC–3' (SEQ ID NO:29).
На Фигуре 12, включая Фигуры 12A и 12B, показаны результаты экспериментов по оценке экспрессии фактора D человека в сыворотке мышей с нокаутом фактора D человека. Вестерн–блоттинг и ИФА проводили для подтверждения присутствия белка фактора D человека в сыворотке мышей с нокаутом фактора D человека. Образцы сыворотки получали у мышей с 3 разными генотипами: дикого типа, гетерозиготных и гомозиготных. НЧС и сыворотку мыши с нокаутом по фактору D мыши (fDKO) использовали для контроля анализа. (Фигура 12A) С помощью Вестерн–блоттинга с использованием поликлональных антител против фактора D человека детектировали полосу белка массой 24 кДа, соответствующую фактору D человека, в нормальной человеческой сыворотке (НЧС), а также у гетерозиготных и гомозиготных мышей с нокаутом фактора D человека (HDKI), тогда как в сыворотке мышей дикого типа (–/–) и гетерозиготных HDKI мышей была обнаружена полоса массой приблизительно 40–45 кДа, соответствующая фактору D мыши. (Фигура 12B) Экспрессия белка фактора D человека может быть подтверждена с помощью сэндвич–ИФА у гомозиготных мышей HDKI. Планшет покрывали поликлональным антителом против фактора D человека (R&D, AF1824). После инкубирования с разведенной сывороткой (1/2 или 1/5) фактор D человека детектировали при использовании биотин–конъюгированного антитела козы против фактора D человека с последующим добавлением HRP–конъюгированного стрептавидина. Как и ожидали, фактор D человека был обнаружен в НЧС, контрольных лунках с рекомбинантным фактором D человека и в сыворотке гомозиготных мышей с нокаутом фактора D человека, но не обнаружен у мышей дикого типа.
На Фигуре 13 показаны результаты экспериментов по оценке ЛПС–индуцированной активности АР комплемента в сыворотке мышей с нокаутом фактора D человека. Даже в отсутствие мышиного фактора D активность AP комплемента была обнаружена у гомозиготных мышей с нокаутом фактора D человека, что указывает на то, что фактор D человека, экспрессируемый у этих мышей, являлся функциональным in vivo. Как показано, анализ ЛПС–индуцированной активации AP комплемента указывает, что гомозиготные мыши с нокаутом фактора D человека, а также мыши дикого типа обладали активностью AP комплемента в сыворотке. С другой стороны, в этом анализе активность АР комплемента не была обнаружена ни в сыворотке мышей с нокаутом по фактору D, ни в сыворотке мышей WT, ни в обработанной ЭДТА сыворотке гомозиготных мышей с нокаутом. Эти наблюдения продемонстрировали, что экспрессия фактора D человека могла восстанавливать активность АР комплемента у мыши, и что мыши с нокаутом могут использоваться в качестве экспериментальной модели на животных для исследования терапии, направленной на фактор D, при заболеваниях и нарушениях, опосредованных АР комплементом.
На Фигуре 14 показаны результаты экспериментов по оценке in vivo активности и кинетики мАт 11–81A у мышей с нокаутом фактора D человека. Гомозиготной мыши с нокаутом фактора D человека вводили 1 мг (в/б) мАт 11–8A1. Образцы сыворотки собирали до инъекции (0 часов) и затем в различные моменты времени после инъекции и исследовали на ЛПС–индуцированную активацию AP комплемента. Как показано, в сыворотке мышей с нокаутом по фактору D или в НЧС, обработанной ЭДТА, активность AP комплемента отсутствовала. Напротив, активность AP комплемента была обнаружена в НЧС и в сыворотке гомозиготных мышей с нокаутом фактора D человека в момент 0 часов (до введения мАт). Активность AP комплемента у гомозиготных мышей с нокаутом фактора D человека была ингибирована через 6 часов и в день 1–5 после введения мАт 11–8A1. Активность AP комплемента возвращалась к нормальному уровню в день 7. Эти результаты указывают, что в дозе 1 мг/мышь мАт 11–8A1 могло ингибировать активность AP комплемента in vivo до 3–5 дней.
На Фигуре 15 показаны результаты экспериментов по оценке in vivo активности и кинетики мАт 1F10–5 и нерелевантного контрольного мАт (MOPC) у мышей с нокаутом фактора D человека. Гомозиготной мыши с нокаутом фактора D человека (HDKI) вводили 1 мг (в/б) мАт 1F10–5 или мАт изотипического контроля (MOPC, мышиный IgG1). Образцы сыворотки собирали до инъекции (0 часов) и затем в различные моменты времени после инъекции и исследовали на ЛПС–индуцированную активацию AP комплемента. Изменения уровней циркулирующего фактора D человека в образцах сыворотки до и после обработки, оценивали с помощью Вестерн–блоттинга при использовании поликлонального антитела козы против фактора D человека. Как показано, в сыворотке мыши с нокаутом по фактору D (DKO) или в сыворотке WT, обработанной ЭДТА, активность AP комплемента отсутствовала. Напротив, активность AP комплемента была обнаружена в сыворотке WT и в сыворотке гомозиготной мыши HDKI в момент 0 часов (до введения мАт). После введения мАт 1F10–5, активность AP комплемента у гомозиготной мыши HDKI была ингибирована в различной степени между 6 часами и днем 5. Она возвращалась к нормальному уровню в день 7. Эти результаты указывают, что мАт 1F10–5 могло вызвать длительное ингибирование активности AP комплемента при системном введении. Данные Вестерн–блоттинга показали накопление фактора D человека в крови вследствие образования комплексов фактора D/антитела к фактору D. Свободный фактор D человека экскретировался из почки и присутствовал в моче мышей HDKI. Повышение уровней фактора D человека в крови мышей HDKI позволяет предположить, что комплексы фактора D/антитела к фактору D не могли экскретироваться через почки. мАт изотипического контроля, MOPC, не ингибировало активность AP комплемента у гомозиготной мыши HDKI и при этом это не вызывало накопления фактора D человека в крови.
На Фигуре 16 показаны результаты экспериментов по оценке активности in vivo и кинетики мАт 11–8A1 у мышей с нокаутом фактора D человека во время длительного лечения. Непрерывное введение мАт 11A8–1 двум гомозиготным мышам с нокаутом фактора D человека (HDKI) (мыши #3 и #21, мАт вводили раз в 4 дня в дозе 1 мг/мышь) вызывало устойчивое ингибирование активности AP комплемента в течение 4–х недельного периода. Как и в предыдущем эксперименте с однократным введением дозы, мАт 118A–1 вызывало накопление фактора D человека в крови, однако фактор D в конечном счете достигал стационарного уровня у обеих обработанных мышей, что определяли с помощью Вестерн–блоттинга. Вместе эти данные показали, что при введении индивиду мАт против фактора D в соответствующих дозах и интервалах можно вызвать устойчивое ингибирование системной активности АР комплемента.
На Фигуре 17, включая Фигуры 17A и 17B, показаны результаты экспериментов по оценке терапевтической эффективности мАт 11–8A1 в предотвращении IgG–индуцированного артрита у мышей K/BxN. (Фигура 17A) Восприимчивость гомозиготных мышей с нокаутом фактора D человека (HDKI) к артриту K/BxN. В этой модели сыворотку или очищенный IgG мышей K/BxN с артритом адоптивно переносили мышам C57BL/6 для индукции артрита высокоэффективным способом. Заболевание демонстрирует много характерных признаков ревматоидного артрита человека, включающих утолщение голеностопного сустава, опухание и прогрессирующее разрушение суставов. Как показано на панели A, как и мыши дикого типа C57BL/6, мыши HDKI также были восприимчивы к артриту K/BxN, что подтверждалось увеличением толщины голеностопного сустава и клиническим показателем после адоптивного переноса IgG мышей K/BxN. Эти данные подтверждали, что фактор D человека был полностью функционален у мышей в условиях AP комплемент–опосредованного заболевания. (Фигура 17B). Терапевтическая эффективность мАт 11–8A1 при артрите K/BxN у мышей HDKI. Введение мАт 11–8A1 (1 мг/мышь, раз в 4 дня, с началом введения до переноса IgG мышей K/BxN) значительно снижало тяжесть симптомов артрита, что подтверждалось уменьшением толщины голеностопного сустава и клиническим показателем по сравнению с мышами, получавшими контрольное мАт (MOPC). Эти результаты продемонстрировали, что можно снизить тяжесть локального повреждения, вызванного активацией комплемента, путем системного направленного воздействия на фактор D.
На Фигуре 18 показаны результаты экспериментов по оценке терапевтической эффективности мАт 11–8A1 в предотвращении внесосудистого гемолиза (EVH) с использованием мыши с нокаутом фактора D человека в качестве модели. Гомозиготным мышам с нокаутом фактора D человека (HDKI) переливали эритроциты (Э) мышей дикого типа и мышей с тройным нокаутом Crry/DAF/C3 (TKO). Реципиентным мышам HDKI за 24 часа до переноса эритроцитов вводили мАт 118A–1 (2 мг/мышь, в/б) или PBS. Смесь 1:1 меченных DDAO–SE WT и меченных CFSE TKO эритроцитов (Эр) вводили реципиентным мышам в хвостовую вену. Через 5 минут и через 1, 2 и 3 дня после переливания эритроцитов у реципиентных мышей забирали кровь и исследовали эритроциты для определения процента перелитых эритроцитов, оставшихся в кровотоке. Количество CFSE–меченных TKO Эр у каждого реципиента нормализовали (в %) по DDAO–SE–меченным Эр WT в каждой временной точке. У реципиентных мышей HDKI без обработки мАт эритроциты TKO быстро подвергались элиминации в результате EVH, в соответствии с полученными ранее данными (Miwa et al., 2002, Blood 99: 3707–3716). Однако у реципиентных мышей HDKI, получавших мАт 11–8A1 против фактора D человека, EVH не наблюдали, при этом перелитые эритроциты TKO сохранялись. Эти результаты демонстрируют, что мАт против фактора D человека был эффективным в профилактике EVH.
На Фигуре 19, включая Фигуры 19A–19D, показано картирование эпитопов мАт 1F10–5 с использованием делеционной конструкции. На Фигуре 19A в зрелой последовательности фактора D человека выделены аминокислоты 132–135, 155–159 (SEQ ID NO:23), 173–176 (SEQ ID NO:24) и 202–208. На Фигуре 19B показана схематическая диаграмма четырех мутантов с делецией фактора D человека для картирования эпитопов. Эти белки были получены в клетках млекопитающих. На Фигуре 19C показаны результаты, подтверждающие экспрессию белка. Супернатант (Sup) и лизат клеток (CL) полноразмерного фактора D и мутантов с делецией подвергали иммуноблоттингу с антителами козы против фактора D человека. На Фигуре 19D показана реактивность мАт 1F10–5 по отношению к полноразмерному белку и мутантным белкам с делецией согласно оценке с помощью ИФА. Эти результаты указывают, что делеция аминокислот NRRTH в положениях 155–159 (SEQ ID NO:23) или SNRR в положениях 173–176 (SEQ ID NO:24) нарушала связывание с мАт 1F10–5.
На Фигуре 20 показаны результаты примерных экспериментов по оценке активности мАт 11–8A1, 1F10–5 и 166–32 in vivo у мышей с нокаутом фактора D человека. Для оценки эффективности мАт 166–32 (см. патент США 8,124,090, Tanox), 11–8A1 и 1F10–5 при блокировании активности альтернативного пути (AP) комплемента in vivo, гуманизированных по фактору D мышей подвергали многократному введению доз (1 мг/мышь, раз в 3 дня, п/к введение). Образцы плазмы собирали до введения мАт (время 0) и через 6 часов, 1, 3, 6 и 9 дней после введения мАт и исследовали на ЛПС–индуцированную активность AP комплемента. Активность AP комплемента в различные моменты времени нормализовали относительно 100% значений, полученных в момент времени 0. Данные показали, что мАт 11–8A1 и 1F10–5 обладали превосходной фармакодинамической активностью in vivo по сравнению с мАт 166–32. В частности, мАт 11–8A1 единообразно ингибировало 80–90% активности АР комплемента во всех временных точках после введения мАт, тогда как мАт 166–32 вызывало сопоставимое ингибирование только через 6 часов и 1 день после введения мАт. мАт 1F10–5 показало 50% ингибирование АР комплемента в день 9, тогда как ингибирование активности АР комплемента под действием мАт 166–32 в день 9 почти не наблюдалось.
На Фигуре 21 показаны результаты примерных экспериментов по оценке in vivo активности химерного мАт 11–8A1 и химерного AFD у мышей с нокаутом фактора D человека. Для оценки эффективности 11–8A1/человеческого IgG4 химерного мАт и AFD/человеческого IgG4 химерного мАт при блокировании активности альтернативного пути (AP) комплемента in vivo, гуманизированных по фактору D мышей подвергали многократному введению доз (1 мг/мышь, раз в 3 дня, п/к введение). Образцы плазмы собирали до введения мАт (время 0) и через 6 часов, 1, 3, 6, 9, 12 и 15 дней после введения мАт и исследовали ЛПС–индуцированную активность AP комплемента. Активность AP комплемента в различных временных точках нормализовало относительно 100% значений, полученных в момент времени 0. AFD представляет собой гуманизированный вариант мАт 166–32 (см. Katschke et al., J Biol Chem. 2012 Apr 13; 287:12886–12892, WO/2008/055206, патент США 8,372,403, патент США 8,273,352, заявка на патент США 2014/0212433). Данные показали, что 11–8A1/человеческое IgG4 химерное мАт было намного более активным и показало намного лучший фармакодинамический профиль, чем AFD/человеческое IgG4 химерное мАт. В частности, тогда как оба мАт вызывали 90–100% ингибирование через 6 часов и 1 день после введения мАт, 11–8A1/человеческое IgG4 химерное мАт, но не AFD/человеческое IgG4 химерное мАт, вызвало больше чем 75% ингибирование активности AP комплемента в день 6–15.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ингибированию альтернативного пути (AP) комплемента с применением антитела против фактора D. В различных вариантах осуществления изобретение направлено на композиции и способы лечения AP–опосредованного заболевания или AP–опосредованного нарушения у пациента путем контакта пациента с антителом против фактора D. AP–опосредованные патологии и состояния, которые можно лечить с применением композиций и способов согласно изобретению, включают, без ограничения перечисленными, макулодистрофию (МД), возрастную макулодистрофию (ВМД), ишемическое и реперфузионное повреждение, артрит, ревматоидный артрит, астму, аллергическую астму, синдром пароксизмальной ночной гемоглобинурии (ПНГ), атипичный гемолитико–уремический синдром (аГУС), буллезный эпидермолиз, сепсис, трансплантацию органа, воспаление (в том числе, без ограничения перечисленным, воспаление, связанное с хирургической операцией в условиях искусственного кровообращения и гемодиализом), C3 гломерулопатию, мембранозную нефропатию, гломерулонефрит (в том числе, без ограничения перечисленным, опосредованный антинейтрофильными цитоплазматическими антителами (АНЦА) гломерулонефрит, волчанку и их комбинации), АНЦА–опосредованный васкулит, шигатоксин–индуцированный ГУС и вызванное антифосфолипидными антителами невынашивание или любые их комбинации.
Определения
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое обычно известно специалисту в области техники, к которой относится настоящее изобретение. Хотя любые материалы и методы, подобные или эквивалентные тем, которые описаны в настоящем документе, могут использоваться при практическом осуществлении или тестировании настоящего изобретения, описаны иллюстративные материалы и методы.
При использовании в настоящем документе каждый из следующих терминов имеет значение, связанное с ним в данном разделе.
Термины "ингибировать" и "ингибирование" при использовании в настоящем документе означают снижать, подавлять, уменьшать или блокировать активность или функцию по меньшей мере приблизительно на 10% относительно контрольного значения. В некоторых вариантах осуществления активность подавлена или блокирована на 50% по сравнению с контрольным значением или на 75%, или на 95%.
Термины "эффективное количество" и "фармацевтически эффективное количество" относятся к достаточному количеству средства, которое обеспечивает требуемый биологический результат. Такой результат может являться снижением и/или облегчением признаков, симптомов или причин заболевания или нарушения или любым другим требуемым изменением в биологической системе. Подходящее эффективное количество в любом отдельном случае может быть определено средним специалистом в данной области при использовании стандартных экспериментов.
Термины "пациент", "индивид", "лицо" и тому подобное используются в настоящем документе попеременно и относятся к любому животному, в некоторых вариантах осуществления млекопитающему, и в некоторых вариантах осуществления человеку, имеющему систему комплемента, в том числе человеку, нуждающемуся в терапии состояния или его последствий или подверженному состоянию или его последствиям. Пациент может включать, например, собак, кошек, свиней, коров, овец, коз, лошадей, крыс, обезьян, а также мышей и людей.
Термин "отклоняющийся от нормы" при использовании в отношении организмов, тканей, клеток или их компонентов относится к таким организмам, тканям, клеткам или их компонентам, которые отличаются по меньшей мере одной заметной или поддающейся обнаружению характеристикой (например, возрастом, лечением, временем суток и т.д.) от тех организмов, тканей, клеток или их компонентов, которые демонстрируют "нормальную" (ожидаемую/гомеостатическую) соответствующую характеристику. Характеристики, которые являются нормальными или предполагаемыми для одной клетки, типа ткани или индивида, могут быть отклоняющимися от нормы для другой клетки или типа ткани.
"Заболевание" является состоянием здоровья индивида, когда индивид не может поддерживать гомеостаз, и если заболевание не устраняется, то тогда состояние здоровья индивида продолжает ухудшаться.
В отличие от этого, "нарушение" у индивида является состоянием здоровья, при котором индивид способен поддерживать гомеостаз, но при котором состояние здоровья индивида менее благоприятное, нежели в отсутствие нарушения. Без лечения нарушение не обязательно приводит к дальнейшему ухудшению состояния здоровья индивида.
Заболевание или нарушение "облегчаются", если тяжесть признака или симптома заболевания или нарушения, частота, с которой такой признак или симптом возникают у пациента, или и то, и другое, уменьшаются.
"Эффективное количество" или "терапевтически эффективное количество" соединения является таким количеством соединения, которое достаточно, чтобы произвести благоприятный эффект у индивида, которому вводят соединение.
При использовании в настоящем документе "инструкционный материал" включает публикацию, запись, диаграмму или любое другое средство выражения, которое может использоваться для описания полезности соединения, композиции, вектора или системы доставки согласно изобретению, в наборе для облегчения различных заболеваний или нарушений, указанных в настоящем документе. Необязательно или альтернативно инструкционный материал может описывать один или более способов облегчения заболеваний или нарушений в клетке или ткани млекопитающего. Инструкционный материал в наборе согласно изобретению может, например, быть прикреплен к контейнеру, который содержит идентифицированное соединение, композицию, вектор или систему доставки согласно изобретению, или отправлен вместе с контейнером, который содержит идентифицированное соединение, композицию, вектор или систему доставки. В альтернативе инструкционный материал может быть отправлен отдельно от контейнера с намерением, чтобы инструкционный материал и соединение применялись реципиентом совместно.
"Функционально связанный" при использовании в настоящем документе может означать, что экспрессия гена находится под контролем промотора, с которым он пространственно связан. Промотор может быть расположен 5' (перед) или 3' (после) гена, находящегося под его контролем. Расстояние между промотором и геном может быть приблизительно таким же, как расстояние между этим промотором и геном, который он контролирует в гене, из которого происходит промотор. Как известно в данной области техники, изменение этого расстояния может быть выполнено без потери функции промотора.
"Терапевтическое лечение" является лечением, назначаемым индивиду, который демонстрирует симптомы заболевания или нарушения, с целью уменьшения или устранения таких признаков.
При использовании в настоящем документе "лечение заболевания или нарушения" означает уменьшение частоты и/или тяжести признака и/или симптома заболевания или нарушения, испытываемого пациентом.
Фраза "биологический образец", "образец" или "проба" при использовании в настоящем документе включает любой образец, содержащий клетку, ткань или физиологическую жидкость, в которой может быть обнаружена экспрессия нуклеиновой кислоты или полипептида. Биологический образец может содержать любой биологический материал, подходящий для обнаружения требуемых биомаркеров, и может содержать клеточный и/или бесклеточный материал, полученный от пациента. Примеры таких биологических образцов включают, без ограничения, кровь, лимфу, костный мозг, биоптат и мазки. Образцы, которые по своей природе являются жидкими, именуются в настоящем документе "биологическими жидкостями". Биологические образцы могут быть получены от пациента различными способами, в том числе, например, путем соскоба или смазывания участка, или с помощью иглы, для получения физиологических жидкостей. Способы взятия различных проб у пациента хорошо известны в данной области.
Термин "антитело" при использовании в настоящем документе относится к молекуле иммуноглобулина, которая способна специфично связываться с определенным эпитопом антигена. Антитела могут быть интактными иммуноглобулинами, полученными из природных источников или из рекомбинантных источников, и могут быть иммунореактивными частями интактных иммуноглобулинов. Антитела в настоящем изобретении могут существовать во множестве форм, включающих, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела ("интратела"), Fv, Fab, Fab', F(ab)2 и F(ab')2, а также одноцепочечные антитела (scFv), антитела из тяжелых цепей, такие как антитела верблюдовых, и гуманизированные антитела (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879–5883; Bird et al., 1988, Science 242:423–426).
Под термином "синтетическое антитело" при использовании в настоящем документе подразумевается антитело, которое получено при использовании технологии рекомбинантных ДНК, такое как, например, антитело, экспрессируемое бактериофагом. Также следует понимать, что данный термин означает антитело, которое было получено в результате синтеза молекулы ДНК, кодирующей антитело, при этом такая молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, определяющую антитело, где последовательность ДНК или аминокислоты была получена при использовании технологии синтетических последовательностей ДНК или аминокислотных последовательностей, которая доступна и хорошо известна в уровне техники.
При использовании в настоящем документе термин "антитело из тяжелых цепей" или "антитела из тяжелых цепей" включает молекулы иммуноглобулинов, полученные из видов верблюдовых или путем иммунизации пептидом и последующего выделения сыворотки, или путем клонирования и экспрессии последовательностей нуклеиновых кислот, кодирующих такие антитела. Термин "антитело из тяжелых цепей" или "антитела из тяжелых цепей" также охватывает молекулы иммуноглобулинов, выделенные у индивида с болезнью тяжелых цепей или полученные при клонировании и экспрессии генов VH (вариабельной области тяжелой цепи иммуноглобулинов) индивида.
"Химерное антитело" относится к типу сконструированного антитела, которое содержит природную вариабельную область (легкую цепь и тяжелые цепи), полученную из донорного антитела, в сочетании с константными областями легкой и тяжелой цепи, полученными из акцепторного антитела.
"Гуманизированное антитело" относится к типу сконструированного антитела, CDR–области которого получены из нечеловеческого донорного иммуноглобулина, а остальные части молекулы иммуноглобулина получены из одного или более иммуноглобулинов человека. Кроме того, остатки каркасной области могут быть изменены с сохранением аффинности связывания (см., например, 1989, Queen et al., Proc. Natl. Acad Sci USA, 86:10029–10032; 1991, Hodgson et al., Bio/Technology, 9:421). Подходящее человеческое акцепторное антитело может быть антителом, которое выбрано из общедоступной базы данных, например, из базы данных KABAT, базы данных Los Alamos и базы данных Swiss Protein, по гомологии с нуклеотидной и аминокислотной последовательностями донорного антитела. Антитело человека, отличающееся гомологией с каркасными областями донорного антитела (на основе аминокислот), может подходить для получения константной области тяжелой цепи и/или вариабельной области тяжелой цепи для вставки донорных CDR–областей. Подходящее акцепторное антитело, способное давать константные или вариабельные каркасные области легкой цепи, может быть выбрано аналогичным образом. Следует отметить, что тяжелые и легкие цепи акцепторного антитела не должны обязательно происходить из одного и того же акцепторного антитела. В предшествующем уровне техники описано несколько способов получения таких гуманизированных антител (см., например, EP–A–0239400 и EP–A–054951).
Термин "донорное антитело" относится к антителу (моноклональному и/или рекомбинантному), из которого аминокислотные последовательности его вариабельных областей, CDR–областей или других функциональных фрагментов или аналогов передают первому иммуноглобулину–партнеру, с получением измененной кодирующей области иммуноглобулина, и в результате экспрессируется измененное антитело с характеристиками антигенной специфичности и нейтрализирующей активности донорного антитела.
Термин "акцепторное антитело" относится к антителу (моноклональному и/или рекомбинантному), гетерологичному по отношению к донорному антителу, из которого все (или любую часть, но в некоторых вариантах осуществления все) аминокислотные последовательности, кодирующие его каркасные области тяжелой и/или легкой цепи, и/или его константные области тяжелой и/или легкой цепи передают первому иммуноглобулину–партнеру. В некоторых вариантах осуществления человеческое антитело является акцепторным антителом.
"CDR–области" определяют как определяющие комплементарность области аминокислотных последовательностей антитела, которые представляют собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельной части иммуноглобулина содержатся три CDR (или CDR–области) тяжелой цепи и три CDR легкой цепи. Таким образом, термин "CDR" при использовании в настоящем документе относится ко всем трем CDR–областям тяжелой цепи или всем трем CDR–областям легкой цепи (или ко всем CDR тяжелой цепи и ко всем CDR легкой цепи, при необходимости). Структура и укладывание антитела могут означать, что другие остатки считаются частью антигенсвязывающей области и будут известны специалисту в данной области. См., например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p 877–883.
При использовании в настоящем документе "иммуноанализ" относится к любому анализу связывания, в котором антитело, способное специфично связываться с молекулой–мишенью, используется для обнаружения и количественного определения молекулы–мишени.
Под термином "специфично связывается", при использовании в настоящем документе в отношении антитела, подразумевается антитело, которое распознает и связывается с определенной молекулой–мишенью, но по существу не распознает или не связывает другие молекулы в образце. В некоторых случаях термины "специфичное связывание" или "специфично связывающий" используются для обозначения, что распознавание и связывание зависят от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на молекуле–мишени. Если, например, антитело специфично связывается с эпитопом "A", присутствие немеченой молекулы, содержащей эпитоп A (или свободный, немеченый A) в реакции, содержащей меченый "A" и антитело, будет уменьшать количество меченого "A", связавшегося с антителом.
Система "CRISPR/Cas" относится к широко распространенному классу бактериальных систем для защиты против чужеродной нуклеиновой кислоты. Системы CRISPR/Cas обнаружены в целом ряде эубактерий и архей. Системы CRISPR/Cas включают I, II и III подтипы. В природных системах CRISPR/Cas II типа используется РНК–опосредованная нуклеаза, Cas9, в комплексе с направляющей и активирующей РНК, для распознавания и расщепления чужеродной нуклеиновой кислоты. Гомологи Cas9 обнаружены в большом разнообразии эубактерий, включающих, без ограничения, бактерий следующих таксономических групп: Actinobacteria, Aquificae, Bacteroidetes–Chlorobi, Chlamydiae–Verrucomicrobia, Chlroflexi, Cyanobacteria, Firmicutes, Proteobacteria, Spirochaetes и Thermotogae. Примером белка Cas9 является белок Cas9 Streptococcus pyogenes. Дополнительные белки Cas9 и их гомологи описаны, например, в публикациях Chylinksi, et al., RNA Biol. 2013 May 1; 10(5):726–737; Nat. Rev. Microbiol. 2011 June; 9(6):467–477; Hou, et al., Proc Natl Acad Sci U S A. 2013 Sep 24; 110(39):15644–9; Sampson et al., Nature. 2013 May 9; 497(7448):254–7; и Jinek, et al., Science. 2012 Aug 17; 337(6096):816–21.
"Кодирующая область" гена состоит из нуклеотидных остатков кодирующей цепи гена и нуклеотидов некодирующей цепи гена, которые являются гомологичными или комплементарными, соответственно, кодирующей области молекулы мРНК, которая образуется в результате транскрипции гена.
"Кодирующая область" молекулы мРНК также состоит из нуклеотидных остатков молекулы мРНК, которые совпадают с антикодоновой областью молекулы транспортной РНК в ходе трансляции молекулы мРНК или кодируют стоп–кодон. Кодирующая область, таким образом, может включать нуклеотидные остатки, включающие кодоны аминокислотных остатков, которые не присутствуют в зрелом белке, кодируемом молекулой мРНК (например, аминокислотных остатков в сигнальной последовательности экспорта белка).
"Дифференциально сниженная экспрессия" или "ингибирование" относятся к уровням продукта биомаркера, которые ниже по меньшей мере на 10% или больше, например, на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% или меньше, и/или ниже в 2,0 раза, 1,8 раза, 1,6 раза, 1,4 раза, 1,2 раза, 1,1 раза, или меньше, включая все возможные целые или дробные приращения между указанными значениями, по сравнению с контролем.
"Дифференциально повышенная экспрессия" или "активация" относятся к уровням продукта биомаркера, которые выше по меньшей мере на 10% или больше, например, на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% или больше, и/или выше в 1,1 раза, 1,2 раза, 1,4 раза, 1,6 раза, 1,8 раза, 2,0 раза или больше, включая все возможные целые или дробные приращения между указанными значениями, по сравнению с контролем.
"Комплементарный", при использовании в настоящем документе в отношении нуклеиновой кислоты, относится к широкой концепции комплементарности последовательностей между областями двух цепей нуклеиновой кислоты или между двумя областями одной и той же цепи нуклеиновой кислоты. Известно, что остаток аденина первой области нуклеиновой кислоты способен образовывать специфические водородные связи ("спаривание оснований") с остатком второй области нуклеиновой кислоты, которая антипараллельна первой области, если таким остатком является тимин или урацил. Аналогичным образом, известно, что остаток цитозина первой цепи нуклеиновой кислоты способен образовывать пару оснований с остатком второй цепи нуклеиновой кислоты, которая антипараллельна первой цепи, если таким остатком является гуанин. Первая область нуклеиновой кислоты комплементарна второй области той же или другой нуклеиновой кислоты, если в том случае, когда две области расположены антипараллельно, по меньшей мере один нуклеотидный остаток первой области способен образовывать пару оснований с остатком второй области. В некоторых вариантах осуществления первая область содержит первую часть, а вторая область содержит вторую часть, при этом, когда первая и вторая части расположены антипараллельно, по меньшей мере приблизительно 50% или по меньшей мере приблизительно 75%, или по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95% нуклеотидных остатков первой части способны образовывать пару оснований с нуклеотидными остатками во второй части. В некоторых вариантах осуществления все нуклеотидные остатки первой части способны образовывать пару оснований с нуклеотидными остатками во второй части.
Термин "ДНК" при использовании в настоящем документе определен как дезоксирибонуклеиновая кислота.
"Кодирующий" относится к неотъемлемому свойству определенных последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матрицы для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК), либо определенную последовательность аминокислот, и в результате обладающих определенными биологическими свойствами. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей такому гену, приводят к образованию белка в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно представлена в списках последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут быть указаны как кодирующие белок или другой продукт этого гена, или кДНК.
Если не определено иное, "нуклеотидная последовательность, кодирующая аминокислотную последовательность" включает все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга и которые кодируют одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, которая кодирует белок или РНК" также может включать интроны в такой степени, в которой нуклеотидная последовательность, кодирующая белок, может, в некотором варианте, содержать интрон(ы).
"Выделенный" означает измененный или удаленный из естественного состояния. Например, нуклеиновая кислота или пептид, обычно присутствующие в нормальных условиях в организме живого индивида, не являются "выделенными", но при этом та же нуклеиновая кислота или пептид, частично или полностью отделенные от сопутствующих материалов своего природного окружения, являются "выделенными". Выделенная нуклеиновая кислота или белок могут существовать по существу в очищенной форме или могут существовать в ненативном окружении, таком как, например, клетка–хозяин.
Термин "гибридома" при использовании в настоящем документе относится к клетке, полученной в результате слияния B–лимфоцита и партнера по слиянию, такого как миеломная клетка. Гибридому можно клонировать и поддерживать в клеточной культуре в течение неопределенного времени, при этом она способна продуцировать моноклональные антитела. Гибридому также можно считать гибридной клеткой.
"Выделенная нуклеиновая кислота" относится к сегменту или фрагменту нуклеиновой кислоты, который был отделен от последовательностей, которые фланкируют его в естественном состоянии, т.е. фрагменту ДНК, который был удален из последовательностей, которые обычно граничат с фрагментом, т.е. последовательностей, граничащих с фрагментом в геноме, в котором он существует в естественном состоянии. Термин также относится к нуклеиновым кислотам, которые были по существу очищены от других компонентов, которые обычно сопутствуют нуклеиновой кислоте, т.е. РНК или ДНК, или белки, которые обычно сопутствуют ей в клетке. Данный термин, таким образом, включает, например, рекомбинантную ДНК, которая включена в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая существует как отдельная молекула (т.е. как кДНК или геномный фрагмент, или фрагмент кДНК, полученный с помощью ПЦР или при расщеплении эндонуклеазами рестрикции), независимо от других последовательностей. Он также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность.
В рамках данного изобретения используются следующие сокращения для обычных оснований нуклеиновых кислот. "А" соответствует аденозину, "C" соответствует цитозину, "G" соответствует гуанозину, "T" соответствует тимидину, и "U" соответствует уридину.
Термин "полинуклеотид" при использовании в настоящем документе определен как цепь нуклеотидов. Кроме того, нуклеиновые кислоты являются полимерами нуклеотидов. Таким образом, нуклеиновые кислоты и полинуклеотиды при использовании в настоящем документе являются взаимозаменяемыми. Специалисту в данной области известно, что нуклеиновые кислоты являются полинуклеотидами, которые могут быть гидролизованы до мономерных "нуклеотидов". Мономерные нуклеотиды могут быть гидролизованы до нуклеозидов. Используемые в настоящем документе полинуклеотиды включают, без ограничения перечисленными, все последовательности нуклеиновых кислот, которые получены любыми способами, доступными в уровне техники, в том числе, без ограничения, рекомбинантными способами, то есть при клонировании последовательностей нуклеиновых кислот из рекомбинантной библиотеки или генома клетки с применением обычной технологии клонирования и ПЦР и тому подобное, а также с помощью методов синтеза.
При использовании в настоящем документе термины "пептид", "полипептид" и "белок" используются попеременно и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должны содержать по меньшей мере две аминокислоты, при этом никакое ограничение не накладывается на максимальное количество аминокислот, которые может включать последовательность белка или пептида. Полипептиды включают любой пептид или белок, включающий две или более аминокислот, соединенных друг с другом пептидными связями. При использовании в настоящем документе термин относится как к коротким цепям, которые также обычно называют в уровне техники пептидами, олигопептидами и олигомерами, например, так и к более длинным цепям, которые обычно называют в уровне техники белками, множество типов которых известно. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки и другие. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию.
Термин "потомство" при использовании в настоящем документе относится к потомку или потомству и включает потомство млекопитающего, а также включает дифференцированную или недифференцированную дочернюю клетку, полученную из родительской клетки. В одном применении термин потомство относится к дочерней клетке, которая генетически идентична родителю. В другом применении термин потомство относится к дочерней клетке, которая генетически и фенотипически идентична родителю. В еще одном применении термин потомство относится к дочерней клетке, которая дифференцировалась из родительской клетки.
Термин "РНК" при использовании в настоящем документе определен как рибонуклеиновая кислота.
Термин "рекомбинантная ДНК" при использовании в настоящем документе определен как ДНК, полученная в результате соединения фрагментов ДНК из разных источников.
Термин "рекомбинантный полипептид" при использовании в настоящем документе определен как полипептид, полученный при помощи методов рекомбинантных ДНК.
При использовании в настоящем документе "конъюгированный" относится к ковалентному присоединению одной молекулы ко второй молекуле.
"Вариант" в качестве термина, используемого в настоящем документе, представляет собой последовательность нуклеиновой кислоты или пептидную последовательность, которая отличается по последовательности от эталонной последовательности нуклеиновой кислоты или последовательности пептида соответственно, но сохраняет существенные биологические свойства эталонной молекулы. Изменения в последовательности варианта нуклеиновой кислоты могут не затрагивать аминокислотную последовательность пептида, кодируемую эталонной нуклеиновой кислотой, или могут приводить к аминокислотным заменам, вставкам, делециям, слияниям и усечениям. Изменения в последовательности вариантов пептидов обычно ограничены или являются консервативными, в результате последовательности эталонного пептида и варианта в целом очень похожи, а во многих областях идентичны. Вариант и эталонный пептид могут отличаться по аминокислотной последовательности одной или более заменами, вставками, делециями в любой комбинации. Вариант нуклеиновой кислоты или пептида может быть природным, таким как аллельный вариант, или может быть вариантом, который, как известно, не существует в природе. Не существующие в природе варианты нуклеиновых кислот и пептидов могут быть получены методами мутагенеза или путем прямого синтеза. В различных вариантах вариантная последовательность по меньшей мере на 99%, по меньшей мере на 98%, по меньшей мере на 97%, по меньшей мере на 96%, по меньшей мере на 95%, по меньшей мере на 94%, по меньшей мере на 93%, по меньшей мере на 92%, по меньшей мере на 91%, по меньшей мере на 90%, по меньшей мере на 89%, по меньшей мере на 88%, по меньшей мере на 87%, по меньшей мере на 86%, по меньшей мере на 85% идентична эталонной последовательности.
Термин "регуляторный" при использовании в настоящем документе может означать любой способ изменения уровня или активности субстрата. Неограничивающие примеры регуляции в отношении белка включают в себя воздействие на экспрессию (включая транскрипцию и/или трансляцию), воздействие на укладывание, воздействие на деградацию или метаболизм белка и воздействие на локализацию белка. Неограничивающие примеры регуляции в отношении фермента дополнительно включают воздействие на ферментативную активность. "Регулятор" относится к молекуле, активность которой включает воздействие на уровень или активность субстрата. Регулятор может быть прямым или непрямым. Регулятор может функционировать, вызывая активацию или ингибирование или модуляцию своего субстрата иным образом.
"Окно сканирования" при использовании в настоящем документе относится к сегменту ряда смежных положений, в которых последовательность может быть оценена независимо от какой–либо фланкирующей последовательности. Окно сканирования обычно перемещают с определенным шагом по оцениваемой последовательности, при этом каждый новый сегмент оценивают независимо. Шаг перемещения может включать 1 или больше одного положения.
"Вектор" при использовании в настоящем документе может означать последовательность нуклеиновой кислоты, содержащую точку начала репликации. Вектор может быть плазмидой, бактериофагом, бактериальной искусственной хромосомой или дрожжевой искусственной хромосомой. Вектор может быть ДНК или РНК вектором. Вектор может быть либо самореплицирующимся внехромосомным вектором, либо вектором, который интегрируется в геном хозяина.
Термин "размножение" используется в настоящем документе для обозначения размножения биологического вида с получением в результате по меньшей мере одного потомка.
Термин "естественное размножение" используется в настоящем документе для обозначения размножения биологического вида путем полового скрещивания.
Термин "инбредное животное" используется в настоящем документе для обозначения животного, которое было скрещено с другими подобными животными того же вида для сохранения и закрепления некоторых признаков или для предотвращения введения других признаков в популяцию скрещиваемых особей.
Термин "аутбредное животное" используется в настоящем документе для обозначения животного, которое скрещивается с любым другим животным или индивидами тех же видов без учета сохранения некоторых признаков.
Диапазоны: по всему тексту настоящего описания различные аспекты изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона предназначено лишь для удобства и краткости, и не должно считаться жестким ограничением объема изобретения. Таким образом, следует считать, что описание диапазона конкретно раскрывает все возможные поддиапазоны, а также отдельные числовые значения в данном диапазоне. Например, описание диапазона, такого как от 1 до 6, должно рассматриваться как прямо раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 6 и т. д., а также отдельные числа в пределах данного диапазона, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применимо независимо от ширины диапазона.
Описание
Данное изобретение относится к ингибированию альтернативного пути (АР) комплемента с применением антитела против фактора D человека. В одном из вариантов осуществления изобретение направлено на способы лечения и предотвращения воспаления и аутоиммунных заболеваний, опосредованных нежелательной, неконтролируемой, избыточной активацией АР комплемента. В одном из вариантов осуществления изобретение направлено на лечение AP–опосредованного заболевания или AP–опосредованного нарушения у пациента путем контакта пациента с антителом против фактора D.
В одном из вариантов осуществления изобретения предложен способ лечения AP–опосредованного заболевания или нарушения у пациента, включающий этап введения указанному пациенту антитела против фактора D с ингибированием, в результате, образования белкового комплекса C3bBb. Примеры опосредованных комплементом патологий, которые можно лечить с применением способов согласно изобретению, включают, без ограничения перечисленным, макулодистрофию (МД), возрастную макулодистрофию (ВМД), ишемическое и реперфузионное повреждение, артрит, ревматоидный артрит, астму, аллергическую астму, синдром пароксизмальной ночной гемоглобинурии (ПНГ), атипичный гемолитико–уремический синдром (аГУС), буллезный эпидермолиз, сепсис, трансплантацию органа, воспаление (в том числе, без ограничения перечисленным, воспаление, связанное с хирургической операцией в условиях искусственного кровообращения и гемодиализом), C3 гломерулопатию, мембранозную нефропатию, гломерулонефрит (в том числе, без ограничения перечисленным, опосредованный антинейтрофильными цитоплазматическими антителами (АНЦА) гломерулонефрит, волчанку и их комбинации), АНЦА–опосредованный васкулит, шигатоксин–индуцированный ГУС и вызванное антифосфолипидными антителами не вынашивание, а также их комбинации.
Способность иммунной системы различать "свои" и "чужие" антигены жизненно важна для функционирования иммунной системы как специфической защиты против проникших извне микроорганизмов. "Чужие" антигены являются антигенами на веществах, поступающих или присутствующих в организме, которые заметно отличаются от или являются чужеродными по отношению к собственным компонентам в организме индивида, тогда как "свои" антигены являются антигенами, которые у здорового индивида заметно не отличаются или не являются чужеродными по отношению к собственным компонентам его организма. В различных вариантах осуществления способов активация AP, которая ингибирована, является активацией, которая была инициирована по меньшей мере одним из группы, состоящей из микробного антигена, небиологической чужеродной поверхности, "измененной своей" ткани или их комбинаций. Одним из примеров небиологической чужеродной поверхности является кровопроводящие магистрали, такие как используемые в аппаратах искусственного кровообращения или гемодиализе. Примеры измененных своих тканей включают апоптотические, некротические и ишемизированные ткани и клетки или их комбинации.
В некоторых вариантах осуществления антитела против фактора D согласно изобретению ингибируют АР, но не ингибируют активацию классического пути (СР) или лектинового пути (LP). Как правило, CP инициируют комплексы антигена–антитела, LP активируется при связывании лектинов с молекулами сахара на поверхности микробов, тогда как AP конститутивно активен на низком уровне, но может быстро усиливаться на поверхности бактериальных клеток, вирусов и паразитарных клетках при отсутствии регуляторных белков. Клетки–хозяева обычно защищены от активации АР комплемента регуляторными белками. Однако в некоторых ситуациях, например, когда регуляторные белки являются дефектными или отсутствуют, АР также может неконтролируемо активироваться на клетках–хозяевах, что приводит к комплемент–опосредованному заболеванию или нарушению. CP состоит из компонентов C1, C2, C4 и совпадает с AP на этапе активации C3. LP состоит из маннозосвязывающих лектинов (MBL) и MBL–ассоциированных сериновых протеаз (Masp) и имеет общие с CP компоненты, C4 и C2. AP состоит из компонентов C3 и нескольких факторов, таких как фактор B, фактор D и регулятор в жидкой фазе, фактор H. Активация комплемента состоит из трех этапов: (a) распознавание, (b) ферментативная активация и (c) атака мембраны, вызывающая гибель клетки. Первая фаза активации комплемента CP начинается с C1. C1 состоит из трех отдельных белков: распознающей субъединицы, C1q, и субкомпонентов сериновых протеаз, C1r и C1s, которые связываются с образованием кальций–зависимого тетрамерного комплекса, C1r2 s2. Интактный C1 комплекс необходим для физиологической активации C1. Активация происходит, когда интактный C1 комплекс связывается с иммуноглобулином, связанным в комплексе с антигеном. Это связывание активирует C1s, который затем расщепляет белки C4 и C2 с образованием C4a и C4b, а также C2a и C2b. Фрагменты C4b и C2a объединяются с образованием C3 конвертазы, C4b2a, которая, в свою очередь, расщепляет C3 с образованием C3a и C3b. Активацию LP инициирует связывание MBL с некоторыми сахарами на поверхности мишени, которое вызывает активацию Masp протеаз, которые затем расщепляют C4 и C2 способом, аналогичным активности C1s в CP, что приводит к образованию C3 конвертазы, C4b2a. Таким образом, CP и LP активируются разными механизмами, но они включают одни и те же компоненты, C4 и C2, и оба пути приводят к образованию одной и той же C3 конвертазы, C4b2a. Расщепление C3 при воздействии C4b2a с образованием C3b и C3a является главным событием пути комплемента по двум причинам. Оно инициирует петлю амплификации AP, поскольку связанный на поверхности C3b является центральным интермедиатом AP. C3a и C3b являются биологически важными. C3a является провоспалительным, и вместе с C5a их называют анафилатоксинами. C3b и его последующие продукты расщепления также связываются с рецепторами комплемента, присутствующими на нейтрофилах, эозинофилах, моноцитах и макрофагах, тем самым способствуя фагоцитозу и клиренсу C3b–опсонизированных частиц. Наконец, C3b может связываться с C4b2a с образованием C5 конвертазы CP и LP, активирующей терминальную последовательность комплемента, которая приводит к образованию C5a, мощного провоспалительного медиатора, и сборке литического мембраноатакующего комплекса (MAC), C5–С9.
Считается, что AP конститутивно активен на низком уровне вследствие спонтанного гидролиза C3 с образованием C3(H2O). C3(H2O) ведет себя подобно C3b, так как он может связываться с fB, что делает fB восприимчивым к расщеплению fD и активации. Образующийся в результате C3(H2O)Bb затем расщепляет C3 с образованием C3b и C3a, инициируя каскад AP при образовании C3 конвертазы AP, C3bBb. Поскольку исходная С3 конвертаза генерирует растущее количество C3b, устанавливается петля амплификации. Следует отметить, что, поскольку при CP и LP также образуется C3b, где C3b может связывать фактор B и запускать AP, цмкл амплификации AP также участвует в CP и LP при активации этих путей. Таким образом, AP состоит из двух функциональных компонентов: независимого пути активации комплемента, который не связан с CP или LP, и процесса амплификации, который уже участвует в CP и LP и способствует проявлению CP и LP в полной мере. Таким образом, в некоторых вариантах осуществления антитела против фактора D согласно изобретению ингибируют процесс амплификации или петлю амплификации.
В одном из вариантов осуществления активностью АР, которая ингибируется с применением способа согласно изобретению, является активация АР, индуцированная по меньшей мере одним из группы, выбранной из липополисахарида (ЛПС), липоолигосахарида (ЛОС), патоген–ассоциированных молекулярных паттернов (PAMP) и ассоциированных с опасностью молекулярных паттернов (DAMP). В другом варианте осуществления активностью АР, которая ингибируется с применением способа согласно изобретению, является образование белкового комплекса C3bBb. В другом варианте осуществления активность АР, которая ингибируется с применением способа согласно изобретению, является зависимой от фактора D.
В некоторых вариантах осуществления способы согласно настоящему изобретению сохраняют способность пациента бороться с инфекцией посредством CP и LP. В одном из вариантов осуществления изобретения предложен способ ингибирования активации AP, индуцированной бактериальным липо-олигосахаридом (ЛОС) у пациента, включающий этап введения указанному пациенту антитела против фактора D и, таким образом, ингибирования активации AP, индуцированной бактериальным ЛОС, у пациента. В другом варианте осуществления в настоящем документе предложен способ ингибирования активации AP, индуцированной бактериальным ЛПС. В некоторых вариантах осуществления активация AP индуцирована ЛПС S.typhosa, и ингибиторы, применяемые в способах, представленных в настоящем документе, не ингибируют активность AP, индуцированную ЛПС S.minnesota или ЛПС E.coli. В различных вариантах осуществления антитела против фактора D согласно изобретению ингибируют AP, но не ингибируют CP–инициированную активацию комплемента, LP–инициированную активацию комплемента, зимозан–индуцированную активацию или индуцированную фактором яда кобры активацию.
В одном из вариантов осуществления в настоящем документе предложен способ ингибирования опосредованной патоген–ассоциированным молекулярным паттерном активации AP у пациента, включающий этап введения указанному пациенту антитела против фактора D, ингибируя, таким образом, PAMP–опосредованную активацию AP у пациента. Примеры PAMP, вызванная которым активация AP может быть ингибирована способами согласно изобретению, включают, без ограничения перечисленными, мурамилдипептид (MDP), CpG мотив из бактериальной ДНК, двухцепочечные вирусные РНК, пептидогликан, липотейхоевую кислоту, поверхностный белок A Borrelia burgdorferi, синтетический микоплазменный макрофаг–активирующий липопротеин–2, трипальмитоил–цистеинил–серил–(лизил)3–лизин (P3CSK4), дипальмитоил–CSK4 (P2–CSK4), монопальмитоил–CSK4 (PCSK4), амфотерицин B, триацилированный или диацилированный бактериальный полипептид и их комбинации.
В одном из вариантов осуществления изобретения предложен способ ингибирования инициации активации AP у пациента, включающий этап введения указанному пациенту антитела против фактора D, ингибируя, таким образом, инициацию активации AP у пациента. В другом варианте осуществления в настоящем документе предложен способ ингибирования амплификации активации AP у пациента, включающий этап введения указанному пациенту ингибитора AP, ингибируя, таким образом, амплификацию активации AP у пациента. Примерами этих вариантов осуществления являются пациенты с ПНГ, которые страдают AP комплемент–опосредованным гемолизом, и пациенты, страдающие AP комплемент–опосредованным аГУС, астмой, ишемическим/реперфузионным повреждением, ревматоидным артритом и АНЦА–опосредованными заболеваниями почек. В различных вариантах осуществления изобретения заболевания и нарушения, которые можно лечить с применением композиций и способов согласно изобретению, включают, без ограничения, AP комплемент–опосредованный гемолиз, AP комплемент–опосредованный аГУС, астму, ишемическое/реперфузионное повреждение, ревматоидный артрит и АНЦА–опосредованные заболевания почек или нарушения функции почек.
В различных вариантах осуществления в настоящем документе предложены способы идентификации потенциального антитела, обладающего ингибирующим действием в отношении AP, включающие этапы: a) введение антитела против фактора D пациенту; b) определение полученного фенотипа пациента; и c) сравнение полученного фенотипа пациента с фенотипом животного с нокаутом фактора D–/–. В другом варианте осуществления антитело против фактора D, применяемое в способах, предложенных в настоящем документе, идентифицировано способом отбора потенциального терапевтического соединения с применением животного с нокаутом фактора D–/–.
В различных других вариантах осуществления в настоящем документе предложены способы идентификации потенциального антитела против фактора D, обладающего ингибирующим действием в отношении АР. Один такой способ включает следующие этапы: a) покрытие планшета липополисахаридом (ЛПС); b) промывку планшета для удаления несвязавшегося ЛПС; c) добавление бычьего сывороточного альбумина (BSA) в фосфатно–солевом буфере (PBS); d) промывку планшета для удаления несвязавшегося BSA; e) добавление смеси кандидатного соединения антитела против фактора D, которое было предварительно инкубировано с сывороткой и смешано с нормальной человеческой сывороткой; f) промывку планшета; g) добавление HRP–конъюгированного антитела против C3 человека; h) промывку планшета для удаления несвязавшегося антитела; i) добавление реагента субстрата HRP; j) добавление серной кислоты для остановки реакции; k) измерение оптической плотности при 450 нм; l) сравнение оптической плотности планшета, содержащего кандидатное соединение антитела против фактора D, с оптической плотностью положительного сравнительного контроля и отрицательного сравнительного контроля; где при уменьшении оптической плотности по сравнению с положительным сравнительным контролем идентифицируют антитело против фактора D.
Антитела против фактора D
В некоторых вариантах осуществления изобретение включает композиции, включающие антитело, которое специфично связывается с фактором D. В одном из вариантов осуществления антитело против фактора D является поликлональным антителом. В еще одном варианте осуществления антитело против фактора D является моноклональным антителом. В некоторых вариантах осуществления антитело против фактора D является химерным антителом. В других вариантах осуществления антитело против фактора D является гуманизированным антителом. В некоторых вариантах осуществления антитело является фрагментом антитела. В некоторых вариантах осуществления фактор D является фактором D человека.
В некоторых вариантах осуществления связывание антитела или фрагмента антитела с фактором D человека ассоциировано со снижением образования C3bBb в пути активации комплемента в интактном организме. В некоторых вариантах осуществления изобретения предложен белок или полипептид, способный связываться с фактором D человека. В некоторых вариантах осуществления антитело или фрагмент антитела; белок или полипептид связываются с соответствующей частью или фракцией или эпитопом фактора D человека; и связывание антитела или фрагмента антитела, или белка или полипептида с соответствующей частью фактора D человека ассоциировано со снижением образования C3bBb в интактном организме.
В некоторых вариантах осуществления связывающее антитело против фактора D или фрагмент связывающего антитела против фактора D конъюгированы с белком, пептидом или другим соединением. В некоторых вариантах осуществления белок, пептид или другое соединение, с которым конъюгировано антитело против фактора D или фрагмент такого антитела, является направляющим фрагментом (т.е. направляющий фрагмент специфично связывается с другой молекулой, отличной от фактора D). В некоторых вариантах осуществления белок, пептид или другое соединение, с которым конъюгировано антитело против фактора D или фрагмент такого антитела, является эффекторной молекулой (например, цитотоксической молекулой).
В одном из вариантов осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает по меньшей мере одну из CDR–областей, выбранных из группы, состоящей из: VH–CDR1: SEQ ID NO:3; VH–CDR2: SEQ ID NO:4; VH–CDR3: SEQ ID NO:5; VL–CDR1: SEQ ID NO:8; VL–CDR2: SEQ ID NO:9; и VL–CDR3: SEQ ID NO:10, или их варианта или вариантов. В другом варианте осуществления антитело против фактора D включает все CDR–области из группы, состоящей из: VH–CDR1: SEQ ID NO:3; VH–CDR2: SEQ ID NO:4; VH–CDR3: SEQ ID NO:5; VL–CDR1: SEQ ID NO:8; VL–CDR2: SEQ ID NO:9; и VL–CDR3: SEQ ID NO:10, или их варианта или вариантов.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:3, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR1: SEQ ID NO:8, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:3; и VL–CDR1: SEQ ID NO:8.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:4, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR2: SEQ ID NO:9, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:4; и VL–CDR2: SEQ ID NO:9.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:5, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR3: SEQ ID NO:10, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:5; и VL–CDR3: SEQ ID NO:10.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:3, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:4, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:5, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VL–CDR1, включающую аминокислотную последовательность SEQ ID NO:8, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VL–CDR2, включающую аминокислотную последовательность SEQ ID NO:9, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR3, включающую аминокислотную последовательность SEQ ID NO:10, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:3, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:4, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:5; VL–CDR1, включающую аминокислотную последовательность SEQ ID NO:8, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VL–CDR2, включающую аминокислотную последовательность SEQ ID NO:9, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR3, включающую аминокислотную последовательность SEQ ID NO:10.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:3; VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:4; VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:5; VL–CDR1, включающую аминокислотную последовательность SEQ ID NO:8; VL–CDR2, включающую аминокислотную последовательность SEQ ID NO:9; и VL–CDR3, включающую аминокислотную последовательность SEQ ID NO:10.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:2, или ее вариант. В других вариантах осуществления антитело против фактора D включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO:7, или ее вариант. В другом варианте осуществления антитело против фактора D является моноклональным антителом, обозначенным мАт 11–8A1. Моноклональное антитело против фактора D, обозначенное мАт 11–8A1, включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:2, или ее вариант, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO:7, или ее вариант. В некоторых вариантах осуществления моноклональное антитело против фактора D гуманизировано. В некоторых вариантах осуществления моноклональное антитело против фактора D, обозначенное мАт 11–8A1, является химерным антителом.
В одном из вариантов осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает по меньшей мере одну из CDR–областей, выбранных из группы, состоящей из: VH–CDR1: SEQ ID NO:13; VH–CDR2: SEQ ID NO:14; VH–CDR3: SEQ ID NO:15; VL–CDR1: SEQ ID NO:18; VL–CDR2: SEQ ID NO:19; и VL–CDR3: SEQ ID NO:20 или их варианта или вариантов. В другом варианте осуществления антитело против фактора D включает все CDR–области из группы, состоящей из: VH–CDR1: SEQ ID NO:13; VH–CDR2: SEQ ID NO:14; VH–CDR3: SEQ ID NO:15; VL–CDR1: SEQ ID NO:18; VL–CDR2: SEQ ID NO:19; и VL–CDR3: SEQ ID NO:20 или их варианта или вариантов.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:13, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR1: SEQ ID NO:18, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:13; и VL–CDR1: SEQ ID NO:18.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:14, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR2: SEQ ID NO:19, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:14; и VL–CDR2: SEQ ID NO:19.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:15, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR3: SEQ ID NO:20, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:15; и VL–CDR3: SEQ ID NO:20.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:13, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:14, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:15, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VL–CDR1, включающую аминокислотную последовательность SEQ ID NO:18, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VL–CDR2, включающую аминокислотную последовательность SEQ ID NO:19, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR3, включающую аминокислотную последовательность SEQ ID NO:20, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:13, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:14, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:15; VL–CDR1, включающую аминокислотную последовательность SEQ ID NO:18, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; VL–CDR2, включающую аминокислотную последовательность SEQ ID NO:19, или ее вариант, включающий до приблизительно 3 (например, приблизительно 1, 2 или 3) аминокислотных замен; и VL–CDR3, включающую аминокислотную последовательность SEQ ID NO:20.
В некоторых вариантах осуществления антитело против фактора D или его антигенсвязывающий фрагмент включает: VH–CDR1, включающую аминокислотную последовательность SEQ ID NO:13; VH–CDR2, включающую аминокислотную последовательность SEQ ID NO:14; VH–CDR3, включающую аминокислотную последовательность SEQ ID NO:15; VL–CDR1, включающую аминокислотную последовательность SEQ ID NO:18; VL–CDR2, включающую аминокислотную последовательность SEQ ID NO:19; и VL–CDR3, включающую аминокислотную последовательность SEQ ID NO:20.
В некоторых вариантах осуществления антитело против фактора D включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:12, или ее вариант. В других вариантах осуществления антитело против фактора D включает легкую цепь, включающую аминокислотную последовательность SEQ ID NO:17, или ее вариант. В другом варианте осуществления антитело против фактора D является моноклональным антителом, обозначенным мАт 1F10–5. Моноклональное антитело против фактора D, обозначенное мАт 1F10–5, включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO:12, или ее вариант, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO:17, или ее вариант. В некоторых вариантах осуществления моноклональное антитело против фактора D гуманизировано. В некоторых вариантах осуществления моноклональное антитело против фактора D является химерным антителом.
В некоторых вариантах осуществления выделенное антитело связывается с фактором D человека, где антитело альтернативно связывается с любым из первого эпитопа и второго эпитопа фактора D, где первый эпитоп и второй эпитоп имеют части, которые принимают спиральную конформацию в своей вторичной структуре, и где часть фактора D, которая принимает конформацию бета–тяжа в своей вторичной структуре, расположена между первым эпитопом и вторым эпитопом.
В некоторых вариантах осуществления антитело против фактора D согласно изобретению является антителом, которое связывается с определенным эпитопом фактора D. В одном из вариантов осуществления по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) из аминокислот в SEQ ID NO:21 находится в эпитопе антитела против фактора D. Аминокислоты SEQ ID NO:21 соответствуют аминокислотам 107–110 в аминокислотной последовательности фактора D. В одном из вариантов осуществления по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) из аминокислот в SEQ ID NO:22 находится в эпитопе антитела против фактора D. Аминокислоты SEQ ID NO:22 соответствуют аминокислотам 148–151 в аминокислотной последовательности фактора D. В одном из вариантов осуществления по меньшей мере одна (например, по меньшей мере 1, 2, 3, 4 или 5) из аминокислот в SEQ ID NO:23 находится в эпитопе антитела против фактора D. Аминокислоты SEQ ID NO:23 соответствуют аминокислотам 155–159 в аминокислотной последовательности фактора D. В одном из вариантов осуществления по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) из аминокислот в SEQ ID NO:24 находится в эпитопе антитела против фактора D. Аминокислоты SEQ ID NO:24 соответствуют аминокислотам 173–176 в аминокислотной последовательности фактора D.
В одном из вариантов осуществления антитело против фактора D является антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3 или 4) аминокислотой в SEQ ID NO:21. В одном из вариантов осуществления антитело против фактора D является антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3 или 4) аминокислотой в SEQ ID NO:22. В одном из вариантов осуществления антитело против фактора D является антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3, 4 или 5) аминокислотой в SEQ ID NO:23. В одном из вариантов осуществления антитело против фактора D является антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3 или 4) аминокислотой в SEQ ID NO:24.
В другом варианте осуществления антитело против фактора D является антителом, которое конкурирует за связывание с антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3 или 4) аминокислотой в SEQ ID NO:21. В другом варианте осуществления антитело против фактора D является антителом, которое конкурирует за связывание с антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3 или 4) аминокислотой в SEQ ID NO:22. В другом варианте осуществления антитело против фактора D является антителом, которое конкурирует за связывание с антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3, 4 или 5) аминокислотой в SEQ ID NO:23. В другом варианте осуществления антитело против фактора D является антителом, которое конкурирует за связывание с антителом, которое связывается по меньшей мере с одной (например, по меньшей мере 1, 2, 3 или 4) аминокислотой в SEQ ID NO:24.
В некоторых вариантах осуществления связывание антитела против фактора D человека или его антигенсвязывающего фрагмента по меньшей мере с любой одной (например, по меньшей мере 1, 2, 3, 4 или 5) из аминокислотных последовательностей, выбранных из SEQ ID NO:21, 22, 23 и 24, фактора D человека в живом организме ассоциировано со снижением образования C3bBb в организме. В некоторых вариантах осуществления организмом является человек. В некоторых вариантах осуществления антителом против фактора D является мАт 11–8A1 или мАт IF10–5. В некоторых вариантах осуществления системное введение терапевтически эффективного количества 11–8A1 мАт или мАт IF10–5 в организм снижает образование C3bBb в пути активации комплемента в организме. В некоторых вариантах осуществления организмом является человек. В некоторых вариантах осуществления изобретение относится к белку, антителу, фрагменту антитела или пептиду, которые могут связываться по меньшей мере с одной (например, по меньшей мере 1, 2, 3, 4 или 5) аминокислотной последовательностью, выбранной из SEQ ID NO:21, 22, 23 и 24, фактора D человека, и которые при введении в терапевтически эффективной дозе в организм способны снижать образование C3bBb в альтернативном пути активации комплемента в организме. В некоторых вариантах осуществления организмом является человек. В некоторых вариантах осуществления изобретение относится к белку, антителу, фрагменту антитела или пептиду, которые могут связываться по меньшей мере с одной (например, по меньшей мере 1, 2, 3, 4 или 5) аминокислотной последовательностью, выбранной из SEQ ID NO:21, 22, 23 и 24, фактора D человека, которые препятствуют каталитическому расщеплению AP фактора B с образованием Ba и Bb. В некоторых вариантах осуществления настоящая заявка охватывает антитело или его фрагмент, белок или пептид, которые могут связываться с четырьмя аминокислотами, имеющими последовательность PLPW, расположенными в положениях 107–110 фактора D человека, или четырьмя аминокислотами, имеющими последовательность VLDR, расположенными в положениях 148–151 фактора D человека, и демонстрируют блокирующую фактор D человека активность.
В некоторых вариантах осуществления антитела являются химерными антителами. В некоторых вариантах осуществления антитело против фактора D человека может включать константные области человеческой легкой цепи и человеческой тяжелой цепи в комбинации с CDR–последовательностями вариабельной области или их вариантом, описанными в другой части настоящего описания. Специалист в данной области сумеет подготовить и получить химерное антитело при использовании известных методов замены соответствующих доменов определенных антител, представляющих интерес. Такое антитело можно легко получить с помощью пересадки гетерогенных доменов антител, включающих одну или более CDR–последовательностей, описанных в настоящей заявке. При использовании известной рекомбинантной технологии можно получить рекомбинантное антитело, содержащее константные области тяжелой и легкой цепи, кодируемые последовательностями нуклеиновых кислот константных областей тяжелой и легкой цепи человека; и вариабельные области тяжелой и легкой цепи, включающие CDR–области, кодируемые последовательностями нуклеиновой кислоты, соответствующими CDR–последовательностям, представленным в описании. Специалист в данной области может получить антитело против фактора D человека, содержащее одну или более CDR–последовательностей, описанных в настоящем описании, в котором части одной легкой цепи или только части тяжелой цепи заменены областями из антитела, относящегося к другому виду, такому как человек. Человеческое антитело против фактора D человека, включающее вариабельные области, содержащие одну или более CDR–последовательностей, выбранных из SEQ ID NO:3–5, 8–10, 13–15 и 18–20, или их вариант или варианты, в комбинации со структурными элементами мышиного или не мышиного антитела вне CDR–областей, могут быть получены с помощью обычных способов, известных в уровне техники. В некоторых вариантах осуществления антитела или фрагменты антител дополнительно гуманизованы при использовании известных методик из уровня техники.
В некоторых вариантах осуществления антитело против фактора D включает антитело, обладающее по меньшей мере приблизительно 85% (например, по меньшей мере, приблизительно любой из 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) аминокислотной идентичностью с одной или более CDR–последовательностей, описанных в настоящем документе, перечисленных в SEQ ID NO:3–5, 8–10, 13–15 и 18–20.
В одном из вариантов осуществления настоящее описание охватывает антитело против фактора D, имеющее CDR–последовательности, обладающие приблизительно 85% идентичностью с CDR–последовательностями, описанными в настоящем документе. Настоящее описание охватывает антитело против фактора D или его антигенсвязывающий фрагмент, имеющие CDR–последовательности, которые по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% и 99% идентичны CDR–последовательностям, описанным в настоящем документе. В одном из вариантов осуществления антитело против фактора D человека имеет вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где VH область имеет аминокислотную последовательность, которая по меньшей мере на приблизительно 85% идентична SEQ ID NO:2, и где VL область имеет аминокислотную последовательность, которая по меньшей мере на приблизительно 85% идентична SEQ ID NO:7.
В некоторых вариантах осуществления антитело или фрагмент антитела модифицированы. В некоторых вариантах осуществления модификации включают слияние антитела или его антигенсвязывающего фрагмента с частями другого белка или фрагментом белка. В некоторых вариантах осуществления антитело или фрагмент антитела согласно изобретению модифицированы с целью увеличения их полупериода циркуляции in vivo. Например, антитело или его фрагмент могут быть слиты с молекулой FcRn, который также известен как неонатальный Fc–рецептор, для повышения стабильности антитела in vivo. (Nature Reviews Immunology 7:715–725). В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгированы (например, слиты) с эффекторной молекулой и/или другим направляющим фрагментом (таким как антитело или фрагмент антитела, распознающие другую молекулу, другой антиген или другой эпитоп).
Специалист в данной области сумеет получить связывающий фактор D человека одноцепочечный вариабельный фрагмент (scFv), содержащий по меньшей мере одну специфическую CDR–последовательность, выбранную из SEQ ID NO:3–5, 8–9, 13–15 и 18–20, или ее вариант или варианты. ScFv может включать последовательности вариабельной области тяжелой цепи, указанные в SEQ ID NO:3–5, или их вариант или варианты, и вариабельные области легкой цепи, указанные в SEQ ID NO:8–10, или их вариант или варианты. ScFv может включать последовательности вариабельной области тяжелой цепи, указанные в SEQ ID NO:13–15, или их вариант или варианты, и вариабельные области легкой цепи, указанные в SEQ ID NO:18–20, или их вариант или варианты. CDR–последовательности, включенные в scFv, обладающие идентичностью аминокислотной последовательности порядка, по меньшей мере, приблизительно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% с CDR–последовательностями, описанными в настоящем описании, включены в объем настоящего описания. ScFv связывается с фактором D человека, например, с эпитопом по меньшей мере в одной из аминокислотных последовательностей, перечисленных в группе, состоящей из SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23 и SEQ ID NO:24.
Скрининговые анализы
Настоящее изобретение находит применение в различных скрининговых анализах, в том числе при определении, может ли кандидатное антитело против фактора D ингибировать АР.
В некоторых вариантах осуществления уровень активности AP в присутствии кандидатного антитела против фактора D сравнивают с активностью AP, обнаруженной в положительном сравнительном контроле. Положительный сравнительный контроль включает активацию AP в отсутствие добавленного тестируемого соединения. В некоторых вариантах осуществления кандидатное антитело против фактора D идентифицируют как ингибитор AP, когда активность AP в присутствии кандидатного антитела против фактора D составляет меньше чем приблизительно 70% активности AP, обнаруженной в положительном сравнительном контроле; это соответствует больше чем приблизительно 30% ингибированию активности AP в присутствии тестируемого соединения. В других вариантах осуществления кандидатное антитело против фактора D идентифицируют как ингибитор AP, когда активность AP в присутствии кандидатного антитела против фактора D составляет меньше чем приблизительно 80% активности AP, обнаруженной в положительном сравнительном контроле; это соответствует больше чем приблизительно 20% ингибированию активности AP в присутствии тестируемого соединения. В других вариантах осуществления кандидатное антитело против фактора D идентифицируют как ингибитор AP, когда активность AP в присутствии кандидатного антитела против фактора D составляет меньше чем приблизительно 90% активности AP, обнаруженной в положительном сравнительном контроле; это соответствует больше чем приблизительно 10% ингибированию активности AP в присутствии тестируемого соединения. В некоторых вариантах осуществления уровень ингибирования AP кандидатным антителом против фактора D сравнивают с уровнем ингибирования, обнаруженным в отрицательном сравнительном контроле.
Различные форматы иммуноанализа, включая конкурентный и неконкурентный форматы иммуноанализа, анализы захвата антигена, сэндвич–анализы с двумя антителами и сэндвич–анализы с тремя антителами, являются полезными способами изобретения (Self et al., 1996, Curr. Opin. Biotechnol. 7:60–65). Изобретение не следует считать ограниченным каким–либо одним типом известного или на сегодняшний день неизвестного анализа, при условии, что анализ позволяет обнаруживать ингибирование АР.
Внесосудистые гемолитические анализы включены в способы согласно изобретению. В различных вариантах осуществления эритроциты (Эр) получают от нормальных (здоровых) лиц или лиц, демонстрирующих признаки или симптомы заболевания или нарушения, такого как, например, ПНГ. В различных вариантах осуществления заболевание или нарушение индуцируют в модели на животных, такой как мышь с тройным нокаутом (TKO) Crry/DAF/C3. В некоторых вариантах осуществления реципиентам перелитых Эр за 24 часа до переноса Эр вводят по меньшей мере одно антитело против фактора D или контрольный раствор, такой как PBS. Донорские Эр промывают и метят CFSE при использовании метода, такого как описанный в публикации Miwa et al., 2002, Blood 99; 3707–3716. В некоторых вариантах осуществления донорские Эр собирают у нормальных доноров, промывают и метят DDAO–SE при использовании методики, описанной производителем, или которую специалист в данной области сочтет подходящей. В некоторых вариантах осуществления смесь нормальных Эр в соотношении 1:1 с Эр TKO специалист вводит реципиенту путем внутривенного введения, который является наиболее подходящим, включая, без ограничения этим, хвостовую вену в случае реципиента мыши. В одном из вариантов осуществления образцы крови собирают в различные моменты времени после введения донорских Эр. В одном из вариантов осуществления образцы крови собирают через 5 минут, 6, 24, 48, 72, 96 и 120 часов после переливания. Собранную кровь анализируют для определения процента эритроцитов, меченных CFSE или DDAO–SE (то есть перелитых), оставшихся в кровотоке. Количество меченных CFSE TKO Эр у каждого реципиента нормализуют по меченным DDAO–SE нормальным Эр в каждый момент времени.
Лечение KRN артрита является полезным способом изобретения. Артрит индуцируют у гомозиготных мышей с нокаутом фактора D человека путем пассивного переноса очищенных суммарных IgG от мышей K/BxN. В одном из вариантов осуществления утолщение голеностопного сустава измеряют штангенциркулем и клинические показатели регистрируют с использованием критериев, таких как критерий, ранее описанный в публикации Kimura et. al. (Kimura et al., 2010, JCI; 3545–3554). Субъектам вводят дозу антитела против фактора D человека. В некоторых вариантах осуществления индивида лечат в день 1, день 3, день 7 и 11, и день 15 после индукции артрита.
Иммуноферментные анализы (ИФА) могут применяться в способах согласно изобретению. Фермент, такой как, без ограничения перечисленным, пероксидаза хрена (HRP), щелочная фосфатаза, бета–галактозидаза или уреаза, может быть связан, например, с антителом против С3 или с вторичным антителом для применения в способе согласно изобретению. Система обнаружения пероксидазы хрена может использоваться, например, с хромогенным субстратом тетраметилбензидином (TMB), который дает растворимый продукт в присутствии перекиси водорода, который можно обнаруживать при 450 нм. Другие подходящие системы с использованием ферментных меток включают, например, систему обнаружения щелочной фосфатазы, которую можно использовать с хромогенным субстратом п–нитрофенилфосфатом для получения растворимого продукта, легко обнаруживаемого при 405 нм. Аналогичным образом, система обнаружения бета–галактозидазы может использоваться с хромогенным субстратом о–нитрофенил–бета–D–галактопиранозидом (ONPG) для получения растворимого продукта, обнаруживаемого при 410 нм. В альтернативе система обнаружения уреазы может использоваться с субстратом, таким как мочевина–бромкрезоловый пурпурный (Sigma Immunochemicals, St. Louis, MO). Полезные первичные и вторичные антитела с ферментной меткой могут быть получены из любых коммерческих источников.
Хемилюминесцентное обнаружение также может применяться для обнаружения ингибирования AP. Хемилюминесцентные вторичные антитела могут быть получены из любых коммерческих источников.
Флуоресцентное обнаружение также может применяться для обнаружения ингибирования AP. Полезные флуорохромы включают, без ограничения, DAPI, флуоресцеин, Hoechst 33258, R–фикоцианин, B–фикоэритрин, R–фикоэритрин, родамин, техасский красный и лиссамин–флуоресцеин– или родамин–меченные антитела.
Радиоиммуноанализы (РИА) также могут применяться в способах согласно изобретению. Такие анализы известны в уровне техники и описаны, например, в публикациях Brophy et al. (1990, Biochem. Biophys. Res. Comm. 167:898–903) и Guechot et al. (1996, Clin. Chem. 42:558–563). Радиоиммуноанализы выполняют, например, с использованием меченного иодом–125 первичного или вторичного антитела (Harlow et al., выше, 1999).
Сигнал, испускаемый обнаруживаемым антителом, анализируют, например, с использованием спектрофотометра для детектирования цвета от хромогенного субстрата; индикатора излучения для обнаружения излучения, такого как счетчик гамма–излучения для детектирования иода–125; или флуорометра для обнаружения флуоресценции в присутствии света определенной длины волны. Если используется анализ с ферментной меткой, количественный анализ проводят с использованием спектрофотометра. Следует понимать, что анализы согласно изобретению могут быть выполнены вручную или, при необходимости, могут быть автоматизированы, и что сигнал, испускаемый от множества образцов, может быть обнаружен одновременно во многих системах, доступных в продаже.
Способы согласно изобретению также охватывают применение иммуноанализов на основе капиллярного электрофореза (CEIA), которые могут быть автоматизированы при необходимости. Иммуноанализы также могут использоваться вместе с лазерно–индуцированной флуоресценцией, как описано, например, в Schmalzing et al. (1997, Electrophoresis 18:2184–2193) и Bao (1997, J. Chromatogr. B. Biomed. Sci. 699:463–480). Липосомные иммуноанализы, такие как проточно–инжекционные липосомные иммуноанализы и липосомные иммуносенсоры, также могут применяться согласно способам изобретения (Rongen et al., 1997, J. Immunol. Methods 204:105–133).
Количественный вестерн–блоттинг также может использоваться для определения уровня ингибирования AP в способах согласно изобретению. Вестерн–блоты анализируют количественно при использовании известных методов, таких как сканирующая денситометрия (Parra et al., 1998, J. Vasc. Surg. 28:669–675).
Способы введения
Способы согласно изобретению включают введение терапевтически эффективного количества по меньшей мере одного антитела против фактора D или его связывающего фрагмента (таких как любое из антител или их фрагментов, описанных в другой части настоящего документа) пациенту, у которого идентифицировано АР–опосредованное заболевание или нарушение. В одном из вариантов осуществления пациент является млекопитающим, имеющим систему АР. В одном из вариантов осуществления пациент является человеком. В различных вариантах осуществления по меньшей мере одно антитело против фактора D или его связывающий фрагмент вводят локально, регионарно или системно. В некоторых вариантах осуществления AP–опосредованным заболеванием или нарушением является C3–гломерулопатия. В некоторых вариантах осуществления AP–опосредованным заболеванием или нарушением является макулодистрофия (такая как ВМД).
Способы согласно изобретению могут включать введение по меньшей мере одного антитела против фактора D или его связывающего фрагмента, однако никоим образом не следует считать, что настоящее изобретение ограничено антителами против фактора D, описанными в настоящем документе, а скорее следует считать, что оно охватывает любое антитело против фактора D, как известное, так и неизвестное, которые уменьшают и снижают активацию AP.
Способ согласно изобретению включает введение терапевтически эффективного количества по меньшей мере одного антитела против фактора D или его связывающего фрагмента пациенту, где композиция согласно настоящему изобретению содержит по меньшей мере одно антитело против фактора D или его связывающий фрагмент либо отдельно, либо в комбинации по меньшей мере с одним другим лекарственным средством. Изобретение может применяться в комбинации с другими методами лечения, такими как, например, противовоспалительная терапия и тому подобное Примеры противовоспалительной терапии, которую можно применять в комбинации со способами согласно изобретению, включают, например, терапии, в которых используются стероидные лекарственные средства, а также терапию, в которой используются нестероидные лекарственные средства.
Способ согласно изобретению включает введение индивиду терапевтически эффективного количества антитела против фактора D или его антигенсвязывающего фрагмента, которые способны связываться в пределах любой из последовательностей, выбранных из SEQ ID NO:21, 22, 23, 24. В некоторых вариантах осуществления изобретение относится к способу лечения заболеваний, связанных с фактором D, включающих нарушение пути активации АР комплемента, путем введения терапевтически эффективного количества антитела согласно изобретению или терапевтически эффективного количество фрагмента антитела, в результате чего у индивида происходит снижение C3bBb. В некоторых вариантах осуществления изобретение относится к способу лечения заболеваний, связанных с фактором D, включающих нарушение пути активации АР комплемента, путем введения терапевтически эффективного количества антитела или фрагмента антитела, способных связываться с некоторым специфическим эпитопом или эпитопами в факторе D человека, таким как эпитоп, содержащийся в аминокислотных последовательностях, выбранных из SEQ ID NO:21–24. В некоторых вариантах осуществления изобретение охватывает способ лечения заболеваний, связанных с фактором D, включающих нарушение пути активации АР комплемента, путем введения индивиду эффективного количества антитела, фрагмента антитела, полипептида, пептида, конъюгированного пептида, способных связываться с некоторыми специфическими эпитопами фактора D человека, где эпитоп содержится в аминокислотных последовательностях, выбранных из SEQ ID NO:21–24, в результате чего активация пути активации АР комплемента у индивида снижается. В некоторых вариантах осуществления способ лечения включает системное введение индивиду эффективной дозы антитела или фрагмента антитела, способных связываться с аминокислотами, выбранными из последовательностей, перечисленных в SEQ ID NO:21–24, в результате чего достигается системное снижение C3bBb у индивида.
Фармацевтические композиции и способы лечения
Введение антитела против фактора D или его связывающего фрагмента в способе лечения согласно изобретению может быть достигнуто различными способами при использовании методов, известных в уровне техники. Терапевтические и профилактические способы согласно изобретению, таким образом, охватывают применение фармацевтических композиций, включающих антитело против фактора D.
Фармацевтические композиции, подходящие для осуществления изобретения, могут вводить для доставки дозы по меньшей мере приблизительно 1 нг/кг, по меньшей мере приблизительно 5 нг/кг, по меньшей мере приблизительно 10 нг/кг, по меньшей мере приблизительно 25 нг/кг, по меньшей мере приблизительно 50 нг/кг, по меньшей мере приблизительно 100 нг/кг, по меньшей мере приблизительно 500 нг/кг, по меньшей мере приблизительно 1 мкг/кг, по меньшей мере приблизительно 5 мкг/кг, по меньшей мере приблизительно 10 мкг/кг, по меньшей мере приблизительно 25 мкг/кг, по меньшей мере приблизительно 50 мкг/кг, по меньшей мере приблизительно 100 мкг/кг, по меньшей мере приблизительно 500 мкг/кг, по меньшей мере приблизительно 1 мг/кг, по меньшей мере приблизительно 5 мг/кг, по меньшей мере приблизительно 10 мг/кг, по меньшей мере приблизительно 25 мг/кг, по меньшей мере приблизительно 50 мг/кг, по меньшей мере приблизительно 100 мг/кг, по меньшей мере приблизительно 200 мг/кг, по меньшей мере приблизительно 300 мг/кг, по меньшей мере приблизительно 400 мг/кг и по меньшей мере приблизительно 500 мг/кг массы тела индивида. В одном из вариантов осуществления изобретения вводят дозу, которая приводит к концентрации антитела против фактора D согласно настоящему изобретению по меньшей мере приблизительно 1 пМ, по меньшей мере приблизительно 10 пМ, по меньшей мере приблизительно 100 пМ, по меньшей мере приблизительно 1 нм, по меньшей мере приблизительно 10 нм, по меньшей мере приблизительно 100 нм, по меньшей мере приблизительно 1 мкМ, по меньшей мере приблизительно 2 мкМ, по меньшей мере приблизительно 3 мкМ, по меньшей мере приблизительно 4 мкМ, по меньшей мере приблизительно 5 мкМ, по меньшей мере приблизительно 6 мкМ, по меньшей мере приблизительно 7 мкМ, по меньшей мере приблизительно 8 мкМ, по меньшей мере приблизительно 9 мкМ и по меньшей мере приблизительно 10 мкМ у пациента. В другом варианте осуществления изобретения предусмотрено введение дозы, которая приводит к концентрации антитела против фактора D согласно настоящему изобретению в пределах по меньшей мере приблизительно 1 пМ, по меньшей мере приблизительно 10 пМ, по меньшей мере приблизительно 100 пМ, по меньшей мере приблизительно 1 нм, по меньшей мере приблизительно 10 нм, по меньшей мере приблизительно 100 нм, по меньшей мере приблизительно 1 мкМ, по меньшей мере приблизительно 2 мкМ, по меньшей мере приблизительно 3 мкМ, по меньшей мере приблизительно 4 мкМ, по меньшей мере приблизительно 5 мкМ, по меньшей мере приблизительно 6 мкМ, по меньшей мере приблизительно 7 мкМ, по меньшей мере приблизительно 8 мкМ, по меньшей мере приблизительно 9 мкМ и по меньшей мере приблизительно 10 мкМ в плазме человека.
В некоторых вариантах осуществления фармацевтические композиции, подходящие для осуществления изобретения, могут быть введены для доставки дозы не больше чем приблизительно 1 нг/кг, не больше чем приблизительно 5 нг/кг, не больше чем приблизительно 10 нг/кг, не больше чем приблизительно 25 нг/кг, не больше чем приблизительно 50 нг/кг, не больше чем приблизительно 100 нг/кг, не больше чем приблизительно 500 нг/кг, не больше чем приблизительно 1 мкг/кг, не больше чем приблизительно 5 мкг/кг, не больше чем приблизительно 10 мкг/кг, не больше чем приблизительно 25 мкг/кг, не больше чем приблизительно 50 мкг/кг, не больше чем приблизительно 100 мкг/кг, не больше чем приблизительно 500 мкг/кг, не больше чем приблизительно 1 мг/кг, не больше чем приблизительно 5 мг/кг, не больше чем приблизительно 10 мг/кг, не больше чем приблизительно 25 мг/кг, не больше чем приблизительно 50 мг/кг, не больше чем приблизительно 100 мг/кг, не больше чем приблизительно 200 мг/кг, не больше чем приблизительно 300 мг/кг, не больше чем приблизительно 400 мг/кг и не больше чем приблизительно 500 мг/кг массы тела индивида. В одном из вариантов осуществления изобретения вводят дозу, которая приводит к концентрации антитела против фактора D согласно настоящему изобретению не больше чем приблизительно 1 пМ, не больше чем приблизительно 10 пМ, не больше чем приблизительно 100 пМ, не больше чем приблизительно 1 нм, не больше чем приблизительно 10 нм, не больше чем приблизительно 100 нм, не больше чем приблизительно 1 мкМ, не больше чем приблизительно 2 мкМ, не больше чем приблизительно 3 мкМ, не больше чем приблизительно 4 мкМ, не больше чем приблизительно 5 мкМ, не больше чем приблизительно 6 мкМ, не больше чем приблизительно 7 мкМ, не больше чем приблизительно 8 мкМ, не больше чем приблизительно 9 мкМ и не больше чем приблизительно 10 мкМ в человеке. В другом варианте осуществления изобретения предусмотрено введение дозы, которая приводит к концентрации антитела против фактора D согласно настоящему изобретению в пределах не больше чем приблизительно 1 пМ, не больше чем приблизительно 10 пМ, не больше чем приблизительно 100 пМ, не больше чем приблизительно 1 нм, не больше чем приблизительно 10 нм, не больше чем приблизительно 100 нм, не больше чем приблизительно 1 мкМ, не больше чем приблизительно 2 мкМ, не больше чем приблизительно 3 мкМ, не больше чем приблизительно 4 мкМ, не больше чем приблизительно 5 мкМ, не больше чем приблизительно 6 мкМ, не больше чем приблизительно 7 мкМ, не больше чем приблизительно 8 мкМ, не больше чем приблизительно 9 мкМ и не больше чем приблизительно 10 мкМ в плазме человека. Также предусмотрены диапазоны доз между любыми из доз, раскрытых в настоящем документе.
Как правило, дозы, которые могут вводить в способе согласно изобретению индивиду, в некоторых вариантах осуществления человеку, изменяются в количестве от 0,5 мкг до приблизительно 50 мг на килограмм массы тела индивида. Хотя точная вводимая доза будет изменяться в зависимости от различных факторов, включающих, без ограничения, тип индивида и тип подвергаемого лечению патологического состояния, возраст индивида и путь введения. В некоторых вариантах осуществления доза соединения будет изменяться от приблизительно 1 мкг до приблизительно 10 мг на килограмм массы тела индивида. В других вариантах осуществления доза будет изменяться от приблизительно 3 мкг до приблизительно 1 мг на килограмм массы тела индивида.
Соединение могут вводить индивиду с частотой несколько раз в день, или его могут вводить реже, например, один раз в день, два раза в день, три раза в день, один раз в неделю, два раза в неделю, три раза в неделю, один раз в две недели, два раза в две недели, три раза в две недели, один раз в месяц, два раза в месяц, три раза в месяц, или еще реже, например, один раз в несколько месяцев или даже один раз или несколько раз в год или меньше. Частота введения дозы будет очевидна специалисту и будет зависеть от различных факторов, таких как, без ограничения перечисленным, тип и тяжесть подвергаемого лечению заболевания, тип и возраст индивида, и т.д. Лекарственные формы фармацевтических композиций могут быть изготовлены любым известным, или разработанным впоследствии, способом в области фармакологии. Как правило, такие способы получения включают этап приведения действующего вещества в ассоциацию с носителем или одним или более другими вспомогательными компонентами, а затем, в случае необходимости или потребности, формования или упаковки продукта в форме требуемой однодозовой или многодозовой единицы.
Хотя описание фармацевтических композиций, представленное в настоящем документе, в основном направлено на фармацевтические композиции, которые подходят для рецептурного медицинского применения, специалисту в данной области будет очевидно, что такие композиции обычно подходят для введения индивидам всех типов. Модификация фармацевтических композиций, подходящих для медицинского применения, с целью получить композиции, подходящие для введения различным индивидам, хорошо известна, при этом ветеринар–фармаколог средней квалификации сможет разработать и выполнить такую модификацию с помощью простых экспериментов, если таковые потребуются. Пациенты, которым предполагается вводить фармацевтические композиции согласно изобретению, включают, без ограничения перечисленными, людей и других приматов, млекопитающих, в том числе коммерчески значимых млекопитающих, таких как приматы, не относящиеся к человеку, крупный рогатый скот, свиньи, лошади, овцы, кошки и собаки.
Фармацевтические композиции, которые могут применяться в способах согласно изобретению, могут быть изготовлены, упакованы или выпущены в продажу в форме препаратов, подходящих для офтальмологического, перорального, ректального, вагинального, парентерального, наружного, ингаляционного, интраназального, буккального, внутриглазного, интравитреального, внутримышечного, внутрикожного и внутривенного путей введения. Другие предполагаемые лекарственные формы включают перспективные наночастицы, липосомные препараты, повторно закрытые эритроциты, содержащие действующее вещество, и лекарственные формы на основе иммунологических средств.
Фармацевтическая композиция согласно изобретению может быть изготовлена, упакована или выпущена в продажу в недозированном виде, в виде однократной единичной дозы или множества однократных единичных доз. Единичная доза представляет собой дискретное количество фармацевтической композиции, содержащее заданное количество действующего вещества. Количество действующего вещества, как правило, равно дозе действующего вещества, которую вводят пациенту, или подходящей части такой дозы, такой как, например, половина или треть такой дозы.
Относительные количества действующего вещества, фармацевтически приемлемого носителя и любых дополнительных компонентов в фармацевтической композиции согласно изобретению будут изменяться в зависимости от идентифицирующих сведений, размера и состояния пациента, подвергаемого лечению, и, кроме того, в зависимости от пути, которым композицию требуется вводить. Например, композиция может включать 0,1–100% (в/в) действующего вещества. В различных вариантах осуществления композиция включает по меньшей мере приблизительно 1%, по меньшей мере приблизительно 2%, по меньшей мере приблизительно 3%, по меньшей мере приблизительно 4%, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 6%, по меньшей мере приблизительно 7%, по меньшей мере приблизительно 8%, по меньшей мере приблизительно 9%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 11%, по меньшей мере приблизительно 12%, по меньшей мере приблизительно 13%, по меньшей мере приблизительно 14%, по меньшей мере приблизительно 15%, по меньшей мере приблизительно 16%, по меньшей мере приблизительно 17%, по меньшей мере приблизительно 18%, по меньшей мере приблизительно 19%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 21%, по меньшей мере приблизительно 22%, по меньшей мере приблизительно 23%, по меньшей мере приблизительно 24%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 26%, по меньшей мере приблизительно 27%, по меньшей мере приблизительно 28%, по меньшей мере приблизительно 29%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 31%, по меньшей мере приблизительно 32%, по меньшей мере приблизительно 33%, по меньшей мере приблизительно 34%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 36%, по меньшей мере приблизительно 37%, по меньшей мере приблизительно 38%, по меньшей мере приблизительно 39%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 41%, по меньшей мере приблизительно 42%, по меньшей мере приблизительно 43%, по меньшей мере приблизительно 44%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 46%, по меньшей мере приблизительно 47%, по меньшей мере приблизительно 48%, по меньшей мере приблизительно 49%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 51%, по меньшей мере приблизительно 52%, по меньшей мере приблизительно 53%, по меньшей мере приблизительно 54%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 56%, по меньшей мере приблизительно 57%, по меньшей мере приблизительно 58%, по меньшей мере приблизительно 59%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 61%, по меньшей мере приблизительно 62%, по меньшей мере приблизительно 63%, по меньшей мере приблизительно 64%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 66%, по меньшей мере приблизительно 67%, по меньшей мере приблизительно 68%, по меньшей мере приблизительно 69%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 71%, по меньшей мере приблизительно 72%, по меньшей мере приблизительно 73%, по меньшей мере приблизительно 74%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 76%, по меньшей мере приблизительно 77%, по меньшей мере приблизительно 78%, по меньшей мере приблизительно 79%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 81%, по меньшей мере приблизительно 82%, по меньшей мере приблизительно 83%, по меньшей мере приблизительно 84%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или по меньшей мере приблизительно 100% (в/в) действующего вещества
В дополнение к действующему веществу фармацевтическая композиция согласно изобретению может также включать один или более дополнительных фармацевтически активных компонентов.
Лекарственные формы фармацевтической композиции согласно изобретению с контролируемым или замедленным высвобождением могут быть получены с применением стандартной технологии.
Парентеральное введение фармацевтической композиции включает любой путь введения, характеризующийся физическим проникновением через ткань пациента и введением фармацевтической композиции через отверстие в ткани. Парентеральное введение может быть локальным, регионарным или системным. Парентеральное введение, таким образом, включает, без ограничения перечисленным, введение фармацевтической композиции путем инъекции композиции, путем нанесения композиции через хирургический разрез, путем нанесения композиции через проникающую в ткань нехирургическую рану и тому подобное В частности, предусмотрено, что парентеральное введение включает, без ограничения перечисленным, внутривенное, внутриглазное, интравитреальное, подкожное, внутрибрюшинное, внутримышечное, внутрикожное, внутригрудинное и внутриопухолевое введение.
Лекарственные формы фармацевтической композиции, подходящие для парентерального введения, включают действующее вещество в сочетании с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический раствор хлорида натрия. Такие лекарственные формы могут быть изготовлены, упакованы или выпущены в продажу в форме, подходящей для болюсного введения или для непрерывного введения. Лекарственные формы для инъекций могут быть изготовлены, упакованы или выпущены в продажу в виде стандартной лекарственной формы, такой как ампулы или многодозовые контейнеры, содержащие консервант. Лекарственные формы для парентерального введения включают, без ограничения перечисленными, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые лекарственные формы с замедленным высвобождением или биоразлагаемые препараты. Такие лекарственные формы могут дополнительно содержать один или более дополнительных компонентов, включающих, без ограничения перечисленными, суспендирующие, стабилизирующие или диспергирующие вещества. В одном из вариантов осуществления лекарственной формы для парентерального введения действующее вещество предоставлено в сухой (то есть порошковой или гранулированной) форме для восстановления подходящим растворителем (например, стерильной апирогенной водой) перед парентеральным введением восстановленной композиции.
Фармацевтические композиции могут быть изготовлены, упакованы или выпущены в продажу в форме стерильной водной или масляной суспензии или раствора для инъекций. Эта суспензия или раствор могут быть изготовлены в соответствии с известным уровнем техники и могут содержать, помимо действующего вещества, дополнительные компоненты, такие как диспергирующие вещества, смачивающие вещества или суспендирующие вещества. Такие стерильные препараты для инъекций могут быть изготовлены с применением нетоксичного, парентерально приемлемого разбавителя или растворителя, такого как, например, вода или 1,3–бутандиол. Другие приемлемые разбавители и растворители включают, без ограничения перечисленными, раствор Рингера, изотонический раствор хлорида натрия и нелетучие масла, такие как синтетические моно– или диглицериды. Другие парентерально вводимые лекарственные формы, которые являются подходящими, включают такие лекарственные формы, которые содержат действующее вещество в микрокристаллической форме, в липосомном препарате или в качестве компонента биоразлагаемых полимерных систем. Композиции для замедленного высвобождения или имплантации могут включать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсию, ионообменную смолу, малорастворимый полимер или малорастворимую соль.
Фармацевтическая композиция согласно изобретению может быть изготовлена, упакована или выпущена в продажу в лекарственной форме, подходящей для ингаляционного введения через полость рта. Такая лекарственная форма может включать сухие частицы, которые включают действующее вещество и имеют диаметр в пределах от приблизительно 0,5 до приблизительно 7 нанометров, и в некоторых вариантах осуществления от приблизительно 1 до приблизительно 6 нанометров. Такие композиции предпочтительно находятся в форме сухих порошков для введения с помощью устройства, включающего резервуар для сухого порошка, в который может быть направлен поток пропеллента для диспергирования порошка, или при использовании низкокипящего растворителя/дозатора сухого порошка, такого как устройство, включающее действующее вещество, растворенное или суспендированное в низкокипящем пропелленте в герметичном контейнере. В некоторых вариантах осуществления такие порошки включают частицы, где по меньшей мере 98% частиц в по весу имеют диаметр больше 0,5 нанометров, и по меньшей мере 95% частиц по количеству имеют диаметр меньше 7 нанометров. В некоторых вариантах осуществления по меньшей мере 95% частиц по весу имеют диаметр больше 1 нанометра, и по меньшей мере 90% частиц по количеству имеют диаметр меньше 6 нанометров. В некоторых вариантах осуществления композиции сухого порошка включают твердый тонкодисперсный разбавитель, такой как сахар, и предпочтительно представлены в форме стандартной дозы.
Низкокипящий пропеллент обычно включает жидкие пропелленты, имеющие точку кипения ниже 65°F (~18°C) при атмосферном давлении. Обычно пропеллент может составлять 50–99,9% (в/в) композиции, и действующее вещество может составлять 0,1–20% (в/в) композиции. Пропеллент может также включать дополнительные компоненты, такие как жидкое неионогенное или твердое анионное поверхностно–активное вещество или твердый разбавитель (в некоторых вариантах осуществления имеющий размер частиц такого же порядка, как и частицы, включающие действующее вещество).
Фармацевтические композиции согласно изобретению, изготовленные для доставки в легкие, также могут предоставлять действующее вещество в форме капель раствора или суспензии. Такие лекарственные формы могут быть изготовлены, упакованы или выпущены в продажу в виде водных или разбавленных спиртовых растворов или суспензий, необязательно стерильных, включающих действующее вещество, и могут быть удобно введены с помощью любого устройства для небулизации или распыления. Такие лекарственные формы могут дополнительно включать один или более дополнительных компонентов, включающих, без ограничения перечисленными, вкусовую добавку, такую как сахарин натрия, летучее масло, буферное вещество, поверхностно–активное вещество или консервант, такой как метилгидроксибензоат. В некоторых вариантах осуществления капли, вводимые таким путем введения, имеют средний диаметр в пределах от приблизительно 0,1 до приблизительно 200 нанометров.
Лекарственные формы также могут применяться для интраназальной доставки фармацевтической композиции согласно изобретению.
Другая лекарственная форма, подходящая для интраназального введения, является грубым порошком, включающим действующее вещество и имеющим среднюю крупность частиц от приблизительно 0,2 до 500 микрометров. Такую лекарственную форму вводят путем быстрого вдыхания порции порошка для ингаляции через носовой ход из контейнера для порошка, удерживаемого близко к ноздре.
Лекарственные формы, подходящие для назального введения, могут, например, включать от приблизительно 0,1% (в/в) и до 100% (в/в) действующего вещества, и могут также включать один или более дополнительных компонентов.
Фармацевтическая композиция согласно изобретению может быть изготовлена, упакована или выпущена в продажу в лекарственной форме, подходящей для буккального введения. Такие лекарственные формы могут быть, например, в форме таблеток или таблеток для рассасывания, изготовленных с применением стандартных способов, и могут, например, содержать от 0,1 до 20% (в/в) действующего вещества, при этом остальная часть включает растворимую в полости рта или разлагаемую композицию и, необязательно, один или более дополнительных компонентов. В альтернативе лекарственные формы, подходящие для буккального введения, могут содержать порошок или аэрозольный или распыляемый раствор, или суспензию, содержащую действующее вещество. В некоторых вариантах осуществления такие порошковые, аэрозольные или распыляемые лекарственные формы при диспергировании имеют средний размер частиц или капель в пределах от приблизительно 0,1 до приблизительно 200 нанометров и дополнительно могут включать один или более дополнительных компонентов.
При использовании в настоящем документе "дополнительные компоненты" включают, без ограничения перечисленным, один или более из следующего: вспомогательные вещества; поверхностно–активные вещества; диспергирующие вещества; инертные разбавители; гранулирующие вещества и разрыхлители; связующие вещества; смазывающие вещества; подсластители; ароматизаторы; красители; консерванты; физиологически разлагаемые композиции, такие как желатин; водные разбавители и растворители; масляные разбавители и растворители; суспендирующие вещества; диспергирующие или смачивающие вещества; эмульгаторы, смягчающие вещества; буферы; соли; загустители; наполнители; эмульгаторы; антиоксиданты; антибиотики; противогрибковые средства; стабилизирующие вещества; и фармацевтически приемлемые полимерные или гидрофобные материалы. Другие "дополнительные компоненты", которые могут быть включены в фармацевтические композиции согласно изобретению, известны в уровне техники и описаны, например, в справочнике Remington's Pharmaceutical Sciences (1985, Genaro, ed., Mack Publishing Co., Easton, PA), который включен в настоящий документ посредством отсылки.
Клетки, продуцирующие антитела и их антигенсвязывающие фрагменты
В некоторых вариантах осуществления изобретения предложена клетка или клеточная линия (такие как клетки–хозяева), которая продуцирует по меньшей мере одно из антител против фактора D или антигенсвязывающих фрагментов, описанных в настоящем документе. В одном из вариантов осуществления клетка или клеточная линия представляет собой генетически модифицированную клетку, которая продуцирует по меньшей мере одно из антител против фактора D или антигенсвязывающих фрагментов, описанных в настоящем документе. В одном из вариантов осуществления клетка или клеточная линия является гибридомой, которая продуцирует по меньшей мере одно из антител против фактора D или антигенсвязывающих фрагментов, описанных в настоящем документе.
Гибридные клетки (гибридомы) обычно получают в результате массовых слияний мышиных спленоцитов, которые обогащены В–лимфоцитами, и миеломных "клетков–партнеров по слиянию" (Alberts et al., Molecular Biology of the Cell (Garland Publishing, Inc. 1994); Harlow et al., Antibodies. A Laboratory Manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988). Клетки при слиянии затем распределяют в пулы, которые можно исследовать на продукцию антител с нужной специфичностью. Положительные пулы могут быть затем подразделены дополнительно, пока не будут идентифицированы одиночные клеточные клоны, которые продуцируют антитела с нужной специфичностью. Антитела, продуцируемые такими клонами, называются моноклональными антителами.
Также предложены нуклеиновые кислоты, кодирующие любое из антител или фрагментов антител, раскрытых в настоящем документе, а также векторы, содержащие нуклеиновые кислоты. Таким образом, антитела и фрагменты согласно изобретению могут быть получены при экспрессии нуклеиновой кислоты в клетке или клеточной линии, такой как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов. Таким образом, антитела и фрагменты согласно изобретению также могут быть получены при клонировании нуклеиновых кислот в один или более векторов экспрессии и трансформации вектора в клеточную линию, такую как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов.
Гены, кодирующие тяжелые и легкие цепи иммуноглобулинов или их фрагменты, могут быть сконструированы в соответствии со способами, включающими, без ограничения, полимеразную цепную реакцию (ПЦР), известную в данной области (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, N.Y., 1989; Berger & Kimmel, Methods in Enzymology, Vol. 152: Guide to Molecular Cloning Techniques, Academic Press, Inc., San Diego, Calif., 1987; Co et al., 1992, J. Immunol. 148:1149). Например, гены, кодирующие тяжелые и легкие цепи или их фрагменты, можно клонировать из геномной ДНК клетки, секретирующей антитело, или кДНК получают в результате обратной транскрипции клеточной РНК. Клонирование выполняют с помощью стандартных методов, включающих использование ПЦР праймеров, которые гибридизуются с последовательностями, фланкирующими или перекрывающимися с генами или сегментами генов, подлежащих клонированию.
Нуклеиновые кислоты, кодирующие антитело по изобретению, или тяжелую цепь или легкую цепь, или их фрагменты, можно получать и применять в соответствии с технологиями рекомбинантных нуклеиновых кислот для получения специфического иммуноглобулина, цепи иммуноглобулина или их фрагмента, или варианта, в различных клетках–хозяевах или в системе трансляции in vitro. Например, нуклеиновые кислоты, кодирующие антитела или их фрагменты, могут быть помещены в подходящие прокариотические или эукариотические векторы, например векторы экспрессии, и введены в подходящую клетку–хозяина подходящим способом, например путем трансформации, трансфекции, электропорации, инфицирования, при этом нуклеиновая кислота функционально связана с одним или более элементами регуляции экспрессии, например в векторе, или интегрирована в геном клетки–хозяина.
В некоторых вариантах осуществления тяжелые и легкие цепи или фрагменты этого, могут быть собраны в двух разных векторах экспрессии, которые могут использоваться для котрансфекции реципиентной клетки. В некоторых вариантах осуществления каждый вектор может содержать два или более селективных генов, один для селекции в бактериальной системе и один для селекции в эукариотической системе. Эти векторы обеспечивают получение и амплификацию генов в бактериальной системе, и последующую котрансфекцию эукариотических клеток и отбор котрансфицированных клеток. Процедура отбора может использоваться для отбора по экспрессии нуклеиновых кислот антитела, введенных в двух разных ДНК векторах в эукариотическую клетку.
В альтернативе нуклеиновые кислоты, кодирующие тяжелые и легкие цепи или их фрагменты, могут экспрессироваться с одного вектора. Хотя легкие и тяжелые цепи кодируются отдельными генами, их можно соединить при использовании рекомбинантных методов. Например, два полипептида можно соединить синтетическим линкером, который позволяет получать их в виде одной белковой цепи, в который VL и VH области спарены с образованием моновалентных молекул (известных как одиноцепочечный Fv (scFv); см., например, Bird et al., 1988, Science 242: 423–426; и Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879–5883).
В изобретении предложена выделенная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, кодирующую тяжелую цепь и/или легкую цепь, а также ее фрагменты. Молекула нуклеиновой кислоты, содержащая последовательности, кодирующие легкую и тяжелую цепь или их фрагменты, может быть сконструирована так, что она содержит синтетическую сигнальную последовательность для секреции антитела или фрагмента при продукции в клетке. Кроме того, молекула нуклеиновой кислоты может содержать специфические ДНК линкеры, которые позволяют вводить другие последовательности антител и сохраняют трансляционную рамку считывания, чтобы не изменять аминокислоты, обычно присутствующие в последовательностях антител.
В соответствии с настоящим изобретением последовательности нуклеиновых кислот, кодирующие антитело, могут быть встроены в соответствующий вектор экспрессии. В различных вариантах осуществления вектор экспрессии содержит необходимые элементы для транскрипции и трансляции нуклеиновой кислоты, кодирующей встроенное антитело, обеспечивая получение молекул рекомбинантной ДНК, которые направляют экспрессию последовательностей антитела для образования антитела или его фрагмента.
Кодирующие антитело нуклеиновые кислоты или их фрагменты могут быть подвергнуты различным генно–инженерным методам, которые известны специалистам в данной области, таким как сайт–направленный мутагенез.
Различные способы могут использоваться для экспрессии нуклеиновых кислот в клетке. Нуклеиновые кислоты можно клонировать во множество типов векторов. Однако настоящее изобретение не следует считать ограниченным каким–либо конкретным вектором. Напротив, настоящее изобретение следует рассматривать как охватывающее целый ряд векторов, которые легко доступны и/или известны в уровне техники. Например, нуклеиновую кислоту согласно изобретению можно клонировать в вектор, включающий, без ограничения перечисленным, плазмиду, фагмиду, производное фага, вирус животного и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы репликации, векторы генерации зондов и секвенирующие векторы.
В конкретных вариантах осуществления вектор экспрессии выбран из группы, состоящей из вирусного вектора, бактериального вектора и вектора клеток млекопитающего. Существует множество векторных систем экспрессии, которые включают, по меньшей мере, часть или все композиции, обсуждаемые выше. Системы на основе прокариотических и/или эукариотических векторов можно использовать для применения в настоящем изобретении для получения полинуклеотидов или их родственных полипептидов. Многие такие системы широко доступны в продаже.
Технология вирусных векторов хорошо известна в данной области и описана, например, в Sambrook et al. (2012) и в Ausubel et al. (1999), а также в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые могут использоваться в качестве векторов, включают, без ограничения перечисленными, ретровирусы, аденовирусы, аденоассоциированные вирусы, герпесвирусы и лентивирусы. В некоторых вариантах осуществления вектор на основе вируса стволовых клеток мыши (MSCV) используется для экспрессии требуемой нуклеиновой кислоты. Было показано, что векторы MSCV эффективно экспрессируют требуемые нуклеиновые кислоты в клетках. Однако изобретение не должно быть ограничено применением только вектора MSCV, напротив, в изобретение включен любой способ ретровирусной экспрессии. Другими примерами вирусных векторов являются векторы на основе вируса мышиного лейкоза Молони (MoMuLV) и ВИЧ. В некоторых вариантах осуществления подходящий вектор содержит точку начала репликации, функционирующую по меньшей мере в одном организме, промоторную последовательность, удобные сайты рестрикции и один или более селективных маркеров (см., например, WO 01/96584; WO 01/29058; и патент США 6,326,193).
Могут использоваться дополнительные регуляторные элементы, например, энхансеры, модулирующие частоту инициации транскрипции. Промотор может быть таким промотором, который обычно связан с последовательностью гена или нуклеиновой кислоты, и который может быть получен при выделении 5'–некодирующих последовательностей, расположенных перед кодирующим сегментом и/или экзоном. Такой промотор может именоваться "эндогенным". Аналогичным образом, энхансер может являться энхансером, обычно связанным с последовательностью нуклеиновой кислоты, расположенным после или перед этой последовательностью. В альтернативе определенные преимущества будут получены при помещении сегмента кодирующей нуклеиновой кислоты под контроль рекомбинантного или гетерологичного промотора, который относится к промотору, который обычно не связан с последовательностью нуклеиновой кислоты в ее естественном окружении. Рекомбинантный или гетерологичный энхансер также относится к энхансеру, обычно не связанному с последовательностью нуклеиновой кислоты в ее естественном окружении. Такие промоторы или энхансеры могут включать в себя промоторы или энхансеры других генов, а также промоторы или энхансеры, выделенные из любой другой прокариотической, вирусной или эукариотической клетки, и промоторы или энхансеры, не встречающиеся в природе, например, содержащие разные элементы из различных областей регуляции транскрипции и/или мутации, которые изменяют экспрессию. В дополнение к получению последовательностей нуклеиновых кислот из промоторов и энхансеров синтетически, последовательности могут быть получены при использовании технологии рекомбинантного клонирования и/или амплификации нуклеиновых кислот, включая ПЦР, в сочетании с композициями, раскрытыми в настоящем документе (патент США 4,683,202, патент США 5,928,906). Кроме того, предполагается, что также могут использоваться контрольные последовательности, которые направляют транскрипцию и/или экспрессию последовательностей внутри неядерных органелл, таких как митохондрии, хлоропласты и тому подобное
Конечно, будет важно использовать промотор и/или энхансер, который эффективно направляет экспрессию сегмента ДНК в типе клетки, органелле и организме, выбранных для экспрессии. Специалистам в области молекулярной биологии обычно известно, как использовать промоторы, энхансеры и комбинации типов клеток для экспрессии белка, например, см. Sambrook et al. (2012). Используемые промоторы могут быть конститутивными, тканеспецифическими, индуцируемыми и/или могут применяться в соответствующих условиях для направления экспрессии введенного сегмента ДНК на высоком уровне, что является преимуществом при крупномасштабном производстве рекомбинантных белков и их фрагментов.
Примером промотора является последовательность предраннего промотора цитомегаловируса (ЦМВ). Эта промоторная последовательность является сильной конститутивной промоторной последовательностью, способной индуцировать высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ней. Впрочем, также могут использоваться другие последовательности конститутивных промоторов, включающие, без ограничения перечисленными, ранний промотор вируса обезьян 40 (SV40), вирус опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор вируса Молони, промотор вируса лейкоза птиц, предранний промотор вируса Эпштейна–Барр, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, без ограничения перечисленными, промотор актина, промотор миозина, промотор гемоглобина и промотор креатина мышц. Кроме того, изобретение не должно ограничиваться применением конститутивных промоторов. Индуцируемые промоторы также рассматриваются как часть изобретения. Применение индуцируемого промотора в изобретении обеспечивает молекулярный включатель, способный включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия требуется, или отключать экспрессию, когда экспрессия нежелательна. Примеры индуцируемых промоторов включают, без ограничения перечисленными, промотор металлотионеина, глюкокортикоидный промотор, прогестероновый промотор и тетрациклиновый промотор. Кроме того, изобретение включает применение тканеспецифического промотора или промотора, специфического для типа клеток, который является промотором, который активен только в требуемой ткани или клетке. Тканеспецифические промоторы хорошо известны в данной области и включают, без ограничения перечисленными, промотор HER–2 и промоторные последовательности, связанные с PSA.
Для оценки экспрессии нуклеиновых кислот вектор экспрессии, который предполагается ввести в клетку, также может содержать либо селективный маркерный ген, либо репортерный ген, либо оба, для облегчения идентификации и отбора экспрессирующих клеток из популяции клеток, которые считаются трансфицированными или инфицированными посредством вирусных векторов. В других вариантах осуществления селективный маркер может находиться на отдельной нуклеиновой кислоте и использоваться в процедуре котрансфекции. Как селективные маркеры, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках–хозяевах. Подходящие селективные маркеры известны в данной области и включают, например, гены устойчивости к антибиотикам, такие как noe и тому подобное
Репортерные гены используются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Репортерные гены, которые кодируют легко определяемые белки, хорошо известны в данной области. Обычно репортерный ген представляет собой ген, который не присутствует или не экспрессируется организмом или тканью реципиента, и который кодирует белок, экспрессия которого проявляется в некотором легко обнаруживаемом свойстве, например ферментативной активности. Экспрессию репортерного гена определяют в подходящее время после введения ДНК в реципиентные клетки.
Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета–галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу, или ген зеленого флуоресцентного белка (см., например, Ui–Tei et al., 2000 FEBS Lett. 479:79–82). Подходящие системы экспрессии хорошо известны и могут быть получены при использовании хорошо известных методик или приобретены на рынке. Как правило, конструкцию с минимальной 5'–фланкирующей областью, демонстрирующую наиболее высокий уровень экспрессии репортерного гена, идентифицируют как промотор. Такие промоторные области могут быть связаны с репортерным геном и могут использоваться для оценки средств на способность модулировать направляемую промотором транскрипцию.
Способы введения и экспрессии нуклеиновых кислот в клетке известны в уровне техники. В отношении вектора экспрессии вектор может быть с легкостью введен в клетку–хозяина, например, клетку млекопитающего, бактериальную, дрожжевую клетку или клетку насекомого любым способом из уровня техники. Например, вектор экспрессии может быть перенесен в клетку–хозяина физическими, химическими или биологическими способами.
Физические способы введения полинуклеотида в клетку–хозяина включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию, лазеропорацию и тому подобное Способы получения клеток, включающих векторы и/или экзогенные нуклеиновые кислоты, известны в уровне техники. См., например, Sambrook et al. (2012) и Ausubel et al. (1999).
Биологические способы введения представляющей интерес нуклеиновой кислоты в клетку–хозяина включают применение ДНК и РНК векторов. Вирусные векторы и особенно ретровирусные векторы стали наиболее широко применяемым методом вставки генов в клетки млекопитающих, например, клетки человека. Другие вирусные векторы могут быть получены из лентивируса, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов, и тому подобное См., например, патенты США 5,350,674 и 5,585,362.
Химические способы введения нуклеиновой кислоты в клетку–хозяина включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии типа масло в воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой для применения в качестве носителя доставки in vitro и in vivo является липосома (например, везикула из искусственной мембраны). Получение и применение таких систем хорошо известно в уровне техники.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку–хозяина или иного воздействия на клетку нуклеиновой кислоты согласно настоящему изобретению, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке–хозяине могут проводить различные анализы. Такие анализы включают, например, "молекулярно–биологические" анализы, хорошо известные специалистам в данной области, такие как Саузерн и Нозерн–блоттинг, ОТ–ПЦР и ПЦР; "биохимические" анализы, такие как обнаружение присутствия или отсутствия конкретного пептида, например, с помощью иммунологических методов (ИФА и Вестерн–блоты) или с помощью анализов, описанных в настоящем документе для идентификации средств, включенных в объем изобретения.
Не относящиеся к человеку животные, экспрессирующие фактор D человека
Изобретение также включает генетически модифицированное животное, не относящееся к человеку, которое экспрессирует фактор D человека. В некоторых вариантах осуществления генетически модифицированное животное, не относящееся к человеку, которое экспрессирует фактор D человека, не экспрессирует фактор D животного, не относящегося к человеку. В одном из вариантов осуществления изобретения предложено генетически модифицированное животное, не относящееся к человеку, которое экспрессирует фактор D человека с эндогенных регуляторных элементов животного, не относящегося к человеку, но не экспрессирует фактор D животного, не относящегося к человеку. В некоторых вариантах осуществления животное, не относящееся к человеку, является млекопитающим. В некоторых вариантах осуществления животное, не относящееся к человеку, является грызуном. В некоторых вариантах осуществления животное, не относящееся к человеку, является крысой или мышью.
Для создания генетически модифицированного животного, не относящегося к человеку, нуклеиновая кислота, кодирующая белок фактора D человека, может быть включена в рекомбинантный вектор экспрессии в форме, подходящей для экспрессии белка фактора D человека в клетке–хозяине. Термин "в форме, подходящей для экспрессии слитого белка в клетке–хозяине" предназначен для обозначения того, что рекомбинантный вектор экспрессии включает одну или более регуляторных последовательностей, функционально связанных с нуклеиновой кислотой, кодирующей белок фактора D человека таким способом, который обеспечивает транскрипцию нуклеиновой кислоты в мРНК и трансляцию мРНК в белок фактора D человека. Термин "регуляторная последовательность" известен в данной области техники и включает промоторы, энхансеры и другие элементы регуляции экспрессии (например, сигналы полиаденилирования). Такие регуляторные последовательности известны специалистам в данной области и описаны в публикации 1990, Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. Следует понимать, что конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки–хозяина для трансфекции и/или количество белка фактора D человека, которое должно быть экспрессировано.
Генетически модифицированное животное, не относящееся к человеку, может быть создано, например, путем введения нуклеиновой кислоты, кодирующей белок фактора D человека (обычно связанный с соответствующими регуляторными элементами, такими как конститутивный или тканеспецифический энхансер), в ооцит, например, путем микроинъекции, с последующим развитием ооцита у самки мыши–основателя. Интронные последовательности и сигналы полиаденилирования также могут быть включены в трансген для повышения эффективности экспрессии трансгена. Способы создания генетически модифицированных животных, таких как мыши, стали стандартными в данной области и описаны, например, в патентах США 4,736,866 и 4,870,009, а также в публикации 1986, Hogan et al., A Laboratory Manual, Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory. Генетически модифицированное животное–основатель может использоваться для размножения дополнительных индивидов, несущих трансген. Генетически модифицированные животные, несущие трансген, кодирующий белок фактора D согласно изобретению, могут быть затем скрещены с другими генетически модифицированными животным, несущим другие трансгены, или другими нокаутными животными, например, нокаутной мышью, которая не экспрессирует ген фактора D мыши. Следует понимать, что в дополнение к генетически модифицированным животным система может применяться для создания других индивидов, экспрессирующих фактор D человека.
В одном из вариантов осуществления генетически модифицированное животное, не относящееся к человеку, которое экспрессирует фактор D человека с регуляторных элементов животного, не относящегося к человеку, но не экспрессирует фактор D животного, не являющегося человеком, получено с применением системы, которая заменяет последовательности экзонов (или последовательности экзонов и интронов) фактора D животного, не относящегося к человеку, последовательностями экзонов (или последовательностями экзонов и интронов) фактора D человека, но оставляет без изменений нативные последовательности одного, нескольких или всех регуляторных элементов животного, не относящегося к человеку (например, промотор, энхансеры, фланкирующие области, интроны и т.д.). Хотя может использоваться любая подходящая система, одной примерной системой, с помощью которой может быть получено генетически модифицированное не относящееся к человеку животное, является система CRISPr/Cas9. Система "CRISPR/Cas" относится к широко распространенному классу бактериальных систем для защиты от чужеродной нуклеиновой кислоты. Системы CRISPR/Cas встречаются в широком спектре эубактериальных и архейных организмов. Системы CRISPR/Cas включают в себя подтипы I, II и III. В системах CRISPR/Cas II дикого типа используется РНК–опосредованная нуклеаза Cas9 в комплексе с направляющей и активирующей РНК для распознавания и расщепления чужеродной нуклеиновой кислоты. Гомологи Cas9 обнаружены в целом ряде эубактерий, включающих, без ограничения перечисленными, бактерии следующих таксономических групп: Actinobacteria, Aquificae, Bacteroidetes–Chlorobi, Chlamydiae–Verrucomicrobia, Chlroflexi, Cyanobacteria, Firmicutes, Proteobacteria, Spirochaetes и Thermototo. Примером белкаа Cas9 является белок Cas9 Streptococcus pyogenes. Дополнительные белки Cas9 и их гомологи описаны, например, в Chylinksi, et al., RNA Biol. 2013 May 1; 10(5): 726–737; Nat. Rev. Microbiol. 2011 June; 9(6):467–477; Hou, et al., Proc Natl Acad Sci U S A. 2013 Sep 24; 110(39):15644–9; Sampson et al., Nature. 2013 May 9; 497(7448):254–7; и Jinek, et al., Science. 2012 Aug 17; 337(6096):816–21.
В одном из вариантов осуществления генетически модифицированное не относящееся к человеку животное согласно настоящему изобретению экспрессирует фактор D человека с промотора β–актина курицы с энхансером CVM–IE, однако специалисту в данной области будет понятно, что генетически модифицированное не относящееся к человеку животное согласно изобретению охватывает экспрессию фактора D человека с других промоторов и энхансеров. Примеры промоторов, которые могут применяться в изобретении, включают, без ограничения перечисленными, нативный промотор мыши, промотор ДНК pol II, промотор PGK, промотор убиквитина, промотор альбумина, промотор глобина, промотор овальбумина, ранний промотор SV40, промотор вируса саркомы Рауса (RSV), ретровирусный LTR и лентивирусный LTR. Системы экспрессии промоторов и энхансеров, используемые в изобретении, также включают индуцируемые и/или тканеспецифические системы экспрессии.
Описанные в настоящем документе генетически модифицированные животные, не относящиеся к человеку, могут применяться в различных исследованиях и для клинических применений. В некоторых вариантах осуществления в настоящей заявке предложены способы скрининга соединения против фактора D (такого как антитело). В некоторых вариантах осуществления в настоящей заявке предложены способы проверки соединения против фактора D (такого как антитело). В некоторых вариантах осуществления в настоящей заявке предложены способы оценки терапевтической эффективности соединения против фактора D (такого как антитело) при различных комплемент–опосредованных заболеваниях и нарушениях, в том числе заболеваниях и нарушениях, которые могут быть индуцированы у гуманизированного не относящегося к человеку животного, или заболеваниях или нарушениях, которые могут самопроизвольно развиваться у не относящихся к человеку животных с двойной мутацией, которые могут быть получены при скрещивании не относящегося к человеку животного с фактором D и другого не относящегося к человеку животного, имеющего другие мутации, которые могут вызывать комплемент–ассоциированное заболевание или нарушение (см., например, Lesher, 2013, J. Am. Soc. Nephrol. 24: 53–65; Ueda et al., 2017, Blood Mar 2; 129: 1184–1196).
Наборы
Изобретение также включает набор, включающий антитело против фактора D или его комбинации согласно изобретению и инструкционный материал, в котором описано, например, введенние антитела против фактора D или его комбинаций пациенту в качестве терапевтического лечения или нелечебное применение, как описано в другой части настоящего документа. В варианте осуществления данный набор дополнительно включает фармацевтически приемлемый носитель, подходящий для растворения или суспендирования терапевтической композиции, включающей антитело против фактора D или его комбинации согласно изобретению, например, перед введением антитела пациенту. Набор необязательно включает аппликатор для введения антитела.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Далее изобретение будет описано со ссылкой на следующие примеры. Эти примеры приведены исключительно с целью иллюстрации, и изобретение никоим образом не следует считать ограниченным этими примерами, а скорее следует рассматривать как охватывающее любые возможные варианты, которые становятся очевидными в качестве результата описания, представленного в настоящем документе.
Без дополнительного описания считается, что средний специалист в данной области, при использовании предыдущего описания и следующих иллюстративных примеров, может получить и применить соединения настоящего изобретения и осуществить на практике заявленные способы. Таким образом, следующие рабочие примеры не должны быть истолкованы как ограничивающие каким–либо образом остальную часть настоящего описания.
Пример 1
Моноклональные антитела против фактора D человека были получены при использовании метода гибридом, первоначально описанного Колером с соавт. (Kohler et al., 1975, Nature, 256:495), с некоторыми модификациями. Самок мышей Balb/c (Jackson laboratory) иммунизировали 100 мкг очищенного фактора D человека (из человеческой плазмы), эмульгированного с адъювантом. В день 21 и день 35 мышей снова иммунизировали 100 мкг очищенного фактора D человека, эмульгированного с адъювантом. Мышей стимулировали 25 мкг очищенного фактора D человека два раза перед слиянием. Затем мышей умерщвляли путем смещения шейных позвонков и забирали селезенку для приготовления суспензии одиночных клеток путем механического разрушения. Суспензию клеток селезенки один раз промывали средой HYB–SFM (Invitrogen) + 10% FBS, после чего клетки посчитывали и смешивали с миеломными клетками X63–Ag8.653 (ATCC) в соотношении 2:1. Смесь клеток снова промывали средой HYB–SFM и получали осадок клеток с помощью центрифугирования (1000 об/мин ×5 мин). Осадок клеток мягко перемешивали и отделяли, а затем слияние клеток вызывали путем медленного добавления полиэтиленгликоля (ПЭГ 1500) (1,5 мл ПЭГ на 3×108 клеток). Клетки оставляли на 1 мин при 37°C, затем 20 мл среды HYB–SFM добавляли к клеткам за 3 мин (1 мл в течение первой минуты, 3 мл в течение второй минуты и 16 мл в течение третьей минуты). Смесь центрифугировали при 1000 об/мин в течение 5 мин и сеяли клетки в 24–луночные планшеты в среде HAT (10 мл HAT [Sigma H0262], 5 мл пен/стреп, 500 мкл гентамицина и 10% FBS в 500 мл среды HYB–SFM). Через 2 недели супернатанты из лунок с видимыми колониями отбирали для скрининга реактивности с очищенным фактором D человека методом ИФА. Положительные клоны отбирали и сеяли в 96–луночные планшеты метод серийных разведений с получением одиночных клонов после второго раунда скрининга с помощью ИФА. Положительные клоны размножали в среде HT (10 мл HT, 5 мл пен/стреп, 500 мкл гентамицина и 10% FBS в 500 мл среды HYB–SFM). Перед сбором антитела клетки гибридомы переводили на бессывороточную среду (ΗΎΒ–SFM) на 2–3 дня. Среду культивирования клеток собирали для очистки мАт с помощью афинной хроматографии с белком G.
Пример 2
Микротитровальные планшеты покрывали липополисахаридом (ЛПС) (2 мкг/лунка) в PBS (фосфатно–солевом буфере) при 37°C в течение 1 часа. После промывки планшетов PBST (фосфатно–солевым буфером и 0,05% tween) 3 раза планшет блокировали 1% BSA в PBS в течение 1 часа при КТ. 10% нормальную человеческую сыворотку (НЧС), нормальную сыворотку яванского макака, нормальную сыворотку резуса, нормальную сыворотку морской свинки, нормальную сыворотку мыши предварительно инкубировали с различными концентрациями мАт 11A8–1 или мАт 1F10–5, или химерного 11A8–1 при 4°C в течение 1 часа. 10% сыворотка в Mg++–ЭГТА GVB++ буфере служила в качестве положительного контроля, и 10% сыворотка в GVB++ ЭДТА буфере служила в качестве отрицательного контроля. Планшеты инкубировали с НЧС при 37°C в течение 1 часа, затем реакцию останавливали холодным 10 мМ ЭДТА в PBS и промывали 3 раза. Планшеты инкубировали с HRP–конъюгированным козьим поликлональным антителом против C3 человека или поликлональным антителом против C3 мыши, разведенным 1:4000 в блокирующем буфере, при комнатной температуре в течение 1 часа. Планшеты 3 раза промывали и проявляли HRP субстратом в течение 6–10 минут. Реакцию останавливали 2 Н H2SO4, считывали планшет при 450 нм в микропланшетном анализаторе.
Пример 3
Полистирольные микротитровальные планшеты покрывали очищенным фактором D человека (50 нг/лунка) в PBS при 37°C в течение 1 часа. После аспирации раствора фактора D лунки блокировали PBS, содержащим 1% BSA в PBS, при комнатной температуре в течение 1 часа. Лунки без fD покрытия служили в качестве фонового контроля. В лунки добавляли различные концентрации мАт 11A8–1 или мАт 1F10–5, или химерного 11A8–1, 50 мкл/лунка в блокирующем растворе. После инкубирования в течение 1 часа при комнатной температуре лунки тщательно промывали PBST. Связавшееся с фактором D человека мАт детектировали при добавлении HRP–конъюгата потив IgG мыши в разведении 1:4000 в блокирующем растворе, который оставляли для инкубирования в течение 1 ч при КТ. После промывки PBST планшет проявляли HRP субстратом в течение 6–10 минут. Реакцию останавливали 2 Н H2SO4 и считывали планшет при 450 нм в микропланшетном анализаторе.
Пример 4
Анализ методом поверхностного плазмонного резонанса использовали для измерения константы скорости ассоциации и скорости диссоциации для связывания фактора D человека с иммобилизированным мАт 11A8–1, мАт 1F10–5 и химерным 11A8–1 при использовании системы BIAcore 3000 (BiaCore AB, Uppsala, Sweden), все эксперименты BiaCore проводили при 25°C. Карбоксилированную декстрановую матрицу сенсорного чипа CM5 использовали для связывания очищенного антитела, мАт 11A8–1, мАт 1F10–5 и химерного 11A8–1 методом аминосочетания с получением поверхностной плотности 400–500 RU. Человеческий fD разводили до 100, 50, 25, 12,5, 6,25, 3,12, 1,56 и 0 нМ в буфере HBSET (забуференном HEPES растворе хлорида натрия с ЭДТА и Tween 20) и образцы инкубировали на поверхности с мАт 11A8–1, мАт 1F10–5 и химерным 11A8–1 при 30 мкл/мин (инъекция 60 мкл) в течение 120 с, и проводили диссоциацию связанного аналита в течение 900 с. Данные анализировали с помощью программы для оценки BIA 3.2 с использованием модели бивалентного связывания. Регенерацию поверхности выполняли инъекциями 50 мкл (50 мкл/мин) 50 мМ NaOH.
Пример 5
Для клонирования кДНК 11A8–1 и 1F10–5, суммарную РНК выделяли из клеток гибридом с помощью реактива TRizol (Sigma). Первую цепь кДНК синтезировали с помощью обратной транскрипции при использовании олиго(dT) праймера, для амплификации кДНК тяжелой цепи (для IgG 1, IgG2a/b) в реакциях ПЦР использовали следующие праймеры: 5'–GAG GTG A AGCTG GTG G AG(T/A) C (T/A) GG–3' (SEQ ID NO:68) и 5'–GGGGCCAGTGGATAGAC–3' (SEQ ID NO:69). Для амплификации k легкой цепи использовали следующие праймеры: смесь 4 прямых праймеров: 5'–CCAGTTCCGAGCTCCAGATGACCCAGACTCCA–3' (SEQ ID NO:70); 5'–CCAGTTCCGAGCTCGTGCTCACCCAGTCTCCA–3' (SEQ ID NO:71); 5'–CCAGTTCCGAGCTCCAGATGACCCAGTCTCCA–3' (SEQ ID NO:72); 5'–CC AGTTC CG G CTC GTG ATG AC AC AGTCTCC–3' (SEQ ID NO:73); обратный праймер: 5'–GTTGGTGCAGCATCAGC–3' (SEQ ID NO:74). ПЦР ампликоны клонировали в вектор pCR TOPO TA 2.1 (Invitrogen) и секвенировали. Для получения последовательности сигнального пептида (лидерной) мАт использовали метод 5'–RACE с набором (GeneRacer) производства Invitrogen. Полные кДНК вариабельной области амплифицировали при использовании специфических праймеров, определенных на основе 5'–RACE и начальных данных секвенирования.
Пример 6
Плазмиду pND1 использовали для сборки окончательного направляющего вектора. Для гомологичной последовательности короткого плеча амплифицировали smaI–smaI фрагмент длиной 4,2 тому подобноен., содержащий 3'–область гена фактора D мыши, при использовании 5'–CCCGGGCTGGGTTTTGGTTTTTGC–3' (прямой; сайт SmaI подчеркнут) и 5'–CCCGGGTCCTTGACATGAACACTTTGC–3' (обратный; сайт SmaI подчеркнут) в качестве праймеров (сайты SmaI подчеркнуты). Этот фрагмент клонировали в вектор pND1 по сайтам KpnI, обработанным затупляющим реактивом. Для гомологичной последовательности длинного плеча амплифицировали фрагмент длиной 5,7 тому подобноен., содержащий 5'–область гена фактора D мыши, при использовании в качестве праймеров 5'–ATCGATACTCAGAAATCTGCCTGCCTC–3' (прямой; сайт ClaI подчеркнут) и 5'–GCGGCCGCTCCTAGGAGGACCAGAACTGCCAGGCGCTCCCAGCTGTGCATTCTGACAGCA–3' (обратный; сайт NotI подчеркнут). Также амплифицировали фрагмент длиной 1,2 тому подобноен., содержащий 3'–область гена фактора D мыши при использовании в качестве праймеров 5'–CTCGAGAGAGACACGTGGCTCACAATA–3' (прямой; сайт XhoI подчеркнут) и 5'–CTCGAGAATTATCGAAGTACTCCACCG–3' (обратный; сайт XhoI подчеркнут) (сайты SmaI подчеркнуты). Фрагмент 826 пн, содержащий кодирующую последовательность фактора D человека, синтезировали в Genscript Corp. и выделяли 0,75 тому подобноен. фрагмент NotI–XhoI при расщеплении NotI и XhoI. Эти три фрагмента, 5,7 тому подобноен. ClaI–NotI фрагмент, 0,75 тому подобноен. NotI–XhoI фрагмент и 1,2 тому подобноен. XhoI–XhoI фрагмент субклонировали в вышеуказанный вектор pND1 по сайтам ClaI–XhoI. Направляющую конструкцию линеаризовали, электропорировали в клетки C57BL/6 ES и отбирали по устойчивости к неомицину. Направляющие ES клоны идентифицировали с помощью Саузерн–блоттинга при использовании 3'–зонда, распознающего 5 тому подобноен. фрагмент дикого типа и 4,5 тому подобноен. фрагмент в правильно модифицированной геномной области после расщепления BamHI (Фиг. 11 c). Правильно направленные клоны ES вводили в бластоцисту с получением химерных мышей. Полученных химерных самцов скрещивали с самками мышей C57BL/6 для определения передачи целевого аллеля по зародышевой линии. Гетерозиготные мыши с нокаутом фактора D человека скрещивали с генетически модифицированными мышами FLPe (фон C57BL/6, Jackson laboratory) для удаления neo кассеты из нокин аллеля фактора D человека. Гетерозиготных мышей с нокаутом фактора D человека без neo кассеты скрещивали с получением гомозиготных мышей с нокаутом фактора D человека. Мышей дикого типа (WT), гетерозиготных (Het) и гомозиготных (Homo) мышей с нокаутом фактора D человека идентифицировали при ПЦР генотипировании ДНК из хвоста с использованием специфичного к фактору D человека (целевой размер: 450 пн) 5'–GTC АГГ GTG CCA ТГК АГГ AG–3' (SEQ ID NO:26) и 5'–CCC ТГК АГГ АГИ АКС АКС TTC–3' (SEQ ID NO:27), и специфичного к фактору D мыши (целевой размер: 292 пн), 5’–CCT CCC ACC CTT AGC TAT CC–3’ (SEQ ID NO:28) и 5’–ACC CAG ACT GTG TCC CTC AC–3’(SEQ ID NO:29) (Фиг. 11d).
Пример 7
Эксперименты проводили для изучения активности и кинетики in vivo мАт 11A8–1 и 1F10–5 у гомозиготных мышей с нокаутом фактора D. Мышам вводили 1 мг (в/б) мАт 11A8–1 или мАт 1F10–5. Образцы крови (50–75 мкл) собирали перед инъекцией (24 часа), а затем в различные моменты времени после инъекции путем забора крови из ретроорбитального синуса и приготовления сыворотки. Образцы сыворотки исследовали на ЛПС–индуцированную активацию AP комплемента. Для этого анализа ИФА планшеты (96–луночные, Nunc) покрывали 50 мкл раствора ЛПС (2 мкг/лунка в PBS, 37°C, 1 час). Планшеты промывали 3 раза PBS, содержащим 0,05% Твин–20 (PBS–T), и в каждую лунку добавляли по 50 мкл серийно разведенной (начиная с 1:10) мышиной сыворотки. Мышиную сыворотку разбавляли GVB–ЭГТА–Mg++ (содержащей 10 мМ ЭГТА и конечную концентрацию Mg++ 2,5 мМ). Планшет оставляли для инкубирования при 37°C в течение 1 часа, 3 раза промывали PBS–T и затем добавляли 50 мкл HRP–конъюгированного антитела козы против C3 мыши (1:4000, Cappel) и оставляли планшет на 1 час при комнатной температуре. Планшет три раза промывали PBS–T и затем проявляли при использовании A+B реагента BD Pharmingen. Реакцию останавливали через 6–10 минут при использовании 2 Н H2SO4. Активацию AP комплемента обнаруживали путем измерения количества осаждения C3 на планшете (OD450).
Пример 8
Для создания мутантов с делециями праймеры (Таблица 1) подбирали таким образом, чтобы сайты контакта были удалены прямым и обратным праймером. Мутанты с заменами создавали при включении нужного нуклеотида в прямой праймер. 20 нг плазмиды pCMV–XL4–hfD амплифицировали с соответствующими прямыми и обратными праймерами при использовании мастер–микса Q5® Hot Start High–Fidelity. Амплифицированные продукты разгоняли на электрофорезе в агарозном геле для подтвержения чистоты. Соответствующие амплифицированные продукты вырезали из агарозного геля и выделяли ДНК при использовании набора для выделения из геля Bioneer. Очищенную ДНК лигировали ДНК–лигазой (Takara DNA ligase mix), трансформировали в компетентные клетки JM109 и 100 мкл сеяли на чашку с LB агаром с ампициллином (50 мкг/мл). Колонии отбирали и инокулировали среду LB, содержащую 75 мкг/мл ампициллина. Плазмиды выделяли и подтверждали присутствие вставки при расщеплении рестриктазой NotI. Положительные в рестрикционном анализе плазмиды секвенировали для обнаружения мутантов с делециями и заменами. Положительные мутанта плазмиды с делециями и заменами использовали для экспрессии делеционного белка при трансфекции.
Таблица 1
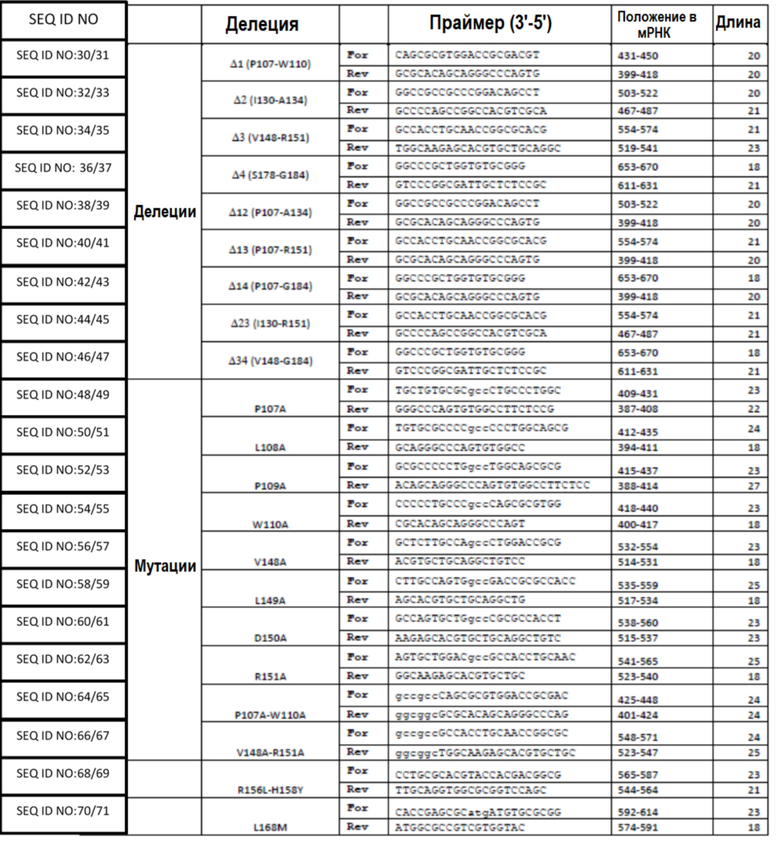

Пример 9
Не содержащие эндотоксин плазмиды использовали для трансфекции. Клеткам яичника китайского хомячка (CHO) позволяли расти в 6–луночных планшетах до 85–90% конфлюэнтности. Плазмиды положительного контроля и мутантные плазмиды с делецией трансфицировали с использованием липофектамина (Invitrogen) в соотношении 1:2 в Opti–MEM (Thermo Fisher Scientific). Через 48 часов после трансфекции супернатант собирали и хранили при –20°C до применения. Клетки промывали охлажденным во льду PBS (Invitrogen), добавляли неденатурирующий буфер RIPA (для радиоиммунопреципитационного анализа) (20 мМ Трис HCl, pH 8, 137 мМ NaCl, 1% NP–40, 2 мМ ЭДТА) и выдерживали во льду в течение 30 мин с периодическим перемешиванием. Лизат клеток собирали после центрифугирования и хранили супернатант при –20°C. Супернатант клеток CHO и лизат клеток использовали в качестве отрицательного контроля.
Пример 10
Картирование эпитопов 11A8–1 выполняли методом иммунопреципитации и Вестерн–блоттинга. 300 мг CNBr–активированных гранул сефарозы 4B (номер по кат. 17–0430–1, GE healthcare) оставляли для набухания в 1 мМ HCl в течение 15 минут. Затем гранулы переносили в воронку со стеклянным фильтром и промывали 200 мл 1 мМ HCl. Гель (гранулы) промывали буфером для связывания pH 9,0 (0,1 М NaHCO3, pH 9,0, 0,5 М NaCl) и сразу переносили в пробирку, содержащую 1 мг антитела 11–8A1 в буфере для связывания, на 5 мин. Пробирку оставляли на ночь на вращающейся платформе при 40°C. Связывание антитела с CNBr гранулами проверяли с помощью измерения оптического поглощения раствора антитела до и после связывания. Избыток лиганда удаляли при промывке 3 раза буфером для связывания, и оставшиеся активные сайты блокировали блокирующим буфером (1 М Трис–основание, pH 9,0) в течение 2 часов при комнатной температуре. Для удаления избытка несвязавшегося лиганда после связывания, гранулы поочередно промывали буфером с низким pH (0,1 М уксусная кислота, 0,5 М NaCl) и высоким pH (буфер для связывания) 2 раза. 200 мкл связавшихся гранул инкубировали с супернатантами после трансфекции и лизатом клеток в течение 2 часов при комнатной температуре на вращающейся платформе. Гранулы промывали 0,5 М NaCl в PBS 5 раз. Белки элюировали буфером для элюции антитела (0,1 М глицин, pH 2,0) и нейтрализовали 1,5 М Трис, pH 9,0. 50 мкл элюированных образцов использовали для иммуноблоттинга.
Пример 11
Картирование эпитопов 1F10–5 выполняли методом ИФА. Микротитровальные планшеты покрывали 1F10–5 (2 мкг/мл) в PBS при 37°C в течение 1 часа. После аспирации раствора антитела лунки блокировали PBS, содержащим 1% BSA в PBS, при комнатной температуре в течение 1 часа. В лунки добавляли супернатанты культуры клеток транзиентных CHO трансфекантов полноразмерного или четырех мутантов с делецией (мутант 9, 10, 11 или 12) фактора D человека. Контролем служила среда клеточной культуры нетрансфицированных клеток. После инкубирования в течение 1 часа при комнатной температуре, лунки тщательно промывали. 1F10–5, связанное с фактором D человека, детектировали при использовании биотин–конъюгированного козьего антитела против фактора D человека с последующим добавлением HRP–конъюгированного стрептавидина. После промывки планшет проявляли HRP субстратом в течение 6–10 минут. Реакцию останавливали 2 Н H2SO4 и считывали планшет при 450 нм в микропланшетном анализаторе.
Для картирования эпитопов, мАт 1F10–5 тестировали на реактивность с полноразмерным и четырьмя мутантами с делецией фактора Д человека. Вестерн–блоттинг подтверждал экспрессию белка для четырех мутантов с делецией. В ИФА мАт 1F10–5 связывало полноразмерный, мутант–9 и –12, но его связывание с мутантом–10 и –11 было значительно снижено. Эти результаты, показанные на Фигуре 19, указывают, что делеция пяти аминокислот NRRTH в положениях 155–159 (SEQ ID NO:23) или четырех аминокислот SNRR в положениях 173–176 (SEQ ID NO:24) нарушала связывание мАт 1F10–5, и что эпитоп мАт 1F–10 включает аминокислоты SNRR.
Пример 12
Гомозиготным мышам с нокаутом фактора D человека переливали эритроциты (Эр) мышей дикого типа и мышей с тройным нокаутом (TKO) Crry/DAF/C3. Реципиентным мышам (гомозиготные мыши с нокаутом фактора D человека) за 24 часа до переноса Эр вводили мАт 118A–1 (2 мг/мышь, в/б) или PBS. Донорские Эр собирали у мышей TKO, промывали в PBS и метили CFSE согласно ранее опубликованной методике (Miwa et al., 2002, Blood 99; 3707–3716). Аналогичным образом, донорские Эр также собирали у мышей дикого типа (C57BL/6J), промывали в PBS и метили DDAO–SE (Thermo Fisher Scientific) согласно инструкциям производителя. Смесь 1:1 WT и TKO Эр, эквивалентных 200 мкл крови, вводили реципиентным мышам в хвостовую вену. Через 5 минут и 6, 24, 48, 72, 96, 120 часов после переливания Эр у реципиентных мышей забирали кровь и исследовали Эр для определения процента CFSE– или DDAO–SE–меченных (т.е. перелитых) Эр, оставшихся в кровотоке. Количество CFSE–меченных TKO Эр у каждого реципиента нормализовали (в %) по DDAO–SE–меченным WT Эр в каждой временной точке.
Пример 13
Артрит индуцировали у гомозиготных мышей с нокаутом фактора D человека путем пассивного переноса очищенных суммарных IgG от мышей K/BxN (2 мг/мышь, в/б в дни 0 и 2). Утолщение голеностопного сустава измеряли штангенциркулем (Mitutoyo), и клинические показатели регистрировали при использовании ранее опубликованных критериев (Kimura et al., 2010, JCI; 3545–3554). Мышам вводили 1 мг 11A8–1 в день–1, день 3, 7, 11 и 15.
Пример 14
Активность 11–8A1 мАт, 1F10–5 и 166–32 in vivo оценивали у мышей с нокаутом фактора D человека. Для оценки эффективности мАт 166–32 (см. Tanox US8124090), 11–8A1 и 1F10–5 при блокировании активности альтернативного пути (AP) комплемента in vivo, фактор D–гуманизированных мышей лечили путем многократного введения доз (1 мг/мышь, раз в 3 дня, п/к введение). Образцы плазмы собирали до лечения мАт (время 0) и через 6 ч, 1, 3, 6 и 9 дней после лечения мАт и исследовали ЛПС–индуцированную активность AP комплемента. Активность AP комплемента в различные временные точки нормализовали по 100% значениям, полученным в момент времени 0. Данные показали, что мАт 11–8A1 и 1F10–5 обладали превосходной фармакодинамической активностью in vivo по сравнению с мАт 166–32 (Фигура 20). В частности, мАт 11–8A1 стабильно ингибировало активность AP комплемента на 80–90% во все временные точки после введения мАт, тогда как мАт 166–32 достигало сопоставимого ингибирования только через 6 часов и в день 1 после введения мАт. мАт 1F10–5 показало 50% ингибирование AP комплемента в день 9, тогда как ингибирование активности AP комплемента мАт 166–32 в день 9 почти не наблюдалось (Фигура 20).
Активность in vivo химерного мАт 11–8A1 и химерного AFD оценивали у мышей с нокаутом фактора D человека. Для оценки эффективности 11–8A1/человеческого IgG4 химерного мАт и AFD/человеческого IgG4 химерного мАт при блокировании активности альтернативного пути (AP) комплемента in vivo, фактор D–гуманизированных мышей лечили путем многократного введения доз (1 мг/мышь, раз в 3 дня, п/к введение). Образцы плазмы собирали до введения мАт (время 0) и через 6 часов, 1, 3, 6, 9, 12 и 15 дней после введения мАт и исследовали на ЛПС–индуцированную активность AP комплемента. Активность AP комплемента в различные временные точки нормализовали по 100% значений, полученных в момент времени 0. AFD представляет собой гуманизированный вариант мАт 166–32 (см. Katschke et al., J Biol Chem. 2012 Apr 13; 287:12886–12892, WO/2008/055206, патент США 8,372,403, патент США 8,273,352, заявка на патент США 2014/0212433). Данные показали, что 11–8A1/человеческое IgG4 химерное мАт было намного более активным и показало лучший фармакодинамический профиль по сравнению с AFD/человеческое IgG4 химерное мАт (Фигура 21). В частности, тогда как оба мАт вызывали 90–100% ингибирование через 6 часов и в день 1 после введения мАт, 11–8A1/человеческое IgG4 химерное мАт, но не AFD/человеческое IgG4 химерное мАт, вызвало более чем 75% ингибирование активности AP комплемента в день 6–15 (Фигура 21).
Далее описаны материалы и методы, используемые в примере.
Очистка мАт 166–32
Для получения очищенного мАт 166–32, мышиные клетки гибридомы (HB124–76), которые секретируют моноклональное антитело 166–322, которое связывается с фактором D человека, получали из ATCC (см. Tanox, патент США 8,124,090) и культивировали. Среду культивирования клеток собирали для очистки мАт с помощью афинной хроматографии с белком G.
Получение 11–8A1/человеческого IgG4 химерного мАт
Для клонирования кДНК мАт 11–8A1, суммарную РНК выделяли из клеток гибридомы при использовании реактива TRizol (Sigma). кДНК первой цепи синтезировали путем обратной транскрипции с использованием олиго(dT) праймера. Для амплификации кДНК тяжелой цепи (для IgG 1, IgG2a/b) в реакциях ПЦР использовали следующие праймеры: 5'–GAGGTGAAGCTGGTGGAG(T/A)C(T/A)GG–3' SEQ ID NO:72 и 5'–GGGGCCAGTGGATAGAC–3' SEQ ID NO:73. Для амплификации каппа легкой цепи использовали следующие праймеры: смесь 4 прямых праймеров: 5'–CCAGTTCCGAGCTCCAGATGACCCAGACTCCA–3' SEQ ID NO:74; 5'–CCAGTTCCGAGCTCGTGCTCACCCAGTCTCCA–3' SEQ ID NO:75; 5'–CCAGTTCCGAGCTCCAGATGACCCAGTCTCCA–3' SEQ ID NO:76; 5'–CCAGTTCCGAGCTCGTGATGACACAGTCTCCA–3' SEQ ID NO:77; обратный праймер: 5'–GTTGGTGCAGCATCAGC–3' SEQ ID NO:78. ПЦР ампликоны клонировали в вектор pCR TOPO TA 2.1 (Invitrogen) и секвенировали. Для получения последовательности сигнального пептида (лидерной) мАт использовали метод 5'–RACE с набором (GeneRacer) производства Invitrogen. Полноразмерные кДНК вариабельных областей амплифицировали с использованием специфичных праймеров, определенных с помощью 5'–RACE и первоначальных данных секвенирования. кДНК, кодирующие вариабельные домены тяжелой цепи и легкой цепи мАт 11–8A1, субклонировали в векторы pFUSE–CHIg–hG4 и pFUSE2–CLIg–hk (InVivoGen, San Diego, CA), соответственно. Для предотвращения обмена молекулами IgG4 мутацию S228P вводили в Fc домен 11–8A1/человеческого IgG4 химерного мАт. Рекомбинантное 11–8A1/человеческое IgG4 химерное антитело экспрессировали в системе экспрессии ExpiCHO (Thermo Fisher Scientific). Среду культивирования клеток собирали для очистки химерного мАт с помощью афинной хроматографии с белком G.
Получение гуманизированного Ат 166–32 (AFD)
кДНК, кодирующие вариабельные домены тяжелой цепи и легкой цепи AFD (см. Katschke et al., J Biol Chem. 2012 Apr 13; 287:12886–12892, WO/2008/055206, патент США 8,372,403, патент США 8,273,352, заявка на патент США 2014/0212433), синтезировали и клонировали в векторы pFUSE–CHIg–hG4 и pFUSE2–CLIg–hk (InVivoGen, San Diego, CA), соответственно. Для предотвращения обмена молекулами IgG4 мутацию S228P вводили в Fc домен AFD/человеческого IgG4 химерного мАт. Рекомбинантное AFD/человеческое IgG4 мАт экспрессировали в системе экспрессии ExpiCHO (Thermo Fisher Scientific). Среду культивирования клеток собирали для очистки химерного мАт с помощью афинной хроматографии с белком G.
Оценка фармакодинамики мАт у гомозиготных мышей с нокаутом фактора D человека
Эксперименты проводили с целью исследования и сравнения активности in vivo мышиных мАт 11–8A1, 1F10–5, 166–32 и 11–8A1/человеческого IgG4 химерного и AFD/человеческого IgG4 химерного мАт у гомозиготных мышей с нокаутом фактора D человека. Мышам (10–12 недель) вводили 1 мг/мышь (п/к в PBS) мАт раз в 3 дня. Обработанные антикоагулянтом лепирудином образцы плазмы (50–75 мкл) собирали до инъекции (время 0) и затем в различные временные точки после инъекции путем забора крови из ретроорбитального синуса и приготавливали плазму. Образцы плазмы замораживали при –80°C и хранили до исследования в анализе ЛПС–индуцированной активации AP комплемента на основе ИФА. Активацию комплемента AP оценивали путем измерения количества активированных фрагментов C3, осаждаемых на планшете (OD450), как описано ранее (см. Kimura et al., 2008, Blood 111:732–40).
Описание каждого патента, заявки на патент и публикации, процитированных в настоящем документе, полностью включено посредством отсылки.
Хотя данное изобретение было раскрыто со ссылкой на конкретные варианты осуществления, очевидно, что другие варианты осуществления и вариации настоящего изобретения могут быть предложены другими специалистами в данной области без отступления от истинной сущности и объема изобретения. Предполагается, что прилагаемая формула изобретения включает все подобные варианты осуществления и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗЕ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ПЕНСИЛЬВАНИЯ
СУН, Вэньчао
ЧЖОУ, Линь
САТО, Саяка
МИВА, Такаси
ГУЛЛИПАЛЛИ, Дамодар
ГОЛЛА, Мадху
<120> АНТИТЕЛА ПРОТИВ ФАКТОРА D И ИХ ПРИМЕНЕНИE
<130> 046483-6155-00-WO.607243
<150> US 62/457,477
<151> 2017-02-10
<160> 78
<170> PatentIn version 3.5
<210> 1
<211> 449
<212> ДНК
<213> Homo sapiens
<400> 1
ctcaaggtcc ttacaatgaa atgcagctgg gttatcgtct tcctgatggc agtggttaca
60
ggggtcaatt cagaggttca gctgcagcag tctggggcag accttgtgag gccaggggcc
120
tcagtcaagt tgtcctgcac aacttctggc ttcaacatta aagacaccta tgtgcactgg
180
gtgaaacaga ggcctgaaca gggcctggaa tggattggaa ggattgatcc tgcgaatggt
240
cttactacat ttgatccgag gttccaggcc aaggccacta taacagcaga cacatcctcc
300
aataccgcct acctgcagct cagcagcctg acatctgagg acactgccgt ctattactgt
360
acatatgcta tggaatattg gggtcaagga acctcagtca ccgtctcctc agccaaaacg
420
acacccccat ctgtctatcc actggcccc
449
<210> 2
<211> 149
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Leu Lys Val Leu Thr Met Lys Cys Ser Trp Val Ile Val Phe Leu Met
1 5 10 15
Ala Val Val Thr Gly Val Asn Ser Glu Val Gln Leu Gln Gln Ser Gly
20 25 30
Ala Asp Leu Val Arg Pro Gly Ala Ser Val Lys Leu Ser Cys Thr Thr
35 40 45
Ser Gly Phe Asn Ile Lys Asp Thr Tyr Val His Trp Val Lys Gln Arg
50 55 60
Pro Glu Gln Gly Leu Glu Trp Ile Gly Arg Ile Asp Pro Ala Asn Gly
65 70 75 80
Leu Thr Thr Phe Asp Pro Arg Phe Gln Ala Lys Ala Thr Ile Thr Ala
85 90 95
Asp Thr Ser Ser Asn Thr Ala Tyr Leu Gln Leu Ser Ser Leu Thr Ser
100 105 110
Glu Asp Thr Ala Val Tyr Tyr Cys Thr Tyr Ala Met Glu Tyr Trp Gly
115 120 125
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
130 135 140
Val Tyr Pro Leu Ala
145
<210> 3
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Phe Asn Ile Lys Asp Thr Tyr Val
1 5
<210> 4
<211> 14
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Trp Ile Gly Arg Ile Asp Pro Ala Asn Gly Leu Thr Thr Phe
1 5 10
<210> 5
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Thr Tyr Ala Met Glu Tyr
1 5
<210> 6
<211> 428
<212> ДНК
<213> Homo sapiens
<400> 6
ggaccaaagt tcaaagacaa aatggatttt caagtgcaga ttttcagctt cctgctaatc
60
agtgcctcag tcatgctgtc cagaggacaa attgttctca cccagtctcc agcaatcatg
120
tctgcatctc caggggagag ggtcaccatg acctgcagtg ccaggtcaga tgtaagttac
180
atgtattggt atcagcagaa gccaggatcc tcccccagac tcctgattta tgacacatcc
240
aacctggctt ctggagtccc tgttcgcttc agtgccagtg ggtctgggac ctcttactct
300
ctcacaatca gccgaatgga ggctgaagat gctgccactt attactgcca gcagtggagt
360
agttacccac cgtggacgtt cggtggaggc accaagctgg aaatcaaacg ggctgatgct
420
gcaccaac
428
<210> 7
<211> 142
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Gly Pro Lys Phe Lys Asp Lys Met Asp Phe Gln Val Gln Ile Phe Ser
1 5 10 15
Phe Leu Leu Ile Ser Ala Ser Val Met Leu Ser Arg Gly Gln Ile Val
20 25 30
Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu Arg Val
35 40 45
Thr Met Thr Cys Ser Ala Arg Ser Asp Val Ser Tyr Met Tyr Trp Tyr
50 55 60
Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Ile Tyr Asp Thr Ser
65 70 75 80
Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Ala Ser Gly Ser Gly
85 90 95
Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu Asp Ala Ala
100 105 110
Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro Pro Trp Thr Phe Gly
115 120 125
Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala Pro
130 135 140
<210> 8
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Arg Ser Asp Val Ser Tyr Met Tyr
1 5
<210> 9
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Leu Leu Ile Tyr Asp Thr Ser Asn Leu Ala Ser
1 5 10
<210> 10
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Gln Gln Trp Ser Ser Tyr Pro Pro Trp
1 5
<210> 11
<211> 431
<212> ДНК
<213> Homo sapiens
<400> 11
gcccaagtct tagacatcat ggattggctg tggaacttgc tattcctgat ggcagctgcc
60
caaagtgccc aagcacagat ccagttggtg cagtctggac ctgagctgaa gaagcctgga
120
gagacagtca agatctcctg caaggcttct gggtatacct tcacaaactt tgaaatgaac
180
tgggtgaagc aggctccagg acagggttta aactggatgg gctgtataaa cacctacact
240
ggagacccaa tatatgctga tgacttcagg ggacggtttg ccttctcttt ggaaacctct
300
gccagcactg cctatttgca gatcaacaac ctcaaaaatg aggacatggc tacatatttc
360
tgttcaagag agggaggggg ggactactgg ggccagggca ccactctcac ggtctcctca
420
gccaaaacga c
431
<210> 12
<211> 143
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Ala Gln Val Leu Asp Ile Met Asp Trp Leu Trp Asn Leu Leu Phe Leu
1 5 10 15
Met Ala Ala Ala Gln Ser Ala Gln Ala Gln Ile Gln Leu Val Gln Ser
20 25 30
Gly Pro Glu Leu Lys Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys
35 40 45
Ala Ser Gly Tyr Thr Phe Thr Asn Phe Glu Met Asn Trp Val Lys Gln
50 55 60
Ala Pro Gly Gln Gly Leu Asn Trp Met Gly Cys Ile Asn Thr Tyr Thr
65 70 75 80
Gly Asp Pro Ile Tyr Ala Asp Asp Phe Arg Gly Arg Phe Ala Phe Ser
85 90 95
Leu Glu Thr Ser Ala Ser Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys
100 105 110
Asn Glu Asp Met Ala Thr Tyr Phe Cys Ser Arg Glu Gly Gly Gly Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr
130 135 140
<210> 13
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Gly Tyr Thr Phe Thr Asn Phe Glu Met Asn
1 5 10
<210> 14
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Cys Ile Asn Thr Tyr Thr Gly Asp Pro Ile Tyr Ala Asp Asp Phe Arg
1 5 10 15
Gly
<210> 15
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Glu Gly Gly Gly Asp Tyr
1 5
<210> 16
<211> 432
<212> ДНК
<213> Homo sapiens
<400> 16
ggaaatacat caggcaggca agggcatcaa gatgaagtca cagacccagg tcttcgtatt
60
tctactgctc tgtgtgtctg gtgctcatgg gagtattgtg atgacccaga ctcccaaatt
120
cctgcttgta tcagcaggag acagggttac cataacctgc aaggccagtc agagtgtgac
180
taatgatgta gcttggtacc aacagaagcc agggcagtct cctagattgc tgatatacca
240
tgcatccaat cgctacactg gagtccctga gcgcttcact ggcagtggat atgggacgga
300
tttcactttc accatcaaca ctgtgcaggc tgaagacctg gcagtttatt tctgtcagca
360
ggattatagc tctcctcgga cgttcggtgg aggcaccaag ctggaaatca aacgggctga
420
tgctgcacca ac
432
<210> 17
<211> 143
<212> БЕЛОК
<213> Homo sapiens
<400> 17
Glu Ile His Gln Ala Gly Lys Gly Ile Lys Met Lys Ser Gln Thr Gln
1 5 10 15
Val Phe Val Phe Leu Leu Leu Cys Val Ser Gly Ala His Gly Ser Ile
20 25 30
Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly Asp Arg
35 40 45
Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Thr Asn Asp Val Ala
50 55 60
Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr His
65 70 75 80
Ala Ser Asn Arg Tyr Thr Gly Val Pro Glu Arg Phe Thr Gly Ser Gly
85 90 95
Tyr Gly Thr Asp Phe Thr Phe Thr Ile Asn Thr Val Gln Ala Glu Asp
100 105 110
Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Pro Arg Thr Phe
115 120 125
Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala Asp Ala Ala Pro
130 135 140
<210> 18
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<400> 18
Lys Ala Ser Gln Ser Val Thr Asn Asp Val Ala
1 5 10
<210> 19
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<400> 19
His Ala Ser Asn Arg Tyr Thr
1 5
<210> 20
<211> 9
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Gln Gln Asp Tyr Ser Ser Pro Arg Thr
1 5
<210> 21
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Pro Leu Pro Trp
1
<210> 22
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 22
Val Leu Asp Arg
1
<210> 23
<211> 5
<212> БЕЛОК
<213> Homo sapiens
<400> 23
Asn Arg Arg Thr His
1 5
<210> 24
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 24
Ser Asn Arg Arg
1
<210> 25
<211> 783
<212> ДНК
<213> Homo sapiens
<400> 25
atgcacagct gggagcgcct ggcagttctg gtcctcctag gagcggccgc ctgcggtgag
60
gaggcctggg cctgggcggc gccgccccgt ggtcggatcc tgggcggcag agaggccgag
120
gcgcacgcgc ggccctacat ggcgtcggtg cagctgaacg gcgcgcacct gtgcggcggc
180
gtcctggtgg cggagcagtg ggtgctgagc gcggcgcact gcctggagga cgcggccgac
240
gggaaggtgc aggttctcct gggcgcgcac tccctgtcgc agccggagcc ctccaagcgc
300
ctgtacgacg tgctccgcgc agtgccccac ccggacagcc agcccgacac catcgaccac
360
gacctcctgc tgctacagct gtcggagaag gccacactgg gccctgctgt gcgccccctg
420
ccctggcagc gcgtggaccg cgacgtggca ccgggaactc tctgcgacgt ggccggctgg
480
ggcatagtca accacgcggg ccgccgcccg gacagcctgc agcacgtgct cttgccagtg
540
ctggaccgcg ccacctgcaa ccggcgcacg caccacgacg gcgccatcac cgagcgcttg
600
atgtgcgcgg agagcaatcg ccgggacagc tgcaagggtg actccggggg cccgctggtg
660
tgcgggggcg tgctcgaggg cgtggtcacc tcgggctcgc gcgtttgcgg caaccgcaag
720
aagcccggga tctacacccg cgtggcgagc tatgcggcct ggatcgacag cgtcctggcc
780
tag
783
<210> 26
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 26
gtcagggtgc catgcaggag
20
<210> 27
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 27
cccaggagaa cctgcacctt c
21
<210> 28
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 28
cctcccaccc ttagctatcc
20
<210> 29
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 29
acccagactg tgtccctcac
20
<210> 30
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 30
cagcgcgtgg accgcgacgt
20
<210> 31
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 31
gcgcacagca gggcccagtg
20
<210> 32
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 32
ggccgccgcc cggacagcct
20
<210> 33
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 33
gccccagccg gccacgtcgc a
21
<210> 34
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 34
gccacctgca accggcgcac g
21
<210> 35
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 35
tggcaagagc acgtgctgca ggc
23
<210> 36
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 36
ggcccgctgg tgtgcggg
18
<210> 37
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 37
gtcccggcga ttgctctccg c
21
<210> 38
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 38
ggccgccgcc cggacagcct
20
<210> 39
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 39
gcgcacagca gggcccagtg
20
<210> 40
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 40
gccacctgca accggcgcac g
21
<210> 41
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 41
gcgcacagca gggcccagtg
20
<210> 42
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 42
ggcccgctgg tgtgcggg
18
<210> 43
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 43
gcgcacagca gggcccagtg
20
<210> 44
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 44
gccacctgca accggcgcac g
21
<210> 45
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 45
gccccagccg gccacgtcgc a
21
<210> 46
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 46
ggcccgctgg tgtgcggg
18
<210> 47
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 47
gtcccggcga ttgctctccg c
21
<210> 48
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 48
tgctgtgcgc gccctgccct ggc
23
<210> 49
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 49
gggcccagtg tggccttctc cg
22
<210> 50
<211> 24
<212> ДНК
<213> Homo sapiens
<400> 50
tgtgcgcccc gccccctggc agcg
24
<210> 51
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 51
gcagggccca gtgtggcc
18
<210> 52
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 52
gcgccccctg gcctggcagc gcg
23
<210> 53
<211> 27
<212> ДНК
<213> Homo sapiens
<400> 53
acagcagggc ccagtgtggc cttctcc
27
<210> 54
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 54
ccccctgccc gcccagcgcg tgg
23
<210> 55
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 55
cgcacagcag ggcccagt
18
<210> 56
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 56
gctcttgcca gccctggacc gcg
23
<210> 57
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 57
acgtgctgca ggctgtcc
18
<210> 58
<211> 25
<212> ДНК
<213> Homo sapiens
<400> 58
cttgccagtg gccgaccgcg ccacc
25
<210> 59
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 59
agcacgtgct gcaggctg
18
<210> 60
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 60
gccagtgctg gcccgcgcca cct
23
<210> 61
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 61
aagagcacgt gctgcaggct gtc
23
<210> 62
<211> 25
<212> ДНК
<213> Homo sapiens
<400> 62
agtgctggac gccgccacct gcaac
25
<210> 63
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 63
ggcaagagca cgtgctgc
18
<210> 64
<211> 24
<212> ДНК
<213> Homo sapiens
<400> 64
gccgcccagc gcgtggaccg cgac
24
<210> 65
<211> 24
<212> ДНК
<213> Homo sapiens
<400> 65
ggcggcgcgc acagcagggc ccag
24
<210> 66
<211> 24
<212> ДНК
<213> Homo sapiens
<400> 66
gccgccgcca cctgcaaccg gcgc
24
<210> 67
<211> 25
<212> ДНК
<213> Homo sapiens
<400> 67
ggcggctggc aagagcacgt gctgc
25
<210> 68
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 68
cctgcgcacg taccacgacg gcg
23
<210> 69
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 69
ttgcaggtgg cgcggtccag c
21
<210> 70
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 70
caccgagcgc atgatgtgcg cgg
23
<210> 71
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 71
atggcgccgt cgtggtac
18
<210> 72
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 72
gaggtgaagc tggtggagac agg
23
<210> 73
<211> 17
<212> ДНК
<213> Homo sapiens
<400> 73
ggggccagtg gatagac
17
<210> 74
<211> 32
<212> ДНК
<213> Homo sapiens
<400> 74
ccagttccga gctccagatg acccagactc ca
32
<210> 75
<211> 32
<212> ДНК
<213> Homo sapiens
<400> 75
ccagttccga gctcgtgctc acccagtctc ca
32
<210> 76
<211> 32
<212> ДНК
<213> Homo sapiens
<400> 76
ccagttccga gctccagatg acccagtctc ca
32
<210> 77
<211> 32
<212> ДНК
<213> Homo sapiens
<400> 77
ccagttccga gctcgtgatg acacagtctc ca
32
<210> 78
<211> 17
<212> ДНК
<213> Homo sapiens
<400> 78
gttggtgcag catcagc
17
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ОПОСРЕДОВАННОГО КОМПЛЕМЕНТОМ | 2016 |
|
RU2727411C2 |
| АНТИ-C5a-АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2773779C2 |
| ИНТРАТЕКАЛЬНОЕ ВВЕДЕНИЕ ВЕКТОРОВ НА ОСНОВЕ АДЕНОАССОЦИИРОВАННЫХ ВИРУСОВ ДЛЯ ГЕННОЙ ТЕРАПИИ | 2016 |
|
RU2775138C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2792237C2 |
| Новые моноклональные антитела к LAM и PIM6/LAM для диагностики и лечения инфекций, вызванных Mycobacterium tuberculosis | 2017 |
|
RU2732502C2 |
| СПОСОБЫ ЛЕЧЕНИЯ БОЛЕЗНИ ДАНОНА И ДРУГИХ НАРУШЕНИЙ АУТОФАГИИ | 2017 |
|
RU2777571C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| РЕКОМБИНАНТНЫЙ ИММУНОТОКСИН, НАЦЕЛЕННЫЙ НА МЕЗОТЕЛИН | 2012 |
|
RU2600067C2 |
| ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ TLR2-ОПОСРЕДОВАННЫХ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2019 |
|
RU2791022C2 |
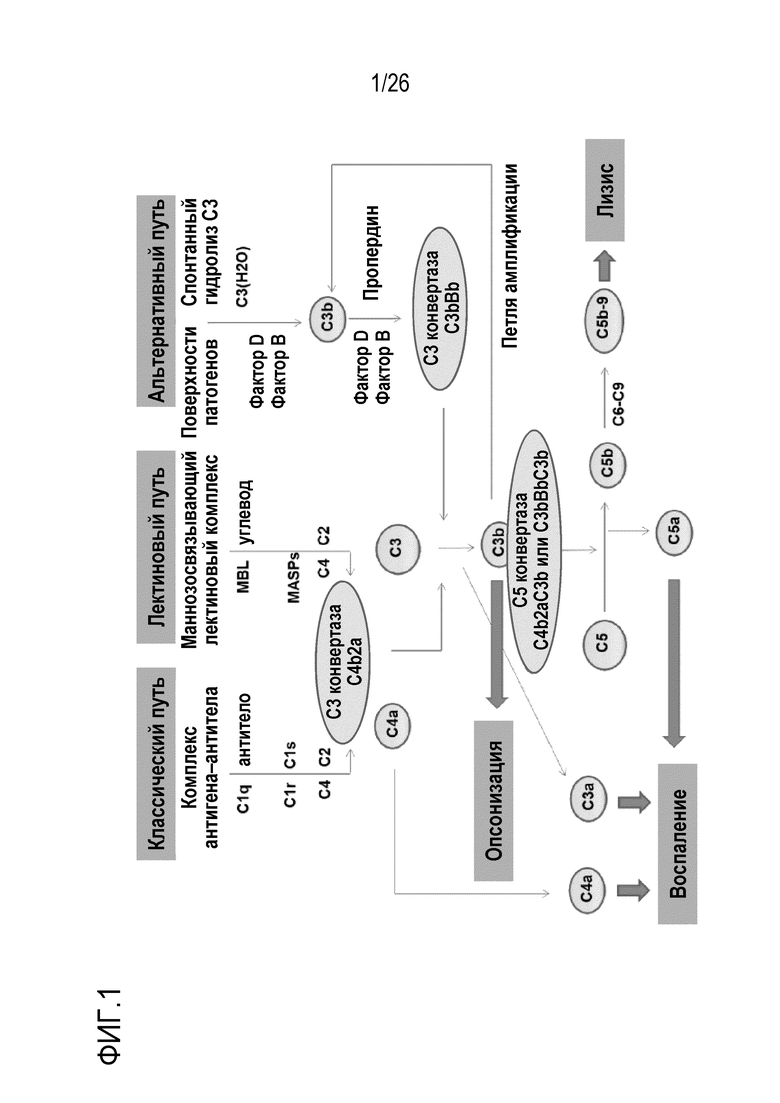
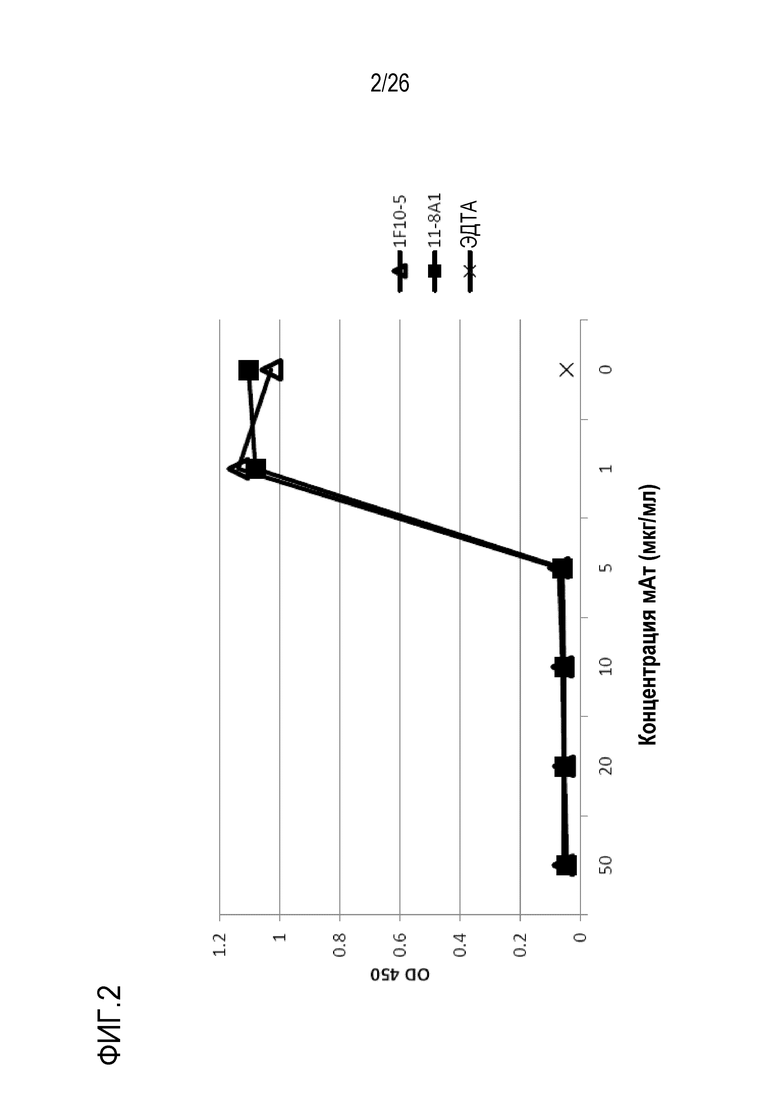
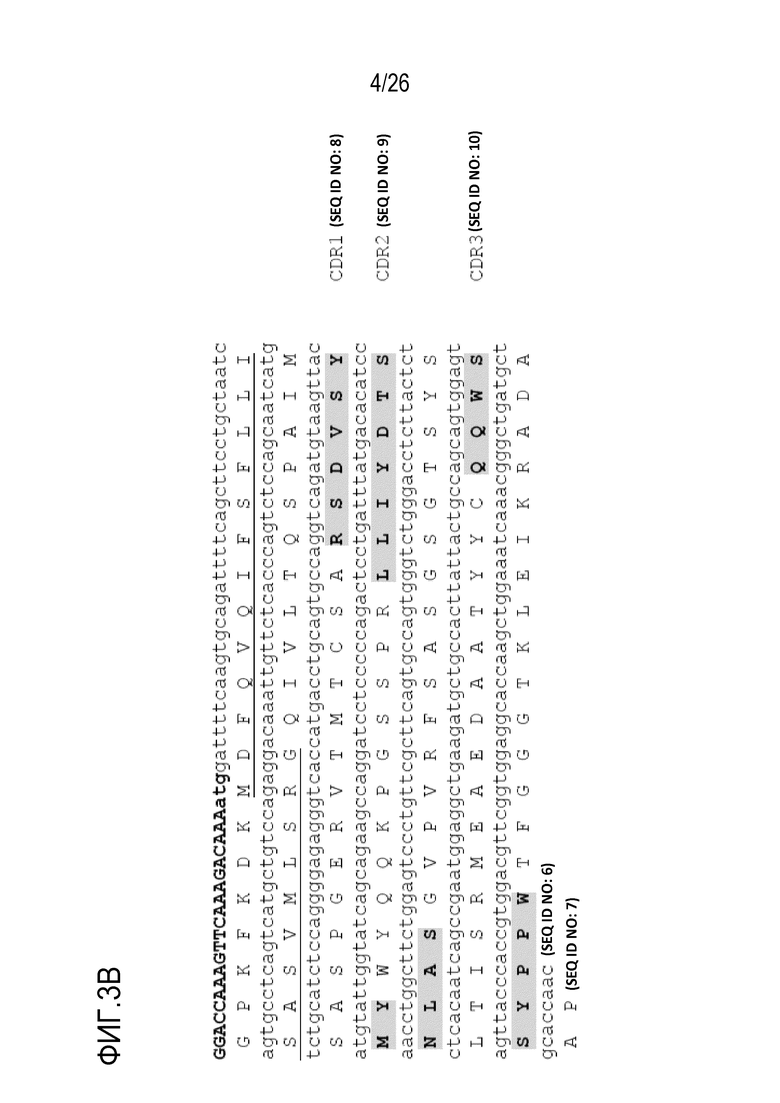
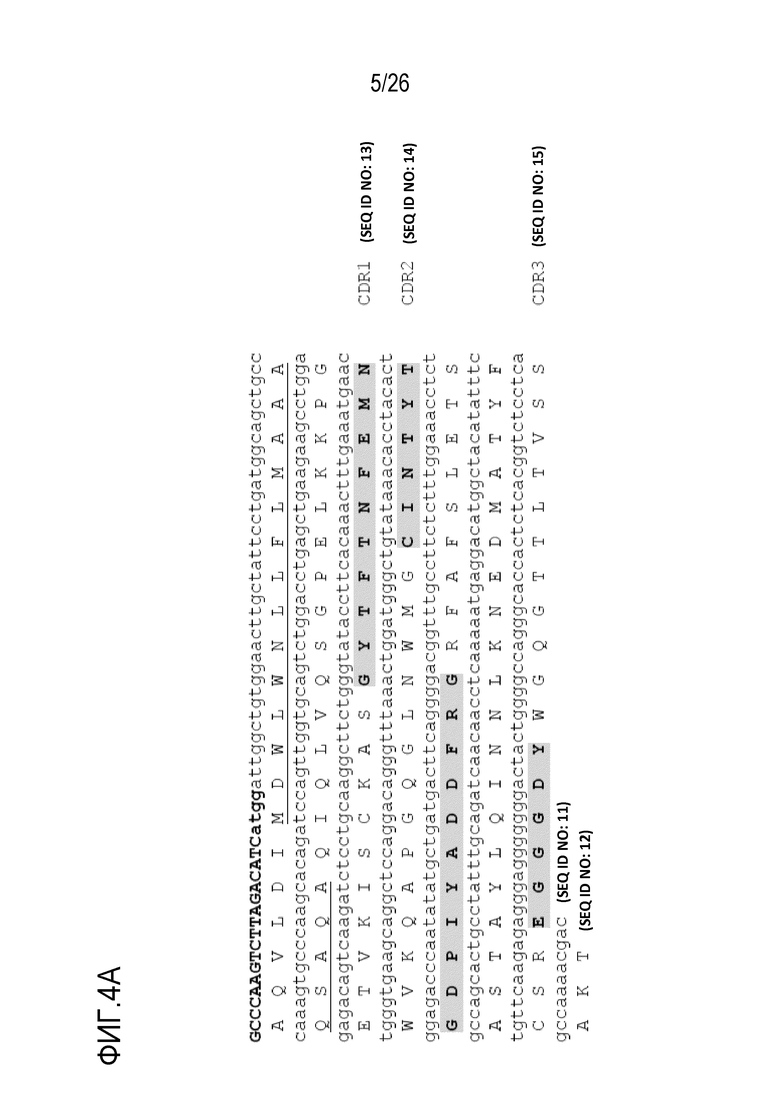
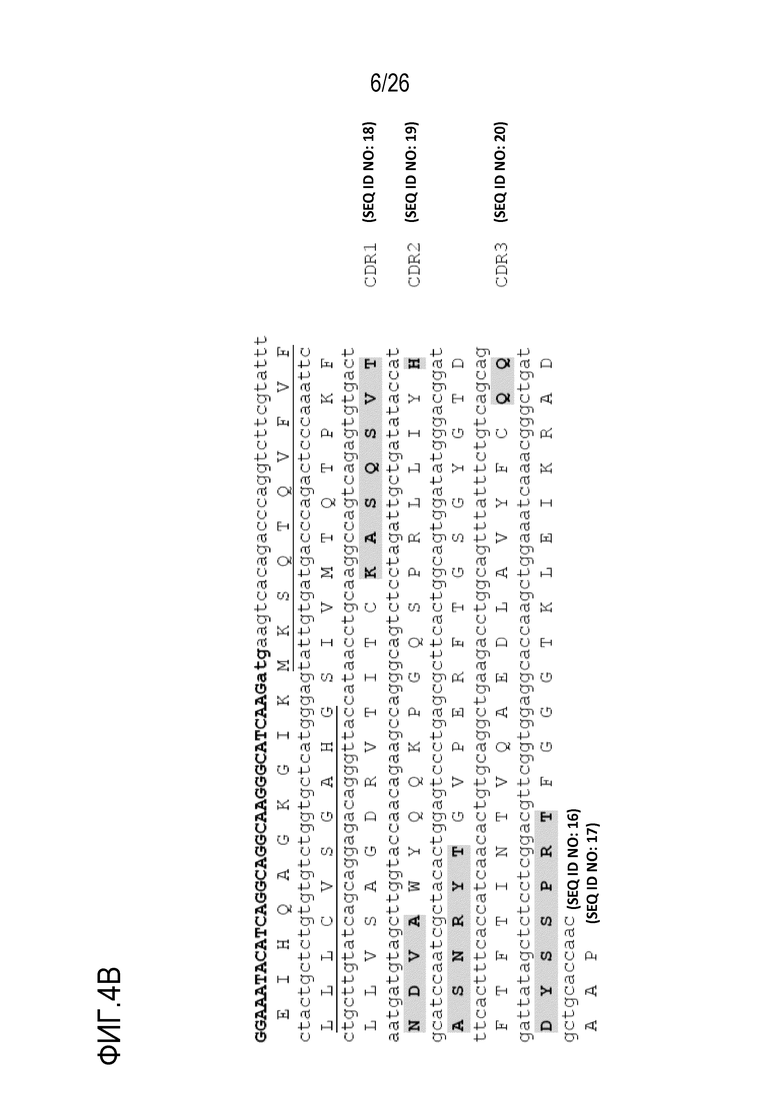
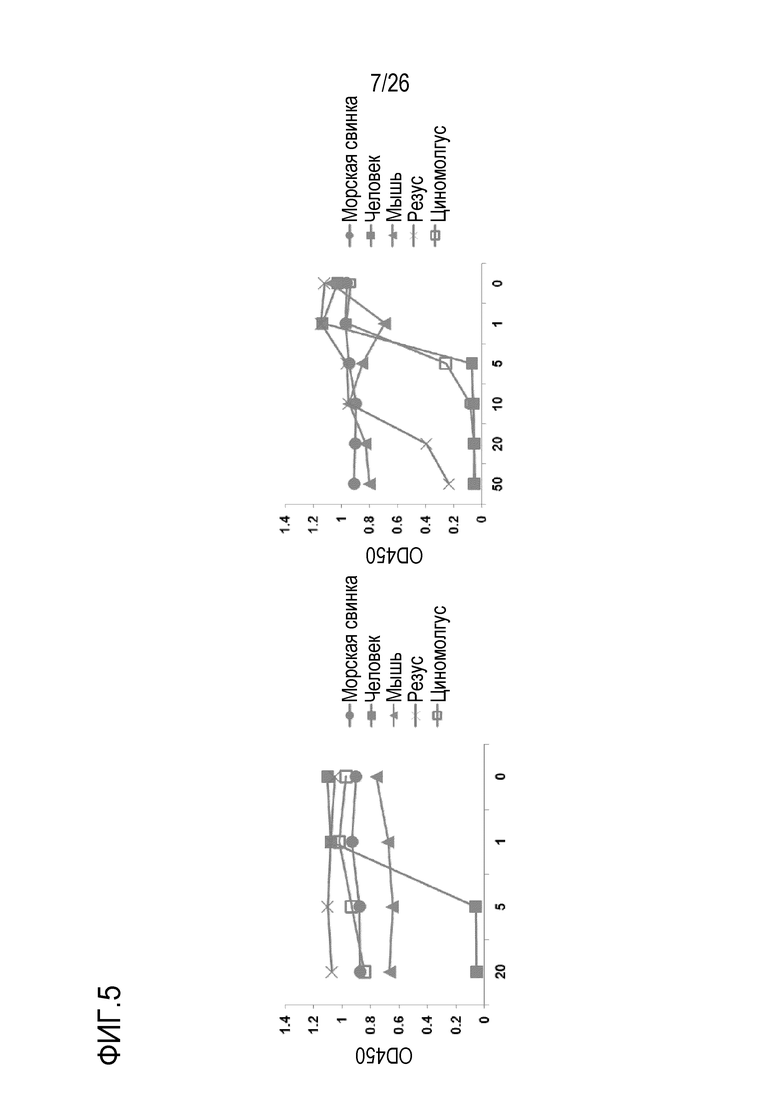
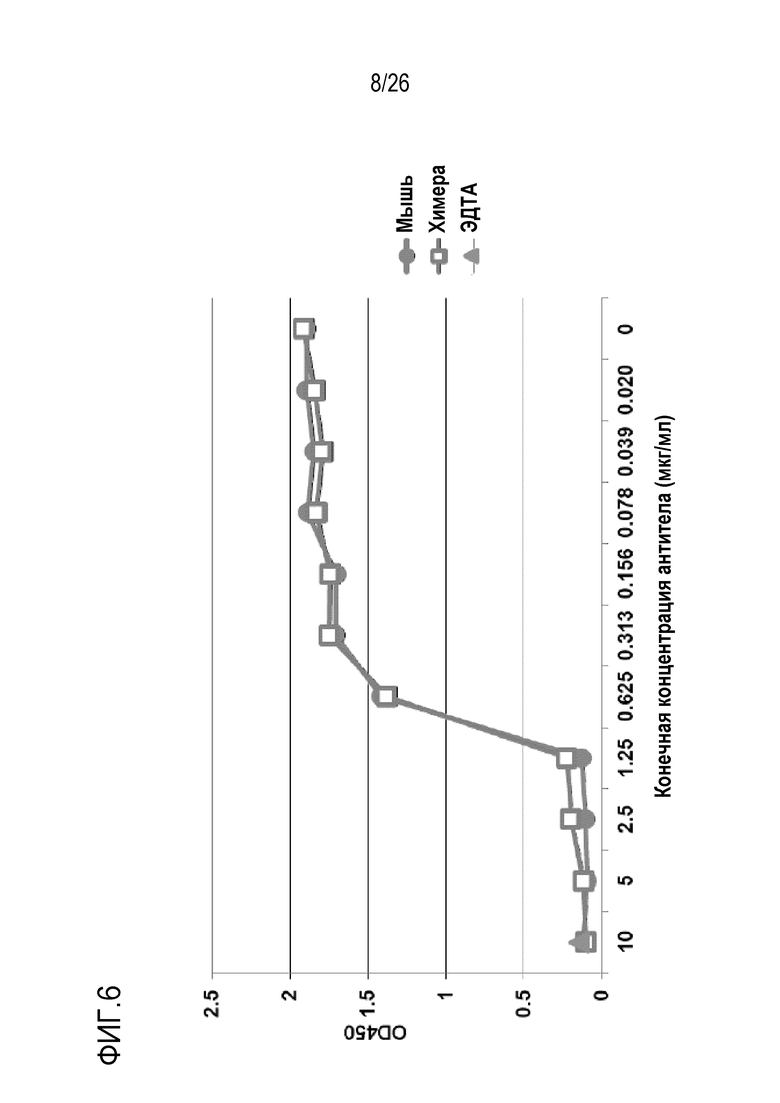
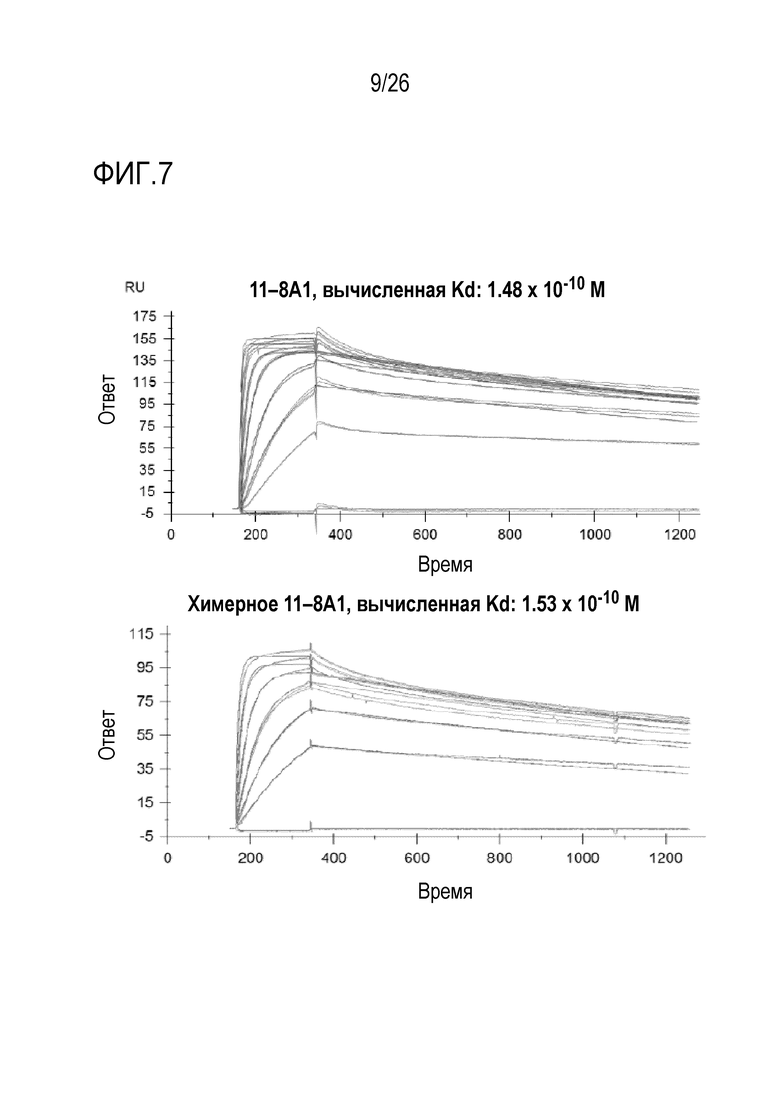
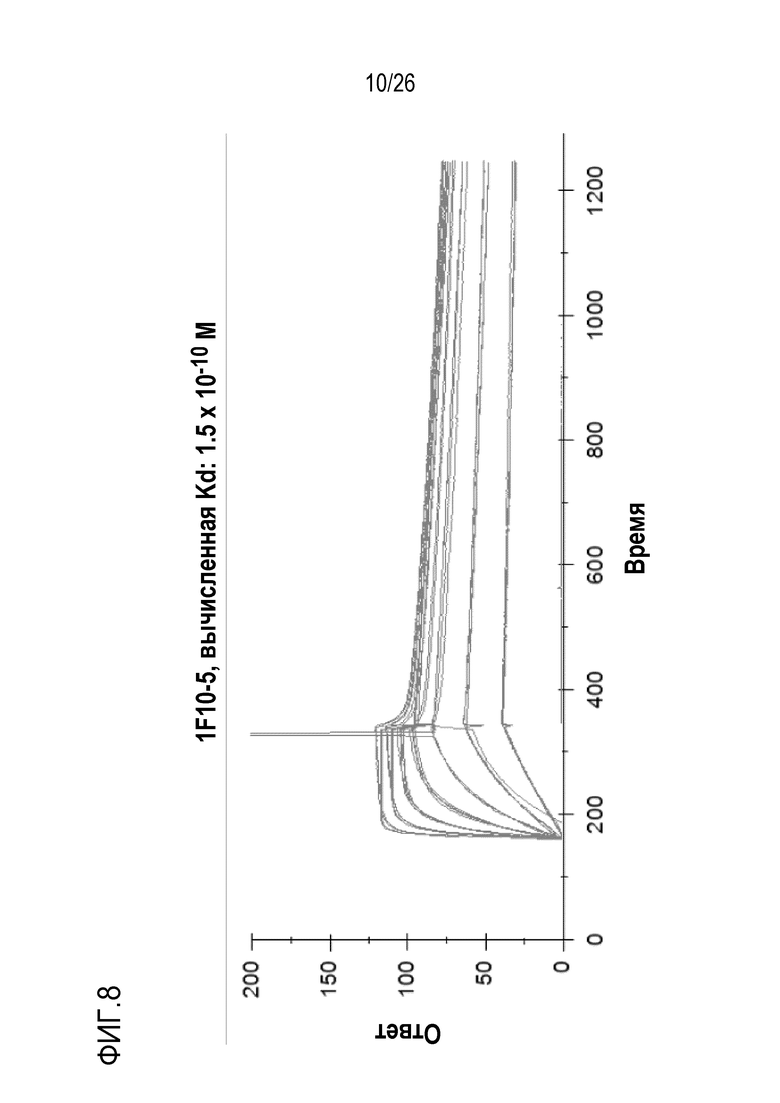

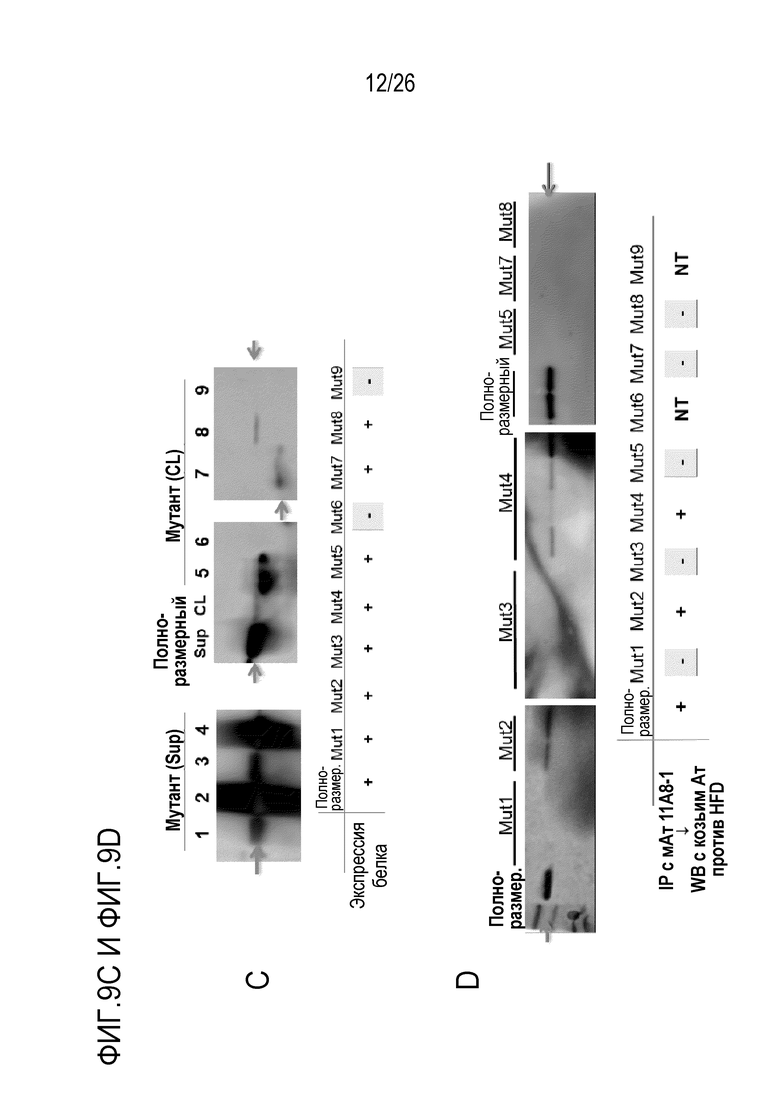
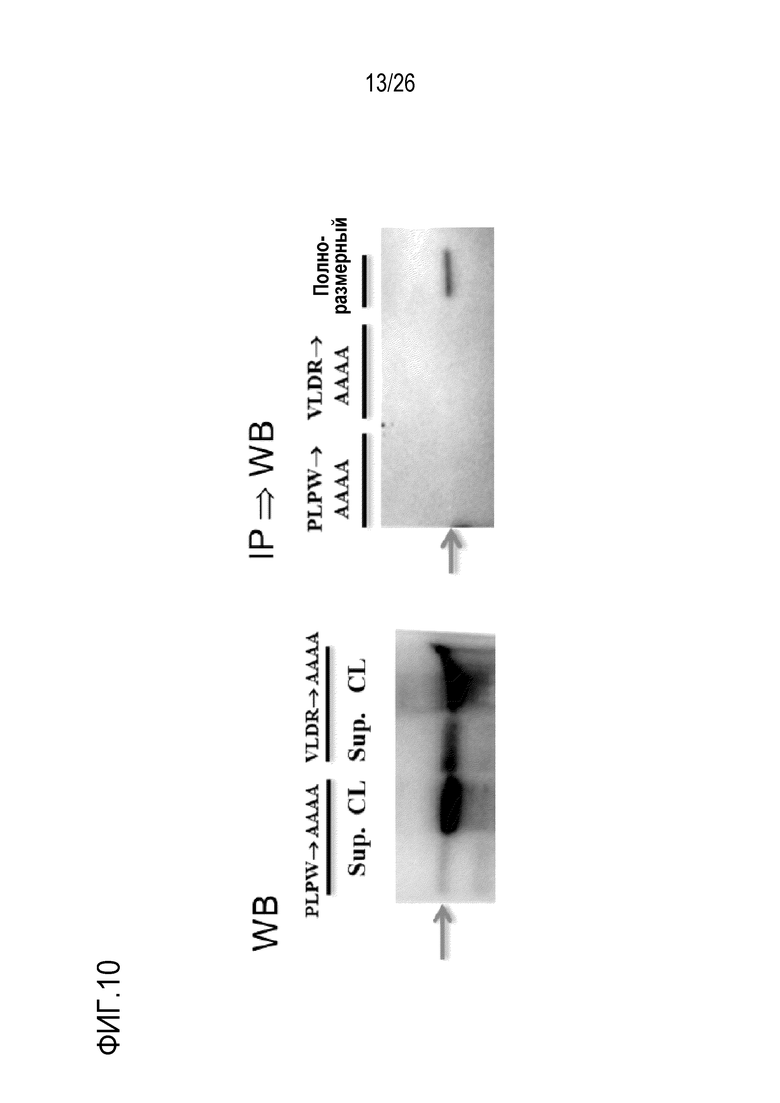
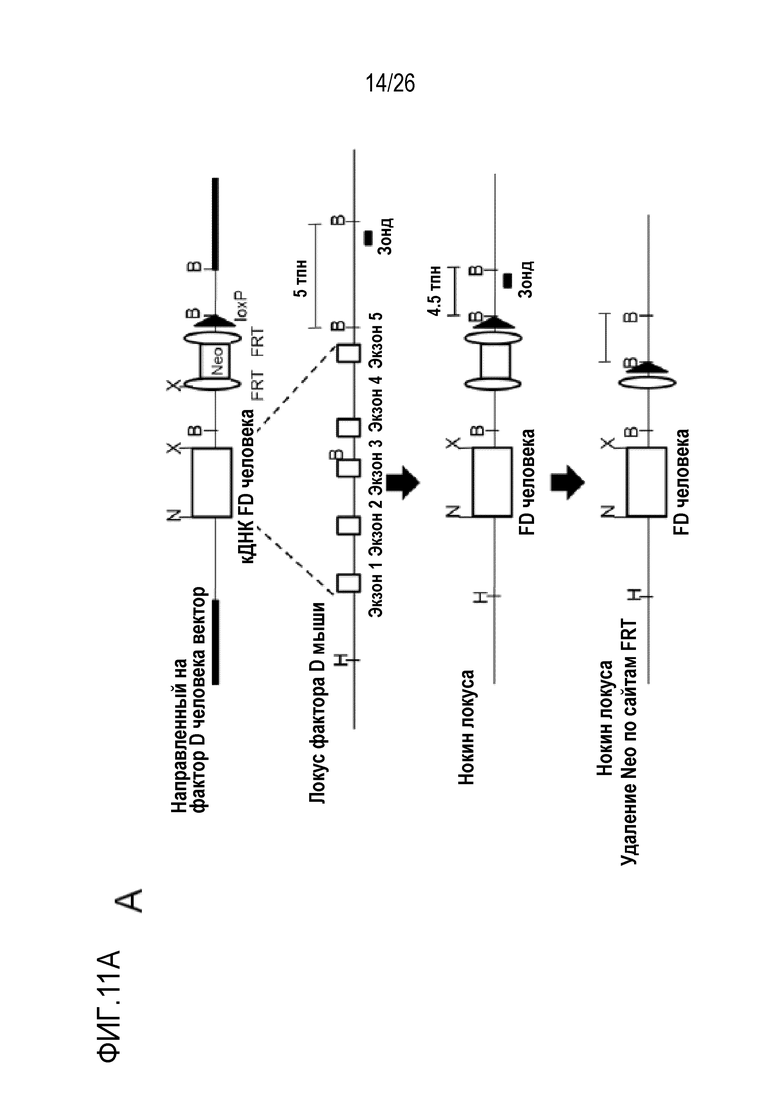

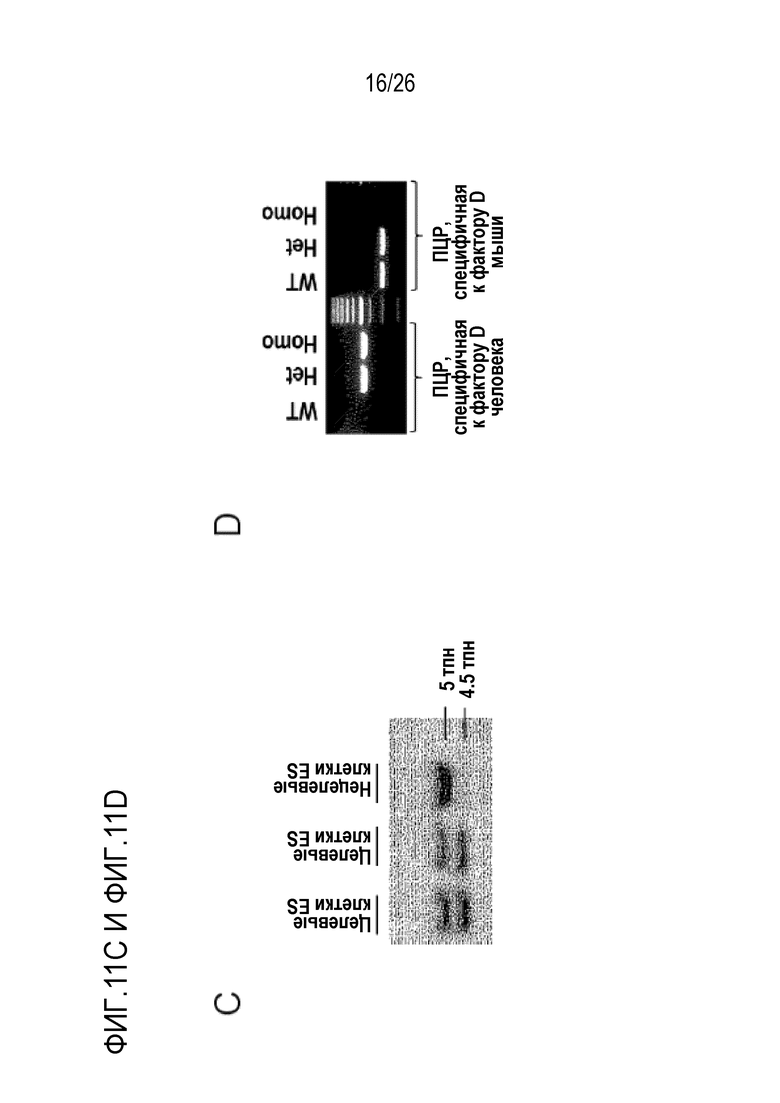
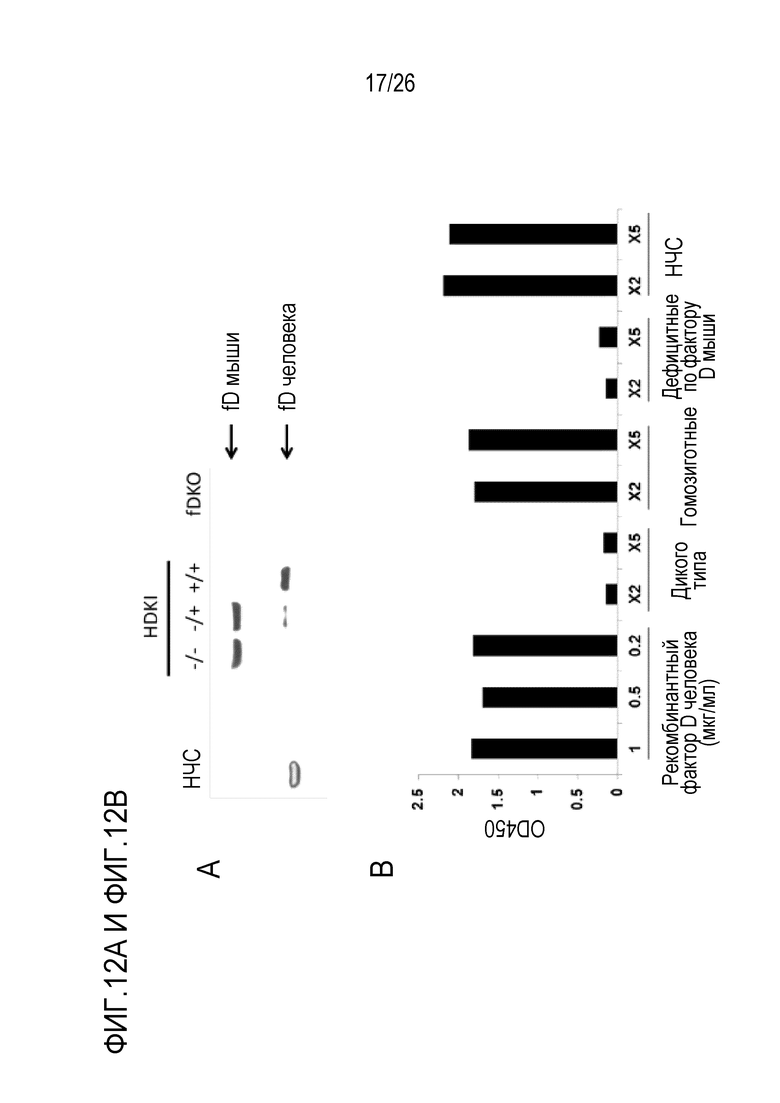
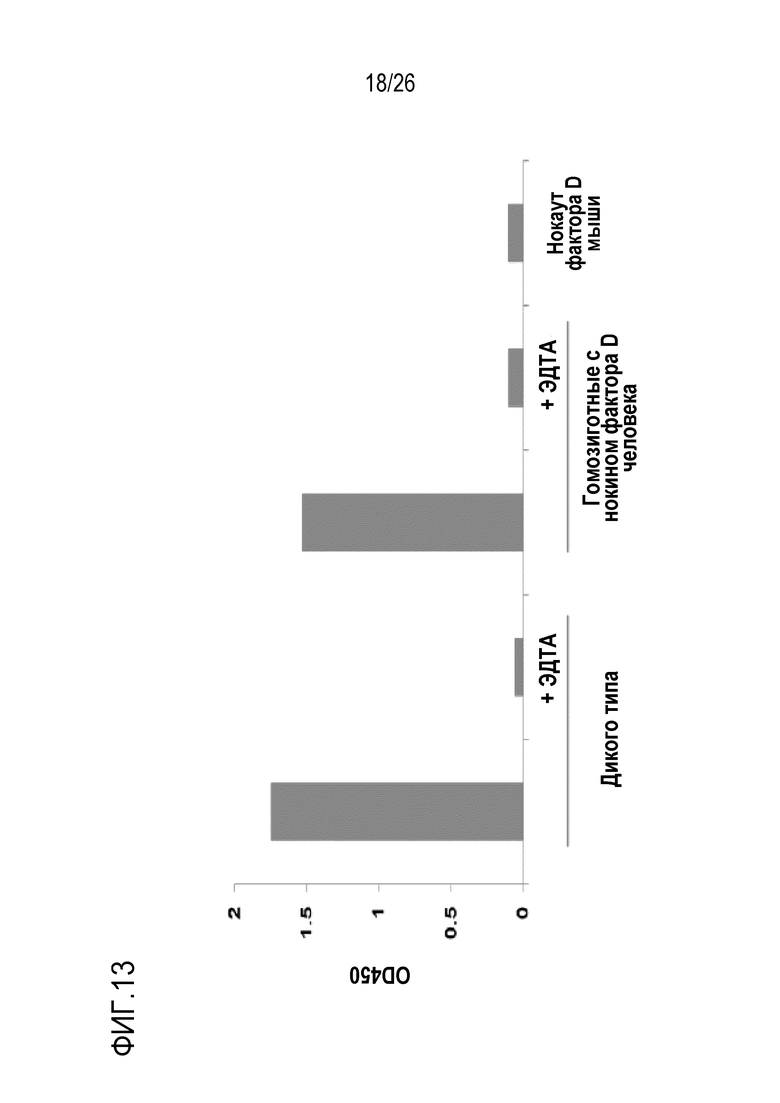
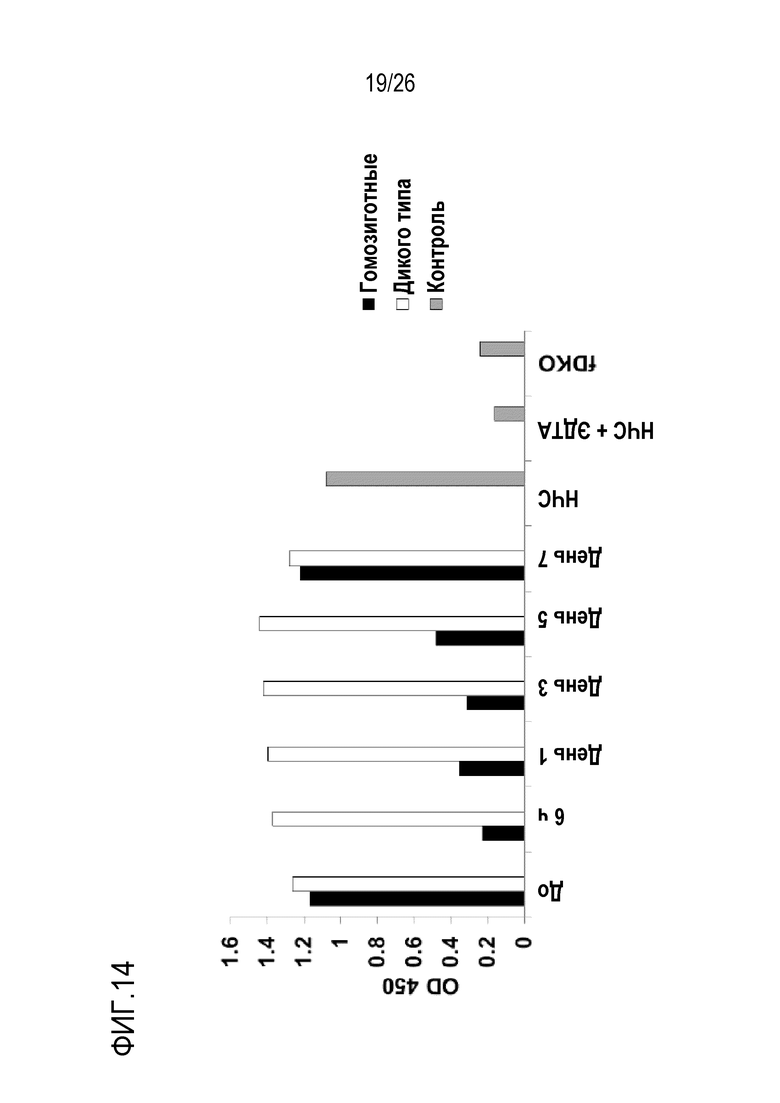
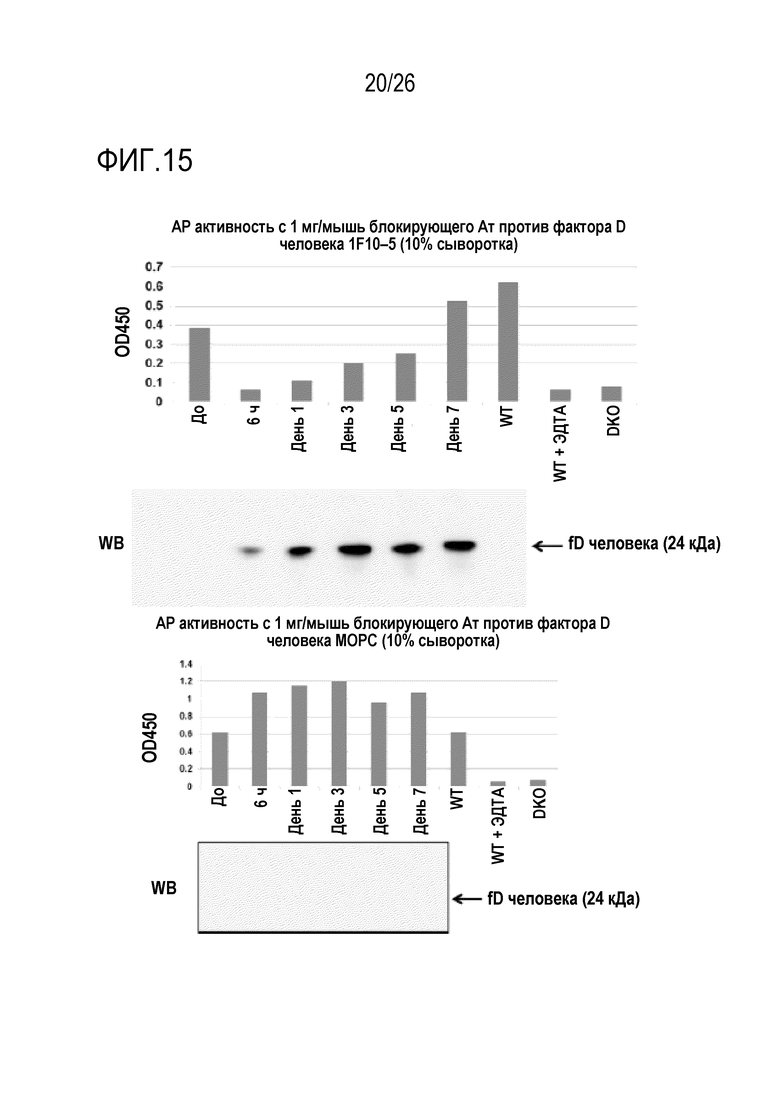
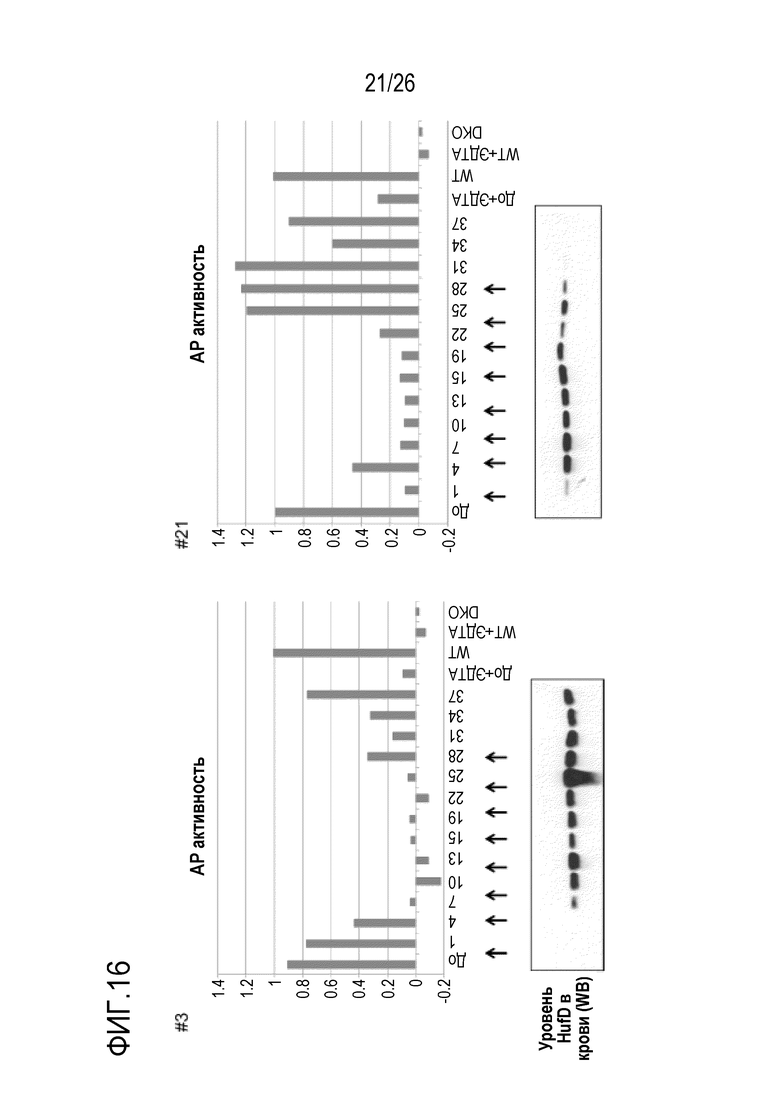
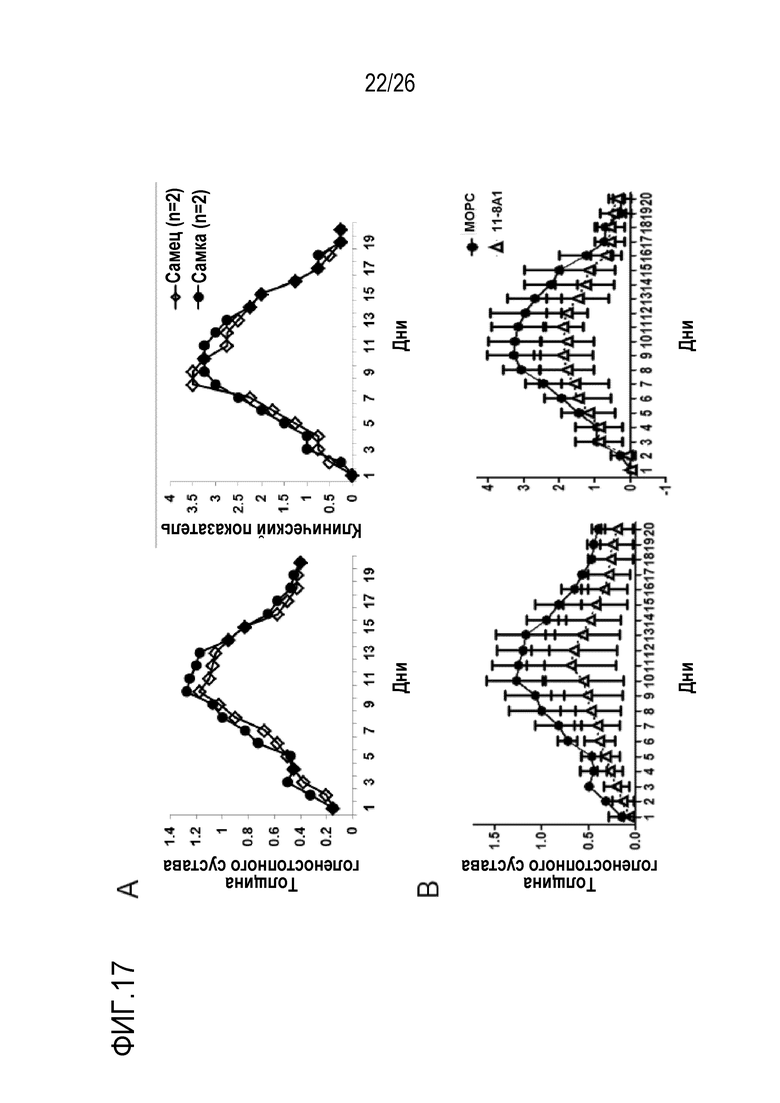
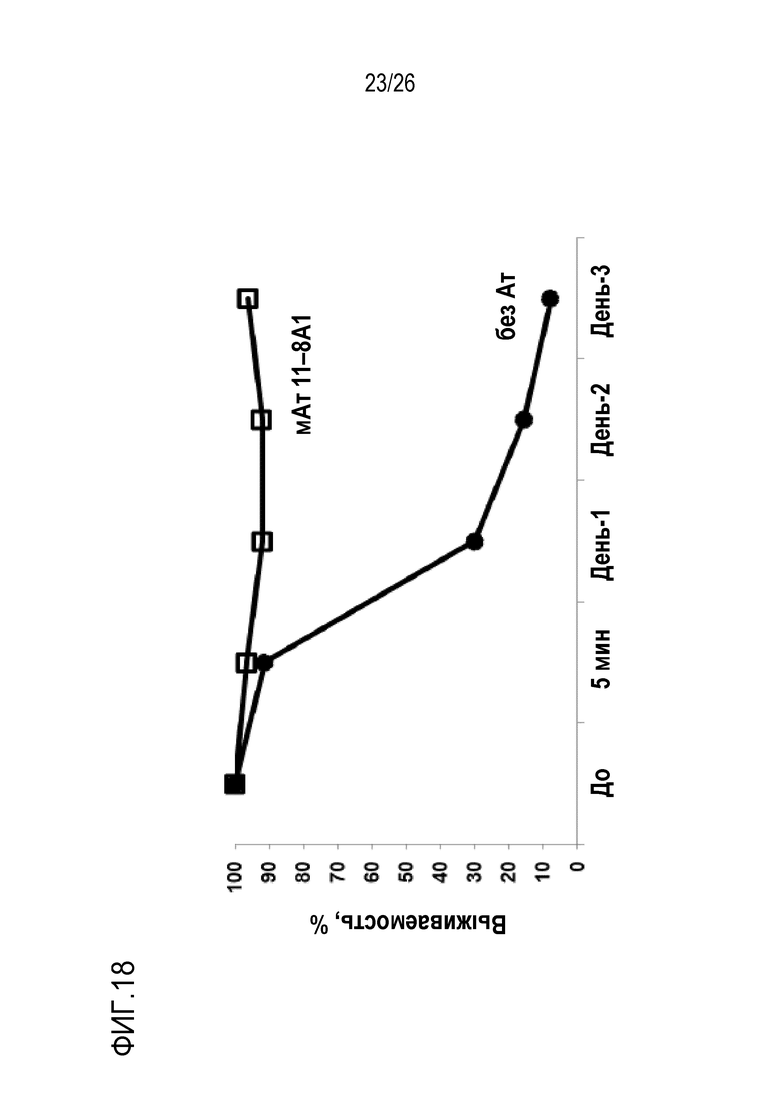
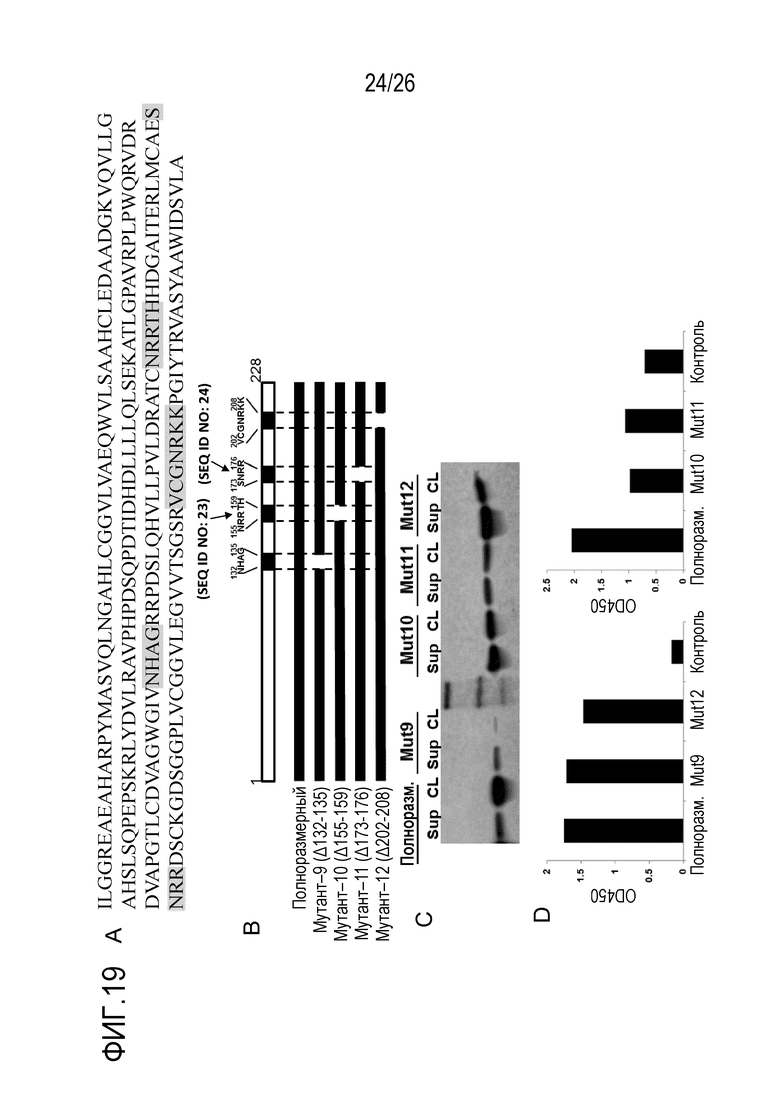
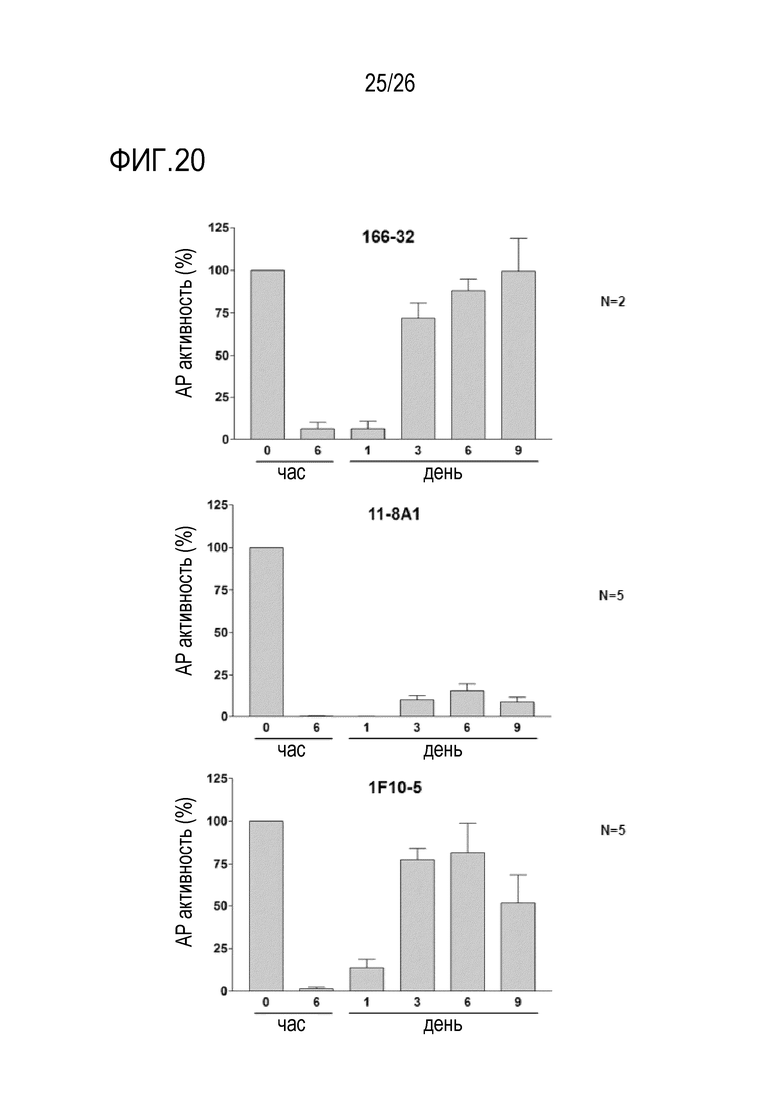
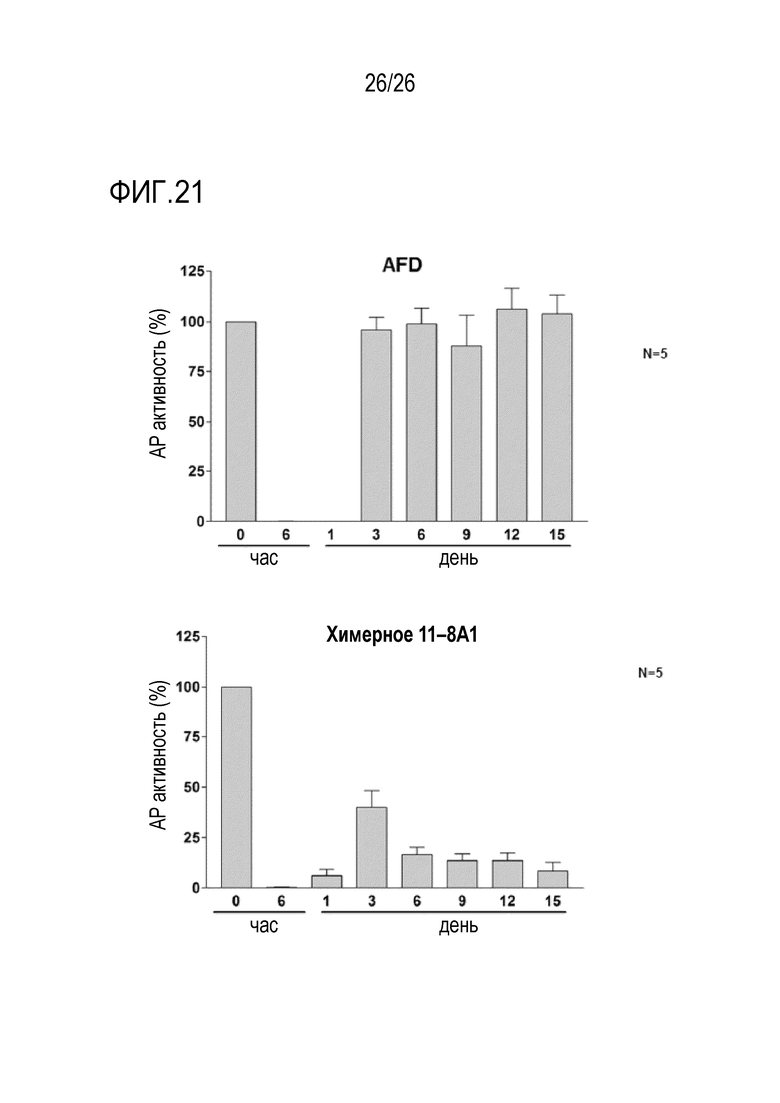
Изобретение относится к области биотехнологии. Предложено антитело, которое специфично связывается с фактором D человека. Также предложен способ лечения заболевания или нарушения, опосредованного альтернативным путем системы комплемента, путем контакта пациента с антителом против фактора D. Также предложен способ снижения активности альтернативного пути системы комплемента у пациента. Изобретение может применяться в терапевтических целях для блокирования активности альтернативного пути комплемента. 5 н. и 8 з.п. ф-лы, 30 ил., 1 табл., 14 пр.
1. Антитело, которое специфично связывается с фактором D человека (антитело против человеческого фактора D),
где антитело против человеческого фактора D содержит:
i) VH–CDR1, содержащий аминокислотную последовательность SEQ ID NO: 3;
ii) VH–CDR2, содержащий аминокислотную последовательность SEQ ID NO: 4;
iii) VH–CDR3, содержащий аминокислотную последовательность SEQ ID NO: 5;
iv) VL–CDR1, содержащий аминокислотную последовательность SEQ ID NO: 8;
v) VL–CDR2, содержащий аминокислотную последовательность SEQ ID NO: 9; и
vi) VL–CDR3, содержащий аминокислотную последовательность SEQ ID NO: 10.
2. Антитело против человеческого фактора D по п. 1, где антитело против человеческого фактора D содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 2, или ее вариант, который по меньшей мере на приблизительно 85% идентичен SEQ ID NO: 2.
3. Антитело против человеческого фактора D по п. 1 или 2, где антитело против человеческого фактора D содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 7, или ее вариант, который по меньшей мере на приблизительно 85% идентичен SEQ ID NO: 7.
4. Антитело против человеческого фактора D по любому из пп. 1-3, где антитело против человеческого фактора D содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 2, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 7.
5. Антитело против человеческого фактора D по любому из пп. 1-4, где антитело против человеческого фактора D связывается с эпитопом человеческого фактора D, содержащим по меньшей мере одну аминокислоту по меньшей мере в одной аминокислотной последовательности SEQ ID NO: 21-24, или ее варианте, который по меньшей мере на приблизительно 85% идентичен SEQ ID NO: 21-24.
6. Антитело против человеческого фактора D по любому из пп. 1-5, где антитело к человеческому фактору D связывается с эпитопом человеческого фактора D, содержащим любую аминокислотную последовательность из SEQ ID NO: 21-24.
7. Способ лечения заболевания или нарушения, опосредованного альтернативным путем системы комплемента, у пациента, включающий стадию введения пациенту эффективного количества антитела против человеческого фактора D по любому из пп. 1-6.
8. Способ по п. 7, где заболевание или нарушение выбрано из группы, состоящей из: макулодистрофии (МД), возрастной макулодистрофии (ВМД), ишемического и реперфузионного повреждения, артрита, ревматоидного артрита, астмы, аллергической астмы, синдрома пароксизмальной ночной гемоглобинурии (ПНГ), атипичного гемолитико-уремического синдрома (аГУС), буллезного эпидермолиза, сепсиса, трансплантации органа, воспаления, C3 гломерулопатии (C3G), мембранозной нефропатии, гломерулонефрита, опосредованного антинейтрофильными цитоплазматическими антителами (АНЦА) васкулита, шигатоксин-индуцированного ГУС, вызванного антифосфолипидными антителами невынашивания, и их комбинаций.
9. Способ по п. 8, где
i) воспаление включает воспаления, связанные с хирургической операцией в условиях искусственного кровообращения и гемодиализом; и/или
ii) гломерулонефрит включает опосредованные антинейтрофильными цитоплазматическими антителами (АНЦА) гломерулонефрит и/или волчанку.
10. Способ снижения активности альтернативного пути системы комплемента у пациента, включающий введение пациенту эффективного количества антитела против человеческого фактора D по любому из пп. 1-6.
11. Способ по любому из пп. 7-10, где введение выбирают из группы, состоящей из энтерального введения, парентерального введения и их комбинации.
12. Клетка, продуцирующая антитело против человеческого фактора D, содержащая антитело против человеческого фактора D по любому из пп. 1-6.
13. Клетка, продуцирующая антитело против человеческого фактора D, содержащая нуклеиновую кислоту, кодирующую антитело против человеческого фактора D по любому из пп. 1-6.
| US 2016017052 A1, 21.01.2016 | |||
| US 2005232920 A1, 20.10.2005 | |||
| ЕГОРОВА А.А., НЕЧИПОРЕНКО П.А., Роль системы комплемента в патогенезе возрастной макулярной дегенерации | |||
| Методы медикаментозного воздействия (литературный обзор), Офтальмологические ведомости, 2012, том V, номер 2, с.77-82. |
Авторы
Даты
2023-07-03—Публикация
2018-02-09—Подача