Изобретение относится к области медицины, в частности к способам получения костных имплантатов на основе пористых материалов с биоактивным покрытием.
Известен способ получения биомедицинского материала для создания костных имплантатов на основе пористого сплава титан-кобальт в режиме СВС, включающий приготовление экзотермической смеси исходных реагентов из порошка титана и кобальта, добавление в смесь не более 4 масс. % гидрида титана, не более 15 масс. % аморфного нанодисперсного порошка гидроксиапатита или аморфного нанокомпозита гидроксиапатита с биополимером природного происхождения, прессование из смеси порошков заготовки, размещение ее в реакторе СВС, предварительный нагрев заготовки до 350-580°C, инициирование процесса горения в инертной атмосфере с последующим выделением целевого продукта (патент RU № 2341293; МПК A61L27/04, A61L27/06, A61L27/24, A61F2/28; 2007 г.).
Однако известный способ является многостадийным, высокотемпературная обработка приводит к разложению биоактивного гидроксиапатита и поровое пространство сплава покрывается соединениями кальция, фосфора и кислорода, представляющими собой продукты его распада, биоактивность которых значительно ниже, чем у гидроксиапатита.
Известен способ изготовления внутритканевых эндопротезов на титановой основе, в котором изготовление имплантатов состоит из следующих стадий: многослойное плазменное напыление на металлическую основу имплантатов биологического активного покрытия, при этом первым и вторым слоями дистанционно напыляют титан, третьим слоем наносят механическую смесь порошка титана и гидроксиапатита, а четвертый слой формируют на основе гидроксиапатита, далее имплантаты с многослойным биологическим активным покрытием помещают в емкость с раствором нитрата серебра (концентрация AgNO3 0,04%) помещенную в дополнительную емкость с водой, и проводят обработку со стороны поверхности напыленного многослойного биологического активного покрытия ультразвуковым излучением в течение 35 секунд при интенсивности ультразвука 9,6 Вт/см2 и частоте 22 кГц (патент RU № 2529262 С1; МПК A61L27/30; A61F2/02; C23C18/42; 27.09.2014 бюл.№27) (прототип).
Недостатком известного способа является многостадийность, сложность аппаратурного оформления, а также применение нитрата серебра, так как предельно допустимая концентрация азотнокислого серебра в воздухе рабочей зоны - 0,5 мг/м3 (ГОСТ 1277-75 Реактивы. Серебро азотнокислое), и ПДК для питьевой воды – 50 мкг/дм3 (второй класс опасности по ГОСТ 12.1.005), кроме того плазменное напыление частично разрушает (снижает биологическую активность) гидроксиапатита, так как местные перегревы (>800 °С) разрушают гидроксиапатит до трехкальциевого фосфата.
Таким образом, перед авторами была поставлена задача разработать простой способ получения биомедицинского материала, обеспечивающий как сохранение минерального состава биоактивного компонента – гидроксиапатита, так и заполняемость основы с хорошей адгезией нанесенного покрытия, при этом не используя агрессивных реагентов.
Поставленная задача решена в предлагаемом способе получения биомедицинского материала, включающем нанесение на металлическую основу гидроксиапатита и последующую обработку ультразвуковым излучением, в котором основу помещают в 35-45%-ную водную суспензию гидроксиапатита и обработку ультразвуковым излучением осуществляют при интенсивности ультразвука 10,0-13,9 Вт/см2 и частоте 35 кГц в течение 0,5 – 1 часа, при этом обработку повторяют от 3 до 5 раз с промежуточной сушкой продукта на воздухе в течение 1 – 5 часов.
В настоящее время не известен способ получения биомедицинского материала, в котором металлическую основу помещают в 35-45%-ную водную суспензию гидроксиапатита и обработку ультразвуковым излучением осуществляют при интенсивности ультразвука 10,0-13,9 Вт/см2 и частоте 35 кГц в течение 0,5 – 1 часа, при этом обработку повторяют от 3 до 5 раз с промежуточной сушкой продукта на воздухе в течение 1 – 5 часов.
В качестве металлических высокопористых основ авторы использовали: титан (Ti) пористости (45, 55%), пористый (85%) никелид титана (NiTi), пористую (91%) нержавеющая сталь и пористый (95%) никель (Ni). В качестве биологически активного покрытия 35-45% водная суспензия ультрадисперсного порошка гидроксиапатита, полученного осаждением из растворов (Патент RU № 2104924). Для нанесения покрытия на основу применяли низкотемпературный метод ультразвуковой обработки 35-45% водной суспензией порошка гидроксиапатита в ультразвуковой ванне «САПФИР 1.3 ТТЦ» (35 кГц) при T=40 °C в течение 0,5-1 часа. Проведенные авторами исследования позволили разработать способ получения биоактивного покрытия на пористом материале, позволяющий сохранить минеральный состав биоактивного компонента - гидроксиапатита (ГАП) наряду с хорошей адгезией нанесенного покрытия, которое оценивали методом центробежного отрыва (центрифуга CM-6M, ELMI; центростремительное ускорение 500 м/c2). Для достижения необходимого результата авторами предлагается способ последовательной, с промежуточной сушкой, 3-5 кратной ультразвуковой обработкой, в ходе которого осуществляют осаждение частиц ГАП из 35-45% водной суспензии ультрадисперсного порошка ГАП, добиваясь этим объемной пропитки и покрытие поверхности высокопористого материала равномерным слоем биоактивного материала. Авторами учитывался тот факт, что современные аддитивные технологии (3D-печать) позволяют осуществлять изготовление пористых материалов с поперечным сечением отверстий (пор) от 500 до 1000 мкм, которые могут быть использованы в качестве металлической основы при получении биомедицинских материалов.
При использовании суспензии с концентрацией менее 35% не происходит заполнения пористого материала суспензией, так как она вытекает перед сушкой, образуя незаполненные поры. Использование суспензии с концентрацией выше 45% ведет к значительному заполнению ближайших от поверхности пор, и не прохождение внутрь пористой основы, высокая вязкость затрудняет получение покрытия в порах по всему объему. Обработку в ультразвуковой ванне пористого материала в суспензии ГАП проводят 3-5-кратную, что позволяет достичь максимального содержания ГАП от массы каркаса в зависимости от исходной пористости основы. Увеличение количества пропиток приводит к зарастанию и снижению остеоинтеграционных свойств материала, а уменьшение мешает возможности создания сплошного биоактивного покрытия. Использование предлагаемого интервала интенсивности ультразвукового излучения объясняется следующими причинами: уменьшение менее 10 Вт/см2 ведет к вероятному несмачиванию суспензией гидроксиапатита всей поверхности пористого материала основы, увеличение более 13,9 Вт/см2 обусловливает избыточные затраты энергии.
Предлагаемый способ может быть осуществлен следующим образом.
Заготовку из пористого материала (титан пористости (45, 55%) или пористый никелид титана (85%) или пористая нержавеющая сталь (91%) или пористый никель (95%)) помещают в емкость с водной суспензией гидроксиапатита (ГАП) состава Ca10(PO4)6 (ОН)2 с концентрацией 35-45%, емкость устанавливают в ультразвуковую ванну и осуществляют обработку ультразвуковым излучением при интенсивности ультразвука 10,0-13,9 Вт/см2 и частоте 35 кГц в течение 0,5 – 1 часа, при этом обработку повторяют от 3 до 5 раз с промежуточной сушкой продукта при комнатной температуре на воздухе в течение 1 – 5 часов. Получают материал с пористой металлической основой, пропитанной ГАП, при этом содержание ГАП составляет 20-60 масс.% от массы полученного материала.
Содержание ГАП от массы полученного материала определяют путем взвешивания образцов до и после обработки. Морфологию образующегося в процессе ультразвуковой пропитки материалов исследовали методом Брунауэра, Эммета и Тейлера (БЭТ) низкотемпературной адсорбцией азота на приборе Gemini VII 2390 VI.03 (V1.03 t), полученные данные представлены в таблице 1.
Таблица 1
Характеристики поверхности исходных пористых металлических материалов и после трехкратной пропитки 40% водной суспензией кристаллического ГАП
Микрофотографии образцов пористых материалов до и после покрытия (см. фиг.1, 2) получали на анализирующем сканирующем электронном микроскопе JSM 6390 LA (JEOL-Япония).
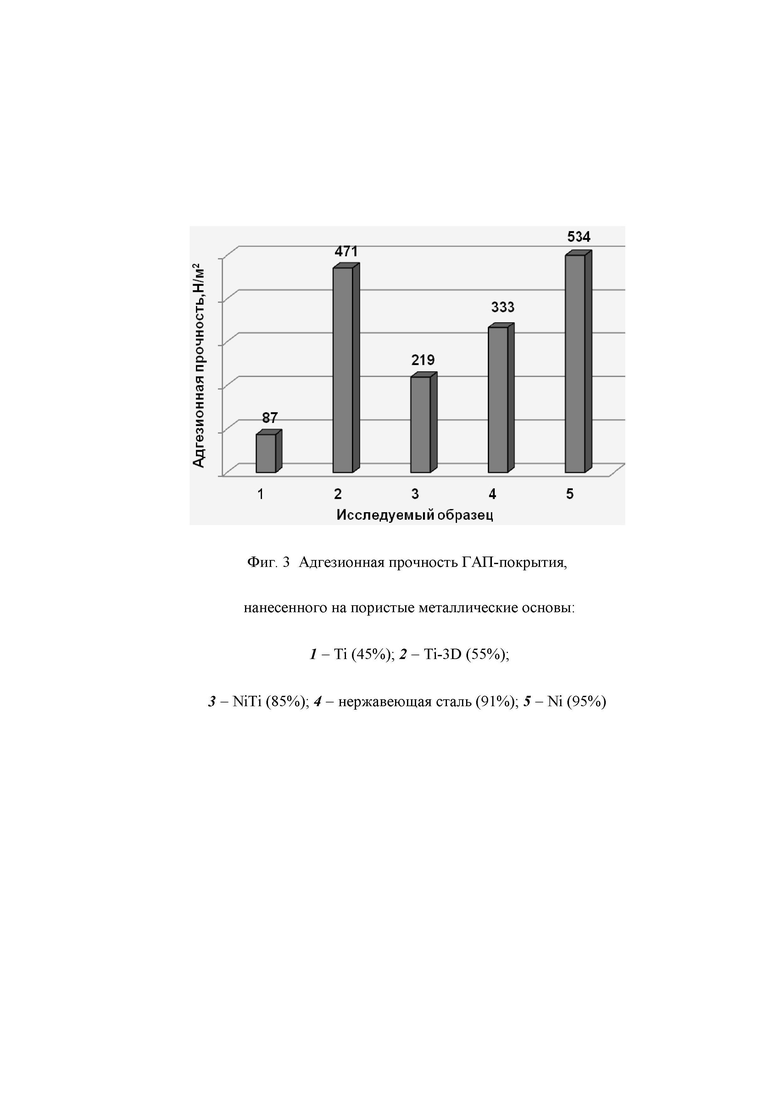
Прочность сцепления биоактивного покрытия с пористой металлической основой определяли методом центробежного отрыва (центрифуга CM-6M, ELMI; центростремительное ускорение 500 м/c2). По полученным методом центробежного отрыва данным была рассчитана адгезионная прочность покрытий на матрицах различной пористости (см. фиг.3) в соответствии с формулой
P= Fцентр./S = m ω2⋅r/S, где
P - адгезионная прочность, H/м2;
m - масса покрытия, кг;
ω - угловая скорость вращения в момент разрыва, с-2;
r – расстояние от центра масс до оси вращения центрифуги, м;
S – площадь контакта покрытия и подложки, м2.
Полученные результаты сопоставимы или превышают в несколько раз адгезионную прочность покрытий получаемых вакуумным импрегнированием (37-95 Н/м2; Е.А. Богданова, В.М. Скачков, А.Г. Широкова, И.Г. Григоров, Н.А. Сабирзянов. Влияние термического отжига на прочность биоактивного покрытия на пористом титане // Физико-химические аспекты изучения кластеров, наноструктур и наноматериалов. 2016. Вып. 8. С. 64-68.)
Предлагаемый способ иллюстрируется следующими примерами.
Пример 1. Образец пористого титана размером 10×10×4 мм (пористость 45%) погружают в емкость с водной суспензией ГАП состава Ca10(PO4)6 (ОН)2 с концентрацией 35%, которую помещают в ультразвуковую ванну и в течение 0,5 часа подвергают ультразвуковой обработке (интенсивность ультразвука 13,9 Вт/см2 и частота 35 кГц). После чего образцы сушат на воздухе при комнатной температуре в течение 5 часов, операцию повторяют 5 раз и получают пористый материал на основе титана с покрытием ГАП, при этом содержание ГАП составляет 20 масс.% от массы титана. На фиг.1 микроизображение поверхности титана пористости 45%: 1а) - исходный образец титана; 1б) - образец титана с покрытием ГАП.
Пример 2. Образец пористого титана полученного методом 3D-печати диаметром 12,5 мм и толщиной 6 мм (пористость 55%) погружают в емкость с водной суспензией ГАП состава Ca10(PO4)6 (ОН)2 с концентрацией 40%, которую помещают в ультразвуковую ванну и в течение 1,0 часа подвергают ультразвуковой обработке (интенсивность ультразвука 10,0 Вт/см2 и частота 35 кГц). После чего образец сушат на воздухе при комнатной температуре в течение 3 часов, операцию повторяют 3 раза и получают материал на основе титана с покрытием ГАП, при этом содержание ГАП составляет 26 масс.% от массы титана. На фиг.1 изображение поверхности титана пористости 55%: 2а) - исходный образец титана; 2б) - образец титана с покрытием ГАП.
Пример 3. Образец пористого никелида титана (NiTi) размером 10×10×4 мм (пористость 85%) погружают в емкость с водной суспензией ГАП состава Ca10(PO4)6 (ОН)2 с концентрацией 45%, которую помещают в ультразвуковую ванну и в течение 0,5 часа подвергают ультразвуковой обработке (интенсивность ультразвука 13,9 Вт/см2 и частота 35 кГц). После чего образцы сушат на воздухе при комнатной температуре в течение 1 часа, операцию повторяют 3 раза и получают пористый материал на основе никелида титана с покрытием ГАП, при этом содержание ГАП составляет 48 масс.% от массы материала. На фиг.1 микроизображение поверхности никелида титана пористости 85%: 3а) - исходный образец никелида титана; 3б) - образец NiTi с покрытием ГАП.
Пример 4. Образец пористой нержавеющей стали размером 10×10×4 мм (пористость 91%) погружают в емкость с водной суспензией ГАП состава Ca10(PO4)6 (ОН)2 с концентрацией 40%, которую помещают в ультразвуковую ванну и в течение 1 часа подвергают ультразвуковой обработке (интенсивность ультразвука 13,9 Вт/см2 и частота 35 кГц). После чего образец сушат на воздухе при комнатной температуре в течение 5 часов, операцию повторяют 4 раза и получают пористый материал на основе нержавеющей стали с покрытием ГАП, при этом содержание ГАП составляет 50 масс.% от массы материала. На фиг.2 микроизображение поверхности нержавеющей стали пористости 91%: 4а) - исходный образец титана; 4б) - образец титана с покрытием ГАП.
Пример 5. Образец пористого никеля (Ni) размером 10×10×4 мм (пористость 95%) погружают в емкость с водной суспензией ГАП состава Ca10(PO4)6 (ОН)2 с концентрацией 45%, который помещают в ультразвуковую ванну и в течение 0,5 часа подвергают ультразвуковой обработке (интенсивность ультразвука 13,9 Вт/см2 и частота 35 кГц). После чего образец сушат на воздухе при комнатной температуре в течение 5 часов, операцию повторяют 3 раза и получают пористый материал на основе никеля с покрытием ГАП, при этом содержание ГАП составляет 55 масс.% от массы материала. На фиг.2 микроизображение поверхности никеля пористости 95%: 5а) - исходный образец Ni; 5б) - образец Ni с покрытием ГАП.
Таким образом, авторами предлагается технологически простой способ получения биомедицинского материала на основе пористых металлических материалов, позволяющий сохранить биологическую активность ГАП за счет исключения высоких температур при обработке и достичь равномерного и прочного покрытия не только на поверхности, но и по всему объему.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОМЕДИЦИНСКОГО МАТЕРИАЛА | 2015 |
|
RU2599039C1 |
| Модифицированное кальций-фосфатное покрытие на титановом имплантате с внедренным в него фармакологическим препаратом и способ его получения | 2024 |
|
RU2833928C1 |
| Биомедицинский материал на основе гидроксиапатита и способ его получения | 2022 |
|
RU2782925C1 |
| Композиционный биоматериал на основе гидроксиапатита и способ его получения | 2023 |
|
RU2816008C1 |
| Биоактивное покрытие для восстановления костной ткани | 2019 |
|
RU2717676C1 |
| Биоактивный композиционный материал для замещения костных дефектов и способ его получения | 2018 |
|
RU2683255C1 |
| Биоактивное покрытие на основе гидроксиапатита для восстановления костной ткани | 2024 |
|
RU2829755C1 |
| Сухая смесь на основе гидроксиапатита для водных суспензий для нанесения покрытий на костные имплантаты и водная суспензия на ее основе | 2022 |
|
RU2797279C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНЫХ ИМПЛАНТАТОВ С МНОГОСЛОЙНЫМ ПОКРЫТИЕМ | 2013 |
|
RU2526252C1 |
| Биоактивный композиционный материал | 2020 |
|
RU2724611C1 |


Изобретение относится к области медицины, в частности к способу получения биомедицинского материала. Способ получения биомедицинского материала, включающий нанесение на металлическую основу гидроксиапатита и последующую обработку ультразвуковым излучением, при этом основу помещают в 35-45%-ную водную суспензию гидроксиапатита и обработку ультразвуковым излучением осуществляют при интенсивности ультразвука 10,0-13,9 Вт/см2 и частоте 35 кГц при Т = 40ºС в течение 0,5–1 часа, при этом обработку повторяют от 3 до 5 раз с промежуточной сушкой продукта на воздухе в течение 1–5 часов. Вышеописанный способ получения биомедицинского материала на основе пористых металлических материалов является технологически простым, позволяющим сохранить биологическую активность гидроксиапатита и достичь равномерного и прочного покрытия не только на поверхности, но и по всему объему. 1 табл., 5 пр., 3 ил.
Способ получения биомедицинского материала, включающий нанесение на металлическую основу гидроксиапатита и последующую обработку ультразвуковым излучением, отличающийся тем, что основу помещают в 35-45%-ную водную суспензию гидроксиапатита и обработку ультразвуковым излучением осуществляют при интенсивности ультразвука 10,0-13,9 Вт/см2 и частоте 35 кГц при Т = 40°С в течение 0,5–1 часа, при этом обработку повторяют от 3 до 5 раз с промежуточной сушкой продукта на воздухе в течение 1–5 часов.
| СПОСОБ ПОЛУЧЕНИЯ БИОМЕДИЦИНСКОГО МАТЕРИАЛА | 2015 |
|
RU2599039C1 |
| ТКАНЕИНЖЕНЕРНЫЙ СОСУДИСТЫЙ ГРАФТ МАЛОГО ДИАМЕТРА И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2012 |
|
RU2496526C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ДЕФЕКТОВ ХРЯЩЕВОЙ ТКАНИ СУСТАВОВ | 2015 |
|
RU2593011C1 |
| US 6258121 B1, 10.07.2001. | |||
Авторы
Даты
2019-05-16—Публикация
2018-07-11—Подача