Изобретение относится к области получения биологически активных фармацевтических и медицинских материалов, которые могут применяться для реконструкции и замещения участков костной ткани, протезирования фрагментов опорно-двигательного аппарата.
Известен композиционный материал, имеющий структуру ядро-оболочка, в котором в качестве оболочки использован гидроксиапатит, а в качестве ядра – наностержни диоксида титана, при этом в оболочку дополнительно диспергирована платина. Известный материал используют для утилизации углекислого газа за счет его фотокаталитических свойств (Appl.CN108543533; МПК B01J 23/42, B01J 35/00, B01D 53/62, B01D 52/86; 2018 год).
Однако известный материал не может быть использован в медицине для восполнения недостатка костной ткани, поскольку не обладает однородной микротвердостью по объему вследствие особенностей его структуры.
Известен биоактивный материал на основе гидроксиапатита, допированного диоксидом титана, с размером частиц 76-150 мкм, полученный путем погружения и выдержки гидроксиапатита в гидрозоль диоксида титана. Материал обладает хорошей биосовместимостью и бактерицидным эффектом и может быть использован в качестве материала для восстановления биологической ткани (Pat.CN106139252; МПК A61L 27/42, C01B 25/32, C01G 23/053, C04B 35/44; 2019 год).
Однако, во-первых, крупный размер частиц снижает биологическую активность известного материала, во- вторых, способ получения известного материала обусловливает неравномерное распределение частиц диоксида титана в матрице гидроксиапатита, что в свою очередь приводит к неравномерному распределению микротвердости по объему.
Известен нанокомпозиционный материал на основе гидроксиапатита с замещением части ионов кальция на титан и с диспергированным в нем диоксидом титана, который предлагается использовать в качестве дезинфицирующего покрытия биологических тканей (Pat. CN 1701844, МПК B01J 20/06, 2005 год).
Недостатком известного материала является невозможность его использования в качестве объемного заменителя биологической ткани в случае устранения костных дефектов вследствие недостаточно высоких прочностных характеристик.
Наиболее близким по технической сущности к предлагаемому является композиционный материал на основе пористого гидроксиапатита с распределенным на его поверхности и в порах диоксидом титана, обеспечивающий дезинфицирующий эффект за счет фотокаталитического разложения органических соединений (Appl. JP 2018020310; МПК B01J 27/18, B01J 35/02, B01J 35/08, B01J 37/04, C01B 25/32; 2018 год)(прототип).
Однако недостатком известного материала является невозможность его использования в качестве объемного заменителя костной ткани вследствие, во-первых, его технического исполнения в виде гранул, во-вторых, низкой микротвердости за счет высокой пористости матрицы и неравномерного распределения диокида титана в объеме гидроксиапатита.
Таким образом, перед авторами стояла задача разработать биоактивный композиционный материал, обладающий наряду с дезинфицирующей способностью повышенной микротвердостью.
Поставленная задача решена в предлагаемом биоактивном композиционном материале на основе гидроксиапатита, в котором диспергирован монооксид титана, отличающийся тем, что он содержит в качестве монооксида титана сверхстехиометрический монооксид титана TiO1,22 при следующем соотношении компонентов, мас.%:
В настоящее время из патентной и научно-технической литературы не известен биоактивный композиционный материал на основе гидроксиапатита, в котором диспергирован сверхстехиометрический монооксид титана TiO1,22 в заявленном массовом соотношении компонентов.
Исследования, проведенные авторами, выявили наличие фотокаталитических свойств предлагаемого биоактивного композиционного материала, содержащего сверхстехиометрический монооксид титана состава TiO1,22, уровень которых соответствует уровню фотокаталитических свойств коммерчески используемого диоксида титана TiO2. На основании полученных данных авторами был разработан биоактивный композиционный материал на основе гидроксиапатита, в котором диспергирован сверхстехиометрический монооксид титана TiO1,22, обладающий дезинфицирующим эффектом за счет возможности разложения вредных органических соединений, обусловленной фотокаталитическими свойствами композиционного материала. Кроме того, использование состава предлагаемого материала позволяет получить плотную керамику, характеризующуюся высокими значениями микротвердости по всему объему, за счет нанокристаллической структуры материала и высокой степени прессуемости вследствие хорошего контакта между частицами гидроксиапатита и монооксида титана TiO1,22. При этом существенным является количественное соотношение компонентов. Так при содержании гидроксиапатита менее чем 77 мас.% наблюдается нежелательное изменение динамики биорезобируемости. Так при содержании гидроксиапатита более чем 79 масс.% наблюдается снижение микротвердости конечного продукта. Совокупность таких характеристик, как высокая микротвердость, с одной стороны, и получение стерильного материала за счет дезинфицирующего эффекта, с другой стороны, позволяют использовать предлагаемый материал в качестве биологически активных костных имплантатов.
Предлагаемый биоактивный композиционный материал может быть получен следующим образом. Смесь металлического титана Ti и диоксида титана TiO2 прессуют в таблетки и подвергают спеканию в вакууме 10-3 Па при температуре 1470 – 1485oC в течение 68 - 72 часов с промежуточным перетиранием продуктов спекания через каждые 22-24 час. Далее проводят отжиг таблеток в вакуумированных кварцевых ампулах (10-4 Па) в течение 180-200 мин при температуре 1020 -1030oC. После чего ампулу с образцами сбрасывают в воду для закалки. Полученный продукт состава TiO1,22 подвергают фрагментации в планетарной шаровой мельнице в течение 480-500 минут с реверсом направления через каждые 30 минут и скоростью вращения 480-520 об/мин в среде изопропилового спирта. Затем добавляют порошок гидроксиапатитата (ГАП) стехиометрического состава Ca10(PO4)6(OH)2, в количестве 77 – 79 мас.% от общего состава, полученный в соответствие с патентом RU2104924, и осуществляют повторную фрагментацию в тех же условиях. После чего порошок просушивают, прессуют в таблетки и отжигают в вакуумированных кварцевых ампулах при температуре 400-420оС в течение 240- 280 мин.
Полученный продукт был исследован с использованием рентгеновского фазового анализа (РФА), растровой электронной микроскопии (РЭМ), метода Брунауэра, Эммета и Теллера (БЭТ), пикнометрии, измерения микротвердости.
Дезинфицирующий эффект, обусловленный способностью разложения органических соединений за счет фотокаталитической активности полученного материала исследовали в тестовой реакции окисления паров ацетона в установке, предназначенной для измерения стационарных параметров окисления органических молекул на образцах фотокатализаторов в проточных условиях под действием видимого излучения. Образцом сравнения являлись коммерческие порошки диоксида титана TiO2 Hombifine N (обозначение HF) фирмы Sachtleben Chemie GmbH, Германия (100% анатаз, SБЭТ ~ 350 м2/г), P25 (обозначение P25) фирмы Evonik Ind., Германия (70% анатаза и 30% рутила, SБЭТ ~ 50 м2/г). Образцы равномерно распределялись на стеклянной подложке площадью 9.1 см2. Основными контролируемыми параметрами при работе установки являются температура проведения реакции, объемная скорость потока реакционной смеси, концентрация реагента и влажность в потоке. Изучение кинетики окисления паров ацетона проводили при следующих значениях рабочих параметров: объемная скорость потока – 0.065±0.001 л/мин, относительная влажность – 19 ± 1 %, температура реактора – 40 ± 0.1°С, давление паров ацетона в КРС – 600 ± 50 млн. д. атм. В качестве источника видимого излучения использовался мощный светодиод, интенсивность которого составляла 420 мВт/см2 с максимумом при λmax ~ 450 нм. Концентрацию СО2 анализировали по изменению площади полосы поглощения, соответствующей данному веществу, на ИК спектрах. Мерой фотокаталитической активности образцов являлась стационарная скорость образования CO2, которую рассчитывали по следующей формуле:
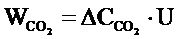
где 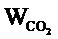
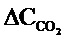
Итоговое значение стационарной скорости образования СО2 для всех образцов усредняли по 4 значениям и рассчитывали доверительный интервал с использованием коэффициента Стьюдента:
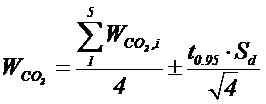
Как показали исследования, скорость разложения ацетона под действием видимого излучения сравнима со скоростью разложения коммерческим катализатором P25 и превышает таковую для HF (см. табл.)
Таблица.
На фиг. 1 представлено изображение фрагмента нанокомпозитного материала 23%TiO1,22+ГАП, полученное с помощью сканирующей электронной микроскопии.
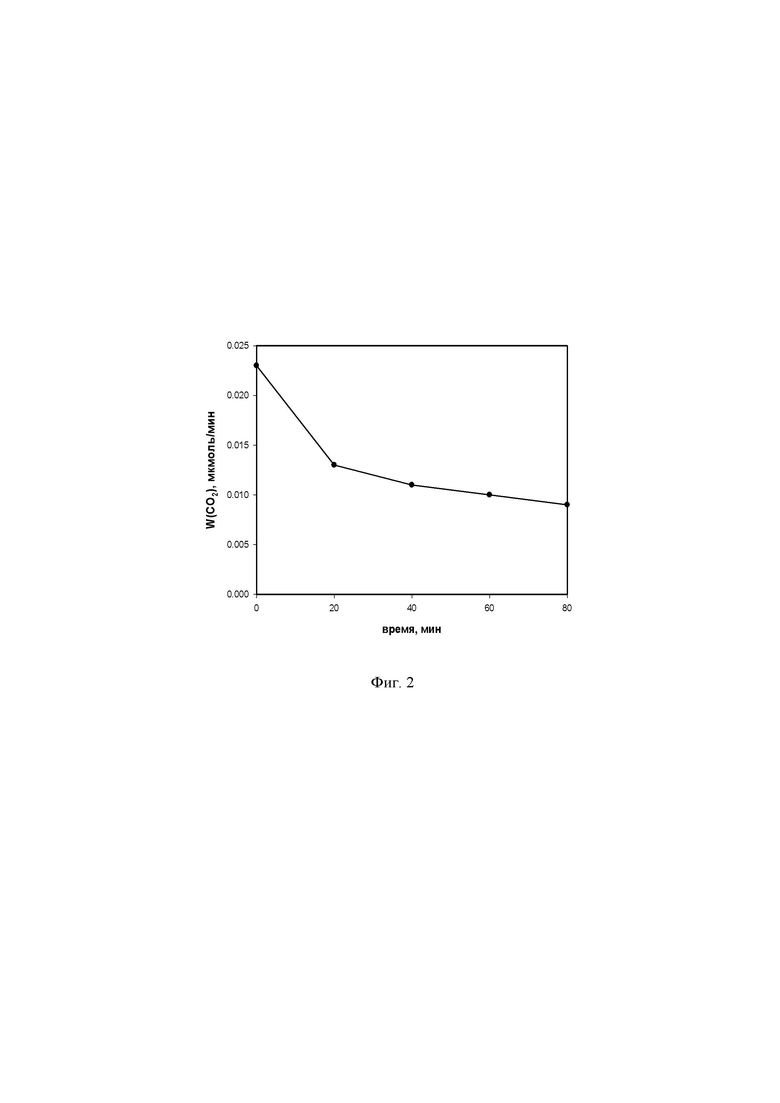
На фиг. 2 представлено изменение активности нанокомпозитного материала при разложении органики под видимым светом при длительных испытаниях.
Предлагаемое техническое решение иллюстрируется следующими примерами.
Пример 1. Берут металлического титана Ti и диоксида титана TiO2 в количестве (зашихтовали смесь) 7.14 гр. и 17.86 гр., соответственно. Смесь прессуют в таблетки и подвергают спеканию в вакууме 10-3 Па при температуре 1470 oC в течение 68 часов с промежуточным перетиранием продуктов спекания через каждые 22 часа. Далее проводят отжиг таблеток в вакуумированных кварцевых ампулах (10-4 Па) в течение 180 мин. при температуре 1020oC. После чего ампулу сбрасывают в воду для закалки. Полученный порошок фрагментируют в планетарной шаровой мельнице в течение 480 минут с реверсом направления через каждые 30 минут и скоростью вращения 480 об/мин в среде изопропилового спирта, взятого в количестве 12 мл. После взвешивания промежуточного продукта добавляют 84 г гидроксиапатитата (ГАП) стехиометрического состава Ca10(PO4)6(OH)2,, полученный смешиванием гидроксида кальция и фосфорной кислоты, отстаиванием, фильтрованием и сушкой (патент RU 2104924), и повторяют фрагментацию смеси в шаровой мельнице в течение 480-500 минут с реверсом направления через каждые 30 минут и скоростью вращения 480-520 об/мин в среде изопропилового спирта, взятого в количестве 12 мл. Полученный порошок просушивают, прессуют в таблетки. После чего отжигают в вакуумированных кварцевых ампулах при температуре 400оС в течение 240 минут.
Получают композиционный материал состава, мас.%: гидроксиапатит Ca10(PO4)6(OH)2 – 77; монооксид титана TiO1,22 – 23; с размером зерен 20-40 нм; удельной поверхностью 10.0952±0.1770 м2/г; пористостью: площадь пор 0,5795 м2/г, объём пор 0,000491 см3/г; плотность 3.0253 ± 0.0048 г/см3; микротвердостью 159,23 MПа. Данные по разложению паров ацетона приведены в табл.
Пример 2. Берут металлического титана Ti и диоксида титана TiO2 в количестве (зашихтовали смесь) 7.14 гр. и 17.86 гр., соответственно. Смесь прессуют в таблетки и подвергают спеканию в вакууме 10-3 Па при температуре 1485oC в течение 72 часов с промежуточным перетиранием продуктов спекания через каждые 24 часа. Далее проводят отжиг таблеток в вакуумированных кварцевых ампулах (10-4 Па) в течение 200 мин при температуре 1030oC. После чего ампулу сбрасывают в воду для закалки. Полученный порошок фрагментируют в планетарной шаровой мельнице в течение 500 мин с реверсом направления через каждые 30 минут и скоростью вращения 520 об/мин в среде изопропилового спирта, взятого в количестве 15 мл. После взвешивания промежуточного продукта добавляют 94 г гидроксиапатита (ГАП) стехиометрического состава Ca10(PO4)6(OH)2, полученный смешиванием гидроксида кальция и фосфорной кислоты, отстаиванием, фильтрованием и сушкой (патент RU 2104924), и повторяют фрагментацию смеси в шаровой мельнице в течение 500 минут с реверсом направления через каждые 30 минут и скоростью вращения 520 об/мин в среде изопропилового спирта, взятого в количестве 15 мл. Полученный порошок просушивают, прессуют в таблетки. После чего отжигают в вакуумированных кварцевых ампулах при температуре 420оС в течение 280 мин.
Получают композиционный материал состава, мас.%: гидроксиапатит Ca10(PO4)6(OH)2 – 79; монооксид титана TiO1,22 – 21; с размером зерен 20-40 нм; удельной поверхностью 10.0952±0.1770 м2/г; пористостью: площадь пор 0,5795 м2/г, объём пор 0,000491 см3/г; плотность 3.0253 ± 0.0048 г/см3; микротвердостью 168,97 MПа. Данные по разложению паров ацетона приведены в табл.
Таким образом, авторами предлагается биоактивный нанокомпозиционный материал, обладающий дезинфекционным эффектом наряду с высокой микротвердостью, который может применяться для реконструкции и замещения участков костной ткани, протезирования фрагментов опорно-двигательного аппарата.
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиционный биоматериал на основе гидроксиапатита и способ его получения | 2023 |
|
RU2816008C1 |
| Биорезорбируемый материал и способ его получения | 2017 |
|
RU2652429C1 |
| Биомедицинский материал на основе гидроксиапатита и способ его получения | 2022 |
|
RU2782925C1 |
| Состав для получения композиционного биоматериала на основе гидроксиапатита | 2024 |
|
RU2827698C1 |
| Биоактивный композиционный материал для замещения костных дефектов и способ его получения | 2018 |
|
RU2683255C1 |
| Биоактивное покрытие для восстановления костной ткани | 2019 |
|
RU2717676C1 |
| Композиционный материал на основе гидроксиапатита для костных имплантатов и способ его получения | 2021 |
|
RU2771382C1 |
| Биоматериал на основе гидроксиапатита | 2020 |
|
RU2735032C1 |
| Биоматериал на основе гидроксиапатита | 2020 |
|
RU2741208C1 |
| Биоактивное покрытие на основе гидроксиапатита для восстановления костной ткани | 2024 |
|
RU2829755C1 |

Изобретение относится к области получения биологически активных фармацевтических и медицинских материалов. Предложен биоактивный композиционный материал на основе гидроксиапатита, в котором диспергирован монооксид титана. Материал содержит в качестве монооксида титана сверхстехиометрический монооксид титана TiO1,22 при следующем соотношении компонентов, мас.%: гидроксиапатит – 77-79, монооксид титана TiO1,22 – 21-23. Предложенный биоактивный композиционный материал обладает дезинфицирующей способностью наряду с высокой микротвердостью и может применяться для реконструкции и замещения участков костной ткани, протезирования фрагментов опорно-двигательного аппарата. 1 табл., 2 пр., 2 ил.
Биоактивный композиционный материал на основе гидроксиапатита, в котором диспергирован монооксид титана, отличающийся тем, что он содержит в качестве монооксида титана сверхстехиометрический монооксид титана TiO1,22 при следующем соотношении компонентов, мас.%:
| Биорезорбируемый материал и способ его получения | 2017 |
|
RU2652429C1 |
| JP 2018020310 A, 08.02.2018 | |||
| СПОСОБ ИЗГОТОВЛЕНИЯ ВНУТРИКОСТНЫХ ИМПЛАНТАТОВ | 1994 |
|
RU2074674C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМЕДИЦИНСКОГО МАТЕРИАЛА | 2015 |
|
RU2599039C1 |
| GREENWOOD N.N | |||
| et al, Chemistry of the elements, Second Edition, Chapter 21 Titanium, Zirconium, Hafnium, 1997, p | |||
| Плавучий мост | 1921 |
|
SU961A1 |
Авторы
Даты
2020-06-25—Публикация
2020-03-12—Подача