ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области фармацевтической и органической химии и предоставляет пирролохинолиновые производные, составы и способы.
УРОВЕНЬ ТЕХНИКИ
Рецепторы серотонина (5-гидрокситриптамина; 5-HT) играют важную роль во многих физиологических и поведенческих функциях у людей и животных (Hannon et al., 2008). Указанные функции опосредованы через 15 подтипов 5-HT-рецепторов (Hoyer et al., 2002). Одним из последних дополнений к суперсемейству серотониновых рецепторов является 5-НТ6 подтип, который посредством стимулирования аденилатциклазы повышает внутриклеточный уровень цАМФ (Ruat et al., 1993; Schoeffter and Weaber, 1994).
Результаты ауторадиографических и иммуногистохимических исследований, а также экспериментов по гибридизации мРНК показали, что рецепторы 5-HT6 были обнаружены почти исключительно в центральной нервной системе (CNS), демонстрируя самую высокую плотность в обонятельном бугорке, коре головного мозга, полосатом теле, прилежащем ядре и гиппокампе (Kohen et al., 1996; Gérard et al., 1997; Ward et al., 1995).
Большая часть современного интереса к рецептору 5-HT6, проистекает из того факта, что несколько психотропных средств проявляют высокое сродство к рецептору 5-HT6 и демонстрируют антагонистические свойства по отношению к этим участкам (Monsma et al., 1993). Указанные соединения включают амитриптилин, клозапин, кветиапин, оланзапин, сертиндол. Однако они имеют многоцелевой профиль.
Результаты исследований in vivo, опубликованные к настоящему времени, указывают на то, что антагонисты 5-HT6 могут вызывать антидепрессантные и противотревожные ответы на моделях животных. Как было продемонстрировано исследователем Wesołowska et al., соединение SB-258585 проявляет эффект, подобный антидепрессанту в тесте принудительного плавания у крыс, и эффект, подобный анксиолитическому средству в питьевом конфликтом тесте у крыс (Wesołowska and Nikiforuk, 2007a). Другие антагонисты 5-HT6, т.е. SB-399885 и SB-271046, также проявляют активность, подобную антидепрессивному средству в тесте принудительного плавания у крыс (Hirano et al., 2009). Кроме того, SB-399885 проявляет эффект, подобный анксиолитическому средству в питьевом конфликтном тесте (Фогеля), и тесте приподнятого крестообразного лабиринта, осуществленном на крысах (Wesołowska and Nikiforuk, 2007b).
Исследование потенциальной роли рецепторов 5-HT6 при шизофрении, проведенное на стандартных моделях этого расстройства, выявило, что антагонисты 5-HT6, по всей вероятности, не проявляют антипсихотического действия (Pouzet et al., 2002). Однако такие соединения улучшают обучение и память на животных моделях, включая распознавание новых объектов (King et al., 2004), обучение водному лабиринту Морриса (Rogers and Hagan, 2001) и переключаемость внимания (Rodefer et al., 2008). Эти результаты указывают на то, что антагонист 5-HT6 может быть пригоден для лечения когнитивных расстройств при шизофрении и других когнитивных нарушений, таких как болезнь Альцгеймера.
Фармакологические исследования лигандов 5-НТ6 позволили обнаружить взаимодействие модуляторов 5-НТ6 и других нейротрансмиттеров головного мозга, главным образом, ацетилхолина (Ach) и глутамата (Glu). Было показано, что антагонисты рецепторов 5-HT6 усиливают передачу сигнала посредством ацетилхолина (Bentley et al., 1999; Riemer et al., 2003). Другие исследования также показали, что SB-271046, антагонист рецепторов 5-HT6, повышает уровень глутамата в коре головного мозга и гиппокампе (Dawson et al., 2001), в то время как применение агониста WAY-466 рецепторов 5-HT6 приводит к уменьшению уровня глутамата в гиппокампе (Schechter et al., 2004). Принимая во внимание роль Ach и Glu в процессах обучения и памяти, эти результаты могут свидетельствовать о том, что рецепторы 5-HT6 могут влиять на когнитивные процессы, которые часто нарушаются при аффективных расстройствах и нейродегенеративных заболеваниях (Mitchell and Neumaier, 2005; Upton et al., 2008).
В последние годы было показано, что агенты рецепторов 5-HT6 уменьшают потребление пищи у крыс, таким образом, было предположено, что модуляторы рецепторов 5-HT6 могут иметь потенциальное использование при расстройствах приема пищи, подобных ожирению, анорексии и булимии (Heal et al., 2008). Поскольку современные фармакологические подходы к лечению ожирения не являются достаточно эффективными, эти наблюдения свидетельствуют о том, что рецепторы 5-HT6 могут представлять собой перспективную молекулярную мишень для новых средств от ожирения. Они представляются важными, так как ожирение - характеризующееся увеличением содержания жира в организме, приводящим к избытку массы тела выше принятых норм - является наиболее распространенным нарушением питания в западном мире. Важно отметить, что это приводит к повышению уровня смертности из-за увеличения случаев таких заболеваний, как сердечно-сосудистые, органов пищеварения, болезни органов дыхания, сахарный диабет 2-го типа.
В заключение, селективные агенты 5-HT6 были идентифицированы как потенциально пригодные в лечении или профилактике некоторых нарушений центральной нервной системы, таких как болезнь Паркинсона, шизофрения, тревожное и депрессивное расстройство, маниакальная депрессия, обсессивно-компульсивные расстройства, расстройства настроения, болезнь Альцгеймера, связанное с возрастом снижение когнитивных способностей, умеренные когнитивные нарушения, нейродегенеративные расстройства, характеризующиеся нарушением роста нейронов, панические атаки, эпилепсия, синдром дефицита внимания с гиперактивностью (ADHD), отказ от употребления наркотиков, таких как кокаин, этанол, никотин и бензодиазепины, и боль. Лиганды 5-HT6 также должны быть пригодны в лечении или профилактике ожирения и диабета 2-го типа.
Первые селективные лиганды рецепторов 5-H6 были определены посредством высокопроизводительного скрининга библиотек соединений, который привел к выбору антагониста I-SB-271046 (Формула (I)). Это был первый агент для рецепторов 5-HT6, который прошел клинические испытания в отношении когнитивного нарушения при шизофрении и болезни Альцгеймера.

В то же время, ряд производных триптамина, основанных на EMDT, был продемонстрирован в качестве агонистов 5-HT6R. Следующим шагом была разработка арилсульфонамидных производных индола и структур, подобных индолу. Было обнаружено, что соединение MS-245 проявляет высокое сродство к рецепторам 5-HT6 и высокую избирательность, превышающую другие моноаминергические рецепторы (Формулы (II)-(III)). Кроме того, введение сульфонамидного фрагмента меняет функциональный профиль из агонистического в антагонистический профиль.

С этого времени, несколько лигандов 5-HT6, включающих в структуру сульфонильный или сульфонамидный фрагмент, были разработаны. По химическому составу, они могут быть разделены на две основные группы. Первую группу составляют основанные на индоле структуры и на подобных индолу структурах. Среди них, PF-05212365 в настоящее время проходит клиническую разработку для лечения когнитивных нарушений при шизофрении и болезни Альцгеймера (Формула (IV)).
Вторая группа включает в себя арилпиперазиновые производные, содержащие одно или более конденсированные ароматические кольца. Препарат PRX-07034 принадлежит к моноарилпиперазиновым производным, модифицированным сульфонильным фрагментом (Формула (V)). В настоящее время, указанное соединение проходит клинические испытания относительно когнитивной деятельности и подавления потребления пищи. Другие арилпиперазиновые производные с плоскими ароматическими системами, например, SB-742457 и R-1485, представляют собой предмет клинических испытаний относительно когнитивного нарушения при шизофрении и болезни Альцгеймера (Формулы (VI)-(VII)).

Стоит отметить, что указанные выше структуры приспособлены к фармакофорным моделям антагонистов рецепторов 5-HT6, независимо разработанным Pullagurla (Pullagurla et al., 2004) и López-Rodriguez (López-Rodriguez et al. 2005). Ключевые элементы, предложенные в этих моделях, представляют собой две гидрофобные области, водородный акцептор, содержащий двойную связь (главным образом, сульфонильный или сульфонамидный фрагмент) и основный центр молекулы.
Хотя сульфонильная или сульфонамидная группа может быть заменена на ее биоизостер с амидной или алкильной группой или карбоксамидную группу (Cole et al., 2003; WO2005030724), арилсульфонильные или арилсульфонамидные производные продолжают составлять важный класс лигандов 5-HT6. В некоторых патентных публикациях, например, США 8003670, США 6423717, США 7960374 B2, США 2009/0069337 A1, WO 2011/044134 A1, EP 2069310 B1, авторы раскрывают несколько классов арилсульфонамидов, и претендуют на их возможное применение в лечении расстройств ЦНС, связанных с нарушением функций рецепторов 5-HT6.
Цель настоящего изобретения относится к предоставлению потенциальных и селективных антагонистов 5-HT6, основанных на пирролохинолиновой структуре в центре молекулы, в качестве соединений, применяемых в лечении некоторых расстройств ЦНС.
Хотя многие годы пирроло[3,2-c]хинолиновая система широко использовалась в качестве сердцевины биологически активных соединений, обладающих противоопухолевыми (Helissey et al., 1987), гипотензивными (Wright et al., 1971) и противовоспалительными свойствами (США 5216162), было показано, что пирролохинолиновые производные гетероциклы также ингибируют (H+/K+)-ATФазу желудка, фермента, ответственного за секрецию кислоты в просвет желудка (Brown et al., 1990).
Антисекреторная активность пирроло[3,2-c]хинолинов оказалась благоприятной в лечении язвы желудка и была раскрыта в международной патентной публикации WO 00/01696 (Формулы (VIII)-(IX)).

Кроме того, производные, содержащие пирроло[3,2-c]хинолин в центральной области молекулы, могут действовать как ингибиторы фермента кинуренингидроксилазы (KYN-OH), который участвует в метаболизме триптофана и приводит к накоплению мощной нейротоксической хинолиновой кислоты. Полагают, что селективное ингибирование KYN-OH может играть роль в защите нейронов (Heidempergher et al., 1999). Синтез пирроло[3,2-c]хинолиновых производных наряду с их использованием для предотвращения и лечения нейродегенеративных заболеваний, выявленных с помощью такого механизма действия, был предметом международной патентной заявки WO 98/05660 (Формулы (X)-(XI)).

Следует отметить, что пирроло[2,3-f]хинолины, как было показано, проявляют сродство к рецепторам 5-HT2A, 5-HT2B и 5-HT2C. Патентная публикация США 6365598 B1 раскрывает ряд по-разному замещенных пирролохинолинов в качестве агонистов и антагонистов рецепторов 5-HT2A и 5-HT2C и их применение в лечении расстройств ЦНС, включающих ожирение, шизофрению, депрессию, тревогу, мигрень, сексуальные расстройства, боль и желудочно-кишечные дисфункции (Формула (XII)).

Кроме того, их структурные аналоги, пирролохиноксалиновые производные, были разработаны в качестве эффективных агонистов рецепторов 5-HT3 с потенциальными свойствами, подобными аналгезирующему средству.
Недавно, Benakki et al. описал синтез N-метилпирроло[3,2-c]хинолиновых производных общей формулы (XIII) (Benakki et al., 2008).

ОПИСАНИЕ
Неожиданно было обнаружено, что некоторые пирролохинолиновые производные представляют собой антагонистов рецепторов 5-HT6. Изобретение относится к соединению общей формулы (XIV):

или таутомеру, стереоизомеру, N-оксиду, меченному изотопом аналогу или фармакологически приемлемой соли, гидрату или сольвату любого из указанных выше соединений, где:
- R1, R2 независимо представляют собой водород, незамещенную алкил(C1-C3) группу, алкил(C1-C3) группу, замещенную одним или более атомами галогена, алкокси(C1-C3) группу, или независимо группу, выбранную из: циано, нитро, амино, гидроксила;
- T представляет собой CO, CH2, замещенную алкил(C1-C2) группу, SO, SO2;
- Ar представляет собой незамещенный арил (5-6-членный), биарил (8-10-членный), гетероарил (5-6-членный), гетероарил (8-10-членный), содержащий 1-3 гетероатома, независимо выбранные из группы, состоящей из N, O, S, необязательно замещенный одним или более заместителями, выбранными из алкил(C1-C3) группы, алкил(C1-C3) группы, замещенной одним или более атомами галогена, алкокси(C1-C3) группы, алкенил(C2-C4) группы, галогена, нитро, гидроксила, циано, амино, алкиламино, карбоксамида;
- R3 представляет собой заместитель, выбранный из группы циклических или линейных, замещенных или незамещенных аминов, состоящей из (XV)-(XVIII):

где:
- A представляет собой NH, O, CH2, NR5;
- B представляет собой NH, O, NR4;
- R4 представляет собой атом водорода или алкил(C1-C3) группу;
- R5 представляет собой алкил(C1-C3) группу или бензил;
- R6 представляет собой алкил(C1-C3) группу;
- n выбирают из 0, 1, 2;
- m выбирают из 0, 1, 2;
- l выбирают из 1 и 2.
В особенности, изобретение относится к соединению общей формулы (XIV) или таутомеру, стереоизомеру, N-оксиду или фармакологически приемлемой соли, гидрату или сольвату любого из указанных выше соединений, где:
- R1, R2 независимо представляют собой водород, метильные, этильные группы, необязательно замещенные одним или более атомами галогена, или независимо замещенные группой, выбранной из: циано, нитро, амино, гидроксила, метокси;
- T представляет собой CO, CH2, замещенную алкил(C1-C2) группу, SO2;
- Ar представляет собой незамещенный арил (5-6-членный), биарил (8-10-членный), гетероарил (5-6-членный), гетероарил (8-10-членный), содержащий 1-3 гетероатома, независимо выбранные из группы, состоящей из N, O, S, необязательно замещенный одним или более заместителями, выбранными из алкил(C1-C3) группы, алкил(C1-C3) группы, замещенной одним или более атомами галогена, метокси, этокси, галогена, нитро, гидрокси, циано, амино, алкиламино, карбоксамида;
- R3 представляет собой заместитель, выбранный из группы циклических или линейных, замещенных или незамещенных аминов, состоящих из структур XV-XVIII, где: A, n, m, l имеют значения, указанные выше;
- B представляет собой NH, O;
- R4 представляет собой атом водорода;
- R5 представляет собой алкил(C1-C3) группу или бензил;
- R6 представляет собой алкил(C1-C3) группу.
Изобретение относится к рацематам, смеси диастереомеров, а также к индивидуальным стереоизомерам соединений формулы (XIV).
Соединения согласно изобретению формулы (XIV), а также их фармакологически приемлемые соли, проявляют антагонистическую активность по отношению к рецепторам 5-HT6, и как таковые применимы в лечении и предотвращении заболеваний, нарушений или состояний, связанных с рецепторами 5-HT6, или поддающихся лечению путем манипуляции этими рецепторами. Таким образом, один аспект изобретения предоставляет способ лечения, контроля или предотвращения таких заболеваний, нарушений или состояний у млекопитающего, который включает введение такому млекопитающему терапевтически эффективного количества соединения формулы XIV. Заболевания, нарушения или состояния, для которых соединения согласно настоящему изобретению представляются пригодными в лечении или предотвращении расстройств, включают, но не ограничиваются ими: шизофрению, тревогу, депрессию, маниакальную депрессию, эпилепсию, обсессивно-компульсивное расстройство, расстройства настроения, мигрень, болезнь Альцгеймера, связанное с возрастом когнитивное нарушение, умеренное когнитивное нарушение, расстройства сна, расстройства приема пищи, анорексию, булимию, панические атаки, синдром дефицита внимания и гиперактивности, синдром дефицита внимания, болезнь Паркинсона, болезнь Гентингтона, отказ от употребления кокаина, этанола, никотина или бензодиазепинов, боль, ожирение и диабет 2-го типа, функциональное заболевание кишечника, синдром раздраженного кишечника.
Другие варианты осуществления изобретения включают:
- фармацевтические композиции для лечения расстройств, возникающих в результате нарушения передачи сигнала через рецепторы 5-HT6, композицию, содержащую соединение формулы (XIV), пролекарства, его фармацевтически приемлемые соли и сольваты и фармацевтически приемлемый носитель;
- способы лечения нарушения или состояния, поддающегося лечению путем блокировки рецепторов 5-HT6, способ, включающий в себя введение млекопитающему при необходимости такого лечения соединения формулы (XIV) или его фармацевтически приемлемой соли;
- фармацевтические композиции для лечения расстройства или состояния, выбранного из расстройств, перечисленных в данном документе, композиции, содержащие соединение формулы (XIV) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель;
- способы противодействия рецепторам 5-HT6, которые включают введение субъекту при необходимости эффективного количества соединения.
Изобретение также относится к использованию соединения или его соли согласно формуле (XIV) для производства лекарственного средства.
Изобретение также относится к комбинированным терапиям, при которых соединение согласно изобретению или его фармацевтически приемлемая соль или фармацевтическая композиция или состав, содержащий соединение согласно изобретению, вводят одновременно или последовательно или в виде комбинированного препарата с другим терапевтическим средством или средствами, для лечения одного или более из состояний, перечисленных выше. Такое другое терапевтическое средство(средства) может быть введено до, одновременно с или после введения соединений согласно изобретению.
Терапевтическое средство или средства, используемое в комбинации с соединением согласно изобретению, относится к соединениям, применяемым для лечения нарушения или состояний, выбранных из нарушений, перечисленных в изобретении, с механизмом действия, который синергическим образом улучшает положительные результаты терапии.
Соединения согласно изобретению проявляют антагонистические свойства по отношению к рецепторам 5-HT6. Эта активность соединений согласно изобретению легко демонстрируется, например, с помощью одного или более анализов, описанных в данном документе, или известных в данной области техники.
Изобретение также предоставляет способы получения соединений согласно изобретению и промежуточных соединений, используемых в указанных способах.
Изобретение относится к промежуточным соединениям общей формулы XIX:

или таутомеру, стереоизомеру, N-оксиду, меченному изотопом аналогу или фармакологически приемлемой соли, гидрату или сольвату любого из приведенных выше соединений, где R1, R2, R3 являются такими же, как в формуле (XIV).
Изобретение относится к рацематам, смеси диастереомеров, а также к индивидуальным стереоизомерам соединений формулы (XIX).
Соединения формулы XIV могут быть получены, например, при использовании реакций и методик, описанных ниже. В основном, соединения, описанные в объеме настоящей патентной заявки, могут быть синтезированы путем, описанным на схеме 1 и в Примерах.

На схеме 1 показано, что соединения формулы XIV (A-9) и XIX (A-8) могут быть получены:
а) реакцией аза-Бейлиса-Хиллмана, осуществляемой в полярном растворителе, выбранном из ацетонитрила, этанола, изопропанола, ДМФА или ДМСО, в присутствии третичного амина, такого как DABCO (1,4-диазабицикло[2.2.2]октан), хинуклидин или 3-гидроксихинуклидин, и кислоты Льюиса, выбранной из Sc(OTf)3, Yb(OTf)3, Ti(Oi-Pr)4 и Cu(OTf)2. Способ обычно осуществляют в течение 24-48 часов при комнатной температуре,
b) путем образования диенового производного A-2 при алкилировании A-1 аллилбромидом в присутствии сильного основания, выбранного из трет-BuOK, трет-BuONa, K2CO3, Cs(CO3)2, TEA, в полярном растворителе, предпочтительно спирте, ацетонитриле или ДМФА,
c) реакцией обмена с замыканием цикла производного A-2. Способ обычно осуществляют при использовании 3-10 мол.% рутениевого катализатора в дихлорметане или толуоле и с дополнительным воздействием микроволнового излучения,
d) обработкой полученного пирролина A-3 сильным основанием с образованием производного пиррола A-4. Реакцию обычно осуществляют в подходящем растворителе, таком как ДМФА или ДМСО, в присутствии основания, выбранного из трет-BuOK, трет-BuONa, K2CO3, Cs(CO3)2 или TEA,
e) восстановлением нитропроизводного A-4 до его аминопроизводного аналога A-5. Превращение до аминопроизводного представляет собой обычный способ, осуществляемый в атмосфере водорода при использовании 5-10 мол.% палладия на активированном угле,
f) циклизацией соединения A-5 до лактама A-6 в кислых условиях, полярном протонном растворителе, например, 2-метоксиэтаноле, изопропаноле, н-BuOH, сек-BuOH, трет-BuOH,
g) превращением лактамового производного A-6 до его хлорсодержащего аналога A-7 путем обработки соединения A-6 хлорирующим средством, таким как POCl3, SOCl2, PCl5, при повышенной температуре,
h) путем получения амино/эфирозамещенных пирролохинолинов общей структуры A-8. Способ может быть осуществлен при использовании различных растворителей, выбранных из неполярных растворителей, таких как толуол, бензол, ксилолы, тетрагидрофуран и диоксан, или полярных растворителей, выбранных из ацетона, ацетонитрила, ДМФА, ДМСО. Реакцию обычно проводят при 70-140°C в течение 2-24 ч и часто сопровождают воздействием микроволнового излучения,
i) обработкой пирролохинолина A-8 по-разному замещенными производными арилсульфонилгалогенида, арилацилгалогенида или арилалкилгалогенида в присутствии сильного основания, выбранного из трет-BuOK, трет-BuONa, NaOH, NaH, TEA, DIEA или фосфазеновых оснований, таких как BTPP, с получением конечных продуктов A-9, в случае Boc-защищенных аминов, у конечных продуктов были удалены защитные группы в кислых условиях.
Выделение и очистка соединений и промежуточных соединений, представленных в описании, были осуществлены, если желательно, любой подходящей методикой разделения и очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, препаративная жидкостная хроматография, при низком или высоком давлении или комбинацией указанных процедур.
Подходящие способы разделения и выделения можно найти в разделе получение и примеры. Тем не менее, другие эквивалентные способы разделения и выделения, конечно, можно также применять.
Соединения согласно настоящему изобретению могут содержать один асимметрический центр, и поэтому они могут существовать в виде рацематов и рацемических смесей или индивидуальных энантиомеров.
Изомерные формы соединений представлены общей формулой (XIV). Формула (XIV) демонстрирует структуру класса соединений без предпочтительной стереохимии. Независимый синтез этих изомеров или их хроматографическое разделение могут быть достигнуты, как известно в данной области техники, путем соответствующей модификации методологии, описанной в данном документе. Их абсолютную стереохимию можно определить рентгеноструктурной кристаллографией кристаллических продуктов или кристаллических промежуточных соединений, которые подвергают дериватизации, в случае необходимости, реагентом, содержащим асимметрический центр известной абсолютной конфигурации. Рацемическая смесь соединений может быть разделена непосредственно хроматографическими методами с применением хиральных стационарных фаз: методами, хорошо известными в данной области техники. В качестве альтернативы, любой энантиомер соединения может быть получен путем стереоселективного синтеза с использованием оптически чистых исходных материалов или реагентов известной конфигурации методами, хорошо известными в данной области техники.
Некоторые из кристаллических форм соединений могут существовать в виде полиморфов: как таковые предназначены быть частью изобретения. В дополнение, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями. Такие растворители также подпадают под объем настоящего изобретения.
Соединения согласно изобретению могут также быть использованы в виде реагентов или стандартов в биохимическом исследовании неврологической функции, дисфункции и заболевании.
Примерами соединений согласно изобретению являются следующие соединения:
Химические названия соединений были даны при использовании программы ChemBioDraw Ultra 12.0. Во избежание сомнений, если химическое название и химическая структура проиллюстрированных выше соединений не соответствуют по ошибке, считается, что химическая структура однозначно определяет соединение.
ОПРЕДЕЛЕНИЯ
Общие термины, используемые при описании соединений, раскрытых в данном документе, имеют свои обычные значения. Термин алкил, употребляемый в данном документе, означает одновалентную насыщенную разветвленную или прямую углеводородную цепь. Если не указано иное, такие цепи могут содержать от 1 до 3 атомов углерода. Представителями таких алкильных групп являются метил, этил, пропил, изопропил и тому подобное. Такое же содержание углерода применимо к термину в описании “алкан”, и к термину производных, таких как “алкокси”. Содержание углерода различных углеродсодержащих фрагментов указано посредством префикса, означающего минимальное и максимальное число атомов углерода во фрагменте, т.е., префикс Cx-Cy определяет число присутствующих атомов углерода от целого числа “x” до целого числа “y” включительно. “Алкил(C1-3)”, например, означает метил, этил, н-пропил или изопропил.
Термин “арил” охватывает моноциклические или конденсированные бициклические ароматические или гетероароматические группы, включающие, но не ограничивающиеся ими, фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, имидазо[2,1-b][1,3]тиазолил, пиразолил, изоксазолил, изотиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазинил, фенил, 1H-индазол-7-ил, 1H-индазол-6-ил, 1H-индол-2-ил, 1H-индол-3-ил, 1H-индол-6-ил, 1H-индол-7-ил, индолизинил, изоиндолил, 1-бензофуран-2-ил, 1-бензофуран-3-ил, 1,2,3,4-тетрагидронафтил, 1,2,3,4-тетрагидроизохинолинил, индалил, инденил, 1-бензотиен-3-ил, 1-бензотиен-2-ил, 2,3-дигидро-1,4-бензодиоксин-5-ил, бензимидазолил, 1,3-бензотиазол-4-ил, 1,3-бензотиазол-5-ил, бензо[1,2,5]тиаздиазолил, хинолинил, изохинолинил, фталазинил, хиназолинил, хиноксалинил, 1,8-нафтиридинил, нафтил, птеридинил или азуленил. “Галоид” или “галоген” означает хлор, фтор, бром или йод; “гетеро”, как в “гетероалкил”, “гетероароматическое” и т.д., означает соединение, содержащее один или более атомы N, O или S. “Гетероалкил” включает алкильные группы с гетероатомами в любом положении, таким образом, включающие N-связанные, O-связанные или S-связанные алкильные группы.
Термин “замещенная” означает, что определенная группа или фрагмент несет один или более заместители. В случае, когда любая группа может нести множество заместителей, и ряд возможных заместителей предоставлен, заместители независимо выбраны и необязательно должны быть одинаковыми. Термин “незамещенная” означает, что определенная группа не несет заместители.
N-оксиды соединений, описанных выше, являются частью изобретения. Третичные амины могут или не могут приводить к образованию метаболитов N-оксидов. Степень, до которой происходит N-окисление, варьируется от следовых количеств до почти количественного превращения. N-оксиды могут быть более активными, чем их соответствующие третичные амины, или менее активными. Хотя N-оксиды могут легко восстанавливаться химическими средствами до их соответствующих третичных аминов, в организме человека это происходит в различной степени. Некоторые N-оксиды претерпевают почти количественное восстановительное превращение до соответствующих третичных аминов, в других случаях имеет место лишь следовая реакция, или она даже полностью отсутствует.
Любое соединение, которое метаболизируется in vivo с образованием биоактивного средства (т.е., соединения формулы (XIV), представляет собой пролекарство в пределах объема и сущности заявки. Пролекарства являются терапевтическими средствами, неактивными сами по себе, но превращающимися в один или более активные метаболиты. Таким образом, в способах лечения согласно настоящему изобретению, термин “введение” будет охватывать лечение различных описанных нарушений соединением, специфически выявленным, или соединением, которое не является специфически выявленным, но которое превращается в определенное соединение in vivo после введения больному. Пролекарства являются биологически обратимыми производными молекул лекарственных средств, используемыми для преодоления некоторых барьеров к пользе для молекулы исходного лекарственного средства. Эти барьеры включают, но не ограничиваются ими, растворимость, проницаемость, стабильность, пресистемный метаболизм и ограничения мишеней. Пролекарства, т.е., соединения, которые при введении людям любым известным способом, метаболизируются до соединений формулы (XIV), являющихся частью изобретения. В частности, это относится к соединениям с первичными или вторичными амино- или гидроксигруппами. Такие соединения могут взаимодействовать с органическими кислотами с получением соединений формулы (XIV), где присутствует дополнительная группа, которая легко удаляется после введения, например, но не ограничиваются ею, амидин, енамин, основание Манниха, гидроксил-метиленовое производное, производное O-(ацилоксиметиленкарбамата), карбамат, сложный эфир, амид или енаминон.
“Кристаллическая форма” относится к различным твердым формам одного и того же соединения, например, полиморфам, сольватам и аморфным формам. Соединение формулы (XIV) и его фармацевтически приемлемые соли могут существовать в виде гидрата или сольвата, и такой гидрат или сольват также охвачены настоящим изобретением. Их примеры включают 1/10 гидратов гидрата, 1/4 гидрата, моногидрат, дигидрохлорид, дигидрат, 3/2 гидрата дигидрохлорида и тому подобное. “Аморфные” формы не являются кристаллическими материалами, не имеющими дальнего порядка, и, как правило, не дают отличительной картины порошковой дифракции рентгеновских лучей.
Термины “селективный” и “селективность” относятся к соединениям, которые проявляют реакционную способность по отношению к конкретному рецептору (например, рецептору 5-HT6), не проявляя существенную перекрестную реактивность по отношению к другому рецептору (например, подтипам рецепторов 5-HT). Таким образом, например, селективные соединения согласно настоящему изобретению могут проявлять реакционную способность по отношению к рецепторам 5-HT6, не проявляя существенной перекрестной реактивности по отношению к другим 5-HT-рецепторам. В одном варианте осуществления изобретения, соединение согласно настоящему изобретению имеет, по меньшей мере, приблизительно 10-кратную селективность по отношению к рецептору 5-HT6, по меньшей мере, приблизительно 50-кратную селективность по отношению к рецептору 5-HT6, по меньшей мере, приблизительно 100-кратную селективность по отношению к рецептору 5-HT6, по меньшей мере, приблизительно 250-кратную селективность по отношению к рецептору 5-HT6 или, по меньшей мере, приблизительно 500-кратную селективность по отношению к желаемой мишени.
На протяжении всего описания и в формуле, следующей за описанием, слово “содержать” и вариации слова, такие как “содержащий” и “включает в себя” не предназначены исключить другие добавки, компоненты, целые числа или стадии.
Хотя для соединений формулы (XIV) может быть возможным введение в виде сырого химического продукта, тем не менее предпочтительно представлять их в виде “фармацевтической композиции”. Согласно дополнительному аспекту, настоящее изобретение предоставляет фармацевтическую композицию, содержащую соединение формулы (XIV) или его фармацевтически приемлемую соль или сольват вместе с одним или более фармацевтически приемлемыми носителями и необязательно с одним или более другими терапевтическими ингредиентами. Носитель(и) должен быть “приемлемым” в смысле совместимости с другими ингредиентами состава и не вреден для реципиента.
Термин “композиция”, употребляемый в данном документе, охватывает продукт, содержащий конкретные ингредиенты в заранее определенном количестве или пропорциях, а также любой продукт, который образуется, прямо или косвенно, из комбинации конкретных ингредиентов в конкретных количествах. Относительно фармацевтических композиций, этот термин охватывает продукт, содержащий один или более активные ингредиенты и оптимальный носитель, включающий в себя инертные ингредиенты, а также любой продукт, который образуется в результате, прямо или косвенно, комбинирования, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействия одного или более ингредиентов. Вообще, фармацевтические композиции получают путем равномерного и тщательного перемешивания активных ингредиентов с жидким носителем или тонко измельченным твердым носителем или с ними обоими, и затем, если необходимо, путем формирования продукта в виде желаемого состава. Фармацевтическая композиция содержит достаточное количество активного заданного соединения, чтобы производить желаемый эффект при прогрессировании состояния или заболевания. Соответственно, фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, полученную путем смешивания соединения согласно настоящему изобретению и фармацевтически приемлемого носителя. Под “фармацевтически приемлемым” подразумевают носитель, разбавитель или эксипиент, который должен быть совместим с другими ингредиентами состава и не наносить вред его реципиенту.
В контексте данной заявки, термин “комбинированный препарат” включает воедино истинные комбинации, подразумевающие соединение формулы (XIV) и одно или более другие лекарственные средства, физически объединенные в одном препарате, таком как таблетка или жидкость для инъекций, содержащая соединение формулы (XIV) и одно или более другие лекарственные средства в отдельных дозированных формах, вместе с инструкцией для пользования, необязательно с дополнительными средствами, которые способствуют соблюдению режима введения составляющих соединений, например, этикетка или графические материалы. Что касается истинных комбинаций, то фармакотерапия, в сущности, является совместной.
Сродство соединения согласно изобретению по отношению к рецепторам 5-HT6 определяли при использовании радиолигандного анализа. Исходя из сродства к связыванию, измеренного для данного соединения формулы (XIV), можно оценить теоретическую наименьшую эффективную дозу. При концентрации соединения, равной удвоенному измеренному значению Ki, почти 100% рецепторов 5-НТ6, вероятно, будут заняты соединением. Превращение такой концентрации в мг соединения на кг массы больного приводит к теоретической наименьшей эффективной дозе, предполагающей идеальную биодоступность. Фармакокинетические, фармакодинамические и другие соображения могут изменять фактически вводимую дозу до более высокой или более низкой величины. Типичная суточная доза активных ингредиентов изменяется в широком диапазоне и будет зависеть от различных факторов, таких как соответствующее показание, путь введения, возраст, вес и пол больного, и может быть определена лечащим врачом. Вообще, общая суточная доза, вводимая больному в виде однократных доз или индивидуальных доз, может составлять количества, например, от 0,001 до 10 мг/кг массы тела в день, а точнее от 0,01 до 1000 мг в день, от общего количества активных ингредиентов.
Термин “терапевтически эффективное количество”, употребляемый в данном документе, относится к количеству терапевтического средства для лечения состояния, поддающегося лечению, путем введения композиции согласно изобретению. Такое количество представляет собой количество, достаточное для проявления определяемого терапевтического ответа или улучшающего действия в тканевой системе животного или человека. Нецелесообразно указывать точное эффективное количество предварительно.
Термин “фармацевтически приемлемая соль” относится к таким солям, которые, с медицинской точки зрения, являются подходящими для использования в контакте с тканями людей и низших животных без неспецифической токсичности, раздражения, аллергической реакции и тому подобного, и которые соответствуют целесообразному отношению польза/риск. Фармацевтически приемлемые соли являются хорошо известными в данной области техники. Они могут быть получены in situ в конце выделения и очистки соединений согласно изобретению, или отдельно путем взаимодействия соединений с фармацевтически приемлемыми нетоксичными кислотами, включающими неорганические или органические кислоты (Berge, 1977). Форма “свободное основание” может быть регенерирована путем взаимодействия соли с основанием и выделения родительского соединения обычным способом. Родительская форма соединения отличается от различных солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но в других отношениях соли эквивалентны родительской форме соединения в контексте настоящего изобретения.
“Комплекс” относится к комплексу соединения согласно изобретению, например, формулы (XIV), образующего комплекс с ионом металла, где, по меньшей мере, один атом металла хелатно связан или блокирован. Комплексы получают способами, хорошо известными в данной области (Dwyer, 1964).
Термин “лечение”, употребляемый в данном документе, относится к любому лечению у млекопитающего, например, человека, состояния или заболевания и включает: (1) торможение заболевания или состояния, т.е., угнетение его развития, (2) ослабление заболевания или состояния, т.е., приводит к состоянию регрессии, или (3) прекращение симптомов заболевания.
Употребляемый в данном документе, термин “лекарственная терапия” предназначен включить профилактические, диагностические и терапевтические программы лечения, осуществляемые in vivo или ex vivo на людях и других млекопитающих.
Сокращения
AcOH уксусная кислота;
BINAP 2,2’-бис(дифенилфосфино)-1,1’-- бинафтил
BTPP основание фосфазена P1-трет- Bu-трис(тетраметилен);
BuOH бутанол;
CDCl3 дейтерированный хлороформ;
CD3OD дейтерированный метанол;
DABCO 1,4-диазабицикло[2.2.2]октан;
DCM - дихлорметан;
DIEA- диизопропилэтиламин;
ДМФА диметилформамид;
ДМСО диметилсульфоксид;
HCl - хлористоводородная кислота;
Hex - гексан;
MeCN ацетонитрил;
MeOH метанол;
NaH - гидрид натрия;
NaOH - гидроксид натрия;
NaOH гидроксид натрия;
Na2SO4 сульфат натрия;
PCl5 пятихлористый фосфор;
Pd/C палладий на активированном угле;
Pd
2(dba)3
трис(дибензилиденацетон)дипалладий(0);
POCl3 хлорокись фосфора;
SOCl2 тионилхлорид;
t-BuOK трет-бутилат калия;
t-BuONa трет-бутилат натрия;
TEA триэтиламин;
MW молекулярная масса;
HPLC высокоэффективная
жидкостная хроматография;
1H ЯМР протонный ядерный
магнитный резонанс;
ЖХ-МС высокоэффективная
жидкостная хроматография, соединенная с масс-спектрометром.
Общие аналитические методы
Синтез осуществляли при температуре окружающей среды, если не указано иное. Органические растворители (от Aldrich и Chempur) были химически чистыми и использовались без очистки. Реагенты доставлены от компаний Aldrich, Chembridge, Fluorochem.
Аналитическую хроматографию ВЭЖХ осуществляли на приборе Waters Alliance HPLC, снабженном колонкой ChromolithSpeedROD (4,6×50 мм). Стандартные условия включали систему элюента А (вода/0,1% ТФУ), систему B (ацетонитрил/0,1% ТФУ). Скорость потока составляла 5 мл/мин, и градиент использовали (0-100%) B в течение 3 мин. Определение осуществляли на детекторе PDA.
Спектры 1H ЯМР получали на спектрометре Varian BB 200, используя TMS (0,00 м.д.) в хлороформе-d1, и записывали при 300 МГц; J величины даны в герцах (Гц), и картины расщепления обозначены следующим образом: с (синглет), д (дублет), т (триплет), м (мультиплет).
ЖХ/МС осуществляли на системе, состоящей из Waters Acquity СВЭЖХ, соединенной с масс-спектрометром Waters TQD. Все анализы выполняли с использованием колонки СВЭЖХ Acquity BEH C18, 50×2,1 мм, при 40°C. Скорость потока составляла 0,3 мл/мин, и градиент использовали (5-95%) B в течение 10 мин. Элюент A: вода/0,1% HCO2H; элюент B: ацетонитрил/0,1% HCO2H. Чистота, определенная СВЭЖХ/МС, всех испытуемых соединений и ключевых промежуточных соединений, составила >97%.
Пример 1
Пример 1.1
Синтез замещенных 7-хлорпирролохинолинов общей структуры A-7
Метил 2-[(2-нитрофенил)-(4-толуолсульфониламино)метил]акрилат (A-1)

В сухой колбе, п-толуолсульфонамид (18 г, 105 ммоль, 1 экв.) и DABCO (1,78 г, 15,7 ммоль, 1 экв.) смешивали вместе с предварительно активированными молекулярными ситами (4 Å, 21 г). Смесь суспендировали в изопропаноле (300 мл), с последующим добавлением нитробензальдегида (15,8 г, 105 ммоль, 1 экв.) и метилакрилата (10,7 мл, 115 ммоль, 1,1 экв.). Затем, Ti(iOPr)4 добавляли в виде свежеприготовленного раствора в изопропаноле (0,6 мл, 2,1 ммоль, 0,02 экв.). Колбу наполняли азотом, и смесь перемешивали при комнатной температуре в течение 24 ч. Затем, смесь фильтровали через целит, который промывали DCM. Растворитель упаривали, и оставшийся сырой материал растворяли в AcOEt, промывали 1M KHSO4, насыщенным NaHCO3, водой и насыщенным раствором соли и сушили над MgSO4. Упаривание растворителя привело к желтому маслу, которое впоследствии растворяли в AcOEt и кристаллизовали путем добавления н-гексана. Появившийся белый осадок фильтровали, промывали диэтиловым эфиром и сушили в вакууме.
Белое твердое вещество, Т.пл. 109-111°C, выход 63%, C18H18N2O6S, молекулярная масса 390,41, моноизотопная масса 390,09, [M+H]+ 391,4.
1H ЯМР (300 МГц, CDCl3) δ (м.д.) 2,40 (с, 3H), 3,56 (с, 3H), 5,68 (с, 1H), 5,84-5,87 (д, 1H, J=8,72 Гц), 6,06-6,09 (д, 1H, J=8,46 Гц), 6,21 (с, 1H), 7,22-7,26 (м, 2H), 7,36-7,42 (тд, 1H, J=7,44 Гц, J=1,28 Гц), 7,51-7,56 (тд, 1H, J=7,70 Гц, J=1,28 Гц), 7,67-7,70 (м, 3H), 7,80-7,84 (дд, 1H, J=8,08 Гц, J=1,54 Гц).
Метил 2-[(N-аллил-N-тозиламино)-(2-нитрофенил)метил]акрилат (A-2)

β-Аминоэфир A-1 (10 г, 25,6 ммоль, 1 экв.) растворяли в ДМФА (100 мл) с последующим добавлением K2CO3 (10,5 г, 76,5 ммоль, 3 экв.). Далее, аллилбромид (4,42 мл, 51,2 ммоль, 2 экв.) добавляли по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем, смесь разбавляли этилацетатом и промывали водой (5×) и насыщенным раствором соли. Органическую фазу концентрировали в вакууме. Полученное желтое твердое вещество обрабатывали диэтиловым эфиром с получением белого осадка, который фильтровали и сушили в вакууме.
Белое твердое вещество, Т.пл. 83-85°C, выход 95%, C21H22N2O6S, молекулярная масса 430,47, моноизотопная масса 430,12, [M+H]+ 430,8. 1H ЯМР (300 МГц, CDCl3) δ (м.д.) 2,41 (с, 3H) 3,49-3,55 (м, 3H) 3,92-4,01 (м, 1H) 4,15-4,25 (м,1H) 4,92-5,03 (м, 2H) 5,43-5,59 (м, 2H) 6,44 (с, 1H) 6,79 (с, 1H) 7,23-7,27 (м, 2H) 7,42-7,49 (м,1H) 7,61-7,68 (м, 3H) 7,75-7,80 (д, 1H, J=7,69 Гц) 7,89-7,93 (дд, 1H, J=8,21, J=1,28 Гц).
Метил-2,5-дигидро-2-(2-нитрофенил)-1-тозил-1H-пиррол-3-карбоксилат (A-3)

β-Аминоэфир A-2 (2 г, 4,64 ммоль, 1 экв.) растворяли в DCM (12 мл), катализатор Grubbs II (300 мг, 0,36 ммоль, 0,03 экв.) добавляли. Смесь подвергали воздействию микроволнового излучения при 38°C в течение 30 мин в Biotage MW. Затем, ДМСО (0,71 мл, 10 ммоль, 2,1 экв.) добавляли к реакционной смеси, и ее перемешивали при комнатной температуре в течение 20 ч. После этого времени, силикагель добавляли, и смесь перемешивали в течение следующих 5 минут. Смесь разбавляли DCM и фильтровали через слой силикагеля. Фильтрат концентрировали при пониженном давлении, и полученный остаток обрабатывали диэтиловым эфиром с получением белого осадка, который фильтровали и сушили в вакууме.
Светло-коричневое твердое вещество, выход 80%, Т.пл. 124-125°C, C19H18N2O6S, молекулярная масса 402,42, моноизотопная масса 402,09, [М+H]+ 403,31. 1H ЯМР 300 МГц, CDCl3) δ (м.д.) 2,36 (с, 3H), 3,45 (с, 3H), 4,29 (м, 1H), 4,54 (м, 1H), 6,61-6,64 (м, 1H), 6,68 (т, 1H, J=2,0 Гц), 7,27 (д, 2H, J=8,27 Гц), 7,31-7,36 (м, 1H), 7,48-7,50 (м, 2H), 7,74 (д, 2H, J=8,27 Гц), 7,83 (д, 1H, J=8,22 Гц).
Метил-2-(2-нитрофенил)-1H-пиррол-3-карбоксилат (A-4)

К раствору 2,5-дигидропиррола A-3 (2,5 г, 6,2 ммоль, 1 экв.) в ДМФА (40 мл) добавляли трет-BuOK (2,09 г, 18,7 ммоль, 3 экв.). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов под контролем ВЭЖХ. Затем, смесь разбавляли этилацетатом, нейтрализовали 1 M KHSO4 (20 мл) и промывали насыщенным раствором NaHCO3, водой (3×) и насыщенным раствором соли. Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный сырой материал очищали на силикагеле с AcOEt/гексан (4/6) в качестве системы растворителей.
Светло-коричневое твердое вещество, выход 100%, C12H10N2O4, молекулярная масса 246,22, моноизотопная масса 246,06, [M+H]+ 247,3.
1H ЯМР (300 МГц, CDCl3) δ (м.д.) 3,62-3,63 (м, 3H) 6,69-6,73 (т, 1H, J=2,95 Гц) 6,82-6,85 (м, 1H) 7,44-7,48 (м, 1H) 7,51-7,58 (м, 1H) 7,60-7,66 (м, 1H) 8,03-8,04 (дд, 1H, J=8,21, J=1,28 Гц).
Метил-2-(2-аминофенил)-1H-пиррол-3-карбоксилат (A-5)

К раствору 2,5-дигидропиррола A-3 (2,5 г, 6,2 ммоль, 1 экв.) в ДМФА (40 мл) добавляли трет-BuOK (2,09 г, 18,7 ммоль, 3 экв.). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов под контролем ВЭЖХ. Затем, смесь разбавляли этилацетатом, нейтрализовали 1 M KHSO4 (20 мл), и промывали насыщенным раствором NaHCO3, водой (3×) и насыщенным раствором соли. Органический слой сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный сырой материал очищали на силикагеле с AcOEt/гексан (4/6) в качестве системы растворителей.
Светло-коричневое твердое вещество, выход 100%, C12H10N2O4, молекулярная масса 246,22, моноизотопная масса 246,06, [M+H]+ 247,3. 1H ЯМР (300 МГц, CDCl3) δ (м.д.) 3,62-3,63 (м, 3H) 6,69-6,73 (т, 1H, J=2,95 Гц) 6,82-6,85 (м, 1H) 7,44-7,48 (м, 1H) 7,51-7,58 (м, 1H) 7,60-7,66 (м, 1H) 8,03-8,04 (дд, 1H, J=8,21, J=1,28 Гц).
Метил-2-(2-аминофенил)-1H-пиррол-3-карбоксилат (A-5)

Нитропроизводное A-4 (2,5 г, 10,2 ммоль, 1 экв.) растворяли в 50 мл метанола, затем добавляли 10% Pd/C (180 мг, 7% масс.) и уксусную кислоту (0,26 мл, 4,6 ммоль, 0,45 экв.). Смесь перемешивали в течение 2 ч в атмосфере водорода. Затем, смесь фильтровали через целит и концентрировали в вакууме с получением соединения А-5 в виде светло-коричневого твердого вещества.
Светло-коричневое твердое вещество, Т.пл. 295-297°C, выход 98%, C12H12N2O2, молекулярная масса 216,24, моноизотопная масса 216,09, [M+H]+ 217,0. 1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 3,60-3,62 (м, 3H) 6,59-6,60 (д, 1H, J=3,08 Гц) 6,67-6,70 (м, 2H) 6,71-6,73 (м, 1H) 7,04-7,11 (м, 2H).
1H-пирроло[3,2-c]хинолин-4(5H)-он (A-6)

Суспензию соединения A-5 (2,5 г, 11,6 ммоль, 1 экв.) в сек-бутаноле (50 мл) и AcOH (0,5 мл, 8,7 ммоль, 0,75 экв.) перемешивали при 70°C в течение 3 ч. Затем, растворитель упаривали в вакууме с получением светло-коричневого твердого вещества.
Светло-коричневое твердое вещество, Т.пл. 292-294°C, выход 99%, C11H8N2O, молекулярная масса 184,19, моноизотопная масса 184,06, [M+H]+ 185,0. 1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 6,81-6,82 (д, 1H, J=3,08 Гц) 7,18-7,20 (д, 1H, J=3,08 Гц) 7,23-7,30 (м, 1H) 7,36-7,45 (м, 2H) 7,95-7,98 (д, 1H, J=7,69 Гц).
4-хлор-1H-пирроло[3,2-c]хинолин (A-7a)

Смесь лактама A-6 (1,2 г, 6,5 ммоль, 1 экв.) и 12 мл POCl3 нагревали при 105°C в течение 12 часов. Затем, смесь выливали на лед и нейтрализовали раствором аммиака. Водную фазу экстрагировали DCM с получением ключевого синтона A-7 в виде светло-коричневого твердого вещества. Осадок в водной фазе фильтровали и объединяли с экстрагированным продуктом.
Светло-коричневое твердое вещество, выход 85%, C11H7ClN2, молекулярная масса 202,64, моноизотопная масса 202,03, [M+H]+ 202,9. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 6,71-6,73 (м, 1H) 7,60-7,66 (м, 3H) 7,93-7,98 (м, 1H) 8,36-8,42 (м, 1H) 12,82 (с, 1H).
Следующие соединения были получены согласно описанному выше способу:
4-хлор-8-нитро-1H-пирроло[3,2-c]хинолин (A-7b)

Коричневое твердое вещество, выход 72%, C11H6ClN3O2, молекулярная масса 247,64, моноизотопная масса 247,01, [M+H]+ 248,0.
4-хлор-1H-пирроло[3,2-c]хинолин-8-карбонитрил (A-7c)

Светло-коричневое твердое вещество, выход 80%, C12H6ClN3, молекулярная масса 227,65, моноизотопная масса 227,03, [M+H]+ 228,0.
4-хлор-8-метокси-1H-пирроло[3,2-c]хинолин (A-7d)

Коричневое твердое вещество, выход 78%, C12H9ClN2O, молекулярная масса 232,67, моноизотопная масса 232,04, [M+H]+ 233,0.
4-хлор-7-фтор-1H-пирроло[3,2-c]хинолин (A-7e)

Коричневое твердое вещество, выход 75%, Т.пл. 143-145°C, C11H6ClFN2, молекулярная масса 220,63, моноизотопная масса 220,02, [M+H]+ 221,0.
4,8-дихлор-1H-пирроло[3,2-c]хинолин (A-7f)

Светло-коричневое твердое вещество, выход 81%, C11H6Cl2N2, молекулярная масса 237,08, моноизотопная масса 235,99, [M+H]+ 237,0. 1H ЯМР (300 МГц, ДМСО-d6) δ (м.д.) 6,68-6,71 (м, 1H) 7,59-7,68 (м, 3H) 7,90-8,00 (м, 1H), 12,75 (с, 1H).
Пример 1.2.
Общий способ получения алифатических аминопроизводных A-8
Способ получения аминопроизводного с алифатической цепью A-8a
Соединение А-7 (200 мг, 1 ммоль, 1 экв.) суспендировали в 5 мл MeCN с последующим добавлением амина (539 мкл, 4,9 ммоль, 5 экв.). Смесь подвергали воздействию микроволнового излучения в течение 10 ч при 140°C. Затем, растворитель упаривали, и смесь очищали на силикагеле с DCM/MeOH/NH3водн. 9/1,5/0,1 (об./об./об.) как с системой растворителей.
N1,N1-диметил-N2-(1H-пирроло[3,2-c]хинолин-4-ил)этан-1,2-диамин (A-8a)

Коричневое масло, выход 56%, C15H18N4, молекулярная масса 254,33, моноизотопная масса 254,15, [M+H]+ 255,0. 1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 2,27-2,29 (с, 6H) 2,56-2,61 (т, 2H, J=5,90) 3,75-3,78 (т, 2H, J=5,90 Гц) 6,61-6,62 (д, 1H, J=3,08 Гц) 7,12-7,16 (м, 2H) 7,26-7,38 (м, 1H) 7,73-7,76 (д, 1H, J=8,21 Гц) 7,86-7,88 (д, 1H, J=7,95 Гц).
Способ получения алициклических производных первичных аминов A-8(b-g)
Соединение A-7 (0,35 г, 1,7 ммоль, 1 экв.) суспендировали в 12 мл MeCN с последующим добавлением амина (6,9 ммоль, 4 экв.). Смесь подвергали воздействию микроволнового излучения в течение 5 ч при 140°C. Далее, растворитель упаривали, и смесь очищали на силикагеле с DCM/MeOH 9/1,5 (об./об.) как с системой растворителей.
трет-бутил-3-((1H-пирроло[3,2-c]хинолин-4-ил)амино)азетидин-1-карбоксилат (A-8b)

Белое пенистое вещество, выход 57%, C19H22N4O2, молекулярная масса 338,40, моноизотопная масса 338,17, [M+H]+ 339,26.
трет-бутил-3-[(1H-пирроло[3,2-c]хинолин-4-ил)амино]пирролидин-1-карбоксилат (A-8c)

Светло-коричневое пенистое вещество, выход 60%, C20H24N4O2, молекулярная масса 352,43, моноизотопная масса 352,19, [M+H]+ 353,5.
(S)-трет-бутил-3-[(1H-пирроло[3,2-c]хинолин-4-ил)амино]пирролидин-1-карбоксилат (A-8d)
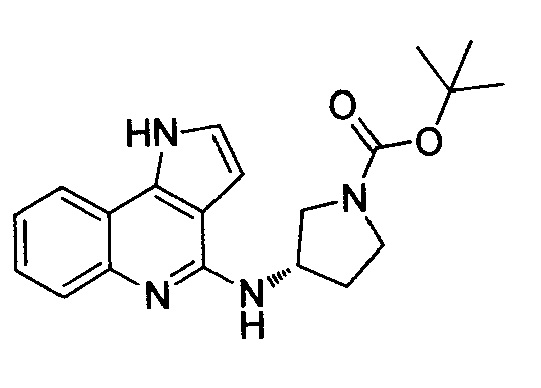
Светло-коричневое пенистое вещество, выход 60%, C20H24N4O2, молекулярная масса 352,43, моноизотопная масса 352,19, [M+H]+ 353,2. 1H ЯМР (300 МГц, ДМСО-d5) δ (м.д.) 1,35-1,49 (м, 9H) 1,98 (ушир. с, 1H) 2,30 (ушир. с, 1H) 3,27-3,56 (м, 4H) 3,71-3,81 (м, 1H) 4,93 (ушир. с, 1H) 6,55 (д, 1H, J=3,08 Гц) 7,13 (д, 1H, J=3,08 Гц) 7,16-7,23 (м, 1H) 7,25-7,27 (м, 1H) 7,33-7,34 (т, 1H, J=7,31 Гц) 7,71-7,81 (д, 1H, J=8,46 Гц) 7,86 (дд, 1H, J=7,95, 1,28 Гц).
(S)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амин (A-8d')

Соединение получено из A-8d с использованием раствора 4N HCl в диоксане и выделено в виде HCl-соли. Белое твердое вещество, выход 60%, C15H16N4, молекулярная масса 252,31, моноизотопная масса 252,14, [M+H]+ 253,1. 1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 2,10-2,26 (м, 1H) 2,43-2,57 (м, 1H) 3,16 (м, 1H) 3,22-3,34 (м, 1H) 3,47-3,68 (м, 3H), 5,36 (ушир. с, 1H) 7,03 (т, 2H, J=7,95 Гц) 7,28-7,37 (м, 1H) 7,47 (т, 1H, J=7,82 Гц) 7,68 (дд, 2H, J=7,82, J=4,74 Гц) 7,74-7,80 (м, 1H) 7,83 (дд, 1H, J=3,85, J=1,28 Гц).
(R)-трет-бутил-3-[(1H-пирроло[3,2-c]хинолин-4-ил)амино]пирролидин-1-карбоксилат (A-8e)

Светло-коричневое пенистое вещество, выход 62%, C20H24N4O2, молекулярная масса 352,43, моноизотопная масса 352,19, [M+H]+ 353,2. 1H ЯМР (300 МГц, ДМСО-d5) δ (м.д.) 1,37-1,50 (м, 9H), 2,00 (ушир. с, 1H), 2,30 (ушир. с, 1H), 3,28-3,56 (м, 4H), 3,70-3,85 (м, 1H), 4,92 (ушир. с, 1H), 6,50-5,58 (д, 1H, J=3,08 Гц), 7,10-7,15 (д, 1H, J=3,08 Гц), 7,17-7,24 (м, 1H), 7,25-7,28 (м, 1H), 7,34-7,43 (т, 1H, J=7,18 Гц), 7,72-7,82 (д, 1H, J=7,95 Гц), 7,83-7,90 (дд, 1H, J=7,95, J=1,03 Гц).
трет-бутил-3-[(7-фтор-1H-пирроло[3,2-c]хинолин-4-ил)амино]пирролидин-1-карбоксилат (A-A-8f)

Коричневое масло, выход 61%, C20H23FN4O2, молекулярная масса 370,42, моноизотопная масса 370,18, [M+H]+ 371,2.
трет-бутил-3-((8-хлор-1H-пирроло[3,2-c]хинолин-4-ил)амино)пирролидин-1-карбоксилат (A-8g)

Светло-коричневое пенистое вещество, выход 63%, C20H23ClN4O2, молекулярная масса 386,88, моноизотопная масса 386,15, [M+H]+ 387,2.
1H ЯМР (300 МГц, ДМСО-d5) δ (м.д.) 1,37-1,51 (м, 9H) 2,00 (ушир. с, 1H) 2,32 (ушир. с, 1H) 3,28-3,57 (м, 4H) 3,71-3,81 (м, 1H) 4,92 (ушир. с, 1H) 6,55 (д, 1H, J=3,08 Гц) 7,13 (д, 1H, J=3,08 Гц) 7,20-7,24 (м, 1H) 7,26-7,28 (м, 1H) 7,71-7,81 (д, 1H, J=8,40 Гц) 7,83 (м, 1H).
Способ получения производных вторичных аминов A-8(h-q)
Соединение A-7 (0,35 г, 1.7 ммоль, 1 экв.) суспендировали в смеси толуола и TEA (1,4 мл, 10,2 ммоль, 6 экв.). Затем, амин (2,4 ммоль, 2 экв.) добавляли, и реакционную смесь перемешивали при 114°C в течение 14 часов. Относительно гомопиперазиновых производных, реакционную смесь подвергали воздействию микроволнового излучения при 140°C в течение 6 часов. Реакционную смесь упаривали, оставшийся сырой продукт очищали на силикагеле с помощтю соответствующих элюентов: AcOEt/гексан 4/6 (об./об.) для Boc-N-метилпирролидин-3-аминовых и Boc-пиперазиновых производных, и DCM/MeOH 9/1,5 (об./об.) для метилпиперазина, бензилпиперазина и гомопиперазина.
трет-бутил-(1-(1H-пирроло[3,2-c]хинолин-4-ил)пирролидин-3-ил)(метил)карбамат (A-8h)

Коричневое масло, выход 67%, C21H26N4O2, молекулярная масса 366,46, моноизотопная масса 366,21, [M+H]+ 367,2.
трет-бутил-4-(1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8i)

Светло-коричневое пенистое вещество, выход 63%, C20H24N4O2, молекулярная масса 352,43, моноизотопная масса 352,19, [M+H]+ 353,4. 1H ЯМР (300 МГц, CDCl3) δ (м.д.) 3,45-3,55 (м, 4H) 3,57-3,66 (м, 4H) 6,45-6,46 (д, 1H, J=3,07 Гц) 7,03-7,08 (д, 1H, J=3,34 Гц) 7,09-7,15 (м, 1H) 7,56-7,64 (д, 1H, J=7,95 Гц) 7,82-7,86 (дд, 1H, J=1,01 Гц, J=7,95 Гц).
4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолин (A-8i')
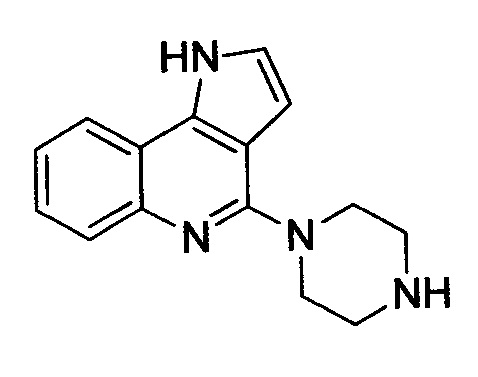
Соединение получено из A-8i с использованием раствора 4N HCl в диоксане и выделено в виде HCl-соли. Белое твердое вещество, выход 100%, C15H16N4, молекулярная масса 252,31, моноизотопная масса 252,14, [M+H]+ 253,1. 1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 2,55-2,59 (т, 4H, J=5,17 Гц) 3,82-3,87 (т, 4H, J=4,90 Гц) 6,64-6,68 (м, 1H) 7,17-7,29 (м, 2H) 7,34-7,41 (м, 1H) 7,79-7,84 (м, 2H).
4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолин (A-8j)
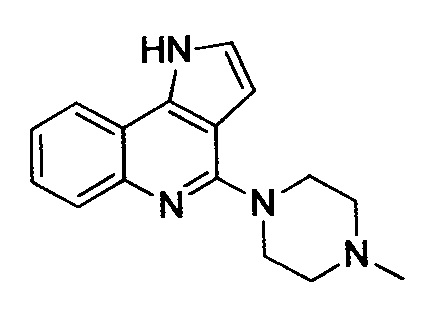
Светло-коричневое пенистое вещество, выход 62%, C16H18N4, молекулярная масса 266,34, моноизотопная масса 266,15, [M+H]+ 267,4.
1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 2,33 (с, 3H) 2,60-2,64 (т, 4H, J=5,12 Гц) 3,87-3,90 (т, 4H, J=4,87 Гц) 6,64-6,64 (д, 1H, J=3,07 Гц) 7,15-7,26 (м, 2H) 7,36-7,42 (м, 1H) 7,83-7,87 (м, 2H).
4-(4-бензилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолин (A-8k)

Коричневое масло, выход 55%, C22H22N4, молекулярная масса 342,44, моноизотопная масса 342,18, [M+H]+ 343,5. 1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 2,66-2,69 (т, 4H, J=4,87 Гц) 3,61 (с, 2H) 3,87-3,90 (т, 4H, J=4,87 Гц) 6,68-6,70 (м, 1H) 7,17-7,19 (м, 1H) 7,24-7,49 (м, 7H) 7,78-7,86 (м, 2H).
трет-бутил-4-(8-нитро-1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8l)

Желтое масло, выход 62%, C20H23N5O4, молекулярная масса 397,43, моноизотопная масса 397,18, [M+H]+ 398,2.
трет-бутил-4-(8-амино-1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8m)

Соединение получено из A-9l реакцией восстановления, катализируемой палладием. Соединение A-9l (300 мг, 0,82 ммоль) растворяли в метаноле и затем добавляли 10% Pd/C (30 мг, 10% масс.) и уксусную кислоту (21 мкл, 0,37 ммоль, 0,45 экв.). Смесь перемешивали в течение 2 ч в атмосфере водорода. Затем, смесь фильтровали через целит и концентрировали в вакууме. Оставшийся сырой материал очищали на силикагеле с AcOEt/гексан 5/5 как системой растворителей.
Коричневое масло, C20H25N5O2, выход 62%, молекулярная масса 367,44, моноизотопная масса 367,20, [M+H]+ 368,2.
трет-бутил-4-(8-циано-1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8n)

Коричневое масло, выход 59%, C21H23N5O4, молекулярная масса 377,44, моноизотопная масса 377,19, [M+H]+ 378,2.
трет-бутил-4-(8-метокси-1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8o)

Светло-коричневое пенистое вещество, выход 64%, C21H26N4O3, молекулярная масса 382,46, моноизотопная масса 382,20, [M+H]+ 383,2.
трет-бутил-4-(8-хлор-1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8p)

Коричневое масло, выход 65%, C20H23ClN4O2, молекулярная масса 386,88, моноизотопная масса 386,15, [M+H]+ 387,2.
8-хлор-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолин (A-8p')

Соединение получено из A-8p при использовании раствора 4N HCl в диоксане и выделено в виде HCl-соли. Белое твердое вещество, C15H15ClN4, молекулярная масса 286,76, моноизотопная масса 286,10, [M+H]+ 287,1.
1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 2,56-2,59 (т, 4H, J=5,19 Гц) 3,83-3,89 (т, 4H, J=4,87 Гц) 6,65-6,67 (м, 1H) 7,19-7,30 (м, 1H) 7,32-7,39 (м, 1H) 7,80-7,84 (м, 2H).
трет-бутил-4-(7-фтор-1H-пирроло[3,2-c]хинолин-4-ил)пиперазин-1-карбоксилат (A-8q)

Коричневое масло, выход 60%, C20H23FN4O2, молекулярная масса 370,42, моноизотопная масса 370,18, [M+H]+ 371,2.
трет-бутил-4-(1H-пирроло[3,2-c]хинолин-4-ил)-1,4-диазепан-1-карбоксилат (A-8r)

Светло-коричневое пенистое вещество, выход 85%, C21H26N4O2, молекулярная масса 366,46, моноизотопная масса 366,21, [M+H]+ 367,2.
4-(1,4-диазепан-1-ил)-1H-пирроло[3,2-c]хинолин (A-8r')

Соединение получено из A-8r при использовании раствора 4N HCl в диоксане и выделено в виде HCl-соли. Белое твердое вещество, выход 85%, C16H18N4, молекулярная масса 266,34, моноизотопная масса 266,15, [M+H]+ 267,2.
1H ЯМР (300 МГц, CD3OD/CDCl3) δ (м.д.) 1,64-1,67 (м, 2H), 2,55-2,57 (м, 2H), 2,78-2,82 (м, 2H), 3,18-3,22 (м, 2H), 3,68-3,42 (м, 2H), 6,42-6,45 (д, 1H, J=3,07 Гц), 7,02-7,10 (м, 1H), 7,36-7,39 (м,1H), 7,68-7,75 (м, 1H), 7,83-7,89 (м, 1H), 8,00-8,12 (м, 1H).
4-(пиперидин-1-ил)-1H-пирроло[3,2-c]хинолин (A-8s)

Соединение A-7 (180 мг, 0,89 ммоль, 1 экв.) суспендировали в толуоле (3 мл), и к суспензии добавляли соответствующий амин (3,56 ммоль, 4 экв.). Смесь подвергали воздействию микроволнового излучения при 125°C в течение 1 ч. Растворитель упаривали, и оставшийся сырой материал очищали на силикагеле с AcOEt/гексан 4/6 как системой растворителей.
Желтое пенистое вещество, выход 60%, C16H17N3, молекулярная масса 251,33, моноизотопная масса 251,14. 1H ЯМР (300 МГц, CDCl3) δ (м.д.) 1,62-1,79 (м, 6H) 3,33 (с, 4H) 6,72 (ушир. с, 1H) 7,25-7,33 (м, 1H) 7,38-7,47 (м, 2H) 7,66-7,74 (д, 1H, J=8,22 Гц) 8,16-8,22 (дд, 1H, J=8,02, J=1,17 Гц) 12,35-12,44 (м, 1H).
4-(1H-пирроло[3,2-c]хинолин-4-ил)морфолин (A-8t)

Соединение A-7 (180 мг, 0,89 ммоль, 1 экв.) суспендировали в толуоле (3 мл), и к суспензии добавляли соответствующий амин (3,56 ммоль, 4 экв.). Смесь подвергали воздействию микроволнового излучения при 125°C в течение 1 ч. Растворитель упаривали, и оставшийся сырой материал очищали на силикагеле с AcOEt/гексан 4/6 как системой растворителей.
Светло-коричневое пенистое вещество, выход 62%, C15H15N3O, молекулярная масса 253,30, моноизотопная масса 253,12. 1H ЯМР (300 МГц, CDCl3) δ (м.д.) 3,65-3,74 (м, 4H) 3,78-3,87 (м, 4H) 6,74-6,78 (дд, 1H, J=3,13, J=1,76 Гц) 7,27-7,33 (м, 1H) 7,38-7,45 (м, 2H) 7,64-7,70 (м, 1H) 8,14-8,21 (м, 1H) 12,29 (ушир. с, 1H).
Пример 1.3.
Общий способ получения эфирных производных A-8(w,x)
Соединение A-7 (400 мг, 2 ммоль, 1 экв.) растворяли в ДМФА и добавляли Cs2CO3 (775 мг, 2,38 ммоль, 1,2 экв.). Бензилбромид (270 мкл, 2,18 ммоль, 1,1 экв.) добавляли по каплям. Реакцию проводили при комнатной температуре в течение 30 мин. Затем, смесь разбавляли AcOEt, промывали водой (3×) и насыщенным раствором соли (1×), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Оставшийся сырой материал очищали на хроматографической колонке с AcOEt/гексан 2/8 (об./об.) как системой растворителей. Полученное соединение A-8u (500 мг, 1,71 ммоль, 1 экв.) смешивали вместе с Pd2(dba)3 (31 мг, 0,03 ммоль, 0,02 экв.), BINAP (42 мг, 0,07 ммоль, 0,04 экв.) и трет-BuOK (268 мг, 2,4 ммоль, 1,4 экв.). Смесь суспендировали в толуоле (10 мл), и к суспензии добавляли 1-Boc-3-гидроксипирролидин (382 мг, 2,00 ммоль, 1,2 экв.). Реакционную смесь подвергали воздействию микроволнового излучения при 115°C в течение 1 ч. Образовавшуюся смесь концентрировали и очищали на силикагеле, используя AcOEt/гексан 3/7 (об./об.) как систему растворителей. Соединение A-8w (620 мг, 1,40 ммоль, 1 экв.) суспендировали в ДМСО, и трет-BuOK (1,25 г, 11,2 ммоль, 8 экв.) добавляли в виде твердого вещества. Колбу помещали на масляную баню, и в смесь пропускали воздух. Реакцию осуществляли при 70°C в течение 30 мин с получением эфирного производного с удаленной защитной группой A-9x. Далее, смесь разбавляли водой и экстрагировали AcOEt (3×40 мл). После сушки над MgSO4, экстракт концентрировали и очищали на силикагеле с AcOEt/гексан 4/6 (об./об.) как системой растворителей.
1-бензил-4-хлор-1H-пирроло[3,2-c]хинолин (A-8u)

Белое пенистое вещество, выход 80%, C18H13ClN2, молекулярная масса 292,76, моноизотопная масса 292,08, [M+H]+ 293,20.
трет-бутил-3-((1-бензил-1H-пирроло[3,2-c]хинолин-4-ил)окси)пирролидин-1-карбоксилат (A-8w)

Белое пенистое вещество, выход 91%, C27H29N3O3, молекулярная масса 443,54, моноизотопная масса 443,22, [M+H]+ 444,1.
трет-бутил-3-((1H-пирроло[3,2-c]хинолин-4-ил)окси)пирролидин-1-карбоксилат (A-9x)

Белое пенистое вещество, выход 90%, C20H23N3O3, молекулярная масса 353,41, моноизотопная масса 353,17, [M+H]+ 354,2.
Пример 1.4.
Общий способ получения пирроло[3,2-c]хинолиновых производных общей структуры A-9
Соединение A-8 (0,28 ммоль, 1 экв.) растворяли в DCM (5 мл). Смесь помещали на баню со льдом, и добавляли порциями сульфонилхлорид или арилацилхлорид или арилалкилгалоид (0,50 ммоль, 1,8 экв.). Реакцию проводили в присутствии сильного основания, выбранного из трет-бутилата калия, гидрида натрия, карбоната цезия или BTPP, и в течение 3 ч. Затем, смесь упаривали, и оставшийся желтый сырой материал очищали на силикагеле. Все Boc-защищенные арилсульфонамидные, ариламидные и арилалкильные производные 1H-пирроло[3,2-c]хинолинов общей структуры A-9 были охарактеризованы методами ЖХ-МС и 1H ЯМР (данные представлены для характерных соединений 5', 21', 27', 29', 43', 46', 48'). Соединения в дальнейшем были подвергнуты обработке с целью удаления защиты при использовании 4N раствора HCl в диоксане с получением конечных арилсульфонамидных производных амин/эфир-замещенных пирролохинолинов A-9.
Выход 60%, C21H22N4O2S, мол. масса 394,49, моноизотопная масса 394,15, [M+H]+ 395,0
Выход, 62%, C20H17ClN4O2S, мол. масса 412,89, моноизотопная масса 412,08, [M+H]+ 413,1
Выход 64%, C24H20N4O2S, мол. масса 428,51, моноизотопная масса 428,13, [M+H]+ 429,1
Выход, 80%, C21H20N4O2S, мол. масса 392,47, моноизотопная масса 392,13, [M+H]+ 393,1
Выход 90%, C21H19ClN4O2S, мол. масса 426,92, моноизотопная масса 426,09, [M+H]+ 427,3
Выход 90%, C26H27ClN4O4S, мол. масса 527,03, моноизотопная масса 526,14, [M+H]+ 527,22.
Выход 92%, Т.пл. 211-21°C, C21H19ClN4O2S, мол. масса 426,92, моноизотопная масса 426,09, [M+H]+ 427,2
Выход 91%, 221-223, C21H19ClN4O2S, мол. масса 426,92, моноизотопная масса 426,09, [M+H]+ 427,2
Выход 89%, C21H19FN4O2S, мол. масса 410,46, моноизотопная масса 410,12 [M+H]+ 411,2
Выход 85%, C21H19FN4O2S, мол. масса 410,46, моноизотопная масса 410,12 [M+H]+ 411,2
Выход 90%, C21H19FN4O2S, мол. масса 410,46, моноизотопная масса 410,12 [M+H]+ 411,2
Выход 88%, C21H19FN4O2S, мол. масса 410,46, моноизотопная масса 410,12, [M+H]+ 411,3
Выход 79%, C21H18F2N4O2S, мол. масса 428,46, моноизотопная масса 428,11, [M+H]+ 429,0
Выход 95%, C22H22N4O3S, мол. масса 422,50, моноизотопная масса 422,14, [M+H]+ 423,2
Выход 90%, C22H19F3N4O2S, мол. масса 460,47, моноизотопная масса 460,12, [M+H]+ 461,3
Выход 91%, C22H19F3N4O2S, мол. масса 460,47, моноизотопная масса 460,12, [M+H]+ 461,3
Выход 88%, C22H19F3N4O2S, мол. масса 460,47, моноизотопная масса 460,12, [M+H]+ 461,3
и выделено в виде HCl-соли.
Выход 78%, C25H28N4O2S, мол. масса 448,58, моноизотопная масса 448,19, [M+H]+ 449,3
Выход 66%, C21H21N5O2S, мол. масса 407,49, моноизотопная масса 407,14, [M+H]+ 408,2
Выход 67%, C21H21N5O2S, мол. масса 407,49, моноизотопная масса 407,14, [M+H]+ 408,2
Выход 66%, C21H21N5O2S, мол. масса 407,49, моноизотопная масса 407,14, [M+H]+ 408,2
Выход 88%, C25H22N4O2S, мол. масса 442,53, моноизотопная масса 442,15, [M+H]+ 443,3
Выход 88%, C30H30N4O4S, мол. масса 542,65, моноизотопная масса 542,20, [M+H]+ 543,27
Выход 86%, C24H21N5O2S, мол. масса 443,52, моноизотопная масса 443,14, [M+H]+ 444,2
Выход 65%, C24H22N4O2S2, мол. масса 462,59, моноизотопная масса 462,12, [M+H]+ 463,0
Выход 82%, C21H19Cl2FN4O2S, мол. масса 481,37, моноизотопная масса 480,06, [M+H]+ 481,1
Выход 80%, C21H18Cl2N4O2S, мол. масса 461,36, моноизотопная масса 460,05, [M+H]+ 461,1
Выход 68%, C22H22N4O2S, мол. масса 406,50, моноизотопная масса 406,15, [M+H]+=407,2
Выход 70%, C21H20N4O2S, мол. масса 392,47, моноизотопная масса 392,13, [M+H]+=393,5
Выход 70%, C26H28N4O4S, мол. масса 492,59, моноизотопная масса 492,18, [M+H]+=493,30
Выход 60%, C21H19BrN4O2S, мол. масса 471,37, моноизотопная масса 470,04, [M+H]+ 471,2
Выход 95%, Т.пл. 161-163°C, C21H19ClN4O2S, мол. масса 426,92, моноизотопная масса 426,09, [M+H]+ 427,2
Выход 95%, C26H27ClN4O4S, мол. масса 527,03, моноизотопная масса 526,14, [M+H]+ 427,46
Выход 93%, Т.пл. 192-193°C, C21H19FN4O2S, мол. масса 410,46, моноизотопная масса 410,12, [M+H]+ 411,3
Выход 95%, C21H19FN4O2S, мол. масса 410,46, моноизотопная масса 410,12, [M+H]+ 411,3
и выделено в виде HCl-соли.
Выход 81%, C21H18F2N4O2S, мол. масса 428,46, моноизотопная масса 428,11, [M+H]+ 429,2
и выделено в виде HCl-соли.
Выход 83%, C21H18F2N4O2S, мол. масса 428,46, моноизотопная масса 428,11, [M+H]+ 429,4
и выделено в виде HCl-соли.
Выход 80%, C21H18Cl2N4O2S, мол. масса 461,36, моноизотопная масса 460,05, [M+H]+ 461,2
Выход 92%, C22H19F3N4O2С, мол. масса 460,47, моноизотопная масса 460,12, [M+H]+ 461,3
Выход 89%, C22H19F3N4O2С, мол. масса 460,47, моноизотопная масса 460,12, [M+H]+ 461,3
и выделено в виде HCl-соли.
Выход 91%, C22H22N4O3С, мол. масса 422,50, моноизотопная масса 422,14, [M+H]+ 423,3
Выход 89%, C22H19N5O2С, мол. масса 417,48, моноизотопная масса 417,13. [M+H]+ 418,2
Выход 80%, C22H23ClN4O2С, мол. масса 406,50, моноизотопная масса 406,15, [M+H]+ 407,1
Выход 79%, C24H26N4O2С, мол. масса 434,55, моноизотопная масса 434,18, [M+H]+ 435,3
Выход 70%, C25H28N4O2С, мол. масса 448,58, моноизотопная масса 448,19, [M+H]+ 449,3
Выход 68%, C21H21N5O2С, мол. масса 407,49, моноизотопная масса 407,14, [M+H]+ 408,2
Выход 86%, Т.пл. 158-160°C, C25H22N4O2С, мол. масса 442,53, моноизотопная масса 442,15, [M+H]+ 443,3
Выход 86%, C30H30N4O4С, мол. масса 542,65, моноизотопная масса 542,20, [M+H]+ 543,34
Выход 88%, C25H23ClN4O2С, мол. масса 442,53, моноизотопная масса 442,15, [M+H]+ 443,1
Выход 85%, C24H21N5O2С, мол. масса 443,53, моноизотопная масса 443,14, [M+H]+ 444,2
Выход 65%, C19H17ClN4O2S2, мол. масса 432,95, моноизотопная масса 432,05, [M+H]+ 433,2
Выход 65%, C24H25ClN4O4S2, мол. масса 533,06, моноизотопная масса 532,10, [M+H]+ 533,2.
Выход 68%, C24H22N4O2S2, мол. масса 462,59, моноизотопная масса 462,12, [M+H]+ 463,9
Выход 63%, C24H21ClN4O2S2, мол. масса 497.03, моноизотопная масса 496,08, [M+H]+ 497,2
Выход 63% C29H29ClN4O4S2, мол. масса 597,15, моноизотопная масса 596,13, [M+H]+ 597,19, 599,42, 600,38
Выход 90%, C21H20Cl2N4O2С, мол. масса 376,88, моноизотопная масса 376,15, [M+H]+ 377,2
Выход 91%, C22H21FN4, мол. масса 360,43, моноизотопная масса 360,18, [M+H]+ 361,2
Выход 87%, C22H20Cl2N4O, мол. масса 427,33, моноизотопная масса 426,10, [M+H] 427,1
Выход 86%, C23H22N4O, мол. масса 370,45, моноизотопная масса 370,18, [M+H]+ 371,2
Выход 85%, C22H22N4O2С, мол. масса 406,50, моноизотопная масса 406,15, [M+H]+ 407,2
Выход 91%, C22H21ClN4O2С, мол. масса 440,95, моноизотопная масса 440,11, [M+H]+ 441,2
Выход 88%, C22H21FN4O2С, мол. масса 424,49, моноизотопная масса 424,14, [M+H]+ 425,3
Выход 81%, C22H21FN4O2С, мол. масса 424,49, моноизотопная масса 424,14, [M+H]+ 425,1
Выход 65%, C22H23N5O2S, мол. масса 421,52 моноизотопная масса 421,16, [M+H]+ 422,2
Выход 89%, C26H24N4O2S, мол. масса 456,56, моноизотопная масса 456,16, [M+H]+ 457,2.
Выход 72%, C22H22N4O2S, мол. масса 457,55, моноизотопная масса 457,16, [M+H]+ 458,4
Выход 93%, C28H26N4O2S, мол. масса 482,60, моноизотопная масса 482,18, [M+H]+ 483,4
Выход 81%, C26H23ClN4O2S2, мол. масса 523,07, моноизотопная масса 522,10, [M+H]+ 523,4
Выход 88%, C31H27N5O2S, мол. масса 533,64, моноизотопная масса 533,19, [M+H]+ 534,5
Выход 70%, C24H25N5O4S, мол. масса 479,55, моноизотопная масса 479,16, [M+H]+ 480,2
Выход 84%, C22H18F3N5O4S, мол. масса 505,47, моноизотопная масса 505,10, [M+H]+ 506,1
Выход 63%, C21H19Cl2N5O2S, мол. масса 476,38, моноизотопная масса 475,06, [M+H]+ 476,1
Выход 72%, C23H21N5O2S, мол. масса 431,14, моноизотопная масса 431,51, [M+H]+ 432,2
1-нафталинсульфонилхлорида, и выделено в виде HCl-соли.
Выход 88%, C26H22ClN5O2S, мол. масса 504,00, моноизотопная масса 503,12, [M+H]+ 504,1
Выход 86%, C23H21F3N4O3S, мол. масса 490,50, моноизотопная масса 490,13, [M+H]+ 491,1
Выход 91%, C22H21FN4O3S, мол. масса 440,49, моноизотопная масса 440,13, [M+H]+ 441,1
3-хлорбензолсульфонилхлорида, и выделено в виде HCl-соли.
Выход 93%, C21H18Cl2N4O2S, мол. масса 461,36, моноизотопная масса 460,05, [M+H]+ 461,1
Выход 88%, C25H21ClN4O2S, мол. масса 476,98, моноизотопная масса: 476,11, [M+H]+ 477,1
Выход 77%, C22H21FN4O2S, мол. масса 424,49, моноизотопная масса: 424,14, [M+H]+ 425,1
Выход 82%, C21H18ClFN4O2S, мол. масса 444,91, моноизотопная масса: 444,08, [M+H]+ 453,2
Выход 89%, C22H20F2N4O2S, мол. масса 442,48, моноизотопная масса: 442,13, [M+H]+ 443,1
Выход 91%, C22H21ClN4O2S, мол. масса 440,95, моноизотопная масса: 440,11, [M+H]+ 441,1
Выход 94%, C22H20ClN3O2S, мол. масса 425,93, моноизотопная масса: 425,10, [M+H]+ 426,0
Выход 95%, C25H22N4O2S, мол. масса 442,53, моноизотопная масса: 442,15, [M+H]+ 443,1
Выход 96%, C21H18ClN3O3S, мол. масса: 427,90, моноизотопная масса 427,08, [M+H]+ 428,0
Выход 89%, C24H20N4O3S, мол. масса 444,51, моноизотопная масса: 444,13, [M+H]+ 445,2
Выход 79%, C22H21N3O3S, мол. масса 407,49, моноизотопная масса: 407,13, [M+H]+ 408,1
Выход 82%, C21H17F2N3O3S, мол. масса 429,44, моноизотопная масса: 429,10, [M+H]+ 430,1
Пример 2a - Оценка in vitro
Радиолигандный анализ применяли для определения сродства и профиля селективности синтезированных соединений по отношению к клонированным рецепторам серотонина: 5-HT1A, 5-HT2A, 5-HT6, 5-HT7, и рецепторам допамина D2L. Этот анализ осуществляли на основе вытеснения соответствующих радиолигандов из комплексов с клонированными рецепторами человека, которые все стабильно экспрессированы в клетках HEK293: [3H]-8-OH-DPAT для 5-HT1AR, [3H]-кетансерин для 5-HT2AR и [3H]-LSD для 5-HT6R, [3H]-5-CT для 5-HT7R и [3H]-раклоприд для D2R.
Культура клеток и получение клеточных мембран
Клетки HEK293 со стабильной экспрессией рецепторов серотонина человека 5-HT1AR, 5-HT2A, 5-HT6, 5-HT7bR или рецепторов допамина D2LR (все получали с использованием липофектамина 2000) поддерживали при 37°C в увлажненной атмосфере с 5% CO2 и выращивали в модифицированной по способу Дульбекко среде Игла, содержащей 10% диализованной фетальной телячьей сыворотки и 500 мг/мл сульфата G418. Для получения мембран, клетки пассировали в чашках диаметром 10 см, выращивали до 90% конфлюенции, промывали дважды предварительно нагретым до 37°С забуференным фосфатом физиологическим раствором (PBS) и осаждали центрифугированием (200 g) в PBS, содержащем 0,1 мМ EDTA и 1 мМ дитиотреитола. До момента использования препаратов мембран, осадки хранили при -80°С.
Радиолигандный анализ связывания
Клеточную массу размораживали и гомогенизировали в 20 объемах буфера для анализа, используя гомогенизатор тканей Ultra Turrax, и центрифугировали дважды при 35 000 g в течение 20 мин при 4°C, с инкубацией в течение 15 мин при 37°С в промежуток между центрифугированиями. Состав буферов для анализа был следующий: для 5-HT1AR: 50 мМ трис-HCl, 0,1 мМ EDTA, 4 мМ MgCl2, 10 мМ паргилина и 0,1% аскорбата; для 5-HT2AR: 50 мМ трис-HCl, 0,1 мМ EDTA, 4 мМ MgCl2 и 0,1% аскорбата; для 5-HT6R: 50 мМ трис-HCl, 0,5 мМ EDTA и 4 мМ MgCl2, для 5-HT7bR: 50 мМ трис-HCl, 4 мМ MgCl2, 10 мМ паргилина и 0,1% аскорбата; для допамина D2LR: 50 мМ трис-HCl, 1 мМ EDTA, 4 мМ MgCl2, 120 мМ NaCl, 5 мМ KCl, 1,5 мМ CaCl2 и 0,1% аскорбата.
Все анализируемые образцы инкубировали в полном объеме 200 мкл в 96-луночном титрационном микропланшете в течение 1 ч при 37°С, за исключением образцов для 5-HT1AR и 5-HT2AR, которые инкубировали при комнатной температуре в течение 1 ч и 1,5 ч, соответственно. Процесс уравновешивания заканчивался при быстром фильтровании через планшеты Unifilter с 96-луночным сборщиком клеток, и радиоактивность, остающуюся на фильтрах, количественно оценивали на аппарате для считывания планшетов Microbeta.
Для оценки силы вытеснения, анализируемые образцы содержали в качестве радиолигандов: 1,5 нМ [3H]-8-OH-DPAT (135,2 Ки/ммоль) для 5-HT1AR; 2 нМ [3H]-кетансерина (53,4 Ки/ммоль) для 5-HT2AR; 2 нМ [3H]-LSD (83,6 Ки/ммоль) для 5-HT6R; 0,6 нМ [3H]-5-CT (39,2 Ки/ммоль) для 5-HT7R или 2,5 нМ [3H]-раклоприда (76,0 Ки/ммоль).
Неспецифическое связывание определяли с 10 мкМ 5-HT в экспериментах по связыванию 5-HT1AR и 5-HT7R, в то время как 10 мкМ хлорпромазина, 10 мкМ метиотепина или 1 мкМ (+)бутакламола использовали в анализах связывания 5-HT2AR, 5-HT6R и D2L, соответственно. Каждое соединение испытывали в трех повторах при 7-8 концентрациях (10-11-10-4 М). Константы ингибирования (Ki) рассчитывали, исходя из уравнения Cheng-Prusoff (Cheng et al., 1973).
Результаты выражали как средние значения, по меньшей мере, трех отдельных экспериментов.
Процедуры получения мембран и общего анализа приспосабливали к 96-микролуночному формату, основываясь на описанных протоколах (Bojarski et al., 1993; Paluchowska et al., 2007; Zajdel et al., 2012a; Zajdel et al., 2012b).
Данные связывания членов библиотеки для рецепторов 5-HT1A, 5-HT6, 5-HT7 и D2
b NT - не тестировали
c вытеснение в % при 10-6 М
Данные связывания членов библиотеки для рецепторов 5-HT1A, 5-HT6, 5-HT7 и D2
b NT -не тестировали
c вытеснение в % при 10-6 М
Пример 2b - Оценка in vitro
Радиолигандный анализ осуществляли с целью определения сродства выбранных соединений по отношению к α1-рецепторам (Greengrass et al., 1979) коры головного мозга крысы, H1-рецепторам (Smit et al., 1996) и 5-HT2C-рецепторам (Stam et al.), экспрессированным в клетках НЕK-293, и M1-рецепторам (Dorje et al., 1991) и D3-рецепторам (Mackenzie et al., 1994), экспрессированным в клетках CHO, 1994). Этот метод сопровождается вытеснением соответствующих радиолигандов: [3H]празозина для α1R, [3H]пириламина для H1R, [3H]пирензепина для M1R, [3H]мезулергина для 5-HT2CR и [3H]метилспиперона для D3R.
Неспецифическое связывание определяли с 0,5 мкМ празозина в экспериментах связывания с α1R и 1 мкМ пириламина в анализах связывания с H1R. Растворы, содержащие 1 мкМ атропина, 10 мкМ RS 102221 и 10 мкМ (+)бутакламола, использовали в экспериментах с M1R, 5-HT2CR и D3R, соответственно. Каждое соединение испытывали в двух повторах при концентрации 10-6 М. Результаты выражали как среднее значение из двух отдельных экспериментов (таблица 3).
Данные связывания членов библиотеки для рецепторов α1, H1, M1, 5-HT2C и D3.
Пример 3 - Функциональная активность (агонизм/антагонизм), изученная на 5-HT6-рецепторах in vitro
Образец для анализа CHO-человеческий рецептор-5HT6-экворин приобретали в компании Euroscreen, Brussels (Euroscreen, технический паспорт, человеческий рекомбинантный рецептор 5-HT6-A1 серотонина, клон ДНК и рекомбинантная клеточная линия CHO AequoScreenTM, номер каталога: ES-316-A, февраль 2003). Клетки человеческий рецептор-5HT6-экворин экспрессировали митохондриально-направленный апоэкворин. Клетки должны быть нагружены коэлентеразином, чтобы реконструировать активный экворин. После связывания агонистов с рецептором 5-HT6, концентрация внутриклеточного кальция повышается, и связывание кальция с апоэкворин/коэлентразином приводит к реакции окисления коэлентразина, в результате которой образуются продукт апоэкворина, коэлентерамид, CO2 и пучок света (λмакс. 469 нм). Полученный люминесцентный ответ зависит от концентрации агониста. Уровень люминесценции измеряли, используя прибор MicroBeta Jet (Perkin Elmer). Агонистические эффекты соединений выражали в виде pEC50. Антагонистические эффекты соединений определяли как степень ингибирования индуцированной 10-6 M α-метилсеротонином люминесценции, и pA2 рассчитывали согласно уравнению Cheng-Preushoff. Соединения испытывали в двух независимых экспериментах с двумя повторами проб.
Агонистический и антагонистический эффект выбранных членов библиотеки
Внутренняя активность для рецепторов 5-HT6 выбранного члена библиотеки.
Пример 4 - Состав, применяемый в экспериментах на животных in vivo
Для внутрибрюшинного (i.p.) введения: к желаемому количеству твердого соединения в лабораторном стеклянном стакане добавляли требуемое количество стерилизованной воды для инъекции, и раствор перемешивали стеклянной палочкой до полного растворения соединения.
Пример 5 - Тест принудительного плавания (FST) на крысах линии Wistar
Животные. В тесте использовали крыс самцов линии Wistar с массой тела 220-250 г. Животных помещали в клетки из поликарбонатного материала Makrolon типа 3 (размеры 26,5×15×42 см) по группам из четырех. Всех животных содержали в экологически контролируемых помещениях (температура окружающей среды 22±2°C; относительная влажность 50-60%; цикл 12:12 свет:темнота, включение света в 8:00). Животных оставляли приспосабливаться к условиям окружающей среды в течение одной недели до начала экспериментов. Стандартное лабораторное питание (Ssniff M-Z) и отфильтрованная вода были в свободном доступе. Эксперименты осуществляли в световой фазе между 09,00 и 14,00 часами. За 1 ч до начала эксперимента, крыс перемещали в экспериментальную комнату для акклиматизации.
Аппаратура и процедура. Эксперимент осуществляли согласно методу Porsolt et al. (1978). В первый день эксперимента, животных осторожно по-отдельности помещали в цилиндры из оргстекла (высота 40 см, диаметр 18 см), наполненные водой на 15 см, температуру которой поддерживали при 25°C в течение 15 мин. После удаления из воды, крыс помещали сушиться в коробку из оргстекла в течение 30 мин под лампой 60 Вт. На следующий день крыс вновь помещали в цилиндр, и общую продолжительность состояния неподвижности записывали на протяжении 5-минутного периода испытания. Свежую воду использовали для каждого животного.
План эксперимента. Соединения вводили IP, за 60 минут до испытания.
Лекарственные средства. Испытуемые соединения растворяли в дистиллированной воде. Все соединения вводили в объеме 2 мл/кг.
Пример 6 - Питьевой конфликтный тест (тест Фогеля) на крысах линии Wistar
Животные. В тесте использовали крыс самцов линии Wistar с массой тела 220-250 г. Животных помещали в клетки из поликарбонатного материала Makrolon типа 3 (размеры 26,5×15×42 см) по группам из четырех. Всех животных содержали в экологически контролируемых помещениях (температура окружающей среды 22±2°C; относительная влажность 50-60%; цикл 12:12 свет:темнота, включение света в 8:00). Животных оставляли приспосабливаться к условиям окружающей среды в течение одной недели до начала экспериментов. Стандартное лабораторное питание (Ssniff M-Z) и отфильтрованная вода были в свободном доступе. Эксперименты осуществляли в световой фазе между 09,00 и 14,00 часами. За 1 ч до начала эксперимента, крыс перемещали в экспериментальную комнату для акклиматизации.
Аппаратура и процедура. Модификацию метода Фогеля et al. (1971) применяли, используя систему мониторного наблюдения состояния тревожности “тест Фогеля”, производимую TSE Systems. Она состояла из клеток из поликарбонатного материала (размеры 26,5×15×42 см), снабженных решетчатым настилом из нержавеющих прутьев и бутылками для питья, содержащими водопроводную воду. Экспериментальные камеры были соединены с программным обеспечением ПК посредством управляющего системного блока и генератора электрического тока. В первый день эксперимента, крысы приспосабливались к экспериментальным камерам в течение 10 мин. После периода адаптации, животных лишали воды в течение 24 ч и затем помещали в экспериментальные камеры в течение другого 10-минутного периода адаптации, в течение которого они имели свободный доступ к бутылкам для питья. После этого, они были допущены к свободному режиму питья в течение 30 мин в их клетках. После дополнительного 24-часового периода лишения воды, крыс помещали вновь в экспериментальные камеры. Запись данных начиналась сразу после первого облизывания, и через каждые 20 облизываний крыс подвергали электрическому шоку (0,5 мА, продолжительность 1 с). Импульсы испускались через горлышко бутылок для питья. Если крыса пила в то время, когда импульс испускался, она подвергалась шоку. Число облизываний и количество шоков, получаемых в течение 5-минутного экспериментального периода, записывали автоматически.
План эксперимента. Соединения вводили IP, за 60 минут до испытания.
Лекарственные средства. Экспериментальные соединения растворяли в дистиллированной воде. Все соединения вводили в объеме 2 мл/кг.
Пример 7 - Тест на распознавание новых объектов (NOR) на крысах линии Sprague-Dawley
Животные. Самцов крыс линии Sprague-Dawley (Charles River, Germany) массой тела ~250 г после доставки помещали в стандартные лабораторные клетки, в стандартных для колоний условиях A/C контролирования кондиционирования воздуха: комнатной температуре 21±2°C, влажности (40-50%), 12-часовом цикле свет/темнота включение света при: 06:00) с неограниченным доступом к пище и воде. Крыс оставляли приспосабливаться в течение, по меньшей мере, 7 дней до начала экспериментальной процедуры. В течение этой недели, животных обрабатывали, по меньшей мере, 3 раза. Поведенческое тестирование осуществляли в течение световой фазы цикла свет/темнота. По меньшей мере, за 1 ч до начала эксперимента, крыс переносили в экспериментальную комнату для акклиматизации.
Аппаратура и процедура. Крысы были протестированы в устройстве с тусклым освещением (25 лк) “открытое поле”, сделанном из пластика тускло-серого цвета (66×56×30 см). После каждого измерения, настил очищали и высушивали.
Процедура, продолжавшаяся в течение 2 дней, состояла из привыкания к арене испытаний (без каких-либо объектов) в течение 5 мин. Период испытания, включающий в себя два испытания, разделенные интервалом между испытаниями (ITI) 1 ч, осуществляли на следующий день.
Во время первого испытания (ознакомление, T1) были представлены два одинаковых объекта (A1 и A2) в противоположных углах открытого поля, примерно 10 см от стен. Во время второго испытания (распознавание, T2) один из А-объектов заменяли на новый объект, так что животным представляли А-знакомый и В-новый объекты. Оба испытания продолжались в течение 3 мин, и животных возвращали в их клетки после T1.
Используемыми объектами были стеклянные стаканы, наполненные гравием, и пластиковые бутылки, наполненные песком. Высота объектов была сопоставимой (~12 см), и объекты были достаточно тяжелыми, чтобы не быть переставленными животными.
Последовательность представлений и расположение объектов были рандомизированно разделены по отношению к каждой крысе. По определению, животные исследовали объекты при просмотре, при облизывании, обнюхивании или касании объекта во время обнюхивания, но не тогда, когда прислонялись к объекту, стояли или сидели на объекте.
Любую крысу, изучающую два объекта в течение менее чем 5 с в пределах 3 мин T1 или T2, исключали из исследования. Время исследования объектов и пройденное расстояние измеряли, используя видеосистему слежения Any-maze®. На основании времени исследования (E) двух объектов в течение T2, индекс различения (DI) рассчитывали согласно формуле:
DI=(EB-EA)/(EA+AB).
План эксперимента. Фенциклидин (PCP), применяемый для ослабления научения, вводили в дозе 5 мг/кг (IP) за 45 мин до фазы ознакомления (T1). Соединения вводили IP, за 1 час и 15 мин до T1.
Лекарственные средства. Гидрохлорид фенциклидина (Sigma-Aldrich) и испытуемые соединения растворяли в дистиллированной воде. Все соединения вводили в объеме 1 мл/кг.
Результаты оценки поведения для выбранных соединений.
(потенциальные антидепрессивные свойства)
Результаты поведенческих тестов, т.е. тест принудительного плавания и питьевой конфликтный тесты на крысах, описанные в примерах 8 и 9, подтвердили потенциальную активность соединений согласно изобретению в терапии депрессии и/или тревожности. В тесте принудительного плавания, референтный антидепрессант имипрамин проявлял эффективность после введения дозы 15 мг/кг, повышая время лазания. Препарат SB-271046 (селективный антагонист рецепторов 5-HT6) проявлял свою активность, подобную действию антидепрессанта, в дозе 10 мг/кг. В питьевом конфликтном тесте (тест Фогеля) на крысах, все исследуемые соединения, а также SB-271046, проявляли активность при дозе ≤10 мг/кг, увеличивая число облизываний и количество получаемых шоков. При сравнении с диазепамом, используемым в качестве референтного анксиолитического лекарственного средства, соединения проявляли эффективность в дозах 5-10 мг/кг.
Результаты поведенческого NOR-теста на крысах, описанного в примере 10, подтвердили потенциальную прокогнитивную активность соединений в терапии психических расстройств, подобных шизофрении, аффективных расстройств и нейродегенеративных заболеваний. Эти данные свидетельствуют о том, что все четыре испытуемых соединения ослабляли когнитивные расстройства в дозах 1 и 3 мг/кг. Препарат SB-271046, используемый в качестве референтного соединения, проявлял эффективность против PCP-индуцированного нарушения также в дозе 1 мг/кг.
Цитируемая литература
Benakki, H.; Colacino, E.; André, C.; Guenoun, F.; Martinez, J.; Lamaty, F. Tetrahedron, 2008, 64, 5949-5955.
Bentley, J.C.; Bourson, A.; Boess, F.G.; Fone, K.C.; Marsden, C.A.; Petit, N.; Sleight, A.J. Br. J. Pharmacol. 1999, 126, 1537-1542.
Berge, S.M.; Bighley, L.D.; Monkhause, D.C. J. Pharm. Sci. 1977, 66, 1-19.
Boissier JR, Simon P, Aron C. Eur. J. Pharmacol. 1968, 4, 145-151.
Bojarski, A.J.; Cegła, M.T.; Charakchieva-Minol, S.; Mokrosz, M.J.; Maćkowiak, M.; Misztal, S.; Mokrosz, J.L. Pharmazie 1993, 48, 289-294.
Brown, T.H.; Ife, R.I.; Keeling, D.J.; Laing, S.M.; Leach, C.A., Parsons, M.E.; Price, C.A.; Reavill, D.R.; Wiggal, K.J. J. Med.Chem. 1990, 33, 527-533.
Cheng, Y.; Prusoff, W.H. Biochem Pharmacol. 1973, 22, 3099.
Cole, D.C.; Kelly, M.G.; Bravo, B.A.; Palmer, Y.L. US Patent 2003232843, 2003.
Dawson, L.A.; Nguyen, H.Q.; Li, P. Neuropsychopharmacology, 2001, 25, 662-668.
Dorje, F.; Wess, J.; Lambrecht, G.; Tacke, R.; Mutschler, E.; Brann, M.R. J. Pharmacol. Exp. Theor. 1991, 256, 727-733.
Dwyer, F.P.; Sargeson, A.M.; James, L.B. J. Am. Chem. Soc. 1964, 86, 590-592.
Gérard, C.; Martres, M.P.; Lefèvre, K.; Miquel, M.C.; Vergé, D.; Lanfumey, L.; Doucet, E.; Hamon, M.; el Mestikawy, S. Brain. Res. 1997, 746, 207-219.
Greengrass, P.; Bremmer, R. Eur. J. Pharmacol. 1979, 55, 323-326.
Hannon, J.; Hoyer, D. Behav. Brain Res. 2008, 195, 198-213.
Heal, D.J.; Smith, S.L.; Fisas, A.; Codony, X.; Buschmann, H. Pharmacol. Ther. 2008, 117, 207.
Heidempergher, F.; Pavarello, P.; Pillan, A.; Pinciroli, V.; Torre, A.D.; Speciale, C.; Marconi, M.; Cini, M.; Toma, S.; Greco, F.; Varasi, M. Il Farmaco, 1999, 54, 152-160.
Helissey, P.; Parrot-Lopez, H.; Renault, J.; Cross, S. Eur. J. Med. Chem. 1987, 22, 366-368.
Hirano, K.; Piers, T.M.; Searle, K.M.; Miller, N.D.; Rutter, R.; Chapman, P.F. Life Sci. 2009, 84, 558-562.
Hoyer, D.; Hannon, J. Pharmacol. Biochem. Beh., 2002, 71, 533-554.
King, M.W.; Sleight, A.J.; Wolley, M.L.; Topham, I.A.; Marsden, C.A.; Fone, K.C.F. Neuropharmacology, 2004, 47, 195-204.
Kohen, R.; Metclaf, M.A.; Khan, N.; Druck, T.; Huebner, K.; Lachowicz, J.E.; Meltzer, H.Y.; Sibley, D.R.; Roth, B.L.; Hamblin, M.W.J. Neurochem. 1996, 66, 47.
López-Rodriguez, M.L.; Benhamú, B.; de la Fuente, T.; Sanz, A.; Pardo, L.; Campillo, M.; J. Med. Chem. 2005, 48, 4216.
MacKenzie, R.G.; VanLeeuwen, D.; Pugsley, T.A.; Shih, Y-H.; Demaltos, S.; Tang, L.; Todd, R.D.; O'Malley, K.L. Eur. J. Pharmacol.1994, 266, 79-85.
Martin, C.M.; Dyson, P.J.; Ingham, S.L.; Johnson, B.F.G.; Blake, A. J. Chem. Soc. Dalton Trans. 1995, 2741-2748.
Mitchell, E.; Neumaier, J.F. Pharmacol. Ther. 2005, 108, 320.
Monsma, F.J., Jr.; Shen, Y.; Ward, R.P.; Hamblin, M.W.; Simbley, D.R. Mol. Pharmacol. 1993, 43, 320-327.
Paluchowska, M.H.; Bugno, R.; Tatarczyńska, E.; Nikiforuk, A.; Lenda, T.; Chojnacka-Wójcik, E. Bioorg. Med. Chem. 2007, 15, 7116.
Porsolt, R. D.; Bertin, A.; Jelfre, M. Arch. Int. Pharmacodyn. Ther. 1977, 229, 327-336.
Pouzet, B.; Didriksen, M.; Arnt, J. Pharmacol. Biochem. Behav. 2002, 71, 634-643.
Pullagurla, M.R.; Westkaemper, R.B.; Glennon, R.A. Bioorg. Med. Chem. Lett. 2004, 14, 4569.
Riemer, C.; Borroni, E.; Levet-Trafit, B.; Martin, J.R.; Poli, S.; Porter, R.H.; Bös, M. J. Med. Chem. 2003, 46, 1273-1276.
Rodefer, S.J.; Nguyen, T.N.; Karlsson, J.J.; Arnt, J. Neuropschopharmacology, 2008, 33, 2657-2666.
Rogers, D.C.; Hagan, J.J.; Psychopharmacology, 2001, 158, 114-119.
Ruat, M.; Traiffort, E.; Arrang, J.M.; Tardivel-Lacombe, J.; Diaz, J.; Leurs, R.; Schwartz, J.C. Biochem. Biophys. Res. Commun. 1993, 193, 268-276.
Schechter, L.E.; Smith, D.L.; Li, P.; Lin, Q.; Soc. Neurosci. Meet, 2004, 394, 11.
Schoeffter, P.; Waeber, C.; Naudyn-Schmied. Arch. Pharmacol. 1994, 350, 356-360.
Smit, M.J; Timmerman, H.; Hijzlelendoorn, J.C.; Fukui, H.; Leurs, R.; Brit. J. Pharmacol. 1996, 117, 1071-1080.
Stam, N.J.; Vanderheyden, P.; van Alebeek, C.; KloТ.пл., J.; de Boer, T.; van Delft, A.M.; Olijve, W. Eur. J. Pharmacol. 1994, 269, 339-348.
Upton, N.; Chuang, T.T.; Hunter, A.J.; Virley, D.J. Neurotherapeutics 2008, 5, 458.
Ward, R.P.; Hamblin, M.W.; Lachowicz, J.E.; Hoffman, B.J.; Sibley, B.R.; Dorsa, D.M. Neuroscience 1995, 64, 1105.
Wesołowska, A.; Nikiforuk, A. Behav. Pharmacol., 2007a, 18, 439-46.
Wesołowska, A.; Nikiforuk, A. Neuropharmacology, 2007b, 52, 1274-1283.
Wright, G.C.; Watson, E.J.; Ebetino, F.F.; Lougheed, G.; Stevenson, B.F.; Winterstein, A.; Bickerton, R.K.; Halliday, R.P.; Pals, D.T. J. Med. Chem. 1971, 14, 1060-1066.
Zajdel P.; Kurczab R; Grychowska K.; Satała G.; Pawłowski M.; Bojarski A.J., Eur. J. Med. Chem., 2012a, 56, 348-60.
Zajdel, P.; Marciniec, K.; Maślankiewicz, A.; Satała, G.; Duszyńska, B.; Bojarski, A. J.; Partyka, A.; Jastrzębska-Więsek, M.; Wróbel, D.; Wesołowska, A.; Pawłowski, M. Bioorg. Med. Chem., 2012b, 20, 1545-1556.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННОЕ ХИНОЛИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2384571C2 |
| ИНГИБИТОР ФОСФОДИЭСТЕРАЗЫ 5 ТИПА, ВЫСВОБОЖДАЮЩИЙ ОКСИД АЗОТА | 2019 |
|
RU2785776C2 |
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT РЕЦЕПТОРОВ | 2010 |
|
RU2567751C2 |
| 6-СУЛЬФАМОИЛХИНОЛИН-4-КАРБОНОВЫЕ КИСЛОТЫ, ИХ ПРОИЗВОДНЫЕ И КОМБИНАТОРНАЯ БИБЛИОТЕКА | 2003 |
|
RU2229475C1 |
| ИНГИБИТОРЫ БРОМДОМЕНА | 2012 |
|
RU2671571C1 |
| ПРОИЗВОДНЫЕ 2-ЗАМЕЩЕННЫХ ФЕНИЛ-5, 7-ДИГИДРОКАРБИЛ-3, 7-ДИГИДРОПИРРОЛО [2, 3-d] ПИРИМИДИН-4-ОНОВ, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2323220C2 |
| ТРИЦИКЛИЧЕСКИЕ ПИРРОЛО ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2012 |
|
RU2591191C2 |
| 3,5-ДИЗАМЕЩЕННОЕ АЛКИНИЛБЕНЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО СОЛЬ | 2013 |
|
RU2576384C1 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2020 |
|
RU2835082C2 |
| ИНДОЛЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT | 2007 |
|
RU2449990C2 |
Изобретение относится к области органической химии, а именно к производному пирролохинолина формулы (XIV) или к его стереоизомеру или фармакологически приемлемой соли или гидрату, где R1, R2 независимо представляют собой водород, алкокси(C1-C3) группу или независимо группу, выбранную из: циано, нитро, амино; T представляет собой CO, CH2, SO2; Ar представляет собой арил (6-членный), необязательно замещенный одним или двумя заместителями, выбранными из алкил(C1-C3) группы, алкил(C1-C3) группы, замещенной тремя атомами галогена, алкокси(C1-C3) группы, галогена, циано и амино; незамещенный биарил (10-членный); гетероарил (5-членный), содержащий 1 атом S и необязательно замещенный одним атомом галогена; гетероарил (9-10-членный), содержащий 1 гетероатом, выбранный из группы, состоящей из N и S, и необязательно замещенный одним или двумя заместителями, выбранными из алкил(C1-C3) группы и галогена; R3 представляет собой заместитель, выбранный из группы циклических или линейных, замещенных или незамещенных аминов, состоящей из структур (XV)-(XVIII), где A представляет собой NH, O, CH2, NR5; BR4 представляет собой NH, O; R5 представляет собой алкил(C1-C3) группу или бензил; R6 представляет собой алкил(C1-C3) группу; n выбирают из 0, 1, 2; m выбирают из 1, 2; l равно 1. Также изобретение относится к конкретным производным пирролохинолина, фармацевтической композиции на основе указанного соединения и его применению, промежуточному соединению формулы (XIX) и способу получения промежуточного соединения. Технический результат: получены новые производные пирролохинолина, полезные при лечении заболеваний, возникших в результате нарушения передачи сигнала через 5-HT6-рецепторы. 8 н. и 6 з.п. ф-лы, 6 табл., 7 пр.



1. Соединение общей формулы (XIV):

или его стереоизомер или фармакологически приемлемая соль или гидрат любого из указанных выше соединений, где:
- R1, R2 независимо представляют собой водород, алкокси(C1-C3) группу или независимо группу, выбранную из: циано, нитро, амино;
- T представляет собой CO, CH2, SO2;
- Ar представляет собой арил (6-членный), необязательно замещенный одним или двумя заместителями, выбранными из алкил(C1-C3) группы, алкил(C1-C3) группы, замещенной тремя атомами галогена, алкокси(C1-C3) группы, галогена, циано и амино; незамещенный биарил (10-членный); гетероарил (5-членный), содержащий 1 атом S и необязательно замещенный одним атомом галогена; гетероарил (9-10-членный), содержащий 1 гетероатом, выбранный из группы, состоящей из N и S, и необязательно замещенный одним или двумя заместителями, выбранными из алкил(C1-C3) группы и галогена;
- R3 представляет собой заместитель, выбранный из группы циклических или линейных, замещенных или незамещенных аминов, состоящей из структур (XV)-(XVIII):

где:
- A представляет собой NH, O, CH2, NR5;
- BR4 представляет собой NH, O;
- R5 представляет собой алкил(C1-C3) группу или бензил;
- R6 представляет собой алкил(C1-C3) группу;
- n выбирают из 0, 1, 2;
- m выбирают из 1, 2;
- l равно 1.
2. Соединение по п. 1 общей формулы (XIV) или стереоизомер или фармакологически приемлемая соль или гидрат любого из указанных выше соединений, где:
- R1, R2 независимо представляют собой водород или независимо выбраны из: циано, нитро, амино, метоксила;
- T представляет собой CO, CH2, SO2;
- Ar представляет собой арил (6-членный), необязательно замещенный одним или двумя заместителями, выбранными из алкил(C1-C3) группы, алкил(C1-C3) группы, замещенной тремя атомами галогена, метокси, галогена, циано и амино; незамещенный биарил (10-членный); гетероарил (9-10-членный), содержащий 1 гетероатом, выбранный из группы, состоящей из N и S, необязательно замещенный одним или двумя заместителями, выбранными из алкил(C1-C3) группы и галогена;
- R3 представляет собой заместитель, выбранный из группы циклических или линейных, замещенных или незамещенных аминов, состоящих из структур XV-XVIII, где A, BR4, R5, R6, n, m, l имеют значения, указанные выше.
3. Соединение по п. 1 или 2 общей формулы (XIV), выбранное из следующих соединений формул:
N1,N1-диметил-N2-(1-(фенилсульфонил)-1H-пирроло[3,2-c]хинолин-4-ил)этан-1,2-диамина
1-((3-хлорфенил)сульфонил)-N-(азетидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-(нафталин-1-илсульфонил)-N-(азетидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-(фенилсульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((3-хлорфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(S)-1-((3-хлорфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(R)-1-((3-хлорфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((3-фторфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(S)-1-((3-фторфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(R)-1-((3-фторфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((4-фторфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((2,5-дифторфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((3-метоксифенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((3-(трифторметил)фенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(S)-1-((3-(трифторметил)фенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(R)-1-((3-(трифторметил)фенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((4-аминофенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(S)-1-((4-аминофенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(R)-1-((4-аминофенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-(нафталин-1-илсульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-(хинолин-8-илсульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
N-метил-1-(1-(фенилсульфонил)-1H-пирроло[3,2-c]хинолин-4-ил)пирролидин-3-амина
1-(фенилсульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((2-бромфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-хлорфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-фторфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((4-фторфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((2,5-дифторфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3,4-дифторфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3,4-дихлорфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-(трифторметил)фенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((4-(трифторметил)фенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-метоксифенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-цианофенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-метилфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((4-изопропилфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(4-(аминофенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(нафталин-1-илсульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(нафталин-2-илсульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(хинолин-8-илсульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((5-хлортиофен-2-ил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((5-метилбензо[b]тиофен-2-ил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((5-хлор-3-метилбензо[b]тиофен-2-ил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(3-хлорбензил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(3-фторбензил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
(3-хлорфенил)-(4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолин-1-ил)метанона
(3-метилфенил)-(4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолин-1-ил)метанона
1-(фенилсульфонил)-4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-хлорфенил)сульфонил)-4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-фторфенил)сульфонил)-4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((4-фторфенил)сульфонил)-4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((4-аминофенил)сульфонил)-4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(нафталин-1-илсульфонил)-4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(фенилсульфонил)-4-(4-бензилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((5-хлортиофен-2-ил)сульфонил)-4-(4-бензилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(хинолин-8-илсульфонил)-4-(4-бензилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-нитро-1-((4-изопропилфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-нитро-1-((3-(трифторметил)фенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-амино-1-((3,4-дихлорфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-карбонитрил-1-(3-метилфенил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-карбонитрил-1-(нафталин-1-илсульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-метокси-1-((3-(трифторметил)фенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-метокси-1-((3-фторфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3,4-дифторфенил)сульфонил)-4-(1,4-диазепан-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-хлорфенил)сульфонил)-4-(1,4-диазепан-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-хлорфенил)сульфонил)-4-(пиперидин-1-ил)-1H-пирроло[3,2-c]хинолина
1-(хинолин-8-илсульфонил)-4-(пиперидин-1-ил)-1H-пирроло[3,2-c]хинолина
1-((3-хлорфенил)сульфонил)-4-(морфолин-4-ил)-1H-пирроло[3,2-c]хинолина
1-(хинолин-8-илсульфонил)-4-(морфолин-4-ил)-1H-пирроло[3,2-c]хинолина
1-((3-метилфенил)сульфонил)-4-(пирролидин-3-илокси)-1H-пирроло[3,2-c]хинолина
1-((2,5-дифторфенил)сульфонил)-4-(пирролидин-3-илокси)-1H-пирроло[3,2-c]хинолин.
4. Соединение, которое выбрано из:
1-((4-(трет-бутил)фенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((5-метилбензо[b]тиофен-2-ил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
7-фтор-1-((3-хлорфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
8-хлор-1-((3-хлорфенил)сульфонил)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
1-((4-(трет-бутил)фенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-хлор-1-((3-хлорфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
8-хлор-1-(нафталин-1-илсульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
7-фтор-1-((3-метилфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
7-фтор-1-((3-хлорфенил)сульфонил)-4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
или их фармакологически приемлемой соли.
5. Соединение по любому из пп. 1-4, где указанное соединение представляет собой оптически активный энантиомер.
6. Соединение по п. 3, где указанное соединение представляет собой оптически активный энантиомер.
7. Фармацевтическая композиция для лечения или профилактики заболеваний, нарушений или состояний, возникающих в результате нарушения передачи сигнала через 5-HT6-рецепторы, содержащая фармацевтически эффективное количество соединения по любому из пп. 1-6 и фармацевтически приемлемый носитель или разбавитель.
8. Способ получения соединения формулы (XIX), в которой все символы имеют значения, указанные в п. 1 и на схеме 1, включающий в себя стадии:
a) реакцию аза-Бейлиса-Хиллмана, осуществляемую в полярном растворителе, в присутствии третичного амина, такого как DABCO (1,4-диазабицикло[2.2.2]октан), хинуклидина или 3-гидроксихинуклидина, и кислоты Льюиса, выбранной из Sc(OTf)3, Yb(OTf)3, Ti(Oi-Pr)4 и Cu(OTf)2,
b) образование диенового производного формулы A-2

при алкилировании соединения формулы A-1

аллилбромидом в присутствии сильного основания, выбранного из трет-BuOK, трет-BuONa, K2CO3, Cs(CO3)2, TEA, в полярном растворителе,
с) реакцию метатезиса с замыканием цикла производного формулы A-2 при использовании 3-10 мол.% рутениевого катализатора в дихлорметане или толуоле, необязательно поддерживаемую воздействием микроволнового излучения,
d) обработку полученного пирролина формулы A-3
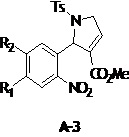
сильным основанием с образованием производного пиррола формулы A-4

в подходящем растворителе, таком как ДМФА или ДМСО, в присутствии основания,
e) восстановление нитропроизводного формулы A-4 до его амино аналога формулы A-5

f) циклизацию соединения формулы A-5 до лактама формулы A-6

в кислых условиях, в полярном протонном растворителе,
g) превращение лактамового производного A-6 в его хлорсодержащий аналог формулы A-7

путем обработки соединения A-6 хлорирующим средством, таким как POCl3, SOCl2, PCl5, при повышенной температуре,
h) получение аминосодержащих/эфиросодержащих замещенных пирролохинолинов общей структуры XIX

из соединения А-7 при использовании растворителей, выбранных из неполярных растворителей или полярных растворителей, необязательно поддерживаемое воздействием микроволнового излучения.
9. Применение соединения формулы XIV по пп. 1-6 в производстве лекарственного средства для лечения или профилактики заболеваний, нарушений или состояний, возникающих в результате нарушения передачи сигнала через 5-HT6-рецепторы, выбранных из группы, состоящей из шизофрении, тревожного состояния, депрессии, маниакальной депрессии, эпилепсии, обсессивно-компульсивного расстройства, расстройства настроения, мигрени, болезни Альцгеймера, связанного с возрастом когнитивного нарушения, умеренного когнитивного нарушения, расстройства сна, расстройства приема пищи, анорексии, булимии, панических атак, синдрома дефицита внимания и гиперактивности, синдрома дефицита внимания, боли, ожирения и диабета 2-го типа, функционального заболевания кишечника, синдрома раздраженного кишечника.
10. Применение соединения формулы XIV по пп. 1-6 в производстве лекарственного средства одновременного, раздельного или последовательного введения с другим лекарственным средством в лечении или профилактике заболеваний, нарушений или состояний, возникающих в результате нарушения передачи сигнала через 5-HT6-рецепторы, выбранных из группы, состоящей из шизофрении, тревожного состояния, депрессии, маниакальной депрессии, эпилепсии, обсессивно-компульсивного расстройства, расстройства настроения, мигрени, болезни Альцгеймера, связанного с возрастом когнитивного нарушения, умеренного когнитивного нарушения, расстройства сна, расстройства приема пищи, анорексии, булимии, панических атак, синдрома дефицита внимания и гиперактивности, синдрома дефицита внимания, боли, ожирения и диабета 2-го типа, функционального заболевания кишечника, синдрома раздраженного кишечника.
11. Применение соединения по любому из пп. 1-6 для получения фармацевтической композиции с целью лечения или профилактики заболеваний, нарушений или состояний, возникающих в результате нарушения передачи сигнала через 5-HT6-рецепторы.
12. Соединение общей формулы (XIX):

или стереоизомер или фармакологически приемлемая соль или гидрат любого из указанных выше соединений, где все символы имеют значения, указанные в п. 1.
13. Соединение по п. 12, указанное соединение представляет собой оптически активный энантиомер.
14. Соединение по п. 12 общей формулы (XIX), выбранное из следующих соединений формул:
N1,N1-диметил-N2-(1H-пирроло[3,2-c]хинолин-4-ил)этан-1,2-диамина
(R)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
(S)-N-(пирролидин-3-ил)-1H-пирроло[3,2-c]хинолин-4-амина
4-(пиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
4-(4-метилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
4-(4-бензилпиперазин-1-ил)-1H-пирроло[3,2-c]хинолина
4-(1,4-диазепан-1-ил)-1H-пирроло[3,2-c]хинолина
4-(пиперидин-1-ил)-1H-пирроло[3,2-c]хинолина
4-(1H-пирроло[3,2-c]хинолин-4-ил)морфолина
4-(пирролидин-3-илокси)-1H-пирроло[3,2-c]хинолина.
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ПИРРОЛОХИНОЛИНА ДЛЯ УНИЧТОЖЕНИЯ КЛИНИЧЕСКИ ЛАТЕНТНЫХ МИКРООРГАНИЗМОВ | 2006 |
|
RU2404982C2 |
| Машина для прядения искусственного шелка | 1929 |
|
SU12110A1 |
Авторы
Даты
2019-05-20—Публикация
2013-07-25—Подача