Область изобретения
Данное изобретение относится к новым химическим веществам и поиску новых физиологически активных веществ, соединений-лидеров и лекарственных кандидатов (drug-candidates), получаемых на основании скрининга комбинаторных библиотек, а также к способам получения новых веществ и комбинаторным библиотекам.
Более конкретно настоящее изобретение относится к новым 6-сульфамоилхинолин-4-карбоновым кислотам и их производным, физиологически активным веществам этого ряда, комбинаторной библиотеке соединений этого ряда, физиологически активным веществам (потенциально антибактериальные, противовоспалительные, противовирусные, иммуномодулирующие и т.д.), а также к способам получения и применения веществ.
Существует большое количество физиологически активных веществ класса хинолин-4-карбоновых кислот, обладающих антибактериальными, противовоспалительными, иммуномодулирующими и пр. свойствами. Например, амиды хинолин-4-карбоновых кислот следующего строения:

являются антагонистами тахикининовых (Tachykinin NK2 and/or NK3) рецепторов и обладают широким спектром физиологической активности, позволяющей рассматривать их как потенциальные анальгетические, противовоспалительные, противоартритные, иммуномодулирующие препараты (GlaxoSmithKline SpA; Laboratoire GlaxoSmithKline SAS. WO 0238547, 2002).
С другой стороны, 6-сульфамоилхинолиновые производные следующего строения:
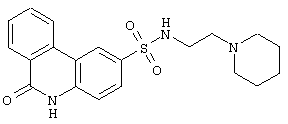
являются ингибиторами NAD+ ADP-Ribosyltransferase, весьма перспективными агентами для лечения широкого спектра нейродегенеративных и онкологических заболеваний (Guilford Pharmaceuticals Inc. WO 0190077, 2001).
В этой связи дизайн новых 6-сульфамоилхинолин-4-карбоновых кислот и их производных, синтез новых физиологически активных веществ этого ряда, разработка способов их получения и создание комбинаторной библиотеки этих соединений представляется перспективным подходом к открытию новых соединений-лидеров, обладающих высоким сродством к тахикининовым рецепторам и лишенных побочных свойств.
В результате проведенных исследований, направленных на поиск новых соединений для поиска биологически активных лидеров, изобретатели получили неизвестные ранее 6-сульфамоилхинолин-4-карбоновые кислоты и их производные, которым свойственна физиологическая активность, разработали способы их получения и комбинаторную библиотеку этих соединений.
Впервые 6-сульфамоилхинолин-4-карбоновые кислоты и их производные, а именно 2-фенил-6-сульфамоилхинолин-4-карбоновая кислота и 2-фенил-6-(2-пиридиламиноульфонил)хинолин-4-карбоновая кислота были описаны в 1942 году [R.Ciusa. Gazzeta Chemica Italiana, 1942, 72, 567-570]. Недавно было установлено, что амиды хинолин-4-карбоновых кислот и их производные являются NK3 антагонистами [SmithKline Beecham Farmaceutici S.P.A. Pat. PCT WO 9602509 A1, 1996; WO 97/19927, 1997; WO 97/19928, 1997].

в которой в числе самых разнообразных значений X, Rl, R2, R3, R4 и R5, представлены значения для Х=О, а R3=SO2NH2 (сульфонамидо).
Кроме того, известно, что соединения ряда 4-карбоксихинолинов или 6-сульфамоилхинолинов могут обладать широким спектром физиологической активности, например антибактериальной [X.Y. Yu, et al. Structure-activity relationship of biphenylquinoline analogs as inhibitors of S. aureus methionyl-TRNA synthetase. 218th ACS Nati Meet (Aug 22-26, New Orleans) 1999, Abst MEDI 296], противовоспалительной [GlaxoSmithKline SpA; Laboratoire GlaxoSmithKline SAS. WO 0238547 May 16, 2002], антигипертензивной [Bristol-Myers Squibb Co. US 6117885 September 12, 2000], иммуномодулирующей [Kyowa Hakko Kogyo Co., Ltd. EP 0721942 July 17,1996] и т.д.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
“Комбинаторная библиотека” - коллекция соединений, полученных параллельным синтезом, предназначенная для поиска лида или оптимизации биологической активности лид-соединения, причем каждое соединение библиотеки соответствует общему скэффолду и библиотека является коллекцией родственных гомологов или аналогов.
“Лид-соединение” - соединение с выдающейся активностью, относящейся к определенной болезни.
“Параллельный синтез” - метод ведения комбинаторного химического синтеза библиотеки.
“Скэффолд” - общая структурная формула, или молекулярный коркас, или инвариантная область соединений, характерная для всех соединений, входящих в комбинаторную библиотеку.
“Заместитель” - химический радикал, который присоединяется к скэффолду или полупродукту синтеза в процессе их синтеза.
“Нуклеофильный” - электронно-избыточный реагент.
“Электрофильный” - электронно-дефицитный реагент.
“Инертный заместитель” ("Non-interfering substituent") - низко или нереакционноспособный радикал включая, но не ограничивая C1-С7алкил, C2-С7алкенил, C1-С7алкинил, C2-С7алкокси, C7-С12аралкил, замещенный аралкил, C7-С12гетероциклилалкил, замещенный гетероциклилалкил, C7-С12алкарил, C3-С10циклоалкил, C3-С10циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, C2-С12алкоксиалкил, C2-С10алкилсульфинил, C2-С10алкилсульфонил, (CH2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил; где m and n имеют значение от 1 до 7. Предпочтительными “инертными заместителями” являются C1-С7алкил, C2-С7алкенил, C2-С7алкинил, C1-С7алкокси, C7-С12аралкил, C7-С12алкарил, C3-С10циклоалкил, C3-С10циклоалкенил, фенил, замещенный фенил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
“NH-Защитный заместитель” - химический радикал, который присоединяется к скэффолду или полупродукту синтеза для временной защиты аминогруппы в мультифункциональных соединениях включая, но не ограничивая: амидный заместитель, такой как формил, необязательно замещенный ацетил (например, трихлорацетил, трифторацетил 3-фенилпропионил и др.), необязательно замещенный бензоил и др.; карбаматный заместитель, такой как необязательно замещенный C1-С7алкилоксикарбонил, например метилоксикарбонил, этилоксикарбонил, трет-бутилоксикарбонил, 9-флуоренилметилоксикарбонил (Fmoc) и др.; необязательно замещенный C1-С7алкильный заместитель, например трет-бутил, бензил, 2,4-диметиксибензил, 9-фенилфлуоренил и др.; сульфонильный заместител, например бензолсульфонил, п-толуолсульфонил и др. Более подробно “NH-Защитные заместители” описаны в книге: Protective groups in оrganic synthesis. Third Edition Greene, T.W. and Wuts, P.G.M. 1999, p. 494-653. Издательство John Wiley & Sons, Inc., New York, Chichester, Weinheim, Brisbane, Toronto, Singapore.
“Нуклеофильный заместитель” - химический радикал, который присоединяется к скэффолду в результате реакции с нуклеофильным реагентом, например, выбранным из группы первичных или вторичных аминов, спиртов, фенолов, меркаптанов и тиофенолов.
“Электрофильный заместитель” - химический радикал, который присоединяется к скэффолду в результате реакции с электрофильным реагентом, например выбранным из группы органических галогенидов (необязательно замещенных C1-С7алкил галогенидов, необязательно замещенных арилC1-С7алкил галогенидов, необязательно замещенных гетероциклилC1-С7алкил галогенидов, необязательно замещенных арил галогенидов, необязательно замещенных гетероциклил галогенидов), органических кислот или их производных (ангидридов, имидазолидов, галогенангидридов), эфиров органических сульфокислот или органических сульфохлоридов, органических галогенформиатов, органических изоцианатов и органических изотиоцианатаминометинов.
“Арил” - один или более ароматических циклов, каждый из которых включает 5 или 6 атомов углерода. “Арил” может быть конденсированным полициклом, например, как нафталин или неконденсированным, например, как бифенил. “Замещенный арил” имеет один или несколько “немешающих” заместителей.
“Галоген” - атом фтора, хлора, брома или йода.
“Гетероцикл” - один или несколько насыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере, один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. “Гетероцикл” может быть конденсированным или каркасным полициклом, например, как бензимидазол, бензоксазол, бензтиазол, хинолин, 1,5,6,8-тетрагидро-2Н,4Н-1,5-метано-пиридо-[1,2-а][1,5]диазоцин, 8-аза-бицикло-[3,2,1]октан, октагидро-1,5-метано-пиридо[1,2-а][1,5]диазоцин или неконденсированным, например, как бипиридил, 3,4,5,6-тетрагидро-2Н-[2,3’]бипиридил.
“Азогетероцикл” - гетероцикл, включающий, по крайней мере, один атом азота, например, как бензимидазол, бензоксазол, бензтиазол, хинолин.
“Замещенный гетероцикл” - гетероцикл, имеющий один или несколько “немешающих” заместителей.
Целью настоящего изобретения являются новые 6-сульфамоилхинолин-4-карбоновые кислоты и их производные общей формулы (1):
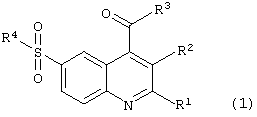
в которой R1 представляет атом водорода, метил, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил;
R2 представляет атом водорода, -С(O)ОН;
R1 и R2 вместе представляют полиметиленовый фрагмент -(СН2)m;
m имеет значение от 3 до 7;
R3 представляет -ОН, -O-N+HR5R6R7, -NH2 или нуклеофильный заместитель, выбранный из группы первичных или вторичных аминов, спиртов, фенолов, меркаптанов и тиофенолов;
R2 и R3 вместе представляют группу -С(O)O- или -C(O)N(R8)-;
R4 представляет нуклеофильный заместитель, выбранный из группы первичных аминов, вторичных аминов, необязательно замещенных, необязательно каркасных и необязательно конденсированных гетероциклов, содержащих в цикле по крайней мере одну вторичную аминогруппу, например необязательно замещенный 1-пирролидинил, необязательно замещенный морфолин, необязательно замещенный 1-пиперидинил, необязательно замещенный 1-азепанил; необязательно замещенный 1-пиперазинил, необязательно замещенный 8-азабицикло[3,2,1]окт-8-ил, необязательно замещенный 3,7-диазабицикло[3.3.1]нонанил, необязательно замещенный 1,2,3,4,5,6-гексагидро-1,5-метано-пиридо[1,2-а][1,5]диазоцинил, необязательно замещенный декагидро-1,5-метано-пиридо[1,2-а] [1,5]диазоцинил;
R5, R6 и R7 независимо друг от друга представляют необязательно замещенный C1-С7-алкил;
R8 представляет инертный заместитель, выбранный из группы, включающей необязательно замещенный C1-С7алкил, необязательно замещенный C2-С7алкенил, необязательно замещенный C2-С7алкинил, необязательно замещенный C1-С7алкокси, необязательно замещенный в алкильном или арильном фрагменте C7-С12аралкил, необязательно замещенный в алкильном или гетероциклическом фрагменте C7-С12гетероциклилалкил, необязательно замещенный в алкильном или арильном фрагменте C7-С12алкарил, C3-С10 необязательно замещенный циклоалкил, необязательно замещенный C3-С10циклоалкенил, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил, причем во всех значениях радикалов гетероциклил означает 5-7-членное кольцо, включающее в качестве гетероатомов азот, кислород, серу, которое может быть необязательно конденсированно с бензольным или гетероциклическим кольцом или может входить в каркасный полицикл, например 8-азабицикло[3,2,1]окт-3-илом, а азагетероциклил означает азотсодержащий 5-7-членный гетероцикл, который может иметь дополнительный гетероатом, выбранный из азота, кислорода или серы, и может быть конденсирован с бензольным или гетероциклическим кольцом, исключая соединение (1), в котором одновременно R1 = фенил, R2 = Н, R3 = ОН, R4 = NH(2-пиридил).
Целью настоящего изобретения является также новая комбинаторная библиотека 6-сульфамоилхинолин-4-карбоновых кислот и их производных общей формулы (1).
Предпочтительным вариантом изобретения являются новые 6-сульфамоилхинолин-4-карбоновые кислоты и их производные общей формулы (1) и комбинаторная библиотека новых 6-сульфамоилхинолин-4-карбоновых кислот и её производных общей формулы (1).
В частности, предпочтительными новыми соединениями являются:
6-Сульфамоилхинолин-4-карбоновые кислоты и их производные общей формулы (1):
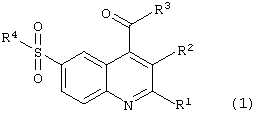
в которой R1 представляет атом водорода, метил, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил;
R2 представляет: атом водорода, -С(O)ОН;
R1 и R2 вместе представляют: полиметиленовый фрагмент -(СН2)m;
m имеет значение от 3 до 7;
R3 представляет -ОН, -O-N+HR5R6R7, -NH2 или нуклеофильный заместитель, выбранный из группы первичных или вторичных аминов, спиртов, фенолов, меркаптанов и тиофенолов;
R2 и R3 вместе представляют группу -С(O)O- или -C(O)N(R8)-;
R4 представляет нуклеофильный заместитель, выбранный из группы первичных аминов, вторичных аминов, необязательно замещенных, необязательно каркасных и необязательно конденсированных гетероциклов, содержащих в цикле по крайней мере одну вторичную аминогруппу, например необязательно замещенный 1-пирролидинил, необязательно замещенный морфолин, необязательно замещенный 1-пиперидинил, необязательно замещенный 1-азепанил; необязательно замещенный 1-пиперазинил, необязательно замещенный 8-азабицикло[3,2,1]окт-8-ил, необязательно замещенный 3,7-диазабицикло[3.3.1]нонанил, необязательно замещенный 1,2,3,4,5,6-гексагидро-1,5-метано-пиридо[1,2-а][1,5]диазоцинил, необязательно замещенный декагидро-1,5-метано-пиридо[1,2-а] [1,5]диазоцинил;
R5, R6 и R7 независимо друг от друга представляют необязательно замещенный C1-С7-алкил;
R8 представляет инертный заместитель, выбранный из группы, включающей необязательно замещенный C1-С7алкил, необязательно замещенный C2-С7алкенил, необязательно замещенный C2-С7алкинил, необязательно замещенный C1-С7алкокси, необязательно замещенный в алкильном или арильном фрагменте C7-С12аралкил, необязательно замещенный в алкильном или гетероциклическом фрагменте C7-С12гетероциклилалкил, необязательно замещенный в алкильном или арильном фрагменте C7-С12алкарил, C3-С10 необязательно замещенный циклоалкил, необязательно замещенный C3-С10циклоалкенил, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил, причем во всех значениях радикалов гетероциклил означает 5-7-членное кольцо, включающее в качестве гетероатомов азот, кислород, серу, которое может быть необязательно конденсировано с бензольным или гетероциклическим кольцом или может входить в каркасный полицикл, например 8-азабицикло[3,2,1]окт-3-илом, а азагетероциклил означает азотсодержащий 5-7-членный гетероцикл, который может иметь дополнительный гетероатом, выбранный из азота, кислорода или серы, и может быть конденсирован с бензольным или гетероциклическим кольцом, исключая соединение (1), в котором одновременно R1 = фенил, R2 = Н, R3 = ОН, R4 = NН(2-пиридил).
Еще более предпочтительными соединениями согласно настоящему изобретению из 6-сульфамоилхинолин-4-карбоновых кислот и их производных общей формулы (1) являются:
6-сульфамоилхинолин-4-карбоновые кислоты общей формулы (1.1):
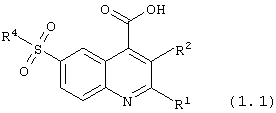
в которой R1, R2 и R4 имеют вышеуказанное значение исключая соединение (1.1), в котором одновременно R1 = фенил, R2 = Н, R3 = ОН, R4 = -NH2, и соединение (1.1), в котором одновременно R1 = фенил, R2 = Н, R3 = ОН, R4 = -NН(2-пиридил).
6-сульфамоилхинолин-4-карбоновые кислоты общей формулы (1.1.1):
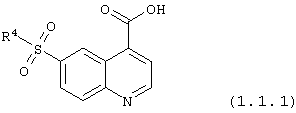
в которой R4 имеет вышеуказанное значение.
6-сульфамоилхинолин-4-карбоновые кислотой общей формулы (1.1.2):
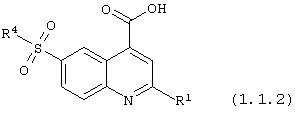
в которой R1 и R4 имеют вышеуказанное значение.
6-сульфамоилхинолин-4-карбоновые кислоты общей формулы (1.1.3):
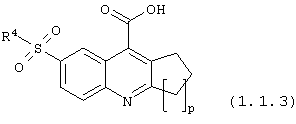
в которой R4 имеет вышеуказанное значение; р = 1-3.
6-сульфамоилхинолин-3,4-дикарбоновые кислоты общей формулы (1.1.4):
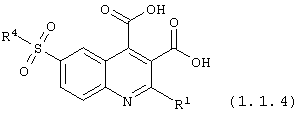
в которой R1, и R4 имеют вышеуказанное значение.
6-сульфамоилхинолин-4-карбоксамиды общей формулы (1.2):
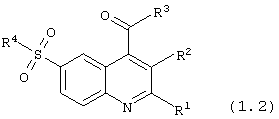
в которой R1, R2 и R4 имеют вышеуказанное значение;
R3 представляет -NH2 или нуклеофильный заместитель, выбранный из группы первичных или вторичных аминов.
6-сульфамоилхинолин-4-карбоксамиды общей формулы (1.2.1):
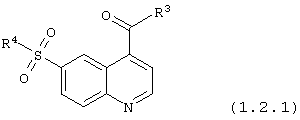
в которой R3 и R4 имеют вышеуказанное значение.
6-сульфамоилхинолин-4-карбоксамиды общей формулы (1.2.2):
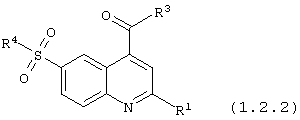
в которой R1, R3 и R4 имеют вышеуказанное значение.
6-сульфамоилхинолин-4-карбоксамиды общей формулы (1.2.3):
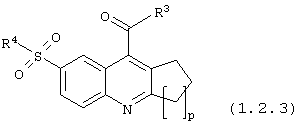
в которой R3, R4 и р имеют вышеуказанное значение.
сложные эфиры или тиоэфиры 6-сульфамоилхинолин-4-карбоновых кислот общей формулы (1.3):
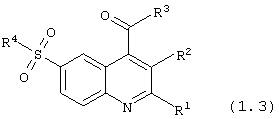
в которой R1, R2 и R4 имеют вышеуказанное значение, R9 представляет нуклеофильный заместитель, выбранный из группы спиртов, фенолов, меркаптанов и тиофенолов;
аммонийные соли 6-сульфамоилхинолин-4-карбоновых кислот общей формулы (1.4):
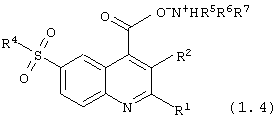
в которой R1, R2, R4, R5, R6 и R7 имеют вышеуказанное значение.
8-сульфамоил-1,3-дигидрофуро[3,4-с]хинолин-1,3-дионы общей формулы (1.5):
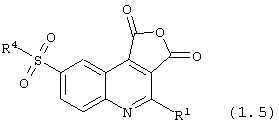
в которой R1 и R4 имеют вышеуказанное значение.
8-сульфамоил-2,3-дигидро-1H-пирроло[3,4-с]хинолин-1,3-дионы общей формулы (1.6):
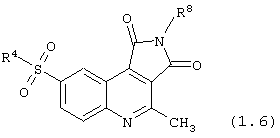
в которой R4 и R8 имеют вышеуказанное значение.
Предпочтительным также являются комбинаторная библиотека соединений, в которой каждое из входящих в нее соединение является 6-сульфамоилхинолин-4-карбоновой кислотой или ее производным общей формулы (1).
Используемые в качестве исходных реагенты в большинстве случаев являются коммерчески доступными или легко получаются известными в литературе способами. Например, используемые в качестве исходных соединений 6-сульфамоилизатины (2) получают по методике, описанной в работах [A.V. Ivachtchenko, A.P. Il’yin, V.V. Kobak, D.A. Zolotarev, L.V. Guro, A.S. Trifilenkov, D.M. Ugoleva, J. Combinat. Chem. 2002, 4, 419-428. D. Lee, S.A. Long, J.H. Murray, J.L. Adams, M.E. Nuttall, D.P. Nadeau, K. Kikly, J.D. Winkler, C.M. Sung, M.D. Ryan, M.A. Levy, P.M. Keller, W.E. DeWolf. J. Med. Chem. 2001, 44, 2015-2026].
Ниже изобретение описывается с помощью конкретных примеров получения конкретных соединений и комбинаторной библиотеки. Структуры полученных соединений подтверждались данными химического, хроматографического и спектрального анализа. Жидкофазный параллельный синтез новых соединений и комбинаторной библиотеки осуществлялся с использованием специальных синтезаторов "CombiSyn-012-3000" [М. Бару, А. Иващенко, патент России 2180609, 2002; РСТ WO 02/087740 A1, 2002] и оборудования [Technology Platform, In Custom Chemistry; Chemical Diversity Labs, Inc.; San Diego, CA, 2002; p. 5].
Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Общая информация. Все растворители и реагенты были получены из коммерческих источников, таких как Акрос (Бельгия), Сигма-Олдрич (США), Ланкастер (Англия) и КемДив (США). Точки плавления (т.пл.) были получены на приборе фирмы Бюхи (Швейцария) модель В-520. 13С ЯМР спектры были получены на спектрометрах фирмы Брукер модель АМ-300 и модель DRX-500 в диметилсульфоксиде-d6. Химические сдвиги приведены в шкале 5 (ppm). Внутренний стандарт тетраметилсилан. Масс-спектры были измерены на приборе Kratos Model MS-890.
Аналитическую ТСХ проводили на силикагеле на алюминиевых пластинках Silufol UV254 (5×15 см) (Kavalier, Czech Republic) или на стеклянных пластинках с 0,25 мм слоем силикагеля 60 F254 (Merck, Germany). Визуализация осуществлялась с помощью УФ света на длине волны 254 нм. Для хроматографической очистки использовали силикагель 5-40 мкм (Chemapol, Czech Republic). В соответствии с данными LC/MS все синтезированные соединения имели содержание основного вещества выше 95%.
Комбинаторная библиотека 6-сульфамоилхинолин-4-карбоновых общей формулы (1.1).
Параллельный синтез комбинаторной библиотеки проводят в синтезаторе "CombiSyn-012-3000". В каждый из 11 реакторов синтезатора загружают по 0,97 г (10,21 ммоль) КОН в смеси 15 мл воды и 10 мл этанола, последовательно прибавляют при перемешивании и комнатной температуре по 5,11 ммоль соответствующего 6-сулфамоилизатина общей формулы (2) и по 6,13 моль метиленактивного карбонильного соединения общей формулы (3), предварительно растворенного в 5 мл этанола. Реакционные массы кипятят 5-18 часов до исчезновения исходного изатина (2). Контроль осуществляют с помощью тонкослойной хроматографии (ТСХ) на силикагеле, в качестве элюента используют смесь хлороформа с этанолом в объемном соотношении 19:1. Для ТСХ контроля 0,1 мл реакционной смеси растворяют в 1 мл воды. Полученные в каждом реакторе растворы нейтрализуют 5% соляной кислотой до рН 3 и экстрагируют 0,25 мл этилацетата. Органические слои отделяют и хроматографируют на пластинках “Silufol UV254” фирмы Kavalier (Чехия).
После окончания процесса из реакционных смесей отгоняют в вакууме спирт, остатки фильтруют и упаривают досуха. Полученные остатки растворяют в минимальном количестве воды и прибавляют 10% соляную кислоту до рН 2-3. Выпавшие осадки отфильтровывают и сушат в вакууме над хлористьм кальцием. Полученные кристаллические продукты экстрагируют этилацетатом, хлороформом или метиленхлоридом, экстракты сушат безводньм сульфатом натрия, фильтруют и упаривают в вакууме. Остатки перекристаллизовывают из подходящего растворителя.
Получают комбинаторную библиотеку, включающую 11 6-сульфамоилхинолин-4-карбоновых кислот (1.1), представляющих собой кристаллические вещества, растворимые в этилацетате, хлороформе, метиленхлориде, умеренно растворимые в этаноле и ацетоне, плохо растворимые в эфире и нерастворимые в гексане.
Ниже приводятся названия кислот (1.1), входящих в комбинаторную библиотеку, использованные при их синтезе метиленактивные карбонильные соединения (3), выходы, точки плавления и спектральные данные.
Пример 1.
6-(4-Диэтиламиносульфонил)-4-хинолинкарбоновая кислота, (1.1.1) {1}: метиленактивные карбонильные соединения (3) - малоновая кислота, или диэтилмалонат, или 3-морфолино-3-оксопропионат; выход 47%; т.пл. 275°С (разл.); ИК: 1707 см-1; Н1 ПМР δ 1.068 (t, 6Н), 3.246 (q, 4Н), 8.1 (d, J=4.4 Hz, 1H), 8.1 (dd, J=8.8 Hz, J=2.0 Hz, 1H), 8.3 (d, J=8.8 Hz, 1H), 9.2 (d, J=4.4 Hz, 1H), 9.3 (d, J=2.1 Hz, 1H), 14.17 (bs, 1H); MS m/z 309 (M·+).
Пример 2.
6-(4-Метилпиперидиносульфонил)-4-хинолинкарбоновая кислота, (1.1.1){2}: метиленактивные карбонильные соединения (3) - малоновая кислота, или диэтилмалонат, или 3-морфолино-3-оксопропионат; выход 41%; т.пл. 304°С (с разл.); ИК: 1705 см-1; H1 ПМР δ 0.93 (d, 3Н), 1.30 (m, 3Н), 1.70 (d, 2H), 2.33 (m, 2H), 3.76 (d, 2Н), 4.70 (bs, 1H) 8.00 (d, 1H), 8.12 (d, 1H) 8.25 (d, 1H) 9.16 (d, 1H), 935 (s, 1H); MS m/z 335 (M·+).
Пример 3.
6-(4-Метилпиперидиносульфонил)-2-(2-пиридил)-4-хинолинкарбоновая кислота, (1.1.2){1}: метиленактивное карбонильное соединение (3) - 2-ацетилпиридин; выход 59%; т.пл. >300°С; δ 0.91 (d, J= 4.80 Hz, 3H), 1.20-1.38 (m, 3Н), 1.71 (d, J=9.90 Hz, 2H), 2.27-2.38 (m, 2H), 3.77 (d, J=11.60 Hz, 2H), 7.46-7.52 (m, 1H), 7.93-7.99 (m, 1H), 8.01 (dd, J=1.40 Hz, J=8.25 Hz, 1H), 8.30 (d, J=8.90 Hz, 1H), 8.69 (d, J=8.25 Hz, 1H), 8.76 (d, J=4.40 Hz, 1H), 9.24 (s, 1H), 9.33 (br s, 1H); 13C ЯМР δ 21.24, 29.17, 32.88, 46.01, 121.03, 121.41, 123.91, 125.54, 126.41, 127.07, 131.26, 135.10, 137.48, 137.65, 149.22, 149.55, 153.64, 157.66, 166.67; MS w/z 410 (М·+).
Пример 4.
6-(4-Метилпиперидиносульфонил)-2-(3-пиридил)-4-хинолинкарбоновая кислота, (1.1.2){2}: метиленактивное карбонильное соединение (3) - 3-ацетилпиридин; выход 80%; mp >300°С; 1Н ПМР δ, 0.90 (d, J=5.30 Hz, 3Н), 1.17-1.38 (m, 3Н), 1.71 (d, J=12.50 Hz, 2H), 2.29-2.40 (m, 2H), 3.75 (d, J=11.20 Hz, 2H), 7.55-7.61 (m, 1H), 8.05 (dd, J=1.00 Hz, J=8.70 Hz, 1H), 8.34 (d, J= 8.70 Hz, 1H), 8.60-8.74 (m, 2H), 8.68 (s, 1H), 9.25 (s, 1H), 9.46 (br s, J=1.00 Hz, 1H); 13С ЯМР δ, 21.22, 29.18, 32.90, 45.99, 121.01, 123.02, 123.97, 126.29, 127.22, 131.22, 132.89, 135.04, 138.50, 148.54, 149.36, 151.08, 156.60, 166.65; MS m/z 410 (M·+).
Пример 5.
6-(4-Метилпиперидиносульфонил)-2-(4-пиридил)-4-хинолинкарбоновая кислота, (1.1.2){1}: метиленактивное карбонильное соединение (3) - 4-ацетилпиридин; выход 68%; т.пл. >300°С; 1Н ПМР δ 0.92 (d, J=4.80 Hz, 3Н), 1.22-1.35 (m, 3Н), 1.71 (d, J=9.90 Hz, 2H), 2.28-2.38 (m, 2H), 3.78 (d, J=11.80 Hz, 2H), 8.04(dd, J=1.75 Hz, J=8.85 Hz, 1H), 8.22 (dd, J=1 Hz, J=4.75 Hz, 2H), 8.32 (d, J=8.85 Hz, 1H), 8.69 (s, 1H), 8.76 (dd, J=1 Hz,7=4.75 Hz, 2H), 9.31 (d, J=1.75 Hz, 1H); 13C ЯМР δ 21.22, 29.14, 32.84, 45.88, 120.59, 121.05, 123.13, 125.87, 126.88, 130.99, 135.02, 138.24, 143.73, 148.77, 149.95, 155.73, 165.98; MS m/z 410 (М·+).
Пример 6.
6-(4-Метилпиперидиносульфонил)-2-(3-тиенил)-4-хинолинкарбоновая кислота, (1.1.2){4}: метиленактивное карбонильное соединение (3) - 3-ацетилтиофен; выход 27%; т.пл. >255°С; 1Н ПМР δ 0.91 (d, J=5.00 Hz, 3H), 1.21-1.34 (m, 3H), 1.70 (d, J=10.70 Hz, 2Н), 2.26-2.36 (m, 2H), 3.75 (d, J=10.20 Hz, 2H), 7.21 (m, J=3.85 Hz, J=3.10 Hz, 1H), 7.65 (d, J=3.85 Hz, 1H), 7.95 (dd, J=1.00 Hz, J=8.90 Hz, 1H), 8.02 (d, J=3.10 Hz, 1H), 8.18 (d, J=8.90 Hz, 1H), 8.52 (s, 1H), 9.20 (br s, 1H); 13C ЯМР δ 21.19, 29.12, 32.80, 45.95, 191.79, 122.71, 126.35, 127.22, 128.90, 129.04, 130.23, 131.43, 133.91, 138.55, 143.21, 149.25, 154.10, 166.67; MS m/z 410 (М·+).
Пример 7.
2-(5-Метил-2-фурил)-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоновая кислота, (1.1.2){5}: метиленактивное карбонильное соединение (3) - 2-ацетил-5-метилфуран; выход 1.5%; т.пл. >255°С; 1Н ПМР δ 0.88 (d, J=5.00 Hz, 3H), 1.30 (m, 3H), 1.70 (d, J=10.65 Hz, 2H), 2.32 (m, 2H), 2.50 (s, 3H), 3.75 (d, J=10.15 Hz, 2H), 6.26 (d, J=3.45 Hz), 7.28 (d, J=3.45 Hz, 1H), 7.94 (dd, J=1.00 Hz, J=8.90 Hz, 1H), 8.12 (d, J=8.90 Hz, 1H), 8.41 (s, 1H), 9.23 (br s, 1H); MS m/z 414 (M·+).
Пример 8.
6-(4-Морфолиносульфонил)-2-(2-пиридил)-4-хинолинкарбоновая кислота, (1.1.2){6}: метиленактивное карбонильное соединение (3) 2-ацетилпиридин; выход 77%; т.пл. >300°С; 1Н ПМР δ 2.96-3.12 (m, 4H), 3.61-3.76 (m, 4H), 7.44-7.52 (m, 1H), 7.91-8.00 (m, 1H), 8.02 (dd, J=1.80 Hz, J=9.10 Hz, 1H), 8.32 (d, J=9.10 Hz, 1H), 8.70 (d, J=7.90 Hz, 1H), 8.76 (d, J=4.70 Hz, 1H), 9.27 (s., 1H), 9.38 (br s, 1H).
Пример 9.
6-(1-Азепанил)-2-(3-пиридил)-4-хинолинкарбоновая кислота, (1.1.2){7}: метиленактивное карбонильное соединение (3) 3-ацетилпиридин; выход 96%; т.пл. >300°С; 1Н ПМР δ 1.50-1.63 (m, 4H), 1.65-1.78 (br s, 4H), 3.27-3.90 (brs, 4H), 7.55-7.64 (m, 1H), 8.10 (dd, J=1.80 Hz, J=8.30 Hz, 1H), 8.32 (d, J=8.30 Hz, 1H), 8.63-8.76 (m, 2H), 8.66 (s, 1H), 9.26 (br s, 1H), 9.46 (s, 1H).
Пример 10.
7-(4-Метилпиперидиносульфонил)-1,2,3;4-тетрагидро-9-акридинкарбоновая кислота, (1.1.3){7}: метиленактивные карбонильные соединения (3) циклогексанон; выход 56.8%; т.пл. >300°С; 1Н ПМР δ 0.91 (d, J=4.70 Hz, 3Н), 1.17-1.34 (m, 3Н), 1.69 (d, J=9.50 Hz, 2H), 1.88-2.05 (m, 4H), 2.18-2.32 (m, 2H), 2.98-3.17 (m, 4H), 3.71 (d, J=11.30 Hz, 2H), 7.84 (dd, J=1.00 Hz, J=8.70 Hz, 1H), 8.04 (d, J=8.70 Hz, 1H), 8.14 (br s, 1H); 13C ЯMP δ 21.20, 21.70, 21.88, 26.41, 29.18, 32.82, 33.59, 45.95, 121.26, 124.78, 125.98, 128.04, 129.27, 133.67, 139.70, 146.51, 162.66, 167.74; MS m/z 388 (M·+).
Пример 11. 2-Метил-6-(4-метилпиперидиносульфонил)-3,4-хинолиндикарбоновая кислота, (1.1.4){1}: метиленактивные карбонильные соединения (3) - этил ацетоацетат; выход 39%; т.пл. 212-214°С; 1H ПМР δ 0.90 (d, J=5.90 Hz, 3H), 1.16-1.36 (m, 3H), 1.69 (d, J=12.30 Hz, 2H), 2.24-2.33 (m, 2H), 2.83 (s, 3H), 3.71 (d, J=11.90 Hz, 2H), 7.99 (dd, J=1.75 Hz, J=9.00 Hz, 1H), 8.15 (d, J=9.00 Hz, 1H), 8.46 (d, J=1.75 Hz, 1H); 13C ЯМР δ 21.24, 24.25, 29.14, 32.83, 45.96, 120.68, 125.99, 126.64, 127.92, 130.31, 134.63, 139.50, 148.11, 158.59, 166.67. 167.70; MS m/z 392 (M·+).
Пример 12.
N-4-Бензил-6-(4-метилпиперидиносульфонил)-4-хинолин-карбоксамид, (1.2.1) {7}:
Метод А. К суспензии 1,00 ммоль 6-(4-метилпиперидиносульфонил)-4-хинолинкарбоновой кислоты (1.1.1) {2}, в 10 мл метанола прибавляют 1,10 ммоль бензиламина и кипятят реакционную массу 5 минут. Из полученной реакционной массы полностью отгоняют в вакууме метанол, а к остатку прибавляют 15 мл безводного толуола, 0,05 г пара-толуолсульфокислоты и кипятят с азеотропной отгонкой воды 60 часов, после чего реакционную массу охлаждают и полностью отгоняют толуол в вакууме. Остаток хроматографируют на силикагеле смесью метиленхлорид : метанол (19:1 по объему). Получают амид (1.2.1){1}, который перекристаллизовывают из смеси метиленхлорид-гексан. Выход 41%; т.пл. 138-140°С; 1H ПМР δ 0,94 (d, 3H), 1,29 (m, 3H), 1,70 (d, 2H), 2,27 (m, 2H), 3,70 (d, 2H), 2,71 (d, 2H), 7,25-7,43 (m, 5H), 7,74 (d, 1H), 7,98 (d, 1H), 8,23 (d, 1H), 8,74 (s, 1H), 9,11 (d, 1H), 9,32 (t, 1H).
Метод Б. К суспензии 0,66 ммоль кислоты (1.1.1){2} в 5 мл сухого диоксана прибавляют 1,32 ммоль бензиламина и перемешивают при 75°С 12 часов. Диоксан полностью отгоняют в вакууме, а к остатку прибавляют 15 мл воды, осадок отфильтровывают, промывают водой, экстрагируют метиленхлоридом (3×10 мл), экстракт сушат над безводным сульфатом натрия, фильтруют и упаривают досуха в вакууме. Получают амид (1.2.1){1} с выходом 63%, идентичный полученному по методу А.
Примеры 12-25.
N-4-(3-трифторметилфенил)-6-(4-метилпиперидиносульфонил)-2-(4-пиридил)-4-хинолинокарбоксамид, (1.2.2) {7}: К суспензии 1 эквивалента кислоты (1.1.1) {2} в сухом метиленхлориде при интенсивном перемешивании и комнатной температуре прибавляют 1,2 эквивалента хлористого тионила, перемешивают при комнатной температуре до образования гомогенного раствора. К полученному раствору постепенно прибавляют и 1,5 эквивалента триэтиламина и продолжают перемешивать 2-3 часа до полного исчезновения исходной кислоты (1.1.1) {2} в реакционной массе (контроль с помощью ТСХ, силикагель, хлороформ: метанол = 19:1 по объему). К полученному раствору хлоангидрида кислоты (1.1.7){2} прибавляют 1,05 эквивалента 3-трифторметиланилина и 0,9 эквивалента триэтиламина. Реакционную смесь перемешивают до окончания реакции (контроль ТСХ). После окончания реакции к реакционной массе при перемешивании прибавляют воду, органический слой отделяют и промывают водой и 1% раствором соляной кислоты и снова водой, сушат безводным сульфатом натрия, фильтруют и упаривают в вакууме досуха. Получают амид (1.2.2){7} с выходом 56%, т.пл. 235-237°С; 1H ПМР δ 0,93 (d, J=5,30 Hz, 3H), 1,22-1,38 (m, 3H), 1,73 (d, J=11,10 Hz, 2Н), 2,30-2,42 (m, 2H), 3,79 (d, J=11,40 Hz, 2H), 7,43 (dd J=1,00 Hz, J=7,60 Hz, 1H), 7,59 (m, 1H,), 8,07 (dd J=1,70 Hz, J=8,95 Hz, 1H), 8,15 (dd, J=1,00 Hz, J=8,20 Hz, 1H), 8,22 (br s, 1H), 8,31 (d, J=5,70 Hz, 2H), 8,35 (d, J=8,95 Hz, 1H), 8,59 (s, 1H), 8,75-8,82 (m, 3H), 11,08 (s, 1H); 13C ЯМР δ 21,16, 29,14, 32,80, 45,93, 116,27, 119,10, 120,71, 121,45, 123,03, 123,64, 125,64, 127,51, 129,32, 129,74, 130,18, 131,41, 135,27, 139,25, 143,08, 144,23, 148,88, 150,57, 156,21, 164,51; MS m/z 554 (М·+).
Комбинаторная библиотека 6-(4-метилпиперидиносульфонил)-хинолин-4-карбоксамидов общей формулы (1.2). Параллельный синтез комбинаторной библиотеки проводят в синтезаторе "CombiSyn-012-3000". В каждый из 7 реакторов синтезатора загружают по 1,00 ммоль кислоты (1.1.1) {2} в 10 мл метанола прибавляют по 1,10 ммоль соответствующего амина (4) и кипятят реакционные массы 5 минут. Из полученных реакционных масс полностью отгоняют в вакууме метанол, а к остаткам прибавляют по 5 мл хлорокиси фосфора или хлористого тионила и перемешивают 3 часа при слабом кипении. Затем реакционные массы охлаждают и упаривают в вакууме досуха. К остаткам прибавляют по 25 мл воды и тонкоизмельченную соду до рН 8-9.
Осадки отфильтровывают, промывают на фильтре водой, сушат и экстрагируют метиленхлоридом. Экстракты сушат над безводным сульфатом натрия, фильтруют и упаривают в вакууме досуха. Полученные продукты перекристаллизовывают из подходящего растворителя и получают комбинаторную библиотеку, включающую 7 6-(4-метилпиперидиносульфонил)хинолин-4-карбоксамидов (1.2). Их названия, выходы, точки плавления и спектральные данные приводится ниже.
Пример 12-1.
N-4-Бензил-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоксамид, (1.2.1) {1}: выход 37%; продукт идентичен полученному в примере 12.
Пример 13.
6-(4-Метилпиперидиносульфонил)-N-4-(2-тиенилметил)-4-хинолин-карбоксамид, (1.2.1){2}: выход 88%; т.пл. 139-141°С (метиленхлорид-гексан); 1H ПМР δ 0,90 (d, 3H), 1,25 (m, 3H), 1,68 (d, 2Н), 2,27 (m, 2H), 3,68 (d, 2H), 4,73 (d, 2H), 6,97 (t, 1H), 7,07 (d, 1H), 7,35 (d, 1H), 7,72 (d, 1H), 7,99 (d, 1H), 8,24 (d, 1H), 8,71 (s, 1H), 9,12 (d, 1H), 9,48 (t, 1H).
Пример 14.
Метил-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоксамидо-ацетат, (1.2.1) {3}: выход 56%; т.пл. 89-91°С (метиленхлорид-гексан); 1H ПМР δ 0,91 (d, 3H), 1,29 (m, 3H), 1,70 (d,), 2,31 (m, 2H), 3,79 (d, 2H), 3,83 (s, 3H), 4,17 (d, 2H), 7,69 (d, 1H), 7,95 (d, 1H), 8,12 (d, 1H), 8,76 (s, 1H), 9,08 (d, 1H), 9,17 (t, 1H).
Пример 15.
N-4-(2-Метокси-карбонилтиофен-3-ил)-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоксамид, (1.2.1) {4}: выход 76%; т.пл. 207-209°С (с разл.) (метиленхлорид-гексан); 1H ПМР δ 0,92 (d, 3H), 1,30 (m, 3H), 1,71 (d, 2H), 2,32 (m, 2H), 3,77 (d, 2H), 3,89 (s, 3H), 7,81 (d, 1H), 7,94 (d, 1H), 8,03 (d, 1H), 8,27 (d, 1H), 8,29 (d, 1H), 8,86 (s, 1H) 9,22 (d, 1H), 11,04 (s, 1H).
Пример 16.
N-4-(4-Этоксикарбонилфенил)-6-(4-метилпиперидиносульфонил)-4-хинолин-карбоксамид, (1.2.1) {5}: выход 92%; т.пл. 237-239°С (метиленхлорид-гексан); 1H ПМР δ 0,95 (d, 3H), 1,32 (m, 3H), 1,42 (t, 3H), 1,73 (d, 2H), 2,34 (m, 2H), 3,74 (d, 2H), 4,33 (q, 2H), 7,89 (d, 1H), 7,97 (m, 5H), 8,27 (d, 1H), 8,70 (s, 1H) 9,18 (d, 1H), 10,98 (s, 1H).
Пример 17.
N-4-(Диэтил)-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоксамид, (1.2.1) {6}: выход 52%; выход 31%; т.пл. 127-129°С (циклогексан); 1H ПМР δ 0,88 (d, 3H), 1,01 (t, 3H), 1,22 (m, 3H), 1,31 (t, 3H), 1,69 (d, 2H), 2,28 (m, 2H), 3,10 (m. 2H), 3,66 (m. 2H), 3,70 (d, 2H), 7,56 (d, 1H), 7,98 (d, 1H), 8,04 (s, 1H), 8,24 (d, 1H), 9,07 (d, 1H).
Пример 18.
N-4-(2-Хлор-этил)-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоксамид, (1.2.1) {7}: выход 18%; т.пл. 159-160°С (метиленхлорид-гексан); 1H ПМР δ 0,94 (d, 3H), 1,32 (m, 3H), 1,72 (d, 2H), 2,31 (m, 2H), 3,75 (m, 6H), 7,69 (d, 1H) 8,54 (d, 1H), 8,18 (d, 1H), 8,72 (s, 1H), 9,01 (t, 1H), 9,06 (d, 1H).
Комбинаторная библиотека 6-сульфамоилхинолин-4-карбоксамидов общей формулы (1.2). Параллельный синтез комбинаторной библиотеки проводят в двух синтезаторах "CombiSyn-012-3000". В каждый из 18 используемых реакторов обоих синтезаторов загружают по 1 эквиваленту соответствующей кислоты (1.1) в сухом метиленхлориде при интенсивном перемешивании и комнатной температуре, прибавляют по 1,1 эквивалента 1,1’-карбонилдиимидазола и продолжают перемешивать до полного растворения кислот. На 1 г кислоты (1.1) используют 40 мл метиленхлорида. В зависимости от используемой кислоты время перемешивания до полного растворения колеблется от 30 минут до нескольких часов. Образование имидазолидов кислот (1.1.8) контролируют с помощью ТСХ (силикагель, хлороформ : метанол = 19:1 по объему). По окончании образования имидазолидов к реакционным смесям при перемешивании и при комнатной температуре прибавляют по 1,1 эквивалента соответствующего амина (4), после чего реакционные смеси кипятят в течение 5 часов. Окончание реакции контролируют с помощью ТСХ. После окончания реакций к реакционным массам при перемешивании прибавляют 2% раствор соды, органический слой отделяют и последовательно промывают 1% раствором соды, водой и 1% раствором соляной кислоты и снова водой, сушат безводным сульфатом натрия, фильтруют и упаривают в вакууме досуха. Получают амиды (1.2), которые перекристаллизовывают из подходящих растворителей. Получают комбинаторную библиотеку, включающую 18 6-сульфамоилхинолин-4-карбоксамидов (1.2). Их названия, выходы, точки плавления и спектральные данные приводится ниже.
Пример 19.
1-Азепанил-6-(4-метилпиперидино-сульфонил)-2-фенил-4-хинолилметанон, (1.2.2) {1}: выход 37%, т.пл. 217-219°С; 1H ПМР δ 0,92 (d, J=5,30 Hz, 3H), 1,19-1,37 (m, 3H), 1,46-1,80 (m, 8H), 1,87-1,98 (m, 2H), 2,28-2,36 (m, 2H), 3,23-3,34 (m, 2H), 3,74 (d, J=11,50 Hz, 2H), 2,83 (s, 3H), 3.71 (d, J=11,90 Hz, 2H), 3,62-3,98 (m, 1H), 7,47-7,57 (m, 3H,), 7,98 (dd, J=1,60 Hz, J=8,75 Hz, 1H), 8,08 (d, J=1,60 Hz, 1H), 8,12 (s, 1H), 8,26 (d, J=8,75 Hz, 1H), 8,29-8,34 (m, 2H); 13C ЯМР δ 21,19, 25,83, 27,10, 28,43, 29,13, 32,83, 44,68, 45,88, 48,81, 116,22, 121,83, 124,75, 126,92, 127,21, 128,51, 130,12, 130,79, 133,72, 137,02, 144,70, 148,35, 157,97, 165,63; MS m/z 394 (М·+-С6Н12Н), 365 (M·+-C6H12NCO), 330 (M·+-C6H12NSO2).
Пример 20.
N-4-(4-Метил-фенетил)-6-(1-азепанилсульфонил)-2-(3-пиридил)-4-хинолинкарбоксамид, 1.2.2) {2}: выход 80%; т.пл. 246-247°С; 1H ПМР δ 1,60 (br s, 4H), 1,72 (br s, 4H), 2,32 (s, 3H), 2,99 (m, 2H), 3,32 (br s, 4H), 3,57-3,72 (m, 2H), 7,07 (d, J=0,80 Hz, 2H), 7,19 (d, J=0,80 Hz, 2H), 7,52-7,58 (m, 1H), 8,04 (dd, J=1,00 Hz, J=8,90 Hz, 1H), 8,20 (s, 1H), 8,25 (d, J=8,90 Hz, 1H), 8,60-8,70 (m, 2H), 8,80 (br s, 2H), 9,45 (s, 1H).
Пример 21.
N-4-(2-Фурилметил)-6-морфолиносульфонил-2-(2-пиридил)-4-хинолинокарбоксамид (1.2.2){3}: выход 53%; т.пл. 255-257°С; 1H ПМР δ 2,90-3,10 (m, 4H), 3,60-3,80 (m, 4H), 4,60 (d, J=5.10 Hz, 2H) 6,33 (d, J=1.00 Hz, 1H), 6,42 (d, J=1.00 Hz, 1H), 7,55-7,61 (m, 2H), 8,03-8,10 (m, 2H), 8,35 (d, J= 8,20 Hz, 1H), 8,65-8,75 (m, 1H), 8,60 (br s, J=1,00 Hz, 1H), 8,75-8,83 (m, 1H), 8,78 (s, 1H), 9,58 (t, J=5,10 Hz, 1H).
Пример 22.
N-4-(3-Метоксипропил)-6-(4-метилпиперидино-сульфонил)-2-(2-тиенил)-4-хинолинокарбоксамид (1.2.2){4}: выход 14%; mp 241-242°С; 1H ПМР δ 0,91 (d, J=5,00 Hz, 3H), 1,20-1,40 (m,), 1,70 (d, J=10,80 Hz, 2H), 1,88 (t, J=7.00 Hz, 2H), 2,22-2,38 (m, 2H), 3,32 (s, 3H), 3,40-3,54 (m, 4H), 3,75 (d, J=10,80 Hz, 2H), 7,22 (m, J=3,90 Hz, J=3,10 Hz, 1H), 7,63 (d, J=3,90 Hz,), 7,93 (dd, J=1,10 Hz, J=9,20 Hz, 1H), 8,01 (d, J=3,10 Hz, 1H), 8,14 (d, J=9,20 Hz, 1H), 8,17 (s, 1H), 8,67 (d, J=1,10 Hz, 1H), 8,80 (t, J=4,50 Hz, 1H).
Пример 23.
N-4-(3-Этил-3-метиланилинопропил)-6-морфолиносульфонил-2-(2-пиридил)-4-хинолинокарбоксамид (1.2.2) {5}: выход 50%; т.пл. 206-208°С; 1Н ПМР δ 1,02 (t, J=3,20 Hz, 3H), 1,90 (t, J=3,10 Hz, 3H), 2,20 (s, 3H), 2,90-3,05 (m, 4H), 3,35-3,45 (m, 4H), 3,49 (q, J=3,20 Hz, 3H), 3,60-3,70 (m, 4H), 6,35 (d, J=7,30 Hz, 1H), 6,48 (s, 1H), 6,49 (d, J=7,30 Hz, 1H), 6,99 (t, J=7,30 Hz, 1H), 7,54-7,61 (m, 1H), 8,00-8,10 (m, 2H), 8,35 (d, J=9,45 Hz,), 8,63-8,73 (m, 1H), 8,74 (br s, 1H), 8,75-8,80 (m, 1H), 8,82 (s, 1H), 9,07 (t, J=6,30 Hz, 1H).
Пример 24.
Этил 1-[6-морфолино-сульфонил-2-(2-пиридил)-4-хинолинокарбонил]-4-пиперидинокарбоксилат (1.2.2){6}: выход 54%; т.пл. 112-115°С; 1H ПМР δ 1,17-4,80 (br m, 9H), 1,22 (t, J=6,40 Hz, 3H), 3,00 (m, 4H), 3,67 (m, 4H), 4,10 (q, J=6,40 Hz, 3H), 4,40-5,80 (m, 1H), 7,46-7,54 (m, 1H), 7,94-8,05 (m, 1H), 8,04 (dd, J=1,00 Hz, J=9,90 Hz, 1H), 8,09-8,20 (m, 1H), 8,34 (d, J=9,90 Hz, 1H), 8,62 (br s, 1H), 8,66-8,80 (m, 2H).
Пример 25 стал 12-25.
Пример 26.
N-4-Бензил-6-морфолино-сульфонил-2-(2-пиридил)-4-хинолинокарбоксамид, (1.2.2) {8}: выход 40%; т.пл. 268-270°С (этанол); 1H ПМР δ 2,80-3,05 (m, 4Н), 3,50-3,75 (m, 4Н), 4,60 (d, 2H, J=6,60 Hz), 7,20-7,70 (m, 6H), 7,95-8,10 (m, 4Н), 8,34 (d, J=7,90 Hz), 8,60-8,85 (m, 5Н), 9,56 (m, 1H, J=6,60 Hz).
Пример 27.
N-4-изо-Пропил-6-морфолиносульфонил-2(2-пиридил)-4-хинолино-карбоксамид, (1.2.2){9}: выход 44%; т.пл. 242-243°С (из спирта); 1H ПМР δ 1,30 (d, 6H, J=6,40 Hz), 2,92-3,10 (m, 4H), 3,60-3,75 (m, 4H), 3.20-4.32 (m, 1H), 7,57-7,65 (m, 1H), 8,02-8,10 (m, 2H), 8,34 (d, J=8,70 Hz, 1H), 8,68 (m, 2H), 8,72 (s, 1H), 8,81 (d. J=2,00 Hz, 1H), 8,87 (d, J=5,80 Hz, 1H).
Пример 28.
N-4-Бензил-6-(4-метилпиперидиносульфонил)-4-хинолинкарбоксамид (1.2.2) {10}: выход 24%; т.пл. 266-267°С (из спирта); 1Н ПМР δ 0,88 (d, J=5.00 Hz, 3H), 1,12-1,35 (m, 3H), 1,68 (d, J=10,80 Hz, 2H), 2,22-2,35 (m, 2H), 3,65 (d, J=10,20 Hz, 2H), 4,61 (d, J=6,20 Hz, 2H), 7,25 (m, J=3,90 Hz, J=3,10 Hz, 1H), 7,30 (t, J=6,30 Hz, 1H), 7,37 (t, J=6,30 Hz, J=7,50 Hz, 2H), 7,44 (d, J=7,50 Hz, 1H), 7,75 (d, J=3,90 Hz, 1H), 7,95 (dd, J=1,15 Hz, J=9,20 Hz, 1H), 8,10 (d, J=3,10 Hz, 1H), 8,16 (d, J=9,20 Hz, 1H), 8,30 (s, 1H), 8,68 (d, J=1,15 Hz, 1H), 9,45 (t, J=6,20 Hz, 1H).
Пример 29.
N-4-(4-Метилфенил)-6-(1-азепанилсульфонил)-2-(3-пиридил)-4-хинолинкарбоксамид, (1.2.2) [11}: выход 80%; т.пл. 246-247°С (из спирта); 1H ПМР δ 1,60 (br s, 4H), 1,72 (brs, 4H), 2,32 (s, 3H), 2,99 (m, 2H), 3,32 (br.s, 4H), 3,57-3,72 (m, 2H), 7,07 (d, J 0.80 Hz, 2H), 7,19 (d, J=0.80 Hz, 2H), 7,52-7,58 (m, 1H), 8,04 (dd, J=1.00 Hz, J=8,90 Hz, 1H), 8,20 (s, 1H), 8,25 (d, J=8,90 Hz, 1H), 8,60-8,70 (m, 2H), 8,80 (br s, 2H), 9,45 (s, 1H).
Пример 30.
N-4-(3-изо-Пропоксипропил)-6-(метилпиперидиносульфонил)-2-(3-пиридил)-4-хинолинокарбоксамид, (1.2.2) {12}: метод Г - выход 73%; т.пл. 222-224°С (из спирта); 1H ПМР δ 0,91 (d, J=5,00 Hz, 3H), 1,30 (d, J=7,40 Hz, 6H), 1,22-1,32 (m, 3H), 1,71 (d, J=10,40 Hz, 2H), 1,89 (t, J=7,45 Hz, 2H), 2,25-2,40 (m, 2H), 3,40-3,60 (m, 5H), 3,80 (d, J=10,40 Hz, 2H), 7,48-7,53 (m, 1H), 7,98 (dd,7=1.00 Hz, J=8,70 Hz, 1H), 8,25 (d, J=8,70 Hz, 1H), 8,33 (s, 1H), 8,64-8,72 (m, 2H), 8,77 (t, J=5,10 Hz, 1H), 8,85 (br s, J=1.00 Hz, 1H), 9,48 (s, 1H).
Пример 31.
N-4-(4-Метилбензил)-6-(метилпиперидиносульфонил)-2-(3-пиридил)-4-хинолинокарбоксамид, (1.2.2){13}: метод Г - выход 49%; т.пл. 251-253°С (из спирта); 1H ПМР δ 0,89 (d, J=5,00 Hz, 3H), 1,18-1,35 (m, 3H), 1,71 (d, J=10,10 Hz, 2H), 2,20-2,41 (m, 2H), 2,35 (s, 3H), 3,82 (d, J=10,10 Hz, 2H), 5,60 (d, J=5,40 Hz, 2H), 7,15 (d, J=8,45 Hz. 2H), 7,35 (d, J=8,45 Hz, 2H), 7,53-7,58 (m, 1H), 8,00 (dd, J=1,00 Hz, J=8,10 Hz, 1H), 8,26 (d, J=8,70 Hz, 1H), 8,38 (s, 1H), 8,63-8,77 (m, 2H), 8,83 (br s, J=1,00 Hz, 1H), 9,37 (t, J=5,60 Hz, 1H), 9,50 (s, 1H).
Пример 32.
N-4-(Метил)-6-(метилпиперидиносульфонил)-2-(2-пиридил)-4-хинолинокарбоксамид, (1.2.2) {14}: метод Г - выход 52%; т.пл. 275-276°С (из спирта); 1H ПМР δ 0,92 (d, J=5,00 Hz, 3H), 1,21-1,40 (m, 3H), 1,75 (d, J=10,00 Hz, 2H), 2,28-2,45 (m, 2H), 3,02 (d, J=7,20 Hz, 3H), 3,73 (d, J=10,00 Hz, 2H), 7,42-7,55, (m, 1H,), 7,90-8.05 (m, 2H), 8,25 (d, J=9,10 Hz, 1H), 8,68-8,88 (m, 5H).
Пример 33.7.
N-4-(4-Метилбензил)-6-(метилпиперидиносульфонил)-2-(2-пиридил)-4-хинолинокарбоксамид, (1.2.2){75}: метод Г - выход 80%; т.пл. 267-269°С (из спирта); 1H ПМР δ 0,91 (d, J=4.50 Hz, 3H), 1,22-1,38 (m, 3H), 1,70 (d, J=11,50 Hz, 2H), 2,25-2,40 (m, 2H), 2,35 (s, 3H), 3,74 (d, J=11,50 Hz, 2H), 4,69 (d, J=7.20 Hz, 2H), 7,15 (d, J=6,70 Hz, 2H), 7,38 (d, J=6.70 Hz, 2H), 7,38-7,48, (m, 1H), 7,80-8,05 (m, 2H), 8,24 (d, J=9,10 Hz, 1H), 8,68-8,73 (m, 2H), 8,75 (d, J=4,20 Hz, 1H), 8,78 (s, 1H), 9,30 (br s, 1H).
Пример 34.
N-4-(2-фурилметил)-6-морфолиносульфонил-2-(2-пиридил)-4-хинолинокарбоксамид, (1.2.2) {16}: метод Г - выход 53%; Т.пл. 255-257°С (из спирта); 1H ПМР δ 2,90-3,10 (m, 4Н), 3,60-3,80 (m, 4H), 4,60 (d, 2H, J=5,10 Hz) 6,33 (d, J=1.00 Hz, 1H), 6,42 (d, J=1,00 Hz, 1H), 7,55-7,61 (m, 2H), 8,03-8,10 (m. 2H), 8,35 (d, J=8,20 Hz, 1H), 8,65-8,75 (m, 1H), 8,60 (br s, J=1,00 Hz, 1H), 8,75-8,83 (m, 1H), 8,78 (s, 1H), 9,58 (t, 1H, J= 5,10 Hz).
Пример 35.
Этил [6-морфолиносульфонил-2-(2-пиридил)-4-хинолинокарбонил]-4-пиперидинокарбоксилат, (1.2.2){17}: метод Г - выход 54%; т.пл. 112-115°С (из эфира); 1H ПМР δ 1,17-4,80 (br m, 9H), 1,22 (t, J=6,40 Hz, 3H), 3,00 (m, 4H), 3,67 (m, 4H), 4,10 (q, J=6,40 Hz, 3H), 4,40-5,80 (m, 1H), 7,46-7,54 (m, 1H), 7,94-8,05 (m, 1 Н), 8,04 (dd, J=1,00 Hz, J=9,90 Hz, 1H), 8,09-8,20 (m, 1H), 8,34 (d, J=9,90 Hz, 1H), 8,62 (br s, 1H), 8,66-8,80 (m, 2H).
Пример 36.
N-4-(3-Метоксипропил)-6-(метилпиперидиносульфонил)-2-(2-тиенил)-4-хинолинокарбоксамид, (1.2.2){18}: метод Г - выход 14%; т.пл. 241-242°С (из спирта); 1H ПМР δ 0,91 (d, J=5.00 Hz, 3H), 1,20-1,40 (m, 3H), 1,70 (d, J=10,80 Hz, 2H), 1,88 (t, J=7,00 Hz, 2H), 2,22-2,38 (m, 2H), 3,32 (s, 3H), 3,40-3,54 (m, 4H), 3,75 (d, J= 10,80 Hz, 2H), 7,22 (m, J=3,90 Hz, J=3,10 Hz, 1H), 7,63 (d, J=3,90 Hz, 1H), 7,93 (dd, J=1,10 Hz, J=9.20 Hz, 1H), 8,01 (d, J=3,10 Hz, 1H), 8,14 (d, J=9,20 Hz, 1H), 8,17 (s, 1H), 8,67 (d, J=1,10 Hz, 1H), 8,80 (t, J=4,50 Hz, 1H).
Пример 37.
N-4-(3-Этил-3-метиланилинопропил)-6-морфолиносульфонил-2-(2-пиридил)-4-хинолинокарбоксамид, (1.2.2){19}: метод Г - выход 50%; т.пл. 206-208°С (из эфира); 1H ПМР δ 1,02 (t, J=3,20 Hz, 3H), 1,90 (t, J=3,10 Hz, 3H), 2,20 (s, 3H), 2,90-3,05 (m, 4H), 3,35-3,45 (m, 4H), 3,49 (q, J=3,20 Hz, 3H), 3,60-3,70 (m, 4H), 6,35 (d, J=7,30 Hz, 1H), 6,48 (s, 1Н), 6,49 (d, J=7,30 Hz, 1H), 6,99 (t, J=7,30 Hz, 1H), 7,54-7,61 (m, 1Н), 8,00-8,10 (m, 2Н), 8,35 (d, J=9,45 Hz, 1H), 8,63-8,73 (m, 1H), 8,74 (br s, J=1,00 Hz, 1H), 8,75-8,80 (m, 1H), 8,82 (s, 1H), 9,07 (t, J=6,30 Hz, 1H).
Пример 38.
2-Метил-6-(метилпиперидиносульфонил)-4-хинолинокарбоксамид, (1.2.2){20}. Перемешивают при комнатной температуре 2,29 г (7.43 ммоль) 6-(метилпиперидиносульфонил)изатина (2) {1}, 17 мл ацетона (229.20 ммоль) в 85 мл (1200 ммоль) 25% водного аммиака в течение 2 часов, после чего выдерживают реакционную массу в течение 15 часов при слабом кипении, охлаждают, осадок отфильтровывают, промывают водой до нейтральной реакции, сушат и перекристаллизовывают из метиленхлорида. Получают 0,89 г (34%) продукта (1.2.2){20} с т.пл >255°С. 1H ПМР δ 0,91 (d, J=5,30 Hz, 3H), 1,20-1,34 (m, 3H), 1,70 (d, J=10,40 Hz, 2Н), 2,24-2,33 (m, 2H,), 2,77 (s, 3H), 3,73 (d, J=11,30 Hz, 2H), 7,63 (s, 1H), 7,72 (br s, 1H), 7,89 (dd, J=1,70 Hz, J=8,75 Hz, 1H), 8,07 (d, J=8,75 Hz, 1H), 8,14 (br s, 1H), 8,75 (dd, J=1,75 Hz, 1H); 13C ЯМР δ 21,20, 24,99, 29,15. 37,78, 45,94, 121,26, 121,75, 126,09, 126,60, 129,98, 133,27, 142,51, 148,68, 161,89, 167,72; MS m/z 347 (М·+).
Пример 39.
2-Фторбензил 6-(метилпиперидиносульфонил)-4-хинолинкароксилат, (1.3){1}: К суспензии 0,39 г (1,27 ммоль) кислоты (1.1.1){20} в 2 мл диметилсульфоксида прибавляют при перемешивании и 20°С раствор 0,07 г (1,27 ммоль) КОН в 4 мл смеси этанол-диметилсульфоксид (1:1). К полученному раствору прибавляют раствор 0,29 г (1,53 ммоль) 2-фторбензилбромида (5) в 1 мл диметилсульфоксида. Реакционную массу перемешивают 3 часа при 20°С, прибавляют 50 мл воды, осадок отфильтровывают, промывают водой (4×5 мл), сушат и промывают 20 мл кипящего метанола. Кристаллы отфильтровывают и получают 0,39 г (1.3) {1}. Выход 74%; т.пл. 122-124°С (метанол); ИК: 1725 cm-1; 1H ПМР δ 0,92 (d, 3H), 1,28 (m, 3H), 1,66 (d, 2H), 2,25 (m,), 3,70 (d, 2H), 5,55 (s, 2H), 7,15 (m, 1H), 7,22 (m, 1H), 7,40 (m, 1H), 7,63 (m, 1H), 7,98 (d, 1H), 8,11 (d, 1H), 8,24 (d, 1H), 9,14 (d, 1H), 9,18 (s, 1H).
Пример 40.
Этил [6-(4-метилпиперидиносульфонил)-4-хинолинокарбонил]тиогликолат, (1.3){2}: К раствору 0,04 г (0,33 ммоль) этилгликолата (5) в 5 мл сухого диоксана прибавляют 0,33 ммоль этилата натрия в этаноле в виде 0,75 М раствора и через 10-15 минут упаривают реакционную массу досуха. К сухому остатку прибавляют 25 мл диоксана, 0,1 г (0,31 ммоль) хлорангидрида кислоты (1.1.7){1}, синтез которого описан ниже. Реакционную массу перемешивают 12 часов при 20°С, после чего упаривают в вакууме досуха. Остаток размешивают в 25 мл воды и нейтрализуют содой до рН 8-9, продукт экстрагтруют метилен хлоридом (3×15 мл), экстракт сушат безводным сульфатом натрия, фильтруют и упаривают в вакууме досуха. Остаток перекристаллизовывают из циклогексана, получают 0,05 г эфира (1.3){2}. Выход 39%; т.пл. 80-81°С**(циклогексан); 1H ПМР δ 0,96 (d, 3H), 1,12 (m, 3H), 1,13 (t, 3H), 1,70 (d, 2H), 2,31 (m, 2H), 3,77 (d, 2H), 4,03 (s, 2Н), 4,23 (q, 2H), 8,02 (m, 2H), 8,26 (d, 1H), 8,68(s, 1H), 9,18(d, 1H).
Пример 41.
6-(4-Метилпиперидиносульфонил)-4-хинолинокарбонил хлорид, (1.1.7){1}: Перемешивают 0,20 г (0,66 ммоль) кислоты (1.1.1){2} в 5 мл хлорокиси фосфора при 70°С до полного растворения кислоты (15-20 минут). Полученный раствор выдерживают 12 часов при 20°С, после чего упаривают в вакууме досуха. Остаток промывают 10 мл сухого эфира, осадок отфильтровывают и промывают на фильтре гексаном. Получают 0,14 г хлорида (1.1.7){7}. Выход 74%; т.пл. 286-290°С. Продукт не рекомендуется хранить и используют сразу в дальнейших синтезах.
Примеры 42, 43. Общий способ получения аммонийных солей 6-сульфамоилхинолин-4-карбоновых кислот общей формулы (1.4). Перемешивании 0,19 ммоль кислоты (1.1) и 0,19 ммоль амина (6) в 1 мл метанола при 20°С до полного растворения кислоты (1 час). Полученный раствор упаривают досуха в вакууме. Получают соль в виде белого кристаллического вещества.
Пример 42.
N,N-диметиламино 6-(4-метилпиперидиносульфонил)-4-хинолинокарбксилат, (1.4){1}: выход 94%; т.пл. 304°С (разл.); ИК 2620 см-1; 1H ПМР δ 0,80 (d, 3H), 1,15 (m, 3H), 1,20 (t, 6H), 1,63 (d, 2H), 2,24 (m, 2H), 2,92 (q, 4H), 3,63 (d, 2Н), 7,69 (d, 1H), 7.88 (d, 1H), 8,14 (d, 1H), 8,97 (d, 1H), 8,50-9,50 (b s, 2H), 9,31 (s, 1H).
Пример 43.
N,N,N-триэтиламино 6-(4-метилпиперидино-сульфонил)-4-хинолинокарбксилат, (1.3){1}: выход 91%; масло; 1H ПМР δ 0,91 (d, 3H), 1,18-1,29 (m, 12Н), 1,69 (d, 2H), 2,26 (m, 2H), 3,04 (q, 6H), 3,70 (d, 2H), 7,87 (m, 2H), 8.14 (d, 1H), 9,01 (d, 1H) 9,42 (s, 1H).
Пример 44.
4-Метил-8-(4-метилпиперидиносульфонил)-1,3-дигидрофуро[3,4-с]хинолин-1,3-дион, (1.5){1}. Перемешивают до полного растворения при 100°С 1,35 г (3,43 ммоль) кислоты 2-метил-6-(4-метилпиперидиносульфонил)хинолин-3,4-дикарбоновой кислоты (1.1.4)){1} в 15 мл уксусного ангидрида. Полученный раствор охлаждают до 0°С и выдерживают при этой температуре 3-4 часа. Выпавший осадок отфильтровывают, промывают на фильтре эфиром, гексаном и сушат в вакууме при 50-60°С. Получают 0,69 г (54%) продукта (1.5){1} с т.пл. 141-143°С, MS m/z 373 (М·+-1).
Комбинаторная библиотека 4-метил-8-(4-метилпиперидино-сульфонил)-2,3-дигидро-1H-пирроло[3,4-с]хинолин-1,3-дионов (1.6{1-13}). Параллельный синтез комбинаторной библиотеки проводят в синтезаторе "CombiSyn-012-3000". В каждый из шести реакторов синтезатора загружают один из 8-сульфамоил-1,3-дигидрофуро[3,4-с]хинолин-1,3-д ионов общей формулы (1.5), один из аминов (7) и триэтиламин в мольном соотношении 1:1:0,1, на 1 г ангидрида используют 20 мл толуола. Реакционные массы перемешивают при кипении реакционных масс в течение 20-48 часов до окончания реакции. Контроль протекания реакции осуществляют с помощью ТСХ (силикагель, хлороформ: метанол = 19:1). После окончания реакций толуол отгоняют в вакууме досуха, к остаткам в каждый реактор синтезатора прибавляют метиленхлорид, перемешивают и отфильтровывают осадки. Фильтраты трижды промывают 3% водным раствором гидроксида натрия, водой, 10% соляной кислотой и снова водой. Сушат безводным сульфатом натрия, фильтруют, отгоняют растворитель в вакууме а остатки хроматографируют на силикагеле метиленхлоридом, а затем смесью метиленхлорид : метанол = 99:1. Получают комбинаторную библиотеку, включающую шесть 4-метил-8-(4-метилпиперидиносульфонил)-2,3-дигидро-1H-пирроло[3,4-с]хинолин 1,3-дионов (1.6), названия которых, их выход, т.пл. и спектральные данные приведены ниже.
Пример 45.
2-Циклогексил-4-метил-8-(4-метилпиперидиносульфонил)-2,3-дигидро-1H-пирроло[3,4-с]хинолин-1,3-дион, (1.6) {1}: выход 19%; т.пл. 223-225°С; 1H ПМР δ 0,91 (d, J=5,70 Hz, 3H), 1.17-1,50 (m, 6H), 1,64-1,83 (m, 5H), 1,91 (d, J=11,60 Hz, 2H), 2,10-2,24 (m, 2H), 2,29-2,40 (m, 2H), 3,01 (s, 3H), 3,78 (d, J=11,60 Hz, 2H), 4,00-4,12 (m, 1H), 8,11 (dd, J=1,20 Hz, J=8,80 Hz, 1H), 8,24 (d, J=8,80 Hz, 1H), 9,05 (br s, 1H); 13C ЯМР δ 20,76, 21,50, 24,63, 25,22, 28,88, 29,18, 32,63, 45,60, 50,48, 118,93, 122,93, 124,21, 128,69, 130,09, 136,23, 136,37, 150,79, 157,02, 167,07, 167,19; MS m/z 456 (М+Н).
Пример 46.
2-Циклогептил-4-метил-8-(4-метилпиперидино-сульфонил)-2,3-дигидро-1H-пирроло[3,4-с]хинолин-1,3-дион, (1.6) {2}: выход 42,0%, т.пл. 221-222°С; 1H ПМР δ 0,89 (d, J=6,40 Hz, 3H), 1,14-1,40 (m, 3H), 1,45-2,00 (m, 12H), 2,13-2,26 (m, 2H), 2,29-1,40 (m, 2H), 2,98 (s, 3H), 1,95 (m, 2H), 2,31 (m, 2H), 3,74 (d, J=11,30 Hz, 2H), 4,16-4,27 (m, 1H), 8,13 (dd, J=1,45 Hz, J=9,05 Hz, 1H), 8,26 (d, J=9,05 Hz, 1H), 9,02 (br s, 1H); 13C ЯМР δ 21,11, 21,81, 24,94, 27,34, 29,16, 32,05, 32,88, 45,93, 52,29, 119,21, 123,28, 124,52, 128,99, 130,36, 136,18, 136,74, 151,01, 157,30, 167,17, 167,31; MS m/z 470 (M+H).
Пример 47. Метил 2-[4-метил-8-(4-метилпиперидиносульфонил)-1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолин-2-ил]ацетат, (1.6){3}: выход 23%; т.пл. 128-130°С; 1H ПМР δ 0,93 (d, J=5,40 Hz, 3H), 1,21-1,37 (m, 3H), 1,72 (d, J=10,90 Hz, 2H), 2,30-2,41 (m, 2H), 3,05 (s, 3H), 3,74-3,82 (m, 2H), 3,79 (s, 3H), 4,48 (s, 2H), 8,13 (dd, J=1,73 Hz, J=9,05 Hz, 1H), 8,24 (d, J=9,05 Hz, 1H), 9,02 (d, J=1,73 Hz, 1H); 13C ЯМР δ 21,21, 22,01, 29,11, 32,81, 45,89, 118,74, 122,81, 124,05, 129,08, 130,12, 135,75, 136,26, 150,74, 156,99, 166,07, 166,15, 167,11; MS m/z 446 (M+H).
Пример 48.
2-(2-Гидроксиэтил)-4-метил-8-(4-метилпиперидиносульфонил)-2,3-дигидро-1H-пирроло[3,4-с]хинолин-1,3-дион, (1.6){4}: выход 25%; т.пл. 134-136°С; 1H ПМР δ 0,92 (d, J=5,10 Hz,), 1,21-1,36 (m, 3H), 1,71 (d, J=11,50 Hz, 2H), 2,30-2,40 (m, 2H), 3,03 (s, 3H), 3,67 (t, J=5,50 Hz, 2H), 3,74-3,82 (m, 4H), 8,10 (dd, J=1,63 Hz, J=9,00 Hz, 1H), 8,22 (d, J=9,00 Hz, 1H), 9,05 (d, J=1,63 Hz, 1H); 13C ЯМР δ 21,21, 21,91, 29,14, 32,81, 40,52, 45,91, 57,69, 118,75, 123,05, 124,08, 128,75, 130,04, 135,55, 136,51, 150,51, 156,75, 166,91, 167,06; MS m/z 418 (M+H).
Пример 49.
Метил 3-[4-метил-8-(4-метилпиперидиносульфонил)-1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолин-2-ил]-2-тиофенкарбоксилат, (1.6){5}: выход 17%; т.пл. 234-236°С; 1H ПМР δ 0,93 (d, J=5,70 Hz, 3H), 1,22-1,36 (m, 3H), 1,71 (d, J=11,60 Hz, 2H), 2,33-2,42 (m, 2H), 3,08 (s, 3H), 3,75-3,82 (m, 2H), 3,79 (s, 3H), 7,26 (d, J=5,25 Hz, 1H), 7,95 (d, J=5,25 Hz, 1H), 8,16 (dd, J=1,67 Hz, J=9,00 Hz, 1H), 8,29 (d, J=9,00 Hz, 1H), 9,07 (d, J=1,67 Hz, 1H); 13C ЯМР δ 21,21, 22,11, 29,12, 32,82, 45,89, 52,25, 118,82, 122,91, 124,08, 126,36, 128,18, 129,25, 130,24, 131,80, 132,52, 135,99, 136,36, 150,18, 157,22, 159,68, 164,96, 165,06; MS m/z 514 (M+H).
Пример 50.
Этил 2-[4-метил-8-(4-метилпиперидино-сульфонил)-1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолин-2-ил]-1,3-тиазол-4-илацетат, (1.6) {6}: выход 11%; т.пл 175-177°С; 1H ПМР δ 0,93 (d, J=5,30 Hz, 3H), 1,23-1,35 (m, 3H), 1,31 (t, J=7,00 Hz, 3H), 1,72 (d, J=11,70 Hz, 2H), 2,31-2,40 (m, 2H), 3,08 (s, 3H), 3,80 (d, J=11,10 Hz, 2H), 3,84 (s, 2H) 4,17 (q, J=7,00 Hz, 2H), 7,49 (s, 1H), 8,16 (dd, J=1,00 Hz, J=9,15 Hz, 1H), 8,28 (d, J=9,15 Hz, 1H), 9,09 (br s, 1H); 13C ЯМР δ 14,12, 21,22, 22,15, 29,14, 32,80, 36,46, 45,93, 60,30, 116,79, 118,78, 122,75, 124,13, 129,24, 130,19, 135,88, 136,24, 145,49, 149,98, 150,66, 157,29, 163,85, 163,99, 169,10; MS m/z 543 (M+H).
По аналогичной методике получают соединения 1.6 {7-13}, представленные ниже.
1-[2-(2-Метоксикарбонил-этил)-4-метил-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-8-сульфонил]-пиперидин-4-карбоновая кислота 1.6 {7}: MS m/z 490 (М+Н).
(S)-(+)-3-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-бензойная кислота 1.6 {8}: MS m/z 510 (М+Н).
(S)-(+)-4-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-илметил]-бензойная кислота 1.6 {9}: MS m/z 534 (М+Н).
(S)-(+)-2-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-1,3-дион-2-ил]-3-метил-бутановая кислота 1.6 {10}: MS m/z 490 (М+Н).
(S)-(+)-3-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-4-метил-пентановая кислота 1.6 {11}: MS m/z 504 (М+Н).
(S)-(+)-1-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-циклогексил-уксусная кислота 1.6 {12}: MS m/z 530 (М+Н).
(S)-(+)-3-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-5-метил-гексановая кислота 1.6 {13}: MS m/z 51S (М+Н).
Примеры 51. Комбинаторная библиотека амидов 4-метил-1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолин-8-сульфоновых кислот (1.6 {1-6, 14-}). В реактор синтезатора загружают 0.2 ммоль дикарбоновой кислоты 1.1.4 и 0.4 мл свежеприготовленного 1.1 М раствора карбонилдиимидазола в N-метилпирролидоне, реакционную смесь перемешивают до полного прекращения выделения CO2. После этого добавляют 0.2 мл 1 М раствора соответствующего амина, смесь перемешивают при комнатной температуре 1 ч, затем 2 ч при 80°С, охлаждают, при перемешивании доводят объем реакционной смеси водой до 3 мл, добавляют 1 мл насыщенного раствора бикарбоната натрия, смесь перемешивают 30 мин. Выпавший осадок центрифугируют, промывают насыщенным раствором бикарбоната натрия, трижды водой, изопропанолом, кристаллизуют из минимального количества изопропанола либо суспендируют в кипящем изопропаноле, всякий раз отделяя осадок центрифугированием. Полученное вещество сушат в вакууме 1 ч, анализируют на LC-MS. В случаях, когда продукт загрязнен исходным амином, его дополнительно промывают 1N раствором НСl, дважды водой и дважды изопропанолом. Выходы составляют 15-65%. Получают комбинаторную библиотеку, включающую шесть амидов 4-метил-1,3-диоксо-2,3-дигидро1Н-пирроло[3,4-с]хинолин-8-сульфоновых кислот, названия которых и спектральные данные приведены ниже:
2-Циклогексил-4-метил-8-(4-метилпиперидиносульфонил)-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-1,3-дион 1.6{1}: выход 64%; т.пл. 223-225°С; MS m/z 456 (М+Н).
2-Циклогептил-4-метил-8-(4-метилпиперидиносульфонил)-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-1,3-дион 1.6 {2}: выход 60%, т.пл. 221-222°С; MS m/z 470 (М+Н).
Метил 2-[4-метил-8-(4-метилпиперидиносульфонил)-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-2-ил]ацетат 1.6{3}: выход 34%; т.пл. 128-130°С; MS m/z 446 (М+Н).
2-(2-Гидроксиэтил)-4-метил-8-(4-метилпиперидиносульфонил)-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-1,3-дион 1.6{4}: выход 35%; т.пл. 134-136°С; MS m/z 418 (М+Н).
Метил 3-[4-метил-8-(4-метилпиперидиносульфонил)-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-2-ил]-2-тиофенкарбоксилат 1.6{5}: выход 30%; т.пл. 234-236°C; MS m/z 514 (M+H).
Этил 2-[4-метил-8-(4-метилпиперидиносульфонил)-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-2-ил]-1,3-тиазол-4-илацетат 1.6{6}: выход 25%; т.пл 175-177°С; MS m/z 543 (М+Н).
2-(2-Метоксиэтил)-4-метил-8-(морфолино-4-сульфонил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{14}; MS m/z 420 (М+Н).
3-(1Н-Имидазол-4-ил)-2-[2-(2-метоксикарбонилэтил)-4-метил-1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолин-8-сульфониламино]-пропионовой кислоты метиловый эфир 1.6{15}; MS m/z 530 (М+Н).
3-[4-Метил-8-(1-октагидрохинолинилсульфонил)-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{16}; MS m/z 494 (М+Н).
3-[8-(3-Гидроксиметил-пиперидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидропирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{17}; MS m/z 476 (М+Н).
3-[4-Метил-8-(4-метил-[1,4]диазепан-1-сульфонил)-1,3-Диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{18}; MS m/z 475 (М+Н).
3-{4-Метил-8-[(1-метил-пиперазин-4-ил)-сульфамоил]-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{19}; MS m/z 461 (М+Н).
1-[2-(2-Метоксикарбонил-этил)-4-метил-1,3-диоксо-2,3-дигидро-1H-пирроло[3,4-с]хинолин-8-сульфонил]пирролидин-2-карбоновой кислоты метиловый эфир 1.6{20}; MS m/z 490 (М+Н).
3-(8-Диизопропилсульфамоил-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил)-пропионовой кислоты метиловый эфир 1.6{21}; MS m/z 462 (М+Н).
3-(8-Диметилсульфамоил-4-метил-1,3-диоксо-1,3-дигидро-пирроло [3,4-с]хинолин-2-ил)-пропионовой кислоты метиловый эфир 1.6{22}; MS m/z 406 (М+Н).
3-{8-[4-(2-Метоксиэтил)-пиперазин-1-сульфанил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{23}; MS m/z 505 (М+Н).
3-[8-(Этоксикарбонилметил-метил-сульфамоил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{24}; MS m/z 478 (М+Н).
3-{8-[Бис-(2-гидроксиэтил)-сульфамоил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{25}; MS m/z 466 (М+Н).
3-[8-(2-Этилпиперидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{26}; MS m/z 474 (М+Н).
3-{8-[4-(2-Гидроксиэтил)-пиперазин-1-сульфанил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{27}; MS m/z 491 (M+H).
3-[4-Метил-8-(метил-фенил-сульфамоил)-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6 {28}; MS m/z 468 (М+Н).
3-[4-Метил-8-(2-метил-пиперидин-1-сульфонил)-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{29}; MS m/z 460 (М+Н).
3-[4-Метил-1,3-диоксо-8-(пирролидин-1-сульфонил)-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{30}; MS m/z 432 (М+Н).
3-[8-(Циклогексил-метил-сульфамоил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{31}; MS w/z 474 (М+Н).
3-[8-(4-Гидроксипиперидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{32}; MS m/z 462 (М+Н).
3-{8-[2-(2-Гидроксиэтил)-пиперидин-1-сульфонил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{33}; MS m/z 476 (М+Н).
3-{8-[(2-Гидроксиэтил)-метил-сульфамоил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{34}; MS m/z 436 (M+H).
3-[4-Метил-8-(морфолино-4-сульфонил)-1,3-диоксо-1,3-дигидро-пирроло [3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{35}; MS m/z 448 (М+Н).
3-{4-Метил-8-[метил-(2-пиридин-2-ил-этил)-сульфамоил]-1,3-диоксо-1,3-дигидропирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{36}; MS m/z 497 (М+Н).
3-{8-[Этил-(2-гидроксиэтил)-сульфамоил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{37}; MS m/z 450 (М+Н).
1-[2-(2-Метоксикарбонил-этил)-4-метил-1,3-диоксо-1,3-дигидро-1Н-пирроло[3,4-с]хинолин-8-сульфонил]-пиперидин-3-карбоновой кислоты этиловый эфир 1.6{38}; MS m/z 518 (M+H).
3-{8-[Бис-(2-гидроксипропил)-сульфамоил]-4-метил-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{39}; MS m/z 494 (М+Н).
3-[8-(Индол-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{40}; MS m/z 478 (М+Н).
3-[4-Метил-8-(4-метил-пиперидин-1-сульфонил)-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{41}; MS m/z 460 (М+Н).
3-[4-Метил-1,3-диоксо-8-(4-оксо-пиперидин-1-сульфонил)-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{42}; MS m/z 460 (М+Н).
1-[2-(2-Метоксикарбонилэтил)-4-метил-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-2-ил]-пиперидин-4-карбоновой кислоты этиловый эфир 1.6{43}; MS m/z 518 (М+Н).
3-{8-[Бензил-(2-гидроксиэтил)-сульфамоил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{44}; MS m/z 512 (М+Н).
3-{4-Метил-8-[4-(2-метилаллил)-пиперазино-1-сульфонил]-1,3-диоксо-1,3-дигидропирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{45}; MS m/z 501 (М+Н).
3-[8-(4-Циклопентил-пиперазино-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидропирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{46}; MS m/z 515 (M+H).
3-{8-[4-(1-Этилпропил)-пиперазино-1-сульфонил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{47}; MS m/z 517 (M+H).
3-[8-(4-втор-Бутил-пиперазино-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидропирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{48}; MS m/z 503 (М+Н).
3-{4-Метил-8-[4-(1-метилбутил)-пиперазино-1-сульфонил]-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{49}; MS m/z 517 (М+Н).
3-[4-Метил-1,3-диоксо-8-(3-фенил-пирролидин-1-сульфонил)-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{50}; MS m/z 508 (М+Н).
3-{8-[(4-Фторфенил)-метил-сульфамоил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{51}; MS m/z 486 (М+Н).
3-{8-[(2-Фторфенил)-метил-сульфамоил]-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил}-пропионовой кислоты метиловый эфир 1.6{52}; MS m/z 486 (М+Н).
3-[8-(2-Гидроксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{53}; MS m/z 462 (М+Н).
3-[4-Метил-1,3-диоксо-8-(3-оксо-3,4-дигидро-2Н-хиноксалин-1-сульфонил)-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{54}; MS m/z 509 (М+Н).
(S)-(+)-2-(2-Азепан-1-ил-этил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метилпирроло[3,4-с]хинолин-1,3-дион 1.6{55}; MS m/z 515 (М+Н).
3-[8-(3,4-Дигидро-2Н-хинолин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{56}; MS m/z 494 (М+Н).
(S)-(+)-[4-Метил-1,3-диоксо-8-(2-феноксиметил-пирролидин-1-сульфонил)-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-уксусной кислоты этиловый эфир 1.6{57}; MS m/z 538 (М+Н).
(S)-(+)-3-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-пропионовой кислоты метиловый эфир 1.6{55}; MS m/z 476 (М+Н).
(S)-(+)-2-Циклогексилметил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-диои 1.6{59}; MS m/z 486 (М+Н).
(S)-(+)-4-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3дигидро-пирроло[3,4-с]хинолин-2-ил]-бензойной кислоты метиловый эфир 1.6{60}; MS m/z 524 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(3-метил-изооксазол-5-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{61}; MS m/z 471 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-фенил-пирроло[3,4-с]хинолин-1,3-дион 1.6{62}; MS m/z 466 (М+Н).
(S)-(+)-2-Изохинолин-5-ил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{63}; MS m/z 51.7 (М+Н).
(S)-(+)-(4,5-Дигидро-тиазол-2-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хииолин-1,3-дион 1.6{64}; MS m/z 475 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(5-метил-[1,3,4]тиадиазол-2-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{65}; MS m/z 488 (М+Н).
(S)-(+)-2-(2-Гидрокси-1-метил-этил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-диои 1.6{66}; MS m/z 448 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(1,2,3,4-тетрагидронафталин-1-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{67}; MS m/z 520 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(5-метил-1Н-пиразол-3-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{68}; MS m/z 470 (М+Н).
(S)-(+)-2-(2-Гидроксиэтил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{69}; MS m/z 434 (М+Н).
(S)-(+)-2-Изооксазол-3-ил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{70}; MS m/z 457 (М+Н).
(S)-(+)-3-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-бензойной кислоты метиловый эфир 1.6{77}; MS m/z 524 (М+Н).
(S)-(+)-2-(1,3-Диоксо-2,3-дигидро-1Н-изоиндол-4-ил)-8-(2-метоксиметил-пирролидии-1-сульфоиил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{72}; MS m/z 535 (М+Н).
(S)-(+)-2-(1Н-Индол-6-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метилпирроло[3,4-с]хинолин-1,3-дион 1.6{73}; MS m/z 505 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(пиридин-4-илметил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{74}; MS m/z 481 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(2-пирролидин-1-ил-этил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{75}; MS m/z 487 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(пиридин-2-илметил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{76}; MS m/z 481 (М+Н).
(S)-(+)-2-(3-Гидроксипропил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метилпирроло[3,4-с]хинолин-1,3-дион 1.6{77}; MS m/z 448 (M+H).
(S)-(+)-2-(3-Диметиламино-пропил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{75}; MS m/z 475 (M+H).
(S)-(+)-2-(2-Диметиламино-этил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{79}; MS m/z 461 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-хинолин-8-ил-пирроло[3,4-с]хинолин-1,3-дион 1.6{80}; MS m/z 517 (M+H).
(S)-(+)-2-Бензо[1,3]диоксол-5-илметил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хииолин-1,3-дион 1.6{57}; MS m/z 524 (M+H).
(S)-(+)-2-[2-(1Н-Имидазол-4-ил)-этил]-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{52}; MS m/z 556 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-фенетил-пирроло[3,4-с]хинолин-1,3-дион 1.6{83}; MS m/z 466 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(тетрагидрофуран-2-илметил)-пирроло[3,4-с|хинолин-1,3-дион 1.6{84}; MS m/z 474 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-[3-(2-оксо-пирролидин-1-ил)-пропил]-пирроло[3,4-с]хинолин-1,3-дион 1.6{85}; MS m/z 515 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(2-пиперидин-1-ил-этил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{86}; MS m/z 501 (M+H).
(S)-(+)-2-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{87}; MS m/z 390 (M+H).
(S)-(+)-2-(Бензо[1,3]диоксол-5-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{55}; MS m/z 510 (M+H).
(S)-(+)-2-(3-гидроксиметил-фенил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {89}; MS m/z 496 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(тиофен-2-илметил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{90}; MS m/z 486 (M+H).
(S)-(+)-2-(2-Гидроксициклогексил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6{91}; MS m/z 488 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(5-метил-изооксазол-3-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6{92}; MS m/z 471 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-хинолин-3-ил-пирроло[3,4-с]хинолин-1,3-дион 1.6{93}; MS m/z 517 (М+Н).
(S)-(+)-4-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-илметил]-циклогексанкарбоновая кислота 1.6 {94}; MS m/z 530 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-2-(3-метоксипропил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {95}; MS m/z 462 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(1Н-[1,2,4]триазол-3-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {96}; MS m/z 457 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(5-метил-фуран-2-илметил)-пирроло[3,4-с]хинолин-1,3-дион 2 1.6 {97}; MS m/z 484 (М+Н).
(S)-(+)-2-(1Н-Индазол-5-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {98}; MS m/z 506 (М+Н).
(S)-(+)-2-Индан-1-ил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {99}; MS m/z 506 (М+Н).
(S)-(+)-2-[4-(2-Гидроксиэтил)-фенил]-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {100}; MS m/z 510 (M+H).
(S)-(+)-2-(1,3-Диоксо-2,3-дигидро-1Н-изоиндол-5-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {101}; MS m/z 535 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(8-метил-8-аза-бицикло[3.2.1]окт-3-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {102}; MS m/z 513 (М+Н).
(S)-(+)-2-(1-Аза-бицикло[2.2.2]ок-3-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {103}; MS m/z 499 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-[1,3,4]тиадиазол-2-илпирроло[3,4-с]хинолин-1,3-дион 2 1.6 {104}; MS m/z 474 (М+Н).
(S)-(+)-2-[2-(1Н-Индол-3-ил)-этил]-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {105}; MS m/z 533 (М+Н).
(S)-(+)-2-Циклопентил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {106}; MS m/z 458 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(2-трифторметил-фенил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {707}; MS m/z 534 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(2-морфолин-4-ил-этил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {108}; MS m/z 503 (М+Н).
(S)-(+)-2-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-4-метил-пентановой кислоты метиловый эфир 1.6 {109}; MS m/z 518 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(3-морфолин-4-ил-пропил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {110}; MS m/z 517 (М+Н).
(S)-(+)-2-Фуран-2-илметил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {111}; MS m/z 470 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-нафталин-1-ил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {112}; MS m/z 516 (М+Н).
(S)-(+)-2-Бензил-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {113}; MS m/z 480 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-пиридин-3-ил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {114}; MS m/z 467 (М+Н).
(S)-(+)-2-(1-Этил-пирролидин-2-илметил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {115}; MS m/z 501 (М+Н).
(S)-(+)-2-(2,5-Диметил-2Н-пиразол-3-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {116}; MS m/z 484 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(5-пиридин-3-ил-2Н-[1,2,4]триазол-3-ил)-пирроло(3,4-с]хинолин-1,3-дион 1.6 {117}; MS m/z 534 (М+Н).
(S)-(+)-2-(4,5-Диметил-тиазол-2-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {118}; MS m/z 501 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-[3-(4-метил-пиперазин-1-ил)-пропил]пирроло[3,4-с]хинолин-1,3-дион 1.6 {779}; MS m/z 530 (М+Н).
(S)-(+)-2-(3-Азепан-1-ил-пропил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {120}; MS m/z 529 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(3-пирролидин-1-ил-пропил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {121}; MS m/z 501 (М+Н).
(S)-(+)-3-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-1,3-дион-2-ил]-1Н-пиразол-4-карбоновой кислоты метиловый эфир 1.6 {122}; MS m/z 514 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-[2-(4-метил-пиперазин-1-ил)-этил]пирроло[3,4-с]хинолин-1,3-дион 1.6 {123}; MS m/z 516 (М+Н).
(S)-(+)-2-(3-Изопропил-сульфанил-пропил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 2 1.6 {124}; MS m/z 506 (М+Н).
(S)-(+)-2-(1-Гидроксиметил-2-метил-бутил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {125}; MS m/z 490 (М+Н).
(S)-(+)-2-(1-Гидроксиметил-2-метил-пропил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {126}; MS m/z 476 (М+Н).
(S)-(+)-2-(2-Гидрокси-1-фенил-этил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {127}; MS m/z 510 (М+Н).
(S)-(+)-2-(1-Гидроксиметил-3-метилсульфонил-пропил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с|хинолин-1,3-дион 1.6 {128}; MS m/z 508 (М+Н).
(S)-(+)-2-(1-Гидроксиметил-2-фенил-этил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {129}; MS m/z 524 (М+Н).
(S)-(+)-2-{2-[(2-Диметиламино-этил)-метил-амино]-этил}-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {130}; MS m/z 518 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-(1,3,5-триметил-1Н-пиразол-4-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {132}; MS m/z 498 (М+Н).
(S)-(+)-2-(4-Имидазол-1-ил-фенил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {132}; MS m/z 532 (М+Н).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-2-(5-метоксиметил-[1,3,4]тиадиазол-2-ил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {133}; MS m/z 518(M+H).
(S)-(+)-2-(5-Диметиламинометил-[1,3,4]тиадиазол-2-ил)-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {134}; MS m/z 531 (M+H).
(S)-(+)-8-(2-Метиксиметил-пирролидин-1-сульфонил)-4-метил-2-(5-метилсульфонилметил-[1,3,4]тиадиазол-2-ил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {135}; MS m/z 534 (M+H).
(S)-(+)-8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-2-[2-(2-оксо-имидазолидин-1-ил)-этил]-пирроло[3,4-с]хинолин-1,3-дион 1.6 {136}; MS m/z 502 (M+H).
(S)-(+)-2[2-(4-Гидрокси-фенил)-этил]-8-(2-метоксиметил-пирролидин-1-сульфонил)-4-метил-пирроло[3,4-с]хинолин-1,3-дион 1.6 {137}; MS m/z 510 (M+H).
(S)-(+)-[8-(2-Метоксиметил-пирролидин-1-сульфонил)-4-метил-1,3-диоксо-1,3-дигидро-пирроло[3,4-с]хинолин-2-ил]-уксусной кислоты этиловый эфир 1.6 {138}; MS m/z 476 (M+H).
Метил (R)-(-)-2-[4-метил-8-(2-гидроксиметил-пирролидино-1-сульфонил)-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-2-ил]ацетат, 1.6 {139}; MS m/z 448 (M+H).
Метил 2-[4-метил-8-(морфолино-4-сульфонил)-1,3-диоксо-2,3-дигидро-1Н-пирроло-[3,4-с]хинолин-2-ил]ацетат, 1.6 {140}; MS m/z 434 (M+H).
Метил 2-[4-метил-8-([1,3]диоксолан-2-илметил-метил-сульфамоил)-1,3-диоксо-2,3-дигидро-1Н-пирроло[3,4-с]хинолин-2-ил]ацетат, 1.6 {141}; MS m/z 464 (M+H).
2-Метил-8-(3,4,5,6-тетрагидро-2Н-[2,3]бипиридинил-1-сульфонил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {142}; MS m/z 437 (M+H).
2-Метил-8-(8-оксо-1,5,6,8-тетрагидро-2Н,4Н-1,5-метано-пиридо-[1,2-а][1,5]диазоцин-3-сульфонил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {143}; MS m/z 465 (M+H).
2-Этил-8-(3-гидрокси-8-аза-бицикло-[3,2,1]октан-8-сульфонил)-пирроло[3,4-с]хинолии-1,3-дион 1.6 {144}; MS m/z 416 (M+H).
2-Метил-8-(октагидро-1,5-метано-пиридо[1,2-а][1,5]диазоцин-3-сульфонил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {145}; MS m/z 455 (M+H).
8-(8-Оксо-октагидро-1,5-метано-пиридо[1,2-а][1,5]диазоцин-3-сульфонил)-пирроло[3,4-с]хинолин-1,3-дион 1.6 {146}; MS m/z 455 (M+H).
Пример 52. Комбинаторная библиотека 4-метил-8-сульфамоил-1,3-дигидро-2H-пирроло[3,4-c]хинолин-1,3-дионов (1.6). Параллельный синтез комбинаторной библиотеки проводят в синтезаторе "CombiSyn-012-3000". В каждый из шести реакторов синтезатора загружают один из 8-сульфамоил-1,3-дигидрофуро[3,4-с]хинолин-1,3-дионов общей формулы (1.5), один из аминов (7) и триэтиламин в мольном соотношении 1:1:0.1 На 1 г ангидрида используют 20 мл толуола. Реакционные массы перемешивают при кипении реакционной массы 20-48 часов до окончания реакции. Контроль протекания реакции осуществляют с помощью ТСХ (силикагель, хлороформ : метанол =19:1). После окончания реакций толуол отгоняют в вакууме досуха, к остаткам в каждый реактор синтезатора прибавляют метиленхлорид, перемешивают и отфильтровывают осадки. Фильтраты трижды промывают 3% водным раствором гидроксида натрия, водой, 10% соляной кислотой и снова водой. Сушат безводным сульфатом натрия, фильтруют, отгоняют растворитель в вакууме, а остатки хроматографируют на силикагеле метиленхлоридом, а затем смесью метиленхлорид : метанол = 99:1. Получают комбинаторную библиотеку 4-метил-8-сульфамоил)-1,3-дигидро-2H-пирроло[3,4-с]хинолин-1,3-дионов (1.6), представленных в таблице.

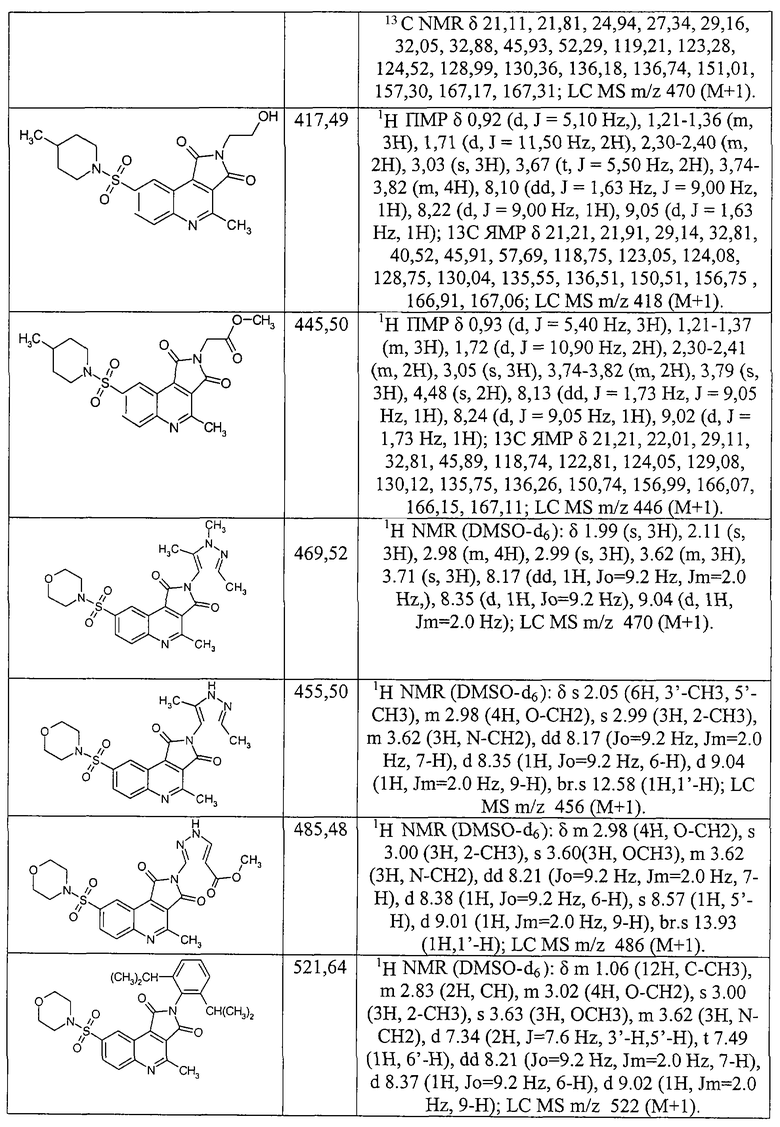
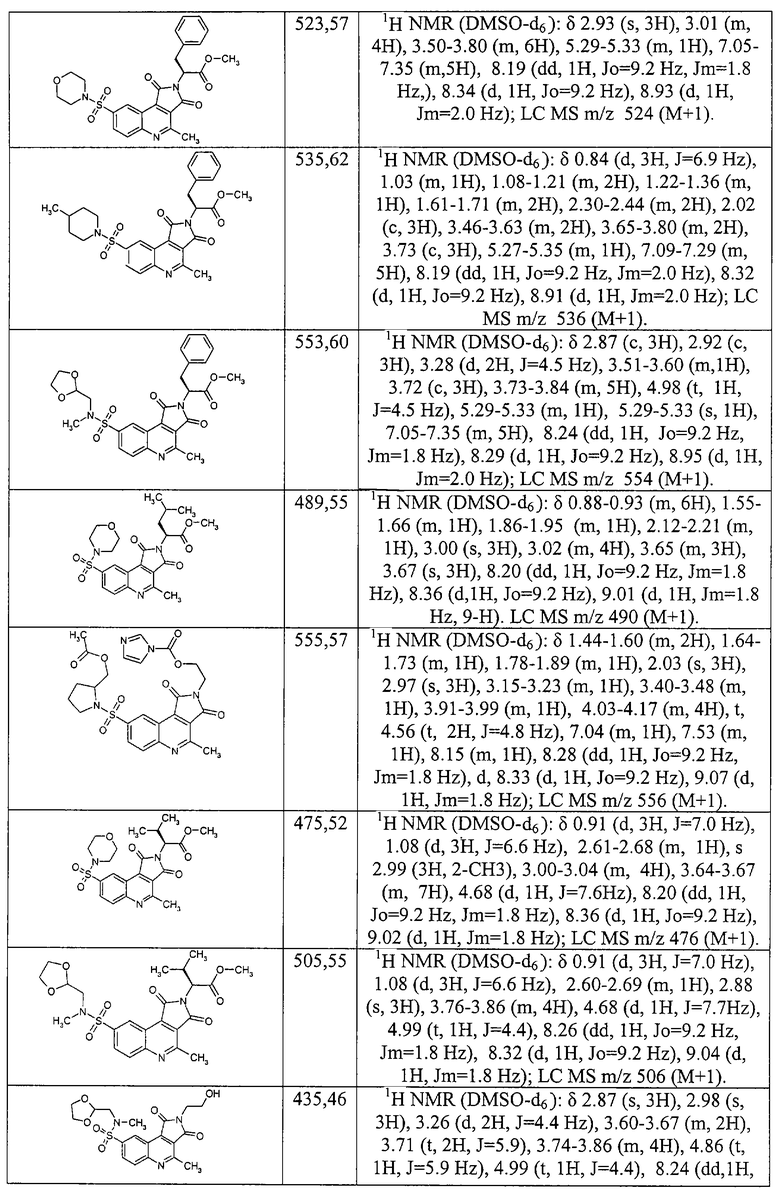
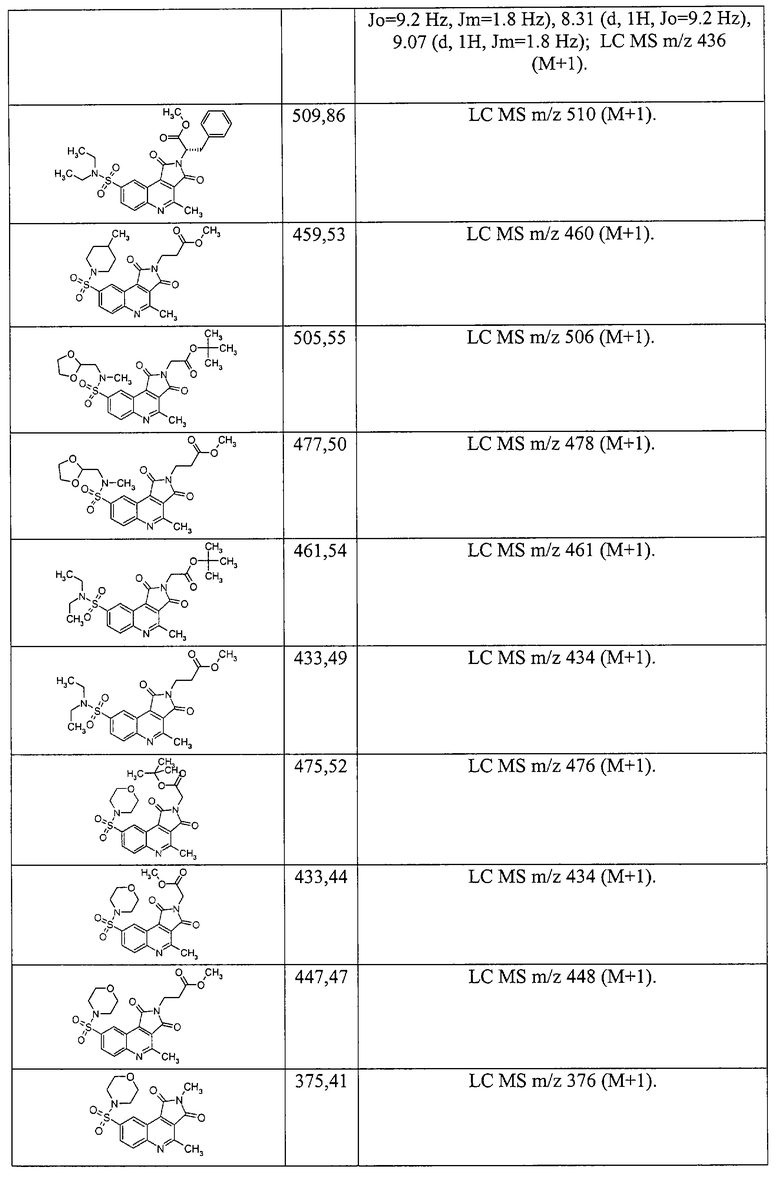
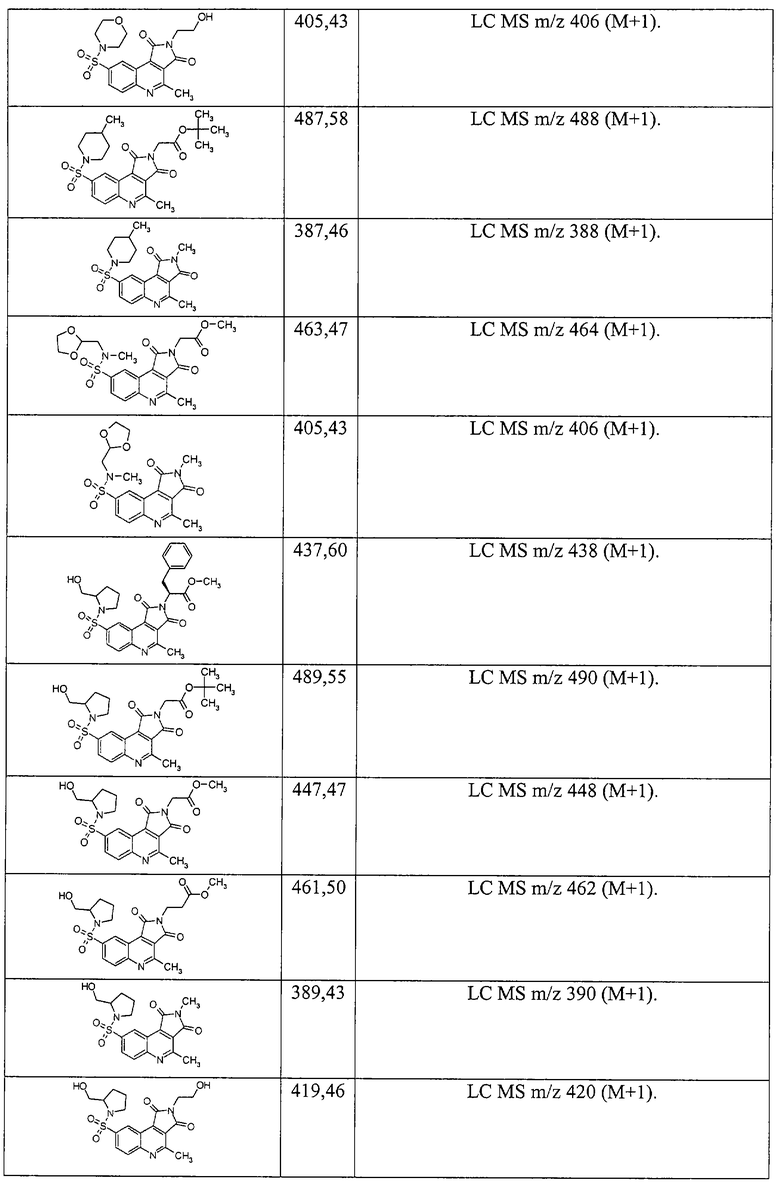

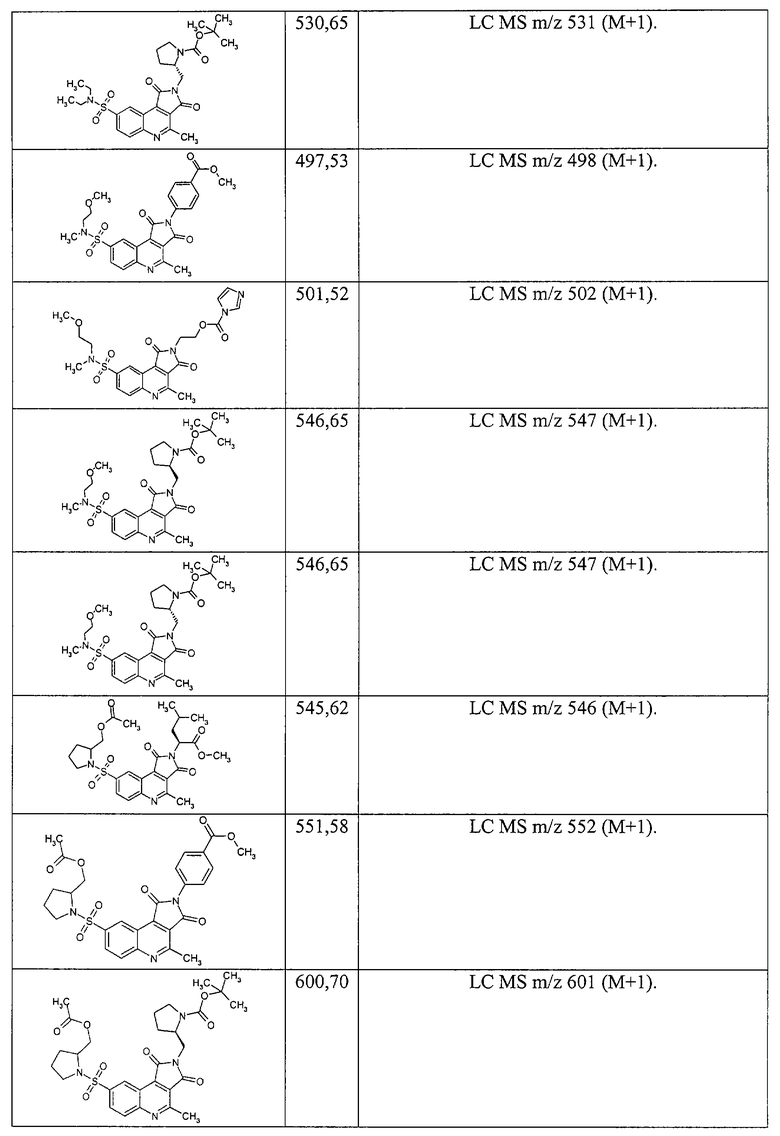



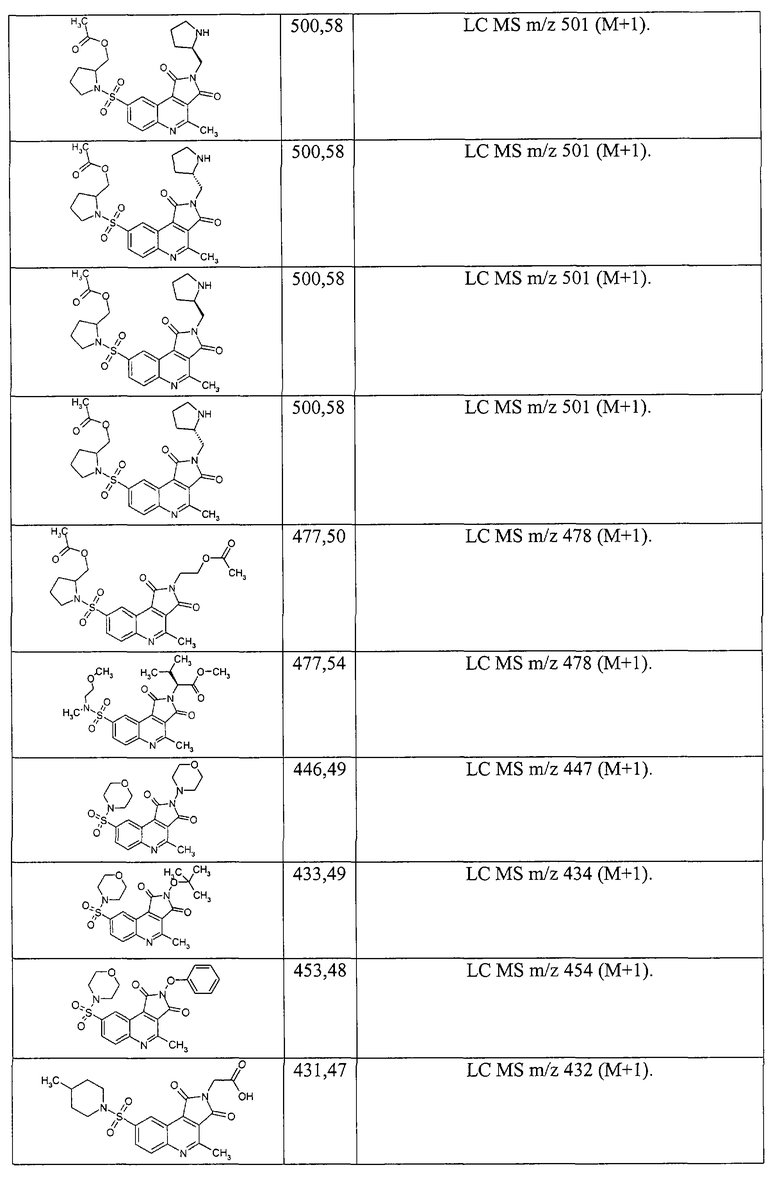
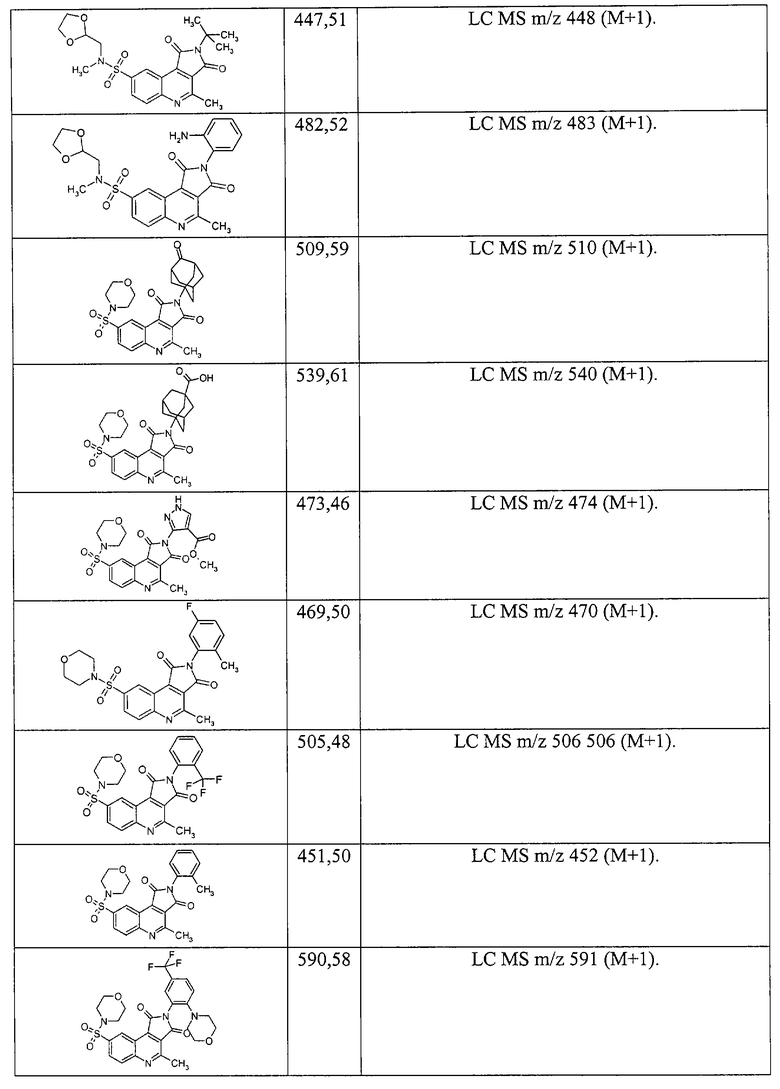
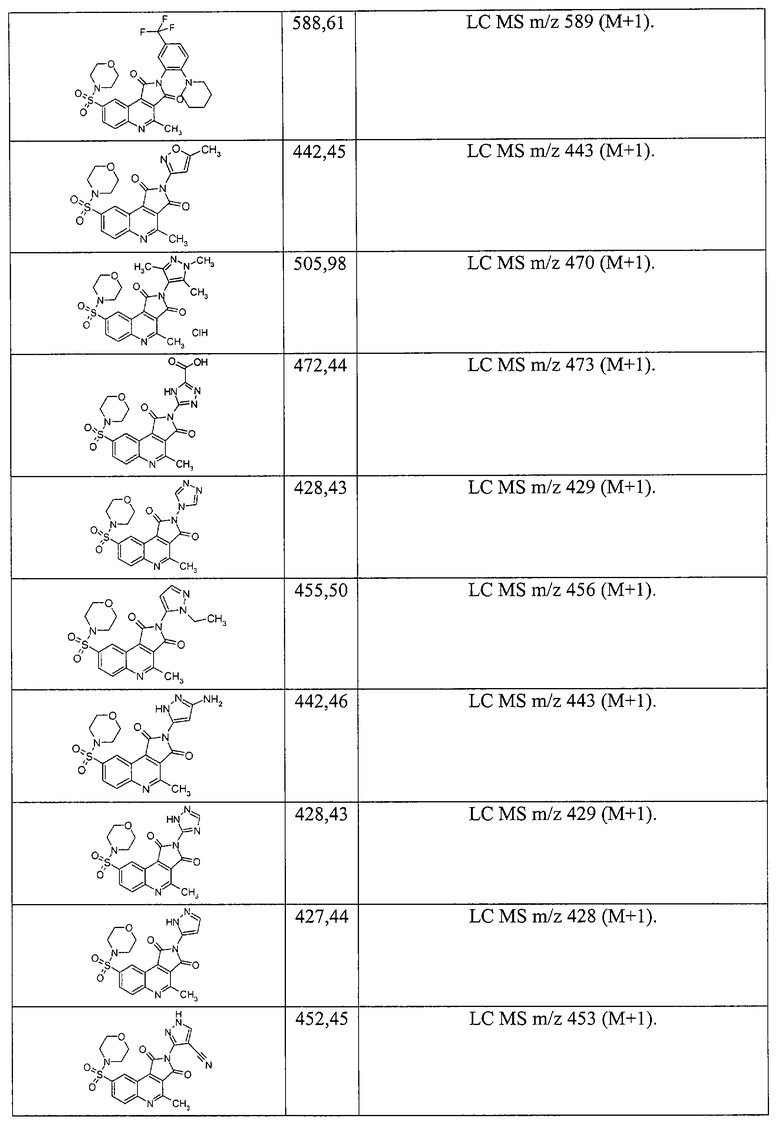

Изобретение относится к производным 6-сульфамоилхинолин-4-карбоновой кислоты формулы (1), где R1, R2, R3 и R4 такие, как определено в формуле изобретения. Также описана комбинаторная библиотека на основе этих соединений. Технический результат - получены новые соединения, обладающие ценными биологическими свойствами. 2 с. и 13 з.п. ф-лы, 1 табл.
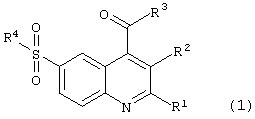
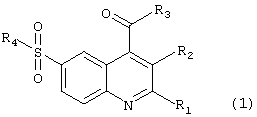
в которой R1 представляет атом водорода, метил, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил, где гетероциклил означает ароматический цикл с 5-7 атомами, один из которых является гетероатомом, выбранным из серы, кислорода и азота, причем гетероциклил может быть конденсированным полициклом;
R2 представляет атом водорода, -С(O)ОН;
R1 и R2 вместе представляют полиметиленовый фрагмент -(СН2)m-;
m имеет значения от 3 до 7;
R3 представляет -ОН, -O-N+HR5R6R7, -NH2 или нуклеофильный заместитель, выбранный из группы первичных или вторичных аминов, спиртов, фенолов, меркаптанов и тиофенолов;
R2 и R3 вместе представляют группу -С(O)O- или -C(O)N(R8)-;
R4 представляет нуклеофильный заместитель, выбранный из группы первичных или вторичных аминов;
R5, R6 и R7 независимо друг от друга представляют С1-C7-алкил;
R8 представляет инертный заместитель, выбранный из группы, включающей необязательно замещенный С1-C7-алкил, С2-C7-алкенил, С2-C7-алкинил, необязательно замещенный С1-C7-алкокси, необязательно замещенный С3-С10-циклоалкил, необязательно замещенный фенил, необязательно замещенный арил, необязательно замещенный гетероциклил, где гетероциклил означает насыщенный или ароматический цикл с 5-7 атомами, по крайней мере один из которых является гетероатомом, выбранным из кислорода, серы и азота, причем гетероциклил может быть конденсированным полициклом;
исключая соединение (1), в котором одновременно R1=фенил, R2=H, R3=ОН, R4=-NH2, и соединение (1), в котором одновременно R1=фенил, R2=H, R3=ОН, R4=-NH(2-пиридил).
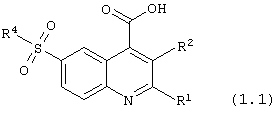
в которой R1, R2 и R4 имеют вышеуказанное значение,
исключая соединение (1.1), в котором одновременно R1=фенил, R2=Н, R3=ОН, R4=-NH2, и соединение (1.1), в котором одновременно R1=фенил, R2=Н, R3=ОН, R4=-NН(2-пиридил).

в которой R4 имеет вышеуказанное значение.
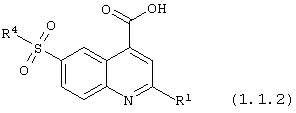
в которой R1 и R4 имеют вышеуказанное значение.
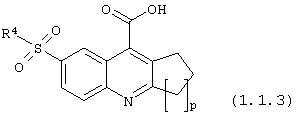
в которой R4 имеет вышеуказанное значение;
p=1-3.
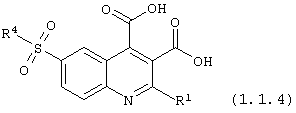
в которой R1 и R 4 имеют вышеуказанное значение.
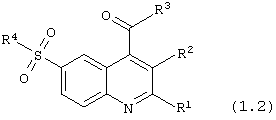
в которой R1, R2 и R4 имеют вышеуказанное значение;
R3 представляет -NH2 или нуклеофильный заместитель, выбранный из группы первичных или вторичных аминов.

в которой R3 и R4 имеют вышеуказанное значение.
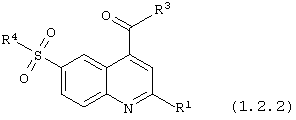
в которой R1, R3 и R4 имеют вышеуказанное значение.
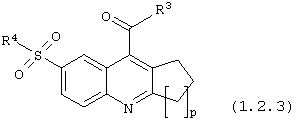
в которой R3, R4 и p имеют вышеуказанное значение.
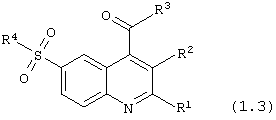
в которой R1, R2 и R4 имеют вышеуказанное значение;
R3 представляет нуклеофильный заместитель, выбранный из группы спиртов, фенолов, меркаптанов и тиофенолов.
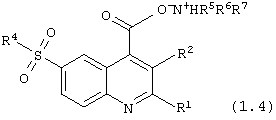
в которой R1, R2, R4, R5, R6 и R7 имеют вышеуказанное значение.
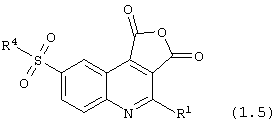
в которой R1 и R4 имеют вышеуказанное значение.

в которой R4 и R8 имеют вышеуказанное значение.
| WO 9719928 A1, 05.06.1997 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| WO 9602509 A1, 01.02.1996 | |||
| US 5811553 А, 22.09.1998 | |||
| Способ получения рацемических или стереоизомерных производных нафталин- или азанафталинкарбоксамидов | 1983 |
|
SU1255050A3 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПРОТИВОДЕЙСТВИЯ ТАХИКИНИНОВЫМ РЕЦЕПТОРАМ | 1994 |
|
RU2135471C1 |
Авторы
Даты
2004-05-27—Публикация
2003-03-06—Подача