ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к новому классу производных (S)-абсцизовой кислоты (далее «(S)-ABA») и рацемической форме абсцизовой кислоты (далее «(±)-ABA»), а также методам их синтеза.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Абсцизовая кислота («АВА») представляет собой регулятор роста растений природного происхождения, который регулирует широкий круг физиологических процессов растений, таких как прорастание семян, элонгация всходов, реакция на абиотический стресс, цветение и развитие плода. S-энантиомер (S)-ABA имеет природное происхождение и является наиболее активной формой АВА. Таким образом, была установлена ценность для коммерческого использования (S)-ABA в различных целях в садоводстве и сельском хозяйстве. (S)-ABA оказывает биологическое воздействие посредством связывания с (S)-ABA-рецепторами и активации каскадов трансдукции клеточных сигналов. Кроме того, было продемонстрировано наличие у (S)-ABA фармацевтических и нутрицевтических свойств (см. Патент США №8536224).
[0003] Синтетические производные АВА могут оказывать биологическое воздействие либо подобно (S)-ABA, но с измененным (расширенным) потенциалом (АВА-агонисты), либо с отличающимся от такового у самой (S)-ABA спектром афинности для множества АВА-рецепторов. С другой стороны, синтетические производные могут оказывать биологическое воздействие для подавления (S)-ABA (например, выступать в качестве АВА-антагонистов). Синтетические производные также могут обладать улучшенным свойством поглощаемости растительными тканями, а также расширенной метаболической стабильностью. В дополнение к этому синтетические производные могут обладать лучшей химической и экологической стабильностью, по сравнению с (S)-ABA. Таким образом, синтетические АВА-производные могут оказывать уникальное биологическое воздействие, и их применение рассматривается в качестве подхода к определению новых регуляторов роста растений.
[0004] В сфере общего пользования известно множество синтетических аналогов АВА. Несколько групп японских ученых синтезировали АВА-аналоги с модифицированными боковыми цепями и/или заменителями циклогексеноновых колец посредством синтеза новообразований (Я. Тодороки и другие (Y. Todoroki, et al, Phytochem) Фитохимия. 1995, 38, 561-568; Я. Тодороки и другие (Y. Todoroki, et al, Phytochem). Фитохимия. 1995, 40, 633-641; С. Накано (S. Nakano, et al, Biosci, Biotech, Biochem). Биологические науки. Биотехнологии. Биохимия. 1995, 59, 1699-176; Я. Тодороки и другие (Y. Todoroki, et al, Biosci, Biotech, Biochem). Биологические науки. Биотехнологии. Биохимия. 1994, 58, 707-715; Я. Тодороки и другие (Y. Todoroki, et al, Biosci, Biotech, Biochem). Биологические науки. Биотехнологии. Биохимия. 1997, 61, 2043-2045; Я. Тодороки и другие (Y. Todoroki, et al, Tetrahedron). Тетраэдр. 1996, 52, 8081-8098). Синтез S-3'-АВА-галогена, S-3'-АВА-азидо и S-3'-АВА-алкилтио из (S)-ABA также был представлен (Я. Тодороки и другие (Y. Todoroki, et al., Tetrahedron). Тетраэдр. (1995, 51, 6911-6926; S. Арай и другие (Arai, et al, Phytochem). Фитохимия. 1999, 52, 1185-1193; J. J. Балсевич и другие (Balsevich, et al, Phytochem). Фитохимия. 1977, 44, 215-220; Я. Тодороки и другие (Y. Todoroki, et al, Tetrahedron). Тетраэдр. 2000, 56, 1649-1653; Я. Тодороки и другие (Y. Todoroki, et al, Bioorg. Med. Chem. Lett.). Биоорг. Мед. Хим. Лет. 2001, 11, 2381-2384). Работу, выполненную С.Р. Абрамсом (S.R. Abrams) и другими учеными из Института биотехнологии растений Национального исследовательского совета Канады, также следует отметить. Применив подходы синтеза новообразований, АВА-аналоги с модифицированными боковыми цепями или замещение С6' были получены либо в качестве рацемических смесей, либо, в некоторых случаях, в качестве чистых стереоизомеров (см. Патент США. 5518995; Д.М. Прист и другие (Priest, et al, FEBS Letters). ФЕБС Обозрение. 2005, 579, 4454-4458). Также было представлено описание тетралоновой серии аналогов, в которых циклогексеноновое кольцо (S)-ABA замещается биоциклическим тетралоновым кольцом (Дж.М. Ньянгулу и другие (J.M. Nyangulu, et al, Org. Biomol. Chem.). Орг. Биомол. Хим. 2006, 4, 1400-1412; Дж.М. Ньянгулу и другие (J.M. Nyangulu, et al, J. Am. Chem. Soc). Дж. Am. Хим. Соц. 2005, 127, 1662-1664; WO 2005/108345).
[0005] Описанные в научной литературе синтетические АВА-аналоги ограничены в своей сфере применения, и их получение часто осуществляют посредством многоэтапного синтеза новообразований. Как правило, такой синтез имеет низкий выход, в частности, когда необходимо получить оптически чистые единичные энантиомеры. Таким образом, данные соединения, как правило, слишком затратно использовать для синтеза в больших количествах или для производства в коммерческих масштабах, что ограничивает их коммерческое применение. (S)-АВА-производные по настоящему изобретению обладают вышеупомянутыми биологическими свойствами и, что является наиболее важным, могут быть эффективно получены из (S)-ABA, что до самого последнего момента не представлялось возможным в больших количествах.
[0006] Биологическое воздействие рацемической (R)-3'-метил-АВА было кратко описано в публикации К. Уено и других ученых (K. Ueno, et al, Bioorg. Med. Chem.). Биоорг. Мед. Хим. 2005, 13, 3359-3370, но процесс синтеза данного состава не был представлен. Согласно Уено и группе других ученых, (R)-3'-метил-АВА продемонстрировал такое же воздействие, как и (S)-ABA, в элонгации семян риса, и более слабое воздействие, чем (S)-ABA, при проведении количественного анализа ингибирования в (S)-ABA 8'-гидроксилазе. Кроме того, 3'-метил-(S)-АВА был упомянут в работе (Я. Тодороки и другие (Y. Todoroki, et al, Bioorg. Med. Chem. Lett.). Биоорг. Мед. Хим. Лет. 2001, 11, 2381-2384), но ни синтез, ни какие-либо биологические свойства данного соединения не были описаны в документах, находящихся в открытом доступе.
[0007] Следовательно, существует потребность в энтантиомерически чистых (S)-ABA производных, которые представлены агонистами и антагонистами (S)-АВА с повышенной или обратной биологической активностью соответственно. Также существует потребность в усовершенствованных способах синтеза аналогов (S)-ABA.
[0008] Несмотря на то, что S-энантиомер (S)-ABA имеет природное происхождение и является наиболее биологически активной формой АВА, рацемическая (R)-ABA также обладает подобными свойствами биологического воздействия, хоть и на несколько другом (более узком) уровне, как было продемонстрировано Унео и др. (Uneo et. al) на примере (R)-3'-метил-АВА (vide superа). Таким образом, можно сделать вывод, что потребность в новых (R)-ABA-производных также существует.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Авторы настоящей заявки открыли новые (S)-АВА-производные, которые являются энантиомерически чистыми, а также методы синтеза (S)-ABA-производных. Более того, авторы открыли новые (±)-АВА-производные и методы синтеза (±)-АВА-производных.
[00010] Один из аспектов настоящего изобретения охватывает соединения из одного энантиомера, представленные Формулой I:
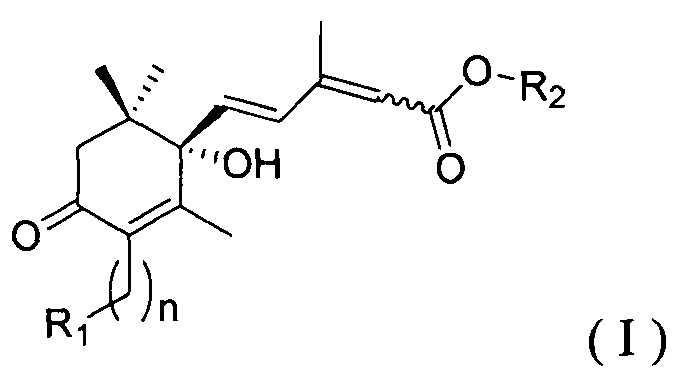
в которой:
n равно 0 или 1;
если n равно 0, то R1 представляет собой замещенный или незамещенный С2-С20 алкил, циклоалкил или гетероциклоалкил;
если n равно 1, то R1 представляет собой циано (-CN), карбоксилат (-СО2Н), алкоксикарбонил (-CO2R'), незамещенный, монозамещенный или двузамещенный карбамоил (-CONR'R''), замещенный или незамещенный алкенил, циклоалкенил, алкинил, арил или гетероарил;
R2 представляет собой водород, замещенный или незамещенный алкил, циклоалкил, гетероциклоалкил, алкенил, циклоалкенил, алкинил, арил или гетероарил; и
R' и R'' независимо представляют собой водород, замещенный или незамещенный С1-С20 алкил, циклоалкил или гетероциклоалкил; и их соли.
[00011] Другой аспект настоящего изобретения охватывает рацемические соединения, представленные Формулой II:
в которой:
n равно 0 или 1;
если n равно 0, то R представляет собой фторметил, дифторметил, трифторметил, замещенный или незамещенный С2-С20 алкил, циклоалкил, гетероциклоалкил, арил или гетероарил;
если n равно 1, то R представляет собой алкенил, циклоалкенил, алкинил, арил или гетероарил;
и их соли.
[00012] Еще один аспект настоящего изобретения охватывает способы регулирования роста растений, включающие нанесение эффективного количества не менее чем одного соединения, представленного Формулами I или II, на растение, что может дать положительный эффект от регулирования роста.
[00013] Далее еще один аспект настоящего изобретения охватывает способы получения соединений, представленных Формулами I и II, посредством химического синтеза.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00014] Соединения, описанные в настоящем изобретении, представляют собой (S)-АВА и (±)-АВА производные, которые относительно просто синтезировать.
[00015] В одном из вариантов осуществления настоящее изобретение охватывает энантиомерически чистые соединения Формулы I:
где, n равно 0 или 1;
если n равно 0, то R1 представляет собой замещенный или незамещенный С2-С20 алкил, циклоалкил или гетероциклоалкил;
если n равно 1, то R1 представляет собой циано, карбоксилат (-СО2Н), алкоксикарбонил (-CO2R'), незамещенный, монозамещенный или двузамещенный карбамоил (-CONR'R''), замещенный или незамещенный алкенил, циклоалкенил, алкинил, арил или гетероарил;
R2 представляет собой водород, замещенный или незамещенный алкил, циклоалкил, гетероциклоалкил, алкенил, циклоалкенил, алкинил, арил или гетероарил; и
R' и R'' независимо представляют собой водород, замещенный или незамещенный С1-С20 алкил, циклоалкил или гетероциклоалкил;
и их соли.
[00016] В предпочтительном варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 0, R1 представляет собой незамещенный С2-С20 алкил, a R2 - водород или алкил. В более предпочтительном варианте осуществления изобретения, n равно 0, R1 представляет собой незамещенный С2-С20 алкил, a R2 _ водород. В еще одном предпочтительном варианте осуществления настоящего изобретения, n равно 0, R1 представляет собой незамещенный С2-С6 низший алкил. В еще более предпочтительном варианте осуществления изобретения, где n равно 0, R1 представляет собой незамещенный С2-С20 алкил, a R2 - алкил. В наиболее предпочтительном варианте осуществления изобретения, n равно 0, R1 представляет собой С2-С6 низший алкил, a R2 - низший алкил.
[00017] В другом варианте осуществления настоящего изобретения R1 представляет собой С2, С3, С4, С5 или С6 низший алкил.
[00018] В варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 0, R1 представляет собой замещенный С2-С20 алкил, a R2 - водород.
[00019] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 1, R1 представляет собой арил, a R2 - водород. В предпочтительном варианте осуществления настоящего изобретения, R1 представляет собой фенил или замещенный фенил. В более предпочтительном варианте осущетсвления настоящего изобретения, R1 представляет собой метил или галоген замещенный фенил. В более предпочтительном варианте осущетсвления настоящего изобретения R1 представляет собой метилфенил, фторфенил, дифторфенил, хлорфенил, метоксифенил или метоксинитрофенил.
[00020] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 1, a R1 представляет собой нафтил.
[00021] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 1, R1 представляет собой гетероарил, a R2 - водород.
[00022] Еще в одном варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 1, R1 представляет собой алкенил, a R2 - водород. В предпочтительном варианте осуществления настоящего изобретения, R1 представляет собой низший алкенил.
[00023] В варианте осущетсвления настоящего изобретения, соединение представляет собой соединение, представленное Формулой I, где n равно 1, R1 представляет собой алкинил, a R2 - водород. В предпочтительном варианте осуществления настоящего изобретения, R1 представляет собой низший алкинил.
[00024] В другом варианте осущетсвления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, где n равно 1, a R1 представляет собой циано (-CN), карбоксилат (-СO2Н), алкоксикарбонил (-CO2R'), незамещенный, монозамещенный или двузамещенный карбамоил (-CONR'R'')''), где как R', так и R'' независимо представляют собой водород, замещенный или незамещенный С1-С20 алкил, циклоалкил или гетероциклоалкил.
[00025] Еще в одном варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой I, a R1 и/или R2 независимо замещены как минимум одним из -ОН, -NH2, -SH, одним или более галогенами, -CN, -NR3R4, -OR3, -SR3, -S(O)R3, -SO2R3, -C(O)R3, -C(O)NR3R4, -NHC(O)R3, -NHSO2R3, -NHC(O)OR5, -SO2NR3R4, или -NHC(O)NR3R4, где R3 и R4 каждый независимо представляют собой водород или низший алкил, a R5 - низший алкил. В предпочтительном варианте осуществления настоящего изобретения R1 замещен -ОН или одним или более галогенами.
[00026] В другом варианте осуществления настоящего изобретения соль соединения, представленного Формулой I, представляет собой алкали или алкалин щелочно-земельный катион, протонированный амин (+NHR6R7R8), где R6, R7 и R8 каждый независимо представляют собой водород, низший алкил, арил или четвертичный аммоний ион (+NR9R10R11R12), где R9, R10, R11 и R12 каждый независимо представляет собой низший алкил или низший арил.
[00027] В варианте осуществления настоящего изобретения соль соединения, представленного Формулой I, представляет собой неорганический анион, выбранный из группы, состоящей из хлорида (Cl-), бромида (Br-), иодида (I-) и сульфата
(SO42-), или органический анион, выбранный из группы, состоящей из формиата (НСO2-), ацетата (СН3СO2-), тартрата (-СO2СН(ОН)СН(ОН)СO2-) и толисулфоната (CH3C6H4SO3-), где R1 или R2 содержит базовый атом азота.
[00028] Еще в одном варианте осуществления настоящее изобретение относится к способам регулирования роста растений, предполагающим нанесение эффективного количества не менее одного соединения, представленного Формулой I, на растение, рост которого необходимо отрегулировать.
[00029] В одном варианте осуществления настоящее изобретение относится к рацемическим соединениям, представленным Формулой II.
где, n равно 0 или 1;
если n равно 0, то R представляет собой фторметил, дифтоометил, трифторметил, замещенный или незамещенный С2-С20 алкил, циклоалкил, гетероциклоалкил, арил или гетероарил;
если n равно 1, то R представляет собой алкенил, циклоалкенил, алкинил, арил или гетероарил;
и их соли.
[00030] В одном варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой II, где n равно 0, и R представляет собой фторметил, дифторметил или трифторметил.
[00031] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой II, где n равно 0, и R представляет собой замещенный или незамещенный С2-С20 алкил, циклоалкил, арил и гетероарил. В предпочтительном варианте осуществления настоящего изобретения R представляет собой замещенный или незамещенный С2-С20 алкил. В более предпочтительном варианте осуществления настоящего изобретения R представляет собой замещенный или незамещенный С2-С6 низший алкил. В наиболее предпочтительном варианте осуществления настоящего изобретения R представляет собой низший алкил, замещенный галогеном. В более предпочтительном варианте осуществления настоящего изобретения галоген представляет собой фтор. В более предпочтительном варианте осуществления настоящего изобретения R представляет собой фторэтил и дифторэтил.
[00032] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой II, где n равно 0, и R представляет собой замещенный или незамещенный арил или гетероарил. В предпочтительном варианте осуществления настоящего изобретения R представляет собой фенил.
[00033] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой II, где n равно 0, и R представляет собой замещенный или незамещенный циклоалкил. В предпочтительном варианте осуществления настоящего изобретения R представляет собой циклопропил, циклобутил, циклопентил или циклогексил.
[00034] В другом варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой II, где n равно 1, и R представляет собой алкенил, циклоалкенил, алкинил, арил и гетероарил.
[00035] Еще в одном варианте осуществления настоящее изобретение относится к способам регулирования роста растений, предполагающим нанесение эффективного количества не менее одного соединения, представленного Формулой II, на растение, рост которого необходимо отрегулировать.
[00036] В предпочтительном варианте осуществления настоящего изобретения соединение представляет собой соединение, представленное Формулой II, a R опционально замещен как минимум одним из ОН, -NH2, -SH, одним или более галогенами, -CN, -NR3R4, -OR3, -SR3, -S(O)R3, -SO2R3, -C(O)R3, -C(O)NR3R4, -NHC(O)R3, -NHSO2R3, -NHC(O)OR5, -SO2NR3R4, или -NHC(O)NR3R4, где R3 и R4 каждый независимо представляют собой водород или низший алкил, a R5 - низший алкил. В предпочтительном варианте осуществления настоящего изобретения R1 замещен -ОН или как минимум одним галогеном.
[00037] В варианте осуществления настоящего изобретения соль соединения, представленного Формулой II, представляет собой алкали или алкалин щелочноземельный катион, протонированный амин (+NHR6R7R8), где R6, R7 и R8 каждый независимо представляют собой водород, низший алкил, арил или четвертичный аммоний ион (+NR9R10R11R12), где R9, R10, R11 и R12 каждый независимо представляет собой низший алкил или низший арил.
[00038] В варианте осуществления настоящего изобретения соль соединения, представленного Формулой II, представляет собой неорганический анион, выбранный из группы, состоящей из хлорида (Сl-), бромида (Br-), иодида (I-) и сульфата
(SO42-), или органический анион, выбранный из группы, состоящей из формиата (НСO2-), ацетата (СН3СO2), тартрата (-СO2СН(ОН)СН(ОН)СO2-) и толисулфоната (CH3C6H4SO3-), где R содержит базовый атом азота.
[00039] В другом варианте осуществления настоящее изобретение относится к процессам производства соединений, представленных Формулой I, которые включают реакцию (S)-АВА с алкилирующим агентом для образования эфира (этап а); обработку (S)-АВА эфира, полученного на этапе а, используя основу и алкилирующий агент в растворителе (этап b); и опциональный гидролиз соединений, полученных на этапе b, используя процедуру гидролиза эфиров. Любая процедура гидролиза эфиров, известная специалистам в данной области, может быть использована. Данные процедуры включают в себя использование LiOH, NaOH или KОН в водном метаноле, ферментативный гидролиз с гидролазами в воде, опционально сочетаемой со смешивающимся органическим растворителем. На Схеме I, приведенной ниже, представлен данный синтез.
Схема I:
[00040] В другом варианте осуществления настоящее изобретение относится к процессам производства соединений, представленных Формулой II, как указано на Схеме II ниже. Соединения, представленные Формулой II, получили в результате окисления промежуточных продуктов дигидрокси-альдегидов структуры G, либо посредством проведения через дигидрокси-кислотные промежуточные продукты структуры I, либо промежуточных продуктов кето-альдегидов структуры Н. Дигидрокси-альдегиды структуры G, в свою очередь, получили посредством селективного окисления триолов структуры F, которые получили из коммерчески доступного 2,6,6-триметилциклогекс-2-ен-1,4-диона (А) на 3 или 4 этапе, как представлено на Схеме II.
Схема II:
[00041] Соединения, описываемые в настоящем изобретении, имеют широкий спектр коммерческих ценностей, включая окрашивание фруктов (например, различные сорта винограда), прореживание, раскрытие почек, обработка семян и управление интенсивностью урожая. Кроме того, данные составы могут быть использованы в нутрицевтической и фармацевтической областях.
[00042] Описываемые варианты осуществления настоящего изобретения представляют собой примерные осуществления идей изобретения, описываемых в настоящем документе, и не должны быть рассмотрены как ограничивающие, если только в пунктах формулы изобретения четко не установлено иное.
Определение терминов
[00043] В контексте настоящего документа замещенное соединение представляет собой такое соединение, в котором один или более атомов водорода в основной структуре заместили функциональной группой, такой как алкил, гидрокси или галоген. В качестве примера замещенного бензола можно привести толуол (С6Н5-СН3).
[00044] В контексте настоящего документа «алкил» означает алкан радикал с насыщенной неразветвленной или разветвленной цепью (например, группа, в которой отсутствует один из атомов водорода, который бы потребовался для образования устойчивой молекулы) и содержащий не менее одного углерода (-CnH2n+1). В качестве примеров алкилов можно рассматривать метил, этил, пропил, изо-пропил, бутил, сек-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил и додецил. В контексте настоящего документа «С2-С20 алкил» означает алкил, содержащий от двух до двадцати углеродов. В контексте настоящего документа «низший алкил» означает алкил, содержащий от одного до шести углеродов. В контексте настоящего документа «С2-С6 низший алкил» означает алкил, содержащий от двух до шести углеродов.
[00045] В контексте настоящего документа «замещенный алкил» означает алкан радикал с неразветвленной или разветвленной цепью, которая содержит не менее двух углеродов, и один из водородов основной структуры был замещен. В качестве примера можно привести гидроксибутил (-С4Н8-ОН).
[00046] В контексте настоящего документа «циклоалкил» означает незамещенный или замещенный радикал алициклическего углеводорода. В качестве примера циклоалкилов можно привести циклопропил, метилциклопропил, циклобутил, циклопентил, циклогексил, циклогептил. В контексте настоящего документа гетероциклоалкил означает циклический алкил с одним элементом, отличным от углерода, в кольце. В качестве примеров гетероциклоалкилов можно привести тетрагидрофуранил, тетрагидропиранил и морфолинил. Предпочтительными алкилами являются низшие алкилы.
[00047] В контексте настоящего документа «алкенил» означает олефиновые радикалы углеводорода, которые получают из алкенов посредством удаления винил протона. Предпочтительно, чтобы алкенил содержал от 2 до 24 атомов углерода, более предпочтительно - от 2 до 12 атомов углерода, а еще предпочтительнее - от 2 до 6 атомов углерода. В контексте настоящего документа, циклоалкенил означает алициклический алкенил. Гетероциклоалкенил означает циклический алкенил с одним элементом, отличным от углерода, в кольце. Наглядные группы алкенилов включают винил (-СН=СН2) и Z- или Е-1-бутен-1-ил (-СН=СНСН2СН3).
[00048] В контексте настоящего документа термин «алкинил» означает монорадикал, который получают из алкина посредством удаления одного из алкинилических протонов, предпочтительно включающий от 2 до 40 атомов углерода, более предпочтительно - от 2 до 20 атомов углерода, а еще предпочтительнее - от 2 до 6 атомов углерода. Предпочтительные алкиниловые группы включают этинил (-С≡СН), 1-пропин-1-ил (-С≡ССН3) и подобные им.
[00049] В контексте настоящего документа термин «арил» означает незамещенную или замещенную ароматическую карбоциклическую группу, содержащую от 6 до 20 атомов углерода с одним кольцом (например, фенил или толил), или множество конденсированных (сочлененных) колец, где, по крайней мере, одно кольцо является ароматическим (например, нафтил, дигидрофенантренил, флюоренил или антрил). Предпочтительно, чтобы арилы включали фенил, нафтил и подобные им.
[00050] В контексте настоящего документа термин «гетероарил» означает ароматическую циклическую группу с элементом, отличным от углерода, в 5-и или 6-и членном кольце или в не менее, чем одном из нескольких конденсированных 5-и или 6-и членных колец. Наглядные гетероариловые группы включают пиридил, оксазолил, тиазолил и индолил.
[00051] В контексте настоящего документа «циано» означает радикал с формулой -C≡N.
[00052] В контексте настоящего документа термин «галоген» означает фтор, хлор, бром и иод. Варианты осуществления настоящего изобретения также могут включать дву или тригалогены.
[00053] В контексте настоящего документа «энантиомерически чистый» или «(S)» означает наличие одного энантиомера АВА с относительной чистотой более 95%.
[00054] В контексте настоящего документа «рацемическая» или «(±)» означает относительно равную смесь R/S энантиомеров.
[00055] В контексте настоящего документа термин «соли» означает те соли, которые сохраняют биологическую эффективность и свойства исходных соединений и которые не являются биологически или по-иному вредными при вводимых дозах. Соли соединений, описываемых в настоящем изобретении, могут получать из неорганических или органических кислот или основ.
[00056] В контексте настоящего документа все числовые значения, которые относятся к количеству, процентному содержанию по массе и подобным показателям, определены как «примерные» или «приблизительные», и каждое конкретное значение может отклоняться в интервале плюс или минус 10% (±10%). Например, фразу «не менее 5% по массе» следует понимать как «не менее чем от 4,5% до 5,5%» по массе». Таким образом, количественные показатели, находящиеся в пределах 10% заявленных значений, заключены в объем настоящей формулы изобретения.
[00057] В английской версии документа использование неопределенного и определенного артиклей с существительными подразумевает как единственное, так и множественное число существительного, за исключением случаев, когда контекстом четко определено иное.
[00058] Следующие примеры предназначены для иллюстрации настоящего изобретения и обучения специалистов в данной области способам применения формул по настоящему изобретению. Они никоим образом не должны рассматриваться как ограничивающие.
ПРИМЕРЫ
Пример 1а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00059] Раствор (S)-АВА (53 г, 0,2 моль) в ацетонитриле (800 мл) охладили, используя ледяную ванну. Добавили карбонат цезия (98 г, 0,3 моль). Смесь перемешивали в течение 10 минут, после чего добавили метил иодид (24,8 мл, 56,5 г, 0,4 моль). После перемешивания при температуре окружающего воздуха в течение ночи, смесь довели до концентрации ~300 мл и добавили воду (500 мл). Полученную смесь экстрагировали, используя этилацетат (3×200 мл). Полученный органический раствор дважды промыли, используя насыщенный водный раствор сульфита натрия, высушили (безводный MgSO4) и пропустили через фильтр. Испарение фильтрата позволило получить титульное соединение в виде грязно-белого сухого вещества (56 г). 1HNMR (CDCl3): δ7.90 (d, 1Н), 6.15 (d, 1H), 5.95 (s, 1H), 5.76 (s, 1H), 3.71 (s, 3H), 2.48 (d, 1H), 2.29 (d, 1H), 2.01 (s, 3H), 1.93 (s, 3H), 1.11 (s, 3H), 1.02 (s, 3H).
Пример 1:
(2Z,4E)-метил 5-((S)-3-этил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00060] Раствор из Примера 1а (2,78 г, 0,01 моль) в обезвоженном тетрагидрофуране (THF, 60 мл) охладили до 0°С, используя ледяную ванну в атмосфере азота. Литий гексаметил дисилазан (1,0 М раствор THF, 15 мл) добавляли по капле через шприц в течение 30 минут. Полученный раствор перемешивали при температуре 0°С на протяжении 30 минут, и удалили ледяную ванну. Раствор йодэтана (0,81 мл, 1,84 г, 13 ммоль) в безводном THF (3 мл) добавляли через шприц на протяжении 10 минут. Полученный раствор перемешивали при температуре окружающего воздуха в течение ночи. Реакцию ослабляли, используя водный раствор хлорида аммония (50 мл), и экстрагировали, используя этилацетат (3×30 мл). Комбинированный органический раствор высушили (MgSO4), пропустили через фильтр и довели до требуемой концентрации. Осадок очистили на силикагелевой колонке и элюировали, используя этилацетат и гексан. Титульное соединение получили в виде сухого вещества белого цвета. 1HNMR (CDCl3): δ7.82 (d, 1Н), 6.13 (d, 1H), 5.73 (s, 1H), 3.70 (s, 3H), 2.44 (d, 1H), 247-2.10 (m, 4H), 2.00 (s, 3H), 1.89 (s, 3H), 1.07 (s, 3H), 1.00 (s, 3H), 0.95 (t, 3Н). Масс-спектроскопия MS (ионизация при атмосферном давлении API-): м/э=305.
Пример 2:
(27,4Е)-5-((S)-3-этил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00061] В раствор из Примера 1 (0,7 г, 2,3 ммоль) в метаноле (18 мл) и воде (2 мл) добавили моногидрат гидроксида лития (0,42 г, 10 ммоль). Смесь перемешивали при комнатной температуре на протяжении 48-и часов, после чего подвергли испарению для удаления большей части метанола. Затем добавили воду (20 мл). Полученную смесь охладили, используя ледяную ванну, и окислили посредством 6N водного раствора НСl до уровня рН 2-3, в результате получив выпадание осадка белого цвета. Смесь экстрагировали, используя этилацетат (3×20 мл). Комбинированный органический раствор высушили (MgSO4), пропустили через фильтр и подвергли испарению для получения титульного соединения в виде сухого вещества белого цвета. В качестве альтернативы данный осадок белого цвета могут извлекать из окисленного водного раствора, пропуская его через фильтр, промывая небольшим количеством воды и высушивая в условиях вакуума для получения титульного соединения. 1HNMR (CDCl3): δ7.75 (d, 1Н), 6.16 (d, 1H), 5.76 (s, 1H), 2.45 (d, 1H), 2.36-2.29 (m, 3H), 2.04 (s, 3H), 1.90 (s, 3H), 1.07 (s, 3H), 0.99 (s, 3H), 0.95 (t, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=291. В результате проведения опытов по методам двухмерной ядерной магнитно-резонансной спектроскопии 2D-NMR (корреляционная спектроскопия COSY, спектроскопия ядерного эффекта Оверхаузера NOESY, гетероядерная спектроскопия с одноквантовым переносом когеренции HSQC, гетероядерная корреляционная спектроскопия через несколько связей НМВС) было установлено, что алкилирование происходит в 3'-позиции. Анализ по методу хиральной высокоэффективной жидкостной хроматографии HPLC ковалентных связей фаз Пиркла, колонка (R,R) Whelk-01, показывает, что данный материал на >99% представляет собой (S)-изомер. (R)-изомер находится ниже порога детектирования ультрафиолетового детектора, установленного на 262 нм.
Пример 3а:
(2Z,4E)-метил 5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-пропилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00062] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив иодоэтан на 1-иодо-пропан.
Пример 3:
(2Z,4E)-5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-пропилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00063] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 3а. 1HNMR (CDCl3): δ7.75 (d, 1Н), 6.17 (d, 1H), 5.75 (s, 1H), 2.45 (d, 1H), 2.37-2.23 (m, 3H), 2.04 (s, 3H), 1.89 (s, 3H), 1.40-1.26 (m, 2H), 1.07 (s, 3H), 1.01 (s, 3H), 0.92 (t, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=305. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, НМВС) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 4а:
(2Z,4E)-метил 5-((S)-3-аллил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00064] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив иодоэтан аллилбромидом.
Пример 4:
(2Z,4E)-5-((S)-3-аллил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00065] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 4а. 1HNMR (CDCl3): δ7.77 (d, 1Н), 6.17 (d, 1H), 5.81-5.69 (m, 2H), 5.00 (d, 1H), 4.96 (s, 1H), 3.18-3.03 (m, 2H), 2.48 (d, 1H), 2.35 (d, 1H), 2.04 (s, 3H), 1.89 (s, 3H), 1.09 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=303. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, НМВС) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 5а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-(проп-2-ин-1-ил)циклогекс 2-ен-1-ил)-3-метилпента-1-диеноат
[00066] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив иодэтан на пропаргил бромид.
Пример 5:
(2Z,4E)-5-((S)-1-гидpoкcи-2,6,6-тpимeтил-4-oкco-3-(пpoп-2-ин-1-ил)циклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диеновая кислота
[00067] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 5а. 1HNMR (CDCl3): δ7.77 (d, 1Н), 6.15 (d, 1H), 5.76 (s, 1H), 3.32 (dd, 1H), 3.22 (dd, 1H), 2.50 (d, 1H), 2.38 (d, 1H), 2.04 (s, 3H), 2.02 (s, 3H), 1.91 (t, 1H), 1.09 (s, 3H), 1.03 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=301. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, НМВС) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 6а
(2Z,4E)-метил 5-((S)-3-бутил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00068] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 1-бутил йодид.
Пример 6:
(2Z,4Е)-5-((S)-3-бутил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00069] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 6а. 1HNMR (CDCl3): δ7.76 (d, 1Н), 6.16 (d, 1H), 5.75 (s, 1H), 2.46 (d, 1H), 2.40-2.22 (m, 3H), 2.04 (s, 3H), 1.89 (s, 3H), 1.40-1.18 (m, 4H), 1.07 (s, 3H), 1.01 (s, 3H), 0.90 (t, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=319. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, НМВС) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 7а:
(2Z,4Е)-метил 5-((S)-3-(4-ацетоксибутил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-1-метилпента-2,4-диеноат
[00070] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 4-йодбутил.
Пример 7:
(2Z,4Е)-5-((S)-1-гидрокси-3-(4-гидроксибутил)-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00071] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 7а. 1HNMR (CDCl3): δ7.76 (d, 1H), 6.14 (d, 1H), 5.74 (s, 1H), 3.72-3.59 (m, 2H), 2.57-2.46 (m, 1H), 2.42 (d, 1H), 2.29-2.17 (m, 2H), 2.04 (s, 3H), 1.91 (s, 3H), 1.65-1.36 (m, 4H), 1.06 (s, 3H), 1.04 (s, 3H). Macc-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э-335. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, НМВС) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 8а:
(2Z,4E)-метил 5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-пентилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00072] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 1-йодпентан.
Пример 8:
(2Z,4Е)-5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-пентилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00073] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 8а. 1HNMR (CDCl3): δ7.76 (d, 1Н), 6.15 (d, 1H), 5.75 (s, 1H), 2.46 (d, 1H), 2.40-2.21 (m, 3H), 2.03 (s, 3H), 1.88 (s, 3H), 1.38-1.17 (m, 6H), 1.07 (s, 3H), 1.00 (s, 3H), 0.87 (t, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=333. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 9а:
(2Z,4E)-метил 5-((S)-3-(2-(трет-бутокси)-2-оксоэтил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00074] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на трет-бутил бромоацетат.
Пример 9:
(2Z,4E)-5-((S)-3-(2-(тpeт-бyтoкcи)-2-oкcoэтил)-l-гидpoкcи-2,6,6-тpимeтил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00075] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 9а. 1HNMR (CDCl3): δ7.83 (d, 1Н), 6.14 (d, 1H), 5.75 (s, 1H), 3.47 (d, 1H), 3.20 (d, 1H), 2.49 (d, 1H), 2.37 (d, 1H), 2.01 (s, 3H), 1.87 (s, 3H), 1.41 (s, 9H), 1.13 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=377. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 10а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-3-(2-метокси-2-оксоэтил)-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00076] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на метил бромоацетат.
Пример 10:
(2Z,4E)-5-((S)-3-(кapбoкcимeтил)-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диеновая кислота
[00077] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 10а. 1HNMR (CDCl3): δ12.03 (bs, 2Н), 7.73 (d, 1H), 6.21 (d, 1H), 5.66 (s, 1H), 5.16 (s, 1H), 3.31 (d, 1H), 3.12 (d, 1H), 2.56 (d, 1H), 2.29 (d, 1H), 2.17 (s, 3H), 1.78 (s, 3H), 0.99 (s, 3H), 0.93 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=321. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 11а:
(2Z,4Е)-метил 5-((S)-3-(цианометил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеонат
[00078] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтаном на 1-бромо-ацетонитрил.
Пример 11:
(2Z,4Е)-5-((S)-3-(цианометил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00079] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 11а. 1HNMR (CDCl3): δ7.77 (d, 1Н), 6.13 (d, 1H), 5.78 (s, 1H), 3.53 (d, 1H), 3.40 (d, 1H), 2.52 (d, 1H), 2.41 (d, 1H), 2.06 (s, 3H), 2.04 (s, 3H), 1.09 (s, 3H), 1.05 (s, 3Н). В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 12а:
(2Z,4E)-метил 5-((S)-3-(2-(диметиламино)-2-оксоэтил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00080] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив N,N-диметил бромоацетамид иодоэтаном.
Пример 12:
(2Z,4Е)-5-((S)-3-(2-(диметиламино)-2-оксоэтил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00081] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 12а. 1HNMR (CDCl3): δ7.84 (d, 1Н), 6.29 (d, 1H), 5.73 (s, 1H), 3.59 (d, 1H), 3.19 (d, 1H), 3.13 (s, 3H), 2.94 (s, 3H), 2.48 (d, 1H), 2.41 (d, 1H), 2.03 (s, 3H), 1.87 (s, 3H), 1.15 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=348. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 13а:
(2Z,4E)-метил 5-((S)-3-бензил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00082] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на бензил бромид.
Пример 13:
(2Z,4Е)-5-((S)-3-бензил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00083] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 13а. 1HNMR (CDCl3): δ7.78 (d, 1Н), 7.26-7.11 (m, 5H), 6.17 (d, 1H), 5.75 (s, 1H), 3.83 (d, 1H), 3.60 (d, 1H), 2.53 (d, 1H), 2.39 (d, 1H), 2.03 (s, 3H), 1.89 (s, 3H), 1.07 (s, 3H), 1.01 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=353. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 14а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-2,6,6-триметил-3-(нафталин-2-илметал)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00084] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 2-брометил-нафталин.
Пример 14:
(2Z,4Е)-5-((S)-1-гидрокси-2,6,6-триметил-3-(нафталин-2-илметил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00085] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 14а. 1HNMR (CDCl3): δ7.84-7.69 (m, 4Н), 7.53 (m, 1H), 7.44-7.35 (m, 2H), 7.26 (dd, 1H), 6.19 (d, 1H), 5.74 (s, 1H), 3.96 (d, 1H), 3.77 (d, 1H), 2.56 (d, 1H), 2.42 (d, 1H), 2.04 (s, 3H), 1.92 (s, 3H), 1.08 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=403. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 15а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-2,6,6-триметил-3-(нафталин-1-илметил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00086] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 1-брометил-нафталин.
Пример 15:
(2Z,4E)-5-((S)-1-гидрокси-2,6,6-триметил-3-(нафталин-1-илметил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00087] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 15а. 1HNMR (CDCl3): δ8.10 (d, 1H), 7.90-7.78 (m, 2Н), 7.66 (d, 1Н), 7.54-7.42 (m, 2H), 7.28 (t, 1H), 6.98 (d, 1H), 6.26 (d, 1H), 5.78 (s, 1H), 4.23 (d, 1H), 4.06 (d, 1H), 2.63 (d, 1H), 2.47 (d, 1H), 2.06 (s, 3H), 1.73 (s, 3H), 1.19 (s, 3H), 1.06 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=403. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 16а:
(2Z,4E)-метил 5-((S)-1-гидрокси-2,6,6-триметил-3-(2-метилбензил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00088] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 2-метилбензил бромид.
Пример 16:
(2Z,4Е)-5-((S)-1-гидрокси-2,6,6-триметил-3-(2-метилбензил)-4-оксоциклогекс-4-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00089] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 16а. 1HNMR (CDCl3): δ7.84 (d, 1Н), 7.12-7.04 (m, 3H), 6.79 (d, 1H), 6.24 (d, 1H), 5.77 (s, 1H), 3.70 (d, 1H), 3.57 (d, 1H), 2.57 (d, 1H), 2.42 (d, 1H), 2.35 (s, 3H), 2.05 (s, 3H), 1.79 (s, 3H), 1.16 (s, 3H), 1.05 (s, 3H). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=367. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 17а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-2,6,6-триметил-3-(3-метилбензил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00090] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 3-метилбензил бромид.
Пример 17:
(2Z,4Е)-5-((S)-1-гидрокси-2,6,6-триметил-3-(3-метилбензил)-4-оксоциклогекс-4-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00091] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 17а. 1HNMR (CDCl3): δ7.79 (d, 1Н), 7.10 (m, 1H), 6.95-6.90 (m, 3H), 6.18 (d, 1H), 5.75 (s, 1H), 3.78 (d, 1H), 3.58 (d, 1H), 2.54 (d, 1H), 2.40 (d, 1H), 2.27 (s, 3H), 2.03 (s, 3H), 1.89 (s, 3H), 1.08 (s, 3H), 1.02 (s, 3H). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=367. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 18а:
(2Z,4E)-метил 5-((S)-1-гидрокси-2,6,6-триметил-3-(4-метилбензил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00092] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 4-метилбензил бромид.
Пример 18:
(2Z,4Е)-5-((S)-1-гидрокси-2,6,6-триметил-3-(4-метилбензил)-4-оксоциклогекс-4-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00093] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 18а. 1HNMR (CDCl3): δ7.78 (d, 1Н), 7.02 (m, 4H), 6.18 (d, 1H), 5.75 (s, 1H), 3.79 (d, 1H), 3.57 (d, 1H), 2.52 (d, 1H), 2.39 (d, 1H), 2.27 (s, 3H), 2.03 (s, 3H), 1.89 (s, 3H), 1.07 (s, 3H), 1.01 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=367. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 19а:
(2Z,4Е)-метил 5-((S)-3-(2-фторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00094] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 2-фторбензил бромид.
Пример 19:
(2Z,4Е)-5-((S)-3-(2-фторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00095] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 19а. 1HNMR (CDCl3): δ7.78 (d, 1Н), 7.20-6.95 (m, 4H), 6.18 (d, 1H), 5.75 (s, 1H), 3.82 (d, 1H), 3.66 (d, 1H), 2.54 (d, 1H), 2.40 (d, 1H), 2.03 (s, 3H), 1.86 (s, 3H), 1.08 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=371. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 20а:
(2Z,4Е)-метил 5-((S)-3-(3-фторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00096] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 3-фторбензил бромид.
Пример 20:
(2Z,4E)-5-((S)-3-(3-фтopбeнзил)-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диеновая кислота
[00097] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 20а. 1HNMR (CDCl3): δ7.78 (d, 1Н), 7.17 (dd, 1H), 6.91 (d, 1H), 6.83-6.82 (m, 2H), 6.18 (d, 1H), 5.76 (s, 1H), 3.81 (d, 1H), 3.61 (d, 1H), 2.54 (d, 1H), 2.40 (d, 1H), 2.04 (s, 3H), 1.89 (s, 3H), 1.08 (s, 3H), 1.02 (s, 3H). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=371. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 21а:
(2Z,4E)-метил 5-((S)-3-(4-фторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[00098] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 4-фторбензил бромид.
Пример 21:
(2Z,4Е)-5-((S)-3-(4-фторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[00099] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 21а. 1HNMR (CDCl3): δ7.79 (d, 1Н), 7.07 (t, 2H), 6.89 (t, 2H), 6.15 (d, 1H), 5.75 (s, 1H), 3.77 (d, 1H), 3.55 (d, 1H), 2.52 (d, 1H), 2.38 (d, 1H), 2.01 (s, 3H), 1.87 (s, 3H), 1.04 (s, 3H), 0.99 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=371. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 22а:
(2Z,4Е)-метил 5-((S)-3-(3,4-дифторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000100] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 3,4-дифлюоробензил бромид.
Пример 22:
(2Z,4Е)-5-((S)-3-(3,4-дифторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-металлента-2,4-диеновая кислота
[000101] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 22а. 1HNMR (CDCl3): δ7.77 (d, 1Н), 7.04-6.85 (m, 3H), 6.17 (d, 1H), 5.76 (s, 1H), 3.75 (d, 1H), 3.57 (d, 1H), 2.53 (d, 1H), 2.39 (d, 1H), 2.04 (s, 3H), 1.90 (s, 3H), 1.07 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=389. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 23а:
(2Z,4E)-метил 5-((S)-3-(3,5-дифторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000102] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 3,5-дифлюоробензил бромид.
Пример 23:
(2Z,4Е)-5-((S)-3-(3,5-дифторбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000103] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 23а. 1HNMR (CDCl3): δ7.78 (d, 1Н), 6.66-6.58 (m, 3H), 6.17 (d, 1H), 5.77 (s, 1H), 3.78 (d, 1H), 3.61 (d, 1H), 2.55 (d, 1H), 2.40 (d, 1H), 2.04 (s, 3H), 1.90 (s, 3H), 1.08 (s, 3H), 1.03 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=389. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 24а:
(2Z,4E)-метил 5-((S)-3-(2-хлорбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000104] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 2-хлорбензил бромид.
Пример 24:
(2Z,4Е)-5-((S)-3-(2-хлорбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000105] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 24а. 1HNMR (CDCl3): δ7.80 (d, 1H), 7.31 (m, 1H), 7.09 (m, 2H), 6.93 (m, 1H), 6.21 (d, 1H), 5.76 (s, 1H), 3.87 (d, 1H), 3.74 (d, 1H), 2.57 (d, 1H), 2.43 (d, 1H), 2.04 (s, 3H), 1.79 (s, 3H), 1.14 (s, 3H), 1.04 (s, 3H). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=387. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 25а:
(2Z,4E)-метил 5-((S)-3-(4-хлорбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000106] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 4-хлорбензил бромид.
Пример 25:
(2Z,4Е)-5-((S)-3-(4-хлорбензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000107] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 25а. 1HNMR (CDCl3): δ7.78 (d, 1H), 7.18 (d, 2H), 7.06 (d, 2H), 6.27 (d, 1H), 5.76 (s, 1H), 3.78 (d, 1H), 3.56 (d, 1H), 2.53 (d, 1H), 2.39 (d, 1H), 2.03 (s, 3H), 1.88 (s, 3H), 1.06 (s, 3H), 1.01 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=387. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 26а:
(2Z,4Е)-метил 5-((S)-3-(3-метоксибензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000108] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 3-метоксибензил бромид.
Пример 26:
(2Z,4Е)-5-((S)-3-(3-метоксибензил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000109] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 26а. 1HNMR (CDCl3): δ7.74 (d, 1Н), 7.14 (t, 1H), 6.73 (d, 1H), 6.69 (d, 1H), 6.68 (s, 1H), 6.17 (d, 1H), 5.75 (s, 1H), 3.78 (d, 1H), 3.75 (s, 3H), 3.61 (d, 1H), 2.53 (d, 1H), 2.38 (d, 1H), 2.03 (s, 3H), 1.89 (s, 3H), 1.08 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=383. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 27а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-3-(2-метокси-4-нитробензил)-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000110] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 2-метокси-4-нитробензил бромид.
Пример 27:
(2Z,4Е)-5-((S)-1-гидрокси-3-(2-метокси-4-нитробензил)-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000111] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 27а. 1HNMR (CDCl3): δ8.08 (d, 1Н), 7.88 (d, 1H), 7.74 (s, 1H), 6.87 (d, 1H), 6.30 (d, 1H), 5.77 (s, 1H), 3.93 (s, 3H), 3.70 (dd, 2H), 2.61 (d, 1H), 2.43 (d, 1H), 2.10 (s, 3H), 1.85 (s, 3H), 1.15 (s, 3H), 1.05 (s, 3H). Macc-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=428.2. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 28а:
(2Z,4Е)-метил 5-((S)-3-(бензо[д]тиазол-2-илметил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000112] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 2-бромметил-бензотиазол.
Пример 28:
(2Z,4Е)-5-((S)-3-(бензо[д]тиазол-2-илметил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000113] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 28а. 1HNMR (CDCl3): δ7.88-7.86 (m, 2Н)7.74 (d, 1H), 7.37-7.32 (m, 2H), 6.21 (d, 1H), 5.76 (s, 1H), 3.78 (d, 1H), 4.38 (d, 1H), 4.17 (d, 1H), 2.60 (d, 1H), 2.47 (d, 1H), 2.07 (s, 3H), 2.04 (s, 3H), 1.15 (s, 3H), 1.08 (s, 3H). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=409.7. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 29а:
2-Циклопропил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000114] В раствор 2,6,6-триметилциклогекс-2-ен-1,4-дион (4,5 г), при комнатной температуре добавили ацетонитрил (60 мл), воду (20 мл) и циклопропанкарбоновую кислоту (6,2 г). Смесь нагрели до температуры 65°С. AgNO3 (1,0 г) добавили в смесь с последующим добавлением по капле раствора персульфата аммония (8,9 г) в воде (50 мл) и ацетонитрила (90 мл) в течение 1,5 часа. Смеси была концентрирована до половинного объема, после чего экстрагирована с использованием этилацетата. Экстракт был промыт насыщенным водным раствором бикарбоната натрия, высушен над безводным MgSO4 и концентрирован. Остаток был очищен колоночной хроматографией на силикагеле и элюирован посредством n-гексан/этилацетата (10/1) для получения титульного соединения (1,0 г).
Пример 29b:
(Z)-2-циклопропил-4-гидрокси-4-(5-гидрокси-3-метилпен-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000115] Раствор n-бутил-лития (1,6 М в n-гексане, 27,6 мл) добавили по капле в раствор 3-метил-пент-4-ин-2-енол (2,25 г) в безводном THF (50 мл) при температуре ниже -30°С. Смесь перемешивали в течение 30 минут в интервале температур от -50 до -60°С. Получившийся дианонный раствор канюлировали в раствор, описанный в Примере 29а (2,5 г) в безводном THF (50 мл), при ниже температуре -50°С в течение 15 минут. Далее смесь перемешивали в течение еще 2 часов, поддерживая температуру в интервале от -50 до -60°С. Далее добавили насыщенный водный раствор хлорида аммония (30 мл), и экстрагировали смесь, используя этилацетат. Экстракт высушили (MgSO4), отфильтровали и концентрировали. Остаток очистили колоночной хроматографией на силикагеле и элюировали посредством n-гексан/этил ацетата (от 2/1 до 1/1), для получения титульного соединения (2,3 г).
Пример 29с:
(2Z,4Е)-5-(3-циклопропил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000116] В раствор, описанный в Примере 29b (1,5 г), в безводном THF (20 мл) добавили 65% (массовая доля) Red-Al / раствора толуола (8,4 мл) в условиях охлаждающей водяной ванны. Смесь перемешивали до тех пор, пока все остатки нерастворимого вещества полностью не исчезли. Воду (10 мл) медленно добавляли для разложения избытка Red-Al. Затем смесь отфильтровали через целит, а фильтрат экстрагировали, используя этилацетат. Экстракт высушили (MgSO4), отфильтровали и концентрировали. Остаток растворили в ацетонитриле (20 мл). N-метилморфолин N-оксид (1,2 г) и тетрапропиламмоний перрутенат (30 мг) добавили при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3-х часов. Затем воду (50 мл) и этил ацетат (50 мл) добавили в смесь. Органическую фазу отделили и промыли насыщенным водным раствором NaCl. Органический раствор высушили безводным MgSO4 и концентрировали при пониженном давлении. Полученный остаток очистили колоночной хроматографией на силикагеле и элюировали посредством n-гексан/этил ацетата (от 3/1 до 2/1) для получения титульного соединения (0,13 г).
Пример 29:
(2Z,4Е)-5-(3-циклопропил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000117] В раствор NaClO2 (0,16 г) и NaH2PO4 (0.28 г) в воде (5 мл) добавили раствор, описанный в Примере 29с (0,13 г), и 2-метил-2-бутен (0,5 г) в 2-метил-1-пропаноле (5 мл) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3-х часов. Затем воду (30 мл) и этил ацетат (50 мл) добавили в смесь. Органическую фазу отделили и промыли водой (10 мл). После того, как органический раствор высушили, используя безводный MgSO4, его концентрировали при пониженном давлении (100 тор.). Масляный остаток очистили колоночной хроматографией на силикагеле и элюировали посредством CHCl3/ТНF/уксусной кислоты (500/35/1), для получения титульного соединения (0,1 г). Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=303 (100%, М-1). 1Н NMR (CDCl3): δ7.72 (1H, d, J=16 Hz), 6.15 (1H, d, J=16 Hz), 5.76 (1H, bs), 2.42 (1H, d, J=17 Hz), 2.26 (1H, d, J=17 Hz), 2.04 (3H, d, J=1.2 Hz), 2.02 (3H, d, J=1.2 Hz), 1.3-1.4 (2H, m), 1.05 (3H, s), 1.00 (3H, s), 0.9-0.85 (1H, m), 0.5-0.6 (1H, m), 0.43-0.48 (1H, m).
Пример 30a:
3,5,5-Триметил-2-пропилциклогекс-2-ен-1,4-дион
[000118] Данное соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на масляную кислоту.
Пример 30b:
(Z)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметил-2-пропилциклогекс-2-енон
[000119] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 30а.
Пример 30с:
(2Z,4E)-5-(1-гидрокси-2,6,6-триметил-4-оксо-3-пропилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000120] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 30b.
Пример 30:
(2Z,4E)-5-(1-гидрокси-2,6,6-триметил-4-оксо-3-пропилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000121] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 30с. 1Н NMR (CDCl3): δ7.75 (1Н, d, J=16 Hz), 6.16 (1Н, d, J=16 Hz), 5.75 (1H, bs), 2.46 (1H, d, J=17 Hz), 2.36-2.25 (3H, m), 2.04 (3H, s), 1.89 (3H, s), 1.41-1.33 (2H, m), 1.08 (3H, bs), 1.01 (3H, bs), 0.92 (3H, t, J=7 Hz).
Пример 31a:
2-изо-Пропил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000122] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 2-метилпропионовую кислоту.
Пример 31b:
(Z)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-2-изопропил-3,5,5-триметилциклогекс-2-енон
[000123] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 31а.
Пример 31с:
(2Z,4E)-5-(1-гидрокси-3-изопропил-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000124] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 31b.
Пример 31:
(2Z,4E)-5-(1-гидрокси-3-изопропил-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000125] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 31с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=305 (100%, М-1). 1Н NMR (CDCl3): δ7.72 (1Н, d, J=16 Hz), 6.14 (1Н, d, J=16 Hz), 5.76 (1H, bs), 3.01-2.94 (1H, m), 2.41 (1H, d, J=17 Hz), 2.23 (1H, d, J=17 Hz), 2.04 (3H, bs), 1.9 (3H, bs), 1.21 (6H, d, J=7 Hz), 1.08 (3H, bs), 1.0 (3H, bs).
Пример 32a:
2-Этил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000126] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 2-пропиновую кислоту.
Пример 32b:
(Z)-2-этил-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000127] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 32а.
Пример 32с:
(2Z,4E)-5-(3-этил-l-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диенал
[000128] Соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 32b.
Пример 32:
(2Z,4E)-5-(3-этил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000129] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 32с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=291 (100%, М-1). 1H NMR (DMSO-d6): δ7.61 (1Н, d, J=16 Hz), 6.17 (1H, d, J=16 Hz), 5.64 (1H, bs), 5.15 (1H, s), 2.43 (1H, d, J=17 Hz), 2.20 (2H, q, J=7 Hz), 2.10 (1H, d, J=17 Hz), 1.95 (3H, bs), 1.79 (3H, bs), 0.90 (6H, bs), 0.86 (3H, t, J=7 Hz).
Пример 33a:
2-Бутил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000130] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на пентановую кислоту.
Пример 33b:
(Z)-2-бутил-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000131] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 33а.
Пример 33с:
(2Z,4E)-5-(3-бутил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000132] Соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 33b.
Пример 33:
(2Z,4E)-5-(3-бутил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000133] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 33с. 1Н NMR (CDCl3): δ7.77 (1H, d, J=16 Hz), 6.16 (1Н, d, J=16 Hz), 5.75 (1H, bs), 2.46 (1H, d, J=17 Hz), 2.32 (2H, d, J=17 Hz), 2.34-2.25 (2H, m), 2.04 (3H, bs), 1.89 (3H, bs), 1.25-1.40 (4H, m), 1.07 (3H, bs), 1.01 (3H, bs), 0.90 (3H, t, J=7 Hz).
Пример 34a:
2-изо-Бутил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000134] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 3-метилбутановую кислоту.
Пример 34b:
(Z)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-2-изобутил-3,5,5-триметилциклогекс-2-енон
[000135] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 34а.
Пример 34с:
(2Z,4E)-5-(1-гидрокси-3-изобутил-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000136] Соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 34b.
Пример 34:
(2Z,4E)-5-(1-гидрокси-3-изобутил-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000137] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 34с. 1Н NMR (CDCl3): δ7.78 (1Н, d, J=16 Hz), 6.18 (1Н, d, J=16 Hz), 5.76 (1H, bs), 2.48 (1H, d, J=17 Hz), 2.35-2.29 (2H, m), 2.16 (1H, dd, J=13 Hz, 7Hz), 1.90 (3H, bs), 1.79-1.72 (1H, m), 1.10 (3H, s), 1.01(3H, s), 0.88 (3H, d, J=7 Hz), 0.87 (3H, d, J=7 Hz).
Пример 35a:
2-(трет-Бутил)-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000138] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на триметилуксусную кислоту.
Пример 35b:
(2)-2-(трет-бутил)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000139] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 35а.
Пример 35с:
(2Z,4E)-5-(3-(трет-бутил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000140] Соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 35b.
Пример 35:
(2Z,4Е)-5-(3-(трет-бутил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000141] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 35с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=319 (100%, М-1). 1H NMR (CDCl3): δ7.80 (1H, d, J=16 Hz), 6.14 (1Н, d, J=16 Hz), 6.08 (1H, s, OH), 5.77 (1H, bs), 2.51 (1H, d, J=17 Hz), 2.30 (1H, d, J=17 Hz), 2.04 (3H, bs), 2.02 (3H, bs), 1.15 (3H, bs), 1.02 (3H, s), 1.01 (9H, s).
Пример 36a:
3,5,5-Триметил-2-(1-метилциклопропил)циклогекс-2-ен-1,4-дион
[000142] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 1-метил циклопропанкарбоновую кислоту.
Пример 36b:
(Z)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметил-2-(1-метилциклопропил)циклогекс-2-енон
[000143] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 36а.
Пример 36с:
(2Z,4Е)-5-(1-гидрокси-2,6,6-триметил-3-(1-метилциклопропил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000144] Соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 36b.
Пример 36:
(2Z,4Е)-5-(1-гидрокси-2,6,6-триметал-3-(1-металциклопропил)-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000145] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 36с. 1H NMR (CDCl3): δ7.67 (1Н, d, J=16 Hz), 6.14 (1Н, d, J=16 Hz), 5.76 (1H, bs), 2.39 (1H, d, J=17 Hz), 2.24 (1H, d, J=17 Hz), 2.04 (6H, s), 1.18 (3H, s), 1.03 (3H, bs), 1.00 (3H, bs), 0.68 (2H, m), 0.48-0.57 (2H, m).
Пример 37a:
2-Гексил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000146] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на гептановую кислоту.
Пример 37b:
(Z)-2-гексил-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000147] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 37а.
Пример 37с:
(2Z,4Е)-5-(3-гексил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000148] Соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 37b.
Пример 37:
(2Z,4E)-5-(3-гeкcил-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диеновая кислота
[000149] Соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 37с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=347 (100%, М-1). 1Н NMR (CDCl3): δ7.76 (1Н, d, J=16 Hz), 6.16 (1Н, d, J=16 Hz), 5.75 (1H, bs), 2.46 (1H, d, J=17 Hz), 2.30-2.20 (3H, m), 2.04 (3H, bs), 1.89 (3H, bs), 1.36-1.20 (8H, m), 1.07 (3H, bs), 1.01 (3H, s), 0.87 (3H, bt, J=7Hz).
Пример 38a:
2-(Дифторметил)-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000150] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на дифторуксусную кислоту.
Пример 38b:
(Z)-2-(дифторметил)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000151] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 38а.
Пример 38с:
(Z)-3-(дифторметил)-1-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-2,6,6-триметилциклогекс-2-ен-1,4-диол
[000152] Гексагидрат хлорида церия (0,16 г) добавили в раствор, описанный в Примере 38b (2 г), в метаноле (50 мл) при комнатной температуре. Смесь охладили до температуры -70°С при перемешивании. Затем в течение 20-и минут добавляли NaBH4 (0,4 г) при температуре ниже -60°С. После перемешивания в течение 1-го часа при температуре ниже -60°С, добавили насыщенный водный раствор хлорида аммония (30 мл) при температуре ниже -40°С. Смеси позволили нагреться до комнатной температуры, после чего ее экстрагировали, используя этилацетат. Экстракт промыли насыщенным водным раствором хлорида натрия, высушили с MgSO4 и довели до требуемой концентрации. Остаток подвергли колоночной хроматографии на силикагеле и элюировали посредством n-гексан/этилацетата (3/2) для получения диастероизомерной смеси титульного соединения (1,19 г). Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=265, 283, 318, 323 (100%, M+Na).
Пример 38d:
3-(Дифторметил)-1-((1E,3Z)-5-гидрокси-3-метилпента-1,3-диен-1-ил)-2,6,6-триметилциклогекс-2-ен-1,4-диол
[000153] В раствор, описанный в Примере 38 с (1,9 г), в безводном THF (60 мл) медленно добавляли Red-Al (65% раствор толуола, 5 мл) при температуре 0-5°С. Смесь перемешивали в условиях ледяной-водяной ванны с охлаждением до тех пор, пока не исчез весь нерастворенный материал. Затем добавили воду для удаления избытка Red-AI. Затем смесь отфильтровали через целит, а фильтрат высушили и довели до требуемой концентрации. Остаток содержал два изомера целевого соединения, как определено анализами по методу жидкостной хроматографии / масс-спектроскопии (LC-MS). Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=285, 303 (М+1), 325 (M+Na).
Пример 38е:
(2Z,4E)-5-(3-(дифтopмeтил)-1,4-дигидpoкcи-2,6,6-тpимeтилциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диенал
[000154] В раствор, описанный в Примере 38d (0,3 г), в ацетонитриле (30 мл) добавили N-метилморфорин-N-оксид (0,5 г) и перрутенат тетрапропиламмоний (0,1 г). Смесь перемешивали при комнатной температуре в течение 4-х часов и затем разбавили водой (20 мл), после чего экстрагировали, используя этилацетат. Экстракт высушили с MgSO4 и довели до требуемой концентрации. Остаток очистили колоночной хроматографией на силикагеле и элюировали посредством n-гексан/этилацетата (от 2/1 до 1/1), для получения смеси двух изомеров целевого соединения (0,21 г). Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=283, 323 (100%, M+Na).
Пример 38f:
(2Z,4E)-5-(3-(дифтopмeтил)-1,4-дигидpoкcи-2,6,6-тpимeтилциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диеновая кислота
[000155] В раствор NaClO2 (0,13 г) и NaH2PO4 (0,22 г) в воде (7 мл) добавили раствор, описанный в Примере 38е (0,21 г), и 2-Метил-2-бутен (1 г) в 2-метил-1-пропаноле (7 мл) при комнатной температуре (20-25°С). Смесь перемешивали при комнатной температуре в течение 6-х часов. Затем в смесь добавили воду (30 мл) и этилацетат (50 мл). Органическую фазу отделили и промыли водой (10 мл). После высушивания безводным MgSO4 органический раствор довели до требуемой концентрации при пониженном давлении (100 тор.). Остаток обработали колоночной хроматографией на силикагеле и элюировали посредством СНСl3/ТHF/уксусной кислоты (300/200/1), для получения неочищенного целевого соединения (40 мг). Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=631 (100%, 2М-1), 315 (М-1).
Пример 38:
(2Z,4E)-5-(3-(дифтopмeтил)-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диеновая кислота
[000156] В раствор неочищенного соединения, описанного в Примере 38f (40 мг), в ацетоне (10 мл) добавили избыточное количество реагента Джонса 2,7 М (раствор хрома в разбавленной серной кислоте) при комнатной температуре. Перемешав в течение 2-х секунд, добавляли 1-пропанол до тех пор, пока реакционная смесь не приобрела зеленый цвет. Смесь разбавили водой и этилацетатом. Органическую фазу отделили и промыли водой. В результате высушивания безводным MgSO4, пропускания через фильтр и доведения до требуемой концентрации получили неочищенный продукт. Колоночная хроматография на силикагеле и элюирование посредством СНCl3/ТНF/уксусная кислота (300/200/1) дали 20 мг целевого соединения. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=293 (100%), 313 (М-1). 1Н NMR (CDCl3): δ7.84 (1Н, d, J=16 Hz), 6.88 (1Н, t, J=54.3 Hz), 6.13 (1H, d, J=16 Hz), 5.80 (1H, bs), 2.53 (1H, d, J=17 Hz), 2.38 (1H, d, J=17 Hz), 2.17 (3H, bs), 2.05 (3H, bs), 1.11 (3H, bs), 1.04 (3H, bs). 19F NMR (CDCl3): δ-117.5 (d).
Пример 39a:
2-(1,1-дифторэтил)-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000157] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 2,2-дифторпропионовую кислоту.
Пример 39b:
(Z)-2-(1,1-дифторэтил)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000158] Соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 39а.
Пример 39с:
(Z)-3-(1,1-дифторэтил)-1-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-2,6,6-триметилциклогекс-2-ен-1,4-диол
[000159] Соединение получили согласно процедуре, описанной в Примере 38с, заместив Пример 38b Примером 39b.
Пример 39d:
3-(1,1-Дифторэтил)-1-((1E,3Z)-5-гидрокси-3-метилпента-1,3-диен-1-ил)-2,6,6-триметилциклогекс-2-ен-1,4-диол
[000160] Соединение получили согласно процедуре, описанной в Примере 38d, заместив Пример 39с Примером 38с.
Пример 39е:
(2Z,4E)-5-(3-(1,1-дифторэтил)-1,4-дигидрокси-2,6,6-триметилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000161] Соединение получили согласно процедуре, описанной в Примере 38е, заместив Пример 38d Примером 39d.
Пример 39f:
(2Z,4E)-5-(3-(1,1-дифторэтил)-1,4-дигидрокси-2,6,6-триметилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000162] Соединение получили согласно процедуре, описанной в Примере 38f, заместив Пример 39е Примером 38е.
Пример 39:
(2Z,4E)-5-(3-(1,1-дифторэтил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000163] Соединение получили согласно процедуре, описанной в Примере 38, заместив Пример 38f Примером 39f. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=327 (М-1), 307 (100%); (ионизация методом электрораспыления ESI+): м/э=351 (M+Na, 100%), 346, 329 (М+1). 1H NMR (CDCl3): δ7.78 (1H, d, J=16 Hz), 6.11 (1Н, d, J=16 Hz), 5.78 (1H, s), 2.46 (1H, d, J-17 Hz), 2.35 (1H, d, J=17 Hz), 2.07 (3H, dd, J=9Hz, 2Hz), 2.04(3H, s), 1.87 (3H, t, J=19 Hz), 1.14 (3H, s), 1.04 (3H, s), 19F NMR (CDCl3): δ - 82.76 (2F, d, J=29 Hz).
Пример 40a:
2-(1-Фторэтил)-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000164] Соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 2-фторпропановую кислоту.
Пример 40b:
(Z)-2-(1-фторэтил)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000165] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 40а.
Пример 40с:
(Z)-3-(1-фторэтил)-1-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-2,6,6-триметилциклогекс-2-ен-1,4-диол
[000166] Данное соединение получили согласно процедуре, описанной в Примере 38с, заместив Пример 38b Примером 40b.
Пример 40d:
3-(1-Фторэтил)-1-((1Е,3Z)-5-гидрокси-3-метилпента-1,3-диен-1-ил)-2,6,6-триметилциклогекс-2-ен-1,4-диол
[000167] Данное соединение получили согласно процедуре, описанной в Примере 38d, заместив Пример 38с Примером 40с.
Пример 40е:
(2Z,4Е)-5-(3-(1-фторэтил)-1,4-дигидрокси-2,6,6-триметилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000168] Данное соединение получили согласно процедуре, описанной в Примере 38е, заместив Пример 38d Примером 40d.
Пример 40f:
(2Z,4Е)-5-(3-(1-фторэтил)-1,4-дигидрокси-2,6,6-триметилциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000169] Данное соединение получили согласно процедуре, описанной в Примере 38f, заместив Пример 38е Примером 40е.
Пример 40:
(2Z,4Е)-5-(3-(1-фторэтил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000170] Данное соединение получили согласно процедуре, описанной в Примере 38, заместив Пример 38f Примером 40f. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=309 (100%, М-1). lH NMR (CDCl3): δ7.72 (1Н, d, J=16 Hz), 6.14 (1Н, d, J=16 Hz), 5.87 (1H, dq, J=48 Hz, 6.6 Hz), 5.78 (1H, bs), 2.44 (1H, d, J=17 Hz), 2.28 (1H, d, J=17 Hz), 2.05 (6H, bs), 1.55 (3H, dd, J=23 Hz, 6.6 Hz), 1.12 (3H, s), 1.03 (3H, s), 19F NMR (CDCl3): δ-180.12 (s).
Пример 41a:
2-Циклобутил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000171] Данное соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на циклобутанкарбоновую кислоту.
Пример 41b:
(Z)-2-циклобутил-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000172] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 41а.
Пример 41с:
(2Z,4Е)-5-(3-циклобутил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000173] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 41b.
Пример 41:
(2Z,4Е)-5-(3-циклобутил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000174] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 41с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=317 (100%, М-1). 1Н NMR (CDCl3): δ7.77 (1Н, d, J=16 Hz), 6.14 (1Н, d, J=16 Hz), 5.76 (1H, bs), 3.34 (1H, t, J=8.9 Hz), 2.42 (1H, d, J=17 Hz), 2.32-2.18 (3H, m), 2.04 (3H, d, J=1 Hz), 1.95-1.84 (2H, m), 1.82 (3H, d, J=1 Hz), 1.10 (3H, bs), 0.99 (3H, bs), 0.85-0.95 (2H, m).
Пример 42a:
2-Циклопентил-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000175] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив циклопропанкарбоновую кислоту на циклопентанкарбоновую кислоту.
Пример 42b:
(Z)-2-циклопентил-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000176] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 42а.
Пример 42с:
(2Z,4E)-5-(3-циклoпeнтил-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-eн-1-ил)-3-метилпента-2,4-диенал
[000177] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 42b.
Пример 42:
(2Z,4Е)-5-(3-цикслопентил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000178] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 42с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=331 (100%, М-1). 1Н NMR (CDCl3): δ7.73 (1H, d, J=16 Hz), 6.16 (1Н, d, J=16 Hz), 5.75 (1H, bs), 3.1-2.9 (1H, m), 2.43 (1H, d, J=17 Hz), 2.25 (1H, d, J=17 Hz), 2.05 (3H, bs), 1.88-1.56 (8H, m), 1.9 (3H, bs), 1.08 (3H, bs), 1.0 (3H, bs).
Пример 43а:
2-(2-Фторциклопропил)-3,5,5-триметилциклогекс-2-ен-1,4-дион
[000179] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив циклопропанкарбоновую кислоту на 2-фторциклопропанкарбоновую кислоту.
Пример 43b:
(Z)-2-(2-фторциклопропил)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметилциклогекс-2-енон
[000180] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 43а.
Пример 43с:
(2Z,4E)-5-(3-(2-фтopциклoпpoпил)-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-ен-1-ил)-3-метилпента-2,4-диенал
[000181] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 43b.
Пример 43:
(2Z,4E)-5-(3-(2-фтopциклoпpoпил)-1-гидpoкcи-2,6,6-тpимeтил-4-oкcoциклoгeкc-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000182] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 43с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=321 (100%, М-1). 1Н NMR (CDCl3): δ7.69 (1Н, d, J=16 Hz), 6.13 (1H, d, J=16 Hz), 5.76 (1H, bs), 4.99 (1H, d, m, J=65 Hz), 2.39 (1H, d, J=17 Hz), 2.30 (1H, d, J=17 Hz), 2.05 (3H, bs), 2.03 (1H, m), 1.8-1.9 (1H, m), 1.45-1.36 (1H, m), 1.84 (3H, bs), 1.06 (3H, bs), 1.0 (3H, bs). 19F NMR (CDCl3): δ-204.3 (d).
Пример 44a:
3,5,5-триметил-2-(2,2,2-трифторэтил)циклогекс-2-ен-1,4-дион
[000183] Данное соединение получили согласно процедуре, описанной в Примере 29а, заместив циклопропанкарбоновую кислоту на 3,3,3-трифторпропионовую кислоту.
Пример 44b:
(Z)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметил-2-(2,2,2-трифторэтил)циклогекс-2-енон
[000184] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 44а.
Пример 44с:
(2Z,4Е)-5-(1-гидрокси-2,6,6-триметил-4-оксо-3-(2,2,2-трифторэтил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000185] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 44b.
Пример 44:
(2Z,4Е)-5-(1-гидрокси-2,6,6-триметил-4-оксо-3-(2,2,2-трифторэтил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000186] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 44с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=345 (100%, М-1). 1Н NMR (CDCl3): δ7.78 (1Н, d, J=16 Hz), 6.14 (1Н, d, J=16 Hz), 5.77 (1H, bs), 3.48-3.39 (1H, m), 3.11-3.22 (1H, m), 2.53 (1H, d, J=17 Hz), 2.41 (1H, d, J=17 Hz), 2.04 (3H, bs), 1.99 (3H, bs), 1.09 (3H, bs), 1.04 (3H, bs). 19F NMR (CDCl3): δ-64.56 (s).
Пример 45a:
3,5,5-Триметил-2-(трифторметил)циклогекс-2-ен-1,4-дион
[000187] В раствор трифторметансульфината калия (7,74 г) в воде (50 мл) добавили раствор 2,6,6-триметилциклогекс-2-ен-1,4-диона (2,3 g) в ацетонитриле (50 мл). Смесь подогрели до температуры 50°С и добавили AgNO3 (1,34 г). Затем в течение 1,5 часа по капле добавляли раствор из персульфата аммония (8,9 г), воды (50 мл) и ацетнитрила (50 мл) в условиях умеренного нагревания с обратным холодильником. Полученную смесь перемешивали в условиях умеренного нагревания с обратным холодильником в течение одного часа, остудили до комнатной температуры и экстрагировали, используя t-бутил метиловый эфир. Экстракт промыли водой, высушили безводным MgSO4 и довели до требуемой концентрации. Остаток очистили колоночной хроматографией на силикагеле и элюировали посредством n-гексан/t-бутил метилового эфира (10/1) для получения титульного соединения (1,47 г). Газовая хроматография / масс-спектроскопия GC/MS: м/э=220 (М+), 205, 164, 136 (100%). 1Н NMR (CDCl3): δ2.81 (2Н, s), 2.23 (3Н, q, J=3 Hz), 1.27 (6Н, s). 19F NMR (CDCl3): δ-59.12 (s).
Пример 45b:
(Z)-4-гидрокси-4-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-3,5,5-триметил-2-(трифторметил)циклогекс-2-енон
[000188] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 45а.
Пример 45с:
(Z)-1-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-2,6,6-триметил-3-(трифторметил)циклогекс-2-ен-1,4-диол
[000189] Данное соединение получили согласно процедуре, описанной в Примере 38с, заместив Пример 38b Примером 45b.
Пример 45d:
1-((1Е,3Z)-5-гидрокси-3-метилпента-1,3-диен-1-ил)-2,6,6-триметил-3-(трифторметил)циклогекс-2-ен-1,4-диол
[000190] Данное соединение (смесь двух изомеров) получили согласно процедуре, описанной в Примере 38d, заместив Пример 38с Примером 45с.
Пример 45е:
(2Z,4E)-5-(1,4-дигидрокси-2,6,6-триметил-3-(трифторметил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000191] Данное соединение (как смесь двух изомеров) получили согласно процедуре, описанной в Примере 38е, заместив Пример 38d Примером 45d.
Пример 45f:
(2Z,4E)-5-(1-гидрокси-2,6,6-триметил-4-оксо-3-(трифторметил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диенал
[000192] Смесь изомеров, описанную в Примере 45е (0,4 г), растворили в ацетоне (50 мл). Избыточное количество агента Джонса (2,7 М) добавили в смесь в условиях охлаждения водяной ванной. Смесь оранжевого цвета перемешивали одну секунду. После этого добавляли достаточное количество 2-пропанола до тех пор, пока смесь не приобрела зеленый цвет. Смесь экстрагировали, используя эфир. Эфирный раствор высушили и довели до требуемой концентрации. Провели хроматографию остатка на колонке с силикагелем и элюировали посредством n-гексана/этилацетата (2/1), для получения титульного соединения (0,33 г). Жидкостная хроматография / масс-спектроскопия LC/MS (ионизация методом электрораспыления ESI+): 334, 317 (М+1). 1Н NMR (CDCl3): δ10.19 (1H, d, J=8 Hz), 7.56 (1Н, d, J=16 Hz), 6.10 (1H, d, J=16 Hz), 5.98 (1H, d, J=8 Hz), 2.57 (1H, d, J=17 Hz), 2.47 (1H, d, J=17 Hz), 2.13 (3H, td, J=6 Hz, 3 Hz), 2.09 (3H, bs), 1.15 (3H, s), 1.05 (3H, s). 19F-NMR (CDCl3): δ-57.68 (s).
Пример 45:
(2Z,4Е)-5-(1-гидрокси-2,6,6-триметил-4-оксо-3-(трифторметил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000193] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 45f. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=331 (100%, М-1). 1Н NMR (CDCl3): δ7.86 (1Н, d, J=16 Hz), 6.09 (1H, d, J=16 Hz), 5.81 (1H, bs), 2.55 (1H, d, J=17 Hz), 2.41 (1H, d, J=17 Hz), 2.14 (3H, q, J=3 Hz), 2.05 (3H, bs), 1.14 (3H, s), 1.05 (3H, s). 19F NMR (CDCl3): δ-57.65 (s).
Пример 46a:
4,4,6-Триметил-3,4-дигидро-[1,1'-бифенил]-2,5-дион
[000194] В раствор из фенилборной кислоты (6,02 г) и нитрата серебра (1,12 г) в воде (150 мл) добавили раствор из 2,6,6-триметилциклогекс-2-ен-1,4-диона (5,0 г) в бензотрифториде (100 мл). Раствор персульфата аммония (12,5 г) в воде (30 мл) добавили по капле в смесь. Температуре позволили подняться до 35°С после добавления всего персульфата аммония. Смесь перемешивали при комнатной температуре в течение 3-х часов. Добавили дополнительную фенилборную кислоту (6,02 г) после добавления по капле раствора дополнительного персульфата аммония (12,5 г) в воде (30 мл). Смесь перемешивали при комнатной температуре в течение 3-х часов, после чего ее выдержали при комнатной температуре в течение ночи. Затем смесь слили в смесь ледяной воды (400 мл) и этилацетата (200 мл). Нерастворимый осадок отфильтровали через целит. Органическая фаза была отделена от фильтрата, а жидкую фазу дважды экстрагировали, используя этилацетат (200 мл). Комбинированный органический раствор высушили над безводным MgSO4 и довели до требуемой концентрации при пониженном давлении. Остаток очистили на силикагелевой колонке и элюировали посредством n-гексана/этилацетата (10/1), для получения титульного соединения (3,89 г). Газовая хроматография / масс-спектроскопия GC/MS: м/э=228 (М+), 213, 116 (100%). lH H-NMR (CDCl3): δ7.45-7.38 (4Н, m), 7.13 (1Н, td, J=4Hz, 1.9 Hz), 2.88 (2Н, s), 1.92 (3Н, s), 1.33 (6Н, s).
Пример 46b:
(Z)-5-гидрокси-5-(5-гидрокси-3-метилпент-3-ен-1-ин-1-ил)-4,4,6-триметил-4,5-дигидро-[1,1'-бифенил]-2(3Н)-он
[000195] Данное соединение получили согласно процедуре, описанной в Примере 29b, заместив Пример 29а Примером 46а.
Пример 46с:
(2Z,4Е)-5-(3-гидрокси-2,4,4-триметил-6-оксо-3,4,5,6-тетрагидро-[1,1'-бифенил]-3-ил)-3-метилпента-2,4-диенал
[000196] Данное соединение получили согласно процедуре, описанной в Примере 29с, заместив Пример 29b Примером 46b.
Пример 46:
(2Z,4Е)-5-(3-гидрокси-2,4,4-триметил-6-оксо-3,4,5,6-тетрагидро-[1,1'-бифенил]-3-ил)-3-метилпента-2,4-диеновая кислота
[000197] Данное соединение получили согласно процедуре, описанной в Примере 29, заместив Пример 29с Примером 46с. Высокоэффективная жидкостная хроматография / масс-спектроскопия HPLC/MS (ионизация методом электрораспыления ESI-): м/э=339 (1%, М-1). 1Н NMR (CDCl3): δ7.88 (1Н, d, J=16 Hz), 7.38 (2Н, t, J=7 Hz), 7.31 (1H, d, J=7 Hz), 7.09 (2H, d, J=7 Hz), 6.27 (1H, d, J=16 Hz), 5.81 (1H, bs), 2.60 (1H, d, J=17 Hz), 2.43 (1H, d, J=17 Hz), 2.10 (3H, d, J=1 Hz), 1.74 (3H, s), 1.23 (3H, s), 1.08 (3H, s).
Пример 47a:
(2Z,4E)-метил 5-((S)-3-(бут-2-ин-1-ил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000198] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 1-бромо-бут-2-ин бромид.
Пример 47:
(2Z,4E)-5-((S)-3-(бут-2-ин-1-ил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000199] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 47а. 1HNMR (CDCl3): δ7.80 (d, 1Н), 6.16 (d, 1H), 5.76 (s, 1H), 3.27 (dd, 1H), 3.12 (dd, 1H), 2.49 (d, 1H), 2.37 (d, 1H), 2.04 (s, 3H), 2.00 (s, 3H), 1.71 (s, 3H), 1.09 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=315. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 48а:
(2Z,4Е)-метил 5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-(пент-2-ин-1-ил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000200] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на 1-бромо-пент-2-ин бромид.
Пример 48:
(2Z,4Е)-5-((S)-1-гидрокси-2,6,6-триметил-4-оксо-3-(пент-2-ин-1-ил)циклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000201] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 48а. 1HNMR (CDCl3): δ7.81 (d, 1Н), 6.16 (d, 1H), 5.76 (s, 1H), 3.29 (dd, 1H), 3.14 (dd, 1H), 2.50 (d, 1H), 2.38 (d, 1H), 2.15-2.00 (m, 8H), 1.10 (s, 3H), 1.05 (s, 3H), 1.02 (s, 3Н). Масс-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=329. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 49а:
(2Z,4Е)-метил 5-((S)-3-((Е)-4-етокси-4-оксобут-2-ен-1-ил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000202] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на этил 4-бромокротонат.
Пример 49:
(2Z,4Е)-5-((S)-3-((Е)-3-карбоксиаллил)-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000203] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 49а. 1HNMR (CDCl3): δ7.72 (d, 1Н), 6.96 (m, 1H), 6.14 (d, 1H), 5.77 (d, 1H), 5.75 (s, 1H), 3.47 (dd, 1H), 3.15 (dd, 1H), 2.46 (d, 1H), 2.29 (d, 1H), 2.04 (s, 3H), 1.93 (s, 3H), 1.09 (s, 3H), 1.07 (s, 3H). Macc-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=347. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 50а:
(2Z,4Е)-метил 5-((S)-3-циннамил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеноат
[000204] Титульное соединение получили согласно процедуре, описанной в Примере 1, заместив йодэтан на циннамил бромид.
Пример 50:
(2Z,4E)-5-((S)-3-циннамил-1-гидрокси-2,6,6-триметил-4-оксоциклогекс-2-ен-1-ил)-3-метилпента-2,4-диеновая кислота
[000205] Титульное соединение получили согласно процедуре, описанной в Примере 2, заместив Пример 1 Примером 50а. 1HNMR (CDCl3): δ7.80 (d, 1Н), 7.31-7.16 (m, 5H), 6.36 (d, 1H), 6.18 (d, 1H), 6.12 (m, 1H), 5.74 (s, 1H), 3.38-3.20 (m, 2H), 2.51 (d, 1H), 2.37 (d, 1H), 2.03 (s, 3H), 1.94 (s, 3H), 1.10 (s, 3H), 1.02 (s, 3H). Macc-спектроскопия MS (ионизация методом электрораспыления ESI-): м/э=379. В результате проведения опытов по методам 2D-NMR (COSY, NOESY, HSQC, HMBC) было подтверждено, что алкилирование происходит в 3'-позиции.
Пример 51:
Количественный анализ предотвращения прорастания семян для испытания соединений, описанных в Примерах 1-28 и 47-50
[000206] Чтобы определить потенциал предотвращения прорастания, которым обладают производные (S)-ABA, провели количественный анализ образца растения Arabidopsis thaliana (резуховидка Таля). Семена Arabidopsis стерилизовали посредством встряхивания в течение пяти минут в 200-proof этаноле, затем посредством встряхивания в течение пяти минут в 10%-ом отбеливающем растворе. Затем семена промывали в течение пяти минут в стерильной дистиллированной деионизированной воде и суспендировали в 0,1%-ом фитоагаре. Трубки, содержащие семена, завернули в алюминиевую фольгу и стратифицировали при температуре 4°С в течение двух дней.
[000207] Все компоненты подвергли испытаниям при восьми концентрациях: 0 (ДМСО проба), 0,01; 0,03; 0,1; 0,3; 1,0; 3,0 и 10,0 м.д. в 96-луночных плашках. Каждая плашка содержала восемь реплик каждой концентрации испытуемого соединения и восемь реплик (S)-АВА при 0,1 м.д. в качестве положительной контрольной пробы. В качестве дополнительного набора контрольных средств каждый этап количественного анализа также содержал одну плашку с дозировкой (S)-ABA, охватывающей ряд концентраций вплоть до 10 м.д. Для каждого соединения подготовили 10 основных растворов, соответствующих каждой испытуемой концентрации, и деионизированную воду, содержащую 5%-ый ДМСО. Основной раствор для испытаний (10 μл) добавили в каждую плашку согласно схеме, описанной выше, после чего 90 μл х среды Мурасиге-Скуга, содержащей 1,2%-ый бактоагар, добавили в каждую плашку (концентрация конечного ДМСО составила 0,5%). Когда среда затвердела, в каждую плашку распределили десять-пятнадцать стерильных стратифицированных семян Arabidopsis, используя пипетдозатор многократного дозирования. Плашки опломбировали киперной лентой и поместили в камеру роста, в которой осуществлялись суточные циклы в 12 часов света при 24°С и 12 часов темноты при 19°С. Затем плашки изучали с третьего по седьмой день, и на седьмой день присвоили соответствующие баллы. 3'-замещенные-(S)-АВА производные были оценены по способности предотвращать прорастание относительно потенциала (S)-ABA. Сводные результаты представлены ниже в «Таблице 1: Воздействие (S)-ABA производных на предотвращение прорастания семян Arabidopsis».
Таблица 1. Воздействие (S)-ABA производных на предотвращение прорастания семян Arabidopsis.
Объяснение: Потенциал (S)-АВА = +++. Другие производные оценивали по потенциалу относительно S-ABA. -- = никакого действия.
[000208] Настоящий биологический количественный анализ свидетельствует об общей агонистической или антагонистической природе производных по сравнению с (S)-АВА.
[000209] При проведении данного анализа авторы настоящей заявки неожиданно для себя обнаружили, что соединение, описанное в Примере 5, обладает более высоким потенциалом, чем (S)-АВА. Авторы настоящей заявки также установили, что соединения, описанные в Примерах 1, 2 и 4, были равны по эффективности (S)-ABA. На основании известных функций (S)-АВА в физиологии растений эти неожиданные результаты позволили предположить, что соединение, описанное в Примере 5, будет более эффективным, чем (S)-ABA в опосредовании закрытости устьиц и активации биосинтеза антоцианина. Таким образом, это новое соединение может оказаться более эффективным для окрашивания фруктов (например, сорта винограда), прореживания, защиты растений от стресса, вызванного засухой, или в других биологических воздействиях (S)-ABA.
Пример 52:
Количественный анализ прорастания семян для испытания соединений, описанных в Примерах 29-46
[000210] Чтобы определить потенциал предотвращения прорастания, которым обладают производные (S)-ABA, провели количественный анализ модельного растения Arabidopsis thaliana (резуховидка Таля). Arabidopsis стерилизовали смачиванием в 70%-ом растворе этанола в течение 5-ти минут, после чего поместили в 5%-ый раствор гипохлорит натрия на 10 минут. Затем семена трижды промыли стерилизованной водой.
[000211] Исследуемые соединения подвергли количественному анализу на предмет прорастания в пяти концентрациях: (0,16; 0,64; 2,5; 10 и 40 μМ) с (S)-ABA (0,16; 0,64 и 2,5 μМ) в качестве контрольной пробы в 6-ти плашках. Подготовили основные растворы ДМСО (S)-АВА и производные при 1000-кратной испытательной концентрации. Основные растворы (5 μL) (S)-АВА и производных добавили в плашки для количественного анализа с 0,8%-ми растворами агара 1/2 среды Мурасиге-Скуга. Шестнадцать стерильных семян разместили на твердой агаровой среде на соответствующем расстоянии. Плашки опломбировали киперной лентой и обернули алюминиевой фольгой, и яровизировали семена при 4°С в течение двух дней. Плашки для количественного анализа инкубировали в камере роста при температуре 22,5°С в условиях циклов дневного света по 16 часов (30 μмоль/м2*сек) в течение 4-х дней после яровизации. Потенциал производных предотвращать прорастание оценили и сопоставили с потенциалом (S)-АВА. Сводные результаты представлены ниже в Таблице 2 «Таблица 2: Воздействие (±)-АВА производных на предотвращение прорастания семян Arabidopsis»
Таблица 2. Воздействие (±)-АВА производных на предотвращение прорастания семян Arabidopsis»
Объяснение: (S)-АВА потенциал = +++. Другие 3' производные оценивали по потенциалу относительно S-ABA. -- = никакого действия.
[000212] Настоящий биологический количественный анализ свидетельствует об общей агонистической природе производных по сравнению с (S)-АВА.
[000213] Авторы настоящей заявки неожиданно для себя обнаружили, что соединения, описанные в Примерах 39, 40 и 45, обладали более высокой активностью в отношении предотвращения прорастания по сравнению с (S)-ABA Авторы настоящей заявки также установили, что соединения, описанные в Примерах 29, 30, 32, 38 и 43, были равны по эффективности (S)-АВА. На основании известных функций (S)-АВА в физиологии растений эти неожиданные результаты позволили предположить, что соединения, описанное в Примерах 39 и 40, будут более эффективны, чем (S)-ABA, в опосредовании закрытости устьиц и активации биосинтеза антоцианина. Таким образом, эти новые соединения могут оказаться более эффективным для окрашивания фруктов (например, сорта винограда), прореживания, защиты растений от стресса, вызванного засухой, или других биологических воздействий (S)-АВА.
| название | год | авторы | номер документа |
|---|---|---|---|
| (S)-3'-МЕТИЛАБСЦИЗОВАЯ КИСЛОТА И ЕЕ ЭФИРЫ | 2015 |
|
RU2685727C2 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО ЦИАНОЕНОНА КАК МОДУЛЯТОРЫ KEAP1 | 2021 |
|
RU2822828C1 |
| Гибридные производные (1Н-1,2,4) триазола и серосодержащих гетероциклов: производных тиазолидин-2,4-диона, тиоморфолин-3-она и 1,4-тиазепан-3-она, обладающих антимикробной активностью | 2020 |
|
RU2771027C1 |
| АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ | 1994 |
|
RU2130011C1 |
| СОЕДИНЕНИЯ ДИГИДРОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТАХ | 2013 |
|
RU2655914C9 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА | 1995 |
|
RU2137770C1 |
| ПРОИЗВОДНЫЕ НЕЙРАМИНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА | 1997 |
|
RU2169145C2 |
| ТИЕНОПИРИДОН КАРБОКСАМИДЫ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2005 |
|
RU2374250C2 |
| АРИЛСУЛЬФОНИЛМЕТИЛЬНЫЕ ИЛИ АРИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ ЛИГАНДАМИ ДОФАМИНОВЫХ D РЕЦЕПТОРОВ, С ИХ ПОМОЩЬЮ | 2005 |
|
RU2442781C2 |
| ПРОТИВОИНФЕКЦИОННЫЕ СОЕДИНЕНИЯ | 2014 |
|
RU2734760C2 |
Изобретение относится к сельскому хозяйству. Энантиомерически чистое соединение по Формуле I:
 ,
,
в которой:
n равно 0 или 1;
если n равно 0, то R1 представляет собой замещенный или незамещенный С2-С20 алкил, циклоалкил или гетероциклоалкил;
если n равно 1, то R1 представляет собой циано (-CN), карбоксилат (-СО2Н), алкоксикарбонил (-CO2R'), незамещенный, монозамещенный или двузамещенный карбамоил (-CONR'R''), замещенный или незамещенный алкенил, циклоалкенил, алкинил, арил или гетероарил;
R2 представляет собой водород, замещенный или незамещенный алкил, циклоалкил, гетероциклоалкил, алкенил, циклоалкенил, алкинил, арил или гетероарил; и
R' и R'' представляют собой водород, замещенный или незамещенный С1-С20 алкил с неразветвленной или разветвеленной цепью, циклоалкил или гетероциклоалкил;
и их соли. Изобретение позволяет повысить эффективность продукта. 3 н. и 16 з.п. ф-лы, 2 табл., 52 пр.
1. Энантиомерически чистое соединение по Формуле I:
 ,
,
в которой:
n равно 0 или 1;
если n равно 0, то R1 представляет собой замещенный или незамещенный С2-С20 алкил, циклоалкил или гетероциклоалкил;
если n равно 1, то R1 представляет собой циано (-CN), карбоксилат (-СО2Н), алкоксикарбонил (-CO2R'), незамещенный, монозамещенный или двузамещенный карбамоил (-CONR'R''), замещенный или незамещенный алкенил, циклоалкенил, алкинил, арил или гетероарил;
R2 представляет собой водород, замещенный или незамещенный алкил, циклоалкил, гетероциклоалкил, алкенил, циклоалкенил, алкинил, арил или гетероарил; и
R' и R'' представляют собой водород, замещенный или незамещенный С1-С20 алкил с неразветвленной или разветвеленной цепью, циклоалкил или гетероциклоалкил;
и их соли.
2. Соединение по п. 1, в котором n равно 0, R1 выбран из группы, состоящей из незамещенного С2-С20 алкила, a R2 выбран из группы, состоящей из водорода и алкила.
3. Соединение по п. 2, в котором n равно 0, R1 представляет собой незамещенный С2-С20 алкил, a R2 - водород.
4. Соединение по п. 3, в котором R1 представляет собой незамещенный С2-С6 низший алкил.
5. Соединение по п. 2, в котором n равно 0, R1 представляет собой С2-С20 алкил, a R2 - алкил.
6. Соединение по п. 5, в котором R2 представляет собой низший алкил.
7. Соединение по п. 1, в котором n равно 0, R1 представляет собой незамещенный С2-С20 алкил, a R2 - водород.
8. Соединение по п. 1, в котором n равно 1, R1 представляет собой циано (-CN), карбоксилат (-СО2Н), алкоксикарбонил (-CO2R'), незамещенный, монозамещенный или двузамещенный карбамоил (-CONR'R'').
9. Соединение по п. 1, в котором n равно 1, R1 представляет собой замещенный или незамещенный арил, a R2 - водород.
10. Соединение по п. 9, в котором R1 представляет собой фенил или замещенный фенил.
11. Соединение по п. 9, в котором R1 представляет собой нафтил или замещенный нафтил.
12. Соединение по п. 1, в котором n равно 1, R1 представляет собой гетероарил, a R2 - водород.
13. Соединение по п. 1, в котором n равно 1, R1 представляет собой алкенил, a R2 - водород.
14. Соединение по п. 1, в котором n равно 1, R1 представляет собой алкинил, a R2 - водород.
15. Соединение по п. 1, в котором R1 и R2 независимо друг от друга замещены как минимум одним из -ОН, -NH2, -SH, одним или больше галогенами, -CN, -NR3R4, -OR3, -SR3, -S(O)R3, -SO2R3, -C(O)R3, -C(O)NR3R4, -NHC(O)R3, -NHSO2R3, -NHC(O)OR5, -SO2NR3R4, или -NHC(O)NR3R4, где R3 и R4 независимо представляют собой водород или низший алкил, a R5 - низший алкил.
16. Соединение по п. 1, в котором соль представляет собой протонированный амин (+NHR6R7R8) катиона щелочного или щелочно-земельного металла, где R6, R7 и R8 каждый независимо представляют собой водород, низший алкил, арил или четвертичный аммоний ион (+NR9R10R11R12), где R9, R10, R11 и R12 каждый независимо представляют собой низший алкил или низший арил.
17. Соединение по п. 1, в котором соль представляет собой неорганический анион, выбранный из группы, состоящей из хлорида (Cl-), бромида (Br-), йодида (I-) и сульфата (SO42-), или органический анион, выбранный из группы, состоящей из формиата (НСО2-), ацетата (СН3СО2-), тартрата (-СО2СН(ОН)СН(ОН)СО2-) и толисульфоната (CH3C6H4SO3-), и в которых R1 или R2 содержит базовый атом азота.
18. Процесс производства соединений по п. 1, включающий этапы:
a) реакция (S)-абсцизовой кислоты с алкилирующим агентом для образования эфира;
b) обработка соединения, полученного на этапе а, базовым и алкилирующим агентом в растворителе; и
c) опциональный гидролиз соединения, полученного на этапе b.
19. Способ регулирования роста растений, включающий нанесение эффективного количества не менее чем одного соединения по п. 1 на растение, рост которого необходимо отрегулировать.
| US 20100160166 A1 (SUZANNE R | |||
| ABRAMS et al.), 24.06.2010 | |||
| US 20060088905 A1 (F | |||
| SAMUEL LOCKWOOD et al | |||
| ), 27.04.2006 | |||
| US 20060178538 A1 (F | |||
| SAMUEL LOCKWOOD et al.), 10.08.2006. |
Авторы
Даты
2019-05-21—Публикация
2015-07-08—Подача