Изобретение относится к физиологии и нанобиотехнологии растений и может быть использовано для эффективной оценки устойчивости растений к НТМ, что послужит критерием биологической безопасности последних.
Развитие новых нанобиотехнологий немыслимо без фундаментальных структурных исследований и детального понимания физических процессов, протекающих как в отдельности в исходных системах, так и в целостной функционализированной структуре (Bayramov et al., 2011). К тому же, новые свойства наноматериалов создают проблемы с точки зрения экологической безопасности, что требует тщательно подходить к вопросу исследования тонких механизмов их воздействия на живые организмы (Priester et al., 2012; Raja et al., 2017). Растения в этом аспекте не исключение, а особый интерес к ним обусловлен базовым положением в структуре пищевых цепей (Müller et al., 2006; Santos et al., 2010; Nair et al., 2011). Все это предъявляет современной биологической науке заказ на исследование механизмов и последствий поглощения наноматериалов растительными клетками, определяемый необходимостью учета и предупреждения соответствующих рисков от подобного взаимодействия (Tiede et al. 2009). Количество исследований по теме влияния металлсодержащих наноматериалов на растения с каждым годом прогрессивно возрастает (Adhikari, 2016; Raliya, 2016; Rui, 2016; Taran et al., 2016). Биологические эффекты варьируются в зависимости от типа наночастиц (НЧ) металлов, вида растений, при этом очень часто данные неоднозначны, а авторы противоречат друг другу (Короткова, 2016; Короткова, 2017; Alidoust, 2013; Ghafariyan, 2013; Kalteh др. 2014; Lebedev et al., 2014; Korotkova et al., 2015; Jeyasubramanian, 2016; Korotkova et al., 2017).
Однако до сих пор отсутствуют способ проведения экспертизы и критерии для оценки безопасности введения наночастиц в растительный организм. Так, одни исследователи проводят изучение формирования устойчивости растений к наномателлам (Ghafariyan др. 2013; Kalteh др. 2014; Giraldo et al., 2014; Rico et al., 2015), другие описывают показатели всхожести семян (Adhikari, 2016), ростовые показатели (Sheykhbaglou et al., 2010; Dimkpa et al., 2012; Dhoke et al., 2013) и состояние фотосинтетического аппарата растений (Lebedev et al., 2014), третьи изучают ответ антиоксидантной системы на воздействие наночастиц (Короткова, 2017; Helaly et al., 2014; Rui, 2016; Taran et al., 2016), проводят сравнительные исследования токсичности наночастиц по сравнению с микрочастицами и ионами металлов (Hernandez-Viezcas et al., 2011; Riahi-Madvar et al., 2012; Masarovicova et al., 2013), изучают изменение биохимических показателей растений при введении НТМ в различных дозах (Jeyasubramanian, 2016; Rui, 2016), изучают цитотоксичность наночастиц оксидов различных металлов (Faisal et al., 2013; Adhikari, 2016; Raliya, 2016) и т.д. Поэтому разработка способа экспресс-оценки безопасности наночастиц металлов и установление пороговых (сублетальных) концентраций при введении в растения, является одной из актуальных задач современной биологии.
Для исследования жизнеспособности клеток в области нанотоксикологии часто используют микроскопические и цитометрические способы (Lecoeur Н. Nuclear apoptosis detection by flow cytometry: influence of endogenous nucleases. Exp CeIl Res. 2002. 277:1-14; Steensma D.P., Timm M., Witzig Т.Е. Flow cytometric methods for detection and quantification of apoptosis. Methods Mol Med. 2003. 85:323-332).
Недостатком этих способов является то, что он требует навыков работы в области микроскопии у экспериментатора, а подготовка объектов исследования к анализу и собственно сам анализ характеризуются значительными трудозатратами.
Имеются различные хорошо установившиеся методологии для оценивания целостности ДНК и дифференциации гибели клеток высших организмов (некроз или апоптоз) с использованием ферментов - терминальной трансферазы (TUNEL) или ДНК-полимеразы (ник-трансляция ISNT) (Didenko V, ed. In situ detection of DNA damage. Humana Press, Totowa, New Yersey, 2002). Однако эти ферменты действуют на 3'-ОН-концы ДНК, что снижает эффективность и воспроизводимость полученных таким методом результатов. Кроме того, метод является дорогостоящим, относительно продолжительным и сложным, следовательно, он не может применяться для рутинной оценки повреждения и деградации ДНК растений, особенно после воздействия на них целого ряда наночастиц тяжелых металлов.
Другим способом для последовательного исследования целостности ДНК клеток после воздействия наночастиц тяжелых металлов является метод ДНК-комет или электрофорез единичных клеток (Olive PL, Durand RE. Heterogeneity in DNA damage using the comet assay. Cytometry 2005; 66:1-8). Эукариотические клетки включают в агарозный микрогель на предметном стекле и подвергают действию лизирующих растворов для экстракции мембран и белков. Таким образом, получают нуклеоиды, в которых петли ДНК релаксированы вследствие нарушения компактности. Эти нуклеоиды подвергают электрофорезу в буферном растворе, так что нити ДНК мигрируют в направлении анода, образуя изображение кометы с «головой» и «хвостом».
Этот способ является вполне чувствительным, но относительно дорогим и сложным тестом для обычной клинической лаборатории и используется только для исследовательских целей. Однако метод ДНК-комет применительно к растениям требует множественных инкубирований, отделения протопласта, а интерпретация изображений в отношении разрывов ДНК растений, является неясной, что ограничивает сферу его применения, особенно касательно исследований в области нанотехнологий.
Известен способ оценки биологической активности наночастиц тяжелых металлов по степени их влияния на скорость реакции окисления молекул, определяемую по интенсивности хемилюминесценции, волюмометрически, барометрически и т.д. (Радилов А.С., Глушкова А.В., Дулов С.А. Экспериментальная оценка токсичности и опасности наноразмерных материалов // Нанотехнологий и охрана здоровья. 2009. Т. 1, №3(1). С. 48; Мелихов И.В., Тенденции развития нанохимии // Российский химический журнал. 2002. Т. XL VI. №5. с. 7-14.).
Недостатком этого метода является то, что способностью к люминесценции обладают лишь очень немногие структуры и молекулы, т.е. возможности его применения ограничены.
Кроме того, известен способ определения биологической активности диспергированных наночастиц тяжелых металлов в воде методом клеточного электрофореза: в ходе анализа выбранный вид живых тестовых клеток помещают в анализируемую жидкость, добавляя в содержащие их сосуды при необходимости минимальные количества вспомогательных веществ для обеспечения стабильной жизнедеятельности тестовых клеток в процессе их инкубирования и анализа (Патент RU 2426794 С1, опубл. 20.08.2011).
Недостатком данного способа является нестабильный уровень амплитуды колебаний клеток в пробе, длительный период ручных измерений, в течение которого заряды клеток могут изменяться и без воздействия НЧ, что влияет на точность и достоверность результата.
Известен также способ оценки влияния тяжелых металлов на клеточные культуры (Патент US №20080295187, опубл. 27.11.2008), заключающийся в проведении тестов in vitro на клетки тест-культур, содержащих суспензии тестируемых тяжелых металлов по определению их влияния на производство активных форм кислорода, образованию апоптотических и некротических клеток, нарушению функций митохондрий с использованием цитологических флуоресцентных маркеров с последующим анализом на проточном цитофлуориметре.
Однако данные подходы требуют больших временных затрат и дорогостоящего оборудования и не подходит для экспресс-диагностики токсических свойств наноматериалов.
Возможным способом оценки последствий воздействия наночастиц тяжелых металлов на растения может служить исследование целостности (интактности) молекул ДНК как достоверного параметра безопасности металлов, однако в настоящее время отсутствует легкий и воспроизводимый способ. При этом, выделение и очистка ДНК из фрагментов органов растений с целью последующего определения устойчивости растений к наноматериалам является одной из основных задач нанотоксикологии. В настоящее время используются следующие способы выделения ДНК.
Известен способ выделения ДНК из растительных тканей с использованием лизирующего буфера, последующей очисткой смесью хлороформа и изоамилового спирта и осаждением изопропанолом (Doyle J.J. and J.L. Doyle. A rapid DNA isolation procedure for small quantities of fresh leaf tissue // Phytochemical Bulletin. 1987. T. 19. P. 11-15). Способ заключается в том, что 100 мг фрагмента растения лизируют в 400 мкл буферного раствора (2% СТАВ, 1.4М NaCI, 20 мМ EDTA, 100 мМ TrisHCI), после добавления 10 мкл РНКазы инкубируют при 65°С в течение 60 мин. После этого проводят двукратную промывку лизата 400 мкл смеси хлороформа и изоамилового спирта (92:8) с промежуточным центрифугированием и переносом супернатанта в чистую пробирку. Далее проводят осаждение ДНК в присутствии 350 мкл изопропанола, центрифугирование и удаление супернатанта. Осадок ДНК промывают 400 мкл 70% этанола, сушат в течение 60 мин при комнатной температуре.
Недостатком данного способа является продолжительность выделения ДНК (более 2 часов), низкое качество ДНК при высоком содержании балластных веществ (хлорофилла, танинов), многостадийность способа.
Известен способ выделения и очистки ДНК, основанный на адсорбции нуклеиновых кислот на твердом сорбенте (Патент РФ №2272072, опубл. 20.03.2006). Образец смешивают с буферным раствором на основе хоатропного агента. Нуклеиновую кислоту сорбируют на стекловолокнистом сорбенте, предварительно обработанном 0,1-7% раствором плавиковой кислоты в течение 1-6 часов. В дальнейшем проводят отмывку сорбента от полимерных составляющих ненуклеиновой природы. Элюцию ДНК проводят буферным раствором или дистиллированной водой.
Недостатком данного способа является зависимость количества выделенной ДНК от объема сорбента (2,3 мкг ДНК на 1 мг сорбента), снижение выхода ДНК в результате необратимой адсорбции и потерей в результате отмывки сорбента.
Известен способ выделения и очистки ДНК, основанный на адсорбции нуклеиновых кислот на твердом сорбенте (Патент РФ №2119954, опубл. 10.10.1998.). Нуклеиновую кислоту сорбируют на аэросиле при нужной концентрации хаотропного агента путем добавления к пробе аэросила до конечной концентрации от 0,3 до 0,6%, смесь инкубируют 1-2 мин, аэросил с сорбированной НК осаждают центрифугированием, промывают 80%-ным изопропанолом. ДНК элюируют водой или буфером с низким содержанием солей.
Недостатком данного метода является трудоемкость, повреждение ДНК при большой концентрации, связанное с необходимостью проведения механического ресуспендирования сорбента во время отмывки ДНК, снижение выхода ДНК в результате необратимой адсорбции.
Известен способ определения устойчивости сортов пшеницы к тяжелым металлам, преимущественно к никелю (Патент РФ, включающий выращивание растений на питательной смеси Кнопа в присутствии уксуснокислой соли тяжелого металла и без нее и последующее определение устойчивости массы растений, выращенных в присутствии тяжелого металла и без него, где в качестве соли тяжелого металла используют уксуснокислый никель в концентрации 3 мг/л, анализ массы растений проводят после 20-дневного выращивания и при отношении масс 1,0-0,9 - сорта устойчивы к никелю, при отношении 0,8-0,5 -среднеустойчивы, при отношении менее 0,5 - неустойчивы.
Недостатком известного способа является трудоемкость процесса, длительный методологический подбор условий и субъективность оценки, не позволяющая в полной мере диагностировать ответное снижение устойчивости растений на воздействие НТМ, которое достигается в заявляемом техническом решении. Между тем, способ не позволяет дифференцировать относительную устойчивость сортов мягкой яровой пшеницы к наночастицам тяжелых металлов (НТМ), так как известно, что концентрация наночастиц не может быть сопоставлена с аналогичными концентрациями их солей (Постановление №79 от 31 октября 2007 г. «Об утверждении Концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов»). Это позволяет сделать вывод о соответствии изобретения «критерию существенные отличия».
Техническим результатом заявляемого способа является ранняя, на стадии проростков, дифференциальная экспресс-диагностика устойчивости пшеницы к наночастицам тяжелых металлов.
Задача решается тем, что в способе оценки устойчивости пшеницы к наночастицам тяжелым металлам, преимущественно к меди и никелю, включающем выращивание растений в присутствии наночастиц тяжелого металла и последующую оценку устойчивости, выращивание растений в присутствии наночастиц тяжелого металла проводят 48 часов при концентрации 0,125 - 1М наночастиц меди или оксида меди или никеля, затем корни проростков пшеницы гомогенизируют с последующим выделением ДНК и их разделением методом горизонтального гель-электрофореза, после чего определяют коэффициент повреждения ДНК Кповр по отношению интенсивности флуоресценции высокомолекулярных фрагментов ДНК Квм 30000-3000 н.п.к низкомолекулярным фрагментам ДНК Кнм<3000 н.п., причем при Кповр≤0,4 пшеница высокоустойчивая, Кповр=0,4-0,59 - устойчивая, Кповр=0,6-0,79 - среднеустойчивая, Кповр=0,8-1,09 - неустойчивая и при Кповр К≥1,1 абсолютно неустойчивая пшеница.
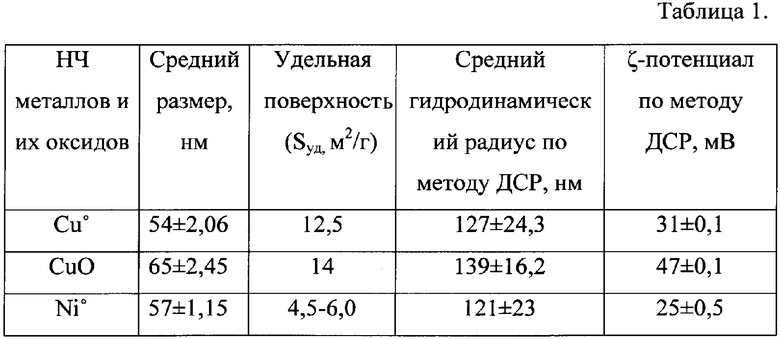
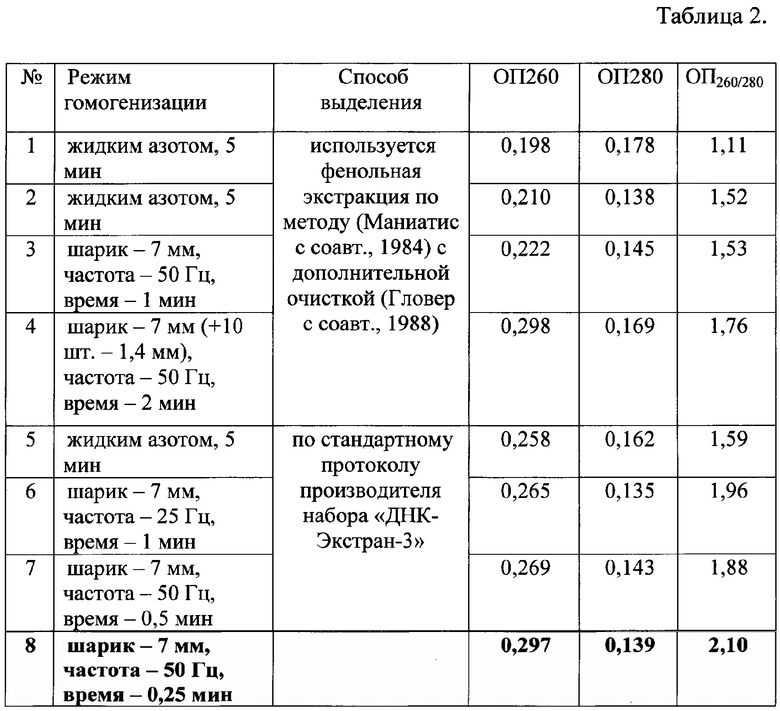
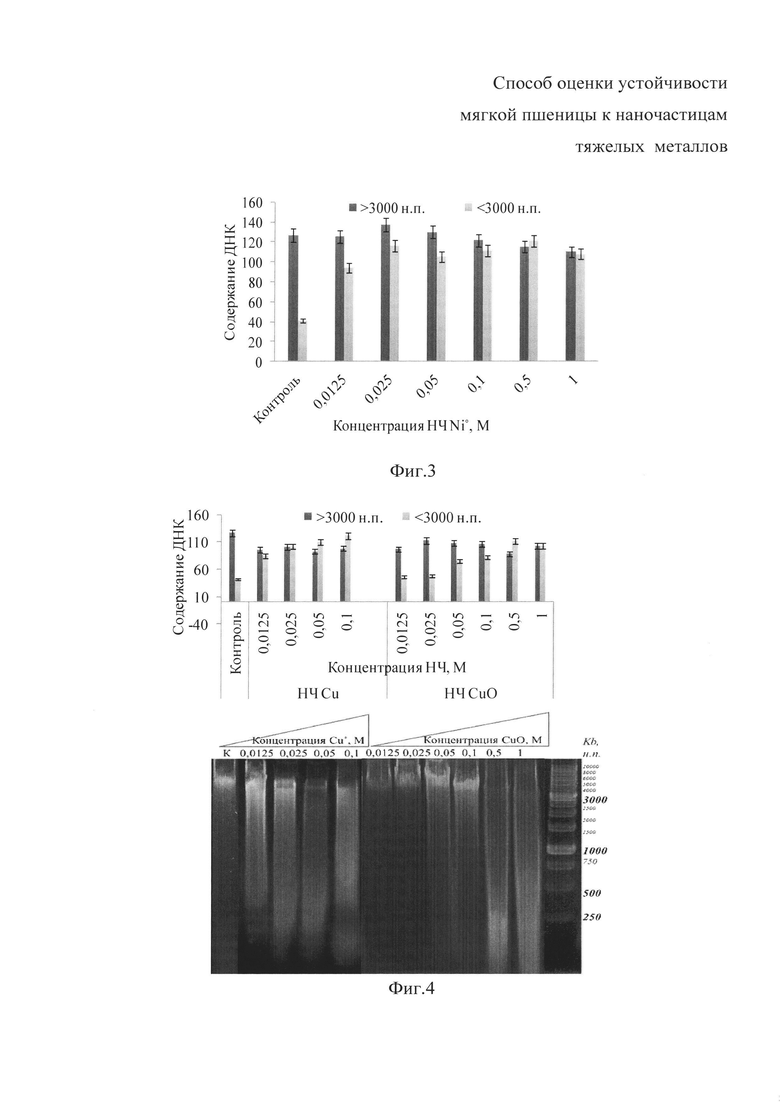
На фиг. 1 представлена электрофореграмма ДНК из корней проростков Т. vulgare после выделения методом ДНК фенольной экстракции (пробы 1-4) и с помощью набора «ДНК-Экстран» (пробы 5-8) М - маркер SM1331 (75-20000 н.п.), на фиг. 2 - электрофореграмма ДНК апикальной части корней Т. vulgare после 48-часового воздействия НЧ Ni° in vivo: К - контроль (дистиллированная вода), М - маркер электрофоретической подвижности ДНК (1 Kb), на фиг. 3 - график абсолютных значений общей площади флуоресценции фрагментов ДНК>3000 н.п. и <3000 н.п с достоверностью P<0,05, рассчитанных в программе ImageJ, на фиг. 4 - электрофореграмма ДНК апикальной части корней Т. vulgare после 48-часового воздействия НЧ Cu° и CuO in vivo.
Способ осуществляют следующим образом.
Для реализации способа используют коммерчески доступные сферические НТМ меди (Cu°, CuO) и никеля (Ni°). Порошки Ni° получены методом электрического взрыва проводника в атмосфере аргона (ООО «Порошковые передовые технологии», г. Томск), a Cu°, CuO - термическим разложением в азотной плазме (производство ООО «Плазмотерм», г. Москва). Серию суспензий НЧ в дистиллированной воде готовят согласно ТУ 931800-4270760-96, пипетируют и диспергируют в ультразвуковой ванне («Сапфир ТТЦ», Россия) при частоте 35 кГц в течение 20 мин. Основные характеристики металлов представлены в таблице 1.
Материаловедческая аттестация ультрадисперсных материалов (измерение размера частиц, полидисперсности, объемности) проводят с использованием электронной сканирующей, просвечивающей и атомно-силовой микроскопии на приборах LEX Т OLS4100, JSM 7401F, JEM-2000FX («JEOL», Япония).
Для проведения измерения ζ-потенциала и размеров агрегатов НЧ методом динамического рассеивания света (ДСР) на аналитических весах готовят навески и суспендируют их в дистиллированной воде в ультразвуковом диспергаторе УЗДН-2Т (Россия), при условиях f-35 кГц, N-300 Вт, А-10 мкА, в течение 30 минут.Конечная концентрация НЧ в растворителе составляет 0,5 мг/мл. Сразу после приготовления образцов проводили измерение ζ-потенциала и среднего гидродинамического размера частиц на анализаторе Brookhaven 90Plus/BIMAS ZetaPALS и Photocor Compact («Фотокор», Россия). Определяли распределение частиц по размерам, вклад каждого компонента в интенсивность светорассеяния, среднее значение радиуса частиц в нм и размер соответствующий максимальной амплитуде пика. Точные размеры НЧ металлов определяли на электронном микроскопе (JSM-740 IF).
Проращивание растений Triticum vulgare в среде наночастиц меди и никеля осуществляли следующим образом.
Семена Т. vulgare («Живые продукты Алтая», Россия) дезинфицируют в 0,01% KMnO4 в течение 10 мин и 3 раза промывают дистиллированной водой каждые 5 мин. Берут чашки Петри (d=9 см) и вместе с марлей стерилизуют в сушильном шкафу в течение 45 мин при 120°С. Далее семена пшеницы раскладывают в чашках между двумя слоями увлажненной марли по 20 шт на расстоянии не менее 0,5-1, 5 см друг от друга, и оставляют на 2-3 ч в термостате при 37°С. После этого семена переносят на подложку из влажной фильтровальной бумаги в чашки Петри и проращивают в климатической камере («Agilent», США) при 12-часовом освещении, температуре 22±1°С и влажности 80±5% в течение 48 ч.
Для получения экспериментального материала одного физиологического возраста при подготовке образцов отбирают одинаково проросшие семена и переносят на влажную фильтровальную бумагу в отдельные чашки с 5 мл суспензий НЧ Cu°, Ni° и CuO в концентрациях от 0,0125 до 1 М. Далее для равномерного распределения НЧ в среде инкубации проводят легкое встряхивание чашек Петри в термошейкере ST-3М («Elmi», Россия) в течение 5 мин. Во избежание вероятного искажения результатов за счет взаимодействующих ионов в среде питательный раствор не добавляют. Образцы оставляют проращивать при описанных выше условиях еще на 48 ч., после чего из каждой экспериментальной группы растений отбирают среднюю пробу (по 3 корня проростков), трижды промывают под струей водопроводной воды, ополаскивают дистиллированной водой (от остатков НЧ) и осторожно промокают фильтровальной бумагой. Затем скальпелем отрезают от каждого корня кончик длиной 0,5 см и формируют аналитическую пробу, готовят точные навески массой 500 мг.
Для выделения ДНК были сделаны 8 проб с различным режимом гомогензации: 1. жидким азотом, 5 мин; 2. жидким азотом, 5 мин; 3. шарик - 7 мм, частота - 50 Гц, 1 мин; 4. шарик - 7 мм (+10 шт. - 1,4 мм), частота - 50 Гц, 2 мин; 5. жидким азотом, 5 мин; 6. шарик - 7 мм, частота - 25 Гц, 1 мин; 7. шарик - 7 мм, частота - 50 Гц, время - 0,5 мин; 8. шарик - 7 мм, частота - 50 Гц, 0,25 мин.
В результате оптимальным режимом гомогенизации ДНК явился способ без дополнительной фрагментации до димерных сшивок массой менее 500 н.п.использовали принцип растирания микронеоднородностей стальными шариками. Для этого 500 мг корней помещали в пробирки с одним стальным шариком диаметром 7 мм, замораживали в холодильнике при -70°С в течение 30 мин и гомогенизировали при частоте 50 Гц в течение 0,25 мин. Результаты электрофореграммы представлена на фиг. 1.
Выделение ДНК производили по стандартному протоколу производителя набора «ДНК-Экстран-3» («Синтол», Россия). Такой вариант экстрагирования ДНК является более упрощенным. Так, 500 мг гомогенизированного сырья помещают в пробирку и добавляют 300 мкл лизирующего раствора; далее в пробирку вносят 3 мкл РНКазы А и, перемешав на вортексе, инкубируют при 60°С в течение 60 мин, остужают пробирки до комнатной температуры; к полученному лизату добавляют 300 мкл осаждающего раствора 1 и перемешивают на вортексе в течение 20 сек; центрифугируют (13000 об/мин, 5 мин); супернатант, не задевая осадок, переносят в чистые 1,5 мл пробирки и добавляют 600 мкл осаждающего раствора; пробы переворачивают 8-10 раз до образования видимого осадка ДНК; центрифугируют (13000 об/мин, 5 мин); осторожно сливают супернатант и подсушивают пробирки до испарения спирта в термостате 10-15 мин при 37°С; затем добавляют 800 мкл промывочного раствора и перемешивают несколько раз переворачиванием; центрифугируют (13000 об/мин, 2 мин); осторожно сливают супернатант и подсушивают пробирки в термостате 10-15 мин при 37°С до полного испарения спирта; добавляют к осадку 50 мкл элюирующего раствора, перемешивают, прогревают в термостате 5 мин при 65°С до растворения ДНК. Выделенная и очищенная ДНК остается в растворе.
В итоге было получено 8 образцов раствора ДНК, качество (степень очистки от примесей белков и липидов) которых проверяют спектрофотометрически с помощью NanoDrop-1000 («Fisher», США) по соотношению показателей ОП260/280. Согласно общепринятому стандарту соотношение угасания на длинах волн ДНК и белка (ОП260/280) Для очень чистой ДНК имеет диапазон от 1,8-2,0.
Для сравнения в первых четырех пробах выделение ДНК проводили с использованием фенольнольной экстракции по методу (Маниатис с соавт., 1984) с дополнительной очисткой (Гловер с соавт., 1988).
Таким образом, максимальное выделение ДНК (ОП26о/28о=2,1) получили с помощью коммерческого набора «ДНК-Экстран-3» после диспергирования на гомогенизаторе. Результаты измерений качества выделенной ДНК, на основе данных УФ-спектрофотометрии представлены в таблице 2.
Разделение и анализ фрагментов ДНК проводят методом горизонтального электрофореза в 1%-ной универсальной агарозе типа I («Helicon», Россия). Подбор концентрации агарозы диктовался необходимостью эффективного разделения детектируемых макромолекул растительной ДНК, имеющих фрагменты в диапазоне от 500 до 10000 Кб. Для идентификации длины фрагмента и концентрации пробы, а также определения молекулярной массы ДНК образца в крайние лунки гелевой пластины вносят 1 мкл 1 Кб ДНК маркера (M12) фирмы «Сибэнзим» (Россия), состоящего из смеси 13 фрагментов специальных плазмид гидролизованных определенными ферментами рестриктазами HindIII и EcoRI, длиной от 250 до 10000 н.п. Также используют маркер SM1331 («Thermofisher Scientific)), США), состоящий из смеси фрагментов длиной от 75 до 20000 н.п. (зоны, соответствующие фрагментам ДНК длиной 1000, 1500 и 5000 п.н., имеют большую интенсивность). В остальные лунки вносят по 10 мкл опытных проб. Буфер бромфеноловый синий или ксиленцианол в лунки не вносят, чтобы избежать изменения хода окислительно-восстановительных реакций и дополнительного связывания ДНК с его компонентами.
Электрофорез проводят в горизонтальной камере SE-1 («Helicon», Россия) при напряженности 4-10 В/см геля, 80 Вт и силе тока 200 мА, задаваемыми источником питания «Эльф-8» («Helicon», Россия). Время электрофоретического разделения в геле образцов, как установлено авторами экспериментально, должно составлять не более 40 мин. Увеличение времени экспозиции приводит к неоправданному возрастанию продолжительности процедуры оценки образцов и снижению производительности.
В качестве электролита используют трис-боратный буфер (Уилсон, Уолкер, 2015), который подходит для электрофореза малых фрагментов ДНК (<1 Кб) и состоит из: 0,04 М трис-HCl («Applichem», Германия), 1 мМ ЭДТА (Реахим, Россия) и 0,089 М борной кислоты («Тульская фармацевтическая фабрика», Россия) (рН 7,2). После того, как пробег был закончен, гель вымачивают в течение 20 мин в 1% растворе этидия бромида, ЭБ на трис-боратном буфере. Далее гель осторожно промывают в дистиллированной воде и визуализируют с помощью установки видеодокументации гелей Gel-Doc («Bio-Rad», США), позволяющей регистрировать интенсивность возбуждения и эмиссии ЭБ после интеркаляции с ДНК в красно-оранжевой области видимого спектра (при длине волны 590 нм).
Затем гели фотографируют и обрабатывают с помощью инструментов универсальной компьютерной программы «ImageJ» («National Institutes of Health», США), в которой анализируют по меньшей мере 3 образца изображений на интенсивность линейных профилей (значок «линия») и общую площадь флуоресценции дорожек (значок «прямоугольник»).
Реализация изобретения для интерпретации ДНК-повреждающего потенциала на примере наночастиц никеля.
Анализ электрофоретической подвижности ДНК, выделенной из корней проростков после 48-часовой обработки НЧ Ni° показал выраженную деградацию ДНК. Так, в концентрациях от 0,0125 до 1 М металл способствовал увеличению линейных низкомолекулярных фрагментов от 60 до 79% относительно контроля. Существенно, что деградация хроматина несла апоптотическую форму и на электрофореграмме проявлялась в виде апоптозной «лестницы» («леддера») из мультимеров размером кратным 180-200 н.п., свидетельствующих о вероятной рестрикции хроматина в розеточных петлях каспазами или эндонуклеазами (Koukalova 1997; Ванюшин, 2001).
Реализация изобретения для интерпретации ДНК-повреждающего потенциала на примере наночастиц меди и оксида меди
Напротив, НЧ Cu° и CuO, в отличие от Ni°, не приводили к межнуклеосомной деградации ДНК до «леддера», а повреждали молекулы до легкоподвижных нуклеотидов вариабельной молекулярной массы (менее 1000 н.п.), в совокупности образующих бесформенные пятна или «шмеры» (Фиг. 4), свидетельствующие о некрозном разрушении (Higuchi, 2004; Tulpan et al., 2010). Визуализация результатов электрофореграммы позволила выявить наиболее сильную деградацию опытных образцов с Cu° от 58,5 до 65,8%, и с CuO - от 33 до 55% соответственно. Причем, в последнем случае, наиболее интенсивное разрушение ДНК приходилось на максимально анализируемые разведения (0,5 и 1 М) (Фиг. 4).
Интерпретация результатов горизонтального гель-электрофореза
По результатам интенсивности флуоресценции (ИФ) фрагментов ДНК, выделенных из корней проростков после экспозиции растений с НТМ, рассчитывается общий коэффициент повреждения ДНК по формуле:
Кповрежд.=ИФ30000-3000 н.п./ИФ<3000 н.п.,
где Кповрежд. - коэффициент повреждения молекул ДНК корней проростков пшеницы после воздействия НТМ; ИФ30000-3000 н.п. - интенсивность флуоресценции высокомолекулярных фрагментов ДНК корней проростков; ИФ<3000 н.п. - интенсивность флуоресценции низкомолекулярных фрагментов ДНК корней проростков.
Далее проводится оценка дифференциации растений по повреждению ДНК и, соответственно, общей устойчивости к НТМ по следующей шкале:
1. Уровень 0: Растения высокоустойчивы, без фрагментированной ДНК (К=≤0,4): визуализируются, в основном, высокомолекулярные фрагменты, характеризующиеся электрофоретической подвижностью относительно ДНК-маркера на уровне 30000-3000 н.п., при этом интенсивность свечения низкомолекулярных фрагментов (в диапазоне менее 3000 н.п.) не отличается от контрольных образцов (обычно менее 50 пикселей).
2. Уровень 1: Растения устойчивы, с низкой степенью повреждения ДНК (К=0,4-0,59): доля высокомолекулярных фрагментов (30000-3000 н.п.) преобладает, но светимость низкомолекулярных фрагментов (менее 3000 н.п.) больше относительно контроля, что свидетельствует о единичных разрывах ДНК.
3. Уровень 2: Растения среднеустойчивые, со средней степенью повреждения ДНК (К=0,6-0,79): высокомолекулярные фрагменты (30000-3000 н.п.) становятся более релаксированными и переходят в область разделения менее 3000 н.п., значительно отличаются от контроля.
4. Уровень 3: Растения неустойчивые, с высокой степенью повреждения ДНК (К=0,8-1,09): высокомолекулярные фрагменты (30000-3000 н.п.) гораздо более релаксированы, с большим количеством отдельных низкомолекулярных фрагментов после разрывов ДНК.
5. Уровень 4: Растения абсолютно неустойчивые, с массивно фрагментированной ДНК (К≥1,1): высокомолекулярные фрагменты (30000-3000 н.п.) практически полностью релаксированы, образуют широкий и диффузный ореол более или менее точкообразных фрагментов ДНК, которые диффундировали в соответствии с градиентом в агарозном матриксе в область менее 3000 н.п., что визуализируется в виде некрозного «шлейфа» или апоптотической «лестницы».
Представленные данные по ДНК-повреждающему коэффициенту убедительно показывают, что устойчивость проростков пшеницы к снижается при увеличении концентрации НЧ меди и никеля. Интерпретация данных по деградации ДНК в оценке относительной устойчивости проростков пшеницы к 48-часовому воздействию НЧ Ni°, Cu° и CuO представлена в таблице 3.
Таким образом, заявляемый способ позволяет на ранней, на стадии проростков, проводить дифференциальну4ю экспресс-диагностику устойчивости пшеницы к наночастицам тяжелых металлов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2556376C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2017 |
|
RU2664865C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2612156C2 |
| СПОСОБ ОДНОВРЕМЕННОГО НАНОПОРОВОГО СЕКВЕНИРОВАНИЯ ПОЛНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ЗНАЧИМЫХ ГЕНОВ ТВЕРДОЙ ПШЕНИЦЫ | 2021 |
|
RU2785924C1 |
| Штаммы, биопрепарат, способ получения биопрепарата и способ биологической защиты сельскохозяйственных культур от фузариоза | 2019 |
|
RU2724464C1 |
| СПОСОБ СТИМУЛИРОВАНИЯ ПРОРАСТАНИЯ РАСТЕНИЙ НАНОЧАСТИЦАМИ ОКСИДА ЦЕРИЯ С ВЫСОКОЙ АНТИРАДИКАЛЬНОЙ И БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2701950C1 |
| ПРОСТОЙ СПОСОБ ИЗОЛЯЦИИ ПРОТОПЛАСТОВ ПШЕНИЦЫ ДЛЯ РЕДАКТИРОВАНИЯ ГЕНОМА | 2021 |
|
RU2783891C2 |
| ТРАНСГЕННОЕ РАСТЕНИЕ БЕРЕЗЫ С ПОВЫШЕННОЙ ПРОДУКТИВНОСТЬЮ | 2013 |
|
RU2593721C2 |
| БАЛЛИСТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ПОДСОЛНЕЧНИКА (HELIANTHUS ANNUUS L.) | 2001 |
|
RU2193066C1 |
| СПОСОБЫ ПОВЫШЕНИЯ УРОЖАЙНОСТИ РЕЗИСТЕНТНЫХ К 2,4-D СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР | 2013 |
|
RU2628504C2 |
Изобретение относится к области физиологии и нанобиотехнологии растений. Способ включает выращивание растений в присутствии тяжелых металлов меди и никеля и последующую оценку устойчивости. Выращивание растений в присутствии наночастиц тяжелого металла проводят 48 ч при концентрации 0,125-1 М наночастиц меди, или оксида меди, или никеля. Затем корни проростков пшеницы гомогенизируют с последующим выделением ДНК и их разделением методом горизонтального гель-электрофореза. Определяют коэффициент повреждения ДНК Кповр по отношению интенсивности флуоресценции высокомолекулярных фрагментов ДНК Квм 30000-3000 н.п. к низкомолекулярным фрагментам ДНК Кнм<3000 н.п. Причем при Кповр≤0,4 - пшеница высокоустойчивая, при Кповр=0,4-0,59 - устойчивая, при Кповр=0,6-0,79 - среднеустойчивая, при Кповр= 0,8-1,09 - неустойчивая и при Кповр≥1,1 - абсолютно неустойчивая пшеница. Способ позволяет провести оценку дифференциальной экспресс-диагностики устойчивости пшеницы на стадии проростков к наночастицам тяжелых металлов. 4 ил., 3 табл.
Способ оценки устойчивости пшеницы к наночастицам тяжелых металлов меди и никеля, включающий выращивание растений в присутствии тяжелого металла и последующую оценку устойчивости, отличающийся тем, что выращивание растений в присутствии наночастиц тяжелого металла проводят 48 ч при концентрации 0,125-1 М наночастиц меди, или оксида меди, или никеля, затем корни проростков пшеницы гомогенизируют с последующим выделением ДНК и их разделением методом горизонтального гель-электрофореза, после чего определяют коэффициент повреждения ДНК Кповр по отношению интенсивности флуоресценции высокомолекулярных фрагментов ДНК Квм 30000-3000 н.п. к низкомолекулярным фрагментам ДНК Кнм<3000 н.п., причем при Кповр≤0,4 – пшеница высокоустойчивая, при Кповр=0,4-0,59 – устойчивая, при Кповр=0,6-0,79 – среднеустойчивая, при Кповр=0,8-1,09 – неустойчивая и при Кповр ≥1,1 – абсолютно неустойчивая пшеница.
| КОРОТКОВА А.М | |||
| и др | |||
| Морфофизиологические изменения у пшеницы (Triticum vulgare L.) под влиянием наночастиц металлов (Fe, Cu, Ni) и их оксидов (Fe3O4, CuO, NiO) // Сельскохозяйственная биология, Биоэффекты металлов и их форм, Т.52, N1, с.172-182 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ СОРТОВ ПШЕНИЦЫ К ТЯЖЕЛЫМ МЕТАЛЛАМ | 1991 |
|
RU2007071C1 |
| Способ анализа митохондриальной ДНК растений | 1990 |
|
SU1759334A1 |
| US 9198434 B1, 01.12.2015. | |||
Авторы
Даты
2019-05-21—Публикация
2018-07-26—Подача