- область техники, к которой относится изобретение;
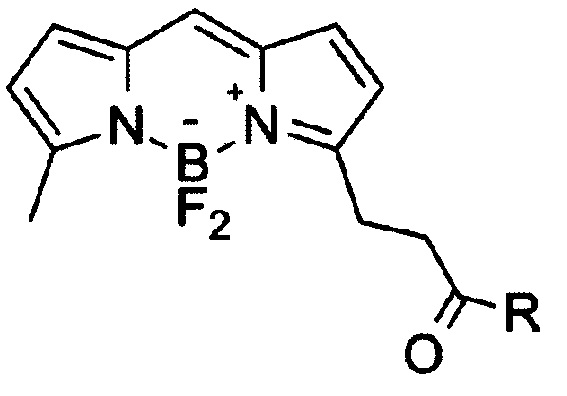
Изобретение относится к области органической химии, в частности новым производным бордипиррометена формулы I
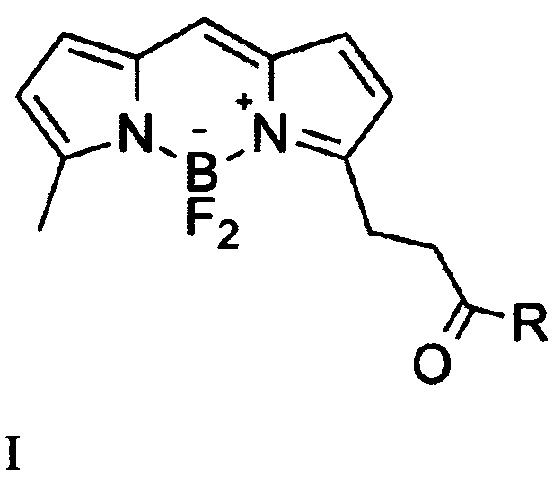
где, R=O(СН2)1-10СН3, NH-(CH2)1-12N3, к указанным соединениям для применения
- в качестве флуоресцентных меток белковых молекул, ДНК, в том числе при производстве меченых антител, применяемых в иммунофлуоресцентном анализе для диагностики инфекционных заболеваний, модифицированных олигонуклеотидов, применяемых в методе ПЦР.
- для флуоресцентного мечения в культурах клеток при исследованиях, требующих высокой фотостабильности флуорофора из-за применения мощных лазеров, в частности анализе клеточной структуры методом проточной цитометрии, исследовании отдельных клеток методом флуоресцентной микроскопии.
- уровень техники;
В литературе имеется описание производных бордипиррометена [1] и способов их получения.
а) Известен способ получения различных производных бордипиррометена формулы (I) реакцией замещенных пирролов с ацилхлоридами или ангидридами. Вначале проводят конденсацию замещенных пирролов с ацилхлоридом или ангидридом в органическом растворителе, затем, не выделяя получившийся продукт, обрабатывают этиламином и комплексом трифторида бора с диэтиловым эфиром [1], после чего выделяют продукт в виде молекулярных кристаллических или аморфных соединений, имеющих в своем составе один атом бора и являющихся цвиттер-ионами (положительно заряженный атом азота и отрицательно заряженный атом бора) (I).
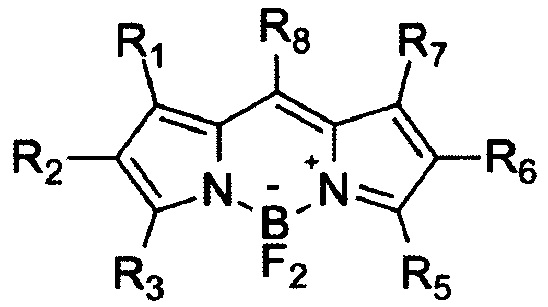
II R1-R8 - Н, алкильные, арильные и иные заместители
б) Известен способ получения производных бордипиррометена формулы (II) реакцией замещенных пирролов с альдегидами. Вначале проводят конденсацию замещенных пирролов с альдегидом в органическом растворителе, затем обрабатывают смесь окислителем, после чего, не выделяя получившийся продукт, обрабатывают этиламином и комплексом трифторида бора с диэтиловым эфиром [1]. Продукт выделяют в виде молекулярных кристаллических или аморфных соединений, имеющих в своем составе один атом бора и являющихся цвиттер-ионами (положительно заряженный атом бора и отрицательно заряженный атом азота) (II).
Известен патент на химически реакционноспособные соединения формулы I, где R - Н, Hal, алкил, арил, циклоалкил, алкиларил, ацил и сульфогруппа [2], а реакционноспособными группами являются карбоксильная группа, ее N-гидроксисукцинимидный эфир или ангидрид, сульфонил хлорид, сульфонил фторид, гидразид, амин, ОН, изоцианат, галоацетамид, альдегид, ацилазид. Патент не упоминает соединения формулы I как предпочтительные или имеющие высокую фотостабильность в контексте применения бордипиррометеновых красителей с высокой стабильностью в проточной цитометрии или флуоресцентной микроскопии, кроме того формула изобретения не включает в качестве реакционноспособной группы алкилазид. Таким образом, патент [2] не описывает соединение формулы I как высокостабильную флуоресцентную метку для приложений, где применяются мощные лазеры, которые могут разрушить метку - проточной цитометрии или флуоресцентной микроскопии.
Настоящие соединения формулы I можно получить известными в данной области способами, например, описанными выше способами (а)-(б). Исходные вещества или имеются в продаже, или же известны из химической литературы, либо могут быть получены в соответствии с хорошо известными в данной области способами.
Выделение и очистку соединений и промежуточных соединений, описанных здесь, можно осуществить, если требуется, с помощью колоночной хроматографии или препаративной жидкостной хроматографии низкого или высокого давления. Конкретные иллюстрации подходящих процедур разделения и выделения приведены ниже.
В литературе соединения формулы I не описаны, их фотостабильность не предсказана.
Описаны соединения формулы III, где R1, R2, R3, R4 Н или СН3, для которых установлены закономерности зависимости фотостабильности от наличия метальных заместителей в положениях 1,3,5,7 и арильного в положении 8 [3].
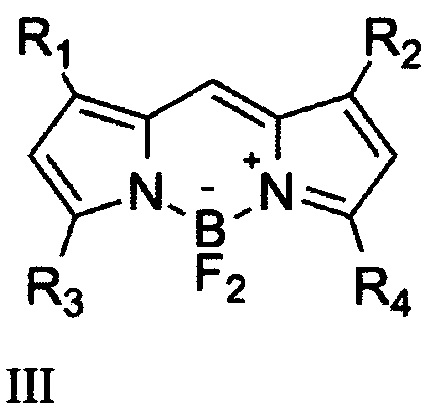
Показано, что наличие арильной группы в положении 8 повышает фотостабильность соединения, так же как и уменьшение числа метальных заместителей в положениях 1,3,5,7. Однако возрастание стабильности негативно сказывается на квантовом выходе флуоресценции вещества - краситель становится неярким, максимальный квантовый выход составляет около 0.6. Поэтому актуальным является увеличение стабильности, при сохранении высокого квантового выхода. Подобная задача для простых бордипиррометенов с немассивными заместителями не решена. Немассивные заместители позволяют работать с красителем, как заменителем широко используемого флуоресцеина (поглощение при 495 нм, испускание при 520). - раскрытие сущности изобретения;
Предлагаются новые соединения общей формулы I, предпочтительно R=ОСН2СН3, NH-(СН2)3N3 к их использованию для флуоресцентного мечения в культурах клеток при исследованиях, требующих высокой фотостабильности флуорофора из-за применения мощных лазеров, в частности анализе клеточной структуры методом проточной цитометрии, исследовании отдельных клеток методом флуоресцентной микроскопии. Неожиданно было обнаружено, что соединения общей формулы I проявляют более высокую фотостабильность по сравнению с известными аналогами - флуорофорами, применяемыми в канале флуоресцеина (поглощение 490 нм, флуоресценция 520 нм). При этом не происходит снижения квантового выхода (0.9) и краситель остается ярким. Это позволяет добиться проведения более длительных и статистически более достоверных экспериментов.
Предлагается применение соединений формулы I как флуоресцентных меток с квантовым выходом более 0,9, и фотостабильностью при этом более высокой, чем это известно из уровня техники, - для использования в методах, требующих использования мощных лазерных источников света, под действием которых флуорофор может утратить флуоресцентные свойства, а именно в лазерной флуоресцентной микроскопии при визуализации единичных белковых молекул, нуклеиновых кислот, клеток, клеточных органелл, в проточной цитометрии для анализа клеточной структуры меченных флуорофорами клеток. Неожиданно было обнаружено, что соединения общей формулы I проявляют более высокую фотостабильность по сравнению с известными аналогами - флуорофорами, применяемыми в канале флуоресцеина (поглощение 490 нм, флуоресценция 520 нм). При этом не происходит снижения квантового выхода (0.9) и краситель остается ярким. Фотостабильность повышается более чем в два раза сильнее, чем это могло бы следовать из уровня техники.
- осуществление изобретения
3-(4,4-дифтор-3-метил-4-боро-3а,4а-диаза-s-индацен-5-ил)-пропионовой кислоты этиловый эфир (соединение I, R=OCH2CH3)
Раствор этилового эфира 2-формил-5-метилпиррола (1,0 г, 9,17 ммоль) и этилового эфира 3-пиррол-2-илпропионовой кислоты (1,53 г, 9,17 ммоль) в хлороформе (20 мл) охлаждали до 0°С и добавляли фосфора оксихлорид (1,4 г, 9,17 ммоль) по каплям (в течение 3 мин). Смесь перемешивали при 0°С в течение 10 мин, затем в течение 6 ч при комнатной температуре, затем охлаждали до 0°С и добавляли комплекс трифторида бора с диэтиловым эфиром (6,51 г, 45,85 ммоль) с последующим добавлением по каплям N,N-диизопропилэтиламин (5,91 г, 45,85 ммоль) в течение 3 мин после чего смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в воду (300 мл) и после чего перемешивали в течение 3 часов. Органическую фазу отделяли, воду экстрагировали хлороформом (3×20 мл), объединенные органические фазы сушили над Na2SO4, растворитель удаляли в вакууме. Продукт выделяли колоночной хроматографией (элюент - толуол, см. примечание 1), получено 1,2 г (42%) целевого продукта (красновато-коричневые кристаллы, Rf=0,5 в элюенте толуол - этилацетат 4:1), наряду с симметричным 3,5-диметил-BODIPY (0,14 г, Rf=0,6) и симметричным этиловым эфиром ди-(3-пиррол-2-илпропионовой кислоты) (0,11 г, Rf=0,4, коричневые кристаллы).
3-(4,4-дифтор-3-метил-4-боро-За,4а-диаза-$-индацен-5-ил)-пропионовая кислота (соединение I, R=ОН, в целях синтеза соединения I, R=-NH-(CH2)3N3)
3-Метил-5-этоксикарбонилэтил-BODIPY (1,2 г, 3,95 ммоль) растворяли в ТГФ (160 мл) и добавляли раствор конц. H2SO4 (12 мл, 22 г, 0,225 моль) в воде (36 мл). Смесь перемешивали при комнатной температуре в течение 3 дней. ТСХ (этилацетат, Rf=0,2) свидетельствовала о хорошей конверсии. ТГФ удаляли в вакууме при 40°С. Образовавшийся осадок отфильтровывали, промывали водой (3×30 мл) и диэтиловым эфиром (3×20 мл) и сушили. Выход 0,85 г (77%) красных кристаллов.
Синтез соединения I, R=-NH-(CH2)3N3
3-Метил-3-карбоксиэтил-BODIPY (2,0 г, 7,19 ммоль) суспендировали в CH2Cl2 (50 мл) и добавляли триэтиламин (0,87 г, 8,63 ммоль) - образовывался прозрачный раствор. TSTU (N,N,N',N'-Тетраметил-О-(N-сукцинимидил) уроний) (2,6 г, 8,63 ммоль) добавляли небольшими порциями (более ~ 3 мин) и смесь перемешивали в течение 1 часа при комнатной температуре. Добавляли триэтиламин (0,87 г, 8,63 ммоль) с последующим добавлением азидопропиламина (0,87 г, 8,63 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. ТСХ (элюэнт - этил ацетат) свидетельствовал о хорошей конверсии, реакционную смесь промывали водой (3×50 мл), сушили над Na2SO4, растворитель удаляли в вакууме. Продукт дважды очищали колоночной хроматографией (элюент металенхлорид-этилацетат 1:1), получая 0,93 г продукта (37%) в виде красновато-коричневых кристаллов.
Полученные соединения I R=-NH-(CH2)3N3, R=ОСН2СН3, обладают следующими свойствами:
- соединение является флуоресцентным красителем.
- спектр флуоресценции соединения находится в том же диапазоне, что и спектр широко используемого в лабораторной практике флуоресцеина, благодаря чему с веществом можно работать на приборах, имеющих фиксированные длины волн возбуждения/излучения, рассчитанные на флуоресцеиновые красители.
- соединение имеет более высокую фотостабильность по сравнению с аналогами (см таблица 1).
соединение IR=-NH-(CH2)3N3 проходит быструю конъюгацию с антителами, модифицированными дибензилциклооктином (реакция клик-химии без присутствия медного катализатора.
Условия проведения экспериментов по фотостабильности:
Приготовлены растворы красителей с приблизительно одинаковой начальной концентрацией (согласно измерению максимума поглощения Dmax=0.06-0.07). Определение фотостабильности проводилось по средствам последовательного интенсивного облучения образца красителя (в кварцевой кювете) светом в течение определенного временного интервала, и последующей регистрации спектра его флуоресценции. Облучение проводилось в алюминиевом резервуаре с матовой отражающей поверхностью при постоянной температуре (±2°С), с использованием 100 Вт светодиода белого света.
Регистрация спектра флуоресценции образца проводилась на флуориметре в области длин волн: 476 нм - 700 нм, при длине волны возбуждения 466 нм.
Согласно описанной процедуре были получены кривые зависимости интегральных интенсивностей флуоресценции образцов красителей от времени облучения. Все полученные кривые с высокой точностью соответствуют общей формуле I=I0*e-kt, где: I - интегральная интенсивность флуоресценции, I0 - начальная интегральная интенсивность флуоресценции (до облучения), k - константа "скорости падения флуоресценции" (в мин-1) t - продолжительность интенсивного облучения (в минутах). Данное уравнение является аналогом уравнения для химической реакции первого порядка C=C0*ekt.
Таким образом, скорость падения интенсивности флуоресценции образца зависит от концентрации красителя (в первой степени) и величины коэффициента к. Коэффициент к, при этом, характеризует фотостабильность флуоресцентного красителя в условиях проведения эксперимента (чем меньше к, тем выше фотостабильность красителя). В серии экспериментов были получены значения коэффициентов к для красителей BODIPY. Для сравнения, было также измерено значение коэффициента к для карбоксифлуоресцеина (6-FAM). Период полураспада красителя t1/2=ln(2)/k. Эти данные представлены в таблице 1.
Из таблицы 1 следует, что наиболее фотостабильными являются красители с меньшим числом алкильных заместителей в положениях 1,3,5,7. При этом стоит отметить, что стабильность соединения I неожиданно превышает ту, которая могла бы следовать из уровня техники. Соединения III известны из уровня техники и закономерность уменьшения стабильности с увеличением алкильных групп также известны из уровня техники. Если рассмотреть математическую корреляцию числа метальных групп и фотостабильности, то она имеет зависимость вида N=Aln(t1/2), близкую к линейной, на нее ложатся все соединения из таблицы 1. Однако соединение IR=ОСН2СН3 неожиданно, что не может быть предсказано из уровня техники, имеет в два раза большую фотостабильность, чем следует из полученной зависимости. Это представляет дополнительный практический интерес, учитывая, что данные красители чаще всего применяются не в форме кислоты, которая удовлетворяет обнаруженной зависимости, а именно в форме амидов или эфиров.
Повышенная фотостабильность не влияет на яркость соединения, которое имеет высокий квантовый выход в воде (0,9), что позволяет надежно отсекать фоновый сигнал возбуждающего излучения в практических применениях.
Пример
Применение соединения I в качестве флуоресцентной метки при исследованиях на флуоресцентном микроскопе: окрашивание фиксированных CD22-позитивных клеток линии Raji анти-CD22 антителами, меченными различными флуорофорами, применение флуоресцентной микроскопии.
Протокол процедуры
Клеточная линия Raji (лимфома Беркитта), гиперэкспрессирующая поверхностный CD22-маркер.
Культивирование клеток проводили в RPMI-1640 с 10% Fetal Bovine Serum.
1. Подготовка клеток.
1) Клетки собирали, центрифугировали (8 мин, 800 g), супернатант декантировали, добавляли 5 мл натрий-фосфатного буфера (PBS) и вновь центрифугировали (5 мин, 800 g).
2) Фиксация: супернатант декантировали, добавляли 1 мл 2% параформальдегида. Инкубировали 40 мин при комнатной температуре, затем помещали на +4°С до проведения процедуры окрашивания.
2. Окрашивание фиксированных клеток.
1) Клетки центрифугировали (10 мин, 1500 g), супернатант декантировали, добавляли 1 мл PBS и центрифугировали (10 мин, 1500 g).
2) Блокирование сайтов неспецифичного связывания проводили параллельно с процедурой окрашивания: к клеткам (0,5 мкл/точка) добавляли 40 мл 10% бычьего сывороточного альбумина (Bovine serum albumin, BSA) на PBS и антитела, конъюгированные с флуорофором, в концентрации 7 мкг/мл. Инкубировали 1 час при комнатной температуре. ГХ71.
3) Клетки центрифугировали (10 мин, 1500 g), супернатант декантировали, добавляли 1 мл PBS и вновь центрифугировали (10 мин, 1500 g).
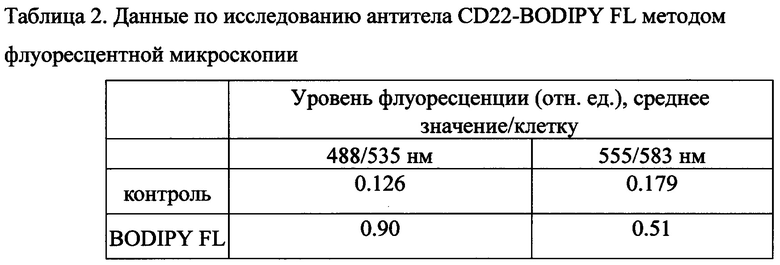
4) Осадок ресуспендировали в 40 мкл PBS, помещали на покровное стекло и анализировали на флуоресцентном микроскопе Olympus 1X71 (Япония), оснащенном флуоресцентными фильтрами (emission filters) с параметрами длин возбуждения/поглощения - excitation/emission (далее ex/em) 488/535 нм и ex/em 555/583 нм, а также объективом с увеличением ×40.
5) При анализе клеток в программе ImageJ (NIH, США) была определена средняя интенсивности уровень флуоресценции (отн. ед.) на клетку, представленная в таблицах 2 и 3.
Фиг. 1. Исследование антитела CD22-BODIPY FL методом флуоресцентной микроскопии
Фиг. 2. Исследование антитела СВ22-соединение I методом флуоресцентной микроскопии

Из фиг. 1 и 2 и таблиц 2 и 3 следует, что конъюгат соединения I с антителом более яркий, чем у известного из уровня техники BODIPY FL.
Определение времени полувыгорания флуорофора во флуоресцентном микроскопе
Расчет времени полувыгорания флуорофора проводили с использованием флуоресцентного фильтра, при применении которого наблюдалась максимальная флуоресценция. Видео, снятое при известной экспозиции, анализировали в программе ImageJ. Перед анализом проводили «вычитание» фоновой флуоресценции. Далее во вкладке Plot Z-axis Profile получали кривую, отражающую падения уровня флуоресценции во время съемки.
Координаты кривой экспортировали в формат.txt и далее анализировали в программе Excel. При анализе отмечали точки с падением уровня флуоресценции в 2 раза и замеряли соответствующий временной интервал, который далее был преобразован в формат «секунд» путем умножения на время экспозиции.
Результаты обсчета времени полувыгорания флуорофора при 488 нм показали, что время полувыгорания соединения I в 3,5 раза больше чем известного из уровня техники BODIPY FL этиловый эфир, а следовательно инкремент фотостабильности соединения I во флуоресцентном микроскопе еще выше, чем при предварительном выгорании в белом свете.
Список литературы
1. Loudet A., Burgess К. Chem. Rev. 2007,107, 4891-4932.
2. Haugland R.P., Kang H.C., Chemically reactive dipyrrometheneboron difluoride dyes, US Patent 4774339 A, 1988.
3. Aijun Cui, Xiaojun Peng, Jiangli Fan, Xiuying Chen, Yunkou Wu, Binchen Guo/ Journal of Photochemistry and Photobiology A: Chemistry 186 (2007) 85-92.
| название | год | авторы | номер документа |
|---|---|---|---|
| КРАСИТЕЛИ НА ОСНОВЕ ДИФТОРИДА ДИПИРРОМЕТЕНБОРА С ДВУХФОТОННЫМ ПОГЛОЩЕНИЕМ И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2296333C2 |
| Флуоресцентный сенсор для детектирования лизосом in vitro | 2019 |
|
RU2717308C1 |
| 2-(4,4-дифтор-1,3,5,7-тетраметил-2,6-дисульфо-4-боро-3а,4а-диаза-s-индацен-8-ил)-бензойная кислота и ее производные, способ их получения и их применение для флуоресцентного мечения белковых молекул | 2017 |
|
RU2680090C1 |
| Флуоресцентная многоцелевая наноразмерная метка и конъюгаты на её основе | 2021 |
|
RU2777648C1 |
| СПОСОБЫ ДЕТЕКЦИИ АНТИЦИТОМЕГАЛОВИРУСНЫХ НЕЙТРАЛИЗУЮЩИХ АНТИТЕЛ | 2013 |
|
RU2660712C2 |
| 4-(2-(ПИРИДИН-2-ИЛ)-9H-ПИРИДО[2,3-b]ИНДОЛ-8-ИЛ)АНИЛИН - КЛЕТОЧНЫЙ ФЛУОРЕСЦЕНТНЫЙ КРАСИТЕЛЬ | 2024 |
|
RU2836779C1 |
| МОДИФИЦИРОВАННЫЕ ЦИАНИНОВЫЕ КРАСИТЕЛИ И ИХ КОНЪЮГАТЫ | 2020 |
|
RU2833355C2 |
| ПИРИДИНЫ, ПИРИМИДИНЫ И ПИРАЗИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ БРУТОНА И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2712220C2 |
| АМИНОАМИДЫ В РЯДУ БАКТЕРИОХЛОРОФИЛЛА A, ОБЛАДАЮЩИЕ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2548675C9 |
| Способ проведения микроскопического анализа клеточного образца | 2023 |
|
RU2835203C1 |


Изобретение относится к области органической химии, а именно к новым производным бордипиррометена. Предложено соединения общей формулы I, где R означает O(CH2)1-10CH3, NH-(CH2)1-12N3, а также применение соединения.
Технический результат: увеличение стабильности при сохранении высокого квантового выхода. 2 н.п. ф-лы, 3 табл., 2 ил.
1. Соединение общей формулы I
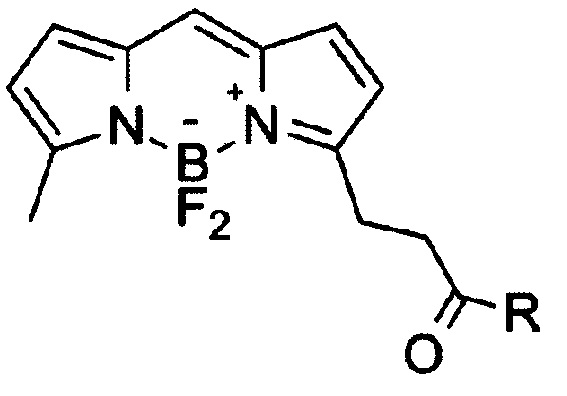
где R означает O(CH2)1-10CH3, NH-(CH2)1-12N3.
2. Применение соединений по п. 1 как флуоресцентных меток для исследования культур клеток методами флуоресцентной микроскопии и проточной цитометрии.
| US 8277775 B2, 10.02.2012 | |||
| US 5573909 A, 11.12.1996 | |||
| An ICT-based fluorescent switch-on probe for hydrogen sulfide in living cells | |||
| Xin Li et al., Chemical Communications (Cambridge, United Kingdom), 49(77), 8656-8658, 2013 | |||
| Design and synthesis of a highly selective fluorescent turn-on probe for thiol bioimaging in living cells | |||
| Xin Li et al., Organic & Biomolecular Chemistry, 8(16), 3627-3630, 2010 | |||
| Synthesis of a BODIPY Library and Its Application to the Development of Live Cell Glucagon Imaging Probe | |||
| Jun-Seok Lee et al., Journal of the American Chemical Society, 131(29), 10077-10082 2009. |
Даты
2019-05-22—Публикация
2017-12-29—Подача