Предлагаемое изобретение относится к химико-фармацевтической промышленности, а так же к медицине, и касается получения нового и ранее неизвестного химического соединения - флуорофора, которое может быть использовано в медицине в качестве флуоресцентного сенсора для детектирования лизосом in vitro.
Известно, что флуоресцентные сенсоры, за счет малых активных молекул, селективно связываются с клеточными органеллами и обеспечивают их фотовизуализацию, что чрезвычайно важно для проведения биохимических и диагностических исследований.
Также известно, что лизосомы являются мембранными органеллами, отвечающими за клеточный метаболизм, которые играют ключевую роль в клеточной защите, производстве антигенов, апоптозе и процессе аутофагии, а также в поддержании клеточного гомеостаза и в различных других физиологических процессах. Повышение или снижение образования лизосом и лизосомальных белков коррелирует более чем с пятьюдесятью заболеваниями, в частности и с заболеваемостью раком.
Флуоресцентные зонды играют важную роль в мониторинге лизосом в живых клетках. Идеальный флуоресцентный зонд должен быть биосовместимым для поддержания жизнеспособности клеток и иметь низкую токсичность. При этом зонды должны демонстрировать высокую специфичность и чувствительность к соответствующим органеллам, а также и высокий квантовый выход для минимизации эффекта фоновых шумов. Для такого применения нужен стабильный флуорофор с минимальными характеристиками фотообесцвечивания.
Известны флуоресцентные сенсоры для визуализации лизосом живых клеток, содержащие флуорофор семейства BODIPY, например, выпускаемые ThermoFisher Scientific (LysoTracker Blue DND-22, LysoTracker Green DND-26, LysoTracker Red DND-99) и Enzo Biochem Inc. (LYSO-ID Green detection kit и LYSO-ID Red detection kit).
Основные недостатки этих сенсоров обусловлены присутствием аминогрупп, которые изменяют рН клетки и обеспечивают эффект подщелачивания.
Кроме этого, использование сенсоров LysoTracker ограничено, т.к. они проявляют значительную клеточную токсичность, вследствие чего их применение ограничено только кратковременной визуализацией лизосом живых клеток.
Так, наборы для визуализации лизосом серии LYSO-ID к тому же обладают малой устойчивостью, из-за чего требуют особых условий хранения и транспортировки - при температурах не выше - 20°С и защиты от света как при хранении, так и при работе.
По способности окрашивать лизосомы прижизненно, наиболее близким к предлагаемому флуоресцентному сенсору, содержащему флуорофор семейства BODIPY, является сенсор LysoTracker Red DND-99, который имеет следующую структурную формулу:
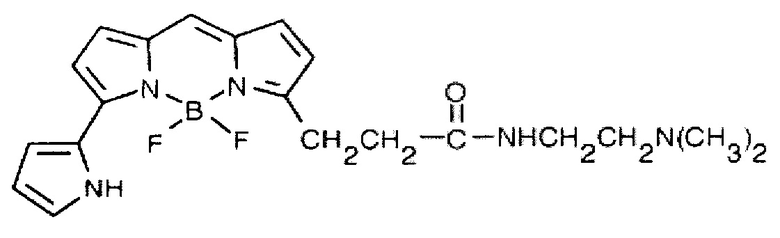
(получено по ссылке с сайта производителя, https://www.thermofisher.com/order/catalog/product/L7528. Дата обращения 10.04.19)
К недостаткам известного сенсора следует отнести:
1) Ограниченное время инкубации - от 30 минут до 2 часов;
2) Ограниченный срок хранения - до 6 месяцев при правильном хранении;
3) Сенсор при хранении должен находится в растворе, т.к. требует предохранения от высушивания;
4) Температура хранения -20°С;
5) Для проведения пробы требуется полностью удалить среду хранения, т.к. среда, не удаленная из пробы, создает помехи и мешает визуализации. После окончания воздействия также требуется перемещения исследуемых клеток в свежую среду, что негативно сказывается на проведении эксперимента (усложнение), требует лишней траты сред.
Задачей заявляемого технического решения является разработка флуоресцентного сенсора, лишенного недостатков известных сенсоров, используемых для детектирования лизосом in vitro.
Техническим результатом предлагаемого изобретения является получение нового флуоресцентного сенсора, способного эффективно детектировать лизосомы in vitro при длительном сроке наблюдения - до 1-х суток - за живыми клетками, а также стабильно сохранять свои фотофизические и биологические свойства при хранении в условиях комнатной температуры.
Технический результат предлагаемого флуоресцентного сенсора для детектирования лизосом in vitro содержит ранее неизвестный флуорофор семейства BODIPY.
Отличие заявляемого флуоресцентного сенсора заключается в том, что в качестве флуорофора он содержит 4,4-дифторо-5-фенил-3-(1,5-дифенил-3-1H-пиразолил)-8-трифторметил-4-бора-3а,4а-диаза-s-индацен (1), имеющий следующую структурную формулу:
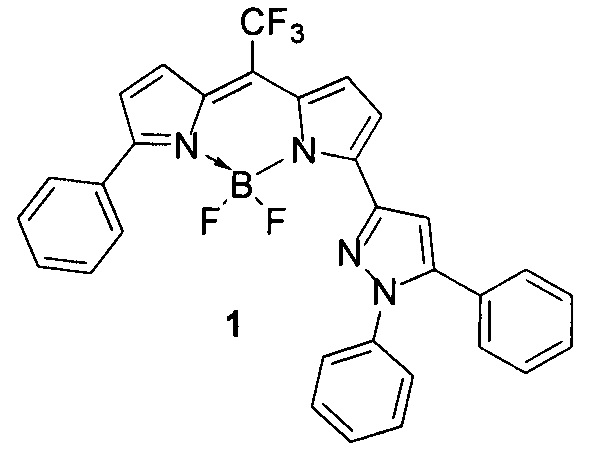
Заявляемый флуоресцентный сенсор отличается от существующих аналогов высокой фотостабильностью при хранении на свету при комнатной температуре как в твердом виде, так и в состоянии раствора, не проявляет заметного фотообесцвечивания. Низкая токсичность и высокая селективность по отношению к лизосомам позволяет осуществлять длительные прижизненные наблюдения за клетками. Высокий квантовый выход флуоресценции позволяет минимизировать фоновые шумы и обеспечивает надежную визуализацию лизосом.
Синтез флуорофора 1 осуществлен конденсацией 1,5-дифенил-3-(1H-пиррол-2-ил)-1H-пиразола 2 с 2,2,2-трифтор-1-(5-фенил-1H-пиррол-2-ил)этан-1-олом 3 (Р2О5, CH2Cl2, 20-25°С, 16 ч) с последующими окислением (DDQ, CH2Cl2, 20-25°С, 10 мин) и комплексобразованием (BF3⋅Et2O, i-Pr2NEt, CH2Cl2, 0°С, 2 ч) 1,5-дифенил-3-(5-(2,2,2-трифтор-1-(5-фенил-1H-пиррол-2-ил)этил)-1H-пиррол-2-ил)-1H-пиразола 4.
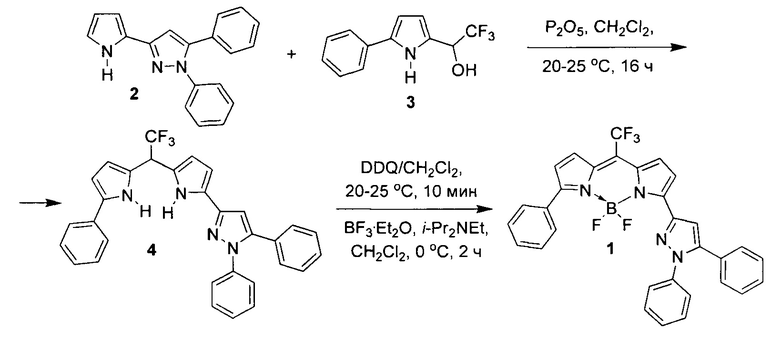
Предлагаемое изобретение иллюстрируется следующими примерами:
Пример 1. Синтез флуорофора BODIPY 1.
К смеси 1,5-дифенил-3-(1H-пиррол-2-ил)-1H-пиразола 2 (1 г, 3.5 ммоль) и 2,2,2-трифтор-1-(5-фенил-1H-пиррол-2-ил)этан-1-ола 3 (0.845 г, 3.5 ммоль) в 15 мл сухого CH2Cl2 прибавляли P2O5 (0.5 г, 3.5 ммоль). Реакционную смесь перемешивали при комнатной температуре 16 часов, затем прибавляли NaHCO3 (15% избыток, 0.34 г, 4 ммоль) и перемешивали еще 1 час. Осадок отфильтровывали и промывали CH2Cl2. Остаток после удаления растворителя фракционировали колоночной хроматографией (SiO2, н-гексан/ CH2Cl2, 3:1) и получали 1.42 г (80%) 1,5-дифенил-3-(5-(2,2,2-трифтор-1-(5-фенил-1H-пиррол-2-ил)этил)-1H-пиррол-2-ил)-1H-пиразола 4. Далее к раствору 1.42 г (2.8 ммоль) соединения 4 в 20 мл CH2Cl2 прибавляли (0.635 г, 2.8 ммоль) дихлордицианобензохинона (DDQ) и перемешивали 1 час при комнатной температуре. Затем прибавляли при перемешивании (i-Pr)2NEt (3.49 г, 27 ммоль), через 10 минут охлаждали реакционную смесь до 0°С, прикапывали BF3⋅Et2O (4.22 г, 29.7 ммоль) и продолжали перемешивание при 0°С еще в течение 2 часов. После чего удаляли ~2/3 растворителя, остаток фракционировали колоночной хроматографией (SiO2, н-гексан/ CH2Cl2, 3:1) и выделяли 0.600 г (39%) флуорофора BODIPY 1.
Зеленые кристаллы, Тпл=175-177°С.
1Н NMR (400.1 MHz, CDCl3) δ 7.94 (м, 2Н), 7.58 (с, 1Н), 7.47 (м, 5Н), 7.40 (м, 1Н), 7.33 (м, 8Н), 7.26 (м, 1H), 7.25 (м, 1Н), 6.72 (м, 1Н).
13C NMR (100.6 MHz, CDCl3) δ 159.9, 155.1, 145.0, 143.5, 139.7, 134.4, 132.9, 132.4, 130.4, 130.0, 129.9, 129.7, 129.2, 129.1, 128.9, 128.7, 128.5, 128.4, 128.3, 125.4, 125.3 (q, J=32.8 Hz), 123.3, 122.8 (q, J=275.9 Hz), 122.1, 111.3.
19F NMR (376.5 MHz, CDCl3) δ -54.9 (CF3), -136.0 (BF2).
IR (KBr, cm-1): 1574, 1521, 1472, 1397, 1351, 1279, 1224, 1137, 1086, 1020, 919, 797, 760, 692.
Anal. Calcd for C31H20BF5N4: C, 67.17; H, 3.64; B, 1.95; F, 17.14; N, 10.11; Found: C, 67.26; H, 3.90; N, 9.89%.
Пример 2.
Исследование предлагаемого флуоресцентного сенсора для детектирования лизосом in vitro проведено на культуре клеток асцитной карциномы Эрлиха, полученных из перевиваемой культуры, поддерживаемой в белых лабораторных мышах. Культура данного перевиваемого штамма приобретена в питомнике Федерального государственного учреждения науки «Государственный научный центр вирусологии и биотехнологии «Вектор» (Россия, Новосибирская область, поселок Кольцово), ветеринарный сертификат 254 №0336050 от 28 июля 2010 г. Забор асцитной жидкости осуществляли на log-фазе размножения штамма асцитной карциномы Эрлиха (через 9 суток). Полученную клеточную суспензию разводили в 500 раз питательной средой DMEM (Dulbecco's Modified Eagle's Medium, «Sigma-Aldrich»), дополненной 50 мкг/мл антибиотика гентамицина, после чего культивировали 1 сутки в 24-луночных планшетах при температуре 37°С, влажности - 80%, содержании CO2 - 5%, используя CO2-инкубатор BioStation СТ (Nikon).
BODIPY растворяли в DMSO, добавляли бидистиллированную воду. Затем полученный раствор вносили в питательную среду DMEM с культивируемыми клетками с доведением до конечных концентраций 0,04 мкМ, 0,2 мкМ, 1 мкМ, 5 мкМ, 25 мкМ, 100 мкМ.
Фотофиксацию проводили каждые 2 часа в течение суток, используя CO2-инкубатор BioStation СТ (Nikon).
Установлено, что через 2 часа после добавления BODIPY, флуоресцентный сенсор обнаруживается в виде яркого специфического свечения в лизосомах. Свечения межклеточного вещества не наблюдалось. Через 4 часа после внесения в среду 1 мкМ BODIPY проявилась яркая специфическая окраска лизосом клеток карциномы Эрлиха, окраска межклеточного вещества не наблюдалась (фиг. 1).
Экспериментальными исследованиями авторов установлено, что достаточное для регистрации свечение выявлено при использовании концентраций: 1 мкМ, 5 мкМ, 25 мкМ, 100 мкМ; свечение низкой яркости - при концентрациях: 0,04 мкМ, 0,2 мкМ.
Авторами так же отмечено нарастание яркости свечения в динамике наблюдения, что наглядно подтверждают фиг. 2 и фиг. 3. Так на фиг. 2 показано специфическое свечение лизосом клеток карциномы Эрлиха через 2 часа инкубации после добавления 100 мкМ BODIPY; на фиг. 3 - через 24 часа инкубации со 100 мкМ BODIPY - показано нарастание интенсивности специфического свечения лизосом клеток карциномы Эрлиха.
Пример 3.
Исследование проведено на культуре фибробластов. BODIPY растворяли в ДМСО, добавляли бидистиллированную воду. Затем полученный раствор вносили в питательную среду DMEM с культивируемыми клетками с доведением до конечных концентраций 0,04 мкМ, 0,2 мкМ, 1 мкМ, 5 мкМ, 25 мкМ, 100 мкМ. Фотофиксацию проводили в течение суток с периодичностью 1 раз в 2 часа, используя CO2-инкубатор BioStation СТ (Nikon).
Результаты: Через 2 часа после добавления BODIPY обнаруживалось свечение лизосом. Окраски межклеточного вещества не зафиксировано.
Свечение низкой яркости выявлено при использовании концентраций 0,04 мкМ, 0,2 мкМ; достаточной яркости - при концентрациях 1 мкМ, 5 мкМ; избыточно яркая окраска - при концентрациях 25 мкМ, 100 мкМ. При использовании любой из указанных концентраций свечения межклеточного вещества зарегистрировано не было.
На фиг. 4 показана окраска лизосом фибробласта через 24 часа инкубации при использовании концентрации 0,04 мкМ; зарегистрировано отсутствие свечения межклеточного вещества.
На фиг. 5 показана окраска лизосом фибробласта через 24 часа инкубации при использовании концентрации 5 мкМ; зарегистрировано отсутствие свечения межклеточного вещества.
Таким образом, доказано, что тестируемое вещество - флуоресцентный сенсор, перспективно для применения для детектирования лизосом in vitro и, за счет прижизненной окраски, позволяет осуществлять длительные наблюдения за клетками.
Предлагаемый флуоресцентный сенсор после внесения в клеточную культуру селективно накапливается в лизосомах. Концентрация 5 мкМ является достаточной для визуализации лизосом на исследованных культурах фибробластов и раковых клеток. Предлагаемый сенсор обладает высокой фотостабильностью (более 24-х часов), его флуоресцентные свойства сохраняются в полной мере при хранении в условиях комнатной температуры более полугода.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, ИНДУЦИРУЮЩИЕ ФЕРРОПТОЗ В МЕТАСТАТИЧЕСКИХ КЛЕТКАХ МЕЛАНОМЫ И РАКА ТОЛСТОЙ КИШКИ | 2019 |
|
RU2722308C1 |
| Ингибитор основной протеазы коронавируса SARS-CoV-2 | 2023 |
|
RU2840908C2 |
| МЕТИЛ 3-МЕТИЛ-5-[2-(4-АРИЛАМИНО)-2-ОКСОАЦЕТИЛ]-1,6-ДИФЕНИЛ-1Н-ПИРАЗОЛО[3,4-b]ПИРИДИН-4-КАРБОКСИЛАТЫ И МЕТИЛ 3-МЕТИЛ-5-[2-(4-АРИЛАМИНО)-2-ОКСОАЦЕТИЛ]-6-СТИРИЛ-1-ФЕНИЛ-1Н-ПИРАЗОЛО[3,4-b]ПИРИДИН-4-КАРБОКСИЛАТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2495039C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ КОАГУЛЯЦИИ ПЛАЗМЫ КРОВИ - АКТИВНОСТИ ТРОМБИНА, ВРЕМЕНИ РЕКАЛЬЦИФИКАЦИИ ПЛАЗМЫ И ТОЛЕРАНТНОСТИ ПЛАЗМЫ К ГЕПАРИНУ | 2020 |
|
RU2786591C2 |
| ФОСФОЛИПИДНЫЙ ФЛУОРЕСЦЕНТНЫЙ ЗОНД И ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФОСФОЛИПАЗЫ А2 В СЫВОРОТКЕ КРОВИ | 2012 |
|
RU2517538C1 |
| 2-(6-АРИЛ-4-АРОИЛ-3-МЕТИЛ-1-ФЕНИЛ-1Н-ПИРАЗОЛО[3,4-b]ПИРИДИН-5-ИЛ)-2-ОКСО-N-АРИЛАЦЕТАМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2501800C2 |
| 1-ЗАМЕЩЕННЫЕ 3-(2-ХЛОР-1Н-ИНДОЛ-3-ИЛ)-4-ФЕНИЛ-1Н-ПИРРОЛ-2,5-ДИОНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ФОТОХИМИЧЕСКОГО ГЕНЕРИРОВАНИЯ СТАБИЛЬНЫХ ФЛУОРЕСЦИРУЮЩИХ СОЕДИНЕНИЙ И 2,8-ЗАМЕЩЕННЫЕ БЕНЗО[а]ПИРРОЛО[3,4-с]КАРБАЗОЛ-1,3-(2Н,8Н)-ДИОНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФЛУОРОФОРОВ | 2009 |
|
RU2402547C1 |
| (1'S*,2'R*,3R*,7a'S*)-2'-Нитро-1',2',5',6',7',7а'-гексагидроспиро[пиррол-3,3'-пирролизин]-2(1Н)-оны | 2020 |
|
RU2742883C1 |
| Применение 9-ароил-8-гидрокси-6-(2-гидроксиалкил)-1,3-дифенил-1,3,6-триазаспиро[4,4]нон-8-ен-2,4,7-трионов в качестве средств, обладающих противомикробной активностью в отношении культуры S. aureus | 2023 |
|
RU2813484C1 |
| 2a-Алкоксикарбонил-5-фенил-1H-спиро[циклопропа[2,3]пирроло[1,2-a]хиноксалин-3,3'-индолин]-1,2,2',4(2aH,5H)-тетраоны | 2023 |
|
RU2798467C1 |



Изобретение относится к химико-фармацевтической промышленности. Флуоресцентный сенсор для детектирования лизосом in vitro содержит флуорофор семейства BODIPY, при этом в качестве флуорофора содержит 4,4-дифторо-5-фенил-3-(1,5-дифенил-3-1Н-пиразолил)-8-трифторметил-4-бора-3а,4а-диаза-8-индацен. Изобретение обеспечивает флуоресцентный сенсор, имеющий высокую фотостабильность, низкую токсичность, позволяющий достоверно выявлять лизосомы в живых клетках и подходящий для прижизненной окраски. 5 ил., 3 пр.
Флуоресцентный сенсор для детектирования лизосом in vitro, содержащий флуорофор семейства BODIPY, отличающийся тем, что в качестве флуорофора содержит 4,4-дифторо-5-фенил-3-(1,5-дифенил-3-1Н-пиразолил)-8-трифторметил-4-бора-3а,4а-диаза-8-индацен.
| WO 2013083966 A2, 13.06.2013 | |||
| WO 2010125068 A2, 04.11.2010 | |||
| RU 2011150286 A, 20.06.2013 | |||
| СИСТЕМЫ И СПОСОБЫ МНОГОСТОРОННЕГО АНАЛИЗА | 2012 |
|
RU2627927C2 |
Авторы
Даты
2020-03-20—Публикация
2019-06-25—Подача