Ссылка на родственные заявки
Согласно настоящей заявке испрашивается приоритет согласно 35 U.S.C. §119 в соответствии с предварительной заявкой на выдачу патента США №61/916680, поданной 16 декабря 2013 г., полное содержание которой включено в настоящий документ посредством ссылки.
Область техники
Настоящее изобретение относится к новым пептидомиметическим соединениям, применимым в качестве линкеров конъюгатов антител с лекарственными средствами (ADC). Настоящее изобретение также относится к ADC, содержащим пептидомиметические линкеры и производные антрациклина. Настоящее изобретение также относится к способам лечения заболеваний у людей.
Уровень техники
В последние годы применение моноклональных антител (тАВ) для доставки противораковых лекарственных средств напрямую к опухолевым клеткам привлекло к себе значительное внимание. Два новых конъюгата антител с лекарственными средствами были одобрены FDA для лечения злокачественной опухоли. Adcetris® (брентуксимаб ведотин) представляет собой направленный на CD30 конъюгат антитела с лекарственным средством (ADC), предназначенный для лечения рецидивирующий или рефрактерной лимфомы Ходжкина и системной анапластической крупноклеточной лимфомы (ALCL). Kadcyla® (адо-трастузумаб эмтанзин), представляет собой новую терапию, одобренную для пациентов с HER2-положительным раком молочной железы на поздней стадии (метастазирующим раком молочной железы). Для получения терапевтического средства с выраженной противоопухолевой активностью, а также с приемлемым терапевтическим индексом в ADC могут быть оптимизированы некоторые аспекты разработки. В частности, хорошо известно, что химическая структура линкера может оказывать существенное влияние как на эффективность, так и на безопасность ADC (Ducry & Stump, Bioconjugate Chem, 2010, 21, 5-13). Выбор правильного линкера влияет на правильную доставку лекарственного средства к предусмотренному клеточному компартменту злокачественных клеток. Линкеры, как правило, можно разделить на две категории: расщепляемые (такие как пептидные, гидразоновые или дисульфидные) или нерасщепляемые (такие как тиоэфирные). Пептидные линкеры, такие как валин-цитруллин (Val-Cit), которые могут гидролизироваться лизосомальными ферментами (такими как катепсин В), использовались для соединения лекарственного средства с антителом (патент США № US 6214345). Они являлись особенно применимыми отчасти благодаря их относительной стабильности в системном кровотоке и способности к эффективному высвобождению лекарственного средства в опухоль. Было показано, что ADC, содержащие линкер Val-Cit, являются относительно стабильными in vivo (t1/2 для высвобождения лекарственного средства ~7 дней (Doronina et al (2008), Bioconjugate Chem., 19, 1960-1963). Тем не менее, химическое пространство, представленное природными пептидами, ограничено; следовательно, существует потребность в разнообразных непептидных линкерах, которые действуют аналогично пептидам и могут эффективно расщепляться лизосомальными протеазами. Большее разнообразие непептидных структур может привести к новым, благоприятным свойствам, которые не могут быть достигнуты с помощью пептидных линкеров. В настоящем документе предусмотрены различные типы непеитидных линкеров для ADC, которые могут расщепляться лизосомальными ферментами.
Сущность изобретения
Настоящее изобретение относится к конъюгатам антител с лекарственными средствами, представленным формулой (I)
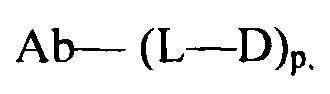
Ab представляет собой антитело;
L представляет собой пептидомиметический линкер, представленный следующей формулой
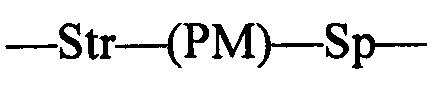
где
Str представляет собой растяжку, ковалентно прикрепленную к Ab;
Sp представляет собой связь или спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту;
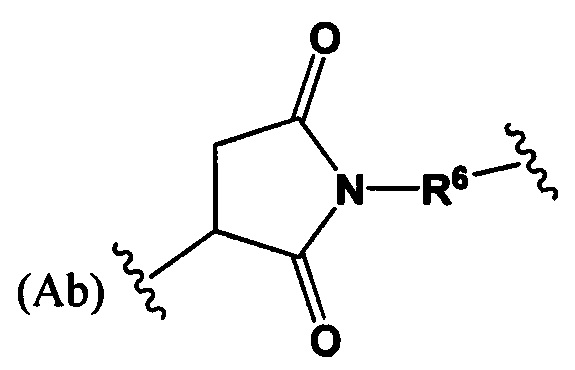
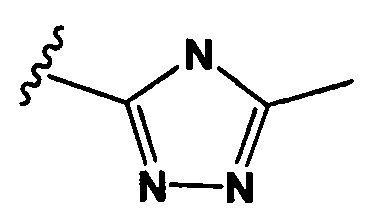
РМ представляет собой непептидный химический фрагмент, выбранный из группы, состоящей из:
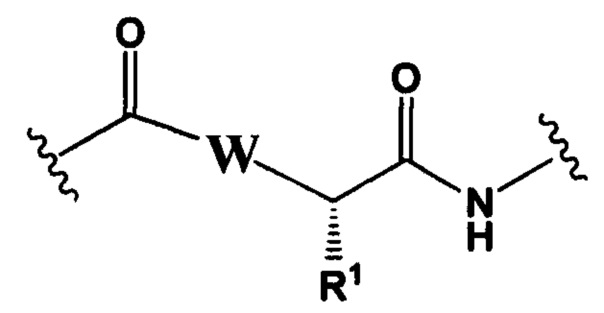
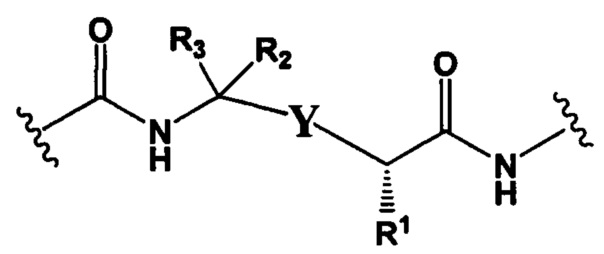
и
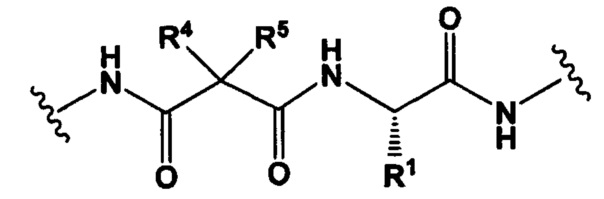
W представляет собой -NH-гетероциклоалкил- или гетероциклоалкил;
Y представляет собой гетероарил, арил, -С(O)С1-С6алкилен, C1-С6алкилен-NH2, С1-С6алкилен-NH-СН3, С1-С6алкилен-N-(СН3)2, C1-С6алкенил или C1-С6алкиленил;
каждый R1 независимо представляет собой C1-С10алкил, C1-С10алкенил, (C1-С10алкил)NHC(NH)NH2 или (С1-С10алкил)NHC(O)NH2;
R3 и R2, каждый независимо, представляют собой Н, C1-С10алкил, C1-С10алкенил, арилалкил или гетероарилалкил, или R3 и R2 вместе могут образовывать С3-С7циклоалкил;
R4 и R5, каждый независимо, представляют собой C1-С10алкил, C1-С10алкенил, арилалкил, гетероарилалкил, (С1-С10алкил)ОСН2-, или R4 и R5 могут образовывать С3-С7циклоалкильное кольцо;
р представляет собой целое число от 1 до 8;
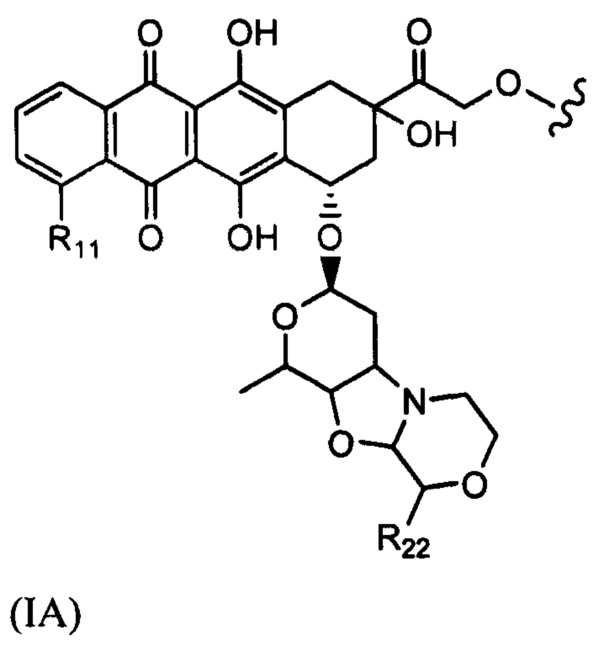
D представляет собой лекарственный фрагмент формулы (IA) или (IB)
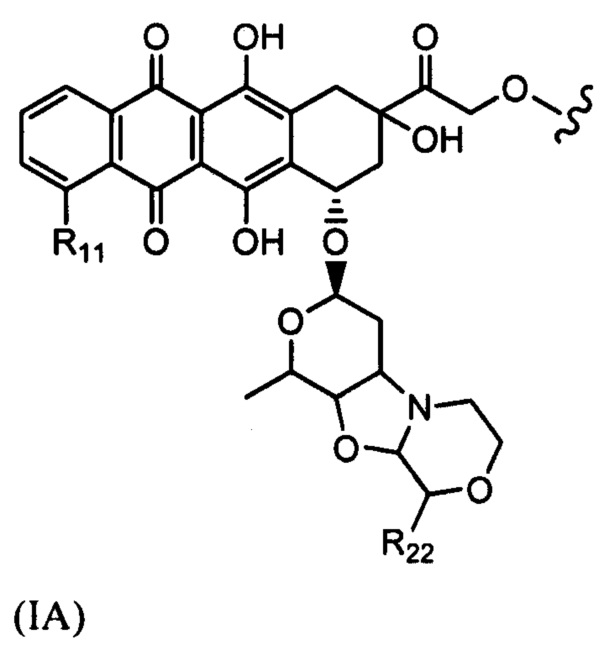

где R11 представляет собой атом водорода, гидрокси- или метокси-группу, и R22 представляет собой С1-С5 алкокси-группу.
Настоящее изобретение также относится к фармацевтическим композициям конъюгатов антител с лекарственными средствами формулы (I).
Настоящее изобретение также относится к способу лечения злокачественной опухоли, применению конъюгатов антител с лекарственными средствами формулы (I) в терапии и применению конъюгатов антител с лекарственными средствами формулы (I) в производстве лекарственного средства для лечения злокачественной опухоли.
Настоящее изобретение также относится к способу получения конъюгатов антител с лекарственными средствами формулы (I).
Краткое описание чертежей
На фигуре 1 показано сравнение эффективности ADC CD33 (CD33 PNU ADC3-2 и ADC2-2) у мышей SCID с опухолями острого миелоидного лейкоза человека HL-60.
На фигуре 2 показано сравнение эффективности ADC CD33 (CD33 PNU ADC4-2 и ADC2-2) у мышей SCID с опухолями острого миелоидного лейкоза человека HL-60.
Подробное описание изобретения
В настоящем документе предусмотрены различные типы непептидных линкеров для ADC, которые являются расщепляемыми лизосомальными ферментами. Например, амидная связь в середине дипептида (например, Val-Cit) замещена амидным миметиком; и/или вся аминокислота (например, аминокислота валин в дипептиде Val-Cit) замещена неаминокислотным фрагментом (например, циклоалкилдикарбонильными структурами (например, размер кольца = 4 или 5)).
Настоящее изобретение относится к конъюгатам антител формулы (I).
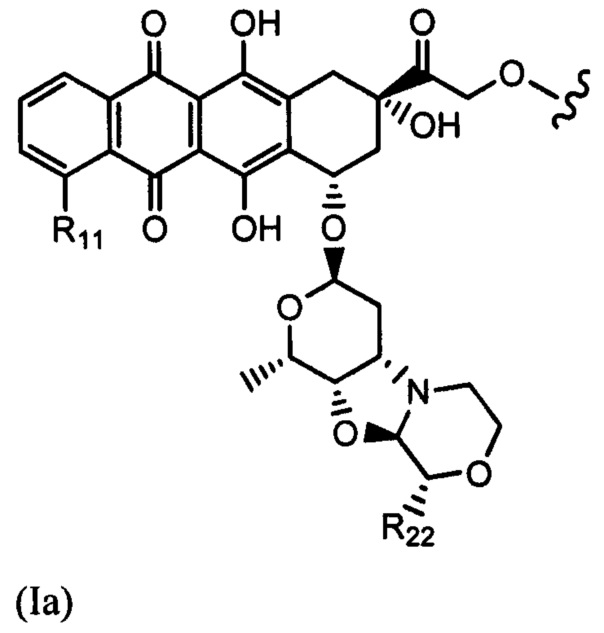
Настоящее изобретение также относится к конъюгатам антител формулы (I), где (IA) представляет собой:
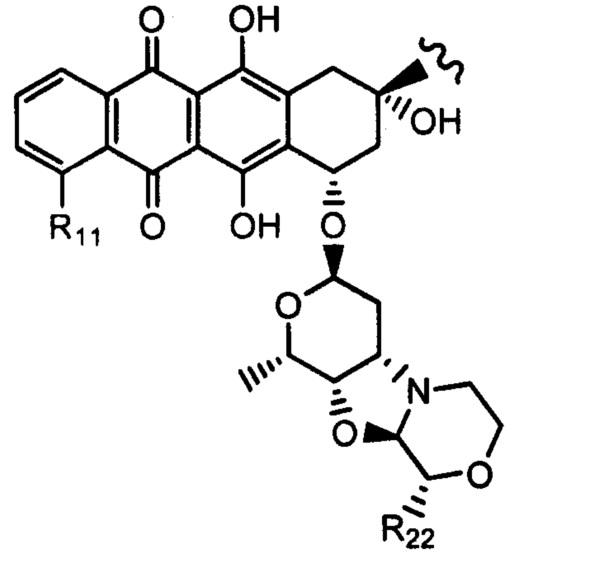
и (IB) представляет собой
Настоящее изобретение также относится к конъюгатам антител формулы (I), где Y представляет собой гетероарил; R4 и R5 вместе образуют циклобутильное кольцо.
Настоящее изобретение также относится к конъюгатам антител формулы (I), где Y представляет собой фрагмент, выбранный из группы, состоящей из
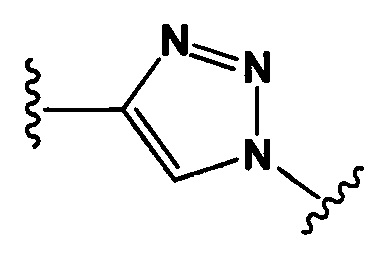
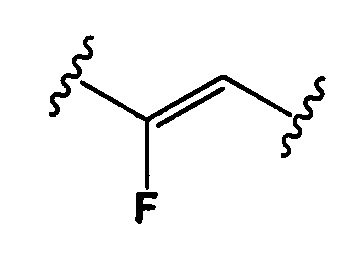 и
и 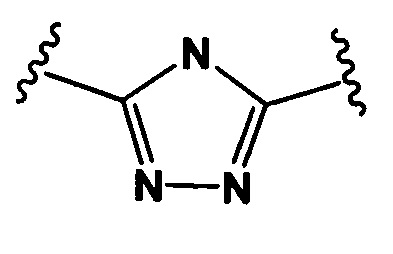
Настоящее изобретение также относится к конъюгатам антител формулы (I), где
Str представляет собой химический фрагмент, представленный следующей формулой:

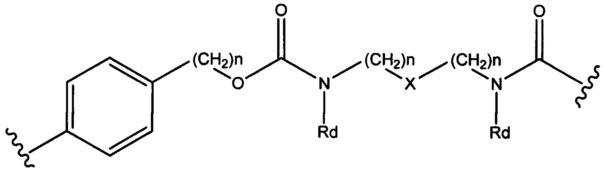
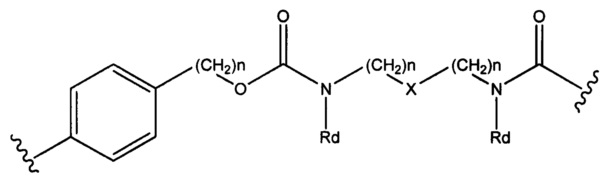
где R6 выбран из группы, состоящей из следующего: C1-С10алкилен, C1-С10алкенил, С3-С8циклоалкил, (С1-С8алкилен)О- и С1-С10алкилен-С(O)N(Ra)-С2-С6алкилен, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: гало, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7 гетероциклоалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или С1-С6алкил;
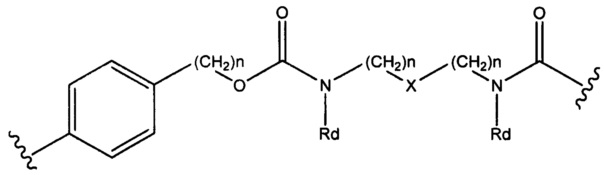
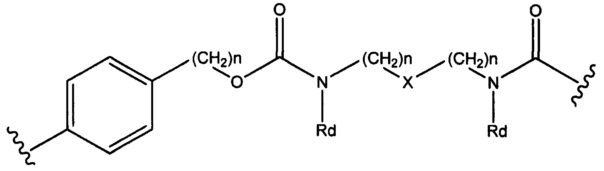
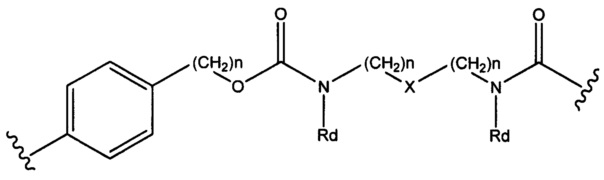
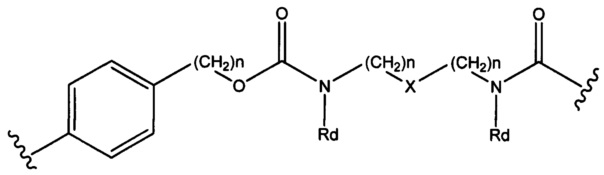
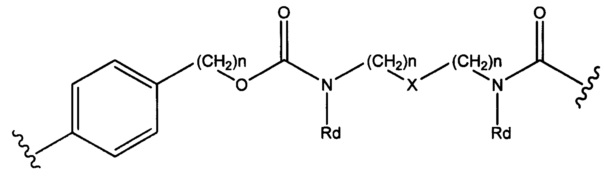
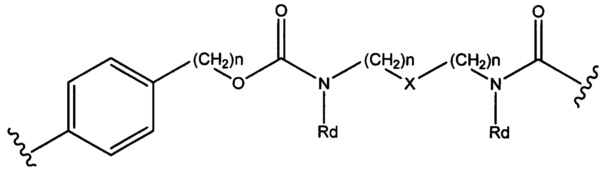
Sp представляет собой 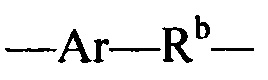 где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O-, или Sp представляет собой следующую формулу
где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O-, или Sp представляет собой следующую формулу
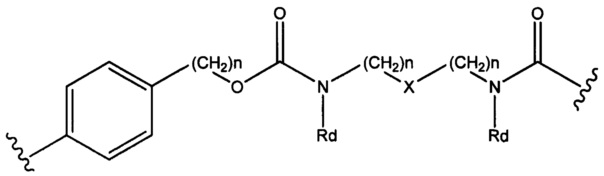
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к конъюгатам антител формулы (I), где Str характеризуется формулой:

где R7 выбран из следующего: C1-С10алкилен, C1-С10алкенил, (С1-С10алкилен)O-, N(Rc)-(C2-C6 алкилен)-N(Rc) и N(Rc)-(С2-С6алкилен); где каждый Rc независимо представляет собой Н или С1-С6 алкил; Sp представляет собой 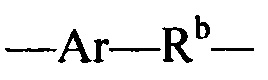 , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к конъюгатам антител формулы (I),
где
L представляет собой непептидный химический фрагмент, представленный следующей формулой
R1 представляет собой C1-С6алкил, C1-С6алкенил, (С1-С6алкил)NHC(NH)NH2 или (С1-С6алкил)NHC(O)NH2;
R3 и R2, каждый независимо, представляют собой Н, С1-С10алкил.
Настоящее изобретение также относится к конъюгатам антител формулы (I),
где
L представляет собой непептидный химический фрагмент, представленный следующей формулой
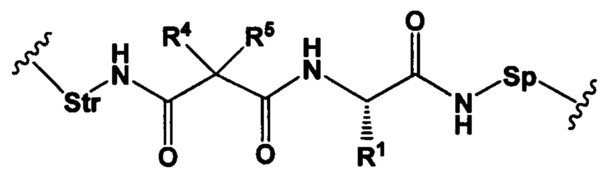
R1 представляет собой C1-С6алкил, (C1-C6aлкил)NHC(NH)NH2 или (C1-С6алкил)NHC(O)NH2;
R4 и R5 вместе образуют С3-С7циклоалкильное кольцо.
Настоящее изобретение также относится к конъюгатам антител формулы (I),
где
L представляет собой непептидный химический фрагмент, представленный следующей формулой
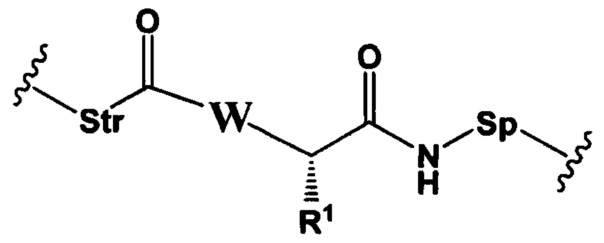
R1 представляет собой C1-С6алкил, (C1-C6алкил)NHC(NH)NH2 или (С1-С6алкил)NHC(O)NH2.
Настоящее изобретение также относится к конъюгатам антител формулы (I), представленным следующей формулой:

где
Str представляет собой химический фрагмент, представленный следующей формулой:
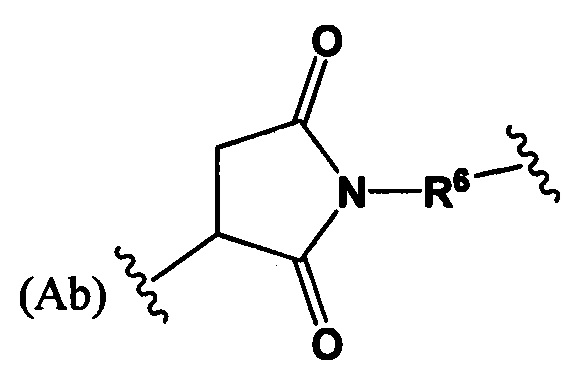
где R6 выбран из группы, состоящей из C1-С10алкилена и C1-С10алкилен-С(O)N(Ra)-С2-С6алкилена, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: гало, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7гетероциклоалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или C1-С6алкил;
р представляет собой 1, 2, 3 или 4.
Настоящее изобретение также относится к конъюгатам антител формулы (I), представленным следующей формулой:
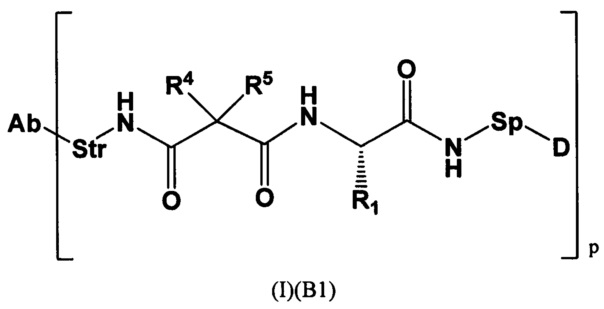
где
Str представляет собой химический фрагмент, представленный следующей формулой:
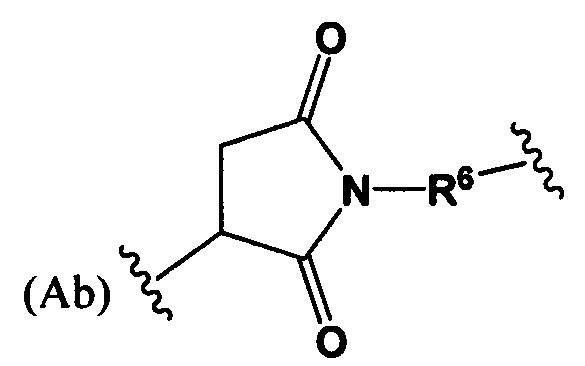
где R6 выбран из группы, состоящей из C1-С10алкилена и С1-С10алкилен-С(O)N(Ra)-С2-С6алкилена, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: гало, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7гетероциклоалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или C1-С6алкил;
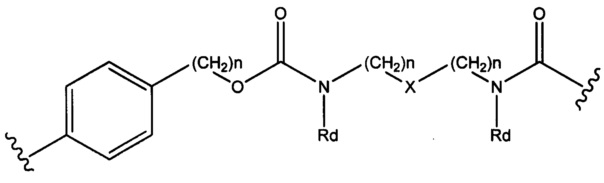
Sp представляет собой 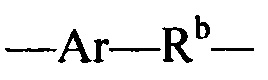 , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь;
каждый Rd независимо представляет собой Н или C1-С3алкил; и
р представляет собой 1, 2, 3 или 4.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител, где Y представляет собой гетероарил, арил или алкенил; R6 представляет собой С1-С10алкилен.
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами формулы (I), представленным следующей формулой:
где
Str представляет собой химический фрагмент, представленный следующей формулой:
где R6 выбран из группы, состоящей из C1-С10алкилена и C1-С10алкилен-С(O)N(Ra)-С2-С6алкилена, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: гало, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7гетероциклоалкил, арил, арилалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или C1-С6алкил;
Sp представляет собой 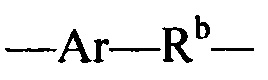 ,где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или
,где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь;
каждый Rd независимо представляет собой Н или C1-С3алкил; и
р представляет собой 1, 2, 3 или 4.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител, где Y представляет собой
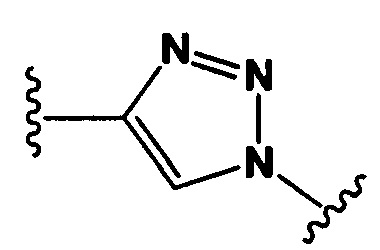
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител, где Y представляет собой
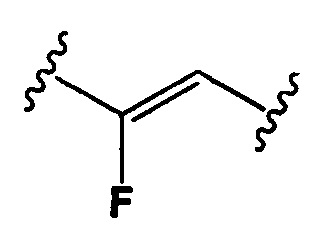
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител, где Y представляет собой
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител, где
Str представляет собой химический фрагмент, представленный следующей формулой:
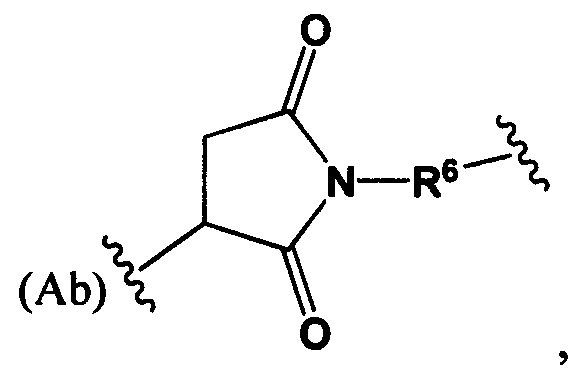
R6 представляет собой C1-С6алкилен;
Sp представляет собой 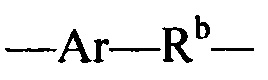 , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител согласно (I), (I)(А1), представленному следующей формулой:
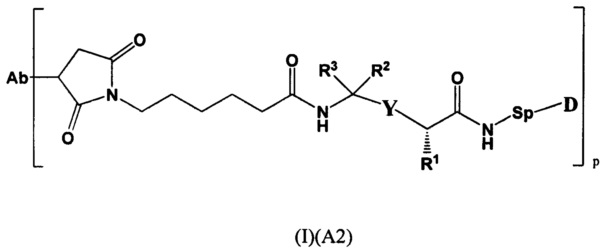
где
R1 представляет собой С1-С6алкил-NH2, (С1-С6алкил)NHC(NH)NH2 или (C1-С6алкил)NHC(O)NH2
р представляет собой 1, 2, 3 или 4;
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител согласно (I), (I)(В1), представленному следующей формулой:

где
р представляет собой 1, 2, 3 или 4;
R1 представляет собой С1-С6алкил-NH2, (С1-С6алкил)NHC(NH)NH2 или (C1-С6алкил)NHC(O)NH2;
R4 и R5, каждый независимо, представляют собой C1-С6алкил, где указанный алкил являются незамещенными, или R4 и R5 могут образовывать С3-С7циклоалкильное кольцо; и
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или С1-С3алкил.
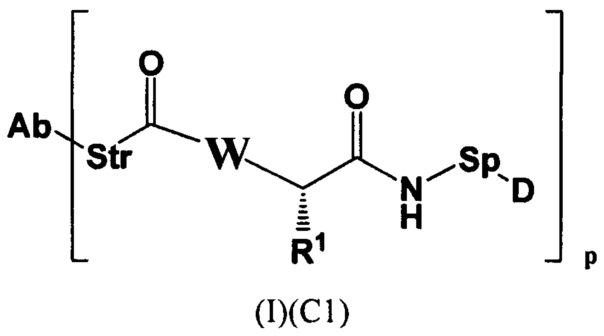
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител (I) и (I)(С1), представленному следующей формулой:

где
р представляет собой 1, 2, 3 или 4;
R1 представляет собой С1-С6алкил-NH2, (C1-C6алкил)NHC(NH)NH2 или (C1-С6алкил)NHC(O)NH2;
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к конъюгатам антител формулы (I), которая представлена следующей формулой:
где
р представляет собой 1, 2, 3 или 4;
R1 представляет собой С1-С6алкил-NH2, (С1-С6алкил)NHC(NH)NH2 или (С1-С6алкил)NHC(O)NH2; и
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
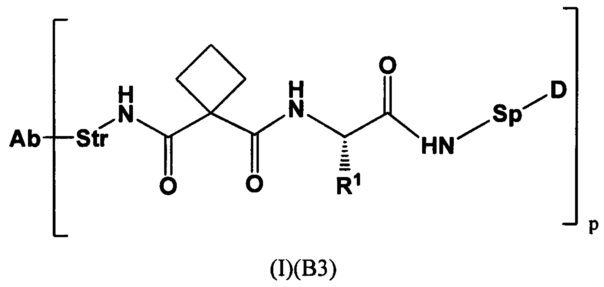
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами согласно (I)(В3), где
Str представляет собой химический фрагмент, представленный следующей формулой:
R6 представляет собой C1-С6алкилен, который может быть замещен 1-3 группами, выбранными из арила и гетероарила;
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами согласно (I)(В3), где R1 представляет собой (CH2)3NHC(O)NH2.
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами согласно (I)(В3), где R1 представляет собой (СН2)4NH2.
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами согласно (I), (I)(В1), (I)(В2) и (I)(В3), где R1 представляет собой (С1-С6алкил)NHC(NH)NH2.
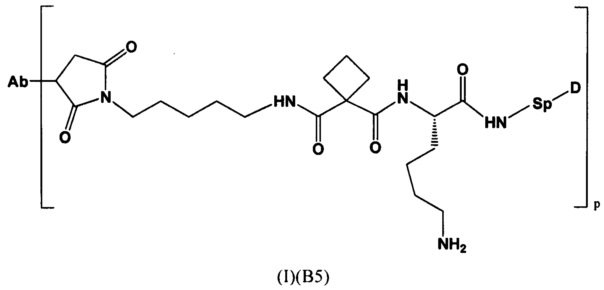
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами формулы (I), которая представлена следующей формулой:
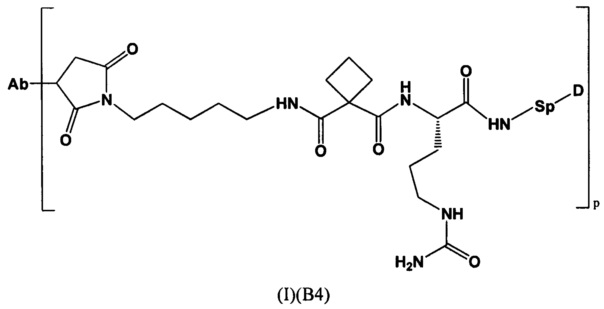
где,
Ab представляет собой антитело, которое связывается с мишенью, выбранной из Her2, CLL1, CD33, CD22 и NaPi2b;
Р представляет собой 1-4; и
Sp представляет собой следующую формулу
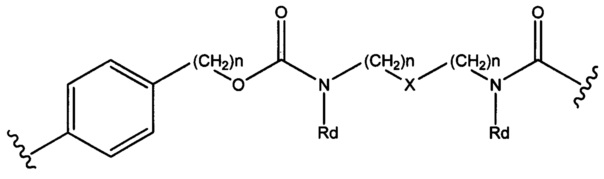
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к конъюгатам антител с лекарственными средствами формулы (I), которая представлена следующей формулой:
где,
Ab представляет собой антитело, которое связывается с мишенью, выбранной из Her2, CLL1, CD33, CD22 и NaPi2b;
Р представляет собой 1-4; и
Sp представляет собой следующую формулу
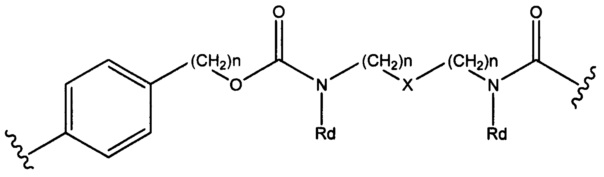
где
каждый n независимо представляет собой 1-6;
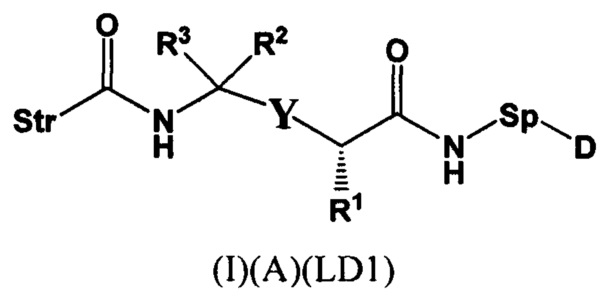
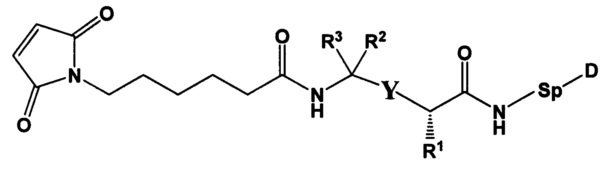
Настоящее изобретение также относится к непептидным соединениям формулы (I)(B)(LD1):
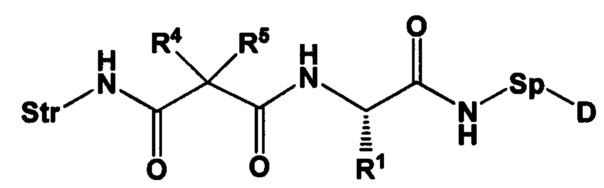
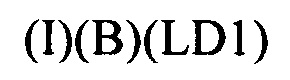
где
Str представляет собой растяжку, которая может быть ковалентно прикреплена к антителу;
Sp представляет собой связь или спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту;
R1 представляет собой C1-С10алкил, (С1-С10алкил)NHC(NH)NH2 или (C1-С10алкил)NHC(О)NH2;
R4 и R5, каждый независимо, представляют собой C1-С10алкил, арилалкил, гетероарилалкил, (С1-С10алкил)ОСН2-, или R4 и R5 могут образовывать С3-С7циклоалкильное кольцо;
D представляет собой лекарственный фрагмент формулы (IA) или (IB)
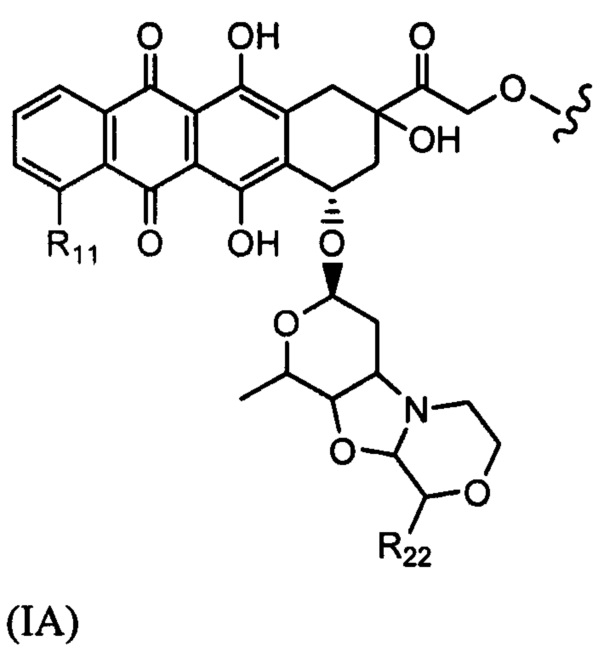
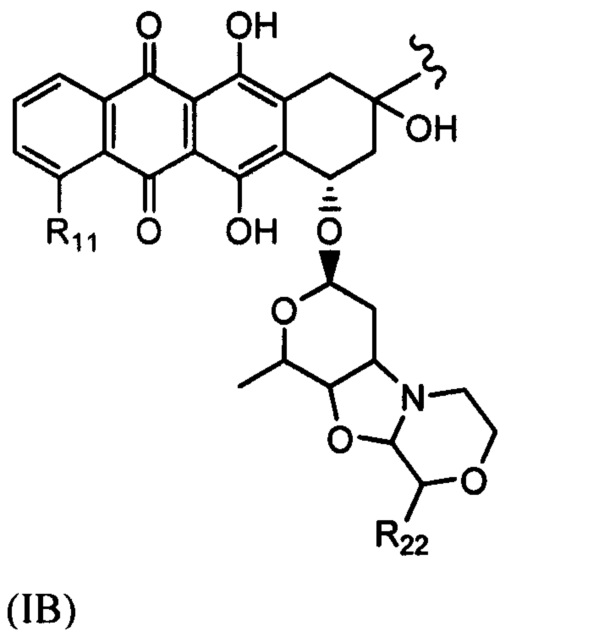
где R11 представляет собой атом водорода, гидрокси- или метокси-группу, и R22 представляет собой С1-С5 алкокси-группу, или их фармацевтически приемлемую соль.
Настоящее изобретение также относится к непептидным соединениям, представленным следующей формулой

где R6 представляет собой C1-С10алкилен; R4 и R5 вместе образуют С3-С7циклоалкильное кольцо.
Настоящее изобретение также относится к непептидным соединениям, представленным следующей формулой
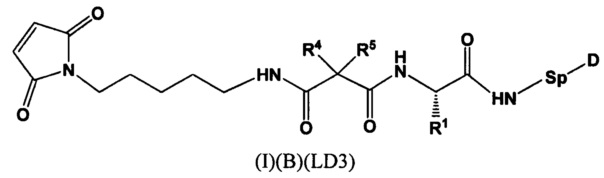
где
R1 представляет собой С1-С6алкил-NH2, (С1-С6алкил)NHC(NH)NH2 или (C1-С6алкил)NHC(O)NH2;
R4 и R5, каждый независимо, представляют собой C1-С6алкил, где указанный алкил являются незамещенными, или R4 и R5 могут образовывать С3-С7циклоалкильное кольцо; и
Sp представляет собой следующую формулу
где 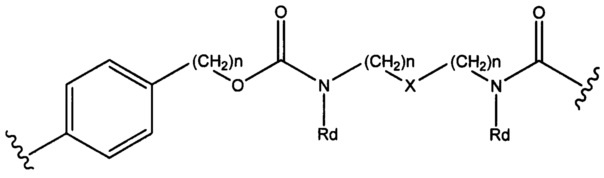
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к непептидным соединениям формулы:
где
Str представляет собой растяжку, которая может быть ковалентно прикреплена к антителу;
Sp представляет собой необязательный спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту;
Y представляет собой гетероарил, арил, -С(O)С1-С6алкилен, С1-С6алкилен-NH2, С1-С6алкилен-NH-СН3, С1-С6алкилен-N-(СН3)2, C1-С6алкенил или С1-С6алкиленил;
R1 представляет собой С1-С10алкил, (С1-С10алкил)NHC(NH)NH2 или (С1-С10алкил)NHC(O)NH2;
R3 и R2, каждый независимо, представляют собой Н, C1-С10алкил, арилалкил или гетероарилалкил, или R3 и R2 вместе могут образовывать С3-С7циклоалкил;
D представляет собой лекарственный фрагмент формулы (IA) или (IB)

где R11 представляет собой атом водорода, гидрокси- или метокси-группу, и R22 представляет собой С1-С5 алкокси-группу, или их фармацевтически приемлемую соль.
Настоящее изобретение также относится к непептидным соединениям, представленным следующей формулой:

где
R1 представляет собой С1-С10алкил, (С1-С10алкил)NHC(NH)NH2 или (C1-С10алкил)NHC(О)NH2;
R3 и R2, каждый независимо, представляют собой Н, C1-С10алкил, арилалкил или гетероарилалкил, или R3 и R2 вместе могут образовывать С3-С7циклоалкил;
R6 представляет собой C1-С10алкилен; и
Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к непептидным соединениям, представленным следующей формулой:
где
R1 представляет собой С1-С10алкил, (С1-С10алкил)NHC(NH)NH2 или (C1-С10алкил)NHC(O)NH2;
R3 и R2, каждый независимо, представляют собой Н, C1-С10алкил, арилалкил или гетероарилалкил, или R3 и R2 вместе могут образовывать С3-С7циклоалкил;
R6 представляет собой C1-С10алкилен; и
Sp представляет собой следующую формулу

где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к любому из вышеперечисленных связанных непептидным линкером лекарственных соединений, где Str характеризуется следующей формулой:
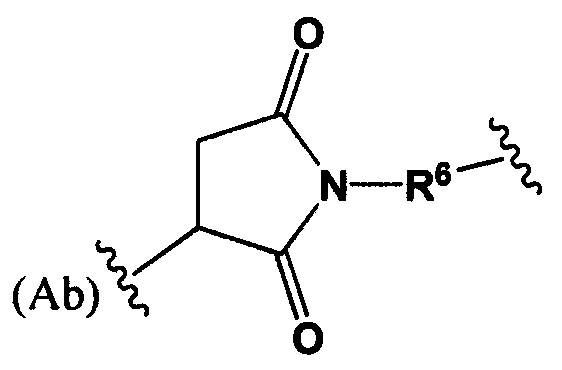
где R6 выбран из группы, состоящей из следующего: C1-С10алкилен, С3-С8циклоалкил, O-(С1-С8алкилен), и С1-С10алкилен-С(O)N(Ra)-С2-С6алкилен, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: гало, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7 гетероциклоалкил арил, арилалкил, гетероарилалкил и гетероарил; каждый Ra независимо представляет собой Н или C1-С6алкил;
Sp представляет собой 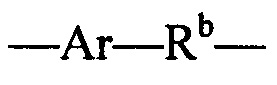 , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к соединениям непептидный линкер -лекарственное средство, где R6 представляет собой C1-С10алкилен, Sp представляет собой 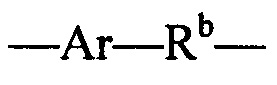 , где Ar представляет собой арил, Rb представляет собой (C1-С6алкилен)O-.
, где Ar представляет собой арил, Rb представляет собой (C1-С6алкилен)O-.
Настоящее изобретение также относится к соединениям непептидный линкер - лекарственное средство, где Str характеризуется формулой:

где R7 выбран из следующего: C1-С10алкилен, C1-С10алкилен-О, N(Rc)-(C2-C6 алкилен)-N(Rc) и N(Rc)-(С2-С6алкилен); где каждый Rc независимо представляет собой Н или С1-С6 алкил;
Sp представляет собой 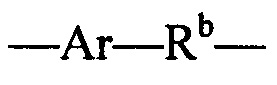 , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10 алкилен)O- или Sp представляет собой следующую формулу
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10 алкилен)O- или Sp представляет собой следующую формулу
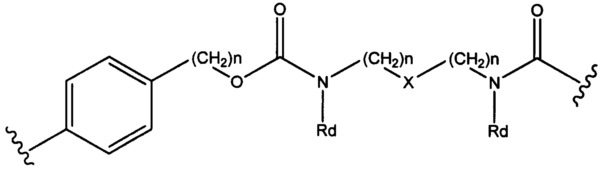
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к соединениям непептидный линкер - лекарственное средство, где R6 представляет собой C1-С10 алкилен, Sp представляет собой следующую формулу
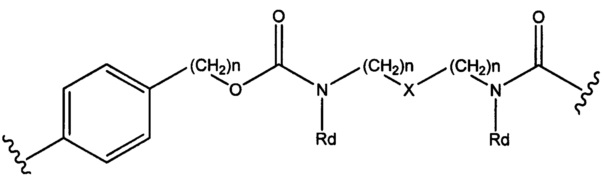
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где р представляет собой 2.
Настоящее изобретение также относится к соединениям линкер - лекарственное средство (I)(A)LD1) и (I)B)(LD1), где (IA) представляет собой
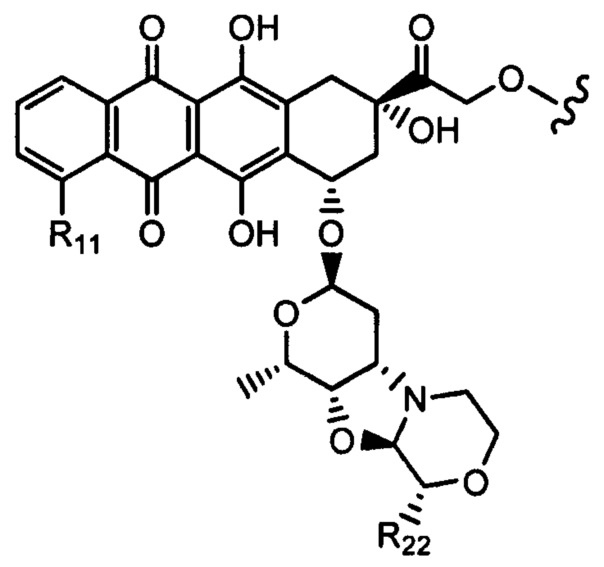
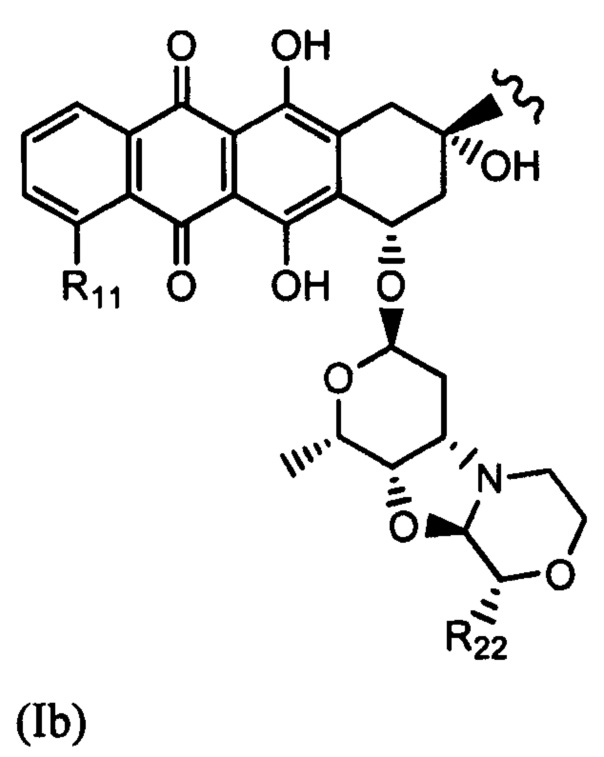
(Ia) и (IB) представляет собой
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с одним или несколькими полипептидами, выбранными из группы, состоящей из следующего:
CLL1;
BMPR1B;
Е16;
STEAP1;
0772Р;
MPF;
NaPi2b;
Sema 5b;
PSCA hlg;
ETBR;
MSG783;
STEAP2;
TrpM4;
CRIPTO;
CD21;
CD79b:
FcRH2;
HER2;
NCA;
MDP;
IL20Rα;
бревикан;
EphB2R;
ASLG659;
PSCA;
GEDA;
BAFF-R;
CD22;
CD79a;
CXCR5;
HLA-DOB;
P2X5;
CD72;
LY64;
FcRH1;
IRTA2;
TENB2;
PMEL17;
TMEFF1;
GDNF-Ra1;
Ly6E;
TMEM46;
Ly6G6D;
LGR5;
RET;
LY6K;
GPR19;
GPR54;
ASPHD1;
тирозиназа;
ТМЕМ118;
GPR172A;
MUC16 и
CD33.
Настоящее изобретение также относится к способам лечения заболевания у нуждающегося в этом человека, включающим введение указанному человеку эффективного количества конъюгата антитела с лекарственным средством по п. 1.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение по п. 1 и его фармацевтически приемлемый носитель.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с одним или несколькими полипептидами, выбранными из группы, состоящей из следующего:
CLL1;
STEAP1;
NaPi2b;
STEAP2;
TrpM4;
CRIPTO;
CD21;
CD79b;
FcRH2;
HER2;
CD22;
CD79a;
CD72;
LY64;
Ly6E;
MUC16; и
CD33.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD33.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD22.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с NaPi2b.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CLL1.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с Her2.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD33, и антитело к CD33 содержит HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 11, HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 12, HVR-L3, содержащую аминокислотную последовательность согласно SEQ ID NO: 13, HVR-H1, содержащую аминокислотную последовательность согласно SEQ ID NO: 14, HVR-H2, содержащую аминокислотную последовательность согласно SEQ ID NO: 15, и HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 16.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD33, и антитело к CD33 содержит домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 17, и домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 18.
Согласно некоторым вариантам осуществления антитело конъюгата антитела с лекарственным средством связывается с CD33. Согласно некоторым вариантам осуществления антитело конъюгата антитела с лекарственным средством содержит (а) HVR-H1, содержащую аминокислотную последовательность согласно SEQ ID NO: 22; (b) HVR-H2, содержащую аминокислотную последовательность согласно SEQ ID NO: 23; (с) HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 24; (d) HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 19; (е) HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 20; и (f) HVR-L3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 21.
Согласно некоторым вариантам осуществления антитело содержит VH, как в любом из предусмотренных выше вариантов осуществления и VL, как в любом из предусмотренных выше вариантов осуществления. Согласно одному варианту осуществления антитело содержит последовательности VL и VH в SEQ ID NO: 25 и SEQ ID NO: 26, соответственно, включая в себя посттрансляционные модификации указанных последовательностей.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с NaPi2b.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с NaPi2b, и антитело к NaPi2b содержит HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 1, HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 2, HVR-L3, содержащую аминокислотную последовательность согласно SEQ ID NO: 3, HVR-H1, содержащую аминокислотную последовательность согласно SEQ ID NO: 4, HVR-H2, содержащую аминокислотную последовательность согласно SEQ ID NO: 5, и HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 6.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с NaPi2b, и антитело к NaPi2b содержит домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 7, и домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 8.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с NaPi2b, и антитело к NaPi2b содержит аминокислотную последовательность согласно SEQ ID NO: 9 и аминокислотную последовательность согласно SEQ ID NO: 10.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD22.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD22, и антитело к CD22 содержит HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 41, HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 42, HVR-L3, содержащую аминокислотную последовательность согласно SEQ ID NO: 43, HVR-H1, содержащую аминокислотную последовательность согласно SEQ ID NO: 44, HVR-H2, содержащую аминокислотную последовательность согласно SEQ ID NO: 45, и HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 46.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD22, и антитело к CD22 содержит домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 47, и домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 48.
Настоящее изобретение также относится к любому из вышеперечисленных конъюгатов антител с лекарственными средствами, где антитело связывается с CD22, и антитело к CD22 содержит аминокислотную последовательность согласно SEQ ID NO: 49 и аминокислотную последовательность согласно SEQ ID NO: 50.
Определения
Если не указано иное, подразумевается, что следующие термины и фразы, используемые в настоящем документе, имеют следующие значения: если в настоящем документе используются торговые названия, подразумевается, что авторы настоящего изобретения независимо включают состав продукта под указанным торговым названием, воспроизведенное лекарственное средство и активный(е) фармацевтический(е) ингредиент(ы) продукта под указанным торговым названием.
Используемый в настоящем документе термин "пептидомиметический", или РМ означает непептидный химический фрагмент. Пептиды представляют собой короткие цепи аминокислотных мономеров, соединенных пептидными (амидными) связями, ковалентными химическими связями, образующимися, когда карбоксильная группа одной аминокислоты реагирует с аминогруппой другой аминокислоты. Самые короткие пептиды представляют собой дипептиды, состоящие из 2 аминокислот, соединенных одной пептидной связью, за ними следуют трипептиды, тетрапептиды и т.д. Пептидомиметический химический фрагмент включает в себя неаминокислотные химические фрагменты. Пептидомиметический химический фрагмент также может включать в себя одну или несколько аминокислот, отделенные одним или несколькими неаминокислотными химическими элементами. Пептидомиметический химический фрагмент не содержит в любой части своей химической структуры две или более смежных аминокислоты, которые соединены пептидными связями.
Используемый в настоящем документе термин "аминокислота" означает глицин, аланин, валин, лейцин, изолейцин, фенилаланин, пролин, серии, треонин, тирозин, цистеин, метионин, лизин, аргинин, гистидин, триптофан, аспарагиновая кислота, I лутаминовая кислота, аспарагин, глутамин или цитруллин.
Термин "антитело" в настоящем документе используется с самом широком смысле и, в частности, охватывает моноклональные антитела, поликлональные антитела, димеры, мультимеры, мультиспецифические антитела (например, биспецифические антитела), и фрагменты антител, при условии, что они проявляют требуемую биологическую активность (Miller et al (2003) Jour, of Immunology 170:4854-4861). Антитела могут являться мышиными, человеческими, гуманизированными, химерными или происходящими из других видов. Антитело представляет собой белок, образованный иммунной системой, который способен распознавать и связываться с конкретным антигеном. (Janeway, С., Travers, P., Walport, М., Shlomchik (2001) Immuno Biology, 5th Ed., Garland Publishing, New York). Целевой антиген, как правило, содержит несколько сайтов связывания, которые также называются эпитопы, распознаваемых CDR на многочисленных антителах. Каждое антитело, которое специфически связывается с другим эпитопом, характеризуется отличающейся структурой. Таким образом, один антиген может иметь больше одного соответствующего антитела. Антитело включает в себя полноразмерную молекулу иммуноглобулина или иммунологически активную часть полноразмерной молекулы иммуноглобулина, т.е. молекулу, которая содержит антигенсвязывающий сайт, который иммуноспецифически связывает антиген представляющей интерес мишени или ее часть, причем такие мишени включают в себя без ограничения злокачественную клетку или клетки, которые производят аутоиммунные антитела, связанные с аутоиммунным заболеванием. Раскрытый в настоящем документе иммуноглобулин может относится к любому типу (например, IgG, IgE, IgM, IgD и IgA), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекулы иммуноглобулина. Иммуноглобулины могут происходить из любого вида. Тем не менее, согласно одному аспекту, иммуноглобулин характеризуется происхождением от человека, мыши или кролика.
Используемый в настоящем документе термин "фрагмент(ы) антитела" содержит часть полноразмерного антитела, как правило, его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают в себя фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; миниантитела (Olafsen et al (2004) Protein Eng. Design & Sel. 17(4):315-323), фрагменты, полученные с помощью Fab-экспрессионной библиотеки, антиидиотипические (анти-Id) антитела, CDR (определяющие комплементарность область), и эпитопсвязывающие фрагменты любого из вышеперечисленных, которые иммуногспецифически связываются с антигенами злокачественных клеток, вирусными антигенами или антигенами микроорганизмов, одноцеиочечные молекулы антител; и мультиспецифические антитела, образованные из фрагментов антител.
Используемый в настоящем документе термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных встречающихся в природе мутаций, присутствующих в незначительных количествах. Моноклональные антитела являются высоко специфическими, будучи направленными против одного антигенного сайта. Более того, в отличие от препаратов поликлональных антител, которые, как правило, включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против одной детерминанты на антигене. В дополнение к их специфичности моноклональные антитела являются преимущественными в том, что они могут быть синтезированы незагрязненными другими антителами. Определение "моноклональное" указывает на характер антитела как антитела, полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, подлежащие использованию согласно настоящему изобретению моноклональные антитела могут быть получены с помощью способа на основе гибридом, впервые описанные Kohler et al (1975) Nature, 256:495, или способов на основе рекомбинантной ДНК (см., например: патенты США №№ US 4816567; US 5807715). Моноклональные антитела также можно выделить из библиотек фаговых антител с использованием техник, описанных, например, в Clackson et al (1991) Nature, 352:624-628; Marks et al (1991) J. Mol. Biol., 222:581-597.
В настоящем документе моноклональные антитела, в частности, включают в себя "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, происходящих из конкретного вида или принадлежащих конкретному классу или подклассу антител, тогда как оставшаяся(иеся) цепь(и) является(ются) идентичной(ыми) или гомологичной(ыми) соответствующим последовательностям в антителах, происходящих из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США №US 4816567; и Morrison et al (1984) Proc. Natl. Acad. Sci. US A, 81:6851-6855). Представляющие интерес в настоящем документе химерные антитела включают в себя "приматизированные" антитела, содержащие антигенсвязывающие последовательности вариабельного домена, происходящие из не являющегося человеком примата (например, мартышковые, высшие приматы и т.д.) и последовательности константной области человека.
Используемый в настоящем документе термин "интактное антитело" представляет собой антитело, содержащее домены VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, СН2 и СН3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с нативной последовательностью человека) или их вариант аминокислотной последовательности. Интактное антитело может характеризоваться одной или несколькими "эффекторными функциями", которые относятся к тем биологическим активностям, которые присущи Fc-константной области (Fc-области с нативной последовательностью или Fc-области с вариантной аминокислотной последовательностью) антитела. Примеры эффекторных функций антитела включают в себя связывание C1q; зависимую от комплемента цитотоксичность; связывание с Fc-рецептором; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз и отрицательную регуляцию рецепторов клеточной поверхности, таких как В-клеточный рецептор и BCR.
Используемый в настоящем документе термин "Fc-область" означает С-концевую область тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Термин включает Fc-области с нативной последовательностью и вариантные Fc-области. Согласно одному варианту осуществления Fc-область тяжелой цепи IgG человека распространяется от Cys226 или от Pro230 до карбокси-конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если иное не указано в настоящем документе, нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, также имеющей название индекс EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Используемый в настоящем документе термин "каркасная область" или "FR" относится к остаткам вариабельного домена, отличным от остатков гипервариабельной области (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR, как правило, находятся в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей, интактные антитела можно отнести к различным "классам". Существуют пять основных классов интактных антител - иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются а, δ, ε, γ и μ, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. Формы Ig включают в себя содержащие шарнир модификации или бесшарнирные формы (Roux et al (1998) J. Immunol. 161:4083-4090; Lund et al (2000) Eur. J. Biochem. 267:7246-7256; US 2005/0048572; US 2004/0229310).
Используемый в настоящем документе термин " антитело человека" относится к антителу, которое содержит аминокислотную последовательность, соответствующую таковой у антитела, произведенного человеком или клеткой человека или происходящего из не относящегося к человеку источника, который использует репертуары антитела человека или другие кодирующие антитело человека последовательности. Это определение антитела человека специально исключает гуманизированное антитело, содержащее не относящиеся к человеку антигенсвязывающие остатки.
Используемый в настоящем документе термин "консенсусная каркасная область человека" относится к каркасной области, которая представляет собой наиболее часто встречающиеся аминокислотные остатки в отборе последовательностей каркасной области VL или VH иммуноглобулина человека. Как правило, отбор последовательностей VL или VH иммуноглобулина человека происходит из подгруппы последовательностей вариабельного домена. Как правило, подгруппа последовательностей представляет собой подгруппу, как в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. Согласно одному варианту осуществления для VL подгруппа представляет собой подгруппу каппа I, как в Kabat et al., ранее. Согласно одному варианту осуществления для VH подгруппа представляет собой подгруппу III, как в Kabat et al., ранее.
Используемый в настоящем документе термин "гуманизированное антитело" относится к химерному антителу, содержащему аминокислотные остатки из не относящихся к человеку HVR и аминокислотные остатки из FR человека. Согласно определенным вариантам осуществления гуманизированное антитело будет содержать, по существу, все по меньшей мере из одного и, как правило, двух вариабельных доменов, в которых все или, по существу, все HVR (например, CDR) соответствуют таковым у не относящегося к человеку антитела, и все или, по существу, все FR соответствуют таковым у антитела человека. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из антитела человека. "Гуманизированная форма" антитела, например, не относящегося к человеку антитела, относится к антителу, которое подверглось гуманизации.
Используемый в настоящем документе термин "гипервариабельная область", или "HVR", относится к каждой из областей вариабельного домена антитела, которые являются гипервариабельными в отношении последовательности и/или образуют структурно определенные петли ("гипервариабельные петли"). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из "определяющих комплементарность областей" (CDR), причем последние характеризуются самой высокой изменчивостью последовательностей и/или вовлечены в распознавание антигена. Иллюстративные гипервариабельный петли находятся на аминокислотных остатках 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3). (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987).) Иллюстративные CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2, и CDR-H3) находятся на аминокислотных остатках 24-34 в L1, 50-56 в L2, 89-97 в L3, 31-35В в H1, 50-65 в Н2 и 95-102 в Н3. (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991).) За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR также содержат "определяющие специфичность остатки", или "SDR", которые представляют собой остатки, которые контактируют с антигеном. SDR содержатся в пределах областей CDR, которые называются укороченные-CDR, или a-CDR. Иллюстративные а-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) находятся на аминокислотных остатках 31-34 в L1, 50-55 в L2, 89-96 в L3, 31-35В в H1, 50-58 в Н2 и 95-102 в Н3. (См. Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008).) Если иное не указано, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) пронумерованы в настоящем документе согласно Kabat et al., ранее.
Используемый в настоящем документе термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, который вовлечен в связывание антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела, как правило, характеризуются аналогичными структурами, причем каждый домен содержит четыре консервативных каркасных области (FR) и три гипервариабельных области (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Одного домена VH или VL может быть достаточно для придания антигенсвязывающей специфичности. Кроме того, антитела, которые связывают конкретный антиген, можно выделить с использованием домена VH или VL из антитела, которое связывает антиген для скрининга библиотеки комплементарных доменов VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
Используемый в настоящем документе термин "вектор" относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, к которой она присоединена. Термин включает в себя вектор в качестве самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки - хозяина, в которую он был введен. Определенные векторы способны направлять экспрессию нуклеиновых кислот, к которым они функционально присоединены. Такие векторы в настоящем документе имеют название "экспрессионный векторы".
Используемый в настоящем документе термин "свободная аминокислота цистеин" относится к аминокислотному остатку цистеину, который был сконструирован в исходное антитело, содержит тиольную функциональную группу (-SH) и не спаривается как внутримолекулярный или межмолекулярный дисульфидный мостик.
Используемый в настоящем документе термин "линкер", "линкерный элемент" или "связующий элемент" означает химический фрагмент, содержащий цепь атомов, которая ковалентно прикрепляет лекарственный фрагмент к антителу. Согласно различным вариантам осуществления линкер представляет собой дивалентный радикал, обозначаемый как L.
Используемый в настоящем документе термин "лекарственный фрагмент" относится к веществу, которое ингибирует или препятствует осуществлению функции клеток и/или вызывает гибель или разрушение клеток. Цитотоксические средства включают в себя без ограничения радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие средства); ингибирующие рост средства; ферменты и их фрагменты, такие как нуклеолитические ферменты; и различные противоопухолевые или противораковые средства, раскрытые ниже.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "ацил" относится к группе -C(O)R', где R' представляет собой алкил, С3-С6циклоалкил или гетероциклил, как каждый из них определен в настоящем документе.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "алкокси" относится к группе -OR', где R' представляет собой С1-С4алкил или С3-С6циклоалкил согласно приведенному выше определению. Примеры "алкокси" включают в себя метокси, этокси, изопропокси, пропокси, бутокси, трет-бутокси, изобутокси, циклопропокси и циклобутокси и их галогенированные формы, например, фторметокси и дифторметокси.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "алкил" относится к неразветвленному или разветвленному, моновалентному или дивалентному радикал углеводородной цепи, содержащему один-двенадцать (С1-С12) атомов углерода, который может являться незамещенным или замещенным с различными степенями замещения, например, одним, двумя, тремя, четырьмя, пятью или шестью, включенными в настоящее изобретение. Примеры заместителей выбраны из группы, состоящей из следующего: гало, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота и алкилтио. Примеры используемого в настоящем документе "алкила" включают в себя без ограничения следующее: метил (Me, -СН3), этил (Et, -СН2СН3), 1-пропил (н-Pr, н-пропил, -СН2СН2СН3), 2-пропил (изо-Pr, изо-пропил, -СН(СН3)2), 1-бутил (н-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (изо-Bu, изо-бутил, -СН2СН(СН3)2), 2-бутил (втор-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (трет-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3, а также их дивалентные ("алкилен") и замещенные версии. Примеры замещенного алкила включают в себя без ограничения гидроксиметил, дифторметил и трифторметил.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "алкенил" означает неразветвленный или разветвленный, моновалентный или дивалентный радикал углеводородной цепи любой длины от двух до восьми атомов углерода (С2-С10) по меньшей мере с одним сайтом ненасыщенности, т.е. углерод-углеродной, sp2 двойной связью, где радикал алкенил может являться необязательно замещенным независимо одним или несколькими описанными выше в определении "алкил" заместителями и включает в себя радикалы, характеризующиеся "цис" и "транс" ориентациями или альтернативно "Е" и "Z" ориентациями. Примеры алкенила включают в себя без ограничения этенил или винил (-СН=СН2), проп-1-енил (-СН=СНСН3), проп-2-енил (-СН2СН=СН2), 2-метилпроп-1-енил, бут-1-енил, бут-2-енил, бут-3-енил, бута-1,3-диенил, 2-метилбута-1,3-диен, гекс-1-енил, гекс-2-енил, гекс-3-енил. гекс-4-енил, гекса-1,3-диенил, а также их дивалентные ("алкенилен") и замещенные версии.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "алкинил" относится к неразветвленному или разветвленному, моновалентному или дивалентному углеводородному радикалу любой длины от двух до восьми атомов углерода (С2-С10) по меньшей мере одним сайтом ненасыщенности, т.е. углерод-углеродной, sp тройной связью, где радикал алкинил может необязательно являться замещенным независимо одним или несколькими заместителями, описанными выше в определении алкила, примеры алкинила включают в себя без ограничения этинил (-C≡CH), проп-1-инил (-С≡ССН3), проп-2-инил (пропаргил, -СН2С≡СН), бут-1-инил, бут-2-инил и бут-3-инил, а также их дивалентные ("алкинилен") и замещенные версии.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "алкиламино" относится к группе -NR'R'', где R' представляет собой Н, C1-С6алкил или С3-С6циклоалкил, и R'' представляет собой C1-С6алкил или С3-С6циклоалкил, примеры алкиламино включают в себя без ограничения метиламино, диметиламино, этиламино, диэтиламино, пропиламино и циклопропиламино.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "амид" относится к группе -C(O)NR'R'', где R' и R'', каждый независимо, представляют собой Н, C1-С6алкил или С3-С6циклоалкил; примеры амида включают в себя без ограничения -C(O)NH2, -C(O)NHCH3 и -C(O)N(CH3)2.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "арил" относится к ароматической углеводородной кольцевой системе. Кольцевая система может являться моноциклической или слитой полициклической (например, бициклической, трициклической и т.д.), замещенной или незамещенной. Согласно различным вариантам осуществления моноциклической арильное кольцо представляет собой С5-С10, или С5-С7, или C5-С6, где указанные числа при атомах углерода относятся к числу атомов углерода, которые образуют кольцевую систему. Кольцевая система С6, т.е. фенильное кольцо, представляет собой арильную группу. Согласно различным вариантам осуществления полициклическое кольцо представляет собой бициклическую арильную группу, причем примеры бициклических арильных групп включают в себя C8-C12 или С9-С10. Нафтильное кольцо, которое содержит 10 атомов углерода, представляет собой полициклическую арильную группу. Примеры заместителей для арила описаны ниже в определении "необязательно замещенный".
Если иное не определено в пункте формулы, используемый в настоящем документе термин "циано" относится к группе -CN.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "циклоалкил" относится к неароматической, замещенной или незамещенной, насыщенной или частично ненасыщенной углеводородной кольцевой группе. Примеры заместителей описаны в определении "необязательно замещенный". Согласно одному примеру циклоалкильная группа содержит 3-12 атомов углерода (С3-С12). Согласно другим примерам циклоалкил представляет собой C3-C8, С3-С10 или С5-С10. Согласно другим примерам циклоалкилная группа, в виде моноцикла, представляет собой С3-C8, С3-С6 или C5-С6. Согласно другому примеру циклоалкильная группа, в виде бицикла, представляет собой C7-C12. Согласно другому примеру циклоалкильная группа, в виде спиро-системы, представляет собой С5-С12. Примеры моноциклического циклоалкила включают в себя циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, пердейтериоциклогексил, 1-циклогекс-1-енил, 1 -циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, ииклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. Иллюстративные расположения бициклических циклоалкилов, характеризующихся 7-12 кольцевыми атомами, включают в себя без ограничения [4,4], [4,5], [5,5], [5,6] или [6,6] кольцевые системы. Иллюстративные соединенными мостиками бициклические циклоалкилы включают в себя без ограничения бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло[3.2.2]нонан. Примеры спироциклоалкила включают в себя. спиро[2.2]пентан, спиро[2.3]гексан, спиро[2.4]гептан, спиро[2.5]октан и спиро[4.5]декан.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "сложный эфир" относится к группе -C(O)OR', где R' представляет собой C1-С6алкил или С3-С6циклоалкил.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "гетероцикл" "гетероциклоалкил" или "гетероциклил" относится к незамещенной и замещенной моно- или полициклической неароматической кольцевой системе, содержащей 2-12 кольцевых атомов углерода и 1-3 кольцевых гетероатомов. Полициклические кольцо системы могут являться слитыми би- или трициклическими, спиро или соединенными мостиками. Примеры гетероатомов включают в себя N, О и S, включая в себя N-оксиды, оксиды и диоксиды серы. Согласно одному варианту осуществления кольцо является 3 - 8-членным и является либо полностью насыщенным, либо характеризуется одной или несколькими степенями ненасыщенности. Множественные степени замещения включены в настоящее определение. Примеры заместителей определены в настоящем документе. Примеры "гетероциклические" группы включают в себя без ограничения тетрагидрофуранил, пиранил, 1,4-диоксанил, 1,3-диоксанил, оксоланил, оксетанил, 2-окса-6-азаспиро[3.3]гептан-6-ил, пиперидинил, пирролидинил, морфолинил, азетидинил, пиперазинил, пирролидинонил, пиперазинонил, пиразолидинил, имидазолинил, имидазолидинил и их различные таутомеры.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "гетероарил", если иное не определено в пункте формулы, относится к ароматической кольцевой системе, содержащей 1-9 атомов углерода и по меньшей мере один гетероатом. Примеры гетероатомов включают в себя N, О и S. Гетероарил может являться моноциклическим или полициклическим, замещенным или незамещенным. Моноциклическая гетероарильная группа может содержать 2-6 кольцевых атомов углерода и 1-3 кольцевых гетероатома в кольце, тогда как полициклический гетероарил может содержать 3-9 кольцевых атомов углерода и 1-5 кольцевых гетероатомов. Полициклическое гетероарильное кольцо может содержать слитые, спиро или соединенные мостиком кольцевые соединения, например, бициклический гетероарил представляет собой полициклический гетероарил. Бициклические гетероарильные кольца могут содержать от 8 до 12 атомов - членов кольца. Моноциклические гетероарилные кольца могут содержать от 5 до 8 атомов - членов кольца (атомы углерода и гетероатомы). Иллюстративные гетероарильные группы включают в себя без ограничения следующее: бензофуранил, бензотиофенил, фуранил. имидазолил, индолил, азаиндолил, азабензимидазолил, бензоксазолил, бензтиазолил, бензотиадиазолил, бензотриазолил, бензоимидазолил, тетразинил, тетразолил, изотиазолил, оксазолил, изоксазолил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, хинолинил, хиназолинил, хиноксалинил, триазинил, триазолил, тиазолил и тиофенил. Примеры заместителей для гетероарила описаны ниже в определении "необязательно замещенный".
Если иное не определено в пункте формулы, используемый в настоящем документе термин "гетероарилалкил" означает группу (гетероарил)С1-С3алкил.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "арилалкил" означает группу (арил)С1-С3алкил.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "мочевина" относится к группе -NR'C(O)NR'', где R' и R'', каждый независимо, представляют собой Н, C1-С6алкил или С3-С6циклоалкил.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "необязательно" означает, что по существу описанный(е) событие(я) может(могут) происходить или может(могут) не происходить, и включает в себя как событие(я), которое(ые) происходит(ят), так и событие(я), которое(ые) не происходит(ят).
Используемый в настоящем документе, если иное не определено, фраза "необязательно замещенный", "замещенный" или их варианты означают необязательное замещение, включая в себя множественные степени замещения одной или несколькими группами заместителей, например, одной, двумя или тремя. Фраза не должна интерпретироваться как дублирующая замещения, описанные и изображенные в настоящем документе. Иллюстративные необязательные группы заместителей включают в себя ацил, C1-С6алкил, сульфонил, амино, сульфонамид, сульфоксид, алкокси, циано, гало, мочевину, сложный эфир, карбоновую кислоту, амид, гидрокси, оксо и нитро.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "лечение" относится к облегчению определенного состояния, устранению или снижению одного или нескольких симптомов состояния, замедлению или устранению прогрессирования состояния.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "эффективное количество" означает такое количество лекарственного средства или фармацевтического средства, которое будет вызывать биологический или медицинский ответ в ткани, системе, у животного или человека, которого добивается, например, исследователь или лечащий врач.
Если иное не определено в пункте формулы, используемый в настоящем документе термин "терапевтически эффективное количество" означает любое количество, которое по сравнению с соответствующим субъектом, который не получил такое количество, приводит к лечению заболевания, нарушение или побочного эффекта или к уменьшению скорости прогрессирования заболевания или нарушения. Термин в свое значение также включает количества, эффективные для усиления нормальной физиологической функции. Для применения в терапии терапевтически эффективные количества соединения формулы I, а также их солей можно вводить в виде сырых химических соединений. Кроме того, активный ингредиент может быть представлен в виде фармацевтической композиции.
Настоящее изобретение также относится к любому из примеров в разделе "Экспериментальные данные".
Используемая в настоящем документе фраза "фармацевтически приемлемая соль" относится к фармацевтически приемлемым органическим или неорганическим солям конъюгата антитела с лекарственным средством (ADC) или группы линкер - лекарственный фрагмент.Иллюстративные соли включают в себя без ограничения следующие соли: сульфат, цитрат, ацетат, оксалат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, пара-толуолсульфонат и памоат (т.е. 1,Г-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может включать включение другой молекулы, такой как ион ацетата, ион сукцината или другой противоион. Противоион может представлять собой любой органический или неорганический фрагмент, который стабилизирует заряд на исходном соединении. Более того, фармацевтически приемлемая соль может содержать больше одного заряженного атома в своей структуре. Случаи, где множественные заряженные атомы являются частью фармацевтически приемлемой соли, могут содержать множественные противоионы. Следовательно, фармацевтически приемлемая соль может содержать один или несколько заряженных атомов и/или один или несколько противоионов.
Другие соли, который не являются фармацевтически приемлемыми, могут являться применимыми в получении соединений согласно настоящему изобретению, и их следует рассматривать как формирующих дополнительный аспект настоящего изобретения. Указанные соли, такие как щавелевая кислота или трифторацетат, не являясь фармацевтически приемлемыми, могут быть применимы в получении солей, применимых в качестве промежуточных соединений в получении соединений согласно настоящему изобретению и их фармацевтически приемлемых солей.
Соединения согласно настоящему изобретению могут существовать в твердой или жидкой форме. В твердом состоянии оно может существовать в кристаллической или некристаллической форме или в виде их смеси. Специалисту в настоящей области техники понятно, что фармацевтически приемлемые сольваты могут быть образованы для кристаллических или некристаллических соединений. В кристаллических сольватах молекулы растворителя встраиваются в кристаллическую решетку во время кристаллизации. Сольваты могут включать в себя неводные растворители, такие как без ограничения этанол, изопропанол, DMSO (диметилсульфоксид), уксусная кислота, этаноламин или этилацетат, или они могут включать в себя воду в качестве растворителя, который встраивается в кристаллическую решетку. Сольваты, в которых вода представляет собой растворитель, встроенный в кристаллическую решетку, типично называются "гидраты". Гидраты включают в себя стойхиометрические гидраты, а также композиции, содержащие изменяющиеся количества воды. Согласно настоящему изобретению предусмотрены все такие сольваты.
Специалисту в настоящей области техники дополнительно будет понятно, что определенные соединения согласно настоящему изобретению, которые существуют в кристаллической форме, включая в себя их различные сольваты, могут проявлять полиморфизм (т.е. способность существовать в различных кристаллических структурах). Указанные различные кристаллические формы, как правило, известны как "полиморфы". Согласно настоящему изобретению предусмотрены все такие полиморфы. Полиморфы характеризуются одинаковым химическим составом, но отличаются по упаковке, геометрическому расположению и другим свойствам, описывающим кристаллическое твердое состояние. Следовательно, полиморфы могут характеризоваться различными физическими свойствами, такими как форма, плотность, твердость, деформируемость, стабильность и свойства растворения. Полиморфы, как правило, проявляют различные точки плавления, ИК-спектры и порошковые рентгеновские диффрактограммы, которые можно использовать при идентификации. Специалисту в настоящей области техники понятно, что различные полиморфы можно получить, например, путем изменения или корректировки условий реакции или реагентов, используемых при получении соединения. Например, изменения температуры, давления или растворителя могут давать в результате полиморфы. Кроме того, один полиморф может спонтанно превращаться в другой полиморф при определенных условиях.
Соединения согласно настоящему изобретению или их соль могут существовать в стереоизомерных формах (например, соединение содержит один или несколько асимметричных атомов углерода). Отдельные стереоизомеры (энантиомеры и диастереомеры) и их смеси включены в объем настоящего изобретения. Аналогично, следует понимать, что соединение или соль формулы (I) могут существовать в таутомерных формах, отличных от тех, которые показаны в формуле, и они также включены в объем настоящего изобретения. Следует понимать, что настоящее изобретение включает в себя все комбинации и подгруппы конкретных групп, определенных в настоящем документе выше. Объем настоящего изобретения включает в себя смеси стереоизомеров, а также очищенные энантиомеры или энантиомерно/диастереомерно обогащенные смеси. Следует понимать, что настоящее изобретение включает в себя все комбинации и подгруппы конкретных групп, определенных в настоящем документе выше.
Настоящее изобретение также включает в себя изотопно-меченные формы соединений согласно настоящему изобретению, за исключением того факта, что один или несколько атомов замещены атомом, характеризующимся атомной массой или массовым числом, отличным от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть встроены в соединения согласно настоящему изобретению и их фармацевтически приемлемые соли, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, йода и хлора, такие как 2Н, 3Н, 11С, 13С, 14С, 15N, 17O, 18O, 31Р, 32Р, 35S, 18F, 36Cl, 123I и 125I.
Соединения согласно настоящему изобретению и фармацевтически приемлемые соли указанных соединений, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, находятся в пределах объема настоящего изобретения. Изотопно-меченные соединения согласно настоящему изобретению, например, те, в которые встроены радиоактивные изотопы, такие как 3Н, 14С, являются применимыми в анализах тканевого распределения лекарственного средства и/или субстрата. Меченные тритием, т.е. 3Н, и углерод-14, т.е. 14С, изотопы широко используются благодаря своей простоте получения и способности к обнаружению. Изотопы 11С и 18F являются применимыми в PET (позитронно-эмиссионная томография), и изотопы 1251 применимы в SPECT (однофотонная эмиссионная компьютерная томография), все являются применимыми в томографии головного мозга. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2Н, может давать определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например, увеличенного периода полураспада in vivo или сниженных потребностей в дозировке и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Изотопно-меченные соединения формулы I и нижеизложенные соединения согласно настоящему изобретению, как правило, можно получить путем проведения процедур, раскрытых в схемах и/или примерах ниже, путем замещения легко доступным изотопно-меченным реагентом реагента, не являющегося изотопно-меченным.
Фармацевтическая композиция ADC
Фармацевтические составы терапевтических конъюгатов антител с лекарственными средствами (ADC) согласно настоящему изобретению, как правило, получают для парентерального введения, т.е. болюса, внутривенной, внутриопухолевой инъекции с фармацевтически приемлемым парентеральным инертным носителем и в стандартной инъекционной лекарственной форме. Конъюгат антитела с лекарственным средством (ADC), характеризующийся требуемой степенью чистоты, необязательно смешивают с фармацевтически приемлемыми разбавителями, носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.), в форме лиофилизированного состава или водного раствора.
Сконструированные на основе цистеина антитела
Соединения согласно настоящему изобретению включают в себя конъюгаты антител с лекарственными средствами, содержащие сконструированные на основе цистеина антитела, в которых одна или несколько аминокислот дикого типа или исходного антитела замещены аминокислотой цистеин. Любая форма антитела может быть сконструирована таким образом, т.е. мутировала. Например, исходный фрагмент антитела Fab может быть сконструирован с образованием сконструированного на основе цистеина Fab, обозначенного в настоящем документе как "ThioFab." Аналогично, исходное моноклональное антитело может быть сконструировано с образованием "ThioMab". Следует отметить, что моносайтовая мутация дает в результате один сконструированный остаток цистеина в ThioFab, тогда как моносайтовая мутация дает в результате два сконструированных остатка цистеина в ThioMab вследствие димерной природы антитела IgG. Мутанты с замещенными ("сконструированными") остатками цистеина (Cys) оценивают в отношении реакционной способность тиольных групп вновь введенного, сконструированного цистеина. Величина реакционной способности является относительной, числовое выражение находится в диапазоне от 0 до 1,0 и может быть измерена для любого сконструированного на основе цистеина антитела. Значения реакционной способности тиола сконструированных на основе цистеина антител согласно настоящему изобретению находятся в диапазонах от 0,6 до 1,0; от 0,7 до 1,0 или от 0,8 до 1,0.
Для получения сконструированного на основе цистеина антитела с помощью мутагенеза ДНК, кодирующую вариант аминокислотной последовательности начального полипептида, получают с помощью разнообразных способов, известных в настоящей области техники. Эти способы включают в себя без ограничения получение путем сайт-направленного (или опосредованного олигонуклеотидами) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученной ДНК, колирующей полипептид. Варианты рекомбинантных антител также можно сконструировать путем манипуляций с рестрикционными фрагментами или с помощью ПЦР с перекрывающимися праймерами с синтетическими олигонуклеотидами. Мутагенные праймеры кодируют замещение(я) кодона цистеина. Стандартные техники мутагенеза можно использовать для создания ДНК, кодирующей такие мутантные сконструированные на основе цистеина антитела. Общее руководство можно найти в Sambrook et al Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и AUS ubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-Interscience, New York, N.Y., 1993.
Аминокислоты цистеин можно сконструировать на реакционно способных сайтах в антителе, и которые не образуют внутрицепочечные или межмолекулярные дисульфидные мостики (Junutula, et al., 2008b Nature Biotech., 26(8):925-932; Dornan et al (2009) Blood 114(13):2721-2729; US 7521541; US 7723485; WO 2009/052249, Shen et al (2012) Nature Biotech., 30(2): 184-191; Junutula et al (2008) Jour of Immun. Methods 332:41-52). Тиольные группы сконструированных цистеиновых остатков могут реагировать с линкерным реагентом или промежуточными соединениями линкер - лекарственное средство согласно настоящему изобретению, которые содержат реагирующие с тиольной группой, электрофильные группы, такие как малеимид или альфа-галоамиды, с образованием ADC со сконструированными на основе цистеина антителами (ThioMabs) и лекарственным (D) фрагментом. Расположение лекарственного фрагмента, таким образом, может быть спроектированным, контролируемым и известным. Загрузка конъюгата лекарственным средством может быть контролируемой, поскольку тиольные группы сконструированного цистеина, как правило, реагируют с реагирующими с тиольными группами линкерными реагентами или промежуточными соединениями линкер - лекарственное средство с высоким выходом. Конструирование антитела для введения аминокислоты цистеин путем замены на одном сайте на тяжелой или легкой цепи дает два новых цистеина на симметричном антителе. Может быть достигнута загрузка лекарственным средством, составляющая около 2, и почти гомогенность продукта конъюгации ADC.
Сконструированные на основе цистеина антитела согласно настоящему изобретению предпочтительно сохраняют антигенсвязывающую способность своих эквивалентов - исходных антител дикого типа. Таким образом, сконструированные на основе цистеина антитела способны связываться, предпочтительно специфически, с антигенами. Такие антигены включают в себя, например, опухолеассоциированные антигены (ТАА), белки рецепторов клеточной поверхности и другие молекулы клеточной поверхности, трансмембранные белки, сигнальные белки, регуляторные факторы клеточной выживаемости, регуляторные факторы клеточной пролиферации, молекулы, ассоциированные с развитием или дифференциацией тканей (например, которые, как известно, или которые предположительно вносят свой функциональный вклад в указанный процесс), лимфокины, цитокины, молекулы, вовлеченные в регуляцию клеточного цикла, молекулы, вовлеченные в васкулогенез, и молекулы, ассоциированные с ангиогенезом (например, которые, как известно, или которые предположительно вносят свой функциональный вклад в указанный процесс). Опухолеассоциированный антиген может представлять собой фактор дифференциации кластера (т.е. белок CD). Антиген, к которым способно связываться сконструированное на основе цистеина антитело, может представлять собой представителя подкласса одной из вышеупомянутых категорий, причем другой(ие) подкласс(ы) указанной категории содержит(ат) другие молекулы/антигены, которые обладают отличающейся характеристикой (по отношению к представляющему интерес антигену).
Сконструированные на основе цистеина антитела получают для конъюгации с промежуточными соединениями линкер - лекарственное средство путем восстановления и повторного окисления внутрицепочечных дисульфидных групп.
Опухолеассоциированные антигены
Антитела, включая в себя без ограничения сконструированные на основе цистеина антитела, которые могут являться применимыми в конъюгатах антител с лекарственными средствами согласно настоящему изобретению в лечении злокачественной опухоли, включают в себя без ограничения антитела против рецепторов клеточной поверхности и опухолеассоциированных антигенов (ТАА). Определенные опухолеассоциированные антигены известны в настоящей области техники и могут быть получены для применения в создании антител с использованием способов и информации, которые хорошо известны в настоящей области техники. В попытках обнаружить эффективные клеточные мишени для диагностики злокачественных опухолей и их терапии исследователи стремились идентифицировать трансмембранные или иным образом опухолеассоциированные полипептиды, которые специфически экспрессируются на поверхности одном или нескольких конкретных типах злокачественной клетки по сравнению с одним или несколькими нормальными незлокачественными опухолевыми клетками. Зачастую такие опухолеассоциированные полипептиды в большем количестве экспрессируются на поверхности злокачественных опухолевых клеток по сравнению с поверхностью незлокачественных опухолевых клеток. Идентификация таких опухолеассоциированных антигенных полипептидов клеточной поверхности обусловила возможность более специфического нацеленного воздействия на злокачественные опухолевые клетки для их разрушения с помощью разновидностей антителотерапии.
Примеры опухолеассоциированных антигенов ТАА включают в себя без ограничения перечисленные ниже опухолеассоциированные антигены. Для удобства информация, относящаяся к указанным антигенам, все из которых известны в настоящей области техники, приведена ниже и включает в себя названия, альтернативные названия, регистрационные номера Genbank и первичную(ые) ссылку(и), в соответствии с конвенциями идентификации последовательностей нуклеиновых кислот и белковых последовательностей Национального центра биотехнологической информации (NCBI). Последовательности нуклеиновых кислот и белковые последовательности, соответствующие ТАА, представленным ниже, доступны в таких общедоступных базах данных, как GenBank. Опухолеассоциированные антигены, на которые нацеленно воздействуют антитела, включают в себя все варианты и изоформы аминокислотных последовательностей, обладающие по меньшей мере приблизительно 70%, 80%, 85%, 90% или 95% идентичностью последовательности по отношению к последовательностям, идентифицированным в процитированных ссылках, и/или которые проявляют по существу такие же биологические свойства или характеристики, что и ТАА, характеризующийся последовательностью, встречающейся в процитированных ссылках. Например, ТАА, характеризующийся вариантной последовательностью, как правило, способен специфически связываться с антителом, которое специфически связывается с ТАА с соответствующей приведенной последовательностью. Последовательности и раскрытие в ссылке, специально процитированной в настоящем документе, полностью включены посредством ссылки.
(1) BMPR1B (рецептор костного морфогенетического белка типа IB, регистрационный номер Genbank NM_001203)
ten Dijke, P., et al Science 264 (5155): 101-104 (1994), Oncogene 14 (11):1377-1382 (1997)); WO 2004063362 (пункт формулы изобретения 2); WO 2003042661 (пункт формулы изобретения 12); US 2003134790-А1 (стр. 38-39); WO 2002102235 (пункт формулы изобретения 13; стр. 296); WO 2003055443 (стр. 91-92); WO 200299122 (пример 2; стр. 528-530); WO 2003029421 (пункт формулы изобретения 6); WO 2003024392 (пункт формулы изобретения 2; фиг. 112); WO 200298358 (пункт формулы изобретения 1: стр. 183): WO 200254940 (стр. 100-101); WO 200259377(стр. 349-350); WO 200230268 (пункт формулы изобретения 27; стр. 376); WO 200148204 (пример; фиг. 4)
NP_001194 рецептор костного морфогенетического белка, тип IB /pid=NP_001194.1 -
Перекрестные ссылки: MIM:603248; NP_001194.1; AY065994
(2) E16 (LAT1, SLC7A5, регистрационный номер Genbank NM_003486)
Biochem. Biophys. Res. Commun. 255 (2), 283-288 (1999), Nature 395 (6699):288-291 (1998), Gaugitsch, H.W., et al (1992) J. Biol. Chem. 267 (16):11267-11273); WO 2004048938 (пример 2); WO 2004032842 (пример IV); WO 2003042661 (пункт формулы изобретения 12); WO 2003016475 (пункт формулы изобретения 1); WO 200278524 (пример 2); WO 200299074 (пункт формулы изобретения 19; стр. 127-129); WO 200286443 (пункт формулы изобретения 27; стр. 222, 393); WO 2003003906 (пункт формулы изобретения 10; стр. 293); WO 200264798 (пункт формулы изобретения 33; стр. 93-95); WO 200014228 (пункт формулы изобретения 5; стр. 133-136); US 2003224454 (фиг. 3); WO 2003025138 (пункт формулы изобретения 12; стр. 150);
NP_003477 семейство переносчиков растворенных веществ 7 (транспортер катионных аминокислот, система у+), представитель 5 /pid=NP_003477,3 - Homo sapiens
Перекрестные ссылки: MIM:600182; NP_003477,3; NM_015923; NM_003486_1
(3) STEAP1 (шестой трансмембранный эпителиальный антиген предстательной железы, регистрационный номер Genbank NM_012449)
Cancer Res. 61 (15), 5857-5860 (2001), Hubert, R.S., et al (1999) Proc. Natl. Acad. Sci. U.S.A. 96 (25): 14523-14528); WO 2004065577 (пункт формулы изобретения 6); WO 2004027049 (фиг. 1L); ЕР 1394274 (пример 11); WO 2004016225 (пункт формулы изобретения 2); WO 2003042661 (пункт формулы изобретения 12); US 2003157089 (пример 5); US 2003185830 (пример 5); US 2003064397 (фиг. 2); WO 200289747 (пример 5; стр. 618-619); WO 2003022995 (пример 9; фиг. 13А, пример 53; стр. 173, пример 2; фиг. 2А);
NP_036581 шестой трансмембранный эпителиальный антиген предстательной железы
Перекрестные ссылки: MIM:604415; NP_036581.1; NM_012449_1
(4) 0772Р (СА125, MUC16, регистрационный номер Genbank AF361486)
J. Biol. Chem. 276 (29):27371-27375 (2001)); WO 2004045553 (пункт формулы изобретения 14); WO 200292836 (пункт формулы изобретения 6; фиг. 12); WO 200283866 (пункт формулы изобретения 15; стр. 116-121); US 2003124140 (пример 16); перекрестные ссылки: GI:34501467; ААК74120.3; AF361486_1
(5) MPF (MPF, MSLN, SMR, мегакариоцитарный потенцирующий фактор, мезотелин, регистрационный номер Genbank NM_005823) Yamaguchi, N., et al Biol. Chem. 269 (2), 805-808 (1994), Proc. Natl. Acad. Sci. U.S.A. 96 (20): 11531-11536 (1999), Proc. Natl. Acad. Sci. U.S.A. 93 (1):136-140 (1996), J. Biol. Chem. 270 (37):21984-21990 (1995)); WO 2003101283 (пункт формулы изобретения 14); (WO 2002102235 (пункт формулы изобретения 13; стр. 287-288); WO 2002101075 (пункт формулы изобретения 4: стр. 308-309); WO 200271928 (стр. 320-321); WO 9410312 (стр. 52-57); перекрестные ссылки: MIM:601051; NP_005814.2; NM_005823_1
(6) NaPi2b (NAPI-3B, NPTIIb, SLC34A2, представитель 2 семейства 34 переносчиков растворенных веществ (фосфата натрия), натрий-зависимый переносчик фосфата 3b типа II, регистрационный номер Genbank NM_006424)
J. Biol. Chem. 277 (22):19665-19672 (2002), Genomics 62 (2):281-284 (1999), Feild, J.A., et al (1999) Biochem. Biophys. Res. Commun. 258 (3):578-582); WO 2004022778 (пункт формулы изобретения 2); EP 1394274 (пример 11); WO 2002102235 (пункт формулы изобретения 13; стр. 326); ЕР 875569 (пункт формулы изобретения 1; стр. 17-19); WO 200157188 (пункт формулы изобретения 20; стр. 329); WO 2004032842 (пример IV); WO 200175177 (пункт формулы изобретения 24; стр. 139-140);
Перекрестные ссылки: МГМ:604217; NP_006415.1; NM_006424_1
(7) Sema 5b (FLJ10372, KIAA1445, Mm,42015, SEMA5B, SEMAG, Семафорин 5b Hlog, sema домен, семь тромбоспондиновых повторов (тип 1 и подобные типу 1), трансмембранный домен (ТМ) и короткий цитоплазматический домен, (семафорин) 5В, регистрационный номер Genbank АВ040878)
Nagase Т., et al (2000) DNA Res. 7 (2): 143-150); WO 2004000997 (пункт формулы изобретения 1); WO 2003003984 (пункт формулы изобретения 1); WO 200206339 (пункт формулы изобретения 1; стр. 50); WO 200188133 (пункт формулы изобретения 1; стр. 41-43, 48-58); WO 2003054152 (пункт формулы изобретения 20); WO 2003101400 (пункт формулы изобретения 11);
Доступ: Q9P283; EMBL; АВ040878; ВАА95969.1. Genew; HGNC: 10737;
(8) PSCA hlg (2700050C12Rik, C530008O16Rik, RIKEN кДНК 2700050C12, ген RIKEN кДНК 2700050C12, регистрационный номер Genbank AY358628); Ross et al (2002) Cancer Res. 62:2546-2553; US 2003129192 (пункт формулы изобретения 2); US 2004044180 (пункт формулы изобретения 12); US 2004044179 (пункт формулы изобретения 11); US 2003096961 (пункт формулы изобретения 11); US 2003232056 (пример 5); WO 2003105758 (пункт формулы изобретения 12); US 2003206918 (пример 5); ЕР 1347046 (пункт формулы изобретения 1); WO 2003025148 (пункт формулы изобретения 20);
Перекрестные ссылки: GI:37182378; AAQ88991.1; AY358628_1
(9) ETBR (рецептор эндотелина типа В, регистрационный номер Genbank AY275463);
Nakamuta М., et al Biochem. Biophys. Res. Commun. 177, 34-39,1991; Ogawa Y., et al Biochem. Biophys. Res. Commun. 178,248-255,1991; Arai H., et al Jpn. Circ. J. 56,1303-1307, 1992; Arai H., et al J. Biol. Chem. 268, 3463-3470, 1993; Sakamoto A., Yanagisawa M., et al Biochem. Biophys. Res. Commun. 178, 656-663, 1991; Elshourbagy N.A., et al J. Biol. Chem. 268, 3873-3879, 1993; Haendler В., et al J. Cardiovasc. Pharmacol. 20, sl-S4, 1992; Tsutsumi M., et al Gene 228, 43-49, 1999; StraUS berg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; Bourgeois C, et al J. Clin. Endocrinol. Metab. 82, 3116-3123, 1997; Okamoto Y., et al Biol. Chem. 272, 21589-21596, 1997; Verheij J.B., et al Am. J. Med. Genet. 108, 223-225, 2002; Hofstra R.M.W., et al Eur. J. Hum. Genet. 5, 180-185, 1997; Puffenberger E.G., et al Cell 79, 1257-1266, 1994; Attie Т., et al, Hum. Mol. Genet. 4, 2407-2409, 1995; Auricchio A., et al Hum. Mol. Genet. 5:351-354, 1996; Amiel J., et al Hum. Mol. Genet. 5. 355-357. 1996; Hofstra R.M.W., et al Nat. Genet. 12, 445-447, 1996; Svensson P.J., et al Hum. Genet. 103, 145-148, 1998; Fuchs S., et al Mol. Med. 7, 115-124, 2001; Pingault V., et al (2002) Hum. Genet. 111, 198-206; WO 2004045516 (пункт формулы изобретения 1); WO 2004048938 (пример 2); WO 2004040000 (пункт формулы изобретения 151); WO 2003087768 (пункт формулы изобретения 1); WO 2003016475 (пункт формулы изобретения 1); WO 2003016475 (пункт формулы изобретения 1); WO 200261087 (фиг. 1); WO 2003016494 (фиг. 6); WO 2003025138 (пункт формулы изобретения 12; стр. 144); WO 200198351 (пункт формулы изобретения 1; стр. 124-125); ЕР 522868 (пункт формулы изобретения 8; фиг. 2); WO 200177172 (пункт формулы изобретения 1; стр. 297-299); US 2003109676; US 6518404 (фиг. 3); US 5773223 (пункт формулы изобретения 1a; Col 31-34); WO 2004001004;
(10) MSG783 (RNF124, гипотетический белок FLJ20315, регистрационный номер Genbank NM_017763);
WO 2003104275 (пункт формулы изобретения 1); WO 2004046342 (пример 2); WO 2003042661 (пункт формулы изобретения 12); WO 2003083074 (пункт формулы изобретения 14; стр. 61); WO 2003018621 (пункт формулы изобретения 1); WO 2003024392 (пункт формулы изобретения 2; фиг. 93); WO 200166689 (пример 6);
Перекрестные ссылки: LocUS ID:54894; NP_060233.2; NM_017763_1
(11) STEAP2 (HGNC_8639, IPCA-1, PCANAP1, STAMP1, STEAP2, STMP, ген, ассоциированный с раком предстательной железы, 1; белок, ассоциированный с раком предстательной железы, 1; шестой трансмембранный эпителиальный антиген предстательной железы 2; шестой трансмембранный белок предстательной железы; регистрационный номер Genbank AF455138)
Lab. Invest. 82 (11):1573-1582 (2002)); WO 2003087306; US 2003064397 (пункт формулы изобретения 1; фиг. 1); WO 200272596 (пункт формулы изобретения 13; стр. 54-55); WO 200172962 (пункт формулы изобретения 1; фиг. 4В); WO 2003104270 (пункт формулы изобретения 11); WO 2003104270 (пункт формулы изобретения 16); US 2004005598 (пункт формулы изобретения 22); WO 2003042661 (пункт формулы изобретения 12); US 2003060612 (пункт формулы изобретения 12; фиг. 10); WO 200226822 (пункт формулы изобретения 23; фиг. 2); WO 200216429 (пункт формулы изобретения 12; фиг. 10);
Перекрестные ссылки: GI:22655488; AAN04080,1; AF455138_1
(12) TrpM4 (BR22450, FLJ20041, TRPM4, TRPM4B, рецептор катионного канала с транзиторным потенциалом, подсемейство М, представитель 4, регистрационный номер Genbank NM_017636)
Xu. X.Z., et al Proc. Natl. Acad. Sci. U.S.A. 98 (19): 10692-10697 (2001), Cell 109 (3):397-407 (2002), J. Biol. Chem. 278 (33):30813-30820 (2003)); US 2003143557 (пункт формулы изобретения 4); WO 200040614 (пункт формулы изобретения 14; стр. 100-103); WO 200210382 (пункт формулы изобретения 1; фиг. 9А); WO 2003042661 (пункт формулы изобретения 12); WO 200230268 (пункт формулы изобретения 27; стр. 391); US 2003219806 (пункт формулы изобретения 4); WO 200162794 (пункт формулы изобретения 14; фиг. 1A-D);
Перекрестные ссылки: MIM:606936; NP_060106,2; NM_017636_1
(13) CRIPTO (CR, CR1, CRGF, CRIPTO, TDGF1, тератокарциномный фактор роста, регистрационный номер Genbank NP_003203 или NM_003212)
Ciccodicola, A., et al EMBO J. 8 (7): 1987-1991 (1989), Am. J. Hum. Genet. 49 (3):555-565 (1991)); US 2003224411 (пункт формулы изобретения 1); WO 2003083041 (пример 1); WO 2003034984 (пункт формулы изобретения 12); WO 200288170 (пункт формулы изобретения 2; стр. 52-53); WO 2003024392 (пункт формулы изобретения 2; фиг. 58); WO 200216413 (пункт формулы изобретения 1; стр. 94-95, 105); WO 200222808 (пункт формулы изобретения 2; фиг. 1); US 5854399 (пример 2; Col 17-18); US 5792616 (фиг. 2);
Перекрестные ссылки: MIM:187395; NP_003203.1; NM_003212_1
(14) CD21 (CR2 (рецептор комплемента 2) или C3DR (рецептор СЗоУвируса Эпштейна-Барр) или Hs.73792 регистрационный номер Genbank М26004)
Fujisaku et al (1989) J. Biol. Chem. 264 (4):2118-2125); Weis J.J., et al J. Exp. Med. 167. 1047-1066, 1988; Moore M., et al Proc. Natl. Acad. Sci. U.S.A. 84, 9194-9198, 1987; Barel M., et al Mol. Immunol. 35, 1025-1031, 1998; Weis J.J., et al Proc. Natl. Acad. Sci. U.S.A. 83, 5639-5643, 1986; Sinha S.K., et al (1993) J. Immunol. 150, 5311-5320; WO 2004045520 (пример 4); US 2004005538 (пример 1); WO 2003062401 (пункт формулы изобретения 9); WO 2004045520 (пример 4); WO 9102536 (фиг. 9,1-9,9); WO 2004020595 (пункт формулы изобретения 1);
Доступ: Р20023; Q13866; Q14212; EMBL; М26004; ААА35786.1.
(15) CD79b (CD79B, CD79β, IGb (ассоциированный с иммуноглобулином бета), В29, регистрационный номер Genbank NM_000626 или 11038674)
Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (7):4126-4131, Blood (2002) 100 (9):3068-3076, Muller et al (1992) Eur. J. Immunol. 22 (6):1621-1625); WO 2004016225 (пункт формулы изобретения 2, фиг. 140); WO 2003087768, US 2004101874 (пункт формулы изобретения 1, стр. 102); WO 2003062401 (пункт формулы изобретения 9); WO 200278524 (пример 2); US 2002150573 (пункт формулы изобретения 5, стр. 15); US 5644033; WO 2003048202 (пункт формулы изобретения 1, стр. 306 и 309); WO 99/558658. US 6534482 (пункт формулы изобретения 13, фиг. 17А/В); WO 200055351 (пункт формулы изобретения 11, стр. 1145-1146);
Перекрестные ссылки: MIM: 147245; NP_000617,1; NM_000626_1
(16) FcRH2 (IFGP4, IRTA4, SPAP1A (фосфатазный якорный белок, содержащий Sm-домен, 1a), SPAP1B, SPAP1C, регистрационный номер Genbank NM_030764, AY358130)
Genome Res. 13 (10):2265-2270 (2003), Immunogenetics 54 (2):87-95 (2002), Blood 99 (8):2662-2669 (2002), Proc. Natl. Acad. Sci. U.S.A. 98 (17):9772-9777 (2001), Xu, M.J., et al (2001) Biochem. Biophys. Res. Commun. 280 (3):768-775; WO 2004016225 (пункт формулы изобретения 2); WO 2003077836; WO 200138490 (пункт формулы изобретения 5; фиг. 18D-1-18D-2); WO 2003097803 (пункт формулы изобретения 12); WO 2003089624 (пункт формулы изобретения 25);
Перекрестные ссылки: MIM:606509; NP_110391.2; NM_030764_1
(17) HER2 (ErbB2, регистрационный номер Genbank Ml 1730)
CoUS sens L., et al Science (1985) 230(4730): 1132-1139); Yamamoto Т., et al Nature 319. 230-234, 1986; Semba K., et al Proc. Natl. Acad. Sci. U.S.A. 82, 6497-6501, 1985; Swiercz J.M., et al J. Cell Biol. 165, 869-880, 2004; Kuhns J.J., et al J. Biol. Chem. 274, 36422-36427, 1999; Cho H.-S., et al Nature 421, 756-760, 2003; Ehsani A., et al (1993) Genomics 15, 426-429; WO 2004048938 (пример 2); WO 2004027049 (фиг. II); WO 2004009622; WO 2003081210; WO 2003089904 (пункт формулы изобретения 9); WO 2003016475 (пункт формулы изобретения 1); US 2003118592; WO 2003008537 (пункт формулы изобретения 1); WO 2003055439 (пункт формулы изобретения 29; фиг. 1А-В); WO 2003025228 (пункт формулы изобретения 37; фиг. 5С); WO 200222636 (пример 13; стр. 95-107); WO 200212341 (пункт формулы изобретения 68; фиг. 7); WO 200213847 (стр. 71-74); WO 200214503 (стр. 114-117); WO 200153463 (пункт формулы изобретения 2; стр. 41-46); WO 200141787 (стр. 15); WO 200044899 (пункт формулы изобретения 52; фиг. 7); WO 200020579 (пункт формулы изобретения 3; фиг. 2); US 5869445 (пункт формулы изобретения 3; Col 31-38); WO 9630514 (пункт формулы изобретения 2; стр. 56-61); ЕР1439393 (пункт формулы изобретения 7); WO 2004043361 (пункт формулы изобретения 7); WO 2004022709; WO 200100244 (пример 3; фиг. 4);
Доступ: Р04626; EMBL; M11767; ААА35808.1. EMBL; Ml 1761; ААА35808.1.
(18) NCA (СЕАСАМ6, регистрационный номер Genbank M18728);
Barnett Т., et al Genomics 3, 59-66, 1988; Tawaragi Y., et al Biochem. Biophys. Res. Commun. 150, 89-96, 1988; StraUS berg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99:16899-16903, 2002; WO 2004063709; EP1439393 (пункт формулы изобретения 7); WO 2004044178 (пример 4); WO 2004031238; WO 2003042661 (пункт формулы изобретения 12); WO 200278524 (пример 2); WO 200286443 (пункт формулы изобретения 27; стр. 427); WO 200260317 (пункт формулы изобретения 2);
Доступ: Р40199; Q14920; EMBL; М29541; ААА59915.1. EMBL; М18728;
(19) MDP (DPEP1, регистрационный номер Genbank ВС017023)
Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899-16903 (2002)); WO 2003016475 (пункт формулы изобретения 1); WO 200264798 (пункт формулы изобретения 33; стр. 85-87); JP 05003790 (фиг. 6-8); WO 9946284 (фиг. 9);
Перекрестные ссылки: MIM:179780; ААН17023.1; BC017023_1
(20) IL20Rα (IL20Ra, ZCYTOR7, регистрационный номер Genbank AF184971); Clark H.F., et al Genome Res. 13, 2265-2270, 2003; Mungall A.J., et al Nature 425, 805-811, 2003; Blumberg H., et al Cell 104, 9-19, 2001; Dumoutier L., et al J. Immunol. 167, 3545-3549, 2001; Parrish-Novak J., et al J. Biol. Chem. 277, 47517-47523, 2002; Pletnev S., et al (2003) Biochemistry 42:12617-12624; Sheikh F., et al (2004) J. Immunol. 172, 2006-2010; EP 1394274 (пример 11); US 2004005320 (пример 5); WO 2003029262 (стр. 74-75); WO 2003002717 (пункт формулы изобретения 2; стр. 63); WO 200222153 (стр. 45-47); US 2002042366 (стр. 20-21); WO 200146261 (стр. 57-59); WO 200146232 (стр. 63-65); WO 9837193 (пункт формулы изобретения 1; стр. 55-59);
Доступ: Q9UHF4; Q6UWA9; Q96SH8; EMBL; AF184971; AAF01320.1.
(21) Бревикан (BCAN, ВЕНАВ, регистрационный номер Genbank AF229053)
Gary S.C., et al Gene 256, 139-147, 2000; Clark H.F., et al Genome Res. 13, 2265-2270. 2003; Strausberg R.L., et al Proc. Natl. Acad. Sci. U.S.A. 99, 16899-16903, 2002; US 2003186372 (пункт формулы изобретения 11); US 2003186373 (пункт формулы изобретения 11); US 2003119131 (пункт формулы изобретения 1; фиг. 52); US 2003119122 (пункт формулы изобретения 1; фиг. 52); US 2003119126 (пункт формулы изобретения 1); US 2003119121 (пункт формулы изобретения 1; фиг. 52); US 2003119129 (пункт формулы изобретения 1); US 2003119130 (пункт формулы изобретения 1); US 2003119128 (пункт формулы изобретения 1; фиг. 52); US 2003119125 (пункт формулы изобретения 1); WO 2003016475 (пункт формулы изобретения 1); WO 200202634 (пункт формулы изобретения 1);
(22) EphB2R (DRT, ERK, Hek5, ЕРНТ3, Tyro5, регистрационный номер Genbank NM_004442)
Chan, J. and Watt, V.M., Oncogene 6 (6), 1057-1061 (1991) Oncogene 10 (5):897-905 (1995), Annu. Rev. Neurosci. 21:309-345 (1998), Int. Rev. Cytol. 196:177-244 (2000)); WO 2003042661 (пункт формулы изобретения 12); WO 200053216 (пункт формулы изобретения 1; стр. 41); WO 2004065576 (пункт формулы изобретения 1); WO 2004020583 (пункт формулы изобретения 9); WO 2003004529 (стр. 128-132); WO 200053216 (пункт формулы изобретения 1; стр. 42);
Перекрестные ссылки: MIM:600997; NP_004433,2; NM_004442_1
(23) ASLG659 (B7h, регистрационный номер Genbank АХ092328)
US 20040101899 (пункт формулы изобретения 2); WO 2003104399 (пункт формулы изобретения И); WO 2004000221 (фиг. 3); US 2003165504 (пункт формулы изобретения 1); US 2003124140 (пример 2); US 2003065143 (фиг. 60); WO 2002102235 (пункт формулы изобретения 13; стр. 299); US 2003091580 (пример 2); WO 200210187 (пункт формулы изобретения 6; фиг. 10); WO 200194641 (пункт формулы изобретения 12; фиг. 7b); WO 200202624 (пункт формулы изобретения 13; фиг. 1А-1В); US 2002034749 (пункт формулы изобретения 54; стр. 45-46); WO 200206317 (пример 2; стр. 320-321, Claim 34; стр. 321-322); WO 200271928 (стр. 468-469); WO 200202587 (пример 1; фиг. 1); WO 200140269 (пример 3; стр. 190-192); WO 200036107 (пример 2; стр. 205-207); WO 2004053079 (пункт формулы изобретения 12); WO 2003004989 (пункт формулы изобретения 1); WO 200271928 (стр. 233-234, 452-453); WO 0116318;
(24) PSCA (предшественник антигена стволовых клеток предстательной железы, регистрационный номер Genbank AJ297436)
Reiter R.E., et al Proc. Natl. Acad. Sci. U.S.A. 95, 1735-1740, 1998; Gu Z., et al Oncogene 19, 1288-1296, 2000; Biochem. Biophys. Res. Commun. (2000) 275(3):783-788; WO 2004022709; EP1394274 (пример 11); US 2004018553 (пункт формулы изобретения 17); WO 2003008537 (пункт формулы изобретения 1); WO 200281646 (пункт формулы изобретения 1; стр. 164); WO 2003003906 (пункт формулы изобретения 10; стр. 288); WO 200140309 (пример 1; фиг. 17); US 2001055751 (пример 1; фиг. 1b); WO 200032752 (пункт формулы изобретения 18; фиг. 1); WO 9851805 (пункт формулы изобретения 17; стр. 97); WO 9851824 (пункт формулы изобретения 10; стр. 94); WO 9840403 (пункт формулы изобретения 2; фиг. 1 В);
Доступ: O43653; EMBL; AF043498; ААС39607.1.
(25) GEDA (регистрационный номер Genbank AY260763);
белок подобный партнеру по слиянию ААР14954 липомы HMGIC /pid=AAP 14954.1 - Homo sapiens
Вид: Homo sapiens (человек)
WO 2003054152 (пункт формулы изобретения 20); WO 2003000842 (пункт формулы изобретения 1); WO 2003023013 (пример 3, пункт формулы изобретения 20); US 2003194704 (пункт формулы изобретения 45);
Перекрестные ссылки: GI:30102449; ААР 14954.1; AY260763_1
(26) BAFF-R (рецептор фактора активации В-клеток, BLyS-рецептор 3, BR3, регистрационный номер Genbank AF116456); рецептор BAFF /pid=NP_443177.1 - Homo sapiens
Thompson, J.S., et al Science 293 (5537), 2108-2111 (2001); WO 2004058309; WO 2004011611; WO 2003045422 (пример; стр. 32-33); WO 2003014294 (пункт формулы изобретения 35; фиг. 6В); WO 2003035846 (пункт формулы изобретения 70; стр. 615-616): WO 200294852 (Col 136-137); WO 200238766 (пункт формулы изобретения 3; стр. 133); WO 200224909 (пример 3; фиг. 3);
Перекрестные ссылки: MIM:606269; NP_443177,1; NM_052945_1; AF132600
(27) CD22 (изоформа В-клеточного рецептора CD22-B, BL-CAM, Lyb-8, Lyb8, SIGLEC-2, FLJ22814, регистрационный номер Genbank АК026467);
Wilson et al (1991) J. Exp. Med. 173:137-146; WO 2003072036 (пункт формулы изобретения 1; фиг. 1);
Перекрестные ссылки: MIM:107266; NP_001762.1; NM_001771_1
(28) CD79a (CD79A, CD79a, ассоциированный с иммуноглобулином альфа специфичный для В-клеток белок, который ковалентно взаимодействует с иммуноглобулином бета (CD79B) и образует комплекс на поверхности с молекулами IgM, передает сигнал, участвующий в дифференцировке В-клеток), pI: 4,84, MW (молекулярная масса): 25028 ТМ: 2 [Р] Хромосома гена: 19q13.2, регистрационный номер Genbank NP_001774.10)
WO 2003088808, US 20030228319; WO 2003062401 (пункт формулы изобретения 9); US 2002150573 (пункт формулы изобретения 4, стр. 13-14); WO 9958658 (пункт формулы изобретения 13, фиг. 16); WO 9207574 (фиг. 1); US 5644033; На et al (1992) J. Immunol. 148(5):1526-1531; Mueller et al (1992) Eur. J. Biochem. 22:1621-1625; Hashimoto et al (1994) Immunogenetics 40(4):287-295; Preud'homme et al (1992) Clin. Exp. Immunol. 90(1):141-146; Yu et al (1992) J. Immunol. 148(2) 633-637; Sakaguchi et al (1988) EMBO J. 7(11):3457-3464;
(29) CXCR5 (рецептор 1 лимфомы Беркитта; рецептор, сопряженный с G белком, активируемый хемокином CXCL13, действует при миграции лимфоцитов и гуморальной защите, играет роль в инфекции DBX-2 и, возможно, в развитии СПИДа, лимфомы, миеломы и лейкоза); 372 аа, pI: 8,54 MW: 41959 ТМ: 7 [Р] Хромосома гена: 11q23.3, регистрационный номер Genbank NP_001707.1)
WO 2004040000; WO 2004015426; US 2003105292 (пример 2); US 6555339 (пример 2): WO 200261087 (фиг. 1); WO 200157188 (пункт формулы изобретения 20, стр. 269); WO 200172830 (стр. 12-13); WO 200022129 (пример 1, стр. 152-153, пример 2, стр. 254-256); WO 9928468 (пункт формулы изобретения 1, стр. 38); US 5440021 (пример 2, col 49-52); WO 9428931 (стр. 56-58); WO 9217497 (пункт формулы изобретения 7, фиг. 5); Dobner et al (1992) Eur. J. Immunol. 22:2795-2799; Barella et al (1995) Biochem. J. 309:773-779;
(30) HLA-DOB (бета-субъединица молекулы МНС класса II (антиген 1a), которая связывается с пептидами и представляет их (CD4+)T-лимфоцитам); 273 аа, pI: 6.56 MW: 30820 ТМ: 1 [Р] Хромосома гена: 6р21.3, регистрационный номер Genbank NP_002111,1)
Tonnelle et al (1985) EMBO J. 4(11):2839-2847; Jonsson et al (1989) Immunogenetics 29(6):411-413; Beck et al (1992) J. Mol. Biol. 228:433-441; StraUS berg et al (2002) Proc. Natl. Acad. Sci US A 99:16899-16903; ServeniUS et al (1987) J. Biol. Chem. 262:8759-8766; Beck et al (1996) J. Mol. Biol. 255:1-13; Naruse et al (2002) Tissue Antigenes 59:512-519; WO 9958658 (пункт формулы изобретения 13, фиг. 15); US 6153408 (Col 35-38); US 5976551 (col 168-170); US 6011146 (col 145-146); Kasahara et al (1989) Immunogenetics 30(1):66-68; Larhammar et al (1985) J. Biol. Chem. 260(26):14111-14119;
(31) P2X5 (пуринергический рецептор P2X лиганд-зависимый ионный канал 5, ионный канал, управляемый внеклеточным АТФ, может участвовать в синаптической передаче и нейрогенезе, недостаточность может вносить вклад в патофизиологическую картину идиопатической нестабильности детрузора); 422 аа), pI: 7,63, MW: 47206 ТМ: 1 [Р] Хромосома гена: 17р13.3, регистрационный номер Genbank NP 002552.2)
Le et al (1997) FEBS Lett. 418(1-2):195-199; WO 2004047749; WO 2003072035 (пункт формулы изобретения 10); Touchman et al (2000) Genome Res. 10:165-173; WO 200222660 (пункт формулы изобретения 20); WO 2003093444 (пункт формулы изобретения 1); WO 2003087768 (пункт формулы изобретения 1); WO 2003029277 (стр. 82);
(32) CD72 (антиген CD72, ассоциированный с дифференцировкой В-клеток, Lyb-2) ПОСЛЕДОВАТЕЛЬНОСТЬ БЕЛКА Полная maeaity…tafrfpd (1…359; 359 аа), pI: 8.66, MW: 40225 ТМ: 1 [Р] Хромосома гена: 9р13.3, регистрационный номер Genbank NP_001773.1)
WO 2004042346 (пункт формулы изобретения 65); WO 2003026493 (стр. 51-52, 57-58); WO 200075655 (стр. 105-106); Von Hoegen et al (1990) J. Immunol. 144(12):4870-4877; StraUS berg et al (2002) Proc. Natl. Acad. Sci USA 99:16899-16903;
(33) LY64 (лимфоцитарный антиген 64 (RP105), мембранный белок семейства белков, богатых лейциновыми повторами (LRR) типа I, регулирует активацию В-клеток и апоптоз, утрата функции связана с повышенной активностью заболевания у больных системной красной волчанкой); 661 аа, pI: 6,20, MW: 74147 ТМ: 1 [Р] Хромосома гена: 5q12, регистрационный номер Genbank NP_005573.1)
US 2002193567; WO 9707198 (пункт формулы изобретения 11, стр. 39-42); Miura et al (1996) Genomics 38(3):299-304; Miura et al (1998) Blood 92:2815-2822; WO 2003083047; WO 9744452 (пункт формулы изобретения 8, стр. 57-61); WO 200012130 (стр. 24-26);
(34) FcRH1 (белок 1, подобный Fc-рецептору, предполагаемый рецептор для Fc-домена иммуноглобулина, который содержит Ig-подобные и ITAM домены С2 типа, может играть роль в дифференцировке В-лимфоцитов); 429 аа, pI: 5,28, MW: 46925 ТМ: 1 [Р] Хромосома гена: 1q21-1q22, регистрационный номер Genbank NP_443170.1)
WO 2003077836; WO 200138490 (пункт формулы изобретения 6, фиг. 18Е-1-18-Е-2); Davis et al (2001) Proc. Natl. Acad. Sci US A 98(17):9772-9777; WO 2003089624 (пункт формулы изобретения 8); EP 1347046 (пункт формулы изобретения 1); WO 2003089624 (пункт формулы изобретения 7);
(35) IRTA2 (рецептор, ассоциированный с транслокацией, суперсемейства иммуноглобулинов 2, предполагаемый иммунорецептор, возможно, играющий роль в развитии В-клеток и лимфомагенезе; нарушение регуляции его гена в результате транслокации встречается при некоторых В-клеточных злокачественных новообразованиях); 977 аа, pI: 6,88 MW: 106468 ТМ: 1 [Р] Хромосома гена: 1q21, регистрационный номер Genbank
Человек: AF343662, AF343663, AF343664, AF343665, AF369794, AF397453, АК090423, АК090475, AL834187, AY358085;
Мышь: АК089756, AY158090, AY506558; NP_112571.1
WO 2003024392 (пункт формулы изобретения 2, фиг. 97); Nakayama et al (2000) Biochem. Biophys. Res. Commun. 277(1):124-127; WO 2003077836; WO 200138490 (пункт формулы изобретения 3, фиг. 18В-1-18В-2);
(36) TENB2 (TMEFF2, томорегулин, TPEF, НРР1, TR, предполагаемый трансмембранный протеогликан, родственный семейству факторов роста EGF/херегулин и фоллистатину); 374 аа, регистрационный номер NCBI: AAD55776, AAF91397, AAG49451, NCBI RefSeq: NP_057276; NCBI Gene: 23671; OMIM: 605734; SwissProt Q9UIK5; регистрационный номер Genbank AF179274; AY358907, CAF85723, CQ782436
WO 2004074320 (SEQ ID NO 810); JP 2004113151 (SEQ ID NOS 2, 4, 8); WO 2003042661 (SEQ ID NO 580); WO 2003009814 (SEQ ID NO 411); EP 1295944 (стр. 69-70); WO 200230268 (стр. 329); WO 200190304 (SEQ ID NO 2706); US 2004249130; US 2004022727; WO 2004063355; US 2004197325; US 2003232350; US 2004005563; US 2003124579; Horie et al (2000) Genomics 67:146-152; Uchida et al (1999) Biochem. Biophys. Res. Commun. 266:593-602; Liang et al (2000) Cancer Res. 60:4907-12; Glynne-Jones et al (2001) Int J Cancer. Oct 15;94(2): 178-84;
(37) PMEL17 (гомолог silver; SILV; D12S53E; PMEL17; (SI); (SIL); ME20; gp100) BC001414; BT007202; M32295; M77348; NM_006928; McGlinchey, R.P. et al (2009) Proc. Natl. Acad. Sci. U.S.A. 106 (33), 13731-13736; Kummer, M.P. et al (2009) J. Biol. Chem. 284 (4), 2296-2306;
(38) TMEFF1 (трансмембранный белок с EGF-подобным и двумя фолиистатин-подобными доменами 1; томорегулин-1; Н7365; C9orf2; C9ORF2; U19878; Х83961) NM_080655; NM_003692; Harms, P.W. (2003) Genes Dev. 17 (21), 2624-2629; Gery, S. et al (2003) Oncogene 22 (18):2723-2727;
(39) GDNF-Ral (рецептор альфа 1 семейства GDNF; GFRA1; GDNFR; GDNFRA; RETL1; TRNR1; RET1L; GDNFR-альфа1; GFR-ALPHA-1; U95847; BC014962; NM_ 145793) NM_005264; Kim, M.H. et al (2009) Mol. Cell. Biol. 29 (8), 2264-2277; Treanor, J.J. et al (1996) Nature 382 (6586):80-83;
(40) Ly6E (комплекс лимфоцитарного антигена 6, локус Е; Ly67,RIG-E,SCA-2,TSA-1) NP_002337.1; NM_002346.2; de Nooij-van Dalen, A.G. et al (2003) Int. J. Cancer 103 (6), 768-774; Zammit, D.J. et al (2002) Mol. Cell. Biol. 22 (3):946-952;
(41) TMEM46 (гомолог shisa 2 (Xenopus laevis); SHISA2) NP_001007539.1; NM_001007538.1; FurUS hima, K. et al (2007) Dev. Biol. 306 (2), 480-492; Clark, H.F. et al (2003) Genome Res. 13 (10):2265-2270;
(42) Ly6G6D (комплекс лимфоцитарного антигена 6, локус G6D; Ly6-D, MEGT1) NP_067079.2; NM_021246.2; Mallya, M. et al (2002) Genomics 80 (1):113-123; Ribas, G. et al (1999) J. Immunol. 163 (l):278-287;
(43) LGR5 (содержащий богатые лейцином повторы связанный с белком G рецептор 5; GPR49, GPR67) NP_003658,1; NM_003667.2; Salanti, G. et al (2009) Am. J. Epidemiol. 170 (5):537-545; Yamamoto, Y. et al (2003) Hepatology 37 (3):528-533;
(44) RET (протоонкоген ret; MEN2A; HSCR1; MEN2B; MTC1; (PTC); CDHF12; Hs.168114; RET51; RET-ELE1) NP_066124.1; NM_020975.4; Tsukamoto, H. et al (2009) Cancer Sci. 100 (10):1895-1901; Narita, N. et al (2009) Oncogene 28 (34):3058-3068;
(45) LY6K (комплекс лимфоцитарного антигена 6, локус К; LY6K; HSJ001348; FLJ35226) NP_059997.3; NM_017527.3; Ishikawa, N. et al (2007) Cancer Res. 67 (24):11601-11611; de Nooij-van Dalen, A.G. et al (2003) Int. J. Cancer 103 (6):768-774;
(46) GPR19 (связанный с белком G рецептор 19; Mm,4787) NP_006134.1; NM_006143.2; Montpetit, А. и Sinnett, D. (1999) Hum. Genet. 105 (1-2): 162-164; O'Dowd, B.F. et al (1996) FEBS Lett. 394 (3):325-329;
(47) GPR54 (рецептор KISS1; KISS1R; GPR54; HOT7T175; AXOR12) NP_115940.2; NM_032551.4; Navenot, J.M. et al (2009) Mol. Pharmacol. 75 (6): 1300-1306; Hata, K. et al (2009) Anticancer Res. 29 (2):617-623;
(48) ASPHD1 (содержащий домен аспартат-бета-гидроксилазы белок 1; LOC253982) NP_859069.2; NM_181718.3; Gerhard, D.S. et al (2004) Genome Res. 14 (10B):2121-2127;
(49) Тирозиназа (TYR; OCAIA; OCA1A; тирозиназа; SHEP3) NP_000363.1; NM_000372.4; Bishop, D.T. et al (2009) Nat. Genet. 41 (8):920-925; Nan, H. et al (2009) Int. J. Cancer 125 (4):909-917;
(50) TMEM118 (белок с "безымянным пальцем", трансмембранный белок 2; RNFT2; FLJ14627) NP_001103373.1; NM_001109903.1; Clark, H.F. et al (2003) Genome Res. 13 (10):2265-2270; Scherer, S.E. et al (2006) Nature 440 (7082):346-351
(51) GPR172A (связанный с белком G рецептор 172A; GPCR41; FLJ11856; D15Ertd747e) NP_078807.1; NM_024531.3; Ericsson, T.A. et al (2003) Proc. Natl. Acad. Sci. U.S.A. 100 (11):6759-6764; Takeda, S. et al (2002) FEBS Lett. 520 (1-3):97-101.
Согласно одному варианту осуществления антитело связывается с одним или несколькими из следующих полипептидов: BMPR1B; Е16; STEAP1; 0772Р; MPF; Napi3b: Sema 5b; PSCA hlg; ETBR; MSG783; STEAP2; TrpM4; CRIPTO; CD21; CD79b; FcRH2; HER2; NCA; MDP; IL20Rα; бревикан; EphB2R; ASLG659; PSCA; GEDA; BAFF-R; CD22; CD79a; CXCR5; HLA-DOB; P2X5; CD72; LY64; FcRH1; IRTA2; TENB2; PMEL17; TMEFF1; GDNF-Ra1; Ly6E; TMEM46; Ly6G6D; LGR5; RET; LY6K; GPR19; GPR54; ASPHD1; тирозиназа; TMEM118; GPR172A и CD33.
Согласно одному варианту осуществления антитело связывается с BMPR1B;
Согласно одному варианту осуществления антитело связывается с Е16;
Согласно одному варианту осуществления антитело связывается с STEAP1;
Согласно одному варианту осуществления антитело связывается с 0772Р;
Согласно одному варианту осуществления антитело связывается с MPF;
Согласно одному варианту осуществления антитело связывается с NaPi2b;
Согласно одному варианту осуществления антитело связывается с Sema 5b;
Согласно одному варианту осуществления антитело связывается с PSCA hlg;
Согласно одному варианту осуществления антитело связывается с ETBR;
Согласно одному варианту осуществления антитело связывается с MSG783;
Согласно одному варианту осуществления антитело связывается с STEAP2;
Согласно одному варианту осуществления антитело связывается с ТгрМ4;
Согласно одному варианту осуществления антитело связывается с CRIPTO;
Согласно одному варианту осуществления антитело связывается с CD21;
Согласно одному варианту осуществления антитело связывается с CD79b;
Согласно одному варианту осуществления антитело связывается с FcRH2;
Согласно одному варианту осуществления антитело связывается с HER2;
Согласно одному варианту осуществления антитело связывается с NCA;
Согласно одному варианту осуществления антитело связывается с MDP;
Согласно одному варианту осуществления антитело связывается с IL20Rα;
Согласно одному варианту осуществления антитело связывается с бревиканом;
Согласно одному варианту осуществления антитело связывается с EphB2R;
Согласно одному варианту осуществления антитело связывается с ASLG659;
Согласно одному варианту осуществления антитело связывается с PSCA;
Согласно одному варианту осуществления антитело связывается с GEDA;
Согласно одному варианту осуществления антитело связывается с BAFF-R;
Согласно одному варианту осуществления антитело связывается с CD22;
Согласно одному варианту осуществления антитело связывается с CD79a;
Согласно одному варианту осуществления антитело связывается с CXCR5;
Согласно одному варианту осуществления антитело связывается с HLA-DOB;
Согласно одному варианту осуществления антитело связывается с Р2Х5;
Согласно одному варианту осуществления антитело связывается с CD72;
Согласно одному варианту осуществления антитело связывается с LY64;
Согласно одному варианту осуществления антитело связывается с FcRH1;
Согласно одному варианту осуществления антитело связывается с IRTA2;
Согласно одному варианту осуществления антитело связывается с TENB2;
Согласно одному варианту осуществления антитело связывается с PMEL17;
Согласно одному варианту осуществления антитело связывается с TMEFF1;
Согласно одному варианту осуществления антитело связывается с GDNF-Ra1;
Согласно одному варианту осуществления антитело связывается с Ly6E;
Согласно одному варианту осуществления антитело связывается с ТМЕМ46;
Согласно одному варианту осуществления антитело связывается с Ly6G6D;
Согласно одному варианту осуществления антитело связывается с LGR5;
Согласно одному варианту осуществления антитело связывается с RET;
Согласно одному варианту осуществления антитело связывается с LY6K;
Согласно одному варианту осуществления антитело связывается с GPR19;
Согласно одному варианту осуществления антитело связывается с GPR54;
Согласно одному варианту осуществления антитело связывается с ASPHD1;
Согласно одному варианту осуществления антитело связывается с тирозиназой;
Согласно одному варианту осуществления антитело связывается с ТМЕМ118;
Согласно одному варианту осуществления антитело связывается с GPR172A;
Согласно одному варианту осуществления антитело связывается с CD33.
Исходное антитело также может представлять собой слитый белок, содержащий последовательность связывающего альбумин пептида (АВР) (Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol Chem. 277:35035-35043; WO 01/45746). Антитела согласно настоящему изобретению включают в себя слитые белки с АВР последовательностями, упомянутые в: (i) Dennis et al (2002) J Biol Chem. 277:35035-35043 в таблицах III и IV, стр. 35038; (ii) US 20040001827 в абзаце [0076]; и (iii) WO 01/45746 на страницах 12-13, и все из которых включены в настоящий документ посредством ссылки.
Антитела можно получить с использованием рекомбинантных способов и композиций, например, описанных в патенте США №4816567 и известных в настоящей области техники. Согласно некоторым вариантам осуществления антитело получают в эукариотической клетке - хозяине (например, относящейся к млекопитающему клетке - хозяине). Согласно некоторым вариантам осуществления антитело получают в прокариотической клетке - хозяине (например, Е. coli).
Согласно определенным вариантам осуществления одна или несколько аминокислотных модификаций могут быть введены в Fc-область антитела, предусмотренного в настоящем документе, тем самым создавая вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-область IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
Согласно определенным вариантам осуществления в настоящем изобретении предусмотрен вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, которые делают его желательным кандидатом для применений, в которых период полужизни антитела in vivo является важным, тогда как определенные эффекторные функции (такие как комплемент-зависимая цитотоксичность и ADCC) не являются необходимыми или являются вредными. In vitro и/или in vivo анализы цитотоксичности можно провести для подтверждения снижения/истощения активностей CDC и/или ADCC. Например, анализы связывания с Fc-рецептором (FcR) можно провести для подтверждения того, что антитело не характеризуется связыванием с FcγR (следовательно, вероятно, не характеризуется активностью ADCC), но сохраняет способность связывания с FcRn.
Загрузка ADC лекарственным средством
Загрузка лекарственным средством представляет собой среднее число лекарственных фрагментов на антитело. Загрузка лекарственным средством может находиться в диапазоне от 1 до 8 лекарственных средств (D) на антитело (АЬ), т.е. при этом 1, 2, 3, 4, 5, 6, 7 и 8 лекарственных фрагментов ковалентно прикреплены к антителу. Композиции ADC включают в себя наборы антител, конъюгированных с диапазоном лекарственных средств, от 1 до 8. Среднее число лекарственных средств на антитело в препаратах ADC из реакций конъюгации можно охарактеризовать с помощью таких общепринятых способов, как масс-спектроскопия, анализ ELISA, электрофорез и ВЭЖХ. Также можно определить количественное распределение ADC в значениях р. С помощью ELISA можно определить среднее значение р в конкретном препарате ADC (Hamblett et al (2004) Clin. Cancer Res. 10:7063-7070; Sanderson et al (2005) Clin. Cancer Res. 11:843-852). Тем не менее, распределение значения р (лекарственного средства) не различимо с помощью связывания антителом антигена и ограничения обнаружения ELISA. Кроме того, анализ ELISA для обнаружения конъюгатов антител с лекарственными средствами не определяет места, где лекарственные фрагменты прикреплены к антителу, такие как фрагменты тяжелой цепи или легкой цепи, или конкретные аминокислотные остатки. В некоторых случаях разделение, очистка, и определение характеристик гомогенного ADC, в котором р представляет собой определенное значение от ADC с другими загрузками лекарственным средством, могут быть достигнуты с помощью таких способов, как обращенно-фазовая ВЭЖХ или электрофорез.
Для некоторых конъюгатов антител с лекарственными средствами р может быть ограничено числом сайтов прикрепления на антителе. Например, антитело может содержать только одну или несколько цистеиновых тиольных групп или может содержать только одну или несколько достаточно реакционно способных тиольных групп, посредством которых может быть прикреплен линкер. Повышенная загрузка лекарственным средством, например, р >5, может вызывать агрегацию, отсутствие растворимости, токсичность или потерю клеточной проницаемости для определенных конъюгатов антител с лекарственными средствами.
Как правило, во время реакции конъюгации с антителом конъюгируется меньше, чем теоретический максимум лекарственных фрагментов. Антитело может содержать, например, много остатков лизина, которые не реагируют с промежуточным соединением линкер - лекарственное средство (X-L-D) или линкерным реагентом. Только наиболее реакционно способные лизиновые группы могут реагировать с линкерным реагентом, реагирующим с амином. Также, только наиболее реакционно способные цистеиновые тиольные группы могут реагировать с реагирующим с тиолом линкерным реагентом или промежуточным соединением линкер - лекарственное средство. Как правило, антитела не содержат много, если вообще содержат, свободных реакционно способных цистеиновых тиольных групп, которые могут быть соединены с лекарственным фрагментом. Большинство цистеиновых тиольных остатков в антителах соединений существуют в виде дисульфидных мостиков и должны быть восстановлены с помощью восстановителя, такого как дитиотреитол (DTT) или ТСЕР, при частичных или полных восстановительных условиях. Загрузка (соотношение лекарственное средство/антитело, "DAR") ADC можно контролировать несколькими различными способами, включающими в себя следующее: (i) ограничение молярного избытка промежуточного соединение линкер - лекарственное средство или линкерного реагента по отношению к антителу, (ii) ограничение времени или температуры реакции конъюгации и (iii) частичные или ограничивающие восстановительные условия для модификации тиола цистеина.
Если больше одной нуклеофильной или электрофильной группы антитела реагируют с промежуточным соединением линкер - лекарственное средство или линкерным реагентом, за которым следует реагент - димерный лекарственный фрагмент, то полученный продукт представляет собой смесь конъюгатов антитела с лекарственным средством с распределением лекарственных фрагментов, прикрепленных к антителу, например 1, 2, 3 и т.д. Такие способы жидкостной хроматографии, как полимерная обратно-фазовая (PLRP) и хроматография на основе гидрофобного взаимодействия (HIC), могут разделять соединения в смеси по значению загрузки лекарственным средством. Можно выделить препараты ADC с отдельным значением загрузки лекарственным средством (р), тем не менее, указанные ADC с отдельным значением загрузки все еще могут представлять собой гетерогенные смеси, поскольку лекарственные фрагменты могут быть прикреплены, посредством линкера, на различных сайтах на антителе. Таким образом, композиции конъюгатов антитела с лекарственным средством согласно настоящему изобретению включают в себя смеси соединений - конъюгатов антитела с лекарственным средством, в которых антитело содержит один или несколько лекарственных фрагментов и где лекарственные фрагменты могут быть прикреплены к антителу на различных аминокислотных остатках.
Иллюстративные лекарственные фрагменты
Согласно некоторым вариантам осуществления предусмотрен ADC, содержащий антрациклин. Антрациклины представляют собой антибиотики, которые проявляют цитотоксическую активность. Не будучи связанными с какой-либо конкретной теорией, исследования показали, что антрациклины могут действовать так, что убивают клетки с помощью ряда различных механизмов, включая в себя следующее: 1) интеркаляция молекул лекарственного средства в ДНК клетки, тем самым ингибируя ДНК-зависимый синтез нуклеиновых кислот; 2) продукция лекарственным средством свободных радикалов, который затем реагируют с клеточными макромолекулами, чтобы вызвать повреждение клеток, и/или 3) взаимодействия молекул лекарственного средства с клеточной мембраной (см., например, С.Peterson et al., "Transport And Storage Of Anthracycline In Experimental Systems And Human Leukemia" в Anthracycline Antibiotics In Cancer Therapy; N.R. Bachur, "Free Radical Damage" id. на стр. 97-102). Благодаря их цитотоксическому потенциалу антрациклины использовали в лечение многочисленных злокачественных опухолей, таких как лейкоз, карцинома молочной железы, карцинома легких, аденокарцинома и саркомы яичника (см., например, Р.Н- Wiernik, в Anthracycline: Current StatUS And New Developments стр. 11).
Неограничивающие иллюстративные антрациклинов включают в себя доксорубицин, эпирубицин, идарубицин, дауномицин, неморубицин и их производные. Были получены и изучены иммуноконъюгаты и пролекарственные средства даунорубицина и доксорубицина (Kratz et al (2006) Current Med. Chem. 13:477-523; Jeffrey et al (2006) Bioorganic & Med. Chem. Letters 16:358-362; Torgov et al (2005) Bioconj. Chem. 16:717-721; Nagy et al (2000) Proc. Natl. Acad. Sci. US A 97:829-834; Dubowchik et al (2002) Bioorg. & Med. Chem. Letters 12:1529-1532; King et al (2002) J. Med. Chem. 45:4336-4343; EP 0328147; US 6630579)). Конъюгат антитела с лекарственным средством BR96-доксорубицин специфически реагирует с опухолеассоциированным антигеном Lewis-Y, и он был исследован в испытаниях I и II фазы (Saleh et al (2000) J. Clin. Oncology 18:2282-2292; Ajani et al (2000) Cancer Jour. 6:78-81; Tolcheretal (1999)У. Clin. Oncology 17:478-484).
PNU-159682 представляет собой высокоактивный метаболит (или производное) неморубицина (Quintieri, et al. (2005) Clinical Cancer Research 11 (4): 1608-1617). Неморубицин представляет собой полусинтетический аналог доксорубицина с группой 2-метоксиморфолино на гликозидной аминогруппе доксорубицина, и он находится в клиническом испытании (Grandi et al (1990) Cancer Treat. Rev. 17:133; Ripamonti et al (1992) Brit. J. Cancer 65:703;), включая в себя испытания II/III фазы в отношении гепатоклеточной карциномы (Sun et al (2003) Proceedings of the American Society for Clinical Oncology 22, Absl448; Quintieri (2003) Proceedings of the American Association of Cancer Research, 44:1st Ed, Abs 4649; Pacciarini et al (2006) Jour. Clin. Oncology 24:14116).
Неограничивающий иллюстративный ADC, содержащий неморубицин или производные неморубицина, показан в формуле Ia:
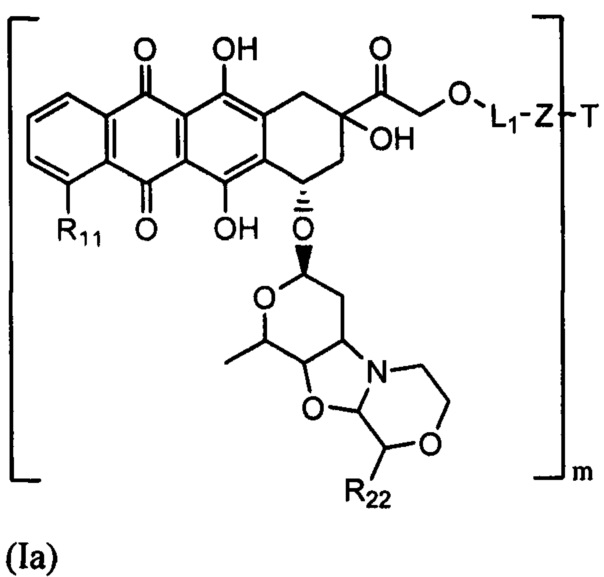
где R11 представляет собой атом водорода, гидрокси- или метокси-группу, и R22 представляет собой С1-С5 алкокси-группу, или их фармацевтически приемлемую соль;
L1 и Z вместе представляют собой линкер (L) согласно приведенному в настоящем документе описанию;
Т представляет собой антитело (Ab) согласно приведенному в настоящем документе описанию; и
m представляет собой 1 - приблизительно 20.
Согласно некоторым вариантам осуществления m представляет собой 1-10, 1-7, 1-5 или 1-4.
Согласно некоторым вариантам осуществления R11 и R22 оба представляют собой метокси (-ОМе).
Дополнительный неограничивающий иллюстративный ADC, содержащий неморубицин или производное неморубицина, показан в формуле Ib:
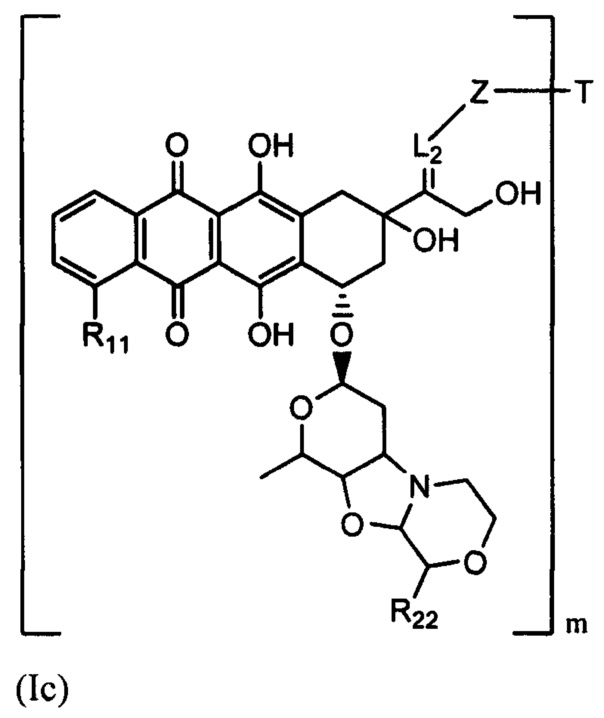
где R11 представляет собой атом водорода, гидрокси- или метокси-группу, и R22 представляет собой С1-С5 алкокси-группу, или их фармацевтически приемлемую соль;
L2 и Z вместе представляют собой линкер (L) согласно приведенному в настоящем документе описанию;
Т представляет собой антитело (Ab) согласно приведенному в настоящем документе описанию; и
m представляет собой 1 - приблизительно 20. Согласно некоторым вариантам осуществления m представляет собой 1-10, 1-7, 1-5 или 1-4.
Согласно некоторым вариантам осуществления R11 и R22 оба представляют собой метокси (-ОМе).
Согласно некоторым вариантам осуществления компонент неморубицин содержащег о неморубицин ADC представляет собой PNU-159682.
Согласно некоторым таким вариантам осуществления лекарственная часть ADC может характеризоваться следующими структурами:
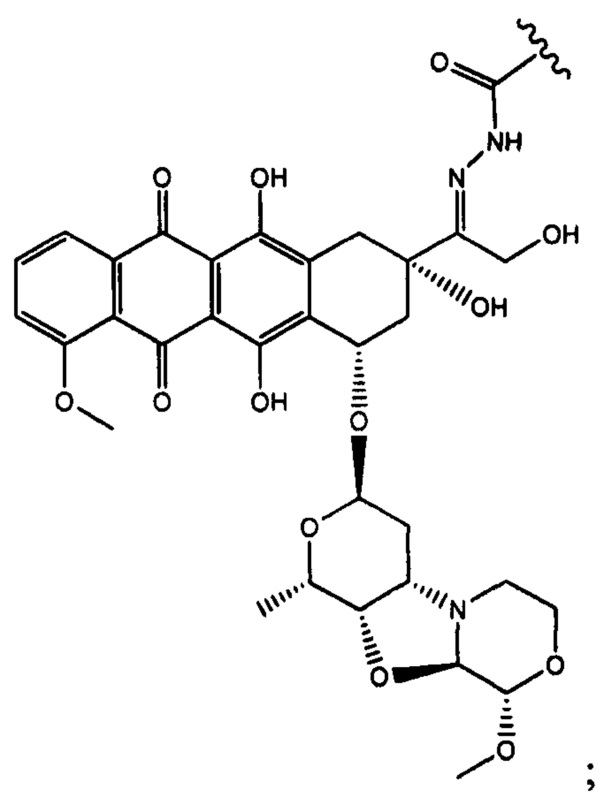 или
или
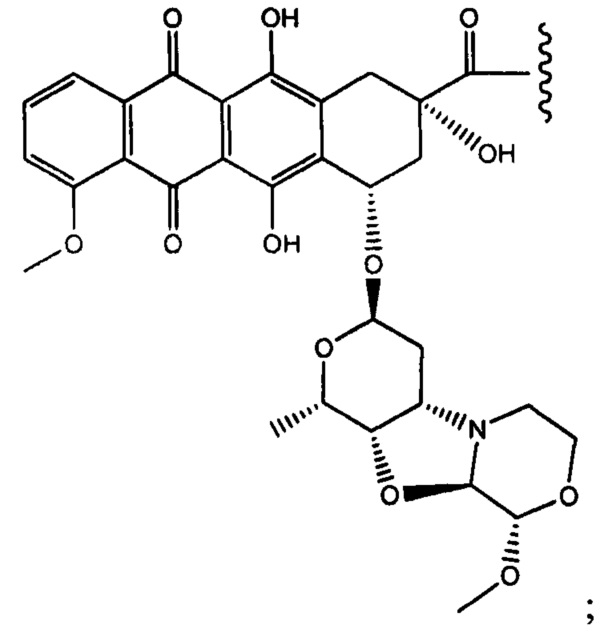
где волнистая линия указывает на прикрепление к линкеру (L).
Антрациклины, включая в себя PNU-159682, могут быть конъюгированы с антителами посредством нескольких сайтов соединения и разнообразных линкеров (US 2011/0076287; WO 2009/099741; US 2010/0034837; WO 2010/009124), включая в себя описанные в настоящем документе линкеры.
Иллюстративные ADC, содержащие неморубицин и линкер, включают в себя без ограничения следующее:

PNU-159682-малеимидацеталь-Ab;
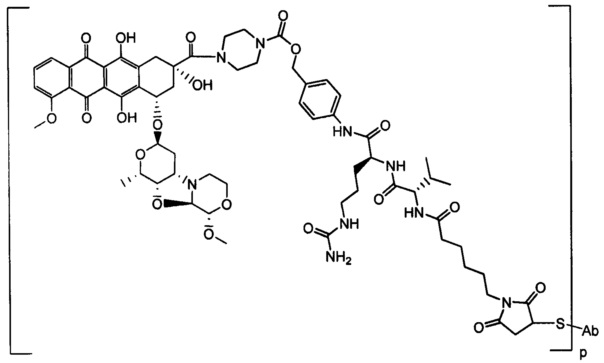
PNU-159682-val-cit-PAB-Ab;

PNU-159682-val-cit-PAB-спейсер-Ab;
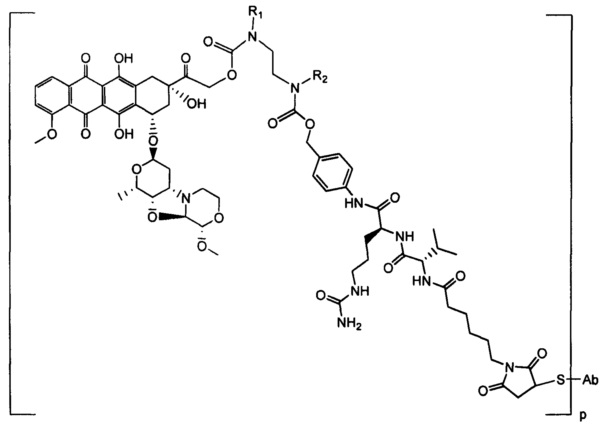
PNU-159682-val-cit-PAB-cneftcep(R1R2)-Ab, где:
R1 и R2 независимо выбраны из Н и C1-С6 алкила; и
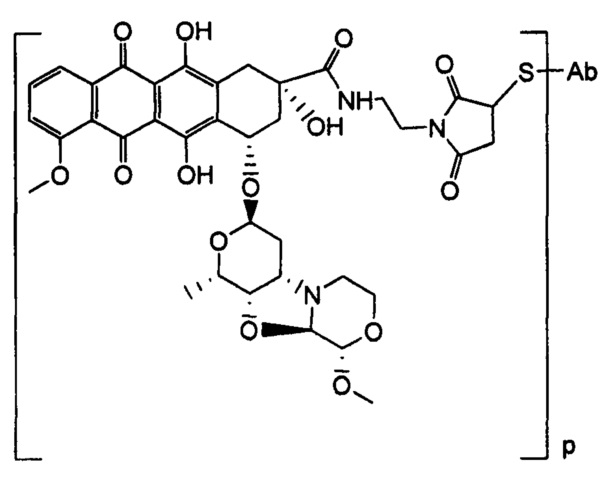
PNU-159682-малеимид-Ab.
Линкер PNU-159682 малеимидацеталь-Ab является кислотолабильным, тогда как линкеры PNU-159682-val-cit-PAB-Ab, PNU-159682-val-cit-PAB-cneficep-Ab и PNU-159682-val-cit-PAB-спейсер(R1R2)-Ab являются расщепляемыми протеазой.
Иллюстративные ADC, содержащие производное антрациклина и пептидомиметический линкер, включают в себя без ограничения следующее:
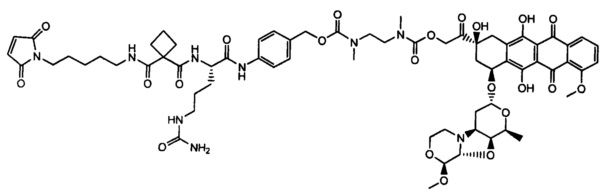
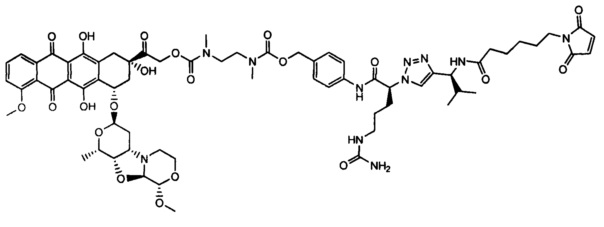
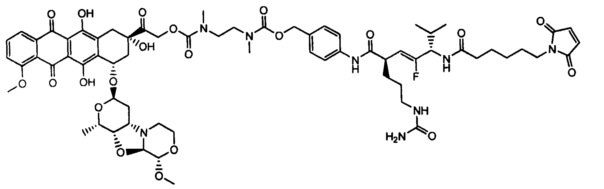
Показания к применению и способы лечения
Предусмотрено, что конъюгаты антител с лекарственными средствами (ADC) согласно настоящему изобретению можно использовать для лечения различных заболеваний или нарушений, например, характеризующихся избыточной экспрессией опухолевого антигена. Иллюстративные состояния или гиперпролиферативные нарушения включают в себя доброкачественные или злокачественные солидные опухоли и гематологические нарушения, такие как лейкоз и лимфоидные злокачественные опухоли. Другие нарушения включают в себя нейрональные, глиальные, астроцитарные, гипоталамические, железистые, макрофагальные, эпителиальные, стромальные, бластоцельные, воспалительные, ангиогенные и иммунологические, включая в себя аутоиммунные, нарушения.
Согласно определенным вариантам осуществления ADC согласно настоящему изобретению, содержащий антитело к NaPi2b согласно приведенному в настоящем документе описанию, используют в способе лечения солидной опухоли, например, яичника.
Согласно другому варианту осуществления ADC согласно настоящему изобретению, содержащий антитело к CD33 согласно приведенному в настоящем документе описанию, используют в способе лечения гематологических злокачественных опухолей, такие как следующие: неходжкинская лимфома (NHL), диффузная крупноклеточная гематопоэтическая лимфома, фолликулярная лимфома, мантийноклеточная лимфома, хронический лимфоцитарный лейкоз, множественная миелома. острый миелоидный лейкоз (AML) и миелоидный лейкоз (MCL), и включая в себя В-клеточные злокачественные опухоли и пролиферативные нарушения. Смотрите: US 8226945; Li et al (2013) Mol. Cancer. Ther. 12(7): 1255-1265; Poison et al (2010) Leukemia 24:1566-1573; Poison et al (2011) Expert Opin. Investig. Drugs 20(1):75-85, содержания которых включены посредством ссылки.
Согласно другому варианту осуществления ADC согласно настоящему изобретению, содержащий антитело к MUC16 согласно приведенному в настоящем документе описанию, используют в способе лечения злокачественных опухолей яичника, молочной железы и поджелудочной железы. Злокачественная опухоль может быть ассоциирована с экспрессией или активностью полипептида MUC16/CA125/0772P. Смотрите: WO 2007/001851; US 7989595; US 8449883; US 7723485; Chen et al (2007) Cancer Res. 67(10): 4924-4932; Junutula, et al., (2008) Nature Biotech., 26(8):925-932, содержания которых включены посредством ссылки.
Согласно определенным вариантам осуществления ADC согласно настоящему изобретению, содержащий антитело к HER2 согласно приведенному в настоящем документе описанию, используют в способе лечения злокачественной опухоли, например, злокачественной опухоли молочной железы или желудка, более конкретно HER2+ злокачественной опухоли молочной железы или желудка, причем способ включает введение такого ADC нуждающемуся в таком лечении пациенту. Согласно одному такому варианту осуществления ADC содержит антитело к HER2 трастузумаб или пертузумаб.
Как правило, подлежащее лечению заболевание или нарушение представляет собой гиперпролиферативное заболевание, такое как злокачественная опухоль. Примеры подлежащей лечению злокачественной опухоли в настоящем документе включают в себя без ограничения карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные опухоли. Более конкретные примеры таких злокачественных опухолей включают в себя следующее: плоскоклеточная злокачественная опухоль (например, эпителиальная плоскоклеточная злокачественная опухоль), рак легких, включая в себя мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких, злокачественная опухоль брюшной полости, гепаклеточный рак, рак желудка, включая в себя рак ЖКТ, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карцинома эндометрия или матки, карцинома слюнной железы, рак почки или почечный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени, карцинома анального канала, карцинома полового члена, а также рак головы и шеи.
Аутоиммунные заболевания, в лечении которых можно использовать конъюгаты антитела с лекарственным средством, включают в себя следующее: ревматологические нарушения (такие как, например, ревматоидный артрит, синдром Шегрена, склеродермия, волчанка, такая как системная красная волчанка (SLE) и волчаночный нефрит, полимиозит/дерматомиозит, криоглобулинемия, синдром антифосфолпидных антител и псориатический артрит), остеоартрит, аутоиммунные нарушения ЖКТ и печени (такие как, например, воспалительные заболевания кишечника (например, неспецифический язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозная анемия, аутоиммунный гепатит, первичный билиарный цирроз, первичный склерозирующий холангит и глютеновая энтеропатия), васкулит (такой как, например, ANCA-ассоциированный васкулит, включая в себя васкулит Чарга-Стросс, грануломатоз Вегенера и полиартериит), аутоиммунные неврологические нарушения (такие как, например, рассеянный склероз, опсо-миокланальный синдром, тяжелая миастения, нейромиелит зрительного нерва, болезнь Паркинсона, болезнь Альцегеймера и аутоиммунные полиневропатии), почечные нарушения (такие как, например, гломерулонефрит, синдром Гудпасчера и болезнь Бергера), аутоиммунные дерматологические нарушения (такие как, например, псориаз, крапивница, ангионевротический отек, обыкновенная пузырчатка, буллезный пемфигоид и кожная красная волчанка), гематологические нарушения (такие как, например, громбоцитопеническая пурпура, тромботическая тромбоцитопеническая пурпура, посттрансфузионная пурпура и аутоиммунная гемолитическая анемия), атеросклероз, увеит, аутоиммунные заболевания слуха (такие как, например, заболевание внутреннего уха и потеря слуха), болезнь Бехчета, синдром Рейно, трансплантация органа и аутоиммунные эндокринные нарушения (такие как, например, родственные сахарному диабету аутоиммунные заболевания, такие как инсулин-зависимый сахарный диабет (IDDM), аддисонова болезнь и аутоиммунное заболевание щитовидной железы (например, диффузный токсический зоб и тиреоидит)). Более предпочтиетльные такие заболевания включают в себя, например, ревматоидный артрит, неспецифический язвенный колит, ANCA-ассоциированный васкулит, волчанка, рассеянный склероз, синдром Шегрена, диффузный токсический зоб, IDDM, пернициозная анемия, тиреоидит и гломерулонефрит.
Для профилактики или лечения заболевания соответствующая дозировка ADC будет зависеть от типа подлежащего лечению заболевания, согласно приведенному выше определению, тяжести и течения заболевания, от того, вводят ли молекулу для профилактических или терапевтических целей, предыдущей терапии, истории болезни пациента и его ответа на антитело и решения лечащего врача. Молекула соответствующим образом вводят пациенту однократно или в течении серии введений. В зависимости от типа и тяжести заболевания приблизительно 1 мг/кг - 15 мг/кг (например, 0,1-20 мг/кг) молекулы представляет собой начальную кандидатную дозировку для введения пациенту, например, либо путем одного введения или нескольких отдельных введений, либо путем непрерывной инфузии. Типичная дневная дозировка может находиться в диапазоне от приблизительно 1 мг/кг до 100 мг/кг или больше, в зависимости от упомянутых выше факторов. Иллюстративная дозировка ADC, подлежащая введению пациенту, находится в диапазоне, составляющем приблизительно 0,1 - приблизительно 10 мг/кг массы пациента.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
Схема 1. Синтез общего промежуточного соединения PNU-INT1
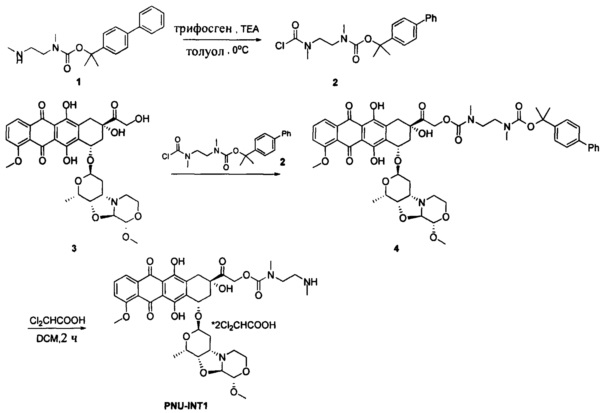
Стадия 1:
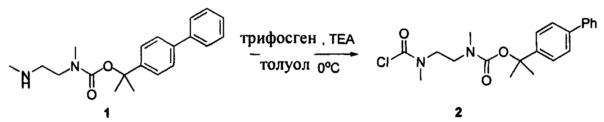
После того, как трифосген (218,2 мг, 0,735 ммоль) в толуоле (6 мл) охлаждали до 0°С, по каплям добавляли раствор соединения 1 (600 мг, 1,84 ммоль) и триэтиламина (372 мг, 3.68 ммоль) в толуоле (4 мл). После того, как реакционную смесь нагревали до комнатной температуры в течение 1 ч, раствор фильтровали и растворитель удаляли при пониженном давлении. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле (EtOAc/Hex 3:7) с получением требуемого продукта 2 в виде белого твердого вещества (600 мг, 83,9%) МС (масс-спектрометрия) (ЭРИ (электрораспылительная ионизация)): 405,59 [M+NH4]+.
Стадия 2:

К раствору соединения 3 (150 мг, 0,234 ммоль) в безводном DCM (2,5 мл) добавляли молекулярные сита (порошок-4  , 100 мг), 4-диметиламинопиридин (142,8 мг, 1,17 ммоль) и раствор соединения 2 (272,75 мг, 0,701 ммоль) в безводном DCM (0,5 мл). Раствор перемешивали в темноте при 25°С в течение 5 дней. Сырой продукт очищали с помощью ТСХ (тонкослойная хроматография, или TLC) (МеОН:CH2Cl2 = 1:40) с получением продукта 4 (140 мг, 60,2%).
, 100 мг), 4-диметиламинопиридин (142,8 мг, 1,17 ммоль) и раствор соединения 2 (272,75 мг, 0,701 ммоль) в безводном DCM (0,5 мл). Раствор перемешивали в темноте при 25°С в течение 5 дней. Сырой продукт очищали с помощью ТСХ (тонкослойная хроматография, или TLC) (МеОН:CH2Cl2 = 1:40) с получением продукта 4 (140 мг, 60,2%).
ЖХ/МС (жидкостная хромато-масс-спектрометрия, LCMS): (5-95, АВ, 1,5 мин), 0,983 мин, МС (масс-спектрометрия) = 994,4 [М+Н]+;
Стадия 3:
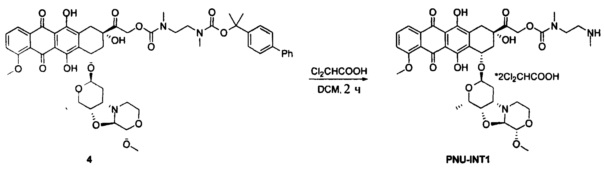
К раствору соединения 4 (80,0 мг, 0,080 ммоль) в DCM (1 мл) в ледяной бане добавляли раствор дихлоруксусной кислоты (1,61 ммоль) в DCM (0,4 мл). Раствор перемешивали при комнатной температуре в течение 2 ч. Добавляли смесь диэтилового)фира и гексана. Сырое красное твердое вещество использовали в следующей стадии без дополнительной очистки (52 мг, 85%).
Синтез INT5
(S)-4-(2-(1-(5-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)пентилкарбамоил)циклобутанкарбоксамидо)-5-уреидопентанамидо)бензил 4-нитрофенилкарбонат
Схема 1
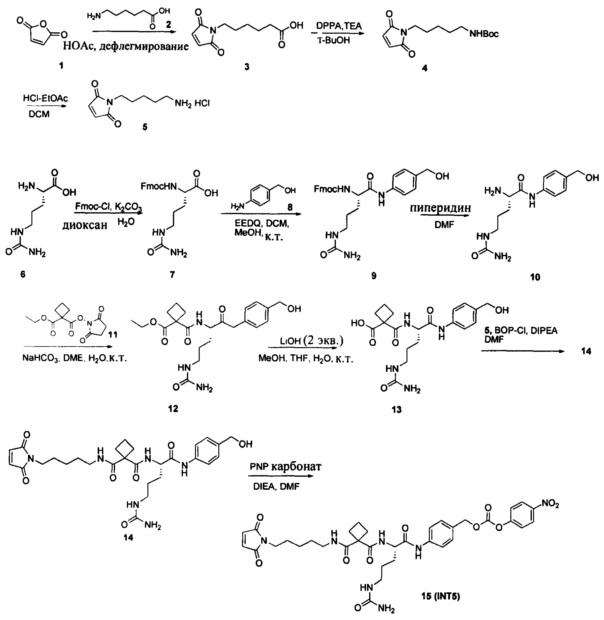
Процедура
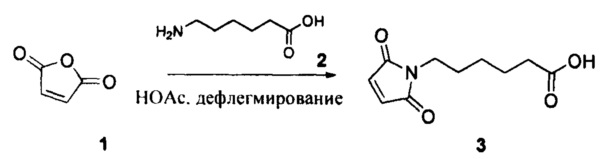
Соединение 1 (150 г, 1,53 моль) добавляли к перемешанному раствору соединения 2 (201 г, 1,53 моль) в НОАс (1000 мл). После того, как смесь перемешивали при комнатной температуре в течение 2 ч, ее нагревали с обратным холодильником в течение 8 ч. Органические растворители удаляли при пониженном давлении и остаток экстрагировали с помощью EtOAc (500 мл × 3), отмывали с помощью Н2О. Комбинированные органические слои высушивали на Na2SO4 и концентрировали с получением сырого продукта. Его отмывали с помощью петролейного эфира с получением соединения 3 в виде белого твердого вещества (250 г, 77,4%).
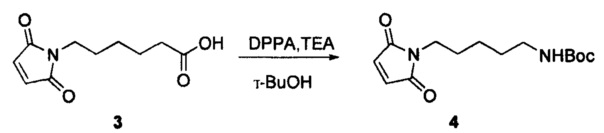
DPPA (130 г, 473 ммоль) и TEA (47,9 г, 473 ммоль) добавляли к раствору соединения 3 (100 г, 473 ммоль) в трет-BuOH (200 мл). Смесь нагревали с обратным холодильником в течение 8 ч в атмосфере N2. Смесь концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле (РЕ:EtOAc = 3:1) с получением соединения 4 (13 г, 10%).
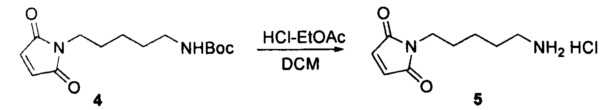
К раствору соединения 4 (28 г, 992 ммоль) в безводном EtOAc (30 мл) добавляли HCl/EtOAc (50 мл) по каплям. После того, как смесь перемешивали при комнатной температуре в течение 5 ч, ее фильтровали и твердое вещество высушивали с получением соединения 5 (16 г, 73,7%). 1Н ЯМР (400 МГц, DMSO-d6): δ 8,02 (s, 2Н), 6,99 (s, 2Н), 3,37-3,34 (m, 2Н), 2,71-2,64 (m, 2Н), 1,56-1,43 (m, 4Н), 1,23-1,20 (m, 2Н).
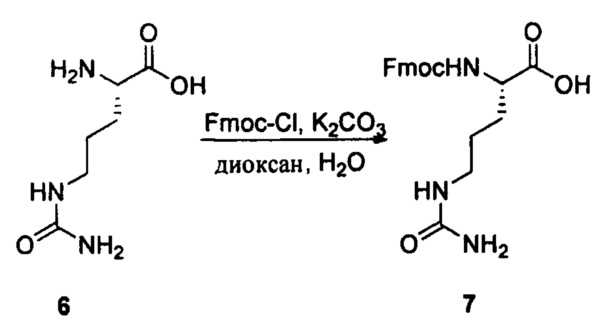
К смеси соединения 6 (17,50 г, 0,10 моль) в смеси диоксана и Н2О (50 мл / 75 мл) добавляли К2СО3 (34,55 г, 0,25 моль). Fmoc-Cl (30,96 г, 0,12 моль) медленно добавляли при 0°С. Реакционную смесь нагревали до комнатной температуры в течение 2 ч. Органический растворитель удаляли при пониженном давлении и водную суспензию доводили до рН=3 с помощью 6 М раствора HCl и экстрагировали с помощью EtOAc (100 мл × 3). Органический слой высушивали на Na2S04, фильтровали и концентрировали при пониженном давлении с получением требуемого продукта 7 (38,0 г, 95,6%).

К раствору соединения 7 (4,0 г, 10 ммоль) в смеси DCM и МеОН (100 мл / 50 мл) добавляли 4-амино-фенил-метанол (8) (1,6 г, 13 ммоль, 1,3 экв.) и EEDQ (3,2 г, 13 ммоль, 1,3 экв.). После того, как смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере N2, ее концентрировали с получением коричневого твердого вещества. МТВЕ (200 мл) добавляли и полученное перемешивали при 15°С в течение 2 ч. Твердое вещество собирали путем фильтрации, отмывали с помощью МТВЕ (50 мл × 2) с получением сырого продукта 9 в виде оранжевого твердого вещества (4,2 г, 84%).
ЖХ/МС (ЭРИ): m/z (отношение массы к заряду) 503,0 [М+1].
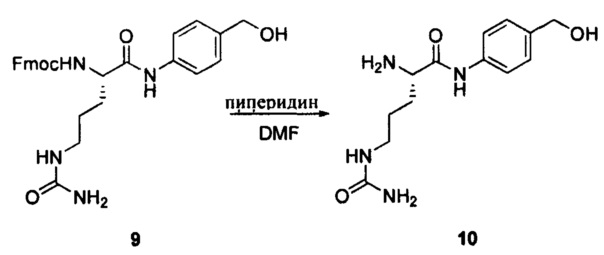
К перемешанному раствору соединения 9 (4,2 г, 8,3 ммоль) в сухом DMF (20 мл) добавляли пиперидин (1,65 мл, 17 ммоль, 2,0 экв.) по каплям при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 30 мин и образовывался твердый осадок. Добавляли сухой DCM (50 мл) и смесь сразу становилась прозрачной. Смесь перемешивали при комнатной температуре в течение следующих 30 мин, и ЖХ/МС показывала, что соединение 9 было израсходовано. Полученное концентрировали до сухого состояния при пониженном давлении (убедиться, что не осталось пиперидина), и остаток разделяли между EtOAc и Н2О (50 мл / 20 мл). Водную фазу отмывали с помощью EtOAc (50 мл × 2) и концентрировали с получением 10 в виде маслянистого остатка (2,2 г, 94%) (содержал небольшое количество DMF).
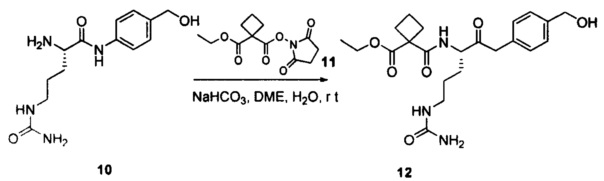
К раствору соединения 11 (8,0 г, 29,7 ммоль) в DME (50 мл) добавляли раствор соединения 10 (6,0 г, 21,4 ммоль) и NaHCO3 (7,48 г, 89,0 ммоль) в воде (30 мл). После того, как смесь перемешивали при комнатной температуре в течение 16 ч, ее концентрировали до сухого состояния при пониженном давлении и остаток очищали с помощью колоночной хроматографии (DCM:MeOH = 10:1) с получением сырого соединения 12 в виде белого твердого вещества (6,4 г, 68,7%).
ЖХ/МС (ЭРИ): m/z 435,0 [М+1].
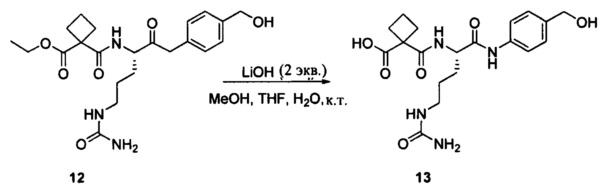
К перемешанному раствору соединения 12 (6,4 г, 14,7 ммоль) в смеси THF и МеОН (20 мл/10 мл) добавляли раствор LiOH.H2O (1,2 г, 28,6 ммоль) в Н2О (20 мл) при комнатной температуре. После того, как реакционную смесь перемешивали при комнатной температуре в течение 16 ч, растворитель удаляли при пониженном давлении, полученный остаток очищали с помощью препаративной ВЭЖХ с получением соединения 13 (3,5 г, выход: 58,5%).
ЖХ/МС (ЭРИ): m/z 406,9 [М+1].
1Н ЯМР (400 МГц, метанол-d4) δ 8,86 (d, J=8,4 Гц, 2 Н), 8,51 (d, J=8,4 Гц, 2Н), 5,88-5,85 (m, 1Н), 5,78 (s, 2Н), 4,54-4,49 (m, 3Н), 4,38-4,32 (m, 1Н), 3,86-3,75 (m, 1Н), 3,84-3,80 (m, 2Н), 3,28-3,21 (m, 1Н), 3,30-3,24 (m, 1Н), 3,00-2,80 (m, 1Н), 2,37-2,28 (m, 2Н).
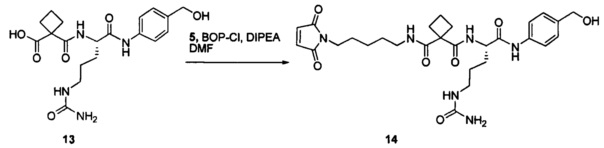
DIPEA (1,59 г, 12,3 ммоль) и ВОР-С1 (692 мг, 2,71 ммоль) добавляли к раствору соединения 13 (1,0 г, 2,46 ммоль) в DMF (10 мл) при 0°С, с последующим добавлением соединения 5 (592 мг, 2,71 ммоль). Смесь перемешивали при 0°С в течение 0,5 ч. Реакционную смесь гасили с помощью раствора лимонной кислоты (10 мл), экстрагировали с помощью DCM/MeOH (10:1). Органический слой высушивали и концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле (DCM:MeOH = 10:1) с получением соединения 14 (1,0 г, 71%).
1Н ЯМР (400 МГц, DMSO-d6): δ 10,00 (s, 1Н), 7,82-7,77 (m, 2Н), 7,53 (d, J=8,4 Гц, 2Н), 7,19 (d, J=8,4 Гц, 2Н), 6,96 (s, 2Н), 5,95 (t, J=6,4 Гц, 1H), 5,39 (s, 2Н), 5,08 (t, J=5,6 Гц, 1Н), 4,40-4,35 (m, 3Н), 4,09 (d, J=4,8 Гц, 1Н), 3,01 (d, J=3,2 Гц, 2Н), 3,05-2,72 (m, 4Н), 2,68-2,58 (m, 3Н), 2,40-2,36 (m, 4Н), 1,72-1,70 (m, 3Н), 1,44-1,42 (m, 1Н), 1,40-1,23 (m, 6Н), 1,21-1,16 (m, 4Н).
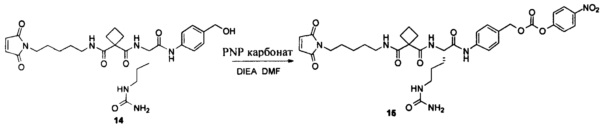
К раствору соединения 14 (500 мг, 0,035 ммоль) в сухом DMF (20 мл) добавляли соединение PNP (533 мг, 1,75 ммоль) и DIPEA (340 мг, 2,63 ммоль) при 20°С и смесь оставляли перемешиваться при 16°С в течение 2 ч в атмосфере N2. Смесь концентрировали и очищали с помощью препаративной ТСХ (DCM/MeOH = 10/1) с получением продукта INT5 (250 мг, 39%) ЖХ/МС (ЭРИ, 5-95АВ, 1,5 мин): 0,842 мин, m/z 736,4 [М+1].
Синтез INT6
4-((2R,5S,Z)-5-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамидо)-4-фтор-6-метил-2-(3-уреидопропил)гепт-3-енамидо)бензил 4-нитрофенил карбонат
Схема 2
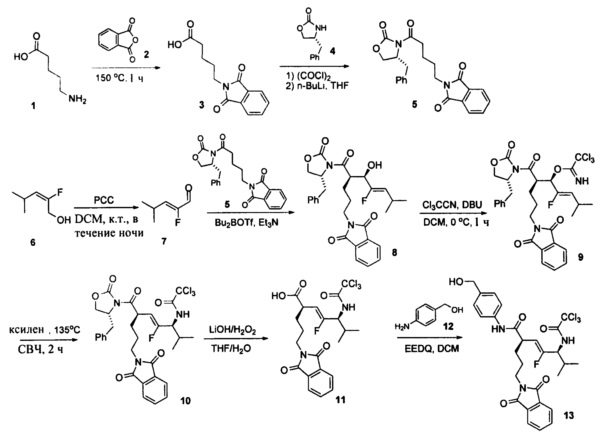
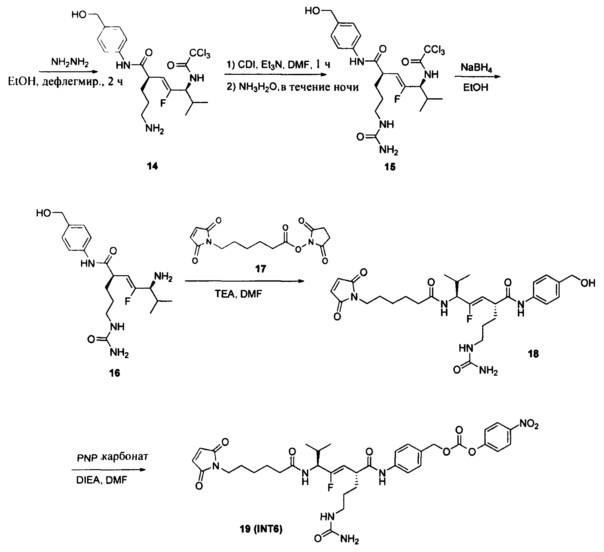
Экспериментальные данные

Смесь соединения 1 (10,0 г, 85,36 ммоль), соединения 2 (13,3 г, 89,79 ммоль) перемешивали при 150°С в течение 1 ч. Смесь охлаждали до 25°С и твердое вещество растворяли в горячей воде. Смесь дополнительно охлаждали в ледяной бане. Осадок собирали путем фильтрации и отмывали водой. Фильтрационный осадок высушивали с получением соединения 3 в виде белого твердого вещества (19,0 г, 90,0%).
1Н ЯМР (400 МГц, DMSO-d6) δ 11,96 (br, 1H), 7,78-7,77 (m, 4Н), 3,52 (t, J=6,8 Гц, 2Н), 2,18 (t, J=7,2 Гц, 2Н), 1,59-1,51 (m, 2Н), 1,47-1,41 (m, 2Н).
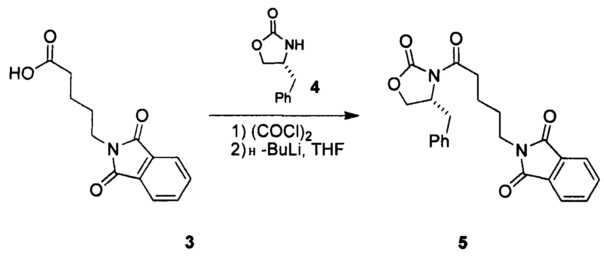
К смеси соединения 3 (9,0 г, 36,40 ммоль) в безводном DCM (100 мл) добавляли (COCl)2 (15,0 мл, 157,76 ммоль), DMF (1 мл) по каплям при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Смесь концентрировали при пониженном давлении и остаток разбавляли в безводном THF (60 мл) и снова концентрировали с получением ацилхлорида в виде желтого твердого вещества. К смеси соединения 4 (6,6 г, 37,25 ммоль) в безводном THF (60 мл) добавляли н-BuLi (15,0 мл, 2,5 М, 37,5 ммоль) по каплям при -78°С в атмосфере N2. Полученный выше ацилхлорид в THF (40 мл) добавляли медленно в смесь при -78°С. Реакционную смесь перемешивали при -78°С в течение 15 мин, затем гасили с помощью водного раствора NH4Cl (30 мл). Смесь экстрагировали с помощью EtOAc, отмывали водой. Комбинированные органические слои высушивали на Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (РЕ/EtOAc 3:1) с получением сырого соединения 5 в виде белого твердого вещества (13,0 г, 87,9%).
1Н ЯМР (400 МГц, DMSO-d6) δ 7,89-7,83 (m, 4Н), 7,32-7,28 (m, 2Н), 7,25-7,22 (m, 1Н), 7,19-7,17 (m, 2Н), 4,66-4,60 (m, 1Н), 4,30 (t, J=8,4 Гц, 1Н), 4,17 (dd, J=9,2, 2,8 Гц, 1Н), 3,61 (t, J=6,4 Гц, 2Н), 3,00-2,78 (m, 4Н), 1,70-1,60 (m, 4Н).
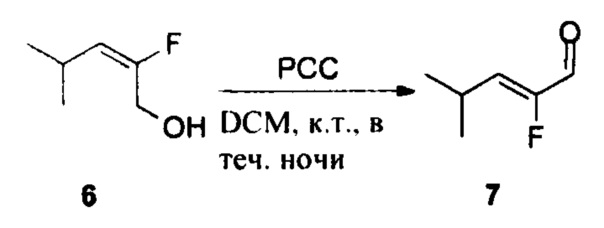
К раствору соединения 6 (3,0 г, 25,39 ммоль) в DCM (100 мл) добавляли РСС (10,9 г, 50,78 ммоль). Смесь перемешивали при 25°С в течение 16 ч в атмосфере N2. Смесь фильтровали через силикагелевую пробку. Фильтрат концентрировали при пониженном давлении при температуре бани, составляющей 25°С с получением соединения 7 в виде масла (1,8 г, 61,0%).
1Н ЯМР (400 МГц, CDCl3) δ 9,18 (d, J=18,4 Hz, 1Н), 5,79 (dd, J=32,8, 9,2 Гц, 1H), 3,02-2,93 (m, 1Н), 1,13 (d, J=6,8 Гц, 6H).
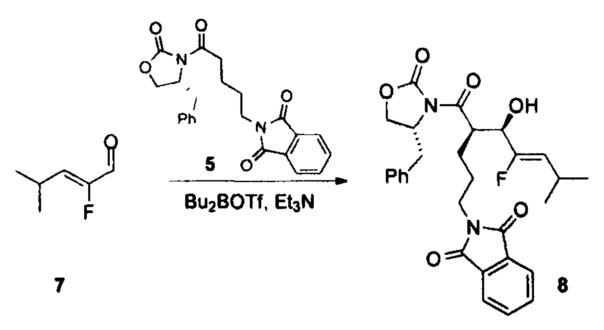
Раствор соединения 5 (6,0 г, 14,7 ммоль) в DCM (20 мл) охлаждали до 0°С с помощью ледяной бани. Bu2BOTf в DCM (1,0 М, 15 мл, 15 ммоль) добавляли по каплям с последующим добавлением Et3N (3,03 г, 30 ммоль) с такой скоростью, чтобы поддержать внутреннюю температуру ниже 3°С.Ледяную баню заменяли баней со смесью сухого льда и ацетона. Когда внутренняя температура падала ниже -65°С, соединение 7 (1,5 г, 12,9 ммоль) в DCM (10 мл) добавляли по каплям. Раствор перемешивали в течение 20 мин в бане со смесью сухого льда и ацетона, затем в течение 1 ч в ледяной бане. Реакционную смесь гасили с помощью водного фосфатного буфера (рН=7,0, 20 мл) и МеОН (10 мл). К полученному мутному раствору добавляли смесь МеОН/30% Н2О2 (2:1, 20 мл) с такой скоростью, чтобы поддержать внутреннюю температуру ниже 10°С.После того, как раствор перемешивали в течение дополнительного 1 ч, летучее соединение удаляли на ротационном испарителе при температуре бани, составляющей 25-30°С. Суспензию экстрагировали с помощью EtOAc (50 мл × 3). Комбинированный органический слой отмывали с помощью насыщенного раствора Na2SO3 (15 мл), 5% раствора NaHCO3 (30 мл) и солевого раствора (25 мл). Полученное высушивали на Na2S04, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (РЕ/EtOAc 3:1) с получением сырого соединения 8 в виде масла (4,0 г, 59,7%).
ЖХ/МС (ЭРИ): m/z 505,0 [М-17].

К раствору соединения 8 (4,0 г, 7,65 ммоль) и Cl3CCN (1,67 г, 11,48 ммоль) в DCM (20 мл) добавляли DBU (234 мг, 1,53 ммоль) при 0°С в атмосфере N2. Смесь перемешивали при 0°С в течение 1 ч. После того, как растворитель удаляли, остаток очищали с помощью колоночной хроматографии на силикагеле (5%-20% петролейный эфир в EtOAc) с получением соединения 9 (3,0 г, 58,8%).
ЖХ/МС (ЭРИ): m/z 505,1 [М-160].
1H ЯМР (400 МГц. CDCl3) δ 8,47 (s, 1H), 7,83-7,80 (m, 2Н), 7,72-7,69 (m, 2Н), 7,36-7,28 (m, 2Н), 7,28-7,22 (m, 3Н), 5,69-5,63 (q, 1Н), 4,89 (dd, J=37,6, 9,6 Гц, 1Н), 4,63-4,58 (m, 2Н), 4,20-4,11 (m, 2Н), 3,74-3,69 (m, 2Н), 3,35 (dd, J=13,2, 3,2 Гц, 1Н), 2,78-2,69 (m, 2Н), 1,99-1,85 (m, 2Н), 1,80-1,76 (m, 2Н), 0,96-0,92 (q, 6Н).
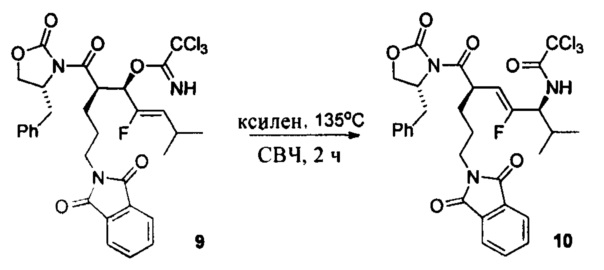
Раствор соединения 9 (3,0 г, 4,50 ммоль) в ксилене (5 мл) нагревали с помощью микроволнового излучения в течение 2 ч при 135°С. Смесь охлаждали до 25°С и очищали с помощью колоночной хроматографии на силикагеле (5%-10%-50% петролейного эфира в0 EtOAc) с получением соединения 10 (1,4 г, 46,7%).
ЖХ/МС (ЭРИ): m/z 685,0 [М+H2O].
1Н ЯМР (400 МГц, CDCl3) δ 7,83-7,81 (m, 2Н), 7,71-7,69 (m, 2Н), 7,36-7,32 (m, 2Н), 7,29-7,25 (m, 1Н), 7,21-7,19(m, 2H), 6,90 (d, J=8,8 Гц, 1H), 5,11 (dd, J=36,4, 9,6 Гц, 1H), 4,81-4,76 (m, 1H), 4,68-4,64 (m, 1H), 4,30-4,16 (m, 3H), 3,75-3,68 (m, 2H), 3,27 (dd, J=13,2, 3,2 Гц, 1H), 2,80-2,74 (q, 1H), 2,08-2,05 (m, 1H), 1,93-1,90 (m, 1H), 1,76-1,70 (m, 2H), 1,65-1,62 (m, 1H), 1,00 (dd, J=6,8, 3,2 Гц, 6H).
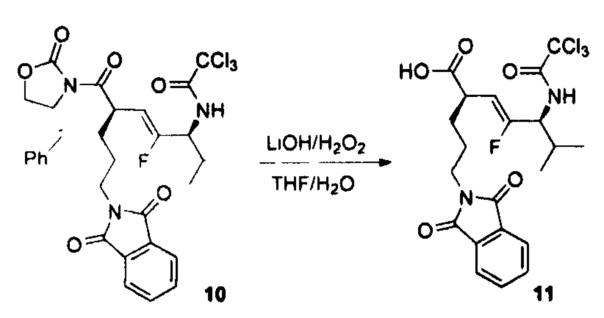
К раствору соединения 10 (1,4 г, 2,1 ммоль) в THF/Н2О (объем/объем 4:1, 10 мл) добавляли Н2О2 (1,43 г, 30% в воде, 12,6 ммоль) с последующим добавлением LiOH H2O (264,6 мг, 6,3 ммоль). После того, как раствор перемешивали в течение 1,5 ч при 25°С, добавляли насыщенный раствор Na2SO3 (8 мл). После удаления растворителя остаток экстрагировали с помощью DCM (20 мл × 2). Водный раствор подкисляли до рН=1,0 с помощью 1М HCl и экстрагировали с помощью EtOAc/МеОН (10/1, 25 мл × 3). Комбинированный органический слой высушивали на Na2SO4, фильтровали и концентрировали с получением соединения 11 (1,0 г, 93,4%).
ЖХ/МС (ЭРИ): m/z 527,0 [M+Na+].
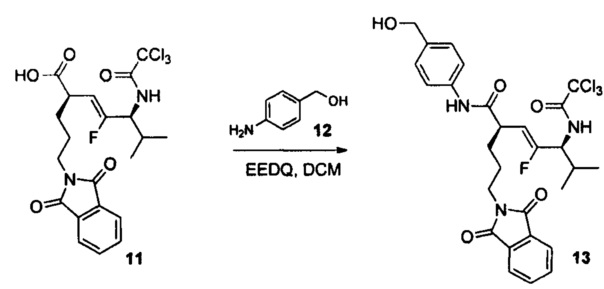
К раствору соединения 11 (1,0 г, 1,97 ммоль) и (4-аминофенил)метанола (364 мг, 2.96 ммоль) в DCM/MeOH (объем/объем 2:1, 7,5 мл) добавляли EEDQ (732 мг, 2,96 ммоль) при 0°С в атмосфере N2. Смесь перемешивали при 25°С в течение 16 ч. Растворитель удаляли и остаток очищали с помощью колоночной хроматографии на силикагеле (30% петролейного эфира в EtOAc) с получением сырого соединения 13 (1,0 г, 82,8%).
ЖХ/МС (ЭРИ): m/z 614,0 [М+Н+].
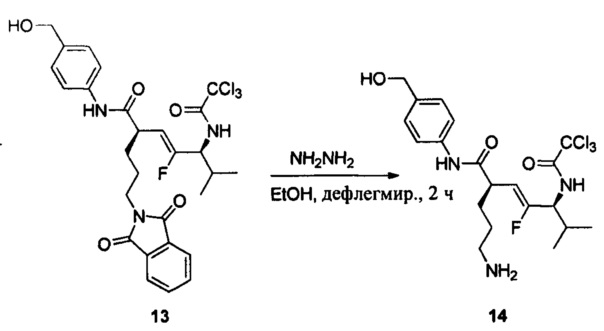
К раствору соединения 13 (1,5 г, 2,45 ммоль) в EtOH (20 мл) добавляли NH2NH2 × Н2О (471 мг, с = 50%, 7,35 ммоль). Реакционную смесь перемешивали при 100°С в течение 2 ч. Смесь концентрировали при пониженном давлении с получением соединения 14 (1,18 г, 100%) в виде сырого продукта.
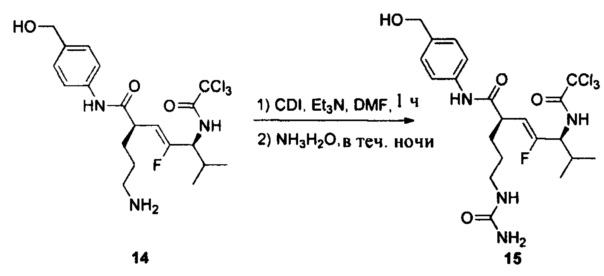
К смеси соединения 14 (1,18 г, 2,45 ммоль) в DMF (10 мл) добавляли TEA (496 мг, 4,90 ммоль), с последующим добавлением CDI (795 мг, 4,90 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли NH3H2O (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. После удаления растворителя, остаток очищали с помощью препаративной ВЭЖХ (FA) с получением соединения 15 (350 мг, 27,1%, 2 стадии) в виде твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ 9,96 (s, 1Н), 9,24 (d, J=8,4 Гц, 1Н), 7,53 (d, J=8,4 Гц, 2Н), 7,22 (d, J=8,4 Гц, 2Н), 5,94 (s, 1Н), 5,38 (br, 2Н), 5,09 (dd, J=38,4, 9,6 Гц, 1H), 4,42 (s, 2Н), 4,07-3,97 (m, 1Н), 3,50-3,40 (m, 2Н), 2,95 (dd, J=15,2, 5,2 Гц, 2Н), 2,18-2,14 (m, 1Н), 1,70-1,65 (m, 1Н), 1,42-1,30 (m, 3Н), 0,94-0,89 (m, 6Н).
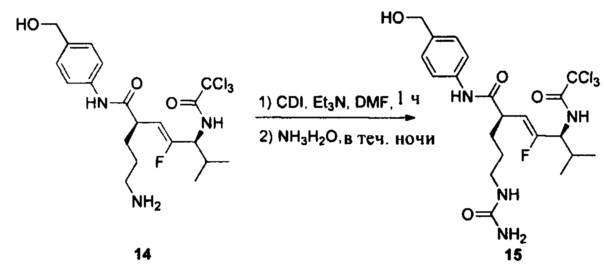
К раствору соединения 15 (120 мг, 0,23 ммоль) в безводном EtOH (10 мл) добавляли NaBH4 (104 мг, 2,74 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Н2О (1 мл) добавляли, чтобы погасить реакцию. Смесь концентрировали при пониженном давлении и остаток очищали с помощью ТСХ (DCM/MeOH = 4:1) с получением сырого соединения 16 (50 мг), которое содержало неизвестные примеси.
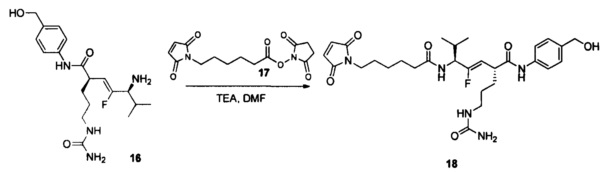
К смеси соединения 16 (50 мг, 0,13 ммоль) в DMF (4 мл) добавляли TEA (39 мг, 0,39 ммоль), с последующим добавлением соединения 17 (61 мг, 0,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь очищали с помощью препаративной ВЭЖХ (FA) с получением соединения 18 (30 мг, 40%) в виде белого твердого вещества.
1Н ЯМР (400 МГц, DMSO-d6) δ 9,93 (s, 1H), 8,00 (d, J=8,4 Гц, 1Н), 7,53 (d, J=8,4 Гц, 2Н), 7,21 (d, J=8,4 Гц, 2Н), 7,00 (s, 2Н), 5,94 (s, 1H), 5,37 (br, 2Н), 4,95 (dd, J=38,8, 9,6 Гц, 1Н), 4,42 (s, 2Н), 4,24-4,15 (m, 1Н), 3,47-3,35 (m, 2Н), 2,95 (dd, J=10,0, 5,2 Гц, 2Н), 2,13-2,09 (m, 2Н), 1,90-1,85 (m, 1Н), 1,20-1,15 (m, 1Н), 1,49-1,43 (m, 6Н), 1,28-1,25 (m, 1H), 1,19-1,15 (m, 2Н), 0,84 (dd, J=6,4, 2,8 Гц, 6Н).
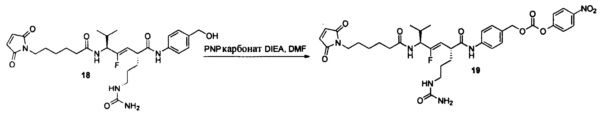
К раствору соединения 18 (20 мг, 0,035 ммоль) в сухом DMF (2 мл) добавляли карбонат PNP (32 мг, 0,105 ммоль) и DIPEA (9 мг, 0,07 ммоль) при 20°С. После того, как смесь перемешивали при 16°С в течение 16 ч в атмосфере N2, ее фильтровали и очищали с помощью ТСХ (DCM/MeOH = 10/1) с получением соединения 19 (INT6) (18 мг, выход: 69%).
Синтез INT7
4-((S)-2-(4-((S)-1-(6-(2,5-диоксо-2,5-дигидро-1Н-пиррол-1-ил)гексанамидо)-2-метилпропил)-1Н-1,2,3-триазол-1-ил)-5-уреидопентанамидо)бензил 4-нитрофенил карбонат
Схема 3
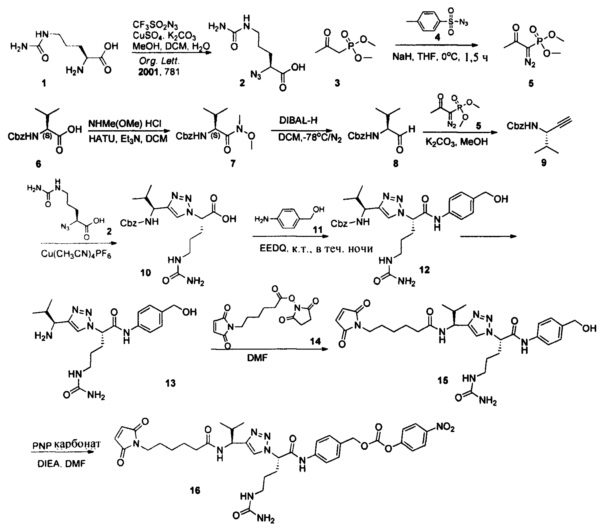
Экспериментальные данные
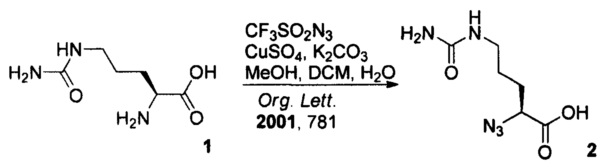
Раствор NaN3 (20 г, 285,7 ммоль) растворяли в дистиллированной Н2О (75 мл) и добавляли DCM (100 мл). Полученное охлаждали в ледяной бане и Tf2O (19,2 мл, 114,28 ммоль) добавляли медленно в течение 30 мин, при этом перемешивание продолжалось в течение 3 ч. Смесь помещали в делительную воронку и собирали фазу CH2Cl2. Водную часть экстрагировали с помощью CH2Cl2 (50 мл × 2). Органические фракции, содержащие трифлилазид объединяли и отмывали один раз с помощью насыщенного Na2CO3 (150 мл) и использовали без дополнительной очистки. Соединение 1 (10 г, 57,14 ммоль) комбинировали с К2СО3 (11,83 г, 85,7 ммоль) и CUSO4•5H2O (1,43 г, 5,71 ммоль), дистиллированной Н2О (50 мл) и МеОН (100 мл). Полученный выше трифлилазид в CH2Cl2 (120 мл) добавляли и смесь перемешивали при комнатной температуре в течение ночи. Впоследствии органические растворители удаляли при пониженном давлении и водную суспензию разбавляли с помощью Н2О (100 мл). Полученное подкисляли до рН 6 с помощью концентрированной HCl и разбавляли с помощью 0,2 М рН 6,2 фосфатного буфера (150 мл) и отмывали с помощью EtOAC (100 мл × 3) для удаления побочного продукта - сульфонамида. Водную фазу затем подкисляли до рН 2 с помощью конц. HCl. Полученное экстрагировали с помощью EtOAc/МеОН (20:1) (100 мл × 4). Экстракции EtOAc/МеОН комбинировали, высушивали на Na2SO4 и испаряли с получением соединения 2 без дополнительной очистки (10 г, 87%).
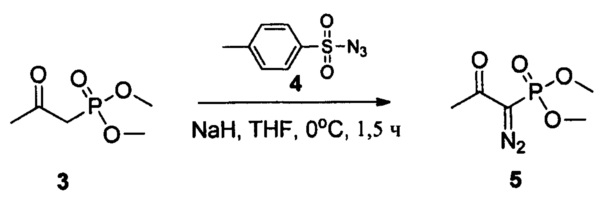
К раствору соединения 3 (18,00 г, 108,36 ммоль) в безводном THF (300 мл) добавляли NaH (5,2 г, 130,03 ммоль) при 0°С. Смесь перемешивали при 0°С в течение 1 ч. затем в смесь медленно добавляли соединение 4 (25,64 г, 130,03 ммоль). Реакционную смесь перемешивали при 0°С в течение 0,5 ч. Смесь фильтровали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле (РЕ:EtOAc=1:1) с получением требуемого продукта (20 г, 96%).
1Н ЯМР (400 МГц, CDCl3) δ 3,84 (s, 3Н), 3,81 (s, 3Н), 2,25 (s, 3Н).
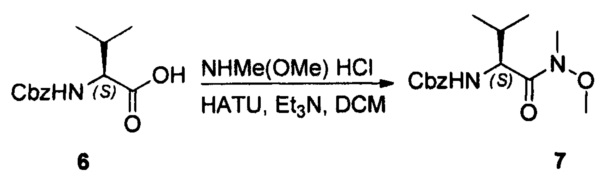
К смеси соединения 6 (20,0 г, 79,59 ммоль) в безводном DCM (150 мл) добавляли Et3N (24,16 г, 238,77 ммоль) и HATU (45,40 г, 119,39 ммоль). Смесь перемешивали при комнатной температуре в течение 15 мин, затем добавляли NHMe(OMe) НС1 (11,65 г, 119,39 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли с помощью DCM, отмывали с помощью насыщенная водн. Na2CO3 (100 мл × 3), насыщенной лимонной кислоты (100 мл × 3) и солевого раствора (100 мл). Органический слой высушивали, концентрировали и очищали с помощью колоночной хроматографии на силикагеле (РЕ:EtOAc=10:1) с получением требуемого продукта (20,0 г, 85,4%).
1Н ЯМР (400 МГц, DMSO-d6) δ 7,97 (s, 1Н), 7,73 (d, J=9,2 Гц, 1H), 7,36-7,29 (m, 5H), 6,01 (s, 1H), 5,40 (dd, J=5,2 Гц, 1H), 5,08-4,99 (m, 2H), 4,58 (dd, J=2,8 Гц, 1H), 2,99-2,94 (m, 2H), 2,21-2,02 (m, 4H), 1,02-1,33 (m, 2H), 0,86-0,77 (m, 6H).
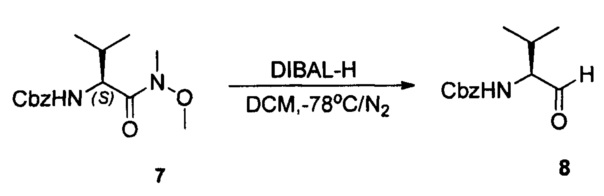
Соединение 7 (12 г, 40,77 ммоль) растворяли в безводном DCM (40 мл) и полученный раствор охлаждали до -78°С с помощью бани с сухим льдом/ацетоном. DIBAL-H (122,3 мл, 122,3 ммоль, 1,0 М в толуоле) добавляли по каплям и полученный раствор перемешивали при -78°С в течение 4 ч. Избыточный гидрид гасили с помощью добавления МеОН (40 мл) при -78°С и полученный раствор нагревали до комнатной температуры. Раствор испаряли с получением соединения 8 (~9,2 г, 96%) без дополнительной очистки.
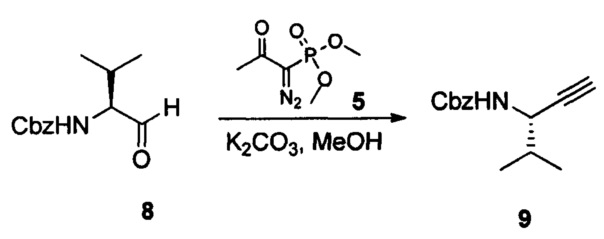
К раствору соединения 8 (сырой продукт, ~9,2 г, 39,1 ммоль) и соединения 5 (11,27 г, 58,65 ммоль) в МеОН (150 мл) добавляли K2CO3 (16,2 г, 117,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле (РЕ:EtOAc=50:1) с получением требуемого продукта (4 г, 44%).
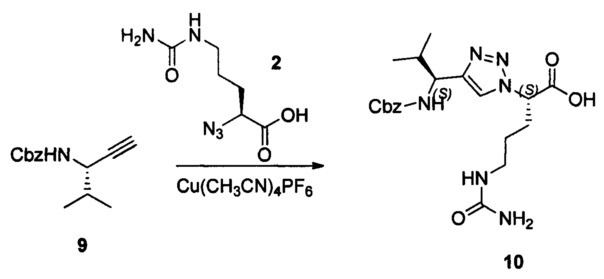
К раствору соединения 9 (4,0 г, 17,29 ммоль) и соединения 2 (4,17 г, 20,75 ммоль) в DMF (15 мл) добавляли Cu(CH3CN)4PF6 (1,29 г, 3,46 ммоль). Реакционную смесь перемешивали при 60°С в течение 2 ч. Смесь очищали с получением соединения 10 (5,0 г, 66,8%).
1Н ЯМР (400 МГц, DMSO-d6) δ 7,97 (s, 1Н), 7,73 (d, J=9,2 Гц, 1H), 7,36-7,29 (m, 5Н), 6,01 (s, 1Н), 5,40 (dd, J=5,2 Гц, 1Н), 5,08-4,99 (m, 2Н), 4,58 (dd, J=2,8 Гц, 1H), 2,99-2,94 (m, 2Н), 2,21-2,02 (m, 4Н), 1,02-1,33 (m, 2Н), 0,86-0,77 (m, 6Н).
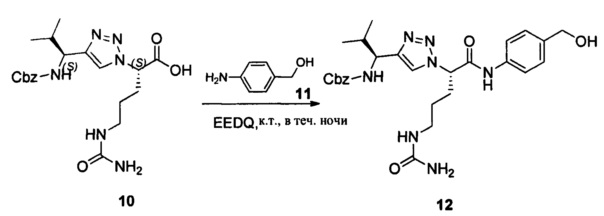
К раствору соединения 10 (сырой продукт, ~3,8 г, 8,79 ммоль) в DMF (15 мл) добавляли EEDQ (4,34 г, 17,58 ммоль) и соединение 11 (1,62 г, 13,18 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в атмосфере N2 в течение ночи. Смесь очищали с помощью препаративной ВЭЖХ с получением соединения 12 (650 мг, 13,7%).
1Н ЯМР (400 МГц, DMSO-d6) δ 10,52 (d, J=6,8 Гц, 1Н), 8,05 (s, 1H), 7,72 (d, J=9,2 Гц, 2Н), 7,33-7,23 (m, 7Н), 6,01 (s, 1Н), 5,47-5,43 (m, 3Н), 5,04-4,96 (m, 2Н), 4,59-4,54 (m, 1Н), 4,41 (s, 2Н), 3,04-2,94 (m, 3Н), 2,09-1,97 (m, 4Н), 1,24 (t, J=6,4 Гц, 2Н), 0,82-0,74 (m, 6Н).

К реакции соединения 12 (650 мг, 1,21 ммоль) в МеОН (15 мл) добавляли Pd/C (300 мг). Реакционную смесь перемешивали при комнатной температуре в атмосфере Н2 в течение 2 ч. Реакционную смесь фильтровали и фильтрат концентрировали с получением 13 (450 мг, 92%).
ЖХ/МС (ЭРИ): RT=0,611 мин, М+Н+=404,0. способ = 5-95/1,5 мин.
1Н ЯМР (400 МГц, DMSO-d6) δ 10,55 (s, 1Н), 8,03 (d, J=7,6 Гц, 1Н), 7,51 (d, J=8,4 Гц, 2Н), 7,23 (d, J=8,4, 2Н), 6,05 (t, J=5,6 Гц, 1Н), 5,46-5,42 (m, 3Н), 5,14 (s, 1H), 4,40 (s, 2H), 3,76 (d, J=5,2 Гц, 2H), 3,00-2,93 (m, 3H), 2,09-2,04 (m, 2H), 1,90-1,87 (m, 1H), 1,25-1,21 (m, 2H), 0,82-0,77 (m, 6H).
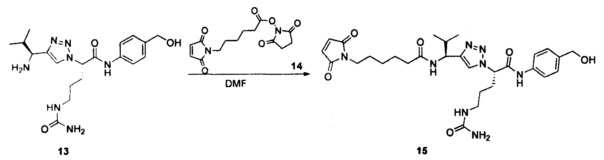
Соединение 13 (390 мг, 0,965 ммоль) и соединение 14 (327 мг, 1,06 ммоль) растворяли в DMF (10 мл) при 16°С. Смесь перемешивали при комнатной температуре в течение 2 ч. Смесь концентрировали в вакууме и очищали с помощью колоночной хроматографии (РЕ/EtOAc=3/1) с получением требуемого продукта 15 (400 мг, выход: 54%)
ЖХ/МС: (5-95, АВ, 1,5 мин), 0,726 мин, МС=597,1 [М+1];
1Н ЯМР (400 МГц, DMSO-d6) δ 10,52 (s, 1Н), 8,09 (d, J=9,2 Гц, 1Н), 8,03 (s, 1Н), 7,53 (d, J=8,4 Гц, 2Н), 7,25 (d, J=8,4 Гц, 2Н), 7,00 (s, 2Н), 6,03-6,00 (t, J=5,6 Гц, 1Н), 5,45 (s, 1Н), 5,42 (s, 2Н), 5,14-5,11 (t, J=5,8 Гц, 1Н)), 4,91-4,87 (m, 1Н), 4,43 (d, J=5,2 Гц, 2Н), 3,38 (s, 2Н), 3,03-2,98 (m, 2Н), 2,14-2,05 (m, 4Н), 1,50-1,46 (m, 4 Н), 1,27-1,18 (m, 4 Н), 0,82-0,77 (m, 6Н).
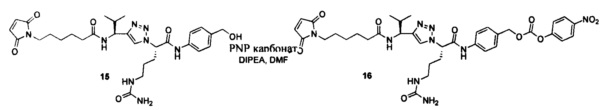
К раствору соединения 15 (30 мг, 0,05 ммоль) в сухом DMF (2 мл) добавляли карбонат PNP (46 мг, 0,15 ммоль) и DIPEA (13 мг, 0,101 ммоль) при 20°С. После того, как смесь перемешивали при 16°С в течение 16 ч в атмосфере N2, ее фильтровали и очищали с помощью ТСХ (DCM/MeOH=10/1) с получением 16 (INT7) (25 мг, выход: 65%).
Синтез PNU-LD2, PNU-LD3 и PNU-LD4 из общего промежуточного соединения.
Схема 4

Стадия 1:
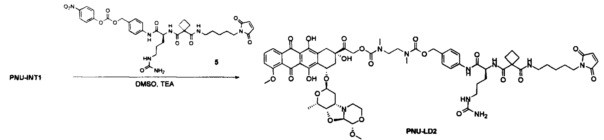
К раствору PNU-INT1 (90,00 мг, 119,08 мкмоль) и соединения INT5 (131,42 мг, 178,63 мкмоль) в DMSO (1 мл) добавляли Et3N (60,25 мг, 592,42 мкмоль) при 25°С. После того, как реакционную смесь перемешивали при 25°С в течение 1 ч, ее разбавляли с помощью Н2О (5 мл) и экстрагировали дважды с помощью DCM/MeOH (10 мл/1 мл). Органический слой высушивали на Na2SO4 и концентрировали с получением сырого продукта, который очищали с помощью ТСХ (DCM:MeOH=10:1) с получением требуемого продукта (50 мг, 31%) [4-[[(2S)-2-[[1-[5-(2,5-диоксопиррол-1-ил)пентилкарбамоил]циклобутанкарбонил]амино]-5-уреидо-пентаноил]амино]фенил]метил N-[2-[[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-метокси-1-метил-3,4,4а,6,7,9,9а,10а-октагидро-1Н-пирано[1,2]оксазоло[3,4-b][1,4]оксазин-3-ил|окси]-2.5,12-тригидрокси-7-метокси-6,11-диоксо-3,4-дигидро-1Н-тетрацен-2-ил]-2-оксо-этокси]карбонил-метил-амино]этил]-N-метил-карбамата, PNU-LD2, в виде красного твердого вещества.
ЖХ/МС: (10-80, АВ, 3,0 мин), 1,948 мин, МС = 1352,5 [М+Н]+;
1Н ЯМР (400 МГц, CDCl3) δ 13,82 (s, 1Н), 13,20 (s, 1Н), 7,96 (d, J=7,2 Гц, 1H), 7,71 (t, J=8,0 Гц, 1Н), 7,53 (d, J=7,2 Гц, 1H), 7,31 (d, J=8,0 Гц, 1Н), 7,23-7,10 (m, 2Н), 6,61 (s, 2Н), 5,4 (br, 1Н), 5,2-4,4 (m, 10Н), 4,01 (s, 6Н), 3,53-3,33 (m, 14Н), 3,16-2,50 (m, 19Н), 1,94-1,18 (m, 22Н).
Стадия 2:
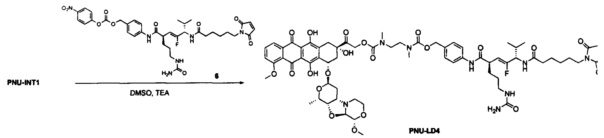
К раствору PNU-INT1 (11,00 мг, 14,55 мкмоль) и соединения INT6 (12,00 мг, 16,01 мкмоль) в DMSO (0,5 мл) добавляли Et3N (7,36 мг, 72,75 мкмоль) при 25°С. Реакционную смесь перемешивали при 25°С в течение 1 ч. Реакционную смесь разбавляли с помощью Н2О (3 мл) и экстрагировали дважды с помощью DCM/MeOH (5 мл/0,5 мл). Органический слой высушивали на Na2SO4 и концентрировали с получением сырого продукта, который очищали с помощью ТСХ (DCM:MeOH=10:l) с получением требуемого продукта [4-[[(Z,2R,5S)-5-[6-(2,5-диоксопиррол-1-ил)гексаноиламино]-4-фтор-6-метил-2-(3-уреидопропил)гепт-3-еноил]амино]фенил]метил N-[2-[[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-метокси-1-метил-3,4,4а,6,7,9,9а,10а-октагидро-1Н-пирано[1,2]оксазоло[3,4-b][1,4]оксазин-3-ил]окси]-2,5,12-тригидрокси-7-метокси-6,11-диоксо-3,4-дигидро-1Н-тетрацен-2-ил]-2-оксо-этокси]карбонил-метил-амино]этил]-N-метил-карбамата, PNU-LD4 (6 мг, 31,17%) в виде красного твердого вещества.
ЖХ/МС: (10-80, АВ, 3,0 мин), 1,894 мин, МС = 1366,5 [М+Н]+;
Стадия 3:

К раствору PNU-INT1 (22,00 мг, 29,11 мкмоль) и соединения INT7 (23,49 мг, 32.02 мкмоль) в DMSO (0,5 мл) добавляли Et3N (14,73 мг, 145,55 мкмоль) при 25°С. Реакционную смесь перемешивали при 25°С в течение 1 ч. Реакционную смесь разбавляли с помощью H2O (3 мл) и экстрагировали дважды с помощью DCM/MeOH (5 мл/0,5 мл). Органический слой высушивали на Na2SO4 и концентрировали с получением сырого продукта, который очищали с помощью ТСХ (DCM:MeOH=10:1) с получением требуемого продукта [4-[[(2S)-2-[4-[(1S)-1-[6-(2,5-диоксопиррол-1-ил)гексаноил амино]-2-метил-пропил]триазол-1-ил]-5-уреидо-пентаноил]амино]фенил]метил N-[2-[[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-метокси-1-метил-3,4,4а,6,7,9,9а,10а-октагидро-1Н-пирано[1,2]оксазоло[3,4-b][1,4]оксазин-3-ил]окси]-2,5,12-тригидрокси-7-метокси-6,11-диоксо-3,4-дигидро-1Н-тетрацен-2-ил]-2-оксо-этокси]карбонил-метил-амино]этил]-N-метил-карбамата, PNU-LD3 (14 мг, 34,89%) в виде красного твердого вещества.
ЖХ/МС: (10-80, АВ, 3,0 мин), 1,938 мин, МС=1378,5 [М+Н]+;
Способ получения ADC
Получение сконструированных на основе цистеина антител для конъюгации путем восстановления и повторного окисления
При определенных условиях сконструированные на основе цистеина антитела можно сделать реакционно способными для конъюгации с промежуточными соединениями линкер - лекарственное средство согласно настоящему изобретению путем обработки восстановителем, таким как DTT (реактив Клеланда, дитиотреитол) или ТСЕР (трис(2-карбоксуэтил)фосфингидрохлорид; Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA). Полномерные сконструированные на основе цистеина моноклональные антитела (ThioMab), экспрессированные в клетках СНО (Gomez et al (2010) Biotechnology and Bioeng. 105(4):748-760; Gomez et al (2010) Biotechnol. Prog. 26:1438-1445) восстанавливали, например, с помощью приблизительно 50-кратного избытка DTT в течение ночи при комнатной температуре с восстановлением дисульфидных связей, которые могут образовываться между вновь введенными остатками цистеина и цистеином, присутствующим в среде культивирования.
Аминокислоты легкой цепи пронумерованы согласно Kabat (Kabat et al., Sequences of proteins of immunological interest, (1991) 5th Ed., US Dept of Health and Human Service, National Institutes of Health, Bethesda, MD). Аминокислоты тяжелой цепи пронумерованы согласно системе нумерации EU (Edelman et al (1969) Proc. Natl. Acad, of Sci. 63(1):78-85), за исключением тех случаев, которые, как отмечено, пронумерованы согласно системе Kabat. Используются однобуквенные сокращения аминокислот.
Полноразмерные сконструированные на основе цистеина моноклональные антитела (ThioMab), экспрессированные в клетках СНО, содержат цистеиновые аддукты (цистины) или глутатионилированы на сконструированных цистеинах под действием условий культивирования клеток. Для высвобождения реакционно способных тиольных групп сконструированных цистеинов ThioMab растворяют в 500 мМ борате натрия и 500 мМ хлориде натрия при приблизительно рН 8,0 и восстанавливают с помощью приблизительно 50-100-кратного избытка 1 мМ ТСЕР (трис(2-карбоксуэтил)фосфингидрохлорида (Getz et al (1999) Anal. Biochem. Vol 273:73-80; Soltec Ventures, Beverly, MA) в течение приблизительно 1-2 ч при 37°С. Альтернативно, в качестве восстановителя можно использовать DTT. Образование межцепочечных дисульфидных связей подвергали мониторингу либо с помощью SDS-PAGE в невосстановительных условиях, либо с помощью обратно-фазовой колоночной хроматографии ВЭЖХ PLRP в денатурирующих условиях. Восстановленное ThioMab разводят и загружают на колонку HiTrap SP FF в 10 мМ ацетате натрия, рН 5, и элюируют с помощью PBS, содержащего 0,3 М хлорид натрия или 50 мМ трис-С1, рН 7,5, содержащий 150 мМ хлорид натрия.
Дисульфидные связи вновь устанавливали между остатками цистеина, присутствующими в исходном Mab путем проведения повторного окисления. Элюированное восстановленное ThioMab обрабатывали с помощью 15Х или 2 мМ дегидроаскорбиновой кислоты (dhAA) при рН 7 в течение 3 ч или в течение 3 ч в 50 мМ трис-Cl, рН 7,5 или с помощью 2 мМ водного сульфата меди (CuSO4) при комнатной температуре в течение ночи. Можно использовать другие окислители, т.е. окисляющие средства, и окисляющие условия, которые известны в настоящей области техники. Окисление окружающим воздухом также может быть эффективно. На этой стадии умеренного, частичного повторного окисления эффективно образуются внутрицепочечные дисульфиды с высокой точностью воспроизведения. Буфер меняли путем элюирования через смолу Sephadex G25 и элюировали с помощью PBS с 1 мМ DTPA. Значение отношения тиол/Ab проверяют путем определения концентрации восстановленного антитела по поглощению при 280 нм раствора и концентрации тиола путем реакции с DTNB (Aldrich, Milwaukee, WI) и определения поглощения при 412 нм.
Жидкостный хромато-масс-спектрометрический анализ проводили на масс-спектрометре TSQ Quantum Triple quadrupole™ с расширенным диапазоном масс (Thermo Electron, San Jose California). Образцы подвергали хроматографии на микрокапиллярной колонке PRLP-S®, 1000 А (50 мм × 2,1 мм, Polymer Laboratories, Shropshire, UK), нагретой до 75°С. Использовали линейный градиент от 30-40% В (растворитель А: 0,05% TFA в воде, растворитель В: 0,04% TFA в ацетонитриле) и элюент напрямую ионизировали с использованием источником электрораспыления. Данные собирали с помощью системы сбора данных Xcalibur® и обратное преобразование свертки проводили с использованием ProMass® (Novatia, LLC, New Jersey). Перед анализом ЖХ/МС антитела или конъюгаты с лекарственным средством (50 мкг) обрабатывали PNG-азой F (2 ед/мл; PROzyme, San Leandro, СА) в течение 2 ч при 37°С для удаления N-связанных углеводов.
Образцы для хроматографии с гидрофобным взаимодействием (HIC) вводили на колонку бутил-HIC NPR (размер частиц 2,5 мкм, 4,6 мм × 3,5 см) (Tosoh Bioscience) и гпюировали с линейным градиентом от 0 до 70% В при объемной скорости потока, составляющей 0,8 мл/мин (А: 1,5 М сульфат аммония в 50 мМ фосфате калия, рН 7, В: 50 мМ фосфат калия, рН 7, 20% изопропанол). Систему Agilent 1100 series HPLC, оснащенную многоволновым детектором и программное обеспечение Chemstation использовали для выявления и количественного определения видов антител с различными соотношениями лекарственных средств к антителу. Сконструированные на основе цистеина антитела согласно настоящему изобретению можно получить согласно описанному выше общему способу.
Конъюгация промежуточных соединений линкер - лекарственное средство с антителами (процедура 1)
Цистеины сконструированных антител блокировали в виде смешанных дисульфидов с помощью глутатиона и/или цистеина, экспрессированного в клетках СНО. Указанные цистеины должны быть "разблокированы" перед конъюгацией.
Разблокированное антитело (5-12 мг/мл) в 20 мМ сукцинате, 150 мМ NaCl, 2 мМ HDTA переносили в 75-100 мМ трис, рН 7,5-8 (с использованием 1 М трис). Сорастворитель (DMSO, DMF или DMA) добавляли к раствору антитела с последующим добавлением линкер - лекарственное средство (в DMSO или DMF) с получением конечной концентрации органического растворителя в %, составляющей 10-13%, и конечной концентрации линкер - лекарственное средство в 2,5-10 раз больше относительно концентрации антитела. Реакции проходили при комнатной температуре в течение 1-12 ч (до достижения максимальной конъюгации). Реакции конъюгации очищали путем катионообменной хроматографии и/или гель-фильтрации с использованием одноразовых колонок (S maxi или Zeba, соответственно). Дополнительную очистку с помощью препаративной гель-фильтрации (колонки S200) проводили, если сырой конъюгат был значительно агрегирован согласно аналитической SEC (гель-фильтрации) (например, >10%). Конъюгаты по существу обменивались в буфере для получения состава (20 мМ His-ацетат, рН 5,5, 240 мМ сахароза) с использованием либо гель-фильтрация, либо диализа. Твин-20 по существу добавляли к очищенному конъюгату до достижения конечной концентрации, составляющей 0,02%. Конечные концентрации конъюгата находились в диапазоне от 2,4 до 7,5 мг/мл (% выхода: 34-81% из разблокированного антитела). Конъюгаты анализировали с помощью ЖХ/МС с получением величины соотношения лекарственного средства к антителу (DAR), которое находилось в диапазоне от 1,3 до 2,1 (в среднем: 1,8). Конъюгаты также анализировали в отношении присутствия высокомолекулярных агрегатов с использованием аналитической SEC (колонки Zenix или Shodex); конечные, очищенные конъюгаты проявляли агрегацию в диапазоне 0-10%. Конъюгаты также исследовали в отношении загрязнением эндотоксином, которое, во всех случаях, не превышало 1,3 ЕЭ (единица эндотоксина)/мг. Свободное, неконъюгированное лекарственное средство не превышало 1% конечного конъюгата.
Конъюгация промежуточных соединений линкер - лекарственное средство с антителами (процедура 2, альтернативная процедура)
После процедур восстановления и повторного окисления в приведенном выше примере антитело растворяли в буфере PBS (фосфатно-солевом буфере) и охлаждали на льду. Избыток от приблизительно 1,5 молярного до 20 эквивалентов промежуточного соединения линкер - лекарственное средство с реагирующей с тиолом функциональной группой, такой как малеимидо или бромацетамид, растворяли в DMSO, разводили в ацетонитриле и воде и добавляли к охлажденному восстановленному, подвергнутому повторному окислению антителу в PBS. Через приблизительно 1 ч избыток малеимида добавляли, чтобы погасить реакцию и кэпировать любые непрореагировавшие тиольные группы антитела. Конъюгационную смесь можно загрузить и элюировать через колонку HiTrap SP FF для удаления избытка промежуточного соединения лекарственное средство-линкер и других примесей. Реакционную смесь концентрировали путем центробежной ультрафильтрации и конъюгат сконструированного на основе цистеина антитела и лекарственного средства очищали и обессоливали путем элюирования через смолу G25 в PBS, фильтровали через 0,2 мкм фильтры при стерильных условиях и замораживали для хранения.
ADC согласно настоящему изобретению можно получить согласно процедуре, описанной в приведенном выше разделе.
Анализы
Выбранные линкеры затем исследовали и обнаружили, что они являются активными в in vitro и in vivo анализах. Данные расщепления показаны в таблице ниже
Анализ расщепления катепсином В
Подобно пептидным линкерам предполагалось, что непептидные линкеры для ADC являются расщепляемыми в лизосоме для надлежащего высвобождения лекарственного средства. Как пищеварительная органелла клетки, лизосома обогащена некоторыми протеазами, которые демонстрируют оптимальную гидролитическую активность при кислом значении рН. Катепсин В представляет собой репрезентативную лисомную протеазу, и было показано, что он вносит свой вклад в активацию пептидных линкеров ADC (ref). В качестве начального скрининга анализ разрабатывали с использованием очищенного катепсина В для идентификации расщепляемых конструктов линкер - лекарственное средство, которые являются подходящими для конъюгации с антителом. Норфлоксацин использовали, чтобы представить лекарственный компонент конструкта линкер - лекарственное средство. Процентное отношение расщепления относительно контрольных пептидов (таких как Val-Cit) измеряли в данной временной точке, а также кинетические параметры реакции расщепления (Km и Vmax). Подробное описание анализа показано ниже. В настоящем анализе идентифицировали разнообразные протеолитически активные и структурно различные линкеры и впоследствии использовали их для создания ADC.
Активность расщепления катепсином В с использованием экспериментальных линкер - лекарственных средств в качестве субстрата измеряли путем мониторинга высвобождения норфлоксацина с использованием ЖХ/МС. Различные концентрации конструкта линкер - лекарственное средство (3-кратные серийные разведения) инкубировали в 20 мкл реакциях, содержащих 20 нМ катепсин В (EMD Millipore № по кат. 219364, печень человека), 10 мМ MES рН 6,0, 1 мМ DTT, 0,03% CHAPS и 25 нМ внутренний стандарт норфлоксацин-а5 (Santa Cruz Biotechnology, № по кат. sc-301482). Реакции инкубировали в течение 1 ч при 37°С с последующим добавлением 60 мкл 2% муравьиной кислоты, чтобы погасить реакции. Образцы анализировали путем введения 2 мкл остановленных реакций на колонку Waters Acquity UPLC ВЕН Phenyl (2,1 мм × 50 мм, № по кат. Waters 186002884). Образцы очищали с использованием линейного 2 минутного градиента (0% до 80%) ацетонитрила, 0,1% муравьиной кислоты на Water Acquity UPLC. Норфлоксацин и внутренний стандарт норфлоксацин-d5 обнаруживали с использованием масс-спектрометра с тремя квадрупольными линзами АВ Sciex QTrap 5500, работающего в режиме положительного MRM (норфлоксацин 320→233 m/z, норфлоксацин-d5 325→233 m/z). Определенный количественно норфлоксацин (нормированный к внутреннему стандарту) наносили на график в зависимости от концентрации линкер - лекарственного средства, и полученный график представлял собой кривую, аппроксимированную уравнением Михаэлис-Ментен с использованием программного обеспечения GraphPad Prism для получения кинетических констант Km и Vmax.
In vitro анализ клеточной пролиферации
Эффективность ADC измеряли с помощью анализа клеточной пролиферации с использованием следующее протокола (люминесцентный анализ жизнеспособности клеток CELLTITER GLO™, Promega Corp. Technical Bulletin TB288; Mendoza et al (2002) Cancer Res. 62:5485-5488):
1. Аликвоту, составляющую 100 мл клеточной культуры, содержащую приблизительно 104 клеток (SKBR-3, ВТ474, MCF7 или MDA-MB-468) в среде помещали в каждую лунку 96-луночного планшета с непрозрачными стенками.
2. Готовили контрольные лунки, содержащие среду и не содержащие клетки.
3. ADC добавляли к экспериментальным лункам и инкубировали в течение 3-5 дней.
4. Планшеты уравновешивали до комнатной температуры в течение приблизительно 30 минут.
5. Добавляли объем реагента CELLTITER GLO™, равный объему среде для культивирования клеток, находящейся в каждой лунке.
6. Содержания перемешивали в течение 2 минут на орбитальном встряхивателе для индукции лизиса клеток.
7. Планшет инкубировали при комнатной температуре в течение 10 минут для стабилизации люминесцентного сигнала.
8. Люминесценцию регистрировали и заносили на графики как RLU = относительные единицы люминесценции.
Данные представляли на графике как среднее значение люминесценции для каждого набора повторностей с планками погрешностей, обозначающих стандартное отклонение. Протокол представляет собой модификацию люминесцентного клеточного анализа CELLTITER GLO™
Среда: рост SK-BR-3 в 50/50/10%РВ8/глутамин/250 мкг/мл G-418 OVCAR-3 рост в RPMI/20%FBS/глутамин
In vivo анализ
1. Эффективность конъюгатов антител к CD33 с лекарственными средствами (ADC) исследовали в мышиной модели ксенотрансплантата HL-60 или EOL-1 (острый миелоидный лейкоз человек). Клеточную линию HL-60 получали из АТСС (Американская коллекция типовых культур; Манасеас, Вирджиния) и клеточную линию EOL-1 получали из DSMZ (Немецкая коллекция микроорганизмов и клеточных культур; Брауншвейг, Германия).
Каждую из самок мышей С. В-17 SCID (Charles River Laboratories; Холлистер, Калифорния) инокулировали подкожно в паховую область пятью миллионами клеток HL-60 или EOL-1. Когда ксенотрансплантатные опухоли достигали среднего объема опухоли, составляющего 100-300 мм3 (что обозначалось как день 0), животных рандомизировали на группы по 7-10 мышей каждая и им вводили однократную внутривенную инъекцию ADC. Приблизительно за 4 часа до введения ADC животным вводили интраперитонеально избыточное количество (30 мг/кг) контрольного антитела к gD, чтобы блокировать возможные сайты связывания с неспецифическим антителом на опухолевых клетках. Опухоли и массы тела мышей измеряли 1-2 раза в неделю в течение всего исследования. Мышам немедленно проводили эвтаназию, когда потеря массы тела составляла >20% их исходной массы. Всем животным проводили эвтаназию до того, как опухоли достигли 3000 мм3 или продемонстрировали признаки неизбежного изъязвления.
2. Эффективность конъюгаты антител к Napi2B с лекарственными средствами (ADC) исследовали в мышиной модели ксенотрансплантата OVCAR3-X2.1 (рак яичника человека). Клеточную линию OVCAR3 получали из АТСС (Американская коллекция типовых культур; Манасеас, Вирджиния) и сублинию OVCAR3-X2.1 создавали в Genentech для оптимального роста в организме мышей.
Каждую из самок мышей С. В-17 SCID-beige (Charles River Laboratories; Сан-Диего, Калифорния) инокулировали в область жировой подушки торакальной молочной железы десятью миллионами клеток OVCAR3-X2.1. Когда ксенотрансплантатные опухоли достигали среднего объема опухоли, составляющего 100-300 мм3 (что обозначалось как день 0), животных рандомизировали на группы по 7-10 мышей каждая и им вводили однократную внутривенную инъекцию ADC. Опухоли и массы тела мышей измеряли 1-2 раза в неделю в течение всего исследования. Мышам немедленно проводили эвтаназию, когда потеря массы тела составляла >20% их исходной массы. Всем животным проводили эвтаназию до того, как опухоли достигли 3000 мм3 или продемонстрировали признаки неизбежного изъязвления.
3. Эффективность конъюгатов антител к CD22 с лекарственными средствами (ADC исследовали в мышиной модели ксенотрансплантата BJAB-luc (лимфома Беркитта человека) или WSU-DLCL2 (диффузная крупноклеточная В-клеточная лимфома человека). Клеточную линию BJAB получали из DSMZ (Немецкая коллекция микроорганизмов и клеточных культур; Брауншвейг, Германия) и сублинию BJAB-luc создавали в Genentech для стабильной экспрессии гена люциферазы. Клеточную линию WSU-DLCL2 также получали из DSMZ.
Каждую из самок мышей С. В-17 SCID (Charles River Laboratories; Hollister, С A) Холлистер, Калифорния) инокулировали подкожно в паховую область 20 миллионами клеток BJAB-luc или WSU-DLCL2. Когда ксенотрансплантатные опухоли достигали среднего объема опухоли, составляющего 100-300 мм3 (что обозначалось как день 0), животных рандомизировали на группы по 7-10 мышей каждая и им вводили однократную внутривенную инъекцию ADC. Опухоли и массы тела мышей измеряли 1-2 раза в неделю в течение всего исследования. Мышам немедленно проводили эвтаназию, когда потеря массы тела составляла >20% их исходной массы. Всем животным проводили эвтаназию до того, как опухоли достигли 3000 мм3 или продемонстрировали признаки неизбежного изъязвления.
4. Эффективность конъюгатов антител к Her2 с лекарственными средствами (ADC) исследовали в мышиной модели аллотрансплантата MMTV-HER2 основателя №5 (опухоль молочной железы мыши). Модель MMTV-HER2 основателя №5 (Fo5) (разработанная в Genentech) представляет собой трансгенную мышиную модель, в которой ген HER2 человека, под транскрипционной регуляцией промотора вируса опухоли молочной железы мыши (MMTV-HER2), избыточно экспрессируется в эпителии молочной железы. Избыточная экспрессия вызывает спонтанное развитие опухолей молочной железы, которая избыточно экспрессирует рецептор HER2 человека. Опухоль молочной железы от одного из животных-основателей (животное-основатель №5. Fo5) репродуцировали у мышей FVB (Charles River Laboratories) путем серийной трансплантации фрагментов опухоли.
Для исследований эффективности трансгенную опухоль молочной железы Ро5хирургическим путем трансплантировали в торакальную жировую подушку самок nu/nu мышей (Charles River Laboratories; Холлистер, Калифорния) в виде фрагментов опухоли, размер которых составлял приблизительно 2 мм × 2 мм. Когда ксенотрансплантатные опухоли достигали среднего объема опухоли, составляющего 100-300 мм3 (что обозначалось как день 0), животных рандомизировали на группы по 7-10 мышей каждая и им вводили однократную внутривенную инъекцию ADC. Опухоли и массы тела мышей измеряли 1 -2 раза в неделю в течение всего исследования. Мышам немедленно проводили эвтаназию, когда потеря массы тела составляла >20% их исходной массы. Всем животным проводили эвтаназию до того, как опухоли достигли 3000 мм3 или продемонстрировали признаки неизбежного изъязвления.
Биологические исследования
Содержащие структуры линкер - лекарственное средство ADC, полученные согласно описанной в настоящем документе общей процедуре
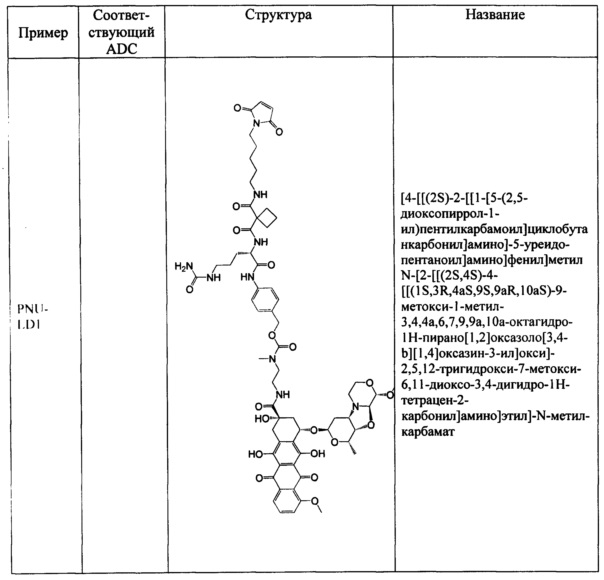
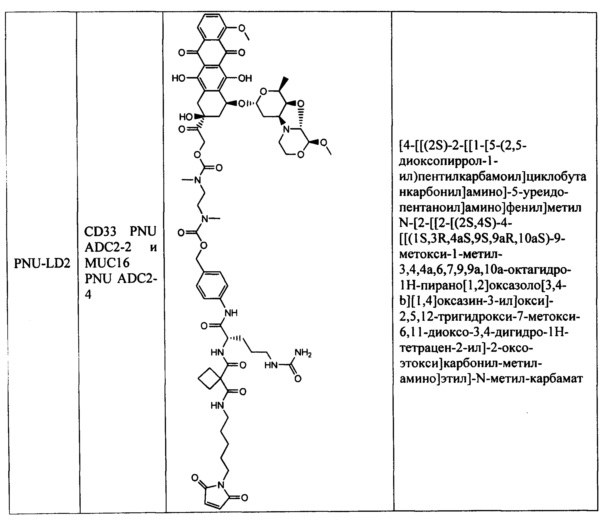
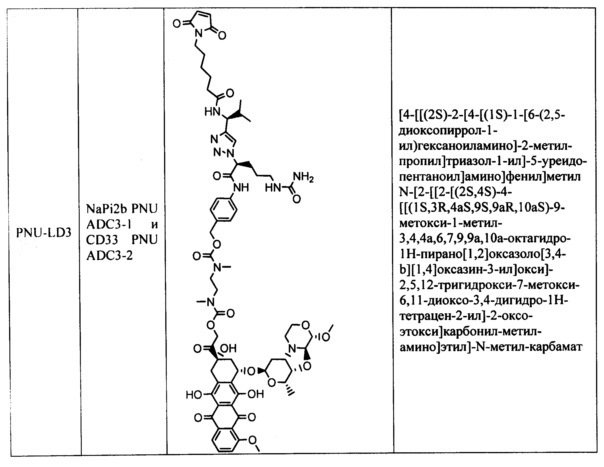
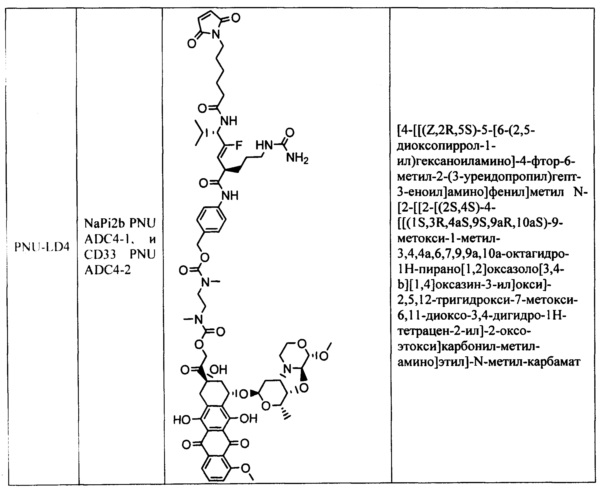
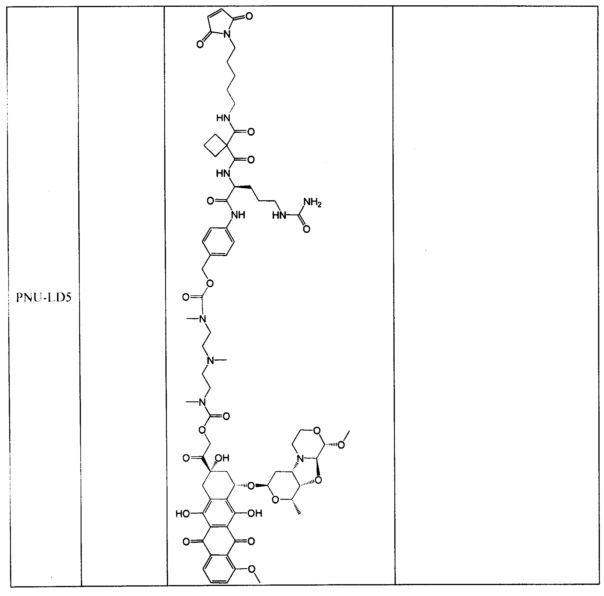
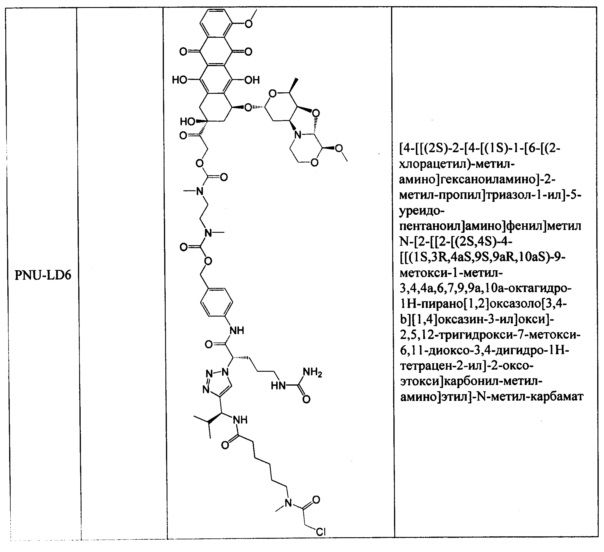
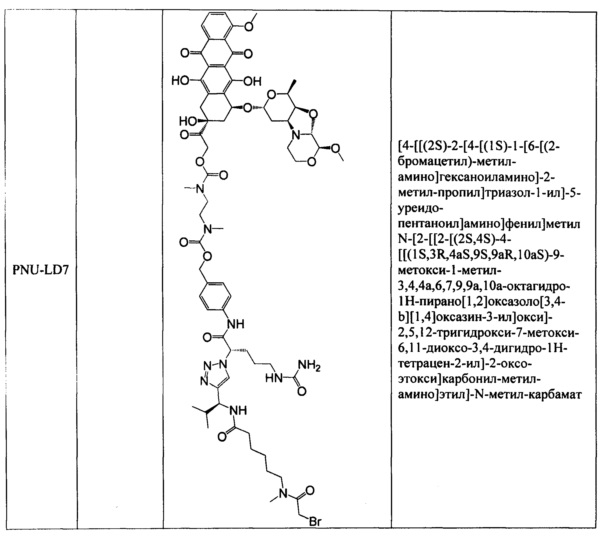
ПОСЛЕДОВАТЕЛЬНОСТИ
Гуманизированное антитело к NaPi2b:
Согласно одному варианту осуществления антитело к NaPi2b ADC согласно настоящему изобретению содержит три гипервариабельных области легкой цепи и три гипервариабельных области тяжелой цепи (SEQ ID NO: 1-6), последовательности которых показаны ниже.
Согласно одному варианту осуществления антитело к NaPi2b ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 7 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 8
Согласно одному варианту осуществления антитело к NaPi2b ADC согласно настоящему изобретению содержит последовательность легкой цепи согласно SEQ ID NO: 9 и последовательность тяжелой цепи согласно SEQ ID NO: 10

Гуманизированное антитело к CD33:
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит три гипервариабельных области легкой цепи и три гипервариабельных области тяжелой цепи, последовательности (SEQ ID NO: 11-16) которых показаны ниже
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 17 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 18

Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит последовательность легкой цепи согласно SEQ ID NO: 19 и последовательность тяжелой цепи согласно SEQ ID NO: 20
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит три гипервариабельных области легкой цепи и три гипервариабельных области тяжелой цепи, последовательности (SEQ ID NO: 19-24) которых показаны ниже.
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 25 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 26
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 27 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 28
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 29 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 30
Согласно одному варианту осуществления антитело к CD33 ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 31 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 32


Гуманизированное антитело к CD22:
Согласно одному варианту осуществления антитело к CD22 ADC согласно настоящему изобретению содержит три гипервариабельных области легкой цепи и три гипервариабельных области тяжелой цепи (SEQ ID NO: 41-46), последовательности которых показаны ниже.
Согласно одному варианту осуществления антитело к CD22 ADC согласно настоящему изобретению содержит последовательность вариабельной области легкой цепи согласно SEQ ID NO: 47 и последовательность вариабельной области тяжелой цепи согласно SEQ ID NO: 48
Согласно одному варианту осуществления антитело к CD22 ADC согласно настоящему изобретению содержит последовательность легкой цепи согласно SEQ ID NO: 49 и последовательность тяжелой цепи согласно SEQ ID NO: 50
Данные in vitro в отношении ADC
Следующие ADC исследовали в описанных выше in vitro анализах и обнаружили, что они являются активными. Активности указанных ADC проиллюстрированы в таблице ниже.


Данные in vivo в отношении ADC
Следующие ADC исследовали в описанных выше in vivo анализах и обнаружили, что они являлись активными. Активности указанных ADC проиллюстрированы на фигурах 1-2 и приведенном ниже описании.
На фигуре 1 показано сравнение эффективности ADC CD33 у мышей SCID с опухолями острого миелоидного лейкоза человека HL-60. CD33 PNU ADC3-2 показал зависимое от дозы ингибирование роста опухоли по сравнению с получившей инертный носитель группой. 5 мкг/м2 доза лекарственного средства ADC3-2 давала в результате снижение роста опухоли аналогичное ADC2-2 в дозе лекарственного средства, составляющей 15 мкг/м2. Ремиссия опухоли достигалась при введении CD33 PNU ADC3-2 в дозе лекарственного средства, составляющей 15 мкг/м2. Не обладающий таргетным действием контроль, NaPi2b PNU ADC3-1, характеризовался минимальным эффектом на рост опухоли.
На фигуре 2 показано сравнение эффективности ADC CD33 у мышей SCID с опухолями острого миелоидного лейкоза человека HL-60. CD33 PNU ADC4-2 показал зависимое от дозы ингибирование роста опухоли по сравнению с получившей инертный носитель группой. Противоопухолевая активность CD33 PNU ADC4-2 была сопоставима с CD33 PNU ADC2-2, приводя в результате к снижению роста опухоли в дозе лекарственного средства, составляющей 10 мкг/м2 (= 0,4 мг/кг дозы антитела). Регрессия опухоли достигалась при введении CD33 PNU ADC4-2 в дозе лекарственного средства, составляющей 20 мкг/м2. Не обладающий таргетным действием контроль, NaPi2b PNU ADC4-1, не оказывал никакого эффекта на рост опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРРОЛОБЕНЗОДИАЗЕПИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2736725C1 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2436796C9 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2553566C2 |
| ПИРРОЛОБЕНЗОДИАЗЕПИНОВЫЕ КОНЪЮГАТЫ | 2017 |
|
RU2744200C2 |
| ПРОЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ НА ОСНОВЕ ГИДРОГЕЛЯ ПОПЕРЕЧНО-СШИТОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ И СПОСОБЫ | 2018 |
|
RU2812787C2 |
| АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2511410C2 |
| КОНЪЮГАТЫ АНТИ-РТК7 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2708075C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ CD79b И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2008 |
|
RU2557319C2 |
| ЛЕКАРСТВЕННЫЙ КОНЪЮГАТ ПРОИЗВОДНОГО ЭРИБУЛИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2830242C1 |





















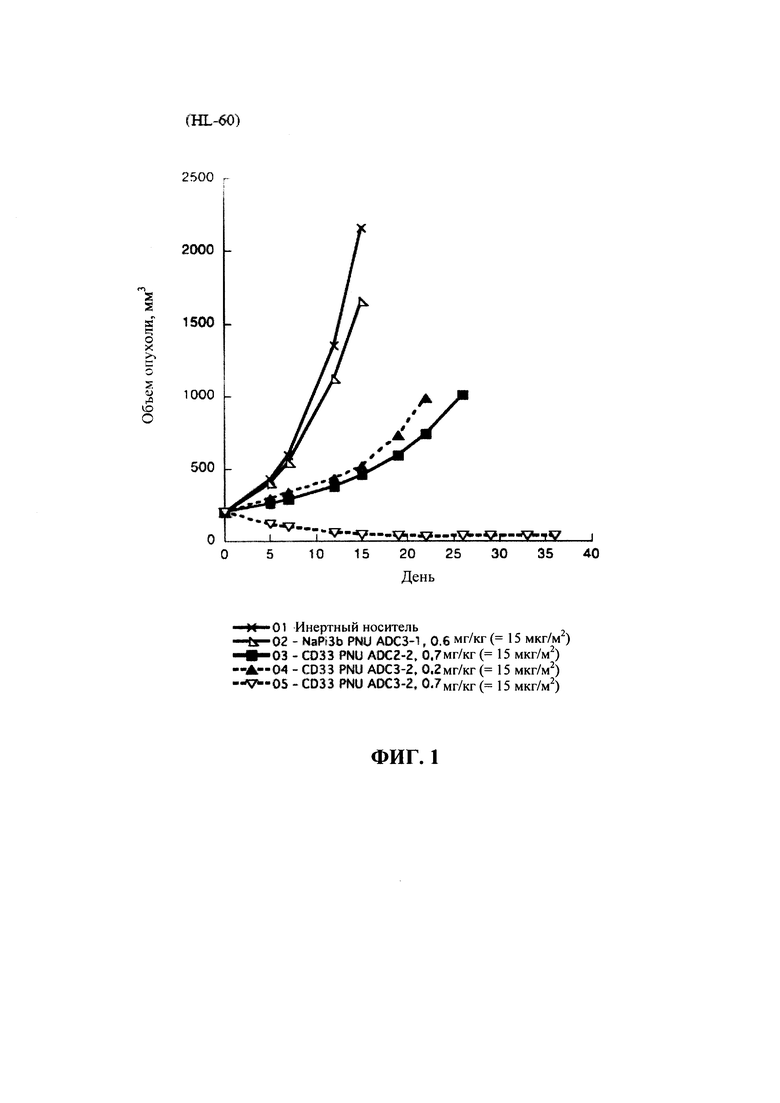
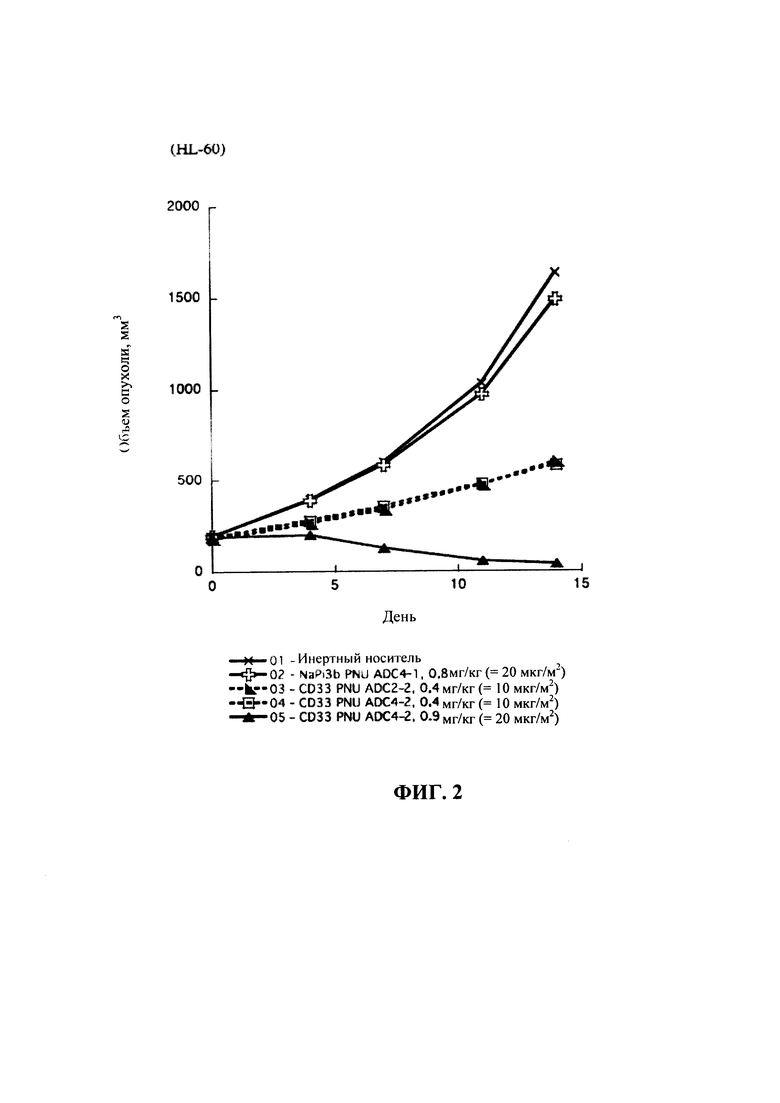
Изобретение относится к конъюгату антитела с лекарственным средством для лечения злокачественной опухоли, представленный формулой (I), 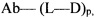 где Ab представляет собой антитело, где антитело связывается с NaPi2b, CD33 или CD22; L представляет собой пептидомиметический линкер, представленный следующей формулой
где Ab представляет собой антитело, где антитело связывается с NaPi2b, CD33 или CD22; L представляет собой пептидомиметический линкер, представленный следующей формулой 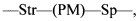 где Str представляет собой растяжку, ковалентно прикрепленную к Ab; Sp представляет собой связь или спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту; РМ представляет собой непептидный химический фрагмент, выбранный из группы, состоящей из:
где Str представляет собой растяжку, ковалентно прикрепленную к Ab; Sp представляет собой связь или спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту; РМ представляет собой непептидный химический фрагмент, выбранный из группы, состоящей из: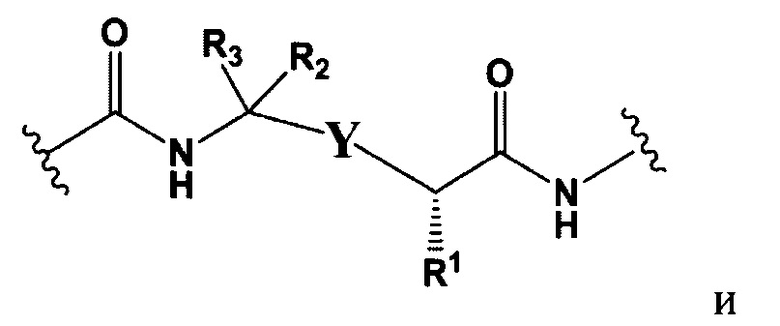
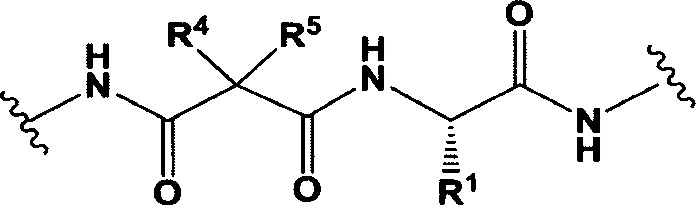 Y выбран из C1-С6алкенила,
Y выбран из C1-С6алкенила, , каждый R1 независимо представляет собой (С1-С10алкил)NHC(O)NH2; R3 и R2, каждый независимо, представляют собой Н или C1-С10 алкил; R4 и R5 вместе могут образовывать С3-С7циклоалкильное кольцо; р представляет собой целое число от 1 до 8; D представляет собой лекарственный фрагмент формулы (IA) или (IB):
, каждый R1 независимо представляет собой (С1-С10алкил)NHC(O)NH2; R3 и R2, каждый независимо, представляют собой Н или C1-С10 алкил; R4 и R5 вместе могут образовывать С3-С7циклоалкильное кольцо; р представляет собой целое число от 1 до 8; D представляет собой лекарственный фрагмент формулы (IA) или (IB): 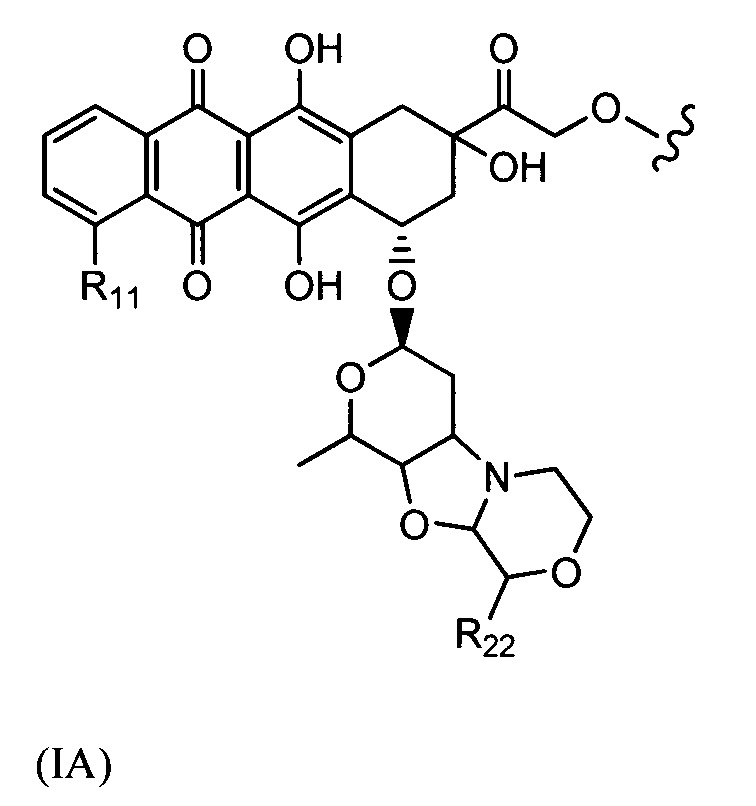
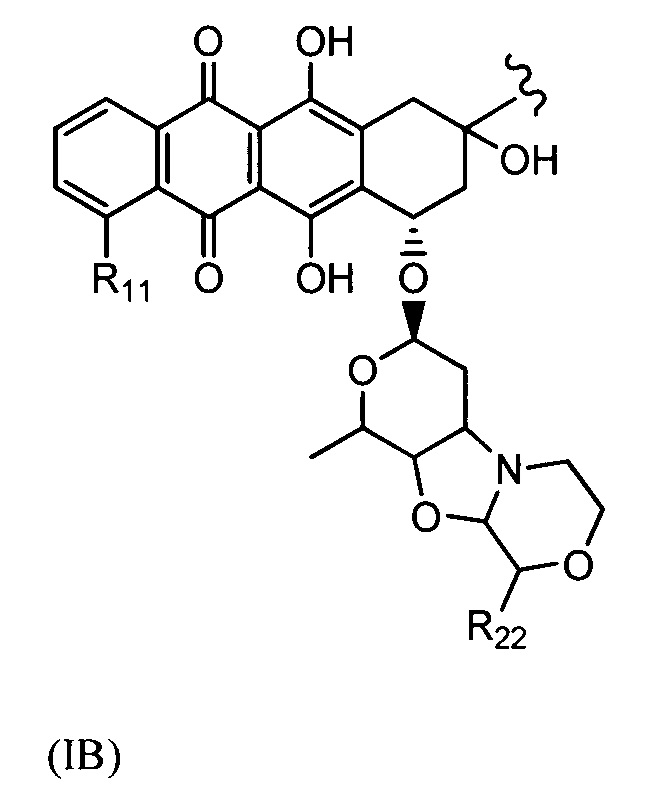 , где R11 представляет собой метокси-группу, и R22 представляет собой С1-С5 алкокси-группу. Также изобретение относится к двум вариантам непептидных соединений, пригодных для получения конъюгата, а также к способу лечения миелоидного лейкоза и фармацевтической композиции для его лечения. Предложенная группа изобретений предоставляет непептидные линкеры для ADC, которые могут расщепляться лизосомальными ферментами. 5 н. и 38 з.п. ф-лы, 2 ил., 7 пр.
, где R11 представляет собой метокси-группу, и R22 представляет собой С1-С5 алкокси-группу. Также изобретение относится к двум вариантам непептидных соединений, пригодных для получения конъюгата, а также к способу лечения миелоидного лейкоза и фармацевтической композиции для его лечения. Предложенная группа изобретений предоставляет непептидные линкеры для ADC, которые могут расщепляться лизосомальными ферментами. 5 н. и 38 з.п. ф-лы, 2 ил., 7 пр.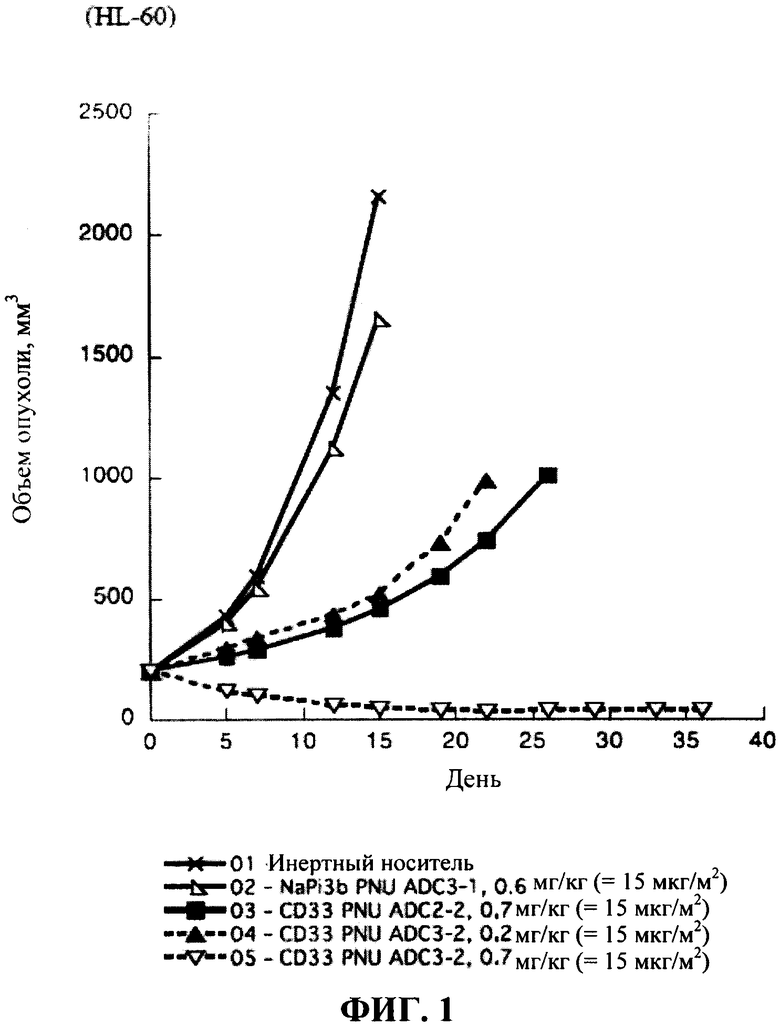
1. Конъюгат антитела с лекарственным средством для лечения злокачественной опухоли, представленный формулой (I)
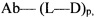
Ab представляет собой антитело, где антитело связывается с NaPi2b, CD33 или CD22;
L представляет собой пептидомиметический линкер, представленный следующей формулой
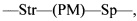 где
где
Str представляет собой растяжку, ковалентно прикрепленную к Ab;
Sp представляет собой связь или спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту;
РМ представляет собой непептидный химический фрагмент, выбранный из группы, состоящей из:
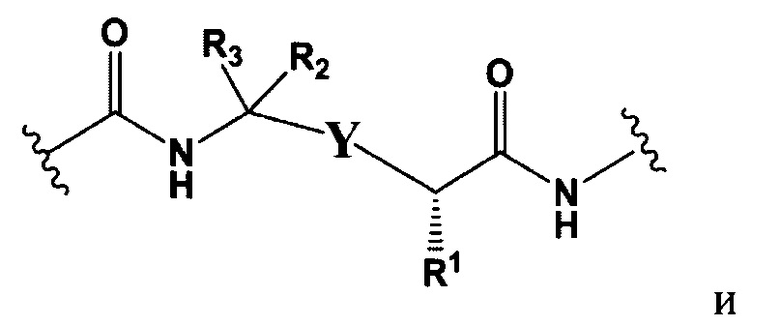
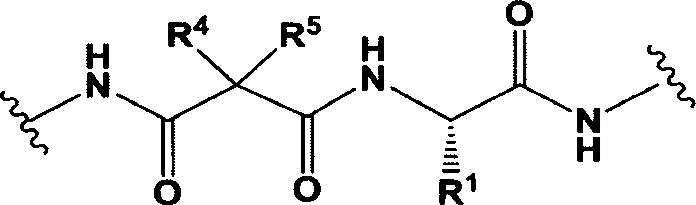
Y выбран из C1-С6алкенила,
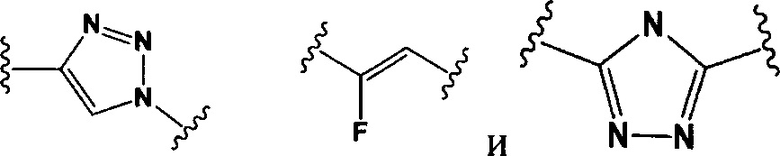
каждый R1 независимо представляет собой (С1-С10алкил)NHC(O)NH2;
R3 и R2, каждый независимо, представляют собой Н или C1-С10алкил;
R4 и R5 вместе могут образовывать С3-С7циклоалкильное кольцо;
р представляет собой целое число от 1 до 8;
D представляет собой лекарственный фрагмент формулы (IA) или (IB):
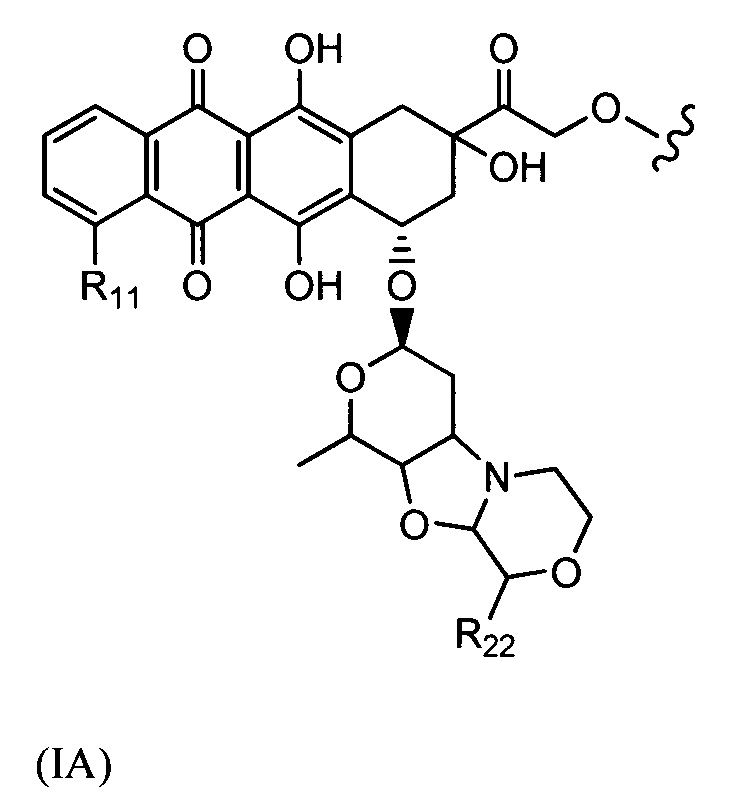

где R11 представляет собой метокси-группу, и R22 представляет собой С1-С5 алкокси-группу.
2. Конъюгат антитела с лекарственным средством по п. 1, где R4 и R5 вместе образуют циклобутильное кольцо.
3. Конъюгат антитела с лекарственным средством по п. 1, где
Str представляет собой химический фрагмент, представленный следующей формулой:
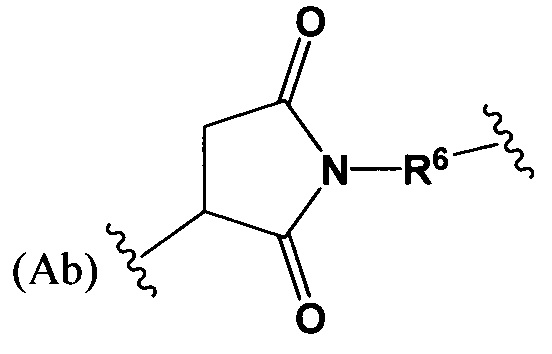
где R6 выбран из группы, состоящей из следующего: C1-С10алкилен, C1-С10алкенил, С3-С8циклоалкил, (С1-С8алкилен)O- и С1-С10алкилен-С(O)N(Ra)-С2-С6алкилен, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: галоген, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7гетероциклоалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или C1-С6алкил;
Sp представляет собой  , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
4. Конъюгат антитела с лекарственным средством по п. 1, где Str характеризуется формулой:
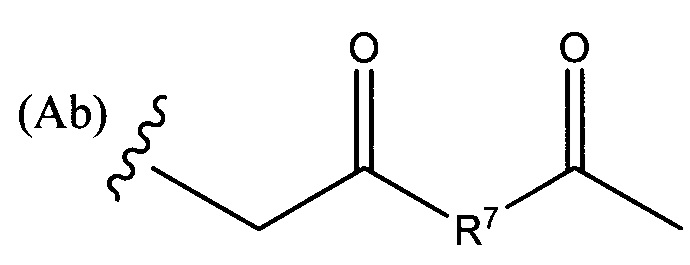
где R7 выбран из следующего: C1-С10алкилен, C1-С10алкенил, (С1-С10алкилен)O-, N(Rc)-(C2-C6 алкилен)-N(Rc) и N(Rc)-(С2-С6алкилен); где каждый Rc независимо представляет собой Н или C1-С6 алкил;
Sp представляет собой  , где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
, где Ar представляет собой арил или гетероарил, Rb представляет собой (С1-С10алкилен)O- или Sp представляет собой следующую формулу
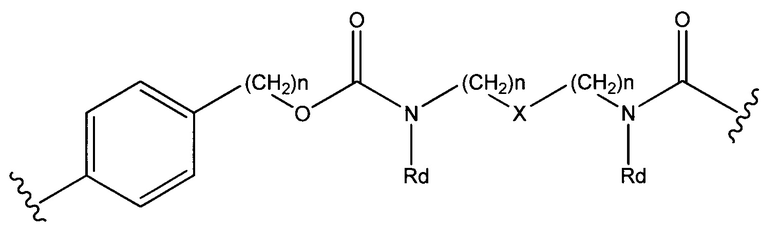
где
каждый n независимо представляет собой 1-6;
X представляет собой N, CH2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
5. Конъюгат антитела с лекарственным средством по п. 3, где
L представляет собой непептидный химический фрагмент, представленный следующей формулой
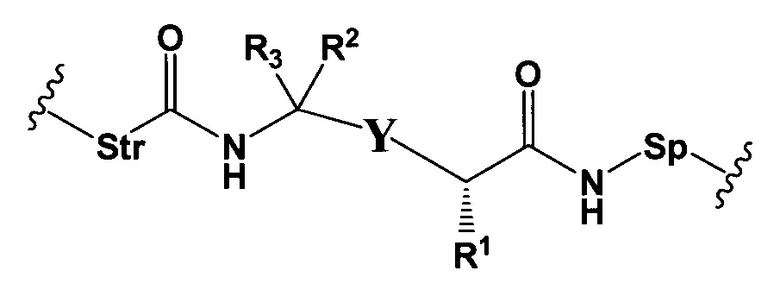
6. Конъюгат антитела с лекарственным средством по п. 3, где
L представляет собой непептидный химический фрагмент, представленный следующей формулой
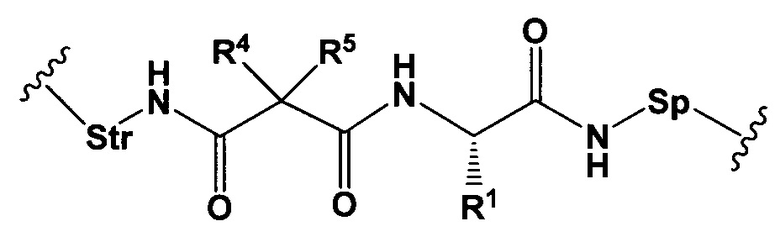
7. Конъюгат антитела с лекарственным средством по п. 3, представленный следующей формулой:
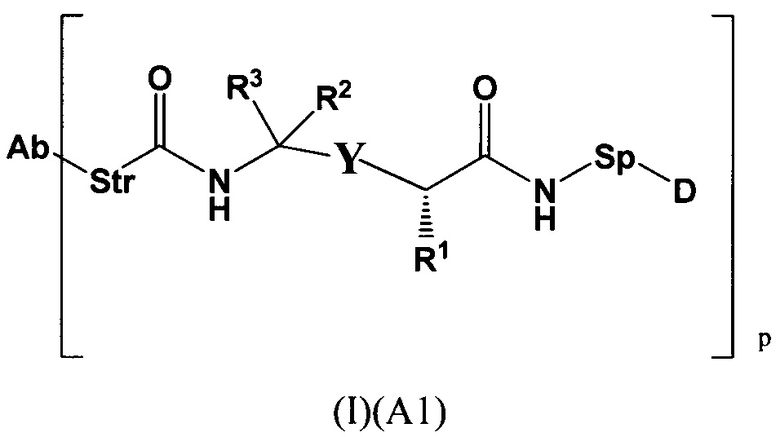
где
R6 выбран из группы, состоящей из C1-С10алкилена и С1-С10алкилен-С(O)N(Ra)-С2-С6алкилена, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: галоген, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7гетероциклоалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или C1-С6алкил;
р представляет собой 1, 2, 3 или 4.
8. Конъюгат антитела с лекарственным средством по п. 6, представленный следующей формулой:
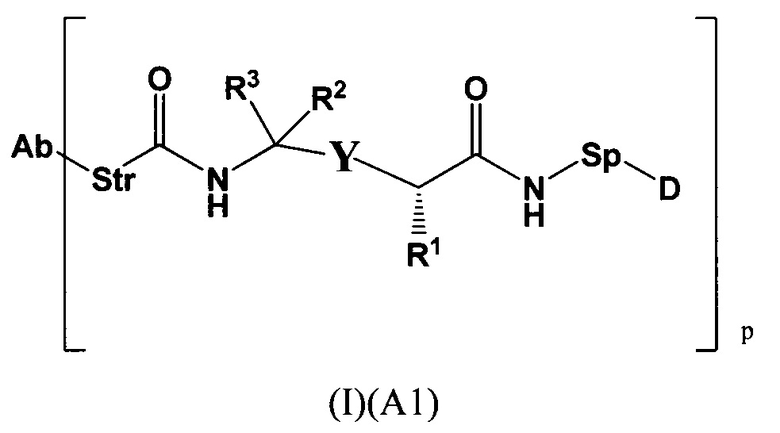
где
R6 выбран из группы, состоящей из C1-С10алкилена и С1-С10алкилен-С(O)N(Ra)-С2-С6алкилена, где каждый алкилен может быть замещен одним - пятью заместителями, выбранными из группы, состоящей из следующего: галоген, трифторметил, дифторметил, амино, алкиламино, циано, сульфонил, сульфонамид, сульфоксид, гидрокси, алкокси, сложный эфир, карбоновая кислота, алкилтио, арил, арилалкил, С3-С8циклоалкил, С4-С7гетероциклоалкил, гетероарилалкил и гетероарил, каждый Ra независимо представляет собой Н или C1-С6алкил;
р представляет собой 1, 2, 3 или 4.
9. Конъюгат антитела с лекарственным средством по п. 3, где R6 представляет собой C1-С10алкилен.
10. Конъюгат антитела с лекарственным средством по п. 9, где Y представляет собой
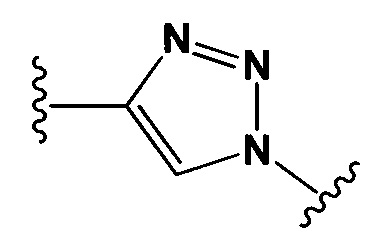
11. Конъюгат антитела с лекарственным средством по п. 9, где Y представляет собой
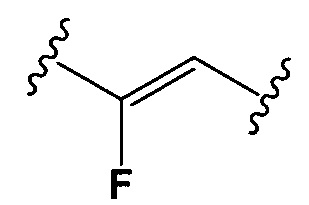
12. Конъюгат антитела с лекарственным средством по п. 9, где Y представляет собой
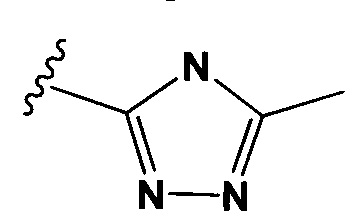
13. Конъюгат антитела с лекарственным средством по п. 7 где
Str представляет собой химический фрагмент, представленный следующей формулой:
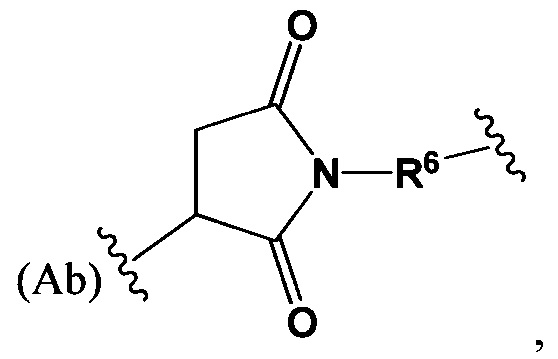
R6 представляет собой C1-С6алкилен;
Sp представляет собой следующую формулу
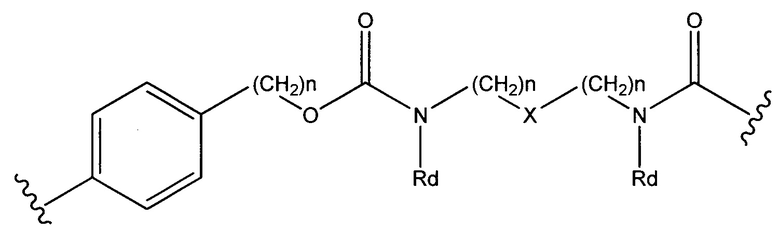
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
14. Конъюгат антитела с лекарственным средством по п. 7, которое представлено следующей формулой:

где
р представляет собой 1, 2, 3 или 4;
Sp представляет собой следующую формулу
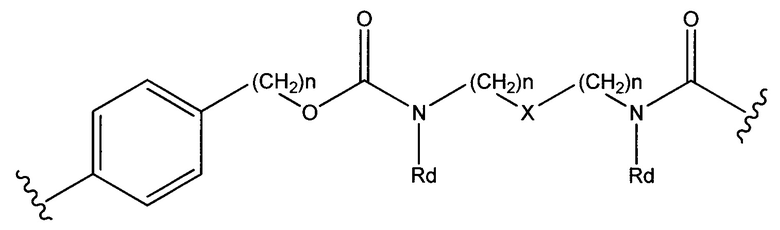
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
15. Конъюгат антитела с лекарственным средством по п. 6, которое представлено следующей формулой:
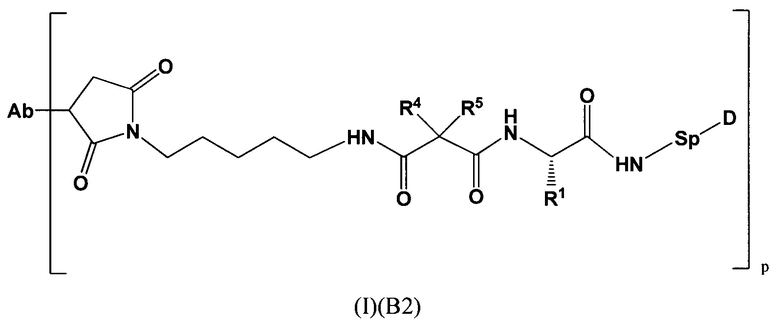
где
р представляет собой 1, 2, 3 или 4;
R1 представляет собой С1-С6алкил-NH2, (С1-С6алкил)NHC(NH)NH2 или (C1-С6алкил)NHC(O)NH2;
R4 и R5, каждый независимо, представляют собой C1-С6алкил, где указанный алкил является незамещенным, или R4 и R5 могут образовывать С3-С7циклоалкильное кольцо; и
Sp представляет собой следующую формулу
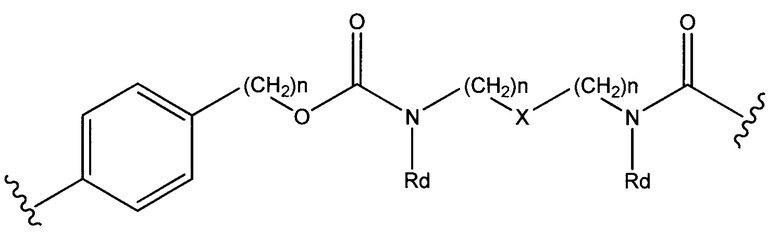
где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
16. Конъюгат антитела с лекарственным средством по любому из пп. 1-15, где р представляет собой 2.
17. Конъюгат антитела с лекарственным средством по любому из пп. 1-15, в котором антитело связывается с CD33.
18. Конъюгат антитела с лекарственным средством по п. 17, в котором антитело к CD33 содержит HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 11, HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 12, HVR-L3, содержащую аминокислотную последовательность согласно SEQ ID NO: 13, HVR-H1, содержащую аминокислотную последовательность согласно SEQ ID NO: 14, HVR-Н2, содержащую аминокислотную последовательность согласно SEQ ID NO: 15, и HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 16.
19. Конъюгат антитела с лекарственным средством по п. 17, в котором указанное антитело к CD33 содержит домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 17, и домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 18.
20. Конъюгат антитела с лекарственным средством по п. 17, в котором указанное антитело к CD33 содержит аминокислотную последовательность согласно SEQ ID NO: 19 и аминокислотную последовательность согласно SEQ ID NO: 20.
21. Конъюгат антитела с лекарственным средством по п. 17, в котором указанное антитело к CD33 содержит аминокислотную последовательность, которая характеризуется по меньшей мере 95% идентичностью последовательности относительно аминокислотной последовательности согласно SEQ ID NO: 19 и которая содержит аминокислотную последовательность, характеризующуюся по меньшей мере 95% идентичностью последовательности относительно аминокислотной последовательности согласно SEQ ID NO: 20.
22. Конъюгат антитела с лекарственным средством по любому из пп. 1-15, в котором антитело связывается с NaPi2b.
23. Конъюгат антитела с лекарственным средством по п. 22, в котором антитело к NaPi2b содержит HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 1, HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 2, HVR-L3, содержащую аминокислотную последовательность согласно SEQ ID NO: 3, HVR-H1, содержащую аминокислотную последовательность согласно SEQ ID NO: 4, HVR-Н2, содержащую аминокислотную последовательность согласно SEQ ID NO: 5, и HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 6.
24. Конъюгат антитела с лекарственным средством по п. 22, в котором указанное антитело к NaPi2b содержит домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 7, и домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 8.
25. Конъюгат антитела с лекарственным средством по п. 22, в котором указанное антитело к NaPi2b содержит аминокислотную последовательность согласно SEQ ID NO: 9 и аминокислотную последовательность согласно SEQ ID NO: 10.
26. Конъюгат антитела с лекарственным средством по п. 22, в котором указанное антитело к NaPi2b содержит аминокислотную последовательность, которая характеризуется по меньшей мере 95% идентичностью последовательности относительно аминокислотной последовательности согласно SEQ ID NO: 9 и которая содержит аминокислотную последовательность, характеризующуюся по меньшей мере 95% идентичностью последовательности относительно аминокислотной последовательности согласно SEQ ID NO: 10.
27. Конъюгат антитела с лекарственным средством по любому из пп. 1-15, в котором антитело связывается с CD-22.
28. Конъюгат антитела с лекарственным средством по п. 27, в котором антитело CD-22 содержит HVR-L1, содержащую аминокислотную последовательность согласно SEQ ID NO: 41, HVR-L2, содержащую аминокислотную последовательность согласно SEQ ID NO: 42, HVR-L3, содержащую аминокислотную последовательность согласно SEQ ID NO: 43, HVR-Н1, содержащую аминокислотную последовательность согласно SEQ ID NO: 44, HVR-H2, содержащую аминокислотную последовательность согласно SEQ ID NO: 45, и HVR-H3, содержащую аминокислотную последовательность согласно SEQ ID NO: 46.
29. Конъюгат антитела с лекарственным средством по п. 27, в котором указанное антитело к CD-22 содержит домен VL, содержащий аминокислотную последовательность согласно SEQ ID NO: 47, и домен VH, содержащий аминокислотную последовательность согласно SEQ ID NO: 48.
30. Конъюгат антитела с лекарственным средством по п. 27, в котором указанное антитело к CD-22 содержит аминокислотную последовательность согласно SEQ ID NO: 49 и аминокислотную последовательность согласно SEQ ID NO: 50.
31. Конъюгат антитела с лекарственным средством по п. 27, в котором указанное антитело к CD-22 содержит аминокислотную последовательность, которая характеризуется по меньшей мере 95% идентичностью последовательности относительно аминокислотной последовательности согласно SEQ ID NO: 49 и которая содержит аминокислотную последовательность, характеризующуюся по меньшей мере 95% идентичностью последовательности относительно аминокислотной последовательности согласно SEQ ID NO: 50.
32. Конъюгат антитела с лекарственным средством по п. 1, где Sp представляет собой следующую формулу:
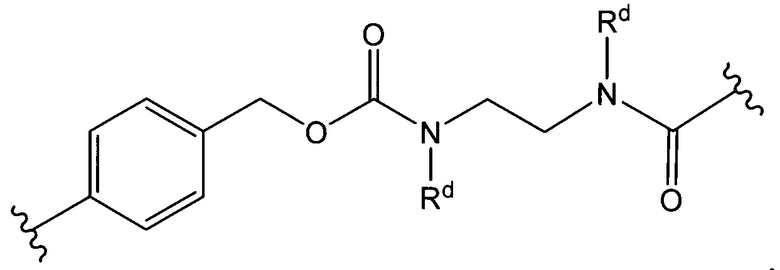
где каждый Rd независимо представляет собой Н или C1-С3алкил.
33. Непептидное соединение, пригодное для получения конъюгата антитела с лекарственным средством для лечения злокачественной опухоли формулы (I)(B)(LD1):
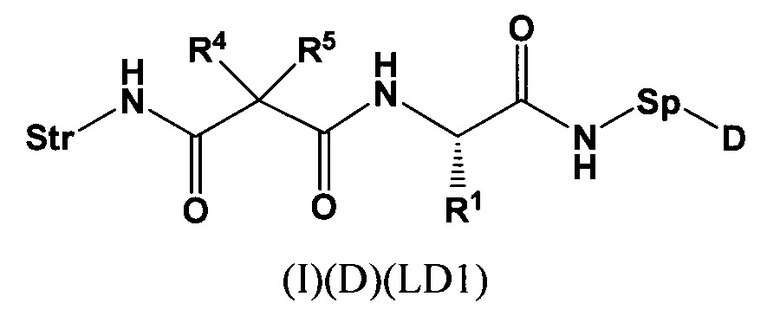
где
Str представляет собой растяжку, которая может быть ковалентно прикреплена к антителу;
Sp представляет собой связь или спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту;
R1 представляет собой (С1-С10алкил)NHC(O)NH2;
R4 и R5 могут образовывать С3-С7циклоалкильное кольцо;
D представляет собой лекарственный фрагмент формулы (IA) или (IB):
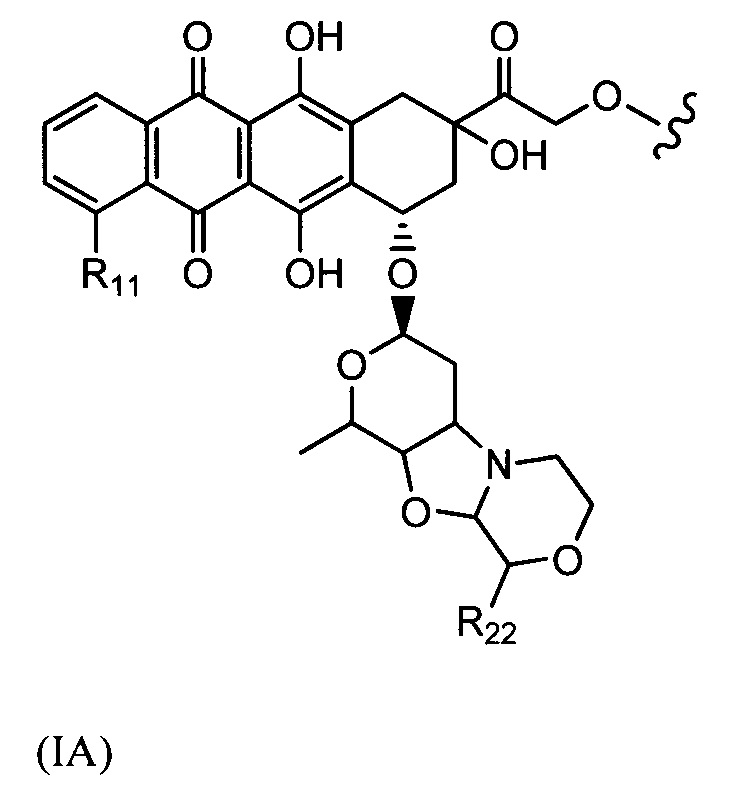
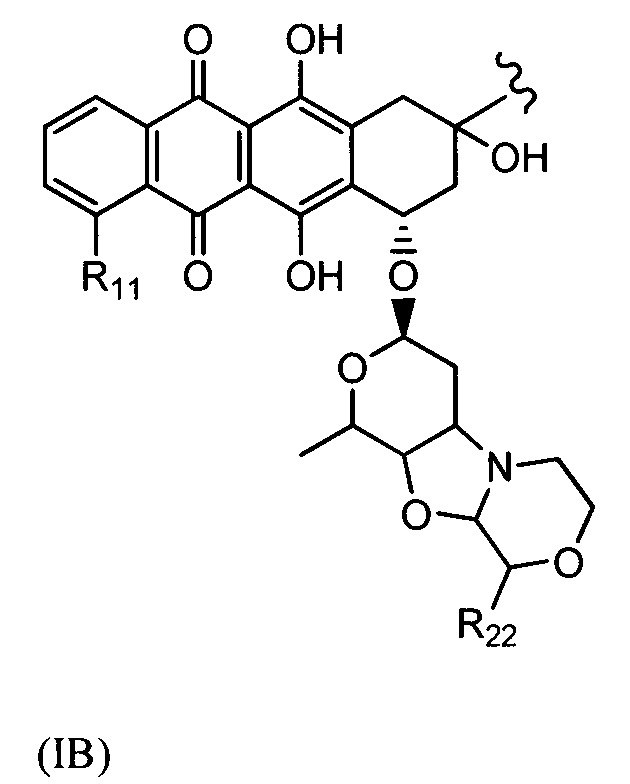
где R11 представляет собой метокси-группу, и R22 представляет собой С1-С5 алкокси-группу.
34. Непептидное соединение по п. 33, представленное следующей формулой
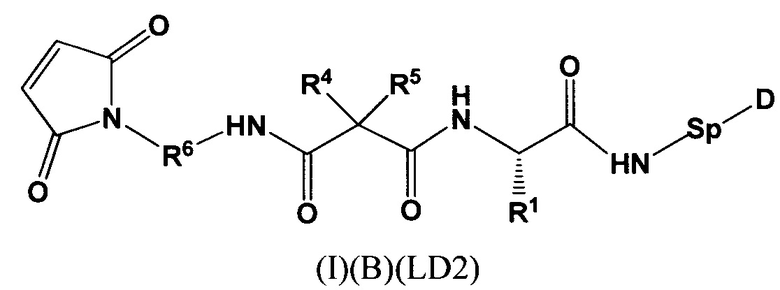
где R6 представляет собой C1-С10алкилен.
35. Непептидное соединение по п. 33, представленное следующей формулой
где
Sp представляет собой следующую формулу

где
каждый n независимо представляет собой 1-6;
X представляет собой N, СН2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
36. Непептидное соединение, пригодное для получения конъюгата антитела с лекарственным средством для лечения злокачественной опухоли формулы:
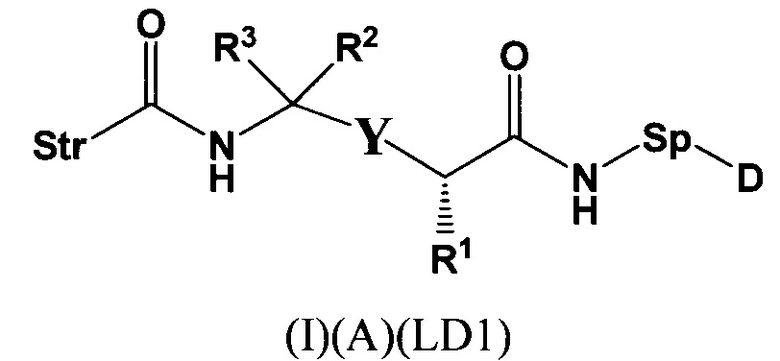
где
Str представляет собой растяжку, которая может быть ковалентно прикреплена к антителу;
Sp представляет собой необязательный спейсерный элемент, ковалентно прикрепленный к лекарственному фрагменту;
Y выбран из C1-С6алкенила,
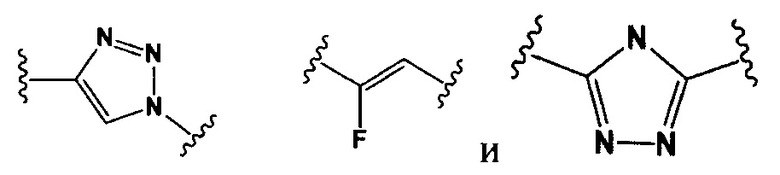
R1 представляет собой (C1-C10алкил)NHC(O)NH2;
R3 и R2, каждый независимо, представляют собой Н или C1-С10алкил;
D представляет собой лекарственный фрагмент формулы (IA) или (IB)
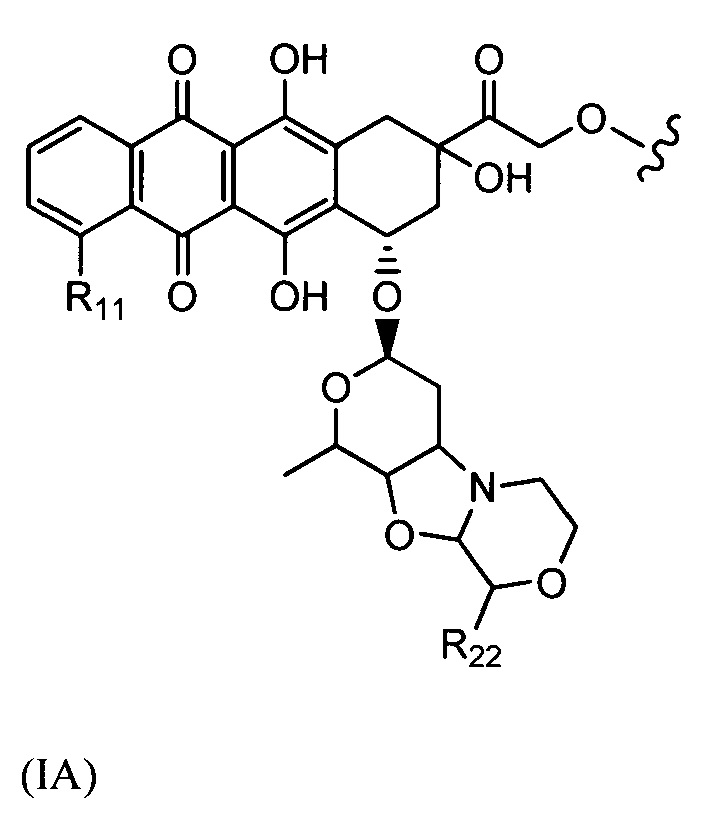
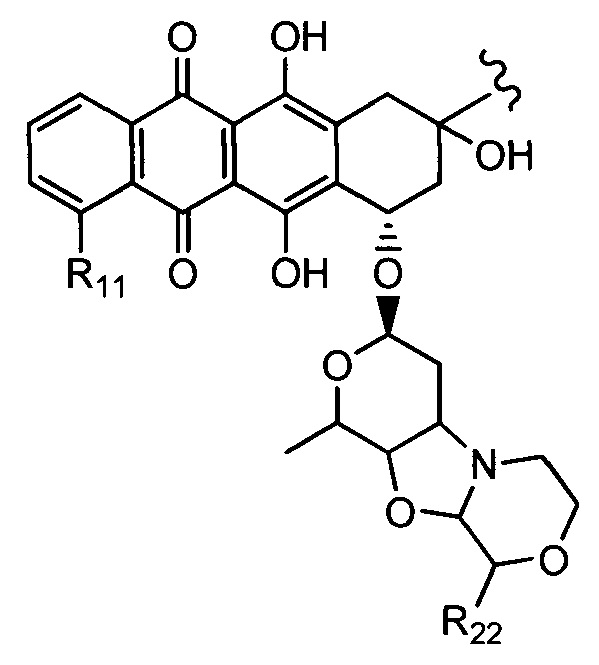
(IB), где R11 представляет собой метокси-группу, и R22 представляет собой С1-С5 алкокси-группу.
37. Непептидное соединение по п. 36, представленное следующей формулой:

где
R6 представляет собой C1-С10алкилен; и
Sp представляет собой следующую формулу
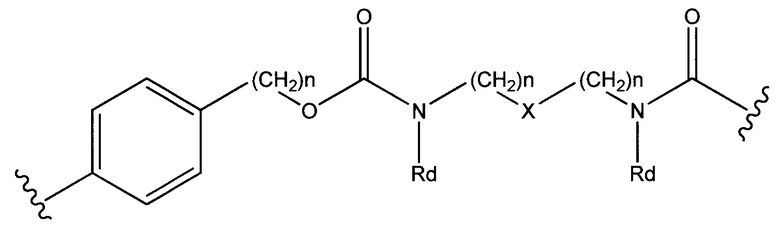
где
каждый n независимо представляет собой 1-6;
X представляет собой N, CH2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
38. Непептидное соединение по п. 37, представленное следующей формулой:

39. Непептидное соединение по п. 33 или 36, где Sp характеризуется следующей формулой:
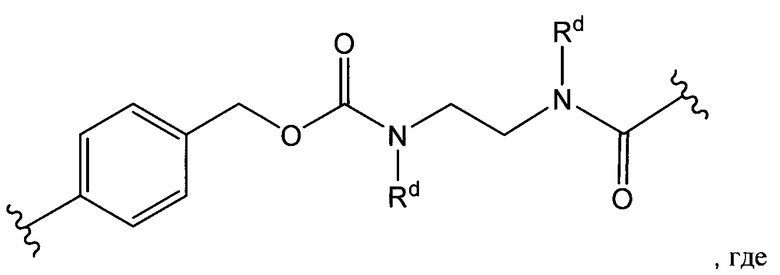
каждый Rd независимо представляет собой Н или C1-С3алкил.
40. Непептидное соединение по п. 33 или 36, где R6 представляет собой C1-С10алкилен,
Sp представляет собой следующую формулу
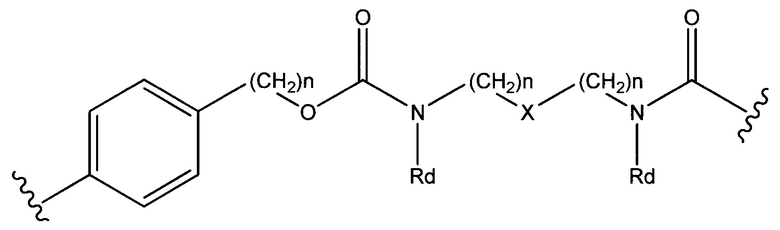
где
каждый n независимо представляет собой 1-6;
X представляет собой N, CH2 или связь; и
каждый Rd независимо представляет собой Н или C1-С3алкил.
41. Непептидное соединение по п. 33 или 36, где R6 представляет собой -(СН2)5.
42. Способ лечения злокачественной опухоли у нуждающегося в этом человека, включающий введение указанному человеку терапевтически эффективного количества конъюгата антитела с лекарственным средством по п. 1, где злокачественная опухоль представляет собой миелоидный лейкоз.
43. Фармацевтическая композиция для лечения злокачественной опухоли, содержащая терапевтически эффективное количество конъюгата антитела с лекарственным средством по п. 1 и его фармацевтически приемлемый носитель, где злокачественная опухоль представляет собой миелоидный лейкоз.
| Колосоуборка | 1923 |
|
SU2009A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| RU 2005119305 A, 20.01.2006. | |||
Авторы
Даты
2019-05-28—Публикация
2014-12-16—Подача