Область техники, к которой относится изобретение
Данное изобретение относится к лекарственным средствам с диацереином, в частности, к способу снижения уровня мочевой кислоты в крови с помощью этого лекарственного средства.
Описание предшествующего уровня техники
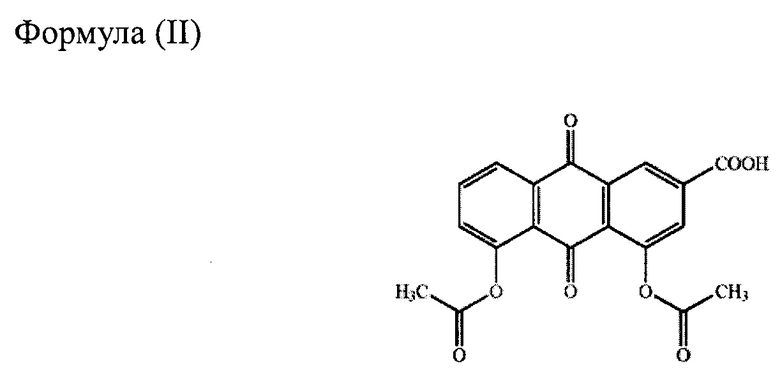
Химически реин представляет собой 9,10-дигидро-4,5дигидрокси-9,10-диоксо2-антраценкарбоновую кислоту, имеющую структуру формулы (I), и одно из его пролекарств, диацереин, представляет собой 4,5-бис(ацетилокси)-9,10-дигидро-4,5-дигидрокси-9,10-диоксо-2-антраценкарбоновую кислоту, имеющую структуру формулы (II). Диацереин полностью превращается в реин до того, как достигает системного кровотока, и выполняет в организме физиологическую функцию в форме реина. 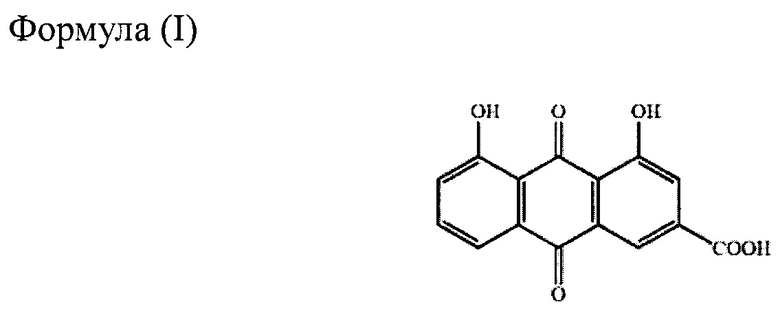
Диацереин является противовоспалительным агентом, широко используемым при лечении остеоартрита, который, как было продемонстрировано, ингибирует сигналинг интерлейкина-1 (IL-1). В настоящее время капсулы с диацереином доступны с дозировкой 50 мг и продаются в разных странах под различными торговыми наименованиями, включая Art 50®, Artrodar® и т.д. Как раскрыто в патенте США №8536152, диацереин также можно использовать в качестве дополнительного лечения сахарного диабета II типа. Хотя диацереин можно вводить пероральным путем, t он не может быть полностью абсорбирован пищеварительным трактом, и оральная биодоступность диацереина оценивается приблизительно как 40-60%. Неполная абсорбция диацереина может приводить к нежелательным побочным эффектам, таким как диарея или неоформленный стул. Исследования in vitro и in vivo показали, что неабсорбированный диацереин метаболизируется до реина в толстой кишке, что затем вызывает слабительный эффект. Таким образом, в данной области все еще существует потребность в лекарственного средстве с диацереином, имеющем уменьшенные неблагоприятные побочные эффекты и/или более высокую биодоступность по сравнению с текущими коммерческими лекарственными средствами.
Как раскрыто в патенте США №8865689, было обнаружено, что диацереин эффективен при снижении уровня мочевой кислоты в крови и может использоваться для лечения гиперурикемии или метаболического нарушения, связанного с гиперурикемией. Тем не менее, до сих пор не разработаны никакие лекарственные средства с диацереином, специфичные в отношении снижения уровня мочевой кислоты в крови.
Ввиду вышеуказанного требования настоящее изобретение предлагает лекарственное средство с диацереином, обладающий улучшенными свойствами, а также его применение в лечении заболеваний, включая, но не ограничиваясь ими, гиперурикемию, метаболические нарушения, связанные с гиперурикемией, остеоартрит и сахарный диабет II типа.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном осуществлении настоящее изобретение предлагает лекарственное средство с контролируемым высвобождением с уменьшенными неблагоприятными побочными эффектами и/или более высокой биодоступностью, содержащий слой с немедленным высвобождением и слой с замедленным высвобождением.
В другом осуществлении настоящее изобретение предлагает способ снижения уровня мочевой кислоты в крови, включающий введение указанного выше лекарственного средства с контролируемым высвобождением субъекту, который в этом нуждается.
В другом осуществлении настоящее изобретение предлагает способ снижения уровня мочевой кислоты в крови у субъекта, включающий введение субъекту, который в этом нуждается, лекарственного средства, содержащего терапевтически эффективное количество соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина, пролекарство и фармацевтически приемлемую соль, где при введении лекарственного средства указанному субъекту он обеспечивает, по меньшей мере, один из следующих фармакокинетических параметров: (i) максимальная концентрация Cmax реина в плазме выше 5,0 мкг/мл; (ii), площадь под кривой «время - концентрация» AUC0-t или AUC0-∞ реина выше 35,0 мкг ч/мл; (iii) Tmax примерно от 3 до 4,5 часов после перорального введения субъекту в условиях не натощак; и (iv) концентрация реина в плазме выше 2,8 мкг/мл в течение, по меньшей мере, 4 часов.
В другом осуществлении настоящее изобретение предлагает способ снижения уровня мочевой кислоты в крови у субъекта, включающий введение субъекту, который в этом нуждается, лекарственного средства, содержащего, по меньшей мере, примерно 75 мг соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина, его пролекарства и фармацевтически приемлемой соли.
Подробные технологии и предпочтительные варианты осуществлениия, реализованные для субъектов данного изобретения, описаны в последующих параграфах, прилагаемых графических материалах для специалистов в данной области для лучшего понимания особенностей заявленного изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
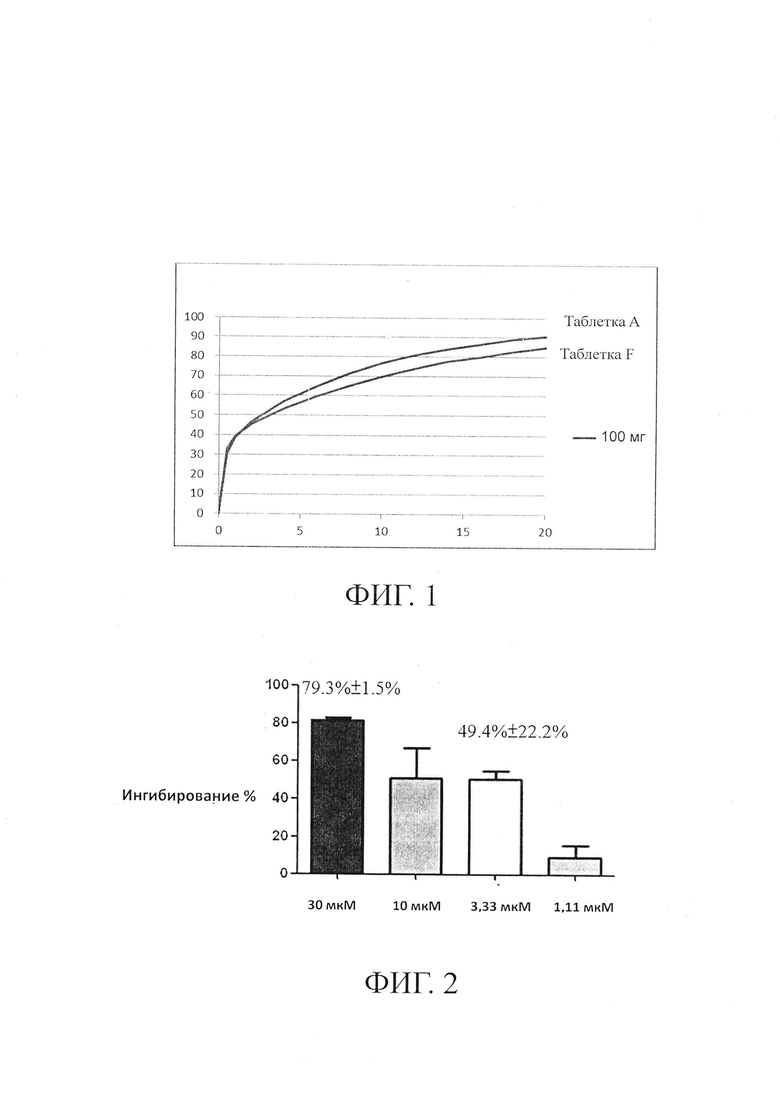
На Фиг. 1 показаны профили растворимости лекарственных средств А и F с контролируемым высвобождением согласно данному изобретению, измеренные с помощью аппарата United States Pharmacopeia (USP) Apparatus II (Paddle) при 50 об/мин в 900 мл PBS с рН 6,8 при 37°С;
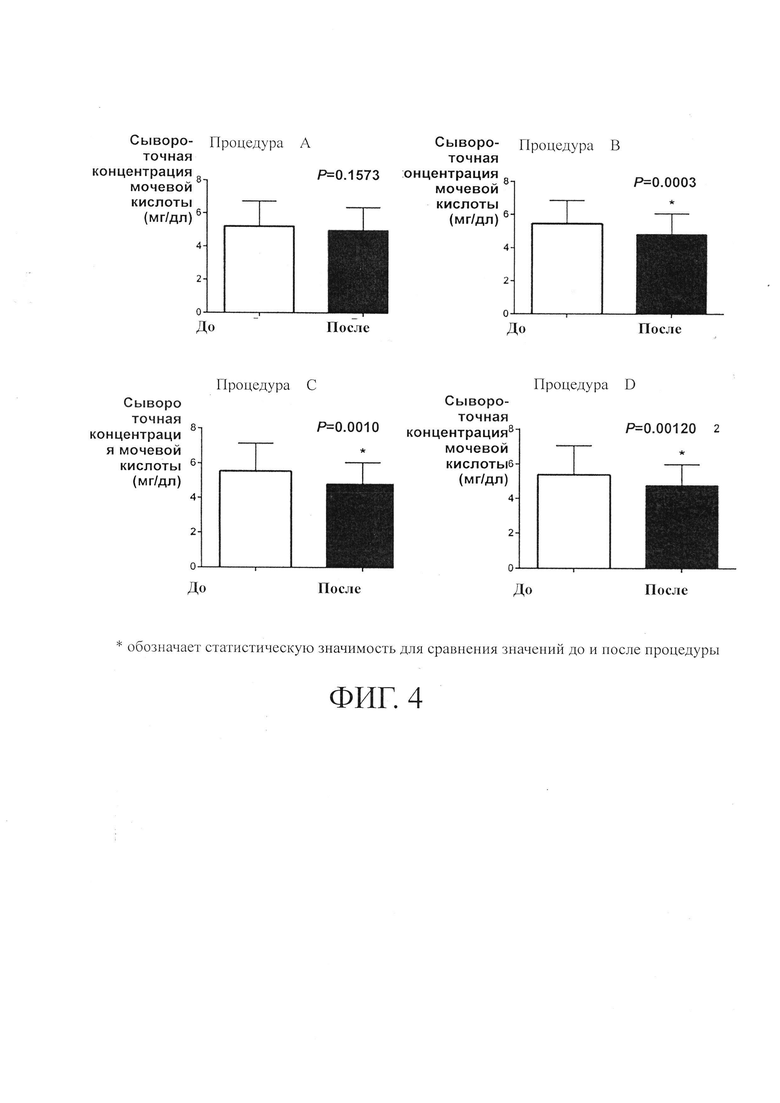
на Фиг. 2 представлена статистическая гистограмма, показывающая ингибирование поглощения мочевой кислоты при различных дозах реина;
на Фиг. 3 показаны усредненные профили «концентрация в плазме -время» реина после того, как пациентам ввели различные лекарственные средства с диацереином; а также
на Фиг. 4 представлена статистическая гистограмма, показывающая концентрацию мочевой кислоты в сыворотке крови до и после введения различных лекарственных средств с диацереином.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемый в данном документе термин «немедленное высвобождение», или «IR», означает, что лекарственный препарат (например, диацереин) высвобождается обычным или немодифицированным способом.
Используемый в данном документе термин «контролируемое высвобождение», или «CR», и «замедленное высвобождение», или «ER», относится к постепенному высвобождению лекарственного препарата с заданной скоростью, отличной от характера немедленного высвобождения, в течение определенного периода времени.
Используемый в данном документе термин «терапевтически эффективное количество» относится к количеству, которое облегчает или уменьшает один или более чем один из симптомов заболевания.
Используемый в данном документе термин «Cmax» относится к максимальной наблюдаемой концентрации в плазме крови, рассчитанной как усредненное значение для отдельных максимальных концентраций в плазме крови.
Используемый в данном документе термин «средняя концентрация в плазме» относится к арифметическому среднему значению концентрации в плазме крови.
Используемый в данном документе термин «Tmax» относится ко времени, при котором наблюдается пиковая (максимальная) концентрация лекарственного препарата в плазме крови для каждого индивидуума, участвующего в исследовании биодоступности.
Используемый в данном документе термин «AUC0-∞» или «AUCinf» относится к среднему значению площади под кривой «концентрация в плазме/сыворотке/крови - время», экстраполированной до бесконечности. Это значение рассчитывают как усредненное арифметическое площади под кривой «концентрация в плазме - время», экстраполированной до бесконечности, рассчитанной для каждого индивидуума, участвующего в исследовании биодоступности.
Используемый в данном документе термин «AUC0-t» относится к площади под кривой «концентрация в плазме/сыворотке/крови - время» от нулевого момента времени до момента времени t, где «t» является последней временной точкой забора образца с измеримой концентрацией для отдельного лекарственного средства.
Используемый в данном документе термин «диацереин или его аналоги» относится к диацереину, реину, моноацетилреину или его фармацевтически приемлемой соли или пролекарству.
Если не указано иное, то термины в единственном числе, используемые в данном описании (особенно в формуле изобретения ниже), должны пониматься как охватывающие и единственную, и множественную форму.
Как указано выше, для уменьшения неблагоприятных побочных эффектов и/или улучшения биодоступности диацереина данное изобретение предлагает лекарственное средство с контролируемым высвобождением, содержащий слой с немедленным высвобождением и слой с замедленным высвобождением.
В одном варианте осуществления слой с немедленным высвобождением содержит терапевтически эффективное количество соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина, его пролекарства и фармацевтически приемлемой соли (далее именуемого «диацереин или его аналоги»); наполнитель; связывающий агент; дезинтегрирующий агент; и смазывающий агент; а слой с замедленным высвобождением включает терапевтически эффективное количество диацереина или его аналогов, полимер с контролируемым высвобождением, наполнитель и смазывающий агент; где весовое отношение диацереина или его аналогов в слое с немедленным высвобождением к таковому в слое с замедленным высвобождением составляет от примерно 2:1 до примерно 1:9.
В одном варианте осуществления указанное лекарственное средство также содержит косметическое покрытие.
Предпочтительно, в лекарственном средств согласно настоящему изобретению слой с немедленным высвобождением содержит от примерно 5% до примерно 60% по весу, предпочтительно от примерно 5% до примерно 50% по весу диацереина или его аналогов; от примерно 30% до примерно 95% по весу, предпочтительно от примерно 40% до примерно 85% по весу наполнителя; от примерно 0,1% до примерно 20% по весу, предпочтительно от примерно 1% до примерно 10% по весу связывающего агента; от примерно 0,1% до примерно 20% по весу, предпочтительно от примерно 1% до примерно 10% по весу дезинтегрирующего агента; и от примерно 0,01% до примерно 5% по весу, предпочтительно от примерно 0,1% до примерно 2,5% по весу смазывающего у агента в расчете на общий вес слоя с немедленным высвобождением; и слой с замедленным высвобождением содержит от примерно 5% до примерно 60%, предпочтительно от примерно 5% до примерно 50% по весу диацереина или его аналогов; от примерно 1% до примерно 60% по весу, предпочтительно от примерно 10% до примерно 50% по весу полимера с контролируемым высвобождением; от примерно 1% до примерно 70% по весу, предпочтительно от примерно 10% до примерно 55% по весу наполнителя; и от примерно 0,01% до примерно 5% по весу, предпочтительно от примерно 0,1% до примерно 2,5% по весу смазывающего агента в расчете на общий вес слоя с замедленным высвобождением.
Примеры наполнителей включают, но не ограничиваются ими, моногидрат лактозы, безводную лактозу и крахмалы. Предпочтительно наполнитель представляет собой моногидрат лактозы.
Примеры связывающих агентов включают, но не ограничиваются ими, повидон, крахмал, желатин, трагакант, метилцеллюлозу, гипромеллозу и гидроксипропилцеллюлозу. Предпочтительно, связывающий агент представляет собой повидон.
Подходящие дезинтегрирующие агенты включают, но не ограничиваются ими, карбоксиметилцеллюлозу натрия, L-гидроксипропилцеллюлозу, кросповидон, кукурузный крахмал, натрия крахмала гликолят, натрия кроскармеллозу и альгиновую кислоту или ее натриевую соль. Предпочтительно дезинтегрирующий агент представляет собой кроскармеллозу натрия.
Подходящие смазывающие агенты включают, но не ограничиваются ими, легкую безводную кремниевую кислоту, тальк, стеариновую кислоту и ее цинковую, магниевую или кальциевую соль и полиэтиленгликоль. Предпочтительно смазывающий агент представляет собой стеарат магния.
Полимеры с контролируемым высвобождением, которые могут быть использованы в данном изобретении, могут представлять собой, например, гидроксипропилметилцеллюлозу (hydroxypropyl methylcellulose, НРМС), гидроксипропилцеллюлозу, альгинат натрия, карбомер, натрия карбоксиметил-целлюлозу, ксантановую камедь, гуаровую камедь, камедь бобов рожкового дерева, поливинилацетат, поливиниловый спирт, карбоксивиниловые полимеры, поливиниловые спирты, глюканы, склероглюканы, маннаны, ксантаны, альгиновую кислоту и ее производные, полиангидриды, полиаминокислоты, карбоксиметилцеллюлозу, сшитую натрия карбоксиметилцеллюлозу, поливинилпирролидон, сшитый поливинилпирролидон, карбоксиметиламид, сополимер метакрилата калия/дивинилбензола, крахмалы и их производные, β-циклодекстрин, производные декстрина с линейными или разветвленными цепями, этилцеллюлозу, метилцеллюлозу, сополимеры метакриловой кислоты и производные целлюлозы. Предпочтительно, полимер с контролируемым высвобождением представляет собой гидроксипропилметилцеллюлозу (НРМС).
Поскольку лекарственные средства согласно данному изобретению уменьшают неблагоприятные побочные эффекты, они могут доставлять более высокую дозу диацереина без усиления побочных эффектов, таких как диарея.
В частности, их можно вводить пациентам в более высокой дозе по сравнению с коммерческими препаратами диацереина (например, Artrodar®, 50 мг QD или BID, 50 или 100 мг в день в целом), и они могут содержать, по меньшей мере, примерно 75 мг, предпочтительно примерно от 75 до 200 мг, более предпочтительно примерно от 75 до 100 мг диацереина или его аналогов, тем самым повышая эффективность лечения в разовой дозе.
В другом объекте изобретения авторы данной заявки обнаружили, что лекарственное средство, содержащее, по меньшей мере, примерно 75 мг диацереина, более эффективен в снижении уровня мочевой кислоты в крови, чем Artrodar® (лекарственное средство с немедленным высвобождением, содержащий 50 мг диацереина). Таким образом, лекарственное средство согласно настоящему изобретению содержит предпочтительно, по меньшей мере, примерно 75 мг, более предпочтительно примерно от 75 до 200 мг, наиболее предпочтительно примерно от 75 до 100 мг диацереина или его аналогов.
В тесте на растворимость лекарственное средство с контролируемым высвобождением предпочтительно имеет скорость растворения in vitro, при измерении соглласно USP, Pharmacopeia (USP) с помощью аппарата (Paddle) при 50 об/мин в 900 мл PBS с рН 6,8 при 37°С, составляющую от примерно 30% до примерно 45%, предпочтительно от примерно 35% до примерно 40% по весу диацереина, высвобождаемого через 1 час; от примерно 50% до примерно 60% по весу диацереина, высвобождаемого через 4 часа; от примерно 60% до примерно 75%, предпочтительно от примерно 65% до примерно 75% по весу диацереина, высвобождаемого через 8 часов; и не менее 80% по весу диацереина, высвобождаемого через 16 часов.
В одном варианте осуществления лекарственное средство с контролируемым высвобождением согласно данному изобретению при введении субъекту может обеспечивать, по меньшей мере, один из следующих фармакокинетических параметров: (i) максимальная концентрация Cmax реина в плазме выше 5,0 мкг/мл; (ii) площадь под кривой «время - концентрация» AUC0-t или AUC0-∞ реина выше 35,0 мкг ч/мл; (iii) Tmax примерно от 3 до 4,5 часов после перорального введения субъекту в условиях не натощак; и (iv) концентрация реина в плазме выше 2,8 мкг/мл, в течение, по меньшей мере, 4 часов. Лекарственное средство, демонстрирующее указанные выше фармакокинетические параметры, демонстрирует уменьшенные „ неблагоприятные побочные эффекты, сниженный пищевой эффект, более высокую биодоступность и/или улучшенный эффект снижения уровня мочевой кислоты в крови по сравнению с обычным лекарственным средством с немедленным высвобождением.
Предпочтительно, лекарственное средство является одноразовым лекарственным средством с контролируемым высвобождением (т.е. принимается один раз в день).
Поскольку лекарственное средство согласно данному изобретению обладает вышеупомянутыми преимуществами, он может быть использован в лечении всех заболеваний,, при которых диацереин является терапевтически эффективным. Эти заболевания включают, но не ограничиваются ими, гиперурикемию, метаболическое нарушение, связанное с гиперурикемией, остеоартрит и сахарный диабет II типа. Метаболическое нарушение, связанное с гиперурикемией, включает, но не ограничивается ими, острую подагру, хроническую подагру, подагрический артрит, вспышки подагры, мочекислую нефропатию, подагрическую нефропатию, сердечно-сосудистые заболевания (например, гипертонию и атеросклероз), ожирение, хроническое заболевание почек и резистентность к инсулину.
Лекарственное средство можно использовать для уменьшения воспалительных влияний подагрического артрита и вспышек подагры, индуцированных гиперурикемией; и/или для растворения камней в почках; и/или для снижения частоты рецидивов острого воспалительного артрита, индуцированного гиперурикемией; и/или для замедления прогрессирования уратной нефропатии у субъекта.
В одном варианте осуществления указанное лекарственное средство может также содержать один или более чем один дополнительный терапевтический агент, такой как противовоспалительный агент или агент, -снижающий уровень уратов, для усиления терапевтического эффекта диацереина. Примеры противовоспалительных агентов включают, но не ограничиваются ими, нестероидные противовоспалительные препараты (non-steroidal anti-inflammatory drug, NSAID), кортикостероиды и колхицины. Примеры агентов, снижающих уровень уратов, включают, но не ограничиваются ими, ингибиторы ксантиноксидазы, урикозурические агенты, уратооксидазы, подщелачиватели мочи и фенофибрат.
Настоящее изобретение также относится к способу снижения уровня мочевой кислоты в крови у субъекта, включающему введение субъекту, нуждающемуся в этом, лекарственного средства, содержащего диацереин или его аналоги.
Лекарственные средства, которые могут быть использованы в этом способе, могут иметь структуру, состав и другие свойства, указанные выше для лекарственного средства согласно настоящему изобретению. Альтернативно, лекарственные средства, подходящие для этого способа, могут иметь отличающуюся структуру и лекарственное средство до тех пор, пока при введении субъекту они могут обеспечить, по меньшей мере, один из следующих фармакокинетических параметров: (i) максимальная концентрация Cmax реина в плазме выше 5,0 мкг/мл; (ii) площадь под кривой «время - концентрация» AUC0-t или AUC0-∞, реина выше 35,0 мкг ч/мл; (iii) Tmax примерно от 3 до 4,5 часов после перорального введения субъекту в условиях не натощак; и (iv) концентрация реина в плазме выше 2,8 мкг/мл в течение, по меньшей мере, 4 часов.
В другом варианте осуществления лекарственное средство, используемое в данном способе, содержит, по меньшей мере, примерно 75 мг, предпочтительно примерно от 75 до 200 мг, более предпочтительно примерно от 75 до 100 мг диацереина или его аналогов.
Далее настоящее изобретение будет более подробно проиллюстрировано со ссылкой на последующие примеры и эксперименты. Тем не менее, эти примеры приведены только с целью иллюстрации и не ограничивают объем данного изобретения.
[Пример получения] Получение лекарственного средства с контролируемым высвобождением, содержащего диацереин
В соответствии с таблицами 1 (а) и 1 (b) были приготовлены десять таблетированных лекарственных средств с контролируемым высвобождением, содержащих 75 или 100 мг диацереина. Полученные таблетки использовали в следующем исследовании in vivo. 

[ПРИМЕР 1] Количественные данные по растворению для лекарственного средства с контролируемым высвобождением диацереина
В этом примере растворение проводили с помощью аппарата USP Apparatus II (Paddle). В качестве среды для растворения использовали буферный раствор PBS с рН 6,8. Образцы отбирали с подходящими временными интервалами и анализировали на содержание диацереина с помощью жидкостной хроматографии высокого давления (high-pressure liquid chromatography, HPLC).
В таблице 2 приведены необработанные данные о растворимости таблеток А и F согласно данному изобретению, а на фиг.1 показаны профили растворимости.

[Пример 2] Анализ поглощения мочевой кислоты на основе URAT1
Мочевая кислота в основном выводится путем экскреции с мочой, и до 90% отфильтрованного урата повторно поглощается. Считается, что снижение скорости экскреции урата повышает уровень мочевой кислоты в сыворотке, что приводит к гиперурикемии. URAT1 (транспортер урата 1, ген SLC22A12) является основным транспортером, ответственным за канальцевую реабсорбцию уратов, и считается основным механизмом регулирования уровней уратов в крови. URAT1 генетически ассоциирован с уровнями уратов, а ингибирование URAT1 может снижать содержание мочевой кислоты в сыворотке.
В этом исследовании был разработан способ исследования in vitro hURAT1-опосредованного поглощения мочевой кислоты [8-14С] временно трансфицированными клетками НЕК293Т, клетками эмбриональной почки человека 293, содержащими транспортер URAT1.
После инкубации трансфицированных клеток НЕК293Т в течение 24-72 часов их повторно сеяли в микропланшет. По меньшей мере, через 12 часов после посева клеток культуральную среду удаляли и клетки промывали, а затем инкубировали в 100 мкл С1-свободного буфера HBSS в течение 5-10 минут. Буфер удаляли и добавляли 50 мкл на лунку С1-свободного буфера HBSS, содержащего 50 мкмоль мочевой кислоты [8-14С] (0,13 мкКи/лунка) с реином или без (в четырех дозах: 30, 10, 3,3 и 1,1 мкМ), к клеткам, инкубированным в течение 5 минут при 37°С. В конце инкубации поглощение мочевой кислоты [8-14С] прекращалось. Клетки промывали три раза и для лизиса к клеткам добавляли по 50 мкл на лунку 100 мМ NaOH, а затем их встряхивали при 600 об/мин в течение, по меньшей мере, 20 минут. Лизат клеток собирали и добавляли по 200 мкл на лунку UltimaGold ТМ XR scintillation, и смесь встряхивали при 600 об/мин в течение 10 минут. Наконец, микропланшет анализировали. Результаты показаны на фиг. 2. 2.
На ФИГ. 2 показано, что поглощение мочевой кислоты ингибировалось реином при 3,3 и 10 мкМ со значением 49,4±22,2% и при 30 мкМ со значением 79,3±1,5%. IC50 реина в ингибировании URAT1 составляет 10 мкМ, что составляет примерно 2,8 мкг/мл. Поддержание концентрации реина в плазме, превышающей 2,8 мкг/мл, может оказывать понижающее действие на уровень мочевой кислоты.
Это исследование показывает, что диацереин или его аналоги могут снижать уровень мочевой кислоты в сыворотке путем ингибирования URAT1 и, таким образом, могут быть использозаны для лечения гиперурикемии и метаболического нарушения, связанного с гиперурикемией.
[ПРИМЕР 3] Фармакокинетическое исследование
Фаза 1 рандомизированного, открытого (без контроля плацебо), однодозового, с 4 вариантами введения, 4 последовательностями введения, 4 периодами продолжительности, перекрестного фармакокинетического исследования лекарственного средства с диацереином с немедленным высвобождением (капсулы Artrodar® 50 мг) и трех разных доз лекарственного средства с контролируемым высвобождением диацереина согласно настоящему изобретению была проведена на здоровых добровольцах мужского и женского пола в условиях не натощак.
Методология: Было проведено 4-стороннее перекрестное сравнительное фармакокинетическое исследование Artrodar® 50 мг и трех разных доз лекарственного средства с контролируемым высвобождением (75, 100 и 200 мг) при пероральцом введении здоровым добровольцам мужского и женского пола. Имел место 7-дневный период вымывания, разделяющий периоды введения.
Субъекты: Здоровые добровольцы отвечали всем критериям включения и ни одному из критериев исключения из исследования.
Процедура: Диацереин, вводимый в разных лекарственных средствах и дозах, сравнивали рандомизированным способом с периодом вымывания 7 дней между периодами. Добровольцы были случайным образом назначены на одну из последовательностей лечения, как показано в следующей таблице 3. Исследование начинали со скринингового посещения. В исследовании участвовали только подходящие добровольцы.

- Процедура А: 1 капсула Artrodar® 50 мг
- Процедура В: 1 таблетка 75 мг
- Процедура С: 1 таблетка 100 мг
- Процедура D: 2 таблетки 100 мг (200 мг)
Сравнение различных лекарственных средств и доз основано на сравнении у одного добровольца, а не между добровольцами. По оценкам, период вымывания продолжительностью 7 дней был достаточным для предотвращения переходящих влияний предыдущих процедур.
Статистический способ(ы) оценки эффективности / фармакокинетики: AUC0-t, AUC0-∞, Cmax и Tmax для реина в плазме популяции по протоколу (per-protocol, РР) определяли и вычисляли с помощью некомпартментных подходов. Для AUC0-t, AUC0-∞, Cmax и Tmax использовали дисперсионный анализ (ANOVA). Tmax анализировали с использованием дополнительного непараметрического теста (тест Уилкоксона).
Оценку безопасности проводили для всех добровольцев, которым была введена хотя бы одна доза исследуемого препарата. Исследователь получал и регистрировал все наблюдаемые неблагоприятные события (adverse event, АЕ) на индивидуальной регистрационной карте (case report form, CRF) или от тех, кто добровольно сообщал о них, включая оценку интенсивности и связи с исследуемыми продуктами. Для всех АЕ исследователь искал и получал информацию, достаточную для определения как исхода АЕ, так и того, соответствует ли он какому-либо критерию серьезности. Все АЕ должны были наблюдаться до разрешения или до стабилизации на уровне, приемлемом для исследователя.
Результаты фармакокинетики показаны в таблицах 4 и 5 и на фиг.3. Субъекты (n=23) были подвергнуты скринингу, и 16 добровольцев были рандомизированы в исследование. 13 добровольцев завершили полное исследование (4 периода) для оценки фармакокинетики в популяции по протоколу. В последующих таблицах приведены данные только для этих добровольцев. 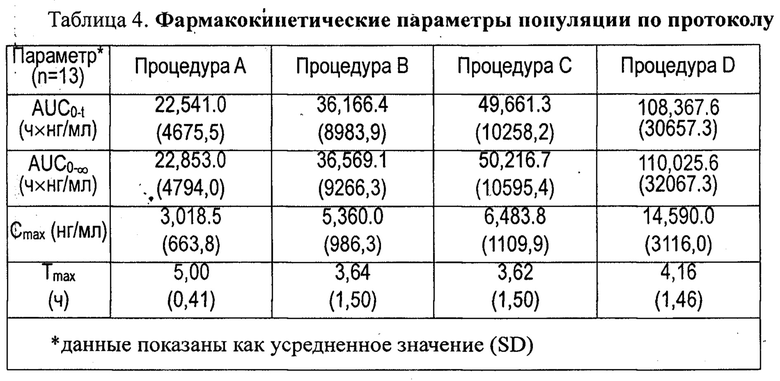

Результаты оценки безопасности представлены в Таблице 6. О значительных неблагоприятных событиях, смерти или серьезных неблагоприятных событиях не сообщалось. Во время исследования наиболее часто сообщаемыми побочными эффектами были диарея, сопровождаемая тошнотой, рвота, сыпь, повышенный уровень креатина, фосфокиназы в крови, контактный дерматит, гипотония и сонливость. Случаи диареи были почти одинаковыми для капсулы 50 мг и таблеток 75 мг и 100 мг. Сообщалось, что все побочные явления были слабыми по интенсивности и разрешались в конце. В заключение, капсулы Artrodar® 50 мг и таблетки 75, 100 и 200 мг безопасны в применении. 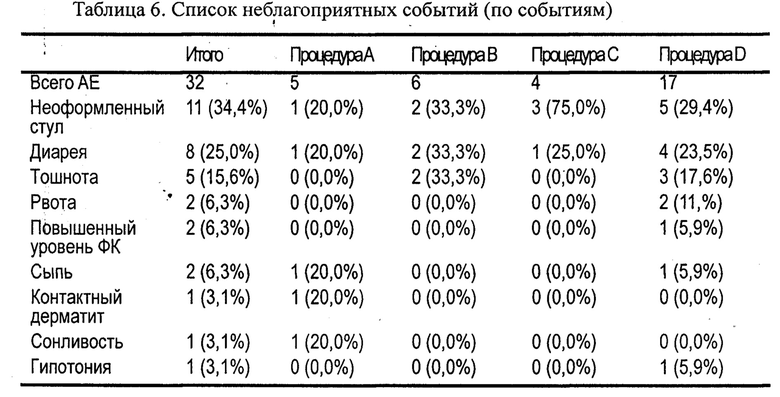
Приведенные выше результаты показали, что лекарственные средства с контролируемым высвобождением согласно данному изобретению демонстрируют Cmax реина выше 5,0 мкг/мл, AUC0-t или AUC0-∞ реина выше 35,0 мкг час/мл и Tmax примерно от 3 до 4,5 часов. Кроме того, лекарственные средства согласно данному изобретению обеспечивали концентрацию реина в крови выше 2,8 мкг/мл (эффективную концентрацию введения в примере 2) в течение, по меньшей мере, 4 часов (введение В: 4,2 часа; введение С: 7 часов; введение D: 12,7 часов) и имели большую биодоступность, чем коммерческий t препарат с немедленным высвобождением, с примерно на 10% более высокими нормированными по дозе значениями AUC и Cmax. Было обнаружено, что значения AUC и Cmax в целом пропорциональны увеличению доз диацереина.
Лекарственные средства с контролируемым высвобождением в дозе 75 мг и 100 мг имели переносимость, сходную с лекарственным средством с немедленным высвобождением в дозе 50 мг, тогда как доза 200 мг была связана с более высокой частотой желудочно-кишечных случаев АЕ. Таким образом, по сравнению с лекарственным средством Artrodar® лекарственные средства согласно данному изобретению продемонстрировали повышенную безопасность при более высоких дозах в дозе 75 мг и 100 мг и, соответственно, уменьшенные неблагоприятные побочные эффекты. Это позволяет вводить пациентам более высокую дозу 75 или 100 мг один раз в день без усиления побочных эффектов.
Средние достигнутые пиковые значения концентрации реина в крови составляли примерно 3,62-4,16 ч после введения в группе согласно данному изобретению, поучавшей таблетки, и 5,00 ч после введения в группе, получавшей капсулы Artrodar® в условиях не натощак. Было продемонстрировано, что натощак Tmax диацереина составляет 2,4 часа после однократного перорального введения 50 мг здоровым добровольцам и увеличивается до 5,2 часов при приеме пищи (Petitjean et al., Clinical Pharmacokinetics, November 1998, Volume 35, Issue 5, pp 347-359). Лекарственные средства согласно данному изобретению быстрее абсорбировались в условиях не натощак и показали меньший пищевой эффект по сравнению с капсулой Artrodar®.
ПРИМЕР 4 Исследование сывороточных уровней мочевой кислоты
При исследовании лекарственного средства с немедленным высвобождением диацереина (капсула Artrodar® 50 мг) и трех разных доз лекарственного средства с контролируемым высвобождением диацереина согласно данному изобретению была проведена оценка снижения уровня мочевой кислоты в сыворотке у здоровых добровольцев в условиях не натощак.
В фармакокинетическом исследовании согласно примеру 3 влияние Artrodar® 50 мг и трех разных доз таблеток согласно данному изобретению (75, 100 и 200 мг) на уровень мочевой кислоты в сыворотке здоровых добровольцев в условиях не натощак также были подвергнуты анализу для популяции по назначенному лечению (intend-to-treat, ITT). Было проанализировано 15 субъектов. Сывороточные концентрации мочевой кислоты сравнивали до и после лечения с помощью парного t-теста.
Результаты показаны на фиг. 4. Сывороточные концентрации мочевой кислоты после процедуры A (Artrodarr 50 мг) существенно не отличались от таковых после введения. Тем не менее, концентрация мочевой кислоты в сыворотке была снижена после введения В по сравнению со значением до введения. Те же результаты были продемонстрированы и при процедуре С и процедуре D. Такая разница в снижении уровня мочевой кислоты в сыворотке может быть обусловлена продолжительностью, с которой реин сохранялся в крови в эффективной концентрации выше 2,8 мкг/мл. Как показано на фиг. 3, процедура А позволяло достичь концентрации реина в крови выше 2,8 мкг/мл в течение довольно короткого периода времени, что было недостаточным для эффекта снижения уровня уратов.
Это исследование показало, что сывороточный уровень мочевой кислоты значительно снижался при введении лекарственного средства с контролируемым высвобождением согласно данному изобретению в различых дозах выше 75 мг.
Приведенное выше описание изобретения относится к подробному техническому содержанию и его изобретательским признакам. Специалисты в данной области смогут провести множество модификаций и замен на основе описания и предложений описанного изобретения, не отступая от его характеристик.

Группа изобретений относится к медицине, а именно к снижению уровня мочевой кислоты в крови. Для этого пациенту, нуждающемся в этом, вводят лекарственное средство с контролируемым высвобождением, содержащее слой с немедленным высвобождением, содержащий от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 30% до 95% по весу наполнителя; от 0,1% до 20% связывающего агента; от 0,1% до 20% по весу дезинтегрирующего агента; и от 0,01% до 5% по весу смазывающего агента; и слой с замедленным высвобождением, содержащим от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 1% до 60% по весу полимера с контролируемым высвобождением; от 1% до 70% по весу наполнителя и от 0,01% до 5% смазывающего агента в расчете на общий вес слоя с замедленным высвобождением; при этом весовое отношение указанного соединения в слое с немедленным высвобождением к таковому в слое с замедленным высвобождением составляет от 2:1 до 1:9. Также раскрыто лекарственное средство с контролируемым высвобождением. Изобретение обеспечивает снижение уровня мочевой кислоты в крови у пациента и при этом лекарственное средство обеспечивает концентрацию реина в плазме выше 2,8 мкг/мл в течение 4 часов. 3 н. и 8 з.п. ф-лы, 4 ил., 6 табл., 4 пр.
1. Способ снижения уровня мочевой кислоты в крови у пациента, включающий введение пациенту, который в этом нуждается, лекарственного средства с контролируемым высвобождением, содержащего слой с немедленным высвобождением и слой с замедленным высвобождением, где слой с немедленным высвобождением содержит терапевтически эффективное количество соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; наполнитель; связывающий агент; дезинтегрирующий агент; и смазывающий агент; а слой с замедленным высвобождением содержит терапевтически эффективное количество соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; полимер с контролируемым высвобождением; наполнитель; и смазывающий агент; где слой с немедленным высвобождением содержит от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 30% до 95% по весу наполнителя; от 0,1% до 20% связывающего агента; от 0,1% до 20% по весу дезинтегрирующего агента; и от 0,01% до 5% по весу смазывающего агента; а слой с замедленным высвобождением содержит от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 1% до 60% по весу полимера с контролируемым высвобождением; от 1% до 70% по весу наполнителя; и от 0,01% до 5% смазывающего агента в расчете на общий вес слоя с замедленным высвобождением; и где весовое отношение указанного соединения в слое с немедленным высвобождением к таковому в слое с замедленным высвобождением составляет от 2:1 до 1:9; где при введении лекарственного средства указанному пациенту, лекарственное средство обеспечивает концентрацию реина в плазме выше 2,8 мкг/мл в течение 4 часов, и где общее количество указанного соединения лекарственного средства с контролируемым высвобождением составляет от 75 мг до 100 мг, и где указанный пациент имеет заболевание или патологическое состояние, выбранное из группы, состоящей из гиперурикемии, метаболического нарушения, связанного с гиперурикемией, остеоартрита и сахарного диабета II типа.
2. Способ по п. 1, где полимер с контролируемым высвобождением выбран из группы, включающей гидроксипропилметилцеллюлозу (НРМС), гидроксипропилцеллюлозу, альгинат натрия, карбомер, натрия карбоксиметилцеллюлозу, ксантановую камедь, гуаровую камедь, камедь бобов рожкового дерева, поливинилацетат, поливиниловый спирт, карбоксивиниловые полимеры, поливиниловые спирты, глюканы, склероглюканы, маннаны, ксантаны, альгиновую кислоту и ее производные, полиангидриды, полиаминокислоты, карбоксиметилцеллюлозу, натрия карбоксиметилцеллюлозу сшитую, поливинилпирролидон, сшитый поливинилпирролидон, карбоксиметиламид, сополимер метакрилата калия/дивинилбензола, крахмалы и их производные, β-циклодекстрин, производные декстрина с линейными или разветвленными цепями, этилцеллюлозу, метилцеллюлозу, сополимеры метакриловой кислоты, производные целлюлозы и любые их комбинации.
3. Способ по п. 1, где лекарственное средство содержит 75 мг диацереина.
4. Способ по п. 1, где при введении лекарственного средства указанному пациенту, лекарственное средство обеспечивает один из следующих фармакокинетических параметров: (i) максимальная концентрация Cmax реина в плазме выше 5,0 мкг/мл; (ii) площадь под кривой «время - концентрация» AUC0-t или AUC0-∞ реина выше 35,0 мкг ч/мл; (iii) Tmax от 3 до 4,5 часов после перорального введения субъекту в условиях не натощак.
5. Способ по п. 1, где лекарственное средство является лекарственным средством с контролируемым высвобождением с однократным приемом в день.
6. Способ снижения уровня мочевой кислоты в крови у пациента, включающий введение пациенту, который в этом нуждается, лекарственного средства, содержащего терапевтически эффективное количество соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и фармацевтически приемлемой соли, где при введении лекарственного средства указанному пациенту лекарственное средство обеспечивает один из следующих фармакокинетических параметров: (i) максимальная концентрация Cmax реина в плазме выше 5,0 мкг/мл; (ii) площадь под кривой «время - концентрация» AUC0-t или AUC0-∞ реина выше 35,0 мкг ч/мл; (iii) Tmax от 3 до 4,5 часов после перорального введения субъекту в условиях не натощак; и (iv) концентрация реина в плазме выше 2,8 мкг/мл в течение 4 часов-., где лекарственное средство это лекарственное средство с контролируемым высвобождением и содержит слой немедленного высвобождения и слой с замедленным высвобождением, где слой с немедленным высвобождением содержит от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 30% до 95% по весу наполнителя; от 0,1% до 20% связывающего агента; от 0,1% до 20% по весу дезинтегрирующего агента; и от 0,01% до 5% по весу смазывающего агента; а слой с замедленным высвобождением содержит от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 1% до 60% по весу полимера с контролируемым высвобождением; от 1% до 70% по весу наполнителя; и и от 0,01% до 5% смазывающего агента в расчете на общий вес слоя с замедленным высвобождением; и где весовое отношение указанного соединения в слое с немедленным высвобождением к таковому в слое с замедленным высвобождением составляет от 2:1 до 1:9; где при введении лекарственного средства указанному пациенту, лекарственное средство обеспечивает концентрацию реина в плазме выше 2,8 мкг/мл в течение 4 часов, и где общее количество указанного соединения лекарственного средства с контролируемым высвобождением составляет от 75 мг до 100 мг.
7. Способ по п. 6, где лекарственное средство содержит 75 мг соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и фармацевтически приемлемой соли.
8. Лекарственное средство с контролируемым высвобождением с уменьшенными неблагоприятными побочными эффектами, содержащее слой с немедленным высвобождением и слой с замедленным высвобождением, где весовое отношение указанного соединения в слое с немедленным высвобождением к таковому в слое с замедленным высвобождением составляет от 2:1 до 1:9, где слой с немедленным высвобождением содержит от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 30% до 95% по весу наполнителя; от 0,1% до 20% связывающего агента; от 0,1% до 20% по весу дезинтегрирующего агента; и от 0,01% до 5% по весу смазывающего агента; а слой с замедленным высвобождением содержит от 5% до 60% по весу соединения, выбранного из группы, состоящей из диацереина, реина, моноацетилреина и его фармацевтически приемлемой соли; от 1% до 60% по весу полимера с контролируемым высвобождением; от 1% до 70% по весу наполнителя; и от 0,01% до 5% смазывающего агента в расчете на общий вес слоя с замедленным высвобождением; и где весовое отношение указанного соединения в слое с немедленным высвобождением к таковому в слое с замедленным высвобождением составляет от 2:1 до 1:9; где при введении лекарственного средства указанному пациенту, лекарственное средство обеспечивает концентрацию реина в плазме выше 2,8 мкг/мл в течение 4 часов, и где общее количество указанного соединения лекарственного средства с контролируемым высвобождением составляет от 75 мг до 100 мг.
9. Лекарственное средство по п. 8, где полимер с контролируемым высвобождением выбран из группы, включающей гидроксипропилметилцеллюлозу (НРМС), гидроксипропилцеллюлозу, альгинат натрия, карбомер, натрия карбоксиметилцеллюлозу, ксантановую камедь, гуаровую камедь, камедь бобов рожкового дерева, поливини л ацетат, поливиниловый спирт, карбоксивиниловые полимеры, поливиниловые спирты, глюканы, склероглюканы, маннаны, ксантаны, альгиновую кислоту и ее производные, полиангидриды, полиаминокислоты, карбоксиметилцеллюлозу, сшитую натрия карбоксиметилцеллюлозу, поливинилпирролидон, сшитый поливинилпирролидон, карбоксиметиламид, сополимер метакрилата калия/дивинилбензола, крахмалы и их производные, β-циклодекстрин, производные декстрина с линейными или разветвленными цепями, этилцеллюлозу, метилцеллюлозу, сополимеры метакриловой кислоты, производные целлюлозы и любые их комбинации.
10. Лекарственное средство по п. 8, где при введении лекарственного средства указанному пациенту, лекарственное средство обеспечивает один из следующих фармакокинетических параметров: (i) максимальная концентрация Cmax реина в плазме выше 5,0 мкг/мл; (ii) площадь под кривой «время - концентрация» AUC0-t или AUC0-∞ реина выше 35,0 мкг ч/мл; (iii) Tmax от 3 до 4,5 часов после перорального введения субъекту в условиях не натощак.
11. Лекарственное средство по п. 8, которое является лекарственным средством с контролируемым высвобождением с однократным приемом в день.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 8865689 B2, 13.09.2012 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2019-06-03—Публикация
2015-04-20—Подача