Изобретение относится к области фармацевтики, а именно к противомикробным препаратам на основе линезолида.
В настоящее время в качестве основного препарата для противоинфекционного лечения используются, в основном, антибиотики. Однако широкое использование антибиотиков достаточно часто вызывает резистентность бактерий, особенно это касается грамположительных бактерий, таких как стрептококки, стафилококки и т.п. Это делает разработку новых лекарственных препаратов, способных воздействовать на такие микроорганизмы практически важным.
Одним из таких препаратов является линезолид- синтетический оксазолидиновый препарат для лечения ряда инфекций, вызванных грамположительными бактериями, которые устойчивы к нескольким антибиотикам.
Линезолид, (S)-N-[[3-[3-фтор-4-(4-морфолинил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамид, структурной формулы
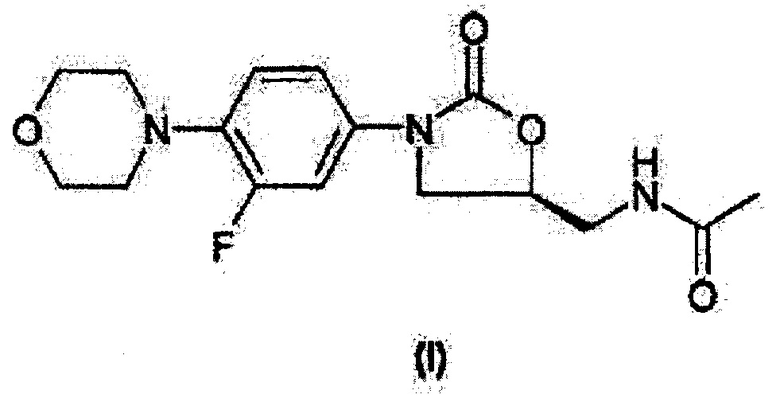
представляет собой пример противомикробного средства, активного почти против всех аэробных грамположительных бактерий. В частности, он активен (как in vitro, так и по результатам клинических исследований при лечении ряда инфекций) в отношении таких аэробных и факультативных грамположительных микроорганизмов, как Enterococcus faecium (включая ван- ванкомицинорезистентные штаммы), Enterococcus faecium (ванкомициночувствительные штаммы), Staphylococcus epidermidis (включая метициллинорезистентные штаммы), Staphylococcus haemolyticus, Streptococcus viridans, Streptococcus agalactiae, Streptococcus pneumoniae (включая полирезистентные штаммы), Streptococcus pyogenes., а также некоторых грамотрицательных, например Pasteurella multocida, и анаэробных бактерий.
Линезолид связывается с бактериальными рибосомами, предотвращая образование функционального инициирующего комплекса 70S - важного компонента процесса трансляции при синтезе белка, что тормозит развитие микроорганизмов. Препарат применяют внутривенно или перорально. Режим дозирования устанавливают индивидуально, в зависимости от показаний и тяжести заболевания, обычная доза для взрослых и детей старше 12 лет - 0,8-1,2 г/сут в 2 введения. Детям от 5 лет рекомендуемая доза составляет 10 мг/кг 2 раза в сутки. Максимальная суточная доза для взрослых и детей старше 12 лет - 1,2 г/сут. (https://www.rlsnet.ru/mnn_index_id_3005.htm).
Линезолид был синтезирован в 1990-х годах и был одобрен для использования в 2000 году. В настоящее время выпускается в США компанией Pfizer, Inc. под названием ZYVOX в виде инъекций, таблеток и пероральной суспензии. Его основными показаниями являются нозокомиальная пневмония, инфекции кожи и кожи, а также ванкомицин-устойчивые инфекции Enterococcus faecium. Структура и свойства линезолида описаны в индексе Merck (13-е издание, номер монографии: 05526, номер регистра CAS: 165800-03-3). Способ его получения раскрыт в патентах US 5,688,792; ЕР 717738, IL 110802, СА 2168560, WO 95/07271 и ряде других публикаций.
Показано, в частности, что он обладает высокой биологической доступностью при пероральном приеме (Stevens et al., "Randomized Comparison of Linezolid (PNU-100766) Versus Oxocillindicloxacillin for Treatment of Complicated Skin and Soft tissue Infections", Antimicrob. Agents Chemother. 44: 3408-3414 (2000); Stevens et al., "Linezolid Versus Vancomycin for the Treatment of Methicillin-Resistant Staphylococcus aureus (MRSA) Infections", Clin. Infec. Dis. 34: 1481-1490 (2000) и Zurenko et al., "In Vitro Activities of U-100592 and U-100766, Novel Oxazolidinone Antibacterial Agents", Antimicrob. Agents Chemother. 40: 839-845 (1996)).
В жидких фармацевтических композициях, полученных с использованием кристаллических форм линезолида твердые ингредиенты растворяют или суспендируют в жидком носителе, таком как вода, растительное масло, спирт, полиэтиленгликоль, пропиленгликоль или глицерин. Они могут дополнительно содержать эмульгаторы для равномерного диспергирования по всей композиции активного ингредиента или другого компонента, который нерастворим в жидком носителе, а также вещество, повышающее вязкость, для улучшения ощущения во рту продукта, подслащивающие агенты, консерванты, хелатирующие агенты и иные вспомогательные вещества.
Наиболее широкое применение нашло использование линезолида в твердой кристаллической форме для перорального или интраперорального введения, то есть для доставки препарата, содержащегося в сердцевине таблетки, пациенту через рот, в результате чего абсорбция препарата происходит в желудочно-кишечном тракте или, по крайней мере, частично через слизистую ротовой полости.
Вместе с тем при создании твердых лекарственных средств на основе линезолида необходимо учитывать полиморфизм, присущий его кристаллам. Полиморфизм - это способность вещества кристаллизоваться в разных кристаллических модификациях, каждая из которых имеет одинаковую химическую структуру, но имеет различное расположение или конформацию молекул в кристаллической решетке из-за их различного расположения в решетке (упаковочный полиморфизм), либо из-за другой конформации молекул (кон-формационный полиморфизм).
Конкретную полиморфную форму во многом определяет конформация и ориентация молекул в элементарной ячейке, что в свою очередь приводит, в частности, к тепловому поведению, отличному от теплового поведения аморфного материала или другой полиморфной формы. (E.G. Karagiannidou. Int. J. of Analitical, Pharmaceutical and Biomedical Sciences. V:2, Issue-2: April-June-2013, p. 27-32). Полиморфизм может существенно влиять на свойства как активного фармацевтического ингредиента, так и конечной лекарственной формы Это связано с тем, что различные модификации (полиморфы) могут проявлять различные физико-химические свойства, такие как растворимость, скорость растворения, биодоступность, а также химическая и физическая стабильность. В частности, структура кристалла влияет на текучесть измельченного твердого вещества, что в свою очередь сказывается на легкость, с которой материал обрабатывается во время переработки в фармацевтический продукт, что может потребовать использования скользящих веществ (US 2006142283, 2007), таких как коллоидный диоксид кремния, тальк, крахмал или трехосновный кальций фосфат. В частности, кристаллические формы с формой тромбоцитов имеют лучшую текучесть, чем кристаллы с формой иглы (М. Rouhi, The Right Stuff, Chemical & Engineering News, 24 <th> Feb. 2003), а кристаллы с формой пластины более выгодны для инъекций, чем кристаллы с формой иглы, так как суспензию пластинчатых кристаллов можно вводить через меньшую иглу с большей легкостью, чем суспензию иглообразных кристаллов. (S.R. Byrn и др. Solid-State Chemistry of Drugs 2 <nd> Edition pg. 4).
Другим важным свойством препарата, на которое влияет структура кристалла является ее воздействие на скорость растворения препарата в водной жидкости, поскольку это может иметь серьезные терапевтические последствия, налагая верхний предел на скорость, с которой оральный вводимый активный ингредиент может достичь кровотока пациента. Кроме того структура метаморфа может влиять на его поведение при уплотнении и его стабильность при хранении. При этом иногда наиболее стабильный полиморфом трудно получить или его метастабильная форма не обладает благоприятными свойствами. В этой связи точное знание особенностей кристаллических форм для разработки препарата необходимо, чтобы избежать нежелательных сюрпризов на поздних стадиях развития технологии.
В случае линезолида насчитывается около 15 модификаций кристаллов, отличающихся показателями рентгеновской дифракцией, спектроскопии и дифференциальной сканирующей калориметрией, а также известен аморфный линезолид (ЕР 1745028, 2007).
В настоящее время найдены различные формы твердого линезолида: кристаллическая форма I (Pfizer "Zyvox (linezolid) Laber Information" (2010-07-16); US 5688792, 1997), форма II (US 6559305,2003: WO 2001/057035, 2001), форма III (WO 2005/035530, 2005; WO 2009/063505, 2009), форма IV [WO 2006/004922, 2006), формы TIII, V, VI, IX, X, XII, XIV, XVII, XVIII (US 20060111350, 2006], аморфной формы [US 20060111350, 2006], гидратированных форм (WO 2007/026369, ЕР 2033960, 2009) и сокристаллов (WO 2009/140466, 2009).
Кристаллическую структуру, полученную при создании линезолида, принято рассматривать в качестве формы I (WO 2013111048). Позднее было установлена, что форма I состоит из формы IV, смешанной с формой II.
В ходе дальнейших исследований было высказано предположение (ЕР 1745028, 2007), что все другие кристаллические формы основываются на двух структурах - формах II и IV и содержат их смеси или гидраты и сольваты этих форм. Так показано, (WO 2006110155) что формы линезолида Till и V состоят из формы IV и содержат менее 10% формы II. При этом форма V содержит приблизительно 0,1 мас. % воды. Кристаллическая линезолидная форма XVII содержит примерно 1% (по массе) формы II.
При этом одни формы могут переходить в другие под воздействием внешних и иных факторов. Так, форма II может быть превращена в соединение линезолида формулы-1, полученную в результате форму I можно затем превратить в другие известные полиморфные формы линезолида. (WO 2013111048, 2017). Форму II можно преобразовать путем нагревания до формы IV через эндотермический процесс, форма III легко получается в ходе загрязнения формы IV (Е. Maccaroni et al. INTERNATIONAL JOURNAL OF PHARMACEUTICS ⋅ APRIL 2008351 (2008) 144-151), форма II была получена из формы I ее перекристаллизацией и т.д. Форма IV при хранении может перейти в форму II, которая является наиболее стабильной морфологической формой линезолида при температуре ниже 85°С.(US 6559305, US 6444813).
Наиболее удобной для использования пациентами пероральной лекарственной формой является таблетка. Однако в случае линезолида клиническая доза достаточно велика, что приводит к необходимости увеличения размера таблетки и в свою очередь оказывает влияние на скорость растворения таблетки, а также на такие ключевые качественные атрибуты таблетки, как клиническую эффективность и токсичность. В этой связи разработка оптимальной рецептуры таблетки для сочетания для сочетания предъявляемых к ней требований требует проведения большого количества исследований.
Таблетка лизонелида состоит, как правило, из центрального ядра и оболочки. При этом центральное ядро содержит кристалл линезолида, разрыхлитель, наполнитель, связующее и смазывающее вещества.
Так, в патенте CN 103893138 предлагается кристаллическая таблетка, содержащая линезолид, лактозу, микрокристаллическую целлюлозу, разрыхлитель, связующее, смазывающее вещество и другие ингредиенты. Недостатком таблетки является сложная технология получения и медленное растворение таблетки в кишечно-желудочном тракте.
В патенте CN 1208058 предлагается состав таблетки, который включает линезолид, крахмал, микрокристаллическую целлюлозу, связующее, дезинтегрин, поливинилпирролидон, стеарат магния, соли металлов, растительные масла и смазку для талька. Способ приготовления включает следующие стадии: предварительную обработку, предварительное смешение, смешивание, гранулирование, сушку, гранулирование, смешивание, сжатие, покрытие и другие стадии, т.е. состав и способ получения таблетки является громоздким и сложным, требует использования большего количества оборудования.
CN 104666256 предлагает таблетку, центральное ядро которой содержит 1-90% линезолида, 20-30% лактозы, 5-15% крахмала, 0,3-2,5% бензоата магния. Особенностью таблетки является снижение негативных побочных эффектов препарата и повышение его безопасности. Однако проведенные эксперименты показали, что данный препарат трудно растворить in vitro.
Вместе с тем, характерной чертой всех рецептур таблетки линезолида является пригодность их состава только для конкретной формы. В частности, специальные рецептуры известны для формы I (CN 103896866), формы II (CN 105055354), формы III (CN 103893138, US 2007104785,) формы IV (CN 1028857, CN 103099792).
В частности, в CN 103893138, 2014, предлагается таблетка, содержащая 67,0-75,0 мас. % линезолида формы III, 2,0-4,8 мас. % лактозы, 9,0-18,0 мас. % микрокристаллической целлюлозы, а также, 2,0-10 мас. % дезинтегрирующего агента, 1,2-4,0 мас. % связующего агента и 0,3-2,0 мас. % смазки. Таблетка, эффективна в чрезвычайно ограниченном диапазоне концентраций добавок, что гарантирует обеспечение хорошей сжимаемости, отличной формуемости и быстрого растворения.
Наиболее близким к заявляемому техническому решению является рецептура препарата Зивокс (Zivox®) (https://www.rlsnet.ru/tn_index_id_l6307.htm), содержащая в ядре линезолид и в качестве вспомогательных веществ: наполнитель - кукурузный крахмал; микрокристаллическую целлюлозу; гидроксипропилцеллюлозу; натриевую соль гликолята крахмала; смачивающее-стеарат магния; а в составе оболочки- краситель Opadry White Y-1-18202-A; карнаубский воск; красные фармацевтические чернила Opacode Red FGE-15040.
Недостатком ближайшего аналога является недостаточная скорость растворения активного начала при использовании линезолида в других морфных формах. В частности, при использовании линезолида полиморфной формы IV вместо полиморфной формы II в среде растворения аналита (фосфатный буферный раствор рН 6,8) за 15 минут растворяется только 51-54% вместо 86-90%.
Технической задачей, решаемой авторами, явилось разработка рецептуры линезолидсодержащего препарата в твердой лекарственной форме с хорошей растворимости, в котором в качестве активного начала могут использоваться кристаллы линезолида различных полиморфных форм.
Технический результат достигается созданием композиции из ядра и оболочки, в которой ядро наряду с линезолидом и низкозамещенной гидроксипропилцелюлозой и магния стеаратом содержит гидролозу (гидрооксипропилцеллюлозу), кроссповидон и аэросил при следующем соотношении ингредиентов, (% масс.): линезолид 60-80; низкозамещенная гидроксипропилцелюлоза 10-16; гипролоза (гидрооксипропилцеллюлоза) 1-2; кроссповидон 7-15; аэросил 1-3; магния стеарат 0,5-2.
В качестве линезолида композиция содержит кристаллы хотя бы одной полиморфной формы из группы, содержащей линезолиды I, II или IV.
Особенностью заявляемой рецептуры является создание вокруг кристаллического ядра защитной оболочки, состоящей из смеси низкозамещенной гидроксипропилцелюлозы, гипролозы и кроссповидона, обеспечивающей одновременно определенную защиту активного начала от воздействия внешней среды, доступ во внутреннее пространство растворителя, что обеспечивает возможность достаточно быстрого растворения кристалла, и в тоже время определенную «свободу» кристаллической составляющей, позволяющей ей менять метаморфическую форму, в частности, иметь формы II, IV и их различные смеси. Выход за пределы заявленных соотношений ведет, как показали эксперименты, к снижению растворимости той или иной кристаллической составляющей, то есть делает рецептуру менее универсальной.
Аэросил - двуокись кремния- в данной рецептуре выступает как разрыхлитель для увеличения сыпучести и скольжения частиц таблеточной массы, а также предотвращения слипания гранулированных частиц линезолида. Магния стеарат - смачиватель, для уменьшения адгезии на границе раздела фаз, таблеточная масса/ пресс инструмент при получении таблеточной формы.
Их концентрация ниже заявленной минимальной не обеспечивает формирование качественной таблетки, а повышение концентрации более максимальной не дает позитивного эффекта и снижает содержащуюся в таблетке эффективную дозу активного начала.
Рецептура может использоваться наряду с таблеткой в таких лекарственных формах как гранулы, капсулы, драже и т.п. содержащие, как правило, примерно 600 мг линезолида.
В качестве оболочки используются стандартные составы, разрешенные фармацией, например, Опадрай белый YS-1-18202-A - смесь 31% диоксида титана, 63% гипромеллозы и 6% макрогола, используемая при производстве препарата Зивокс, гидроксипропилцелюлозу, а в случае капсул - желатин и другие вещества разрешенные фармацией.
Препарат получают следующим образом. Линезолид и гидроксипропилцеллюлозу в виде водной суспензии или сухого порошка объединяют, перемешивают в смесителе с высоким усилием сдвига добавляют воду, гранулируют, калибруют, сушат, подвергают сухому просеиванию, отбирая фракцию менее 2000 мм. Далее добавляют расчетное количество кроссповидона, низкозамещенной гидроксипропилцеллюлозы и диоксид кремния и производят перемешивание. В полученную смесь добавляют магния стеарат и перемешивают до нужной степени в смесителе.
При необходимости получения таблеток, применяют ротационный или эксцентриковый таблеточный пресс и пуансоны. Готовую порошковую смесь прессуют в таблетки нужного размера и формы. На таблетки наносят покрытие на основе гидроксипропилметилцеллюлозы, суспензию готовой смеси Opadry или другое покрытие, разрешенное фармакопией.
Пример 1. Таблетки в соответствии с настоящим изобретением предпочтительно получают следующим образом. Связующий раствор получают, добавляя 12 г гидроксипропилцеллюлозы к 228 мл очищенной воды, перемешивая смесь до полного растворения, после чего полученный раствор фильтруют через сито с размером отверстий 0,315 мм.
600 г Линезолид вносят в мешалку с высоким усилием сдвига и при перемешивании добавляют расчетное количество, полученного связующего раствора (240 г). Полученный гранулят подвергают мокрому калиброванию (продавливанию), сушат, с использованием сушилки с псевдоожиженным слоем или полочной сушилки После сушки гранулята его подвергают сухому просеиванию через вибросито.
Далее смешивают в смесителе, добавляя 84,0 г кроссповидона, 118,8 г низкозамещенной гидроксипропилцеллюлозы, 16,8 г диоксида кремния, В полученную смесь добавляют 8,4 г стеарата магния предварительно просеянного через сито с размером отверстий 0,315 мм, и перемешивают.
Полученная масса поступает на ротационный или эксцентриковый таблеточный пресс, где смесь прессуют в таблетки нужной массы, твердости, размера и формы. На таблетки наносят покрытие которое включает 21,0 г готовой смеси Opadry, для чего Opadry и очищенную воду смешивают, получая суспензию, и процеживают через сито с размером отверстий 0,315 мм. Таблеточную массу таблеток помещают в барабан машины покрытия и на движущиеся таблетки разбрызгивают раствор для нанесения пленочных покрытий до тех пор, пока на них не будет нанесено равномерное покрытие. В результате было получено 861 г таблеток (1000 шт), содержащих, % масс): линезолид 71,4%; гидроксипропилцелюлоза 15; гипролоза 1,4; кроссповидон 10; аэросил- диоксид кремния 2; магния стеарат 1; оболочка Опадрай белый - 2,4 - образец 1.
Пример 2. По технологии примера 1 были получены таблетки с различным содержанием ингредиентов.
Образец 1. - линезолид, форма II - 71,4%; гидроксипропилцелюлоза 15; гипролоза 1,4; кроссповидон 10; аэросил 2; магния стеарат 1; оболочка Опадрай белый - 2,4.
Образец 2 - линезолид, форма I - 71,4%; гидроксипропилцелюлоза 15; гипролоза 1,4; кроссповидон 10; аэросил 2; магния стеарат 1; оболочка Опадрай белый -2,4.
Образец 3 - линезолид, форма IV - 71,4%; гидроксипропилцелюлоза 15; гипролоза 1,4; кроссповидон 10; аэросил 2; магния стеарат 1; оболочка Опадрай белый -2,4.
Образец 4 - линезолид, форма II и IV в соотношении 1:1 - 71,4%; гидроксипропилцелюлоза 15; гипролоза 1,4; кроссповидон 10; аэросил 2; магния стеарат 1; оболочка Опадрай белый - 2,4.
Образец 5 - линезолид, форма 4 - 60%; гидроксипропилцелюлоза 10; гипролоза 1; кроссповидон 7; аэросил 2; магния стеарат 1; оболочка Опадрай белый -2,4.
Образец 6 - линезолид, форма IV - 80%; гидроксипропилцелюлоза 16; гипролоза 2; кроссповидон 15; аэросил 1; магния стеарат 0,5; оболочка Опадрай белый -2,4.
Образец 7 - линезолид, форма II - 71,4%; гидроксипропилцелюлоза 10; гипролоза 1,4; кроссповидон 10; аэросил 3; магния стеарат 2; оболочка гидроксипропилцелюлоза - 3.
Образец 8 - линезолид, форма II и IV в соотношении 1:1 80%; гидроксипропилцелюлоза 12; гипролоза 1,6; кроссповидон 12; аэросил 1; магния стеарат 1,3; оболочка желатин - 2.
Пример 3. Была проведена оценка влияния состава препарата на скорость его растворения на примере образцов 1-8 В качестве препарата сравнения использовали таблетки Зивокс®, покрытые пленочной оболочкой производства «Пфайзер Фармасьютикалз ЭнЭлСи», Пуэрто-Рико - серия N99167, которые содержали форму II линезолида, а также таблетки, полученные по данной технологии с заменой формы II другими метаформами линезолида.
Изучение сравнительной кинетики растворения проводили в буферных средах с рН=1,2 (0,1 М раствор хлористоводородной кислоты) и с рН=6,8 (фосфатный буферный раствор) в соответствии с требованиями ГФ XIII, т. 2, с. 209 (ОФС.1.4.2.0009.15)
Для получения статистически достоверных результатов исследование проводили с использованием 12 таблеток каждого образца препарата.
Последовательный отбор проб проводили через 5, 15 и 30 мин отбирая по 10 мл раствора, причем такой же объем соответствующего буферного раствора добавлялся в среду растворения для сохранения объема. Полученные пробы охлаждали при комнатной температуре и фильтровали через мембранный фильтр Владипор МФФК-3Г, отбрасывая первые 5 мл фильтрата. 1 мл фильтрата помещали в мерную колбу вместимостью 50 мл, доводили объем раствора соответствующим буферным раствором до метки и перемешивали. Около 33 мг (точная навеска) образца линезолида помещали в мерную колбу вместимостью 50 мл, прибавляли 30 мл среды растворения и перемешивали до полного растворения. Доводили объем раствора средой растворения до метки и перемешивали. 1 мл полученного раствора помещали в мерную колбу вместимостью 50 мл и доводили объем раствора до метки средой растворения, перемешивали и измеряли оптическую плотность испытуемого раствора и раствора с образцом линезолида на спектрофотометре в максимуме поглощения при длине волны 251 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали среду растворения.
Количество линезолида, перешедшее в раствор, в процентах (X) от заявленного количества рассчитывают по формуле:
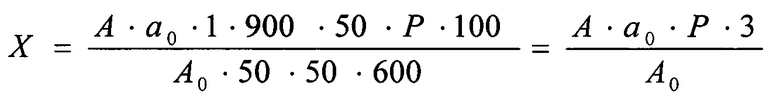 , где
, где
А - оптическая плотность испытуемого раствора;
А0 - оптическая плотность раствора образца линезолида;
а 0 - навеска образца линезолида, мг;
Р - чистота раствора образца линезолида, мг/мг.
Результаты измерения представлены в таблице 1
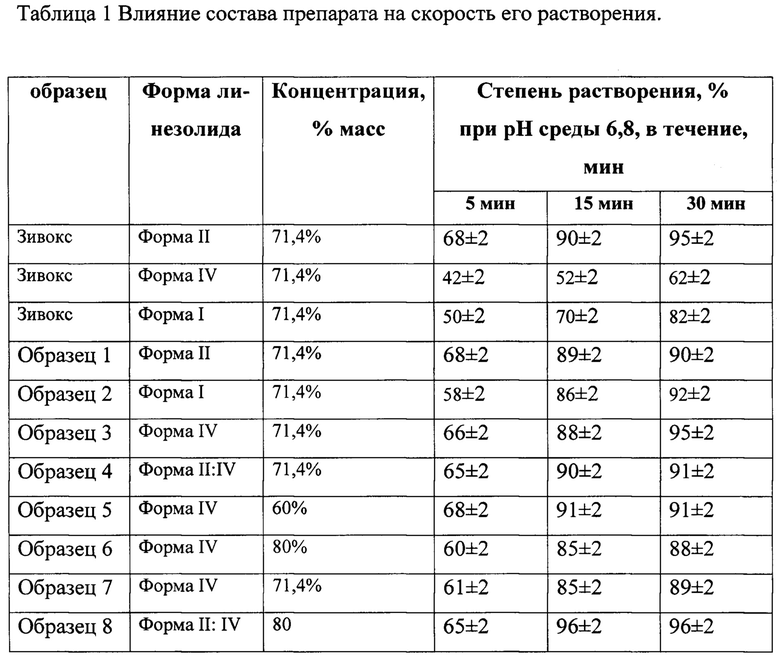
Полученные результаты свидетельствуют, что заявляемое изобретение позволяет выпускать препараты в виде таблеток, содержащих различные формы линезолида, и обладающие заданной скоростью растворения активного начала.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ИМАТИНИБА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМОЙ СОЛИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ(Ы) ЛЕЧЕНИЯ | 2012 |
|
RU2517216C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ В ФОРМЕ ТАБЛЕТКИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2747525C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ ИМАТИНИБА | 2008 |
|
RU2470641C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТОК, ПОКРЫТЫХ КИШЕЧНОРАСТВОРИМОЙ ОБОЛОЧКОЙ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2668499C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВИЧ-ИНФЕКЦИИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2505286C1 |
| Комбинированная система доставки малорастворимого противоопухолевого средства при пероральном введении и содержащая её диспергируемая таблетка | 2021 |
|
RU2803114C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, В ВИДЕ ТВЕРДОЙ ДОЗИРОВАННОЙ ФОРМЫ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2003 |
|
RU2254860C2 |
| ПРОТИВОВИРУСНОЕ И ИММУНОСТИМУЛИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2593570C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ ТРИМЕТАЗИДИНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2012 |
|
RU2530558C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ФАБОМОТИЗОЛА ДИГИДРОХЛОРИДА | 2022 |
|
RU2828872C2 |
Изобретение относится к области фармацевтики, а именно к противомикробным препаратам на основе линезолида. Предлагается состав препарата линезолида, позволяющий использовать в своем составе его различные метаморфические формы. Препарат состоит из ядра, содержащего линезолид, гидроксипропилцелюлозу, стеарат магния и иные вспомогательные добавки, и оболочки, причем ядро дополнительно содержит гипролозу, кроссповидон и аэросил - диоксид кремния при следующем соотношении ингредиентов (мас.%): линезолид 60-80; низкозамещенная гидроксипропилцелюлоза 10-16; гипролоза 1-2; кроссповидон 7-15; аэросил 1-3; магния стеарат 0,5-2. Препарат в качестве линезолида он содержит линезолид полиморфной формы I, II, IV или их смеси. Препарат может быть выполнен в форме таблетки, гранул, капсул, драже и пригоден для использования любых форм линезолида с требуемой скоростью растворения при попадании в биологическую жидкость. 5 з.п. ф-лы, 3 пр., 1 табл.
1. Линезолидсодержащий препарат в виде твердой лекарственной формы, состоящий из ядра, содержащего линезолид, гидроксипропилцелюлозу и стеарат магния, и оболочки, отличающийся тем, что ядро содержит хотя бы одну полиморфную форму кристаллов линезолида, выбранную из группы, содержащей линезолид полиморфной формы I, линезолид полиморфной формы II, линезолид полиморфной формы IV, а также дополнительно содержит гипролозу, кроссповидон и аэросил при следующем соотношении ингредиентов (мас.%):
Линезолид 60-80;
Низкозамещенная гидроксипропилцелюлоза 10-16;
Гипролоза 1-2;
Кроссповидон 7-15;
Аэросил 1-3;
Магния стеарат 0,5-2.
2. Линезолидсодержащий препарат по п. 1, отличающийся тем, что оболочка содержит смесь Опадрай белый,
3. Линезолидсодержащий препарат по п. 1, отличающийся тем, что оболочка содержит гидроксипропилцелюлозу,
4. Линезолидсодержащий препарат по п. 1, отличающийся тем, что он выполнен в форме таблетки.
5. Линезолидсодержащий препарат по п. 1, отличающийся тем, что он выполнен в форме гранул.
6. Линезолидсодержащий препарат по п. 1, отличающийся тем, что он выполнен в форме капсулы.
| WO 2010026597 A1, 2010.03.11 | |||
| US 2007104785 A1, 2007.05.10 | |||
| US 2006111350 A1, 2006.05.25 | |||
| СТОЙКИЕ К РАЗРУШЕНИЮ ЛЕКАРСТВЕННЫЕ ФОРМЫ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ ФИЗИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА | 2006 |
|
RU2399371C2 |
| CN 103896866 A, 2014.07.02 | |||
| CN 105055354 A, 2015.11.18 | |||
| CN 103893138 A, 2014.07.02 | |||
| CN 103099792 A, 2013.05.15. | |||
Авторы
Даты
2019-06-04—Публикация
2017-07-19—Подача