ПЕРЕКРЕСТНАЯ ССЫЛКА К РОДСТВЕННЫМ ЗАЯВКАМ
[0001] Данное изобретение заявляет право на приоритет, вытекающее из следующих предварительных патентных заявок США: №60/995321, зарегистрированной 25 сентября 2007, и №60/995651, зарегистрированной 26 сентября 2007 г. Содержание этих заявок включено в данное изобретение в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Изобретение относится к составам, содержащим иматиниб, с высокой полиморфной стабильностью.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0003] Иматиниб мезилат, 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-[(4-пиридин-3-ил)пиримидин-2-иламино]фенил]бензамида мезилат, является соединением, имеющим химическую структуру
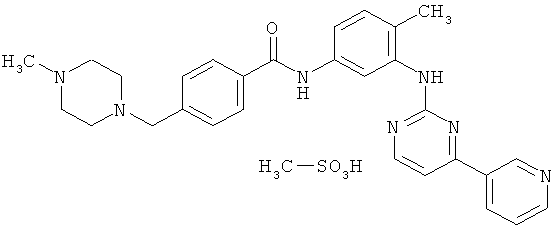
Иматиниб является ингибитором протеинтирозинкиназы. Он особенно пригоден при лечении различных типов рака и также может применяться для лечения атеросклероза, тромбоза, рестеноза и фиброза. Таким образом, иматиниб может также применяться для лечении доброкачественных заболеваний. Иматиниб обычно вводится перорально в виде соответствующей соли, например в форме иматиниба мезилата.
[0004] Публикации патентных заявок №WO 99/03854, WO 2005/077933, WO 2005/095379, WO 2004/106326, WO 2006/054314, WO 2006/024863, WO 2006/048890, US2006/0030568 и WO 2007/023182 и патент США №6894051 предположительно описывают аморфный иматиниб и кристаллические формы иматиниба мезилата, обозначенные как формы H1, α, α2, β, δ, ε, I и II.
[0005] WO 99/03854, US2006/0030568 и патент США №6894051 предположительно описывают формы α и β иматиниба мезилата. Форма α характеризуется порошковой рентгеновской дифрактограммой (powder X-ray diffraction, "PXRD") с пиками при 4,9, 10,5, 14,9, 16,5, 17,7, 18,1, 18,6, 19,1, 21,3, 21,6, 22,7, 23,2, 23,8, 24,9, 27,4, 28,0 и 28,6±0,2° 2θ. Форма β характеризуется PXRD с пиками при 9,7, 13,9, 14,7, 17,5, 18,2, 20,0, 20,6, 21,1, 22,1, 22,7, 23,8, 29,8 и 30,8±0,2° 2θ.
[0006] WO 2005/077933 предположительно описывает кристаллическую форму α2 иматиниба мезилата, которая характеризуется PXRD с пиками при 4,8, 10,4, 11,2, 11,9, 12,9, 13,8, 14,9, 16,4, 17,0, 17,6, 18,1, 18,6, 19,0, 19,8, 21,2, 21,6, 22,6, 23,1, 23,7, 24,9, 26,3, 27,3, 28,5, 31,9, 32,5 и 43,4±0,2° 2θ.
[0007] WO 2004/106326 предположительно описывает кристаллическую форму HI иматиниба мезилата, которая характеризуется PXRD с пиками при 9,9, 11,1, 16,3, 17,3, 18,1, 19,1, 19,6, 20,3, 21,1, 21,9, 23,2, 23,6, 24,2, 24,9, 25,6, 26,0, 27,3, 27,9, 28,9, 29,4, 30,4 и 30,5±0,2° 2θ. WO 2004/106326 также предположительно описывает аморфный гидрат иматиниба мезилата с содержанием воды 2,0-3,2%.
[0008] WO 2006/054314 предположительно описывает кристаллические формы I и II иматиниба мезилата, которые характеризуются PXRD с пиками при 9,7, 10,0, 10,8, 12,5, 13,0,14,0, 15,2, 16,0, 17,1, 17,9, 18,9, 19,3, 20,0, 20,9, 21,7, 22,4, 23,0, 24,7, 25,2, 25,8, 27,1, 28,0, 28,7, 29,2, 30,2, 30,9, 31,4, 33,3, 36,4 и 38,3±0,2°29, и пиками при 2,4, 2,8, 4,4, 4,9, 5,5, 7,9, 8,4, 8,9, 9,6, 11,1, 11,5, 12,1, 12,7, 14,1, 14,7, 15,3, 16,1, 17,0, 17,6, 18,6, 19,4,19,6, 20,3, 20,7, 21,4, 22,0, 22,7, 23,5, 24,0, 24,6, 25,2, 25,7, 26,9, 27,7, 28,2, 28,6, 29,1, 28,5, 30,1, 30,6, 21,8, 33,5, 34,4, 34,9, 35,7, 35,9, 37,1, 37,5, 37,9, 37,2, 39,7, 40,6, 41,3, 43,4, 43,8, 44,6, 45,2, 45,7, 46,5, 47,1 и 48,0±0,2° 2θ соответственно.
[0009] WO 2007/023182 предположительно раскрывает кристаллические формы δ и ε иматиниба мезилата. В данном изобретении форма δ характеризуется PXRD с пиками при 19,2, 19,4, 19,8, 20,3, 20,7, 20,9 и 21,1±0,2° 2θ, и форма ε характеризуется PXRD с пиками при 13,9, 17,0, 17,9, 18,5, 19,6, 20,7 и 24,1±0,2° 2θ. Международная патентная заявка №WO 2007/136510 описывает дополнительные кристаллические формы иматиниба мезилата, включая формы V и X, которые описываются подробно ниже.
[0010] WO 2003/090720 относится к таблетке, содержащей приблизительно 30-80% вес./вес. иматиниба. К тому же, в WO 01/47507 описывается фармацевтический состав/таблетка, содержащая приблизительно 22% вес./вес. иматиниба мезилата. Как патентная заявка США №2006/0275372, так и WO 2007/119601 описывают составы иматиниба мезилата, состоящие из наночастиц.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0011] В одном варианте данное изобретение предлагает фармацевтический состав, предпочтительно таблетку, содержащую иматиниб, предпочтительно иматиниб мезилат, где фармацевтический состав обеспечивает высокую полиморфную стабильность.
[0012] В другом варианте данное изобретение предлагает способ получения фармацевтического состава, предпочтительно таблетки, содержащей иматиниб, предпочтительно иматиниб мезилат, где фармацевтический состав обеспечивает высокую полиморфную стабильность, включающий: нанесение покрытия на фармацевтический состав, предпочтительно таблетку, содержащую кристаллический иматиниб, с помощью раствора для нанесения покрытия, предпочтительно раствора для покрытия таблетки, содержащего органический растворитель с количеством менее чем приблизительно 20% вес./об. воды, предпочтительно менее чем 10% вес./об., более предпочтительно менее чем 5% вес./об.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
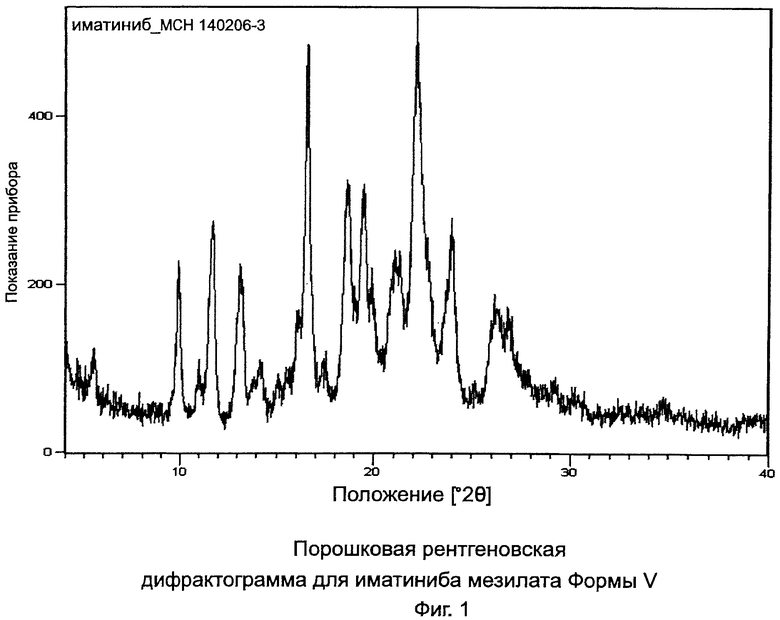
[0013] Фиг.1: Порошковая рентгеновская дифрактограмма (PXRD) для иматиниба мезилата формы V.
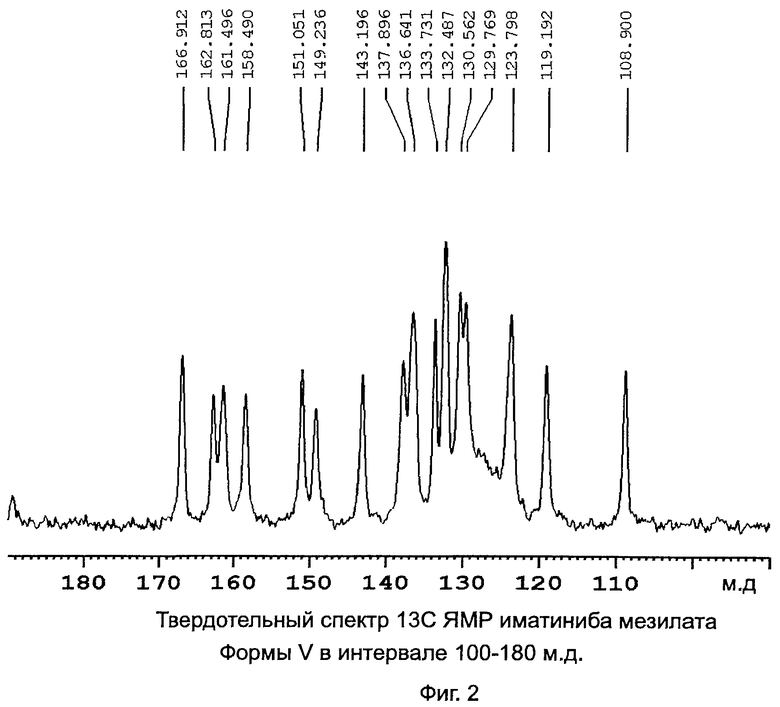
[0014] Фиг.2: Твердотельный спектр 13C ЯМР иматиниба мезилата формы V в интервале 100-180 м.д. (миллионная доля, parts per million-ppm).
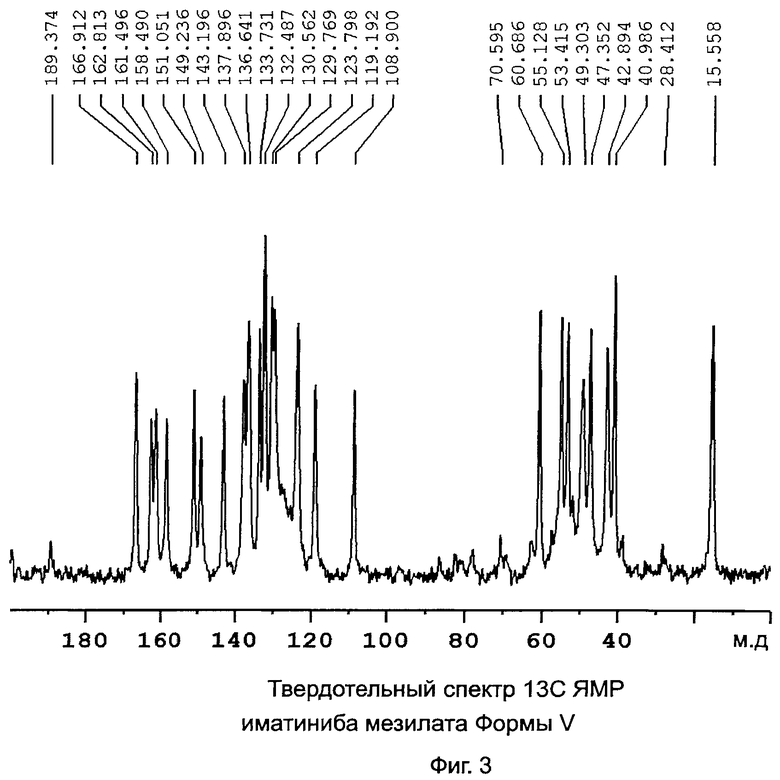
[0015] Фиг.3: Твердотельный спектр 13C ЯМР иматиниба мезилата формы V.
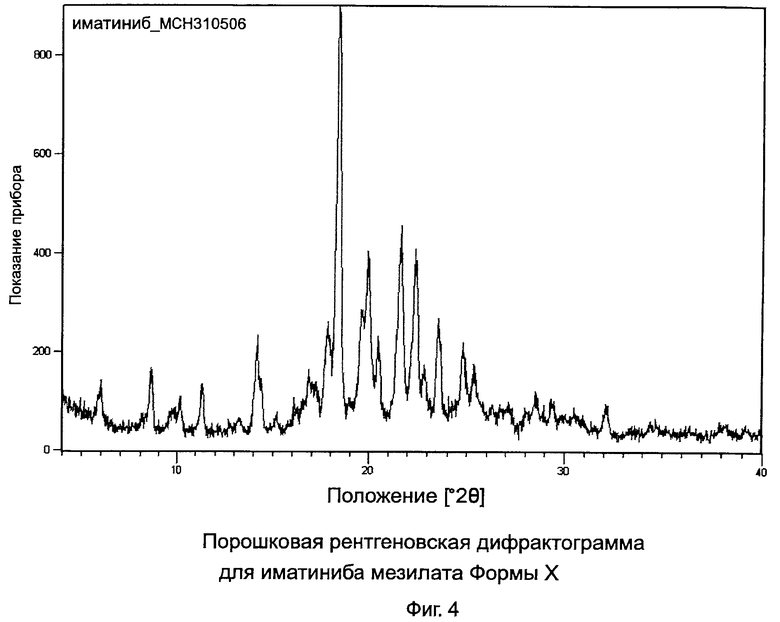
[0016] Фиг.4: Порошковая рентгеновская дифрактограмма (PXRD) для иматиниба мезилата формы X.
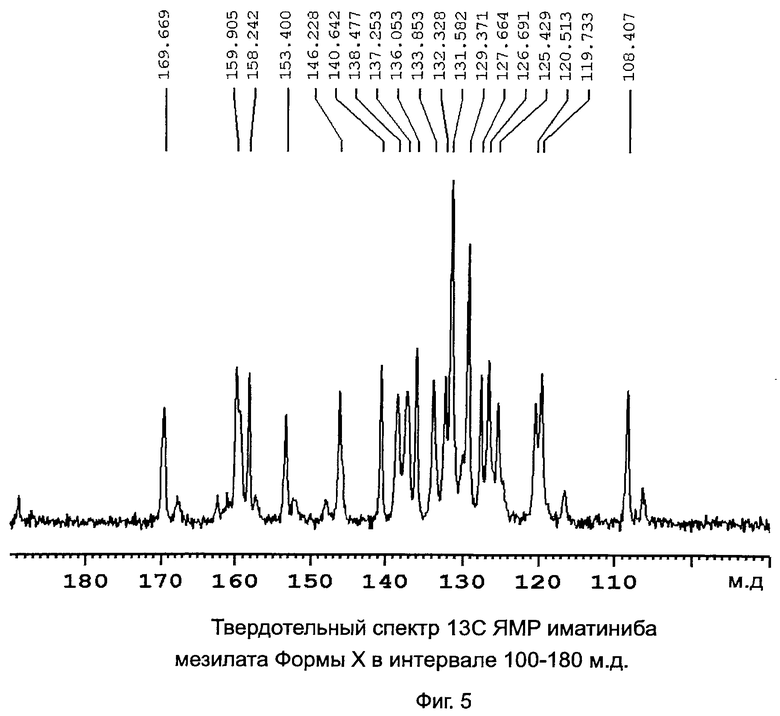
[0017] Фиг 5: Твердотельный спектр 13C ЯМР иматиниба мезилата формы Х в интервале 100-180 м.д.
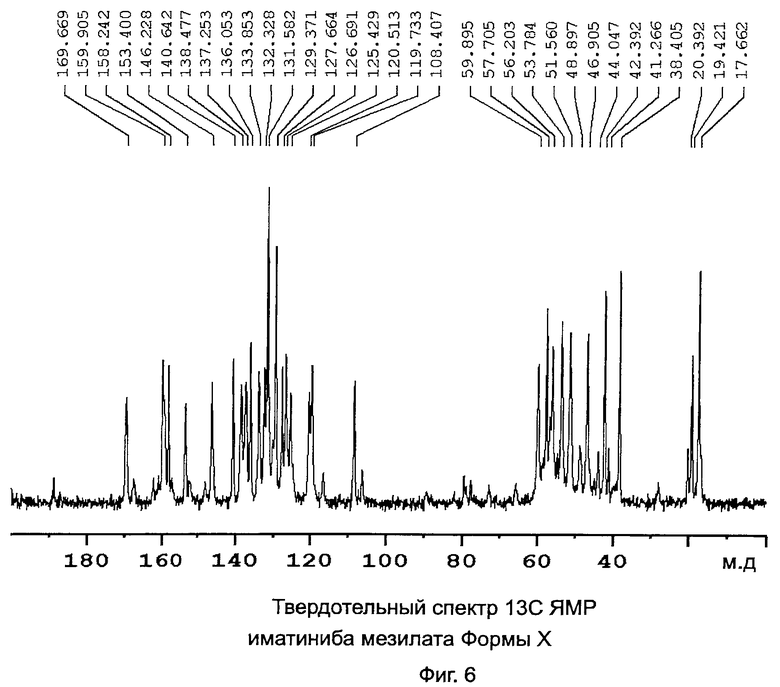
[0018] Фиг.6: Твердотельный спектр 13C ЯМР иматиниба мезилата формы X.
ПОДРОБНОЕ ОПИСАНИЕ
[0019] Данное изобретение преимущественно предлагает фармацевтический состав, предпочтительно таблетку, содержащую иматиниб, предпочтительно иматиниб мезилат, где фармацевтический состав, предпочтительно таблеточный состав, обеспечивает полиморфную стабильность. Предпочтительно данное изобретение предлагает таблетку, содержащую иматиниб мезилат, где таблетка обеспечивает высокую полиморфную стабильность для иматиниба мезилата. Как применяется в данном изобретении, термин "высокая стабильность" относится к не более чем 10%-ному превращению, предпочтительно не более чем 5%-ному превращению, более предпочтительно не более чем 3%-ному превращению полиморфной формы альфа или бета, предпочтительно формы бета.
[0020] Как применяется в данном изобретении, термин "исходная полиморфная форма" относится к полиморфной форме иматиниба, предпочтительно иматинибу, который входит в состав фармацевтической композиции перед ее хранением. Процентное количество исходной полиморфной формы составляет приблизительно 100%.
[0021] Как применяется в данном изобретении, термин "полиморфная стабильность" относится к стабильности иматиниба с тем, чтобы он оставался в исходной полиморфной форме и не претерпевал полиморфного превращения во времени, например при хранении.
[0022] Как применяется в данном изобретении, термин "хранение" относится к периоду по меньшей мере приблизительно одному месяцу. Предпочтительно, когда хранение происходит при 40°C и 75% RH (относительная влажность, relative humidity).
[0023] Как применяется в данном изобретении, термин "полиморфное превращение" относится к превращению полиморфной формы в любую другую полиморфную форму иматиниба мезилата, как, например, превращение в любую из форм H1, α, α2, β, δ, ε, I и II или аморфную форму. В вариантах данного изобретения термин "полиморфное превращение" относится к превращению из полиморфной формы V или Х иматиниба мезилата в форму α или форму β, предпочтительно в форму β.
[0024] Полиморфное превращение измеряется методами, известными в данной области. В частности, каждая известная полиморфная форма иматиниба, как, например, формы H1, α, α2, β, δ, ε, I и II и аморфная форма, может характеризоваться уникальным набором пиков порошковых рентгеновских дифрактограмм (PXRD) или пиков инфракрасных (infrared, "IR") спектров. Используя известные методы, количество каждой полиморфной формы в смеси полимерных форм может вычисляться по отношению к относительной интенсивности единичных характеризующих пиков каждой полиморфной формы. Предпочтительно, когда процент полиморфного превращения измеряется с помощью пиков XRPD, твердотельной спектроскопии 13C ЯМР или инфракрасной области спектра ("IR"). Если измерение проводится PXRD, содержание формы альфа можно определить с помощью одного или нескольких пиков, выбранных из следующего набора пиков 5,0, 10,5, 12,0, 15,0, 18,7, 19,1, 21,4, 28,6±0,2 градусов 2Θ, и содержание формы бета можно определить с помощью одного или нескольких пиков, выбранных из следующего набора пиков 9,7, 13,9, 14,7, 17,5, 18,2, 21,1, 22,1, 22,7, 29,8, 30,8±0,2 градусов 2Θ. Выбор пиков XRPD, используемых для определения, может зависеть от наполнителей, применяемых для приготовления состава. Если измерение проводят с помощью твердотельной спектроскопии 13С ЯМР, содержание формы альфа определяется с помощью одного или нескольких пиков в интервале 100-180 м.д., выбранных из следующего набора пиков 112,2, 117,3, 122,3, 126,2, 129,7, 130,1, 134,7, 135,7, 137,9, 142,0,148,3, 151,5, 158,0, 163,9, 164,7, 165,9±0,2 м.д., и содержание формы бета определяется с помощью одного или нескольких пиков в интервале 100-180 м.д., выбранных из следующего набора пиков 104,8, 121,5, 123,2, 124,8, 125,9, 128,6, 131,0, 134,9, 136,4, 139,0, 141,7, 146,5, 150,9, 158,9, 168,6±0,2 м.д. Выбор сдвигов твердотельной спектроскопии 13C ЯМР, используемых для определения, может зависеть от наполнителей, применяемых для приготовления состава.
[0025] Можно следовать общей части европейской фармакопеи 5.08, части 2.9.33 "Исследование кристаллических твердых веществ с помощью XRPD". При измерении XRPD может применяться сбор данных медленным сканированием для соответствующего предела детектирования/количественного определения или другими известными методиками. При измерении с помощью твердотельной спектроскопии 13С ЯМР фоновое количество можно минимизировать путем сбора данных в течение длительного времени или других известных методик.
[0026] В предпочтительном варианте иматиниб находится в форме его мезилатной соли. Более предпочтительно, когда иматиниб мезилат находится в полиморфной форме V или форме X. Формы V и Х подробно описаны в одновременно рассматриваемой заявке США №11/796573, опубликованной как US 2008-0090833 (или как международная патентная заявка WO 2007/136510) и которая приведена в данном изобретении в виде ссылки. Форма V характеризуется данными, выбранными из группы, состоящей из: PXRD дифрактограммы с пиками при приблизительно 9,9, 11,7, 13,3, 16,6 и 22,1±0,2° 2θ; PXRD дифрактограммы с пиками при приблизительно 9,9, 11,7, 13,3 и 16,6±0,2° 2θ; PXRD дифрактограммы с пиками при приблизительно: 5,6, 9,9, 11,7, 13,3, 16,6 и 18,5±0,2° 2θ; PXRD дифрактограммы с по меньшей мере пятью пиками, выбранными из перечня, состоящего из пиков при приблизительно 5,6, 9,9, 11,7, 13,3, 16,6, 18,5, 22,1, 24,0, 26,2 и 26,9±0,2° 2θ; PXRD дифрактограммы, изображенной на Фиг.1; твердотельного спектра 13C ЯМР с сигналами при приблизительно 162,8, 161,5 и 158,5±0,2 м.д.; твердотельного спектра 13С ЯМР с разностями химических сдвигов между сигналом, проявляющим наименьший химический сдвиг, и другим в интервале химического сдвига от 100 до 180 м.д. приблизительно 53,9, 52,6 и 49,6±0,1 м.д.; твердотельного спектра 13С ЯМР, изображенного на Фиг.2; и твердотельного спектра 13С ЯМР, изображенного на Фиг.3.
[0027] Форма Х характеризуется данными, выбранными из группы, состоящей из: PXRD дифрактограммы с пиками при приблизительно 6,0, 8,6, 11,4, 14,2, 18,3±0,2° 2θ; PXRD дифрактограммы с пиками при приблизительно: 6,0, 8,6, 10,2, 11,4, 14,2,±0,2° 2θ; PXRD дифрактограммы с по меньшей мере пятью пиками, выбранными из перечня, состоящего из пиков при приблизительно 6,0, 8,6, 10,2, 11,4, 14,2, 17,8, 18,3, 21,6, 22,4, 23,6 и 24,8±0,2° 2θ; PXRD дифрактограммы, изображенной на Фиг.4; твердотельного спектра 13C ЯМР с сигналами при приблизительно 159,9, 158,2 и 153,4±0,2 м.д.; твердотельного спектра 13C ЯМР с разностями химических сдвигов между сигналом, проявляющим наименьший химический сдвиг, и другим в интервале химических сдвигов от 100 до 180 м.д. приблизительно 51,5, 49,8 и 45,0±0,1 м.д.; твердотельного спектра 13C ЯМР, изображенного на Фиг.5; и твердотельного спектра 13C ЯМР, изображенного на Фиг.6.
[0028] В одном варианте изобретение предлагает фармацевтический состав, предпочтительно таблетку, содержащую иматиниб мезилат Формы V или Формы Х и обеспечивающую полиморфную стабильность. Предпочтительно, когда кристаллический иматиниб мезилат Формы V или Формы Х не претерпевает полиморфного превращения в какую-либо из форм α или β иматиниба мезилата во время приготовления или при хранении фармацевтического состава, предпочтительно таблетки. Более предпочтительно, когда кристаллический иматиниб мезилат не претерпевает полиморфного превращения в форму β. Кроме того, превращение кристаллического иматиниба мезилата Формы V или Х в фармацевтическом составе, описанном в данном изобретении, составляет предпочтительно менее 10%, более предпочтительно менее 5% и наиболее предпочтительно менее 3%, в расчете на вес любой другой полиморфной формы, предпочтительно форм α или β, более предпочтительно формы β.
[0029] Предпочтительно, когда фармацевтический состав, описанный в данном изобретении, включает лекарственную форму, содержащую от приблизительно 50 мг до приблизительно 500 мг, более предпочтительно от приблизительно 100 мг до приблизительно 400 мг, еще более предпочтительно 100 мг или 400 мг иматиниба, предпочтительно иматиниба мезилата.
[0028] Полиморфная стабильность иматиниба, предпочтительно иматиниба мезилата, в фармацевтическом составе, предпочтительно таблетке, может приписываться наличию покрытия в виде оболочки. Раствор для нанесения покрытия, который применяется для фармацевтического состава, предпочтительно таблетки, включающей кристаллический иматиниб мезилат, содержит органический растворитель с менее чем приблизительно 20% воды, предпочтительно менее 10%, более предпочтительно менее 5% вес./об. Предпочтительно, когда растворителем является C1-4 спирт, более предпочтительно этанол или изопропиловый спирт ("ИПС").
[0029] Предпочтительно, когда не содержащий оболочки фармацевтический состав, как, например, таблетку, описанную в данном изобретении, получают сухой грануляцией или прямым прессованием. Сухая грануляция может включать смешивание состава, содержащего активный ингредиент - иматиниб, предпочтительно кристаллический иматиниб мезилат, и один или несколько наполнителей; прессование смеси в компактную массу или тонкую пластину; измельчение компактной массы или тонкой пластины в компактные гранулы; и прессование компактных гранул в таблетку.
[0030] Прямое прессование может включать смешивание состава, содержащего активный ингредиент - иматиниб, предпочтительно кристаллический иматиниб мезилат, и один или несколько наполнителей и прессование его непосредственно в таблетку. Прессование непосредственно в компактную лекарственную форму осуществляется с помощью технологических приемов прямого прессования. Прямое прессование является удобным, простым и пригодным для промышленного масштаба способом. Наполнители, которые особенно подходят для прямого таблеточного прессования, включают микрокристаллическую целлюлозу, высушенную распылением лактозу, старлак (Starlac, 82%-88% лактозы моногидрата с 12%-18% кукурузного крахмала), дикальция фосфат дигидрат и/или коллоидную двуокись кремния. Надлежащее применение этих и других наполнителей при прямом прессовании таблеток известно специалисту с опытом и навыком работы в области, связанной с определенной технологией приготовления лекарственного средства прямым таблеточным прессованием.
[0031] Данное изобретение также предлагает способ получения фармацевтического состава, предпочтительно таблетки, содержащей иматиниб, предпочтительно иматиниб мезилат, где фармацевтический состав, предпочтительно таблетка, обеспечивает полиморфную стабильность, включающий: обеспечение фармацевтического состава, предпочтительно таблетки, содержащей иматиниб, предпочтительно иматиниб мезилат, которую можно приготовить в соответствии с вышеописанными способами, и нанесение покрытия на фармацевтический состав с помощью раствора для нанесения покрытия, содержащего органический растворитель с менее чем приблизительно 20% вес./об. воды, предпочтительно менее 10% вес./об., более предпочтительно менее 5% вес./об. Предпочтительно, когда растворителем является С1-4 спирт, более предпочтительно этанол или изопропиловый спирт (ИПС). Предпочтительно, когда затем фармацевтический состав с нанесенным покрытием сушат.
[0032] Разбавители увеличивают объем твердого фармацевтического состава и могут сделать фармацевтическую лекарственную форму, содержащую состав, более удобной в обращении для больного и лица, осуществляющего уход за ним. Разбавители для твердых составов включают, например, микрокристаллическую целлюлозу (например АВИЦЕЛ® (AVICEL®)), микроизмельченную целлюлозу, лактозу, крахмал, прежелатинизированный крахмал (крахмальный клейстер), карбонат кальция, сульфат кальция, сахар, декстраты, декстрин, декстрозу, двузамещенный фосфат кальция дигидрат, трехзамещенный фосфат кальция, каолин, карбонат магния, окись магния, мальтодекстрин, маннит, полиметакрилаты (например, ЭУДРАГИТ® (EUDRAGIT®)), хлорид калия, порошкообразную целлюлозу, хлорид натрия, сорбит и тальк. Наиболее предпочтительно, когда разбавителем является лактоза.
[0033] Твердый фармацевтический состав, который прессуется в лекарственную форму, например таблетку, может включать наполнители, чьи функции заключаются в облегчении связывания активного ингредиента и других наполнителей вместе после прессования. Связующие вещества для твердых фармацевтических составов включают по меньшей мере одно вещество, выбранное из гуммиарабика, альгиновой кислоты, карбомера (например, карбопола), натрий-карбоксиметилцеллюлозы, декстрина, этилцеллюлозы, желатина, гуаровой камеди, гидрогенированного растительного масла, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы (например, КЛУЦЕЛ® (KLUCEL®)), гидроксипропилметилцеллюлозы (например, МЕТОЦЕЛ® (METHOCEL®)), жидкой глюкозы, магний-алюминия силиката, мальтодекстрина, метилцеллюлозы, полиметакрилатов, повидона (например, КОЛЛИДОН®, ПЛАСДОН® (KOLLIDON®, PLASDONE®)), прежелатинизированного крахмала (крахмального клейстера), альгината натрия или крахмала.
[0034] Скорость растворения компактной твердой фармацевтической композиции в желудке больного можно увеличить прибавлением к композиции разрыхлителя. Разрыхлители включают альгиновую кислоту, кальций карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу (например, АЦ-ДИ-СОЛ@ПРИМЕЛЛОЗА (AC-DI-SOL@PRIMELLOSE®), коллоидную двуокись кремния, кроскармеллозу натрия, кросповидон (например, КОЛЛИДОН®, ПОЛИПЛАСДОН® (KOLLIDON®, POLYPLASDONE®)), гуаровую камедь, магний-алюминия силикат, метилцеллюлозу, микрокристаллическую целлюлозу, калия полиакрилин, порошкообразную целлюлозу, прежелатинизированный крахмал (крахмальный клейстер), альгинат натрия, натрий крахмал гликолат (например, ЭКСПЛОТАБ® (EXPLOTAB®)) или крахмал, но выбор ими не ограничивается. Наиболее предпочтительно, когда разрыхлители выбраны из группы, состоящей из кросповидона, микрокристаллической целлюлозы и их смесей.
[0035] Для улучшения характеристик текучести непрессованного твердого состава и повышения точности дозирования могут добавляться вещества, способствующие скольжению. Наполнители, которые могут функционировать как вещества, способствующие скольжению, включают коллоидную двуокись кремния, трисиликат магния, порошкообразную целлюлозу, крахмал, тальк и/или трехзамещенный фосфат кальция. Наиболее предпочтительно, когда веществом, способствующим скольжению, является коллоидная двуокись кремния.
[00361 Если лекарственную форму, как, например, таблетку, изготавливают прессованием порошкообразного состава, состав подвергается выдавливанию с помощью пуансона и матрицы. Некоторые наполнители и активные ингредиенты имеют тенденцию прилипать к поверхностям пуансона и матрицы, что может привести к выкрашиванию продукта и другим поверхностным дефектам. Для уменьшения прилипания и лучшего высвобождения продукта из матрицы к составу может прибавляться смазочное вещество. Смазочные вещества включают стеарат магния, стеарат кальция, глицерилмоностеарат, глицерилпалмитостеарат, гидрогенированное касторовое масло, гидрогенированное растительное масло, минеральное масло, полиэтиленгликоль, бензоат натрия, лаурилсульфат натрия, стеарилфумарат натрия, стеариновую кислоту, тальк и/или стеарат цинка, но выбор ими не ограничивается. Наиболее предпочтительно, когда смазочным веществом является стеарат магния.
[0037] Ароматизирующие вещества и усилители вкуса и запаха делают лекарственную форму более приятной для больного. Обычными ароматизирующими веществами и усилителями вкуса и запаха для фармацевтических продуктов, которые могут включаться в состав, описанный в данном изобретении, являются: мальтол, ванилин, этилванилин, ментол, лимонная кислота, фумаровая кислота, этилмальтол или винная кислота, но выбор ими не ограничивается. Твердые составы могут также окрашиваться с помощью любого фармацевтически приемлемого красящего вещества для улучшения их внешнего вида и/или чтобы облегчить пациенту идентификацию продукта и уровень дозированной формы.
[0038] Выбор наполнителей и количеств, которые применяются, может легко определяться специалистом, занимающимся технологией приготовления лекарственного средства, на основе опыта и рассмотрения стандартных методик и справочных изданий в данной области.
[0039] В предпочтительном варианте таблетки в соответствии с данным изобретением содержат: от 20 до 80% вес./вес. иматиниба мезилата; от 10 до 60% вес./вес., более предпочтительно от приблизительно 25% до приблизительно 60% вес./вес. разбавителя или наполнителя, предпочтительно лактозы, более предпочтительно старлака (82-88% лактозы моногидрата и 12-18% кукурузного крахмала); от 4 до 30% вес./вес., более предпочтительно от приблизительно 10% до приблизительно 25% вес./вес. разрыхлителя, предпочтительно кросповидона; от приблизительно 0 до приблизительно 10% вес./вес., более предпочтительно от приблизительно 1,5 до 9% вес./вес. другого разрыхлителя, предпочтительно микрокристаллической целлюлозы; от приблизительно 0 до приблизительно 5% вес./вес., более предпочтительно от 1 до 5% вес./вес. другого связующего вещества, предпочтительно гидроксипропилцеллюлозы (КЛУЦЕЛ® (KLUCEL®)); от 0,2 до 5% вес./вес. вещества, способствующего скольжению, предпочтительно коллоидной двуокиси кремния, маннита или аэросила, или их комбинаций; и от 0,1 до 4% вес./вес., более предпочтительно от приблизительно 0,5% до приблизительно 2% вес./вес. смазывающего вещества, предпочтительно стеарата магния или натрия стеарилфумарата. Более предпочтительно, когда каждая таблетка содержит:
119,5 мг иматиниба мезилата;
117,3 мг лактозы;
0-18,0 мг кросповидона;
48,0 мг микрокристаллической целлюлозы;
18,0 мг Клуцела (Klucel);
68,0 мг маннита;
2,5 мг Аэросила и;
12,7 мг натрия стеарилфумарата; и
9,0 мг Опадрай (Opadry) (оболочка).
[0040] Описав изобретение со ссылками на некоторые предпочтительные варианты, другие варианты должны быть понятны специалисту в данной области при рассмотрении описания. Изобретение далее определяется ссылкой на следующие примеры, подробно описывающие приготовление состава и способы применения, приведенные в изобретении. Специалисту в данной области должно быть понятно, что многие модификации как веществ, так и способов могут осуществляться на практике в пределах объема изобретения.
[0041] Следующие примеры приведены с целью иллюстрации изобретения и не могут быть истолкованы как ограничивающие объем и сущность изобретения.
Примеры
Приборы
Порошковая рентгеновская дифрактометрия
[0042] XRD дифрактометрию проводили на порошковом рентгеновском дифрактометре: PanAlytical X'pert Pro порошковый дифрактометр. Сu-трубка, параметры сканирования: CuКα излучение, λ=1,5418 Å. Непрерывное сканирование со скоростью: 0,02° 2θ/0,3 с.
13С ЯМР
[0043] CP/MAS 13С ЯМР измерения проводили на спектрометре Broker Avance 500 NMR US/WB в 4-мм ZrO2 роторе. Скорость вращения под магическим углом (magic angle spinning, MAS) составляла 10 кГц. Как применяется в данном изобретении, термин "13С ЯМР химические сдвиги" относится к сдвигам, измеренным при вышеописанных указанных условиях, однако эти смещения могут слегка изменяться от одного прибора к другому и могут смещаться или в сторону сильного поля, или слабого поля вследствие различной установки прибора и примененной калибровки. Тем не менее, последовательность индивидуальных пиков остается идентичной.
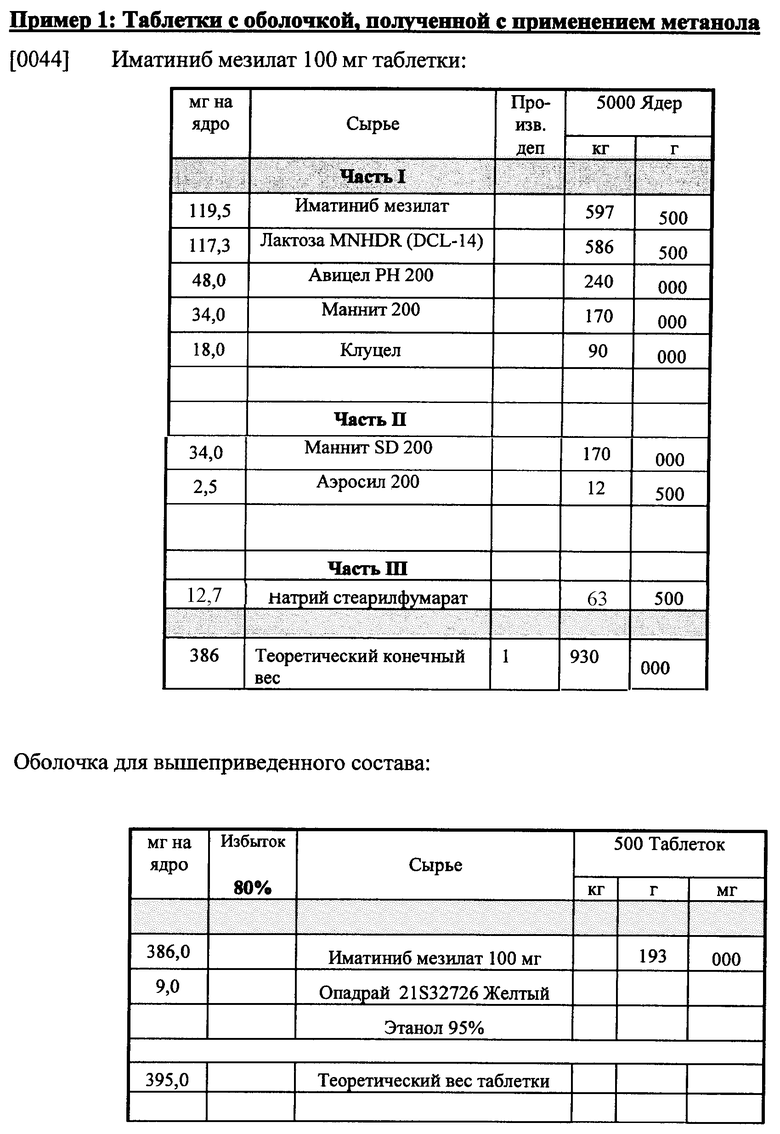
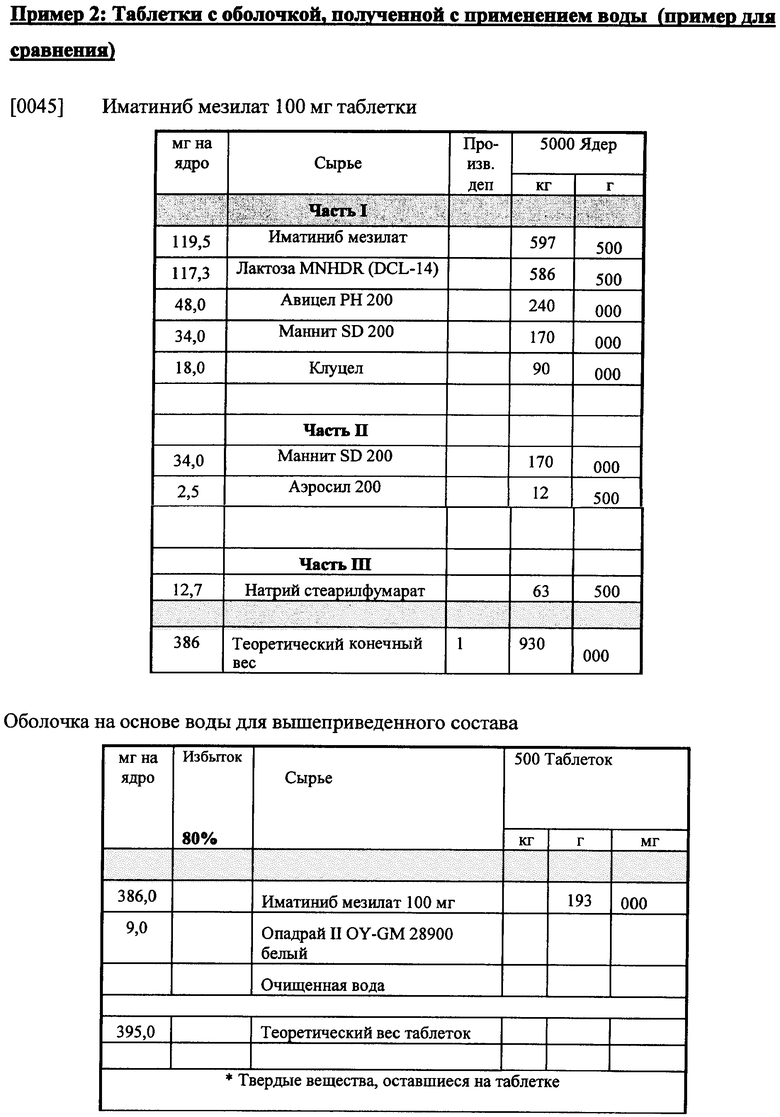
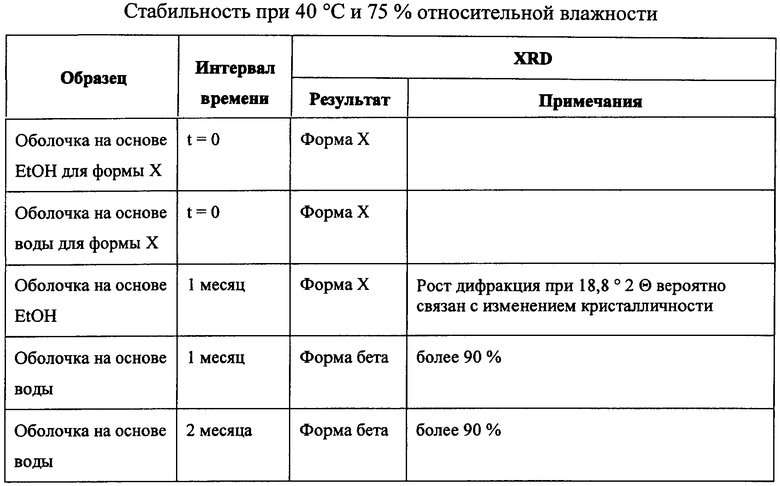
Пример 3: Сравнение полиморфной стабильности после хранения при 40°C и 75% относительной влажности (RB).
Таблетки, полученные и покрытые оболочкой при применении вышеприведенных составов, хранились в течение различного по длительности времени при 40°C и 75% RH. Как показано ниже в таблице, на некоторые таблетки наносилась оболочка на основе 95% этанола и на другие наносилась оболочка на основе воды, как выше в примере 2. Применяемый иматиниб представлял собой кристаллический иматиниб мезилат формы X. Результаты показывают, что в таблетках, покрытых оболочкой с применением этанола, полиморфная форма иматиниба сохраняется во времени, тогда как при применении воды при нанесении оболочки на таблетку состав таблетки из иматиниба формы Х превращается в иматиниб формы бета.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ И ПОЛИМОРФЫ 8-ФТОР-2-{4-[(МЕТИЛАМИНО)МЕТИЛ]ФЕНИЛ}-1,3,4,5-ТЕТРАГИДРО-6Н-АЗЕПИНО[5,4,3-cd]ИНДОЛ-6-ОНА | 2011 |
|
RU2570198C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 1-((2R,4R)-2-(1H-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)-1-МЕТИЛПИПЕРИДИН 4-ИЛ)-3-(4-ЦИАНОФЕНИЛ)МОЧЕВИНЫ МАЛЕАТА | 2016 |
|
RU2717564C2 |
| КРИСТАЛЛИЧЕСКИЕ ТВЕРДЫЕ ФОРМЫ 6-КАРБОКСИ-2-(3,5-ДИХЛОРФЕНИЛ)БЕНЗОКСАЗОЛА | 2015 |
|
RU2692252C2 |
| ПОЛИМОРФНАЯ ФОРМА СОЛИ ГИДРАТА МОНОФОСФАТА ИЗВЕСТНОГО ПРОИЗВОДНОГО ТЕТРАГИДРОИЗОХИНОЛИНА | 2020 |
|
RU2801355C2 |
| АНТИБАКТЕРИАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2561037C2 |
| Твердые формы селективного ингибитора CDK4/6 | 2014 |
|
RU2619944C2 |
| НОВАЯ ПОЛИМОРФНАЯ ФОРМА КАЛЬЦИМИМЕТИЧЕСКОГО СОЕДИНЕНИЯ | 2011 |
|
RU2599788C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ | 2008 |
|
RU2518898C2 |
| СОЛИ ДАСАТИНИБА В КРИСТАЛЛИЧЕСКОЙ ФОРМЕ | 2014 |
|
RU2662805C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ НАТРИЕВОЙ СОЛИ(4-{ 4-[5-(6-ТРИФТОРМЕТИЛ-ПИРИДИН-3-ИЛАМИНО) ПИРИДИН-2-ИЛ] ФЕНИЛ} ЦИКЛОГЕКСИЛ) УКСУСНОЙ КИСЛОТЫ | 2011 |
|
RU2612556C2 |
Изобретение относится к области медицины и химико-фармацевтической промышленности и касается составов, содержащих иматиниб, предпочтительно иматиниб мезилат с высокой полиморфной стабильностью, и способов их получения. 2 н. и 15 з.п. ф-лы, 3 пр., 6 ил.
1. Фармацевтический состав в форме таблетки с оболочкой, содержащий исходную полиморфную форму иматиниба мезилата, выбранную из иматиниба мезилата формы X, в котором менее 10% полиморфной формы иматиниба мезилата превращается в форму α или форму β после хранения при 40°C и 75% относительной влажности в течение одного месяца, причем таблетка с оболочкой получена путем нанесения на таблетку оболочки с применением органического растворителя с менее чем приблизительно 20% вес./об. воды, при этом форма Х характеризуется данными, выбранными из группы, состоящей из: PXRD дифрактограммы с пиками при приблизительно 6,0, 8,6, 11,4, 14,2, 18,3±0,2° 2θ; PXRD дифрактограммы с пиками при приблизительно: 6,0, 8,6, 10,2, 11,4 и 14,2±0,2° 2θ; PXRD дифрактограммы с по меньшей мере пятью пиками, выбранными из перечня, состоящего из пиков при приблизительно 6,0, 8,6, 10,2, 11,4, 14,2, 17,8, 18,3, 21,6, 22,4, 23,6 и 24,8±0,2° 2θ; PXRD дифрактограммы, изображенной на Фиг.4; твердотельного спектра 13С ЯМР с сигналами при приблизительно 159,9, 158,2 и 153,4±0,2 м.д.; твердотельного спектра 13С ЯМР с разностями химических сдвигов между сигналом, проявляющим наименьший химический сдвиг, и другим в интервале химических сдвигов от 100 до 180 м.д. приблизительно 51,5, 49,8 и 45,0±0,1 м.д.; твердотельного спектра 13С ЯМР, изображенного на Фиг.5; и твердотельного спектра 13С ЯМР, изображенного на Фиг.6.
2. Фармацевтический состав по п.1, в котором указанному превращению подвергается менее 5% исходной полиморфной формы иматиниба мезилата.
3. Фармацевтический состав по п.2, в котором указанному превращению подвергается менее 3% исходной полиморфной формы иматиниба мезилата.
4. Фармацевтический состав по п.1, в котором менее 10% иматиниба мезилата формы Х превращается в иматиниб мезилат формы β.
5. Фармацевтический состав по п.1, в котором таблетка, покрытая оболочкой, получена путем нанесения оболочки на таблетку с применением органического растворителя с менее чем приблизительно 10% вес./об. воды.
6. Фармацевтический состав по п.5, в котором органическим растворителем является C1-4 спирт.
7. Фармацевтический состав по п.6, в котором C1-4 спирт представляет собой этанол или изопропиловый спирт.
8. Фармацевтический состав по п.1, содержащий от приблизительно 20% до приблизительно 80% вес./вес. иматиниба мезилата, от приблизительно 10% до приблизительно 60% вес./вес. разбавителя, от приблизительно 4% до приблизительно 30% вес./вес. разрыхлителя, от приблизительно 0 до приблизительно 9% вес./вес. другого разрыхлителя, от приблизительно 0 до приблизительно 5% вес./вес. связующего вещества, от приблизительно 0,2% до приблизительно 5% вес./вес. вещества, способствующего скольжению, от приблизительно 0,1% до приблизительно 4% вес./вес. смазочного вещества и от приблизительно 1,5% до приблизительно 3% вес./вес. нанесенной оболочки.
9. Фармацевтический состав по п.8, в котором разбавителем является лактоза, разрыхлителем является кросповидон или микрокристаллическая целлюлоза, связующим веществом является Клуцел, веществом, способствующим скольжению, является Аэросил или коллоидная двуокись кремния и смазочным веществом является стеарат магния или натрий стеарилфумарат.
10. Фармацевтический состав по п.1, содержащий 119,5 мг иматиниба мезилата, 117,3 мг лактозы, 48,0 мг микрокристаллической целлюлозы, 68,0 мг маннита, 18,0 мг Клуцела, 2,5 мг Аэросила, 12,7 мг натрий стеарилфумарата и 9,0 мг Опадрай.
11. Способ получения фармацевтического состава по любому из пп.1-10, содержащего иматиниб мезилат с высокой полиморфной стабильностью, включающий: обеспечение таблетки, содержащей кристаллический иматиниб мезилат, и нанесение покрытия на таблетку в виде таблеточной оболочки с помощью органического растворителя с менее чем приблизительно 10% вес./об. воды.
12. Способ по п.11, в котором иматиниб мезилат представляет собой кристаллический иматиниб мезилат формы X.
13. Способ по любому из пп.11 или 12, в котором получение таблетки обеспечивается способом, выбранным из сухой грануляции и прямого прессования смеси, содержащей иматиниб мезилат.
14. Способ по п.13, в котором таблетку получают смешиванием иматиниба мезилата, разбавителя, одного или нескольких разрыхлителей и связующего вещества прибавлением к полученной смеси вещества, способствующего скольжению, и прибавлением к полученной таким образом смеси смазочного вещества для получения конечной смеси для образования лекарственной формы.
15. Способ по п.14, в котором разбавителем является лактоза, один или несколько разрыхлителей представляют собой авицел и маннит, связующим веществом является Клуцел, веществом, способствующим скольжению, является Аэросил и смазочным веществом является натрий стеарилфумарат.
16. Способ по п.11, в котором органическим растворителем является C1-4 спирт.
17. Способ по п.16, в котором C1-4 спирт представляет собой этанол или изопропиловый спирт.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Большаков В.И | |||
| Вспомогательные вещества в технологии лекарственных форм | |||
| Текст лекций | |||
| - Л., 1991, с.28. | |||
Авторы
Даты
2012-12-27—Публикация
2008-09-25—Подача