РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка испрашивает приоритет согласно предварительной заявке США №61/975687, поданной 4 апреля 2014 г. Lali K. MEDINA-KAUWE с соавт. под названием «АДРЕСНОЕ ВОЗДЕЙСТВИЕ НА УСТОЙЧИВЫЙ К ТРАСТУЗУМАБУ HER2+ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ ПОСРЕДСТВОМ НАНОЧАСТИЦ, МИШЕНЬЮ КОТОРЫХ ЯВЛЯЕТСЯ HER3», содержание которой полностью включено в настоящий документ посредством ссылки, включая чертежи.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[002] Настоящая заявка содержит Список последовательностей, представленный в формате ASCII через EFS-Web и полностью включенный в настоящий документ посредством ссылки. Имя указанной ASCII-копии, созданной 4 апреля 2015 г., -EOS006PCT_SEQLISTING.txt, а ее размер составляет 17 килобайт.
ПРАВА ПРАВИТЕЛЬСТВА
[003] Объект изобретения, описанный в настоящем документе, был получен при поддержке правительства посредством грантов NIH/NCI R01 СА140995 и NIH/NCI R01 СА129822, предоставленных Национальным институтом здравоохранения/Национальным институтом рака. Правительство США имеет определенные права на описанный объект изобретения.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[004] Настоящее изобретение относится к области терапевтических средств и, конкретнее, к области лечения рака.
УРОВЕНЬ ТЕХНИКИ
[005] Общеизвестно, что гиперэкспрессия семейства рецепторов HER, например, рецепторов HER1 (EGFR), HER2, HER3 и HER4 в клетке приводит к сильному и постоянному функционированию пролиферативных сигнальных путей в клетке, что в конечном итоге приводит к развитию некоторых видов рака, например, рака молочной железы. HER2-пoлoжитeльныe виды рака молочной железы составляют почти четверть инвазивных раковых опухолей молочной железы и являются признаком плохой выживаемости пациента. Трастузумаб представляет собой моноклональное антитело, которое мешает функционированию рецептора HER2/neu. В настоящее время оно доступно в продаже под несколькими торговыми названиями, например, Herceptin®, для лечения некоторых видов рака молочной железы. Пертузумаб - еще одно моноклональное антитело против HER2, используемое при лечении рака. Лапатиниб представляет собой низкомолекулярное органическое соединение, оказывающее терапевтический эффект при раке молочной железы. Эти терапевтические средства обычно используются в качестве последней линии обороны против рака после неудачного применения других терапевтических схем. К сожалению, хотя многие пациенты с HER2-положительным раком молочной железы первоначально реагируют на эти виды лечения, направленные против HER2, у значительной части из них развивается устойчивость к этим терапевтическим средствам. После развития устойчивости к терапевтическим средствам на поздней стадии количество вариантов лечения сокращается до крайне небольшого количества. Следовательно, существует серьезная необходимость в разработке новых лекарств, эффективных против этих HER2+ опухолей, которые не реагируют или развили устойчивость к указанным терапевтическим средствам.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[006] В настоящем документе описаны способы лечения рака у пациента, включающие выявление пациента, устойчивого к лечению терапевтическим средством против HER2; и введение пациенту молекулы для доставки лекарственного вещества, содержащей молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; молекулу нуклеиновой кислоты, связанную с полипептидной последовательностью посредством электростатических взаимодействий; и химический агент, нековалентно связанный с нуклеотидной последовательностью. Кроме того, описаны способы индукции апоптоза в HER2+ клетках рака молочной железы, устойчивых к терапевтическому средству против HER2, включающие приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного вещества.
[007] Кроме того, в настоящем документе описаны способы лечения рака у пациента, включающие выявление пациента, устойчивого к терапевтическому средству против HER2; и введение пациенту терапевтически эффективного количества молекулы для доставки лекарственного вещества, содержащей молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; и молекулу сульфонированного коррола, связанную с полипептидной последовательностью. Наконец, в настоящем документе описаны способы индукции апоптоза в HER2+ клетке рака молочной железы, устойчивой к терапевтическому средству против HER2, включающие приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного вещества, содержащей молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; и молекулу сульфонированного коррола, связанную с полипептидной последовательностью.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[008] На фигуре 1 показана система доставки в соответствии с вариантом реализации настоящего изобретения.
[009] На фигуре 2 показана система доставки, сконфигурированная для доставки Dox в HER2+ клетки рака молочной железы в соответствии с вариантом реализации настоящего изобретения. На этапе (1) показано получение и очистка HERPBK10 в виде рекомбинантного гибридного белка в бактериальной клетке. На этапе (2) показан ДНК-Dox, образованный посредством нековалентного интеркалирующего взаимодействия. На этапе (3) показано, как ДНК-Dox связывает HerPBK10 за счет нековалентного зарядового взаимодействия (анионные фосфатные группы ДНК электрофильно связывают катионный полилизин).
[0010] На фигуре 3 показана схема функционирования системы доставки, сконфигурированной для доставки Dox к HER2+ клеткам рака молочной железы в соответствии с вариантом реализации настоящего изобретения, в том числе (1) связывание с рецептором клеточной мембраны, (2) интернализация комплекса, (3) высвобождение в цитозоле химиотерапевтического средства (Dox), нековалентно связанного с дцДНК посредством интеркалирующего взаимодействия, и (4) проникновение химиотерапевтического средства и дцДНК в ядро.
[0011] На фигуре 4 (А) показано относительное содержание Dox в фильтратах во время сборки ДНК-Dox. Двуцепочечный олигонуклеотид, полученный путем отжига комплементарных 30-п.о. олигонуклеотидов, инкубировали в течение одного часа при комнатной температуре с Dox при молярном соотношении ДНК : Dox, равном 1:16. Свободный Dox удаляли путем фильтрации на центрифужных колонках с порогом 10 MW. После первого центрифугирования для удаления Dox (промывка 1) фильтры 4 раза промывали физиологическим раствором с буфером HEPES (HBS) (промывки 2-5).
[0012] На фигуре 4 (В) показано поглощение фильтратов и концентратов в УФ/видимом спектре во время сборки ДНК-Dox.
[0013] На фигуре 5 показана сборка HerDox. ДНК-Dox инкубировали с HerPBK10 на льду в течение 2 ч при молярном соотношении HerPBK10 : ДНК-Dox, равном 9:1. Смесь подвергали эксклюзионной ВЭЖХ; фракции, соответствующие 6-10 минутам, собирали для электрофореза в ДСН-ПААГ и иммуноблоттинга. HerDox собирали из пика, соответствующего 6 мин. Концентрацию Dox в HerDox оценивали путем измерения поглощения при длине волны 480 нм (длина волны поглощения Dox). 1-5 фракции HerDox при ВЭЖХ-очистке соответствуют образцам, собранным в промежуток времени 6-10 минут. Иммуноблоттинг фракций 1-5 также визуализировали с использованием антитела к пентоновому основанию, используемого для идентификации HerPBK10.
[0014] На фигуре 6 (А) показана стабильность конъюгата при различных условиях хранения или в сыворотке крови. HerDox инкубировали до 12 дней при 4°C, комнатной температуре или 37°C. Образцы фильтровали через центрифужные колонки для ультрафильтрации через день. Оптическую плотность концентрата и фильтрата измеряли при длине волны 480 нм для определения относительного удерживания Dox или его высвобождения из конъюгатов, соответственно.
[0015] Фигура 6 (В) имитирует длительное воздействие HerDox на клетки в культуральной среде. HerDox, иммобилизованный на гранулах Ni-HTA, инкубировали с сывороткой крупного рогатого скота в DMEM в течение указанного времени при 37°C до осаждения каждого образца. Оптическую плотность супернатантов (фильтратов) и элюатов гранул (концентратов) измеряли при длине волны 480 нм с целью обнаружения Dox. Относительное высвобождение или удерживание Dox в сыворотке представляли в виде значения, нормированного по контрольному материалу (соответствующему образцу, не содержащему сыворотки). N=3 на момент времени. Расчет Т-критериев (P<0,05) для образцов по сравнению с контрольными образцами не продемонстрировал существенных различий.
[0016] На фигуре 7 показана токсичность по отношению к мишени. Каждую линию клеток подвергали воздействию rHerDox (концентрация Dox 0,5 мкМ), только Dox (0,5 мкМ) или только HerPBK10 в течение 4 часов при 37°C в полных (т.е. содержащих сыворотку) средах с последующей аспирацией для удаления свободного конъюгата и добавлением свежей среды при непрерывном росте клеток. Титр клеток определяли путем метаболического (т.е. МТТ) анализа. На верхнем графике фигуры 7 показано влияние HerDox на выживаемость клеток MDA-MB-231 (HER2-) и MDA-MB-435 (HER2+). Относительное количество выживших клеток представлено в виде % от соответствующих необработанных клеток. На нижнем графике фигуры 7 показано сравнение HerDox, только Dox или только HerPBK10 на выживаемость HER2- и HER2+ клеток. Относительная выживаемость (в виде % от количества необработанных клеток) показана для 3 дня обработки.
[0017] На фигуре 8 показана специфичность рецептора. Клетки MDA-MB-435 (HER2+) инкубировали со свободным лигандом (eHRG) при 10-кратном молярном избытке HerDox в течение часа при 4°C. Среду аспирировали для удаления свободного eHRG и добавляли к клеткам свежую среду, содержащую HerDox (0,5 мкМ). Выживаемость клеток измеряли посредством МТТ-анализа и представляли в виде % от относительного количества необработанных клеток.
[0018] На фигуре 9 (А) показано адресное воздействие в смешанной клеточной культуре. Равное количество клеток MDA-MB-435 и GFP(+) MDA-MB-231 обрабатывали только Dox (0,5 мкМ), Her-Dox (содержащим 0,5 мкМ Dox) или HerPBK10 (1,2 мкг/лунку, что эквивалентно HerPBK10 в HerDox). Лунки анализировали, определяя флуоресценцию GFP (с целью определения относительного количества MDA-MB-231) и окрашивание кристалл-виолетом (с целью определения общего количества клеток).
[0019] На фигуре 9 (В) дополнительно показано адресное воздействие в смешанной клеточной культуре. Выживаемость клеток определяли путем расчета относительного времени удвоения (DT) количества экспериментальных (ехр) клеток, нормированного по контрольным (con) клеткам, на основании окрашивания кристал-виолетом (общее количество клеток) и флуоресценции GFP (клетки MDA-MB-231). DT клеток MDA-MB-435 определяли путем вычитания DT клеток MDA-MB-231 из общего DT клеток. Относительная выживаемость показана для 2 дня обработки.
[0020] На фигуре 9 (С) показано наличие стабильности в клеточной культуре. Аликвоты культуральной среды, содержащей HerDox (после инкубирования в течение указанного времени при 37°C) подвергали электрофорезу в 2% агарозном геле. Параллельно обрабатывали HerDox, инкубированный при 37°C в физиологическом растворе с HEPES-буфером, не содержащем сыворотки. Флуоресценцию DOX визуализировали путем УФ-возбуждения. Свободный Dox (только Dox) не удерживался в геле, тогда как Dox в составе HerDox - удерживался. Для выравнивания флуоресцентных полос с HerPBK10 и оценки загрузки на полосу гель окрашивали кумасси синим, который также позволял выявить сывороточный белок в образцах культуральных сред.
[0021] На фигуре 10 показано преимущественное адресное воздействие GFP-Her на HER2+ опухоли. Мышам, несущим опухоли, вводили 3 нмоль GFP-Her в хвостовую вену. Ткани собирали через 3,5 ч после инъекции и визуализировали с помощью томографа Xenogen для мелких животных. Флуоресценция GFP показана в виде красного псевдо-окрашивания (синее псевдо-окрашивание указывает на отсутствие флуоресценции, в то время как интенсивность GFP показана по сдвигу окрашивания в сторону красного цвета на цветной шкале).
[0022] На фигуре 11 (А) показано преимущественное адресное воздействие HerDox на HER2+ опухоли. Мышам, несущим опухоли, вводили 0,75 нмоль HerDox или Dox в хвостовую вену, и подвергали их визуализации на пользовательском томографе для мелких животных. На фигуре 11 (А) приведены изображения живых мышей после в/в доставки HerDox. Опухоли указаны стрелками.
[0023] На фигуре 11 (В) дополнительно изображено преимущественное адресное воздействие HerDox на HER2+ опухоли. Мышам, несущим опухоли, вводили 0,75 нмоль HerDox или Dox в хвостовую вену, и подвергали их визуализации на пользовательском томографе для мелких животных. На фигуре 11 (В) приведены изображения опухолей и тканей, собранных через 3 ч после инъекции HerDox или Dox. Сигнал флуоресценции Dox псевдо-окрашен согласно цветовой шкале, причем переход к 100 указывает на высокую интенсивность флуоресценции. На фигуре 11 (В) показано сравнение адресной доставки Dox к HER2+ клеткам рака молочной железы при минимальной доставке к другим органам и тканям с использованием системы доставки в соответствии с вариантом реализации настоящего изобретения (левая панель), с введением только Dox (правая панель).
[0024] На фигуре 12 (А) показано сравнение влияния HerDox и Dox на рост опухоли.
[0025] На фигуре 12 (А) показано сравнение влияния HerDox и Dox на массу животного.
[0026] На фигуре 12 (С) показано сравнение влияния HerDox и Dox на сердечную ткань.
[0027] На фигуре 12 (D) показано сравнение влияния HerDox и Dox на функцию сердца.
[0028] На фигуре 13 показана стабильность в цельной крови мыши. Свежесобранную цельную кровь обрабатывали путем ультрафильтрации через мембраны с порогом 10K MW после инкубирования в течение 1 часа с HerDox или Dox при температуре 37°C. Поскольку в качестве антикоагулянта использовали 0,5 мМ ЭДТА, параллельно обрабатывали только HerDox в ЭДТА (без крови). Столбики представляют собой флуоресценцию удерживаемого (концентраты) или высвобожденного (фильтраты) Dox в виде процента от общей флуоресценции в каждом образце. Масштаб по оси у скорректировали, чтобы показать наличие образцов фильтрата. N=3 на вариант обработки.
[0029] На фигуре 14 (А) изображено сравнение транслокации HerDox и Dox в клетки и их мишеней в живых клетках. Клетки MDA-MB-435 инкубировали с HerDox или свободным Dox (0,5 мкМ) при температуре 37°C. Живые (нефиксированные) клетки визуализировали посредством светлопольной и флуоресцентной микроскопии.
[0030] На фигуре 14 (В) изображено сравнение транслокации HerDox и Dox в клетки и их мишеней в живых клетках. Клетки MDA-MB-435 инкубировали с HerDox или свободным Dox (0,5 мкМ) при температуре 37°C. Живые (нефиксированные) клетки визуализировали посредством DIC и конфокальной флуоресцентной микроскопии.
[0031] На фигуре 15 изображена миграция HerDox в клетках рака молочной железы. Клетки, инкубированные с HerDox при 37°C, фиксировали в указанные моменты времени и обрабатывали путем измерения иммунофлуоресценции, используя антитело против HerPBK10. Изображения получали с помощью конфокальной микроскопии при флуоресценции и в светлом поле, n - ядро; длина масштабной полосы ~8 мкм.
[0032] На рисунке 16 изображено связывание HerPBK10 с клетками MDA-MB-435 в сыворотке крови пациентов-людей с HER2+ или HER2- раком молочной железы. Клетки обрабатывали HerPBK10 (1,2 мкг/лунку) в средах, содержащих сыворотку каждого из 5 пациентов-людей с HER2+ раком молочной железы или HER2- контрольных субъектов соответствующего возраста до химиотерапии. Клетки обрабатывали, выполняя твердофазный ИФА с использованием антител против HerPBK10. Контрольные (С) лунки, в которые вносили HerPBK10 в средах, содержащих сыворотку крупного рогатого скота со 10О-кратным молярным избытком конкурентного ингибитора лиганда (+Her) или без него, обозначены светлыми столбиками. Сыворотку пациентов предоставил банк тканей WCRI медицинского центра Сидарс-Синай. N=3 лунки на вариант обработки.
[0033] На фигуре 17 (А) изображены относительные уровни субъединиц HER на поверхности клеток и цитотоксичность в зависимости от типа клеток. Клетки инкубировали с антителами против субъединицы HER с последующей обработкой ПХ-конъюгированными вторичными антителами с использованием стандартных процедур. Относительное количество клеток измеряли по окрашиванию кристалл-виолетом, количественно измеряя оптическую плотность кристалл-виолета при 590 нм. Относительные уровни субъединиц регистрировали как сигнал твердофазного ИФА для каждой популяции клеток, нормированный по относительному количеству клеток, или ОП при 450 нм/590 нм. На фигуре 17 (А) приведен график относительного уровня субъединиц HER на поверхности клеток согласно твердофазному ИФА.
[0034] На фигуре 17 (В) приведена токсичность по отношению к клеткам, демонстрирующим различный уровень HER2. Цитотоксичность различных доз HerDox оценивали для каждой линии клеток посредством метаболического анализа и подтверждали путем окрашивания кристалл-виолетом. Значения CD50, показанные в логарифмической шкале, определяли посредством нелинейного регрессионного анализа кривых дозы HerDox с помощью научной программы построения графиков и подтверждали с помощью калькулятора. Относительный уровень HER2 для каждой линии клеток отображали рядом с каждым значением CD50.
[0035] На фигуре 18 изображена оптимизация HerPBK10. Способность измененного белка HerPBrgdK10 к доставке тестировали в контексте невирусного комплекса для передачи генов, эффективность доставки оценивали по экспрессии трансгена (люциферазы) в клетках рака молочной железы человека MDA-MB-453. *=Р<0,005 по сравнению с эквивалентной концентрацией HerPBK10 согласно двустороннему Т-критерию. На фигуре показано, что настоящее изобретение никоим образом не ограничивается HerPBK10, поскольку возможно внедрение различных мутаций, улучшающих адресное воздействие, связывание с рецептором, проникновение в клетку и/или внутриклеточную миграцию белка.
[0036] На фигуре 19 изображен график, демонстрирующий, что длина дц-олигонуклеотида не влияет на включение Dox в целевой комплекс. На графике продемонстрировано отсутствие заметных различий во включении Dox при использовании дуплексов из 30 или 48 пар оснований.
[0037] На фигуре 20 (А) показано, что HerDox токсичен по отношению к клеткам глиомы. На фигуре 20 (А) показана иммунофлуоресценция HER на клетках U251 глиомы человека. Изображения были получены с помощью лазерной сканирующей конфокальной флуоресцентной микроскопии.
[0038] На фигуре 20 (В) приведен график токсичности HerDox по сравнению с Dox для клеток U251. Двусторонние критерии позволили выявить существенные различия.
[0039] На фигуре 21 (А) показано, что устойчивость повышает токсичность HerDox. (А) Относительные уровни HER3 (и HER2) на поверхности клеток исходных и устойчивых к трастузумабу линий рака молочной железы, обнаруженные посредством твердофазного ИФА без пермеабилизации мембраны. N=3. *=р<0,05 по сравнению с исходными клетками.
[0040] На фигуре 21 (В) изображено уничтожение опухолевых клеток за счет HerDox (через 48-72 ч после обработки) по сравнению с только трастузумабом, только пертузумабом и комбинацией трастузумаб-пертузумаб. N=3.
[0041] Фигура 22 представляет собой график, на котором показано, что HerDox уничтожает устойчивые к трастузумабу опухоли in vivo. Самки бестимусных мышей, несущие опухоли JIMT-1, получали указанные реагенты в указанных дозах путем в/в (в хвостовую вену) инъекции, когда опухоли достигли объема ~100 мм3 (инъекции два раза в неделю в течение 4-6 недель). Объем опухолей измеряли штангенциркулем. День 0 соответствует первому дню лечения. N=10 опухолей на вариант обработки.
[0042] Фигура 23 представляет собой графики, показывающие, что предобработка трастузумабом усиливает токсичность HerDox. Исходные или неустойчивые клетки (А-С) и клетки, устойчивые к трастузумабу (D-F), обрабатывали трастузумабом в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0043] На фигуре 24 (А) приведено графическое изображение HerDox, образованного путем нековалентной самосборки с учетом стабильности в сыворотке, показан HerPBK10 с делинеаризованными функциональными доменами и электрофильное связывание с дц-олигонуклеотидом с интеркалированным Dox.
[0044] На фигуре 24 (В) приведено CryoEM-изображение частиц HerDox.
[0045] Фигура 24 (С) представляет собой ВЭЖХ-хроматограмму HerDox, на которой показан профиль элюирования поглощения Dox. На фигуре 24 (С) дополнительно показан электрофорез фракций, собранных при НРСЕ, в ДСН-ПААГ.
[0046] На фигуре 24 (D) показана защита дц-олигонуклеотида с помощью HerPBK10 от нуклеазного гидролиза в сыворотке. Двуцепочечный олигонуклеотид инкубировали в течение 20 минут в 100% сыворотке мыши (Abcam, Кембридж, штат Массачусетс, США) до электрофореза в ПААГ и окрашивали EtBr для визуализации ДНК.
[0047] На фигуре 24 (Е) показано, что HerDox остается стабильным в крови. Dox или HerDox инкубировали в течение часа в крови мыши при 37°C, а затем подвергали ультрафильтрации с целью отделения высвобожденного Dox (фильтрат) от комплекса (концентрат). N=3. *=р<0,05 по сравнению с соответствующими концентратами
[0048] На фигуре 25 показано, что HerDox опосредует адресную доставку в опухоль in vitro и in vivo.
[0049] Фиг. 25-А сравнивает цитотоксичность по отношению к HER2+ (MDA-MB-435) и HER2- клеткам (MDA-MB-231) в отдельных культурах, обработанных HerDox или Dox (окончательная концентрация Dox 0,5 мкМ). Относительная выживаемость клеток (в виде % от количества необработанных клеток) показана для 3 дня обработки. (+Her), предварительное инкубирование клеток MDA-MB-435 с лигандом, блокирующим рецептор (рекомбинантный зерегулин) до получения HerDox. N=3.
[0050] Фиг. 25-В сравнивает биораспределение HerDox и Dox у мышей с опухолями, экспрессирующими различные HER2-3. Ткани собирали от независимо получивших инъекции мышей, умерщвленных в указанные моменты времени после инъекции; интенсивность флуоресценции/ткань с флуоресценцией получали с помощью многорежимного томографа.
[0051] На фиг. 25-С изображена локализация HerPBK10 и Dox через один час после поглощения HerDox клетками MDA-MB-435. n - ядро. Длина масштабной полосы - приблизительно 4 мкм.
[0052] На фигуре 25-D приведено сравнение влияния HerDox и Dox на рост опухоли (N=8-10 опухолей на вариант обработки). День 0=3 дня до инъекции в хвостовую вену (мыши получали ежедневные инъекции в течение 7 дней). Контрольных (получавших инъекции физиологического раствора) мышей умерщвляли вскоре после начала эксперимента из-за изъязвления опухоли в соответствии с правилами IACUC.
[0053] На фигуре 25-Е показано сравнение влияния HerDox и Dox на неспецифическую ткань. День 0=3 дня до инъекции в хвостовую вену (мыши получали ежедневные инъекции в течение 7 дней). Контрольных (получавших инъекции физиологического раствора) мышей умерщвляли вскоре после начала эксперимента из-за изъязвления опухоли в соответствии с правилами IACUC. На микрофотографиях (увеличение 20х) на фиг. 25-Е показаны типичные окрашенные гематоксилином и эозином образцы миокарда и иммунофлуоресцентные образцы печени обработанных мышей. Зеленая флуоресценция в ядрах указывает на апоптоз (положительное окрашивание TUNEL). Верхний график - количественная оценка окрашивания TUNEL; нижние графики - эхокардиографические измерения через 25 дней после инъекции. *=Р<0,05 по сравнению с физиологическим раствором (имитатором исследуемого соединения).
[0054] На фигуре 26-А показан твердофазный ИФА связывания HerPBK10 с иммобилизованным HER3 (внеклеточный домен ErbB3 человека; Prospec) -/+ предварительное инкубирование с растворимым пептидом HER3 в качестве конкурентного ингибитора (блокирование HER3). Un - без HerPBK10.
[0055] На фигуре 26-В показан твердофазный ИФА связывания HerPBK10 с HER2+ клетками -/+ предварительное инкубирование с 1х и 10х молярным соотношением растворимого пептида HER3, растворимого пептида HER4 (ERBB4 пептид, Abnova), бетацеллюлина (10 мкг/мл) или пертузумаба (Pz) в качестве конкурентных ингибиторов. Сыворотка пациента не ингибирует связывание HerPBK10 с HER3.
[0056] На фигуре 27-А показано, что устойчивость повышает токсичность HerDox. На фиг. 27-А показаны относительные уровни HER3 (и HER2) на поверхности клеток исходных и устойчивых к трастузумабу линий рака молочной железы, обнаруженные посредством твердофазного ИФА без пермеабилизации мембраны. N=3. *=р<0,05 по сравнению с исходными клетками.
[0057] На фигуре 27-В показано, что устойчивость повышает токсичность HerDox. На фиг. 27-В показано уничтожение опухолевых клеток за счет HerDox (через 48-72 ч после обработки) по сравнению с Tz, Pz, Tz+Pz и только Dox. N=3.
[0058] На фигуре 27-С изображен вклад HER3 в токсичность по отношению к мишени. Исходные и устойчивые линии клеток обрабатывали HerDox -/+ пептид, блокирующий HER3 (ErbB3 человека; Prospec) и проверяли выживаемость клеток через 48 часов. Конкретнее, HerDox адсорбировали с использованием пептида HER3 в эквимолярном соотношении HER3 : HerPBK10 в холодном PBS в течение часа перед добавлением к клеткам при окончательной концентрации HerDox, равной 0,1 мкМ (JIMT-1, естественная устойчивость к обработке трастузумабом), 0,125 мкМ (ВТ-474) или 1 мкМ (SKBR3). Обработку сравнивали с обработкой соединением-имитатором (физиологическим раствором). N=3. *=р<0,05 по сравнению с соединением-имитатором.
[0059] На фигуре 27-D изображены относительные уровни HER3 (и HER2) на поверхности клеток исходных и устойчивых к трастузумабу линий рака молочной железы, обнаруженные посредством твердофазного ИФА без пермеабилизации мембраны. N=3. *=р<0,05 по сравнению с исходными клетками.
[0060] На фиг. 27-Е изображено уничтожение опухолевых клеток за счет HerDox (через 48-72 ч после обработки) по сравнению с Tz, Pz, Tz+Pz и только Dox. N=3.
[0061] На фигуре 28 продемонстрировано, что HerDox устраняет рост устойчивых к трастузумабу опухолей in vivo. Самки бестимусных мышей, несущие опухоли JIMT-1, получали указанные реагенты в указанных дозах путем внутривенной (в хвостовую вену) инъекции, когда опухоли достигли объема ~100 мм3 (инъекции два раза в неделю в течение 4 недель). Объем опухолей измеряли штангенциркулем. День 0 соответствует первому дню лечения. N=10 опухолей на вариант обработки.
[0062] На фигуре 29-А показано, что предобработка трастузумабом усиливает токсичность HerDox. На фиг. 29-А показано индуцированное повышение уровня HER3 за счет Tz и усиленное связывание с HerPBK10. Клетки исходных линий предварительно обработали 0,5 мг/мл Tz за 24 часа до тестирования уровня HER3 на поверхности этих клеток.
[0063] На фигуре 29-В показано, что предобработка трастузумабом усиливает токсичность HerDox. На фиг. 29-В показано индуцированное повышение уровня HER3 за счет Tz и усиленное связывание с HerPBK10. Клетки исходных линий предварительно обработали 0,5 мг/мл Tz за 24 часа до тестирования связывания HerPBK10 с этими клетками.
[0064] На фигуре 29-С показано, что предобработка трастузумабом усиливает токсичность HerDox. Исходные клетки SKBR3 обрабатывали Tz в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0065] На фигуре 29-D показано, что предобработка трастузумабом усиливает токсичность HerDox. Исходные клетки SK-474 обрабатывали Tz в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0066] На фигуре 29-Е показано, что предобработка трастузумабом усиливает токсичность HerDox. Неустойчивые клетки MDA-MB-435 обрабатывали Tz в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0067] На фигуре 29-F показано, что предобработка трастузумабом усиливает токсичность HerDox. Клетки, устойчивые к Tz, обрабатывали Tz в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0068] На фигуре 29-G показано, что предобработка трастузумабом усиливает токсичность HerDox. Клетки, устойчивые к Tz, обрабатывали Tz в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0069] На фигуре 29-Н показано, что предобработка трастузумабом усиливает токсичность HerDox. Клетки, устойчивые к Tz, обрабатывали Tz в указанных концентрациях (см. верхние оси X) за 4 и 24 часа до обработки HerDox и анализировали выживаемость через 48-72 ч после обработки. N=3.
[0070] На фигуре 30-А показано сравнение биораспределения и внутриклеточной миграции HerPBK10 и Tz. На фиг. 30-А показана визуализация на томографе Xenogen и количественная оценка биораспределения меченых HerPBK10, Tz и BSA за счет флуоресценции.
[0071] На фигуре 30-В показаны флуоресцентные конфокальные микрофотографии клеток MDA-MB-435 в разные моменты времени после связывания HerPBK10 (зеленый) и Tz (зеленый) с поверхностью клеток. На графике показаны относительные уровни HER2 (левая панель) и HER3 (правый бар) на поверхности клеток, количественная оценка которых выполнена посредством твердофазного ИФА поверхности клеток, нормированные по плотности клеток.
[0072] На фигуре 31-А показано связывание с клетками первичной опухоли человека. Клетки первичной опухоли, полученные из хирургического образца HER2+ пациента, исследовали на предмет уровня рецепторов на поверхности клеток.
[0073] На фигуре 31-В показано связывание с клетками первичной опухоли человека. Клетки первичной опухоли, полученные из хирургического образца HER2+ пациента, исследовали на предмет связывания HerPBK10.
[0074] Фигура 32-А представляет собой выравнивание аминокислотных последовательностей I-II доменов (херегулин-связывающего домена) человека (SEQ ID NO: 13) и HER3 мыши (SEQ ID NO: 14).
[0075] На фигуре 32-В приведено сравнение относительных уровней HER3 на клетках различных линий, обнаруженных посредством твердофазного ИФА (без пермеабилизации) с использованием антитела против HER3, перекрестно реагирующего с HER3 человека и мыши (1В2Е; Cell Signaling Technologies).
[0076] На фигуре 32-С изображено связывание HerPBK10 с клетками опухоли молочной железы мыши 4Т1. N=3. *=р<0,05 по сравнению с только HerPBK10.
[0077] На фигуре 33-А показаны химические структуры металлированных (S2Ga, S2MN) и неметаллированных (S2FB) сульфированных корролов и схема нековалентной сборки с HerPBK10 с образованием круглых частиц, обозначенных как HerFB, HerGa и HerMn, соответственно. В таблице приведена сводная информация по характерным особенностям трех указанных корролов.
[0078] На фигуре 33-В показано CryoEM-изображение частиц HerGa.
[0079] На фигуре 33-С показано измерение динамического светорассеяния HerMn в растворе. На врезке показана ПЭМ-фотография частицы HerMn.
[0080] На фигуре 34-А показано, что S2FB ингибирует SOD1, а неметаллированные корролы - нет. Анализ in vitro, измеряющий продукцию супероксида XOD -/+ СОД. Только S2FB (1 мкМ) влияли на активность СОД, снижая ее приблизительно на одну треть.
[0081] На фигуре 34-В показано, что пик поглощения S2FB смещается (стрелка) при инкубировании с СОД.
[0082] На фигуре 34-С показано, что CuCl2 гасит флуоресценцию S2FB.
[0083] На фигуре 35-А изображена сводная схема случайного мутагенеза и биопэннинга библиотеки мутантных пентоновых оснований.
[0084] На фигуре 35-В показана схема полноразмерных и укороченных клонов, выделенных при биопэннинге и выровненных с HerPBK10.
[0085] На фигуре 35-С показаны иммуноблоты субклеточных фракций (20 мкг/дорожку), при обнаружении с использованием антитела против N-концевого гистидинового маркера.
[0086] На фигуре 35-D показана иммунофлуоресценция клеток MDA-MB-435 через 30 мин после поглощения указанного рекомбинантного белка (10 мкг/лунку, 12-луночная чашка). Длина масштабной полосы - приблизительно 10 мкм.
[0087] На фигуре 36-А показано, что S2Ga взаимодействует с TSPO. На фиг. 36-А показано, что растворимый рекомбинантный белок TSPO инкубировали с S2Ga при эквивалентных молярных концентрациях (1 мкМ) в течение ~20 мин при комнатной температуре с последующей ультрафильтрацией с целью удаления свободного несвязанного S2Ga. Концентраты оценивали на предмет наличия коррола, связанного с белком, путем измерения спектров поглощения и флуоресценции. Там, где это указано, PK11195 использовали в качестве конкурентного ингибитора сайта связывания порфирина на TSPO.
[0088] На фигуре 36-В дополнительно показано, что S2Ga взаимодействует с TSPO. На фиг. 36-В показано, что растворимый рекомбинантный белок TSPO инкубировали с S2Ga при эквивалентных молярных концентрациях (1 мкМ) в течение ~20 мин при комнатной температуре с последующей ультрафильтрацией с целью удаления свободного несвязанного S2Ga. Концентраты оценивали на предмет наличия коррола, связанного с белком, путем измерения спектров поглощения и флуоресценции. Там, где это указано, PK11195 использовали в качестве конкурентного ингибитора сайта связывания порфирина на TSPO.
[0089] На фигуре 36-С показано доказательство взаимодействия HerGa с TSPO in situ. Клетки MDA-MB-435 трансфицировали плазмидой, экспрессирующей экзогенный TSPO, за 24 часа до обработки клеток HerGa и исследовали HerGa-опосредованное разрушение митохондрий, отслеживаемое по снижению накопления красного флуоресцентного красителя в митохондриях и накоплению зеленой флуоресценции в цитоплазме.
[0090] На фигуре 36-D показана количественная оценка красной флуоресценции, видимой на фиг. 36-С. *, р<0,05
[0091] На фигуре 37 показана токсичность HerMn для HER2+ и HER2- опухолевых клеток человека. Клетки каждой линии обработали указанной концентрацией HerMn или S2Mn и оценивали на предмет выживаемости через 24 часа посредством окрашивания кристалл-виолетом (CV). N=3 на концентрацию, данные из 3-х отдельных экспериментов.
[0092] На фигуре 38-А показан механизм цитотоксичности HerMn.На конфокальных флуоресцентных снимках показано действие HerMn на клетки MDA-MB-435. Масштабная линейка = 10 мкм. На фиг. 38-А показано снижение мембранного потенциала митохондрий в клетках, получающих 10 мкМ S2Mn или HerMn, с последующей обработкой TMRM (30 нМ) в HBSS через 24 часа. Контроль - обработка PBS.
[0093] На фигуре 38-В показан механизм цитотоксичности HerMn. На конфокальных флуоресцентных снимках показано действие HerMn на клетки MDA-MB-435. Масштабная линейка = 10 мкм. На фиг. 38-В показан супероксид-опосредованный коллапс актина (красный) и тубулина (зеленый) под действием HerMn (5 мкМ) после 24-часового инкубирования клеток. S2Mn (5 мкМ), HerPBK10 (при концентрации белка, эквивалентной HerMn) и PBS использовали в качестве контрольных материалов. Дополнительные клетки получали тирон (5 мМ) за час до обработки HerMn.
[0094] На фигуре 39 показано биологическое распределение у мышей, несущих опухоли. Визуализация на томографе Xenogen и количественное определение Alexa680-меченого HerMn, Tz и BSA (по 12 нмоль) после инъекции в хвостовую вену. График, средняя флуоресценция -/+ ТЭМ.
[0095] На фигуре 40-А показана терапевтическая эффективность HerMn. На фиг. 40-А показан рост HER2+ опухоли MDA-MB-435 у самок бестимусных мышей, получавших внутривенные инъекции (в хвостовую вену) HerMn или S2Mn (5 нмоль коррола/инъекцию) раз в день в течение 6 дней подряд. Контрольные группы получали физиологический раствор или HerPBK10 в концентрации, эквивалентной HerMn. Обработку начали при среднем объеме опухоли ~200 мм3. Объем опухолей измеряли до (день 1), во время (день 3), и после (дни 8, 15, и 22) инъекций реагентов. N=8-10 опухолей/группу. *р<0,05 (однофакторный ANOVA).
[0096] На фигуре 40-В показана жизнеспособность CDC человека после 48-часового воздействия HerMn, S2Mn, HerPBK10 или доксорубицина (Dox). N=3 на концентрацию, данные из 3-х отдельных экспериментов.
[0097] На фигуре 41-А показано, что HerMn усиливает контраст при МРТ. На фиг. 41-А показано сокращение релаксации Т1 в растворе.
[0098] На фигуре 41-В показано, что HerMn усиливает контраст при MPT in vivo. На снимках (слева) показаны поперечные сечения мышей, несущих опухоли, после ежедневных системных (в/в) инъекций HerMn или S2Mn (8 нмоль на инъекцию) в течение 8 дней с целью обеспечить накопление сигнала, или одной инъекции гадолиния в дозе 0,1 ммоль/кг за 10 мин до получения снимка. Опухоли обведены прямоугольными областями и увеличены (справа).
[0099] На фигуре 42-А показаны относительные уровни HER3 (и HER2) на поверхности клеток исходных и устойчивых к трастузумабу линий рака молочной железы, обнаруженные посредством твердофазного ИФА без пермеабилизации мембраны. N=3. *=р<0,05 по сравнению с исходными клетками.
[00100] На фигуре 42-В показаны относительные уровни HER3 (и HER2) на поверхности клеток линии рака молочной железы JIMT-1, обнаруженные посредством твердофазного ИФА без пермеабилизации мембраны. N=3. *=р<0,05 по сравнению с исходными клетками.
[00101] На фигуре 42-С показано индуцированное повышение уровня HER3 за счет Tz и усиленное связывание с HerPBK10. Клетки исходных линий предварительно обработали 0,5 мг/мл Tz за 24 часа до измерения уровня HER3 на поверхности клеток.
[00102] На фигуре 42-D показано индуцированное повышение уровня HER3 за счет Tz и усиленное связывание с HerPBK10. Клетки исходных линий предварительно обработали 0,5 мг/мл Tz за 24 часа до тестирования связывания HerPBK10 с этими клетками.
[00103] На фигуре 42-Е показаны уровни рецепторов на поверхности клеток первичных опухолей, полученных из хирургического образца от HER2+ пациента.
[00104] На фигуре 42-F показано связывание HerPBK10 с клетками первичных опухолей, полученных из хирургического образца от HER2+ пациента.
[00105] На фигуре 43 показано, что нанобиологические частицы корролов, например, HerGa, проявляют повышенную токсичность по отношению к Tz-устойчивым опухолевым клеткам in vitro и in vivo.
[00106] На фигуре 43-А показаны относительные уровни HER3 на поверхности клеток исходных и устойчивых к трастузумабу линий рака молочной железы, обнаруженные посредством твердофазного ИФА без пермеабилизации мембраны. N=3. *=р<0,05 по сравнению с исходными клетками.
[00107] На фигуре 43-В показано уничтожение опухолевых клеток за счет HerGa (через 48-72 ч после обработки) по сравнению с Tz. N=3.
[00108] На фигуре 43-С показано уничтожение опухолевых клеток за счет HerGa (через 48-72 ч после обработки) по сравнению с комбинированной обработкой Tz+Pz. N=3.
[00109] На фигуре 43-D показано снижение опухолевого роста in vivo Самки бестимусных мышей, несущие опухоли ВТ474, получали указанные реагенты в указанных дозах путем внутривенной инъекции (в хвостовую вену), когда опухоли достигли объема ~100 мм3 (инъекции два раза в неделю в течение 4-6 недель). Объем опухолей измеряли штангенциркулем. День 0 соответствует первому дню лечения. N=10 опухолей на вариант обработки.
[00110] На фигуре 43-Е показано снижение опухолевого роста in vivo Самки бестимусных мышей, несущие опухоли ВТ474, получали указанные реагенты в указанных дозах путем внутривенной инъекции (в хвостовую вену), когда опухоли достигли объема ~100 мм3 (инъекции два раза в неделю в течение 4-6 недель). Объем опухолей измеряли штангенциркулем. День 0 соответствует первому дню лечения. N=10 опухолей на вариант обработки.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ
СПОСОБЫ ЛЕЧЕНИЯ
[00111] В одном аспекте в настоящем документе описаны способы лечения рака у пациента, включающие:
выявление пациента, устойчивого к лечению терапевтическим средством против HER2; и
введение пациенту терапевтически эффективного количества молекулы для доставки лекарственного средства, содержащей:
молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа;
молекулу нуклеиновой кислоты, связанную с полипептидной последовательностью посредством электростатических взаимодействий; и
химический агент, нековалентно связанный с нуклеотидной последовательностью.
[00112] Молекулы для доставки лекарственного средства, используемые в способах, описанных в настоящем документе, описаны в других источниках. Например, в международной публикации WO 2009/009441 и публикации заявки на патент США US 2010/0331273 А1 подробно описаны компоненты молекул для доставки лекарственных средств и способы их получения. Содержание каждой из этих публикаций полностью включено в настоящий документ посредством ссылок, включая чертежи. В частности, в настоящий документ посредством ссылок включены абзацы [0055]-[0094], чертежи и их описания, а также перечни последовательностей, приведенные в публикации US 2010/0331273 А1.
[00113] «Терапевтически эффективное количество», используемое в настоящем документе, относится к такому количеству, которое позволяет достичь благоприятных результатов у пациента с раком. Терапевтически эффективное количество можно определить на индивидуальной основе; оно должно быть по меньшей мере частично основано на физиологических особенностях млекопитающего, типе системы доставки или используемой терапевтической методики и времени введения по отношению к прогрессированию заболевания. Благоприятный результат получают, если: 1) раковая опухоль уменьшается в размерах; 2) раковая опухоль перестает расти; или 3) скорость роста раковой опухоли замедляется по сравнению с периодом времени до введения терапевтического средства.
[00114] В некоторых вариантах реализации терапевтическое средство против HER2 представляет собой терапевтическое средство на основе антитела. В этих вариантах реализации антитело, эффективно действующее против HER2, вводят пациенту. Примеры таких антител включают трастузумаб и пертузумаб или их биологические аналоги. В других вариантах реализации терапевтическое средство против HER2 представляет собой терапевтическое средство на основе низкомолекулярного соединения. В этих вариантах реализации низкомолекулярное органическое соединение, т.е. соединение, не являющееся полипептидом, нуклеиновой кислотой или полимером, эффективно действующее против HER2, вводят пациенту. Примером низкомолекулярного лекарственного вещества является лапатиниб.
[00115] В некоторых вариантах реализации молекула полипептида содержит лиганд, обеспечивающий адресное воздействие. В некоторых вариантах реализации молекула полипептида содержит положительно заряженный домен. В других вариантах реализации полипептид является рекомбинантным гибридным белком. В некоторых из указанных вариантов реализации рекомбинантный гибридный белок содержит сегмент Her. В некоторых вариантах реализации рекомбинантный гибридный белок содержит сегмент пептонового основания. В некоторых вариантах реализации молекула полипептида содержит рецептор-связывающий домен, который в некоторых вариантах реализации представляет собой херегулин-α. В некоторых вариантах реализации молекула полипептида содержит эндосомолитический домен. В некоторых из указанных вариантов реализации эндосомолитический домен содержит мотив Arg-Gly-Asp, в то время как в других вариантах реализации эндосомолитический домен содержит мотив Glu-Gly-Asp. В некоторых вариантах реализации молекула полипептида содержит полилизиновый мотив, который в некоторых вариантах реализации представляет собой декализин (K10). В некоторых вариантах реализации последовательность полипептида представляет собой SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 или их комбинацию. В некоторых вариантах реализации последовательность полипептида представляет собой HerPBK10.
[00116] В настоящем документе «РВ» относится к сегменту пентонового основания, которое обычно опосредует связывание с клетками, проникновение в клетку и в цитозоль аденовируса 5 серотипа на ранних стадиях инфекции. Пример такого белка пентонового основания представлен в настоящем документе под названием SEQ ID NO: 10. Этот белок пентонового основания обычно содержит мотив RGD (Arg-Gly-Asp). В настоящем документе «K10» относится к декализиновому мотиву, который обладает способностью связывать нуклеиновые кислоты за счет электрофильного взаимодействия, представленному в настоящем документе под названием SEQ ID NO: 11. Пример нуклеотидной последовательности, кодирующей HerPBK10, приведен в настоящем документе под названием SEQ ID NO: 4, а ее комплементарная цепь - SEQ ID NO: 5. Аналогичным образом, можно использовать точечную мутацию в мотиве RGD для создания мотива EGD (Glu-Gly-Asp), что приводит к получению молекулы полипептида HerPBrgdK10 (а не HerPBK10).
[00117] В одном варианте реализации указанная молекула нуклеиновой кислоты представляет собой двуцепочечный олигонуклеотид. В некоторых из указанных вариантов реализации двуцепочечный олигонуклеотид связывается с рекомбинантным гибридным белком за счет электростатических взаимодействий.
[00118] В некоторых вариантах реализации химический агент представляет собой токсин. В некоторых вариантах реализации химический агент представляет собой химиотерапевтический агент, которое в некоторых вариантах реализации представляет собой доксорубицин или его фармацевтический эквивалент. В некоторых вариантах реализации химический агент интеркалирован в молекулу нуклеиновой кислоты. В настоящем документе термин «интеркалирующий» относится к возможности вставки в существующую структуру, например, полинуклеотидную последовательность.
[00119] Термин «химиотерапевтический агент», используемый в настоящем документе, относится к агентам, способным разрушать, уничтожать, препятствовать росту и/или оказывать иное вредоносное воздействие на раковые клетки или опухоли. Указанные агенты могут включать алкилирующие агенты (например, бусульфан, цисплатин, карбоплатин, хлорамбуцил, циклофосфамид, ифосфамид, дакарбазин, мехлоретамин, мелфалан и темозоломид), производные нитрозомочевины (например, стрептозоцин, кармустин и ломустин), антрациклины и родственные препараты (например, доксорубицин, эпирубицин, идарубицин и митоксантрон), ингибиторы топоизомеразы I и II (например, топотекан, иринотекан, этопозид и тенипозид) и ингибиторы митоза (например, таксаны, например, паклитаксел и доцетаксел, и алкалоиды барвинка, например, винбластин, винкристин и винорелбин), но никоим образом не ограничиваются ими. Другие химиотерапевтические агенты известны специалистам в данной области и могут использоваться в связи с альтернативными вариантами реализации, описанными в настоящем документе, в рабочем порядке.
[00120] В некоторых вариантах реализации тип клеток представляет собой HER2+ клетки рака молочной железы, устойчивые к терапевтическому средству против HER2. Как правило, HER2+ клетки рака молочной железы реагируют на лечение, например, с использованием антитела против HER2, например, трастузумаба или пертузумаба, или низкомолекулярного соединения, например, лапатиниба. Под термином «реагировать» на лечение подразумевают, что при введении антитела в раковую клетку, либо при системном введении антитела in vivo в организм ракового пациента, или при контакте клетки с антителом in vitro происходит снижение количества клеток в образце или в организме пациента, например, за счет индуцированного апоптоза, или замедление или приостановка роста клеток в образце или в организме пациента. У пациентов это проявляется в снижении размера раковой опухоли, отсутствии роста опухоли или замедлении роста опухоли по сравнению с периодом времени до введения антитела. «HER2+ клетки рака молочной железы, устойчивые к терапевтическому средству против HER2» представляют собой клетки, которые не реагируют на лечение с использованием антитела или низкомолекулярного соединения. Эти клетки продолжают расти даже после введения терапевтического агента. Некоторые клетки по своей природе устойчивы к лечению. Эти клетки никогда не реагируют на лечение. Другие клетки приобретают устойчивость к лечению. Эти клетки вначале реагируют на лечение, но через некоторое время перестают реагировать. Таким образом, пациент становится невосприимчивым к лечению.
[00121] В некоторых вариантах реализации HER2+ клетка рака молочной железы характеризуется уровнем поверхностного HER3 выше, чем уровень поверхностного HER3 на HER2+ клетках рака молочной железы, неустойчивых к терапевтическому средству. Под понятием «HER2+ клетки рака молочной железы, неустойчивые к терапевтическому средству» подразумевают HER2+ раковые клетки, реагирующие на лечение с использованием терапевтического агента, например, антитела против HER2 или низкомолекулярного соединения, и не становящиеся устойчивыми к нему. В других вариантах реализации устойчивая клетка рака молочной железы характеризуется таким же уровнем поверхностной экспрессии HER3, как и уровень на HER2+ клетках рака молочной железы, неустойчивых к терапевтическому средству. В некоторых вариантах реализации антитело против HER2 представляет собой трастузумаб или пертузумаб. В некоторых вариантах реализации HER2+ клетка рака молочной железы является по своей природе устойчивой к терапевтическому средству против HER2, в то время как в других вариантах реализации HER2+ клетка рака молочной железы приобрела устойчивость к терапевтическому средству против HER2.
[00122] В некоторых вариантах реализации способы, описанные в настоящем документе, дополнительно включают этап совместного введения терапевтического агента против HER2 с молекулой для доставки лекарственного средства. В некоторых из этих вариантов реализации терапевтический агент и молекулу для доставки лекарственного средства вводят одновременно. В некоторых из этих вариантов реализации как терапевтический агент, так и молекула для доставки лекарственного средства содержатся в одной и той же вводимой лекарственной форме. В других вариантах реализации терапевтический агент и молекулу для доставки лекарственного средства вводят в разное время. В некоторых вариантах реализации пациент является наивным по отношению к лечению с применением терапевтического агента. В других вариантах реализации пациента в течение некоторого времени подвергали лечению с применением терапевтического агента, а затем к терапевтической схеме добавили лечение с применением молекулы для доставки лекарственного средства.
[00123] В некоторых вариантах реализации пациент является млекопитающим, выбранным из группы, состоящей из мыши, крысы, кролика, морской свинки, собаки, кошки, овцы, козы, коровы, обезьяны, шимпанзе, человекообразной обезьяны и человека. В некоторых вариантах реализации пациент является человеком.
[00124] В еще одном аспекте в настоящем документе описаны способы индукции апоптоза в HER2+ клетках рака молочной железы, устойчивых к терапевтическому средству против HER2, включающие.
приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного средства, содержащей:
молекулу полипептида, адаптированного к мишени и/или проникающую в клетки определенного типа;
молекулу нуклеиновой кислоты, связанную с полипептидной последовательностью посредством электростатических взаимодействий; и
химический агент, нековалентно связанный с нуклеотидной последовательностью.
[00125] В вариантах реализации этого аспекта молекула для доставки лекарственного средства является такой, как описано выше и в других разделах настоящего документа.
[00126] В некоторых вариантах реализации приведение в контакт происходит in vitro. Например, в этих вариантах реализации клетки выращивают в лаборатории, и контакт происходит в рамках лабораторного эксперимента.
[00127] В некоторых вариантах реализации приведение в контакт происходит in vivo. В этих вариантах реализации молекулу для доставки лекарственного средства или ее пролекарство вводят пациенту. Если вводят пролекарство, то указанное пролекарство преобразуется в молекулу для доставки лекарственного средства, и контакт происходит в организме пациента.
[00128] В некоторых вариантах реализации HER2+ клетка рака молочной железы, устойчивая к терапевтическому средству против HER2, является клеткой млекопитающего, причем указанное млекопитающее необязательно выбрано из группы, состоящей из мыши, крысы, кролика, морской свинки, собаки, кошки, овцы, козы, коровы, обезьяны, шимпанзе, человекообразной обезьяны и человека.
[00129] В третьем аспекте в настоящем документе описан способ лечения рака у пациента, включающий:
выявление пациента, устойчивого к терапевтическому средству против HER2; и
введение пациенту терапевтически эффективного количества молекулы для доставки лекарственного средства, содержащей:
молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; и
молекулу сульфонированного коррола, связанную с полипептидной последовательностью.
[00130] В некоторых вариантах этого аспекта молекула сульфонированного коррола содержит атом металла, например, марганца (Mn), железа (Fe) и/или галлия (Ga), но не ограничивается ими. В некоторых вариантах реализации молекула для доставки лекарственного средства представляет собой HerMn, HerFe или HerGa. В одном варианте реализации терапевтическое средство против HER2 представляет собой терапевтическое средство на основе антитела. В некоторых из этих вариантов реализации указанное антитело представляет собой трастузумаб или пертузумаб. В другом варианте реализации терапевтическое средство против HER2 представляет собой терапевтическое средство на основе низкомолекулярного соединения. В некоторых из этих вариантов реализации указанное низкомолекулярное соединение представляет собой лапатиниб.
[00131] В некоторых вариантах реализации молекула полипептида содержит лиганд, обеспечивающий адресное воздействие. В некоторых вариантах реализации молекула полипептида содержит положительно заряженный домен. В некоторых вариантах реализации полипептид является рекомбинантным гибридным белком. В некоторых из указанных вариантов реализации рекомбинантный гибридный белок содержит сегмент Her. В других вариантах реализации рекомбинантный гибридный белок содержит сегмент пептонового основания. В некоторых вариантах реализации молекула полипептида содержит рецептор-связывающий домен. В некоторых из этих вариантов реализации указанный рецептор-связывающий домен представляет собой херегулин-α. В некоторых вариантах реализации молекула полипептида содержит эндосомолитический домен. В некоторых из этих вариантов реализации эндосомолитический домен содержит мотив Arg-Gly-Asp. В других вариантах реализации эндосомолитический домен содержит мотив Glu-Gly-Asp. В некоторых вариантах реализации молекула полипептида содержит полилизиновый мотив. В некоторых из этих вариантов реализации указанный полилизиновый мотив представляет собой декализин.
[00132] В одном варианте реализации полинуклеотидная последовательность представляет собой SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 или их комбинацию. В одном варианте реализации последовательность полипептида представляет собой HerPBK10. Пример нуклеотидной последовательности, кодирующей HerPBK10, приведен в настоящем документе под названием SEQ ID NO: 4, а ее комплементарная цепь - SEQ ID NO: 5.
[00133] В одном варианте реализации тип клеток представляет собой HER2+ клетки рака молочной железы, устойчивые к терапевтическому средству против HER2. В некоторых из этих вариантов реализации HER2+ клетка рака молочной железы характеризуется уровнем поверхностного HER3 выше, чем уровень поверхностного HER3 на HER2+ клетках рака молочной железы, реагирующих на лечение. В некоторых вариантах реализации HER2+ клетка рака молочной железы по своей природе устойчива к терапевтическому средству против HER2. В других вариантах реализации HER2+ клетка рака молочной железы приобрела устойчивость к терапевтическому средству против HER2.
[00134] В некоторых вариантах реализации пациент является млекопитающим, выбранным из группы, состоящей из мыши, крысы, кролика, морской свинки, собаки, кошки, овцы, козы, коровы, обезьяны, шимпанзе, человекообразной обезьяны и человека.
[00135] В четвертом аспекте в настоящем документе описаны способы индукции апоптоза в HER2+ клетках рака молочной железы, устойчивых к терапевтическому средству против HER2, включающие.
приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного средства, содержащей:
молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; и
молекулу сульфонированного коррола, связанную с полипептидной последовательностью.
[00136] В некоторых вариантах этого аспекта молекула сульфонированного коррола содержит атом металла, например, марганца (Mn), железа (Fe) и/или галлия (Ga), но не ограничивается ими. В некоторых вариантах реализации молекула для доставки лекарственного средства представляет собой HerMn, HerFe или HerGa. В одном варианте реализации терапевтическое средство против HER2 представляет собой терапевтическое средство на основе антитела. В некоторых из этих вариантов реализации указанное антитело представляет собой трастузумаб или пертузумаб. В другом варианте реализации терапевтическое средство против HER2 представляет собой терапевтическое средство на основе низкомолекулярного соединения. В некоторых из этих вариантов реализации указанное низкомолекулярное соединение представляет собой лапатиниб.
[00137] В некоторых вариантах реализации молекула полипептида содержит лиганд, обеспечивающий адресное воздействие. В некоторых вариантах реализации молекула полипептида содержит положительно заряженный домен. В некоторых вариантах реализации полипептид является рекомбинантным гибридным белком. В некоторых из указанных вариантов реализации рекомбинантный гибридный белок содержит сегмент Her. В других вариантах реализации рекомбинантный гибридный белок содержит сегмент пептонового основания. В некоторых вариантах реализации молекула полипептида содержит рецептор-связывающий домен. В некоторых из этих вариантов реализации указанный рецептор-связывающий домен представляет собой херегулин-α. В некоторых вариантах реализации молекула полипептида содержит эндосомолитический домен. В некоторых из этих вариантов реализации эндосомолитический домен содержит мотив Arg-Gly-Asp. В других вариантах реализации эндосомолитический домен содержит мотив Glu-Gly-Asp. В некоторых вариантах реализации молекула полипептида содержит полилизиновый мотив. В некоторых из этих вариантов реализации указанный полилизиновый мотив представляет собой декализин.
[00138] В одном варианте реализации полинуклеотидная последовательность представляет собой SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 или их комбинацию. В одном варианте реализации последовательность полипептида представляет собой HerPBK10. Пример нуклеотидной последовательности, кодирующей HerPBK10, приведен в настоящем документе под названием SEQ ID NO: 4, а ее комплементарная цепь - SEQ ID NO: 5.
[00139] В одном варианте реализации тип клеток представляет собой HER2+ клетки рака молочной железы, устойчивые к терапевтическому средству против HER2. В некоторых из этих вариантов реализации HER2+ клетка рака молочной железы характеризуется уровнем поверхностного HER3 выше, чем уровень поверхностного HER3 на HER2+ клетках рака молочной железы, реагирующих на лечение. В некоторых вариантах реализации HER2+ клетка рака молочной железы по своей природе устойчива к терапевтическому средству против HER2. В других вариантах реализации HER2+ клетка рака молочной железы приобрела устойчивость к терапевтическому средству против HER2.
[00140] В некоторых вариантах реализации пациент является млекопитающим, выбранным из группы, состоящей из мыши, крысы, кролика, морской свинки, собаки, кошки, овцы, козы, коровы, обезьяны, шимпанзе, человекообразной обезьяны и человека.
[00141] В некоторых вариантах реализации приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного средства происходит in vitro. В других вариантах реализации приведение в контакт происходит in vivo.
[00142] В некоторых вариантах реализации HER2+ клетка рака молочной железы, устойчивая к терапевтическому средству против HER2, является клеткой млекопитающего. В некоторых вариантах реализации млекопитающее выбирают из группы, состоящей из мыши, крысы, кролика, морской свинки, собаки, кошки, овцы, козы, коровы, обезьяны, шимпанзе, человекообразной обезьяны и человека.
МОЛЕКУЛА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА
[00143] В настоящем документе описаны системы доставки, включающие комплекс, получаемый путем самосборки, для адресного воздействия химических агентов на клетки. Система доставки, способная оказывать адресное воздействие на больные клетки in vitro и in vivo, избегает тканей сердца (в тех случаях, когда это желательно) и связывается с клетками-мишенями и проникает в них. Кроме того, сборка комплекса осуществляется нековалентно (т.е. без необходимости химического присоединения, например, химиотерапевтического агента к специфическому носителю) и использует небольшой нуклеотидный носитель в качестве мостика для связывания лекарственного вещества со специфическим белком-носителем.
[00144] В соответствии с различными вариантами реализации, описанными в настоящем документе, можно использовать любое количество полинуклеотидных последовательностей или небольших двуцепочечных нуклеиновых кислот. Например, в одном варианте реализации в качестве полинуклеотидной последовательности или двуцепочечной нуклеиновой кислоты используют SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 или их комбинацию.
[00145] В соответствии с различными вариантами реализации, описанными в настоящем документе, можно использовать любое количество специфических лигандов. Например РВ сам по себе может выступать в качестве специфического лиганда PBK10 при адресном воздействии на интегрины, например, αvβ3. Как известно специалисту в данной области техники, интегрины сверхэкспрессируются в различных типах метастатических опухолей. Таким образом, в сочетании с различными вариантами реализации, описанными в настоящем документе, PBK10 можно использовать для адресного воздействия на метастатические опухоли и клетки с высокой экспрессией интегринов.
[00146] Описанная система доставки включает комплекс, который можно вводить млекопитающему различными способами, после чего он сосредотачивается в области клеток-мишеней (например, раковых клеток), доставляя молекулы, например, агенты для визуализации или терапевтические агенты, в эти клетки. В одном варианте реализации комплекс обеспечивает доставку терапевтических агентов в раковые клетки, не затрагивая нормальные, здоровые клетки.
[00147] Как показано на фиг. 1, вариант реализации описанной системы доставки включает три компонента, образующие один специфический конъюгат путем самосборки. Первый компонент («блок А») - это уникальный белок, проникающий в клетки, который оказывает адресное воздействие на клетку(и) определенного типа и проникает в них. Он содержит лиганд (рецептор-связывающий домен), домен для проникновения через мембрану и ДНК-связывающий домен. Второй компонент («блок В») представляет собой небольшую нуклеиновую кислоту (например, двуцепочечный олигонуклеотид), которая связывается с блоком А посредством электростатических взаимодействий. Третий компонент («блок С») представляет собой химический агент, который связывает блок В посредством интеркалирующих взаимодействий. В одном варианте реализации указанных химический агент является токсичным веществом. В одном варианте реализации тип клеток представляет собой раковую клетку, а химический агент является химиотерапевтическим агентом. В еще одном варианте реализации тип клеток представляет собой HER2+ клетки рака молочной железы, а химический агент представляет собой Dox или его фармацевтический эквивалент.
[00148] В одном варианте реализации HerPBK10 смешивают с небольшой двхцепочечной нуклеиновой кислотой (двуцепочечным олигонуклеотидом) размером 30 пар оснований, содержащей интеркалированный доксорубицин (Dox). В некоторых вариантах реализации это приводит к нековалентной сборке круглых частиц диаметром 10-50 нм, наблюдавшихся cryoEM) (фиг. 24 В), удерживающих Dox при ультрафильтрации, ВЭЖХ (фиг. 24 С), длительном хранении при различных температурах и устойчивых к высвобождению лекарственного вещества в сыворотке (фиг. 24 D) и крови (фиг. 24 Е). В некоторых из этих вариантов реализации последовательность двуцепочечного олигонуклеотида не имеет отношения к загрузке Dox, и более длинный двуцепочечный олигонуклеотид, например, фрагмент размером 48 п.о., не обязательно демонстрирует повышенную несущую способность. В некоторых вариантах один олигонуклеотид размером 30 п.о. может связывать до 50 молекул доксорубицина включительно. В одном варианте реализации собранные наночастицы, содержащие белок, ДНК и Dox, связывают до 10 молекул белкового комплекса HerPBK10 включительно. В еще одном варианте реализации спектроскопия частиц после сборки в УФ/видимом спектре подтвердила, что каждый фрагмент двуцепочечного олигонуклеотида связывает 5, 6, 7, 8 или более молекул HerPBK10 и приблизительно 10-40 молекул Dox. Это согласуется с прогнозируемыми молярными соотношениями, необходимыми для нейтрализации ДНК и ее насыщения интеркалированным Dox.
[00149] В некоторых вариантах реализации HerDox оказывает рецептор-зависимое адресное воздействие на HER2+ клетки in vitro и in vivo. В одном из этих вариантов реализации, как показано на фигуре 25-А, частицы HerDox преимущественно токсичны для HER2+, но не HER2- клеток в раздельных (фиг. 25-А) и смешанных клеточных культурах (фиг. 9). В еще одном варианте реализации частица HerDox является токсичной для HER2- клеток, например, клеток трижды негативного рака молочной железы (ТНРМЖ), которые сверхэкспрессируют HER3. Блокирование рецепторов ингибирует цитотоксичность. На фигуре 25-В показано, что HerDox характеризуется преимущественным биораспределением в опухолевых клетках с повышенным (по сравнению с пониженным) уровнем рецептора in vivo. В одном варианте реализации, показанном на фигуре 25-С, исследования адресного воздействия на опухоли и внутриклеточной миграции показали, что Dox не высвобождается из частиц HerDox до проникновения в клетку, после чего Dox быстро накапливается в ядре, в то время как HerPBK10 остается на периферии ядра. На фигурах 25-D и 25-Е показано, что системная доставка in vivo вызывает гибель HER2+ клеток опухоли при очень низкой фармакологической дозе (0,004 мг/кг Dox), не проявляя токсичности по отношению к печени и сердцу. Это отличается от свойств неспецифического Dox, который требует более высоких доз для аналогичной токсичности по отношению к опухоли и при этом повреждает ткань печени и миокард.
[00150] В одном варианте реализации устойчивость к ингибированию HER2 делает опухоли особенно чувствительными к воздействию HerDox. Тем не менее, устойчивость не является необходимым условием эффективности HerDox - HerDox эффективен как по отношению к трастузумаб-чувствительным, так и к устойчивым опухолевым клеткам и обладает преимуществами по сравнению с ингибированием сигнальных путей в обоих типах клеток, но особенно в устойчивых клетках.
[00151] В различных вариантах реализации описанная система доставки входит в фармацевтическую композицию, которую можно составить с учетом доставки посредством любого пути введения. «Путь введения» может относиться к любому пути введения, известному в данной области техники, включая аэрозоли, назальное, пероральное, трансмукозальное, трансдермальное или парентеральное введение, но не ограничиваясь ими. «Парентеральное» относится к пути введения, который обычно связан с инъекцией, включая интраорбитальную инъекцию, вливание, внутриартериальную, внутрикапсульную, внутрисердечную, внутрикожную, внутримышечную, внутрибрюшинную, внутрилегочную, внутрипозвоночную, внутригрудинную, интратекальную, внутриматочную, внутривенную, субарахноидальную, субкапсулярную, подкожную, трансмукозальную или транстрахеальную инъекцию. При парентеральном введении композиции могут быть в виде растворов или суспензий для вливания или для инъекции, или в виде лиофилизированных порошков.
[00152] В некоторых вариантах реализации фармацевтические композиции также содержат любой фармацевтически приемлемый носитель. «Фармацевтически приемлемый носитель» в настоящем документе относится к фармацевтически приемлемому материалу, композиции или среде-носителю, участвующему в переносе или транспортировке исследуемого комплекса из одной ткани, органа или части тела в другую ткань, орган или часть тела. Например, носитель может представлять собой жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или материал для инкапсуляции или их комбинацию. Каждый компонент носителя должен быть «фармацевтически приемлемым» в том смысле, что он должен быть совместим с другими ингредиентами состава. Он также должен быть пригодным для применения в контакте с любыми тканями или органами, с которыми он может вступать в контакт, что означает, что он не должен создавать риск токсического действия, раздражения, аллергической реакции, иммуногенности или любых других осложнений, который чрезмерно перевешивает его терапевтические преимущества.
[00153] В некоторых вариантах реализации фармацевтические композиции инкапсулируют, таблетируют или получают в виде эмульсии или сиропа для перорального применения.
[00154] Фармацевтически приемлемые твердые или жидкие носители можно добавлять с целью активации или стабилизации композиции или для облегчения получения композиции. Жидкие носители включают патоку, арахисовое масло, оливковое масло, глицерин, физиологический раствор, спирты и воду. Твердые носители включают крахмал, лактозу, сульфат кальция, дигидрат, гипс, стеарат магния или стеариновую кислоту, тальк, пектин, гуммиарабик, агар или желатин. Носитель также может включать материал для замедленного высвобождения, например, глицерилмоностеарат или глицерилдистеарат, по отдельности или с воском.
[00155] Фармацевтические препараты получают в соответствии с обычными фармацевтическими методиками, при необходимости включающими измельчение, смешивание, гранулирование и прессование для получения таблеток; или измельчение, смешивание и заполнение для получения твердых желатиновых капсул. При использовании жидкого носителя препарат получают в виде сиропа, эликсира, эмульсии или водной или неводной суспензии. Такие жидкие составы можно непосредственно вводить п/о или заливать в мягкие желатиновые капсулы.
[00156] Фармацевтические композиции, описанные в настоящем документе, можно доставлять в терапевтически эффективном количестве. Точное терапевтически эффективное количество представляет собой количество композиции, позволяющее получить наиболее эффективные результаты с точки зрения эффективности лечения данного субъекта. Это количество зависит от целого ряда факторов, включая характеристики терапевтического комплекса (в том числе активность, фармакокинетику, фармакодинамику и биодоступность), физиологическое состояние субъекта (в том числе возраст, пол, тип и стадию заболевания, общее физическое состояние, реакцию на данную дозировку и тип лекарственного средства), характер фармацевтически приемлемого носителя или носителей в составе и путь введения, но не ограничиваясь ими. Специалист в клинической и фармакологической области может определить терапевтически эффективное количество посредством обычных экспериментов, например, путем мониторинга реакции субъекта на введение комплекса и соответствующей коррекции дозы. Дополнительные рекомендации см. в Remington: The Science and Practice of Pharmacy (Gennaro ed. 20th edition, Williams & Wilkins PA, USA) (2000).
[00157] Типичные дозировки описанной системы доставки и, в частности, терапевтических агентов (например, химиотерапевтических агентов), особенно Dox и/или агентов для визуализации, доставляемых с ее помощью, находятся в диапазонах, рекомендованных производителем, где используются известные терапевтические соединения или агентов для визуализации, и соответствуют указаниям квалифицированного специалиста, основанным на реакциях in vitro или реакциях животных моделей. Фактическая дозировка зависит от решения врача, состояния пациента и эффективности способа лечения.
[00158] Кроме того, описаны способы лечения заболеваний путем введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества описанной системы доставки, включающей терапевтический агент, подходящий для лечения указанного заболевания. В одном варианте реализации заболевание представляет собой рак, а химический агент является химиотерапевтическим агентом. В еще одном варианте реализации заболевание представляет собой рак молочной железы и/или HER2+ рак молочной железы, а терапевтический агент представляет собой Dox.
ДОСТАВКА ЛЕКАРСТВЕННОГО СРЕДСТВА
[00159] В одном варианте реализации молекула для доставки лекарственного средства, описанная в настоящем документе, способствует доставке существующих соединений в область опухоли. В некоторых из этих вариантов реализации молекулы для доставки лекарственного средства, описанные в настоящем документе, используют с целью улучшенной доставки соединения, заведомо обладающего терапевтической эффективностью. В некоторых вариантах реализации использование соединения для лечения заболевания одобрено управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (FDA). В некоторых вариантах реализации лекарственное средство, утвержденное FDA, используют вне зарегистрированных показаний. В одном варианте реализации лекарственное средство представляет собой доксорубицин. В некоторых вариантах реализации стабильный захват лекарственного вещества комплексом HerDox способствует эффективности и безопасности лекарственного вещества в молекуле для доставки лекарственного средства. Этот подход является выгодным по сравнению с загрузкой лекарственного вещества в капсулы, которые склонны к утечке путем диффузии, или химической модификацией лекарственного вещества путем ковалентного конъюгирования, которая может влиять на его активность и эффективность.
СРАВНЕНИЕ С ИНГИБИТОРАМИ HER2.
[00160] Повышение уровня HER3, связанное с устойчивостью к ингибированию HER2 и EGFR, стимулировало разработку антител против HER3 для подавления сигнальных путей, опосредованных HER3. HerDox обладает рядом преимуществ перед такими ингибиторами. В одном варианте реализации терапевтическая активность HerPBK10 не основана на ослаблении сигнала; вместо этого HerPBK10 использует HER3 в качестве портала для быстрого эндоцитоза в опухолевые клетки и уничтожения клетки изнутри за счет доставки токсичного вещества. В некоторых вариантах реализации антитела, в отличие от HerPBK10, не вызывают поглощения. Вместо этого антитела интернализируются пассивно, медленно и в незначительной степени.
[00161] В качестве примера, существуют важные различия между HerDox и эмтанзином, конъюгированным с трастузумабом (T-DM1), недавно утвержденным для клинического применения. Во-первых, мишенью T-DM1 является HER2 и, таким образом, он не действует на опухоли, устойчивые к ингибированию HER2. Во-вторых, хотя применение T-DM1 предусматривает его интернализацию с целью доставки ингибитора митоза, эмтанзина, HER2 по себе не подвергается эндоцитозу; его действие основано на пассивном проникновении в клетку при обновлении рецептора или совместном поглощении с лигандами, связанными с HER3. Таким образом, поглощение конъюгатов трастузумаба (Tz) является медленным (порядка нескольких часов) и относительно незначительным, в отличие от активного проникновения, вызванного связыванием лиганда с HER. Этот результат показан на фигуре 30, где приведено сравнение поглощения HerPBK10 с поглощением Tz. В-третьих, устойчивость к T-DM1 опосредована индукцией HER3 и транспортеров, осуществляющих выведение лекарственного вещества. С другой стороны, Dox остается защищенным в частицах HerDox до поглощения клеткой и перемещения в ядро, где это лекарственное вещество высвобождается с последующим накоплением в ядре. Эта миграция частиц происходит в обход транспортеров, осуществляющих выведение лекарственного вещества.
[00162] Эти различия механизмов действия HerDox и других антител влияет на дозировку, необходимую для достижения терапевтической эффективности. В качестве примера авторы изобретения показали, что для адресного воздействия и снижения опухолевого роста при отсутствии влияния на здоровую ткань, например, сердце и печень у мышей, достаточно приблизительно 0,004 мг/кг HerDox. Это отличается от терапевтической дозы, необходимой для T-DM1 (приблизительно 3,6 мг/кг) и неспецифического Dox у пациентов (приблизительно 1-5 мг/кг) и мышей (более 0,04 мг/кг), которые приводят к известному нежелательному влиянию на неспецифические ткани.
[00163] В одном варианте реализации способ лечения рака, описанный в настоящем документе, применяют для лечения трижды негативного рака молочной железы (ТНРМЖ). ТНРМЖ устойчив к HER2 по своей природе. Недостаток эстрогена, прогестерона и рецепторов HER2 в этих опухолях ограничивает типы специфических терапевтических средств, которые можно использовать. Недавние исследования показывают, что ТНРМЖ экспрессирует HER3. Хотя при таких опухолях используют ингибиторы EGF-R, повышенный уровень HER3 также способствует развитию устойчивости к таким ингибиторам. Способы лечения рака, описанные в настоящем документе, применимы к таким изначально устойчивым к HER2 опухолям. Аналогичным образом, способы, описанные в настоящем документе, также применимы к опухолям молочной железы, желудка, толстой кишки, легких и яичников, где выявлена стимуляция HER3 в ответ на ингибиторы киназ EGFR, HER2 и РБК.
МЕХАНИЗМ ДЕЙСТВИЯ HERDOX
[00164] В некоторых вариантах реализации HER2+ опухоли с приобретенной устойчивостью к ингибиторам HER2 чувствительны к HerDox из-за (i) HER3-опосредованного адресного воздействия, (ii) секвестрации и подавления рецепторов за счет эндоцитоза частиц и эндосомолиза и/или (iii) миграции эндосом и частиц, обеспечивающей защиту полезной загрузки и обход путей выведения лекарственного вещества.
[00165] В некоторых из этих вариантов реализации кластеризация, эндоцитоз HER3 и эндосомолиз, индуцированные HerDox, изолируют HER3 от активации HER2 и ослабляют участие эндосом в сигнальных путях. В одном варианте реализации в дополнение к повышенному уровню HER3, облегчающему адресное воздействие на устойчивые клетки, поливалентность наночастиц HerPBK10 вызывает гомо-олигомеризацию HER3 и его изоляцию от HER2 (и любых других тирозинкиназ), тем самым предотвращая фосфорилирование и активацию HER3. В еще одном варианте реализации повышение уровня HER3 также способствует лиганд-индуцированному образованию гомо-олигомеров HER3 и, таким образом, такое явление особенно характерно для устойчивых клеток. Кроме того, разрушение рецептор-секвестрированных везикул за счет эндосомолиза, обеспечивающее проникновение в цитоплазму, подавляет эндосомальные сигнальные пути, поддерживая доставку Dox к внутриклеточным мишеням токсического действия и тем самым внося вклад в общую цитотоксичность.
[00166] В некоторых вариантах реализации миграция эндосом и частиц защищает полезную загрузку от механизмов выведения лекарственного вещества. Сочетание эндоцитозного транспорта, инкапсуляции лекарственного вещества за счет HerPBK10 и переноса HerDox на периферию ядра способствует обходу путей выведения лекарственного вещества. В некоторых вариантах реализации HerDox обеспечивает улучшенную адресную токсичность по отношению к HER2+ опухолям с приобретенной устойчивостью к ингибиторам HER2 по сравнению с комбинированной терапией. Эти варианты монотерапии и комбинированного лечения на основе ингибиторов HER2 включают Tz, Tz-Pz, Tz-Lp и T-DM1, но не ограничиваются ими.
[00167] В некоторых вариантах реализации эффективность ингибиторов HER2 увеличивается при их использовании в качестве адъювантов для терапии наивных HER2+ опухолей с применением HerDox. В некоторых из этих вариантов реализации ингибиторы HER2 индуцируют HER3 и повышают чувствительность наивных опухолей к HerDox in vivo. В других вариантах реализации HerPBK10 связывается с опухолевой тканью HER2+ пациентов за счет HER3. В одном варианте реализации ингибитирование HER2 не индуцирует токсичности HerDox по отношению к CDC человека.
[00168] В некоторых вариантах реализации, описанных в настоящем документе, HER2- опухоли молочной железы, включая ТНРМЖ, подвержены адресному воздействию HerDox за счет HER3 и дополнительно сенсибилизируются за счет адъювантной обработки ингибиторами EGF-R. В некоторых из этих вариантов реализации ингибиторы EGF-R индуцируют HER3 и повышают чувствительность клеток ТНРМЖ к HerDox in vitro. В некоторых вариантах реализации HerDox является терапевтически эффективным в модели ТНРМЖ в метастатических и иммунокомпетентных условиях.
КОРРОЛЫ КАК НОВЫЕ ВАРИАНТЫ ПОЛЕЗНОЙ ЗАГРУЗКИ
[00169] Корролы известны и описаны в данной области техники, например, в публикации патентной заявки США № US 2014/03350251 А1, полностью включенной в настоящий документ посредством ссылки, включая чертежи.
[00170] В настоящем документе описаны способы лечения рака у пациента, включающие выявление пациента, устойчивого к терапевтическому средству против HER2; и введение пациенту терапевтически эффективного количества молекулы для доставки лекарственного вещества, содержащей молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; и молекулу сульфонированного коррола, связанную с полипептидной последовательностью. Кроме того, в настоящем документе описаны способы индукции апоптоза в HER2+ клетке рака молочной железы, устойчивой к терапевтическому средству против HER2, включающие приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного вещества, содержащей молекулу полипептида, адаптированную к мишени и/или проникающую в клетки определенного типа; и молекулу сульфонированного коррола, связанную с полипептидной последовательностью.
[00171] Корролы структурно сходны с порфиринами. В некоторых вариантах реализации коррол является сульфонированным корролом. В некоторых вариантах реализации сульфонированные корролы являются амфифильными, растворимыми в физиологических растворах и/или связываются с полипептидами посредством нековалентных взаимодействий. В некоторых вариантах нековалентные взаимодействия являются электростатическими взаимодействиями. В некоторых вариантах реализации полипептид является рекомбинантным белком. В некоторых вариантах реализации рекомбинантный белок является рекомбинантным гибридным белком. Анионные сульфонатные группы предотвращают неспецифическое проникновение в клетку из-за отталкивания отрицательно заряженной клеточной мембраной, тем самым направляя доставку коррола в клетки-мишени за счет белка-носителя.
[00172] В некоторых вариантах реализации коррол содержит атом химического элемента-металла. В некоторых из этих вариантов реализации металл представляет собой переходный металл. В некоторых вариантах реализации металл представляет собой железо (Fe), марганец (Mn) или галлий (Ga). В других вариантах реализации коррол является неметаллированным. Металлированные и неметаллированные корролы связываются в углублениях белковой молекулы с незначительной диссоциацией. В качестве иллюстративного примера, HerGa, описанный на фигуре 33, состоит из сульфонированного коррола галлия (III) (S2Ga), полученного путем сборки с участием HerPBK10. HerGa устойчив при переносе корролов к белкам сыворотки in vitro и in vivo. Сборка коррола с участием HerPBK10 позволяет получить 25-35 молекул коррола/белок, что приводит к образованию круглых частиц размером 10-20 нм (фиг. 33-В), выдерживающих высокоскоростную ультрафильтрацию. В качестве еще одного иллюстративного примера, HerMn, сульфонированный коррол марганца (III) (S2Mn), собранный с участием HerPBK10, образует круглые частицы размером приблизительно 20 нм (фиг. 33-С).
[00173] В одном варианте реализации HerGa, помимо интенсивной флуоресценции, характеризуется преимущественным адресным воздействием на опухоль in vivo после системной доставки в обход большинства здоровых тканей, в том числе сердца, и замедляет рост опухоли при крайне низкой фармакологической дозе (0,008 мг/кг). В другом варианте реализации HerMn характеризуется аналогичным преимущественным адресным воздействием на опухоль и подавлением роста in vivo, и, хотя не является флуоресцентным, обеспечивает более клинически значимую визуализацию посредством магнитно-резонансной томографии (МРТ). В обоих указанных вариантах реализации HerGa и HerMn вызывают ROS-опосредованное разрушение цитоскелета и митохондрий. Королы, например, в числе прочего, HerGA оказывают адресное воздействие на митохондриальный белок TSPO, важный для гомеостаза клетки и поддержки опухоли, и/или связывается с ним. Аналогичным образом, сульфонированный неметаллированный коррол (S2FB) в форме свободного основания (фиг. 33-С), также характеризующийся интенсивной флуоресценцией, может непосредственно взаимодействовать с SOD1 (фиг. 34-В) и ингибировать активность СОД (фиг. 34-А) за счет хелатирования металлического лиганда фермента (фиг. 4С).
[00174] В одном варианте реализации частицы HerPBK10-коррол, описанные в настоящем документе, меняют продолжительность своей флуоресценции в ответ на pH. Таким образом, частицы коррола используются в качестве диагностического зонда, передающего информацию об условиях в своем непосредственном микроокружении. Эта функция полезна на клеточном уровне, например, для изучения путей миграции или внутриклеточного местоположения. Эта функция также полезна на тканевом уровне, например, для выявления областей опухолевого роста. В качестве неограничивающего примера, продолжительность флуоресценции HerGa зависит от того, находится ли он в опухоли или ткани печени, как ex vivo, так и in vivo, что позволяет различать опухолевую и неопухолевую ткань при оптической визуализации. В качестве еще одного неограничивающего примера, HerMn можно применять для обнаружения опухолей, поскольку частицы HerMn предотвращают взаимодействие коррола с молекулами воды в растворе, в то время как проникновение в опухоль улучшает сокращение релаксации Т1 и усиливает контраст за счет коррола, что указывает на высвобождение коррола S2Mn из частиц после поглощения тканью. В качестве третьего неограничивающего примера, HerGa сохраняется и обнаруживается в опухоли в течение длительного периода (до 30 дней включительно) после IT-инъекции, но выводится из неопухолевой ткани в более ранние сроки при подкожном введении. Эта функция, которую может частично стимулировать HerPBK10, вносит вклад в возможное преимущество HerMn над HerGd (Gd = гадолиний), поскольку HerGd быстро выводится после инъекции.
[00175] В еще одном варианте реализации частица HerPBK10-коррол, описанная в настоящем документе, действует как фотосенсибилизатор. Фотовозбуждение при максимальной длине волны флуоресценции S2Ga генерирует синглетный кислород, который вызывает быстрое повреждение клеток, поглотивших HerGa. Хотя HerGa уже обладает достаточной токсичностью по отношению к опухоли без облучения, фотовозбуждение при 424 нм существенно снижает IC50 HerGa in vitro в сотни и тысячи раз. Возбуждение при длине волны вторичного пика поглощения (приблизительно 620 нм) приводит почти к столь же эффективной гибели клеток, что позволяет использовать более длинные волны для облучения и может способствовать проникновению в более глубокие ткани.
[00176] В еще одном варианте реализации нанобиологические средства на основе коррола, описанные в настоящем документе, действуют на устойчивые к лекарственным средствам раковые клетки. Повышение уровня HER3, способствующее развитию устойчивости к ингибированию HER2, делает указанные опухоли особенно чувствительными к адресному лечению опухоли с применением коррола. Таким образом, ингибиторы HER2, например, Tz, действуют как адъюванты, повышая чувствительность опухоли к нанотерапевтическим средствам на основе корролов за счет повышения уровня HER3.
[00177] В некоторых вариантах реализации терапевтическая эффективность корролов, оказывающих адресное воздействие на опухоль, усиливается по отношению к опухолевым клеткам, устойчивым к ингибиторам, благодаря сочетанию HER3-опосредованного подавления рецепторов, миграции частиц и коррол-опосредованной токсичности по отношению к множественным внутриклеточным мишеням.
[00178] В одном варианте реализации кластеризация, эндоцитоз HER3 и эндосомолиз, индуцированные частицами коррола, изолируют HER3 от активации HER2 и ослабляют участие эндосом в сигнальных путях. В дополнение к повышенному уровню HER3, облегчающему адресное воздействие на устойчивые клетки, поливалентность наночастиц HerPBK10 вызывает гомо-олигомеризацию HER3 и его изоляцию от HER2 (и других тирозинкиназ), тем самым предотвращая фосфорилирование и активацию HER3. Повышение уровня HER3 также способствует лиганд-индуцированному образованию гомо-олигомеров HER3; такое явление особенно характерно для устойчивых клеток. Кроме того, разрушение рецептор-секвестрированных везикул за счет эндосомолиза, обеспечивающее проникновение в цитоплазму, подавляет эндосомальные сигнальные пути, поддерживая доставку корролов к внутриклеточным мишеням токсического действия и тем самым внося вклад в общую цитотоксичность. Это согласуется с наблюдением авторов изобретения, что HerPBK10 сам по себе не индуцирует пролиферации опухолевых клеток in vitro или in vivo, несмотря на его происхождение от лиганда, стимулирующего сигнальный путь.
[00179] В еще одном варианте реализации корролы обходят механизмы выведения лекарственных веществ за счет быстрого переноса к клеточным белкам после проникновения в цитоплазму. Флуоресценция HerGa распространяется по всей цитоплазме живых клеток после высвобождения из везикул, в то время как HerPBK10 накапливается на периферии ядра. Кроме того, свободный S2Mn, но не частицы HerMn, демонстрирует значительное сокращение релаксации Т1 в растворе, в то время как HerMn демонстрирует улучшение сокращения Т1 при поглощении тканями. В настоящем документе термин «релаксация Т1» относится к спин-решеточной релаксации. Кроме того, низкий уровень pH не высвобождает S2Ga из HerPBK10. Совместно эти результаты показывают, что корролы высвобождаются из HerPBK10 после проникновения в цитоплазму за счет pH-независимого механизма. Кроме того, обширное повреждающее воздействие кислородных радикалов на цитоскелет и митохондрии, для которого требуется непосредственная близость к области образования ROS, показывает, что корролы присоединяются к клеточным органеллами и повреждают их глобальным образом. Таким образом, корролы быстро переносятся к внутриклеточным белкам после поглощения клеткой, что помогает изолировать корролы от транспортеров, осуществляющих выведение лекарственного вещества.
[00180] В еще одном варианте реализации токсичность и визуализация усиливаются за счет объединения взаимодополняющих активностей коррола. Сочетание S2FB-опосредованного ингибирования СОД, S2Ga- или S2Mn-опосредованного повышения уровня ROS и S2Ga-опосредованного ингибирования TSPO усиливает токсичность за счет объединения взаимодополняющих активностей. Такой подход также сочетает различные способы обнаружения, например, флуоресценцию и МРТ.
[00181] В некоторых вариантах реализации корролы, специфичные по отношению к опухоли, оказывают адресное воздействие на HER2+ опухоли, устойчивые к ингибированию HER2, in vivo.
[00182] В одном из этих вариантов реализации распределение частиц в устойчивых опухолях in vivo коррелирует с HER3. Опухоли, устойчивые к ингибиторам HER2 (например, BT-474R и JIMT-1), демонстрируют повышенную скорость накопления частиц по сравнению с исходными опухолями (например, ВТ-474) вследствие повышенного уровня HER3. В некоторых из этих вариантов реализации адресное воздействие на опухоль in vivo опосредовано HER3.
[00183] В еще одном варианте реализации частиц в коррола обеспечивают улучшенную адресную токсичность по отношению к HER2+ опухолям с приобретенной и существующей устойчивостью к ингибиторам HER2 по сравнению с комбинированной терапией. В еще одном варианте реализации ингибиторы, блокирующие сигнальную активность HER2, действуют как адъюванты для оптимизированной терапии, опосредованной наночастицами коррола, мишенью которой является Her.
[00184] В некоторых вариантах реализации корролы, специфичные по отношению к опухоли, оказывают адресное воздействие на опухоли ТНРМЖ в иммунокомпетентных условиях диссеминированого рака.
[00185] В некоторых из этих вариантов реализации ингибиторы EGF-R индуцируют HER3 и повышают чувствительность клеток ТНРМЖ к частицам коррола in vitro. В одном варианте реализации HerPBK10 связывает HER3 на клетках 4Т1 мыши, при том, что уровни HER3 на клетках ВТ-549 человека еще выше; это показывает, что оптимизированные наночастицы коррола, специфичные по отношению к Her, оказывают адресное токсическое действие на эти линии клеток ТНРМЖ. Кроме того, повышение уровня HER3, ассоциированное с устойчивостью к ингибированию EGF-R на TNBC15, показывает, что такие ингибиторы дополняют адресное воздействие оптимизированных наночастиц коррола, специфичных по отношению к Her, и их токсическое действие на эти клетки.
[00186] В еще одном варианте реализации частицы коррола являются терапевтически эффективными в модели ТНРМЖ в метастатических и иммунокомпетентных условиях. Модель BALB/c-4T1 обычно используют в качестве модели ТНРМЖ и диссеминированного рака. При трансплантации в молочные железы мыши клетки 4Т1 образуют опухоли, метастазирующие в легкие и головной мозг, что представляет собой модель рака молочной железы IV стадии. Сингенная модель демонстрирует адресное токсическое действие на диссеминированные опухоли и позволяет оценить терапевтическую эффективность оптимизированных наночастиц коррола, специфичных по отношению к Her, при наличии интактного иммунного окружения.
ПРИМЕРЫ
[00187] Следующие примеры приведены с целью лучшей демонстрации заявленного изобретения и не должны рассматриваться как ограничивающие его область. Конкретные материалы упоминаются исключительно для иллюстративных целей и не должны рассматриваться в качестве ограничений заявленного изобретения. Специалист в данной области техники может разработать эквивалентные средства или реактивы без привлечения изобретательских способностей и не выходя за рамки заявленного изобретения.
Пример 1: Адресная доставка химиотерапевтического агента к HER2+ клеткам рака молочной железы
[00188] Описанная технология была протестирована на HER2+ клетках рака молочной железы in vitro и in vivo. Как показано на фиг. 2, при создании молекулы для доставки лекарственного вещества для адресного воздействия на HER2+ рак молочной железы блок А содержит белок под названием HerPBK10, полученный с помощью способов, описанных в статье L.K. Medina-Kauwe et al. Gene Therapy, 8:1753-1761 (2001), полностью включенной в настоящий документ посредством ссылки. HerPBK10 содержит рецептор-связывающий домен херегулина, объединенный с проникающим белком пентонового основания аденовируса, модифицированным по С-концу декализином. Сегмент «Her» белка HerPBK10 получен из рецептор-связывающего домена херегулина-α, специфически связывающегося с гетеродимерами субъединиц HER2/HER3 или HER2/HER4. Хотя херегулин взаимодействует непосредственно с HER3 или HER4, но не HER2, сродство лиганда значительно усиливается HER2. Таким образом, опухолевые клетки, сверхэкспрессирующие HER2 (т.е. клетки HER2+ опухолей) считаются хорошими кандидатами для херегулин-опосредованного адресного воздействия.
[00189] Активность белка пентонового основания аденовируса 5 серотипа (Ad5) по проникновению в клетку встроена в «РВ»-сегмент HerPBK10 с целью облегчить проникновение в клетки-мишени. Сегмент «K10» содержит десять остатков лизина, чей положительный заряд облегчает транспорт отрицательно заряженных молекул, например, нуклеиновых кислот, за счет электрофильного взаимодействия.
[00190] Блок В содержит два комплементарных олигонуклеотида, отожженные друг с другом и образующие небольшую двуцепочечную нуклеиновую кислоту. Блок С состоит из химиотерапевтического агента Dox. Эти три компонента объединяли друг с другом в два этапа путем инкубирования при комнатной температуре. На 1 этапе ДНК блока В инкубировали с Dox блока С с образованием структуры ДНК-Dox (т.е. блок В + блок С). Она образуется за счет интеркаляции молекулы Dox между парами оснований ДНК. На 2 этапе структуру ДНК-Dox инкубировали с HerPBK10 с образованием окончательного комплекса под названием HerDox (т.е. блок А + блок В + блок С). Это взаимодействие формируется за счет электрофильного связывания отрицательно заряженного фосфатного каркаса ДНК с положительно заряженным полилизиновым хвостом HerPBK10.
[00191] На фиг. 3 показана схема работы описанной системы доставки в данном конкретном варианте реализации, а на фиг. 11-В изображено ее успешное применение in vivo по сравнению с обычным введением Dox. Использование описанной системы доставки обеспечивало адресную доставку Dox к раковым клеткам; в раковую клетку доставлялись относительно высокие количества лекарственного вещества по сравнению с обычной доставкой Dox, а в неспецифические ткани попадали относительно более низкие количества лекарственного вещества.
Пример 2: HerDox характеризуется высокой стабильностью во время сборки
[00192] HerDox состоит из трех компонентов: Dox; небольшой двуцепочечной нуклеиновой кислоты (непосредственно отвечающей за перенос Dox); и специфического белка HerPBK10. HerDox собирали в два этапа. Во-первых, Dox смешивали с ДНК с образованием пары ДНК-Dox за счет ДНК-интеркаляции. Затем пару ДНК-Dox смешивали с HerPBK10 с образованием HerDox за счет электрофильного взаимодействия. Для отделения ДНК-Dox от свободного Dox смесь подвергали ультрафильтрации с центрифугированием. Авторы настоящего изобретения обнаружили, что >95% Dox, добавленного к ДНК, не высвобождается из ДНК во время ультрафильтрации с центрифугированием, что указывает на высокую степень удерживания лекарственного вещества даже при высокой скорости центрифугирования (фиг. 4-А). Спектры поглощения концентрата и фильтрата после этого центрифугирования подтверждают, что максимум поглощения концентрата совпадает с нефильтрованным Dox, в то время как в фильтрате такое поглощение не обнаруживается (фиг. 4 (В)). Концентрат затем инкубировали с HerPBK10, полученный комплекс HerDox отделяли от свободных компонентов посредством эксклюзионной высокоэффективной жидкостной хроматографии (ВЭЖХ). В настоящем примере авторы изобретения показали, что поглощение Dox главным образом совместно элюировалось с HerPBK10 (фиг. 5), что подтверждается электрофорезом элюированных фракций в ДСН-ПААГ (фиг. 5).
Пример 3: HerDox характеризуется высокой стабильностью при хранении и в сыворотке
[00193] Авторы настоящего изобретения протестировали стабильность HerDox в течение 12 дней при различных температурах хранения: 40°C, комнатной температуре или 37°C. Каждый день образец подвергали ультрафильтрации, затем измеряли фильтраты и концентраты с целью определения высвобождения Dox из комплекса. При 4°C 100% продукта оставалось интактным до 12 дня, и примечательно, что, по-видимому, комнатная температура и 37°C усиливали встраивание препарата в продукт HerDox (фиг. 6-А и 6 В). В целом эти результаты показывают, что HerDox остается стабильным и не высвобождает Dox после длительного хранения при различных температурах. Авторы настоящего изобретения также проверили стабильность HerDox в средах, содержащих сыворотку, при температуре 37°C. HerDox, иммобилизованный на никель-сефарозе (за счет гистидинового маркера HerPBK10) инкубировали при 37°C в полной (т.е. содержащей 10% эмбриональную бычью сыворотку) среде (для имитации условий тканевой культуры) в течение различного времени до осаждения гранул, и измеряли высвобожденный Dox в супернатантах. Удерживание Dox в конъюгате также оценивали путем элюирования конъюгата из гранул в каждый момент времени. Авторы настоящего изобретения наблюдали, что сыворотка не приводила к значительному высвобождению Dox из конъюгата, что должно было бы обнаруживаться по увеличению поглощения Dox в фильтрате в образцах, содержащих сыворотку (фиг. 6-В, верхняя панель), и что Dox полностью удерживался конъюгатом в каждый момент времени (фиг. 6-Б, нижняя панель).
Пример 4: HerDox оказывает, a Dox не оказывает адресного токсического воздействия
[00194] Авторы настоящего изобретения сравнили действие HerDox или только Dox в эквивалентных дозах (0,5 мкМ по концентрации Dox) на HER2+ и HER2- клетки рака молочной железы в отдельных чашках. За три дня HerDox снижал количество HER2+ клеток более чем на 75%, не влияя на выживаемость HER2- клеток (фиг. 7). Эквивалентные концентрации Dox вне комплекса снижали количество HER2+ и HER2- клеток в одинаковой степени (фиг. 7). Эти выводы подчеркивают важность адресного воздействия, демонстрируя, что неспецифическое лекарственное вещество влияет на клетки, не являющиеся мишенями (т.е. HER2- клетки). Важно отметить, что белок-носитель HerPBK10 сам по себе в концентрации, эквивалентной концентрации белка в HerDox (0,1 мкМ) не влиял на клетки любой линии (фиг. 7), в том числе не индуцировал пролиферацию. Для тестирования адресного воздействия на рецепторы авторы изобретения использовали свободный лиганд-херегулин (Her или eHRG) в качестве конкурентого ингибитора. Свободный лиганд полностью ингибировал уничтожение клеток за счет HerDox (фиг. 8), что указывало на связывание и проникновение HerDox в клетку за счет рецепторов херегулина. В качестве окончательной проверки in vitro авторы изобретения протестировали способность HerDox специфически индуцировать токсическое действие по отношению к HER2+ клеткам в смешанной культуре HER2+ и HER2- клеток рака молочной железы. Для этого авторы изобретения получили линию HER2- клеток, меченых зеленым флуоресцентным белком (GFP), для идентификации клеток в смешанной культуре (фиг. 9-А). Авторы настоящего изобретения обнаружили, что HerDox почти полностью останавливал пролиферацию клеток без GFP (HER2+), не влияя на рост клеток, содержащих GFP (HER2-) (фиг. 9-В). В целом эти результаты указывают, что HerDox обладает способностью к преимущественно адресной токсичности по отношению к HER2+ клеткам. Важно отметить, что все эти эксперименты выполнены в полных (т.е. содержащих сыворотку) средах, что указывает на то, что HerDox оказывает адресное воздействие на клетки, несмотря на присутствие белков сыворотки. Кроме того, преимущественное уничтожение HER2+ клеток в смешанной культуре HER2+ и HER2- клеток означает, что после гибели и лизиса клеток-мишеней Dox, высвобожденный в этих клетках, не может продолжать оказывать токсическое действие на HER2- клетки. Для дополнительного подтверждения стабильности HerDox в клеточной культуре HerDox выделяли из культуральной среды в отдельных экспериментах в указанные моменты времени и подвергали электрофорезу в агарозном геле, который затем облучали УФ для обнаружения Dox и окрашивали кумасси синим для обнаружения белка HerPBK10 (фиг. 9-С). Поскольку гель не удерживал свободный Dox, потеря флуоресценции Dox с течением времени должна была бы означать высвобождение Dox из конъюгата. В средах, содержащих сыворотку, такой потери HerDox не обнаружили. В бессывороточных условиях наблюдали снижение флуоресценции Dox через 1 ч, однако окрашивание кумасси синим показало, что снижение флуоресценции обусловлено меньшим количеством образца, загруженного в дорожку геля. Кроме того, совместная миграция полос HerPBK10 подтвердила, что конъюгаты оставались интактными в клеточных средах. Совместно с анализом стабильности в сыворотке, описанным ранее, эти результаты показывают, что конъюгат остается интактным во время продолжительной инкубации в клеточной культуре (обычно содержащей по меньшей мере 10% сыворотку).
Пример 5: GFP-Her позволяет оценить показатель адресного воздействия in vivo
[00195] Для понимания способности лиганда оказывать адресное воздействие in vivo и установления показателя адресного воздействия in vivo авторы изобретения использовали лиганд, меченый зеленым флуоресцентным белком (GFP) (GFP-Her). Важно отметить, что этот лиганд был идентичен «Her»-домену HerPBK10. Они получили HER2+ опухоли у 6-8 недельных самок бестимусных мышей путем двусторонней инъекции клеток MDA-MB-435. После разрастания опухоли до 250-300 мм3 (3-4 недели после имплантации опухолевых клеток) в хвостовую вену вводили 3 нмоль GFP-Her. Мыши, которым вводили имитатор исследуемого соединения, получали только физиологический раствор. Указанные ткани собирали через 3,5 часа после инъекции и подвергали визуализации для обнаружения GFP с использованием трехмерной системы визуализации для мелких животных in vivo Xenogen IVIS (Xenogen, Аламеда, штат Калифорния, США). В опухоли обнаружили преимущественное накопление флуоресценции GFP по сравнению с другими тканями (фиг. 10). В печени и мышцах обнаружили низкие или пренебрежимо малые уровни флуоресценции; в других тканях, в том числе в сердце флуоресценция GFP не обнаруживалась (фиг. 10). В тканях животных, обработанных имитатором исследуемого соединения, флуоресценция отсутствовала.
Пример 6: HerDox оказывает адресное воздействие на HER2+ клетки рака молочной железы in vivo
[00196] Dox испускает красную флуоресценцию при соответствующей длине волны возбуждения, что использовали для обнаружения биораспределения после системной доставки HerDox. Мыши, несущие 4-недельные опухоли (~700-800 мм3), получали однократную инъекцию Dox или HerDox в хвостовую вену (концентрация Dox 0,008 мг/мл), после чего с помощью изготовленной на заказ системы макроподсветки и обнаружения получили снимки живых мышей в режиме реального времени или органов/тканей, собранных через три часа после инъекции. Флуоресценцию наблюдали во всем организме через 10 мин после инъекции HerDox, затем (к 20 минуте) она быстро накапливалась в опухолях, где обнаруживалась до 100 мин после инъекции (фиг. 11 (А)). Ткани и опухоли, собранные через ~ 3 ч после инъекции HerDox, продемонстрировали интенсивную флуоресценцию в опухолях и значительно более низкие уровни флюоресценции в печени (фиг. 11 (В)). Следовую флуоресценцию обнаружили в почках, в то время как в других тканях, включая сердце, селезенку, легкие и скелетные мышцы, флуоресценция отсутствовала. В отличие от этого, ткани, собранные из мышей, которым ввели эквивалентную дозу Dox, демонстрировали обнаруживаемую флуоресценцию в печени, опухоли и почках. Более низкие уровни флюоресценции также обнаруживались в легких и скелетных мышцах.
[00197] Для оценки токсичности по отношению к опухоли in vivo мыши, несущие 3-4-недельные двусторонние опухоли на боковой поверхности тела, начали получать ежедневные инъекции Dox или HerDox в хвостовую вену (концентрация Dox 0,004 мг/кг), только HerPBK10 (при концентрации белка, эквивалентной HerDox) или физиологического раствора в течение 7 дней подряд. Опухоли измеряли в процессе роста опухоли, начиная с 2 недель до инъекции в хвостовую вену, и показали, что в то время как Dox замедлял рост опухоли, HerDox практически останавливал рост опухоли, а только HerPBK10 и физиологический раствор не оказывали эффекта (рис. 12 (А)). Существенной потери массы тела обработанных и контрольных мышей с течением времени не наблюдали (фиг. 12 (В)).
[00198] Через 25 дней после инъекций опухоли и органы собирали и подвергали гистохимической обработке. Установлено, что Dox может вызывать острую и долгосрочную кардиотоксичность, поэтому авторы изобретения исследовали сердца мышей, обработанных HerDox или Dox. Сердца мышей, обработанных Dox, выглядели слегка увеличенными и расширенными по сравнению с сердцами мышей, обработанных HerDox и физиологическим раствором (не показаны), что указывало на дилатационную кардиомиопатию, ассоциированную с токсическим действием Dox. Миокарды мышей, обработанных физиологическим раствором, демонстрировали нормальную морфологию, в то время как миокарды мышей, обработанных Dox, демонстрировали очаговую дегенерациею, потерю миофибрилл, повышенную вакуолизацию цитоплазмы и конденсацию или растворение ядер, типичные для кардиотоксичности, вызываемой Dox, в то время как морфология миокарда мышей, обработанных HerDox, была аналогична морфологии у мышей, обработанных физиологическим раствором (фиг. 12-С). В соответствии с этими данными, эхокардиограммы, полученные для оценки функции сердца обработанных мышей, демонстрировали признаки дисфункции, вызванной Dox, которая не обнаруживалась у мышей, обработанных HerDox: Dox вызывал умеренное или выраженное снижение ударного объема, сердечного выброса и внутренних размеров и объема левого желудочка, в то время как HerDox не влиял на эти показатели, аналогично мышам, обработанным имитатором исследуемого соединения (физиологическим раствором) (фиг. 12-D).
[00199] Для оценки целесообразности измерения стабильности in vivo, изобретатели инкубировали HerDox (при окончательной концентрации Dox 0,12 мг/мл) или свободный Dox в эквивалентной концентрации в свежесобранной цельной крови мышей при 37°C в течение часа. Поскольку при пробоотборе крови присутствовал 0,5 мм ЭДТА в качестве антикоагулянта, образцы параллельно инкубировали при 37°C в ЭДТА без крови. Образцы, представляющие исходный HerDox (до инкубирования в крови) инкубировали при 370С в физиологическом растворе с HEPES-буфером. Затем все образцы центрифугировали через фильтры с пороговой молекулярной массой 1 OK MW и измеряли флуоресценцию Dox в концентратах и фильтратах (SpectraMax М2 от Molecular Devices). Результаты показали отсутствие обнаружимой потери Dox из конъюгата на основании отсутствия обнаруживаемого увеличения флуоресценции HerDox в фильтрате, особенно по сравнению с HerDox, инкубированным в HBS или ЭДТА, или свободным Dox (фиг. 13). Аналогичным образом, в концентратах HerDox образцов, инкубированных с кровью, не наблюдали существенной потери Dox по сравнению с образцами, инкубированными с физиологическим раствором или только ЭДТА (фиг. 13). В совокупности с результатами биологической визуализации эти результаты показывают, что HerDox остается интактным в крови и сохраняет стабильность in vivo на пути к опухоли-мишени.
Пример 7: Механизм HerDox: высвобождение Dox в цитоплазму и накопление в ядре
[00200] HerPBK10 сам по себе не вызывает гибели клеток (фиг. 7), поэтому именно доставка Dox в клетку является фактором, способствующим уничтожению клеток за счет HerDox. Для понимания механизма HerDox-опосредованной гибели опухолевых клеток авторы изобретения выполнили микроскопическое исследование HER2+ клеток после обработки HerDox, используя флуоресценцию Dox для обнаружения его внутриклеточного местоположения. На ранних этапах после введения (на 0 мин поглощения) HerDox появлялся в основном на периферии клетки, что показывало, что этот конъюгат связался с поверхностью клетки, но еще не интернализировался (фиг. 14-А). Напротив, свободный Dox уже находился внутри клетки на периферии ядра (фиг. 14-А). На 60 минуте, когда большая часть херегулин-специфических белов проникла в клетки, Dox накапливался в ядре, аналогично свободному Dox (фиг. 14-А). Эта динамика, в дополнение к более ранним результатам исследования адресного воздействия, подтверждала рецептор-опосредованный механизм проникновения HerDox. Даже картина накопления Dox внутри ядра при доставке HerPBK10 отличалась от картины, характерной для свободного Dox. В то время как неспецифический Dox накапливался в ядре клетки, HerDox преимущественно накапливался в ядрышковых структурах при некоторой еще видимой флуоресценции в цитоплазме (фиг. 14-Б).
[00201] Чтобы определить, остается ли Dox связанным с HerPBK10 во время поглощения, авторы изобретения использовали иммунофлуоресценцию против HerPBK10. На 15 минуте поглощения HerPBK10 локализовался главным образом совместно с Dox, что указывало на то, что значительное количество HerDox по-прежнему остается интактным, хотя уже наблюдалась некоторая степень накопления Dox в ядре (фиг. 15). На 30 и 60 минуте отмечено повышенное накопление Dox в ядре, в то время как большая часть HerPBK10 оставалась в цитоплазме (фиг. 15). В фиксированных клетках накопление в ядрышках не обнаруживалось в той степени, как в живых клетках (фиг. 14 (В)). В целом эти результаты показывают, что HerPBK10 доставляет Dox в клетку и высвобождает Dox внутри клетки, где он подвергается накоплению в ядре в соответствии с механизмом доставки (фиг. 11 В).
Пример 8: Сыворотка человека не оказывает заметного влияния на связывание с клетками
[00202] Чтобы определить, конкурирует ли HerPBK10 с циркулирующим лигандом, который может присутствовать в сыворотке, авторы изобретения протестировали связывание HerPBK10 с HER2+ клетками рака молочной железы в сыворотке человека, полученной от HER2+ пациентов. Институт исследований рака у женщин в Сидарс-Синае иногда приобретает ограниченное количество сыворотки пациентов, причем сыворотка HER2+ пациентов составляет лишь небольшую долю от этого количества. В частности, сыворотка человека, используемая в настоящем примере, фактически являлась фракцией сыворотки и связанных с ней белков, выделенной из собранной цельной крови HER2+ и HER2- пациентов соответствующего возраста. Более ранние эксперименты продемонстрировали, что HerDox связывает клетки-мишени в полной среде, содержащей 10% бычью сыворотку, и что избыток свободного лиганда конкурентно ингибирует это связывание. В настоящем примере авторы изобретения заменили бычью сыворотку в обычной культуральной среде сывороткой человека, полученной из приобретенных образцов пациентов, для оценки способности сыворотки человека, особенно HER2+ пациентов, ингибировать связывание с клетками. Авторы изобретения обеспечили значительное воздействие сыворотки человека на клетки (2 часа, что представляет собой время, достаточное для связывания любого циркулирующего лиганда с рецептором) перед обработкой. Попарное сравнение связывания клеток в сыворотке HER2+ пациентов, HER2- пациентов или бычьей сыворотке продемонстрировало отсутствие существенных различий (фиг. 16), что показывает, что протестированные образцы сыворотки человека в данном примере не мешали связыванию HerPBK10 с клетками-мишенями. Конкурентное ингибирование с использованием 100х лиганда-херегулина (+Her) подтвердило, что контрольная связывающая активность специфична по отношению к рецепторам херегулина.
Пример 9: Уровни субъединицы HER и цитотоксичность по отношению к клеткам предлагаемых типов
[00203] Авторы изобретения измерили уровни субъединиц HER на поверхности клеток различных линий и типов, описанных в настоящем документе, поскольку ранее описанные уровни могут не отражать фактические уровни в доступных для использования клетках. Авторы изобретения приобрели указанные линии клеток в АТСС и NIH/NCI и оценили их профили по отношению к уровням субъединиц HER (фиг. 17 (А)). Чтобы оценить наличие токсического действия HerDox в соответствии с уровнем HER2, авторы изобретения выбрали линии, экспрессирующие HER2 на поверхности клеток при относительно высоком (SKBR3), умеренном (MDA-MB-435, MDA-MB-453, HeLa) и низком или необнаружимом уровне (MDA-MB-231), и получили кривые зависимости цитотоксичности от дозы. Авторы изобретения наблюдали обратную корреляцию CD50 HerDox с уровнем HER2 на поверхности клеток этих выбранных линий: линия клеток с относительно высоким уровнем HER2 демонстрировала относительно более высокую чувствительность к HerDox, линия клеток с низким уровнем HER2 демонстрировала низкую чувствительность, а линия с промежуточным уровнем HER2 также демонстрировала промежуточную чувствительность (фиг. 17 (В); значения CD50 показаны на логарифмической шкале).
Пример 10
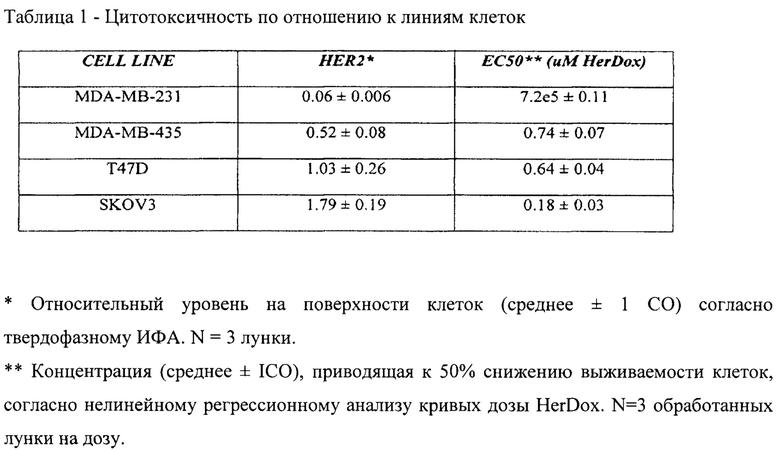
Пример 11: Оптимизация HerPBK10
[00204] Поскольку белок HerPBK10 происходит от белка пентонового основания аденовируса, естественной мишенью связывания для которого являются альфа-v интегрины, авторы настоящего изобретения проверили, улучшает ли мутация Arg-Gly-Asp (RGD) в интегрин-связывающем мотиве способность белка к доставке нагрузки в клетки. Хотя предыдущие исследования показали, что добавление лиганда, связывающегося с рецептором херегулина, к пентоновому основанию делает его специфичным почти исключительно к рецепторам херегулина (как показано с помощью анализа конкурентного ингибирования), возможно, что HerPBK10 все еще может кооптировать рецепторы интегрина, что может перенаправить белок по другому внутриклеточному пути или привести к конкуренции за сайты связывания на самом белке. Преобразование мотива RGD в EGD посредством точечной мутации устраняет возможность связывания с интегрином. Таким образом, получили мутантный белок HerPBrgdK10, несущий эту мутацию, и протестировали его на предмет доставки генов по сравнению с исходным HerPBK10. При эквивалентных концентрациях белка HerPBrgdK10 демонстрировал умеренное (в ~1,8 раза) или резкое (в ~18 раз) улучшение переноса генов (фиг. 18), что может отражать улучшенное связывание рецептора или активность после связывания.
Пример 12: ДНК-конструкты
[00205] Авторы настоящего изобретения использовали общий 5'-олигонуклеотидный праймер, содержащий последовательность 5'-ATCGAAGGATCCATGCGGCGCGCGGCGATGTAT-3' (SEQ ID NO: 12), для амплификации пентоновых последовательностей из матрицы генома аденовируса pJMl 7 дикого типа и меченых лизином последовательностей. Последовательности 3'-праймеров представляли собой РВ: 5'-GCATCAGAATTCTCAAAAAGTGCGGCTCGATAG-3' (SEQ ID NO: 1) и PBK10 5'-CATGAATTCA(ТТТ)10AAAAGTGCGGCTCGATAGGA-3' (SEQ ID NO: 2). В 5'-праймер внедрили сайт рестрикции BamHI, а в 3'-праймеры - сайт рестрикции EcoRl с целью инсерции пентонов дикого типа и меченых лизином пентонов в одной рамке считывания в бактериальную экспрессирующую плазмиду pRSET-A (Invitrogen, Карлсбад, штат Калифорния, США). Эта плазмида экспрессирует рекомбинантный белок в виде гибрида, меченого гистидином по N-концу, для аффинной очистки посредством никель-хелатной аффинной хроматографии.
[00206] Полимеразную цепную реакцию (ПЦР) использовали для добавления последовательности, кодирующей короткий полиглициновый линкер, к N-концу PBK10. Последовательность, кодирующая линкер, содержала сайт рестрикции 5OcII для дополнительного клонирования. Лиганд, специфичный к херегулину, получали с помощью ПЦР-амплификации домена, аналогичного эпидермальному фактору роста (ЭФР), гена 29 херегулина с использованием 5'-олигонуклеотидного праймера, содержащего сайт BamHI, и 3'-праймера, содержащего сайт SacU, для клонирования в одной рамке считывания с PBK10. Специфический лиганд добавляли в меченый лизином конструкт с целью создания HerPBK10 путем лигирования ПЦР-продукта с N-концом PBK10. Конструирование Her и GFP-Her было описано ранее (Medina-Kauwe L.K., et al, BioTechniques 2000, 29: 602-609). HerK10 получили с помощью ПЦР-амплификации конструкта Her с использованием 5'-Her праймера (Medina-Kauwe L.K., et al, BioTechniques 2000, 29: 602-609) и 3'-олигонуклеотидного праймера, содержащего последовательность 5'-ATGAATTCA(ТТТ)10AGATCTACTTCCACCACTTCCACC-3' (SEQ ID NO: 3).
Пример 13: Длина дц-олигонуклеотида не влияет на включение Dox в целевой комплекс
[00207] Дуплексы дц-олигонуклеотидов образовали из комплементарных последовательностей размером 30 п.о. LLAA-5 (SEQ ID NO: 6) и LLAA-3 (SEQ ID NO: 7) или последовательностей размером 48 п.о. BglIIHis-5 (SEQ ID NO: 8) и BglIIHis-3 (SEQ ID NO: 9). Dox добавляли к каждому набору дуплексов, отожженных при молярном соотношении дуплекс : Dox 1:10, 1:20 или 1:40 (при конечной концентрации Dox 20, 40 или 80 мкМ) в 10 мМ трис/HCl буфере, pH 8,0, на 30 минут при комнатной температуре. Затем смеси центрифугировали через ультрафильтрационные мембраны (Microcon Ultracel YMlO; Millipore) при 10000 g для отделения свободного Dox от включенного Dox. Концентраты и фильтраты собирали по отдельности и измеряли оптическую плотность каждого из них при 480 нм с использованием планшет-ридера SpectraMax М2 (Molecular Devices). Результаты (фиг. 19) показывают отсутствие заметных различий во включении Dox при использовании дуплексов из 30 или 48 п.о.
Пример 14: HerDox токсичен по отношению к клеткам глиомы
[00208] Клетки глиомы человека U251 оценивали на предмет уровней субъединицы HER посредством иммуногистохимии без пермеабилизации и обнаружили относительно значительный уровень HER2, HER3 и HER4 на их поверхности (фиг. 20 (А)).
[00209] Клетки U251, растущие в чашках, инкубировали с HerDox или Dox (в концентрации 0,5 мкМ или 1 мкМ) в культуральной среде в течение 4-х часов при температуре 37°C, 5% CO2, после чего добавляли свежую полную среду для увеличения конечного объема культуры приблизительно в четыре раза и поддерживали клетки при 37°C, 5% CO2 в течение четырех дней. Клетки обрабатывали трипсином и подсчитывали в последний день.
[00210] Результаты авторов настоящего изобретения показывают, что HerDox проявляет в 8-10 раз большую токсичность по отношению к клеткам U251, чем эквивалентные концентрации Dox, и, аналогично, 10-кратно меньшая доза HerDox обладает токсичностью, аналогичной Dox (фиг. 20 (В)).
Пример 15: Тестирование оптимизированного комплекса, состоящего из модифицированного капсидного белка, двуцепочечного олигонуклеотида и интеркалятора ДНК для адресного воздействия, и терапевтическая эффективность по отношению к HER2+ опухолям in vivo.
[00211] Устойчивые опухолевые клетки характеризуются повышенным уровнем HER3 и усиленной чувствительностью к HerDox. Линии HER2+ клеток рака молочной железы с приобретенной устойчивостью к трастузумабу характеризуются повышенными уровнями HER3 на поверхности клеток по сравнению с исходными линиями (ВТ474 и SKBR3) (фиг. 21-А), что согласуется с другими исследованиями, показывающими, что повышение уровня HER3 связано с устойчивостью к лекарственному веществу. Обработку HerDox сравнивали с трастузумабом и комбинированной терапией с применением трастузумаба и пертузумаба на исходных и устойчивых к трастузумабу линиях ВТ474 и SKBR3 в культуре. Каждое терапевтическое средство вводили в диапазонах концентраций, заведомо обеспечивающих терапевтическую эффективность. Трастузумаб (Tz) снижал выживаемость исходных клеток ВТ474 на 50%, а добавление пертузумаба (Pz) не увеличивало гибель клеток в значительной степени (фиг. 21B). Обе схемы были неэффективны по отношению к устойчивым клеткам ВТ474. HerDox продемонстрировал повышенную гибель клеток по сравнению с Tz и Tz+Pz по отношению к исходным клеткам ВТ474, и полностью уничтожал устойчивые клетки ВТ474. Результаты, полученные для SKBR3, были аналогичны, поскольку как исходные, так и устойчивые клетки демонстрировали незначительную реакцию на Tz сам по себе или комбинированную терапию (Tz+Pz) (фиг. 21B). В противоположность этому, HerDox вызывал гибель 50% клеток исходной линии SKBR3, и гибель >80% устойчивых клеток SKBR3.
[00212] Эффективность HerDox также проверили на исходно устойчивой линии клеток. Линию клеток JIMT-1 получили из опухоли, никогда не реагировавшей на лечение трастузумабом. Эти клетки не реагируют на Tz и Tz+Pz в широком диапазоне концентраций (фиг. 21-С). В противоположность этому, HerDox обеспечивал дозозависимую гибель клеток и уничтожил до 90% клеток (фиг. 21-С). Кроме того, системная доставка HerDox в организмы мышей, несущих опухоли JIMT-1, подавляла опухолевый рост, в отличие от Tz и Dox по отдельности (фиг. 22).
[00213] Предобработка трастузумабом повышает чувствительность HER2+ клеток к HerDox. Предыдущие исследования показали усиление транскрипции и трансляции HER3 уже через 4 часа после ингибирования HER2 за счет лапатиниба или сайленсинга генов. Повышенная эффективность HerDox по отношению к Tz-устойчивым клеткам по сравнению с исходными клетками указывает, что трастузумаб может действовать как адъювант для HerDox, индуцируя повышение уровня HER3 для усиления хоминга HerDox к устойчивым клеткам. Для проверки этого исходные и устойчивые линии предварительно обработали трастузумабом за 4 или 24 часа до обработки HerDox. HerDox уже демонстрировал улучшенное уничтожение исходных клеток SKBR3 по сравнению с трастузумабом, но предобработка усиливала его токсичность еще на 40-50% при максимальных протестированных дозах (фиг. 23А). Токсичность HerDox по отношению к исходным клеткам ВТ474 умеренно превосходила токсичность трастузумаба, но 4-ч предобработка трастузумабом усилила токсичность HerDox еще на 50%, а 24-ч предобработка обеспечила почти 75% повышение токсичности (фиг. 23B). Даже HER2-3-экспрессирующие клетки MDA-MB-435, которые уже были чувствительны к HerDox, продемонстрировали умеренное повышение токсичности при 24-ч предобработке трастузумабом (фиг. 23С). С другой стороны, Tz-устойчивые линии уже демонстрировали выраженную чувствительность к HerDox, и, таким образом, предобработка по большей части не являлась необходимой (фиг. 23D-F). Tz-устойчивые клетки ВТ474, в частности, полностью погибали при всех протестированных концентрациях HerDox (фиг. 23Е). Соответственно, концентрации HerDox были снижены для оценки наличия эффекта предобработки трастузумабом. Пятикратно более низкие концентрации HerDox по-прежнему оказывали мощное воздействие на выживаемость клеток, и предобработка трастузумабом дополнительно усиливала цитотоксичность (фиг. 23F). Совместно эти результаты показывают, что трастузумаб можно применять в качестве адъюванта при обработке HerDox.
Пример 16: HerPBK10 является специфичным по отношению к HER3.
[00214] На фигуре 26 показано, что HerPBK10 является специфичным по отношению к HER3, поскольку HerPBK10 связывается с иммобилизованным пептидом, содержащим внеклеточный домен HER3 человека, что ингибировалось предварительной адсорбцией HerPBK10 со свободным пептидом HER3 in vitro (фиг. 26-А). Эта же предварительная адсорбция также ингибировала связывание HerPBK10 с HER2+ клетками в культуре (фиг. 26-В). Важно отметить, что димеризация HER2 с HER3 не является необходимой для связывания HerPBK10, поскольку антитело пертузумаб (Pz), блокирующее гетеродимер, не предотвращало связывания HerPBK10 с его рецептором на HER2+ клетках (фиг. 26-В). Пептид HER4 или бетацеллюлин (который блокирует HER4) также не ингибировали связывание (фиг. 26-В).
Пример 17: Сыворотка пациента не ингибирует связывание с рецептором
[00215] Образцы сыворотки пяти HER2+ пациентов и контрольных субъектов соответствующего возраста не предотвращали связывания HerPBK10 с HER2+ клетками в культуре и не продемонстрировали статистически значимых различий друг от друга. Таким образом, сыворотка пациента не ингибирует связывание с рецептором Повторное введение HerPBK10 в терапевтических и 10-кратно превышающих терапевтические уровнях иммунокомпетентным мышам не привело к обнаружимому образованию нейтрализующих антител против белка.
Пример 18: Устойчивые опухолевые клетки характеризуются повышенным уровнем HER3 и усиленной чувствительностью к HerDox.
[00216] На фигуре 27 (А) показано, что линии клеток HER2+ рака молочной железы с приобретенной устойчивостью к трастузумабу (при стандартных схемах долгосрочного культивирования с увеличивающимися концентрациями ингибитора HER2) продемонстрировали повышенные уровни HER3 на поверхности клеток по сравнению с исходными линиями (ВТ474 и SKBR3). Этот результат согласуется с известной специалистам информацией о том, что повышение уровня HER3 ассоциировано с устойчивостью к лекарственным веществам.
[00217] Воздействие HerDox на раковые клетки сравнивали с (i) трастузумабом и (ii) комбинированной терапией с применением трастузумаба (Tz) и пертузумаба (Pz). Эксперимент выполняли с использованием исходных и устойчивых к трастузумабу линий клеток ВТ474 и SKBR3 в культуре. Каждое терапевтическое средство вводили в диапазонах концентраций, заведомо обеспечивающих терапевтическую эффективность согласно установленным данным или литературе. Tz снижал выживаемость исходных клеток ВТ474 на 50%, добавление Pz не увеличивало гибель клеток в значительной степени (фиг. 27-В). Обе схемы были неэффективны для устойчивых клеток ВТ474. С другой стороны, HerDox продемонстрировал повышенную гибель клеток по сравнению с Tz и Tz+Pz по отношению к исходным клеткам ВТ474, и эффективно ликвидировал устойчивые клетки ВТ474.
[00218] Аналогичные результаты были получены для линии клеток SKBR3. Как исходные, так и устойчивые клетки демонстрировали незначительную реакцию на Tz сам по себе или комбинированную терапию (Tz+Pz) (фиг. 27-В). В противоположность этому, HerDox вызывал гибель 50% клеток исходной линии SKBR3 и >80% устойчивых клеток SKBR3. Таким образом, эти результаты показывают, что устойчивые опухолевые клетки характеризуются повышенной чувствительностью к HerDox.
[00219] Вклад HER3 в адресную токсичность определяли путем оценки возможности блокирования цитотоксичности за счет предварительной адсорбции HerDox с пептидом, содержащим лиганд-связывающий домен HER3. Хотя HerDox вызывал усиленную гибель клеток исходных и устойчивых линий, HER3 пептид ингибировал этот эффект (фиг. 27-С), что указывало на то, что гибель клеток осуществляется за счет лиганд-направленной доставки полезной нагрузки - Dox. На фигуре 27 (Е) показана эффективность HerDox по отношению к исходно устойчивой линии клеток. Линию клеток JIMT-1 получили из HER2+ опухоли, никогда не реагировавшей на лечение трастузумабом. Эти клетки по-прежнему не реагируют на Tz и Tz+Pz и лишь частично реагируют на Dox в широком диапазоне концентраций. В противоположность этому, HerDox обеспечивал дозозависимую гибель клеток и уничтожал до 90% клеток (фиг. 27-Е). Наконец, системная доставка HerDox в организмы мышей, несущих опухоли JIMT-1, подавляла опухолевый рост, в отличие от Tz и Dox по отдельности при той же дозе лекарственного вещества, что и в HerDox (0,004 мг Dox/кг/инъекцию). Фактически, влияние Tz или Dox по отдельности на рост опухоли лишь незначительно отличается от воздействия имитатора исследуемого соединения - физиологического раствора (фиг. 28). Таким образом, эти результаты показывают, что HerDox вызывает усиленную гибель устойчивых опухолевых клеток.
Пример 19: Трастузумаб повышает чувствительность HER2+ клеток к HerDox.
[00220] На фигуре 29 (А) показано, что предобработка Tz in vitro повышает уровень HER3 в исходных клетках (фиг. 29-А), усиливает связывание HerPBK10 с этими клетками (фиг. 29-В) и усиливает токсичность HerDox по отношению к этим клеткам (фиг. 29-С, 29-D). Клетки исходных и устойчивых линий предварительно обработали трастузумабом за 4 или 24 часа до обработки HerDox. HerDox уже демонстрировал улучшенное уничтожение исходных клеток SKBR3 по сравнению с Tz, но предобработка усиливала его токсичность еще на 40-50% при максимальных протестированных дозах (фиг. 29-С). Повышенная эффективность HerDox по отношению к Tz-устойчивым клеткам по сравнению с исходными клетками показывает, что трастузумаб действует как адъювант для HerDox, индуцируя повышение уровня HER3 для усиления хоминга HerDox к устойчивым клеткам.
[00221] Токсичность HerDox по отношению к исходным клеткам ВТ474 умеренно превосходила токсичность Tz, но предобработка трастузумабом в течение четырех часов усилила токсичность HerDox еще на 50%, а предобработка в течение 24 часов обеспечила почти 75% повышение токсичности (фиг. 29-D). Даже HER2-3-экспрессирующие клетки MDA-MB-435, которые уже были чувствительны к HerDox, продемонстрировали умеренное повышение токсичности при 24-часовой предобработке Tz (фиг. 29-Е). С другой стороны, Tz-устойчивые линии уже демонстрировали выраженную чувствительность к HerDox, и, таким образом, предобработка по большей части не являлась необходимой (фиг. 29-F, 29-G). Tz-устойчивые клетки ВТ474, в частности, полностью погибали при всех протестированных концентрациях HerDox (фиг. 29-G). Соответственно, концентрации HerDox были снижены для оценки наличия эффекта предобработки трастузумабом. Пятикратно более низкие концентрации HerDox по-прежнему оказывали мощное воздействие на выживаемость клеток, и предобработка Tz дополнительно усиливала цитотоксичность (фиг. 29-Н). Совместно эти результаты демонстрируют, что Tz можно применять в качестве адъюванта при обработке HerDox. Аналогичным образом, пертузумаб, лапатиниб, T-DM1 также действуют как адъюванты при обработке HerDox.
Пример 20. Поглощение HerPBK10 является более быстрым и эффективным по сравнению с трастузумабом.
[00222] HerPBK10, меченый флуоресцентной меткой, получили с целью оценки его биораспределения и поглощения клетками по сравнению с меченым Tz. Эквивалентные дозы каждого реагента вводили в хвостовую вену мышей, несущих HER2+ опухоли. Ткани собирали через четыре часа после инъекции для визуализации. Оба реагенты сравнивали с меченым неспецифическим белком - BSA. HerPBK10 и Tz продемонстрировали эквивалентные уровни накопления в опухоли (которые были выше, чем для BSA) и почти полное отсутствие доставки в сердце, селезенку и мышцы (фиг. 30-А). Однако доставка в другие неопухолевые ткани, например, печень, легкие и почки, была выше для Tz, чем для HerPBK10. В отличие от Tz, HerPBK10 не демонстрировал доставки в легкие (фиг. 30-А).
[00223] Кроме того, оценивали поглощение HER2+ клетками MDA-MB-435. Уровни рецепторов на поверхности этих клеток показаны на графике на фиг. 30-В. HerPBK10 демонстрировал кластеризацию клеточной поверхности с последующим выраженным эндоцитозом в течение 45 мин после его поглощения клеткой (фиг. 30-В). В противоположность этому, несмотря на повышенный уровень HER2 по сравнению с HER3 на этих клетках, Tz демонстрировал разрозненное связывание с поверхностью клеток и оставался в областях разрозненных точек на клетках до двух часов после связывания с клеткой (фиг. 30-В).
[00224] Эти результаты показывают, что поглощение HerPBK10 является более быстрым и эффективным по сравнению с Tz.
Пример 21: HerPBK10 демонстрирует более интенсивное по сравнению с трастузумабом связывание с опухолевой тканью пациента, экспрессирующей более высокие уровни HER3 по сравнению с HER2.
[00225] Чтобы определить способность наночастиц, описанных в настоящей заявке, распознавать HER3 в тканях человека, получили ткань опухоли молочной железы из хирургического образца от HER2+ пациента. Эту ткань исследовали с целью определить, связывается ли HerPBK10 с этой тканью за счет HER3. На фигуре 31 показано, что связывание HerPBK10 и Tz с отдельными клетками этого образца опухоли зависит от концентрации, причем HerPBK10 демонстрировал более выраженное связывание, чем Tz (фиг. 31-В). Эта кривая связывания коррелировала с повышенным уровнем HER3 и очень низким уровнем HER2, измеряемым на поверхности опухолевых клеток (фиг. 31-А).
Пример 22: HerPBK10 распознает HER3 мыши.
[00226] Клетки 4Т1 мыши, полученные из опухоли молочной железы мыши BALB/c, были трижды негативными и использовались в качестве сингенной модели ТНРМЖ у мышей BALB/c. HER3 экспрессируется на поверхности клеток 4Т1 на значительном уровне (фиг. 32-В), распознается HerPBK10 (фиг. 32-С) и конкурентно ингибируется пептидом HER3 человека (фиг. 32-С). Рецептор-специфическое связывание HerPBK10 с HER3 мыши отражает высокий уровень идентичности аминокислотной последовательности HER3 мыши и человека: 91% идентичность для всего белка и 94% в области связывания херегулина (внеклеточные домены I и II) (фиг. 32-А). Эти результаты показывают, что модель BALB/c-4T1 можно использовать для тестирования направленного воздействия в иммунокомпетентных условиях. Кроме того, распознавание HER3 мыши посредством HerPBK10 повышает клиническое значение существующих результатов, полученных авторами изобретения для моделей ксенотрансплантатов: HerDox демонстрировал преимущественную адресную токсичность по отношению к опухоли, даже когда он распознавал эндогенный HER3 у мышей. Важно отметить, что клетки ВТ-549 человека, которые также происходят от ТНРМЖ, характеризуются повышенным уровнем HER3 на поверхности клеток (фиг. 32-В) и представляют собой дополнительную линию клеток ТНРМЖ, которую можно использовать в качестве мишени.
Пример 23: Домен пентонового основания необходим для проникновения в цитозоль.
[00227] Делеционные мутанты HerPBK10, у которых отсутствует РВ-домен, не могли доставлять S2Ga в цитоплазму клеток. Это подтверждает, что домен пентонового основания HerPBK10 необходим для проникновения через мембрану эндосом после рецептор-опосредованного поглощения.
Пример 24: Мутанты по системам внутриклеточной миграции, полученные путем направленной эволюции.
[00228] Для выделения белковых вариантов домена пентонового основания с потенциально усиленной внутриклеточной миграцией использовали направленную эволюцию и биопэннинг фагового дисплея. Эта методика предусматривает случайный мутагенезу рекомбинантного гена пентонового основания, экспрессию полученной библиотеки мутантов в бактериофаге Т7 и скрининг фаговой библиотеки на клетках HeLa (которые осуществляют эндоцитоз пентонового основания) в культуре. «Селективное давление» на скрининг состояло в выделении мутантов, характеризующихся расширенным цитозольным и/или ядерным распределением, что показывало, что белок облегчает полное проникновение в клетку и миграцию к желательному внутриклеточному компартменту (фиг. 35-А). Выделено несколько укороченных и полноразмерных вариантов с точечными мутациями, которые клонировали в HerPBK10, заменив ими домен пентонового основания (фиг. 35-В). Два из этих полноразмерных мутантов (111С и 333F) демонстрировали улучшенное распределение в цитозольных, цитоскелетных и ядерных компартментах по сравнению с исходным белком (дт HerPBK10) (фиг. 35-С), в то время как укороченные варианты (т.е. ТМ) не могли выйти из эндосом (фиг. 35-D).
Пример 25: S2Ga взаимодействует с TSPO.
[00229] Исследования механизма токсичности корролов установили, что HerGa вызывает супероксид-опосредованное повреждение цитоскелета, а также нарушает проницаемость митохондриальных мембран, что приводит к гибели посредством апоптоза. На фигуре 36-А и 36-В показано, что S2Ga непосредственно связывает белок митохондриальной наружной мембраны TSPO (фиг. 36А-В). TSPO транслоцирует порфирины и другие метаболиты в митохондрии для переработки, а также взаимодействует с компонентами митохондриального порового комплекса переходной проницаемости и имеет крайне важное значение для клеточного гомеостаза, поскольку нокаут по TSPO вызывает гибель эмбрионов у мышей. S2Ga специфически распознает сайт связывания порфирина на TSPO (фиг. 36А-В), и PK11195, который ингибирует связывание порфирина с TSPO, конкурентно ингибирует связывание S2Ga. Сверхэкспрессия рекомбинантного растворимого TSPO в клетках MDA-MB-435 предотвращает HerGa-опосредованное нарушение митохондриального мембранного потенциала (фиг. 36C-D), демонстрируя, что HerGa взаимодействует с TSPO in situ.
Пример 26: HerMn обеспечивает адресную токсичность и МР-обнаружение.
[00230] В то время как характерные особенности флуоресценции HerGa позволили использовать корролы в качестве агентов для визуализации, клиническая применимость оптической визуализации ограничена глубиной проникновения волны возбуждения и длины волны испускаемого излучения. Соответственно, использовали альтернативные металлированные корролыс, которые в комбинации с HerPBK10 являются столь же цитотоксическими, как HerGa, однако обладают достаточными контрастными свойствами, чтобы обеспечить обнаружение с использованием клинически значимых способов, например, магнитно-резонансной томографии (МРТ). HerMn характеризуется адресной токсичностью по отношению к HER2+, но не HER2- клеткам опухолей в культуре, в то время как S2Mn не оказывает влияния на выживаемость клеток (фиг. 37). HerMn нарушает потенциал митохондриальной мембраны (фиг. 38-А) и повреждает цитоскелет за счет повышения уровня супероксида (фиг. 38-В). HerMn концентрируется в опухолях in vivo после системной доставки, не затрагивая большинство здоровых тканей, в том числе сердце (фиг. 39), и замедляет рост опухоли в очень низкой фармакологической дозе (0,008 мг/кг), в отличие от обработки свободным S2Mn, HerPBK10 самим по себе или физиологическим раствором (фиг. 40-А). В растворе частицы HerMn демонстрируют ограниченное сокращение Т1 (спин-решеточной) релаксации по сравнению со свободным S2Mn (фиг. 41-А), что указывает на то, что инкапсуляция в частицы белка предотвращает доступ к молекулам воды. Однако доставка HerMn in vivo приводит в выраженному снижению релаксации Т1 и усилению МРТ-контраста в опухолях, в том числе по сравнению со свободным S2Mn и Gd (фиг. 40-В), что указывает на высвобождение коррода из частиц после поглощения тканями. Длительное удерживание корролов в опухолевой ткани показывает, что HerMn может являться контрастным агентом более длительного действия по сравнению с быстрым выведением Gd.
Пример 27: HerGa и HerMn не токсичны для клеток человека кардиологического происхождения (CDC).
[00231] Для оценки возможности переноса свойств исследовали жизнеспособность клеток человека кардиологического происхождения (CDC) в присутствии HerGa и/или HerMn. Возрастающие концентрации HerGa, HerMn и отдельных компонентов (только HerPBK10, только S2Ga и только S2Mn) не оказывали обнаружимого влияния на жизнеспособность CDC в отличие от Dox (фиг. 40-В), который известен своей кардиотоксичностью.
Пример 28: Устойчивые опухолевые клетки характеризуются повышенным уровнем HER3 и усиленным связыванием с HerPBK10.
[00232] Линии HER2+ клеток рака молочной железы с приобретенной устойчивостью к Tz (при использовании стандартных схем долговременного культивирования в присутствии возрастающих концентраций ингибитора HER2) характеризуются повышенными уровнями HER3 на поверхности клеток по сравнению с исходными линиями (ВТ474 и SKBR3) (фиг. 42-А, 43-А), что согласуется с известной информацией о том, что повышение уровня HER3 связано с устойчивостью к лекарственному веществу. Линия клеток рака молочной железы JIMT-1, полученная из HER2+ опухоли, никогда не реагировавшей на лечение трастузумабом, также демонстрировала повышенный уровень HER3 по сравнению с HER2 (фиг. 42-В). Усиление транскрипции и трансляции HER3 происходило уже через 4 часа после ингибирования HER2 за счет Lp или сайленсинга генов. Исходные линии подвергали воздействию Tz в течение 24 часов, а затем измеряли уровень HER3 на поверхности клеток по сравнению с необработанными исходными клетками. Обработка Tz не только повышала уровень HER3, но и пропорционально увеличивала связывание HerPBK10 с этими клетками (фиг. 42-С, 42-D). Для оценки способности наночастиц, описанных в настоящей заявке, распознавать HER3 в тканях человека, получили ткань опухоли молочной железы из хирургического образца от HER2+ пациента и исследовали возможность связывания HerPBK10 с этой тканью за счет HER3. Обнаружено, что связывание HerPBK10 и Tz с отдельными клетками этого образца опухоли зависело от концентрации, причем HerPBK10 демонстрировал более выраженное связывание, чем Tz (фиг. 42-F). Эта кривая связывания коррелировала с повышенным уровнем HER3 и очень низким уровнем HER2, измеряемым на поверхности опухолевых клеток (фиг. 42-Е).
Пример 29: HerGa проявляет повышенную токсичность по отношению к Tz-устойчивым опухолевым клеткам in vitro и in vivo.
[00233] Эффективность HerGa сравнивали с Tz и комбинированной терапией (Tz+Pz) с использованием исходных и Tz-устойчивых линий ВТ474. Каждое терапевтическое средство вводили в диапазонах концентраций, заведомо обеспечивающих терапевтическую эффективность, согласно литературным данным. Tz снижал выживаемость исходных клеток ВТ474 на 50% (фиг. 42-В), причем добавление Pz не увеличивало гибель клеток в значительной степени (фиг. 43-С). HerGa демонстрировал аналогичные результаты на исходных клетках (фиг. 43-В, 43-С). Tz и Tz+Pz были неэффективны по отношению к устойчивым клеткам ВТ474 (фиг. 43-В, 43-С). В противоположность этому, HerGa полностью уничтожал устойчивые клетки ВТ474 (фиг. 43-В). Результаты, полученные с использованием Tz+Lp-устойчивых клеток ВТ474 были аналогичны в том аспекте, что Tz демонстрировал отсутствие эффективности, в то время как HerGa вызывал почти полную гибель клеток.
[00234] Системная доставка HerGa (0,008 мг/кг/инекцию) в организмы мышей, несущих Tz-устойчивые опухоли ВТ474, подавляла опухолевый рост, в отличие от S2Ga и HerPBK10 по отдельности (фиг. 43-D). Поскольку эти мыши не получали поддерживающих доз Tz для поддержания устойчивости, чувствительность к Tz, по-видимому, восстанавливалась in vivo, однако эти опухоли в конечном итоге приобрели устойчивость к лечению Tz и начали расти в размерах, несмотря на терапевтические дозы Tz (фиг. 43-Е). Внутривенная доставка HerGa в организмы этих мышей привела к снижению размера этих опухолей (фиг. 43-Е).
[00235] Хотя настоящее изобретение описано в контексте некоторых вариантов реализации и примеров, специалисты в данной области техники должны понимать, что варианты реализации изобретения выходят за рамки конкретных описанных вариантов реализации, и возможны другие альтернативные варианты реализации и/или применения и их модификации и эквиваленты.
[00236] Многие варианты и альтернативные элементы описаны в вариантах реализации настоящего изобретения. Дополнительные варианты и альтернативные элементы очевидны для специалиста в данной области техники. Эти варианты, без ограничения, включают выбор составных модулей для композиций согласно изобретению, а также заболевания и другие клинические состояния, которые можно диагностировать, прогнозировать или лечить с их помощью. Различные варианты реализации изобретения могут специфически включать или исключать любой из этих вариантов или элементов.
[00237] Следует понимать, что в некоторых вариантах реализации числа, отражающие количество ингредиентов, свойства, например, концентрацию, условия реакции и т.д., используемые для описания и в формуле изобретения по отношению к некоторым вариантам реализации изобретения, в некоторых случаях модифицируются путем добавления термина «приблизительно». Соответственно, в некоторых вариантах реализации численные параметры, приведенные в письменном описании и прилагаемой формуле изобретения, являются приблизительными и могут меняться в зависимости от желательных свойств, необходимых для получения конкретного варианта реализации. В некоторых вариантах реализации численные параметры следует рассматривать с учетом количества приведенных значащих цифр, а также посредством применения обычных методик округления. Несмотря на то, что численные диапазоны и параметры, представляющие основную сущность некоторых вариантов реализации изобретения, являются приблизительными, численные значения, изложенные в конкретных примерах, приведены с как можно большей точностью. Численные значения, представленные в некоторых вариантах реализации изобретения, могут содержать некоторые ошибки, неизбежно вытекающие из стандартного отклонения соответствующих измерений при их тестировании.
[00238] В некоторых вариантах реализации термины «какой-либо», «этот» и аналогичные обозначения в контексте описания конкретных вариантов реализации (особенно в контексте формулы изобретения, приведенной ниже) следует рассматривать как охватывающие и единственное, и множественное число. Подразумевается, что перечисление диапазонов значений в настоящем документе используют лишь для укорачивания описания способа, относящегося к каждому отдельно взятому значению, лежащему в пределах этого диапазона. Если в настоящем документе не указано иное, каждое отдельное значение включено в описание, как если бы оно было отдельно приведено в настоящем документе. Все способы, описанные в настоящем документе, можно выполнять в любом подходящем порядке, если в настоящем документе не указано иное или иное не противоречит контексту явным образом. Подразумевается, что использование всевозможных примеров или иллюстративных выражений (например, «такой, как») по отношению к некоторым вариантам реализации представлено в настоящем документе лишь для лучшего освещения изобретения и не предполагает ограничения рамок изобретения, если иное не указано в формуле изобретения. Ни одно выражение в описании не следует рассматривать в качестве обозначения элемента, не предусмотренного формулой изобретения и необходимого для осуществления изобретения.
[00239] Группировка альтернативных элементов или вариантов реализации изобретения, описанные в настоящем документе, не должна истолковываться в качестве ограничений. Каждый член группы может упоминаться и входить в состав формулы изобретения по отдельности или в любой комбинации с другими членами группы или другими элементами, содержащимися в настоящем документе. Один или более членов группы могут быть включены или удалены из группы из соображений удобства и/или патентоспособности. При таком включении или удалении считается, что настоящее описание содержит модифицированную группу, таким образом соответствуя письменному описанию всех групп Маркуша, используемых в прилагаемой формуле изобретения.
[00240] В настоящем документе описаны предпочтительные варианты реализации настоящего изобретения, включая наилучшие способы его осуществления, известные авторам. Изменения этих предпочтительных вариантов реализации станут очевидны для специалистов при чтении вышеприведенного описания. Предполагается, что квалифицированные специалисты в соответствующих случаях могут использовать такие изменения, и изобретение можно осуществить иначе, чем описано в настоящем документе. Соответственно, многие варианты реализации настоящего изобретения включают все модификации и эквиваленты объекта изобретения, описываемого формулой изобретения, прилагаемой к настоящему документу, как предусмотрено действующим законодательством. Более того, настоящее изобретение включает любые комбинации вышеописанных элементов и их всевозможных вариантов, если иное не указано в настоящем документе или не следует из контекста явным образом.
[00241] Кроме того, в данное описание внесены многочисленные ссылки на патенты и печатные публикации. Каждый из вышеупомянутых источников и печатных публикаций полностью включен в настоящий документ посредством ссылки в качестве отдельного источника.
[00242] В заключение следует понимать, что варианты реализации изобретения, описанные в настоящем документе, иллюстрируют принципы настоящего изобретения. Другие используемые модификации могут находиться в рамках изобретения. Так, в качестве неограничивающего примера, можно использовать альтернативные конфигурации настоящего изобретения в соответствии с информацией, приведенной в настоящем документе. Соответственно, варианты реализации настоящего изобретения не ограничены буквальным приведенным описанием.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕЦЕПТОР-НАПРАВЛЕННЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2682335C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ БЛОКИРОВАНИЕМ СЕМАФОРИНА 4D (SEMA4D) И ТЕРАПИЕЙ ДК1 | 2020 |
|
RU2801828C2 |
| НАНОЧАСТИЦЫ ФЕРРИТИНА, СОДЕРЖАЩИЕ ХИМИОТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО | 2019 |
|
RU2810594C2 |
| НЕКОНКУРЕНТНЫЕ В ОТНОШЕНИИ НЕЙРЕГУЛИНА АЛЛОСТЕРИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО HER3 И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2704228C2 |
| АНТАГОНИСТЫ НЕУРЕГУЛИНА И ПРИМЕНЕНИЕ ИХ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2011 |
|
RU2587619C2 |
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПЕЦИФИЧНЫЕ ПО ОТНОШЕНИЮ К HER3, И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2620068C2 |
| НОВЫЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2627185C1 |
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, КОТОРОЕ СВЯЗЫВАЕТСЯ С ДОМЕНОМ II HER2, И ЕГО КИСЛЫЕ ВАРИАНТЫ | 2009 |
|
RU2543664C2 |
| ВВЕДЕНИЕ ФИКСИРОВАННЫХ ДОЗ HER-АНТИТЕЛ | 2005 |
|
RU2438705C2 |








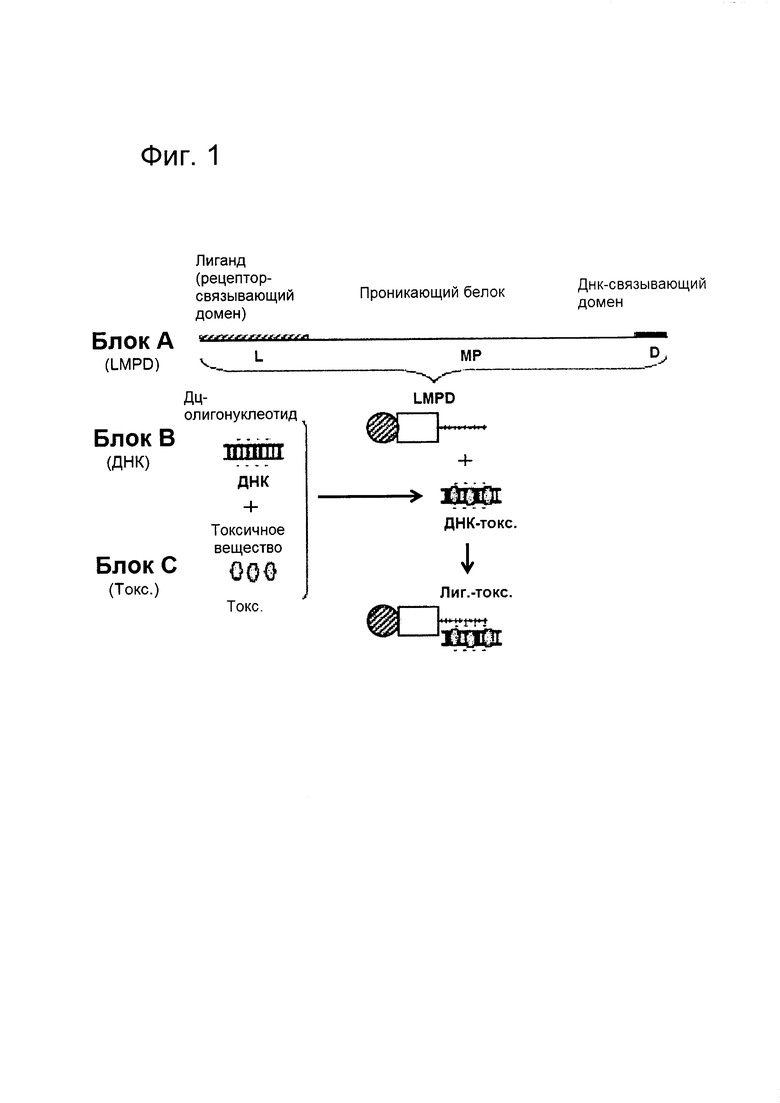
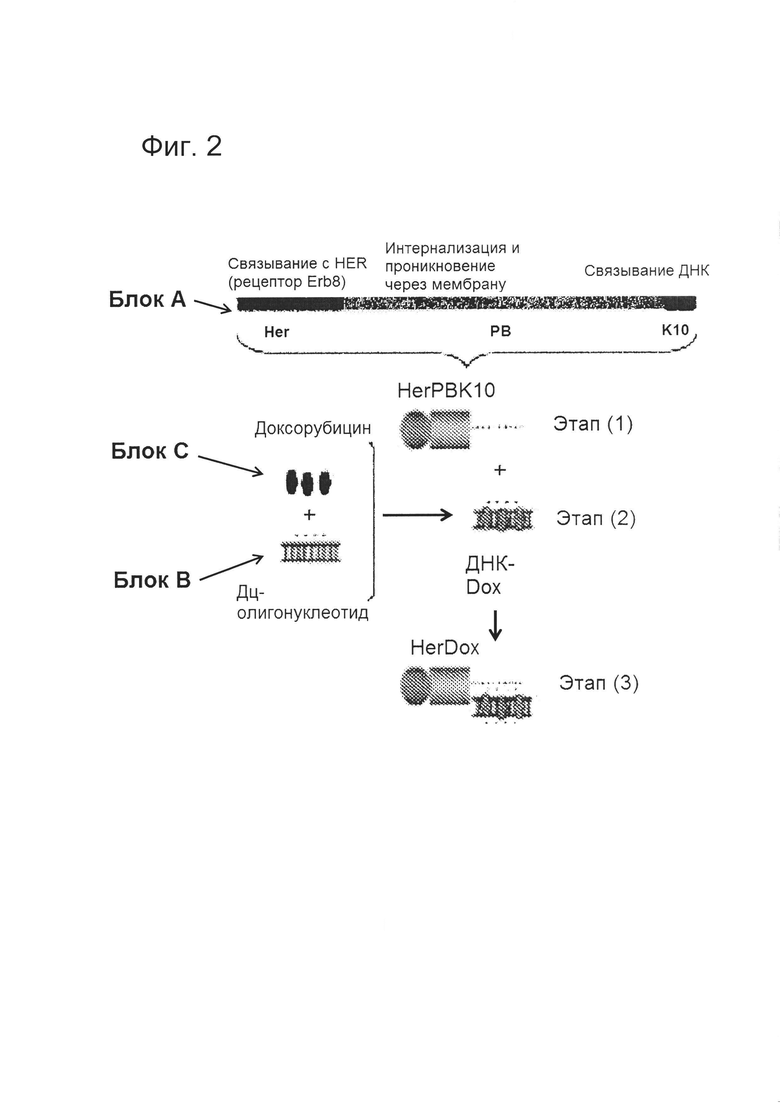
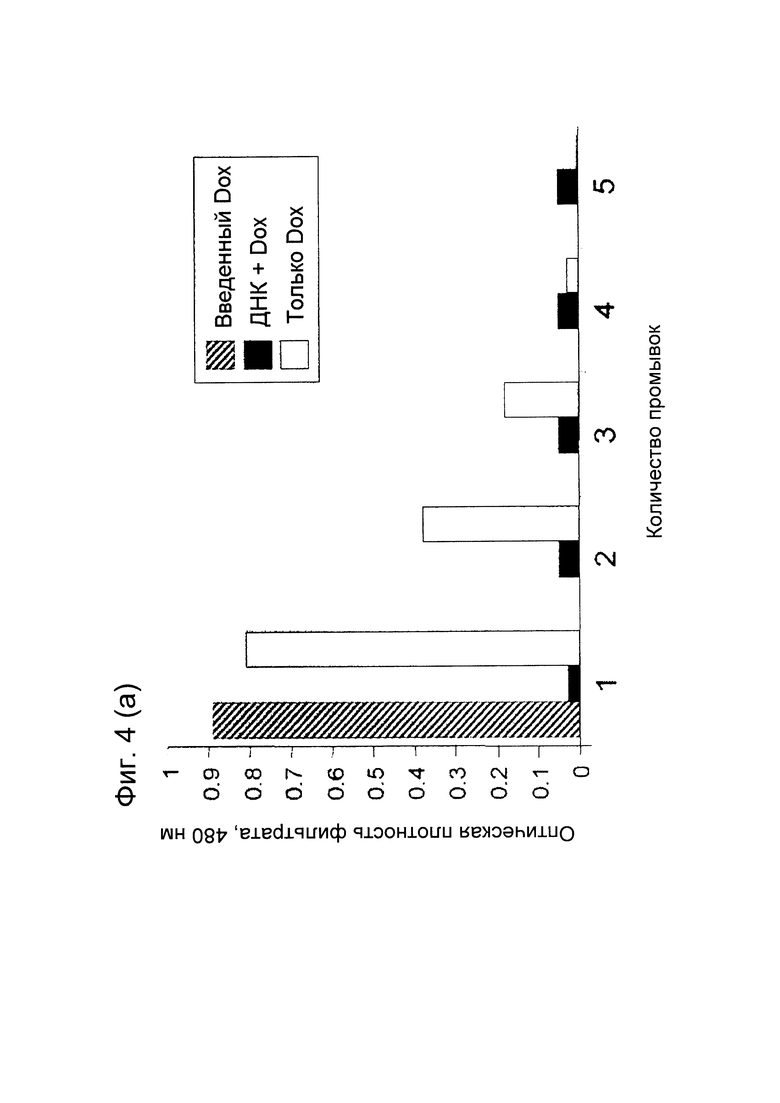
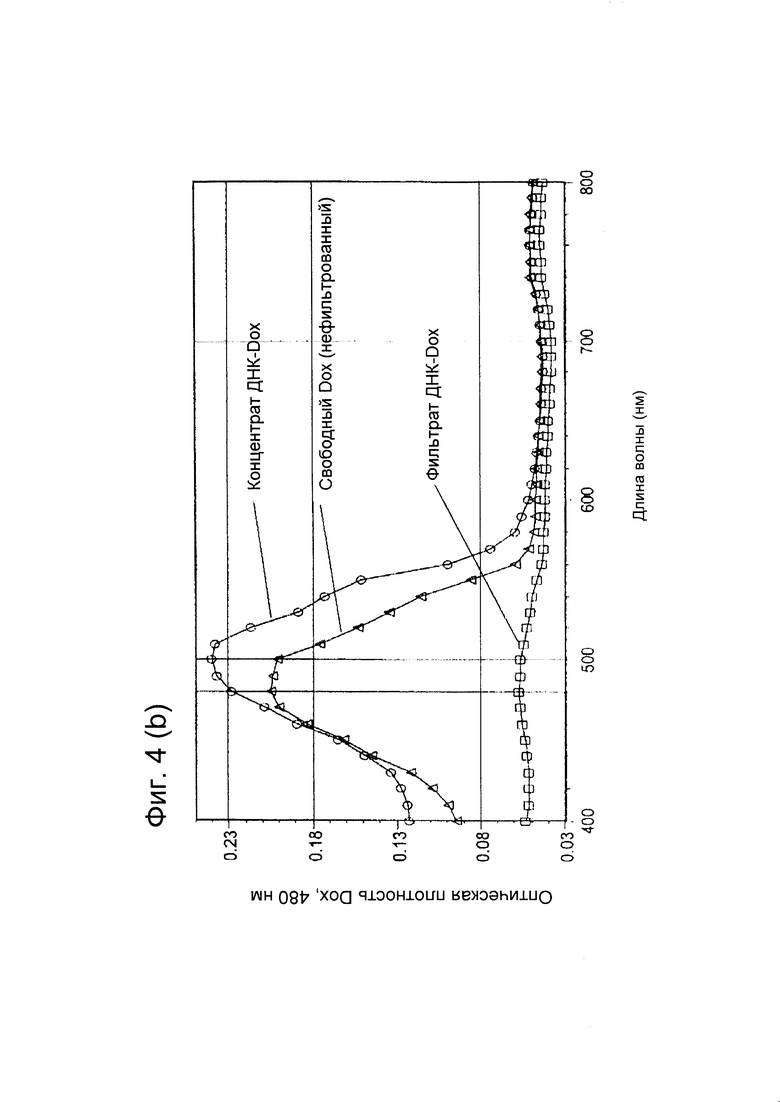
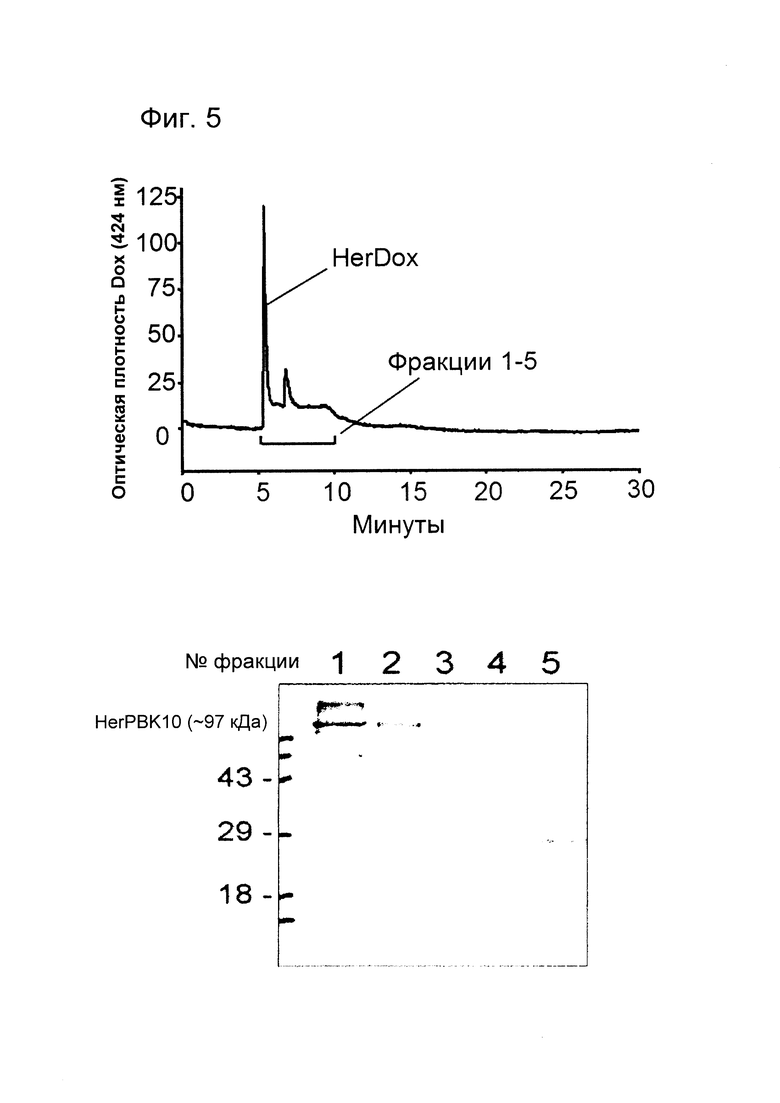
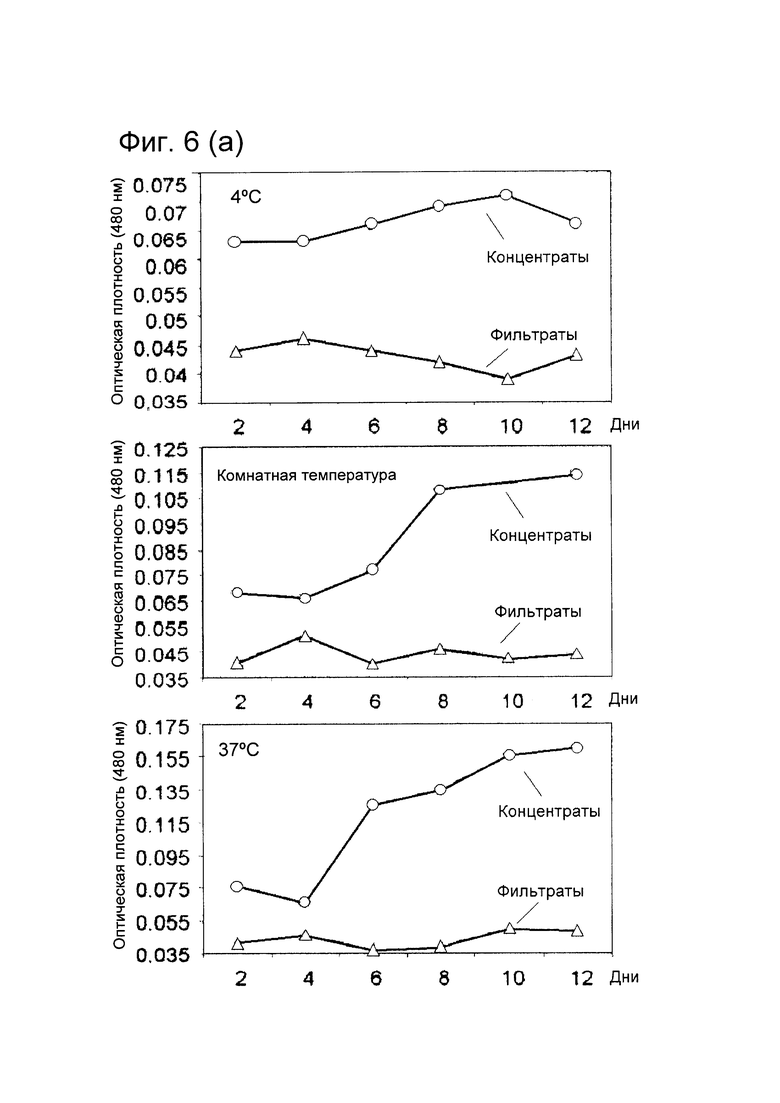
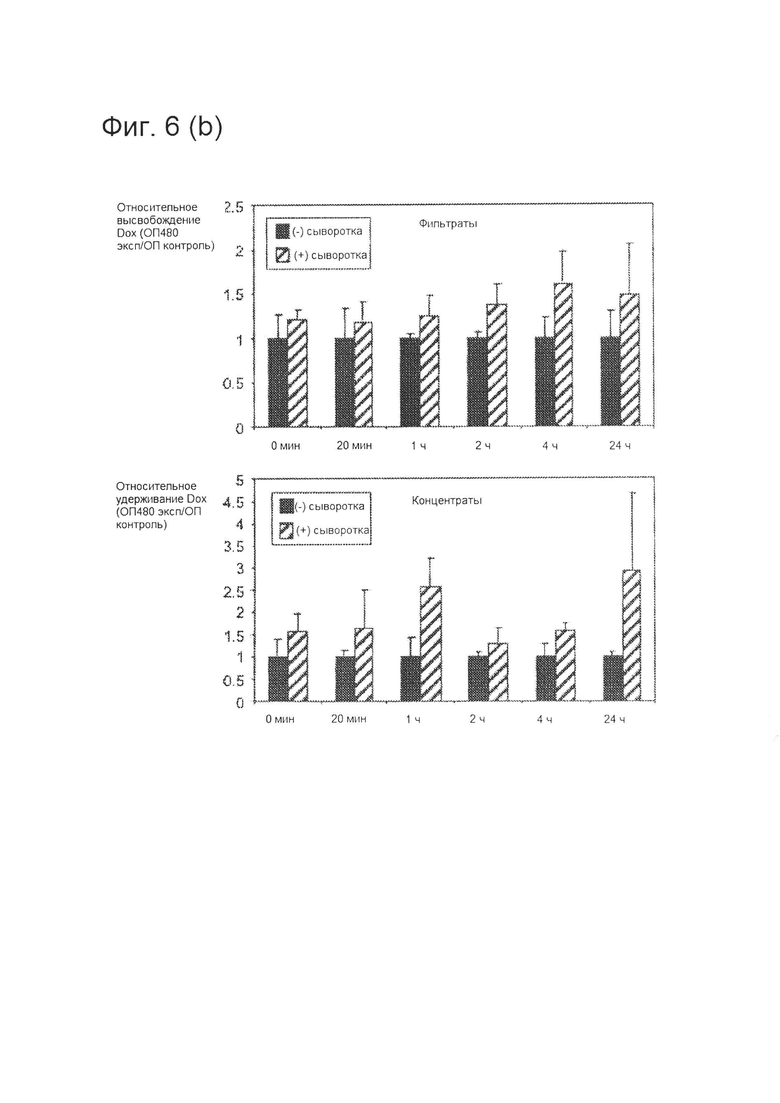
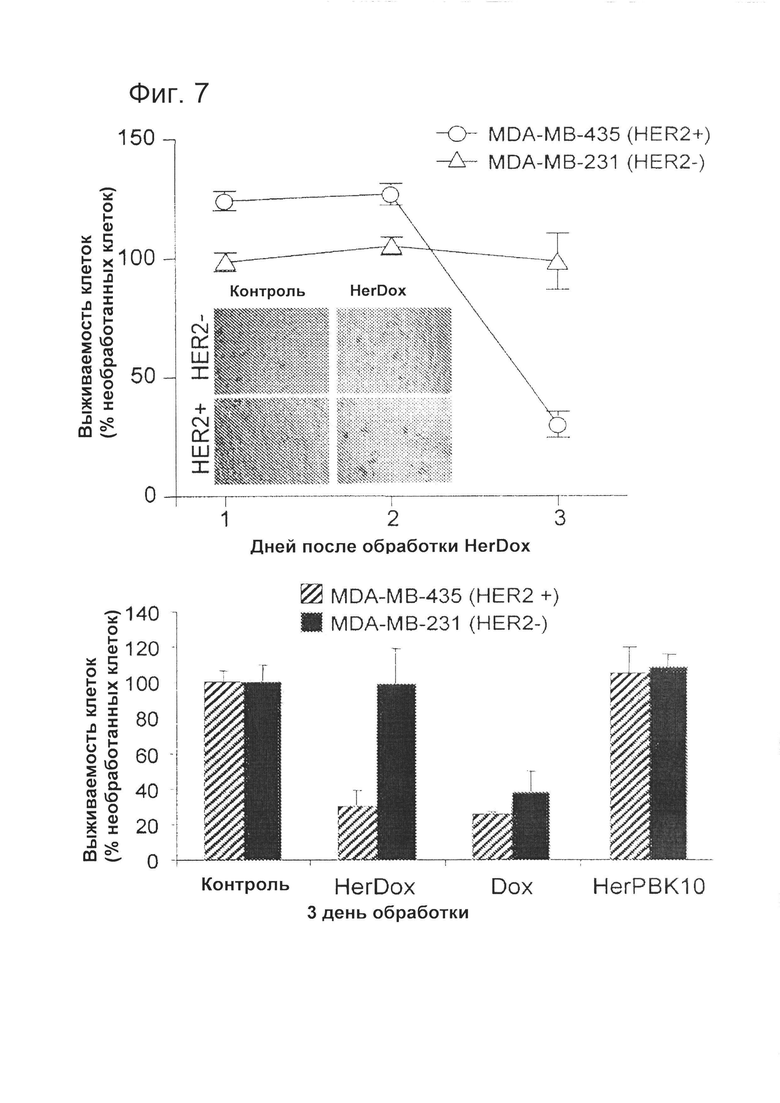
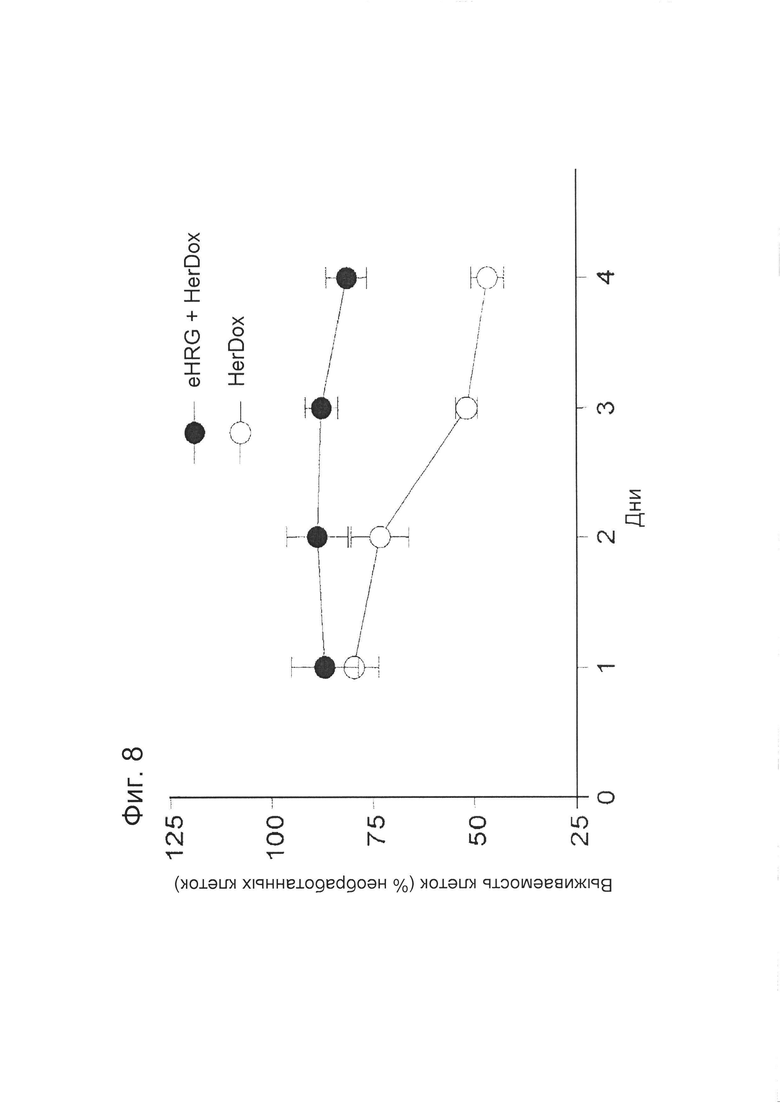
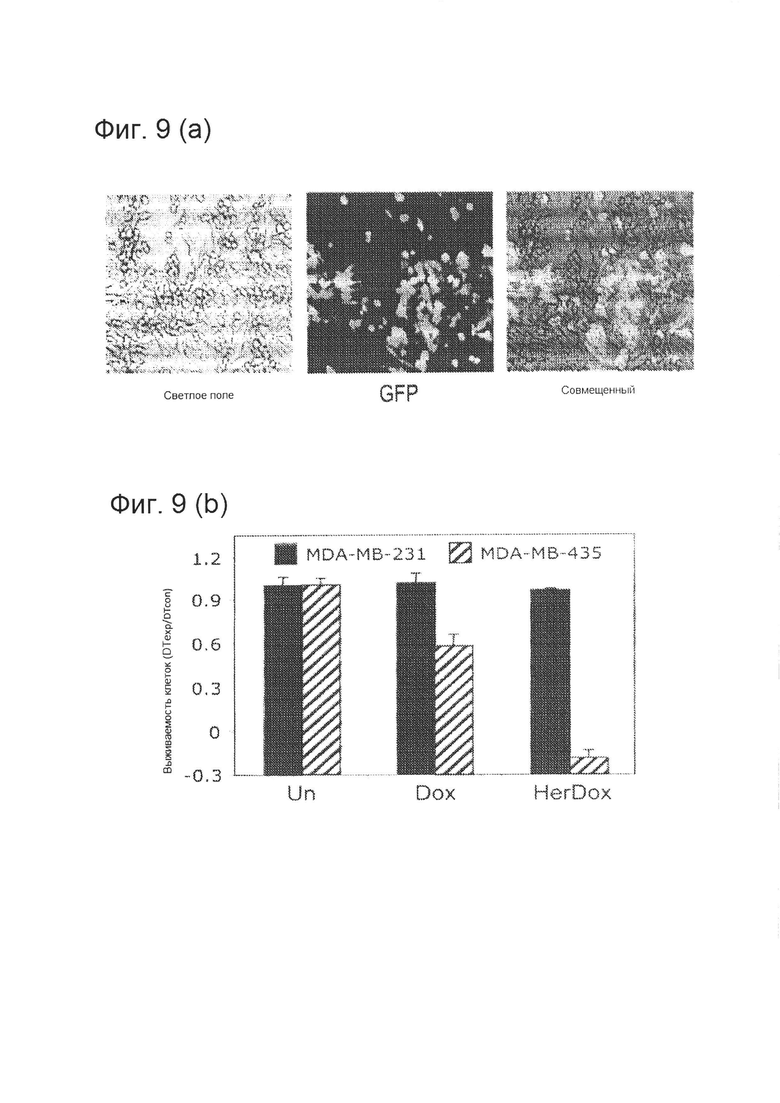

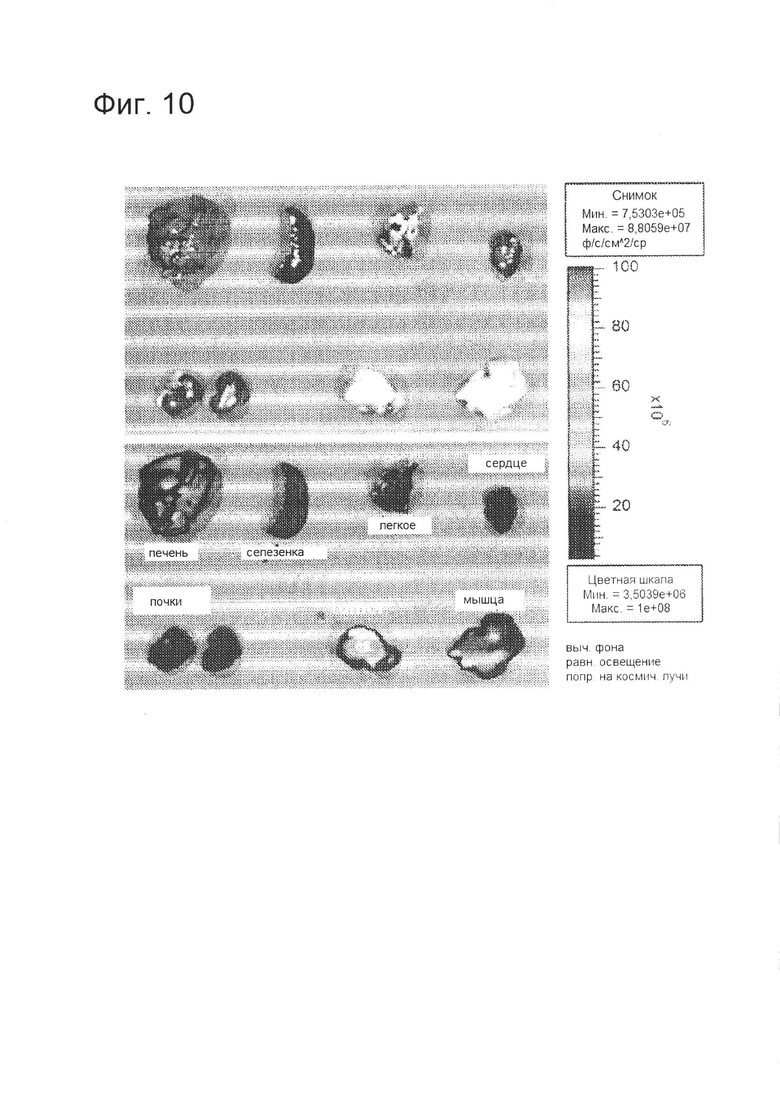
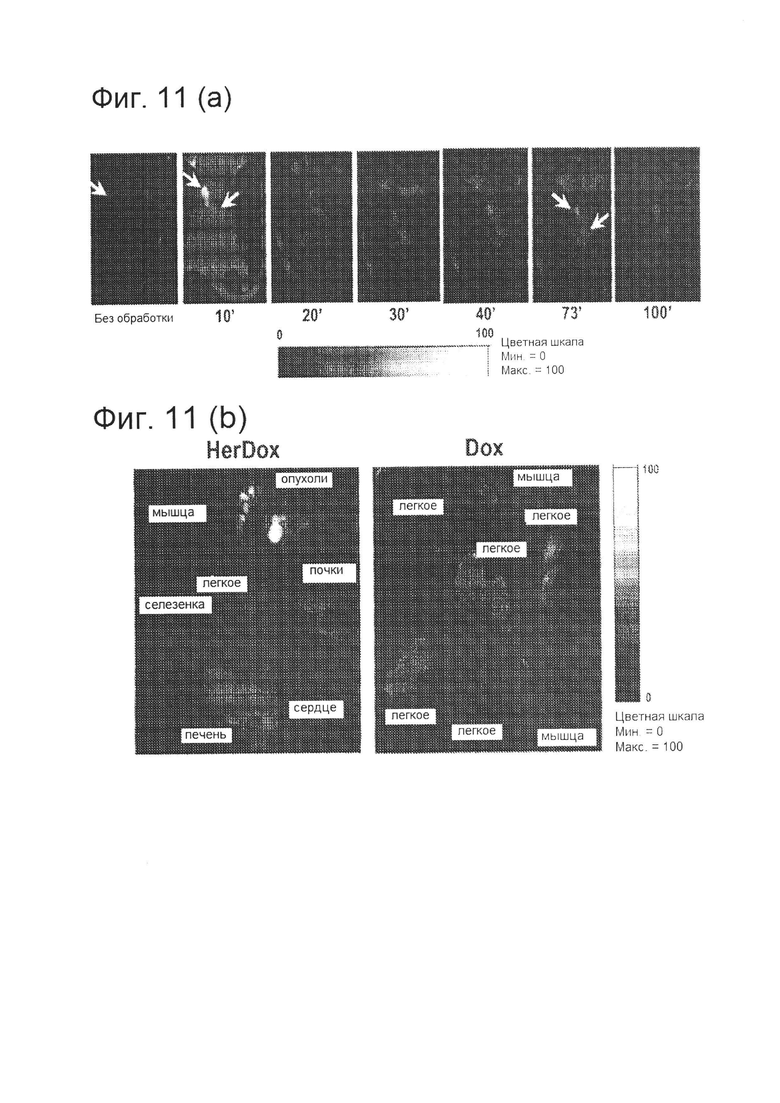
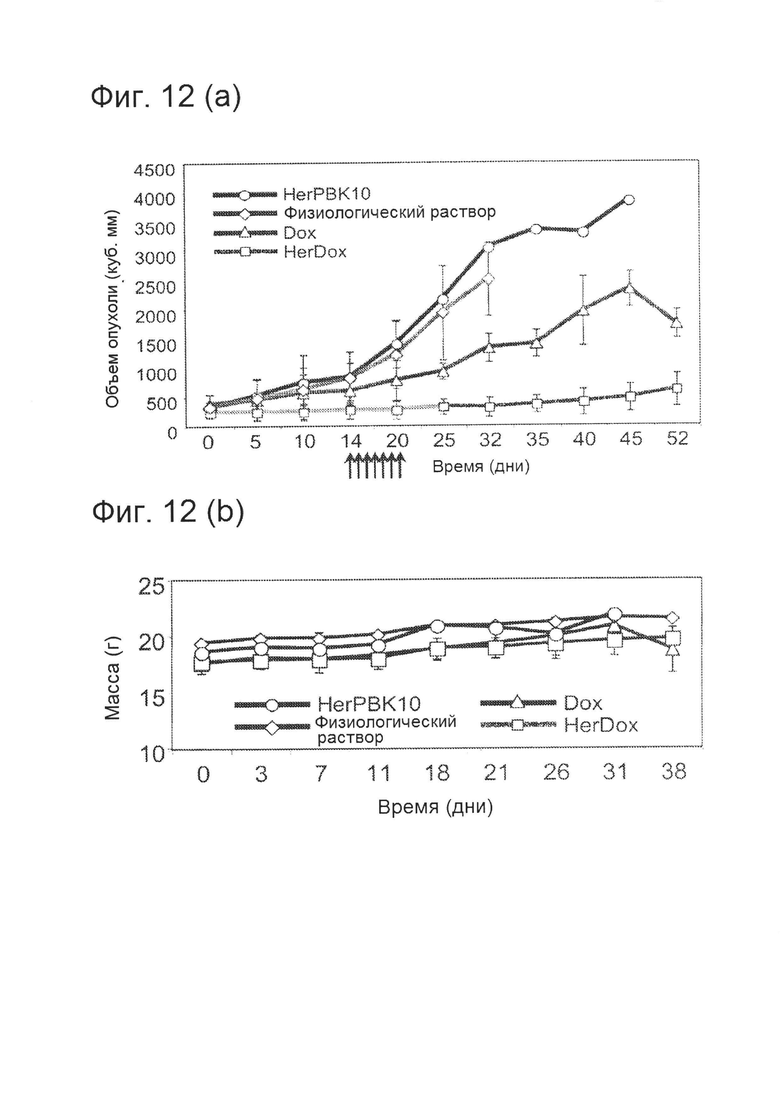

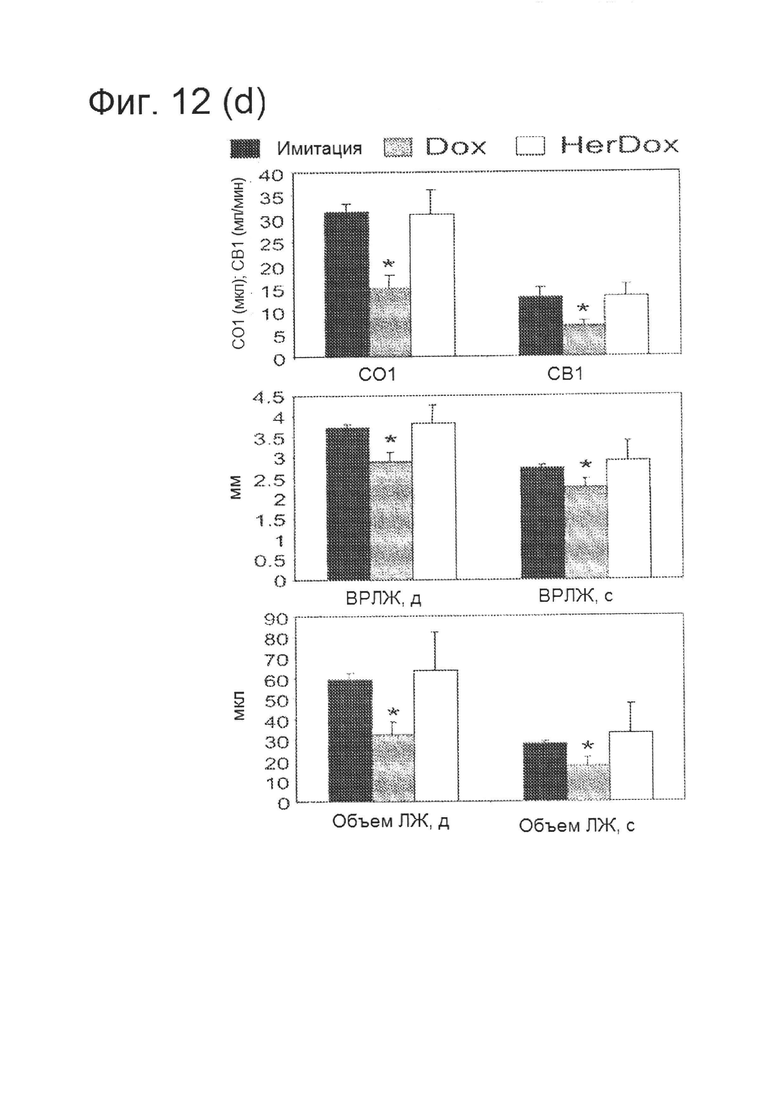
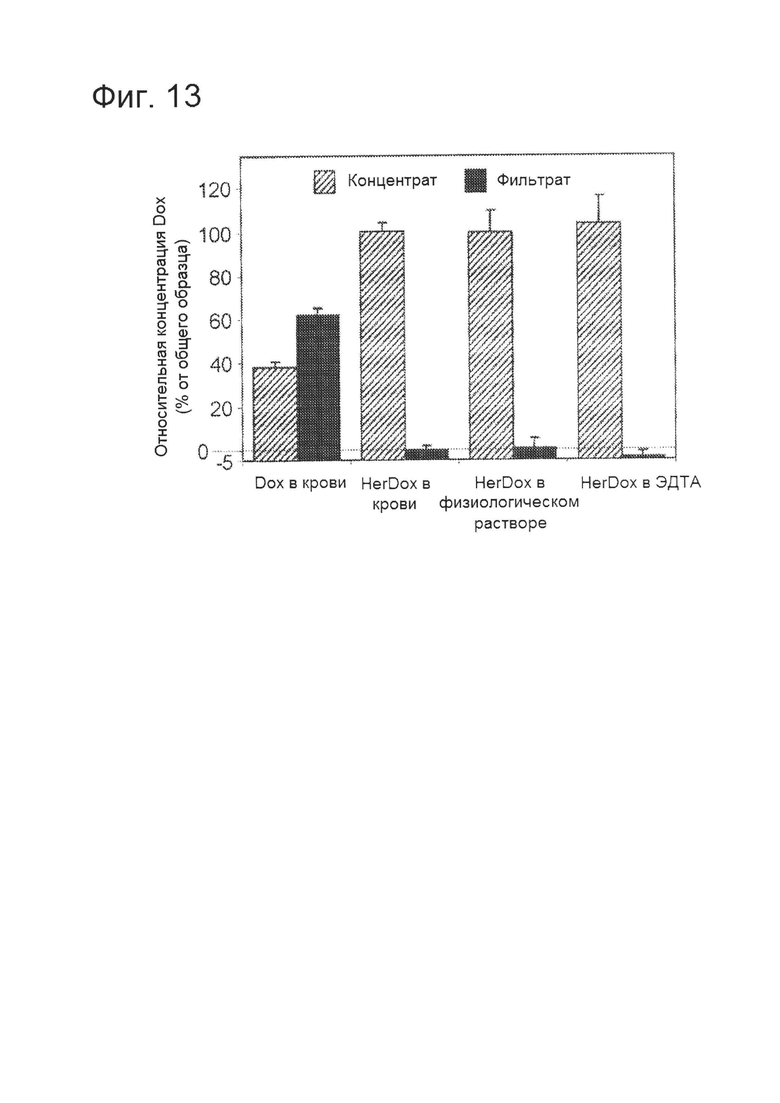
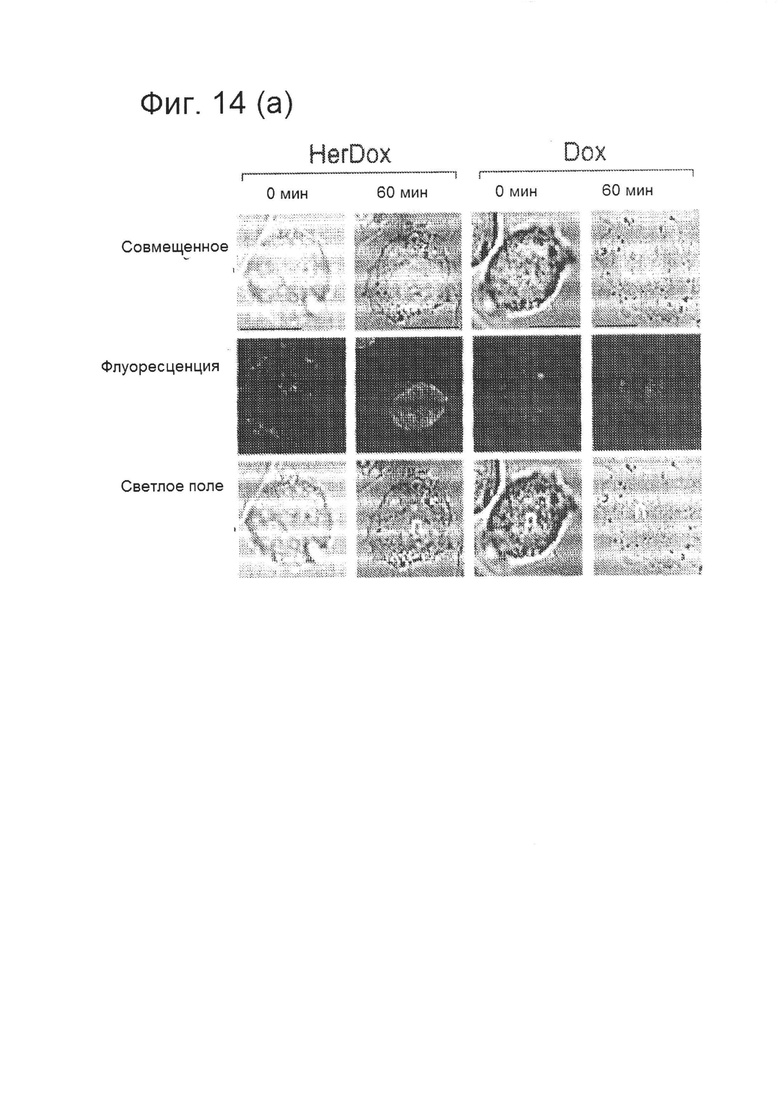
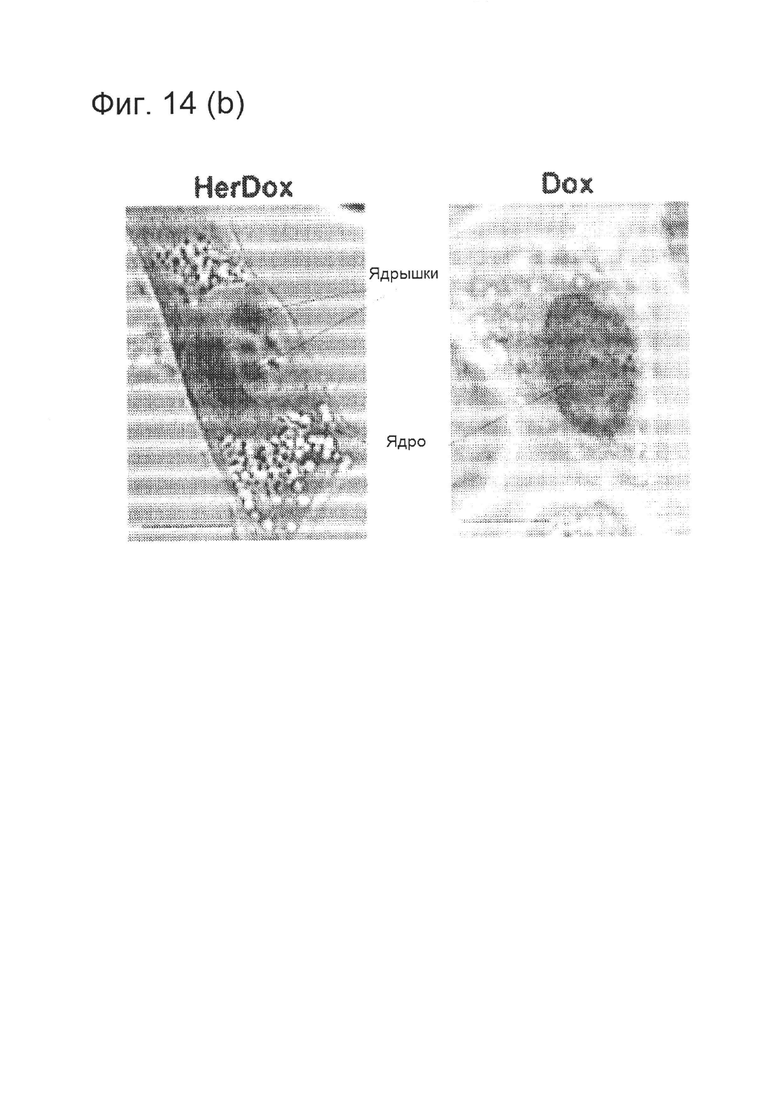
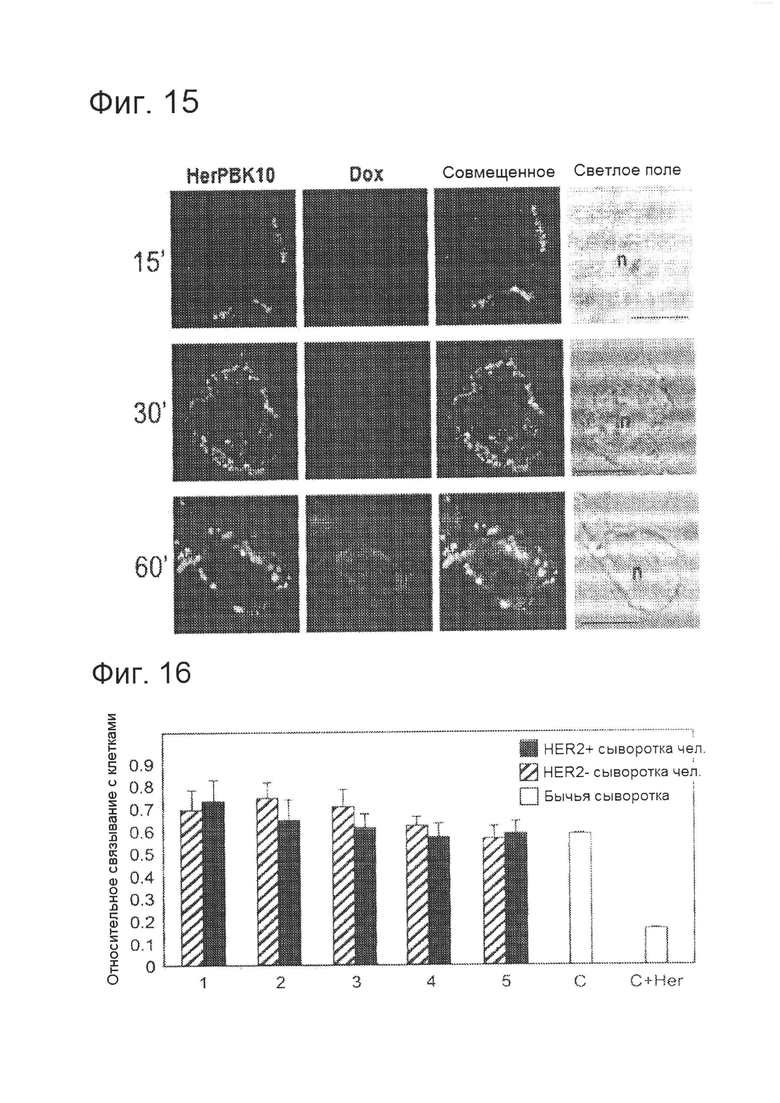
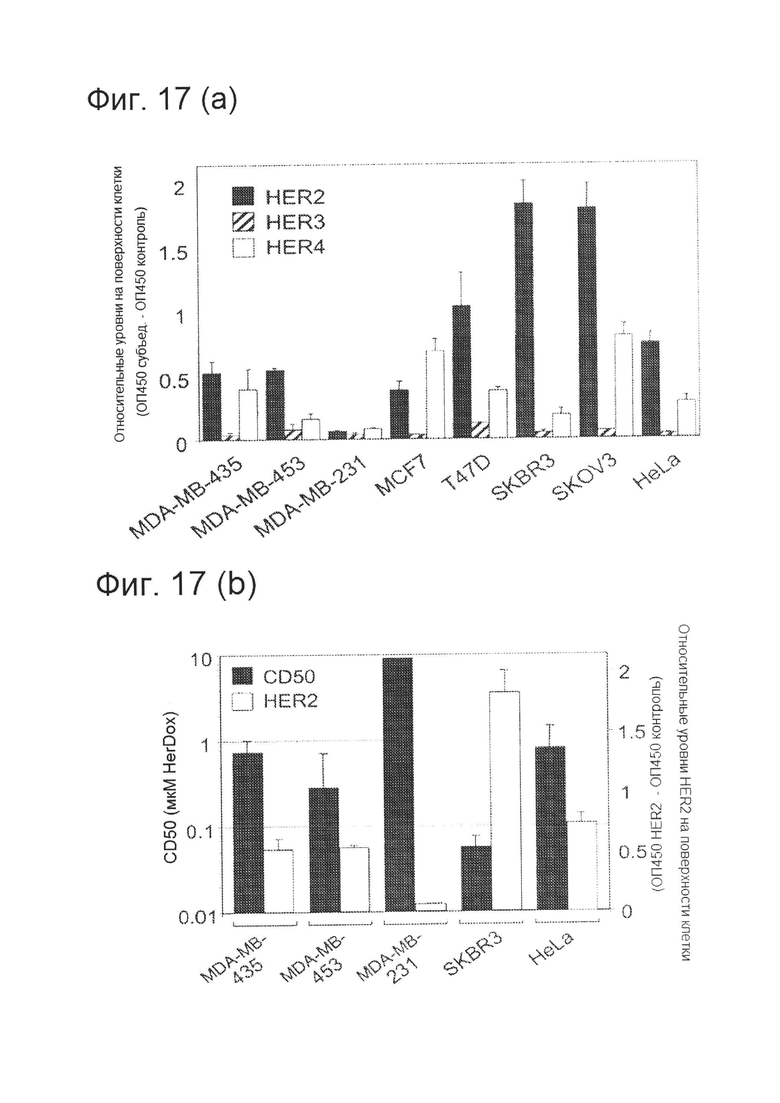
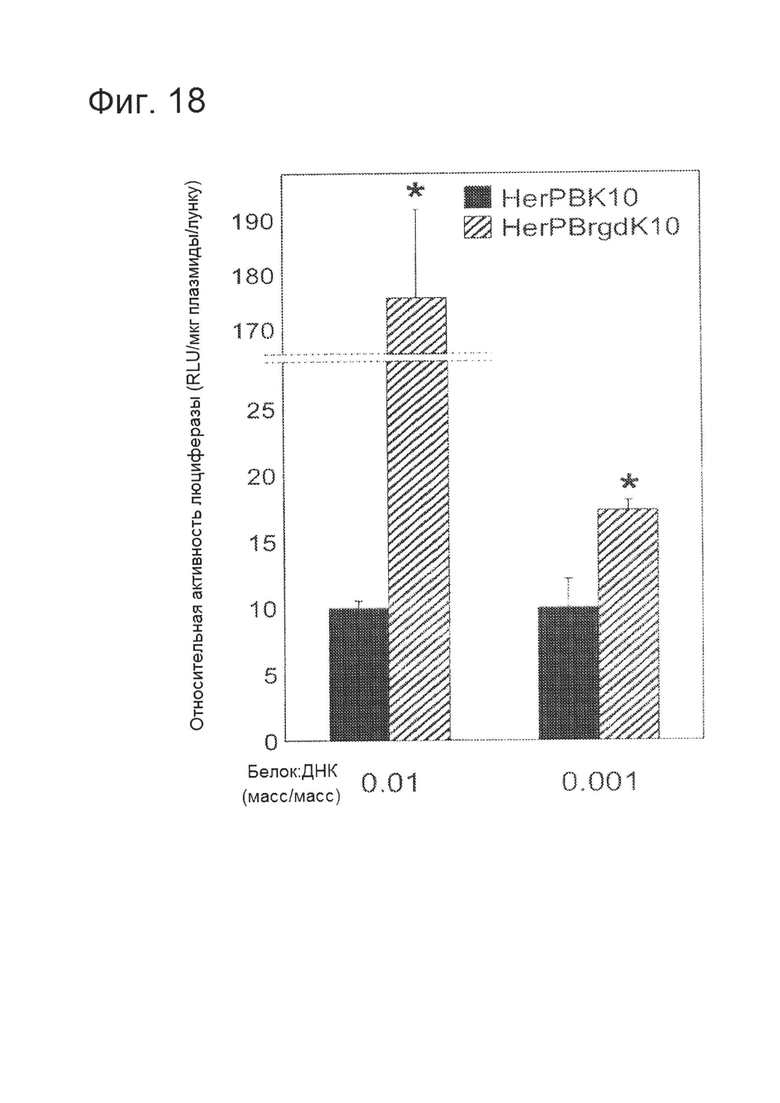
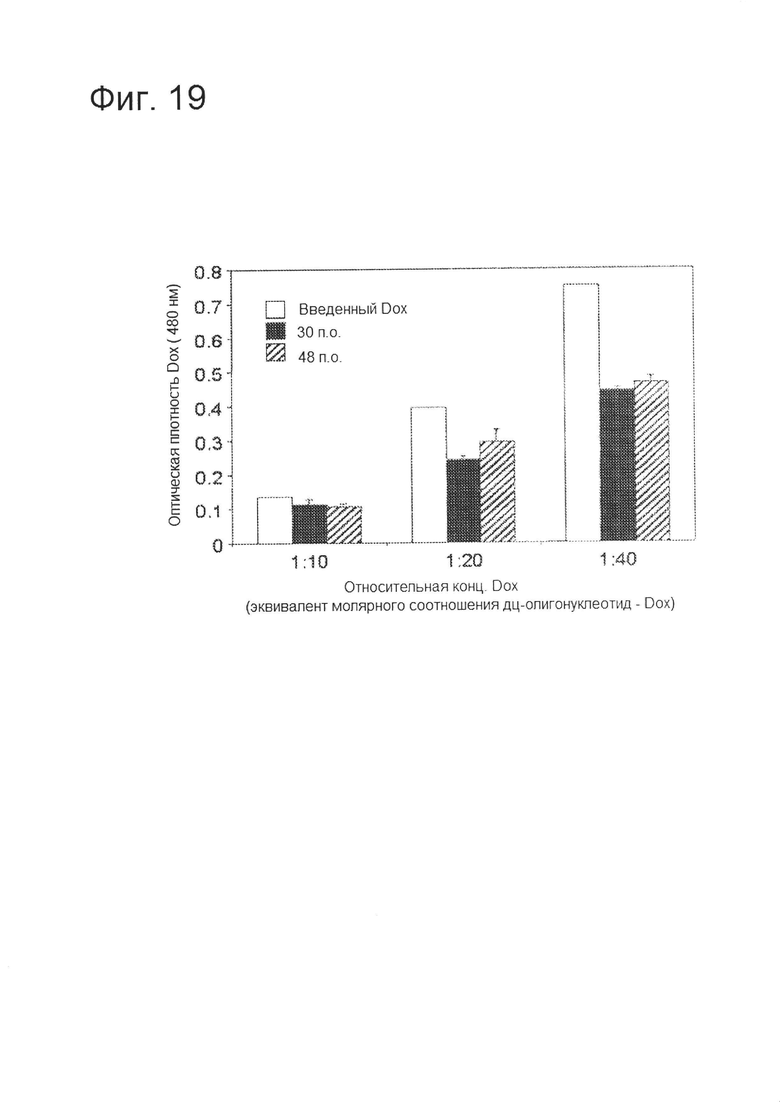
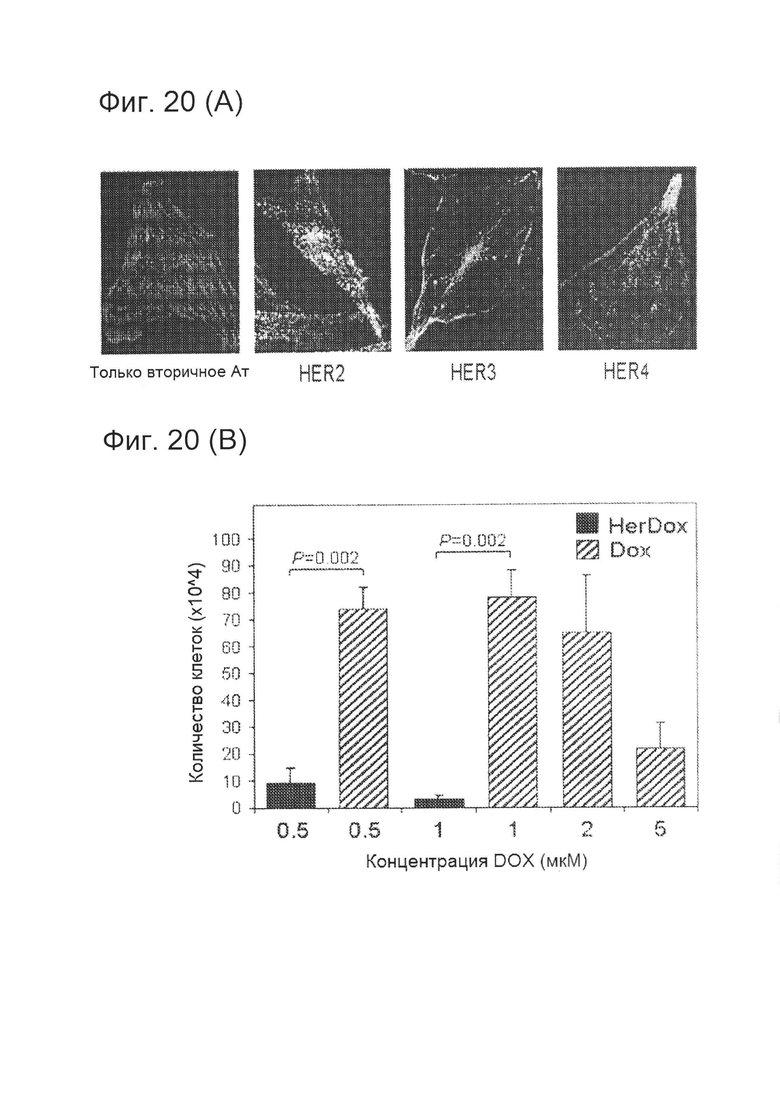
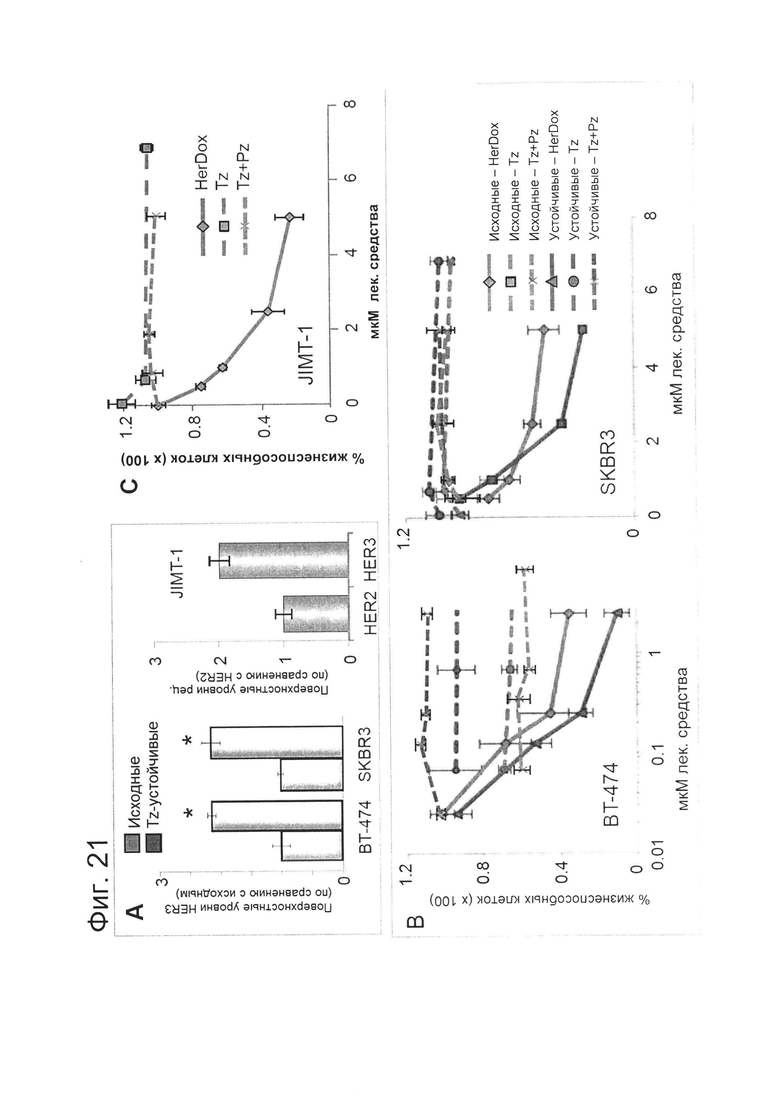
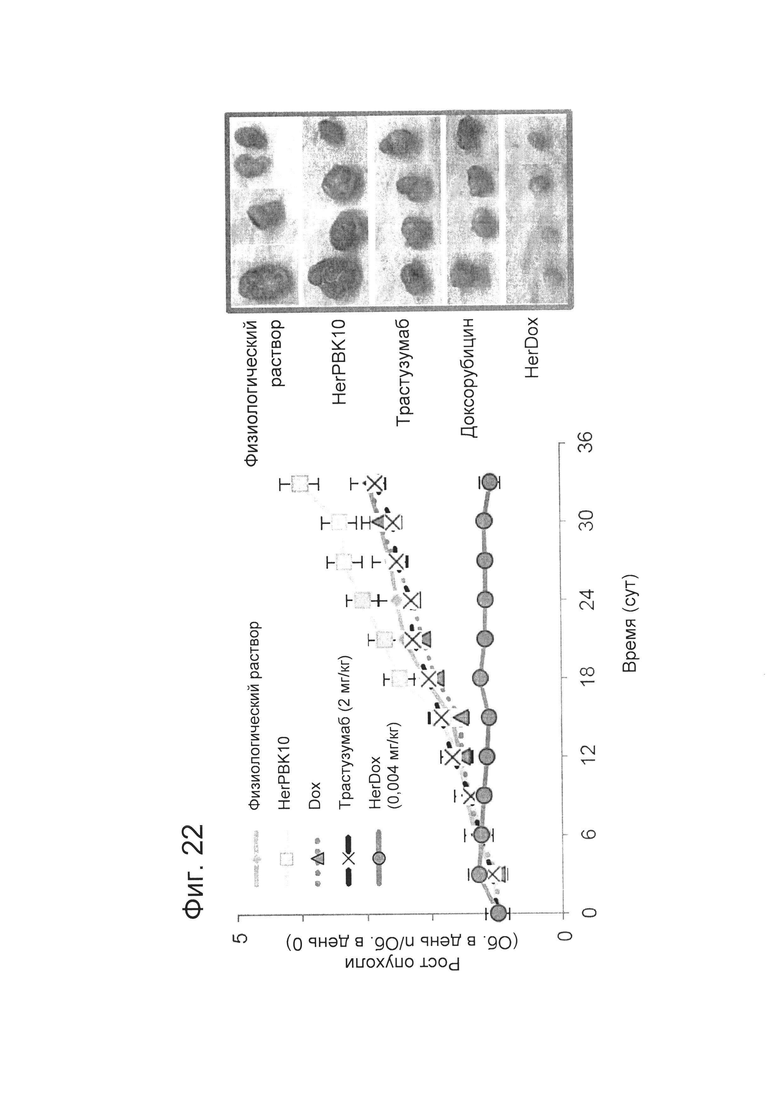

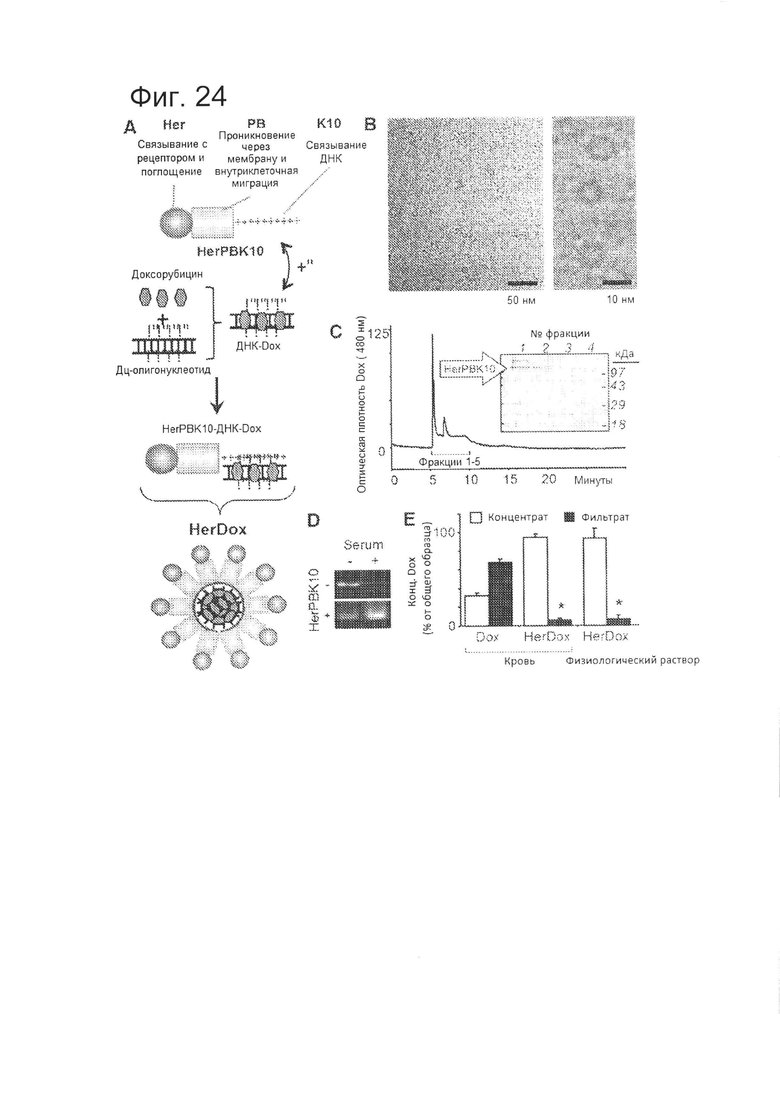

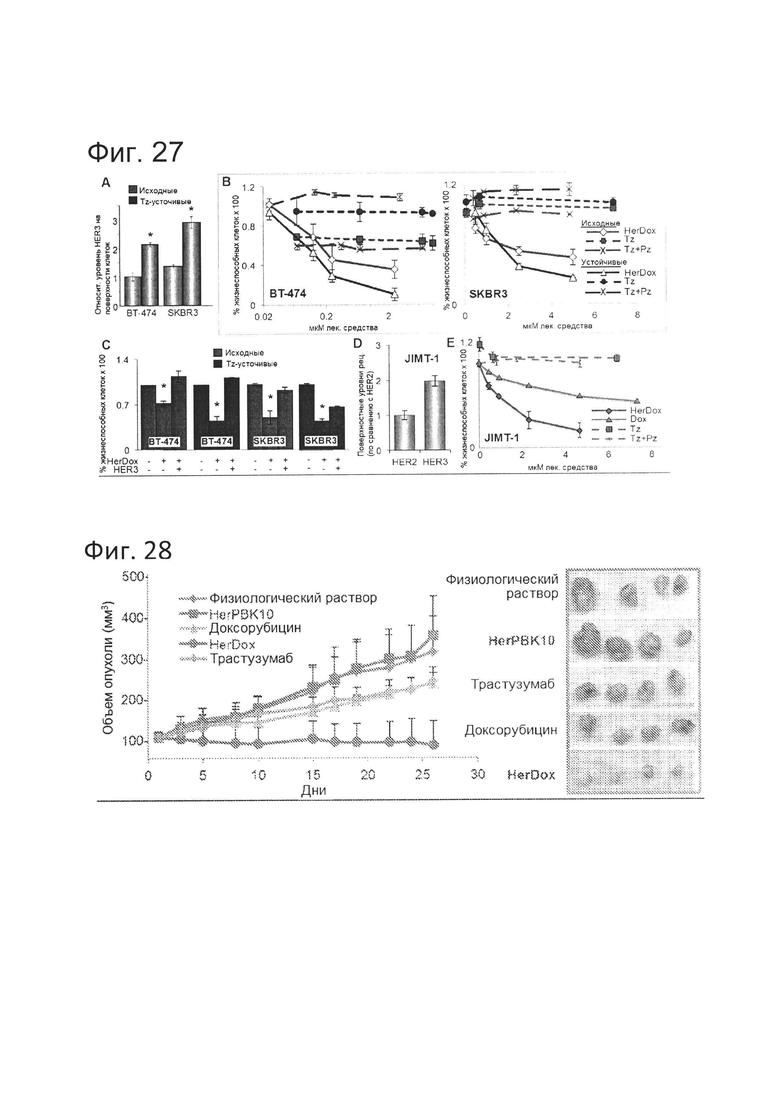
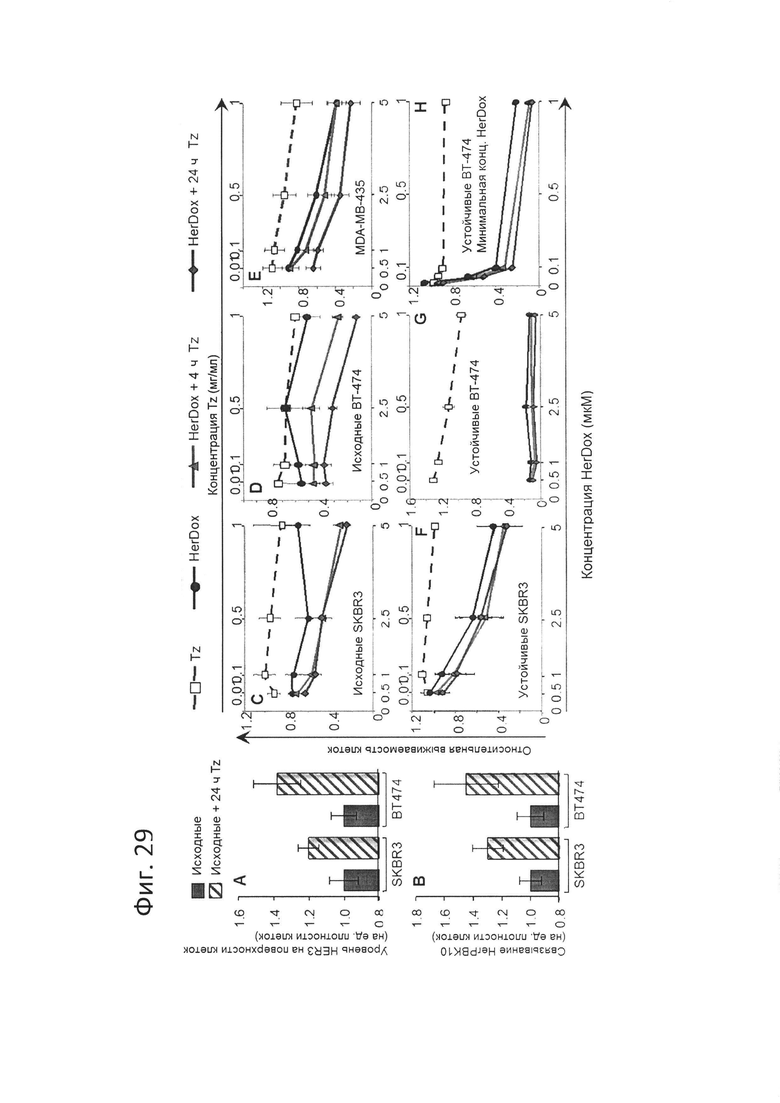
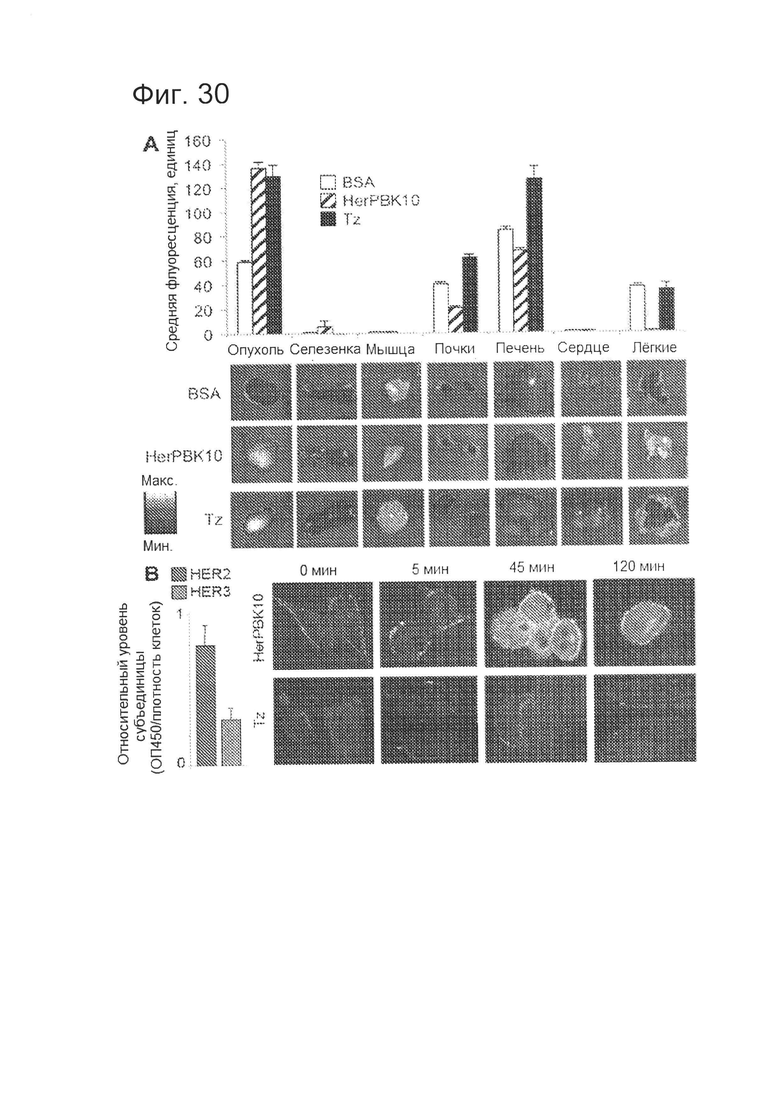
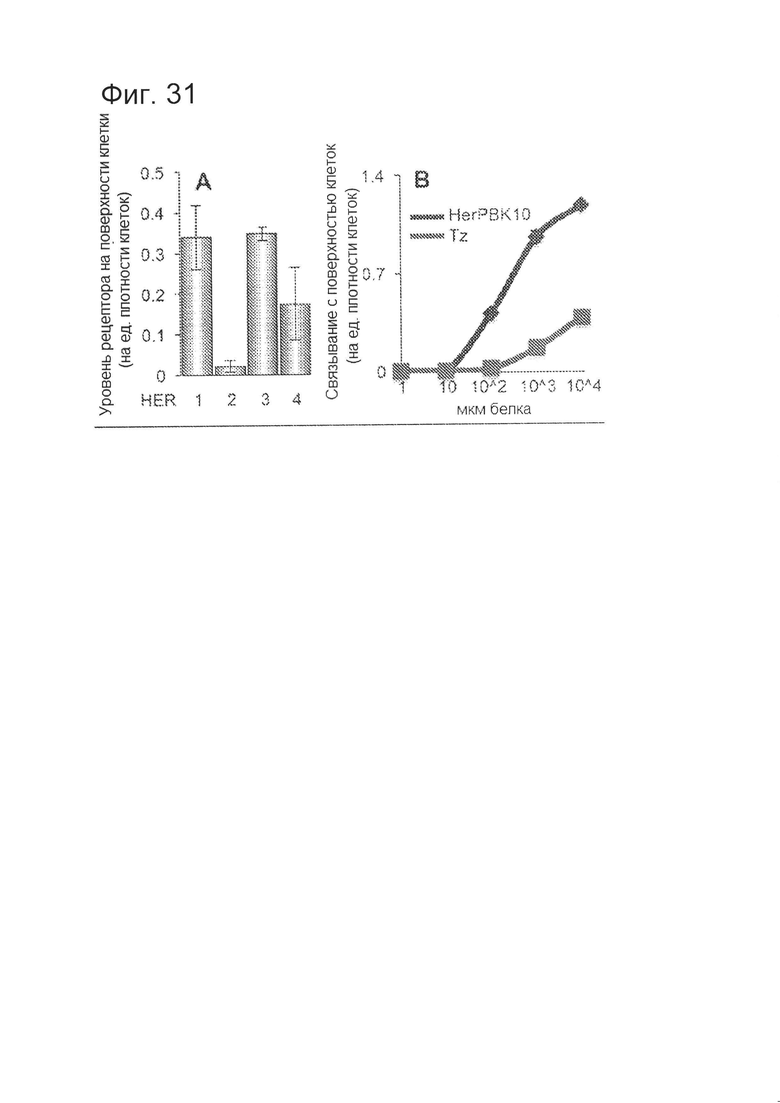
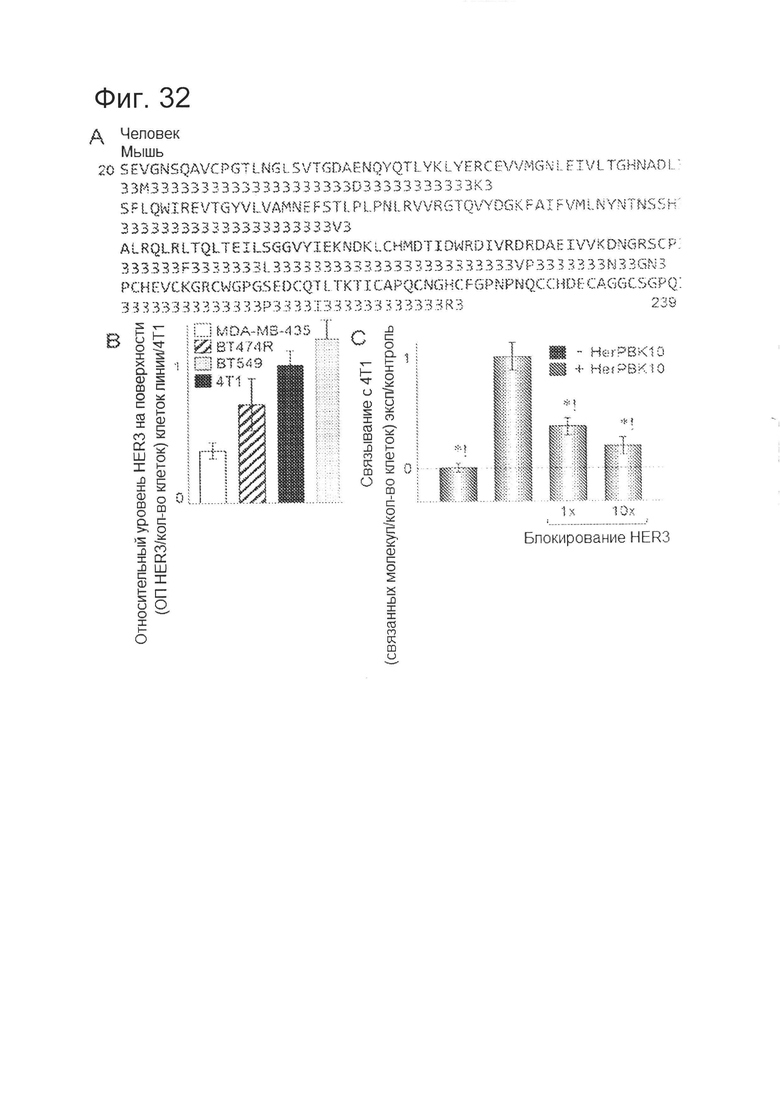
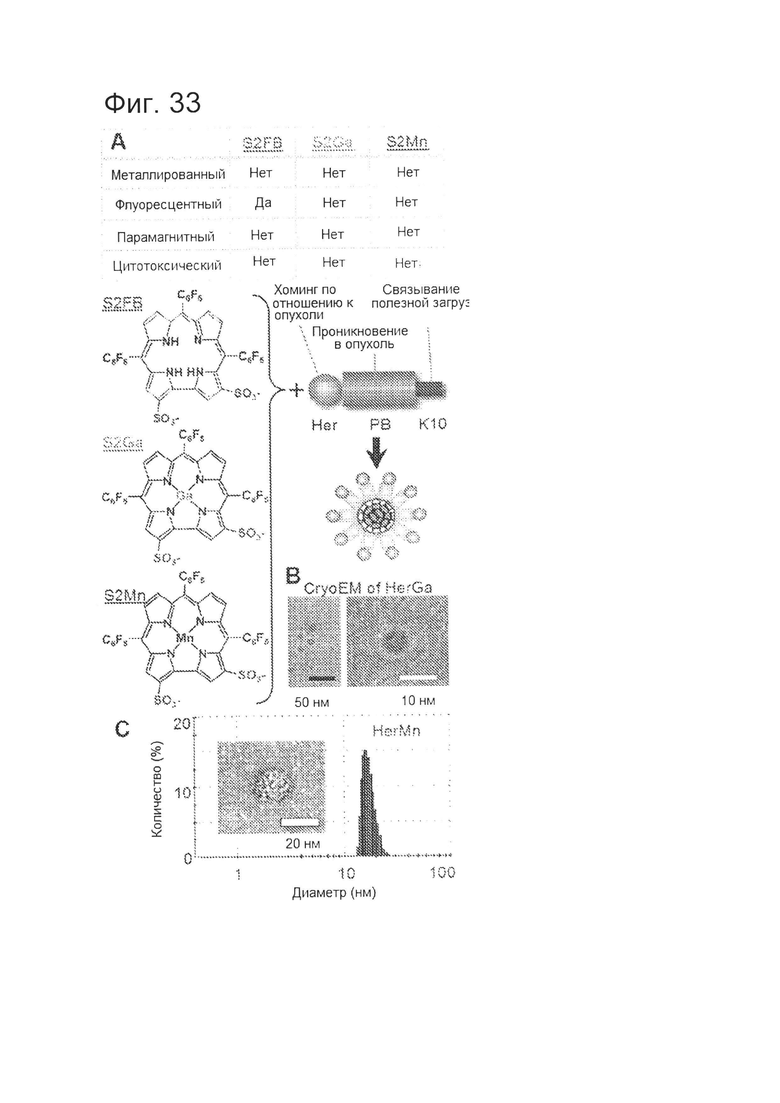
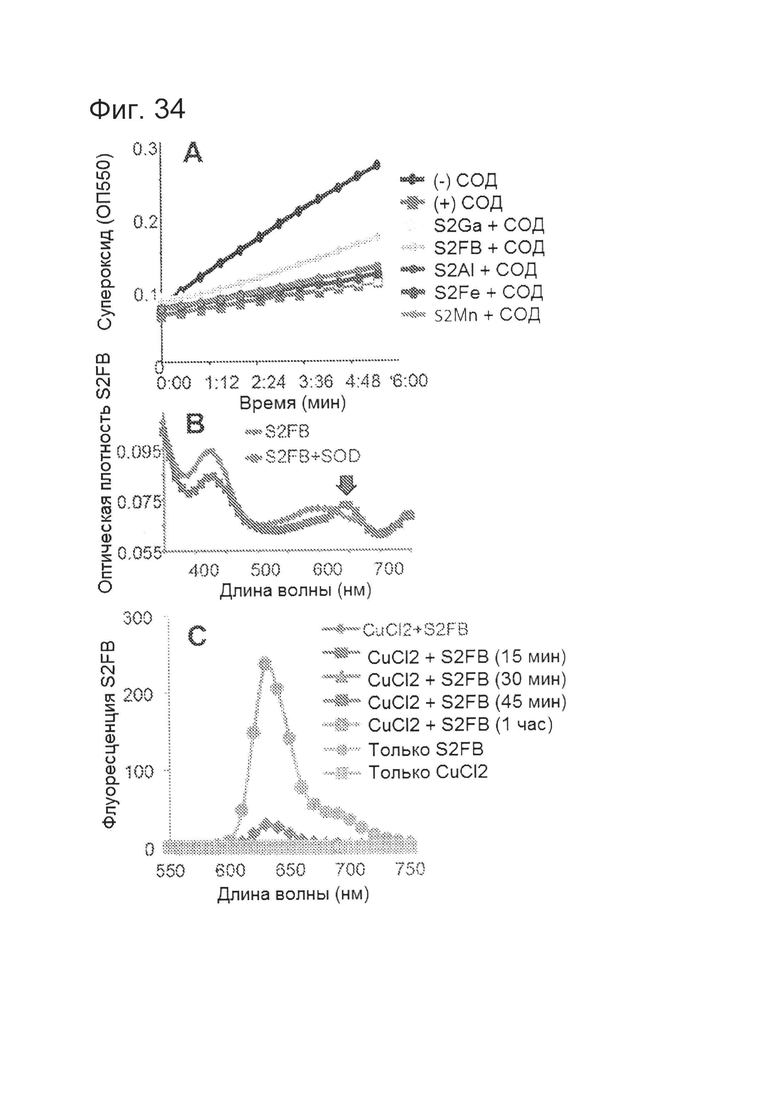
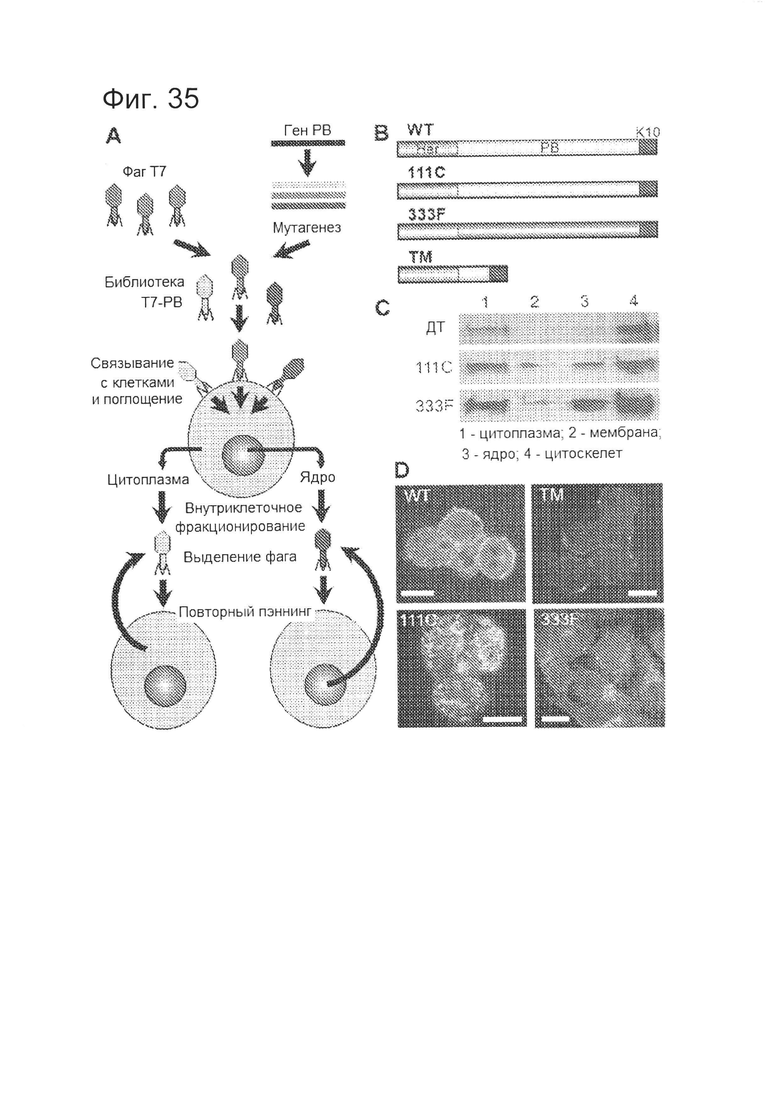
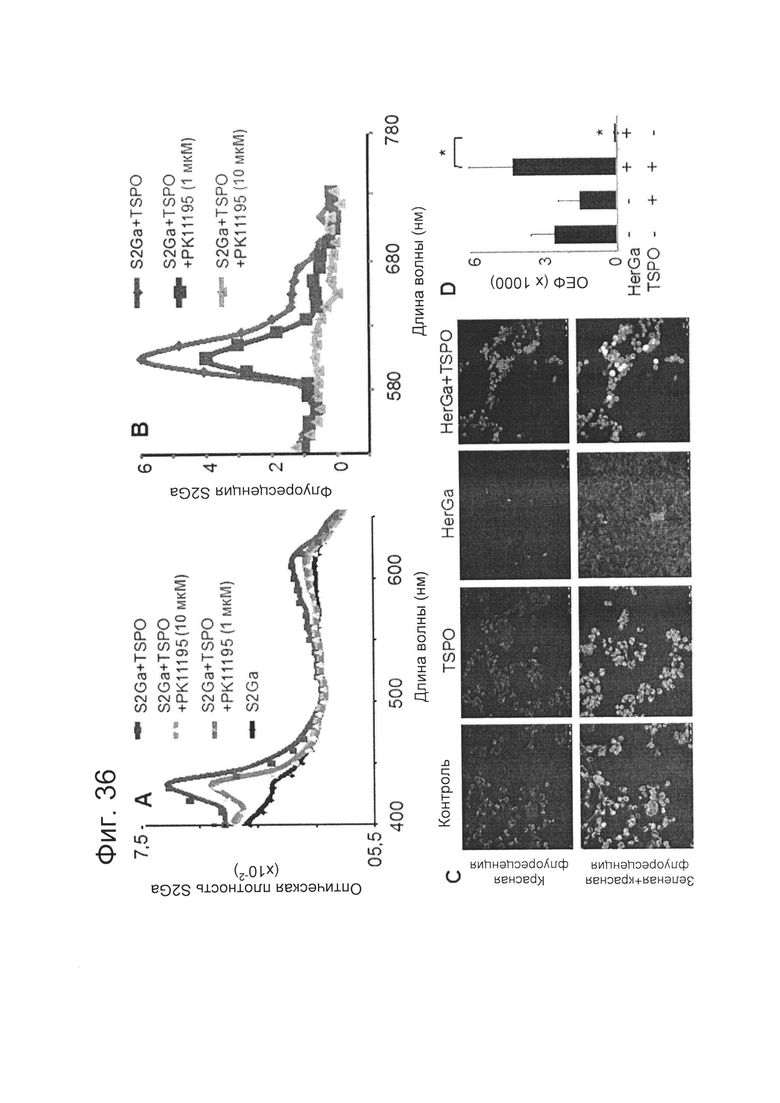
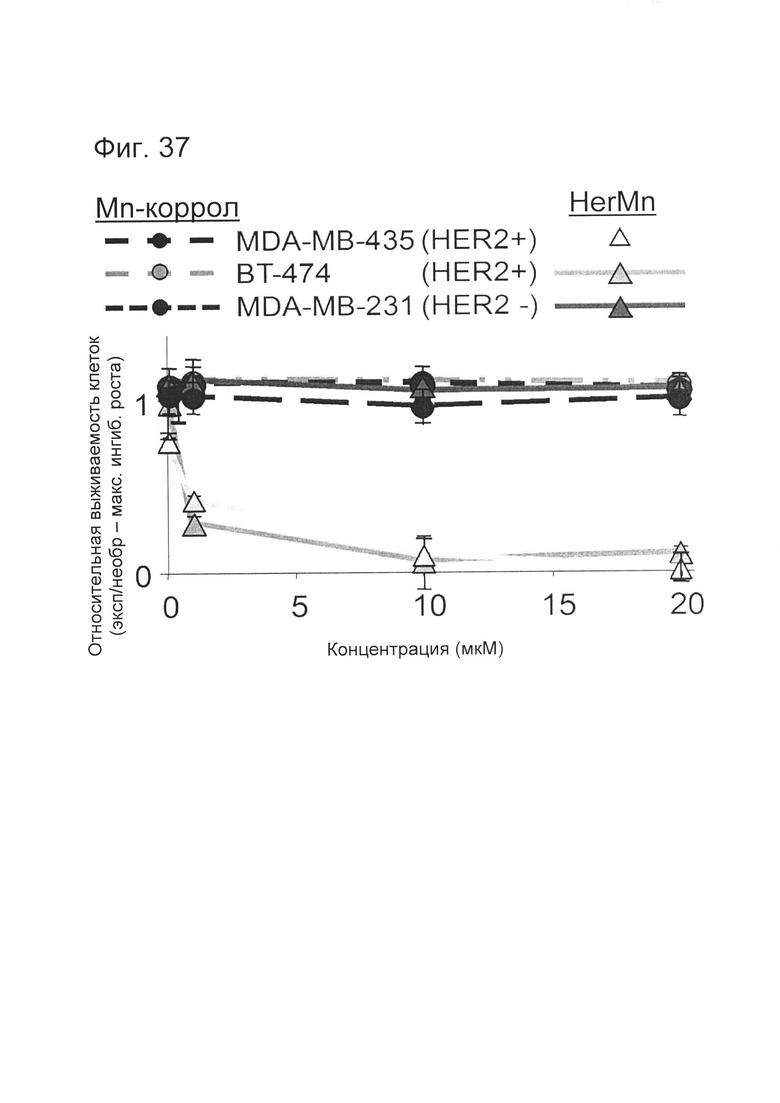
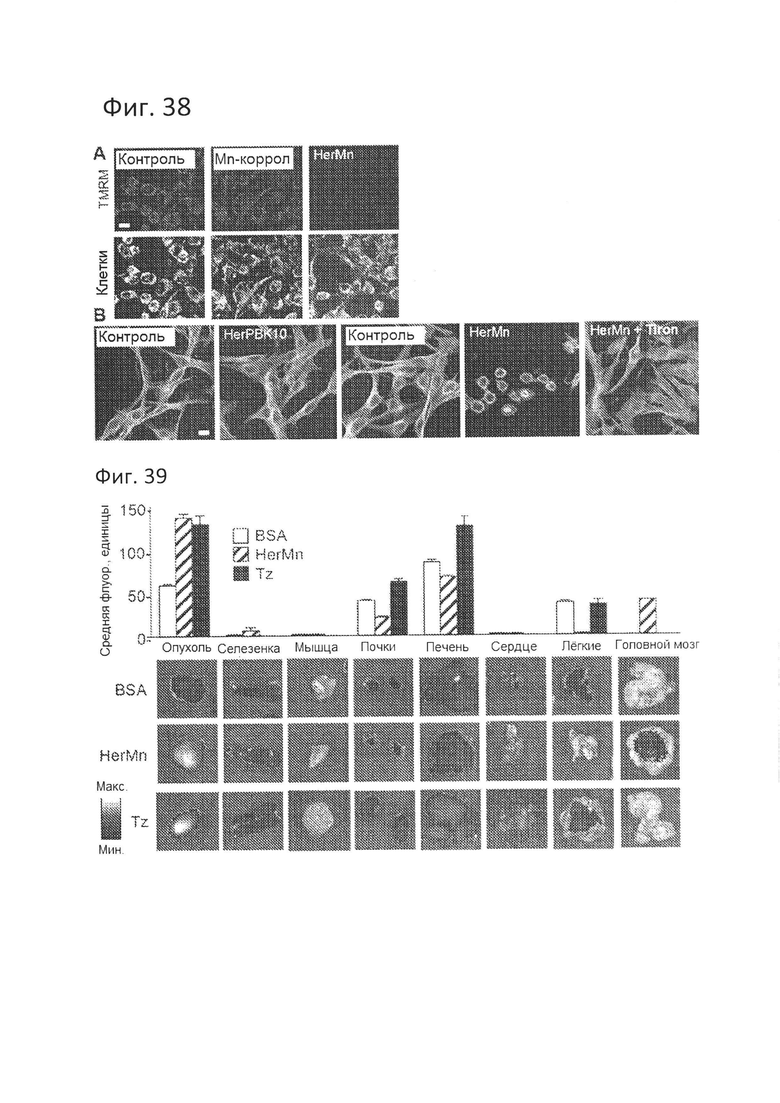
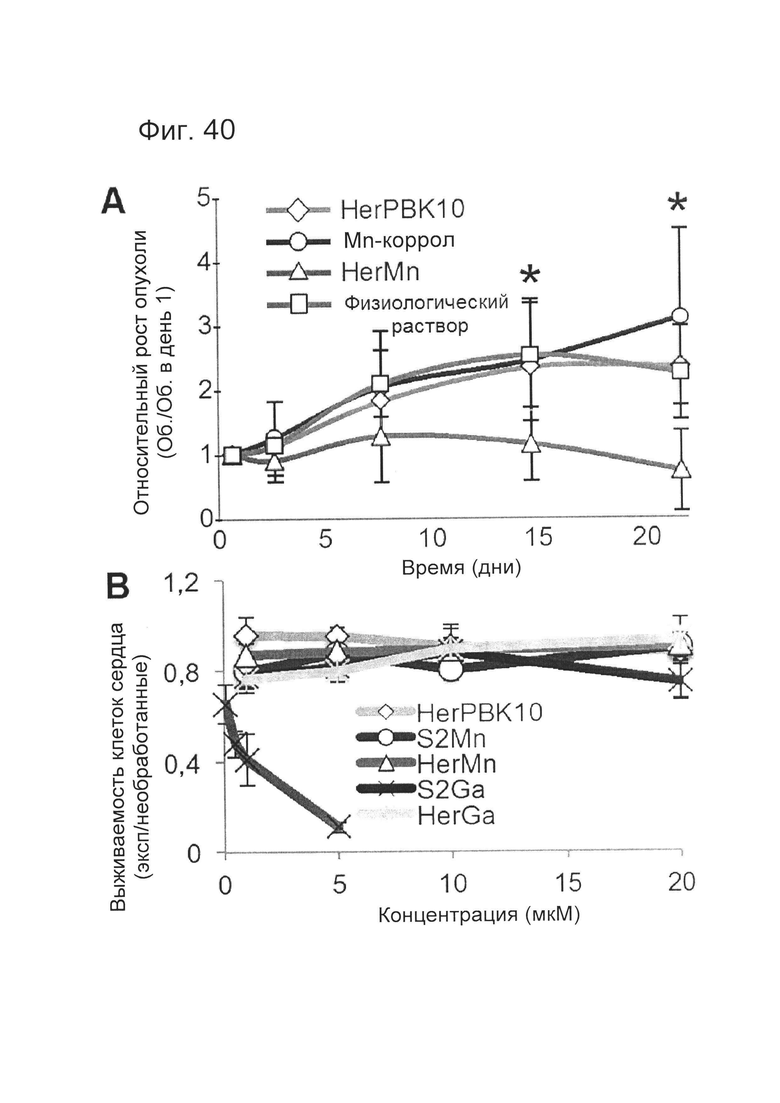
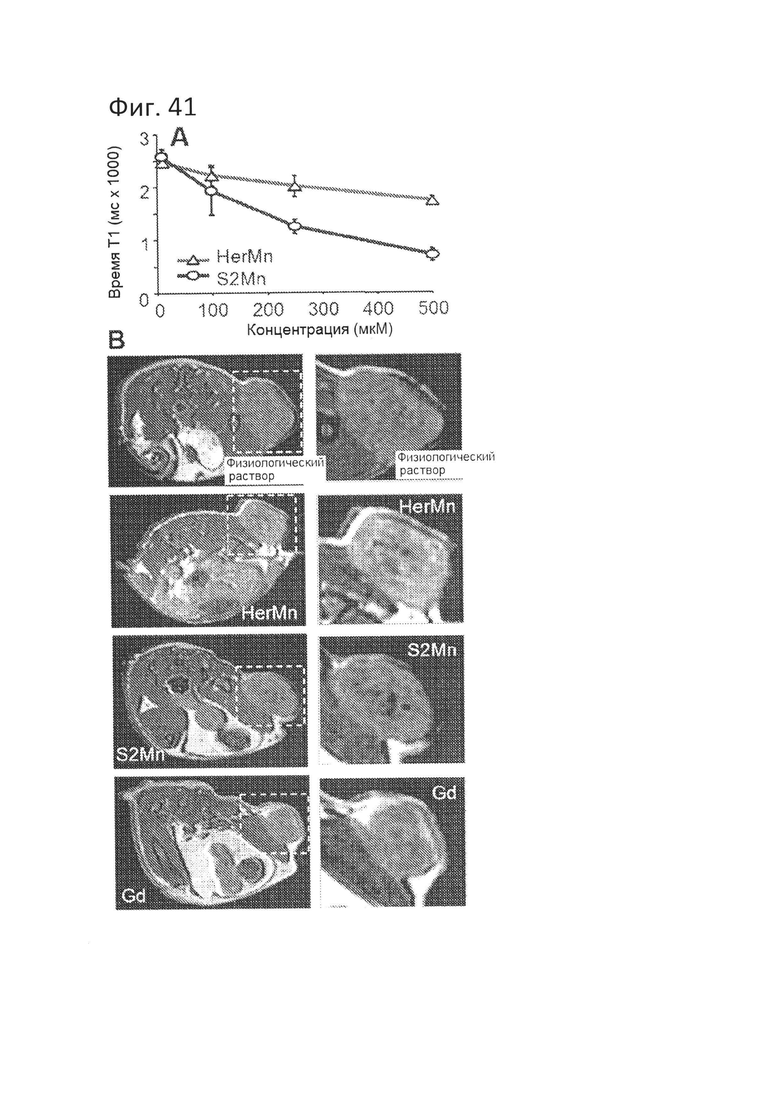
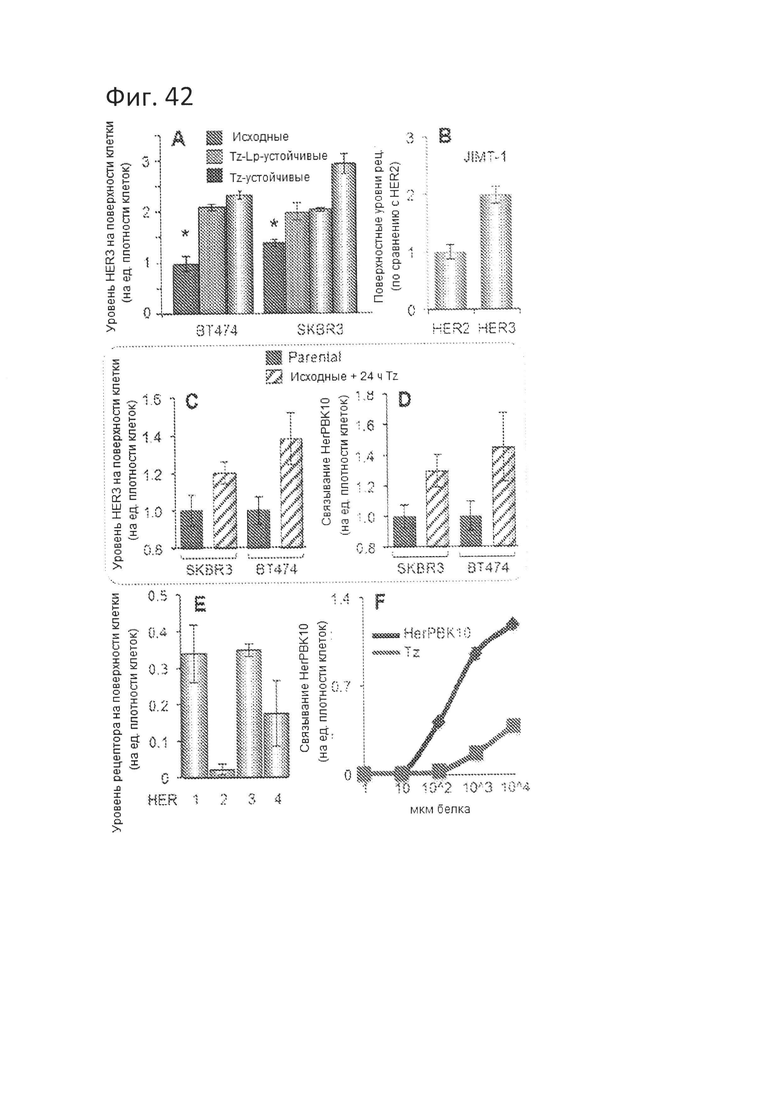
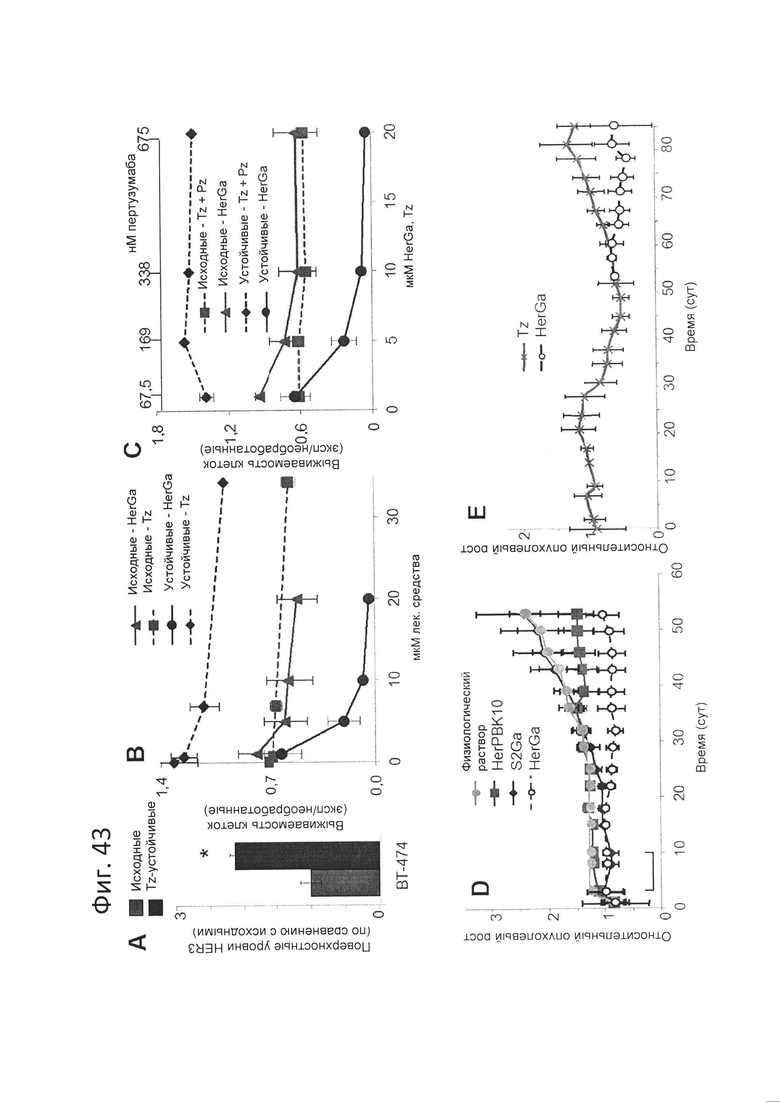
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована при лечении трижды негативного рака молочной железы. Способы по изобретению включают введение молекулы для доставки лекарственного средства (ТНРМЖ), содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен; и молекулу нуклеиновой кислоты, связанную с полипептидом посредством электростатических взаимодействий, и химиотерапевтический агент, нековалентно связанный с молекулой нуклеиновой кислоты, либо молекулы для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен, и коррол, связанный с полипептидом. Использование изобретений позволяет лечить ТНРМЖ за счет связывания полипептида с рецептором НЕR3, который экспрессируется на поверхности клеток, и интернализации этими клетками полипептида со связанным с ним химиотерапевтическим агентом или корролом. 6 н. и 84 з.п. ф-лы, 1 табл., 43 ил., 29 пр.
1. Способ лечения трижды негативного рака молочной железы у пациента, включающий введение пациенту молекулы для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен; и молекулу нуклеиновой кислоты, связанную с полипептидом посредством электростатических взаимодействий, и химиотерапевтический агент, нековалентно связанный с молекулой нуклеиновой кислоты.
2. Способ по п. 1, отличающийся тем, что молекула нуклеиновой кислоты представляет собой двуцепочечный олигонуклеотид.
3. Способ по п. 1, отличающийся тем, что химиотерапевтический агент представляет собой антрациклин.
4. Способ по п. 1, отличающийся тем, что химиотерапевтический агент представляет собой доксорубицин.
5. Способ по п. 1, отличающийся тем, что химиотерапевтический агент интеркалирован в молекулу нуклеиновой кислоты.
6. Способ по п. 1, отличающийся тем, что молекула нуклеиновой кислоты содержит последовательность, которая представляет собой SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9 или их комбинацию.
7. Способ по п. 1, отличающийся тем, что молекула для доставки лекарственного средства представляет собой HerDox.
8. Способ по п. 1, отличающийся тем, что положительно заряженный домен содержит полилизиновый мотив.
9. Способ по п. 8, отличающийся тем, что полилизиновый мотив представляет собой декализин.
10. Способ по п. 1, отличающийся тем, что полипептид представляет собой HerPBK10.
11. Способ по п. 1, отличающийся тем, что трижды негативный рак молочной железы сверхэкспрессирует HER3.
12. Способ по п. 1, отличающийся тем, что трижды негативный рак молочной железы представляет собой метастатический рак.
13. Способ по п. 1, отличающийся тем, что пациент является человеком.
14. Способ лечения трижды негативного рака молочной железы у пациента, включающий введение пациенту молекулы для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен, и коррол, связанный с полипептидом.
15. Способ по п. 14, отличающийся тем, что коррол является металлированным корролом.
16. Способ по п. 14, отличающийся тем, что коррол содержит железо, марганец или галлий.
17. Способ по п. 14, отличающийся тем, что коррол является сульфонированным корролом.
18. Способ по п. 15, отличающийся тем, что коррол является сульфонированным корролом.
19. Способ по п. 16, отличающийся тем, что коррол является сульфонированным корролом.
20. Способ по п. 14, отличающийся тем, что молекула для доставки лекарственного средства представляет собой HerMn, HerFe или HerGa.
21. Способ по п. 14, отличающийся тем, что положительно заряженный домен содержит полилизиновый мотив.
22. Способ по п. 21, отличающийся тем, что полилизиновый мотив представляет собой декализин.
23. Способ по п. 14, отличающийся тем, что полипептид представляет собой HerPBK10.
24. Способ по п. 14, отличающийся тем, что трижды негативный рак молочной железы сверхэкспрессирует HER3.
25. Способ по п. 14, отличающийся тем, что трижды негативный рак молочной железы представляет собой метастатический рак.
26. Способ по п. 14, отличающийся тем, что пациент является человеком.
27. Способ индукции апоптоза в HER2+ клетках рака молочной железы, устойчивых к терапевтическому средству против HER2, включающий приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен; и молекулу нуклеиновой кислоты, связанную с полипептидом посредством электростатических взаимодействий, и химиотерапевтический агент, нековалентно связанный с молекулой нуклеиновой кислоты.
28. Способ по п. 27, отличающийся тем, что молекула нуклеиновой кислоты представляет собой двуцепочечный олигонуклеотид.
29. Способ по п. 27, отличающийся тем, что химиотерапевтический агент представляет собой антрациклин.
30. Способ по п. 27, отличающийся тем, что химиотерапевтический агент представляет собой доксорубицин.
31. Способ по п. 27, отличающийся тем, что химиотерапевтический агент интекралирован с молекулой нуклеиновой кислоты.
32. Способ по п. 27, отличающийся тем, что молекула нуклеиновой кислоты содержит последовательность, которая представляет собой SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9 или их комбинацию.
33. Способ по п. 27, отличающийся тем, что молекула для доставки лекарственного средства представляет собой HerDox.
34. Способ по п. 27, отличающийся тем, что положительно заряженный домен содержит полилизиновый мотив.
35. Способ по п. 34, отличающийся тем, что полилизиновый мотив представляет собой декализин.
36. Способ по п. 27, отличающийся тем, что полипептид представляет собой HerPBK10.
37. Способ по п. 27, отличающийся тем, что приведение в контакт происходит in vitro.
38. Способ по п. 27, отличающийся тем, что приведение в контакт происходит in vivo.
39. Способ индукции апоптоза в HER2+ клетках рака молочной железы, устойчивых к терапевтическому средству против HER2, включающий приведение HER2+ клетки рака молочной железы, устойчивой к терапевтическому средству против HER2, в контакт с молекулой для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен, и коррол, связанный с полипептидом.
40. Способ по п. 39, отличающийся тем, что коррол является металлированным корролом.
41. Способ по п. 39, отличающийся тем, что коррол содержит железо, марганец или галлий.
42. Способ по п. 39, отличающийся тем, что коррол является сульфонированным корролом.
43. Способ по п. 40, отличающийся тем, что коррол является сульфонированным корролом.
44. Способ по п. 41, отличающийся тем, что коррол является сульфонированным корролом.
45. Способ по п. 39, отличающийся тем, что молекула для доставки лекарственного средства представляет собой HerMn, HerFe или HerGa.
46. Способ по п. 39, отличающийся тем, что положительно заряженный домен содержит полилизиновый мотив.
47. Способ по п. 46, отличающийся тем, что полилизиновый мотив представляет собой декализин.
48. Способ по п. 39, отличающийся тем, что полипептид представляет собой HerPBK10.
49. Способ по п. 39, отличающийся тем, что приведение в контакт происходит in vitro.
50. Способ по п. 39, отличающийся тем, что приведение в контакт происходит in vivo.
51. Способ лечения рака, устойчивого к терапевтическому средству против HER2, у пациента, включающий введение пациенту молекулы для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен, и коррол, связанный с полипептидом.
52. Способ по п. 51, отличающийся тем, что коррол является металлированным корролом.
53. Способ по п. 51, отличающийся тем, что коррол содержит марганец (Mn), железо (Fe) или галлий (Ga).
54. Способ по п. 51, отличающийся тем, что коррол является сульфонированным корролом.
55. Способ по п. 52, отличающийся тем, что коррол является сульфонированным корролом.
56. Способ по п. 53, отличающийся тем, что коррол является сульфонированным корролом.
57. Способ по п. 51, отличающийся тем, что молекула для доставки лекарственного средства представляет собой HerMn, HerFe или HerGa.
58. Способ по п. 51, отличающийся тем, что терапевтическое средство против HER2 включает терапевтическое средство на основе антитела.
59. Способ по п. 58, отличающийся тем, что терапевтическое средство на основе антитела содержит трастузумаб или пертузумаб.
60. Способ по п. 51, отличающийся тем, что терапевтическое средство против HER2 включает терапевтическое средство на основе низкомолекулярного соединения.
61. Способ по п. 60, отличающийся тем, что терапевтическое средство на основе низкомолекулярного соединения содержит лапатиниб.
62. Способ по п. 51, отличающийся тем, что положительно заряженный домен содержит полилизиновый мотив.
63. Способ по п. 62, отличающийся тем, что полилизиновый мотив представляет собой декализин.
64. Способ по п. 51, отличающийся тем, что полипептид представляет собой HerPBK10.
65. Способ по п. 51, отличающийся тем, что рак, устойчивый к терапевтическому средству против HER2, представляет собой HER2+ рак молочной железы, устойчивый к терапевтическому средству против HER2.
66. Способ по п. 65, отличающийся тем, что HER2+ рак молочной железы характеризуется более высоким уровнем поверхностного HER3, чем уровень поверхностного HER3 у HER2+ рака молочной железы, реагирующего на лечение.
67. Способ по п. 66, отличающийся тем, что HER2+ рак молочной железы по своей природе устойчив к терапевтическому средству против HER2.
68. Способ по п. 66, отличающийся тем, что HER2+ рак молочной железы обладает приобретенной устойчивостью к терапевтическому средству против HER2.
69. Способ по п. 51, дополнительно включающий совместное введение терапевтического агента против HER2 с молекулой для доставки лекарственного средства.
70. Способ по п. 51, отличающийся тем, что пациент является человеком.
71. Способ лечения рака, устойчивого к терапевтическому средству против HER2, у пациента, включающий введение пациенту молекулы для доставки лекарственного средства, содержащей полипептид, который содержит рецепторсвязывающий домен херегулина-α, сегмент пентонового основания и положительно заряженный домен; и молекулу нуклеиновой кислоты, связанную с полипептидом посредством электростатических взаимодействий, и химиотерапевтический агент, нековалентно связанный с молекулой нуклеиновой кислоты.
72. Способ по п. 71, отличающийся тем, что молекула нуклеиновой кислоты представляет собой двуцепочечный олигонуклеотид.
73. Способ по п. 71, отличающийся тем, что химиотерапевтический агент представляет собой антрациклин.
74. Способ по п. 71, отличающийся тем, что химиотерапевтический агент представляет собой доксорубицин.
75. Способ по п. 71, отличающийся тем, что химиотерапевтический агент интекралирован с молекулой нуклеиновой кислоты.
76. Способ по п. 71, отличающийся тем, что молекула нуклеиновой кислоты содержит последовательность, которая представляет собой SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9 или их комбинацию.
77. Способ по п. 71, отличающийся тем, что молекула для доставки лекарственного средства представляет собой HerDox.
78. Способ по п. 71, отличающийся тем, что терапевтическое средство против HER2 включает терапевтическое средство на основе антитела.
79. Способ по п. 78, отличающийся тем, что терапевтическое средство на основе антитела содержит трастузумаб или пертузумаб.
80. Способ по п. 71, отличающийся тем, что терапевтическое средство против HER2 включает терапевтическое средство на основе низкомолекулярного соединения.
81. Способ по п. 80, отличающийся тем, что терапевтическое средство на основе низкомолекулярного соединения содержит лапатиниб.
82. Способ по п. 71, отличающийся тем, что положительно заряженный домен содержит полилизиновый мотив.
83. Способ по п. 82, отличающийся тем, что полилизиновый мотив представляет собой декализин.
84. Способ по п. 71, отличающийся тем, что полипептид представляет собой HerPBK10.
85. Способ по п. 71, отличающийся тем, что рак, устойчивый к терапевтическому средству против HER2, представляет собой HER2+ рак молочной железы, устойчивый к терапевтическому средству против HER2.
86. Способ по п. 85, отличающийся тем, что HER2+ рак молочной железы характеризуется более высоким уровнем поверхностного HER3, чем уровень поверхностного HER3 у HER2+ рака молочной железы, реагирующего на лечение.
87. Способ по п. 86, отличающийся тем, что HER2+ рак молочной железы по своей природе устойчив к терапевтическому средству против HER2.
88. Способ по п. 86, отличающийся тем, что HER2+ рак молочной железы обладает приобретенной устойчивостью к терапевтическому средству против HER2.
89. Способ по п. 71, дополнительно включающий совместное введение терапевтического агента против HER2 с молекулой для доставки лекарственного средства.
90. Способ по п. 71, отличающийся тем, что пациент является человеком.
| US 20100331273 A1, 30.12.2010 | |||
| US 20130065778 A1, 14.03.2013 | |||
| MEDINA-KAUWE LK | |||
| Development of adenovirus capsid proteins for targeted therapeutic delivery//Ther Deliv | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| WANG Y.C | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2019-06-21—Публикация
2015-04-04—Подача