Изобретение относится к области биотехнологии, а именно к способам получения, выделения и очистки рекомбинантных белков, в частности к получению высокоочищенного препарата рекомбинантной эндонуклеазы Serratia marcescens (далее S.marcescens). Основными сферами применения полученной предлагаемым способом рекомбинантной бактериальной эндонуклеазы S.marcescens является включение ее в технологический процесс получения биофармацевтических препаратов, а также для изучения структуры и свойств полинуклеотидов.
Изобретение решает задачу создания способа получения в промышленных объемах высокоочищенной ферментативно активной рекомбинантной эндонуклеазы S.marcescens, пригодной для использования на стадии удаления нуклеиновых кислот в биофармацевтическом производстве.
Изобретение относится также к способу получения препарата рекомбинантной эндонуклеазы S.marcescens, имеющего высокую степень чистоты, гомогенного по целевому продукту, с низким содержанием бактериальных эндотоксинов и белков - хозяина продуцента.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
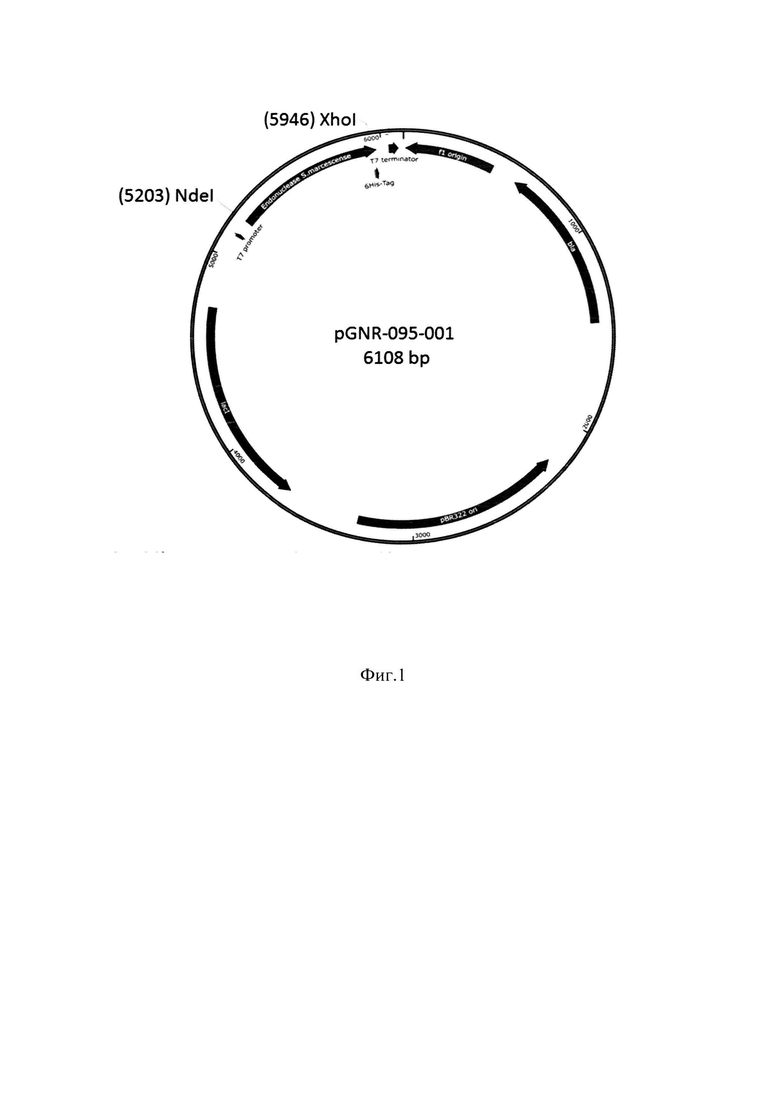
Фиг. 1 Карта плазмиды pGNR-095-001 - экспрессионный вектор для получения эндонуклеазы S.marcescens. Обозначения: Т7 promoter-промотор Т7 РНК-полимеразы; Endonuclease S.marcescens - ген эндонуклеазы, состоящий из 768 нуклеотидных остатков; 6His-Tag- гексагистидиновый таг; Т7- terminator - терминатор Т7 РНК-полимеразы;
f1 origin - f1-ориджин репликации; bla- ген устойчивости к ампициллину; pBR322 ori- рВR322-ориджин репликации; lacI- ген лактозного репрессора; NdeI- сайт узнавания эндонуклеазы рестрикции NdeI;
XhoI- сайт узнавания эндонуклеазы рестрикции Xhol.
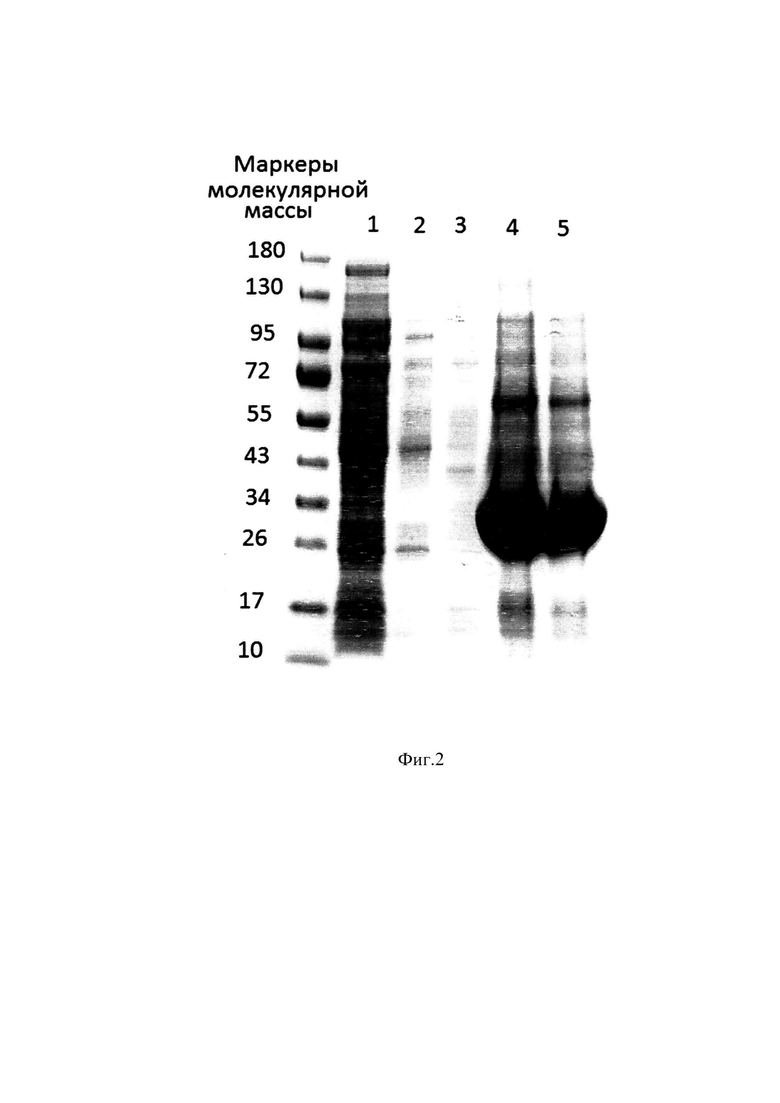
Фиг. 2 Электрофореграмма образцов лизата, отмывного раствора и раствора телец включения.
Образец 1 - Клеточный лизат; Образец 2 - Отмыв 1; Образец 3 - Отмыв 2; Образец 3 - Раствор телец включения; Образец 4 - Раствор телец включения, 2ХР;
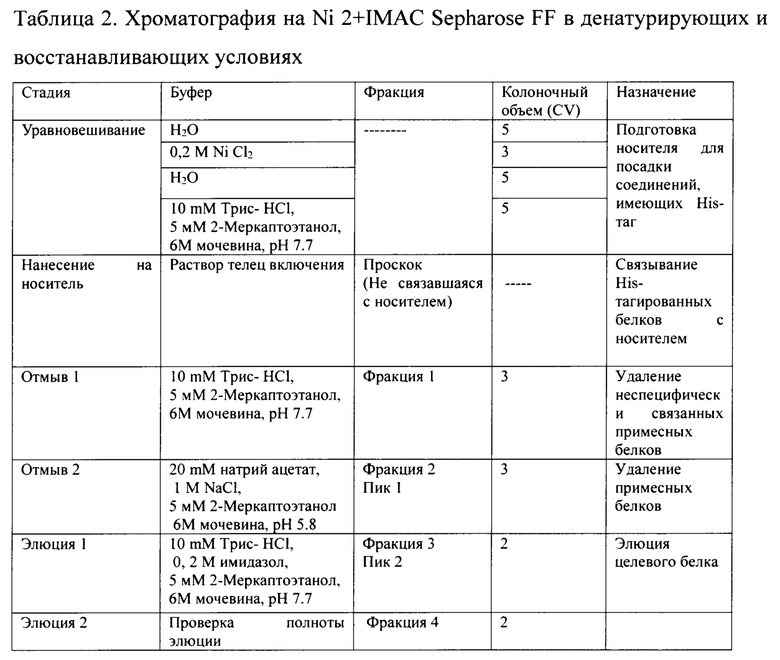
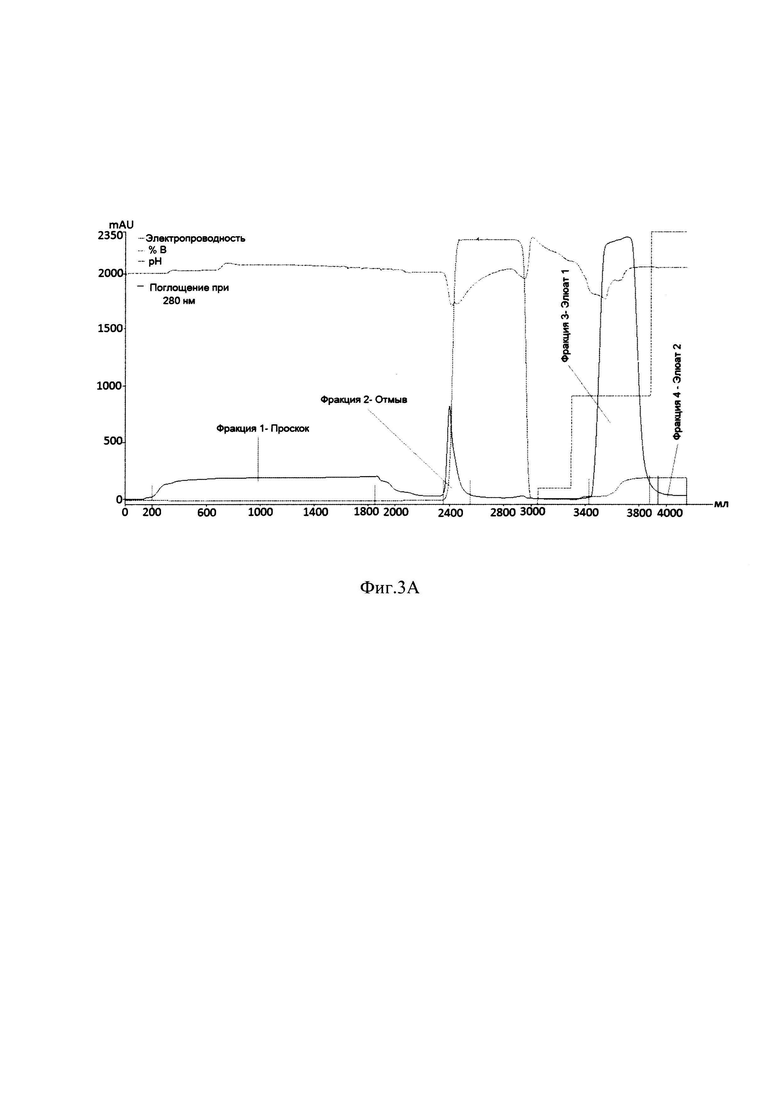
Фиг. 3А Профиль хроматографии с Ni 2+IMAC Sepharose FF в денатурирующих и восстанавливающих условиях
Фракция 1 - Проскок; Фракция 2 - Отмыв; Фракция 3 - Элюат 1; Фракция 4 -Элюат 2;
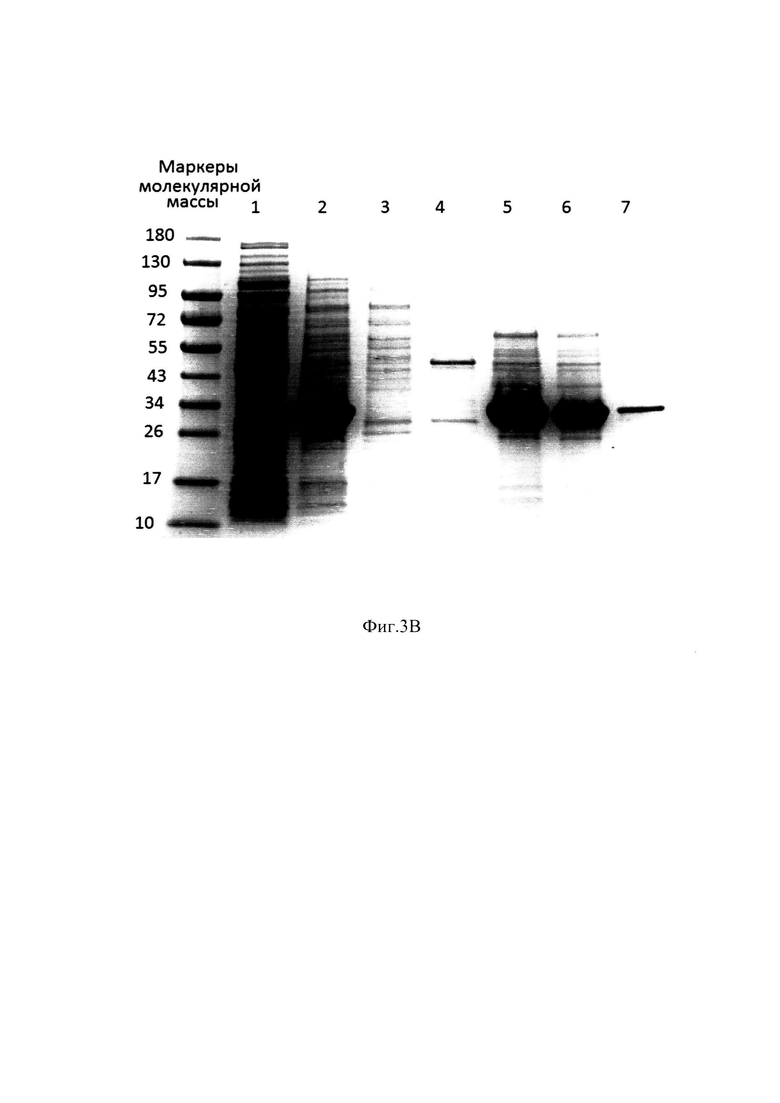
Фиг. 3В Электрофореграмма фракций с хроматографии Ni 2+IMAC Sepharose FF в денатурирующих и восстанавливающих условиях.
Образец 1 - Клеточный лизат; Образец 2 - Раствор телец включения; Образец 3 - Проскок с Ni 2+IMAC Sepharose FF; Образец 4 - Отмыв 1 с Ni 2+IMAC Sepharose FF; Образец 5 - элюат 1 с Ni 2+IMAC Sepharose FF, фракция 1; Образец 6 - элюат 1 с Ni 2+IMAC Sepharose FF, фракция 2; Образец 7 - элюат 2 с Ni 2+IMAC Sepharose FF;
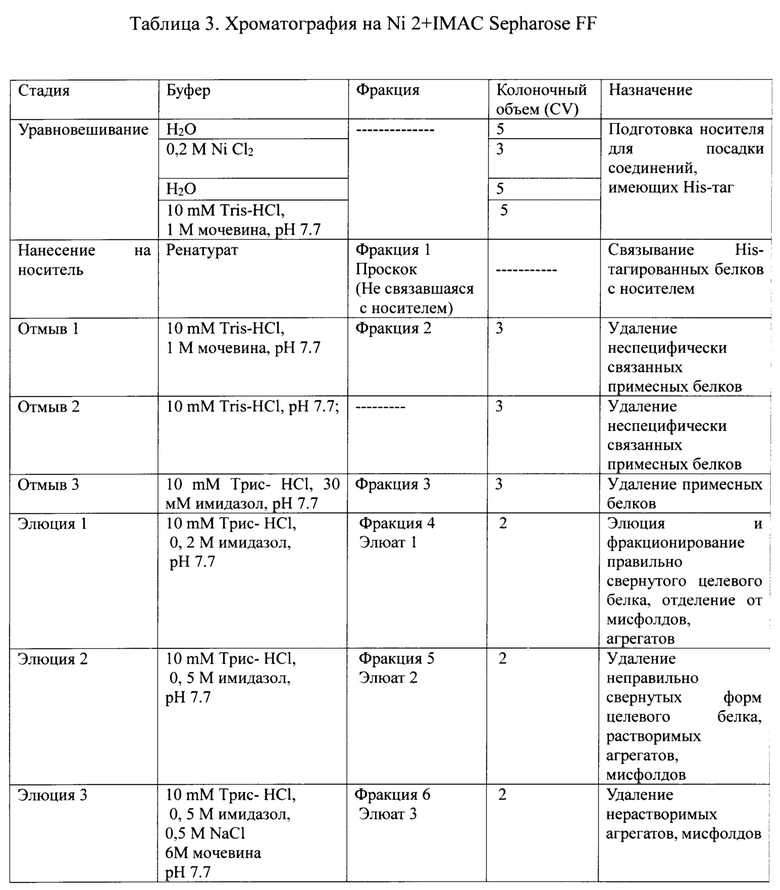
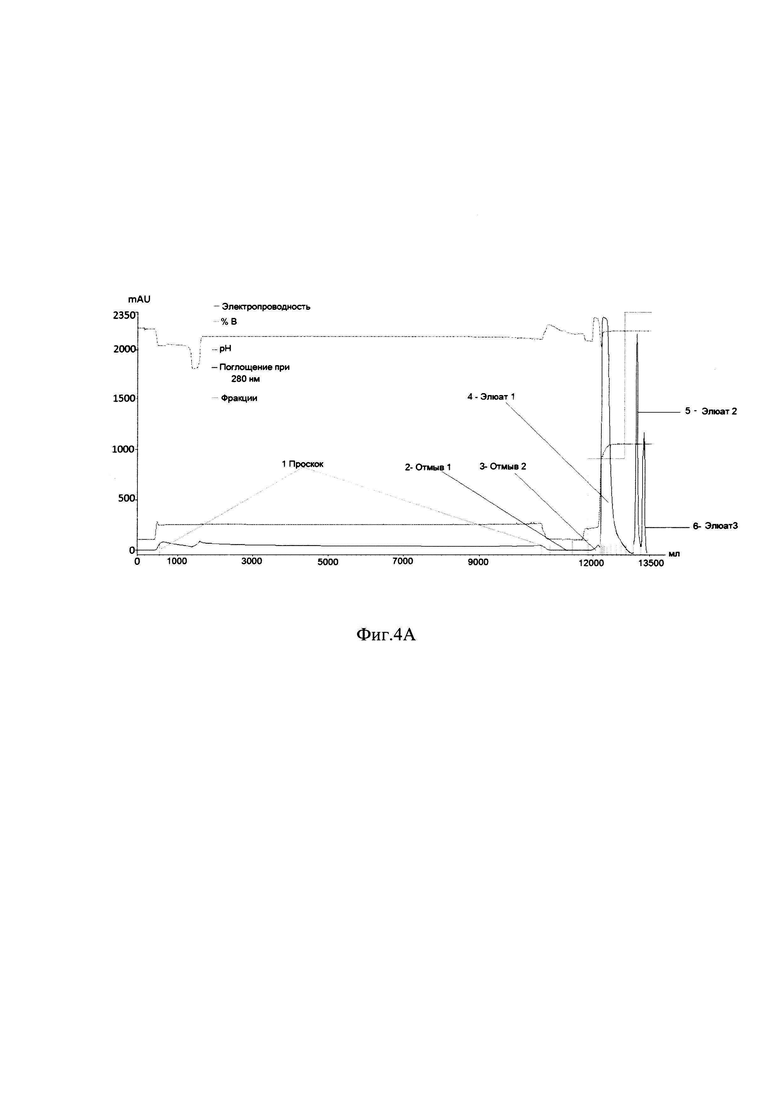
Фиг. 4А Профиль хроматографии рефолдируемой смеси с Ni 2+IMAC Sepharose FF
1 - Проскок; 2 - Отмыв 1; 3 - Отмыв 2; 4 - Элюат 1; 5 - Элюат 2; 6 - Элюат 3;
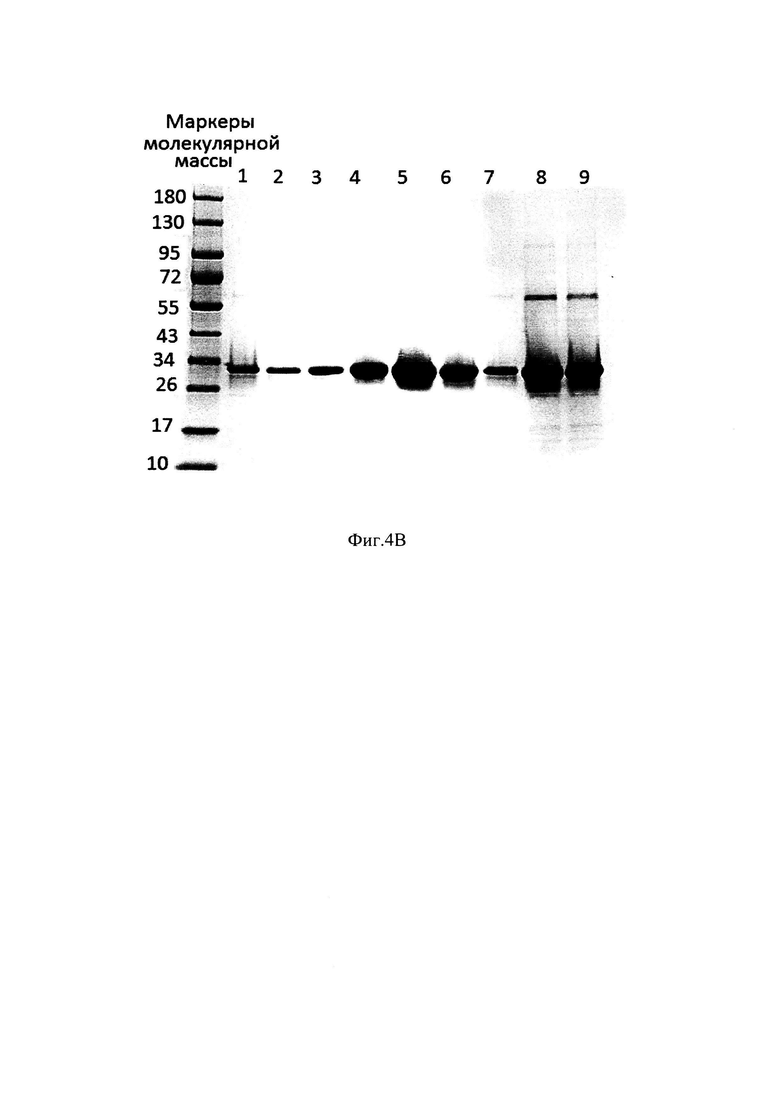
Фиг. 4В Электрофореграмма фракций с хроматографии Ni 2+IMAC Sepharose FF
Образец 1 - Рефолдированная смесь; Образец 2 - Элюат 1 с Ni 2+IMAC Sepharose FF, фракция 3; Образец 3 - Элюат 1 с Ni 2+IMAC Sepharose FF, фракция 4; Образец 4 - Элюат 1 с Ni 2+IMAC Sepharose FF, фракция 5; Образец 5 - Элюат 1 с Ni 2+IMAC Sepharose FF, фракция 6; Образец 6 - Элюат 1 с Ni 2+IMAC Sepharose FF, фракция 7, 10XP; Образец 7 - Элюат 1 с Ni 2+IMAC Sepharose FF, фракция 8, 10XP; Образец 8 - Элюат 2 с Ni 2+IMAC Sepharose FF; Образец 9 - Элюат 3 с Ni 2+IMAC Sepharose FF;
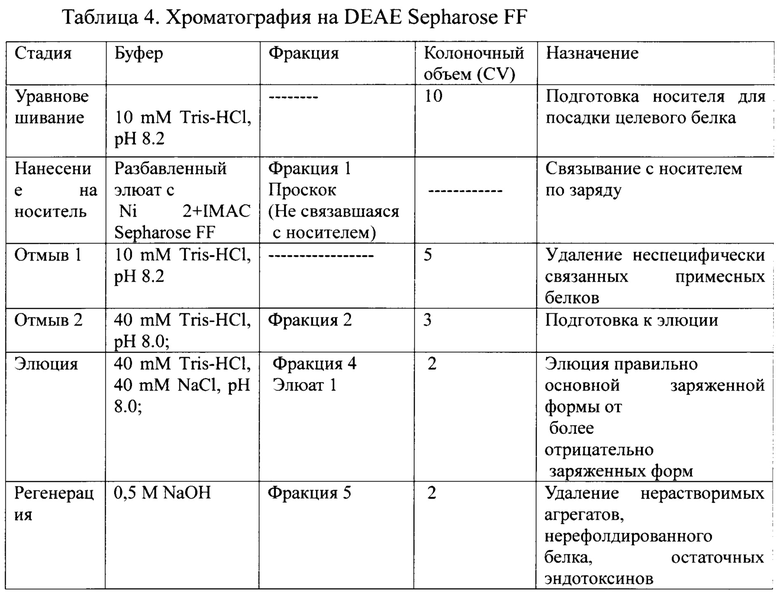
Фиг. 5 Профиль хроматографии с DEAE Sepharose FF 1 - Проскок; 2 - Отмыв; 3 - Элюат; 4 - Регенерация;
Фиг. 6 Типичная электрофореграмма препарата рекомбинантной эндонуклеазы S.marcescens.
Фиг. 7 Падение флуоресценции этидиум бромида при разрушении плазмидной ДНК альфа- ДНК-азой 1, rNucSm (коммерческой нуклеазой Serratia m.), rNucSm серия 1 (рекомбинантной эндонуклеазой Serratia m.) и rNucSm серия 2 (рекомбинантной эндонуклеазой S.marcescens). Разведения, где дорожка под номером 1 соответствует 10 Ед, 2-3.33 Ед, 3-1 Ед, 4-0.33 Ед, 5-0.1 Ед, 6-0.033 Ед, 7-0.01 Ед, 8-0 Ед и времени реакции (крайний левый столбец).
Нуклеазы представляют собой гидролитические ферменты, которые способны гидролизовать фосфодиэфирные связи в нуклеиновых кислотах. Нуклеазы встречаются повсеместно во всех организмах и имеют большое научное и экономическое значение (Bettina Haberland, Die extrazellulare Endonuklease aus S.marcescens: Untersuchungen zur Substratbindung und zur Katalyse // Inaguration dissertation zur Erlangung des Grades Doktor der Naturwissenschaften - Dr. rer. nat. -des Fachbereichs Biologie, Chemie und Geowissenschaften, FB 08 der Justus-Liebig-Universitat Gieβen. - 2001. -p. 1-119). Нуклеазы классифицируют в зависимости от природы гидролизуемого субстрата (ДНК, РНК - ДНК- азы и РНК -азы), экзонуклеазы (расщепляет связь внутри ДНК) и/или эндонуклеазы (действует на свободные концы ДНК), специфические (структурно зависимые (действие только на двухцепочечную (ds) НК (нуклеиновую кислоту) или одноцепочечную (ss) НК) или неспецифические (структурно независимые (действие и на двухцепочечную (ds) НК и на одноцепочечную(ss) НК) (Qing Song and Xiaobo Zhang, Characterization of a novel non-specific nuclease from thermophilic bacteriophage GBSV1// BMC Biotechnology. - 2008. - 8:43. - p. 1-9., Li Lia, Shumei Linb, Feng Yangaa, Functional identification of the non-specific nuclease from white spot syndrome virus // Virology. - 2005. -337. -p. 399-406, E. Srinivasan Rangarajan, Vepatu Shankar, Sugar 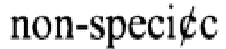 endonucleases// FEMS Microbiology Reviews. - 2001. - 25. - p. 583-613).
endonucleases// FEMS Microbiology Reviews. - 2001. - 25. - p. 583-613).
Специфические нуклеазы, такие как РНКазы и ДНКазы, широко известны, как рестрикционные ферменты, и являются незаменимыми инструментами в молекулярной биологии, служат для характеристики ДНК, картографирования и создания новых генетических конструкций (Richard J. Roberts, How restriction enzymes became the workhorses of molecular biology // PNAS. - 2005. - V. 102. - N. 17. - p. 5905-5908, Francesca Di Felice, Gioacchino Micheli and Giorgio Camilloni, Restriction enzymes and their use in molecular biology: An overview// J. Biosci. -2019. - p. 44:38.). Неспецифические нуклеазы, характеризующиеся способностью гидролизовать и ДНК и РНК без явных предпочтений в отношении оснований, были обнаружены в самых разных источниках, таких как вирусы, бактерии, грибы и млекопитающие. Неспецифические нуклеазы играют важную роль в различных аспектах основных генетических механизмов, в том числе в предотвращение мутаций, восстановлении, репликации и рекомбинации ДНК, удалении нуклеотидов и фосфатов для роста и метаболизма, защите хозяина против чужеродных молекул нуклеиновых кислот, апопотозе и инфекции. Принимая во внимание их важную роль в метаболизме нуклеиновых кислот, неспецифические нуклеазы широко используются в исследованиях в области молекулярной биологии, например, в определении структуры нуклеиновых кислот, быстром секвенировании РНК, удалении нуклеиновых кислот при очистке белков, а также применяются в качестве противовирусных средств (Qing Song and Xiaobo Zhang, Characterization of a novel non-specific nuclease from thermophilic bacteriophage GBSV1// BMC Biotechnology. - 2008.- 8:43. - p. 1-9).
Один из аспектов применения эндонуклеазы S.marcescens, а именно удаление из образцов как ДНК, так и РНК, представляет значительный экономический интерес.Данная функция привлекательна при производстве широкого спектра молекул клеточными или бесклеточными биологическими системами, в которых целевым продуктом является не нуклеиновая кислота, а такие биофармацевтические продукты, как антитела или ферменты, полисахариды, липиды, или низкомолекулярные вещества, такие как антибиотики или низкомолекулярные химические вещества. Необходимость удаления нуклеиновых кислот становится особенно важной, если продукция молекул происходит внутриклеточно или, если часть продуцируемых клеток лизируется во время продуцирования. В результате этого, во время получения целевых продуктов также высвобождаются или содержатся в препарате большие количества нуклеиновых кислот. Присутствие остаточных нуклеиновых кислот хозяина в финальном продукте вызывает опасения в потенциальном переносе и интегрировании в генетический материал пациента, способствует вязкости технологической жидкости и загрязнению хроматографических смол, снижает полезную емкость, вызывает соосаждение и агрегацию (Gousseinov Е., Kools W., Pattnaik P., Nucleic acid impurity reduction in viral vaccine manufacturing// Bioprocess Int. - 2014. -12. -p. - 59-68, John O. Konz, Ann L. Lee, John A. Lewis and Sangeetha L. Sagar, Development of a Purification Process for Adenovirus: Controlling Virus Aggregation to Improve the Clearance of Host Cell DNA// Biotechnol. Prog. - 2005. - 21. - p. - 466-472).
Вирусные векторы и вирусные вакцины играют все более важную роль в современных медицинских подходах. Генные векторы, такие как аденовирусы, аденоассоциированные вирусы или ретровирусы разрабатываются, как средства доставки генетического материала для клеток-мишеней в генной терапии (R.Morenweiser, Downstream processing of viral vectors and vaccines. -Gene Therapy. -2005.- 12. p. 103-110). Клиренс ДНК клетки-хозяина является критическим показателем для производства вакцин, а также очистки аденовирусных и лентивирусных векторов. (Si-Ming Li, Fu-Liang Bai, Wen-Juan Xu, Yong-Bi Yang, Ying An, Tian-He Li, Yin-Hang Yu, De-Shan Li, Wen-Fei Wang, Removing residual DNA from Vero-cell culture-derived human rabies vaccine by using nuclease,// Biologicals. - 2014. -xxx.- p. 1-6). Два вида активности ДНК, которые являются потенциальными факторами риска: первое - это онкогенная активность, второй - это риск инфекционности.
Известно, что все вирусные вакцины содержат остаточную загрязняющую ДНК. Инфекционность примесной ДНК может быть снижена до уровня ниже определяемого либо путем уменьшения среднего размера клеточной ДНК до 200-350 пар оснований, либо обработкой химическими веществами. Самый распространенный метод уменьшения размера остаточной ДНК клеточного субстрата в вакцинах получается путем расщепления неспецифической нуклеазой (Li Sheng-Fowler, Andrew М. Lewis Jr., Keith Peden, Quantitative determination of the infectivity of the proviral DNA of a retrovirus in vitro: Evaluation of methods for DNA inactivation,// Biologicals. -2009. - 37.-p.259-269, Si-Ming Li et al., Removing residual DNA from Vero-cell culture-derived human rabies vaccine by using nuclease,// Biologicals.- 2014.-xxx.-p. 1-6).
Обработка неспецифической нуклеазой используется не только для уменьшения размера ДНК, но и для снижения объемной вязкости, так как нуклеиновые кислоты увеличивают вязкость препаратов до такой степени, что последующие стадии, такие как фильтрация или хроматография, невозможны. Кроме того, обработка нуклеазой предотвращает образование комплексов с вирусными частицами, поскольку сильный отрицательный заряд ДНК способствует взаимодействию с вирусными частицами. Предотвращение подобной агрегации способствует увеличению выхода конечного продукта (John О. Konz, Ann L. Lee, John A. Lewis, and Sangeetha L. Sagar, Development of a Purification Process for Adenovirus: Controlling Virus Aggregation to Improve the Clearance of Host Cell DNA// Biotechnol. Prog.- 2005.- 21.- p.466-472, A.J. Hagen, R. A. Aboud, P. A. De Phillips, C. N. Oliver, C. J. Orella, R. D. Sitrin, Use of nuclease enzyme in the purification of VAQTA, a hepatitis A vaccine// Biotechnol. Appl. Biochem. -1996.-23.-3.-p. 209-215).
Большинство публикаций ссылаются на применение нуклеазы из S.marcescens, фермента, выпускаемого компанией Merck под торговой маркой Benzonase, (WO 2016/156613 Al, Schlegl R. et al., Aseptic purification process for viruses; US 2009/0017523 Al, Weggeman et al., Virus purification methods; Piergiuseppe Nestola, Cristina Peixoto, Ricardo R.J.S. Silva, Paula M. Alves, Jose Р. В. Mota,Manuel J. Т. Carrondo, Improved Virus Purification Processes for Vaccines and Gene Therapy// Bioseparations and Downstream Processing Biotechnology and Bioengineering; Gousseinov E, Kools W, Pattnaik P. Nucleic acid impurity reduction in viral vaccine manufacturing.// Bioprocess Int.-2014. -12. - p. 59-68).
Это нуклеаза грамотрицательной бактерии S.marcescens, обладающая высокой активностью и стабильностью. В работе Marion Nestle, D W. K. Roberts, Purification and some properties of the enzyme,// The Journal of Biological Chemistry. -1969. -V. 244. - N. 19. - p.5213-5218, описано выделение внеклеточной нуклеазы из S.marcescens, которая быстро гидролизовала ДНК и РНК с одинаковой скоростью. В другой своей работе авторы (Marion Nestle, D W. K. Roberts, Specificity of the enzyme,// The Journal of Biological Chemistry. -1969. -V. 244. - N. 19.- p. 5219-5225) исследовали специфичность выделенной внеклеточной нуклеазы из S.marcescens и пришли к выводу, что фермент гидролизует как двухцепочечные, так и одноцепочечные ДНК, а также РНК до 5'-фосфорилированных тетра, три-, ди-, а также в небольшом количестве мононуклеотидов. Фермент требует Mg2+ в качестве кофактора в концентрациях от 5 до 10 мМ, который может быть заменен другим ионами двухвалентных металлов, таким как Мn2+. Он активен в широком диапазоне рН от 7 до 10. Kensuke Yonemura с соавторами (Yonemura et al., Isolation and Characterization of Nucleases from a Clinical Isolate of S.marcescens kums 3958, //Biochem. - 1983. -93. -p. 1287-1295) установили, что фермент имеет наибольшую активность при рН 8,0, а также характеризуется большой устойчивостью к некоторым денатурирующим агентам, таким как мочевина или меркаптоэтанол.
Филимонова М.Н с соавторами в своей работе сообщают о некоторых физико-химических свойствах эндонуклеазы S.marcescens. Ими определен аминокислотный состав фермента. Показано, также, что белковая молекула содержит 1 SH-группу и 1 S-S- связь. Установлено, что N-концевой аминокислотой является треонин (Филимонова М.Н., Баратова Л.А., Воспельникова Н.Д., Желтова А.О., Лещинская И.Б., Эндонуклеаза S. marcescens. Характеристика фермента.// Биохимия.- 1981.-Т. 46.- Вып. 9. - с - 1660-1665).
S.marcescens, патогенная грамотрицательная кишечная бактерия, внеклеточно секретирует помимо нуклеазы еще несколько белков: две липазы, две хитиназы и две протеазы (Mitchell D. Miller, Michael J. Benedik, Merry C. Sullivan, Nancy S. Shipley and Kurt L. Krause, Crystallization and Preliminary Crystallographic Analysis of a Novel Nuclease from S. marcescens//.I. Mol. Biol. -1991. - 222.- p. 27-30). S.marcescens использует различные секреторные системы, с помощью которых она экспортирует белки в культуральную среду. Механизм экспорта нуклеазы остается неясным и имеет особенности, предполагающие, что он может быть уникальным. Эффективность и кинетика секреции нуклеазы Serratia регулируется многими факторами, такими, как физиология клетки, состав питательной среды, условиями роста и мутациями клетки-хозяина (Yousin Sun, Shida Jin, Timothy K. Ball, Michael J. Benedik, Two-Step Secretion of the S. marcescens Extracellular Nuclease// Journal of Bacteriology. - 1996.- 7. - p. 3771-3778.; Michael J. Benedik, Ulrich Strych, S. marcescens and its extracellular nuclease// FEMS Microbiology Letters.- 1998. -165. - p. - 1-13). Кроме того, помимо основной изоформы секретируемой нуклеазы, в среде присутствуют и другие изоформы, идентифицированные капиллярным электрофорезом (Jytte Pedersen and Mikael Pedersen, Separation of isoforms of S.marcescens nuclease by capillary electrophoresis// Journal of Chromatography. -1993.- 645.-p.353-361). Все эти, выше указанные аспекты, затрудняют использование бактерии S.marcescens в качестве культуры для экономически выгодного производства нуклеазы в достаточных количествах и с требуемой чистотой.
С применением рекомбинантных технологий получают желаемый продукт с использованием организмов стандартной экспрессии путем гетерологичной экспрессии, т.е. генетическая информация о желаемом белке включается в экспрессирующий организм, который затем осуществляет экспрессию, т.е. е. синтез чужеродного белка. Это часто имеет то преимущество, что производительность этих экспрессирующих организмов может быть значительно увеличена по сравнению с исходным организмом, и разработаны установленные процессы для культивирования экспрессирующих организмов и их дальнейшей очистки для изготовления конечного продукта.
Особенность нуклеаз в том, что они могут оказывать высокий токсический потенциал на организм-хозяин, если нуклеаза уже переходит в активную форму в цитозоле, она расщепляет нуклеиновые кислоты клетки хозяина и вызывает их гибель или подавляет их рост, что затрудняет экспрессию нуклеазы в других клетках-хозяевах (Michael J. Benedik, Ulrich Strych, S. marcescens and its extracellular nuclease// FEMS Microbiology Letters.- 1998. -165. -p. - 1-13).
Timothy K. Ball с соавторами сообщили о клонировании гена секретируемой нуклеазы из S.marcescens и его полную нуклеотидную последовательность. Оказалось, что для внеклеточной секреции нуклеазы в E.coli дополнительные гены не требуются, из чего был сделан вывод, что E.coli способна секретировать определенные белки внеклеточно (Timothy K. Ball, Peter N. Saurugger and Michael J. Benedik, The extracellular nuclease gene of S.marcescens and its secretion from Escherichia coli // Gene.- 1987. - 57. - c. 183-192). Kirsten Biederman с соавторами сообщили об определении первичной структуры и физико-химических свойства нуклеазы, экспрессируемой и секретируемой Escherichia coli. Плазмида несла последовательность ДНК, выделенную из S.marcescens, кодирующую фермент. Во время культивирования клеток E.coli 85% фермента высвобождалось в культуральную жидкость. Фермент был очищен и показал единственную полосу с молекулярной массой около 30 600 дальтон на SDS-PAGE и был аналогичен нуклеазе, выделенной из S.marcescens. Аминокислотный состав и аминокислотная последовательность полученного фермента, определенные авторами, подтвердили первичную структуру из 245 аминокислот, предсказанную на основе последовательности ДНК (Kirsten Biederman, Pia Knak Jepsen, Erik Riise, Ib Svendsen, Purification and Characterization of a S.marcescens Nuclease produced by Esherichia Coli // Carlsberg Res. Commun.-1989. -V. 54. -p. 17-27).
В публикациях ЕР О 229 866 Al Bacterial enzymes and method for their production, US 5173418, Molin et al., Production in Esherichia Coli of Extracellular Serratia SPP Hydrolases, описан способ получения рекомбинантной нуклеазы из S.marcescens, свободной от других бактериальных белков, при этом часть фермента секретируется E.coli в культуральную среду и собирается из культуральной среды. Через 16-20 часов в стационарной фазе роста ферментационную среду из 25 литров культуры E.coli, содержащую экспрессированную рекомбинантную нуклеазу S. marcescens, собирали фильтрацией через фильтр 0,45 мкм с последующим концентрированием ультрафильтрацией через мембрану 10000 дальтон. После диализа против 10 мМ трис-HCl (рН 7,5), 1 мМ EDTA препарат фильтровали через стеклянный фильтр и фильтры 0,45 и 0,22 мкм и получали чистый фермент.
В публикации US 2008/0118949 Al, Pei-Chung Hsieh, Intracellular Production of Nuclease, представлен способ получения рекомбинантных нуклеаз из S.marcescens (S.marcescens) и Staphylococcus aureus (S.aureus). Он включает в себя сверхэкспрессию МВР (мальтоза-связывающий белок), являющийся частью гибридной последовательности рекомбинантного белка МВР и укороченной нуклеазы (без сигнального пептида) в растворимой форме в цитоплазме клетки-хозяина, из которой он легко извлекается методами аффинной хроматографии. Особенностью модифицированной нуклеазы является то, что более 80% экспрессированного слитого белка нуклеазы диспергировано в цитоплазме клетки-хозяина. Со 100 мл клеточной культуры E.coli авторы получали 3,2 мг рекомбинантного слитого белка- МВР- нуклеазы.
В публикации US 9 796 994 В2, Thomas Greiner, Stefan Schoenert, Method for Producing S.marcescens Nuclease using a Bacillus expression host, описан способ получения рекомбинантной нуклеазы из Serratia marscens в Bacillus sp.
Показано, что нуклеазы грамотрицательных бактерий могут быть получены с высокими выходами и высокой чистотой в грамположительных бактериях путем гетерологичной экспрессии. В частности, было обнаружено, что нуклеаза S.marcescens может эффективно экспрессироваться в Bacillus sp.секрецией в культуральную среду. Заявленным способом авторы получали до 100000 единиц активности на 1 мл культуральной среды. Препарат нуклеазы по изобретению предпочтительно имел от 250 единиц эндотоксина (EU) до 1 EU на мега единиц (1000000 ME) нуклеазной активности.
В таблице 1 (US 9 796 994 В2, Thomas Greiner; Stefan Schoenert Method for Producing S.marcescens Nuclease using a Bacillus expression host) сопоставлены выходы экспрессированной нуклеазы, полученные в разных хозяевах. Столбец (1) показывает лучший выход экспрессии нуклеазы из грамотрицательного хозяина S.marcescens в грамотрицательном хозяине Escherichia coli и (2) показывает выход экспрессии нуклеазы из грамотрицательного хозяина S.marcescens в грамположительном хозяине Bacillus subtilis.

Выше указанные способы производства имеют очевидные недостатки для получения фермента в промышленных масштабах, самым существенным, из которых является низкий выход целевого белка даже при экспрессии в Bacillus subtilis (см. таблица 1).
К другим недостаткам указанных способов производства неспецифической нуклеазы можно отнести и то, что микроорганизмы или бактериальные источники, используемые для производства, являются либо патогенами человека, либо эти микроорганизмы и источники требуют относительно сложных ростовых сред и условий, либо требуют особых методов и технических решений для получения качественного очищенного препарата.
Таким образом, очевидна востребованность в экономичном, качественном отечественном препарате неспецифической нуклеазы, который соответствует строгим требованиям, предъявляемым к препаратам, использующимся для биофармацевтического производства.
Целью настоящего изобретения является предоставление способа для получения фермента эндонуклеазы S.marcescens рекомбинантной, экспрессированной в Escherichia coli и накапливающейся преимущественно в виде нерастворимой фракции.
Наиболее близким по назначению предложенному способу является техническое решение, изложенное в статье Peter Friedhoff с соавторами (Peter Friedhoff, Oleg Gimadutdinow and Alfred Pingoud, Identification of catalytically relevant amino acids of the extracellular S.marcescens endonuclease by alignment-guided mutagenesis// Nucleic Acids Research.- 1994.- V. 22.- No. 16. -p. 3280-3287). В более ранней своей работе (Peter Friedhoff, Oleg Gimadutdinow, Thomas 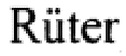 , Wolfgang Wende, Claus Urbanke, Hubert Thole and Alfred Pingoud, A procedure for Renaturation and Purification of the Extracellular S. marcescens Nuclease from Genetically Engineered Escherichia coli // Protein Expression and purification. -1994. -5. -p. 37-43) авторы сообщали о создании генетической конструкции, содержащей гены экстрацеллюлярной нуклеазы из S.marcescens, которые были получены в результате скрининга геномной библиотеки S.marcescens. Затем стандартными методами была получена плазмида, несущая ген нуклеазной активности pSmaNuc под контролем PL-промотора. Для экспрессии нуклеазы плазмида была трансформирована в штамм E.coli DH5α. Культура рутинно выращивалась при 28°С в среде LB. Индукцию PL-промотора производили ростом температуры с 28°С до 42°С.
, Wolfgang Wende, Claus Urbanke, Hubert Thole and Alfred Pingoud, A procedure for Renaturation and Purification of the Extracellular S. marcescens Nuclease from Genetically Engineered Escherichia coli // Protein Expression and purification. -1994. -5. -p. 37-43) авторы сообщали о создании генетической конструкции, содержащей гены экстрацеллюлярной нуклеазы из S.marcescens, которые были получены в результате скрининга геномной библиотеки S.marcescens. Затем стандартными методами была получена плазмида, несущая ген нуклеазной активности pSmaNuc под контролем PL-промотора. Для экспрессии нуклеазы плазмида была трансформирована в штамм E.coli DH5α. Культура рутинно выращивалась при 28°С в среде LB. Индукцию PL-промотора производили ростом температуры с 28°С до 42°С.
Экспрессированный белок накапливался преимущественно в клетке в виде нерастворимой фракции - телец включения. После 2,5 ч ферментирования клетки собирались центрифугированием. Полученные клетки суспендировали в буфере для лизиса -10 мМ трис-НС1, 1 мМ EDTA, рН 8,2. Клетки разрушали при 4°С с помощью ультразвукового дезинтегратора. Осадок собирали центрифугированием и растворяли в буфере 10 мМ Трис-НС1, 6 М мочевина, рН 8,2, в течение ночи. Лизат осветляли центрифугированием, осадок отбрасывали, а супернатант диализовали против буфера 50 mМ натрий-ацетат, рН 5,2. Нерастворимый осадок удаляли центрифугированием, осветленный лизат подвергали хроматографии на фосфоцеллюлозе Р11, целевой белок элюировали с носителя линейным градиентом молярности и рН: от 50 mМ натрий-ацетат, рН 5,2 до 250 mМ натрий-ацетат, рН 7,5. Фракции, обогащенные белком собирали, диализовали против 10 мМ Трис-HCl, рН 8,2 и концентрировали белок на DE 52, элюировали белок 10 мМ Трис-HCl, 0,5 М NaCl, pH 8,2. Получали с 0,5 л культуральной среды 10 мг целевого белка, с общей активностью 80000000 Ед (активность белка определяли по модифицированной методике Kunitz для ДНК-азы I). В следующей своей работе авторы (Peter Friedhoff, Oleg Gimadutdinow and Alfred Pingoud, Identification of catalytically relevant amino acids of the extracellular S.marcescens endonuclease by alignment-guided mutagenesis// Nucleic Acids Research.- 1994. -V. 22.- No. 16 -p. 3280-3287) описывают создание генетической конструкции, наиболее близкой к настоящему изобретению. Была получена плазмида, содержащая ген нуклеазы S.marcescens с N-концевым His6-тагом под контролем Pl -промотора. Для трансформации были использованы штаммы E.coli - LK111 и TGE900. Индукцию также начинали повышением температура до 42°С в течение 15 мин. Через 1-1,5 ч ферментации клетки собирали центрифугированием, промывали STE-буфером (8% (маc. / об.) сахароза, 50 мМ Трис-HCl, рН 8,0, 5 мМ ЭДТА) и снова центрифугировали. Индуцированные клетки хранили при -20°С или использовали непосредственно для выделения белка. Целевой белок выделяли следующим образом, 500 мг индуцированных клеток оттаивали и ресуспендировали примерно в 20 мл 10 мМ трис-НС1, 1 мМ EDTA, рН 8,2. Клетки разрушали обработкой ультразвуком при 4°С. Нерастворимую фракцию осаждали центрифугированием. Осадок ресуспендировали в 20 мл буфера 10 мМ Трис-HCl, 6 М мочевина, 10 мМ имидазол, рН 8,2 в течение ночи. Нерастворимый дебрис удаляли центрифугированием. Супернатант наносили на колонку со смолой Ni-NTA, уравновешенную буфером 10 мМ Трис-HCl, 6 М мочевина, 10 мМ имидазол. Фракцию, не сорбировавшуюся на колонке, снова подавали на колонку со смолой Ni-NTA, и эту процедуру повторяли дважды. Белок элюировали с использованием буфера 10 мМ Трис-HCl, 6 М мочевина, 200 мМ имидазол, рН 8,2 по фракциям. Фракции, содержащие нуклеазу, объединяли и тщательно диализовали против 10 мМ трис-HCl, рН 8,2. После диализа любой осадок удаляли центрифугированием. Супернатант содержал чистую нуклеазу и хранился при 4°С. Выход нуклеазы по дикому типу (wt HisNuc) на литр культуры составил - 25 мг (0,025 мг/мл) (45000000 Ед, активность белка определяли по методике Kunitz).
Недостатками прототипа является:
- заниженный выход рекомбинантной нуклеазы S.marcescens по сравнению с предложенным в заявленном изобретении способом;
- трудности технического характера при масштабировании лабораторной методики в промышленное производство;
- Не охарактеризован полученный продукт на содержание примесей клеточных белков хозяина и эндотоксинов для применения на биофармацевтическом производстве;
Известный способ был использован в заявленном изобретении в части использования в качестве денатурирующего агента 6М мочевину в буфере 10 мМ Трис, рН 8,2, содержащем имидазол, но примерно в три раза меньше концентрации, а именно 3 мМ, а не 10 мМ, и использование для очистки денатурированного белка аффинной хроматографии на Ni-NTA сорбенте в денатурирующих условиях.
Для решения задачи получения высокоочищенного и активного препарата рекомбинантной эндонуклеазы S.marcescens в промышленных объемах в заявленном изобретении предложен оригинальный способ получения рекомбинантной эндонуклеазы S.marcescens, включающий синтез оптимизированной для трансляции в E.coli последовательности ДНК, кодирующий белок эндонуклеазу S.marcescens, конструирование экспрессионного плазмидного вектора, кодирующего химерный белок с С-концевой химеризацией, длиною 255 аминокислотных остатков и расчетной молекулярной массой 29,9 кДа, получение рекомбинантного белка продукцией в E.coli в виде нерастворимых телец включения, получение и отмывку телец включения с последующей солюбилизацией тел включения и очисткой денатурированного восстановленного белка на Ni- IMAC Sepharose в денатурирующих и восстанавливающих условиях, рефолдингом с целью получения активной формы белка за счет образования 2-х дисульфидных связей внутри молекулы, и далее хроматографичекую очистку белка из рефолдируемой смеси, где первую стадию проводят с помощью металлохелатной хроматографии на Ni-IMAC Sepharose. Далее проводят концентрирующую и полирующую анионообменую хроматографию с получением готовой формы высокоочищенного активного препарата рекомбинантной эндонуклеаз S.marcescens, пригодного для удаления примесей нуклеиновых кислот в биофармацевтическом производстве, не менее 700 мг с литра бактериальной культуры.
Основным техническим результатом изобретения является получение в промышленных масштабах высокоочищенного и активного препарата рекомбинантной эндонуклеазы S.marcescens, пригодного для использования на производстве лекарственных препаратов и для изучения структуры и свойств полинуклеотидов.
Осуществление изобретения раскрыто в одном из его возможных воплощений, специалистам понятно, что могут быть использованы различные штаммы E.Coli, нуклеотидные и аминокислотные последовательности могут быть в известных пределах модифицированы, параметры очистки хроматографией на каждой отдельной стадии также могут варьировать. В одном из воплощений был создан штамм генно-инженерно-модифицированного микроорганизма E.coli BL21(DE3)/pGNR-095-001: штамм получен трансформацией реципиентного штамма-хозяина BL21(DE3) плазмидой pGNR095-001 несущей ген эндонуклеазы S.marcescens, составной частью которого являются последовательности 249 аминокислотных остатков эндонуклеазы S.marcescens и 6 аминокислотных остатков содержащих гексагистидиновый тэг на С-конце. В существующих гис-тагированных вариантах молекулы эндонуклеазы S.marcescens 6His-таг помещен на N-конец, как и в прототипе изобретения, вероятно с целью увеличения выхода растворимого активного белка. Мы же предлагаем вариант с 6His-тагом на С-конце с увеличением выхода сверхэкспрессированного нерастворимого белка, что верно для многих белков, согласно литературным данным (Esmeralda А. Woestenenk, Martin 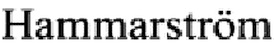 , Susanne van den Berg,
, Susanne van den Berg, 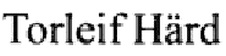 and Helena Berglund, His tag effect on solubility of human proteins produced in Escherichia coli: a comparison between four expression vectors // Journal of Structural and Functional Genomics.- 2004. -5. - p. 217-229). Благодаря предлагаемому способу достигается высокий выход целевого продукта, что делает процесс рентабельным. На Фиг. 1. представлена плазмидная карта pGNR-095-001 (экспрессионный вектор для получения эндонуклеазы S.marcescens).
and Helena Berglund, His tag effect on solubility of human proteins produced in Escherichia coli: a comparison between four expression vectors // Journal of Structural and Functional Genomics.- 2004. -5. - p. 217-229). Благодаря предлагаемому способу достигается высокий выход целевого продукта, что делает процесс рентабельным. На Фиг. 1. представлена плазмидная карта pGNR-095-001 (экспрессионный вектор для получения эндонуклеазы S.marcescens).
В заявленном изобретении критическое значение имеет схема рефолдинга. Рефолдинг требуется, так как белок синтезируется в бактериальной цитоплазме преимущественно в не растворенном состоянии в виде телец включения при культивировании E.coli BL21(DE3)/pGNR-095-001 с уровнем биосинтеза не менее 1300 мг/л культуральной жидкости. В предложенном масштабируемом способе очистки рефолдинг рекомбинантной эндонуклеазы Serratia marcescens проводится методом разбавления при концентрации рефолдируемого белка от 0,3 до 0,5 г/л. В этом заключается существенное отличие от прототипа, где используется метод диализа, обычно технически трудно выполнимый для масштабирования и переноса на производство. Типичные концентрации рефолдинга для сложных молекул, таких как молекулы, содержащие два или более дисульфида, составляют менее 0,05 г / л и более типично 0,001-0,01 г / л (Biomolecules. -2014. - 4. - р. - 235-251; Biotechnol. J. -2012. - 7. -р. 1-15), таким образом, данная модификаиция является неочевидной, при том, что позволяет внести существенное усовершенствование в способ.
С использованием представленного описания, специалисту будет понятно, что в различных вариантах воплощения изобретения возможны различные частные случаи его осуществления, не влияющие на масштабируемость предложенного способа очистки. При том, что наилучшие результаты были получены с использованием буфера для рефолдинга, содержащего денатурирующий агент мочевину в концентрации 1 М, подавитель агрегации глицерин в концентрации 10%, данные значения могут варьировать в известных специалисту пределах. Наилучшие выходы целевого белка получены при использовании окислительно/ восстановительной пары 0,3 mM L-цистин / 5 mМ 2-меркаптоэтанол, однако, в ее отсутствие проведение рефолдинга так же возможно. При проведении рефолдинга наилучшие результаты были получены в буфере 20 mМ Трис-HCl, рН-8.2, при постоянном перемешивании при 4°С в аэробных условиях в течение 60 часов.
Предложенный вариант рефолдинга продемонстрировали стабильную масштабируемость от 1,5 л до 10,5 л с выходом желаемого продукта приблизительно 50% в обоих масштабах. Данный технический результат необходим для получения активного целевого белка и проведения дальнейшей очистки, так как именно на этой стадии происходит структурная сборка молекулы целевого белка за счет образования дисульфидных связей внутри молекулы. Правильно рефолдированный активный белок должен иметь две внутрицепочечные дисульфидные связи. Далее очистку можно проводить так, как это указано в прототипе, либо, для получения высокоочищенного белка, применить дополнительные стадии очистки.
Одним из частных вариантов воплощения является также растворение отмытых телец включения в растворе 6 М мочевины в присутствии восстановителя 20 мМ 2-Меркаптоэтанола при рН 8,2. В отличие от известных приемов, когда при солюбилизации нерастворимой фракции используется только хаотропный агент, а именно 6М мочевина, в заявленном способе используют и восстанавливающий агент 2-Меркаптоэтанол.
Одним из частных вариантов воплощения является хроматографическая очистка денатурированного и восстановленного белка из раствора телец включения на сорбенте IMAC -Ni в восстанавливающих и денатурирующих условиях. Совместимость матрицы IMAC с широким спектром химических веществ, таких как хаотропы, соли, органические растворители, детергенты, восстанавливающие агенты, делает ее незаменимой для очистки His-тагированных рекомбинантных белков, которые необходимо очистить в денатурированной форме.
Высокоэффективное извлечение телец включения из клеток стало возможным в результате процедуры лизиса бактериальных клеток с использованием гомогенизатора высокого давления и применением фермента эндонуклеазы S.marcescens рекомбинантной для уменьшения вязкости раствора и увеличения выхода активного целевого продукта.
Получение готовой формы высокоочищенного препарата эндонуклеазы S.marcescens может быть достигнуто благодаря разработанной схеме получения очищенных от примесей клеточных белков телец включения в результате промывок и очистке денатурированного восстановленного белка хроматографией на Ni-IMAC Sepharose в денатурирующих и восстанавливающих условиях, оптимального рефолдинга и последующей хроматографической очистки, которая, в совокупности с применением некоторых стандартных приемов очистки белков (аффинной хроматографии на Ni- IMAC Sepharose, анионообменной хроматографии на слабом анионообменном сорбенте DEAE Sepharose FF и последующем переводе в буфер готовой формы добавлением стабилизирующих добавок непосредственно в элюат), является высокоэффективной для разделения правильно свернутого активного белка рекомбинантной эндонуклеазы S.marcescens и неправильно свернутой рекомбинантной эндонуклеазы S.marcescens и контаминирующих примесей, таких как продукты деградации, мисфолды, агрегаты и другие формы целевого белка, примесей клеточных белков, эндотоксинов, с привлекательными с коммерческой точки зрения выходами продукта, способными обеспечивать препараты рекомбинантной эндонуклеазы S.marcescens высокой чистоты и активности и получением стабильной готовой формы высокоочищенного препарата рекомбинантной эндонуклеазы S.marcescens, не менее 700 мг с литра бактериальной культуры.
Представленный в изобретении пример иллюстрирует получение генно-инженерной конструкции (ГИК) pGNR-095-001, в которой 6His-таг расположен на С-конце молекулы и экспрессию целевого белка путем культивирования E.Coli BL21(DE3) /pGNR-095-001 в реакторе Biostat Bplus Twin 5L. Процесс культивирования банка клеток BL21(DE3)/pGNR-095-001 был ориентирован на получение высокого количества биомассы с целенаправленной локализацией белка рекомбинантной эндонуклеазы S.marcescens в телах включения.
Представленный в изобретении пример иллюстрирует лизис клеточной биомассы и получение телец включения с применением фермента рекомбинантной эндонуклеазы S.marcescens и Mg2+ до 2 мМ. Удаление примеси геномной ДНК E.Coli, освобождающейся при лизисе с помощью нуклеазы, устраняет не только объемную вязкость и облегчает проведение лизиса на проточном дезинтеграторе высокого давления, но и повышает выход целевого белка при рефолдинге, устраняя субстрат, на котором сорбированный целевой белок не рефолдируется. Использование отмывок телец включения для удаления контаминирующих примесей клеточных компонентов уже на первой стадии буферным раствором: 10 mM Tris, 0.2% Тритон Х-100, рН 8.2 позволяет удалить некоторые контаминирующие примеси пигментов, клеточных белков и эндотоксинов уже на первой стадии. На Фиг. 2 представлена электрофореграмма образцов клеточного лизата, отмывных растворов и раствора телец включения, полученного с применением отмывных растворов. Образец 1 - клеточный лизат, на электрофореграмме можем наблюдать отсутствие растворимой формы целевого белка, образцы 2 и 3 демонстрируют наличие примесных белков в отмывных растворах и отсутствие целевого белка, образцы 4 и 5 - раствор телец включения показывает наличие денатурированного химерного белка и наличие некоторого количества оставшихся клеточных белков. Для более полного удаления оставшихся примесей клеточных белков авторы изобретения применяют хроматографию в денатурирующих и восстанавливающих условиях денатурированного и восстановленного химерного белка.
Представленный в изобретении пример иллюстрирует пример растворения полученных телец включения в соответствующем растворе мочевины, обычно на уровне, эквивалентном 6 М мочевины. Белок восстанавливали с помощью 2-Меркаптоэтанола, 10-20 мМ, при рН 8,2, предпочтительнее 20 мМ, и инкубировали при 4°С в течение приблизительно 16-18 ч. В отличие от прототипа (Peter Friedhoff, Oleg Gimadutdinow and Alfred Pingoud, Identification of catalytically relevant amino acids of the extracellular S. marcescens endonuclease by alignment-guided mutagenesis// Nucleic Acids Research. - 1994.- V. 22. - No. 16. -p. 3280-3287), когда при солюбилизации нерастворимой фракции используется только хаотропный агент, а именно 6М мочевина, авторы представленного изобретения используют и восстанавливающий агент 2-Меркаптоэтанол в концентрации 20 мМ.
Представленный в изобретении пример иллюстрирует хроматографическую очистку денатурированного и восстановленного белка из раствора телец включения на сорбенте IMAC -Ni в восстанавливающих и денатурирующих условиях. Подбор оптимальных условий посадки, отмывки и элюции позволяет максимально очистить денатурированный целевой белок от контаминирующих примесей клеточных белков.
Представленный в изобретении пример рефолдинга иллюстрирует идентифицированные и оцененные условия рефолдинга, которые оптимизируют выход целевого белка и минимизируют образование агрегатов и мисфолдов. Прежде всего, была подобрана концентрация рефолдируемого белка. Типичные концентрации рефолдинга для сложных молекул, таких как молекулы, содержащие два или более дисульфида, составляют менее 0,05 г / л и более типично 0,001-0,01 г/л (Hiroshi Yamaguchi, and Masaya Miyazaki, Refolding Techniques for Recovering Biologically Active Recombinant Proteins from Inclusion Bodies// Biomolecules.- 2014.- 4.- p.- 235-251; Satoshi Yamaguchi, Etsushi Yamamoto, Teruhisa Mannen and Teruyuki Nagamune, Protein refolding using chemical refolding additives// Biotechnol. J. -2012. - 7. - p. 1-15). В связи с большими объемами материала и размерами пула, используемыми при работе с производством белка в промышленном масштабе, можно сэкономить значительное время и ресурсы, исключив или упростив один, или несколько этапов процесса, например, увеличив концентрацию белка в рефолдируемой смеси.
В заявленном способе очистки мы предлагаем проводить рефолдинг рекомбинантной эндонуклеазы S.marcescens методом разбавления при концентрации рефолдируемого белка от 0,3 до 0,5 г/л, что является отличием способа от прототипа. Предложены оптимальные значения стабилизирующих концентраций добавок мочевины, глицерина, рН, окислительно/ восстановительной пары, температуры и времени рефолдинга. Наилучшие результаты были получены с использованием буфера для рефолдинга, содержащего денатурирующий агент мочевину в концентрации 1,0 М, подавитель агрегации глицерин в концентрации 10%, окислительно-восстановительные компоненты 0,3 mM L-цистин / 5 mМ 2-меркаптоэтанол в буфере 20 mМ Трис-HCl, рН-8.2, при постоянном перемешивании при 4°С в аэробных условиях в течение 60 часов. Описанный процесс продемонстрировал стабильную масштабируемость от 1,5 л до 10,5 л с выходом желаемого продукта приблизительно 50% в обоих масштабах.
В работе Timothy K.Ball с соавторами сообщается, что наличие двух дисульфидных связей является четким требованием для активности и стабильности нуклеазы S.marcescens. В исследовании использовали сайт-специфический мутагенез, когда цистеиновые остатки были заменены на серии. Все мутанты обнаружили низкую удельную активность при отсутствии одного или нескольких дисульфидов и оказались менее стабильны, чем дикий тип (Timothy K.Ball, Yousin Suh and Michael J.Benedik, Disulfide bonds are required for S. marcescens nuclease activity//Nucleic Acids Research. -1992. - V. 20. - N. 19. -p. 4971-4974).
Представленный в изобретении пример иллюстрирует хроматографическую очистку рефолдируемой смеси с целью получения высоко очищенной готовой формы рекомбинантной эндонуклеазы S.marcescens.
Для первой стадии очистки, исходя из наличия в химерном белке His-тага, авторами использовалась металлохелатная хроматография на IMAC Shepharose FF, специально созданном аффинном сорбенте на основе агарозной матрицы и лиганда нитрилотриуксусной кислоты (NTA), который, удерживая ион Ni2+четырьмя валентностями, оставляет доступными две валентности иона металла для взаимодействия с кольцами имидазола гистидиновых остатков (Helena Block, Barbara Maertens, Anne Spriestersbach, Nicole Brinker, Jan Kubicek, Roland Fabis,  Labahn, Frank
Labahn, Frank  , Immobilized-metal affinity chromatography (IMAC): a review. In: Richard, B.R. and Deutscher, M.R, eds. // Methods Enzymol. - 2009. -463. -p. - 439-473). На этой стадии происходит разделение правильно свернутого белка, от неправильно свернутого белка, у которого сайты связывания с металлом расположены таким образом, что смещают равновесие ассоциации / диссоциации больше в сторону ассоциации, приводящую к более сильному связыванию, чем у белка, имеющего правильную трехмерную структуру.
, Immobilized-metal affinity chromatography (IMAC): a review. In: Richard, B.R. and Deutscher, M.R, eds. // Methods Enzymol. - 2009. -463. -p. - 439-473). На этой стадии происходит разделение правильно свернутого белка, от неправильно свернутого белка, у которого сайты связывания с металлом расположены таким образом, что смещают равновесие ассоциации / диссоциации больше в сторону ассоциации, приводящую к более сильному связыванию, чем у белка, имеющего правильную трехмерную структуру.
Основная очистка целевого белка от бактериальных эндотоксинов, примесных белков, оставшихся агрегатов и мисфолдов, и одновременно, концентрирование, осуществляется анионообменной хроматографией на слабом анионообменнике DEAE Sepharose FF. Условия сорбции и элюции целевого белка были подобраны таким образом, чтобы для изготовления готовой формы препарата было достаточно добавить в получаемый элюат стабилизирующие добавки такие как, глицерин до 50% и Mg2+до 2 мМ Применение сильных анионообменников на основе четвертичных аминов, таких как Q Sepharose FF, YMC Q30, Source 30 Q, не позволяет достичь таких результатов.
В результате очистки заявленным способом, удалось получить целевой белок рекомбинантную эндонуклеазу S.marcescens - гомогенный препарат, фактически соответствующий расчетной молекулярной массе (на электрофореграмме образца присутствует одна основная полоса соответствующая молекулярной массе около 30 кДа (Фиг. 6)), с содержанием бактериальных эндотоксинов менее 0,3 ЕЭ/мг, содержанием остаточных белков штамма-продуцента E.Coli менее 1,8 нг/мг и обладающий специфической биологической активностью от 900000 до 1000000 Ед/мг (определение активности проводят спектрофотометрическим методом с использованием субстрата ДНК-метилового зеленого).
Материалы и методы
Для экспрессии рекомбинантной эндонуклеазы S.marcescens получают генно-инженерную конструкцию (ГИК) BL21(DE3)/pGNR-095-001. Для получения экспрессионного вектора, была синтезирована кодон-оптимизированная для экспрессии в Е. coli, кодирующая эндонуклеаз S.marcescens нуклеотидная последовательность, фланкированная с 5' и 3' концов сайтами рестрикции NdeI и XhoI соответственно (SEQ ID NO 1). Синтезированная последовательность была клонирована по вышеуказанным сайтам в вектор, в котором экспрессия белка с клонированной последовательности находится под контролем Т7 промотора. Образующаяся в результате клонирования рамка считывания кодирует эндонуклеазу с 6His С-концевым тагом (SEQ ID NO 2). Полученный вектор далее обозначается как pGNR095-001.
Вектором pGNR-095-001 был трансформирован штамм E.coli BL21(DE3). Полученный в результате штамм-продуцент BL21(DE3)/pGNR-095-001 использовался для экспрессии рекомбинантной эндонуклеазы S.marcescens.
Процесс культивирования банка клеток BL21(DE3)/pGNR-095-001 был ориентирован на получение высокого количества биомассы и протекал в два этапа. На первом этапе проводили культивирование клеток BL21(DE3)/pGNR-095-001 в колбах Эрленмейра, которые затем использовались на втором этапе производства в качестве посевной культуры. Одну криовиалу с рабочим банком клеток BL21(DE3)/pGNR-095-001 инокулировали в 250 мл стерильной среды 2YT и растили при 37°С в течение 16 часов при 180 оборотов в минуту. Второй этап ферментирования включал следующие шаги:
(1) 250 мл стартовой культуры BL21(DE3)/pGNR-095-001, выращенная на первом этапе, была загружена в реакторе Biostat Bplus Tween 5L с 4 л среды 2YT;
(2) рН в ферментере поддерживали на уровне 7.0 с помощью растворов 12,5% аммиака и 10% ледяной уксусной кислоты;
(3) DO в реакторе установлен на 40% насыщения, который регулировался скоростью оборотов мешалки и изменением процента растворенного кислорода;
(4) температура ферментации установлена на 37°С;
Экспрессия рекомбинантной эндонуклеазы S.marcescens индуцируется добавлением ИПТГ до финальной концентрации 1,0 мМ, когда оптическая плотность культуры BL21(DE3) /pGNR-095-001 составляет 10-20 оптических единиц. Пост-индукционная фаза ферментирования продолжается еще 3 часа с почасовым отбором проб для контроля оптической плотности культуры. Конечная оптическая плотность культуры спустя 3 часа после постиндукционной фазы ферментирования составляла не менее 30 о.е. Выход биомассы составлял от 30-40 г/л культуры. Рекомбинантная эндонуклеаза S.marcescens экспрессируется на уровне 20-30% от тотального белка и находится исключительно в виде телец включения. Бактериальную биомассу собирали центрифугированием и хранили при - 70°С.
Замороженную биомассу клеток E.coli суспендировали в буфере для дезинтеграции 10 мМ Tris НС1, 300 мМ NaCl, рН 8,2 с добавлением ингибитора протеаз для ингибирования протеолиза фенил-метил-сульфонил-фторида (PMSF), 500 Ед/мл рекомбинантной эндонуклеазы S.marcescens и Mg 2+ до 2 мМ. Разрушение клеток проводили на проточном дезинтеграторе высокого давления в режиме: давление II ступени - 80 бар, I ступени - 450-800 бар, собирая лизат в емкость, помещенную в ледяную баню. Тела включения получали центрифугированием из дезинтегрированной суспензии клеток при 30350 х g при 4°С в течение 35 мин.
Полученные тела включения дважды отмывали 10 mМ Трис-НС1, рН 8,2 буферным раствором, содержащим 0,2% Тритон Х-100. Отмытые тела включения растворяли в буферном растворе 10 mМ Трис- НС1,3 мМ имидазола, 20 мМ 2-Меркаптоэтанола, 6М мочевины, рН 8.2 при 4°С в течение 16-18 ч. Полученный раствор осветляли центрифугированием 30350 х g (JA-30.50) при 4°С в течение 40 мин. Затем, с целью повышения выхода правильно свернутого белка в рефролдинге, проводили очистку денатурированного белка металлохелатной хроматографией в денатурирующих и восстанавливающих условиях на колонке сорбентом IMAC Sepharose FF, предварительно заряженной Ni 2+ и уравновешенной буфером 10 mМ Трис-НCl, 5 мМ 2-Меркаптоэтанол, 6М мочевина, рН 7.7. Для удаления примесных клеточных белков применяли промывку буфером 20 mМ натрий ацетат, содержащим 1 М NaCl, 5 мМ 2-Меркаптоэтанол и 6М мочевину, рН 5.8 и буферным раствором 10 mМ Трис- НС1, содержащим 0,03 М имидазол, 5 мМ 2-Меркаптоэтанол, 6М мочевину, рН 7.7. Элюцию целевого белка с носителя осуществляли буферным раствором 10 mМ Трис- НСl, содержащим 0, 2 М имидазол, 5 мМ 2-Меркаптоэтанол, 6М мочевину, рН 7.7.
На Фиг. 3А. и Фиг. 3В. представлены профиль хроматографии и электрофореграмма фракций с Ni 2+IMAC Sepharose FF, проводимой в денатурирующих и восстанавливающих условиях, где можно наблюдать пик оптической плотности, соответствующий фракции, несорбирующейся на носитель (Фракция 1, Проскок, Фиг. 3А.; Образец 3, Фиг. 3.В), пик, соответствующий элюции буфера 20 mМ натрий ацетат, 1 М NaCl, 5 мМ 2-Меркаптоэтанол 6М мочевина, рН 5.8, в котором элюируются примесные белки и следовые количества целевого белка (Фракция 2, Отмыв, Фиг. 3А.; Образец 4, Фиг. 3.В), высокий пик оптической плотности, соответствующий элюции целевого белка (Фракция 3, Элюат 1, Фиг. 3А.; Образец 5 и Образец 6,Фиг. 3.В) с небольшим количеством примесных клеточных белков и Фракция 4, Элюат 2 (Фиг. 3А.), в котором не наблюдаются пика оптической плотности (в образце на электрофореграмме присутствуют небольшие количества целевого белка (Образец 7, Фиг. 3В.), что говорит о полноте элюции.
Сводная таблица по результатам хроматографии на с Ni 2+IMAC Sepharose FF, проводимой в денатурирующих и восстанавливающих условиях представлена в таблице 2.
Рефолдинг целевого белка рекомбинантной эндонуклеазы S.marcescens проводили методом разбавления в буфере 20 mМ Трис-HCl; 1 М мочевина; 10% глицерин; 0,3 mМ L-цистин; 5mM 2-меркаптоэтанол; рН-8.2, при концентрации белка (от 0,3 до 0,5 г/л) в течение 60 часов при 4°С при постоянном перемешивании. Выход рефолдированного целевого белка сохранялся при масштабировании процесса с 1,5 л до 10,5 л рефолдируемой смеси и составлял не менее 50% активной рекомбинантной эндонуклеазы S.marcescens.
Очистку целевого белка производили путем разделения правильно свернутых и неправильно свернутых конформаций данного белка, отделения контаминирующих примесей клеточных белков аффинной металлохелатной хроматографией на Ni2+IMAC Sepharose FF, в условиях отмывки буферным раствором 10 mM Tris-HCl, содержащим 0.03 М имидазола, рН-7,7, элюцией целевого правильно свернутого белка буферным раствором 10 mM Tris-HCl, содержащим 0.2 М имидазола, рН-7,7. Элюцию мисфолдов и агрегатов осуществляли буферами 10 mM Tris-HCl, содержащим 0.5 М имидазола, рН-7,7 и 10 mМ Tris-HCl, содержащим 0.5 М имидазола, 0,5 М NaCl, 6М мочевины, рН-7,7.
На Фиг. 4.А и Фиг. 4.В. представлены профиль хроматографии рефолдируемой смеси и электрофореграмма фракций с Ni 2+IMAC Sepharose FF. Согласно профилю хроматографии (Фиг. 4.А.), можно наблюдать незначительное поглощение оптической плотности, соответствующее фракции несорбирующейся на носитель (1 Проскок), высокий пик оптической плотности, соответствующий элюции правильно свернутого целевого белка (Элюат 2, Фиг. 4.А., Образцы с 3 по 7 Фиг. 4.В). Также можно наблюдать пик оптический плотности, соответствующий элюции буфером 10 mM Tris-HCl, содержащим 0.5 М имидазола, рН-7,7, (Элюат 2, Фиг. 4.А, Образец 8, Фиг. 4.В), который демонстрирует элюцию соединений более высокой концентрацией имидазола - 0,5 М по сравнению с правильно свернутым ферментом, что свидетельствует о том, что они были связаны с носителем прочнее. Эти молекулы являются неправильно свернутыми молекулами фермента, скорее всего растворимыми агрегатами и мисфолдами. Пик оптической плотности, соответствующий элюции буфером, содержащим 0.5 М имидазола, 0,5 М NaCl и 6М мочевины, рН-7,7, (Элюат 3, Фиг. 4.А, Образец 9, Фиг. 4.В), демонстрирует, что элюируемые соединения настолько прочно связаны с носителем, что удаляются только раствором высокой молярности имидазола и соли в присутствии 6М мочевины, что свидетельствует о том, что эти соединения, скорее всего нерастворимые агрегаты и нерефолдированный белок.
Сводная таблица по результатам хроматографии на с Ni 2+IMAC Sepharose FF, представлена в таблице 3.
Для проведения следующей стадии очистки на сорбенте DEAE Sepharose FF, элюат с хроматографии Ni 2+IMAC Sepharose FF разбавляли 10-14 раз охлажденной 4°С водой очищенной до электропроводности 0,5 до 0,8 мСм/см, доводили рН раствора до значения 8,0±0,05 и наносили на колонку с DEAE Sepharose FF, уравновешенную буфером 10 mM Tris-HCl, рН 8.2. После нанесения носитель промывали буфером для уравновешивания для удаления не специфически сорбированных примесей, затем промывали носитель буфером 40 mM Tris-HCl, рН 8.0 до показания электропроводности буфера. Элюировали буфером 40 mM Tris-HCl, 40 mM NaCl, рН 8.0. На Фиг. 5представлен профиль хроматографии, где можно наблюдать пик оптической плотности, соответствующий элюату целевого белка (3 Элюат). Наблюдаются так же и небольшой двойной пик, соответствующий пику регенерации (4 Регенерация), на этой стадии удаляются нерефолдированный целевой белок, нерастворимые агрегаты, примеси клеточных белков, остаточные эндотоксины.
Сводная таблица по результатам хроматографии на DEAE Sepharose FF представлена в таблице 4.
Для приготовления готовой формы препарата рекомбинантной эндонуклеазы S.marcescens в элюате измеряли содержание белка, разбавляли до нужной концентрации буфером 40 mM Tris-HCl, 40 mМ NaCl, рН 8.0, добавляли глицерин до 50% и Mg 2+ до концентрации 2 мМ в конечном объеме. Готовый препарат стерильно фильтровали. Выход белка составил не менее 700 мг на литр бактериальной культуры.
Измерения параметров различных партий готовой формы препарата рекомбинантной эндонуклеазы S.marcescens показали, что в результате очистки заявленным способом получается гомогенный препарат, фактически соответствующий расчетной молекулярной массы около 30 кДа (Фиг. 6). На Фиг. 7 представлены результаты измерения относительной биологической активности различных партий препаратов готовой формы рекомбинантной эндонуклеазы S.marcescens в сравнении с ДНК-азой 1 и коммерческим препаратом рекомбинантной эндонуклеазы S.marcescens на примере гидролитического расщепления плазмидной ДНК. Анализ основан на способности красителя этидиум бромида (2,7 - диамино - 10 - этил - 9 -фенилфенантрен бромид) интеркалировать между двумя парами оснований спирали ДНК и резко увеличивать интенсивность флуоресценции. При обработке ДНК нуклеазами комплекс разрушается и интенсивность флуоресценции падает. На Фиг. 7 продемонстрировано падение флуоресценции при разрушении плазмидной ДНК альфа - ДНК-азой 1, rNucSm (коммерческой нуклеазой S. marcescens) и rNucSm серия 1 (рекомбинантной эндонуклеазы S. marcescens) и rNucSm серия 2 (рекомбинантной эндонуклеазы S. marcescens) различных разведений, где дорожка под номером 1 соответствует 10 единицам активности, 2- 3.33, 3-1,4- 0.33, 5-0.1, 6-0.033, 7-0.01 и 8-0, соответственно, и времени реакции (крайний левый столбец). Анализ проводили на льду, чтобы замедлить скорость реакции. Анализируя представленные данные можно заключить, что полученные заявленным образом препараты обладают биологической активностью даже при высоких разведениях и при 4°С.
Специфическая биологическая активность препарата определялась спектрофотометрическим методом с использованием субстрата ДНК-метилового зеленого. В лунки 96-луночного несорбирующего планшета вносили разведения СО эндонуклеазы S.marcescens рекомбинантной и разведения испытуемого образца эндонуклеазы S.marcescens рекомбинантной. Затем в каждую лунку вносили по 100 мкл субстрата ДНК с метиловым зеленым, осторожно перемешивали. После чего планшет заклеивали пленкой и инкубировали без перемешивания в термошейкере в течение 2 ч±5 мин при температуре (37±1)°С.
Измеряли оптическую плотность содержимого лунок на спектрофотометре при длинах волн 630 нм и 492 нм (длина волны коррекции). С помощью программного обеспечения GraphPad Prism 6.0 строили графики зависимости оптической плотности от десятичного логарифма содержания эндонуклеазы S.marcescens рекомбинантной в разведениях СО эндонуклеазы S.marcescens рекомбинантной и разведениях испытуемого образца. Для этого использовали 4-параметрическую логистическую функцию ингибирования. Расчет значений IC50 для раствора СО эндонуклеазы S.marcescens рекомбинантной и испытуемого образца производили автоматически, применяя опцию «constrain-shared value for all data set» для верхней (top) и нижней (bottom) асимптот и угла наклона (HillSlope) кривых.
Специфическую активность эндонуклеазы S.marcescens рекомбинантной в испытуемом образце (А), в ЕД/мг, рассчитывали по формуле:
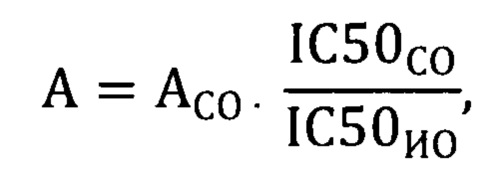
где:
АСО - специфическая удельная активность
эндонуклеазы S.marcescens рекомбинантной согласно сертификату производителя, ЕД/мг;
IC50СО - значение IC50 для раствора СО эндонуклеазы S.marcescens рекомбинантной
рассчитанное с помощью программного обеспечения;
IС50ИО - значение IC50 для испытуемого
образца, рассчитанное с помощью программного обеспечения.
Специфическая биологическая активность различных партий готовой формы препарата рекомбинантной эндонуклеазы S.marcescens составила в среднем 950000±50000 Ед/мг.
Готовая форма препарата рекомбинантной эндонуклеазы S.marcescens может содержать различные примеси биологической природы связанные с продуцентом: (эндотоксины, белки клетки-хозяина). Содержание данных примесей может оказывать влияние на безопасность препарата, поэтому должно быть оценено в очищенном продукте.
Количественное определение бактериальных эндотоксинов в различных партиях готовой формы рекомбинантной эндонуклеазы S.marcescens определялось методом гель-тромб теста, в соответствии с требованиями ГФ РФ, ОФС.1.2.4.0006.15 «Бактериальные эндотоксины» и составило менее 0,0004 ЕЭ на 1000 Ед.
Количественное определение белков штамма продуцента (E.coli) в различных партиях готовой формы рекомбинантной эндонуклеазы S.marcescens определялось методом твердофазного иммуноферментного анализа (ИФА), в соответствии с требованиями ГФ РФ, ОФС.1.7.2.0033.15 «Метод иммуноферментного анализа» и составило менее 2 нг/мг.
Для лучшего понимания сущности изобретения ниже следуют примеры его воплощения. Специалистам понятно, что указанные в примерах параметры могут варьировать:
Пример 1. Микробиологический синтез белка рекомбинантной эндонуклеазы S.marcescens
Заявляемый способ реализован для штамма-продуцента BL21(DE3) pGNR-095-001 при культивировании в ферментере (Sartorius Biostat В Plus Twin 5L, Германия) в объеме среды 4 л. Весь процесс культивирования ведут при температуре 37°С. Водородный показатель рН среды поддерживают на уровне 7,0-7,1, титрованием 10% раствором уксусной кислоты и 12,5% раствором аммиака. Уровень аэрации 4 л/мин и концентрации растворенного кислорода на уровне 40%, который регулируется каскадом оборотов мешалки.
Выращенный инокулят в объем 250 мл вносят в биореактор со стерильной питательной средой 2YT. В качестве стартового субстрата в среду вносят глюкозу в количестве 10 г/л и глицерина 30 г/л.
В период пред-индукционной фазы роста клетки утилизируют глюкозу из среды. Уровень рН падет. Спустя 3-4 часа клетки достигают оптической плотности 10-20 оптических единиц. Экспрессия рекомбинантной эндонуклеазы S.marcescens индуцируется добавлением ИГПТ до финальной концентрации 1,0 мМ. Далее пост-индукционная фаза ферментирования продолжается еще 3 часа с почасовым отбором проб для контроля оптической плотности культуры. Спустя 3 часа конечная оптическая плотность культуры достигает 30-50 о.е. Процесс ферментирования прекращается. Бактериальную биомассу собирают центрифугированием при 7000 об/мин в течение 20 мин и помещают на хранение при - 70°С.
Пример 2. Выделение и очистка белка рекомбинантной эндонуклеазы S.marcescens из бактериальной биомассы. Получение промышленной серии препарата рекомбинантной эндонуклеазы S.marcescens.
2.1 Дезинтеграция биомассы.
Буфер А - 10 mM Tris, 0.3 М NaCl, 0,001% PMSF, рН 8.2;
Замороженную биомассу клеток 110 г суспендируют в 1100 мл буфера А в течение 15 мин на льду. К суспензии добавляют 2,2 мл 1 М раствора MgCl2 и 1000000 Ед фермента рекомбинантной эндонуклеазы S.marcescens, затем разрушают клетки в проточном гомогенизаторе высокого давления Panda Plus 2000(GEA Niro Soavi). Гомогенизатор промывают 250 мл охлажденной до 0°С водой очищенной, настраивают по охлажденному до 0°С буферу А, настройка II ступени - 80 бар, настройка I ступени - 450-800 бар, затем лизируют суспензию клеток в этом режиме, собирая лизат в емкость, помещенную в ледяную баню, промывают гомогенизатор 30 мл буфера А. Лизат осветляют центрифугированием 30350 х g при 4°С в течение 40 мин. Надосадочную жидкость отбрасывают, собирают осадок телец включения.
2.2 Отмыв телец включения
Буфер В: 10 mM Tris, 0.2% Тритон Х-100, рН 8.2;
Буфер Е: 10 mM Tris НС1, рН 8,2;
Осадок телец включения, помещают в емкость объемом 1 л, к осадку доливают 1000±10 мл буферного раствора В. В стакан помещают насадку диспергатора и диспергируют в течение 3-5 минут. Разливают суспензию в 0,25 л центрифужные стаканы, попарно уравновешивая их на весах, помещают в ротор (JLA-16.250) центрифуги (Avanti J-20XP) и центрифугируют 30350 х g при 4°С в течение 30 мин. После завершения центрифугирования надосадочную жидкость отбрасывают.
Выше описанную процедуру последовательно повторяют еще раз с буфером В, затем с буфером Е.
В результате получают не менее - 45±2 г отмытых телец включения. Полученный продукт хранят при температуре минус 80°С.
2.3. Растворение телец включения
Буфер F: 10 mM Tris-HCl, 3 мМ имидазол, 20 мМ меркаптоэтанол, 6М мочевина, рН 8.2;
Осадок телец включения (m=45±2 г) из холодильника помещают в мерный пластиковый стакан объемом 1,0 л, к осадку доливают 600±0,1 мл свежеприготовленного раствора F. Диспергируют в течение 5 минут. Стакан помещают на магнитную мешалку и перемешивают при 4°С в течение 16-18 ч. Суспензию центрифугируют 40000 х g при 4°С в течение 90 мин. После завершения центрифугирования осторожно отбирают надосадочную жидкость.
2.4. Хроматография на Ni2+IMAC Sepharose FF в восстанавливающих и денатурирующих условиях. Металлохелатная хроматография -1.
Буфер G: 10 mM Tris, 5 мМ меркаптоэтанол, 6М мочевина, рН 7.7;
Буфер Н: 10 mM Tris, 0, 5 М имидазол, 5 мМ меркаптоэтанол, 6М мочевина, рН 7.7;
Буфер I: 20 mМ натрий ацетат, 1 М NaCl, 5 мМ меркаптоэтанол, 6М мочевина, рН 5.8;
Буфер J: 10 mM Tris, 6М мочевина, рН 7.8;
Стадию очистки денатурированного и восстановленного целевого белка проводят на колонке, заполненной сорбентом IMAC Sepharose FF объемом 350 мл с использованием хроматографической системы Akta Pure 150 при температуре 4°С.
Супернатант разбавляют буфером J в 3 раза, доводят рН до 7,8 2М NaOH, и наносят на колонку с Ni2+IMAC Sepharose, предварительно заряженную 0,2 М раствором NiCl2 и уравновешенную буфером G. После нанесения колонку промывают буфером G, буфером J, промывают 6% буфера Н в буфере G (содержащем 30 мМ) имидазола. Целевой белок элюируют 40% буфера Н в буфере G (содержащем 200 мМ имидазола). Полноту элюции проверяют 100% буфера Н.
Для регенерации, санации и хранения сорбент последовательно промывают 3 колоночными объемами 0,5 М раствора ЭДТА, 3 колоночными объемами 0,5 М раствора натрия гидроксида, 3 колоночными объемами 0,1 М раствора Трис-HCl, рН 7,5, 3 колоночными объемами 20% спирта этилового. До следующего использования хранят колонку с закрытыми входным и выходным отверстиями при температуре 2-8°С.
2.5. Рефолдинг.
Буфер К: 20 mМ Трис-HCl; 1 М мочевина; 10% глицерин; 0,3mM L-цистин; 5 тМ 2-меркаптоэтанол; рН-8.2;
Элюат с металлохелатной хроматографии -1 объемом 500±10 мл медленно по каплям при постоянном перемешивании добавляют в охлажденный до 4±1°С буфер К объемом 10000 мл, измеряют рН раствора, при отклонении рН от 8,2 корректируют хлористоводородной кислотой или раствором натрия гидроксида. Емкость помещают на мешалку и продолжают процесс ренатурации белка при температуре 4±1°С при постоянном перемешивании в течении 60 часов.
2.6. Хроматография на Ni2+IMAC Sepharose FF. Металлохелатная хроматография -2.
Буфер L: 10 mM Tris-HCl, 1 М мочевина, рН 7.7;
Буфер М: 10 mM Tris-HCl, рН 7.7;
Буфер N: 10 mМ Tris-HCl, 0,5 М имидазол, рН 7.7;
Металлохелатную хроматографию -2 проводят на хроматографической колонке заполненной сорбентом IMAC Sepharose FF объемом 350 мл с использованием хроматографической системы Akta Pure 150 при температуре окружающей среды 4°С.
В рефолдируемой смеси доводят рН до значения 7,7±0,05 5 М раствором соляной кислоты и наносят на колонку Ni2+IMAC Sepharose FF, предварительно заряженную 0,2 М раствором NiCl2 и уравновешенную буфером L. По окончании нанесения последовательно промывают колонку 3 колоночными объемами раствора L, 3 колоночными объемами раствора М, 1-2 колоночными объемами 6% буферного раствора N в растворе М до выхода оптической плотности на плато.
Элюируют целевой белок с носителя 40% раствора N в растворе М.
Для регенерации, санации и хранения сорбент последовательно промывают 3 колоночными объемами 0,5 М раствора ЭДТА, 3 колоночными объемами 0,5 М раствора натрия гидроксида, 3 колоночными объемами 0,1 М раствора Трис-HCl, рН 7,5, 3 колоночными объемами 20% спирта этилового. До следующего использования хранят колонку с закрытыми входным и выходным отверстиями при температуре 2-8°С.
2.7 Хроматографическая очистка на сорбенте DEAE Sepharose FF. Анионообменная хроматография.
Буфер О: 10 mM Tris-HCl, рН 8.2;
Буфера Р: 40 mМ Tris-HCl, рН 8.0;
Буфер Q: 40 mМ Tris-HCl, 40 mМ NaCl, рН 8.0;
Буфер R: 5 mМ Tris-HCl, рН 8.0;
Анионобменную хроматографию проводят на хроматографической колонке ХK-50/40 заполненной сорбентом DEAE Sepharose FF объемом 200 мл с использованием хроматографической системы  Pure 150 при температуре окружающей среды 4°С.
Pure 150 при температуре окружающей среды 4°С.
Элюат после хроматографии на Ni2+IMAC Sepharose FF разбавляют в 10-14 раз буфером R, доводят рН раствора до значения 8,0±0,05 концентрированной соляной кислотой или раствором 5М натрия гидроксида (если необходимо), доводят электропроводность раствора от 0,5 до 0,8 мСм/см охлажденной до 4°С водой очищенной и наносят на колонку DEAE Sepharose FF, уравновешенную буфером О. По окончании нанесения омывают колонку 3 колоночными объемами раствора О, 3 колоночными объемами (или более) раствора Р до выхода электропроводности на плато. Элюируют целевой белок с носителя буферным раствором Q.
2.8 Изготовление готовой формы.
Буфер Q: 40 mM Tris-HCl, 40 mM NaCl, рН 8.0; Раствор R: 1М MgCl2
Элюат с DEAE Sepharose FF разбавляют буфером Q до концентрации белка 2,0-2,1 мг/мл, вносят глицерин до концентрации 50% и раствор R до концентрации 2 мМ в конечном растворе. Раствор готовой формы фильтруют в ламинарном потоке воздуха. Для стерилизующей фильтрации используют стерилизующую систему FILTERMAX, 1000 ml, PES, с размером пор 0,22 мкм, используя мембранный вакуумный насос.
После фильтрации отбирают пробу для проведения технологического контроля. Полученный раствор является готовой формой рекомбинантной эндонуклеазы S.marcescens.
Получено:
2419,5 мл; С=1.09 мг/мл; 2637,2 мг; 2 407 763 600 Ед; Содержание бактериальных эндотоксинов: Менее 0,0003 ЕЭ на 1000 Ед, менее 0,3 ЕЭ/мг; Специфическая активность: 913000 Ед/мг; Остаточные белки штамма-продуцента: Менее 1,8 нг/мг.





Изобретение относится к области биотехнологии, а именно к способам получения, выделения и очистки рекомбинантных белков, в частности к получению высокоочищенного препарата правильно свернутой рекомбинантной эндонуклеазы S.marcescens. Способ, предусматривающий получение рекомбинантной эндонуклеазы Serratia marcescens, продуцируемой в E.coli, включающий стадии отмывки и растворения телец включения, рефолдинга и хроматографии белка, отличающийся тем, что рефолдинг проводится методом разбавления при концентрации рефолдируемого белка приблизительно от 0,3 до 0,5 г/л. 9 з.п. ф-лы, 2 пр., 7 ил., 4 табл.
1. Способ получения рекомбинантной эндонуклеазы Serratia marcescens, продуцируемой в E.coli, включающий стадии отмывки и растворения телец включения, рефолдинга и хроматографии белка, отличающийся тем, что рефолдинг проводится методом разбавления при концентрации рефолдируемого белка приблизительно от 0,3 до 0,5 г/л.
2. Способ по п. 1, где растворение отмытых телец включения проводят в растворе 6 М мочевины в присутствии восстановителя 20 мМ 2-меркаптоэтанола при рН 8,2.
3. Способ по п. 1, где буфер для рефолдинга содержит денатурирующий агент мочевину в концентрации 1 М и подавитель агрегации глицерин в концентрации 10%.
4. Способ по п. 1, где рефолдинг проводится при использовании окислительно/восстановительной пары 0,3 мM L-цистин/5 мM 2-меркаптоэтанол.
5. Способ по п. 1, где хроматографическая очистка денатурированного и восстановленного белка из раствора телец включения проводится на сорбенте IMAC-Ni в восстанавливающих и денатурирующих условиях.
6. Способ по п. 1, где рефолдинг для получения активной формы фермента за счет образования 2-х внутрицепочечных дисульфидных связей проводят после проведения металлохелатной хроматографии на Ni2+IMAC Sepharose FF.
7. Способ по п. 6, где хроматографическую очистку белка из рефолдируемой смеси проводят металлохелатной хроматографией на Ni2+IMAC Sepharose FF.
8. Способ по п. 6, где полировочную очистку белка после металлохелатной хроматографии на Ni2+IMAC Sepharose FF проводят анионообменной хроматографией на DEAE Sepharose FF.
9. Способ по п. 8, где после проведения хроматографической очистки на DEAE Sepharose FF перевод в буфер готовой формы осуществляется добавлением стабилизирующих добавок непосредственно в элюат.
10. Способ по п. 1, где генно-инженерная конструкция для экспрессии в E.coli кодирует полноразмерный белок эндонуклеазы S. Marcescens, слитой с С-концевым гистагом.
| FRIEDHOFF P | |||
| et al., Identification of catalytically relevant amino acids of the extracellular Serratia marcescens endonuclease by alignment-guided mutagenesis, Nucleic Acids Research, 1994, Vol.22, N16, pp.3280-3287 | |||
| JAMALUDDIN M | |||
| J | |||
| A | |||
| et al., On-column refolding of recombinant fungal endoglucanase //Aust J Basic and Appl Sci, 2012, N6, |
Авторы
Даты
2023-05-05—Публикация
2021-08-03—Подача