Перекрестная ссылка на родственные заявки
[1] Данная заявка заявляет приоритет и преимущество заявки на патент США №61/730749, поданной 28 ноября 2012 г., полное содержание которой включено в данный документ посредством ссылки.
Предпосылки изобретения
[2] Заболевания дыхательной системы, широко известные как заболевания легких, представляют собой третью по распространенности причину смерти в США. Наиболее часто диагностируемые заболевания дыхательной системы включают эмфизему, астму, пневмонию, туберкулез, легочную гипертензию и рак легкого. Легочная гипертензия является хроническим и прогрессирующим заболеванием. Ключевым патологическим изменением при легочной гипертензии является ремоделирование мелких легочных артерий, характеризующееся утолщением внутренней, средней и внешней оболочки. Прогрессирующее сужение микрососудов легких и последующее увеличение сопротивления сосудов снижает их способность переносить кровь и приводит к повышению давления. Со временем повышенное давление индуцирует адаптивную гипертрофию правого желудочка (RV), и в конечном итоге вызывает сердечную недостаточность, и приводит к смерти пациента.
[3] Легочная гипертензия может быть вызвана сочетанием факторов, включая аутоиммунные заболевания, такие как склеродермия и ревматоидный артрит, врожденные пороки сердца, тромбы в легких (эмболия легочной артерии), застойная сердечная недостаточность, порок клапанов сердца, ВИЧ-инфекция, длительные периоды низкого уровня кислорода в крови, заболевание легких, такое как COPD и фиброз легких, злоупотребление различными лекарственными препаратами и веществами и/или синдром обструктивного апноэ сна. Хотя точный патофизиологический механизм легочной гипертензии остается неизвестным, существует все больше доказательств крайне важной роли воспаления и активации врожденного и адаптивного иммунитета в развитии и прогрессировании легочной гипертензии (Price et al., Chest 2012, 141:210-221).
[4] Для медикаментозного лечения легочной гипертензии было разработано несколько терапевтических средств, включая простаноиды, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы 5 типа, активаторы растворимой гуанилатциклазы и два ингибитора PDE5, тадалафил и силденафил. Оксид азота (NO) является сильнодействующим релаксантом для гладкомышечных клеток легочных артерий, который проявляет активность посредством циклического GMP (cGMP). Внутриклеточный уровень cGMP зависит от активации ряда фосфодиэстераз (PDE), среди которых PDE5 является изоформой, экспрессирующейся в легочном круге кровообращения в наибольшем количестве.
[5]Острое повреждение легких (ALI) и его более тяжелая форма, острый респираторный дистресс-синдром (ARDS), характеризуются острой воспалительной реакцией, локализирующейся в воздушном пространстве и легочной паренхиме легких. ALI и ARDS являются основной причиной острой дыхательной недостаточности и ассоциированы с большим числом осложнений и высокой смертностью у тяжелобольных пациентов. ARDS может являться причиной 36000 случаев смерти в год в стране такой величины, как США. Несмотря на прогресс в ведении пациентов с ALI и ARDS, такой как протективная вентиляция, все еще существует необходимость в эффективных способах лечения.
[6] Фарнезоид Х-рецептор (FXR) является представителем суперсемейства ядерных рецепторов, которые экспрессируются в большом количестве в различных органах, включая жировую ткань, печень, почку, надпочечники, кишечник и сосудистое русло (Lefebvre, Physiol. Rev. 2009). Сигнальная система FXR модулирует несколько метаболических путей, осуществляя регуляцию гомеостаза триглицеридов, холестерина, глюкозы и энергетического гомеостаза, и возможно влияет на патогенез атеросклероза, повышая выработку NO и уменьшая пролиферацию неоинтимы и сосудистое воспаление (Lefebvre, Physiol. Rev. 2009). FXR также экспрессируется в эндотелиальных клетках (ЕС) легочных артерий крыс (He, F., et al., Circulation Research 2006, 98: 192-199). Активация FXR в EC приводит к понижающей регуляции экспрессии эндотелина (ЕТ)-1, сильнодействующего сосудосуживающего вещества. Управление экспрессией ЕТ-1 в ЕС сосудов может быть полезным для контроля легочной гипертензии. Также активация FXR подавляет воспаление в легких и стимулирует восстановление легких после повреждения. У мышей с нокаутом гена FXR наблюдалось усиление воспаления в легких и неполноценная регенерация легких после острого повреждения легких, индуцированного обработкой липополисахаридом. In vitro активация FXR, как было показано, подавляла экспрессию P-селектина и индуцировала экспрессию Foxm 1b. Вместе данные эффекты способствуют уменьшению проницаемости легкого, подавлению выхода лейкоцитов из кровотока и движения в воспаленные ткани и стимулируют восстановление легкого в мышиной модели воспаления (Zhang, L., Mol. Endocrinol. 2012, 26(1): 27-36). Аналогичные результаты наблюдали и в мышиной модели фиброза легких (Zhou et al., 2013, 761-65). Эти полученные данные подтверждают возможную способность FXR или его агониста подавлять повреждение легких и стимулировать восстановление легких для лечения индуцированного воспалением повреждения легких.
[7] Поскольку имеющиеся в настоящее время способы лечения являются малоэффективными для увеличения выживаемости пациентов, страдающих заболеванием дыхательной системы, таким как легочная гипертензия, крайне необходимы альтернативные виды терапии. Настоящее изобретение соответствует таким требованиям.
Краткое описание графических материалов
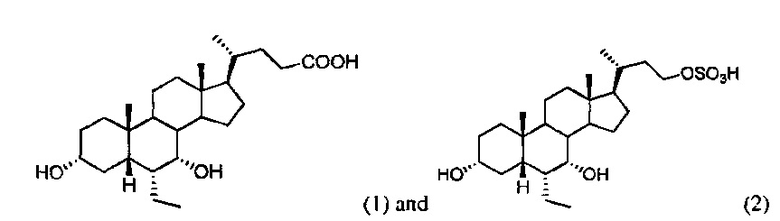
[8] Фигура 1 представляет собой диаграмму, на которой показана общая схема исследования и календарный план осуществления анализа кровяного давления, мочи и крови у "солечувствительных" крыс Dahl (DSS). DSS-крысы были включены в четыре группы (см. пример 4, называемые в данном документе крысами DSS-исследования).
[9] Фигура 2 представляет собой график, на котором показан вес тела (граммы) крыс DSS-исследования в зависимости от времени (недели).
[10] Фигура 3 представляет собой график, на котором показан уровень выживаемости (%) крыс DSS-исследования в зависимости от времени (недели).
[11] Фигура 4 представляет собой график, на котором показана частота сердечных сокращений (bpm) крыс DSS-исследования в зависимости от времени (недели).
[12] Фигура 5 представляет собой график, на котором показано систолическое давление крови (SBP; мм рт.ст.) крыс DSS-исследования в зависимости от времени (недели).
[13] Фигура 6А представляет собой график, на котором показан % массы сердца от веса тела (BW) у крыс DSS-исследования.
[14] Фигура 6в представляет собой график, на котором показан % массы легких от ВW у крыс DSS-исследования.
[15] Фигура 6С представляет собой график, на котором показан % массы почек от BW у крыс DSS-исследования.
[16] Фигура 7 представляет собой график, на котором показана концентрация глюкозы крови натощак (мг/дл) в зависимости от времени (мин.) в ходе теста толерантности к глюкозе (GTT) у крыс DSS-исследования.
[17] Фигура 8 представляет собой график, на котором показана концентрация инсулина плазмы крови натощак (нг/мл) в зависимости от времени (мин.) в ходе GTT у крыс DSS-исследования.
[18] Фигура 9 представляет собой гистограмму, на которой показана чувствительность к инсулину с помощью индекса инсулинорезистентности (TR) у крыс DSS-исследования.
[19] Фигура 10A представляет собой график, на котором показано количество альбумина (мг/сутки) в моче крыс DSS-исследования.
[20] Фигура 10 В представляет собой график, на котором показано соотношение альбумина и креатинина в моче (UACR) крыс DSS-исследования.
[21] Фигура 11А представляет собой график, на котором показаны уровни ADMA (мкмоль/л) в сыворотке крови крыс DSS-исследования в зависимости от времени (недели).
[22] Фигура 11В представляет собой график, на котором показаны уровни ADMA (нмоль/организм) в моче крыс DSS-исследования в зависимости от времени (недели).
[23] Фигура 11С представляет собой график, на котором показаны уровни NO (мкмоль/л) в сыворотке крови крыс DSS-исследования в зависимости от времени (недели).
[24] Фигура 11D представляет собой график, на котором показаны уровни NO (нмоль/организм) в моче крыс DSS-исследования в зависимости от времени (недели).
[25] Фигура 12 представляет собой схему, на которой показана степень гипертрофии правого желудочка (RVH) для крыс DSS-исследования каждой группы обработки после умерщвления животных.
[26] Фигуры 13A-D представляют собой 20Х увеличенные изображения окрашенных гематоксилин-эозином срезов легкого, полученных от крыс контрольной группы (А), обработанной монокроталином группы (В), обработанной монокроталином плюс обетихолевой кислотой (ОСА) группы (С) и обработанной монокроталином плюс тадалафилом группы (D) на день 7. Длинные стрелки указывают на просвет сосуда, а короткие стрелки указывают на стенку сосуда.
[27] Фигура 13Е представляет собой гистограмму, на которой показана толщина стенки легочной артерии на день 7 у обработанных крыс по сравнению с таковой у контрольной группы крыс. * p<0,0001 по сравнению с контролем, ° p<0,0001 по сравнению с монокроталином, и n: число артерий, подвергнутых оценке.
[28] Фигуры 14A-D представляют собой 20Х увеличенные изображения окрашенных гематоксилин-эозином срезов легкого, полученных от крыс контрольной группы (А), обработанной монокроталином группы (В), обработанной монокроталином плюс ОСА группы (С) и обработанной монокроталином плюс тадалафилом группы (D) на день 28. Длинные стрелки указывают на просвет сосуда, а короткие стрелки указывают на стенку сосуда.
[29] Фигура 14Е представляет собой гистограмму, на которой показана толщина стенки легочной артерии на день 28 у обработанных крыс по сравнению с таковой у контрольной группы крыс. * p<0,0001 по сравнению с контролем, ° p<0,0001 по сравнению с монокроталином, и n: число артерий, подвергнутых оценке.
[30] Фигура 15 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК МСР-1 в контрольной и тестируемой группах в дни 7 и 28.
[31] Фигура 16 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК IL-6 в контрольной и тестируемой группах в дни 7 и 28.
[32] Фигура 17 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК VEGF в контрольной и тестируемой группах в дни 7 и 28.
[33] Фигура 18 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК АСЕ2 в контрольной и тестируемой группах в дни 7 и 28.
[34] Фигура 19 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК PKG1 в контрольной и тестируемой группах в дни 7 и 28.
[35] Фигура 20 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК GC1a3 в контрольной и тестируемой группах в дни 7 и 28.
[36] Фигура 21 представляет собой схему, на которой показан эффект ОСА на экспрессию мРНК PDE5 в контрольной и тестируемой группах в дни 7 и 28.
[37] Фигура 22 представляет собой график, на котором изображен однофакторный анализ выживаемости необработанных или обработанных крыс в зависимости от времени (дни).
Краткое описание изобретения
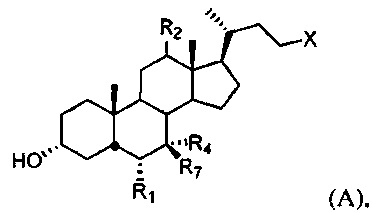
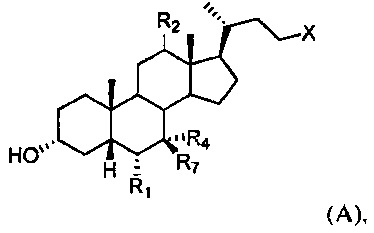
[38] Настоящее изобретение относится к способу лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы у субъекта, включающему введение субъекту терапевтически эффективного количества соединения формулы А:
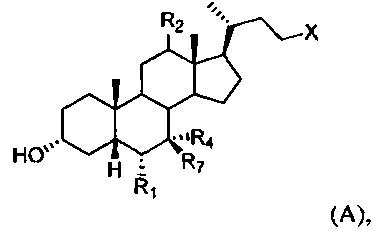
или его фармацевтически приемлемой соли, где R1, R2, R4, R7 и X определены в данном документе.
[39] Настоящее изобретение также относится к применению соединения формулы А или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[40] Настоящее изобретение также относится к соединению формулы А или его фармацевтически приемлемой соли для лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[41] Настоящее изобретение дополнительно относится к способу уменьшения или подавления воспаления в легком у субъекта, включающему введение субъекту терапевтически эффективного количества соединения формулы А:
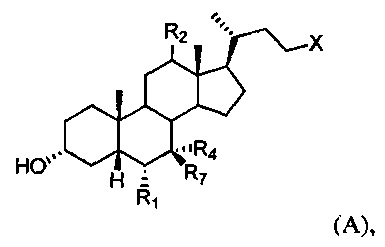
или его фармацевтически приемлемой соли, где R1, R2, R4, R7 и X определены в данном документе.
[42] Настоящее изобретение также относится к применению соединения формулы А или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для уменьшения или подавления воспаления в легком у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[43] Настоящее изобретение также относится к соединению формулы А или его фармацевтически приемлемой соли для уменьшения или подавления воспаления в легком у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[44] Настоящее изобретение дополнительно относится к способу стимуляции восстановления легкого у субъекта, включающему введение субъекту терапевтически эффективного количества соединения формулы А:
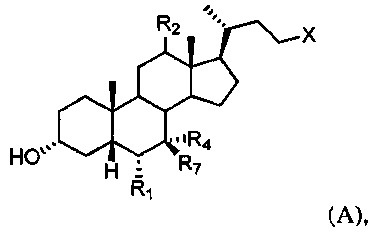
или его фармацевтически приемлемой соли, где R1, R2, R4, R7 и X определены в данном документе.
[45] Настоящее изобретение также относится к применению соединения формулы А или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для стимуляции восстановления легкого у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[46] Настоящее изобретение также относится к соединению формулы А или его фармацевтически приемлемой соли для стимуляции восстановления легкого у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[47] Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей соединение формулы А или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или вспомогательное вещество, для лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы, или для уменьшения или подавления воспаления в легком, или для стимуляции восстановления легкого у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[48] Настоящее изобретение дополнительно относится к набору, включающему соединение по настоящему изобретению для применения в способе лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы, или уменьшения или подавления воспаления в легком, или стимуляции восстановления легкого у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[49] Если не определено иное, все технические и научные выражения, применяемые в данном документе, имеют то же значение, которое обычно понимает специалист в данной области техники, к которой принадлежит настоящее изобретение. В случае конфликта настоящее описание, включая определения, будет иметь преимущественную силу. В настоящем описании формы единственного числа также включают формы множественного, если в контексте явно не указано иное. Хотя способы и материалы, аналогичные или эквивалентные таковым, описанным в данном документе, можно применять в практическом осуществлении или испытании настоящего изобретения, подходящие способы и материалы описаны ниже.
Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в данном документе, включены посредством ссылки. Ссылки, приводимые в данном документе, не признаются предшествующим уровнем техники для заявляемого изобретения. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
[50] Другие признаки и преимущества настоящего изобретения станут очевидны из нижеследующего подробного описания и формулы изобретения.
Подробное описание изобретения
[51] Настоящее изобретение относится к способу лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы, способу уменьшения или подавления воспаления в легком и способу стимуляции восстановления легкого путем введения агониста FXR субъекту, нуждающемуся в этом.
[52] В частности, настоящее изобретение относится к способу лечения, уменьшения риска, предупреждения или облегчения симптома заболевания или состояния дыхательной системы, включающему введение субъекту, нуждающемуся в этом, соединения формулы А:
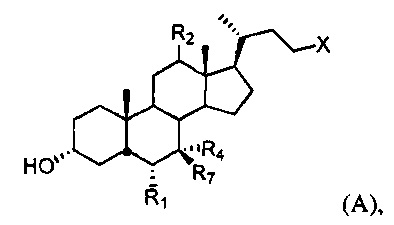
или его фармацевтически приемлемой соли, где R1, R2, R4, R7 и X описаны в данном документе.
[53] Настоящее изобретение также относится к способу уменьшения или подавления воспаления в легком, включающему введение субъекту, нуждающемуся в этом, соединения формулы А или его фармацевтически приемлемой соли, где R1, R2, R4, R7 и X описаны в данном документе.
[54] Настоящее изобретение также относится к способу стимуляции восстановления легкого, включающему введение субъекту, нуждающемуся в этом, соединения формулы А или его фармацевтически приемлемой соли, где R1, R2, R4, R7 и X описаны в данном документе.
[55] В одном варианте осуществления способы по настоящему изобретению включают введение субъекту, нуждающемуся в этом, соединения, описанного в данном документе. Например, соединение представляет собой соединение, описанное в абзацах [00067]-[00082].
[56] Настоящее изобретение дополнительно относится к применению соединения формулы А:
или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[57] Настоящее изобретение также относится к применению соединения формулы А или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для уменьшения или подавления воспаления в легком у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[58] Настоящее изобретение также относится к соединению формулы А или его фармацевтически приемлемой соли для стимуляции восстановления легкого у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[59] В одном варианте осуществления соединение для применений настоящего изобретения в изготовлении лекарственного препарата представляет собой соединение, описанное в данном документе. Например, соединение представляет собой соединение, описанное в абзацах [00067]-[00082].
[60] Настоящее изобретение также относится к соединению формулы А:
или его фармацевтически приемлемой соли для лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[61] Настоящее изобретение также относится к соединению формулы А или его фармацевтически приемлемой соли для уменьшения или подавления воспаления в легком у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[62] Настоящее изобретение также относится к соединению формулы А или его фармацевтически приемлемой соли для стимуляции восстановления легкого у субъекта, где R1, R2, R4, R7 и X определены в данном документе.
[63] В одном варианте осуществления соединение для лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы, или для уменьшения или подавления воспаления в легком, или для стимуляции восстановления легкого представляет собой соединение, описанное в данном документе. Например, соединение представляет собой соединение, описанное в абзацах [00067]-[00082].
[64] Соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А:
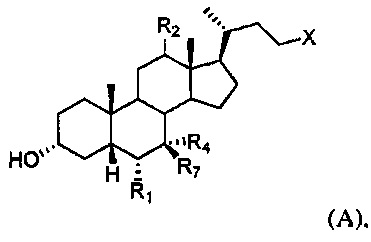
или его фармацевтически приемлемую соль, где
R1 представляет собой водород или незамещенный С1-С6алкил;
R2 представляет собой водород или α-гидроксил;
X представляет собой С(O)ОН, C(O)NH(CH2)mSO3H, C(O)NH(CH2)nCO2H или OSO3H;
R4 представляет собой гидроксил или водород;
R7 представляет собой гидроксил или водород; m равняется 1, 2 или 3; и n равняется 1, 2 или 3.
[65] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соль соединения формулы А. В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой катионную соль соединения формулы А, где X превращается в соответствующий анион. Например, X превращается в анион, выбранный из С(O)O-, 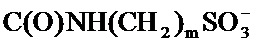
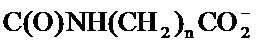
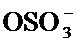
[66] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой натриевую соль соединения формулы А, например, соединения формулы А, где X превращается в 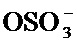
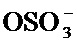
[67] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где R1 представляет собой незамещенный С1-С6алкил. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где R1 представляет собой незамещенный С1-С3алкил. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где R1 выбран из метила, этила и пропила. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где R1 представляет собой этил.
[68] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где X выбран из С(O)ОН, C(O)NH(CH2)mSO3H и C(O)NH(CH2)nCO2H. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где X выбран из С(O)ОН, C(O)NH(CH2)SO3H, C(O)NH(CH2)CO2H, C(O)NH(CH2)2SO3H, C(O)NH(CH2)2CO2H. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где X представляет собой С(O)ОН. В другом варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где X представляет собой OSO3H. В другом варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где X представляет собой 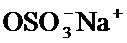
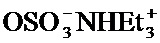
[69] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы А, где R1 выбран из метила, этила и пропила, R4 представляет собой OH, R7 представляет собой H, и R2 представляет собой H.
[70] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы I или IA:
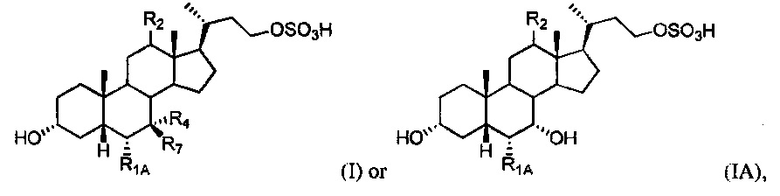
или его фармацевтически приемлемую соль, где
R1A представляет собой водород или незамещенный С1-С6алкил;
R2 представляет собой водород или α-гидроксил;
R4 представляет собой гидроксил или водород; и R7 представляет собой гидроксил или водород.
[71] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой натриевую соль формулы I или IA. В одном варианте осуществления соединение по настоящему изобретению представляет собой триэтиламмониевую соль соединения формулы I или IА.
[72] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы II или IIА:
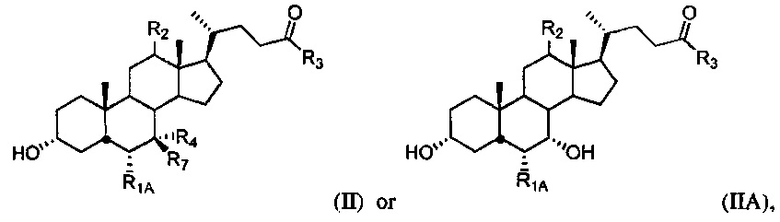
или его фармацевтически приемлемую соль, где
R1A представляет собой водород или незамещенный С1-С6алкил;
R2 представляет собой водород или α-гидроксил;
R3 представляет собой гидроксил, NH(CH2)mSO3H или NH(CH2)nCO2H;
R4 представляет собой гидроксил или водород; и R7 представляет собой гидроксил или водород.
[73] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы II или IIА, где R3 выбран из OH, NH(CH2)SO3H, NH(CH2)CO2H, NH(CH2)2SO3H и NH(CH2)2CO2H. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формул II или IIА, где R3 представляет собой OH.
[74] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы A, I, IA, II или IIА, где R2 представляет собой водород.
[75] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формул А, I или II, где R4 представляет собой гидроксил, и R7 представляет собой водород.
[76] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы I, IA, II или IIА, где R1A представляет собой незамещенный С1-С6алкил. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы I, IA, II или IIА, где R1A представляет собой незамещенный C1-С3алкил. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы I, IA, II или IIА, где R1A выбран из метила, этила и пропила. В дополнительном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение формулы I, IA, II или IIА, где R1A представляет собой этил.
[77] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение, выбранное из
или их фармацевтически приемлемой соли.
[78] Соединение 1 также называется 6ECDCA или обетихолевой кислотой (ОСА).
[79] В одном варианте осуществления соединение, применяемое в настоящем изобретении, представляет собой соединение, выбранное из
[80] Соединения формулы I, IA, II или IIА представляют собой подмножества соединений формулы А. Признаки, описанные в данном документе для соединений формулы А, относятся в равной степени к соединениям формулы I, IA, II или IIА.
[81] Соединения по настоящему изобретению могут быть без труда получены специалистами в данной области техники. В частности, соединения по настоящему изобретению могут быть получены в соответствии с опубликованными процедурами из патентов США №№7786102, 7994352 и/или 7932244.
[82] Соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения или ослабления симптома множества заболеваний или состояний дыхательной системы. Заболеваниями и состояниями дыхательной системы считаются такие, которые поражают дыхательную или легочную систему организма. Не желая ограничиваться теорией, соединения по настоящему изобретению пригодны для лечения, уменьшения риска, предупреждения или ослабления симптома множества заболеваний или состояний дыхательной системы путем повышения выработки NO, понижающей регуляции эндотелина (ЕТ)-1, уменьшения проницаемости легкого и/или подавления передвижения лейкоцитов или фиброцитов из кровотока в воспаленные ткани.
[83] В одном варианте осуществления соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения или ослабления симптома заболеваний или состояний дыхательной системы, вызванных воспалением, аутоиммунными заболеваниями, такими как склеродермия и ревматоидный артрит, острое повреждение легких (ALI), острый респираторный дистресс-синдром (ARDS), врожденные пороки сердца, тромбы в легких (эмболия легочной артерии), застойная сердечная недостаточность, порок клапанов сердца, ВИЧ-инфекция, длительные периоды низкого уровня кислорода в крови, злоупотребление различными лекарственными препаратами и веществами и/или синдром обструктивного апноэ сна, или связанных с ними. В одном варианте осуществления заболевания или состояния дыхательной системы вызваны воспалением легких или связаны с ним. В другом варианте осуществления заболевания или состояния дыхательной системы вызваны ALI или ARDS или связаны с ними.
[84] В одном варианте осуществления соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения или ослабления симптома заболеваний или состояний дыхательной системы, вызванных поражениями или повреждениями легких или связанных с ними. В одном варианте осуществления поражения или повреждения легких являются результатом, например, применения лекарственных препаратов, злоупотребления веществами или патологического процесса. В одном варианте осуществления поражения или повреждения легких вызывают воспаление в легких.
[85] В одном варианте осуществления соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения или ослабления симптома заболеваний и состояний дыхательной системы, вызванных сужением кровеносных сосудов легких или связанных с ним. В одном варианте осуществления сужение кровеносных сосудов легких является результатом, например, применения лекарственных препаратов, злоупотребления веществами или патологического процесса. В одном варианте осуществления сужение кровеносных сосудов легких (например, артерий, вен и капилляров) вызывает уменьшение количества крови, протекающей по кровеносным сосудам. В одном варианте осуществления сужение кровеносных сосудов легких вызывает повышение давления крови, протекающей по кровеносным сосудам легких.
[86] Заболевания и состояния дыхательной системы включают, без ограничения, хроническую обструктивную болезнь легких (COPD), эмфизему, астму, идиопатический легочный фиброз, пневмонию, туберкулез, муковисцидоз, бронхит, легочную гипертензию (например, идиопатическую легочную артериальную гипертензию (IРАН) (также известную как первичная легочная гипертензия (РРH)) и вторичная легочная гипертензия (SPH)), интерстициальную легочную болезнь и рак легких.
[87] Интерстициальная легочная болезнь возникает, если интерстициальная ткань, которая выстилает альвеолы в легких, подвергается рубцеванию. Рубцевание вызывает воспаление данных тканей, воздействуя на их способность поглощать кислород. Причины интерстициальной легочной болезни включают, без ограничения, загрязнение окружающей среды, повреждение легочной ткани в результате травмы или инфекции и различные заболевания соединительной ткани.
[88] Астма поражает миллионы человек во всем мире, от детей до населения пожилого возраста. Астма обусловлена сокращением мышц дыхательных путей, избыточной выработкой слизи и отеком или воспалением дыхательных путей или их разветвлений в легких. Констрикция и воспаление дыхательных путей приводят к уменьшению потока воздуха к легким, о чем часто свидетельствуют свистящие звуки, которые может производить человек с приступом астмы. Лечение и ведение астмы определяют индивидуально, и они зависят от факторов, включающих тяжесть и частоту приступов астмы, которые наблюдаются у пациента.
[89] Бронхит представляет собой хроническую инфекционную болезнь бронхиол в легких. Бронхиолы включают альвеолы, которые отвечают за газообмен в процессе дыхания. При инфицировании бронхиол ответ иммунной системы приводит в результате к отеку и увеличению выработки слизи в дыхательных путях, затрудняя процесс дыхания. Бронхит также проявляется хроническим болезненным кашлем.
[90] Эмфизема также поражает альвеолы до такой степени, что клетки, формирующие их, полностью разрушаются. При эмфиземе также разрушаются ворсинки в легких. Ворсинки представляют собой волосоподобные структуры, которые выталкивают чужеродные вещества из легких. При их гибели увеличивается вероятность инфицирования легких. Эффекты, вызываемые эмфиземой, являются постоянными и приводят в результате к затруднению процесса дыхания на протяжении всей жизни.
[91] Одной из наиболее распространенных форм COPD является эмфизема. COPD поражает альвеолы в легких, которые представляют собой маленькие альвеолярные мешочки, находящиеся на конце разветвлений легкого, которые доставляют кислород к мешочкам. Ослабление стенок мешочков препятствует достаточному потоку кислорода в мешочки и из них, вызывая постоянную нехватку воздуха.
[92] Муковисцидоз является еще одним распространенным заболеванием дыхательной системы, имеющим наследственный характер, что означает, что это состояние часто передается по роду. Генная мутация обуславливает то, что легкие поглощают избыточные количества воды и натрия, что приводит в результате к накоплению жидкости в легких, что снижает их способность поглощать достаточное количество кислорода для оптимального функционирования. Данное состояние постепенно усугубляется, поскольку клетки легких повреждаются все больше и в конечном итоге погибают.
[93] Идиопатический легочный фиброз (IPF) (или криптогенный фиброзирующий альвеолит (CFA)) является хронической, прогрессирующей формой заболевания легких, характеризующейся фиброзом поддерживающего каркаса (интерстиция) легких. По определению, выражение используют, только когда причина фиброза легких неизвестна ("идиопатический").
[94] Туберкулез представляет собой заболевание, которое может распространяться от человека к человеку по воздуху. Это бактериальная инфекция легких. Для достаточно эффективного уничтожения бактерий необходимы противотуберкулезные лекарственные средства. Однако у некоторых штаммов, вызывающих туберкулез, развилась устойчивость к антибактериальным лекарственным средствам, применяемым для лечения заболевания.
[95] В одном варианте осуществления соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения или ослабления симптома интерстициальной легочной болезни, астмы, бронхита, COPD, эмфиземы, муковисцидоза, IPF, туберкулеза или легочной гипертензии (например, ГРАН, РРН и SPH).
[96] В одном варианте осуществления соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения, или ослабления симптома COPD, эмфиземы, астмы, муковисцидоза или легочной гипертензии (например, IP АH, РРH и SPH).
[97] В одном варианте осуществления соединения, описанные в данном документе, пригодны для лечения, уменьшения риска, предупреждения или ослабления легочной гипертензии.
[98] Соединения, описанные в данном документе, также пригодны для уменьшения или подавления воспаления в легких. "Подавляя", "подавлять" или "подавление" означает препятствование возникновению, усугублению, сохранению, продолжению или рецидивированию воспаления. "Уменьшая", "уменьшать" или "уменьшение" означает снижение тяжести, частоты или длительности воспаления. Не желая ограничиваться теорией, соединения по настоящему изобретению уменьшают или подавляют воспаление путем уменьшения проницаемости легкого и/или подавления передвижения лейкоцитов или фиброцитов из кровотока в воспаленные ткани.
[99] Соединения, описанные в данном документе, также пригодны для стимуляции восстановления или нормализации состояния легкого. "Стимуляция" или "стимулировать" означает уменьшение времени восстановления или нормализации состояния легкого после повреждений или поражений легких или увеличение степени восстановления или нормализации состояния легких. В одном варианте осуществления соединения стимулируют восстановление или нормализацию состояния легких путем уменьшения или подавления воспаления в легких.
[100] В одном варианте осуществления соединения, описанные в данном документе, являются агонистами FXR. "Агонист FXR" означает, что соединения по настоящему изобретению имитируют действие FXR-рецептора. Например, соединения по настоящему изобретению связываются с тем же рецептором(рецепторами) или клеточной целью(целями), что и FXR. Например, соединения по настоящему изобретению регулируют или запускают сигнальный путь FXR. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря тому, что они регулируют или запускают сигнальный путь FXR.
[101] В одном варианте осуществления соединения, описанные в данном документе, уменьшают количество фиброцитов, передвигающихся в легкие или в место повреждения в легких из кровотока. В одном варианте осуществления соединения, описанные в данном документе, уменьшают количество белка, пептида или хемокина, вырабатываемого фиброцитами в легких или в месте повреждения в легких. В одном варианте осуществления соединения, описанные в данном документе, уменьшают количество коллагена I или CXCL12, вырабатываемого фиброцитами в легких или в месте повреждения в легких.
[102] В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению количества фиброцитов, передвигающихся в легкие или в место повреждения в легких из кровотока. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению количества белка, пептида или хемокина, вырабатываемого фиброцитами в легких или в месте повреждения в легких. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению количества коллагена I или CXCL12, вырабатываемого фиброцитами в легких или в месте повреждения в легких.
[103] В одном варианте осуществления соединения, описанные в данном документе, увеличивают экспрессию диметиларгинин диметиламиногидролазы (DDAH). В одном варианте осуществления соединения, описанные в данном документе, уменьшают количество ω-N°,N°-асимметричного диметиларгинина (ADMA).
[104] В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря увеличению экспрессии DDAH. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению количества ADMA.
[105] В одном варианте осуществления соединения, описанные в данном документе, уменьшают чувствительность к инсулину. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению чувствительности к инсулину.
[106] В одном варианте осуществления соединения, описанные в данном документе, регулируют экспрессию гена, участвующего в воспалении. В одном варианте осуществления соединения, описанные в данном документе, уменьшают экспрессию провоспалительного фактора. В одном варианте осуществления соединения, описанные в данном документе, уменьшают экспрессию IL-6 или моноцитарного хемоатрактантного белка-1 (MCP-1).
[107] В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря регуляции экспрессии гена, участвующего в воспалении. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению экспрессии провоспалительного фактора. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря уменьшению экспрессии IL-6 или МСР-1.
[108] В одном варианте осуществления соединения, описанные в данном документе, регулируют экспрессию гена, участвующего в пролиферации эндотелия. В одном варианте осуществления соединения, описанные в данном документе, увеличивают экспрессию эндотелиального фактора роста. В одном варианте осуществления соединения, описанные в данном документе, увеличивают экспрессию VEGF или АСЕ2.
[109] В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря регуляции экспрессии гена, участвующего в пролиферации эндотелия. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря увеличению экспрессии эндотелиального фактора роста. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря увеличению экспрессии VEGF или АСЕ2.
[110] В одном варианте осуществления соединения, описанные в данном документе, регулируют экспрессию гена, участвующего в сигнальной системе NO. В одном варианте осуществления соединения, описанные в данном документе, увеличивают экспрессию гена, участвующего в сигнальной системе NO. В одном варианте осуществления соединения, описанные в данном документе, увеличивают экспрессию GC1a3, GC1b3, PKG1 или PDE5.
[111] В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря регуляции экспрессии гена, участвующего в сигнальной системе NO. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря увеличению экспрессии гена, участвующего в сигнальной системе NO. В одном варианте осуществления соединения, описанные в данном документе, пригодны для способов и применений по настоящему изобретению благодаря увеличению экспрессии GC1a3, GC1b3, PKG1 или PDE5.
[112] Как используется в данном документе, применимы следующие определения.
[113] "Алкил", а также другие группы с префиксом "алк", такие как алкокси и алканоил, означают углеродные цепи, которые могут быть линейными или разветвленными, и их комбинации, если углеродная цепь не определена иначе. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изо-, втор- и трет-бутил, пентил и гексил и т.п.
[114] Соединения, входящие в объем настоящего изобретения, могут иметь хиральные центры и, таким образом, могут существовать как рацематы, рацемические смеси, диастереоизомеры и одиночные энантиомеры. Все подобные формы следует понимать как входящие в объем настоящего изобретения.
[115] Термин "соединение по настоящему изобретению" или "соединения по настоящему изобретению", применяемый в данном документе, следует понимать как включающий соединение любой из формул A, I, IA, II и IIА или фармацевтически приемлемую солевую форму и любые соединения, непосредственно раскрытые в данном документе.
[116] Соединения по настоящему изобретению можно вводить в исходной форме или в виде их фармацевтически приемлемой соли. Фармацевтически приемлемые соли можно получить из исходного соединения, которое содержит основный или кислотный фрагменты, с помощью традиционных химических способов. Соли присоединения кислоты могут включать, без ограничения, такие соли, как гидрохлорид, гидробромид, йодгидрат, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензилсульфонат, п-толуолсульфонат и памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)). Некоторые соединения по настоящему изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Пригодные основные соли включают, без ограничения, соли алюминия, кальция, лития, магния, калия, натрия, цинка, диэтаноламина, диэтиламино и триэтиламино. Для обзора, фармацевтически приемлемые соли см. в S.М. Berge, L.D. Bighley and D. С.
Monkhouse, Pharmaceutical Salts, J. Pharm. Sci., 66 (1977), 1-19 и P.H. Stahl and C.G. Wermuth (eds.), Pharmaceutical Salts: Properties, Selection, and Use, Weinheim, Germany: Wiley and Zurich: Verlag Helvetica Chimica Acta, 2002 [ISBN 3-906390-26-8], включенные в данный документ посредством ссыпки. Любое упоминание исходного соединения или его соли, как следует понимать, включает все гидраты соединения и все полиморфные формы исходного соединения.
[117] В настоящем изобретении представлены способы лечения, уменьшения риска, предупреждения или ослабления симптома заболевания или состояния дыхательной системы, или уменьшения или подавления воспаления в легком, или стимуляции восстановления легкого у субъекта. Соединения применимы в лечении всех форм заболеваний и состояний дыхательной системы, в которые вовлечены воспаление и/или активация иммунного ответа. Соединения также применимы в лечении всех форм заболеваний и состояний дыхательной системы, в которое вовлечены увеличение выработки NO, понижающая регуляция эндотелина (ЕТ)-1, уменьшение проницаемости легкого, подавление передвижения лейкоцитов или фиброцитов из кровотока в воспаленные ткани или любая их комбинация.
[118] Настоящее изобретение также направлено на способ изготовления лекарственного препарата для лечения, уменьшения риска, предупреждения или ослабления заболевания или состояния дыхательной системы, или для уменьшения или подавления воспаления в легком, или для стимуляции восстановления легкого у субъекта.
[119] Как применяется в данном документе, "субъект" означает человека или животное (в случае животного чаще всего млекопитающее). В одном аспекте субъектом является человек. Субъект может считаться нуждающимся в лечении.
[120] Как применяется в данном документе, "фармацевтически приемлемое вспомогательное вещество" или "фармацевтически приемлемый носитель" означает фармацевтически приемлемое вещество, композицию или среду, участвующие в придании формы или консистенции фармацевтической композиции. Каждое вспомогательное вещество или носитель должны быть совместимыми с другими ингредиентами фармацевтической композиции при смешивании, так что не допускаются взаимодействия, которые могли бы значительно уменьшить эффективность соединения по настоящему изобретению при введении субъекту, и взаимодействия, результатом которых могли бы быть фармацевтические композиции, не являющиеся фармацевтически приемлемыми. Кроме того, каждое вспомогательное вещество или носитель должны, разумеется, иметь достаточно высокую степень чистоты, что делает их фармацевтически приемлемыми.
[121] Соединение по настоящему изобретению можно вводить в виде фармацевтической композиции. Соединение по настоящему изобретению и фармацевтически приемлемое вспомогательное вещество или вспомогательные вещества будут, как правило, составлены в лекарственной форме, адаптированной для введения субъекту посредством желаемого пути введения. Например, лекарственные формы включают лекарственные формы, адаптированные для (1) перорального введения, например, таблетки, капсулы, каплеты, пилюли, пастилки, порошки, сиропы, настойки, суспензии, растворы, эмульсии, саше и крахмальные облатки; (2) парентерального введения, например, стерильные растворы, суспензии и порошки для разведения; (3) трансдермального введения, например, трансдермальные пластыри; (4) ректального введения, например, суппозитории; (5) ингаляции, например, аэрозоли, растворы и сухие порошки и (6) местного применения, например, крема, мази, лосьоны, растворы, пасты, спреи, пенки, гели и пластыри.
[122] Пригодные фармацевтически приемлемые вспомогательные вещества будут различаться в зависимости от конкретной выбранной лекарственной формы. Кроме того, пригодные фармацевтически приемлемые вспомогательные вещества могут быть выбраны для конкретной функции, которую они могут выполнять в композиции. Например, определенные фармацевтически приемлемые вспомогательные вещества могут быть выбраны благодаря своей способности облегчать получение единообразных лекарственных форм. Определенные фармацевтически приемлемые вспомогательные вещества могут быть выбраны благодаря своей способности облегчать получение стабильных лекарственных форм. Определенные фармацевтически приемлемые вспомогательные вещества могут быть выбраны благодаря своей способности облегчать перенос или транспортировку соединения или соединений по настоящему изобретению, введенных субъекту, от одного органа или части тела к другому органу или части тела. Определенные фармацевтически приемлемые вспомогательные вещества могут быть выбраны благодаря своей способности повышать комплаенс.
[123] Пригодные фармацевтически приемлемые вспомогательные вещества включают следующие типы вспомогательных веществ: разбавители, наполнители, связующие вещества, разрыхлители, смазывающие вещества, скользящие вещества, средства для гранулирования, покрывающие средства, увлажняющие средства, растворители, сорастворители, суспендирующие вещества, эмульгаторы, подсластители, вкусовые вещества, маскирующие вкус средства, красители, средства против слеживания, смачивающие средства, хелатирующие средства, пластификаторы, средства, увеличивающие вязкость, антиоксиданты, консерванты, стабилизаторы, поверхностно-активные вещества и буферные вещества. Специалисту в данной области будет понятно, что определенные фармацевтически приемлемые вспомогательные вещества могут выполнять более одной функции и могут выполнять альтернативные функции в зависимости от того, какое количество вспомогательного вещества присутствует в составе, и того, какие еще ингредиенты присутствуют в составе.
[124] Специалисты в данной области обладают знаниями и навыками в данной области техники, которые позволят им выбрать пригодные фармацевтически приемлемые вспомогательные вещества в необходимых количествах для применения в настоящем изобретении. Кроме того, существует ряд источников, доступных для специалиста в данной области, в которых описываются фармацевтически приемлемые вспомогательные вещества и которые могут быть полезными при выборе пригодных фармацевтически приемлемых вспомогательных веществ. Примеры включают Remington's Pharmaceutical Sciences (Mack Publishing Company), The Handbook of Pharmaceutical Additives (Gower Publishing Limited) и The Handbook of Pharmaceutical Excipients (the American Pharmaceutical Association and the Pharmaceutical Press).
[125] Фармацевтические композиции по настоящему изобретению получают с помощью техник и способов, известных специалистам в данной области. Некоторые из способов, обычно применяемых в данной области техники, описаны в Remington's Pharmaceutical Sciences (Mack Publishing Company).
[126] Соединения по настоящему изобретению также могут быть соединены с растворимыми полимерами в качестве нацеливаемых носителей лекарственных средств. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламид-фенол, полигадроксиэтиласпартамид-фенол или полиэтиленоксидполилизин, замещенный пальмитоиловыми остатками. Кроме того, соединения по настоящему изобретению могут быть соединены с классом биоразлагаемых полимеров, пригодных для достижения контролируемого высвобождения лекарственного средства, например, полимолочной кислотой, полепсилон капролактоном, полигидроксимасляной кислотой, сложными полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрплатами и сшитыми или амфипатическими блок-сополимерами гидрогелей.
[127] В одном варианте осуществления настоящее изобретение направлено на твердую лекарственную форму для перорального введения, такую как таблетка или капсула, содержащая безопасное и эффективное количество соединения по настоящему изобретению и разбавитель или наполнитель. Пригодные разбавители и наполнители включают лактозу, сахарозу, декстроза, маннит, сорбит, крахмал (например, кукурузный крахмал, картофельный крахмал и предварительно клейстеризованный крахмал), целлюлозу и ее производные (например, микрокристаллическую целлюлозу), сульфат кальция и двухосновный фосфат кальция. Твердая лекарственная форма для перорального введения может дополнительно содержать связующее вещество. Пригодные связующие вещества включают крахмал (например кукурузный крахмал, картофельный крахмал и предварительно клейстеризованный крахмал), желатин, гуммиарабик, альгинат натрия, альгиновую кислоту, трагакант, гуаровую камедь, повидон и целлюлозу и ее производные (например, микрокристаллическую целлюлозу). Твердая лекарственная форма для перорального введения может дополнительно содержать разрыхлитель. Пригодные разрыхлители включают кросповидон, натрия крахмалгликолят, кроскармеллозу, альгиновую кислоту и карбоксиметилцеллюлозу натрия. Твердая лекарственная форма для перорального введения может дополнительно содержать смазывающее вещество. Пригодные смазывающие вещества включают стеариновую кислоту, стеарат магния, стеарат кальция и тальк.
[128] При необходимости составы с однократной дозировкой для перорального введения могут быть микроинкапсулированными. Также может быть получена композиция с пролонгированным или замедленным высвобождением, как, например, посредством покрытия или заключения материала на основе частиц в полимеры, воск или подобное.
[129] В другом варианте осуществления настоящее изобретение направлено на жидкую лекарственную форму для перорального введения. Жидкости для перорального введения, такие как раствор, сиропы и настойки, могут быть получены в лекарственной форме с однократной дозировкой таким образом, что данное количество содержит предварительно установленное количество соединения по настоящему изобретению. Сиропы могут быть получены путем растворения соединения по настоящему изобретению в подходящим образом ароматизированном водном растворе, тогда как настойки получают посредством использования нетоксичной спиртовой среды. Суспензии могут быть составлены путем диспергирования соединения по настоящему изобретению в нетоксичной среде. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и эфиры полиоксиэтиленсорбита, консерванты, вкусовая добавка, такая как масло мяты перечной или природные подсластители, или сахарин, или другие искусственные подсластители и т.п.
[130] В другом варианте осуществления настоящее изобретение направлено на пероральную ингаляцию или интраназальное введение. Подходящие для такого введения лекарственные формы, такие как аэрозольный состав или дозирующий ингалятор, могут быть получены с помощью традиционных техник.
[131] Для введения путем ингаляции соединения могут доставляться в форме подачи спрей-аэрозоля из упаковок под давлением или небулайзера с применением пригодного газа-вытеснителя, например, дихлордифторметана, трихлорфторметана, тетрафтордихлорэтана, гидрофторалкана, такого как тетрафторэтан или гептафторпропан, углекислого газа или другого пригодного газа. В случае аэрозоля под давлением единица дозирования может определяться путем обеспечения клапана для доставки отмеренного количества. Капсулы и кассеты из желатина для применения в ингаляторе или инсуффляторе могут быть составлены так, чтобы они содержали порошковую смесь соединения по настоящему изобретению и пригодной порошковой основы, такой как лактоза или крахмал.
[132] Сухие порошковые композиции для доставки в легкие при местном применении путем ингаляции могут, например, быть представлены в капсулах и кассетах, например, из желатина или блистерах, например, из листовой алюминиевой фольги для применения в ингаляторе или инсуффляторе. Порошковые смешанные составы, как правило, содержат порошковую смесь для ингаляции соединения по настоящему изобретению и пригодной порошковой основы (носителя/разбавителя/вспомогательного вещества), такой как моно-, ди- или полисахариды (например, лактозы или крахмала). Каждая капсула или кассета, как правило, может содержать от 20 мкг до 10 мг соединения по настоящему изобретению, необязательно в комбинации с другим терапевтически активным ингредиентом. В альтернативном случае, соединение по настоящему изобретению может быть представлено без вспомогательных веществ.
[133] Соответственно, корпус/дозатор лекарственного препарата относятся к типу, выбранному из группы, состоящей из резервуарного порошкового ингалятора (RDPI), мультидозового порошкового ингалятора (MDPI) и дозирующего ингалятора (MDI).
[134] Под резервуарным порошковым ингалятором (RDPI) понимают ингалятор с упаковкой в форме резервуара, пригодный для содержания множества (неотмеренных доз) лекарственного препарата в форме сухого порошка и включающий приспособление для отмеривания дозы лекарственного препарата из резервуара к положению вывода. Приспособления для отмеривания могут, например, включать мерную чашечку, которая может перемещаться из первого положения, где чашечка может наполняться лекарственным препаратом из резервуара, во второе положение, где отмеренная доза лекарственного препарата становится доступной для субъекта, производящего ингаляцию.
[135] Под мультидозовым порошковым ингалятором (MDPI) понимают ингалятор, пригодный для дозирования лекарственного препарата в форме сухого порошка, где лекарственный препарат содержится внутри мультидозовой упаковки, содержащей (или иным образом вмещающей) множество установленных доз (или их частей) лекарственного препарата. В одном варианте осуществления носитель имеет форму блистерной упаковки, но он также может, например, включать капсульную форму упаковки или носитель, на который был нанесен лекарственный препарат посредством любого пригодного способа, включая прессование, нанесение покрытия и вакуумную фиксацию.
[136] В случае мультидозовой доставки состав может быть предварительно отмеренным (например, как в Diskus, см. GB 2242134, патенты США №№6632666, 5860419, 5873360 и 5590645, или Diskhaler, см. GB 2178965,2129691 и 2169265, патенты США №№4778054, 4811731 и 5035237, раскрытия каждого из которых включены в данный документ посредством ссылки) или отмеряемым в процессе применения (например, как в Turbuhaler, см. ЕР 69715, или в устройствах, описанных в патенте США №6321747, раскрытия каждого из которых включены в данный документ посредством ссылки). Примером однодозового устройства является Rotahaler (см. GB 2064336 и патент США №4353656, раскрытия каждого из которых включены в данный документ посредством ссылки).
[137] Ингаляционное устройство Diskus содержит удлиненную полоску, состоящую из пластины-основы, имеющей некоторое количество углублений, расположенных по ее длине, и покрывающей пластины, спаянной с ней герметично, но с возможностью отслоения, ограничивая некоторое количество контейнеров, при этом каждый контейнер содержит состав для ингаляции, содержащий соединение по настоящему изобретению, необязательно в комбинации с лактозой. Полоска достаточно гибкая, чтобы ее можно было свернуть в рулон. Покровная пластина и пластина-основа предпочтительно будут иметь части, представляющие собой ведущий конец, которые не спаяны друг с другом, и по меньшей мере одна из указанных частей, представляющих собой ведущий конец, устроена так, чтобы быть прикрепленной к механизму намотки. Также, герметическая запайка между пластиной-основой и покровной пластиной простирается по всей их ширине. Покровная пластина может предпочтительно отслаиваться от пластины-основы в продольном направлении, начиная от первого конца указанной пластины-основы.
[138] В одном варианте осуществления мультидозовая упаковка представляет собой блистерную упаковку, включающую множество блистеров для содержания лекарственного препарата в форме сухого порошка. Блистеры, как правило, равномерно расположены для легкости высвобождения из них лекарственного препарата.
[139] В одном варианте осуществления мультидозовая блистерная упаковка включает многочисленные блистеры, расположенные большей частью по кругу на блистерной упаковке, имеющей форму диска. В другом варианте осуществления мультидозовая блистерная упаковка имеет удлиненную форму, что, например, включает полоску или ленту.
[140] В одном варианте осуществления мультидозовая блистерная упаковка ограничивается двумя элементами, соединенными друг с другом с возможностью отслоения. В патентах США №№5860419, 5873360 и 5590645 описаны упаковки лекарственного препарата этого общего типа. В устройстве обычно имеется участок открытия, содержащий отслаивающие приспособления для расслаивания элементов для получения доступа к каждой дозе лекарственного препарата. Соответственно, устройство адаптировано для применения в случаях, когда расслаиваемые элементы представляют собой удлиненные пластины, ограничивающие некоторое количество контейнеров с лекарственным препаратом, расположенных по их длине, при этом в устройстве имеется нумерующее приспособление для нумерования каждого контейнера в порядке очереди. Также устройство адаптировано для применения в случаях, когда одна из пластин представляет собой пластину-основу с некоторым количеством карманов в ней, а другая пластина представляет собой покровную пластину, каждый карман и прилегающая часть покровной пластины ограничивают соответствующий один из контейнеров, при этом устройство содержит движущее приспособление для отрывания покровной пластины и пластины-основы в участке открытия.
[141] Под дозирующим ингалятором (MDI) понимают дозатор лекарственного препарата, пригодный для дозирования лекарственного препарата в аэрозольной форме, где лекарственный препарат содержится в аэрозольном контейнере, пригодном для содержания аэрозольного состава лекарственного препарата с газом-вытеснителем в качестве основы. Аэрозольный контейнер, как правило, снабжен дозировочным клапаном, например, подвижным клапаном для высвобождения состава лекарственного препарата в аэрозольной форме субъекту. Аэрозольный контейнер, как правило, разработан для доставки предварительно установленной дозы лекарственного препарата при каждом приведении в действие при помощи клапана, который может открываться либо при нажатии на клапан, тогда как контейнер остается на месте, либо при нажатии на контейнер, тогда как клапан остается на месте.
[142] В случае, когда контейнер с лекарственным препаратом представляет собой аэрозольный контейнер, клапан, как правило, содержит корпус клапана, имеющий впускное отверстие, через которое аэрозольный состав лекарственного препарата может попадать в указанный корпус клапана, выпускное отверстие, через которое аэрозоль может выходить из корпуса клапана, и механизм открытия-закрытия, при помощи которого регулируется поток через указанное выпускное отверстие. Клапан может представлять собой подвижной клапан, в котором механизм открытия-закрытия содержит кольцевой уплотнитель и принимаемый кольцевым уплотнителем шток клапана с каналом подачи, при этом шток клапана выполнен с возможностью скользящего движения в кольце из положения "клапан закрыт" в положение "клапан открыт", где внутренняя часть корпуса клапана сообщается с внешней частью корпуса клапана посредством канала подачи.
[143] Как правило, клапан представляет собой дозировочный клапан. Отмеряемые объемы, как правило, составляют от 10 до 100 мкл, например, 25 мкл, 50 мкл или 63 мкл. В одном аспекте корпус клапана ограничивает дозирующую камеру для отмеривания количества состава лекарственного препарата и механизм открытия-закрытия, при помощи которого регулируется поток через впускное отверстие в дозирующую камеру. Предпочтительно, корпус клапана содержит отборную камеру, сообщающуюся с дозирующей камерой посредством второго впускного отверстия, при этом указанное впускное отверстие выполнено с возможностью регулирования при помощи механизма открытия-закрытия, посредством чего регулируется поток состава лекарственного препарата в дозирующую камеру.
[144] Клапан может также включать "клапан аэрозольной упаковки со свободным течением", имеющий камеру и шток клапана, выступающий в камеру и выполненный с возможностью движения относительно камеры от положения подачи к положению отсутствия подачи. Конфигурация штока клапана и внутренняя конфигурация камеры таковы, что отмеряемый объем ограничен в таком промежутке и так, что в процессе движения от положения подачи к положению отсутствия подачи шток клапана последовательно: (i) обеспечивает возможность свободного потока аэрозольного состава в камеру, (ii) ограничивает замкнутый отмеряемый объем для аэрозольного состава под давлением между наружной поверхностью штока клапана и внутренней поверхностью камеры и (iii) двигается вместе с замкнутым отмеряемым объемом внутри камеры без уменьшения объема замкнутого отмеряемого объема до тех пор, пока отмеряемый объем не начинает сообщаться с выпускным каналом, что позволяет дозировать отмеряемый объем аэрозольного состава под давлением. Клапан данного типа описан в патенте США
№5772085. Кроме того, интраназальная доставка соединений согласно настоящему изобретению является эффективной.
[145] Для составления эффективной фармацевтической композиции для интраназального введения лекарственный препарат должен легко доставляться во все отделы полостей носа (целевые ткани), где она выполняет свою фармакологическую функцию. Кроме того, лекарственный препарат должен сохранять контакт с целевыми тканями в течение относительно длительных периодов времени. Чтобы лекарственный препарат дольше сохранял контакт с целевой тканью, лекарственный препарат должен быть способен противостоять тем движущим силам в носовых ходах, которые выполняют функцию удаления частиц из носа. Такие движущие силы, называемые "мукоцилиарным клиренсом", как полагают, являются высоко эффективными в быстром удалении частиц из носа, например, в течение 10-30 минут от момента времени, когда частицы попали в нос.
[146] Другими желаемыми характеристиками композиции для интраназального введения являются следующие: она не должна содержать ингредиенты, вызывающие неудобство у пользователя, и она имеет удовлетворительные свойства стабильности и срока хранения, и она не включает составляющие, считающиеся вредными для окружающей среды, например, вещества, разрушающие озоновый слой.
[147] Пригодным режимом дозирования для состава по настоящему изобретению при введении в нос будет глубокое вдыхание субъектом после очистки полости носа. При ингаляции состав применяют к одной ноздре, прижимая в это время другую рукой. Данную процедуру затем повторяют для другой ноздри.
[148] Способ применения состава по настоящему изобретению к носовым ходам подразумевает применение насоса с предварительным сжатием. Например, насосом с предварительным сжатием является модель VP7, изготовляемая Valois SA. Такой насос является предпочтительным, поскольку он обеспечивает то, что состав не высвобождается до тех пор, пока не будет приложена достаточная сила, а иначе могут применяться меньшие дозы. Еще одним преимуществом насоса с предварительным сжатием является то, что обеспечивается распыление спрея, поскольку при этом состав не будет высвобождаться до тех пор, пока не будет достигнуто пороговое давление для эффективного распыления спрея. Как правило, модель VP7 может применяться с баллоном, способным вмещать 10-50 мл состава. Каждый спрей, как правило, доставляет 50-100 мкл такого состава, следовательно, модель VP7 способна обеспечить по меньшей мере 100 отмеренных доз.
[149] Распыляемые композиции для доставки в легкие при местном применении путем ингаляции могут, например, быть составлены в виде водных растворов или суспензий или в виде. аэрозолей, доставляемых из упаковок под давлением, таких как дозирующий ингалятор, с применением пригодного сжиженного газа-вытеснителя. Аэрозольные композиции, пригодные для ингаляции, могут представлять собой либо суспензию, либо раствор и, как правило, содержат соединение формулы (I), необязательно в комбинации с другим терапевтически активным ингредиентом и пригодным газом-вытеснителем, таким как фторуглерод или водород-содержащий хлорфторуглерод или их смеси, в частности, гидрофторалканы, например, дихлордифторметан, трихлорфторметан, тетрафтордихлорэтан, в особенности 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафтор-н-пропан или их смесь. Углекислый газ или другой пригодный газ также можно применять в качестве газа-вытеснителя. Аэрозольная композиция может не содержать вспомогательные вещества или может необязательно содержать дополнительные вспомогательные вещества для составления, хорошо известные из уровня техники, такие как поверхностно-активные вещества, например, олеиновая кислота или лецитин и сорастворители, например, этанол. Составы под давлением, как правило, хранятся в емкости {например, алюминиевой емкости), закрытой клапаном {например, дозировочным клапаном) и вставленной в мундштук, оснащенный загубником.
[150] Лекарственные препараты для введения посредством ингаляции желательно имеют нормируемый размер частиц. Оптимальный размер частиц для ингаляции в бронхиальной системе обычно составляет 1-10 мм, предпочтительно 2-5 мм. Частицы с размером более 20 мм, как правило, являются слишком большими, чтобы достигнуть мелких дыхательных путей при ингаляции. Чтобы достичь таких размеров частиц, размер частиц активного ингредиента при получении может быть уменьшен традиционными способами, например, с помощью микронизации. Желаемые фракции могут быть отделены с помощью воздушной сортировки или просеивания. Соответственно, частицы будут в кристаллической форме. Если применяют вспомогательное вещество, такое как лактоза, как правило, размер частиц вспомогательного вещества будет намного большим, чем у ингаляционного лекарственного препарата по настоящему изобретению. Если вспомогательным веществом является лактоза, она, как правило, будет присутствовать в виде измельченной лактозы, при этом не более 85% частиц лактозы будут характеризоваться MMD 60-90 мм, а не менее 15% будут характеризоваться MMD менее 15 мм.
[151] Интраназальные спреи могут быть составлены с водными или безводными средами с добавлением таких средств, как загустители, буферные соли, или кислота, или щелочь для регуляции pH, средства для регуляции изотоничности или антиоксиданты.
[152] Растворы для ингаляции посредством распыления могут быть составлены с водной средой с добавлением таких средств, как кислота или щелочь, буферные соли, средства для регуляции изотоничности или противомикробные вещества. Они могут быть стерилизованы посредством фильтрации или нагревания в автоклаве или представлены как нестерильный продукт.
[153] Фармацевтические композиции, адаптированные для трансдермального введения, могут быть представлены в виде отдельных пластырей, которые должны оставаться в близком контакте с эпидермисом субъекта в течение длительного периода времени. Например, активный ингредиент может доставляться из пластыря за счет ионтофореза, как в целом описано в Pharmaceutical Research, 3(6), 318 (1986).
[154] Фармацевтические композиции, адаптированные для местного применения, могут быть составлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел.
[155] Для способов лечения наружных тканей, например рта и кожи, композиции можно наносить в виде мази или крема для местного применения. Будучи составленным в мази, соединение по настоящему изобретению можно применять либо с парафиновой, либо со смешивающейся с водой мазевой основой. В альтернативном случае соединение по настоящему изобретению может быть составлено в креме с основой для крема "масло в воде" или основой "вода в масле".
[156] Фармацевтические композиции, адаптированные для парентерального введения, включают водные и безводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворенные вещества, которые обеспечивают изотоничность состава относительно крови предполагаемого реципиента; и водные и безводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Композиции могут быть представлены в однодозовых или мультидозовых контейнерах, например, запаянных ампулах и флаконах и могут храниться в сублимированном (лиофилизированном) состоянии, при этом требуется только добавить стерильный жидкий носитель, например, воду для инъекций непосредственно перед применением. Предназначенные для немедленного приема инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток.
[157] Соединения по настоящему изобретению можно вводить субъекту до или после повреждения легких. В одном варианте осуществления соединения по настоящему изобретению вводят субъекту после повреждения легких, например, повреждения легких, индуцированного или вызванного воспалением, аутоиммунными заболеваниями, такими как склеродермия и ревматоидный артрит, острым повреждением легких (ALI), острым респираторным дистресс-синдромом (ARDS), врожденными пороками сердца, тромбами в легких (эмболией легочной артерии), застойной сердечной недостаточностью, пороком клапанов сердца, ВИЧ-инфекцией, длительными периодами низкого уровня кислорода в крови, злоупотреблением различными лекарственными препаратами и веществами и/или синдромом обструктивного апноэ сна. В одном варианте осуществления соединения по настоящему изобретению вводят субъекту после того, как повреждение легких было индуцировано или вызвано воспалением, аутоиммунными заболеваниями, такими как склеродермия и ревматоидный артрит, ALI и/или ARDS. В одном варианте осуществления соединения по настоящему изобретению вводят субъекту после того, как повреждение легких было индуцировано или вызвано лекарственными препаратами и другими веществами, которые способны вызывать повреждения легких.
[158] Способы и применения по настоящему изобретению можно осуществлять посредством применения техник и материалов, известных из уровня техники. Например, способы и применения по настоящему изобретению можно осуществлять с помощью техник и материалов, описанных в Ghebremariam Y.Т. et al, PLoS One 8: e60653 (2013), Cowan K.N. et al., Nat Med 6:698-702 (2000) и Sakuma F. et al., Lung 177:77-88 (1999). Дополнительные техники и материалы для анализа или оценки соединений по настоящему изобретению известны из уровня техники. Например, соединения по настоящему изобретению можно анализировать или оценивать путем измерения ответа субъекта на соединения. В одном примере соединения по настоящему изобретению можно анализировать или оценивать путем измерения у субъекта количества или концентрации вещества (например, белка, пептида, хемокина, ДНК, РНК, мРНК, гена, метаболита и клеток), на количество или концентрацию которого у субъекта влияют (например, увеличивают, повышающе регулируют, повышают, уменьшают, понижающе регулируют и снижают) соединения по настоящему изобретению, например, посредством сигнального пути FXR. В одном примере соединения по настоящему изобретению можно анализировать или оценивать путем измерения количества лейкоцитов и/или фиброцитов, передвигающихся в легкие субъекта. В другом примере соединения по настоящему изобретению можно анализировать или оценивать путем измерения количества или концентрации белка, пептида или хемокина (например, коллагена, CXCL12, диметиларгинин диметиламиногидролазы (DDAH) и -ω-N°,N°-асимметричного диметиларгинина (ADMA)) у субъекта (например, в легких субъекта). В другом примере соединения по настоящему изобретению можно анализировать или оценивать путем измерения количества или концентрации гена, участвующего в воспалении, пролиферации эндотелия или сигнальной системе NO (например, провоспалительного фактора (например, IL-6 и МСР-1), эндотелиального фактора роста (например, VEGF и АСЕ2), GC1a3, GC1b3, PKG1 или PDE5).
Эквиваленты
[159] Специалисты в данной области узнают или будут способны установить, используя не более, чем обычные эксперименты, многие эквиваленты конкретных вариантов осуществления и способов, описанных в данном документе. Подразумевается, что такие эквиваленты охвачены объемом настоящего изобретения.
[160] Все патенты, заявки на патенты и литературные источники, цитируемые в данном документе, непосредственно включены в данный документ посредством ссылки.
[161] Следующие примеры являются иллюстративными и не должны толковаться каким-либо образом, ограничивающим объем настоящего изобретения.
Примеры
Пример 1. Получение соединения 1
[162] а) Получение метил-3α-гидрокси-7-кето-5β-холаната (III).
17.0 17,0 кг 3α-гидрокси-7-кето-5β-холановой кислоты, 68 кг метанола и 0,17 кг метансульфокислоты загружали в реактор. Реакционную смесь затем нагревали до 30-60°C в течение 1 часа и добавляли 25,5 кг деминерализованной воды. Полученную смесь затем перемешивали, охлаждали до 20-25°C до достижения надлежащего осаждения, затем дополнительно охлаждали до 0-15°C. Осадок фильтровали и промывали смесью воды и метанола и дополнительно сушили в сушильном шкафу при приблизительно 40°C. Таким образом, получали 15 кг метил-3α-гидрокси-7-кето-5β-холаната (III). Стехиометрический выход составлял 85,2%.
[163] b) Получение метил 3α-триметилсилокси-7-кето-5β-холаната (IV).
15.0 15,0 кг метил-3α-гидрокси-7-кето-5β-холаната, 45 кг толуола, 7,5 кг триэтиламина и 7,5 кг триметилхлорсилана загружали в реактор. Смесь нагревали до 70-80°C и продолжали перемешивать при этой температуре в течение приблизительно 1 часа, затем добавляли 37,5 кг воды и смесь перемешивали при 15-20°C. Нижнюю водную фазу затем отделяли и удаляли. Органическую фазу концентрировали до получения маслянистого остатка, к которому добавляли 15 кг тетрагидрофурана. Полученный таким образом раствор, содержащий метил-3α-триметилсилокси-7-кето-5β-холанат (IV), использовали на следующей стадии (с).
[164] c) Получение метил-3α,7α-ди-триметилсилилокси-5β-холаната (V).
30 кг тетрагидрофурана помещали в реакционный сосуд, затем смесь доводили до температуры от -90° до -60°C. Добавляли 9,8 кг 100% диизопропиламида лития и 9,3 кг триметилхлорсилана и вливали весь раствор тетрагидрофурана, полученного в (b) и содержащего метил-3α-триметилсилокси-7-кето-5β-холанат. Смесь затем перемешивали в течение приблизительно 1 часа при температуре от -60 до -90°C в течение 1 часа. Затем вливали раствор 4,50 кг бикарбоната натрия и 60 кг воды, и перемешивали смесь при 0-10°C, и нижнюю водную фазу отделяли и удаляли. Нижнюю фазу затем концентрировали до получения маслянистого остатка, к которому добавляли 45,0 кг метиленхлорида.
Раствор полученного таким образом метил-3α,7α-ди-триметилсилилокси-5β-холаната направляли на следующую стадию (d).
[165] d) Получение метил-3α-гидрокси-6-этилиден-7-кето-5β-холаната (VI). Весь раствор метил-3α,7α-ди-триметилсилилокси-5β-холаната в метиленхлориде, поступившего из предыдущей стадии, загружали в реактор и охлаждали до температуры от -90 до -60°C. Затем добавляли 1,97 кг ацетальдегида и 5,5 кг эфирата трехфтористого бора. Реакционную смесь продолжали перемешивать при вышеуказанной температуре в течение 2-4 часов, после чего ее нагревали до 30-35°C и держали при данной температуре в течение приблизительно 2-4 часов. Затем добавляли 60 кг воды. Полученную смесь перемешивали и отделяли водную фазу. Полученный таким образом раствор, содержащий метил-3α-гидрокси-6-этилиден-7-кето-5β-холанат, использовали на следующей стадии.
[166] е) Получение 3α-гидрокси-6-этилиден-7-кето-5β-холановой кислоты (VII). Раствор метил-3α-гидрокси-6-этилиден-7-кето-5β-холаната в метиленхлориде, полученный на предшествующей стадии, загружали в реактор. Растворитель затем удаляли посредством дистилляции до получения маслянистого остатка, к которому добавляли 15 кг метанола. Реакционную смесь затем нагревали до 45-50°C, и добавляли 7,5 кг 30% гидроксида натрия, и держали реакционную смесь при вышеуказанной температуре в течение приблизительно 1 часа. Затем добавляли 30 кг воды, а затем 45,0 кг метиленхлорида и 7,5 кг 85% фосфорной кислоты. Нижнюю органическую фазу отделяли и водную фазу вслед за этим удаляли. Растворитель удаляли из органической фазы посредством дистилляции до получения пастообразного остатка.
Приблизительно 37,5 кг этилацетата добавляли к остатку и смесь нагревали до 65-75°C, затем охлаждали до 10-35°C. Осадок получали, фильтровали, и промывали этилацетатом, и сушили. Получали 8,0 кг 3α-гидрокси-6-этилиден-7-кето-5β-холановой кислоты со стехиометрическим выходом 51,8%, рассчитанным по метил-3α-гидрокси-7-кето-5β-холанату.
[167] f) Получение 3α-гидрокси-6β-этил-7-кето-5β-холановой кислоты (IX).
8.0 8,0 кг 3α-гидрокси-6-этилиден-7-кето-5β-холановой кислоты, 48,0 кг воды, 5,1 кг 30% гидроксида натрия, 0,80 кг 5% палладия на углероде загружали в реактор. Реакционную смесь гидрогенизировали при давлении от 1 до 3 атмосфер до того момента, когда поглощение водорода больше не наблюдалось.
[168] g) Получение 3α-гидрокси-6α-этил-7-кето-5β-холановой кислоты (ГХ).
В конце реакции смесь нагревали до 95-105°C и держали при данной температуре в течение нескольких часов, чтобы обеспечить возможность превращения 3α-гидрокси-6β-этил-7-кето-5β-холановой кислоты (VIII) в соответствующий эпимер желаемой 3α-гидрокси-6α-этил-7-кето-5β-холановой кислоты (IX). Суспензию фильтровали и извлекали катализатор. 5,1 кг 85% фосфорной кислоты, 9,6 кг этилацетата добавляли к профильтрованному раствору и реакционную смесь нагревали до температуры от 40 до 70°C. Ее охлаждали до температуры от 0 до 30°C и осадок извлекали посредством фильтрации. После промывания этилацетатом осадок сушили в сушильном шкафу при 65°C. Получали 5,0 кг 3α-гидрокси-6α-этил-7-кето-5β-холановой кислоты. Стехиометрический выход: 62,2%. m.p. 185-188°C.
[169] h) Получение 3α,7α-дигидрокси-6α-этил-5β-холановой кислоты. 5,0 кг
3α-гидрокси-6α-этил-7-кето-5β-холановой кислоты, 5,0 кг воды, 2,50 кг гидроксида натрия загружали в реактор. Смесь затем нагревали до 70-105°C и вливали смесь борогидрида натрия, растворенного в 2,50 кг воды, смесь затем поддерживали теплой в течение 1 часа, охлаждали до комнатной температуры и добавляли 10,0 кг деминерализованной воды, 15,0 кг метиленхлорида и 3,00 кг 85% фосфорной кислоты. Смесь перемешивали, нижнюю органическую фазу отделяли и водную фазу удаляли. Кристаллизации неочищенного продукта достигали путем охлаждения органического раствора. Этот продукт растворяли в 50 кг деминерализованной воды и 1,10 кг 30% аммиака. Смесь затем перемешивали до получения полного количества раствора. Смесь держали при 20-50°C и вливали 1,50 кг фосфорной кислоты. Осажденную смесь перемешивали при температуре от 20 до 50°C, затем осадок извлекали посредством фильтрации, промывали водой и сушили. 4,50 кг 3α,7α-дигидрокси-6α-этил-5β-холановой кислоты. Стехиометрический выход: 89,6%.
Пример 2. Получение соединений 2-4
[170] 3α-Тетрагидропиранилокси-7-кето-5β-холан-24-овая кислота (2А).
3,4-Дигидро-2Н-пиран (1,74 мл, 19 ммоль) в диоксане (12 мл) медленно вливали каплями в раствор п-толуолсульфокислоты (115 мг, 0,6 мл) и 6α-этил-7-кетолитохолевой кислоты (5,0 г, 12 ммоль) в диоксане (55 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Затем добавляли воду (40 мл) и смесь по частям концентрировали в вакууме и экстрагировали с помощью ЕtOAc (4 раза/25 мл). Объединенные органические фракции промывали соляным раствором (1 раз/50 мл), сушили над безводным Na2SO4 и выпаривали в вакууме с получением 6 г соединения 2А. Неочищенное производное использовали на следующей стадии без дополнительной очистки.
[171] 3α-Тетрагидропиранилокси-6α-этил-7-кето-24-нор-5β-холан-23-йодид (3А). При облучении с помощью 300 Вт лампы накаливания с вольфрамовой нитью йод (5 г, 20 ммоль) в CCl4 (75 мл) добавляли каплями к раствору 2 (5,5 г, 11 ммоль) и тетраацетата свинца (4,9 г, 11 ммоль) в ССl4 (200 мл). Реакционную смесь перемешивали до получения постоянного цвета (18 ч.). Смесь охлаждали и фильтровали на Celite®. Органическую фазу промывали 5% раствором Na2S2O3, 5% NaOH, соляным раствором (15 мл), сушили над безводным Na2SO4 и выпаривали в вакууме. Остаток очищали посредством флэш-хроматографии на силикагеле с помощью смеси петролейного эфира/ЕtOAс 95/5 в качестве подвижной фазы с получением 4,6 г соединения 3А (выход 40%).
[172] 3α-гидрокси-6α-этил-7-кето-24-нор-5β-холан-23-йодид (4А). Соединение 3А (2,2 г, 3,8 ммоль) перемешивали в 37% растворе НСl в THF (50 мл) в течение ночи при комнатной температуре.
Реакционную смесь промывали насыщенным раствором NaHCO3 (20 мл), Н2O (20 мл) и соляным раствором (20 мл), сушили над Na2SO4 и выпаривали в вакууме с получением 1,4 г соединения 4А (выход 80%). Неочищенное производное использовали на следующей стадии без дополнительной очистки.
[173] 3α-Трет-бутилдиметилсилилокси-6α-этил-7-кето-24-нор-5β-холан-23-йодид (5А). К раствору 4А (1,4 г, 2,8 ммоль) в СН2Сl2 (30 мл) добавляли трет-бутилдиметилсилилхлорид (496 мг, 3,22 ммоль) и имидазол (230 мг, 3,36 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь промывали насыщенным раствором NaHCO3 (30 мл), соляным раствором (30 мл) и сушили над безводным Na2SO4. Органическую фазу выпаривали в вакууме с получением 1,5 г соединения 5А (выход 87%). Неочищенное производное использовали на следующей стадии без дополнительной очистки.
[174] 3α-Трет-бутилдиметилсилилокси-6α-этил-7-кето-24-нор-5β-холан-23-ол (6А). К раствору 5 (1,2 г, 1,96 ммоль) в ацетоне (12 мл) добавляли Ag2CO3 (1,1 г, 3,9 ммоль). Реакционную смесь нагревали с обратным холодильником в течение ночи, а затем охлаждали до r.t., фильтровали на Celite®, промывали ацетоном и объединенные органические фазы концентрировали с получением 1 г соединения 6А. Неочищенное производное использовали на следующей стадии без дополнительной очистки.
[175] 3α-Трет-бутилдиметилсилилокси-7α-гидрокси-6α-этил-24-нор-5β-холан-23-ол (7А).
К раствору 6А (1 г, 1,96 ммоль) в смеси THF (50 мл) и Н2O (12,5 мл) добавляли NaBH4 (740 мг, 19,6 ммоль) и смесь перемешивали при комнатной температуре в течение 1 часа и 30 минут. Реакционный раствор по частям концентрировали в вакууме и экстрагировали с помощью СНСl3 (3 раза/20 мл). Объединенные органические слои промывали соляным раствором (1 раз/50 мл), сушили над безводным Na2SO4 и выпаривали в вакууме. Неочищенный остаток очищали с помощью флэш-хроматографии на силикагеле с использовании смеси СН2Сl2:МеОН 99:1 в качестве подвижной фазы с получением 0,8 г 7А (выход 81%).
[176] 3α-Трет-бутилдиметилсилилокси-7α-гидрокси-6α-этил-24-нор-5β-холан-23-сульфат триэтил аммониевая соль (8А). К раствору 7А (0,5 г, 0,99 ммоль) в THF (7 мл), охлажденному до -3°C, добавляли Et3N (0,3 мл, 2,1 ммоль) и полученную в результате смесь перемешивали в течение 10 мин. Добавляли ClSO3H (0,1 мл, 1,5 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли воду (10 мл) и смесь экстрагировали с помощью СН2Сl2 (3 раза/15 мл), сушили над безводным Na2SO4 и выпаривали в вакууме. Неочищенное сульфатное производное использовали для следующей стадии без дополнительной очистки.
[177] Триэтиламмониевая соль 3α,7α,23-тригидрокси-6α-этил-24-нор-5β-холан-23-сульфата (соединение 4). К раствору 8А (0,5 г, 0,77 ммоль) в ацетоне (8 мл) добавляли PdCl2(CH3CN)2 (10 мг, 0,05 экв.) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали, концентрировали в вакууме и очищали с помощью Lichroprep RP-8 при среднем давлении с использованием смеси МеОН/Н2O 8/2 в качестве подвижной фазы с получением 0,115 г 4, mp 118-121°C.
[178] Натриевая соль 3α,7α,23-тригидрокси-6α-этил-24-нор-5β-холан-23-сульфата (соединение 3). К раствору 8А (0,4 г, 0,72 ммоль) в смеси ацетона (4 мл) и Н2O (0,08 мл) добавляли PdCl2(CH3CN)2 (10 мг, 0,05 экв.) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали через Celite® и концентрировали в вакууме. Полученный в результате остаток обрабатывали метаноловым раствором 10% NaOH в течение 2 ч. Полученную в результате смесь концентрировали в вакууме и подвергали жидкостной очистке при среднем давлении с использованием смеси СН3ОН/Н2O (7:3) в качестве подвижной фазы с получением 0,09 г 3 (выход 25%).
Пример 3. Способ активации FXR с помощью соединения 1 улучшает состояние в мышиной модели индуцированного блеомицином фиброза легких.
[179] При создании мышиной модели индуцированный блеомицином фиброз легких индуцировали у мышей С57В1/6 дикого типа и FXR-/- мышей (самок, возрастом 6-8 недель). Группы обработки включали:
мышей WT: А - солевой раствор (день 0); В - блеомицин (день 0); С - блеомицин (день 0) - соединение 1 (также называемое 6ECDCA) (5 мг/кг, ежедневно);
FXR-/- мыши: D - солевой раствор (день 0); Е - блеомицин (день 0); F - блеомицин (день 0) соединение 1 (также называемое 6ECDCA) (5 мг/кг, ежедневно).
[180] Через 22 дня мышей умерщвляли и проводили последующие анализы: (1) окрашивание срезов легкого Н&Е и сириус красным; (2) количественное определение коллагена I в легком с помощью qRT-PCR и анализа коллагена Sircol; (3) количественное определение мРНК FXR, SHP и CXCL12 с помощью qRT-PCR и (4) количественное определение белка CXCL12 в гомогенатах легкого с помощью ELISA.
[181] Не желая ограничиваться теорией, полагают, что соединения по настоящему изобретению активируют FXR и оказывают влияние при улучшении состояния при фиброзе легких путем (1) уменьшения выработки коллагена I фибробластами-резидентами, и (2) уменьшения выработки CXCF12 фибробластами-резидентами, и, как следствие, уменьшения рекрутинга циркулирующих фиброцитов в место повреждения.
[182] Активация FXR снижает выработку коллагена I и CXCR12 фибробластами-резидентами. В частности, по истечении 24-часового периода без добавления компонентов среды клетки мышиной клеточной линии легочных фибробластов (номер согласно АТСС CCL-206) стимулировали при помощи TGFβ1 (10 нг/мл) и 6ECDCA (10 мкМ) или при их отсутствии в течение 24 часов, а затем анализировали экспрессию генов FXR, SHP и Col I с помощью qRT-PCR. По истечении 24-часового периода без добавления компонентов среды клетки мышиной клеточной линии легочных фибробластов (номер согласно АТСС CCF-206) стимулировали при помощи TNFα (10 нг/мл) и 6ECDCA (10 мкМ) или при их отсутствии в течение 24 часов, а затем анализировали экспрессию генов FXR, SHP и CXCL12 с помощью qRT-PCR.
[183] Индуцированная 6ECDCА понижающая регуляция Col I и CXCL12 была FXR-опосредованной. После периода ночи без добавления компонентов среды мышиную клеточную линию легочных фибробластов (номер согласно АТСС CCL-206) стимулировали при помощи TGFβ1 (10 нг/мл) и 6ECDCA (1 мкМ) или при их отсутствии в течение 24 часов - с блокированием FXR с помощью siRNA и без него - а затем анализировали экспрессию генов FXR, SHP, Col I и CXCL12 с помощью qRT-PCR.
Секрецию CXCL12 и Col I в надосадочной жидкости анализировали с помощью ELISA и анализа коллагена Sircol, соответственно.
[184] Индуцированная 6ECDCA понижающая регуляция Col I и CXCL12 была SHP-опосредованной. В частности, трансфекцию легочных фибробластов вектором, несущим химерную конструкцию HA-SHP, выполняли для индукции сверхэкспрессии SHP (WB-анализ экспрессии HA-SHP). Экспрессию Col I и CXCL12 анализировали (с помощью qRT-PCR) на начальном уровне и после стимуляции TGFβ1. Сверхэкспрессия SHP была достаточной для понижающей регуляции экспрессии Col I и CXCL12 изначально и после стимуляции TGFβ1.
[185] После периода ночи без добавления компонентов среды мышиную клеточную линию легочных фибробластов (номер согласно АТСС CCL-206) стимулировали при помощи/при отсутствии TGFβ1 (10 нг/мл) и 6ECDCA (1 мкМ) в течение 24 часов - с блокированием SHP с помощью siRNA и без него - а затем анализировали экспрессию генов FXR, SUP, Col I и CXCL 12 с помощью qRT-PCR. Секрецию CXCL 12 и Col I в надосадочной жидкости анализировали с помощью ELISA и анализа коллагена Sircol, соответственно.
[186] Измеряли уменьшение СХСЕ12-опосредованного рекрутинга циркулирующих фиброцитов в месте повреждения. Количество мышиных CD45+/Col I+/CXCR+ фиброцитов в легких мышей с индуцированным блеомицином фиброзом легких (обработанных и необработанных) определяли с помощью FACS-анализа.
[187] Выделение человеческих циркулирующих фиброцитов выполняли следующим образом: РВМС выделяли из лейкаферезной массы, затем культивировали в DMEM с 20% FCS в течение 1 недели. Фиброциты очищали посредством иммуномагнитного негативного отбора для извлечения В- и Т лимфоцитов и моноцитов/макрофагов (способ с использованием парамагнитных микрошариков Dynabeads). Очищенные фиброциты возвращали, чтоб культивировать их в течение дополнительных 5 дней перед FACS-анализом на чистоту (CD45+/Col I+/CXCR4+ клеток) и их введением SCID мышам.
[188] В частности, индукцию блеомицином фиброза легких, обработку с помощью 6ECDCA и анализ инфильтрации человеческими фиброцитами легких выполняли следующим образом.
[189] Индукция фиброза легких посредством интратрахеального введения блеомицина SCID мышам: Через 4 дня все мыши получали инъекции в хвостовую вену 1*106 очищенных человеческих фиброцитов. Группы: А - солевой раствор; В - блеомицин; С – блеомицин + 6ECDCA; D – блеомицин + антитела к мышиному CXCL12. Через еще 4 дня количество человеческих CD45+/Col I+/CXCR4+ фиброцитов в легких анализировали с помощью FACS-анализа.
[190] Дополнительный анализ: окрашивание срезов легкого Н&Е и сириус красным; количественное определение коллагена I в легком с помощью qRT-PCR и анализа коллагена Sircol; количественное определение мРНК FXR, SHP и CXCL 12 с помощью qRT-PCR; количественное определение белка CXCL 12 в гомогенатах легкого с помощью ELISA.
Пример 4. Исследования 6ECDCA на "солечувствительных" крысах Dahl
[191] ADMA (ω-N°,N°-асимметричный диметиларгинин) является главной причиной эндотелиальной дисфункции, которая приводит к образованию бляшек, их росту и разрушению. См. Coke, Circulation, 109 (2004): 1813-1819. Многие заболевания ассоциированы с повышенными уровнями ADMA. Эти заболевания включают, например, окклюзионное поражение вен сетчатки, раннюю стадию аутосомно-доминантной поликистозной болезни почек, протеинурию, вторичный амилоидоз и эндотелиальную дисфункцию, спорадический фокально-сегментарный гломерулосклероз у детей, преэклампсию, хроническую тромбоэмболическую легочную гипертензию, неосложненный сахарный диабет 1 типа, легочную гипертензию, серповидноклеточную анемию, депрессию, застойную сердечную недостаточность, болезнь Альцгеймера (также есть сообщения о снижении уровней ADMA), заболевание почек, ассоциированное с заболеванием сердечно-сосудистой системы, гиперхолестеринемию, гипергомоцистеинемию, гипертензию, атеросклероз и инсульт. DDAH (диметиларгинин диметиламиногидролаза) посредством метаболизирования ADMA оказывает благоприятное влияние на кровяное давление и инсулинорезистентность. Сверхэкспрессия DDAH может увеличить синтез NO и снижает кровяное давление. Н. Dayoub et al., Circulation 108 (24): 3042-3047. Сверхэкспрессия DDAH может также повысить чувствительность к инсулину. Sydow et al., Arterioscler Throm Vase Biol. 28 (2008): 692-697. ADMA играет роль в развитии солечувствительной гипертензии. Н. Matsuoka et al., Hypertension 1997, 29: 242-247.
[192] Нижеизложенный эксперимент показал, что 6ECDCA может повышать чувствительность к инсулину и снижать кровяное давление у крыс с солечувствительной гипертензией, путем увеличения экспрессии DDAH и уменьшения уровней ADMA.
[193] Для создания модели солечувствительной гипертензии на грызунах использовали ("солечувствительных" Dahl) DSS-крыс (например, Rapp). У DSS-крыс (рацион с 8% NaCl) наблюдаются определенные характеристики, включая, например, альбуминурию, гипертрофию аорты и сердца, сердечную недостаточность с застоем крови в легких, инсулинорезистентность, гиперинсулинемию, гипертриглицеридемию и гиперлипидемию. В частности, для создания использованной для исследования модели на грызунах использовали самцов DSS-крыс в возрасте 4 недели (например, SS/JrHsd) от Harlan Laboratories. Нормальный рацион DSS-крыс содержал 0,49% NaCl, а рацион с высоким содержанием соли содержал 8% NaCl (например, Teklad Custom Research Diet). Крыс разделяли на четыре группы (называемые в данном документе крысами DSS-исследования).
Группа 1; рацион с нормальным содержанием соли (1% метилцеллюлоза) (N=6).
Группа 2; рацион с высоким содержанием соли (среда; 1% MC) (N=9).
Группа 3; рацион с высоким содержанием соли (6ECDCA, 10 мг/кг/сутки) (N=6).
Группа 4; рацион с высоким содержанием соли (6ECDCA, 30 мг/кг/сутки) (N=9).
[194] Выполняли анализы следующих показателей: уровни ADMA и NO в сыворотке крови, и моче, и тканях (например, в печени, мышцах и почках), кровяное давление и частота сердечных сокращений, глюкоза крови и инсулин натощак (HOMA-IR), ipGTT (IR-индекс) и белок и креатинин в моче. Также могут быть выполнены дополнительные исследования, такие как анализ электролитов (Na+), гистологический анализ и анализ экспрессии TGF-бета в почках, экспрессии и активности DDAH в печени, скелетных мышцах и почках и уровня Akt-фосфорилирования в печени, скелетных мышцах и почках.
[195] 6ECDCA вводили перорально ежедневно в течение 6 недель. Сбор крови и мочи осуществляли в неделю 0 и неделю 6 и анализировали с помощью способов, известных из уровня техники. Измерение кровяного давления осуществляли в неделю 0, 1, 2, 4 и 6 с помощью устройств хвостовых манжет, которое проводили на модельных животных, находящихся в сознании, и которое было неинвазивным. Данные о кровяном давлении также получали посредством катетера, что осуществляли после умерщвления модельного животного. Глюкозотолерантный тест проводили в неделю 5. Функцию почек анализировали путем измерения объема мочи, количества белка и креатинина в образце мочи, собранном за 24 часа. Гистологический анализ осуществляли при помощи трихромового окрашивания по Массону. Инсулинорезистентность анализировали с помощью ipGTT теста и индекса HOMA/TR. Уровни ADMA и NO выявляли по концентрации в крови и экскреции с мочой (фиг. 1).
[196] В семинедельном исследовании (1) модели с низким содержанием соли, (2) модели с высоким содержанием соли (HS) + среды, (3) HS + 6ECDCA при 10 мг/кг и (4) HS + 6ECDCA при 30 мг/кг 6ECDCA не оказывал влияния на вес тела крыс с рационом с высоким содержанием соли (фиг. 2).
[197] Ранее сообщалось, что рацион с высоким содержанием соли в RAPP-модели являлся причиной смерти. Фиг. 3 представляет собой график, на котором показан уровень выживаемости (%) крыс DSS-исследования в зависимости от времени (недели).
[198] Было показано, что рацион с высоким содержанием соли увеличивал кровяное давление, а обработка с помощью 6ECDCA не влияла на частоту сердечных сокращений, кровяное давление или снижала кровяное давление (фиг. 4 и 5).
[199] Пища с высоким содержанием соли, как известно, индуцирует гипертрофию сердца, застой крови в легких и фиброз почек. 6ECDCA уменьшало вес легких в дозе 30 мг/кг, что предполагает, что 6ECDCA оказывает защитный эффект в отношении застоя крови в легких (фиг. 6А-6С).
[200] Измеряли концентрацию глюкозы крови натощак в зависимости от времени в ходе теста толерантности к глюкозе (GTT) у DSS-крыс (фиг. 7). Фигура 7 представляет собой график, на котором показана концентрация глюкозы крови натощак (мг/дл) в зависимости от времени (мин.) в ходе GTT у крыс DSS-исследования. Значения представляют собой среднее ±SEM для: контроля (n=6); среды (n=7); 6ECDCA при 10 мг/кг (n=5) и 6ECDCA при 30 мг/кг (n=9).
[201] Измеряли концентрацию инсулина плазмы крови натощак в зависимости от времени в ходе GTT у крыс DSS-исследования (фиг. 8). Фигура 8 представляет собой график, на котором показана концентрация инсулина плазмы крови натощак (нг/мл) в зависимости от времени (мин.) в ходе GTT у крыс DSS-исследования. Значения представляют собой среднее ±SEM для: контроля (n=6); среды (n=7); 6ECDCA при 10 мг/кг (n=5) и 6ECDCA при 30 мг/кг (n=9).
[202] По результатам оценки чувствительности к инсулину (индекс инсулинорезистентности) 6ECDCA вызывало обратное развитие инсулинорезистентности, индуцированное рационом с высоким содержанием соли. IR-индекс представляет собой результат умножения частного от деления среднего повышения концентрации глюкозы плазмы крови на значение натощак и средней концентрации инсулина плазмы крови (фиг. 9). Фигура 9 представляет собой гистограмму, на которой показана чувствительность к инсулину с помощью индекса инсулинорезистентности (IR) у крыс DSS-исследования. Значения представляют собой среднее ±SEM для: контроля (n=6); среды (n=6); 6ECDCA при 10 мг/кг (n=5) и 6ECDCA при 30 мг/кг (n=9).
[203] Обработка с помощью 6ECDCA продемонстрировала защитный эффект для почек в дозе 30 мг/кг. 6ECDCA уменьшало альбуминурию, индуцированную рационом с высоким содержанием соли (фиг. 10А-В).
[204] Обработка с помощью 6ECDCA ни уменьшала ADMA, ни увеличивала уровни NO в сыворотке крови и моче (фиг. 11).
[205] У DSS-крыс, рацион кормления которых содержал 8% NaCl (HS), как правило обнаруживались связанные между собой увеличение кровяного давления и смертности, и гипертрофия сердца и почек, и застой крови в легких (что обнаруживалось по увеличению веса органа). У DSS-крыс с HS рационом питания также обнаруживалась инсулинорезистентность. Уровни глюкозы и инсулина умели тенденцию к снижению у животных, обработанных 6ECDCA, а IR-индекс снижался на 38% и 21% у животных, обработанных 6ECDCA при 10 мг/кг и 30 мг/кг, по сравнению с обработкой средой, соответственно. 6ECDCA не уменьшал кровяное давление у DSS-крыс с HS питанием. 6ECDCA оказывало благоприятное влияние на функцию почек (уменьшало альбуминурию), а также уменьшало застой крови в легких. Эти эффекты не зависят от системных изменений уровней ADMA и NO.
Пример 5. Эффекты длительной обработки соединением 1 (также называемым ОСА) в модели индуцированной монокроталином легочной гипертензии у крыс
[206] Модель МСТ-индуцированной легочной гипертензии у крыс
[207] Легочную гипертензию индуцировали с помощью подкожной инъекции 60 мг/кг монокроталина (МСТ) (Sigma Chemicals, Сент-Луис, Миссури, США), растворенного в 0,5 н. растворе НСl. Вкратце, самцов крыс Sprague-Dawley (SD), весивших от 200 до 250 г, содержали в условиях контролируемого климата с циклом 12 часов света: 12 часов темноты со свободным доступом к корму и воде. Крыс SD случайным образом распределяли в следующие группы:
1) крысы SD, оставшиеся необработанными и умерщвленные через 7 (n=5) или 28 (n=5) дней;
2) крысы SD, получавшие одну подкожную инъекцию МСТ со средой, умерщвленные через 7 дней (n=5);
3) крысы SD, получавшие одну подкожную инъекцию МСТ со средой, умерщвленные через 28 дней (n=10);
4) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг, n=5], умерщвленные через 7 дней;
5) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг, n=15], умерщвленные через 28 дней;
6) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг] и сразу же обработанные с помощью ОСА (30 мг/кг, ежедневно, 5 дней в неделю, посредством перорального зондового питания, n=5) в течение 7 дней];
7) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг] и сразу же обработанные с помощью ОСА (30 мг/кг, ежедневно, 5 дней в неделю, посредством перорального зондового питания, n=10) в течение 28 дней];
8) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг] и сразу же обработанные тадалафилом (10 мг/кг/сутки, в питьевой воде, n=5) в течение 7 дней];
9) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг] и сразу же обработанные тадалафилом (10 мг/кг/сутки, в питьевой воде, n=10) в течение 28 дней];
10) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг] и сразу же обработанные с помощью ОСА со средой (посредством перорального зондового питания, n=5) в течение 7 дней;
11) крысы SD, получавшие одну подкожную инъекцию МСТ [60 мг/кг] и сразу же обработанные с помощью ОСА со средой (посредством перорального зондового питания, n=10) в течение 28 дней.
[208] Крыс взвешивали и наблюдали за общими проявлениями на протяжении периода исследования. Крыс умерщвляли путем смещения шейных позвонков через 7 или 28 дней и образцы легкого и сердца собирали и обрабатывали для дальнейших анализов. Обращение с животными соответствовало требованиям Институционального комитета по содержанию и использованию животных Университета Флоренции, Флоренция, Италия, согласно закону №116/92 административного права Италии.
[209] После умерщвления животных взвешивали правый желудочек (RV), левый желудочек и межжелудочковую перегородку (LV+S). Соотношение значений для RV к LV+S [RV/(LV+S)] использовали как индекс гипертрофии правого желудочка (RVH).
[210] МСТ индуцировал увеличение индекса гипертрофии правого желудочка (RVH) в день 7 (не показано), с достижением статистической значимости в день 28, по сравнению с контрольной группой (фиг. 12). Обработка с помощью ОСА вызывала полную нормализацию в отношении RVH в день 28. Аналогичные результаты наблюдали после 28 дня обработки тадалафилом (фиг. 12).
[211] Ремоделирование легочных сосудов оценивали путем определения толщины стенки (WT). Легкие фиксировали в 10% буферном формалине и погружали в парафин, затем делали срезы с толщиной 5 мкм и окрашивали гематоксилин-эозином. Два патоморфолога в слепом режиме относительно группирования животных независимо изучали десять легочных артерий на предмет структурной целостности с использованием системы для морфометрического анализа изображений. Определяли WT, диаметр сосуда (ED). WT (%)=(2×WT/ED)×100%. Более 50 изображений легочных артериол (с диаметром от 25 до 100 мкм) по меньшей мере из трех срезов тканей при увеличении х20 запечатлели при помощи цифровой камеры для микроскопии и анализировали с помощью программы для анализа изображений (Fiji-win32). Измеряли наружный диаметр (D) и среднюю толщину с каждой стороны (M1 и М2), а также наименьший диаметр. Средняя толщина стенки была представлена следующим образом: % толщины стенки = [(M1+M2)/2/D]×100.
[212] Изучали среднюю толщину стенки в различных экспериментальных группах (фиг. 13, 14). МСТ индуцировал значительное увеличение толщины стенки (WT) мелких легочных артерий по сравнению с контролем либо в день 7 (фиг. 13), либо в день 28 (фиг. 14) [в день 7: (33±0,8% для МСТ по сравнению с 19±0,7 для контроля; р<0,00001); в день 28: (32,6±0,7% для МСТ по сравнению с 16,8±0,8% для контроля, р<0,00001)]. Обработка с помощью ОСА как в день 7, так и в день 28 значительно снижала МСТ-индуцированное увеличение WT (в обоих случаях р<0,00001, фиг. 13 и 14, соответственно).
[213] Осуществляли анализ экспрессии мРНК генов, участвующих в воспалении [интерлейкина 6 (IL-6), моноцитарного хемоатрактантного белка-1 (MCP-1/CCL2), циклооксигеназы-2], эндотелиальных факторов роста (фактора роста эндотелия сосудов (VEGF) и ангиотензин-превращающего фермента 2 (АСЕ2)), сигнальной системы NO [эндотелиальной синтазы оксида азота (eNOS), фосфодиэстеразы 5 типа (PDE5), субъединиц гуанилатциклазы типа 1а3 и 1b3, GC1a3, GC1b3, протеинкиназы G 1, PKG1]. Выделение РНК из легких, qRT-PCR осуществляли в соответствии с методикой флуоресцентных зондов TaqMan. ПЦР-праймеры и зонды, специфичные в отношении последовательностей мРНК вышеупомянутых целевых генов, и 18S рРНК гена для сравнения приобретали у Life Technologies (Пейсли, Великобритания).
[214] Экспрессия гена МСР-1 значительно увеличивалась после обработки с помощью МСТ как в день 7, так и 28. Примечательно, что обработка с помощью ОСА значительно уменьшала МСТ-индуцированную экспрессию МСР-1 как на 7, так и на 28 день (фиг. 15). Аналогично, в день 28 ОСА значительно уменьшало экспрессию мРНК IL-6, повышающе регулируемую дозированием МСТ (фиг. 16).
[215] Экспрессия генов VEGF и АСЕ2 значительно не различалась среди групп в день 7. И наоборот, наблюдалось уменьшение обоих показателей в группе МСТ по сравнению с контрольной группой в день 28. Обработка с помощью ОСА была способна значительную повышающе регулировать экспрессию мРНК как VEGF (фиг. 17), так и АСЕ2 (фиг. 18) (р=0,001 и р=0,038, соответственно, по сравнению с МСТ в тот же момент времени).
[216] Через 7 дней дозирования ОСА наблюдалось значительное увеличение в отношении генов, связанных с сигнальной системой NO, в том числе GC1a3, PKG1 и PDE5 (фиг. 19-21). В день 28 наблюдалось значительное уменьшение экспрессии всех этих генов (для всех р<0,01 по сравнению с контролем в тот же момент времени). Обработка с помощью ОСА в течение 28 дней значительно повышающе регулирует экспрессию мРНК PKG1 (р=0,01 по сравнению с МСТ в тот же момент времени; фиг 19).
[217] В течение периода исследования осуществляли наблюдение за животными ежедневно на предмет смертности, а среднее время выживания в каждой группе рассчитывали при помощи анализа Каплана-Мейера.
[218] На фигуре 22 показан однофакторный анализ выживаемости необработанных или обработанных МСТ крыс. Наблюдение на предмет смертности осуществляли ежедневно, и уровень выживаемости был показан в каждый указанный момент времени. Уровень выживаемости в день 0 в начале обработки составлял 100%. МСТ индуцировал статистически значимое уменьшение выживаемости (р=0,022). ОСА уменьшало число случаев смерти с 24 до 13,2%. Хотя данное снижение статистически не отличалось от МСТ, оно в результате также не отличалось от контроля.
[219] Результаты выражены как среднее ±SEM. (среднеквадратическое отклонение) для n экспериментов, как указано. Статистический анализ осуществляли с помощью однофакторного дисперсионного анализа с последующим применением критерия множественных сравнений Тьюки-Крамера для того, чтобы оценить различия между группами, и р<0,05 считалось значимым. В случае, если данные не подчинялись нормальному распределению, статистическое различие рассчитывали с использованием критерия Крускала-Уоллиса и U-критерия Манна-Уитни для сравнения групп. Корреляцию оценивали с помощью метода Спирмена, а статистический анализ осуществляли с помощью пакета программ обработки статистических данных общественных наук (SPSS, Inc., Чикаго, Иллинойс, США) для Windows 20.0.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДЕЙТЕРИРОВАННОЕ ПРОИЗВОДНОЕ ХЕНОДЕЗОКСИХОЛЕВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННОЕ СОЕДИНЕНИЕ | 2016 |
|
RU2712033C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2827865C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ПРИМЕНЕНИЕМ ПРЕПАРАТА ЦЕНИКРИВИРОК ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА | 2015 |
|
RU2723559C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ АГОНИСТОВ FXR | 2017 |
|
RU2737324C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА | 2021 |
|
RU2803733C1 |
| СПОСОБ УМЕНЬШЕНИЯ МУЛЬТИЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ С ИСПОЛЬЗОВАНИЕМ ТРИПИРОФОСФАТА ИНОЗИТА | 2010 |
|
RU2563127C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2805207C1 |
| СПОСОБЫ И КОМПОЗИЦИИ, ОТНОСЯЩИЕСЯ К ЭМУЛЬСИЯМ, СОДЕРЖАЩИМ РЫБИЙ ЖИР И/ИЛИ ОМЕГА-3 ЖИРНЫЕ КИСЛОТЫ | 2018 |
|
RU2783166C2 |
| НОВЫЙ АГОНИСТ ЕР4 | 2011 |
|
RU2564414C2 |
| СНИЖЕНИЕ УРОВНЕЙ/АКТИВНОСТИ АРГИНАЗЫ | 2007 |
|
RU2469742C2 |
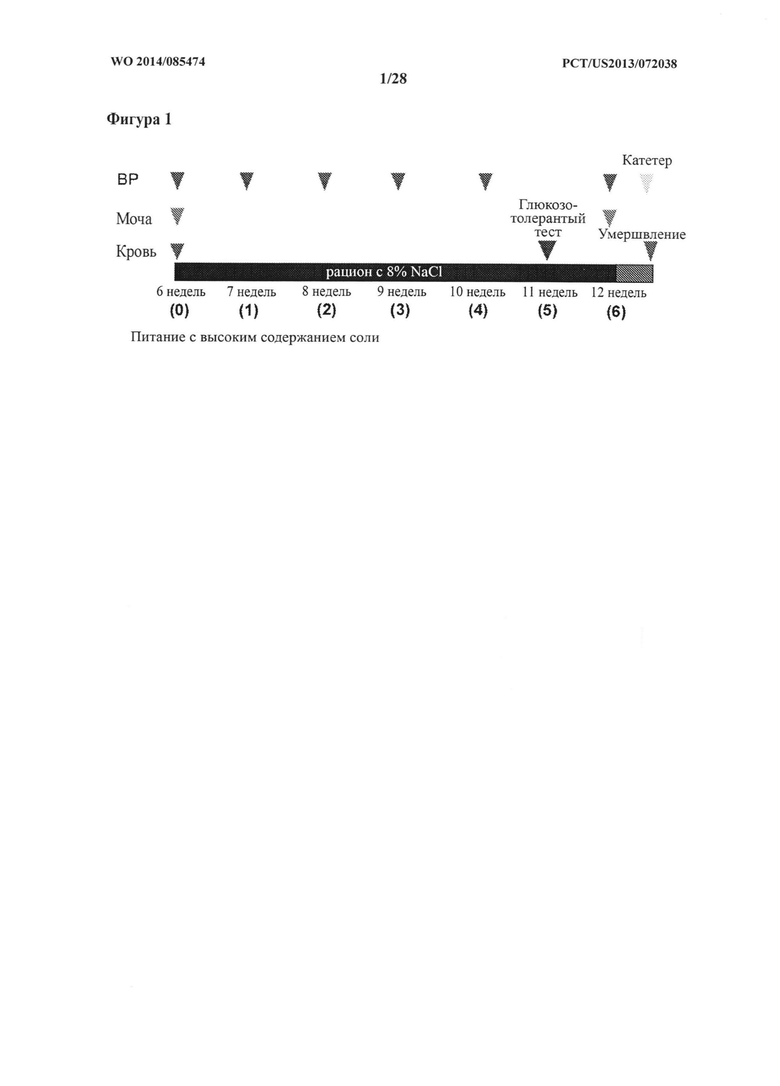

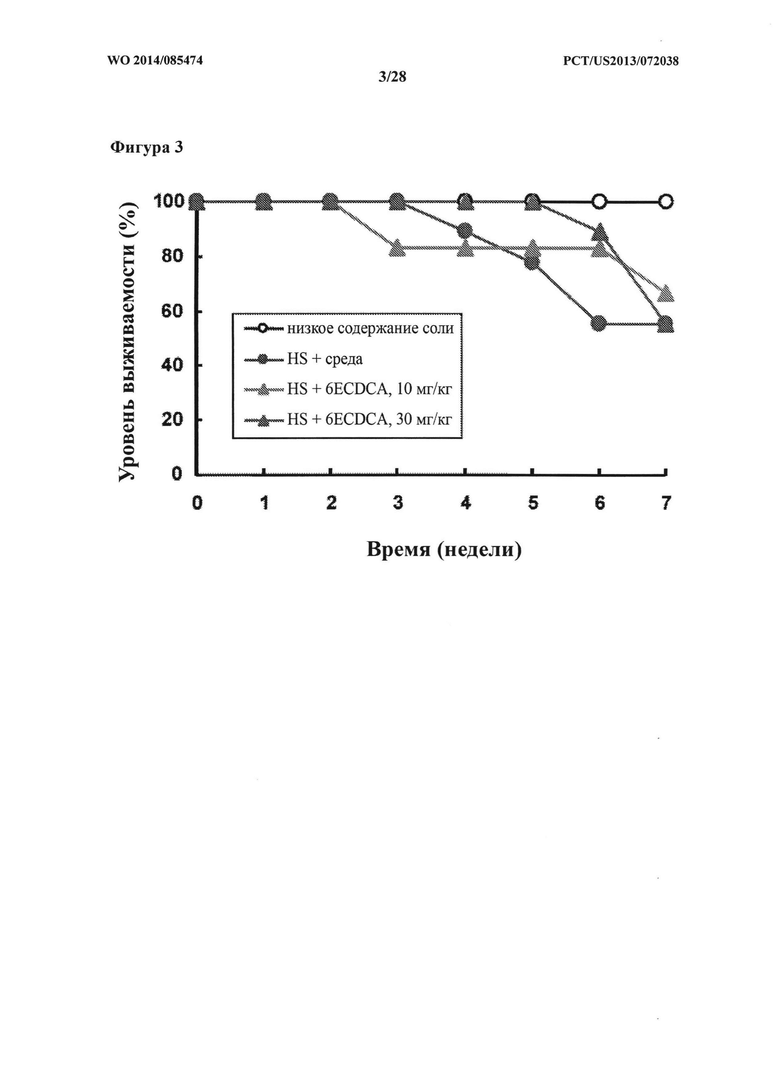
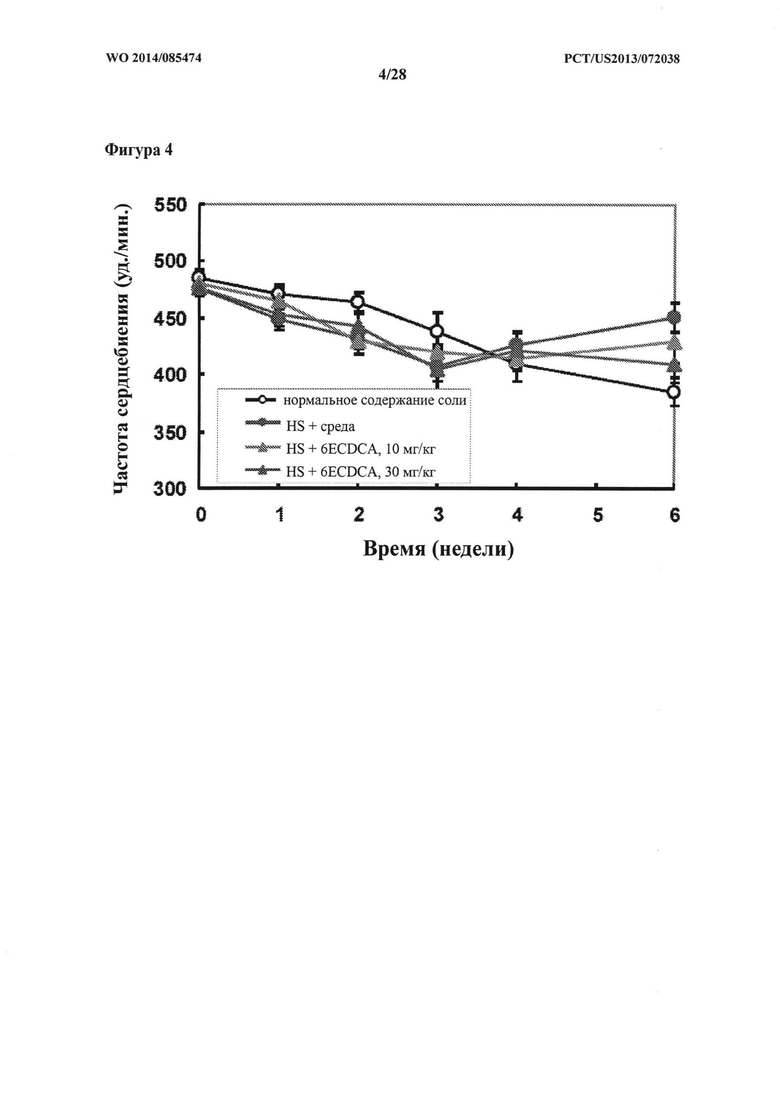
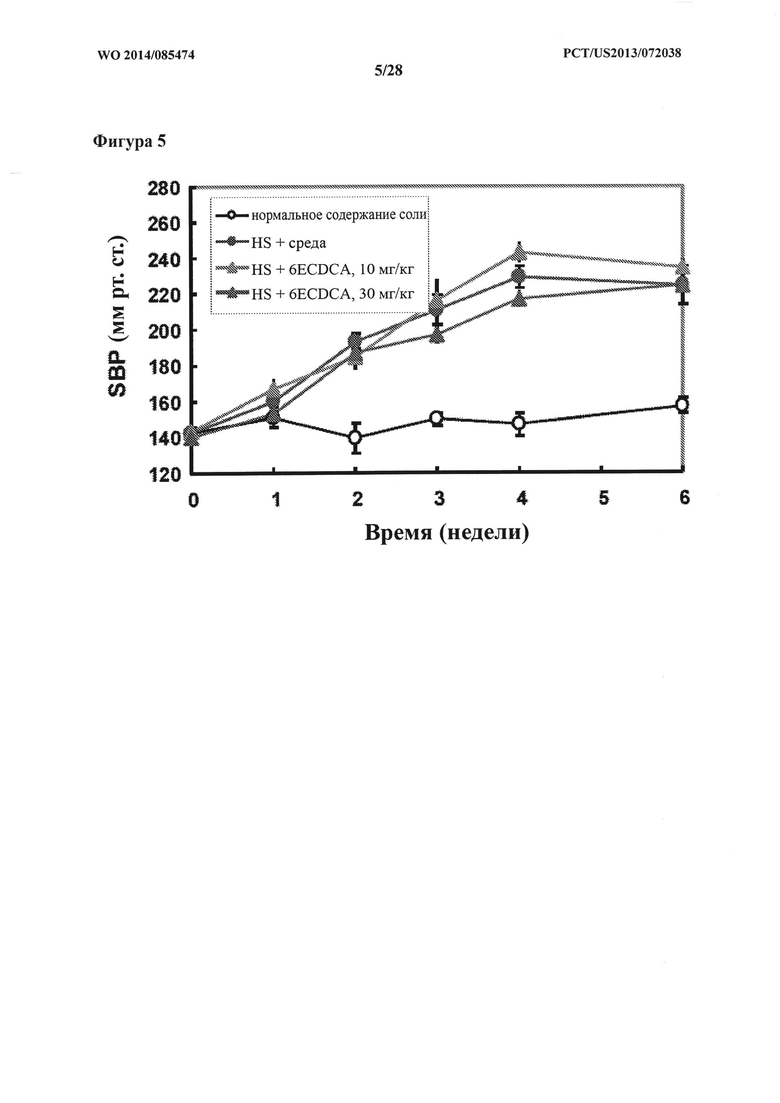
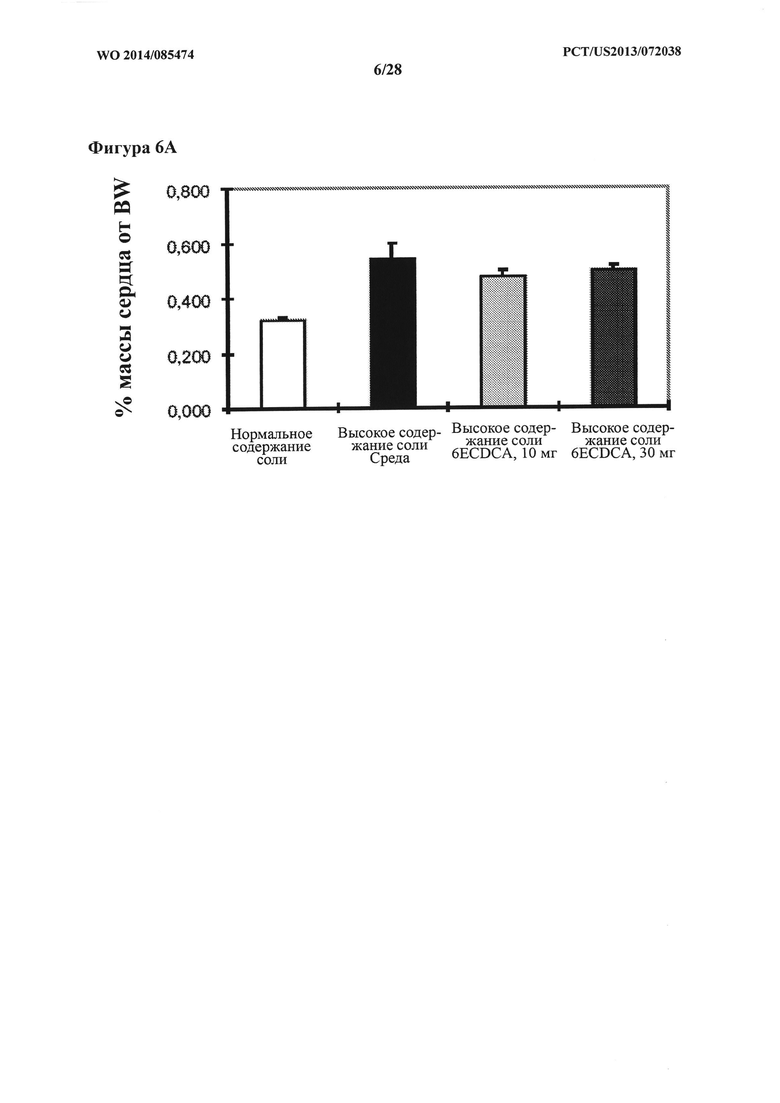
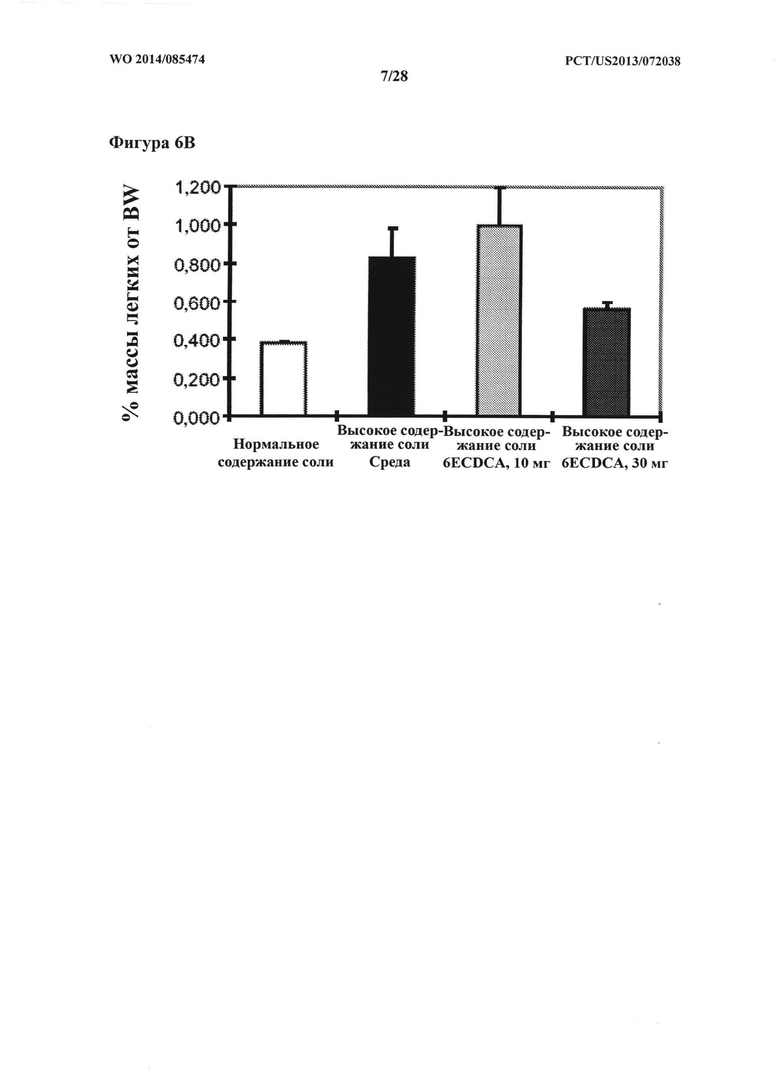
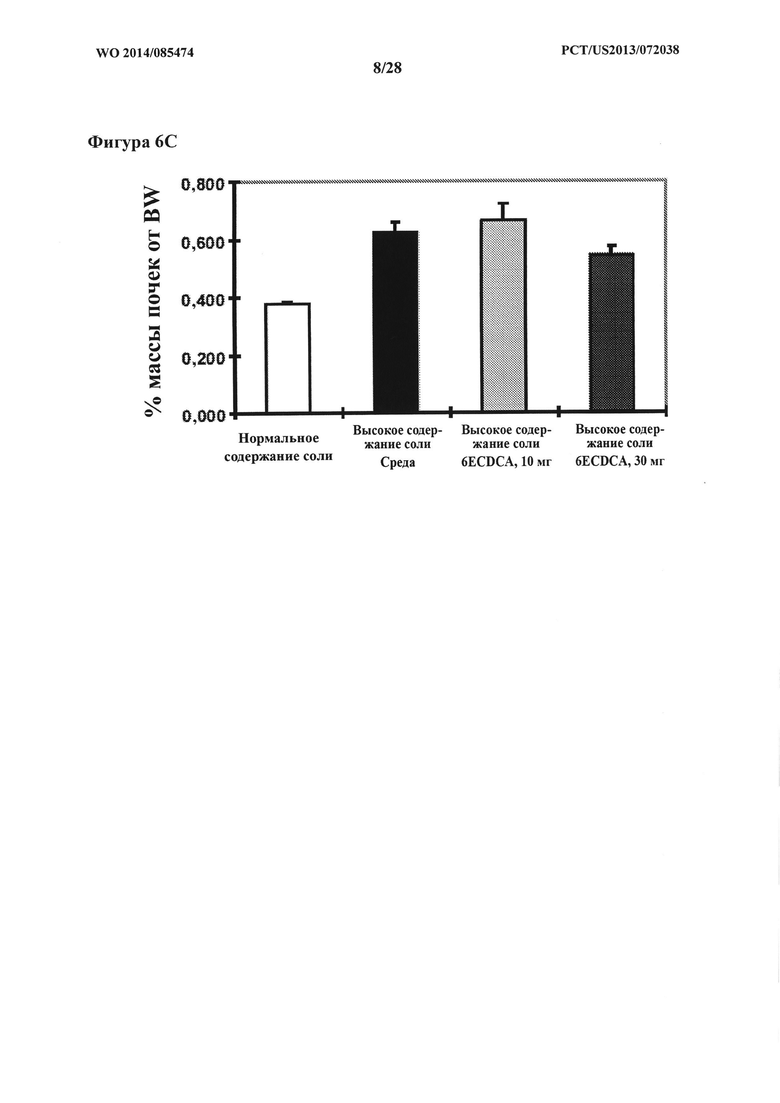
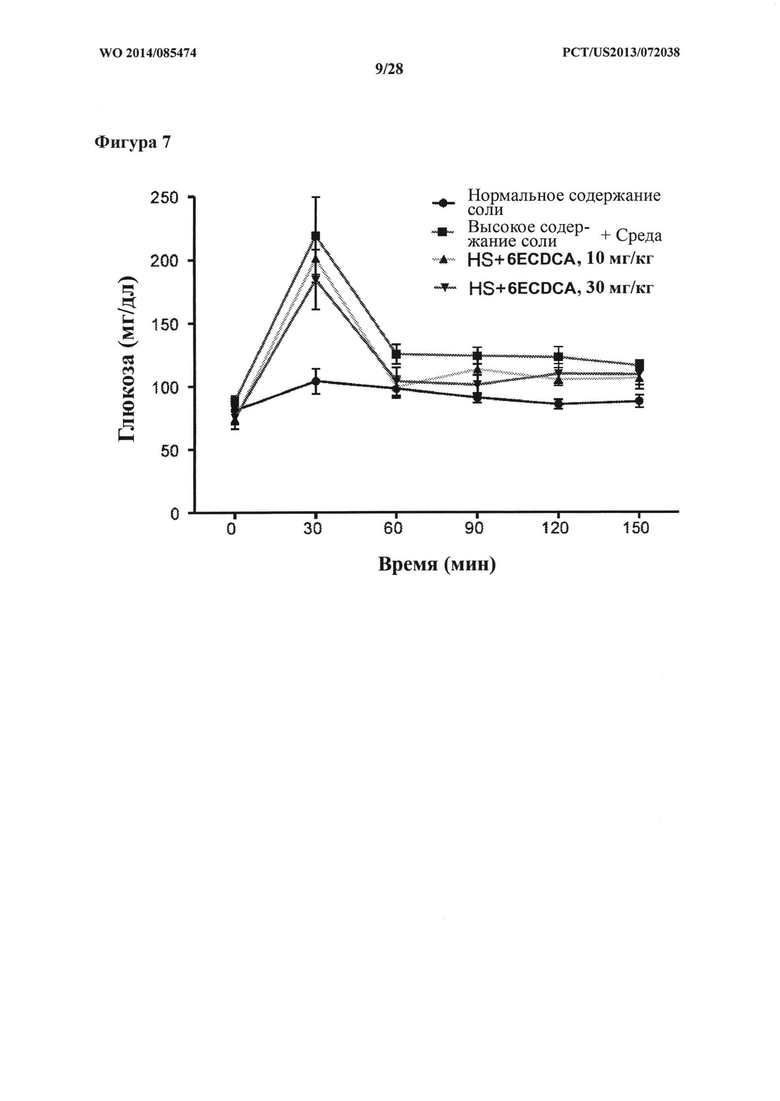
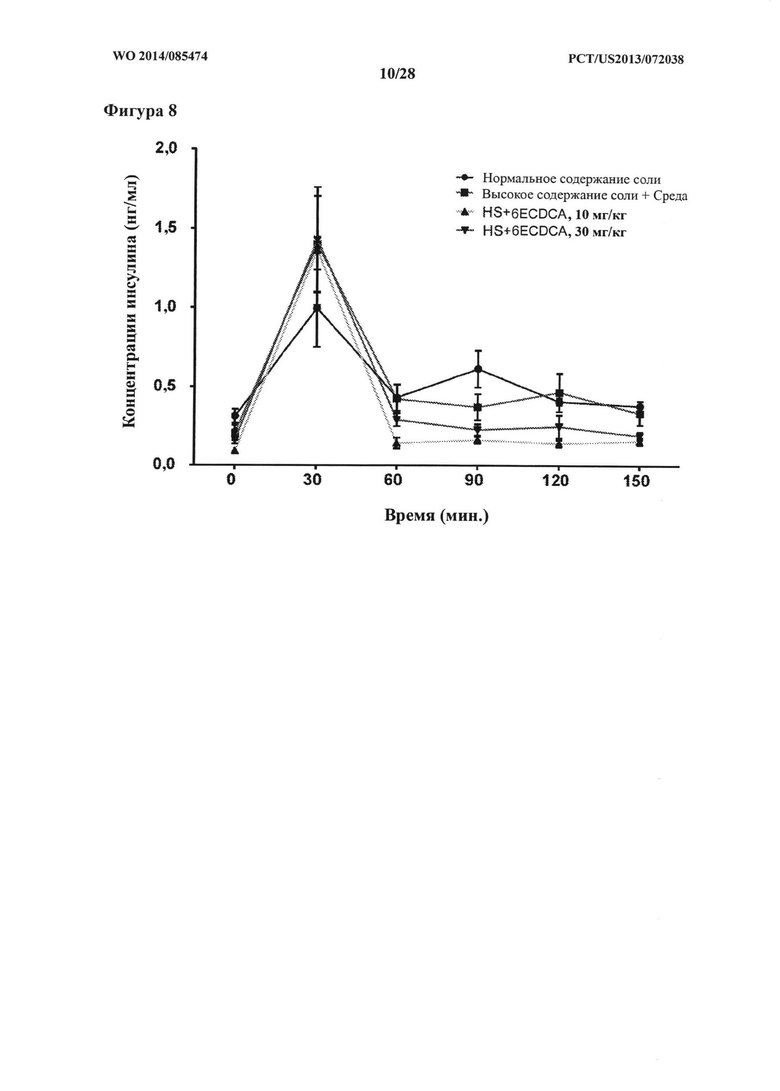
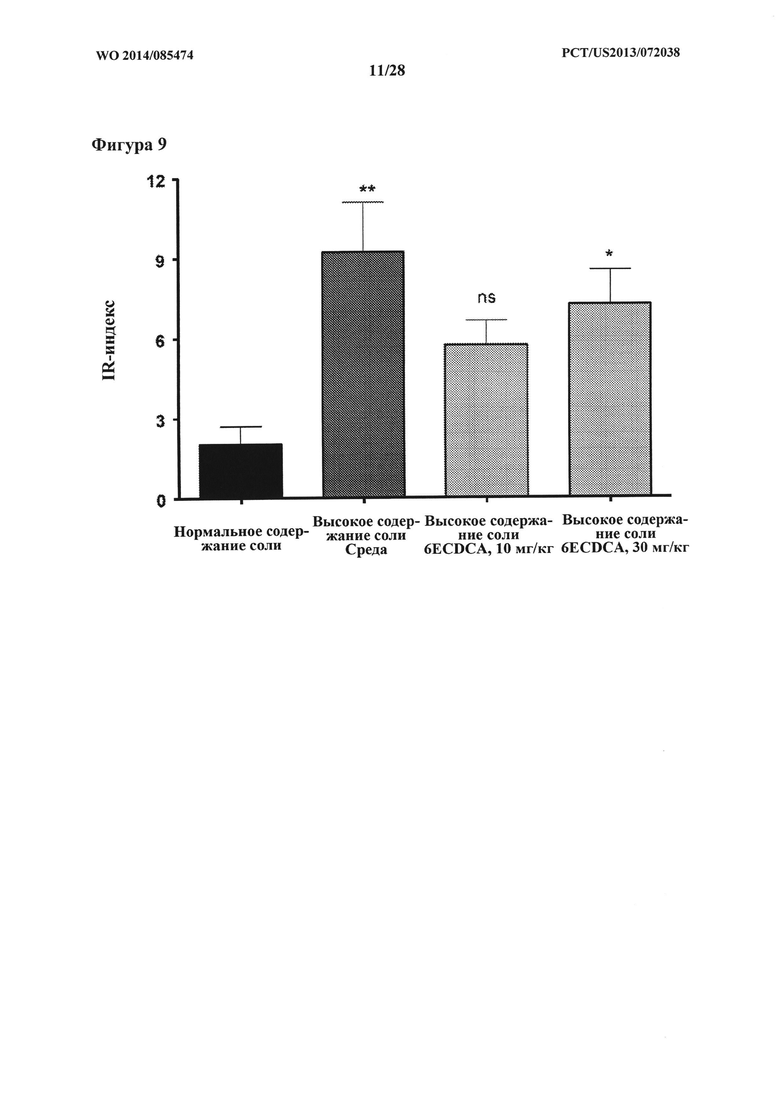
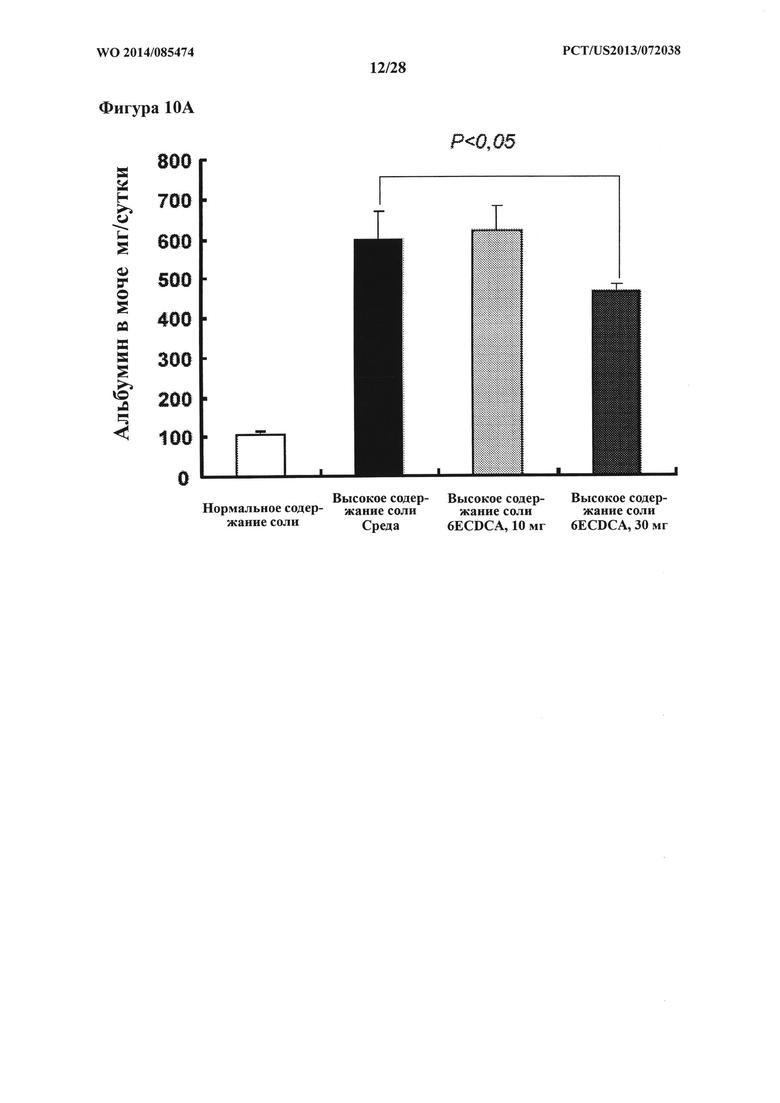
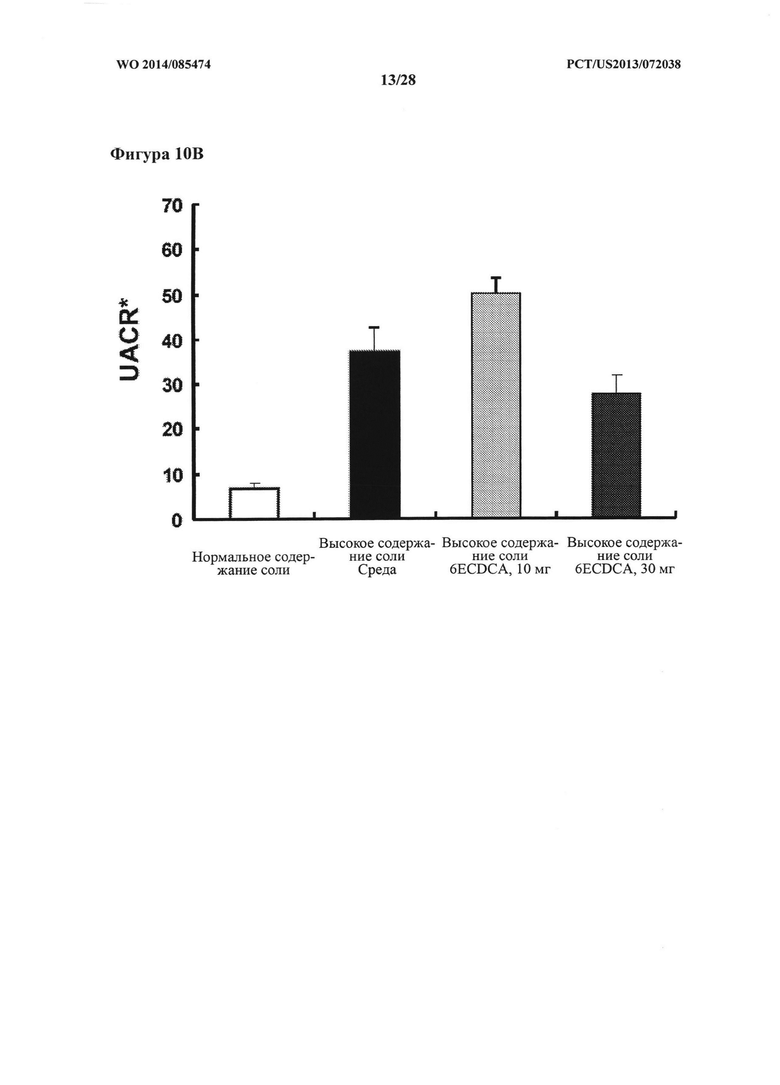
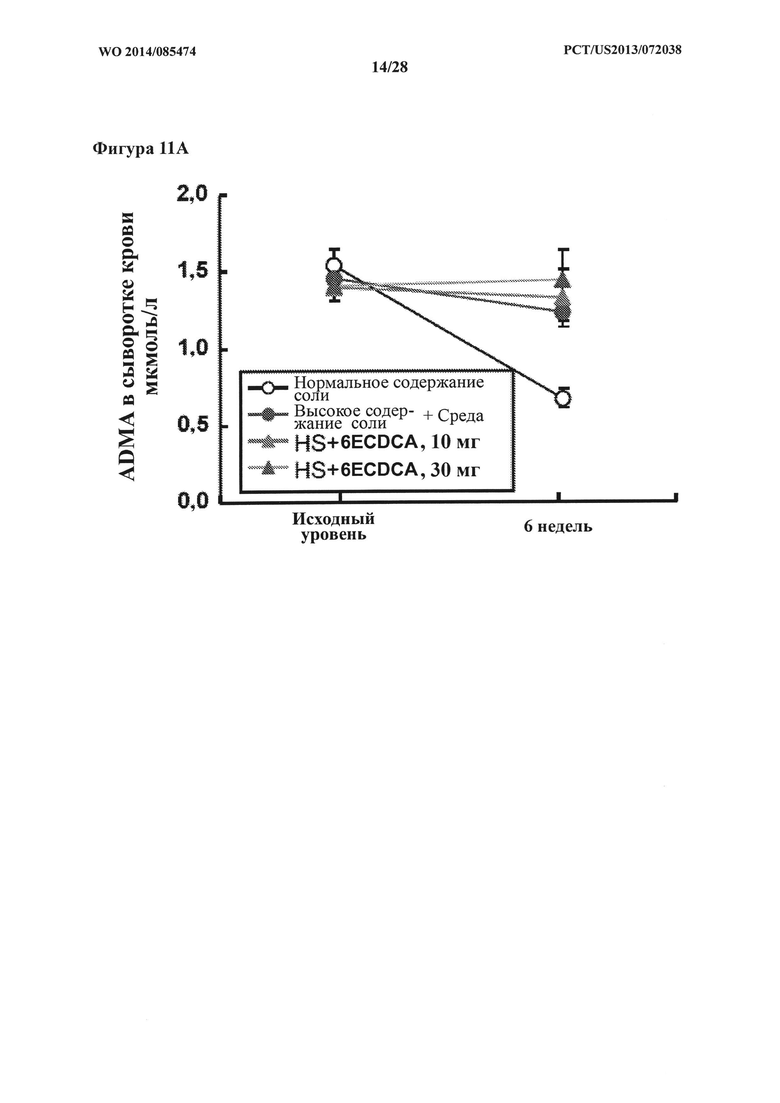

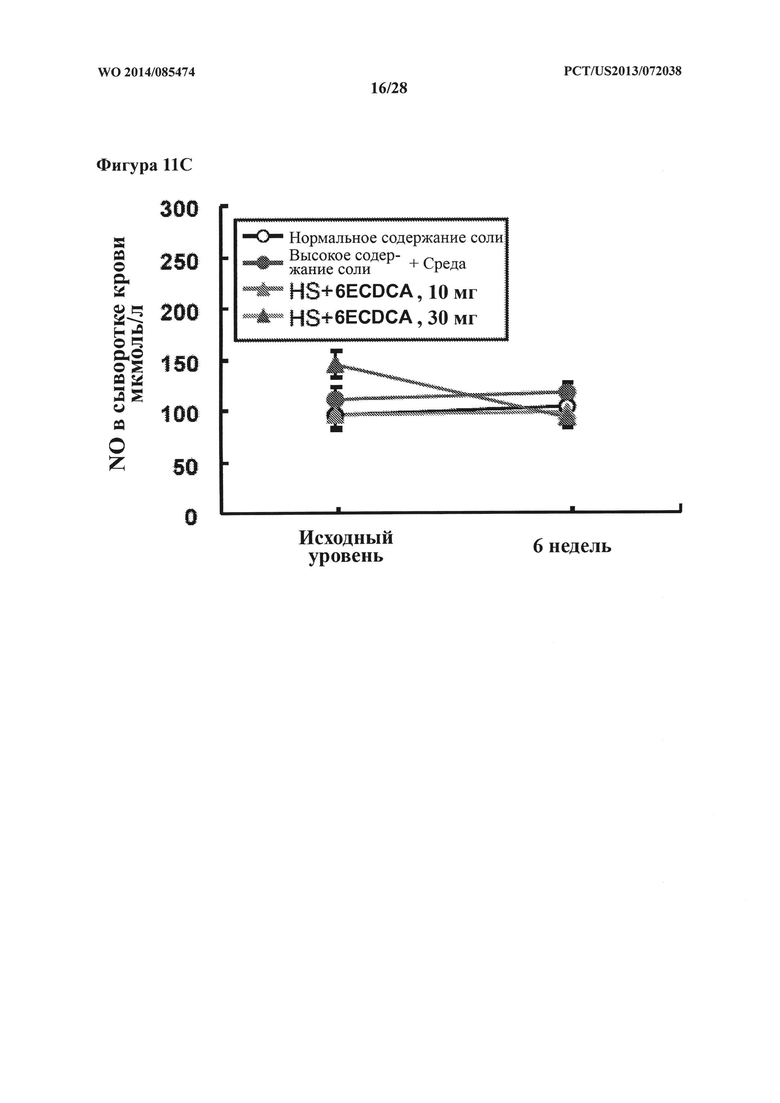
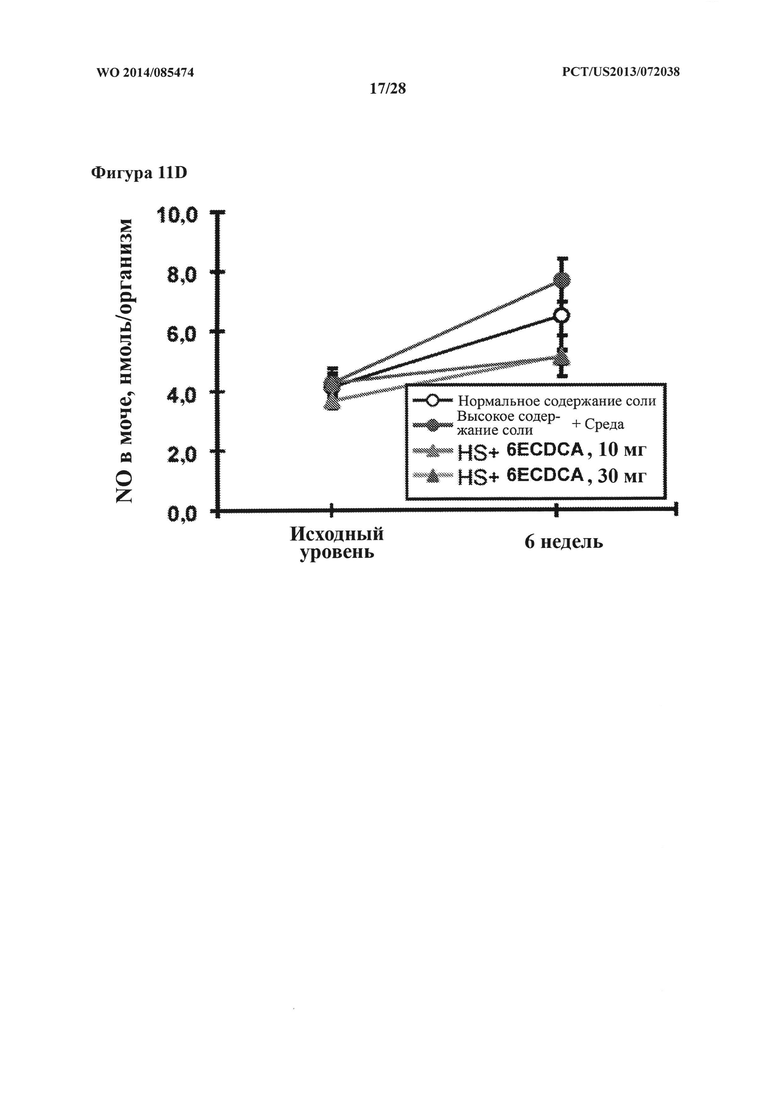
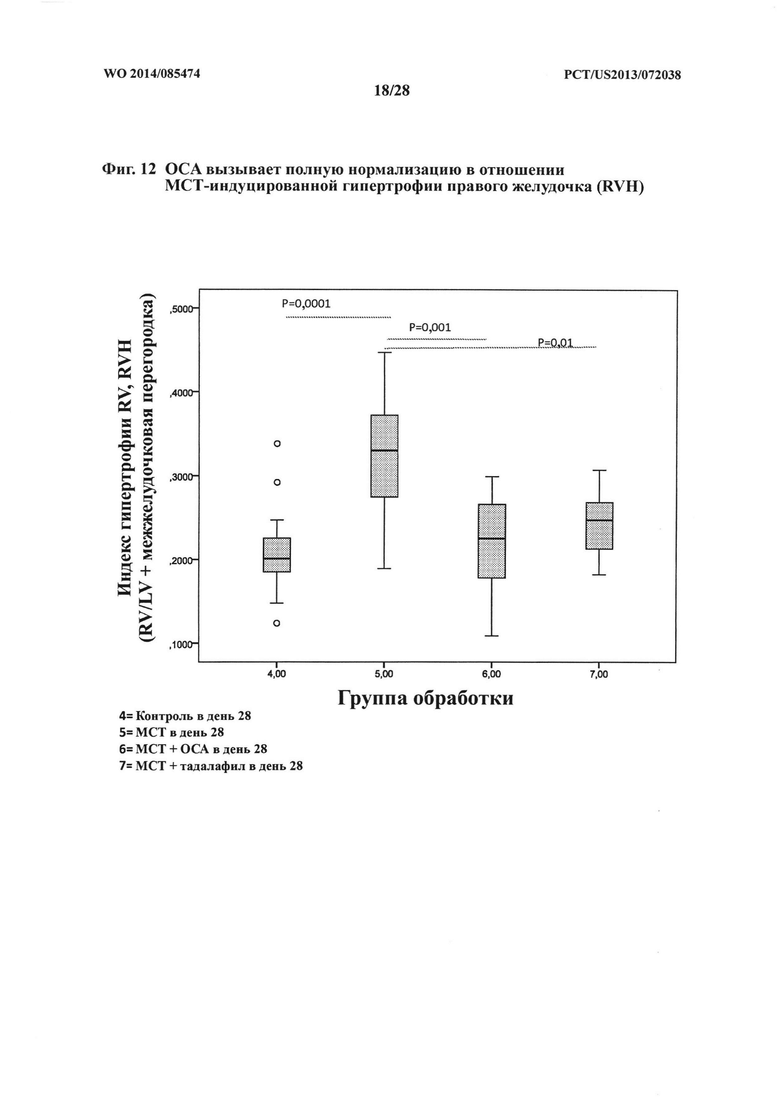
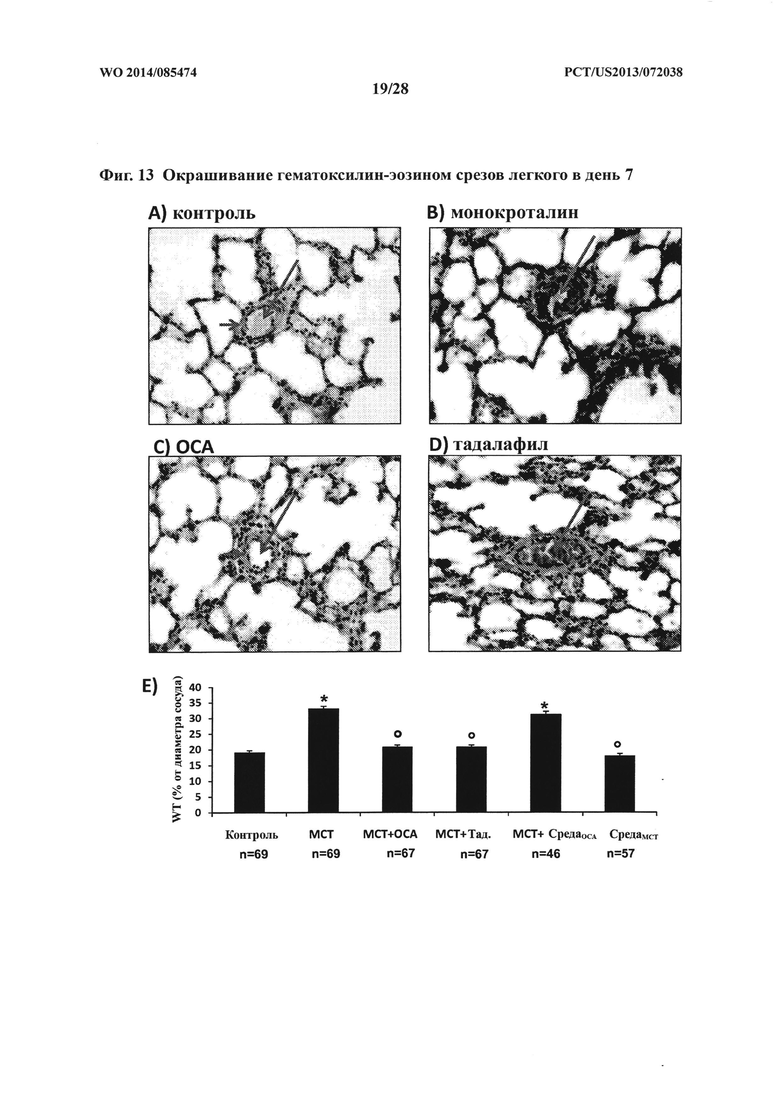
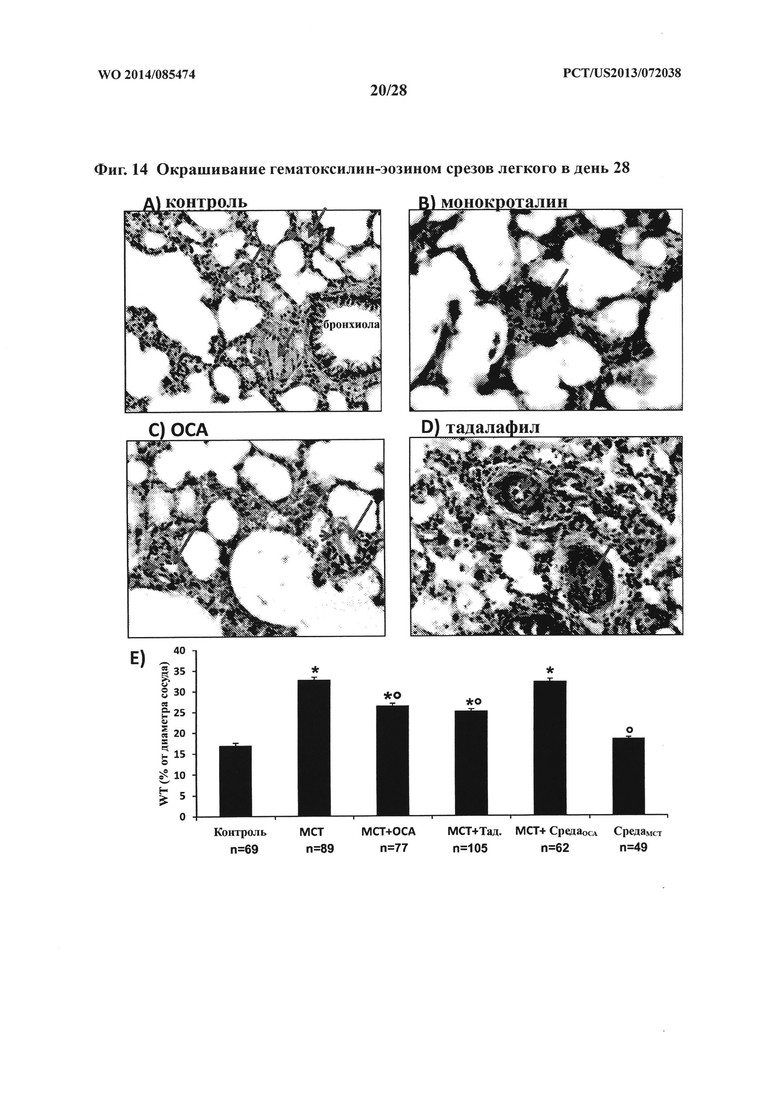
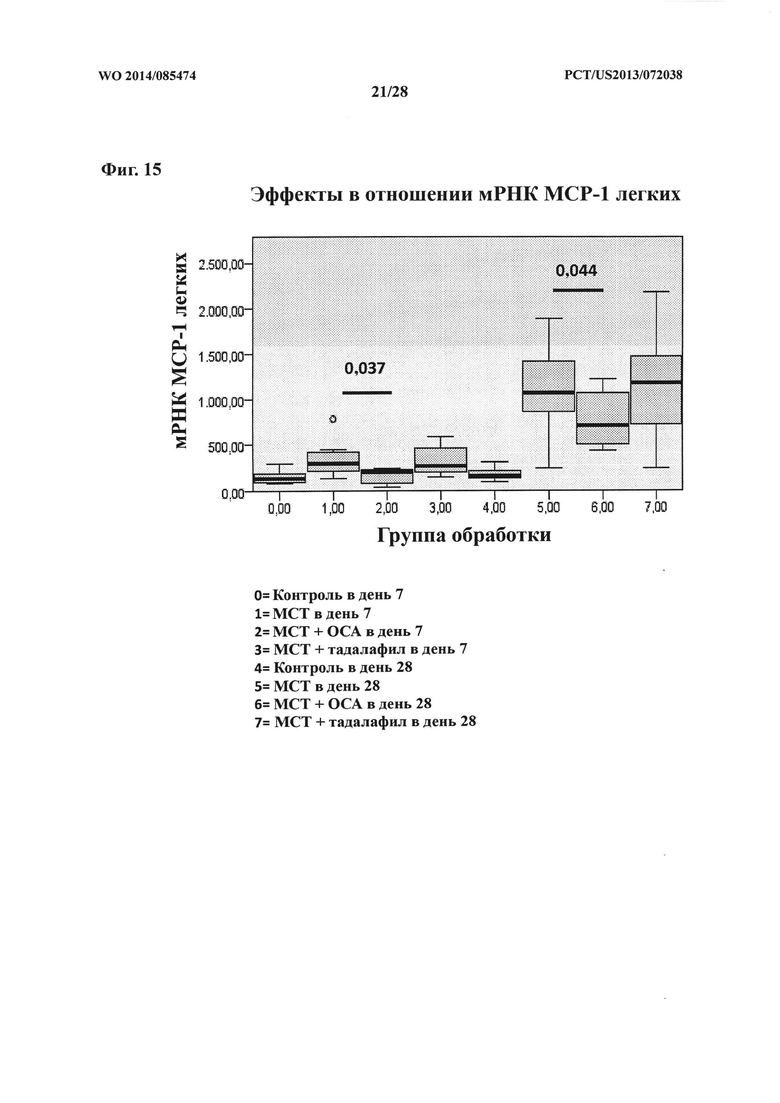
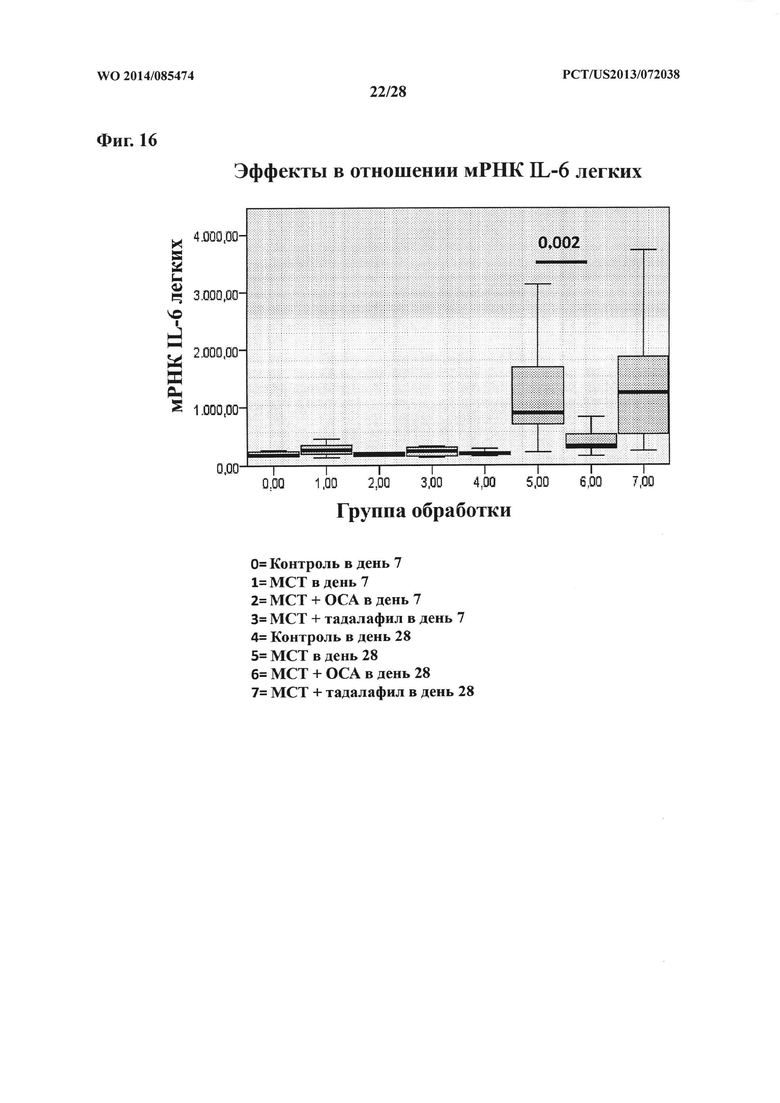
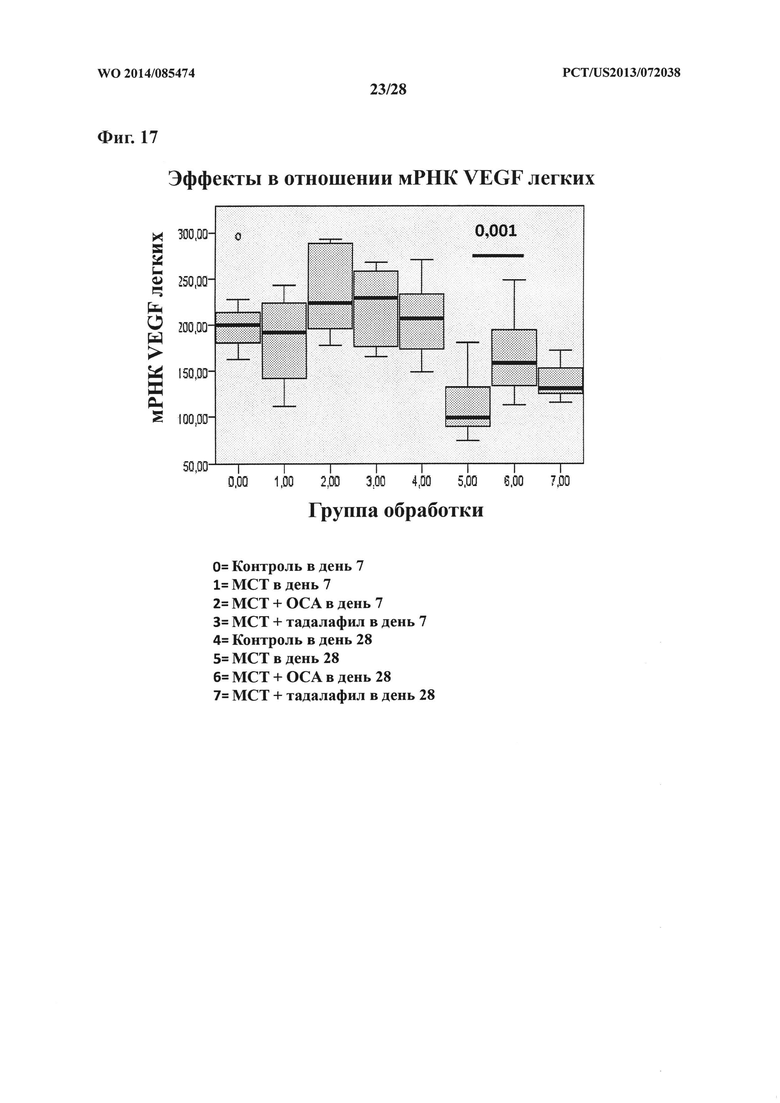
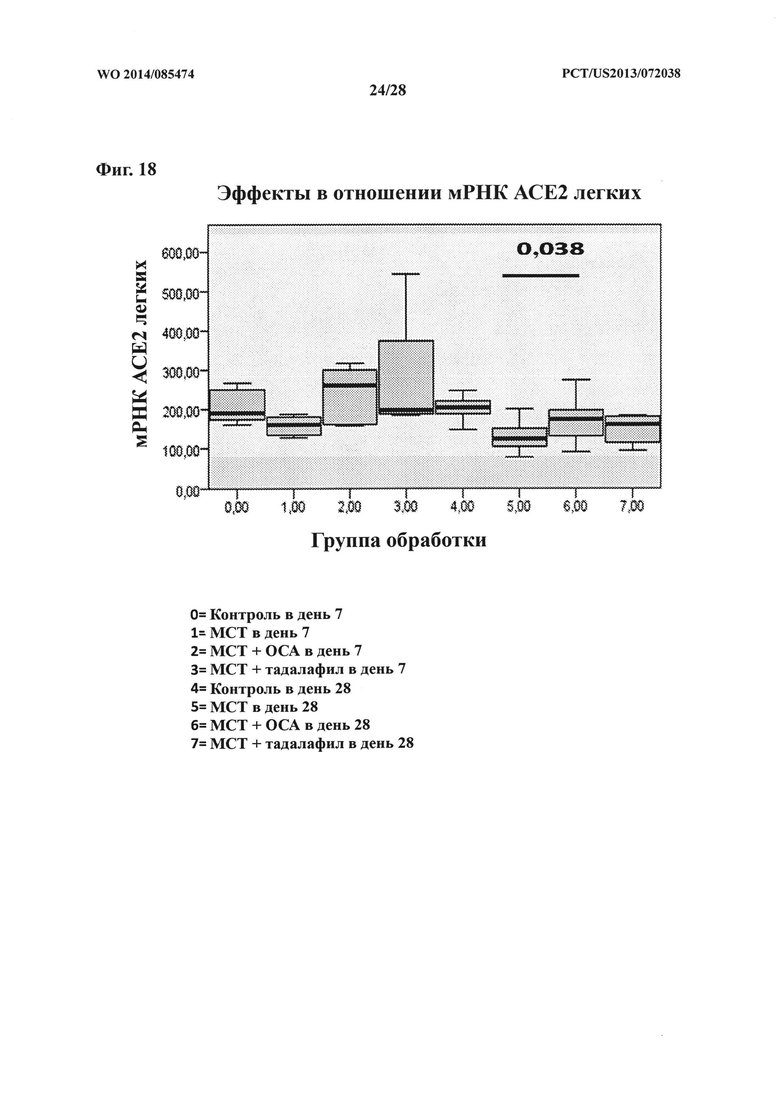
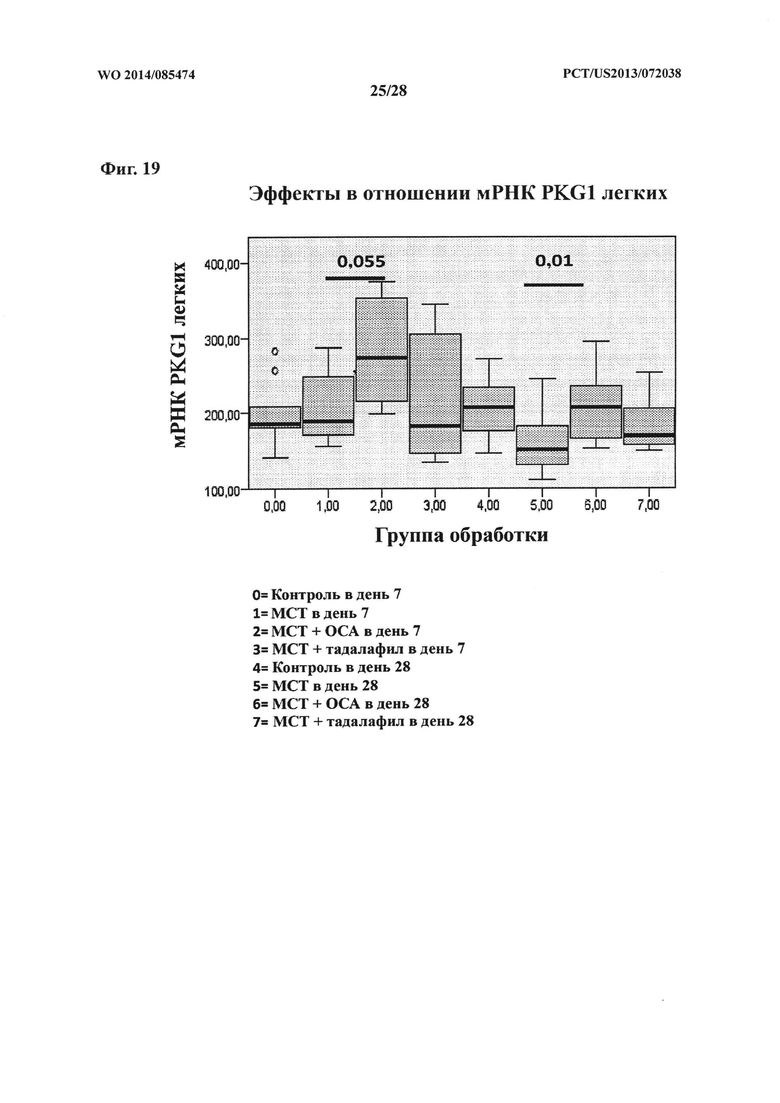
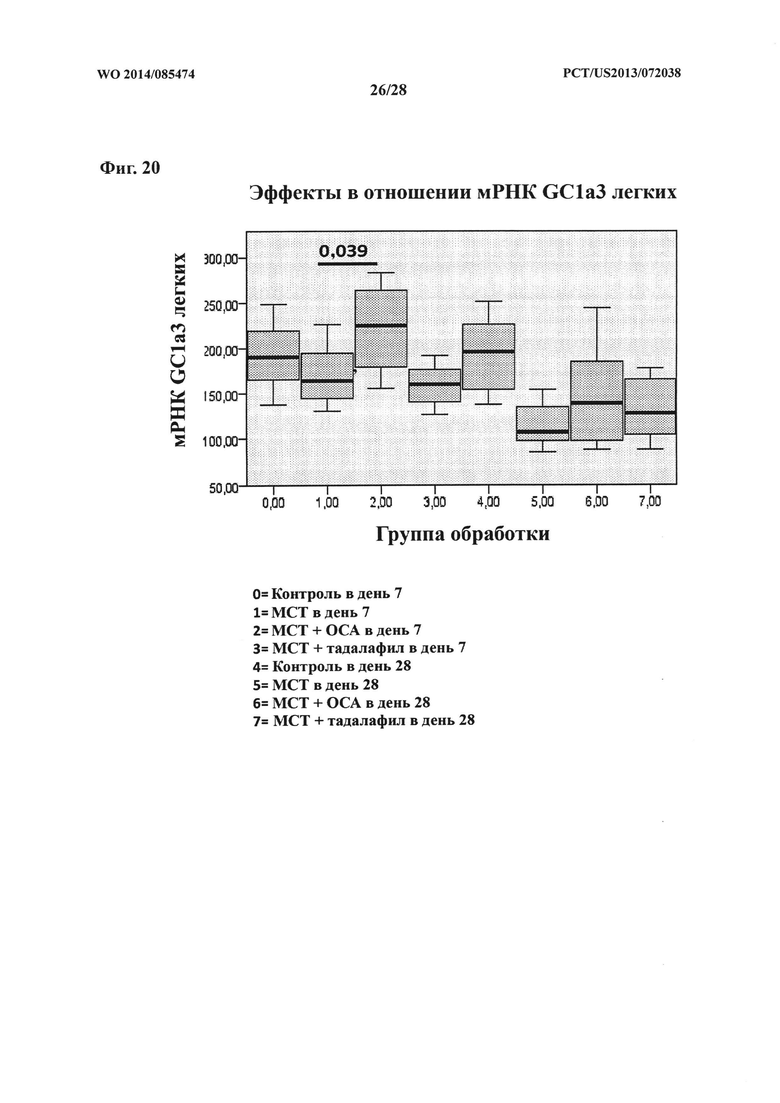
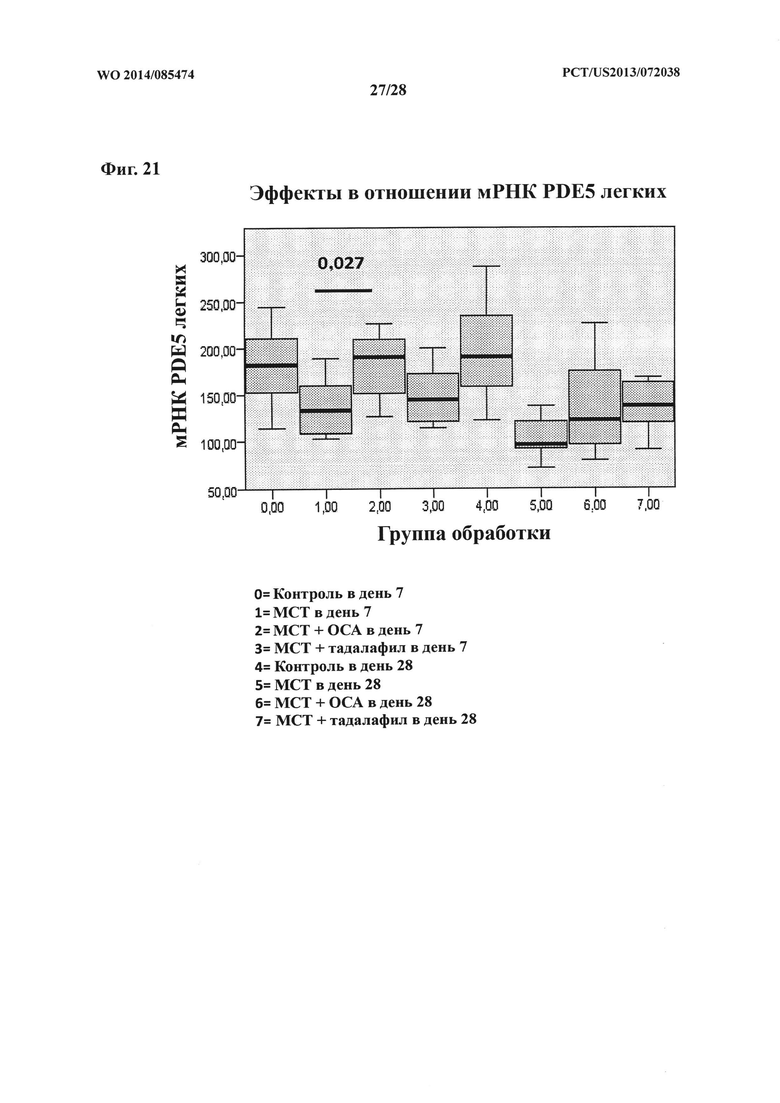
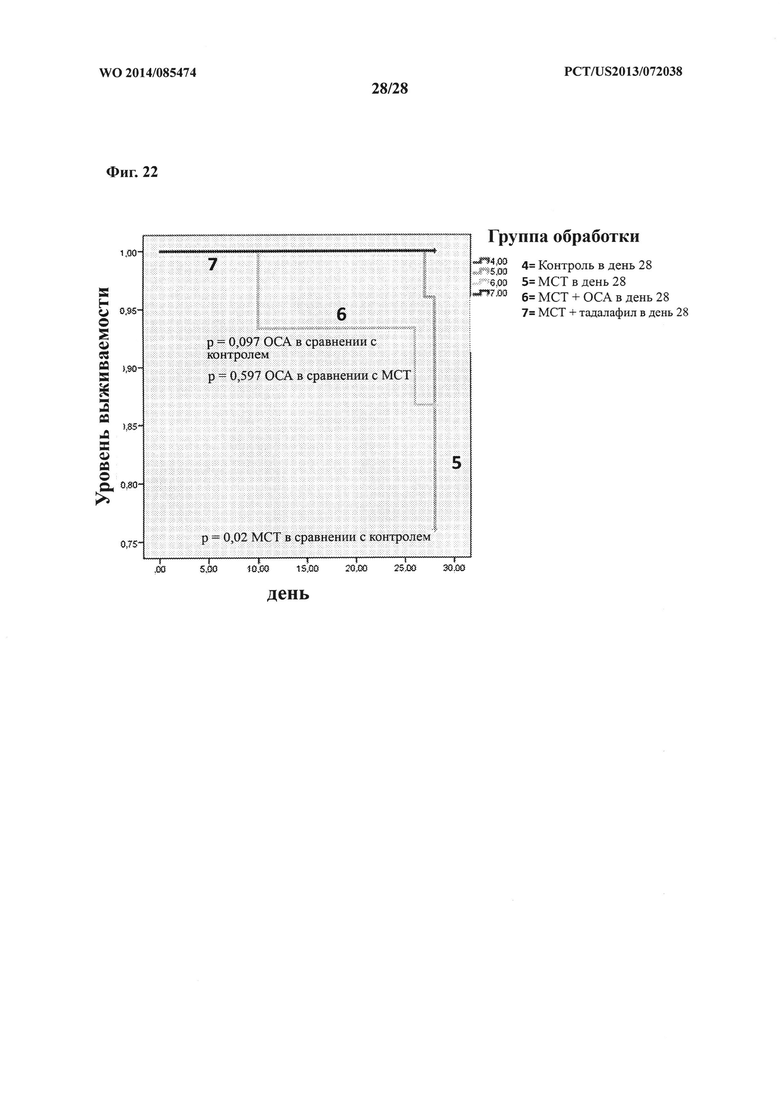
Настоящее изобретение относится к медицине, а именно к терапии и пульмонологии, и касается лечения или облегчения идиопатического легочного фиброза. Для этого вводят композицию, включающую 6-ECDCA или ее аналоги. Это снижает количество коллагена I и CXCL12 продуцируемых фиброцитами в легких или в месте повреждения в легких. 6 з.п. ф-лы, 5 пр., 22 ил.
1. Композиция для лечения или облегчения идиопатического легочного фиброза, включающая соединение формулы A:
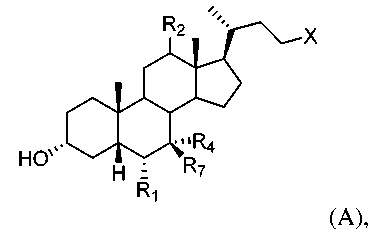
или его фармацевтически приемлемую соль, где
R1 представляет собой метил, этил или пропил;
R2 представляет собой водород;
X представляет собой C(O)OH, C(O)NH(CH2)mSO3H, C(O)NH(CH2)nCO2H;
R4 представляет собой гидроксил;
R7 представляет собой водород;
m представляет собой 2; и
n представляет собой 1.
2. Композиция по п. 1, где R1 представляет собой этил.
3. Композиция по п. 1, где соединение представляет собой
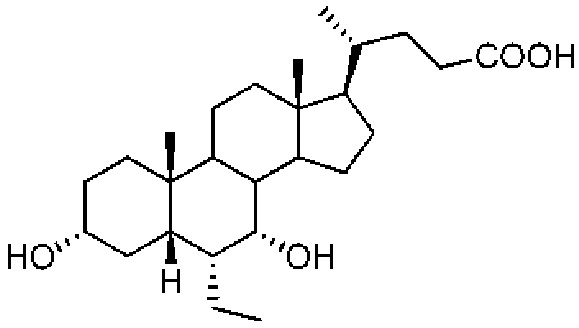
или его фармацевтически приемлемую соль.
4. Композиция по п. 1, где соединение представляет собой фармацевтически приемлемую соль.
5. Композиция по п. 4, где соль представляет собой натриевую соль или триэтиламмониевую соль.
6. Композиция по п. 1, где субъектом является человек.
7. Композиция по п. 1, где соединение вводят системно, перорально, внутривенно, внутримышечно, внутрибрюшинно или посредством ингаляции.
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА, МЕТОДЫ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ ИХ В КАЧЕСТВЕ АГОНИСТОВ ФАРНЕЗОИД-Х-РЕЦЕПТОРА (FXR) И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ | 2007 |
|
RU2424233C2 |
| WO 2008002573 A2, 03.01.2008 | |||
| WO 2011022838 A1, 03.03.2011 | |||
| PELLICCIARI R | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Med | |||
| Chem | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| ZHANG L | |||
| et al | |||
| "FXR Protects Lung From Lipopolysacchatide-induced Acute injury" | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
Авторы
Даты
2019-07-02—Публикация
2013-11-26—Подача