Изобретение относится к области химической энзимологии и химико-фармацевтической промышленности и касается способа получения частиц, которые могут быть использованы при лечении гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом. В данных частицах ядро из антиоксидантного фермента супероксиддисмутазы (СОД) покрыто внутренней оболочкой из поликатиона и внешней оболочкой из полианиона.
Известен способ получения частиц для лечения заболеваний, сопровождающихся окислительным стрессом, путем получения биодеградируемых кальций-фосфатных наночастиц в присутствии СОД с последующим покрытием частиц дисахаридами и лиофильной сушкой полученного продукта (патент RU 2577236 C1, A61K 33/08, 2014, см. описание).
Данный способ содержит признаки, совпадающие с существенными признаками предлагаемого технического решения, такие как использование в частицах СОД и лиофильная сушка, полученного продукта.
Известен способ получения частиц на основе СОД для лечения заболеваний, связанных с неконтролируемым выбросом реактивных свободных радикалов, путем смешения СОД в буферном растворе на основе 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (ХЕПЕС) в присутствии NaCl вначале с поликатионом - протамином или полиаргинином, затем с полианионом блок-сополимером (СПЛ) полиглутаминовой кислоты (ПГ) и полиэтиленгликоля (ПЭГ) в вышеуказанном буферном растворе с последующей очисткой смеси с использованием мембранной фильтрующей системы с пределом пропускания ультрафильтрационной мембраны 50 килодальтон (кДа) с получением дисперсии частиц (патент RU 2552340 C1, A61K 38/44 (2006.01), см. описание)
Данный способ содержит признаки, совпадающие с существенными признаками предлагаемого технического решения, такие как смешение СОД в буферном растворе вначале с поликатионом - протамином или полиаргинином, затем с полианионом блок-сополимером ПГ-ПЭГ в буферном растворе с последующей очисткой смеси с использованием мембранной фильтрующей системы.
Наиболее близким к заявляемому является известный способ получения частиц на основе СОД для лечения заболеваний, сопровождающихся окислительным стрессом, путем смешения буферных растворов антиоксидантного фермента СОД и поликатиона, выбранного из группы, включающей протамин, полилизин и полиаргинин, перемешивания и выдерживания полученной смеси с последующим добавлением в нее буферного раствора полианиона блок-сополимера ПГ-ПЭГ или блок-СПЛ полиаспарагиновой кислоты (ПА) и ПЭГ, перемешиванием и выдерживанием полученной смеси, добавлением в нее водного раствора глутарового альдегида, взятого в количестве, обеспечивающем его мольное соотношение с аминогруппами поликатиона 2-10, выдерживанием смеси, добавлением в смесь водного раствора боргидрида натрия и очисткой смеси (методом центрифугирования) с использованием мембранной фильтрующей системы с пределом пропускания мембраны 50 кДа с получением дисперсии вышеуказанных частиц (патент RU 2575836 С2, МПК A61K 38/00 (2006.01) - прототип, см. описание).
Из прототипа известно, что полученные частицы могут быть использованы для лечения заболеваний, связанных с неконтролируемым выбросом реактивных свободных радикалов (активных форм кислорода). По мнению авторов патента, взрывообразное высвобождение активных форм кислорода характерно для таких заболеваний, как болезни Альцгеймера и Паркинсона, инфаркт, инсульт, ревматоидный артрит, онкологические и аутоиммунные заболевания и различные травмы спинного и головного мозга. Однако, лечение гинекологических и проктологических заболеваний в прототипе не описано. Вместе с тем из научно-технической литературы известно, что многие воспалительные гинекологические и проктологические заболевания обусловлены именно окислительным стрессом (патент RU 2293558 С2, МПК A61K 31/4425 (2006.01), см. описание).
Известный способ содержит признаки, совпадающие с существенными признаками предлагаемого технического решения, такие как смешение буферных растворов СОД и поликатиона, выбранного из группы, включающей протамин, полилизин и полиаргинин, перемешивание и выдерживание полученной смеси с последующими добавлением в нее буферного раствора полианиона блок-сополимера ПГ - ПЭГ или блок-сополимера ПА - ПЭГ, перемешиванием и выдерживанием полученной смеси, добавлением в нее водного раствора глутарового альдегида, выдерживанием смеси, добавлением в смесь водного раствора боргидрида натрия и очисткой смеси с использованием мембранной фильтрующей системы.
Для лечения любых, в том числе гинекологических и проктологических заболеваний, сопровождающихся (обусловленных) окислительным стрессом, необходимо, чтобы действующее вещество на основе частиц, содержащих антиоксидантный фермент, обладало высоким суммарным выходом СОД по активности у частиц и стабильностью значений активности СОД у них в процессе хранения.
Однако, из прототипа известно, что суммарный выход СОД по активности у используемых в прототипе частиц относительно невелик и составляет 28-35%. Что касается стабильности значений активности СОД в процессе хранения, то в прототипе проводили только сравнение этого параметра у используемых в прототипе частиц и у нативной СОД. В прототипе также указано, что полученная дисперсия частиц стабильна при хранении при 4°С в течение 3-х месяцев.
Приведенные данные, а также проведенный контрольный опыт (см. пример 7) показал, что недостатками известного способа являются относительно низкий суммарный выход СОД по активности у полученных частиц и недостаточная стабильность значений активности СОД у частиц в процессе их хранения.
Техническая проблема изобретения заключается в разработке способа получения частиц на основе СОД для лечения гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом, лишенного указанных выше недостатков.
Технический результат изобретения состоит в увеличении суммарного выхода СОД по активности у частиц и повышении стабильности значений активности СОД у частиц в процессе их хранения.
Предварительно были проведены эксперименты с различными частицами, содержащими СОД, которые показали, что указанный технический результат достигается в том случае, когда в способе получения частиц для лечения гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом, путем смешения буферных растворов антиоксидантного фермента СОД и поликатиона, выбранного из группы, включающей протамин, полилизин и полиаргинин, перемешивания и выдерживания полученной смеси с последующими добавлением в нее буферного раствора полианиона блок-сополимера ПГ-ПЭГ или блок-сополимера ПА-ПЭГ, перемешиванием и выдерживанием полученной смеси, добавлением в нее водного раствора глутарового альдегида, выдерживанием смеси, добавлением в смесь водного раствора боргидрида натрия и очисткой смеси с использованием мембранной фильтрующей системы, глутаровый альдегид добавляют в количестве, обеспечивающем его мольное соотношение с аминогруппами поликатиона 0,3-1,5, и используют фильтрующую систему с пределом пропускания 90-130 кДа, причем после очистки смеси проводят ее лиофильную сушку.
Предлагаемый способ является новым и не описан в патентной и научно-технической литературе. Полученные частицы также являются новыми.
Данные частицы могут выступать в качестве действующего вещества и после их смешения с фармакологически приемлемой основой быть использованы при получении лекарственных форм, используемых при лечении гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом, например, таких как вагинит, вульвит, вульвовагинит, цервицит, геморрой, проктит, парапроктит и др.
Все реагенты и расходные материалы (фильтрующие мембраны), использованные в заявленном способе, коммерчески доступны. Так, СОД коммерчески доступна (http://sodferment.ru, ООО НПП «Ферментные технологии», Россия) и является известным антиоксидантным ферментом, инактивирующим супероксидные радикалы [McCord J.М., Fridovich I. Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein) //Journal of Biological chemistry. - 1969. - T. 244. - №. 22. - C. 6049-6055].
В предложенном способе водную суспензию частиц, как и в прототипе, получают путем смешения буферных растворов поликатиона и СОД. При этом состав буферных растворов может быть различен и их рН может варьироваться и составлять, например, 5-8.
При осуществлении предлагаемого способа концентрация СОД в использованном буферном растворе может быть различной и составлять, например, 2,5-10,0 мг/мл. Концентрация коммерчески доступных (Sigma-Aldrich, США) вышеуказанных поликатионов в буферном растворе также может варьироваться и составлять, например, 2,5-10,0 мг/мл. Следует отметить, что раствор поликатиона следует по каплям добавлять к раствору СОД при перемешивании. Если вышеуказанные растворы смешивать не по каплям, а, например, за один прием, то возрастает вероятность образования частиц с широким распределением по размеру, что нежелательно, поскольку это затрудняет очистку суспензии частиц. При этом количество использованных СОД и поликатиона может варьироваться, однако заряд СОД после модификации поликатионом должен быть положительным для обеспечения возможности последующего покрытия частиц слоем одного из вышеуказанных полианионов. После смешения компонентов полученную смесь необходимо выдерживать при перемешивании в течение, например, 25-40 мин для обеспечения возможности получение более однородных по размеру частиц, затем по каплям добавлять в нее водный буферный раствор блок-СПЛ. Если вышеуказанные растворы смешивать не по каплям, а, например, за один прием, то возрастает вероятность образования частиц с широким распределением по размеру, что нежелательно. Используемые при этом блок-сополимеры ПА - ПЭГ и ПГ -ПЭГ коммерчески доступны (http://www.alamanda-polymers.com/, Alamanda Polymers, США). При проведении данной стадии синтеза концентрация блок-СПЛ в буферном растворе может варьироваться и составлять, например, 2,5-10,0 мг/мл. При этом общее количество ранее обработанной поликатионом СОД и блок-СПЛ может варьироваться, однако после повторной модификации заряд полученных частиц должен поменять знак, т.е. стать отрицательным.
Образование на частицах СОД слоя поликатиона в ходе вышеуказанной обработки антиоксидантного фермента буферным раствором поликатиона, а также образование дополнительного внешнего слоя блок-СПЛ в ходе обработки модифицированных частиц СОД буферным раствором блок-СПЛ подтверждено контрольными примерами 8-10 и 11-16, соответственно.
После смешения вышеуказанных компонентов полученную смесь необходимо перемешивать и выдерживать в течение, например, 25-40 мин для обеспечения возможности получение более однородных по размеру частиц. При этом для обеспечения сохранности активности фермента выдерживание целесообразно проводить при пониженной относительно комнатной температуре, например, в холодильнике при 3-8°С.
После окончания данной стадии синтеза в полученную смесь при перемешивании по каплям добавляют свежеприготовленный водный раствор глутарового альдегида, который, как известно, выступает в качестве неизбирательного сшивающего агента химических соединений, содержащих первичные аминогруппы [Migneault I. et al. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking //Biotechniques. - 2004. - T. 37. - №. 5. - C. 790-802.]. При этом экспериментально было показано, что для увеличения суммарного выхода СОД по активности у частиц и повышения стабильности значений активности СОД у частиц в процессе их хранения в отличие от прототипа необходимо добавлять водный раствор глутарового альдегида, взятого в количестве, обеспечивающем его мольное соотношение с аминогруппами поликатиона 0,3-1,5. При этом концентрация раствора глутарового альдегида может быть различной. Затем для обеспечения полноты протекания ковалентного связывания (сшивки) аминогрупп полученную смесь необходимо выдерживать, например, в течение 8-12 ч при пониженной относительно комнатной температуре, например, в холодильнике при 3-8°С. После этого для повышения стабильности полученных частиц в вышеуказанную смесь при перемешивании по каплям добавляют избыток свежеприготовленного водного раствора боргидрида натрия с целью восстановления неустойчивых двойных связей между углеродом и азотом в полученных основаниях Шиффа с образованием стабильной ковалентной связи. При этом концентрация раствора боргидрида натрия может варьироваться и составлять, например, 1-2 мг/мл.
Ковалентное связывание глутарового альдегида с частицами СОД/поликатион/полианион подтверждено контрольным примером 17.
Полученную суспензию частиц очищают от побочных продуктов и не вступивших в реакцию реагентов с использованием мембранной фильтрующей системы. При этом можно использовать мембранную фильтрующую систему, например, в комбинации с перистальтическим насосом, подающим полученную суспензию частиц на мембрану (фильтр) под давлением, или применять центрифугирование с использованием помещенного в пробирку центрифуги ультрафильтрационного фильтра (мембраны). В последнем случае скорость вращения ротора центрифуги может варьироваться и составлять, например, 3000-4000 оборотов (об)/мин. В отличие от прототипа при этом используют мембранную фильтрующую систему с экспериментально подобранным пределом пропускания 90-130 к Да. Например, мембрана с пределом пропускания 90 кДа пропускает вещества с молекулярной массой менее 90 кДа. Следует отметить, что использование в предлагаемом способе описанной в прототипе ультрафильтрационной мембраны с пределом пропускания 50 кДа не позволяет провести надлежащую очистку полученных частиц в связи с забивкой пор в мембране.
При использовании центрифугирования в пробирку центрифуги помещают фильтр на основе ультрафильтрационной мембраны, заполненный аликвотой вышеописанной суспензии, с последующим введением перед каждой новой стадией центрифугирования дистиллированной воды.
При использовании поточной фильтрующей системы в накопительную емкость наливают полученную суспензию частиц. Далее фильтруемая суспензия из накопительной емкости с помощью перистальтического насоса под давлением подается на фильтрационный картридж с мембраной с пределом пропускания 90-130 кДа и двигается вдоль мембраны. Часть жидкости с низкомолекулярными побочными продуктами и не вступившими в реакцию реагентами проходит сквозь поры фильтрующей системы и накапливается в емкости. Очищенные от низкомолекулярных компонентов частицы, не прошедшие сквозь мембрану, потоком жидкости рециркулируются обратно в накопительную емкость, где смешиваются с постоянно поступающей дистиллированной водой. В результате общая концентрация низкомолекулярных побочных продуктов и не вступивших в реакцию реагентов в накопительной емкости уменьшается. На завершающем этапе фильтрации останавливают подачу жидкости в накопительную емкость, и может быть осуществлено концентрирование очищенной суспензии (уменьшают ее объем), например, в 2-4 раза.
Предлагаемый способ дает возможность получать водную суспензию частиц СОД / поликатион / полианион с определенным методом динамического светорассеяния средним гидродинамическим диаметром 90-200 нм. При этом погрешность измерений составляет не более 4%. Размер получаемых частиц можно варьировать изменением рН и ионной силы использованного буферного раствора, например, изменением в буферном растворе концентрации NaCl.
Ввиду того, что полученные частицы предполагается использовать в качестве действующего вещества и смешивать с фармакологически приемлемой, как правило, гидрофильной или гидрофобной твердой основой, полученную суспензию частиц подвергают лиофильной сушке, которую проводят с помощью традиционной лиофильной сушилки или вакуумной камеры. При этом перед лиофильной сушкой в суспензию частиц могут быть введены фармакологически приемлемые стабилизаторы, в качестве которых могут быть использованы, например, аминокислоты, моно- или полисахариды, полипептиды или белки. В группу аминокислот могут входить, например, аланин и глицин. В группу моно- или полисахаридов могут входить, например, глюкоза, сахароза, лактоза, трегалоза, манноза. В качестве полипептидов или белков могут быть использованы альбумины. При этом используемые стабилизаторы будут входить в качестве компонента в основу лекарственной формы.
Анализ активности СОД в лиофилизованном продукте проводят с использованием метода, в основе которого лежит реакция ингибирования автоокисления пирогаллола под действием СОД [Marklund S., Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase //European journal of biochemistry. - 1974. - T. 47. - №. 3. - C. 469-474]. Измерения проводят в 96-луночном планшете. Предварительно лиофилизат диспергируют в буферном растворе с получением суспензии частиц с известной концентрацией. Для одного образца используют 8 лунок (один столбец). Последовательным разбавлением получают 8 точек объемом 20 мкл с концентрациями СОД от 0,45 до 1000 мкг/мл. В каждую из лунок добавляют 160 мкл 50 мМ Трис-буфера с рН 8,2 и 20 мкл раствора пирогаллола, полученного растворением навески пирогаллола в рассчитанном объеме ацетона с получением раствора с концентрацией 5 мг/мл и его разбавлением в 10 раз водой. Затем в течение 5 мин через каждые 30 сек с помощью спектрофотометра определяют изменение оптической плотности раствора от времени в результате окисления пирогаллола растворенным в воде кислородом в отсутствии и присутствии СОД и строят график зависимости скорости окисления пирогаллола от концентрации СОД в логарифмическом масштабе. С помощью программного обеспечения Origin 8.1 полученную зависимость аппроксимируют кривой «доза-ответ» и находят концентрацию, соответствующую 50%-ному ингибированию реакции (ЕС50, мкг/мл). Далее рассчитывают активность СОД по формуле: А=1000000/(20*ЕС50) [Ед/мг]. Выход СОД по активности у частиц определяют как отношение активности СОД у частиц к начальной активности используемого в синтезе раствора СОД и измеряют в процентах. Следует отметить, что активность зависит от концентрации раствора СОД и снижается с ее уменьшением, а также от строения частиц и реагентов, используемых при их получении. Поэтому корректное сравнение значений активности СОД в частицах возможно проводить с учетом только вышеуказанных условий. Стабильность частиц в процессе их хранения и использования определяют по изменению их активности и размеров.
Определение концентрации белка в образцах проводят с помощью набора Micro ВСА™ Protein Assay Kit в соответствии с инструкцией производителя. Метод основан на колориметрическом определении комплекса бицинхониновой кислоты с ионами Cu+ образующегося путем восстановления ионов Си белками. Выход СОД по белку (ферменту) определяют как отношение конечной массы белка в суспензии частиц к начальной массе используемого белка в синтезе.
Суммарный выход СОД по активности вычисляют как произведение выхода СОД по активности и выхода СОД по белку.
Полученный лиофилизат целесообразно хранить при пониженной температуре в морозильной камере. Лиофилизат частиц может быть использован для получения средств для лечения гинекологических и проктологических заболеваний, например, суппозиториев (свечей), мазей, гелей и т.д. Указанные лекарственные формы могут быть получены путем смешения действующего вещества - лиофилизата частиц с основой, выбранной из группы, включающей в себя, например, полиэтиленоксид 1500, полиэтиленоксид 400, витепсол, твердые жиры, бутирол, ланоль, масло какао, гидрогенизированные жиры или желатин-глицериновая смесь и т.д. Суппозитории из вышеуказанной композиции могут быть получены, например, традиционным методом выливания или ручного формирования. Смесь вышеуказанных веществ может дополнительно содержать стабилизаторы, консерванты, другие лекарственные препараты и т.д. При этом соотношения действующего вещества и основы могут быть различны. В зависимости от вида и тяжести заболевания схема лечения также может быть также различна.
Испытания лекарственной формы на основе предлагаемых частиц были проведены на добровольцах.
Преимущества предлагаемого способа иллюстрируют следующие примеры.
Пример 1.
В пластиковую пробирку объемом 15 мл помещают 1,8 мл раствора СОД с концентрацией 5,00 мг/мл в буферном растворе, содержащем гидрофосфат натрия и дигидрофосфат натрия с концентрациями 0,57 мг/мл и 0,11 мг/ мл соответственно, с рН 7,4 с добавлением NaCl с концентрацией 130 мМ, затем туда при перемешивании по каплям добавляют 0,97 мл раствора поликатиона протамина с концентрацией 5,00 мг/мл в вышеописанном буферном растворе, что соответствует 32,8 мкмолям аминогрупп протамина, и полученную смесь выдерживают в течение 30 мин при перемешивании. После этого в полученный раствор при перемешивании по каплям добавляют 1,07 мл раствора полианиона блок-сополимера ПГ-ПЭГ с концентрацией 5,00 мг/мл в вышеописанном буферном растворе, и полученную смесь при перемешивании выдерживают в течение 30 мин при 4°С. Затем в полученную смесь при перемешивании по каплям добавляют 0,90 мл свежеприготовленного водного раствора глутарового альдегида с концентрацией 0,4% по объему (39,6 мкмоль), что соответствует мольному соотношению с аминогруппами поликатиона 1,2, и полученную смесь выдерживают в течение 10 ч при 4°С. После этого в вышеуказанную смесь при перемешивании по каплям добавляют 0,20 мл свежеприготовленного водного раствора боргидрида натрия с концентрацией 1,00 мг/мл. Для очистки суспензии полученных частиц используют поточную мембранную фильтрующую систему. Полученную суспензию наливают в накопительную емкость, откуда суспензия с помощью перистальтического насоса поступает на фильтрационные картриджи, содержащие мембраны с пределом пропускания 90 кДа, и с большой скоростью двигается вдоль мембран. Часть буферного раствора с низкомолекулярными побочными продуктами и не вступившими в реакцию реагентами проходит сквозь поры мембраны и накапливается в емкости. Остальная часть суспензии частиц, не прошедшая сквозь мембрану, рециркулируется обратно в накопительную емкость, где смешивается с постоянно поступающей дистиллированной водой.
В итоге получают 2,50 мл суспензии частиц, у которых ядро из СОД покрыто внутренней оболочкой из протамина и внешней оболочкой из блок-СПЛ. Диаметр полученных частиц, определенный методом динамического светорассеяния, составляет 90 нм. Активность СОД у частиц в полученной суспензии равна 13500±1000 Ед/мл. Суммарный выход СОД по активности у частиц составляет 52%.
Далее проводят лиофильную сушку полученной очищенной суспензии частиц. Суспензию переносят в круглодонную колбу, содержимое колбы замораживают при -78°С, после чего колбу соединяют с лиофильной сушилкой, в ловушку сушилки заливают жидкий азот и с помощью форвакуумного насоса внутри сушилки с подвешенной колбой создают вакуум. В процессе сушки колба снаружи покрывается инеем из атмосферной влаги, и сушку осуществляют до тех пор, пока иней не исчезнет. Колбу с лиофилизатом снимают с сушилки, лиофилизат переносят в пластиковую пробирку с плотно прилегающей крышкой. Пробирку с полученным лиофилизатом хранят в морозильной камере при -18°С.
После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 8%, а размер частиц в суспензии после диспергирования лиофилизата практически не изменился.
Для получения композиции 7,5 мг лиофилизата смешивают с 75,00 г желатин-глицериновой основы, состоящей из 8,50 г желатина, 47,00 г глицерина и 19,50 г воды. Получают композицию, в которой масс. % действующего вещества равен 0,01, а остальное основа, из которой формируют 20 суппозиториев массой по 3,00 г.
Больная А., 29 лет. Диагноз: острый вагинит. Больной вводили внутривагинально по 1 суппозиторию 2 раза в день в течение 10 дней. В результате наблюдалось: на 2 день после применения значительное уменьшение боли, зуда и чувства жжения, также явное уменьшение отечности и гиперемии наружных половых органов и слизистой влагалища.
Результаты опыта показывают, что полученные частицы могут быть использованы для лечения гинекологического заболевания, сопровождающегося окислительным стрессом.
Пример 2.
В пластиковую пробирку объемом 200 мл помещают 45,00 мл раствора СОД с концентрацией 2,50 мг/мл в буферном растворе, содержащем гидрофосфат натрия и дигидрофосфат натрия с концентрациями 0,03 мг/мл и 0,57 мг/ мл соответственно, с рН 5 с добавлением NaCl с концентрацией 140 мМ, затем туда при перемешивании по каплям добавляют 24,25 мл раствора поликатиона полилизина с концентрацией 2,50 мг/мл в вышеописанном буферном растворе, что соответствует 410 мкмолям аминогрупп поликатиона, и полученную смесь выдерживают в течение 25 мин при перемешивании. После этого в полученный раствор при перемешивании по каплям добавляют 26,75 мл раствора полианиона блок-сополимера ПГ-ПЭГ с концентрацией 2,50 мг/мл в вышеописанном буферном растворе, и полученную смесь при перемешивании выдерживают в течение 25 мин при 3°С. Затем в полученную смесь при перемешивании по каплям добавляют 11,25 мл свежеприготовленного водного раствора глутарового альдегида с концентрацией 0,1% по объему (123 мкмоль), что соответствует мольному соотношению с аминогруппами поликатиона 0,3, и полученную смесь выдерживают в течение 8 ч при 3°С. После этого в вышеуказанную смесь при перемешивании по каплям добавляют 5,00 мл свежеприготовленного водного раствора боргидрида натрия с концентрацией 1,00 мг/мл. Для очистки суспензии полученных частиц используют поточную мембранную фильтрующую систему. Полученную суспензию наливают в накопительную емкость, откуда суспензия с помощью перистальтического насоса поступает на фильтрационные картриджи, содержащие мембраны с пределом пропускания 130 кДа, и с большой скоростью двигается вдоль мембран. Часть буферного раствора с низкомолекулярными побочными продуктами и не вступившими в реакцию реагентами проходит сквозь поры мембраны и накапливается в емкости. Остальная часть суспензии частиц, не прошедшая сквозь мембрану, рециркулируется обратно в накопительную емкость, где смешивается с постоянно поступающей дистиллированной водой.
В итоге получают 62,00 мл суспензии частиц, у которых ядро из СОД покрыто внутренней оболочкой из полилизина и внешней оболочкой из блок-СПЛ. Диаметр полученных частиц, определенный методом динамического светорассеяния, составляет 123 нм. Активность СОД у частиц в полученной суспензии равна 6500±1000 Ед/мл. Суммарный выход СОД по активности у частиц составляет 55%.
Далее проводят лиофильную сушку, полученной суспензии частиц аналогично примеру 1. Однако, в качестве стабилизатора в суспензию вводят 31,25 мл раствора мальтозы с концентрацией 21%.
После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 4%, а размер частиц в суспензии после диспергирования лиофилизата в воде практически не изменился.
Для получения композиции 2,26 г лиофилизата, содержащего мальтозу смешивают с 72,74 г формирующего компонента основы - масла какао. Получают композицию, содержащую 1,00 масс. % действующего вещества, а остальное основа. Суппозитории массой по 3,00 г из полученной композиции получают методом ручного формирования.
Больной М., 62 года. Диагноз: хронический геморрой, стадия обострения. Больному вводили по 1 суппозиторию в прямую кишку 2 раза в день в течение 7 дней. На 4 день после начала лечения отмечено значительное улучшение состояния - кровотечение прекратилось, уменьшились боли и зуд в области заднего прохода. К концу курса лечения геморроидальный узел значительно уменьшился в размерах, воспаление было практически ликвидировано.
Результаты опыта показывают, что полученные частицы могут быть использованы для лечения проктологического заболевания, сопровождающегося окислительным стрессом.
Пример 3.
В пластиковую емкость объемом 7000 мл помещают 1800 мл раствора СОД с концентрацией 10,00 мг/мл в буферном растворе, содержащем гидрофосфат натрия и дигидрофосфат натрия с концентрациями 0,58 мг/мл и 0,04 мг/ мл соответственно, с рН 8 с добавлением NaCl с концентрацией 150 мМ, затем туда при перемешивании по каплям добавляют 970 мл раствора поликатиона полиаргинина с концентрацией 10,00 мг/мл в вышеописанном буферном растворе, что соответствует 65,6 ммолям аминогрупп протамина, и полученную смесь выдерживают в течение 40 мин при перемешивании. После этого в полученный раствор при перемешивании по каплям добавляют 1070 мл раствора полианиона блок-сополимера ПГ-ПЭГ с концентрацией 10,00 мг/мл в вышеописанном буферном растворе, и полученную смесь при перемешивании выдерживают в течение 40 мин при 8°С. Затем в полученную смесь при перемешивании по каплям добавляют 1800 мл свежеприготовленного водного раствора глутарового альдегида с концентрацией 0,5% по объему (98,4 ммоль), что соответствует мольному соотношению с аминогруппами поликатиона 1,5, и полученную смесь выдерживают в течение 12 ч при 8°С. После этого в вышеуказанную смесь при перемешивании по каплям добавляют 200 мл свежеприготовленного водного раствора боргидрида натрия с концентрацией 2,00 мг/мл. Для очистки суспензии полученных частиц от побочных продуктов и не вступивших в реакцию реагентов в пробирки центрифуги помещают фильтр с ультрафильтрационной мембраной с пределом пропускания 100 кДа, затем фильтр вначале заполняют 5 мл полученной суспензии частиц, после чего туда добавляют 10 мл дистиллированной воды, пробирки с фильтром помещают в центрифугу и проводят центрифугирование в течение 12 мин при скорости вращения ротора центрифуги 3500 об/мин. После этого в пробирки повторно добавляют 10 мл дистиллированной воды, снова помещают в центрифугу и проводят повторное центрифугирование, затем снова добавляют 10 мл дистиллированной воды и осуществляют третье центрифугирование. Находящуюся над фильтром очищенную суспензию переносят в пластиковую пробирку и хранят при 8°С.
В итоге получают 2500 мл суспензии частиц, у которых ядро из СОД покрыто внутренней оболочкой из полиаргинина и внешней оболочкой из блок-СПЛ. Диаметр полученных частиц, определенный методом динамического светорассеяния, составляет 196 нм. Активность СОД у частиц в полученной суспензии составляет 26200±1000 Ед/мл. Суммарный выход СОД по активности у частиц равен 47%.
Далее проводят лиофильную сушку, полученной суспензии частиц аналогично примеру 1, однако не используют стабилизатор.
После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 9%, а размер частиц в суспензии после диспергирования лиофилизата практически не изменился.
Для получения композиции 15,0 г лиофилизата смешивают с 60,0 г основы, включающей в себя 15,0 г полиэтиленоксида 400 и 45,0 г полиэтиленоксида 1500. Получают композицию, в которой масс. % действующего вещества равен 20,00, а остальное основа. Из полученной композиции формируют суппозитории массой 3,0 г.
Больная Л., 41 год. Диагноз: острый вульвит. Больной вводили по 1 суппозиторию 2 раза в день в течение 10 дней. На 4 день после начала лечения отмечено значительное улучшение состояния - отмечено значительное уменьшение боли, зуда и чувства жжения, констатировали уменьшение отечности и гиперемии наружных половых органов и слизистой влагалища.
Результаты опыта показывают, что полученные частицы могут быть использованы для лечения гинекологического заболевания, сопровождающегося окислительным стрессом.
Пример 4.
Опыт проводят аналогично примеру 1, однако в качестве полианиона используют блок-сополимер ПА - ПГ.
Диаметр полученных частиц, определенный методом динамического светорассеяния, составляет 153 нм. Активность СОД у частиц в полученной суспензии составляет 13500±1000 Ед/мл. Суммарный выход СОД по активности у частиц равен 52%. После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 7%, а размер частиц в суспензии после диспергирования лиофилизата практически не изменился.
Далее из полученного лиофилизата готовят суппозитории (свечи) аналогично примеру 1.
Больная Т. 45 лет. Обратилась с жалобами на частое болезненное мочеиспускание, зуд и жжение в области гениталий, тянущие боли в промежности. Диагноз: хронический рецидивирующий цервицит, период обострения. Было назначено лечение предлагаемыми суппозиториями по 1 суппозиторию 2 раза в день в течение 7 дней. Спустя 2 дня было отмечено значительное уменьшение боли и чувства жжения. При повторном осмотре очаг воспалительного процесса значительно уменьшился. Назначено лечение в течение еще 5 дней, по истечении которых пациент полностью вылечился.
Результаты опыта показывают, что полученные частицы могут быть использованы для лечения гинекологического заболевания, сопровождающегося окислительным стрессом.
Пример 5.
Опыт проводят аналогично примеру 2, однако в качестве полианиона используют блок-сополимер ПА - ПГ.
Диаметр полученных частиц, определенный методом динамического светорассеяния, составляет 118 нм. Активность СОД у частиц в полученной суспензии равна 7200±1000 Ед/мл. Суммарный выход СОД по активности у частиц равен 47%. После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 6%, а размер частиц в суспензии после диспергирования лиофилизата практически не изменился.
Далее из полученного лиофилизата готовят суппозитории (свечи) аналогично примеру 2.
Больная К, 49 лет. Диагноз: вагинит, вызванный смешанной инфекцией. Было назначено лечение предлагаемыми суппозиториями по 1 суппозиторию 2 раза в день в течение 7 дней. При повторном осмотре воспаление отсутствовало, наблюдалось улучшение клинической картины.
Результаты опыта показывают, что полученные частицы могут быть использованы для лечения гинекологического заболевания, сопровождающегося окислительным стрессом.
Пример 6.
Опыт проводят аналогично примеру 3, однако в качестве полианиона используют блок-сополимер ПА - ПГ.
Диаметр полученных частиц, определенный методом динамического светорассеяния, равен 186 нм. Активность СОД у частиц в полученной суспензии составляет 24900±1000 Ед/мл. Суммарный выход СОД по активности у частиц равен 49%. После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 5%, а размер частиц в суспензии после диспергирования лиофилизата практически не изменился.
Далее из полученного лиофилизата готовят суппозитории (свечи) аналогично примеру 3.
Больной Д., 56 лет. Диагноз: поверхностный проктит. Больному вводили по 1 суппозиторию 2 раза в день в течение 10 дней. В конце курса лечения наблюдалось купирование воспалительных процессов в тканях, уменьшение явления отека, исчезновение болевого синдрома, зуда, а также уменьшение отечности.
Результаты опыта показывают, что полученные частицы могут быть использованы для лечения проктологического заболевания, сопровождающегося окислительным стрессом.
Пример 7 (контрольный, по прототипу)
В пластиковую пробирку объемом 15 мл помещают 1,80 мл раствора СОД с концентрацией 5 мг/мл в 0,01 М буферном растворе ХЕПЕС с рН 7,4 с добавлением NaCl с концентрацией 150 мМ, затем туда при перемешивании по каплям добавляют 0,97 мл раствора поликатиона протамина с концентрацией 5 мг/мл в вышеописанном буферном растворе, что соответствует 32,8 мкмолям аминогрупп поликатиона, и полученную смесь выдерживают в течение 30 мин при перемешивании. После этого в полученный раствор при перемешивании по каплям добавляют 1,07 мл раствора полианиона блок-сополимера ПГ - ПЭГ с концентрацией 5 мг/мл в вышеописанном буферном растворе и полученную смесь при перемешивании выдерживают в течение 30 мин при 4°С. Затем в полученную смесь при перемешивании по каплям добавляют 0,90 мл свежеприготовленного водного раствора глутарового альдегида с концентрацией 1,0% по объему (98,4 мкмоль), что соответствует мольному соотношению с аминогруппами поликатиона 3,0, и полученную смесь выдерживают в течение 10 ч при 4°С. После этого в вышеуказанную смесь при перемешивании по каплям добавляют 0,09 мл свежеприготовленного водного раствора боргидрида натрия с концентрацией 1 мг/мл. Для очистки суспензии полученных частиц от побочных продуктов и не вступивших в реакцию реагентов в пробирку центрифуги помещают фильтр с ультрафильтрационной мембраной с пределом пропускания 50 кДа, затем фильтр вначале заполняют 4,80 мл полученной суспензии частиц, после чего туда добавляют 10,00 мл буферного раствора ХЕПЕС, пробирку с фильтром помещают в центрифугу и проводят центрифугирование в течение 15 мин при скорости вращения ротора центрифуги 4000 об/мин. После этого в пробирку повторно добавляют 10,00 мл буферного раствора ХЕПЕС, снова помещают в центрифугу и проводят повторное центрифугирование, затем снова добавляют 10,00 мл буферного раствора ХЕПЕС и осуществляют третье центрифугирование. Находящуюся над фильтром очищенную суспензию переносят в пластиковую пробирку и хранят при 4°С. Получают 2,50 мл суспензии частиц, у которых ядро из СОД покрыто внутренней оболочкой из протамина и внешней оболочкой из блок-СПЛ. Диаметр полученных частиц, определенный методом динамического светорассеяния, равен 52 нм. Активность СОД у частиц в полученной суспензии составляет 11500±1000 Ед/мл. Суммарный выход СОД по активности у частиц равен 35%.
Для хранения известных частиц, полученных по прототипу, и предлагаемых частиц в одинаковых условиях дополнительно проводят лиофильную сушку полученной в примере суспензии аналогично примеру 1.
После хранения в течение одного года в морозильной камере при -18°С активность СОД у частиц снижалась на 25%, а распределение частиц по размеру расширилось и стало бимодальным.
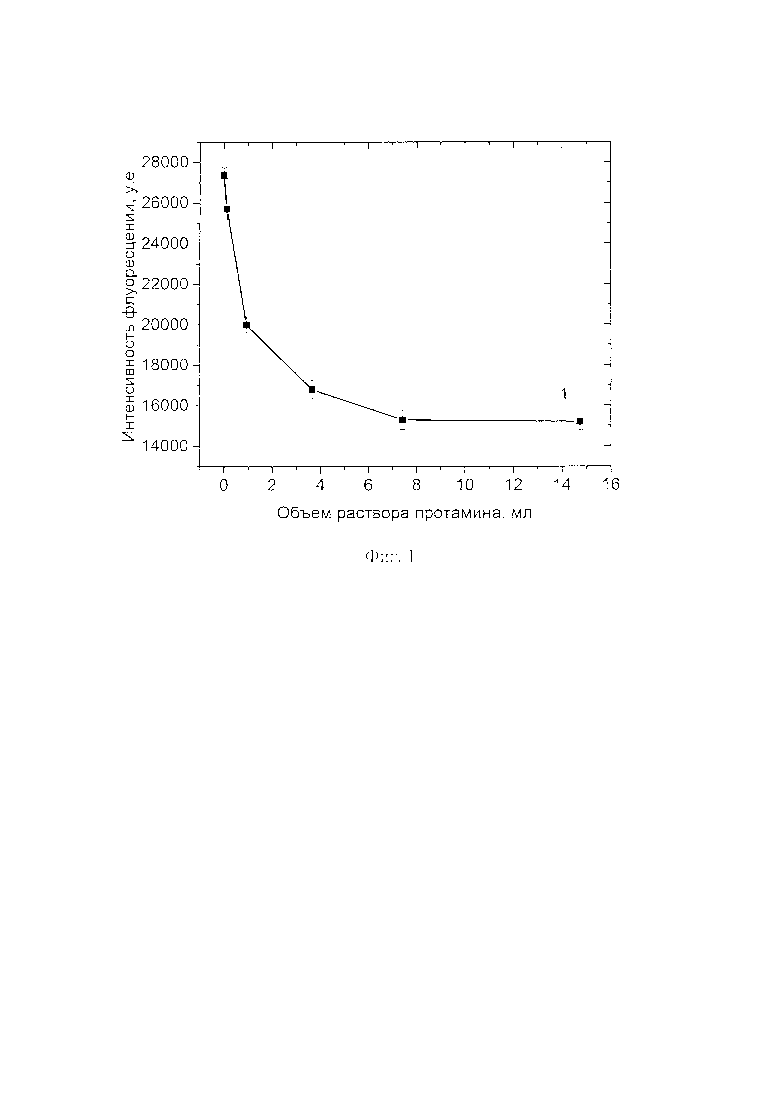
Пример 8 (контрольный, с обработкой частиц СОД буферным раствором поликатиона протамина) Для определения взаимодействия между положительно заряженным протамином с отрицательно заряженной СОД ее модифицируют с помощью флуоресцентного красителя Alexa 488 (А20000, ThermoFisher, США) и наблюдают тушение флуоресценции при добавлении протамина. Метод тушения флуоресценции является одним из удобных и информативных методов для исследования полиэлектролитных реакций.
С целью проверки модификации протамином на первом этапе к раствору СОД с концентрацией 5 мг/мл добавляют раствор флуоресцентного красителя Alexa 488 с концентрацией 10 мг/мл, далее проводят очистку от непрореагировавших молекул красителя с использованием колонки NAP-10 (GE Healthcare, США). Далее к раствору СОД, помеченному с помощью красителя, добавляют раствор протамина. С помощью флуоресцентного спектрометра измеряют интенсивность флуоресценции и рассчитывают уменьшение (тушение) интенсивности флуоресценции раствора, связанное с взаимодействием молекул протамина с молекулами СОД.
На Фиг. 1 показано, что при увеличении количества добавляемого раствора протамина происходит уменьшение интенсивности флуоресценции раствора, что связано с взаимодействием протамина с меченной СОД. При этом цифрой 1 обозначено изменение интенсивности флуоресценции раствора СОД, меченной красителем. Из Фиг. следует, что СОД взаимодействует с протамином, который в свою очередь образует внутренний слой (оболочку), тем самым уменьшает флуоресценцию красителя, связанного с СОД.
Пример 9 (контрольный, с обработкой частиц СОД буферным раствором поликатиона полилизина)
Опыт проводят аналогично примеру 8, однако, в качестве поликатиона используют, полилизин. Были получены результаты, аналогичные примеру 8, которые показали, что СОД взаимодействует с полилизином с образованием слоя поликатиона на СОД.
Пример 10 (контрольный, с обработкой частиц СОД буферным раствором поликатиона полиаргинина)
Опыт проводят аналогично примеру 8, однако в качестве поликатиона используют полиаргинин. Были получены результаты, аналогичные примеру 8, из которых следует, что СОД взаимодействует с полиаргиниом с образованием слоя поликатиона на СОД.
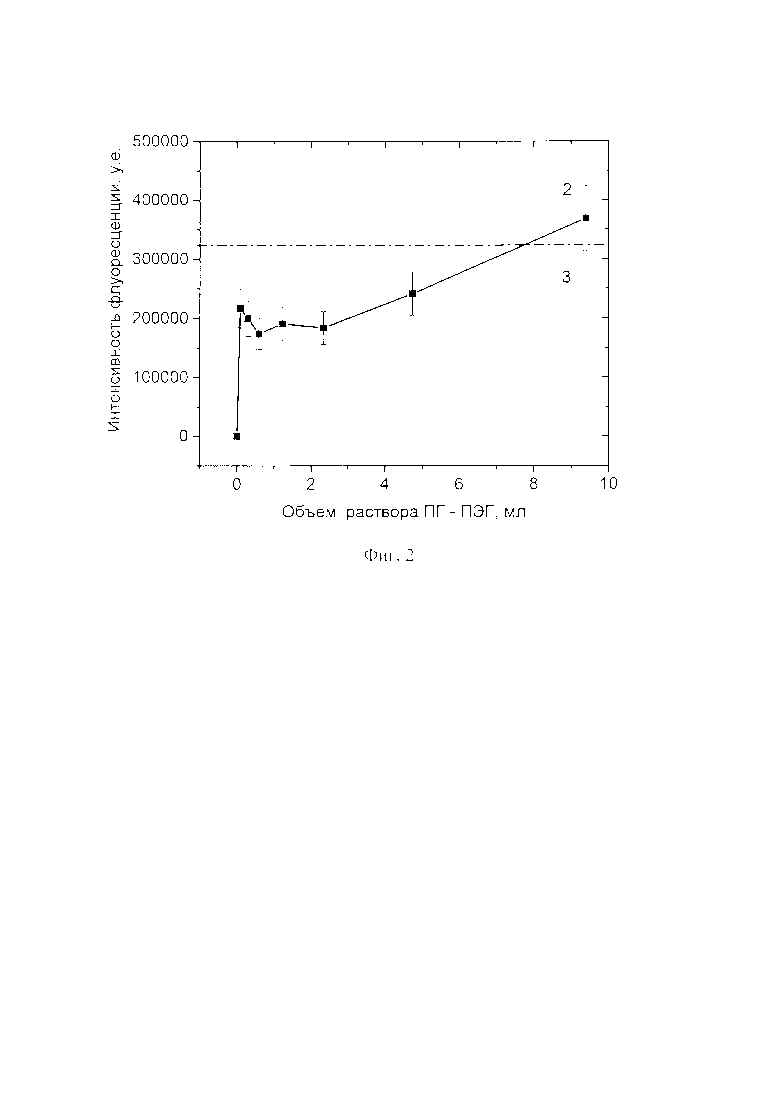
Пример 11 (контрольный, с обработкой частиц СОД, покрытых оболочкой из поликатиона протамина, раствором полианиона блок-сополимера ПГ - ПЭГ)
Для определения включения блок-СПЛ в состав частиц блок-сополимера ПГ - ПЭГ модифицируют с помощью флуоресцентного красителя флуоресцеина изоционата (F2181, ThermoFisher, США) и добавляют к раствору с СОД, покрытой оболочкой из протамина. С целью проверки модификации блок-сополимера ПГ - ПЭГ к раствору блок-СПЛ с концентрацией 5 мг/мл добавляют раствор флуоресцентного красителя с концентрацией 10 мг/мл, далее проводят очистку от непрореагировавших молекул с использованием колонки NAP-10 (GE Healthcare, США).
Далее раствор блок-СПЛ, помеченный красителем, добавляют по каплям при перемешивании к раствору СОД, покрытой оболочкой из протамина. С помощью флуоресцентного спектрометра измеряют уменьшение (тушение) интенсивности флуоресценции, связанное с взаимодействием молекул блок-сополимера ПГ - ПЭГ с СОД, покрытой оболочкой из протамина.
На Фиг. 2 показано, что при увеличении количества добавляемого блок-СПЛ, вначале происходит уменьшение флуоресценции (кривая 2) относительно начального значения уровня флуоресценции раствора (кривая 3). Уменьшение (тушение) флуоресценции происходит за счет взаимодействия СОД, модифицированного поликатионом, и меченного красителем блок-СПЛ, однако при избытке блок - СПЛ, наблюдается увеличение уровня флуоресценции (кривая 2), что связано с избытком блок-СПЛ по отношению к СОД, покрытой оболочкой из протамина. Количество отрицательно заряженных групп молекул блок-СПЛ превышает общее количество положительно заряженных групп в частицах СОД, модифицированных протамином, поэтому молекулы блок-СПЛ, меченные красителем, находятся в свободной форме в растворе, увеличивая интенсивность флуоресценции раствора.
Из Фиг. 2 следует, что полианион блок - СПЛ вступает во взаимодействие с СОД, покрытой протамином, при этом по данным, полученным с помощью метода динамического светорассеяния, наблюдается формирование частиц диаметром 90 нм, что также подтверждает факт взаимодействия, поскольку исходный размер ядра частиц СОД составляет 70 нм.
Пример 12 (контрольный, с обработкой частиц СОД, покрытых оболочкой из поликатиона полилизина, раствором полианиона блок-сополимера ПГ - ПЭГ)
Опыт проводят аналогично примеру 11, однако в качестве поликатиона используют полилизин. Были получены результаты, аналогичные примеру 11, из которых следует, что блок - СПЛ вступает во взаимодействие с СОД, покрытой полилизином, с образованием слоя полианиона. При этом по данным, полученным с помощью метода динамического светорассеяния, наблюдается формирование частиц диаметром 125 нм, что также подтверждает факт взаимодействия.
Пример 13 (контрольный, с обработкой частиц СОД, покрытых оболочкой из поликатиона полиаргинина раствором полианиона блок-сополимера ПГ - ПЭГ)
Опыт проводят аналогично примеру 8, однако в качестве поликатиона используют полиаргинин. Были получены результаты, аналогичные примеру 11, из которых следует, что блок - СПЛ вступает во взаимодействие с СОД, покрытой полиаргинином, с образованием слоя полианиона. При этом по данным, полученным с помощью метода динамического светорассеяния, наблюдается формирование частиц диаметром 196 нм, что также подтверждает факт взаимодействия.
Пример 14 (контрольный, с обработкой частиц СОД, покрытых оболочкой из поликатиона протамина раствором полианиона блок-сополимера ПА - ПЭГ)
Опыт проводят аналогично примеру 8, однако в качестве полианиона используют блок- сополимер ПА - ПЭГ. Были получены результаты, аналогичные примеру 11, из которых следует, что блок - СПЛ вступает во взаимодействие с СОД, покрытой протамином, с образованием слоя полианиона. При этом по данным, полученным с помощью метода динамического светорассеяния, наблюдается формирование частиц диаметром 153 нм.
Пример 15 (контрольный, с обработкой частиц СОД, покрытых оболочкой из поликатиона полилизина раствором полианиона блок-сополимера ПА - ПЭГ)
Опыт проводят аналогично примеру 8, однако в качестве поликатиона используют полилизин, а в качестве полианиона используют блок-сополимер ПА - ПЭГ. Были получены результаты, аналогичные примеру 11, из которых следует, что блок - СПЛ вступает во взаимодействие с СОД, покрытой полилизином, с образованием слоя полианиона. При этом по данным, полученным с помощью метода динамического светорассеяния, наблюдается формирование частиц диаметром 118 нм.
Пример 16 (контрольный, с обработкой частиц СОД, покрытых оболочкой из поликатиона полиаргинина раствором полианиона блок-сополимера ПА - ПЭГ)
Опыт проводят аналогично примеру 8, однако в качестве поликатиона используют полиаргинин, а в качестве полианиона используют блок-сополимер ПА - ПЭГ. Были получены результаты, аналогичные примеру 11, из которых следует, что блок - СПЛ вступает во взаимодействие с СОД, покрытой полиаргинином, с образованием слоя полианиона. При этом по данным, полученным с помощью метода динамического светорассеяния, наблюдается формирование частиц диаметром 186 нм.
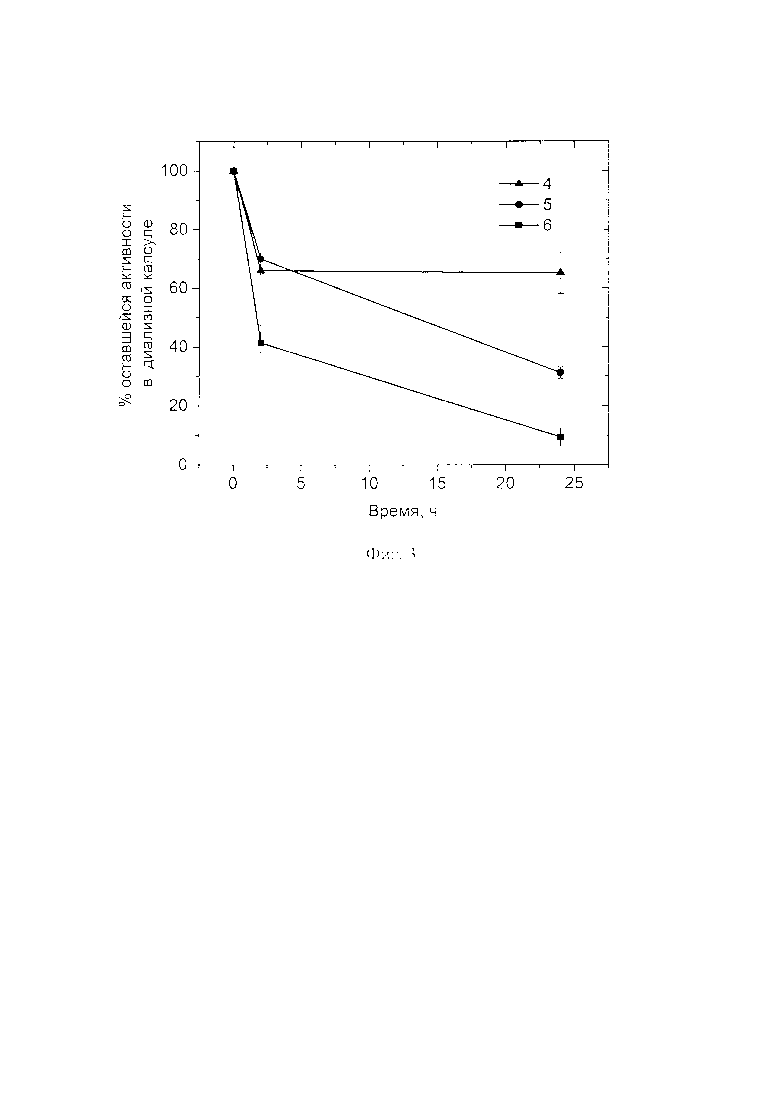
Пример 17 (контрольный, с обработкой частиц глутаровым альдегидом)
Для определения степени удерживания СОД в частицах, полученных в примере 1, а также оценки стабильности частиц в растворе используют диализные капсулы с пределом пропускания 100 кДа марки Float-A-Lyzer® G2 (Spectrum Laboratories, США). Каждую капсулу заполняют 1 мл либо раствора нативной СОД с концентрацией 1 мг/мл, либо суспензией частиц до обработки глутаровым альдегидом, либо суспензией частиц после обработки глутаровым альдегидом. Далее каждую капсулу опускают в емкость с описанным в примере 1 фосфатным буфером с рН 7,4 объемом 30 мл и отбирают пробы из каждой капсулы через заданные промежутки времени. Затем в пробах измеряют активность СОД. Если составляющие частицы не связаны ковалентно, то СОД способна высвобождаться из оболочки и диффундировать сквозь мембрану диализной капсулы, тем самым понижая общую активность внутри капсулы.
На Фиг 3. показано, что частицы, обработанные водным раствором глутарового альдегида (кривая 4), обладают более высокой стабильностью, благодаря ковалентному связыванию полимеров и фермента в частице. Из Фиг. 3 также видно, что СОД в частицах, обработанных глутаровым альдегидом, удерживается лучше, чем в необработанных. Так, после 24 ч процент оставшейся активности СОД в частицах, обработанных глутаровым альдегидом (кривая 4), значительно выше, чем в образцах, необработанных глутаровым альдегидом (кривая 5), и в образцах раствора СОД (кривая 6).
Суспензии частиц, полученные по примерам 2-6 с обработкой глутаровым альдегидом также обладают большей стабильностью, по сравнению с частицами без обработки глутаровым альдегидом.
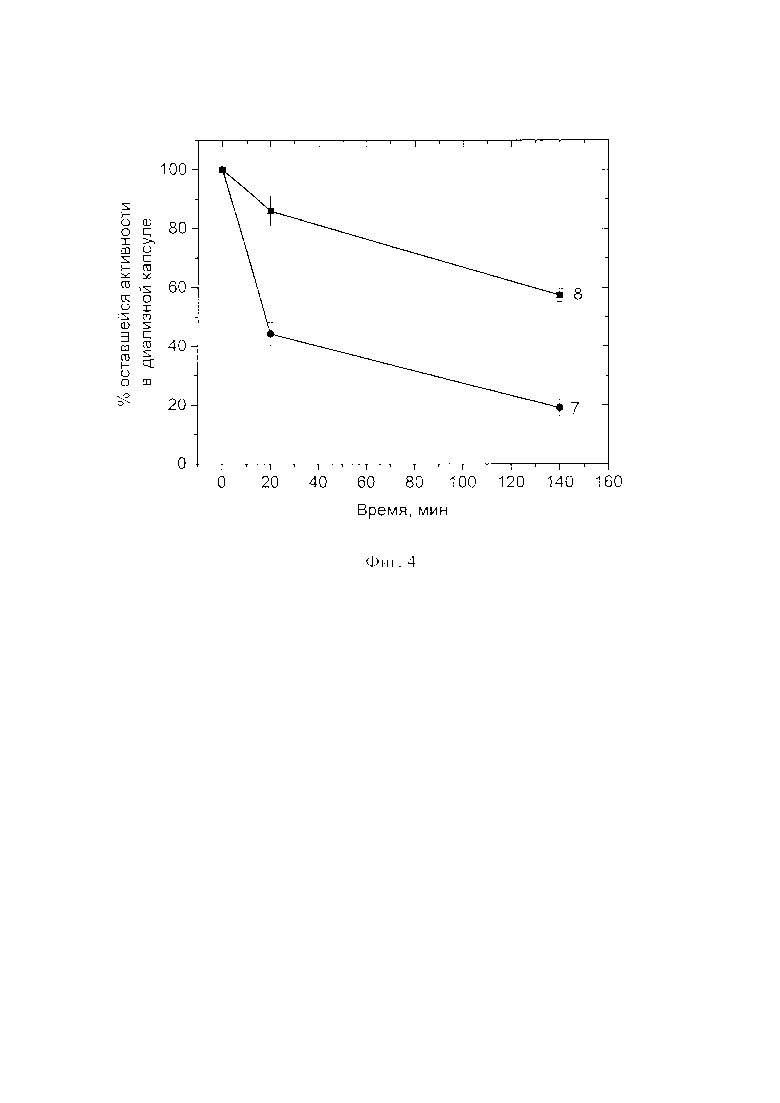
Пример 18 (контрольный, со сравнением выхода по активности СОД в различных буферах)
Получают частицы с использованием фосфатного буфера по примеру 1 и ХЕПЕС буфера по примеру 7. Для определения степени удерживания СОД в частицах, а также оценки стабильности частиц в растворе в процессе их хранения используют диализные капсулы с мембраной с пределом пропускания 100 кДа марки Float-A-Lyzer® G2 (Spectrum Laboratories, США). Каждую капсулу заполняют водосодержащей суспензией частиц, полученных в различных буферах, затем помещают в пробирку с 30 мл соответствующего буфера и после чего отбирают из капсул аликвоты с течением времени с целью оценки оставшейся активности СОД в частицах. Если составляющие частицы недостаточно ковалентно связаны между собой, то СОД способна высвобождаться из оболочки и диффундировать сквозь мембрану диализной капсулы, поскольку молекулярная масса СОД гораздо ниже предела пропускания использованной мембраны. При этом понижается общая активность СОД внутри капсулы.
На Фиг. 4 показано, что процент оставшейся активности в диализной капсуле с частицами, полученными в вышеописанном буфере ХЕПЕС (кривая 7), значительно ниже, чем в суспензиях частиц, полученных в фосфатных буферах по примеру 1 (кривая 8), что свидетельствует о более быстром высвобождении СОД из частиц, полученных с использованием буферного раствора ХЕПЕС.
Полученные результаты свидетельствуют о том, что выбор фосфатного буферного раствора более оправдан ввиду повышенной стабильности частиц.
Таким образом, из приведенных примеров видно, что предложенный способ действительно дает возможность получать частицы на основе антиоксидантного фермента СОД, покрытые внутренней оболочкой из поликатиона и внешней оболочкой из полианиона, пригодные для лечения гинекологических и проктологических заболеваний, у которых суммарный выход СОД по активности возрастает с 35 до 55%, в 2,5-3 раза повышается стабильность значений активности СОД у частиц в процессе их хранения и размер частиц в процессе их хранения практически не меняется, что свидетельствует о повышении стабильности размеров частиц.
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиция для лечения гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом | 2019 |
|
RU2733948C2 |
| Способ получения водосодержащей суспензии частиц, состоящих из антиоксидантного фермента супероксиддисмутазы, поликатиона и полианиона | 2019 |
|
RU2709536C1 |
| Композиция, снижающая окислительный стресс в глазу | 2019 |
|
RU2733928C2 |
| ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ СОСТАВА ФЕРМЕНТ-ПОЛИКАТИОН-ПОЛИАНИОН, СОДЕРЖАЩИЕ АНТИОКСИДАНТНЫЙ ФЕРМЕНТ, ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2575836C2 |
| НАНОЧАСТИЦЫ АНТИОКСИДАНТНОГО ФЕРМЕНТА СУПЕРОКСИДДИСМУТАЗЫ В ВИДЕ ПОЛИЭЛЕКТРОЛИТНОГО КОМПЛЕКСА СОСТАВА ФЕРМЕНТ-ПОЛИКАТИОН-ПОЛИАНИОН И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2552340C1 |
| Фармацевтическая композиция для лечения заболеваний глаз, сопровождающихся окислительным стрессом, и способ ее применения | 2018 |
|
RU2694226C1 |
| СРЕДСТВО ДЛЯ ПЕРЕНОСА НУКЛЕИНОВЫХ КИСЛОТ ИЛИ ИХ ПРОИЗВОДНЫХ В КЛЕТКИ ЧЕЛОВЕКА ИЛИ ЖИВОТНЫХ | 1992 |
|
RU2113485C1 |
| СПОСОБ ПЕРЕНОСА НУКЛЕИНОВОЙ КИСЛОТЫ В КЛЕТКИ ЖИВОТНЫХ | 1990 |
|
RU2098487C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИЭЛЕКТРОЛИТНЫХ МИКРОЧАСТИЦ, СОДЕРЖАЩИХ ИНКАПСУЛИРУЕМОЕ ВЕЩЕСТВО, ЧУВСТВИТЕЛЬНЫХ К ИЗМЕНЕНИЮ СОСТАВА ОКРУЖАЮЩЕЙ СРЕДЫ | 2005 |
|
RU2300369C1 |
| КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ БЕЛКОВ И МЕТОДЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2526904C2 |
Изобретение относится к химико-фармацевтической промышленности. Способ получения частиц для лечения гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом, включает смешение буферных растворов антиоксидантного фермента супероксиддисмутазы (СОД) и поликатиона, выбранного из протамина, полилизина и полиаргинина, перемешивание и выдерживание полученной смеси с последующими добавлением в нее буферного раствора полианиона блок-сополимера полиглутаминовой кислоты и полиэтиленгликоля или блок-сополимера полиаспарагиновой кислоты и полиэтиленгликоля, перемешивание и выдерживание полученной смеси, добавление в нее водного раствора глутарового альдегида, выдерживание смеси, добавление в смесь водного раствора боргидрида натрия и очистку смеси с использованием мембранной фильтрующей системы и отличается тем, что глутаровый альдегид добавляют в количестве, обеспечивающем его мольное соотношение с аминогруппами поликатиона 0,3-1,5, и используют фильтрующую систему с пределом пропускания 90-130 килодальтон, причем после очистки смеси проводят ее лиофильную сушку. Изобретение увеличивает суммарный выход СОД по активности и повышает в 2,5-3 раза стабильность значений активности СОД у частиц. 4 ил., 18 пр.
Способ получения частиц для лечения гинекологических и проктологических заболеваний, сопровождающихся окислительным стрессом, путем смешения буферных растворов антиоксидантного фермента супероксиддисмутазы и поликатиона, выбранного из группы, включающей протамин, полилизин и полиаргинин, перемешивания и выдерживания полученной смеси с последующими добавлением в нее буферного раствора полианиона блок-сополимера полиглутаминовой кислоты и полиэтиленгликоля или блок-сополимера полиаспарагиновой кислоты и полиэтиленгликоля, перемешиванием и выдерживанием полученной смеси, добавлением в нее водного раствора глутарового альдегида, выдерживанием смеси, добавлением в смесь водного раствора боргидрида натрия и очисткой смеси с использованием мембранной фильтрующей системы, отличающийся тем, что глутаровый альдегид добавляют в количестве, обеспечивающем его мольное соотношение с аминогруппами поликатиона 0,3-1,5, и используют фильтрующую систему с пределом пропускания 90-130 килодальтон, причем после очистки смеси проводят ее лиофильную сушку.
| ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ СОСТАВА ФЕРМЕНТ-ПОЛИКАТИОН-ПОЛИАНИОН, СОДЕРЖАЩИЕ АНТИОКСИДАНТНЫЙ ФЕРМЕНТ, ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2575836C2 |
| С.В | |||
| Угланова и др | |||
| Стабилизация ферментов-антиоксидантов в комплексах и конъюгатах с блоксополимерами: перспективы лечения заболеваний центральной нервной системы | |||
| ВЕСТН | |||
| МОСК | |||
| УН-ТА | |||
| СЕР | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ХИМИЯ | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 2012162490 А1, 29.11.2012. | |||
Авторы
Даты
2019-07-10—Публикация
2019-03-28—Подача