ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к (S)-энантиомеру пирлиндола или его фармацевтически приемлемым солям, а также к включающим их композициям для применения для терапевтического лечения и предупреждения боли.
УРОВЕНЬ ТЕХНИКИ
Лечение болевых патологических состоянии обладает самой большой важностью для медицины и во всем мире необходимы средства их лечения и предупреждения.
Боль является самым распространенным симптомом, при котором пациенты обращаются за медицинской помощью. Хотя для нее и отсутствует точное определение, ее можно определить, как неприятное сенсорное и эмоциональное ощущение, связанное с реальным или потенциальным поражением тканей или описанное с помощью такого поражения (International Association for the Study of Pain, IASP).
Боль является весьма адекватным симптомом, характеризующимся сложным патогенезом. В медицине ее наличие указано для большого количества синдромов и заболеваний. В тяжелых формах боль переходит в разного рода инвалидность, затруднения при осуществлении повседневной деятельности, ухудшение настроения, профессиональной деятельности и социальных отношений.
Кроме того, восприятие боли меняется при переходе от индивидуума к индивидууму, у данного индивидуума в разные моменты его жизни и зависит от меняющихся физического, биологического, социокультурного и эмоционального состояний.
По топографическому расположению можно различить 3 типа боли: периферическую боль, центральную боль и психогенную боль.
Периферическая боль является результатом органического нарушения в периферических нервных волокнах, которые при передаче нервных импульсов вызывают ощущение боли. Периферическая боль можно дополнительно разделяется на поверхностную периферическую боль и глубокую периферическую боль. Первая является острой и проникающей и находится в месте образования. Глубокую периферическую боль можно разделить на соматическую или висцеральную. Соматическая глубокая периферическая боль может быть локализованной (боль проявляется в месте образования болевого стимула) или иррадиирующей (боль является диффузной и удаленной от места образования болевого стимула). В заключение, следует отметить, что глубокую висцеральную периферическую боль затруднительно ограничить топографически.
Центральная боль представляет собой спонтанную боль, обусловленную неврологическим поражением центров центральной нервной системы, таких как спинной мозг, продолговатый мозг, таламус или кора головного мозга.
Психогенная боль определяется, как болевое ощущение, которое не имеет органической основы. Она представляет собой любую боль, которая является исключительно эмоциональной и которая обладает специфическим анатомическим расположением.
С патофизиологической точки зрения боль может быть ноцицептивной или невропатической.
Ноцицептивную боль можно определить, как боль, которая возникает вследствие реального или угрожающего поражения не являющейся нервной ткани и обусловлена активацией болевых рецепторов. Ноцицептивную боль можно разделить на соматическую или висцеральную. Соматическая боль обусловлена активацией болевых рецепторов в соматических тканях, таких как кости, суставы, мышцы или кожа. При висцеральной боли висцеральные болевые рецепторы активируются по другим патологическим механизмам (например, вследствие механического повреждения, воспаления, облучения, воздействия токсичных агентов). И висцеральная, и соматическая ноцицептивная боль может быть острой или хронической. Висцеральную боль труднее охарактеризовать и она менее восприимчива по отношению к обычному лечению боли. Некоторые болевые синдромы (например, боль при раке) включают элементы и висцеральной, и соматической ноцицептивной боли.
Невропатическую боль можно определить, как боль, возникающую в качестве прямого следствия поражения или заболевания, влияющего на соматосенсорную систему (т. е. периферический нерв, ганглий заднего корешка или задний корешок, или центральную нервную систему).
Почти все патологические процессы, для которых известно, что они приводят к повреждению или нарушению функции нервной ткани, можно считать потенциальными причинами невропатической боли: вирусные, бактериальные, обусловленные асептическим воспалением, обусловленные воздействием новообразования или других структурных поражений, дегенеративные, ишемические, аутоиммунные, токсические, травматические или эндокринные/метаболические механизмы все они участвуют в возникновении невропатической боли.
Однако наиболее подробно исследованные невропатические болевые состояния включают диабетическую невропатическую боль (диабетическую NP), постгерпетическую невралгию (PHN), невралгию тройничного нерва и центральную невропатическую боль (повреждение спинного мозга (SCI)), центральную боль после удара (CPSP) и боль, связанную с рассеянным склерозом.
Другие невропатические болевые состояния включают невропатию, связанную с инфекцией ВИЧ (вирус иммунодефицита человека) (ВИЧ невропатия), посттравматическую или послеоперационную невропатическую боль, хроническую радикулопатию, связанную с раком невропатическую боль, фантомную боль и обладающие разной этиологией невропатические боли.
Невропатия является функциональным нарушением или патологическим изменением, которое поражает нервы. Ее называют мононевропатией, если она включает один нервный ствол, множественной мононевропатией, если она последовательно включает несколько нервных стволов, и полиневропатией, если она включает, диффузно и билатерально, несколько нервных стволов.
Периферические невропатии могут быть сенсорными, моторными или автономными. Наиболее частыми моторными проявлениями являются мышечные спазмы, клонус, фасцикуляции, амиотрофия и утрата мышечной силы или физической ловкости.
Негативные сенсорные проявления включают гипоальгезию и гипестезию. В свою очередь, позитивные сенсорные проявления включают парестезию, дисестезию, гиперпатию, гипералгезию и аллодинию, кроме ощущения покалывания, пощипывания или шума в ушах. Примеры невропатии включают, периферическую полиневропатию, характеризующуюся ощущением жжения или покалывания иголками в стопах и кончиках пальцев, которая ухудшается при ходьбе, аллодинией, гипестезией стопы и отсутствием ахиллова рефлекса; невралгию тройничного нерва, характеризующуюся сильной острой болью, шокоподобной, продолжающейся в течение нескольких секунд в верхней губе и в носу, которая ухудшается при жевании или расчесывании волос и которая не сопровождается изменениями результатов неврологического обследования; туннельный синдром запястья, характеризующийся острой болью, ощущениями пощипывания и пониженной чувствительностью 1-го, 2-го и 3-го пальцев и ладонной поверхности руки, которая ухудшается ночью, с пониженной мышечной силой при абдукции большого пальца и положительным результатом теста Фалена; мононевропатию латерального кожного нерва бедра, характеризующуюся ощущением жжения и покалывания в боковой части бедра и наличием ограниченного участка кожной гиперчувствительности; постгерпетическую невралгию, характеризующуюся жгучей болью с баннероподобным распределением в области груди после появления пузырьков, протекание которой не улучшается после излечивания кожи, гиперхромными прыщами на коже и аллодинией.
В последние десятилетия усилилось влияние боли на индивидуальное и социальное благосостояние.
В связи с этим невропатическая боль повсеместно считается одним из наиболее трудных для лечения болевых синдромов и результаты лечения часто являются неудовлетворительными. По оценкам невропатическая боль поразила до 7-8% населения Европы (European Federation of Neurological Societies guidelines on the pharmacological treatment of neuropathic pain, 2010).
Лечение невропатической боли является сложным процессом и часто разочаровывающим для пациента, а также врача. Для лечения боли и тем более невропатической боли часто используют лекарственные средства, механизм действия которых не направлен на изменение лежащих в ее основе патофизиологических процессов или такие, которые вводят в субтерапевтических дозах.
Это обусловлено относительно неполным пониманием механизма действия лекарственных средств и ограниченной эффективностью имеющихся в настоящее время анальгетиков. Терапевтические методики разных врачей сильно различаются и не поддающиеся лечению синдромы хронической боли оправдывают использование междисциплинарного подхода и более активных фармацевтических средств.
Применение анальгетических лекарственных средств проводят в рамках постадийного подхода. Первая стадия соответствует слабой боли и ее следует лечить неопиоидными анальгетическими лекарственными средствами (противовоспалительные лекарственные средства и парацетамол); второй является умеренная боль, в случае которой показаны слабые опиоиды, и на третьей стадии, при сильной боли, показаны сильнодействующие опиоиды. В зависимости от интенсивности боли лечение следует начинать на соответствующем уровне с использованием подходящих доз. Если боль сохраняется или усиливается, следует оптимизировать дозы лекарственного средства.
Анальгетические лекарственные средства можно разделить на две большие группы: неопиоидные и опиоидные анальгетические лекарственные средства.
Неопиоидные анальгетические лекарственные средства включают парацетамол и нестероидные противовоспалительные лекарственные средства (NSAIDs). Парацетамол не обладает хорошо известным механизмом действия, хотя предполагается центральное действие. Введение больших доз, разовое или постоянное, сопряжено с опасностью гепатотоксичности, связанной с израсходованием сульфгидрильных радикалов.
Нестероидные противовоспалительные лекарственные средства действуют путем ингибирования циклооксигеназы (COX), ингибирования синтеза простагландинов (PG), участвующих в воспалительном процессе и в боли. Они могут быть неселективными, ингибируя COX1 и COX2, как ацетилсалициловая кислота (AAS), ибупрофен или диклофенак, или селективными, ингибируя только COX2, как целекоксиб, рофекоксиб или эторикоксиб. Нестероидные противовоспалительные лекарственные средства приводят к некоторым побочным эффектам, включая желудочно-кишечные (тошнота, эпигастралгия, изъязвление, кровотечение), почечные (острая почечная недостаточность, интерстициальный нефрит), гематологические (препятствование агрегации тромбоцитов, кровоизлияния) или реакции гиперчувствительности. Эти эффекты в наибольшей степени выражены в случае неселективных NSAIDs. Основным побочным эффектом в случае ингибиторов COX2 является повышенная опасность сердечно-сосудистых поражений вследствие ингибирования простациклина. Лечение нестероидными противовоспалительными лекарственными средствами связано с повышенной опасностью побочных реакций со стороны желудочно-кишечного тракта.
Так называемые слабые опиоидные лекарственные средства включают такие лекарственные средства, как трамадол, гидрокодон и декстропропоксифен. Эти лекарственные средства характеризуются максимальной зависимостью от дозы вследствие повышенной частоты побочных реакций при высоких дозах. Трамадол является синтетическим производным кодеина, который действует путем связывания с опиоидными μ рецепторами ингибирования обратного захвата серотонина нейронами. Трамадол подвергается метаболизму к печени и выводится почками, поэтому для него может потребоваться снижение дозы или увеличение интервала между дозами у пациентов, страдающих от почечной или ренальной недостаточности.
Гидрокодон является синтетическим производным кодеина и декстропропоксифена и обладает структурой, аналогичной структуре метадона. Пациентов, у которых наблюдается боль от слабой до умеренной, следует лечить слабым опиоидом вместе с NSAID или парацетамолом. Если боль невозможно устранить с помощью терапевтических доз, следует не рассматривать переход на другое лекарственное средство этой группы, а использовать более активные опиоиды.
Опиоиды действуют путем связывания с рецепторами μ, κ и δ и в соответствии с их собственной активностью их можно разделить на агонисты (морфин, фентанил, метадон, оксикодон, гидроморфон и петидин), частичный агонист/антагонист (бупренорфин) и агонист/антагонист (пентазоцин). Чистый агонист представляет собой лекарственное средство, которое действует на μ рецепторы и на другие рецепторы. Частичный агонист/антагонист оказывает частичное агонистическое воздействие на один рецептор и антагонистическое воздействие по меньшей мере на один рецептор и агонист/антагонист оказывает чистое агонистическое воздействие на один рецептор и агонистическое воздействие по меньшей мере на один рецептор.
Опиоиды приводят к предсказуемым нежелательным побочным эффектам, которые, если они не сведены к минимуму, могут препятствовать подбору дозы и соблюдению пациентом режима лечения. Побочные эффекты включают угнетение дыхания, тошноту и рвоту, констипацию, задержку мочи, эйфорию, седативный эффект, миоз, противокашлевое действие, гипотензию, брадикардию, когнитивные изменения (галлюцинации, бредовые идеи), гипералгезию, миоклонию, диспепсию, прурит, переносимость и зависимость.
Морфин можно вводить пероральным или парентеральным путем (подкожным и внутривенным). Для внутривенного введения требуется особая осторожности и его применение ограничено стационарами. Для подкожного введения используют насосы для вливаний.
Трициклические антидепрессанты (амитриптилин, нортриптилин и дезипрамин) используют в комбинации с анальгетическими лекарственными средствами, предпочтительно в комбинации с опиоидами и в основном для лечения невропатической боли. Вследствие их антихолинергического действия побочные эффекты включают констипацию, ксеростомию, задержку мочи и тахикардию.
Противосудорожные средства (карбамазепин, окскарбазепин, фенитоин, вальпроат натрия, клоназепам, ламотриджин, габапентин, прегабалин) также используют для лечения боли, в особенности невропатической боли. Карбамазепин и фенитоин могут оказать токсическое воздействие на печень, привести к лейкопении и тромбоцитопении и поэтому необходим мониторинг их концентраций в сыворотке.
Кортикостероиды, из числа которых для лечения боли чаще всего используют дексаметазон, связаны с возникновением желудочно-кишечных нарушений, сахарного диабета, нервно-психических нарушений и проксимальной миопатии.
Поэтому в данной области техники все еще необходим поиск новых терапевтических подходов для лечения боли, не только как симптома заболевания, но как самого заболевания.
Задачей, которую решает настоящее изобретение, является получение альтернативного, нового и эффективного средства для лечения боли, которое по отдельности или в комбинации с другими анальгетическими средствами обеспечивает эффективное лечение боли при уменьшении побочных эффектов с сохранением желательной анальгетической активности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на установлении того, что оптически активное соединение (S)-энантиомер пирлиндола обладает превосходной анальгетической активностью, применимой для терапевтического лечения и предупреждения боли.
Авторы настоящего изобретения неожиданно установили, что оптически активный (S)-энантиомер пирлиндола обладает анальгетической активностью по данным модели боли на животных, что, в свою очередь, объясняет неожиданную активность (S)-энантиомера пирлиндола при терапевтическом лечении и предупреждении боли, в частности, невропатической боли.
Кроме того, показано, что анальгетическое воздействие (S)-энантиомера пирлиндола неожиданно оказалось более сильным, чем у (R)-энантиомера пирлиндола и (рац)-пирлиндола.
Показано, что (S)-пирлиндол является эффективным средством для лечения и предупреждения боли, предпочтительно невропатической боли, при использовании по отдельности в качестве единственного активного ингредиента или в комбинированной терапии вместе с дополнительными анальгетическими средствами, причем показано, что (S)-пирлиндол также усиливает воздействие этих дополнительных анальгетических средств.
Поэтому объектом настоящего изобретения является получение (S)-пирлиндола или его фармацевтически приемлемой соли в качестве анальгетического средства для лечения боли.
Другим объектом настоящего изобретения также является получение (S)-пирлиндола или его фармацевтически приемлемой соли по отдельности или в качестве части комбинированной терапии вместе по меньшей мере с одним дополнительным анальгетическим средством для лечения боли.
Дополнительным объектом настоящего изобретения также является получение фармацевтической композиции, включающей (S)-пирлиндол или его фармацевтически приемлемую соль вместе с приемлемыми носителями, разбавителями и/или подходящими инертными наполнителями, для лечения боли.
Другим объектом настоящего изобретения также является получение фармацевтической композиции, включающей (S)-пирлиндол или его фармацевтически приемлемую соль, в комбинации по меньшей мере с одним дополнительным анальгетическим средством и вместе с приемлемыми носителями, разбавителями и/или подходящими инертными наполнителями, для лечения боли, где и (S)-пирлиндол или его фармацевтически приемлемую соль, и другие анальгетические средства готовят так, чтобы вводить в фиксированных дозах или раздельных дозах, например, для одновременного или последовательного введения.
Еще одним объектом настоящего изобретения также является (S)-пирлиндол или его фармацевтически приемлемая соль для применения в комбинированной терапии вместе с дополнительными анальгетическими средствами для усиления воздействия этих дополнительных анальгетических средств для лечения боли.
Настоящее изобретение также относится к способу лечения боли у нуждающегося в нем субъекта, отличающемуся введением субъекту эффективного количества (S)-пирлиндола или его фармацевтически приемлемой соли по отдельности или в комбинации по меньшей мере с одним дополнительным анальгетическим средством.
Настоящее изобретение также относится к способу лечения боли у нуждающегося в нем субъекта путем усиления воздействия дополнительных анальгетических средств, отличающемуся введением субъекту эффективного количества (S)-пирлиндола или его фармацевтически приемлемой соли в комбинации с дополнительными анальгетическими средствами
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1A представлена средняя наименьшая сила (г), которая приводила к быстрой реакции отодвигания во время 2-й недели лечения в группах: контрольная без повреждения (отрицательный контроль), контрольная с имитацией повреждения, SNI с введением воды (положительный контроль), SNI с введением (рац)-пирлиндола 20 мг/кг, SNI с введением (S)-пирлиндола 20 мг/кг и SNI с введением (R)-пирлиндола 20 мг/кг.
На фиг. 1B представлена средняя наименьшая сила (г), которая приводила к быстрой реакции отодвигания во время 3-й недели лечения в группах: контрольная без повреждения (отрицательный контроль), контрольная с имитацией повреждения, SNI с введением воды (положительный контроль), SNI с введением (рац)-пирлиндола 20 мг/кг, SNI с введением (S)-пирлиндола 20 мг/кг и SNI с введением (R)-пирлиндола 20 мг/кг.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В контексте настоящего изобретения приведенные ниже термины обладают указанными ниже значениями:
"Боль" при использовании в настоящем изобретении включает любое неприятное сенсорное и эмоциональное ощущение, связанное с реальным или потенциальным поражением или описанное с помощью такого поражения. Она включает: периферическую боль, центральную боль и психогенную боль и включает поверхностную периферическую боль, соматическую глубокую периферическую боль, висцеральную глубокую периферическую боль, боль, обусловленную неврологическим поражением центров центральной нервной системы, таких как спинной мозг, продолговатый мозг, таламус или кора головного мозга, и психогенную боль, которая не имеет органической основы.
Кроме того, "боль" включает ноцицептивную или невропатическую боль. Ноцицептивная боль возникает вследствие реального или угрожающего поражения не являющейся нервной ткани и обусловлена активацией болевых рецепторов и разделяется на соматическую или висцеральную. Соматическая боль обусловлена активацией болевых рецепторов в соматических тканях (например, костях, суставах, мышцах или коже). При висцеральной боли висцеральные болевые рецепторы активируются по другим патологическим механизмам (например, вследствие механического повреждения, воспаления, облучения, воздействия токсичных агентов). И висцеральная, и соматическая ноцицептивная боль может быть острой или хронической и включает боль при раке.
"Невропатическую боль" в настоящем изобретении можно определить, как боль, возникающую в качестве прямого следствия поражения или заболевания, влияющего на соматосенсорную систему (т. е. периферический нерв, ганглий заднего корешка или задний корешок, или центральную нервную систему) и включает боль связанную со следующим:
- Невропатиями, которые являются функциональным нарушением или патологическим изменением, которое поражает нервы, такими как мононевропатия, если она включает один нервный ствол, множественная мононевропатия, если она последовательно включает несколько нервных стволов, и полиневропатия, если она включает, диффузно и билатерально, несколько нервных стволов.
- Периферическими невропатиями, которые могут быть сенсорными, моторными или автономными. Наиболее частыми моторными проявлениями являются мышечные спазмы, клонус, фасцикуляции, амиотрофия и утрата мышечной силы или физической ловкости.
- Негативными сенсорными проявлениями, такими как гипоальгезия и гипестезия.
- Позитивными сенсорными проявлениями, такими как парестезия, дисестезия, гиперпатия, гипералгезия и аллодиния, кроме ощущения покалывания, пощипывания или шума в ушах.
Наряду с другими примеры невропатической боли включают: диабетическую невропатическую боль (диабетическую NP), постгерпетическую невралгию (PHN), невралгию тройничного нерва и центральную невропатическую боль (повреждение спинного мозга (SCI)), центральную боль после удара (CPSP) и боль, связанную с рассеянным склерозом, невропатию, связанную с инфекцией ВИЧ (ВИЧ невропатия), посттравматическую или послеоперационную невропатическую боль, хроническую радикулопатию, связанную с раком невропатическую боль, фантомную боль и обладающие разной этиологией невропатические боли, периферическую полиневропатию, характеризующуюся ощущением жжения или покалывания иголками в стопах и кончиках пальцев, которая ухудшается при ходьбе, аллодинией, гипестезией стопы и отсутствием ахиллова рефлекса; невралгию тройничного нерва, характеризующуюся сильной острой болью, токсические невропатии, компрессионные невропатии и травма, которые характеризуются самопроизвольной колющей, жгучей болью и шокоподобной болью, а также аллергической болью, включая тактильную аллодинию, колющую гипералгезию и гиперпатию, шокоподобную боль, продолжающуюся в течение нескольких секунд в верхней губе и в носу, которая ухудшается при жевании или расчесывании волос и которая не сопровождается изменениями результатов неврологического обследования; туннельный синдром запястья, характеризующийся острой болью, ощущениями пощипывания и пониженной чувствительностью 1-го, 2-го и 3-го пальцев и ладонной поверхности руки, которая ухудшается ночью, с пониженной мышечной силой при абдукции большого пальца и положительным результатом теста Фалена; мононевропатию латерального кожного нерва бедра, характеризующуюся ощущением жжения и покалывания в боковой части бедра и наличием ограниченного участка кожной гиперчувствительности; постгерпетическую невралгию, характеризующуюся жгучей болью с баннероподобным распределением в области груди после появления пузырьков, протекание которой не улучшается после излечивания кожи и гиперхромными прыщами на коже.
Термин "усиление воздействия дополнительных анальгетических средств" означает, что совместное введение в фиксированных дозах или раздельных дозах, например, при одновременном или последовательном введении (S)-пирлиндола и по меньшей мере одного дополнительного анальгетического средства, включая опиоиды и опиаты, усиливает анальгетическое воздействие последнего, позволяя снизить дозу активных вводимых средств и уменьшить опасность проявления побочных реакций, зависимости и переносимости.
Для задач настоящего изобретения соединение считается энантиомерно чистым, если энантиомерная чистота, рассчитанная с помощью хиральной хроматографии или удельного оптического вращения, больше или равна 97%.
Термин "фармацевтически приемлемая соль" означает такие соли, которые в рамках тщательной медицинской оценки являются подходящими для применения при соприкосновении с тканями и органами людей и низших животных без проявления токсичности, раздражения, аллергической реакции и т. п. и соответствуют разумному отношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Перечень солей, предпочтительных в контексте настоящего изобретения, приведен в настоящем описании.
Термин "фармацевтически приемлемый носитель, разбавитель или инертный наполнитель" при использовании в настоящем изобретении означает твердый, полужидкий или инертный жидкий наполнитель, наполнитель, капсулирующий или способствующий приготовлению состава материал любого типа, уже известный специалисту в данной области техники.
Пирлиндол, 2,3,3a,4,5,6-гексагидро-8 метил-1H-пиразино [3, 2, 1-j, k] карбазол, является тетрациклическим соединением, описывающимся следующей формулой:
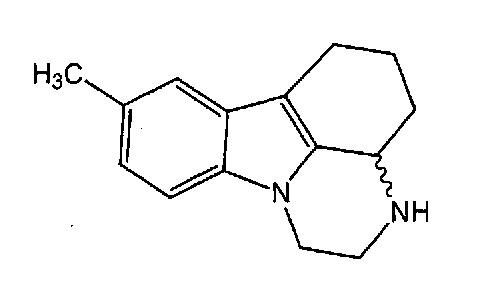
Пирлиндол является обратимым ингибитором моноаминоксидазы A (MAO-A), до настоящего времени использующимся в качестве лекарственного средства для лечения депрессии.
Пирлиндол содержат асимметрический атом углерода, но в настоящее время в медицине используют только рацемат, (рац)-пирлиндол, соответствующий смеси обоих энантиомеров, (R) и (S), в равных количествах.
(S)-Энантиомер пирлиндола описывается следующей формулой:
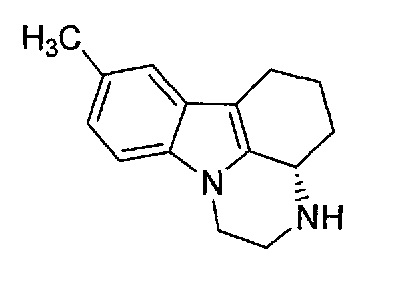
Для задач настоящего изобретения (S)-энантиомер пирлиндола, например, можно получить по методике, описанной P.Chiap et al. в публикации "Automated determination of pirlindole enantiomers in plasma by on-line coupling of a pre-column packed with restricted access material to a chiral liquid chromatographic column" Journal of Pharmaceutical and Biomedical Analysis, 27(2002) 447-455.
По этой методике (S)-пирлиндол можно синтезировать путем получения производного рацемического пирлиндола с R-фенетилизоцианатом, разделения соответствующих диастереоизомеров с помощью препаративной LC, гидролиза и перекристаллизации.
(S)-Пирлиндол, предлагаемый в настоящем изобретении, является энантиомерно чистым.
Настоящее изобретение основано на установлении того, что оптически активный (S)-энантиомер пирлиндола обладает анальгетической активностью по данным модели боли на животных, что, в свою очередь, объясняет неожиданную активность (S)-энантиомера пирлиндола при терапевтическом лечении и предупреждении боли, предпочтительно невропатической боли.
Поэтому объектом настоящего изобретения является получение (S)-энантиомера пирлиндола и его фармацевтически приемлемых солей в качестве альтернативного и нового средства для предупредительного и терапевтического лечения боли, более предпочтительно невропатической боли, включая боль, связанную с любым типом периферической невропатии.
Авторы настоящего изобретения установили, что (S)-энантиомер пирлиндола или его фармацевтически приемлемые соли можно использовать по отдельности в качестве единственного активного ингредиента или в качестве части комбинированной терапии вместе по меньшей мере с одним дополнительным анальгетическим средством для терапевтического лечения и предупреждения боли.
(S)-Энантиомер пирлиндола обеспечивает улучшенную эффективность предупредительного и терапевтического лечения боли, более предпочтительно невропатической боли. Кроме того, (S)-пирлиндол характеризуется более безопасным профилем, чем другие анальгетические лекарственные средствам. (S)-Пирлиндол не приводит к побочным эффектам, присущим опиоидам, из числа которых особенно важными являются задержка мочи, тошнота и рвота, респираторные эффекты (угнетение дыхания) и переносимость. Кроме того, применение (S)-пирлиндола исключает побочные эффекты, связанные с нестероидными противовоспалительными лекарственными средствами (NSAIDs), включая поражение почек, желудочно-кишечное кровотечение, подавление агрегации тромбоцитов, гипертензию и застойную сердечную недостаточность. Преклонный возраст является основным фактором риска для проявления нежелательных желудочно-кишечных проявлений, связанных с введением NSAID. Смертность у пациентов, госпитализированных вследствие вызванного NSAID кровотечения в верхних отделах желудочно-кишечного тракта, составляет примерно 5-10%.
В действительности, если (S)-энантиомер пирлиндола или его фармацевтически приемлемые соли используют в комбинированной терапии вместе с дополнительными анальгетическими средствами, анальгетическое воздействие этих дополнительных анальгетических средств усиливается, так что для обеспечения желательного терапевтического эффекта требуется меньшая доза активных ингредиентов, что уменьшает опасность проявления нежелательных реакций, зависимости и переносимости этих анальгетических лекарственных средств.
Совместное введение (S)-энантиомера пирлиндола или его фармацевтически приемлемых солей вместе по меньшей мере с одним дополнительным анальгетическим средством позволяет уменьшить дозу анальгетических средств на 25-50% по сравнению с дозой, принимаемой при некомбинированной терапии.
Совместное введение или применение в комбинированной терапии (S)-пирлиндола и дополнительных анальгетических средств включает совместное введение (S)-пирлиндола или его фармацевтически приемлемой соли вместе по меньшей мере с одним(двумя, тремя, четырьмя и т. п.) дополнительным анальгетическим средством, где приготовление активных ингредиентов проводят в фиксированных дозах (один препарат) или в раздельных дозах, где каждый активный ингредиент готовят в форме, подходящей для одновременного или последовательного введения.
В объем настоящего изобретения входит предоставление указанного препарата для комбинированной терапии в комбинированной упаковке вместе с инструкциями по применению.
Дополнительные анальгетические средства или лекарственные средства, предлагаемые для использования в настоящем изобретении в комбинированной терапии вместе с (S)-пирлиндолом или его фармацевтически приемлемыми солями, включают по меньшей мере одно соединение или лекарственное средство из следующего перечня: соединения, которые уменьшают гипервозбудимость нейронов, такие как ингибиторы натриевых каналов (карбамазепин, окскарбазепин, эсликарбазепин, фенитоин, вальпроевая кислота), антагонисты кальциевых каналов (прегабалин), антагонисты ионотропного и метаботропного глутаматного рецептора, усилители активности γ-аминомасляной кислоты (габапентин) или агонисты μ, κ и δ опиоидного рецептора, частичные агонисты/антагонисты и антагонисты.
Кроме того, пациенту, который страдает от боли или который в будущем может страдать от боли, более предпочтительно невропатической боли, связанной с периферической невропатией любого типа, может быть полезно применение, в соответствии с настоящим изобретением, в фиксированной или раздельной комбинированной терапии, (S)-пирлиндола или его фармацевтически приемлемых солей и по меньшей мере одного соединения или лекарственного средства, выбранного из приведенного ниже перечня: соединения, действующего по любому механизму кроме уменьшения гипервозбудимости нейронов, такие как парацетамол, нестероидные противовоспалительные лекарственные средства (ацетилсалициловая кислота, диклофенак, набуметон, нимесулид, набуметон, этодолак, пироксикам, клониксинат лизина, дифлунизал, ацеметацин, глюкаметацин, индометацин, проглуметацин, оксаметацин, сулиндак, ацеклофенак, фентиазак, кеторолак, зомепирак, мелоксикам, теноксикам, лорноксикан, фенопрофен, фенбуфен, флурбипрофен, беноксапрофен, ибупрофен, кетопрофен, декскетопрофен, пирпрофен, индопрофен, напроксен, оксапрозин, тиапрофен, дексибупрофен, меклофенаминовая кислота, мефенаминовая кислота, флуфенамовая кислота, толфенамовая кислота, нифлумовая кислота, этофенамат, азапропазон, орготеин, фепразон, морнифлумат, тенидап, глюкозаминогликан, полисульфат, целекоксиб, рофекоксиб, парекоксиб, валдекоксиб и эторикоксиб), глюкозамин или диацереин.
В объем настоящего изобретения входит предоставление композиций, включающей эффективное количество (S)-пирлиндола или его фармацевтически приемлемой соли, которые готовят в виде фармацевтических композиций в комбинации с одним или большим количеством фармацевтически приемлемых носителей по известным методикам приготовления фармацевтически применимых композиций.
Такие составы подробно описаны в целом ряде источников, которые хорошо известны и легко доступны специалистам в данной области техники. Например, в публикации Remingtonʹs The Science and Practice of Pharmacy, edited by Allen, Loyd V., Jr, 22nd edition, описано приготовление составов, которые можно использовать в контексте настоящего изобретения.
Фармацевтические композиции, предлагаемые в настоящем изобретении, можно приготовить для введения людям и другим млекопитающим перорально (в жидких или твердых формах), ректально, парентерально, интрацистернально, внутривагинально, внутрибрюшинно, местно (в форме порошков, мазей или капель), трансбуккально или в форме перорального или назального спрея. Термин "парентерально" при использовании в настоящем изобретении означает пути введения, включающие внутривенное, внутримышечное, внутрибрюшинное, интрацистернальное, подкожное введение, внутрисуставную инъекцию и вливание.
Фармацевтические композиции для парентеральной инъекции включают водные или неводные растворы, дисперсии, суспензии или эмульсии, фармацевтически приемлемые стерильные или нестерильные, и порошки для восстановления в виде стерильных растворов для инъекций или дисперсий.
При необходимости и для более эффективного распределения соединения, предлагаемые в настоящем изобретении, можно включить в системы пролонгированного регулируемого высвобождения или непосредственного введения, такие как полимерные матрицы, липосомы и микросферы.
Дозировка (S)-пирлиндола или его фармацевтически приемлемой соли, вводимой индивидууму, зависит от желательной реакции и может зависеть от подвергающегося лечению субъекта, его возраста, состояния здоровья, массы тела, частоты введения и т. п. Например, дозировки, использующиеся в настоящем изобретении включают от 0,1 до 10 мг/кг для перорального введения, от 0,01 до 10 мг/кг для внутривенного введения.
Молекула (S)-пирлиндола содержит вторичную аминогруппу, которая обладает основным характером и поэтому легко образует соли с кислотами, которыми в контексте настоящего изобретения могут быть фармацевтически приемлемые соли с кислотами.
Типичные фармацевтически приемлемые соли с кислотами включают, но не ограничиваются только ими ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, фумарат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат (изетионат), лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат, ундеканоат и манделат.
Примеры кислот, которые можно использовать для образования предпочтительных фармацевтически приемлемых солей с кислотами (S)-пирлиндола, предлагаемых в настоящем изобретении, включают неорганические кислоты, такие как хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту и фосфорную кислоту, и органические кислоты, такие как метансульфоновую кислоту, лимонную кислоту, миндальную кислоту, янтарную кислоту и лимонную кислоту.
Предпочтительными фармацевтически приемлемыми солями являются: (R)-манделат (S)-пирлиндола, мезилат (S)-пирлиндола и цитрат (S)-пирлиндола.
Приведенные ниже примеры предназначены для илллюстрации настоящего изобретения и их не следует рассматривать в качестве ограничивающих объем настоящего изобретения.
ПРИМЕРЫ
Пример 1:
Таблетки гидрохлорида (S)-пирлиндола
Приготовление таблеток проводят путем прямого прессования и оно включает смешивание всех компонентов, их пропускание через сито и прессование с использованием подходящей сжимающей силы при необходимой относительно влажности атмосферы.
Качественный и количественный состав (содержания приведены в мас.% в пересчете на всю композицию)
Таблетки гидрохлорида (S)-пирлиндола
Приготовление таблеток проводят путем мокрого гранулирования с последующим прессованием, включая гранулирование активных ингредиентов с использованием подходящего раствора, сушку и пропускание через сито, добавление необходимых инертных наполнителей и прессование с использованием подходящей сжимающей силы при необходимой относительно влажности атмосферы.
Качественный и количественный состав (содержания приведены в мас.% в пересчете на всю композицию)
Пример 2:
Это исследование in vivo демонстрирует благоприятное воздействие (S)-энантиомера пирлиндола при лечении боли.
Для этой цели авторы настоящего изобретения выбрали модель на животных, которую предложили Decosterd and Woolf (Pain, 2000), которые разработали модель частичной денервации, технически легкую в использовании и подверженную минимальным изменениям в зависимости от степени нанесенного повреждения. Важнее всего, что эта модель обеспечивает прямое измерение изменений и в пораженных первичных сенсорных нейронах, и в соседних неповрежденных сенсорных нейронах, так что можно исследовать их относительный вклад в патофизиологию боли.
Основной идеей модели является изучение того, что произойдет, если две из трех терминальных дистальных ветвей седалищного нерва подвергнуть аксотомии (большеберцовый и общий малоберцовый нервы), оставив один (икроножный нерв); поэтому такую модель называют моделью повреждения сохраненного нерва (SNI).
Доказано, что модель повреждения сохраненного нерва является надежной при существенных и пролонгированных изменениях механической чувствительности и восприимчивости к тепловому воздействию, которые хорошо имитируют многие особенности клинической невропатической боли.
Все процедуры проводили на взрослых (200-250 г) самцах крыс Sprague-Dawley. При анестезии галотаном (2%) надрезали кожу на боковой поверхности бедра и делали разрез прямо через двуглавую мышцу бедра, от общий малоберцовый открывая седалищный нерв и его три терминальные ветви: икроножный, общий малоберцовый и большеберцовый нервы. Процедура повреждения оставшегося нерва включает аксотомию и перевязку большеберцового и общего малоберцового нерва при сохранении неповрежденным икроножного нерва. Общий малоберцовый и большеберцовый нервы туго перевязывали шелковой нитью 5.0 и обрезали дистально от перевязки, оставляя дистальный конец нерва длиной 2±4 мм. Необходимо соблюдать большую осторожность, чтобы не коснуться неповрежденного икроножного нерва или не растянуть его. Мышцы и кожу закрывали в два слоя. Контроли с имитацией повреждения включали обнажение седалищного нерва и его ветвей без повреждения.
Тест фон Фрея представляет собой исследование механической чувствительности, в котором используются тонкие калиброванные пластмассовые волокна, называющиеся нитями фон Фрея, которыми воздействуют на подошвенную поверхность задней лапы подопытного животного. Нити обладают разными степенями жесткости и это используют для определения того, какая из них вызывает отодвигание лапы. Каждой нитью. начиная с менее жесткой, воздействуют на подошвенную поверхность обеих задних лап каждой крысы. Процедуру повторяют с использованием нитей фон Фрея увеличивающейся жесткости, пока она не приведет к рефлекторному и стойкому отодвиганию задней лапы. Это состояние определяют, как порог отодвигания, измеряют в граммах и он является индикатором механической аллодинии.
В представленном примере животных разделяли на 6 (шесть) групп (n=7 в каждой группе): контрольная без повреждения (отрицательный контроль), контрольная с имитацией повреждения, SNI с введением воды (положительный контроль), SNI с введением (рац)-пирлиндола 20 мг/кг, SNI с введением (S)-пирлиндола 20 мг/кг, SNI с введением (R)-пирлиндола 20 мг/кг и SNI с введением (рац)-пирлиндола 20 мг/кг.
После проведения хирургического вмешательства в группах контроля с имитацией повреждения, SNI с введением воды (положительный контроль), SNI с введением (рац)-пирлиндола, SNI с введением (S)-пирлиндола и SNI с введением (R)-пирлиндола животных помещали в клетки на 7 недель для полного развития механической аллодинии. Через 3 недели начинали период лечения и ежедневно внутрибрюшинным путем вводили воду или одно из исследуемых средств (рац-пирлиндол, S-пирлиндол и R-пирлиндол).
В настоящем исследовании использовали следующие составы:
Раствор гидрохлорида (S)-пирлиндола для внутрибрюшинного введения
Раствор гидрохлорида (R)-пирлиндола для внутрибрюшинного введения
Раствор гидрохлорида пирлиндола для внутрибрюшинного введения
Гидрохлорид (S)-пирлиндола, гидрохлорид (R)-пирлиндола и гидрохлорид (рац)-пирлиндола готовили путем растворения активного ингредиента в воде до полного растворения.
На 2-й и 3-й неделях лечения изучали механическую аллодинию. Животных помешали на поднятую проволочную сетку и подошвенную поверхность лап стимулировали с помощью последовательности мононитей фон Фрея с увеличивающейся силой. За пороговое значение принимали наименьшую силу, которая приводила к быстрой реакции отодвигания в ответ на повторяющиеся стимулы (Tal and Bennett, 1994). Исследовали боковые и медиальные подошвенные поверхности лапы, а также ее дорсальную поверхность.
Средняя наименьшая сила (г), которая приводила к быстрой реакции отодвигания для положительной группы (группы положительного контроля) равнялась 0,41 г в конце 2-й недели и 0,14 г в конце 3-й недели. Эти значения были намного меньшими, чем полученные для контрольной группы без повреждения (группы отрицательного контроля) и контрольной группы с имитацией повреждения, для обеих групп средняя наименьшая сила равнялась 15 г в конце 2-й недели и 3-й недели. См. фиг. 1A и фиг. 1B.
В группе активного лечения SNI с внутрибрюшинным введением (S)-пирлиндола 20 мг/кг средняя наименьшая сила неожиданно оказалась большей (4,51 г и 7,43 г соответственно на 2-й неделе и 3-й неделе), чем в группе активного лечения SNI с внутрибрюшинным введением (R)-пирлиндола 20 мг/кг (для которой средняя наименьшая сила равнялась 3,08 г и 1,39 г на 2-й неделе и 3-й неделе соответственно) и в группе активного лечения SNI с введением (рац)-пирлиндола 20 мг/кг (для которой средняя наименьшая сила равнялась 3,50 г и 2,08 г соответственно на 2-й неделе и 3-й неделе). См. фиг. 1A и фиг. 1B.
Эти неожиданные результаты подтверждают преимущество (S)-пирлиндола для лечения боли, в частности, синдромов невропатической боли, и, кроме того, демонстрируют неожиданное превосходство (S)-пирлиндола по сравнению с (рац)- и (R)-пирлиндолами при указанном лечении.
| название | год | авторы | номер документа |
|---|---|---|---|
| (R)-ПИРЛИНДОЛ И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ | 2014 |
|
RU2695607C2 |
| НОВОЕ ПРОФИЛАКТИЧЕСКОЕ И/ИЛИ ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОТИВ НЕВРОПАТИЧЕСКОЙ БОЛИ | 2008 |
|
RU2462459C2 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ЭНАНТИОМЕРОВ ПИРЛИНДОЛА ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ | 2014 |
|
RU2706688C2 |
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ТРАМАДОЛ И ЦЕЛЕКОКСИБ, ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2010 |
|
RU2707752C2 |
| СПОСОБЫ ТЕРАПЕВТИЧЕСКОГО ПРИМЕНЕНИЯ СТЕРОИДНЫХ СОЕДИНЕНИЙ | 2006 |
|
RU2427375C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ ЭНАНТИОМЕРОВ ПИРЛИНДОЛА И ЕГО СОЛЕЙ | 2014 |
|
RU2666731C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ СПИРО-ОКСИНДОЛЬНОГО СОЕДИНЕНИЯ ДЛЯ МЕСТНОГО ВВЕДЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2011 |
|
RU2596488C2 |
| ЭНАНТИОМЕРЫ СПИРО-ОКСИНДОЛЬНЫХ СОЕДИНЕНИЙ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2010 |
|
RU2535667C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ ФЕНОКСИПРОПИЛАМИНОВОГО СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2019 |
|
RU2797615C2 |
| НОВЫЕ ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ МИРТАЗАПИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ БОЛЕВЫХ РАССТРОЙСТВАХ | 2013 |
|
RU2509560C1 |

Изобретение относится к области медицины. Предложено применение(S)-Пирлиндола или его фармацевтически приемлемой соли, а также включающие их фармацевтические композиции для терапевтического лечения и предупреждения боли. 2 н. и 4 з.п. ф-лы, 1 ил.
1. Применение (S)-Энантиомера пирлиндола или его фармацевтически приемлемой соли в качестве анальгетического средства для терапевтического лечения или предупреждения невропатической боли.
2. Применение (S)-Энантиомера пирлиндола или его фармацевтически приемлемой соли по п. 1, отличающийся тем, что (S)-пирлиндол является энантиомерно чистым.
3. Применение (S)-Энантиомера пирлиндола или его фармацевтически приемлемой соли по любому из п.п. 1-2 в форме (R)-манделата (S)-пирлиндола.
4. Применение (S)-Энантиомера пирлиндола или его фармацевтически приемлемой соли по любому из п.п. 1-2 в форме мезилата (S)-пирлиндола.
5. Применение (S)-Энантиомера пирлиндола или его фармацевтически приемлемой соли по любому из п.п. 1-2 в форме цитрата (S)-пирлиндола.
6. Фармацевтическая композиция для лечения невропатической боли, включающая (S)-энантиомер пирлиндола или его фармацевтически приемлемую соль в качестве анальгетического средства, определенную по любому из предыдущих пунктов вместе с фармацевтически приемлемыми носителями, разбавителями или инертными наполнителями.
| К.О.Чахава, ГНЦ социальной и судебной психиатрии им | |||
| В.П.Сербского, Москва | |||
| Терапия пиразидолом (пирлиндол) больных с депрессиями и хроническим болевым синдромом | |||
| Психиатрия и психофармакотерапия им | |||
| П.Б | |||
| Ганнушкина | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Pascal De Tullio et al, Effective resolution of racemic pirlindole at the preparative scale, Chirality, 29 March 1999, Volume 11, Issue 4, 1999, Pages 261-266, https://doi.org/10.1002/(SICI)1520-636X(1999)11:4<261::AID-CHIR1>3.0.CO;2-S, abstract, 2 пар., табл | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 2006048242 A2, 11.05.2006 | |||
| WO 2005025550 A1, 24.03.2005 | |||
| N.I | |||
| ANDREEVA ET AL, ANTIDEPRESSANT-ENHANCED ANALGESIC ACTION OF CLONIDINE, PHARMACEUTICAL CHEMISTRY JOURNAL, VOL.31, N 4, 1997 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Рельсовый башмак | 1921 |
|
SU166A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор для запора стрелок | 1921 |
|
SU167A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| EA 200501023 A1, 29.12.2005. | |||
Авторы
Даты
2019-07-25—Публикация
2014-05-09—Подача