Предлагаемое изобретение относится к медицине, а именно к медицинской микологии, дерматовенерологии, клинической лабораторной диагностике, и может быть использовано для выделения гриба Microsporum canis, являющегося возбудителем микроспории.
Микроспория - высококонтагиозное заболевание грибковой природы, наиболее распространенное в педиатрической практике, поражающее кожу и волосы [Сергеев А.Ю., Сергеев Ю.В. Грибковые инфекции. Руководство для врачей. 2 изд. - М.: Изд-во БИНОМ, 2008. - 480 с].
Известны питательные среды для выделения М. canis: сусло-агар, мясопептонно-глицериновый агар, среда Сабуро (с добавлением антибиотиков различных групп, пищевых и растительных ингредиентов) [Медицинская микология: руководство / В.А. Андреев, А.В. Зачиняева, А.В. Москалев, В.Б. Сбойчаков; под ред. В.Б. Сбойчакова. - М.: ГЭОТАР-Медиа, 2008. - 208 с]. Ввиду содержания множества компонентов эти среды сложны в приготовлении.
Традиционным методом диагностики дерматомикозов, позволяющим определить вид гриба, остается культуральный посев на среду Сабуро. Среда Сабуро включает в себя: пептон - 10 г, глюкоза или мальтоза 40 г, агар - 18-20 г, дистиллированная вода - 1 л. Инкубация посевов проводится в течение 30 дней при температуре 28-30°С [Кашкин П.Н., Лисин В.В. Практическое руководство по медицинской микологии. - Л.: Медицина, 1983. - 190 с].
Недостатком данной среды является то, что через 18-24 часа в ней происходит рост микрофлоры, чаще всего это бактерии рода Bacillus, которые образуют большие колонии, препятствующие росту грибов, что обуславливает добавление антибактериальных средств [Лещенко В.М. Лабораторная диагностика грибковых заболеваний. - Медицина, 1982].
Наиболее близким аналогом изобретения является питательная среда для выделения дерматофитов, имеющая следующий состав, г/л: глюкоза - 40,0; пептон - 10,0; агар - 18,0-20,0; гидролизат кератина (в пересчете на сухое вещество) - 10,0-20,0; левомицетин - 50000 ЕД; дистиллированная вода - остальное [патент RU 2275631, 2006 г.]. Недостатками прототипа являются трудоемкость получения гидролизата казеина и необходимость добавления антибиотика.
Задачей изобретения является создание эффективной и простой в приготовлении питательной среды для выделения культуры М. canis из материла больного.
Технический результат при использовании изобретения - сокращение сроков выделения культуры М. canis из клинического материала от больных.
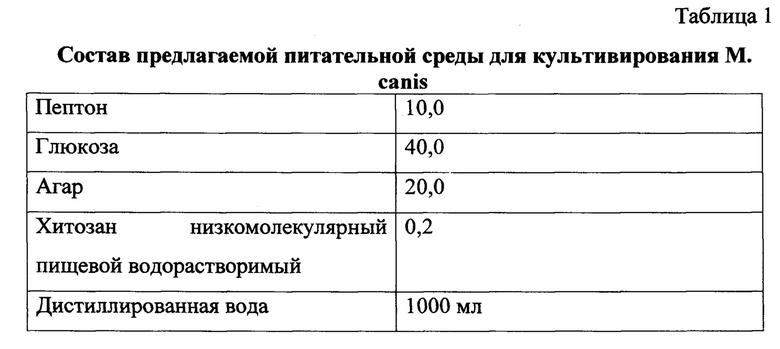
Предлагаемая среда для выделения гриба Microsporum canis содержит: глюкоза - 40,0 г, пептон - 10,0 г, агар - 20,0 г, хитозан низкомолекулярный пищевой водорастворимый - 0,2 г и дистиллированная вода - 1 л.
В настоящее время известно более 70 направлений практического применения хитозана: в пищевой промышленности, виноделии, сельском хозяйстве, в фармакологии и медицине, в производстве косметических препаратов для ухода за кожей, средств для очистки и стабилизации воды [Чермит З.М., Агеева Н.М. О применении препаратов хитозана в пищевой промышленности // Плодоводство и виноградарство Юга России. - 2016. - №.39. - С. 192-208.].
Имеется ряд исследований, в которых хитозан добавляется в питательные среды с антибактериальной целью, в частности высокое антибактериальное действие оказывает на культуры бактерий Bacillus [Ильина А.В. и др. Получение и исследование моносахаридных производных низкомолекулярного хитозана // Прикладная биохимия и микробиология. - 2008. - Т. 44. - №.5. - С. 606-614], Pseudomonas aureofaciens, Enterobacter agglomerans, Bifidobacterium bifidum [Герасименко Д.В. и др. Антибактериальная активность водорастворимых низкомолекулярных хитозанов в отношении различных микроорганизмов // Прикладная биохимия и микробиология. - 2004. - Т. 40. - №.3. - С. 301-306], Staphylococcus aureus и Staphylococcus epidermidis [Куликов С.Н., Тюрин Ю.А., Хайруллин Р.З. Антибактериальная активность хитозана в отношении энтеробактерий и стафилококков, выделенных у пациентов с дисбактериозом кишечника // Казанский медицинский журнал. - 2010. - Т. 91. - №.5].
В литературе имеются данные о том, что именно низкомолекулярные образцы хитозана обладают наиболее выраженной антибактериальной активностью [Kumar В.A., Varadaraj М.С, Tharanathan R.N. Low molecular weight chitosan-preparation with the aid of pepsin, characterization, and its bactericidal activity // Biomacromolecules. - 2007. - T. 8. - №.2. - C. 566-572].
Также хитозан обладет противогрибковым действием в концентрации 500 мкг/мл, практически полностью ингибируя рост некоторых мицелиальных грибов, в частности Penicillium tardum, Penicillium chrizogenum, Aspergillus flavus, Phoma betae, Cladosporium herbarum [Куликов С.H. и др. Фунгицидная активность хитозана в отношении мицелиальных грибов // Практическая медицина. - 2010. - №.1. - С. 119].
В доступной научно-медицинской и патентной литературе сведений об известности использования хитозана в питательной среде для выделения культуры М. Canis не обнаружено.
Обоснованием использования хитозана в предлагаемой питательной среде является то, что для грибов - дерматофитов кератин, содержащийся в коже и ее придатках, служит субстратом для питания [Воржева И.И., Черняк Б.А. Аллергия к дерматофитным грибам // аллергология. - 2004. - №.4. - С. 42-47]. В свою очередь, хитозан - аминополисахарид, близкий по своим функциональным свойствам к компонентам эпидермиса, в частности кератина, и дермы кожи [Бузинова Д.А. и др. Культивирование эпителиоподобных клеток на пленочных матриксах из хитозана // Гены и клетки. - 2011. - Т. 6. - №.1].
Способ получения предлагаемой питательной культуральной среды следующий: в 800 мл дистиллированной воды растворяли 20 г бактериологического агара. Через 30 минут добавляли 40 г глюкозы, 10 г мясного пептона и доводили смесь до кипения. Далее полученную смесь фильтровали. Затем добавляли 0,2 г хитозана низкомолекулярного пищевого водорастворимого, доливали 200 мл воды и тщательно перемешивали. Полученную среду стерилизовали 30 минут при 120°С. После стерилизации слегка остуженный субстрат разливали по пробиркам.
В исследовании использовали хитозан низкомолекулярный пищевой водорастворимый (ООО «Биопрогресс» г. Щелково), полученный из хитозана краба путем взаимодействия с янтарным ангидридом по запатентованной технологии.
В этот же день проводили посев исследуемого материала. Полученную питательную среду сравнивали с питательной средой с добавлением гидролизата кератина по скорости роста культуры.
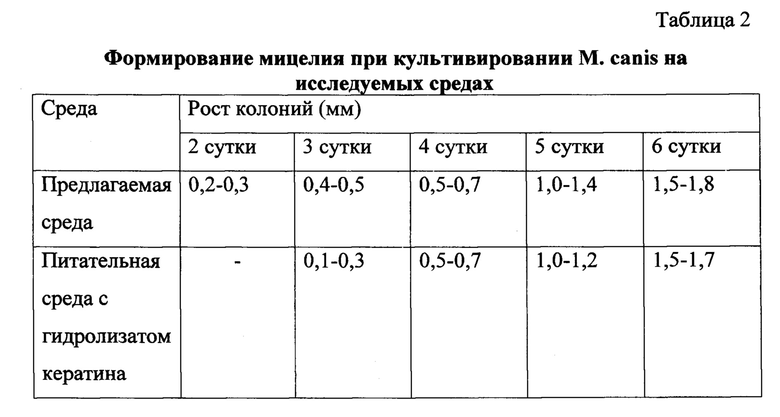
Пример 1. Клинический материал (волосы из очага поражения) от больного микроспорией высевали в чашки Петри на питательную среду с гидролизатом кератина и в предлагаемую среду (табл. 1). В исследование включались больные микроспорией волосистой части головы, подтвержденной положительным результатом микроскопического исследования. Посевы выдерживали в термостате при температуре 20°С. Появление колоний и их развитие оценивали каждые 24 часа.
На предлагаемой культуральной среде рост М. canis отмечался на 1-2 сутки, идентифицировать культуру было возможно на 3-4 сутки. На питательной среде с гидролизатом кератина рост М. canis отмечался на 2-3 сутки, идентификация была возможна на 5-6 день.
Пример 2. Материал (волосы из очага поражения) от больного микроспорией высевали в чашки Петри на питательную среду с гидролизатом кератина и в предлагаемую культуральную среду. Культуральные посевы выдерживали в термостате при температуре 20°С. Появление колоний и их рост на предлагаемой культуральной среде происходило быстрее, чем на среде с гидролизатом кератина (табл. 2).
Пример 3. Клинический материал (волосы из очага поражения) от больных микроспорией высевали в чашки Петри на питательную среду с гидролизатом кератина и в предлагаемую среду. После посева 15 клинических образцов на предлагаемую среду, рост культуры М. canis был выявлен на седьмые сутки в 60% (9 образцов), в то время как после посева на среду с гидролизатом кератина 15 клинических образцов, рост наблюдался в 40% (6 образцов).
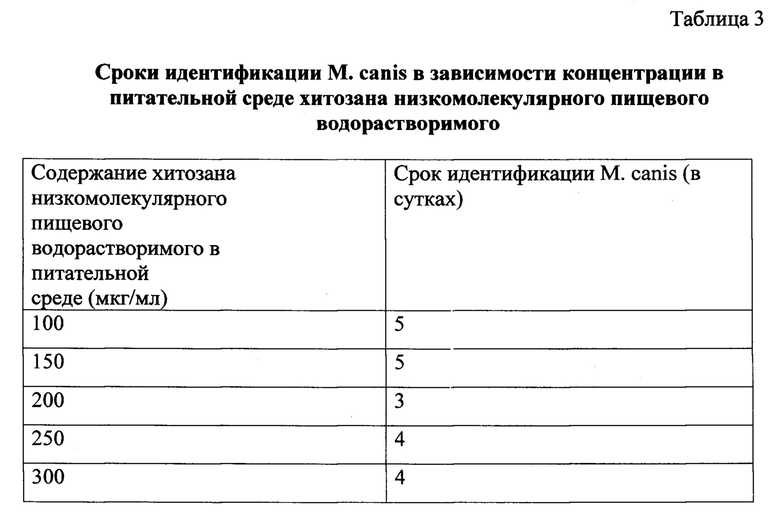
Пример 4. Клинический материал (волосы из очага поражения) от больных микроспорией высевали в чашки Петри на предлагаемую питательную среду с хитозаном низкомолекулярным пищевым водорастворимым в следующих концентрациях (мкг/мл): 100,0; 150,0; 200,0; 250,0; 300,0. Культуральные посевы выдерживали в термостате при температуре 20°С. Появление и развитие грибов оценивали каждые 24 часа. Полученные данные свидетельствуют о том, что наиболее оптимальная концентрация хитозана низкомолекулярного пищевого водорастворимого в питательной среде должна быть 200 мкг/мл (табл. 3).
Таким образом, заявляемая питательная среда обладает следующими преимуществами: сокращение сроков выделения культуры М. canis, простота приготовления. Во всех случаях был достигнут указанный технический результат.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ трихоскопии с использованием искусственных нейронных сетей для диагностики поврежденных спорами дерматофитов волос у кошек | 2022 |
|
RU2796767C1 |
| СПОСОБ ДИАГНОСТИКИ ДЕРМАТОМИКОЗОВ И ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ДЕРМАТОФИТОВ | 2004 |
|
RU2275631C1 |
| СПОСОБ СПЕЦИФИЧЕСКОЙ ДЕТЕКЦИИ MICROSPORUM CANIS В КЛИНИЧЕСКОМ МАТЕРИАЛЕ ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ ФОРМАХ ЗАБОЛЕВАНИЯ | 2014 |
|
RU2558927C1 |
| СЕЛЕКТИВНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ВОЗБУДИТЕЛЕЙ ДЕРМАТОФИТОЗОВ | 2020 |
|
RU2745159C1 |
| СПОСОБ ДИАГНОСТИКИ МИКРОСПОРИИ | 2011 |
|
RU2458991C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДЕРМАТОФИТОВ ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2000 |
|
RU2181144C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ МИЦЕЛИАЛЬНЫХ ГРИБОВ-ДЕРМАТОМИЦЕТОВ ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2013 |
|
RU2527074C1 |
| СПОСОБ СПЕЦИФИЧЕСКОЙ ДЕТЕКЦИИ TRICHOPHYTON VERRUCOSUM В КЛИНИЧЕСКОМ МАТЕРИАЛЕ ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ ФОРМАХ ЗАБОЛЕВАНИЯ | 2014 |
|
RU2562540C1 |
| ШТАММ ГРИБА MICROSPORIUM CANIS, ИСПОЛЬЗУЕМЫЙ ДЛЯ КОНТРОЛЯ ИММУНОГЕННОСТИ ВАКЦИН ПРОТИВ ДЕРМАТОФИТОЗОВ ЖИВОТНЫХ | 1994 |
|
RU2074252C1 |
| ВАКЦИНА "МИКРОДЕРМ" ПРОТИВ ДЕРМАТОФИТОЗОВ ЖИВОТНЫХ | 1994 |
|
RU2084240C1 |
Изобретение относится к биотехнологии и может быть использовано для детекции гриба Microsporum canis, являющегося возбудителем микроспории. Предлагаемая питательная среда содержит глюкозу, пептон, агар, хитозан низкомолекулярный пищевой водорастворимый и дистиллированную воду при заданном содержании компонентов. Изобретение позволяет сократить сроки выделения культуры М. canis из клинического материала от больных. 3 табл., 4 пр.
Питательная среда для выделения гриба Microsporum canis из клинического материала от больных, содержащая глюкозу - 40,0 г; агар - 20,0 г; пептон - 10,0 г; дистиллированную воду - 1000 мл и источник кератина, отличающаяся тем, что в качестве источника кератина содержит хитозан низкомолекулярный пищевой водорастворимый в количестве 0,2 г.
| СПОСОБ ДИАГНОСТИКИ ДЕРМАТОМИКОЗОВ И ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ДЕРМАТОФИТОВ | 2004 |
|
RU2275631C1 |
| МИКРОБИОЛОГИЧЕСКАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ TRICHOPHYTON VERRUCOSUM | 2002 |
|
RU2237709C2 |
| СПОСОБ СПЕЦИФИЧЕСКОЙ ДЕТЕКЦИИ MICROSPORUM CANIS В КЛИНИЧЕСКОМ МАТЕРИАЛЕ ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ ФОРМАХ ЗАБОЛЕВАНИЯ | 2014 |
|
RU2558927C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДЕРМАТОФИТОВ ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2000 |
|
RU2181144C1 |
Авторы
Даты
2019-07-25—Публикация
2019-03-05—Подача