Настоящее изобретение имеет отношение к иммуногенным пептидам, способным индуцировать образование антител, направленных на пропротеин-конвертазу субтилизин/кексин тип 9 (PCSK9).
Сосудистые расстройства, такие как гиперхолестеринемия, атеросклероз, ишемическая болезнь сердца и инсульт являются одной из основных причин смерти по всему миру, причем повышенные уровни холестерина липопротеинов низкой плотности (LDL) играют ключевую роль в этом патогенезе. Таким образом, регулировка LDL является очень важным аспектом успешного лечения дислипидемии и атеросклероза.
Открытие в 2003 году PCSK9 и идентификация этой молекулы как третьего фактора, помимо LDLR и АроВ-100, вовлеченного в развитие аутосомно-доминантной гиперхолестеринемии (ADH), предоставило новые сведения, касающиеся механизма развития ADH болезни. Кроме того, генетические исследования на людях подтвердили наличие связи между уровнями LDL, PCSK9 и началом ишемической болезни сердца. Связь между PCSK9 и повышенным уровнем LDL также наблюдалась на различных животных моделях.
PCSK9 в основном экспрессируется в печени, кишечнике и почках и также выделяется в кровоток. Эта молекула непосредственно взаимодействует с рецептором (LDLR) липопротеинов низкой плотности (LDL), а затем образованный комплекс интернализируется. При связывании с LDLR PCSK9 способствует деградации рецептора, что приводит к повышению уровня LDL в плазме. "Мутация с приобретением функции" (GOF) в PCSK9 гене увеличивает его взаимодействие с LDLR, приводя к значительно более высоким уровням LDL, в дальнейшем к гиперхолестеринемии и предрасположенности к атеросклерозу. Тогда как "мутации с потерей функции (LOF)" в PCSK9 связаны с пониженным риском развития ишемической болезни сердца (CHD). Примечательно, что два случая здоровой женщины, имеющей потерю функционального PCSK9 и очень низкий уровень LDL (~14 мг/дл), продемонстрировали PCSK9 как не необходимый и как перспективную мишень для снижения уровней LDL в кровотоке.
Сверхэкспрессия PCSK9 у мышей дикого типа значительно снижает печеночный LDLR белок независимо от стабильных уровней мРНК, приводя к повышению LDL в кровообращении. Для сравнения, сверхэкспрессия PCSK9 у LDLR -/- мышей не влияет на уровни LDL, что подтверждает зависимость PCSK9 от LDLR для обеспечения роли в катаболизме LDL. Как и ожидалось, PCSK9 -/- мыши продемонстрировали увеличение в 2.8 раза уровней LDLR и уменьшение LDL по сравнению с животными дикого типа. И наконец, выделение PCSK9 в кровообращение подавлялась после инактивации PCSK9 в ткани печени, подтверждая, что печень является основным органом, ответственным за секрецию PCSK9.
Таким образом, PCSK9 играет ключевую роль в катаболизме LDL посредством прямого воздействия на LDLR. Ингибирование PCSK9 оказывается благоприятным для уровней LDL. Следовательно, анти-PCSK9 методы лечения представляют собой перспективный подход с точки зрения благоприятного изменения уровней LDL.
PCSK9, также известная как нервная апоптоз-регулируемая конвертаза 1 (NARC-1), представляет собой секретируемую протеиназа K-подобную субтилазу и является членом семейства пропротеинконвертаз (PC) млекопитающих. Она синтезируется в виде пропротеина ~72 kDa. Для того, чтобы стать функциональным, предшественник (про-PCSK9) подвергается автокаталитическому процессингу. Это приводит к образованию продукта (аа31-152), который нековалентно связывается в соотношении 1:1 с PCSK9 фрагментом (aa153-692) с образованием комплекса, в этой зрелой форме (~60-63 kDa) PCSK9 следует по секреторному пути.
В дополнение к этой зрелой форме PCSK9 во многих клеточных линиях и плазме крови была обнаружена другая укороченная (расщепляемая фурином) форма PCSK9. Человеческая и мышиная плазма содержит две формы PCSK9, зрелую (aa153-692) и ее укороченную версию (аа218-692), причем в мышиной плазме укороченная форма может составлять до ~50% всей PCSK9 в плазме. Эта расщепляемая фурином укороченная PCSK9 представляет собой продукт расщепления зрелой PCSK9 (аа153-692) в сайте аа218-219, в связи с этим называемым сайтом расщепления фурин/РС5/6А. В результате такого расщепления образуется следующий укороченный фрагмент PCSK9 (аа219-692) (так называемый расщепляемый фурином PCSK9).
Новые данные подтвердили способность обоих форм, зрелой PCSK9 (aa153-692) и расщепляемой фурином PCSK9 (аа219-аа692), связываться с рецептором липопротеинов низкой плотности (LDLR) и таким образом регулировать его уровень и, следовательно, уровни LDL.
В процессе связывания с LDLR каталитический домен PCSK9 взаимодействует с LDLR за счет использования различных сайтов. В результате этого связывания PCSK9 вместе с EGF (В) доменом LDLR образует структурную конфигурацию, которая опять усиливает и оптимизирует это взаимодействие при участии второго сайта, известного как участок, в котором располагается фурин/РС5/6А расщепляемый сайт (аа218-219).
Таким образом, терапевтические средства, нацеленные на фурин/РС5/6А расщепляемый сайт PCSK9 (аа218-219), помимо их способности подавлять точное позиционирование PCSK9 относительно LDLR, могли бы блокировать действие фурина на PCSK9. Такие терапевтические средства параллельно будут отменять непрямое PCSK9/LDLR-взаимодействие (позиционирование) и будут ингибировать выработку укороченной LDLR, связывающей активную форму PCSK9 (аа219-692). Это должно приводить к благотворному увеличению LDLR и, следовательно, к существенному снижению LDL в плазме.
Клинические испытания на протяжении последних 25 лет подтвердили явную пользу при лечении сердечно-сосудистых заболеваний и снижение уровней циркулирующих LDL при использовании ингибиторов 3-гидрокси-3-метил-глутарил коэнзима А редуктазы (статинов). Статины действуют путем ингибирования биосинтеза холестерина в печени, приводя к последующему увеличению белка, связывающего стерол-регулирующие элементы (в дальнейшем называемого SREBP). SREBP является регулятором генов, вовлеченных в липидный гомеостаз, например, LDLR. При этом повышенное количество SREBP приводит к увеличению уровней LDLR белка и последующему увеличению «захвата» LDL из кровообращения.
Статины являются наиболее распространенным методом лечения дислипидемии. Однако, несмотря на их эффективность, лечение статинами часто связано с такими побочными действиями, как повышенные уровни ферментов печени, мышечная боль и миозит. Кроме того, значительное количество пациентов, леченых статинами, оказываются неспособными достичь своих целей с точки зрения благотворного регулирования LDL, причем некоторые из них становятся непереносящими статины. Интересно отметить, что воздействуя на SREBP, статины не только увеличивают LDLR, но также повышают экспрессию PCSK9, приводя к противодействующему фармакологическому эффекту.
Таким образом, комбинирование статинов с анти-PCSK9 терапией рассматривалось как перспективный подход к регулированию LDL, учитывая потенциальную возможность синергетического/аддитивного эффекта в сравнении с дифференцированным лечением.
В значительной степени анти-PCSK9 терапия стала даже более привлекательным и перспективным LDL-модулятором. То есть, подходящей не только в качестве монотерапии, но также в качестве новой адъювантной терапии применительно к наиболее рекомендуемым и используемым в настоящее время видам лечения, таким как статины и другие вещества, такие как фибраты или никотиновая кислота. Между тем, разрабатываются некоторые другие стратегии подавления синтеза или функционирования PCSK9. В течение последнего десятилетия весьма активно разрабатывались подходы к ингибированию синтеза путем выключения гена с помощью антисмысловых олигонуклеотидов (ASO), закрытой/запертой нуклеиновой кислоты-антисмысловых олигонуклеотидов (LNO-ASO) и siRNA. В дополнение к этому, для ингибирования аполипопротеина-В была успешно применена ASO-технология, которая недавно одобрена Управлением по контролю за продуктами питания и лекарственными средствами (FDA). На самом деле, применение siRNA против PCSK9 у обезьян (Масаса fascicularis) приводило к значительному снижению общего содержания холестерина. В целом, конечный результат использования различных методов сайленсинга (выключения) гена PCSK9 является неоднозначным и, несомненно, зависит от специфичности подхода. Две клинические фазы I с использованием siRNA и LNA-олигонуклеотида столкнулись с некоторыми проблемами и были прекращены досрочно по неопределенным причинам. Однако, с другой стороны, фаза I третьих клинических испытаний ингибирования PCSK9 с помощью siRNA была успешно завершена.
Были разработаны другие перспективные терапевтические подходы с целью ингибирования взаимодействия PCSK9-LDLR с помощью пептидомиметиков и аднектинов. Однако, несмотря на разные возможные варианты ингибирования, одним из самых современных подходов к снижению LDL путем модулирования PCSK9 является применение анти-PCSK9 моноклональных антител. На сегодняшний день продолжается несколько клинических исследований, оценивающих применение анти-PCSK9 моноклональных антител. В фазе I клинических испытаний со здоровыми субъектами было показано, что однократная доза анти-PCSK9 моноклональных антител, введенных внутривенно или подкожно, способна уменьшить уровни LDL на 67%. Более того, те же самые mAB, примененные подкожно дважды в неделю или с 4 недельными интервалами у субъектов, находящихся на статиновой терапии, вызывали уменьшение LDL на 81%. В дополнение к этому в фазе II клинических испытаний с использованием тех же моноклональных антител (лечение два раза в неделю) у пациентов, непереносящих статиновую терапию, было продемонстрировано снижение LDL в пределах 41-66%. Эти исследования подтвердили, что анти-PCSK9 терапия является эффективной не только для здоровых субъектов, но также для леченых статинами и непереносящих статины популяций. Более того, исходя из положительного результата доведенной до конца фазы III клинических испытаний, были проведены клинические испытания с целью оценки эффекта анти-PCSK9 терапии mAB на пациентах с инфарктом миокарда или инсультом в анамнезе, факторами риска инфаркта миокарда и коронарным синдромом, и недавно было сообщено об удовлетворительных результатах в отношении комбинированной первичной конечной точки оценки эффективности. Однако, одной из основных проблем лечения моноклональными антителами к PCSK9 является отсутствие долгосрочного постоянного регулирования LDL.
WO 2009/055783 А2, WO 2009/100297 A1, WO 2010/057242 А2, WO 2011/02757 А2, WO 2011/117401 A1, WO 2012/59573 A1, WO 2013/037889 А2 и WO 2013/148284 А1 раскрывают вакцины с антигенными PCSK9 пептидами. Luo et al. (J. Lipid Res. 50(2009): 1581-1588) раскрывает функционирование и распространение циркулирующей человеческой PCSK9, экспрессированной вне печени трансгенных мышей.
Цель настоящего изобретения - предоставить средства и способы уменьшения LDL у индивидуума; отдельной целью настоящего изобретения является предоставление новых антигенных пептидов PCSK9 в качестве вакцин с улучшенным антигенным потенциалом, являющихся эффективными для снижения холестерина у вакцинированных индивидуумов.
Настоящее изобретение касается конкретных иммуностимулирующих вариантов (с аминокислотными заменами и необязательными укорочениями) PCSK9 фрагмента, состоящего из аминокислотных остатков 209-222 SEQ ID No. 1.
Пептиды настоящего изобретения представляют собой так называемые VARIOTOPE®, т.е. аминокислотные модификации первоначальной, природной последовательности пептида PEEDGTRFHRQASK (SEQ.ID.No. 1). VARIOTOPE® имеют аминокислотную последовательность, которая отличается от первоначальной белковой/пептидной последовательности, из которой они получены. VARIOTOPE® согласно настоящему изобретению воспринимаются иммунной системой как чужеродные, вследствие чего отсутствует необходимость в нарушении аутотолерантности.
Настоящее изобретение имеет отношение к вакцине, вакцинной композиции или композиции, содержащей, по меньшей мере, один пептид, состоящий из VARIOTOPE® пептида или фрагмента пептида, полученного из PCSK9 фрагмента, состоящего из аминокислотных остатков 209-222 (SEQ ID No. 1).
Следовательно, настоящее изобретение предоставляет вакцину, содержащую, по меньшей мере, один пептид, состоящий из 9-25 аминокислотных остатков, при этом указанный пептид является вариантом пептида PEEDGTRFHRQASK (SEQ.ID.No. 1) с повышенной иммуногенностью у млекопитающих, в частности, у людей, по сравнению с PEEDGTRFHRQASK (SEQ.ID.No. 1), при этом указанный вариант отличается, по меньшей мере, одной и самое большее четырьмя аминокислотными заменами по сравнению с PEEDGTRFHRQASK (SEQ.ID.No. 1).
Предпочтительно, вакцина согласно настоящему изобретению содержит, по меньшей мере, один пептид, состоящий из 9-25 аминокислотных остатков, причем указанный пептид имеет или содержит аминокислотную последовательность
X1X2EDGX6RFX9X10X11X12X13X14, (SEQ ID No. 46),
в которой
X1 является аминокислотным остатком, выбранным из группы, состоящей из лизина, треонина, аланина и пролина, предпочтительно аланина или пролина,
Х2 является глутамином или аспарагиновой кислотой, предпочтительно аспарагиновой кислотой,
Х6 является треонином или серином,
Х9 является аминокислотным остатком, выбранным из группы, состоящей из гистидина, аланина и серина,
Х10 является аминокислотным остатком, выбранным из группы, состоящей из аргинина, аланина, глутамина, лизина, метионина, пролина и серина, предпочтительно аргинина, серина или аланина,
Х11 является аминокислотным остатком, выбранным из группы, состоящей из глутамина, аланина, глутаминовой кислоты, лизина, треонина и аргинина, предпочтительно глутамина, лизина, аргинина и треонина,
Х12 является аминокислотным остатком, выбранным из группы, состоящей из аланина, серина и треонина, предпочтительно аланина или серина,
Х13 является аминокислотным остатком, выбранным из группы, состоящей из серина, аланина и аспарагина, предпочтительно серина,
Х14 является аминокислотным остатком, выбранным из группы, состоящей из лизина, аланина, аргинина, лейцина, серина, треонина и валина, предпочтительно лизина или серина,
или фрагмент SEQ.ID.No. 46, имеющий, по меньшей мере, 9 последовательных аминокислотных остатков, и
в которой SEQ ID No. 46 не является PEEDGTRFHRQASK (SEQ.ID.No. 1) или ее фрагментом, укороченным с N- или С-конца.
Согласно предпочтительному варианту осуществления настоящего изобретения, вакцина содержит пептид, который состоит или содержит аминокислотную последовательность, выбранную из группы, состоящей из AEEDGTRFHRQASK, PEEDGTRFARQASK, PEEDGTRFHAQASK, PEEDGTRFHRAASK, PEEDGTRFHRQAAK, PEEDGTRFHRQASA, TEEDGTRFHRQASK, PQEDGTRFHRQASK, PEEDGSRFHRQASK, PEEDGTRFHQQASK, PEEDGTRFHKQASK, PEEDGTRFHMQASK, PEEDGTRFHREASK, PEEDGTRFHRRASK, PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFHRQANK, PEEDGTRFHRQASR, PEEDGTRFHRQASL, KEEDGTRFHRQASK, PEEDGTRFSRQASK, PEEDGTRFHPQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGTRFHRQAST, PEEDGTRFHRQASV, PEEDGSRFHKQASK, PEEDGSRFHMQASK, PEEDGSRFHRRASK, и PEEDGSRFHRQATK; предпочтительно, AEEDGTRFHRQASK, PEEDGTRFARQASK, PEEDGTRFHAQASK, PEEDGTRFHRAASK, PEEDGTRFHRQASA, TEEDGTRFHRQASK, PQEDGTRFHRQASK, PEEDGTRFHRRASK, PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFSRQASK, PEEDGTRFHPQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGTRFHRQASV, PEEDGSRFHKQASK, PEEDGSRFHRRASK, и PEEDGSRFHRQATK; особенно AEEDGTRFHRQASK, PEEDGTRFHAQASK, PQEDGTRFHRQASK, PEEDGTRFHRRASK PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFSRQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGSRFHKQASK и PEEDGSRFHRRASK.
Пептиды, предоставленные настоящим изобретением, являются иммуностимулирующими вариантами природной PCSK9 аминокислотной последовательности PEEDGTRFHRQASK (SEQ ID No. 1). Пептиды согласно настоящему изобретению разработаны и отобраны, чтобы обеспечить улучшенный иммунный ответ на PCSK9, при это тщательно рассмотрена проблема аутотолерантности, обычно связанная с вакцинами, основанными на природных последовательностях PCSK9.
Пептиды согласно настоящему изобретению имеют различия в аминокислотах по сравнению с природной последовательностью PEEDGTRFHRQASK (SEQ ID No. 1). Согласно предпочтительному варианту осуществления количество изменений (замен аминокислотных остатков) не превышает 3 аминокислотных остатков. Предпочтительно, пептид согласно настоящему изобретению имеет только одну или две замены аминокислот. Удивительно, что несколько таких замен аминокислот обеспечивают изменения иммуностимулирующего пептида, в частности в отношении его другого полезного свойства, а именно того, что эти новые пептиды не должны нарушать аутотолерантность.
Предпочтительно пептиды согласно настоящему изобретению обладают повышенной иммуногенностью по сравнению с пептидом PEEDGTRFHRQASK (SEQ.ID.No. 1), по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 100%, в частности, по меньшей мере, 200%, о чем свидетельствует исследование сыворотки методом ELISA, например, что подтверждено примером ниже.
Согласно предпочтительному варианту осуществления пептиды в вакцине настоящего изобретения обладают повышенной способностью снижать уровни общего холестерина по сравнению с пептидом PEEDGTRFHRQASK (SEQ.ID.No. 1), по меньшей мере, на 3%, предпочтительно, по меньшей мере, на 5%, в частности, по меньшей мере, на 10%, о чем свидетельствует тест на холестерин в сыворотке (в абсолютных цифрах, в сравнении с результатом без воздействия, принятым за 100%), например, что подтверждено примером ниже. По меньшей мере, для некоторых из пептидов согласно настоящему изобретению такое снижение повышенных уровней общего холестерина по сравнению с природной последовательностью было экспериментально подтверждено на принятой в науке модели изучения холестерина. Соответственно, вариант согласно настоящему изобретению предпочтительно выбирают из группы, состоящей из AEEDGTRFHRQASK (SEQ.ID.No. 2), TEEDGTRFHRQASK (SEQ.ID.No. 9), PQEDGTRFHRQASK (SEQ.ID.No. 10), PEEDGTRFHRRASK (SEQ.ID.No. 17), PEEDGTRFHRKASK (SEQ.ID.No. 18), PEEDGTRFHRQASR (SEQ.ID.No. 23) и PEEDGTRFHRTASK (SEQ.ID.No. 36). Хотя уже удивительно, что вариант природной последовательности пептида обладает повышенной иммуногенностью по сравнению с природной последовательностью пептида PEEDGTRFHRQASK (SEQ.ID.No. 1), еще более удивительно, что такие пептиды также могут (на принятой с научной точки зрения модели холестерина) снижать уровень общего холестерина более эффективно, чем соответствующая природная последовательность.
Пептиды, содержащиеся в вакцинах согласно настоящему изобретению, предпочтительно соединены или связаны с фармацевтически приемлемым носителем, предпочтительно белковым носителем, в частности протеином, содержащим, по меньшей мере, один Т-клеточный эпитоп.
Введение вакцины согласно настоящему изобретение дает возможность лечить или предотвращать патологические состояния, связанные с PCSK9 и его ролью при таких заболеваниях, как дислипидемия, гиперлипидемия, гиперхолестеринемия и/или атеросклероз.
Пептиды настоящего изобретения являются вариантами (аминокислотными заменами и необязательными укорочениями) PCSK9 фрагмента, имеющего аминокислотную последовательность PEEDGTRFHRQASK (SEQ ID No. 1), и состоят из 9-25 аминокислотных остатков, предпочтительно 9-20 аминокислотных остатков, в частности, 9-15 аминокислотных остатков. Конкретнее, предпочтительно пептиды согласно настоящему изобретению состоят из 10, 11, 12, 13, 14 или 15 аминокислотных остатков, предпочтительно 13 или 14 аминокислотных остатков, в частности, 14 аминокислотных остатков. Несмотря на то, что PCSK9 VARIOTOPE® пептиды согласно настоящему изобретению предпочтительно используются в той форме, когда пептиды состоят из установленных последовательностей (например, SEQ ID №2-46; необязательно с линкером, присоединенным к N- или С-концу, в частности, к С-концу; указанный линкер представляет собой или содержит предпочтительно остаток цистеина, в частности, остаток цистеина на С-конце); однако, также возможно использование укороченных или более длинных последовательностей (смотри, например, WO 2013/037889 А1). Например, можно удалить одну аминокислоту с N- или С-конца и получить практически аналогичную пептидную вакцину в отношении иммуногенности или снижения ТС. Предпочтительно, такое удаление может быть сделано на С-конце. Также, в некоторых случаях могут быть сделаны более длинные удаления (т.е. двух или более аминокислот) (смотри, в частности, WO 2013/037889 А1, дополнительные эксперименты, предусмотренные для IPRP (Фигуры 5/6)). С другой стороны, также возможно добавление аминокислотных остатков на N- или С-конце (предпочтительно С-конце) без значительного изменения свойств этих пептидов в соответствии с настоящим изобретением (смотри, например, Amar et al., AHA presentation 18960 (2014)). Добавления аминокислотных остатков на N- или С-конце предпочтительно представляют собой добавления дополнительных аминокислотных остатков, встречающихся в природе в этом месте (добавочных), т.е. обеспечивающих естественное удлинение последовательности в таких VARIOTOPE®.
Вакцина настоящего изобретения содержит, по меньшей мере, один, по меньшей мере, 2, или, по меньшей мере, 3 пептида, определенных в описании, и обеспечивает активную иммунизацию млекопитающего, в частности, человека, когда нейтрализующие антитела к PCSK9 индуцируются вакцинацией с использованием полученных фрагментов, в частности, когда они связаны или соединены с пептидом или полипептидом или белковым носителем (например, молекулой, содержащей Т-клеточный эпитоп).
Комбинация пептид/носитель является очень важной, поскольку пептиды настоящего изобретения обычно не обладают способностью индуцировать релевантные количества антител, когда они вводятся без такого сопряжения.
Таким образом, вакцина может содержать комбинацию двух или более пептидов, как раскрывается в описании. Однако также может быть, что вакцина настоящего изобретения содержит наряду с одним или более пептидами, связанными с SEQ ID No. 1, как указано в данном документе, также другие пептиды, такие как мимотопы (т.е. мутанты PCSK9 фрагментов; ЕР 12182241) или фрагменты PCSK9 (смотри, например, WO 2013/037889).
Пептиды настоящего изобретения можно получить путем химического синтеза с помощью методов, хорошо известных в данной области техники. Также можно получить пептиды настоящего изобретения с помощью рекомбинантных методов. Кроме того, пептиды могут продуцироваться в микроорганизмах, таких как бактерии, дрожжи или грибы, в эукариотических клетках, таких как клетки млекопитающих или клетки насекомых, или с помощью рекомбинантного вирусного вектора, такого как аденовирус, поксвирус, вирус герпеса, вирус леса Семлики, бакуловирус, бактериофаг, вирус Синдбис и Вирус Сендай. Подходящие бактерии для получения пептидов включают Е. coli, В. subtilis или любую другую бактерию, которая способна экспрессировать такие пептиды. Подходящие для экспрессии пептидов настоящего изобретения клетки дрожжей включают Saccharomyces cerevisiae, Schizosaccharomyces pombe, Candida, Pichia pastoris или любые другие дрожжи, способные экспрессировать пептиды. Соответствующие средства и методы хорошо известны в данной области техники. Также хорошо известны в данной области техники методы выделения и очистки полученных рекомбинантным способом пептидов, такие методы включают, например, гель-фильтрацию, аффинную хроматографию, ионообменную хроматографию и т.д.
Пептиды согласно настоящему изобретению способны индуцировать антитела, специфически связывающиеся с человеческой PCSK9 и ингибирующие PCSK9-опосредованную деградацию LDLR.
Для облегчения выделения пептидов настоящего изобретения могут быть получены гибридные полипептиды, в которых пептиды являются трансляционно гибридизированными (ковалентно связанными) с гетерологичным полипептидом, который обеспечивает возможность выделения с помощью аффинной хроматографии. Типичными гетерологичными полипептидами являются His-Tag (например, His6; 6 остатков гистидина), GST-Tag (глутатион-S-трансфераза) и т.д. Гибридный полипептид способствует не только очистке пептидов, но также может предотвратить деградацию пептидов во время стадий очистки. Если желательно удалить гетерологичный полипептид после очистки, гибридный полипептид может содержать сайт расщепления в месте между пептидом и гетерологичным полипептидом. Сайт расщепления может состоять из аминокислотной последовательности, которая расщепляется ферментом, специфическим к данной аминокислотной последовательности (например, протеазами).
Вакцина и пептиды настоящего изобретения могут быть введены любому виду млекопитающих, включая человека. Однако, введение вакцины и пептидов настоящего изобретения людям является предпочтительным.
Согласно предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, один пептид, входящий в состав вакцины настоящего изобретения, выбирают из группы, состоящей из
Seq 2: AEEDGTRFHRQASK, Seq 4: PEEDGTRFARQASK, Seq 5: PEEDGTRFHAQASK, Seq 6: PEEDGTRFHRAASK, Seq 7: PEEDGTRFHRQAAK, Seq 8: PEEDGTRFHRQASA, Seq 9: TEEDGTRFHRQASK, Seq 10: PQEDGTRFHRQASK, Seq 12: PEEDGSRFHRQASK, Seq 13: PEEDGTRFHQQASK, Seq 14: PEEDGTRFHKQASK, Seq 15: PEEDGTRFHMQASK, Seq 16: PEEDGTRFHREASK, Seq 17: PEEDGTRFHRRASK, Seq 18: PEEDGTRFHRKASK, Seq 19: PEEDGTRFHRQSSK, Seq 21: PEEDGTRFHRQANK, , Seq 23: PEEDGTRFHRQASR, Seq 24: PEEDGTRFHRQASL, Seq 25: KEEDGTRFHRQASK, Seq 29: PEEDGTRFSRQASK, Seq 34: PEEDGTRFHPQASK, Seq 35: PEEDGTRFHSQASK, Seq 36: PEEDGTRFHRTASK, Seq 37: PEEDGTRFHRQTSK, Seq 38: PEEDGTRFHRQASS, Seq 39: PEEDGTRFHRQAST, Seq 40: PEEDGTRFHRQASV, Seq 41: PEEDGSRFHKQASK, Seq 42: PEEDGSRFHMQASK, Seq 43: PEEDGSRFHRRASK, Seq 44: PEEDGSRFHRQATK;
и их фрагментов, имеющих в длину, по меньшей мере, 9 аминокислот.
Следующие пептиды, не обладающие способностью вызывать гуморальный иммунный ответ, нацеленный на PCSK9, иллюстрируют, что аминокислотные замены должны быть тщательно выбраны, чтобы дать в результате иммуногенные пептиды, индуцирующие антитела, эффективно блокирующие функцию PCSK9:
Seq 26: PEWDGTRFHRQASK, Seq 28: PEEDGTGFHRQASK, Seq 32: PEEDGTRFGRQASK.
Согласно особенно предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, один пептид, содержащийся в вакцине настоящего изобретения, выбирают из группы, состоящей из
Seq 2: AEEDGTRFHRQASK, Seq 4: PEEDGTRFARQASK, Seq 5: PEEDGTRFHAQASK, Seq 6: PEEDGTRFHRAASK, Seq 7: PEEDGTRFHRQAAK, Seq 8: PEEDGTRFHRQASA, Seq 9: TEEDGTRFHRQASK, Seq 10: PQEDGTRFHRQASK, Seq 12: PEEDGSRFHRQASK, Seq 13: PEEDGTRFHQQASK, Seq 14: PEEDGTRFHKQASK, Seq 15: PEEDGTRFHMQASK, Seq 16: PEEDGTRFHREASK, Seq 17: PEEDGTRFHRRASK, Seq 18: PEEDGTRFHRKASK, Seq 19: PEEDGTRFHRQSSK, Seq 21: PEEDGTRFHRQANK, Seq 23: PEEDGTRFHRQASR, Seq 24: PEEDGTRFHRQASL, Seq 25: KEEDGTRFHRQASK, Seq 29: PEEDGTRFSRQASK, Seq 34: PEEDGTRFHPQASK, Seq 35: PEEDGTRFHSQASK, Seq 36: PEEDGTRFHRTASK, Seq 37: PEEDGTRFHRQTSK, Seq 38: PEEDGTRFHRQASS, Seq 39: PEEDGTRFHRQAST, Seq 40: PEEDGTRFHRQASV, Seq 41: PEEDGSRFHKQASK, Seq 42: PEEDGSRFHMQASK, Seq 43: PEEDGSRFHRRASK, Seq 44: PEEDGSRFHRQATK.
Согласно особенно предпочтительному варианту осуществления, по меньшей мере, один пептид, входящий в состав вакцины настоящего изобретения, содержит на своем N-и/или С-конце, по меньшей мере, один остаток цистеина, соединенный с ним напрямую или через спейсерную последовательность.
Этот остаток цистеина может служить в качестве реакционно-способной группы для связывания пептида с другой молекулой или носителем. Например, эта группа может использоваться для связывания пептида с белковым носителем. Остаток цистеина может связываться с пептидами настоящего изобретения напрямую или через спейсерную последовательность. Спейсерная последовательность содержит предпочтительно, по меньшей мере, один, предпочтительно, по меньшей мере, два, более предпочтительно, по меньшей мере, три, даже более предпочтительно, по меньшей мере, четыре, и необязательно максимум десять, предпочтительно минимум пять небольших неполярных аминокислотных остатков, таких как глицин.
Однако, понятно, что такой остаток цистеина или другие аминокислотные линкеры (такие как, например, CG-, CGG-, -GC, -GGC и т.д.) не должны считаться (N- или С- концевыми) заменами или вариантами эпитопа нативного PCSK9 пептида PEEDGTRFHRQASK (SEQ.ID.No. 1) или его фрагментов, а являются добавлениями к последовательности эпитопа, вызывающими образование специфических антител у вакцинированного индивидуума.
Согласно предпочтительному варианту осуществления настоящего изобретения вакцина согласно настоящему изобретению содержит белковый носитель, предпочтительно белковый носитель, выбранный из группы, состоящей из гемоцианина лимфы улитки (KLH), CRM (предпочтительно CRM 197), столбнячного токсина (ТТ), дифтерийного токсина (DT), протеина D или любого другого белка или пептида, содержащего эпитопы хелперных Т-клеток.
Согласно настоящему изобретению пептид предпочтительно соединяется или связывается с фармацевтически приемлемым носителем, предпочтительно KLH (гемоцианином лимфы улитки), CRM, столбнячным токсином, альбумин-связывающим белком, бычьим сывороточным альбумином, дендримером, пептидными линкерами (или фланкирующими участками), а также адъювантными веществами, описанными в Singh et al. (Singh et al., Nat. Biotech. 17, (1999): 1075-1081 (в частности, представленными в Таблице 1 этого документа)), и O'Hagan et al. (O'Hagan и Valiante, Nature Reviews, Drug Discovery 2 (9); (2003): 727-735 (в частности, эндогенными иммуностимулирующими соединениями и системами доставки, описанными в этом документе)) или их смесями. Химические методы получения конъюгатов (например, посредством гетеробифункциональных соединений, таких как GMBS и разумеется также других, описанных в "Bioconjugate Techniques", Greg Т. Hermanson) в этом контексте могут быть выбраны из реакций, известных специалисту в данной области техники.
Альтернативно, также можно соединить, по меньшей мере, один пептид настоящего изобретения с белковым носителем с помощью известных в данной области техники методов. Такие белки содержат пептид, описанный в этом документе, вместе с неродственным иммуногенным белком. Предпочтительно иммуногенный белок способен вызывать вторичный иммунный ответ. Примеры таких пептидов включают белки столбняка, туберкулеза, гепатита и протеин D, поверхностный белок грамотрицательной бактерии Haemophilus influenza В (WO 91/18926). Предпочтительно используется производное протеина D, которое содержит приблизительно первую треть протеина (например, первые 100-110 N-концевых аминокислот) и которые могут быть липидированы. Другим носителем, который может использоваться для получения гибридных белков, может быть белок, известный как LYTA или его часть (предпочтительно С-концевой участок). LYTA получают из Streptococcus pneumoniae, который синтезирует N-ацетил-L-аланин амидазу, известную как амидаза LYTA (кодированная геном LytA; Gene 43; (1986): 265-292). LYTA представляет собой аутолизин, который специфически разрушает некоторые связи в главной цепи пептидогликанов. В предпочтительном варианте осуществления в гибридный белок может быть вставлена часть повтора LYTA. Часть повтора содержится на С-концевом участке, начиная с остатка 178. В частности, предпочтительно часть повтора включает остатки 188-305.
Согласно предпочтительному варианту осуществления настоящего изобретения пептид заключается в состав с адъювантом, предпочтительно адсорбируется на гидроокиси алюминия (Alhydrogel, Al(ОН)3).
Вакцина согласно настоящему изобретению может быть заключена в состав с адъювантом, предпочтительно низко растворимой алюминиевой композицией, в частности, гидроокисью алюминия. Разумеется, также могут использоваться такие адъюванты, как MF59, фосфат алюминия, фосфат кальция, цитокины (например, IL-2, IL-12, GM-CSF), сапонины (например, QS21), MDP производные, CpG олигонуклеотиды, LPS, MPL, полифосфазены, эмульсии (например, Фрейнда, SAF), липосомы, виросомы, искомы, кохлеаты, PLG микрочастицы, полоксамерные частицы, вирусоподобные частицы, термолабильный энтеротоксин (LT), холерный токсин (СТ), мутантные токсины (например, LTK63 и LTR72), микрочастицы и/или полимеризованные липосомы.
Подходящие адъюванты имеются в продаже как, например, AS01B, AS02A, AS15, AS-2 и их производные (GlaxoSmithKline, Philadelphia, PA); CWS, TDM, Leif, соли алюминия, такие как гель гидроокиси алюминия (alum) или фосфат алюминия; соли кальция, железа или цинка; нерастворимая суспензия ацилированного тирозина; ацилированные сахара; катионно- или анионно-дериватизированные полисахариды; полифосфазены; биодеградируемые микросферы; монофосфорил липид А и Квил А. Цитокины, такие как GM-CSF или интерлейкин-2, -7 или -12, также могут использоваться в качестве адъювантов.
Предпочтительные адъюванты для применения с целью стимулирования преимущественно ответа Th1-типа включают, например, комбинацию монофосфорил липида А, предпочтительно 3-О-деацилированного монофосфорил липида A (3D-MPL), необязательно с алюминиевой солью (смотри, например, Ribi et al., Immunology и Immunopharmacology of Bacterial Endotoxins, Plenum Publ. Corp., NY, (1986): 407-419; GB 2122204B; GB 2220211; и US 4,912,094). Предпочтительной формой 3D-MPL является эмульсия, имеющая небольшой размер частиц (менее чем 0.2 мм в диаметре), способ ее производства раскрывается в WO 94/21292. Водные композиции, содержащие монофосфорил липид А и поверхностно-активное вещество, описаны в WO 98/43670. Примеры предпочтительных адъювантов включают AS01B (MPL и QS21 в липосомной композиции), 3D-MPL и QS21 в липосомной композиции, AS02A (MPL и QS21 и эмульсия масло-в-воде), 3D-MPL и QS21 и эмульсия масло-в-воде, и AS 15. MPL адъюванты раскрываются, например, в US 4,436,727; US 4,877,611; US 4,866,034 и US 4,912,094.
CpG-содержащие олигонуклеотиды (в которых CpG динуклеотид является неметилированным) также вызывают преимущественно Тh1 ответ.CpG - это аббревиатура для мотивов цитозин-гуанозин динуклеотида, присутствующих в ДНК. Такие олигонуклеотиды хорошо известны и описаны, например, в WO 96/02555, WO 99/33488, US 6008200 и US 5856462. Иммуностимулирующие ДНК последовательности также описаны, например, Sato et al., Science 273; (1996): 352. Как правило, при включении CpG в состав вакцина вводится в свободном растворе вместе со свободным антигеном (WO 96/02555; McCluskie и Davis, supra) или ковалентно конъюгированной с антигеном (WO 98/16247), или заключается в состав с носителем, таким как гидроокись алюминия ((поверхностный антиген гепатита) Davis et al., выше; Brazolot-Millan et al., PNAS USA, 95(26), (1998): 15553-8). В данной области техники известно, что CpG является адъювантом, который может быть введен как системным, так и мукозальным путем (WO 96/02555, ЕР 0468520, Davis et al., J. Immunol, 160(2), (1998): 870-876; McCluskie и Davis, J. Immunol., 161(9), (1998): 4463-6).
Другим предпочтительным адъювантом является сапонин или миметики сапонина или производные, предпочтительно QS21 (Aquila Biopharmaceuticals Inc.), которые могут использоваться отдельно или в комбинации с другими адъювантами. Например, усовершенствованная система включает комбинации монофосфорил липида А и производного сапонина, такие как комбинация QS21 и 3D-MPL, описанная в WO 94/00153, или менее реактогенная композиция, где QS21 блокирован холестерином, описанная в WO 96/33739. Другие предпочтительные композиции содержат эмульсию масло-в-воде и токоферол. В частности, сильная адъювантная композиция, включающая QS21, 3D-MPL и токоферол в эмульсии масло-в-воде, описана в WO 95/17210. Дополнительные сапониновые адъюванты, используемые в настоящем изобретении, включают QS7 (описанный в WO 96/33739 и WO 96/11711) и QS17 (описанный в US 5,057,540 и ЕР 0362279 В1).
Другие предпочтительные адъюванты включают Монтанид ISA 720 (Seppic, Франция), SAF (Chiron, Калифорния, Соединенные Штаты), ISCOMS (CSL), MF-59 (Chiron), серию адъювантов SBAS (например, SBAS-2, AS2', AS2, SBAS-4 или SBAS6, доступные от компании GlaxoSmithKline), Detox (Corixa), RC-529 (Corixa, Hamilton, MT) и другие амино-алкил-глюкозаминид-4-фосфаты (AGPs). Дополнительные примеры адъювантов включают синтетический MPL и адъюванты на основе субъединицы В токсина Шига (смотри WO 2005/112991). Особенно предпочтительным является использование гидроокиси алюминия в качестве адъюванта.
Вакцина настоящего изобретения может быть введена любым подходящим способом, известным для введения вакцин, предпочтительно подкожно, внутримышечно, внутрикожно или внутривенно. В зависимости от способа введения медикамент может содержать подходящие носители, адъюванты и/или эксципиенты.
Вакцина, содержащая пептид настоящего изобретения и фармацевтически приемлемый носитель, может быть введена любым подходящим способом, например, внутрикожно (i.d.), внутрибрюшинно (i.p.), внутримышечно (i.m.), интраназально, орально, подкожно (s.c.) и т.д., с помощью любого подходящего устройства для доставки (O'Hagan et al., Nature Reviews, Drug Discovery 2 (9), (2003), 727-735). Пептиды настоящего изобретения предпочтительно создаются для внутрикожного, подкожного или внутримышечного введения. Средства и методы получения соответствующих композиций известны специалистам в данной области техники.
Согласно предпочтительному варианту осуществления настоящего изобретения вакцина используется для лечения и/или предотвращения заболеваний, вызванных гиперлипидемией, гиперхолестеринемией и/или атеросклерозом, предпочтительно сердечно-сосудистых заболеваний, инсульта или болезней периферических сосудов и других заболеваний, связанных с PCSK9, например, неопластических болезней, таких как меланома и метастазы рака печени (Sun et al, Neoplasia, 14(12) 2012, 1122-1131), в частности, у млекопитающих, предпочтительно у людей.
Как уже было указано, пептиды настоящего изобретения способны вызывать образование антител, которые специфически связываются с PCSK9. Взаимодействие антител с PCSK9 приводит к увеличению рецептора липопротеинов низкой плотности в гепатоцитах печени in vivo, увеличению поглощения холестерина и последующему уменьшению уровней LDL холестерина в плазме и, таким образом, уровней общего холестерина.
В частности, настоящее изобретение имеет отношение к антителам, способным связываться с аа209-222 PCSK9 участком, вследствие чего они отрицательно влияют на PCSK9/LDLR взаимодействие и, следовательно, благотворно снижают уровень холестерина в плазме. Эти антитела также блокируют расщепление зрелого PCSK9 (aa153-692) белка фурином и, следовательно, ингибируют выработку LDLR-связывающей укороченной формы PCSK9 (аа219-692). В дополнение к этому пептиды настоящего изобретения способны вызывать образование антител, которые могут связываться с PCSK9 в области 209-222 и ингибировать процесс расщепления фурином зрелой формы PCSK9.
Болезнь, связанную с атеросклерозом предпочтительно выбирают из группы, состоящей из окклюзионной болезни периферических артерий, ишемической болезни сердца, апоплексического черепно-мозгового инсульта и инсульта.
Термины "болезни, связанные с гиперлипидемией, гиперхолестеринемией и/или атеросклерозом," и "болезни, вызванные гиперлипидемией, гиперхолестеринемией и/или атеросклерозом," относятся к заболеваниям, которые являются следствием гиперлипидемии, гиперхолестеринемии и атеросклероза. Эти болезни включают, в числе других, окклюзивную болезнь периферических артерий, ишемическую болезнь сердца и апоплексические мозговые инсульты (смотри, например, Steinberg, D. J Lipid Res 46(2005): 179-190 и Steinberg, D. J Lipid Res 47(2006): 1339-1351). Согласно предпочтительному варианту осуществления настоящего изобретения пептиды настоящего изобретения вводятся млекопитающему или индивидууму в количестве от 0.1 нг до 10 мг, предпочтительно от 0.5 до 500 мкг, более предпочтительно от 1 до 100 мкг, на иммунизацию. В предпочтительном варианте осуществления эти количества относятся ко всем пептидам (если в вакцине используется более одного пептида), присутствующим в вакцине. В другом предпочтительном варианте осуществления эти количества относятся к каждому отдельному фрагменту, присутствующему в вакцине. Разумеется, может быть предоставлена вакцина, в которой пептиды присутствуют в разных или одинаковых количествах. Однако, альтернативно, пептиды настоящего изобретения могут вводиться млекопитающему или индивидууму в количестве от 0.1 нг до 10 мг, предпочтительно от 10 нг до 1 мг, в частности, от 100 нг до 300 мкг/кг веса тела.
Количество пептидов, которые могут быть объединены с носителем для получения единичной лекарственной формы, будет варьировать в зависимости от хозяина, которого лечат и конкретного способа введения. Доза вакцины может варьировать в соответствии с такими факторами как состояние болезни, возраст, пол и вес млекопитающего или индивидуума, и способности антитела вызывать желательный ответ у индивидуума. Режим дозирования может быть отрегулирован с целью обеспечения оптимального терапевтического ответа. Например, ежедневно может быть введено несколько дробных доз или доза может быть пропорционально уменьшена, что определяется потребностями терапевтической ситуации. Доза вакцины также может варьировать для обеспечения оптимального профилактического эффекта дозы в зависимости от обстоятельств.
Например, пептиды и вакцина настоящего изобретения могут быть введены индивидууму с интервалом в несколько дней, одну или две недели или даже месяцев или лет всегда в зависимости от уровня антител к PCSK9.
В предпочтительном варианте осуществления настоящего изобретения пептид/вакцина применяется от 2 до 10, предпочтительно от 2 до 7 и наиболее предпочтительно до 5 раз. Это количество иммунизаций может привести к базовой иммунизации. В особенно предпочтительном варианте осуществления интервал времени между последовательными вакцинациями выбирается в интервале от 2 недель до 5 лет, предпочтительно от 1 месяца до 3 лет, более предпочтительно от 2 месяцев до 1.5 лет. Типичная схема вакцинации может содержать 3-4 первоначальных вакцинации в течение периода от 6-8 недель и до 6 месяцев, предпочтительно с последующими дополнительными введениями после таких первоначальных вакцинаций. После этого вакцинация может повторяться, например, каждые от 2 до 10 лет. Повторное введение пептида/вакцины настоящего изобретения может максимально увеличить конечный результат терапевтической вакцинации.
Вакцина настоящего изобретения также может содержать антигены, полученные из других белков. Например, протеины, вовлеченные в регуляцию уровней LDL и/или HDL в организме человека. Например, PCSK9 фрагменты настоящего изобретения могут быть объединены с эпитопами, полученными из человеческого СЕТР белка. Вакцина настоящего изобретения также может содержать антигены, полученные из разных эпитопов PCSK9 белка.
Вакцина настоящего изобретения также может содержать антигены, полученные из других белков, подходящих для лечения гиперлипидемии, гиперхолестеринемии и/или атеросклероза, предпочтительно сердечнососудистых болезней, инсульта или заболеваний периферических кровеносных сосудов.
В большинстве случаев вакцина содержит пептиды настоящего изобретения в количестве от 0.5 до 500 мкг, предпочтительно от 1 до 100 мкг и альтернативно от 0.1 нг до 10 мг, предпочтительно от 10 нг до 1 мг, в частности от 100 нг до 100 мкг, или, альтернативно, например, от 100 фемтомоль до 10 мкмоль, предпочтительно от 10 пмоль до 1 мкмоль, в частности от 100 пмоль до 100 нмоль. В большинстве случаев вакцина также может содержать вспомогательные вещества, например, буферные вещества, стабилизирующие вещества и т.д.
В еще одном аспекте настоящее изобретение имеет отношение к способу лечения индивидуума, страдающего от или имеющего повышенный риск развития атеросклероза или болезни, связанной с атеросклерозом, в ходе которого пептид или вакцина согласно настоящему изобретению вводится указанному индивидууму.
Наряду с вакциной настоящего изобретения индивидуум, которого необходимо лечить, может получать также другие активные ингредиенты, влияющие на уровни LDL и/или HDL у людей и животных, такие как статины, фибраты, никотиновая кислота, ингибитор абсорбции холестерина (например, эзетимиб), ApoA1 Milano, делипидизированный HDL, растительные стеролы. Особенно предпочтительно введение индивидууму вакцины настоящего изобретения вместе (т.е. одновременно, последовательно и т.д.) со статинами. Вакцину настоящего изобретения также можно сочетать с другими методами, такими как LDL аферез. LDL аферез является видом афереза, предназначенным для устранения липопротеинов низкой плотности (LDL) из кровотока. Как правило, LDL аферез проводят путем пропускания венозной крови через колонку, покрытую антителами к аполипопротеину В (основной протеин LDL-частиц), сульфатом декстрана или полиакрилатом, или путем осаждения LDL с использованием гепарина при низком значении рН. Соответствующие методы известны специалистам в данной области техники.
Использованный в описании термин "предотвращение" означает не только предотвращение появления болезни, например, снижение фактора риска, но также задержку прогрессирования болезни и уменьшение ее последствий, после того, как они были зафиксированы.
Использованный в описании термин "лечение" или его грамматические эквиваленты включает улучшение и/или устранение симптомов болезни. Соединение, вызывающее улучшение каких-либо параметров, связанных с болезнью, при использовании в методах скрининга текущего изобретения, вследствие этого может называться терапевтическим соединением. Термин "лечение" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Например, в число тех лиц, кто может извлечь пользу из лечения композициями и способами настоящего изобретения, включаются уже имеющие заболевание и/или нарушение, а также те, у которых болезнь и/или нарушение следует предотвратить (например, с использованием профилактического лечения настоящего изобретения).
Далее настоящее изобретение иллюстрируется с помощью следующего примера и фигур, однако, без ограничения этим.
Фиг. 1 ELISA белков
Фигура 1А и 1В показывает сравнение среднего значения титров антител (n=5 мышей на группу) к человеческому PCSK9 белку, индуцированных указанными последовательностями.
Результаты показали способность выбранных VARIOTOPEs® индуцировать более высокий титр антител к человеческому PCSK9 белку в сравнении с природной последовательностью (Seq 1: PEEDGTRFHRQASK).
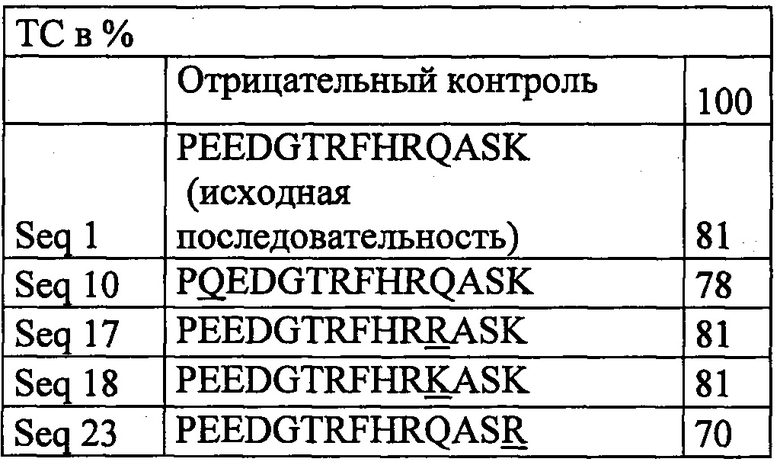
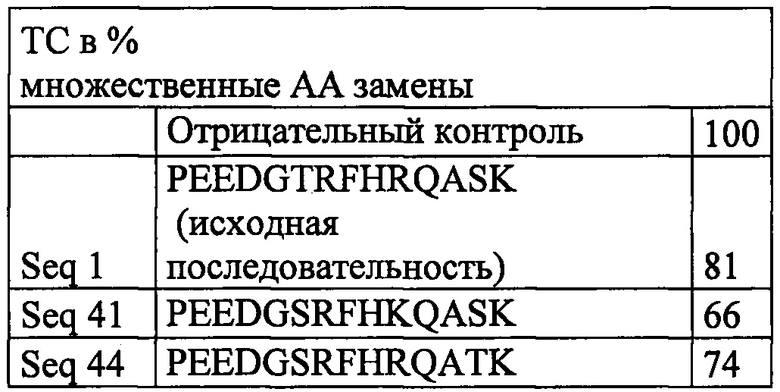
Фиг. 2 Общий холестерин (%) в сравнении с отрицательной контрольной группой, принятой за 100%.
Фигура 2А показывает сравнение среднего значения (%) (n=3 мышей на группу) уровней общего холестерина у мышей, иммунизированных выбранными иммуногенными VARIOTOPE® (Seq 10: PQEDGTRFHRQASK, Seq 17: PEEDGTRFHRRASK, Seq 18: PEEDGTRFHRKASK, Seq 23: PEEDGTRFHRQASR) в сравнении с группой отрицательный контроль, иммунизированной нерелевантным пептидом, и с нативной первоначальной последовательностью PCSK9 (Seq 1: PEEDGTRFHRQASK). Следует отметить способность VARIOTOPE® уменьшать уровни общего холестерина до сходных или даже более низких уровней в сравнении с природной последовательностью.
Фигура 2В показывает сравнение средних значений (%) уровней общего холестерина (n=5 мышей на группу) у мышей, иммунизированных выбранным иммуногенным VARIOTOPE® (Seq 36: PEEDGTRFHRTASK) в сравнении с отрицательной контрольной группой, иммунизированной нерелевантным пептидом, и с нативной первоначальной последовательностью PCSK9 (Seq 1: PEEDGTRFHRQASK). Следует отметить способность VARIOTOPE® уменьшать уровни общего холестерина сильнее природной последовательности.
Фигура 2С показывает сравнение средних значений (%) уровней общего холестерина (n=5 мышей на группу) у мышей, иммунизированных выбранным VARIOTOPE® с множеством аа замен (Seq 41: PEEDGSRFHKQASK и Seq 44: PEEDGSRFHRQATK) в сравнении с отрицательной контрольной группой, иммунизированной нерелевантным пептидом, и с нативной первоначальной последовательностью PCSK9 (Seq 1: PEEDGTRFHRQASK). Следует отметить способность VARIOTOPE® уменьшать уровни общего холестерина сильнее природной последовательности.
Фиг. 3. Ингибирование расщепления фурином и выработка укороченного расщепляемого фурином PCSK9.
Фигура 3 показывает способность выбранных высокоиммуногенных VARIOTOPE® (Seq 10: PQEDGTRFHRQASK, Seq 17: PEEDGTRFHRRASK, Seq 18: PEEDGTRFHRKASK, Seq 23: PEEDGTRFHRQASR) индуцировать антитела, способные ингибировать расщепление фурином зрелой PCSK9 (aa153-692) и, таким образом, подавлять выработку укороченной PCSK9 (продукт~50kDa) (аа219-692). Процесс расщепления сравнивается с отрицательным контролем (PCSK9, проинкубированная с плазмой, полученной от мышей, которым вводили нерелевантный пептид) и положительными контролями (huPCSK9, проинкубированные с или без фурина).
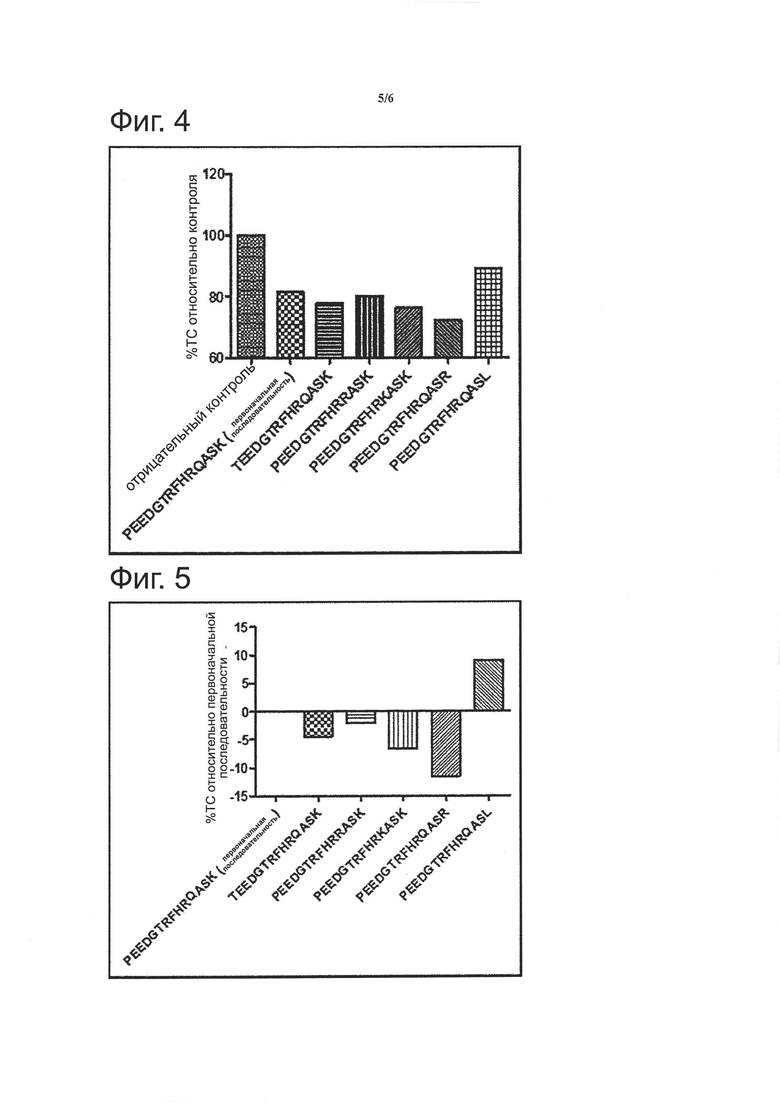
Фигура 4 показывает содержание (%) общего холестерина (ТС) в сравнении с отрицательной контрольной группой, принятой за 100%.
Фигура 5 показывает различие ТС (%) в группах, обработанных VARITOPE®, в сравнении с группой, обработанной исходной последовательностью, принятой за 0.
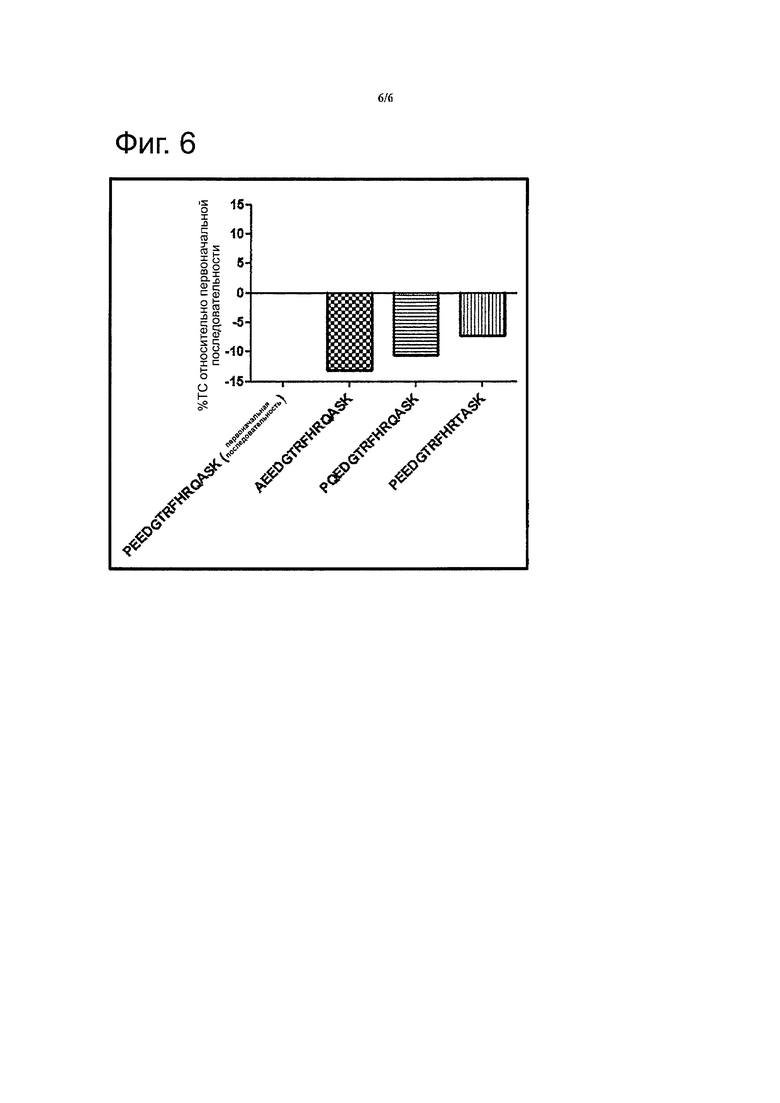
Фигура 6 показывает различие ТС (%) в группах, обработанных VARITOPE®, в сравнении с группой, обработанной исходной последовательностью, принятой за 0.
ПРИМЕРЫ:
Материалы и методы
Вакцина:
Пептиды были соединены с помощью гетеробифункционального линкера GMBS (N-гидроксисукцинимидный эфир 4-малеимидомасляной кислоты) с KLH (гемоцианин лимфы улитки).
Эксперименты на животных:
5 мышей BALB/c иммунизировали подкожно. Мыши имели свободный доступ к воде и корму и содержались при 12 часовом цикле день/ночь. В начале эксперимента возраст мышей составлял 8-10 недель.
Мышам с 2-недельным интервалом четыре раза вводили по 15 мкг чистого пептида, соединенного с KLH и адсорбированного на гидроокиси алюминия (Alhydrogel) в качестве адъюванта, общий объем составлял 1 мл.
Кровь собирали приблизительно через 2 недели после последней инъекции.
ELISA белков:
Чтобы определить иммуногенность вакцин и, таким образом, установить количество PCSK9-специфических антител в плазме иммунизированных животных, проводили иммуноанализ ELISA. Иммуноанализ ELISA вызывает сигнал, который может быть легко определен количественно и представляет собой показатель количества вакцины, которое индуцирует PCSK9-специфические антитела. Таким образом, титры, измеренные с помощью ELISA, коррелируют непосредственно с количеством (мкг/мл) мишень-специфических антител в образце плазмы обработанных животных. Все образцы плазмы были собраны через две недели после завершающей иммунизации и обработаны одинаково. Для того, чтобы иметь прямое сравнение, была проведена количественная оценка с помощью иммуноанализа (методом ELISA) белка PCSK9 индуцированных вакциной PCSK9-специфических антител, и выполнено сравнение с их относительными контролями (исходные последовательности и отрицательный контроль) для всех образцов одновременно. С этой целью, ELISA планшеты были покрыты рекомбинантно экспрессированным человеческим PCSK9 белком. Неспецифическое связывание блокировали инкубацией с блокирующим буфером (1% BSA в PBS). Соответствующие разведения сыворотки (при начальном разведении 1:100) добавили к лункам, серийно разбавили 1:2 (12 шагов разведения) и инкубировали в течение приблизительно 1 часа. Связанные антитела обнаруживали путем инкубации с антимышиными IgG антителами, ABTS добавляли в качестве субстрата и затем измеряли OD при 405 нм. В качестве отрицательного контроля анализировали сыворотки контрольной группы животных, которым вводили нерелевантный пептид. Титры были определены как разведение сыворотки, где достигалось 50% значение ODmax в данном исследовании.
Анализ содержания общего холестерина:
Все образцы плазмы собирали через две недели после последней иммунизации и обрабатывали одинаково. Измерение содержания общего холестерина (ТС) проводили во всех образцах одновременно и одновременно сравнивали их с соответствующими контролями (исходные последовательности и отрицательный контроль). Синхронно проводили количественное определение уровней ТС в плазме в мг/дл с помощью набора LabAssay™ Cholesterol Kit (Wako). Подробнее, после инкубации с реактивом хромоген, содержащим холестеринэстеразу, сложные эфиры холестерина в образцах разлагались на свободный холестерин и жирные кислоты. Потом свободный холестерин окислялся холестеролоксидазой, что приводило к одновременному высвобождению перекиси водорода. Полученная перекись водорода давала DAOS и 4-аминоантипирин окислялся и конденсировался количественно пероксидазой (HRP), которая вырабатывала синий пигмент продуцировала. Оптическую плотность измеряли при 600 нм и количество ТС вычисляли с помощью стандартной кривой.
Ингибирование расщепления фурином
Реакцию расщепления фурином проводили с помощью 2 единиц (U) фурина (~110нг) (New Engl и Biolabs) в PCSK9 буфере, содержащем 100 мМ Hepes Buffer рН 7.5, 5% Тритон-Х и 1 мМ CaCl. Подробно, 4 мкл мышиной плазмы от вакцинированных VARIOTOPE® мышей инкубировали с 250 нг биотинилированной huPCSK9 (BPS Bioscience) в PCSK9 буфере в течение 1 часа при комнатной температуре. Затем 2U фурина (~110 нг) (New Engl и Biolabs) добавили в реакционный раствор и инкубировали в течение ночи при комнатной температуре. Продукт реакции анализировали с помощью SDS-PAGE при восстановительных условиях.
Результаты
1. Сведения о последовательностях и титрах к huPCSK9 (ODmax/2)
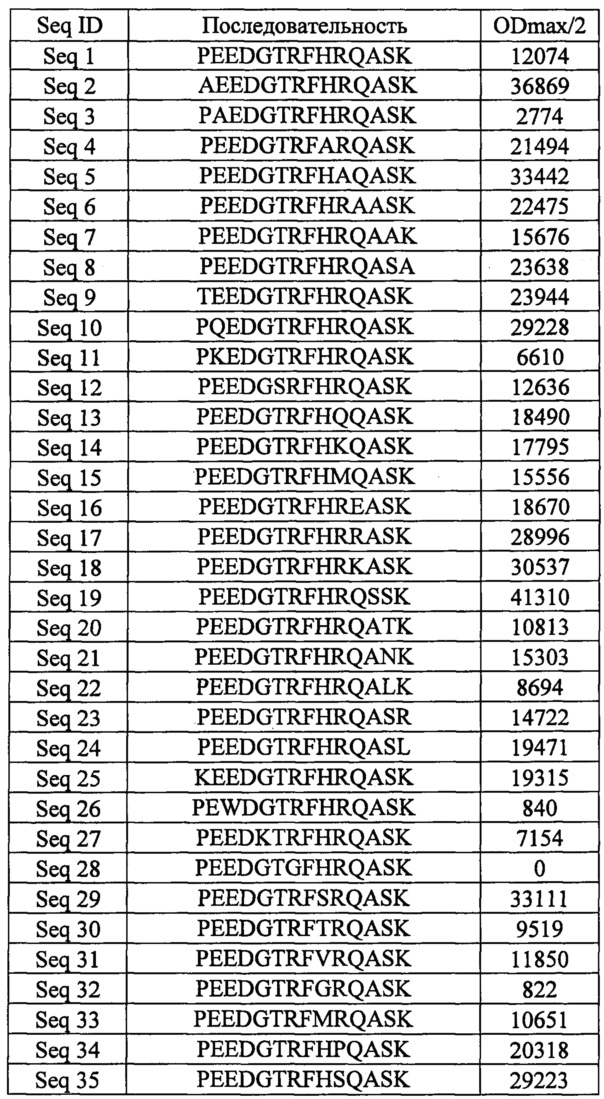

Эти результаты также показаны на фиг. 1. Согласно настоящему изобретению те VARIOPTOPE®, которые обладают возможностью вызывать более высокий титр к huPCSK9 (например, измеренный в виде ODmax/2) согласно данному примеру), считаются иммуностимулирующими вариантами природной последовательности PEEDGTRFHRQASK. Предпочтительно VARIOPTOPE® согласно настоящему изобретению обладает выраженной иммуностимулирующей способностью (измеренной, например, как ODmax/2 в настоящем примере выше 20000 или как повышение этого эффекта до 150%, предпочтительно удвоение этого  , по сравнению с природной последовательностью). И даже более предпочтительно VARIOPTOPE® согласно настоящему изобретению обладает даже более выраженной иммуностимулирующей способностью (измеренной, например, как ODmax/2 в настоящем примере выше 25000, предпочтительно выше 30000; или в виде увеличения втрое этого эффекта, по сравнению с природной последовательностью).
, по сравнению с природной последовательностью). И даже более предпочтительно VARIOPTOPE® согласно настоящему изобретению обладает даже более выраженной иммуностимулирующей способностью (измеренной, например, как ODmax/2 в настоящем примере выше 25000, предпочтительно выше 30000; или в виде увеличения втрое этого эффекта, по сравнению с природной последовательностью).
2. Содержание общего холестерина (%) сравнивали с контрольной группой, принятой за 100% у мышей, иммунизированных VARIOTOPE® с одной АА заменой (Seq 10, 17, 18 и 23; Фигура 2А и Seq 36 2В) и несколькими заменами (Seq 41, 44; Фигура 2С).
Фигура 2А
Фигура 2В

Фигура 2С
Эти результаты также представлены на Фиг. 2. Согласно настоящему изобретению предпочтительными являются такие VARIOPTOPE®, которые обладают способностью вызывать сравнимое уменьшение ТС при сравнении с исходной последовательностью PEEDGTRFHRQASK. Разумеется, еще более предпочтительный VARIOPTOPE® согласно настоящему изобретению обладает способностью уменьшать ТС в еще более высокой степени, чем исходная последовательность (измеренная, например, как уменьшение ТС в %, как измеряется в настоящем примере более чем на 5%, в частности, более чем на 10% (в абсолютном значении, т.е. по сравнению с отрицательным контролем), по сравнению с исходной последовательностью).
3. Вестерн-блоттинг подтвердил способность индуцированных антител после иммунизации последовательностями Seq 10, 17, 18 и 23 ингибировать образование укороченной расщепляемой фурином PCSK9 (а219-692; ~50kDa) (см. Фиг. 3).
Уменьшение общего холестерина (ТС) у леченых животных
Были проведены дополнительные эксперименты для того, чтобы предоставить дополнительное экспериментальное подтверждение, показывающее, что выбранные для вакцины VARIOTOPE® кандидаты обладают способностью уменьшать общий холестерин (ТС) у леченых животных в большей степени, чем вакцина, содержащая соответствующую природную (исходную) последовательность.
Пептиды, использованные для иммунизации в следующих экспериментах:
Seq 1: PEEDGTRFHRQASK (исходная природная последовательность)
Seq 2: AEEDGTRFHRQASK
Seq 9: TEEDGTRFHRQASK
Seq 10: PQEDGTRFHRQASK
Seq 17: PEEDGTRFHRRASK
Seq 18: PEEDGTRFHRKASK
Seq 23: PEEDGTRFHRQASR
Seq 36: PEEDGTRFHRTASK
Seq 24: PEEDGTRFHRQASL
Для того чтобы оценить способность выбранных для вакцины кандидатов VARIOTOPE® уменьшать ТС и чтобы сравнить величину уменьшения ТС у животных, обработанных VARIOTOPE®, с уменьшением ТС у животных, обработанных вакциной, содержащей исходную последовательность, 5-10 мышам (на группу) вводили пять раз с интервалом 2 недели вакцины, содержащие 1 мкг чистого пептида. Как обычно антигенные пептиды соединяли с KLH и адсорбировали на 0.2% Alhydrogel в качестве адьюванта в суммарном объеме 1 мл. Для описанных экспериментов использовали GMP-подобный материал. Образцы крови собирали приблизительно через 2 недели после последней инъекции.
В первом эксперименте были протестированы вакцины, содержащие исходную последовательность и содержащие следующие VARIOTOPE®:
Seq 1: PEEDGTRFHRQASK
Seq 9: TEEDGTRFHRQASK
Seq 17: PEEDGTRFHRRASK
Seq 18: PEEDGTRFHRKASK
Seq 23: PEEDGTRFHRQASR
Для того, чтобы включить вакцину, способную уменьшать уровни ТС у обработанных животных, но уступающую в уменьшении уровней ТС по сравнению с вакциной, содержащей исходную последовательность, в этот эксперимент была включена следующая пептидная вакцина:
Seq 24: PEEDGTRFHRQASL
Как уже было изложено выше (Фигура 1А), все вакцины-кандидаты являются высоко иммуногенными и обладают способностью вызывать образование антител, которые эффективно связываются с huPCSK9, а также мышиной PCSK9. Для подтверждения эффективности индуцированных антител были сделаны измерения ТС в образцах крови, полученных от отдельных мышей. Фигура 4 показывает относительные средние значения ТС (%) в группе по сравнению с контрольной группой, принятой за 100%. В этом эксперименте иммунизировали 5 животных на группу. Как можно видеть, во всех группах, обработанных вакциной, значения ТС были значительно уменьшены по сравнению с контрольной группой.
Поскольку целью этого эксперимента было сравнение группы, обработанной VARIOTOPE®, с группой, обработанной исходной природной последовательностью, на Фигуре 5 представлен % уменьшения значений ТС в группах, обработанных вакциной, по сравнению с группой, обработанной исходной последовательностью, принятой за 0%.
Как показано на Фигуре 5, вакцины, содержащие последовательности
Seq 9: TEEDGTRFHRQASK
Seq 17: PEEDGTRFHRRASK
Seq 18: PEEDGTRFHRKASK
Seq 23: PEEDGTRFHRQASR
являются на 3-10% более сильными в отношении уменьшения уровней ТС по сравнению с вакциной, содержащей исходную последовательность. В противоположность этому, вакцина, содержащая Seq 24: PEEDGTRFHRQASL, обладает способностью уменьшать уровни ТС по сравнению с отрицательным контролем (Фигура 4), однако по сравнению с вакциной, содержащей исходный пептид, уровни ТС были более высокими (+9%).
В следующем эксперименте были протестированы следующие VARIOTOPE® и вновь были сравнены с Seq 1:
Seq 2: AEEDGTRFHRQASK
Seq 10: PQEDGTRFHRQASK
Seq 36: PEEDGTRFHRTASK
В этом эксперименте 10 животным на группу были введены пять раз с 2-недельными интервалами вакцины, содержащие 1 мкг чистого пептида. Образцы крови были также взяты приблизительно через 2 недели после последней инъекции. Для того чтобы сравнить уменьшение ТС у этих животных напрямую со значениями ТС у животных, обработанных исходной последовательностью, % уменьшения значений ТС групп, обработанных вакциной VARITOPE®, по сравнению группой, обработанной исходной последовательностью, принятой за 0% представлен на Фигуре 6.
Как видно на фигуре 6 все три вакцины-кандидаты, протестированные в этом эксперименте, были более сильными в отношении уменьшения уровней ТС по сравнению с вакциной, содержащей исходную последовательность (от -7% до -13%).
Исходя из данного раскрытия, можно выделить следующие предпочтительные варианты осуществления:
1. Вакцина, содержащая, по меньшей мере, один пептид, состоящий из 9-25 аминокислотных остатков, при этом указанный пептид является вариантом пептида PEEDGTRFHRQASK (SEQ.ID.No. 1) с повышенной иммуногенностью у млекопитающих, в частности, людей, по сравнению с PEEDGTRFHRQASK (SEQ.ID.No. 1) и при этом указанный вариант характеризуется, по меньшей мере, одной или самое большее четырьмя заменами аминокислот по сравнению с PEEDGTRFHRQASK (SEQ.ID.No. 1), причем указанный вариант предпочтительно выбирают из группы, состоящей из AEEDGTRFHRQASK (SEQ.ID.No. 2), TEEDGTRFHRQASK (SEQ.ID.No. 9), PQEDGTRFHRQASK (SEQ.ID.No. 10), PEEDGTRFHRRASK (SEQ.ID.No. 17), PEEDGTRFHRKASK (SEQ.ID.No. 18), PEEDGTRFHRQASR (SEQ.ID.No. 23), и PEEDGTRFHRTASK (SEQ.ID.No. 36).
2. Вакцина согласно варианту осуществления 1, содержащая, по меньшей мере, один пептид, состоящий из 9-25 аминокислотных остатков, при этом указанный пептид имеет или содержит аминокислотную последовательность
X1X2EDGX6RFX9X10X11X12X13X14, (SEQ ID No. 46),
в которой
X1 является аминокислотным остатком, выбранным из группы, состоящей из лизина, треонина, аланина и пролина, предпочтительно аланина или пролина,
Х2 является глутамином или аспарагиновой кислотой, предпочтительно аспарагиновой кислотой,
Х6 является треонином или серином,
Х9 является аминокислотным остатком, выбранным из группы, состоящей из гистидина, аланина и серина,
Х10 является аминокислотным остатком, выбранным из группы, состоящей из аргинина, аланина, глутамина, лизина, метионина, пролина и серина, предпочтительно аргинина, серина или аланина,
Х11 является аминокислотным остатком, выбранным из группы, состоящей из глутамина, аланина, глутаминовой кислоты, лизина, треонина и аргинина, предпочтительно глутамина, лизина, аргинина и треонина,
Х12 является аминокислотным остатком, выбранным из группы, состоящей из аланина, серина и треонина, предпочтительно аланина или серина,
Х13 является аминокислотным остатком, выбранным из группы, состоящей из серина, аланина и аспарагина, предпочтительно серина,
Х14 является аминокислотным остатком, выбранным из группы, состоящей из лизина, аланина, аргинина, лейцина, серина, треонина и валина, предпочтительно лизина или серина,
или фрагмент SEQ.ID.No. 46, имеющий, по меньшей мере, 9 последовательных аминокислотных остатков, и
в которой SEQ ID No. 46 не является PEEDGTRFHRQASK (SEQ.ID.No. 1) или ее фрагментом, укороченным с N- или С-конца.
3. Вакцина согласно варианту осуществления 1 или 2, в которой пептид состоит или содержит аминокислотную последовательность, выбранную из группы, состоящей из
AEEDGTRFHRQASK, PEEDGTRFARQASK, PEEDGTRFHAQASK, PEEDGTRFHRAASK, PEEDGTRFHRQAAK, PEEDGTRFHRQASA, TEEDGTRFHRQASK, PQEDGTRFHRQASK, PEEDGSRFHRQASK, PEEDGTRFHQQASK, PEEDGTRFHKQASK, PEEDGTRFHMQASK, PEEDGTRFHREASK, PEEDGTRFHRRASK, PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFHRQANK, PEEDGTRFHRQASR, PEEDGTRFHRQASL, KEEDGTRFHRQASK, PEEDGTRFSRQASK, PEEDGTRFMRQASK, PEEDGTRFHPQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGTRFHRQAST, PEEDGTRFHRQASV, PEEDGSRFHKQASK, PEEDGSRFHMQASK, PEEDGSRFHRRASK, и PEEDGSRFHRQATK; предпочтительно AEEDGTRFHRQASK, PEEDGTRFARQASK, PEEDGTRFHAQASK, PEEDGTRFHRAASK, PEEDGTRFHRQASA, TEEDGTRFHRQASK, PQEDGTRFHRQASK, PEEDGTRFHRRASK, PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFSRQASK, PEEDGTRFHPQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGTRFHRQASV, PEEDGSRFHKQASK, PEEDGSRFHRRASK, и PEEDGSRFHRQATK; в частности, AEEDGTRFHRQASK, PEEDGTRFHAQASK, PQEDGTRFHRQASK, PEEDGTRFHRRASK PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFSRQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGSRFHKQASK и PEEDGSRFHRRASK.
4. Вакцина по любому одному из вариантов осуществления 1-3, в которой указанный по меньшей мере, один пептид соединяется или связывается с фармацевтически приемлемым носителем.
5. Вакцина по любому одному из вариантов осуществления 1-4, в которой, по меньшей мере, один пептид содержит на своем N- и/или С-конце, по меньшей мере, один остаток цистеина, связанный с ним напрямую или через спейсерную последовательность.
6. Вакцина согласно варианту осуществления 4 или 5, в которой фармацевтически приемлемый носитель является белковым носителем.
7. Вакцина согласно варианту осуществления 6, в которой белковый носитель выбирают из группы, состоящей из гемоцианина лимфы улитки (KLH), столбнячного токсина (ТТ), CRM197, протеина D или дифтерийного токсина (DT), предпочтительно мутированного дифтерийного токсина, CRM 197 или KLH, в частности, KLH.
8. Вакцина по любому одному из вариантов осуществления 1-7, в котором в состав вакцины включается адъювант, предпочтительно Al(ОН)3 (гидроокись алюминия).
9. Вакцина по любому одному из вариантов осуществления 1-8, в которой указанный, по меньшей мере, один пептид состоит из 9-20 аминокислотных остатков, в частности, 9-15 аминокислотных остатков.
10. Вакцина согласно любому из вариантов осуществления 1-9, в которой указанный, по меньшей мере, один пептид состоит из 10, 11, 12, 13, 14 или 15 аминокислотных остатков, предпочтительно 13 или 14 аминокислотных остатков, в частности, 14 аминокислотных остатков.
11. Вакцина по любому из вариантов осуществления 1-10, содержащая, по меньшей мере, 2, по меньшей мере, 3, или по меньшей мере, 4 из указанных пептидов, состоящих из 9-25 аминокислотных остатков.
12. Вакцина по любому из вариантов осуществления 1-11, содержащая, по меньшей мере, один пептид в количестве от 0.1 нг до 10 мг, предпочтительно от 0.5 до 500 мкг, более предпочтительно от 1 до 100 мкг.
13. Вакцина по любому из вариантов осуществления 1-12, в которой пептид обладает повышенной иммуногенностью по сравнению с пептидом PEEDGTRFHRQASK (SEQ.ID.No. 1), по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 100%, в частности, по меньшей мере, на 200%, что подтверждено путем исследования сыворотки методом ELISA.
14. Вакцина по любому одному из вариантов осуществления 1-13, в которой пептид обладает повышенной способностью уменьшать уровни общего холестерина по сравнению с пептидом PEEDGTRFHRQASK (SEQ.ID.No. 1), по меньшей мере, на 3%, предпочтительно, по меньшей мере, на 5%, в частности, по меньшей мере, на 10%, что подтверждено исследованием холестерина в сыворотке.
15. Вакцина по любому одному из вариантов осуществления 1-14, предназначенная для применения при лечении и/или предотвращении заболеваний, вызванных гиперлипидемией, гиперхолестеринемией и/или атеросклерозом, предпочтительно сердечно-сосудистых болезней, инсульта или заболеваний периферических кровеносных сосудов, или неопластических болезней, предпочтительно меланомы и метастазов рака печени, связанных с PCSK9.
16. Пептид, состоящий из 9-25 аминокислотных остатков, при этом указанный пептид является вариантом пептида PEEDGTRFHRQASK (SEQ.ID.No. 1) с повышенной иммуногенностью у млекопитающих, в частности, у людей, по сравнению с PEEDGTRFHRQASK (SEQ.ID.No. 1) и при этом указанный вариант отличается, по меньшей мере, одной и самое большее четырьмя заменами аминокислот по сравнению с PEEDGTRFHRQASK (SEQ.ID.No. 1).
17. Пептид согласно варианту осуществления 16, состоящий из 9-25 аминокислотных остатков, при этом указанный пептид имеет или содержит аминокислотную последовательность
X1X2XEDGX6RFX9X10X11X12X13X14, (SEQ ID No. 46),
в которой
X1 является аминокислотным остатком, выбранным из группы, состоящей из лизина, треонина, аланина и пролина, предпочтительно аланина или пролина,
Х2 является глутамином или аспарагиновой кислотой, предпочтительно аспарагиновой кислотой,
Х6 является треонином или серином,
Х9 является аминокислотным остатком, выбранным из группы, состоящей из гистидина, аланина и серина,
Х10 является аминокислотным остатком, выбранным из группы, состоящей из аргинина, аланина, глутамина, лизина, метионина, пролина и серина, предпочтительно аргинина, серина или аланина,
Х11 является аминокислотным остатком, выбранным из группы, состоящей из глутамина, аланина, глутаминовой кислоты, лизина, треонина и аргинина, предпочтительно глутамина, лизина, аргинина и треонина,
Х12 является аминокислотным остатком, выбранным из группы, состоящей из аланина, серина и треонина, предпочтительно аланина или серина,
Х13 является аминокислотным остатком, выбранным из группы, состоящей из серина, аланина и аспарагина, предпочтительно серина,
Х14 является аминокислотным остатком, выбранным из группы, состоящей из лизина, аланина, аргинина, лейцина, серина, треонина и валина, предпочтительно лизина или серина,
или фрагмент SEQ.ID.No. 46, имеющий, по меньшей мере, 9 последовательных аминокислотных остатков, и
в которой SEQ ID No. 46 не является PEEDGTRFHRQASK (SEQ.ID.No. 1) или ее фрагментом, укороченным с N- или С-конца.
18. Пептид согласно варианту осуществления 16 или 17, отличающийся тем, что пептид состоит или содержит аминокислотную последовательность, выбранную из группы, состоящей из группы, состоящей из AEEDGTRFHRQASK, PEEDGTRFARQASK, PEEDGTRFHAQASK, PEEDGTRFHRAASK, PEEDGTRFHRQAAK, PEEDGTRFHRQASA, TEEDGTRFHRQASK, PQEDGTRFHRQASK, PEEDGSRFHRQASK, PEEDGTRFHQQASK, PEEDGTRFHKQASK, PEEDGTRFHMQASK, PEEDGTRFHREASK, PEEDGTRFHRRASK, PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFHRQANK, PEEDGTRFHRQASR, PEEDGTRFHRQASL, KEEDGTRFHRQASK, PEEDGTRFSRQASK, PEEDGTRFMRQASK, PEEDGTRFHPQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGTRFHRQAST, PEEDGTRFHRQASV, PEEDGSRFHKQASK, PEEDGSRFHMQASK, PEEDGSRFHRRASK и PEEDGSRFHRQATK; предпочтительно AEEDGTRFHRQASK, PEEDGTRFARQASK, PEEDGTRFHAQASK, PEEDGTRFHRAASK, PEEDGTRFHRQASA, TEEDGTRFHRQASK, PQEDGTRFHRQASK, PEEDGTRFHRRASK, PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFSRQASK, PEEDGTRFHPQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGTRFHRQASV, PEEDGSRFHKQASK, PEEDGSRFHRRASK и PEEDGSRFHRQATK; в частности AEEDGTRFHRQASK, PEEDGTRFHAQASK, PQEDGTRFHRQASK, PEEDGTRFHRRASK PEEDGTRFHRKASK, PEEDGTRFHRQSSK, PEEDGTRFSRQASK, PEEDGTRFHSQASK, PEEDGTRFHRTASK, PEEDGTRFHRQTSK, PEEDGTRFHRQASS, PEEDGSRFHKQASK и PEEDGSRFHRRASK.
19. Пептид по любому из вариантов осуществления 16-18, согласно которому пептид состоит из 9-20 аминокислотных остатков, в частности 9-15 аминокислотных остатков.
20. Пептид по любому из вариантов осуществления 16-19, согласно которому пептид состоит из 10, 11, 12, 13, 14 или 15 аминокислотных остатков, предпочтительно 13 или 14 аминокислотных остатков, в частности 14 аминокислотных остатков.
21. Пептид по любому из вариантов осуществления 16-20, согласно которому пептид обладает повышенной иммуногенностью по сравнению с пептидом PEEDGTRFHRQASK (SEQ.ID.No. 1), по меньшей мере, на 50%, предпочтительно по меньшей мере, на 100%, в частности, по меньшей мере, на 200%, что подтверждено путем исследования сыворотки методом ELISA.
22. Пептид по любому из вариантов осуществления 16-21, согласно которому пептид обладает повышенной способностью уменьшать уровни общего холестерина по сравнению с пептидом PEEDGTRFHRQASK (SEQ.ID.No. 1), по меньшей мере, на 3%, предпочтительно, по меньшей мере, на 5%, в частности, по меньшей мере, на 10%, что подтверждено исследованием холестерина в сыворотке.
23. Способ лечения пациентов, имеющих или подвергающихся риску развития заболеваний, вызванных гиперлипидемией, гиперхолестеринемией и/или атеросклерозом, включающий введение пациенту эффективного количества вакцины по любому из вариантов осуществления 1-15.
24. Способ по варианту осуществления 23, согласно которому заболевание выбирают из группы, состоящей из сердечно-сосудистых болезней, инсульта или заболеваний периферических кровеносных сосудов.
25. Способ по варианту осуществления 23 или 24, согласно которому предпочтительным является подкожное, внутримышечное, внутрикожное или внутривенное введение.
26. Способ по любому варианту осуществления 23-25, согласно которому вводимая вакцина содержит, по меньшей мере, один пептид в количестве от 0.1 нг до 10 мг, предпочтительно от 0.5 до 500 мкг, в частности, от 1 до 100 мкг.
27. Способ по любому варианту осуществления 23-26, согласно которому вакцина вводится пациенту от 2 до 10, предпочтительно от 2 до 7 и наиболее предпочтительно до 5 раз.
28. Способ по любому варианту осуществления 23-27, согласно которому вакцина 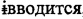 , по меньшей мере, дважды, при этом интервал введения составляет от 2 недель до 5 лет, предпочтительно от 1 месяца до 3 лет, более предпочтительно от 2 месяцев до 1.5 лет.
, по меньшей мере, дважды, при этом интервал введения составляет от 2 недель до 5 лет, предпочтительно от 1 месяца до 3 лет, более предпочтительно от 2 месяцев до 1.5 лет.
29. Способ по любому варианту осуществления 23-28, согласно которому вакцина вводится в виде 3-4 первоначальных вакцинаций в течение периода от 6-8 недель и до 6 месяцев, предпочтительно с последующими дополнительными введениями после этих первоначальных вакцинаций.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА | 2012 |
|
RU2640258C2 |
| АНТАГОНИСТЫ PCSK9 | 2009 |
|
RU2528735C2 |
| АНТАГОНИСТЫ PCSK9 | 2014 |
|
RU2618869C2 |
| ВАКЦИНА ПРОТИВ PCSK9 | 2010 |
|
RU2538162C2 |
| ЛЕЧЕНИЕ АНТИТЕЛАМИ ПРОТИВ PCSK9 | 2012 |
|
RU2576034C2 |
| АНТИТЕЛА С РН-ЗАВИСИМЫМ СВЯЗЫВАНИЕМ АНТИГЕНА | 2011 |
|
RU2570729C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ХОЛЕСТЕРИНОМ | 2021 |
|
RU2832333C1 |
| Антитело против PCSK9 и его применение | 2016 |
|
RU2756012C2 |
| Иммуногенный пептидный фрагмент металлопротеиназы ADAMTS-7 и его применение в противодействии атеросклерозу и родственным заболеваниям | 2020 |
|
RU2799526C1 |
| АНТИТЕЛА ЧЕЛОВЕКА К PCSK9 ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ ЛЕЧЕНИЯ КОНКРЕТНЫХ ГРУПП ИНДИВИДУУМОВ | 2012 |
|
RU2603481C2 |













Изобретение относится к области биотехнологии, конкретно к вакцине против пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9), и может быть использовано в медицине для лечения или предотвращения заболеваний, связанных с PCSK9, выбранных из гиперлипидемии, гиперхолестеринемии, атеросклероза или неопластических болезней. Конъюгат варианта фрагмента PCSK9 с SEQ ID NO:1 с иммуногенным белковым носителем может быть использован в составе вакцины для усиленной индукции образования антител к PCSK9, по сравнению с конъюгатом фрагмента природного PCSK9. 4 н. и 3 з.п. ф-лы, 6 ил., 2 табл., 1 пр.
1. Вакцина против пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9), содержащая эффективное количество по меньшей мере одного пептида, где указанный пептид является вариантом пептида PEEDGTRFHRQASK с SEQ ID No: 1, и где указанный пептид соединен с белковым носителем, выбранным из группы, состоящей из гемоцианина лимфы улитки (KLH), столбнячного токсина (TT), CRM197, белка D, дифтерийного токсина (DT) или мутированного дифтерийного токсина, где указанный вариант выбирают из группы, состоящей из PEEDGTRFHRRASK с SEQ ID No: 17, PEEDGTRFHRKASK с SEQ ID No: 18, PEEDGTRFHRTASK с SEQ ID No: 36, PEEDGSRFHKQASK с SEQ ID No: 41 и PEEDGSRFHRQATK с SEQ ID No: 44, и содержащая фармацевтически приемлемый носитель или адъювант, для применения в уменьшении уровней LDL холестерина плазмы у млекопитающих.
2. Вакцина по п. 1, где адъювант представляет собой гидроокись алюминия Al(OH)3.
3. Применение вакцины по любому из пп. 1 или 2 для лечения или предотвращения заболеваний, связанных с PCSK9, выбранных из гиперлипидемии, гиперхолестеринемии, атеросклероза или неопластических болезней.
4. Применение по п. 3, где атеросклероз представляет собой сердечно-сосудистое заболевание, инсульт или заболевания периферических кровеносных сосудов.
5. Применение по п. 3, где неопластическое заболевание представляет собой меланому и метастазы рака печени.
6. Конъюгат, включающий, по меньшей мере, один пептид, который является вариантом пептида PEEDGTRFHRQASK с SEQ ID No: 1, где указанный пептид соединен с белковым носителем, выбранным из группы, состоящей из гемоцианина лимфы улитки (KLH), столбнячного токсина (TT), CRM197, белка D, дифтерийного токсина (DT) или мутированного дифтерийного токсина, где указанный вариант выбирают из группы, состоящей из PEEDGTRFHRRASK с SEQ ID No: 17, PEEDGTRFHRKASK с SEQ ID No: 18, PEEDGTRFHRTASK с SEQ ID No: 36, PEEDGSRFHKQASK с SEQ ID No: 41 и PEEDGSRFHRQATK с SEQ ID No: 44, для индукции PCSK9-специфичных антител.
7. Применение конъюгата по п. 6 для лечения пациентов, имеющих или подвергающихся риску развития заболеваний, связанных с PCSK9, выбранных из гиперлипидемии, гиперхолестеринемии и/или атеросклероза.
| WO 2013037889, 21.03.2013 | |||
| WO 2011117401, 29.09.2011 | |||
| HARRIS J | |||
| R | |||
| et al., Keyhole limpet hemocyanin (KLH): a biomedical review, Micron, 1999, V | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ФЕДОСЕЕНКО М | |||
| В | |||
| et al., Эпоха конъюгированных вакцин: международный опыт успешного применения, Педиатрическая фармакология, 2008, V | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2019-09-02—Публикация
2015-02-23—Подача