РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке испрашивается приоритет для предварительной заявки США №61/507865, поданной 14 июля 2011 года, предварительной заявки США №61/614312, поданной 22 марта 2012 года, и предварительной заявки США №61/643063, поданной 4 мая 2012 года, все из которых тем самым являются включенными сюда посредством ссылки во всей их полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается терапевтических схем для лечения расстройств, характеризуемых заметными повышениями уровня частиц липопротеинов низкой плотности («LDL») в плазме. Заявленные терапевтические схемы включают введение антитела против пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9), одного или в комбинации со статином. Согласно заявленным терапевтическим схемам предложено усиленное снижение уровней LDL-холестерина в крови, и они могут быть использованы в предупреждении и/или лечении расстройств метаболизма холестерина и липопротеинов, включающих семейную гиперхолестеринемию, атерогенную дислипидемию, атеросклероз, острый коронарный синдром и, в более общем случае, сердечно-сосудистое заболевание.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Миллионы людей в США подвергаются риску сердечных заболеваний и возникающих в их результате кардиологических явлений. Сердечно-сосудистое заболевание и лежащий в его основе атеросклероз является ведущей причиной смерти во всех демографических группах, несмотря на доступность терапий, направленных на его многочисленные факторы риска. Атеросклероз представляет собой заболевание артерий, и он является ответственным за коронарную болезнь сердца, связанную со многими смертями в индустриально развитых странах. К настоящему времени идентифицировали несколько факторов риска для коронарной болезни сердца: дислипидемии, гипертензию, диабет, курение, плохую диету, малоподвижный образ жизни и стресс. Самые клинически релевантные и обычные дислипидемии характеризуются увеличением уровней бета-липопротеинов (липопротеины очень низкой плотности (VLDL) и LDL) с гиперхолестеринемией в отсутствие или в присутствии гипертриглицеридемии (Fredrickson et al., 1967, N Engl J Med. 276:34-42, 94-103, 148-156, 215-225 и 273-281). Существует назревшая значительная неудовлетворенная потребность в лечении сердечно-сосудистого заболевания при том, что 60-70% сердечно-сосудистых явлений, сердечных приступов и инсультов происходит, несмотря на лечение статинами (современный стандарт лечения при атеросклерозе). Кроме того, новые руководства говорят о том, что для защиты пациентов, подверженных высокому риску преждевременного сердечно-сосудистого заболевания, должны достигаться даже меньшие уровни LDL (Национальная образовательная программа по холестерину (NCEP) 2004).
PCSK9 считали главным регулятором холестерина липопротеинов низкой плотности (LDL-C) в плазме, и обнаружено, что он является многообещающей мишенью для предупреждения и лечения коронарной болезни сердца (CHD) (Hooper et al., 2011, Expert Opin Ther Targets 15(2): 157-68). В исследованиях генетики человека идентифицировали мутации приобретения функции, которые были ассоциированы с повышенными сывороточными уровнями LDL-C и преждевременными и распространенными случаями CHD, тогда как мутации потери функции были ассоциированы с низким уровнем LDL-C и с пониженным риском развития CHD (Abifadel, 2003, Nat Genet. 43(2): 154-6; Cohen, 2005, Nat Genet. 37(2):161-5; Cohen, 2006, N Engl J Med. 354(12): 1264-72; Kotowski, 2006, Am J Hum Genet. 78(3):410-22). У человека полная потеря PCSK9 приводит к низкому сывороточному уровню LDL-C, составляющему меньше 20 мг/дл, у здоровых в иных отношениях субъектов (Hooper, 2007, 193(2):445-8; Zhao, 2006, Am J Hum Genet. 79(3):514-523).
PCSK9 принадлежит к семейству субтилизина сериновых протеаз, и он образован N-концевым продоменом, субтилизин-подобным каталитическим доменом и С-концевым доменом, обогащенным цистеином/гистидином (CHRD). Будучи экспрессируемым в печени на высоком уровне, PCSK9 секретируется после автокаталитического расщепления продомена, который остается нековалентно ассоциирован с каталитическим доменом. Каталитический домен PCSK9 связывается с повтором А, подобным эпидермальному фактору роста (EGF-A), домена рецептора липопротеинов низкой плотности (LDLR), при рН сыворотки 7,4 и с большей аффинностью - при рН эндосом, составляющим приблизительно 5,5-6,0 (Bottomley, 2009, J Biol Chem. 284(2): 1313-23). С-концевой домен участвует в интернализации комплекса LDLR-PCSK9, не связываясь с каталитическим доменом (Nassoury, 2007, Traffic 8(7):950; Ni, 2010, J Biol Chem. 285(17): 12882-91; Zhang, 2008, Proc Natl Acad Sci USA, 2008, 105(35): 13045-50). Обе функциональные группировки PCSK9 требуются для направленной доставки комплекса LDLR-PCSK9 для лизосомальной деградации и снижения уровня LDL-C, что согласуется с мутациями в обоих доменах, связанных с потерей функции и приобретением функции (Lambert, 2009, Atherosclerosis 203(1): 1-7).
В настоящее время разрабатываются разные терапевтические подходы для ингибирования PCSK9, включая сайленсинг гена посредством миРНК (малая интерферирующая РНК) или антисмысловых олигонуклеотидов и нарушение взаимодействия PCSK9-LDLR посредством антител (Brautbar et al., 2011, Nature Reviews Cardiology 8, 253-265). Например, и Chan, 2009, и Ni, 2011, сообщают о моноклональном антителе против PCSK9, имеющем активность, снижающую уровень LDL-C у мышей и приматов, не являющихся человеком; сообщали, что период полувыведения каждого антитела составляет приблизительно 61 ч и 77 ч, соответственно у приматов, не являющихся человеком, при введении в дозировке 3 мг/кг антагонистического антитела против PCSK9 (Chan, 2009, Proc Natl Acad Sci USA 106(24):9820-5; Ni, 2011, J Lipid Res. 52(1):78-86). Сообщали, что антагонистическое антитело 7D4 против PCSK9 эффективно снижает уровни сывороточного холестерина у яванского макака; период полувыведения 7D4 у яванских макаков составлял меньше чем 2 суток при одиночной дозе 10 мг/кг антагонистического антитела против PCSK9 (патентная заявка PCT WO 2010/029513).
Из информации, доступной в данной области, и имеющейся до настоящего изобретения, остается не ясным, были бы низкие, нечастые дозы антагонистического антитела против PCSK9 эффективны в уменьшении гиперхолестеринемии и ассоциированной заболеваемости CHD у пациентов-людей и, если это так, какие схемы дозировки нужны для такой эффективности in vivo.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к терапевтическим схемам для длительного снижения уровней LDL-C в крови путем ингибирования активности PCSK9 и к соответствующим эффектам PCSK9 на уровни LDL-C в плазме.
В некоторых воплощениях согласно изобретению предложен способ лечения пациента-человека, подверженного расстройству, характеризующемуся повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, или у которого было диагностировано расстройство, включающий введение пациенту начальной дозы, составляющей по меньшей мере примерно 0,25 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 6 мг/кг, 8 мг/кг, 12 мг/кг, 50 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг или 400 мг антагонистического антитела против пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9); и введение пациенту множества последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая, и дополнительные последующие дозы разделены во времени друг от друга по меньшей мере примерно одной, двумя, тремя или четырьмя неделями. Изобретение можно воплощать на практике, например, используя антагонистическое антитело L1L3 против PCSK9. В некоторых воплощениях изобретение можно осуществлять на практике с использованием антитела, содержащего три CDR (области, определяющие комплементарность) из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO:11, и три CDR из вариабельной области легкой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO:12.
В некоторых воплощениях начальная доза может составлять примерно 0,25 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг или примерно 1,5 мг/кг, и начальная доза и первая последующая доза, и дополнительные последующие дозы могут быть отделены друг от друга во времени примерно одной неделей.
В других воплощениях начальная доза может составлять примерно 2 мг/кг, примерно 4 мг/кг, примерно 8 мг/кг или примерно 12 мг/кг, и начальная доза и первая последующая доза, и дополнительные последующие дозы могут быть отделены друг от друга во времени по меньшей мере примерно двумя неделями.
В других воплощениях начальная доза может составлять примерно 50 мг, примерно 100 мг, примерно 150 мг или примерно 175 мг, и начальная доза и первая последующая доза, и дополнительные последующие дозы могут быть отделены друг от друга во времени по меньшей мере примерно двумя неделями.
В других воплощениях начальная доза может составлять примерно 3 мг/кг или примерно 6 мг/кг, и начальная доза и первая последующая доза, и дополнительные последующие дозы могут быть отделены друг от друга во времени по меньшей мере примерно четырьмя неделями. В других воплощениях начальная доза может составлять примерно 200 мг или примерно 300 мг, и начальная доза и первая последующая доза, и дополнительные последующие дозы могут быть отделены друг от друга во времени по меньшей мере примерно четырьмя неделями. В некоторых воплощениях антагонистическое антитело против PCSK9 вводится подкожно. В некоторых воплощениях антагонистическое антитело против PCSK9 вводится внутривенно.
В некоторых воплощениях начальная доза и первая последующая доза и дополнительные последующие дозы могут быть отделены друг от друга во времени примерно четырьмя неделями. В некоторых воплощениях начальная доза и первая последующая доза, и дополнительные последующие дозы могут быть отделены друг от друга во времени примерно восемью неделями. Каждая из множества последующих доз может представлять собой примерно такое же количество или меньшее, чем в начальной дозе.
В некоторых воплощениях расстройство может представлять собой гиперхолестеринемию, дислипидемию, атеросклероз, сердечно-сосудистое заболевание, коронарную болезнь сердца или острый коронарный синдром (ACS). Пациент-человек перед введением начальной дозы антагонистического антитела против PCSK9 может иметь общий уровень холестерина натощак, например, примерно 600 мг/дл или больше. Пациент-человек перед введением начальной дозы антагонистического антитела против PCSK9 может иметь уровень холестерина LDL натощак, например, примерно 130 мг/дл или больше. В некоторых воплощениях пациент-человек перед введением начальной дозы антагонистического антитела против PCSK9 может иметь уровень холестерина LDL натощак примерно 145 мг/дл или больше.
В некоторых воплощениях пациента лечат статином. В некоторых воплощениях пациента лечат ежесуточной дозой статина. В некоторых воплощениях пациенту-человеку перед введением начальной дозы антагонистического антитела против PCSK9 возможно вводили эффективное количество статина. В некоторых воплощениях перед введением начальной дозы антитела против PCSK9 пациент получает стабильные дозы статина. Стабильные дозы, например, могут представлять собой ежесуточную дозу или дозу через сутки. В некоторых воплощениях перед введением начальной дозы антагонистического антитела против PCSK9 пациент-человек получает ежесуточную стабильную дозу статина в течение по меньшей мере примерно двух, трех, четырех, пяти или шести недель. В некоторых воплощениях пациент-человек, получающий стабильные дозы статина, перед введением начальной дозы антагонистического антитела против PCSK9 имеет уровень LDL холестерина натощак, составляющий, например, примерно 70 или 80 мг/дл.
В некоторых воплощениях данный способ кроме того включает введение эффективного количества статина.
В некоторых воплощениях начальная доза антагонистического антитела против PCSK9 может составлять примерно 3 мг/кг или примерно 6 мг/кг, и начальная доза и первая последующая доза и дополнительные последующие дозы могут быть отделены друг от друга во времени примерно четырьмя неделями или примерно одним месяцем. В некоторых воплощениях начальная доза антагонистического антитела против PCSK9 может составлять примерно 200 мг или примерно 300 мг, и начальная доза и первая последующая доза и дополнительные последующие дозы могут быть отделены друг от друга во времени примерно четырьмя неделями или примерно одним месяцем.
Статин может представлять собой, например, аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин, симвастатин, или комбинированную терапию, выбранную из группы, состоящей из симвастатина плюс эзетимиба, ловастатина плюс ниацина, аторвастатина плюс амлодипина и симвастатина плюс ниацина. В некоторых воплощениях доза статина может составлять, например, 40 мг аторвастатина, 80 мг аторвастатина, 20 мг розувастатина, 40 мг розувастатина, 40 мг симвастатина или 80 мг симвастатина.
В некоторых воплощениях способ включает введение пациенту начальной дозы по меньшей мере примерно 3 мг/кг или примерно 6 мг/кг антагонистического антитела L1L3 против PCSK9; и введение пациенту ряда последующих доз антитела, в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая и дополнительные последующие дозы отделены друг от друга во времени по меньшей мере примерно четырьмя неделями, где пациента лечат стабильной ежесуточной дозой статина. В некоторых воплощениях стабильная ежесуточная доза статина может составлять 40 мг аторвастатина, 80 мг аторвастатина, 20 мг розувастатина, 40 мг розувастатина, 40 мг симвастатина или 80 мг симвастатина.
В некоторых воплощениях способ включает введение пациенту начальной дозы по меньшей мере примерно 200 мг или примерно 300 мг антагонистического антитела L1L3 против PCSK9; и введение пациенту ряда последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая и дополнительные последующие дозы отделены друг от друга во времени по меньшей мере примерно четырьмя неделями, где пациента лечат стабильной ежесуточной дозой статина. В некоторых воплощениях способ включает введение пациенту начальной дозы по меньшей мере примерно 50 мг, примерно 100 мг, примерно 150 мг или примерно 175 мг антагонистического антитела L1L3 против PCSK9; и введение пациенту ряда последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая и дополнительные последующие дозы отделены друг от друга во времени по меньшей мере примерно двумя неделями, где пациента лечат стабильной ежесуточной дозой статина. В некоторых воплощениях стабильная ежесуточная доза статина может составлять 40 мг аторвастатина, 80 мг аторвастатина, 20 мг розувастатина, 40 мг розувастатина, 40 мг симвастатина или 80 мг симвастатина.
В некоторых воплощениях антагонистическое антитело против PCSK9 вводят подкожно или внутривенно.
Согласно изобретению также предложено изделие, содержащее контейнер, композицию в контейнере, содержащую антагонистическое антитело против PCSK9, и листок-вкладыш, содержащий инструкции по введению начальной дозы антагонистического антитела против PCSK9, составляющей по меньшей мере примерно 0,25 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 6 мг/кг, 8 мг/кг, 12 мг/кг, 50 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг или 400 мг, и по меньшей мере одной последующей дозы, которая представляет собой такое же или меньшее количество, чем начальная доза. В некоторых воплощениях изобретение можно осуществлять на практике с использованием антитела, содержащего три CDR из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO:11, и три CDR из вариабельной области легкой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO:12. В некоторых воплощениях изобретение можно осуществлять на практике с использованием антагонистического антитела L1L3 против PCSK9.
Введение начальной дозы и последующих доз может быть отделено во времени, например, по меньшей мере примерно одной, по меньшей мере примерно двумя, тремя, четырьмя, пятью, шестью, семью или восемью неделями. В некоторых воплощениях инструкции могут служить, например, для введения начальной дозы внутривенной инъекции и по меньшей мере одной последующей дозы - внутривенной или подкожной инъекции. В других воплощениях инструкции могут служить, например, для введения начальной дозы подкожной инъекции и по меньшей мере одной последующей дозы -внутривенной или подкожной инъекции.
В некоторых воплощениях можно вводить ряд последующих доз. В этом ряду последующие дозы могут быть отделены друг от друга во времени, например, по меньшей мере двумя, тремя, четырьмя, пятью, шестью, семью или восемью неделями.
В некоторых воплощениях листок-вкладыш может дополнительно включать инструкции для введения антагонистического антитела против PCSK9 пациенту, которого лечат статином. Статин может представлять собой, например, аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин, симвастатин, или комбинированную терапию, выбранную из группы, состоящей из симвастатина плюс эзетимиба, ловастатина плюс ниацина, аторвастатина плюс амлодипина и симвастатина плюс ниацина.
В некоторых воплощениях изделие может дополнительно включать этикетку на контейнере или ассоциированную с ним, на которой указано, что композицию можно использовать для лечения состояния, характеризующегося повышенным уровнем холестерина липопротеинов низкой плотности в крови. На этикетке может быть указано, что композицию можно использовать, например, для лечения гиперхолестеринемии, атерогенной дислипидемии, атеросклероза, сердечно-сосудистого заболевания и/или острого коронарного синдрома (ACS).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ.1 изображен график, демонстрирующий абсолютные уровни LDL-C натощак в мг/мл после введения антитела L1L3.
На ФИГ.2 изображен график, демонстрирующий процентное изменение уровней LDL-C натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.3 изображен график, демонстрирующий процентное изменение уровней общего холестерина натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.4 изображен график, демонстрирующий процентное изменение уровней аполипопротеина В натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.5 изображен график, демонстрирующий процентное изменение уровней холестерина липопротеинов высокой плотности натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.6 изображен график, демонстрирующий процентное изменение уровней холестерина триглицеридных липопротеинов натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.7А изображен график, демонстрирующий абсолютные уровни LDL-C натощак в мг/дл после введения антитела L1L3. На ФИГ.7Б изображен график, демонстрирующий процентное изменение уровней LDL-C натощак в мг/дл относительно исходного уровня после введения антитела L1L3.
На ФИГ.8 изображен график, демонстрирующий процентное изменение уровней LDL-C натощак относительно исходного уровня после введения антитела L1L3, в присутствии или в отсутствие статина. По оси Х показано количество дозы антагонистического антитела L1L3 против PCSK9 в мг/кг.
На ФИГ.9А-Е изображены смоделированные профили во времени для L1L3 (А-В) и LDL-C (Д-Е). (А) и (Г): антагонистическое антитело L1L3 против PCSK9 в дозировке 2 мг/кг.(Б) и (Д): антагонистическое антитело L1L3 против PCSK9 в дозировке 6 мг/кг.(В) и (Е): плацебо. По оси Х показано время в сутках.
На ФИГ.10 изображены смоделированные профили во времени для LDL-C после дозирования указанных количеств дозы L1L3.
На ФИГ.11 изображена схема исследования для монотерапии L1L3.
На ФИГ.12 изображен график, демонстрирующий абсолютные уровни LDL-C натощак в мг/дл после введения антитела L1L3.
На ФИГ.13 изображен график, демонстрирующий процентное изменение уровней LDL-C натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.14 изображена таблица, демонстрирующая среднее процентное изменение уровней LDL-C натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.15 изображен график, демонстрирующий процентное изменение уровней LDL-C натощак относительно исходного уровня после введения антитела L1L3.
На ФИГ.16 изображен график, демонстрирующий процентное изменение уровней LDL-C натощак относительно исходного уровня после введения антитела L1L3 с исключением субъектов с отсутствующими дозами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Здесь предложены терапевтические схемы для лечения расстройств, характеризуемых заметными увеличениями уровней частиц LDL в плазме. Рассматриваемые терапевтические схемы включают введение антагонистического антитела против PCSK9, одного или в комбинации со статином. Рассматриваемые терапевтические схемы обеспечивают длительное снижение уровней холестерина LDL в крови и могут использоваться в предупреждении и/или лечении расстройств метаболизма холестерина и липопротеинов, включающих семейную гиперхолестеринемию, атерогенную дислипидемию, атеросклероз, острый коронарный синдром (ACS) и, в более общем случае, сердечно-сосудистое заболевание.
Общие методики
В воплощении настоящего изобретения на практике будут использоваться, если не указано иное, традиционные методики молекулярной биологии (включая методы генной инженерии), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах квалификации специалистов в данной области. Такие методики полностью объяснены в литературе, как, например, в Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
«Антитело» представляет собой молекулу иммуноглобулина, способную к специфичному связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. Термин «антитело» в том виде, как он здесь используется, охватывает не только интактные поликлональные или моноклональные антитела, но также и любой антигенсвязывающий фрагмент (т.е. «антигенсвязывающую часть») или его одиночную цепь, слитые белки, содержащие антитело, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена, включающую, например, без ограничения, scFv, однодоменные антитела (например, антитела акул и Camelid), макситела, минитела, интратела, диатела, триатела, тетратела, v-NAR и bis-scFv (см., например, Hollinger and Hudson, 2005, Nature Biotechnology 23(9): 1126-1136). Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или его подкласс), и антитело не должно принадлежать к какому-либо конкретному классу. В зависимости от аминокислотной последовательности константной области их тяжелых цепей, иммуноглобулины могут быть приписаны к разным классам. Есть пять главных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю соответственно. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны.
Термин «антигенсвязывающая часть» антитела в том виде, как он здесь используется, относится к одному или более чем одному фрагменту интактного антитела, который сохраняет способность специфично связываться с данным антигеном (например, PCSK9). Антигенсвязывающие функции антитела могут выполняться фрагментами интактного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть» антитела, включают Fab; Fab′; F(ab′)2; и фрагмент Fd, состоящий из доменов VH и СН1; фрагмент Fv, состоящий из доменов VL и VH одной ручки антитела; фрагмент в виде однодоменного антитела (dAb) (Ward et al., 1989, Nature 341:544-546) и выделенную область, определяющую комплементарность (CDR).
Термин «моноклональное антитело» (Mab) относится к антителу, которое происходит от одной копии или клона, и включает, например, любой клон эукариотического, прокариотического или фагового происхождения, а не способ, посредством которого оно получено. Предпочтительно моноклональное антитело по изобретению существует в гомогенной или по существу гомогенной популяции.
Термин «гуманизированное» антитело относится к формам антител, не являющихся человеческими (например, мышиным), которые представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab; Fab′; F(ab′)2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина, не являющегося человеческим. Предпочтительно гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в котором остатки из области, определяющей комплементарность (CDR), реципиента заменены остатками из CDR вида, не являющегося человеком (донорное антитело), такого как мышь, крыса или кролик, имеющими желательную специфичность, аффинность и эффективность.
Термин «человеческое антитело» в том виде, как он здесь используется, означает антитело, имеющее аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, которое может продуцироваться человеком, и/или которое было получено с использованием любой из методик для получения человеческих антител, известных специалистам в данной области или раскрытых здесь. Данное определение человеческого антитела включает антитела, содержащие по меньшей мере один полипептид человеческой тяжелой цепи или по меньшей мере один полипептид человеческой легкой цепи. Одним таким примером является антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи. Человеческие антитела можно получать с использованием разных методик, известных в данной области. В одном воплощении человеческое антитело выбрано из фаговой библиотеки, где данная фаговая библиотека экспрессирует человеческие антитела (Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., 1998, Proc. Natl. Acad. Sci. (USA) 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et al., 1991, J. Mol. Biol., 222:581). Человеческие антитела также могут быть получены иммунизацией животных, в которых вместо эндогенных локусов были трансгенно введены локусы человеческого иммуноглобулина, например, мышей, у которых были частично или полностью инактивированы эндогенные гены иммуноглобулинов. Данный подход описан в патентах США №5545807; 5545806; 5569825; 5625126; 5633425 и 5661016. В качестве альтернативы, человеческое антитело может быть получено посредством создания бессмертных человеческих В-лимфоцитов, которые продуцируют антитело, направленное против антигена-мишени (такие В-лимфоциты можно выделять из индивидуума или можно иммунизировать in vitro) (см., например, Cole et al. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77, 1985; Boerner et al., 1991, J. Immunol., 147 (1):86-95 и патент США №5750373).
Термин «вариабельная область» антитела относится к вариабельной области легкой цепи антитела или к вариабельной области тяжелой цепи антитела, либо одной, либо в комбинации. Как известно в данной области, каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя областями, определяющими комплементарность (CDR), также известными как гипервариабельные области, и содействует образованию антигенсвязывающего сайта антител. Если желательны варианты рассматриваемой вариабельной области, конкретно с заменой аминокислотных остатков вне области CDR (т.е. в каркасной области), подходящую аминокислотную замену, предпочтительно консервативную аминокислотную замену, можно идентифицировать путем сравнения рассматриваемой вариабельной области с вариабельными областями других антител, которые содержат последовательности CDR1 и CDR2 того же самого канонического класса, что и рассматриваемая вариабельная область (Chothia and Lesk, J Mol Biol 196(4): 901-917, 1987). При выборе FR для фланкирования рассматриваемых CDR, например, при проведении гуманизации или оптимизации антитела, предпочтительными являются FR из антител, которые содержат последовательности CDR1 и CDR2 того же самого канонического класса.
"CDR" вариабельного домена представляют собой аминокислотные остатки в пределах вариабельной области, которые идентифицированы согласно определениям Kabat, Chothia, сочетанию Kabat и Chothia, AbM, контактному и/или конформационному определениям, или любым способом определения CDR, хорошо известным в данной области. CDR антитела могут быть идентифицированы как гипервариабельные области, исходно определенные Kabat et al. (см., например, Kabat et al., 1992, Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, NIH, Washington D.C.). Положения CDR также можно идентифицировать как структуры, имеющие форму петель, первоначально описанные Chothia с соавторами (см., например, Chothia et al., 1989, Nature 342:877-883). Другие подходы к идентификации CDR включают «определение АbМ», которое представляет собой компромисс между определениями Kabat и Chothia и является результатом использования программы для моделирования антител АbМ от Oxford Molecular (теперь Accelrys®), или «контактное определение» CDR, основанное на наблюдаемых контактах с антигеном, изложенное в MacCaIlum et al., 1996, J. Mol. Biol., 262:732-745. В другом подходе, названном здесь «конформационное определение» CDR, положения CDR можно идентифицировать как остатки, которые осуществляют энтальпический вклад в связывание антигена (см., например, Makabe et al., 2008, Journal of Biological Chemistry, 283:1156-1166). Кроме того, другие пограничные определения CDR могут строго не следовать одному из приведенных выше подходов, но, тем не менее, будут перекрываться по меньшей мере с частью CDR Kabat, хотя они и могут быть укорочены или удлинены в свете предсказания или экспериментальных сведений о том, что конкретные остатки или группы остатков, или даже целые CDR значимо не влияют на связывание антигена. Термин «CDR» в том виде, как он здесь используется, может относиться к CDR, определенным любым подходом, известным в данной области, включая комбинации подходов. В применяемых здесь способах могут использоваться CDR, определенные согласно любому из данных подходов. Для любого данного воплощения, содержащего более чем одну CDR, эти CDR могут быть определены согласно любому определению: по Kabat, Chothia, расширенному, АbМ, контактному и/или конформационному.
Как известно в данной области, термин «константная область» антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, либо одной, либо в комбинации.
Термин «PCSK9» в том виде, как он здесь используется, относится к любой форме PCSK9 и его вариантам, которые сохраняют по меньшей мере часть активности PCSK9. Если не указано иначе, как, например, посредством конкретной ссылки на человеческий PCSK9, PCSK9 включает PCSK9 с нативной последовательностью всех видов млекопитающих, например, человеческий, собачий, кошачий, лошадиный или коровий. Один типичный человеческий PCSK9 можно найти под номером доступа Uniprot Q8NBP7 (SEQ ID NO:1).
Термин «антагонистическое антитело против PCSK9» в том виде, как он здесь используется, относится к антителу против PCSK9, которое способно ингибировать биологическую активность PCSK9 и/или последующий(-ие) путь (пути), опосредованный(-ые) сигналингом PCSK9, включая опосредованную PCSK9 понижающую регуляцию LDLR и опосредованное PCSK9 снижение клиренса LDL в крови. Антагонистическое антитело против PCSK9 охватывает антитела, которые блокируют, оказывают антагонистический эффект, подавляют или уменьшают (в любой степени, включая значительную) биологическую активность PCSK9, включая последующие пути, опосредованные сигналингом PCSK9, такие как взаимодействие с LDLR и/или индукция клеточного ответа на PCSK9. Для цели настоящего изобретения будет недвусмысленно понятно, что термин «антагонистическое антитело против PCSK9» охватывает все ранее идентифицированные термины, названия и функциональные состояния и характеристики, посредством которых сам PCSK9, биологическая активность PCSK9 (включая ее способность опосредовать любой аспект взаимодействия с LDLR, понижающую регуляцию LDLR и пониженный клиренс LDL в крови, но не ограничиваясь ими) или последовательности биологической активности по существу исчезают, снижаются или нейтрализуются в любой значимой степени. В некоторых воплощениях антагонистическое антитело против PCSK9 связывается с PCSK9 и предотвращает взаимодействие с LDLR. Примеры антагонистических антител против PCSK9 приведены, например, в публикации заявки на патент США №20100068199, которая включена сюда посредством ссылки во всей ее полноте.
Термин «полный антагонист» в том виде, как он здесь используется, представляет собой антагонист, который, при эффективной концентрации, по существу полностью блокирует измеримый эффект PCSK9. Под частичным антагонистом подразумевается антагонист, который способен частично блокировать измеримый эффект, но который, даже при наивысшей концентрации, не является полным антагонистом. Под «по существу полностью» подразумевается по меньшей мере примерно 80%-ное, предпочтительно по меньшей мере примерно 90%-ное, более предпочтительно по меньшей мере примерно 95%-ное и наиболее предпочтительно по меньшей мере примерно 98%-ное или 99%-ное блокирование измеримого эффекта. Релевантные «измеримые эффекты» описаны здесь и включают понижающую регуляцию LDLR антагонистом PCSK9 при анализе в клетках Huh7 in vitro, снижение in vivo уровней общего холестерина в крови (или в плазме) и снижение in vivo уровней LDL в крови (или в плазме).
Термин «клинически значимый» в том виде, как он здесь используется, означает по меньшей мере 15%-ное снижение уровней холестерина LDL в крови у людей или по меньшей мере 15%-ное снижение уровня общего холестерина в крови у мышей. Очевидно, что измерения в плазме или в сыворотке могут служить в качестве заменителей измерений уровней в крови.
Термин «схема дозирования» в том виде, как он здесь используется, относится ко всему курсу лечения, назначенному пациенту, например, к лечению антагонистическим антителом против PCSK9.
Термин «непрерывный» в том виде, как он здесь используется, в контексте времени, в которое средний уровень холестерина LDL в крови находится в пределах определенного интервала уровней, означает, что время, в течение которого средний уровень находится в данном определенном интервале, не прерывается каким-либо временем, в которое данный средний уровень не находится в пределах данного определенного интервала уровней.
Термин «не непрерывный» в том виде, как он здесь используется, в контексте времени, в которое средний уровень холестерина LDL в крови находится в пределах определенного интервала уровней, означает, что время, в течение которого средний уровень находится в данном определенном интервале, прерывается некоторым количеством времени (например, 15 минут, 20 минут, 30 минут, 45 минут, 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 8 часов, 10 часов, 12 часов, 14 часов, 16 часов, 18 часов, 20 часов, 24 часа, 28 часов, 32 часа, 36 часов, 40 часов, 44 часа, 48 часов, 60 часов, 72 часа, 84 часа, 90 часов или любой интервал времени, имеющий верхнюю и нижнюю границы из любого из приведенных выше конкретно определенного времени), в которое данный средний уровень не находится в пределах этого определенного интервала уровней.
Термины «полипептид», «олигопептид», «пептид» и «белок» используются здесь взаимозаменяемо для того, чтобы назвать цепи аминокислот любой длины, предпочтительно относительно короткие (например, из 10-100 аминокислот). Данная цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может быть прервана не аминокислотами. Данные термины также охватывают аминокислотную цепь, которая была модифицирована при помощи природных механизмов или путем вмешательства: например, образованием дисульфидной связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или любой другой манипуляция или модификацией, такой как конъюгирование с меченым компонентом. Также в данное определение включены, например, полипептиды, содержащие один или более чем один аналог аминокислоты (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области. Понятно, что полипептиды могут встречаться в виде одиночных цепей или ассоциированных цепей.
Как известно в данной области, термины «полинуклеотид» или «нуклеиновая кислота», используемые здесь взаимозаменяемо, относятся к цепям нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в цепь ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае ее присутствия, модификация структуры нуклеотида может осуществляться до или после сборки цепи. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, посредством конъюгирования с меченым компонентом. Другие типы модификаций включают, например, «кэпы», замещение одного или более чем одного нуклеотида, встречающегося в природе, аналогом, межнуклеотидные модификации, такие как, например, модификации незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие присоединенные группировки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), алкиляторы, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(-ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищенными стандартными защитными группами, или активированными с получением дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5′- и 3′-концевой ОН может быть фосфорилирован или замещен аминами или группировками органической кэппирующей группы из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизированы до стандартных защитных групп. Полинуклеотиды также могут содержать аналогичные формы рибозных или дезоксирибозных Сахаров, которые обычно известны в данной области, включая, например, 2′-O-метильные-, 2′-O-аллильные-, 2′-фтор- или 2′-азидо-рибозные, карбоциклические аналоги Сахаров, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и безосновные аналоги нуклеозидов, такие как метилрибозид. Одна или более чем одна фосфодиэфирная связь может быть заменена альтернативными связывающими группами. Эти альтернативные связывающие группы включают воплощения, в которых фосфат заменен Р(O)S(«тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR′, CO или СН2 («формацеталь»), в которых каждый R или R′ представляет собой независимо Н или замещенный или незамещенный алкил (1-20С), возможно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил, но не ограничиваются ими. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем полинуклеотидам, на которые здесь дается ссылка, включая РНК и ДНК.
Фраза антитело «взаимодействует с» PCSK9 в том виде, как она здесь используется, когда равновесная константа диссоциации равна или меньше чем 20 нМ, предпочтительно меньше чем примерно 6 нМ, более предпочтительно меньше чем примерно 1 нМ, наиболее предпочтительно меньше чем примерно 0,2 нМ при измерении способами, раскрытыми в Примере 2 публикации заявки на патент США №20100068199.
Антитело, которое «предпочтительно связывается» или «специфично связывается» (используются здесь взаимозаменяемо) с эпитопом, представляет собой хорошо понятный в данной области термин, и способы определения такого специфичного или предпочтительного связывания также хорошо известны в данной области. Говорят, что молекула демонстрирует «специфичное связывание» или «предпочтительнее связывание», если она реагирует или ассоциирует с конкретной клеткой или веществом чаще, быстрее, более длительно и/или с большей аффинностью, чем она делает это с другими клетками или веществами. Антитело «специфично связывается» или «предпочтительно связывается» с мишенью, если оно связывается с большей аффинностью, авидностью, легче и/или более длительно, чем оно связывается с другими веществами. Например, антитело, которое специфично или предпочтительно связывается с эпитопом PCSK9 представляет собой антитело, которое связывается с данным эпитопом с большей аффинностью, авидностью, легче и/или более длительно, чем оно связывается с другими эпитопами PCSK9 или эпитопами, не являющимися эпитопами PCSK9. При прочтении данного определения также понятно, что, например, антитело (или группировка, или эпитоп), которое специфично или предпочтительно связывается с первой мишенью, может или не может специфично или предпочтительно связываться со второй мишенью. «Специфичное связывание» или «предпочтительное связывание», как таковое, не обязательно требует (хотя оно и может включать) исключительного связывания. Обычно, но не обязательно, ссылка на связывание означает предпочтительное связывание.
Фраза «по существу чистый» в том виде, как она здесь используется, относится к веществу, которое является по меньшей мере на 50% чистым (т.е. не содержащим примесей), более предпочтительно по меньшей мере на 90% чистым, более предпочтительно по меньшей мере на 95% чистым, еще более предпочтительно по меньшей мере на 98% чистым и наиболее предпочтительно по меньшей мере на 99% чистым.
«Клетка-хозяин» включает индивидуальную клетку или культуру клеток, которая может быть или была реципиентом вектора(-ов) для включения полинуклеотидных вставок. Клетки-хозяева включают потомство одной клетки-хозяина, и данное потомство не обязательно может быть полностью идентичным (по морфологии или по набору геномной ДНК) с исходной родительской клеткой из-за природной, случайной или преднамеренной мутации. Клетки-хозяева включают клетки, трансфицированные in vivo полинуклеотидом(-ами) по данному изобретению.
Как известно в данной области, термин «область Fc» используется для определения С-концевой области тяжелой цепи иммуноглобулина. «Область Fc» может представлять собой область Fc нативной последовательности или вариант области Fc. Несмотря на то, что границы области Fc тяжелой цепи иммуноглобулина могут варьировать, область Fc тяжелой цепи человеческого IgG обычно определяют как простирающуюся от аминокислотного остатка в положении Cys226 или от Рго230 до его карбоксильного конца. Нумерация остатков в области Fc представляет собой нумерацию согласно индексу Европейского союза, как приведено в Kabat (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991). Область Fc иммуноглобулина обычно содержит два константных домена - СН2 и СН3.
Термины «рецептор Fc» и «FcR» в том виде, в котором они используются в данной области, описывают рецептор, который связывается с областью Fc антитела. Предпочтительным FcR является человеческий FcR с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывается с антителом IgG (гамма рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы данных рецепторов, возникшие в результате альтернативного сплайсинга. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и Fc/RIIB («ингибирующий рецептор»), которые имеют аналогичные аминокислотные последовательности, которые отличаются, главным образом, в их цитоплазматических доменах. Обзор FcR дается в Ravetch and Kinet, 1991, Ann. Rev. Immunol., 9:457-92; Capel et al., 1994, Immunomethods, 4:25-34 и de Haas et al., 1995, J. Lab. Clin. Med., 126:330-41. «FcR» также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., 1976 J. Immunol., 117:587 и Kirn et al., 1994, J. Immunol., 24:249).
Термин «конкурировать» в том виде, как он здесь используется в отношении антитела, означает то, что первое антитело или его антигенсвязывающая часть связывается с эпитопом способом, в достаточной степени аналогичным способу связывания второго антитела или его антигенсвязывающей части, так что результат связывания первого антитела с его когнатным эпитопом детектируемо снижается в присутствии второго антитела по сравнению со связыванием первого антитела в отсутствие второго антитела. Альтернатива, когда связывание второго антитела с его эпитопом также детектируемо снижается в присутствии первого антитела может, но не обязательно имеет место. То есть, первое антитело может ингибировать связывание второго антитела с его эпитопом без того, что второе антитело ингибирует связывание первого антитела с его соответствующим эпитопом. Однако когда каждое антитело детектируемо ингибирует связывание другого антитела с его когнатным эпитопом или лигандом, с той же самой, большей или меньшей степенью, говорят, что антитела «перекрестно конкурируют» друг с другом за связывание с их соответствующим(-ми) эпитопом(-ми). Настоящим изобретением охватываются и конкурирующие, и перекрестно конкурирующие антитела. Независимо от механизма, посредством которого осуществляется такая конкуренция или перекрестная конкуренция (например, стерический барьер, конформационное изменение или связывание с общим эпитопом или его частью), квалифицированный специалист на основе приведенных здесь идей понял бы, что такие конкурирующие и/или перекрестно конкурирующие антитела охватываются и могут быть полезными для раскрытых здесь способов.
Под антителом с эпитопом, который «перекрывается» с другим (вторым) эпитопом или с поверхностью на PCSK9, которая взаимодействует с EGF-подобным доменом LDLR, подразумевается общее использование пространства в том, что касается остатков PCSK9, с которыми осуществляется взаимодействие. Для расчета процента перекрывания, например, рассчитывают процент перекрывания эпитопа PCSK9 заявленного антитела с поверхностью PCSK9, которая взаимодействует с EGF-подобным доменом LDLR, площадью поверхности PCSK9, скрытой, когда она находится в комплексе с LDLR, на основе остатков. Для этих остатков также рассчитывают скрытую площадь в комплексе PCSK9:антитело. Для предотвращения более чем 100%-го возможного перекрывания, площадь поверхности для остатков, которые имеют большую скрытую площадь поверхности в комплексе PCSK9:антитело, чем в комплексе LDLR.-PCSK9, принимают за 100% на основе значений, полученных для комплекса LDLR: PCSK9. Процент перекрывания поверхности рассчитывают, суммируя все взаимодействующие остатки в LDLR:PCSK9 и находя их вес по площади взаимодействия.
«Функциональная область Fc» обладает по меньшей мере одной эффекторной функцией области Fc с нативной последовательностью. Типичные «эффекторные функции» включают связывание C1q; комплементзависимую цитотоксичность; связывание с рецептором Fc; зависимую от антитела клеточно-опосредованную цитотоксичность; фагоцитоз; понижающую регуляцию рецепторов поверхности клетки (например, рецептора В-клеток) и т.д. Такие эффекторные функции обычно требуют того, чтобы область Fc объединялась с доменом связывания (например, с вариабельным доменом антитела), и их можно оценивать с использованием разных анализов, известных в данной области для оценки таких эффекторных функций антитела.
«Область Fc с нативной последовательностью» содержит аминокислотную последовательность, идентичную аминокислотной последовательности области Fc, обнаруженной в природе. «Вариант области Fc» содержит аминокислотную последовательность, которая отличается от природной аминокислотной последовательности области Fc по меньшей мере одной аминокислотной модификацией, но все еще сохраняет по меньшей мере одну эффекторную функцию области Fc с нативной последовательностью. Предпочтительно вариант области Fc имеет по меньшей мере одну аминокислотную замену по сравнению с областью Fc с нативной последовательностью или с областью Fc родительского полипептида, например, от примерно одной до примерно десяти аминокислотных замен и, предпочтительно, от примерно одной до примерно пяти аминокислотных замен в области Fc с нативной последовательностью или в области Fc родительского полипептида. Вариант области Fc здесь предпочтительно будет обладать по меньшей мере примерно 80%-ной идентичностью последовательности с областью Fc с нативной последовательностью и/или с областью Fc родительского полипептида, и наиболее предпочтительно по меньшей мере примерно 90%-ной идентичностью последовательности с ними, более предпочтительно по меньшей мере примерно 95%-ной, по меньшей мере примерно 96%-ной, по меньшей мере примерно 97%-ной, по меньшей мере примерно 98%-ной, по меньшей мере примерно 99%-ной идентичностью последовательности с ними.
Термины «аторвастатин», «церивастатин», «флувастатин», «ловастатин», «мевастатин», «питавастатин», «правастатин», «розувастатин» и «симвастатин» в том виде, как они здесь используются, включают соответственно аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин и симвастатин и их любые фармацевтически приемлемые соли или стереоизомеры. Термин «фармацевтически приемлемая соль» в том виде, как он здесь используется, включает соли, которые физиологически переносятся пациентом. Такие соли обычно получают из неорганических кислот или оснований и/или органических кислот или оснований. Примеры этих кислот и оснований хорошо известны обычным специалистам в данной области.
Термин «лечение» в том виде, как он здесь используется, представляет собой подход для получения полезных или желательных клинических результатов. Для целей данного изобретения полезные или желательные клинические результаты включают одно или более чем одно из следующего: увеличение клиренса LDL и уменьшение заболеваемости, или уменьшение интенсивности нарушений уровней холестерина и/или липопротеинов, возникающих из-за метаболических расстройств и/или расстройств питания, или включающих семейную гиперхолестеринемию, атерогенную дислипидемию, атеросклероз, ACS и, в более общем случае, сердечнососудистое заболевание (CVD), но не ограничиваются ими.
«Уменьшение заболеваемости» означает любое уменьшение тяжести, которое может включать уменьшение потребности в и/или количества (например, воздействия) других лекарственных средств и/или терапий, обычно используемых для данного состояния. Как понятно специалистам в данной области, индивидуумы могут отличаться в отношении их ответа на лечение, и, например, «способ уменьшения заболеваемости», как таковой, отражает введение антагонистического антитела против PCSK9, основанное на мотивированном ожидании, что такое введение вероятно может вызвать такое уменьшение заболеваемости у данного конкретного индивидуума.
Термин «уменьшение интенсивности» означает ослабление или улучшение одного или более чем одного симптома по сравнению с отсутствием введения антагонистического антитела против PCSK9. Термин «уменьшение интенсивности» также включает сокращение или уменьшение продолжительности симптома.
Термин «эффективная дозировка» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции в том виде, как он здесь используется, представляет собой достаточное количество для получения любого одного или более чем одного полезного или желательного результата. Для профилактического применения полезные или желательные результаты включают устранение или уменьшение риска, уменьшение тяжести или задержку начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, представленные во время развития заболевания. Для терапевтического применения полезные или желательные результаты включают такие клинические результаты как уменьшение гиперхолестеринемии или одного или более чем одного симптома дислипидемии, атеросклероза, сердечно-сосудистого заболевания или коронарного заболевания сердца, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства и/или задержку развития заболевания пациентов. Эффективную дозировку можно вводить за одно или более чем одно введение. Для целей данного изобретения эффективная дозировка лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения либо непосредственно, либо опосредованно. Как понятно в клиническом контексте, эффективная дозировка лекарственного средства, соединения или фармацевтической композиции может или не может достигаться в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективная дозировка» может рассматриваться в контексте введения одного или более чем одного терапевтического агента, и один агент может считаться дающимся в эффективном количестве, если, в сочетании с одним или более чем одним другим агентом, может иметь место или достигаться желательный результат.
«Индивидуум» или «субъект» представляет собой млекопитающее, более предпочтительно - человека. Млекопитающие также включают сельскохозяйственных животных, спортивных животных, домашних животных, приматов, лошадей, собак, кошек, мышей и крыс, но не ограничиваются ими.
Термин «вектор» в том виде, как он здесь используется, означает конструкцию, которая способна доставлять и предпочтительно экспрессировать один или более чем один интересующий ген или последовательность в клетке-хозяине. Примеры векторов включают вирусные векторы, экспрессионные векторы на основе голой ДНК или РНК, плазмидные, космидные или фаговые векторы, экспрессионные векторы на основе ДНК или РНК, ассоциированные с катионными конденсирующими агентами, экспрессионные векторы на основе ДНК или РНК, инкапсулированные в липосомы, и определенные эукариотические клетки, такие как клетки-продуценты, но не ограничиваются ими.
Термин «последовательность контроля экспрессии» в том виде, как он здесь используется, означает последовательность нуклеиновой кислоты, которая управляет транскрипцией нуклеиновой кислоты. Последовательность контроля экспрессии может представлять собой промотор, такой как конститутивный или индуцибельный промотор, или энхансер. Последовательность контроля экспрессии функционально связана с последовательностью нуклеиновой кислоты, подлежащей транскрипции.
Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» в том виде, как он здесь используется, включает любое вещество, которое, при объединении с активным ингредиентом, обеспечивает сохранение ингредиентом биологической активности и не вызывает реакцию иммунной системы субъекта. Примеры включают любые стандартные фармацевтические носители, такие как фосфатно-солевой буферный раствор, вода, водномаслянная эмульсия и разные типы увлажнителей, но не ограничиваются ими. Предпочтительные разбавители для аэрозольного или парентерального введения представляют собой фосфатно-солевой буферный раствор (PBS) или нормальный (0,9%-ный) физиологический раствор. Композиции, содержащие такие носители, готовят хорошо известными традиционными способами (см., например, Remington′s Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990 и Remington, The Science and Practice of Pharmacy, 20th Ed., Mack Publishing, 2000).
Термин «kon» в том виде, как он здесь используется, относится к константе скорости для ассоциации антитела с антигеном. Конкретно константы скорости (Ron и koff) и равновесные константы диссоциации измеряют с использованием Fab фрагментов антител (т.е. одновалентных) и PCSK9.
Термин «koff» в том виде, как он здесь используется, относится к константе скорости для диссоциации антитела от комплекса антитело/антиген.
Термин «kD» в том виде, как он здесь используется, относится к равновесной константе диссоциации взаимодействия антитело-антиген.
Приведенная здесь ссылка на значение или параметр, которому предшествует слово «примерно», включает (и описывает) воплощения, которые направлены на данное значение или параметр как таковой. Например, описание, относящееся к «примерно X», включает описание «X». Числовые интервалы включают числа, определяющие интервал.
Понятно, что всякий раз, когда воплощения описываются здесь с выражением «содержащий», также приводятся аналогичные в иных отношениях воплощения, описываемые в терминах «состоящий из» и/или «по существу состоящий из».
Когда аспекты или воплощения изобретения описаны в терминах группы Маркуша или других групп альтернативных вариантов, настоящее изобретение охватывает не только всю группу, перечисленную целиком, но и каждого члена группы индивидуально и все возможные подгруппы главной группы, но также и главную группу, за исключением одного или более чем одного члена группы. В настоящем изобретении также рассматривается прямо выраженное исключение одного или более чем одного любого члена группы в заявленном изобретении.
Если не определено иначе, все использованные здесь технические и научные термины имеют такое же значение, которое обычно понятно обычному специалисту в области, которой принадлежит данное изобретение. Здесь описаны типичные методы и материалы, несмотря на то, что в воплощении на практике или тестировании настоящего изобретения также можно использовать методы и материалы, аналогичные или эквивалентные тем, которые здесь описаны. Все публикации и другие упомянутые здесь ссылки являются включенными посредством ссылки во всей их полноте. В случае конфликта, настоящее описание, включая определения, будет иметь преимущество. Несмотря на то, что здесь процитирован ряд документов, данное цитирование не является допущением того, что любой из этих документов формирует часть обычного общего знания в данной области. Будет понятно, что во всем данном описании и формуле изобретения слово «содержать» или вариации, такие как «содержит» или «содержащий», подразумевает включение заявленного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Если контекст не требует иного, термины в единственном числе будут включать множественное число, и термины во множественном числе будут включать единственное число. Данные материалы, методы и примеры являются лишь иллюстративными, и подразумевается, что они не являются ограничивающими.
Опубликованная информация, относящаяся к антителам против PCSK9, включает следующие опубликованные заявки: РСТ/1 В2009/053990, опубликованную 18 марта 2010 года в виде WO 2010/029513, и заявку на патент США №12/558312, опубликованную 18 марта 2010 года в виде US 2010/0068199, каждая из которых включена сюда посредством ссылки во всей ее полноте.
Лечение антителами против PCSK9
Здесь предложены терапевтические схемы для лечения расстройств, характеризующихся заметными увеличениями уровня частиц LDL в плазме. Рассматриваемые терапевтические схемы включают введение антагонистического антитела против PCSK9. В некоторых воплощениях рассматриваемые терапевтические схемы включают введение антагонистического антитела против PCSK9 пациенту, который получал стабильные дозы статина. Согласно описанным здесь терапевтическим схемам предложено эффективное количество антагонистического антитела против PCSK9, которое оказывает антагонистический эффект на PCSK9 в системе кровообращения, для применения при лечении или предупреждении гиперхолестеринемии и/или по меньшей мере одного симптома дислипидемии, атеросклероза, сердечно-сосудистого заболевания, острого коронарного синдрома (ACS) или коронарной болезни сердца у индивидуума.
Описанные здесь терапевтические схемы преимущественно приводят к существенному и долговременному снижению LDL-C. Предпочтительно уровень холестерина в крови и/или уровень LDL в крови по меньшей мере примерно на 10% или 15% ниже, чем до введения. Более предпочтительно уровень холестерина в крови и/или уровень LDL в крови по меньшей мере примерно на 20, 30, 40, 50, 60, 70 или 80% ниже, чем до введения антитела.
Схемы дозирования
В некоторых воплощениях схема дозировки включает введение начальной дозы примерно 2 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 2 мг/кг каждые 4 недели. В других воплощениях схема дозировки включает введение начальной дозы примерно 4 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 4 мг/кг каждые 4 недели. В других воплощениях схема дозировки включает введение начальной дозы примерно 4 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 4 мг/кг каждые 8 недель. В других воплощениях схема дозировки включает введение начальной дозы примерно 8 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 8 мг/кг каждые 8 недель. В других воплощениях схема дозировки включает введение начальной дозы примерно 12 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 12 мг/кг каждые 8 недель.
В других воплощениях схема дозировки включает введение еженедельной дозы примерно 0,25 мг/кг антитела против PCSK9. В других воплощениях схема дозировки включает введение еженедельной дозы примерно 0,5 мг/кг антитела против PCSK9. В других воплощениях схема дозировки включает введение еженедельной дозы примерно 1 мг/кг антитела против PCSK9. В других воплощениях схема дозировки включает введение еженедельной дозы примерно 1,5 мг/кг антитела против PCSK9.
Однако полезными могут быть другие схемы дозировки, в зависимости от картины фармакокинетического затухания, которой желает добиться практик. Прогресс данной терапии легко отслеживается традиционными методиками и анализами. В предпочтительных воплощениях начальная доза и первая последующая и дополнительные последующие дозы отделены во времени друг от друга по меньшей мере четырьмя неделями. Схема дозировки (включая используемый(-ые) антагонист(-ы) PCSK9) может варьировать во времени.
Обычно для введения антител против PCSK9 начальная подходящая дозировка может составлять от примерно 0,3 мг/кг до примерно 18 мг/кг антагонистического антитела против PCSK9. Для цели настоящего изобретения типичная дозировка может варьировать от примерно любого значения от примерно 3 мкг/кг до 30 мкг/кг, до 300 мкг/кг, до 3 мг/кг, до 30 мг/кг, до 100 мг/кг или более, в зависимости от вышеупомянутых факторов. Например, можно использовать дозировку примерно 0,3 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 1,5 мг/кг, примерно 2 мг/кг, примерно 2,5 мг/кг, примерно 3 мг/кг, примерно 3,5 мг/кг, примерно 4 мг/кг, примерно 4,5 мг/кг, примерно 5 мг/кг, примерно 5,5 мг/кг, примерно 6 мг/кг, примерно 6,5 мг/кг, примерно 7 мг/кг, примерно 7,5 мг/кг, примерно 8 мг/кг, примерно 8,5 мг/кг, примерно 9 мг/кг, примерно 9,5 мг/кг, примерно 10 мг/кг, примерно 10,5 мг/кг, примерно 11 мг/кг, примерно 11,5 мг/кг, примерно 12 мг/кг, примерно 12,5 мг/кг, примерно 13 мг/кг, примерно 13,5 мг/кг, примерно 14 мг/кг, примерно 14,5 мг/кг, примерно 15 мг/кг, примерно 15,5 мг/кг, примерно 16 мг/кг, примерно 16,5 мг/кг, примерно 17 мг/кг, примерно 17,5 мг/кг, примерно 18 мг/кг, примерно 18,5 мг/кг, примерно 19 мг/кг, примерно 19,5 мг/кг, примерно 20 мг/кг, примерно 20,5 мг/кг, примерно 21 мг/кг, примерно 21,5 мг/кг, примерно 22 мг/кг, примерно 22,5 мг/кг, примерно 23 мг/кг, примерно 23,5 мг/кг, примерно 24 мг/кг, примерно 24,5 мг/кг и примерно 25 мг/кг. Для повторных введений в течение нескольких суток или дольше, в зависимости от состояния, лечение продолжают, пока не происходит желательное подавление симптомов, или пока не достигаются достаточные терапевтические уровни, например, для снижения уровней LDL в крови.
Типичная схема дозировки включает введение начальной дозы примерно 0,25 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 1,5 мг/кг, примерно 2 мг/кг, примерно 2,5 мг/кг, примерно 3 мг/кг, примерно 4 мг/кг, примерно 5 мг/кг, примерно 6 мг/кг, примерно 7 мг/кг, примерно 8 мг/кг, примерно 9 мг/кг, примерно 10 мг/кг, примерно 11 мг/кг, примерно 12 мг/кг, примерно 13 мг/кг, примерно 14 мг/кг, примерно 15 мг/кг, примерно 16 мг/кг, примерно 17 мг/кг или примерно 18 мг/кг, с последующей поддерживающей дозой примерно 0,25 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 1,5 мг/кг, примерно 2 мг/кг, примерно 2,5 мг/кг, примерно 3 мг/кг, примерно 4 мг/кг, примерно 5 мг/кг, примерно 6 мг/кг, примерно 7 мг/кг, примерно 8 мг/кг, примерно 9 мг/кг, примерно 10 мг/кг, примерно 11 мг/кг, примерно 12 мг/кг, примерно 13 мг/кг, примерно 14 мг/кг, примерно 15 мг/кг, примерно 16 мг/кг, примерно 17 мг/кг или примерно 18 мг/кг антитела против PCSK9. В некоторых воплощениях поддерживающую дозу вводят еженедельно. В некоторых воплощениях поддерживающую дозу вводят через неделю. В некоторых воплощениях поддерживающую дозу вводят примерно каждые три недели. В некоторых воплощениях поддерживающую дозу вводят примерно каждые четыре недели. В некоторых воплощениях поддерживающую дозу вводят примерно каждые пять недель. В некоторых воплощениях поддерживающую дозу вводят примерно каждые шесть недель. В некоторых воплощениях поддерживающую дозу вводят примерно каждые семь недель. В некоторых воплощениях поддерживающую дозу вводят примерно каждые восемь недель. В предпочтительных воплощениях начальная доза и первая последующая и дополнительные последующие дозы отделены во времени друг от друга по меньшей мере примерно четырьмя неделями. В некоторых воплощениях поддерживающую дозу вводят ежемесячно.
В других воплощениях можно использовать фиксированную дозу. Например, можно использовать дозу антагонистического антитела против PCSK9 примерно 0,25 мг, примерно 0,3 мг, примерно 0,5 мг, примерно 1 мг, примерно 1,5 мг, примерно 2 мг, примерно 2,5 мг, примерно 3 мг, примерно 4 мг, примерно 5 мг, примерно 6 мг, примерно 7 мг, примерно 8 мг, примерно 9 мг, примерно 10 мг, примерно 11 мг, примерно 12 мг, примерно 13 мг, примерно 14 мг, примерно 15 мг, примерно 16 мг, примерно 17 мг, примерно 18 мг, примерно 19 мг, примерно 20 мг, примерно 21 мг, примерно 22 мг, примерно 23 мг, примерно 24 мг, примерно 25 мг, примерно 26 мг, примерно 27 мг, примерно 28 мг, примерно 29 мг, примерно 30 мг, примерно 31 мг, примерно 32 мг, примерно 33 мг, примерно 34 мг, примерно 35 мг, примерно 36 мг, примерно 37 мг, примерно 38 мг, примерно 39 мг, примерно 40 мг, примерно 41 мг, примерно 42 мг, примерно 43 мг, примерно 44 мг, примерно 45 мг, примерно 46 мг, примерно 47 мг, примерно 48 мг, примерно 49 мг, примерно 50 мг, примерно 51 мг, примерно 52 мг, примерно 53 мг, примерно 54 мг, примерно 55 мг, примерно 56 мг, примерно 57 мг, примерно 58 мг, примерно 59 мг, примерно 60 мг, примерно 61 мг, примерно 62 мг, примерно 63 мг, примерно 64 мг, примерно 65 мг, примерно 66 мг, примерно 67 мг, примерно 68 мг, примерно 69 мг, примерно 70 мг, примерно 71 мг, примерно 72 мг, примерно 73 мг, примерно 74 мг, примерно 75 мг, примерно 76 мг, примерно 77 мг, примерно 78 мг, примерно 79 мг, примерно 80 мг, примерно 81 мг, примерно 82 мг, примерно 83 мг, примерно 84 мг, примерно 85 мг, примерно 86 мг, примерно 87 мг, примерно 88 мг, примерно 89 мг, примерно 90 мг, примерно 91 мг, примерно 92 мг, примерно 93 мг, примерно 94 мг, примерно 95 мг, примерно 96 мг, примерно 97 мг, примерно 98 мг, примерно 99 мг, примерно 100 мг, примерно 101 мг, примерно 102 мг, примерно 103 мг, примерно 104 мг, примерно 105 мг, примерно 106 мг, примерно 107 мг, примерно 108 мг, примерно 109 мг, примерно 110 мг, примерно 111 мг, примерно 112 мг, примерно 113 мг, примерно 114 мг, примерно 115 мг, примерно 116 мг, примерно 117 мг, примерно 118 мг, примерно 119 мг, примерно 120 мг, примерно 121 мг, примерно 122 мг, примерно 123 мг, примерно 124 мг, примерно 125 мг, примерно 126 мг, примерно 127 мг, примерно 128 мг, примерно 129 мг, примерно 130 мг, примерно 131 мг, примерно 132 мг, примерно 133 мг, примерно 134 мг, примерно 135 мг, примерно 136 мг, примерно 137 мг, примерно 138 мг, примерно 139 мг, примерно 140 мг, примерно 141 мг, примерно 142 мг, примерно 143 мг, примерно 144 мг, примерно 145 мг, примерно 146 мг, примерно 147 мг, примерно 148 мг, примерно 149 мг, примерно 150 мг, примерно 151 мг, примерно 152 мг, примерно 153 мг, примерно 154 мг, примерно 155 мг, примерно 156 мг, примерно 157 мг, примерно 158 мг, примерно 159 мг, примерно 160 мг, примерно 161 мг, примерно 162 мг, примерно 163 мг, примерно 164 мг, примерно 165 мг, примерно 166 мг, примерно 167 мг, примерно 168 мг, примерно 169 мг, примерно 170 мг, примерно 171 мг, примерно 172 мг, примерно 173 мг, примерно 174 мг, примерно 175 мг, примерно 176 мг, примерно 177 мг, примерно 178 мг, примерно 179 мг, примерно 180 мг, примерно 181 мг, примерно 182 мг, примерно 183 мг, примерно 184 мг, примерно 185 мг, примерно 186 мг, примерно 187 мг, примерно 188 мг, примерно 189 мг, примерно 190 мг, примерно 191 мг, примерно 192 мг, примерно 193 мг, примерно 194 мг, примерно 195 мг, примерно 196 мг, примерно 197 мг, примерно 198 мг, примерно 199 мг, примерно 200 мг, примерно 250, примерно 300, примерно 350, примерно 400, примерно 450 или примерно 500 мг. В некоторых воплощениях фиксированные дозы вводят подкожно или внутривенно.
Антагонистические антитела против PCSK9 можно вводить индивидууму, получающему стабильные дозы статина, согласно одной или более чем одной описанной здесь схеме дозировки. Стабильные дозы могут представлять собой, например, без ограничения, ежесуточную дозу статина или дозу, вводимую через сутки. Специалистам в данной области известно множество статинов, и они включают, например, без ограничения, аторвастатин, симвастатин, ловастатин, правастатин, розувастатин, флувастатин, церивастатин, мевастатин, питавастатин и комбинированные терапии статинами. Неограничивающие примеры комбинированных терапий статинами включают аторвастатин плюс амлодипин (CADUET™), симвастатин плюс эзетимиб (VYTORIN™), ловастатин плюс ниацин (ADVICOR™) и симвастатин плюс ниацин (SIMCOR™).
В некоторых воплощениях индивидуум получал стабильные дозы статина в течение по меньшей мере одной, двух, трех, четырех, пяти или шести недель до введения начальной дозы антагонистического антитела против PCSK9. Предпочтительно индивидуум, получающий стабильные дозы статина, имеет уровень LDL-C натощак больше чем или равный примерно 70 мг/дл до введения начальной дозы антагонистического антитела против PCSK9. В некоторых воплощениях индивидуум, получающий стабильные дозы статина, имеет уровень LDL-C натощак больше чем или равный примерно 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мг/дл до введения начальной дозы антагонистического антитела против PCSK9.
Для цели настоящего изобретения типичная доза статина может варьировать от примерно 1 мг до примерно 80 мг, в зависимости от вышеупомянутых факторов. Например, можно использовать дозу статина примерно 0,3 мг, примерно 0,5 мг, примерно 1 мг, примерно 2,5 мг, примерно 3 мг, примерно 4 мг, примерно 5 мг, примерно 6 мг, примерно 7 мг, примерно 8 мг, примерно 9 мг, примерно 10 мг, примерно 11 мг, примерно 12 мг, примерно 13 мг, примерно 14 мг, примерно 15 мг, примерно 16 мг, примерно 17 мг, примерно 18 мг, примерно 19 мг, примерно 20 мг, примерно 21 мг, примерно 22 мг, примерно 23 мг, примерно 24 мг, примерно 25 мг, примерно 26 мг, примерно 27 мг, примерно 28 мг, примерно 29 мг, примерно 30 мг, примерно 31 мг, примерно 32 мг, примерно 33 мг, примерно 34 мг, примерно 35 мг, примерно 36 мг, примерно 37 мг, примерно 38 мг, примерно 39 мг, примерно 40 мг, примерно 41 мг, примерно 42 мг, примерно 43 мг, примерно 44 мг, примерно 45 мг, примерно 46 мг, примерно 47 мг, примерно 48 мг, примерно 49 мг, примерно 50 мг, примерно 51 мг, примерно 52 мг, примерно 53 мг, примерно 54 мг, примерно 55 мг, примерно 56 мг, примерно 57 мг, примерно 58 мг, примерно 59 мг, примерно 60 мг, примерно 61 мг, примерно 62 мг, примерно 63 мг, примерно 64 мг, примерно 65 мг, примерно 66 мг, примерно 67 мг, примерно 68 мг, примерно 69 мг, примерно 70 мг, примерно 71 мг, примерно 72 мг, примерно 73 мг, примерно 74 мг, примерно 75 мг, примерно 76 мг, примерно 77 мг, примерно 78 мг, примерно 79 мг или примерно 80 мг.
В предпочтительных воплощениях используют дозу аторвастатина 40 мг или 80 мг. В других воплощениях используют дозу розувастатина 20 мг или 40 мг. В других воплощениях используют дозу симвастатина 40 мг или 80 мг.
В некоторых воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 2 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 2 мг/кг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 3 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 3 мг/кг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 4 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 4 мг/кг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 5 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 5 мг/кг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 4 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 4 мг/кг каждые 8 недель. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 6 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 6 мг/кг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 8 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 8 мг/кг каждые 8 недель. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 12 мг/кг антитела против PCSK9, с последующей поддерживающей дозой примерно 12 мг/кг каждые 8 недель.
В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 200 мг антитела против PCSK9 подкожно, с последующей поддерживающей дозой примерно 200 мг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 300 мг антитела против PCSK9, с последующей поддерживающей дозой примерно 300 мг примерно каждые 4 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 50 мг антитела против PCSK9, с последующей поддерживающей дозой примерно 50 мг примерно каждые 2 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 100 мг антитела против PCSK9, с последующей поддерживающей дозой примерно 100 мг примерно каждые 2 недели. В других воплощениях схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 150 мг антитела против PCSK9, с последующей поддерживающей дозой примерно 150 мг примерно каждые 2 недели.
Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 0,25 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 0,25 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 0,5 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 0,5 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 1 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 1 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 1,5 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 1,5 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 2 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 2 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 3 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 4 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 4 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 5 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 5 мг/кг антагонистического антитела против PCSK9. Другая типичная схема дозировки включает введение субъекту, получающему стабильные дозы статина, начальной дозы примерно 6 мг/кг антагонистического антитела против PCSK9. В некоторых воплощениях схема дозировки дополнительно включает введение ежемесячной поддерживающей дозы примерно 6 мг/кг антагонистического антитела против PCSK9.
Однако полезными могут быть другие схемы дозировки, в зависимости от картины фармакокинетического затухания, которой желает добиться практик. Прогресс данной терапии легко отслеживается традиционными методиками и анализами. В предпочтительных воплощениях начальная доза и первая последующая и дополнительные последующие дозы отделены друг от друга во времени по меньшей мере четырьмя неделями. Схема дозировки (включая используемый (-ые) антагонист (-ы) PCSK9) может варьировать во времени.
Антагонистические антитела против PCSK9
Следует описание относительно типичной методики получения антител, используемых согласно настоящему изобретению. Антиген PCSK9, подлежащий применению для получения антител, может представлять собой, например, полноразмерный человеческий PCSK9, полноразмерный мышиный PCSK9 и различные пептидные фрагменты PCSK9. Другие формы PCSK9, полезные для получения антител, будут очевидными специалистам в данной области.
Моноклональные антитела получали иммунизированием мышей с нуль-мутацией по PCSK9 рекомбинантным полноразмерным белком PCSK9. Этот способ получения антител давал антагонистические антитела, которые демонстрируют полное блокирование связывания PCSK9 с LDL-R, полное блокирование PCSK9-опосредованного снижения уровней LDL-R в клетках Huh7 и снижение уровней холестерина LDL in vivo у мышей до уровней, сравнимых с уровнем, наблюдаемым у PCSK9 -/- мышей, как показано в Примере 7 заявки на патент США №12/558312.
Как будет понятно, антитела для применения в настоящем изобретении могут быть получены из гибридом, но также могут экспрессироваться в линиях клеток, отличных от гибридом. Последовательности, кодирующие кДНК или геномные клоны конкретных антител, можно использовать для трансформации подходящих клеток-хозяев млекопитающих или не млекопитающих. Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии, хорошо известны в данной области и включают многие иммортализованные линии клеток, доступные из Американской коллекции типовых культур (АТСС), включая клетки яичника китайского хомяка (СНО), NSO, клетки HeLa, клетки почки новорожденного хомяка (ВНК), клетки почки обезьяны (COS) и клетки человеческой печеночно-клеточной карциномы (например, Нер G6). Также можно использовать клетки не млекопитающих, включая бактериальные, дрожжевые клетки, клетки насекомых и растительные клетки. Может быть предпочтительным сайт-направленный мутагенез домена СН6 антитела для устранения гликозилирования для того, чтобы предотвратить изменения или в иммуногенности, фармакокинетике, и/или в эффекторных функциях, возникающих в результате гликозилирования не по человеческому типу. Глутаминсинтазная система экспрессии обсуждается целиком или частично в связи с европейскими патентами 616846, 656055 и 363997, и европейской патентной заявкой 89303964.4. Кроме того, для получения антитела может быть использована дигидрофолатредуктазная (DHFR) экспрессионная система, включая системы, известные в данной области.
В некоторых воплощениях изобретение применяют с использованием антагонистического антитела L1L3 против PCSK9. В некоторых воплощениях изобретение применяют с использованием антитела, которое распознает эпитоп PCSK9, который является таким же, что и эпитоп, который распознается антителом L1L3.
В некоторых воплощениях изобретение применяют с использованием антитела, содержащего три CDR из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO:11, и три CDR из вариабельной области легкой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO:12.
В некоторых воплощениях изобретение применяют с использованием антитела, которое специфично связывается с PCSK9, содержащего область один, определяющую комплементарность (CDR1) VH, имеющую аминокислотную последовательность, показанную в SEQ ID NO:2 (SYYMH), SEQ ID NO:13 (GYTFTSY) или SEQ ID NO:14 (GYTFTSYYMH); CDR2 VH, имеющую аминокислотную последовательность, показанную в SEQ ID NO:3 (EISPFGGRTNYNEKFKS) или SEQ ID NO:15 (ISPFGGR), и/или CDR3 VH, имеющую аминокислотную последовательность, показанную в SEQ ID NO:4 (ERPLYASDL), или его варианта, имеющего одну или более чем одну консервативную аминокислотную замену в указанных последовательностях CDR1, CDR2 и/или CDR3, где вариант сохраняет по существу такую же специфичность связывания, что и CDR, определенная указанными последовательностями. Предпочтительно вариант содержит вплоть до примерно десяти аминокислотных замен и, более предпочтительно, вплоть до примерно четырех аминокислотных замен.
В некоторых воплощениях изобретение применяют с использованием антитела, содержащего CDR1 VL, имеющую аминокислотную последовательность, показанную в SEQ ID NO:5 (RASQGISSALA), CDR2, имеющую аминокислотную последовательность, показанную в SEQ ID NO:6 (SASYRYT), и/или CDR3, имеющую аминокислотную последовательность, показанную в SEQ ID NO:7 (QQRYSLWRT), или его варианта, имеющего одну или более чем одну консервативную аминокислотную замену в указанных последовательностях CDR1, CDR2 и/или CDR3, где вариант сохраняет по существу такую же специфичность связывания, что и CDR1, определенная указанными последовательностями. Предпочтительно вариант содержит вплоть до примерно десяти аминокислотных замен и, более предпочтительно, вплоть до примерно четырех аминокислотных замен.
В некоторых воплощениях изобретение применяют с использованием антитела, имеющего последовательность тяжелой цепи, содержащую или состоящую из SEQ ID NO:8 или 10, и последовательность легкой цепи, содержащую или состоящую из SEQ ID NO:9.
В некоторых воплощениях изобретение применяют с использованием антитела, имеющего вариабельную область тяжелой цепи, содержащую или состоящую из аминокислотной последовательности, показанной в SEQ ID NO:11, и вариабельную область легкой цепи, содержащую или состоящую из аминокислотной последовательности, показанной в SEQ ID NO:12.
В некоторых воплощениях изобретение применяют с использованием антитела, которое распознает эпитоп на человеческом PCSK9, содержащий аминокислотные остатки 153-155, 194, 195, 197, 237-239, 367, 369, 374-379 и 381 аминокислотной последовательности SEQ ID NO:1 PCSK9. Предпочтительно эпитоп антитела на человеческом PCSK9 не содержит один или более чем один из аминокислотных остатков 71, 72, 150-152, 187-192, 198-202, 212, 214-217, 220-226, 243, 255-258, 317, 318, 347-351, 372, 373, 380, 382 и 383 аминокислотной последовательности SEQ ID NO:1 PCSK9.
В некоторых воплощениях изобретение применяют с использованием антитела, которое распознает первый эпитоп PCSK9, который является тем же самым или перекрывается со вторым эпитопом, который распознается моноклональным антителом, выбранным из группы, состоящей из 5А10, которое продуцируется гибридомной линией клеток, депонированной в Американскую коллекцию типовых культур, и которой присвоен регистрационный номер РТА-8986; 4А5, которое продуцируется гибридомной линией клеток, депонированной в Американскую коллекцию типовых культур, и которой присвоен регистрационный номер РТА-8985; 6F6, которое продуцируется гибридомной линией клеток, депонированной в Американскую коллекцию типовых культур, и которой присвоен регистрационный номер РТА-8985, и 7D4, которое продуцируется гибридомной линией клеток, депонированной в Американскую коллекцию типовых культур, и которой присвоен регистрационный номер РТА-8983. В предпочтительных воплощениях изобретение применяют с использованием антагонистического антитела L1L3 против PCSK9 (см. PCT/IB2009/053990, опубликованную 18 марта 2010 года как WO 2010/029513, и заявку на патент США №12/558312, опубликованную 18 марта 2010 года как US 2010/0068199).
Предпочтительно вариант содержит вплоть до примерно двадцати аминокислотных замен и, более предпочтительно, вплоть до примерно восьми аминокислотных замен. Предпочтительно антитело кроме того содержит иммунологически инертную константную область, и/или антитело имеет изотип, который выбран из группы, состоящей из IgG2, 1964, IgG4, IgG2Δa, IgG4Δb, IgG4 S228P, IgG4Δb S228P и IgG4Δс S228P. В другом предпочтительном воплощении константная область представляет собой агликозилированную Fc.
Полезные в настоящем изобретении антитела могут охватывать моноклональные антитела, поликлональные антитела, фрагменты антител (например, Fab, Fab′, F(ab′)2, Fv, Fc и т.д.), химерные антитела, биспецифичные антитела, гетероконъюгатные антитела, одноцепочечные (ScFv), их мутанты, слитые белки, содержащие часть в виде антитела (например, доменного антитела), человеческие антитела, гуманизированные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена требующейся специфичности, включая варианты антител по гликозилированию, варианты антител по аминокислотной последовательности и ковалентно модифицированные антитела. Антитела могут быть мышиными, крысиными, человеческими или любого другого происхождения (включая химерные или гуманизированные антитела).
В некоторых воплощениях антагонистическое антитело против PCSK9 представляет собой моноклональное антитело. Антагонистическое антитело против PCSK9 также может быть гуманизированным. В других воплощениях антитело является человеческим.
В некоторых воплощениях антитело содержит модифицированную константную область, такую как иммунологически инертную константную область, то есть, имеющую пониженный потенциал для вызова иммунного ответа. В некоторых воплощениях константная область модифицирована, как описано в Eur. J. Immunol., 1999, 29:2613-2624; Публикация РСТ № WO 99/58572 и/или заявке на патент Великобритании №9809951.8. Fc может представлять собой Fc человеческого IgG2 или человеческого IgG4. Fc может представлять собой Fc человеческого IgG2, содержащую мутацию АЗЗОР331 до S330S331 (IgG2Δa), в которой аминокислотные остатки пронумерованы со ссылкой на последовательность IgG2 дикого типа (Eur. J. Immunol., 1999, 29:2613-2624). В некоторых воплощениях антитело содержит константную область lgG4, содержащую следующие мутации (Armour et al., 2003, Molecular Immunology 40 585-593): E233F234L235 до P233V234A235 (IgG4Δc), в которой нумерация осуществляется со ссылкой на lgG4 дикого типа. В еще одном другом воплощении, Fc представляет собой Fc человеческого IgG4 с мутациями E233F234L235 до P233V234A235 с делецией G236 (IgG4Δb). В другом воплощении, Fc представляет собой Fc любого человеческого IgG4 (IgG4, IgG4Δb или IgG4Δc), содержащую стабилизирующую мутацию шарнирной области S228 до Р228 (Aalberse et al., 2002, Immunology 105, 9-19). В другом воплощении Fc может представлять собой агликозилированную Fc.
В некоторых воплощениях константная область является агликозилированной посредством мутирования остатка присоединения олигосахарида (такого как Asn297) и/или фланкирования остатков в константной области, которые являются частью последовательности распознавания для гликозилирования. В некоторых воплощениях константная область является ферментативно агликозилированной в отношении N-связанного гликозилирования. Константная область может быть агликозилированной в отношении N-связанного гликозилирования ферментативно или посредством экспрессии в клетке-хозяине, дефицитной в отношении гликозилирования.
В некоторых воплощениях может присутствовать более чем одно антагонистическое антитело. Может присутствовать по меньшей мере одно, по меньшей мере два, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять или более разных антагонистических антител и/или пептидов. Обычно эти антагонистические антитела или пептиды против PCSK9 могут иметь дополняющие активности, которые не оказывают друг на друга негативного влияния. Антагонистическое антитело против PCSK9 также можно использовать в сочетании с другими антагонистами PCSK9 или антагонистами рецептора PCSK9. Например, можно использовать один или более чем один из следующих антагонистов PCSK9: антисмысловую молекулу, направленную на PCSK9 (включая антисмысловую молекулу, направленную на нуклеиновую кислоту, кодирующую PCSK9), соединение, ингибирующее PCSK9, и структурный аналог PCSK9. Антагонистическое антитело против PCSK9 также можно использовать в сочетании с другими агентами, которые служат для усиления и/или дополнения эффективности агентов.
Что касается всех описанных здесь способов, ссылка на антагонистические антитела против PCSK9 также включает композиции, содержащие один или более чем один дополнительный агент. Эти композиции, кроме того, могут содержать подходящие эксципиенты, такие как фармацевтически приемлемые эксципиенты, включающие буферы, которые хорошо известны в данной области. Настоящее изобретение можно использовать одно или в комбинации с другими традиционными способами лечения.
Антагонистическое антитело против PCSK9 можно вводить индивидууму посредством любого подходящего пути. Специалисту в данной области должно быть очевидно, что описанные здесь примеры не предназначены для ограничения изобретения каким-либо образом, а предназначены только для иллюстрирования доступных методик. Соответственно, в некоторых воплощениях антагонистическое антитело против PCSK9 вводят индивидууму согласно известным способам, таким как внутривенное введение, например, в виде болюса или посредством непрерывной инфузии в течение определенного периода времени, внутримышечным, внутрибрюшинным путем, в спинной мозг, чрескожным, подкожным, внутрисуставным, подъязычным, внутриссиновиальным путем, посредством вдувания, подоболочечным, пероральным путем, посредством ингаляции или местным путем. Введение может быть системным, например, внутривенным введением, или локализованным. Полезными для введения являются имеющиеся в продаже небулайзеры для жидких композиций, включающие струйные небулайзеры и ультразвуковые небулайзеры. Жидкие композиции можно распылять непосредственно, и лиофилизированный порошок можно распылять после растворения. В качестве альтернативы, антагонистическое антитело против PCSK9 можно распылять с использованием фторуглеродной композиции и ингалятора с отмеренной дозой или ингалировать в виде лиофилизированного и размолотого порошка.
В одном воплощении антагонистическое антитело против PCSK9 вводят посредством методик сайтспецифичной или направленной местной доставки. Примеры методик сайтспецифичной или направленной местной доставки включают разные имплантируемые источники антагонистического антитела против PCSK9 в виде депо или катетеры для местной доставки, такие как инфузионные катетеры, постоянные катетеры или игольные катетеры, синтетические импланты, адвентициальные манжеты, шунты и стенты, и другие имплантируемые устройства, сайтспецифичные носители, прямое введение или прямое нанесение (см., например, публикацию РСТ № WO 00/53211 и патент США №5981568).
Для введения можно использовать разные композиции антагонистического антитела против PCSK9. В некоторых воплощениях антагонистическое антитело против PCSK9 можно вводить в чистом виде. В некоторых воплощениях антагонистическое антитело против PCSK9 и фармацевтически приемлемый эксципиент могут находиться в разных композициях. Фармацевтически приемлемые эксципиенты известны в данной области и представляют собой относительно инертные вещества, которые облегчают введение фармакологически эффективного вещества. Например, эксципиент может придавать форму или консистенцию, или действовать в качестве разбавителя. Подходящие эксципиенты включают стабилизаторы, увлажнители и эмульгаторы, соли для изменения осмотичности, инкапсулирующие агенты, буферы и усилители проникновения через кожу, но не ограничиваются ими. Эксципиенты, а также композиции для парентеральной и не парентеральной доставки лекарственных средств изложены в Remington, The Science and Practice of Pharmacy, 20th Ed., Mack Publishing (2000).
Данные агенты можно объединять с фармацевтически приемлемыми носителями, такими как физиологический раствор, раствор Рингера, раствор декстрозы и тому подобное. Конкретная схема дозировки, то есть доза, расписание и повторность, будут зависеть от конкретного индивидуума и его медицинской истории.
Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и могут содержать буферы, такие как фосфатный, цитратный и на основе других органических кислот; соли, такие как хлорид натрия; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше чем из примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелаторы, такие как EDTA (этилендиаминтетрауксусная кислота); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как ион натрия; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Липосомы, содержащие антагонистическое антитело против PCSK9 получают способами, известными в данной области, такими как способы, описанные в Epstein, et al., 1985, Proc. Natl. Acad. Sci. USA 82:3688; Hwang, et al., 1980, Proc. Natl Acad. Sci. USA 77:4030 и патенты США №4485045 и 4544545. Липосомы с повышенным временем нахождения в системе кровообращения описаны в патенте США №5013556. Особенно полезные липосомы можно получать способом обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и дериватизированный PEG фосфатидилэтаноламин (PEG-PE). Липосомы экструдируют через фильтры с определенным размером пор с получением липосом желательного диаметра.
Активные ингредиенты также можно захватывать в микрокапсулах, полученных, например, методиками коацервации или полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозных или желатиновых микрокапсулах и в поли-(метилметакрилатных) микрокапсулах соответственно, в коллоидных системах доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие методики описаны в Remington, The Science and Practice of Pharmacy, 20th Ed., Mack Publishing (2000).
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело, которые находятся в виде формованных предметов, например пленок или микрокапсул. Примеры матриц для замедленного высвобождения включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент США №3773919), сополимеры L-глутаминовой кислоты и 7-этил-L-глутамата, недеградирующий этилен-винилацетат, деградирующие сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и лейпролида ацетата), сахарозы ацетат изобутират и поли-D-(-)-3-гидроксимасляная кислота.
Композиции, подлежащие применению для введения in vivo, должны быть стерильными. Это легко осуществляется, например, фильтрованием через мембраны для стерилизующего фильтрования. Терапевтические композиции антагонистического антитела против PCSK9 обычно помещают в контейнер, имеющий стерильный порт доступа, например, в мешок с внутривенным раствором или во флакон, имеющий пробку, прокалываемую подкожной инъекционной иглой.
Подходящие эмульсии можно получать с использованием имеющихся в продаже эмульсий жиров, таких как Intralipid™, Liposyn™, Infonutrol™, Lipofundin™ и Lipiphysan™. Активный ингредиент может быть либо растворен в предварительно смешанной композиции эмульсии, либо, в качестве альтернативы, он может быть растворен в масле (например, в соевом масле, сафлоровом масле, хлопковом масле, кунжутном масле, кукурузном масле или миндальном масле), и эмульсия образуется при смешивании с фосфолипидом (например, с фосфолипидами яйца, фосфолипидами сои или лецитином сои) и водой. Будет понятно, что могут быть добавлены другие ингредиенты, например, глицерин или глюкоза, для корректировки тоничности эмульсии. Подходящие эмульсии будут типично содержать вплоть до 20% масла, например, от 5 до 20%. Эмульсия жира может содержать капельки жира, имеющие размер от 0,1 и 1,0 мкм, в частности 0,1 и 0,5 мкм, и иметь рН в интервале от 5,5 до 8,0.
Композиции эмульсии могут представлять собой композиции, полученные путем смешивания антагонистического антитела против PCSK9 с Intralipid™ или его компонентами (соевое масло, фосфолипиды яйца, глицерин и вода).
Композиции для ингаляции или вдувания включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях или их смесях и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые эксципиенты, как изложено выше. В некоторых воплощениях композиции вводят пероральным или назальным респираторным путем для местного или системного эффекта. Композиции в предпочтительно стерильных фармацевтически приемлемых растворителях могут распыляться посредством применения газов. Распыляемые растворы могут вдыхаться непосредственно из распыляющего устройства, или распыляющее устройство может быть присоединено к надеваемой на лицо маске, тенту или дыхательной установке с периодической подачей положительного давления. Композиции в виде раствора, суспензии или порошка можно вводить, предпочтительно перорально или назально, из устройств, которые доставляют композицию подходящим способом.
Полинуклеотиды, кодирующие вариабельные области тяжелой и легкой цепи антитела L1L3 были депонированы в Американскую коллекцию типовых культур (АТСС), 10801 University Boulevard, Manassas, VA 90110, США, 25 августа 2009 года. Депонированию полинуклеотида вариабельной области тяжелой цепи L1L3 был присвоен регистрационный номер АТСС РТА-10302, и депонированию полинуклеотида вариабельной области легкой цепи L1L3 был присвоен регистрационный номер АТСС РТА-10303. Депонирования были сделаны согласно положениям Будапештского соглашения по международному признанию депонирования микроорганизмов для цели патентной процедуры и регламентов на его основе (Будапештское соглашение). Это обеспечивает поддержание жизнеспособной депонированной культуры в течение 30 лет с даты депонирования. АТСС сделает доступным депонирование согласно условиям Будапештского соглашения и в соответствии с соглашением между Pfizer, Inc. и АТСС, которое гарантирует постоянную и неограниченную общедоступность потомства депонированной культуры при выдаче соответствующего патента США или при размещении в открытом публичном доступе любой патентной заявки США или иностранной патентной заявки, независимо от того, что происходит сначала, и гарантирует доступность потомства для того, кто определен комиссаром по патентам и торговым маркам США как обладающий правом на это согласно Разделу 122 Капитула 35 U.S.C. (Свод законов США) и правам комиссара согласно этому (включая Раздел 1.14 Капитула 37 C.F.R. (Свод федеральных правил США) с конкретной ссылкой на 886 OG 638).
Патентообладатель настоящей заявки согласен с тем, что если культура депонированных материалов погибнет или будут потеряна, или испорчена во время культивирования при подходящих условиях, материалы будут быстро заменены по уведомлению другими такими же материалами. Доступность депонированного материала не следует истолковывать как лицензию на воплощение данного изобретения на практике в нарушение прав, даруемых по распоряжению любого правительства согласно его патентным законам.
ПРИМЕРЫ
Подразумевается, что следующие примеры иллюстрируют способы и материалы по настоящему изобретению. Подходящие модификации и адаптации описанных условий и параметров, обычно встречающиеся в данной области, которые являются очевидными специалистам в данной области, находятся в пределах сущности и объема настоящего изобретения.
Пример 1: лечение гуманизированным антагонистическим антителом L1L3 против PCSK9 является эффективным для снижения уровней холестерина в сыворотке и холестерина LDL
Данный пример иллюстрирует эффективность гуманизированного антагонистического антитела L1L3 против PCSK9 в снижении уровней холестерина в сыворотке и холестерина LDL в животных моделях.
L1L3 представляет собой гуманизированное (меньше 5% мышиных остатков) моноклональное антитело, которое связывается с секретируемым PCSK9, эффективно предотвращает его понижающую регуляцию LDLR, приводя к улучшенному клиренсу LDL в сыворотке и снижению уровня LDL-C.
При введении 10 мг/кг L1L3 в виде одной внутрибрюшинной (в.б.) дозы мышам C57BL/6, которых кормили нормальной диетой (n равно 10), уровни холестерина в сыворотке снижались до 47 мг/дл (37%-ное снижение) по сравнении с 75 мг/дл у контролей, обработанных физиологическим раствором, через 48 часов после обработки и до 44 мг/дл (47%-ное снижение) по сравнению с 83 мг/дл у контрольных животных через 4 суток после обработки. Уровни холестерина в сыворотке восстанавливались до 69 мг/дл к суткам 7 после обработки.
L1L3 вводили в виде одной в.б. дозы в дозировке 0; 0,1; 1; 10 и 80 мг/кг (n равно 6 на группу) в эксперименте по ответу на дозу у крыс Спрага-Доули, которых кормили нормальной диетой. Уровни холестерина в сыворотке дозозависимо снижались с максимальным эффектом 50%, наблюдаемым при 10 и 80 мг/кг через 48 часов после дозировки. Продолжительность подавления уровней холестерина также была дозозависимой, варьируя от 1 до 21 суток. И величина, и продолжительность эффекта L1L3 на снижение уровня холестерина коррелировали с экспозицией лекарственного средства. Уровни триглицеридов в сыворотке не натощак также дозозависимо возрастали с максимальным приблизительно трехкратным увеличением при 80 мг/кг и динамикой, коррелирующей с экспозицией лекарственного средства. Поскольку аналогичные эффекты L1L3 на уровни триглицеридов в сыворотке не наблюдались у других видов, таких как мыши и приматы, не являющиеся человеком (см. ниже), и об изменениях уровней триглицеридов в крови не сообщалось у людей, имеющих мутации PCSK9 (Abifadel et al., 2003, Nat. Genet, 34:154-156; Cohen et al., 2005, Nat. Genet. 37:161-165; Zhao et al., 2006, Am. J. Hum. Genet. 79:514-523), увеличение уровней триглицеридов в сыворотке, вызванное обработкой L1L3, по-видимому, является видоспецифичным явлением у крыс.
У яванских макаков, которых кормили нормальной диетой, L1L3 вводили в виде одиночной в.в. дозы в дозировке 0,1, 1, 3 и 10 мг/кг (n равно 4 на группу). Введение 0,1 мг/кг L1L3 вызывало кратковременное 50%-ное снижение уровней LDL-C в сутки 2 и быстрое восстановление к суткам 5. Дозировка один (1) мг/кг достигала максимального эффекта в виде 71%-ного снижения LDL-C на сутки 5, и его уровень сразу после этого начинал восстанавливаться, достигая уровней до дозы к суткам 14. Дозировка три (3) мг/кг достигала максимального эффекта в виде 72%-ного снижения LDL-C к суткам 7, уровни начинали восстанавливаться к суткам 13 и восстанавливались до исходного уровня к суткам 22. Дозировка десять (10) мг/кг поддерживала 70%-ное снижение уровней LDL-C до суток 21 после дозировки, и уровень у животных полностью восстанавливался к суткам 31. И величина, и продолжительность эффекта снижения уровня LDL-C L1L3 коррелировали с экспозицией лекарственного средства. Обработка L1L3 не влияла на уровни HDL-C во всех группах дозировки.
Обезьянам в группе с дозировкой 3 мг/кг (n равно 4) также давали две дополнительные в.в. дозы 3 мг/кг L1L3 в сутки исследования 42 и 56 (разделенные 2 неделями). Эти две дополнительные дозы вновь снижали уровень LDL-C и поддерживали уровни LDL-C меньше чем 50% в течение 4 недель. Через две недели уровни LDL-C возвращались к норме. Уровни HDL-C в сыворотке оставались неизменными.
РК исследования проводили путем однократной болюсной в.в. инъекции 0,1, 1,0, 3,0, 10,0 и 100,0 мг/кг L1L3 у яванских макаков, и измеряли общую концентрацию антитела. Оценочный период полувыведения β-фазы для L1L3 составлял 0,67 суток при одной дозе 0,1 мг/кг и возрастал до 1,91, 2,33, 3,49 и 5,25 суток при 1,0, 3,0, 10,0 и 100,0 мг/кг соответственно. Таким образом, L1L3 у яванских макаков демонстрировало дозозависимое и нелинейное сокращение периода полувыведения, согласующееся с деградацией, опосредованной антигеном, и наблюдаемое у терапевтических средств на основе антител, имеющих мембраноассоциированные антигены.
В заключение, L1L3 связывается и оказывает антагонистический эффект на функцию PCSK9 в сыворотке, что приводит к быстрому и значимому снижению уровней холестерина в сыворотке и холестерина LDL в животных моделях.
Пример 2: фармакокинетика и фармакодинамика после одиночных. возрастающих, внутривенных доз антагонистического антитела L1L3 против PCSK9
Данный пример иллюстрирует пробное клиническое испытание для оценки фармакокинетики и фармакодинамики после одиночных, возрастающих, внутривенных доз гуманизированного антагонистического антитела L1L3 против PCSK9 у здоровых в иных отношениях человеческих субъектов, которые были кандидатами для терапии по снижению уровня холестерина. Введение L1L3 приводило к снижению LDL-C во всех оцененных группах дозировки.
Данное исследование подразумевало рандомизированное плацебо-контролируемое исследование с одной возрастающей дозой L1L3. От субъектов, исследователя и местного персонала (за исключением местного персонала, ответственного за приготовление лекарственного средства) были скрыты назначения лечения, как и для назначенных должностных лиц CRO (контрактная исследовательская организация); в то время как клиническая исследовательская команда спонсора не была скрытой. Исследование проводили в 6 запланированных когортах по 8 субъектов на когорту в попытке найти максимальную переносимую дозу или MTD (всего приблизительно 48 субъектов). В пределах каждой когорты субъектов рандомизировали в отношении L1L3 или плацебо (соотношение распределения 3:1). Дозы вводили после голодания в течение ночи в виде внутривенной инфузии в течение 60 минут. Скорости инфузии тщательно контролировали посредством инфузионного устройства согласно протоколу. Инфузии будут вводиться в виде одной инфузии в течение 60 минут.
Дозировка будет такой, как проиллюстрировано ниже в Таблице 1:
Плацебо
2
Плацебо
2
Плацебо
2
Плацебо
2
Плацебо
2
Плацебо
2
Схему дозировки корректировали для обеспечения введения меньших, промежуточных или больших доз с получением максимальной переносимой дозы и дозы, не дающей эффект. Каждый субъект, подключенный к исследованию, независимо от приписывания к когорте, на протяжении его участия в исследовании получал только одну дозу исследуемого лекарственного средства. За всеми пациентами вели наблюдение на предмет безопасности в течение еще 21 суток (всего 28 суток) до завершения исследования с ними.
Первичными ожидаемыми результатами РК исследования были auc(o-([последнее]), Tmax и Cmax L1L3. Вторичные ожидаемые результаты РК включали терминальный период полувыведения (Ti/2), клиренс (CL), объем в стационарном состоянии (Vss) и AUC(0-∞) L1L3. Оценивали изменения уровней липидов в сыворотке (общего холестерина, LDL, HDL, триглицеридов, не-HDL-C и апобелка В).
Скрининг происходил в пределах 28 суток с момента дозирования каждому субъекту. Субъекты получали одиночную дозу L1L3 в сутки 0 с ежесуточными оценками РК и безопасности на протяжении периода госпитализации (сутки исследования -1, 0 и 1), а также в сутки 4, 7, 14, 21, 28 и, в зависимости от исходных данных РК, - после суток 28.
Критерии включения для данного исследования были следующими: здоровые, находящиеся на амбулаторном наблюдении, мужчины и/или женщины (женщины будут представлять собой женщин неспособных к деторождению) в возрасте от 18 до 70 лет включительно; исходный уровень общего холестерина больше или равен 200 мг/дл, исходный уровень LDL больше или равен 130 мг/дл; индекс массы тела (BMI) составляет от 18,5 до 35 кг/м2, и масса тела меньше или равна 150 кг включительно; доказательство лично подписанного и датированного документа об информированном согласии, в котором указано то, что субъект (или законный представитель) был проинформирован обо всех относящихся к делу аспектах исследования; и желает и способен соблюдать план запланированных посещений, план лечения, лабораторных анализов и других процедур исследования.
Критериями исключения из исследования было следующее:
доказательство или история клинически значимого гематологического, почечного, эндокринного, легочного, желудочно-кишечного, сердечнососудистого, печеночного, психиатрического, неврологического или аллергического заболевания (включая аллергии на лекарственные средства, но исключая не подвергавшиеся лечению, асимптоматические, сезонные аллергии во время дозирования); вторичная гиперлипидемия; субъекты не должны были принимать другие прописанные лекарственные средства в течение по меньшей мере 1 недели до дозирования. Если пациенты получали лекарственные средства, понижающие уровень липидов, прием данных лекарственных средств должен был быть прерван на адекватный период времени для обеспечения возвращения уровней сывороточных липидов к уровням до обработки; история лихорадочного заболевания в пределах 5 суток до дозирования; история инсульта или кратковременного ишемического приступа; история инфаркта миокарда в пределах последнего года; положительный результат анализа мочи на выявление наркотиков; история регулярного потребления алкоголя, превышающего 7 выпивок в неделю для женщин или 14 выпивок в неделю для мужчин (1 выпивка равна 5 унциям (150 мл) вина или 12 унциям (360 мл) пива, или 1,5 унциям (45 мл) крепкого алкогольного напитка) в пределах 6 месяцев относительно времени проведения скрининга; обработка исследуемым лекарственным средством в пределах 30 суток или 5 периодов полувыведения (какой бы из них не был дольше), предшествующая первой дозе исследуемого лекарственного средства; ЭКГ (электрокардиограмма) в 12 отведениях, демонстрирующая при скрининге QTc больше 450 мс; беременные или кормящие грудью женщины; женщины, способные к деторождению; донорство крови в объеме приблизительно 1 пинта (500 мл) в пределах 56 суток до дозирования; история чувствительности к гепарину или индуцированная гепарином тромбоцитопения (если гепарин используется для промывки внутривенных катетеров); другое тяжелое острое или хроническое медицинское или психиатрическое состояние или лабораторное отклонение, которое может повышать риск, ассоциированный с участием в исследовании или с введением исследуемого продукта, или может мешать интерпретации результатов исследования и, по мнению исследователя, сделало бы субъекта не подходящим для вступления в данное исследование.
Субъектов рандомизировали в исследовании, при условии, что они удовлетворяли всем критериям для отбора субъектов. Для приписывания субъектам последовательностей обработки использовали схему рандомизации, генерированную компьютером.
В том, что касается увеличения дозы, решение о переходе к более высокой дозе L1L3 принималось спонсором и исследователем после обзора доступных данных по безопасности и переносимости от всех когорт субъектов, наблюдаемых в течение по меньшей мере 7 суток после введения предыдущего уровня дозы.
Лекарственный продукт L1L3 (100 мг) предоставляли в стерильной жидкой форме в концентрации 10 мг/мл в стеклянном флаконе для внутривенного (в.в.) введения с резиновой пробкой и алюминиевым колпачком. Каждый флакон содержал 10 мл (извлекаемый объем) L1L3 в концентрации 10 мг/мл и при рН 5,5. L1L3 и плацебо готовили согласно инструкциям по дозировке и введению в фармацевтическом руководстве, которое будет предоставлено в место исследования. Лекарственное средство было приготовлено квалифицированным местным персоналом не вслепую и распределено вслепую пациенту и персоналу, непосредственно проводящему исследование. L1L3 вводили посредством внутривенной инфузии с контролем скорости в течение приблизительно 60 минут согласно инструкциям по введению дозировки (DAI), находящимся в фармацевтическом руководстве и справочнике по исследовательской работе.
Протокол исследования
Сутки 1: Субъектам назначали случайный номер и госпитализировали в клиническое исследовательское отделение по меньшей мере за 12 часов до начала действий в сутки 0, и требовалось, чтобы они оставались в клиническом исследовательском отделении (CRU) до завершения процедур в сутки 1. Субъект начинал голодать вечером по меньшей мере за 10 часов до запланированного в сутки 0 получения липидограммы. Были выполнены следующие процедуры: проведен обзор изменений в истории болезни с момента скрининга; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; проведен обзор истории потребления наркотиков, алкоголя и табака с момента скрининга; были оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; физический осмотр, включающий взвешивание; скрининг на содержание наркотиков в моче; были получены основные показатели состояния организма субъекта, лежащего на спине; была получена ЭКГ в 12 отведениях с тройной повторностью с интервалами приблизительно 2-4 минуты.
Сутки 0: до дозирования были выполнены следующие процедуры:
получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не-HDL холестерина, АроВ и триглицеридов); отобраны образцы для стандартных и дополнительных лабораторных анализов: гематологии, химии, свертывания крови, амилазной активности, анализа мочи; отобран образец для анализа РК до введения дозы; отобран образец для определения уровней РС8К9/интересующих маркеров PD (фармакодинамика); отобран образец для определения антител против L1L3; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; были оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; получены основные показатели состояния организма субъекта, лежащего на спине; проведено инфузионное введение исследуемого лекарственного средства согласно инструкциям фармацевтического руководства.
После дозирования выполняли следующие процедуры: получали ЭКГ в 12 отведениях с тройной повторностью с интервалами приблизительно 2-4 минуты, начиная в пределах 10 минут с окончания инфузии (EOI); получали основные показатели состояния организма субъекта, лежащего на спине, в момент EOI; отбирали образец крови для РК (фармакокинетический) анализа в момент EOI и в следующие моменты времени после инфузии (т.е. EOI плюс следующие моменты времени): 60 минут, 120 мин и 360 мин.
Сутки 1: были выполнены следующие процедуры: отобран образец крови для РК анализа в 1440 мин (24 часа) плюс/минут 30 мин после дозы; проведен сокращенный физический осмотр; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов); отобран образец для определения уровней РСЗКЭ/интересующих маркеров PD; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине; произведена выписка из CRU.
Сутки 4: были выполнены следующие процедуры: отобраны образцы для стандартных лабораторных анализов: гематологии, химии, и анализа мочи; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов); отобран один образец крови для РК анализа; отобран образец для определения уровней РСЗКЭ/интересующих маркеров PD; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине.
Сутки 7: были выполнены следующие процедуры: проведен сокращенный физический осмотр; отобраны образцы для стандартных и дополнительных лабораторных анализов: гематологии, химии, свертывания крови, амилазной активности, анализа мочи; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не-HDL холестерина, АроВ и триглицеридов); отобран один образец крови для РК анализа; отобран образец для определения уровней РС8К9/интересующих маркеров PD; отобран образец для определения антител против L1L3; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; проведен обзор истории потребления наркотиков, алкоголя и табака с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине; получены ЭКГ в 12 отведениях с тройной повторностью с интервалами приблизительно 2-4 минуты.
Сутки 14: были выполнены следующие процедуры: проведен сокращенный физический осмотр; отобраны образцы для стандартных и дополнительных лабораторных анализов: гематологии, химии, свертывания крови, амилазной активности, анализа мочи; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов); отобран один образец крови для РК анализа; отобран образец для определения уровней PCSKQ/интересующих маркеров PD; отобран образец для определения антител против L1L3; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; проведен обзор истории потребления наркотиков, алкоголя и табака с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине.
Сутки 21: были выполнены следующие процедуры: проведен сокращенный физический осмотр; отобраны образцы для стандартных и дополнительных лабораторных анализов: гематологии, химии, свертывания крови, амилазной активности, анализа мочи; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов); отобран один образец крови для РК анализа; отобран образец для определения уровней РС8К9/интересующих маркеров PD; отобран образец для определения антител против L1L3; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; проведен обзор истории потребления наркотиков, алкоголя и табака с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине.
Сутки 28: были выполнены следующие процедуры: проведен полный физический осмотр; измерена масса тела субъекта; отобраны образцы для стандартных и дополнительных лабораторных анализов: гематологии, химии, свертывания крови, амилазной активности, анализа мочи; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов);
отобран один образец крови для РК анализа; отобран образец для определения уровней РСЗКЭ/интересующих маркеров PD; отобран образец для определения антител против L1L3; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; проведен обзор истории потребления наркотиков, алкоголя и табака с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине; получены ЭКГ в 12 отведениях с тройной повторностью с интервалами приблизительно 2-4 минуты.
Дополнительное последующее наблюдение для пролонгированной РК: были выполнены следующие процедуры, когда это применимо: проведен сокращенный физический осмотр; отобраны образцы для стандартных и дополнительных лабораторных анализов: гематологии, химии, свертывания крови, амилазной активности, анализа мочи; получен профиль липидов натощак после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов); отобран один образец крови для РК анализа; отобран образец для определения уровней РС8К9/интересующих маркеров PD; отобран образец для определения антител против L1L3; оценены симптомы посредством спонтанных сообщений о нежелательных явлениях и прося субъектов ответить на не наводящий вопрос, такой как «Как вы себя чувствуете?»; проведен обзор изменений в содержании сопутствующих лекарственных средств с момента скрининга; проведен обзор истории потребления наркотиков, алкоголя и табака с момента скрининга; получены основные показатели состояния организма субъекта, лежащего на спине; получены ЭКГ в 12 отведениях с тройной повторностью с интервалами приблизительно 2-4 минуты.
Общий объем отбираемых образцов крови для индивидуальных пациентов составлял приблизительно 183-210 мл. Образцы плазмы для анализа уровней L1L3 отбирали до дозирования в сутки 0, в момент завершения инфузии и в 60, 120, 360 и 1440 минут (24 часа) после завершения инфузии. Кроме того, одиночные образцы для РК анализа были получены в сутки 4, 7, 14, 21, 28 и во время дополнительного последующего посещения для отбора крови РК анализа (если это применимо). В каждый момент времени отбирали один образец.
Образцы крови для оценки уровней PCSK9 и других интересующих экспериментальных фармакодинамических маркеров были получены до дозы в сутки 0 и в сутки 1, 4, 7, 14, 21, 28 и во время дополнительного последующего посещения, если это применимо.
Получение профиля липидов натощак было проведено после по меньшей мере 10-часового голодания (общий уровень холестерина, LDL, HDL, не HDL холестерина, АроВ и триглицеридов).
Результаты исследования
Результаты РК NCA (фармакокинетический некомпартментный анализ) L1L3: медиана периода полувыведения L1L3, введенного в дозировке 0,3 мг/кг, составляла 2,71 суток. Медиана периода полувыведения L1L3, введенного в дозировке 1 мг/кг, составляла 4,77 суток. Медиана периода полувыведения L1L3, введенного в дозировке 3 мг/кг, составляла 8,1 суток. Медиана периода полувыведения L1L3, введенного в дозировке 6 мг/кг, составляла 7,75 суток. Медиана периода полувыведения L1L3, введенного в дозировке 12 мг/кг, составляла 12,24 суток. Медиана периода полувыведения L1L3, введенного в дозировке 18 мг/кг, составляла 11,76 суток. РК профили концентрации L1L3 относительно времени были многофазными и согласующимися с распределением лекарственного средства, опосредованным мишенью. Однако период полувыведения L1L3 у человеческих субъектов является неожиданно и значительно более продолжительным, чем период полувыведения L1L3 у яванских макаков (т.е. 1,91, 2,33, 3,49 и 5,25 суток при дозировке 1,0, 3,0, 10,0 и 100,0 мг/кг соответственно у яванских макаков (см. Пример 1)). Средняя скорость клиренса (CI) лекарственного средства для L1L3, введенного в дозировках 0,3, 1, 3, 6, 12 и 18 мг/кг, составляла 8,70, 6,58, 4,54, 4,33, 3,28 и 3,85 мл/сутки/кг соответственно. Результаты РК NCA из данного исследования обобщены в Таблице 2, приведенной ниже. В колонках 2-7 таблицы верхнее значение указывает среднее, и нижнее значение - медиану.
Обработка L1L3 приводила к существенному и долговременному дозозависимому снижению уровня LDL-холестерина (LDL-C) натощак. Профили LDL-C во времени показаны на ФИГ.1. Исходный уровень LDL-C натощак составлял приблизительно 145 мг/дл. В сутки 7 после дозирования уровни LDL-С у субъектов, обработанных одиночной дозой 0,3, 1, 3, 6, 12 или 18 мг/кг L1L3, составляли от 50 до 100 мг/дл. В отличие от этого, уровни LDL-C у субъектов, которым вводили плацебо, обычно оставались примерно на исходном уровне. К суткам 14 после дозирования уровни LDL-C у субъектов, обработанных 1, 3, 6, 12 или 18 мг/кг L1L3, составляли примерно 70 мг/дл или ниже. К суткам 14 после дозирования субъекты, обработанные 6 мг/кг или 12 мг/кг L1L3, имели уровни LDL-C примерно 55 мг/дл, и субъекты, обработанные 18 мг/кг L1L3, имели уровни LDL-C примерно 20 мг/дл. Уровни LDL-C у субъектов, обработанных одной дозой 12 мг/кг L1L3, оставались на уровне примерно 60 мг/дл или ниже этого значения по меньшей мере до примерно 57 суток после дозирования (конец исследования). Уровни LDL-C у субъектов, обработанных одной дозой 18 мг/кг L1L3, оставались на уровне ниже 50 мг/дл по меньшей мере до примерно 57 суток после дозирования. Уровни LDL-C у субъектов, обработанных одной дозой 6 мг/кг L1L3, оставались ниже 50 мг/дл в течение примерно 42 суток после дозирования и ниже 100 мг/дл по меньшей мере до примерно 57 суток после дозирования. Уровни LDL-C у субъектов, обработанных одной дозой 3 мг/кг L1L3, составляли примерно 70 мг/дл в сутки 14 после дозирования, примерно 60 мг/дл в сутки 21 после дозирования и оставались ниже 100 мг/дл до примерно 36 суток после дозирования. Уровни LDL-C у субъектов, обработанных одной дозой 1 мг/кг L1L3, составляли примерно 65 мг/дл в сутки 14 после дозирования и оставались ниже 100 мг/дл до примерно 21 суток после дозирования. Уровни LDL-C у субъектов, обработанных одной дозой 0,3 мг/кг L1L3, составляли примерно 85 мг/дл в сутки 7 после дозирования и оставались ниже 100 мг/дл до примерно 10 суток после дозирования.
Процентное изменение уровней LDL-C в крови натощак относительно исходного уровня показано на ФИГ.2 (данные показаны как среднее значение плюс/минус SE (стандартная ошибка)) и обобщены в Таблице 3, приведенной ниже. В данной таблице «N» указывает число субъектов, «среднее» указывает среднее процентное изменение относительно исходных уровней LDL-C натощак, и «РВО» обозначает плацебо.
LDL-C у субъектов, которым дозировали плацебо, обычно оставался на исходном уровне или превышал его, что указано как «0» на ФИГ.2. Как отмечено выше, исходный уровень LDL-C натощак составлял примерно 145 мг/дл. Введение 18 мг/кг L1L3 приводило к вплоть до примерно 83%-му изменению относительно исходного уровня (ФИГ.2). Одна доза 18 мг/кг L1L3 поддерживала уровни LDL-С более чем примерно на 65% меньшие относительно исходного уровня в течение вплоть до по меньшей мере 57 суток после введения. Одна доза 6 мг/кг или 12 мг/кг L1L3 поддерживала уровни LDL-С более чем примерно на 60% меньшие относительно исходного уровня вплоть до 43 суток после введения. Одна доза 3 мг/кг L1L3 поддерживала уровни LDL-С более чем примерно на 60% меньшие относительно исходного уровня вплоть до 29 суток после введения и более чем примерно на 20% меньшие относительно исходного уровня вплоть до 50 суток после введения.
Обработка L1L3 приводила к значительному и долговременному дозозависимому снижению общего уровня холестерина (ТС) натощак. Процентное изменение от исходного уровня уровней ТС в крови натощак показано на ФИГ.3 (показанные данные представляют собой среднее значение плюс/минус 2 SE). Исходный уровень ТС натощак составлял примерно 230 мг/дл; исходный уровень на ФИГ.3 указан как «0». Примерно к суткам 9 после дозирования уровни ТС у субъектов, которым дозировали одну дозу 12 или 18 мг/кг L1L3, снижались примерно на 30% относительно исходного уровня или более; эффект снижения уровня ТС длился по меньшей мере до суток 57 после дозирования (конец исследования). Уровни ТС у субъектов, которым дозировали одну дозу 6 мг/кг L1L3, снижались примерно на 30% относительно исходного уровня или более примерно к суткам 9 после дозирования до примерно суток 52 после дозирования. Уровни ТС у субъектов, которым дозировали одну дозу 3 мг/кг L1L3, снижались примерно на 30% относительно исходного уровня примерно к суткам 9 после дозирования и примерно на 40% относительно исходного уровня примерно к суткам 22 после дозирования. Уровни ТС у субъектов, которым дозировали одну дозу 3 мг/кг L1L3, снижались примерно на 40% относительно исходного уровня примерно к суткам 22 после дозирования. Уровни ТС у субъектов, которым дозировали одну дозу 1 мг/кг L1L3, снижались примерно на 36% относительно исходного уровня примерно к суткам 15 после дозирования. Уровни ТС у субъектов, которым дозировали одну дозу 0,3 мг/кг L1L3, снижались примерно на 25% примерно к суткам 9 после дозирования. К суткам 15 после дозирования многие субъекты имели уровни ТС, меньшие чем 50% относительно исходного уровня после дозирования одной дозы 12 или 18 мг/кг L1L3. К суткам 30 после дозирования многие субъекты имели уровни ТС, меньшие чем 50% относительно исходного уровня после дозирования одной дозы 6 мг/кг L1L3. Уровни ТС у субъектов, которым дозировали плацебо, оставались на исходном уровне или более чем на 2% ниже его на протяжении исследования.
Обработка L1L3 приводила к значительному и долговременному дозозависимому снижению уровня аполипопротеина В (аро В) натощак. Процентное изменение от исходного уровня уровней аро В в крови натощак показано на ФИГ.4. Показанные данные представляют собой средние значения плюс/минус 2 SE. Исходный уровень АроВ натощак составлял примерно 119 мг/дл; исходный уровень на ФИГ.4 показан как «О». Уровни АроВ у субъектов, которым дозировали плацебо, оставались примерно на исходном уровне на протяжении исследования. Уровни АроВ у субъектов, которым дозировали 12 или 18 мг/кг L1L3, снижались до примерно 50% относительно исходного уровня к суткам 14 и оставались на уровне, примерно на 50% меньшем или еще меньшем, чем исходный уровень в течение оставшейся части исследования. Уровни АроВ у субъектов, которым дозировали 6 мг/кг L1L3, снижались примерно на 40% относительно исходного уровня к суткам 14, примерно на 50% относительно исходного уровня к суткам 21 и обычно ниже примерно 30% относительно исходного уровня в течение оставшейся части исследования. Уровни АроВ у субъектов, которым дозировали 3 мг/кг L1L3, снижались примерно на 40% относительно исходного уровня к суткам 14, примерно на 50% относительно исходного уровня к суткам 28. Уровни АроВ у субъектов, которым дозировали 1 мг/кг L1L3, снижались примерно на 40% относительно исходного уровня к суткам 14. Уровни АроВ у субъектов, которым дозировали 0,3 мг/кг L1L3 снижались примерно на 25% относительно исходного уровня к суткам 7.
Как показано на ФИГ.5, уровни холестерина липопротеинов высокой плотности (HDL-C) значимо не изменялись после обработки L1L3. Данные, показанные на ФИГ.5, представляют собой средние значения плюс/минус 2 SE. Исходный уровень HDL-C натощак составлял примерно 49 мг/дл; исходный уровень на ФИГ.5 показан как «0». Уровни HDL-C у субъектов, которым дозировали плацебо, оставались примерно на исходном уровне на протяжении исследования. Уровни триглицеридов (TG) натощак оставались неизменными на протяжении исследования. Процентное изменение от исходного уровня уровней TG в крови натощак показано на ФИГ.6. Показанные данные представляют собой средние значения плюс/минус 2 SE. Исходный уровень TG натощак составлял примерно 173 мг/дл; исходный уровень на ФИГ.6 показан как «0».
В данном исследовании не возникали серьезные нежелательные явления, и не было субъектов, лечение которых было прервано из-за возникших во время лечения нежелательных явлений (ТЕАЕ). Большинство ТЕАЕ имели умеренную интенсивность; ни одно из них не было серьезным.
В заключение, введение L1L3 приводило к снижению уровня LDL-C во всех оценивавшихся группах дозировки. В общем, максимальное процентное снижение уровня LDL-C наблюдалось в измерениях, проведенных в сутки 15 или сутки 22. Эффекты снижения уровня наблюдали уже в сутки 3. Степень и продолжительность снижения уровня LDL-C были дозозависимыми. Данные результаты демонстрируют то, что L1L3 имеет большую продолжительность действия, т.е. с максимальным эффектом в течение 7 и 14 суток для доз 0,3 мг/кг и 1,0 мг/кг, соответственно, в течение вплоть до 4 недель для дозы 3,0 мг/кг, и в течение более чем 6 недель при дозах антитела L1L3 6 мг/кг, 12 мг/кг и 18 мг/кг. Данные продолжительности эффектов были неожиданными на основе данных по T½ для L1L3.
Пример 3: фармакокинетика и фармакодинамика одной дозы антагонистического антитела L1L3 против PCSK9 в комбинации со статином
Данный пример иллюстрирует опытное клиническое исследование по оценке фармакокинетики и фармакодинамики одной дозы антагонистического антитела (L1L3) против PCSK9 у человеческих субъектов, получающих стабильные дозы аторвастатина.
В данном исследовании человеческим субъектам, получающим стабильные дозы аторвастатина, вводили одну дозу антитела L1L3 в дозировке антагонистического антитела против PCSK9 0,5 мг/кг или 4 мг/кг. L1L3 вводили в виде одной инфузии в течение приблизительно 60 минут. Скорости инфузии тщательно контролировали инфузионным устройством согласно протоколу. Аторвастатин (40 мг ежесуточно) вводили, как описано ниже в протоколе исследования. Субъекты самостоятельно вводили себе аторвастатин на протяжении их участия в данном исследовании, за исключением суток 1-7 во время их госпитализации в клинике, когда такая же доза вводилась квалифицированным местным персоналом.
Инъекция L1L3, 10 мг/мл была представлена в виде стерильного раствора для внутривенного (в.в.) введения. Каждый флакон содержал 100 мг L1L3 в 10 мл водного буферного раствора и был закрыт покрытой пробкой и алюминиевым колпачком. Аторвастатин (40 мг) представляет собой белую таблетку, закодированную как «PD 157» на одной стороне и «40» на другой стороне.
Скрининг происходил в пределах 28 суток с момента введения дозы каждому субъекту. Субъекты получали стабильные дозировки аторвастатина в течение по меньшей мере 45 суток до скрининга. Субъекты получали одну дозу L1L3 в сутки 4, с многократными оценками РК и безопасности на протяжении периода госпитализации (сутки исследования -1, 1-7). Субъекты возвращались в клиническое исследовательское отделение для последующих посещений.
Ключевыми критериями включения для субъектов были: получение стабильных доз аторвастатина (40 мг ежесуточно) в течение 45 суток до суток 1, индекс массы тела (BMI) от 18,5 до 40 кг/м2 включительно, и масса тела, равная или меньшая, чем 150 кг. Ключевыми критериями для исключения субъектов были: история сердечно-сосудистого события (например, инфаркта миокарда (MI)) на протяжении последнего года; плохо контролируемый сахарный диабет типа 1 или типа 2 (определение: неконтролируемый диабет определяется как HBIAc больше 9%); и плохо контролируемая гипертензия (неконтролируемая гипертензия определяется как систолическое кровяное давление больше чем 140 мм рт.ст. или диастолическое кровяное давление больше чем 90 мм рт.ст., даже при лечении). Субъекты, которые имеют гипертензию, и она контролируется путем введения стабильных доз антигипертензивных лекарственных средств, могли быть включены. Данное исследование включало субъектов обоих полов с границей минимального возраста 18 лет и границей максимального возраста 80 лет.
Оценки фармакокинетических параметров антитела L1L3 в присутствии аторвастатина производились после одной дозы 0,5 или 4 мг/кг антитела L1L3. После введения антитела L1L3 измеряли абсолютное и процентное изменение уровня холестерина LDL (LDL-C) натощак относительно исходного уровня. В исследовании измеряли частоту субъектов, удовлетворяющих критериям токсичности или непереносимой дозы. Случаи нежелательных явлений, возникающих во время лечения (ТЕАЕ), классифицировали по тяжести, и также измеряли причинную связь с исследуемым лекарственным средством. Временными рамками для измерения каждого из вышеупомянутых результатов были два месяца.
Протокол исследования
Сутки -1: субъектов госпитализировали в клиническое исследовательское отделение (CRU) и выполняли следующее: проводили обзор и обновление критериев включения и исключения; проводили обзор и обновление медицинской истории; проводили обзор и обновление истории всех прописанных и не прописанных лекарственных средств и пищевых добавок, которые принимали в пределах 28 суток до запланированной первой дозы;
краткий физический осмотр; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, свертываемость крови, активность липазы, амилазы, CRP (С-реактивный белок) после 10-часового голодания; анализ мочи на наркотики и алкоголь; анализ мочи на беременность (женщины репродуктивного возраста); отбор образца крови для анализа иммуногенности (антитело против L1L3); отбирали образец крови для фармакодинамического анализа (PCSK9 и липидные частицы); отбирали образец крови для фармакогеномики (необязательно, требуется согласие субъекта); ЭКГ в положении лежа на спине в тройной повторности; оценка потребления алкоголя, кофеина и табака; оценка исходных симптомов/нежелательных явлений; и рандомизация субъектов.
Сутки 1: до дозирования выполняли следующее: ЭКГ в положении лежа на спине в тройной повторности (до введения в. в. катетера, при необходимости); измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали образец крови (сутки 1,0 ч) для РК (аторвастатин); субъекты принимали предоставленную спонсором дозу аторвастатина (40 мг); после дозировки отбирали образцы крови для РК (аторвастатин) в следующие моменты времени для суток 1: 0,25; 0,5; 1; 2; 3; 4; 6; 8 и 12 часов. Выполняли следующее: оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Субъекты голодали по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 2.
Сутки 2: до дозирования выполняли следующее: измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 2, 0 ч) образец крови для РК (аторвастатин); получали липидограмму после 10-часового голодания; субъекты принимали предоставленную спонсором дозу аторвастатина (40 мг). Выполняли следующее: оценивали исходные симптомы/нежелательные явления и проводили обзор сопутствующих лекарственных средств.
Сутки 3: до дозирования выполняли следующее: отбирали (сутки 3, 0 ч) образец крови для РК (аторвастатин); проводили измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; субъекты принимали предоставленную спонсором дозу аторвастатина (40 мг). Выполняли следующее: оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Субъекты голодали по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 4.
Сутки 4: до дозирования аторвастатина и L1L3 выполняли следующее: ЭКГ в положении лежа на спине в тройной повторности; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 4, 0 ч) образцы крови для РК (аторвастатина); отбирали (сутки 4, 0 ч) образцы крови для РК L1L3; отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, активность липазы, амилазы, CRP) после 10-часового голодания; измеряли массу тела; отбирали липидограмму после 10-часового голодания; отбирали образец крови для фармакодинамических анализов (PCSK9 и липидные частицы); отбирали образец крови для иммуногенности (антитела против L1L3). Введение дозы: субъекты принимали предоставленный спонсором аторвастатин (40 мг). L1L3 вводили внутривенной инфузией с контролируемой скоростью в течение приблизительно 60 минут. После введений дозы выполняли следующее: отбирали образцы крови для РК (аторвастатин) для суток 4 в 0,25; 0,5; 1; 2; 3; 4; 6; 8 и 12 часов после дозы аторвастатина; отбирали образцы крови для РК (L1L3) для суток 4 в 1, 4, 8 и 12 часов с момента начала инфузии; ЭКГ в положении лежа на спине в тройной повторности через 1 час после дозы; измеряли основные показатели состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя через 1 и 4 часа с момента начала инфузии L1L3; оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Субъекты голодали по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 5 и 6.
Сутки 5 и 6: до дозирования выполняли следующее: измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 5, 0 ч) образец крови для РК (аторвастатин); отбирали (сутки 5) образец крови для РК (L1L3); получали липидограмму после 10-часового голодания. Только сутки 5: отбирали образец крови для фармакодинамических анализов (PCSK9 и липидные частицы). Субъекты принимали предоставленную спонсором дозу аторвастатина (40 мг). Выполняли следующее: оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Субъекты голодали по меньшей мере 10 часов до отбора крови на липидограмму в сутки 7.
Сутки 7: до дозирования выполняли следующее: ЭКГ в положении лежа на спине в тройной повторности; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 7) образец крови для РК (аторвастатин); отбирали (сутки 7) образец крови для РК (L1L3); получали липидограмму после 10-часового голодания; отбирали образец крови для фармакодинамических анализов (PCSK9 и липидные частицы); отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, свертываемость крови, активность липазы, амилазы, CRP) после 10-часового голодания. Субъекты принимали последнюю предоставленную спонсором дозу аторвастатина (40 мг). Перед выпиской из учреждения выполняли следующее: краткий физический осмотр; оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Напоминали субъектам о возвращении в клинику и о голодании в течение по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 15. Субъекты продолжали принимать прописанный им аторвастатин на протяжении оставшейся части исследования.
Сутки 15 (плюс/минус 1 сутки): выполняли следующее: краткий физический осмотр; проверка соблюдения схемы и режима лечения в отношении аторвастатина; стандартная ЭКГ в положении лежа на спине; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 15) образец крови для РК (L1L3); получали липидограмму после 10-часового голодания; отбирали образец крови для оценки иммуногенности (антитела против L1L3); отбирали образец крови для фармакодинамического анализа (PCSK9 и липидные частицы); отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, CRP) после 10-часового голодания; оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Напоминали субъектам о возвращении в клинику и о голодании в течение по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 22.
Сутки 22 (плюс/минус 1 сутки): выполняли следующее: краткий физический осмотр; проверка соблюдения схемы и режима лечения в отношении аторвастатина; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 22) образец крови для РК (L1L3); получали липидограмму после 10-часового голодания; отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, CRP) после 10-часового голодания; оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Напоминали субъектам о возвращении в клинику и о голодании в течение по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 29.
Сутки 29 (плюс/минус 1 сутки): выполняли следующее: полный физический осмотр; проверка соблюдения схемы и режима лечения в отношении аторвастатина; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали (сутки 29) образец крови для РК (L1L3); отбирали образец крови для фармакодинамического анализа (PCSK9 и липидные частицы); отбирали образец крови для оценки иммуногенности (антитела против L1L3); получали липидограмму после 10-часового голодания; ЭКГ в положении лежа на спине в тройной повторности; отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, свертывание крови, активность липазы, амилазы) после 10-часового голодания; анализ мочи на наркотики и алкоголь; анализ сыворотки на беременность (женщины, способные к деторождению); оценивали исходные симптомы/нежелательные явления; проверяли прием сопутствующих лекарственных средств. Напоминали субъектам о возвращении в клинику и о голодании в течение по меньшей мере 10 часов до отбора образца крови на липидограмму в сутки 36.
Сутки 36, 43, 50, 57 и 64 (заключительное посещение): выполняли следующее: краткий физический осмотр; проверка соблюдения схемы и режима лечения в отношении аторвастатина; стандартная ЭКГ в положении лежа на спине; измерения основных показателей состояния организма (кровяное давление, частота пульса, температура тела) в положении лежа на спине и стоя; отбирали образец крови для РК (L1L3); отбирали образец крови для иммуногенности (антитела против L1L3); получали липидограмму после 10-часового голодания; отбирали образцы крови и мочи для лабораторных анализов безопасности (химический состав сыворотки, гематология, анализ мочи, активность липазы, амилазы, CRP) после 10-часового голодания; оценивали исходные симптомы/нежелательные явления; проводили обзор сопутствующих лекарственных средств. Только сутки 64: анализ мочи на беременность (женщины, способные к деторождению); коагулограмма; измерение массы тела; отбирали образец крови для фармакодинамических анализов (PCSK9 и липидные частицы).
Сутки 78 и 92: в некоторых случаях добавляли два посещения - в сутки 78 и 92, в зависимости от фармакокинетических результатов в сутки 57. В данном случае процедуры для суток 57 соответствовали процедурам для суток 78, а процедуры для суток 64 соответствовали процедурам для суток 92. Сутки 92 стали заключительным посещением.
Результаты
В данном исследовании не было субъектов, лечение которых было прервано. Имелось одно серьезное нежелательное явление (SAE), т.е. усиление мигрени, которое не имело отношения к приему лекарственного средства. ТЕАЕ обычно были неспецифичными, и ни один не был серьезным по интенсивности. Кроме того, ТЕАЕ были кратковременными с активностью аланинаминотрансферазы (ALT) и/или аспартатаминотрансферазы (AST), большей, чем 3х ULN (верхняя граница нормы), без клинических признаков/симптомов, и все они проходили в пределах одной недели.
В таблице 4 обобщены РК параметры L1L3 данного исследования.
В таблице 5 обобщены результаты из этого опытного клинического исследования для оценки фармакокинетики и фармакодинамики одной дозы L1L3 у человеческих субъектов, получающих стабильные дозы аторвастатина. Приведено среднее процентное изменение уровней LDL-C натощак после введения антитела L1L3 относительно исходного уровня (Таблица 4).
Обработка L1L3 в присутствии аторвастатина (доза равна 40 мг) приводила к существенному и долговременному дозозависимому снижению уровня LDL-C натощак. Исходный уровень LDL-C натощак составлял примерно 72,5 мг/дл. На ФИГ.7А проиллюстрированы абсолютные уровни LDL-C натощак после введения антитела L1L3. На ФИГ.7Б проиллюстрировано процентное изменение уровней LDL-C натощак после введения антитела L1L3 относительно исходного уровня. Исходный уровень на ФИГ.7Б указан как «О». При использовании дозы L1L3 0,5 мг/кг максимальный эффект снижения уровня LDL-C наблюдали на сутки 3 после введения L1L3. При использовании дозы L1L3 4 мг/кг максимальный эффект снижения уровня LDL-C наблюдали до суток 32 после введения L1L3. Дозозависимый ответ по снижению уровня LDL-C показан на ФИГ.8. Как показано на ФИГ.8, L1L3 снижало уровень LDL-C у пациентов, получающих стабильные дозы статина, при каждой введенной дозе. Кроме того, эффект снижения уровня LDL-C у пациентов, получающих стабильные дозы статина, был больше, чем у пациентов, которым дозировали одно1-11-3(ФИГ.8).
Пример 4: моделирование PK-PD и смоделированные профили во времени
На основе данных, приведенных в вышеописанных исследованиях, получали смоделированные профили уровней L1L3 в сыворотке во времени и профили уровней LDL-C во времени. На ФИГ.9А-Е проиллюстрированы графики смоделированных профилей во времени для L1L3 (верхняя панель) и LDL-C (нижняя панель) после введения L1L3 в указанных дозах или плацебо. Смоделированные профили были получены для дозирования 2 мг/кг L1L3 (слева) или 6 мг/кг L1L3 (посередине) по сравнению с плацебо (справа). L1L3 или плацебо вводили в сутки 0 и сутки 29, т.е. две дозы с интервалом четыре недели. На ФИГ.10 проиллюстрированы смоделированные профили LDL-C во времени после введения следующих дозируемых количеств L1L3: 0,25 мг/кг, 0,5 мг/кг, 1 мг/кг, 2 мг/кг, 4 мг/кг и 6 мг/кг, причем каждое из них вводили в сутки О, сутки 29 и сутки 56 (ФИГ.10). Смоделированные профили L1L3 во времени и профили LDL-C во времени демонстрируют то, что низкие дозы L1L3, введенные один раз каждые четыре недели, давали значительное снижение уровня LDL-C.
Пример 5: фармакокинетика и фармакодинамика после многократных доз L1L3
Данный пример иллюстрирует клиническое опытное исследование для оценки фармакокинетики и фармакодинамики после многократных внутривенных доз антагонистического антитела (L1L3) против PCSK9 у человеческих субъектов.
Данное исследование представляло собой рандомизированное многоцентровое двойное слепое плацебо-контролируемое исследование с параллельными группами с 28-суточным периодом скрининга, 4-недельным периодом обработки и 8-недельным периодом последующего наблюдения (Фиг.11). В этом исследовании человеческим субъектам-японцам вводили антитело L1L3 в дозировке данного антагонистического антитела против PCSK9 0,25 мг/кг, 0,5 мг/кг, 1,0 мг/кг или 1,5 мг/кг. Для каждого субъекта исследование состояло из 3 периодов: скрининга, обработки и последующего наблюдения. Период обработки длился вплоть до приблизительно 28 суток с 4 одиночными в.в. дозами либо L1L3, либо плацебо, введенными в сутки 1,8, 15 и 22. Период последующего наблюдения будет длиться приблизительно 8 недель, от приблизительно суток 29 до последнего посещения (сутки 78). Субъектов периодически наблюдали в клинике для оценок безопасности и отбора крови для обычных лабораторных анализов, отбора образцов для определения профиля липидов, РК, PD и иммуногенности.
Еженедельная обработка L1L3 во всех протестированных дозах приводила к сохраняющемуся, значительному и надежному дозозависимому снижению уровня LDL-C натощак. Исходный уровень LDL-C натощак составлял приблизительно 155 мг/дл. На ФИГ.12 проиллюстрированы абсолютные уровни LDL-C натощак после введения антитела L1L3. На ФИГ.13 проиллюстрировано процентное изменение уровней LDL-C натощак после введения антитела L1L3 относительно исходного уровня. Исходный уровень на ФИГ.13 указан как «0».
В таблице на ФИГ.14 обобщены результаты из данного клинического опытного исследования для оценки фармакокинетики и фармакодинамики после многократных доз L1L3 у человеческих субъектов, получающих стабильные дозы аторвастатина. Приведено среднее процентное изменение («среднее») уровней LDL-C натощак после введения антитела L1L3 относительно исходного уровня (ФИГ.14).
Пример 6: фармакокинетика и фармакодинамика после многократных доз L1L3 в комбинации со статином
Данный пример иллюстрирует клиническое опытное исследование для оценки фармакокинетики и фармакодинамики после многократных внутривенных доз антагонистического антитела против PCSK9 (L1L3) у человеческих субъектов, получающих стабильные дозы аторвастатина, симвастатина или розувастатина.
Данное исследование представляло собой рандомизированное многоцентровое двойное слепое плацебо-контролируемое исследование с параллельными группами с 3-недельным периодом скрининга, 12-недельным периодом обработки и 8-недельным периодом последующего наблюдения.
Субъекты, включенные в данное исследование, удовлетворяли всем из следующих критериев: субъекты мужского и женского пола в возрасте, большем чем или равном 18 лет; индекс массы тела от 18,5 до 40 кг/м2; общая масса тела больше чем 50 кг (110 фунтов) и меньше чем 150 кг (330 фунтов); получающие стабильные ежесуточные дозы статина, определенные как 40 или 80 мг аторвастатина, 20 или 40 мг розувастатина или 40 или 80 мг симвастатина, в течение минимум 45 суток до суток 1; липиды удовлетворяли следующим критериям в два квалифицирующих посещения (скрининг и сутки - 7): уровень LDL-C натощак больше чем или равен 100 мг/дл.
Субъектов периодически наблюдали в клинике для оценок безопасности и отбора крови для анализов на безопасность, образцов для определения профиля липидов, РК, PD и иммуногенности. Перед каждым посещением делали звонки по телефону, напоминая им о требованиях 10-часового голодания во время скрининга и в сутки 3 для оценки нежелательных явлений, и фиксировали контакт во входном документе субъекта. Субъекты получали одну инфузию 1 мг/кг L1L3, 3 мг/кг L1L3, 6 мг/кг L1L3 или плацебо в сутки 1, 29 и 57 с многократными оценками эффективности, безопасности и РК на протяжении всех периодов обработки и последующего наблюдения. Скорости инфузии тщательно контролировали посредством инфузионного устройства согласно протоколу. Инфузии вводили в виде однократной инфузии в течение приблизительно 60 минут.
Результаты
И схема дозировки 3 мг/кг, и схема дозировки 6 мг/кг достигали статистической значимости и превышали целевое значение 30%-го изменения LDL-C относительно исходного значения. Не наблюдали эффекта L1L3 на триглицериды. Наблюдали небольшое увеличение HDL вплоть до 9%. Группы обработки и количество участников показаны в Таблице 6.
Заранее определенной первичной конечной точкой оценки эффективности являлось процентное изменение уровня LDL-C в сутки 85 относительно исходного уровня при использовании модели ANCOVA (ковариационный анализ). Конечная модель ANCOVA содержала элементы, характеризующие исходный уровень LDL-C и обработку. Для сохранения общего уровня значимости ошибки первого рода на уровне 0,05 для анализа первичной конечной точки использовали значение ограничения Haybittle-Peto 0,001 альфа.
Наблюдали сильный эффект обработки с ясным ответом на дозу с варьированием LDL-C в группах обработки 3 и 6 мг/кг, которое было обусловлено недостаточностью доз (ФИГ.15 и 16). Данные по LDL-C затем анализировали с использованием смешанной модели с повторными измерениями для того, чтобы оценить как обработку во времени, так и эмпирические профили доза-ответ.
Заданное целевое значение в виде дополнительного 30%-го снижения LDL-C при добавлении к статинам было подтверждающим концепцию критерием успеха. Данный целевой уровень 30%-го или большего снижения LDL-C, при добавлении к терапии статинами, явно достигался при использовании доз 3 и 6 мг/кг, которые давали каждые 4 недели (ФИГ.15 и 16). График на ФИГ.15 показывает процентное изменение относительно исходного уровня по суткам исследования и обработке, и график на ФИГ.16 показывает процентное изменение относительно исходного уровня по суткам исследования и обработке с исключением субъектов с отсутствующими дозами. При схеме дозирования 3 мг/кг L1L3 у пациентов, которые получали стабильную ежесуточную дозу статина, достигалось снижение уровня LDL-C примерно на 50% относительно исходного уровня на сутки 29 (ФИГ.15). При схеме дозирования 6 мг/кг L1L3 у пациентов, которые получали стабильную ежесуточную дозу статина, достигалось снижение уровня LDL-C примерно на 65% относительно исходного уровня на сутки 29 (ФИГ.15). При использовании обеих схем дозирования - 3 мг/кг и 6 мг/кг более чем 30%-е снижение LDL-C сохранялось в течение 28 суток (ФИГ.16). Статистическое обобщение эффектов обработки с поправкой на плацебо в сутки 85 приведено в Таблице 7. В Таблице 7 исходный профиль липидов определен как среднее значений, наблюдавшихся в сутки -7 и 1.
Обобщение Cmax и минимальных концентраций L1L3 показано в Таблице 8.
Ежемесячная обработка 3 и 6 мг/кг L1L3 у пациентов, получающих стабильные ежесуточные дозы статина, приводила к более чем 30%-ному снижению уровней LDL-C в крови относительно исходного уровня. Наблюдали незначительные (вплоть до 9%) увеличения уровней HDL и небольшие эффекты L1L3 на триглицериды. L1L3 обычно был безопасным и хорошо переносился. Изменения LFT (проба функции печени), СК (креатинкиназа), ЭКГ (электрокардиограмма) и ВР (кровяное давление) были кратковременными, умеренными по природе и в большинстве случаев считались не связанным с обработкой. Ни один из субъектов не был позитивным в отношении ADA (аденозиндезаминаза).
Пример 7: фармакокинетика и фармакодинамика после многократных доз L1L3 в комбинации со статином.
Данный пример иллюстрирует клиническое экспериментальное исследование по оценке уровней LDL-C после многократных подкожных доз антагонистического антитела против PCSK9 (L1L3) у человеческих субъектов, получающих статин.
Данное исследование представляет собой рандомизированное многоцентровое двойное слепое плацебо-контролируемое исследование с параллельными группами и варьированием дозы, разработанное для оценки эффективности, безопасности и переносимости L1L3 после подкожного дозирования один раз в месяц и дважды в месяц в течение шести месяцев у гиперхолестеринемических субъектов, получающих статин. Запланировано всего 7 групп доз в двух схемах дозировки (Q28d или Q14d) с 50 субъектами на дозу. Схема протокола изложена в Таблице 9.
Пригодность: возраст 18 лет или старше.
Критерии включения: субъекты должны получать стабильные дозы (по меньшей мере 6 недель) любого статина и продолжать получать такую же дозу статина на протяжении данного испытания. Липиды должны удовлетворять следующим критериям при исходной обработке статином в 2 скрининговых посещения, которые происходят при скрининге и по меньшей мере за 7 суток до рандомизации в сутки 1: уровень LDL-C натощак, больший чем или равный 80 мг/дл (2,31 ммоль/л); уровень TG натощак, меньший чем или равный 400 мг/дл (4,52 ммоль/л); уровень LDL-C натощак у субъекта должен быть больше чем или равен 80 мг/дл (2,31 ммоль/л в момент первичного скринингового посещения при скрининге, и значение в момент второго посещения в пределах 7 суток от рандомизации должно быть не меньше чем 20% от этого исходного значения для того, чтобы удовлетворять критериям пригодности для этого испытания.
Первичным критерием эффективности будет абсолютное изменение LDL-C относительно исходного уровня в конце недели 12 после рандомизации. Вторичные критерии эффективности включают следующее: уровень LDL-C будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; стационарные фармакокинетические параметры L1L3 в плазме; доля субъектов, имеющих уровень LDL-C, меньший, чем в определенных границах (меньше 100 мг/дл, меньше 70 мг/дл, меньше 40 мг/дл, меньше 25 мг/дл); общий уровень холестерина будет оцениваться как изменение и % изменения относительно исходного уровня в конце недели 12 после рандомизации; уровень АроВ будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; уровень АроА1 будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; уровень липопротеина (а) будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; уровень HDL-холестерина будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; уровень холестерина липопротеинов очень низкой плотности будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; уровень триглицеридов будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации; и уровень не-HDL-холестерина будет оцениваться как изменение и процент изменения относительно исходного уровня в конце недели 12 после рандомизации.
Хотя раскрытые идеи и были описаны со ссылкой на разные применения, способы и композиции, будет понятно, что можно делать различные изменения и модификации без отступления от приведенных здесь идей и приведенной ниже формулы изобретения. Вышеизложенные примеры приведены для лучшей иллюстрации раскрытых идей и не предназначены для ограничения объема представленных здесь идей. В то время как настоящие идеи были описаны в терминах данных типичных воплощений, квалифицированный специалист легко поймет, что возможны многочисленные вариации и модификации данных типичных воплощений без чрезмерного экспериментирования. Все такие вариации и модификации находятся в пределах объема настоящих идей.
Все процитированные здесь ссылки, включая патенты, патентные заявки, статьи, учебники и тому подобное, и ссылки, процитированные в них, в том объеме, в котором они еще не были включены сюда, тем самым являются включенными посредством ссылки во всей их полноте. В случае, когда один или более чем один из включенных литературных источников и аналогичных материалов отличается от данной заявки или противоречит ей, включая определенные термины, применение терминов, описанные методики или тому подобное, но не ограничиваясь ими, данная заявка будет иметь преимущество.
Вышеизложенное описание и Примеры подробно описывают определенные конкретные воплощения изобретения и описывают лучший способ, рассматриваемый авторами изобретения. Однако будет понятно, что независимо от того, как подробно вышеописанное может появиться в тесте, изобретение можно воплощать на практике многими способами, и данное изобретение следует истолковывать согласно приложенной формуле изобретения и ее любым эквивалентам.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ЧЕЛОВЕКА К PCSK9 ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ ЛЕЧЕНИЯ КОНКРЕТНЫХ ГРУПП ИНДИВИДУУМОВ | 2012 |
|
RU2603481C2 |
| АНТАГОНИСТЫ PCSK9 | 2009 |
|
RU2528735C2 |
| АНТАГОНИСТЫ PCSK9 | 2014 |
|
RU2618869C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ХОЛЕСТЕРИНОМ | 2021 |
|
RU2832333C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ГЕТЕРОЗИГОТНОЙ СЕМЕЙНОЙ ГИПЕРХОЛЕСТЕРИНЕМИЕЙ (HEFH) | 2015 |
|
RU2735521C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ВЫСОКИМ РИСКОМ ВОЗНИКНОВЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, ИМЕЮЩИХ ГИПЕРХОЛЕСТЕРИНЕМИЮ | 2015 |
|
RU2723018C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИТЕЛА К PCSK9 ЧЕЛОВЕКА | 2012 |
|
RU2604139C2 |
| АНТИТЕЛА ЧЕЛОВЕКА К PCSK9 ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ ЛЕЧЕНИЯ КОНКРЕТНЫХ ГРУПП ИНДИВИДУУМОВ | 2012 |
|
RU2721279C2 |
| АНТИТЕЛА С РН-ЗАВИСИМЫМ СВЯЗЫВАНИЕМ АНТИГЕНА | 2011 |
|
RU2570729C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ГИПЕРЛИПИДЕМИИ У ПАЦИЕНТОВ С ДИАБЕТОМ ПОСРЕДСТВОМ ВВЕДЕНИЯ ИНГИБИТОРА PCSK9 | 2018 |
|
RU2772712C2 |











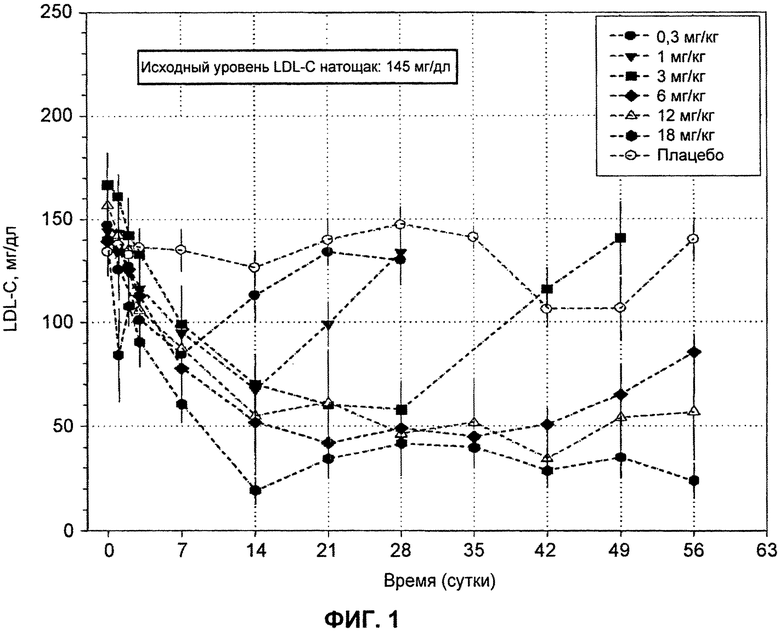
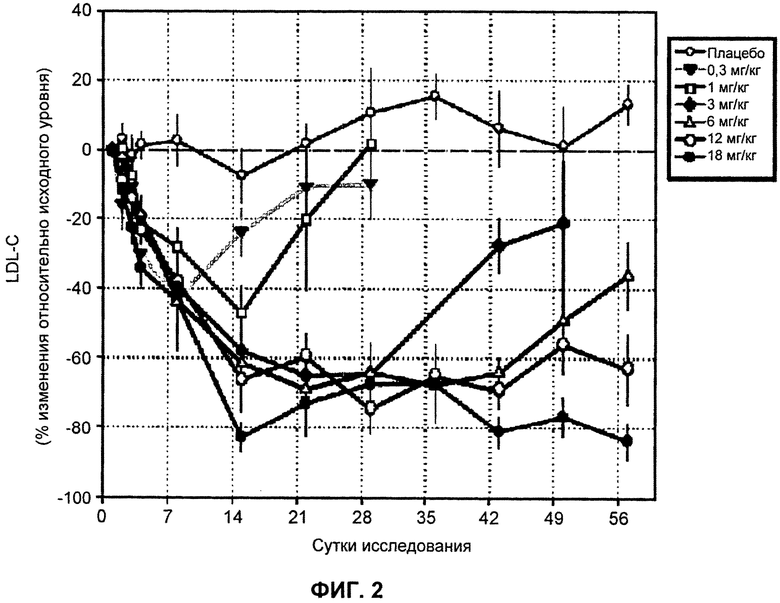
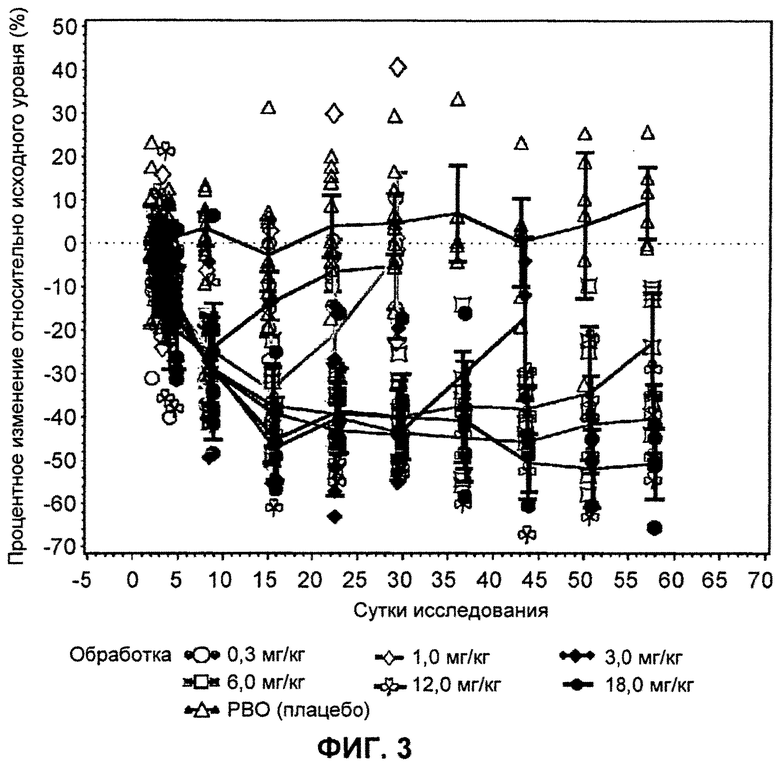
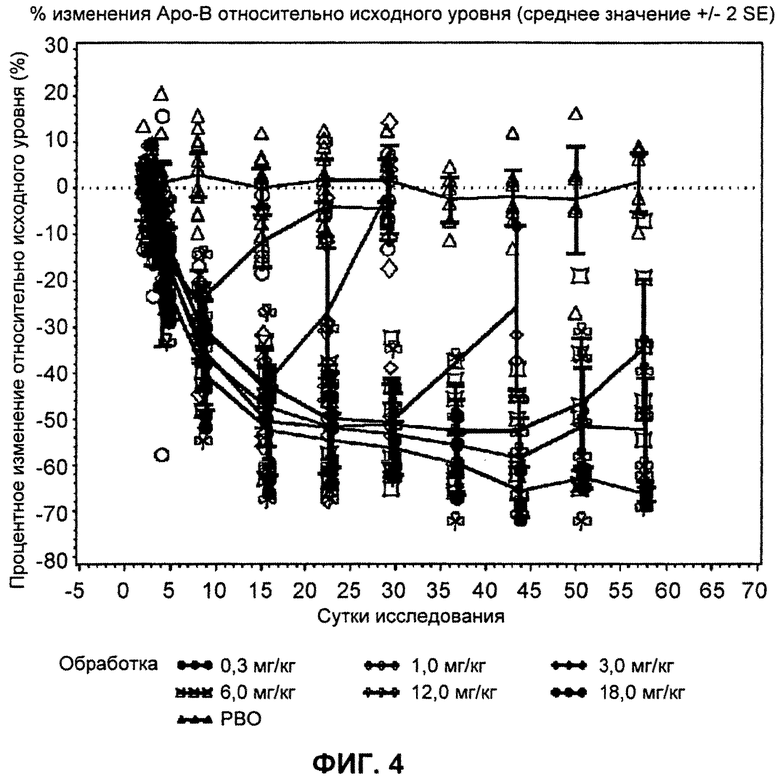
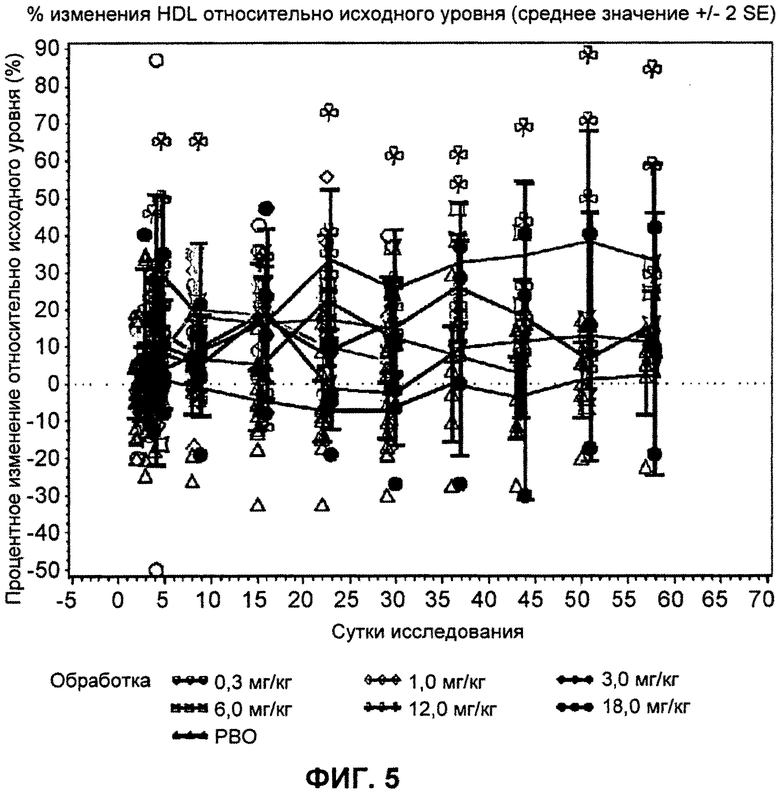
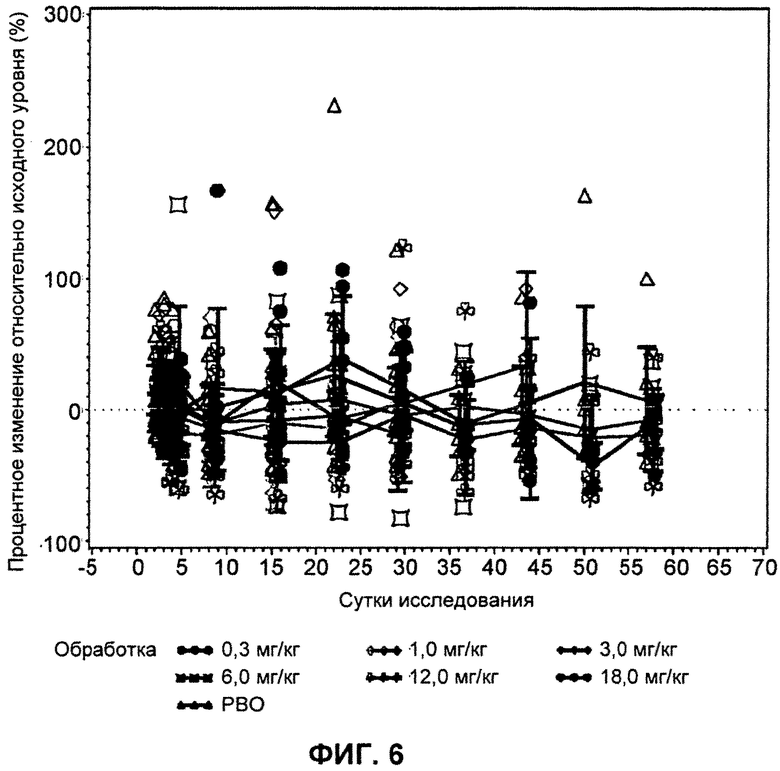
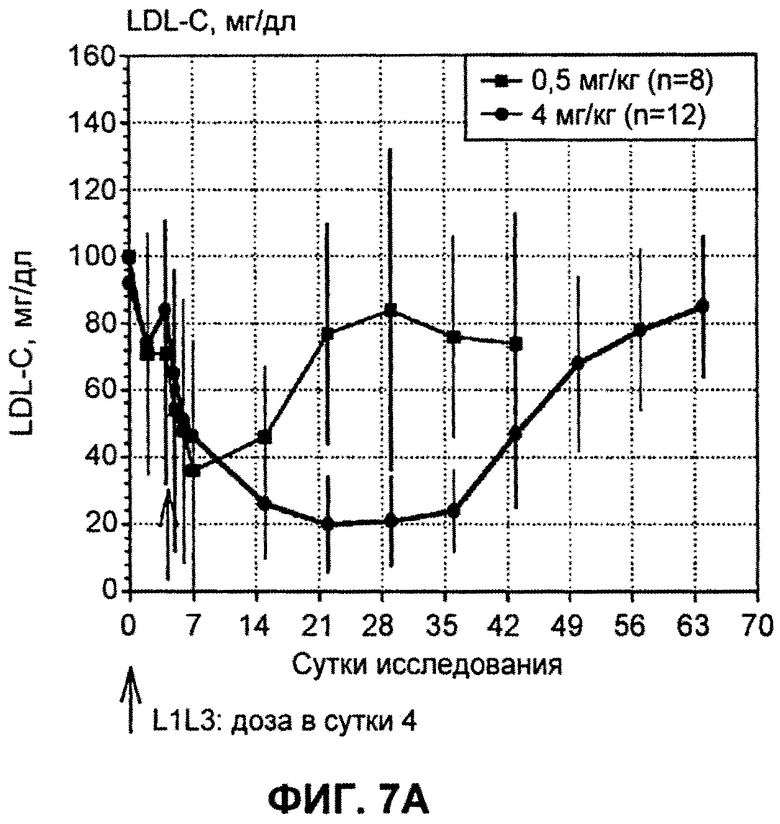
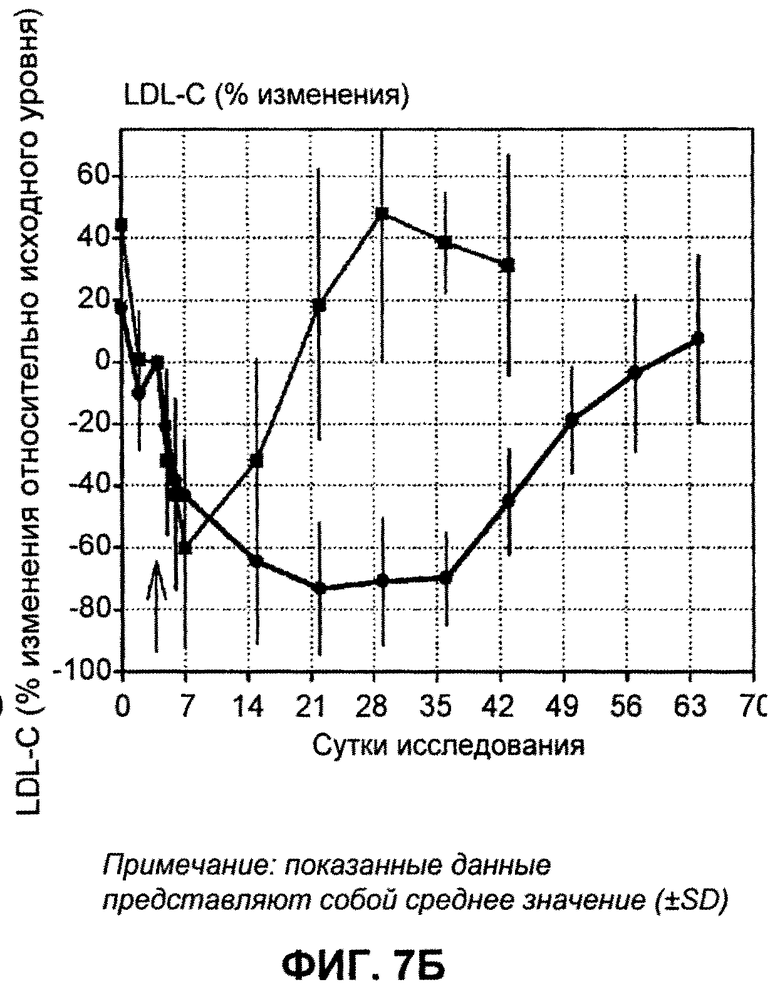
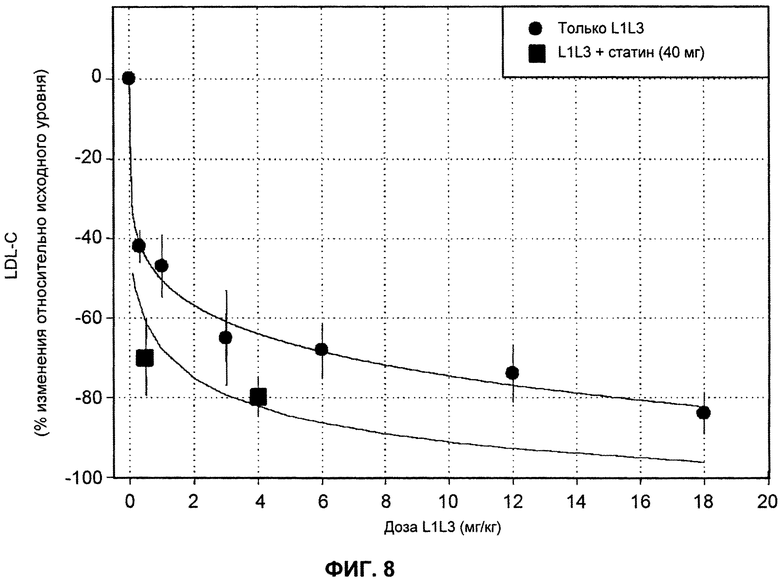
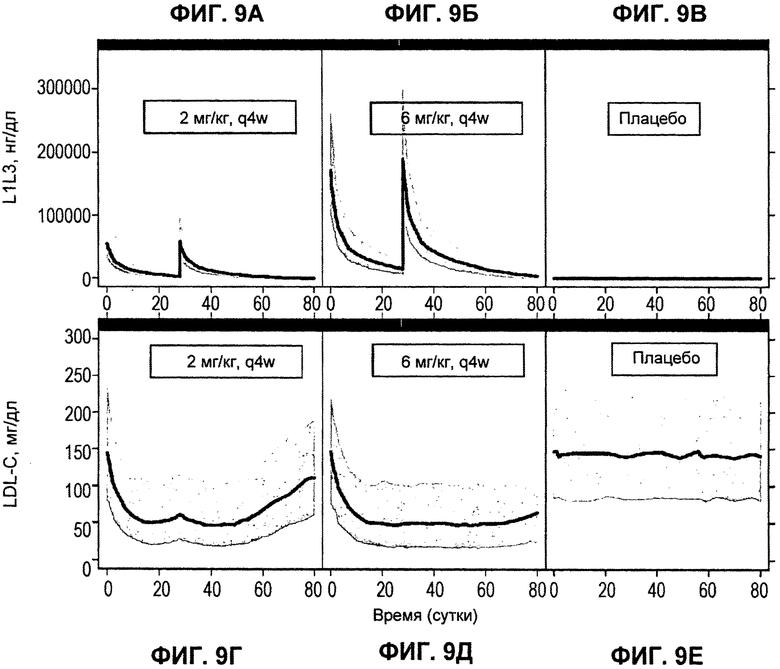
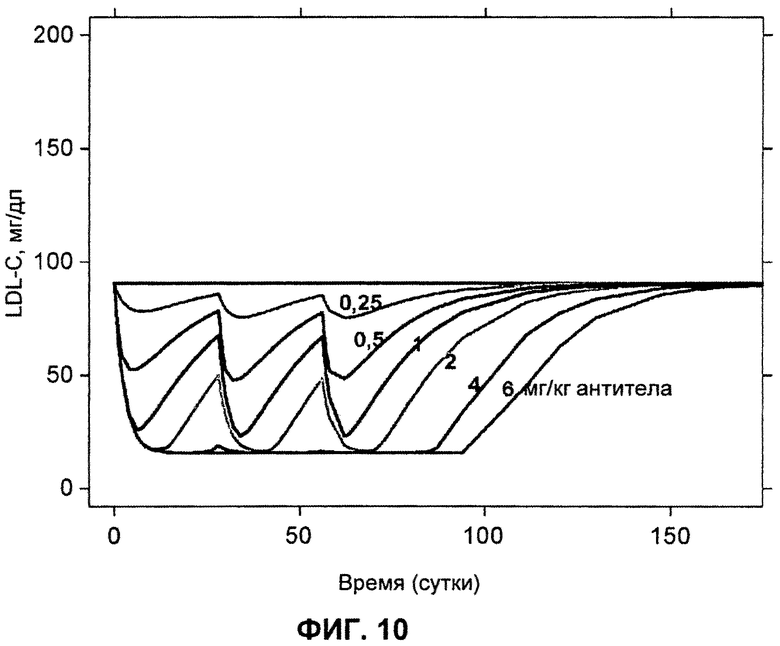
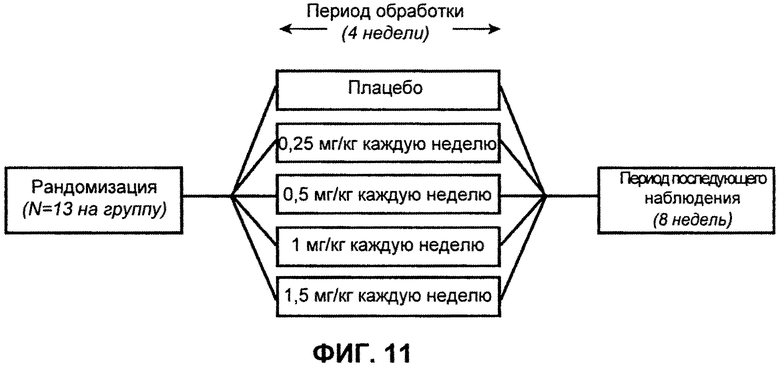
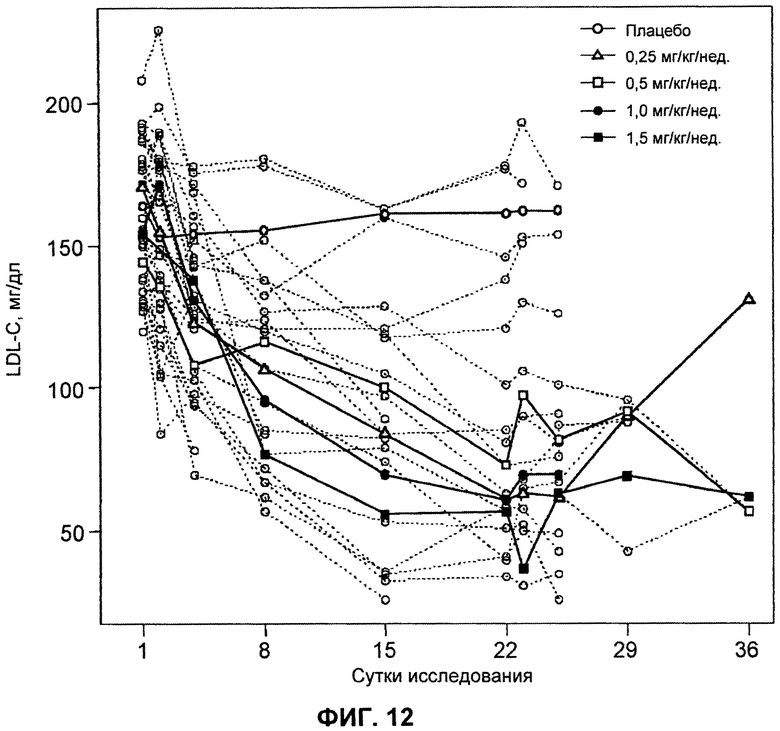
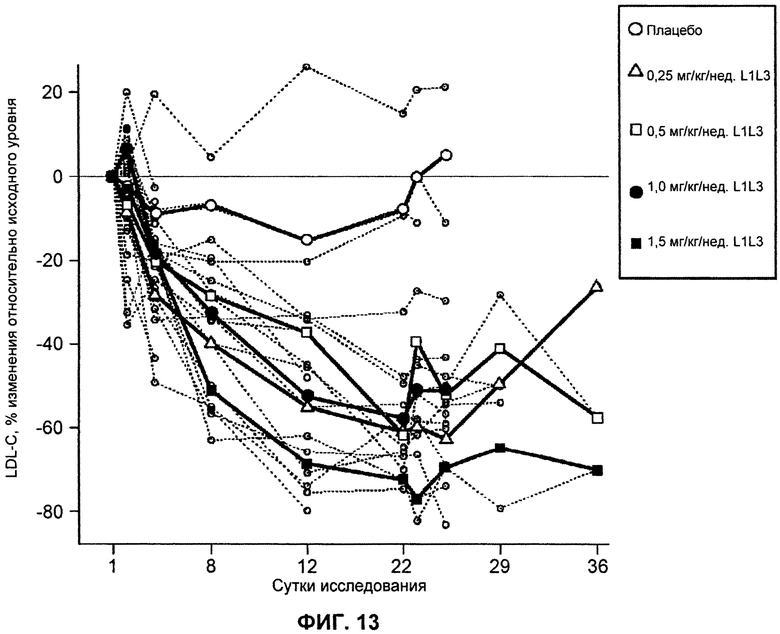
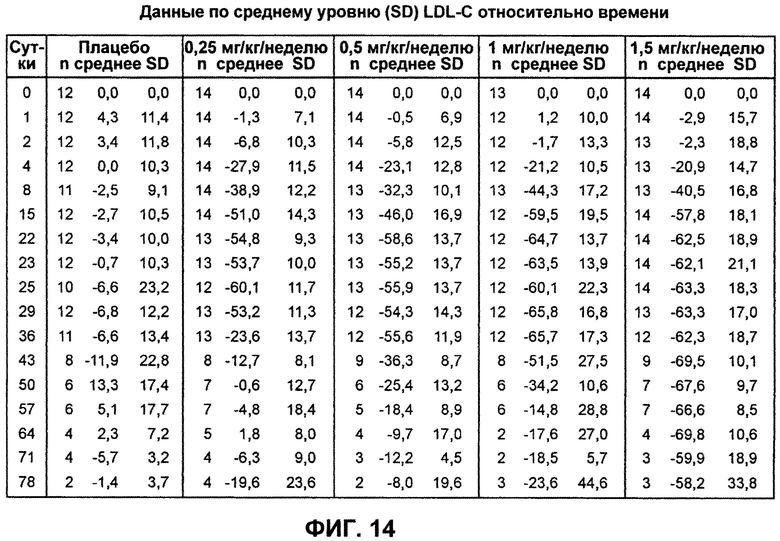
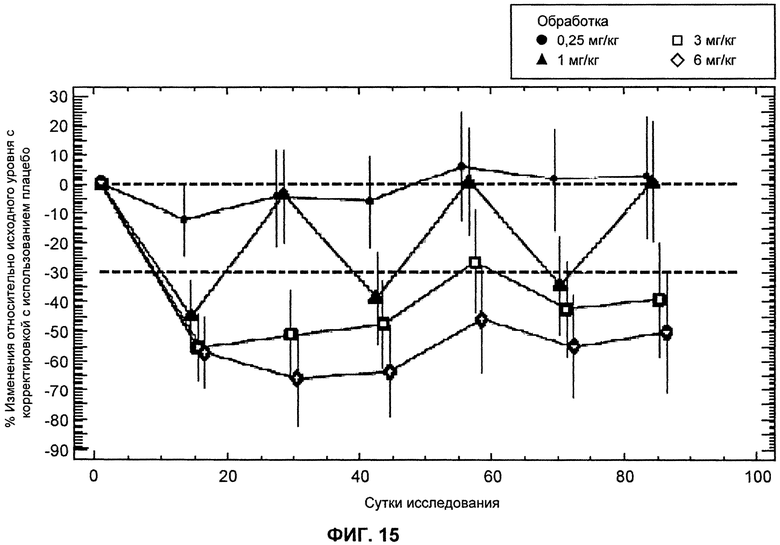
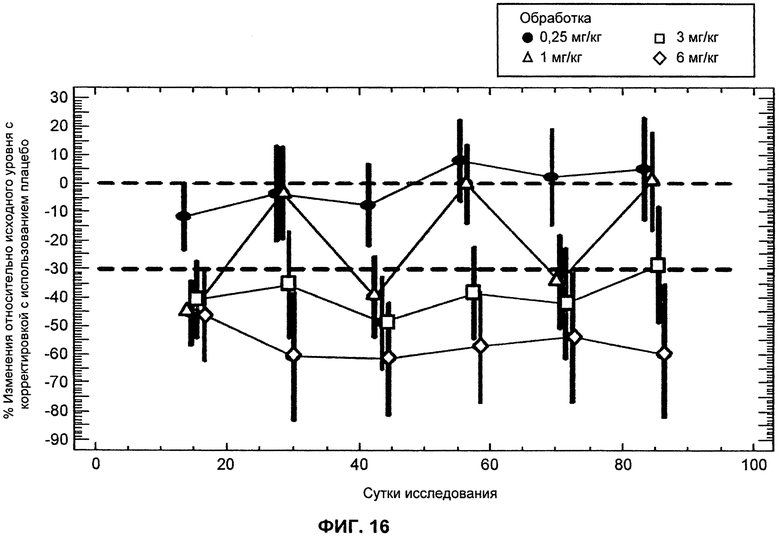
Группа изобретений относится к медицине и касается способа лечения пациента, подверженного расстройству, характеризующегося повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, или у которого было диагностировано указанное расстройство, включающего введение пациенту начальной дозы антагонистического антитела против пропротеинконвертазы субтилизин/кексин типа 9; и введение пациенту множества последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза. Группа изобретений также касается изделия для лечения расстройства, характеризующегося повышенным уровнем LDL-C в крови, содержащего контейнер, композицию в контейнере, содержащую антагонистическое антитело против PCSK9, и листок-вкладыш, содержащий инструкции по введению антагонистического антитела против PCSK9. Группа изобретений обеспечивает длительный период действия антагонистического антитела против PCSK9. 5 н. и 19 з.п. ф-лы, 7 пр., 16 ил., 9 табл.
1. Способ лечения пациента, подверженного расстройству, характеризующемуся повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, или у которого было диагностировано указанное расстройство, включающий:
введение пациенту начальной дозы, составляющей по меньшей мере примерно 3 мг/кг, примерно 4 мг/кг, примерно 5 мг/кг или примерно 6 мг/кг антагонистического антитела против пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9); и
введение пациенту множества последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая и дополнительные последующие дозы разделены друг от друга во времени по меньшей мере примерно четырьмя неделями.
2. Способ лечения пациента, подверженного расстройству, характеризующемуся повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, или у которого было диагностировано указанное расстройство, включающий:
введение пациенту начальной дозы, составляющей по меньшей мере примерно 200 мг или примерно 300 мг антагонистического антитела против пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9); и
введение пациенту множества последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая и дополнительные последующие дозы разделены друг от друга во времени по меньшей мере примерно четырьмя неделями.
3. Способ лечения пациента, подверженного расстройству, характеризующемуся повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, или у которого было диагностировано указанное расстройство, включающий:
введение пациенту начальной дозы, составляющей по меньшей мере примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 140 мг или примерно 150 мг антагонистического антитела против пропротеинконвертазы субтилизин/кексин типа 9 (PCSK9); и
введение пациенту множества последующих доз антитела в количестве, которое является примерно таким же или меньшим, чем начальная доза, где начальная доза и первая последующая и дополнительные последующие дозы разделены друг от друга во времени по меньшей мере примерно двумя неделями.
4. Способ по любому из пп. 1-3, где пациента лечат статином.
5. Способ по п. 4, где пациента лечат ежесуточной дозой статина.
6. Способ по п. 4, где пациент получал стабильные дозы статина в течение по меньшей мере примерно двух, трех, четырех, пяти или шести недель до начальной дозы антитела против PCSK9.
7. Способ по п. 4, где статин представляет собой аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин, симвастатин или их любые фармацевтически приемлемые соли или стереоизомеры.
8. Способ по п. 5, где ежесуточная доза статина выбрана из группы, состоящей из 40 мг аторвастатина, 80 мг аторвастатина, 20 мг розувастатина, 40 мг розувастатина, 40 мг симвастатина и 80 мг симвастатина.
9. Способ по любому из пп. 1-3, где расстройство представляет собой гиперхолестеринемию, дислипидемию, гиперлипидемию, атеросклероз, сердечно-сосудистое заболевание или острый коронарный синдром (ACS).
10. Способ по любому из пп. 1-3, где до введения начальной дозы антагонистического антитела против PCSK9 пациент имеет общий уровень холестерина натощак примерно 70 мг/дл или больше.
11. Способ по любому из пп. 1-3, где до введения начальной дозы антагонистического антитела против PCSK9 пациент имеет уровень холестерина LDL натощак примерно 130 мг/дл или больше.
12. Способ по любому из пп. 1-3, где антитело содержит три CDR из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO: 11, и три CDR из вариабельной области легкой цепи, имеющей аминокислотную последовательность, показанную в SEQ ID NO: 12.
13. Способ по п. 12, где антитело представляет собой L1L3.
14. Способ по любому из пп. 1-3, где антитело вводят подкожно или внутривенно.
15. Способ по любому из пп. 1-3, где антитело вводят примерно один раз или два раза в месяц.
16. Изделие для лечения расстройства, характеризующегося повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, содержащее контейнер, композицию в контейнере, содержащую антагонистическое антитело против PCSK9, и листок-вкладыш, содержащий инструкции по введению начальной дозы антагонистического антитела против PCSK9, составляющей по меньшей мере примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 140 мг, примерно 150 мг, и по меньшей мере одной последующей дозы, которая представляет собой такое же или меньшее количество, чем начальная доза, где введение начальной дозы и последующих доз разделено во времени по меньшей мере примерно двумя неделями.
17. Изделие для лечения расстройства, характеризующегося повышенным уровнем холестерина липопротеинов низкой плотности (LDL-C) в крови, содержащее контейнер, композицию в контейнере, содержащую антагонистическое антитело против PCSK9, и листок-вкладыш, содержащий инструкции по введению начальной дозы антагонистического антитела против PCSK9, составляющей по меньшей мере примерно 200 мг или примерно 300 мг, и по меньшей мере одной последующей дозы, которая представляет собой такое же или меньшее количество, чем начальная доза, где введение начальной дозы и последующих доз разделено во времени по меньшей мере примерно четырьмя неделями.
18. Изделие по п. 16 или 17, где листок-вкладыш включает инструкции для введения антагонистического антитела против PCSK9 индивидууму, которого лечат статином.
19. Изделие по п. 18, где статин представляет собой аторвастатин, церивастатин, флувастатин, ловастатин, мевастатин, питавастатин, правастатин, розувастатин, симвастатин или их любые фармацевтически приемлемые соли или стереоизомеры.
20. Изделие по п. 16 или 17, где инструкции предназначены для введения начальной дозы посредством внутривенной или подкожной инъекции и по меньшей мере одной последующей дозы посредством внутривенной или подкожной инъекции.
21. Изделие по п. 16 или 17, где вводят множество последующих доз.
22. Изделие по п. 16 или 17, дополнительно содержащее этикетку на контейнере или ассоциированную с ним, на которой указано, что композицию можно использовать для лечения состояния, характеризующегося повышенным уровнем холестерина липопротеинов низкой плотности в крови.
23. Изделие по п. 16 или 17, где на этикетке указано, что композицию можно использовать для лечения гиперхолестеринемии, атерогенной дислипидемии, гиперлипидемии, атеросклероза, сердечно-сосудистого заболевания или острого коронарного синдрома (ACS).
24. Изделие по п. 16 или 17, где антитело представляет собой L1L3.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| ALBORN W.E., et al., Serum proprotein convertase subtilisin kexin type 9 is correlated directly with serum LDL cholesterol | |||
| Clin Chem | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| DUFF CJ., et al., PCSK9: an emerging target for treatment of hypercholesterolemia | |||
| Expert Opin Ther Targets | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| doi: | |||
Авторы
Даты
2016-02-27—Публикация
2012-07-10—Подача