ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет согласно предварительной заявке на патент США № 61/777016, поданной 12 марта 2013 года, содержание которой включено сюда посредством ссылки для любых задач.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение в общем относится к области получения рекомбинантных химерных слитых белков, предназначенных для использования в терапии рака, и более конкретно к слитым молекулам анти-EGFR1-TGFβRII, анти-EGFR1-PD1 и анти-CTLA4-PD1 и способам их получения, причем способы уменьшают стоимость получения и увеличивают гомогенность рекомбинантных химерных слитых белков.
Предшествующий уровень техники
Несмотря на многочисленные достижения в медицинском исследовании, рак остается второй главной причиной смерти в Соединенных Штатах Америки. При традиционных способах клинического лечения, таких как хирургическая резекция, радиотерапия и химиотерапия, имеет место значительный процент неблагоприятных исходов, в особенности в отношении солидных опухолей. Неблагоприятные исходы возникают либо вследствие толерантности исходной опухоли, либо вследствие рецидива из-за возобновления роста в исходной области или метастаза. Рак остается в центре внимания для медицинского исследования и разработки.
Иммунотерапия рака исследовалась больше века, но только в течение последнего десятилетия различные продукты на основе антител были введены в стратегию лечения пациентов с различными форм рака. В настоящее время она представляет собой одну из наиболее активно развивающихся областей клинического исследования с многочисленными терапевтическими продуктами на основе антител, уже одобренными в онкологии.
Использование специфических антител в качестве терапевтических агентов обеспечивает преимущества по сравнению с воздействующими не направленно способами терапии, такими как системная химиотерапия путем перорального или внутривенного введения лекарственных средств или радиационная терапия. Существуют два типа терапии на основе антител. Самый распространенный тип заключается в идентификации опухолевого антигена (т.е. белка, экспрессирующегося в опухолях и раковых клетках, но не в нормальных тканях) и разработке антитела, предпочтительно моноклонального антитела (mAb), направленного против опухолевого антигена. Тогда можно конъюгировать любой терапевтический агент, такой как химиотерапевтический агент, радионуклид, модифицированный токсин и тому подобное, с этим антителом для обеспечения воздействующей направленно терапии опухоли терапевтическим агентом. Другая разновидность терапии на основе антител заключается в том, чтобы обеспечить антитело, которое само по себе обладает терапевтическими свойствами против опухолевых/раковых клеток, на которых оно нацелено. Дополнительное преимущество этой второй формы терапии на основе антител заключается в том, что можно дополнительно конъюгировать еще один терапевтический агент с терапевтическим антителом для достижения более эффективного лечения. Основное преимущество любой терапии направленными антителами и терапии с использованием моноклональных антител (mAb) заключается, в частности, в способности доставлять к опухоли увеличенные дозы терапевтического агента при большем сбережении нормальной ткани от побочных действий терапевтического агента.
Несмотря на идентификацию нескольких антител для терапии рака, все еще сохраняется потребность в идентификации новых и более эффективных терапевтических средствах для преодоления иммунной толерантности и активации T-клеточных ответов. Кроме того, даже при том, что молекулярная инженерия улучшилась, перспективы таких терапевтических средств на основе антител все еще продолжают непрерывно рассматриваться в отношении получения рекомбинантных продуктов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен новый и надежный способ синтеза для создания гомогенных рекомбинантных слитых иммуномодулирующих молекул и более конкретно рекомбинантных химерных полипептидов, содержащих антитела направленного взаимодействия, связанные с иммуномодулирующими белками.
Для того чтобы опосредовать иммунный ответ против рака, важны как T-клеточная активация, так и костимуляция. Костимуляция T-клеток в основном опосредуется путем вовлечения CD28 с его лигандами семейства B7 на антигенпрезентирующих клетках (APC). Тем не менее, после активации T-клетки экспрессируют молекулу, называемую антиген 4 цитотоксических Т-лимфоцитов (CTLA-4), которая связывается с лигандами B7 с гораздо большей аффинностью по сравнению с CD28, и такое связывание оказывает понижающую модуляцию T-клеточной активности. Таким образом, включение антитела, связывающегося с рецептором CTLA-4, может блокировать взаимодействие с лигандами семейства B7 и усиливать противоопухолевый ответ.
Лиганд 1 запрограммированной гибели (PDL1), представляющий собой один из лигандов B7, обсуждаемых выше, препятствует противоопухолевому иммунитету путем того, что (1) лишает иммуногенности опухоль-реактивные T-клетки путем связывания со своим рецептором PD1 (CD279) на T-клетках; (2) придает опухолевым клеткам резистентность к CD8+ T-клеткам и FasL-опосредованному лизису путем передачи сигналов PD-1 через экспрессируемый опухолевыми клетками PDL1; и (3) способствуют развитию и поддержанию индуцированных T-регуляторных клеток. Таким образом, PDL1 представляет собой основное препятствие для природного противоопухолевого иммунитета и для иммунотерапий рака, требующих активацию опосредованного T-клетками противоопухолевого иммунитета хозяина. Данная концепция поддерживается исследованиями, демонстрирующими, что блокировка антителом взаимодействий PDL1-PD1 улучшает T-клеточную активацию и уменьшает прогрессирование опухоли. Хотя антитела против PDL1 или PD1 демонстрируют терапевтическую эффективность в подгруппе пациентов с раком, большая часть пациентов не получают пользу от лечения антителами. Таким образом, необходим механизм регулирования функции PD-L1, который приведет к новому универсально применимому лечению для минимизирования PD-L1-опосредованной иммунной супрессии у пациентов с раком и который является более эффективным по сравнению с доступными в настоящее время mAb против PD-1 или PD-L1.
Характеристикой множества эпителиальных форм рака, таких как рак толстой кишки, головы и шеи, молочной железы, яичника, немелкоклеточный рак легкого (NSCL) и рак поджелудочной железы, является аномально высокие уровни рецептора эпидермального фактора роста (EGFR) на поверхности раковых клеток. Семейство рецепторов эпидермального фактора роста (EGFR; HER1, HER2/new, HER3 и HER4) включает рецепторы клеточной мембраны с собственной тирозинкиназной активностью, которая запускает каскад биофизиологических сигнальных реакций в ответ на связывание различных лигандов. Эти рецепторы играют ключевую роль в поведении злокачественных клеток во множестве человеческих опухолей, вызывая увеличенную пролиферацию, уменьшая апоптоз и усиливая подвижность опухолевой клетки и ангиогенез. Таким образом, настоящее изобретение включает антитела, направленного взаимодействия с членами семейства EGFR.
Таким образом, в настоящем изобретении предложены способы снижения роста раковых клеток путем противодействия иммунной толерантности раковых клеток, где T-клетки остаются активными и ингибируют рекрутинг T-регуляторных клеток, которые, как известно, подавляют ответ иммунной системы на опухоль. Таким образом, химерные полипептиды, продуцированные полинуклеотидными последовательностями по настоящему изобретению, полезны для лечения рака из-за экспрессирующихся слитых или химерных полипептидов.
В одном из аспектов в настоящем изобретении предложены химерные полипептиды, содержащие по меньшей мере одну группировку направленного взаимодействия для нацеливания на раковую клетку и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковой клетки, где группировка направленного взаимодействия и иммуномодулирующая группировка связаны аминокислотным спейсером с достаточной длиной, измеряемой количеством аминокислотных остатков, так, что обе группировки могут успешно связываться с их отдельными мишенями. Альтернативно, группировка направленного взаимодействия и иммуномодулирующая группировка, противодействующая иммунной толерантности раковой клетки, могут быть связаны непосредственно друг с другом. Химерные/слитые полипептиды по изобретению полезны для связывания с рецептором раковой клетки и снижения способности раковых клеток избегать иммунного ответа.
Предпочтительно, группировка направленного взаимодействия представляет собой антитело, обладающее связывающей аффинностью в отношении CTLA-4 или EGFR1, транскрибирующееся из полинуклеотидной последовательности, лишенной нуклеотидов для экспрессии C-концевого лизина тяжелой цепи экспрессирующегося антитела. Обнаружено, что при удалении C-концевого лизина тяжелой цепи антитела во время транскрипции конечный продукт демонстрирует увеличенную гомогенность, таким образом уменьшая необходимость в дальнейшей очистке и ее стоимость.
Известно, что во время процесса транскрипции и трансляции молекулы IgG в клетках CHO (клетки яичника китайского хомячка) будет экспрессироваться лизин (K) на C-конце тяжелой цепи. В имеющемся в продаже продукте такие экспрессированные лизины должны быть удалены для увеличения чистоты. Существует значительная гетерогенность в получаемом продукте, как представлено на Фиг. 1. Это происходит потому, что в клетках CHO имеется эндогенный фермент карбоксипептидаза B (CPB), который расщепляет C-концевой лизин до тех пор, пока экспрессирующееся антитело все еще находится внутри клетки. Тем не менее, как только антитело секретируется в среду, этот фермент не расщепляет лизин. Таким образом, эффективность расщепления этой эндогенной CPB основана на доступности внутри клетки. Сами по себе некоторые из антител будут секретироваться с лизином, а некоторые без него, и такая комбинация вызовет значительную гетерогенность в секретированном продукте, заключающуюся в том, что некоторые антитела будут иметь C-концевой лизин, а некоторые нет. Поскольку рекомбинантный продукт используется для терапевтического применения, его необходимо очищать до гомогенности. Таким образом, рекомбинантные продукты предшествующего уровня техники требуют дополнительных стадий очистки, где рекомбинантный продукт необходимо сначала обрабатывать ферментом CPB и очищать еще раз, используя дополнительную стадию для удаления любого лизина и фермента CPB из конечного продукта. Эти дополнительные стадии добавляют значительную стоимость способу получения.
Настоящее изобретение позволяет избежать недостатков предшествующих способов синтеза рекомбинантных антител против CTLA-4 и против EGFR1 путем транскрибирования экспрессирующегося белка из полинуклеотидной последовательности, лишенной нуклеотидов для экспрессии C-концевого лизина на тяжелой цепи экспрессирующегося антитела.
Настоящее изобретение основано на получении химерных/слитых белков путем экспрессии полинуклеотидов, кодирующих слитые белки, противодействующие или обращающие иммунную толерантность раковых клеток. Раковые клетки способны избежать элиминации химиотерапевтическими агентами или антителами направленного взаимодействия с опухолью при помощи специфических иммуносупрессивных механизмов в опухолевом микроокружении, и такая способность раковых клеток рассматривается как иммунная толерантность. Такие иммуносупрессивные механизмы включают иммуносупрессивные цитокины (например трансформирующий фактор роста бета (TGF-β)) и регуляторные T-клетки и/или иммуносупрессивные миелоидные дендритные клетки (DC). Путем противодействия вызванной опухолью иммунной толерантности в настоящем изобретении предложены эффективные композиции и способы лечения рака, возможно в комбинации с другим существующим лечением рака. В настоящем изобретении предложены стратегии противодействия вызванной опухолью иммунной толерантности и усиления противоопухолевой эффективности химиотерапии путем активации и эффективного использования опосредованного T-клетками адаптивного противоопухолевого антитела против резистентных или диссеминированных раковых клеток.
В другом аспекте настоящего изобретения предложена молекула, содержащая по меньше мере одну группировку направленного взаимодействия, слитую с по меньшей мере одной иммуномодулирующей группировкой. Группировка направленного взаимодействия специфически связывается с молекулой-мишенью, а иммуномодулирующая группировка специфически связывается с одной из следующих молекул: (1) трансформирующий фактор роста бета (TGF-β) и/или (2) лиганд 1 запрограммированной гибели-1 (PD-L1).
В еще одном аспекте группировка направленного взаимодействия включает антитело, содержащее как тяжелую цепь, так и легкую цепи, специфически связывающееся с компонентом опухолевой клетки, опухолевым антигеном, сосудистой сетью опухоли, микроокружением опухоли или инфильтрирующей опухоль иммунной клеткой. Стоит отметить, что тяжелая цепь и/или легкая цепь может быть отдельно связана с иммуномодулирующей группировкой того же типа или отдельной и отличной иммуномодулирующей группировкой. Кроме того, тяжелая или легкая цепь антительной группировки направленного взаимодействия может быть связана с иммуномодулирующей группировкой, которая, в свою очередь, может быть дополнительно связана со второй иммуномодулирующей группировкой, причем имеется линкер между двумя иммуномодулирующими группировками.
В еще одном аспекте предложен химерный полипептид, содержащий группировку направленного взаимодействия с опухолью и иммуномодулирующую группировку, включающую молекулу, связывающую трансформирующий фактор роста бета (TGF-β), где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с EGFR1, где антитело может представлять собой полноразмерное антитело, тяжелую цепь или легкую цепь.
Группировка направленного взаимодействия с опухолью может включать моноклональные антитела, которые направленно взаимодействуют с раковой клеткой, включая цетуксимаб, трастузумаб, ритуксимаб, ипилимумаб, тремелимумаб, муромонаб-CD3, абциксимаб, даклизумаб, базиликсимаб, паливизумаб, инфликсимаб, гемтузумаб озогамицин, алемтузумаб, ибритумомаб тиуксетан, адалимумаб, омализумаб, тозитумомаб, I-131 тозитумомаб, эфализумаб, бевацизумаб, панитумумаб, пертузумаб, натализумаб, этанерцепт, IGN101 (Aphton), волоциксимаб (Biogen Idee и PDL BioPharm), mAb против CD80 (Biogen Idee), mAb против CD23 (Biogen Idel), CAT-3888 (Cambridge Antibody Technology), CDP-791 (Imclone), эпратузумаб (Immunomedics), MDX-010 (Medarex и BMS), MDX-060 (Medarex), MDX-070 (Medarex), матузумаб (Merck), CP-675,206 (Pfizer), CAL (Roche), SGN-30 (Seattle Genetics), занолимумаб (Serono и Genmab), адекатумумаб (Sereno), ореговомаб (United Therapeutics), нимотузумаб (YM Bioscience), ABT-874 (Abbott Laboratories), деносумаб (Amgen), AM 108 (Amgen), AMG 714 (Amgen), фонтолизумаб (Biogen Idee и PDL BioPharm), даклизумаб (Biogent Idee и PDL BioPharm), голимумаб (Centocor и Schering-Plough), CNTO 1275 (Centocor), окрелизумаб (Genetech и Roche), HuMax-CD20 (Genmab), белимумаб (HGS и GSK), эпратузумаб (Immunomedics), MLN1202 (Millennium Pharmaceuticals), визилизумаб (PDL BioPharm), тоцилизумаб (Roche), окрелизумаб (Roche), цертолизумаб пегол (UCB, ранее Celltech), экулизумаб (Alexion Pharmaceuticals), пекселизумаб (Alexion Pharmaceuticals и Procter & Gamble), абциксимаб (Centocor), ранибизумаб (Genentech), меполизумаб (GSK), TNX-355 (Tanox), или MYO-029 (Wyeth), но не ограничиваясь ими.
В предпочтительном воплощении группировка направленного взаимодействия с опухолью представляет собой моноклональные антитело, связывающееся с CTLA-4 или EGFR1, созданное способами по настоящему изобретению, включающими осуществление следующих стадий:
а. получение кодон-оптимизированной нуклеотидной последовательности, кодирующей слитый белок, где кодон-оптимизированная последовательность для антитела лишена нуклеотидов для экспрессии лизина на C-конце тяжелых цепей антитела;
б. клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к транзиентной или непрерывной экспрессии;
в. выращивание клетки-хозяина в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
г. сбор секретированных слитых белков.
В еще одном аспекте иммуномодулирующая группировка включает молекулу, связывающуюся с TGF-β и ингибирующую его функцию. Конкретно, иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен рецептора трансформирующего фактора роста бета TGF-βRII, TGF-βRIIb или TGF-βRIII. В еще одном аспекте иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен (ECD) TGF-βRII
В еще одном аспекте группировка направленного взаимодействия включает антитело, специфически связывающееся с HER2/neu, EGFR1, CD20 или антигеном 4 цитотоксических Т-лимфоцитов (CTLA-4), и где иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен TGF-βRII.
В еще одном аспекте иммуномодулирующая группировка включает молекулу, специфически связывающуюся с лигандом 1 запрограммированной гибели-1 (PD-L1) и ингибирующую его активность.
В еще одном аспекте группировка направленного взаимодействия включает антитело, фрагмент антитела или полипептид, специфически связывающиеся с HER2/neu, EGFR1, CD20, антигеном 4 цитотоксических Т-лимфоцитов (CTLA-4), CD25 (рецептор lL-2a; IL-2aR) или CD4, и где иммуномодулирующая группировка включает внеклеточный связывающийся с лигандом домен или эктодомен запрограммированной гибели-1 (PD-1).
В еще одном аспекте группировка направленного взаимодействия включает антитело, специфически связывающееся с EGFR1 и CTLA-4, а иммуномодулирующая группировка включает последовательность, взаимодействующую с трансформирующим фактором роста-β (TGF-β).
В одном из аспектов настоящего изобретения предложены оптимизированные гены, кодирующие слитый полипептид, содержащий по меньшей мере одну группировку направленного взаимодействия и по меньшей мере одну иммуномодулирующую группировку, для лечения рака у субъекта-человека, где гены оптимизированы для повышения их экспрессии у субъекта-человека и/или в клетках.
В еще одном аспекте настоящего изобретения предложен вектор, содержащий оптимизированные гены, для лечения рака у субъекта-человека, модифицированные для увеличения содержания последовательностей CG. Предпочтительно, вектор содержит нуклеотидные последовательности, кодирующие по меньшей мере одну группировку направленного взаимодействия, по меньшей мере одну иммуномодулирующую группировку и связывающую группировку, где оптимизированные нуклеотидные последовательности выбраны из SEQ ID NO: 1-7, как представлено на Фиг. 2.
В еще одном аспекте настоящего изобретения предложен способ лечения рака у субъекта, включающий:
получение по меньшей мере одного рекомбинантного вектора, содержащего нуклеотидные последовательности, кодирующие по меньшей мере одну группировку направленного взаимодействия, по меньшей мере одну иммуномодулирующую группировку и связывающую группировку, расположенную между группировкой направленного взаимодействия и иммуномодулирующей группировкой, где нуклеотидные последовательности выбраны из SEQ ID NO: 1-7; и
введение субъекту рекомбинантного вектора в таких условиях, что указанные нуклеотидные последовательности экспрессируются на уровне, при котором у субъекта продуцируется терапевтически эффективное количество кодируемых слитых белков.
В еще одном аспекте настоящего изобретения предложена рекомбинантная клетка-хозяин, трансфицированная полинуклеотидной последовательностью, кодирующей слитый пептид по настоящему изобретению, где полинуклеотидные последовательности выбраны из SEQ ID NO: 1-7.
В еще одном аспекте настоящее изобретение охватывает способ получения химерного слитого белка по настоящему изобретению, включающий:
трансфицирование клетки-хозяина полинуклеотидной последовательностью, кодирующей химерный слитый белок, с получением трансформированной клетки-хозяина, где полинуклеотидная последовательность кодирует по меньшей мере одну группировку направленного взаимодействия и по меньшей мере одну иммуномодулирующую группировку, где полинуклеотидная последовательность содержит комбинацию последовательностей, выбранных из SEQ ID NO: 1-7; и
поддержание трансформированной клетки-хозяина в биологических условиях, достаточных для экспрессии химерного слитого белка.
В еще одном аспекте настоящее изобретение относится к применению химерного слитого белка, содержащего анти-EGFR1-линкер-PD1 (SEQ ID NO: 8, 9, 10 и 11); анти-EGFR1-линкер-TGFβRII (SEQ ID NO: 8, 9, 10 и 12); анти-CTLA-4-линкер-PD1 (SEQ ID NO: 13, 14, 10 и 11), как показано на Фиг. 3, 4 и 5, соответственно, при использовании лекарственного средства для лечения рака. Предпочтительно, слитый белок экспрессируется в клетке-хозяине, и такие экспрессированные белки вводят в терапевтическом количестве для уменьшения эффектов рака у субъекта, нуждающегося в этом.
В еще одном аспекте настоящего изобретения предложен способ лечения неопластического заболевания. Способ включает введение субъекту, нуждающемуся в этом, одного или более чем одного слитого белка по настоящему изобретению, в различных аспектах, субъекту вводят один или более чем один слитый белок по настоящему изобретению в комбинации с другой противораковой терапией. В одном из аспектов противораковая терапия включает химиотерапевтическую молекулу, антитело, низкомолекулярный киназный ингибитор, гормональный агент или цитотоксический агент. Антираковая терапия может также включать ионизирующее излучение, ультрафиолетовое излучение, криоабляцию, термическую абляцию или радиочастотную абляцию.
В предпочтительном воплощении терапевтически активные слитые белки антитело-пептид представляют собой антитело направленного взаимодействия, слитое с одной или более чем одной иммуномодулирующей группировкой, противодействующей иммунной толерантности раковой клетки. В одном из аспектов иммуномодулирующая группировка может быть связана посредством аминокислотного спейсера, длина которого достаточна для обеспечения возможности биспецифического связывания молекулы. Иммуномодулирующая группировка может быть связана либо с N-концом или с C-концом тяжелой цепи, либо с N-концом или C-концом легкой цепи антитела.
В способе по настоящему изобретению предложены нуклеотидные последовательности, кодирующие терапевтически активные слитые белки антитело-пептид, и такая экспрессия может быть проведена в транзиентной клеточной линии или стабильной клеточной линии. Транзиентную экспрессию осуществляют путем трансфицирования или трансформирования клетки-хозяина векторами, несущими кодируемые слитые белки, в клетки-хозяева млекопитающих.
После экспрессии слитых пептидов их предпочтительно подвергают очистке и тестам in vitro для проверки их биспецифичности, то есть того, обладают ли они способностью связываться как с группировкой направленного взаимодействия, так и с иммуномодулирующей группировкой. Такие тесты могут включать тесты in vitro, такие как ELISA (иммуноферментный анализ) или анализы связывания с NK/T-клетками, для валидации бифункционального связывания с мишенями или стимулирования иммунной клетки.
Стоит отметить, что когда специфические слитые пептиды демонстрируют желаемую биспецифичность, тогда полинуклеотидные последовательности, кодирующие такие слитые пептиды отбирают для субклонирования в стабильную клеточную линию для более крупномасштабной экспрессии и очистки. Такие стабильные клеточные линии были раскрыты ранее, такие как линия клеток млекопитающих, включая HEK293, CHO или NSO, но не ограничиваясь ими.
В другом аспекте настоящего изобретения предложен способ ингибирования и/или уменьшения связывания PDL1 с PD1, увеличивая тем самым иммунный ответ против опухолевых клеток, включающий:
а. получение химерного полипептида, содержащего PD1 и антитело против EGFR1 или против CTLA-4; и
б. приведение опухолевой клетки в контакт с химерным полипептидом, связывающимся с по меньшей мере PDL1 опухолевой клетки.
В еще одном аспекте настоящего изобретения предложен способ получения терапевтически активных слитых белков антитело-пептид, включающий:
а. получение кодон-оптимизированной последовательности указанного слитого белка, где кодон-оптимизированные последовательности для антител против EGFR1 и против CTLA-4 лишены нуклеотидов для экспрессии лизина на C-конце тяжелых цепей антител;
б. клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к транзиентной или непрерывной экспрессии;
в. выращивание клетки-хозяина в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
г. сбор секретированных слитых белков.
В еще одном аспекте настоящего изобретения предложена последовательность нуклеиновой кислоты, кодирующая химерный слитый белок, содержащий по меньшей мере одну группировку направленного взаимодействия, обладающую аффинностью в отношении раковой клетки, и по меньшей мере одну иммуномодулирующую группировку, противодействующую иммунной толерантности раковой клетки, где группировка направленного взаимодействия представляет собой антитело, и последовательность нуклеиновой кислоты группировки направленного взаимодействия лишена нуклеотидов для экспрессии лизина на C-конце тяжелых цепей антитела. Последовательность нуклеиновой кислоты, кодирующая тяжелую цепь антитела предпочтительно включает SEQ ID NO: 1 или SEQ ID NO:5. Последовательность нуклеиновой кислоты, кодирующая химерные слитые белки, предпочтительно содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 2, 4 и 7; SEQ ID NO: 1, 2, 3 и 4; и SEQ ID NO: 5, 6, 3 и 4.
В еще одном аспекте настоящего изобретения предложен способ лечения рака у субъекта, включающий:
а. получение терапевтически активного слитого белка, содержащего группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую молекулу, где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с CTLA-4 или EGFR1, и где слитый белок получают осуществлением следующих стадий:
1) получение кодон-оптимизированной нуклеотидной последовательности, кодирующей слитый белок, где кодон-оптимизированная нуклеотидная последовательность для антитела лишена нуклеотидов для экспрессии лизина на C-конце тяжелых цепей антитела;
2) клонирование оптимизированной последовательности указанного слитого белка в клетке-хозяине, способной к транзиентной или непрерывной экспрессии;
3) выращивание клетки-хозяина в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
4) сбор секретированных слитых белков;
б. введение субъекту терапевтически активного количества секретированных слитых белков.
Слитый белок выбран из группы аминокислотных последовательностей, состоящей из SEQ ID NO: 15 и 9; SEQ ID NO: 8 и 16; SEQ ID NO: 17 и 9; SEQ ID NO: 8 и 18; SEQ ID NO: 27 и 9; SEQ ID NO: 8 и 28; SEQ ID NO: 29 и 9; SEQ ID NO: 8 и 30; SEQ ID NO: 31 и 28; SEQ ID NO: 31 и 30; SEQ ID NO: 29 и 28; SEQ ID NO: 29 и 30; SEQ ID NO: 32 и 14; SEQ ID NO: 13 и 33; SEQ ID NO: 34 и 14; SEQ ID NO: 13 и 35; SEQ ID NO: 32 и 33; SEQ ID NO: 32 и 35; SEQ ID NO: 34 и 33 и SEQ ID NO: 34 и 35.
В другом аспекте настоящего изобретения предложен способ лечения неопластического заболевания, включающий введение субъекту, нуждающемуся в этом, одного или более чем одного слитого белка, кодируемого по меньшей мере одной полинуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, 2, 4 и 7; SEQ ID NO: 1, 2, 3 и 4; и SEQ ID NO: 5, 6, 3 и 4. Стоит отметить, что путем использования указанных выше полинуклеотидных последовательностей может экспрессироваться следующая комбинация слитых белков, включая анти-EGFR1-линкер-PD1 (SEQ ID NO: 8, 9, 10 и 11); анти-EGFR1-линкер-TGFβRII (SEQ ID NO: 8, 9, 10 и 12); и анти-CTLA-4-линкер-PD1 (SEQ ID NO: 13, 14, 10 и 11).
Другие признаки и преимущества изобретения станут понятны из следующего подробного описания, графических материалов и формулы изобретения.
Краткое изложение графических материалов
На Фиг. 1 показаны различные возможности расположения лизина на тяжелой цепи, и такая гетерогенность приводит к необходимости производить очистку.
На Фиг. 2 показаны кодон-оптимизированные нуклеотидные последовательности, использованные для экспрессии слитых белков антитело-пептид по настоящему изобретению, включая тяжелую цепь антитела против EGFR1 (SEQ ID NO: 1); легкую цепь антитела против EGFR1 (SEQ ID NO: 2); PD1 (SEQ ID NO: 7); линкер (SEQ ID NO: 4); тяжелую цепь антитела против CTLA-4 (SEQ ID NO: 5); легкую цепь антитела против CTLA-4 (SEQ ID NO: 6) и TGFβRII (SEQ ID NO: 3).
На Фиг. 3 показаны аминокислотные остатки для конструкции анти-EGFR1-линкер-PD1 (SEQ ID NO: 8, 9, 10 и 11).
На Фиг. 4 показаны аминокислотные остатки для конструкции анти-EGFR1-линкер-TGFβRII (SEQ ID NO: 8, 9, 10 и 12).
На Фиг. 5 показаны аминокислотные остатки для анти-CTLA-4-линкер-PD1 (SEQ ID NO: 13, 14, 10 и 11).
На Фиг. 6 показаны различные возможности для расположения молекулы PD1 на антителе против EGFR1 для FMab5, FMab6, FMab7 и FMab8.
На Фиг. 7 показаны аминокислотные последовательности для анти-EGFR1 HC-PD1 + анти-EGFR1 LC, где молекула PD1 связана с C-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 15 и 9.
На Фиг. 8 показаны аминокислотные последовательности для анти-EGFR1 HC + анти-EGFR1 LC-PD1, где молекула PD1 связана с C-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 16.
На Фиг. 9 показаны аминокислотные последовательности для анти-EGFR1 HC + анти-EGFR1 LC-PD1, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 17 и 9.
На Фиг. 10 показаны аминокислотные последовательности для анти-EGFR1 HC + PD1-анти-EGFR1 LC, где молекула PD1 связана с N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 18.
На Фиг. 11 показаны экспрессионные конструкции, разработанные с использованием кДНК, как представлено в SEQ ID NO: 1, 2 и 7.
На Фиг. 12 показаны различные возможности для размещения молекулы TGFβRII на антителе против EGFR1, FMabl, FMab2, FMab3, FMab4, FMab9, FMab10, FMab11 и FMab12.
На Фиг. 13 показаны аминокислотные последовательности для анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC, где молекула TGFβRII связана с C-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 27 и 9.
На Фиг. 14 показаны аминокислотные последовательности для анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII, где молекула TGFβRII связана с C-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 28.
На Фиг. 15 показаны аминокислотные последовательности для TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC, где молекула TGFβRII связана с N-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 29 и 9.
На Фиг. 16 показаны аминокислотные последовательности для анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC, где молекула TGFβRII связана с N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 8 и 30.
На Фиг. 17 показаны аминокислотные последовательности для анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC-TGFβRII, где молекула TGFβRII связана с C-концом тяжелой и легкой цепи, отделенной линкером; включают SEQ ID NO: 31 и 28.
На Фиг. 18 показаны аминокислотные последовательности для анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC, где молекула TGFβRII связана с C-концом тяжелой цепи и N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 31 и 30.
На Фиг. 19 показаны аминокислотные последовательности для TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII, где молекула TGFβRII связана с N-концом тяжелой цепи и C-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 29 и 28.
На Фиг. 20 показаны аминокислотные последовательности для TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC, где молекула TGFβRII связана с N-концом тяжелой цепи и N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 29 и 30.
На Фиг. 21 показаны экспрессионные конструкции, разработанные с использованием кДНК, как представлено в SEQ ID NO: 1, 2 и 3.
На Фиг. 22 показаны образцы, очищенные на белке А, анализируемые на 12% редуцирующем SDS-PAGE (элекрофорез в полиакриламидном геле с додецилсульфатом натрия).
На Фиг. 23 показаны образцы, очищенные на белке А, анализируемые на 6% нередуцирующем SDS-PAGE.
На Фиг. 24 показаны различные возможности для размещения молекулы PD1 на антителе против CTLA4.
На Фиг. 25 показаны аминокислотные последовательности анти-CTLA4 HC-PD1 + анти-CTLA4 LC, где молекула PD1 связана с C-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 32 и 14.
На Фиг. 26 показаны аминокислотные последовательности для анти-CTLA4 HC + анти-CTLA4 LC-PD1, где молекула PD1 связана с C-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 13 и 33.
На Фиг. 27 показаны аминокислотные последовательности для PD1-анти-CTLA4 HC + анти-CTLA4 LC, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером; включают SEQ ID NO: 34 и 14.
На Фиг. 28 показаны аминокислотные последовательности для анти-CTLA4 HC + PD1-анти-CTLA4 LC, где молекула PD1 связана с N-концом легкой цепи, отделенной линкером; включают SEQ ID NO: 13 и 35.
На Фиг. 29 показаны аминокислотные последовательности для анти-CTLA4 HC-PD1 + анти-CTLA4 LC-PD1, где молекула PD1 связана с C-концом тяжелой цепи и легкой цепи, отделенной линкером; включают SEQ ID NO: 32 и 33.
На Фиг. 30 показаны аминокислотные последовательности для анти-CTLA4 HC-PD1 + PD1-анти-CTLA4 LC, где молекула PD1 связана с C-концом тяжелой цепи, отделенной линкером, и N-концом легкой цепи; включают SEQ ID NO: 32 и 35.
На Фиг. 31 показаны аминокислотные последовательности для PD1-анти-CTLA4 HC + анти-CTLA4 LC-PD1, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером, и C-концом легкой цепи, и включают SEQ ID NO: 34 и 33.
На Фиг. 32 показаны аминокислотные последовательности для PD1-анти-CTLA4 HC + PD1-анти-CTLA4 LC, где молекула PD1 связана с N-концом тяжелой цепи, отделенной линкером, и N-концом легкой цепи; включают SEQ ID NO: 34 и 35.
На Фиг. 33 показаны экспрессионные конструкции, разработанные с использованием кДНК, как представлено в SEQ ID NO: 7, 5 и 6.
На Фиг. 34 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 35 показано связывание с мишенью TGFβ в ELISA. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 36 показан бифункциональный ELISA. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 37 показан анализ путем проточной цитометрии связывания слитого анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab с клетками A431, экспрессирующими EGFR1.
На Фиг. 38 показана ADCC (антителозависимая клеточная цитотоксичность) против клеток A-431, экспрессирующих EGFR1. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab опосредует ADCC против клеток A-431, экспрессирующих EGFR1, и эффект является дозозависимым.
На Фиг. 39 показан анализ ингибирования пролиферации. Слитое анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC Mab ингибирует пролиферацию клеток A-431, экспрессирующих EGFR1.
На Фиг. 40 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 41 показано связывание с мишенью TGFp в ELISA. Слитое анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII Mab связывается со своей мишенью TGFβ.
На Фиг. 42 показан бифункциональный ELISA. Слитое анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 43 показан анализ ингибирования пролиферации. Слитое анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII Mab ингибирует пролиферацию клеток A-431, экспрессирующих EGFR1.
На Фиг. 44 показано связывание с мишенью EGFR1 в ELISA. Слитое TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 45 показано связывание с мишенью TGFP в ELISA. Слитое TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 46 показан бифункциональный ELISA. Слитое TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 47 показан анализ ингибирования пролиферации. Слитое TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC Mab ингибирует пролиферацию клеток A-431, экспрессирующих EGFR1.
На Фиг. 48 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 49 показано связывание с мишенью TGFβ в ELISA. Слитое анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 50 показан бифункциональный ELISA. Слитое анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 51 показан анализ путем проточной цитометрии связывания слитого анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab с клетками A431, экспрессирующими EGFR1.
На Фиг. 52 показано связывание с мишенью EGFR1 в ELISA. Слитое анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 53 показано связывание с мишенью TGFβ в ELISA. Слитое анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 54 показан бифункциональный ELISA. Слитое анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC одновременно Mab связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 55 показано связывание с мишенью EGFR1 в ELISA. Слитое TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab связывается со своей иммобилизованной мишенью EGFR1.
На Фиг. 56 показано связывание с мишенью TGFβ в ELISA. Слитое TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab связывается со своей мишенью TGFβ.
На Фиг. 57 показан бифункциональный ELISA. Слитое TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR1 и TGFβ.
На Фиг. 58 показан бифункциональный ELISA. Слитое анти-CTLA4 HC-PD1 + анти-CTLA4 LC Mab одновременно связывается с обеими своими мишенями CTLA4 и PDL1.
На Фиг. 59 показан бифункциональный ELISA. Слитое анти-CTLA4 HC + анти-CTLA4 LC-PD1 Mab одновременно связывается с обеими своими мишенями CTLA4 и PDL1.
На Фиг. 60 показан бифункциональный ELISA. Слитое PD1-анти-CTLA4 HC + анти-CTLA4 LC Mab одновременно связывается с обеими своими мишенями CTLA4 и PDL1.
На Фиг. 61 показан бифункциональный ELISA. Слитые анти-CTLA4 HC-PD1 + PD1-анти-CTLA4 LC-PD1, анти-CTLA4 HC-PD1 + анти-CTLA4 LC-PD1 и анти-CTLA4 HC-PD1 + PD1-анти-CTLA4 LC Mab одновременно связываются с обеими своими мишенями CTLA4 и PDL1.
На Фиг. 62 показан бифункциональный ELISA. Слитые PD1-анти-CTLA4 HC + анти-CTLA4 LC-PD1 и PD1-анти-CTLA4 HC + PD1-анти-CTLA4 LC Mab одновременно связываются с обеими своими мишенями CTLA4 и PDL1.
На Фиг. 63 показан бифункциональный ELISA. Слитое анти-EGFR1 HC-PD1 + анти-EGFR1 LC Mab одновременно связывается с обеими своими мишенями EGFR и PDL1.
На Фиг. 64 показан бифункциональный ELISA. Слитое анти-EGFR1 HC + анти-EGFR1 LC-PD1 Mab одновременно связывается с обеими своими мишенями EGFR и PDL1.
Подробное описание изобретения
Для того чтобы облегчить обзор различных воплощений изобретения и понимания различных элементов и составляющих, использованных при создании и при использовании настоящего изобретения, следующие термины, использованные в описании изобретения, имеют следующие значения.
Использованные здесь термины "полипептид", "белок" и "пептид" используются взаимозаменяемо для обозначения полимерной последовательности из по меньшей мере двух аминокислот, ковалентно связанных амидной связью, независимо от длины или посттрансляционной модификации (например гликозилирования, фосфорилирования, липидизации, миристилирования, убиквитинирования и тому подобного). Также включены D- и L-аминокислоты и смеси D- и L-аминокислот.
Химерный полипептид относится к аминокислотной последовательности, имеющей две или более чем две части, которые как правило не обнаруживают вместе в аминокислотной последовательности в природе.
Используемый здесь термин "спейсер/линкер" относится к молекуле, которая связывает две мономерные белковые единицы с образованием химерной молекулы, а также предложена для связывания частей с желаемыми рецепторами. Конкретные примеры спейсера/линкеров могут включать аминокислотный спейсер, где три аминокислотные последовательности могут иметь по существу любую длину, например всего лишь 5 или до 200 или более предпочтительно от примерно 5 до 30 аминокислотных остатков.
Используемый здесь термин "терапевтический" означает лечение, применяемое к субъекту, у которого представлены симптомы патологии, для уменьшения или устранения этих симптомов.
Используемый здесь термин "терапевтически эффективное количество" означает количество химерного белка, которое достаточно для того, чтобы обеспечить благоприятное действие в отношении субъекта, которому вводят химерный белок.
Еще один пример модификации представляет собой добавление гетерологичного домена, придающего особую функциональность химерному полипептиду. Гетерологичный домен может представлять собой любую небольшую органическую или неорганическую молекулу или макромолекулу, если она придает дополнительную функцию. Конкретные примеры гетерологичных доменов, придающих отличительную функцию, включают аминокислотную последовательность, которая придает направленное воздействие на мишень (например лиганд рецептора, антитело и т.п.), иммуностимулирующую функцию (например иммуноглобулин, адъювант), обеспечивают очистку, выделение или обнаружение (например myc, метка T7, полигистидин, авидин, биотин, лектины и т.д.).
Как приведено здесь в примерах, полипептидные последовательности могут включать замены, вариации или дериватизации аминокислотной последовательности одной или обеих полипептидных последовательностей, которые включают химерный полипептид, до тех пор, пока модифицированный химерный полипептид обладает по существу той же самой активностью или функцией, что и немодифицированный химерный полипептид.
Использованный здесь термин "по существу та же самая активность или функция" при использовании в отношении таким образом модифицированного химерного полипептида означает, что полипептид сохраняет наибольшую часть, всю или большую часть активности, ассоциированной с немодифицированным полипептидом, как описано здесь или известно из уровня техники.
Включенные здесь модифицированные химерные полипептиды, которые являются "активными" или "функциональными", могут быть идентифицированы при помощи стандартного функционального анализа. Например, с использованием анализов связывания антитела или анализов связывания корецептора легко можно определить, обладает ли модифицированный химерный полипептид активностью. Поскольку модифицированный химерный полипептид сохраняет активность или функцию, ассоциированную с немодифицированным химерным полипептидом, то модифицированный химерный полипептид в общем имеет аминокислотную последовательность, "по существу идентичную" или "по существу гомологичную" аминокислотной последовательности немодифицированного полипептида.
Использованный здесь термин "по существу идентичный" или "по существу гомологичный", использованный в отношении полипептидной последовательности, означает, что последовательность полипептида по меньшей мере на 50% идентична референсной последовательности. Модифицированные полипептиды и по существу идентичные полипептиды как правило имеют по меньшей мере 70%, альтернативно 85%, более вероятно 90%, и наиболее вероятно 95% гомологию с референсным полипептидом.
В соответствии с изложенным здесь, по существу идентичные или гомологичные полипептиды включают добавки, усечения, внутренние делеции или вставки, консервативные и неконсервативные замены или другие модификации, расположенные в положениях аминокислотной последовательности, которые лишают химерный полипептид функции (определенной в соответствии с функциональными анализами, например, описанными здесь). Конкретный пример замены представляет собой пример, когда одна или более чем одна аминокислота заменена другим химически или биологически похожим остатком. Использованный здесь термин "консервативная замена" относится к замене одного остатка на химически или биологически похожий остаток. Примеры консервативных замен включают замену гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой остаток, замену полярного остатка на другой остаток, такую как замена аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин и т.п. Специалистам в данной области техники известны многочисленные аминокислоты, которые могут быть модифицированы или заменены на другие химически похожие остатки по существу без изменения активности.
Модифицированные полипептиды дополнительно включают "химические производные", в которых одна или более чем одна аминокислота имеет боковую цепь, которая изменена химически или дериватизирована. Такие дериватизированные полипептиды включают, например, аминокислоты, в которых свободные аминогруппы образуют гидрохлориды, пара-толуолсульфонильные группы, карбобензоксигруппы амина; свободные карбоксигруппы образуют соли, метиловые и этиловые эфиры; свободные гидроксильные группы образуют O-ацильные или O-алкильные производные, а также встречающиеся в природе аминокислотные производные, например 4-гидроксипролин для пролина, 5-гидроксилизин для лизина, гомосерин для серина, орнитин для лизина и т.п. Также включены D-аминокислоты и аминокислотные производные, которые могут изменять ковалентное связывание, например дисульфидная связь, которая образуется между двумя цистеиновым остатками, что приводит к циклизированному полипептиду.
Использованные здесь термины "выделенный" или "по существу чистый" при использовании в отношении модификатора химерных полипептидов, фрагментов их последовательности и полинуклеотидов по изобретению, означают, что они получены вследствие вмешательства человека и выделены из естественного для них клеточного окружения in vivo. Как правило, выделенные таким образом полипептиды и полинуклеотиды по существу свободны от других белков, нуклеиновых кислот, липидов, углеводов или других веществ, с которыми они связаны в природе.
Полипептиды по настоящему изобретению могут быть получены при помощи стандартных методик, хорошо известных специалистам в данной области техники. Такие методики включают, без ограничения, выделение и очистку из тканей, в отношении которых известно, что они содержат этот полипептид, и экспрессию из клонированной ДНК, которая кодирует такой полипептид, с использованием трансформированных клеток. Химерный полипептид может быть получен путем экспрессии полинуклеотида, кодирующего полипептид в клетке-хозяине, такой как бактерия, дрожжи или клетка млекопитающих, и очистки экспрессированного химерного полипептида путем очистки с использованием типичных биохимических способов (например иммуноаффинная очистка, гель-фильтрация, скрининг экспрессии и т.п.). Другие хорошо известные способы описаны в Deutscher et al., 1990. Альтернативно, химерный полипептид может быть химически синтезирован. Чистота может быть измерена при помощи любого подходящего способа, например электрофореза в полиакриламидном геле и последующего окрашивания геля (например окрашивание серебром) или при помощи анализа HPLC (высокоэффективная жидкостная хроматография).
В настоящем изобретении также предложены полинуклеотидные последовательности, кодирующие химерные полипептиды, их фрагменты и комплементарные последовательности. Использованные здесь термины "нуклеиновая кислота", "полинуклеотид", "олигонуклеотид" и "праймер" используются взаимозаменяемо в отношении дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК), как двух-, так и одноцепочечной, линейной или кольцевой. РНК может представлять собой несплайсированную или сплайсированную мРНК, рРНК, тРНК или антисмысловую РНКи. ДНК может представлять собой комплементарную ДНК (кДНК), геномную ДНК или антисмысловую. Определенно включены нуклеотидные аналоги и производные, такие как аналоги и производные, резистентные к деградации нуклеазой, которые могут функционировать для кодирования химерного полипептида по изобретению. Олигонуклеотиды и полинуклеотиды, резистентные к нуклеазе, особенно полезны для описанных здесь вакцин на основе нуклеиновых кислот по настоящему изобретению.
"Выделенный" или "по существу чистый" полинуклеотид означает, что нуклеиновая кислота непосредственно не сопряжена с кодирующими последовательностями или с 5'-конца, или с 3'-конца, с которым она непосредственно сопряжена во встречающемся в природе геноме организма, из которого она имеет происхождение. Таким образом, указанный термин включает, например, рекомбинантную ДНК (например кДНК или фрагмент геномной ДНК, получаемый при помощи ПЦР (полимеразная цепная реакция) или обработки эндонуклеазой рестрикции, продуцируемой во время клонирования), а также рекомбинантную ДНК, включенную в вектор, автономно реплицирующуюся плазмиду или вирус, или геномную ДНК прокариота или эукариота.
Полинуклеотидные последовательности по настоящему изобретению могут быть получены с использованием стандартных методик, известных в данной области техники (например молекулярное клонирование, химический синтез), а чистота может быть определена при помощи электрофореза в полиакриламидном или агарозном геле, анализа путем секвенирования и т.п. Полинуклеотиды также могут быть выделены с использованием гибридизации или компьютерных методик, которые хорошо известны в данной области техники. Такие методики включают, без ограничения: (1) гибридизацию библиотек геномной ДНК или кДНК с зондами для обнаружения гомологичных нуклеотидных последовательностей; (2) скрининг при помощи антител полипептидов, экспрессирующихся из последовательностей ДНК (например с использованием экспрессионной библиотеки); (3) полимеразную цепную реакцию (ПЦР) геномной ДНК или кДНК с использованием праймеров, способных к отжигу с интересующей последовательностью нуклеиновой кислоты; (4) компьютерный поиск в базах данных последовательностей, родственных данной последовательности; и (5) дифференциальный скрининг библиотеки нуклеиновых кислот с вычитанием.
Изобретение также включает по существу гомологичные полинуклеотиды. Использованный здесь термин "гомологичный" при использовании в отношении молекулы нуклеиновой кислоты относится к сходству между двумя нуклеотидными последовательностями. Когда положение нуклеотида в обеих молекулах занято идентичными нуклеотидами, тогда они являются гомологичными по данному положению. "По существу гомологичные" последовательности нуклеиновых кислот по меньшей мере на 50% гомологичны, более вероятно по меньшей мере на 75% гомологичны и наиболее вероятно на 90% гомологичны или более. Так же как с по существу гомологичными химерными полипептидами по изобретению, полинуклеотиды, по существу гомологичные полинуклеотидам по изобретению, кодирующим химерные полипептиды, кодируют полипептиды, которые сохраняют большую часть или всю активность или функцию, ассоциированную с последовательностью, которой они гомологичны. Для полинуклеотидов длина сравнения между последовательностями как правило составляет по меньшей мере 30 нуклеотидов, альтернативно по меньшей мере 50 нуклеотидов, более вероятно по меньшей мере 75 нуклеотидов и наиболее вероятно 110 нуклеотидов или более. Алгоритмы для идентификации гомологичных последовательностей, которые учитывают гэпы в полинуклеотидной последовательности и несовпадающие олигонуклеотиды, хорошо известны в данной области техники, такие как BLAST (см. Altschul, 1990).
Полинуклеотиды по настоящему изобретению могут, если это желательно: быть представлены сами по себе или находиться в носителе, подходящем для прохождения через клеточную мембрану (например полинуклеотид-липосомный комплекс или коллоидная дисперсная система), содержаться в векторе (например ретровирусном векторе, аденовирусных векторах и т.п.), связанном с инертными шариками или другими гетерологичными доменами (например антителами, лигандами, биотином, стрептавидином, лектинами и т.п.), или других подходящих композициях, раскрытых здесь или известных в данной области техники. Таким образом, могут быть получены и рассматриваться вирусные и невирусные средства доставки полинуклеотидов. Полинуклеотиды по настоящему изобретению также могут содержать дополнительные связанные с ними последовательности нуклеиновых кислот, кодирующие полипептид, обладающий отличающейся функцией, такие как изложенные здесь различные гетерологичные домены.
Полинуклеотиды по настоящему изобретению также могут быть модифицированы, например, таким образом, чтобы быть резистентными к нуклеазам для увеличения их стабильности в фармацевтической композиции. Описанные полинуклеотиды полезны для кодирования химерных полипептидов по настоящему изобретению, особенно когда такие полинуклеотиды включены в экспрессионные системы, раскрытые здесь или известные в данной области техники. Соответственно, также включены полинуклеотиды, включающие экспрессионный вектор.
Для репликации или экспрессии в клетках описанные здесь полинуклеотиды могут быть встроены в вектор. Термин "вектор" относится к плазмиде, вирусу или другому носителю, известному в данной области техники, которым можно манипулировать путем вставки или включения нуклеиновой кислоты. Такие векторы могут быть использованы для генетической манипуляции (т.е. "клонирующие векторы") или могут быть использованы для транскрипции или трансляции встроенного полинуклеотида (т.е. "экспрессионные векторы"). Вектор как правильно содержит по меньшей мере ориджин репликации для репликации в клетке и промотор. Контрольные элементы, включающие промоторы, представленные в экспрессионном векторе, включены для облегчения надлежащей транскрипции и трансляции (например сигнал сплайсинга для интронов, поддержание правильной рамки считывания гена для того, чтобы дать возможность для внутрирамочной трансляции мРНК, и стоп кодоны). Экспрессия описанных здесь полинуклеотидов in vivo или in vitro может обеспечиваться промотором, функционально связанным с нуклеиновой кислотой.
"Промотор" относится к минимальной последовательности нуклеиновой кислоты, достаточной для того, чтобы управлять транскрипцией нуклеиновой кислоты, с которой промотор функционально связан (см. Bitter 1987). Промоторы могут конститутивно управлять транскрипцией, могут быть тканеспецифическими или могут обеспечивать индуцируемую или репрессируемую транскрипцию; такие элементы в общем расположены в 5'- или 3'-областях регулируемого таким образом гена.
Использованный здесь термин "функционально связанный" означает, что выбранный полинуклеотид (например кодирующий химерный полипептид) и регуляторная(ые) последовательность(и) связана(ы) таким образом, чтобы дать возможность для транскрипции, когда подходящие молекулы (например белки активации транскрипции) связаны с регуляторной(ыми) последовательностью(ями). Как правило, промотор располагается на 5'-конце полинуклеотида и может находиться в тесной близости с сайтом инициации транскрипции для того, чтобы обеспечить регуляцию экспрессии полинуклеотида промотором.
При клонировании в бактериальных системах могут быть использованы конститутивные промоторы, такие как T7 и т.п., а также индуцибельные промоторы, такие как pL бактериофага гамма, plac, ptrp, ptac. При клонировании в системах клеток млекопитающих могут быть использованы конститутивные промоторы, такие как SV40, RSV и т.п., или индуцибельные промоторы, происходящие из генома клеток млекопитающих (например металлотионеиновый промотор) или из вирусов млекопитающих (например длинный концевой повтор вируса опухоли молочной железы мышей, поздний промотор аденовируса). Промоторы, получаемые при помощи методик рекомбинантной ДНК или синтетических методик, также могут использоваться для обеспечения транскрипции последовательностей нуклеиновой кислоты по изобретению.
Могут быть сконструированы экспрессионные системы млекопитающих, в которых рекомбинантные вирусы или вирусные элементы управляют экспрессией. Например, при использовании аденовирусных экспрессионных векторов последовательность нуклеиновой кислоты может быть лигирована с аденовирусным комплексом контроля транскрипции/трансляции, например поздним промотором и трехчленной лидерной последовательностью. Альтернативно, может быть использован промотор 7.5K вируса коровьей оспы (см. Mackett 1982; Mackett 1984; Panicali 1982).
Для дрожжевой экспрессии может быть использовано множество векторов, содержащих конститутивные или индуцибельные промоторы (см. Ausubel 1988; Grant 1987; Glover 1986; Bitter 1987; и Strathem 1982). Полинуклеотиды могут быть встроены в экспрессионный вектор для экспрессии in vitro (например, с использованием наборов для транскрипции/трансляции in vitro, имеющихся в продаже) или могут быть встроены в экспрессионный вектор, который содержит промоторную последовательность, которая облегчает экспрессию либо в прокариотах, либо в эукариотах, путем переноса подходящей нуклеиновой кислоты в подходящую клетку, орган, ткань или организм in vivo.
Использованный здесь термин "трансген" представляет собой любой фрагмент полинуклеотида, искусственно встроенный в клетку-хозяина и ставший частью организма, который развивается из этой клетки. Трансген может включать один или более чем один промотор и любую другую ДНК, такую как интроны, необходимые для экспрессии выбранной ДНК, все из которых функционально связаны с выбранной ДНК, и может включать энхансерную последовательность. Трансген может включать полинуклеотид, который частично или полностью является гетерологичным (т.е. чужеродным) в отношении трансгенного организма, или может представлять ген, гомологичный эндогенному гену организма. Трансгены могут интегрироваться в геном клеток-хозяев или поддерживаться в виде самореплицирующейся плазмиды.
Использованный здесь термин "клетка-хозяин" представляет собой клетку, в которую введен полинуклеотид, который может реплицироваться, транскрибироваться или кодировать экспрессируемый полипептид. Этот термин также включает любое потомство рассматриваемой клетки-хозяина. Понятно, что все потомство может быть не идентичным родительской клетке, поскольку могут существовать мутации, которые возникают во время репликации. Клетки-хозяева включают клетки бактерий, дрожжей, насекомых и млекопитающих, но не ограничиваются ими. Например, бактерии, трансформированные экспрессионными векторами на основе рекомбинантного полинуклеотида бактериофага, плазмидной нуклеиновой кислотой или космидной нуклеиновой кислотой; дрожжи, трансформированные рекомбинантными дрожжевыми экспрессионными векторами; системы на основе клеток растений, инфицированные рекомбинантными вирусными экспрессионными векторами (например вирусом мозаики цветной капусты, CaMV; вирусом табачной мозаики, TMV), или трансформированные рекомбинантными плазмидными экспрессионными векторами (например плазмидой Ti), системы на основе клеток насекомых, инфицированные рекомбинантными вирусными экспрессионными векторами (например бакуловирусными), или системы на основе клеток животных, инфицированные рекомбинантными вирусными экспрессионными векторами (например ретровирусными, аденовирусными, на основе вируса коровьей оспы), или трансформированные системами на основе клеток млекопитающих, сконструированными для стабильной экспрессии.
Использованный здесь термин "трансформация" означает генетическое изменение в клетке после включения полинуклеотида (например трансгена), экзогенного относительно клетки. Таким образом, "трансформированная клетка" представляет собой клетку или потомство клетки, в которые введен полинуклеотид при помощи рекомбинантных методик. Трансформация клетки-хозяина может быть осуществлена при помощи обычных методик, известных специалистам в данной области техники. Когда клетка-хозяин представляет собой эукариота, тогда способы трансформации ДНК включают, например, ортофосфат кальция, микроинъекцию, электропорацию, липосомы и вирусные векторы. Эукариотические клетки также могут быть котрансформированы полинуклеотидными последовательностями по изобретению или их фрагментами и второй молекулой ДНК, кодирующей выбираемый маркер, как здесь описано или иным образом известно в данной области техники. Еще один способ заключается в применении эукариотического вирусного вектора, такого как вирус обезьян 40 (SV40) или вирус папилломы крупного рогатого скота, для транзиентного инфицирования или трансформации эукариотических клеток и экспрессии белка (см. Gluzman 1982). Когда хозяин представляет собой прокариотический организм (например E. coli), тогда компетентные клетки, способные к захвату ДНК, могут быть получены из клеток, собираемых после фазы экспоненциального роста, и затем обработанных при помощи способа CaCl2 с использованием процедур, хорошо известных в данной области техники. Трансформация прокариот также может быть осуществлена путем слияния протопласта клетки-хозяина.
Химерные полипептиды, полинуклеотиды и экспрессионные векторы, содержащие полинуклеотиды по настоящему изобретению, могут быть инкапсулированы в липосомы с использованием стандартных методик и введены в клетки или целые организмы. Катионные липосомы являются предпочтительными для доставки полинуклеотидов. Применение липосом для введения различных композиций in vitro или in vivo, включая белки и полинуклеотиды, известно специалистам в данной области техники.
Липосомы могут быть нацелены на интересующий тип клетки или ткани путем добавления к препарату липосомы лиганда, такого как полипептид, для которого идентифицирован соответствующий клеточный рецептор. Моноклональные антитела также могут быть использованы для нацеливания; множество таких антител, специфических для широкого разнообразия белков клеточной поверхности, известны специалистам в данной области техники и являются доступными. Выбранный лиганд ковалентно конъюгируют с липидным якорем в заранее приготовленных липосомах или включают во время приготовления липосом (см. Lee 1994 и Lee 1995).
Поскольку химерные полипептиды или полинуклеотиды по настоящему изобретению будут вводиться людям, в настоящем изобретении также предложены фармацевтические композиции, содержащие раскрытые химерные полипептиды или полинуклеотиды. Таким образом, вводимые субъекту композиции находятся в "фармацевтически приемлемом" или "физиологически приемлемом" препарате.
Использованные здесь термины "фармацевтически приемлемый" и "физиологически приемлемый" относятся к носителям, разбавителям, эксципиентам и т.п., которые могут быть введены субъекту, предпочтительно без чрезмерных неблагоприятных побочных действий (например тошноты, головных болей и т.п.). Такие препараты для введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей представляют собой пропиленгликоль, полиэтиленгликоль, растительные масла, такие оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включать воду, спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и забуференные среды. Наполнители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, раствор Рингера с лактатом или нелетучие масла. Наполнители для внутривенного введения включают жидкие и питательные компенсирующие добавки, электролитные компенсирующие добавки (такие как добавки, основанные на декстрозе Рингера) и т.п. Также могут быть представлены консерванты и другие добавки, такие как, например, антимикробные вещества, антиоксиданты, хелатообразующие агенты и инертные газы и т.п. Различные фармацевтические композиции, подходящие для введения субъекту, известные в данной области техники, применимы в способах по изобретению (например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Co., Easton, PA (1990); и The Merck Index, 12th ed., Merck Publishing Group, Whitehouse, NJ (1996)).
Контроль длительности действия или контролируемая доставка вводимой композиции может быть достигнута путем включения композиции в частицы или полимерное вещество, такое как полиэфиры, полиаминокислоты, гидрогель, поливинилпирролидон, этиленвинилацетат, метилцеллюлоза, карбоксиметилцеллюлоза, протаминсульфат или лактидные/гликолидные сополимеры, полилактидные/гликолидные сополимеры или этиленвинилацетатные сополимеры. Скорость высвобождения композиции может контролироваться путем изменения концентрации или состава таких макромолекул. Коллоидные дисперсные системы включают макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и липидные системы, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы.
Композиции, вводимые при осуществлении способа по настоящему изобретению, могут быть введены парентерально путем инъекции, путем постепенной перфузии с течением времени или путем введения болюса или при помощи изготовленного микротехнологическими методами имплантируемого устройства. Композиция может быть введена путем ингаляции, внутривенным, внутрибрюшинным, внутримышечным, подкожным, внутриполостным (например вагинальным или анальным), трансдермальным, местным или внутрисосудистым путем. Композиции могут быть введены путем множественных доз. Эффективное количество легко может быть определено специалистом в данной области техники.
Если не определено иное, то все используемые здесь технические и научные термины имеют то же самое значение, как обычно понимаемое специалистами в данной области техники, к которой относится изобретение. Хотя способы и вещества, похожие на описанные здесь или эквивалентные им, могут быть использованы на практике или при тестировании по настоящему изобретению, подходящие способы и вещества описаны ниже. Другие признаки и преимущества изобретения будут понятны из следующего подробного описания и формулы изобретения. Изобретение дополнительно описано в следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
Примеры
1. Конструкция слитого белка анти-EGFR1-PD1 для раковых мишеней
Антитело против EGFR (цетуксимаб) одобрено для плоскоклеточного рака головы и шеи (распространенного локально или регионально в комбинации с радиотерапией, и метастатического после платиновой терапии) и экспрессирующего EGFR метастатического колоректального рака (монотерапия у пациентов после неблагоприятного исхода химиотерапии на основе как оксалиплатины и иринотекана у пациентов, не толерантных к химиотерапии на основе иринотекана). Не применим для пациентов с колоректальным раком (CRC), имеющих мутации K-RAS.
В различных исследованиях примерно 55-60% пациентов с mCRC (метастатический колоректальный рак) реагируют на цетуксимаб при терапии первой линии, тем не менее, этот ответ также является временным (увеличение выживаемости без прогрессирования (PFS) на 1,5-2 месяца) (EPAR). Значительная доля пациентов не реагирует на цетуксимаб или становится резистентной к терапии. При рецидивирующем метастатическом раке головы и шеи только 35% пациентов реагируют на цетуксимаб при химиотерапии лишь с 2-3 месячным увеличением общей выживаемости (OS) и PFS.
Ясно, что существует значительная неудовлетворенная потребность в увеличении эффективности терапии цетуксимабом при обоих этих показаниях. Кроме того, EGFR также экспрессируется при раке желудка, немелкоклеточном раке легкого (NSCLC) и раке поджелудочной железы. Тем не менее, для цетуксимаба не удалось доказать какую-либо значимую пользу при этих показаниях по сравнению со стандартным лечением. Таким образом, в настоящем изобретении предложено улучшение путем комбинирования цетуксимаба с иммуномодулирующей терапией.
Рецептор запрограммированной гибели-1 (PD-1) представляет собой ингибирующий рецептор, экспрессирующийся на T-клетках после активации. Показано, что он оказывает понижающую регуляцию в отношении T-клеточной активности при связывании со своим лигандом PD-L1 на APC. Множество опухолей конститутивно экспрессируют PD-L1, и его сверхэкспрессия ассоциируется с нарушением противоопухолевого иммунитета, более агрессивным заболеванием и сниженной выживаемостью (см. Thompson 2004). К настоящему моменту продемонстрировано, что экспрессия PD-L1 коррелирует с плохим прогнозом у пациентов с почечно-клеточным раком (RCC), раком яичника и меланомой. Иммуногистохимический анализ свежевыделенных образцов опухоли у пациентов с раком яичника, легкого и молочной железы, почечно-клеточной карциномой, плоскоклеточной карциномой головы и шеи, карциномой пищевода, глиобластомой, тимомой, карциномой толстой кишки, поджелудочной железы и меланомой, выявил, что в подавляющем большинстве экспрессируется B7-H1 (см. Flies 2011; Nomi 2007). Несколько преклинических исследований продемонстрировали увеличенное отторжение опухоли путем блокирования взаимодействия PD1-PDL1. Недавно анти-PD1 и -PD-L1 терапии продемонстрировали значительную активность при меланоме и некоторых других солидных опухолях, подтверждая возможность их применения в качестве одной из наиболее многообещающих противораковых терапий.
Терапия на основе цетуксимаба может быть улучшена путем ее комбинирования с иммуномодулированием для удаления иммуносупрессивного окружения или задержки развития резистентности. Кроме того, пациенты, у которых развивается резистентность к цетуксимабу вследствие мутаций в последующих путях все еще могут получать пользу от анти-EGFR1-PD-1, поскольку слитый белок по настоящему изобретению связывается с рецептором EGFR и нейтрализует PD-L1, экспрессируемые опухолями, давая возможность T-клеткам осуществлять противоопухолевый ответ. Соответственно, слитые белки по настоящему изобретению могут связываться как с EGFR, так и с PD-L1 на поверхности противоопухолевых клеток.
Конструкции слитого белка анти-EGFR1-PD1 по настоящему изобретению могут быть использованы при колоректальном раке, плоскоклеточном раке головы и шеи, немелкоклеточном раке легкого, раке желудка и раке поджелудочной железы.
Конструирование и выбор молекул:
Слитые молекулы на основе антитела по настоящему изобретению обладают двойственными терапевтическими свойствами. С одной стороны молекула сохраняет полную активность антитела против EGFR1 (цетуксимаб), а параллельно она обладает активностью, связывающей рецептор PD-L1 в опухолевом окружении. Новые молекулы слитого белка анти-EGFR1-PD1, которые разработаны для терапии рака, лишены аминокислоты лизин "K" на C-конце тяжелой цепи по причинам, описанным выше. Основная задача конструирования слитого белка заключается в поддержании анти-EGFR1 молекулы интактной при том, что ее функция не меняется, и дает возможность для слияния молекулы PD1 с различными положениями на антителе против EGFR1. Таким образом, возможно слияние с C-концом HC (тяжелой цепи), C-концом LC (легкой цепи), N-концом HC и/или N-концом LC и двойные слияния на обеих цепях, как показано на Фиг. 6.
Были сконструированы следующие конструкции.
Таблица 1
Фиг. 6
Фиг. 6
Фиг. 6
Фиг. 6
Экспрессия указанных выше слитых конструкций в клетках CHO:
Кодон-оптимизированные нуклеотидные последовательности отдельных доменов анти-EGFR1-PD1 оптимизировали для экспрессии в клетках CHO. Такие оптимизированные последовательности (SEQ ID NO: 1, 2, 7 и 4) собирали в экспрессионном векторе млекопитающих с помощью праймеров, описанных в Таблице 2:
Таблица 2
FMAB7FP1 AGA TAT CGC CAC CAT GAT GTC CTT CGT G SEQ ID NO: 19
FMAB7FP2 GGC GGC GGA GGC TCT CAG GTG CAG CTG AAG CAG TC SEQ ID NO: 20
FMAB7RP1 AGT ATA CTC AGC CGG GGG AC A GAG A SEQ ID NO: 21
FMAB7RP2 TTC AGC TGC ACC TGA GAG CCT CCG CCG CCA CTT C SEQ ID NO: 22
FMAB7LCRP ATT AAT TAA TCA AC A CTC GCC CCG GTT GAA GGA CT SEQ ID NO: 23
FMAB6FP2 CTC TGT CCC CCG GCG GCG GCG GAG GAT CTG GCG GA SEQ ID NO: 24
FMAB6RP2 GAT CCT CCG CCG CCG CCG GGG GAC AGA GAC AGG GA SEQ ID NO: 25
FMAB6RP1 AGT ATA CTC AC A CCA GGG TCT GGA AC SEQ ID NO: 26
С использованием представленного выше набора праймеров кДНК собирали конструкции, представленные на Фиг. 11.
2. Слитые белки анти-EGFR1-TGFβRII для лечения рака
Высокие уровни TGFβ продуцируются множеством типов опухолей, включая меланомы и рак молочной железы, толстой кишки, пищевода, желудка, печени, легкого, поджелудочной железы и предстательной железы, а также гематологические злокачественные новообразования (см. Teicher 2001; Dong 2006). Известно, что TGFβ является иммуносупрессивным в отношении T-клеток и NK-клеток путем блокирования IL-2 (интерлейкин-2) и других механизмов, включая образование T-reg (T-регуляторных клеток). Ряд данных свидетельствуют о том, что подавление активности TGFβ может усиливать противоопухолевые эффекты T-клеток (Wrzesinski 2007). Кроме того, TGFβ может благоприятствовать опухолевому росту посредством эпителиально-мезенхимального перехода и способствуя ангиогенезу. Экспрессия TGFβ также ассоциирована с неблагоприятным прогнозом у пациентов и ранним рецидивом. Тем не менее, рассматривая плейотропные эффекты TGFβ при контролировании иммунного ответа, было показано, что генерализованное блокирование активности TGFβ может приводить в результате к обширной аутовоспалительной активности. Следовательно, локализованное истощение TGFβ в окружении опухоли может представлять собой альтернативный путь для модуляции иммуносупрессивной окружающей среды. Слитый белок анти-EGFR1-TGFβRII по настоящему изобретению связывается с EGFR на опухолевых клетках и препятствует TGFβ вокруг опухоли для усиления иммунного ответа против опухолевых клеток.
Конструирование и выбор молекул:
Задача заключается в конструировании слитых молекул на основе антитела, которые обладают двойственными терапевтическими свойствами. С одной стороны молекула должна сохранять полную активность антитела против EGFR1 (цетуксимаб), а параллельно она должна обладать активностью, связывающей TGFβ в опухолевом окружении. Аминокислотная последовательность анти-EGFR1 молекулы IgG была сохранена за исключением того, что лизин не экспрессировался на C-конце тяжелой цепи. Как единичное, так и двойное слияние и уровни экспрессии представлены в Tаблице 3, где TGFβRII слит с антителом против EGFR1.
Таблица 3
Фиг. 12
(а.к. последовательности на Фиг. 13, SEQ ID NO: 27 и 9)
Фиг. 12
(а.к. последовательности на Фиг. 14, SEQ ID NO: 8 и 28)
Фиг. 12
(а.к. последовательности на Фиг. 15, SEQ ID NO: 29 и 9)
Фиг. 12
(а.к. последовательности на Фиг. 16, SEQ ID NO: 8 и 30)
Фиг. 12
(а.к. последовательности на Фиг. 17, SEQ ID NO: 31 и 28)
Фиг. 12
(а.к. последовательности на Фиг. 18, SEQ ID NO: 31 и 30)
Фиг. 12
(а.к. последовательности на Фиг. 19, SEQ ID NO: 29 и 28)
Фиг. 12
(а.к. последовательности на Фиг. 20, SEQ ID NO: 29 и 30)
Экспрессия указанных выше слитых конструкций в клетках CHO:
Кодон-оптимизированные нуклеотидные последовательности отдельных доменов анти-EGFR1-TGFβRII оптимизировали для экспрессии в клетках CHO. Такие последовательности (SEQ ID NO: 1, 2, 4 и 3) собирали в экспрессионном векторе млекопитающих. Экспрессионные конструкции представлены на Фиг. 21.
Трансфекция указанных выше комбинации векторов с получением желаемой клеточной линии:
Разработанные выше экспрессионные конструкции трансфицировали в следующей комбинации, как изложено в Таблице 4, в клетки CHO для продукции следующих слитых белков с использованием конструкций, как определено на Фиг. 21.
Таблица 4
сионных конструкций
ная клеточная линия
г/л
(HC-C-конец)
VL
VL
Очистка супернатантов слитых Mab с использованием колонки на основе белка A:
Слитые моноклональные антитела (Mab) с использованием супернатанта культуры клеток CHO, продуцирующей рекомбинантный белок.
Процедура:
В процедуре подробно описан способ очистки в небольшом масштабе IgG с использованием колонки C10/10 или XK26 и с использованием аффинной смолы Mab Select Xtra. Образцы, полученные при помощи этого протокола, могут быть использованы для различных анализов.
Последовательность операций:
культуральный супернатант, секретированный рекомбинантной клеточной линией, продуцирующей моноклональные антитела или слитые моноклональные антитела в стерильных условиях, тестировали в отношении титра и эндотоксинов;
аффинную хроматографию с использованием смолы Mab Select Xtra на основе белка A промывали и уравновешивали связывающим буфером;
pH супернатанта корректировали с использованием 0,5 M фосфата до той же самой величины pH, что и в колонке;
супернатант оставляли для связывания с колонкой/прохождения через колонку при скорости потока 0,5 мл/минуту для достижения максимального связывания;
все слитые Mab связываются через область Fc, а оставшаяся часть примесей проходит в виде проскока;
колонку промывали уравновешивающим буфером;
связанные слитые Mab элюировали с использованием 0,1 M глицина с pH 3,0;
элюированные белки доводили обратно до нейтрального pH или pH стабильной композиции;
очищенные белки хранили при -20°C или при 2-8°C в зависимости от стабильности
Анализ очищенных на белке A слитых Mab с использованием SDS PAGE:
Полученные трансфицированные супернатанты очищали с использованием аффинной колонки на основе белка A. Позже их анализировали с помощью редуцирующего и нередуцирующего SDS-PAGE для обнаружения целостности молекулы, как показано на Фиг. 22, где образцы, очищенные на белке А, анализировали на 12% редуцирующем SDS-PAGE. Как ожидали, все слитые партнеры демонстрировали ожидаемую картину на SDS-PAGE. Слитые LC и HC движутся рядом, но полосы разделены. Указанная более высокая подвижность может быть следствием 8 сайтов N-гликозилирования (TGFβRII 3*2=6 + 2 на LC)
На Фиг. 23 показаны результаты для образцов, очищенных на белке А, которые анализировали на 6% нередуцирующем SDS-PAGE, и хотя аминокислотная композиция является той же самой, существует различие в подвижности. Последнее может быть следствием различных уровней картины гликозилирования, основанной на положении TGFβRII и доступа в молекуле.
3. Конструкции слитого белка анти-CTLA4-PD1 для раковых мишеней
Иммуногистохимический анализ свежевыделенных образцов опухоли у пациентов с раком яичника, легкого и молочной железы, почечно-клеточной карциномой, плоскоклеточной карциномой головы и шеи, карциномой пищевода, глиобластомой, тимомой, карциномой толстой кишки, поджелудочной железы и меланомой, выявил, что в подавляющем большинстве экспрессируется B7-H1 (см. Flies 2011; Nomi 2007). Несколько преклинических исследований продемонстрировали увеличенное отторжение опухоли путем блокирования взаимодействия PD1-PDL1. Недавно анти-PD1 и -PD-L1 терапии продемонстрировали значительную активность при меланоме и некоторых других солидных опухолях, подтверждая возможность их применения в качестве одной из наиболее многообещающих противораковых терапий.
Хотя антитело против CTLA4 может обеспечить возможность костимуляции T-клеток, оно все еще может ингибироваться вследствие взаимодействия PD-L1-PD-1. Последнее может представлять собой одну из причин того, что лишь минимальное количество пациентов обладают ответом в виде антитела против CTLA4. Слитые антитела как против CTLA4, так и PD1 более эффективны, чем каждый агент сам по себе, поскольку анти-CTLA4 обеспечивает возможность костимулирования T-клеток, тогда как PD1 связывается с PD-L1 на опухолевых клетках, подавляя иммуносупрессию T-клеток в опухолевом микроокружении. Они могут быть даже безопасней чем антитело против CTLA4, поскольку использование исключительно антитела против CTLA4 приводит к побочным действиям, вызывающим сбой иммунитета.
Конструирование и выбор молекул:
Задача заключается в конструировании слитых молекул на основе антитела, которые обладают двойственными терапевтическими свойствами. С одной стороны молекула должна сохранять полную активность антитела против CTLA4 (ипилимумаб), а параллельно она должна обладать активностью, связывающей PDL1 в опухолевом окружении. Использовали полную аминокислотную последовательность анти-CTLA4 молекулы IgG за исключением того, что лизин на C-конце тяжелой цепи был удален. Линкер из 15 аминокислот располагали между PD1 и антителом против CTLA4. Конструировали следующие комбинации конструкций, изложенные в Таблице 5, как показано на Фиг. 24. Подробная информация о указанных выше слитых белковых конструкциях приведена ниже.
Таблица 5
Экспрессия указанных выше слитых конструкций в клетках CHO:
Полная нуклеотидная последовательность отдельных доменов анти-CTLA4-PD1 была кодон-оптимизирована для экспрессии в клетках CHO (SEQ ID NO: 7, 4, 5 и 6). Синтезировали кДНК. Конструкции собирали в экспрессионные векторы млекопитающих. Экспрессия слитых белков анти-CTLA4-PD1 была осуществлена с использованием конструкций, как показано на Фиг. 33.
Экспрессионные конструкции, разработанные и представленные на Фиг. 33, трансфицировали в следующей комбинации в клетки CHO (Таблица 6) для продукции следующих слитых белков. Титр, полученный для каждой из конструкций, упоминается в последнем столбце.
Таблица 6
зованная клеточная линия
г/л
анти-CTLA4 LC-PD1
Очистка и характеристика слитых белков:
В процедуре описано применение способа очистки в небольшом масштабе IgG с использованием колонки C10/10 или XK26 и с использованием аффинной смолы Mab Select Xtra. Образцы, полученные при помощи этого протокола, могут быть использованы для различных анализов.
Последовательность операций:
культуральный супернатант, секретированный рекомбинантной клеточной линией, продуцирующей моноклональные антитела или слитые моноклональные антитела в стерильных условиях, тестировали в отношении титра и эндотоксинов;
аффинную хроматографию с использованием смолы Mab Select Xtra на основе белка A промывали и уравновешивали связывающим буфером;
pH супернатанта корректировали с использованием 0,5 M фосфата до той же самой величины pH, что и у колонки;
супернатант оставляли для связывания с колонкой/прохождения через колонку при скорости потока 0,5 мл/минуту для достижения максимального связывания;
все слитые Mab связываются через область Fc, а оставшаяся часть примесей проходит в виде проскока;
колонку промывали уравновешивающим буфером;
связанные слитые Mab элюировали с использованием 0,1 M глицина с pH 3,0;
элюированные белки доводили обратно до нейтрального pH или pH стабильной композиции; и
очищенные белки хранили при -20°C или при 2-8°C в зависимости от стабильности.
4. Анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC (Fmab 1)
ELISA связывания: Процедура:
Слитый Mab тестировали в отношении его способности связываться со своими мишенями в трех различных ELISA: 1) ELISA связывания мишени EGFR1, 2) ELISA связывания мишени TGFβ и 3) бифункциональный ELISA.
Для ELISA с нацеленным связыванием мишени (химеру rhEGFR-Fc или TGFβ) наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. Связывание слитых Mab обнаруживали путем добавления биотинилированного вторичного антитела против человеческого IgG F(ab)2 с последующей инкубацией в течение 1 ч с конъюгированным с пероксидазой хрена стрептавидином при комнатной температуре. Добавляли раствор субстрата TMB (тетраметилбензидин), и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Для бифункционального ELISA химеру rhEGFR-Fc наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли TGFβ, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли анти-TGFβ-биотин-антитела, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли стрептавидин-HRP (пероксидаза хрена), и планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Результаты:
Связывание слитого Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC с обеими мишенями EGFR1 (Фиг. 34) и TGFβ (Фиг. 35) сравнимо с анти-EGFR1-TGFβRII. Слитое Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC также тестировали в бифункциональном ELISA для определения того, могут ли домены против EGFR1 и TGFβRII в Mab связываться со своими соответствующими мишенями, не взаимодействуя друг с другом. Как видно на Фиг. 36, слитое Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC связывается с обеими своими мишенями, указывая на отсутствие взаимодействия при связывании с каждой мишенью вследствие конструкции слитого Mab.
Связывание с клетками, экспрессирующими EGFR1:
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали и собирали. Клетки окрашивали различными разведениями слитого Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC или контрольным Ig при 2-8°C в течение 30 минут. Клетки промывали и инкубировали с конъюгатом антитело против человеческого IgG - FITC (фенилизотиоцианат) при 2-8°C в течение 30 минут. После промывания клетки анализировали на проточном цитометре. Живые клетки отбирали на основе их профилей FSC (прямое светорассеяние) против SSC (боковое светорассеяние). Регистрировали общую MFI (средняя интенсивность флуоресценции) для отобранной популяции.
Результаты:
Слитая конструкция анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC связывается с клетками A-431, экспрессирующими EGFR, дозо-зависимым образом (Фиг. 37). Связывание анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC сравнимо со связыванием анти-EGFR1-TGFβRII.
Антителозависимая цитотоксическая активность
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали, собирали и высевали в 96-луночные планшеты. Клетки метили различными разведениями слитого Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC или контрольного Ig при 2-8°C в течение 30 минут. Меченые клетки коинкубировали со свежевыделенными человеческими PBMC (мононуклеарными клетками периферической крови) при 37°C, 5% CO2 в течение 24 часов. Цитотоксичность измеряли с использованием наборов для анализа цитотоксичности Cyto-Tox-Glo.
Результаты:
Слитая конструкция анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC опосредует ADCC клеток A-431, экспрессирующих EGFR, человеческими эффекторными клетками PBMC. ADCC является дозо-зависимым (Фиг. 38). Эти результаты свидетельствуют о том, что фрагмент Fc слитого Mab является интактным и функциональным.
Ингибирование пролиферации
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали, собирали и высевали в 96-луночные планшеты. Различные разведения слитого Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC или контрольного Ig добавляли к клеткам. Планшеты инкубировали при 37°C, 5% CO2 в течение трех суток. На третьи сутки клеточную пролиферацию измеряли при помощи способа, включающего использование AlamarBlue.
Результаты:
Известно, что антитела против EGFR, такие цетуксимаб, ингибируют пролиферацию клеток, экспрессирующих EGFR1. Как видно на Фиг. 39, анти- EGFR фрагмент слитого Mab анти-EGFR1 HC-TGFβRII + анти-EGFR1 LC является интактным и обладает антипролиферативной активностью.
5. Анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII (Fmab2)
ELISA связывания: Процедура:
Слитое Mab анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII тестировали в отношении его способности связываться со своими мишенями в трех различных ELISA: 1) ELISA связывания мишени EGFR1, 2) ELISA связывания мишени TGFβ и 3) бифункциональный ELISA.
Для ELISA с нацеленным связыванием мишени (химеру rhEGFR-Fc или TGFβ) наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитых Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. Связывание слитых Mab обнаруживали путем добавления биотинилированного вторичного антитела против человеческого IgG F(ab)2 с последующей инкубацией в течение 1 ч с конъюгированным с пероксидазой хрена стрептавидином при комнатной температуре. Добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Результаты:
Связывание слитого Mab анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII с обеими мишенями EGFR1 (Фиг. 40) и TGFβ (Фиг. 41) сравнимо с анти-EGFR1-TGFβRII. Слитое Mab анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII также тестировали в бифункциональном ELISA для определения того, могут ли домены против EGFR1 и TGFβRII в Mab связываться со своими соответствующими мишенями, не взаимодействуя друг с другом. Как видно на Фиг. 42, слитое Mab анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII связывается с обеими своими мишенями, указывая на отсутствие взаимодействия в связывании с каждой мишенью вследствие конструкции слитого Mab.
Ингибирование пролиферации
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали, собирали и высевали в 96-луночные планшеты. Различные разведения слитого Mab анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII или контрольный Ig добавляли к клеткам. Планшеты инкубировали при 37°C, 5% CO2 в течение трех суток. На третьи сутки клеточную пролиферацию измеряли при помощи способа, включающего использование AlamarBlue.
Результаты:
Известно, что антитела против EGFR, такие как цетуксимаб, ингибируют пролиферацию клеток, экспрессирующих EGFR1. Как видно на Фиг. 43, анти- EGFR фрагмент слитого Mab анти-EGFR1 HC + анти-EGFR1 LC-TGFβRII является интактным и обладает антипролиферативной активностью.
6. TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC (Fmab 3)
ELISA связывания: Процедура:
Слитое Mab тестировали в отношении его способности связываться со своими мишенями в трех различных ELISA: 1) ELISA связывания мишени EGFR1, 2) ELISA связывания мишени TGFβ и 3) бифункциональный ELISA.
Для ELISA с нацеленным связыванием мишени (химеру rhEGFR-Fc или TGFβ) наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. Связывание слитого Mab обнаруживали путем добавления биотинилированного вторичного антитела против человеческого IgG F(ab)2 с последующей инкубацией в течение 1 ч с конъюгированным с пероксидазой хрена стрептавидином при комнатной температуре. Добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Для бифункционального ELISA химеру rhEGFR-Fc наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли TGFβ, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли антитело против TGFβ-биотин, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли стрептавидин-HRP, и планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Результаты:
Связывание слитого Mab TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC с обеими мишенями EGFR1 (Фиг. 44) и TGFβ (Фиг. 45) было сравнимо с анти-EGFR1-TGFβRII. Слитое Mab TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC также тестировали в бифункциональном ELISA для определения того, могут ли домены против EGFR1 и TGFβRII в Mab связываться со своими соответствующими мишенями, не взаимодействуя друг с другом. Как видно на Фиг. 46, связывание слитого Mab TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC уменьшается по сравнению с анти-EGFR1-TGFβRII, указывая на то, что существует некоторое взаимодействие в связывании с каждой мишенью вследствие конструкции слитого Mab.
Связывание с клетками, экспрессирующими EGFR1:
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали и собирали. Клетки окрашивали различными разведениями слитого Mab TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC или контрольным Ig при 2-8°C в течение 30 минут. Клетки промывали и инкубировали с конъюгатом антитело против человеческого IgG - FITC при 2-8°C в течение 30 минут. После промывания клетки анализировали на проточном цитометре. Живые клетки отбирали на основе их профилей FSC против SSC. Регистрировали общую MFI для отобранной популяции.
Результаты:
Слитая конструкция TGFβRII-анти-EGFR 1 HC + анти-EGFR1 LC связывается с клетками A-431, экспрессирующими EGFR дозо-зависимым образом. Связывание TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC сравнимо со связыванием анти-EGFR1-TGFβRII.
Ингибирование пролиферации
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали, собирали и высевали в 96-луночные планшеты. Различные разведения слитого Mab TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC или контрольный Ig добавляли к клеткам. Планшеты инкубировали при 37°C, 5% CO2 в течение трех суток. На третьи сутки клеточную пролиферацию измеряли при помощи способа, включающего использование AlamarBlue.
Результаты:
Известно, что антитела против EGFR, такие как цетуксимаб, ингибируют пролиферацию клеток, экспрессирующих EGFR1. Как видно на Фиг. 47, анти-EGFR фрагмент слитого Mab TGFβRII-анти-EGFR1 HC + анти-EGFR1 LC является интактным и обладает антипролиферативной активностью.
6. Анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC (Fmab 4)
ELISA связывания: Процедура:
Слитые Mab тестировали в отношении их способности связываться со своими мишенями в трех различных ELISA: 1) ELISA связывания мишени EGFR1, 2) ELISA связывания мишени TGFβ и 3) бифункциональный ELISA.
Для ELISA с нацеленным связыванием мишени (химеру rhEGFR-Fc или TGFβ) наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. Связывание слитого Mab обнаруживали путем добавления биотинилированного вторичного антитела против человеческого IgG F(ab)2 с последующей инкубацией в течение 1 ч с конъюгированным с пероксидазой хрена стрептавидином при комнатной температуре. Добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Для бифункционального ELISA химеру rhEGFR-Fc наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли TGFβ, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли анти-TGFβ-биотин-антитело, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли стрептавидин-HRP, и планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Результаты:
Связывание слитого Mab анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC с обеими мишенями EGFR1 (Фиг. 48) и TGFβ (Фиг. 49) сравнимо с анти-EGFR1-TGFβRII. Слитое Mab анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC также тестировали в бифункциональном ELISA для определения того, могут ли домены против EGFR1 и TGFβRII в Mab связываться со своими соответствующими мишенями, не взаимодействуя друг с другом. Как видно на Фиг. 50, связывание слитого Mab анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC уменьшается по сравнению с анти-EGFR1-TGFβRII, указывая на то, что существует некоторое взаимодействие в связывании с каждой мишенью вследствие конструкции слитого Mab.
Связывание с клетками, экспрессирующими EGFR1:
Процедура:
Клетки A-431 выращивали в колбах до тех пор, пока они не достигали 70-80% конфлюентности. Клетки трипсинизировали и собирали. Клетки окрашивали различными разведениями слитого Mab анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC или контрольным Ig при 2-8°C в течение 30 минут. Клетки промывали и инкубировали с конъюгатом антитело против человеческого IgG - FITC при 2-8°C в течение 30 минут. После промывания клетки анализировали на проточном цитометре. Живые клетки отбирали на основе их профилей FSC против SSC. Регистрировали общую MFI для отобранной популяции.
Результаты:
Слитая конструкция анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC связывается с клетками A-431, экспрессирующими EGFR дозо-зависимым образом (Фиг. 51). Связывание анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC уменьшается по сравнению со связыванием анти-EGFR1-TGFβRII.
8. Анти-EGFR1 HC-TGFBRII + TGFBRII-анти-EGFR1 LC (Fmab 10)
ELISA связывания: Процедура:
Слитое Mab тестировали в отношении их способности связываться со своими мишенями в трех различных ELISA: 1) ELISA связывания мишени EGFR1, 2) ELISA связывания мишени TGFβ и 3) бифункциональный ELISA.
Для ELISA с нацеленным связыванием мишени (химеру rhEGFR-Fc или TGFP) наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. Связывание слитого Mab обнаруживали путем добавления биотинилированного вторичного антитела против человеческого IgG F(ab)2, с последующей инкубацией в течение 1 ч с конъюгированным с пероксидазой хрена стрептавидином при комнатной температуре. Добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Для бифункционального ELISA химеру rhEGFR-Fc наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли TGFβ, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли анти-TGFβ-биотин-антитело, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли стрептавидин-HRP, и планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Результаты:
Связывание слитого Mab анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC с мишенью EGFR1 слегка уменьшалось (Фиг. 52), но было выше для TGFβ (Фиг. 53) по сравнению со связыванием анти-EGFR1-TGFβRII. Слитое Mab анти-EGFR1-TGFβRII + TGFβRII-анти-EGFR1 LC также тестировали в бифункциональном ELISA для определения того, могут ли домены против EGFR1 и TGFβRII в Mab связываться со своими соответствующими мишенями, не взаимодействуя друг с другом. Как видно на Фиг. 54, связывание слитого Mab анти-EGFR1 HC-TGFβRII + TGFβRII-анти-EGFR1 LC сравнимо с анти-EGFR1-TGFβRII, указывая на отсутствие взаимодействия в связывании с каждой мишенью вследствие конструкции слитого Mab.
9. TGFβRII-анти-EGFR 1 HC + TGFβRII-анти-EGFR1 LC (Fmab 12)
ELISA связывания: Процедура:
Слитое Mab тестировали в отношении его способности связываться со своими мишенями в трех различных ELISA: 1) ELISA связывания мишени EGFR1, 2) ELISA связывания мишени TGFβ и 3) бифункциональный ELISA.
Для ELISA с нацеленным связыванием мишени (химеру rhEGFR-Fc или TGFβ) наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. Связывание слитого Mab обнаруживали путем добавления биотинилированного вторичного антитела против человеческого IgG F(ab)2 с последующей инкубацией в течение 1 ч с конъюгированным с пероксидазой хрена стрептавидином при комнатной температуре. Добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Для бифункционального ELISA химеру rhEGFR-Fc наносили на планшеты NUNC maxisorb в течение ночи при 4°C. Планшеты промывали и затем блокировали суперблокирующим агентом при комнатной температуре в течение 2 ч. Различные разведения слитого Mab или антитело в качестве отрицательного контроля добавляли в планшет. Планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли TGFβ, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли анти-TGFβ-биотин-антитело, и планшет инкубировали при комнатной температуре в течение 1 ч. Планшет промывали, и добавляли стрептавидин-HRP, и планшет инкубировали при комнатной температуре в течение 1 ч. После промывания добавляли раствор субстрата TMB, и реакцию останавливали при помощи 1 н. H2SO4. Поглощение измеряли при 450 нм на ридере BioTek Synergy H4 Hybrid.
Результаты:
Связывание слитого Mab TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC с мишенью EGFR1 слегка уменьшалось (Фиг. 53), но было выше для TGFβ (Фиг. 56) по сравнению со связыванием анти-EGFR1-TGFβRII. Слитое Mab TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC также тестировали в бифункциональном ELISA для определения того, могут ли домены против EGFR1 и TGFβRII в Mab связываться со своими соответствующими мишенями, не взаимодействуя друг с другом. Как видно на Фиг. 57, связывание слитого Mab TGFβRII-анти-EGFR1 HC + TGFβRII-анти-EGFR1 LC уменьшается по сравнению с анти-EGFR1-TGFβRII, указывая на то, что имеется взаимодействие в связывании с каждой мишенью вследствие конструкции слитого Mab.
Ссылки
Содержимое всех цитируемых здесь документов включено сюда для всех задач путем ссылки.
Altschul, et al., 1990, Basic local alignment search tool, J. Mol. Biol. 15:403- 10.
Ausubel, et al., (ed), 1998, Current Protocols in Molecular Biology, Vol. 2, Ch. 13, Greene Publish. Assoc. & Wiley Interscience.
Bitter, et al., 1987, Expression and Secretion Vectors for Yeast; Methods in Enzymology, 153:5 16-544.
Bitter, 1987, Heterologous Gene Expression in Yeast, Methods in Enzymology, Vol. 152, pp. 673-684.
Dong M., et al., 2006, Role of transforming growth factor-P in hematologic malignancies. Blood. 107:4589-4596.
Deutscher, M., et al., Guide to Protein Purification: Methods in Enzymology, Vol. 182, Academic Press (1990).
Flies, et al., 2011, Blockade of the B7-H1/PD-1 Pathway for Cancer Immunotherapy, J Biol Med., 84(4): 409-421.
Glover, 1986, DNA Cloning, Vol. II, Ch. 3, IRL Press, Wash., D.C.
Gluzman (ed.), 1982, Eukaryotic Viral Vectors, Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory.
Grant, et al., 1987, Expression and Secretion Vectors for Yeast, Methods in Enzymology, Vol. 153, 516-544.
Lee, et al., 1994, Delivery of liposomes into cultured KB cells via folate receptor-mediated endocytosis. J Biol. Chem., 269:3 198.
Lee, et al., 1995, Folate-mediated tumor cell targeting of liposome-entrapped doxorubicin in vitro. Biochem. Biophys. Actu, 1233: 134-144.
Mackett, et al., 1982, Vaccinia virus: a selectable eukaryotic cloning and expression vector, Proc. Natl. Acad. Sci. USA, 79:7415-7419.
Mackett, et al., 1984, General method for production and selection of infectious vaccinia virus, J. Virol., 49:857-864.
Nomi, et al., 2007, Clinical significance and therapeutic potential of the programmed death-1 ligand/programmed death-1 pathway in human pancreatic cancer. Clin Cancer Res., 13:2151-7.
Okazaki, et al., 2007, PD-1 and PD-1 ligands: from discovery to clinical Application. International Immunology, Vol. 19, No. 7, pp. 813-824.
Panicali, et al.,1982, Construction of poxviruses as cloning vectors: insertion of the thymidine, Proc. Natl. Acad. Sci. USA, 79:4927-4931.
Pardoll, DM., 2012, The blockage of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer, 12(4): 252-64.
Strathem, et al., 1982, The Molecular Biology of the Yeast Saccharomyces, Cold Spring Harbor Press, Vols. I and II.
Thompson RH, et al., 2004, Costimulatory B7-H1 in renal cell carcinoma patients: Indicator of tumor aggressiveness and potential therapeutic target. Proc Natl Acad Sci US A., 101(49): 17174-9.
Teicher BA., 2001, Malignant cells, directors of the malignant process: role of transforming growth factor beta. Cancer Metastasis Rev, 20:133-143.
Wrzesinski, et al., 2007, Transforming Growth Factor-P and the Immune Response: Implications for Anticancer Therapy, Clin Cancer Res, 13; 5262.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЕ ИММУНОМОДУЛИРУЮЩИЕ БЕЛКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2662991C2 |
| НАЦЕЛЕННЫЕ/ИММУНОМОДУЛИРУЮЩИЕ СЛИТЫЕ БЕЛКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2636342C2 |
| НАПРАВЛЕННОЕ ИНГИБИРОВАНИЕ TGF БЕТА | 2015 |
|
RU2752424C2 |
| АНГИОПОЭТИН-2-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ | 2005 |
|
RU2404992C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| КОНЪЮГАТЫ АНТИТЕЛО-ФИНОМЕР | 2015 |
|
RU2732226C2 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| АНТИ-PD-1-АНТИТЕЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2656181C1 |
| Антитела к интерлейкину-1альфа и способы применения | 2013 |
|
RU2666915C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |


























































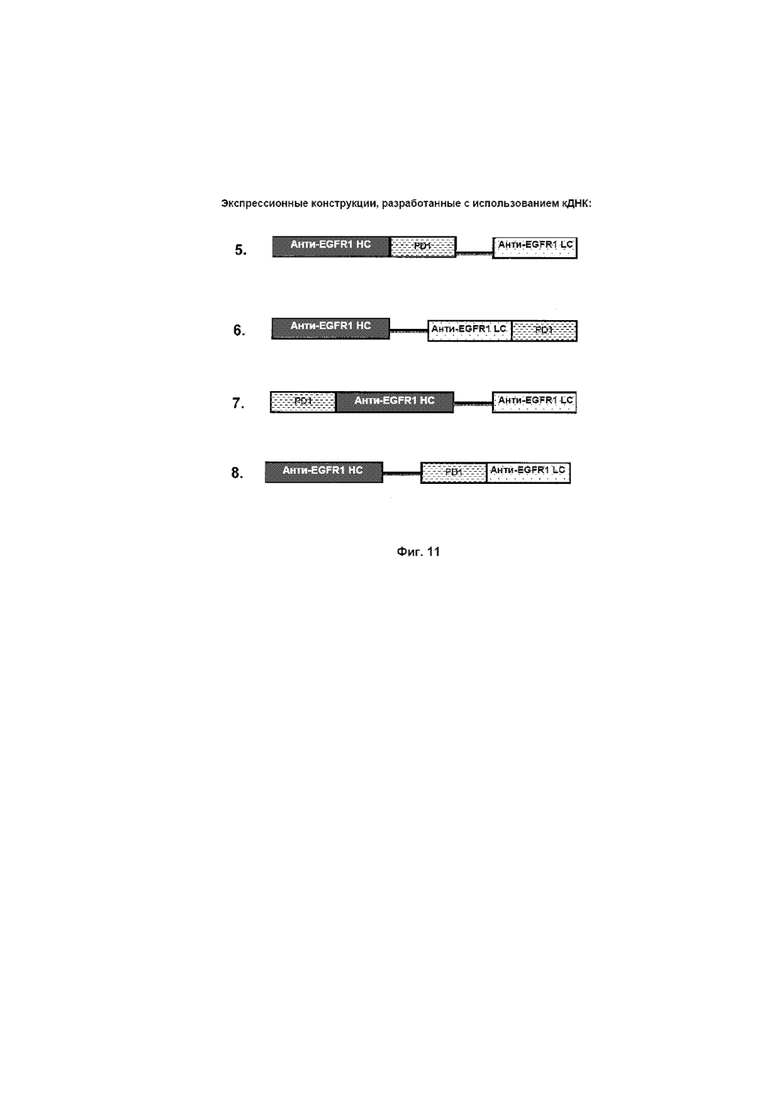
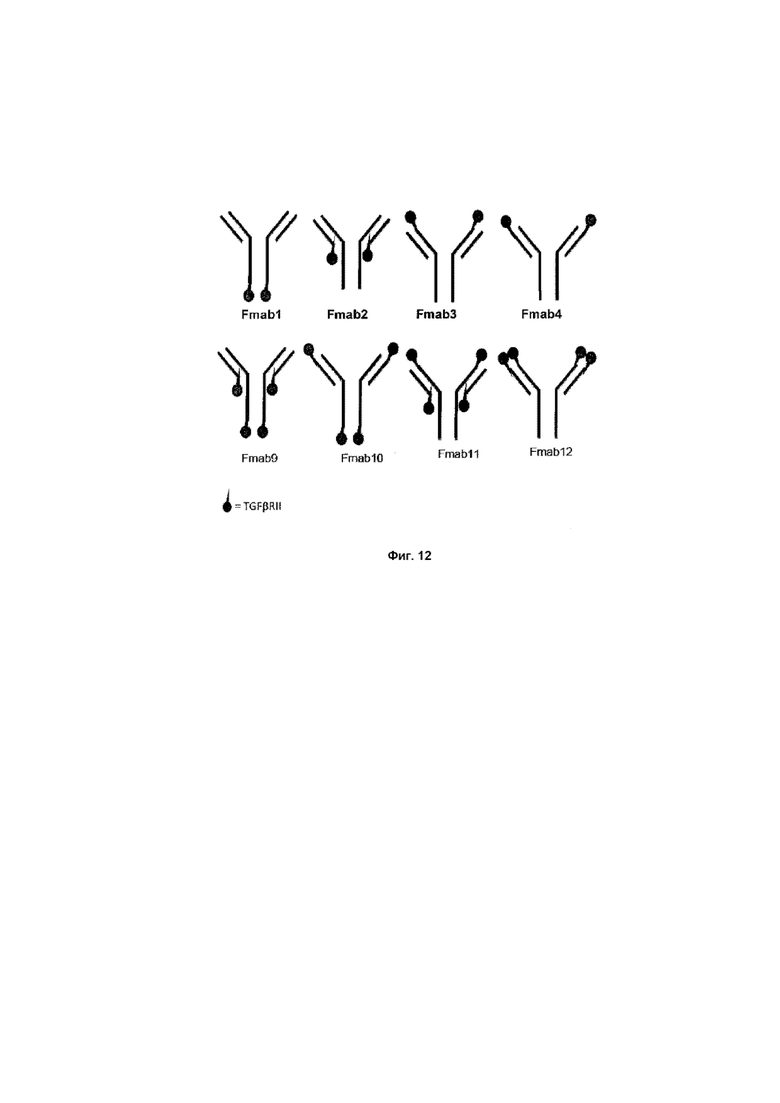









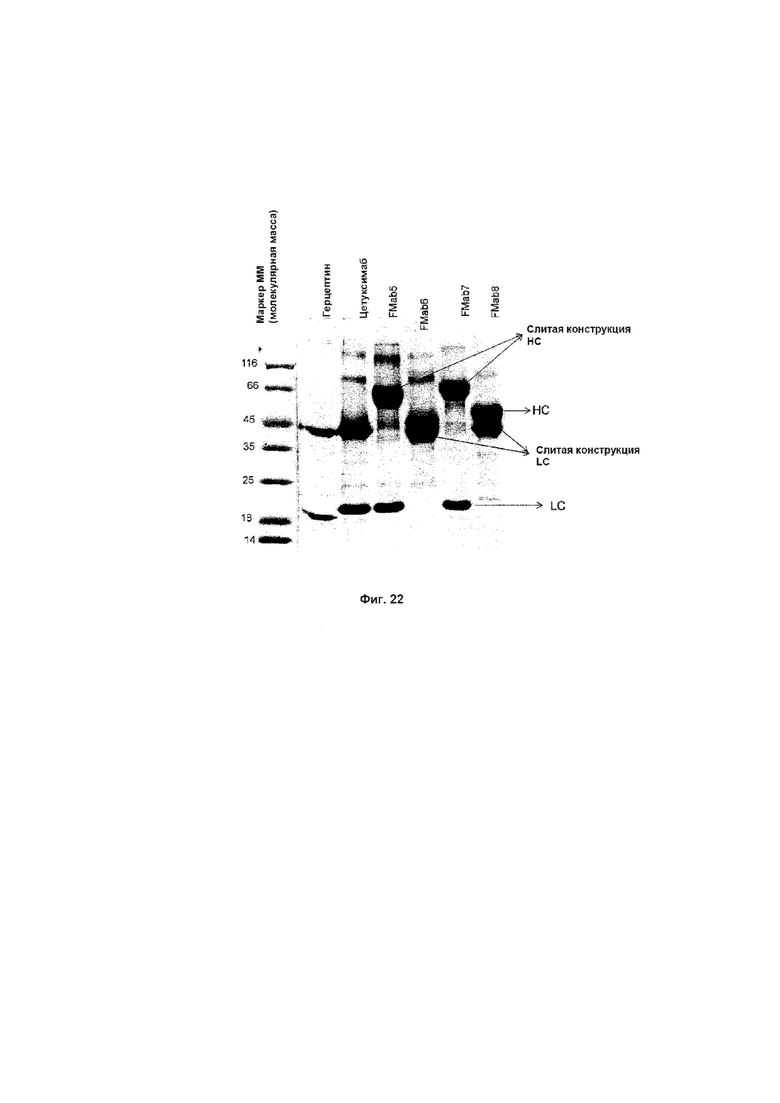

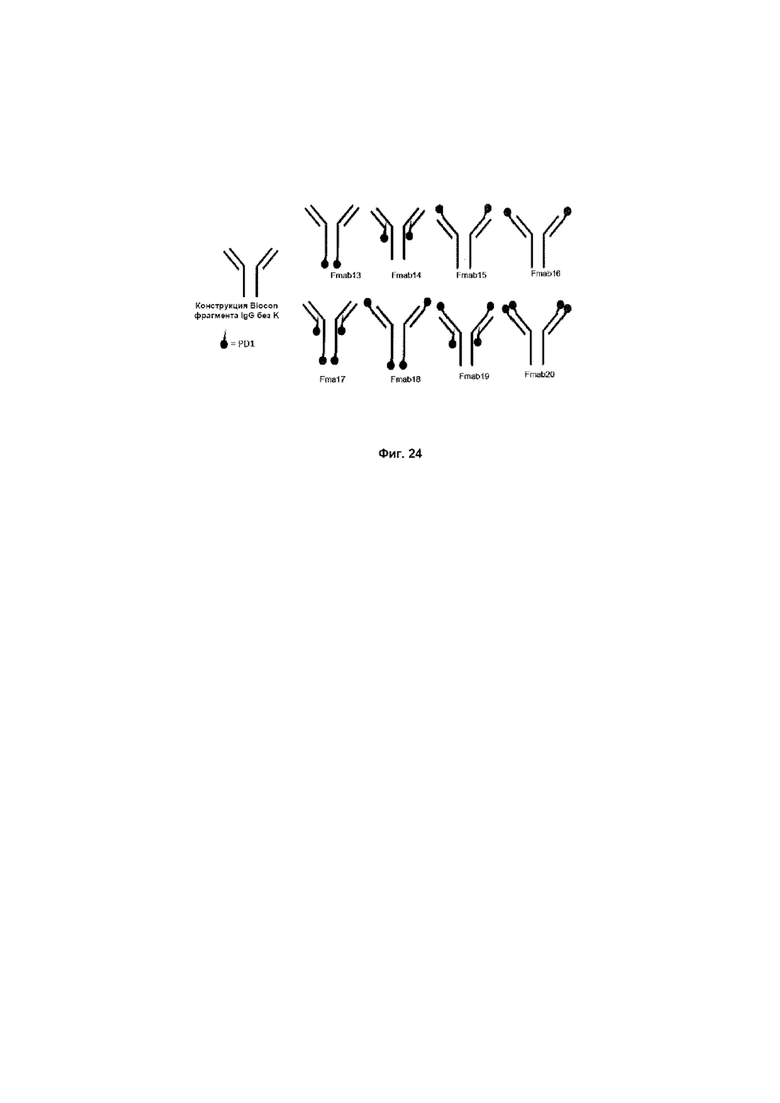









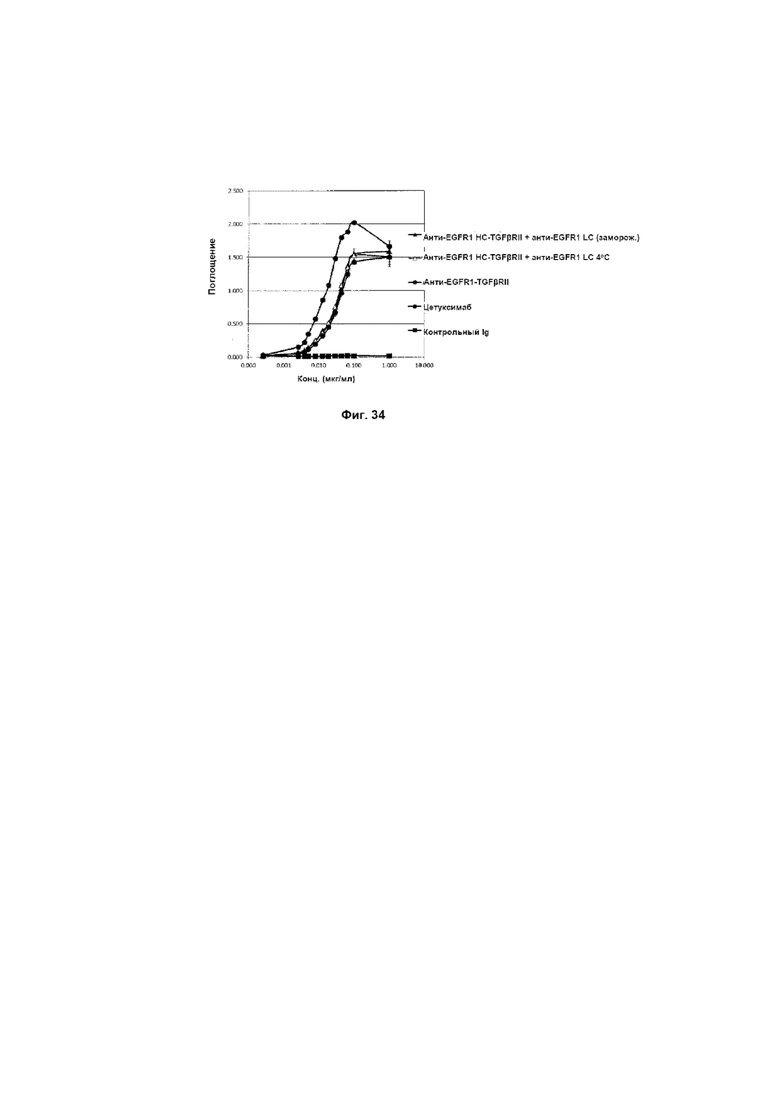
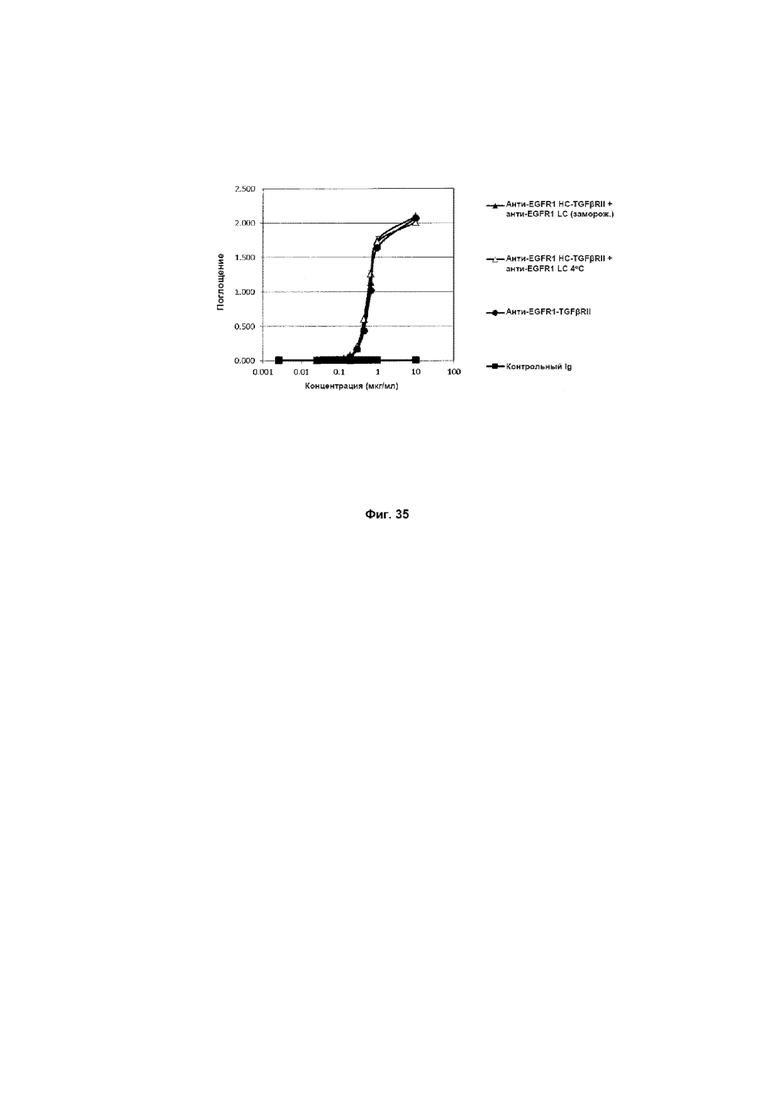


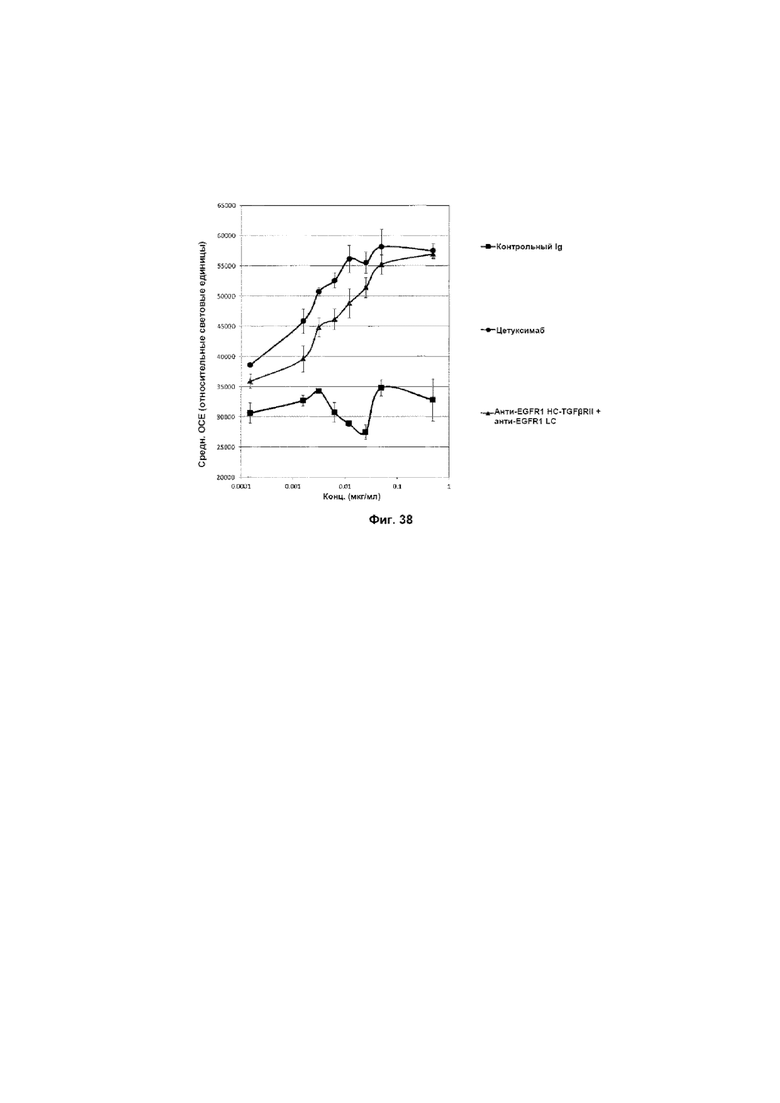

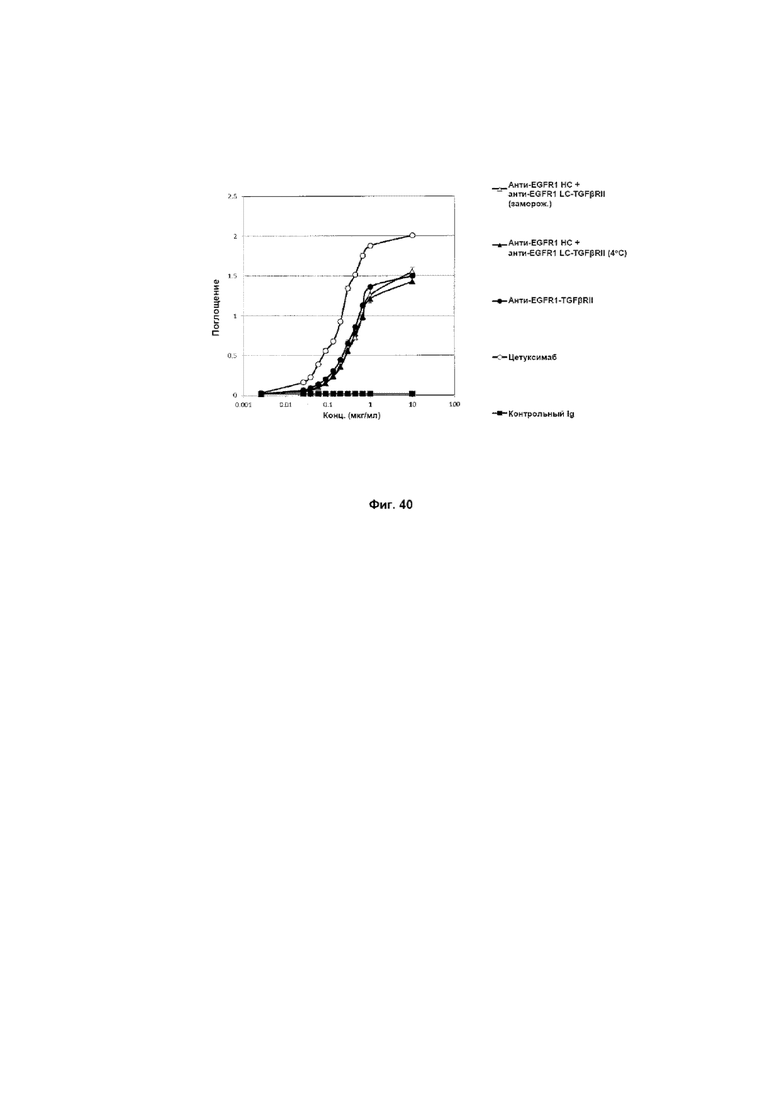
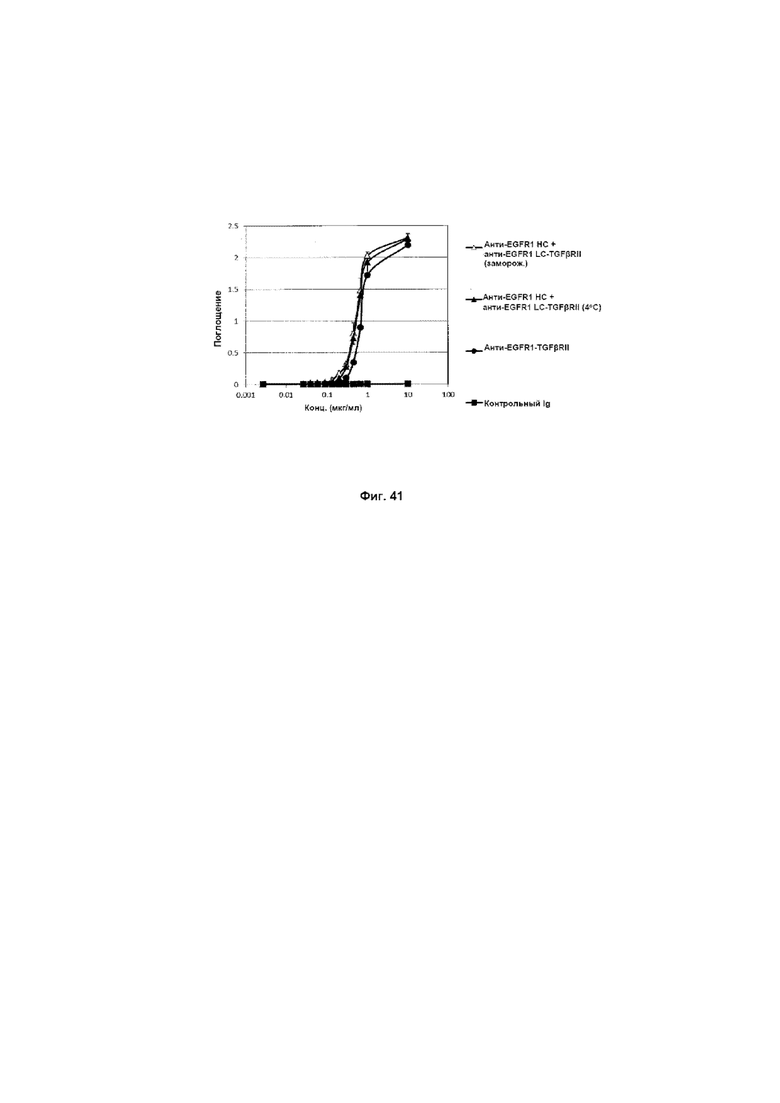
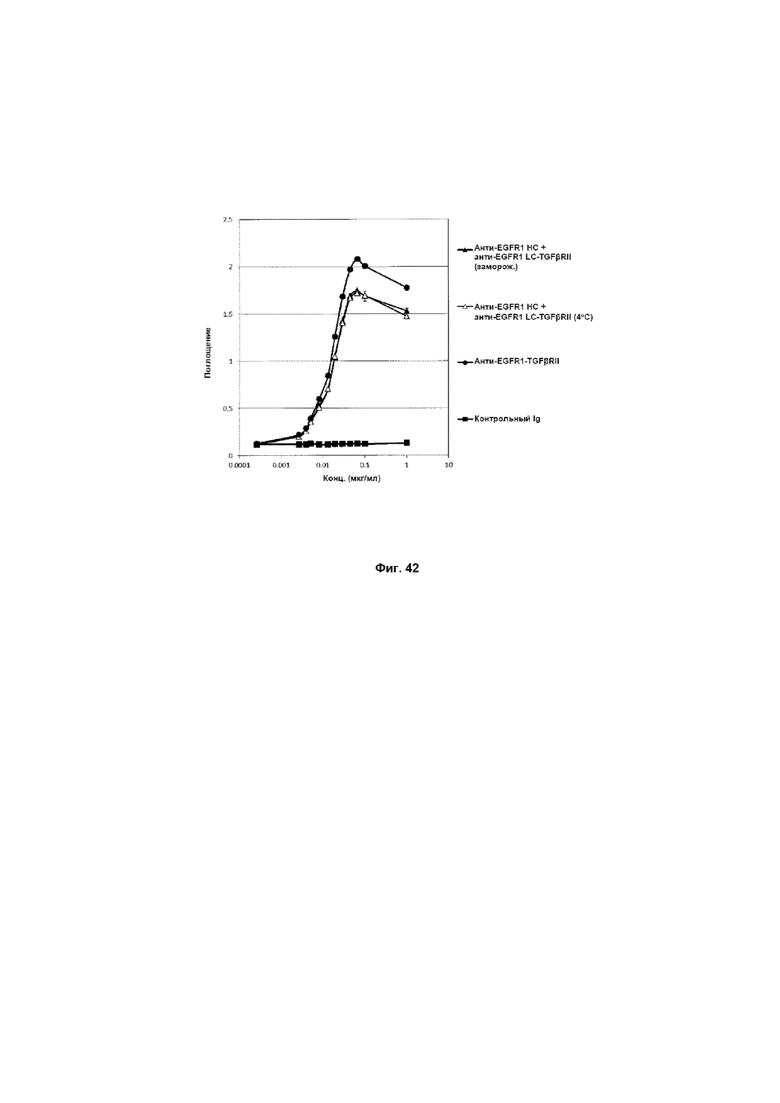
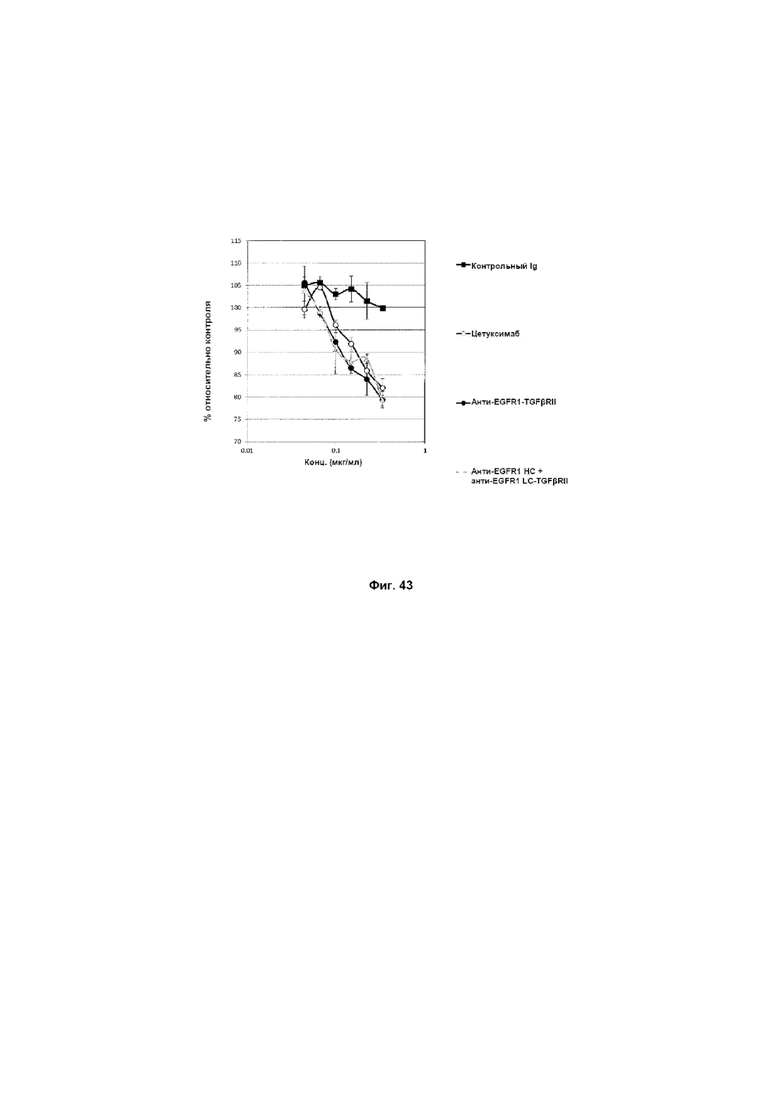
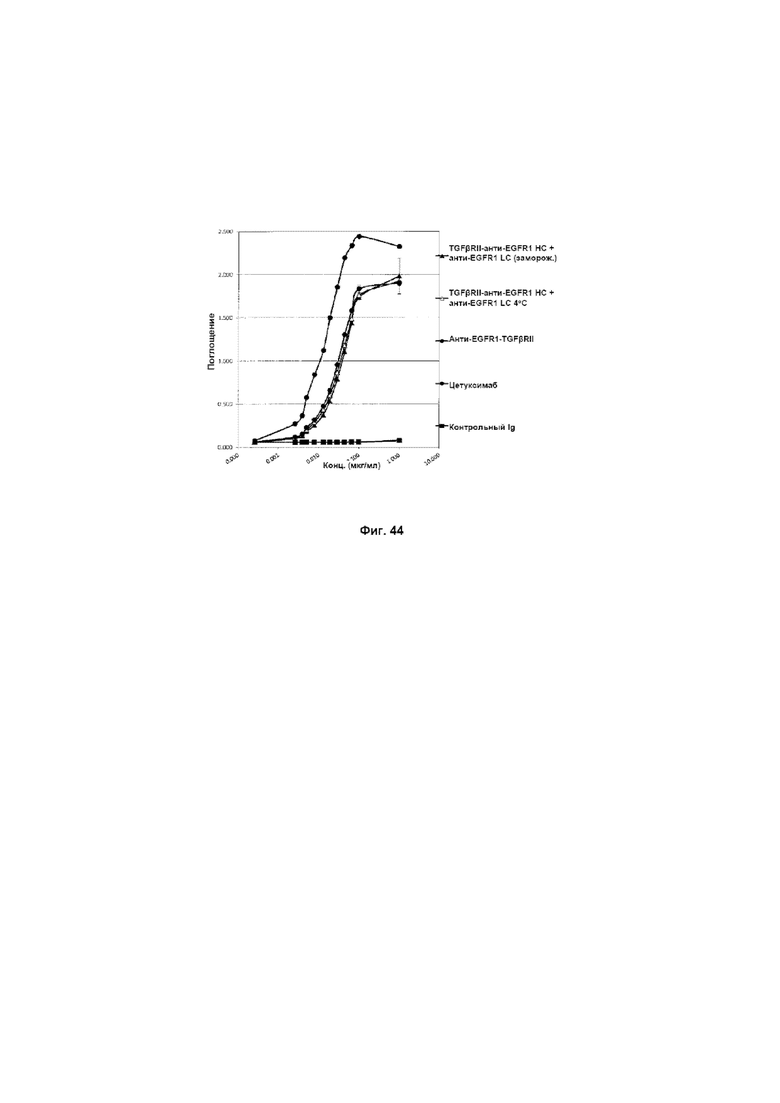
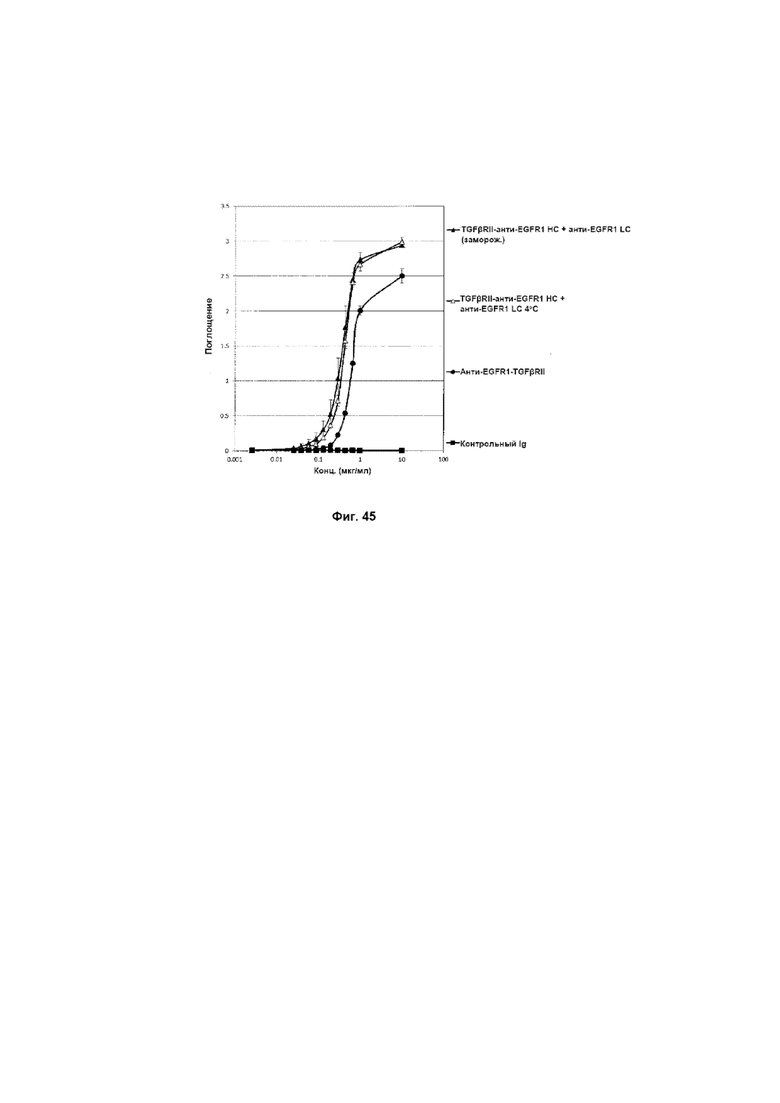
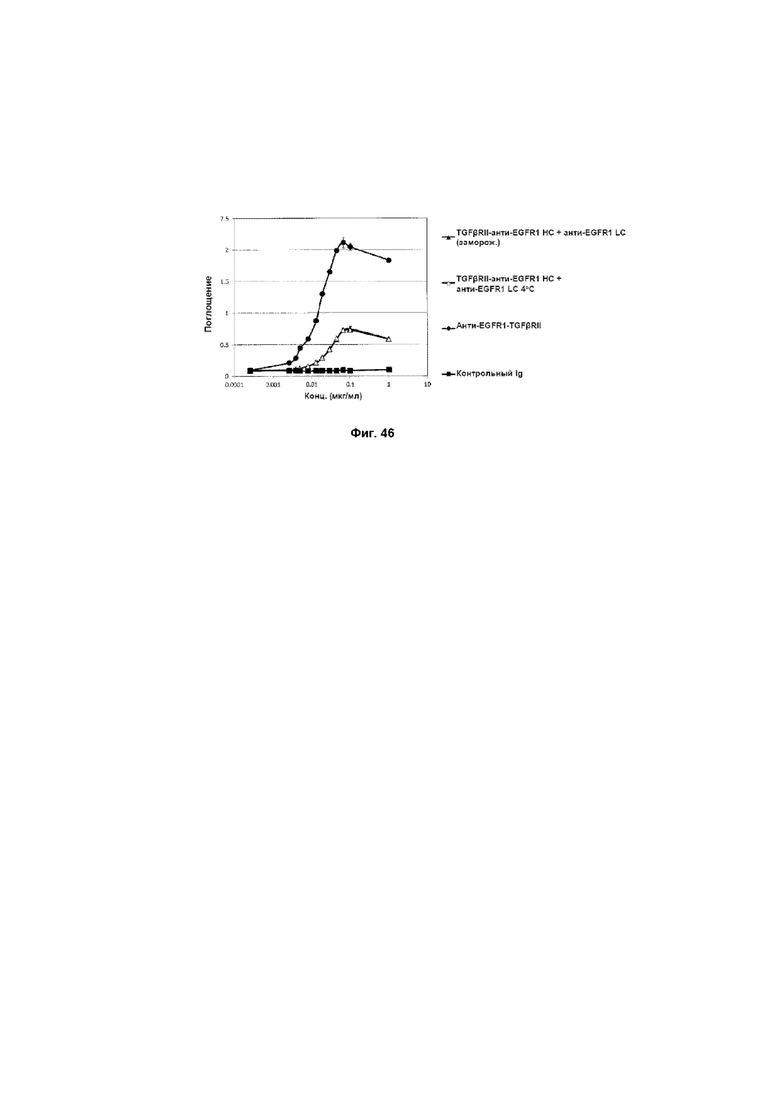

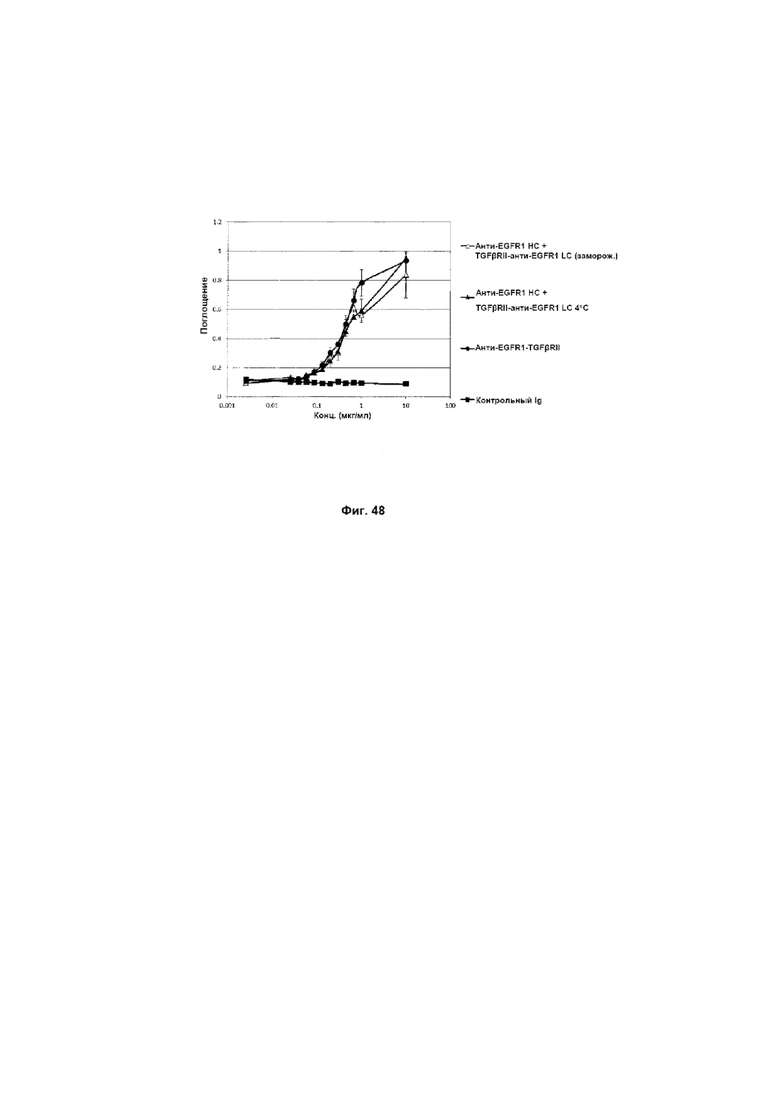
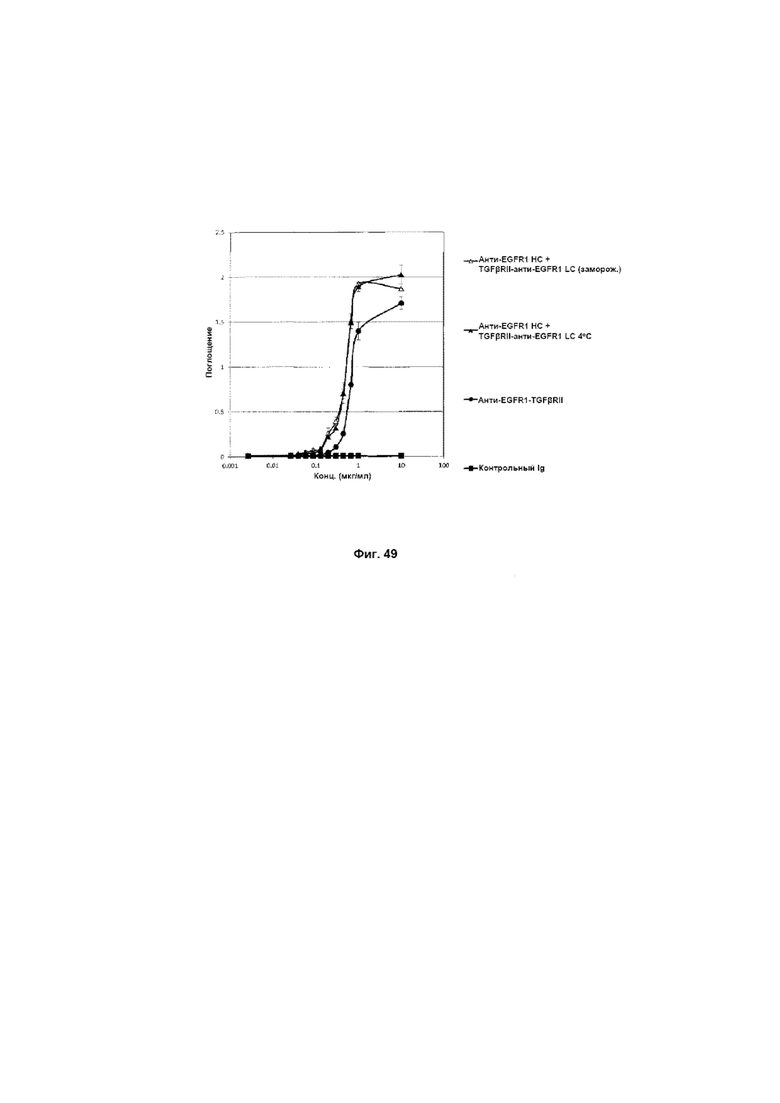
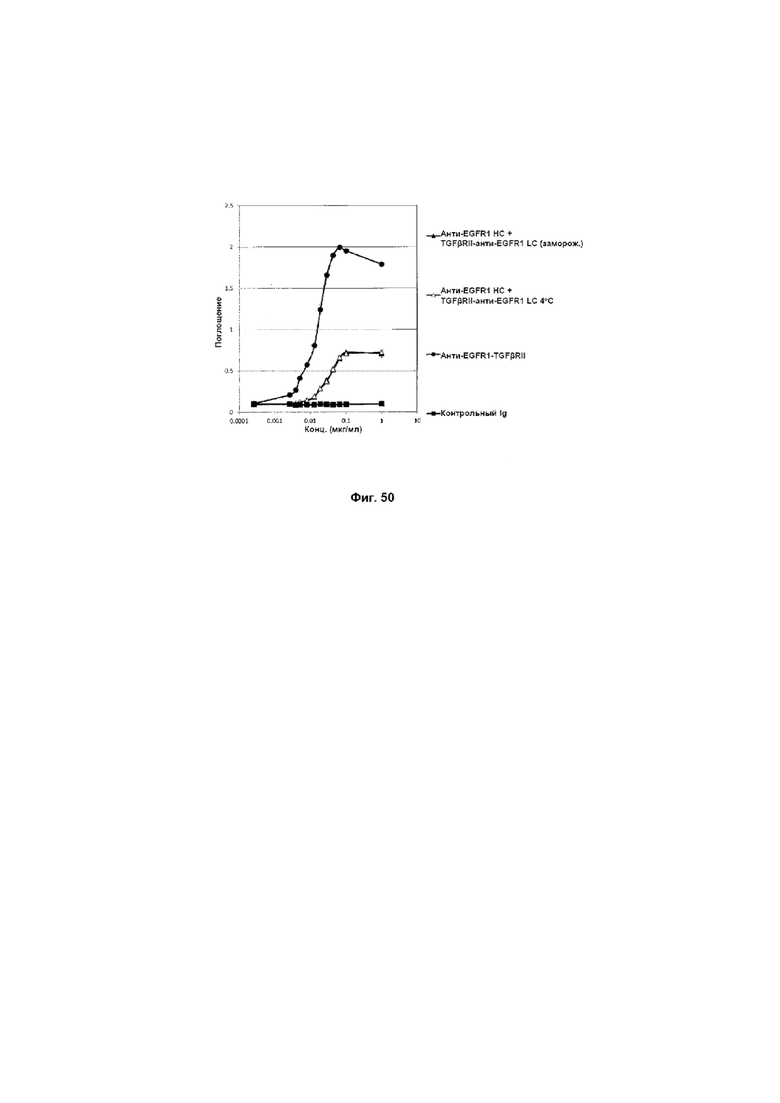
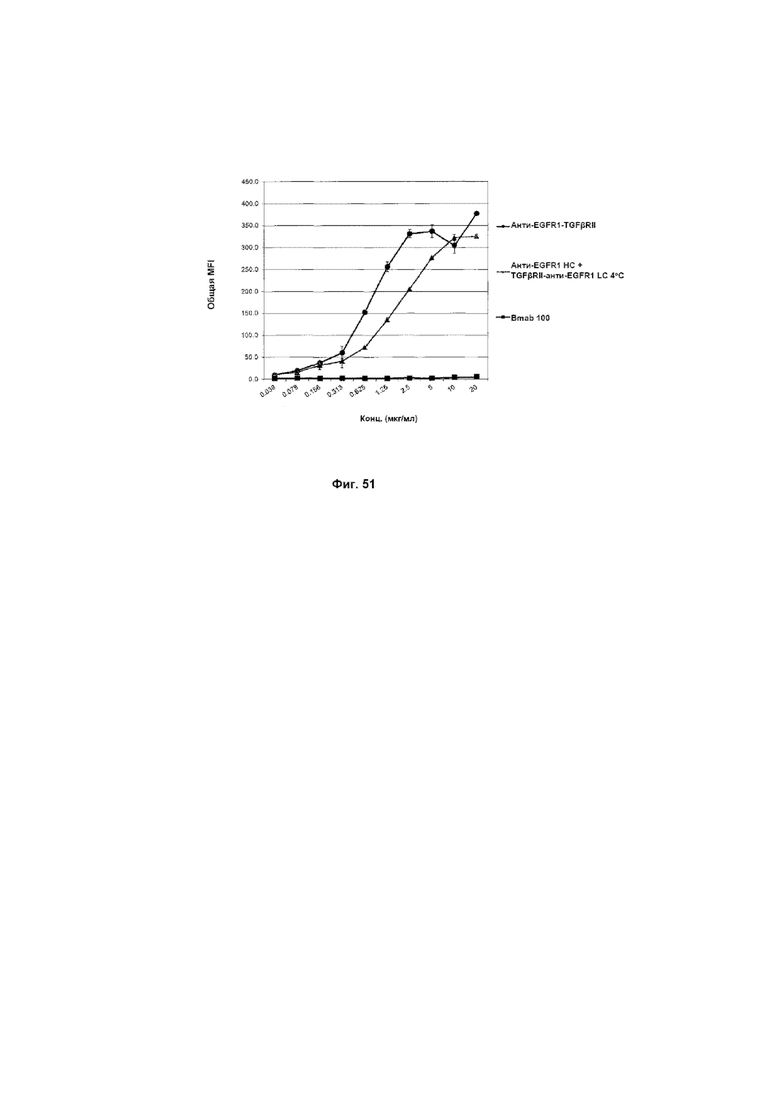
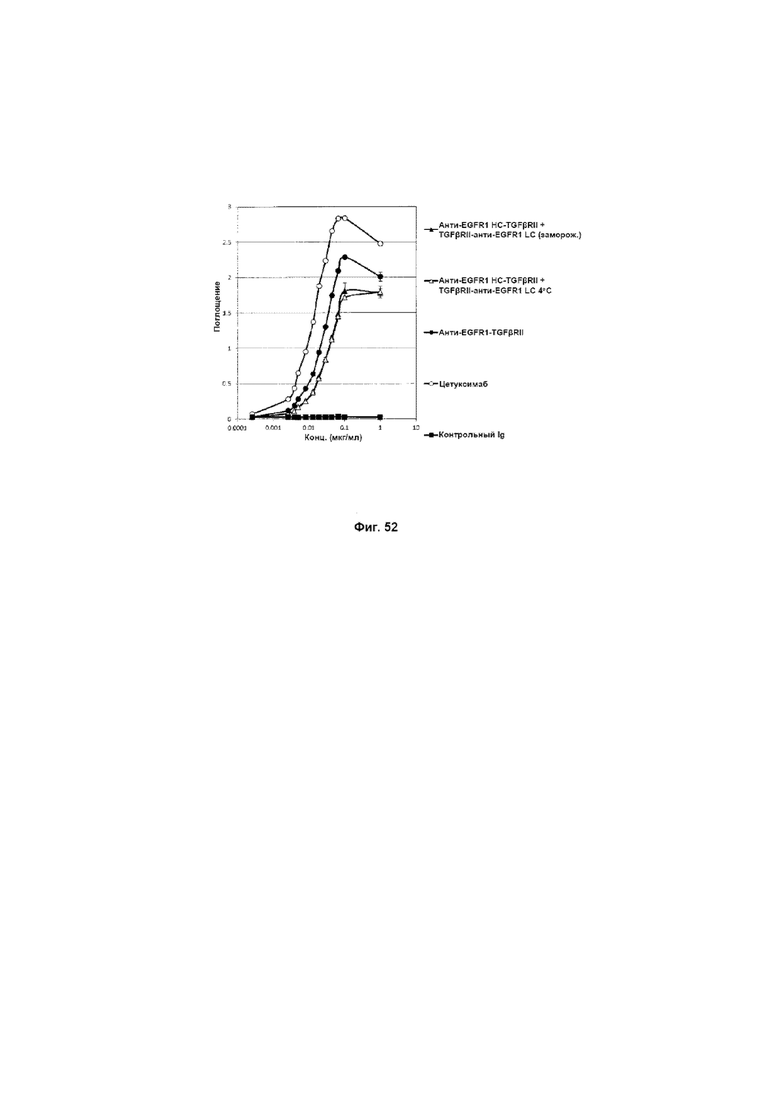
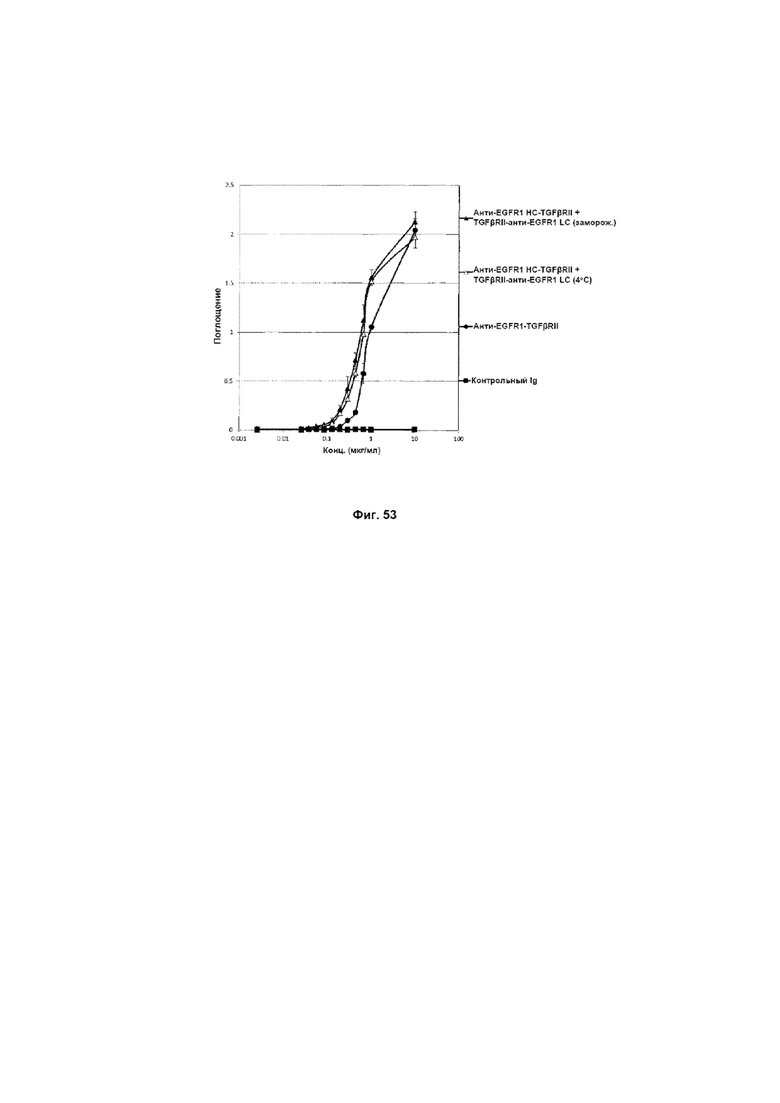
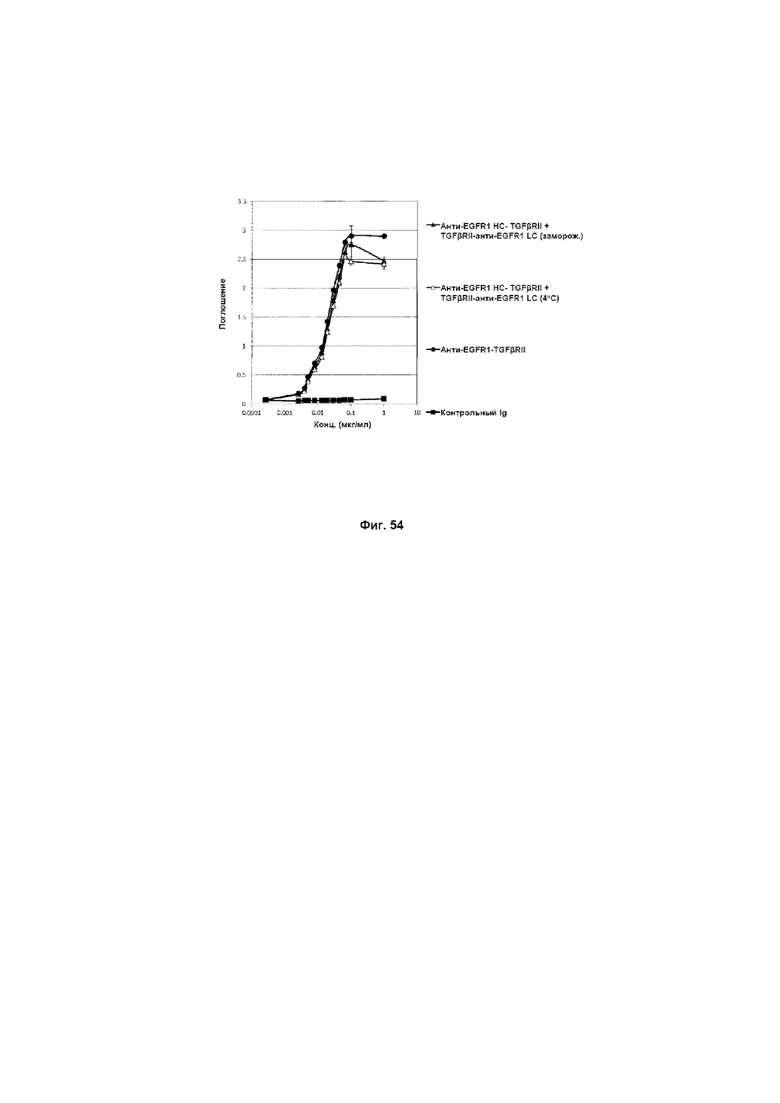
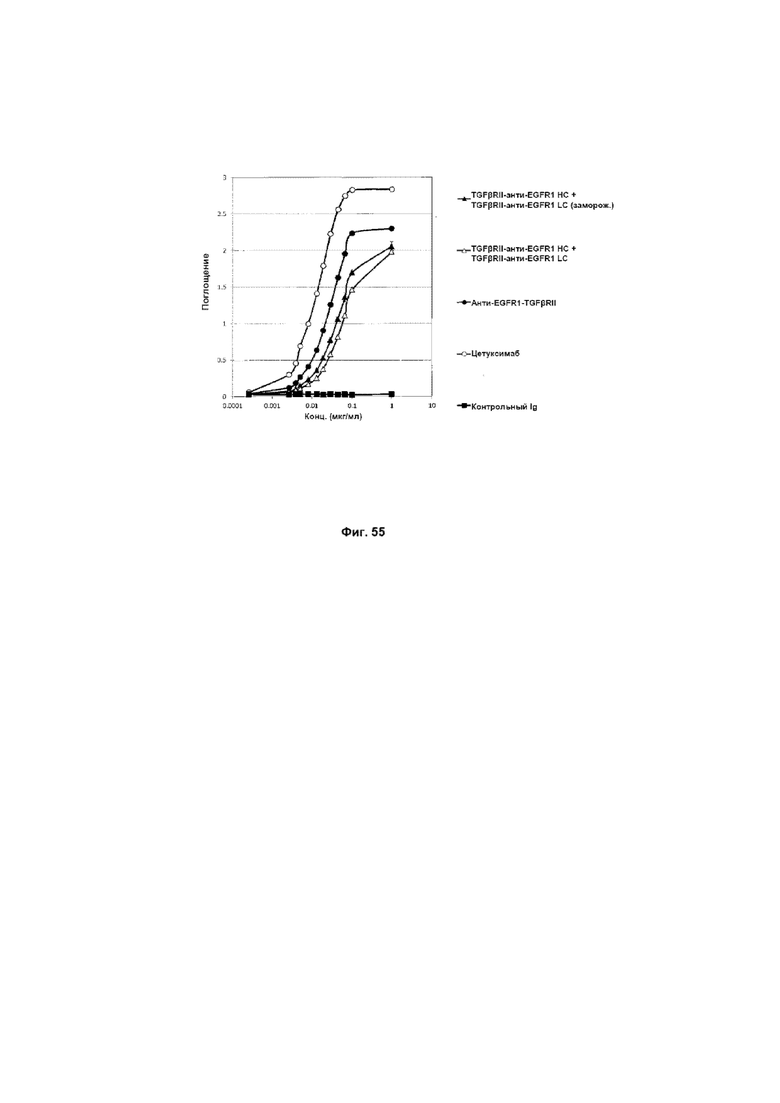
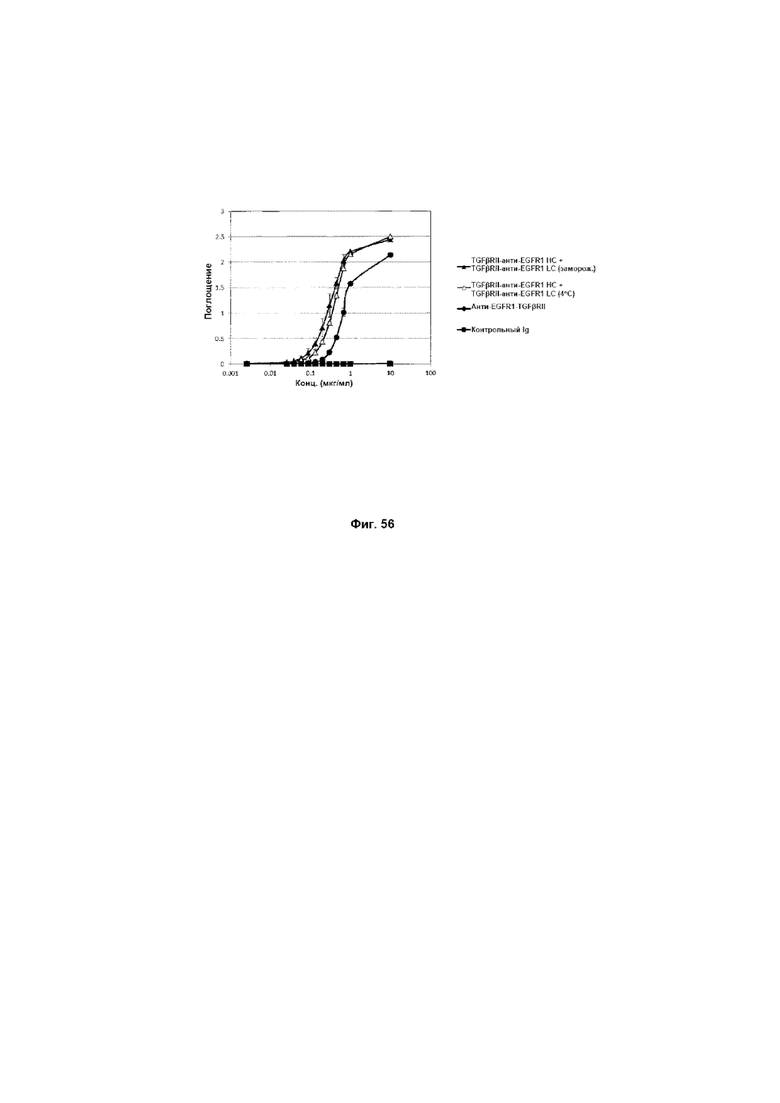
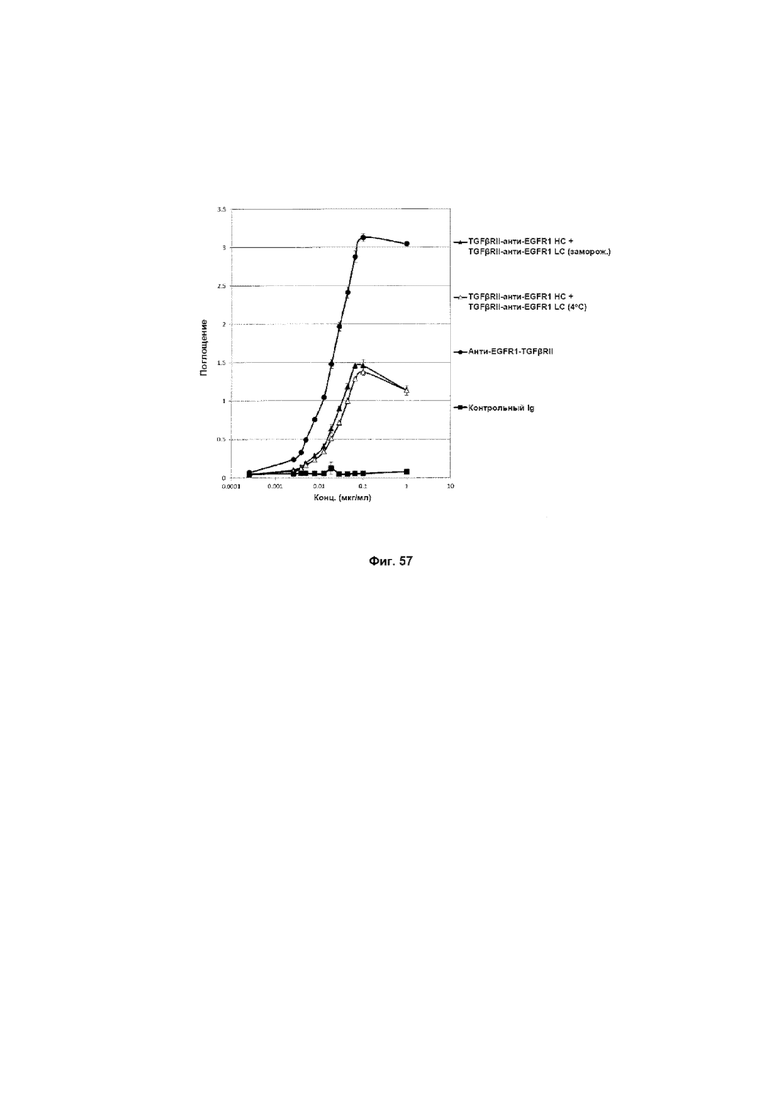
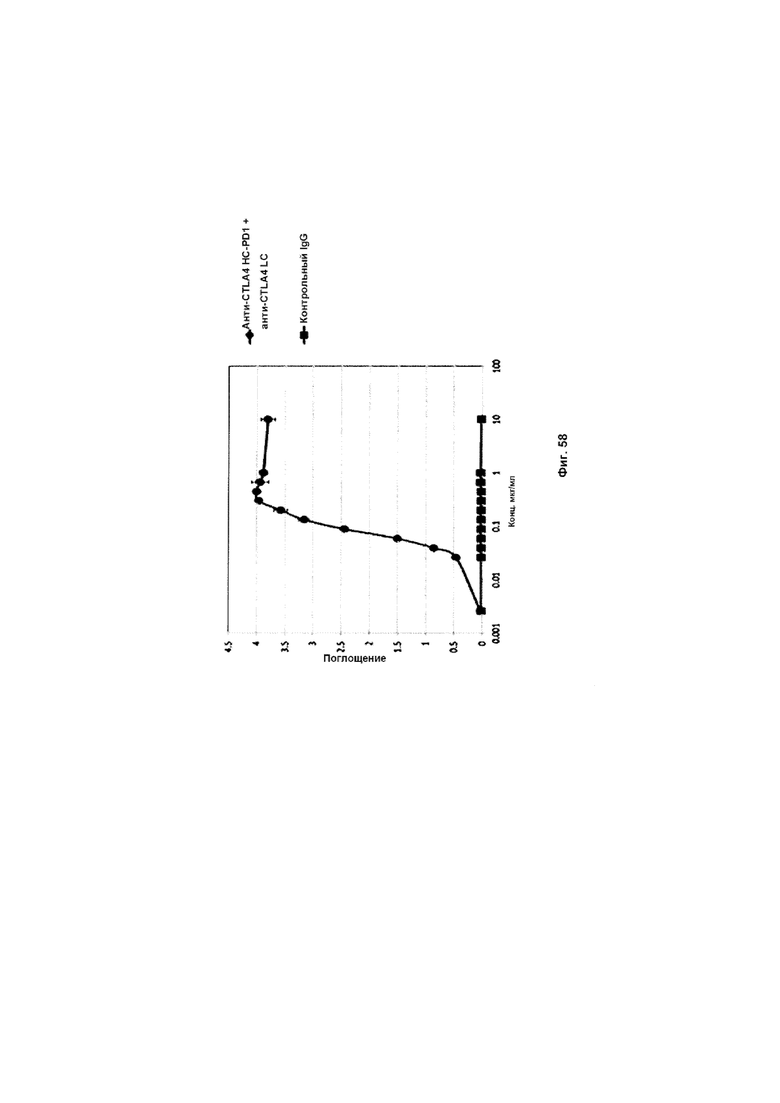
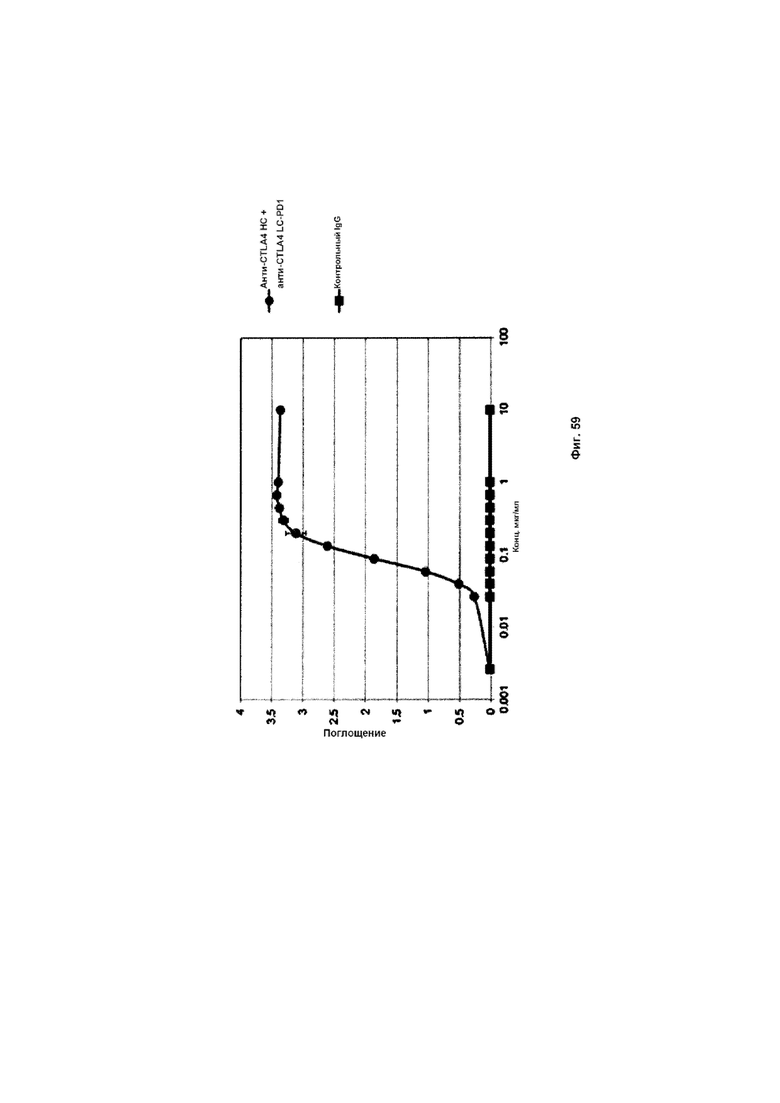
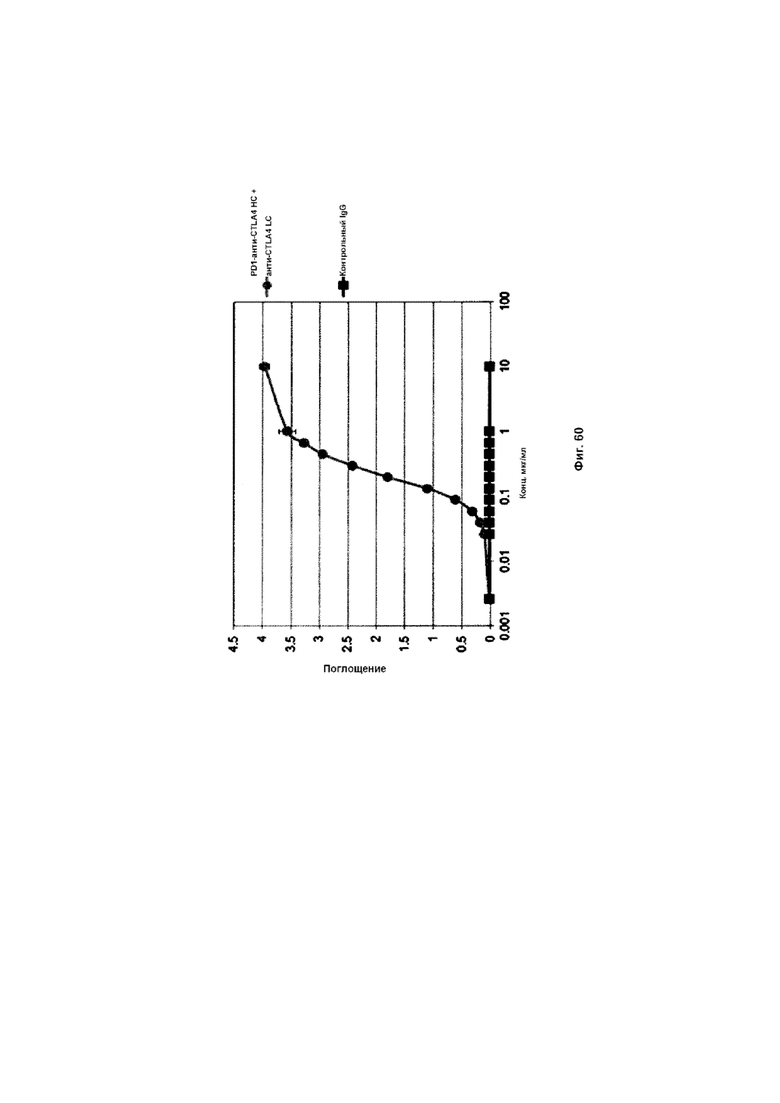


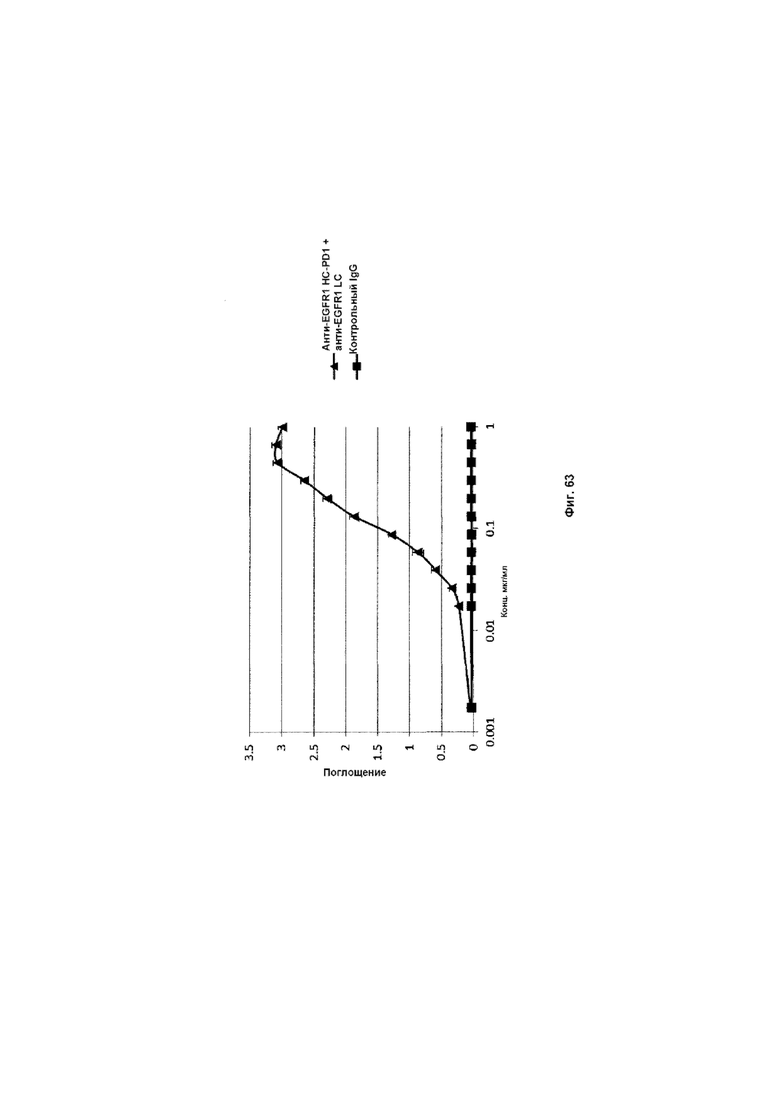
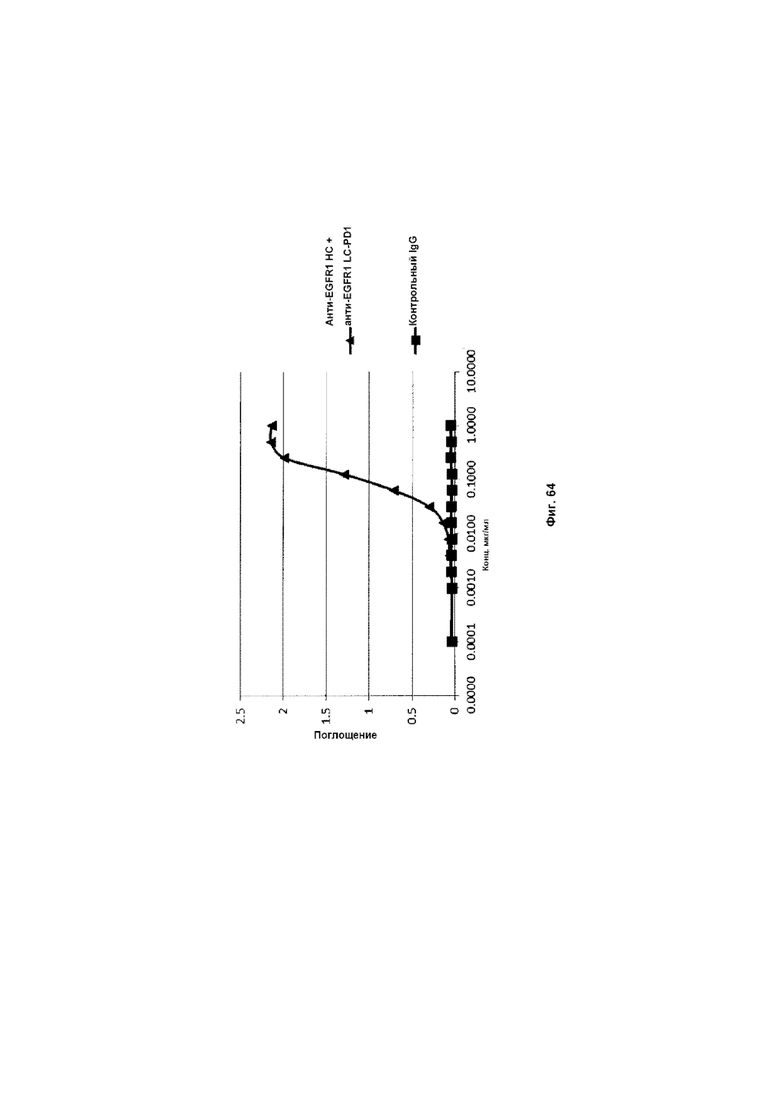
Изобретение относится к области биохимии, в частности к способу получения терапевтически активного слитого белка, содержащего группировку направленного взаимодействия с опухолью и, по меньшей мере, одну иммуномодулирующую группировку, а также к препарату для ослабления Т-клеточной активации в раковых клетках, содержащему эффективное количество гомогенных терапевтически активных слитых белков, полученных вышеуказанным способом. Также раскрыта нуклеиновая кислота, кодирующая слитый белок, содержащий группировку направленного взаимодействия с опухолью и, по меньшей мере, одну иммуномодулирующую группировку. Изобретение также относится к экспрессионному вектору, содержащему вышеуказанную нуклеиновую кислоту. Изобретение позволяет эффективно получать терапевтически активный слитый белок для ослабления Т-клеточной активации в раковых клетках. 4 н. и 6 з.п. ф-лы, 64 ил., 6 табл., 9 пр.
1. Способ получения терапевтически активного слитого белка, содержащего группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую группировку, где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с CTLA-4 (антиген 4 цитотоксических Т-лимфоцитов), иммуномодулирующая группировка представляет собой PD1, и где слитый белок получают осуществлением следующих стадий:
получение кодон-оптимизированной нуклеотидной последовательности, кодирующей слитый белок для экспрессии в клетках CHO (клетки яичника китайского хомячка), где кодон-оптимизированная нуклеотидная последовательность модифицирована для увеличения содержания последовательностей CG, и где кодон-оптимизированная нуклеотидная последовательность содержит SEQ ID NO: 5 и SEQ ID NO: 6, кодирующие тяжелую и легкую цепи антитела, связывающегося с CTLA-4, и SEQ ID NO: 7 для иммуномодулирующей группировки PD1, где иммуномодулирующая группировка связана с антителом посредством аминокислотной последовательности, экспрессирующейся из нуклеотидной последовательности SEQ ID NO: 4, и где нуклеотидная последовательность SEQ ID NO: 5 для тяжелой цепи антитела, связывающегося с CTLA-4, лишена нуклеотидов для экспрессии лизина на C-конце;
клонирование оптимизированной последовательности указанного слитого белка в клетках CHO, способных к транзиентной или стабильной экспрессии;
выращивание клеток CHO в среде в условиях, подходящих для выращивания и обеспечения клетке-хозяину возможности экспрессировать слитый белок; и
сбор секретированных слитых белков, возможно, для дальнейшей очистки.
2. Способ по п. 1, где иммуномодулирующая группировка связана через линкер с N- или C-концом тяжелой цепи антитела, N- или C-концом легкой цепи антитела либо как N-, так и C-концом обеих цепей.
3. Способ по п. 1, где кодон-оптимизированные нуклеотидные последовательности содержат SEQ ID NO: 5, 6, 7 и 4.
4. Препарат для ослабления T-клеточной активации в раковых клетках, содержащий эффективное количество гомогенных терапевтически активных слитых белков, содержащих группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую группировку, где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с CTLA-4 (антиген 4 цитотоксических Т-лимфоцитов), и где слитые белки получены согласно п. 1, где слитый белок имеет кодон-оптимизированную нуклеотидную последовательность, кодирующую слитый белок для экспрессии в клетках CHO (клетки яичника китайского хомячка), где кодон-оптимизированная нуклеотидная последовательность модифицирована для увеличения содержания последовательностей CG, и где кодон-оптимизированная нуклеотидная последовательность содержит SEQ ID NO: 5 и SEQ ID NO: 6, кодирующие тяжелую и легкую цепи антитела, связывающегося с CTLA-4, и SEQ ID NO: 7 для иммуномодулирующей группировки PD1 соответственно, где иммуномодулирующая группировка связана с антителом посредством аминокислотной последовательности, экспрессирующейся из нуклеотидной последовательности SEQ ID NO: 4, и где кодон-оптимизированная нуклеотидная последовательность SEQ ID NO: 5 для тяжелой цепи антитела, связывающегося с CTLA-4, лишена нуклеотидов для экспрессии лизина на C-конце тяжелой цепи антитела.
5. Нуклеиновая кислота, кодирующая слитый белок, содержащий группировку направленного взаимодействия с опухолью и по меньшей мере одну иммуномодулирующую группировку, где группировка направленного взаимодействия с опухолью представляет собой антитело, связывающееся с CTLA-4 (антиген 4 цитотоксических Т-лимфоцитов), и где слитый белок получен согласно п. 1, где слитый белок имеет кодон-оптимизированную нуклеотидную последовательность, кодирующую слитый белок для экспрессии в клетках CHO (клетки яичника китайского хомячка), где кодон-оптимизированная нуклеотидная последовательность модифицирована для увеличения содержания последовательностей CG, и где кодон-оптимизированная нуклеотидная последовательность содержит SEQ ID NO: 5 и SEQ ID NO: 6, кодирующие тяжелую и легкую цепи антитела, связывающегося с CTLA-4, и SEQ ID NO: 7 для иммуномодулирующей группировки PD1, где иммуномодулирующая группировка связана с антителом посредством аминокислотной последовательности, экспрессирующейся из нуклеотидной последовательности SEQ ID NO: 4, и где нуклеотидная последовательность SEQ ID NO: 5 для тяжелой цепи антитела, связывающегося с CTLA-4, лишена нуклеотидов для экспрессии лизина на C-конце.
6. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 5.
7. Способ по п. 1, где слитый белок содержит аминокислотные последовательности SEQ ID NO: 32 и одну из SEQ ID NO: 14, 33 или 35.
8. Способ по п. 1, где слитый белок содержит аминокислотные последовательности SEQ ID NO: 13 и одну из SEQ ID NO: 33 или 35.
9. Способ по п. 1, где слитый белок содержит аминокислотные последовательности SEQ ID NO: 34 и одну из SEQ ID NO: 14, 33 или 35.
10. Способ по п. 1, где слитый белок содержит аминокислотные последовательности SEQ ID NO: 13, 14, 10 и 11.
| WO 2011109789 A2, 09.09.2011 | |||
| WO 2011102845 A1, 25.08.2011 | |||
| WO 2009027471 A1, 05.03.2009 | |||
| ТЕПЛООБМЕННИК СИСТЕМЫ ЖИДКОСТНОГО ОХЛАЖДЕНИЯ ДВИГАТЕЛЯ МОТОЦИКЛА С БОКОВЫМ ПРИЦЕПОМ | 1993 |
|
RU2083854C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПОЛИПЕПТИДА, ГИБРИДНАЯ ДНК (ВАРИАНТЫ), СЛИТЫЙ БЕЛОК (ВАРИАНТЫ) | 1991 |
|
RU2120475C1 |
Авторы
Даты
2019-09-02—Публикация
2014-03-10—Подача